의약품 제조업체: Astellas Pharma US, Inc. (Updated: 2025-01-22)
처방 정보 하이라이트
XTANDI® (엔잘루타마이드) 캡슐, 경구용
XTANDI® (엔잘루타마이드) 정제, 경구용
미국 최초 승인: 2012
적응증 및 용법
용법 및 용량
- •
- XTANDI 160mg을 1일 1회 경구 투여합니다. 식사와 상관없이 복용할 수 있습니다. (2.1)
- •
- 모든 약물이 성공적으로 삼켜졌는지 확인하기 위해 환자에게 각 캡슐 또는 정제를 충분한 양의 물과 함께 통째로 복용하도록 지시하십시오. (2.1, 5.7)
- •
- 거세 저항성 전립선암 또는 전이성 거세 민감성 전립선암에 대해 XTANDI를 투여받는 환자는 동시에 성선자극호르몬 방출 호르몬(GnRH) 유사체를 투여받거나 양측 고환절제술을 받았어야 합니다. (2.1)
- •
- 전이 위험이 높은 생화학적 재발이 있는 비전이성 거세 민감성 전립선암 환자는 GnRH 유사체를 사용하거나 사용하지 않고 치료할 수 있습니다. (2.1)
금기 사항
없음. (4)
경고 및 주의 사항
- •
- XTANDI를 투여받은 환자의 0.6%에서 발작이 발생했습니다. 발작을 일으킬 수 있는 요인이 있는 환자의 경우 2.2%에서 발작이 보고되었습니다. 치료 중 발작이 발생하는 환자에게는 XTANDI 투여를 영구적으로 중단하십시오. (5.1)
- •
- 후방 가역성 뇌병증 증후군(PRES): XTANDI 투여를 중단하십시오. (5.2)
- •
- 과민반응: XTANDI 투여를 중단하십시오. (5.3)
- •
- 허혈성 심장 질환: 심혈관 위험 요인 관리를 최적화하십시오. 3-4등급 이상의 유해 반응이 발생하는 경우 XTANDI 투여를 중단하십시오. (5.4)
- •
- 낙상 및 골절: 환자의 골절 및 낙상 위험을 평가하고 확립된 지침에 따라 골 표적 약물로 환자를 치료하십시오. (5.5)
- •
- 태아-태아 독성: XTANDI는 태아에게 해를 끼치고 임신 손실을 유발할 수 있습니다. 생식 능력이 있는 여성 파트너가 있는 남성에게는 효과적인 피임법을 사용하도록 조언하십시오. (5.6, 8.1, 8.3)
- •
- 제품 크기와 관련된 심한 연하곤란 또는 질식: 삼키는 데 어려움이 있는 환자에게는 더 작은 XTANDI 정제를 사용하는 것을 고려하십시오. 캡슐이나 정제를 삼킬 수 없는 환자의 경우 XTANDI 투여를 중단하십시오. (2.1, 5.7)
유해 반응
XTANDI 치료 환자에서 위약보다 더 자주(위약 대비 ≥2%) 발생한 가장 흔한 유해 반응(≥10%)은 근골격계 통증, 피로, 안면홍조, 변비, 식욕 감퇴, 설사, 고혈압, 출혈, 낙상, 골절 및 두통입니다. (6.1)
의심되는 유해 반응을 보고하려면 Astellas Pharma US, Inc.에 1-800-727-7003으로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
- •
- 강력한 CYP2C8 억제제: 강력한 CYP2C8 억제제는 피하십시오. 병용 투여를 피할 수 없는 경우 XTANDI의 용량을 줄이십시오. (2.3, 7.1)
- •
- 강력한 CYP3A4 유도제: 강력한 CYP3A4 유도제는 피하십시오. 병용 투여를 피할 수 없는 경우 XTANDI의 용량을 늘리십시오. (2.3, 7.1)
- •
- 농도의 최소 감소가 기질의 치료 실패로 이어질 수 있는 특정 CYP3A4, CYP2C9 또는 CYP2C19 기질과의 병용 투여는 피하십시오. 활성 대사체가 생성되는 경우 활성 대사체에 대한 노출이 증가할 수 있습니다. (7.2)
환자 상담 정보 및 FDA 승인 환자 라벨링은 17번을 참조하십시오.
개정: 2025년 1월
목차
전문 정보: 목차*
1 적응증 및 용법
2 용법 및 용량
2.1 권장 용량
2.2 이상반응에 대한 용량 조절
2.3 약물 상호작용에 대한 용량 조절
3 제형 및 강도
4 금기사항
5 경고 및 주의사항
5.1 발작
5.2 후방 가역성 뇌병증 증후군 (PRES)
5.3 과민반응
5.4 허혈성 심장 질환
5.5 낙상 및 골절
5.6 배아-태아 독성
5.7 연하곤란 또는 질식
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 다른 약물이 XTANDI에 미치는 영향
7.2 XTANDI가 다른 약물에 미치는 영향
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
10 과량투여
11 일반적 특성
12 약리학적 특성
12.1 작용기전
12.2 약력학
12.3 약동학
13 비임상적 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
14 임상시험
16 포장단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분은 목록에 포함되지 않습니다.
1 적응증 및 사용법
XTANDI®는 다음 환자의 치료에 사용됩니다.
- •
- 거세 저항성 전립선암 (CRPC)
- •
- 전이성 거세 민감성 전립선암 (mCSPC)
- •
- 전이가 높은 위험군인 생화학적 재발이 있는 비전이성 거세 민감성 전립선암 (nmCSPC with high-risk BCR)
2 용법 및 투여
2.1 권장 용량
XTANDI의 권장 용량은 음식과 함께 또는 음식 없이 1일 1회 160mg를 경구 투여하는 것입니다 [임상 약리학 (12.3) 참조]. 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 투여합니다.
환자에게 각 캡슐 또는 정제를 충분한 양의 물과 함께 삼켜 모든 약물이 성공적으로 삼켜지도록 해야 한다고 알려주십시오. 캡슐을 씹거나, 녹이거나, 열지 마십시오. 정제를 자르거나, 부수거나, 씹지 마십시오.
XTANDI를 투여받는 CRPC 또는 mCSPC 환자는 동시에 성선자극호르몬 방출 호르몬(GnRH) 유사체를 투여받거나 양측 고환절제술을 받았어야 합니다.
고위험 BCR이 있는 nmCSPC 환자는 GnRH 유사체와 함께 또는 없이 XTANDI로 치료할 수 있습니다. GnRH 유사체와 함께 또는 없이 XTANDI를 투여받는 환자의 경우, 치료 36주 후 PSA가 검출되지 않으면 (<0.2 ng/mL) 치료를 중단할 수 있습니다. 이전에 근치적 전립선 절제술을 받은 환자의 경우 PSA가 ≥2.0 ng/mL로 증가하거나, 이전에 일차 방사선 치료를 받은 환자의 경우 PSA가 ≥5.0 ng/mL로 증가하면 치료를 재개합니다 [임상 연구 (14) 참조].
2.2 유해 반응에 대한 용량 조절
환자가 ≥3등급 또는 불내성 유해 반응을 경험하는 경우, 증상이 ≤2등급으로 호전될 때까지 또는 1주일 동안 XTANDI 투여를 중단한 다음, 필요한 경우 동일하거나 감소된 용량(120mg 또는 80mg)으로 투여를 재개합니다 [경고 및 주의사항 (5.1, 5.2) 참조].
2.3 약물 상호작용에 대한 용량 조절
강력한 CYP2C8 억제제
강력한 CYP2C8 억제제와의 병용 투여는 피하십시오. 강력한 CYP2C8 억제제와의 병용 투여를 피할 수 없는 경우, XTANDI 용량을 1일 1회 80mg으로 감소시킵니다. 강력한 억제제의 병용 투여를 중단하는 경우, 강력한 CYP2C8 억제제 투여 시작 전에 사용했던 용량으로 XTANDI 용량을 증가시킵니다 [임상 약리학 (12.3) 참조].
강력한 CYP3A4 유도제
강력한 CYP3A4 유도제와의 병용 투여는 피하십시오. 강력한 CYP3A4 유도제와의 병용 투여를 피할 수 없는 경우, XTANDI 용량을 1일 1회 경구 160mg에서 240mg으로 증가시킵니다. 강력한 CYP3A4 유도제의 병용 투여를 중단하는 경우, 강력한 CYP3A4 유도제 투여 시작 전에 사용했던 용량으로 XTANDI 용량을 감소시킵니다 [임상 약리학 (12.3) 참조].
3 제형 및 함량
XTANDI 40mg 캡슐은 검정 잉크로 ENZ가 각인된 흰색에서 약간 희끄무레한 장방형 연질 젤라틴 캡슐입니다.
XTANDI 40mg 정제는 노란색 원형 필름 코팅 정제이며 E 40이 각인되어 있습니다.
XTANDI 80mg 정제는 노란색 타원형 필름 코팅 정제이며 E 80이 각인되어 있습니다.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 발작
8건의 무작위 대조 임상 시험에서 XTANDI를 투여받은 환자의 0.6%에서 발작이 발생했습니다. 이러한 시험에서 발작의 소인이 있는 환자는 일반적으로 제외되었습니다. 발작은 XTANDI 투여 시작 후 13일에서 2250일 사이에 발생했습니다. 발작을 경험한 환자는 치료를 영구적으로 중단했으며, 모든 발작 증상은 해소되었습니다.
발작의 소인이 있는 환자에서 발작 위험을 평가하기 위해 설계된 단일군 시험에서, XTANDI 치료를 받은 366명 중 8명(2.2%)에서 발작이 발생했습니다. 8명 중 3명은 첫 번째 발작이 해소된 후 XTANDI 치료를 계속하는 동안 두 번째 발작을 경험했습니다. 항경련제가 XTANDI로 인한 발작을 예방할 수 있는지 여부는 알려져 있지 않습니다. 연구에 참여한 환자들은 다음과 같은 하나 이상의 소인을 가지고 있었습니다. 발작 역치를 낮출 수 있는 약물 사용(~ 54%), 외상성 뇌손상 또는 두부 손상 병력(~ 28%), 뇌혈관 사고 또는 일과성 허혈 발작 병력(~ 24%), 알츠하이머병, 수막종 또는 전이성 수막염(전립선암으로 인한), 최근 12개월 이내의 원인 불명의 의식 상실, 과거 발작 병력, 뇌의 공간 차지 병변 존재, 뇌동정맥 기형 병력 또는 뇌 감염 병력(모두 < 5%). 환자의 약 17%는 두 개 이상의 위험 요인을 가지고 있었습니다.
XTANDI를 투여받는 동안 발작이 발생할 위험과 의식을 갑자기 잃으면 자신이나 다른 사람에게 심각한 해를 끼칠 수 있는 활동에 참여하는 것에 대해 환자에게 알려주십시오.
치료 중 발작이 발생하는 환자에게는 XTANDI를 영구적으로 중단하십시오.
5.2 후방 가역성 뇌병증 증후군(PRES)
XTANDI를 투여받은 환자에서 후방 가역성 뇌병증 증후군(PRES)이 보고되었습니다 [유해 반응 (6.2) 참조]. PRES는 발작, 두통, 무기력증, 혼돈, 실명 및 기타 시각 및 신경 장애를 포함하여 빠르게 진행되는 증상으로 나타날 수 있는 신경 장애이며, 고혈압이 동반될 수도 있고 동반되지 않을 수도 있습니다. PRES 진단에는 뇌 영상, 바람직하게는 자기 공명 영상(MRI)으로 확인해야 합니다. PRES가 발생하는 환자에게는 XTANDI를 중단하십시오.
5.3 과민증
8건의 무작위 대조 임상 시험에서 엔잘루타마이드를 사용하여 얼굴 부종(0.5%), 혀 부종(0.1%) 또는 입술 부종(0.1%)을 포함한 과민증 반응이 관찰되었습니다. 인두 부종은 시판 후 사례에서 보고되었습니다. 과민증 증상이 나타나는 환자에게는 XTANDI를 일시적으로 중단하고 즉시 의료 서비스를 받도록 조언하십시오. 심각한 과민증 반응의 경우 XTANDI를 영구적으로 중단하십시오.
5.4 허혈성 심장 질환
5건의 무작위, 위약 대조 임상 연구의 통합 데이터에서 허혈성 심장 질환은 위약군 환자보다 XTANDI군 환자에서 더 흔하게 발생했습니다(3.5% 대 2%). 3-4등급 허혈성 사건은 XTANDI군 환자의 1.8%, 위약군 환자의 1.1%에서 발생했습니다. 허혈성 사건으로 인한 사망은 XTANDI군 환자의 0.4%, 위약군 환자의 0.1%에서 발생했습니다.
허혈성 심장 질환의 징후와 증상을 모니터링하십시오. 고혈압, 당뇨병 또는 이상지질혈증과 같은 심혈관 위험 요인의 관리를 최적화하십시오. 3-4등급 허혈성 심장 질환의 경우 XTANDI를 중단하십시오.
5.5 낙상 및 골절
XTANDI를 투여받은 환자에서 낙상 및 골절이 발생했습니다. 골절 및 낙상 위험에 대해 환자를 평가하십시오. 확립된 치료 지침에 따라 골절 위험이 있는 환자를 모니터링하고 관리하며 골 표적 약물의 사용을 고려하십시오.
5건의 무작위, 위약 대조 임상 연구의 통합 데이터에서 XTANDI로 치료받은 환자의 12%에서 낙상이 발생한 반면, 위약으로 치료받은 환자의 6%에서 낙상이 발생했습니다. 낙상은 의식 상실이나 발작과 관련이 없었습니다. XTANDI로 치료받은 환자의 13%와 위약으로 치료받은 환자의 6%에서 골절이 발생했습니다. 3-4등급 골절은 XTANDI로 치료받은 환자의 3.4%와 위약으로 치료받은 환자의 1.9%에서 발생했습니다. XTANDI로 치료받은 환자의 골절 발생 중앙값 시간은 420일(범위: 1일~2348일)이었습니다. 연구에서는 일상적인 골밀도 평가 및 골 표적 약물을 사용한 골다공증 치료를 실시하지 않았습니다.
5.6 배아-태아 독성
여성에서 XTANDI의 안전성 및 유효성은 확립되지 않았습니다. 동물 생식 연구 및 작용 기전을 바탕으로, XTANDI는 임신한 여성에게 투여될 경우 태아에게 해를 끼치고 임신 손실을 유발할 수 있습니다. 생식 능력이 있는 여성 파트너가 있는 남성에게 XTANDI 치료 중 및 마지막 XTANDI 투여 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 (8.1, 8.3) 참조].
5.7 삼킴곤란 또는 질식
XTANDI 제품 크기로 인해 생명을 위협할 수 있는 의료 개입 또는 사망을 요구하는 사건을 포함하여 심각한 삼킴곤란 또는 질식이 발생할 수 있습니다. 환자에게 각 캡슐 또는 정제를 충분한 양의 물과 함께 통째로 복용하여 모든 약물이 성공적으로 삼켜지도록 하십시오. 삼키기 어려운 환자의 경우 더 작은 크기의 XTANDI 정제 사용을 고려하십시오. 캡슐이나 정제를 삼킬 수 없는 환자의 경우 XTANDI를 중단하십시오.
6 부작용 반응
다음은 라벨의 다른 섹션에서 자세히 설명합니다.
- •
- 발작 [see 경고 및 주의사항 (5.1)]
- •
- 가역적 후측 뇌병증 증후군(PRES) [see 경고 및 주의사항 (5.2)]
- •
- 과민증 [see 경고 및 주의사항 (5.3)]
- •
- 허혈성 심장 질환 [see 경고 및 주의사항 (5.4)]
- •
- 낙상 및 골절 [see 경고 및 주의사항 (5.5)]
- •
- 연하곤란 또는 질식 [see 경고 및 주의사항 (5.7)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상 시험에서 관찰된 이상 반응률을 다른 약물의 임상 시험에서 관찰된 이상 반응률과 직접 비교할 수 없으며 실제로 관찰된 이상 반응률을 반영하지 않을 수 있습니다.
경고 및 주의사항의 데이터는 CRPC(N = 3651), mCSPC(N = 752) 또는 고위험 BCR이 있는 nmCSPC 환자에서 XTANDI로 치료한 안전성 분석을 수행하기 위해 통합된 8개의 무작위 대조 시험[AFFIRM, PREVAIL, TERRAIN, PROSPER, ARCHES, EMBARK, Asian PREVAIL (NCT02294461) 및 STRIVE (NCT01664923)]을 반영합니다. 환자들은 XTANDI 160mg(N = 5110) 또는 위약을 1일 1회 경구 투여(N = 2829) 또는 비칼루타미드 50mg을 1일 1회 경구 투여(N = 387) 받았습니다. 이 8개의 시험에서 XTANDI를 투여받은 환자의 치료 기간 중앙값은 22.1개월(범위: < 0.1~95.0)이었습니다.
5개의 위약 대조 시험(AFFIRM, PROSPER, PREVAIL, ARCHES 및 EMBARK)에서 XTANDI 그룹의 치료 기간 중앙값은 19.4개월(범위: < 0.1~90.4)이었습니다. [see 임상 연구 (14)]. 이 5개의 시험에서 XTANDI 치료 환자에서 위약보다 더 자주(≥ 2%) 발생한 가장 흔한 이상 반응(≥ 10%)은 근골격계 통증, 피로, 안면 홍조, 변비, 식욕 감소, 설사, 고혈압, 출혈, 낙상, 골절 및 두통이었습니다.
AFFIRM: 화학 요법 후 전이성 CRPC에서 XTANDI 대 위약
AFFIRM에는 이전에 도세탁셀을 투여받은 전이성 CRPC 환자 1199명이 등록했습니다. XTANDI의 치료 기간 중앙값은 8.3개월이었고 위약의 치료 기간 중앙값은 3.0개월이었습니다. 시험 기간 동안 XTANDI군 환자의 48%와 위약군 환자의 46%가 글루코코르티코이드를 투여받았습니다.
3등급 이상의 이상 반응은 XTANDI 치료 환자의 47%에서 보고되었습니다. 이상 반응으로 인한 치료 중단은 XTANDI 치료 환자의 16%에서 보고되었습니다. 치료 중단으로 이어진 가장 흔한 이상 반응은 발작이었으며, 이는 XTANDI 치료 환자의 0.9%에서 발생했으며 위약 치료 환자에서는 발생하지 않았습니다(0%). 표 1은 AFFIRM에서 보고된 이상 반응 중 위약군에 비해 XTANDI군에서 ≥ 2% 더 높은 빈도로 발생한 이상 반응을 보여줍니다.
| XTANDI (N = 800) |
위약 (N = 399) |
|||
|---|---|---|---|---|
| 1-4등급* (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
전신 장애 |
||||
|
Asthenic Conditions† (쇠약 상태) |
51 |
9 |
44 |
9 |
|
Peripheral Edema (말초 부종) |
15 |
1 |
13 |
0.8 |
|
근골격계 및 결합 조직 장애 |
||||
|
Back Pain (요통) |
26 |
5 |
24 |
4 |
|
Arthralgia (관절통) |
21 |
2.5 |
17 |
1.8 |
|
Musculoskeletal Pain (근골격계 통증) |
15 |
1.3 |
12 |
0.3 |
|
Muscular Weakness (근육 약화) |
10 |
1.5 |
7 |
1.8 |
|
Musculoskeletal Stiffness (근골격계 경직) |
2.6 |
0.3 |
0.3 |
0 |
|
위장 장애 |
||||
|
Diarrhea (설사) |
22 |
1.1 |
18 |
0.3 |
|
혈관 장애 |
||||
|
Hot Flush (안면 홍조) |
20 |
0 |
10 |
0 |
|
Hypertension (고혈압) |
6 |
2.1 |
2.8 |
1.3 |
|
신경계 장애 |
||||
|
Headache (두통) |
12 |
0.9 |
5 |
0 |
|
Dizziness‡ (현기증) |
9 |
0.5 |
7 |
0.5 |
|
Spinal Cord Compression and Cauda Equina Syndrome (척수 압박 및 마미 증후군) |
7 |
7 |
4.5 |
3.8 |
|
감각이상 (Paresthesia) |
7 |
0 |
4.5 |
0 |
|
정신 장애 (Mental Impairment Disorders)§ |
4.3 |
0.3 |
1.8 |
0 |
|
감각저하 (Hypoesthesia) |
4 |
0.3 |
1.8 |
0 |
|
감염 및 감염증 (Infections and Infestations) |
||||
|
상기도 감염 (Upper Respiratory Tract Infection)¶ |
11 |
0 |
6 |
0.3 |
|
하기도 및 폐 감염 (Lower Respiratory Tract And Lung Infection)# |
8 |
2.4 |
4.8 |
1.3 |
|
정신 질환 (Psychiatric Disorders) |
||||
|
불면증 (Insomnia) |
9 |
0 |
6 |
0.5 |
|
불안 (Anxiety) |
6 |
0.3 |
4 |
0 |
|
신장 및 비뇨기계 질환 (Renal and Urinary Disorders) |
||||
|
혈뇨 (Hematuria) |
7 |
1.8 |
4.5 |
1 |
|
빈뇨 (Pollakiuria) |
4.8 |
0 |
2.5 |
0 |
|
손상, 중독 및 시술 합병증 (Injury, Poisoning and Procedural Complications) |
||||
|
낙상 (Fall) |
4.6 |
0.3 |
1.3 |
0 |
|
비병적 골절 (Non-pathologic Fractures) |
4 |
1.4 |
0.8 |
0.3 |
|
피부 및 피하 조직 질환 (Skin and Subcutaneous Tissue Disorders) |
||||
|
가려움증 (Pruritus) |
3.8 |
0 |
1.3 |
0 |
|
건성 피부 (Dry Skin) |
3.5 |
0 |
1.3 |
0 |
|
호흡기 질환 (Respiratory Disorders) |
||||
|
코피(Epistaxis) |
3.3 |
0.1 |
1.3 |
0.3 |
PREVAIL: XTANDI 대 위약, 화학 요법 미경험 전이성 CRPC
PREVAIL에는 이전에 세포 독성 화학 요법을 받지 않은 전이성 CRPC 환자 1717명이 등록되었으며, 그중 1715명이 최소 1회의 연구 약물을 투여받았습니다. 치료 기간 중앙값은 XTANDI의 경우 17.5개월, 위약의 경우 4.6개월이었습니다. 3-4등급 이상반응은 XTANDI 치료 환자의 44%, 위약 치료 환자의 37%에서 보고되었습니다. 이상반응으로 인한 치료 중단은 XTANDI 치료 환자의 6%에서 보고되었습니다. 치료 중단으로 이어진 가장 흔한 이상반응은 피로/무력증이었으며, 각 치료군의 환자 1%에서 발생했습니다. 표 2에는 PREVAIL에서 보고된 이상반응 중 위약군에 비해 XTANDI군에서 발생 빈도가 2% 이상 높았던 이상반응이 포함되어 있습니다.
| XTANDI (N = 871) |
위약 (N = 844) |
|||
|---|---|---|---|---|
| 1-4등급* (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
전신 장애 |
||||
|
무력 상태† |
47 |
3.4 |
33 |
2.8 |
|
말초 부종 |
12 |
0.2 |
8 |
0.4 |
|
근골격계 및 결합 조직 장애 |
||||
|
요통 |
29 |
2 |
22 |
3 |
|
관절통 |
21 |
1.6 |
16 |
1.1 |
|
위장 장애 |
||||
|
변비 |
23 |
0.7 |
17 |
0.4 |
|
설사 |
17 |
0.3 |
14 |
0.4 |
|
혈관 장애 |
||||
|
열감(Hot Flush) |
18 |
0.1 |
8 |
0 |
|
고혈압(Hypertension) |
14 |
7 |
4.1 |
2.3 |
|
Nervous System Disorders |
||||
|
현기증(Dizziness)‡ |
11 |
0.3 |
7 |
0 |
|
두통(Headache) |
11 |
0.2 |
7 |
0.4 |
|
미각장애(Dysgeusia) |
8 |
0.1 |
3.7 |
0 |
|
정신 장애(Mental Impairment Disorders)§ |
6 |
0 |
1.3 |
0.1 |
|
하지불안증후군(Restless Legs Syndrome) |
2.1 |
0.1 |
0.4 |
0 |
|
Respiratory Disorders |
||||
|
호흡곤란(Dyspnea)¶ |
11 |
0.6 |
8 |
0.6 |
|
Infections and Infestations |
||||
|
상기도 감염(Upper Respiratory Tract Infection)# |
16 |
0 |
11 |
0 |
|
하기도 및 폐 감염(Lower Respiratory Tract And Lung Infection)Þ |
8 |
1.5 |
4.7 |
1.1 |
|
Psychiatric Disorders |
||||
|
불면증(Insomnia) |
8 |
0.1 |
6 |
0 |
|
Renal and Urinary Disorders |
||||
|
혈뇨(Hematuria) |
9 |
1.3 |
6 |
1.3 |
|
Injury, Poisoning and Procedural Complications |
||||
|
낙상 |
13 |
1.6 |
5 |
0.7 |
|
Non-Pathological Fracture (비병리적 골절) |
9 |
2.1 |
3 |
1.1 |
|
Metabolism and Nutrition Disorders (대사 및 영양 장애) |
||||
|
식욕 감퇴 |
19 |
0.3 |
16 |
0.7 |
|
Investigations (검사) |
||||
|
체중 감소 |
12 |
0.8 |
8 |
0.2 |
|
Reproductive System and Breast Disorders (생식기계 및 유방 질환) |
||||
|
여성형 유방 |
3.4 |
0 |
1.4 |
0 |
TERRAIN: XTANDI 대 비칼루타미드, 화학 요법 미경험 전이성 CRPC
TERRAIN에는 이전에 세포 독성 화학 요법을 받지 않은 전이성 CRPC 환자 375명이 등록되었으며, 그중 372명이 최소 1회의 연구 약물을 투여받았습니다. 치료 기간 중앙값은 XTANDI의 경우 11.6개월, 비칼루타미드의 경우 5.8개월이었습니다. 이상 반응을 주된 이유로 치료를 중단한 경우는 XTANDI 치료 환자의 8%와 비칼루타미드 치료 환자의 6%에서 보고되었습니다. 치료 중단으로 이어진 가장 흔한 이상 반응은 요통과 병적 골절이었으며, 각각 XTANDI 치료 환자의 3.8%에서 발생했고 비칼루타미드 치료 환자의 2.1%와 1.6%에서 발생했습니다. 표 3은 XTANDI 치료 환자의 전체 및 흔한 이상 반응(≥ 10%)을 보여줍니다.
| XTANDI (N = 183) |
Bicalutamide (N = 189) |
|||
|---|---|---|---|---|
| 1-4등급* (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
전체 |
94 |
39 |
94 |
38 |
|
전신 장애 |
||||
|
무력 상태† |
32 |
1.6 |
23 |
1.1 |
|
근골격계 및 결합 조직 장애 |
||||
|
요통 |
19 |
2.7 |
18 |
1.6 |
|
근골격계 통증‡ |
16 |
1.1 |
14 |
0.5 |
|
혈관 장애 |
||||
|
안면 홍조 |
15 |
0 |
11 |
0 |
|
고혈압 |
14 |
7 |
7 |
4.2 |
|
위장 장애 |
||||
|
메스꺼움 |
14 |
0 |
18 |
0 |
|
변비 |
13 |
1.1 |
13 |
0.5 |
|
설사 |
12 |
0 |
9 |
1.1 |
|
감염 및 감염증 |
||||
|
상기도 감염§ |
12 |
0 |
6 |
0.5 |
|
Investigational |
||||
|
체중 감소 |
11 |
0.5 |
8 |
0.5 |
PROSPER: 전이되지 않은 CRPC 환자에서 XTANDI 대 위약
PROSPER에는 전이되지 않은 CRPC 환자 1401명이 등록되었으며, 이 중 1395명이 최소 1회 이상 연구 약물을 투여받았습니다. 환자들은 2:1로 무작위 배정되어 1일 1회 160mg 용량의 XTANDI(N = 930) 또는 위약(N = 465)을 투여받았습니다. 분석 당시 치료 기간 중앙값은 XTANDI의 경우 18.4개월(범위: 0.0~42개월), 위약의 경우 11.1개월(범위: 0.0~43개월)이었습니다.
전반적으로 XTANDI를 투여받은 환자 32명(3.4%)이 이상반응으로 사망했습니다. 2명 이상의 환자에서 사망 원인은 관상동맥 질환(n = 7), 급사(n = 2), 심장 부정맥(n = 2), 전반적인 신체 건강 악화(n = 2), 뇌졸중(n = 2), 이차 악성종양(n = 5; 급성 골수성 백혈병, 뇌종양, 중피종, 소세포 폐암, 원발 부위 불명의 악성 종양 각 1건)이었습니다. 위약을 투여받은 환자 3명(0.6%)이 심정지(n = 1), 좌심실 부전(n = 1), 췌장암(n = 1) 등의 이상반응으로 사망했습니다. 3등급 이상의 이상반응은 XTANDI 치료 환자의 31%, 위약 치료 환자의 23%에서 보고되었습니다. 이상반응을 주된 이유로 치료를 중단한 경우는 XTANDI 치료 환자의 9%, 위약 치료 환자의 6%에서 보고되었습니다. 이 중 치료 중단으로 이어진 가장 흔한 이상반응은 피로였으며, XTANDI 치료 환자의 1.6%에서 발생한 반면 위약 치료 환자에서는 발생하지 않았습니다. 표 4는 PROSPER에서 보고된 이상반응 중 XTANDI군에서 위약군보다 2% 이상 높은 빈도로 발생한 이상반응을 보여줍니다.
| XTANDI (N = 930) |
위약 (N = 465) |
|||
|---|---|---|---|---|
| 1-4등급* (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
대사 및 영양 장애 |
||||
|
식욕 감퇴 |
10 |
0.2 |
3.9 |
0.2 |
|
신경계 장애 |
||||
|
어지러움† |
12 |
0.5 |
5 |
0 |
|
두통 |
9 |
0.2 |
4.5 |
0 |
|
인지 및 주의력 장애‡ |
4.6 |
0.1 |
1.5 |
0 |
|
혈관 장애 |
||||
|
안면 홍조 |
13 |
0.1 |
8 |
0 |
|
고혈압(Hypertension) |
12 |
4.6 |
5 |
2.2 |
|
위장 장애(Gastrointestinal Disorders) |
||||
|
메스꺼움(Nausea) |
11 |
0.3 |
9 |
0 |
|
변비(Constipation) |
9 |
0.2 |
7 |
0.4 |
|
전신 장애 및 투여 부위 이상(General Disorders and Administration Site Conditions) |
||||
|
무력증(Asthenic Conditions)§ |
40 |
4 |
20 |
0.9 |
|
검사(Investigations) |
||||
|
체중 감소(Weight Decreased) |
6 |
0.2 |
1.5 |
0 |
|
손상, 중독 및 시술 합병증(Injury, Poisoning and Procedural Complications) |
||||
|
낙상(Fall) |
11 |
1.3 |
4.1 |
0.6 |
|
골절(Fractures)¶ |
10 |
2 |
4.9 |
1.7 |
|
정신 장애(Psychiatric Disorders) |
||||
|
불안(Anxiety) |
2.8 |
0.2 |
0.4 |
0 |
ARCHES: 전이성 거세저항성 전립선암 (mCSPC) 환자에서 XTANDI 대 위약
ARCHES는 mCSPC 환자 1150명을 무작위 배정했으며, 이 중 1146명이 최소 1회 이상의 연구 약물을 투여받았습니다. 모든 환자는 성선자극호르몬분비호르몬 (GnRH) 유사체를 병용 투여받거나 양측 고환절제술을 받았습니다. 환자들은 XTANDI 160mg을 1일 1회 (N = 572) 또는 위약 (N = 574)을 투여받았습니다. 치료 기간 중앙값은 XTANDI의 경우 12.8개월 (범위: 0.2~26.6개월), 위약의 경우 11.6개월 (범위: 0.2~24.6개월)이었습니다.
전반적으로 XTANDI를 투여받은 환자 10명 (1.7%)이 이상반응으로 사망했습니다. 2명 이상의 환자에서 사망 원인은 심장 질환 (n = 3), 패혈증 (n = 2), 폐색전증 (n = 2)이었습니다. 위약을 투여받은 환자 8명 (1.4%)이 이상반응으로 사망했습니다. 2명 이상의 환자에서 사망 원인은 심장 질환 (n = 2)과 급사 (n = 2)였습니다. 3등급 이상의 이상반응은 XTANDI 치료 환자의 24%에서 보고되었습니다. 이상반응을 주된 이유로 영구적인 치료 중단은 XTANDI 치료 환자의 4.9%, 위약 치료 환자의 3.7%에서 보고되었습니다. XTANDI 치료 환자에서 영구적인 치료 중단으로 이어진 가장 흔한 이상반응은 alanine aminotransferase 증가, aspartate aminotransferase 상승, 발작이었으며, 각각 0.3%였습니다. 위약 치료 환자에서 영구적인 치료 중단으로 이어진 가장 흔한 이상반응은 관절통과 피로였으며, 각각 0.3%였습니다.
이상반응으로 인한 용량 감량은 XTANDI를 투여받은 환자의 4.4%에서 발생했습니다. 피로/무력증은 XTANDI 치료 환자의 2.1%, 위약 치료 환자의 0.7%에서 용량 감량이 필요한 가장 흔한 이상반응이었습니다.
표 5는 ARCHES에서 보고된 이상반응 중 XTANDI군에서 위약군보다 2% 이상 높은 빈도로 발생한 이상반응을 보여줍니다.
| XTANDI (N = 572) |
위약 (N = 574) |
|||
|---|---|---|---|---|
| 1-4등급* (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
대사 및 영양 장애 |
||||
|
식욕 감퇴 |
4.9 |
0.2 |
2.6 |
0 |
|
신경계 장애 |
||||
|
인지 및 기억 장애† |
4.5 |
0.7 |
2.1 |
0 |
|
하지불안증후군 |
2.4 |
0 |
0.3 |
0 |
|
혈관 장애 |
||||
|
안면홍조 |
27 |
0.3 |
22 |
0 |
|
고혈압(Hypertension) |
8 |
3.3 |
6 |
1.7 |
|
전신 장애 및 투여 부위 이상(General Disorders and Administration Site Conditions) |
||||
|
쇠약 상태(Asthenic conditions)‡ |
24 |
1.7 |
20 |
1.6 |
|
근골격계 및 결합 조직 장애(Musculoskeletal and Connective Tissue Disorders) |
||||
|
근골격계 통증(Musculoskeletal Pain) |
6 |
0.2 |
4 |
0.2 |
|
손상, 중독 및 시술 합병증(Injury, Poisoning and Procedural Complications) |
||||
|
골절(Fractures)§ |
6 |
1.0 |
4.2 |
1 |
EMBARK: 고위험 BCR을 가진 비전이성 CSPC 환자에서 XTANDI 대 위약
EMBARK에는 고위험 BCR을 가진 1068명의 환자가 등록되었으며, 그중 1061명의 환자가 최소 1회의 연구 약물을 투여받았습니다. 환자들은 루프롤리드와 병용하여 1일 1회 160mg 용량의 XTANDI(N = 353), 공개 라벨 단독 요법으로 1일 1회 160mg 용량의 XTANDI(N = 354), 또는 루프롤리드와 병용하여 위약(N = 354)을 투여받았습니다. 36주차에 PSA 값이 검출되지 않은(<0.2 ng/mL) 환자의 경우 37주차에 치료가 중단되었습니다. 이전에 전립선 절제술을 받은 환자의 경우 PSA 값이 ≥2.0 ng/mL로 증가했을 때, 전립선 절제술을 받지 않은 환자의 경우 PSA 값이 ≥5.0 ng/mL로 증가했을 때 치료가 재개되었습니다. 36주차에 PSA 값이 검출 가능한(≥0.2 ng/mL) 환자의 경우 영구적인 치료 중단 기준이 충족될 때까지 치료가 중단 없이 계속되었습니다.
표 6은 세 가지 치료군의 총 치료 기간을 보여줍니다.
| XTANDI + Leuprolide (N = 353) |
Placebo + Leuprolide (N = 354) |
XTANDI
(N = 354) |
|
|---|---|---|---|
|
|||
|
총 치료 기간* |
|||
|
중앙값, 개월 |
60.6 |
55.6 |
60.4 |
|
범위, 개월 |
0.1 – 90.4 |
0.7 – 94.1 |
0.4 – 95.0 |
|
약물 치료 기간 |
|||
|
중앙값, 개월 |
32.4 |
35.4 |
45.9 |
|
범위, 개월 |
0.1 – 83.4 |
0.7 – 85.7 |
0.4 – 88.9 |
|
약물 치료 중단 기간 |
|||
|
중앙값, 개월 |
20.2 |
16.8 |
11.1 |
|
범위, 개월 |
5.7 – 87.9 |
3.4 – 83.0 |
2.3 – 84.9 |
|
37주차에 약물 치료가 중단된 환자 |
|||
|
환자 수 (%) |
321 (90.9) |
240 (67.8) |
304 (85.9) |
전체 치료 기간 동안 이상반응으로 인한 사망은 XTANDI와 루프롤리드 병용 투여군에서 6명(1.7%), XTANDI 단독 투여군에서 8명(2.3%), 위약과 루프롤리드 병용 투여군에서 3명(0.8%)에서 발생했습니다. XTANDI와 루프롤리드 병용 투여군에서 2명 이상 사망 원인은 감염(n=2)이었고, XTANDI 단독 투여군에서 2명 이상 사망 원인은 동맥 혈전색전증(n=2)이었습니다.
전체 치료 기간 동안 3등급 이상의 이상반응은 XTANDI와 루프롤리드 병용 투여군의 46%, XTANDI 단독 투여군의 50%, 위약과 루프롤리드 병용 투여군의 43%에서 보고되었습니다. 전체 치료 기간 동안 이상반응으로 인한 영구적인 치료 중단은 XTANDI와 루프롤리드 병용 투여군의 21%, XTANDI 단독 투여군의 18%, 위약과 루프롤리드 병용 투여군의 10%에서 보고되었습니다. 영구적인 치료 중단을 초래한 가장 흔한 이상반응에는 피로(XTANDI와 루프롤리드 병용 투여군의 3.4%, XTANDI 단독 투여군의 3.7%, 위약과 루프롤리드 병용 투여군의 1.4%), 안면홍조(XTANDI와 루프롤리드 병용 투여군의 2%, XTANDI 단독 투여군의 0%, 위약과 루프롤리드 병용 투여군의 1.1%), 메스꺼움(XTANDI와 루프롤리드 병용 투여군의 1.1%, XTANDI 단독 투여군의 0.6%, 위약과 루프롤리드 병용 투여군의 0.3%), 인지 장애(XTANDI와 루프롤리드 병용 투여군의 1.1%, XTANDI 단독 투여군의 1.4%, 위약과 루프롤리드 병용 투여군의 0.8%)가 포함되었습니다.
이상반응으로 인한 용량 감량은 XTANDI와 루프롤리드 병용 투여군의 7%, XTANDI 단독 투여군의 16%, 위약과 루프롤리드 병용 투여군의 4.5%에서 발생했습니다. 피로는 XTANDI와 루프롤리드 병용 투여군의 3.1%, XTANDI 단독 투여군의 10%, 위약과 루프롤리드 병용 투여군의 1.7%에서 용량 감량이 필요한 가장 잦은 이상반응이었습니다.
표 7은 EMBARK에서 보고된 이상반응 중 XTANDI 투여군에서 위약군보다 5%(1-4등급) 이상 또는 2%(3-4등급) 이상 높은 빈도로 발생한 이상반응을 보여줍니다.
| XTANDI + Leuprolide (N = 353) |
Placebo + Leuprolide (N = 354) |
XTANDI
(N = 354) |
||||
|---|---|---|---|---|---|---|
| Grade 1-4* (%) |
Grade 3-4 (%) |
Grade 1-4 (%) |
Grade 3‑4 (%) |
Grade 1-4 (%) |
Grade 3-4 (%) |
|
|
신경계 장애 |
||||||
|
인지 장애† |
10 |
0.3 |
4.8 |
0.6 |
10 |
0.3 |
|
실신 |
4.8 |
4.2 |
2.3 |
1.7 |
2.5 |
2 |
|
혈관 장애 |
||||||
|
홍조 |
69 |
0.6 |
57 |
0.8 |
22 |
0.3 |
|
출혈† |
20 |
3.4 |
15 |
1.7 |
21 |
3.7 |
|
위장 장애 |
||||||
|
설사† |
15 |
0.6 |
9 |
0.8 |
14 |
0.3 |
|
메스꺼움 |
12 |
0.3 |
8 |
0.3 |
15 |
0.6 |
|
검사 |
||||||
|
체중 감소 |
7 |
0.3 |
3.4 |
0 |
11 |
0.3 |
|
전신 장애 및 투여 부위 이상 |
||||||
|
피로† |
50 |
4 |
38 |
1.7 |
54 |
4.8 |
|
근골격계 및 결합 조직 장애 |
||||||
|
근골격계 통증† |
50 |
4.8 |
43 |
2.3 |
48 |
3.1 |
|
골관절염 |
6 |
2.8 |
4.2 |
0.6 |
5 |
0.6 |
|
손상, 중독 및 시술 합병증 |
||||||
|
낙상 |
21 |
1.1 |
14 |
1.1 |
16 |
2 |
|
골절† |
18 |
4 |
13 |
2.5 |
11 |
2 |
|
생식계 및 유방 질환 |
||||||
|
여성형 유방† |
9 |
0 |
10 |
0 |
49 |
0.8 |
|
유방 압통† |
5 |
0 |
2.8 |
0 |
35 |
0 |
|
심장 질환 |
||||||
|
허혈성 심장 질환† |
5 |
4 |
6 |
3.1 |
9 |
6 |
임상적으로 관련 있는 이상반응 중 표 7에 포함 기준을 충족하지 못한 이상반응에는 고혈압(XTANDI + 루프롤리드, 25%; XTANDI 단독요법, 21%), 혈관부종(XTANDI + 루프롤리드, 2.5%; XTANDI 단독요법, 2%), 발작(XTANDI + 루프롤리드, 1.1%; XTANDI 단독요법, 0.8%)이 포함됩니다.
검사 이상
표 8은 무작위 배정, 위약 대조, 통합 연구에서 위약군에 비해 XTANDI군에서 ≥ 5%의 환자에게서 발생하고 더 자주 (> 2%) 발생한 검사 이상을 보여줍니다.
| XTANDI (N = 3526) |
Placebo (N = 2636) |
|||
|---|---|---|---|---|
| Grade 1-4 (%) |
Grade 3-4 (%) |
Grade 1-4 (%) |
Grade 3-4 (%) |
|
|
혈액학 |
||||
|
헤모글로빈 감소 |
50 |
1.8 |
47 |
1.5 |
|
호중구 감소 |
20 |
1 |
17 |
0.5 |
|
백혈구 감소 |
18 |
0.5 |
11 |
0.2 |
|
화학 |
||||
|
고혈당증 |
86 |
3.7 |
78 |
4.3 |
|
고마그네슘혈증 |
17 |
0.1 |
14 |
0.3 |
|
저나트륨혈증 |
14 |
1.6 |
9 |
1.4 |
|
저인산혈증 |
10 |
1.4 |
7 |
0.8 |
|
고칼슘혈증 |
8 |
0.1 |
5 |
0.1 |
고혈압(Hypertension)
5건의 무작위 위약 대조 임상 시험에서 얻은 통합 데이터에서, XTANDI를 투여받은 환자의 14%와 위약을 투여받은 환자의 7%에서 고혈압이 보고되었습니다. 고혈압 병력은 각 군에서 균형을 이루었습니다. 고혈압으로 인해 각 군에서 < 1%의 환자가 연구를 중단했습니다.
6.2 시판 후 경험(Post-Marketing Experience)
XTANDI 시판 후 사용 중 다음과 같은 추가 이상반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 발생 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
위장 장애(Gastrointestinal Disorders): 구토, 연하곤란(XTANDI 제품 크기와 관련된 질식 포함)
면역 체계 장애(Immune System Disorders): 과민증(얼굴, 혀, 입술 또는 인두의 부종)
신경계 장애(Neurological Disorders): PRES(posterior reversible encephalopathy syndrome), 미각 이상(dysgeusia)
피부 및 피하 조직 장애(Skin and Subcutaneous Tissue Disorders): 발진, 중증 피부 이상반응(Stevens-Johnson 증후군(SJS), 다형 홍반, 독성 표피 괴사(TEN), 약물 반응 동반 호산구증가 및 전신 증상(DRESS), 급성 전신성 발진성 농포증(AGEP) 포함)
7 약물 상호 작용
7.1 다른 약물이 XTANDI에 미치는 영향
강력한 CYP2C8 억제제
XTANDI와 젬피브로질(강력한 CYP2C8 억제제)을 병용 투여하면 엔잘루타마이드와 N-데스메틸 엔잘루타마이드의 혈장 농도가 증가하여 XTANDI의 유해 반응 발생률과 중증도가 증가할 수 있습니다. 강력한 CYP2C8 억제제와 XTANDI의 병용 투여는 피하십시오. 강력한 CYP2C8 억제제와 XTANDI의 병용 투여를 피할 수 없는 경우, XTANDI의 용량을 줄이십시오 [용법 및 용량 (2.3), 임상 약리학 (12.3) 참조].
강력한 CYP3A4 유도제
XTANDI와 리팜핀(강력한 CYP3A4 유도제이자 중등도 CYP2C8 유도제)을 병용 투여하면 엔잘루타마이드와 N-데스메틸 엔잘루타마이드의 혈장 농도가 감소하여 XTANDI의 효능이 감소할 수 있습니다. 강력한 CYP3A4 유도제와 XTANDI의 병용 투여는 피하십시오. 강력한 CYP3A4 유도제와 XTANDI의 병용 투여를 피할 수 없는 경우, XTANDI의 용량을 늘리십시오 [용법 및 용량 (2.3), 임상 약리학 (12.3) 참조].
7.2 XTANDI가 다른 약물에 미치는 영향
특정 CYP3A4, CYP2C9 또는 CYP2C19 기질
XTANDI는 강력한 CYP3A4 유도제이자 중등도 CYP2C9 및 CYP2C19 유도제입니다. XTANDI를 병용 투여하면 특정 CYP3A4, CYP2C9 또는 CYP2C19 기질의 농도가 감소합니다 [임상 약리학 (12.3) 참조]. 이로 인해 해당 기질의 효능이 감소할 수 있습니다. 농도의 최소 감소가 기질의 치료 실패로 이어질 수 있는 특정 CYP3A4, CYP2C9 또는 CYP2C19 기질과 XTANDI의 병용 투여는 피하십시오. 병용 투여를 피할 수 없는 경우, 처방 정보에 따라 해당 기질의 용량을 늘리십시오. 활성 대사체가 생성되는 경우 활성 대사체에 대한 노출이 증가할 수 있습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
XTANDI의 여성에 대한 안전성 및 유효성은 확립되지 않았습니다. 동물 생식 연구 및 작용 기전에 근거하여, XTANDI는 태아에게 해를 끼치고 임신 손실을 유발할 수 있습니다. 임신한 여성에서 XTANDI 사용에 대한 인체 데이터는 없습니다. 동물 생식 연구에서, 기관 형성 중 임신한 생쥐에게 엔잘루타마이드를 경구 투여하면 최대 권장 인체 용량보다 낮은 용량에서 유해한 발달 효과가 나타났습니다 (자료 참조).
자료
동물 자료
생쥐의 배아-태아 발달 독성 연구에서, 엔잘루타마이드는 기관 형성 기간(임신 6-15일) 동안 10 또는 30 mg/kg/일의 경구 용량으로 투여했을 때 발달 독성을 유발했습니다. 그 결과에는 배아-태아 치사율(착상 후 손실 및 흡수 증가) 및 ≥ 10 mg/kg/일에서 항문-생식기 거리 감소, 그리고 30 mg/kg/일에서 구개열 및 구개골 결손이 포함되었습니다. 30 mg/kg/일의 용량은 모체 독성을 유발했습니다. 생쥐에서 시험한 용량(1, 10 및 30 mg/kg/일)은 환자의 노출량에 대해 각각 약 0.04, 0.4 및 1.1배의 전신 노출량(AUC)을 나타냈습니다. 엔잘루타마이드는 토끼에서 기관 형성 기간(임신 6-18일) 동안 최대 10 mg/kg/일의 용량 수준으로 투여했을 때 발달 독성을 유발하지 않았습니다(AUC 기준 환자의 노출량의 약 0.4배).
임신 14일에 단일 경구 30 mg/kg 엔잘루타마이드를 투여한 임신 랫트의 약동학 연구에서, 엔잘루타마이드 및/또는 그 대사산물은 태아에 존재했으며, Cmax는 모체 혈장에서 발견된 농도의 약 0.3배였고 투여 후 4시간에 발생했습니다.
8.2 수유부
위험 요약
XTANDI의 여성에 대한 안전성 및 유효성은 확립되지 않았습니다. 모유 내 XTANDI의 존재, 수유아에 대한 약물의 영향 또는 모유 생산에 대한 약물의 영향에 대한 정보는 없습니다. 엔잘루타마이드 및/또는 그 대사산물은 수유 랫트의 모유에 존재했습니다 (자료 참조).
자료
출산 후 14일에 단일 경구 투여 후, 엔잘루타마이드 및/또는 그 대사산물은 모유에 존재했으며, Cmax는 혈장 농도보다 4배 높았고 투여 후 4시간에 발생했습니다.
8.3 생식 잠재력이 있는 여성 및 남성
피임
남성
동물 생식 연구 결과에 근거하여, 생식 잠재력이 있는 여성 파트너가 있는 남성 환자에게는 XTANDI 치료 중 및 마지막 투여 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 (8.1) 참조].
불임
남성
동물 연구에 근거하여, XTANDI는 생식 잠재력이 있는 남성의 생식능력을 손상시킬 수 있습니다 [비임상 독성학 (13.1) 참조].
8.5 노인 사용
8건의 무작위 대조 임상 시험에서 XTANDI를 투여받은 5110명의 환자 중 78%가 65세 이상이었고, 33%는 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 안전성 또는 유효성에 전반적인 차이가 관찰되지 않았습니다. 다른 보고된 임상 경험에서 노인과 젊은 환자 사이의 반응에 차이가 확인되지 않았지만, 일부 노인의 민감도가 더 높을 가능성을 배제할 수는 없습니다.
8.6 신장 장애
경증에서 중등도 신장 장애(크레아티닌 청소율 [CLcr] ≥ 30 mL/min) 환자에게는 용량 조절이 권장되지 않습니다. XTANDI는 중증 신장 장애(CLcr < 30 mL/min) 또는 말기 신부전 환자에서 연구되지 않았습니다 [임상 약리학 (12.3) 참조].
10 과다 복용
과다 복용 시, XTANDI 치료를 중단하고 5.8일의 반감기를 고려하여 일반적인 지지 요법을 시작하십시오. 용량 증량 연구에서, 1일 < 240mg에서는 발작이 보고되지 않았지만, 360mg, 480mg, 600mg 1일 복용 시 각각 1건씩 총 3건의 발작이 보고되었습니다. 과다 복용 후 환자는 발작 위험이 증가할 수 있습니다.
11 설명
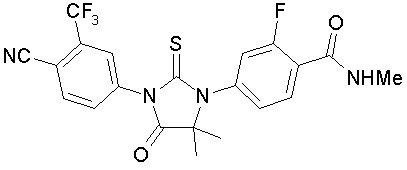
엔잘루타마이드는 안드로겐 수용체 억제제입니다. 화학명은 4-{3-[4-cyano-3-(trifluoromethyl)phenyl]-5,5-dimethyl-4-oxo-2-sulfanylideneimidazolidin-1-yl}-2-fluoro-N-methylbenzamide입니다.
분자량은 464.44이며, 분자식은 C21H16F4N4O2S입니다. 구조식은 다음과 같습니다:
엔잘루타마이드는 백색의 결정성 비흡습성 고체입니다. 물에 거의 녹지 않습니다.
XTANDI는 경구 투여용 액상 충전 연질 젤라틴 캡슐로 제공됩니다. 각 캡슐에는 카프릴로카프로일 폴리옥시글리세라이드 용액 형태로 엔잘루타마이드 40mg이 함유되어 있습니다. 부형제는 카프릴로카프로일 폴리옥시글리세라이드, 부틸화 히드록시아니솔, 부틸화 히드록시톨루엔, 젤라틴, 소르비톨 소르비탄 용액, 글리세린, 정제수, 이산화티타늄 및 흑색 산화철입니다.
XTANDI는 경구 투여용 필름 코팅 정제로도 제공됩니다. 각 정제에는 엔잘루타마이드 40mg 또는 80mg이 함유되어 있습니다. 부형제는 히프로멜로스 아세테이트 석시네이트, 미결정 셀룰로오스, 콜로이드성 이산화규소, 크로스카멜로오스나트륨 및 스테아린산마그네슘입니다. 정제 필름 코팅에는 히프로멜로스, 활석, 폴리에틸렌글리콜, 이산화티타늄 및 산화철이 포함되어 있습니다.
12 약물동력학
12.1 작용 기전
Enzalutamide는 안드로겐 수용체 신호 전달 경로의 여러 단계에 작용하는 안드로겐 수용체 억제제입니다. Enzalutamide는 안드로겐 수용체에 대한 안드로겐 결합을 경쟁적으로 억제하는 것으로 나타났으며, 결과적으로 안드로겐 수용체의 핵 이동 및 DNA와의 상호 작용을 억제합니다. 주요 대사체인 N-desmethyl enzalutamide는 Enzalutamide와 유사한 in vitro 활성을 나타냈습니다. Enzalutamide는 in vitro에서 전립선암 세포의 증식을 감소시키고 세포 사멸을 유도했으며, 마우스 전립선암 이종 이식 모델에서 종양 부피를 감소시켰습니다.
12.2 약력학
ADT에 추가하여 1일 160mg Enzalutamide를 투여하면 mCSPC 환자의 68%(ARCHES)에서 PSA 수치가 검출되지 않는 수준(< 0.2 ng/mL)으로 감소했습니다.
1일 160mg Enzalutamide를 1회 투여한 후 AFFIRM의 효능 결과를 바탕으로 전체 생존율의 효능 종점에 대한 노출-반응 관계를 확인할 수 없었습니다. 또한, 160mg/일의 제한된 노출 범위 내에서 부작용(예: 피로, 홍조, 두통 또는 고혈압)에 대한 임상적으로 의미 있는 노출-반응 관계는 없었습니다.
심장 전기 생리학
권장 용량으로 XTANDI는 QT 간격을 크게(즉, > 20msec) 증가시키지 않습니다.
12.3 약동학
Enzalutamide는 28일에 정상 상태에 도달하며, 단회 투여량에 비해 AUC가 약 8.3배 축적됩니다. 정상 상태에서 Enzalutamide와 N-desmethyl Enzalutamide의 평균(%CV) 최고 농도(Cmax)는 각각 16.6 µg/mL(23%) 및 12.7 µg/mL(30%)이고, 평균(%CV) 최저 농도(Cmin)는 각각 11.4 µg/mL(26%) 및 13.0 µg/mL(30%)입니다.
Enzalutamide는 30mg(승인된 권장 용량의 0.2배)에서 360mg(승인된 권장 용량의 2.25배)의 일일 용량 범위에서 약물 용량에 비례하는 약동학을 나타냈습니다.
흡수
캡슐의 160mg 단회 투여 후 중앙값 Tmax는 1시간(0.5~3시간)이고, 정제의 160mg 단회 투여 후에는 2시간(0.5~6시간)입니다.
음식의 영향
고지방 식사(단백질 약 150칼로리, 탄수화물 250칼로리, 지방 500~600칼로리)와 함께 XTANDI를 투여한 후 Enzalutamide 또는 N-desmethyl Enzalutamide의 약동학에 임상적으로 의미 있는 영향은 없었습니다.
분포
단회 경구 투여 후 평균(%CV) 분포 용적은 110L(29%)입니다.
Enzalutamide는 97~98%가 주로 알부민에 결합된 혈장 단백질에 결합합니다. N-desmethyl Enzalutamide는 95%가 혈장 단백질에 결합합니다.
배설
Enzalutamide는 주로 간 대사에 의해 배설됩니다.
단회 투여 후 Enzalutamide의 평균 외관상 청소율(CL/F)은 0.56 L/h(0.33~1.02 L/h)입니다. 단회 경구 투여 후 Enzalutamide의 평균 최종 반감기(t1/2)는 5.8일(2.8~10.2일)입니다. N-desmethyl Enzalutamide의 평균 최종 t1/2는 약 7.8~8.6일입니다.
대사
Enzalutamide는 CYP2C8 및 CYP3A4에 의해 대사됩니다. CYP2C8은 주로 활성 대사체(N-desmethyl Enzalutamide) 형성을 담당합니다. 카르복실에스테라아제 1은 N-desmethyl Enzalutamide와 Enzalutamide를 비활성 카르복실산 대사체로 대사합니다.
특정 집단
연령(41~92세), 인종(백인, 중국인 및 일본인), 체중(46kg~163kg), 경도에서 중등도 신장 장애(CLcr ≥ 30 mL/min) 및 간 장애(Child-Pugh A, B 및 C)에 따라 Enzalutamide의 약동학에 임상적으로 의미 있는 차이는 관찰되지 않았습니다. 중증 신장 장애 및 말기 신장 질환(CLcr < 30 mL/min)은 연구되지 않았습니다.
약물 상호작용 연구
임상 연구
CYP2C8 억제제가 XTANDI에 미치는 영향: 160mg XTANDI와 gemfibrozil(강력한 CYP2C8 억제제)을 병용 투여하면 Enzalutamide와 N-desmethyl Enzalutamide의 AUC가 2.2배 증가하고 Cmax에는 최소한의 영향을 미쳤습니다.
CYP3A4 및 CYP2C8 유도제가 XTANDI에 미치는 영향: 여러 차례 경구 투여한 rifampin(강력한 CYP3A4 및 중등도 CYP2C8 유도제) 후 160mg XTANDI를 병용 투여하면 Enzalutamide와 N-desmethyl Enzalutamide의 AUC가 37% 감소하고 Cmax에는 영향을 미치지 않았습니다.
CYP3A4 억제제가 XTANDI에 미치는 영향: 여러 차례 경구 투여한 itraconazole(강력한 CYP3A4 억제제) 후 160mg XTANDI를 병용 투여하면 Enzalutamide와 N-desmethyl Enzalutamide의 AUC가 1.3배 증가하고 Cmax에는 영향을 미치지 않았습니다.
XTANDI가 다른 약물에 미치는 영향:
1일 1회 경구로 160mg XTANDI를 midazolam(민감한 CYP3A4 기질)과 병용 투여하면 midazolam의 AUC가 86%, Cmax가 77% 감소했습니다.
1일 1회 경구로 160mg XTANDI를 warfarin(민감한 CYP2C9 기질)과 병용 투여하면 S-warfarin의 AUC가 56%, Cmax가 17% 감소했습니다.
1일 1회 경구로 160mg XTANDI를 omeprazole(민감한 CYP2C19 기질)과 병용 투여하면 omeprazole의 AUC가 72%, Cmax가 62% 감소했습니다.
1일 1회 경구로 160mg XTANDI를 digoxin(P-glycoprotein 기질)과 병용 투여하면 digoxin의 AUC가 33%, Cmax가 17% 증가했습니다.
pioglitazone(민감한 CYP2C8 기질), caffeine(민감한 CYP1A2 기질), dextromethorphan(민감한 CYP2D6 기질) 또는 rosuvastatin(BCRP 기질)의 노출량에 임상적으로 의미 있는 변화는 관찰되지 않았습니다.
시험관내 연구
시토크롬 P450(CYP) 효소: Enzalutamide는 임상적으로 달성 가능한 농도에서 CYP2B6을 유도합니다.
수송체 시스템: Enzalutamide, N-desmethyl Enzalutamide 및 주요 비활성 카르복실산 대사체는 P-glycoprotein 또는 BCRP의 기질이 아닙니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
수컷 및 암컷 랫드를 대상으로 경구 enzalutamide 투여량 10, 30, 및 100 mg/kg/day로 2년간 발암성 연구를 실시했습니다. Enzalutamide는 모든 시험 용량 수준(AUC 기준 인체 노출량의 ≥ 0.3배)에서 고환의 양성 Leydig 세포 종양 발생률을 증가시켰으며, 100 mg/kg/day(AUC 기준 인체 노출량의 1.4배)의 용량으로 수컷 랫드의 요로 상피 유두종 및 암의 발생률을 증가시켰습니다. 고환에서 나타난 결과는 enzalutamide의 약리 작용과 관련이 있는 것으로 간주됩니다. 랫드는 고환의 간질 세포 종양 발생에 있어 사람보다 더 민감한 것으로 간주됩니다. 26주 동안 매일 경구적으로 enzalutamide를 투여한 수컷 및 암컷 rasH2 형질전환 마우스에서는 최대 20 mg/kg/day의 용량에서도 신생물 발생률이 증가하지 않았습니다.
Enzalutamide는 박테리아 역돌연변이(Ames) 분석에서 돌연변이를 유도하지 않았으며, in vitro 마우스 림프종 티미딘 키나아제(Tk) 유전자 돌연변이 분석 또는 in vivo 마우스 소핵 분석에서도 유전독성을 나타내지 않았습니다.
Enzalutamide의 약리 작용과 일치하는 반복 투여 독성 연구의 비임상적 결과를 바탕으로, XTANDI 치료로 인해 수컷의 생식능력이 저하될 수 있습니다. 랫드를 대상으로 한 26주 연구에서, 30 mg/kg/day 이상(AUC 기준 인체 노출량과 동일)의 용량에서 전립선 및 정낭의 위축이 관찰되었습니다. 개를 대상으로 한 4주, 13주 및 39주 연구에서, 4 mg/kg/day 이상(AUC 기준 인체 노출량의 0.3배)의 용량에서 정자 생성 저하 및 전립선과 부고환의 위축이 관찰되었습니다.
14 CLINICAL STUDIES
XTANDI의 효능은 CRPC 환자 (N = 4692), mCSPC 환자 (N = 1150), 또는 고위험 BCR을 가진 nmCSPC 환자 (N = 1068)를 대상으로 한 6건의 무작위 배정 다기관 임상 시험에서 입증되었습니다. 별도로 명시되지 않는 한, 환자들은 GnRH 치료를 병용하거나 이전에 양측 고환절제술을 받았습니다.
AFFIRM (NCT00974311): 화학요법 후 전이성 CRPC에 대한 XTANDI 대 플라시보
AFFIRM 연구에서는 이전에 도세탁셀 기반 화학요법을 받은 총 1199명의 환자를 2:1의 비율로 무작위 배정하여 XTANDI를 1일 1회 160mg 경구 투여 (N = 800) 또는 플라시보를 1일 1회 경구 투여 (N = 399) 받도록 하였습니다. 질병 진행 (방사선학적 진행, 골 관련 사건 또는 임상적 진행 증거), 새로운 전신 항암 치료 시작, 용인할 수 없는 독성 또는 연구 중단 시까지 연구 치료를 계속했습니다. 이전에 발작 병력이 있거나, 발작 역치를 낮추는 것으로 알려진 약물을 복용하거나, 발작 위험 요인이 있는 환자는 연구 대상에서 제외되었습니다 [경고 및 주의사항 (5.1) 참조].
다음 환자 인구통계학적 특징 및 기저 질환 특징은 치료군 간에 균형을 이루었습니다. 중앙값 연령은 69세 (범위 41-92세)였으며, 인종 분포는 백인 92.7%, 흑인 3.9%, 아시아인 1.1%, 기타 2.1%였습니다. 환자의 92%는 ECOG 수행 상태 점수가 0-1이었고, 28%는 평균 간략한 통증 설문지 점수가 ≥ 4였습니다. 환자의 91%는 골 전이가 있었고, 23%는 폐 및/또는 간에 내장 전이가 있었습니다. 환자의 59%는 연구 시작 시 질병 진행의 방사선학적 증거가 있었고, 41%는 PSA만 진행되었습니다. 모든 환자는 이전에 도세탁셀 기반 치료를 받았고, 24%는 두 가지 세포독성 화학요법 요법을 받았습니다. 연구 기간 동안 XTANDI 투여군 환자의 48%와 플라시보 투여군 환자의 46%가 글루코코르티코이드를 투여받았습니다.
XTANDI 투여군 환자 520명과 플라시보 투여군 환자를 비교한 사전 지정된 중간 분석 시점에서 전체 생존율의 통계적으로 유의미한 개선이 입증되었습니다 (표 9 및 그림 1).
| NR = 미달성. | ||
|
XTANDI (N = 800) |
플라시보 (N = 399) |
|
|
사망자 수 (%) |
308 (38.5) |
212 (53.1) |
|
중앙 생존 기간, 개월 (95% CI) |
18.4 (17.3, NR) |
13.6 (11.3, 15.8) |
|
P 값* |
p < 0.0001 |
|
|
위험비 (95% CI)† |
0.63 (0.53, 0.75) |
|
PREVAIL (NCT01212991): 화학요법을 시행받지 않은 전이성 CRPC 환자에서 XTANDI 대비 위약
PREVAIL 연구에서는 화학요법을 시행받지 않은 1717명의 환자를 1:1로 무작위 배정하여 XTANDI를 1일 1회 160mg 경구 투여(N = 872) 또는 위약을 1일 1회 경구 투여(N = 845) 받도록 하였습니다. 내장 전이가 있는 환자, 경증에서 중등도 심부전(NYHA class I 또는 II)의 병력이 있는 환자, 발작 역치를 낮추는 것과 관련된 약물을 복용하는 환자는 허용되었습니다. 이전에 발작 병력이 있거나 발작을 유발할 수 있는 질환이 있는 환자 및 전립선암으로 인한 중등도 또는 중증 통증이 있는 환자는 제외되었습니다. 질병 진행(방사선학적 진행 증거, 골격 관련 사건 또는 임상적 진행) 및 세포독성 화학요법 또는 연구 약물의 시작, 용인할 수 없는 독성 또는 중단까지 연구 치료가 계속되었습니다. 전체 생존율과 방사선학적 무진행 생존율(rPFS)을 평가했습니다. 방사선학적 진행은 순차적 영상을 사용하여 평가되었으며, 확인된 2개 이상의 새로운 골 병변의 골 스캔 확인(전립선암 임상 시험 작업 그룹 2 기준) 및/또는 고형 종양의 반응 평가 기준(RECIST v 1.1)에 따른 연조직 병변 진행 기준으로 정의되었습니다. rPFS의 주요 분석에는 중앙에서 검토한 진행의 방사선학적 평가를 사용했습니다.
환자 인구통계학적 특징과 기저 질환 특징은 연구 시작 시 치료군 간에 균형을 이루었습니다. 중앙값 연령은 71세(범위 42-93세)였으며, 인종 분포는 백인 77%, 아시아인 10%, 흑인 2%, 기타 11%였습니다. ECOG 수행 상태 점수는 환자의 68%가 0이었고 32%가 1이었습니다. 간략한 통증 설문지 단축형(연구 시작 시 지난 24시간 동안 최악의 통증)에 따라 기저 통증 평가는 환자의 67%가 0-1(무증상)이었고 32%가 2-3(경증 증상)이었습니다. 환자의 54%가 질병 진행의 방사선학적 증거를 보였고 43%가 PSA만 진행되었습니다. 환자의 12%가 내장(폐 및/또는 간) 질환에 연루되었습니다. 연구 기간 동안 XTANDI 군 환자의 27%와 위약 군 환자의 30%가 다양한 이유로 글루코코르티코이드를 투여받았습니다.
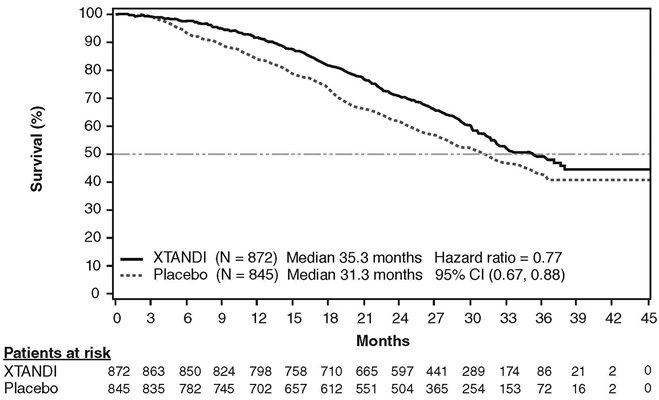
540명의 사망 후 실시된 사전 지정된 중간 분석에서 XTANDI로 치료받은 환자는 위약으로 치료받은 환자에 비해 전체 생존율이 통계적으로 유의하게 향상되었습니다(표 10). XTANDI 치료 환자의 40%와 위약 치료 환자의 70%가 전체 생존율을 연장할 수 있는 전이성 CRPC에 대한 후속 치료를 받았습니다. 784명의 사망이 관찰되었을 때 업데이트된 생존율 분석이 실시되었습니다. 중앙 추적 관찰 기간은 31개월이었습니다. 이 분석의 결과는 사전 지정된 중간 분석의 결과와 일치했습니다(표 10, 그림 2). 업데이트된 분석에서 XTANDI 치료 환자의 52%와 위약 치료 환자의 81%가 전이성 CRPC에서 전체 생존율을 연장할 수 있는 후속 치료를 받았습니다. XTANDI는 XTANDI 치료 환자의 2%와 위약 치료 환자의 29%에서 후속 치료로 사용되었습니다.
| NR = 미달성. | ||
|
XTANDI (N = 872) |
위약 (N = 845) |
|
|
사전 지정된 중간 분석* |
||
|
사망자 수 (%) |
241 (28) |
299 (35) |
|
중앙 생존 기간, 개월 (95% CI) |
32.4 (30.1, NR) |
30.2 (28.0, NR) |
|
P 값† |
p < 0.0001 |
|
|
위험 비 (95% CI)‡ |
0.71 (0.60, 0.84) |
|
|
업데이트된 생존율 분석§ |
||
|
사망자 수 (%) |
368 (42) |
416 (49) |
|
중앙 생존 기간, 개월 (95% CI) |
35.3 (32.2, NR) |
31.3 (28.8, 34.2) |
|
위험비 (95% CI)‡ |
0.77 (0.67, 0.88) |
|
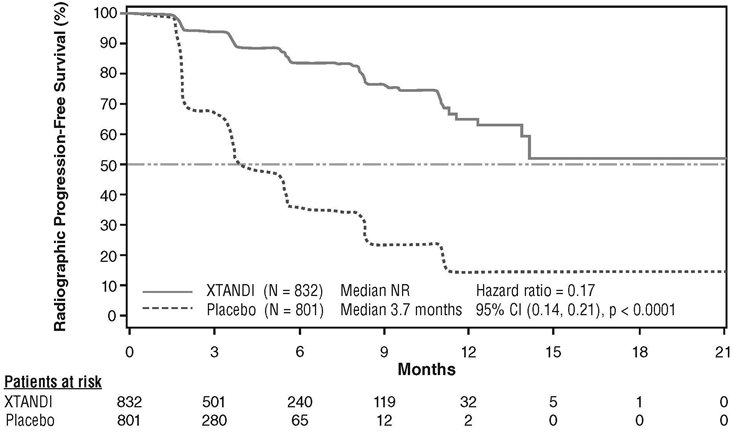
XTANDI로 치료받은 환자군에서 위약으로 치료받은 환자군에 비해 통계적으로 유의미한 rPFS 개선이 입증되었습니다 (표 11, 그림 3).
| NR = 미달성. 참고: rPFS 분석의 마감일 기준으로 1633명의 환자가 무작위 배정되었습니다. |
||
|
XTANDI (N = 832) |
위약 (N = 801) |
|
|
진행 또는 사망자 수 (%) |
118 (14) |
320 (40) |
|
중앙 rPFS (개월) (95% CI) |
NR (13.8, NR) |
3.7 (3.6, 4.6) |
|
P-값* |
p < 0.0001 |
|
|
위험비 (95% CI)† |
0.17 (0.14, 0.21) |
|
XTANDI 치료 후 세포독성 화학요법 시작까지의 시간이 연장되었으며, XTANDI 투여군 환자의 중앙값은 28.0개월이었고 위약 투여군 환자의 중앙값은 10.8개월이었습니다 [HR = 0.35 (95% CI: 0.30, 0.40), p < 0.0001].
XTANDI 투여군 환자의 첫 번째 골 관련 사건까지의 중앙값 시간은 31.1개월이었고 위약 투여군 환자의 중앙값 시간은 31.3개월이었습니다 [HR = 0.72 (95% CI: 0.61, 0.84), p < 0.0001]. 골 관련 사건은 전립선암에 대한 골 방사선 치료 또는 수술, 병적 골절, 척수 압박 또는 골 통증 치료를 위한 항암 치료 변경으로 정의되었습니다.
TERRAIN (NCT01288911): 화학요법을 시행받지 않은 전이성 CRPC 환자에서 XTANDI 대 비칼루타마이드
TERRAIN 연구는 화학요법을 시행받지 않은 375명의 환자를 대상으로 실시되었으며, 이들은 1:1로 무작위 배정되어 1일 1회 160mg의 XTANDI 경구 투여군 (N = 184) 또는 1일 1회 50mg의 비칼루타마이드 경구 투여군 (N = 191)에 배정되었습니다. 이전에 발작 병력이 있거나 발작을 유발할 수 있는 상태에 있는 환자와 전립선암으로 인한 중등도 또는 중증 통증이 있는 환자는 제외되었습니다. 환자는 이전에 비칼루타마이드를 투여받은 경험이 있을 수 있었지만, 이전 항안드로겐 요법 (예: 비칼루타마이드)으로 질병이 진행된 환자는 제외되었습니다. 연구 치료는 질병 진행 (방사선학적 진행 증거, 골 관련 사건), 후속 항암제 투여 시작, 허용할 수 없는 독성 또는 중단까지 계속되었습니다. 방사선학적 질병 진행은 전립선암 임상시험 연구 그룹 2 기준 및/또는 고형 종양에 대한 반응 평가 기준 (RECIST v 1.1) 기준을 사용하여 독립 중앙 검토 (ICR)에 의해 평가되었습니다. 방사선학적 무진행 생존율 (rPFS)은 무작위 배정부터 ICR에 의해 평가된 최초의 객관적인 방사선학적 진행 증거 또는 사망 시점까지의 시간으로 정의되었습니다 (어느 것이 먼저 발생하든).
환자 인구통계학적 특징과 기저 질환 특징은 연구 시작 시 치료군 간에 균형을 이루었습니다. 중앙값 연령은 71세 (범위 48-96세)였으며, 인종 분포는 백인 93%, 흑인 5%, 아시아인 1%, 기타 1%였습니다. ECOG 수행 상태 점수는 환자의 74%가 0점, 26%가 1점이었습니다. 기저 통증 평가는 간략한 통증 목록 단축 양식 질문 3 (연구 시작 시 지난 24시간 동안 최악의 통증)에 따라 환자의 58%가 0-1 (무증상), 36%가 2-3 (경증 증상)이었습니다. 연구 시작 시 환자의 98%가 질병 진행의 객관적인 증거를 보였습니다. 환자의 46%가 이전에 비칼루타마이드 치료를 받았지만, XTANDI 치료를 받은 환자는 없었습니다.
XTANDI 치료를 받은 환자는 비칼루타마이드 치료를 받은 환자에 비해 rPFS가 개선되었습니다 (표 12, 그림 4).
| XTANDI (N = 184) |
비칼루타마이드 (N = 191) |
|
|---|---|---|
| NR = 도달하지 않음. | ||
|
||
|
진행 또는 사망 수 (%) |
72 (39) |
74 (39) |
|
중앙값 rPFS (개월) (95% CI) |
19.5 (11.8, NR) |
13.4 (8.2, 16.4) |
|
위험비 (95% CI)* |
0.60 (0.43, 0.83) |
|
PROSPER (NCT02003924): 비전이성 CRPC에서 XTANDI 대 플라시보
PROSPER는 비전이성 CRPC 환자 1401명을 대상으로 하루 1회 160mg의 XTANDI 경구 투여군(N = 933)과 하루 1회 플라시보 경구 투여군(N = 468)으로 2:1의 비율로 무작위 배정했습니다. PROSPER 시험의 모든 환자는 성선자극호르몬 방출 호르몬(GnRH) 유사체를 투여받았거나 이전에 양측 고환절제술을 받았습니다. 환자는 전립선 특이 항원(PSA) 배가 시간(PSADT)과 골 표적 약물 사용에 따라 계층화되었습니다. 환자는 PSA 배가 시간 ≤ 10개월, PSA ≥ 2 ng/mL 및 맹검 독립 중앙 검토(BICR)에 의한 비전이성 질환 확인이 필요했습니다. PSA 결과는 맹검 처리되었으며 치료 중단에 사용되지 않았습니다. 어느 군에 무작위 배정된 환자든 BICR에 의해 확인된 방사선학적 질환 진행, 새로운 치료 시작, 용인할 수 없는 독성 또는 중단으로 인해 치료를 중단했습니다.
다음 환자 인구통계학적 특징과 기준 특징은 두 치료군 간에 균형을 이루었습니다. 무작위 배정 시 중앙값 연령은 74세(범위 50-95세)였으며 23%가 80세 이상이었습니다. 인종 분포는 백인 71%, 아시아인 16%, 흑인 2%였습니다. 대다수의 환자(77%)는 Gleason 점수가 7 이상이었습니다. 중앙값 PSADT는 3.7개월이었습니다. 환자의 54%는 수술 또는 방사선 치료를 포함한 전립선암에 대한 이전 치료를 받았습니다. 환자의 63%는 이전에 항안드로겐 치료를 받았으며, 56%는 비칼루타마이드를, 11%는 플루타마이드를 투여받았습니다. 모든 환자는 연구 참여 시 동부 협력 종양학 그룹 수행 상태(ECOG PS) 점수가 0 또는 1이었습니다.
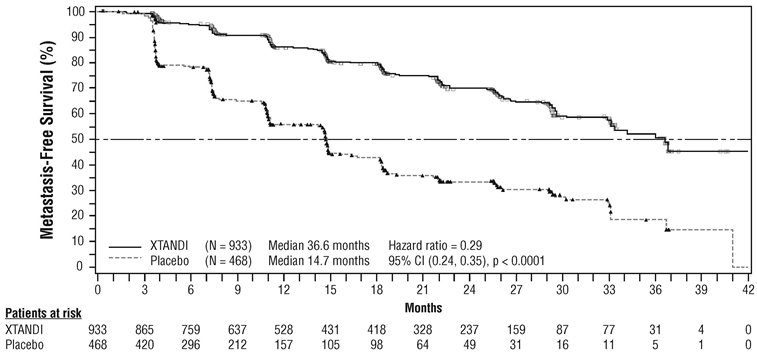
이 연구의 주요 유효성 결과는 전이 없는 생존율(MFS)이었으며, 이는 무작위 배정부터 다음 중 먼저 발생한 시점까지의 시간으로 정의됩니다. 1) BICR에 따른 국소 및/또는 원격 방사선학적 진행 또는 2) 방사선학적 진행 증거 없이 치료 중단 후 최대 112일까지의 사망. 플라시보를 투여받은 환자와 비교하여 XTANDI를 투여받은 환자에서 MFS 및 OS의 통계적으로 유의미한 개선이 입증되었습니다. 절단 날짜에 관계없이 원격 방사선학적 진행 사건 또는 사망만 고려할 때 일관된 MFS 결과가 관찰되었습니다. 또한 사전에 지정된 PSADT(< 6개월 또는 ≥ 6개월) 및 이전 골 표적 약물 사용(예 또는 아니오)의 계층화된 환자 하위 그룹에서도 일관된 MFS 결과가 관찰되었습니다. PROSPER의 유효성 결과는 표 13, 그림 5 및 그림 6에 요약되어 있습니다.
| NR = 도달하지 않음. | |||
|
XTANDI |
플라시보 |
||
|
전이 없는 생존율 |
|||
|
사건 수 (%) |
219 (23.5) |
228 (48.7) |
|
|
중앙값, 개월 (95% CI)* |
36.6 (33.1, NR) |
14.7 (14.2, 15.0) |
|
|
위험 비 (95% CI)† |
0.29 (0.24, 0.35) |
||
|
P 값† |
p < 0.0001 |
||
|
전체 생존율‡ |
|||
|
사건 수 (%) |
288 (30.9) |
178 (38.0) |
|
|
중앙값, 개월 (95% CI)* |
67.0 (64.0, NR) |
56.3 (54.4, 63.0) |
|
|
위험비 (95% CI)† |
0.73 (0.61, 0.88) |
|
|
P-값† |
p = 0.0011 |
|
주요 유효성 결과는 XTANDI군 환자에서 위약군 환자에 비해 새로운 항암 치료(TTA)의 첫 사용 시점이 통계적으로 유의하게 지연된 것으로 나타났습니다. XTANDI 투여 환자의 중앙값 TTA는 39.6개월이었고, 위약 투여 환자의 중앙값 TTA는 17.7개월이었습니다(HR = 0.21; 95% CI: [0.17, 0.26], p < 0.0001).
ARCHES (NCT02677896): 전이성 CSPC에서 XTANDI 대 위약
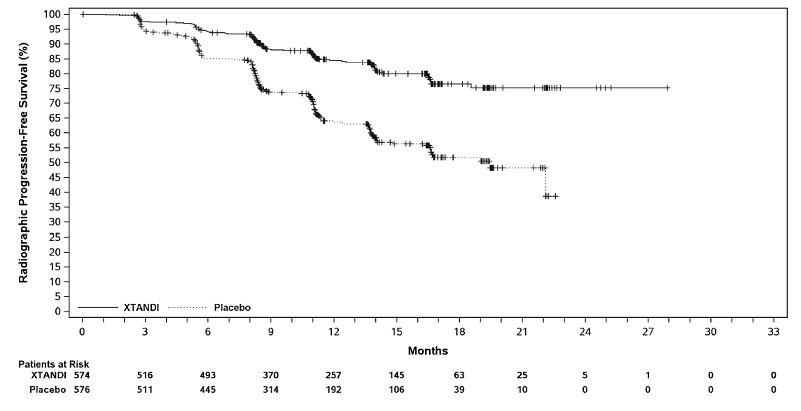
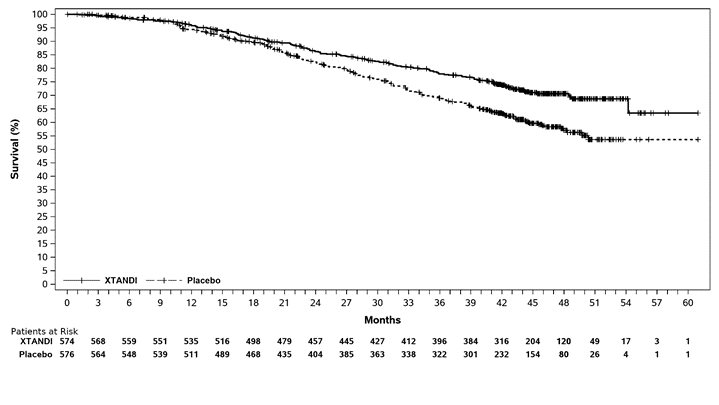
ARCHES 연구에는 전이성 CSPC 환자 1150명이 등록되었으며, 1:1로 무작위 배정되어 XTANDI 160mg을 1일 1회 경구 투여(N = 574)하거나 1일 1회 경구 위약을 투여(N = 576) 받았습니다. 시험에 참여한 모든 환자는 GnRH 유사체를 투여받았거나 이전에 양측 고환 절제술을 받았습니다. 환자는 질병 용적(저용량 대 고용량)과 전립선암에 대한 이전 도세탁셀 치료(이전 도세탁셀 없음, 1-5 사이클 또는 6 사이클)에 따라 계층화되었습니다. 고용량 질병은 내장을 침범하는 전이 또는 내장 병변이 없는 경우 척추와 골반뼈 이외의 뼈 구조에서 적어도 하나 이상의 4개 이상의 골 병변이 있는 것으로 정의됩니다. 동시 도세탁셀 치료는 허용되지 않았습니다. 환자는 방사선학적 질병 진행, 새로운 치료 시작, 용인할 수 없는 독성 또는 중단될 때까지 치료를 계속했습니다.
다음 환자 인구 통계 및 기준 특성은 두 치료군 간에 균형을 이루었습니다. 무작위 배정 시 중앙값 연령은 70세(범위: 42-92세)였으며, 30%가 75세 이상이었습니다. 인종 분포는 백인 81%, 아시아인 14%, 흑인 1%였습니다. 환자의 66%는 Gleason 점수가 ≥ 8이었습니다. 환자의 37%는 질병 용적이 낮았고 63%는 질병 용적이 높았습니다. 환자의 82%는 이전 도세탁셀 치료를 받지 않았습니다. 환자의 2%는 1~5 사이클의 도세탁셀을 투여받았고, 16%는 이전에 6 사이클의 도세탁셀 치료를 받았습니다. 환자의 12%는 전립선암 및 비전립선암 적응증을 포함한 동시 골 표적 약물(비스포스포네이트 또는 RANKL 억제제)을 투여받았습니다. 연구 시작 시 동부 협력 종양학 그룹 수행 상태(ECOG PS) 점수는 환자의 78%가 0이고 22%가 1이었습니다.
주요 유효성 결과 측정 항목은 맹검 독립 중앙 검토(BICR)를 기반으로 한 방사선학적 무진행 생존율(rPFS)이었습니다. 방사선학적 무진행 생존율은 무작위 배정부터 임의 시점의 방사선학적 질병 진행 또는 연구 약물 중단 후 24주 이내 사망까지의 기간으로 정의되었습니다. 방사선학적 질병 진행은 확인된(전립선암 작업 그룹 2 기준) 골 스캔에서 2개 이상의 새로운 골 병변 확인 및/또는 연조직 질환 진행으로 정의되었습니다. 새로운 항암 치료 시간 및 OS는 추가적인 유효성 평가 지표였습니다.
XTANDI는 위약에 비해 rPFS 및 OS가 통계적으로 유의하게 개선됨을 보였습니다. 질병 용적이 높거나 낮은 환자와 이전 도세탁셀 치료를 받았거나 받지 않은 환자 모두에서 일관된 rPFS 결과가 관찰되었습니다. ARCHES의 rPFS 및 OS에 대한 유효성 결과는 표 14, 그림 7 및 그림 8에 요약되어 있습니다.
| NR = 도달하지 않음. | |||
|
XTANDI |
위약 |
||
|
방사선학적 무진행 생존율* |
|||
|
사건 수 (%) |
89 (15.5) |
198 (34.4) |
|
|
방사선학적 질병 진행 |
77 (13.4) |
185 (32.1) |
|
|
치료 중단 후 24주 이내 사망 |
12 (2.1) |
13 (2.3) |
|
|
중앙값, 개월 (95% CI)† |
NR |
19.4 (16.6, NR) |
|
위험비 (95% CI)‡ |
0.39 (0.30, 0.50) |
|
|
P값§ |
p < 0.0001 |
|
|
전체 생존율 |
||
|
사건 수 (%) |
154 (26.8) |
202 (35.1) |
|
중앙값, 개월 (95% CI)† |
NR (NR, NR) |
NR (49.7, NR) |
|
위험비 (95% CI)‡ |
0.66 (0.53, 0.81) |
|
|
P값§ |
p < 0.0001 |
|
새로운 항암 치료 시작 시간에 대해서도 위약군과 비교하여 XTANDI군에서 통계적으로 유의미한 개선이 보고되었습니다 (HR = 0.28 [95% CI: 0.20, 0.40]; p < 0.0001).
EMBARK (NCT02319837): 고위험 BCR을 가진 비전이성 CSPC에서 XTANDI 대 위약
EMBARK는 고위험 BCR을 가진 비전이성 CSPC 환자 1068명을 대상으로, 1:1:1 비율로 무작위 배정하여 루프롤라이드와 병용 투여하는 1일 1회 160mg 경구 XTANDI (N = 355), 단독 요법으로 1일 1회 160mg 경구 XTANDI (N = 355), 또는 루프롤라이드와 병용 투여하는 1일 1회 경구 위약 (N = 358)을 투여 받도록 하였습니다. 모든 환자는 치료 목적으로 근치적 전립선 절제술 또는 방사선 치료 (브래키테라피 포함)를 받았거나, 또는 두 가지 모두를 받았습니다. 등록 당시에는 구제 방사선 치료를 받을 수 없는 환자였습니다. 환자는 BICR에 의해 비전이성 질환이 확인되어야 하며, 고위험 BCR (PSA 배가 시간 ≤ 9개월로 정의) 및 전립선암의 일차 치료로 근치적 전립선 절제술 (방사선 치료 유무)을 받은 경우 PSA 값 ≥1 ng/mL 또는 방사선 치료만 받은 경우 최저치보다 최소 2 ng/mL 이상 높은 PSA 값을 가져야 했습니다.
36주차에 PSA 값이 검출되지 않은 (<0.2 ng/mL) 환자의 경우, 37주차에 치료를 중단한 후 PSA 값이 근치적 전립선 절제술을 받은 환자의 경우 ≥2.0 ng/mL, 근치적 전립선 절제술을 받지 않은 환자의 경우 ≥5.0 ng/mL로 증가하면 치료를 재개했습니다. 36주차에 PSA 값이 검출된 (≥0.2 ng/mL) 환자의 경우, 영구적인 치료 중단 기준을 충족할 때까지 치료를 중단하지 않고 계속했습니다. 모든 환자의 경우, BICR에 의해 확인된 방사선학적 질병 진행, 새로운 치료 시작, 허용할 수 없는 독성 또는 중단으로 인해 치료가 영구적으로 중단되었습니다.
무작위 배정 당시 중앙 연령은 69세 (범위: 49-93세)였으며, 23%가 75세 이상이었습니다. 인종 분포는 백인 83%, 아시아인 7%, 흑인 4%, 기타 2.3%, 보고되지 않음 2.7%였으며, 5.5%의 환자가 히스패닉 또는 라틴계였습니다. 중앙 PSADT는 4.9개월이었습니다. 74%의 환자가 근치적 전립선 절제술을 받았고, 34%의 환자가 일차 방사선 치료 (브래키테라피 포함)를 받았으며, 49%의 환자가 수술과 방사선 치료 (보조 및 구제 방사선 치료 포함)를 모두 받았습니다. 32%의 환자가 Gleason 점수 ≥ 8을 가졌습니다. 연구 시작 시 ECOG PS 점수는 92%의 환자가 0점, 8%의 환자가 1점이었습니다.
주요 유효성 평가 지표는 루프롤라이드와 병용 투여하는 XTANDI를 투여받은 환자군과 루프롤라이드와 병용 투여하는 위약을 투여받은 환자군에서의 전이 없는 생존율 (MFS)이었습니다. MFS는 무작위 배정부터 다음 중 먼저 발생하는 시점까지의 기간으로 정의되었습니다. 1) BICR에 따른 방사선학적 진행 또는 2) 사망. 단독 요법으로 XTANDI를 투여받은 환자군과 루프롤라이드와 병용 투여하는 위약을 투여받은 환자군에서의 MFS 및 전체 생존율 (OS)은 추가적인 유효성 평가 지표였습니다.
루프롤라이드와 병용 투여하는 XTANDI를 투여받은 환자군과 루프롤라이드와 병용 투여하는 위약을 투여받은 환자군을 비교했을 때 MFS에서 통계적으로 유의미한 개선이 나타났습니다. 단독 요법으로 XTANDI를 투여받은 환자군과 루프롤라이드와 병용 투여하는 위약을 투여받은 환자군을 비교했을 때에도 MFS에서 통계적으로 유의미한 개선이 나타났습니다. 결과는 표 15 및 그림 9에 요약되어 있습니다.
| NR = 도달하지 않음. | |||
|
XTANDI +
루프롤라이드 |
위약 +
루프롤라이드 |
XTANDI (N = 355) |
|
|
전이 없는 생존율 |
|||
|
사건 수 (%)* |
45 (12.7) |
92 (25.7) |
63 (17.7) |
|
중앙값, 개월 (95% CI)† |
NR (NR, NR) |
NR (85.1, NR) |
NR (NR, NR) |
|
위험비, 위약 + Leuprolide 대비 (95% CI)‡ |
0.42 (0.30, 0.61) |
— |
0.63 (0.46, 0.87) |
|
위약 + Leuprolide와의 비교에 대한 P-값§ |
p < 0.0001 |
— |
p = 0.0049 |
MFS 분석 시점에는 OS 데이터가 성숙되지 않았습니다(전체 환자 1068명 중 12.2% 사망).
16 제공/보관 및 취급 방법
XTANDI (엔잘루타마이드) 40mg 캡슐은 흰색에서 약간 벗겨진 흰색의 장방형 연질 젤라틴 캡슐로, 검정색 잉크로 ENZ가 각인되어 있으며 다음과 같은 포장 단위로 제공됩니다.
- •
- 내용물 안전 잠금장치가 있는 120캡슐들이 병 (NDC 0469-0125-99)
XTANDI (엔잘루타마이드) 40mg 정제는 노란색 원형 필름 코팅 정제로 E 40이 각인되어 있으며 다음과 같은 포장 단위로 제공됩니다.
- •
- 내용물 안전 잠금장치가 있는 120정들이 병 (NDC 0469-0625-99)
XTANDI (엔잘루타마이드) 80mg 정제는 노란색 타원형 필름 코팅 정제로 E 80이 각인되어 있으며 다음과 같은 포장 단위로 제공됩니다.
- •
- 내용물 안전 잠금장치가 있는 60정들이 병 (NDC 0469-0725-60)
XTANDI 캡슐과 정제는 건조한 곳에 20°C~25°C (68°F~77°F)에서 보관하고 용기를 단단히 밀봉하십시오. 15°C~30°C (59°F~86°F)의 온도 편차는 허용됩니다.
17 환자 상담 정보
FDA 승인 환자용 설명서(Patient Information)를 읽도록 환자에게 알려주십시오.
발작
- •
- XTANDI는 발작 위험 증가와 관련이 있다는 점을 환자에게 알려주십시오. 발작을 유발할 수 있는 상태와 발작 역치를 낮출 수 있는 약물에 대해 논의하십시오. 의식 상실로 인해 자신이나 타인에게 심각한 해를 입힐 수 있는 활동을 하는 것에 대한 위험을 환자에게 알려주십시오. 의식 상실이나 발작이 발생하면 즉시 의료 제공자에게 연락하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.1) 참조].
후방 가역성 뇌병증 증후군(PRES)
- •
- 발작, 두통, 의식 저하, 혼란, 시력 감소 또는 흐릿한 시야와 같이 PRES를 나타낼 수 있는 증상이 급속히 악화되는 경우 즉시 의료 제공자에게 연락하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.2) 참조].
과민증
- •
- XTANDI는 얼굴, 입술, 혀 또는 목의 붓기를 포함한 과민 반응과 관련이 있을 수 있다는 점을 환자에게 알려주십시오 [경고 및 주의사항 (5.3) 참조]. 이러한 유형의 과민증 증상이 나타나는 환자에게는 XTANDI 복용을 중단하고 즉시 의료 제공자에게 연락하도록 조언하십시오.
허혈성 심장 질환
- •
- XTANDI는 허혈성 심장 질환의 위험 증가와 관련이 있다는 점을 환자에게 알려주십시오. 심혈관계 사건을 시사하는 증상이 나타나면 즉시 의료 치료를 받도록 환자에게 조언하십시오 [경고 및 주의사항 (5.4) 참조].
낙상 및 골절
- •
- XTANDI는 어지러움/현기증, 낙상 및 골절 발생률 증가와 관련이 있다는 점을 환자에게 알려주십시오. 환자에게 이러한 유해 반응을 의료 제공자에게 보고하도록 조언하십시오 [경고 및 주의사항 (5.5) 참조].
연하곤란 또는 질식
- •
- XTANDI 캡슐 및 정제의 크기는 심각한 연하곤란 또는 질식과 관련이 있다는 점을 환자에게 알려주십시오.
- •
- 용법 및 용량에 따라 각 캡슐 또는 정제를 복용하도록 환자에게 조언하십시오.
- •
- XTANDI를 삼키는 데 어려움이 있는 경우 의료 제공자에게 알리도록 환자에게 조언하십시오 [경고 및 주의사항 (5.7) 참조].
고혈압
용법 및 용량
- •
- 양측 고환 절제술을 받지 않았고 GnRH 요법을 받고 있는 환자에게는 XTANDI 치료 과정 동안 이 치료를 유지해야 한다는 점을 알려주십시오.
- •
- 매일 같은 시간에 (1일 1회) 복용하도록 환자에게 지시하십시오. XTANDI는 음식과 함께 또는 음식 없이 복용할 수 있습니다. 모든 약물이 성공적으로 삼켜지도록 충분한 양의 물과 함께 각 캡슐 또는 정제를 통째로 복용하도록 환자에게 조언하십시오. 캡슐을 씹거나, 녹이거나, 열지 마십시오. 정제를 자르거나, 부수거나, 씹지 마십시오 [경고 및 주의사항 (5.7) 참조].
- •
- 의료 제공자와 상담하지 않고 XTANDI 복용을 중단하거나, 용량을 변경하거나, 중단해서는 안 된다는 점을 환자에게 알려주십시오.
- •
- 복용량을 놓친 경우 기억나는 대로 복용하도록 환자에게 알려주십시오. 하루 종일 복용량을 잊은 경우 다음 날 정상 복용량을 복용하십시오. 처방된 1일 복용량보다 많이 복용해서는 안 됩니다 [용법 및 용량 (2.1) 참조].
배아-태아 독성
- •
- XTANDI는 태아의 발달에 해롭고 유산을 유발할 수 있다는 점을 환자에게 알려주십시오.
- •
- 생식 능력이 있는 여성 파트너가 있는 남성 환자에게는 XTANDI 마지막 복용 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 임신한 여성과 성관계를 갖는 남성 환자에게는 콘돔을 사용하도록 조언하십시오 [경고 및 주의사항 (5.6) 참조].
불임
- •
- XTANDI는 남성의 생식 능력을 손상시킬 수 있다는 점을 남성 환자에게 알려주십시오 [특정 집단에서의 사용 (8.3) 참조].
제조 및 유통: Astellas Pharma US, Inc., Northbrook, IL 60062
판매:
Astellas Pharma US, Inc., Northbrook, IL 60062 Pfizer Inc., New York, NY 10017
415196-XTA-USA
처방전 의약품
© 2025 Astellas Pharma Inc. 또는 그 계열사
환자 포장 삽입물
|
환자 정보 |
|
|
XTANDI® (엑스탠디) (엔잘루타마이드) 캡슐 |
XTANDI® (엑스탠디) (엔잘루타마이드) 정제 |
|
XTANDI®란 무엇입니까? XTANDI는 다음과 같은 전립선암 남성을 치료하는 처방약입니다.
여성에게 XTANDI가 안전하고 효과적인지 여부는 알려져 있지 않습니다. 소아에게 XTANDI가 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
|
XTANDI 복용 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. XTANDI는 다른 약물의 작용 방식에 영향을 미칠 수 있으며, 다른 약물은 XTANDI의 작용 방식에 영향을 미칠 수 있습니다. XTANDI를 처방한 의료 제공자와 상담하기 전에는 어떤 약물도 시작하거나 중단해서는 안 됩니다. 복용하는 약을 알고 있어야 합니다. 새로운 약을 받을 때 의료 제공자와 약사에게 보여줄 수 있도록 약 목록을 가지고 다니십시오. |
|
|
XTANDI는 어떻게 복용해야 합니까?
|
|
|
XTANDI의 가능한 부작용은 무엇입니까? XTANDI는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
심각한 부작용이 발생하면 의료 제공자는 XTANDI 치료를 중단할 것입니다. |
|
|
XTANDI의 가장 흔한 부작용은 다음과 같습니다. |
|
|
|
|
XTANDI는 남성의 생식 능력에 문제를 일으켜 자녀를 갖는 능력에 영향을 미칠 수 있습니다. 생식 능력에 대한 우려 사항이 있는 경우 의료 제공자와 상담하십시오. 이것들은 XTANDI의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다(1-800-FDA-1088). |
|
|
XTANDI의 안전하고 효과적인 사용에 대한 일반 정보.
XTANDI 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
|
XTANDI의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 설명서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 XTANDI를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게도 XTANDI를 제공하지 마십시오. 해를 끼칠 수 있습니다. 의료 제공자 또는 약사에게 의료 전문가를 위해 작성된 XTANDI에 대한 정보를 문의할 수 있습니다. |
|
|
XTANDI의 성분은 무엇입니까? XTANDI 캡슐 활성 성분: enzalutamide 비활성 성분: caprylocaproyl polyoxylglycerides, butylated hydroxyanisole, butylated hydroxytoluene, gelatin, sorbitol sorbitan solution, glycerin, purified water, titanium dioxide, black iron oxide. XTANDI 정제 활성 성분: enzalutamide 비활성 성분: hypromellose acetate succinate, microcrystalline cellulose, colloidal silicon dioxide, croscarmellose sodium, and magnesium stearate. 정제 필름 코팅에는 hypromellose, talc, polyethylene glycol, titanium dioxide 및 ferric oxide가 포함되어 있습니다. 제조 및 유통: Astellas Pharma US, Inc., Northbrook, IL 60062 자세한 내용은 www.Xtandi.com을 방문하거나 1-800-727-7003으로 전화하십시오. |
|
|
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2025년 1월 |
|
포장/라벨 주요 표시면
NDC 0469-0125-99
처방전 의약품
Xtandi®
(enzalutamide)
캡슐
40 mg
캡슐을 충분한 양의 물과 함께 통째로 삼키십시오.
캡슐을 씹거나, 녹이거나, 열지 마십시오.
120 캡슐
제조원:
Catalent Pharma Solutions, LLC for
Astellas Pharma US, Inc.,
Northbrook, IL 60062
111607-04
415196-XTA-USA
4006396
포장/라벨 주요 표시면
NDC 0469-0625-99
처방전 의약품
Xtandi®
(enzalutamide)
정
40 mg
정제를 충분한 양의 물과 함께 통째로 삼키십시오. 정제를 자르거나, 부수거나, 씹지 마십시오.
120정
Astellas Pharma US, Inc., Northbrook, IL 60062에서 유통
75104449
415196-XTA-USA
4006397
포장/라벨 주요 표시면
NDC 0469-0725-60
처방전 의약품
Xtandi®
(enzalutamide)
정제
80 mg
정제를 충분한 양의 물과 함께 통째로 삼키십시오.
정제를 자르거나, 부수거나, 씹지 마십시오.
60정
Astellas Pharma US, Inc. Northbrook, IL 60062 판매
75104452
415196-XTA-USA
4006399
포장/라벨 주요 표시면
NDC 0469-1125-56
처방전 의약품
Xtandi®
40 mg
연질캡슐 56정
샘플
샘플 – 판매용 아님
포장/라벨 주요 표시면
NDC 0469-1725-56
처방전 의약품
Xtandi®
(enzalutamide)
정제
40 mg
정제를 충분한 양의 물과 함께 통째로 삼키십시오. 정제를 자르거나, 부수거나, 씹지 마십시오.
56정
샘플 – 판매용 아님
Astellas Pharma US, Inc. 수입, Northbrook, IL 60062
75104450
415196-XTA-USA
4006398