의약품 제조업체: Genentech, Inc. (Updated: 2024-11-20)
처방 정보 하이라이트
본 요약에는 XOLAIR를 안전하고 효과적으로 사용하는 데 필요한 모든 정보가 포함되어 있지 않습니다. XOLAIR의 전체 처방 정보를 참조하십시오.
XOLAIR
® (omalizumab) 주사제, 피하 주사용
XOLAIR® (omalizumab) 주사제, 피하 주사용
미국 최초 승인: 2003년
경고: 아나필락시스
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
기관지 경련, 저혈압, 실신, 두드러기 및/또는 인후 또는 혀의 안면 부종으로 나타나는 아나필락시스가 XOLAIR 투여 후 발생한 것으로 보고되었습니다. 아나필락시스는 XOLAIR의 첫 번째 투여 후에 발생했지만 치료 시작 후 1년 이상 지나서도 발생했습니다. 의료기관에서 XOLAIR 치료를 시작하고, XOLAIR 투여 후 적절한 기간 동안 환자를 면밀히 관찰하고, 생명을 위협할 수 있는 아나필락시스를 관리할 준비를 하십시오. 환자에게 아나필락시스의 징후와 증상을 알리고 증상이 발생하면 즉시 의료 서비스를 받도록 하십시오. XOLAIR의 자가 투여를 위한 환자 선택은 아나필락시스의 위험을 줄이기 위한 기준에 따라야 합니다. (2.6, 5.1, 6.1, 6.2)
적응증 및 용법
XOLAIR는 다음에 사용되는 항-IgE 항체입니다:
- 다년생 항원에 대한 양성 피부 검사 또는 시험관 내 반응성이 있고 흡입용 코르티코스테로이드로 적절히 조절되지 않는 증상이 있는 6세 이상 성인 및 소아 환자의 중등도에서 중증의 지속성 천식 (1.1)
- 비강 코르티코스테로이드에 대한 반응이 불충분한 18세 이상 성인 환자의 부비동염과 비용종(CRSwNP)에 대한 추가 유지 요법 (1.2)
- 우발적인 하나 이상의 음식물 노출로 발생할 수 있는 아나필락시스를 포함한 알레르기 반응(I형) 감소를 위한 1세 이상 성인 및 소아 환자의 IgE 매개 음식 알레르기. 음식 알레르겐 회피와 병용하여 사용 (1.3)
- H1 항히스타민제 치료에도 불구하고 증상이 지속되는 12세 이상 성인 및 청소년의 만성 자발적 두드러기(CSU) (1.4)
사용상의 제한:
- 급성 기관지 경련 또는 천식 발작에는 적응증이 없습니다. (1.1, 5.3)
- 아나필락시스를 포함한 알레르기 반응의 응급 치료에는 적응증이 없습니다. (1.3)
- 다른 형태의 두드러기에는 적응증이 없습니다. (1.4)
용법 및 용량
피하(SC) 투여 전용입니다. (2.2, 2.3, 2.4, 2.5)
투여 지침에 대한 전체 처방 정보를 참조하십시오. (2.6, 2.7, 2.8)
-
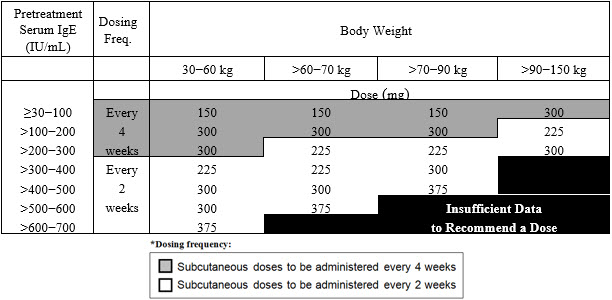
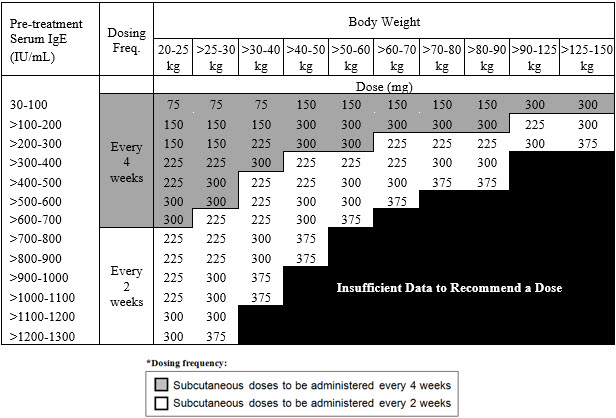
천식: XOLAIR 75~375mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL) 및 체중(kg)에 따라 용량(mg) 및 투여 빈도를 결정합니다. 용량 결정 차트를 참조하십시오. (2.2)
-
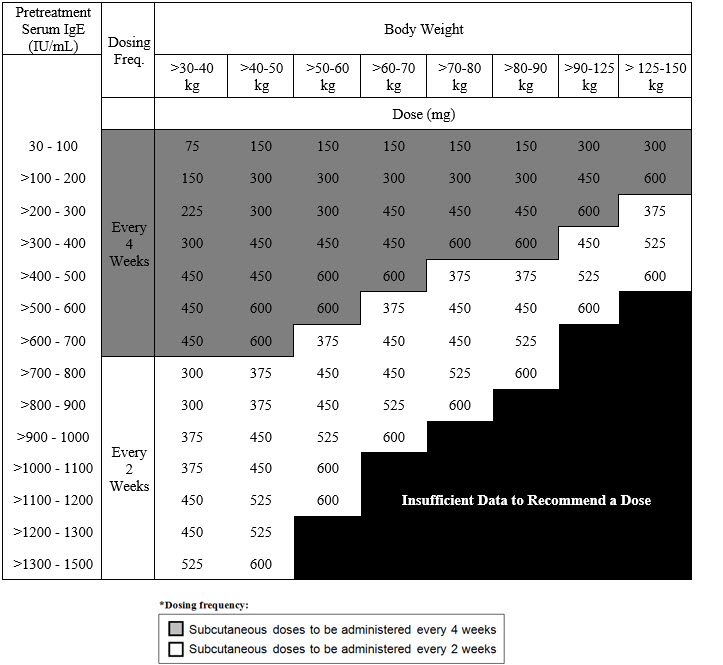
비용종을 동반한 만성 부비동염: XOLAIR 75~600mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL) 및 체중(kg)에 따라 용량(mg) 및 투여 빈도를 결정합니다. 용량 결정 차트를 참조하십시오. (2.3)
-
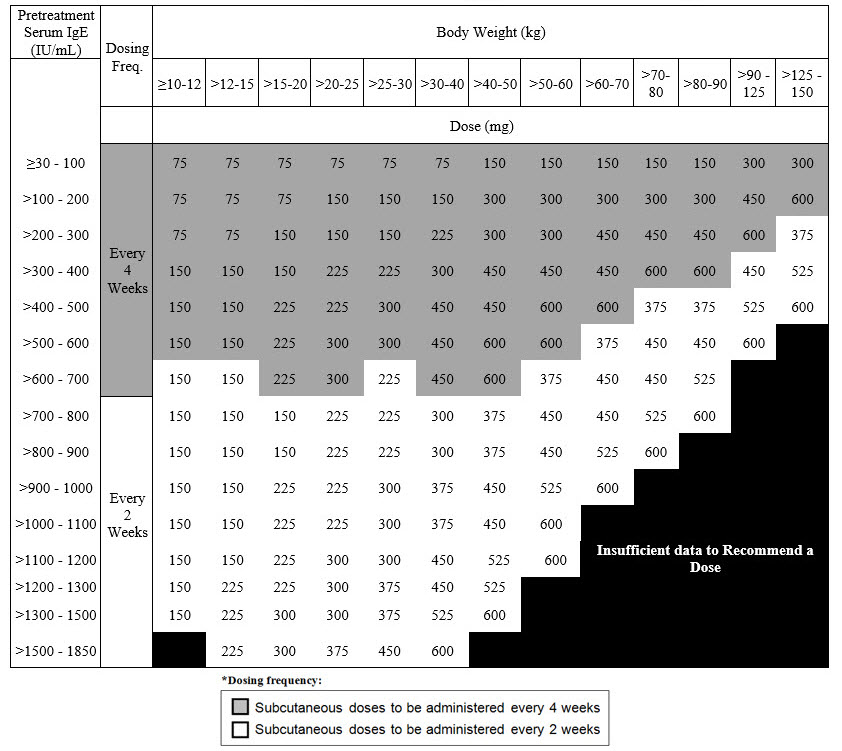
IgE 매개 음식 알레르기: XOLAIR 75~600mg을 2주 또는 4주마다 피하 투여합니다. 치료 시작 전에 측정한 혈청 총 IgE 수치(IU/mL) 및 체중(kg)에 따라 용량(mg) 및 투여 빈도를 결정합니다. 용량 결정 차트를 참조하십시오. (2.4)
-
만성 자발적 두드러기: XOLAIR 150 또는 300mg을 4주마다 피하 투여합니다. CSU의 용량은 혈청 IgE 수치 또는 체중에 따라 달라지지 않습니다. (2.5)
제형 및 강도
- 주사제: 1회용 프리필드 시린지에 75mg/0.5mL, 150mg/mL 및 300mg/2mL 용액 (3)
- 주사제: 1회용 프리필드 오토인젝터에 75mg/0.5mL, 150mg/mL 및 300mg/2mL 용액 (3)
- 주사용: 재구성을 위한 1회용 바이알에 150mg 동결건조 분말 (3)
금기사항
XOLAIR 또는 XOLAIR의 성분에 대한 중증 과민반응 (4, 5.1)
경고 및 주의사항
- 아나필락시스: 생명을 위협할 수 있는 아나필락시스를 관리할 준비가 된 의료 환경에서 XOLAIR 치료를 시작하고, 투여 후 적절한 기간 동안 환자를 관찰하십시오. (5.1)
- 악성종양: 임상 연구에서 악성종양이 관찰되었습니다. (5.2)
- 급성 천식 증상: 급성 기관지 경련 또는 천식 발작의 치료에는 사용하지 마십시오. (5.3)
- 코르티코스테로이드 감량: XOLAIR 치료 시작 시 코르티코스테로이드를 갑자기 중단하지 마십시오. (5.4)
- 호산구 증가 질환: 특히 경구 코르티코스테로이드 감량 시 호산구 증가증, 혈관염 발진, 악화되는 폐 증상, 심장 합병증 및/또는 신경병증에 유의하십시오. (5.5)
- 발열, 관절통 및 발진: 환자에게 혈청병과 유사한 징후 및 증상이 나타나면 XOLAIR를 중단하십시오. (5.6)
- 아나필락시스의 응급 치료와 관련된 잠재적 약물 오류: XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에는 사용해서는 안 됩니다. (5.9)
유해 반응
-
천식: 성인 및 12세 이상 청소년 환자를 대상으로 한 임상 연구에서 가장 흔한 유해 반응(≥ 1% 환자)은 관절통, 통증(전반적), 다리 통증, 피로, 어지러움, 골절, 팔 통증, 가려움증, 피부염 및 귀 통증이었습니다. 6세 이상 12세 미만 소아 환자를 대상으로 한 임상 연구에서 가장 흔한 유해 반응(≥3% 환자)은 비인두염, 두통, 발열, 상복부 통증, 연쇄상구균 인두염, 중이염, 바이러스성 위장염, 절지동물 물림 및 코피였습니다. (6.1)
-
비용종을 동반한 만성 부비동염: 성인 환자를 대상으로 한 임상 연구에서 가장 흔한 유해 반응(≥ 3% 환자)은 두통, 주사 부위 반응, 관절통, 상복부 통증 및 어지러움증이었습니다. (6.1)
-
IgE 매개 식품 알레르기: 가장 흔한 유해 반응(≥3% 환자)은 주사 부위 반응과 발열이었습니다. (6.1)
-
만성 자발성 두드러기: 가장 흔한 유해 반응(≥2% 환자)은 메스꺼움, 비인두염, 부비동염, 상기도 감염, 바이러스성 상기도 감염, 관절통, 두통 및 기침이었습니다. (6.1)
의심되는 유해 반응을 보고하려면 Genentech에 1-888-835-2555 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
공식적인 약물 상호작용 연구는 수행되지 않았습니다. (7)
환자 상담 정보 및 약물 안내서에 대해서는 17을 참조하십시오.
개정: 2024년 2월
목차
전문 정보: 목차*
제품에 대한 경고(BOXED WARNING)
경고: 아나필락시스
기관지경련, 저혈압, 실신, 두드러기 및/또는 인후 또는 혀의 안면부종으로 나타나는 아나필락시스가 XOLAIR 투여 후 발생한 것으로 보고되었습니다. 아나필락시스는 XOLAIR 첫 투여 후에 발생했을 뿐만 아니라, 정기적으로 투여되는 치료를 시작한 후 1년 이상 지나서도 발생했습니다. 아나필락시스 위험 때문에, 의료기관에서 XOLAIR 치료를 시작하고 XOLAIR 투여 후 적절한 기간 동안 환자를 면밀히 관찰하십시오. XOLAIR을 투여하는 의료 제공자는 생명을 위협할 수 있는 아나필락시스를 관리할 준비를 해야 합니다. 환자에게 아나필락시스의 징후와 증상을 알리고 증상이 발생하면 즉시 의료 서비스를 받도록 지시하십시오. XOLAIR의 자가 투여를 위한 환자 선택은 아나필락시스의 위험을 완화하기 위한 기준에 따라야 합니다 [투여 및 투약 방법 (2.6), 경고 및 예방 조치 (5.1) 및 유해 반응 (6.1), 6.2) 참조].
1 적응증 및 사용법
1.1 천식
XOLAIR는 다년생 항원에 대한 양성 피부 반응 검사 또는 시험관 내 반응성을 보이고 흡입용 코르티코스테로이드로 증상 조절이 불충분한 중등도에서 중증의 지속성 천식 성인 및 6세 이상 소아 환자에게 적응증이 있습니다.
사용상의 제한:
XOLAIR는 급성 기관지 경련 또는 천식 발작의 치료에 적응증이 없습니다.
1.2 비용종을 동반한 만성 비부비동염
XOLAIR는 비강 코르티코스테로이드에 대한 반응이 불충분한 18세 이상 성인 환자의 비용종을 동반한 만성 비부비동염(CRSwNP)의 추가 유지 요법에 적응증이 있습니다.
1.3 IgE 매개 식품 알레르기
XOLAIR는 IgE 매개 식품 알레르기가 있는 1세 이상 성인 및 소아 환자에서 우발적인 하나 이상의 식품 노출 시 발생할 수 있는 아나필락시스를 포함한 알레르기 반응(I형)의 감소에 적응증이 있습니다.
XOLAIR는 식품 알레르겐 회피와 함께 사용해야 합니다.
사용상의 제한:
XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에 적응증이 없습니다.
1.4 만성 자발성 두드러기
XOLAIR는 H1 항히스타민제 치료에도 증상이 지속되는 만성 자발성 두드러기(CSU) 성인 및 12세 이상 청소년의 치료에 적응증이 있습니다.
사용상의 제한:
XOLAIR는 다른 유형의 두드러기 치료에는 적응증이 없습니다.
2 용법 및 투여
2.1 투여량 결정 개요
천식, 비용종을 동반한 만성 비부비동염 및 IgE 매개 식품 알레르기
-
치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)을 기준으로 XOLAIR의 투여량을 결정하십시오.
-
천식, 비용종을 동반한 만성 비부비동염(CRSwNP) 및 IgE 매개 식품 알레르기 환자의 경우, XOLAIR를 처방하는 주요 진단을 기준으로 투여량을 결정해야 합니다.
-
치료 중 체중의 현저한 변화에 따라 용량을 조정하십시오.
-
천식 치료 권장 용량은 표 1과 2를, CRSwNP 치료 권장 용량은 표 3을, IgE 매개 식품 알레르기 치료 권장 용량은 표 4를 참조하십시오.
-
총 IgE 수치는 치료 중에 상승하며 치료 중단 후 최대 1년까지 상승된 상태를 유지합니다. 따라서 XOLAIR 치료 중 IgE 수치 재검사는 용량 결정 지침으로 사용할 수 없습니다.
- 1년 미만의 치료 중단: 초기 용량 결정 시 얻은 혈청 IgE 수치를 기준으로 용량을 결정합니다.
- 1년 이상의 치료 중단: 용량 결정을 위해 총 혈청 IgE 수치를 재검사합니다(환자의 나이를 기준으로 천식 치료의 경우 표 1 또는 2, CRSwNP 치료의 경우 표 3, IgE 매개 식품 알레르기 치료의 경우 표 4 참조).
2.2 천식 권장 용량
천식 권장 용량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)을 기준으로 2주 또는 4주마다 피하 주사로 XOLAIR 75mg~375mg을 투여하는 것입니다 [see Dosage and Administration (2.1)].
- 12세 이상의 성인 및 청소년 환자: 표 1에 따라 투여를 시작합니다.
- 6세~12세 미만의 소아 환자: 표 2에 따라 투여를 시작합니다.
치료 기간
환자의 질병 중증도와 천식 조절 수준에 따라 지속적인 치료의 필요성을 주기적으로 재평가하십시오.
2.3 비용종을 동반한 만성 비부비동염 권장 용량
비용종을 동반한 만성 비부비동염(CRSwNP) 권장 용량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중(kg)을 기준으로 2주 또는 4주마다 피하 주사로 XOLAIR 75mg~600mg을 투여하는 것입니다 [see Dosage and Administration (2.1)]. CRSwNP 환자의 혈청 총 IgE 수치와 체중을 기준으로 한 권장 용량은 표 3을 참조하십시오.
Duration of Therapy
환자의 질병 중증도 및 증상 조절 수준에 따라 지속적인 치료의 필요성을 정기적으로 재평가하십시오.
2.4 IgE 매개 식품 알레르기 권장 복용량
IgE 매개 식품 알레르기에 권장되는 XOLAIR 복용량은 치료 시작 전 측정한 혈청 총 IgE 수치(IU/mL)와 체중을 기준으로 2주 또는 4주마다 피하 주사로 75mg~600mg입니다. [복용량 및 투여(2.1) 참조]. IgE 매개 식품 알레르기 환자의 혈청 IgE 수치 및 체중을 기준으로 권장되는 복용량은 표 4를 참조하십시오.
치료 기간
IgE 매개 식품 알레르기에 대한 적절한 치료 기간은 평가되지 않았습니다. 지속적인 치료의 필요성을 정기적으로 재평가하십시오.
2.5 만성 특발성 두드러기에 권장되는 용량
만성 특발성 두드러기(CSU)에 권장되는 용량은 4주마다 피하 주사로 XOLAIR 150mg 또는 300mg입니다.
-
300mg 용량은 300mg/2mL 피하 주사 1회 또는 150mg/mL 피하 주사 2회로 투여할 수 있습니다.
- CSU 환자에서 XOLAIR의 용량은 혈청 IgE(유리 또는 총) 수치 또는 체중에 따라 달라지지 않습니다.
치료 기간
CSU에 대한 적절한 치료 기간은 평가되지 않았습니다. 지속적인 치료의 필요성을 정기적으로 재평가하십시오.
2.6 투여 개요
-
XOLAIR는 피하 주사로 투여합니다.
-
XOLAIR는 의료 전문가의 지도 하에 사용해야 합니다.
-
의료 기관에서 치료를 시작하고 치료가 안전하게 확립되면 의료 전문가는 아나필락시스 위험 및 완화 전략에 대한 신중한 평가를 바탕으로 환자 또는 간병인이 XOLAIR 사전 충전 주사기 또는 자동 주사기를 자가 투여하는 것이 적절한지 판단할 수 있습니다.
XOLAIR 사전 충전 주사기 또는 자동 주사기 자가 투여 환자 선택
의료 전문가는 자가 투여 환자를 선택할 때 XOLAIR에 대한 아나필락시스의 알려진 위험 요소[경고 및 주의사항 (5.1) 참조] 및 완화 전략을 고려해야 합니다. 다음 기준을 포함한 환자별 요소를 고려해야 합니다.
- 1a)
-
천식, CRSwNP 및 CSU: 환자는 XOLAIR 또는 음식, 약물, 생물학적 제제 등과 같은 다른 약제에 대한 아나필락시스 병력이 없어야 합니다.
- 1b)
-
IgE 매개 식품 알레르기: 환자는 XOLAIR 또는 (음식 제외) 약물, 생물학적 제제 등과 같은 다른 약제에 대한 아나필락시스 병력이 없어야 합니다.
- 2)
-
환자는 의료 전문가의 지도 하에 과민 반응 없이 최소 3회의 XOLAIR 용량을 투여받아야 합니다.
- 3)
-
환자 또는 간병인은 아나필락시스 증상을 인지할 수 있어야 합니다.
- 4)
-
환자 또는 간병인은 아나필락시스를 적절하게 치료할 수 있어야 합니다.
- 5)
-
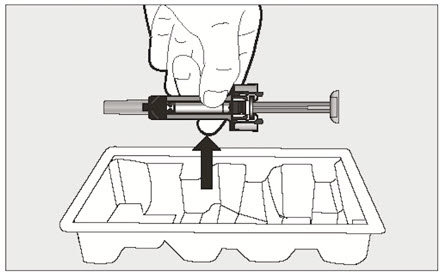
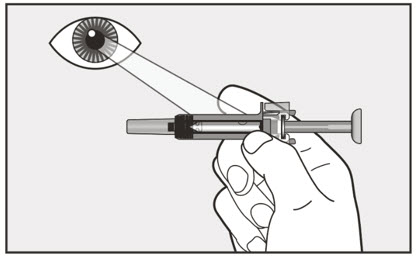
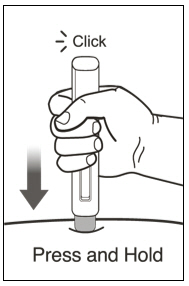
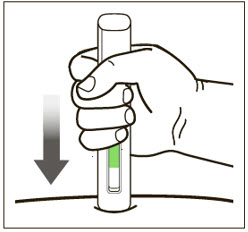
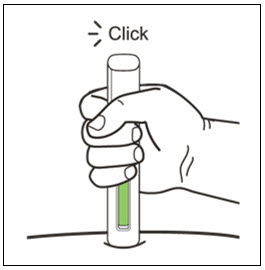
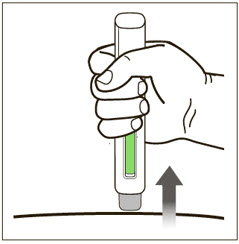
환자 또는 간병인은 처방된 용량 요법 및 사용 설명서에 따라 적절한 기술로 XOLAIR 사전 충전 주사기 또는 자동 주사기를 사용하여 피하 주사를 수행할 수 있어야 합니다.
2.7 XOLAIR 사전 충전 주사기 및 자동 주사기
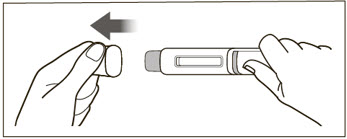
XOLAIR 주사 용량은 사전 충전 주사기 또는 자동 주사기로 제공됩니다. 환자 또는 간병인에게 XOLAIR 사전 충전 주사기 또는 자동 주사기의 준비 및 투여에 대한 “사용 설명서“에 제공된 지침을 따르도록 지시하십시오. [사용 설명서 참조].
XOLAIR 사전 충전 주사기
-
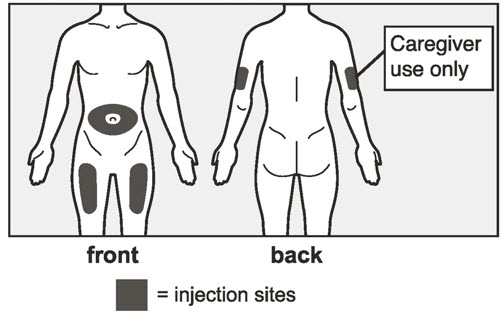
12세 이상 청소년: XOLAIR 사전 충전 주사기는 성인 감독 하에 자가 투여할 수 있습니다.
-
1~11세 소아 환자: XOLAIR 사전 충전 주사기는 간병인이 투여해야 합니다.
XOLAIR 자동 주사기
-
12세 이상 청소년: XOLAIR 자동 주사기는 성인 감독 하에 자가 투여할 수 있습니다. XOLAIR 자동 주사기(모든 용량)는 성인과 12세 이상 청소년에게만 사용하도록 되어 있습니다.
-
1~11세 소아 환자: XOLAIR 자동 주사기(모든 용량)는 12세 미만 소아 환자에게 사용해서는 안 됩니다.
사전 충전 주사기 및 자동 주사기 투여 지침
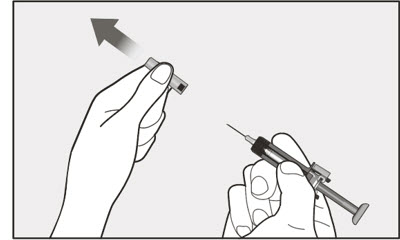
- 라텍스 알레르기가 있는 사람은 XOLAIR 사전 충전형 주사기를 취급해서는 안 됩니다. XOLAIR 75mg/0.5mL 및 150mg/mL 사전 충전형 주사기의 바늘 캡에는 천연 고무 라텍스의 유도체가 포함되어 있어 라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있습니다. [see How Supplied/Storage and Handling (16)].
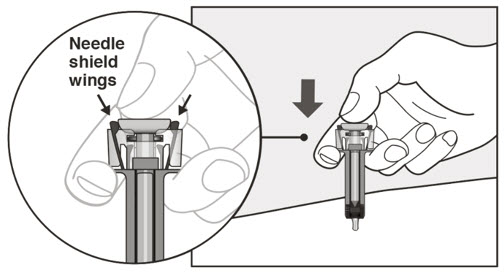
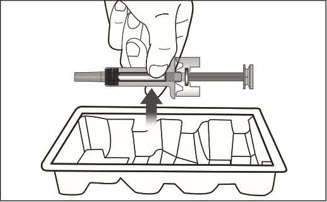
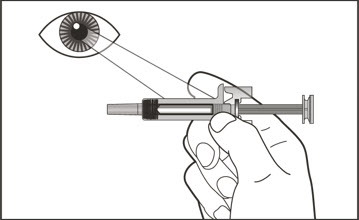
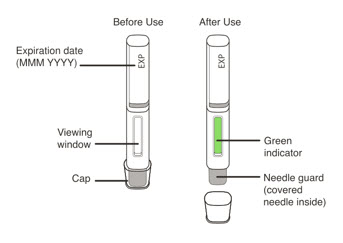
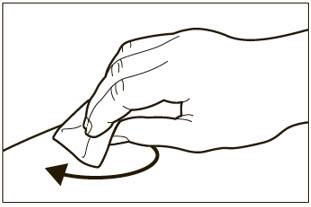
- 투여 전에 사전 충전형 주사기 또는 자동 주사기의 내용물에 미립자나 변색이 있는지 육안으로 검사하십시오. XOLAIR 사전 충전형 주사기 또는 자동 주사기 용액은 투명하고 무색에서 옅은 갈색을 띤 노란색이어야 합니다. 약이 흐리거나 변색되었거나 입자가 포함된 경우 사전 충전형 주사기 또는 자동 주사기를 사용하지 마십시오.
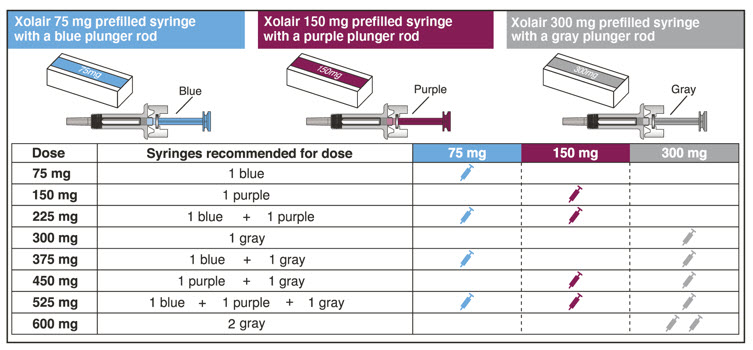
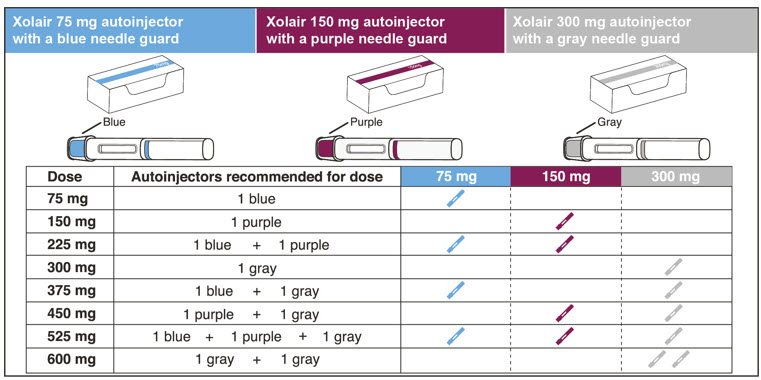
- 환자의 복용량에 필요한 사전 충전형 주사기 또는 자동 주사기의 수를 확인하십시오( 표 5 참조). 1~11세 소아 환자의 경우 필요한 사전 충전형 주사기 주사 횟수와 환자 체중 대비 주사할 용량을 고려해야 합니다.
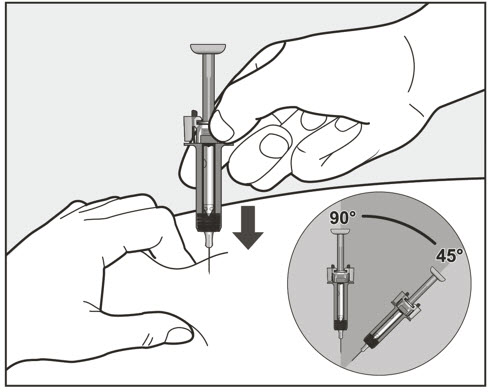
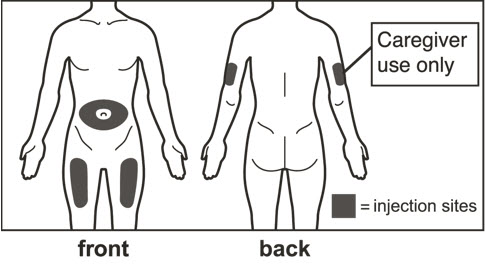
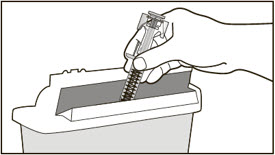
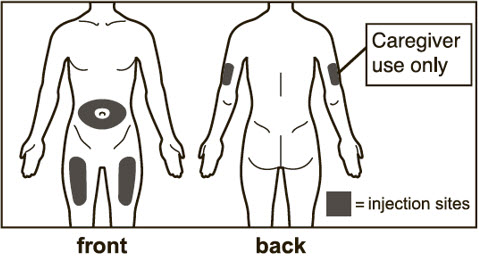
- 전체 용량을 투여하기 위해 1회 이상 주사해야 하는 환자의 경우 각 주사를 다른 주사 부위에서 최소 1인치(2.5cm) 간격을 두고 투여하십시오.
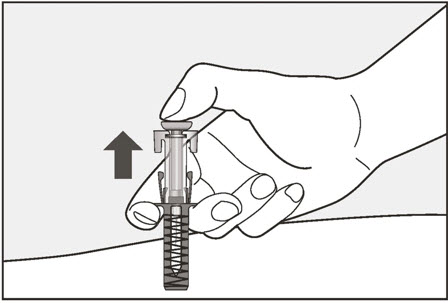
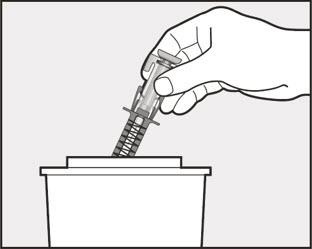
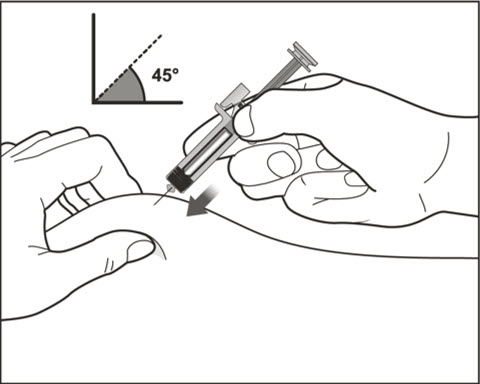
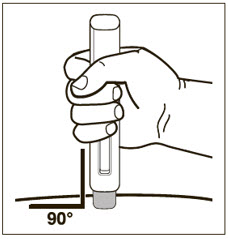
- 배꼽 주변 2인치(5cm) 영역을 피해 허벅지 또는 복부에 피하 주사합니다. 팔 위쪽 바깥쪽 부위는 간병인이나 의료 서비스 제공자가 주사하는 경우에만 사용할 수 있습니다. [see Instructions for Use]. 주사하는 데 최대 15초가 걸릴 수 있습니다.
2.8 XOLAIR 동결건조 분말 사용 준비 및 주사
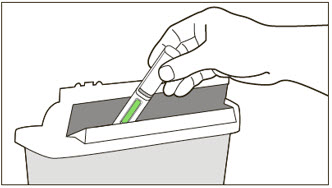
XOLAIR 동결건조 분말은 의료 전문가만 준비하고 주사해야 합니다. 제공된 XOLAIR 동결건조 분말은 다음 지침에 따라 주사용 멸균수(SWFI) USP로 재구성해야 합니다.
- 1)
-
재구성하기 전에 재구성해야 할 바이알 수를 확인합니다(각 바이알은 1.2mL에 150mg의 XOLAIR를 제공합니다)(표 6 참조).
- 2)
- 1인치 18게이지 바늘이 장착된 3mL 주사기에 SWFI, USP 1.4mL를 넣습니다.
- 3)
- 바이알을 평평한 표면에 똑바로 세우고 표준 무균 기술을 사용하여 바늘을 삽입하고 SWFI, USP를 제품에 직접 주입합니다.
- 4)
- 바이알을 똑바로 세운 상태에서 약 1분 동안 부드럽게 돌려 분말을 골고루 적십니다. 흔들지 마십시오.
- 5)
- 약 5분마다 5~10초 동안 바이알을 부드럽게 돌려 남아 있는 고형물을 녹입니다. 동결건조 제품은 용해되는 데 15~20분이 걸립니다. 완전히 용해되는 데 20분 이상 걸리는 경우 용액에 눈에 보이는 젤 같은 입자가 없을 때까지 약 5분마다 5~10초 동안 바이알을 부드럽게 돌립니다. 바이알 내용물이 40분 이내에 완전히 용해되지 않으면 사용하지 마십시오.
- 6)
- 재구성 후 XOLAIR 용액은 다소 점성이 있으며 투명하거나 약간 유백색으로 보입니다. 바이알 가장자리 주변에 작은 기포나 거품이 있는 것은 허용됩니다. 재구성된 용액에 눈에 보이는 젤 같은 입자가 없어야 합니다. 이물질이 있는 경우 사용하지 마십시오.
- 7)
- 용액이 마개 쪽으로 흘러내리도록 바이알을 15초 동안 뒤집습니다.
- 8)
-
재구성 후 바이알에 2ºC~8ºC(36ºF~46ºF)에서 보관할 경우 8시간 이내에, 실온에서 보관할 경우 재구성 후 4시간 이내에 XOLAIR 용액을 사용하십시오. 재구성된 XOLAIR 바이알은 햇빛으로부터 보호해야 합니다.
- 9)
- 1인치 18게이지 바늘이 장착된 새 3mL 주사기를 사용하여 바늘을 뒤집힌 바이알에 삽입합니다. 용액을 주사기로 넣을 때 바늘 끝을 바이알 마개의 용액 바닥에 놓습니다. 재구성된 제품은 다소 점성이 있습니다. 주사기에서 공기나 과도한 용액을 배출하기 전에 바이알에서 모든 제품을 withdrawn 합니다. 바늘을 바이알에서 제거하기 전에 플런저를 주사기 배럴 끝까지 완전히 당겨 뒤집힌 바이알에서 모든 용액을 제거합니다.
- 10)
- 피하 주사를 위해 18게이지 바늘을 25게이지 바늘로 교체합니다.
- 11)
- 150mg XOLAIR 용량에 해당하는 1.2mL의 부피를 얻기 위해 공기, 큰 기포 및 과도한 용액을 배출합니다. 75mg XOLAIR 용량에 해당하는 0.6mL의 부피를 얻으려면 공기, 큰 기포를 배출하고 주사기에서 0.6mL를 버립니다. 주사기 용액 상단에 작은 기포가 얇게 남아 있을 수 있습니다.
- 12)
- 피하 주사로 XOLAIR를 투여합니다. 용액이 약간 점성이 있기 때문에 주사하는 데 5~10초가 걸릴 수 있습니다. 주사 부위당 150mg(한 바이알의 내용물) 이상을 투여하지 마십시오. 150mg 이상의 용량은 두 개 이상의 주사 부위로 나눕니다. 다른 주사에 사용된 부위에서 최소 1인치 떨어진 곳에 새로운 주사마다 다른 주사 부위를 선택합니다.
3 제형 및 함량
주사제:
- 75 mg/0.5 mL: 바늘 보호대가 있는 1회용 프리필드 시린지 또는 1회용 프리필드 오토인젝터에 담긴 무색 투명 내지 약간 불투명하고 무색에서 연한 갈색을 띠는 용액
- 150 mg/mL: 바늘 보호대가 있는 1회용 프리필드 시린지 또는 1회용 프리필드 오토인젝터에 담긴 무색 투명 내지 약간 불투명하고 무색에서 연한 갈색을 띠는 용액
- 300 mg/2 mL: 바늘 보호대가 있는 1회용 프리필드 시린지 또는 1회용 프리필드 오토인젝터에 담긴 무색 투명 내지 약간 불투명하고 무색에서 연한 갈색을 띠는 용액
- 주사용: 재구성을 위한 1회용 바이알에 담긴 150 mg의 백색 동결건조 분말
4 금기 사항
XOLAIR는 XOLAIR 또는 XOLAIR의 성분에 대한 중증 과민 반응이 있는 환자에게 금기입니다. [경고 및 주의사항 (5.1) 참조].
5 경고 및 주의사항
5.1 아나필락시스
시판 전 임상 시험 및 시판 후 자발적 보고에서 XOLAIR 투여 후 아나필락시스가 발생한 것으로 보고되었습니다 [경고 및 유해 반응 (6.2) 참조]. 이러한 보고된 사례에서 나타난 징후 및 증상에는 기관지 경련, 저혈압, 실신, 두드러기 및/또는 인후 또는 혀의 안면 부종이 포함되었습니다. 이러한 사건 중 일부는 생명을 위협하는 것이었습니다. 천식 환자를 대상으로 한 시판 전 임상 시험에서 3,507명 중 3명(0.1%)의 환자에게서 아나필락시스가 보고되었습니다. 아나필락시스는 2명의 환자에게서 XOLAIR 첫 번째 투여 시, 1명의 환자에게서 네 번째 투여 시 발생했습니다. 아나필락시스 발병까지의 시간은 2명의 환자에게서 투여 후 90분, 1명의 환자에게서 투여 후 2시간이었습니다.
천식 환자를 대상으로 한 대조군 연구에 따르면, XOLAIR 사용자 중 음식, 약물 또는 기타 원인에 대한 아나필락시스 병력이 있는 환자는 이전에 아나필락시스 병력이 없는 환자에 비해 XOLAIR와 관련된 아나필락시스 위험이 증가했습니다 [유해 반응 (6.1) 참조].
시판 후 자발적 보고에서 XOLAIR 사용으로 인한 아나필락시스의 빈도는 2003년 6월부터 2006년 12월까지 약 57,300명의 환자 노출을 기준으로 환자의 최소 0.2%로 추정되었습니다. 아나필락시스는 XOLAIR 첫 번째 투여 후에 발생했을 뿐만 아니라 정기적으로 예정된 치료를 시작한 후 1년 이상 후에도 발생했습니다. 아나필락시스 사례의 약 60%~70%는 XOLAIR의 처음 세 번의 투여 내에 발생한 것으로 보고되었으며, 추가 사례는 세 번째 투여 이후 산발적으로 발생했습니다.
생명을 위협할 수 있는 아나필락시스를 관리할 수 있는 의료 환경에서만 XOLAIR를 시작하십시오. 시판 전 임상 시험 및 시판 후 자발적 보고에서 나타난 아나필락시스 발병 시간을 고려하여 XOLAIR 투여 후 적절한 기간 동안 환자를 면밀히 관찰하십시오 [유해 반응 (6.1), 6.2) 참조]. 환자에게 아나필락시스의 징후 및 증상을 알리고, 징후 또는 증상이 나타날 경우 즉시 의료 서비스를 받도록 지시하십시오.
XOLAIR 치료가 확립된 후에는 환자 또는 보호자가 의료 환경 외부에서 XOLAIR 프리필드 시린지 또는 오토인젝터를 투여하는 것이 특정 환자에게 적절할 수 있습니다. 환자 선택은 의료 제공자가 환자와 상의하여 결정하며, 시판 전 임상 시험 및 시판 후 자발적 보고에서 나타난 아나필락시스 사건의 패턴과 개별 환자 위험 요인(예: 이전 아나필락시스 병력), 아나필락시스의 징후 및 증상을 인식하는 능력, 처방된 투여 계획 및 사용 지침에 따라 XOLAIR 프리필드 시린지 또는 오토인젝터를 적절한 기술로 피하 주사할 수 있는 능력을 고려해야 합니다 [투여 및 관리 (2.6), 유해 반응 (6.1), 6.2) 참조].
중증 과민 반응이 발생한 환자에게서는 XOLAIR를 중단하십시오 [금기 사항 (4) 참조].
5.2 악성 종양
성인 및 12세 이상 청소년 천식 및 기타 알레르기 질환 임상 연구에서 XOLAIR 치료 환자 4,127명 중 20명(0.5%)에서 악성 신생물이 관찰된 반면, 대조군 환자 2,236명 중 5명(0.2%)에서 관찰되었습니다. XOLAIR 치료 환자에게서 관찰된 악성 종양은 다양한 유형이었으며, 유방암, 비흑색종 피부암, 전립선암, 흑색종 및 이하선암이 1회 이상 발생했고, 다른 5가지 유형이 각각 1회 발생했습니다. 대부분의 환자는 1년 미만 동안 관찰되었습니다. XOLAIR에 대한 장기간 노출 또는 악성 종양 위험이 높은 환자(예: 노인, 현재 흡연자)에서의 사용의 영향은 알려져 있지 않습니다.
중등도에서 중증의 지속성 천식 및 다년생 공기 알레르겐에 대한 양성 피부 반응 또는 시험관 내 반응성이 있는 5,007명의 XOLAIR 치료 청소년 및 성인 환자와 2,829명의 비 XOLAIR 치료 환자를 최대 5년 동안 추적 관찰한 후속 관찰 연구에서, XOLAIR 치료 환자(12.3)와 비 XOLAIR 치료 환자(13.0) 간의 일차 악성 종양 발생률(1,000 환자년당)은 유사했습니다 [유해 반응 (6.1) 참조]. 그러나 연구의 한계로 인해 XOLAIR를 사용한 악성 종양 위험을 명확하게 배제할 수 없습니다. 연구의 한계에는 관찰 연구 설계, 이전에 XOLAIR에 노출된 환자(88%)의 등록 허용으로 인한 편향, 암 또는 전암 상태 병력이 있는 환자(56%)의 등록이 연구 제외 기준이었던 점, 그리고 높은 연구 중단률(44%)이 포함됩니다.
5.3 급성 천식 증상 및 질병 악화
XOLAIR은 급성 천식 악화를 완화하는 것으로 나타나지 않았습니다. 급성 기관지 경련 또는 천식 발작 치료에는 XOLAIR을 사용하지 마십시오. XOLAIR 치료 시작 후 천식이 조절되지 않거나 악화되는 경우 환자는 의학적 조언을 구해야 합니다.
5.4 코르티코스테로이드 감량
천식 또는 CRSwNP에 대한 XOLAIR 치료 시작 시 전신 또는 흡입 코르티코스테로이드를 갑자기 중단하지 마십시오. 의사의 직접적인 감독하에 코르티코스테로이드를 점진적으로 감량하십시오. CSU 환자의 경우 코르티코스테로이드와 병용한 XOLAIR의 사용은 평가되지 않았습니다.
5.5 호산구 증가 질환
드물게, XOLAIR 치료를 받는 천식 환자에게서 때때로 혈관염의 임상 증상을 보이는 전신성 호산구 증가증이 나타날 수 있으며, 이는 종종 전신 코르티코스테로이드 요법으로 치료되는 Churg-Strauss 증후군과 일치합니다. 이러한 사건은 항상 그런 것은 아니지만, 대개 경구용 코르티코스테로이드 요법의 감량과 관련이 있습니다. 의사는 환자에게서 호산구 증가증, 혈관염 발진, 악화되는 폐 증상, 심장 합병증 및/또는 신경병증이 나타나는지 주의해야 합니다. XOLAIR와 이러한 기저 질환 간의 인과 관계는 확립되지 않았습니다.
5.6 발열, 관절통 및 발진
시판 후 사용에서 일부 환자는 XOLAIR의 첫 번째 또는 그 이후의 주사 후 1일에서 5일 사이에 관절염/관절통, 발진, 발열 및 림프절병증을 포함한 일련의 징후와 증상을 경험했습니다. 일부 환자의 경우 추가 용량 투여 후 이러한 징후와 증상이 재발했습니다. 이러한 경우에 III형 반응과 일치하는 순환 면역 복합체 또는 피부 생검이 관찰되지 않았지만, 이러한 징후와 증상은 혈청병 환자에게서 나타나는 징후와 증상과 유사합니다. 환자에게 이러한 일련의 징후와 증상이 나타나면 의사는 XOLAIR 투여를 중단해야 합니다 [유해 반응 (6.2) 참조].
5.7 기생충(구충) 감염
XOLAIR 치료 중 지리성 구충 감염 위험이 높은 환자를 모니터링합니다. XOLAIR 치료 중단 후 지리성 구충 감염에 필요한 모니터링 기간을 결정할 수 있는 충분한 데이터가 없습니다.
지리성 구충 감염(회충, 구충, 편충, 사상충) 위험이 높은 성인 및 청소년 환자를 대상으로 브라질에서 실시된 1년간의 임상 시험에서 표준 대변 검사로 진단된 감염은 XOLAIR 치료 환자의 53%(36/68)에서 발생한 반면, 위약 대조군에서는 42%(29/69)에서 발생했습니다. 감염에 대한 승산비 점 추정치는 1.96이었으며, 95% 신뢰 구간(0.88, 4.36)은 이 연구에서 감염된 환자가 감염되지 않은 환자보다 XOLAIR를 투여받을 가능성이 0.88배에서 4.36배임을 나타냅니다. 대변 배설란 수로 측정한 적절한 항지리성 구충 감염 치료에 대한 반응은 치료군 간에 차이가 없었습니다.
5.8 검사
XOLAIR:IgE 복합체 형성으로 인해 XOLAIR 투여 후 혈청 총 IgE 수치가 증가합니다 [임상 약리학 (12.2) 참조]. 상승된 혈청 총 IgE 수치는 XOLAIR 중단 후 최대 1년 동안 지속될 수 있습니다. 이러한 수치는 정상 상태의 유리 IgE 수치를 반영하지 않을 수 있으므로, XOLAIR 중단 후 1년 미만에 얻은 혈청 총 IgE 수치를 사용하여 천식, 비용종을 동반한 만성 부비동염 또는 IgE 매개 식품 알레르기 환자의 투여 용량 요법을 재평가하지 마십시오 [투여 및 투약 (2.2), 2.3, 2.4) 참조].
5.9 아나필락시스 응급 치료와 관련된 잠재적 약물 오류
XOLAIR는 아나필락시스를 포함한 알레르기 반응의 응급 치료에 사용해서는 안 됩니다. 사용을 시뮬레이션하기 위한 연구에서 일부 환자와 보호자는 XOLAIR가 아나필락시스를 포함한 알레르기 반응의 응급 치료를 위해 의도된 것이 아님을 이해하지 못했습니다. 아나필락시스를 포함한 알레르기 반응의 응급 치료에 대한 XOLAIR의 안전성 및 유효성은 확립되지 않았습니다. 환자에게 XOLAIR는 식품 알레르겐을 피하면서 아나필락시스를 포함한 알레르기 반응을 줄이기 위한 유지 요법임을 알려주십시오.
6 부작용 반응
다음의 임상적으로 유의한 이상 반응은 라벨의 다른 곳에서 설명됩니다.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응률을 다른 약물의 임상 시험에서의 이상 반응률과 직접 비교할 수 없으며 임상 실습에서 관찰된 이상 반응률을 반영하지 않을 수 있습니다.
12세 이상의 천식 성인 및 청소년 환자에 대한 임상 연구의 이상 반응
아래에 설명된 데이터는 위약 대조 또는 기타 대조 천식 연구에서 6개월 동안 노출된 1687명의 환자와 1년 이상 노출된 555명의 환자를 포함하여 2076명의 12세 이상 성인 및 청소년 환자에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 환자의 평균 연령은 42세였으며, 134명의 환자는 65세 이상이었습니다. 60%는 여성이었고 85%는 백인이었습니다. 환자들은 2주 또는 4주마다 XOLAIR 150mg~375mg을 투여받았거나, 대조군에 배정된 환자의 경우 위약 유무에 관계없이 표준 치료를 받았습니다.
임상적 개입(예: XOLAIR 중단 또는 이상 반응 치료를 위한 병용 약물의 필요성)을 가장 자주 초래하는 이상 반응은 주사 부위 반응(45%), 바이러스 감염(23%), 상기도 감염(20%), 부비동염(16%), 두통(15%), 인두염(11%)이었습니다. 이러한 반응은 XOLAIR 치료 환자와 대조군 환자에서 유사한 비율로 관찰되었습니다.
표 7은 12세 이상의 성인 및 청소년 환자에서 위약을 투여받은 환자보다 XOLAIR를 투여받은 환자에서 1% 이상 발생하고 더 자주 발생한 4건의 위약 대조 천식 시험의 이상 반응을 보여줍니다. 이상 반응은 국제 의학 명명법(IMN) 사전의 선호 용어를 사용하여 분류되었습니다. 주사 부위 반응은 다른 이상 반응 보고와 별도로 기록되었습니다.
나이 (65세 미만 환자 중), 성별 또는 인종에 따라 이상반응 발생률의 차이는 없었습니다.
아나필락시스 증례 대조 연구
후향적 증례 대조 연구에서는 천식 치료를 위해 XOLAIR를 투여받은 환자에서 XOLAIR에 대한 아나필락시스의 위험 요소를 조사했습니다. XOLAIR에 대한 아나필락시스 병력이 있는 증례를 그러한 병력이 없는 대조군과 비교했습니다. 이 연구에서는 XOLAIR 아나필락시스 환자(30명 중 57%)가 대조군(88명 중 23%)에 비해 음식, 약물 또는 기타 원인에 대한 자가 보고 아나필락시스 병력이 더 흔하다는 것을 발견했습니다[OR 8.1, 95% CI 2.7~24.3]. 이것은 증례 대조 연구이기 때문에 XOLAIR 사용자의 아나필락시스 발생률을 제공할 수 없습니다. 다른 출처에 따르면 XOLAIR에 대한 아나필락시스는 임상 시험에서 환자의 0.1%, 시판 후 보고에 따르면 환자의 최소 0.2%에서 관찰되었습니다. 증례의 약 60~70%가 XOLAIR의 처음 세 번의 투여 내에 발생했으며, 세 번째 투여 이후 산발적으로 추가 증례가 발생했습니다. 아나필락시스 발생 시간은 대부분의 증례(약 75%)에서 2시간 이내에 발생하는 것으로 보고되었습니다 [see Warnings and Precautions (5.1), Adverse Reactions (6.2)].
주사 부위 반응
성인 및 청소년에서 모든 중증도의 주사 부위 반응 발생률은 XOLAIR 치료 환자에서 45%, 위약 치료 환자에서 43%였습니다. 주사 부위 반응의 유형에는 멍, 발적, 온감, 작열감, 따끔거림, 가려움증, 두드러기 형성, 통증, 경결, 종괴 및 염증이 포함됩니다.
중증 주사 부위 반응은 위약군 환자에 비해 XOLAIR 치료 환자에서 더 자주 발생했습니다(12% 대 9%).
대부분의 주사 부위 반응은 주사 후 1시간 이내에 발생했으며 8일 미만 지속되었으며 일반적으로 후속 투여 방문 시 빈도가 감소했습니다.
6세~12세 미만 소아 천식 환자에 대한 임상 연구의 이상반응
아래에 설명된 데이터는 위약 대조 또는 기타 대조 천식 연구에서 6개월 동안 노출된 583명의 환자와 1년 이상 노출된 292명의 환자를 포함하여 6세~12세 미만의 926명의 환자에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 소아 환자의 평균 연령은 8.8세였으며, 69%는 남성이었고 64%는 백인이었습니다. 소아 환자는 2주 또는 4주마다 XOLAIR 75mg~375mg을 투여받았거나 대조군에 배정된 환자의 경우 위약 유무에 관계없이 표준 치료를 받았습니다. 이러한 시험에서 XOLAIR로 치료받은 환자에서 악성 종양의 사례는 보고되지 않았습니다.
XOLAIR를 투여받은 소아 환자에서 3% 이상 발생하고 위약 치료 환자보다 더 자주 발생하는 가장 흔한 이상반응은 비인두염, 두통, 발열, 상복부 통증, 연쇄상구균성 인두염, 중이염, 바이러스성 위장염, 절지동물 물림 및 코피였습니다.
가장 자주 임상적 개입(예: XOLAIR 중단 또는 이상반응 치료를 위한 병용 약물의 필요성)을 초래하는 이상반응은 기관지염(0.2%), 두통(0.2%) 및 두드러기(0.2%)였습니다. 이러한 반응은 XOLAIR 치료 환자와 대조군 환자에서 유사한 비율로 관찰되었습니다.
만성 비부비동염(비용종 포함) 성인 환자에 대한 임상 연구의 이상반응
아래에 설명된 데이터는 두 건의 위약 대조 연구에서 6개월 동안 노출된 18세 이상의 135명의 환자에 대한 XOLAIR 노출을 반영합니다. XOLAIR를 투여받은 환자의 평균 연령은 49.7세였으며, 64%는 남성이었고 94%는 백인이었습니다. 환자는 표 3에 따라 2주 또는 4주마다 XOLAIR 또는 위약 SC를 투여받았습니다. 모든 환자는 연구 기간 내내 비강 모메타손 요법을 받았습니다. 표 8에는 만성 비부비동염(비용종 포함)(CRSwNP) 시험 1 및 2에서 XOLAIR 치료 환자의 3% 이상에서 발생하고 위약 치료 환자보다 더 자주 발생하는 이상반응이 나열되어 있습니다. 결과는 종합되었습니다.
IgE 매개 식품 알레르기 환자에 대한 임상 연구의 이상 반응
우발적인 하나 이상의 식품 노출로 발생할 수 있는 아나필락시스를 포함한 IgE 매개 알레르기 반응(제1형) 환자에서 XOLAIR의 안전성은 땅콩 및 최소 두 가지 다른 식품에 알레르기가 있는 168명의 환자(소아 환자 165명 및 성인 3명)를 대상으로 한 무작위, 이중 맹검, 위약 대조 시험인 식품 알레르기(FA) 시험의 데이터를 기반으로 합니다 [see Clinical Studies (14.3)]. 환자들은 치료 시작 전에 측정된 IgE 수치(IU/mL) 및 표 4에 제공된 체중(kg)을 기반으로 권장 복용량에 따라 16~20주 동안 2주 또는 4주마다 XOLAIR 또는 위약을 피하 주사로 투여받았습니다 [see Dosage and Administration (2.4)]. 표 9에 제공된 안전성 데이터는 1세~17세 소아 환자의 주요 분석 집단에서 얻은 것입니다. 이 시험에서 성인(n=3)에게서 얻은 안전성 데이터는 제한적입니다. 표 9에는 FA 시험에서 XOLAIR로 치료받은 소아 환자의 ≥3%에서 발생하고 위약으로 치료받은 환자보다 더 자주 발생한 이상 반응이 나열되어 있습니다. 이상 반응으로 인한 치료 중단은 없었습니다.
만성 특발성 두드러기를 가진 환자를 대상으로 한 임상 연구에서의 이상 반응
만성 특발성 두드러기(CSU) 치료를 위한 XOLAIR의 안전성은 12주(CSU 연구 2) 및 24주(CSU 연구 1 및 3) 기간의 위약 대조, 다중 용량 임상 시험 세 건에서 평가되었습니다. CSU 연구 1과 2에서 환자들은 치료 기간 동안 기준 H1 항히스타민제 치료 수준에 더하여 4주마다 XOLAIR 75mg, 150mg 또는 300mg 또는 위약을 투여받았습니다. CSU 연구 3에서 환자들은 기준 H1 항히스타민제 치료 수준에 더하여 4주마다 XOLAIR 300mg 또는 위약을 무작위로 투여받았습니다. 아래에 설명된 데이터는 세 건의 임상 시험에 등록되어 최소 1회 XOLAIR 용량을 투여받은 733명의 환자에 대한 XOLAIR 노출을 반영하며, 여기에는 12주 동안 노출된 684명의 환자와 24주 동안 노출된 427명의 환자가 포함됩니다. XOLAIR 300mg을 투여받은 환자의 평균 연령은 43세였고, 75%는 여성이었으며, 89%는 백인이었습니다. XOLAIR 150mg 및 75mg을 투여받은 환자의 인구 통계학적 프로필은 유사했습니다.
표 10은 XOLAIR(150mg 또는 300mg)을 투여받은 환자의 ≥2%에서 발생했으며 위약을 투여받은 환자보다 더 자주 발생한 이상 반응을 보여줍니다. 이상 반응은 CSU 연구 2와 CSU 연구 1 및 3의 첫 12주 동안의 데이터를 종합한 것입니다.
만성 특발성 두드러기 임상시험 1상 및 3상의 24주 치료 기간 동안 보고된 추가 반응[졸레어(150mg 또는 300mg) 투여 환자의 2% 이상에서 발생했으며 위약 투여 환자보다 더 빈번하게 발생]에는 치통, 진균 감염, 요로 감염, 근육통, 사지 통증, 근골격계 통증, 말초 부종, 발열, 편두통, 부비동 두통, 불안, 구인두 통증, 천식, 두드러기, 탈모가 포함됩니다.
만성 특발성 두드러기 환자의 주사 부위 반응
연구 기간 동안 모든 중증도의 주사 부위 반응이 위약 투여 환자 2명(0.8%)에 비해 더 많은 졸레어 투여 환자[300mg 투여 환자 11명(2.7%), 150mg 투여 환자 1명(0.6%)]에서 발생했습니다. 주사 부위 반응의 유형에는 부종, 홍반, 통증, 멍, 가려움증, 출혈, 두드러기가 포함되었습니다. 이러한 이상반응으로 인해 연구가 중단되거나 치료가 중단된 경우는 없었습니다.
천식 환자를 대상으로 한 임상 연구에서 심혈관 및 뇌혈관계 이상반응
중등도에서 중증의 지속성 천식과 다년생 공기 알레르겐에 대한 양성 피부 반응 검사를 보인 12세 이상 환자를 대상으로 악성 종양 위험을 포함한 졸레어의 장기 안전성을 평가하기 위해 5년 관찰 코호트 연구를 수행했습니다 [see Warnings and Precautions (5.2)]. 총 5007명의 졸레어 치료 환자와 2829명의 비졸레어 치료 환자가 연구에 등록했습니다. 두 코호트에서 현재 흡연자(5%) 또는 과거 흡연자(29%)의 비율은 비슷했습니다. 환자의 평균 연령은 45세였으며 평균 3.7년 동안 추적 관찰했습니다. 비졸레어 치료 환자(23%)에 비해 더 많은 졸레어 치료 환자(50%)가 중증 천식 진단을 받았으며, 환자의 44%가 조기에 연구를 중단했습니다. 또한 졸레어 치료 코호트 환자의 88%는 이전에 평균 8개월 동안 졸레어에 노출된 적이 있었습니다.
비졸레어 치료 환자(8.1)에 비해 졸레어 치료 환자(13.4)에서 전체 심혈관 및 뇌혈관계 중대한 이상반응(SAE)의 발생률(환자년수 1000명당)이 더 높게 관찰되었습니다. 일과성 허혈 발작(0.7 대 0.1), 심근 경색(2.1 대 0.8), 폐고혈압(0.5 대 0), 폐색전증/정맥 혈전증(3.2 대 1.5), 불안정 협심증(2.2 대 1.4)의 발생률 증가가 관찰되었지만, 허혈성 뇌졸중 및 심혈관계 사망의 발생률은 두 연구 코호트에서 유사했습니다. 결과는 졸레어로 치료받은 환자에서 심혈관 및 뇌혈관계 중대한 이상반응의 위험이 증가할 가능성을 시사합니다. 그러나 관찰 연구 설계, 이전에 졸레어에 노출된 환자 포함(88%), 치료군 간 심혈관 위험 요인의 기준 불균형, 측정되지 않은 위험 요인을 조정할 수 없음, 높은 연구 중단율로 인해 위험의 크기를 정량화하는 능력이 제한됩니다.
위의 관찰 코호트 연구에서 나타난 심혈관 및 뇌혈관계 SAE의 불균형을 추가로 평가하기 위해 8~52주 동안 진행된 25건의 무작위 이중맹검, 위약 대조 임상시험에 대한 통합 분석을 수행했습니다. 총 3342명의 졸레어 치료 환자와 2895명의 위약 치료 환자가 통합 분석에 포함되었습니다. 환자의 평균 연령은 38세였으며 평균 6.8개월 동안 추적 관찰했습니다. 위에 나열된 심혈관 및 뇌혈관계 SAE 발생률에서 주목할 만한 불균형은 관찰되지 않았습니다. 그러나 통합 분석 결과는 관찰 코호트 연구보다 적은 수의 이상반응, 약간 더 젊은 환자, 더 짧은 추적 관찰 기간을 기반으로 했으므로 관찰 코호트 연구에서 나타난 결과를 확인하거나 반박하기에 충분하지 않습니다.
건강한 성인을 대상으로 한 임상 연구의 이상반응
건강한 성인의 주사 부위 반응
300mg/2mL 자동 주사기와 300mg/2mL 사전 충전 주사기를 비교한 건강한 성인을 대상으로 한 공개 임상시험에서 사전 충전 주사기로 치료받은 피험자의 14%(9/64명)에 비해 자동 주사기로 치료받은 피험자의 24%(16/66명)에서 주사 부위 반응(예: 경화, 통증, 홍반, 출혈, 부종, 불편함, 멍, 감각저하, 부기, 가려움증)이 관찰되었습니다.
6.2 시판 후 조사
졸레어 시판 후 사용 중 다음과 같은 이상반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되므로 항상 발생 빈도를 확실하게 추정하거나 약물 노출과의 인과관계를 확립할 수 있는 것은 아닙니다.
아나필락시스: 자발적 보고 및 2003년 6월부터 2006년 12월까지 약 57,300명의 환자에 대한 추정 노출량을 기준으로 졸레어 사용으로 인한 아나필락시스 발생 빈도는 환자의 최소 0.2%로 추정되었습니다.
아나필락시스의 진단 기준은 피부 또는 점막 조직 관련, 기도 손상 및/또는 관련 증상 유무에 관계없이 혈압 감소, 다른 식별 가능한 원인 없이 졸레어 투여와의 시간적 관련성이었습니다. 이러한 보고된 사례의 징후 및 증상에는 기관지 경련, 저혈압, 실신, 두드러기, 목구멍 또는 혀의 혈관부종, 호흡곤란, 기침, 가슴 답답함 및/또는 피부 혈관부종이 포함되었습니다. 사례의 89%에서 폐 관련이 보고되었습니다. 사례의 14%에서 저혈압 또는 실신이 보고되었습니다. 보고된 사례의 15%가 입원으로 이어졌습니다. 졸레어와 관련 없는 이전 아나필락시스 병력은 사례의 24%에서 보고되었습니다.
보고된 XOLAIR로 인한 아나필락시스 사례 중 39%는 첫 번째 투여에서, 19%는 두 번째 투여에서, 10%는 세 번째 투여에서, 나머지는 그 이후 투여에서 발생했습니다. 한 사례는 39회 투여 후(19개월 동안 지속적인 치료 후 3개월 간격을 두고 치료를 재개했을 때 아나필락시스가 발생) 발생했습니다. 이러한 사례에서 아나필락시스 발생까지의 시간은 35%에서 최대 30분, 16%에서 30분 초과 60분 이내, 2%에서 60분 초과 90분 이내, 6%에서 90분 초과 120분 이내, 5%에서 2시간 초과 6시간 이내, 14%에서 6시간 초과 12시간 이내, 8%에서 12시간 초과 24시간 이내, 5%에서 24시간 초과 4일 이내였습니다. 9%의 사례에서는 발생 시간을 알 수 없었습니다.
아나필락시스를 경험한 23명의 환자에게 XOLAIR를 다시 투여했으며 18명의 환자에게서 유사한 아나필락시스 증상이 재발했습니다. 또한 이전에 두드러기만 경험했던 4명의 환자에게서 XOLAIR 재투여 시 아나필락시스가 발생했습니다.
Hematologic: 중증 혈소판 감소증이 보고되었습니다.
7 약물 상호 작용
XOLAIR에 대한 공식적인 약물 상호작용 연구는 수행되지 않았습니다.
천식, CRSwNP 및 IgE 매개 음식 알레르기 환자에서 XOLAIR와 알레르겐 면역 요법의 병용 사용은 평가되지 않았습니다.
CSU 환자에서 면역억제 요법과 함께 XOLAIR를 사용하는 것은 연구되지 않았습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 중 XOLAIR 노출에 대한 등록 연구 결과, 주요 선천적 기형 또는 유산율의 증가는 관찰되지 않았습니다. 그러나 출생 시 평균 재태 기간에도 불구하고 등록된 영아에서 저체중 출산율이 다른 코호트의 영아에 비해 증가했습니다. 하지만 임신 중 XOLAIR를 복용한 여성은 천식이 더 심했기 때문에 저체중이 약물 때문인지 질병의 중증도 때문인지 판단하기 어렵습니다 [자료 참조]. 임신 중 천식이 잘 조절되지 않거나 중등도로 조절되지 않을 경우 위험이 있습니다 [임상적 고려 사항 참조].
인간 IgG 항체는 태반 장벽을 통과하는 것으로 알려져 있습니다. 따라서 XOLAIR는 어머니로부터 태아로 전달될 수 있습니다.
동물 생식 연구에서, 최대 권장 인체 용량(MRHD)의 약 5배에 해당하는 피하 투여량의 omalizumab을 투여한 Cynomolgus 원숭이에서 태아 손상의 증거는 관찰되지 않았습니다 [자료 참조].
해당 인구집단(들)에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 배경 위험은 각각 2%~4% 및 15%~20%로 추정됩니다.
임상적 고려 사항
질병 관련 모체 및/또는 배아/태아 위험
천식이 잘 조절되지 않거나 중등도로 조절되지 않는 여성의 경우, 어머니에게는 임신중독증 위험이 증가하고 신생아에게는 조산, 저체중 및 재태 연령에 비해 작은 체구의 위험이 증가한다는 증거가 있습니다. 임산부의 천식 조절 수준을 면밀히 모니터링하고 필요에 따라 치료를 조정하여 최적의 조절을 유지해야 합니다.
자료
인체 자료
2006년부터 2018년까지 미국에서 실시된 전향적 코호트 임신 노출 등록 연구에는 XOLAIR로 치료받은 천식이 있는 임산부 250명이 포함되었습니다. 이 중 246명의 환자가 임신 첫 삼 분기에 XOLAIR에 노출되었으며, 중앙값 노출 기간은 8.7개월이었습니다.
해당 모체 및 영아 하위 그룹에 대한 등록 결과는 캐나다 퀘벡 주 거주자의 의료 데이터베이스에서 확인된 XOLAIR에 노출되지 않은 천식이 있는 임산부 1,153명으로 구성된 질병 일치 외부 코호트(퀘벡 외부 비교 코호트(“비교 코호트”))의 연령 조정 빈도와 비교되었습니다.
해당 등록 영아 중 주요 선천적 기형의 유병률(8.1%)은 비교 코호트 영아의 유병률(8.9%)과 유사했습니다. 해당 등록 임신 중 99.1%가 생존아 출산으로 이어졌으며, 이는 비교 코호트의 99.3%와 유사했습니다. 등록 영아의 저체중 출산율(13.7%)은 비교 코호트(9.8%)에 비해 증가했지만, 임신 중 XOLAIR를 복용한 여성은 천식이 더 심했기 때문에 저체중이 약물 때문인지 질병의 중증도 때문인지 판단하기 어렵습니다.
등록 연구는 관찰 연구의 특성, 표본 크기가 작고 등록 인구와 비교 코호트 간의 잠재적 차이를 포함한 방법론적 한계로 인해 어떠한 위험도 없다는 것을 확실하게 밝힐 수 없습니다.
동물 자료
Cynomolgus 원숭이를 대상으로 생식 연구가 수행되었습니다. 기관 형성 기간 동안 omalizumab을 투여했을 때, 최대 권장 인체 용량(MRHD)의 약 5배에 해당하는 노출을 유발하는 용량(모체 피하 투여량 최대 75mg/kg/주 기준 mg/kg)에서 모체 독성, 배아 독성 또는 기형 발생의 증거는 없었습니다. omalizumab은 후기 임신 기간, 분만 및 수유 기간 동안 투여했을 때 태아 또는 신생아 성장에 부작용을 일으키지 않았습니다.
8.2 수유
위험 요약
모유 내 omalizumab의 존재 여부 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다. 그러나 omalizumab은 인간 단클론 항체(IgG1 kappa)이며, 면역글로불린(IgG)은 소량으로 모유에 존재합니다.
임신 노출 등록 연구에 참여한 영아의 대부분(80.9%, 186/230)은 모유 수유를 받았습니다. 모유 수유를 통해 XOLAIR에 노출된 영아와 모유 수유를 하지 않은 영아 또는 XOLAIR에 노출되지 않고 모유 수유를 한 영아를 비교했을 때, “감염 및 기생충 감염”으로 분류된 사건은 유의하게 증가하지 않았습니다.
모유 수유의 발달 및 건강상 이점을 어머니의 XOLAIR에 대한 임상적 필요성과 omalizumab 또는 기저 모체 질환으로 인해 모유 수유를 하는 아동에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
천식
만 6세 이상 소아 환자에서 다년생 항원에 대한 양성 피부 반응 검사 또는 시험관 내 반응성이 있고 흡입용 코르티코스테로이드로 증상 조절이 불충분한 중등도에서 중증의 지속성 천식 환자에 대한 XOLAIR의 안전성 및 유효성이 입증되었습니다. 이 적응증에 대한 XOLAIR의 사용은 적절하고 잘 통제된 연구 결과를 바탕으로 합니다. XOLAIR는 다년생 항원에 대한 양성 피부 반응 검사 또는 시험관 내 반응성이 있는 중등도에서 중증의 지속성 천식 환자 926명(XOLAIR 624명, 플라시보 302명)의 소아 환자(6세~12세 미만)를 대상으로 한 2건의 임상시험에서 평가되었습니다. 한 임상시험은 성인 및 청소년 천식 임상시험 1상 및 2상과 유사한 설계 및 수행 방식의 주요 임상시험이었습니다. 다른 임상시험은 주로 안전성 연구였으며 유효성을 2차 결과로 평가했습니다. 주요 임상시험에서 XOLAIR 치료 환자는 악화율이 통계적으로 유의하게 감소했습니다(악화는 전신 코르티코스테로이드 치료가 필요하거나 기준 ICS 용량의 2배가 필요한 천식 악화로 정의됨) [임상 연구(14.1) 참조].
만 6세 미만 소아 천식 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
비강용종을 동반한 만성 부비동염
만 18세 미만 소아 환자에서 비강용종을 동반한 만성 부비동염(CRSwNP)에 대한 안전성 및 유효성은 확립되지 않았습니다.
IgE 매개 식품 알레르기
우발적인 하나 이상의 식품 노출로 발생할 수 있는 알레르기 반응(I형), 아나필락시스를 포함한 IgE 매개 식품 알레르기가 있는 만 1세 이상 소아 환자에서 알레르기 반응 감소에 대한 XOLAIR의 안전성 및 유효성이 입증되었습니다. 이 적응증에 대한 XOLAIR의 사용은 총 165명의 소아 환자(만 1세~만 6세 미만 61명, 만 6세~만 18세 미만 104명)를 포함한 적절하고 잘 통제된 연구 결과를 바탕으로 합니다. 플라시보 치료 환자와 비교하여 XOLAIR 치료 환자에서 용량 제한 증상 없이 단일 식품(땅콩, 캐슈너트, 우유, 계란)을 섭취할 수 있는 비율이 유의하게 높았습니다 [임상 연구(14.3) 참조].
만 1세 미만 IgE 매개 식품 알레르기 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
만성 자발성 두드러기
H1 항히스타민제 치료에도 불구하고 증상이 지속되는 만성 자발성 두드러기(CSU) 환자에서 만 12세 이상 소아 환자에 대한 XOLAIR의 안전성 및 유효성이 입증되었습니다. 이 집단에서 XOLAIR의 사용은 적절하고 잘 통제된 연구 결과를 바탕으로 합니다. CSU가 있는 청소년 환자는 3건의 무작위, 플라시보 대조 CSU 임상시험에 포함된 만 12세~17세 환자 39명(XOLAIR 29명, 플라시보 10명)에서 평가되었습니다. 주간 가려움증 점수의 수치적 감소가 관찰되었으며, 이상 반응은 만 18세 이상 환자에서 보고된 이상 반응과 유사했습니다.
만 12세 미만 CSU 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 환자에 대한 사용
임상 연구에서 만 65세 이상 천식 환자 134명, CRSwNP 환자 20명, CSU 환자 37명 및 IgE 매개 식품 알레르기 환자 0명이 XOLAIR로 치료되었습니다. 이러한 연구에서 연령 관련 차이가 명확하게 관찰되지 않았지만, 만 65세 이상 환자 수가 충분하지 않아 더 젊은 환자와 반응이 다른지 여부를 확인할 수 없습니다.
11 설명
오말리주맙은 재조합 DNA 유래의 인간화 IgG1κ 단클론 항체로, 인간 면역글로불린 E(IgE)에 선택적으로 결합합니다. 이 항체의 분자량은 약 149 kDa입니다. XOLAIR는 중국 햄스터 난소 세포 현탁 배양에 의해 생산됩니다.
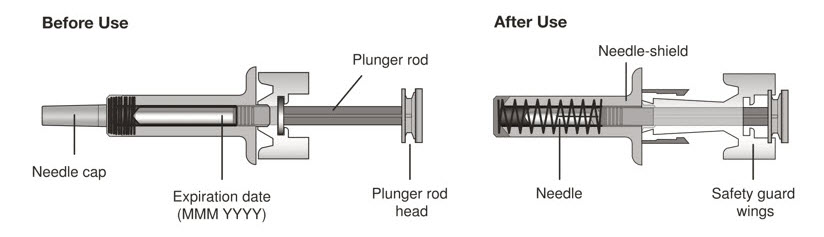
XOLAIR (오말리주맙)는 피하(SC) 주사제로 투여되며, 프리필드 시린지, 오토인젝터 및 바이알 형태로 제공됩니다.
XOLAIR 주사제 (프리필드 시린지 또는 오토인젝터)
XOLAIR (오말리주맙) 주사제는 무균, 방부제 무첨가, 무색 투명 내지 약간 불투명하고 무색에서 연한 갈색을 띠는 피하 주사용 용액으로 제공됩니다. XOLAIR (오말리주맙) 주사제는 1회용 프리필드 시린지 또는 1회용 오토인젝터로 제공됩니다.
75mg 프리필드 시린지 또는 오토인젝터 각각은 0.5mL에 오말리주맙 75mg을 함유하며, 아르기닌염산염 (21.05mg), 히스티딘 (0.68mg), L-히스티딘염산염 일수화물 (1.17mg), 폴리소르베이트 20 (0.2mg)을 주사용수(SWFI), USP에 함유하고 있습니다.
150mg 프리필드 시린지 또는 오토인젝터 각각은 1mL에 오말리주맙 150mg을 함유하며, 아르기닌염산염 (42.1mg), 히스티딘 (1.37mg), L-히스티딘염산염 일수화물 (2.34mg), 폴리소르베이트 20 (0.4mg)을 SWFI, USP에 함유하고 있습니다.
300mg 프리필드 시린지 또는 오토인젝터 각각은 2mL에 오말리주맙 300mg을 함유하며, 아르기닌염산염 (84.2mg), 히스티딘 (2.74mg), L-히스티딘염산염 일수화물 (4.68mg), 폴리소르베이트 20 (0.8mg)을 SWFI, USP에 함유하고 있습니다.
26 게이지 고정 바늘이 있는 XOLAIR 75mg/0.5mL 및 150mg/mL 프리필드 시린지의 바늘캡에는 천연 고무 라텍스 유도체가 포함되어 있어 라텍스에 과민한 사람에게 알레르기 반응을 일으킬 수 있습니다 [제공 형태/보관 및 취급 (16) 참조].
XOLAIR 오토인젝터는 천연 고무 라텍스로 만들어지지 않았습니다.
주사용 XOLAIR (바이알)
주사용 XOLAIR (오말리주맙)는 무균, 백색, 방부제 무첨가 동결건조 분말로 1회용 바이알에 들어 있습니다. 주사용수(SWFI), USP 1.4mL로 재구성한 후, 바이알에는 피하 주사용 재구성 용액 1.2mL당 오말리주맙 150mg이 함유되어 있습니다. 재구성된 용액 1.2mL에는 히스티딘 (1.3mg), L-히스티딘염산염 일수화물 (2.1mg), 폴리소르베이트 20 (0.4mg) 및 수크로스 (108mg)도 함유되어 있습니다.
12 약물동력학
12.1 작용 기전
천식, 비용종을 동반한 만성 비부비동염 및 IgE 매개 식품 알레르기
Omalizumab은 비만세포, 호염기구 및 수지상 세포 표면의 고친화도 IgE 수용체(FcεRI)에 대한 IgE의 결합을 억제하여 이러한 세포에서 FcεRI의 하향 조절을 유도합니다.
알레르기성 천식 환자에서 omalizumab 치료는 IgE 매개 염증을 억제하는데, 이는 감소된 혈액 및 조직 호산구와 IL-4, IL-5 및 IL-13을 포함한 감소된 염증 매개체로 입증됩니다.
만성 자발적 두드러기
Omalizumab은 IgE에 결합하여 유리 IgE 수치를 낮춥니다. 그 후 세포의 IgE 수용체(FcεRI)가 하향 조절됩니다. omalizumab의 이러한 효과가 만성 자발적 두드러기(CSU) 증상의 개선으로 이어지는 기전은 알려져 있지 않습니다.
12.2 약력학
천식
임상 연구에서 혈청 유리 IgE 수치는 첫 번째 투여 후 1시간 이내에 용량 의존적으로 감소했으며, 투여 간격 사이에 유지되었습니다. 권장 용량을 사용하여 평균 혈청 유리 IgE 감소는 96% 이상이었습니다. 유리 IgE에 비해 제거 속도가 느린 omalizumab:IgE 복합체의 형성으로 인해 첫 번째 투여 후 혈청 총 IgE 수치(즉, 결합 및 비결합)가 증가했습니다. 표준 분석법을 사용할 때 첫 번째 투여 후 16주 후 평균 혈청 총 IgE 수치는 치료 전에 비해 5배 더 높았습니다. XOLAIR 투여 중단 후 XOLAIR 유도 총 IgE 증가 및 유리 IgE 감소는 가역적이었으며 약물 세척 후 IgE 수치의 반등은 관찰되지 않았습니다. 총 IgE 수치는 XOLAIR 투여 중단 후 1년까지 치료 전 수치로 돌아가지 않았습니다.
비용종을 동반한 만성 비부비동염
비용종을 동반한 만성 비부비동염(CRSwNP) 환자를 대상으로 한 임상 연구에서 omalizumab 치료는 천식 환자에서 관찰된 것과 유사하게 혈청 유리 IgE 감소 및 혈청 총 IgE 수치 증가로 이어졌습니다. CRSwNP 시험 1 및 2에서 기준선의 평균 총 IgE 농도는 각각 168 IU/mL 및 218 IU/mL였습니다. 표 3에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 평균 투여 전 유리 IgE 농도는 CRSwNP 시험 1에서 10.0 IU/mL, CRSwNP 시험 2에서 11.7 IU/mL였으며, 24주 치료 시에도 안정적으로 유지되었습니다. 유리 IgE에 비해 제거 속도가 느린 omalizumab-IgE 복합체의 형성으로 인해 혈청 총 IgE 수치가 증가했습니다. 표 3에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 평균 및 중앙값 투여 전 혈청 총 IgE 수치는 치료 전 수치보다 3~4배 더 높았으며, 16주와 24주 사이에 안정적으로 유지되었습니다.
IgE 매개 식품 알레르기
IgE 매개 식품 알레르기 환자를 대상으로 한 임상 연구에서 omalizumab 치료는 천식 환자에서 관찰된 것과 유사하게 혈청 유리 IgE 감소 및 혈청 총 IgE 수치 증가로 이어졌습니다. 기준선의 평균 총 IgE 농도는 810 IU/mL였습니다. 표 4에 따른 용량 및 빈도로 2주 또는 4주마다 반복 투여한 후, 16주차의 평균 투여 전 유리 IgE 농도는 10.0 IU/mL였습니다. 유리 IgE에 비해 반감기가 더 긴 omalizumab-IgE 복합체의 형성으로 인해 혈청 평균 총 IgE 수치가 약 2.4배 증가했습니다.
만성 자발적 두드러기
만성 자발적 두드러기(CSU) 환자를 대상으로 한 임상 연구에서 XOLAIR 치료는 천식 환자에서 관찰된 것과 유사하게 혈청 유리 IgE의 용량 의존적 감소 및 혈청 총 IgE 수치 증가로 이어졌습니다. 유리 IgE의 최대 억제는 첫 번째 피하 투여 후 3일째에 관찰되었습니다. 4주마다 한 번씩 반복 투여한 후, 12주와 24주 사이에 투여 전 혈청 유리 IgE 수치는 안정적으로 유지되었습니다. 유리 IgE에 비해 제거 속도가 느린 omalizumab-IgE 복합체의 형성으로 인해 첫 번째 투여 후 혈청 총 IgE 수치가 증가했습니다. 75mg에서 최대 300mg까지 4주마다 한 번씩 반복 투여한 후, 12주차의 평균 투여 전 혈청 총 IgE 수치는 치료 전 수치보다 2~3배 더 높았으며, 12주와 24주 사이에 안정적으로 유지되었습니다. XOLAIR 투여 중단 후 유리 IgE 수치는 증가하고 총 IgE 수치는 16주 추적 관찰 기간 동안 치료 전 수치로 감소했습니다.
12.3 약동학
피하 투여 후 omalizumab은 평균 절대 생체 이용률 62%로 흡수되었습니다. 천식 성인 및 청소년 환자에서 단일 피하 투여 후 omalizumab은 천천히 흡수되어 평균 7~8일 후에 최고 혈청 농도에 도달했습니다. CSU 환자에서 단일 피하 투여 후 최고 혈청 농도는 유사한 시간에 도달했습니다. omalizumab의 약동학은 0.5mg/kg 이상의 용량에서 선형이었습니다. 천식 환자에서 여러 번 XOLAIR를 투여한 후, 정상 상태에서 0일부터 14일까지의 혈청 농도-시간 곡선 아래 면적은 첫 번째 투여 후 면적의 최대 6배였습니다. CSU 환자에서 omalizumab은 단일 피하 투여로 75mg에서 600mg의 용량 범위에서 선형 약동학을 나타냈습니다. 4주마다 75mg에서 300mg까지 반복 투여한 후, omalizumab의 골 혈청 농도는 용량 수준에 비례하여 증가했습니다.
시험관 내에서, 오말리주맙은 제한된 크기의 IgE 복합체를 형성했습니다. 침전 복합체 및 분자량이 1백만 달톤을 초과하는 복합체는 시험관 내 또는 생체 내에서 관찰되지 않았습니다. Cynomolgus 원숭이를 대상으로 한 조직 분포 연구에서는 어떤 기관이나 조직에서도 125I-오말리주맙의 특이적인 흡수가 나타나지 않았습니다. 피하 투여 후 천식 환자에서 오말리주맙의 명백한 분포 용적은 78 ± 32 mL/kg이었습니다. CSU 환자의 경우, 모집단 약동학에 기초하여, 오말리주맙의 분포는 천식 환자의 경우와 유사했습니다.
오말리주맙의 청소율에는 IgG 청소율 과정뿐만 아니라 표적 리간드인 IgE와의 특이적 결합 및 복합체 형성을 통한 청소율이 포함되었습니다. IgG의 간 제거에는 간 망상 내피계(RES) 및 내피 세포에서의 분해가 포함되었습니다. 온전한 IgG는 담즙으로도 배설되었습니다. 마우스와 원숭이를 대상으로 한 연구에서, 오말리주맙:IgE 복합체는 RES 내의 Fcγ 수용체와의 상호 작용을 통해 제거되었으며, 그 속도는 일반적으로 IgG 청소율보다 빨랐습니다. 천식 환자에서 오말리주맙 혈청 제거 반감기는 평균 26일이었으며, 명백한 청소율은 평균 2.4 ± 1.1 mL/kg/일이었습니다. 체중이 두 배가 되면 명백한 청소율도 약 두 배가 되었습니다. CSU 환자의 경우, 정상 상태에서 모집단 약동학에 기초하여, 오말리주맙 혈청 제거 반감기는 평균 24일이었으며, 명백한 청소율은 평균 240 mL/일이었습니다(80kg 환자의 경우 3.0 mL/kg/일에 해당).
특정 집단
천식
오말리주맙의 모집단 약동학은 천식 환자에서 인구 통계적 특성의 영향을 평가하기 위해 분석되었습니다. 이러한 데이터 분석 결과 연령(6~76세), 인종, 민족 또는 성별에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다.
비용종을 동반한 만성 부비동염
오말리주맙의 모집단 약동학 분석 결과 비용종을 동반한 만성 부비동염(CRSwNP) 환자에서 오말리주맙의 약동학적 특성은 천식 환자의 경우와 일치하는 것으로 나타났습니다. 오말리주맙 노출 및 임상 반응에 대한 인구 통계적 특성 및 기타 요인의 영향을 평가하기 위해 그래픽 공변량 분석이 수행되었습니다. 이러한 분석 결과 연령(18~75세) 또는 성별에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다. CRSwNP 연구에서는 인종 및 민족 데이터가 너무 제한적이어서 용량 조절 정보를 제공할 수 없습니다.
IgE 매개 식품 알레르기
오말리주맙의 모집단 약동학(PK) 분석 결과 IgE 매개 식품 알레르기 환자에서 오말리주맙의 PK는 일반적으로 천식 환자의 경우와 일치하는 것으로 나타났습니다. 오말리주맙 노출 및 임상 반응에 대한 인구 통계적 특성 및 기타 요인의 영향을 평가하기 위해 공변량 분석이 수행되었습니다. 이러한 분석 결과 연령(1세 이상), 인종, 민족 또는 성별에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다.
만성 자발성 두드러기
만성 자발성 두드러기(CSU) 환자에서 오말리주맙 노출에 대한 인구 통계적 특성 및 기타 요인의 영향을 평가하기 위해 오말리주맙의 모집단 약동학이 분석되었습니다. 오말리주맙 농도와 임상 반응 간의 관계를 분석하여 공변량 효과를 평가했습니다. 이러한 분석 결과 연령(12~75세), 인종/민족, 성별, 체중, 체질량 지수 또는 기준 IgE 수치에 따른 용량 조절이 필요하지 않은 것으로 나타났습니다.
12.6 면역원성
관찰된 항체 생성율은 분석의 민감도와 특이도에 따라 크게 달라집니다. 분석 방법의 차이로 인해 아래에 설명된 연구에서 관찰된 항체 생성율을 다른 연구(XOLAIR 또는 기타 오말리주맙 제품 포함)에서 관찰된 항체 생성율과 의미 있게 비교할 수 없습니다.
천식 환자를 대상으로 한 임상 연구에서 12세 이상 환자에게 XOLAIR를 투여받은 환자 중 약 1/1723(<0.1%)에서 XOLAIR에 대한 항체가 검출되었습니다. 소아를 대상으로 한 3건의 연구에서, XOLAIR를 투여받고 항체를 평가받은 6~12세 미만 환자 581명 중 1명에서 XOLAIR에 대한 항체가 검출되었습니다. CSU 임상 시험에서 치료받은 환자에게서는 검출 가능한 항체가 없었지만, 항치료 항체 샘플링 당시 XOLAIR 수치 및 일부 환자의 샘플 누락으로 인해 이러한 임상 연구에서 치료받은 733명 환자 중 88%에서만 XOLAIR에 대한 항체를 확인할 수 있었습니다. 이 데이터는 ELISA 분석에서 XOLAIR에 대한 항체에 대해 양성으로 간주된 환자의 비율을 반영하며, 분석의 민감도와 특이도에 크게 의존합니다.
CRSwNP 또는 IgE 매개 식품 알레르기 시험에서는 항체가 측정되지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
XOLAIR의 발암 가능성을 평가하기 위한 장기 연구는 동물을 대상으로 수행되지 않았습니다.
피하 투여 용량이 최대 75 mg/kg/주 (체중 kg당 최대 권장 인체 용량의 약 5배)인 XOLAIR를 투여받은 수컷 및 암컷 시노몰구스 원숭이에서 생식능력 및 생식 능력에 대한 영향은 없었습니다.
14 CLINICAL STUDIES
14.1 천식
12세 이상 성인 및 청소년 환자
XOLAIR의 안전성과 유효성은 무작위, 이중맹검, 위약대조, 다기관 시험 세 건에서 평가되었습니다.
이 시험에는 중등도에서 중증의 지속성(NHLBI 기준) 천식을 최소 1년 이상 앓고 있고, 다년생 공기 알레르겐에 대한 피부 검사 반응이 양성인 12세에서 76세 사이의 환자가 등록되었습니다. 모든 시험에서 XOLAIR 용량은 체중과 기준 혈청 총 IgE 농도를 기준으로 했습니다. 모든 환자는 기준 IgE가 30~700 IU/mL이고 체중이 150kg 이하여야 했습니다. 환자들은 4주마다 최소 0.016mg/kg/IU(IgE/mL)의 XOLAIR 또는 동일한 양의 위약을 투여하기 위해 용량표에 따라 치료를 받았습니다. 4주마다 최대 XOLAIR 용량은 750mg이었습니다.
세 가지 시험 모두에서 악화는 전신 코르티코스테로이드 치료 또는 기준 ICS 용량의 두 배가 필요한 천식 악화로 정의되었습니다. 대부분의 악화는 외래 환자 환경에서 관리되었으며 대다수는 전신 스테로이드로 치료되었습니다. 입원율은 XOLAIR 치료 환자와 위약 치료 환자 간에 유의미한 차이가 없었지만, 전체 입원율은 낮았습니다. 악화를 경험한 환자 중 악화 중증도 분포는 치료군 간에 유사했습니다.
천식 시험 1 및 2
스크리닝 시 천식 시험 1 및 2의 환자는 1초간 강제 호기량(FEV1)이 예상치의 40%에서 80% 사이였습니다. 모든 환자는 베타2-작용제 투여 후 FEV1이 최소 12% 개선되었습니다. 모든 환자는 증상이 있었고 흡입 코르티코스테로이드(ICS)와 속효성 베타2-작용제로 치료를 받고 있었습니다. 다른 병용 조절제를 투여받는 환자는 제외되었으며, 연구 중 추가 조절제 시작은 금지되었습니다. 현재 흡연 중인 환자는 제외되었습니다.
각 시험은 공통 ICS(베클로메타손 디프로피오네이트)로 안정적으로 전환하기 위한 준비 기간으로 구성되었으며, 그 후 XOLAIR 또는 위약에 무작위 배정되었습니다. 환자들은 급성 악화로 인해 증량이 필요한 경우를 제외하고 변경되지 않은 코르티코스테로이드 용량으로 16주 동안 XOLAIR를 투여받았습니다. 그런 다음 환자들은 12주간의 ICS 감량 단계에 들어갔고, 이 기간 동안 단계적으로 ICS 용량 감량을 시도했습니다.
연구 기간 동안 각 그룹의 환자당 천식 악화 횟수 분포는 안정적인 스테로이드 기간과 스테로이드 감량 기간에 대해 별도로 분석되었습니다.
천식 시험 1과 2 모두에서 환자당 악화 횟수는 위약에 비해 XOLAIR로 치료받은 환자에서 감소했습니다(표 11).
이러한 시험에서는 기류 측정(FEV1)과 천식 증상도 평가했습니다. 치료 관련 차이의 임상적 관련성은 알려져 있지 않습니다. 안정적인 스테로이드 단계 천식 시험 1의 결과는 표 12에 나와 있습니다. 천식 시험 2의 안정적인 스테로이드 단계와 천식 시험 1과 2의 스테로이드 감량 단계의 결과는 표 12에 제시된 결과와 유사했습니다.
천식 임상시험 3
천식 임상시험 3에서는 FEV1 선별 기준에 제한이 없었으며, 천식 임상시험 1 및 2와 달리 지속성 베타2-작용제가 허용되었습니다. 환자들은 최소 1000 µg/일의 플루티카손 프로피오네이트를 투여받았으며, 일부 환자들은 경구 코르티코스테로이드도 투여받았습니다. 다른 병용 조절제를 투여받는 환자는 제외되었으며, 연구 중 추가 조절제의 시작은 금지되었습니다. 현재 흡연 중인 환자는 제외되었습니다.
이 임상시험은 공통 ICS(플루티카손 프로피오네이트)로 안정적인 전환을 달성하기 위한 준비 기간으로 구성되었으며, 그 후 XOLAIR 또는 위약에 무작위 배정되었습니다. 환자들은 ICS 단독 사용 또는 경구 스테로이드와 병용 ICS 사용으로 계층화되었습니다. 환자들은 급성 악화로 인해 증량이 필요한 경우를 제외하고는 변경되지 않은 코르티코스테로이드 용량으로 16주 동안 XOLAIR를 투여받았습니다. 그런 다음 환자들은 16주간의 ICS 감량 단계에 들어갔으며, 이 기간 동안 ICS 또는 경구 스테로이드 용량 감량이 단계적으로 시도되었습니다.
XOLAIR로 치료받은 환자의 악화 횟수는 위약으로 치료받은 환자의 악화 횟수와 유사했습니다(표 13). 관찰된 치료 효과가 없는 것은 천식 임상시험 1 및 2와 비교한 환자 집단의 차이, 연구 표본 크기 또는 기타 요인과 관련이 있을 수 있습니다.
세 가지 임상시험 모두에서 무작위 배정 당시 FEV1이 80%를 초과한 XOLAIR 치료 환자에서 천식 악화 감소가 관찰되지 않았습니다. 유지 요법으로 경구 스테로이드가 필요한 환자에서는 악화 감소가 나타나지 않았습니다.
6세~12세 미만 소아 환자
중등도에서 중증 천식이 있는 6세~12세 미만 소아 환자에서 XOLAIR의 안전성과 유효성은 무작위 배정, 이중 눈가림, 위약 대조, 다기관 임상시험(천식 임상시험 4 [NCT00079937]) 및 추가 지원 연구(천식 임상시험 5)를 기반으로 합니다.
천식 임상시험 4는 흡입 코르티코스테로이드(플루티카손 프로피오네이트 DPI ≥200mcg/일 또는 동등한 용량)와 기타 천식 조절제 병용 여부에 관계없이 적절하게 조절되지 않는 중등도에서 중증 천식이 있는 6세~12세 미만 소아 환자 628명을 대상으로 추가 요법으로서 XOLAIR의 안전성과 유효성을 평가한 52주 연구였습니다. 적격 환자는 천식 진단을 받은 지 1년 이상 경과했고, 최소 하나의 다년생 공기 알레르겐에 대한 피부 단자 검사 양성이었으며, 연구 참여 전 1년 이내에 주간 및/또는 야간 증상 및 악화와 같은 임상적 특징의 병력이 있는 환자였습니다. 치료 첫 24주 동안 스테로이드 용량은 기준치에서 일정하게 유지되었습니다. 이후 28주 동안 흡입 코르티코스테로이드 조정이 허용되었습니다.
주요 유효성 변수는 24주 고정 스테로이드 치료 단계 동안의 천식 악화율이었습니다. 천식 악화는 연구자의 임상적 판단에 따라 천식 증상의 악화로 정의되었으며, 기준 흡입 코르티코스테로이드 용량의 2배 이상을 최소 3일 동안 투여하거나 구조용 전신(경구 또는 IV) 코르티코스테로이드로 최소 3일 동안 치료해야 했습니다. 24주차에 XOLAIR 그룹은 통계적으로 유의미하게 낮은 천식 악화율(0.45 vs. 0.64)을 보였으며 추정 비율은 0.69(95% CI: 0.53, 0.90)였습니다.
XOLAIR 그룹은 또한 전체 52주 이중 눈가림 치료 기간 동안 위약에 비해 천식 악화율이 더 낮았습니다(0.78 vs. 1.36; 비율: 0.57; 95% CI: 0.45, 0.72). 야간 증상 점수, 베타-작용제 사용 및 기류 측정(FEV1)과 같은 기타 유효성 변수는 위약에 비해 XOLAIR 치료 환자에서 유의미한 차이가 없었습니다.
천식 임상시험 5는 흡입 코르티코스테로이드(베클로메타손 디프로피오네이트 168-420mcg/일)로 잘 조절된 중등도에서 중증 천식이 있는 소아 환자 334명(그중 298명은 6세~12세 미만)을 대상으로 안전성을 주로 평가한 28주 무작위 배정, 이중 눈가림, 위약 대조 연구였습니다. 16주 스테로이드 치료 기간 후 12주 스테로이드 용량 감량 기간이 이어졌습니다. XOLAIR로 치료받은 환자는 16주 고정 스테로이드 치료 기간(0.18 vs. 0.32; 비율: 0.58; 95% CI: 0.35, 0.96)과 28주 치료 기간(0.38 vs. 0.76; 비율: 0.50; 95% CI: 0.36, 0.71) 모두에서 위약에 비해 천식 악화가 더 적었습니다.
14.2 비용종을 동반한 만성 부비동염
18세 이상 성인 환자
XOLAIR의 안전성과 유효성은 비강 코르티코스테로이드에 대한 반응이 불충분한 비용종을 동반한 만성 부비동염(CRSwNP) 환자를 등록한 두 건의 무작위 배정, 다기관, 이중 눈가림, 위약 대조 임상시험(CRSwNP 임상시험 1 [NCT03280550] 및 CRSwNP 임상시험 2 [NCT03280537])에서 평가되었습니다(CRSwNP 임상시험 1, n=138; CRSwNP 임상시험 2, n=127). 환자들은 표 3에 따라 2주 또는 4주마다 XOLAIR 또는 위약 SC를 24주 동안 투여받았으며, 이후 4주 추적 관찰 기간을 거쳤습니다. 모든 환자는 치료 기간과 5주 예비 기간 동안 비강 모메타손 요법을 병행했습니다. 무작위 배정 전에 환자들은 예비 기간 동안 비강 모메타손을 사용했음에도 불구하고 비용종 점수(NPS) ≥ 5(각 비강 NPS ≥ 2)로 판단되는 양측 비용종의 증거가 있어야 했습니다. NPS는 내시경을 통해 측정되었으며 총 NPS(범위 0-8)에 대해 점수가 매겨졌습니다(비강당 범위 0-4: 0= 비용종 없음; 1=중비도에 있는 작은 비용종으로 중비갑개의 하단 경계 아래로 도달하지 않음; 2=중비갑개의 하단 경계 아래로 도달하는 비용종; 3=하비갑개의 하단 경계에 도달하는 큰 비용종 또는 중비갑개 내측의 비용종; 4=하비강의 완전 폐쇄를 유발하는 큰 비용종). 또한 환자들은 무작위 배정 전에 비강 모메타손을 사용했음에도 불구하고 주간 평균 비강 혼잡 점수(NCS)가 1보다 높아야 했습니다. 비강 혼잡은 0~3점 심각도 척도(0=없음, 1=경증, 2=중등도, 3=중증)에 대한 일일 평가로 측정되었습니다. 이전 부비동 수술 또는 이전 전신 코르티코스테로이드 사용은 임상시험에 포함하기 위한 요건이 아니었으며 부비동 불투명도를 평가하기 위해 부비동 CT 스캔을 수행하지 않았습니다. 알레르기 동반 질환을 포함한 인구 통계 및 기준 특성은 표 14에 설명되어 있습니다.
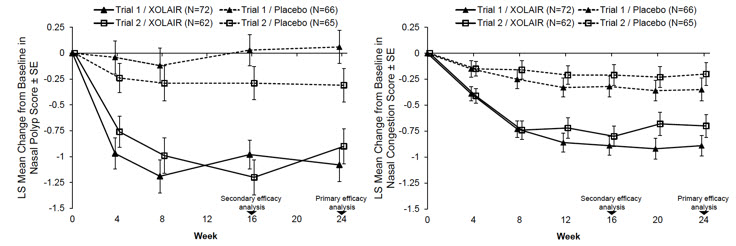
CRSwNP 임상시험 1 및 2의 공동 1차 평가변수는 24주차의 NPS 및 일일 평균 NCS였습니다. 두 임상시험 모두에서 XOLAIR를 투여받은 환자는 위약을 투여받은 환자보다 24주차에 NPS 및 주간 평균 NCS에서 기준치 대비 통계적으로 유의미하게 더 큰 개선을 보였습니다. CRSwNP 임상시험 1 및 2의 결과는 표 15에 나와 있습니다.
그림 1에서 볼 수 있듯이 두 연구 모두에서 위약군에 비해 XOLAIR군의 NPS 및 NCS의 더 큰 개선은 4주차의 첫 번째 평가에서 관찰되었습니다.
각 연구 주차별 치료군의 평균 NPS 및 NCS는 그림 1에 나와 있습니다.
XOLAIR는 위약 대비 후각 점수에서 통계적으로 유의미한 개선을 보였습니다. 후각은 0에서 3점까지의 중증도 척도(0=증상 없음, 1=경증, 2=중등도, 3=중증)에 대한 일일 평가로 측정되었습니다. 24주차에 후각 점수 기준선 변화에 대한 XOLAIR와 위약 비교 LS 평균 차이는 CRSwNP 시험 1에서 -0.3(95% CI: -0.6, -0.1), CRSwNP 시험 2에서 -0.5(95% CI: -0.7, -0.2)였습니다.
XOLAIR는 위약 대비 후비루에서 통계적으로 유의미한 개선을 보였습니다. 24주차에 후비루 점수 기준선 변화에 대한 XOLAIR와 위약 비교 LS 평균 차이는 CRSwNP 시험 1에서 -0.6(95% CI: -0.8, -0.3), CRSwNP 시험 2에서 -0.5(95% CI: -0.8, -0.3)였습니다.
XOLAIR는 위약 대비 콧물에서 통계적으로 유의미한 개선을 보였습니다. 24주차에 콧물 점수 기준선 변화에 대한 XOLAIR와 위약 비교 LS 평균 차이는 CRSwNP 시험 1에서 -0.4(95% CI: -0.7, -0.2), CRsWNP 시험 2에서 -0.6(95% CI: -0.9, -0.4)였습니다.
24주 치료 기간 동안의 전신 코르티코스테로이드 사용에 대한 사전 지정된 통합 분석에서 치료군 간에 전신 코르티코스테로이드 사용의 유의미한 감소는 없었습니다. XOLAIR에서 전신 코르티코스테로이드를 복용한 환자의 비율은 2.3%였으며 위약에서는 6.2%였습니다. 위약 대비 XOLAIR를 사용한 전신 코르티코스테로이드 사용의 오즈비는 0.4(95% CI: 0.1, 1.5)였습니다.
두 시험 모두에서 위약군 또는 XOLAIR군에서 비강 수술 보고는 없었습니다.
14.3 IgE-Mediated Food Allergy
XOLAIR의 안전성과 유효성은 땅콩과 우유, 계란, 밀, 캐슈, 헤이즐넛 또는 호두(즉, 연구 식품)를 포함한 최소 두 가지 다른 식품에 알레르기가 있는 1세 이상 56세 미만의 성인 환자 및 소아 환자 168명을 대상으로 한 다기관, 무작위 배정, 이중 눈가림, 위약 대조 식품 알레르기(FA) 시험[NCT03881696]에서 평가되었습니다. FA 시험에는 스크리닝 이중 눈가림 위약 대조 식품 유발 검사(DBPCFC) 중 단일 용량 ≤100mg의 땅콩 단백질 및 다른 두 가지 식품(우유, 계란, 밀, 캐슈, 헤이즐넛 또는 호두) 각각에 대해 ≤300mg의 단백질에 대해 용량 제한 증상(예: 중등도에서 중증의 피부, 호흡기 또는 위장관 증상)을 경험한 환자를 등록했습니다. 중증 아나필락시스(신경학적 손상 또는 삽관 필요로 정의됨) 병력이 있는 환자는 연구에서 제외되었습니다. 환자는 표 4 [용법·용량(2.4) 참조]에 따라 치료 시작 전 측정된 혈청 총 IgE 수치(IU/mL) 및 체중을 기준으로 16~20주 동안 XOLAIR 또는 위약의 피하 주사를 2:1 비율로 무작위 배정받았습니다. 16~20주 치료 후 각 환자는 위약과 3가지 연구 식품 각각으로 구성된 DBPCFC를 완료했습니다. DBPCFC 이후, 연구의 이중 눈가림, 위약 대조 단계를 완료한 소아 환자 59명과 성인 환자 1명을 포함한 최초 60명의 환자는 24~28주 공개 연장 연구에서 XOLAIR를 계속 투여받을 수 있었습니다.
XOLAIR의 유효성은 아래 제공된 유효성 분석에 포함된 소아 환자 165명을 기반으로 합니다. 소아 환자의 평균 연령은 8세(연령 범위: 1~17세)였습니다. 37%는 6세 미만, 38%는 6세 이상 12세 미만, 25%는 12세 이상 18세 미만이었습니다. 환자 집단은 남성 56%, 백인 63%, 아시아인 13%, 흑인 7%, 기타 16%였으며, 환자의 55%는 천식 병력이 있었습니다.
주요 유효성 평가 변수는 DBPCFC 중 용량 제한 증상(예: 중등도에서 중증의 피부, 호흡기 또는 위장관 증상) 없이 단일 용량 ≥600mg의 땅콩 단백질을 섭취할 수 있는 환자의 비율이었습니다. 표 16은 XOLAIR 치료가 위약(5%)보다 통계적으로 더 높은 반응률(68%)을 보였음을 나타냅니다.
이차 유효성 평가 변수는 DBPCFC 중 용량 제한 증상 없이 단일 용량 ≥1000mg의 캐슈, 우유 또는 계란 단백질을 섭취할 수 있는 환자의 비율이었습니다. 이 연구는 이차 평가 변수를 충족했으며 XOLAIR 치료가 세 가지 식품 모두에서 위약보다 통계적으로 더 높은 반응률을 보였음을 입증했습니다. 자세한 내용은 표 16을 참조하십시오.
XOLAIR로 치료받은 환자의 17%는 중등도에서 중증의 용량 제한 증상 없이 100mg 이상의 땅콩 단백질을 섭취할 수 없었습니다. XOLAIR로 치료받은 환자의 18%, 22%, 41%는 중등도에서 중증의 용량 제한 증상 없이 각각 300mg 이상의 우유, 계란 또는 캐슈 단백질을 섭취할 수 없었습니다.
추가적인 2차 분석에는 DBPCFC 동안 두 가지 또는 세 가지 음식을 모두 섭취할 수 있는 환자의 비율이 포함되었습니다. 두 가지 음식의 경우, XOLAIR 치료 환자의 71%가 위약군의 5%에 비해 600mg 이상의 단일 용량을 섭취할 수 있었고 67%는 위약군의 4%에 비해 1000mg 이상의 단일 용량을 섭취할 수 있었습니다. 세 가지 음식의 600mg 이상 단일 용량에 대한 반응률은 XOLAIR군에서 48%, 위약군에서 4%였으며, 세 가지 음식의 1000mg 이상 단일 용량에 대한 반응률은 XOLAIR군에서 39%였으며 위약 환자는 증상 없이 시험 용량을 섭취할 수 없었습니다.
성인에서 XOLAIR의 효과는 소아 환자에 대한 적절하고 잘 통제된 XOLAIR 시험, 소아 및 성인 환자의 질병 유사성, 약동학(PK) 유사성에 의해 뒷받침됩니다. [see Clinical Pharmacology (12.3)].
비대조, 공개 연구에서는 효능을 확립할 수 없지만, 공개 연장 연구에서 24-28주 동안 XOLAIR를 계속 투여한 38명의 소아 환자의 경우, 중등도에서 중증의 용량 제한 증상 없이 600mg 이상의 땅콩 단백질과 1000mg 이상의 계란, 우유 및/또는 캐슈 단백질을 섭취할 수 있는 환자의 비율이 유지되었습니다.
14.4 만성 자발 두드러기
12세 이상 성인 및 청소년 환자
이전에 만성 특발 두드러기(CIU)라고 불렸던 만성 자발 두드러기(CSU) 치료에 대한 XOLAIR의 안전성과 효능은 24주(CSU 시험 1; n=319, [NCT01287117]) 및 12주(CSU 시험 2; n=322, [NCT01292473]) 동안 진행된 두 건의 위약 대조, 다중 용량 임상 시험에서 평가되었습니다. 환자들은 24주 또는 12주 동안 기준 H1 항히스타민제 치료 수준에 더하여 4주마다 XOLAIR 75mg, 150mg 또는 300mg 또는 위약을 피하 주사로 투여받았으며, 이후 16주간의 추적 관찰 기간을 거쳤습니다. 효능 분석에는 총 640명의 환자(남성 165명, 여성 475명)가 포함되었습니다. 대부분의 환자는 백인(84%)이었고 중앙 연령은 42세(범위 12-72세)였습니다.
질병 중증도는 주간 두드러기 활동 점수(UAS7, 범위 0-42)로 측정되었으며, 이는 주간 가려움증 중증도 점수(범위 0-21)와 주간 두드러기 개수 점수(범위 0-21)의 합성 점수입니다. 모든 환자는 무작위 배정 전 7일 동안 UAS7 ≥16, 주간 가려움증 중증도 점수 ≥8이어야 했으며, 최소 2주 동안 H1 항히스타민제를 사용했음에도 불구하고 이러한 기준을 충족해야 했습니다.
기준 시점에서 평균 주간 가려움증 중증도 점수는 치료군 간에 상당히 균형을 이루었으며 승인된 용량의 H1 항히스타민제를 사용했음에도 불구하고 13.7에서 14.5 사이였습니다. 등록 시 보고된 CSU의 중앙 지속 기간은 치료군 전체에서 2.5년에서 3.9년 사이였습니다(전체 대상 수준 범위는 0.5년에서 66.4년).
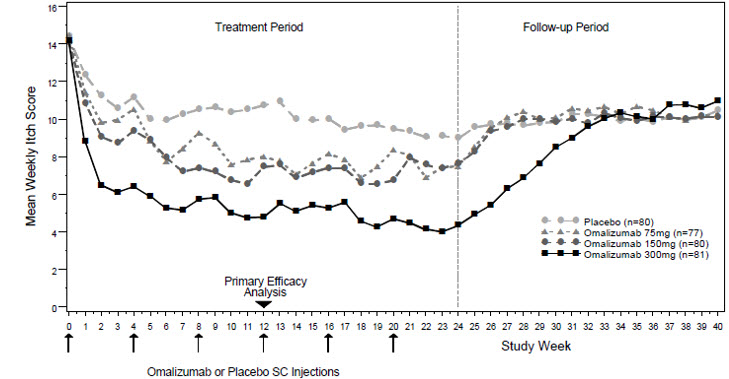
CSU 시험 1과 2 모두에서 XOLAIR 150mg 또는 300mg을 투여받은 환자는 12주차에 위약보다 주간 가려움증 중증도 점수와 주간 두드러기 개수 점수가 기준치에서 더 크게 감소했습니다. CSU 시험 1의 대표적인 결과가 표시되어 있습니다(표 17); CSU 시험 2에서도 유사한 결과가 관찰되었습니다. 75mg 용량은 일관된 효능 증거를 보여주지 못했으며 사용이 승인되지 않았습니다.
12주차 평균 가려움증 심각도 점수는 그림 2에 나와 있습니다. CSU 임상시험 1의 대표적인 결과가 표시되어 있으며, CSU 임상시험 2에서도 유사한 결과가 관찰되었습니다. XOLAIR를 사용한 CSU 치료의 적절한 기간은 아직 결정되지 않았습니다.
CSU 임상시험 1에서 12주차에 가려움증과 두드러기가 없는 것으로 보고된 환자 비율(UAS7=0)은 XOLAIR 300mg 투여군(36%)이 XOLAIR 150mg 투여군(15%), XOLAIR 75mg 투여군(12%), 위약군(9%)보다 높았습니다. CSU 임상시험 2에서도 유사한 결과가 관찰되었습니다.
16 제공/보관 및 취급 방법
주사제 (프리필드 시린지 또는 오토인젝터)
XOLAIR (omalizumab) 주사제는 피하 사용을 위한 무색 투명 또는 약간 불투명하고 무색에서 연한 갈색을 띠는 용액입니다.
XOLAIR 주사제는 고정된 바늘, 단단한 바늘캡 및 바늘 실드가 있는 1회용 프리필드 시린지 또는 고정된 바늘, 바늘캡 및 바늘 가드가 있는 1회용 프리필드 오토인젝터로 제공됩니다.
XOLAIR는 표 18과 19에 설명된 대로 프리필드 시린지 및 오토인젝터로 제공됩니다.
XOLAIR 오토인젝터는 천연 고무 라텍스로 만들어지지 않았습니다.
보관
XOLAIR 프리필드 시린지 및 오토인젝터는 원래 포장 상태로 냉장 보관 (2°C~8°C [36°F~46°F])하여 운송 및 보관해야 합니다. 직사광선을 피하십시오. 필요한 경우 XOLAIR 프리필드 시린지 및 오토인젝터를 냉장고에서 꺼내 다시 넣을 수 있습니다. 냉장고 밖에 있는 총 시간은 2일을 초과할 수 없습니다. 프리필드 시린지 또는 오토인젝터가 25°C (77°F) 이상의 온도에 노출된 경우 사용하지 마십시오.
냉동하지 마십시오. 프리필드 시린지 또는 오토인젝터가 냉동된 경우 사용하지 마십시오.
주사용 (바이알)
XOLAIR는 보존제가 없는 1회용 바이알에 동결 건조된 흰색의 무균 분말로 제공됩니다. 각 상자에는 다음이 포함되어 있습니다.
- XOLAIR® (omalizumab) 150 mg 주사용 1회용 바이알 1개 NDC 50242-040-62.
보관
XOLAIR는 조절된 실온 (≤30°C [≤86°F])에서 운송해야 합니다. XOLAIR는 원래 포장 상태로 냉장 보관 (2°C~8°C [36°F~46°F])하십시오. 상자에 표시된 유효 기간이 지난 경우 사용하지 마십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자용 라벨(의약품 안내서 및 사용법)을 읽어보도록 알려주십시오.
아나필락시스
다음 사항을 포함하여 XOLAIR와 관련된 생명을 위협하는 아나필락시스 위험에 대해 환자에게 알려주십시오 [경고 및 경고 및 주의사항 (5.1) 참조]:
- XOLAIR 투여 후 최대 4일까지 아나필락시스가 발생했다는 보고가 있습니다.
- 의료 서비스 제공자가 의료기관에서만 XOLAIR를 처음 투여하십시오.
- 투여 후 환자를 면밀히 관찰하십시오.
- 환자에게 아나필락시스의 징후와 증상을 알려주십시오.
- 그러한 징후나 증상이 나타날 경우 즉시 의료 서비스를 받도록 환자에게 지시하십시오.
아나필락시스 응급 치료와 관련된 잠재적 약물 오류
환자, 부모 또는 보호자에게 아나필락시스를 포함한 알레르기 반응의 응급 치료에 XOLAIR를 사용해서는 안 된다는 점을 알려주십시오 [경고 및 주의사항 (5.9) 참조].
다른 약물의 계속 복용
XOLAIR을 복용하는 환자에게 의사의 지시가 없는 한 다른 천식, 비용종을 동반한 만성 비부비동염, 만성 자발성 두드러기 또는 IgE 매개 식품 알레르기 약물이나 알레르겐 면역 요법의 용량을 줄이거나 복용을 중단하지 않도록 지시하십시오. 환자에게 XOLAIR 치료를 시작한 후 천식, 비용종을 동반한 만성 비부비동염, 만성 자발성 두드러기 또는 IgE 매개 식품 알레르기 증상이 즉시 개선되지 않을 수 있다는 점을 알려주십시오.
사전 충전 주사기 바늘 덮개에는 라텍스가 포함되어 있습니다.
사전 충전 주사기의 바늘 덮개에는 건조 천연 고무(라텍스 유도체)가 포함되어 있어 라텍스에 민감한 사람에게 알레르기 반응을 일으킬 수 있다는 점을 환자에게 알려주십시오 [포장 단위/보관 및 취급 (16) 참조].
주사 기술에 대한 지침
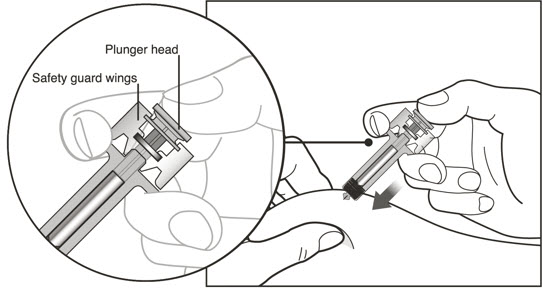
환자 또는 보호자가 XOLAIR 사전 충전 주사기 또는 오토인젝터를 피하 투여하는 경우, 주사 기술에 대한 지시를 하고 피하 주사 능력을 평가하여 XOLAIR의 적절한 투여를 확인하십시오. 처방된 용량을 완료하기 위해 1회 이상의 주사가 필요한 환자의 경우, 모든 주사를 연속적으로 한 번에 투여하도록 지시하십시오 [용법 및 용량 (2.7), 경고 및 주의사항 (5.1) 및 사용법 참조].
SPL 미분류 섹션
제조:
Genentech, Inc.
Roche Group의 회원사
1 DNA Way
South San Francisco, CA 94080-4990
미국 라이선스 번호: 1048
약물 안내문