의약품 제조업체: Amgen Inc (Updated: 2024-01-12)
처방 정보 하이라이트
Xgeva (denosumab) injection, for subcutaneous use
Initial U.S. Approval: 2010
최근 주요 변경 사항
| Warnings and Precautions, Hypocalcemia (5.3) | 02/2020 |
적응증 및 용법
용량 및 투여
- Xgeva는 피하 경로로만 사용되며 정맥 내, 근육 내 또는 피내로 투여해서는 안 됩니다. (2.1)
- 다발성 골수종 및 고형 종양의 뼈 전이: 4주마다 상완, 허벅지 또는 복부에 120mg을 피하 주사합니다. (2.2)
- 골 거대 세포종: 4주마다 120mg을 투여하고 첫 달 8일째와 15일째에 120mg을 추가로 투여합니다. 상완, 허벅지 또는 복부에 피하 투여합니다. (2.3)
- 저칼슘혈증을 치료하거나 예방하기 위해 필요에 따라 칼슘과 비타민 D를 투여합니다. (2.2, 2.3)
- 악성 종양의 고칼슘혈증: 4주마다 120mg을 투여하고 첫 달 8일째와 15일째에 120mg을 추가로 투여합니다. 상완, 허벅지 또는 복부에 피하 투여합니다. (2.4)
투여 형태 및 함량
- 주사제: 1회용 바이알에 든 120mg/1.7mL(70mg/mL) 용액 (3)
경고 및 주의사항
- 동일한 활성 성분: Xgeva를 투여받는 환자는 Prolia®를 복용해서는 안 됩니다. (5.1)
- 아나필락시스를 포함한 과민 반응이 발생할 수 있습니다. 임상적으로 유의미한 반응이 발생하면 영구적으로 중단합니다. (5.2)
- 저칼슘혈증: Xgeva는 심각한 증상성 저칼슘혈증을 유발할 수 있으며 사망 사례가 보고되었습니다. Xgeva 치료를 시작하기 전에 저칼슘혈증을 교정하십시오. 치료 중, 특히 치료 시작 후 처음 몇 주 동안 칼슘 수치를 모니터링하고 모든 환자에게 칼슘과 비타민 D를 적절하게 보충합니다. (5.3)
- 턱뼈 괴사(ONJ)는 Xgeva를 투여받는 환자에서 보고되었습니다. Xgeva 치료를 시작하기 전에 구강 검사를 실시합니다. 증상을 모니터링합니다. Xgeva 치료 중에는 침습적 치과 시술을 피하십시오. (5.4)
- 비정형 대퇴골 골절: 대퇴골 골절을 배제하기 위해 허벅지 또는 사타구니 통증이 있는 환자를 평가합니다. (5.5)
- 골 거대 세포종 환자 및 골격 성장 환자에서 치료 중단 후 고칼슘혈증: 환자에게 고칼슘혈증의 징후와 증상이 있는지 모니터링하고 임상적으로 적절하게 관리합니다. (5.6, 8.4)
- 치료 중단 후 다발성 척추 골절(MVF): Xgeva 치료를 중단할 때 개별 환자의 척추 골절 위험을 평가합니다. (5.7)
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 가임 여성에게 태아에게 미칠 수 있는 잠재적 위험에 대해 알리고 효과적인 피임법을 사용하도록 조언합니다. (5.8, 8.1, 8.3)
이상 반응
- 고형 종양의 뼈 전이: 가장 흔한 이상 반응(≥ 25%)은 피로/무력증, 저인산혈증 및 메스꺼움이었습니다. (6.1)
- 다발성 골수종: 가장 흔한 이상 반응(≥ 10%)은 설사, 메스꺼움, 빈혈, 요통, 혈소판 감소증, 말초 부종, 저칼슘혈증, 상기도 감염, 발진 및 두통이었습니다. (6.1)
- 골 거대 세포종: 가장 흔한 이상 반응(≥ 10%)은 관절통, 두통, 메스꺼움, 요통, 피로 및 사지 통증이었습니다. (6.1)
- 악성 종양의 고칼슘혈증: 가장 흔한 이상 반응(> 20%)은 메스꺼움, 호흡 곤란, 식욕 감소, 두통, 말초 부종, 구토, 빈혈, 변비 및 설사였습니다. (6.1)
의심되는 이상 반응을 보고하려면 Amgen Inc.(1-800-77-AMGEN(1-800-772-6436)) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch)에 문의하십시오.
특정 집단에서의 사용
환자 상담 정보는 17을 참조하십시오.
개정일: 2020년 6월
목차
전문 정보: 내용*
1 적응증 및 사용법
1.1 다발성 골수종 및 고형 종양의 골 전이
1.2 거대 세포 종양
1.3 악성 종양에 의한 고칼슘혈증
2 투여량 및 투여 방법
2.1 중요한 투여 지침
2.2 다발성 골수종 및 고형 종양의 골 전이
2.3 거대 세포 종양
2.4 악성 종양에 의한 고칼슘혈증
2.5 준비 및 투여
3 제형 및 강도
4 금기 사항
4.1 저칼슘혈증
4.2 과민증
5 경고 및 주의 사항
5.1 동일한 활성 성분을 가진 의약품
5.2 과민증
5.3 저칼슘혈증
5.4 턱뼈 괴사 (ONJ)
5.5 비정형 대전자 및 골간부 대퇴골 골절
5.6 거대 세포 종양 환자 및 성장하는 골격을 가진 환자에서 치료 중단 후 고칼슘혈증
5.7 치료 중단 후 다발성 척추 골절 (MVF)
5.8 태아-태아 독성
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
6.3 면역원성
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장 장애
10 과량 투여
11 설명
12 임상 약리
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
13.2 동물 독성 및/또는 약리학
14 임상 시험
14.1 고형 종양의 골 전이
14.2 다발성 골수종
14.3 거대 세포 종양
14.4 악성 종양에 의한 고칼슘혈증
16 포장/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.2 거대 세포 골 종양
Xgeva는 절제 불가능하거나 수술적 절제가 심각한 질병으로 이어질 가능성이 있는 성인 및 골격 성숙 청소년의 거대 세포 골 종양 치료에 사용됩니다 [임상 시험 참조 (14.2)].
2 복용량 및 투여 방법
2.2 다발성 골수종 및 고형 종양의 뼈 전이
Xgeva의 권장 복용량은 4주마다 상완, 허벅지 또는 복부에 피하 주사로 120mg을 투여하는 것입니다.
저칼슘혈증을 치료하거나 예방하기 위해 필요에 따라 칼슘과 비타민 D를 투여하십시오. [경고 및 주의 사항 (5.3)]을 참조하십시오.
2.3 거대 세포 골종양
Xgeva의 권장 복용량은 4주마다 120mg을 투여하고 첫 달 치료 8일과 15일에 120mg을 추가로 투여하는 것입니다. 상완, 허벅지 또는 복부에 피하 투여하십시오.
저칼슘혈증을 치료하거나 예방하기 위해 필요에 따라 칼슘과 비타민 D를 투여하십시오. [경고 및 주의 사항 (5.3)]을 참조하십시오.
2.4 악성 종양으로 인한 고칼슘혈증
Xgeva의 권장 복용량은 4주마다 120mg을 투여하고 첫 달 치료 8일과 15일에 120mg을 추가로 투여하는 것입니다. 상완, 허벅지 또는 복부에 피하 투여하십시오.
2.5 준비 및 투여
투여하기 전에 Xgeva에 입자나 변색이 있는지 육안으로 검사하십시오. Xgeva는 무색에서 옅은 노란색의 투명한 용액으로, 반투명에서 흰색의 미량의 단백질 입자가 포함될 수 있습니다. 용액의 색깔이 변했거나 흐리거나, 용액에 입자가 많거나 이물질이 있는 경우 사용하지 마십시오.
투여하기 전에 Xgeva를 냉장고에서 꺼내 원래 용기에 담아 실온(최대 25°C/77°F)에서 보관하여 실온이 되도록 할 수 있습니다. 일반적으로 15~30분 정도 소요됩니다. 다른 방법으로 Xgeva를 데우지 마십시오. [공급 방법/보관 및 취급 (16)]을 참조하십시오.
27게이지 바늘을 사용하여 바이알의 내용물 전체를 뽑아 주입하십시오. 바이알에 바늘을 다시 삽입하지 마십시오. 1회 용량을 사용하거나 바늘을 삽입한 후에는 바이알을 폐기하십시오.
3. 투여 형태 및 용량
주사: 단회용 앰플에 120 mg/1.7 mL (70 mg/mL) 용액이 들어 있습니다.
4 금기
4.2 Hypersensitivity
Xgeva는 Xgeva에 대해 알려진 임상적으로 유의미한 과민성이 있는 환자에게는 금기입니다 [see Warnings and Precautions (5.2) and Adverse Reactions (6.2)].
5. 경고 및 주의사항
5.1 동일 활성 성분을 함유한 의약품
Xgeva는 Prolia에 함유된 것과 동일한 활성 성분(데노수맙)을 포함하고 있습니다. Xgeva를 투여받는 환자는 Prolia를 복용해서는 안 됩니다.
5.2 과민증
Xgeva 사용 시 아나필락시스를 포함한 임상적으로 유의미한 과민증이 보고되었습니다. 반응에는 저혈압, 호흡곤란, 상기도 부종, 입술 부종, 발진, 가려움증 및 두드러기가 포함될 수 있습니다. 아나필락시스 반응이나 기타 임상적으로 유의미한 알레르기 반응이 발생하는 경우 적절한 치료를 시작하고 Xgeva 치료를 영구적으로 중단하십시오. [see Contraindications (4.2) and Adverse Reactions (6.2)].
5.3 저칼슘혈증
Xgeva는 중증의 증상성 저칼슘혈증을 유발할 수 있으며, 사망 사례가 보고되었습니다. Xgeva 치료 전에 기존의 저칼슘혈증을 교정하십시오. Xgeva 치료를 받는 동안, 특히 치료 시작 후 처음 몇 주 동안 칼슘 수치를 모니터링하고 필요에 따라 칼슘, 마그네슘 및 비타민 D를 투여하십시오. 칼슘 수치를 낮출 수 있는 칼슘 유사체 및 기타 약물을 병용하면 저칼슘혈증 위험이 악화될 수 있으므로 혈청 칼슘 수치를 면밀히 모니터링해야 합니다. 저칼슘혈증 증상이 나타나면 의료 전문가에게 연락하도록 환자에게 조언하십시오. [see Contraindications (4.1), Adverse Reactions (6.1, 6.2), and Patient Counseling Information (17)].
신기능 장애가 있는 환자, 가장 흔하게는 중증의 신기능 장애(크레아티닌 청소율 30mL/min 미만 및/또는 투석 중인 경우)가 있는 환자와 칼슘 보충이 부적절하거나 없는 환자를 대상으로 한 임상 시험에서 저칼슘혈증 위험 증가가 관찰되었습니다. 칼슘 수치와 칼슘 및 비타민 D 섭취를 모니터링하십시오. [see Adverse Reactions (6.1), Use in Specific Populations (8.6), and Clinical Pharmacology (12.3)].
5.4 턱뼈 괴사(ONJ)
턱뼈 괴사(ONJ)는 Xgeva를 투여받는 환자에서 보고되었으며, 턱 통증, 골수염, 골염, 골 미란, 치아 또는 치주 감염, 치통, 잇몸 궤양 또는 잇몸 미란으로 나타납니다. 치과 수술 후 구강이나 턱의 지속적인 통증이나 느린 치유 또한 ONJ의 징후일 수 있습니다. 암 환자를 대상으로 한 임상 시험에서 ONJ의 발생률은 노출 기간이 길수록 더 높았습니다. [see Adverse Reactions (6.1)]. ONJ 환자의 79%는 발치, 구강 위생 불량 또는 치과 기구 사용을 소인으로 가지고 있었습니다. ONJ 발생의 다른 위험 요인으로는 면역억제 요법, 혈관 생성 억제제 치료, 전신 코르티코스테로이드, 당뇨병 및 잇몸 감염이 있습니다. 마찬가지로 ONJ가 발생한 다발성 골수종 환자의 경우 58%가 침습적 치과 시술을 소인으로 가지고 있었습니다.
Xgeva 치료를 시작하기 전과 치료 중 정기적으로 구강 검진과 적절한 예방 치과 진료를 받으십시오. 구강 위생 실천에 대해 환자에게 조언하십시오. Xgeva 치료 중에는 침습적 치과 시술을 피하십시오. 침습적 치과 시술을 받아야 하는 경우 Xgeva 치료를 일시적으로 중단하는 것을 고려하십시오. 치료 중단의 최적 기간을 시사하는 데이터는 없습니다.
Xgeva 투여 중 ONJ가 의심되거나 발생한 환자는 치과 의사 또는 구강 외과 의사의 진료를 받아야 합니다. 이러한 환자의 경우 ONJ를 치료하기 위한 광범위한 치과 수술은 상태를 악화시킬 수 있습니다. 치료 의료 전문가의 임상적 판단에 따라 개별 위험/이점 평가를 기반으로 각 환자의 관리 계획을 안내해야 합니다.
5.5 비전형적 전자간 및 대퇴골 간 골절
Xgeva 사용 시 비전형적 대퇴골 골절이 보고되었습니다. [see Adverse Reactions (6.1)]. 이러한 골절은 소전자 바로 아래에서 상과융기 위까지 대퇴골 간 어디에서나 발생할 수 있으며, 분쇄의 증거 없이 횡단면 또는 짧은 사선 방향입니다.
비전형적 대퇴골 골절은 영향을 받은 부위에 외상이 거의 없거나 전혀 없는 경우 가장 흔하게 발생합니다. 양측성일 수 있으며, 많은 환자가 완전 골절이 발생하기 몇 주 또는 몇 달 전에 영향을 받은 부위에 전구 통증을 보고합니다. 많은 보고에 따르면 환자들은 골절 당시 글루코코르티코이드(예: 프레드니손)로 치료를 받고 있었습니다.
Xgeva 치료 중에는 새롭거나 비정상적인 허벅지, 엉덩이 또는 사타구니 통증을 보고하도록 환자에게 조언해야 합니다. 허벅지 또는 사타구니 통증이 있는 환자는 비전형적 골절이 의심되어야 하며, 불완전 대퇴골 골절을 배제하기 위해 평가를 받아야 합니다. 비전형적 대퇴골 골절이 있는 환자는 반대쪽 사지의 골절 증상 및 징후에 대해서도 평가를 받아야 합니다. 개별적으로 위험/이점 평가를 보류하는 동안 Xgeva 치료 중단을 고려해야 합니다.
5.6 거대 세포 골종 환자 및 성장 골격을 가진 환자에서 치료 중단 후 고칼슘혈증
Xgeva 치료를 받은 거대 세포 골종 환자 및 성장 골격을 가진 환자에서 입원이 필요하고 급성 신장 손상으로 인해 복잡해지는 임상적으로 유의한 고칼슘혈증이 보고되었습니다. 치료 중단 후 첫 해 이내에 고칼슘혈증이 보고되었습니다. 치료를 중단한 후, 환자의 고칼슘혈증 징후 및 증상을 모니터링하고, 혈청 칼슘을 주기적으로 평가하고, 환자의 칼슘 및 비타민 D 보충 요구 사항을 재평가하고, 임상적으로 적절하게 환자를 관리하십시오. [부작용 (6) 및 특정 집단에서의 사용 (8.4) 참조]
5.7 치료 중단 후 다발성 척추 골절(MVF)
데노수맙으로 치료를 중단한 후 다발성 척추 골절(MVF)이 보고되었습니다. MVF 위험이 높은 환자에는 골다공증 위험 요인이 있거나 과거 골절 이력이 있는 환자가 포함됩니다.
Xgeva 치료를 중단할 때 개별 환자의 척추 골절 위험을 평가하십시오. [환자 상담 정보 (17) 참조]
5.8 배아-태아 독성
동물 연구 및 작용 기전에 따른 데이터를 기반으로 할 때, Xgeva는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 동물 생식 연구에서 체중을 기준으로 권장되는 사람용 Xgeva 용량보다 25배 높은 용량의 데노수맙을 임신 기간 동안 히말라야원숭이에게 투여한 결과, 태아 손실, 사산 및 출생 후 사망률이 증가했으며, 말초 림프절 부재, 비정상적인 뼈 성장 및 신생아 성장 감소의 증거와 함께 나타났습니다.
Xgeva 치료를 시작하기 전에 가임 여성의 임신 상태를 확인하십시오. 임산부 및 가임 여성에게 임신 중 또는 임신 전 5개월 이내에 Xgeva에 노출되면 태아에게 해를 끼칠 수 있음을 알리십시오. 가임 여성에게 치료 중 및 Xgeva 마지막 투여 후 최소 5개월 동안 효과적인 피임법을 사용하도록 조언하십시오. [특정 집단에서의 사용 (8.1, 8.3) 및 임상 약리학 (12.1) 참조]
6. 부작용
다음의 부작용은 아래 및 라벨의 다른 부분에서 논의됩니다.
• 과민반응 [경고 및 주의 사항 (5.2)]
• 저칼슘혈증 [경고 및 주의 사항 (5.3) 및 특정 인구 집단에서의 사용 (8.6)]
• 턱뼈 괴사 [경고 및 주의 사항 (5.4)]
• 비정형 소전자 및 골간부 대퇴골 골절 [경고 및 주의 사항 (5.5)]
• 골 거대 세포 종양 환자 및 성장하는 골격을 가진 환자에서 치료 중단 후 고칼슘혈증 [경고 및 주의 사항 (5.6) 및 특정 인구 집단에서의 사용 (8.4)]
• 치료 중단 후 다발성 척추 골절 (MVF) [경고 및 주의 사항 (5.7)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 부작용 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
고형 종양의 뼈 전이
Xgeva의 안전성은 총 2841명의 환자를 대상으로 한 3개의 무작위 배정, 이중 맹검, 이중 가짜 약물 시험 [임상 시험 (14.1)] 에서 평가되었으며, 이 환자들은 전립선암, 유방암 또는 기타 고형 종양에서 뼈 전이 또는 다발성 골수종에서 용해성 뼈 병변이 있었으며, Xgeva를 최소한 1회 투여 받았습니다. 연구 20050136, 20050244 및 20050103에서 환자들은 4주마다 피하 주사로 Xgeva 120mg을 투여 받거나 4주마다 정맥 (IV) 주입으로 졸레드론산 4mg (신장 기능 저하에 따라 용량 조절)을 투여 받도록 무작위 배정되었습니다. 참여 기준에는 혈청 칼슘 (보정) 8~11.5mg/dL (2~2.9mmol/L) 및 크레아티닌 청소율 30mL/분 이상이 포함되었습니다. IV 비스포스포네이트를 투여 받은 환자는 제외되었으며, 이전에 ONJ 또는 턱뼈 골수염의 병력이 있는 환자, 구강 수술이 필요한 활동적인 치과 또는 턱뼈 질환이 있는 환자, 치유되지 않은 치과/구강 수술이 있는 환자 또는 계획된 침습적인 치과 절차가 있는 환자도 제외되었습니다. 연구 기간 동안 칼슘 및 인을 포함한 혈청 화학 검사는 4주마다 모니터링되었습니다. 칼슘 및 비타민 D 보충제는 권장되었지만 필수는 아니었습니다.
Xgeva에 대한 노출의 중간 기간은 12개월 (범위: 0.1-41)이었고, 연구 참여의 중간 기간은 13개월 (범위: 0.1-41)이었습니다. Xgeva를 투여 받은 환자 중 46%는 여성이었습니다. 85%는 백인, 5%는 히스패닉/라틴계, 6%는 아시아계, 3%는 흑인이었습니다. 중간 연령은 63세 (범위: 18-93)였습니다. Xgeva를 투여 받은 환자의 75%는 동반 화학 요법을 받았습니다.
환자에서 가장 흔한 부작용 (발생률이 25% 이상)은 피로/무력증, 저인산혈증 및 메스꺼움이었습니다 (표 1 참조). 가장 흔한 심각한 부작용은 호흡 곤란이었습니다. Xgeva 투여 중단으로 이어진 가장 흔한 부작용은 턱뼈 괴사 및 저칼슘혈증이었습니다.
| 신체계 | Xgeva n = 2841 % |
졸레드론산 n = 2836 % |
| 위장 | ||
| 메스꺼움 | 31 | 32 |
| 설사 | 20 | 19 |
| 일반 | ||
| 피로/무력증 | 45 | 46 |
| 검사 | ||
| 저칼슘혈증b | 18 | 9 |
| 저인산혈증b | 32 | 20 |
| 신경 | ||
| 두통 | 13 | 14 |
| 호흡기 | ||
| 호흡 곤란 | 21 | 18 |
| 기침 | 15 | 15 |
a Xgeva 투여 환자의 20050136, 20050244 및 20050103 연구에서 10% 이상의 환자에게 보고된 이상 반응으로 다음 기준 중 하나를 충족합니다.
b 실험실에서 유래되었으며 중앙 실험실의 정상 하한 값 미만 [칼슘의 경우 8.3 – 8.5 mg/dL (2.075 – 2.125 mmol/L) 및 인의 경우 2.2 – 2.8 mg/dL (0.71 – 0.9 mmol/L)] |
||
심각한 무기질/전해질 이상
▪ Xgeva로 치료받은 환자의 3.1%와 졸레드론산으로 치료받은 환자의 1.3%에서 심각한 저칼슘혈증(보정된 혈청 칼슘이 7 mg/dL 또는 1.75 mmol/L 미만)이 발생했습니다. 심각한 저칼슘혈증을 경험한 환자 중 33%는 심각한 저칼슘혈증을 2회 이상 경험했고 16%는 3회 이상 경험했습니다 [경고 및 주의 사항 (5.3) 및 특정 인구 집단에서의 사용 (8.6) 참조].
▪ Xgeva로 치료받은 환자의 15.4%와 졸레드론산으로 치료받은 환자의 7.4%에서 심각한 저인산혈증(혈청 인이 2 mg/dL 또는 0.6 mmol/L 미만)이 발생했습니다.
턱뼈 괴사 (ONJ)
연구 20050136, 20050244 및 20050103의 1차 치료 단계에서 Xgeva 그룹 환자의 1.8%(중간 노출 기간 12.0개월; 범위: 0.1-40.5)와 졸레드론산 그룹 환자의 1.3%에서 ONJ가 확인되었습니다. 유방암(연구 20050136) 또는 전립선암(연구 20050103) 환자를 대상으로 한 임상 시험에는 환자가 4주마다 1회 Xgeva 120 mg를 투여받는 Xgeva 오픈 라벨 연장 치료 단계가 포함되었으며(중간 전체 노출 기간 14.9개월; 범위: 0.1-67.2), 환자-년 조정 발생률(100 환자-년당 발생 건수)은 치료 첫 해에 1.1%, 둘째 해에 3.7%, 그 이후 매년 4.6%였습니다. ONJ까지의 중간 시간은 20.6개월(범위: 4-53)이었습니다 [경고 및 주의 사항 (5.4) 참조].
비전이성 전립선암 환자에서 골 전이 예방을 위한 Xgeva를 평가한 위약 대조군 임상 시험에서 최대 7년의 연장 치료 단계를 거친 결과(Xgeva가 적응증이 없는 환자군), 환자-년 조정 발생률(100 환자-년당 발생 건수)은 치료 첫 해에 1.1%, 둘째 해에 3.0%, 그 이후 매년 7.1%였습니다.
비정형 소전자 및 골간부 골절
임상 시험 프로그램에서 Xgeva로 치료받은 환자에게 비정형 대퇴골 골절이 보고되었으며, 위험은 치료 기간이 길어질수록 증가했습니다. 발생은 치료 중 및 치료 중단 후에 발생했습니다 [경고 및 주의 사항 (5.5) 참조]..
다발성 골수종
Xgeva의 안전성은 새로 진단된 다발성 골수종 환자를 대상으로 질병 진행까지 치료를 실시한 국제적 무작위 배정(1:1), 이중맹검, 활성 대조군 임상 시험에서 평가되었습니다 [임상 시험 (14.2) 참조]. 이 임상 시험에서 환자는 피하 주사로 4주마다 120 mg Xgeva를 투여받았습니다(n = 850) 또는 IV 주입으로 4주마다 4 mg(신장 기능에 따라 용량 조정) 졸레드론산을 투여받았습니다(n = 852). 입학 기준에는 혈청 칼슘(보정)이 8~11.5 mg/dL(2~2.9 mmol/L)이고 크레아티닌 청소율이 30 mL/min 이상이 포함되었습니다. IV 비스포스포네이트를 투여받은 환자는 제외되었으며, 이전에 ONJ 또는 턱뼈 골수염 병력이 있는 환자, 구강 수술이 필요한 활성 치과 또는 턱뼈 질환이 있는 환자, 치유되지 않은 치과/구강 수술을 받은 환자, 또는 계획된 침습적 치과 수술을 받을 예정인 환자도 제외되었습니다. 연구 기간 동안 칼슘과 인을 포함한 혈청 화학 검사를 4주마다 모니터링했습니다. 칼슘과 비타민 D 보충제를 권장했지만 필수는 아니었습니다.
Xgeva에 대한 중간 노출 기간은 16개월(범위: 1-50)이었고 연구 참여 기간은 17개월(범위: 0-49)이었습니다. Xgeva를 투여받은 환자 중 46%는 여성이었고 83%는 백인, 13%는 아시아인, 3%는 흑인 또는 아프리카계 미국인, 4%는 히스패닉/라틴계였습니다. Xgeva를 무작위 배정받은 환자의 중간 연령은 63세(범위: 29-91)였으며 Xgeva를 투여받은 모든 환자는 다발성 골수종 항암 화학 요법을 병용했습니다.
다발성 골수종 환자에서 Xgeva의 부작용 프로파일(연구 20090482)은 연구 20050136, 20050244 및 20050103에서 관찰된 프로파일과 유사했습니다. 가장 흔한 부작용(발생률 ≥ 10%)은 설사(34%), 메스꺼움(32%), 빈혈(22%), 요통(21%), 혈소판 감소증(19%), 말초 부종(17%), 저칼슘혈증(16%), 상기도 감염(15%), 발진(14%) 및 두통(11%)이었습니다. 가장 흔한 중증 부작용(발생률 ≥ 5%)은 폐렴(8%)이었습니다. Xgeva 중단으로 이어진 가장 흔한 부작용(≥ 1.0%)은 턱뼈 괴사였습니다.
저칼슘혈증 및 저인산혈증
심각한 저칼슘혈증(보정된 혈청 칼슘이 7 mg/dL 또는 1.75 mmol/L 미만)과 심각한 저인산혈증(혈청 인이 2 mg/dL 또는 0.6 mmol/L 미만)은 각각 Xgeva로 치료받은 환자의 2%와 21%에서 발생했습니다.
턱뼈 괴사 (ONJ)
연구 20090482의 1차 치료 단계에서 Xgeva 그룹 환자의 4.1%(중간 노출 기간 16개월; 범위: 1-50)와 졸레드론산 그룹 환자의 2.8%(중간 15개월, 범위: 1-45개월)에서 ONJ가 확인되었습니다. 연구 20090482의 이중맹검 치료 단계가 완료된 시점에서 Xgeva 그룹(중간 노출 기간 19.4개월; 범위 1-52)의 환자-년 조정 발생률(100 환자-년당 발생 건수)은 치료 첫 해에 2.0%, 둘째 해에 5.0%, 그 이후 매년 4.5%였습니다. ONJ까지의 중간 시간은 18.7개월(범위: 1-44)이었습니다 [경고 및 주의 사항 (5.4) 참조].
거대 세포 종양
Xgeva의 안전성은 총 548명의 성인 또는 골격 성숙한 청소년 환자를 대상으로 한 두 개의 단일군 시험(연구 20062004 및 연구 20040215) [임상 시험(14.3)] 에서 평가되었으며, 이들은 모두 골 거대 세포 종양을 앓고 있었으며 Xgeva를 최소 1회 투여 받았습니다. 환자들은 치료 첫 달 8일차와 15일차에 추가로 120mg을 투여하여 4주마다 피하로 120mg의 Xgeva를 투여 받았습니다. 비스포스포네이트 병용 요법을 받는 환자는 두 연구 모두에서 등록에서 제외되었습니다. ONJ 또는 턱 골수염의 병력이 있는 환자, 구강 수술이 필요한 활동적인 치과 또는 턱 상태, 치유되지 않은 치과/구강 수술 또는 계획된 침습적 치과 절차가 있는 환자는 연구 20040215에서 등록에서 제외되었습니다. 시험 기간 동안 칼슘과 인을 포함한 혈청 화학 검사는 4주마다 모니터링되었습니다. 칼슘과 비타민 D 보충제는 권장되었지만 필수는 아니었습니다.
Xgeva를 투여 받은 548명의 환자 중 467명의 환자가 Xgeva로 ≥ 1년, 323명의 환자가 ≥ 2년, 255명의 환자가 ≥ 3년 동안 치료를 받았습니다. 투여 받은 용량의 중앙값은 33회(범위: 4-138회)였으며 연구 참여 기간의 중앙값은 60개월(범위: 0-140개월)이었습니다. 등록된 환자의 57%는 여성이었고 82%는 백인이었습니다. 중앙값 연령은 33세(범위: 13-83세)였으며 총 19명의 환자가 골격 성숙한 청소년(12세에서 <17세)이었습니다.
골 거대 세포 종양 환자에서 Xgeva의 흔한 부작용 프로파일은 일반적으로 연구 20050136, 20050244 및 20050103에서 보고된 것과 유사했습니다. 환자에서 가장 흔한 부작용(발생률 ≥ 10%)은 관절통, 요통, 사지 통증, 피로, 두통, 메스꺼움, 비인두염, 근골격계 통증, 치통, 구토, 저인산혈증, 변비, 설사 및 기침이었습니다. 가장 빈번한 심각한 부작용은 턱뼈 괴사(3.6%), 뼈 거대 세포 종양(1.5%), 빈혈(1.1%), 폐렴(0.9%) 및 요통(0.9%)이었습니다. Xgeva 중단으로 이어지는 가장 빈번한 부작용은 턱뼈 괴사(발생률 3.6%)였습니다. 부작용 프로파일은 골격 성숙한 청소년과 성인에서 유사하게 나타났습니다.
저칼슘혈증 및 저인산혈증
- Xgeva로 치료받은 환자의 5%에서 중등도에서 중증의 저칼슘혈증(보정된 혈청 칼슘이 8mg/dL 또는 2mmol/L 미만)이 발생했습니다.
- Xgeva로 치료받은 환자의 20%에서 중증의 저인산혈증(혈청 인이 2~1mg/dL 또는 0.6~0.3mmol/L 미만)이 발생했습니다.
턱뼈 괴사(ONJ)
연구 20062004 및 연구 20040215에서 ONJ는 Xgeva를 투여 받은 환자의 6.6%에서 확인되었습니다. [경고 및 주의 사항(5.4)].
비정형 대전자 및 골간부 골절
비정형 대퇴골 골절은 Xgeva와 관련하여 보고되었으며, 풀링된 안전성 모집단에서 환자의 0.9%에서 관찰되었습니다 [경고 및 주의 사항(5.5)].
치료 중단 후 고칼슘혈증
풀링된 안전성 모집단에서 환자의 0.7%가 치료 중단 후 30일 이상 지속된 고칼슘혈증의 심각한 부작용을 경험했으며, 일부 환자에서 재발했습니다 [경고 및 주의 사항(5.6)].
악성 종양의 고칼슘혈증
Xgeva는 정맥 주사 비스포스포네이트 요법에 내성이 있는 악성 종양의 고칼슘혈증(뼈 전이 유무에 관계없이)이 있는 33명의 환자를 등록한 개방형 단일군 시험(연구 20070315)에서 평가되었습니다 [임상 시험(14.4)].
악성 종양의 고칼슘혈증 환자에서 Xgeva의 부작용 프로파일은 연구 20050136, 20050244, 20050103, 20062004 및 20040215에서 보고된 것과 유사했습니다. 환자의 20% 이상에서 발생한 부작용은 메스꺼움(30%), 호흡 곤란(27%), 식욕 감소(24%), 두통(24%), 말초 부종(24%), 구토(24%), 빈혈(21%), 변비(21%) 및 설사(21%)였습니다. 연구 치료와 관련된 3등급 이상의 심각도를 가진 다음 부작용이 연구 중에 보고되었습니다. 피로(3%) 및 감염(6%). 3등급 실험실 이상은 저마그네슘혈증(3%), 저칼륨혈증(3%) 및 저인산혈증(76%)이었습니다. 연구 중에 Xgeva 치료와 관련된 사망은 없었습니다.
6.2 시판 후 경험
다음 부작용은 Xgeva의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
6.3 면역원성
모든 치료용 단백질과 마찬가지로 면역원성이 발생할 가능성이 있습니다. 항체 형성의 검출은 검사의 민감도와 특이성에 크게 의존합니다. 또한 검사에서 관찰된 항체(중화 항체 포함) 양성률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 아래에 설명된 연구에서 데노수맙에 대한 항체 발생률을 다른 연구 또는 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
전기화학 발광 브리징 면역 분석법을 사용하여 4주 또는 12주마다 30-180mg의 데노수맙을 투여받은 골 전이 환자 2758명 중 1% 미만(7/2758)이 데노수맙에 대한 결합 항체에 대해 양성 반응을 보였습니다. 연구 20040215에서 거대 세포 종양 환자 37명 중 데노수맙에 대한 결합 항체에 대해 양성 반응을 보인 환자는 없었습니다. 연구 20062004에서 거대 세포 종양 환자 506명 중 3명이 데노수맙 치료 후 일시적인 결합 항체에 대해 양성 반응을 보였습니다. 연구 20090482에서 다발성 골수종 환자 중 기준선 이후 결과가 있는 환자 199명 중 1명이 데노수맙에 대한 결합 항체에 대해 양성 반응을 보였습니다. 화학 발광 세포 기반 in vitro 생물학적 분석법을 사용하여 평가한 결과, 결합 항체에 대해 양성 반응을 보인 환자는 중화 항체에 대해 양성 반응을 보인 환자가 없었습니다. 데노수맙에 대한 결합 항체 발생과 관련된 약동학적 프로파일, 독성 프로파일 또는 임상 반응의 변화는 관찰되지 않았습니다.
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과 및 작용 기전을 고려할 때, Xgeva는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다 [임상 약리학 (12.1) 참조]. 임산부에서 데노수맙 사용에 대한 데이터가 부족하여 약물 관련 부작용 발생 위험을 알 수 없습니다. 자궁 내 데노수맙 노출은 임신 기간 동안 매달 체중 기반으로 Xgeva 권장 인간 용량의 25배 높은 용량으로 데노수맙을 투여한 시노몰구스 원숭이에서 태아 사망, 사산 및 출생 후 사망률 증가; 림프절 결손, 비정상적인 뼈 성장 및 신생아 성장 감소를 초래했습니다 [데이터 참조].
임산부에게 태아에 대한 잠재적 위험을 알려주십시오.
지정된 인구 집단에서 주요 선천적 기형 및 유산의 배경 발생률은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
데이터
동물 데이터
데노수맙의 태아 발달에 대한 영향은 시노몰구스 원숭이와 유전자 조작 마우스에서 모두 연구되었습니다. 유전자 조작 마우스는 RANK 리간드(RANKL) 발현이 유전자 제거( “녹아웃 마우스”)에 의해 꺼졌습니다. 임신 기간 동안 임신 20일부터 시작하여 체중 기반으로 Xgeva 권장 인간 용량의 25배 높은 약리학적으로 활성적인 용량으로 데노수맙을 피하 주사한 시노몰구스 원숭이에서 임신 중 태아 사망, 사산 및 출생 후 사망률이 증가했습니다. 자손에서 발견된 다른 소견으로는 겨드랑이, 서혜부, 하악 및 장간막 림프절의 부재; 비정상적인 뼈 성장, 뼈 강도 감소, 조혈 감소, 치아 형성 이상 및 치아 배열 불량; 신생아 성장 감소가 있습니다. 출생부터 생후 1개월까지 영아는 측정 가능한 데노수맙 혈중 농도를 보였습니다(모체 수준의 22-621%).
출생부터 생후 6개월까지 회복 기간 후, 뼈 품질 및 강도에 대한 영향은 정상으로 돌아왔습니다. 치아 맹출에 대한 부작용은 없었지만 치아 형성 이상은 여전히 뚜렷했습니다. 겨드랑이 및 서혜부 림프절은 없었지만 하악 및 장간막 림프절은 존재했지만 작았습니다. 회복 동물 한 마리에서 여러 조직의 최소에서 중등도의 광물화가 관찰되었습니다. 분만 전에는 모체에 해가 없다는 증거가 없었습니다. 분만 중에 모체 부작용이 드물게 발생했습니다. 모체 유선 발달은 정상이었습니다. 이 연구에서 평가된 용량이 50mg/kg 한 가지뿐이었기 때문에 태아 NOAEL(관찰 가능한 부작용 수준 없음)은 확립되지 않았습니다. 생후 6개월에 유선 조직 병리학은 자궁 내 데노수맙에 노출된 암컷 자손에서 정상이었습니다. 그러나 발달 및 수유는 완전히 평가되지 않았습니다.
RANKL 녹아웃 마우스에서 RANKL(데노수맙의 표적)이 없으면 태아 림프절 무형성이 발생하고 출생 후 치아 및 뼈 성장 장애로 이어졌습니다. 임신한 RANKL 녹아웃 마우스는 모체 유선의 성숙이 변화되어 수유 장애가 발생했습니다 [특정 인구 집단에서의 사용 (8.3) 및 비임상 독성학 (13.2) 참조].
8.2 수유
위험 요약
모유에서 Xgeva(데노수맙)의 존재 여부, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다. 데노수맙은 데노수맙의 마지막 투여 후 최대 1개월까지 시노몰구스 원숭이의 모유에서 검출되었습니다( 모유:혈청 비율 ≤ 0.5%) 그리고 모체 유선 발달은 정상이었으며 수유 장애는 없었습니다. 그러나 임신한 RANKL 녹아웃 마우스는 모체 유선의 성숙이 변화되어 수유 장애가 발생했습니다 [특정 인구 집단에서의 사용 (8.1) 및 비임상 독성학 (13.2) 참조]. 모유 수유의 발달 및 건강상 이점과 함께 어머니의 Xgeva 치료에 대한 임상적 필요성, 그리고 Xgeva 또는 기저 모체 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용을 고려하십시오.
8.3 생식 능력이 있는 여성 및 남성
동물 연구 결과 및 작용 기전을 고려할 때, Xgeva는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다 [특정 인구 집단에서의 사용 (8.1) 참조].
임신 검사
Xgeva 치료를 시작하기 전에 생식 능력이 있는 여성의 임신 여부를 확인하십시오.
피임
여성
생식 능력이 있는 여성에게는 치료 기간 동안 그리고 Xgeva의 마지막 투여 후 최소 5개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
8.4 소아 사용
뼈가 성숙한 청소년(12-16세)을 제외하고 소아 환자에서 Xgeva의 안전성 및 유효성은 확립되지 않았습니다. 뼈가 성숙한 청소년(12-16세)에서 거대 세포 종양의 치료에만 Xgeva를 사용하는 것이 좋습니다 [적응증 및 사용 (1.2) 참조]. 뼈가 성장하는 소아 환자에서 거대 세포 종양 또는 승인되지 않은 적응증으로 데노수맙을 투여받은 후 치료 중단 후 임상적으로 유의미한 고칼슘혈증이 보고되었습니다 [부작용 (6.2) 및 경고 및 주의 사항 (5.6) 참조].
Xgeva는 골 거대 세포 종양이 있는 19명의 청소년 환자(12~16세)를 대상으로 한 개방형 시험에서 연구되었으며, 이 환자들은 골격 성숙에 도달했으며, 1개 이상의 성숙한 장골(예: 상완골의 폐쇄된 골단 성장판)이 있고 체중이 ≥ 45 kg [적응증 및 사용법 (1.2) 및 임상 시험 (14.3) 참조]. 평가 가능한 청소년 환자 5명 중 1명(20%)은 수정된 고형 종양 반응 평가 기준(RECIST 1.1)에 따른 방사선학적 반응의 회고적 독립적 평가에 의해 객관적 반응을 보였습니다. 부작용 프로파일과 유효성 결과는 골격 성숙이 된 청소년과 성인에서 유사한 것으로 나타났습니다 [부작용 (6.1) 및 임상 시험 (14.3) 참조].
동물 데이터
Xgeva로 치료하면 개방된 성장판이 있는 어린이의 골 성장이 손상될 수 있으며 치아의 맹출을 억제할 수 있습니다. 신생아 쥐에서 RANKL(Xgeva 치료의 표적)을 Fc에 결합된 골 보호 단백질의 구조체(OPG-Fc)로 10 mg/kg 이하의 용량으로 억제하면 골 성장과 치아 맹출이 억제되었습니다. 체중(mg/kg)을 기준으로 4주마다 1회 투여되는 권장 인간 용량 120 mg보다 5배 및 25배(10 mg/kg 및 50 mg/kg 용량) 높은 용량으로 데노수맙을 투여한 청소년 영장류는 비정상적인 성장판을 보였으며, 이는 데노수맙의 약리학적 활성과 일치하는 것으로 간주되었습니다.
데노수맙에 태내 노출된 짧은꼬리 원숭이는 골 이상, 혈액 생성 감소, 치아 배열 불량, 신생아 성장 감소, 겨드랑이, 서혜부, 하악 및 장간막 림프절이 없는 것을 보였습니다. 출생 후 노출이 중단되면 일부 골 이상이 회복되었지만, 겨드랑이 및 서혜부 림프절은 출생 후 6개월까지 없었습니다 [특정 인구 집단에서의 사용 (8.1)] 참조.
8.5 노인
Xgeva를 투여받은 임상 연구(n = 2841)의 총 환자 수 중 연구 20050136, 20050244 및 20050103에서 1271명(44%)이 ≥ 65세였고, 473명(17%)이 ≥ 75세였습니다. Xgeva를 투여받은 연구 20090482의 859명의 환자 중 387명(45%)이 ≥ 65세였고, 141명(16%)이 ≥ 75세였습니다. 노인 환자와 젊은 환자 간에 안전성 또는 유효성에 대한 전반적인 차이가 관찰되지 않았습니다.
8.6 신장애
암이 없는 다양한 정도의 신장 기능을 가진 환자를 대상으로 2건의 임상 시험이 수행되었습니다.
한 연구에서 다양한 정도의 신장 기능(정상에서 투석이 필요한 말기 신장 질환까지)을 가진 환자(N = 55)에게 데노수맙을 60 mg 피하 단일 용량으로 투여했습니다. 두 번째 연구에서 심각한 신장 기능 장애(크레아티닌 청소율이 30 mL/min 미만 및/또는 투석 중)를 가진 환자(N = 32)에게 데노수맙을 120 mg 피하 용량으로 2회 투여했습니다. 두 연구 모두에서 신장애가 심할수록, 그리고 칼슘 보충이 부족하거나 없을 경우 저칼슘혈증이 발생할 위험이 더 높았습니다. 저칼슘혈증은 환자의 96%에서 경증에서 중등도였습니다. 칼슘 수치와 칼슘 및 비타민 D 섭취량을 모니터링합니다 [경고 및 주의 사항 (5.3), 부작용 (6.1), 및 임상 약리학 (12.3) 참조].
10 과다 복용
Xgeva 과다 복용에 대한 경험은 없습니다.
11. 제품 설명
Xgeva (데노수맙)은 인간 RANKL에 결합하는 인간 IgG2 모노클로날 항체입니다. 데노수맙은 약 147 kDa의 분자량을 가지며 유전자 조작된 포유류 (중국 햄스터 난소) 세포에서 생산됩니다.
Xgeva는 멸균된 방부제가 없는 투명하고 무색에서 옅은 노란색 용액입니다.
Xgeva 단회용 바이알은 데노수맙 120mg, 아세테이트 (18mM), 폴리소르베이트 20 (0.01%), 소르비톨 (4.6%), 주사용수 (USP) 및 수산화나트륨 (pH 5.2)을 함유하고 있습니다.
12. 임상 약리학
12.1 작용 기전
Xgeva는 골 흡수를 담당하는 세포인 파골세포의 형성, 기능 및 생존에 필수적인 막횡단 또는 가용성 단백질인 RANKL에 결합하여 뼈에서 칼슘 방출을 조절합니다. RANKL에 의해 자극된 파골세포 활성 증가는 골 전이가 있는 고형 종양에서 골 병리의 매개체입니다. 마찬가지로, 골 거대 세포 종양은 RANKL을 발현하는 기질 세포와 RANK 수용체를 발현하는 파골세포 유사 거대 세포로 구성되며, RANK 수용체를 통한 신호 전달은 골 용해 및 종양 성장에 기여합니다. Xgeva는 RANKL이 파골세포, 그 전구체 및 파골세포 유사 거대 세포 표면의 수용체인 RANK를 활성화하는 것을 방지합니다.
12.2 약력학
유방암 및 골 전이 환자에서 Xgeva 120mg을 피하 투여한 후 1주일 이내에 uNTx/Cr의 중간 감소는 82%였습니다. 연구 20050136, 20050244 및 20050103에서 2075명의 Xgeva 치료 환자에서 기준선에서 3개월까지 uNTx/Cr의 중간 감소는 약 80%였습니다.
새로 진단된 다발성 골수종 환자를 대상으로 Xgeva 120mg을 4주마다(Q4W) 피하 투여한 3상 연구에서 5주째에 uNTx/Cr의 중간 감소가 약 75%로 관찰되었습니다. 120mg Q4W 투여를 지속한 9주에서 49주까지 uNTx/Cr의 중간 감소는 74%에서 79%로 유지되었습니다.
피하 투여한 Xgeva 120mg Q4W를 8일과 15일에 120mg 로딩 용량으로 투여한 골 거대 세포 종양이 있는 성인 및 골격 성숙 청소년 환자에서 기준선에서 uNTx/Cr의 중간 감소는 13주째에 84%, 25주째에 82%였습니다.
12.3 약동학
피하 투여 후 생체 이용률은 62%였습니다. 데노수맙은 60mg 미만의 용량에서 비선형 약동학을 보였지만, 더 높은 용량에서는 노출량이 용량에 비례하여 증가했습니다.
4주마다 120mg을 1회 피하 투여한 경우, 혈청 데노수맙 농도가 최대 2.8배까지 축적되었으며, 6개월 만에 정상 상태에 도달했습니다. 6개월 만에 평균 (± 표준 편차) 혈청 정상 상태 골 농도는 20.5 (± 13.5) mcg/mL였습니다. 평균 제거 반감기는 28일이었습니다.
새로 진단된 다발성 골수종 환자에게 4주마다 120mg을 투여한 경우, 데노수맙 농도는 6개월 만에 정상 상태에 도달하는 것으로 나타났습니다. 골 거대 세포 종양 환자의 경우, 4주마다 120mg을 피하 투여하고 치료 첫 달 8일과 15일에 120mg을 추가로 투여한 후, 첫 번째 투여 후 8일, 15일 및 1개월째의 평균 (± 표준 편차) 혈청 골 농도는 각각 19.0 (± 24.1), 31.6 (± 27.3), 36.4 (± 20.6) mcg/mL였습니다. 치료 시작 후 3개월 만에 평균 혈청 골 농도가 23.4 (± 12.1) mcg/mL로 정상 상태에 도달했습니다.
특별 인구 집단
체중: 인구 약동학 분석을 통해 인구 통계적 특성의 영향을 평가했습니다. 데노수맙의 청소율과 분포 용적은 체중에 비례했습니다. 4주마다 120mg을 반복적으로 피하 투여한 후 45kg과 120kg 피험자의 정상 상태 노출량은 각각 일반적인 66kg 피험자의 노출량보다 48% 높고 46% 낮았습니다.
연령, 성별 및 인종: 데노수맙의 약동학은 연령, 성별 및 인종의 영향을 받지 않았습니다.
소아과: 골 거대 세포 종양(GCTB)이 있는 골격 성숙 청소년 환자(12~16세)에게 4주마다 120mg을 투여하고 8일과 15일에 120mg 로딩 용량을 투여한 경우, 데노수맙의 약동학은 GCTB가 있는 성인 환자에서 관찰된 약동학과 유사했습니다.
간 기능 장애: 간 기능 장애가 데노수맙의 약동학에 미치는 영향을 평가하기 위한 임상 시험은 수행되지 않았습니다.
신장 기능 장애: 투석 환자를 포함하여 다양한 정도의 신장 기능 장애가 있는 환자 87명을 대상으로 한 임상 시험에서 신장 기능 장애의 정도는 데노수맙의 약동학 및 약력학에 영향을 미치지 않았습니다 [특정 인구 집단에서의 사용(8.6)].
약물 상호 작용
Xgeva와의 공식적인 약물 상호 작용 시험은 수행되지 않았습니다. 다양한 항암 치료가 데노수맙의 전신 노출 및 약력학적 효과에 영향을 미친다는 증거는 없었습니다. 이전에 정맥 내 비스포스포네이트 치료를 받은 환자와 그렇지 않은 환자에서 1개월과 3개월째의 혈청 데노수맙 농도와 3개월째의 골 전환 마커 uNTx/Cr(크레아티닌으로 보정한 요 N-말단 텔로펩티드) 감소는 유사했으며, 동반 화학 요법 및/또는 호르몬 요법에 의해 변경되지 않았습니다.
13. 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
데노수맙의 발암 가능성은 장기 동물 연구에서 평가되지 않았습니다. 데노수맙의 유전독성 가능성은 평가되지 않았습니다.
데노수맙은 체중 기준(mg/kg)으로 4주마다 1회 피하 투여되는 권장 인간 용량 120mg보다 6.5~25배 높은 용량에서 원숭이의 암컷 생식력이나 수컷 생식 기관에 영향을 미치지 않았습니다.
13.2 동물 독성 및/또는 약리학
데노수맙은 RANKL 억제를 통한 파골 세포 골 흡수 억제제입니다.
동물에서 데노수맙의 생물학적 활성은 비인간 영장류에 특이적이기 때문에 유전자 조작(녹아웃) 마우스 평가 또는 RANK/RANKL 경로의 다른 생물학적 억제제인 OPG-Fc 및 RANK-Fc의 사용은 데노수맙의 약력학적 특성에 대한 추가 정보를 제공했습니다. RANK/RANKL 녹아웃 마우스는 림프절 형성이 없었고, 유선 성숙(임신 중 소엽-포상샘 발달) 억제로 인해 수유가 없었습니다. 신생아 RANK/RANKL 녹아웃 마우스는 골 성장이 감소하고 치아 맹출이 없었습니다. RANKL 억제제 OPG-Fc를 투여한 2주령 쥐에서 수행된 확인 연구에서도 골 성장 감소, 성장판 변화 및 치아 맹출 장애가 나타났습니다. RANKL 억제제 투여를 중단하면 이 모델에서 이러한 변화가 부분적으로 회복되었습니다.
14건의 임상 시험
14.1 고형 종양의 뼈 전이
고형 종양의 뼈 전이 환자에서 골격 관련 사건 예방을 위한 Xgeva의 안전성 및 유효성은 Xgeva와 zoledronic acid를 비교한 3건의 국제적 무작위 배정(1:1), 이중맹검, 활성 대조, 비열등성 시험에서 입증되었습니다. 3건의 시험 모두에서 환자는 4주마다 120mg Xgeva를 피하 주사 또는 4주마다 4mg zoledronic acid를 정맥 주사(IV)로 투여받도록 무작위 배정되었습니다(감소된 신장 기능에 대한 용량 조정). 크레아티닌 청소율이 30mL/분 미만인 환자는 제외되었습니다. 각 시험에서 주요 결과 측정은 zoledronic acid와 비교하여 첫 번째 골격 관련 사건(SRE)까지의 시간의 비열등성을 입증하는 것이었습니다. 보조 결과 측정은 첫 번째 SRE까지의 시간의 우월성과 첫 번째 및 후속 SRE까지의 시간의 우월성이었습니다. 이러한 결과 측정에 대한 검사는 주요 결과 측정이 통계적으로 유의미한 경우에 발생했습니다. SRE는 다음 중 하나로 정의되었습니다. 병리적 골절, 뼈에 대한 방사선 치료, 뼈에 대한 수술 또는 척수 압박.
연구 20050136(NCT00321464)에는 진행된 유방암 및 뼈 전이가 있는 환자 2046명이 등록되었습니다. 무작위 배정은 이전 SRE 병력(유무), 무작위 배정 전 6주 이내에 화학 요법을 받았는지 여부(유무), 이전 경구 비스포스포네이트 사용(유무) 및 지역(일본 또는 기타 국가)에 따라 계층화되었습니다. 환자의 40%가 이전 SRE를 경험했고, 40%가 무작위 배정 전 6주 이내에 화학 요법을 받았으며, 5%가 이전 경구 비스포스포네이트를 사용했으며, 7%가 일본에서 등록되었습니다. 중앙값 연령은 57세였으며, 환자의 80%가 백인이었고, 99%가 여성이었습니다. 투여된 중앙값 용량은 denosumab의 경우 18회, zoledronic acid의 경우 17회였습니다.
연구 20050244(NCT00330759)에는 유방암 및 거세 저항성 전립선암을 제외한 고형 종양 및 뼈 전이 및 다발성 골수종이 있는 성인 1776명이 등록되었습니다. 무작위 배정은 이전 SRE(유무), 무작위 배정 시 전신 항암 요법(유무) 및 종양 유형(비소세포 폐암, 골수종 또는 기타)에 따라 계층화되었습니다. 무작위 배정 시 87%가 전신 항암 요법을 받고 있었고, 52%가 이전 SRE를 경험했으며, 환자의 64%가 남성이었고, 87%가 백인이었으며, 중앙값 연령은 60세였습니다. 환자의 40%가 비소세포 폐암, 10%가 다발성 골수종, 9%가 신세포 암종, 6%가 소세포 폐암을 앓았습니다. 기타 종양 유형은 각각 등록된 인구의 5% 미만을 차지했습니다. 투여된 중앙값 용량은 denosumab과 zoledronic acid 모두 7회였습니다.
연구 20050103(NCT00321620)에는 거세 저항성 전립선암 및 뼈 전이가 있는 남성 1901명이 등록되었습니다. 무작위 배정은 이전 SRE, PSA 수치(10ng/mL 미만 또는 10ng/mL 이상) 및 무작위 배정 전 6주 이내에 화학 요법을 받았는지 여부(유무)에 따라 계층화되었습니다. 환자의 26%가 이전 SRE를 경험했고, 15%가 PSA가 10ng/mL 미만이었으며, 14%가 무작위 배정 전 6주 이내에 화학 요법을 받았습니다. 중앙값 연령은 71세였으며, 환자의 86%가 백인이었습니다. 투여된 중앙값 용량은 denosumab의 경우 13회, zoledronic acid의 경우 11회였습니다.
Xgeva는 골 전이가 있는 유방암 또는 거세 저항성 전립선암(CRPC) 환자에서 무작위 배정 후 첫 번째 SRE까지의 시간을 zoledronic acid와 비교하여 지연시켰습니다(표 2). 기타 고형 종양 또는 다발성 골수종으로 인한 용해성 병변으로 인한 뼈 전이가 있는 환자의 경우 Xgeva는 무작위 배정 후 첫 번째 SRE까지의 시간을 지연시키는 데 zoledronic acid와 비열등했습니다.
전반적인 생존율과 무진행 생존율은 3건의 시험 모두에서 두 군 간에 유사했습니다.
| 연구 20050136 전이성 유방암 |
연구 20050244 전이성 고형 종양 또는 다발성 골수종 |
연구 20050103 전이성 CRPCa |
|||||||||
| Xgeva N = 1026 |
Zoledronic Acid N = 1020 |
Xgeva N = 886 |
Zoledronic Acid N = 890 |
Xgeva N = 950 |
Zoledronic Acid N = 951 |
||||||
| 첫 번째 연구 SRE | |||||||||||
| SRE를 경험한 환자 수(%) | 315 (30.7) | 372 (36.5) | 278 (31.4) | 323 (36.3) | 341 (35.9) | 386 (40.6) | |||||
| 첫 번째 SRE의 구성 요소 | |||||||||||
| 뼈에 대한 방사선 치료 | 82 (8.0) | 119 (11.7) | 119 (13.4) | 144 (16.2) | 177 (18.6) | 203 (21.3) | |||||
| 병적 골절 | 212 (20.7) | 238 (23.3) | 122 (13.8) | 139 (15.6) | 137 (14.4) | 143 (15.0) | |||||
| 뼈 수술 | 12 (1.2) | 8 (0.8) | 13 (1.5) | 19 (2.1) | 1 (0.1) | 4 (0.4) | |||||
| 척수 압박 | 9 (0.9) | 7 (0.7) | 24 (2.7) | 21 (2.4) | 26 (2.7) | 36 (3.8) | |||||
| SRE까지의 중간 시간(개월) | NRb | 26.4 | 20.5 | 16.3 | 20.7 | 17.1 | |||||
| 위험 비율(95% CI) | 0.82 (0.71, 0.95) | 0.84 (0.71, 0.98) | 0.82 (0.71, 0.95) | ||||||||
| 비열등성 p-값 | < 0.001 | < 0.001 | < 0.001 | ||||||||
| 우월성 p-값c | 0.010 | 0.060 | 0.008 | ||||||||
| 첫 번째 및 후속 SREd | |||||||||||
| 환자당 평균 수 | 0.46 | 0.60 | 0.44 | 0.49 | 0.52 | 0.61 | |||||
| 비율 비율(95% CI) | 0.77 (0.66, 0.89) | 0.90 (0.77, 1.04) | 0.82 (0.71, 0.94) | ||||||||
| 우월성 p-값e | 0.001 | 0.145 | 0.009 | ||||||||
| a CRPC = 거세 저항성 전립선암. b NR = 달성되지 않음. c 우월성 검사는 데노수맙이 시험 내에서 조레드론산에 비열등한 것으로 입증된 후에만 수행됨. d 무작위 배정 후 모든 골격 사건; 새로운 사건은 이전 사건 후 ≥ 21일 후 발생으로 정의됨. e 조정된 p-값이 제시됨. |
|||||||||||
14.2 다발성 골수종
Xgeva의 골격 관련 사건 예방 효능은 질병 진행을 통한 치료를 받는 새로 진단된 다발성 골수종 환자에서 연구 20090482(NCT01345019)에서 평가되었으며, 이 연구는 Xgeva와 졸레드론산을 비교하는 국제적, 무작위(1:1), 이중맹검, 활성 대조, 비열등성 시험이었습니다. 이 시험에서 환자는 4주마다 피하 주사로 120mg Xgeva를 투여받거나 4주마다 정맥 주사(IV)로 4mg 졸레드론산을 투여받았습니다(감소된 신장 기능에 대한 용량 조정). 크레아티닌 청소율이 30mL/분 미만인 환자는 제외되었습니다. 이 시험에서 주요 효능 결과 측정은 첫 번째 골격 관련 사건(SRE)까지의 시간의 비열등성이었습니다. 추가적인 효능 결과 측정은 첫 번째 SRE까지의 시간, 첫 번째 및 후속 SRE까지의 시간, 전체 생존율이었습니다. SRE는 다음 중 하나로 정의되었습니다. 병리적 골절, 뼈에 대한 방사선 치료, 뼈에 대한 수술 또는 척수 압박.
연구 20090482는 뼈 병변이 있는 새로 진단된 다발성 골수종 환자 1718명을 등록했습니다. 무작위 배정은 이전 SRE 병력(유무), 1차 치료에서 사용되거나 사용될 예정인 항골수종 약물(신규 치료 기반 또는 비신규 치료 기반[신규 치료에는 보르테조밉, 레날리도마이드 또는 탈리도마이드 포함]), 자가 PBSC 이식을 받을 의향(유무), 진단 시기(국제 단계 시스템 I 또는 II 또는 III) 및 지역 일본(유무)에 따라 계층화되었습니다. 연구 등록 시, 환자의 96%가 신규 치료 기반 1차 항골수종 치료를 받고 있었거나 받을 예정이었고, 환자의 55%가 자가 PBSC 이식을 받을 의향이 있었고, 환자의 61%가 이전 SRE가 있었고, 32%가 ISS 단계 I, 38%가 ISS 단계 II, 29%가 ISS 단계 III였으며, 2%가 일본에서 등록되었습니다. 중앙값 연령은 63세였고, 환자의 82%가 백인이었으며, 환자의 46%가 여성이었습니다. 투여된 중앙값 용량은 Xgeva의 경우 16회, 졸레드론산의 경우 15회였습니다.
Xgeva는 무작위 배정 후 첫 번째 SRE까지의 시간을 지연시키는 데 졸레드론산에 비열등했습니다(HR = 0.98, 95% CI, 0.85-1.14). 전체 생존율(OS) 결과는 Xgeva와 졸레드론산 치료 그룹 간에 위험 비율이 0.90(95% CI: 0.70, 1.16)으로 비슷했습니다.
| 연구 20090482 다발성 골수종 |
||
| Xgeva N = 859 |
졸레드론산 N = 859 |
|
| 첫 번째 연구-SRE | ||
| SRE가 발생한 환자 수(%) | 376(43.8) | 383(44.6) |
| 첫 번째 SRE의 구성 요소 | ||
| 뼈에 대한 방사선 치료 | 47(5.5) | 62(7.2) |
| 병리적 골절 | 342(39.8) | 338(39.3) |
| 뼈에 대한 수술 | 37(4.3) | 48(5.6) |
| 척수 압박 | 6(0.7) | 4(0.5) |
| SRE까지의 중앙값 시간(월) (95% CI) |
22.8 (14.7, NEa) |
24 (16.6, 33.3) |
| 위험 비율(95% CI) | 0.98 (0.85, 1.14) | |
| a NE = 추정 불가 | ||
14.3 뼈 거대 세포 종양
성인 또는 골격 성숙 청소년에서 뼈 거대 세포 종양 치료를 위한 Xgeva의 안전성 및 유효성은 재발성, 절제 불가능하거나 계획된 수술이 심각한 질병을 초래할 가능성이 있는 것으로 조직학적으로 확인된 측정 가능한 뼈 거대 세포 종양이 있는 환자를 등록한 두 개의 공개 라벨 시험 [연구 20040215 (NCT00396279) 및 연구 20062004 (NCT00680992)]에서 입증되었습니다. 환자는 치료 첫 주기의 8일차와 15일차에 로딩 용량을 투여하여 4주마다 피하로 120mg Xgeva를 투여받았습니다. Xgeva를 중단한 환자는 최소 60개월 동안 안전성 추적 관찰 단계에 진입했습니다. 안전성 추적 관찰 중에 Xgeva에 대한 반응을 보인 환자(예: 재발성 질환의 경우)는 Xgeva로 재치료가 허용되었습니다.
연구 20040215는 절제 불가능하거나 재발성 뼈 거대 세포 종양이 있는 37명의 성인 환자를 대상으로 한 단일군, 약력학적 및 개념 증명 시험이었습니다. 환자는 조직학적으로 확인된 뼈 거대 세포 종양과 연구 등록 전 28일 이내에 얻은 컴퓨터 단층 촬영(CT) 또는 자기 공명 영상(MRI)에서 측정 가능한 질병의 방사선학적 증거가 있어야 했습니다. 연구 20040215에 등록된 환자는 Xgeva 치료 중 기준선과 분기별로 뼈 거대 세포 종양에 대한 CT 또는 MRI 평가를 받았습니다.
연구 20062004는 조직학적으로 확인된 뼈 거대 세포 종양과 측정 가능한 활성 질병의 증거가 있는 535명의 성인 또는 골격 성숙 청소년 환자를 대상으로 한 병렬 코호트, 개념 증명 및 안전성 시험이었습니다. 연구 20062004는 12-16세의 환자 19명을 등록했습니다 [특정 인구 집단에서의 사용(8.4) 참조]. 환자는 세 가지 코호트 중 하나에 등록되었습니다. 코호트 1은 수술로 구제할 수 없는 질병(예: 질병의 천골 또는 척추 부위 또는 폐 전이)이 있는 환자 268명을 등록했습니다. 코호트 2는 수술로 구제할 수 있는 질병이 있지만 연구자는 계획된 수술이 심각한 질병을 초래할 가능성이 있다고 판단한 환자 252명을 등록했습니다(예: 관절 절제술, 사지 절단 또는 반골반 절제술). 코호트 3은 이전에 연구 20040215에 참여한 환자 15명을 등록했습니다. 환자는 치료 의사가 결정한 간격으로 질병 상태에 대한 영상 평가를 받았습니다.
독립적인 검토 위원회가 실시한 회고적 중간 분석은 기준선과 기준선 이후 방사선학적 평가가 최소한 한 번 이상 가능한 연구 20040215와 연구 20062004에 등록되어 치료받은 환자 187명(연구 20040215에 등록된 37명 중 27명과 연구 20062004의 코호트 1과 2에 등록된 270명 중 160명)에서 객관적 반응을 평가했습니다. 주요 유효성 결과 측정은 고형 종양 반응 평가 기준(RECIST) v 1.1을 사용한 객관적 반응률이었습니다.
전반적인 객관적 반응률(RECIST 1.1)은 25%(95% CI: 19, 32)였습니다. 모든 반응은 부분 반응이었습니다. 추정 중앙값 반응 시간은 3개월이었습니다. 객관적 반응을 보인 47명의 환자에서 추적 관찰의 중앙값 기간은 20개월(범위: 2-44개월)이었고, 51%(24/47)는 최소 8개월 지속되는 반응 기간을 가졌습니다. 3명의 환자가 객관적 반응 후 질병 진행을 경험했습니다.
14.4 악성 종양성 고칼슘혈증
Xgeva의 안전성 및 유효성은 정맥 내 비스포스포네이트 치료에 내성이 있는 악성 종양성 고칼슘혈증(뼈 전이 유무)이 있는 환자 33명을 등록한 공개 라벨, 단일군 시험 [연구 20070315 (NCT00896454)]에서 입증되었습니다. 환자는 치료 첫 달의 8일차와 15일차에 추가로 120mg 용량을 투여하여 4주마다 피하로 Xgeva를 투여받았습니다.
이 시험에서 악성 종양성 고칼슘혈증에 대한 내성은 Xgeva 치료 시작 전 7-30일 동안 정맥 내 비스포스포네이트 치료에도 불구하고 알부민 보정 칼슘이 > 12.5mg/dL(3.1mmol/L)인 것으로 정의되었습니다. 주요 결과 측정은 Xgeva 투여 후 10일 이내에 보정 혈청 칼슘(CSC) ≤ 11.5mg/dL(2.9mmol/L)로 정의된 반응을 달성한 환자의 비율이었습니다. 유효성 데이터는 그림 1과 표 4에 요약되어 있습니다. 동시 화학 요법은 Xgeva에 대한 반응에 영향을 미치지 않는 것으로 나타났습니다.
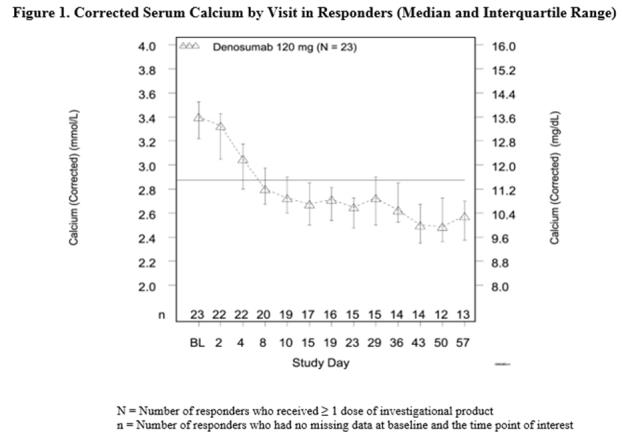
| N = 33 | 비율 (%) (95% CI) |
|
| 10일까지 모든 반응자(CSC ≤ 11.5mg/dL) | 21 | 63.6 |
| (45.1, 79.6) | ||
| 57일까지 모든 반응자 | 23 | 69.7 |
| (51.3, 84.4) | ||
| 10일까지 완전 반응자(CSC ≤ 10.8mg/dL) | 12 | 36.4 |
| (20.4, 54.9) | ||
| 57일까지 모든 완전 반응자 | 21 | 63.6 |
| (45.1, 79.6) |
반응까지의 중간 시간(CSC ≤ 11.5 mg/dL)은 9일(95% CI: 8, 19)이었고, 반응의 중간 지속 시간은 104일(95% CI: 7, 추정 불가)이었습니다. 완전 반응까지의 중간 시간(CSC ≤ 10.8 mg/dL)은 23일(95% CI: 9, 36)이었고, 완전 반응의 중간 지속 시간은 34일(95% CI: 1, 134)이었습니다.
16 공급/보관 및 취급 방법
Xgeva는 단회 투여 바이알로 제공됩니다.
| 120 mg/1.7 mL | 카톤당 바이알 1개 | NDC 55513-730-01 |
Xgeva는 원래 포장 상태로 냉장 보관(2°C~8°C/36°F~46°F)하십시오. 냉동하지 마십시오. 냉장고에서 꺼낸 Xgeva는 25°C/77°F 이상의 온도 또는 직사광선에 노출되지 않도록 하고 14일 이내에 사용해야 합니다. 14일 이내에 사용하지 않은 Xgeva는 폐기하십시오. 라벨에 인쇄된 유효 기간이 지난 Xgeva는 사용하지 마십시오.
Xgeva를 직사광선과 열로부터 보호하십시오.
Xgeva를 심하게 흔들지 마십시오.
17 환자 상담 정보
동일 활성 성분을 함유한 의약품
데노수맙은 Prolia로도 판매되고 있음을 환자에게 알리고, Xgeva를 복용하는 경우 Prolia를 투여해서는 안 됨을 알려야 합니다 [경고 및 주의 사항 (5.1) 참조].
과민 반응
과민 반응의 징후 또는 증상이 나타나면 즉시 의료 처치를 받도록 환자에게 알려야 합니다. 전신 과민 반응의 징후 또는 증상이 있었던 환자에게는 데노수맙 (Xgeva 또는 Prolia)을 투여해서는 안 됨을 알려야 합니다 [경고 및 주의 사항 (5.2) 및 금기 사항 (4.2) 참조].
저칼슘혈증
환자에게 칼슘과 비타민 D를 적절히 보충하고 Xgeva를 투여하는 동안 혈청 칼슘 수치를 유지하는 것이 중요함을 알려야 합니다 [경고 및 주의 사항 (5.3) 및 특정 환자군에서의 사용 (8.6) 참조]. 저칼슘혈증의 징후 또는 증상이 나타나면 즉시 의료 처치를 받도록 환자에게 알려야 합니다.
턱뼈 괴사
환자에게 Xgeva 치료를 받는 동안 구강 위생을 철저히 유지하고 치과 치료를 받기 전에 Xgeva를 투여받고 있음을 치과 의사에게 알리도록 알려야 합니다. 환자는 Xgeva 치료를 받는 동안 침습적인 치과 치료를 피해야 하며, 치과 수술 후 입이나 턱에 지속적인 통증 및/또는 느린 치유가 발생하면 의료진 또는 치과 의사에게 알려야 합니다 [경고 및 주의 사항 (5.4) 참조].
비정형 소전자 및 골간부 대퇴골 골절
환자에게 새로운 또는 특이한 허벅지, 엉덩이 또는 사타구니 통증을 보고하도록 알려야 합니다 [경고 및 주의 사항 (5.5) 참조].
거대 세포 종양 골 및 성장 골격 환자에서 치료 중단 후 고칼슘혈증
환자에게 치료 중단 후 메스꺼움, 구토, 두통 및 의식 저하를 보고하도록 알려야 합니다 [경고 및 주의 사항 (5.6) 및 특정 환자군에서의 사용 (8.4) 참조].
치료 중단 후 다발성 척추 골절 (MVF)
환자에게 Xgeva 치료를 중단한 후 특히 골절이 있었거나 골다공증이 있는 환자의 경우 척추에서 골절이 발생할 위험이 증가할 수 있음을 알려야 합니다. 환자에게 의사의 조언 없이 Xgeva 치료를 중단하지 않도록 알려야 합니다 [경고 및 주의 사항 (5.7) 참조].
태아 독성
임신 가능성이 있는 여성에게 Xgeva가 태아에게 해를 끼칠 수 있으며, 임신 사실을 알고 있거나 의심되는 경우 의료진에게 알리도록 알려야 합니다 [경고 및 주의 사항 (5.8) 및 특정 환자군에서의 사용 (8.1, 8.3) 참조].
임신 가능성이 있는 여성에게 치료 기간 동안 및 Xgeva 마지막 투여 후 최소 5개월 동안 효과적인 피임 방법을 사용하도록 알려야 합니다 [특정 환자군에서의 사용 (8.3) 참조].
Xgeva® (데노수맙)
제조사:
Amgen Inc.
One Amgen Center Drive
Thousand Oaks, California 91320-1799
U.S. License No. 1080
특허: http://pat.amgen.com/xgeva/
© 2010-2020 Amgen Inc. 모든 권리 보유.
1xxxxx – v20
주요 표시 패널 – 1.7mL 바이알 상자
AMGEN®
120
mg/1.7mL
XGEVA®
(덴오수맙)
120 mg/1.7 mL
(70 mg/mL)
주사
피하 주사용
단회용 앰플. 사용하지 않은 부분은 폐기하십시오.


