의약품 제조업체: Janssen Pharmaceuticals, Inc. (Updated: 2024-10-29)
처방 정보의 주요 내용
XARELTO
® (리바록사반) 정제, 경구 투여
XARELTO
® (리바록사반) 현탁액, 경구 투여
미국 최초 승인: 2011
경고: (A) XARELTO의 조기 중단은 혈전색전증 위험을 증가시키고, (B) 척추/경막 외혈종
전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.
(A) XARELTO의 조기 중단은 혈전색전증 위험을 증가시킵니다
XARELTO를 포함한 모든 경구 항응고제의 조기 중단은 혈전색전증 위험을 증가시킵니다. 이 위험을 줄이기 위해 XARELTO가 병리적 출혈 또는 치료 과정 완료 이외의 이유로 중단되는 경우 다른 항응고제로의 적용을 고려하십시오. (
2.2,
2.3,
5.1,
14.1)
(B) 척추/경막 외혈종
경막 외 또는 척추 외혈종은 신경축 마취를 받거나 척추 천자를 시행한 XARELTO 치료 환자에서 발생했습니다. 이러한 혈종은 장기간 또는 영구적인 마비를 초래할 수 있습니다. (
5.2,
5.3,
6.2)
환자를 신경 장애의 징후 및 증상에 대해 자주 모니터링하고, 관찰되는 경우 긴급히 치료하십시오. 항응고제를 투여받고 있거나 투여해야 하는 환자의 경우 신경축 개입 전에 이점과 위험을 고려하십시오. (
5.3)
적응증 및 사용
XARELTO는 다음과 같은 경우에 사용되는 요인 Xa 억제제입니다.
- 비판막 심방세동에서 뇌졸중 및 전신 색전증 위험 감소 (
1.1)
- 심부 정맥 혈전증 (DVT) 치료 (
1.2)
- 폐색전증 (PE) 치료 (
1.3)
- DVT 또는 PE 재발 위험 감소 (
1.4)
- 무릎 또는 고관절 치환 수술을 받은 환자에서 PE로 이어질 수 있는 DVT 예방 (
1.5)
- 급성 질환 환자에서 정맥혈전색전증 (VTE) 예방 (
1.6)
- 관상 동맥 질환 (CAD) 환자에서 주요 심혈관 사건 위험 감소 (
1.7)
- 말초 동맥 질환 (PAD) 환자, 특히 증상성 PAD로 인해 최근 하지 재혈관화술을 받은 환자에서 주요 혈전성 혈관 사건 위험 감소 (
1.8)
- 출생부터 18세 미만의 소아 환자에서 VTE 치료 및 재발 위험 감소 (
1.9)
- 폰탄 수술 후 2세 이상의 선천성 심장 질환 소아 환자에서 혈전 예방 (
1.10)
투여량 및 투여 방법
-
비판막 심방세동: 음식과 함께 하루에 15mg 또는 20mg 1회 (
2.1)
-
DVT 및/또는 PE 치료: 처음 21일 동안 음식과 함께 하루에 15mg 2회 경구 투여, 그 후 나머지 치료 기간 동안 음식과 함께 하루에 20mg 1회 경구 투여 (
2.1)
-
DVT 및/또는 PE 재발 위험 감소 (DVT 및/또는 PE 재발 위험이 있는 환자): 표준 항응고제 치료를 최소 6개월 동안 받은 후 음식과 함께 또는 음식 없이 하루에 10mg 1회 (
2.1)
-
고관절 또는 무릎 치환 수술 후 DVT 예방: 음식과 함께 또는 음식 없이 하루에 10mg 1회 경구 투여 (
2.1)
-
혈전색전증 합병증 위험이 있지만 출혈 위험이 높지 않은 급성 질환 환자에서 VTE 예방: 음식과 함께 또는 음식 없이 하루에 10mg 1회, 입원 중 및 퇴원 후 총 31일에서 39일 동안 권장 (
2.1)
-
CAD 또는 PAD: 음식과 함께 또는 음식 없이 하루에 2.5mg 2회 경구 투여, 아스피린 (75~100mg)과 함께 하루에 1회 (
2.1)
-
소아 환자: 전체 처방 정보에서 투약 권장 사항 참조 (
2.2)
경고 및 주의 사항
부작용
의심되는 부작용을 보고하려면 Janssen Pharmaceuticals, Inc.에 1-800-526-7736 또는 FDA에 1-800-FDA-1088 또는
www.fda.gov/medwatch로 연락하십시오.
특정 인구 집단에서의 사용
환자 상담 정보 및 약물 안내서를 보려면 17을 참조하십시오.
개정: 2023년 2월
목차
전문 정보: 목차*
경고: (A) XARELTO의 조기 중단은 혈전색전증 위험 증가, (B) 척추/경막 외 혈종
1 적응증 및 사용법
1.1 비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
1.2 심부 정맥 혈전증 치료
1.3 폐색전증 치료
1.4 심부 정맥 혈전증 및/또는 폐색전증 재발 위험 감소
1.5 고관절 또는 무릎 인공관절 수술 후 심부 정맥 혈전증 예방
1.6 혈전색전증 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 중증 질환 환자에서 정맥혈전색전증 예방
1.7 관상동맥 질환(CAD) 환자에서 주요 심혈관 사건 위험 감소
1.8 말초 동맥 질환(PAD) 환자, 특히 증상성 PAD로 인한 하지 재혈관화술을 시행한 환자에서 주요 혈전색전증 혈관 사건 위험 감소
1.9 소아 환자에서 정맥혈전색전증 치료 및 재발 위험 감소
1.10 폰탄 수술 후 선천성 심장 질환이 있는 소아 환자에서 혈전 예방
2 용법 및 용량
2.1 성인에서 권장 용량
2.2 소아 환자에서 권장 용량
2.3 XARELTO로의 전환 및 XARELTO에서의 전환
2.4 수술 및 기타 시술을 위한 중단
2.5 복용 누락
2.6 투여 경로
2.7 경구용 현탁액 XARELTO의 약국 준비 지침
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 조기 중단 후 혈전색전증 위험 증가
5.2 출혈 위험
5.3 척추/경막 외 마취 또는 천자
5.4 신장애 환자에서의 사용
5.5 간장애 환자에서의 사용
5.6 P-gp 및 강력한 CYP3A 억제제 또는 유도제와의 병용
5.7 임신 관련 출혈 위험
5.8 인공 심장 판막 환자
5.9 혈역학적으로 불안정한 환자 또는 혈전 용해제 또는 폐색전증 절제술이 필요한 환자에서 급성 PE
5.10 삼중 양성 항인지질 증후군 환자에서 혈전증 위험 증가
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 일반적인 억제 및 유도 특성
7.2 시토크롬 P450 3A 효소 및 약물 수송 시스템을 억제하는 약물
7.3 시토크롬 P450 3A 효소 및 약물 수송 시스템을 유도하는 약물
7.4 항응고제 및 NSAID/아스피린
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
10 과량 복용
11 설명
12 약리 작용
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 QT/QTc 연장
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 비판막성 심방세동에서 뇌졸중 예방
14.2 심부 정맥 혈전증(DVT) 및/또는 폐색전증(PE) 치료
14.3 DVT 및/또는 PE 재발 위험 감소
14.4 고관절 또는 무릎 인공관절 수술 후 심부 정맥 혈전증 예방
14.5 혈전색전증 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 중증 질환 환자에서 정맥혈전색전증 예방
14.6 CAD 환자에서 주요 심혈관 사건 위험 감소
14.7 말초 동맥 질환(PAD) 환자, 특히 증상성 PAD로 인한 하지 재혈관화술을 시행한 환자에서 주요 혈전색전증 혈관 사건 위험 감소
14.8 소아 환자에서 정맥혈전색전증 치료 및 재발 위험 감소
14.9 폰탄 수술 후 선천성 심장 질환이 있는 소아 환자에서 혈전 예방
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: (A) XARELTO의 조기 중단은 혈전색전증 위험을 증가시키고, (B) 척추/경막 외혈종
A. XARELTO의 조기 중단은 혈전색전증 위험을 증가시킵니다
XARELTO를 포함한 모든 경구 항응고제의 조기 중단은 혈전색전증 위험을 증가시킵니다. XARELTO로 항응고 요법을 병리적 출혈 또는 치료 과정 완료 이외의 이유로 중단하는 경우, 다른 항응고제로 치료를 고려하십시오.
[
2.4),
임상 연구 (14.1) 참조]
.
B. 척추/경막 외혈종
경막 외 또는 척추혈종은 척추 마취를 받거나 척추 천자를 시행한 XARELTO 치료 환자에서 발생했습니다. 이러한 혈종은 장기간 또는 영구적인 마비를 초래할 수 있습니다. 환자를 척추 수술 일정을 잡을 때 이러한 위험을 고려하십시오. 이러한 환자에서 경막 외 또는 척추혈종 발생 위험을 증가시킬 수 있는 요인은 다음과 같습니다.
- 경막 외 카테터 삽입
- 비 스테로이드성 항염증제 (NSAIDs), 혈소판 억제제, 다른 항응고제와 같은 지혈에 영향을 미치는 다른 약물의 병용
- 외상성 또는 반복적인 경막 외 또는 척추 천자의 병력
- 척추 기형 또는 척추 수술 병력
- XARELTO 투여와 척추 수술 사이의 최적 시간은 알려져 있지 않습니다
[
5.3) 및
부작용 (6.2) 참조].
신경 손상의 징후와 증상을 자주 모니터링하십시오. 신경 손상이 나타나면 긴급 치료가 필요합니다.
[
경고 및 주의 사항 (5.3) 참조]
.
혈전증 예방을 위해 항응고제를 투여하거나 투여할 예정인 환자의 경우 척추 수술의 이점과 위험을 고려하십시오.
[
경고 및 주의 사항 (5.3) 참조]
.
1 적응증 및 용법
1.1 비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
XARELTO는 비판막성 심방세동이 있는 성인 환자에서 뇌졸중 및 전신 색전증 위험을 줄이기 위해 사용됩니다.
와파린 치료가 잘 조절된 경우 뇌졸중 및 전신 색전증 위험 감소에 대한 XARELTO와 와파린의 상대적 효과에 대한 데이터는 제한적입니다.
[
임상 연구 (14.1) 참조].
1.4 심부 정맥 혈전증 및/또는 폐색전증 재발 위험 감소
XARELTO는 최소 6개월 동안 지속된 초기 치료 완료 후 재발 위험이 있는 성인 환자에서 DVT 및/또는 PE 재발 위험을 줄이기 위해 사용됩니다.
1.6 혈전색전증 위험이 높지 않은 급성 질환 환자에서 정맥 혈전색전증 예방
XARELTO는 중등도 또는 중증의 제한된 이동성 및 VTE에 대한 다른 위험 요인으로 인해 혈전색전증 합병증 위험이 있는 급성 질환으로 입원한 성인 환자에서 입원 기간 및 퇴원 후 정맥 혈전색전증(VTE) 및 VTE 관련 사망을 예방하기 위해 사용됩니다.
[
임상 연구 (14.5) 참조].
1.7 관상 동맥 질환(CAD) 환자에서 주요 심혈관 사건 위험 감소
XARELTO는 아스피린과 병용하여 관상 동맥 질환이 있는 성인 환자에서 주요 심혈관 사건(심혈관 사망, 심근 경색 및 뇌졸중) 위험을 줄이기 위해 사용됩니다.
1.8 말초 동맥 질환(PAD) 환자, 특히 증상성 PAD로 인해 하지 재혈관화술을 받은 환자에서 주요 혈전색전증 사건 위험 감소
XARELTO는 아스피린과 병용하여 말초 동맥 질환(PAD)이 있는 성인 환자, 특히 증상성 PAD로 인해 최근 하지 재혈관화술을 받은 환자에서 주요 혈전색전증 사건(심근 경색, 허혈성 뇌졸중, 급성 사지 허혈 및 혈관 병변으로 인한 주요 절단) 위험을 줄이기 위해 사용됩니다.
1.9 소아 환자에서 정맥 혈전색전증 치료 및 재발 위험 감소
XARELTO는 최소 5일 동안 초기 비경구 항응고제 치료를 받은 출생부터 18세 미만의 소아 환자에서 정맥 혈전색전증(VTE) 치료 및 재발 위험 감소에 사용됩니다.
1.10 폰탄 수술 후 선천성 심장 질환이 있는 소아 환자에서 혈전 예방
XARELTO는 폰탄 수술을 받은 2세 이상의 선천성 심장 질환이 있는 소아 환자에서 혈전 예방에 사용됩니다.
2 투여 및 관리
2.1 성인에 대한 권장 용량
| 적응증 | 신장 고려 사항 | 용량 | 음식/시간 |
|---|---|---|---|
| 비판막성 심방 세동에서 뇌졸중 위험 감소 | CrCl >50 mL/min | 1일 1회 20mg | 저녁 식사와 함께 복용 |
| CrCl ≤50 mL/min | 1일 1회 15mg | 저녁 식사와 함께 복용 | |
| 심재색전증 및/또는 폐색전증 치료 | CrCl ≥15 mL/min | 15mg
1일 2회 1일 1회 |
매일 같은 시간에 음식과 함께 복용 |
| CrCl <15 mL/min | 사용하지 마십시오 | ||
| 심재색전증 및/또는 폐색전증 재발 위험 감소 (심재색전증 및/또는 폐색전증 재발 위험이 있는 환자) | CrCl ≥15 mL/min | 표준 항응고제 치료를 최소 6개월 동안 받은 후, 1일 1회 10mg | 음식과 함께 또는 음식 없이 복용 |
| CrCl <15 mL/min | 사용하지 마십시오 | ||
| 다음과 같은 경우 심재색전증 예방: | |||
|
CrCl ≥15 mL/min | 수술 후 지혈이 확인된 후 6~10시간 후, 35일 동안 1일 1회 10mg | 음식과 함께 또는 음식 없이 복용 |
| CrCl <15 mL/min | 사용하지 마십시오 | ||
|
CrCl ≥15 mL/min | 수술 후 지혈이 확인된 후 6~10시간 후, 12일 동안 1일 1회 10mg | 음식과 함께 또는 음식 없이 복용 |
| CrCl <15 mL/min | 사용하지 마십시오 | ||
| 혈전색전증 합병증 위험이 있는 급성 중증 질환 환자에서 VTE 예방 (출혈 위험이 높지 않은 환자) | CrCl ≥15 mL/min | 입원 중 및 퇴원 후, 총 31일에서 39일 동안 1일 1회 10mg | 음식과 함께 또는 음식 없이 복용 |
| CrCl <15 mL/min | 사용하지 마십시오 | ||
| 관상동맥 질환에서 주요 심혈관 사건 (심혈관 사망, 심근 경색 및 뇌졸중) 위험 감소 | CrCl에 따른 용량 조절 필요 없음 | 2.5mg
1일 2회, 아스피린 (75~100mg) 1일 1회 추가 |
음식과 함께 또는 음식 없이 복용 |
| 말초 동맥 질환(PAD)에서 주요 혈전 색전성 혈관 사건의 위험 감소, 하지 재혈관화 후 PAD 증상 환자 포함 | CrCl에 따른 용량 조절 필요 없음 | 2.5 mg
1일 2회, 아스피린(75–100 mg) 1일 1회 추가. 성공적인 하지 재혈관화 절차 후 치료를 시작할 때, 지혈이 확립되면 시작합니다. |
음식과 함께 또는 음식 없이 복용 |
2.2 소아 환자에서 권장 용량
소아 환자에서 정맥혈전색전증 치료 및 재발성 정맥혈전색전증 위험 감소
| 투여 형태 | 체중 | 1 mg XARELTO = 1 mL 현탁액 | |||
|---|---|---|---|---|---|
| 용량 | 총 일일 용량 | ||||
| 1일 1회 | 1일 2회 | 1일 3회 | |||
| 경구 현탁액만 | 2.6 kg to 2.9 kg | 0.8 mg | 2.4 mg | ||
| 3 kg to 3.9 kg | 0.9 mg | 2.7 mg | |||
| 4 kg to 4.9 kg | 1.4 mg | 4.2 mg | |||
| 5 kg to 6.9 kg | 1.6 mg | 4.8 mg | |||
| 7 kg to 7.9 kg | 1.8 mg | 5.4 mg | |||
| 8 kg to 8.9 kg | 2.4 mg | 7.2 mg | |||
| 9 kg to 9.9 kg | 2.8 mg | 8.4 mg | |||
| 10 kg to 11.9 kg | 3 mg | 9 mg | |||
| 12 kg to 29.9 kg | 5 mg | 10 mg | |||
| 경구 현탁액 또는 정제 | 30 kg to 49.9 kg | 15 mg | 15 mg | ||
| ≥50 kg | 20 mg | 20 mg | |||
XARELTO의 투약은 연구되지 않았으며 따라서 다음 환자군에서는 투약을 확실하게 결정할 수 없습니다. 따라서 다음과 같은 경우 6개월 미만의 소아에게 사용하는 것은 권장되지 않습니다.
- 출생 시 재태 기간이 37주 미만
- 경구 영양 섭취 기간이 10일 미만
- 체중이 2.6kg 미만
흡수를 높이기 위해 모든 용량은 수유 중 또는 식사와 함께 복용해야 합니다.
특히 12kg 미만의 소아의 경우 체중을 모니터링하고 용량을 정기적으로 검토해야 합니다. 이는 치료 용량이 유지되도록 하기 위함입니다.
Fontan 수술 후 선천성 심장 질환이 있는 소아 환자의 혈전 예방
| 투약 형태 | 체중 | 1mg XARELTO = 1mL 현탁액 | ||
|---|---|---|---|---|
| 용량 | 총 일일 용량 | |||
| 하루에 한 번 | 하루에 두 번 | |||
| 경구 현탁액만 | 7kg ~ 7.9kg | 1.1mg | 2.2mg | |
| 8kg ~ 9.9kg | 1.6mg | 3.2mg | ||
| 10kg ~ 11.9kg | 1.7mg | 3.4mg | ||
| 12kg ~ 19.9kg | 2mg | 4mg | ||
| 20kg ~ 29.9kg | 2.5mg | 5mg | ||
| 30kg ~ 49.9kg | 7.5mg | 7.5mg | ||
| 경구 현탁액 또는 정제 | ≥50kg | 10mg | 10mg | |
소아 환자에서의 투여
음식 효과:
소아에서 VTE 치료를 위해, 흡수를 증가시키기 위해 음식과 함께 복용해야 합니다.
Fontan 수술 후 혈전색전증 예방을 위해, 음식과 함께 또는 음식 없이 복용할 수 있습니다.
구토 또는 토사물: 환자가 복용 후 30분 이내에 구토하거나 토사물을 토해낸 경우, 새로운 용량을 투여해야 합니다. 그러나 환자가 복용 후 30분 이상 후에 구토하는 경우, 용량을 재투여하지 않아야 하며 다음 용량은 예정된 대로 복용해야 합니다. 환자가 반복적으로 구토하거나 토사물을 토해내는 경우, 보호자는 즉시 소아의 의사에게 연락해야 합니다.
소아 환자에서의 신장애 환자에서의 사용
1세 이상 환자
- 경증 신장애 (eGFR: 50 to ≤ 80 mL/min/1.73 m
2): 용량 조절이 필요하지 않습니다.
- 중등도 또는 중증 신장애 (eGFR: <50 mL/min/1.73 m
2): 임상 데이터가 제한적이므로 사용하지 마십시오.
추정 사구체 여과율 (eGFR)은 업데이트된 Schwartz 공식을 사용하여 계산할 수 있습니다. eGFR (Schwartz) = (0.413 × 키 (cm))/혈청 크레아티닌 (mg/dL), 혈청 크레아티닌 (SCr)은 동위원소 희석 질량 분석법 (IDMS)으로 추적 가능하도록 교정된 효소적 크레아티닌 방법으로 측정한 경우.
SCr이 IDMS로 추적 가능하도록 재교정되지 않은 일반적인 방법 (예: 기존 Jaffé 반응)으로 측정한 경우, eGFR은 원래 Schwartz 공식에서 얻어야 합니다. eGFR (mL/min/1.73 m
2) = k * 키 (cm)/SCr (mg/dL), 여기서 k는 비례 상수입니다.
- k = 1세에서 13세까지의 어린이의 경우 0.55
- k = 13세 이상 18세 미만의 여자의 경우 0.55
- k = 13세 이상 18세 미만의 남자의 경우 0.70
1세 미만 환자
혈청 크레아티닌을 사용하여 신장 기능을 확인하십시오. 혈청 크레아티닌 결과가 97.5
th 백분위수를 초과하는 1세 미만의 소아 환자에게는 XARELTO를 사용하지 마십시오. 임상 데이터가 없기 때문입니다.
| 나이 | 크레아티닌의 97.5
th 백분위수 (mg/dL) |
크레아티닌의 97.5
th 백분위수 (µmol/L) |
|---|---|---|
| 2주 | 0.52 | 46 |
| 3주 | 0.46 | 41 |
| 4주 | 0.42 | 37 |
| 2개월 | 0.37 | 33 |
| 3개월 | 0.34 | 30 |
| 4–6개월 | 0.34 | 30 |
| 7–9개월 | 0.34 | 30 |
| 10–12개월 | 0.36 | 32 |
2.3 XARELTO로의 전환 및 XARELTO에서의 전환
와파린에서 XARELTO로 전환 – 와파린에서 XARELTO로 환자를 전환할 때, 성인의 경우 국제표준화비율(INR)이 3.0 미만이고 소아 환자의 경우 2.5 미만이 될 때까지 와파린을 중단하고 XARELTO를 시작하여 불충분한 항응고 기간을 피하십시오.
XARELTO에서 와파린으로 전환 –
- 성인:
XARELTO에서 와파린으로 환자를 전환하는 방법을 안내하는 임상 시험 데이터는 없습니다. XARELTO는 INR에 영향을 미치므로 와파린과 병용 투여하는 동안 측정한 INR은 와파린의 적절한 용량을 결정하는 데 유용하지 않을 수 있습니다. 한 가지 방법은 XARELTO를 중단하고 다음 XARELTO 투여 시간에 정맥 주사 항응고제와 와파린을 모두 시작하는 것입니다.
- 소아 환자:
XARELTO에서 와파린으로 전환하는 동안 적절한 항응고를 보장하기 위해 와파린 첫 번째 투여 후 최소 2일 동안 XARELTO를 계속 투여하십시오. 와파린과 2일간 병용 투여 후, 다음 예정된 XARELTO 투여 전에 INR을 측정해야 합니다. INR이 ≥ 2.0이 될 때까지 XARELTO와 와파린의 병용 투여를 계속하는 것이 좋습니다.
XARELTO를 중단하면 마지막 투여 후 24시간 후에 INR 검사를 신뢰할 수 있게 수행할 수 있습니다.
2.4 수술 및 기타 시술을 위한 중단
수술 또는 기타 시술로 인한 출혈 위험을 줄이기 위해 항응고를 중단해야 하는 경우, 출혈 위험을 줄이기 위해 시술 최소 24시간 전에 XARELTO를 중단해야 합니다.
[
. 마지막 XARELTO 투여 후 24시간까지 시술을 연기할지 여부를 결정할 때, 출혈 위험 증가와 개입의 긴급성을 비교해야 합니다. XARELTO는 수술 또는 기타 시술 후 적절한 지혈이 확립되면 즉시 재개해야 하며, 치료 효과가 나타나는 시간이 짧다는 점에 유의하십시오.
[
. 수술 중 또는 후에 경구 약물을 복용할 수 없는 경우, 정맥 주사 항응고제를 투여하는 것을 고려하십시오.
2.5 누락된 복용량
성인
- 1일 2회 2.5mg을 투여받는 환자: 복용량을 놓친 경우, 환자는 다음 예정된 시간에 권장대로 단일 2.5mg XARELTO 복용량을 복용해야 합니다.
- 1일 2회 15mg을 투여받는 환자: 환자는 1일 30mg XARELTO를 복용하도록 즉시 XARELTO를 복용해야 합니다. 15mg 정제 2개를 한 번에 복용할 수 있습니다.
- 1일 1회 20mg, 15mg 또는 10mg을 투여받는 환자: 환자는 놓친 XARELTO 복용량을 즉시 복용해야 합니다. 놓친 복용량을 보충하기 위해 같은 날에 복용량을 두 배로 늘리면 안 됩니다.
소아 환자
- XARELTO를 1일 1회 복용하는 경우, 환자는 발견 즉시 가능한 한 빨리 놓친 복용량을 복용해야 하지만 같은 날에만 복용해야 합니다. 이것이 불가능한 경우, 환자는 복용량을 건너뛰고 처방된대로 다음 복용량을 계속 복용해야 합니다. 환자는 놓친 복용량을 보충하기 위해 두 번 복용해서는 안 됩니다.
- XARELTO를 1일 2회 복용하는 경우, 환자는 발견 즉시 가능한 한 빨리 놓친 아침 복용량을 복용해야 합니다. 놓친 아침 복용량은 저녁 복용량과 함께 복용할 수 있습니다. 놓친 저녁 복용량은 같은 저녁에만 복용할 수 있습니다.
- XARELTO를 1일 3회 복용하는 경우, 복용량을 놓친 경우, 환자는 놓친 복용량을 건너뛰고 놓친 복용량을 보충하지 않고 평소 시간에 정기적인 복용 일정으로 돌아가야 합니다.
다음 날에는 환자는 정기적인 요법을 계속해야 합니다.
2.6 투여 옵션
정제를 통째로 삼킬 수 없는 성인 환자의 경우, XARELTO 정제(모든 강도)를 분쇄하여 사용 직전에 사과 소스와 섞어 경구로 투여할 수 있습니다. 분쇄된 XARELTO 15mg 또는 20mg 정제를 투여한 후에는 즉시 음식을 섭취해야 합니다. 2.5mg 또는 10mg 정제의 경우 음식과 함께 투여할 필요가 없습니다.
[
.
투여 XARELTO 정제를 비강관 (NG) 또는 위 영양관을 통해 투여하는 경우: 관이 위에 위치했는지 확인한 후, XARELTO 정제 (모든 강도)를 분쇄하여 50mL의 물에 현탁시켜 NG 관 또는 위 영양관을 통해 투여할 수 있습니다. 리바록사반의 흡수는 약물 방출 부위에 따라 달라지므로, 흡수 감소 및 약물 노출 감소로 이어질 수 있는 위보다 원위부로 XARELTO를 투여하지 마십시오. 분쇄된 XARELTO 15mg 또는 20mg 정제를 투여한 후에는 즉시 경장 영양을 실시해야 합니다. 2.5mg 또는 10mg 정제를 투여한 후에는 경장 영양이 필요하지 않습니다.
[
.
분쇄된 XARELTO 정제 (모든 강도)는 물과 사과 소스에 최대 4시간 동안 안정적입니다.
시험관 내 적합성 연구에 따르면 분쇄된 XARELTO 정제의 수성 현탁액에서 리바록사반이 PVC 또는 실리콘 비강관 (NG) 튜브에 흡착되지 않는 것으로 나타났습니다.
XARELTO 현탁액을 NG 관 또는 위 영양관을 통해 투여하는 경우: XARELTO 경구 현탁액은 NG 관 또는 위 영양관을 통해 투여할 수 있습니다. 투여 후에는 영양관을 물로 씻어내십시오.
소아 환자에서 재발성 VTE의 치료 또는 위험 감소를 위해서는 흡수를 높이기 위해 투여 후 즉시 경장 영양을 실시해야 합니다. 폰탄 수술을 받은 선천성 심장 질환이 있는 소아 환자의 혈전증 예방의 경우에는 투여 후 경장 영양이 필요하지 않습니다.
An
시험관 내 적합성 연구에 따르면 XARELTO 현탁액은 PVC, 폴리우레탄 또는 실리콘 NG 튜브와 함께 사용할 수 있습니다.
2.7 XARELTO 경구 현탁액의 약국 준비 지침
제품은 이미 맛을 낸 (달콤하고 크리미한) 상태이므로 맛을 추가하지 마십시오.
분배 전에 재구성하십시오.
- 모든 과립이 자유롭게 흐를 때까지 병을 두드립니다.
- 재구성을 위해 정제수 150mL를 첨가합니다.
- 60초 동안 흔듭니다. 모든 과립이 적셔지고 현탁액이 균일한지 확인하십시오.
- 어댑터를 병목에 밀어 넣고 병뚜껑을 닫습니다.
- 현탁액은 60일 이내에 사용해야 합니다.
- 병과 갑자에 “폐기 날짜”를 적습니다.
분배 지침:
- 원래 병에 분배하십시오.
- 원래 상자에 제공된 주사기를 사용하여 병을 세워서 분배하십시오.
재구성된 현탁액은 20°C에서 25°C(68°F에서 77°F)의 실온에 보관하십시오. 15°C에서 30°C(59°F에서 86°F)의 범위에서 변동이 허용됩니다. 냉동하지 마십시오.
약사가 보호자에게 적절한 사용 방법을 알려주는 것이 좋습니다. 환자 또는 보호자에게 약물 안내서와 사용 지침을 읽도록 알립니다.
3 제형 및 함량
- 2.5 mg 정제: 둥글고, 연한 노란색이며, 한쪽에는 아래쪽을 향하는 삼각형 위에 “2.5”가 표시되어 있고 다른 쪽에는 “Xa”가 표시된 필름 코팅 정제
- 10 mg 정제: 둥글고, 연한 빨간색이며, 양쪽이 볼록하고, 한쪽에는 아래쪽을 향하는 삼각형 위에 “10”이 표시되어 있고 다른 쪽에는 “Xa”가 표시된 필름 코팅 정제
- 15 mg 정제: 둥글고, 빨간색이며, 양쪽이 볼록하고, 한쪽에는 아래쪽을 향하는 삼각형 위에 “15”가 표시되어 있고 다른 쪽에는 “Xa”가 표시된 필름 코팅 정제
- 20 mg 정제: 삼각형 모양이며, 진한 빨간색이고, 한쪽에는 아래쪽을 향하는 삼각형 위에 “20”이 표시되어 있고 다른 쪽에는 “Xa”가 표시된 필름 코팅 정제
- 경구 현탁액용: 백색에서 거의 백색의 과립; 재구성 후, 1 mg/mL의 농도로 맛을 낸 백색에서 거의 백색의 불투명한 액체를 제공합니다.
4 금기사항
XARELTO는 다음 환자에게 금기입니다.
- 활성 병적 출혈
[경고 및 주의 사항 (5.2) 참조
Warnings and Precautions (5.2)]
- XARELTO에 대한 중증 과민 반응 (예: 아나필락시스 반응)
[부작용 (6.2) 참조
5 경고 및 주의사항
5.1 조기 중단 후 혈전색전증 위험 증가
XARELTO를 포함한 모든 경구 항응고제의 적절한 대체 항응고제 없이 조기 중단은 혈전색전증 위험을 증가시킵니다. 심방세동 환자에서 XARELTO에서 와파린으로 전환하는 동안 임상 시험에서 뇌졸중 발생률이 증가했습니다. XARELTO가 병적 출혈 또는 치료 과정 완료 이외의 이유로 중단되는 경우, 다른 항응고제로 치료를 고려하십시오.
[
2.4) 및
임상 연구 (14.1) 참조]
.
5.2 출혈 위험
XARELTO는 출혈 위험을 증가시키며 심각하거나 치명적인 출혈을 유발할 수 있습니다. 출혈 위험이 증가된 환자에게 XARELTO를 처방할지 여부를 결정할 때 혈전색전증 위험과 출혈 위험을 비교해야 합니다.
혈액 손실의 징후 또는 증상이 나타나면 즉시 평가하고 수혈 필요성을 고려하십시오. 활성 병적 출혈이 있는 환자에게는 XARELTO를 중단하십시오. 리바록사반의 말단 제거 반감기는 20세에서 45세의 건강한 피험자에서 5~9시간입니다.
지혈을 손상시키는 다른 약물과의 병용은 출혈 위험을 증가시킵니다. 여기에는 아스피린, P2Y
12 혈소판 억제제, 이중 항혈소판 요법, 기타 항혈전제, 섬유소 용해 요법, 비스테로이드성 항염증제 (NSAIDs)
[
약물 상호 작용 (7.4) 참조]
, 선택적 세로토닌 재흡수 억제제 및 세로토닌 노르에피네프린 재흡수 억제제가 포함됩니다.
P-gp 및 강력한 CYP3A 억제제로 알려진 약물과의 병용은 리바록사반 노출을 증가시키고 출혈 위험을 증가시킬 수 있습니다.
[
약물 상호 작용 (7.2) 참조]
.
출혈 위험이 높은 급성 질환 환자에서 출혈 위험
다음과 같은 상태의 급성 질환 환자는 원발성 VTE 예방을 위해 XARELTO를 사용할 경우 출혈 위험이 증가합니다. 기관지 확장증, 폐 공동 또는 폐 출혈 병력, 활성 암(즉, 급성 입원 암 치료를 받는 경우), 치료 전 3개월 이내에 활성 위십이지장 궤양, 치료 전 3개월 이내에 출혈 병력 또는 이중 항혈소판 요법. XARELTO는 출혈 위험이 높은 입원한 급성 질환 환자의 원발성 VTE 예방에 사용해서는 안 됩니다.
항응고 효과의 역전
리바록사반의 항-factor Xa 활성을 역전시키는 약물이 있습니다. 리바록사반은 고농도의 혈장 단백질 결합으로 인해 투석이 불가능합니다.
[
임상 약리학 (12.3) 참조]
. 프로타민 설페이트와 비타민 K는 리바록사반의 항응고 활성에 영향을 미치지 않을 것으로 예상됩니다. 프로트롬빈 복합체 농축액 (PCC), 활성화된 프로트롬빈 복합체 농축액 또는 재조합 factor VIIa와 같은 응고 촉진 역전제의 사용을 고려할 수 있지만 임상 효능 및 안전성 연구에서 평가되지 않았습니다. 응고 검사(PT, INR 또는 aPTT) 또는 항-factor Xa (FXa) 활성을 사용하여 리바록사반의 항응고 효과를 모니터링하는 것은 권장되지 않습니다.
5.3 척추/경막 마취 또는 천자
신경축 마취(척추/경막 마취) 또는 척추 천자를 시행할 때 혈전색전증 합병증 예방을 위해 항응고제로 치료받는 환자는 장기간 또는 영구적인 마비를 초래할 수 있는 경막외 또는 척추혈종이 발생할 위험이 있습니다.
[
경고 참조]
.
XARELTO와 경막외 또는 척추 마취/진통제 또는 척추 천자의 병용과 관련된 출혈 위험을 줄이기 위해 XARELTO의 약동학적 특성을 고려하십시오.
[
임상 약리학 (12.3) 참조]
. 경막외 카테터의 삽입 또는 제거 또는 요추 천자는 XARELTO의 항응고 효과가 낮을 때 수행하는 것이 가장 좋지만 각 환자에서 충분히 낮은 항응고 효과에 도달하는 정확한 시기는 알려져 있지 않습니다.
체류형 경막외 또는 척추강내 카테터는 XARELTO 마지막 투여 후 최소 2개의 반감기(즉, 20세에서 45세의 젊은 환자의 경우 18시간, 60세에서 76세의 노인 환자의 경우 26시간)가 지날 때까지 제거해서는 안 됩니다.
[
임상 약리학 (12.3) 참조]
. 다음 XARELTO 용량은 카테터 제거 후 6시간 이전에 투여해서는 안 됩니다. 외상성 천자가 발생하면 XARELTO 투여를 24시간 연기하십시오.
의사가 경막외 또는 척추 마취/진통제 또는 요추 천자의 맥락에서 항응고제를 투여하기로 결정한 경우, 중앙선 등통, 감각 및 운동 장애(하지의 저림, 따끔거림 또는 약화), 배변 및/또는 방광 기능 장애와 같은 신경 손상의 징후 또는 증상을 자주 모니터링하십시오. 환자에게 위의 징후 또는 증상이 나타나면 즉시 보고하도록 지시하십시오. 척추혈종의 징후 또는 증상이 의심되는 경우, 이러한 치료가 신경학적 후유증을 예방하거나 역전시키지 못할 수 있더라도 척수 감압을 고려한 긴급 진단 및 치료를 시작하십시오.
5.4 신장애 환자에서의 사용
심방세동(판막성이 아닌)
임상적으로 필요한 경우 (예: 신장 기능이 저하될 수 있는 상황에서는 더 자주) 신장 기능을 주기적으로 평가하고 그에 따라 치료를 조정하십시오.
[
용법 및 용량 (2.1) 참조]
. XARELTO를 복용하는 동안 급성 신부전이 발생한 환자의 경우 XARELTO의 용량 조절 또는 중단을 고려하십시오.
[
특정 집단에서의 사용 (8.6) 참조].
심부정맥혈전증(DVT), 폐색전증(PE) 치료 및 DVT 및 PE 재발 위험 감소
CrCl <30 mL/min인 환자의 경우 리바록사반 노출 및 약력학적 효과는 정상 신장 기능을 가진 환자에 비해 증가합니다. CrCl 15~<30 mL/min인 환자에 대한 임상 데이터는 제한적이므로 이러한 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min(투석 환자 포함)인 환자에 대한 임상 데이터는 없으므로 이러한 환자의 경우 XARELTO를 사용하지 마십시오.
치료 중 급성 신부전이 발생한 환자의 경우 XARELTO를 중단하십시오.
[
.
고관절 또는 무릎 인공관절 수술 후 심부정맥혈전증 예방
CrCl <30 mL/min인 환자의 경우 리바록사반 노출 및 약력학적 효과는 정상 신장 기능을 가진 환자에 비해 증가합니다. CrCl 15~<30 mL/min인 환자에 대한 임상 데이터는 제한적이므로 이러한 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min(투석 환자 포함)인 환자에 대한 임상 데이터는 없으므로 이러한 환자의 경우 XARELTO를 사용하지 마십시오.
치료 중 급성 신부전이 발생한 환자의 경우 XARELTO를 중단하십시오.
[
특정 집단에서의 사용 (8.6) 참조].
혈전색전증 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 중증 질환 환자에서의 정맥혈전색전증 예방
CrCl <30 mL/min인 환자의 경우 리바록사반 노출 및 약력학적 효과는 정상 신장 기능을 가진 환자에 비해 증가합니다. CrCl 15~<30 mL/min인 환자에 대한 임상 데이터는 제한적이므로 이러한 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min(투석 환자 포함)인 환자에 대한 임상 데이터는 없으므로 이러한 환자의 경우 XARELTO를 사용하지 마십시오.
치료 중 급성 신부전이 발생한 환자의 경우 XARELTO를 중단하십시오.
[
특정 집단에서의 사용 (8.6) 참조].
5.5 간장애 환자에서의 사용
중증 간장애가 있는 성인 환자에 대한 임상 데이터는 없습니다.
약물 노출 및 출혈 위험이 증가할 수 있으므로 중등도(Child-Pugh B) 및 중증(Child-Pugh C) 간장애가 있는 환자 또는 응고 장애와 관련된 간 질환이 있는 환자의 경우 XARELTO를 사용하지 마십시오.
[
.
간장애가 있는 소아 환자에 대한 임상 데이터는 없습니다.
5.6 P-gp 및 강력한 CYP3A 억제제 또는 유도제와의 병용
알려진 P-gp 및 강력한 CYP3A 억제제와 XARELTO를 병용하지 마십시오.
[
약물 상호 작용 (7.2) 참조]
.
알려진 P-gp 및 강력한 CYP3A 유도제와 XARELTO를 병용하지 마십시오.
[
약물 상호 작용 (7.3) 참조]
.
5.7 임신 관련 출혈 위험
임산부의 경우 잠재적 이점이 모체 및 태아에 대한 잠재적 위험을 정당화하는 경우에만 XARELTO를 사용해야 합니다. 임신 중 XARELTO 투여량은 연구되지 않았습니다. XARELTO의 항응고 효과는 표준 실험실 검사로 모니터링할 수 없습니다. 출혈을 암시하는 징후 또는 증상(예: 헤모글로빈 및/또는 헤마토크릿 감소, 저혈압 또는 태아 곤란)을 신속하게 평가하십시오.
[
.
5.8 인공 심장 판막 환자
GALILEO 연구 결과에 따르면, XARELTO는 경피적 대동맥 판막 치환술(TAVR)을 받은 환자에게 권장되지 않습니다. XARELTO 투여군 환자는 항혈소판 요법 투여군 환자에 비해 사망 및 출혈 발생률이 높았습니다. XARELTO의 안전성 및 유효성은 다른 인공 심장 판막 또는 다른 판막 수술을 받은 환자에서 연구되지 않았습니다. XARELTO는 인공 심장 판막 환자에게 권장되지 않습니다.
5.9 혈역학적으로 불안정한 환자 또는 혈전 용해 요법 또는 폐색전술이 필요한 환자의 급성 폐색전증
혈역학적으로 불안정하거나 혈전 용해 요법 또는 폐색전술을 받을 수 있는 폐색전증 환자의 경우, XARELTO는 비분획 헤파린의 대안으로 급성적으로 시작하는 것이 권장되지 않습니다.
5.10 삼중 양성 항인지질 증후군 환자의 혈전증 위험 증가
XARELTO를 포함한 직접 작용 경구 항응고제(DOAC)는 삼중 양성 항인지질 증후군(APS) 환자에게 사용하는 것이 권장되지 않습니다. APS 환자(특히 루푸스 항응고제, 항카디오리핀 및 항베타 2-글리코단백 I 항체에 대해 양성인 환자)의 경우 DOAC 치료는 비타민 K 길항제 치료에 비해 재발성 혈전색전증 발생률이 높은 것과 관련이 있습니다.
6 부작용
다음의 임상적으로 유의한 부작용은 라벨의 다른 섹션에서도 논의됩니다.
- 비판막성 심방세동 중단 후 뇌졸중 위험 증가
[see
Boxed Warning and
Warnings and Precautions (5.1)]
- 출혈 위험
[see
Warnings and Precautions (5.2,
5.4,
5.5,
5.6,
5.7)]
- 척추/경막외혈종
[see
Boxed Warning and
Warnings and Precautions (5.3)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험 발생률과 직접 비교할 수 없으며 임상 실습에서 관찰된 발생률을 반영하지 않을 수 있습니다.
승인된 적응증에 대한 임상 개발 과정에서 34,947명의 성인 환자가 XARELTO에 노출되었습니다.
출혈
XARELTO의 가장 흔한 부작용은 출혈 합병증이었습니다.
[see
Warnings and Precautions (5.2)]
.
비판막성 심방세동
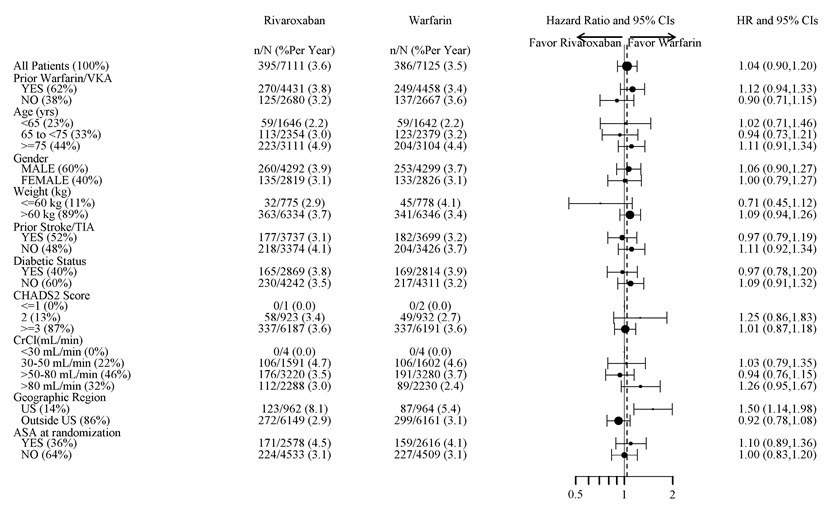
ROCKET AF 시험에서 영구적인 약물 중단과 관련된 가장 흔한 부작용은 출혈 사건이었으며, XARELTO의 경우 4.3%, 와파린의 경우 3.1%의 발생률을 보였습니다. 비출혈 부작용으로 인한 중단 발생률은 두 치료군에서 유사했습니다.
표 5는 ROCKET AF 시험에서 다양한 유형의 출혈 사건을 경험한 환자 수를 보여줍니다.
| 매개변수 | XARELTO
N=7111 n (%/년) |
와파린
N=7125 n (%/년) |
XARELTO vs. 와파린
HR (95% CI) |
|---|---|---|---|
| 약어: HR = 위험 비율, CI = 신뢰 구간, CRNM = 임상적으로 관련된 비주요. | |||
|
|||
| 주요 출혈 | 395 (3.6) | 386 (3.5) | 1.04 (0.90, 1.20) |
| 두개내 출혈 (ICH) | 55 (0.5) | 84 (0.7) | 0.67 (0.47, 0.93) |
| 출혈성 뇌졸중 | 36 (0.3) | 58 (0.5) | 0.63 (0.42, 0.96) |
| 기타 ICH | 19 (0.2) | 26 (0.2) | 0.74 (0.41, 1.34) |
| 위장관 (GI) | 221 (2.0) | 140 (1.2) | 1.61 (1.30, 1.99) |
| 치명적 출혈 | 27 (0.2) | 55 (0.5) | 0.50 (0.31, 0.79) |
| ICH | 24 (0.2) | 42 (0.4) | 0.58 (0.35, 0.96) |
| 두개내 출혈 이외 | 3 (0.0) | 13 (0.1) | 0.23 (0.07, 0.82) |
그림 1은 주요 하위 그룹에서 주요 출혈 사건의 위험을 보여줍니다.
| 참고: 위의 그림은 모두 기준 특성이고 모두 사전 지정된 다양한 하위 그룹의 효과를 나타냅니다(당뇨병 상태는 하위 그룹에서 사전 지정되지 않았지만 CHADS2 점수의 기준이었습니다). 표시된 95% 신뢰 한계는 비교 횟수를 고려하지 않으며 다른 모든 요인을 조정한 후 특정 요인의 영향을 반영하지 않습니다. 그룹 간의 명백한 동질성 또는 이질성을 과도하게 해석해서는 안 됩니다. |
| 그림 1: ROCKET AF – 치료 중 + 2일 기준 특성별 주요 출혈 사건 위험 |
|
|
심부정맥 혈전증 (DVT) 및/또는 폐색전증 (PE) 치료
EINSTEIN DVT 및 EINSTEIN PE 연구
EINSTEIN DVT 및 EINSTEIN PE 임상 연구의 통합 분석에서 영구적인 약물 중단으로 이어지는 가장 흔한 이상반응은 출혈 사건이었으며, XARELTO 대 에녹사파린/비타민 K 길항제 (VKA) 발생률은 각각 1.7% 대 1.5%였습니다. XARELTO 치료 환자의 평균 치료 기간은 208일이었고 에녹사파린/VKA 치료 환자의 평균 치료 기간은 204일이었습니다.
표 6은 EINSTEIN DVT 및 EINSTEIN PE 연구의 통합 분석에서 주요 출혈 사건을 경험한 환자 수를 보여줍니다.
| 매개변수 | XARELTO
† n (%) |
Enoxaparin/VKA
† n (%) |
|---|---|---|
|
||
| 주요 출혈 사건 | 40 (1.0) | 72 (1.7) |
| 치명적 출혈 | 3 (<0.1) | 8 (0.2) |
| 두개내 | 2 (<0.1) | 4 (<0.1) |
| 비치명적 중요 장기 출혈 | 10 (0.2) | 29 (0.7) |
| 두개내 | 3 (<0.1) | 10 (0.2) |
| 복막후 | 1 (<0.1) | 8 (0.2) |
| 안구내 | 3 (<0.1) | 2 (<0.1) |
| 관절내 | 0 | 4 (<0.1) |
| 비치명적 비중요 장기 출혈 | 27 (0.7) | 37 (0.9) |
| Hb ≥ 2g/dL 감소 | 28 (0.7) | 42 (1.0) |
| 전혈 또는 적혈구 농축액 2단위 이상 수혈 | 18 (0.4) | 25 (0.6) |
| 임상적으로 관련 있는 비주요 출혈 | 357 (8.6) | 357 (8.7) |
| 모든 출혈 | 1169 (28.3) | 1153 (28.0) |
심부정맥혈전증 및/또는 폐색전증 재발 위험 감소
EINSTEIN CHOICE 연구
EINSTEIN CHOICE 임상 연구에서 영구적인 약물 중단과 관련된 가장 흔한 이상반응은 출혈 사건이었으며, 발생률은 XARELTO 10mg의 경우 1%, XARELTO 20mg의 경우 2%, 아세틸살리실산(아스피린) 100mg의 경우 1%였습니다. XARELTO 10mg 치료 환자의 평균 치료 기간은 293일이었고 아스피린 100mg 치료 환자의 평균 치료 기간은 286일이었습니다.
표 7은 EINSTEIN CHOICE 연구에서 출혈 사건을 경험한 환자 수를 보여줍니다.
| 매개변수 | XARELTO
† N=1127 n (%) |
아세틸살리실산 (아스피린)
† 100 mg N=1131 n (%) |
|---|---|---|
|
||
| 주요 출혈 사건 | 5 (0.4) | 3 (0.3) |
| 치명적 출혈 | 0 | 1 (<0.1) |
| 비치명적 중요 장기 출혈 | 2 (0.2) | 1 (<0.1) |
| 비치명적 비중요 장기 출혈 | 3 (0.3) | 1 (<0.1) |
| 임상적으로 관련 있는 비주요(CRNM) 출혈 | 22 (2.0) | 20 (1.8) |
| 모든 출혈 | 151 (13.4) | 138 (12.2) |
인 EINSTEIN CHOICE 연구에서 XARELTO 20mg 그룹은 XARELTO 10mg 또는 아스피린 100mg 그룹에 비해 출혈, 주요 및 CRNM 출혈의 발생률이 증가했습니다.
고관절 또는 슬관절 치환 수술 후 심부정맥혈전증 예방
RECORD 임상 시험에서 XARELTO로 인한 영구적인 치료 중단으로 이어지는 부작용의 전체 발생률은 3.7%였습니다.
RECORD 임상 시험에서 환자에서 관찰된 주요 출혈 사건 및 모든 출혈 사건의 비율은 표 8에 나와 있습니다.
| XARELTO 10mg | 엔옥사파린 | |
|---|---|---|
| 총 치료 환자 | N = 4487
n (%)
|
N = 4524
n (%)
|
| 주요 출혈 사건 | 14 (0.3) | 9 (0.2) |
| 치명적인 출혈 | 1 (<0.1) | 0 |
| 중요 장기에의 출혈 | 2 (<0.1) | 3 (0.1) |
| 재수술이 필요한 출혈 | 7 (0.2) | 5 (0.1) |
| 2단위 이상의 전혈 또는 농축 적혈구 수혈이 필요한 외과적 부위 이외의 출혈 | 4 (0.1) | 1 (<0.1) |
| 모든 출혈 사건 | 261 (5.8) | 251 (5.6) |
| 고관절 수술 연구 | N = 3281
n (%)
|
N = 3298
n (%)
|
| 주요 출혈 사건 | 7 (0.2) | 3 (0.1) |
| 치명적인 출혈 | 1 (<0.1) | 0 |
| 중요 장기에의 출혈 | 1 (<0.1) | 1 (<0.1) |
| 재수술이 필요한 출혈 | 2 (0.1) | 1 (<0.1) |
| 2단위 이상의 전혈 또는 농축 적혈구 수혈이 필요한 외과적 부위 이외의 출혈 | 3 (0.1) | 1 (<0.1) |
| 모든 출혈 사건 | 201 (6.1) | 191 (5.8) |
| 슬관절 수술 연구 | N = 1206
n (%)
|
N = 1226
n (%)
|
| 주요 출혈 사건 | 7 (0.6) | 6 (0.5) |
| 치명적인 출혈 | 0 | 0 |
| 중요 장기에의 출혈 | 1 (0.1) | 2 (0.2) |
| 재수술이 필요한 출혈 | 5 (0.4) | 4 (0.3) |
| 2단위 이상의 전혈 또는 농축 적혈구 수혈이 필요한 외과적 부위 이외의 출혈 | 1 (0.1) | 0 |
XARELTO 치료 후, 주요 출혈 합병증(≥60%)의 대부분은 수술 후 첫 주 동안 발생했습니다.
혈전색전증 위험이 있는 급성 질환 의료 환자에서 출혈 위험이 높지 않은 정맥 혈전색전증 예방
MAGELLAN 연구에서 영구적인 약물 중단과 관련된 가장 흔한 이상반응은 출혈 사건이었습니다. 폐출혈 및 기관지확장증을 동반한 폐출혈 사례가 관찰되었습니다. 기관지확장증/폐 공동화, 활동성 암(즉, 급성 입원 암 치료 중), 이중 항혈소판 요법 또는 활동성 위십이지장 궤양 또는 지난 3개월 동안 출혈이 있는 환자는 모두 에녹사파린/위약에 비해 XARELTO에서 과도한 출혈을 보였으며 표 9에 제시된 모든 MAGELLAN 데이터에서 제외되었습니다. 약물 중단으로 이어지는 출혈 발생률은 XARELTO의 경우 2.5%, 에녹사파린/위약의 경우 1.4%였습니다.
표 9는 MAGELLAN 연구에서 다양한 유형의 출혈 사건을 경험한 환자 수를 보여줍니다.
| MAGELLAN 연구 | XARELTO 10 mg
N=3218 n (%) |
에녹사파린 40 mg /위약
N=3229 n (%) |
|---|---|---|
|
||
| 주요 출혈 | 22 (0.7) | 15 (0.5) |
| 중요 부위 출혈 | 7 (0.2) | 4 (0.1) |
| 치명적인 출혈 | 3 (<0.1) | 1 (<0.1) |
| 임상적으로 관련 있는 비주요 출혈 사건(CRNM) | 93 (2.9) | 34 (1.1) |
관상동맥질환(CAD) 환자의 주요 심혈관계 사건 위험 감소
COMPASS 임상시험에서 전반적으로 약물 투여 영구 중단과 관련된 가장 빈번한 이상반응은 출혈 사건이었으며, 아스피린 100mg 1일 1회를 배경 치료로 복용하는 모든 환자에서 XARELTO 2.5mg 1일 2회 투여군의 발생률은 2.7%, 위약군의 발생률은 1.2%였다. COMPASS에서 CAD 및 PAD 환자군의 중요 출혈 사건 발생률은 유사했다.
표 10은 COMPASS 임상시험에서 다양한 유형의 주요 출혈 사건을 경험한 환자 수를 보여준다.
| 매개변수 | XARELTO
† n (%/년) |
위약
† n (%/년) |
XARELTO vs. 위약
HR (95 % CI) |
|---|---|---|---|
| CI: 신뢰 구간; HR: 위험 비; ISTH: 국제혈전지혈학회 | |||
|
|||
| 수정된 ISTH 주요 출혈 | 263 (1.6) | 144 (0.9) | 1.8 (1.5, 2.3) |
|
12 (<0.1)
6 (<0.1) 6 (<0.1) |
8 (<0.1)
3 (<0.1) 5 (<0.1) |
1.5 (0.6, 3.7)
2.0 (0.5, 8.0) 1.2 (0.4, 4.0) |
|
58 (0.3)
23 (0.1) 18 (0.1) 6 (<0.1) |
43 (0.3)
21 (0.1) 13 (<0.1) 9 (<0.1) |
1.4 (0.9, 2.0)
1.1 (0.6, 2.0) 1.4 (0.7, 2.8) 0.7 (0.2, 1.9) |
|
7 (<0.1) | 6 (<0.1) | 1.2 (0.4, 3.5) |
|
188 (1.1) | 91 (0.5) | 2.1 (1.6, 2.7) |
| 주요 위장관 출혈 | 117 (0.7) | 49 (0.3) | 2.4 (1.7, 3.4) |
하지 혈관 재건술 후 증상이 있는 말초 동맥 질환(PAD) 환자를 포함한 말초 동맥 질환(PAD) 환자의 주요 혈전 혈관 사건 위험 감소
VOYAGER 연구에서 아스피린 100mg 1일 1회를 배경 치료로 하여 XARELTO 2.5mg 1일 2회 투여군 대 위약군의 출혈 사건으로 인한 조기 영구 중단 발생률은 각각 4.1% 대 1.6%였으며, COMPASS PAD 연구에서는 각각 2.7% 대 1.3%였다.
표 11은 VOYAGER 연구에서 다양한 유형의 TIMI(심근경색증 혈전용해) 주요 출혈 사건을 경험한 환자 수를 보여줍니다. 가장 흔한 출혈 부위는 위장관이었습니다.
| XARELTO
† |
위약
† |
XARELTO 대 위약
HR (95 % CI) |
|||
|---|---|---|---|---|---|
| 매개변수 | n (%) | 사건 발생률
%/년 |
n (%) | 사건 발생률
%/년 |
|
| CABG: 관상동맥 우회술; CI: 신뢰 구간; HR: 위험 비; TIMI: 심근경색증 혈전용해 출혈 기준 | |||||
| TIMI 주요 출혈
(CABG/비 CABG) |
62 (1.9) | 0.96 | 44 (1.4) | 0.67 | 1.4 (1.0, 2.1) |
| 치명적 출혈 | 6 (0.2) | 0.09 | 6 (0.2) | 0.09 | 1.0 (0.3, 3.2) |
| 두개내 출혈 | 13 (0.4) | 0.20 | 17 (0.5) | 0.26 | 0.8 (0.4, 1.6) |
| 헤모글로빈 ≥5g/dL 감소 또는 헤마토크릿 ≥15% 감소와 관련된 임상적으로 명백한 출혈 징후 | 46 (1.4) | 0.71 | 24 (0.7) | 0.36 | 1.9 (1.2, 3.2) |
기타 이상반응
EINSTEIN DVT 및 EINSTEIN PE 연구에서 XARELTO 치료 환자의 ≥1%에서 보고된 비출혈성 이상반응은 표 12에 나와 있습니다.
| 신체 기관계
이상반응 |
||
|---|---|---|
|
||
| EINSTEIN DVT 연구 | XARELTO 20 mg
N=1718 n (%)
|
Enoxaparin/VKA
N=1711 n (%)
|
| 위장 장애 | ||
| 복통 | 46 (2.7) | 25 (1.5) |
| 전신 장애 및 투여 부위 이상 | ||
| 피로 | 24 (1.4) | 15 (0.9) |
| 근골격계 및 결합 조직 장애 | ||
| 요통 | 50 (2.9) | 31 (1.8) |
| 근육 경련 | 23 (1.3) | 13 (0.8) |
| 신경계 장애 | ||
| 현기증 | 38 (2.2) | 22 (1.3) |
| 정신 장애 | ||
| 불안 | 24 (1.4) | 11 (0.6) |
| 우울증 | 20 (1.2) | 10 (0.6) |
| 불면증 | 28 (1.6) | 18 (1.1) |
| EINSTEIN PE 연구 | XARELTO 20 mg
N=2412 n (%)
|
Enoxaparin/VKA
N=2405 n (%)
|
| 피부 및 피하 조직 장애 | ||
| 소양증 | 53 (2.2) | 27 (1.1) |
RECORD 1–3 연구에서 XARELTO 치료 환자의 ≥1%에서 보고된 비출혈성 이상반응은 표 13에 나와 있습니다.
| 신체 기관계
이상반응 |
XARELTO
10 mg N=4487 n (%) |
Enoxaparin
† n (%) |
|---|---|---|
| 손상, 중독 및 시술 합병증 | ||
| 상처 분비물 | 125 (2.8) | 89 (2.0) |
| 근골격계 및 결합 조직 장애 | ||
| 사지 통증 | 74 (1.7) | 55 (1.2) |
| 근육 경련 | 52 (1.2) | 32 (0.7) |
| 신경계 장애 | ||
| 실신 | 55 (1.2) | 32 (0.7) |
| 피부 및 피하 조직 장애 | ||
| 가려움증 | 96 (2.1) | 79 (1.8) |
| 물집 | 63 (1.4) | 40 (0.9) |
소아 환자
소아 환자의 정맥 혈전색전증 치료 및 재발성 정맥 혈전색전증 위험 감소
안전성 평가는 생후 18세 미만의 환자 491명을 대상으로 한 EINSTEIN Junior 3상 연구의 데이터를 기반으로 합니다. 환자들은 체중에 따라 XARELTO 또는 비교군(비분획 헤파린, 저분자량 헤파린, 폰다파리눅스 또는 VKA)을 2:1 비율로 무작위 배정받았습니다.
출혈 사건으로 인한 치료 중단은 XARELTO 그룹에서 6명(1.8%), 비교군에서 3명(1.9%)에서 발생했습니다.
표 14는 EINSTEIN Junior 연구에서 출혈 사건을 경험한 환자 수를 보여줍니다. 초경을 경험한 12세~18세 미만 여성 환자의 경우, XARELTO 그룹의 여성 환자 23명(27%)과 비교군의 여성 환자 5명(10%)에서 월경 과다가 발생했습니다.
| 매개변수 | XARELTO
† n (%) |
비교군
‡ n (%) |
|---|---|---|
|
||
| 주요 출혈 | 0 | 2 (1.2) |
| 임상적으로 관련 있는 비주요 출혈 | 10 (3.0) | 1 (0.6) |
| 사소한 출혈 | 113 (34.3) | 44 (27.2) |
| 모든 출혈 | 119 (36.2) | 45 (27.8) |
XARELTO 치료 환자의 5% 이상에서 보고된 비출혈 이상 반응은 표 15에 나와 있습니다.
| 이상 반응 | XARELTO
N=329 n (%) |
비교군
N=162 n (%) |
|---|---|---|
| 사지 통증 | 23 (7) | 7 (4.3) |
| 피로 | 23 (7) | 7 (4.3) |
XARELTO 치료 환자에서 임상적으로 관련 있는 이상반응은 구토였습니다(XARELTO 그룹 10.6% vs 비교군 8%).
폰탄 수술 후 선천성 심장 질환(CHD) 소아 환자의 혈전 예방
아래 데이터는 UNIVERSE 연구 파트 B를 기반으로 하며, 이 연구는 최소 1회의 연구 약물을 복용한 폰탄 수술 후 CHD 소아 98명에서 XARELTO의 혈전 예방에 대한 안전성과 유효성을 평가하기 위해 설계되었습니다. 파트 B의 환자들은 체중 조절 XARELTO 용량 또는 아스피린(약 5mg/kg)을 2:1로 무작위 배정받았습니다.
출혈 사건으로 인한 치료 중단은 XARELTO 그룹에서 1명(1.6%), 아스피린 그룹에서는 없었습니다.
표 16은 UNIVERSE 연구에서 출혈 사건을 경험한 환자 수를 보여줍니다.
| 매개변수 | XARELTO
* n (%) |
Aspirin
* n (%) |
|---|---|---|
| 주요 출혈 | 1 (1.6) | 0 |
| 수혈로 이어지는 코피 | 1 (1.6) | 0 |
| 임상적으로 관련 있는 비주요(CRNM) 출혈 | 4 (6.3) | 3 (8.8) |
| 경미한 출혈 | 21 (32.8) | 12 (35.3) |
| 모든 출혈 | 23 (35.9) | 14 (41.2) |
XARELTO 치료 환자의 ≥5%에서 보고된 비출혈 이상반응은 표 17에 나와 있습니다.
6.2 시판 후 경험
XARELTO 시판 후 사용 중 다음과 같은 이상반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 발생 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
혈액 및 림프계 장애: 무과립구증, 혈소판 감소증
간담도계 장애: 황달, 담즙정체, 간염 (간세포 손상 포함)
면역 체계 장애: 과민증, 아나필락시스 반응, 아나필락시스 쇼크, 혈관부종
신경계 장애: 편마비
신장 장애: Anticoagulant-related nephropathy
호흡기계, 흉부 및 종격 장애: 호산구성 폐렴
피부 및 피하 조직 장애: Stevens-Johnson 증후군, 약물 반응과 호산구증가 및 전신 증상(DRESS)
7 약물 상호작용
7.1 일반적인 억제 및 유도 특성
리바록사반은 CYP3A4/5, CYP2J2 및 P-gp 및 ATP 결합 카세트 G2 (ABCG2) 수송체의 기질입니다. P-gp 및 강력한 CYP3A 억제제를 병용하면 리바록사반에 대한 노출이 증가하여 출혈 위험이 증가할 수 있습니다. P-gp 및 강력한 CYP3A 유도제를 병용하면 리바록사반에 대한 노출이 감소하여 혈전색전증 위험이 증가할 수 있습니다.
7.2 시토크롬 P450 3A 효소 및 약물 수송 시스템을 억제하는 약물
P-gp 및 강력한 CYP3A 억제제와의 상호 작용
XARELTO를 알려진 P-gp 및 강력한 CYP3A 억제제(예: 케토코나졸 및 리토나비르)와 병용 투여하지 마십시오.
[
임상 약리학 (12.3) 참조]
.
클라리스로마이신은 P-gp 및 강력한 CYP3A 억제제이지만, 약동학적 데이터에 따르면 XARELTO와 병용 투여 시 노출 변화가 출혈 위험에 영향을 미칠 가능성이 낮으므로 주의 사항이 필요하지 않습니다.
[
임상 약리학 (12.3) 참조]
.
신장애 환자에서 P-gp 및 중등도 CYP3A 억제제와의 상호 작용
CrCl 15~<80 mL/min인 환자의 경우 P-gp 및 중등도 CYP3A 억제제(예: 에리스로마이신)를 병용 투여하는 경우 XARELTO를 사용하지 않아야 합니다. 잠재적 이점이 잠재적 위험을 정당화하는 경우에만 사용하십시오.
[
임상 약리학 (12.3) 참조]
.
7.3 시토크롬 P450 3A 효소 및 약물 수송 시스템을 유도하는 약물
P-gp 및 강력한 CYP3A 유도제(예: 카르바마제핀, 페니토인, 리팜핀, 세인트 존스 워트)와 XARELTO를 병용 투여하지 마십시오.
[
임상 약리학 (12.3) 참조]
.
7.4 항응고제 및 NSAID/아스피린
에녹사파린, 와파린, 아스피린, 클로피도그렐 및 만성 NSAID 사용을 병용 투여하면 출혈 위험이 증가할 수 있습니다.
[
임상 약리학 (12.3) 참조].
이점이 위험을 상회하는 경우를 제외하고는 다른 항응고제와 XARELTO를 병용 투여하지 마십시오. 환자가 아스피린, 다른 혈소판 응집 억제제 또는 NSAID를 병용 투여하는 경우 출혈 징후 또는 증상을 즉시 평가하십시오.
[
경고 및 주의 사항 (5.2) 참조]
.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임산부에 대한 XARELTO의 제한된 이용 가능한 데이터는 약물 관련 태아 발달 결과의 위험을 알리기에 충분하지 않습니다. 임신 관련 출혈 및/또는 응급 분만 가능성으로 인해 임산부에게 XARELTO를 신중하게 사용하십시오. XARELTO의 항응고 효과는 표준 실험실 검사로는 신뢰할 수 있게 모니터링할 수 없습니다. 임산부에게 XARELTO를 처방할 때는 모체에 대한 XARELTO의 이점과 위험, 태아에 대한 가능한 위험을 고려하십시오.
[
5.7)]
.
임신 중에 발생하는 부작용은 모체의 건강이나 약물 사용과 관계없이 발생합니다. 지정된 인구에 대한 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 배아/태아 위험
임신은 정맥혈전색전증의 위험 요소이며, 유전적 또는 후천적 혈전증이 있는 여성의 경우 그 위험이 증가합니다. 혈전색전증이 있는 임산부는 자간전증을 포함한 모체 합병증의 위험이 증가합니다. 모체 혈전색전증은 자궁 내 성장 제한, 태반 조기 박리 및 임신 초기 및 후기 손실 위험을 증가시킵니다.
데이터
인간 데이터
임산부에 대한 XARELTO의 적절하거나 잘 통제된 연구는 없으며, 임산부에 대한 투약량은 확립되지 않았습니다. 시판 후 경험은 현재 리바록사반 관련 주요 선천적 기형 또는 유산 위험을 결정하기에 충분하지 않습니다.
시험관 내 태반 관류 모델에서 결합되지 않은 리바록사반은 인간 태반을 통해 빠르게 이동했습니다.
동물 데이터
리바록사반은 동물에서 태반을 통과합니다. 임신한 토끼에게 기관 형성 기간 동안 경구로 ≥10 mg/kg 리바록사반을 투여했을 때 리바록사반은 태아 독성(흡수 증가, 살아있는 태아 수 감소 및 태아 체중 감소)을 증가시켰습니다. 이 용량은 가장 높은 권장 인간 용량인 20 mg/일에서 AUC 비교를 기반으로 결합되지 않은 약물의 인간 노출의 약 4배에 해당합니다. 임신한 쥐에게 기관 형성 기간 동안 경구로 120 mg/kg을 투여했을 때 태아 체중이 감소했습니다. 이 용량은 가장 높은 권장 인간 용량에서 결합되지 않은 약물의 인간 노출의 약 14배에 해당합니다. 쥐에서 리바록사반 용량이 40 mg/kg(인간 용량 20 mg/일에서 결합되지 않은 약물의 최대 인간 노출의 약 6배)일 때 분만 전 모체 출혈과 모체 및 태아 사망이 발생했습니다.
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
항응고제가 필요한 생식 능력이 있는 여성은 의사와 임신 계획에 대해 상담해야 합니다.
자궁 출혈 위험이 있는 여성과 비정상적인 자궁 출혈이 있는 여성의 경우 XARELTO를 포함한 경구 항응고제로 인해 자궁 출혈이 발생할 수 있으며, 이는 여성 생식기 수술이 필요할 수 있습니다.
8.4 소아 사용
XARELTO의 안전성 및 유효성은 VTE 치료 및 VTE 재발 위험 감소를 위해 출생부터 18세 미만의 소아 환자에서 확립되었습니다. XARELTO의 사용은 성인에서 XARELTO에 대한 적절하고 잘 통제된 연구에서 얻은 증거와 출생부터 18세 미만의 소아 환자 500명을 대상으로 한 다기관, 전향적, 공개, 활성 대조군 무작위 연구에서 얻은 추가 약동학적, 안전성 및 유효성 데이터에 의해 이러한 연령대에서 뒷받침됩니다. XARELTO는 6개월 미만의 소아, 출생 시 37주 미만의 임신 기간, 경구 영양 섭취 기간이 10일 미만이거나 체중이 2.6kg 미만인 소아에서 연구되지 않았으므로 이러한 소아에 대한 투약량을 확실하게 결정하거나 권장할 수 없습니다.
[참조
.
XARELTO의 안전성 및 유효성은 폰탄 수술을 받은 선천성 심장 질환이 있는 2세 이상의 소아 환자에서 사용하기 위해 확립되었습니다. XARELTO의 사용은 성인에서 XARELTO에 대한 적절하고 잘 통제된 연구에서 얻은 증거와 폰탄 수술을 받은 단일 심실 생리학을 가진 소아에서 XARELTO의 단일 및 다중 투여 약동학적 특성과 12개월 동안 혈전증 예방을 위한 XARELTO의 안전성 및 유효성을 평가하기 위해 112명의 소아 환자를 대상으로 한 다기관, 전향적, 공개, 활성 대조군 연구에서 얻은 추가 데이터에 의해 이러한 연령대에서 뒷받침됩니다.
[참조
.
안전성, 유효성, 약동학 및 약력학 데이터를 평가한 임상 연구는 소아 환자에서 XARELTO 10mg, 15mg 및 20mg 정제의 사용을 뒷받침합니다. XARELTO 2.5mg 정제의 경우 소아 환자에서 사용을 뒷받침하는 안전성, 유효성, 약동학 및 약력학 데이터가 없습니다. 따라서 XARELTO 2.5mg 정제는 소아 환자에게 사용하지 않는 것이 좋습니다.
성인에서 확인된 모든 부작용이 소아 및 청소년 환자의 임상 시험에서 관찰된 것은 아니지만, 성인에 대한 경고 및 주의 사항은 소아 및 청소년에게도 고려해야 합니다.
8.5 노인 사용
XARELTO의 승인된 적응증에 대한 임상 시험에 참여한 성인 환자(N=64,943명) 중 64%가 65세 이상이었고, 27%가 75세 이상이었습니다. 임상 시험에서 노인(65세 이상)에서 XARELTO의 유효성은 65세 미만의 환자에서 관찰된 유효성과 유사했습니다. 혈전증 및 출혈 사건 발생률은 이러한 노인 환자에서 더 높았습니다.
[참조
.
8.6 신장애
약동학 연구에서, 정상적인 크레아티닌 청소율을 가진 건강한 성인 피험자와 비교하여 신장애가 있는 성인 피험자에서 리바록사반 노출이 약 44~64% 증가했습니다. 약력학적 효과의 증가도 관찰되었습니다.
[참조
.
판막 없는 심방 세동
투석을 받지 않는 만성 신장 질환 환자
ROCKET AF 시험에서 CrCl 30~50mL/min인 환자에게 XARELTO 15mg을 1일 1회 투여한 결과, 리바록사반의 혈청 농도와 임상 결과가 더 나은 신장 기능을 가진 환자에게 XARELTO 20mg을 1일 1회 투여한 결과와 유사했습니다. CrCl <30mL/min인 환자는 연구 대상이 아니었지만, XARELTO 15mg을 1일 1회 투여하면 중등도 신장애가 있는 환자에서 관찰된 리바록사반의 혈청 농도와 유사한 혈청 농도가 나타날 것으로 예상됩니다.
[참조
.
심재색전증 및/또는 폐색전증 치료 및 심재색전증 및/또는 폐색전증 재발 위험 감소
EINSTEIN 임상 시험에서 스크리닝 시 CrCl 값이 <30 mL/min인 환자는 연구에서 제외되었지만, XARELTO를 투여하면 중등도 신장애(CrCl 30~<50 mL/min) 환자와 유사한 리바록사반 혈청 농도가 나타날 것으로 예상됩니다.
[
임상 약리학 (12.3) 참조].
CrCl 15~<30 mL/min인 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min인 환자에게는 XARELTO를 사용하지 마십시오.
고관절 또는 슬관절 치환술 후 DVT 예방
RECORD 1~3 임상 효능 연구의 통합 분석 결과, CrCl 30~50 mL/min인 환자의 경우 출혈 위험이 증가하지 않았으며, 이러한 환자군에서 총 정맥혈전색전증이 증가할 가능성이 보고되었습니다. RECORD 1~3 임상 시험에서 스크리닝 시 CrCl 값이 <30 mL/min인 환자는 연구에서 제외되었지만, XARELTO 10mg을 1일 1회 투여하면 중등도 신장애(CrCl 30~<50 mL/min) 환자와 유사한 리바록사반 혈청 농도가 나타날 것으로 예상됩니다.
[
임상 약리학 (12.3) 참조].
CrCl 15~<30 mL/min인 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min인 환자에게는 XARELTO를 사용하지 마십시오.
혈전색전증 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 중증 질환 환자의 정맥혈전색전증 예방
스크리닝 시 CrCl 값이 <30 mL/min인 환자는 MAGELLAN 연구에서 제외되었습니다. CrCl <30 mL/min인 환자의 경우 XARELTO 10mg을 1일 1회 투여하면 중등도 신장애(CrCl 30~<50 mL/min) 환자와 유사한 리바록사반 혈청 농도가 나타날 것으로 예상됩니다.
[
임상 약리학 (12.3) 참조]
. CrCl 15~<30 mL/min인 환자의 경우 출혈 징후 또는 증상을 주의 깊게 관찰하고 신속하게 평가하십시오. CrCl <15 mL/min인 환자에게는 XARELTO를 사용하지 마십시오.
관상동맥 질환 환자의 주요 심혈관 사건 위험 감소 및 최근 하지 재혈관화술을 시행한 환자를 포함하여 말초 동맥 질환 환자의 주요 혈전성 혈관 사건 위험 감소
투석을 받지 않는 만성 신장 질환 환자
스크리닝 시 CrCl <15 mL/min인 환자는 COMPASS 및 VOYAGER에서 제외되었으며, CrCl 15~30 mL/min인 환자에 대한 데이터는 제한적입니다. CrCl <30 mL/min인 환자의 경우 XARELTO 2.5mg을 1일 2회 투여하면 중등도 신장애(CrCl 30~<50 mL/min) 환자와 유사한 노출량이 나타날 것으로 예상됩니다.
[
임상 약리학 (12.3) 참조]
, 이 환자군의 효능 및 안전성 결과는 신장 기능이 보존된 환자와 유사했습니다.
투석을 받는 말기 신장 질환 환자
이러한 환자는 COMPASS 또는 VOYAGER에 등록되지 않았기 때문에 투석을 받는 ESRD 환자에서 아스피린과 함께 XARELTO를 사용한 임상 결과 데이터는 없습니다. 간헐적 혈액 투석을 받는 ESRD 환자의 경우 XARELTO 2.5mg을 1일 2회 투여하면 COMPASS 연구에서 중등도 신장애 환자에서 관찰된 리바록사반 농도 및 약력학적 활성과 유사한 농도가 나타납니다.
[
12.3) 참조]
. 투석을 받는 ESRD 환자에서 이러한 농도가 COMPASS에서 관찰된 것과 유사한 CV 위험 감소 및 출혈 위험으로 이어질지는 알 수 없습니다.
소아 사용
경증 신장애(eGFR 50~≤ 80 mL/min/1.73 m
2)가 있는 1세 이상 환자의 경우 용량 조절이 필요하지 않습니다. 중등도 또는 중증 신장애(eGFR <50 mL/min/1.73 m
2)가 있는 1세 이상 소아 환자에 대한 임상 데이터는 제한적이므로 이러한 환자에게는 XARELTO를 사용하지 마십시오.
혈청 크레아티닌 결과가 97.5
th 백분위수를 초과하는 1세 미만 소아 환자에 대한 임상 데이터는 없으므로 이러한 환자에게는 XARELTO를 사용하지 마십시오.
[
용법 및 용량 (2.2) 참조]
.
8.7 간 기능 저하
약동학 연구에서 정상 간 기능을 가진 건강한 성인 피험자와 비교하여 중등도 간 기능 저하(Child-Pugh B)가 있는 성인 피험자에서 AUC가 127% 증가했습니다.
중증 간 기능 저하(Child-Pugh C) 환자에서 XARELTO의 안전성 또는 PK는 평가되지 않았습니다.
[
임상 약리학 (12.3) 참조]
.
중등도(Child-Pugh B) 및 중증(Child-Pugh C) 간 기능 저하가 있는 환자 또는 응고 장애와 관련된 간 질환이 있는 환자에게는 XARELTO를 사용하지 마십시오.
간 기능 저하가 있는 소아 환자에 대한 임상 데이터는 없습니다.
10 과다 복용
XARELTO 과량 복용은 출혈로 이어질 수 있습니다. 과량 복용과 관련된 출혈 합병증이 발생하면 XARELTO를 중단하고 적절한 치료를 시작하십시오. 제한된 흡수로 인해 단일 용량이 50mg을 초과하면 리바록사반의 전신 노출이 더 이상 증가하지 않습니다. XARELTO 과량 복용 시 흡수를 줄이기 위해 활성탄 사용을 고려할 수 있습니다. 리바록사반은 고농도의 혈장 단백질 결합으로 인해 투석이 불가능합니다.
[
임상 약리학 (12.3) 참조]
. 혈장 제제를 사용하면 실험실 항응고 지표를 부분적으로 역전시킬 수 있습니다. 리바록사반의 항-Xa 활성을 역전시키는 약제가 있습니다.
11 설명
리바록사반은 Xa 인자(FXa) 억제제로, XARELTO
® 정제 및 XARELTO
® 경구용 현탁액의 활성 성분이며, 화학명은 5-클로로-N-({(5S)-2-옥소-3-[4-(3-옥소-4-모르폴리닐)페닐]-1,3-옥사졸리딘-5-일}메틸)-2-티오펜카르복사미드입니다. 리바록사반의 분자식은 C
19H
18ClN
3O
5S이며 분자량은 435.89입니다. 구조식은 다음과 같습니다.
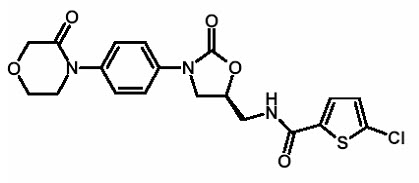
리바록사반은 순수한 (
S)-거울상 이성질체입니다. 무취, 비흡습성, 백색에서 황색을 띠는 분말입니다. 리바록사반은 유기 용매(예: 아세톤, 폴리에틸렌 글리콜 400)에 약간 용해되며 물 및 수성 매질에는 실질적으로 용해되지 않습니다.
XARELTO 정제 1정에는 리바록사반 2.5mg, 10mg, 15mg 또는 20mg이 함유되어 있습니다. XARELTO의 비활성 성분은 다음과 같습니다. 크로스카멜로스나트륨, 히프로멜로스, 유당 일수화물, 마그네슘 스테아레이트, 미결정 셀룰로스, 라우릴황산나트륨. 또한, XARELTO 2.5mg에 사용되는 고유 필름 코팅 혼합물은 Opadry
® Light Yellow이며, 황색 산화철, 히프로멜로스, 폴리에틸렌 글리콜 3350, 이산화티탄을 함유하고 있으며, XARELTO 10mg 정제에는 Opadry
® Pink, XARELTO 15mg 정제에는 Opadry
® Red가 사용되며, 모두 적색 산화철, 히프로멜로스, 폴리에틸렌 글리콜 3350, 이산화티탄을 함유하고 있으며, XARELTO 20mg 정제에는 Opadry
® II Dark Red가 사용되며, 적색 산화철, 폴리에틸렌 글리콜 3350, 부분 가수분해된 폴리비닐 알코올, 활석, 이산화티탄을 함유하고 있습니다.
경구용 현탁액 XARELTO는 리바록사반 155mg(재구성 후 1mL당 리바록사반 1mg)이 함유된 병에 과립 형태로 제공됩니다. 비활성 성분은 다음과 같습니다. 무수 구연산, 히프로멜로스, 만니톨, 미결정 셀룰로스 및 카르복시메틸셀룰로스나트륨, 벤조산나트륨, 수크랄로스, 달콤하고 크리미한 향료, 잔탄검.
12 임상약리학
12.1 작용 기전
XARELTO는 FXa의 선택적 억제제입니다. 활성화를 위해 보조 인자(예: 항트롬빈 III)가 필요하지 않습니다. 리바록사반은 유리 FXa 및 프로트롬빈 활성을 억제합니다. 리바록사반은 혈소판 응집에 직접적인 영향을 미치지 않지만 트롬빈에 의해 유도된 혈소판 응집을 간접적으로 억제합니다. FXa를 억제함으로써 리바록사반은 트롬빈 생성을 감소시킵니다.
12.2 약력학
리바록사반은 FXa 활성을 용량 의존적으로 억제합니다. 프로트롬빈 시간(PT), 활성화 부분 트롬보플라스틴 시간(aPTT) 및 HepTest
®와 같은 응고 검사도 용량 의존적으로 연장됩니다. 리바록사반으로 치료받은 어린이의 경우 항-FXa에서 혈장 농도까지의 상관 관계는 기울기가 1에 가까운 선형입니다.
항-FXa 활성 또는 응고 검사를 사용하여 리바록사반의 항응고 효과를 모니터링하는 것은 권장되지 않습니다.
특정 인구집단
신장애
리바록사반의 전신 노출과 약력학적 활성 간의 관계는 건강한 대조군에 비해 신장애가 있는 성인 피험자에서 변경되었습니다.
[
참조].
| 측정값 | 매개변수 | 크레아티닌 청소율 (mL/min) | ||||
|---|---|---|---|---|---|---|
| 50–79 | 30–49 | 15–29 | ESRD (투석 중) | ESRD (투석 후) | ||
| PT = 프로트롬빈 시간; FXa = 응고 인자 Xa; AUC = 혈장 농도-시간 곡선 아래 면적; AUEC = 효과-시간 곡선 아래 면적 | ||||||
|
||||||
| 노출 | AUC | 44 | 52 | 64 | 47 | 56 |
| FXa 억제 | AUEC | 50 | 86 | 100 | 49 | 33 |
| PT 연장 | AUEC | 33 | 116 | 144 | 112 | 158 |
12.3 약동학
흡수
리바록사반의 절대 생체 이용률은 용량 의존적입니다. 2.5mg 및 10mg 용량의 경우 80%에서 100%로 추정되며 음식의 영향을 받지 않습니다. XARELTO 2.5mg 및 10mg 정제는 음식과 함께 또는 음식 없이 복용할 수 있습니다. 공복 상태에서 투여된 XARELTO 20mg은 절대 생체 이용률이 약 66%입니다. XARELTO를 음식과 함께 투여하면 20mg 용량의 생체 이용률이 증가합니다(음식과 함께 투여했을 때 평균 AUC 및 C
max가 각각 39% 및 76% 증가). XARELTO 15mg 및 20mg 정제는 음식과 함께 복용해야 합니다
[
참조].
리바록사반의 최대 농도(C
max)는 정제 섭취 후 2~4시간에 나타납니다. 리바록사반의 약동학은 위산도를 변화시키는 약물의 영향을 받지 않았습니다. XARELTO(30mg 단일 용량)를 H
2-수용체 길항제 라니티딘(150mg 1일 2회) 또는 제산제 수산화알루미늄/수산화마그네슘(10mL)과 함께 투여하거나 XARELTO(20mg 단일 용량)를 PPI 오메프라졸(40mg 1일 1회)과 함께 투여했을 때 리바록사반의 생체 이용률과 노출에 영향을 미치지 않았습니다(
참조).
리바록사반의 흡수는 위장관에서 약물 방출 부위에 따라 달라집니다. 리바록사반 과립이 근위부 소장에서 방출될 경우 정제에 비해 AUC 및 C
max가 각각 29% 및 56% 감소하는 것으로 보고되었습니다. 약물이 원위부 소장 또는 상행 결장에서 방출될 경우 노출이 더 감소합니다. 흡수 감소 및 관련 약물 노출로 이어질 수 있으므로 위장관에서 위장보다 원위부로 리바록사반을 투여하지 마십시오.
건강한 피험자 44명을 대상으로 한 연구에서 사과 소스에 섞어 경구 투여한 20mg 리바록사반의 평균 AUC 및 C
max 값은 전체 정제 투여 후 값과 유사했습니다. 그러나 물에 현탁시켜 NG 튜브를 통해 투여하고 액체 식사를 한 후에는 전체 정제 투여 후 값과 평균 AUC만 유사했고 C
max는 18% 낮았습니다.
대사
경구 투여된 [
14C]-리바록사반 용량의 약 51%는 비활성 대사체로서 소변(30%)과 대변(21%)에서 회수되었습니다. CYP3A4/5 및 CYP2J2에 의해 촉매되는 산화적 분해 및 가수분해가 생체 변환의 주요 부위입니다. 변하지 않은 리바록사반은 혈장에서 주요 성분이었으며, 주요 또는 활성 순환 대사체는 없었습니다.
배설
1상 연구에서 [
14C]-리바록사반을 투여한 후 약 1/3(36%)이 변하지 않은 약물로서 소변에서 회수되었고, 7%가 변하지 않은 약물로서 대변에서 회수되었습니다. 변하지 않은 약물은 주로 활성 세뇨관 분비를 통해 소변으로 배설되고, 사구체 여과를 통해 소변으로 배설되는 비율은 낮습니다(약 5:1 비율). 리바록사반은 유출 수송체 단백질 P-gp 및 ABCG2(BCRP라고도 함)의 기질입니다. 리바록사반의 유입 수송체 단백질에 대한 친화력은 알려져 있지 않습니다.
리바록사반은 저 클리어런스 약물이며, 정맥 주사 후 건강한 자원봉사자에서 전신 클리어런스는 약 10L/hr입니다. 리바록사반의 말단 제거 반감기는 20~45세 건강한 피험자에서 5~9시간입니다.
특정 집단
신장 기능 저하 정도, 연령, 체중 및 간 기능 저하 정도가 리바록사반의 약동학에 미치는 영향은 그림 2에 요약되어 있습니다.
그림 2: 리바록사반의 약동학에 미치는 특정 성인 집단의 영향
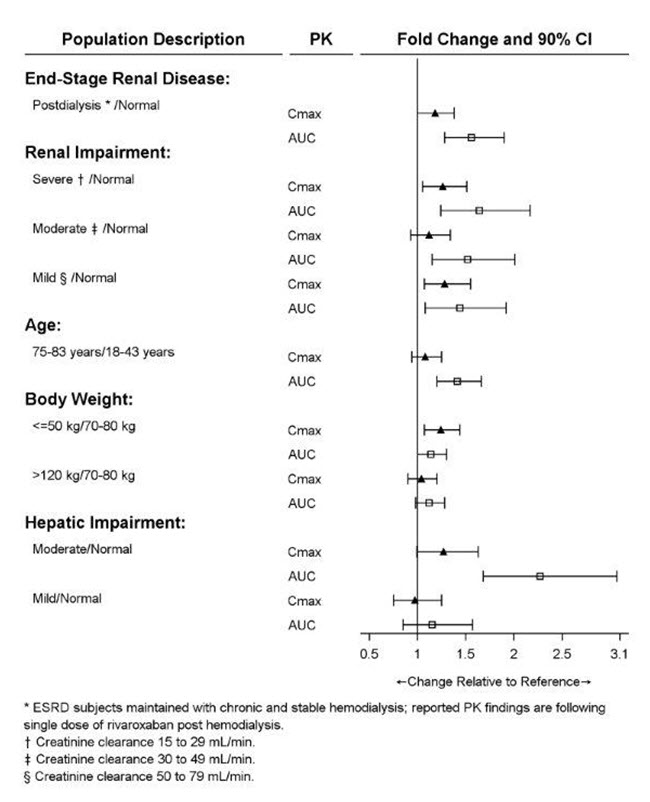
[
참조]
인종
건강한 일본인 피험자는 중국인을 포함한 다른 민족에 비해 평균 20%에서 40%까지 노출이 높은 것으로 나타났습니다. 그러나 체중으로 값을 보정하면 이러한 노출 차이는 감소합니다.
노인
말단 제거 반감기는 60~76세 노인 피험자에서 11~13시간입니다
[
참조].
소아 환자
정제와 현탁액의 흡수 속도와 정도는 유사했습니다. VTE 치료를 위해 리바록사반을 반복적으로 투여한 후, 출생부터 18세 미만의 피험자에서 리바록사반의 혈장 C
max는 중앙값 1.5~2.2시간에 관찰되었습니다.
6개월에서 9세 사이의 어린이에서,
시험관 내 리바록사반의 혈장 단백질 결합은 약 90%입니다.
VTE 치료를 받은 소아 환자의 혈장에서 리바록사반의 반감기는 나이가 어릴수록 감소했습니다. 평균 반감기 값은 청소년에서 4.2시간, 2~12세 어린이에서 3시간, 0.5~<2세 어린이에서 1.9시간, <0.5세 어린이에서 1.6시간이었습니다.
VTE 치료를 받은 소아 환자를 대상으로 한 탐색적 분석 결과, 성별이나 인종에 따른 리바록사반 노출량의 유의미한 차이는 발견되지 않았습니다.
ESRD 환자의 혈액 투석: 4시간 혈액 투석 세션 완료 후 3시간(투석 후)에 단일 15mg 용량으로 투여된 리바록사반에 대한 전신 노출은 정상 신장 기능을 가진 피험자에 비해 56% 높습니다(
표 18 참조). 4시간 혈액 투석 세션 2시간 전에 투여된 리바록사반에 대한 전신 노출은 투석액 유량이 600mL/분이고 혈액 유량이 320~400mL/분 범위인 경우 정상 신장 기능을 가진 사람에 비해 47% 높습니다. 증가 범위는 XARELTO 15mg을 복용하는 CrCl 15~50mL/분 환자의 증가 범위와 유사합니다. 혈액 투석은 리바록사반 노출에 유의미한 영향을 미치지 않았습니다. 이 연구에서 건강한 대조군과 ESRD 환자의 단백질 결합은 유사했습니다(86%~89%).
소아 환자: 중등도 또는 중증 신장애(eGFR <50mL/분/1.73m
2)가 있는 1세 이상의 어린이 또는 혈청 크레아티닌 수치가 97.5퍼센타일을 초과하는 1세 미만의 어린이에 대한 임상 데이터는 제한적입니다(
[
특정 집단에서의 사용(8.6) 참조]
.
신장애
건강한 피험자[CrCl ≥80mL/분(n=8)]와 다양한 정도의 신장애가 있는 피험자를 대상으로 한 연구에서 단일 용량 XARELTO(10mg)의 안전성과 약동학을 평가했습니다(
그림 2 참조). 정상 크레아티닌 청소율을 가진 건강한 피험자에 비해 신장애가 있는 피험자에서 리바록사반 노출이 증가했습니다. 약력학적 효과의 증가도 관찰되었습니다(
[
특정 집단에서의 사용(8.6) 참조]
.
간 기능 장애
건강한 성인 피험자(n=16)와 다양한 정도의 간 기능 장애가 있는 성인 피험자를 대상으로 한 연구에서 단일 용량 XARELTO(10mg)의 안전성과 약동학을 평가했습니다(
그림 2 참조). 중증 간 기능 장애(Child-Pugh C)가 있는 환자는 연구 대상에 포함되지 않았습니다. 정상 간 기능을 가진 건강한 피험자에 비해 중등도 간 기능 장애(Child-Pugh B)가 있는 피험자에서 리바록사반 노출이 유의미하게 증가했습니다(
그림 2 참조). 약력학적 효과의 증가도 관찰되었습니다(
[
특정 집단에서의 사용(8.7) 참조]
.
간 기능 장애가 있는 소아 환자에 대한 임상 데이터는 없습니다.
약물 상호 작용
시험관 내 연구 결과 리바록사반은 주요 시토크롬 P450 효소 CYP1A2, 2C8, 2C9, 2C19, 2D6, 2J2 및 3A를 억제하지 않으며 CYP1A2, 2B6, 2C19 또는 3A를 유도하지 않습니다.
시험관 내 데이터는 또한 P-gp 및 ABCG2 수송체에 대한 리바록사반의 억제 가능성이 낮음을 나타냅니다.
동시 투여된 약물이 리바록사반 노출의 약동학에 미치는 영향은 그림 3에 요약되어 있습니다(
[
약물 상호 작용(7) 참조]
.
그림 3: 성인에서 동시 투여된 약물이 리바록사반의 약동학에 미치는 영향
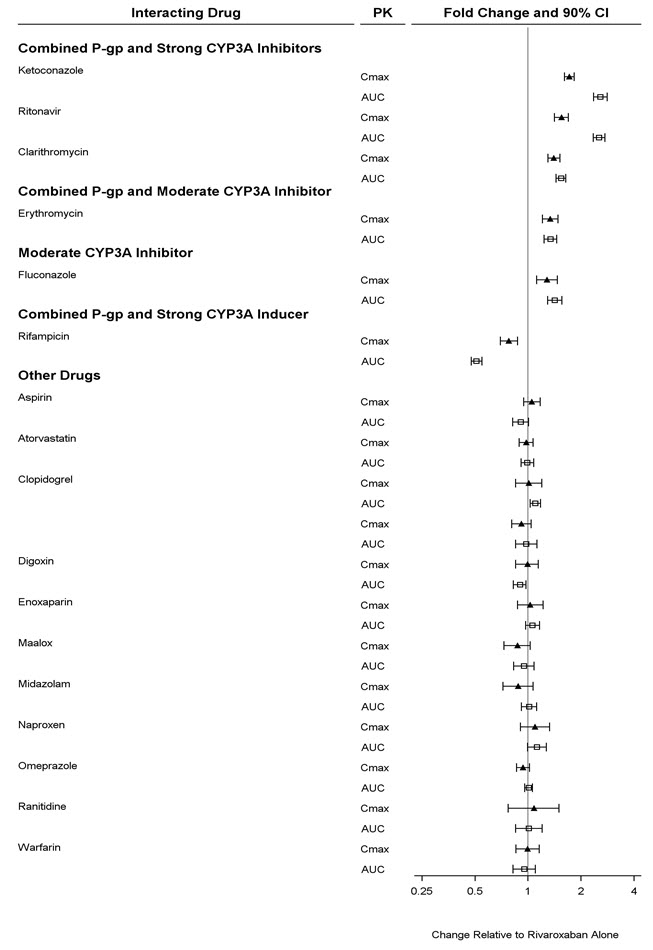
항응고제
약물 상호 작용 연구에서 에녹사파린(피하 40mg)과 XARELTO(10mg)를 단일 용량으로 동시에 투여한 결과 항-Xa 활성에 대한 상가적 효과가 나타났습니다. 또 다른 연구에서 와파린(15mg)과 XARELTO(5mg)를 단일 용량으로 투여한 결과 Xa 인자 억제 및 PT에 대한 상가적 효과가 나타났습니다. 에녹사파린과 와파린 모두 리바록사반의 약동학에 영향을 미치지 않았습니다(
그림 3 참조).
NSAID/아스피린
ROCKET AF에서 이중맹검 단계 동안 동시 아스피린 사용(거의 대부분 100mg 이하 용량)은 주요 출혈의 독립적인 위험 요인으로 확인되었습니다. NSAID는 출혈을 증가시키는 것으로 알려져 있으며, NSAID를 XARELTO와 함께 사용하면 출혈 위험이 증가할 수 있습니다. 나프록센과 아스피린 모두 리바록사반의 약동학에 영향을 미치지 않았습니다(
그림 3 참조).
Clopidogrel
건강한 피험자에서 클로피도그렐(300mg 로딩 용량 후 75mg 일일 유지 용량)과 XARELTO(15mg 단일 용량)를 병용 투여한 두 가지 약물 상호 작용 연구에서, 이러한 연구에서 각각 약 45%와 30%의 피험자에서 출혈 시간이 45분으로 증가하는 것으로 나타났습니다. 출혈 시간의 변화는 각 약물을 단독으로 투여했을 때 관찰된 최대 증가량의 약 2배였습니다. 두 약물의 약동학적 변화는 없었습니다.
시토크롬 P450 3A 효소 및 약물 수송 시스템을 억제하는 약물과의 약물-질환 상호 작용
약동학적 시험에서, XARELTO는 경증(CrCl = 50~79 mL/min) 또는 중등도 신장애(CrCl = 30~49 mL/min)가 있는 피험자에게 에리스로마이신(P-gp 및 중등도 CYP3A 억제제의 조합)을 다중 용량으로 투여한 후 단일 용량으로 투여되었습니다. 정상 신장 기능(CrCl >80 mL/min)을 가진 피험자에게 XARELTO를 단독으로 투여한 경우와 비교하여, 에리스로마이신을 병용 투여한 경증 및 중등도 신장애가 있는 피험자는 AUC
inf가 각각 76% 및 99% 증가하고 C
max가 각각 56% 및 64% 증가한 것으로 보고되었습니다. 약력학적 효과에서도 유사한 경향이 관찰되었습니다.
12.6 QT/QTc 연장
50세 이상의 건강한 남녀를 대상으로 한 철저한 QT 연구에서, XARELTO(15mg 및 45mg, 단일 용량)에 대한 QTc 연장 효과는 관찰되지 않았습니다.
13. 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
리바록사반은 최대 2년 동안 마우스 또는 랫드에 경구 투여했을 때 발암성이 없었습니다. 최고 용량(60mg/kg/day)에서 시험한 수컷 및 암컷 마우스의 결합되지 않은 리바록사반의 전신 노출(AUC)은 인간 용량 20mg/day에서 결합되지 않은 약물의 인간 노출의 각각 1배 및 2배였습니다. 최고 용량(60mg/kg/day)에서 시험한 수컷 및 암컷 랫드의 결합되지 않은 약물의 전신 노출은 인간 노출의 각각 2배 및 4배였습니다.
리바록사반은 박테리아(Ames-Test)에서 돌연변이 유발성이 없었고, V79 중국 햄스터 폐 세포에서 염색체 이상 유발성이 없었습니다.
in vitro 또는 마우스 소핵 시험에서
in vivo.
리바록사반을 최대 200mg/kg/day까지 경구 투여했을 때 수컷 또는 암컷 랫드에서 생식능력 저해는 관찰되지 않았습니다. 이 용량은 결합되지 않은 AUC를 기준으로 하여 리바록사반 20mg을 매일 투여받은 인간의 노출보다 최소 13배 높은 노출 수준을 초래했습니다.
14 임상 연구
14.1 비판막성 심방세동에서의 뇌졸중 예방
XARELTO의 효능 및 안전성에 대한 증거는
Rivaroxaban
Once-daily oral direct factor Xa inhibition
Compared with vitamin
K antagonist for the prevention of stroke and
Embolism
Trial in
Atrial
Fibrillation (ROCKET AF) [NCT00403767]에서 얻어졌으며, 이는 XARELTO(CrCl >50 mL/min인 환자의 경우 저녁 식사와 함께 1일 1회 20mg, CrCl 30~50 mL/min인 환자의 경우 저녁 식사와 함께 1일 1회 15mg)와 와파린(INR 2.0~3.0으로 적정)을 비교하여 비판막성 심방세동(AF) 환자에서 뇌졸중 및 비중추신경계(CNS) 전신 색전증의 위험을 줄이는 다국적, 이중맹검 연구입니다. 환자는 뇌졸중에 대한 다음과 같은 추가 위험 요인 중 하나 이상을 가져야 합니다.
- 이전 뇌졸중(허혈성 또는 유형 불명), 일과성 허혈 발작(TIA) 또는 비-CNS 전신 색전증, 또는
- 다음 위험 요인 중 2개 이상:
- 연령 ≥75세,
- 고혈압,
- 심부전 또는 좌심실 박출 분율 ≤35%, 또는
- 당뇨병
ROCKET AF는 심방세동에서 와파린의 이전 위약 대조 연구에서 확립된 바와 같이 XARELTO가 와파린 효과의 50% 이상을 유지한다는 것을 입증하기 위해 설계된 비열등성 연구였습니다.
총 14,264명의 환자가 무작위 배정되었으며, 중앙값 590일 동안 연구 치료를 받았습니다. 평균 연령은 71세였으며 평균 CHADS
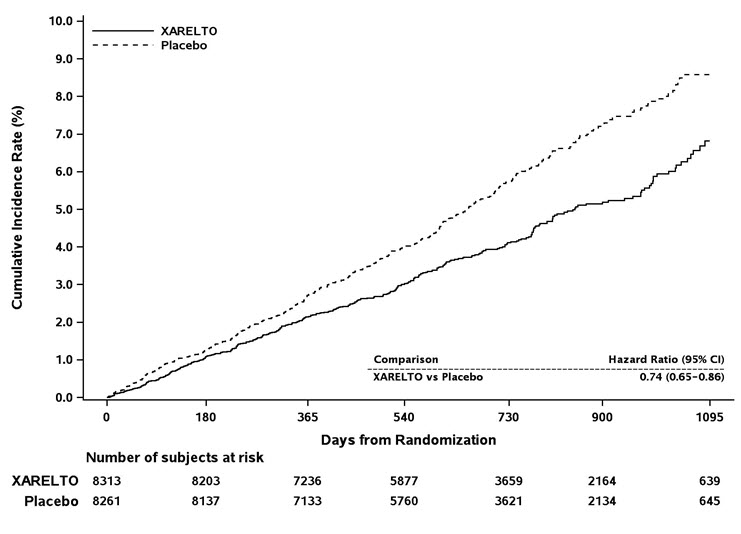
2 점수는 3.5였습니다. 인구는 남성 60%, 백인 83%, 아시아인 13%, 흑인 1.3%였습니다. 뇌졸중, TIA 또는 비-CNS 전신 색전증의 병력이 있는 환자는 55%였으며, 환자의 38%는 선별 검사 시 6주 이내에 비타민 K 길항제(VKA)를 복용하지 않았습니다. 이 연구에 참여한 환자의 동반 질환에는 고혈압 91%, 당뇨병 40%, 울혈성 심부전 63%, 이전 심근 경색 17%가 포함되었습니다. 기준선에서 환자의 37%는 아스피린(거의 전적으로 100mg 이하 용량으로)을 복용했으며, 클로피도그렐을 복용한 환자는 거의 없었습니다. 환자는 동유럽(39%), 북미(19%), 아시아, 호주 및 뉴질랜드(15%), 서유럽(15%), 라틴 아메리카(13%)에 등록되었습니다. 와파린에 무작위 배정된 환자는 연구 초기 몇 달 동안 낮았지만 INR 목표 범위 2.0~3.0에서 평균 시간 비율이 55%였습니다.
ROCKET AF에서 XARELTO는 첫 번째 발생 뇌졸중(모든 유형) 또는 비-CNS 전신 색전증까지의 시간에 대한 1차 복합 결과에 대해 와파린에 비해 비열등성이 입증되었지만 [HR(95% CI): 0.88(0.74, 1.03)], 와파린에 대한 우월성은 입증되지 않았습니다. 와파린 요법이 잘 조절된 경우 XARELTO와 와파린을 비교하는 데 필요한 경험이 충분하지 않습니다.
표 19는 1차 복합 결과 및 그 구성 요소에 대한 전반적인 결과를 보여줍니다.
| XARELTO | 와파린 | XARELTO 대 와파린 | |||
|---|---|---|---|---|---|
| 사건 | N=7081
n (%) |
사건 발생률
(100 환자-년당) |
N=7090
n (%) |
사건 발생률
(100 환자-년당) |
위험 비율
(95% CI) |
| 1차 복합 결과 | 269 (3.8) | 2.1 | 306 (4.3) | 2.4 | 0.88 (0.74, 1.03) |
| 뇌졸중 | 253 (3.6) | 2.0 | 281 (4.0) | 2.2 | |
| 출혈성 뇌졸중 | 33 (0.5) | 0.3 | 57 (0.8) | 0.4 | |
| 허혈성 뇌졸중 | 206 (2.9) | 1.6 | 208 (2.9) | 1.6 | |
| Unknown Stroke Type | 19 (0.3) | 0.2 | 18 (0.3) | 0.1 | |
| Non-CNS Systemic Embolism | 20 (0.3) | 0.2 | 27 (0.4) | 0.2 | |
그림 4는 두 치료군에서 무작위 배정부터 첫 번째 주요 종료점 사건 발생까지의 시간을 나타낸 것입니다.
그림 4: 치료군별 뇌졸중(모든 유형) 또는 비-CNS 전신 색전증의 첫 번째 발생까지의 시간 (의도적 치료 집단)
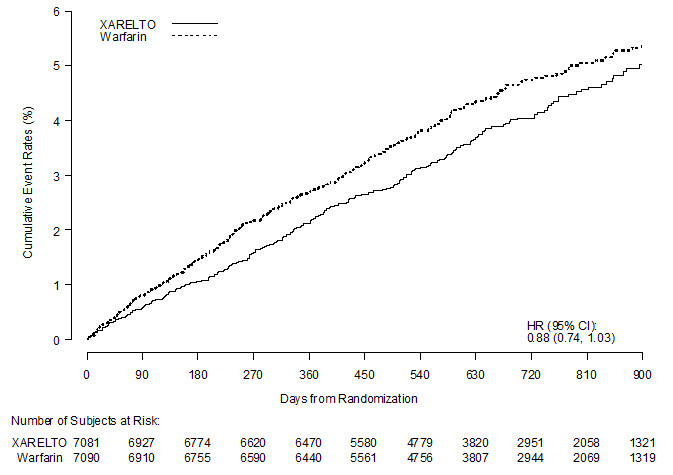
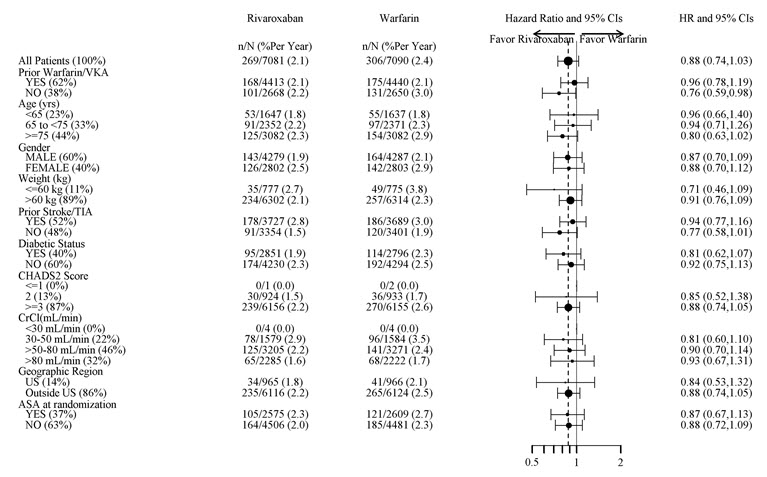
그림 5는 주요 하위 집단에서 뇌졸중 또는 비-CNS 전신 색전증의 위험을 보여줍니다.
| 참고: 위 그림은 기준선 특성인 다양한 하위 집단에서의 효과를 보여주며, 이러한 모든 특성은 사전에 지정되었습니다(당뇨병 상태는 하위 집단에서 사전에 지정되지 않았지만 CHADS2 점수에 대한 기준이었습니다). 표시된 95% 신뢰 구간은 얼마나 많은 비교가 이루어졌는지 고려하지 않으며, 다른 모든 요인에 대한 조정 후 특정 요인의 효과를 반영하지 않습니다. 그룹 간의 명백한 동질성 또는 이질성은 과도하게 해석해서는 안 됩니다. |
|
|
그림 5: ROCKET AF에서 기준선 특성별 뇌졸중 또는 비-CNS 전신 색전증 위험 * (의도적 치료 집단)
|
|
|
XARELTO의 효능은 주요 하위 그룹에서 일반적으로 일관되었습니다.
ROCKET AF 프로토콜은 연구 약물 중단 후 항응고 요법을 규정하지 않았지만, 연구를 완료한 와파린 환자는 일반적으로 와파린을 계속 복용했습니다. XARELTO 환자는 일반적으로 와파린과 XARELTO를 함께 투여하는 기간 없이 와파린으로 전환되었으므로, XARELTO를 중단한 후 치료적 INR에 도달할 때까지 적절한 항응고 요법을 받지 못했습니다. 연구 종료 후 28일 동안, XARELTO를 복용한 4637명의 환자에서 22명의 뇌졸중이 발생한 반면, 와파린을 복용한 4691명의 환자에서 6명의 뇌졸중이 발생했습니다.
ROCKET AF에서 심방세동에 대한 전기적 심장박동 전환을 받은 환자는 거의 없었습니다. 심장박동 전환 후 뇌졸중 및 전신 색전증 예방을 위한 XARELTO의 유용성은 알려져 있지 않습니다.
14.2 심부 정맥 혈전증(DVT) 및/또는 폐색전증(PE) 치료
EINSTEIN 심부 정맥 혈전증 및 EINSTEIN 폐색전증 연구
DVT 및/또는 PE 치료를 위한 XARELTO는 EINSTEIN DVT [NCT00440193] 및 EINSTEIN PE [NCT00439777]에서 연구되었으며, 이는 XARELTO(처음 3주 동안 음식과 함께 1일 2회 15mg을 투여한 후 음식과 함께 1일 1회 20mg의 XARELTO를 투여)를 에녹사파린 1mg/kg을 1일 2회 최소 5일 동안 VKA와 함께 투여한 후 목표 INR(2.0–3.0)에 도달하면 VKA만으로 계속 투여하는 것과 비교한 다국적, 개방표지, 비열등성 연구입니다. 혈전 용해술, 하대 정맥 필터 삽입 또는 섬유소 용해제 사용이 필요한 환자와 크레아티닌 청소율이 <30 mL/min인 환자, 심각한 간 질환이 있는 환자 또는 활동성 출혈이 있는 환자는 연구에서 제외되었습니다. 의도된 치료 기간은 무작위 배정 전에 연구자의 평가에 따라 3개월, 6개월 또는 12개월이었습니다.
총 8281명(EINSTEIN DVT에서 3449명, EINSTEIN PE에서 4832명)의 환자가 무작위 배정되었으며, XARELTO 그룹에서는 평균 208일, 에녹사파린/VKA 그룹에서는 평균 204일 동안 연구 치료를 받았습니다. 평균 연령은 약 57세였습니다. 인구는 남성 55%, 백인 70%, 아시아인 9%, 흑인 약 3%였습니다. EINSTEIN DVT 및 EINSTEIN PE 연구에서 XARELTO를 투여받은 환자의 약 73% 및 92%는 각각 중앙값 2일 동안 초기 비경구 항응고제 치료를 받았습니다. EINSTEIN DVT 및 EINSTEIN PE 연구에서 에녹사파린/VKA를 투여받은 환자는 중앙값 8일 동안 초기 비경구 항응고제 치료를 받았습니다. 아스피린은 두 치료 그룹 모두에서 약 12%의 환자에게 동반 항혈전제로 치료 중에 복용했습니다. VKA에 무작위 배정된 환자의 경우, EINSTEIN DVT 연구에서는 INR 목표 범위 2.0~3.0에서 조정되지 않은 평균 시간 비율이 58%, EINSTEIN PE 연구에서는 60%였으며, 연구 첫 달 동안 더 낮은 값이 나타났습니다.
EINSTEIN DVT 및 EINSTEIN PE 연구에서, 환자의 49%는 기준선에서 특발성 DVT/PE를 보였습니다. 다른 위험 요인으로는 이전 DVT/PE 발병(19%), 최근 수술 또는 외상(18%), 부동(16%), 에스트로겐 함유 약물 사용(8%), 알려진 혈전증(6%) 또는 활동성 암(5%)이 있습니다.
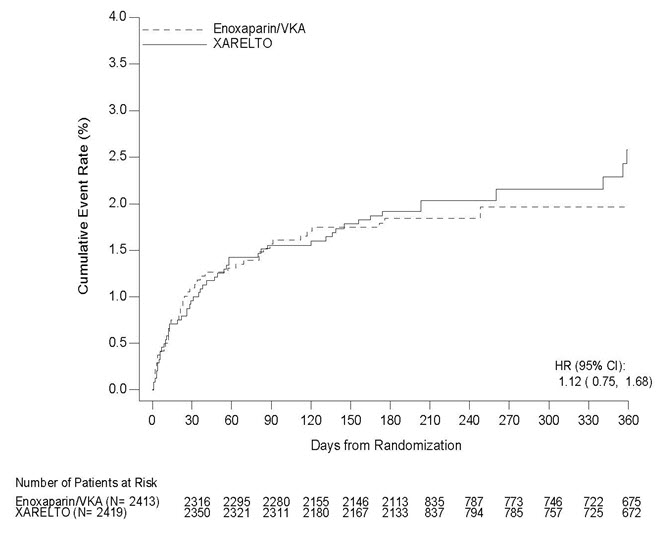
EINSTEIN DVT 및 EINSTEIN PE 연구에서, XARELTO는 재발성 DVT 또는 비치명적 또는 치명적 PE의 첫 발생까지의 시간인 1차 복합 종말점에 대해 에녹사파린/VKA에 비해 비열등한 것으로 나타났습니다[EINSTEIN DVT HR(95% CI): 0.68(0.44, 1.04); EINSTEIN PE HR(95% CI): 1.12(0.75, 1.68)]. 각 연구에서 비열등성 결론은 위험 비율에 대한 95% 신뢰 구간의 상한이 2.0 미만인 것을 기반으로 했습니다.
표 20은 EINSTEIN DVT 및 EINSTEIN PE 연구의 1차 복합 종말점 및 그 구성 요소에 대한 전반적인 결과를 보여줍니다.
| 사건 | XARELTO 20mg | 에녹사파린/VKA | XARELTO 대 에녹사파린/VKA
위험 비율 (95% CI) |
|---|---|---|---|
|
|||
| EINSTEIN DVT 연구 | N=1731
n (%)
|
N=1718
n (%)
|
|
| 1차 복합 종말점 | 36 (2.1) | 51 (3.0) | 0.68 (0.44, 1.04) |
| 사망(PE) | 1 (<0.1) | 0 | |
| 사망 (PE 배제 불가) | 3 (0.2) | 6 (0.3) | |
| 증상성 PE 및 DVT | 1 (<0.1) | 0 | |
| 증상성 재발성 PE만 | 20 (1.2) | 18 (1.0) | |
| 증상성 재발성 DVT만 | 14 (0.8) | 28 (1.6) | |
| EINSTEIN PE 연구 | N=2419
n (%)
|
N=2413
n (%)
|
|
| 1차 복합 평가 지표 | 50 (2.1) | 44 (1.8) | 1.12 (0.75, 1.68) |
| 사망 (PE) | 3 (0.1) | 1 (<0.1) | |
| 사망 (PE 배제 불가) | 8 (0.3) | 6 (0.2) | |
| 증상성 PE 및 DVT | 0 | 2 (<0.1) | |
| 증상성 재발성 PE만 | 23 (1.0) | 20 (0.8) | |
| 증상성 재발성 DVT만 | 18 (0.7) | 17 (0.7) | |
그림 6과 7은 각각 EINSTEIN DVT 및 EINSTEIN PE 연구에서 두 치료 그룹의 무작위 배정부터 첫 번째 주요 유효성 평가 종료점 사건 발생까지의 시간을 나타낸 그래프입니다.
그림 6: 치료 그룹별 재발성 DVT 또는 비치명적 또는 치명적 PE의 복합 사건 발생까지의 시간 (의도적 치료 집단) – EINSTEIN DVT 연구
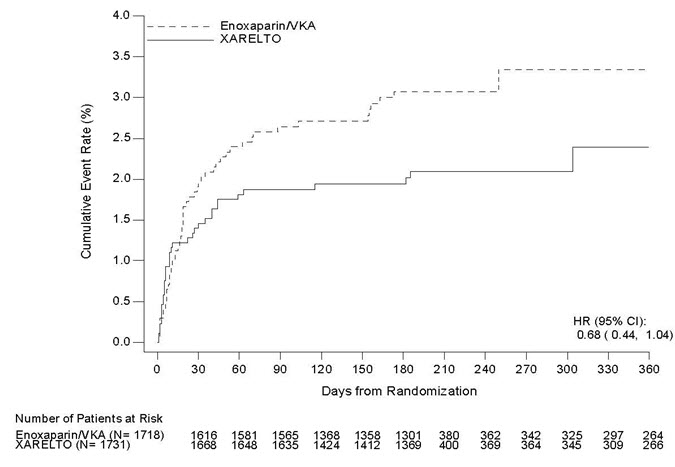
그림 7: 치료 그룹별 재발성 DVT 또는 비치명적 또는 치명적 PE의 복합 사건 발생까지의 시간 (의도적 치료 집단) – EINSTEIN PE 연구
14.3 DVT 및/또는 PE 재발 위험 감소
EINSTEIN CHOICE 연구
DVT 및/또는 PE의 재발 위험 감소를 위한 XARELTO는 EINSTEIN CHOICE 연구 [NCT02064439]에서 평가되었으며, 이 연구는 급성 사건 후 DVT 및/또는 PE에 대한 항응고제 치료를 6개월에서 12개월 동안 완료한 환자에서 XARELTO (식사와 함께 1일 1회 10mg 또는 20mg)를 1일 1회 100mg 아세틸살리실산 (아스피린)과 비교한 다국적, 이중맹검, 우월성 연구였습니다. 연구에서 의도된 치료 기간은 최대 12개월이었습니다. 지속적인 치료 용량 항응고제가 필요한 환자는 제외되었습니다.
아스피린과 비교한 20mg 용량보다 아스피린과 비교한 10mg 용량에서 유익성-위험 평가가 더 유리했기 때문에 아래에서는 10mg 용량에 대한 데이터만 논의합니다.
총 2275명의 환자가 무작위 배정되었으며 XARELTO 및 아스피린 치료 그룹에 대해 평균 290일 동안 연구 치료를 받았습니다. 평균 연령은 약 59세였습니다. 인구는 남성 56%, 백인 70%, 아시아인 14%, 흑인 3%였습니다. EINSTEIN CHOICE 연구에서 환자의 51%는 DVT만, 33%는 PE만, 16%는 PE와 DVT를 함께 가졌습니다. 다른 위험 요인으로는 특발성 VTE (43%), 이전 DVT/PE 발병 (17%), 최근 수술 또는 외상 (12%), 장기간 고정 (10%), 에스트로겐 함유 약물 사용 (5%), 알려진 혈전증 (6%), Factor V Leiden 유전자 돌연변이 (4%), 또는 활동성 암 (3%)이 포함되었습니다.
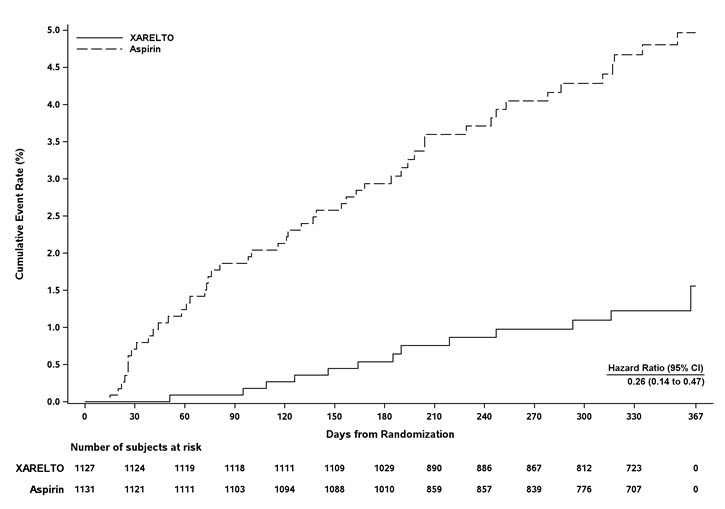
EINSTEIN CHOICE 연구에서 XARELTO 10mg은 재발성 DVT 또는 비치명적 또는 치명적 PE의 첫 번째 발생까지의 시간에 대한 주요 복합 종료점에 대해 아스피린 100mg보다 우수한 것으로 나타났습니다.
표 21은 주요 복합 종료점 및 그 구성 요소에 대한 전반적인 결과를 보여줍니다.
| 사건 | XARELTO
10mg N=1,127 n (%) |
아세틸살리실산 (아스피린)
100mg N=1,131 n (%) |
XARELTO 10mg vs. 아스피린 100mg
위험 비율 (95% CI) |
|---|---|---|---|
|
|||
| 주요 복합 종료점 | 13 (1.2) | 50 (4.4) | 0.26
(0.14, 0.47) p<0.0001 |
| 증상성 재발성 DVT | 8 (0.7) | 29 (2.6) | |
| 증상성 재발성 PE | 5 (0.4) | 19 (1.7) | |
| 사망 (PE) | 0 | 1 (<0.1) | |
| 사망 (PE 배제 불가) | 0 | 1 (<0.1) | |
그림 8은 두 치료 그룹에서 무작위 배정부터 첫 번째 주요 효능 종료점 사건 발생까지의 시간을 나타낸 그래프입니다.
그림 8: 치료 그룹별 재발성 DVT 또는 비치명적 또는 치명적 PE의 복합 사건 발생까지의 시간 (전체 분석 집합) – EINSTEIN CHOICE 연구
14.4 고관절 또는 무릎 교체 수술 후 심부 정맥 혈전증 예방
XARELTO는
REgulation of
Coagulation in
ORthopedic Surgery to Prevent
DVT and PE, Controlled, Double-blind, Randomized Study of BAY 59-7939 in the Extended Prevention of VTE in Patients Undergoing Elective Total Hip or Knee Replacement (RECORD 1, 2, and 3) [NCT00329628, NCT00332020, NCT00361894] 연구에서 9011명의 환자(XARELTO 치료군 4487명, 에녹사파린 치료군 4524명)를 대상으로 연구되었습니다.
선택적 총 고관절 교체 수술을 받은 환자를 대상으로 한 두 건의 무작위 배정, 이중 맹검 임상 연구(RECORD 1 및 2)에서 XARELTO 10mg을 상처 봉합 후 최소 6~8시간(환자의 약 90%가 6~10시간에 투여)부터 1일 1회 투여한 경우와 에녹사파린 40mg을 수술 전 12시간부터 1일 1회 투여한 경우를 비교했습니다. RECORD 1 및 2에서 총 6727명의 환자가 무작위 배정되었으며 6579명이 연구 약물을 투여받았습니다. 평균 연령 [± 표준 편차(SD)]은 63 ± 12.2(범위 18~93)세였으며, 환자의 49%가 65세 이상이었고 55%가 여성이었습니다. 환자의 82% 이상이 백인이었고, 7%가 아시아인이었으며, 2% 미만이 흑인이었습니다. 이 연구는 단계적 양측 총 고관절 교체를 받은 환자, 추정 크레아티닌 청소율이 30mL/분 미만인 심각한 신장 장애가 있는 환자 또는 유의미한 간 질환(간염 또는 간경변증)이 있는 환자는 제외했습니다. RECORD 1에서 활성 XARELTO와 에녹사파린에 대한 평균 노출 기간(± SD)은 각각 33.3 ± 7.0일과 33.6 ± 8.3일이었습니다. RECORD 2에서 활성 XARELTO와 에녹사파린에 대한 평균 노출 기간은 각각 33.5 ± 6.9일과 12.4 ± 2.9일이었습니다. 13일 이후, 에녹사파린 그룹에서는 이중 맹검 연구 기간 동안 나머지 기간 동안 경구 위약제를 계속 투여했습니다. RECORD 1 및 2의 효능 데이터는 표 22에 나와 있습니다.
| RECORD 1 | RECORD 2 | |||||
|---|---|---|---|---|---|---|
| 치료 용량 및 기간 | XARELTO
10mg 1일 1회 |
에녹사파린
40mg 1일 1회 |
RRR
*, p-값 |
XARELTO
10mg 1일 1회 |
에녹사파린
† |
RRR
*, p-값 |
| 환자 수 | N=1513 | N=1473 | N=834 | N=835 | ||
| 총 VTE | 17 (1.1%) | 57 (3.9%) | 71%
(95% CI: 50, 83), p<0.001 |
17 (2.0%) | 70 (8.4%) | 76%
(95% CI: 59, 86), p<0.001 |
| 총 VTE 구성 요소 | ||||||
| 근위 DVT | 1 (0.1%) | 31 (2.1%) | 5 (0.6%) | 40 (4.8%) | ||
| 원위 DVT | 12 (0.8%) | 26 (1.8%) | 11 (1.3%) | 43 (5.2%) | ||
| 비치명적 PE | 3 (0.2%) | 1 (0.1%) | 1 (0.1%) | 4 (0.5%) | ||
| 사망 (모든 원인) | 4 (0.3%) | 4 (0.3%) | 2 (0.2%) | 4 (0.5%) | ||
| 환자 수 | N=1600 | N=1587 | N=928 | N=929 | ||
| 주요 VTE‡ | 3 (0.2%) | 33 (2.1%) | 91% (95% CI: 71, 97),
p<0.001 |
6 (0.7%) | 45 (4.8%) | 87% (95% CI: 69, 94),
p<0.001 |
| 환자 수 | N=2103 | N=2119 | N=1178 | N=1179 | ||
| 증상성 VTE | 5 (0.2%) | 11 (0.5%) | 3 (0.3%) | 15 (1.3%) | ||
선택적 슬관절 전치환술을 받은 환자를 대상으로 한 무작위 배정, 이중맹검 임상 연구(RECORD 3)에서 상처 봉합 후 최소 6~8시간(환자의 약 90%가 6~10시간에 투약)에 시작한 XARELTO 10mg 1일 1회 투약을 에녹사파린과 비교했습니다. RECORD 3에서 에녹사파린 요법은 수술 전 12시간에 시작한 40mg 1일 1회 투약이었습니다. 연구에 참여한 환자의 평균 연령(± SD)은 68±9.0(범위 28~91)세였으며, 환자의 66%가 65세 이상이었습니다. 환자의 68%가 여성이었습니다. 환자의 81%가 백인이었고, 7% 미만이 아시아인이었으며, 2% 미만이 흑인이었습니다. 이 연구는 추정 크레아티닌 청소율이 30mL/분 미만인 심각한 신장애 환자 또는 유의미한 간 질환(간염 또는 간경변증)이 있는 환자를 제외했습니다. 활성 XARELTO와 에녹사파린에 대한 평균 노출 기간(± SD)은 각각 11.9±2.3일과 12.5±3.0일이었습니다. 효능 데이터는 표 23에 제공됩니다.
| RECORD 3 | |||
|---|---|---|---|
| 치료 용량 및 기간 | XARELTO
10mg 1일 1회 |
에녹사파린
40mg 1일 1회 |
RRR
*, p-값 |
| 환자 수 | N=813 | N=871 | |
| 총 VTE | 79 (9.7%) | 164 (18.8%) | 48%
(95% CI: 34, 60), p<0.001 |
| 총 VTE에 기여하는 사건 구성 요소 | |||
| 근위 심부 정맥 혈전증 | 9 (1.1%) | 19 (2.2%) | |
| 원위 심부 정맥 혈전증 | 74 (9.1%) | 154 (17.7%) | |
| 비치명적 폐색전증 | 0 | 4 (0.5%) | |
| 사망(모든 원인) | 0 | 2 (0.2%) | |
| 환자 수 | N=895 | N=917 | |
| 주요 VTE† | 9 (1.0%) | 23 (2.5%) | 60% (95% CI: 14, 81),
p = 0.024 |
| 환자 수 | N=1206 | N=1226 | |
| 증상성 VTE | 8 (0.7%) | 24 (2.0%) | |
14.5 출혈 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 질환 환자에서 정맥혈전색전증 예방
출혈 위험이 높지 않은 혈전색전증 합병증 위험이 있는 급성 질환 환자에서 정맥혈전색전증 예방에 대한 XARELTO의 효능 및 안전성은 MAGELLAN 연구(
Multicenter, r
Andomized, parallel
Group
Efficacy and safety study for the prevention of venous thromboembolism in hospitalized medically i
LL patients comparing rivaroxab
aN with enoxaparin [NCT00571649])에서 평가되었습니다. MAGELLAN은 입원한 급성 질환 환자에서 입원 기간 및 퇴원 후 기간 동안 VTE 예방에 대한 XARELTO와 에녹사파린을 비교한 다기관, 무작위 배정, 이중맹검, 병행군 효능 및 안전성 연구였습니다. 적격 환자는 만 40세 이상의 성인으로, 급성 질환으로 입원했으며, 중등도 또는 중증의 불활동으로 인해 VTE 위험이 있고, VTE에 대한 추가적인 위험 요인이 있는 환자였습니다. VTE 위험이 있는 인구는 장기간 불활동, 75세 이상, 암 병력, VTE 병력, 심부전 병력, 혈전증, 입원에 기여하는 급성 감염성 질환 및 BMI ≥35 kg/m
2 등의 VTE 위험 요인 중 하나 이상을 가져야 했습니다. 입원 원인에는 심부전, 활동성 암, 급성 허혈성 뇌졸중, 급성 감염성 및 염증성 질환, 급성 호흡 부전이 포함되었습니다. 환자는 입원 시 시작하여 퇴원 후까지 35±4일 동안 XARELTO 10mg을 1일 1회(n=4050) 투여하거나, 입원 시 시작하여 퇴원 후에는 위약제를 투여하는 에녹사파린 40mg을 1일 1회 10±4일 동안 투여(n=4051)하도록 무작위 배정되었습니다.
MAGELLAN 시험의 주요 효능 결과는 하지 근위부 무증상 심부 정맥 혈전증(DVT), 하지 근위부 또는 원위부 증상성 DVT, 증상성 비치명적 폐색전증(PE), 정맥혈전색전증(VTE) 관련 사망을 포함하는 복합 종말점이었습니다.
총 6024명의 환자가 주요 효능 결과 분석(XARELTO 10mg 1일 1회 투여 환자 2967명, 에녹사파린/위약제 투여 환자 3057명)에 대해 평가 가능했습니다. 평균 연령은 68.9세였으며, 피험자의 37.1%가 75세 이상이었습니다. VTE 위험 요인에는 연구 시작 시 중증 불활동(99.9%), D-dimer > 2× ULN(43.7%), 심부전 병력(35.6%), BMI ≥ 35 kg/m
2(15.2%), 만성 정맥 부전(14.9%), 급성 감염성 질환(13.9%), 중증 정맥류(12.5%), 암 병력(16.2%), VTE 병력(4.5%), 호르몬 대체 요법(1.1%), 혈전증(0.3%), 최근 주요 수술(0.8%), 최근 심각한 외상(0.2%)이 포함되었습니다. 인구는 남성 54.7%, 백인 68.2%, 아시아인 20.4%, 흑인 1.9%, 기타 5.3%였습니다. 입원 진단은 급성 감염성 질환(43.8%)이었고, 그 다음으로 심장성 부종 NYHA 3등급 또는 4등급(33.2%), 급성 호흡 부전(26.4%), 급성 허혈성 뇌졸중(18.5%), 급성 염증성 질환(3.4%)이었습니다.
표 24는 효능 결과 및 그 구성 요소에 대한 사전 지정된 수정된 의도적 치료(mITT) 분석의 전반적인 결과를 보여줍니다. 이 분석은 초음파 평가를 하지 않은 환자(13.5%), 35일째 적절한 평가를 하지 않은 환자(8.1%), 연구 약물을 복용하지 않은 환자(1.3%) 등 약 25%의 환자를 제외합니다.
| mITT: 수정된 의도적 치료; PP: 프로토콜에 따라; DVT: 심부 정맥 혈전증; PE: 폐색전증; VTE: 정맥혈전색전증; CI: 신뢰 구간; RR: 상대 위험 | |||
| 1일째부터 35일째까지의 사건, mITT 분석 집합 | XARELTO
10 mg N=2967 n (%)
|
에녹사파린 40 mg/위약제
N=3057 n (%)
|
RR
(95% CI)
|
| 35일째의 주요 복합 종말점 | 131 (4.4%) | 175 (5.7%) | 0.77
(0.62, 0.96) |
| 증상성 비치명적 PE | 10 (0.3) | 14 (0.5) | |
| 하지 증상성 DVT | 13 (0.4) | 15 (0.5) | |
| 하지 근위부 무증상 DVT | 103 (3.5) | 133 (4.4) | |
| VTE 관련 사망 | 19 (0.6) | 30 (1.0) | |
| 1일부터 10일까지의 사건, PP 분석 집합 | XARELTO
10 mg N=2938 n (%)
|
에녹사파린
40 mg N=2993 n (%)
|
RR
(95% CI)
|
| 10일째의 일차 복합 종말점 | 78 (2.7) | 82 (2.7) | 0.97
(0.71, 1.31) |
| 증상이 있는 비치명적 PE | 6 (0.2) | 2 (<0.1) | |
| 하지의 증상이 있는 DVT | 7 (0.2) | 6 (0.2) | |
| 하지의 무증상 근위부 DVT | 71 (2.4) | 71 (2.4) | |
| VTE 관련 사망 | 3 (0.1) | 6 (0.2) | |
| mITT 분석 집합 + 모든 원인 사망 | N=3096
n (%)
|
N=3169
n (%)
|
RR
(95% CI)
|
| 35일째의 다른 복합 종말점 | 266 (8.6) | 293 (9.2) | 0.93
(0.80, 1.09) |
| 증상이 있는 비치명적 PE | 10 (0.3) | 14 (0.4) | |
| 하지의 증상이 있는 DVT | 13 (0.4) | 15 (0.5) | |
| 하지의 무증상 근위부 DVT | 103 (3.3) | 133 (4.2) | |
| 모든 원인 사망 | 159 (5.1) | 153 (4.8) | |
기관지확장증/폐공동, 활동성 암, 이중 항혈소판 요법 또는 활동성 위십이지장 궤양 또는 지난 3개월 이내 출혈이 있는 환자(19.4%)는 모두 XARELTO와 비교하여 에녹사파린/위약에서 출혈이 과도하게 발생했습니다. 따라서 이러한 기준을 충족하는 환자는 아래에 제시된 다음 분석에서 제외되었습니다.
표 25는 출혈 위험이 높지 않은 환자 하위 그룹에 대한 효능 결과를 제공합니다.
| mITT: 수정된 ITT; PP: 프로토콜에 따름; DVT: 심부 정맥 혈전증; PE: 폐색전증; VTE: 정맥혈전색전증; CI: 신뢰 구간; RR: 상대 위험 | |||
|
|||
| 1일차부터 35일차까지의 사건, mITT 분석 집합 | XARELTO
10 mg N=2419 n (%)
|
에녹사파린 40 mg/위약
N=2506 n (%)
|
RR
(95% CI)
|
| 35일차 주요 복합적 종말점 | 94 (3.9) | 143 (5.7) | 0.68
(0.53, 0.88) |
| 증상이 있는 비치명적 PE | 7 (0.3) | 10 (0.4) | |
| 하지의 증상이 있는 DVT | 9 (0.4) | 10 (0.4) | |
| 하지의 무증상 근위부 DVT | 73 (3.0) | 110 (4.4) | |
| VTE 관련 사망 | 15 (0.6) | 26 (1.0) | |
| 1일차부터 10일차까지의 사건, PP 분석 집합 | XARELTO
10 mg N=2385 n (%)
|
에녹사파린
40 mg N=2433 n (%)
|
RR
(95% CI)
|
| 10일차 주요 복합적 종말점 | 58 (2.4) | 72 (3.0) | 0.82
(0.58, 1.15) |
| 증상이 있는 비치명적 PE | 5 (0.2) | 2 (<0.1) | |
| 하지의 증상이 있는 DVT | 6 (0.3) | 4 (0.2) | |
| 하지의 무증상 근위부 DVT | 52 (2.2) | 62 (2.5) | |
| VTE 관련 사망 | 2 (<0.1) | 6 (0.2) | |
| mITT 분석 집합 + 모든 원인 사망 | N=2504
n (%)
|
N=2583
n (%)
|
RR
(95% CI)
|
| 35일차 다른 복합적 종말점 | 184 (7.3) | 225 (8.7) | 0.84
(0.70, 1.02) |
| 증상이 있는 비치명적 PE | 7 (0.3) | 10 (0.4) | |
| 하지의 증상이 있는 DVT | 9 (0.4) | 10 (0.4) | |
| 하퇴부 무증상 근위부 심부정맥혈전증 | 73 (2.9) | 110 (4.3) | |
| 모든 원인 사망 | 107 (4.3) | 112 (4.3) | |
14.6 관상동맥 질환 환자에서 주요 심혈관 사건 위험 감소
관상동맥 질환(CAD) 또는 말초 동맥 질환(PAD) 환자에서 뇌졸중, 심근 경색 또는 심혈관 사망 위험 감소에 대한 XARELTO의 효능 및 안전성에 대한 증거는 이중맹검, 위약 대조
Cardiovascular
Outco
Mes for
People using
Anticoagulation
Strategie
S trial (COMPASS) [NCT10776424]에서 얻어졌습니다. 총 27,395명의 환자가 리바록사반 2.5mg을 1일 2회 경구 투여와 아스피린 100mg을 1일 1회 경구 투여, 리바록사반 5mg을 1일 2회 경구 투여 또는 아스피린 100mg을 1일 1회 경구 투여로 무작위 배정되었습니다. 5mg 단독 투여는 아스피린 단독 투여보다 우수하지 않았기 때문에 아래에서는 2.5mg 투여와 아스피린 병용 투여에 대한 데이터만 논의합니다.
확립된 CAD 또는 PAD 환자가 대상이었습니다. 65세 미만의 CAD 환자는 또한 적어도 두 개의 혈관계에 걸쳐 동맥경화증이 있는 것으로 확인되었거나 적어도 두 개의 추가 심혈관 위험 요인(현재 흡연, 당뇨병, 추정 사구체 여과율 [eGFR] <60mL/분, 심부전 또는 1개월 이상 전 비락운성 허혈성 뇌졸중)이 있는 것으로 확인되어야 했습니다. PAD 환자는 발목-팔 지수 <0.90으로 증상이 있거나 무증상 경동맥 협착증 ≥50%, 이전 경동맥 재혈관화 수술 또는 한쪽 또는 양쪽 하지의 확립된 허혈성 질환이 있었습니다. 이중 항혈소판제, 아스피린 이외의 다른 항혈소판제 또는 경구 항응고제 치료, 1개월 이내의 허혈성, 비락운성 뇌졸중, 언제든지 출혈성 또는 락운성 뇌졸중 또는 eGFR <15mL/분인 경우 환자는 제외되었습니다.
평균 연령은 68세였으며 피험자의 21%가 ≥75세였습니다. 포함된 환자 중 91%가 CAD(COMPASS CAD 집단이라고 함), 27%가 PAD(COMPASS PAD 집단이라고 함), 18%가 CAD와 PAD를 모두 가졌습니다. CAD 환자 중 69%는 이전 MI, 60%는 이전 경피적 관상 동맥 혈관 성형술(PTCA)/동맥 절제술/경피적 관상 동맥 중재술(PCI)을 받았고 26%는 연구 전에 관상 동맥 우회 수술(CABG)의 병력이 있었습니다. PAD 환자 중 49%는 간헐적 파행, 27%는 말초 동맥 우회 수술 또는 말초 경피적 관상 동맥 혈관 성형술을 받았고, 26%는 무증상 경동맥 협착증 > 50%를 보였으며, 4%는 동맥 혈관 질환으로 인해 사지 또는 발 절단을 받았습니다.
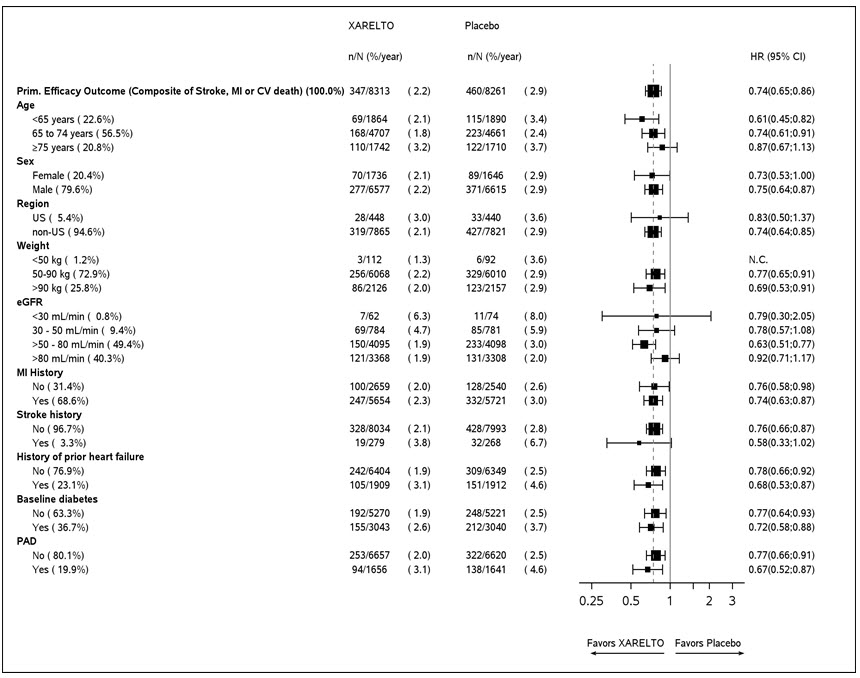
평균 추적 기간은 23개월이었습니다. 위약에 비해 XARELTO는 뇌졸중, 심근 경색 또는 심혈관 사망의 일차 복합 결과 발생률을 감소시켰습니다. HR 0.76(95% CI: 0.66, 0.86; p=0.00004). COMPASS CAD 집단에서 이점은 전체 치료 기간 동안 일정한 치료 효과를 보이며 초기부터 관찰되었습니다(
표 26 및
그림 10 참조).
COMPASS의 데이터에서 위험-이점 분석은 XARELTO 그룹과 위약 그룹에서 예방된 CV 사건(CV 사망, 심근 경색 및 비출혈성 뇌졸중)의 수를 치명적 또는 생명을 위협하는 출혈 사건(치명적 출혈 + 중요한 장기로의 증상이 있는 비치명적 출혈)의 수와 비교하여 수행되었습니다. 위약에 비해 XARELTO는 10,000 환자-년의 치료 기간 동안 CV 사건은 70건 적고 생명을 위협하는 출혈은 12건 더 많이 발생할 것으로 예상되어 이점과 위험의 유리한 균형을 나타냅니다.
COMPASS CAD 집단의 결과는 주요 하위 집단에서 일관되었습니다(
그림 9 참조).
| 사건 | XARELTO
† |
위약
† |
위험 비율
(95% CI) |
||
|---|---|---|---|---|---|
| n (%) | 사건 발생률
(%/년) |
n (%) | 사건 발생률
(%/년) |
||
| CHD: 관상 동맥 질환, CI: 신뢰 구간; CV: 심혈관; MI: 심근 경색 | |||||
|
|||||
| 뇌졸중, MI 또는 CV 사망 | 347 (4.2) | 2.2 | 460 (5.6) | 2.9 | 0.74 (0.65, 0.86) |
| – 뇌졸중 | 74 (0.9) | 0.5 | 130 (1.6) | 0.8 | 0.56 (0.42, 0.75) |
| – MI | 169 (2.0) | 1.1 | 195 (2.4) | 1.2 | 0.86 (0.70, 1.05) |
| – CV 사망 | 139 (1.7) | 0.9 | 184 (2.2) | 1.1 | 0.75 (0.60, 0.93) |
| 관상 동맥 질환 사망, MI, 허혈성 뇌졸중, 급성 사지 허혈 | 299 (3.6) | 1.9 | 411 (5.0) | 2.6 | 0.72 (0.62, 0.83) |
| – 관상 동맥 질환 사망 | 80 (1.0) | 0.5 | 107 (1.3) | 0.7 | 0.74 (0.55, 0.99) |
| – 허혈성 뇌졸중 | 56 (0.7) | 0.3 | 114 (1.4) | 0.7 | 0.49 (0.35, 0.67) |
| – 급성 사지 허혈 | 13 (0.2) | 0.1 | 27 (0.3) | 0.2 | 0.48 (0.25, 0.93) |
| CV 사망,
# MI, 허혈성 뇌졸중, 급성 사지 허혈 |
349 (4.2) | 2.2 | 470 (5.7) | 3.0 | 0.73 (0.64, 0.84) |
| 모든 원인 사망 | 262 (3.2) | 1.6 | 339 (4.1) | 2.1 | 0.77 (0.65, 0.90) |
14.7 말초 동맥 질환(PAD) 환자, 특히 증상성 PAD로 인한 하지 재혈관화술을 받은 환자에서 주요 혈전색전성 혈관 사건 위험 감소
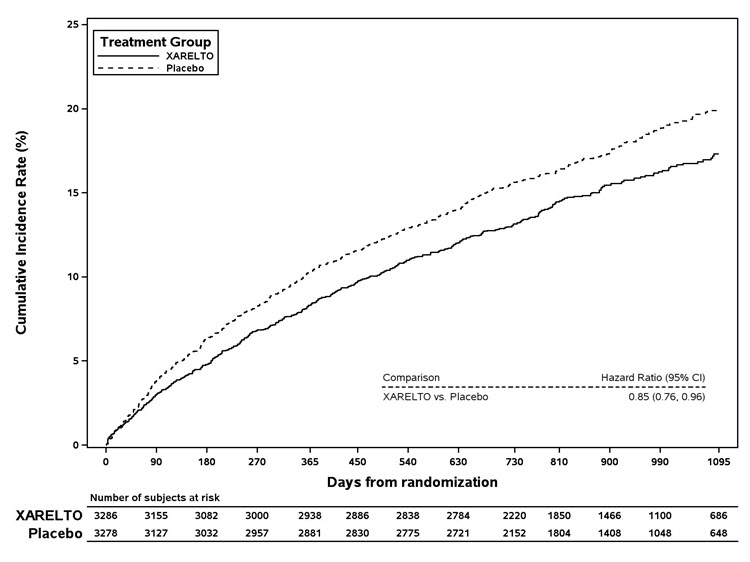
COMPASS 연구(n=4996)에서 아스피린 100mg을 1일 1회 투여 받는 배경 치료 하에 경구로 1일 2회 XARELTO 2.5mg을 투여한 경우와 위약을 투여한 경우의 효능과 안전성을 PAD 환자에서 평가했으며, 이를 COMPASS PAD 모집단이라고 합니다.
[
참조]
.
또한 증상성 말초 동맥 질환(PAD)으로 인해 하지 대퇴부 아래 재혈관화술을 받은 환자에서 심근경색, 허혈성 뇌졸중, 심혈관 사망, 급성 사지 허혈(ALI), 혈관 기원의 주요 절단의 복합적 종말점 위험 감소에 대한 XARELTO의 효능과 안전성을 이중맹검, 위약 대조
Vascular
Outcomes stud
Y of
ASA alon
G with rivaroxaban in
Endovascular or surgical limb
Revascularization for peripheral artery disease (PAD) trial (VOYAGER) [NCT02504216]에서 평가했습니다. 총 6,564명의 환자가 아스피린 100mg을 1일 1회 투여 받는 배경 치료 하에 경구로 1일 2회 XARELTO 2.5mg을 투여한 군과 위약을 투여한 군에 무작위 배정되었습니다.
적격 환자는 증상성 하지 동맥 경화성 PAD가 있는 것으로 확인된 만 50세 이상의 성인으로, 클로피도그렐을 사용하거나 사용하지 않고 성공적인 말초 수술 또는 혈관 내 수술을 받았습니다(최대 6개월까지 허용됨; 치료 기간 중앙값은 31일). 환자는 발목-팔 지수가 ≤0.85인 사지 재혈관화술 병력이 있거나 발목-팔 지수가 ≤0.80인 사지 재혈관화술 병력이 없는 경우였습니다. 6개월 이상 이중 항혈소판제가 필요하거나 아스피린과 클로피도그렐을 제외한 추가 항혈소판제 또는 경구 항응고제를 사용하는 환자, 또는 두개내 출혈, 뇌졸중 또는 일과성 허혈 발작(TIA) 병력이 있는 환자, 또는 eGFR이 <15 mL/min인 환자는 제외되었습니다.
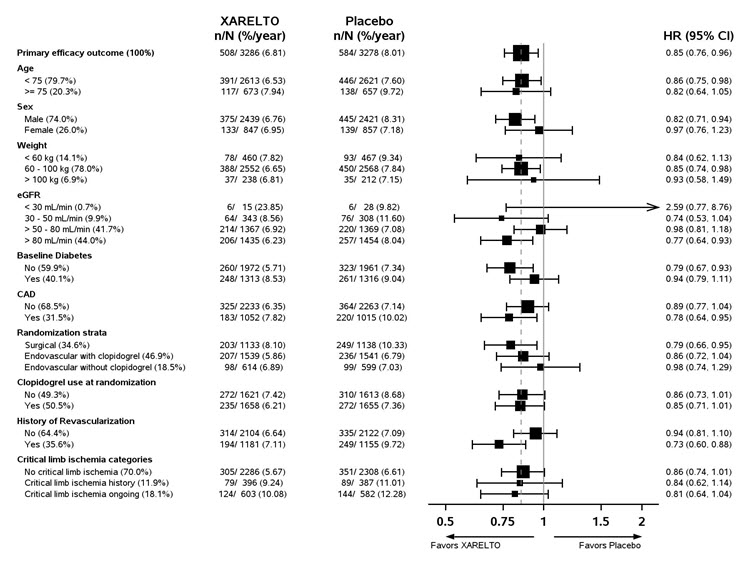
평균 연령은 67세였으며, 대상 모집단의 20%가 ≥75세였습니다. 포함된 환자 중 35%는 수술적 재혈관화술을 받았고, 47%는 클로피도그렐을 사용한 혈관 내 재혈관화술을 받았으며, 18%는 클로피도그렐을 사용하지 않은 혈관 내 재혈관화술을 받았습니다. 추적 관찰 기간 중앙값은 30.8개월이었습니다.
XARELTO 2.5mg을 1일 2회 투여한 경우는 위약을 투여한 경우보다 심근경색, 허혈성 뇌졸중, 심혈관 사망, 급성 사지 허혈(ALI), 혈관 기원의 주요 절단의 복합적 종말점 발생률을 줄이는 데 우수했습니다. 주요 효능 결과 및 그 구성 요소는 표 27에 나와 있습니다. 주요 효능 결과에 대한 Kaplan-Meier 플롯은 그림 11에 나와 있습니다. 2차 효능 결과는 사전에 지정된 계층적 순서로 우수성을 검증했으며, 7개 종말점 중 처음 5개 종말점은 리바록사반 치료군에서 유의하게 감소했습니다(
참조). 10,000 환자-년의 치료 기간 동안 위약과 비교하여 XARELTO는 주요 결과 사건이 181건 적고 TIMI 주요 출혈 사건이 29건 더 많이 발생할 것으로 예상되어 유익성과 위험성의 균형이 유리하게 나타났습니다.
|
| 그림 11: VOYAGER에서 주요 효능 결과(심근경색, 허혈성 뇌졸중, 심혈관 사망, 급성 사지 허혈, 혈관 기원의 주요 절단)가 처음 발생할 때까지의 시간 |
|
|
그림 12는 주요 하위 집단에서 주요 효능 결과의 위험을 보여줍니다. 하위 집단 분석은 많은 수의 분석에서 우연의 결과가 나타날 수 있으므로 주의 깊게 해석해야 합니다. 주요 효능 종말점은 일반적으로 하위 집단에서 동질적인 결과를 보여줍니다.
표 27은 VOYAGER의 사전 지정된 종점에 대한 유효성 사건 발생률과 COMPASS PAD 모집단의 유사한 종점을 보여줍니다.
| VOYAGER | COMPASS PAD | |||||
|---|---|---|---|---|---|---|
| XARELTO
N=3286 |
위약
N=3278 |
위험 비율
(95% CI) * |
XARELTO
N=2492 |
위약
N=2504 |
위험 비율
(95% CI) |
|
| 결과 구성 요소 | 사건 발생률
(%/년) |
사건 발생률
(%/년) |
||||
| COMPASS PAD의 유효성 종점은 적용 가능한 경우 VOYAGER의 사전 지정된 종점에 따라 분석되었습니다. | ||||||
| ALI=급성 사지 허혈, CHD=관상 동맥 질환; CI=신뢰 구간, CV=심혈관; MI=심근 경색, VTE=정맥 혈전색전증. | ||||||
|
||||||
| 5가지 구성 요소 결과(주요 혈전 색전성 혈관 사건) | 6.8 | 8.0 | 0.85 (0.76, 0.96)
p=0.0085 |
3.4 | 4.8 | 0.71 (0.57, 0.87) |
| MI | 1.7 | 1.9 | 0.88 (0.70, 1.12) | 1.1 | 1.5 | 0.76 (0.53, 1.09) |
| 허혈성 뇌졸중 | 0.9 | 1.0 | 0.87 (0.63, 1.19) | 0.5 | 0.9 | 0.55 (0.33, 0.93) |
| CV 사망 | 2.5 | 2.2 | 1.14 (0.93, 1.40) | 1.4 | 1.7 | 0.82 (0.59, 1.14) |
| ALI | 2.0 | 3.0 | 0.67 (0.55, 0.82) | 0.4 | 0.8 | 0.56 (0.32, 0.99) |
| 혈관 원인에 의한 주요 절단 | 1.3 | 1.5 | 0.89 (0.68, 1.16) | 0.2 | 0.6 | 0.40 (0.20, 0.79) |
| VOYAGER 2차 유효성 결과 | ||||||
| MI, 허혈성 뇌졸중, 관상동맥 질환 사망,
ß ALI 및 혈관 원인으로 인한 주요 절단 |
5.8 | 7.3 | 0.80 (0.71, 0.91)
p=0.0008 |
2.8 | 4.2 | 0.66 (0.53, 0.83) |
| 재발성 사지 허혈에 대한 계획되지 않은 지표 사지 재혈관화 | 8.4 | 9.5 | 0.88 (0.79, 0.99)
p=0.028 |
N/A | N/A | N/A |
| 혈전성 성격의 관상 동맥 또는 말초 원인으로 인한 입원 | 3.5 | 4.8 | 0.72 (0.62, 0.85)
p<0.0001 |
1.7 | 2.9 | 0.58 (0.44, 0.77) |
| MI, 허혈성 뇌졸중, 모든 원인 사망, ALI 및 혈관 원인으로 인한 주요 절단 | 8.2 | 9.3 | 0.89 (0.79, 0.99)
p=0.029 |
4.8 | 6.0 | 0.80 (0.67, 0.96) |
| MI, 모든 원인 뇌졸중, 심혈관 사망, ALI 및 혈관 원인으로 인한 주요 절단 | 6.9 | 8.1 | 0.86 (0.76, 0.96)
p=0.010 |
3.4 | 4.9 | 0.70 (0.57, 0.86) |
| 모든 원인 사망 | 4.0 | 3.7 | 1.08 (0.92, 1.27) | 2.8 | 3.1 | 0.91 (0.72, 1.16) |
| VTE 사건 | 0.3 | 0.5 | 0.61 (0.37, 1.00) | 0.2 | 0.3 | 0.67 (0.30, 1.49) |
14.8 소아 환자에서 정맥혈전색전증 치료 및 재발 위험 감소
정맥혈전색전증(VTE) 치료 및 재발 위험 감소를 위한 XARELTO는 EINSTEIN Junior 3상 연구[NCT02234843]에서 평가되었습니다. 이 연구는 출생부터 18세 미만의 확진된 VTE 소아 환자 500명을 대상으로 다기관, 공개, 활성 대조, 무작위 배정 연구였습니다. 12세에서 18세 미만의 어린이 276명, 6세에서 12세 미만의 어린이 101명, 2세에서 6세 미만의 어린이 69명, 2세 미만의 어린이 54명이 있었습니다. 출생 시 재태 기간이 37주 미만이거나, 경구 섭취가 10일 미만이거나, 체중이 2.6kg 미만인 경우 6개월 미만의 환자는 등록에서 제외되었습니다.
지표 VTE는 중심 정맥 카테터 관련 VTE(CVC-VTE), 뇌정맥 및 정맥동 혈전증(CVST), 그리고 DVT 및 PE를 포함한 기타 모든 VTE(비-CVC-VTE)로 분류되었습니다.
환자는 최소 5일 동안 치료 용량의 비분획 헤파린(UFH), 저분자량 헤파린(LMWH) 또는 폰다파리눅스로 초기 치료를 받았으며, 3개월의 주요 연구 치료 기간 동안 XARELTO의 체중 조정 용량(성인의 20mg 일일 용량과 일치하는 노출) 또는 비교군(UFH, LMWH, 폰다파리눅스 또는 VKA)을 2:1로 무작위 배정 받았습니다(CVC-VTE가 있는 2세 미만의 어린이는 1개월). 기준선과 주요 연구 치료 종료 시 진단 영상 검사를 실시했습니다. 임상적으로 필요한 경우 치료는 최대 12개월까지 연장되었습니다(CVC-VTE가 있는 2세 미만의 어린이는 최대 3개월까지).
표 28은 1차 및 2차 유효성 결과를 보여줍니다.
| 사건 | XARELTO
* n (%) (95% CI) |
비교군
‡ n (%) (95% CI) |
XARELTO 대 비교군
위험 차이 (95% CI) |
XARELTO 대 비교군
위험 비 (95% CI) |
|---|---|---|---|---|
| 1차 유효성 결과:
증상성 재발 VTE |
4 (1.2)
(0.4%, 3.0%) |
5 (3.0)
(1.2%, 6.6%) |
-1.8%
(-6.0%, 0.6%) |
0.40
(0.11, 1.41) |
| 2차 유효성 결과:
증상성 재발 VTE 또는 반복 영상에서의 무증상 악화 |
5 (1.5)
(0.6%, 3.4%) |
6 (3.6)
(1.6%, 7.6%) |
-2.1%
(-6.5%, 0.6%) |
|
반복 영상에서 재발성 VTE 없이 혈전이 완전히 해소된 경우 XARELTO 그룹에서는 335명의 어린이 중 128명(38.2%, 95% CI 33.0%, 43.5%), 비교 그룹에서는 165명의 어린이 중 43명(26.1%, 95% CI 19.8%, 33.0%)에서 나타났습니다. XARELTO 그룹에서는 335명의 어린이 중 4명(1.2%, 95% CI 0.4%, 3.0%), 비교 그룹에서는 165명의 어린이 중 7명(4.2%, 95% CI 2.0%, 8.4%)에서 증상이 있는 재발성 VTE 또는 주요 출혈 사건이 발생했습니다.
14.9 Fontan 수술 후 선천성 심장 질환이 있는 소아 환자의 혈전증 예방
UNIVERSE 3상 연구 [NCT02846532]에서 Fontan 수술을 받은 선천성 심장 질환이 있는 소아 환자의 혈전증 예방에 대한 XARELTO의 효능과 안전성을 평가했습니다. UNIVERSE는 XARELTO의 단일 및 다중 투여 약동학적 특성을 평가하기 위해 설계된 전향적, 개방표지, 활성 대조군, 다기관, 2부 연구였습니다(A부). 또한, Fontan 수술을 받은 단일 심실 생리 소아(2~8세)에서 아스피린과 비교하여 12개월 동안 혈전증 예방에 사용했을 때 XARELTO의 안전성과 효능을 평가했습니다(B부). B부의 환자는 체중 조정된 XARELTO 용량(성인의 1일 10mg 용량과 일치하는 노출) 또는 아스피린(약 5mg/kg)을 받도록 2:1로 무작위 배정되었습니다. eGFR <30 ml/min/1.73 m
2인 환자는 제외되었습니다.
A부에서 Fontan 수술과 XARELTO 첫 투여 사이의 중간 시간은 4일(범위: 2~61일)이었고, B부에서는 34일(범위: 2~124일)이었습니다. 반면, 아스피린 투여 시작까지의 중간 시간은 24일(범위 2~117일)이었습니다.
표 29는 주요 효능 결과를 보여줍니다.
| A부 | B부 | |||
|---|---|---|---|---|
| 사건 | XARELTO
N=12 n (%) (95% CI) |
XARELTO
§ n (%) (95% CI) |
아스피린
§ n (%) (95% CI) |
XARELTO vs. 아스피린
위험 차이 (95% CI) |
| 주요 효능 결과:
혈전증 사건 |
1 (8.3)
(0.4%, 34.9%) |
1 (1.6)
(0.1%, 7.8%) |
3 (8.8)
(2.4%, 22.2%) |
-7.3%
(-21.7%, 1.1%) |
| 허혈성 뇌졸중 | 0
(0.0%, 23.6%) |
0
(0.0%, 5.6%) |
1 (2.9)
0.2%, 15.1%) |
-2.9%
(-16.2%, 2.9%) |
| 폐색전증 | 0
(0.0%, 23.6%) |
1 (1.6)
(0.1%, 7.8%) |
0
(0.0%, 9.0%) |
1.6%
(-9.9%, 8.4%) |
| 정맥 혈전증 | 1 (8.3)
(0.4%, 34.9%) |
0
(0.0%, 5.6%) |
2 (5.9)
(1.1%, 18.8%) |
-5.9%
(-20.6%, -0.1%) |
16 제공/보관 및 취급 방법
XARELTO
® (리바록사반) 정제는 아래에 나열된 강도와 포장으로 제공됩니다.
- 2.5mg 정제는 둥글고 밝은 노란색이며, 한쪽에는 아래쪽을 향하는 삼각형 위에 “2.5”가 표시되어 있고 다른 쪽에는 “Xa”가 표시된 필름 코팅 정제입니다. 정제는 아래에 나열된 포장으로 제공됩니다.
NDC 50458-577-60 정제 60개가 들어 있는 병 NDC 50458-577-18 정제 180개가 들어 있는 병 NDC 50458-577-10 정제 100개가 들어 있는 블리스터 포장(정제 10개가 들어 있는 블리스터 카드 10개) - 10mg 정제는 둥글고 밝은 빨간색이며, 한쪽에는 아래쪽을 향하는 삼각형 위에 “10”이 표시되어 있고 다른 쪽에는 “Xa”가 표시된 양쪽 볼록 필름 코팅 정제입니다. 정제는 아래에 나열된 포장으로 제공됩니다.
NDC 50458-580-30 정제 30개가 들어 있는 병 NDC 50458-580-90 정제 90개가 들어 있는 병 NDC 50458-580-10 정제 100개가 들어 있는 블리스터 포장(정제 10개가 들어 있는 블리스터 카드 10개) - 15mg 정제는 둥글고 빨간색이며, 한쪽에는 아래쪽을 향하는 삼각형 위에 “15”가 표시되어 있고 다른 쪽에는 “Xa”가 표시된 양쪽 볼록 필름 코팅 정제입니다. 정제는 아래에 나열된 포장으로 제공됩니다.
NDC 50458-578-30 정제 30개가 들어 있는 병 NDC 50458-578-90 정제 90개가 들어 있는 병 NDC 50458-578-10 정제 100개가 들어 있는 블리스터 포장(정제 10개가 들어 있는 블리스터 카드 10개) - 20mg 정제는 삼각형 모양이며, 한쪽에는 아래쪽을 향하는 삼각형 위에 “20”이 표시되어 있고 다른 쪽에는 “Xa”가 표시된 진한 빨간색 필름 코팅 정제입니다. 정제는 아래에 나열된 포장으로 제공됩니다.
NDC 50458-579-30 정제 30개가 들어 있는 병 NDC 50458-579-90 정제 90개가 들어 있는 병 NDC 50458-579-89 정제 1000개가 들어 있는 대용량 병 NDC 50458-579-10 정제 100개가 들어 있는 블리스터 포장(정제 10개가 들어 있는 블리스터 카드 10개) - 심부 정맥 혈전증 치료 및 폐색전증 치료를 위한 스타터 팩:
NDC 50458-584-51 30일 스타터 블리스터 팩(정제 51개: 15mg 정제 42개와 20mg 정제 9개)
XARELTO
® (리바록사반) 경구 현탁액은 아래에 나열된 강도와 포장으로 제공됩니다.
| NDC 50458-575-01 | 150mL의 정제수로 재구성한 후, 현탁액 1mL에 리바록사반 1mg이 함유된 호박색 유리병에 리바록사반 155mg이 들어 있는 흰색에서 벗어난 흰색 과립으로 제공됩니다. 경구 투여용 주사기 2개가 함께 제공됩니다. |
병에 적힌 “폐기 날짜” 이후에는 재구성된 현탁액을 폐기하십시오.
정제, 과립 및 재구성된 현탁액 보관:
20°C~25°C(68°F~77°F)의 실온에 보관하십시오. 15°C~30°C(59°F~86°F)의 온도 편차는 허용됩니다. [USP 제어 실온 참조].
과립이나 재구성된 현탁액을 냉동하지 마십시오.
어린이의 손이 닿지 않는 곳에 보관하십시오.
17 환자 상담 정보
정제의 경우, 환자 및/또는 간병인에게 FDA 승인 환자 라벨(복약 안내서)을 읽도록 권고하십시오.
현탁액의 경우, 환자 및/또는 간병인에게 FDA 승인 환자 라벨(복약 안내서 및 사용 설명서)을 읽도록 권고하십시오.
환자 사용 지침
- 환자에게 XARELTO를 지시대로만 복용하도록 권고하십시오.
- 환자에게 담당 의료 전문가와 먼저 상의하지 않고 XARELTO 복용을 중단하지 않도록 상기시키십시오.
성인
- 심방세동 환자에게 저녁 식사와 함께 XARELTO를 1일 1회 복용하도록 권고하십시오.
- DVT 및/또는 PE의 초기 치료를 받는 환자에게 매일 거의 같은 시간에 음식과 함께 XARELTO 15mg 또는 20mg 정제를 복용하도록 권고하십시오.
[
용법 및 용량 (2.1) 참조]
.
- 최소 6개월의 초기 치료 후 재발성 DVT 및/또는 PE의 위험이 지속되는 환자에게 음식과 함께 또는 음식 없이 XARELTO 10mg을 1일 1회 복용하도록 권고하십시오.
[
용법 및 용량 (2.1) 참조].
- 정제를 통째로 삼킬 수 없는 환자에게 XARELTO를 부수어 소량의 애플소스와 섞은 후 음식과 함께 복용하도록 권고하십시오.
[
용법 및 용량 (2.6) 참조]
.
- NG 튜브 또는 위장 공급 튜브가 필요한 환자의 경우, 환자 또는 간병인에게 XARELTO 정제를 부수어 소량의 물과 섞은 후 튜브를 통해 투여하도록 지시하십시오.
[
용법 및 용량 (2.6) 참조]
.
- 복용량을 놓친 경우, 환자에게 복용 일정에 따라 전체 처방 정보의 지침에 따라 조치하도록 권고하십시오.
[
용법 및 용량 (2.5) 참조]
.
소아 환자
- 성인 간병인이 복용량을 투여해야 합니다. 간병인에게 원래 상자에 제공된 주사기를 사용하도록 권고하십시오.
- 간병인에게 복용량을 음식과 함께 복용해야 하는지 여부를 알려주십시오.
[
용법 및 용량 (2.2) 참조]
.
- 간병인에게 정제의 일부를 제공하기 위해 정제를 나누어서는 안 된다는 점을 알려주십시오.
[
용법 및 용량 (2.2) 참조]
.
- 아이가 복용량을 받은 후 30분 이내에 토하거나 뱉어낸 경우, 새로운 복용량을 투여해야 합니다. 그러나 아이가 복용량을 복용한 후 30분 이상 지나서 토하는 경우, 복용량을 다시 투여해서는 안 되며 다음 복용량을 예정대로 복용해야 합니다. 아이가 반복적으로 토하거나 뱉어내는 경우, 간병인은 즉시 아이의 의사에게 연락해야 합니다.
[
용법 및 용량 (2.2) 참조]
.
- 정제를 통째로 삼킬 수 없는 어린이의 경우, XARELTO 경구 현탁액을 사용할 수 있습니다.
- 복용량을 놓친 경우, 환자에게 복용 일정에 따라 전체 처방 정보의 지침에 따라 조치하도록 권고하십시오.
[
용법 및 용량 (2.5) 참조]
.
출혈 위험
- 환자에게 비정상적인 출혈이나 멍이 들면 의사에게 보고하도록 권고하십시오. XARELTO로 치료받는 동안 출혈이 멈추는 데 평소보다 오래 걸릴 수 있으며, 더 쉽게 멍이 들고/들거나 출혈이 발생할 수 있음을 환자에게 알리십시오.
[
경고 및 주의사항 (5.2) 참조]
.
- 환자가 척추 마취 또는 척추 천자를 받았고, 특히 NSAID 또는 혈소판 억제제를 병용하는 경우, 환자에게 등 통증, 따끔거림, 무감각(특히 하지), 근육 약화, 대변 또는 소변 실금과 같은 척추 또는 경막외 혈종의 징후와 증상을 주의하도록 권고하십시오. 이러한 증상이 나타나면 환자에게 즉시 의사에게 연락하도록 권고하십시오.
[
경고 참조]
.
병용 약물 및 허브 제품
환자에게 처방약, 일반 의약품 또는 허브 제품을 복용하고 있거나 복용할 계획이라면 의사와 치과 의사에게 알리도록 권고하여 의료 전문가가 잠재적인 상호 작용을 평가할 수 있도록 하십시오.
[
약물 상호 작용 (7) 참조]
.
임신 및 임신 관련 출혈
- 환자에게 XARELTO 치료 중 임신했거나 임신할 계획이라면 즉시 의사에게 알리도록 권고하십시오.
[
.
- XARELTO를 투여받는 임산부에게 출혈이나 실혈 증상이 나타나면 즉시 의사에게 보고하도록 권고하십시오.
[
경고 및 주의사항 (5.7) 참조]
.
SPL 미분류 섹션
제조사:
Janssen Pharmaceuticals, Inc.
Titusville, NJ 08560
라이선스:
Bayer HealthCare AG
51368 Leverkusen, Germany
특허 정보: www.janssenpatents.com
© 2011–2021 Janssen Pharmaceutical Companies
약물 안내문
| MEDICATION GUIDE | ||||
|---|---|---|---|---|
| XARELTO
® (zah-REL-toe) (rivaroxaban) tablets |
XARELTO
® (zah-REL-toe) (rivaroxaban) oral suspension |
|||
| This Medication Guide has been approved by the U.S. Food and Drug Administration | Revised: 02/2023 | |||
| XARELTO에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
XARELTO는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
||||
|
|
|||
| XARELTO는 인공 심장 판막이 있는 사람에게는 사용하지 않습니다.
XARELTO는 특히 삼중 항체 검사가 양성인 경우 항인지질 증후군(APS)이 있는 사람에게는 사용하지 않습니다. |
||||
| XARELTO는 무엇입니까? XARELTO는 다음과 같은 용도로 사용되는 처방약입니다.
XARELTO는 다음과 같은 용도로 저용량 아스피린과 함께 사용됩니다.
XARELTO는 다음과 같은 용도로 어린이에게 사용됩니다.
XARELTO는 다음과 같은 경우 6개월 미만의 어린이에게 연구되지 않았으며 권장되지 않습니다.
|
||||
귀하 또는 귀하의 자녀가 다음과 같은 경우 XARELTO를 복용하지 마십시오.
|
||||
XARELTO를 복용하기 전에 귀하 또는 귀하의 자녀가 다음과 같은 경우 모든 의학적 상태를 의사에게 알리십시오.
모든 의사와 치과 의사에게 귀하 또는 귀하의 자녀가 XARELTO를 복용하고 있음을 알리십시오. 수술, 의료 또는 치과 시술을 받기 전에 귀하를 위해 XARELTO를 처방한 의사와 상담해야 합니다. 귀하 또는 귀하의 자녀가 복용하는 모든 약물을 의사에게 알리십시오. 처방약과 일반 의약품, 비타민 및 허브 보충제를 포함합니다. 다른 약물 중 일부는 XARELTO의 작용 방식에 영향을 미쳐 부작용을 일으킬 수 있습니다. 특정 약물은 출혈 위험을 증가시킬 수 있습니다. ” XARELTO에 대해 가장 중요한 정보는 무엇입니까?” |
||||
|
|
|||
XARELTO는 어떻게 복용해야 합니까?
XARELTO를 복용하는 경우:
XARELTO를 복용하는 어린이:
|
||||
| XARELTO의 가능한 부작용은 무엇입니까?
XARELTO는 심각한 부작용을 유발할 수 있습니다.
성인에서 XARELTO의 가장 흔한 부작용은 출혈이었습니다. 어린이에서 XARELTO의 가장 흔한 부작용은 다음과 같습니다.
|
||||
|
|
|||
| 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1 800-FDA-1088. | ||||
XARELTO는 어떻게 보관해야 합니까?
XARELTO 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||||
| XARELTO의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 XARELTO를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 XARELTO를 주지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의사에게 의료 전문가를 위해 작성된 XARELTO에 대한 정보를 문의할 수 있습니다. |
||||
| XARELTO의 성분은 무엇입니까? 활성 성분: 리바록사반
비활성 성분 정제: XARELTO 2.5mg 정제의 독점적 필름 코팅 혼합물은 Opadry ® 연한 노란색이며 다음을 포함합니다. 황색 산화철, 히프로멜로스, 폴리에틸렌글리콜 3350 및 이산화티탄. XARELTO 10mg 정제의 독점적 필름 코팅 혼합물은 Opadry ® 분홍색이며 다음을 포함합니다. 적색 산화철, 히프로멜로스, 폴리에틸렌글리콜 3350 및 이산화티탄. XARELTO 15mg 정제의 독점적 필름 코팅 혼합물은 Opadry ® 적색이며 다음을 포함합니다. 적색 산화철, 히프로멜로스, 폴리에틸렌글리콜 3350 및 이산화티탄. XARELTO 20mg 정제의 독점적 필름 코팅 혼합물은 Opadry ® II 진한 적색이며 다음을 포함합니다. 적색 산화철, 폴리에틸렌글리콜 3350, 폴리비닐알코올(부분 가수분해), 활석 및 이산화티탄.
경구 현탁액의 비활성 성분: 제조: Janssen Pharmaceuticals, Inc. Titusville, NJ 08560 라이선스: Bayer HealthCare AG 51368 Leverkusen, Germany 특허 정보: www.janssenpatents.com © 2011–2021 Janssen Pharmaceutical Companies 상표는 각 소유자의 재산입니다. 자세한 내용은 www.XARELTO-US.com을 방문하거나 1-800-526-7736으로 전화하십시오. |
||||
자렐토® (리바록사반) 경구용 현탁액 사용 설명서
이 사용 설명서는 XARELTO 경구 현탁액의 복용량을 투여하는 방법에 대한 정보를 담고 있습니다.
XARELTO를 투여하기 전과 매번 리필할 때마다 이 사용 설명서를 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 설명서는 자녀의 질병 상태 또는 치료에 대해 의사와 상담하는 것을 대신할 수 없습니다.
중요 정보:
- XARELTO 현탁액은 경구용으로만 사용됩니다.
- 의사가 처방한 대로 정확하게 자녀에게 XARELTO를 투여하십시오. 성인 보호자가 복용량을 투여해야 합니다. 질문이 있는 경우 복용량 투여에 대한 자세한 내용은 의사 또는 약사에게 문의하십시오.
- XARELTO 경구 현탁액과 함께 제공된 경구 투약 주사기만 사용하십시오. 경구 투약 주사기가 없거나 분실 또는 손상된 경우 의사 또는 약사에게 문의하십시오.
 보관 정보
보관 정보
XARELTO 경구 현탁액을
68°F ~ 77°F (20°C ~ 25°C)의 실온에서 보관하십시오.
냉동하지 마십시오.
병을 똑바로 세우고 경구 투약 주사기를 원래 상자에 보관하십시오.
XARELTO 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
XARELTO 경구 투약 주사기:
XARELTO 병

| 1단계 | 준비 |
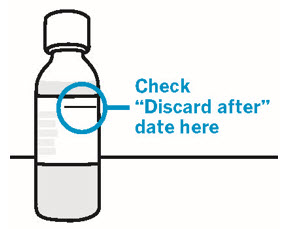
XARELTO 병에 있는 “폐기일”을 확인하십시오.
“폐기일”이 지난 경우
사용하지 말고 의사 또는 약사에게 문의하십시오.
손을 씻으십시오.
비누와 따뜻한 물로 손을 깨끗이 씻으십시오.
| 2단계 | XARELTO 준비 |
매번 사용하기 전에 병을 10초 동안 천천히 흔드십시오.
| 병을 너무 빨리 흔들지 마십시오. 거품이 발생할 수 있습니다.
거품이 발생하면 잘못된 복용량을 투여할 수 있습니다. |
XARELTO 경구 현탁액을 확인하십시오.
병 바닥에 덩어리 또는 과립이 있는 경우 병을
천천히 다시
10초 동안 흔드십시오.
| 3단계 | 처방된 복용량 확인 |
복용량 선을 찾으십시오.
주사기의 양쪽 면을 사용하여 복용량을 설정할 수 있습니다.
주사기의 mL 면을 사용하는 경우:
플런저 상단이 처방된 mL와 일치해야 합니다.
주사기의 색상 면을 사용하는 경우:
플런저 상단이
색상 띠의 하단에 있는 처방된 mL 복용량 선과 일치해야 합니다.
| XARELTO 경구 현탁액과 함께 제공된 경구 투약 주사기만 사용하십시오. |
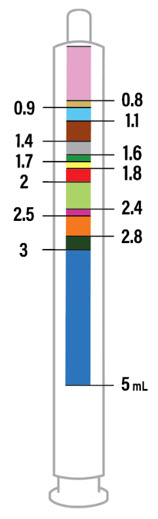
복용량이 5mL 이상인 경우.
동일한 주사기를 두 번 이상 사용해야 합니다. 복용량을 채우려면 4단계와 5단계를 반복합니다. 잘 모르겠으면 약사에게 문의하십시오.
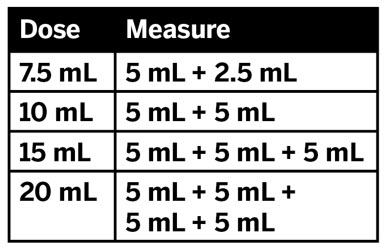
| 4단계 | 처방된 복용량 설정 |
플런저를 끝까지 밀어 넣어 공기를 제거합니다.
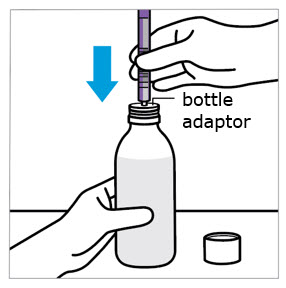
경구 투여용 주사기를 병 어댑터에 삽입합니다.
병에서 뚜껑을 돌려서 뗍니다.
병에서 병 어댑터를 제거하지 마십시오.
주사기 끝을 병 어댑터에 삽입합니다.
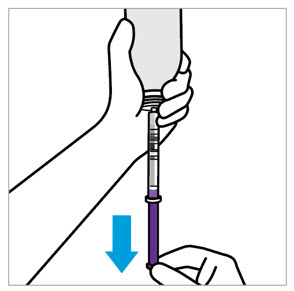
경구 투여용 주사기를 채웁니다.
표시된 것처럼 병을 거꾸로 뒤집습니다.
플런저를 당겨 경구 투여용 주사기를
처방된 복용량 선보다 약간 더 많이 채워 기포를 제거합니다.
 주의:
주의:
전체 복용량에 충분한 약이 있는지 확인하십시오. 부분 복용량을 복용하지 마십시오.
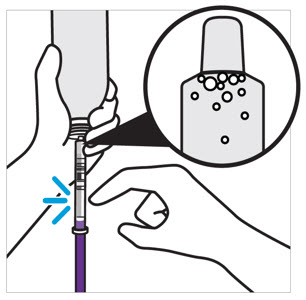
주사기를 가볍게 두드려 기포를 위로 이동시킵니다.
이렇게 하면 정확한 복용량을 설정하는 데 도움이 됩니다.
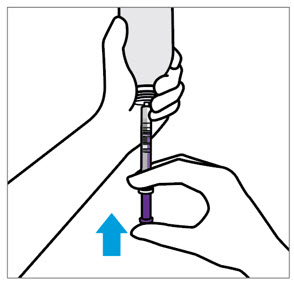
처방된 복용량으로 조정합니다.
주사기의 mL 쪽을 사용하는 경우: 플런저를 밀어 처방된 복용량 선에 맞춥니다.
주사기의 색상 쪽을 사용하는 경우: 플런저를 밀어
색상 띠의 아래쪽에 있는 처방된 mL 복용량 선에 맞춥니다.
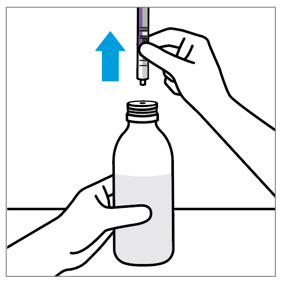
경구 투여용 주사기를 제거합니다.
병을 평평한 표면에 놓습니다.
병에서 경구 투여용 주사기를 제거합니다.
| 5단계 | 복용량 투여 |
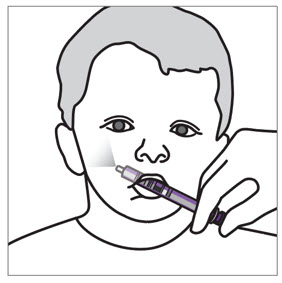
복용량을 투여합니다.
경구 투여용 주사기를
주사기 끝이 뺨을 향하도록 아이의 입에 부드럽게 넣고 플런저를 천천히 누릅니다.
이렇게 하면 아이가 자연스럽게 삼킬 수 있습니다.
아이가 전체 복용량을 삼켰는지 확인하십시오.
아이가 약을 반복적으로 토하거나 뱉어내는 경우 즉시 아이의 의사에게 연락하십시오.
| 복용량이
5mL 이상인 경우, 동일한 주사기를 두 번 이상 사용해야 합니다. 복용량을 채우려면 4단계와 5단계를 반복합니다. |
| 6단계 | 헹구고 보관 |
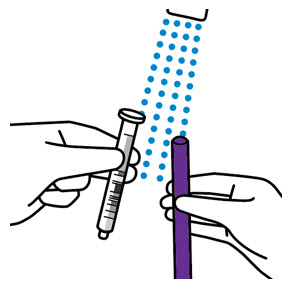
XARELTO 병을 닫고 경구 투여용 주사기를 헹굽니다.
경구 투여용 주사기를 수돗물로 헹구고 자연 건조시킵니다.
| 경구 투여용 주사기를 식기 세척기에 넣지 마십시오. |
XARELTO 병 및 주사기 폐기
- XARELTO 병을 가정용 쓰레기통에 버립니다.
- 새 XARELTO 병을 열면 사용한 경구 투여용 주사기를 버립니다.
- XARELTO 현탁액을 배수구(예: 싱크대, 변기, 샤워기 또는 욕조)에 붓지 마십시오.
- 병을 재활용하지 마십시오.
제조업체:
Janssen Pharmaceuticals, Inc.
Titusville, NJ 08560
라이선스 제공:
Bayer HealthCare AG
51368 Leverkusen, Germany
특허 정보: www.janssenpatents.com
© 2021 Janssen Pharmaceutical Companies
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
발행일: 2023년 2월
주요 표시면 – 2.5mg 정제 병 라벨
NDC 50458-577-60
Xarelto
®
(리바록사반)
정제 2.5 mg
동봉된
약물 안내서를 각 환자에게 제공하십시오.
각 정제는
리바록사반 2.5 mg을 함유하고 있습니다.
처방전에 의해서만 구입 가능
60 정
주요 표시 패널 – 10mg 정제 병 라벨
NDC 50458-580-30
Xarelto
®
(rivaroxaban)
Tablets 10 mg
각 환자에게 첨부된 복약 안내서를 제공하십시오.
Medication Guide to each patient.
각 정제는 10mg의 리바록사반을 함유하고 있습니다.
10 mg of rivaroxaban.
처방전 전용 (Rx only)
30정 (30 Tablets)
주요 표시면 – 15mg 정제 병 라벨
NDC 50458-578-30
Xarelto
®
(리바록사반)
정제 15 mg
동봉된
약물 안내서를 각 환자에게 제공하십시오.
각 정제는
리바록사반 15 mg을 함유하고 있습니다.
처방전에 의해서만 구입 가능
30 정
주 표시면 – 20mg 정제 병 라벨
NDC 50458-579-30
Xarelto
®
(리바록사반)
정제 20 mg
동봉된
약물 안내서를 각 환자에게 제공하십시오.
각 정제는
리바록사반 20 mg을 함유하고 있습니다.
처방전에 의해서만 구입 가능
30 정
주요 표시면 – 키트 상자
Xarelto
®
(rivaroxaban) Tablets
NDC 50458-584-51
Rx only
제품설명서 전체, 주의사항, 그리고 복약 안내서를 참조하십시오.
BOXED WARNINGS, and Medication Guide inside.
스타터 팩
심부정맥 혈전증 및 폐색전증 치료용
1-21일차
1정당 15mg, 1일 2회 복용
42정
22-30일차
1정당 20mg, 1일 1회 복용
9정
최초 30일 공급량
열려면 여기를 들어 올리십시오

주요 표시면 – 1mg/mL 병 포장
NDC 50458-575-01
Xarelto
®
(리바록사반)
경구용 현탁액
1 mg/mL
(재구성 시)
약사:
- 조제 전에
재구성해야 합니다.
- 보호자에게 적절한 사용법을 알려주십시오.
주의: 동봉된 약물 안내서를
각 환자에게 제공하십시오.
경구 투여 전용
처방전 의약품
janssen