의약품 제조업체: Octapharma Pharmazeutika Produktionsgesellschaft m.b.H. (Updated: 2010-08-20)
처방 정보 요약
Wilate, von Willebrand Factor/Coagulation Factor VIII Complex (Human), 용액용 분말, 정맥 주사 전용.
미국 최초 승인: 2009
적응증 및 사용
•
Wilate는 중증 von Willebrand 질환(VWD) 환자뿐만 아니라 데스모프레신 사용이 비효과적이거나 금기인 것으로 알려지거나 의심되는 경증 또는 중등도 VWD 환자의 자발적 및 외상 유발 출혈 에피소드 치료에 사용되는 von Willebrand Factor/Coagulation Factor VIII Complex (Human)입니다. (
1
)
•Wilate는 VWD 환자의 자발적 출혈 에피소드 예방 또는 수술 중 및 후 과도한 출혈 예방에 사용되지 않습니다.
•Wilate는 혈우병 A에 사용되지 않습니다.
•
투여량 및 투여 방법
투여 형태 및 강도
•
Wilate는 정맥 주사용 재구성을 위한 멸균된 동결 건조 분말로, 바이알당 다음과 같은 명목 강도로 제공됩니다. (
3
):
•5mL에 VWF:RCo 500 IU 및 FVIII 활성 500 IU
•10mL에 VWF:RCo 1000 IU 및 FVIII 활성 1000 IU
•
금기 사항
•
인간 혈장 유래 제품, 제제의 성분 또는 용기의 구성 요소에 대한 알려진 아나필락시스 또는 심각한 전신 반응을 동반한 과민 반응. (
4
)
•
경고 및 주의 사항
부작용
•
VWD에 대한 임상 연구에서 가장 흔한 부작용은 두드러기와 현기증(각각 2.2%)이었습니다. (
6.1
).
•
•의심되는 부작용을 보고하려면 Octapharma USA Inc.에 전화 # 866-766-4860 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
•
약물 상호 작용
•
알려진 바 없음 (
7
).
•
특정 인구 집단에서의 사용
•
임신: 인간 또는 동물 데이터 없음. 명확히 필요한 경우에만 사용하십시오. (
8.1
).
•
•환자 상담 정보는 17을 참조하십시오.
•개정: 2010년 8월
•
•
•_____________________________________________
•
•
환자 상담 정보는 17을 참조하십시오.
개정: 2010년 8월
목차
전문 정보: 내용*
1 적응증 및 사용법
2 용법 및 용량
2.1 폰 빌레브란트병에서의 용량
2.2 투약 일정
2.3 투여
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 혈전색전증 위험
5.3 억제제 형성
5.4 인간 혈장으로 인한 감염 위험
5.5 모니터링 및 실험실 검사
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 인구 집단에서의 사용
8.1 임신
8.2 분만 및 분만
8.3 수유부
8.4 소아 사용
8.5 노인 사용
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
14 임상 연구
15 참고 문헌
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
Wilate는 중증 폰 빌레브란트병(VWD) 환자뿐만 아니라 데스모프레신의 사용이 비효과적이거나 금기인 것으로 알려지거나 의심되는 경증 또는 중증 VWD 환자의 자발적 및 외상 유발 출혈 에피소드 치료에 사용되는 폰 빌레브란트 인자/응고 인자 VIII 복합체(인간)입니다.
VWD 환자에서 자발적 출혈을 예방하기 위한 Wilate의 예방적 투여에 대한 안전성 및 유효성을 평가하는 임상 시험은 수행되지 않았습니다.
Wilate는 VWD 환자에서 수술 중 및 수술 후 과도한 출혈 예방에 사용되지 않습니다.
Wilate는 혈우병 A에 사용되지 않습니다.
2 투여 및 관리
- 재구성 후 정맥 주사용
- 치료는 응고 장애 치료에 경험이 있는 의사의 감독하에 시작해야 합니다.
- Wilate 바이알 하나에는 리스토세틴 보조 인자 분석(VWF:RCo)으로 측정한 폰 빌레브란트 인자(VWF) 활성의 국제 단위(IU)와 크로모젠 기질 분석으로 측정한 응고 인자 VIII(FVIII) 활성의 표시된 양이 들어 있습니다.
- 투여되는 VWF:RCo 및 FVIII 활성의 단위 수는 IU로 표시되며, 이는 VWF 및 FVIII 제품에 대한 현재 WHO 표준과 관련이 있습니다. 혈장의 VWF:RCo 및 FVIII 활성은 백분율(정상 인간 혈장에 대한 상대적 비율) 또는 IU(혈장의 VWF:RCo 및 FVIII 활성에 대한 국제 표준에 대한 상대적 비율)로 표시됩니다.
2.1 폰 빌레브란트병에서의 용량
Wilate의 VWF:RCo와 FVIII 활성의 비율은 약 1:1입니다.
용량은 출혈의 정도와 위치에 따라 조정해야 합니다. 특히 위장관(GI) 출혈이 있는 VWD 3형 환자의 경우 더 높은 용량이 필요할 수 있습니다.
2.2 투약 일정
치료 요법에 대한 의사의 감독이 필요합니다. 중증 및 경증 출혈 치료에 대한 투약 가이드는
표 1
에 나와 있습니다.
생명을 위협하는 출혈의 경우 대체 요법을 신중하게 조절하는 것이 특히 중요합니다. FVIII 함유 VWF 제품을 사용하는 경우 치료를 계속하면 FVIII 활성이 과도하게 증가할 수 있음을 치료 의사는 알아야 합니다.[
1
]
표 1 경증 및 중증 출혈 치료를 위한 Wilate 투약 가이드
| 출혈 유형 | 적재 용량 (IU VWF:RCo /kg 체중) | 유지 용량 (IU VWF:RCo /kg 체중) | 치료 목표 |
|---|---|---|---|
|
경증 출혈 |
20-40 IU/kg |
12-24시간마다 20-30 IU/kg* |
VWF:RCo 및 FVIII 활성이 30% 이상 |
|
중증 출혈 |
40-60 IU/kg |
12-24시간마다 20-40 IU/kg* |
VWF:RCo 및 FVIII 활성이 50% 이상 |
2.3 투여
Wilate는 정맥 주입으로 투여합니다. Wilate는 동결 건조 분말을 희석액에 재구성하기 위한 Mix2Vial
TM
전달 장치, 10mL 주사기, 주입 세트 및 알코올 솜 2개와 함께 제공됩니다.
재구성 지침:
|
|
1) 밀봉된 바이알에 있는 분말과 희석액을 실온까지 데웁니다. 재구성하는 동안 이 온도를 유지해야 합니다. 물로 데우는 경우, 고무 마개(무라텍스) 또는 바이알 뚜껑에 물이 닿지 않도록 주의해야 합니다. 물로 데우는 온도는 +37°C(98°F)를 초과해서는 안 됩니다.
2) 농축액(Wilate) 바이알과 희석액 바이알의 뚜껑을 제거하고 알코올 솜으로 고무 마개를 닦습니다. |
|
|
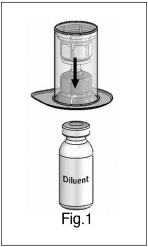
3) Mix2Vial™ 전달 세트의 외부 포장의 뚜껑을 벗깁니다. 무균성을 유지하기 위해 Mix2Vial™ 장치를 투명한 외부 포장에 그대로 둡니다. 희석액 바이알을 수평한 표면에 놓고 바이알을 단단히 잡습니다. Mix2Vial™을 외부 포장에 넣은 상태로 희석액 바이알 위로 뒤집습니다. Mix2Vial™의 파란색 플라스틱 캐뉼라를 희석액 바이알의 고무 마개를 통해 단단히 밀어 넣습니다(그림 1). 희석액 바이알을 잡고 있는 상태에서 Mix2Vial™이 희석액 바이알에 단단히 부착되도록 주의하면서 Mix2Vial™의 외부 포장을 조심스럽게 제거합니다(그림 2). |
|
|
4) 농축액(Wilate) 바이알을 수평한 표면에 단단히 잡고 있는 상태에서 Mix2Vial™이 부착된 희석액 바이알을 빠르게 뒤집어 Mix2Vial™의 투명한 플라스틱 캐뉼라 끝을 농축액(Wilate) 바이알의 마개를 통해 단단히 밀어 넣습니다(그림 3). 진공에 의해 희석액이 농축액(Wilate) 바이알로 들어갑니다. |
|
|
5) 두 바이알이 여전히 연결된 상태에서 제품 바이알을 부드럽게 흔들어 제품이 완전히 용해되어 투명한 용액이 되도록 합니다. Wilate 바이알의 내용물이 완전히 용해되면 Mix2Vial™의 투명 부분과 파란색 부분을 단단히 잡습니다. Mix2Vial™을 두 개의 별도 부분으로 분리하여 돌립니다(그림 4). 빈 희석액 바이알과 Mix2Vial™의 파란색 부분을 버립니다. |
- 분말은 주사 직전에만 재구성해야 합니다. Wilate는 방부제가 포함되어 있지 않으므로 재구성 후 즉시 사용해야 합니다.
- 주사제는 용액과 용기가 허용하는 경우 투여 전에 이물질과 변색 여부를 시각적으로 검사해야 합니다.
- 여과된 용액은 투명하거나 약간 불투명하며 무색 또는 약간 노란색입니다. 농축액이 완전히 용해되지 않거나 응집체가 형성된 경우, 제제를 사용해서는 안 됩니다.
주사 지침:
- Wilate 바이알을 여전히 위로 세운 상태에서 플라스틱 일회용 주사기를 Mix2Vial™(투명 플라스틱 부분)에 연결합니다. 시스템을 뒤집어 재구성된 Wilate를 주사기에 넣습니다.
- Wilate가 주사기에 옮겨지면 주사기 배럴을 단단히 잡고(주사기 플런저를 아래로 향하게 유지) Mix2Vial™을 주사기에서 분리합니다. Mix2Vial™(투명 플라스틱 부분)과 빈 Wilate 바이알을 버립니다.
- 주사할 부위를 알코올 솜으로 닦습니다.
- 적절한 주입 바늘을 주사기에 연결합니다.
- 용액을 분당 2-4mL의 속도로 천천히 정맥 주입합니다.
- 예방 조치로, 주사 전후 및 주사 중에 환자의 맥박을 측정해야 합니다. 맥박이 현저히 증가하면 주사 속도를 줄이거나 투여를 중단해야 합니다.
- 사용하지 않은 제품이나 폐기물은 현지 규정에 따라 폐기해야 합니다.
비호환성
Wilate는 다른 의약품과 혼합해서는 안 되며 동일한 주입 세트에서 다른 정맥 주입 제제와 동시에 투여해서는 안 됩니다.
3 제형 및 함량
윌레이트는 정맥 주사용으로 재구성되는 멸균 동결건조 분말이며, 다음과 같은 명목상의 강도로 각 바이알에 제공됩니다:
- 500 IU VWF:RCo 및 500 IU FVIII 활성이 5 mL
- 1000 IU VWF:RCo 및 1000 IU FVIII 활성이 10 mL
4 금기 사항
Wilate는 혈장 유래 제품, 제제의 성분 또는 용기의 구성 요소에 대한 알려진 아나필락시스 또는 심각한 전신 반응이 있는 환자에게 금기입니다. 성분의 전체 목록은
설명
(
11
)을 참조하십시오.
5 경고 및 주의사항
5.1 과민성
Wilate 사용 시 과민성 또는 알레르기 반응(혈관부종, 주입 부위의 작열감 및 따끔거림, 오한, 홍조, 전신 두드러기, 두통, 두드러기, 저혈압, 무기력증, 메스꺼움, 불안, 빈맥, 가슴 답답함, 따끔거림, 구토, 천명 포함)이 관찰되었으며, 경우에 따라 발열을 동반하거나 동반하지 않는 심각한 아나필락시스(쇼크 포함)로 진행될 수 있습니다.[
2
] Wilate를 투여받는 환자를 면밀히 모니터링하고 주입 기간 동안 증상이 나타나는지 주의 깊게 관찰하십시오.
두드러기, 전신 두드러기, 가슴 답답함, 천명, 저혈압, 아나필락시스 등 과민 반응의 초기 징후에 대해 환자에게 알리십시오. 알레르기 증상이 나타나면 즉시 투여를 중단하고 의사에게 연락하십시오. 억제제 항체는 아나필락시스 반응과 동시에 발생할 수 있으므로 아나필락시스 반응을 경험하는 환자는 억제제 존재 여부를 평가해야 합니다.[
2
]
5.2 혈전색전증 위험
FVIII 함유 VWF 제품을 사용할 때, 치료 의사는 지속적인 치료로 인해 FVIII 활성이 과도하게 증가할 수 있음을 알고 있어야 합니다.[
1
] Wilate를 투여받는 환자의 혈장 VWF:RCo 및 FVIII 활성 수치를 모니터링하여 혈전증 위험을 증가시킬 수 있는 지속적인 과도한 VWF 및 FVIII 활성 수치를 피하십시오.
5.3 억제제 형성
VWD 환자, 특히 유형
3
환자는 VWF에 대한 중화 항체(억제제)를 발생시킬 수 있습니다. 환자가 VWF(또는 FVIII)에 대한 억제제를 발생시키는 경우, 이 상태는 불충분한 임상 반응으로 나타납니다. 따라서 예상되는 VWF 활성 혈장 수치에 도달하지 못하거나 적절한 용량 또는 반복 투여로 출혈이 조절되지 않으면 적절한 분석을 수행하여 VWF 억제제가 있는지 확인하십시오. VWF에 대한 항체가 있는 환자의 경우 VWF가 효과적이지 않으며 이 단백질의 주입은 심각한 부작용을 초래할 수 있습니다. 이러한 환자에게는 다른 치료 옵션을 고려하십시오. 지혈 장애 환자 치료 경험이 있는 의사가 관리를 지시해야 합니다.[
3
] 이러한 모든 경우 출혈 장애 전문 센터에 연락하는 것이 좋습니다.
억제제 항체는 아나필락시스 반응과 동시에 발생할 수 있으므로 아나필락시스 반응을 경험하는 환자는 억제제 존재 여부를 평가해야 합니다.[
2
]
5.4 사람 혈장으로 인한 감염 위험
Wilate는 사람 혈장으로 만들어집니다. 이 제품은 사람 혈액으로 만들어졌기 때문에 바이러스와 같은 감염성 물질과 이론적으로 변종 크로이츠펠트-야콥병(vCJD) 인자를 전파할 위험이 있습니다. 또한 알려지지 않은 감염성 물질이 이러한 제품에 존재할 가능성도 있습니다. 이러한 제품이 바이러스를 전파할 위험은 혈장 기증자를 대상으로 특정 바이러스에 대한 사전 노출 여부를 선별하고, 특정 현재 바이러스 감염 여부를 검사하고, 제조 과정에서 특정 바이러스를 비활성화하고 제거함으로써 감소되었습니다. 이러한 조치에도 불구하고 이러한 제품은 여전히 잠재적으로 질병을 전파할 수 있습니다. [
4
]
Wilate를 환자에게 투여할 때마다 제품의 배치 번호를 기록하고, Wilate를 정기적으로/반복적으로 투여받는 환자에게 적절한 예방 접종(A형 및 B형 간염 바이러스에 대한)을 고려하십시오. 의사가 이 제품에 의해 전파되었을 가능성이 있는 것으로 생각되는 모든 감염은 의사 또는 기타 의료 제공자가 Octapharma USA, Inc.(전화번호: 1-866-766-4860)에 보고해야 합니다.
5.5 모니터링 및 실험실 검사
Wilate를 투여받는 환자의 혈장 VWF:RCo 및 FVIII 활성 수치를 모니터링하여 특히 임상적 또는 실험실적 위험 인자가 알려진 환자의 경우 혈전증 위험을 증가시킬 수 있는 지속적인 과도한 VWF 및 FVIII 활성 수치를 피하십시오.
VWF 및 FVIII 억제제 발생 여부를 모니터링하십시오. 예상되는 Wilate 용량으로 출혈이 조절되지 않으면 VWF 및/또는 FVIII 억제제가 있는지 확인하기 위해 분석을 수행하십시오. [
5
]
6 부작용
VWD 환자에서 Wilate 치료와 관련된 가장 흔한 부작용은 두드러기와 현기증이었습니다.
VWD 환자에서 Wilate 치료와 관련된 가장 심각한 부작용은 과민 반응이었습니다.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 부작용 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
예방적 사용, 필요에 따른 치료, 수술 및 약동학을 포함한 임상 연구에서 5676회에 걸쳐 Wilate를 투여받은 VWD 환자 92명이 있었습니다. 그들의 안전성 데이터는 가장 흔한 부작용이 두드러기와 현기증(각각 2명의 환자; 2.2%)이라는 것을 보여주었습니다. 또한 파르보바이러스 B19에 대한 항체에 대한 세로변환을 보인 환자 4명(4.4%)이 있었지만 질병의 임상적 징후는 동반되지 않았습니다. Wilate 제조에 사용되는 혈장의 미니풀 테스트가 시행된 이후로 세로변환은 보고되지 않았습니다.
6.2 시판 후 경험
다음 부작용은 Wilate의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 그 빈도를 신뢰할 수 있게 추정하거나 제품 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
VWD 치료를 받은 환자에서 보고된 시판 후 부작용에는 과민 반응, 호흡 곤란, 메스꺼움, 구토 및 기침이 포함됩니다.
7 약물 상호 작용
다른 의약품과의 상호 작용은 알려져 있지 않습니다.
8 특정 집단에서의 사용
8.1 임신
임신 카테고리 C. Wilate를 이용한 동물 생식 연구는 수행된 바 없습니다. 또한 임산부에게 Wilate를 투여했을 때 태아에게 해를 끼칠 수 있는지 또는 생식 능력에 영향을 미칠 수 있는지 여부는 알려져 있지 않습니다. Wilate는 명확하게 필요한 경우에만 임산부에게 투여해야 합니다.
8.4 소아에서의 사용
임상 연구에서 5~16세(8명 유형 3, 1명 유형 2, 2명 유형 1)의 VWD 소아 환자 11명에게 234회의 출혈 에피소드(BE)에 대해 Wilate를 투여했습니다. 이러한 연구에 따르면 이 집단에서 BE의 88%가 성공적으로 치료되었습니다(
표 7
). 투여된 용량이 성인 집단에서 사용된 용량과 유사했기 때문에 소아 환자의 경우 용량 조절이 필요하지 않습니다(
표 8
).
8.5 노인에서의 사용
Wilate 연구에 참여한 일부 환자는 65세 이상이었지만, 노인 집단에 대한 권장 사항을 뒷받침하는 하위 그룹 분석을 허용하기에는 환자 수가 충분하지 않았습니다.
11 설명
Wilate는 인간 혈장에서 유래한, 멸균된, 정제된, 이중 바이러스 불활성화된 폰 빌레브란트 인자/응고 인자 VIII 복합체 (인간)입니다. Wilate는 정맥 주사를 위한 재구성을 위한 동결 건조 분말로 제공됩니다.
Wilate는 바이알당 실제 VWF:RCo 및 FVIII 활성을 IU로 표시합니다. VWF 활성 (VWF:RCo)은 현재 “폰 빌레브란트 인자 농축물에 대한 WHO 국제 표준”을 참조하여 수동 응집 방법을 사용하여 결정됩니다. FVIII 활성은 현재 “인간 응고 인자 VIII 농축물에 대한 WHO 국제 표준”을 참조하여 크로모젠 기질 분석을 사용하여 결정됩니다. 분석 방법은 유럽 약전 (Ph.Eur.)에 따릅니다.
Wilate는 방부제를 포함하지 않습니다. 동결 건조 분말을 재구성하기 위한 희석액은 0.1% 폴리소르베이트 80이 포함된 주사용수입니다.
안정제로 알부민을 첨가하지 않습니다. Wilate의 결과적인 특정 활성은 총 단백질 mg당 ≥ 60 IU VWF:RCo 및 ≥ 60 IU FVIII 활성입니다.
Wilate의 명목상 조성은 다음과 같습니다.
| 성분 | 수량/ 5 mL 바이알 | 수량/ 10 mL 바이알 |
|---|---|---|
|
VWF:RCo |
500 IU |
1000 IU |
|
FVIII |
500 IU |
1000 IU |
|
총 단백질 |
≤ 7.5 mg |
≤ 15.0 mg |
|
글리신 |
50 mg |
100 mg |
|
수크로스 |
50 mg |
100 mg |
|
염화나트륨 |
117 mg |
234 mg |
|
시트르산나트륨 |
14.7 mg |
29.4 mg |
|
염화칼슘 |
0.8 mg |
1.5 mg |
|
주사용수 |
5 mL |
10 mL |
|
폴리소르베이트 80 |
1 mg/mL |
1 mg/mL |
Wilate는 미국 FDA 승인 혈장 기증 센터에서 수집된 대량의 인간 혈장에서 유래합니다. 모든 혈장 기증은 EU CPMP 및 FDA 지침의 요구 사항을 준수하여 바이러스 마커에 대해 검사됩니다. 또한 제조 풀에서 인간 파르보바이러스 B19 DNA의 역가 한계는 10
4
IU/mL를 초과하지 않도록 설정됩니다.
이 제품은 냉동 침전물에서 제조되며, 이는 완충액에 재구성되고 수산화알루미늄으로 처리된 다음 두 가지 다른 크로마토그래피 단계, 초여과 및 투석 여과, 멸균 여과를 거칩니다. 제조 공정에는 두 가지 바이러스 불활성화 단계가 포함됩니다. 즉, 트리-n-부틸 포스페이트 (TNBP)와 옥톡시놀-9로 구성된 유기 용매/세제 (S/D) 혼합물로 처리하고 최종 용기에 동결 건조 제품에 대한 말단 건열 (TDH) 처리를 수행합니다 [+100°C (212°F)에서 120분 동안 지정된 잔류 수분 수준 0.
7
– 1.6%]. 또한 Wilate 제조 중에 사용되는 이온 교환 크로마토그래피 단계는 일부 바이러스를 제거하기도 합니다 [
7
]. 이러한 단계의 평균 누적 바이러스 감소 요인은
표 2
에 요약되어 있습니다.
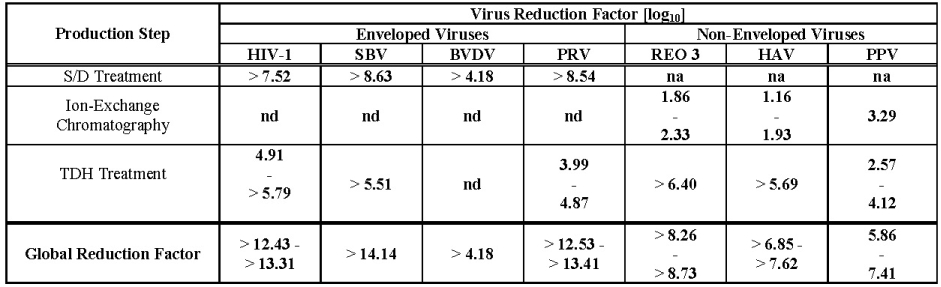
na: 해당 없음
nd: 수행되지 않음 (S/D 시약 존재)
HIV-1: 인간 면역 결핍 바이러스 – 1
SBV: 신드비스 바이러스
BVDV: 소 바이러스성 설사 바이러스
PRV: 가짜 광견병 바이러스
REO 3: 레오바이러스 유형 3
HAV: A형 간염 바이러스
PPV: 돼지 파르보바이러스
12 임상약리학
12.1 작용 기전
VWF와 FVIII은 인간 혈장의 정상 구성 성분입니다. VWF는 두 가지 주요 기능을 하는 다량체 단백질입니다. 이는 혈소판과 손상된 내피하 조직 사이의 결합을 매개하는 접착 분자입니다. 또한 FVIII의 운반 및 안정화에 관여하는 운반체 단백질이기도 합니다. VWD를 앓고 있는 환자는 VWF 결핍 또는 이상이 있습니다. 혈류에서 VWF 농도가 이렇게 감소하면 그에 따라 FVIII 활성이 낮아지고 혈소판 기능이 비정상적으로 되어 과도한 출혈이 발생합니다. [
8
]
Wilate의 VWF는 정상 인간 혈장에서 유래되었으며 내인성 VWF와 동일한 방식으로 작용할 것으로 예상됩니다. 따라서 VWF를 투여하면 다음 두 가지 수준에서 VWD 환자의 지혈 이상을 교정할 수 있습니다.
- VWF는 혈관 손상 부위에서 혈관 내피하에 대한 혈소판 접착을 재확립하여(혈관 내피하와 혈소판 막 모두에 결합하기 때문에) 출혈 시간을 단축함으로써 나타나는 것처럼 일차 지혈을 제공합니다. 이 효과는 즉시 나타납니다.
-
VWF는 VWD에서 관련된 FVIII 결핍을 교정합니다. 정맥 내로 투여된 VWF는 내인성 FVIII(환자에 의해 정상적으로 생성됨)과 결합하고, 이 인자를 안정화하여 빠르게 분해되는 것을 방지합니다. 이 작용은 약간 지연됩니다. 그러나 Wilate와 같은 FVIII 함유 VWF 제제를 투여하면 FVIII 활성 수치가 정상으로 빠르게 회복됩니다.[
8
]
12.3 약동학
미국 내 6개 시험 기관에서 Wilate와 비교 제품을 사용한 공개 라벨, 전향적, 무작화, 대조군, 이중 교차 2상 연구가 수행되었습니다. 이 연구에서 Wilate의 약동학(PK) 프로파일은 FVIII 활성, VWF:RCo, VWF:Ag 및 VWF:CB에 의해 결정되었습니다.
유전성 VWD 환자 22명[유형 1, n=6, 유형 2, n=9(유형 2A 6명, 유형 2B 1명, 유형 2M 2명), 유형 3, n=7] 각각에게 약 40IU의 VWF:RCo/kg BW를 함유한 Wilate를 정맥 내 일시 주사했습니다. 20명의 피험자가 프로토콜에 따라 연구를 완료했습니다. VWF:RCo 및 FVIII의 PK 파라미터는 각각
표 3
및
표 4
에 요약되어 있습니다.
표 3 VWF:RCo의 약동학 파라미터: 평균 ± SD(범위)
| 파라미터 | VWD 유형 I(n = 5) | VWD 유형 II(n = 9) | VWD 유형 III(n = 6) | 전체(n = 20) |
|---|---|---|---|---|
|
Cmax(IU/dL) |
74 ± 13 (62 – 91) |
77 ± 18 (40 – 100) |
79 ± 13 (65 – 102) |
76 ± 15 (40 – 102) |
|
AUC(0-inf) (IU*hr/dL) |
1633 ± 979 (984 – 3363) |
1172 ± 421 (571 – 1897) |
995 ± 292 (527 – 1306) |
1235 ± 637 (527 – 3363) |
|
반감기(시간) |
24.7 ± 17.9 (11.2 – 48.5 ) |
15.3 ± 6.3 (6.0 – 26.4) |
9.1± 2.6 (5.7 – 12.9 ) |
15.8 ± 11.0 (5.7 – 48.5) |
|
CL(mL/h/kg) |
3.1 ± 1.1 (1.2 – 4.1) |
4.1 ± 1.7 (2.0 – 7.1) |
4.2 ± 1.4 (3.0 – 6.6) |
3.9 ± 1.5 (1.2 – 7.1) |
|
Vss(mL/kg) |
81.7 ± 38.5 (15.3 – 74.2) |
76.6 ± 35.4 (45.3 – 158.8) |
49.4 ± 16.7 (29.7 – 67.1) |
69.7 ± 33.2 (29.7 – 158.8) |
|
MRT(시간) |
32.7 ± 25.8 (15.3 – 74.2) |
19.7 ± 5.6 (9.9 – 27.1) |
11.9 ± 2.9 (9.2 – 15.9) |
20.6 ± 14.8 (9.2 – 74.2) |
|
회복률 (%IU/kg) |
1.8 ± 0.2 (1.5 – 2.0) |
1.8 ± 0.5 (1.0 – 2.4) |
2.1 ± 0.3 (1.8 – 2.6) |
1.9 ± 0.4 (1.0 – 2.6) |
C
max
= 최고 농도, AUC = 곡선하면적, CL = 청소율, Vss = 정상 상태에서의 분포 용적, MRT = 평균 체류 시간
표 3
에 보고된 PK 파라미터는 수정된 Behring Coagulation System(BCS) 분석법을 사용하여 얻은 VWF:RCo 값을 기반으로 합니다. 수정된 BCS는 표준 BCS에 비해 검증된 낮은 변동성으로 인해 사용되었습니다. 측정된 농도(IU VWF:RCo/mL)는 일부 임상 실험실에서 사용되는 표준 BCS 분석법보다 수정된 BCS에서 더 높습니다. 이 수정된 BCS 방법으로 결정된 용량 조정 C
max
및 AUC는 표준 BCS 방법보다 약 1.5배 더 높습니다. 증분 회복률의 차이는 발견되지 않았습니다.
표 4 FVIII:C의 약동학적 파라미터: 평균 ± SD(범위) – 발색
| 파라미터 | VWD 유형 I (n = 5) | VWD 유형 II (n = 8*) | VWD 유형 III (n = 6) | 전체 (n = 19*) |
|---|---|---|---|---|
|
Cmax (IU/dL) |
117.1 ± 12.1 (103 – 135) |
147.2 ± 32.6 (102 – 206) |
120 ± 23 (91 – 148) |
112 ± 23 (59 – 148) |
|
AUC(0-inf) (IU*hr/dL) |
1187 ± 382 (523 – 1483) |
1778 ± 1430 (544 – 4821) |
2670 ± 854 (1874 – 3655) |
2290 ± 1045 (464 – 4424) |
|
반감기(시간) |
17.5 ± 4.9 (10.9 – 23.8) |
23.6 ± 8.3 (12.6 – 34.7) |
16.1 ± 3.1 (11.8 – 20.1) |
19.6 ± 6.9 (10.9 – 34.7) |
|
CL (mL/h/kg) |
4.4 ± 3.7 (2.5 – 11.0) |
2.5 ± 0.9 (1.2 – 3.5) |
2.0 ± 0.6 (1.4 – 2.8) |
2.9 ± 2.1 (1.2 – 11.0) |
|
Vss (mL/kg) |
95.0 ± 53.8 (57.1 – 190.0) |
79.5 ± 23.1 (52.8 – 116.2) |
44.2 ± 10.4 (31.8 – 57.1) |
72.4 ± 36.2 (31.8 – 190.0) |
|
MRT (시간) |
24.1 ± 5.5(17.2 – 31.5) |
35.1 ± 14.2 (17.5 – 61.6) |
23.0 ± 3.7 (18.0 – 27.7) |
28.4 ± 11.1 (17.2 – 61.6) |
|
회복률 (%IU/kg) |
1.9 ± 0.5 (1.1 – 2.5) |
2.2 ± 0.4 (1.6 – 2.8) |
2.5 ± 0.5 (2.0 – 3.0) |
2.2 ± 0.5 (1.1 – 3.0) |
C
max
= 최고 농도, AUC = 곡선하면적, CL = 청소율, Vss = 정상 상태에서의 분포 용적, MRT = 평균 체류 시간
Wilate의 약동학에 대한 연령 및 VWD 유형의 영향:
표본 크기가 작고(연령 또는 VWD 유형 하위 집합에서) PK 변동성이 높기 때문에 연령 또는 VWD 유형이 Wilate의 약동학에 영향을 미치는지 여부를 결론짓기 어렵습니다.
Wilate의 약동학에 대한 성별의 영향:
남성 8명과 여성 12명의 Wilate의 PK 데이터에 따르면 여성(4.35 ± 1.54mL/hr/kg)이 남성(3.16 ± 1.19mL/hr/kg)보다 VWF:RCo 청소율이 더 높은 것으로 나타났습니다. 이 발견의 임상적 중요성은 알려져 있지 않습니다.
14 임상 연구
VWD 환자의 출혈 조절에 대한 Wilate의 임상적 효능은 4건의 전향적 임상 연구에서 확인되었습니다. 여기에는 1068건의 출혈 에피소드(BEs) 치료가 포함되었습니다. 70명의 VWD 환자(그 중 37명은 3형)로부터 데이터를 얻었으며, BEs는
표 5
에 요약되어 있습니다. 치료된 BEs는 객관적인 기준 세트와 주관적인 4점 지혈 효능 척도(우수, 양호, 보통 및 없음)를 사용하여 효능을 분석했습니다. 이러한 객관적인 기준을 사용하여 효능을 평가할 때, 출혈 에피소드의 치료는 아래에 나열된 기준 중 어느 것도 충족되지 않은 경우에만 성공으로 분류되었습니다.
- 에피소드가 다른 VWF 함유 제품(전혈 제외)으로 추가 치료되었는지,
- 환자가 에피소드 동안 수혈을 받았는지,
- Wilate의 일일 복용량으로 초기 복용량보다 50%(≥ 50%) 이상 높은 복용량으로 추적 치료(1일 이상 치료한 출혈 에피소드의 경우),
-
심한 출혈(위장관 출혈 제외)의 경우 4일 이상(>
4일)의 치료 기간, -
중등도 출혈(위장관 출혈 제외)의 경우 3일 이상(>
3일)의 치료 기간, -
경미한 출혈(위장관 출혈 제외)의 경우 2일 이상(>
2일)의 치료 기간, - 출혈 에피소드의 마지막 효능 평가가 ‘보통’ 또는 ‘없음’이었는지.
임상 연구(PK 연구 제외)에서 Wilate를 투여받은 70명의 VWD 환자 중 45명은 BEs에 대한 필요에 따라 치료를 받았습니다. 위의 객관적인 기준을 사용하여 각 출혈 사건에 대한 해당 효능은 에피소드의 84%에서 성공적인 것으로 평가되었습니다. 이러한 BEs가 있는 45명의 환자에서 성공적으로 치료된 BEs의 93%가 VWD 3형 환자(n=25)에서 발생했습니다.
표 5 Wilate로 출혈 에피소드를 성공적으로 치료한 비율(n=45)
| 95% CI | ||||
|---|---|---|---|---|
|
에피소드* |
성공 |
성공률(%) |
하한 CL |
상한 CL |
|
1068 |
898 |
84.1 |
81.8 |
86.2 |
지역 출혈에 대한 972건의 성공적으로 치료된 “출혈 에피소드”(1423회 주입)에 대한 투약 정보는
표 6
에 요약되어 있습니다. 동시에 발생한 지역 출혈에 대한 성공/실패를 할당하기 위해 동일한 기간 동안 다른 부위에서 발생한 출혈은 별도의 BE로 계산됩니다. 따라서 이러한 “에피소드”의 수는
표 5
에 있는 출혈 에피소드 치료에 대한 Wilate의 성공/실패에 대한 전반적인 평가에서의 수와 다릅니다.
표 6 Wilate로 성공적으로 치료된 출혈 에피소드*에 투여된 용량(VWF:RCo IU/kg): 평균 ± SD(범위)(n=45)
| 위치 | 모든 용량 고려 | 초기 용량 | 후속 용량 | |||
|---|---|---|---|---|---|---|
|
|
주입 횟수 |
용량: 평균 ± SD(범위) |
주입 횟수 |
용량: 평균 ± SD(범위) |
주입 횟수 |
용량: 평균 ± SD(범위) |
|
관절 |
801 |
26 ± 12 (7 – 69) |
542 |
28 ± 13 (7 – 69) |
259 |
21 ± 10 (7 – 60) |
|
코피 |
132 |
24 ± 11 (8 – 78) |
91 |
25 ± 10 (13 – 78) |
41 |
22 ± 14 (8 – 77) |
|
위장관 |
125 |
40 ± 20 (9 – 76) |
64 |
43 ± 19 (9 – 76) |
61 |
36 ± 21 (9 – 76) |
|
구강 |
41 |
26 ± 14 (8 – 80) |
33 |
27 ± 14 (10 – 80) |
8 |
24 ± 18 (8 – 60) |
|
산부인과 |
87 |
27 ± 14 (9 – 77) |
52 |
28 ± 17 (12 – 77) |
35 |
26 ± 9 (9 – 52) |
|
기타** |
237 |
23 ± 12 (10 – 95) |
189 |
24 ± 12 (12 – 95) |
48 |
20 ± 13 (10 – 95) |
**“기타”에는 주로 근육 출혈, 혈뇨, 멍, 혈종 및 기타 다양한 출혈 부위가 포함됩니다.**
대부분의 BEs는 1-3일 동안 치료되었습니다. 위장관 출혈 환자의 경우 출혈을 조절하기 위한 제품 사용 기간이 훨씬 더 길 수 있습니다(최대 7일).
소아 환자(≤16세)의 경우 치료된 BEs 수와 해당 객관적 효능 평가에 대한 요약이
표 7
에 나와 있습니다.
표 7 소아 인구(5~16세)(n=11)의 출혈 에피소드에서의 효능 – Wilate로 출혈 에피소드를 성공적으로 치료한 비율
| 95% CI | ||||
|---|---|---|---|---|
|
에피소드* |
성공 |
성공률 |
하한 CL |
상한 CL |
|
234 |
205 |
87.6 |
82.7 |
91.5 |
성공적으로 치료된 211건의 출혈 에피소드(289회 주입)에 대한 투약 정보는
표 8
에 요약되어 있습니다. 여러 출혈 부위는 별도의 에피소드로 계산됩니다.
표 8 소아 인구(5~16세)(n=11)에서 Wilate로 성공적으로 치료된 출혈 에피소드*에서 투여된 용량(VWF:RCo IU/kg): 평균 ± SD(범위)
| 위치 | 모든 용량 고려 | 초기 용량 | 후속 용량 | |||
|---|---|---|---|---|---|---|
|
|
주입 횟수 |
용량: 평균 ± SD(범위) |
주입 횟수 |
용량: 평균 ± SD(범위) |
주입 횟수 |
용량: 평균 ± SD(범위) |
|
관절 |
158 |
30 ± 13 (12 – 69) |
117 |
32 ± 13 (14 – 69) |
41 |
25 ± 9 (12 – 62) |
|
코피 |
30 |
27 ± 14 (12 – 77) |
25 |
25 ± 10 (14 – 52) |
5 |
37 ± 25 (12 – 77) |
|
위장관 |
1 |
22 (N/A) |
1 |
22 (N/A) |
0 |
N/A |
|
구강 |
23 |
25 ± 8 (16 – 52) |
21 |
24 ± 8 (16 – 52) |
2 |
25 ± 13 (16 – 35) |
|
부인과 |
58 |
27 ± 13 (12 – 69) |
33 |
27 ± 16 (12 – 69) |
25 |
26 ± 8 (12 – 52) |
|
기타* |
19 |
25 ± 7 (16 – 37) |
14 |
27 ± 7 (19 – 37) |
5 |
19 ± 4 (16 – 26) |
**“기타”에는 주로 근육 출혈, 혈뇨, 멍, 혈종 및 기타 다양한 출혈 부위가 포함됩니다.**
15 참고 문헌
- Mannucci P.M.: Venous thromboembolism in von Willebrand disease. Thromb Haemost 2002;88:378-379
- Mollison.P.L., Engelfriet C.P., Contreras M.: Some unfavourable effects of transfusion; in Klein H.G., Anstee D.J. (eds): Mollison’s Blood Transfusion in Clinical Medicine. Blackwell Publishing, 2005, pp 666-700
- Mannucci P.M., Federici A.B.: Antibodies to von Willebrand factor in von Willebrand disease; in Aledort L.M. (ed): Inhibitors to Coagulation Factors. New York, Plenum Press, 1995, pp 87-92
- Y. Kasper, C.K., Kipnis, S.A. Hepatitis and Clotting Factor Concentrates. JAMA1972; 221:510
- X. Biggs, R. Jaundice and Antibodies Directed Against Factors VIII and IX in Patients Treated for Haemophilia or Christmas Disease in the United Kingdom. Br J Haematol 1974; 26:313-329
- Azzi A., Morfini M., Mannucci P.M.: The transfusion-associated transmission of parvovirus B19. Transfus.Med.Rev. 1999;13:194-204
- Stadler M., et al. Characterisation of a novel high-purity, double virus inactivated von Willebrand Factor and Factor VIII concentrate (Wilate). DOI: 10.1016/j.biologicals. Biologicals 2006, 34:281-288 1-8.
- Mannucci P.M.: Treatment of von Willebrand’s disease. New England Journal of Medicine 2004;351:683-694
16 공급/보관 및 취급 방법
| NDC 번호 | 크기 | 단백질 함량 |
|---|---|---|
|
67467-182-01 67467-182-02 |
5mL 중 VWF:RCo 500 IU 및 FVIII 500 IU 활성 10mL 중 VWF:RCo 1000 IU 및 FVIII 1000 IU 활성 |
≤ 7.5 mg ≤ 15.0 mg |
- Wilate는 단회용 분말 바이알과 희석제(0.1% 폴리소르베이트 80 함유 주사용수) 바이알, Mix2VialTM 이송 장치, 10mL 주사기, 주입 세트 및 알코올 솜 2개가 함께 포장되어 제공됩니다.
- Wilate 바이알 각각에는 수동 응집 방법으로 측정한 VWF:RCo 활성의 IU 표시량과 발색 기질 분석법으로 측정한 FVIII 활성의 IU가 포함되어 있습니다.
- Wilate 포장에 사용된 구성품에는 라텍스가 포함되어 있지 않습니다.
- Wilate는 제조일로부터 최대 36개월 동안 +2°C~+8°C(36°F~46°F)에서 빛을 차단하여 보관하십시오. 이 기간 동안 Wilate는 최대 6개월 동안 실온(최대 +25°C 또는 77°F)에서 보관할 수 있습니다. 실온 보관 시작일은 제품 상자에 명확하게 기록해야 합니다. 실온에서 보관한 후에는 냉장고에 다시 보관할 수 없습니다. 유효 기간은 실온 보관 후 또는 제품 바이알에 표시된 유효 기간 중 더 빠른 날짜가 만료됩니다. 냉동하지 마십시오.
- 유효 기간이 지난 제품은 사용하지 마십시오.
- 빛으로부터 보호하기 위해 원래 용기에 보관하십시오.
- Wilate 분말은 주사 직전에만 희석하십시오. 희석 후 즉시 용액을 사용하십시오. 희석된 용액은 한 번만 사용하고 남은 용액은 버리십시오.
17 환자 상담 정보
-
환자에게 두드러기, 전신 두드러기, 가슴 답답함, 천명, 저혈압 및 아나필락시스를 포함한 과민 반응의 초기 증상을 알려주십시오. 알레르기 증상이 나타나면 환자는 투여를 즉시 중단하고 의사에게 연락해야 합니다. [
경고 및 주의 사항
(
5.1
)]을 참조하십시오. -
환자에게 Wilate로 여러 번 치료를 받으면 혈전색전증 위험이 증가할 수 있으므로 혈장 VWF:RCo 및 FVIII 활성도를 자주 모니터링해야 함을 알려주십시오. [
경고 및 주의 사항
(
5.2
)]을 참조하십시오. -
환자에게 VWF에 대한 억제제가 발생할 가능성이 있으며, 이로 인해 임상 반응이 불충분할 수 있음을 알려주십시오. 따라서 예상되는 VWF 활성 혈장 수준에 도달하지 않거나 적절한 용량 또는 반복 투여로 출혈이 조절되지 않으면 치료 의사에게 연락하십시오. [
2
] [
경고 및 주의 사항
(
5.3
)]을 참조하십시오. -
환자에게 기증자 및 혈장 선별 절차와 감염성 제제 불활성화 또는 제거 절차에도 불구하고 혈장 유래 제품으로 감염성 제제가 전파될 가능성을 완전히 배제할 수 없음을 알려주십시오. [
경고 및 주의 사항
(
5.4
)]을 참조하십시오.
제조사:
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
A-1100 Vienna, Austria
미국 라이선스 번호 1646
판매원:
Octapharma USA Inc.
121 River Street, 12th floor
Hoboken, NJ 07030
주요 표시 패널
주요 표시 패널 – 포장 라벨
폰 빌레브란트 인자/응고 인자 VIII 복합체 (인체 유래)
Octapharma Pharmazeutika Produktionsges.m.b.H
500IU/5mL
NDC 67467-182-01

1000IU/10mL
NDC 67467-182-02