의약품 제조업체: Pfizer Laboratories Div Pfizer Inc (Updated: 2025-01-01)
처방 정보 하이라이트
VYNDAQEL® (타파미디스 메글루민) 캡슐, 경구 투여용
미국 최초 승인: 2019
VYNDAMAX™ (타파미디스) 캡슐, 경구 투여용
미국 최초 승인: 2019
적응증 및 용법
VYNDAQEL 및 VYNDAMAX는 야생형 또는 유전성 트랜스티레틴 매개 아밀로이드증의 심근병증 치료에 사용되는 트랜스티레틴 안정화제로, 심혈관 사망률 및 심혈관 관련 입원을 감소시키는 데 사용됩니다. (1)
용법 및 용량
제형 및 강도
캡슐: 타파미디스 메글루민 20mg 및 타파미디스 61mg. (3)
금기
없음. (4)
유해 반응
의심되는 유해 반응을 보고하려면 Pfizer Inc.에 1-800-438-1985 또는 FDA에 1-800-FDA-1088로 연락하거나 www.fda.gov/medwatch를 방문하십시오.
환자에 대한 정보 및 FDA 승인 환자 라벨링은 17항을 참조하십시오.
개정: 2023년 10월
목차
전문 정보: 목차*
1. 적응증 및 용법
2. 용법 및 용량
2.1 권장 용량
2.2 투여 지침
3. 제형 및 강도
4. 금기
6. 이상반응
6.1 임상시험 경험
7. 약물 상호작용
7.1 BCRP 기질
8. 특정 환자군에서의 사용
8.1 임신
8.2 수유부
8.3 생식 가능 연령의 여성 및 남성
8.4 소아 사용
8.5 노인 사용
10. 과량투여
11. 일반적 특성
12. 임상약리
12.1 작용기전
12.2 약력학
12.3 약동학
13. 비임상 약리독성
13.1 발암성, 돌연변이원성, 생식능력 저하
14. 임상 연구
16. 포장단위/보관 및 취급
17. 환자 상담 정보
- *
- 전문 정보에서 생략된 부분은 목록에 포함되지 않습니다.
1. 적응증 및 용법
VYNDAQEL 및 VYNDAMAX는 성인의 야생형 또는 유전성 트랜스티레틴 매개 아밀로이드증(ATTR-CM) 심근병증 치료에 사용되어 심혈관 사망률 및 심혈관 관련 입원을 감소시키는 데 적응증이 있습니다.
2. 복용량 및 투여 방법
2.1 권장 용량
권장 용량은 VYNDAQEL 80mg (20mg 타파미디스 메글루민 캡슐 4정)을 1일 1회 경구 투여하거나 VYNDAMAX 61mg (61mg 타파미디스 캡슐 1정)을 1일 1회 경구 투여하는 것입니다.
VYNDAMAX와 VYNDAQEL은 mg 기준으로 상호 교환할 수 없습니다 [임상 약리 (12.3) 참조].
2.2 투여 지침
캡슐은 부수거나 자르지 말고 통째로 삼켜야 합니다.
복용량을 놓친 경우, 환자에게 기억나는 대로 복용하거나 놓친 복용량을 건너뛰고 다음 복용량을 정기적으로 예정된 시간에 복용하도록 지시합니다. 복용량을 두 배로 하지 마십시오.
3. 투여 형태 및 강도
VYNDAQEL은 다음과 같은 형태로 제공됩니다:
- •
- 타파미디스 메글루민 20mg: 노란색, 불투명, 장방형 캡슐, 빨간색으로 “VYN 20″이 인쇄되어 있습니다.
VYNDAMAX는 다음과 같은 형태로 제공됩니다:
- •
- 타파미디스 61mg: 적갈색, 불투명, 장방형 캡슐, 흰색으로 “VYN 61″이 인쇄되어 있습니다.
4. 금기 사항
없음.
6. 부작용
6.1 임상시험 경험
임상시험은 매우 다양한 조건 하에서 수행되므로, 특정 약물의 임상시험에서 관찰된 유해반응 발생률을 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
이 데이터는 ATTR-CM 환자 377명에게 VYNDAQEL 20mg 또는 80mg (20mg 캡슐 4정으로 투여)을 1일 1회 평균 24.5개월(1일~111개월) 동안 투여한 결과를 반영합니다.
유해사건은 주로 30개월간의 위약 대조 임상시험을 포함한 VYNDAQEL을 사용한 ATTR-CM 임상시험에서 평가되었습니다 [임상 연구 (14) 참조]. VYNDAQEL 20mg 투여군(n=88) 또는 80mg 투여군(n=176; 20mg 캡슐 4정으로 투여)에서 유해사건 발생 빈도는 위약군(n=177)과 유사했습니다.
30개월 위약 대조 임상시험에서 유해사건으로 인해 연구 약물 투여를 중단한 VYNDAQEL 투여군과 위약 투여군의 비율은 유사했습니다: VYNDAQEL 80mg 투여군 12명(7%), VYNDAQEL 20mg 투여군 5명(6%), 위약군 11명(6%).
7. 약물 상호 작용
7.1 BCRP 기질
타파미디스는 사람에게서 유방암 저항성 단백질 (BCRP)을 억제합니다 [임상 약리학 (12.3) 참조]. 타파미디스와 BCRP 기질인 약물을 함께 투여하면 이러한 수송체의 기질(예: 메토트렉세이트, 로수바스타틴, 이마티닙)의 노출이 증가하고 기질 관련 독성의 위험이 증가할 수 있습니다. BCRP 기질 관련 독성 징후를 모니터링하고 적절한 경우 기질의 용량을 수정하십시오.
8. 특정 환자군에서의 사용
8.1 임신
위험 요약
동물 연구 결과에 따르면, VYNDAQEL 및 VYNDAMAX는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 그러나 임산부에서 VYNDAQEL (1일 20mg 용량) 사용에 대한 제한적인 인체 데이터에서는 주요 선천적 기형, 유산 또는 임산부 또는 태아의 불량 결과에 대한 약물 관련 위험이 확인되지 않았습니다. 동물 생식 연구에서, 기관 형성 중 임신한 토끼에게 타파미디스 메글루민을 경구 투여한 결과, VYNDAQEL (80mg)의 최대 권장 인체 용량(MRHD)에서 인체 노출(AUC)의 약 9배에 해당하는 용량에서 발달에 부작용(배자-태아 사망률, 태아 체중 감소 및 태아 기형)이 발생했으며, MRHD에서 인체 노출(AUC)과 동등한 용량에서 태아 골격 변이 발생률이 증가했습니다. 출산 후 사망률, 성장 지연 및 학습 및 기억력 장애는 임신 기간과 수유 기간 동안 체표면적 기준(mg/m2)으로 MRHD의 약 2배에 해당하는 용량으로 타파미디스 메글루민을 투여받은 임신 랫트의 자손에서 관찰되었습니다 (자세한 내용은 데이터 참조). 임산부에게 태아에 대한 잠재적 위험을 알려주십시오. 임신 사례는 1-800-438-1985의 Pfizer 보고 라인에 보고하십시오.
해당 인구집단에서 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 불량 결과의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
데이터
동물 데이터
임신한 랫트에서 기관 형성 전반에 걸쳐 타파미디스 메글루민 (0, 15, 30 및 45 mg/kg/일)을 경구 투여한 결과, ≥30 mg/kg/일 (AUC 기준 MRHD에서 인체 노출의 약 10배)에서 태아 체중이 감소했습니다. 랫트의 배자-태아 발달에 대한 무해 작용 수준(NOAEL)은 15 mg/kg/일 (AUC 기준 MRHD에서 인체 노출의 약 7배)이었습니다.
임신한 토끼에서 기관 형성 전반에 걸쳐 타파미디스 메글루민 (0, 0.5, 2 및 8 mg/kg/일)을 경구 투여한 결과, 8 mg/kg/일 (AUC 기준 MRHD에서 인체 노출의 약 9배)에서 배자-태아 사망률 증가, 태아 체중 감소 및 태아 기형 발생률 증가가 나타났으며, 이는 모체 독성을 나타내는 것이기도 했습니다. ≥0.5 mg/kg/일 (AUC 기준 MRHD에서 인체 노출과 거의 동일) 용량에서 태아 골격 변이의 발생률이 증가했습니다.
출산 전후 연구에서, 임신한 랫트는 임신 기간과 수유 기간 (임신 7일차부터 수유 20일차까지) 동안 0, 5, 15 또는 30 mg/kg/일 용량으로 타파미디스 메글루민을 경구 투여받았습니다. 15 mg/kg/일 (mg/m2 기준 MRHD의 약 2배)로 처리된 어미 랫트의 자손에서 생존율 및 체중 감소, 수컷 성적 성숙 지연 및 신경 행동 효과 (학습 및 기억력 장애)가 관찰되었습니다. 랫트의 출산 전후 발달에 대한 NOAEL은 5 mg/kg/일 (mg/m2 기준 MRHD와 거의 동일)이었습니다.
8.2 수유
위험 요약
모유에서 타파미디스의 존재 여부, 수유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 타파미디스는 랫트의 모유에 존재합니다 (자세한 내용은 데이터 참조). 약물이 동물의 모유에 존재하는 경우, 사람의 모유에도 약물이 존재할 가능성이 높습니다. 수유아에게 심각한 부작용이 발생할 가능성을 시사하는 동물 연구 결과를 바탕으로, VYNDAQEL 또는 VYNDAMAX 치료 중에는 수유를 권장하지 않는다는 것을 환자에게 알려주십시오.
8.3 생식 잠재력이 있는 여성 및 남성
피임
여성
동물 연구 결과에 따르면, VYNDAQEL 및 VYNDAMAX는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 인구집단에서의 사용 (8.1) 참조]. 생식 잠재력이 있는 여성의 경우 임신 계획 및 예방을 고려하십시오.
8.5 노인 사용
고령자 (≥65세)의 경우 용량 조절이 필요하지 않습니다 [임상 약리학 (12.3) 참조]. 임상 연구에 참여한 총 환자 수 (n=441) 중 90.5%가 65세 이상이었으며, 중앙값 연령은 75세였습니다.
10. 과량 복용
과다복용에 대한 임상 경험은 제한적입니다. 임상 시험 중 두 명의 환자가 우발적으로 160mg의 VYNDAQEL 단회 용량을 복용했으나 이상 반응은 나타나지 않았습니다. 건강한 지원자에게 임상 시험에서 투여된 tafamidis meglumine의 최고 용량은 단회 용량으로 480mg이었습니다. 이 용량에서 경미한 맥립종(hordeolum)이라는 이상 반응이 한 건 보고되었습니다.
11. 제품 설명
VYNDAQEL (tafamidis meglumine) 및 VYNDAMAX (tafamidis)는 transthyretin의 선택적 안정제인 활성 성분 tafamidis를 함유하고 있습니다.
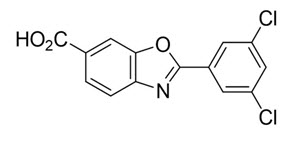
tafamidis meglumine의 화학명은 2-(3,5-dichlorophenyl)-1,3-benzoxazole-6-carboxylic acid mono (1-deoxy-1-methylamino-D-glucitol)입니다. 분자식은 C14H7Cl2NO3 C7H17NO5이며, 분자량은 503.33 g/mol입니다. 구조식은 다음과 같습니다.
경구용 tafamidis meglumine 20mg 연질 젤라틴 캡슐은 흰색에서 분홍색의 tafamidis meglumine 20mg (tafamidis 유리산 12.2mg에 해당) 현탁액과 다음과 같은 불활성 성분을 함유하고 있습니다: 28% 수산화암모늄, 브릴리언트 블루 FCF, 카민, 젤라틴, 글리세린, 산화철(황색), 폴리에틸렌 글리콜 400, 폴리소르베이트 80, 폴리비닐 아세테이트 프탈레이트, 프로필렌 글리콜, 소르비탄 모노올레에이트, 소르비톨, 이산화티타늄.
tafamidis의 화학명은 2-(3,5-dichlorophenyl)-1,3-benzoxazole-6-carboxylic acid입니다. 분자식은 C14H7Cl2NO3이며, 분자량은 308.12 g/mol입니다. 구조식은 다음과 같습니다.
경구용 tafamidis 61mg 연질 젤라틴 캡슐은 흰색에서 분홍색의 tafamidis 61mg 현탁액과 다음과 같은 불활성 성분을 함유하고 있습니다: 28% 수산화암모늄, 부틸화히드록시톨루엔, 젤라틴, 글리세린, 산화철(적색), 폴리에틸렌 글리콜 400, 폴리소르베이트 20, 포비돈(K값 90), 폴리비닐 아세테이트 프탈레이트, 프로필렌 글리콜, 소르비톨, 이산화티타늄.
12. 임상 약리학
12.1 작용 기전
타파미디스는 TTR의 선택적 안정화제입니다. 타파미디스는 티록신 결합 부위에서 TTR에 결합하여 사량체를 안정화시키고 단량체로의 해리 속도를 늦추는데, 이는 아밀로이드 생성 과정의 속도 제한 단계입니다.
12.2 약력학
독점적인 TTR 안정화 분석법을 약력학적 지표로 사용하여 생체 외에서 TTR 사량체의 안정성을 평가했습니다. TTR 안정화 분석법은 요소를 사용한 2일간의 생체 외 변성 전후 혈장 내 안정적인 TTR 사량체의 면역 탁도 측정을 정량화합니다. 이 독점적인 분석법을 사용하여 VYNDAQEL 80mg의 경우 VYNDAQEL 20mg에 비해 더 큰 TTR 사량체 안정화에 대한 용량 의존적 경향이 관찰되었습니다. 그러나 더 높은 TTR 사량체 안정화가 심혈관계 결과에 미치는 임상적 관련성은 알려져 있지 않습니다.
VYNDAQEL은 1일 1회 투여 후 검증된 14가지 TTR 변이체의 야생형 TTR 사량체와 사량체 모두를 안정화시켰습니다. 타파미디스는 생체 외에서 검사한 25가지 변이체의 TTR 사량체도 안정화시켰습니다.
VYNDAQEL과 VYNDAMAX는 갑상선 자극 호르몬(TSH)의 변화 없이 총 티록신 혈청 농도를 감소시킬 수 있습니다. 총 티록신 값의 이러한 감소는 타파미디스의 TTR 티록신 수용체에 대한 높은 결합 친화력으로 인해 트랜스티레틴(TTR)에 대한 티록신 결합 감소 또는 TTR로부터의 티록신 치환의 결과일 가능성이 높습니다. 저갑상선증과 일치하는 해당 임상 소견은 관찰되지 않았습니다.
심부전과 관련된 바이오마커(NT-proBNP 및 트로포닌 I)는 위약에 비해 VYNDAQEL이 유리했습니다.
12.3 약동학
VYNDAMAX 61mg 캡슐과 20mg 캡슐 4개로 투여된 VYNDAQEL의 정상 상태 Cmax 및 시간에 따른 혈장 농도 곡선 아래 면적(AUC)에 임상적으로 유의미한 차이는 관찰되지 않았습니다.
타파미디스 노출은 1일 1회 투여 시 단회(최대 480mg) 또는 다회(최대 80mg)(승인된 권장 용량의 1~6배) 투여에 따라 비례적으로 증가합니다.
VYNDAQEL 80mg의 단회 및 반복 투여 후 명백한 청소율은 유사했습니다.
분포
타파미디스 메글루민의 명백한 정상 상태 분포 용적은 16리터이고 타파미디스의 경우 18.5리터입니다. 타파미디스의 혈장 단백질 결합은 생체 외에서 >99%입니다. 타파미디스는 주로 TTR에 결합합니다.
배설
타파미디스의 평균 반감기는 약 49시간입니다. 타파미디스 메글루민의 명백한 경구 청소율은 0.228 L/h(타파미디스의 경우 0.263 L/h)입니다. 반복적인 타파미디스 일일 투여 후 정상 상태에서의 약물 축적 정도는 단회 투여 후 관찰된 것보다 약 2.5배 더 큽니다.
특정 집단
연령, 인종/민족(백인 및 일본인) 또는 신장 장애에 따라 타파미디스의 약동학에 임상적으로 유의미한 차이는 관찰되지 않았습니다.
간 기능 장애 환자
중등도 간 기능 장애(Child-Pugh 점수 7~9) 환자는 건강한 피험자에 비해 타파미디스의 전신 노출이 감소(약 40%)하고 청소율이 증가(약 68%)했습니다. 중등도 간 기능 장애가 있는 피험자의 TTR 수치는 건강한 피험자보다 낮지만, TTR 양에 대한 타파미디스의 노출은 이러한 환자에서 TTR 사량체의 안정화를 유지하기에 충분합니다. 건강한 피험자에 비해 경도 간 기능 장애(Child-Pugh 점수 5~6) 환자에서 타파미디스의 약동학에 임상적으로 유의미한 차이는 관찰되지 않았습니다. 중증 간 기능 장애가 타파미디스에 미치는 영향은 알려져 있지 않습니다.
약물 상호작용 연구
임상 연구
13. 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 장애 (Carcinogenesis, Mutagenesis, Impairment of Fertility)
발암성 (Carcinogenesis)
Tg-rasH2 마우스에게 26주 동안 매일 0, 10, 30 또는 90mg/kg 용량을 반복 투여한 결과, 종양 발생률 증가의 증거는 없었습니다. 랫트에서 MRHD에서 AUC의 최대 18배까지 노출된 2년 발암성 연구에서 종양 발생률 증가의 증거는 없었습니다.
생식능력 장애 (Impairment of Fertility)
어떤 용량에서도 tafamidis meglumine이 랫트의 생식력, 생식 능력 또는 교미 행동에 영향을 미치지 않았습니다. 랫트에게 동거 전 (암컷의 경우 최소 15일, 수컷의 경우 28일), 동거 기간 내내 수컷의 종료 전날까지, 그리고 암컷의 착상까지 (임신 7일) 매일 (0, 5, 15, 30mg/kg/일) 투여했습니다. 어떤 용량에서도 수컷 및 암컷 랫트의 독성, 생식력 및 교미 행동에 대한 부작용은 관찰되지 않았습니다. tafamidis meglumine의 생식 독성에 대한 부모 및 모체 무독성량 (NOAEL)은 30mg/kg/일이며, 이는 mg/m2 기준으로 MRHD의 약 4배입니다.
14. 임상 연구
다기관, 국제, 무작위 배정, 이중 눈가림, 위약 대조 연구에서 야생형 또는 유전성 ATTR-CM 환자 441명을 대상으로 효능이 입증되었습니다(NCT01994889).
환자들은 1:2:2 비율로 무작위 배정되어 VYNDAQEL 20 mg (n=88), VYNDAQEL 80 mg (VYNDAQEL 20 mg 캡슐 4개 투여) (n=176) 또는 대조 위약 (n=177)을 30개월 동안 1일 1회 표준 치료(예: 이뇨제)와 함께 투여받았습니다. 치료 배정은 변이 TTR 유전형 유무와 기준 질병 중증도(NYHA 등급)에 따라 층화되었습니다. 이식 환자는 이 연구에서 제외되었습니다. 표 1은 환자 인구 통계 및 기준 특성을 설명합니다.
| 특성 | Tafamidis 통합 N=264 |
위약 N=177 |
|---|---|---|
| 약어: ATTRm = 변이 트랜스티레틴 아밀로이드, ATTRwt = 야생형 트랜스티레틴 아밀로이드 | ||
|
연령 — 세 |
||
|
평균 (표준 편차) |
74.5 (7.2) |
74.1 (6.7) |
|
중앙값 (최소값, 최대값) |
75 (46, 88) |
74 (51, 89) |
|
성별 — 명 (%) |
||
|
남성 |
241 (91.3) |
157 (88.7) |
|
여성 |
23 (8.7) |
20 (11.3) |
|
TTR 유전형 — 명 (%) |
||
|
ATTRm |
63 (23.9) |
43 (24.3) |
|
ATTRwt |
201 (76.1) |
134 (75.7) |
|
NYHA 등급 — 명 (%) |
||
|
NYHA Class I |
24 (9.1) |
13 (7.3) |
|
NYHA Class II |
162 (61.4) |
101 (57.1) |
|
NYHA Class III |
78 (29.5) |
63 (35.6) |
주요 분석에서는 사례별 사망과 심혈관 관련 입원 빈도(심혈관 관련 질병으로 입원한 횟수)에 Finkelstein-Schoenfeld (F-S) 방법을 적용한 계층적 조합을 사용했습니다. 이 방법은 각 계층 내에서 모든 환자를 쌍으로 비교하여 사망률을 기준으로 환자를 구분할 수 없는 경우 심혈관 관련 입원 빈도에 따라 계층적으로 진행합니다.
이 분석은 VYNDAQEL 20mg 및 80mg 투여군을 병합한 군과 위약군을 비교했을 때 사례별 사망 및 심혈관 관련 입원 빈도가 유의미하게 감소했음을 보여주었습니다(p=0.0006)(표 2).
| 주요 분석 | VYNDAQEL 병합 N=264 |
위약 N=177 |
|---|---|---|
|
||
|
30개월 생존 대상 수(%)* |
186 (70.5) |
101 (57.1) |
|
30개월 생존자 중 심혈관 관련 입원 평균 횟수(환자 1인당 연간) |
0.297 |
0.455 |
|
F-S 방법의 p-값 |
0.0006 |
|
주요 분석의 개별 구성 요소(사례별 사망 및 심혈관 관련 입원) 분석에서도 VYNDAQEL이 위약에 비해 유의미한 감소를 보였습니다.
VYNDAQEL 병합군 대 위약군의 사례별 사망 Cox 비례 위험 모델의 위험 비는 0.70(95% 신뢰 구간 [CI] 0.51, 0.96)으로, 위약군에 비해 사망 위험이 30% 상대적으로 감소했음을 나타냅니다(p=0.026). 두 치료군 모두 전체 사망의 약 80%가 심혈관 관련 사망이었습니다. 사례별 사망까지의 시간에 대한 Kaplan-Meier 플롯은 그림 1에 나와 있습니다.
|
|
그림 1: 사례별 사망* |
 |
VYNDAQEL은 위약과 비교하여 심혈관 관련 입원이 유의하게 적었으며, 위험 감소율은 32%로 상대 위험 비율은 0.68입니다(표 3).
| 통합 VYNDAQEL N=264 |
위약 N=177 |
|
|---|---|---|
|
||
|
심혈관 관련 입원 환자 총 수(%) |
138 (52.3) |
107 (60.5) |
|
연간 심혈관 관련 입원* |
0.48 |
0.70 |
|
통합 VYNDAQEL 대 위약 치료 차이(상대 위험 비율)* |
0.68 |
|
|
p-값* |
<0.0001 |
|
VYNDAQEL의 기능적 용량 및 건강 상태에 대한 치료 효과는 각각 6분 보행 검사(6MWT) 및 캔자스시 심근병증 설문지-전체 요약(KCCQ-OS) 점수로 평가했습니다. VYNDAQEL에 유리한 유의미한 치료 효과가 6개월째에 처음 관찰되었으며 6MWT 거리와 KCCQ-OS 점수 모두에서 30개월까지 일관되게 유지되었습니다(그림 2 및 표 4).
그림 2: 기준선에서 30개월까지 6MWT 거리 및 KCCQ-OS 점수 변화
약어: 6MWT=6분 보행 검사, KCCQ-OS=캔자스시 심근병증 설문지-전체 요약.
패널 A는 6MWT 거리에서 위약 환자와 비교하여 통합 VYNDAQEL 환자의 기준선에서 30개월까지의 변화를 보여줍니다.
패널 B는 KCCQ-OS 점수에서 위약 환자와 비교하여 통합 VYNDAQEL 환자의 기준선에서 30개월까지의 변화를 보여줍니다.
캔자스시 심근병증 설문지-전체 요약(KCCQ-OS) 점수는 총 증상(증상 빈도 및 증상 부담), 신체적 제한, 삶의 질 및 사회적 제한의 네 가지 영역으로 구성됩니다. 전체 요약 점수 및 영역 점수는 0에서 100까지이며, 점수가 높을수록 건강 상태가 더 좋음을 나타냅니다. 30개월째에 네 가지 영역 모두 위약에 비해 통합 VYNDAQEL에 유리했으며 KCCQ-OS 점수와 유사한 치료 효과를 보였습니다(그림 2 및 표 4). KCCQ-OS의 기준선에서 30개월까지의 변화에 대한 분포(그림 3)는 KCCQ-OS 점수가 악화된 환자의 비율이 위약군에 비해 통합 VYNDAQEL 치료군에서 더 낮았고 점수가 개선된 환자의 비율은 더 높았음을 보여줍니다(그림 3).
그림 3: 기준선에서 30개월까지 KCCQ-전체 요약 점수 변화 히스토그램
Abbreviation: KCCQ-OS=Kansas City Cardiomyopathy Questionnaire-Overall Summary.
| Abbreviations: 6MWT = 6-Minute Walk Test; KCCQ-OS = Kansas City Cardiomyopathy Questionnaire-Overall Summary; SD = standard deviation; LS = least squares; SE = standard error; CI = confidence interval | |||||
|
평가 변수 |
기준 평균 (SD) |
기준선에서 30개월까지의 변화, LS 평균 (SE) |
위약 대비 치료 차이 |
||
|
VYNDAQEL 병합 |
위약 |
VYNDAQEL 병합 |
위약 |
||
|
6MWT |
351 |
353 |
-55 |
-131 |
76 |
|
KCCQ-OS |
67 |
66 |
-7 |
-21 |
14 |
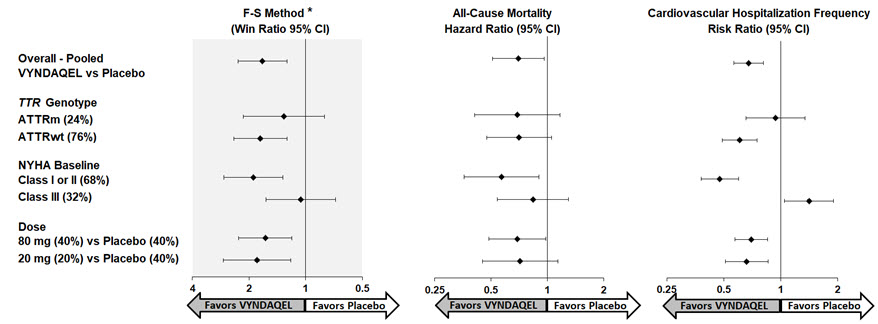
복합 평가 변수 및 그 구성 요소(모든 원인으로 인한 사망률 및 심혈관 관련 입원 빈도)에 대한 승률로 표시되는 F-S 방법의 결과는 NYHA Class III의 심혈관 관련 입원 빈도를 제외한 모든 하위 그룹(야생형, 변이형 및 NYHA Class I & II, III)에서 위약 대비 VYNDAQEL에 대해 일관되게 유리했습니다(그림 4). 승률은 위약 환자 “승리” 쌍 수로 나눈 VYNDAQEL 치료 환자 “승리” 쌍 수입니다. 6MWT 및 KCCQ-OS 분석 또한 각 하위 그룹 내에서 위약에 비해 VYNDAQEL에 유리했습니다.
그림 4: 하위 그룹, 용량 및 1차 분석 구성 요소별 결과
Abbreviations: ATTRm = variant transthyretin amyloid, ATTRwt = wild-type transthyretin amyloid, F-S = Finkelstein Schoenfeld, CI = Confidence Interval
*F-S 결과는 승률을 사용하여 제시됨(모든 원인으로 인한 사망률 및 심혈관 입원 빈도 기준)
심장 이식 및 심장 기계 보조 장치는 사망으로 처리됨.
1차 분석, 30개월째 6MWT 및 30개월째 KCCQ-OS의 결과는 위약 대비 VYNDAQEL 80mg 및 20mg 용량 모두에서 통계적으로 유의했으며 두 용량 모두 유사한 결과를 보였습니다.
16. 공급 형태/보관 및 취급
VYNDAQEL 20-mg (tafamidis meglumine) 연질 젤라틴 캡슐은 노란색의 불투명한 직사각형 모양이며 빨간색으로 “VYN 20″이라고 인쇄되어 있으며 다음과 같은 포장 구성으로 제공됩니다.
| VYNDAQEL 캡슐 | ||
|---|---|---|
| 포장 구성 | Strength | NDC |
|
4개의 중간 상자로 구성된 상자. 각 중간 상자에는 3개의 블리스터 카드가 들어 있습니다. 각 블리스터 카드에는 10개의 캡슐이 들어 있습니다. (총 120개 캡슐) |
20 mg |
NDC 0069-1975-40 |
VYNDAMAX 61-mg (tafamidis) 연질 젤라틴 캡슐은 적갈색의 불투명한 직사각형 모양이며 흰색으로 “VYN 61″이라고 인쇄되어 있으며 다음과 같은 포장 구성으로 제공됩니다.
| VYNDAMAX 캡슐 | ||
|---|---|---|
| 포장 구성 | Strength | NDC |
|
3개의 블리스터 카드가 들어 있는 상자. 각 블리스터 카드에는 10개의 캡슐이 들어 있습니다. (총 30개 캡슐) |
61 mg |
NDC 0069-8730-30 |
VYNDAQEL 및 VYNDAMAX는 20°C ~ 25°C(68°F ~ 77°F)의 실온에서 보관하십시오. 15°C ~ 30°C(59°F ~ 86°F)까지의 일시적인 온도 변화는 허용됩니다. [USP Controlled Room Temperature 참조].
17. 환자 상담 정보
환자에게 FDA 승인 환자용 라벨(환자 정보)을 읽도록 알려주십시오.
임신
임신 사실은 1-800-438-1985번 Pfizer 보고 전화로 보고하십시오. 임신 중인 여성과 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알려주십시오. 여성에게 알려진 또는 의심되는 임신 사실을 의료 제공자에게 알리도록 조언하십시오 [특정 집단에서의 사용 (8.1) 참조].
이 제품의 라벨이 업데이트되었을 수 있습니다. 전체 처방 정보는 www.pfizer.com을 방문하십시오.
VYNDAQEL 또는 VYNDAMAX에 대한 의학 정보는 www.pfizermedinfo.com을 방문하거나 1‑800‑438‑1985로 전화하십시오.
SPL 미분류 섹션
LAB-0497-6.0
환자 사용 설명서
|
본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. |
발행: 2023년 10월 |
|
환자 정보 |
|
|
VYNDAQEL® (빈-두-켈) |
VYNDAMAX™ (빈-다-맥스) |
|
VYNDAQEL과 VYNDAMAX란 무엇입니까? |
|
|
VYNDAQEL 또는 VYNDAMAX 복용 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약 또는 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. |
|
|
VYNDAQEL 또는 VYNDAMAX는 어떻게 복용해야 합니까?
|
|
|
VYNDAQEL과 VYNDAMAX의 가능한 부작용은 무엇입니까? |
|
|
VYNDAQEL과 VYNDAMAX는 어떻게 보관해야 합니까?
|
|
|
VYNDAQEL과 VYNDAMAX의 안전하고 효과적인 사용에 대한 일반 정보. |
|
|
VYNDAQEL과 VYNDAMAX의 성분은 무엇입니까?
|
|
주요 표시면 – 20mg 캡슐 블리스터 카드
NDC 0069-1975-12
Vyndaqel®
(tafamidis meglumine) capsules
20 mg per capsule
Pfizer Labs.
LOT/EXP
PEEL & PUSH
주요 표시면 – 20mg 캡슐 블리스터 카드 상자
Vyndaqel®
(tafamidis meglumine) capsules
캡슐당 20mg*
담당 약사님께: Vyndaqel은 다른 tafamidis 제품과 mg 기준으로 대체 처방이 불가능합니다.
개별 재판매 불가
Pfizer
포함 내용: 카톤 당 총 30캡슐.
각 카톤에는 블리스터 카드 3장이 들어 있습니다. 각
블리스터 카드에는 10캡슐이 들어 있습니다.
처방전 의약품
주요 표시 패널 – 20mg 캡슐 블리스터 카드 카톤
NDC 0069-1975-40
Vyndaqel®
(tafamidis meglumine) capsules
20 mg per capsule*
Attention Pharmacist: Vyndaqel은 다른 tafamidis 제품과 mg 기준으로 대체할 수 없습니다.
Pfizer
포함 내용: 카톤 당 총 120캡슐.
각 카톤에는 중간 카톤 4개가 들어 있습니다.
각 중간 카톤에는 블리스터 카드 3개가 들어 있습니다.
각 블리스터 카드에는 캡슐 10개가 들어 있습니다.
처방전 의약품
주요 표시 패널 – 61mg 캡슐 블리스터 카드
NDC 0069-8730-01
Vyndamax™
(tafamidis) capsules
61 mg per capsule
Pfizer Labs.
LOT/EXP
PEEL & PUSH
주요 표시 패널 – 61mg 캡슐 블리스터 카드 카톤
NDC 0069-8730-30
Vyndamax™
(tafamidis) capsules
61 mg per capsule
Attention Pharmacist: Vyndamax는 tafamidis meglumine 제품과 mg 기준으로 대체 처방이 불가능합니다.
Pfizer
포장 단위: 총 30캡슐 (카톤당)
각 카톤에는 3개의 블리스터 카드가 들어 있습니다. 각
블리스터 카드에는 10캡슐이 들어 있습니다.
처방전 의약품