의약품 제조업체: Allergan, Inc. (Updated: 2024-11-22)
처방 정보 하이라이트
VRAYLAR® (cariprazine) 경구용 캡슐
미국 최초 승인: 2015
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가 및 자살 생각 및 행동
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
최근 주요 변경 사항
적응증 및 용법
투여 및 투약
용법 및 용량
캡슐: 1.5mg, 3mg, 4.5mg 및 6mg (3)
금기사항
- VRAYLAR에 대한 알려진 과민증 (4)
경고 및 주의사항
- 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 이상 반응: 뇌혈관계 이상 반응(예: 뇌졸중, 일과성 허혈 발작)의 발생률 증가 (5.3)
- 악성 신경이완제 증후군: 즉시 투여 중단 및 면밀한 관찰 (5.4)
- 지연성 운동 이상증: 적절한 경우 투여 중단 (5.5)
- 늦게 나타나는 이상 반응: VRAYLAR의 긴 반감기로 인해 VRAYLAR 투여 시작 후 및 각 용량 변경 후 몇 주 동안 이상 반응 및 환자 반응을 모니터링합니다. (5.6)
- 대사 변화: 고혈당/당뇨병, 이상지질혈증 및 체중 증가 모니터링 (5.7)
- 백혈구 감소증, 호중구 감소증 및 무과립구증: 기존의 백혈구 수치가 낮거나 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자에게는 완전 혈구 수(CBC) 검사를 실시합니다. 다른 원인 인자가 없는 경우 임상적으로 유의미한 WBC 감소가 발생하면 VRAYLAR 투여 중단을 고려합니다. (5.8)
- 기립성 저혈압 및 실신: 심박수와 혈압을 모니터링하고 알려진 심혈관 질환 또는 뇌혈관 질환 및 탈수 또는 실신 위험이 있는 환자에게 경고합니다 (5.9)
- 발작: 발작 병력이 있거나 발작 역치를 낮추는 질환이 있는 환자에게는 신중하게 사용하십시오 (5.11)
- 인지 및 운동 장애 가능성: 기계 작동 시 주의하십시오 (5.12)
이상 반응
가장 흔한 이상 반응(발생률 ≥ 5%이고 위약 대비 최소 2배 이상)은 다음과 같습니다 (6.1):
- 조현병: 추체외로 증상 및 아카시지아
- 조울증 급성기: 추체외로 증상, 아카시지아, 소화불량, 구토, 졸음 및 불안
- 조울증 우울증상: 메스꺼움, 아카시지아, 불안 및 추체외로 증상
- MDD의 병용 치료: 아카시지아, 불안, 피로, 변비, 메스꺼움, 불면증, 식욕 증가, 어지러움 및 추체외로 증상
의심되는 이상 반응을 보고하려면 AbbVie에 1-800-678-1605 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
특정 환자군에서의 사용
- 임신: 동물 데이터에 따르면 태아에게 해를 끼칠 수 있습니다. (8.1)
환자에 대한 정보 및 약물 안내서에 대해서는 17항을 참조하십시오.
개정: 2024년 11월
목차
전문 정보: 목차*
경고: 치매 관련 정신병을 가진 노인 환자의 사망률 증가 및 자살 생각 및 행동
1
적응증 및 용법
2
용법 및 용량
2.1
일반적인 용량 정보
2.2
조현병 권장 용량
2.3
조울증 1형 장애 관련 조증 또는 혼합 에피소드 권장 용량
2.4
조울증 1형 장애 관련 우울 에피소드(조울증 우울증) 권장 용량
2.5
주요 우울 장애 치료를 위한 항우울제 병용 요법 권장 용량
2.6
CYP3A4 억제제 및 유도제에 대한 용량 조절
2.7
치료 중단
3
제형 및 강도
4
금기사항
5
경고 및 주의사항
5.1
치매 관련 정신병을 가진 노인 환자의 사망률 증가
5.2
소아, 청소년 및 청년 성인의 자살 생각 및 행동
5.3
치매 관련 정신병을 가진 노인 환자의 뇌혈관계 이상 반응(뇌졸중 포함)
5.4
악성 신경이완제 증후군(NMS)
5.5
지연성 운동 이상증
5.6
늦게 발생하는 이상 반응
5.7
대사 변화
5.8
백혈구 감소증, 호중구 감소증 및 무과립구증
5.9
기립성 저혈압 및 실신
5.10
낙상
5.11
발작
5.12
인지 및 운동 장애 가능성
5.13
체온 조절 장애
5.14
연하곤란
6
이상 반응
6.1
임상 시험 경험
6.2
시판 후 경험
7
약물 상호작용
8
특정 환자군에서의 사용
8.1
임신
8.2
수유
8.4
소아 사용
8.5
노년층 사용
8.6
간 손상
8.7
신장 손상
8.8
흡연
8.9
기타 특정 집단
9
약물 남용 및 의존성
9.1
통제 약물
9.2
남용
9.3
의존성
10
과량 복용
10.1
인체 경험
10.2
과량 복용 관리
11
설명
12
임상 약리학
12.1
작용 기전
12.2
약력학
12.3
약동학
13
비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식능 저해
13.2
동물 독성 및/또는 약리학
14
임상 연구
14.1
정신분열병
14.2
조울증 I 장애와 관련된 조증 또는 혼합 에피소드
14.3
조울증 I 장애와 관련된 우울 에피소드 (조울증 우울증)
14.4
주요 우울 장애의 보조 치료
16
포장 단위/보관 및 취급
16.1
포장 단위
16.2
보관 및 취급
17
환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가 및 자살 생각 및 행동
치매 관련 정신병이 있는 노인 환자의 사망률 증가
항정신병 약물로 치료받는 치매 관련 정신병이 있는 노인 환자는 사망 위험이 증가합니다. VRAYLAR는 치매 관련 정신병 환자의 치료에는 승인되지 않았습니다[경고 및 주의 사항 (5.1)] 참조하십시오.
자살 생각 및 행동
항우울제는 단기 연구에서 소아 및 청소년 환자의 자살 생각 및 행동 위험을 증가시켰습니다. 모든 항우울제 치료 환자의 임상적 악화 및 자살 생각 및 행동의 발생을 면밀히 모니터링하십시오[경고 및 주의 사항 (5.2)] 참조하십시오. VRAYLAR의 안전성 및 유효성은 소아 환자에서 확립되지 않았습니다[특정 집단에서의 사용 (8.4)] 참조하십시오.
1 적응증 및 사용법
VRAYLAR®는 다음 질환에 사용됩니다.
- 성인의 조현병 치료 [임상 연구 (14.1)] 참조
- 성인의 조울증 1형 장애와 관련된 급성 조증 또는 혼합 에피소드 치료 [임상 연구 (14.2)] 참조
- 성인의 조울증 1형 장애와 관련된 우울 에피소드 (조울증 우울증) 치료 [임상 연구 (14.3)] 참조
- 성인의 주요 우울 장애 (MDD) 치료를 위한 항우울제 보조 요법 [임상 연구 (14.4)] 참조
2 용법 및 투여
2.1
일반 용량 정보
VRAYLAR는 1일 1회 경구 투여하며, 음식과 함께 또는 음식 없이 복용할 수 있습니다.
카리프라진과 그 활성 대사체의 반감기가 길기 때문에 용량 변경은 혈장 내에서 몇 주 후에야 완전히 반영됩니다. 처방자는 VRAYLAR 투여 시작 후 및 각 용량 변경 후 몇 주 동안 환자의 이상 반응 및 치료 반응을 모니터링해야 합니다 [경고 및 주의 사항 (5.6), 임상 약리학 (12.3)].
2.2
조현병 권장 용량
VRAYLAR의 시작 용량은 1일 1회 경구 1.5mg입니다. 권장 용량 범위는 1일 1회 경구 1.5mg~6mg입니다. 2일에 3mg으로 용량을 증가시킬 수 있습니다. 임상 반응 및 내약성에 따라 1.5mg 또는 3mg 단위로 추가 용량 조절을 할 수 있습니다. 최대 권장 용량은 1일 1회 경구 6mg입니다. 단기간 대조 시험에서 1일 6mg 이상의 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않았습니다 [이상 반응 (6.1), 임상 연구 (14.1)].
2.3
조울증 1형 장애 관련 조증 또는 혼합 에피소드 권장 용량
VRAYLAR의 시작 용량은 1일 1회 경구 1.5mg입니다. 2일에 1일 1회 경구 3mg으로 용량을 증가시킵니다. 권장 용량 범위는 1일 1회 경구 3mg~6mg입니다. 임상 반응 및 내약성에 따라 1.5mg 또는 3mg 단위로 추가 용량 조절을 할 수 있습니다. 최대 권장 용량은 1일 1회 경구 6mg입니다. 단기간 대조 시험에서 1일 6mg 이상의 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않았습니다 [이상 반응 (6.1), 임상 연구 (14.2)].
2.4
조울증 1형 장애 관련 우울 에피소드 (조울증) 권장 용량
VRAYLAR의 시작 용량은 1일 1회 경구 1.5mg입니다. 임상 반응 및 내약성에 따라 15일에 1일 1회 경구 3mg으로 용량을 증가시킬 수 있습니다. 최대 권장 용량은 1일 1회 경구 3mg입니다.
2.5
주요 우울 장애 치료를 위한 항우울제 병용 요법 권장 용량
VRAYLAR의 시작 용량은 1일 1회 경구 1.5mg입니다. 임상 반응 및 내약성에 따라 15일에 1일 1회 경구 3mg으로 용량을 증가시킬 수 있습니다. 임상 시험에서 14일 미만의 간격으로 용량 적정을 실시한 결과 이상 반응 발생률이 높았습니다 [이상 반응 (6.1)]. 최대 권장 용량은 1일 1회 경구 3mg입니다.
2.6
CYP3A4 저해제 및 유도제에 대한 용량 변경
강력하거나 중등도의 CYP3A4 저해제를 복용하는 동안 VRAYLAR 투여 시작
강력하거나 중등도의 CYP3A4 저해제를 복용하는 환자의 VRAYLAR 시작 용량에 대한 용량 변경은 표 1에 제시되어 있습니다.
표 1: 강력하거나 중등도의 CYP3A4 저해제를 복용하는 환자의 VRAYLAR 시작 용량에 대한 용량 변경
| VRAYLAR 시작 용량 | ||
| 강력한 CYP3A4 저해제 복용 시 |
중등도 CYP3A4 저해제 복용 시 | |
| 조현병 | 1.5mg을 경구 투여, 3일 간격으로 시작; 필요에 따라 1.5mg을 경구 투여, 격일로 증량* | 1.5mg을 경구 투여, 격일로 시작; 필요에 따라 1.5mg을 경구 투여, 매일 증량* |
| 조울증 급성기 | ||
| 조울증 우울증 | 1.5mg을 경구 투여, 3일 간격 | 1.5mg을 경구 투여, 격일 |
| MDD 치료의 추가 요법 | ||
*임상적 반응 및 내약성에 따라 달라집니다.
안정적인 VRAYLAR 용량 복용 중 강력하거나 중등도의 CYP3A4 저해제 투여 시작
안정적인 VRAYLAR 용량 복용 중 강력하거나 중등도의 CYP3A4 저해제 투여를 시작하는 환자에 대한 용량 권장 사항(표 2 참조):e:
표 2: 강력하거나 중등도의 CYP3A4 저해제 투여를 시작하고 안정적인 VRAYLAR 용량을 복용하는 경우 VRAYLAR 용량 변경
| 현재 VRAYLAR 용량 | 강력한 CYP3A4 저해제 투여 시작 시 VRAYLAR 용량 | 중등도 CYP3A4 저해제 투여 시작 시 VRAYLAR 용량 |
| 1일 1회 1.5mg 또는 3mg | 1.5mg을 경구 투여, 3일 간격 | 1.5mg을 경구 투여, 격일 |
| 1일 1회 4.5mg 또는 6mg | 1.5mg을 경구 투여, 격일 | 1.5mg을 경구 투여, 매일 |
강력하거나 중등도의 CYP3A4 저해제 투여를 중단하는 경우, 임상적 반응 및 내약성에 따라 VRAYLAR 용량을 증량해야 할 수 있습니다 [약물 상호작용 (7)] 참조.
CYP3A4 유도제와 함께 VRAYLAR를 병용 투여하는 환자에 대한 용량 변경
VRAYLAR과 CYP3A4 유도제의 병용 투여는 평가되지 않았으며 권장되지 않습니다 [용법 및 용량 (2.1), 경고 및 주의사항 (5.6), 약물 상호작용 (7), 임상 약리 (12.3)] 참조.
2.7
치료 중단
VRAYLAR 투여 중단 후 활성 약물 및 대사체의 혈장 농도 감소는 환자의 임상 증상에 즉시 반영되지 않을 수 있습니다. 카리프라진 및 그 활성 대사체의 혈장 농도는 약 1주일 후 50% 감소합니다 [임상 약리 (12.3)] 참조. VRAYLAR에서 다른 항정신병 약물로의 전환 또는 다른 항정신병 약물과의 병용 투여에 대해 특별히 다루는 체계적으로 수집된 데이터는 없습니다.
3 제형 및 함량
VRAYLAR(카리프라진) 캡슐은 네 가지 용량으로 제공됩니다.
- 1.5mg 캡슐: 흰색 캡과 몸체에 “FL 1.5” 각인
- 3mg 캡슐: 녹색에서 청록색 캡과 흰색 몸체에 “FL 3” 각인
- 4.5mg 캡슐: 녹색에서 청록색 캡과 몸체에 “FL 4.5” 각인
- 6mg 캡슐: 보라색 캡과 흰색 몸체에 “FL 6” 각인
4 금기 사항
VRAYLAR은 카리프라진에 대한 과민반응 병력이 있는 환자에게는 금기입니다. 반응은 발진, 가려움증, 두드러기 및 안젤오에데마를 시사하는 반응(예: 혀 부종, 입술 부종, 안면 부종, 인두 부종 및 안면 부종)에 이르기까지 다양했습니다.
5 경고 및 주의사항
5.1
치매 관련 정신병이 있는 노인 환자의 사망률 증가
항정신병 약물은 치매 관련 정신병이 있는 노인 환자의 모든 원인 사망 위험을 증가시킵니다. 17건의 치매 관련 정신병 위약 대조 시험(10주 모드 기간, 대부분 비정형 항정신병 약물을 복용하는 환자) 분석 결과, 약물 치료 환자의 사망 위험이 위약 치료 환자보다 1.6배에서 1.7배였습니다. 일반적인 10주 대조 시험 기간 동안 약물 치료 환자의 사망률은 약 4.5%였던 반면, 위약 치료 환자의 사망률은 약 2.6%였습니다.
사망 원인은 다양했지만, 대부분의 사망은 심혈관계(예: 심부전, 돌연사) 또는 감염성(예: 폐렴) 질환으로 나타났습니다. VRAYLAR는 치매 관련 정신병 환자의 치료에는 승인되지 않았습니다 [경고 참조, 경고 및 주의 사항 (5.3)].
5.2
소아, 청소년 및 청년 성인의 자살 생각 및 행동
약 77,000명의 성인 환자와 4,500명의 소아 환자를 포함한 항우울제(SSRI 및 기타 항우울제 계열)의 위약 대조 시험의 통합 분석에서 24세 이하의 항우울제 치료 환자의 자살 생각 및 행동 발생률이 위약 치료 환자보다 높았습니다. 약물 간 자살 생각 및 행동 위험에는 상당한 차이가 있었지만, 연구된 대부분의 약물에서 어린 환자의 위험이 증가했습니다. 다양한 적응증에 따른 자살 생각 및 행동의 절대 위험에는 차이가 있으며, MDD 환자에서 발생률이 가장 높았습니다. 치료받은 1000명의 환자당 자살 생각 및 행동 사례 수의 약물-위약 차이는 표 3에 나와 있습니다.
| 연령대 | 치료받은 1000명의 환자당 자살 생각 또는 행동 환자 수의 약물-위약 차이 |
| 위약과 비교하여 증가 | |
| <18세 | 14명 증가 |
| 18-24세 | 5명 증가 |
| 위약과 비교하여 감소 | |
| 25-64세 | 1명 감소 |
| ≥65세 | 6명 감소 |
* VRAYLAR는 소아 환자에게 사용하도록 승인되지 않았습니다.
소아, 청소년 및 청년 성인에서의 자살 생각 및 행동의 위험이 4개월 이상의 장기간 사용으로 확대되는지 여부는 알려져 있지 않습니다. 그러나 MDD 성인을 대상으로 한 위약 대조 유지 치료 시험의 상당한 증거에 따르면 항우울제는 우울증의 재발을 지연시키며 우울증 자체가 자살 생각 및 행동의 위험 요소입니다.
모든 항우울제 치료 환자에 대해 임상적 악화 및 자살 생각 및 행동의 발생 여부를 모니터링해야 합니다. 특히 약물 치료 초기 몇 달 동안과 용량 변경 시점에 주의 깊게 모니터링해야 합니다. 가족 구성원이나 환자 간병인에게 행동 변화를 모니터링하고 의료 제공자에게 알리도록 교육해야 합니다. 우울증이 지속적으로 악화되거나 자살 생각이나 행동이 갑자기 나타나는 환자의 경우 치료 요법을 변경하는 것을 고려해야 하며, VRAYLAR 중단도 포함됩니다.
5.3
뇌혈관계 이상 반응(뇌졸중 포함) 및 치매 관련 정신병이 있는 노인 환자
치매 노인 환자를 대상으로 한 위약 대조 시험에서 리스페리돈, 아리피프라졸 및 올란자핀을 무작위 배정받은 환자는 뇌졸중 및 일과성 허혈 발작(치명적인 뇌졸중 포함)의 발생률이 더 높았습니다. VRAYLAR는 치매 관련 정신병 환자의 치료에는 승인되지 않았습니다 [경고, 경고 및 주의 사항 (5.1)]를 참조하십시오.
5.4
악성 신경이완증후군(NMS)
잠재적으로 치명적인 증상 복합체인 악성 신경이완증후군(NMS)이 항정신병 약물 투여와 관련하여 보고되었습니다. NMS의 임상적 징후는 고열, 근육 강직, 섬망 및 자율 신경계 불안정입니다. 추가적인 징후로는 크레아틴 키나제 상승, 횡문근융해증(근육 붕괴) 및 급성 신부전이 있습니다.
NMS가 의심되는 경우 VRAYLAR 투여를 즉시 중단하고 집중적인 증상 치료 및 모니터링을 제공해야 합니다.
5.5
지연성 운동 이상증
잠재적으로 비가역적인 불수의적 운동 이상을 특징으로 하는 지연성 운동 이상증이 VRAYLAR를 포함한 항정신병 약물로 치료받는 환자에게서 발생할 수 있습니다. 위험은 특히 고령 여성을 포함한 고령자에서 가장 높은 것으로 보이지만, 어떤 환자가 이 증후군을 발생시킬 가능성이 높은지 예측할 수는 없습니다. 항정신병 약물 제제가 지연성 운동 이상증을 유발할 가능성이 서로 다른지 여부는 알려져 있지 않습니다.
지연성 운동 이상증의 위험과 그것이 비가역적으로 될 가능성은 치료 기간과 누적 용량에 따라 증가합니다. 이 증후군은 비교적 짧은 치료 기간 후에도 저용량에서 발생할 수 있습니다. 또한 치료 중단 후에도 발생할 수 있습니다.
항정신병 치료를 중단하면 지연성 운동 이상증이 부분적 또는 완전히 회복될 수 있습니다. 그러나 항정신병 치료 자체는 증후군의 징후와 증상을 억제(또는 부분적으로 억제)하여 기저 과정을 가릴 수 있습니다. 증상 억제가 지연성 운동 이상증의 장기적 경과에 미치는 영향은 알려져 있지 않습니다.
이러한 고려 사항을 고려하여 VRAYLAR는 지연성 운동 이상증의 위험을 줄일 가능성이 가장 높은 방식으로 처방해야 합니다. 만성 항정신병 치료는 일반적으로 다음과 같은 환자에게만 예약해야 합니다. 1) 항정신병 약물에 반응하는 것으로 알려진 만성 질환을 앓고 있는 환자; 2) 대체 가능하고 효과적이지만 잠재적으로 해가 적은 치료법을 사용할 수 없거나 적절하지 않은 환자. 만성 치료가 필요한 환자의 경우 만족스러운 임상적 반응을 얻는 데 필요한 최저 용량과 최단 기간의 치료를 사용해야 합니다. 치료의 지속적인 필요성을 주기적으로 재평가해야 합니다.
VRAYLAR를 복용하는 환자에게 지연성 운동 이상증의 징후와 증상이 나타나는 경우 약물 중단을 고려해야 합니다. 그러나 일부 환자는 증후군이 있음에도 불구하고 VRAYLAR 치료가 필요할 수 있습니다.
5.6
늦게 나타나는 이상 반응
이상 반응은 VRAYLAR 치료 시작 후 몇 주 후에 처음 나타날 수 있으며, 이는 카리프라진과 주요 대사산물의 혈장 농도가 시간이 지남에 따라 축적되기 때문일 가능성이 높습니다. 결과적으로 단기 시험에서의 이상 반응 발생률은 장기간 노출 후의 발생률을 반영하지 않을 수 있습니다 [용법 및 용량 (2.1), 이상 반응 (6.1), 임상 약리학 (12.3)]를 참조하십시오.
추체외로 증상(EPS) 또는 아카시시아를 포함한 이상 반응과 환자의 반응을 환자가 VRAYLAR를 시작한 후 몇 주 동안 그리고 각 용량 증가 후에 모니터링해야 합니다. 용량 감소 또는 약물 중단을 고려하십시오.
5.7
대사 변화
VRAYLAR을 포함한 비정형 항정신병 약물은 고혈당, 당뇨병, 이상지질혈증 및 체중 증가를 포함한 대사 변화를 유발했습니다. VRAYLAR로 치료받은 환자에게서 고혈당이 보고되었습니다. 현재까지 이 계열의 모든 약물에서 어느 정도의 대사 변화가 나타나는 것으로 나타났지만, 각 약물마다 고유한 위험 프로파일이 있습니다.
고혈당 및 당뇨병
비정형 항정신병 약물로 치료받은 환자에게서 케톤산증 또는 고삼투성 혼수 또는 사망과 관련된 경우도 있는 고혈당이 보고되었습니다. 항정신병 약물 투여 시작 전 또는 직후 공복 혈당을 평가하고 장기 치료 중에는 주기적으로 모니터링하십시오.
정신분열병
성인 정신분열병 환자를 대상으로 한 6주간의 위약 대조 시험에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL)으로, 그리고 경계선(≥100 및 <126 mg/dL)에서 고혈당으로 변화한 환자의 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다. 장기간 개방표지 정신분열병 연구에서 정상 헤모글로빈 A1c 기준치를 가진 환자의 4%에서 상승된 수치(≥ 6.5%)가 나타났습니다.
양극성 장애
성인 양극성 장애(조증 또는 우울증) 환자를 대상으로 최대 8주간 진행된 6건의 위약 대조 시험에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL)으로, 그리고 경계선(≥100 및 <126 mg/dL)에서 고혈당으로 변화한 환자의 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다. 장기간 개방표지 양극성 장애 연구에서 정상 헤모글로빈 A1c 기준치를 가진 환자의 4%에서 상승된 수치(≥ 6.5%)가 나타났습니다.
주요 우울 장애의 추가 치료
성인 주요 우울 장애 환자를 대상으로 한 6주간의 위약 대조 시험 2건에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL)으로 변화한 환자의 비율은 VRAYLAR 3mg/일 + 항우울제 요법군(3.2%)에서 VRAYLAR 1.5mg/일 + 항우울제 요법군(2%) 또는 위약 치료군(1.3%)보다 가장 높았습니다. 정상에서 경계선(≥100 및 <126 mg/dL)으로 또는 경계선에서 고혈당으로 변화한 환자의 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다. 장기간 개방표지 주요 우울 장애 추가 치료 연구에서 정상 헤모글로빈 A1c 기준치를 가진 환자의 7%에서 상승된 수치(> 6%)가 나타났습니다.
성인 주요 우울 장애 환자를 대상으로 한 8주간의 위약 대조 시험 1건에서 시험 종료 시점까지 기준치에서의 공복 혈당 변화는 VRAYLAR 및 위약 + 항우울제 요법 치료군에서 유사했습니다. 8주간의 시험 기간 동안 혈청 인슐린 수치는 VRAYLAR 1mg~2mg/일군에서 12 pmol/L, VRAYLAR 2mg~4.5mg/일군에서 20 pmol/L, 위약군에서 8.5 pmol/L 증가했습니다.
이상지질혈증
비정형 항정신병 약물은 지질에 부정적인 변화를 일으킵니다. 항정신병 약물 투여 시작 전 또는 직후 기준치에서 공복 지질 프로필을 얻고 치료 중에는 주기적으로 모니터링하십시오.
정신분열병
성인 정신분열병 환자를 대상으로 한 6주간의 위약 대조 시험에서 공복 총 콜레스테롤, LDL, HDL 및 트리글리세리드 변화 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다.
양극성 장애
성인 양극성 장애(조증 또는 우울증) 환자를 대상으로 최대 8주간 진행된 6건의 위약 대조 시험에서 공복 총 콜레스테롤, LDL, HDL 및 트리글리세리드 변화 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다.
주요 우울 장애의 추가 치료
성인 주요 우울 장애 환자를 대상으로 한 6주간의 위약 대조 시험 2건에서 총 콜레스테롤, 공복 LDL, HDL 및 공복 트리글리세리드 변화 비율은 VRAYLAR로 치료받은 환자와 위약을 투여받은 환자에서 유사했습니다.
체중 증가
VRAYLAR을 포함한 비정형 항정신병 약물 사용과 함께 체중 증가가 관찰되었습니다. 기준치에서 체중을 모니터링하고 그 이후로 자주 모니터링하십시오. 표 4, 5, 6 및 7은 각각 6주간의 정신분열병 시험, 3주간의 양극성 조증 시험, 6주간 및 8주간의 양극성 우울증 시험 및 6주간 및 8주간의 주요 우울 장애 추가 치료 시험에서 기준치부터 종료 시점까지 발생한 체중 변화를 보여줍니다.
| VRAYLAR* | ||||
| 위약 (N=573) |
1.5 – 3 mg/일 (N=512) |
4.5 – 6 mg/일 (N=570) |
9 – 12⸰ mg/일 (N=203) |
|
| 종료 시점 평균 변화 | +0.3 | +0.8 | +1 | +1 |
| 체중 증가 비율 (≥7%) | 5% | 8% | 8% | 17% |
*모달 일일 용량(환자당 가장 빈번하게 투여되는 용량으로 정의)으로 표시된 데이터
⸰최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
조현병 환자를 대상으로 한 장기간 무작위 대조 시험에서 VRAYLAR의 12주, 24주, 48주 시점의 체중 변화(기준치 대비 평균)는 각각 1.2kg, 1.7kg, 2.5kg이었습니다.
| VRAYLAR* | |||
| 플라시보 (N=439) |
3 – 6 mg/day (N=259) |
9 – 12⸰ mg/day (N=360) |
|
| 종점 시점 평균 변화 | +0.2 | +0.5 | +0.6 |
| 체중 증가 (≥7%) 환자 비율 | 2% | 1% | 3% |
*모달 일일 용량(환자당 가장 빈번하게 투여되는 용량으로 정의)으로 표시된 데이터
⸰최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
| VRAYLAR | |||
| 플라시보 | 1.5 mg/day | 3 mg/day | |
| (N=463) | (N=467) | (N=465) | |
| 종점 시점 평균 변화 | -0.1 | +0.7 | +0.4 |
| 체중 증가 (≥7%) 환자 비율 | 1% | 3% | 3% |
| VRAYLAR | |||
| 6주 시험 | 플라시보 +ADT | 1.5 mg/day +ADT | 3 mg/day +ADT |
| (N=503) | (N=502) | (N=503) | |
| 종점 시점 평균 변화 | +0.2 | +0.7 | +0.7 |
| 체중 증가 (≥7%) 환자 비율 | 1% | 2% | 2% |
| 8주 시험 | 플라시보 + ADT (N=266) |
1 to 2 mg/day + ADT (N=273) |
2 to 4.5 mg/day + ADT (N=273) |
| 종점 시점 평균 변화 | 0 | +0.9 | +0.9 |
| 체중 증가 (≥7%) 환자 비율 | 2% | 2% | 3% |
장기간, MDD의 추가 치료를 위한 공개 표지 연구에서, 체중 증가로 인해 2명의 환자(0.6%)가 치료를 중단했습니다. VRAYLAR는 26주차에 기준치 대비 평균 체중 변화 1.7kg과 관련이 있었습니다. 장기간, MDD의 추가 치료를 위한 공개 표지 연구에서, 환자의 19%가 체중이 ≥7% 증가했고, 5%는 체중이 ≥7% 감소했습니다.
5.8
백혈구 감소증, 호중구 감소증 및 무과립구증
VRAYLAR을 포함한 항정신병 약물 치료 중 백혈구 감소증과 호중구 감소증이 보고되었습니다. 다른 계열 약물에서 무과립구증(치명적인 경우 포함)이 보고되었습니다.
백혈구 감소증과 호중구 감소증의 가능한 위험 요인에는 기존의 낮은 백혈구 수(WBC) 또는 절대 호중구 수(ANC) 및 약물 유발 백혈구 감소증 또는 호중구 감소증의 병력이 포함됩니다. 기존의 낮은 WBC 또는 ANC 또는 약물 유발 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자의 경우, 치료 초기 몇 달 동안 자주 완전 혈구 수(CBC) 검사를 실시하십시오. 이러한 환자의 경우, 다른 원인이 없는 상황에서 WBC의 임상적으로 유의미한 감소의 첫 징후가 나타나면 VRAYLAR 투여 중단을 고려하십시오.
임상적으로 유의미한 호중구 감소증이 있는 환자의 경우 발열 또는 기타 감염 증상이나 징후를 모니터링하고 이러한 증상이나 징후가 나타나면 즉시 치료하십시오. 절대 호중구 수 < 1000/mm3인 환자의 경우 VRAYLAR 투여를 중단하고 회복될 때까지 WBC를 추적 관찰하십시오.
5.9
기립성 저혈압 및 실신
비정형 항정신병 약물은 기립성 저혈압과 실신을 유발합니다. 일반적으로 위험은 초기 용량 적정 중과 용량 증가 시 가장 큽니다. VRAYLAR 임상 시험에서 증상이 있는 기립성 저혈압은 빈번하지 않았으며, 위약보다 VRAYLAR에서 더 빈번하지 않았습니다. 실신은 관찰되지 않았습니다.
저혈압에 취약한 환자(예: 노인 환자, 탈수 환자, 저혈량 환자 및 항고혈압제 병용 치료 환자), 알려진 심혈관 질환 환자(심근 경색, 허혈성 심장 질환, 심부전 또는 전도 이상 병력), 뇌혈관 질환 환자의 경우 기립성 활력 징후를 모니터링해야 합니다. VRAYLAR는 최근 심근 경색 또는 불안정한 심혈관 질환 병력이 있는 환자에게 평가되지 않았습니다. 이러한 환자는 시판 전 임상 시험에서 제외되었습니다.
5.10
낙상
VRAYLAR을 포함한 항정신병 약물은 졸음, 기립성 저혈압, 운동 및 감각 불안정을 유발하여 낙상 및 그에 따른 골절 또는 기타 부상으로 이어질 수 있습니다. 이러한 효과를 악화시킬 수 있는 질병, 상태 또는 약물이 있는 환자의 경우, 항정신병 치료를 시작할 때 그리고 장기간 항정신병 치료를 받는 환자의 경우 반복적으로 낙상 위험 평가를 완료하십시오.
5.11
발작
다른 항정신병 약물과 마찬가지로 VRAYLAR는 발작을 유발할 수 있습니다. 이 위험은 발작 병력이 있거나 발작 역치를 낮추는 상태가 있는 환자에게 가장 큽니다. 발작 역치를 낮추는 상태는 고령 환자에게 더 흔할 수 있습니다.
5.12
인지 및 운동 장애 가능성
VRAYLAR은 다른 항정신병 약물과 마찬가지로 졸음을 유발할 수 있으며 판단력, 사고력 또는 운동 기술을 손상시킬 가능성이 있습니다.
6주간의 조현병 임상 시험에서, 졸음(과다 수면, 진정 및 졸음)은 VRAYLAR 치료 환자의 7%에서 보고된 반면, 위약 치료 환자의 경우 6%였습니다. 3주간의 양극성 조증 임상 시험에서, 졸음은 VRAYLAR 치료 환자의 8%에서 보고된 반면, 위약 치료 환자의 경우 4%였습니다. 6주간 및 8주간의 양극성 I 장애의 우울증 에피소드 임상 시험 두 건에서, VRAYLAR 치료 환자의 7%가 졸음을 보고했고, 위약 치료 환자의 경우 4%였습니다. 6주간의 주요 우울 장애 추가 치료 임상 시험에서, 졸음은 VRAYLAR 치료 환자의 6%에서 보고된 반면, 위약 치료 환자의 경우 4%였습니다. 8주간의 주요 우울 장애 추가 치료 임상 시험 한 건에서, 졸음은 VRAYLAR 치료 환자의 11%에서 보고된 반면, 위약 치료 환자의 경우 6%였습니다.
VRAYLAR 치료가 자신에게 부정적인 영향을 미치지 않는다고 합리적으로 확신할 때까지 위험한 기계(자동차 포함)를 작동하지 않도록 환자에게 주의를 주어야 합니다.
5.13
체온 조절 장애
비정형 항정신병 약물은 신체의 심부 체온을 낮추는 능력을 방해할 수 있습니다. 격렬한 운동, 극심한 열에 대한 노출, 탈수 및 항콜린성 약물은 심부 체온 상승에 기여할 수 있습니다. 이러한 상태를 경험할 수 있는 환자에게는 VRAYLAR을 주의해서 사용하십시오.
5.14
연하곤란
식도 운동 장애 및 흡인은 항정신병 약물 사용과 관련이 있습니다. VRAYLAR에서 연하곤란이 보고되었습니다. VRAYLAR 및 기타 항정신병 약물은 흡인 위험이 있는 환자에게 주의해서 사용해야 합니다.
6 부작용 반응
다음의 유해 반응은 이 약물 설명서의 다른 부분에서 더 자세히 설명하고 있습니다.
- 치매 관련 정신병이 있는 고령 환자의 사망률 증가 [경고 및 경고 및 주의사항 (5.1)]
- 자살 생각 및 행동 [경고 및 경고 및 주의사항 (5.2)]
- 치매 관련 정신병이 있는 고령 환자의 뇌혈관계 유해 반응(뇌졸중 포함) [경고 및 주의사항 (5.3)]
- 악성 신경이완제 증후군 [경고 및 주의사항 (5.4)]
- 지연성 운동 이상 [경고 및 주의사항 (5.5)]
- 늦게 발생하는 유해 반응[경고 및 주의사항 (5.6)]
- 대사 변화 [경고 및 주의사항 (5.7)]
- 백혈구 감소증, 호중구 감소증 및 무과립구증 [경고 및 주의사항 (5.8)]
- 기립성 저혈압 및 실신 [경고 및 주의사항 (5.9)]
- 낙상 [경고 및 주의사항 (5.10)]
- 발작 [경고 및 주의사항 (5.11)]
- 인지 및 운동 장애 가능성 [경고 및 주의사항 (5.12)]
- 체온 조절 장애 [경고 및 주의사항 (5.13)]
- 연하곤란 [경고 및 주의사항 (5.14)]
6.1
임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
아래 정보는 VRAYLAR의 임상 연구 통합 데이터베이스에서 얻은 것으로, 위약 대조 연구에서 정신분열병, 조증 또는 혼합 에피소드(조울증 1형 관련), 조울증 우울증 및 주요 우울 장애의 보조 치료를 위해 VRAYLAR을 한 번 이상 복용한 6,722명의 성인 환자를 대상으로 합니다. 이 경험은 총 1,182.8 환자-연에 해당합니다. 총 4,329명의 VRAYLAR 치료 환자는 최소 6주 이상, 296명의 VRAYLAR 치료 환자는 최소 48주 이상 노출되었습니다.
정신분열병 환자
다음 결과는 VRAYLAR 용량이 1.5mg~12mg 1일 1회인 4건의 위약 대조 6주 정신분열병 임상 시험을 기반으로 합니다. 최대 권장 용량은 1일 6mg입니다.
치료 중단과 관련된 유해 반응: VRAYLAR 치료 환자에서 2% 이상 발생하고 위약군보다 최소 2배 이상 높은 비율로 발생하여 치료 중단으로 이어진 단일 유해 반응은 없었습니다.
흔한 유해 반응 (≥ 5%이고 위약군보다 최소 2배 이상 높은 비율): 추체외로 증상 및 아카시지아.
어떤 용량에서든지 발생률이 ≥ 2%이고 위약보다 높은 유해 반응은 표 8에 나와 있습니다.
| VRAYLAR* | ||||
| 시스템 장기 계급 / 선호 용어 |
위약 (N= 584) (%) |
1.5~3mg/일 (N=539) (%) |
4.5~6mg/일 (N=575) (%) |
9~12mg/일⸰ (N=203) (%) |
| 심장 질환s | ||||
| Tachycardiaa | 1 | 2 | 2 | 3 |
| 위장관 장애 | ||||
| 복통b | 5 | 3 | 4 | 7 |
| 변비 | 5 | 6 | 7 | 10 |
| 설사c | 3 | 1 | 4 | 5 |
| 구강건조 | 2 | 1 | 2 | 3 |
| 소화불량 | 4 | 4 | 5 | 5 |
| 오심 | 5 | 5 | 7 | 8 |
| 치통 | 4 | 3 | 3 | 6 |
| 구토 | 3 | 4 | 5 | 5 |
| 일반장애/투여부위 상태 | ||||
| 피로d | 1 | 1 | 3 | 2 |
| 감염 및 기생충 감염 | ||||
| 비인두염 | 1 | 1 | 1 | 2 |
| 요로감염 | 1 | 1 | <1 | 2 |
| 검사 | ||||
| 혈중 크레아틴 인산 키나아제 증가 | 1 | 1 | 2 | 3 |
| 간 효소 증가e | <1 | 1 | 1 | 2 |
| 체중 증가 | 1 | 3 | 2 | 3 |
| 대사 및 영양 장애 | ||||
| 식욕 감퇴 | 2 | 1 | 3 | 2 |
| 근골격계 및 결합조직 장애 | ||||
| 관절통 | 1 | 2 | 1 | 2 |
| 요통 | 2 | 3 | 3 | 1 |
| 사지통 | 3 | 2 | 2 | 4 |
| 신경계 장애 | ||||
| 아카시시아 | 4 | 9 | 13 | 14 |
| 추체외로 증상f | 8 | 15 | 19 | 20 |
| 두통g | 13 | 9 | 11 | 18 |
| 졸음h | 5 | 5 | 8 | 10 |
| 현기증 | 2 | 3 | 5 | 5 |
| 정신장애 | ||||
| 불안 | 4 | 3 | 5 | 3 |
| 불면증i | 11 | 12 | 13 | 11 |
| 불안정 | 3 | 4 | 6 | 5 |
| 불안 | 4 | 6 | 5 | 3 |
| 호흡기, 흉부 및 종격 장애 | ||||
| 기침 | 2 | 1 | 2 | 4 |
| 피부 및 피하 조직 장애 | ||||
| 발진 | 1 | <1 | 1 | 2 |
| 혈관 장애 | ||||
| 고혈압j | 1 | 2 | 3 | 6 |
참고: 수치는 가장 가까운 정수로 반올림
* 환자당 가장 빈번하게 투여된 용량으로 정의된 최빈 일일 용량에 의해 표시된 데이터
a빈맥 용어: 심박수 증가, 동성 빈맥, 빈맥
b복통 용어: 복부 불편감, 복통, 하복통, 상복통, 위장통
c설사 용어: 설사, 잦은 배변
d피로 용어: 쇠약, 피로
e간 효소 증가 용어: 알라닌 아미노전달효소 증가, 아스파르트산 아미노전달효소 증가, 간 효소 증가
f추체외로 증상 용어: 서동증, 톱니바퀴 강직, 타액 분비, 운동 이상, 이긴장증, 추체외로 장애, 저운동증, 가면 얼굴, 근육 강직, 근육 긴장, 근골격계 강직, 안구 회전 발작, 구강 악안면 이긴장증, 파킨슨병, 타액 과다 분비, 지연성 운동 이상, 사경, 진전, 악관절 강직
g두통 용어: 두통, 긴장성 두통
h졸음 용어: 과다 수면, 진정, 졸음
i불면증 용어: 초기 불면증, 불면증, 중간 불면증, 말기 불면증
j고혈압 용어: 이완기 혈압 상승, 혈압 상승, 수축기 혈압 상승, 고혈압
⸰ 최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
조울증 환자
다음 결과는 3~12mg의 VRAYLAR을 1일 1회 투여하는 3주간의 위약 대조 조울증 삽화 임상시험 3건을 기반으로 합니다. 최대 권장 용량은 1일 6mg입니다.
치료 중단과 관련된 이상 반응: VRAYLAR 치료 환자에서 2% 이상의 비율로 발생하고 위약 대비 최소 2배 이상의 비율로 발생한 치료 중단으로 이어진 이상 반응은 아카시지아(2%)였습니다. 전반적으로 VRAYLAR을 투여받은 환자의 12%가 이상 반응으로 인해 치료를 중단한 반면, 이러한 임상시험에서 위약 치료 환자는 7%였습니다.
흔한 이상 반응(≥ 5% 및 위약 대비 최소 2배 이상의 비율): 추체외로 증상, 아카시지아, 소화 불량, 구토, 졸음 및 불안.
어떤 용량에서든지 2% 이상의 발생률을 보이고 위약보다 높은 이상 반응은 표 9에 나와 있습니다.
| VRAYLAR* | ||||
| 시스템 장기 계급 / 선호 용어 |
위약 (N= 442) (%) |
3~6 mg/일 (N=263) (%) |
9~12 mg/일⸰ (N=360) (%) |
|
| 심장 질환 | ||||
| 빈맥a | 1 | 2 | 1 | |
| 안과 질환 | ||||
| 시력 흐림 | 1 | 4 | 4 | |
| 위장관 질환 | ||||
| 오심 | 7 | 13 | 11 | |
| 변비 | 5 | 6 | 11 | |
| 구토 | 4 | 10 | 8 | |
| 구강 건조 | 2 | 3 | 2 | |
| 소화 불량 | 4 | 7 | 9 | |
| 복통b | 5 | 6 | 8 | |
| 설사c | 5 | 5 | 6 | |
| 치통 | 2 | 4 | 3 |
| 일반 장애/투여 부위 상태 | |||
| 피로d | 2 | 4 | 5 |
| 발열e | 2 | 1 | 4 |
| 검사 | |||
| 혈중 크레아틴 인산 키나아제 증가 | 2 | 2 | 3 |
| 간 효소 증가f | <1 | 1 | 3 |
| 체중 증가 | 2 | 2 | 3 |
| 대사 및 영양 장애 | |||
| 식욕 감퇴 | 3 | 3 | 4 |
| 근골격계 및 결합 조직 장애 | |||
| 사지 통증 | 2 | 4 | 2 |
| 요통 | 1 | 1 | 3 |
| 신경계 장애 | |||
| 아카시시아 | 5 | 20 | 21 |
| 추체외로 증상g | 12 | 26 | 29 |
| 두통h | 13 | 14 | 13 |
| 현기증 | 4 | 7 | 6 |
| 졸음i | 4 | 7 | 8 |
| 정신 장애 | |||
| 불면증j | 7 | 9 | 8 |
| 불안 | 2 | 7 | 7 |
| 호흡기, 흉부 및 종격동 장애 | |||
| 구인두 통증 | 2 | 1 | 3 |
| 혈관 장애 | |||
| 고혈압k | 1 | 5 | 4 |
참고: 수치는 가장 가까운 정수로 반올림
*환자당 가장 빈번하게 투여된 용량으로 정의된 최빈 일일 용량으로 표시된 데이터
a빈맥 용어: 심박수 증가, 동성 빈맥, 빈맥
b복통 용어: 복부 불편감, 복통, 상복부 통증, 복부 압통,
c설사: 설사, 잦은 배변
d피로 용어: 무력증, 피로
e발열 용어: 체온 상승, 발열
f간 효소 증가 용어: 알라닌 아미노전달효소 증가, 아스파르트산 아미노전달효소 증가, 간 효소 증가, 트랜스아미나제 증가
g추체외로 증상 용어: 무운동증, 타액 분비 과다, 운동 이상, 이긴장증, 추체외로 장애, 저운동증, 근육 강직, 근육 긴장, 근골격계 강직, 구강 악안면 이긴장증, 파킨슨증, 타액 과다 분비, 진전
h두통 용어: 두통, 긴장성 두통
i졸음 용어: 과다 수면, 진정, 졸음
j불면증 용어: 초기 불면증, 불면증, 중간 불면증
k고혈압 용어: 이완기 혈압 상승, 혈압 상승, 고혈압
⸰ 최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
조울증 환자
다음 결과는 VRAYLAR 1.5mg 및 3mg 1일 1회 용량을 사용한 6주 2건 및 8주 1건의 위약 대조 조울증 임상 시험을 기반으로 합니다.
치료 중단과 관련된 이상 반응: VRAYLAR 치료 환자에서 2% 이상의 발생률로 나타나고 위약 대비 최소 2배 이상의 발생률을 보이는 치료 중단으로 이어지는 이상 반응은 없었습니다. 전반적으로 VRAYLAR을 투여받은 환자의 6%가 이상 반응으로 인해 치료를 중단한 반면, 이러한 임상 시험에서 위약 투여 환자는 5%였습니다.
흔한 이상 반응 (≥ 5% 및 위약 대비 최소 2배 이상의 발생률): 메스꺼움, 아카시시아, 불안, 추체외로 증상.
1.5mg 또는 3mg 용량에서 2% 이상의 발생률을 보이고 위약보다 높은 발생률을 보이는 이상 반응은 표 10에 나와 있습니다.
| VRAYLAR | |||
| 위약 (N=468) (%) |
1.5mg/일 (N=470) (%) |
3mg/일 (N=469) (%) |
|
| 불안 | 3 | 2 | 7 |
| 아카시시아 | 2 | 6 | 10 |
| 추체외로 증상a | 2 | 4 | 6 |
| 현기증 | 2 | 4 | 3 |
| 졸음b | 4 | 7 | 6 |
| 메스꺼움 | 3 | 7 | 7 |
| 식욕 증가 | 1 | 3 | 3 |
| 체중 증가 | <1 | 2 | 2 |
| 피로c | 2 | 4 | 3 |
| 불면증d | 7 | 7 | 10 |
a추체외로 증상 용어: 무운동증, 타액 분비 과다, 운동 이상, 이긴장증, 추체외로 장애, 저운동증, 근육 긴장, 근골격계 강직, 근간대성 경련, 안구 회전 발작, 타액 과다 분비, 지연성 운동 이상, 진전
b졸음 용어: 과다 수면, 진정, 졸음
c피로 용어: 무력증, 피로, 불쾌감
d불면증 용어: 초기 불면증, 불면증, 다른 정신 질환과 관련된 불면증, 중간 불면증, 수면 장애, 말기 불면증
주요 우울 장애의 병용 요법
다음 결과는 VRAYLAR 1.5mg 및 3mg 1일 1회 복용량과 항우울제 병용 투여에 대한 위약 대조, 고정 용량 6주 시험 2건과 VRAYLAR (1~2mg) 및 (2~4.5mg) 1일 1회 복용량과 항우울제 병용 투여에 대한 위약 대조, 가변 용량 8주 시험 1건을 기반으로 합니다 (주요 우울 장애의 병용 요법).
치료 중단과 관련된 이상 반응: VRAYLAR 투여 환자에서 2% 이상 발생하고 위약 대비 최소 2배 이상 높은 비율로 발생한 치료 중단으로 이어진 이상 반응은 아카시지아(2%)였습니다. 전반적으로, 이러한 시험에서 VRAYLAR을 투여받은 환자의 6%가 이상 반응으로 인해 치료를 중단한 반면, 위약 투여 환자는 3%였습니다.
흔한 이상 반응 (≥ 5% 및 위약 대비 최소 2배 이상의 비율): 아카시지아, 오심, 불면증은 6주 고정 용량 시험 2건에서 발생했습니다. 아카시지아, 불안, 피로, 변비, 오심, 식욕 증가, 어지러움, 불면증 및 추체외로 증상은 8주 가변 용량 시험 1건에서 발생했습니다.
1.5mg 또는 3mg 용량에서 2% 이상 발생하고 위약보다 높은 발생률을 보인 이상 반응은 표 11에 나와 있습니다.
| 시스템 기관 계급/ 선호 용어 |
위약 + ADT (N=503) (%) |
VRAYLAR | |
| 1.5mg/일 + ADT (N=502) (%) |
3mg/일 + ADT (N=503) (%) |
||
| 안과 질환 | |||
| 시력 흐림 | <1 | <1 | 2 |
| 위장관 질환 | |||
| 오심 | 3 | 7 | 6 |
| 구강 건조 | 2 | 3 | 3 |
| 변비 | 1 | 2 | 2 |
| 구토 | 1 | 1 | 2 |
| 일반 장애 | |||
| 피로 | 2 | 3 | 3 |
| 검사 | |||
| 체중 증가 | 1 | 2 | 2 |
| 신경계 장애 | |||
| 아카시지아a | 2 | 7 | 10 |
| 졸음b | 4 | 5 | 7 |
| 추체외로 증상c |
4 | 5 | 6 |
| 정신 장애 | |||
| 불면증d | 5 | 9 | 10 |
| 불안 | 2 | 4 | 4 |
| 불안감 | 1 | 2 | 1 |
| 피부 및 피하 조직 장애 | |||
| 다한증 | 1 | 1 | 2 |
참고: 수치는 가장 가까운 정수로 반올림
a아카시시아 용어: 아카시시아, 정신운동 과다 활동, 안절부절못함, 불안, 긴장
b졸음 용어: 과다수면, 진정, 무기력, 졸음
c추체외로 증상 용어: 타액 분비 과다, 운동 이상, 추체외로 장애, 저긴장증, 불수의 근육 수축, 근육 강직, 근육 경련, 근육 긴장, 근육 경련, 근골격계 강직, 근간대성 경련, 구강악안면 이긴장증, 파킨슨병, 안정 시 진전, 불안한 다리 증후군, 경직된 다리 증후군, 타액 과다 분비, 뻣뻣한 혀, 지연성 운동 이상, 진전, 악관절 경련
d불면증 용어: 초기 불면증, 불면증, 중간 불면증, 수면 질 저하, 수면 장애, 말기 불면증
1mg~2mg/일 또는 2mg~4.5mg/일 용량에서 위약보다 발생률이 ≥2% 더 높은 이상 반응은 표 12에 나와 있습니다.
| 시스템 기관 계급/선호 용어 | 위약 + ADT (N=266) (%) |
VRAYLAR 1~2mg/일 + ADT (N=273) (%) |
VRAYLAR 2~4.5mg/일 + ADT (N=273) (%) |
|
| 심장 질환 | ||||
| 두근거림 | 1 | 2 | <1 | |
| 안과 질환 | ||||
| 시력 흐림 | 1 | 1 | 4 | |
| 위장 장애 | ||||
| 메스꺼움 | 5 | 7 | 13 | |
| 변비 | 2 | 2 | 5 | |
| 구강 건조 | 3 | 5 | 4 | |
| 구토 | <1 | 1 | 3 | |
| 일반 장애 | ||||
| 피로 | 4 | 7 | 10 | |
| 부종 | <1 | 2 | 1 | |
| 감염 | ||||
| 비인두염 | 2 | 4 | 1 | |
| 검사 | ||||
| 식욕 증가 | 2 | 2 | 5 | |
| 체중 증가 | 1 | 2 | 3 | |
| 근골격계 및 결합 조직 장애 | ||||
| 요통 | 1 | 2 | 3 | |
| Myalgia | 0 | 1 | 2 |
| 신경계 장애 | |||
| Akathisiaa | 3 | 8 | 23 |
| Extrapyramidal symptomsb | 5 | 12 | 18 |
| Somnolencec | 6 | 10 | 11 |
| Dizziness | 2 | 4 | 5 |
| 정신 장애 | |||
| Insomniad | 8 | 14 | 16 |
| Restlessness | 3 | 8 | 8 |
| Agitation | <1 | <1 | 3 |
| Anxiety | <1 | 1 | 3 |
a아카시시아 관련 용어: 아카시시아, 불안감, 신경과민, 긴장
b추체외로 증상 관련 용어: 기어가는 강직, 타액 분비 과다, 운동 이상, 추체외로 장애, 고장력, 턱 경직, 불수의 근육 수축, 근육 장애, 근육 강직, 근육 경련, 근육 긴장, 근육 경련, 근골격계 강직, 항강직, 파킨슨병, 정신 운동 지체, 얼굴 표정 감소, 안정 시 진전, 불안한 다리 증후군, 무거움 감각, 타액 과다 분비, 진전
c졸음 관련 용어: 과다 수면, 진정, 무기력증, 졸음
d불면증 관련 용어: 초기 불면증, 불면증, 중간 불면증, 말기 불면증, 수면 장애, 수면 질 저하
이상 운동증
근육군의 장기간 비정상적인 수축인 이상 운동증 증상은 치료 시작 후 처음 몇 일 동안 민감한 개인에게 발생할 수 있습니다. 이상 운동증 증상에는 경부 근육의 경련(때로는 인후의 긴장으로 진행), 삼키기 어려움, 호흡 곤란 및/또는 혀 돌출이 포함됩니다. 이러한 증상은 저용량에서 발생할 수 있지만, 고활성 및 고용량의 1세대 항정신병 약물에서 더 자주 그리고 더 심각하게 발생합니다. 급성 이상 운동증의 위험이 높은 것은 남성과 젊은 연령대에서 관찰됩니다.
추체외로 증상(EPS) 및 아카시시아
정신분열병, 양극성 조증, 양극성 우울증 및 주요 우울 장애의 보조 치료 시험에서, 치료로 인한 EPS(파킨슨병)(기준선에서 SAS 총점 ≤ 3 및 기준선 이후 > 3)에 대한 Simpson Angus Scale(SAS)과 치료로 인한 아카시시아(기준선에서 BARS 총점 ≤ 2 및 기준선 이후 > 2)에 대한 Barnes Akathisia Rating Scale(BARS)을 사용하여 데이터를 객관적으로 수집했습니다.
6주 정신분열병 시험에서 아카시시아 및 불안을 제외한 추체외로 증상(EPS)과 관련된 보고된 이상 반응의 발생률은 VRAYLAR 치료 환자의 경우 17%, 위약 치료 환자의 경우 8%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 0.3%, 위약 치료 환자의 0.2%가 치료 중단되었습니다. 아카시시아의 발생률은 VRAYLAR 치료 환자의 경우 11%, 위약 치료 환자의 경우 4%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 0.5%, 위약 치료 환자의 0.2%가 치료 중단되었습니다.
3주 양극성 조증 시험에서 아카시시아 및 불안을 제외한 추체외로 증상(EPS)과 관련된 보고된 이상 반응의 발생률은 VRAYLAR 치료 환자의 경우 28%, 위약 치료 환자의 경우 12%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 1%, 위약 치료 환자의 0.2%가 치료 중단되었습니다. 아카시시아의 발생률은 VRAYLAR 치료 환자의 경우 20%, 위약 치료 환자의 경우 5%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 2%, 위약 치료 환자의 0%가 치료 중단되었습니다.
두 번의 6주 및 한 번의 8주 양극성 우울증 시험에서 아카시시아 및 불안을 제외한 EPS와 관련된 보고된 이상 반응의 발생률은 VRAYLAR 치료 환자의 경우 4%, 위약 치료 환자의 경우 2%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 0.4%, 위약 치료 환자의 0%가 치료 중단되었습니다. 아카시시아의 발생률은 VRAYLAR 치료 환자의 경우 8%, 위약 치료 환자의 경우 2%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 1.5%, 위약 치료 환자의 0%가 치료 중단되었습니다.
두 번의 6주 주요 우울 장애 보조 치료 시험에서 아카시시아 및 불안을 제외한 EPS와 관련된 보고된 이상 반응의 발생률은 VRAYLAR 치료 환자의 경우 6%, 위약 치료 환자의 경우 4%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 0.3%, 위약 치료 환자의 0.6%가 치료 중단되었습니다. 아카시시아 및 불안의 결합된 발생률은 VRAYLAR 치료 환자의 경우 12%, 위약 치료 환자의 경우 4%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 2%, 위약 치료 환자의 0.4%가 치료 중단되었습니다.
한 번의 8주 주요 우울 장애 보조 치료 시험에서 아카시시아 및 불안을 제외한 EPS와 관련된 보고된 이상 반응의 발생률은 VRAYLAR 치료 환자의 경우 12%, 위약 치료 환자의 경우 5%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 1%, 위약 치료 환자의 0.4%가 치료 중단되었습니다. 아카시시아 및 불안의 발생률은 VRAYLAR 치료 환자의 경우 22%, 위약 치료 환자의 경우 6%였습니다. 이러한 반응으로 VRAYLAR 치료 환자의 3%, 위약 치료 환자의 0.0%가 치료 중단되었습니다.
백내장
비임상 연구에서 백내장 발생이 관찰되었습니다 [비임상 독성학(13.2)참조]. 카리프라진의 시판 전 임상 시험 중에 백내장이 보고되었지만, 시험 기간이 카리프라진 사용과의 연관성을 평가하기에는 너무 짧았습니다.
활력 징후 변화
정신분열병이 있는 9~12mg/일 VRAYLAR 치료 환자의 앙와위 이완기 혈압 증가를 제외하고, 기준선부터 종점까지의 평균 변화에서 VRAYLAR 치료 환자와 위약 치료 환자 간에 앙와위 혈압 매개변수에 임상적으로 의미 있는 차이가 없었습니다.
6주 정신분열병 시험의 통합 데이터는 표 13에, 3주 양극성 조증 시험의 통합 데이터는 표 14에 나와 있습니다.
| 위약 (N=574) |
VRAYLAR* | |||
| 1.5 – 3 mg/day (N=512) |
4.5 – 6 mg/day (N=570) |
9 – 12 mg/day⸰ (N=203) |
||
| 앙와위 수축기 혈압 (mmHg) | +0.9 | +0.6 | +1.3 | +2.1 |
| 앙와위 이완기 혈압 (mmHg) | +0.4 | +0.2 | +1.6 | +3.4 |
* 환자별 가장 빈번하게 투여된 용량으로 정의된 모달 일일 용량에 따른 데이터 표시
⸰ 최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
| 플라시보 (N=439) |
VRAYLAR* | ||
| 3 – 6 mg/day (N=259) |
9 – 12 mg/day⸰ (N=360) |
||
| 앙와위 수축기 혈압 (mmHg) | -0.5 | +0.8 | +1.8 |
| 앙와위 이완기 혈압 (mmHg) | +0.9 | +1.5 | +1.9 |
* 모달 일일 용량에 의해 표시된 데이터는 환자당 가장 빈번하게 투여되는 용량으로 정의됨
⸰ 최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
6주 2건 및 8주 1건의 양극성 우울증 임상시험에서 VRAYLAR 치료 환자와 위약 치료 환자 간 기준치부터 종료 시점까지의 평균 변화에는 임상적으로 의미 있는 차이가 없었습니다. VRAYLAR 치료 환자의 앙와위 혈압은 0.1~0.3mmHg 증가했고, 위약 치료 환자의 앙와위 혈압은 0.2mmHg 증가했습니다.
6주 2건 및 8주 1건의 주요 우울 장애 병용 치료 임상시험에서 VRAYLAR 치료 환자와 위약 치료 환자 간 기준치부터 종료 시점까지의 평균 변화에는 임상적으로 의미 있는 차이가 없었습니다. 6주 임상시험 종료 시점에서 VRAYLAR 치료 환자의 앙와위 수축기 혈압은 0.1~0.7mmHg 감소했고, 위약 치료 환자의 앙와위 수축기 혈압은 0.1mmHg 감소했습니다. VRAYLAR 치료 환자의 앙와위 이완기 혈압은 0.1mmHg 증가했고, 위약 치료 환자의 앙와위 이완기 혈압은 0.2mmHg 증가했습니다.
검사치 변화
6주 조현병 임상시험에서 VRAYLAR 치료 환자의 경우 정상 참고 범위 상한의 ≥3배에 달하는 트랜스아미나제 상승 환자 비율은 용량에 따라 1~2%였으며, 위약 치료 환자의 경우 1%였습니다. 3주 양극성 조증 임상시험에서 VRAYLAR 치료 환자의 경우 정상 참고 범위 상한의 ≥3배에 달하는 트랜스아미나제 상승 환자 비율은 투여 용량군에 따라 2~4%였으며, 위약 치료 환자의 경우 2%였습니다. 6주 및 8주 양극성 우울증 임상시험에서 VRAYLAR 치료 환자의 경우 정상 참고 범위 상한의 ≥3배에 달하는 트랜스아미나제 상승 환자 비율은 투여 용량군에 따라 0~0.5%였으며, 위약 치료 환자의 경우 0.4%였습니다. 주요 우울 장애 병용 치료 6주 임상시험 2건에서 VRAYLAR 치료 환자의 경우 정상 참고 범위 상한의 ≥3배에 달하는 트랜스아미나제 상승 환자 비율은 투여 용량군에 따라 0~1%였으며, 위약 치료 환자의 경우 0%였습니다.
6주 조현병 임상시험에서 VRAYLAR 치료 환자의 경우 1000 U/L를 초과하는 크레아틴 키나제(CPK) 상승 환자 비율은 용량에 따라 4~6%였으며, 위약 치료 환자의 경우 4%였습니다. 3주 양극성 조증 임상시험에서 VRAYLAR 및 위약 치료 환자의 경우 1000 U/L를 초과하는 CPK 상승 환자 비율은 약 4%였습니다. 6주 및 8주 양극성 우울증 임상시험에서 VRAYLAR 치료 환자의 경우 1000 U/L를 초과하는 CPK 상승 환자 비율은 0.2~1%였으며, 위약 치료 환자의 경우 0.2%였습니다. 주요 우울 장애 병용 치료 6주 임상시험 2건에서 VRAYLAR 치료 환자의 경우 1000 U/L를 초과하는 CPK 상승 환자 비율은 0.6~0.8%였으며, 위약 치료 환자의 경우 0%였습니다.
VRAYLAR의 시판 전 평가 중 관찰된 기타 이상 반응
아래에 나열된 이상 반응은 시판 전 데이터베이스에 포함된 5,763명의 VRAYLAR 치료 환자 중 1일 1회 ≥1.5mg 용량으로 VRAYLAR을 투여받은 환자에게서 보고되었습니다. 나열된 반응은 임상적으로 중요할 수 있는 반응과 약리학적 또는 기타 근거로 약물과 관련이 있을 가능성이 있는 반응입니다. VRAYLAR 라벨의 다른 곳에 나와 있는 반응은 포함되지 않았습니다.
반응은 장기 계통별로 추가 분류되며, 다음 정의에 따라 빈도가 감소하는 순서대로 나열됩니다. 환자 100명 중 1명 이상에서 발생한 경우(빈번함) [위약 대조 연구의 표 형태 결과에 이미 나열되지 않은 것만 이 목록에 표시됨]; 환자 100명 중 1명에서 1,000명 중 1명 사이에서 발생한 경우(드물게); 환자 1,000명 중 1명 미만에서 발생한 경우(희귀함).
위장 장애: 드물게: 위식도 역류 질환, 위염
간담도 장애: 희귀함: 간염
대사 및 영양 장애: 빈번함: 식욕 감퇴; 희귀함: 저나트륨혈증
근골격 및 결합 조직 장애: 희귀함: 횡문근융해증
신경계 장애: 희귀함 허혈성 뇌졸중
정신 장애: 드물게: 자살 생각; 희귀함 자살 완료, 자살 시도
신장 및 비뇨기 장애: 드물게 빈뇨
피부 및 피하 조직 장애: 드물게: 다한증
6.2
시판 후 경험
다음과 같은 이상 반응이 VRAYLAR의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되었기 때문에, 그 빈도를 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
피부 및 피하 조직 장애 – Stevens-Johnson syndrome
7 약물 상호 작용
표 15는 VRAYLAR과의 임상적으로 중요한 약물 상호작용을 보여줍니다.
| 강력하거나 중등도의 CYP3A4 억제제 | |
| 임상적 영향: | VRAYLAR을 강력하거나 중등도의 CYP3A4 억제제와 병용하면 VRAYLAR 단독 사용과 비교하여 카리프라진과 주요 활성 대사체인 디데스메틸카리프라진(DDCAR)의 노출이 증가합니다 [임상 약리학( 12.3) 참조]. |
| 개입: | VRAYLAR을 강력하거나 중등도의 CYP3A4 억제제와 함께 사용하는 경우 VRAYLAR 용량을 줄입니다 [용법 및 용량 (2.6) 참조]. |
| CYP3A4 유도제 | |
| 임상적 영향: | CYP3A4는 카리프라진의 활성 대사체의 생성 및 제거에 관여합니다. CYP3A4 유도제가 VRAYLAR의 노출에 미치는 영향은 평가되지 않았으며, 그 순 영향은 불분명합니다 [임상 약리학 (12.3) 참조]. |
| 개입: | CYP3A4 유도제와 VRAYLAR의 병용은 권장되지 않습니다 [용법 및 용량 (2.1, 2.6) 참조]. |
8 특정 집단에서의 사용
8.1
임신
임신 노출 등록
임신 중 VRAYLAR에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록이 있습니다. 자세한 내용은 1-866-961-2388로 National Pregnancy Registry for Atypical Antipsychotics에 문의하거나 http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/를 방문하십시오.
위험 요약
임신 3기에 항정신병 약물에 노출된 신생아는 분만 후 추체외로 및/또는 금단 증상의 위험이 있습니다 (see Clinical Considerations). 선천적 결손증이나 유산에 대한 약물 관련 위험을 알리기 위해 임산부에서 VRAYLAR를 사용한 데이터는 없습니다. 카리프라진의 주요 활성 대사체인 DDCAR는 VRAYLAR 중단 후 최대 12주까지 성인 환자에서 검출되었습니다 [see Clinical Pharmacology (12.3)].
동물 데이터에 따르면 VRAYLAR는 태아에게 해를 끼칠 수 있습니다.
기관 형성 기간 동안 랫드에 카리프라진을 투여하면 최대 권장 용량(MRHD)인 6mg/일에서의 사람 노출량보다 낮은 약물 노출에서 기형, 새끼 생존율 감소 및 발달 지연이 발생했습니다. 그러나 카리프라진은 최대 4.6배 MRHD인 6mg/일 용량의 토끼에서는 기형 발생을 일으키지 않았습니다 [see Data].
표시된 집단에 대한 주요 선천적 결손증 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 결손증 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오.
임상적 고려 사항
태아/신생아 이상 반응
임신 3기에 항정신병 약물에 노출된 산모에게서 태어난 신생아에서 초조, 과긴장증, 저긴장증, 떨림, 졸음, 호흡 곤란 및 수유 장애를 포함한 추체외로 및/또는 금단 증상이 보고되었습니다. 이러한 증상은 중증도가 다양했습니다. 일부 신생아는 특별한 치료 없이 몇 시간 또는 며칠 내에 회복되었지만 다른 신생아는 장기 입원이 필요했습니다. 신생아의 추체외로 및/또는 금단 증상을 모니터링하고 증상을 적절하게 관리하십시오.
데이터
동물 데이터
기관 형성 기간 동안 임신한 랫드에 총 카리프라진(즉, 카리프라진, DCAR 및 DDCAR의 합)의 AUC를 기준으로 최대 권장 용량(MRHD)인 6mg/일의 0.2~3.5배인 0.5, 2.5 및 7.5mg/kg/일의 경구 용량으로 카리프라진을 투여하면 모든 용량에서 체중 감소, 수컷 생식기 거리 감소 및 구부러진 사지 뼈, 견갑골 및 상완골의 골격 기형을 포함한 태아 발달 독성이 발생했습니다. 이러한 영향은 모체 독성의 유무에 관계없이 발생했습니다. 체중 및 음식 섭취 감소로 관찰된 모체 독성은 총 카리프라진의 AUC를 기준으로 MRHD인 6mg/일의 1.2배 및 3.5배 용량에서 발생했습니다. 이러한 용량에서 카리프라진은 태아 외부 기형(국소 태아 흉부 부종), 내장 변이(발달되지 않은/저발달된 신장 유두 및/또는 팽창된 요도) 및 골격 발달 변이(구부러진 갈비뼈, 골화되지 않은 흉골)를 유발했습니다. 카리프라진은 태아 생존에 영향을 미치지 않았습니다.
임신 및 수유 기간 동안 임신한 랫드에 총 카리프라진의 AUC를 기준으로 MRHD인 6mg/일의 0.03~0.4배인 0.1, 0.3 및 1mg/kg/일의 경구 용량으로 카리프라진을 투여하면 총 카리프라진의 AUC를 기준으로 MRHD인 6mg/일의 0.4배 용량에서 모체 독성 없이 1세대 새끼의 출생 후 생존율, 출생 체중 및 이유 후 체중이 감소했습니다. 1세대 새끼는 또한 창백하고 차가운 몸과 발달 지연(신장 유두가 발달되지 않았거나 저발달되었고 수컷의 청각 놀람 반응 감소)을 보였습니다. 1세대 새끼의 생식 능력은 영향을 받지 않았습니다. 그러나 2세대 새끼는 1세대 새끼와 유사한 임상 징후와 낮은 체중을 보였습니다.
기관 형성 기간 동안 임신한 토끼에 총 카리프라진의 AUC를 기준으로 MRHD인 6mg/일의 0.02~4.6배인 0.1, 1 및 5mg/kg/일의 경구 용량으로 카리프라진을 투여했을 때 기형 발생을 일으키지 않았습니다. 모체 체중과 음식 섭취는 총 카리프라진의 AUC를 기준으로 MRHD인 6mg/일의 4.6배에서 감소했습니다. 그러나 임신 매개변수 또는 생식 기관에 대한 부작용은 관찰되지 않았습니다.
8.2
수유
위험 요약
모유에서 카리프라진의 존재, 모유 수유 유아에 대한 영향 또는 모유 생산에 대한 영향을 평가하기 위한 수유 연구는 수행되지 않았습니다. 카리프라진은 랫드 젖에 존재합니다. 모유 수유의 발달 및 건강상의 이점은 VRAYLAR에 대한 산모의 임상적 필요성 및 VRAYLAR 또는 기저 산모 질환으로 인한 모유 수유 유아에 대한 잠재적 부작용과 함께 고려해야 합니다.
8.4
소아 사용
소아 환자의 안전성과 유효성은 확립되지 않았습니다. VRAYLAR에 대한 소아 연구는 수행되지 않았습니다. 항우울제는 소아 환자에서 자살 생각 및 행동의 위험을 증가시켰습니다 [see Boxed Warning, Warnings and Precautions (5.2)].
8.5
노인 환자에 대한 사용 (Geriatric Use)
VRAYLAR의 임상 시험은 65세 이상의 환자를 충분히 포함하지 않았기 때문에 고령 환자의 반응이 젊은 환자와 다른지 여부를 판단할 수 없습니다. 일반적으로, 고령 환자의 경우 간, 신장 또는 심장 기능 저하 및 동반 질환이나 다른 약물 치료의 빈도가 더 높다는 점을 반영하여 저용량부터 시작하는 등 용량 선택에 주의해야 합니다.
항정신병 약물은 치매 관련 정신병이 있는 고령 환자의 사망 위험을 증가시킵니다. VRAYLAR는 치매 관련 정신병 환자 치료에 대해 승인되지 않았습니다[see 경고 (Boxed Warning) 및 경고 및 주의사항 (5.1, 5.3)].
8.6
간 장애 (Hepatic Impairment)
경증에서 중등도의 간 장애(Child-Pugh 점수 5~9점) 환자의 경우 VRAYLAR의 용량 조절이 필요하지 않습니다 [see Clinical Pharmacology (12.3)]. 중증 간 장애(Child-Pugh 점수 10~15점) 환자에게는 VRAYLAR 사용이 권장되지 않습니다. VRAYLAR는 이 환자 집단에서 평가되지 않았습니다.
8.7
신장 장애 (Renal Impairment)
경증에서 중등도(CrCL ≥ 30 mL/minute) 신장 장애 환자의 경우 VRAYLAR의 용량 조절이 필요하지 않습니다 [see Clinical Pharmacology (12.3)].
중증 신장 장애(CrCL < 30 mL/minute) 환자에게는 VRAYLAR 사용이 권장되지 않습니다. VRAYLAR는 이 환자 집단에서 평가되지 않았습니다.
8.8
흡연 (Smoking)
흡연자의 경우 VRAYLAR의 용량 조절이 필요하지 않습니다. VRAYLAR는 CYP1A2의 기질이 아니므로 흡연이 VRAYLAR의 약동학에 영향을 미치지 않을 것으로 예상됩니다.
8.9
기타 특정 집단 (Other Specific Populations)
환자의 나이, 성별 또는 인종에 따라 용량 조절이 필요하지 않습니다. 이러한 요인은 VRAYLAR의 약동학에 영향을 미치지 않습니다 [see Clinical Pharmacology (12.3)].
9 약물 남용 및 의존성
10 과다 복용
10.1
Human Experience
약 5000명의 환자 또는 건강한 피험자를 대상으로 VRAYLAR를 사용한 시판 전 임상 시험에서 한 환자에게서 우발적인 급성 과다 복용(48mg/일)이 보고되었습니다. 이 환자는 기립성 저혈압과 진정 작용을 경험했습니다. 환자는 같은 날 완전히 회복되었습니다.
10.2
Management of Overdosage
VRAYLAR에 대한 특정 해독제는 알려져 있지 않습니다. 과다 복용을 관리할 때는 면밀한 의학적 감독 및 모니터링을 포함한 지지 요법을 제공하고 여러 약물이 관련되었을 가능성을 고려하십시오. 과다 복용의 경우, 공인 독극물 관리 센터(1-800-222-1222)에 문의하여 최신 지침과 조언을 얻으십시오.
11 설명
VRAYLAR의 활성 성분은 비정형 항정신병약물인 염산 카리프라진입니다. 화학명은 trans-N-{4-[2-[4-(2,3-dichlorophenyl)piperazine-1-yl]ethyl]cyclohexyl}-N’,N’-dimethylurea hydrochloride이며, 실험식은 C21H32Cl2N4O•HCl이고 분자량은 463.9 g/mol입니다. 화학 구조는 다음과 같습니다.
![VRAYLAR의 화학 구조는 비정형 항정신병약물인 염산 카리프라진입니다. 화학명은 trans-N-{4-[2-[4-(2,3-dichlorophenyl)piperazine-1-yl]ethyl]cyclohexyl}-N’,N’-dimethylurea hydrochloride이며, 실험식은 C21H33Cl3N4O이고 분자량은 463.9 g/mol입니다.](/images/91/vraylar-01.jpg)
VRAYLAR 캡슐은 경구 투여 전용입니다. 각 경질 젤라틴 캡슐에는 카리프라진염산염의 백색에서 유백색 분말이 포함되어 있으며, 이는 카리프라진염기 1.5, 3, 4.5 또는 6mg에 해당합니다. 또한, 캡슐에는 다음과 같은 불활성 성분이 포함되어 있습니다: 젤라틴, 마그네슘 스테아레이트, 젤라틴화 전분, 셸락, 이산화티타늄. 색소에는 흑색 산화철(1.5, 3, 6mg), FD&C Blue 1 (3, 4.5, 6mg), FD&C Red 3 (6mg), FD&C Red 40 (3, 4.5mg) 또는 황색 산화철 (3, 4.5mg)이 포함됩니다.
12 약물동력학
12.1
작용 기전
카리프라진의 작용 기전은 알려져 있지 않습니다. 그러나 카리프라진의 효능은 중추 도파민 D2 및 세로토닌 5-HT1A 수용체에서의 부분 작용제 활성과 세로토닌 5-HT2A 수용체에서의 길항제 활성의 조합을 통해 매개될 수 있습니다. 카리프라진은 두 가지 주요 대사체인 데스메틸카리프라진(DCAR)과 디데스메틸카리프라진(DDCAR)을 형성하는데, 이들은 모 약물과 유사한 in vitro 수용체 결합 프로파일을 가지고 있습니다.
12.2
약력학
카리프라진은 높은 결합 친화력(Ki 값 0.085 nM 및 0.49 nM (D2L)과 0.69 nM (D2S))을 가진 도파민 D3 및 D2 수용체에서 부분 작용제로 작용하며, 세로토닌 5-HT1A 수용체에서도 작용합니다 (Ki 값 2.6 nM). 카리프라진은 높고 중간 정도의 결합 친화력(Ki 값 각각 0.58 nM 및 18.8 nM)을 가진 5-HT2B 및 5-HT2A 수용체에서 길항제로 작용하며, 히스타민 H1 수용체에도 결합합니다 (Ki 값 23.2 nM). 카리프라진은 세로토닌 5-HT2C 및 α1A-아드레날린 수용체에 대한 결합 친화력이 낮으며 (Ki 값 각각 134 nM 및 155 nM), 콜린성 무스카린 수용체에 대한 친화력은 거의 없습니다 (IC50>1000 nM).
QTc 간격에 대한 영향
최대 권장 용량의 3배 용량에서 카리프라진은 QTc 간격을 임상적으로 유의미한 수준으로 연장시키지 않습니다.
12.3
약동학
VRAYLAR의 활성은 카리프라진과 그 두 가지 주요 활성 대사체인 데스메틸카리프라진(DCAR)과 디데스메틸카리프라진(DDCAR)에 의해 매개되는 것으로 생각되며, 이들은 약리학적으로 카리프라진과 동등합니다.
VRAYLAR의 다회 투여 후, 평균 카리프라진 및 DCAR 농도는 약 1~2주에 정상 상태에 도달했고, 평균 DDCAR 농도는 12주 연구에서 약 4~8주에 정상 상태에 접근하는 것으로 나타났습니다(그림 1). 평균 농도-시간 곡선에서 추정된 정상 상태에 도달하는 시간을 기준으로 한 반감기는 카리프라진의 경우 2~4일, DCAR의 경우 약 1~2일, DDCAR의 경우 약 1~3주입니다. 주요 활성 대사체인 DDCAR의 정상 상태 도달 시간은 환자마다 다양했으며, 일부 환자는 12주 치료 종료 시에도 정상 상태에 도달하지 못했습니다 [용법 및 용량 (2.1), 경고 및 주의사항 (5.6)]. 12주 치료 종료 시 DCAR 및 DDCAR의 평균 농도는 카리프라진 농도의 각각 약 30% 및 400%입니다.
VRAYLAR 중단 후, 카리프라진, DCAR 및 DDCAR의 혈장 농도는 다지수 방식으로 감소했습니다. 마지막 투여 1주 후 DDCAR의 평균 혈장 농도는 약 50% 감소했고, 카리프라진 및 DCAR의 평균 농도는 약 1일 만에 약 50% 감소했습니다. 카리프라진 및 DCAR의 혈장 노출량은 1주일 이내에 약 90% 감소했고, DDCAR의 경우 약 4주 후에 감소했습니다. 1mg 카리프라진 단회 투여 후, DDCAR은 투여 후 8주 동안 검출 가능했습니다.
VRAYLAR의 다회 투여 후, 카리프라진, DCAR 및 DDCAR의 혈장 노출량은 치료 용량 범위에서 약 비례적으로 증가합니다.
그림 1. 혈장 농도 (평균 ± SE)-시간 프로파일 (카리프라진 6mg/일 12주 치료 중 및 후)a
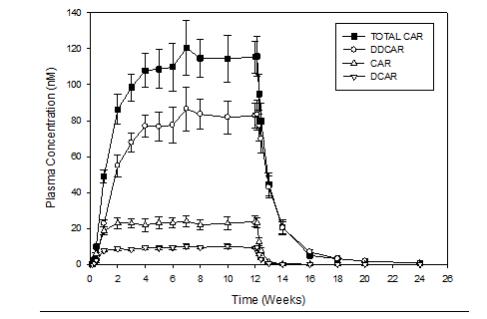
a 카리프라진 6mg/일 치료 중 측정된 골농도를 나타냅니다.
SE: 표준 오차; TOTAL CAR: 카리프라진, DCAR 및 DDCAR의 총 농도; CAR: 카리프라진
흡수
VRAYLAR 단회 투여 후, 최고 혈장 카리프라진 농도는 약 3~6시간에 나타났습니다.
고지방 식사와 함께 1.5mg VRAYLAR 캡슐을 단회 투여한 경우 카리프라진 또는 DCAR의 Cmax 및 AUC에 유의미한 영향을 미치지 않았습니다.
분포
카리프라진과 그 주요 활성 대사체는 혈장 단백질에 매우 높게 결합되어 있습니다 (91~97%).
배설
대사
카리프라진은 CYP3A4에 의해, 그리고 더 적은 정도로 CYP2D6에 의해 DCAR 및 DDCAR로 광범위하게 대사됩니다. DCAR은 CYP3A4 및 CYP2D6에 의해 DDCAR로 추가 대사됩니다. DDCAR은 CYP3A4에 의해 하이드록실화 대사체로 대사됩니다.
배출
27일 동안 정신분열증 환자에게 12.5mg/일 카리프라진을 투여한 후, 일일 용량의 약 21%가 소변에서 발견되었으며, 일일 용량의 약 1.2%가 변화되지 않은 카리프라진으로 소변으로 배설되었습니다.
특정 집단에서의 연구
간 손상
경도 또는 중등도 간 손상 환자(Child-Pugh 점수 5~9)의 경우, 건강한 피험자와 비교하여 0.5mg 카리프라진을 14일간 매일 투여한 후 카리프라진의 노출(Cmax 및 AUC)은 약 25% 증가하였고, 주요 대사체(DCAR 및 DDCAR)의 노출은 20~30% 감소하였습니다 [특정 환자군에서의 사용 (8.6)].
신장 손상
카리프라진과 주요 활성 대사체는 소변으로 최소량 배설됩니다. 약동학 분석 결과, 혈장 청소율과 크레아티닌 청소율 사이에 유의미한 상관관계가 없는 것으로 나타났습니다 [특정 환자군에서의 사용 (8.7)].
CYP2D6 저대사자
CYP2D6 저대사자 상태는 카리프라진, DCAR 또는 DDCAR의 약동학에 임상적으로 유의미한 영향을 미치지 않습니다.
연령, 성별, 인종
연령, 성별 또는 인종은 카리프라진, DCAR 또는 DDCAR의 약동학에 임상적으로 유의미한 영향을 미치지 않습니다.
약물 상호작용 연구
In vitro 연구
카리프라진과 주요 활성 대사체는 CYP1A2 및 CYP3A4 효소를 유도하지 않았으며, CYP1A2, CYP2C9, CYP2D6 및 CYP3A4의 약한 억제제였습니다 in vitro. 카리프라진은 또한 CYP2C19, CYP2A6 및 CYP2E1의 약한 억제제였습니다 in vitro.
카리프라진과 주요 활성 대사체는 P-glycoprotein (P-gp), 유기 음이온 수송 다배체 1B1 및 1B3 (OATP1B1 및 OATP1B3) 또는 유방암 저항성 단백질 (BCRP)의 기질이 아닙니다.
카리프라진과 주요 활성 대사체는 in vitro에서 OATP1B1, OATP1B3, BCRP, 유기 양이온 수송체 2 (OCT2) 및 유기 음이온 수송체 1 및 3 (OAT1 및 OAT3)의 약한 억제제 또는 비억제제였습니다. 카리프라진이 고용량에서 이론적인 GI 농도를 기반으로 P-gp 억제제일 가능성이 있었지만, 주요 활성 대사체는 수송체 P-gp의 약한 억제제 또는 비억제제였습니다 in vitro.
In vitro 연구 결과를 바탕으로, VRAYLAR는 CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E, CYP3A4 또는 OATP1B1, OATP1B3, BCRP, OCT2, OAT1 및 OAT3의 기질과 임상적으로 유의미한 약물 상호작용을 일으킬 가능성이 낮습니다.
In vivo 연구 및 모델 기반 접근법
CYP3A4 억제제
임상 약물-약물 상호작용 연구에서, 강력한 CYP3A4 억제제인 케토코나졸(400mg/일, 4일간)을 VRAYLAR(0.5mg/일)과 병용 투여하면 총 카리프라진(카리프라진, DCAR 및 DDCAR의 합)의 Cmax 및 AUC0-24h가 약 100% 증가했습니다. 중등도 CYP3A4 억제제인 에리스로마이신(500mg, 1일 2회, 21일간)을 VRAYLAR(1.5mg/일)과 병용 투여하면 총 카리프라진의 Cmax 및 AUC0-24h가 약 50% 증가했습니다.
생리학적 기반 약동학 모델 기반 분석에 따르면, 정상 상태에서 케토코나졸(400mg/일)을 VRAYLAR(0.5mg/일)과 병용 투여하면 총 카리프라진의 Cmax 및 AUC0-24h가 각각 약 5.5배 및 6배까지 증가할 것으로 예측됩니다. 정상 상태에서 중등도 CYP3A 억제제인 플루코나졸(200mg/일)을 VRAYLAR(0.5mg/일)과 병용 투여하면 총 카리프라진의 Cmax 및 AUC0-24h가 약 3배까지 증가할 것으로 예측됩니다.
CYP3A4 유도제
CYP3A4는 카리프라진의 활성 대사체의 생성 및 제거에 관여합니다. CYP3A4 유도제가 카리프라진 및 주요 활성 대사체의 혈장 노출에 미치는 영향은 평가되지 않았으며, 그 순 영향은 불분명합니다.
CYP2D6 억제제
CYP2D6 저대사자에서의 관찰 결과를 바탕으로, CYP2D6 억제제는 카리프라진, DCAR 또는 DDCAR의 약동학에 영향을 미칠 것으로 예상되지 않습니다.
프로톤 펌프 억제제
정신분열증 환자에서 프로톤 펌프 억제제인 판토프라졸(40mg/일)을 VRAYLAR(6mg/일)과 15일간 병용 투여해도, Cmax 및 AUC0-24를 기준으로 정상 상태에서 카리프라진 노출에 영향을 미치지 않았습니다. 마찬가지로, DCAR 및 DDCAR의 노출에도 유의미한 변화가 관찰되지 않았습니다.
13 비임상 독성학
13.1
발암성, 돌연변이원성, 생식능력 저해
발암성
카리프라진을 랫트에게 2년 동안, Tg.rasH2 마우스에게 6개월 동안 매일 경구 투여한 결과, 총 카리프라진 AUC(즉, 카리프라진, DCAR 및 DDCAR의 AUC 값의 합) 기준으로 최대 4배(랫트) 및 19배(마우스)의 MRHD 6mg/day에 해당하는 용량에서 종양 발생률의 증가는 없었습니다.
랫트는 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 0.2~1.8배(수컷)/0.8~4.1배(암컷)에 해당하는 0.25, 0.75 및 2.5mg/kg/day(수컷)/1, 2.5 및 7.5mg/kg/day(암컷)의 경구 용량으로 카리프라진을 투여받았습니다.
Tg.rasH2 마우스는 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 0.2~7.9배(수컷)/2.6~19배(암컷)에 해당하는 1, 5 및 15mg/kg/day(수컷)/5, 15 및 50mg/kg/day(암컷)의 경구 용량으로 카리프라진을 투여받았습니다.
돌연변이원성
카리프라진은 in vitro 세균 역돌연변이 분석에서 돌연변이원성이 없었으며, in vitro 인간 림프구 염색체 이상 분석 또는 in vivo 마우스 골수 미세핵 분석에서 염색체 이상을 유발하지 않았습니다. 그러나 카리프라진은 대사 활성화 조건 하에서 in vitro 마우스 림프종 분석에서 돌연변이 빈도를 증가시켰습니다. 주요 인간 대사체인 DDCAR은 in vitro 세균 역돌연변이 분석에서 돌연변이원성이 없었지만, in vitro 인간 림프구 염색체 이상 분석에서 염색체 이상을 유발하고 구조적 염색체 이상을 유도했습니다.
생식능력 저해
카리프라진은 교배 전, 교배 중 및 임신 7일까지 수컷 및 암컷 랫트에게 1, 3 및 10mg/kg/day의 경구 용량으로 투여되었으며, 이는 mg/m2 기준으로 MRHD 6mg/day의 1.6~16배에 해당합니다. 암컷 랫트의 경우, mg/m2 기준으로 MRHD 6mg/day의 1.6배 이상인 모든 용량 수준에서 생식력 및 수정 지수가 감소하는 것으로 나타났습니다. 수컷 생식력에 대한 영향은 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 최대 4.3배에 해당하는 용량까지 어떤 용량에서도 관찰되지 않았습니다.
13.2
동물 독성 및/또는 약리학
카리프라진은 13주 및/또는 1년 동안 매일 경구 투여 후 개에서 양측 백내장 및 망막의 낭성 변성을 유발했으며, 2년 동안 매일 경구 투여 후 랫트에서 망막 변성/위축을 유발했습니다. 개에서 백내장은 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 7.1배(수컷) 및 7.7배(암컷)에 해당하는 4mg/kg/day에서 관찰되었습니다. 개에서 백내장 및 망막 독성에 대한 NOEL은 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 5배(수컷)~3.6배(암컷)에 해당하는 2mg/kg/day입니다. 랫트에서 망막 변성/위축의 발생률 및 중증도는 MRHD 6mg/day의 임상 노출(AUC)보다 낮은 총 카리프라진 혈장 수준에서 0.75mg/kg/day의 저용량을 포함한 모든 시험 용량에서 증가했습니다. 색소 마우스 또는 알비노 랫트에서 반복 투여 연구에서 백내장은 관찰되지 않았습니다.
인지질증은 임상적으로 관련된 총 카리프라진의 노출(AUC)에서 랫트, 개 및 마우스의 폐(염증 유무에 관계없이)와 개의 부신 피질에서 관찰되었습니다. 인지질증은 1~2개월의 약물 투여 중단 기간이 끝난 후에도 가역적이지 않았습니다. 1년 동안 매일 투여된 개의 폐에서 염증이 관찰되었으며, NOEL은 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 2.7배(수컷) 및 1.7배(암컷)에 해당하는 1mg/kg/day였습니다. 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 5배(수컷) 및 3.6배(암컷)에 해당하는 2mg/kg/day 투여 후 2개월의 약물 투여 중단 기간이 끝난 후에는 염증이 관찰되지 않았지만, 더 높은 용량에서는 여전히 염증이 존재했습니다.
부신 피질의 비대는 각각 2년 및 6개월 동안 카리프라진을 매일 경구 투여한 후 랫트(암컷만 해당) 및 마우스에서 임상적으로 관련된 총 카리프라진 혈장 농도에서 관찰되었습니다. 개에서 1년 동안 카리프라진을 매일 경구 투여한 후 부신 피질의 가역적 비대/증식 및 공포/소포화가 관찰되었습니다. NOEL은 총 카리프라진 AUC 기준으로 MRHD 6mg/day의 5배(수컷) 및 3.6배(암컷)에 해당하는 2mg/kg/day였습니다. 이러한 결과의 인체 위험성과의 관련성은 알 수 없습니다.
14 CLINICAL STUDIES
14.1
조현병
VRAYLAR의 조현병 치료 효능은 진단 및 통계 편람 정신 질환 4판, 텍스트 개정판(DSM-IV-TR) 기준에 부합하는 환자(평균 연령 37세, 18~60세; 여성 31%; 백인 45%)를 대상으로 한 3건의 6주 무작위 이중맹검 위약 대조 시험에서 입증되었습니다. 분석 민감도를 평가하기 위해 활성 대조군(리스페리돈 또는 아리피프라졸)이 2건의 시험에 포함되었습니다. 3건의 시험 모두에서 VRAYLAR는 위약보다 우수했습니다.
양성 및 음성 증후군 척도(PANSS)와 임상 전반적 인상-중증도(CGI-S) 등급 척도는 각 시험에서 정신과적 징후 및 증상을 평가하기 위한 1차 및 2차 효능 측정치로 사용되었습니다.
- PANSS는 조현병의 양성 증상(7항목), 음성 증상(7항목) 및 일반적 정신병리(16항목)을 측정하는 30항목 척도이며, 각 항목은 1(없음)에서 7(극심함)까지의 척도로 평가됩니다. PANSS 총점은 30~210 범위일 수 있으며, 점수가 높을수록 중증도가 더 높음을 나타냅니다.
- CGI-S는 검증된 임상의 관련 척도로서 환자의 현재 질병 상태와 전반적인 임상 상태를 1(정상, 전혀 아픔이 없음)에서 7점(극도로 아픔) 척도로 측정합니다.
각 연구에서 1차 종점은 6주차 말 PANSS 총점의 기준치 변화였습니다. VRAYLAR 및 활성 대조군의 기준치 변화는 위약과 비교되었습니다. 시험 결과는 표 16에 나와 있습니다. 연구 2의 효능 결과 시간 경과는 그림 2에 나와 있습니다.
연구 1: 3가지 고정 용량의 VRAYLAR(1.5, 3 또는 4.5mg/일)와 활성 대조군(리스페리돈)을 포함하는 6주 위약 대조 시험(N = 711)에서 모든 VRAYLAR 용량과 활성 대조군은 PANSS 총점과 CGI-S에서 위약보다 우수했습니다.
연구 2: 2가지 고정 용량의 VRAYLAR(3 또는 6mg/일)와 활성 대조군(아리피프라졸)을 포함하는 6주 위약 대조 시험(N = 604)에서 두 가지 VRAYLAR 용량과 활성 대조군 모두 PANSS 총점과 CGI-S에서 위약보다 우수했습니다.
연구 3: 2가지 가변 용량 범위 그룹의 VRAYLAR(3~6mg/일 또는 6~9mg/일)을 포함하는 6주 위약 대조 시험(N = 439)에서 두 가지 VRAYLAR 그룹 모두 PANSS 총점과 CGI-S에서 위약보다 우수했습니다.
VRAYLAR의 효능은 위약과 비교하여 1.5~9mg/일의 용량 범위에서 입증되었습니다. 그러나 특히 6mg을 초과하는 용량에서는 특정 유해 반응이 용량 의존적으로 증가했습니다. 따라서 최대 권장 용량은 1일 6mg입니다.
연령(55세 이상 환자는 거의 없음), 성별 및 인종에 따른 인구 하위 그룹 검사에서는 차별적 반응성에 대한 명확한 증거가 나타나지 않았습니다.
| 연구 번호 |
치료군 (# ITT 환자) |
1차 효능 종점: PANSS 총점 | ||
| 평균 기준치 점수 (SD) |
LS 평균 기준치 변화 (SE) |
위약 차이 차이a (95% CI) |
||
| 연구 1 | VRAYLAR (1.5mg/일)* (n=140) | 97.1 (9.1) | -19.4 (1.6) | -7.6 (-11.8, -3.3) |
| VRAYLAR (3mg/일)* (n=140) |
97.2 (8.7) | -20.7 (1.6) | -8.8 (-13.1, -4.6) | |
| VRAYLAR (4.5mg/일)* (n=145) |
96.7 (9.0) | -22.3 (1.6) | -10.4 (-14.6, -6.2) | |
| 위약 (n=148) |
97.3 (9.2) | -11.8 (1.5) | — | |
| 연구 2 | VRAYLAR (3mg/일)* (n=151) | 96.1 (8.7) | -20.2 (1.5) | -6.0 (-10.1, -1.9) |
| VRAYLAR (6mg/일)* (n=154) |
95.7 (9.4) | -23.0 (1.5) | -8.8 (-12.9, -4.7) | |
| 위약 (n=149) |
96.5 (9.1) | -14.3 (1.5) | — | |
| 연구 3 | VRAYLAR (3-6mg/일)* (n=147) |
96.3 (9.3) | -22.8 (1.6) | -6.8 (-11.3, -2.4) |
| VRAYLAR (6-9mg/일)*b (n=147) |
96.3 (9.0) | -25.9 (1.7) | -9.9 (-14.5, -5.3) | |
| 위약 (n=145) |
96.6 (9.3) | -16.0 (1.6) | — | |
| ITT: 치료 의도; SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 비조정 신뢰 구간 a기준치로부터의 최소 제곱 평균 변화의 차이(약물 – 위약) *위약보다 통계적으로 유의하게 우수한 용량 b최대 권장 일일 용량은 6mg입니다. 1일 6mg을 초과하는 용량은 용량 관련 유해 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다. |
||||
그림 2. 주차별 방문에 따른 PANSS 총점의 기준치 변화 (연구 2)
정신분열증 성인 환자의 유지 치료제로서 VRAYLAR의 안전성 및 효능은 무작위 중단 시험에서 입증되었습니다. 이 시험에는 DSM-IV 기준에 따라 정신분열증 진단을 받은 200명의 환자가 포함되었으며, 이들은 3~9mg/일 용량의 카리프라진을 사용한 20주간의 공개 표지 치료 후 임상적으로 안정적인 상태였습니다. 환자들은 재발 관찰을 위해 최대 72주 동안 위약 또는 동일 용량의 카리프라진을 무작위로 투여받았습니다. 1차 종점은 재발까지의 시간이었습니다. 이중맹검 단계(DBP) 중 재발은 다음 기준 중 하나에 해당하는 경우로 정의되었습니다. 정신분열증 악화로 인한 입원, PANSS 총점 30% 이상 증가, CGI-S 점수 2점 이상 증가, 자해 행위, 공격적이거나 폭력적인 행동, 임상적으로 유의미한 자살 또는 타살 사고, 또는 다음 PANSS 항목 중 하나 이상에서 4점 초과: 망상(P1), 개념 장애(P2), 환각(P3), 의심 또는 박해(P6), 적대감(P7), 비협조(G8), 또는 충동 조절 장애(G14).
VRAYLAR의 효능은 위약과 비교하여 3~9mg/일의 용량 범위에서 입증되었습니다. 그러나 특히 6mg을 초과하는 용량에서는 특정 이상 반응이 용량 의존적으로 증가했습니다. 따라서 최대 권장 용량은 1일 6mg입니다.
장기 시험의 이중맹검, 위약 대조, 무작위 중단 단계에서 재발까지의 시간에 대한 Kaplan-Meier 곡선은 그림 3에 나와 있습니다. 재발까지의 시간은 VRAYLAR 치료군에서 위약군에 비해 통계적으로 유의하게 더 길었습니다.
그림 3. 이중맹검 치료 기간 동안 누적 재발률의 Kaplan-Meier 곡선
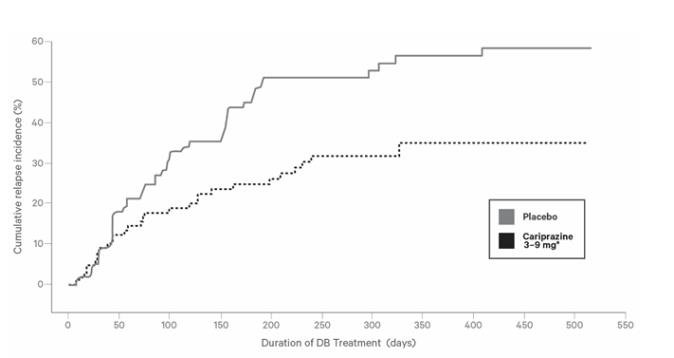
DB = 이중맹검
*최대 권장 1일 용량은 6mg입니다. 1일 6mg을 초과하는 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다.
14.2
조울증 I 장애와 관련된 조증 또는 혼합 에피소드
급성 조울증 치료에서 VRAYLAR의 효능은 조울증 1장애(정신병적 특징 유무)를 가진 조증 또는 혼합 에피소드 환자(평균 연령 39세, 범위 18~65세; 40% 여성; 48% 백인)를 대상으로 한 3건의 3주 위약 대조 시험에서 확립되었습니다. 세 시험 모두에서 VRAYLAR는 위약보다 우수했습니다.
각 시험에서 정신과적 징후 및 증상을 평가하기 위한 1차 및 2차 효능 측정으로 각각 Young 조증 평가 척도(YMRS)와 임상 전반적 인상-중증도 척도(CGI-S)가 사용되었습니다.
- YMRS는 조증 증상의 정도를 평가하는 데 전통적으로 사용되는 11개 항목의 임상의 평가 척도입니다. YMRS 총점은 0~60까지이며, 점수가 높을수록 중증도가 높음을 나타냅니다.
- CGI-S는 환자의 현재 질병 상태와 전반적인 임상 상태를 1(정상, 전혀 아픔 없음)에서 7점(극도로 아픔) 척도로 측정하는 검증된 임상의 관련 척도입니다.
각 연구에서 1차 종점은 3주차 말 YMRS 총점의 기준치 변화였습니다. 각 VRAYLAR 용량군의 기준치 변화는 위약과 비교되었습니다. 시험 결과는 표 17에 나와 있습니다. 효능 결과의 경과는 그림 4에 나와 있습니다.
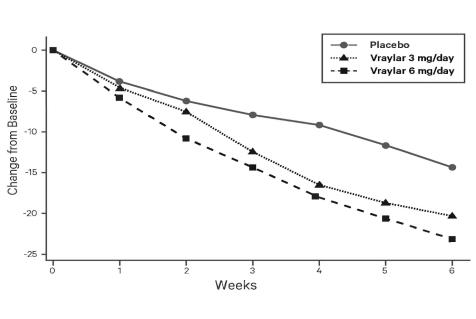
연구 4: VRAYLAR의 두 가지 유연 용량 범위군(3~6mg/일 또는 6~12mg/일)을 포함하는 3주 위약 대조 시험(N = 492)에서 두 VRAYLAR 용량군 모두 YMRS 총점과 CGI-S에서 위약보다 우수했습니다. 6~12mg/일 용량군은 추가적인 이점을 보이지 않았습니다.
연구 5: VRAYLAR의 유연 용량 범위(3~12mg/일)를 포함하는 3주 위약 대조 시험(N = 235)에서 VRAYLAR는 YMRS 총점과 CGI-S에서 위약보다 우수했습니다.
연구 6: VRAYLAR의 유연 용량 범위(3~12mg/일)를 포함하는 3주 위약 대조 시험(N = 310)에서 VRAYLAR는 YMRS 총점과 CGI-S에서 위약보다 우수했습니다.
VRAYLAR의 효능은 3~12mg/일의 용량 범위에서 확립되었습니다. 6mg을 초과하는 용량은 더 낮은 용량보다 추가적인 이점이 없는 것으로 나타났으며(표 17), 특정 이상 반응이 용량 의존적으로 증가했습니다. 따라서 최대 권장 용량은 1일 6mg입니다.
연령(55세 이상 환자는 거의 없음), 성별 및 인종에 따른 인구 하위 집단 검사에서는 차별적인 반응성에 대한 명확한 증거가 나타나지 않았습니다.
| 연구 번호 |
치료군 (ITT 환자 수) |
주요 효능 종점: YMRS 총점 | ||
| 평균 기준값 점수 (SD) |
최소자승 평균 기준값으로부터의 변화 (SE) |
플라시보 차이 차이a (95% CI) |
||
| 연구 4 | VRAYLAR (3-6 mg/day)* (n=165) |
33.2 (5.6) | -18.6 (0.8) | -6.1 (-8.4, -3.8) |
| VRAYLAR (6-12 mg/day)*b (n=167) |
32.9 (4.7) | -18.5 (0.8) | -5.9 (-8.2, -3.6) | |
| 플라시보 (n=160) |
32.6 (5.8) | -12.5 (0.8) | — | |
| 연구 5 | VRAYLAR (3-12 mg/day)*b (n=118) |
30.6 (5.0) | -15.0 (1.1) | -6.1 (-8.9, -3.3) |
| 플라시보 (n=117) |
30.2 (5.2) | -8.9 (1.1) | — | |
| 연구 6 | VRAYLAR (3-12 mg/day)*b (n=158) |
32.3 (5.8) | -19.6 (0.9) | -4.3 (-6.7, -1.9) |
| 플라시보 (n=152) |
32.1 (5.6) | -15.3 (0.9) | — | |
| ITT: 치료 의도(intent-to-treat); SD: 표준 편차; SE: 표준 오차; LS Mean: 최소자승 평균; CI: 조정되지 않은 신뢰 구간 a기준값으로부터의 최소자승 평균 변화에서의 차이 (약물 – 플라시보) *플라시보보다 통계적으로 유의하게 우수한 용량 b최대 권장 일일 용량은 6mg입니다. 6mg을 초과하는 일일 용량은 용량 관련 이상 반응을 상쇄할 만큼 충분한 효과 증가를 제공하지 않습니다. |
||||
그림 4. 기준치 대비 YMRS 총점 변화 (연구 4)
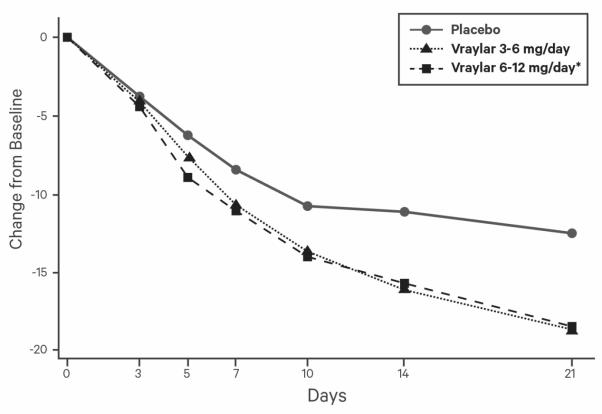
* 최대 권장 1일 용량은 6mg입니다. 6mg을 초과하는 1일 용량은 용량 관련 이상 반응을 상쇄할 만큼 효과가 증가하지 않습니다.
14.3
조울증 1형 장애 관련 우울증 에피소드 (조울증 우울증)
조울증 1형 장애 관련 우울증 에피소드 치료에서 VRAYLAR의 효능은 DSM-IV-TR 또는 DSM-5 기준에 따라 조울증 1형 장애 관련 우울증 에피소드를 충족하는 환자(평균 연령 43세, 범위 18~65세; 61% 여성; 75% 백인)를 대상으로 한 8주간의 플라시보 대조 시험 1건과 6주간의 플라시보 대조 시험 2건에서 입증되었습니다.
각 연구에서 주요 평가변수는 6주차 말 Montgomery-Asberg 우울증 평가 척도(MADRS) 총점의 기준치 대비 변화였습니다. MADRS는 임상의가 평가하는 10개 항목으로 구성된 척도이며, 총점은 0(우울증 증상 없음)에서 60(최대 점수)까지입니다. VRAYLAR과 플라시보를 비교한 MADRS 총점의 기준치 대비 변화는 표 18에 나와 있습니다. 연구 8의 효능 결과의 시간 경과는 그림 5에 나와 있습니다. 각 연구에서 VRAYLAR 1.5mg 용량은 플라시보에 비해 통계적으로 유의미한 결과를 보였습니다. 이차 평가변수는 CGI-S의 기준치 대비 6주차 변화였습니다. CGI-S는 환자의 현재 질병 상태와 전반적인 임상 상태를 1(정상, 전혀 아픔 없음)에서 7(극도로 아픔)까지 7점 척도로 측정하는 검증된 임상의 관련 척도입니다.
연구 7: 3가지 고정 용량의 VRAYLAR(0.75mg/일, 1.5mg/일, 3mg/일)을 포함한 8주간의 플라시보 대조 시험(N = 571)에서 VRAYLAR 1.5mg은 6주차 말 MADRS 총점과 CGI-S에서 플라시보보다 우수했습니다.
연구 8: 2가지 고정 용량의 VRAYLAR(1.5mg/일 및 3mg/일)을 포함한 6주간의 플라시보 대조 시험(N = 474)에서 VRAYLAR 1.5mg 및 3mg은 6주차 말 MADRS 총점에서 플라시보보다 우수했습니다.
연구 9: 2가지 고정 용량의 VRAYLAR(1.5mg/일 및 3mg/일)을 포함한 6주간의 플라시보 대조 시험(N = 478)에서 VRAYLAR 1.5mg은 6주차 말 MADRS 총점과 CGI-S에서 플라시보보다 우수했습니다.
연령(55세 이상 환자는 소수였음), 성별 및 인종에 따른 인구 하위 집단 검토 결과, 반응성의 명확한 차이를 나타내는 증거는 없었습니다.
| 표 18. 조울증 우울증 시험의 주요 분석 결과 | ||||
| 연구 번호 | 치료군 (# ITT 환자) |
주요 효능 평가변수: MADRS 총점 | ||
| 평균 기준치 점수 (SD) |
LS 평균 기준치 대비 변화 (SE) |
플라시보 차이 (95% CI)a |
||
| 연구 7 | VRAYLAR (1.5mg/일)* (n=145) VRAYLAR (3mg/일) (n=145) 플라시보 (n=141) |
30.3 (4.4) 30.6 (4.7) 30.4 (4.6) |
-15.1 (0.8) -13.7 (0.9) -11.1 (0.9) |
-4.0 (-6.3, -1.6) -2.5 (-4.9, -0.1) |
| 연구 8 | VRAYLAR (1.5mg/일)* (n=154) | 30.7 (4.3) | -15.1 (0.8) | -2.5 (-4.6, -0.4) |
| VRAYLAR (3mg/일)* (n=164) |
31.0 (4.9) | -15.6 (0.8) | -3.0 (-5.1, -0.9) | |
| 플라시보 (n=156) |
30.2 (4.4) | -12.6 (0.8) | ||
| 연구 9 | VRAYLAR (1.5mg/일)* (n=162) |
31.5 (4.3) | -14.8 (0.8) | -2.5 (-4.6, -0.4) |
| VRAYLAR (3mg/일) (n=153) |
31.5 (4.8) | -14.1 (0.8) | -1.8 (-3.9, 0.4) | |
| 플라시보 (n=163) |
31.4 (4.5) | -12.4 (0.8) | ||
| ITT: 치료 의도; SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 신뢰 구간 a기준치 대비 최소 제곱 평균 변화의 차이 (약물 – 플라시보) *플라시보보다 통계적으로 유의하게 우수한 용량 |
||||
그림 5. 방문별 MADRS 총점의 LS 평균* 기준치 대비 변화 (연구 8)
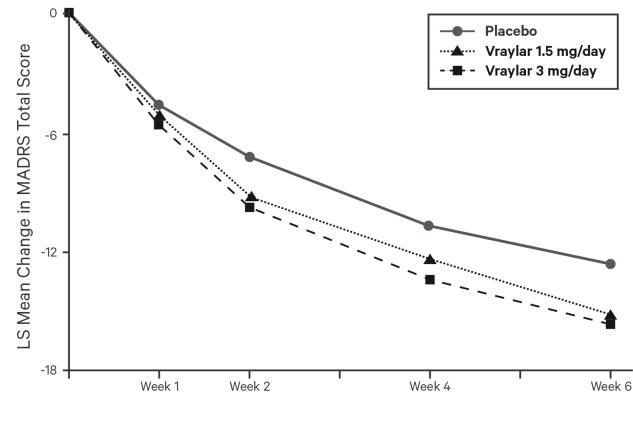
| *LS 평균: 최소 제곱 평균 |
14.4
주요 우울 장애의 병용 요법
주요 우울 장애(MDD) 치료를 위한 항우울제 병용 요법으로서 VRAYLAR의 효능은 성인 환자(평균 연령 45세, 범위 18~65세; 72% 여성; 85% 백인) 2건의 시험에서 평가되었습니다. 이 환자들은 불안 증상의 유무에 관계없이 DSM-IV-TR 또는 DSM-5 기준에 부합하는 MDD를 앓고 있으며, 1~3회의 이전 항우울제(ADT) 치료에 대한 반응이 부적절했습니다. 항우울제 치료 중 부적절한 반응은 적절한 용량과 기간의 항우울제 치료에 대한 개선이 50% 미만인 것으로 정의되었습니다.
각 연구에서 1차 종점은 Montgomery-Asberg 우울증 평가 척도(MADRS) 총점의 기준치부터 6주차(연구 10) 또는 8주차(연구 11)까지의 변화였습니다. MADRS는 임상의가 평가하는 10개 항목으로 구성된 척도로, 우울 증상의 정도를 평가하며, 0은 증상 없음을, 60은 최악의 증상을 나타냅니다.
연구 10: 6주간의 위약 대조 시험(N = 751)에서는 두 가지 고정 용량의 VRAYLAR(1일 1.5mg 또는 1일 3mg) + ADT를 사용했으며, VRAYLAR 1.5mg + ADT는 6주차 말 MADRS 총점에서 위약 + ADT보다 우수했습니다. VRAYLAR 1일 3mg + ADT군(대 위약 + ADT)의 치료 효과는 통계적으로 유의하지 않았습니다.
연구 11: 8주간의 위약 대조 시험(N = 808)에서는 VRAYLAR 1일 1~2mg + ADT 또는 1일 2~4.5mg + ADT의 가변 용량을 사용했습니다. VRAYLAR 2~4.5mg(평균 용량 2.6mg) + ADT는 8주차 말 MADRS 총점에서 위약 + ADT보다 우수했습니다. VRAYLAR 1일 1~2mg + ADT군(대 위약 + ADT)의 치료 효과는 통계적으로 유의하지 않았습니다.
두 시험(연구 10 및 11)의 1차 효능 매개변수 결과는 아래 표 19에 나와 있습니다. 아래 그림 6은 연구 10에서 1차 효능 측정(MADRS 총점)에 따른 반응의 시간 경과를 보여줍니다.
| 연구 번호 | 치료군 (# ITT 환자) | 1차 효능 종점: MADRS 총점 | ||
| 평균 기준 점수 (SD) | 기준치로부터의 LS 평균 변화 (SE) | 위약 차이a (95% CI) | ||
| 연구 10 | VRAYLAR (1.5mg/일) + ADT* (n=250) VRAYLAR (3mg/일) + ADT (n=252) 위약 + ADT (n=249) |
32.8 (5.0) 32.7 (4.9) 31.9 (5.7) |
-14.1 (0.7) -13.1 (0.7) -11.5 (0.7) |
-2.5(-4.2, -0.9) -1.5 (-3.2, 0.1) |
| 연구 11 | VRAYLAR (1일 1~2mg) + ADT (n=273) | 29.0 (4.3) | -13.4 (0.5) | -0.9 (-2.4, 0.6) |
| VRAYLAR (1일 2~4.5mg) + ADT* (n=271) |
29.3 (4.1) | -14.6 (0.6) | -2.2 (-3.7, -0.6) | |
| 위약 + ADT (n=264) |
28.9 (4.3) | -12.5 (0.5) | ||
SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 조정되지 않은 신뢰 구간
* 위약보다 통계적으로 유의하게 우수한 용량
a 기준치로부터의 최소 제곱 평균 변화의 차이(약물 – 위약)
연령, 성별 및 인종에 따른 인구 하위 집단 검사에서는 차별적인 반응성에 대한 명확한 증거가 나타나지 않았습니다.
그림 6. LS 평균‡ 기준치부터 6주차까지의 변화 MADRS 총점 주요 우울 장애의 병용 요법 (연구 10)
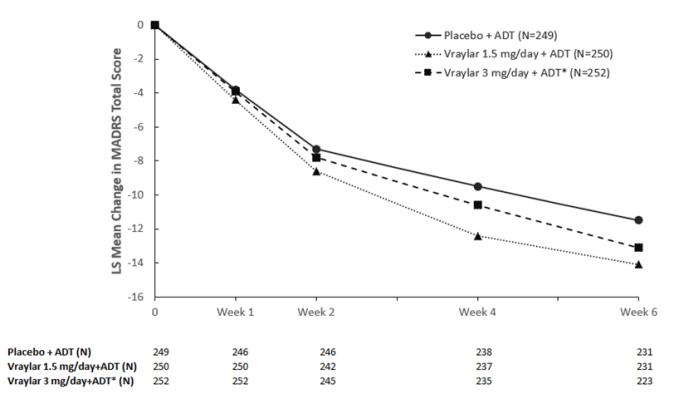
‡ LS 평균: 최소 제곱 평균
* 용량이 통계적으로 유의하지 않았습니다.
16 제공/보관 및 취급 방법
16.1
제품 정보
VRAYLAR (카리프라진) 캡슐은 다음과 같이 공급됩니다.
| 캡슐 함량 |
각인 코드 |
캡슐 색상 | 포장 형태 | NDC 코드 |
| 1.5 mg | FL 1.5 | 흰색 캡 및 바디 |
7정 블리스터 포장 | 61874-115-17 |
| 30정 병 포장 | 61874-115-30 | |||
| 90정 병 포장 | 61874-115-90 | |||
| 20정 상자 포장 (병원 단위 용량) | 61874-115-20 | |||
| 3 mg | FL 3 | 녹색에서 청록색 캡 및 흰색 바디 | 30정 병 포장 | 61874-130-30 |
| 90정 병 포장 | 61874-130-90 | |||
| 20정 상자 포장 (병원 단위 용량) | 61874-130-20 | |||
| 4.5 mg | FL 4.5 | 녹색에서 청록색 캡 및 바디 | 30정 병 포장 | 61874-145-30 |
| 90정 병 포장 | 61874-145-90 | |||
| 6 mg | FL 6 | 보라색 캡 및 흰색 바디 |
30정 병 포장 | 61874-160-30 |
| 90정 병 포장 | 61874-160-90 | |||
| (1) 1.5 mg, (6) 3 mg |
FL 1.5, FL 3 |
7정 혼합 블리스터 포장 | 61874-170-08 |
16.2
보관 및 취급
20ºC~25°C (68ºF~77°F)에 보관하십시오. 15°C~30°C (59°F~86°F)의 온도 편차는 허용됩니다 [USP 제어 실온 참조]. 3mg 및 4.5mg 캡슐은 변색을 방지하기 위해 빛으로부터 보호하십시오.
17 환자 상담 정보
환자 또는 간병인에게 FDA 승인 환자 라벨링( 복약 안내)을 읽도록 권장하십시오.
자살 생각 및 행동
환자와 간병인에게 특히 치료 초기에 그리고 용량을 늘리거나 줄일 때 자살 생각 및 행동의 출현을 살피도록 권장하고 그러한 증상을 의료 서비스 제공자에게 보고하도록 지시하십시오. [참조 박스형 경고 및 경고 및 주의사항 (5.2)].
복용량 및 투여
VRAYLAR는 음식과 함께 또는 음식 없이 복용할 수 있음을 환자에게 알리십시오. 복용량 증량 지침을 따르는 것의 중요성에 대해 상담하십시오. [see Dosage and Administration (2)].
Neuroleptic Malignant Syndrome (NMS)
항정신병 약물 투여와 관련하여 보고된 잠재적으로 치명적인 부작용인 악성 신경이완제 증후군(NMS)에 대해 환자에게 상담하십시오. 환자, 가족 또는 간병인에게 NMS의 징후 및 증상이 나타나면 의료 서비스 제공자에게 연락하거나 응급실에 보고하도록 권장하십시오. [see Warnings and Precautions (5.4)].
Tardive Dyskinesia
지연성 운동이상증의 징후와 증상에 대해 환자에게 상담하고 이러한 비정상적인 움직임이 발생하면 의료 서비스 제공자에게 연락하도록 하십시오. [see Warnings and Precautions (5.5)].
Late-Occurring Adverse Reactions
VRAYLAR 치료 시작 후 몇 주가 지나야 부작용이 나타날 수 있음을 환자에게 알리십시오. [see Warnings and Precautions (5.6)].
Metabolic Changes (Hyperglycemia and Diabetes Mellitus, Dyslipidemia, and Weight Gain)
대사 변화의 위험, 고혈당증 및 당뇨병의 증상을 인지하는 방법, 혈당, 지질 및 체중을 포함한 특정 모니터링의 필요성에 대해 환자를 교육하십시오. [see Warnings and Precautions (5.7)].
Leukopenia/Neutropenia
기존에 백혈구 수치가 낮거나 약물 유발 백혈구 감소증/호중구 감소증 병력이 있는 환자에게 VRAYLAR를 복용하는 동안 CBC를 모니터링해야 한다고 조언하십시오. [see Warnings and Precautions (5.8)].
Orthostatic Hypotension and Syncope
특히 치료 초기에, 그리고 치료를 다시 시작하거나 용량을 늘릴 때 기립성 저혈압 및 실신의 위험에 대해 환자에게 상담하십시오. [see Warnings and Precautions (5.9)].
Interference with Cognitive and Motor Performance
VRAYLAR 치료가 자신에게 부정적인 영향을 미치지 않는다는 확신이 들 때까지 위험한 기계 작동이나 자동차 운전과 같이 정신적 주의가 필요한 활동을 수행하는 것에 대해 환자에게 주의를 주십시오. [see Warnings and Precautions (5.12)].
Heat Exposure and Dehydration
과열 및 탈수를 피하기 위한 적절한 관리에 대해 환자를 교육하십시오. [see Warnings and Precautions (5.13)].
Concomitant Medications
상호 작용의 가능성이 있으므로 환자에게 처방약이나 일반 의약품을 복용하고 있거나 복용할 계획이 있는 경우 의사에게 알리도록 권장하십시오. [see Drug Interactions (7.1)].
Pregnancy
임신 3기에 VRAYLAR를 사용하면 신생아에게 추체외로 증상 및/또는 금단 증상이 발생할 수 있음을 환자에게 알리십시오. 임신이 확인되었거나 의심되는 환자는 의료 서비스 제공자에게 알리도록 권장하십시오. [see Use in Specific Populations (8.1)].
Pregnancy Registry
임신 중 VRAYLAR에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록부가 있음을 환자에게 알리십시오. [see Use in Specific Populations (8.1)].
Licensed from Gedeon Richter Plc.
Manufactured by:
Forest Laboratories Ireland Limited
Dublin, IE.
Distributed by:
AbbVie Inc.
North Chicago, IL 60064, USA
VRAYLAR and its design are trademarks of Allergan Pharmaceuticals International Limited, an AbbVie company.
© 2024 AbbVie. All rights reserved.
v7.0USPI115
약물 안내문
| 의약품 사용 설명서 VRAYLAR® (VRAY-lar) (카리프라진) 캡슐 |
|
| VRAYLAR에 대해 가장 중요한 정보는 무엇입니까? VRAYLAR는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
나 자신이나 가족 구성원의 자살 생각과 행동을 어떻게 주의하고 예방할 수 있습니까? |
|
|
|
|
|
|
|
|
|
|
|
|
|
| VRAYLAR은 무엇입니까? VRAYLAR은 성인에서 사용되는 처방약입니다.
VRAYLAR이 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
| 카리프라진에 알레르기가 있는 경우 VRAYLAR을 복용하지 마십시오. VRAYLAR의 성분 목록은 이 의약품 사용 설명서의 끝 부분을 참조하십시오. | |
VRAYLAR을 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. |
|
- 의료 제공자의 지시에 따라 VRAYLAR를 정확하게 복용하십시오. 의료 제공자와 상의하지 않고 복용량을 변경하거나 VRAYLAR 복용을 중단하지 마십시오.
- VRAYLAR는 하루에 1회, 음식과 함께 또는 음식 없이 복용하십시오.
- VRAYLAR를 과다 복용한 경우 의료 제공자 또는 독극물 관리 센터(1-800-222-1222)에 전화하거나 가장 가까운 병원 응급실로 즉시 가십시오.
- VRAYLAR이 자신에게 어떤 영향을 미치는지 알 때까지 운전, 기계 조작 또는 기타 위험한 활동을 하지 마십시오. VRAYLAR은 졸음을 유발할 수 있습니다.
- VRAYLAR 치료 중 과열되거나 탈수되지 않도록 하십시오.
○ 과도한 운동을 하지 마십시오.
○ 더운 날씨에는 가능하면 시원한 곳에 머무르십시오.
○ 햇볕을 쬐지 마십시오.
○ 너무 많은 옷이나 무거운 옷을 입지 마십시오.
○ 충분한 물을 마시십시오.
VRAYLAR은 다음과 같은 심각한 부작용을 유발할 수 있습니다.
-
“VRAYLAR에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
-
치매 관련 정신병이 있는 노인의 경우 사망으로 이어질 수 있는 뇌졸중(뇌혈관 질환).
- 악성 신경이완제 증후군(NMS)은 사망으로 이어질 수 있는 심각한 질환입니다. 다음과 같은 NMS의 징후 및 증상이 나타나면 의료 제공자에게 전화하거나 가장 가까운 병원 응급실로 즉시 가십시오.
- 조절할 수 없는 신체 움직임(지연성 운동 이상). VRAYLAR은 얼굴, 혀 또는 신체의 다른 부위에서 조절할 수 없는 움직임을 유발할 수 있습니다. 지연성 운동 이상은 VRAYLAR 복용을 중단해도 사라지지 않을 수 있습니다. 지연성 운동 이상은 VRAYLAR 복용을 중단한 후에도 시작될 수 있습니다.
- 늦게 나타나는 부작용. VRAYLAR은 체내에 오랫동안 남아 있습니다. 일부 부작용은 즉시 나타나지 않고 VRAYLAR 복용을 시작한 후 몇 주 후 또는 VRAYLAR 복용량이 증가한 후에 시작될 수 있습니다. 의료 제공자는 VRAYLAR 복용 시작 후 및 복용량 증가 후 몇 주 동안 부작용을 모니터링해야 합니다.
-
다음과 같은 신진대사 문제:
○ 고혈당(고혈당증) 및 당뇨병. VRAYLAR을 복용하는 일부 사람들에게서 혈당 증가가 발생할 수 있습니다. 극도로 높은 혈당은 혼수 상태 또는 사망으로 이어질 수 있습니다. 의료 제공자는 VRAYLAR 복용을 시작하기 전 또는 시작한 직후, 그리고 VRAYLAR 장기 치료 중 정기적으로 혈당을 확인해야 합니다.
VRAYLAR 치료 중 다음과 같은 고혈당 증상이 나타나면 의료 제공자에게 전화하십시오.
• 매우 목마름 • 평소보다 소변을 더 자주 봄
• 매우 배고픔 • 쇠약하거나 피곤함
• 메스꺼움 • 혼란스럽거나 호흡에서 과일 향이 남
- 혈중 지방 수치(콜레스테롤 및 트리글리세리드) 증가. 의료 제공자는 VRAYLAR 복용을 시작하기 전 또는 시작한 직후, 그리고 VRAYLAR 치료 중 주기적으로 혈중 지방 수치를 확인해야 합니다.
- 체중 증가. 자신과 의료 제공자는 VRAYLAR 복용을 시작하기 전과 치료 중 자주 체중을 확인해야 합니다.
- 백혈구 감소증. 의료 제공자는 VRAYLAR 치료 첫 몇 달 동안 혈액 검사를 실시할 수 있습니다.
- 혈압 저하(기립성 저혈압). 앉거나 누운 자세에서 일어설 때 어지러움이나 실신을 느낄 수 있습니다.
- 낙상. VRAYLAR은 졸음이나 어지러움을 유발할 수 있으며, 자세 변화 시 혈압 저하(기립성 저혈압)를 유발할 수 있으며, 사고와 운동 기술을 느리게 하여 골절이나 기타 부상을 유발할 수 있는 낙상으로 이어질 수 있습니다.
- 발작(경련).
- 졸음, 졸음, 피로감, 정상적인 활동을 생각하고 수행하는 데 어려움. “VRAYLAR 복용 중 피해야 할 사항은 무엇입니까?”를 참조하십시오.
- 체온 조절 문제로 너무 따뜻함을 느낌. “VRAYLAR 복용 중 피해야 할 사항은 무엇입니까?”를 참조하십시오.
- 연하곤란으로 음식이나 액체가 폐로 들어갈 수 있습니다.
VRAYLAR의 가장 흔한 부작용은 다음과 같습니다. 운동 장애 또는 느린 움직임, 진전, 조절할 수 없는 신체 움직임, 불안감 및 움직일 필요성, 졸음, 메스꺼움, 구토, 소화 불량, 변비, 피로감, 수면 장애, 식욕 증가 및 어지러움증입니다.
이것들은 VRAYLAR의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다(1-800-FDA-1088).
- VRAYLAR는 섭씨 20°C~25°C(화씨 68°F~77°F)의 실온에 보관하십시오.
VRAYLAR 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
| VRAYLAR의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방되기도 합니다. 처방받지 않은 질환에 VRAYLAR을 사용하지 마십시오. 자신과 같은 증상이 있는 다른 사람에게 VRAYLAR을 제공하지 마십시오. 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 VRAYLAR에 대한 정보는 약사 또는 의료 제공자에게 문의할 수 있습니다. |
|
| VRAYLAR의 성분은 무엇입니까? 활성 성분: cariprazine 비활성 성분: 젤라틴, 마그네슘 스테아레이트, 젤라틴화 전분, 셸락 및 이산화티타늄. 착색제 포함: 흑색 산화철, FD&C Blue 1, FD&C Red 3, FD&C Red 40 또는 황색 산화철. 제조사: Forest Laboratories Ireland Limited, Dublin, IE. 판매원: AbbVie Inc. North Chicago, IL 60064, USA ©2024 AbbVie. All rights reserved. VRAYLAR 및 디자인은 AbbVie 계열사인 Allergan Pharmaceuticals International Limited의 상표입니다. 자세한 내용은 www.VRAYLAR.com을 방문하거나 1-800-678-1605로 전화하십시오. |
이 의약품 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정 11/2024
v7.0MG115
주요 표시 패널
NDC 61874-115-20
처방전 의약품
Vraylar®
(cariprazine) capsules
캡슐당 1.5mg
처방자 주의: 각 환자에게 약물 안내서를 제공하십시오.
각 캡슐은 1.5mg의 cariprazine base에 해당하는 cariprazine HCl을 함유하고 있습니다.
20캡슐 (10캡슐씩 2개의 블리스터 카드).
주요 표시 패널
NDC 61874-130-20
Rx Only
Vraylar®
(cariprazine) capsules
3 mg per capsule
처방자 유의사항: 각 환자에게 복약 안내서를 제공하십시오.
Each capsule contains cariprazine HCl equivalent to
3 mg cariprazine base.
20 capsules (2×10-count blister cards)
주요 표시 패널
NDC 61874-145-30
처방전 의약품
Vraylar®
(cariprazine) capsules
4.5 mg per capsule
처방자 주의: 각 환자에게 약물 안내서를
제공하십시오.
30 Capsules
주요 표시 패널
NDC 61874-160-30
처방전 의약품
Vraylar®
(cariprazine) capsules
캡슐당 6mg
처방자 주의: 각 환자에게 약물 안내서를
제공하십시오.
30캡슐
주요 표시 패널
NDC 61874-170-08
Rx Only
Vraylar®
(브레이라)


