의약품 제조업체: Takeda Pharmaceuticals America, Inc. (Updated: 2023-04-07)
처방 정보의 주요 내용
VONVENDI [폰 빌레브란트 인자 (재조합)] 용액용 동결 건조 분말, 정맥 주사용
미국 최초 승인: 2015
적응증 및 사용법
투여량 및 투여 방법
재구성 후 정맥 주사만 가능합니다.
요청 시 치료 및 출혈 에피소드 조절
- 각 출혈 에피소드에 대해, 8인자 기준치가 40% 미만이거나 알 수 없는 경우, 승인된 재조합 (폰 빌레브란트 인자를 포함하지 않은) 8인자와 함께 VONVENDI의 첫 번째 투여량을 투여하십시오. (2.1)
- 초기 투여량은 체중 (BW) 1kg당 40~80 국제 단위 (IU)입니다. 출혈의 정도와 위치에 따라 투여량을 조정하십시오. (2.1)
| 출혈 에피소드 | 초기 투여량 | 후속 투여량 |
|---|---|---|
| 경미한 | 40~50 IU/kg | 8~24시간마다 40~50 IU/kg |
| 중증 | 50~80 IU/kg | 약 2~3일 동안 8~24시간마다 40~60 IU/kg |
수술 전 출혈 관리
선택적 수술 절차
- 내인성 8인자 수치가 최소 30 IU/dL (경미한 수술) 또는 60 IU/dL (중증 수술)까지 증가하도록 수술 12~24시간 전에 VONVENDI를 투여할 수 있습니다. (2.1)
- 수술 3시간 전에 FVIII:C 수치를 평가하십시오. FVIII:C 수치가 권장 최소 목표 수치 이상인 경우, 절차 1시간 전에 VONVENDI만 투여하십시오. FVIII:C 수치가 권장 최소 목표 수치 미만인 경우, VWF:RCo 및 FVIII:C를 높이기 위해 VONVENDI에 재조합 8인자를 추가로 투여하십시오. (2.1)
응급 수술
- 수술 3시간 전에 기준 VWF:RCo 및 FVIII:C 수치를 평가하십시오. 사용할 수 없는 경우, 체중 기반 투여량 계산을 사용하십시오. (2.1)
- 재조합 8인자와 함께 또는 재조합 8인자 없이 수술 1시간 전에 VONVENDI를 투여하고 VWF:RCo 및 FVIII:C를 적절한 수준으로 높이기 위해 투여량을 조정하십시오. (2.1)
| 수술 유형 | 목표 최고 혈장 수치 | rVWF 투여량 계산 (필요한 IU VWF:RCo) |
|
|---|---|---|---|
| VWF:RCo | FVIII:C | ||
| 경미한 | 50~60 IU/dL | 40~50 IU/dL | ∆ VWF:RCo × BW (kg)/IR |
| 중증 | 100 IU/dL | 80~100 IU/dL | ∆ VWF:RCo × BW (kg)/IR |
- 수술 후 VWF:RCo 및 FVIII:C 혈장 수치를 계속 모니터링하십시오. (2.1)
요청 시 치료를 받는 중증 3형 VWD 환자의 출혈 빈도 감소를 위한 일상적인 예방
VONVENDI의 초기 용량은 체중 kg당 40~60 IU로 주 2회 투여합니다. 출혈 빈도에 따라 용량을 주 2회 최대 60 IU/kg까지 조정할 수 있습니다. (2.1)
용량 형태 및 강도
VONVENDI는 명목상 650 또는 1300 국제 단위 VWF:RCo를 함유한 단일 용량 바이알에 동결 건조 분말 형태로 제공됩니다. (3)
금기 사항
VONVENDI 또는 그 구성 요소(구연산 삼나트륨 이수화물, 글리신, 만니톨, 트레할로스 이수화물 폴리소르베이트 80, 햄스터 또는 마우스 단백질)에 대한 생명을 위협하는 과민 반응이 있었던 환자에게는 사용하지 마십시오. (4)
경고 및 주의 사항
- 특히 혈전증 위험 요인이 있는 환자의 경우 혈전색전증 반응이 발생할 수 있습니다. 혈전증의 초기 징후를 모니터링하고 현재 권장 사항에 따라 혈전색전증 예방 조치를 취하십시오. 임상 시험에서 VONVENDI로 치료받은 VWD 환자 100명 중 1명이 총 고관절 치환술 후 수술 후 기간에 근위 심부 정맥 혈전증을 발생시켰습니다. 재조합 제8인자와 함께 VONVENDI를 자주 투여해야 하는 환자의 경우 지속적인 과도한 제8인자 혈장 수치는 혈전색전증 위험을 증가시킬 수 있으므로 FVIII:C에 대한 혈장 수치를 모니터링하십시오. (5.1)
- 아나필락시스를 포함한 과민 반응이 발생할 수 있습니다. 과민 반응 증상이 나타나면 VONVENDI 투여를 중단하고 적절한 응급 처치를 실시하십시오. (5.2)
- 폰 빌레브란트 인자(VWF) 및/또는 제8인자에 대한 억제제가 발생할 수 있습니다. 예상되는 VWF 활성(VWF:RCo) 혈장 수치가 달성되지 않거나 적절한 용량으로 출혈이 조절되지 않으면 적절한 검사를 통해 항-VWF 또는 항-제8인자 억제제가 있는지 확인하십시오. (5.3)
부작용
- 관찰된 가장 흔한 부작용(≥2%의 피험자)은 두통, 구토, 메스꺼움, 현기증, 관절통, 관절 손상, 현훈, ALT 증가 및 전반적인 가려움증이었습니다. (6.1)
- 수술 환경에서 VONVENDI로 치료받은 한 명의 피험자가 총 고관절 치환술 후 심부 정맥 혈전증을 발생시켰습니다. (6.1)
의심되는 부작용을 보고하려면 Takeda Pharmaceuticals U.S.A., Inc.에 1-877-TAKEDA-7(1-877-825-3327) 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2023년 3월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용도
2 용법 및 용량
2.1 권장 용량
2.2 준비 및 재구성
2.3 투여
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 색전증 및 혈전증
5.2 과민 반응
5.3 중화 항체
5.4 모니터링 검사
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
6.3 면역원성
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
15 참고 문헌
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용
VONVENDI [폰 빌레브란트 인자 (재조합)]는 다음과 같은 경우에 von Willebrand 질환 (VWD)으로 진단된 성인 (18세 이상)에서 사용하도록 승인된 재조합 폰 빌레브란트 인자 (rVWF)입니다.
- 요청 시 치료 및 출혈 에피소드 조절.
- 수술 전 출혈 관리.
- 요청 시 치료를 받는 중증 3형 VWD 환자에서 출혈 에피소드 빈도를 줄이기 위한 일상적인 예방.
2 투여 및 관리
2.1 권장 용량
재구성 후 정맥 주사만 가능합니다.
- VONVENDI 바이알 각각은 리스토세틴 보조인자 검사(VWF:RCo)로 측정한 국제 단위(IU)로 표시된 실제 rVWF 활성량으로 표시됩니다.
- 용량 및 빈도는 임상 판단에 따라 개별화하고, 대상자의 체중, 출혈 에피소드/수술 개입의 유형 및 중증도, 적절한 임상 및 실험실 측정 모니터링을 기반으로 합니다.
- 출혈을 경험하는 환자의 경우, 제8인자 응고 활성(FVIII:C)이 40 IU/데시리터(dL)(즉, 정상 활성의 40%)에 도달할 때까지 지혈을 보장할 수 없습니다. 환자의 기저 혈장 FVIII:C 수준이 40% 미만이거나 알 수 없는 경우, VONVENDI의 첫 번째 주입과 함께 승인된 재조합(폰 빌레브란트 인자를 함유하지 않은) 제8인자(rFVIII)를 투여하여 지혈 혈장 FVIII:C 수준을 달성합니다. 그러나 FVIII:C의 즉각적인 상승이 필요하지 않거나 기저 FVIII:C 수준이 지혈을 보장하기에 충분한 경우, rFVIII 없이 VONVENDI를 투여합니다.
- 환자의 기저 FVIII:C 수준에 따라, 대부분의 환자에서 VONVENDI의 단일 주입은 6시간 이내에 40% 이상의 내인성 FVIII:C 활성 증가로 이어질 것으로 예상됩니다.
- 반복 주입이 필요한 경우, 제8인자 수준을 모니터링하여 후속 주입에 rFVIII가 필요한지 확인합니다.
요청 시 치료 및 출혈 에피소드 조절
체중(BW) 40~80 IU/kg의 초기 용량을 투여합니다. 경미한 출혈 및 중증 출혈 치료에 대한 용량 지침은 표 1에 제공됩니다.
환자의 임상 판단, 출혈의 중증도, 부위, 병력을 고려하여 지정된 범위 내에서 VONVENDI를 투여합니다. 출혈 에피소드의 범위 및 위치에 따라 용량을 조절합니다. 임상적으로 필요한 한 후속 용량을 투여합니다. 적절한 임상 및 실험실 측정을 모니터링합니다 [경고 및 주의 사항(5.2, 5.3)].
| 출혈 에피소드 | 초기 용량* | 후속 용량 (임상적으로 필요한 경우) |
|---|---|---|
| 경미한 (예: 쉽게 관리되는 코피, 구강 출혈, 월경 과다) | 40~50 IU/kg | 8~24시간마다 40~50 IU/kg |
| 중증† (예: 심한 또는 난치성 코피, 월경 과다, 위장관 출혈, 중추 신경계 외상, 혈관절 출혈 또는 외상성 출혈) | 50~80 IU/kg | 약 2~3일 동안 8~24시간마다 40~60 IU/kg |
Calculating Dose
VONVENDI 용량 [IU] = 용량 [IU/kg] × 체중 [kg]
기저 혈액 응고 인자 VIII 수치가 알려지지 않은 주요 출혈 에피소드의 경우, rFVIII는 약 2 (IU/dL)/(IU/kg)의 평균 회복률을 기반으로 FVIII:C 목표 최고 수치 80~100 IU/dL를 달성하기 위해 투여해야 합니다. 사용되는 rFVIII의 체중 기반 용량 계산은 라벨을 참조하십시오.
예상 VWF 활성 혈장 수치가 달성되지 않거나 적절한 용량으로 출혈 에피소드가 조절되지 않으면 VWF 또는 혈액 응고 인자 VIII 억제제의 존재를 측정하는 검사를 수행합니다. [경고 및 주의 사항 (5.3) 참조].
수술 전 출혈 관리
선택적 수술
수술 전 VONVENDI 용량은 수술 12~24시간 전에 투여하여 내인성 혈액 응고 인자 VIII 수치가 적재 용량(수술 전 1시간 용량)의 rVWF(rFVIII 포함 또는 미포함) 투여 전에 최소 30 IU/dL(경미한 수술) 또는 60 IU/dL(주요 수술)까지 증가하도록 할 수 있습니다.
12~24시간 수술 전 용량의 필요성을 결정하기 전에 기저 FVIII:C 수치를 확인하십시오. FVIII:C 수치는 수술 절차 시작 3시간 이내에 평가해야 합니다. 수치가 권장 최소 목표 수치(경미한 수술의 경우 30 IU/dL, 주요 수술의 경우 60 IU/dL)에 도달하면 수술 1시간 전에 VONVENDI 용량만(혈액 응고 인자 VIII 치료 없이) 투여하십시오. FVIII:C 수치가 권장 최소 목표 수치보다 낮으면 VWF:RCo와 FVIII:C를 높이기 위해 VONVENDI 전체 용량을 투여한 후 10분 이내에 rFVIII를 투여하십시오.
표 2를 참조하여 수술 전 출혈 관리를 위한 권장 VWF:RCo 및 FVIII:C 목표 최고 혈장 수치와 용량 지침을 확인하십시오.
12~24시간 수술 전 용량 투여 후 3시간 이내에 기저 VWF:RCo 수치를 평가하십시오. 12~24시간 수술 전 용량이 투여되지 않으면 수술 전에 기저 수치 VWF:RCo를 평가하십시오.
가능하면 수술 전에 VONVENDI에 대한 증분 회복(IR)을 측정하십시오. IR 계산을 위해 기저 혈장 VWF:RCo를 측정하십시오. 그런 다음 VONVENDI 50 IU/kg 용량을 주입하십시오. VONVENDI 주입 후 30분 후에 VWF:RCo를 측정하십시오.
다음 공식을 사용하여 IR을 계산하십시오.
IR = [30분 후 혈장 VWF:RCo (IU/dL) – 기저 혈장 VWF:RCo (IU/dL)]/용량 (IU/kg)
응급 수술
응급 수술이 필요한 대상의 경우 12~24시간 수술 전 용량이 실현 가능하지 않을 수 있습니다. 가능하면 수술 절차 시작 3시간 이내에 기저 VWF:RCo 및 FVIII:C 수치를 평가해야 합니다. 적재 용량(수술 전 1시간 용량)은 목표 최고 및 기저 혈장 VWF:RCo 수치의 차이를 IR로 나눈 값으로 계산할 수 있습니다. IR을 사용할 수 없는 경우 IR을 2.0 IU/dL/IU/kg로 가정합니다.
기저 VWF:RCo 및 FVIII:C를 사용할 수 없는 경우 일반적인 지침으로 VONVENDI 적재 용량(수술 전 1시간 용량) 40~60 IU/kg VWF:RCo를 투여해야 합니다. 또한 혈액 응고 인자 VIII 혈장 수치가 이미 40~50 IU/dL(경미한 수술) 또는 80~100 IU/dL(주요 수술) 미만인(또는 그럴 가능성이 높은) 환자의 경우 VONVENDI 주입 후 바람직하게는 10분 이내에 30~45 IU/kg 용량의 rFVIII를 순차적으로 주입할 수 있습니다.
표 2를 참조하여 수술 전 출혈 관리를 위한 권장 VWF:RCo 및 FVIII:C 목표 최고 혈장 수치와 용량 지침을 확인하십시오.
| 수술 유형 | VWF:RCo 목표 최고 혈장 수치 | FVIII:C 목표 최고 혈장 수치* | rVWF 용량 계산 (수술 1시간 전에 투여) (필요한 IU VWF:RCo) |
|---|---|---|---|
|
|||
| 경미한 | 50~60 IU/dL | 40~50 IU/dL | ∆† VWF:RCo × BW (kg) /IR‡ |
| 주요 | 100 IU/dL | 80 to 100 IU/dL | ∆† VWF:RCo × BW (kg) /IR‡ |
기준 FVIII:C, VWF:RCo 및 증가율이 없는 경우 표 3에 명시된 바와 같이 체중 기반 투여를 사용하는 것이 좋습니다.
| 수술 유형 | VWF:RCo (IU VWF:RCo/kg BW) | VWF:RCo 목표 최고 혈장 수준 | FVIII:C (IU FVIII:C/kg BW) | FVIII:C 목표 최고 혈장 수준 |
|---|---|---|---|---|
| 경미 | 25 to 30 IU/kg | 50 to 60 IU/dL | 20 to 25 IU/kg | 40 to 50 IU/dL |
| 주요 | 50 ± 10 IU/kg | 100 IU/dL | 40 to 50 IU/kg | 80 to 100 IU/dL |
수술 후 12~24시간부터 시작하여 수술 전후 기간 동안 최소 24시간마다 VWF:RCo 및 FVIII:C 혈장 수준을 모니터링하여 VONVENDI 또는 rFVIII 수준의 투여량을 조정합니다. VWF:RCo 및 FVIII:C 혈장 수준을 모니터링하고 약동학(PK) 결과 및 지혈 과제의 강도 및 지속 시간에 따라 수술 전후 유지 요법을 개별화해야 합니다. VONVENDI 투여 빈도는 하루 두 번에서 48시간마다 한 번까지 다양해야 합니다.
수술 후 후속 유지 용량에 대한 권장 VWF:RCo 및 FVIII:C 목표 최저 혈장 수준 및 최소 치료 기간은 표 4를 참조하십시오.
| 수술 유형 | VWF:RCo 목표 최저 혈장 수준 |
FVIII:C 목표 최저 혈장 수준 |
최소 치료 기간 | 투여 빈도 | ||
|---|---|---|---|---|---|---|
| 수술 후 최대 72시간 | 수술 후 72시간 이후 | 수술 후 최대 72시간 | 수술 후 72시간 이후 | |||
| 경미 | ≥30 IU/dL | – | >30 IU/dL | – | 48시간 | 12~24시간마다 또는 격일로 |
| 주요 | >50 IU/dL | >30 IU/dL | >50 IU/dL | >30 IU/dL | 72시간 | |
2.2 준비 및 재구성
- VONVENDI와 주사용 멸균수(희석제)를 실온에 도달하도록 합니다.
- 환자가 주사당 VONVENDI 바이알을 하나 이상 필요로 하는 경우 다음 지침에 따라 각 바이알을 재구성합니다.
- 재구성된 바이알에 플레이크나 입자가 남아 있을 수 있습니다. Mix2Vial 장치에 포함된 필터는 과도한 플레이크나 입자를 제거하며, 주사기의 결과 용액은 맑고 무색이어야 합니다. 바이알에서 주사기로 여과한 후 용액이 흐리거나 플레이크나 입자가 포함되어 있는 경우 주사기의 용액을 사용하지 마십시오.
재구성
- VONVENDI 바이알과 주사용수 바이알에서 플라스틱 캡을 제거합니다.
- 멸균 알코올 솜으로 고무 마개를 닦습니다.
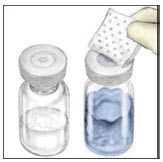
- Mix2Vial 이송 장치의 덮개를 벗겨냅니다. 멸균성을 유지하기 위해 Mix2Vial 장치를 투명 플라스틱 포장에 그대로 두십시오.
- 희석제 바이알을 수평 표면에 단단히 고정한 상태에서 Mix2Vial을 플라스틱 포장에 넣고 희석제 바이알 위로 뒤집습니다. Mix2Vial의 파란색 플라스틱 캐뉼라를 고무 마개를 통해 아래로 똑바로 밀어 넣습니다. 플라스틱 포장을 조심스럽게 제거하여 Mix2Vial이 희석제 바이알에 단단히 부착되도록 합니다.
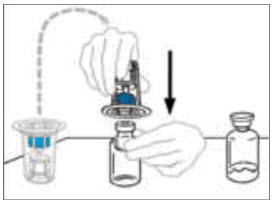
- VONVENDI 바이알을 수평 표면에 단단히 고정한 상태에서 Mix2Vial이 부착된 희석제 바이알을 빠르게 뒤집고 Mix2Vial의 투명 플라스틱 캐뉼라 끝을 VONVENDI 바이알의 마개를 통해 아래로 똑바로 밀어 넣습니다. 진공에 의해 희석제가 VONVENDI 바이알로 빨려 들어갑니다.
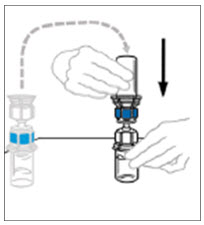
- 희석제 이송이 완료되었는지 확인합니다. 진공이 손실된 경우 사용하지 마십시오.
- 두 바이알이 여전히 연결된 상태에서 바이알을 부드럽게 흔들거나 재구성된 제품을 5분 동안 그대로 두었다가 부드럽게 흔들어 분말이 완전히 용해되도록 합니다.
흔들지 마십시오. 흔들면 제품의 무결성에 악영향을 미칩니다.
참고: 재구성된 바이알에 플레이크나 입자가 남아 있을 수 있습니다. Mix2Vial 장치에 포함된 필터는 과도한 플레이크나 입자를 제거하며, 주사기의 결과 용액은 맑고 무색이어야 합니다. 바이알에서 주사기로 여과한 후 용액이 흐리거나 플레이크나 입자가 포함되어 있는 경우 주사기의 용액을 사용하지 마십시오.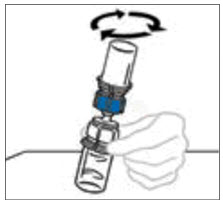
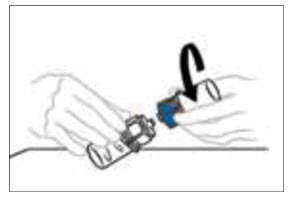
- 내용물이 완전히 용해되면 Mix2Vial의 투명 부분과 파란색 부분을 단단히 잡습니다. Mix2Vial을 두 개의 별도 부분으로 분리하여 비어 있는 희석제 바이알과 Mix2Vial의 파란색 부분을 버립니다. 참고: Mix2Vial은 VONVENDI와 희석제 단일 바이알에 한 번만 사용하도록 설계되었습니다. 용량이 VONVENDI 바이알 하나 이상을 필요로 하는 경우 각 바이알을 별도로 재구성합니다.
재구성 후 냉장 보관하지 마십시오.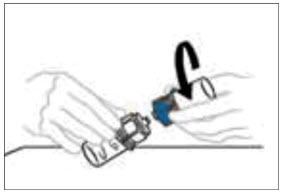
2.3 투여
정맥 주사만 가능합니다.
- 재구성 후 즉시 VONVENDI를 투여합니다. 그렇지 않은 경우 실온(25°C(77°F) 이하)에 최대 3시간까지 보관합니다. 3시간 후에는 버립니다.
- VONVENDI 바이알을 두 개 이상 단일 주사기에 혼합할 수 없습니다. 두 개 이상의 바이알을 주사기에 혼합하면 필라멘트가 형성될 수 있으며, 이 경우 주사기의 용액을 버려야 합니다. 환자가 VONVENDI 바이알을 하나 이상 투여받아야 하는 경우 주사기를 바이알에 부착하거나 주사기 끝을 적절한 멸균 캡으로 덮어 오염 위험을 줄입니다.
- 이 제품에는 플라스틱 주사기를 사용하십시오. 제품의 단백질이 유리 주사기 표면에 달라붙는 경향이 있습니다.
- VONVENDI를 다른 의약품과 혼합하지 마십시오.
투여
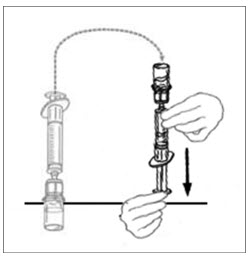
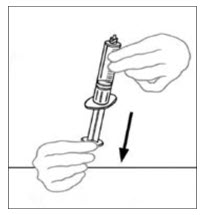
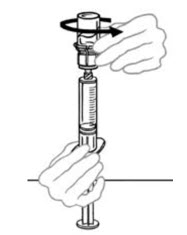
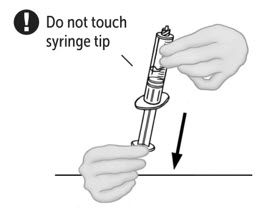
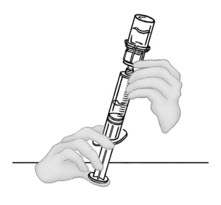
- 빈 멸균 일회용 플라스틱 주사기에 공기를 주입합니다. 공기량은 바이알에서 빼낼 재구성된 VONVENDI의 양과 같아야 합니다.
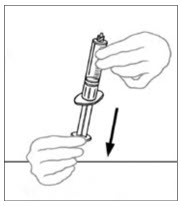
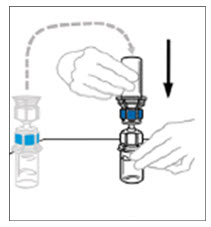
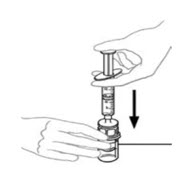
- 수평 작업대에 VONVENDI 바이알(용해된 제품 포함)을 둔 상태에서 주사기를 투명 플라스틱 커넥터에 연결하여 시계 방향으로 돌립니다. (그림 A). 한 손으로 바이알을 잡고 다른 손으로 주사기의 공기를 모두 바이알로 밀어 넣습니다. (그림 B). 공기를 모두 바이알로 밀어 넣지 않으면 필요한 양의 제품이 주사기로 빨려 들어가지 않습니다.
그림 A 그림 B 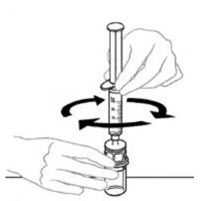
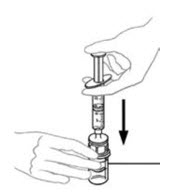
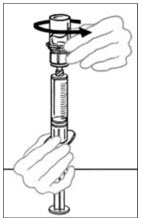
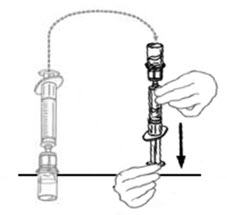
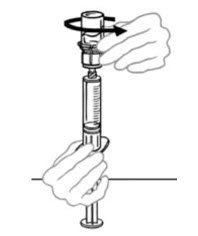
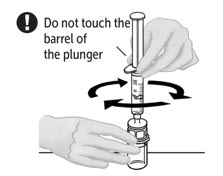
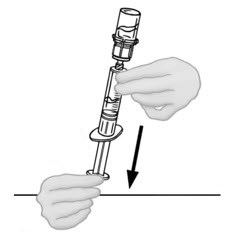
- 연결된 주사기와 VONVENDI 바이알을 뒤집어 바이알이 위로 오도록 합니다. 주사기 플런저를 계속 눌러주세요. 플런저를 천천히 뒤로 당겨 VONVENDI를 주사기에 채웁니다. 주사기와 바이알 사이에서 용액을 앞뒤로 밀어넣지 마세요. 그렇게 하면 제품의 무결성이 손상될 수 있습니다.
- 투여 전에 주사기에 여과/흡입된 VONVENDI를 변색 및 이물질 유무를 확인합니다. 용액은 투명하거나 약간 불투명해야 합니다. 이물질, 변색 또는 혼탁이 관찰되면 투여하지 말고 다케다 의약품 정보 1-877-TAKEDA-7(1-877-825-3327)에 알립니다.
- 주입할 준비가 되면 주사기 배럴을 단단히 잡고(주사기 플런저가 아래로 향하게 유지) Mix2Vial을 주사기에서 분리합니다. Mix2Vial(투명 플라스틱 부분)과 빈 VONVENDI 바이알을 버립니다. 환자가 VONVENDI를 2개 이상의 바이알을 투여받아야 하는 경우 최대 2개 바이알의 내용물을 단일 주사기에 채울 수 있습니다. 주사기에 합칠 VONVENDI의 두 번째 바이알에 공기를 주입할 때 바이알과 연결된 주사기를 바이알이 위로 오도록 배치합니다.
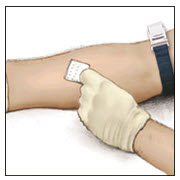
- 멸균 알코올 솜으로 주입 부위를 깨끗이 닦습니다.
- 주사기에 적합한 주입 바늘을 연결합니다. 환자의 편안함을 보장할 수 있을 만큼 충분히 천천히, 최대 분당 4mL의 속도로 정맥 주입합니다.
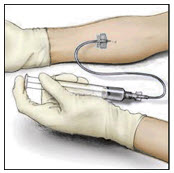
- 심계항진이 발생하면 주입 속도를 낮추거나 투여를 중단해야 합니다.
- 사용하지 않은 제품이나 폐기물은 현지 규정에 따라 폐기합니다.
3 투여 형태 및 강도
VONVENDI는 각각 650 IU 또는 1300 IU VWF:RCo/바이알을 함유하는 단회용 바이알에 재구성을 위한 비발열성 백색에서 백색을 띤 흰색의 동결 건조 분말로 제공됩니다.
각 VONVENDI 바이알은 VWF 농축액에 대한 현재 세계보건기구(WHO) 표준을 기반으로 IU로 표시된 VWF:RCo 단위 수로 표시됩니다.
4 금기사항
VONVENDI는 VONVENDI 또는 제품 구성 요소(구연산삼나트륨 이수화물, 글리신, 만니톨, 트레할로스 이수화물, 폴리소르베이트 80 및 햄스터 또는 마우스 단백질)에 대한 생명을 위협하는 과민 반응을 보인 환자에게 금기입니다. [설명 (11) 참조].
5 경고 및 주의 사항
5.1 색전증 및 혈전증
특히 낮은 ADAMTS13 수치를 가진 혈전증 위험 요소가 있는 환자의 경우, disseminated intravascular coagulation (DIC), 정맥 혈전증, 폐색전증, 심근 경색 및 뇌졸중을 포함한 혈전색전증 반응이 발생할 수 있습니다 [설명 (11) 참조]. 통증, 부종, 변색, 호흡 곤란, 기침, 객혈 및 실신과 같은 혈전증의 초기 징후와 증상을 모니터링하고 현재 권장 사항 및 표준 치료에 따라 혈전색전증 예방 조치를 취하십시오.
rFVIII와 함께 VONVENDI를 자주 투여해야 하는 환자의 경우, 지속적인 과도한 VIII 인자 혈장 수치는 혈전색전증 합병증의 위험을 증가시킬 수 있으므로 VIII 인자:C 활성에 대한 혈장 수치를 모니터링하십시오.
임상 시험에서 VONVENDI로 치료받은 100명의 피험자 중 한 명은 고위험 환자에 대한 병원의 표준 치료의 일환으로 수행된 영상 검사에서 VONVENDI를 투여받은 후 3일째에 고관절 전치환 수술 후 심부 정맥 혈전증 진단을 받았습니다.
5.2 과민 반응
VONVENDI와 관련하여 과민 반응이 발생했습니다. 이러한 반응에는 아나필락시스 쇼크, 전신 두드러기, 혈관 부종, 가슴 답답함, 저혈압, 쇼크, 졸음, 메스꺼움, 구토, 감각 이상, 가려움증, 불안, 시력 흐림, 천명음 및/또는 급성 호흡 곤란이 포함될 수 있습니다. 심각한 알레르기 반응의 징후와 증상이 나타나면 즉시 VONVENDI 투여를 중단하고 적절한 지지 치료를 제공하십시오.
VONVENDI에는 2 ng/IU VONVENDI 이하의 마우스 면역 글로불린 G (MuIgG) 및 햄스터 단백질이 미량 함유되어 있습니다. 이 제품으로 치료받은 환자는 비인간 포유류 단백질에 대한 과민 반응을 일으킬 수 있습니다.
5.3 중화 항체
VWF 및/또는 VIII 인자에 대한 중화 항체(억제제)가 발생할 수 있습니다. 예상되는 VWF 활성(VWF:RCo) 혈장 수치에 도달하지 못하면 적절한 검사를 수행하여 항-VWF 또는 항-VIII 인자 억제제가 있는지 확인하십시오. 다른 치료 옵션을 고려하고 환자를 VWD 또는 혈우병 A 치료에 경험이 있는 의사에게 의뢰하십시오.
VWF 또는 VIII 인자에 대한 억제제 수치가 높은 환자의 경우 VONVENDI 치료가 효과적이지 않을 수 있으며 이 단백질의 주입은 심각한 과민 반응을 유발할 수 있습니다. 억제제 항체는 아나필락시스 반응과 동시에 발생할 수 있으므로 아나필락시스 반응을 경험하는 환자는 억제제가 있는지 평가하십시오.
5.4 실험실 검사 모니터링
지속적인 과도한 VWF 및/또는 VIII 인자 활성 수치는 특히 알려진 임상적 또는 실험실적 위험 요소가 있는 환자의 경우 혈전증 발생 위험을 증가시킬 수 있으므로 VONVENDI를 투여받는 환자의 경우 VWF:RCo 및 VIII 인자 활성의 혈장 수치를 모니터링하십시오.
의심되는 경우 VWF 및/또는 VIII 인자 억제제의 발생을 모니터링하십시오. 예상되는 VONVENDI 용량으로 출혈이 조절되지 않으면 적절한 억제제 검사를 수행하여 VWF 및/또는 VIII 인자 억제제가 있는지 확인하십시오.
6 부작용
VONVENDI 임상 시험(n=100)에서 2% 이상의 환자에게서 나타난 가장 흔한 이상 반응은 두통, 구토, 메스꺼움, 어지러움, 관절통, 관절 손상, 현기증, ALT 증가, 전신 가려움증이었습니다.
수술 중 출혈 관리를 위해 수술 연구에서 VONVENDI로 치료받은 한 환자에게서 수술 후 근위부 심부 정맥 혈전증이 발생했습니다. [경고 및 주의사항 (5.1) 참조].
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 특정 약물의 임상 시험에서 관찰된 이상 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실무에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
VONVENDI의 안전성 프로파일은 5건의 전향적, 다기관 시험에서 평가되었습니다. 4건은 VWD 환자(n=100)를 대상으로 수행되었고, 1건은 혈우병 A 환자(n=12)를 대상으로 수행되었습니다. 아래 나열된 이상 약물 반응(ADR) 용어 (표 5)는 VONVENDI를 PK 평가, 주문형 치료 및 수술을 받는 환자의 수술 중 출혈 관리에 사용한 3건의 임상 시험(n=80)에서 의뢰자/회사가 시험 약물과 타당한 인과 관계가 있다고 평가한 것입니다.
| 계통 기관 분류(SOC) | 이상 반응 | 피험자 수 (%)† (n=80) |
|---|---|---|
| 심장 질환 | 빈맥 | 1 (1.25%) |
| 위장관 질환 | 구토 | 3 (3.75%) |
| 메스꺼움 | 3 (3.75%) | |
| 전신 장애 및 투여 부위 상태 | 주입 부위 감각 이상 | 1 (1.25%) |
| 흉부 불편감 | 1 (1.25%) | |
| 피부 및 피하 조직 질환 | 전신 가려움증 | 2 (2.50%) |
| 혈관 질환 | 안면 홍조 | 1 (1.25%) |
| 고혈압 | 1 (1.25%) | |
| 심부 정맥 혈전증 | 1 (1.25%) | |
| 신경계 질환 | 어지러움 | 3 (3.75%) |
| 현기증 | 2 (2.50%) | |
| 미각장애 | 1 (1.25%) | |
| 떨림 | 1 (1.25%) | |
| 검사 | 심박수 증가 | 1 (1.25%) |
| 심전도 T파 역전 | 1 (1.25%) | |
임상 시험에서 본벤디로 치료받은 단일 환자에서 주입 관련 반응이 나타났습니다. 이 환자는 이전에 아무런 증상 없이 본벤디에 노출된 적이 있습니다. 주입을 시작한 지 3분 후에 흉부 불편감과 심박수 증가가 나타났습니다. 이 환자는 지지 요법으로 치료를 받았고 증상은 3시간 이내에 해결되었습니다.
완료된 예방 임상 연구에서 연구 참여 전에 혈장 유래 VWF로 주문형 요법 또는 예방 요법을 받은 18세 이상의 성인 피험자 22명이 연구 중에 본벤디로 예방 치료를 받았습니다. 이상 약물 반응(ADR) 용어는 아래에 나열되어 있습니다. (표 6).
| 계통 기관 분류(SOC) | 이상 반응 | 전체 (N=22) n (%)† |
|---|---|---|
| N=각 열 내 안전성 분석 세트의 피험자 총 수. n=해당 범주에서 하나 이상의 사건이 발생한 피험자 수. |
||
| 신경계 장애 | 두통‡ | 4 (18.2%) |
| 근골격계 및 결합 조직 장애 | 관절통 | 3 (13.6%) |
| 검사 | ALT 증가 | 2 (9.1%) |
| AST 증가 | 1 (4.5%) | |
| 심장 장애 | 상심실성 빈맥 | 1 (4.5%) |
| 심실성 기외수축 | 1 (4.5%) | |
| 위장관 장애 | 설사 | 1 (4.5%) |
| 피부 및 피하 조직 장애 | 자반병 | 1 (4.5%) |
| 가려움성 발진 | 1 (4.5%) | |
| 전신 장애 및 투여 부위 상태 | 주사 부위 자극 | 1 (4.5%) |
6.2 시판 후 경험
본벤디의 시판 후 사용 중 다음과 같은 이상 약물 반응(ADR)이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
본벤디 치료와 관련하여 보고된 시판 후 ADR에는 빈맥, 홍조, 발진, 호흡곤란, 시야 흐림과 같은 증상으로 임상적으로 나타날 수 있는 주입 관련 반응(IRR)이 포함됩니다. 보고된 시판 후 사례에서 증상이 해결되었고 환자는 주입을 중단한 후 4시간 이내에 완전히 회복되었습니다.
시판 후 환경에서 본벤디 사용과 관련하여 아나필락시스 반응이 보고되었습니다.
6.3 면역원성
임상 시험에서 VWF 및 FVIII에 대한 중화 항체뿐만 아니라 VWF, Furin, 중국 햄스터 난소(CHO) 단백질 및 마우스 IgG에 대한 결합 항체의 발생을 평가하여 본벤디의 면역원성을 평가했습니다. 임상 시험에서 본벤디를 투여받은 100명의 피험자 중 수술 후 주변기에 본벤디로 치료받은 한 피험자에서 VWF에 대한 치료 후 발생 결합 항체가 발생했으며, 이 피험자에게서는 이상 사례나 지혈 효능 부족이 보고되지 않았습니다. 본벤디로 치료한 후 rFurin, CHO 단백질 또는 마우스 IgG와 같은 잠재적 불순물에 대한 결합 항체는 발생하지 않았습니다.
연구에 포함된 두 명의 피험자는 VWF에 대한 기존의 고역가 특이적 결합 항체를 가지고 있었습니다. 고역가 결합 항VWF 항체는 혈장 유래 VWF(pdVWF) 또는 rVWF 주입 후 VWF:Ag 활성이 유의하게 감소했으며 결과적으로 VWF:RCo, VWF:CB 및 FVIII:C 활성이 감소했습니다. 이러한 결과는 기존 결합(비중화) 항체의 잠재적 임상적 중요성을 나타냅니다. 이전에 pdVWF 농축액으로 치료받은 VWD 환자는 rVWF에 처음 노출되기 전에 VWF에 대한 기존 결합 항체를 발현할 위험이 있으며, 이는 잠재적으로 rVWF에 대한 지혈 반응 감소를 초래할 수 있습니다. 이러한 환자는 각 환자의 PK 데이터를 기반으로 더 높은 용량의 rVWF를 투여하여 임상적으로 관리할 수 있습니다.
8 특정 인구 집단에서의 사용
8.2 수유
위험 요약
모유에서 VONVENDI의 존재 여부, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다.
모유 수유의 발달적 및 건강상 이점은 VONVENDI에 대한 어머니의 임상적 필요와 VONVENDI 또는 기저 모성 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
11. 성분, 조성 및 포장
VONVENDI는 중국 햄스터 난소(CHO) 세포에서 발현되는 정제된 rVWF입니다. VONVENDI는 최종 제품의 세포 배양, 정제 또는 제제에 사람 또는 동물에서 유래한 외인성 원료를 첨가하지 않고 생산 및 제제됩니다. 최종 용기 제품에 존재하는 rVWF 이외의 단백질은 미량의 마우스 면역글로불린(면역 친화성 정제에서 유래한 IgG), 숙주 세포(즉, CHO) 단백질, r퓨린(rVWF를 추가로 처리하는 데 사용됨) 및 재조합 인자 VIII(rFVIII)입니다.
폰 빌레브란트 인자는 일반적으로 혈장에서 발견되는 큰 다량체 당단백질이며, 혈액으로 분비되기 전에 혈소판의 알파 과립과 바이블-팔라드체로 알려진 세포내 소기관에 초대형 다량체로 저장됩니다.1 VWF가 혈류로 방출되어 ADAMTS13(혈액 내 단백질 분해 효소)과 접촉하면 SDS 아가로스 겔로 다량체 밴드로 검출될 수 있는 더 작은 크기로 절단되며, 이는 순환 내의 다양한 VWF 종을 나타냅니다. VONVENDI는 제조 공정 중 ADAMTS13에 의한 단백질 분해에 노출되지 않으므로 혈장에서 발견되는 모든 다량체 외에도 초대형 다량체를 포함하는 rVWF입니다.
VONVENDI는 재구성 후 정맥 주사를 위한 멸균된 비발열성 백색 내지 회백색의 부서지기 쉬운 분말로 제형화됩니다. 단회 투여 바이알에 든 VONVENDI는 명목상 650IU 또는 1300IU VWF:RCo를 함유합니다.
이 제품에는 방부제가 들어 있지 않습니다. 제공된 주사용 멸균수로 재구성하면 최종 용액에는 목표량의 다음과 같은 안정제와 부형제가 포함됩니다. (표 7):
| 안정제 및 부형제 | 공칭 함량에 대한 목표 농도(650, 1300IU) |
|---|---|
| 삼나트륨 시트르산 이수화물 | 15mM |
| 글리신 | 15mM |
| 만니톨 | 20g/L |
| 트레할로스 이수화물 | 10g/L |
| 폴리소르베이트 80 | 0.1g/L |
VONVENDI의 각 바이알에는 현재 VWF 농축액에 대한 세계보건기구(WHO) 표준을 기반으로 하는 IU로 표시된 VWF:RCo 단위의 특정 수가 표시되어 있습니다. 동결 건조 분말을 재구성하고 주사기로 여과/채취한 후 모든 투여 강도는 입자가 없는 투명하고 무색의 용액을 생성합니다.
12 임상약리학
12.1 작용 기전
VWD 환자에서 VONVENDI는 1) 손상된 혈관 내피 하 기질(예: 콜라겐)에 대한 혈소판 부착 및 혈소판 응집을 매개하여 지혈을 촉진하고, 2) 제8인자의 운반 단백질로 작용하여 빠른 단백질 분해로부터 보호합니다. VWF의 접착 활성은 다량체의 크기에 따라 달라지며, 더 큰 다량체가 콜라겐 및 혈소판 수용체와의 상호 작용을 지원하는 데 가장 효과적입니다.1 VONVENDI의 혈장 내 제8인자에 대한 결합 용량 및 친화력은 내인성 VWF와 유사하여 VONVENDI가 제8인자 제거를 감소시킬 수 있습니다.2
12.2 약력학
VONVENDI로 예방적 치료를 받은 후 VWF의 PD는 임상 시험에서 조사되었습니다. 3형 VWD가 있는 Prior OD 성인 피험자에서 VONVENDI 단일 주입은 FVIII:C 증가를 유발했으며, 주입 후 약 24시간에 최고 수준이 관찰되었습니다(평균 [SD] 용량: 50.2 [3.33] IU/kg). 1년 동안 VONVENDI 50 ± 10 IU/kg을 일주일에 두 번 반복 주입한 후, 용량 전 FVIII:C 중앙값(범위)은 세척 후 기준선(N=10)의 2.0(2.0~4.0) IU/dL에서 12개월(N=8)의 10.5(6.0~31.0) IU/dL로 증가했습니다. 용량 전 FVIII:C(중앙값 [범위] ≥10.5 [1.0~148] IU/dL)는 1, 2, 3, 6, 9 및 12개월의 예방적 방문에서 관찰되었습니다. 12개월에 FVIII:C의 평균(SD) Cmax 및 AUC(0-96 hours)는 각각 106(37.2) IU/dL 및 5962(2671) IU*h/dL(N=8)이었습니다.
12.3 약동학
VONVENDI의 PK 프로파일은 단일 용량 투여 후 VWF:RCo, VWF:Ag 및 VWF:CB를 평가하여 두 임상 시험의 데이터 분석을 기반으로 결정되었습니다. 피험자는 비출혈 상태에서 평가되었습니다.
표 8은 50 IU/kg(PK50) 또는 80 IU/kg VWF:RCo(PK80) VONVENDI 주입 후 VONVENDI의 PK 매개변수를 요약합니다.
| 매개변수(단위) | ADVATE*를 사용한 PK50 VONVENDI | PK50 VONVENDI | PK80 VONVENDI |
|---|---|---|---|
| 평균(SD) 최소; 최대 |
평균(SD) 최소; 최대 |
평균(SD) 최소; 최대 |
|
| AUC(0-inf) = 주입 후 0시간부터 무한대 시간까지 혈장 농도-시간 곡선 아래 면적; IR = 증분 회복; CL = 청소율; t1/2 = 반감기. | |||
|
|||
| T1/2 | 19.3 (10.99) | 22.6 (5.34) | 19.1 (4.32) |
| (h) | 10.8; 51.2 | 17.0; 37.2 | 11.8; 28.0 |
| CL | 0.04 (0.028) | 0.02 (0.005) | 0.03 (0.009) |
| ([dL/kg]/h) | 0.01; 0.16 | 0.02; 0.04 | 0.02; 0.05 |
| IR | 1.7 (0.62) | 1.9 (0.41) | 2.0 (0.39) |
| ([IU/dL]/([IU/kg]) | 1.0; 3.6 | 1.2; 2.7 | 1.4; 2.9 |
| AUC0-inf | 1541.4 (554.31) | 2105.4 (427.51) | 2939.0 (732.72) |
| (IU*h/dL) | 173.8; 2862.0 | 1334.0; 2813.3 | 1507.8; 4121.1 |
| AUC0-inf/Dose | 33.4 (13.87) | 42.1 (8.31) | 36.8 (8.97) |
| ([IU*h/dL]/[IU/kg]) | 6.4; 70.4 | 27.8; 54.8 | 18.8; 50.4 |
VONVENDI로 예방적 치료 후 VWF의 PK는 임상 시험에서 조사되었습니다. VWF:RCo의 정상 상태 PK 매개변수는 연구 참여 전에 모든 VWF 제품으로 필요에 따라(OD) 치료받은 3형 VWD 환자(Prior OD 그룹)와 연구 등록 전에 혈장 유래 VWF 제품으로 예방적으로 치료받은 환자(Switch 그룹)에 대해 표 9에 제시되어 있습니다. 단회 투여 및 다회 투여(12개월) 후 VWF의 약동학은 Prior OD 그룹에서 유사했습니다.
| 매개변수 (단위) |
Prior OD 그룹 N=8 평균 (SD) 최소; 최대 |
Switch 그룹 N=6 평균 (SD) 최소; 최대 |
|---|---|---|
| AUC(0-96시간) = 주입 후 0시간에서 96시간까지의 혈장 농도-시간 곡선 아래 면적; Cmax = 최대 혈장 농도; IR = 증가된 회복; CL = 청소율; t1/2 = 반감기; Prior OD 그룹의 3형 VWD 환자의 투여 용량은 41~56 IU/kg이고 Switch 그룹의 3형 VWD 환자의 투여 용량은 24~63 IU/kg이었습니다. | ||
| T1/2 | 16.5 (4.13)* | 14.1 (6.13)† |
| (h) | 10.9; 22.4 | 9.4; 22.9 |
| CL | 0.04 (0.012)* | 0.04 (0.014)† |
| ([dL/kg]/h) | 0.02; 0.05 | 0.02, 0.06 |
| IR at Cmax | 1.8 (0.58) | 1.8 (0.25) |
| ([IU/dL] / [IU/kg]) | 0.9, 2.7 | 1.6, 2.2 |
| Cmax | 86.4 (34.2) | 90.6 (33.7) |
| (IU/dL) | 41.6, 149.0 | 46.7, 141.0 |
| Cmax/Dose | 1.8 (0.58) | 1.8 (0.25) |
| ([IU/dL]/[IU/kg]) | 0.9, 2.7 | 1.6; 2.2 |
| AUC(0-96 hours) | 1199 (760) | 1662 (677)‡ |
| (IU*h/dL) | 460, 2940 | 1230, 2440 |
| AUC(0- 96 hours)/Dose | 24.3 (13.40) | 27.5 (9.74)‡ |
| ([IU*h/dL]/[IU/kg]) | 9.8, 53.0 | 21.7, 38.7 |
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
In vitro 및 in vivo 유전독성 연구 결과 VONVENDI는 돌연변이 유발 가능성이 없는 것으로 나타났습니다. VONVENDI의 발암 가능성을 평가하기 위한 장기 동물 연구는 수행되지 않았습니다. VONVENDI의 발달 및 생식 독성을 평가하는 동물 연구는 수행되지 않았습니다.
14 임상 연구
요청 시 치료 및 출혈 에피소드 조절
VONVENDI의 지혈 효능은 von Willebrand 질환으로 진단받은 성인(18세 이상)에서 요청 시 치료 및 출혈 에피소드 조절을 위한 다양한 투약 전략을 rFVIII 유무와 함께 조사한 다기관, 공개 표지 시험에서 평가되었습니다. 이 시험에서 rFVIII가 필요한 모든 피험자는 ADVATE [항혈우인자(재조합)]를 받았습니다.
출혈 에피소드는 처음에 VONVENDI와 ADVATE를 각각 1.3:1의 비율(즉, ADVATE보다 30% 더 많은 VONVENDI)로 주입하여 치료했으며, 그 후 FVIII:C 수치에 따라 VONVENDI를 ADVATE와 함께 또는 ADVATE 없이 투여했습니다. VONVENDI와 ADVATE의 초기 투여 목표는 60 IU/dL(60%) 이상의 VWF:RCo 혈장 수치와 40 IU/dL(40%) 이상의 FVIII:C 혈장 수치를 달성하는 것이었습니다.
요청 시 치료를 위해 VONVENDI에 노출된 37명의 피험자 중 22명에서 총 193건의 출혈 에피소드가 보고되었습니다. 인구 통계적 특징과 기준선 특징은 표 10에 나와 있습니다.
| 매개변수 | 범주 | 노출된 피험자 n=37 n (%) |
치료받은 피험자 n=22 n (%) |
|---|---|---|---|
| 성별 | 남성 | 17 (45.9) | 10 (45.5) |
| 여성 | 20 (54.1) | 12 (54.5) | |
| 나이 | 중앙값(년) | 37.0 | 28.0 |
| 인종 | 코카서스 | 32 (86.5) | 20 (90.9) |
| 아시아 | 5 (13.5) | 2 (9.1) | |
| 민족 | 히스패닉 또는 라틴계 | 2 (5.4) | 2 (9.1) |
| 히스패닉 또는 라틴계 아님 | 35 (94.6) | 20 (90.9) | |
| VWD 유형 | 1 | 2 (5.4) | 0 (0.0) |
| 2A | 5 (13.5) | 4 (18.2) | |
| 2B | 0 (0.0) | 0 (0.0) | |
| 2M | 0 (0.0) | 0 (0.0) | |
| 2N | 1 (2.7) | 1 (4.5) | |
| 3 | 29 (78.4) | 17 (77.3) |
주요 유효성 평가 종료점은 출혈 에피소드 조절에 대한 치료 성공을 보인 대상자 수였습니다. 치료 성공은 시험 기간 동안 VONVENDI(ADVATE 유무와 관계없이)로 치료받은 모든 대상자의 출혈 에피소드에 대한 평균 유효성 평가 점수가 2.5 미만인 것으로 정의되었습니다. 유효성 평가는 연구자에 의해 평가된 출혈 에피소드를 치료하는 데 필요한 예상 주입 횟수와 실제 투여된 주입 횟수를 비교하는 사전에 지정된 4점 평가 척도를 사용하여 평가했습니다. 4점 평가 척도 각각에 대한 정의는 표 11에 제공됩니다.
| 평가 | 경미 및 중등도 출혈 사건 | 중증 출혈 사건 |
|---|---|---|
| 우수 (= 1) |
실제 주입 횟수 ≤ 해당 출혈 에피소드를 치료하는 데 필요한 예상 주입 횟수. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
실제 주입 횟수 ≤ 해당 출혈 에피소드를 치료하는 데 필요한 예상 주입 횟수. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
| 양호 (= 2) |
해당 출혈 에피소드를 조절하는 데 필요한 예상 횟수보다 1~2회 더 많은 주입. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
<1.5× 해당 출혈 에피소드를 조절하는 데 필요한 예상 횟수보다 더 많은 주입. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
| 보통 (= 3) |
해당 출혈 사건을 조절하는 데 사용된 예상 횟수보다 3회 이상 더 많은 주입. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
≥1.5× 해당 출혈 사건을 조절하는 데 사용된 예상 횟수보다 더 많은 주입. 추가 VWF 응고 인자 함유 제품이 필요하지 않습니다. |
| 없음 (= 4) |
심각한 비조절 출혈 또는 출혈 강도가 변하지 않음. 추가 VWF 응고 인자 함유 제품이 필요합니다. |
심각한 비조절 출혈 또는 출혈 강도가 변하지 않음. 추가 VWF 응고 인자 함유 제품이 필요합니다. |
2차 유효성 평가 지표는 ‘우수’ 또는 ‘양호’한 유효성 평가를 받은 치료된 출혈 에피소드 수, 주입 횟수 및 VONVENDI 단위 수, ADVATE와 함께 또는 ADVATE 없이 출혈 에피소드당 투여된 수였습니다.
1차 유효성 평가는 GI 출혈이 있는 피험자(n=2)와 출혈 에피소드를 조절하기 위한 주입 횟수가 회고적으로 추정된 피험자(n=2)를 제외했습니다. 치료 성공률은 100%(95% CI, 81.5~100)였습니다. GI 출혈을 포함한 출혈 에피소드와 연구자가 필요한 주입 횟수를 회고적으로 평가해야 했던 출혈 에피소드(n=22: 17명은 3형 VWD, 4명은 2A형 VWD, 1명은 2N형 VWD)에 대한 치료 성공률의 민감도 분석은 각 시나리오에 대한 100% 치료 성공률로 1차 분석을 확인했습니다.
VONVENDI와 ADVATE 또는 VONVENDI 단독으로 치료된 모든 출혈 에피소드는 우수(96.9%) 또는 양호(3.1%)한 유효성 평가를 받아 조절되었습니다. 출혈 에피소드의 조절은 모든 중증도에서 일관되었습니다.
출혈 중증도별 및 출혈 에피소드를 치료하는 데 필요한 주입 횟수별 지혈 효능 개요는 표 12를 참조하십시오.
| 출혈당 주입 횟수 | 출혈 에피소드 중증도 | ||||
|---|---|---|---|---|---|
| 경미 n (%) n=122 |
중등도 n (%) n=61 |
중증/심각 n (%) n=7 |
알 수 없음 n (%) n=2 |
전체 n (%) n=192 |
|
|
|||||
| 1 | 113 (92.6%) | 41 (67.2%) | 1 (14.3%) | 2 (100%) | 157 (81.8%) |
| 2 | 8 (6.6%) | 13 (21.3%) | 4 (57.1%) | 0 (0.0) | 25 (13.0%) |
| 3 | 1 (0.8%) | 6 (9.8%) | 2 (28.6%) | 0 (0.0) | 9 (4.7%) |
| 4 | 0 (0.0) | 1 (1.6%) | 0 (0.0) | 0 (0.0) | 1 (0.5%) |
| 중앙값 | 1 | 1 | 2 | 1 | 1 |
| 범위 | 1~3 | 1~4 | 1~3 | 1~1 | 1~4 |
출혈 에피소드당 투여된 VONVENDI의 중앙값 누적 용량(ADVATE와 함께 또는 ADVATE 없이)은 48.2 IU/kg(90% CI, 43.9~50.2) IU/kg였습니다. 출혈 중증도와 관련하여 출혈 에피소드를 치료하기 위한 중앙값 누적 용량은 경미한 출혈 에피소드(n=122)의 경우 43.3(범위, 25.2~158.2) IU/kg, 중등도 출혈 에피소드(n=61)의 경우 52.7(범위, 23.8~184.9) IU/kg, 중증 출혈 에피소드(n=7)의 경우 100(범위, 57.5~135) IU/kg였습니다.
표 13은 출혈 에피소드 위치별 주입 횟수 및 유효성 평가 등급에 대한 데이터를 요약합니다.
| 위치별 출혈 에피소드(n) | 주입 횟수 중앙값(범위) | 등급(%) |
|---|---|---|
| 관절(n=59) | 1(1~3) | 우수(96.6%) |
| 양호(3.4%) | ||
| GI(n=6) | 1(1~2) | 우수(83.3%) |
| 양호(16.7%) | ||
| 점막: 여성 생식기(n=32) | 1(1~2) | 우수(96.9%) |
| 양호(3.1%) | ||
| 점막: 비인두(n=42) | 1(1~2) | 우수(97.6%) |
| 양호(2.4%) | ||
| 점막: 입 및 구강(n=26) | 1(1~4) | 우수(100%) |
| 양호(0%) |
수술 중 출혈 관리
VONVENDI의 지혈 효능은 전향적, 개방표지, 다기관 시험에서 평가되었으며, 이 시험은 중증 VWD로 진단된 성인(18세 이상)에서 선택적 수술 절차에서 VONVENDI 단독 또는 ADVATE와 병용 투여 시 효능 및 안전성을 평가하기 위해 실시되었으며, 대상자는 수술 후 14일 동안 추적 관찰되었습니다.
총 15명의 VWD 대상자가 시험을 완료했으며, 93%의 대상자가 65세 미만(범위 20~70세)이었고, 그 중 53.3%가 여성이었으며 53%(8/15)가 3형 VWD 환자였습니다. 15명의 대상자 중 10명은 주요 수술을 받았고 5명은 경미한 수술을 받았습니다.
주요 수술에는 정형외과 수술: 고관절 전치환술, 슬관절 전치환술, 슬관절 인공관절, 발목 인공관절, 전방 십자인대 수술 및 반월판 절제술이 포함되었습니다. 기타 주요 수술에는 복강경 담낭 절제술, 복강경 낭종 절제술 및 복잡한 치아 발치가 포함되었습니다.
모든 대상자는 수술 전 12~24시간 동안 VONVENDI 40~60 IU/kg을 투여하여 제8인자 수치를 목표 수치로 높였습니다. 수술 전 3시간 이내에 대상자의 FVIII:C 수치를 평가하여 경미한 수술의 경우 30 IU/dL, 주요 수술의 경우 60 IU/dL 목표를 달성했는지 확인했습니다. 수술 전 1시간 이내에 대상자는 VONVENDI를 투여받았습니다. ADVATE(재조합 제8인자)는 수술 전 3시간에 실시한 FVIII:C 수치에 따라 투여되었습니다. VWF 및 제8인자 증가 회복률은 초기 및 후속 투여량을 안내하는 데 사용되었습니다.
주요 수술을 받은 10명의 대상자 중 6명은 프로토콜에서 지정한 적재 용량을 투여받았습니다. 프로토콜에서 지정한 적재 용량은 수술 전 12~24시간 동안 투여하기 전에 평가한 VWF:RCo 수치를 기반으로 했다는 점에 유의해야 합니다. 주요 수술을 받은 10명의 대상자 중 4명과 경미한 수술을 받은 5명의 대상자 중 4명은 적재 용량 투여 전 및 수술 전 12~24시간 동안 투여 후에 평가한 VWF:RCo를 기반으로 VONVENDI 적재 용량을 투여받았습니다. 수술 전 12~24시간 동안 투여하기 전에 평가한 수치를 기반으로 한 프로토콜에서 지정한 적재 용량과 달리, 이 8명의 대상자에게 투여된 적재 용량은 수술 전 투여 후에 평가한 VWF:RCo 수치를 기반으로 계산되었으며, 따라서 프로토콜에서 지정한 적재 용량보다 낮은 용량이었습니다. 두 그룹 간에 안전성 또는 효능의 차이는 관찰되지 않았습니다.
주요 결과 측정 항목은 마지막 수술 중 VONVENDI 주입 후 24시간 또는 연구 방문 완료 시(둘 중 빠른 시점)에 평가한 전반적인 지혈 효능이었으며, 예상되는 실제 혈액 손실, 수혈 요구량 및 수술 후 출혈 및 삼출에 따라 표 14에 제시된 4점 서열 효능 척도(“우수”, “양호”, “보통” 및 “없음”)를 사용했습니다. 결과를 성공으로 선언하려면 우수 또는 양호 등급이 필요했습니다.
| 등급 | 마지막 수술 중 IP 주입 후 24시간 또는 14일차 방문 완료 시(둘 중 빠른 시점)에 평가한 전반적인 지혈 효능 |
|---|---|
| 우수(1) | rVWF 단독 또는 ADVATE와 병용 투여로 달성한 수술 중 및 수술 후 지혈은 지혈 능력이 정상인 대상자에서 수행된 수술 유형에 대해 예상되는 것과 같거나 더 좋았습니다. |
| 양호(2) | rVWF 단독 또는 ADVATE와 병용 투여로 달성한 수술 중 및 수술 후 지혈은 지혈 능력이 정상인 대상자에서 수행된 수술 유형에 대해 예상되는 것과 거의 같았습니다. |
| 보통(3) | rVWF 단독 또는 ADVATE와 병용 투여로 달성한 수술 중 및 수술 후 지혈은 수행된 수술 유형에 대해 최적 수준보다 분명히 낮았지만, rVWF 농축액을 변경할 필요 없이 유지되었습니다. |
| 없음(4) | 대상자는 적절한 투여량에도 불구하고 치료 반응이 불충분하여 제어되지 않는 출혈을 경험했으며, rVWF 농축액을 변경해야 했습니다. |
주요 수술 및 경미한 수술에 대한 전반적인 지혈 효능은 100%(15/15)였으며, 90% 신뢰 구간은 81.9%~100%였습니다. 수술의 60%는 우수했고 40%는 양호했습니다.
수술 중 지혈 효능은 2차 종료점이었습니다. 주요 수술 및 경미한 수술의 경우 100%였으며, 90% 신뢰 구간은 81.9%~100%였습니다. 수술의 73.3%는 우수했고 26.7%는 양호했습니다.
경미한 수술 및 주요 수술에 대한 지혈 효능에 대한 자세한 내용은 표 15를 참조하십시오.
| 수술 유형 | 우수 9/15 (60%) |
양호 6/15 (40%) |
보통 0/15 (0.0%) |
총 N=15 |
|---|---|---|---|---|
| 경미한 | 4 | 1 | 0 | 5 |
| 주요 | 5 | 5 | 0 | 10 |
수술 전 증가적 회복 결과를 기반으로 투약이 개별화되었습니다.
수술 전 평균 총 12~24시간 투약량은 50.9 IU/kg(중앙값 55.0 IU/kg; 범위, 36.1~59.9 IU/kg)이었습니다.
주입 당 평균 총 로딩 투약량(수술 전 1시간 투약량)은 38.6 IU/kg(중앙값 35.8 IU/kg; 범위, 8.0~82.7 IU/kg)이었습니다. 주요 수술에는 42.8 IU/kg(중앙값 37.6 IU/kg; 범위, 15.7~82.7 IU/kg)의 평균 로딩 투약량이 필요했던 반면, 경미한 수술에는 30.2 IU/kg(중앙값 34.2 IU/kg; 범위, 8.0~46.4 IU/kg)의 평균 로딩 투약량이 필요했습니다.
VONVENDI(ADVATE 유무와 관계없이)로 치료받은 대상자의 경우, 수술 후 첫 7일 이내의 평균 총 수술 후 투약량은 114.2 IU/kg(범위 23.8~318.9 IU/kg)(n=13)이었고, 다음 7일 동안의 수술 후 투약량은 76.2 IU/kg(범위 23.8~214.4 IU/kg)(n=8)이었습니다.
중증 3형 VWD 환자에서 요구 시 치료를 받는 출혈 빈도 감소를 위한 일상적인 예방
VONVENDI는 VWD로 진단받은 성인 대상자(만 18세 이상)에서 출혈 빈도 감소에 대한 예방 치료의 효능, 안전성, PK 및 약력학(PD)을 평가하기 위해 전향적, 단일군, 공개표지, 국제 다기관 연구에서 연구되었습니다.
대상자는 연구 참여 전 출혈 관리를 위해 받은 치료를 기반으로 두 가지 치료군에 등록되었으며, 요구 시(OD) 치료만 받은 대상자를 포함하는 Prior OD 군과 혈장 유래 VWF(pdVWF)로 예방 치료를 받은 대상자를 포함하는 Switch 군으로 구성되었습니다. 효능은 모든 출혈, 자발적 출혈 및 관절 출혈에 대한 연간 출혈률 중앙값을 기반으로 평가되었으며, 기술 통계를 기반으로 했습니다.
효능 평가 가능한 22명의 대상자가 중앙값 92.5회의 투약을 받았으며, 이 중 12명의 대상자는 이전에 요구 시 치료를 받았고(Prior OD 군), 10명의 대상자는 이 연구에 등록하기 전에 pdVWF로 예방 치료를 받았습니다(Switch 군). OD 군의 9명의 대상자와 Switch 군의 8명의 대상자가 12개월 치료를 요구하는 연구를 완료했습니다.
연구 대상자의 중앙값 연령은 34세(18~77세)였으며, 54.5%가 남성이었고, 96%의 대상자가 백인이었으며, 86.4%가 히스패닉이 아니거나 라틴계였습니다. Prior OD 군의 12명의 대상자 중 1명은 중증 1형, 1명은 중증 2형 VWD, 10명은 중증 3형 VWD를 가졌습니다. Switch 군의 10명의 대상자 중 1명은 중증 1형, 1명은 중증 2형 VWD, 8명은 중증 3형 VWD를 가졌습니다.
Prior OD 군의 대상자는 주 2회 주입 당 50 ± 10 IU/kg으로 치료를 시작했습니다. Prior OD 군의 한 명의 대상자는 돌파 출혈 관리를 위해 투약 조정이 필요했습니다. Prior OD 군에서 3형 VWD를 가진 대상자 대부분(9/10)은 Vonvendi를 주 2회 투약했으며, 중앙값 최대 투약량은 55.9(IU/kg)였습니다.
이 연구는 연구 참여 전에 예방 치료를 받은 3형 VWD 대상자에서 Vonvendi의 예방 치료로 출혈 사건을 줄이는 효능을 충분히 입증하지 못했습니다(Switch 군).
연구 참여 전에 요구 시 치료를 받은 3형 VWD 대상자에서 예방 치료로서 Vonvendi의 효능 매개변수는 표 16에 제공됩니다. ABR의 기존 대비 연구 중 변화의 중앙값 백분율은 다음과 같습니다. 모든 출혈 -54.7%, 자발적 출혈 -75.9%, 관절 출혈 -100.0%.
15 참고문헌
- Stockschlaeder M, Schneppenheim R, Budde U, von Willebrand factor 다량체에 대한 최신 정보: 고분자량 다량체에 초점을 맞추고 지혈 작용에서의 역할. Blood Coagul Fibrinolysis 2014, 25:206-216.
- Turecek PL, Mitterer A, Matthiessen HP, Gritsch H, Varadi K, Siekmann J, Schnecker K, Plaimauer B, Kaliwoda M, Purtscher M, Woehrer W, Mundt W, Muchitsch EM, Suiter T, Ewenstein BM, Ehrlich HJ, Schwarz HP, 혈장 및 알부민이 없는 재조합 von Willebrand factor 개발. Haemastaseologie 2009; 29 (Suppl 1): 32-38.
16. 공급/보관 및 취급
공급 형태
VONVENDI는 주사용 멸균수(sWFI), Mix2Vial 재구성 장치 1개, 처방 의사 정보지 1부, 환자 정보지 1부와 함께 포장됩니다.
VONVENDI는 다음과 같은 제품 강도를 포함하는 단회용 바이알로 제공됩니다.
| 색상 코드 | VWF:RCo 역가 범위 | 카톤 NDC | sWFI 충전량 |
|---|---|---|---|
| 녹색 | 바이알당 450–850 IU | 0944-7551-02 | 5 mL |
| 진홍색 | 바이알당 900–1700 IU | 0944-7553-02 | 10 mL |
각 VONVENDI 바이알 및 카톤의 라벨에는 국제 단위로 표시된 실제 폰 빌레브란트 인자 활성이 인쇄되어 있습니다.
구성 요소는 천연 고무 라텍스로 만들어지지 않았습니다.
보관 및 취급
- 냉장 보관(2°C~8°C(36°F~46°F)) 또는 실온(30°C(86°F) 이하)에 보관하십시오.
- 냉동하지 마십시오.
- 원래 상자에 보관하고 강한 빛에 노출되지 않도록 하십시오.
- VONVENDI 바이알 라벨 또는 카톤에 인쇄된 유효 기한을 넘지 않도록 사용하십시오.
- 바이알에서 주사기로 여과한 후 주사기 내 용액이 흐리거나 조각이나 입자가 포함되어 있는 경우 사용하지 마십시오.
- 재구성된 제품은 즉시 사용하거나 재구성 후 3시간 이내에 사용하십시오.
- 3시간 후에는 사용하지 않은 재구성된 제품을 버리십시오.
17 환자 상담 정보
환자에게 다음과 같이 알려주십시오.
- FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽어보도록 하십시오.
- 아나필락시스 쇼크, 전신 두드러기, 혈관 부종, 가슴 답답함, 저혈압, 쇼크, 졸음, 메스꺼움, 구토, 감각 이상, 가려움증, 불안, 천명음 및/또는 급성 호흡곤란을 포함한 과민 반응의 초기 증상에 대해 알려주십시오. 이러한 증상이 나타나면 제품 사용을 중단하고 소생술을 포함한 즉각적인 응급 치료를 받도록 하십시오.
- 폰 빌레브란트 인자 치료에 대한 임상적 반응이 없는 경우, 이는 억제제의 발현일 수 있으므로 추가 치료 및/또는 평가를 위해 담당 의사 또는 치료 센터에 연락하도록 하십시오.
- 여행 전에 담당 의사 또는 의료 서비스 제공자와 상담하도록 하십시오. 여행 중에는 현재 치료 요법에 따라 충분한 양의 VONVENDI를 휴대하도록 하십시오.
SPL 분류되지 않은 섹션
武田製薬アメリカ株式会社
レキシントン、MA 02421
米国ライセンス番号 1898
VONVENDI® は、Baxalta Incorporatedの登録商標です。
TAKEDA® およびTAKEDAロゴ® は、武田薬品工業株式会社の登録商標です。
Mix2Vial® は、West Pharmaceutical Services, Inc.の子会社であるWest Pharma. Services IL, Ltd.の登録商標です。
特許取得済み: www.takeda.com/en-us/patentsをご覧ください
VON355
환자 안내문
| 환자 정보 VONVENDI [von Willebrand factor (recombinant)] |
|---|
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. |
| 본 팜플렛은 VONVENDI에 대한 중요한 정보를 요약한 것입니다. 본 약을 사용하기 전에 주의 깊게 읽어보십시오. 본 정보는 의료 서비스 제공자와의 상담을 대신할 수 없으며 VONVENDI에 대한 모든 중요한 정보를 포함하고 있지 않습니다. 본 팜플렛을 읽은 후 궁금한 점이 있으면 의료 서비스 제공자에게 문의하십시오. 의료 서비스 제공자 또는 혈우병 센터에서 교육을 받지 않은 경우 스스로 주입을 시도하지 마십시오. VONVENDI 주입에 대한 용량 및 일정에 관한 의료 서비스 제공자의 지시를 주의 깊게 따라야 치료 효과가 극대화됩니다. |
| VONVENDI란 무엇입니까? VONVENDI는 von Willebrand 질환 환자에서 낮은 수준 또는 제대로 작동하지 않는 von Willebrand 인자를 대체하는 데 사용되는 재조합 의약품입니다. von Willebrand 질환은 혈액이 정상적으로 응고되지 않는 유전성 출혈 장애입니다. VONVENDI는 von Willebrand 질환으로 진단받은 성인(18세 이상)에게 다음과 같은 경우에 사용됩니다.
|
| 누가 VONVENDI를 사용해서는 안 됩니까? 다음과 같은 경우 VONVENDI를 사용해서는 안 됩니다.
임신 중이거나 모유 수유 중인 경우 의료 서비스 제공자에게 알리십시오. VONVENDI가 적합하지 않을 수 있습니다. |
| VONVENDI를 사용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? 다음과 같은 경우 의료 서비스 제공자에게 알려야 합니다.
|
| VONVENDI를 어떻게 사용해야 합니까? VONVENDI는 직접 혈류로 주입됩니다. 각 출혈 에피소드에 대한 VONVENDI의 첫 번째 용량은 의료 서비스 제공자의 지시에 따라 재조합 인자 VIII(혈장에서 생산되지 않은 인자 VIII)와 함께 투여될 수 있습니다. 의료 서비스 제공자는 재조합 인자 VIII와 함께 또는 재조합 인자 VIII 없이 VONVENDI의 추가 용량이 필요한지 여부를 알려줍니다. 혈우병 치료 센터, 의료 서비스 제공자의 진료실 또는 집에서 VONVENDI를 주입할 수 있습니다. 의료 서비스 제공자 또는 혈우병 치료 센터에서 주입 방법에 대한 교육을 받아야 합니다. von Willebrand 질환이 있는 많은 사람들이 스스로 또는 가족 구성원의 도움을 받아 VONVENDI를 주입하는 방법을 배우게 됩니다. 의료 서비스 제공자는 체중, von Willebrand 질환의 심각도 및 출혈 부위에 따라 사용할 VONVENDI의 양을 알려줍니다. VONVENDI를 복용한 후에도 출혈이 멈추지 않으면 즉시 의료 서비스 제공자에게 연락하십시오. 재구성된 제품(건조 제품을 제공된 멸균수와 혼합한 후)을 즉시 사용하십시오. 그렇지 않은 경우 최대 25°C(77°F)의 실온에서 최대 3시간 동안 보관하십시오. 3시간 후에는 폐기하십시오. |
| VONVENDI의 가능한 부작용은 무엇입니까? VONVENDI에 알레르기 반응이 나타날 수 있습니다. 발진이나 두드러기, 가려움증, 목이 조이는 느낌, 가슴 통증이나 압박감, 호흡 곤란, 현기증, 어지러움, 메스꺼움 또는 실신이 발생하면 즉시 의료 서비스 제공자에게 연락하고 치료를 중단하십시오. VONVENDI와 관련하여 보고된 부작용으로는 두통, 메스꺼움, 구토, 주입 부위의 따끔거림 또는 화끈거림, 가슴 불편함, 어지러움, 관절통, 관절 손상, 혈액 내 간 효소 수치 증가, 열감, 가려움증, 고혈압, 근육 경련, 이상한 맛, 혈전 및 심박수 증가가 있습니다. 이것들은 VONVENDI의 모든 가능한 부작용이 아닙니다. 의료 서비스 제공자에게 의료 전문가를 위한 정보가 적힌 자료를 요청할 수 있습니다. 불편하거나 사라지지 않는 부작용에 대해 의료 서비스 제공자에게 알리십시오. |
| VONVENDI의 용량 강도는 무엇입니까? 주사용 멸균수 및 Mix2Vial 재구성 장치가 포함된 VONVENDI는 두 가지 다른 용량 강도로 제공됩니다. |
| 녹색: 약 650 국제 단위(450–850 IU)의 용량 강도(5mL의 멸균수로 재구성). |
| 진한 빨간색: 약 1300 국제 단위(900–1700 IU)의 용량 강도(10mL의 멸균수로 재구성). |
|
VONVENDI를 어떻게 보관해야 합니까?
|
| VONVENDI 및 폰 빌레브란트병에 대해 알아야 할 사항은 무엇입니까? 신체는 폰 빌레브란트 인자 또는 제8인자에 대한 억제제를 형성할 수 있습니다. 억제제는 신체의 정상적인 방어 시스템의 일부입니다. 억제제가 형성되면 VONVENDI 또는 FVIII가 제대로 작동하지 못하게 할 수 있습니다. 폰 빌레브란트 인자 또는 제8인자에 대한 억제제가 발생하는지 혈액 검사를 통해 주의 깊게 모니터링되도록 의료 서비스 제공자와 상담하십시오. 의약품은 때때로 여기에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 상태에 대해 VONVENDI를 사용하지 마십시오. 동일한 증상이 있는 다른 사람과 VONVENDI를 공유하지 마십시오. |
| 환자에게 제공되는 다케다의 리소스: VONVENDI에 대한 자세한 제품 정보는 www.VONVENDI.com 을 방문하거나 1-877-TAKEDA-7(1-877-825-3327)로 전화하십시오. 다케다 환자 리소스에 대한 자세한 내용은 www.VONVENDI.com을 방문하십시오. 다케다 제약 미국, Inc. 렉싱턴, MA 02421 미국 라이선스 번호 1898 VONVENDI®는 벡살타 주식회사의 등록 상표입니다. TAKEDA® 및 TAKEDA 로고®는 다케다 제약 주식회사의 등록 상표입니다. Mix2Vial®은 웨스트 제약 서비스, Inc.의 자회사인 웨스트 제약 서비스 IL, Ltd.의 등록 상표입니다. 특허: www.takeda.com/en-us/patents 참조 개정: 2023년 3월 VON355 |
사용 설명서 VONVENDI[폰 빌레브란트 인자 (재조합)] (정맥 주사용 전용)
각 출혈 에피소드에 대한 첫 번째 투여량의 경우, 의사의 지시에 따라 재조합 제8인자와 함께 사용하십시오.
- 항상 의료 서비스 제공자의 구체적인 지시를 따르십시오. 아래에 나열된 단계는 VONVENDI 사용에 대한 일반적인 지침입니다. 절차가 확실하지 않으면 사용하기 전에 의료 서비스 제공자에게 전화하십시오.
- VONVENDI를 사용한 후에도 출혈이 조절되지 않으면 즉시 의료 서비스 제공자에게 전화하십시오.
- 의료 서비스 제공자가 복용해야 할 VONVENDI 용량을 처방할 것입니다. 새로운 출혈 에피소드를 조절하기 위한 첫 번째 주입인 경우, 재조합 제8인자가 필요하다면 의사의 지시에 따라 재조합 제8인자의 올바른 용량을 확보하십시오.
- 의료 서비스 제공자가 때때로 혈액 검사를 할 수 있습니다.
- 여행 전에 의료 서비스 제공자와 상담하십시오. 이 기간 동안 치료에 필요한 충분한 VONVENDI를 가져가십시오.
- 재구성된 VONVENDI 제품의 잔여물을 포함한 모든 재료를 적절한 용기에 버리십시오.
VONVENDI를 재구성하고 투여하는 단계별 지침은 아래를 참조하십시오.
재구성
- 깨끗한 평평한 표면을 준비하고 주입에 필요한 모든 재료를 모으십시오. 유효 기간을 확인하고 VONVENDI를 실온으로 데우십시오. 손을 씻고 깨끗한 검사용 장갑을 착용하십시오. 집에서 스스로 주입하는 경우 장갑 착용은 선택 사항입니다.
- VONVENDI 농축액 및 희석제 바이알에서 캡을 제거하여 고무 마개 중앙을 노출시킵니다.
- 각 마개를 별도의 멸균 알코올 솜(또는 의료 서비스 제공자 또는 혈우병 센터에서 권장하는 다른 적합한 멸균 용액)으로 몇 초 동안 문지르고 사용하기 전에 건조시켜 소독하십시오. 바이알을 평평한 표면에 놓습니다.
- Mix2Vial 장치 포장을 완전히 벗겨 내부를 만지지 않고 뚜껑을 완전히 벗겨서 엽니다. Mix2Vial 장치를 포장에서 꺼내지 마십시오.
- Mix2Vial 장치가 있는 포장을 거꾸로 뒤집어 희석제 바이알 위에 놓습니다. 장치의 파란색 플라스틱 스파이크를 희석제 바이알 마개 중앙에 똑바로 눌러 넣습니다. 포장 가장자리를 잡고 Mix2Vial 장치에서 들어올립니다. 투명 플라스틱 스파이크를 만지지 않도록 주의하십시오. 희석제 바이알에 이제 Mix2Vial 장치가 연결되어 있으며 VONVENDI 바이알에 연결할 준비가 되었습니다.
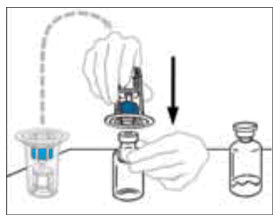
- 희석제 바이알을 VONVENDI 바이알에 연결하려면 희석제 바이알을 뒤집어 VONVENDI 농축액이 들어 있는 바이알 위에 놓습니다. 투명 플라스틱 스파이크를 VONVENDI 바이알 마개에 똑바로 눌러 넣습니다. 액체가 세균에 오염되지 않도록 즉시 수행해야 합니다. 희석제가 진공에 의해 VONVENDI 바이알로 흘러 들어갑니다. 희석제 전달이 완료되었는지 확인하십시오. 진공이 손실된 경우 사용하지 마십시오.
- 연결된 바이알을 부드럽게 지속적으로 빙빙 돌리거나 재구성된 제품을 5분 동안 그대로 두었다가 부드럽게 빙빙 돌려 분말이 완전히 용해되도록 합니다. 흔들지 마십시오. 흔들면 제품에 악영향을 미칩니다. 재구성 후 냉장 보관하지 마십시오.
참고: 재구성된 바이알에 약간의 조각이나 입자가 남아 있을 수 있습니다. Mix2Vial 장치에 포함된 필터는 여분의 조각이나 입자를 제거하며, 주사기의 결과 용액은 투명하고 무색이어야 합니다. 바이알에서 주사기로 여과한 후 용액이 흐리거나 조각이나 입자가 포함되어 있으면 사용하지 마십시오.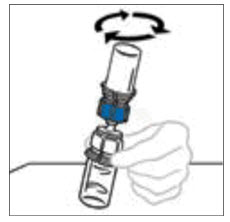
- VONVENDI 바이알(용해된 제품 포함)에 연결된 Mix2Vial 장치의 투명 플라스틱 측면을 한 손으로, 희석제 바이알에 연결된 Mix2Vial 장치의 파란색 플라스틱 측면을 다른 손으로 잡고 Mix2Vial의 양쪽을 분리합니다. 파란색 플라스틱 측면을 시계 반대 방향으로 돌리고 두 바이알을 부드럽게 분리합니다. 용해된 제품이 들어 있는 VONVENDI 바이알에 연결된 플라스틱 커넥터 끝을 만지지 마십시오. VONVENDI 바이알을 평평한 작업대에 놓습니다. 빈 희석제 바이알을 버립니다.
- 플런저를 뒤로 당겨 빈 멸균 일회용 플라스틱 주사기에 공기를 주입합니다. 공기량은 바이알에서 빼낼 재구성된 VONVENDI의 양과 같아야 합니다.
- VONVENDI 바이알(용해된 제품 포함)을 평평한 작업대에 그대로 두고 주사기를 시계 방향으로 연결하고 돌려 투명 플라스틱 커넥터에 연결합니다. (그림 A). 한 손으로 바이알을 잡고 다른 손으로 주사기에서 바이알로 공기를 모두 밀어 넣습니다. (그림 B). 공기를 모두 바이알로 밀어 넣지 않으면 필요한 양의 제품이 주사기로 빨려 들어가지 않습니다.
그림 A 그림 B 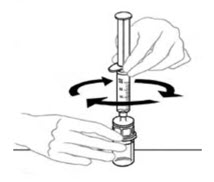
- 연결된 주사기와 VONVENDI 바이알을 뒤집어 바이알이 위로 오도록 합니다. 주사기 플런저를 계속 눌러 놓으십시오. 플런저를 천천히 뒤로 당겨 VONVENDI를 주사기로 흡입합니다. 주사기와 바이알 사이에서 용액을 앞뒤로 밀어 넣거나 당기지 마십시오. 그렇게 하면 제품의 무결성이 손상될 수 있습니다. 주사기를 시각적으로 검사하여 입자가 있는지 확인하십시오. 용액은 외관상 맑고 무색이어야 합니다. 플레이크나 입자가 보이면 용액을 사용하지 말고 의료 서비스 제공자에게 알리십시오.
- 주입할 준비가 되면 주사기를 시계 반대 방향으로 돌려 분리합니다.
- 용량이 VONVENDI 바이알 하나 이상을 필요로 하는 경우 위의 재구성 단계(2~8)에 따라 별도의 Mix2Vial 장치를 사용하여 각 바이알을 재구성합니다.
- VONVENDI 바이알은 최대 2개까지 단일 주사기에 합칠 수 있습니다. 재구성된 VONVENDI 바이알이 두 번째로 있는 경우:
- 재구성된 용액이 들어 있는 주사기를 VONVENDI 첫 번째 바이알에서 시계 반대 방향으로 돌려 주의해서 분리합니다. 노출된 커넥터를 만지지 마십시오.
- 플런저를 뒤로 당겨 재구성된 VONVENDI 첫 번째 바이알이 들어 있는 주사기에 공기를 흡입합니다. 흡입하는 공기의 양은 두 번째 바이알에서 빼낼 재구성된 VONVENDI의 양과 같아야 합니다. 노출된 커넥터를 만지지 마십시오.
- VONVENDI 두 번째 바이알을 평평한 표면에 놓고 플라스틱 커넥터에 연결하여 주사기를 시계 방향으로 돌려 주사기를 연결합니다.
- 연결된 주사기와 VONVENDI 두 번째 바이알을 뒤집어 바이알이 위로 오도록 합니다 (그림 C). 한 손으로 바이알을 잡고 다른 손으로 주사기 플런저를 천천히 눌러 바이알에 공기를 주입합니다 (그림 D). 주사기에서 바이알로 액체를 주입하지 마십시오.
그림 C 그림 D 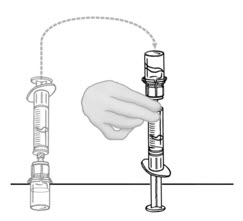
- 플런저를 천천히 뒤로 당겨 VONVENDI 두 번째 바이알에서 재구성된 VONVENDI를 주사기로 흡입합니다. 주사기에서 바이알로 액체를 주입하지 마십시오.
- 오염 위험을 줄이기 위해 주입할 준비가 될 때까지 주사기를 바이알에 연결해 둡니다. 용량이 재구성된 VONVENDI 바이알 2개 이상을 필요로 하는 경우 9단계로 돌아가 새 플라스틱 주사기에 세 번째 바이알을 흡입합니다. VONVENDI 바이알은 최대 2개까지 단일 주사기에 합칠 수 있습니다. 주사기에 2개 이상의 바이알을 합치면 필라멘트가 형성될 수 있으며, 이 경우 주사기의 용액을 버려야 합니다.
- 재구성된 용액이 들어 있는 주사기를 VONVENDI 첫 번째 바이알에서 시계 반대 방향으로 돌려 주의해서 분리합니다. 노출된 커넥터를 만지지 마십시오.
- 재조합 제8인자를 주입해야 하는 경우 해당 제품의 포장 삽입지에 명시된 지침에 따라 재조합 제8인자를 재구성합니다. VONVENDI 전체 용량을 주입할 때까지 재조합 제8인자를 투여하지 마십시오. 항상 의료 서비스 제공자의 구체적인 지시를 따르십시오.
투여
- VONVENDI 용액이 들어 있는 주사기에 주입 바늘을 연결합니다. 편의를 위해 날개가 달린(나비) 주입 세트를 사용하는 것이 좋습니다. 바늘을 위로 향하게 하고 주사기를 손가락으로 가볍게 두드려 공기 방울을 제거한 다음 주사기와 바늘에서 공기를 천천히 조심스럽게 밀어냅니다.
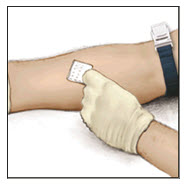
- 지혈대를 착용하고 의료 서비스 제공자 또는 혈우병 센터에서 권장하는 소독된 알코올 솜(또는 다른 적절한 소독 용액)으로 피부를 잘 닦아 주입 부위를 준비합니다.
- 바늘을 정맥에 삽입하고 지혈대를 제거합니다. VONVENDI를 천천히 주입합니다. 분당 4mL보다 빠르게 주입하지 마십시오.
- 빈 주사기를 분리합니다. 용량이 여러 개의 주사기를 필요로 하는 경우 VONVENDI의 각 추가 주사기를 한 번에 하나씩 연결하여 투여합니다.
- 모든 주사기를 주입할 때까지 나비 바늘을 제거하지 말고 주사기에 연결된 루어 포트를 만지지 마십시오.
- 의료 서비스 제공자가 재조합 제8인자를 처방한 경우 VONVENDI 전체 용량을 주입한 후 10분 이내에 재조합 제8인자를 투여합니다.
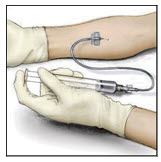
- 바늘을 정맥에서 빼내고 소독된 거즈로 주입 부위를 몇 분 동안 압박합니다.
- 바늘을 다시 캡핑하지 마십시오. 바늘, 주사기, 빈 VONVENDI 및 희석제 바이알(들)을 적절히 폐기하기 위해 단단한 벽이 있는 날카로운 물체 용기에 넣습니다. 이러한 물품을 일반 가정 쓰레기와 함께 버리지 마십시오.
중요: 문제가 발생하면 의료 서비스 제공자 또는 지역 혈우병 치료 센터에 연락하십시오..
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
U.S. License No. 1898
VONVENDI®는 Baxalta Incorporated의 등록 상표입니다.
TAKEDA® 및 TAKEDA 로고®는 Takeda Pharmaceutical Company Limited의 등록 상표입니다.
Mix2Vial®은 West Pharmaceutical Services, Inc.의 자회사인 West Pharma. Services IL, Ltd.의 등록 상표입니다.
특허: www.takeda.com/en-us/patents 참조
개정: 3/2023
VON355
이 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다.
주요 표시 패널 – 키트 상자 – 650 IU
NDC 0944 – 7551 – 02
VONVENDI
폰 빌레브란트 인자
(재조합)
실제 약효
단회용 바이알, 용액제를 위한 동결건조 분말
재구성 후에만 정맥주사용.
전문의 처방전에 한함.
Takeda

주요 표시 패널 – 650 IU 바이알 라벨
NDC 0944-7550-01
VONVENDI
폰 빌레브란트 인자
(재조합)
단회용 바이알, 동결 건조 분말, 멸균
처방전에 의해서만 구입 가능
재구성 후 정맥 주사만 가능합니다.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
미국 허가 번호 1898

주요 디스플레이 패널 – 5 mL 바이알 라벨
5 mL
NDC 64764-515-50
타케다
주사용 멸균수, USP
동봉된 제품의 재구성에 사용
투명하지 않으면 사용하지 마십시오. 항균제 또는 다른 물질이 첨가되지 않았습니다. 적절한 용질을 첨가하여 약용 등장이 되도록 만들지 않고는 혈관내 주사에 사용하지 마십시오.
사용하지 않은 부분은 폐기하십시오.
의사 처방전만
0754013
단회용 용기
비피rogen성

주요 표시면 – 키트 상자 – 1300 IU
NDC 0944-7553-02
VONVENDI
von Willebrand factor
(Recombinant)
ACTUAL POTENCY
Single-dose vials, lyophilized powder for solution
용액 재구성 후 정맥 투여 전용.
Rx Only
Takeda

주요 표시 패널 – 1300 IU 바이알 라벨
NDC 0944-7552-01
VONVENDI
폰 빌레브란트 인자
(재조합)
단일 용량 바이알, 동결건조 분말, 무균
Rx 전용
재구성 후에만 정맥 투여용.
다케다 제약 미국 주식회사
렉싱턴, MA 02421
미국 라이센스 번호 1898
주요 표시 패널 – 10mL 바이알 라벨
10 mL
NDC 64764-516-10
다케다
주사용 멸균수, USP
수반 제품의 용해제용
투명하지 않으면 사용하지 마십시오. 항균제나 기타 물질이
추가되지 않았습니다. 적절한 용질을 첨가하여 약간 등장이 되도록 하지 않고는 혈관내 주사에 사용하지 마십시오.
사용하지 않은 부분을 폐기하십시오.
의사处방전전용
0754448
단회용 용기
발열성이 없음


