의약품 제조업체: Novo Nordisk (Updated: 2024-11-01)
처방 정보의 주요 내용
VICTOZA® (리라글루티드) 주사제, 피하 사용
미국 최초 승인: 2010
경고: 갑상선 C 세포 종양 위험
전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.
- •
- 리라글루티드는 임상적으로 관련된 노출 수준에서 수컷 및 암컷 쥐와 마우스 모두에서 갑상선 C 세포 종양을 유발합니다. 리라글루티드 유발 설치류 갑상선 C 세포 종양의 인체 관련성이 결정되지 않았으므로 VICTOZA가 인간에게 갑상선 C 세포 종양(수질성 갑상선암(MTC) 포함)을 유발하는지 여부는 알 수 없습니다(5.1, 13.1).
- •
- VICTOZA는 개인 또는 가족력에 MTC가 있는 환자 또는 다발성 내분비종양증 2형(MEN 2) 환자에게는 금기입니다. 환자에게 MTC의 잠재적 위험과 갑상선 종양의 증상에 대해 알려주십시오(4, 5.1).
최근 주요 변경 사항
경고 및 주의 사항, 전신 마취 또는 심한 진정 중 폐흡인(5.8)…………………………………11/2024
적응증 및 용법
용법 및 용량
-
- •
- 성인 환자: 1주일 동안 1일 1회 피하 주사로 0.6mg으로 시작한 후 1.2mg으로 증량합니다. 추가적인 혈당 조절이 필요한 경우, 1.2mg 1일 용량으로 1주일간 치료 후 용량을 1.8mg으로 증량합니다(2.1).
- •
- 소아 환자: 최소 1주일 동안 1일 1회 피하 주사로 0.6mg으로 시작합니다. 추가적인 혈당 조절이 필요한 경우 1.2mg으로 증량하고, 추가적인 혈당 조절이 여전히 필요한 경우 1.2mg 1일 용량으로 최소 1주일간 치료 후 용량을 1.8mg으로 증량합니다(2.1).
- •
- 매번 주사하기 전에 시각적으로 검사하십시오. 용액이 투명하고 무색이며 입자가 없는 경우에만 사용하십시오(2.3).
- •
- VICTOZA를 1일 1회 식사와 관계없이 하루 중 언제든지 복부, 허벅지 또는 상완에 피하 주사하십시오(2.3).
- •
- 인슐린과 VICTOZA를 함께 사용하는 경우, 별도로 주사하십시오. 절대 혼합하지 마십시오(2.3).
제형 및 강도
주사제: 0.6mg, 1.2mg 또는 1.8mg 용량을 제공하는 1회용 프리필드 펜에 든 6mg/mL 용액 (3).
금기사항
경고 및 주의사항
- •
- 췌장염: 치명적이거나 치명적이지 않은 출혈성 또는 괴사성 췌장염을 포함한 시판 후 보고. 췌장염이 의심되면 즉시 중단하십시오. 췌장염이 확인되면 재투여하지 마십시오(5.2).
- •
- 절대 VICTOZA 펜을 환자 간에 공유하지 마십시오. 바늘을 교체하더라도 (5.3).
- •
- 저혈당증: 인슐린 분비 촉진제 또는 인슐린을 복용하는 성인 환자는 심각한 저혈당증을 포함한 저혈당증 위험이 증가할 수 있습니다. 10세 이상 소아 환자의 경우, 인슐린 및/또는 메트포르민 사용 여부에 관계없이 VICTOZA를 사용하면 저혈당증 위험이 더 높았습니다. 인슐린 분비 촉진제 또는 인슐린 용량 감소가 필요할 수 있습니다 (5.4).
- •
- 급성 신손상: 시판 후, 보통 메스꺼움, 구토, 설사 또는 탈수와 관련이 있으며, 때때로 혈액투석이 필요할 수 있습니다. 신장 장애가 있는 환자에게 VICTOZA의 용량을 시작하거나 증량할 때는 주의하십시오 (5.5).
- •
- 과민반응: 심각한 과민반응(예: 아나필락시스 반응 및 안면부종)에 대한 시판 후 보고. VICTOZA를 중단하고 즉시 의사의 진료를 받으십시오 (5.6).
- •
- 급성 담낭 질환: 담석증 또는 담낭염이 의심되는 경우 담낭 검사가 필요합니다 (5.7).
- •
- 전신 마취 또는 심한 진정 중 폐흡인: 선택적 수술 또는 시술을 받는 GLP-1 수용체 작용제를 투여받는 환자에게서 보고되었습니다. 환자에게 예정된 수술 또는 시술에 대해 의료 제공자에게 알리도록 지시하십시오(5.8).
유해 반응
약물 상호작용
- •
- 위 배출 지연의 경구 약물에 대한 영향: VICTOZA는 위 배출을 지연시키고 동시에 투여되는 경구 약물의 흡수에 영향을 미칠 수 있습니다 (7).
특정 집단에서의 사용
- •
- 임신: 잠재적 이점이 태아에 대한 잠재적 위험을 정당화하는 경우에만 임신 중에 VICTOZA를 사용해야 합니다(8.1).
환자 상담 정보 및 의약품 안내서에 대한 자세한 내용은 17번을 참조하십시오.
개정: 2024년 11월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
경고: 갑상선 C-세포 종양 위험
1 적응증 및 용법
2 용량 및 투여
2.1 권장 용량
2.2 복용량 누락에 대한 권장 사항
2.3 중요 투여 지침
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 갑상선 C-세포 종양 위험
5.2 췌장염
5.3 환자 간 VICTOZA 펜 공유 금지
5.4 저혈당증
5.5 급성 신장 손상
5.6 과민 반응
5.7 급성 담낭 질환
5.8 전신 마취 또는 깊은 진정 중 폐 흡인
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 경구 약물에 대한 위 배출 지연 효과
7.2 인슐린 분비 촉진제(예: 설포닐우레아) 또는 인슐린과의 병용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간 장애
8.8 위마비
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식력 손상
14 임상 연구
14.1 제2형 당뇨병 성인 환자의 혈당 조절 시험
14.2 제2형 당뇨병이 있는 10세 이상 소아 환자의 혈당 조절 시험
14.3 죽상동맥경화성 심혈관 질환이 있는 제2형 당뇨병 성인 환자의 심혈관 결과 시험
16 공급/보관 및 취급 방법
16.1 공급 방법
16.2 권장 보관 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: 갑상선 C 세포 종양 위험
- •
- 리라글루티드는 랫트와 마우스의 수컷과 암컷 모두에서 임상적으로 관련된 노출 수준에서 용량 의존적이고 치료 기간 의존적인 갑상선 C 세포 종양을 유발합니다. 리라글루티드 유발 설치류 갑상선 C 세포 종양의 인체 관련성이 밝혀지지 않았으므로 VICTOZA가 인체에서 갑상선 C 세포 종양(수질성 갑상선암(MTC) 포함)을 유발하는지 여부는 알 수 없습니다 [경고 및 주의 사항 (5.1) 및 비임상적 독성학 (13.1) 참조].
- •
- VICTOZA는 개인 또는 가족력에 MTC가 있는 환자와 다발성 내분비종양증 2형(MEN 2) 환자에게는 금기입니다. VICTOZA 사용과 관련된 MTC의 잠재적 위험에 대해 환자에게 알리고 갑상선 종양의 증상(예: 목의 종괴, 삼킴곤란, 호흡곤란, 지속적인 쉰 목소리)을 알려주십시오. VICTOZA로 치료받는 환자의 MTC 조기 진단을 위해 혈청 칼시토닌을 정기적으로 모니터링하거나 갑상선 초음파를 사용하는 것은 그 가치가 불확실합니다 [금기 사항 (4) 및 경고 및 주의 사항 (5.1) 참조].
1 적응증 및 용법
VICTOZA는 다음의 경우에 사용됩니다:
- •
- 식이요법 및 운동과 병행하여 10세 이상의 제2형 당뇨병 성인 및 소아 환자의 혈당 조절 개선,
- •
- 제2형 당뇨병과 확립된 심혈관 질환을 가진 성인의 주요 심혈관계 이상 사건(심혈관계 사망, 비치명적 심근
경색 또는 비치명적 뇌졸중) 위험 감소.
사용 제한:
VICTOZA는 제1형 당뇨병 환자에게 사용해서는 안 됩니다.
VICTOZA는 liraglutide를 함유하고 있으며 다른 liraglutide 함유 제품과 병용 투여해서는 안 됩니다.
2 투여 및 관리
2.1 권장 용량
성인 환자
- •
- VICTOZA의 권장 초기 용량은 1주일 동안 1일 1회 피하 주사로 0.6mg입니다. 1일 1회 0.6mg 용량은 초기 적정 기간 동안 위장 증상을 줄이기 위한 것이며 [유해 반응 (6.1) 참조] 성인의 혈당 조절에는 효과적이지 않습니다.
- •
- 1일 1회 0.6mg 용량으로 1주일 후에는 용량을 1일 1회 피하 주사로 1.2mg으로 증량합니다.
- •
- 추가적인 혈당 조절이 필요한 경우, 1일 1회 1.2mg 용량으로 최소 1주일간 치료한 후 권장 최대 용량인 1일 1회 피하 주사 1.8mg으로 증량합니다.
10세 이상 소아 환자
- •
- VICTOZA의 권장 초기 용량은 1일 1회 피하 주사로 0.6mg입니다.
- •
- 추가적인 혈당 조절이 필요한 경우, 현재 용량으로 최소 1주일 후 0.6mg씩 증량합니다.
- •
- 권장 최대 용량은 1일 1회 피하 주사로 1.8mg입니다.
2.2 누락된 용량에 대한 권장 사항
- •
- VICTOZA 용량을 누락한 환자에게는 처방된 대로 다음 예정된 용량으로 1일 1회 용량 요법을 재개하도록 지시합니다. 누락된 용량을 보충하기 위해 추가 용량을 투여하거나 용량을 증량하지 마십시오.
- •
- 마지막 VICTOZA 용량 투여 후 3일 이상 경과한 경우, 치료 재개와 관련된 위장 증상을 완화하기 위해 1일 1회 0.6mg으로 VICTOZA를 재개합니다. 재개 시, VICTOZA는 의료 제공자의 재량에 따라 적정해야 합니다.
2.3 중요한 투여 지침
- •
- 매 투여 전에 시각적으로 검사하십시오. 용액이 투명하고 무색이며 입자가 없는 경우에만 사용하십시오.
- •
- VICTOZA는 식사와 관계없이 하루 중 언제든지 1일 1회 피하 주사합니다.
- •
- VICTOZA는 복부, 허벅지 또는 상완에 피하 주사합니다. 주사 부위 및/또는 시간을 변경하는 경우 용량 조정이 필요하지 않습니다.
- •
- 피부 아밀로이드증의 위험을 줄이기 위해 [유해 반응 (6.2) 참조] 같은 부위 내에서 주사 부위를 바꿔야 합니다.
- •
- 인슐린과 VICTOZA를 함께 사용하는 경우, 별도로 주사합니다. 절대 혼합하지 마십시오. VICTOZA와 인슐린을 같은 신체 부위에 주사하는 것은 허용되지만, 주사는 서로 인접해서는 안 됩니다.
3 제형 및 함량
주사제: 사전 충전된 1회용 펜에 담긴 18 mg/3 mL (6 mg/mL)의 투명하고 무색의 용액으로 0.6 mg, 1.2 mg 또는 1.8 mg 용량을 제공합니다.
4 금기사항
VICTOZA는 다음 환자에게는 금기입니다.
- •
- 수질성 갑상선암(MTC)의 개인 또는 가족력이 있는 환자 또는 다발성 내분비종양증 2형(MEN 2) 환자 [경고 및 주의사항 (5.1) 참조].
- •
- 리라글루타이드 또는 VICTOZA의 어떤 첨가제에 대한 중대한 과민반응. VICTOZA와 관련하여 아나필락시스 반응 및 안면부종을 포함한 중대한 과민반응이 보고되었습니다 [경고 및 주의사항 (5.6) 참조].
5 경고 및 주의사항
5.1 갑상선 C-세포 종양 위험
Liraglutide는 임상적으로 관련 있는 용량에서 쥐와 생쥐의 암수 모두에서 용량 의존적 및 치료 기간 의존적인 갑상선 C-세포 종양(선종 및/또는 암종)을 유발합니다 [비임상 독성학 (13.1) 참조]. 악성 갑상선 C-세포 암종은 쥐와 생쥐에서 검출되었습니다. Liraglutide로 유발된 설치류 갑상선 C-세포 종양과 인간의 관련성이 밝혀지지 않았기 때문에 VICTOZA가 인간에서 수질 갑상선암(MTC)을 포함한 갑상선 C-세포 종양을 유발할지는 알려져 있지 않습니다.
VICTOZA로 치료받은 환자에서 MTC 사례가 시판 후 보고되었습니다. 이 보고서의 데이터는 인간에서 MTC와 VICTOZA 사용 간의 인과 관계를 확립하거나 배제하기에 충분하지 않습니다.
VICTOZA는 개인 또는 가족력에 MTC가 있거나 MEN 2가 있는 환자에게는 금기입니다. 환자에게 VICTOZA 사용으로 발생할 수 있는 MTC 위험에 대해 상담하고 갑상선 종양의 증상(예: 목의 덩어리, 연하곤란, 호흡곤란, 지속적인 목쉼)을 알려주십시오.
혈청 칼시토닌의 정기적인 모니터링 또는 갑상선 초음파 사용은 VICTOZA로 치료받는 환자에서 MTC의 조기 발견에 대한 가치가 불확실합니다. 혈청 칼시토닌 검사의 특이도가 낮고 갑상선 질환의 배경 발생률이 높기 때문에 이러한 모니터링은 불필요한 시술의 위험을 증가시킬 수 있습니다. 혈청 칼시토닌 수치가 유의하게 상승하면 MTC를 나타낼 수 있으며 MTC 환자는 일반적으로 칼시토닌 수치가 >50ng/L입니다. 혈청 칼시토닌을 측정하여 상승된 것으로 확인되면 환자를 추가적으로 평가해야 합니다. 신체 검사 또는 목 영상에서 갑상선 결절이 발견된 환자도 추가적으로 평가해야 합니다.
5.2 췌장염
자발적인 시판 후 보고에 따르면 치명적 및 비치명적 출혈성 또는 괴사성 췌장염을 포함한 급성 췌장염이 VICTOZA로 치료받은 환자에서 관찰되었습니다. VICTOZA 시작 후 환자에게 췌장염의 징후와 증상(구토를 동반하거나 동반하지 않을 수 있는 지속적인 심한 복통 포함, 때때로 등으로 퍼짐)이 있는지 주의 깊게 관찰하십시오. 췌장염이 의심되는 경우 VICTOZA를 즉시 중단하고 적절한 치료를 시작해야 합니다. 췌장염이 확인되면 VICTOZA를 다시 시작해서는 안 됩니다.
VICTOZA의 혈당 조절 시험에서 VICTOZA 치료 환자 중 13건의 췌장염 사례와 비교군(글리메피리드) 치료 환자 중 1건의 사례가 있었습니다(환자-년 1000명당 2.7건 대 0.5건). VICTOZA를 사용한 13건 중 9건은 급성 췌장염으로 보고되었고 4건은 만성 췌장염으로 보고되었습니다. VICTOZA 치료 환자의 한 사례에서 괴사를 동반한 췌장염이 관찰되었고 사망에 이르렀습니다. 그러나 임상적 인과 관계는 확립될 수 없었습니다. 일부 환자는 담석증 병력이나 알코올 남용과 같은 췌장염의 다른 위험 요소를 가지고 있었습니다.
VICTOZA는 췌장염 병력이 있는 소수의 환자에서 연구되었습니다. 췌장염 병력이 있는 환자가 VICTOZA를 사용할 때 췌장염 발생 위험이 더 높은지는 알려져 있지 않습니다.
5.3 환자 간에 VICTOZA 펜을 절대 공유하지 마십시오
바늘을 교체하더라도 VICTOZA 펜을 환자 간에 절대 공유해서는 안 됩니다. 펜 공유는 혈액 매개 병원체 전파 위험을 초래합니다.
5.4 저혈당증
인슐린 분비촉진제(예: 설포닐우레아) 또는 인슐린과 함께 VICTOZA를 투여받는 성인 환자는 심각한 저혈당증을 포함한 저혈당증 위험이 증가할 수 있습니다. 10세 이상의 소아 환자에서 저혈당증 위험은 인슐린 및/또는 메트포르민 사용 여부와 관계없이 VICTOZA를 사용할 때 더 높았습니다. [이상반응 (6.1), 약물 상호작용 (7.2) 참조].
설포닐우레아(또는 병용 투여되는 기타 인슐린 분비촉진제) 또는 인슐린의 용량을 줄이면 저혈당증 위험을 낮출 수 있습니다. 이러한 병용 약물을 사용하는 환자와 소아 환자에게 저혈당증의 위험을 알리고 저혈당증의 징후와 증상에 대해 교육하십시오.
5.5 급성 신장 손상
VICTOZA는 동물 연구 또는 임상 시험에서 직접적인 신독성이 없는 것으로 나타났습니다.
VICTOZA 치료 환자에서 급성 신부전 및 만성 신부전 악화에 대한 시판 후 보고가 있었으며 때때로 혈액투석이 필요할 수 있습니다 [이상반응 (6.2) 참조]. 이러한 사례 중 일부는 기저 신장 질환이 알려지지 않은 환자에서 보고되었습니다. 보고된 사례의 대부분은 메스꺼움, 구토, 설사 또는 탈수를 경험한 환자에서 발생했습니다 [이상반응 (6.1) 참조]. 보고된 사례 중 일부는 신장 기능 또는 수분 상태에 영향을 미치는 것으로 알려진 하나 이상의 약물을 복용하는 환자에서 발생했습니다. 변경된 신장 기능은 보고된 많은 사례에서 VICTOZA를 포함한 잠재적인 원인 물질의 중단 및 지지 치료로 회복되었습니다. 신장애 환자에서 VICTOZA의 용량을 시작하거나 증량할 때 주의하십시오 [특정 집단에서의 사용 (8.6) 참조].
5.6 과민반응
VICTOZA로 치료받은 환자에서 시판 후 심각한 과민반응(예: 아나필락시스 반응 및 안면부종)이 보고되었습니다 [유해반응 (6.2)]. 과민반응이 발생하면 VICTOZA 투여를 중단하고 표준 치료에 따라 즉시 치료하며 징후 및 증상이 사라질 때까지 모니터링합니다.
다른 GLP-1 수용체 작용제에서 아나필락시스 및 안면부종이 보고되었습니다. 다른 GLP-1 수용체 작용제에 대한 아나필락시스 또는 안면부종의 병력이 있는 환자에게는 VICTOZA에 대한 이러한 반응이 발생할 가능성이 있는지 알 수 없으므로 주의하여 사용하십시오. 리라글루티드 또는 VICTOZA의 어떤 첨가제에 대해서도 심각한 과민반응이 있었던 환자에게는 VICTOZA가 금기입니다 [금기사항 (4)].
5.7 급성 담낭 질환
담석증 또는 담낭염과 같은 급성 담낭 질환 사례가 GLP-1 수용체 작용제 시험 및 시판 후에 보고되었습니다. LEADER 시험 [임상 연구 (14.3)]에서 VICTOZA 치료 환자의 3.1% 대비 위약 치료 환자의 1.9%에서 담석증 또는 담낭염과 같은 급성 담낭 질환 사례가 보고되었습니다.
[유해반응 (6.1)]. 담석증이 의심되는 경우 담낭 검사 및 적절한 임상 추적 관찰이 필요합니다.
5.8 전신 마취 또는 심정지 중 폐흡인
VICTOZA는 위 배출을 지연시킵니다 [임상 약리학 (12.2)]. 전신 마취 또는 심정지가 필요한 선택적 수술 또는 시술을 받는 GLP-1 수용체 작용제를 투여받는 환자에서 수술 전 금식 권장 사항을 준수했다는 보고에도 불구하고 잔류 위 내용물이 있는 폐흡인이 드물게 시판 후 보고되었습니다.
VICTOZA를 복용하는 환자에서 전신 마취 또는 심정지 중 폐흡인 위험을 줄이기 위한 권장 사항(수술 전 금식 권장 사항을 수정하거나 VICTOZA 투여를 일시적으로 중단하는 것이 잔류 위 내용물 발생률을 줄일 수 있는지 여부 포함)을 알려줄 수 있는 데이터가 충분하지 않습니다. 환자에게 VICTOZA를 복용 중인 경우 계획된 수술 또는 시술 전에 의료 제공자에게 알리도록 지시하십시오.
6 부작용
다음의 심각한 부작용은 아래 또는 처방 정보의 다른 곳에 설명되어 있습니다.
- •
- 갑상선 C-세포 종양 위험 [경고 및 주의사항 (5.1) 참조]
- •
- 췌장염 [경고 및 주의사항 (5.2) 참조]
- •
- 저혈당증 [경고 및 주의사항 (5.4) 참조]
- •
- 급성 신장 손상 [경고 및 주의사항 (5.5) 참조]
- •
- 과민 반응 [경고 및 주의사항 (5.6) 참조]
- •
- 급성 담낭 질환 [경고 및 주의사항 (5.7) 참조]
- •
- 전신 마취 또는 깊은 진정 중 폐 흡인 [경고 및 주의사항 (5.8) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
흔한 부작용
제2형 당뇨병 환자에서 VICTOZA의 안전성은 성인에서 5건의 혈당 조절, 위약 대조 시험과 10세 이상 소아 환자에서 52주 동안 진행된 한 건의 시험에서 평가되었습니다. [임상 연구 (14.1) 참조]. 표 1의 데이터는 1,673명의 성인 환자의 VICTOZA 노출 및 평균 37.3주의 VICTOZA 노출 기간을 반영합니다. 성인 환자의 평균 연령은 58세였으며, 4%는 75세 이상이었고 54%는 남성이었습니다. 모집단은 백인 79%, 흑인 또는 아프리카계 미국인 6%, 아시아인 13%였으며, 4%는 히스패닉 또는 라틴계였습니다. 기준선에서 모집단은 평균 9년 동안 당뇨병을 앓았으며 평균 HbA1c는 8.4%였습니다. 기준선에서 추정된 신장 기능은 통합 모집단의 88%에서 정상 또는 경도 장애였고 12%에서 중등도 장애였습니다.
표 1은 저혈당증을 제외하고 제2형 당뇨병 치료를 위해 VICTOZA 사용과 관련된 성인의 흔한 부작용을 보여줍니다. 이러한 부작용은 위약보다 VICTOZA에서 더 흔하게 발생했으며 VICTOZA로 치료받은 환자의 최소 5%에서 발생했습니다. 전반적으로 10세 이상 소아 환자에서 부작용의 유형 및 중증도는 성인 모집단에서 관찰된 것과 비슷했습니다.
표 1 제2형 당뇨병으로 VICTOZA 치료를 받은 성인 환자의 ≥ 5%에서 보고된 부작용
|
위약 N=661 |
Liraglutide 1.2 mg N= 645 |
Liraglutide 1.8 mg N= 1024 |
||
|
부작용 |
(%) |
(%) |
(%) |
|
|
메스꺼움 |
5 |
18 |
20 |
|
|
설사 |
4 |
10 |
12 |
|
|
두통 |
7 |
11 |
10 |
|
|
비인두염 |
8 |
9 |
10 |
|
|
구토 |
2 |
6 |
9 |
|
|
식욕 감퇴 |
1 |
10 |
9 |
|
|
소화불량 |
1 |
4 |
7 |
|
상기도 감염 |
6 |
7 |
6 |
|
변비 |
1 |
5 |
5 |
|
요통 |
3 |
4 |
5 |
코크란-맨텔-하엔젤(Cochran-Mantel-Haenszel) 가중치를 사용하여 연구를 결합하여 누적 비율을 계산했습니다.
플라시보 및 활성 대조 시험의 분석에서, 저혈당을 제외한 흔한 부작용의 유형 및 빈도는 표 1에 나열된 것과 유사했습니다.
기타 부작용
위장관 부작용
5개의 혈당 조절, 플라시보 대조 성인 임상 시험의 풀에서, 위장관 부작용으로 인한 중단은 VICTOZA로 치료받은 환자의 4.3%와 플라시보로 치료받은 환자의 0.5%에서 발생했습니다. 위장관 부작용으로 인한 중단은 주로 시험의 처음 2 – 3개월 동안 발생했습니다.
주사 부위 반응
5개의 이중 맹검, 최소 26주 기간의 혈당 조절 시험에서 VICTOZA로 치료받은 성인 환자의 약 2%에서 주사 부위 반응(예: 주사 부위 발진, 홍반)이 보고되었습니다. VICTOZA로 치료받은 환자의 0.2% 미만이 주사 부위 반응으로 중단되었습니다.
저혈당
최소 26주 기간의 5개의 성인 혈당 조절, 플라시보 대조 임상 시험에서, 다른 사람의 도움이 필요한 저혈당은 8명의 VICTOZA로 치료받은 환자(1000 환자-년당 7.5건)에서 발생했습니다. 이 8명의 VICTOZA로 치료받은 환자 중 7명은 설포닐우레아를 동시에 사용하고 있었습니다.
|
|
|
|
메트포르민에 추가 |
플라시보 + 메트포르민 (N = 121) |
VICTOZA + 메트포르민
|
|
자가 치료가 불가능한 환자 |
|
|
|
자가 치료가 가능한 환자 |
|
|
|
글리메피리드에 추가 |
|
|
|
자가 치료가 불가능한 환자 |
|
|
|
자가 치료가 가능한 환자 |
|
|
|
미분류 |
|
|
|
메트포르민 + 로시글리타존에 추가 |
(N = 175) |
VICTOZA + 메트포르민 + 로시글리타존
|
|
자가 치료가 불가능한 환자 |
|
|
|
자가 치료가 가능한 환자 |
|
|
|
미분류 |
|
|
|
메트포르민 + 글리메피리드에 추가 |
(N = 114) |
VICTOZA + 메트포르민 + 글리메피리드
|
|
자가 치료 불가능 환자 |
|
|
|
자가 치료 가능 환자 |
|
|
|
분류되지 않음 |
|
|
“타인의 도움이 필요한 치료”는 치료를 위해 다른 사람의 도움이 필요한 사례로 정의됩니다.
10세 이상 소아 2형 당뇨병 환자를 대상으로 26주 동안 위약 대조 임상 시험을 실시하고 26주 개방표지 확장 연구를 진행한 결과, VICTOZA 치료 환자(평균 연령 14.6세)의 21.2%에서 증상 유무와 관계없이 혈당 <54 mg/dL의 저혈당이 발생했습니다(1000 환자년당 335건). VICTOZA 치료군에서는 중증 저혈당 사례가 발생하지 않았습니다(중증 저혈당은 탄수화물, 글루카곤 또는 기타 소생 조치를 적극적으로 투여하기 위해 다른 사람의 도움이 필요한 사례로 정의됨).
유두상 갑상선암
VICTOZA의 성인 혈당 조절 임상 시험에서 VICTOZA 치료 환자 7명과 비교 치료 환자 1명에게서 유두상 갑상선암이 보고되었습니다(1000 환자년당 1.5건 대 0.5건). 이러한 유두상 갑상선암의 대부분은 최대 직경이 1cm 미만이었으며, 혈청 칼시토닌 또는 갑상선 초음파 검사를 통해 시행된 프로토콜 규정 검사 결과에 따라 갑상선 절제술 후 병리 조직 검사 표본에서 진단되었습니다.
담석증 및 담낭염
VICTOZA의 성인 혈당 조절 임상 시험에서 VICTOZA 치료 환자와 위약 치료 환자 모두에서 담석증 발생률은 0.3%였습니다. VICTOZA 치료 환자와 위약 치료 환자 모두에서 담낭염 발생률은 0.2%였습니다.
LEADER 시험 [임상 연구(14.3)]에서 표준 치료를 배경으로 성인 VICTOZA 치료 환자의 담석증 발생률은 1.5%(관찰 환자년당 1000명당 3.9건)였고, 위약 치료 환자의 발생률은 1.1%(관찰 환자년당 1000명당 2.8건)였습니다. 성인 VICTOZA 치료 환자의 급성 담낭염 발생률은 1.1%(관찰 환자년당 1000명당 2.9건)였고, 위약 치료 환자의 발생률은 0.7%(관찰 환자년당 1000명당 1.9건)였습니다. 대부분의 사례는 입원 또는 담낭절제술이 필요했습니다.
검사실 검사
빌리루빈
26주 이상 지속된 5건의 성인 혈당 조절 임상 시험에서 VICTOZA 치료 환자의 4.0%, 위약 치료 환자의 2.1%, 활성 비교약 치료 환자의 3.5%에서 경도의 상승된 혈청 빌리루빈 농도(기준 범위 상한의 최대 2배까지 상승)가 발생했습니다. 이러한 소견은 다른 간 기능 검사 이상과 동반되지 않았습니다. 이러한 단독 소견의 중요성은 알 수 없습니다.
칼시토닌
MTC의 생물학적 지표인 칼시토닌은 임상 개발 프로그램 전반에 걸쳐 측정되었습니다. 성인 혈당 조절 임상 시험 종료 시, 조정된 평균 혈청 칼시토닌 농도는 위약 치료 환자에 비해 VICTOZA 치료 환자에서 더 높았지만 활성 비교약을 투여받은 환자와 비교했을 때는 그렇지 않았습니다. 조정된 평균 혈청 칼시토닌 값의 군 간 차이는 약 0.1 ng/L 이하였습니다. 치료 전 칼시토닌 <20 ng/L인 성인 환자 중에서 칼시토닌이 >20 ng/L로 상승한 경우는 VICTOZA 치료 환자의 0.7%, 위약 치료 환자의 0.3%, 활성 비교약 치료 환자의 0.5%였습니다. 이러한 소견의 임상적 중요성은 알 수 없습니다.
리파제 및 아밀라제
신장 장애 환자를 대상으로 한 한 건의 성인 혈당 조절 임상 시험에서 VICTOZA 치료 환자의 경우 기준치 대비 리파제는 평균 33% 증가하고 아밀라제는 15% 증가한 반면, 위약 치료 환자의 경우 리파제는 평균 3% 감소하고 아밀라제는 1% 증가했습니다.
LEADER 시험에서 혈청 리파제와 아밀라제는 정기적으로 측정되었습니다. 성인 VICTOZA 치료 환자 중 7.9%에서 치료 중 언제든지 정상 상한의 3배 이상인 리파제 값이 나타났고, 위약 치료 환자는 4.5%였으며, VICTOZA 치료 환자 중 1%에서 치료 중 언제든지 정상 상한의 3배 이상인 아밀라제 값이 나타났고, 위약 치료 환자는 0.7%였습니다.
다른 췌장염 징후 및 증상이 없는 경우 VICTOZA와 관련된 리파제 또는 아밀라제 상승의 임상적 중요성은 알 수 없습니다 [경고 및 주의 사항(5.2) 참조].
활력 징후
VICTOZA는 혈압에 부작용을 미치지 않았습니다. 위약과 비교하여 VICTOZA로 치료받은 성인 환자에서 심박수는 기준치보다 평균 2~3회/분 증가했습니다.
6.2 시판 후 경험
다음과 같은 추가적인 이상 반응이 VICTOZA의 시판 후 사용 중에 보고되었습니다. 이러한 사례는 불확실한 규모의 모집단으로부터 자발적으로 보고되었으므로, 일반적으로 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것은 불가능합니다.
- •
- 위장관계: 급성 췌장염, 출혈성 및 괴사성 췌장염(때로는 사망으로 이어짐), 일레우스
- •
- 일반 장애 및 투여 부위 상태: 알레르기 반응: 발진 및 가려움증
- •
- 담도계: 간 효소 상승, 고빌리루빈혈증, 담즙 정체, 담낭염, 담낭절제술이 필요한 담석증, 간염
- •
- 면역계: 안젤오에데마 및 아나필락시스 반응
- •
- 대사 및 영양: 메스꺼움, 구토 및 설사로 인한 탈수
- •
- 신생물: 수질성 갑상선암
- •
- 신경계: 미각 이상, 어지러움
- •
- 폐: GLP-1 수용체 작용제를 투여받고 선택적 수술 또는 전신 마취 또는 심부 진정이 필요한 시술을 받은 환자에게서 폐흡인이 발생했습니다.
- •
- 신장 및 비뇨기: 혈청 크레아티닌 증가, 급성 신부전 또는 만성 신부전 악화(때로는 혈액 투석이 필요함).
- •
- 피부 및 피하 조직: 피부 아밀로이드증
7 약물 상호작용
7.1 위장 배출 지연이 경구 약물에 미치는 영향
빅토자는 위장 배출을 지연시키므로, 동시에 투여되는 경구 약물의 흡수에 영향을 미칠 가능성이 있습니다. 임상 약리학 시험에서 빅토자는 시험된 경구 투여 약물의 흡수에 임상적으로 유의미한 정도로 영향을 미치지 않았습니다 [임상 약리학 (12.3) 참조]. 그럼에도 불구하고, 빅토자와 경구 약물을 동시에 투여할 때는 주의해야 합니다.
7.2 인슐린 분비 촉진제(예: 설폰요소제) 또는 인슐린과의 병용
빅토자는 혈당 농도가 상승된 경우 인슐린 분비를 자극합니다. 인슐린 분비 촉진제(예: 설폰요소제) 또는 인슐린과 함께 빅토자를 투여받는 환자는 저혈당증, 심한 저혈당증을 포함한 위험이 증가할 수 있습니다. 빅토자 투여를 시작할 때 저혈당증 위험을 줄이기 위해 동시에 투여되는 인슐린 분비 촉진제(설폰요소제 등) 또는 인슐린의 용량을 줄이는 것을 고려해야 합니다 [경고 및 주의 사항 (5.4) 및 이상 반응 (6.1) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 생식 연구에 따르면 임신 중 VICTOZA에 노출되면 태아에게 위험이 있을 수 있습니다. VICTOZA는 잠재적 이점이 태아에 대한 잠재적 위험을 정당화하는 경우에만 임신 중에 사용해야 합니다.
동물 생식 연구에서 임신 중 노출로 인한 부작용 발생 증가가 확인되었습니다. Liraglutide 노출은 최대 권장 용량(MRHD)인 1.8mg/일의 임상 노출량에 근접한 용량으로 기관 형성 기간 동안 liraglutide를 투여받은 임신 쥐에서 초기 배아 사망 및 일부 태아 기형의 불균형과 관련이 있었습니다. 기관 형성 기간 동안 liraglutide를 투여받은 임신 토끼에서 MRHD에서의 사람 노출량보다 낮은 노출량에서 태아 체중 감소 및 주요 태아 기형 발생률 증가가 관찰되었습니다. [동물 데이터 참조].
임신 전 당뇨병이 조절되지 않는 여성(헤모글로빈 A1C >7)의 주요 선천적 결손증의 추정 배경 위험은 6~10%입니다. 헤모글로빈 A1C >10인 여성의 주요 선천적 결손증 발생률은 20~25%로 보고되었습니다. 미국의 일반 인구에서 임상적으로 확인된 임신의 주요 선천적 결손증 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
임상적 고려 사항
질병 관련 산모 및/또는 배아/태아 위험
임신 중 당뇨병이 제대로 조절되지 않으면 당뇨병성 케톤산증, 자간전증, 자연 유산, 조산 및 분만 합병증의 산모 위험이 증가합니다. 당뇨병이 제대로 조절되지 않으면 주요 선천적 결손증, 사산 및 거대아 관련 이환율의 태아 위험이 증가합니다.
동물 데이터
짝짓기 2주 전부터 임신 17일까지 0.1, 0.25, 1.0mg/kg/일의 liraglutide 피하 주사를 투여받은 암컷 쥐는 혈장 AUC 비교를 기준으로 MRHD에서 사람 노출량의 0.8배, 3배, 11배의 전신 노출량을 보였습니다. 1mg/kg/일 그룹에서 초기 배아 사망 수가 약간 증가했습니다. 모든 용량에서 신장 및 혈관의 태아 기형 및 변이, 두개골의 불규칙적인 골화, 더 완전한 골화 상태가 발생했습니다. 얼룩덜룩한 간과 최소한으로 꼬인 갈비뼈는 최고 용량에서 발생했습니다. 동시 및 과거 대조군을 초과하는 liraglutide 치료 그룹에서 태아 기형의 발생률은 0.1mg/kg/일에서 기형 인두 및/또는 후두로의 좁아진 개구부, 0.1 및 0.25mg/kg/일에서 제대 탈장이었습니다.
임신 6일부터 18일까지 0.01, 0.025, 0.05mg/kg/일의 liraglutide 피하 주사를 투여받은 임신 토끼는 혈장 AUC를 기준으로 모든 용량에서 1.8mg/일의 MRHD에서 사람 노출량보다 낮은 전신 노출량을 보였습니다. Liraglutide는 태아 체중을 감소시켰고 용량 의존적으로 모든 용량에서 총 주요 태아 기형의 발생률을 증가시켰습니다. 기형의 발생률은 0.01mg/kg/일(신장, 견갑골), ≥ 0.01mg/kg/일(눈, 앞다리), 0.025mg/kg/일(뇌, 꼬리 및 천골 척추, 주요 혈관 및 심장, 배꼽), ≥ 0.025mg/kg/일(흉골) 및 0.05mg/kg/일(두정골, 주요 혈관)에서 동시 및 과거 대조군을 초과했습니다. 두개골과 턱, 척추뼈와 갈비뼈, 흉골, 골반, 꼬리, 견갑골에서 불규칙적인 골화 및/또는 골격 기형이 발생했으며 용량 의존적인 경미한 골격 변이가 관찰되었습니다. 혈관, 폐, 간, 식도에서 내장 기형이 발생했습니다. 모든 치료 그룹에서 이엽 또는 분기 담낭이 관찰되었지만 대조군에서는 관찰되지 않았습니다.
임신 6일부터 수유 종료 또는 수유 24일에 수유 종료까지 0.1, 0.25, 1.0mg/kg/일의 liraglutide 피하 주사를 투여받은 임신 암컷 쥐에서 혈장 AUC를 기준으로 추정 전신 노출량은 MRHD 1.8mg/일에서 사람 노출량의 0.8배, 3배, 11배였습니다. 대부분의 치료받은 쥐에서 분만 지연이 약간 관찰되었습니다. liraglutide 치료를 받은 댐에서 태어난 신생 쥐의 그룹 평균 체중은 대조군 댐에서 태어난 신생 쥐보다 낮았습니다. 1mg/kg/일의 liraglutide로 치료받은 댐의 수컷 쥐에서 피 묻은 딱지와 불안한 행동이 발생했습니다. 출생부터 산후 14일까지의 그룹 평균 체중은 대조군에서 태어난 F2세대 쥐에 비해 liraglutide 치료를 받은 쥐에서 태어난 F2세대 쥐에서 낮은 경향을 보였지만 어떤 그룹에서도 차이가 통계적 유의성에 도달하지 못했습니다.
8.2 수유
위험 요약
모유에서 VICTOZA의 존재, 모유 수유 유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. Liraglutide는 수유 쥐의 모유에 존재했습니다. [데이터 참조].
모유 수유의 발달 및 건강상의 이점은 VICTOZA에 대한 산모의 임상적 필요성 및 VICTOZA 또는 기저 산모 질환으로 인한 모유 수유 유아에 대한 잠재적 부작용과 함께 고려해야 합니다.
데이터
수유 쥐에서 liraglutide는 모체 혈장 농도의 약 50% 농도로 모유에 변하지 않고 존재했습니다.
8.4 소아에서의 사용
VICTOZA는 식이요법 및 운동과 병행하여 10세 이상 소아 제2형 당뇨병 환자의 혈당 조절 개선에 대한 안전성과 유효성이 확립되었습니다. 이 적응증에 대한 VICTOZA의 사용은 제2형 당뇨병이 있는 10세에서 17세 사이의 소아 환자 134명을 대상으로 한 26주 위약 대조 임상 시험 및 26주 공개 연장 연구, 소아 약동학 연구, 그리고 제2형 당뇨병이 있는 성인을 대상으로 한 연구에 의해 뒷받침됩니다 [임상 약리학 (12.3) 및 임상 연구 (14.1,14.2) 참조]. 인슐린 및/또는 메트포르민 사용 여부와 관계없이 소아 환자에서 VICTOZA를 사용했을 때 저혈당 위험이 더 높았습니다 [이상반응 (6.1) 참조].
10세 미만 소아 환자에서 VICTOZA의 안전성과 유효성은 확립되지 않았습니다.
8.5 노인에서의 사용
혈당 조절 시험의 VICTOZA 치료군에서 총 832명(19.3%)의 환자가 65세에서 74세였고 145명(3.4%)은 75세 이상이었습니다 [임상 연구 (14.1) 참조]. LEADER 시험의 VICTOZA 치료군 [임상 연구 (14.3) 참조]에서 총 1738명(37.2%)의 환자가 65세에서 74세였고, 401명(8.6%)은 75세에서 84세였으며, 17명(0.4%)은 기준 시점에서 85세 이상이었습니다.
65세 이상 환자와 그보다 젊은 환자 사이에서 VICTOZA의 안전성 또는 유효성에 전반적인 차이는 관찰되지 않았습니다.
8.6 신장애
신장애 환자의 경우 VICTOZA 용량 조절이 권장되지 않습니다 [임상 약리학 (12.3) 참조]. 중등도 신장애(eGFR 30~60mL/min/1.73m2) 환자가 포함된 26주 임상 연구에서 VICTOZA의 안전성과 유효성을 평가했습니다 [임상 연구 (14.1) 참조].
LEADER 시험의 VICTOZA 치료군 [임상 연구 (14.3) 참조]에서 1932명(41.4%)의 환자는 기준 시점에서 경증 신장애가 있었고, 999명(21.4%)의 환자는 중등도 신장애가 있었으며, 117명(2.5%)의 환자는 중증 신장애가 있었습니다. 이러한 환자에서 정상 신기능을 가진 환자와 비교했을 때 안전성 또는 유효성에 전반적인 차이는 나타나지 않았습니다.
말기 신질환 환자에서 VICTOZA 사용 경험은 제한적입니다. 시판 후 급성 신부전 및 만성 신부전 악화 사례가 보고되었으며, 때때로 혈액투석이 필요할 수 있습니다 [경고 및 주의사항 (5.5) 및 이상반응 (6.2) 참조]. 탈수 증상이 나타나는 환자에게는 주의해서 사용하십시오.
8.7 간장애
경증, 중등도 또는 중증 간장애 환자에 대한 경험은 제한적입니다. 따라서 이러한 환자 집단에서는 VICTOZA를 주의해서 사용해야 합니다. 간장애 환자의 경우 VICTOZA 용량 조절이 권장되지 않습니다 [임상 약리학 (12.3) 참조].
10 과다 복용
빅토자의 임상시험 및 시판 후 사용에서 과량 복용 사례가 보고되었습니다. 관찰된 증상으로는 심한 메스꺼움, 심한 구토 및 심한 저혈당이 포함됩니다. 과량 복용 시 환자의 임상 징후 및 증상에 따라 적절한 지지 치료를 시작해야 합니다.
11 설명
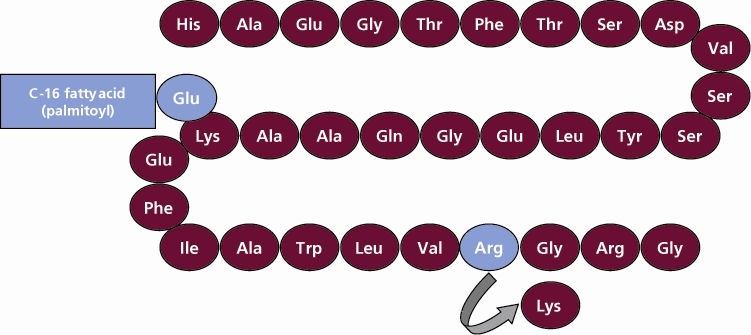
VICTOZA는 인간 GLP-1의 유사체인 liraglutide를 함유하고 있으며 GLP-1 수용체 작용제로 작용합니다. Saccharomyces cerevisiae에서 재조합 DNA의 발현을 포함하는 공정으로 생산된 liraglutide의 펩타이드 전구체는 34번째 위치의 라이신을 아르기닌으로 치환하여 천연 인간 GLP-1과 97% 상동성을 갖도록 설계되었습니다. Liraglutide는 펩타이드 전구체의 26번째 위치에 있는 나머지 라이신 잔기에 글루탐산 스페이서를 사용하여 C-16 지방산(팔미트산)을 부착하여 만들어집니다. Liraglutide의 분자식은 C172H265N43O51이며 분자량은 3751.2 Daltons입니다. 구조식(그림 1)은 다음과 같습니다.
그림 1 Liraglutide의 구조식
VICTOZA 주사제는 피하 사용을 위한 멸균된 수성의 투명하고 무색 또는 거의 무색의 용액입니다. VICTOZA 용액 1mL에는 6mg의 liraglutide와 다음과 같은 비활성 성분이 포함되어 있습니다: 이수소 인산염 이수화물 1.42mg, 프로필렌 글리콜 14mg, 페놀 5.5mg, 주사용수. VICTOZA의 pH는 약 8.15이며, pH를 조정하기 위해 염산 또는 수산화나트륨을 첨가할 수 있습니다. 각 프리필드 펜에는 18mg의 liraglutide(무수 유리 염기)에 해당하는 3mL의 VICTOZA 용액이 들어 있습니다.
12 임상약리학
12.1 작용 기전
리라글루타이드는 97%의 아미노산 서열 상동성을 가진 아실화된 인간 글루카곤 유사 펩타이드-1 (GLP-1) 수용체 작용제로서, 내인성 인간 GLP-1(7-37)과 유사합니다. GLP-1(7-37)은 총 순환 내인성 GLP-1의 <20%를 차지합니다. GLP-1(7-37)과 마찬가지로, 리라글루타이드는 췌장 베타 세포에서 자극성 G-단백질인 Gs에 의해 아데닐릴 사이클라제에 결합된 세포 표면 수용체인 GLP-1 수용체를 활성화합니다. 리라글루타이드는 세포 내 cAMP (cyclic AMP)를 증가시켜 고혈당 농도에서 인슐린 분비를 유도합니다. 이러한 인슐린 분비는 혈당 농도가 감소하고 정상 혈당치에 가까워짐에 따라 감소합니다. 리라글루타이드는 또한 포도당 의존적 방식으로 글루카곤 분비를 감소시킵니다. 혈당 강하 기전에는 위 배출 지연도 포함됩니다.
GLP-1(7-37)은 유비쿼터스 내인성 효소인 디펩티딜 펩티다제 IV (DPP-IV)와 중성 엔도펩티다제 (NEP)에 의한 분해로 인해 1.5-2분의 반감기를 갖습니다. native GLP-1과 달리, 리라글루타이드는 두 펩티다제에 의한 대사 분해에 안정적이며, 피하 투여 후 13시간의 혈장 반감기를 갖습니다. 1일 1회 투여에 적합하게 만드는 리라글루타이드의 약동학적 특성은 흡수를 지연시키는 자가 회합, 혈장 단백질 결합 및 DPP-IV와 NEP에 의한 대사 분해에 대한 안정성의 결과입니다.
12.2 약력학
VICTOZA의 약력학적 특성은 단회 피하 투여 후 관찰된 약동학적 특성과 일치하며, VICTOZA는 하루 종일 공복, 식전 및 식후 혈당을 낮췄습니다 [임상 약리학 (12.3)].
0.6, 1.2 및 1.8 mg VICTOZA 또는 플라시보로 정상 상태에 도달한 후 표준화된 식사 전후 최대 5시간까지 공복 및 식후 혈당을 측정했습니다. 플라시보와 비교하여, VICTOZA 1.2 mg 투여 후 식후 혈장 포도당 AUC0-300min은 35% 감소했고, VICTOZA 1.8 mg 투여 후에는 38% 감소했습니다.
포도당 의존성 인슐린 분비
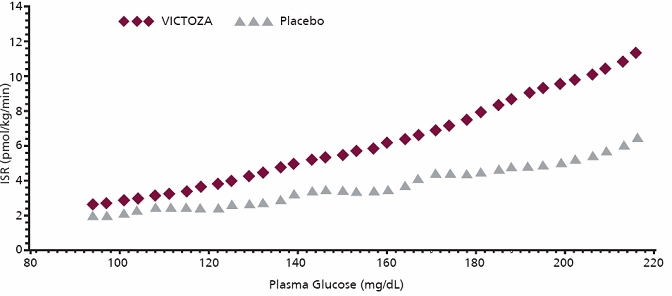
2형 당뇨병 환자 10명에서 단회 7.5 mcg/kg (~0.7 mg) VICTOZA 투여가 단계적 포도당 주입 중 인슐린 분비율 (ISR)에 미치는 영향을 조사했습니다. 이 환자들에서 평균적으로 ISR 반응은 포도당 의존적 방식으로 증가했습니다 (그림 2).
그림 2 2형 당뇨병 환자 (N=10)에서 단계적 포도당 주입 중 단회 투여 VICTOZA 7.5 mcg/kg (~0.7 mg) 또는 플라시보 투여 후 평균 인슐린 분비율 (ISR) 대 포도당 농도
글루카곤 분비
VICTOZA는 인슐린 분비를 자극하고 글루카곤 분비를 감소시켜 혈당을 낮췄습니다. 7.5 mcg/kg (~0.7 mg)의 단회 VICTOZA 투여는 저혈당 농도에 대한 글루카곤 반응을 손상시키지 않았습니다.
위 배출
VICTOZA는 위 배출을 지연시켜 식후 혈당이 순환계에 나타나는 속도를 감소시킵니다.
심장 전기 생리학 (QTc)
QTc 연구에서 VICTOZA의 심장 재분극에 대한 영향을 검사했습니다. 최대 1.8 mg의 일일 용량으로 정상 상태 농도의 VICTOZA는 QTc 연장을 유발하지 않았습니다.
12.3 약동학
흡수
피하 투여 후 리라글루타이드의 최대 농도는 투여 후 8-12시간에 달성됩니다. 0.6 mg의 피하 단회 투여량에 대한 리라글루타이드의 평균 최고 농도 (Cmax) 및 총 노출량 (AUC)은 각각 35 ng/mL 및 960 ng·h/mL였습니다. 피하 단회 투여 후 리라글루타이드의 Cmax 및 AUC는 0.6 mg에서 1.8 mg의 치료 용량 범위에서 비례적으로 증가했습니다. 1.8 mg VICTOZA에서 리라글루타이드의 24시간 평균 정상 상태 농도는 약 128 ng/mL였습니다. 상완과 복부, 상완과 대퇴 사이의 AUC0-∞은 동일했습니다. 대퇴부의 AUC0-∞는 복부보다 22% 낮았습니다. 그러나 이 세 가지 피하 주사 부위에서 리라글루타이드 노출량은 비슷한 것으로 간주되었습니다. 피하 투여 후 리라글루타이드의 절대 생체 이용률은 약 55%입니다.
분포
VICTOZA 0.6 mg 피하 투여 후 평균 명백 분포 용적은 약 13 L입니다. VICTOZA 정맥 투여 후 평균 분포 용적은 0.07 L/kg입니다. 리라글루타이드는 혈장 단백질에 광범위하게 결합됩니다 (>98%).
배설
리라글루타이드 단회 투여 후 평균 명백 청소율은 약 1.2 L/h이며, 약 13시간의 제거 반감기를 갖습니다.
대사
건강한 피험자에게 단회 [3H]-리라글루타이드 용량을 투여한 후 처음 24시간 동안 혈장의 주요 성분은 그대로의 리라글루타이드였습니다. 리라글루타이드는 주요 배설 경로로 특정 장기가 없는 대형 단백질과 유사한 방식으로 내인성적으로 대사됩니다.
배출
[3H]-리라글루타이드 용량 투여 후, 그대로의 리라글루타이드는 소변이나 대변에서 검출되지 않았습니다. 투여된 방사능의 일부만이 소변 또는 대변에서 리라글루타이드 관련 대사산물로 배설되었습니다 (각각 6% 및 5%). 소변 및 대변 방사능의 대부분은 처음 6-8일 동안 배설되었습니다.
특정 집단
노인 환자
건강한 고령자(65~83세)를 대상으로 한 약동학 연구 및 18~80세 환자의 집단 약동학 분석 결과에 따르면 연령은 VICTOZA의 약동학에 영향을 미치지 않았습니다 [특정 집단에서의 사용 (8.5절) 참조].
소아 환자
2형 당뇨병을 가진 72명의 소아 환자(10~17세)의 데이터를 사용하여 VICTOZA에 대한 집단 약동학 분석을 실시했습니다. 소아 환자에서 VICTOZA의 약동학적 특성은 성인과 일치했습니다.
남성 및 여성 환자
집단 약동학 분석 결과에 따르면 여성의 체중 조정 청소율은 남성에 비해 25% 낮습니다.
인종 또는 민족 집단
백인, 흑인 또는 아프리카계 미국인, 아시아인 및 히스패닉 또는 라티노/비히스패닉 또는 라티노 대상자를 포함한 집단 약동학 분석 결과에 따르면 인종과 민족은 VICTOZA의 약동학에 영향을 미치지 않았습니다.
체중
집단 약동학 분석 결과에 따르면 체중은 VICTOZA의 약동학에 유의미한 영향을 미칩니다. 리라글루티드의 노출은 기준 체중 증가에 따라 감소합니다. 그러나 임상 시험에서 평가된 40~160kg의 체중 범위에서 VICTOZA 1.2mg 및 1.8mg 1일 용량은 적절한 전신 노출을 제공했습니다. 리라글루티드는 체중이 160kg을 초과하는 환자에게서 연구되지 않았습니다.
신장애 환자
다양한 정도의 신장애 환자에서 VICTOZA의 단회 투여 약동학을 평가했습니다. 경증(추정 크레아티닌 청소율 50-80 mL/min)부터 중증(추정 크레아티닌 청소율 <30 mL/min) 신장애 환자 및 투석이 필요한 말기 신부전 환자를 시험에 포함했습니다. 건강한 대상자와 비교하여 경증, 중등도 및 중증 신장애 및 말기 신부전 환자의 리라글루티드 AUC는 각각 평균 35%, 19%, 29% 및 30% 낮았습니다 [특정 집단에서의 사용 (8.6절) 참조].
간장애 환자
다양한 정도의 간장애 환자에서 VICTOZA의 단회 투여 약동학을 평가했습니다. 경증(Child-Pugh 점수 5-6)부터 중증(Child-Pugh 점수 >9) 간장애 환자를 시험에 포함했습니다. 건강한 대상자와 비교하여 경증, 중등도 및 중증 간장애 환자의 리라글루티드 AUC는 각각 평균 11%, 14% 및 42% 낮았습니다 [특정 집단에서의 사용 (8.7절) 참조].
약물 상호작용 연구
약물-약물 상호작용의 시험관내 평가
VICTOZA는 시토크롬 P450(CYP) 및 혈장 단백질 결합과 관련된 약물-약물 상호작용의 가능성이 낮습니다.
약물-약물 상호작용의 생체내 평가
약물-약물 상호작용 연구는 VICTOZA 1.8mg/일로 정상 상태에서 수행되었습니다. 동시 치료를 투여하기 전에 대상자는 0.6mg의 주간 용량 증가를 거쳐 1.8mg/일의 최대 용량에 도달했습니다. 상호 작용하는 약물의 투여 시기는 VICTOZA의 Cmax(8-12시간)가 동시 투여된 약물의 흡수 피크와 일치하도록 조정되었습니다.
디곡신
정상 상태에서 VICTOZA 투여 7시간 후에 디곡신 1mg 단회 용량을 투여했습니다. VICTOZA와의 동시 투여는 디곡신 AUC를 16% 감소시켰습니다. Cmax는 31% 감소했습니다. 디곡신 중앙값 최대 농도 시간(Tmax)은 1시간에서 1.5시간으로 지연되었습니다.
리시노프릴
정상 상태에서 VICTOZA 투여 5분 후에 리시노프릴 20mg 단회 용량을 투여했습니다. VICTOZA와의 동시 투여는 리시노프릴 AUC를 15% 감소시켰습니다. Cmax는 27% 감소했습니다. 리시노프릴 중앙값 Tmax는 VICTOZA와 함께 6시간에서 8시간으로 지연되었습니다.
아토르바스타틴
정상 상태에서 VICTOZA 투여 5시간 후에 아토르바스타틴 40mg 단회 용량을 투여한 후 VICTOZA는 아토르바스타틴의 전반적인 노출(AUC)을 변화시키지 않았습니다. 아토르바스타틴 Cmax는 38% 감소했고 중앙값 Tmax는 VICTOZA와 함께 1시간에서 3시간으로 지연되었습니다.
아세트아미노펜
정상 상태에서 VICTOZA 투여 8시간 후에 아세트아미노펜 1000mg 단회 용량을 투여한 후 VICTOZA는 아세트아미노펜의 전반적인 노출(AUC)을 변화시키지 않았습니다. 아세트아미노펜 Cmax는 31% 감소했고 중앙값 Tmax는 최대 15분 지연되었습니다.
그리세오풀빈
정상 상태에서 VICTOZA와 함께 그리세오풀빈 500mg 단회 용량을 동시 투여한 후 VICTOZA는 그리세오풀빈의 전반적인 노출(AUC)을 변화시키지 않았습니다. 그리세오풀빈 Cmax는 37% 증가했지만 중앙값 Tmax는 변화하지 않았습니다.
경구 피임약
0.03mg 에티닐에스트라디올과 0.15mg 레보노르게스트렐을 함유한 경구 피임약 복합 제제의 단회 용량을 음식 섭취 후 정상 상태에서 VICTOZA 투여 7시간 후에 투여했습니다. VICTOZA는 에티닐에스트라디올과 레보노르게스트렐 Cmax를 각각 12%와 13% 낮췄습니다. VICTOZA는 에티닐에스트라디올의 전반적인 노출(AUC)에 영향을 미치지 않았습니다. VICTOZA는 레보노르게스트렐 AUC0-∞를 18% 증가시켰습니다. VICTOZA는 에티닐에스트라디올과 레보노르게스트렐 모두의 Tmax를 1.5시간 지연시켰습니다.
인슐린 데테미르
2형 당뇨병 환자에게 인슐린 데테미르 0.5 Unit/kg(단회 투여)과 VICTOZA 1.8mg(정상 상태)을 별도로 피하 주사했을 때 VICTOZA와 인슐린 데테미르 사이에 약동학적 상호작용은 관찰되지 않았습니다.
12.6 면역원성
관찰된 항체 생성율은 검사의 민감도와 특이도에 크게 의존합니다. 검사 방법의 차이로 인해 아래에 설명된 연구에서의 항체 생성율을 VICTOZA 또는 기타 리라글루티드 제품을 포함한 다른 연구의 항체 생성율과 의미 있게 비교할 수 없습니다.
26주 이상 지속된 5건의 성인 이중맹검 임상 시험에서 VICTOZA 치료 환자의 하위 집단(2501명 중 1104명, 44%)을 대상으로 치료 종료 시점에 항-리라글루티드 항체의 존재 여부를 검사했습니다 [임상 연구 (14.1)] . VICTOZA 치료 환자 1104명 중 102명(9%)이 항-리라글루티드 항체를 생성했습니다. 이들 102명의 VICTOZA 치료 환자 중 56명(5%)이 천연 GLP-1과 교차 반응하는 항체를 생성했습니다. 이러한 교차 반응 항체는 천연 GLP-1에 대한 중화 효과에 대해 검사되지 않았으므로 천연 GLP-1의 임상적으로 유의미한 중화 가능성은 평가되지 않았습니다. 시험관내 검사에서 리라글루티드에 대한 중화 효과를 나타내는 항체는 VICTOZA 치료 환자 12명(1%)에서 발생했습니다. 항-리라글루티드 항체는 VICTOZA의 효과에 임상적으로 유의미한 영향을 미치지 않았습니다.
VICTOZA를 사용한 5건의 이중맹검 성인 혈당 조절 임상 시험에서 면역원성과 관련이 있을 가능성이 있는(예: 두드러기, 안젤오에데마) 복합적인 이상 사례는 VICTOZA 치료 환자의 0.8%, 비교군 치료 환자의 0.4%에서 발생했습니다. 두드러기는 VICTOZA 치료 환자의 이러한 복합적인 사례의 약 절반을 차지했습니다. 항-리라글루티드 항체를 생성한 환자는 항-리라글루티드 항체를 생성하지 않은 환자보다 면역원성 사례 복합체의 사례가 발생할 가능성이 더 높지 않았습니다.
LEADER 시험 [임상 연구 (14.3)]에서 항체 측정을 실시한 1247명의 성인 VICTOZA 치료 환자 중 11명(0.9%)에서 항-리라글루티드 항체가 검출되었습니다. 항-리라글루티드 항체를 생성한 11명의 성인 VICTOZA 치료 환자 중 리라글루티드에 대한 중화 항체가 발생한 환자는 없었으며, 5명의 환자(0.4%)가 천연 GLP-1에 대한 교차 반응 항체를 생성했습니다.
10세 이상 소아 환자를 대상으로 한 임상 시험 [임상 연구 (14.2)], 에서 26주차에 VICTOZA 치료 환자 1명(2%), 53주차에 5명(9%)에서 항-리라글루티드 항체가 검출되었습니다. 5명 중 어느 누구도 천연 GLP-1과 교차 반응하는 항체를 가지고 있거나 중화 항체를 가지고 있지 않았습니다.
13 비임상 독성학
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
104주간의 발암성 연구가 수컷 및 암컷 CD-1 마우스에서 리라글루티드 0.03, 0.2, 1.0, 3.0 mg/kg/day 용량으로 피하 주사로 실시되었으며, 1.8 mg/day의 최대 권장 용량에서 혈장 AUC 비교를 기준으로 각각 인체 노출량의 0.2배, 2배, 10배, 45배에 해당하는 전신 노출을 나타냈습니다. 1.0 및 3.0 mg/kg/day 투여군에서 양성 갑상선 C-세포 선종의 용량 의존적 증가가 관찰되었으며, 발생률은 수컷에서 각각 13% 및 19%, 암컷에서 각각 6% 및 20%였습니다. C-세포 선종은 대조군 또는 0.03 및 0.2 mg/kg/day 투여군에서는 발생하지 않았습니다. 치료 관련 악성 C-세포 암종은 3.0 mg/kg/day 투여군 암컷의 3%에서 발생했습니다. 갑상선 C-세포 종양은 마우스의 발암성 시험에서 드물게 발견되는 소견입니다. 약물 주사에 사용된 신체 표면인 등 피부와 피하에서 섬유육종의 치료 관련 증가가 3 mg/kg/day 투여군 수컷에서 관찰되었습니다. 이러한 섬유육종은 주사 부위 근처의 높은 국소 약물 농도 때문인 것으로 여겨집니다. 임상 제형의 리라글루티드 농도(6 mg/mL)는 발암성 연구에서 마우스에게 3 mg/kg/day 리라글루티드를 투여하는 데 사용된 제형의 농도(0.6 mg/mL)보다 10배 높습니다.
104주간의 발암성 연구가 수컷 및 암컷 Sprague Dawley 랫트에서 리라글루티드 0.075, 0.25, 0.75 mg/kg/day 용량으로 피하 주사로 실시되었으며, 혈장 AUC 비교를 기준으로 최대 권장 용량에서 각각 인체 노출량의 0.5배, 2배, 8배에 해당하는 노출을 나타냈습니다. 양성 갑상선 C-세포 선종의 치료 관련 증가가 0.25 및 0.75 mg/kg/day 리라글루티드 투여군 수컷에서 각각 12%, 16%, 42%, 46%의 발생률로 관찰되었으며, 모든 암컷 리라글루티드 투여군에서 0(대조군), 0.075, 0.25, 0.75 mg/kg/day 투여군에서 각각 10%, 27%, 33%, 56%의 발생률로 관찰되었습니다. 악성 갑상선 C-세포 암종의 치료 관련 증가가 모든 수컷 리라글루티드 투여군에서 0(대조군), 0.075, 0.25, 0.75 mg/kg/day 투여군에서 각각 2%, 8%, 6%, 14%의 발생률로 관찰되었으며, 0.25 및 0.75 mg/kg/day 투여군 암컷에서 0(대조군), 0.075, 0.25, 0.75 mg/kg/day 투여군에서 각각 0%, 0%, 4%, 6%의 발생률로 관찰되었습니다. 갑상선 C-세포 암종은 랫트의 발암성 시험에서 드물게 발견되는 소견입니다.
마우스 연구에서 리라글루티드 유발 C-세포 증식은 GLP-1 수용체에 의존적이며, 리라글루티드는 갑상선 C-세포에서 RET(Rearranged during Transfection) 원종양유전자의 활성화를 유발하지 않는다는 것이 입증되었습니다.
마우스 및 랫트에서 갑상선 C-세포 종양의 인체 관련성은 알려져 있지 않으며, 임상 연구 또는 비임상 연구에 의해 확인되지 않았습니다[see Boxed Warning and Warnings and Precautions (5.1)].
리라글루티드는 돌연변이 유발성에 대한 에임즈 검사와 파손성에 대한 인간 말초 혈액 림프구 염색체 이상 검사에서 대사 활성화 유무에 관계없이 음성이었습니다. 리라글루티드는 랫트에서 반복 투여 in vivo 소핵 시험에서 음성이었습니다.
리라글루티드 0.1, 0.25, 1.0 mg/kg/day의 피하 용량을 사용한 랫트 생식력 연구에서 수컷은 교배 전 4주 동안 및 교배 기간 동안, 암컷은 교배 전 2주 동안 및 임신 17일까지 교배 기간 동안 치료를 받았습니다. 혈장 AUC를 기준으로 최대 권장 용량에서 인체 노출량의 11배에 해당하는 높은 용량인 1.0 mg/kg/day까지의 용량에서 수컷 생식력에 대한 직접적인 부작용은 관찰되지 않았습니다. 암컷 랫트에서는 1.0 mg/kg/day에서 초기 배아 사망이 증가했습니다. 1.0 mg/kg/day 용량의 암컷에서 체중 증가 감소 및 음식 섭취 감소가 관찰되었습니다.
14 임상 연구
14.1 2형 당뇨병 성인의 혈당 조절 시험
성인 대상 혈당 조절 시험에서 VICTOZA는 단독 요법 및 하나 또는 두 가지 경구용 항당뇨병 약물 또는 기저 인슐린과 병용하여 연구되었습니다. VICTOZA는 심혈관계 결과 시험(LEADER 시험)에서도 연구되었습니다.
위약 대조 시험에서 VICTOZA 치료는 위약과 비교하여 헤모글로빈 A1c 및 공복 혈장 포도당(FPG)을 임상적으로 그리고 통계적으로 유의하게 개선했습니다.
모든 VICTOZA 치료 환자는 0.6mg/일로 시작했습니다. 이러한 고용량에 무작위 배정된 환자의 경우 0.6mg씩 매주 증량하여 1.2mg 또는 1.8mg에 도달했습니다. VICTOZA 0.6mg은 혈당 조절에 효과적이지 않으며 위장관 내약성을 줄이기 위한 시작 용량으로만 사용됩니다 [용법 및 용량 (2)].
단독 요법
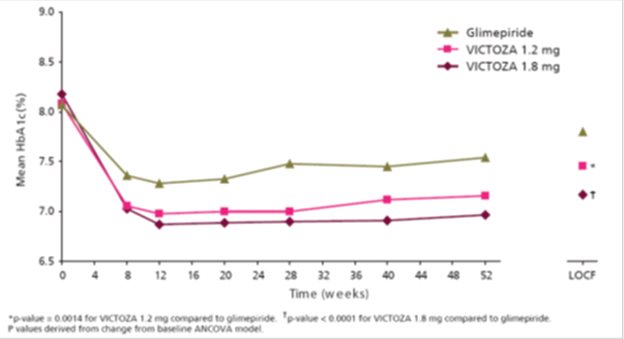
이 52주 시험에서 2형 당뇨병 성인 환자 746명을 VICTOZA 1.2mg, VICTOZA 1.8mg 또는 글리메피리드 8mg에 무작위 배정했습니다. 글리메피리드에 무작위 배정된 환자는 처음 2주 동안 1일 2mg으로 치료를 시작하여 2주 후 1일 4mg으로 증량하고, 마지막으로 1일 8mg으로 증량했습니다. VICTOZA 1.8mg 및 1.2mg 치료는 글리메피리드와 비교하여 HbA1c를 통계적으로 유의하게 감소시켰습니다(표 3). 비효과적인 치료로 인해 중단한 환자의 비율은 VICTOZA 1.8mg 치료군에서 3.6%, VICTOZA 1.2mg 치료군에서 6.0%, 글리메피리드 치료군에서 10.1%였습니다.
참가자의 평균 연령은 53세였으며 당뇨병의 평균 지속 기간은 5년이었습니다. 참가자 중 49.7%가 남성이었고, 77.5%가 백인, 12.6%가 흑인 또는 아프리카계 미국인, 35.0%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 33.1kg/m2였습니다.
표 3 2형 당뇨병 성인의 52주 단독 요법 시험 결과a
|
VICTOZA 1.8 mg |
VICTOZA 1.2 mg |
|
||
|
치료 의도 집단 (N) |
246 |
251 |
|
|
|
HbA1c (%) (평균) |
||||
|
기준 |
8.2 |
8.2 |
|
|
|
기준치 변화 (조정 평균) b |
-1.1 |
-0.8 |
|
|
|
글리메피리드군과의 차이 (조정 평균) b |
-0.6** |
-0.3* |
||
|
95% 신뢰 구간 |
(-0.8, -0.4) |
(-0.5, -0.1) |
||
|
HbA1c <7% 달성 환자 비율 |
51 |
43 |
|
|
|
공복 혈장 포도당 (mg/dL) (평균) |
||||
|
기준 |
172 |
168 |
|
|
|
기준치 변화 (조정 평균) b |
-26 |
-15 |
|
|
|
글리메피리드군과의 차이 (조정 평균) b |
-20** |
-10* |
|
|
95% 신뢰구간 |
(-29, -12) |
(-19, -1) |
|
|
체중 (kg) (평균) |
|||
|
기준치 |
92.6 |
92.1 |
|
|
기준치로부터의 변화 (조정 평균) b |
-2.5 |
-2.1 |
|
|
글리메피리드군과의 차이 (조정 평균) b |
-3.6** |
-3.2** |
|
|
95% 신뢰구간 |
(-4.3, -2.9) |
(-3.9, -2.5) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
*p-값 <0.05
**p-값 <0.0001
그림 3 52주 시험을 완료한 2형 당뇨병 성인 환자의 평균 HbA1c 및 52주차 마지막 관찰치 전달(LOCF, 치료 의도) 데이터(단독 요법)
병용 요법
메트포르민 추가
이 26주 시험에서, 2형 당뇨병 성인 환자 1,091명을 메트포르민 추가 요법으로서 VICTOZA 0.6mg, VICTOZA 1.2mg, VICTOZA 1.8mg, 플라시보 또는 글리메피리드 4mg(미국에서 승인된 최대 용량의 절반)군으로 무작위 배정했습니다. 무작위 배정은 3주간의 초기 강제 메트포르민 적정 기간과 그 후 3주간의 유지 기간으로 구성된 6주간의 투약 전 기간 후에 이루어졌습니다. 적정 기간 동안 메트포르민 용량은 1일 최대 2000mg까지 증가했습니다. 메트포르민 추가 요법으로서 VICTOZA 1.2mg 및 1.8mg은 플라시보 추가 요법에 비해 유의미한 평균 HbA1c 감소를 가져왔으며, 메트포르민 추가 요법으로서 글리메피리드 4mg에 비해 유사한 평균 HbA1c 감소를 가져왔습니다(표 4). 치료 효과 없음으로 인해 투약을 중단한 환자의 비율은 VICTOZA 1.8mg + 메트포르민 치료군에서 5.4%, VICTOZA 1.2mg + 메트포르민 치료군에서 3.3%, 플라시보 + 메트포르민 치료군에서 23.8%, 글리메피리드 + 메트포르민 치료군에서 3.7%였습니다.
참가자의 평균 연령은 57세였으며, 당뇨병의 평균 지속 기간은 7년이었습니다. 참가자 중 58.2%가 남성이었고, 87.1%가 백인이었으며, 2.4%가 흑인 또는 아프리카계 미국인이었습니다. 평균 BMI는 31.0 kg/m2였습니다.
표 4 2형 당뇨병 성인에서 메트포르민 추가 요법으로서 VICTOZA의 26주 시험 결과a
|
VICTOZA 1.8mg + 메트포르민 |
VICTOZA 1.2mg + 메트포르민 |
|
글리메피리드 4mg† +
|
|
|
치료 의도 집단 (N) |
242 |
240 |
|
|
|
HbA1c (%) (평균) |
||||
|
기준치 |
8.4 |
8.3 |
|
|
|
기준치 변화 (조정 평균)b |
-1.0 |
-1.0 |
|
|
|
플라시보 + 메트포르민군과의 차이 (조정 평균)b |
-1.1** |
-1.1** |
||
|
95% 신뢰 구간 |
(-1.3, -0.9) |
(-1.3, -0.9) |
||
|
글리메피리드 + 메트포르민군과의 차이 (조정 평균)b |
0.0 |
0.0 |
||
|
95% 신뢰 구간 |
(-0.2, 0.2) |
(-0.2, 0.2) |
||
|
HbA1c <7% 달성 환자 비율 |
42 |
35 |
|
|
|
공복 혈당 (mg/dL) (평균) |
||||
|
기준치 |
181 |
179 |
|
|
|
기준치 변화 (조정 평균) b |
-30 |
-30 |
|
|
|
플라시보 + 메트포르민 그룹과의 차이 (조정 평균) b |
-38** |
-37** |
||
|
95% 신뢰 구간 |
(-48, -27) |
(-47, -26) |
||
|
글리메피리드 + 메트포르민 그룹과의 차이 (조정 평균) b |
-7 |
-6 |
||
|
95% 신뢰 구간 |
(-16, 2) |
(-15, 3) |
||
|
체중 (kg) (평균) |
||||
|
기준치 |
88.0 |
88.5 |
|
|
|
기준치 변화 (조정 평균) b |
-2.8 |
-2.6 |
|
|
|
플라시보 + 메트포르민 그룹과의 차이 (조정 평균) b 95% 신뢰 구간 |
-1.3* (-2.2, -0.4) |
-1.1* (-2.0, -0.2) |
||
|
글리메피리드 + 메트포르민 그룹과의 차이 (조정 평균) b |
-3.8** |
-3.5** |
||
|
95% 신뢰 구간 |
(-4.5, -3.0) |
(-4.3, -2.8) |
||
|
a최종 관찰 연구를 사용한 치료 의도 집단 b기준값에 대해 조정된 최소 제곱 평균 † 글리메피리드의 경우, 미국에서 승인된 최대 용량의 절반. *p-값 <0.05 **p-값 <0.0001 |
||||
메트포르민 병용 요법으로 시타글립틴과 비교한 VICTOZA
이 26주 동안 진행된 공개 표지 임상 시험에서, 메트포르민 1,500mg/일 이상을 복용 중인 2형 당뇨병 성인 환자 665명을 승인된 라벨링에 따라 VICTOZA 1.2mg 1일 1회, VICTOZA 1.8mg 1일 1회 또는 시타글립틴 100mg 1일 1회 투여군으로 무작위 배정했습니다. 환자들은 시험 전 안정적인 용량과 투여 빈도로 메트포르민 치료를 계속했습니다.
참가자의 평균 연령은 56세였으며, 당뇨병 평균 지속 기간은 6년이었습니다. 참가자 중 52.9%가 남성이었고, 86.6%가 백인, 7.2%가 흑인 또는 아프리카계 미국인, 16.2%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 32.8 kg/m2였습니다.
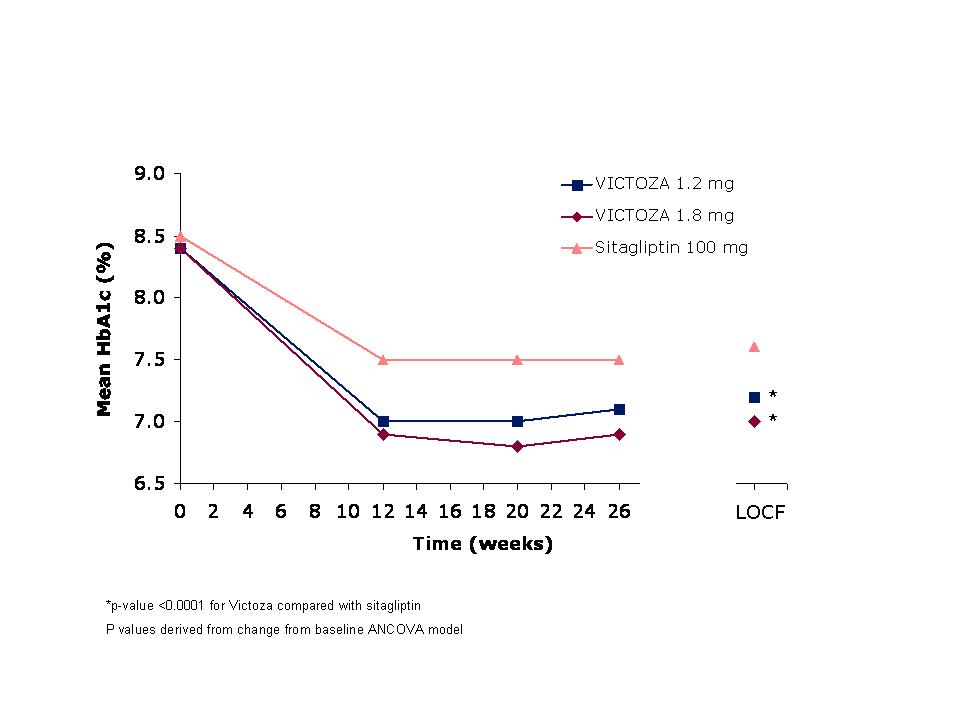
주요 평가 지표는 26주차 기준선부터의 HbA1c 변화였습니다. VICTOZA 1.2mg 및 VICTOZA 1.8mg 치료는 시타글립틴 100mg에 비해 HbA1c를 통계적으로 유의하게 감소시켰습니다(표 5). 치료 효과 부족으로 인해 치료를 중단한 환자의 비율은 VICTOZA 1.2mg 군에서 3.1%, VICTOZA 1.8mg 투여군에서 0.5%, 시타글립틴 100mg 투여군에서 4.1%였습니다. 평균 기준 체중 94kg에서 VICTOZA 1.2mg은 2.7kg, VICTOZA 1.8mg은 3.3kg, 시타글립틴 100mg은 0.8kg 감소했습니다.
표 5 2형 당뇨병 성인에서 메트포르민 병용 시타글립틴과 비교한 VICTOZA의 26주 공개 표지 임상 시험 결과a
|
VICTOZA 1.8 mg + 메트포르민 |
VICTOZA 1.2 mg + 메트포르민 |
시타글립틴 100 mg + 메트포르민 |
|
|
치료 의도 집단 (N) |
218 |
221 |
|
|
HbA1c (%) (평균) |
|||
|
기준선 |
8.4 |
8.4 |
|
|
기준선 대비 변화 (조정 평균) |
-1.5 |
-1.2 |
|
|
시타글립틴 투여군과의 차이 (조정 평균) b 95% 신뢰 구간 |
-0.6** (-0.8, -0.4) |
-0.3** (-0.5, -0.2) |
|
|
HbA1c <7% 달성 환자 비율 |
56 |
44 |
|
|
공복 혈당 (mg/dL) (평균) |
|||
|
기준선 |
179 |
182 |
|
|
기준선 대비 변화 (조정 평균) |
-39 |
-34 |
|
|
시타글립틴 투여군과의 차이 (조정 평균) b 95% 신뢰 구간 |
-24** (-31, -16) |
-19** (-26, -12) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
**p-값 <0.0001
그림 4 26주 시험을 완료한 2형 당뇨병 성인 환자 및 26주차 최종 관찰치 전향(LOCF, 치료 의도) 데이터에 대한 평균 HbA1c
메트포르민 및 인슐린 병용 요법
이 26주 공개 표지 시험에는 메트포르민 단독 요법(≥1,500 mg/일)으로 부적절한 혈당 조절(HbA1c 7-10%)을 보이는 2형 당뇨병 성인 환자 또는 메트포르민(≥1500 mg/일)과 설폰요소제로 부적절한 혈당 조절(HbA1c 7-8.5%)을 보이는 2형 당뇨병 성인 환자 988명이 등록되었습니다. 메트포르민과 설폰요소제를 복용하던 환자는 설폰요소제 복용을 중단했으며, 모든 환자는 1일 1회 1.8mg까지 적정하는 VICTOZA 추가 요법을 받는 12주 유도 기간에 들어갔습니다. 유도 기간 종료 시, 498명(50%)의 환자가 VICTOZA 1.8mg와 메트포르민으로 HbA1c <7%를 달성하여 비무작위 관찰군에서 치료를 계속했습니다. 또 다른 167명(17%)의 환자가 유도 기간 중 시험에서 탈락했으며, 이 중 약 절반은 위장관계 이상 반응으로 인해 탈락했습니다 [이상 반응(6.1)]. 유도 기간에 들어간 환자 중 HbA1c ≥7%인 나머지 323명(33%)은 저녁에 추가 요법으로 1일 1회 인슐린 데테미르를 26주 동안 투여받는 군(N=162) 또는 VICTOZA 1.8mg와 메트포르민으로 변경되지 않은 치료를 계속하는 군(N=161)에 무작위 배정되었습니다. 인슐린 데테미르의 시작 용량은 1일 10단위였으며, 26주 무작위 기간 말의 평균 용량은 1일 39단위였습니다. 26주 무작위 치료 기간 동안, 비효과적인 치료로 인해 중단한 환자의 비율은 VICTOZA 1.8mg와 메트포르민으로 치료를 계속한 군에서는 11.2%, 인슐린 데테미르 추가 요법 군에서는 1.2%였습니다.
참가자의 평균 연령은 57세였으며, 당뇨병의 평균 지속 기간은 8년이었습니다. 참가자 중 55.7%가 남성이었고, 91.3%가 백인, 5.6%가 흑인 또는 아프리카계 미국인, 12.5%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 34.0 kg/m2였습니다.
VICTOZA 1.8mg + 메트포르민에 추가하여 인슐린 데테미르로 치료하면 VICTOZA 1.8mg + 메트포르민 단독으로 변경되지 않은 치료를 계속하는 것에 비해 HbA1c 및 FPG가 통계적으로 유의하게 감소했습니다(표 6). 무작위 배정 후 평균 기준 체중 96kg에서 인슐린 데테미르 추가 요법을 받은 환자의 평균 감소량은 0.3kg이었고, VICTOZA 1.8mg + 메트포르민 단독으로 변경되지 않은 치료를 계속한 환자의 평균 감소량은 1.1kg이었습니다.
표 6 12주간 메트포르민과 VICTOZA 치료 후 HbA1c < 7%를 달성하지 못한 2형 당뇨병 성인 환자에서 VICTOZA + 메트포르민에 추가한 인슐린 데테미르의 26주 공개 표지 시험 결과(VICTOZA + 메트포르민 단독 치료와 비교)a
|
인슐린 데테미르 + VICTOZA + 메트포르민 |
VICTOZA + 메트포르민 |
|||
|
치료 의도 집단 (N) |
162 |
157 |
||
|
HbA1c (%) (평균) |
||||
|
기준(0주) |
7.6 |
7.6 |
||
|
기준치와의 변화 (조정 평균) |
-0.5 |
0 |
||
|
-0.5** |
|||
|
(-0.7, -0.4) |
|||
|
HbA1c <7%를 달성한 환자의 비율 |
43 |
17 |
||
|
공복 혈당 (mg/dL) (평균) |
||||
|
기준(0주) |
166 |
159 |
||
|
기준치 변화 (조정된 평균) |
-39 |
-7 |
|
-31** |
|
|
(-39, -23) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
**p-값 <0.0001
Sulfonylurea 추가
이 26주 시험에서, 2형 당뇨병 성인 환자 1,041명이 glimepiride 추가 요법으로 VICTOZA 0.6mg, VICTOZA 1.2mg, VICTOZA 1.8mg, 위약 또는 rosiglitazone 4mg (미국에서 승인된 최대 용량의 절반) 중 하나에 무작위 배정되었습니다. 무작위 배정은 초기 2주간의 강제 glimepiride 적정 기간과 그 후 2주간의 유지 기간으로 구성된 4주간의 투약 기간 후에 이루어졌습니다. 적정 기간 동안 glimepiride 용량은 1일 4mg으로 증가되었습니다. 무작위 배정 후, 용납할 수 없는 저혈당증이나 기타 이상 반응이 발생하는 경우, 연구자의 재량에 따라 glimepiride 용량을 1일 4mg에서 3mg 또는 2mg(최소)으로 감소시킬 수 있었습니다.
참가자의 평균 연령은 56세였으며 당뇨병의 평균 지속 기간은 8년이었습니다. 참가자 중 49.4%가 남성이었고, 64.4%가 백인이었으며, 2.8%가 흑인 또는 아프리카계 미국인이었습니다. 평균 BMI는 29.9 kg/m2였습니다.
gimepiride 추가 요법으로 VICTOZA 1.2mg 및 1.8mg으로 치료한 결과, glimepiride 추가 위약에 비해 평균 HbA1c가 통계적으로 유의하게 감소했습니다 (표 7). 치료 효과가 없어서 투약을 중단한 환자의 비율은 VICTOZA 1.8mg + glimepiride 치료군에서 3.0%, VICTOZA 1.2mg + glimepiride 치료군에서 3.5%, 위약 + glimepiride 치료군에서 17.5%, rosiglitazone + glimepiride 치료군에서 6.9%였습니다.
표 7 2형 당뇨병 성인 환자에서 Sulfonylurea 추가 요법으로 VICTOZA를 투여한 26주 시험 결과a
|
VICTOZA 1.8 mg + Glimepiride |
VICTOZA 1.2 mg + Glimepiride |
|
|
|
|
치료 의도 집단 (N) |
234 |
228 |
|
|
|
HbA1c (%) (평균) |
||||
|
8.5 |
8.5 |
|
|
|
-1.1 |
-1.1 |
|
|
|
-1.4** |
-1.3** |
||
|
(-1.6, -1.1) |
(-1.5, -1.1) |
||
|
HbA1c <7% 달성 환자 비율 |
42 |
35 |
|
|
|
공복 혈당 (mg/dL) (평균) |
||||
|
174 |
177 |
|
|
|
-29 |
-28 |
|
|
|
-47** |
-46** |
||
|
(-58, -35) |
(-58, -35) |
||
|
||||
|
83.0 |
80.0 |
|
|
|
-0.2 |
+0.3 |
|
|
|
-0.1 |
0.4 |
||
|
(-0.9, 0.6) |
(-0.4, 1.2) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
† 로시글리타존의 경우, 미국에서 승인된 최대 용량의 절반.
**p-값 <0.0001
메트포르민 및 설폰요소제 병용 요법
이 26주 시험에서, 2형 당뇨병 성인 환자 581명을 메트포르민과 글리메피리드 병용 요법에 추가하여 VICTOZA 1.8mg, 플라시보 또는 인슐린 글라르진 투여군으로 무작위 배정했습니다. 무작위 배정은 3주간의 강제 메트포르민 및 글리메피리드 적정 기간과 그 후 3주간의 유지 기간으로 구성된 6주간의 투여 전 기간 후에 이루어졌습니다. 적정 기간 동안 메트포르민과 글리메피리드의 용량은 각각 최대 2,000mg/일 및 4mg/일까지 증가되었습니다. 무작위 배정 후, VICTOZA 1.8mg 투여군 환자는 2주간의 VICTOZA 적정 기간을 거쳤습니다. 시험 기간 동안 VICTOZA 및 메트포르민 용량은 고정되었지만, 글리메피리드 및 인슐린 글라르진 용량은 조정될 수 있었습니다. 환자들은 적정 당일 자가 측정 공복 혈장 포도당 수치에 따라 치료 첫 8주 동안 2주에 한 번씩 글라르진 용량을 적정했습니다. 8주 후, 인슐린 글라르진 적정 빈도는 연구자의 재량에 맡겼지만, 최소한 12주차와 18주차에 필요한 경우 글라르진 용량을 수정해야 했습니다. 글라르진 투여군 환자의 20%만이 사전에 지정된 목표 공복 혈장 포도당 수치 ≤100mg/dL에 도달했습니다. 따라서 대부분의 환자에서 인슐린 글라르진 용량의 최적 적정이 이루어지지 않았습니다.
참가자의 평균 연령은 58세였으며, 당뇨병의 평균 지속 기간은 9년이었습니다. 참가자 중 56.5%가 남성이었고, 75.0%가 백인이었으며, 3.6%가 흑인 또는 아프리카계 미국인이었습니다. 평균 BMI는 30.5kg/m2였습니다.
글리메피리드 및 메트포르민 병용 요법에 추가한 VICTOZA 치료는 플라시보를 글리메피리드 및 메트포르민에 추가한 경우와 비교하여 HbA1c에서 통계적으로 유의미한 평균 감소를 가져왔습니다(표 8). 치료 효과가 없어서 중단한 환자의 비율은 VICTOZA 1.8mg + 메트포르민 + 글리메피리드 치료군에서 0.9%, 인슐린 글라르진 + 메트포르민 + 글리메피리드 치료군에서 0.4%, 플라시보 + 메트포르민 + 글리메피리드 치료군에서 11.3%였습니다.
표 8 2형 당뇨병 성인 환자에서 메트포르민 및 설폰요소제 병용 요법에 추가한 VICTOZA의 26주 시험 결과a
|
VICTOZA 1.8mg + 메트포르민 + 글리메피리드 |
플라시보 + 메트포르민 + 글리메피리드 |
인슐린 글라르진† + 메트포르민 + 글리메피리드 |
|
|
치료 의도 집단 (N) |
230 |
114 |
|
|
HbA1c (%) (평균) |
|||
|
기준값 |
8.3 |
8.3 |
|
|
기준값으로부터의 변화 (조정 평균) b |
-1.3 |
-0.2 |
|
|
-1.1** |
||
|
(-1.3, -0.9) |
||
|
HbA1c <7% 달성 환자 비율 |
53 |
15 |
|
|
공복 혈장 포도당 (mg/dL) (평균) |
|||
|
기준값 |
165 |
170 |
|
|
기준치 변화 (조정 평균) b |
-28 |
+10 |
|
|
-38** |
||
|
(-46, -30) |
||
|
체중 (kg) (평균) |
|||
|
기준치 |
85.8 |
85.4 |
|
|
기준치 변화 (조정 평균) b |
-1.8 |
-0.4 |
|
|
-1.4* |
||
|
(-2.1, -0.7) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
† 인슐린 글라르긴의 경우, 환자의 80%에서 최적 적정 요법이 달성되지 않았습니다.
*p-값 <0.05
**p-값 <0.0001
메트포르민 및/또는 설폰닐우레아 병용 요법에 추가된 엑세나타이드와 비교한 VICTOZA
이 26주 동안의 공개 표지 시험에서, 메트포르민 단독 요법, 설폰닐우레아 단독 요법 또는 메트포르민과 설폰닐우레아 병용 요법을 배경으로 하는 2형 당뇨병 성인 환자 464명을 1일 1회 VICTOZA 1.8mg 또는 1일 2회 엑세나타이드 10mcg에 무작위 배정했습니다. 시험 기간 동안 배경 요법의 최대 내약 용량은 변경되지 않았습니다. 엑세나타이드에 무작위 배정된 환자는 4주 동안 1일 2회 5mcg 용량으로 시작한 후 1일 2회 10mcg로 증량했습니다.
참가자의 평균 연령은 57세였으며 당뇨병의 평균 지속 기간은 8년이었습니다. 참가자 중 51.9%가 남성이었고, 91.8%가 백인, 5.4%가 흑인 또는 아프리카계 미국인, 12.3%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 32.9 kg/m2였습니다.
VICTOZA 1.8mg으로 치료한 결과, 엑세나타이드에 비해 HbA1c와 FPG가 통계적으로 유의하게 감소했습니다(표 9). VICTOZA 치료군에서 치료 효과가 없어 중단한 환자의 비율은 0.4%였고, 엑세나타이드 치료군에서는 0%였습니다. 두 치료군 모두 체중이 기준치에서 약 3kg 감소했습니다.
표 9 2형 당뇨병 성인 환자에서 메트포르민 및/또는 설폰닐우레아와 병용한 VICTOZA 대 엑세나타이드의 26주 공개 표지 시험 결과a
|
VICTOZA 1.8mg 1일 1회 + 메트포르민 및/또는 설폰닐우레아 |
엑세나타이드 10mcg 1일 2회 + 메트포르민 및/또는 설폰닐우레아 |
|
|
치료 의도 집단 (N) |
233 |
231 |
|
HbA1c (%) (평균) |
||
|
기준치 |
8.2 |
8.1 |
|
기준치로부터의 변화 (조정된 평균) b |
-1.1 |
-0.8 |
|
엑세나타이드군과의 차이 (조정된 평균) b 95% 신뢰 구간 |
-0.3** (-0.5, -0.2) |
|
|
HbA1c <7%를 달성한 환자의 비율 |
54 |
43 |
|
공복 혈당 (mg/dL) (평균) |
||
|
기준치 |
176 |
171 |
|
기준치로부터의 변화 (조정된 평균) b |
-29 |
-11 |
|
엑세나타이드군과의 차이 (조정된 평균) b 95% 신뢰 구간 |
-18** (-25, -12) |
a최종 관찰값을 가지고 분석한 ITT(Intent-to-treat) 모집단
b기준값에 대해 조정된 최소자승평균
**p-값 <0.0001
메트포르민 및 티아졸리딘디온 병용요법
이 26주 시험에서, 2형 당뇨병 성인 환자 533명을 로시글리타존(8mg)과 메트포르민(2,000mg) 병용요법에 추가하여 VICTOZA 1.2mg, VICTOZA 1.8mg 또는 위약 투여군으로 무작위 배정했습니다. 환자들은 로시글리타존(2주 이내에 4mg에서 8mg/일로 증량)과 메트포르민(500mg으로 시작하여 매주 500mg씩 증량하여 최종 용량 2,000mg/일)을 사용하여 9주간의 투여 기간(3주간의 강제 용량 증량 후 6주간의 용량 유지 단계)을 거쳤습니다. 로시글리타존 최종 용량(8mg/일)과 메트포르민 최종 용량(2000mg/일)을 잘 견디고 6주간의 용량 유지 단계를 완료한 환자만 시험에 무작위 배정될 자격이 있었습니다.
참가자의 평균 연령은 55세였으며 당뇨병의 평균 지속 기간은 9년이었습니다. 참가자 중 61.6%가 남성이었고, 84.2%가 백인, 10.2%가 흑인 또는 아프리카계 미국인, 16.4%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 33.9 kg/m2였습니다.
메트포르민과 로시글리타존 병용요법에 추가하여 VICTOZA를 투여한 경우, 메트포르민과 로시글리타존 병용요법에 위약을 추가한 경우와 비교하여 평균 HbA1c가 통계적으로 유의하게 감소했습니다(표 10). 치료 효과가 없어 투약을 중단한 환자의 비율은 VICTOZA 1.8mg + 메트포르민 + 로시글리타존 투여군에서 1.7%, VICTOZA 1.2mg + 메트포르민 + 로시글리타존 투여군에서 1.7%, 위약 + 메트포르민 + 로시글리타존 투여군에서 16.4%였습니다.
표 10 2형 당뇨병 성인 환자에서 메트포르민 및 티아졸리딘디온 병용요법에 추가한 VICTOZA의 26주 시험 결과a
|
VICTOZA 1.8 mg + 메트포르민 + 로시글리타존 |
VICTOZA 1.2 mg + 메트포르민 + 로시글리타존 |
위약 + 메트포르민 +
|
|
|
ITT 모집단 (N) |
178 |
177 |
|
|
HbA1c (%) (평균) |
|||
|
기준값 |
8.6 |
8.5 |
|
|
기준값으로부터의 변화 (조정된 평균) b |
-1.5 |
-1.5 |
|
|
-0.9** |
-0.9** |
|
|
(-1.1, -0.8) |
(-1.1, -0.8) |
|
|
HbA1c <7% 달성 환자 비율 |
54 |
57 |
|
|
공복 혈당 (mg/dL) (평균) |
|||
|
기준값 |
185 |
181 |
|
|
기준값으로부터의 변화 (조정된 평균) b |
-44 |
-40 |
|
|
-36** |
-32** |
|
|
(-44, -27) |
(-41, -23) |
|
|
체중 (kg) (평균) |
|||
|
기준치 |
94.9 |
95.3 |
|
|
기준치로부터의 변화 (조정 평균) b |
-2.0 |
-1.0 |
|
|
-2.6** |
-1.6** |
|
|
(-3.4, -1.8) |
(-2.4, -1.0) |
a연구의 마지막 관찰치를 사용한 치료 의도 집단
b기준값에 대해 조정된 최소자승 평균
**p-값 <0.0001
2형 당뇨병 환자 및 중등도 신장 장애 환자에서 메트포르민 및/또는 설폰닐우레아 및/또는 피오글리타존 및/또는 기저 또는 혼합 인슐린 유무에 관계없이 위약과 비교한 VICTOZA
2형 당뇨병 성인 환자를 대상으로 한 26주 이중맹검 무작위 위약 대조 병행군 시험에서 MDRD 공식(eGFR 30−59 mL/min/1.73 m2)에 따라 중등도 신장 장애가 있는 279명의 환자를 VICTOZA 또는 위약 1일 1회 투여군에 무작위 배정했습니다. VICTOZA는 환자의 시험 전 안정적인 항당뇨병 요법(인슐린 요법 및/또는 메트포르민, 피오글리타존 또는 설폰닐우레아)에 추가되었습니다. VICTOZA의 용량은 승인된 라벨링에 따라 1.8mg/일 용량에 도달하도록 증량되었습니다. 기준 HbA1c ≤ 8%인 환자의 경우 무작위 배정 시 인슐린 용량을 20% 감소시키고 리라글루티드 용량 증량이 완료될 때까지 고정했습니다. 저혈당증의 경우 인슐린 및 SU의 용량 감소가 허용되었으며, 인슐린의 용량 증량은 허용되었지만 시험 전 용량을 초과해서는 안 되었습니다.
참가자의 평균 연령은 67세였으며 당뇨병의 평균 지속 기간은 15년이었습니다. 참가자 중 50.5%가 남성이었고, 92.3%가 백인, 6.6%가 흑인 또는 아프리카계 미국인, 7.2%가 히스패닉 또는 라틴계였습니다. 평균 BMI는 33.9 kg/m2였습니다. 환자의 약 절반이 30~<45mL/min/1.73 m2 사이의 eGFR을 가졌습니다.
VICTOZA 치료는 26주차에 위약과 비교하여 기준치에서 HbA1c가 통계적으로 유의미하게 감소했습니다(표 11 참조). 123명의 환자가 1.8mg의 VICTOZA 용량에 도달했습니다.
표 11 2형 당뇨병 및 중등도 신장 장애 성인 환자에서 위약과 비교한 VICTOZA의 26주 시험 결과a
|
VICTOZA 1.8mg + 인슐린 및/또는 OAD |
위약 + 인슐린 및/또는 OAD |
|
|
치료 의도 집단 (N) |
140 |
137 |
|
HbA1c (%) |
||
|
기준(평균) |
8.1 |
8.0 |
|
기준치로부터의 변화 (추정 평균) b, c |
-0.9 |
-0.4 |
|
위약과의 차이b, c 95% 신뢰 구간 |
-0.6* (-0.8, -0.3) |
|
|
HbA1c < 7% 달성 비율 d |
39.3 |
19.7 |
|
FPG (mg/dL) |
||
|
기준(평균) |
171 |
167 |
|
기준치로부터의 변화 (추정 평균) e |
-22 |
-10 |
|
위약과의 차이e 95% 신뢰 구간 |
-12** (-23, -0.8) |
a ITT(Intent-to-treat) 모집단
b 반복 측정을 위한 혼합 모델을 사용하여 추정하였으며, 치료, 국가, 층화 그룹을 요인으로, 기준선을 공변량으로, 방문 내에 모두 중첩시켰습니다. 다중 대체법은 치료를 중단한 누락 데이터를 가진 환자에 대한 치료 효과의 “wash out”을 모델링했습니다.
c 26주 전에 조기에 치료를 중단한 비율은 VICTOZA군과 위약군에서 각각 25%와 22%였습니다.
d HbA1c < 7%를 달성한 대상자 수를 기준으로 합니다. 상기 b)에 설명된 다중 대체법을 적용할 경우, HbA1c < 7%를 달성한 추정 비율은 VICTOZA군과 위약군에서 각각 47.6%와 24.9%입니다.
e 반복 측정을 위한 혼합 모델을 사용하여 추정하였으며, 치료, 국가, 층화 그룹을 요인으로, 기준선을 공변량으로, 방문 내에 모두 중첩시켰습니다.
*p-값 <0.0001
**p-값 <0.05
14.2 10세 이상 2형 당뇨병 소아 환자의 혈당 조절 시험
VICTOZA는 10세 이상의 2형 당뇨병 소아 환자 134명을 대상으로 한 26주, 이중맹검, 무작위, 병행군, 위약 대조 다기관 시험(NCT01541215)에서 평가되었습니다. 환자들은 메트포르민 병용 또는 메트포르민과 기저 인슐린 병용 치료와 함께 1일 1회 VICTOZA 또는 1일 1회 위약 투여군으로 무작위 배정되었습니다. 모든 환자는 무작위 배정 전에 1000~2000mg의 메트포르민 용량을 복용했습니다. 기저 인슐린 용량은 무작위 배정 시 20% 감소되었으며, VICTOZA는 내약성 및 ≤110 mg/dL의 평균 공복 혈장 포도당 목표에 따라 2~3주 동안 0.6mg씩 매주 적정되었습니다.
평균 연령은 14.6세였습니다. 29.9%는 10~14세였고, 70.1%는 14세 이상이었습니다. 남성은 38.1%, 백인은 64.9%, 아시아인은 13.4%, 흑인 또는 아프리카계 미국인은 11.9%였으며, 히스패닉 또는 라틴계는 29.1%였습니다. 평균 BMI는 33.9 kg/m2였고, 평균 BMI SDS는 2.9였습니다. 기준선에서 18.7%의 환자가 기저 인슐린을 사용하고 있었습니다. 당뇨병의 평균 지속 기간은 1.9년이었고, 평균 HbA1c는 7.8%였습니다.
26주차에 VICTOZA 치료는 기준선 대비 HbA1c 감소에 있어 위약보다 우수했습니다. VICTOZA와 위약 간의 기준선 대비 HbA1c 감소량의 추정 치료 차이는 -1.06%였으며, 95% 신뢰 구간은 [-1.65%; -0.46%]였습니다(표 12 참조).
표 12 10세 이상 2형 당뇨병 소아 환자에서 메트포르민 병용 또는 메트포르민과 기저 인슐린 병용 치료와 함께 VICTOZA를 메트포르민 병용 또는 메트포르민과 기저 인슐린 병용 치료와 함께 위약과 비교한 시험의 26주차 결과
|
VICTOZA+메트포르민±기저 인슐린 |
위약+메트포르민±기저 인슐린 |
||
|
N |
66 |
68 |
|
|
HbA1c (%) |
|||
|
기준선 |
7.9 |
7.7 |
|
|
26주차 종료 시점 |
7.1 |
8.2 |
|
|
26주 후 기준선 대비 조정된 평균 변화량a |
-0.64 |
0.42 |
|
|
치료 차이 [95% CI] VICTOZA 대 위약 |
-1.06 [-1.65; -0.46]* |
||
|
HbA1c <7%를 달성한 환자 비율b |
63.7 |
36.5 |
|
|
FPG (mg/dL) |
|||
|
기준선 |
157 |
147 |
|
|
26주차 종료 시점 |
132 |
166 |
|
|
26주 후 기준치 대비 평균 변화량a |
-19.4 |
14.4 |
|
치료 효과 차이 [95% CI] 빅토자 대비 위약 |
-33.83 [-55.74 ; -11.92] |
|
a HbA1c 및 FPG의 기준치 대비 치료 종료 시점 변화는 다중 대체를 사용한 패턴 혼합 모델을 이용하여 분석되었습니다. 결측 관찰치(VICTOZA군 10.6%, 위약군 14.5%)는 다중(x10,000) 대체를 기반으로 위약군에서 대체되었습니다. 그런 다음 26주차 데이터는 치료, 성별 및 연령대를 고정 효과로, 기준값을 공변량으로 포함하는 ANCOVA 모델을 사용하여 분석되었습니다.
b 범주는 결측 관찰치에 대한 다중 대체를 사용한 패턴 혼합 모델을 이용하여 HbA1c의 연속 측정값에서 파생됩니다.
* p-값 <0.001
14.3 2형 당뇨병 및 죽상동맥경화성 심혈관 질환 성인 환자의 심혈관계 결과 시험
LEADER 시험(NCT01179048)은 다국가, 다기관, 위약 대조, 이중 맹검 시험이었습니다. 이 연구에서는 2형 당뇨병이 적절하게 조절되지 않고 죽상동맥경화성 심혈관 질환(CVD)이 있는 성인 환자 9,340명을 VICTOZA 1.8mg 또는 위약군에 무작위 배정하여 중앙값 3.5년 동안 치료했습니다. 이 연구는 2형 당뇨병에 대한 기본 표준 치료와 함께 추가적으로 병용 투여했을 때 VICTOZA와 위약 간의 주요 심혈관계 유해 사건의 위험을 비교했습니다. 주요 평가 지표인 주요 심장 사건(MACE)은 심혈관 사망, 치명적이지 않은 심근 경색 및 치명적이지 않은 뇌졸중을 포함하는 3가지 구성 요소의 복합 결과가 처음 발생할 때까지의 시간이었습니다.
시험에 참여할 수 있는 환자는 다음과 같습니다. 50세 이상이고 확립된 안정적인 심혈관 질환, 뇌혈관 질환, 말초 동맥 질환, 만성 신장 질환 또는 뉴욕 심장 협회(NYHA) II 및 III급 심부전(등록된 인구의 80%)이 있거나 60세 이상이고 심혈관 질환에 대한 기타 특정 위험 요인이 있는 경우(등록된 인구의 20%).
기준선에서 인구통계학적 특징과 질병 특징은 균형을 이루었습니다. 평균 연령은 64세였으며, 인구의 64.3%가 남성, 77.5%가 백인, 10.0%가 아시아인, 8.3%가 흑인 또는 아프리카계 미국인이었습니다. 연구에서 인구의 12.1%가 히스패닉 또는 라틴계 민족으로 확인되었습니다. 2형 당뇨병의 평균 지속 기간은 12.8년이었고, 평균 HbA1c는 8.7%였으며, 평균 BMI는 32.5 kg/m2였습니다. 무작위 배정된 사람들의 31%에서 이전 심근 경색의 병력이 보고되었고, 39%에서 이전 재관류술이 시행되었으며, 11%에서 이전 허혈성 뇌졸중이 있었고, 9%에서 증상이 있는 관상 동맥 질환이 확인되었고, 26%에서 증상이 없는 심장 허혈이 확인되었고, 14%에서 NYHA II~III급 심부전 진단을 받았습니다. 기준선에서 평균 eGFR은 79 mL/min/1.73 m2였으며, 환자의 41.8%가 경도 신장 장애(eGFR 60~90 mL/min/1.73m2), 20.7%가 중등도 신장 장애(eGFR 30~60 mL/min/1.73m2)를 보였고, 2.4%의 환자가 중증 신장 장애(eGFR < 30 mL/min/1.73m2)를 보였습니다.
기준선에서 환자들은 다음과 같은 방법으로 당뇨병을 치료했습니다. 식이요법과 운동만(3.9%), 경구 혈당 강하제만(51.5%), 경구 혈당 강하제와 인슐린(36.7%) 또는 인슐린만(7.9%). 기준선 및 시험에서 가장 일반적으로 사용된 기본 혈당 강하제는 메트포르민, 설폰요소제 및 인슐린이었습니다. DPP-4 억제제 및 기타 GLP-1 수용체 작용제는 프로토콜에 의해 제외되었으며, 소디움-글루코스 공동 수송체-2(SGLT-2) 억제제는 승인되지 않았거나 널리 사용되지 않았습니다. 기준선에서 심혈관 질환 및 위험 요인은 이뇨제가 아닌 항고혈압제(92.4%), 이뇨제(41.8%), 스타틴 요법(72.1%) 및 혈소판 응집 억제제(66.8%)로 관리되었습니다. 시험 기간 동안 연구자들은 혈당, 지질 및 혈압에 대한 지역 표준 치료 목표를 달성하고 지역 치료 지침에 따라 급성 관상 동맥 증후군 또는 뇌졸중 사건에서 회복 중인 환자를 관리하기 위해 당뇨병 및 심혈관계 약물을 수정할 수 있었습니다.
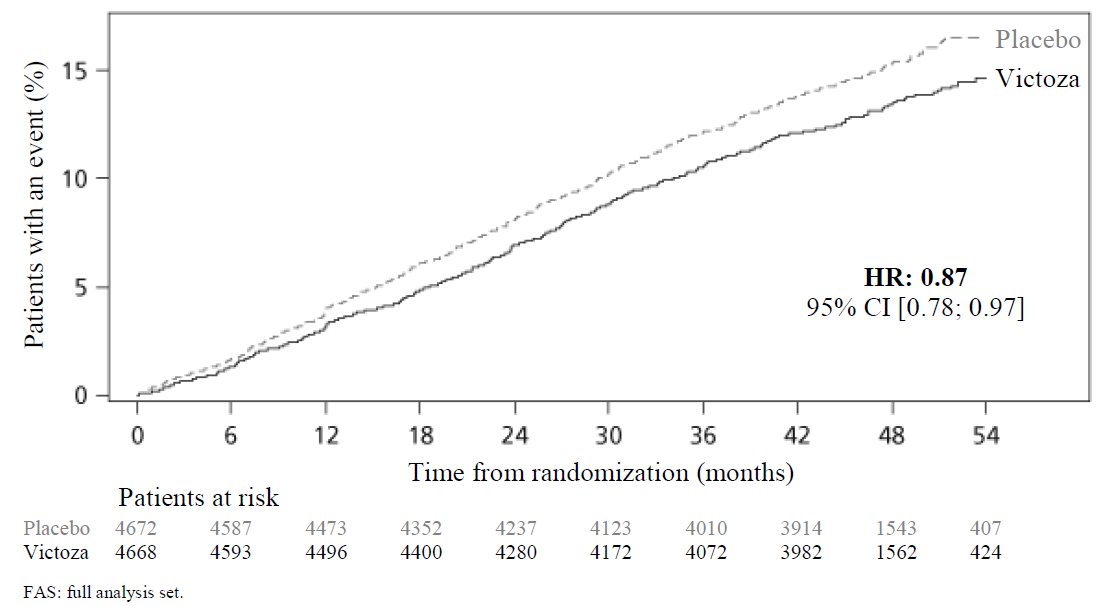
주요 분석을 위해 Cox 비례 위험 모델을 사용하여 MACE의 위험 비율에 대한 사전 지정된 위험 한계인 1.3에 대한 비열등성을 검정하고, 비열등성이 입증된 경우 MACE에 대한 우월성을 검정했습니다. 유형 1 오류는 여러 검정에서 제어되었습니다.
VICTOZA는 MACE의 발생을 유의하게 감소시켰습니다. 첫 번째 MACE 발생까지의 시간에 대한 추정 위험 비율(95% CI)은 0.87(0.78, 0.97)이었습니다. 그림 5와 표 13을 참조하십시오.
시험에서 피험자의 99.7%에 대해 생존 상태를 확인할 수 있었습니다. LEADER 시험 기간 동안 총 828명의 사망자가 기록되었습니다. 시험에서 대부분의 사망은 심혈관 사망으로 분류되었으며, 심혈관계가 아닌 사망은 치료군 간에 균형을 이루었습니다(VICTOZA로 치료받은 환자의 3.5%, 위약으로 치료받은 환자의 3.6%). VICTOZA와 위약을 비교한 모든 원인 사망까지의 시간에 대한 추정 위험 비율은 0.85(0.74, 0.97)이었습니다.
그림 5 Kaplan-Meier: LEADER 시험에서 MACE의 첫 발생까지의 시간(2형 당뇨병 및 죽상동맥경화성 CVD 환자)
표 13 LEADER 시험에서 주요 복합 평가 지표인 MACE 및 구성 요소에 대한 치료 효과(2형 당뇨병 및 죽상동맥경화성 CVD 환자)a
|
VICTOZA N=4668 |
위약 N=4672 |
위험 비율 (95% CI)b |
|
심혈관계 사망, 비치명적 심근경색, 비치명적 뇌졸중 (MACE)의 복합 (최초 발생 시점) c |
608 (13.0%) |
694 (14.9%) |
0.87 (0.78; 0.97) |
|
비치명적 심근경색d |
281 (6.0%) |
317 (6.8%) |
0.88 (0.75;1.03) |
|
비치명적 뇌졸중d |
159 (3.4%) |
177 (3.8%) |
0.89 (0.72;1.11) |
|
심혈관계 사망d |
219 (4.7%) |
278 (6%) |
0.78 (0.66;0.93) |
a전체 분석 집단 (무작위 배정된 모든 환자)
b치료를 요인으로 하는 Cox 비례 위험 모형
c우월성에 대한 p-값 (양측) 0.011
d최초 사건의 수와 백분율
16 제공/보관 및 취급 방법
16.1 How Supplied
VICTOZA 주사제: 18 mg/3 mL (6 mg/mL) 무색 투명 용액으로, 0.6 mg, 1.2 mg 또는 1.8 mg 용량을 투여하는 1회용 프리필드 펜으로 제공되며, 다음과 같은 포장 단위로 제공됩니다:
2 x VICTOZA 펜 NDC 0169-4060-12
3 x VICTOZA 펜 NDC 0169-4060-13
16.2 Recommended Storage
최초 사용 전, VICTOZA는 냉장 보관 (2ºC~8ºC, 36ºF~46ºF)해야 합니다. 냉동 보관하거나 냉장고 냉각 장치 바로 옆에 보관하지 마십시오. VICTOZA를 얼리지 마십시오. VICTOZA가 얼었을 경우 사용하지 마십시오.
VICTOZA 펜을 처음 사용한 후에는, 펜을 30일 동안 실온 (15°C~30°C, 59°F~86°F) 또는 냉장 보관 (2°C~8°C, 36°F~46°F)할 수 있습니다. 사용하지 않을 때는 펜 캡을 닫아 보관하십시오. VICTOZA를 과도한 열과 직사광선으로부터 보호하십시오. 매 투여 후에는 항상 바늘을 제거하고 안전하게 버리고, 주사 바늘을 꽂지 않은 상태로 VICTOZA 펜을 보관하십시오. 이렇게 하면 오염, 감염 및 누출 가능성을 줄이고 용량 정확성을 보장할 수 있습니다. 오염을 방지하기 위해 항상 새로운 바늘을 사용하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자용 라벨(의약품 안내서)을 읽도록 알려주십시오.
갑상선 C 세포 종양 위험
리라글루티드는 마우스와 랫트에서 양성 및 악성 갑상선 C 세포 종양을 유발하며, 이러한 발견의 인체 관련성은 알려져 있지 않다는 점을 환자에게 알려주십시오. 갑상선 종양의 증상(예: 목에 혹, 목소리 쉬임, 삼킴곤란 또는 호흡곤란)이 나타나면 의사에게 보고하도록 환자에게 알려주십시오 [경고 및 주의사항 상자 및 경고 및 주의사항 참조 (5.1)].
췌장염
췌장염의 잠재적 위험성에 대해 환자에게 알려주십시오. 심한 복통이 지속되고 등으로 퍼질 수 있으며 구토를 동반하거나 동반하지 않을 수 있다는 점을 설명하십시오. 심한 복통이 지속되면 즉시 VICTOZA 복용을 중단하고 의사에게 연락하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.2)].
절대 다른 환자와 VICTOZA 펜을 공유하지 마십시오
바늘을 교체하더라도 혈액 매개 병원체 전파 위험이 있으므로 다른 사람과 VICTOZA 펜을 절대 공유해서는 안 된다는 점을 환자에게 알려주십시오 [경고 및 주의사항 (5.3)].
저혈당
VICTOZA를 인슐린 분비 촉진제 또는 인슐린과 함께 사용할 경우 저혈당이 보고되었으며, 동반되는 항당뇨병 치료와 관계없이 소아 환자에게 발생할 수 있다는 점을 환자에게 알려주십시오. 환자 또는 보호자에게 저혈당의 징후와 증상에 대해 교육하십시오 [경고 및 주의사항 (5.4)].
급성 신손상
위장관계 이상 반응으로 인한 탈수의 잠재적 위험성을 환자에게 알리고 체액 고갈을 피하기 위한 예방 조치를 취하도록 하십시오. 일부 경우 투석이 필요할 수 있는 신기능 악화의 잠재적 위험성에 대해 환자에게 알려주십시오 [경고 및 주의사항 (5.5)].
과민반응
VICTOZA의 시판 후 사용 중 심각한 과민반응이 보고되었다는 점을 환자에게 알려주십시오. 과민반응의 증상에 대해 환자에게 알려주고 그러한 증상이 나타나면 VICTOZA 복용을 중단하고 즉시 의학적 조언을 구하도록 지시하십시오 [경고 및 주의사항 (5.6)].
급성 담낭 질환
담석증 또는 담낭염의 잠재적 위험성에 대해 환자에게 알려주십시오. 담석증 또는 담낭염이 의심되는 경우 적절한 임상적 추적 관찰을 위해 의사에게 연락하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.7)].
전신 마취 또는 심한 진정 중 폐흡인
VICTOZA는 위 배출 속도를 늦출 수 있으며, 이는 계획된 수술 또는 시술 중 마취 또는 심한 진정에 합병증을 유발할 수 있다는 점을 환자에게 알려주십시오. VICTOZA를 복용 중인 경우 계획된 수술 또는 시술 전에 의료 제공자에게 알리도록 환자에게 지시하십시오 [경고 및 주의사항 (5.8)].
복용 누락
복용 누락을 보충하기 위해 추가로 VICTOZA를 복용하지 않도록 환자에게 알려주십시오. 복용량을 놓친 경우, 다음 예정된 복용량으로 처방된 대로 1일 1회 요법을 재개해야 합니다. 마지막 복용 후 3일 이상 경과한 경우, 치료 재개와 관련된 위장 증상을 완화하기 위해 0.6mg으로 VICTOZA를 다시 시작하도록 환자에게 알려주십시오. 의료 제공자의 재량에 따라 VICTOZA의 용량을 조절해야 합니다 [용법 및 용량 (2.2)].
제조사:
Novo Nordisk A/S
DK-2880 Bagsvaerd, Denmark
버전: 17
VICTOZA®는 Novo Nordisk A/S의 등록 상표입니다.
특허 정보: http://novonordisk-us.com/products/product-patents.html
© 2024 Novo Nordisk
VICTOZA에 대한 정보는 다음으로 문의하십시오:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536
1-877-484-2869
약물 안내문
|
VICTOZA® (빅토자) |
|
VICTOZA를 처음 사용하기 전과 재충전할 때마다 이 약물 안내서를 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 의료 상태 또는 치료에 대해 의료 제공자와 상담하는 것을 대체하지 않습니다. |
|
VICTOZA에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
|
|
VICTOZA란 무엇입니까? VICTOZA는 다음과 같은 용도로 사용되는 주사제 처방약입니다.
VICTOZA는 1형 당뇨병 환자에게 사용해서는 안 됩니다. 리라글루타이드가 포함된 다른 약물과 함께 사용해서는 안 됩니다. VICTOZA가 10세 미만 어린이의 혈당(포도당)을 낮추는 데 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
누가 VICTOZA를 사용해서는 안 됩니까?
|
|
VICTOZA를 사용하기 전에 의료 제공자에게 무엇을 알려야 합니까?
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. VICTOZA는 일부 약물의 작용 방식에 영향을 미칠 수 있으며 일부 약물은 VICTOZA의 작용 방식에 영향을 미칠 수 있습니다. VICTOZA를 사용하기 전에 저혈당 및 관리 방법에 대해 의료 제공자와 상담하십시오. 인슐린이나 설폰요소제를 포함하여 당뇨병 치료를 위해 다른 약을 복용하는 경우 의료 제공자에게 알리십시오. 복용하는 약을 알고 있어야 합니다. 새로운 약을 받을 때 의료 제공자와 약사에게 보여줄 수 있도록 목록을 보관하십시오. |
|
VICTOZA는 어떻게 사용해야 합니까?
VICTOZA 및 기타 당뇨병 약물의 용량은 다음과 같은 이유로 변경이 필요할 수 있습니다.
|
|
VICTOZA의 가능한 부작용은 무엇입니까?
VICTOZA의 가장 흔한 부작용은 메스꺼움, 설사, 구토, 식욕 감퇴, 소화 불량 및 변비입니다. 귀찮거나 사라지지 않는 부작용에 대해서는 의료 제공자와 상담하십시오. 이것들은 VICTOZA의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1‑800‑FDA‑1088. |
|
VICTOZA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 VICTOZA를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 VICTOZA를 제공하지 마십시오. 해를 끼칠 수 있습니다. 자세한 내용은 의료 제공자와 상담하십시오. 약사 또는 의료 제공자에게 의료 전문가를 위해 작성된 VICTOZA에 대한 정보를 요청할 수 있습니다. |
|
VICTOZA의 성분은 무엇입니까? |
|
제조사: Novo Nordisk A/S, DK-2880 Bagsvaerd, Denmark Victoza®는 Novo Nordisk A/S의 등록상표입니다. 자세한 내용은 victoza.com을 방문하거나 1-877-484-2869로 전화하십시오. 특허 정보: http://novonordisk-us.com/patients/products/product-patents.html © 2024 Novo Nordisk 이 약물 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2024년 11월 |
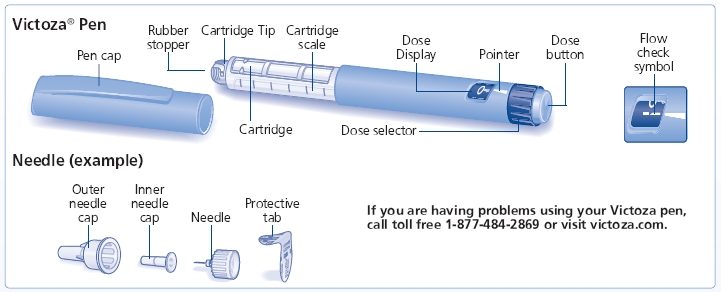
사용법
빅토자(리라글루티드) 주사제
먼저 빅토자 개인용 펜과 함께 제공되는 약물 안내서를 읽은 후, 빅토자 펜을 올바르게 사용하는 방법에 대한 정보는 이 환자 사용 설명서를 읽으십시오.
이 지침은 의료 상태 또는 치료에 대해 의료 제공자와 상담하는 것을 대체하지 않습니다.
바늘을 교체했더라도 다른 사람과 빅토자 펜을 공유하지 마십시오. 다른 사람에게 심각한 감염을 일으키거나 다른 사람으로부터 심각한 감염을 얻을 수 있습니다.
빅토자 펜은 3mL의 빅토자를 포함하는 일회용 개인용 프리필드 펜 인젝터이며 0.6mg, 1.2mg 또는 1.8mg의 용량을 제공합니다. 빅토자 펜으로 복용할 수 있는 용량의 수는 처방된 약물 용량에 따라 달라집니다. 의료 제공자가 빅토자 복용량을 알려줄 것입니다.
빅토자 펜은 노보 노르디스크 일회용 바늘과 함께 사용해야 합니다. 빅토자 펜에 사용할 바늘에 대한 자세한 내용은 의료 제공자 또는 약사와 상담하십시오.
중요 정보
- Δ 오염을 방지하려면 항상 새로운 바늘을 사용하십시오.
- Δ 항상 각 주사 후 바늘을 제거하고 바늘 없이 펜을 보관하십시오.
- 이렇게 하면 오염, 감염, 리라글루티드 누출,
- 바늘 막힘 및 부정확한 투여량의 위험을 줄일 수 있습니다.
- Δ 빅토자 펜과 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
- Δ 빅토자 펜을 떨어뜨린 경우 “새 펜에 대한 첫 사용”(A단계
- 부터 D단계)를 반복하십시오.
- Δ 바늘이 구부러지거나 손상되지 않도록 주의하십시오.
- Δ 주입할 빅토자의 양을 측정하기 위해 카트리지 눈금을 사용하지 마십시오.
- Δ 바늘 찔림 부상을 피하기 위해 사용한 바늘을 취급할 때 주의하십시오.
- Δ 처음 사용한 후 최대 30일 동안 빅토자 펜을 사용할 수 있습니다.
새 펜에 대한 첫 사용
A단계. 펜 확인
- •
- 새 빅토자 펜을 냉장고에서 꺼냅니다.
- •
- 사용 전에 비누와 물로 손을 씻으십시오.
- •
- 사용 전에 매번 펜 라벨을 확인하여 빅토자 펜인지 확인하십시오.
- •
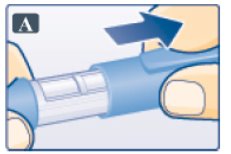
- 펜 캡을 벗깁니다(그림 A 참조).
- •
- 카트리지의 빅토자를 확인합니다. 액체는 투명하고 무색이며 입자가 없어야 합니다. 그렇지 않으면 사용하지 마십시오.
- •
- 알코올 솜으로 고무 마개를 닦으십시오.
B단계. 바늘 부착
- •
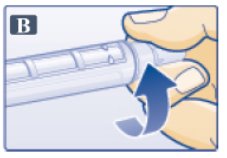
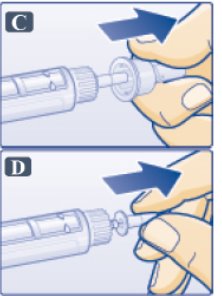
- 외부 바늘 캡에서 보호 탭을 제거합니다(그림 B 참조).
- •
- 바늘이 있는 외부 바늘 캡을 펜에 직선으로 밀어 넣은 다음 바늘이 고정될 때까지 돌립니다.
- •
- 외부 바늘 캡을 벗깁니다(그림 C 참조). 버리지 마십시오.
- •
- 내부 바늘 캡을 벗겨 버립니다(그림 D 참조). 약간의 액체가 나타날 수 있습니다. 이는 정상입니다.
C단계. 유량 확인 기호로 다이얼 설정
이 단계는 새 펜마다 한 번만 수행하며 새 펜을 처음 사용할 때 필요한 경우에만 수행됩니다.
- •
- 유량 확인 기호(–)가 포인터와 일치할 때까지 용량 선택기를 돌립니다(그림 E 참조). 유량 확인 기호는 의료 제공자가 처방한 용량을 투여하지 않습니다.
- •
- 의료 제공자가 처방한 용량을 선택하려면 “일상적인 사용” 아래의 G단계로 계속 진행하십시오.
D단계. 펜 준비
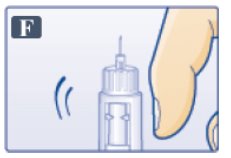
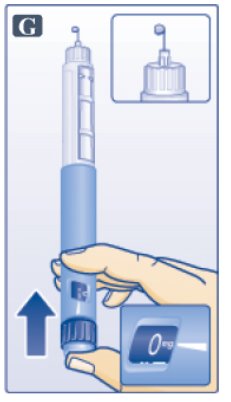
- •
- 바늘이 위쪽을 향하도록 펜을 잡습니다.
- •
- 카트리지 상단에 기포가 생기도록 손가락으로 카트리지를 여러 번 가볍게 두드립니다(그림 F 참조).
- •
- 바늘이 위쪽을 향하도록 하고 0mg이 포인터와 일치할 때까지 용량 버튼을 누릅니다(그림 G 참조). 바늘 끝에 빅토자 방울이 나타날 때까지 C단계와 D단계를 최대 6번 반복합니다.
빅토자 방울이 여전히 보이지 않으면 새 펜을 사용하고 1-877-484-2869로 노보 노르디스크에 문의하십시오.
“일상적인 사용” 아래의 G단계로 계속 진행 →
일상적인 사용
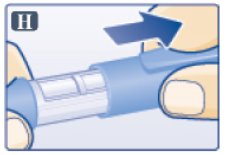
E단계. 펜 확인
- •
- 빅토자 펜을 보관 장소에서 꺼냅니다.
- •
- 사용 전에 비누와 물로 손을 씻으십시오.
- •
- 사용 전에 매번 펜 라벨을 확인하여 빅토자 펜인지 확인하십시오.
- •
- 펜 캡을 벗깁니다(그림 H 참조).
- •
- 카트리지의 빅토자를 확인합니다. 액체는 투명하고 무색이며 입자가 없어야 합니다. 그렇지 않으면 사용하지 마십시오.
- •
- 알코올 솜으로 고무 마개를 닦으십시오.
F단계. 바늘 부착
- •
- 외부 바늘 캡에서 보호 탭을 제거합니다. (Remove protective tab from outer needle cap.)
- •
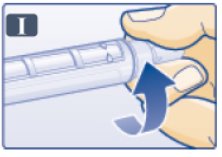
- 바늘이 들어 있는 외부 바늘 캡을 펜에 똑바로 밀어 넣은 다음 바늘을 단단히 고정될 때까지 돌려 끼웁니다(그림 I 참조). (Push outer needle cap containing the needle straight onto the pen, then screw needle on until secure (See Figure I).)
- •
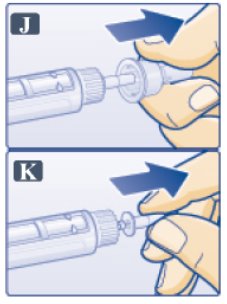
- 외부 바늘 캡을 벗깁니다. 버리지 마십시오(그림 J 참조). (Pull off outer needle cap. Do not throw away (See Figure J).)
- •
- 내부 바늘 캡을 벗겨서 버립니다(그림 K 참조). 작은 물방울이 나타날 수 있습니다. 이는 정상입니다. (Pull off inner needle cap and throw away (See Figure K). A small drop of liquid may appear. This is normal.)
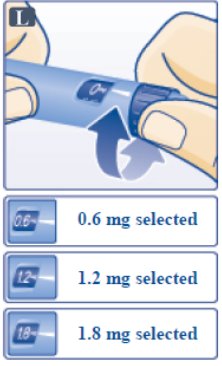
단계 G. 용량 설정 (Step G. Dial the Dose)
- •
- Victoza 펜은 0.6mg(시작 용량), 1.2mg 또는 1.8mg의 용량을 투여할 수 있습니다. 처방된 Victoza 용량을 확인하십시오. (Victoza pen can give a dose of 0.6 mg (starting dose), 1.2 mg or 1.8 mg. Be sure that you know the dose of Victoza that is prescribed for you.)
- •
- 필요한 용량이 포인터(0.6mg, 1.2mg 또는 1.8mg)와 일치될 때까지 용량 선택기를 돌립니다(그림 L 참조). (Turn the dose selector until your needed dose lines up with the pointer (0.6 mg, 1.2 mg or 1.8 mg) (See Figure L).)
- •
- 용량 선택기를 돌릴 때마다 “딸깍” 소리가 납니다. 듣는 딸깍 소리의 횟수로 용량을 설정하지 마십시오. (You will hear a “click” every time you turn the dose selector. Do not set the dose by counting the number of clicks you hear.)
- •
- 잘못된 용량을 선택한 경우 올바른 용량이 포인터와 일치할 때까지 용량 선택기를 앞뒤로 돌려 변경합니다. 용량 선택기를 돌릴 때 용량 버튼을 누르지 않도록 주의하십시오. Victoza가 나올 수 있습니다. (If you select a wrong dose, change it by turning the dose selector backwards or forwards until the correct dose lines up with the pointer. Be careful not to press the dose button when turning the dose selector. This may cause Victoza to come out.)
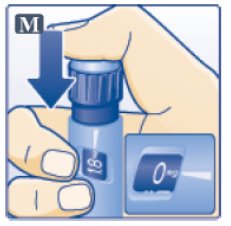
단계 H. 용량 주사 (Step H. Injecting the Dose)
- •
- 의료 제공자가 보여준 주사 기법을 사용하여 위(복부), 허벅지 또는 팔뚝에 바늘을 삽입합니다. Victoza를 정맥이나 근육에 주사하지 마십시오. (Insert needle into your skin in the stomach (abdomen), thigh or upper arm. Use the injection technique shown to you by your healthcare provider. Do not inject Victoza into a vein or muscle.)
- •
- 0mg가 포인터와 일치할 때까지 용량 버튼 중앙을 눌러 주사합니다(그림 M 참조). (Press down on the center of the dose button to inject until 0 mg lines up with the pointer (See Figure M).)
- •
- 다른 손가락으로 용량 표시를 만지지 않도록 주의하십시오. 주사를 방해할 수 있습니다. (Be careful not to touch the dose display with your other fingers. This may block the injection.)
- •
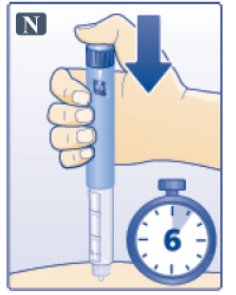
- 용량 버튼을 계속 누르고 전체 용량이 주사되도록 6초 동안 바늘을 피부 아래에 두십시오. 피부에서 바늘을 제거할 때까지 주사 버튼에 엄지손가락을 대고 있습니다(그림 N 참조). (Keep the dose button pressed down and make sure that you keep the needle under the skin for a full count of 6 seconds to make sure the full dose is injected. Keep your thumb on the injection button until you remove the needle from your skin (See Figure N).)
- •
- 각 용량에 대해 선택한 부위 내에서 주사 부위를 변경(회전)합니다. 매 주사마다 동일한 주사 부위를 사용하지 마십시오.(Change (rotate) your injection sites within the area you choose for each dose. Do not use the same injection site for each injection.)
- •
- 빅토자 펜은 30일 동안만 사용합니다. 빅토자 펜을 사용을 시작한 후 30일이 지나면, 펜 안에 약이 남아있더라도 사용한 빅토자 펜을 버려야 합니다.
- •
- 빅토자 펜은 59°F에서 86°F(15°C에서 30°C) 사이의 온도에서 보관하거나 냉장고에서 36°F에서 46°F(2°C에서 8°C) 사이의 온도에서 보관하세요.
- •
- 집 밖에서 펜을 휴대할 때는 59°F에서 86°F(15°C에서 30°C) 사이의 온도에서 보관하세요.
- •
- 빅토자가 86°F(30°C) 이상의 온도에 노출된 경우에는 버려야 합니다.
- •
- 빅토자 펜을 열과 햇빛으로부터 보호하세요.
- •
- 빅토자 펜을 사용하지 않을 때는 펜 뚜껑을 씌워주세요.
- •
- 매번 주사 후에는 바늘을 항상 제거하고 바늘이 부착되지 않은 상태로 펜을 보관하세요. 이렇게 하면 오염, 감염, 누출 및 정확하지 않은 투여량의 위험을 줄일 수 있습니다.
주요 표시 패널 – 빅토자 펜 3개
NDC 0169-4060-13
List 406013
VICTOZA®
(liraglutide) injection
단일 환자 사용만 가능
18 mg/3 mL (6 mg/mL)
각 펜은 0.6 mg, 1.2 mg 또는 1.8 mg 용량을 제공합니다
피하 주사만 가능
첫 사용 후 30일 후 폐기
냉장 보관 – 동결 금지
처방전 의약품
포함 내용: Victoza 펜 3개, 제품 설명서
동봉된 약물 사용 설명서를 각 환자에게 제공하십시오
Novo Nordisk 일회용 바늘과 함께 사용하기 위한 것
펜 3개
빅토자 펜 2개입 – 주 표시면
NDC 0169-4060-12
List 406012
VICTOZA®
(liraglutide) injection
단일 환자 사용만 가능
18 mg/3 mL (6 mg/mL)
각 펜은 0.6 mg, 1.2 mg 또는 1.8 mg 용량을 제공합니다
피하 주사용
첫 사용 후 30일 후 폐기
냉장 보관 – 동결 금지
처방전 의약품
포함 내용: Victoza 펜 2개, 제품 설명서
동봉된 약물 사용 설명서를 각 환자에게 제공하십시오
Novo Nordisk 일회용 바늘과 함께 사용하기 위한 것
2개 펜