의약품 제조업체: Novartis Pharmaceuticals Corporation (Updated: 2024-12-18)
처방 정보 하이라이트
TASIGNA® (닐로티닙) 캡슐, 경구용
미국 최초 승인: 2007
경고: QT 간격 연장 및 돌연사
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
- Tasigna는 QT 간격을 연장시킵니다. Tasigna 투여 전과 주기적으로 저칼륨혈증 또는 저마그네슘혈증을 모니터링하고 결핍을 교정하십시오. (5.2) 기준선, 투여 시작 후 7일째, 그 이후 주기적으로 그리고 용량 조절 후에 QTc를 모니터링하기 위해 심전도를 얻으십시오. (5.2, 5.3, 5.7, 5.12)
- Tasigna를 복용하는 환자에서 돌연사가 보고되었습니다. (5.3) 저칼륨혈증, 저마그네슘혈증 또는 QT 연장 증후군이 있는 환자에게는 Tasigna를 투여하지 마십시오. (4, 5.2)
- QT 간격을 연장시키는 것으로 알려진 동시 투여 약물 및 강력한 CYP3A4 억제제의 사용을 피하십시오. (7.1, 7.2)
- 복용 2시간 전과 1시간 후에는 음식을 섭취하지 마십시오. (2.1)
적응증 및 용법
용법 및 용량
- 권장 성인 용량: 새로 진단된 Ph+ CML-CP: 1일 2회 300mg 경구 투여. 내성 또는 불내성 Ph+ CML-CP 및 CML-AP: 1일 2회 400mg 경구 투여. (2.1)
- 권장 소아 용량: 새로 진단된 Ph+ CML-CP 또는 이전 TKI 치료에 내성 또는 불내성인 Ph+ CML-CP 및 CML-AP: 1일 2회 230mg/m2 경구 투여(가장 가까운 50mg으로 반올림, 최대 단일 용량 400mg). (2.1)
- 전체 투여 지침 및 독성에 대한 용량 감소 지침은 용법 및 용량을 참조하십시오. (2.1)
- 기준 간 기능 장애가 있는 환자의 경우 시작 용량을 줄입니다. (2.7)
- 최소 3년 동안 Tasigna를 복용하고 지속적인 분자 반응(MR4.5)을 달성한 새로 진단된 Ph+ CML-CP 성인 환자와 최소 3년 동안 Tasigna를 복용하고 지속적인 분자 반응(MR4.5)을 달성한 이마티닙에 내성이 있거나 불내성인 Ph+ CML-CP 환자는 치료 중단을 고려할 수 있습니다. (2.2, 2.3, 5.16)
제형 및 강도
캡슐: 50mg, 150mg 및 200mg (3)
금기
저칼륨혈증, 저마그네슘혈증 또는 QT 연장 증후군이 있는 환자에게는 Tasigna가 금기입니다. (4)
경고 및 주의사항
- 골수억제: 치료 중에는 완전혈구계수(CBC)를 모니터링하고 치료 중단 또는 용량 감소로 관리합니다. (5.1)
- 심장 및 동맥 혈관 폐쇄 사건: Tasigna 치료 중 심혈관 상태를 평가하고 심혈관 위험 요소를 모니터링하고 관리합니다. (5.4)
- 췌장염 및 상승된 혈청 리파제: 혈청 리파제를 모니터링합니다. 수치 상승이 복통을 동반하는 경우, 용량을 중단하고 췌장염을 배제하기 위한 적절한 진단을 고려합니다. (5.5)
- 간독성: 매달 또는 임상적으로 필요한 경우 간 기능 검사를 모니터링합니다. (5.6)
- 전해질 이상: Tasigna는 저인산혈증, 저칼륨혈증, 고칼륨혈증, 저칼슘혈증 및 저나트륨혈증을 유발할 수 있습니다. Tasigna 투여를 시작하기 전에 전해질 이상을 교정하고 치료 중에 주기적으로 모니터링합니다. (5.7)
- 종양 용해 증후군: Tasigna 치료를 시작하기 전에 충분한 수분을 유지하고 요산 수치를 교정합니다. (5.8)
- 출혈: 어떤 부위에서든 출혈이 발생할 수 있습니다. 환자에게 출혈의 징후와 증상을 보고하도록 알리고 필요에 따라 의학적으로 관리합니다. (5.9)
- 체액 저류: 예상치 못한 급격한 체중 증가, 부종 및 호흡 곤란에 대해 환자를 모니터링합니다. 의학적으로 관리합니다. (5.13)
- 소아 환자의 성장 및 발달에 대한 영향: Tasigna로 치료받은 소아 환자에서 성장 지연이 보고되었습니다. 소아 환자의 성장과 발달을 모니터링합니다. (5.14)
- 배아-태아 독성: 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임법을 사용하도록 조언합니다. (5.15, 8.1, 8.3)
- 치료 중단: 환자는 전형적인 BCR-ABL 전사체를 가져야 합니다. MR4.5 미만의 검출 한계를 가진 FDA 승인 검사를 사용하여 중단 자격을 결정해야 합니다. 환자는 재발 가능성을 감지하기 위해 FDA 승인 검사를 통해 자주 모니터링해야 합니다. (5.16)
유해 반응
성인 및 소아 환자에서 가장 흔하게 보고된 비혈액학적 유해 반응(≥ 20%)은 메스꺼움, 발진, 두통, 피로, 가려움증, 구토, 설사, 기침, 변비, 관절통, 비인두염, 발열 및 야간 발한이었습니다. 혈액학적 유해 약물 반응에는 골수억제: 혈소판 감소증, 호중구 감소증 및 빈혈이 포함됩니다. (6.1)
의심되는 유해 반응을 보고하려면 Novartis Pharmaceuticals Corporation에 1-888-669-6682 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
특정 집단에서의 사용
- 수유: 여성에게 모유 수유를 하지 말라고 조언합니다. (8.2)
환자 상담 정보 및 의약품 안내서에 대해서는 17을 참조하십시오.
개정: 2024년 2월
목차
전문 정보: 목차*
경고: QT 간격 연장 및 돌연사
1
적응증 및 용법
1.1
신규 진단된 Ph+ CML-CP 성인 및 소아 환자
1.2
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자
1.3
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 소아 환자
2
투여량 및 투여 방법
2.1
권장 용량
2.2
Tasigna 치료 후 지속적인 분자 반응 (MR4.5) 이후 치료 중단
2.3
Tasigna로 치료 중단 후 분자 반응이 소실된 환자의 치료 재개
2.4
QT 간격 연장에 대한 용량 조절
2.5
골수억제에 대한 용량 조절
2.6
선택된 비혈액학적 실험실 이상 및 기타 독성에 대한 용량 조절
2.7
간 손상에 대한 용량 조절
2.8
강력한 CYP3A4 억제제와 병용 투여 시 용량 조절
3
제형 및 강도
4
금기
5
경고 및 주의사항
5.1
골수억제
5.2
QT 간격 연장
5.3
돌연사
5.4
심혈관 및 동맥 혈관 폐쇄성 질환
5.5
췌장염 및 상승된 혈청 리파제
5.6
간독성
5.7
전해질 이상
5.8
종양 용해 증후군
5.9
출혈
5.10
전 위 절제술
5.11
유당
5.12
실험실 검사 모니터링
5.13
체액 저류
5.14
소아 환자의 성장 및 발달에 대한 영향
5.15
배아-태아 독성
5.16
BCR-ABL 전사체 수준 모니터링
6
유해 반응
6.1
임상 시험 경험
6.2
시판 후 경험
7
약물 상호작용
7.1
다른 약물이 Tasigna에 미치는 영향
7.2
QT 간격을 연장하는 약물
8
특정 집단에서의 사용
8.1
임신
8.2
수유
8.3
생식 잠재력이 있는 여성 및 남성
8.4
소아 사용
8.5
노인 사용
8.6
심장 질환
8.7
간 손상
10
과량 투여
11
약물 설명
12
임상 약리학
12.1
작용 기전
12.2
약력학
12.3
약동학
12.5
약물 유전체학
13
비임상 독성학
13.1
발암성, 돌연변이 유발성, 생식능력 장애
14
임상 연구
14.1
신규 진단된 Ph+ CML-CP 성인 환자
14.2
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자
14.3
지속적인 분자 반응 (MR4.5)에 도달한 신규 진단된 Ph+ CML-CP 환자의 치료 중단
14.4
이전 이마티닙 치료 후 지속적인 분자 반응 (MR4.5)에 도달한 Ph+ CML-CP 환자의 Tasigna 치료 중단
14.5
신규 진단된 Ph+ CML-CP 또는 내성 또는 불내성 Ph+ CML-CP 소아 환자
16
포장 단위/보관 및 취급
17
환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: QT 간격 연장 및 돌연사
- Tasigna는 QT 간격을 연장시킵니다. Tasigna 투여 전과 주기적으로 저칼륨혈증 또는 저마그네슘혈증을 모니터링하고 결핍을 교정하십시오 [경고 및 주의사항 (5.2) 참조]. 기준선, 투여 시작 7일 후, 그 이후 주기적으로 그리고 용량 조절 후에 QTc를 모니터링하기 위해 ECG를 얻으십시오 [경고 및 주의사항 (5.2, 5.3, 5.7, 5.12) 참조].
- Tasigna를 투여받은 환자에서 돌연사가 보고되었습니다 [경고 및 주의사항 (5.3) 참조]. 저칼륨혈증, 저마그네슘혈증 또는 Long QT 증후군 환자에게는 Tasigna를 투여하지 마십시오 [금기사항 (4), 경고 및 주의사항 (5.2) 참조].
- QT 간격을 연장시키는 것으로 알려진 동시 투여 약물 및 강력한 CYP3A4 억제제의 사용을 피하십시오 [약물 상호작용 (7.1, 7.2) 참조].
- 복용 2시간 전과 1시간 후에는 음식을 섭취하지 마십시오 [용법 및 용량 (2.1) 참조].
1 적응증 및 사용법
1.1
신규 진단 성인 및 소아 환자의 Ph+ CML-CP
Tasigna는 만성기 Philadelphia 염색체 양성 만성 골수성 백혈병 (Ph+ CML)이 새로 진단된 1세 이상의 성인 및 소아 환자의 치료에 사용됩니다.
1.2
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자
Tasigna는 이마티닙을 포함한 이전 치료에 내성이 있거나 불내성인 만성기 및 가속기 Philadelphia 염색체 양성 만성 골수성 백혈병 (Ph+ CML) 성인 환자의 치료에 사용됩니다.
1.3
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 소아 환자
Tasigna는 이전 티로신 키나제 억제제 (TKI) 치료에 내성이 있거나 불내성인 만성기 및 가속기 Philadelphia 염색체 양성 만성 골수성 백혈병 (Ph+ CML) 1세 이상의 소아 환자의 치료에 사용됩니다.
2 용법 및 투여
2.1 권장 용량
Tasigna는 공복 시 12시간 간격으로 1일 2회 복용하십시오. 복용 2시간 전과 1시간 후에는 음식을 섭취하지 마십시오. 환자에게 캡슐을 물과 함께 통째로 삼키도록 지시하십시오 [경고, 임상 약리학 (12.3) 참조].
캡슐을 삼킬 수 없는 환자의 경우, 각 캡슐의 내용물을 사과소스 (애플소스 퓨레) 1티스푼에 섞어 복용할 수 있습니다. 혼합물은 즉시 (15분 이내) 복용해야 하며, 나중에 사용하기 위해 보관해서는 안 됩니다 [임상 약리학 (12.3) 참조].
임상적으로 필요한 경우, Tasigna는 에리스로포이에틴 또는 G-CSF와 같은 조혈 성장 인자와 병용 투여할 수 있습니다. 임상적으로 필요한 경우, Tasigna는 하이드록시우레아 또는 아나그렐라이드와 병용 투여할 수 있습니다.
신규 진단된 Ph+ CML-CP 성인 환자의 용량
Tasigna의 권장 용량은 1일 2회 경구 300mg입니다.
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자의 용량
Tasigna의 권장 용량은 1일 2회 경구 400mg입니다.
신규 진단된 Ph+ CML-CP 또는 내성 또는 불내성 Ph+ CML-CP 및 CML-AP 소아 환자의 용량
소아 환자의 Tasigna 권장 용량은 1일 2회 경구 230 mg/m2이며, 가장 가까운 50mg 단위로 반올림합니다 (최대 단회 용량 400mg) (표 1 참조). 필요한 경우, 다양한 강도의 Tasigna 캡슐을 병용하여 원하는 용량을 얻을 수 있습니다. 임상적 이점이 관찰될 때까지 또는 용인할 수 없는 독성이 발생할 때까지 치료를 계속합니다.
| 체표면적 | 단회 용량 | 1일 총 용량 |
| 0.32 m2 미만 | 50 mg | 100 mg |
| 0.33 – 0.54 m2 | 100 mg | 200 mg |
| 0.55 – 0.76 m2 | 150 mg | 300 mg |
| 0.77 – 0.97 m2 | 200 mg | 400 mg |
| 0.98 – 1.19 m2 | 250 mg | 500 mg |
| 1.20 – 1.41 m2 | 300 mg | 600 mg |
| 1.42 – 1.63 m2 | 350 mg | 700 mg |
| 1.64 m2 이상 | 400 mg | 800 mg |
2.2
Tasigna 치료 중단 (지속적인 분자 반응(MR4.5) 후)
환자 선택
치료 중단 자격
전형적인 BCR-ABL 전사체를 가진 Ph+ CML-CP 환자로, 최소 3년 동안 Tasigna를 복용해 왔으며 지속적인 분자 반응(MR4.5, BCR-ABL/ABL ≤ 0.0032% IS에 해당)에 도달한 경우 치료 중단이 적절할 수 있습니다 [임상 연구(14.3, 14.4) 참조]. 치료 중단 자격을 결정하기 위한 BCR-ABL 전사체의 검출 및 정량화에 대한 FDA 승인 시험에 대한 정보는 http://www.fda.gov/CompanionDiagnostics에서 확인할 수 있습니다.
전형적인 BCR-ABL 전사체(e13a2/b2a2 또는 e14a2/b3a2)를 가지고 지속적인 MR4.5 기준을 달성한 환자는 Tasigna 중단이 적절합니다. 환자는 치료 중단 후 분자 완화 상실 가능성에 대해 지속적으로 모니터링해야 합니다. 치료 중 및 치료 중단 후 분자 반응 수준을 일관되게 모니터링하려면 동일한 FDA 승인 시험을 사용하십시오.
다음과 같은 새로 진단된 Ph+ CML-CP 환자의 경우 중단을 고려하십시오.
- 최소 3년 동안 Tasigna로 치료받은 경우
- 치료 중단 1년 전부터 최소 MR4.0(BCR-ABL/ABL ≤ 0.01% IS에 해당)의 분자 반응을 유지한 경우
- 치료 중단 직전에 실시한 마지막 평가에서 MR4.5에 도달한 경우
- 전형적인 BCR-ABL 전사체(e13a2/b2a2 또는 e14a2/b3a2)를 발현하는 것으로 확인된 경우
- 가속기 또는 폭발 위기의 병력이 없는 경우
- 재발로 이어진 이전의 치료 중단 시도가 없는 경우.
이마티닙에 내성이 있거나 이마티닙에 대한 내약성이 없는 Ph+ CML-CP 환자로 Tasigna에서 지속적인 분자 반응(MR4.5)을 달성한 경우 중단을 고려하십시오. 다음과 같은 경우 해당됩니다.
- 최소 3년 동안 Tasigna로 치료받은 경우
- Tasigna 치료 전에 이마티닙만으로 치료받은 경우
- MR4.5(BCR-ABL/ABL ≤ 0.0032% IS에 해당)의 분자 반응을 달성한 경우
- 치료 중단 직전 최소 1년 동안 MR4.5를 유지한 경우
- 전형적인 BCR-ABL 전사체(e13a2/b2a2 또는 e14a2/b3a2)를 발현하는 것으로 확인된 경우
- 가속기 또는 폭발 위기의 병력이 없는 경우
- 재발로 이어진 이전의 치료 중단 시도가 없는 경우.
Tasigna 치료를 중단한 환자의 경우 1년 동안 매달, 그 후 2년 동안 6주마다, 그 이후에는 12주마다 BCR-ABL 전사체 수준과 백혈구 수(CBC)를 감별하여 모니터링합니다 [경고 및 주의 사항(5.16) 참조].
무치료 단계에서 MR4.0(BCR-ABL/ABL ≤ 0.01% IS에 해당)이 상실되면 BCR-ABL 수준이 주요 분자 반응[(MMR), MR3.0 또는 BCR-ABL/ABL ≤ 0.1% IS에 해당] 미만으로 4회 연속 측정될 때까지 2주마다 BCR-ABL 전사체 수준을 모니터링합니다. 그런 다음 환자는 원래 모니터링 일정으로 진행할 수 있습니다.
2.3
Tasigna 치료 중단 후 분자 반응 상실 환자의 치료 재개
- MMR을 상실한 새로 진단된 환자는 치료 중단 전 용량 수준으로 4주 이내에 치료를 재개해야 합니다 [경고 및 주의 사항(5.16) 참조]. Tasigna 치료를 재개하는 환자는 주요 분자 반응이 재확립될 때까지 매달, 그 이후에는 12주마다 BCR-ABL 전사체 수준을 모니터링해야 합니다.
- 이마티닙을 포함한 이전 치료에 내성이 있거나 내약성이 없는 환자로 MR4.0(최소 4주 간격으로 분리된 2회 연속 측정에서 MR4.0 상실) 또는 MMR 상실이 확인된 경우 치료 중단 전 용량 수준으로 4주 이내에 치료를 재개해야 합니다 [경고 및 주의 사항(5.16) 참조]. Tasigna 치료를 재개하는 환자는 이전 주요 분자 반응 또는 MR4.0이 재확립될 때까지 매달, 그 이후에는 12주마다 BCR-ABL 전사체 수준을 모니터링해야 합니다.
2.4
QT 간격 연장에 대한 용량 조절
QT 간격 연장에 대한 용량 조절은 표 2를 참조하십시오 [경고 및 주의 사항(5.2), 임상 약리학(12.2) 참조].
| 약어: ECG, 심전도. | |
| QTc 연장 정도 | 용량 조절 |
| QTc가 480msec를 초과하는 ECG | 1. Tasigna 복용을 중단하고 혈청 칼륨 및 마그네슘 분석을 실시하며, 정상치 하한 미만인 경우 보충제로 정상치 내로 교정합니다. 병용 약물 사용을 검토해야 합니다. 2. QTcF가 450msec 미만으로 돌아오고 기준치 20msec 이내로 돌아오면 2주 이내에 이전 용량으로 재개합니다. 3. 2주 후 QTcF가 450msec와 480msec 사이인 경우 성인은 1일 1회 400mg으로, 소아는 1일 1회 230mg/m2로 용량을 줄입니다. 4. 성인은 1일 1회 400mg으로, 소아는 1일 1회 230mg/m2로 용량을 줄인 후 QTcF가 480msec를 초과하는 경우 Tasigna 복용을 중단합니다. 5. 용량 조절 후 약 7일 후에 ECG를 반복해야 합니다. |
2.5
골수억제에 대한 용량 조절
기저 백혈병과 관련 없는 혈액학적 독성 (호중구 감소증, 혈소판 감소증)에 대해 Tasigna 용량을 중단하거나 감량합니다 (표 3) [경고 및 주의사항 (5.1) 참조].
| 약어: ANC, 절대 호중구 수; Ph+ CML, 필라델피아 염색체 양성 만성 골수성 백혈병. | ||
| 진단 | 골수억제 정도 | 용량 조절 |
성인 환자:
|
ANC 1.0 x 109/L 미만 및/또는 혈소판 수 50 x 109/L 미만 | 1. Tasigna 투여 중단하고 혈액 수치 모니터링. 2. ANC 1.0 x 109/L 초과 및 혈소판 50 x 109/L 초과인 경우 2주 이내에 이전 용량으로 재개. 3. 2주 이상 혈액 수치가 낮게 유지되는 경우, 용량을 1일 1회 400mg으로 감량.
|
소아 환자:
|
ANC 1.0 x 109/L 미만 및/또는 혈소판 수 50 x 109/L 미만 | 1. Tasigna 투여 중단하고 혈액 수치 모니터링. 2. ANC 1.5 x 109/L 초과 및/또는 혈소판 75 x 109/L 초과인 경우 2주 이내에 이전 용량으로 재개. 3. 2주 이상 혈액 수치가 낮게 유지되는 경우, 1일 1회 230 mg/m2로 용량 감량이 필요할 수 있습니다. 4. 용량 감량 후에도 사건이 발생하는 경우, 치료 중단을 고려하십시오. |
2.6
선택된 비혈액학적 실험실 이상 및 기타 독성에 대한 용량 조절
리파제, 아밀라제, 빌리루빈 및/또는 간 전이효소 상승에 대한 용량 조절은 표 4를 참조하십시오 [경고 및 주의사항 (5.5, 5.6), 이상 반응 (6.1) 참조].
| 비혈액학적 실험실 이상 정도 | 용량 조절 |
| 3등급 이상의 상승된 혈청 리파제 또는 아밀라제 | 성인 환자: 1. Tasigna 투여 중단하고 혈청 리파제 또는 아밀라제 모니터링. 2. 혈청 리파제 또는 아밀라제가 1등급 이하로 회복되면 1일 1회 400mg으로 치료 재개. |
| 소아 환자: 1. 1등급 이하로 회복될 때까지 Tasigna 투여 중단. 2. 이전 용량이 1일 2회 230 mg/m2이었던 경우 1일 1회 230 mg/m2로 치료 재개; 이전 용량이 1일 1회 230 mg/m2이었던 경우 치료 중단. |
|
| 성인 환자의 경우 3등급 이상, 소아 환자의 경우 2등급 이상의 상승된 빌리루빈 | 성인 환자: 1. Tasigna 투여 중단하고 빌리루빈 모니터링. 2. 빌리루빈이 1등급 이하로 회복되면 1일 1회 400mg으로 치료 재개. |
| 소아 환자: 1. 1등급 이하로 회복될 때까지 Tasigna 투여 중단. 2. 이전 용량이 1일 2회 230 mg/m2이었던 경우 1일 1회 230 mg/m2로 치료 재개; 이전 용량이 1일 1회 230 mg/m2이었던 경우, 1등급 이하로 회복되는 데 28일 이상 걸리는 경우 치료 중단. |
|
| 3등급 이상의 상승된 간 전이효소 | 성인 환자: 1. Tasigna 투여 중단하고 간 전이효소 모니터링. 2. 간 전이효소가 1등급 이하로 회복되면 1일 1회 400mg으로 치료 재개. |
| 소아 환자: 1. 1등급 이하로 회복될 때까지 Tasigna 투여 중단. 2. 이전 용량이 1일 2회 230 mg/m2이었던 경우 1일 1회 230 mg/m2로 치료 재개; 이전 용량이 1일 1회 230 mg/m2이었던 경우, 1등급 이하로 회복되는 데 28일 이상 걸리는 경우 치료 중단. |
임상적으로 유의한 중등도 또는 중증의 비혈액학적 독성이 발생하는 경우(의학적으로 심각한 체액 저류 포함) 용량 조절에 대해 표 5를 참조하십시오 [유해 반응 (6.1) 참조].
| 약어: CML-AP, 만성 골수성 백혈병-급성기; CML-CP, 만성 골수성 백혈병-만성기; Ph+, 필라델피아 염색체 양성. | |
| “기타 비혈액학적 독성”의 정도 | 용량 조절 |
| 기타 임상적으로 중등도 또는 중증의 비혈액학적 독성 | 성인 환자: 1. 독성이 해소될 때까지 Tasigna 투여를 중단합니다. 2. 이전 용량이 성인 환자에서 CML-CP 신규 진단 환자의 경우 1일 1회 300mg 또는 내성 또는 불내성 CML-CP 및 CML-AP 성인 환자의 경우 1일 2회 400mg이었던 경우 1일 1회 400mg으로 치료를 재개합니다. 3. 이전 용량이 성인 환자에서 1일 1회 400mg이었던 경우 치료를 중단합니다. 4. 임상적으로 적절한 경우 용량을 1일 2회 300mg(신규 진단 Ph+ CML-CP) 또는 1일 2회 400mg(내성 또는 불내성 Ph+ CML-CP 및 CML-AP)으로 재증량하는 것을 고려합니다. |
| 소아 환자: 1. 독성이 해소될 때까지 Tasigna 투여를 중단합니다. 2. 이전 용량이 1일 2회 230mg/m2이었던 경우 1일 1회 230mg/m2으로 치료를 재개합니다. 이전 용량이 1일 1회 230mg/m2이었던 경우 치료를 중단합니다. 3. 임상적으로 적절한 경우 용량을 1일 2회 230mg/m2으로 재증량하는 것을 고려합니다. |
|
2.7
간 손상에 대한 용량 변경
가능한 경우 대체 치료법을 고려하십시오. 간 손상 환자에게 Tasigna를 투여해야 하는 경우 다음과 같은 용량 감소를 고려하십시오 [특정 집단에서의 사용 (8.7) 참조]:
| 진단 | 간 손상 정도 | 용량 조절 |
| 만성기의 신규 진단 Ph+ CML | 경도(Child-Pugh A), 중등도(Child-Pugh B) 또는 중증(Child-Pugh C) | 용량을 1일 2회 200mg으로 감소시킵니다. 내약성에 따라 용량을 1일 2회 300mg으로 증량합니다. |
|
내성 또는 불내성 Ph+ CML 만성기 또는 급성기 |
경도 또는 중등도 | 용량을 1일 2회 300mg으로 감소시킵니다. 내약성에 따라 용량을 1일 2회 400mg으로 증량합니다. |
| 중증 | 용량을 1일 2회 200mg으로 감소시킵니다. 내약성에 따라 용량을 1일 2회 300mg으로, 그 다음 1일 2회 400mg으로 증량합니다. |
2.8
동시 강력한 CYP3A4 억제제와 함께 투여 시 용량 변경
강력한 CYP3A4 억제제와의 병용 투여는 피하십시오. 이러한 약물 중 어떤 약물로 치료가 필요한 경우 Tasigna 치료를 중단하십시오. 환자에게 강력한 CYP3A4 억제제를 병용 투여해야 하는 경우, 내성 또는 불내성 Ph+ CML 환자의 경우 1일 1회 300mg으로, 신규 진단 Ph+ CML-CP 환자의 경우 1일 1회 200mg으로 용량을 감소시킵니다. 그러나 강력한 CYP3A4 억제제를 투여받는 환자에서 이러한 용량 조절에 대한 임상 데이터는 없습니다. 강력한 억제제 투여를 중단하는 경우, Tasigna 용량을 상향 조절하기 전에 세척 기간을 허용하십시오. 강력한 CYP3A4 억제제 사용을 피할 수 없는 환자의 경우 QT 간격 연장에 대해 면밀히 모니터링하십시오 [경고, 경고 및 주의 사항 (5.2), 약물 상호작용 (7.1, 7.2), 임상 약리학 (12.3)의 경고 상자 참조].
3 제형 및 함량
캡슐:
- 50 mg 빨간색 불투명 캡과 연노란색 불투명 몸체의 경질 젤라틴 캡슐, 검은색 방사형 인쇄 “NVR/ABL.” 포함
- 150 mg 빨간색 불투명 경질 젤라틴 캡슐, 검은색 축 방향 인쇄 “NVR/BCR.” 포함
- 200 mg 연노란색 불투명 경질 젤라틴 캡슐, 빨간색 축 방향 인쇄 “NVR/TKI.” 포함
4 금기 사항
Tasigna는 저칼륨혈증, 저마그네슘혈증 또는 Long QT 증후군 환자에게는 금기입니다 [경고란 참조].
5 경고 및 주의사항
5.1
Myelosuppression
Tasigna 치료는 3/4 등급의 혈소판 감소증, 호중구 감소증 및 빈혈을 유발할 수 있습니다. 처음 2개월 동안 2주마다, 그 후에는 매달 또는 임상적으로 필요에 따라 CBC를 시행하십시오. 골수억제는 일반적으로 가역적이며 일반적으로 Tasigna 투여를 일시적으로 중단하거나 용량을 줄임으로써 관리되었습니다. [투여량 및 투여(2.5) 참조].
5.2
QT Prolongation
Tasigna는 표면 심전도(ECG)에서 QT 간격으로 측정한 심실 재분극을 농도 의존적으로 연장하는 것으로 나타났습니다. [이상반응(6.1), 임상 약리학(12.2) 참조]. QT 간격 연장은 실신, 발작 및/또는 사망을 초래할 수 있는 Torsade de pointes라고 하는 유형의 심실 빈맥을 유발할 수 있습니다. 심전도는 기준선, Tasigna 시작 7일 후, 임상적으로 필요에 따라 정기적으로, 용량 조정 후에 시행해야 합니다. [투여량 및 투여(2.4), 경고 및 주의사항(5.12) 참조].
Tasigna는 저칼륨혈증, 저마그네슘혈증 또는 긴 QT 증후군이 있는 환자에게 사용해서는 안 됩니다. Tasigna를 시작하기 전과 정기적으로 전해질, 칼슘 및 마그네슘 혈중 농도를 검사하십시오. 저칼륨혈증 또는 저마그네슘혈증은 Tasigna를 시작하기 전에 교정해야 하며 이러한 전해질은 치료 중에 정기적으로 모니터링해야 합니다. [경고 및 주의사항(5.12) 참조].
Tasigna를 음식 및/또는 강력한 CYP3A4 억제제 및/또는 QT 연장 가능성이 알려진 의약품과 부적절하게 함께 복용하면 QT 간격이 유의하게 연장될 수 있습니다. 따라서 음식과 함께 복용해서는 안 되며 강력한 CYP3A4 억제제 및/또는 QT 연장 가능성이 알려진 의약품과 병용해서는 안 됩니다. [투여량 및 투여(2.1), 약물 상호작용(7.1, 7.2) 참조]. 저칼륨혈증과 저마그네슘혈증이 있는 경우 QT 간격이 더 연장될 수 있습니다. [경고 및 주의사항(5.7, 5.12) 참조].
5.3
Sudden Deaths
5661명의 환자를 대상으로 한 임상 연구에서 Tasigna로 치료받은 CML 환자의 0.3%에서 급사가 보고되었습니다. Tasigna 시작과 관련하여 이러한 사망의 일부가 비교적 초기에 발생했다는 것은 심실 재분극 이상이 사망 발생에 기여했을 가능성을 시사합니다.
5.4
Cardiac and Arterial Vascular Occlusive Events
동맥 혈관 폐색 사건을 포함한 심혈관 사건은 새롭게 진단된 CML 환자에 대한 무작위 임상 시험에서 보고되었으며 Tasigna 치료를 받는 환자의 시판 후 보고에서 관찰되었습니다. [이상반응(6.1) 참조]. 임상 시험에서 치료 기간 중앙값이 60개월인 경우 동맥 혈관 폐색 사건을 포함한 심혈관 사건은 Tasigna 300mg 및 400mg 1일 2회 투여군 환자의 각각 9% 및 15%, 이마티닙 투여군의 3.2%에서 발생했습니다. 여기에는 허혈성 심장 질환 관련 심장 사건(Tasigna 300mg 및 400mg 1일 2회 투여군에서 각각 5% 및 9%, 이마티닙 투여군에서 2.5%), 말초 동맥 폐색 질환(Tasigna 300mg 및 400mg 1일 2회 투여군에서 각각 3.6% 및 2.9%, 이마티닙 투여군에서 0%), 허혈성 뇌혈관 사건(Tasigna 300mg 및 400mg 1일 2회 투여군에서 각각 1.4% 및 3.2%, 이마티닙 투여군에서 0.7%)을 포함한 심혈관 사건이 포함되었습니다. 심혈관 사건의 급성 징후 또는 증상이 발생하면 즉시 의료진의 진료를 받도록 환자에게 조언하십시오. 환자의 심혈관 상태를 평가하고 표준 지침에 따라 Tasigna 치료 중 심혈관 위험 요인을 모니터링하고 적극적으로 관리해야 합니다. [투여량 및 투여(2.4) 참조].
5.5
Pancreatitis and Elevated Serum Lipase
Tasigna는 혈청 리파아제 증가를 유발할 수 있습니다. [이상반응(6.1) 참조]. 이전에 췌장염 병력이 있는 환자는 혈청 리파아제 상승 위험이 더 높을 수 있습니다. 리파아제 상승과 함께 복부 증상이 나타나면 투여를 중단하고 췌장염을 배제하기 위한 적절한 진단을 고려하십시오. [투여량 및 투여(2.6) 참조]. 매달 또는 임상적으로 필요에 따라 혈청 리파아제 수치를 검사하십시오.
5.6
Hepatotoxicity
Tasigna는 빌리루빈, 아스파르테이트 아미노전이효소(AST), 알라닌 아미노전이효소(ALT) 및 알칼리성 인산분해효소의 상승으로 측정되는 간독성을 유발할 수 있습니다. 소아 환자에서 성인 환자보다 3-4등급의 빌리루빈, AST 및 ALT 상승이 더 자주 보고되었습니다. 매달 또는 임상적으로 필요에 따라 간 기능 검사를 모니터링하십시오. [경고 및 주의사항(5.12) 참조] 용량 조정 후. [투여량 및 투여(2.6) 참조].
5.7
Electrolyte Abnormalities
Tasigna를 사용하면 저인산혈증, 저칼륨혈증, 고칼륨혈증, 저칼슘혈증 및 저나트륨혈증이 발생할 수 있습니다. Tasigna를 시작하기 전과 치료 중에 전해질 이상을 교정하십시오. 치료 중에 이러한 전해질을 정기적으로 모니터링하십시오. [경고 및 주의사항(5.12) 참조].
5.8
종양 용해 증후군
Tasigna로 치료받은 내성 또는 불내성 CML 환자에서 종양 용해 증후군(TLS) 사례가 보고되었습니다. 이러한 사례의 대부분에서 악성 질환 진행, 높은 백혈구 수 및/또는 탈수가 나타났습니다. TLS의 가능성 때문에 Tasigna 치료를 시작하기 전에 적절한 수분 공급을 유지하고 요산 수치를 교정하십시오.
5.9
출혈
Tasigna로 치료받은 CML 환자에서 치명적인 사례를 포함한 심각한 출혈 사건이 발생했습니다. 새롭게 진단된 만성기 Ph+ CML 환자를 대상으로 Tasigna와 imatinib을 비교한 무작위 시험에서 Tasigna 300mg 1일 2회 투여군의 1.1%, Tasigna 400mg 1일 2회 투여군의 1.8%, imatinib 투여군의 0.4%에서 3등급 또는 4등급 출혈이 발생했습니다. 위장관 출혈은 Tasigna 300mg 1일 2회 투여군과 400mg 1일 2회 투여군에서 각각 2.9%와 5%의 환자에서 발생했으며, imatinib 투여군에서는 1.4%의 환자에서 발생했습니다. 3등급 또는 4등급 사건은 Tasigna 300mg 1일 2회 투여군과 400mg 1일 2회 투여군에서 각각 0.7%와 1.4%의 환자에서 발생했으며, imatinib 투여군에서는 발생하지 않았습니다. 출혈의 징후와 증상을 모니터링하고 필요에 따라 의학적으로 관리하십시오.
5.10
전체 위절제술
전체 위절제술을 받은 환자의 경우 Tasigna 노출이 감소하므로 이러한 환자를 더 자주 모니터링하십시오. 전체 위절제술을 받은 환자의 경우 용량 증량 또는 대체 요법을 고려하십시오. [see Clinical Pharmacology (12.3)].
5.11
유당
캡슐에는 유당이 포함되어 있으므로 드문 유전적 갈락토스 불내성, 심각한 유당분해효소 결핍증, 유당 함유 제품에 대한 심각한 불내성 또는 포도당-갈락토스 흡수장애가 있는 환자에게는 Tasigna를 권장하지 않습니다.
5.12
모니터링 검사
처음 2개월 동안 2주마다, 그 이후에는 매달 전혈구 수를 검사해야 합니다. 치료 전과 정기적으로 전해질, 칼슘, 마그네슘, 간 효소, 지질 프로필 및 포도당을 포함한 화학 패널을 수행하십시오. 심전도는 기준선, 시작 후 7일째, 그 이후 정기적으로, 그리고 용량 조정 후에 얻어야 합니다. [see Warnings and Precautions (5.2)]. Tasigna 치료 첫 해 동안 정기적으로, 만성 치료 중에는 최소 연 1회 지질 프로필과 포도당을 모니터링하십시오. 지질 상승을 치료하기 위해 HMG-CoA 환원효소 억제제(지질 저하제)로 치료해야 하는 경우 특정 HMG-CoA 환원효소 억제제는 CYP3A4 경로에 의해 대사되므로 치료를 시작하기 전에 약물 상호 작용 가능성을 평가하십시오. [see Drug Interactions (7.1)]. Tasigna 치료를 시작하기 전에 포도당 수치를 평가하고 치료 중에 임상적으로 필요에 따라 모니터링하십시오. 검사 결과에 따라 치료가 필요한 경우 의사는 해당 지역의 표준 관행 및 치료 지침을 따라야 합니다.
5.13
체액 저류
새롭게 진단된 만성기 Ph+ CML 환자를 대상으로 한 무작위 시험에서 중증(3등급 또는 4등급) 체액 저류는 Tasigna 300mg 1일 2회 투여군과 400mg 1일 2회 투여군에서 각각 3.9%와 2.9%에서 발생했으며, imatinib 투여군에서는 2.5%에서 발생했습니다. 삼출(흉막 삼출, 심낭 삼출, 복수 포함) 또는 폐부종은 Tasigna 300mg 1일 2회 투여군과 400mg 1일 2회 투여군에서 각각 2.2%와 1.1%에서 관찰되었으며, imatinib 투여군에서는 2.1%에서 관찰되었습니다. 삼출은 Tasigna 300mg 1일 2회 투여군과 400mg 1일 2회 투여군에서 각각 0.7%와 0.4%에서 중증(3등급 또는 4등급)이었으며, imatinib 투여군에서는 발생하지 않았습니다. 시판 후 보고에서도 유사한 사례가 관찰되었습니다. Tasigna 치료 중 심각한 체액 저류 징후(예: 예상치 못한 급격한 체중 증가 또는 부종) 및 호흡기 또는 심장 손상 증상(예: 호흡 곤란)이 있는지 환자를 모니터링하고 원인을 평가하고 그에 따라 환자를 치료하십시오.
5.14
소아 환자의 성장 및 발달에 미치는 영향
Tasigna로 치료받은 만성기 Ph+ CML 소아 환자에서 성장 지연이 보고되었습니다. 중앙값 노출 기간이 56.7개월인 만성기 Ph+ CML 소아 환자 58명을 대상으로 한 소아 임상시험에서 8명의 환자에서 성장 감소(기준선에서 최소 두 개의 주요 신장 백분위수 선 교차)가 관찰되었습니다. 5명(9%)은 기준선에서 두 개의 주요 백분위수 선을 교차했고 3명(5%)은 기준선에서 세 개의 주요 백분위수 선을 교차했습니다(백분위수 선: 5번째, 10번째, 25번째, 50번째, 75번째, 90번째, 95번째). 성장 감소는 기준선에서 12세 미만의 어린이에서 더 두드러졌습니다. 성장 지연과 관련된 이상 반응은 3명(5%)의 환자에서 보고되었습니다. Tasigna 치료를 받는 소아 환자의 성장과 발달을 모니터링하십시오.
5.15
배아-태아 독성 (Embryo-Fetal Toxicity)
동물 연구 결과 및 작용 기전에 따르면, Tasigna는 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. 동물 생식 연구에서, 임신한 쥐와 토끼에게 기관 형성 기간 동안 nilotinib를 투여한 결과, 권장 용량을 투여받는 환자의 AUC의 약 2배 및 0.5배에 해당하는 모체 AUC에서 각각 쥐의 배아-태아 치사율/태아 영향 (작은 신유두, 태아 부종 및 골격 변이) 및 토끼의 태아 흡수 증가 및 태아 골격 변이를 포함한 부작용 발생 결과가 나타났습니다. 임산부에게 태아에게 미칠 수 있는 잠재적 위험에 대해 알려주십시오.
가임기 여성에게는 치료 중 및 마지막 복용 후 14일 동안 효과적인 피임법을 사용하도록 권고하십시오. [특정 집단에서의 사용 (8.1, 8.3), 임상 약리학 (12.1) 참조].
5.16
BCR-ABL 전사 수준 모니터링
Tasigna 투여를 중단한 환자의 BCR-ABL 전사 수준 모니터링
최소 MR4.5 (BCR-ABL/ABL ≤ 0.0032% IS)의 민감도로 분자 반응 수준을 측정하기 위해 검증된 FDA 승인 검사를 사용하여 치료 중단 자격이 있는 환자의 BCR-ABL 전사 수준을 모니터링하십시오. Tasigna 치료를 중단한 환자의 경우, 치료 중단 기간 동안 1년 동안 매달 BCR-ABL 전사 수준을 평가하고, 그 후 2년 동안 6주마다, 그리고 그 이후에는 12주마다 평가하십시오. [임상 연구 (14.3, 14.4), 용량 및 투여 (2.2) 참조].
새롭게 진단받은 환자는 주요 분자 반응 (MMR, MR3.0 또는 = BCR-ABL/ABL ≤ 0.1% IS에 해당) 소실 후 4주 이내에 Tasigna 치료를 다시 시작해야 합니다.
이전에 imatinib를 포함한 치료에 내성이 있거나 불내성인 환자는 MMR 소실 또는 MR4.0의 확진된 소실 (최소 4주 간격으로 MR4.0 소실을 보이는 두 번의 연속 측정, = BCR-ABL/ABL ≤ 0.01% IS에 해당) 후 4주 이내에 Tasigna 치료를 다시 시작해야 합니다.
치료 재개 후 3개월 이내에 MMR을 달성하지 못한 환자의 경우, BCR-ABL 키나제 도메인 돌연변이 검사를 수행해야 합니다.
분자 반응 소실 후 치료를 재개시한 환자의 BCR-ABL 전사 수준 모니터링
분자 반응 정량화 소실로 인해 Tasigna 치료를 재개시한 환자의 경우, 주요 분자 반응이 다시 확립될 때까지 4주마다, 그 후에는 12주마다 CBC 및 BCR-ABL 전사체를 모니터링하십시오.
6 부작용 반응
다음과 같은 임상적으로 중요한 이상 반응이 Tasigna에서 발생할 수 있으며, 이는 라벨의 다른 섹션에서 자세히 설명되어 있습니다.
- 골수억제 [경고 및 주의 사항 (5.1) 참조]
- QT 연장 [경고, 경고 및 주의 사항 (5.2) 참조]
- 돌연사 [경고, 경고 및 주의 사항 (5.3) 참조]
- 심혈관 및 동맥 혈관 폐쇄성 질환 [경고 및 주의 사항 (5.4) 참조]
- 췌장염 및 혈청 리파제 상승 [경고 및 주의 사항 (5.5) 참조]
- 간독성 [경고 및 주의 사항 (5.6) 참조]
- 전해질 이상 [경고, 경고 및 주의 사항 (5.7) 참조]
- 출혈 [경고 및 주의 사항 (5.9) 참조]
- 체액 저류 [경고 및 주의 사항 (5.13) 참조]
6.1
임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되기 때문에, 약물의 임상 시험에서 관찰된 이상 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 관찰된 발생률을 반영하지 않을 수 있습니다.
새로 진단받은 Ph+ CML-CP 성인 환자
아래 데이터는 권장 용량인 1일 2회 300mg으로 치료받은 새로 진단받은 Ph+ 만성기 CML 환자(n = 279)의 무작위 시험에서 Tasigna 노출을 반영합니다. Tasigna 1일 2회 300mg 투여군의 중앙값 치료 기간은 61개월(범위, 0.1~71개월)이었습니다. Tasigna 1일 2회 300mg 투여군의 중앙값 실제 용량 강도는 1일 593mg이었습니다.
가장 흔한(10% 초과) 비혈액학적 이상 약물 반응은 발진, 가려움증, 두통, 메스꺼움, 피로, 탈모, 근육통 및 상복부 통증이었습니다. 변비, 설사, 건조한 피부, 근육 경련, 관절통, 복통, 말초 부종, 구토 및 무력증은 덜 흔하게(10% 이하 및 5% 초과) 관찰되었으며, 경증에서 중등도의 중증도였고, 관리 가능했으며 일반적으로 용량 감소가 필요하지 않았습니다.
기준치보다 60msec 초과하는 QTcF 증가는 1일 2회 300mg 투여군에서 1명의 환자(0.4%)에서 관찰되었습니다. 연구 약물 복용 중에 500msec를 초과하는 절대 QTcF를 가진 환자는 없었습니다.
가장 흔한 혈액학적 이상 약물 반응(모든 등급)은 다음을 포함한 골수억제였습니다. 혈소판 감소증(18%), 호중구 감소증(15%), 빈혈(8%). 3/4등급 실험실 이상에 대해서는 표 9를 참조하십시오.
연구 약물과의 관계에 관계없이 이상 반응으로 인한 치료 중단은 환자의 10%에서 관찰되었습니다.
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자
단일군, 공개, 다기관 임상 시험에서 이마티닙을 포함한 이전 치료법에 내성이 있거나 불내성인 Ph+ CML-CP 및 CML-AP 환자 총 458명(CML-CP = 321명; CML-AP = 137명)이 권장 용량인 1일 2회 400mg으로 치료받았습니다.
CML-CP 및 CML-AP 환자의 중앙값 노출 기간(일)은 각각 561일(범위, 1~1096일) 및 264일(범위, 2~1160일)입니다. CML-CP 및 CML-AP 환자의 중앙값 용량 강도는 각각 1일 789mg(범위, 151~1110mg) 및 1일 780mg(범위, 150~1149mg)이며, 계획된 1일 2회 400mg 투여에 해당합니다.
CML-CP 환자의 용량 중단 누적 기간(일) 중앙값은 20일(범위, 1~345일)이었고, CML-AP 환자의 용량 중단 기간(일) 중앙값은 23일(범위, 1~234일)이었습니다.
CML-CP 환자에서 가장 흔하게 보고된 비혈액학적 이상 약물 반응(10% 이상)은 발진, 가려움증, 메스꺼움, 피로, 두통, 변비, 설사, 구토 및 근육통이었습니다. 흔한 심각한 약물 관련 이상 반응(1% 이상 및 10% 미만)은 혈소판 감소증, 호중구 감소증 및 빈혈이었습니다.
CML-AP 환자에서 가장 흔하게 보고된 비혈액학적 이상 약물 반응(10% 이상)은 발진, 가려움증 및 피로였습니다. 흔한 심각한 이상 약물 반응(1% 이상 및 10% 미만)은 혈소판 감소증, 호중구 감소증, 발열성 호중구 감소증, 폐렴, 백혈구 감소증, 두개내 출혈, 리파제 상승 및 발열이었습니다.
돌연사 및 QT 연장이 보고되었습니다. 정상 상태에서 기준치로부터 최대 평균 QTcF 변화는 10msec였습니다. 기준치보다 60msec 초과하는 QTcF 증가는 환자의 4.1%에서 관찰되었고, 500msec를 초과하는 QTcF는 4명의 환자(1% 미만)에서 관찰되었습니다 [경고, 경고 및 주의 사항 (5.2, 5.3), 임상 약리학 (12.2) 참조].
이상 약물 반응으로 인한 치료 중단은 CML-CP 환자의 16%와 CML-AP 환자의 10%에서 관찰되었습니다.
가장 빈번하게 보고된 이상 반응
표 7과 8은 연구 약물과의 관계에 관계없이 비혈액학적 이상 반응(실험실 이상 제외)을 경험한 성인 환자의 비율을 보여줍니다. Tasigna를 최소 1회 이상 투여받은 성인 환자의 10% 이상에서 보고된 이상 반응이 나열되어 있습니다.
| 약어: CML-CP, 만성 골수성 백혈병-만성기; Ph+, 필라델피아 염색체 양성. a실험실 이상 제외. bNCI 일반 용어 기준(CTC) 이상 사건, 버전 3.0. |
|||||||||||
| 새로 진단받은 Ph+ CML-CP 환자 | |||||||||||
| Tasigna 300 mg 1일 2회 |
이마티닙 400 mg 1일 1회 |
Tasigna 300 mg 1일 2회 |
이마티닙 400 mg 1일 1회 |
||
| N = 279 | N = 280 | N = 279 | N = 280 | ||
| 신체계통 및 이상반응 | 모든 등급 (%) | CTC 등급b 3/4 (%) | |||
| 피부 및 피하조직 장애 | 발진 | 38 | 19 | < 1 | 2 |
| 가려움증 | 21 | 7 | < 1 | 0 | |
| 탈모 | 13 | 7 | 0 | 0 | |
| 건조한 피부 | 12 | 6 | 0 | 0 | |
| 위장관 장애 | 오심 | 22 | 41 | 2 | 2 |
| 변비 | 20 | 8 | < 1 | 0 | |
| 설사 | 19 | 46 | 1 | 4 | |
| 구토 | 15 | 27 | < 1 | < 1 | |
| 상복부 통증 | 18 | 14 | 1 | < 1 | |
| 복통 | 15 | 12 | 2 | 0 | |
| 소화불량 | 10 | 12 | 0 | 0 | |
| 신경계 장애 | 두통 | 32 | 23 | 3 | < 1 |
| 현기증 | 12 | 11 | < 1 | < 1 | |
| 일반 장애 및 투여 부위 이상 | 피로 | 23 | 20 | 1 | 1 |
| 발열 | 14 | 13 | < 1 | 0 | |
| 쇠약 | 14 | 12 | < 1 | 0 | |
| 말초 부종 | 9 | 20 | < 1 | 0 | |
| 안면 부종 | < 1 | 14 | 0 | < 1 | |
| 근골격계 및 결합조직 장애 | 근육통 | 19 | 19 | < 1 | < 1 |
| 관절통 | 22 | 17 | < 1 | < 1 | |
| 근육 경련 | 12 | 34 | 0 | 1 | |
| 사지 통증 | 15 | 16 | < 1 | < 1 | |
| 요통 | 19 | 17 | 1 | 1 | |
| 호흡기, 흉부 및 종격동 장애 | 기침 | 17 | 13 | 0 | 0 |
| 구인두 통증 | 12 | 6 | 0 | 0 | |
| 호흡곤란 | 11 | 6 | 2 | < 1 | |
| 감염 및 기생충 감염 | 비인두염 | 27 | 21 | 0 | 0 |
| 상기도 감염 | 17 | 14 | < 1 | 0 | |
| 인플루엔자 | 13 | 9 | 0 | 0 | |
| 위장염 | 7 | 10 | 0 | < 1 | |
| 안과 질환 | 안검 부종 | 1 | 19 | 0 | < 1 |
| 안와 주위 부종 | < 1 | 15 | 0 | 0 | |
| 정신 장애 | 불면증 | 11 | 9 | 0 | 0 |
| 혈관 장애 | 고혈압 | 10 | 4 | 1 | < 1 |
| 약어: CML-AP, 만성 골수성 백혈병-급성기; CML-CP, 만성 골수성 백혈병-만성기; Ph+, 필라델피아 염색체 양성. a검사실 이상 제외. bNCI 이상 사례에 대한 일반 용어 기준, version 3.0. c선호 용어인 식욕부진도 포함. |
|||||||||||
| 신체계 및 이상반응 | CML-CP | CML-AP | |||||||||
| N = 321 | N = 137 | ||||||||||
| 모든 등급 (%) | CTC 등급b 3/4 (%) | 모든 등급 (%) | CTC 등급b 3/4 (%) | ||||||||
| 피부 및 피하 조직 장애 | 발진 | 36 | 2 | 29 | 0 | ||||||
| 가려움증 | 32 | < 1 | 20 | 0 | |||||||
| 야간 발한 | 12 | < 1 | 27 | 0 | |||||||
| 탈모 | 11 | 0 | 12 | 0 | |||||||
| 위장 장애 | 오심 | 37 | 1 | 22 | < 1 | ||||||
| 변비 | 26 | < 1 | 19 | 0 | |||||||
| 설사 | 28 | 3 | 24 | 2 | |||||||
| 구토 | 29 | < 1 | 13 | 0 | |||||||
| 복통 | 15 | 2 | 16 | 3 | |||||||
| 상복부 통증 | 14 | < 1 | 12 | < 1 | |||||||
| 소화불량 | 10 | < 1 | 4 | 0 | |||||||
| 신경계 장애 | 두통 | 35 | 2 | 20 | 1 | ||||||
| 일반 장애 및 투여 부위 상태 | 피로 | 32 | 3 | 23 | < 1 | ||||||
| 발열 | 22 | < 1 | 28 | 2 | |||||||
| Asthenia | 16 | 0 | 14 | 1 | |
| 말초 부종 | 15 | < 1 | 12 | 0 | |
| 근골격계 및 결합조직 장애 | 근육통 | 19 | 2 | 16 | < 1 |
| 관절통 | 26 | 2 | 16 | 0 | |
| 근육 경련 | 13 | < 1 | 15 | 0 | |
| 골통 | 14 | < 1 | 15 | 2 | |
| 사지 통증 | 20 | 2 | 18 | 1 | |
| 요통 | 17 | 2 | 15 | < 1 | |
| 근골격계 통증 | 11 | < 1 | 12 | 1 | |
| 호흡기, 흉부 및 종격동 장애 | 기침 | 27 | < 1 | 18 | 0 |
| 호흡곤란 | 15 | 2 | 9 | 2 | |
| 구인두 통증 | 11 | 0 | 7 | 0 | |
| 감염 및 기생충 감염 | 비인두염 | 24 | < 1 | 15 | 0 |
| 상기도 감염 | 12 | 0 | 10 | 0 | |
| 대사 및 영양 장애 | 식욕 감퇴c | 15 | < 1 | 17 | < 1 |
| 정신 장애 | 불면증 | 12 | 1 | 7 | 0 |
| 혈관 장애 | 고혈압 | 10 | 2 | 11 | < 1 |
검사치 이상
표 9는 Tasigna를 최소 1회 이상 투여받은 성인 환자에서 치료로 인해 발생한 3/4등급 검사치 이상의 비율을 보여줍니다.
| 약어: ALT 알라닌 아미노전달효소; AST, 아스파르트산 아미노전달효소; CML-AP, 만성 골수성 백혈병-급성기; CML-CP, 만성 골수성 백혈병-만성기; Ph+, 필라델피아 염색체 양성. *NCI 유해사례 공통 용어 기준, version 3.0. 1CML-CP: 혈소판 감소증: 12%가 3등급, 18%가 4등급이었습니다. 2CML-CP: 호중구 감소증: 16%가 3등급, 15%가 4등급이었습니다. 3CML-AP: 혈소판 감소증: 11%가 3등급, 32%가 4등급이었습니다. 4CML-AP: 호중구 감소증: 16%가 3등급, 26%가 4등급이었습니다. |
|||||||||||
| 환자군 | |||||||||||
| 신규 진단 성인 Ph+ CML-CP | 내성 또는 불내성 성인 Ph+ | ||||||||||
| CML-CP | CML-AP | ||||||||||
| Tasigna 300 mg 1일 2회 N = 279 (%) |
이마티닙 400 mg 1일 1회 N = 280 (%) |
Tasigna 400 mg 1일 2회 N = 321 (%) |
Tasigna 400 mg 1일 2회 N = 137 (%) |
||||||||
| 혈액학적 지표 | |||||||||||
| 혈소판 감소증 | 10 | 9 | 301 | 423 | |||||||
| 호중구 감소증 | 12 | 22 | 312 | 424 | |||||||
| 빈혈 | 4 | 6 | 11 | 27 | |||||||
| 생화학적 지표 | |||||||||||
| 리파제 증가 | 9 | 4 | 18 | 18 | |||||||
| 고혈당 | 7 | < 1 | 12 | 6 | |||||||
| 저인산혈증 | 8 | 10 | 17 | 15 | |||||||
| 빌리루빈 (총) 증가 | 4 | < 1 | 7 | 9 | |||||||
| SGPT (ALT) 증가 | 4 | 3 | 4 | 4 | |||||||
| 고칼륨혈증 | 2 | 1 | 6 | 4 | |||||||
| 저나트륨혈증 | 1 | < 1 | 7 | 7 | |||||||
| 저칼륨혈증 | < 1 | 2 | 2 | 9 | |||||||
| SGOT (AST) 증가 | 1 | 1 | 3 | 2 | |||||||
| 알부민 감소 | 0 | < 1 | 4 | 3 |
| 저칼슘혈증 | < 1 | < 1 | 2 | 5 |
| 알칼리성 인산가수분해효소 증가 | 0 | < 1 | < 1 | 1 |
| 크레아티닌 증가 | 0 | < 1 | < 1 | < 1 |
총 콜레스테롤 상승 (모든 등급)은 Tasigna 300mg 1일 2회 복용군에서 28%, 이마티닙 복용군에서 4%에서 발생했습니다. 중성지방 상승 (모든 등급)은 Tasigna 및 이마티닙 군 환자에서 각각 12% 및 8%에서 발생했습니다. 고혈당증 (모든 등급)은 Tasigna 및 이마티닙 군 환자에서 각각 50% 및 31%에서 발생했습니다.
가장 흔한 생화학 검사 이상 (모든 등급)은 알라닌 아미노전달효소 증가 (72%), 혈액 빌리루빈 증가 (59%), 아스파르트산 아미노전달효소 증가 (47%), 리파아제 증가 (28%), 혈당 증가 (50%), 혈중 콜레스테롤 증가 (28%), 혈중 중성지방 증가 (12%)였습니다.
지속적인 분자 반응 (MR4.5)을 달성한 Ph+ CML-CP 환자에서의 치료 중단
지속적인 분자 반응 (MR4.5) 달성 후 Tasigna 치료를 중단한 적격 환자에서 표 10에 나타낸 바와 같이 치료 중단 후 첫 해에 치료 중단 전보다 근골격계 증상 (예: 근육통, 사지 통증, 관절통, 골통, 척추 통증 또는 근골격계 통증)이 더 자주 보고되었습니다. 근골격계 증상 발생률은 일반적으로 치료 중단 후 2년차에 감소했습니다.
TFR 단계 중 언제든지 근골격계 증상이 발생한 신규 진단 환자군에서 53명 중 23명 (43%)은 TFR 종료일 또는 데이터 컷오프일까지 해결되지 않았습니다. 이마티닙으로 이전에 치료받은 환자군에서 TFR 단계 중 언제든지 근골격계 증상이 발생한 경우, 57명 중 32명 (56%)이 데이터 컷오프일까지 해결되지 않았습니다.
Tasigna 재치료 (NTRI) 단계에 진입한 환자의 근골격계 증상 발생률은 신규 진단 환자군에서 88명 중 11명 (13%), 이마티닙으로 이전에 치료받은 환자군에서 56명 중 14명 (25%)로 감소했습니다. Tasigna 재치료 단계에서 관찰된 다른 이상 반응은 신규 진단 Ph+ CML-CP 환자, 내성 또는 불내성 Ph+ CML-CP 및 CML-AP 환자에서 Tasigna 사용 중 관찰된 이상 반응과 유사했습니다.
| 약어: CML-CP, 만성 골수성 백혈병-만성기; Ph+, 필라델피아 염색체 양성; TFR, 무치료 관해. | |||||||||||
| 모든 TFR 환자의 전체 TFR 기간 | 48주 이상 TFR인 환자 하위 집단에서 시간 간격별 | ||||||||||
| Ph+ CML-CP 환자 |
N |
TFR 중앙 추적 기간 | 근골격계 증상이 있는 환자 |
N |
Tasigna 중단 전 1년 |
Tasigna 중단 후 1st년 |
Tasigna 중단 후 2nd년 |
||||
| 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 | ||||
| 신규 진단 |
190 |
76주 |
28% |
1% |
100 |
17% |
0% |
34% |
2% |
9% |
0% |
| 이마티닙으로 이전에 치료받음 |
126 |
99주 |
45% |
2% |
73 |
14% |
0% |
48% |
3% |
15% |
1% |
임상시험 추가 자료
다음 약물 이상 반응은 Tasigna 임상 연구에서 권장 용량으로 투여받은 성인 환자에게서 보고되었습니다. 이러한 약물 이상 반응은 빈도에 따라 분류되며, 가장 빈번한 것부터 다음 규칙을 사용하여 순위가 매겨집니다. 흔한(1% 이상 10% 미만), 드문(0.1% 이상 1% 미만), 빈도 불명(단일 사례). 표 7과 8에 포함되지 않은 매우 흔한(10% 이상) 실험실 이상 또한 보고됩니다. 이러한 이상 반응은 임상적 관련성을 기반으로 포함되며, 각 범주 내에서 심각도가 감소하는 순서대로 순위가 매겨집니다. 2건의 임상 연구에서 얻은 자료입니다.
1. 새로 진단받은 Ph+ CML-CP 성인 환자 60개월 분석 및,
2. 내성 또는 불내성 Ph+ CML-CP 및 CMP-AP 성인 환자 24개월 분석.
감염: 흔한: 모낭염. 드문: 폐렴, 기관지염, 요로 감염, 칸디다증(구강 칸디다증 포함). 빈도 불명: B형 간염 재활성화, 패혈증, 피하 농양, 항문 농양, 종기, 무좀.
신생물(양성, 악성 및 불명): 흔한: 피부 유두종. 빈도 불명: 구강 유두종, 단백질혈증.
혈액 및 림프계 장애: 흔한: 백혈구 감소증, 호산구 증가증, 발열성 호중구 감소증, 전혈구 감소증, 림프구 감소증. 빈도 불명: 혈소판 증가증, 백혈구 증가증.
면역계 장애: 빈도 불명: 과민증.
내분비 장애: 드문: 갑상선 기능 항진증, 갑상선 기능 저하증. 빈도 불명: 이차성 부갑상선 기능 항진증, 갑상선염.
대사 및 영양 장애: 매우 흔한: 저인산혈증. 흔한: 전해질 불균형(저마그네슘혈증, 고칼륨혈증, 저칼륨혈증, 저나트륨혈증, 저칼슘혈증, 고칼슘혈증, 고인산혈증 포함), 당뇨병, 고혈당증, 고콜레스테롤혈증, 고지혈증, 고중성지방혈증. 드문: 통풍, 탈수, 식욕 증가. 빈도 불명: 고요산혈증, 저혈당증.
정신 장애: 흔한: 우울증, 불안. 빈도 불명: 방향 감각 상실, 혼돈 상태, 기억 상실, 불쾌감.
신경계 장애: 흔한: 말초 신경병증, 감각 저하, 감각 이상. 드문: 두개내 출혈, 허혈성 뇌졸중, 일과성 허혈 발작, 뇌경색, 편두통, 의식 상실(실신 포함), 진전, 주의력 장애, 감각 과민, 안면 마비. 빈도 불명: 기저 동맥 협착, 뇌 부종, 시신경염, 무기력증, 감각 이상, 불안한 다리 증후군.
안과적 장애: 흔한: 안구 출혈, 안구 소양증, 결막염, 안구 건조증(건성 안구증 포함). 드문: 시력 장애, 시력 흐림, 시력 감소, 광시증, 충혈(공막, 결막, 안구), 안구 자극, 결막 출혈. 빈도 불명: 유두 부종, 복시, 광선 공포증, 안구 부종, 결막염, 안구 통증, 맥락망막병증, 알레르기성 결막염, 안구 표면 질환.
이 및 미로 장애: 흔한: 현기증. 빈도 불명: 청력 장애, 귀 통증, 이명.
심장 장애: 흔한: 협심증, 부정맥(방실 블록, 심방세동, 기외수축, 심방세동, 빈맥, 서맥 포함), 두근거림, QT 연장 심전도. 드문: 심부전, 심근 경색, 관상 동맥 질환, 심잡음, 관상 동맥 협착, 심근 허혈, 심낭 삼출, 청색증. 빈도 불명: 심실 기능 장애, 심낭염, 박출 분획 감소.
혈관 장애: 흔한: 홍조. 드문: 고혈압 위기, 말초 동맥 폐쇄성 질환, 간헐적 파행, 사지 동맥 협착, 혈종, 동맥 경화증. 빈도 불명: 출혈성 쇼크, 저혈압, 혈전증, 말초 동맥 협착.
호흡기, 흉부 및 종격동 장애: 흔한: 운동성 호흡 곤란, 코피, 발성 장애. 드문: 폐부종, 흉막 삼출, 간질성 폐 질환, 흉막통, 흉막염, 인두후두통, 인후 자극. 빈도 불명: 폐 고혈압, 천명.
위장 장애: 흔한: 췌장염, 복통, 복부 팽만, 미각 이상, 팽만감. 드문: 위장 출혈, 흑색 변, 구강 궤양, 위식도 역류, 구내염, 식도 통증, 구강 건조증, 위염, 치아 민감성. 빈도 불명: 위장 궤양 천공, 복막후 출혈, 토혈, 위궤양, 궤양성 식도염, 아급성 장폐색, 장염, 치질, 열공 헤르니아, 직장 출혈, 치은염.
간담도 장애: 매우 흔한: 고빌리루빈혈증. 흔한: 간 기능 이상. 드문: 간독성, 독성 간염, 황달. 빈도 불명: 담즙 정체, 간 비대.
피부 및 피하 조직 장애: 흔한: 습진, 두드러기, 홍반, 다한증, 타박상, 여드름, 피부염(알레르기성, 박탈성 및 여드름성 포함). 드문: 박탈성 발진, 약물 발진, 피부 통증, 반상 출혈. 빈도 불명: 건선, 다형 홍반, 결절 홍반, 피부 궤양, 수장 홍반 각화증, 자반증, 광과민증, 수포, 진피낭종, 피지선 증식증, 피부 위축, 피부 변색, 피부 박리, 피부 색소 침착, 피부 비대, 각화증.
근골격계 및 결합 조직 장애: 흔한: 골통, 근골격계 흉통, 근골격계 통증, 요통, 경부 통증, 측복부 통증, 근육 약화. 드문: 근골격계 강직, 관절 부종. 빈도 불명: 관절염.
신장 및 비뇨기 장애: 흔한: 빈뇨. 드문: 배뇨곤란, 급박뇨, 야뇨. 빈도 불명: 신부전, 혈뇨, 요실금, 색뇨.
생식기계 및 유방 장애: 드문: 유방 통증, 여성형 유방, 발기 부전. 빈도 불명: 유방 경화, 월경 과다, 유두 부종.
일반 장애 및 투여 부위 상태: 흔함: 발열, 흉통(비심장성 흉통 포함), 통증, 흉부 불편감, 권태감. 흔하지 않음: 중력 부종, 인플루엔자 유사 질환, 오한, 체온 변화 감지(열감, 추위감 포함). 빈도 불명: 국소 부종.
검사: 매우 흔함: 알라닌 아미노전달효소 증가, 아스파르트산 아미노전달효소 증가, 리파제 증가, 지단백 콜레스테롤(매우 저밀도 및 고밀도 포함) 증가, 총 콜레스테롤 증가, 혈중 트리글리세라이드 증가. 흔함: 헤모글로빈 감소, 혈중 아밀라아제 증가, 감마-글루타밀전달효소 증가, 혈중 크레아틴 키나아제 증가, 혈중 알칼리성 인산가수분해효소 증가, 체중 감소, 체중 증가, 글로불린 감소. 흔하지 않음: 혈중 젖산 탈수소효소 증가, 혈중 요소 증가. 빈도 불명: 트로포닌 증가, 혈중 비결합 빌리루빈 증가, 인슐린 C-펩타이드 감소, 혈중 부갑상선 호르몬 증가.
신규 진단된 Ph+ CML-CP 또는 내성 또는 불내성 Ph+ CML-CP 소아 환자
아래 데이터는 2세 이상 18세 미만의 신규 진단된 Ph+ CML-CP 또는 이마티닙/다사티닙 내성 또는 불내성 Ph+ CML-CP 소아 환자에서 권장 용량인 1일 2회 230 mg/m2로 치료받은 두 연구(n = 69)의 Tasigna 노출을 반영합니다 [임상 연구(14.5) 참조]. Tasigna 치료 중앙값 기간은 39.6개월(범위, 0.7~63.5개월)이었습니다. 중앙값 실제 용량 강도는 427.7 mg/m2/일(범위 149.1~492.8 mg/m2/일)이었고, 중앙값 상대 용량 강도는 93%(범위, 32.4~107.1%)였습니다. 39명(57%)의 환자는 90%를 초과하는 상대 용량 강도를 보였습니다.
Ph+ CML-CP 소아 환자에서 가장 흔한(20% 초과) 비혈액학적 이상 반응은 고빌리루빈혈증, 두통, 알라닌 아미노전달효소 증가, 발진, 발열, 오심, 아스파르트산 아미노전달효소 증가, 사지 통증, 상기도 감염, 구토, 설사 및 비인두염이었습니다. 가장 흔한(5% 초과) 3/4등급 비혈액학적 이상 반응은 고빌리루빈혈증, 발진, 알라닌 아미노전달효소 증가 및 호중구 감소증이었습니다.
고빌리루빈혈증(3/4등급: 16%) 및 트랜스아미나제 상승(AST 3/4등급: 2.9%, ALT 3/4등급: 10%)과 같은 이상 검사 결과는 성인 환자보다 더 높은 빈도로 보고되었습니다.
가장 흔한 혈액학적 이상 검사 결과(모든 등급의 환자 중 30% 이상)는 백혈구 총수 감소(54%), 혈소판 수 감소(44%), 절대 호중구 감소(44%), 헤모글로빈 감소(38%) 및 절대 림프구 감소(36%)였습니다.
이상 반응으로 인한 연구 치료 중단은 15명(22%)의 환자에서 발생했습니다. 중단으로 이어진 가장 빈번한 이상 반응은 고빌리루빈혈증(9%) 및 발진(6%)이었습니다.
기준치보다 30msec 이상 증가한 QTcF는 19명(28%)의 환자에서 관찰되었습니다. 어떤 환자도 500msec를 초과하는 절대 QTcF 또는 기준치보다 60msec를 초과하는 QTcF 증가를 보이지 않았습니다.
소아 인구에서의 성장 지연
Tasigna로 치료받은 신규 진단 또는 내성 Ph+ CML-CP 소아 환자 58명을 대상으로 한 다기관, 공개, 단일군 연구에서 중앙값 노출 기간이 56.7개월인 경우 키에 대한 성장 및 성장 둔화와 관련된 이상 반응이 3명(5%)의 환자에서 보고되었습니다. 이상 반응에는 2명의 청소년 환자의 성장 지연과 나머지 환자(연령 범주: 아동)의 성장 호르몬 결핍과 저신장이 포함됩니다. 58명의 소아 환자 중 5명(9%)은 기준치에서 두 개의 주요 백분위수 선을 넘었고 3명(5%)은 기준치에서 세 개의 주요 백분위수 선을 넘었습니다(백분위수 선: 5th, 10th, 25th, 50th, 75th, 90th, 및 95th). Tasigna 치료 중 소아 환자의 성장을 면밀히 모니터링하는 것이 권장됩니다 [경고 및 주의 사항(5.14) 참조].
6.2
시판 후 경험
다음 이상 반응은 Tasigna의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
혈액 및 림프계 장애: 혈전성 미세 혈관 병증
신경계 장애: 안면 마비
근골격계 및 결합 조직 장애: 골괴사
7 약물 상호 작용
7.1
타시그나에 대한 다른 약물의 효과
강력한 CYP3A 저해제
강력한 CYP3A 저해제와 병용 투여 시 타시그나 단독 투여와 비교하여 닐로티닙 농도가 증가하였습니다 [임상 약리 (12.3) 참조]. 이는 타시그나 독성의 위험을 증가시킬 수 있습니다. 타시그나와 강력한 CYP3A 저해제의 병용 투여는 피하십시오. 환자에게 강력한 CYP3A4 저해제를 병용 투여해야 하는 경우 타시그나 용량을 감소시키십시오 [용법 및 용량 (2.8) 참조].
강력한 CYP3A 유도제
강력한 CYP3A 유도제와 병용 투여 시 타시그나 단독 투여와 비교하여 닐로티닙 농도가 감소하였습니다 [임상 약리 (12.3) 참조]. 이는 타시그나의 효능을 감소시킬 수 있습니다. 타시그나와 강력한 CYP3A 유도제의 병용 투여는 피하십시오.
프로톤 펌프 억제제
프로톤 펌프 억제제(PPI)와 병용 투여 시 타시그나 단독 투여와 비교하여 닐로티닙 농도가 감소하였습니다 [임상 약리 (12.3) 참조]. 이는 타시그나의 효능을 감소시킬 수 있습니다. 타시그나와 PPI의 병용 투여는 피하십시오. PPI 대신 타시그나 투여 약 10시간 전 또는 약 2시간 후에 H2 차단제를 사용하거나, 타시그나 투여 약 2시간 전 또는 약 2시간 후에 제산제를 사용하십시오.
7.2
QT 간격을 연장하는 약물
항부정맥제와 같이 QT 간격을 연장할 수 있는 약물과 타시그나의 병용 투여는 피하십시오 [경고, 용법 및 용량 (2.4), 경고 및 주의사항 (5.2), 약물 상호작용 (7.1), 임상 약리 (12.2) 참조].
8 특정 집단에서의 사용
8.1
임신
위험 요약
동물 연구 결과 및 작용 기전을 바탕으로, Tasigna는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [임상 약리학 (12.1) 참조]. 약물 관련 위험을 알려주는 임산부에 대한 데이터는 없습니다. 동물 생식 연구에서, 기관 형성 중 임신한 랫트와 토끼에게 nilotinib를 투여하면 배아-태아 치사, 태아 영향 및 랫트와 토끼의 태아 변이를 포함한 유해한 발달 결과가 발생했습니다. 이는 권장 용량으로 투여받은 환자의 노출량 대비 각각 약 2배 및 0.5배의 모체 노출량(AUC)에서 나타났습니다(데이터 참조). 임산부에게 태아에 대한 잠재적 위험을 알려주십시오.
해당 모집단에서 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 유산 또는 기타 유해한 결과의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
데이터
동물 데이터
랫트와 토끼의 배아-태아 발달 연구에서, 임신한 동물은 기관 형성 기간 동안 각각 최대 100 mg/kg/일 및 300 mg/kg/일의 nilotinib 경구 용량을 투여받았습니다.
랫트에서 nilotinib의 경구 투여는 30 mg/kg/일 이상의 용량에서 배아 치사/태아 영향을 유발했습니다. 30 mg/kg/일 이상에서 전두골의 불완전 골화 및 기형 흉골의 골격 변이가 관찰되었고, 작은 신장 유두 및 태아 부종의 발생률이 증가했습니다. 100 mg/kg/일에서 nilotinib는 모체 독성(임신 중량, 임신 자궁 중량, 순 중량 증가 및 식사량 감소)과 관련이 있었고, 구개열 1건 및 창백한 피부 2건이 태아에서 관찰되었습니다. 100 mg/kg/일에서 작은 신장 유두를 보이는 태아에서 요관 확장 1건이 관찰되었습니다. 전족 및 후족 지골 골화되지 않음, 융합된 흉골, 이분 흉골 골화 및 경추의 불완전 골화의 추가 변이가 100 mg/kg/일에서 관찰되었습니다.
토끼에서 nilotinib의 경구 투여는 두 마리의 암컷의 조기 희생, 모체 독성 및 300 mg/kg/일에서 태아 흡수 증가를 초래했습니다. 태아 골격 변이(설골의 불완전 골화, 구부러진 설골, 과잉 짧은 분리된 늑골 및 비골, 전두골 근처 및 흉골 기둥에 추가 골화 부위 존재)도 모체 독성이 있는 이 용량에서 증가했습니다. 100 mg/kg/일에서 약간의 모체 독성이 나타났지만 이 용량에서는 생식 또는 배아-태아 영향이 없었습니다.
랫트의 30 mg/kg/일 및 토끼의 300 mg/kg/일에서 모체 전신 노출(AUC)은 각각 72700 ng*hr/mL 및 17100 ng*hr/mL였으며, 이는 하루 두 번 400mg의 최고 권장 용량으로 투여받은 사람의 노출량의 약 2배 및 0.5배에 해당합니다.
임신한 랫트에 기관 형성 중 및 수유 기간 동안 nilotinib를 투여했을 때, 유해한 영향으로는 더 긴 임신 기간, 이유 시까지 새끼의 체중 감소 및 성숙에 도달했을 때 새끼의 생식 지수 감소가 포함되었으며, 이는 모두 60 mg/kg(즉, 360 mg/m2, 체표면적 기준으로 하루 두 번 400mg의 임상 용량의 약 0.7배)의 모체 용량에서 나타났습니다. 최대 20 mg/kg(즉, 120 mg/m2, 체표면적 기준으로 하루 두 번 400mg의 임상 용량의 약 0.25배)의 용량에서는 모체 동물이나 새끼에게 유해한 영향이 관찰되지 않았습니다.
8.2
수유부
위험 요약
모유에서 nilotinib 또는 그 대사산물의 존재 여부, 수유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 그러나 nilotinib는 수유 랫트의 모유에 존재합니다. 수유아에게 심각한 유해 반응이 발생할 가능성이 있으므로, Tasigna 치료 중 및 마지막 투여 후 14일 동안은 수유하지 않도록 여성에게 권고하십시오.
동물 데이터
수유 랫트에 단일 20 mg/kg의 [14C] nilotinib 용량을 투여한 후, 모유로의 모약물 및 그 대사산물의 전달이 관찰되었습니다. AUC0-24h 또는 AUC0-INF 값을 기준으로 총 방사능의 전반적인 모유-혈장 노출 비율은 약 2였습니다. 모유에만 고유한 nilotinib의 랫트 대사산물은 검출되지 않았습니다.
8.3
생식 잠재력이 있는 여성 및 남성
동물 연구에 따르면, Tasigna는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 모집단에서의 사용 (8.1) 참조].
임신 검사
생식 잠재력이 있는 여성은 Tasigna 치료를 시작하기 전에 임신 검사를 받아야 합니다.
피임
여성
생식 잠재력이 있는 여성에게 Tasigna 치료 중 및 마지막 투여 후 14일 동안 효과적인 피임법을 사용하도록 권고하십시오.
불임
생식 잠재력이 있는 여성 또는 남성의 불임 위험은 사람에게서 연구되지 않았습니다. 랫트와 토끼에 대한 연구에서 수컷과 암컷의 생식력에는 영향을 미치지 않았습니다 [비임상 독성학 (13.1) 참조].
8.4 소아 사용
Tasigna의 안전성 및 유효성은 새로 진단된 및 내성 또는 불내성 Ph+ CML 만성기의 1세 이상 소아 환자에서 확립되었습니다 [임상 연구(14.5) 참조]. 2세 미만 소아 환자에 대한 데이터는 없습니다. 새로 진단되거나 내성 또는 불내성 Ph+ CML 만성기의 1세 이상 2세 미만 소아 환자에서 Tasigna 사용은 이러한 적응증에 대한 2세에서 6세 소아 환자의 유효성을 근거로 합니다. Tasigna의 안전성 및 유효성은 성인에 대한 적절하고 잘 통제된 단일군 연구의 유효성 증거 [임상 연구(14.2) 참조]를 바탕으로 내성 또는 불내성 Ph+ CML 가속기의 1세 이상 소아 환자에서 확립되었으며, 다음 단락에 설명된 두 건의 소아 연구의 안전성 데이터를 바탕으로 합니다.
1세 이상 18세 미만 소아 환자에서 Tasigna 사용은 두 건의 임상 시험의 증거를 바탕으로 합니다 [임상 연구(14.5) 참조]. 새로 진단된 Ph+ CML-CP 환자 25명은 다음 연령대에 속했습니다. 6명의 어린이(2세 이상 12세 미만)와 19명의 청소년(12세 이상 18세 미만). 내성 또는 불내성 Ph+ CML-CP 환자 44명 중에는 18명의 어린이(2세 이상 12세 미만)와 26명의 청소년(12세 이상 18세 미만)이 포함되었습니다. 모든 소아 환자는 1일 2회 230 mg/m2 용량의 Tasigna 치료를 받았으며, 가장 가까운 50mg 용량으로 반올림했습니다(최대 단일 용량 400mg). 두 시험에서 서로 다른 연령 하위 그룹 간에 유효성 또는 안전성에 차이가 관찰되지 않았습니다.
관찰된 유해 반응의 빈도, 유형 및 중증도는 일반적으로 성인에서 관찰된 것과 일치했지만, 고빌리루빈혈증(3/4등급: 16%) 및 트랜스아미나제 상승(AST 3/4등급: 2.9%, ALT 3/4등급: 10%)의 실험실 이상은 성인보다 소아 환자에서 더 높은 빈도로 보고되었습니다 [유해 반응(6.1) 참조]. 소아의 성장 및 발달과 관련하여, Tasigna로 치료받은 Ph+ CML-CP 소아 환자에서 성장 지연이 보고되었습니다 [경고 및 주의 사항(5.1) 참조, 유해 반응(6.1) 참조].
새로 진단되거나 내성 또는 불내성 Ph+ CML 만성기 및 가속기의 1세 미만 소아 환자에서 Tasigna의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
Tasigna의 임상 시험(새로 진단된 Ph+ CML-CP 및 내성 또는 불내성 Ph+ CML-CP 및 CML-AP 환자)에서 환자의 약 12% 및 30%가 각각 65세 이상이었습니다.
- 새로 진단된 Ph+ CML-CP 환자: 65세 미만 환자와 65세 이상 환자 간에 주요 분자 반응에 차이가 없었습니다.
- 내성 또는 불내성 CML-CP 환자: 65세 미만 환자와 65세 이상 환자 간에 주요 세포유전학적 반응률에 차이가 없었습니다.
- 내성 또는 불내성 CML-AP 환자: 65세 미만 환자의 혈액학적 반응률은 44%였고, 65세 이상 환자의 반응률은 29%였습니다.
65세 이상 환자와 65세 미만 환자 간에 안전성에 큰 차이가 관찰되지 않았습니다.
8.6 심장 질환
임상 시험에서 최근 심근 경색, 울혈성 심부전, 불안정형 협심증 또는 임상적으로 유의한 서맥을 포함한 조절되지 않은 또는 심각한 심혈관 질환의 병력이 있는 환자는 제외되었습니다. 관련 심장 질환이 있는 환자에게는 주의해야 합니다 [경고, 경고 및 주의 사항(5.2)의 경고 상자 참조].
8.7 간 손상
간 손상이 있는 환자의 경우 Tasigna 용량을 줄이고 이러한 환자의 QT 간격을 면밀히 모니터링합니다 [용법 및 용량(2.7), 임상 약리학(12.3) 참조].
10 과다 복용
Nilotinib 과다복용이 보고되었으며, 알코올 및 기타 약물과 함께 불특정 수량의 Tasigna 캡슐을 섭취한 경우였습니다. 나타난 증상으로는 호중구 감소증, 구토 및 졸음이 포함됩니다. 과다복용 시 환자를 관찰하고 적절한 지지 치료를 제공하십시오.
11 설명
Tasigna는 kinase 억제제로 알려진 약리학적 약물 계열에 속하는 nilotinib을 함유하고 있습니다.
일수화염산염 일수화물 형태의 Nilotinib 원료 의약품은 백색에서 약간 황색 또는 약간 녹황색 분말이며, 분자식 및 분자량은 각각 C28H22F3N7O•HCl • H2O 및 584 g/mol입니다 (무수 nilotinib base의 해당 분자식 및 분자량은 각각 C28H22F3N7O 및 529 g/mol임). 수용액에서 Nilotinib의 용해도는 pH가 증가함에 따라 감소합니다. Nilotinib는 광학적으로 활성이 없습니다. pKa1은 2.1로 측정되었고; pKa2는 5.4로 추정되었습니다.
일수화염산염 일수화물인 Nilotinib의 화학명은 4-methyl-N-[3-(4-methyl-1H-imidazol-1-yl)-5-(trifluoromethyl)phenyl]-3-[[4-(3-pyridinyl)-2-pyrimidinyl]amino]-benzamide, monohydrochloride, monohydrate입니다. 구조는 아래와 같습니다.

경구용 Tasigna (nilotinib) 캡슐은 50mg, 150mg 또는 200mg의 무수 nilotinib base (각각 55mg, 166mg 및 221mg의 일수화염산염 일수화물 nilotinib에 해당)를 함유하며, 다음과 같은 불활성 성분이 포함되어 있습니다: colloidal silicon dioxide, crospovidone, lactose monohydrate, magnesium stearate, and poloxamer 188. 캡슐에는 gelatin, iron oxide (red), iron oxide (yellow), iron oxide (black), and titanium dioxide가 포함되어 있습니다.
12 약물동력학
12.1
작용 기전
Nilotinib는 BCR-ABL 키나아제의 억제제입니다. Nilotinib는 ABL 단백질의 키나아제 도메인의 비활성 형태에 결합하여 안정화시킵니다. 시험관 내에서 Nilotinib는 Ph+ CML 환자에게서 유래한 마우스 백혈병 세포주 및 인간 세포주의 BCR-ABL 매개 증식을 억제했습니다. 분석 조건 하에서 Nilotinib는 테스트된 33개 돌연변이 중 32개에서 BCR-ABL 키나아제 돌연변이로 인한 이마티닙 내성을 극복할 수 있었습니다. Nilotinib는 다음 키나아제의 자가 인산화를 표시된 IC50 값에서 억제했습니다: BCR-ABL (20~60 nM), PDGFR (69 nM), c-KIT (210 nM), CSF-1R (125~250 nM), 그리고 DDR1 (3.7 nM).
12.2
약력학
효능에 대한 노출-반응 분석에 따르면, 임상 연구에서 약물 노출과 반응 가능성 증가 사이의 관계가 관찰되었습니다. 안전성에 대한 노출-반응 분석에 따르면, 임상 연구에서 노출과 안전성 사건 가능성 증가(총 빌리루빈 상승 발생률 증가 포함) 사이의 관계가 관찰되었습니다.
심장 전기생리학
Tasigna는 농도 의존적인 QT 연장과 관련이 있습니다. 건강한 피험자에게 음식 없이 1일 2회 400mg의 Tasigna를 투여했을 때, 최대 평균 위약 조정 QTcF 변화는 10.4msec (90% CI: 2.85, 18.0)였습니다. 건강한 피험자에게 고지방 식사와 함께 800mg(최대 승인 권장 용량의 2배)의 Tasigna를 단회 투여했을 때, 최대 평균 위약 조정 QTcF 변화는 18.0msec (90% CI: 9.65, 25.8)였습니다. QT 연구에서 최고 혈장 농도는 단일군 연구에 등록된 환자에서 관찰된 농도보다 26% 낮거나 비슷했습니다 [경고 및 주의사항(5.2), 이상 반응(6.1)의 경고 문구 참조].
12.3
약동학
정상 상태 Nilotinib 노출은 용량 의존적이었으며, 1일 1회 또는 2회 투여로 400mg 이상의 용량 수준에서 용량 비례적 증가보다 적었습니다. 내성이 있거나 이마티닙에 불내성인 Ph+ CML 성인 환자에게 1일 2회 400mg의 Tasigna를 투여했을 때, 정상 상태 평균(% CV) Cmax 및 AUC0-12h는 각각 2260 ng/mL (35%) 및 18000 ng∙h/mL (33%)였습니다. 새로 진단받은 Ph+ CML 성인 환자에게 1일 2회 300mg의 Tasigna를 투여했을 때, 정상 상태 평균(% CV) Cmax 및 AUC0-12h는 각각 1540 ng/mL (48%) 및 13337 ng∙h/mL (46%)였습니다.
정상 상태는 8일째에 달성되었습니다. 첫 번째 용량과 정상 상태 사이의 Nilotinib 혈청 노출 증가는 1일 1회 투여의 경우 약 2배, 1일 2회 투여의 경우 약 3.8배였습니다. 평균 정상 상태 Nilotinib 최저 및 최고 농도는 12개월 동안 변하지 않았습니다.
흡수
Nilotinib 캡슐의 상대적 생체 이용률은 경구 용액(pH 1.2~1.3)과 비교하여 약 50%입니다. Nilotinib의 최고 농도는 경구 투여 후 3시간에 도달합니다. Nilotinib는 시험관 내에서 P-gp의 기질입니다.
전체 위 절제술을 받은 환자의 Nilotinib 중간 정상 상태 최저 농도는 수술을 받지 않은 환자와 비교하여 53% 감소했습니다 [경고 및 주의사항(5.10) 참조].
음식의 영향
공복 상태와 비교하여, 고지방 식사(총 칼로리의 50%가 지방인 800~1000칼로리 식사; 단백질 약 150칼로리, 탄수화물 약 250칼로리, 지방 약 500~600칼로리) 후 30분에 용량을 투여했을 때 전신 노출(AUC)이 82% 증가했습니다.
각각 1티스푼의 사과 소스에 분산시킨 200mg Nilotinib 캡슐 2개를 15분 이내에 투여하는 단회 투여는 200mg 정제 2개를 단회 투여하는 것과 생체 동등한 것으로 나타났습니다.
분포
Nilotinib의 혈액-혈청 비율은 0.68입니다. 혈청 단백질 결합은 약 98%입니다.
배설
평균(CV%) 명백한 배설 반감기는 약 17시간(69%)으로 추정되며, 평균(CV%) 명백한 청소율은 약 29 L/h(61%)입니다.
대사
Nilotinib는 주로 CYP3A4 매개 산화를 통해 대사되며, 소량은 CYP2C8에 의해 대사됩니다. Nilotinib는 혈청에서 주요 순환 성분입니다. 어떤 대사체도 Nilotinib의 약리 작용에 유의미하게 기여하지 않습니다.
배출
방사성 표지된 Nilotinib를 단회 투여한 후, 투여 용량의 90% 이상이 7일 이내에 배설되었습니다. 용량의 93%가 대변으로 배설되었습니다. 모약물은 용량의 69%를 차지했습니다.
특정 집단
연령, 성별, 인종/민족 또는 체중은 Nilotinib의 약동학에 유의미한 영향을 미치지 않았습니다. 신장 장애가 Nilotinib 약동학에 미치는 영향은 알려져 있지 않습니다.
소아 환자
승인된 권장 소아 용량의 Nilotinib를 투여한 후, Nilotinib의 정상 상태 노출은 1일 2회 400mg으로 치료받은 성인 환자와 2배 이내였습니다. 정상 상태 Cmin은 모든 연령대(2세 이상 18세 미만 소아 환자), 질병(새로 진단받은 환자 및 내성 또는 이마티닙 불내성 Ph+ CML 환자) 및 연구에서 비슷했습니다.
체표면적은 Nilotinib 청소율과 상관관계가 있으며, 소아와 성인 간의 약동학적 차이에 대한 주요 요인이었습니다.
간 기능 장애 환자
200mg(최대 승인 권장 용량의 0.5배)의 Tasigna를 단회 투여한 후, 경도(Child-Pugh A등급), 중등도(Child-Pugh B등급) 및 중증(Child-Pugh C등급) 간 기능 장애 환자의 Nilotinib 평균 AUC는 정상 간 기능을 가진 피험자와 비교하여 각각 1.4배, 1.4배 및 1.6배 증가했습니다.
약물 상호작용 연구
임상 연구
강력한 CYP3A 저해제: 케토코나졸(강력한 CYP3A 저해제) 400mg을 1일 1회 6일간 병용 투여하면 닐로티닙 AUC가 약 3배 증가합니다. 이중 강도 자몽 주스를 단회 병용 섭취하면 닐로티닙 AUC가 1.3배 증가합니다.
강력한 CYP3A 유도제: 리팜피신(강력한 CYP3A 유도제) 600mg을 1일 12일간 병용 투여하면 닐로티닙 AUC가 약 80% 감소합니다.
프로톤 펌프 억제제(PPI): Tasigna는 pH 의존적 수용액 용해도를 나타냅니다. 에소메프라졸(PPI) 40mg을 1일 다회 투여하면 닐로티닙 AUC가 34% 감소합니다. Tasigna 400mg 단회 용량을 파모티딘(H2 차단제) 투여 10시간 후 및 2시간 전 또는 제산제(예: 수산화알루미늄, 수산화마그네슘, 시메티콘) 투여 2시간 후 및 2시간 전에 투여했을 때 닐로티닙 약동학의 유의미한 변화는 관찰되지 않았습니다.
중등도 CYP3A 저해제: 닐로티닙 400mg을 1일 2회 이마티닙(중등도 CYP3A 저해제) 400mg 1일 1회 또는 400mg 1일 2회와 병용 투여한 후 닐로티닙의 AUC는 30%~50% 증가하고 이마티닙의 AUC는 약 20% 증가했습니다.
CYP3A4 기질: 다회 용량의 Tasigna는 경구 미다졸람(CYP3A4 기질)의 전신 노출을 2.6배 증가시켰습니다.
CYP2C9 기질: Tasigna 단회 용량은 와파린(CYP2C9 기질)의 약동학 및 약력학에 변화를 주지 않았습니다.
체내 시험에서 약물 상호작용 가능성이 추가적으로 임상적으로 평가되지 않은 경우
CYP 기질: 닐로티닙은 CYP2C8, CYP2D6의 경쟁적 저해제이며 CYP2B6 및 CYP2C8의 유도제입니다.
수송체 기질: 닐로티닙은 UGT1A1 및 P-gp의 저해제입니다.
12.5
약물유전체학
Tasigna는 빌리루빈 수치를 증가시킬 수 있습니다. UGT1A1의 (TA)7/(TA)7 유전형은 (TA)6/(TA)6 및 (TA)6/(TA)7 유전형에 비해 고빌리루빈혈증 위험의 통계적으로 유의미한 증가와 관련이 있었습니다. 그러나 빌리루빈의 가장 큰 증가는 (TA)7/(TA)7 유전형(UGT1A1*28) 환자에서 관찰되었습니다 [경고 및 주의사항 (5.6) 참조].
13 비임상 독성학
13.1
발암성, 돌연변이원성, 생식능력 저해
2년 동안 랫드를 대상으로 경구 투여 방식으로 nilotinib를 5, 15, 40 mg/kg/day 용량으로 투여하는 발암성 연구를 실시했습니다. 가장 높은 용량으로 투여받은 동물의 노출량은 nilotinib 400mg 1일 2회 복용 시 인체 노출량(AUC 기준)의 약 2~3배였습니다. 이 연구에서는 발암성 소견이 관찰되지 않았습니다. 유전적으로 종양 변형에 대한 감수성이 증가하도록 유전자 변형된 Tg.rasH2 마우스를 대상으로 26주 동안 경구 투여 방식으로 nilotinib를 30, 100, 300 mg/kg/day 용량으로 투여하는 발암성 연구를 실시했습니다. 300 mg/kg/day 용량의 nilotinib는 암컷에서 유두종 발생률의 통계적으로 유의미한 증가를 유발했고, 수컷에서는 유두종 및 유두종과 암의 병합 발생률의 통계적으로 유의미한 증가를 피부 및 피하 조직에서 유발했습니다. 피부 종양 병변에 대한 무해작용수준(NOAEL)은 100 mg/kg/day였습니다.
Nilotinib는 박테리아 돌연변이 유발 시험(Ames 시험)에서 돌연변이원성이 없었고, 인간 림프구의 염색체 이상 시험에서 클라스토젠성이 없었으며, L5178Y 마우스 림프종 세포에서 DNA 손상(혜성 분석)을 유발하지 않았고, 최대 2000 mg/kg/회 용량으로 경구 투여를 두 번 실시한 생체 내 랫드 골수 미세핵 시험에서도 클라스토젠성이 없었습니다.
랫드(수컷 및 암컷 각각 400mg 1일 2회 복용 시 환자의 AUC 대비 약 4~7배) 최대 180 mg/kg 용량 또는 토끼(400mg 1일 2회 복용 시 환자의 AUC 대비 약 1/2) 최대 300 mg/kg 용량에서 수컷 및 암컷 랫드와 암컷 토끼의 교미 또는 생식능력에 영향을 미치지 않았습니다.. Tasigna가 인간의 생식능력에 미치는 영향은 알려져 있지 않습니다. 수컷 및 암컷 랫드에 경구 투여 방식으로 nilotinib를 20~180 mg/kg/day 용량(400mg 1일 2회 복용 시 환자의 AUC 대비 약 1~6.6배)으로 교미 전 및 교미 기간 동안 투여하고 교미시킨 후, 임신 랫드에 대해 임신 6일까지 투여하는 연구에서 nilotinib는 모든 시험 용량에서 착상 후 손실 및 조기 흡수를 증가시키고 생존 태자 수와 산자 수를 감소시켰습니다.
14 CLINICAL STUDIES
14.1
성인 신규 진단 Ph+ CML-CP
ENESTnd (임상시험에서 Nilotinib의 효능 및 안전성 평가-신규 진단 환자) 연구(NCT00471497)는 염색체 이상으로 확인된 신규 진단 Ph+ CML-CP 성인 환자에서 Tasigna와 imatinib 정제의 효능을 확인하기 위해 실시된 공개, 다기관, 무작위 대조 시험이었습니다. 환자들은 진단 후 6개월 이내였으며, hydroxyurea 및/또는 anagrelide를 제외하고는 CML-CP에 대해 이전에 치료받은 적이 없었습니다. 효능은 총 846명의 환자를 기준으로 했습니다: imatinib 400mg 1일 1회 복용군 283명, Tasigna 300mg 1일 2회 복용군 282명, Tasigna 400mg 1일 2회 복용군 281명.
이마티닙 군의 중앙값 연령은 46세였고 Tasigna 군은 모두 47세였으며, imatinib 400mg 1일 1회 복용군, Tasigna 300mg 1일 2회 복용군 및 Tasigna 400mg 1일 2회 복용군에서 각각 65세 이상 환자의 비율은 12%, 13%, 10%였습니다. 모든 군에서 여성보다 남성 환자의 비율이 약간 더 높았습니다 (imatinib 400mg 1일 1회 복용군, Tasigna 300mg 1일 2회 복용군 및 Tasigna 400mg 1일 2회 복용군에서 각각 56%, 56%, 62%). 모든 환자의 60% 이상이 백인이었고 25%는 아시아인이었습니다.
주요 데이터 분석은 846명의 모든 환자가 12개월간의 치료를 완료했을 때(또는 조기에 중단했을 때) 수행되었습니다. 그 후 환자들이 24, 36, 48, 60개월의 치료를 완료했을 때(또는 조기에 중단했을 때) 분석이 수행되었습니다. 세 치료군 모두에서 치료 기간 중앙값은 약 61개월이었습니다.
주요 효능 평가 지표는 연구 약물 투여 시작 후 12개월 시점의 주요 분자 반응(MMR)이었습니다. MMR은 RQ-PCR로 측정한 국제 척도에 따른 0.1% 이하의 BCR-ABL/ABL %로 정의되었으며, 이는 표준화된 기준치에서 BCR-ABL 전사체의 3 log 이상 감소에 해당합니다. 효능 평가 지표는 표 11에 요약되어 있습니다.
Tasigna 군에서 2명의 환자가 가속기 또는 폭발기로 진행되었으며(둘 다 치료 시작 후 6개월 이내), imatinib 군에서는 12명의 환자가 가속기 또는 폭발기로 진행되었습니다(7명은 6개월 이내, 2명은 6~12개월, 2명은 12~18개월, 1명은 18~24개월).
| 약어: CI, 신뢰 구간. aSokal 위험군에 따라 계층화된 CMH 검정. bCCyR: 0% Ph+ 중기세포. 세포유전학적 반응은 각 골수 샘플에서 20개 이상의 중기세포 중 Ph+ 중기세포의 백분율을 기준으로 했습니다. |
||
| Tasigna 300 mg 1일 2회 |
imatinib 400 mg 1일 1회 |
|
| N = 282 | N = 283 | |
| 12개월 시점 MMR (95% CI) | 44% (38.4, 50.3) | 22% (17.6, 27.6) |
| P-값a | < 0.0001 | |
| 12개월 시점 CCyRb (95% CI) | 80% (75.0, 84.6) | 65% (59.2, 70.6) |
| 24개월 시점 MMR (95% CI) | 62% (55.8, 67.4) | 38% (31.8, 43.4) |
| 24개월 시점 CCyRb (95% CI) | 87% (82.4, 90.6) | 77% (71.7, 81.8) |
60개월 시점에서, Tasigna 투여 환자의 77%, imatinib 투여 환자의 60%에서 MMR이 달성되었으며; Tasigna 투여 환자의 53.5%, imatinib 투여 환자의 31.4%에서 MR4.5가 달성되었습니다. 두 군 모두에서 중앙값 전체 생존 기간은 도달하지 않았습니다. 60개월 최종 분석 시점에서, Tasigna 투여 환자의 추정 생존율은 93.7%, imatinib 투여 환자의 추정 생존율은 91.7%였습니다.
14.2
내성 또는 불내성 Ph+ CML-CP 및 CML-AP 성인 환자
Study CAMN107A2101(연구 A2101이라고 함)(NCT00109707)은 만성기 및 가속기 질환에 대한 별도 코호트를 포함하여 imatinib 내성 또는 불내성 CML 환자에서 Tasigna(1일 2회 400mg)의 효능 및 안전성을 평가하기 위해 수행된 단일군, 공개, 다기관 연구였습니다. imatinib 내성의 정의에는 완전 혈액학적 반응(3개월 이내) 미달성, 세포유전학적 반응(6개월 이내) 또는 주요 세포유전학적 반응(12개월 이내) 미달성 또는 이전 세포유전학적 또는 혈액학적 반응 후 질병 진행이 포함되었습니다. imatinib 불내성은 독성으로 인한 치료 중단 및 연구 참여 시점의 주요 세포유전학적 반응 부재로 정의되었습니다. 데이터 컷오프 시점에서, 최소 24개월의 추적 관찰을 거친 CML-CP 환자 321명과 CML-AP 환자 137명이 등록되었습니다. 이 연구에서, CML-CP 및 CML-AP 환자의 약 50%가 남성이었고, 90% 이상(CML-CP) 및 80%(CML-AP)가 백인이었으며, 약 30%가 65세 이상이었습니다.
전반적으로, 환자의 73%가 imatinib 내성이었고 27%가 imatinib 불내성이었습니다. 이전 imatinib 치료의 중앙값 기간은 CML-CP의 경우 약 32개월, CML-AP의 경우 약 28개월이었습니다. 이전 치료에는 환자의 85%에서 hydroxyurea, 56%에서 interferon, 8%에서 줄기세포 또는 골수 이식이 포함되었습니다. CML-CP 및 CML-AP 환자의 이전 imatinib 최고 용량 중앙값은 1일 600mg이었으며, 모든 환자의 74%에서 이전 imatinib 최고 용량이 600mg/일 이상이었고, 40%의 환자가 800mg/일 이상의 imatinib 용량을 투여받았습니다.
Tasigna 치료의 중앙값 기간은 CML-CP 환자의 경우 18.4개월, CML-AP 환자의 경우 8.7개월이었습니다.
CML-CP의 효능 종점은 완전 및 부분 세포유전학적 반응을 포함하는 미확인 주요 세포유전학적 반응(MCyR)이었습니다.
CML-AP의 효능 종점은 완전 혈액학적 반응(CHR) 또는 백혈병 증거 없음(NEL)으로 정의된 확인된 혈액학적 반응(HR)이었습니다. CML-CP 및 CML-AP 환자의 반응률은 표 12에 보고되어 있습니다.
데이터 분석 시점에서 반응의 중앙값 기간은 도달하지 않았습니다.
| a세포유전학적 반응 기준: 완전(0% Ph+ 중기 세포) 또는 부분(1%~35%). 세포유전학적 반응은 각 골수 샘플에서 20개 이상의 중기 세포 중 Ph-양성 중기 세포의 백분율을 기준으로 했습니다. b혈액학적 반응 = CHR + NEL(모든 반응은 4주 후 확인됨). |
|
| 세포유전학적 반응률(미확인)(%)a | |
| 만성기 (n = 321) |
|
| 주요(95% CI) | 51% (46% – 57%) |
| 완전(95% CI) | 37% (32% – 42%) |
| 부분(95% CI) | 15% (11% – 19%) |
| 가속기 (n = 137) |
|
| 혈액학적 반응률(확인)(95% CI)b | 39% (31% – 48%) |
| 완전 혈액학적 반응률(95% CI) | 30% (22% – 38%) |
| 백혈병 증거 없음(95% CI) | 9% (5% – 16%) |
CHR (CML-CP): 백혈구 10 x 109/L 미만, 혈소판 450,000/mm3 미만, 말초혈액에서의 폭발구 또는 전골수구 없음, 골수에서의 골수구 + 중간골수구 5% 미만, 말초혈액에서의 호염기구 20% 미만, 그리고 골수외 병소 없음.
CHR (CML-AP): 호중구 1.5 x 109/L 이상, 혈소판 100 x 109/L 이상, 말초혈액에서의 골수모세포 없음, 골수에서의 골수모세포 5% 미만, 그리고 골수외 병소 없음.
NEL: CHR과 동일한 기준이나 호중구 1.0 x 109/L 이상 및 혈소판 20 x 109/L 이상이며 수혈이나 출혈 없음.
만성기 성인 환자
321명의 CML-CP 환자에서 MCyR 비율은 51%였습니다. 반응자의 MCyR까지의 중앙값 시간은 2.8개월(범위, 1~28개월)이었습니다. MCyR의 중앙값 지속 기간은 추정할 수 없습니다. 이 단일군 시험에서 중앙값 노출 기간은 18.4개월이었습니다. MCyR을 달성한 CML-CP 환자 중 62%는 18개월 이상 MCyR이 지속되었습니다. CCyR 비율은 37%였습니다.
가속기 성인 환자
CML-AP 환자 137명에서 전반적인 확인된 혈액학적 반응률은 39%였습니다. 반응자의 첫 번째 혈액학적 반응까지의 중앙값 시간은 1개월(범위, 1~14개월)이었습니다. HR을 달성한 CML-AP 환자 중 44%는 18개월 이상 반응이 지속되었습니다.
이마티닙 실패 후, 돌연변이에 대해 평가받은 만성기 및 가속기 CML 환자의 42%와 54%에서 각각 24가지의 서로 다른 BCR-ABL 돌연변이가 관찰되었습니다.
14.3
지속적인 분자 반응(MR4.5)을 달성한 신규 진단 Ph+ CML-CP 환자에서의 치료 중단
ENESTfreedom (임상 시험에서의 Nilotinib 효능 및 안전성 평가-자유) 연구(NCT01784068)는 개방표지, 다기관, 단일군 연구로, 1차 치료제로 Tasigna로 ≥ 2년간 치료받고 MolecularMD MRDx® BCR-ABL 검사로 측정한 MR4.5를 달성한 Ph+ CML-CP 성인 환자 215명을 추가 52주 동안 Tasigna 치료(Tasigna 강화 단계)를 계속하도록 등록했습니다.
215명의 환자 중 190명(88.4%)은 강화 단계 동안 지속적인 분자 반응(MR4.5)을 달성한 후 다음 기준으로 정의된 “치료 없는 관해”(TFR) 단계에 진입했습니다.
- 마지막 4번의 분기별 평가(12주마다 실시)가 최소 MR4(BCR-ABL/ABL ≤ 0.01% IS)였고 1년 동안 유지됨
- 마지막 평가가 MR4.5(BCR-ABL/ABL ≤ 0.0032% IS)임
- MR4와 MR4.5 사이(0.0032% IS < BCR-ABL/ABL ≤ 0.01% IS)에 해당하는 평가가 두 번 이하임.
TFR 단계에 진입한 환자의 중앙값 연령은 55세였으며, 49.5%가 여성이었고, 21.1%의 환자가 65세 이상이었습니다. TFR 단계의 처음 48주 동안 BCR-ABL 수치는 4주마다 모니터링되었습니다. MR4.0 상실 시 모니터링 빈도가 2주마다로 강화되었습니다. 2주마다 모니터링은 다음 시점 중 하나에서 종료되었습니다.
- 환자가 Tasigna 치료를 재개해야 하는 MMR 상실
- BCR-ABL 수치가 MR4.0과 MR4.5 사이의 범위로 돌아왔을 때
- BCR-ABL 수치가 연속적인 4번의 측정(초기 MR4.0 상실 후 8주) 동안 MMR보다 낮게 유지되었을 때.
TFR 단계 동안 MMR 상실이 있는 환자는 MMR 상실을 보여주는 혈액 샘플 채취일로부터 5주 이내에 내약성 관점에서 필요한 경우 1일 2회 300mg 또는 1일 1회 400mg의 감량된 용량으로 Tasigna 치료를 재개했습니다. Tasigna 치료 재개가 필요한 환자는 처음 24주 동안 4주마다, 그 후 MMR을 회복한 환자는 12주마다 BCR-ABL 수치를 모니터링했습니다.
효능은 96주 분석 데이터 마감일을 기준으로 하였으며, 그 시점까지 91명의 환자(47.9%)가 MMR 상실로 인해 TFR 단계에서 중단되었고, 1명(0.5%), 1명(0.5%), 1명(0.5%) 및 3명(1.6%)의 환자가 각각 원인 불명의 사망, 의사 결정, 추적 관찰 상실 및 피험자 결정으로 인해 중단되었습니다. MMR 상실로 인해 TFR 단계를 중단한 91명의 환자 중 88명의 환자가 Tasigna 치료를 재개했고 3명의 환자가 연구에서 영구적으로 중단되었습니다.
96주 데이터 마감 시점까지, TFR 단계에서 MMR 상실로 인해 치료를 재개한 88명의 환자 중 87명(98.9%)의 환자가 MMR을 회복했고(한 명의 환자는 MMR 회복 없이 7.1주 후 피험자 결정으로 인해 연구를 영구적으로 중단함) 81명(92.0%)의 환자가 마감일까지 MR4.5를 회복했습니다. 치료 재개 후 24주 시점에 회복된 MMR 및 MR4.5의 누적률은 각각 97.7%(88명 중 86명) 및 86.4%(88명 중 76명)였습니다.
| 약어: CI, 신뢰 구간. 1TFR 단계에서 지정된 시점에 MMR에 있는 환자. 2TFR 단계 동안 사건 발생 시간(MMR 상실) 데이터를 기반으로 함. |
|||
| 치료 없는 관해(TFR) 단계에 진입한 환자(전체 분석 집합, N = 190) | |||
| TFR 단계 환자1 지정된 시점 |
지정된 시점까지 MMR2 상실 |
||
| % | 95% CI | % | |
| 24주 | 62.1 | (54.8, 69.0) | 35.8 |
| 48주 | 51.6 | (44.2, 58.9) | 45.8 |
| 96주 | 48.9 | (41.6, 56.3) | 47.9 |
TFR 단계에 있던 190명의 환자 중 98명은 96주 시점까지 치료 중단 생존(TFS) 사건(어떤 이유로든 TFR 단계 중단, MMR 소실, 어떤 원인으로 인한 사망, TFR 단계 종료 시까지 AP/BC로의 진행 또는 연구에서 어떤 이유로든 치료 재개)을 경험했습니다.
그림 1: TFR 시작 후 치료 중단 생존의 Kaplan-Meier 추정치 (전체 분석 집합 ENESTfreedom)
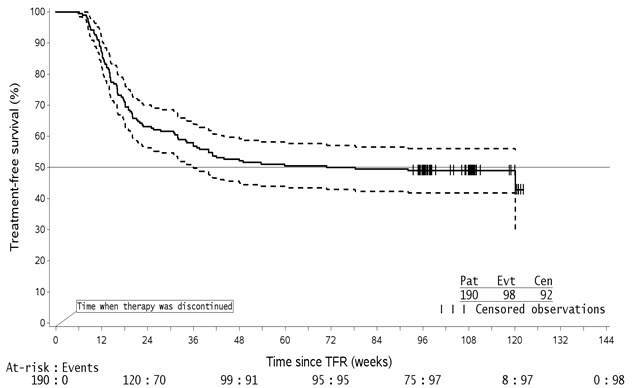
- 주어진 시점에서, 점선 곡선상의 점은 실선 곡선상의 관련 KM 추정치에 대한 95% 신뢰 구간을 나타냅니다.
- 96주 데이터 컷오프 시점까지, 단 한 명의 환자만이 120주차에 MMR을 소실했으며, 당시 위험군으로 간주된 환자는 8명에 불과했습니다. 이는 곡선 말단의 인위적인 하락을 설명합니다.
14.4
이전 이마티닙 치료 후 Tasigna에서 지속적인 분자 반응(MR4.5)을 달성한 Ph+ CML-CP 환자의 치료 중단
ENESTop (임상 시험에서 Nilotinib의 효능 및 안전성 평가-중단) 연구(NCT01698905)는 개방표지, 다기관, 단일군 연구로, 타이로신 키나제 억제제(TKI)를 3년 이상 복용한(이마티닙을 초기 TKI 치료제로 4주 이상 복용했지만 Tasigna로 전환 당시 이마티닙에서 MR4.5가 문서화되지 않은 성인 Ph+ CML-CP 환자, 그 후 최소 2년 동안 Tasigna로 전환), MolecularMD MRDx® BCR-ABL 검사로 측정한 Tasigna 치료에서 MR4.5를 달성한 163명의 성인 환자를 추가 52주 동안 Tasigna 치료를 계속하도록 등록했습니다(Tasigna 강화 단계). 163명의 환자 중 126명(77.3%)은 다음 기준으로 정의된 강화 단계 중 지속적인 분자 반응(MR4.5)을 달성한 후 TFR 단계에 진입했습니다.
- 마지막 4번의 분기별 평가(12주마다 실시)에서 1년 동안 MR4.5(BCR-ABL/ABL ≤ 0.0032% IS)의 확인된 소실이 없었습니다.
TFR 단계에 진입한 환자의 중앙 연령은 56세였으며, 55.6%가 여성이었고, 27.8%의 환자가 65세 이상이었습니다. 52주 Tasigna 강화 단계 동안 중앙 실제 용량 강도는 771.8 mg/일이었으며, 환자의 52.4%, 29.4%, 0.8%, 16.7%, 0.8%가 각각 TFR 단계 진입 직전에 800 mg, 600 mg, 450 mg, 400 mg 및 300 mg의 일일 Tasigna 용량을 복용했습니다.
TFR 단계에 진입했지만 BCR-ABL/ABL > 0.01% IS를 두 번 연속 측정한 환자는 MR4.0의 확인된 소실이 있는 것으로 간주되어 Tasigna 치료를 재개했습니다. TFR 단계에서 MMR을 소실한 환자는 확인 없이 즉시 Tasigna 치료를 재개했습니다. Tasigna 치료를 재개한 모든 환자는 처음 24주 동안 매 4주마다, 그 후 12주마다 BCR-ABL 전사체 수준을 모니터링했습니다.
효능은 96주 분석 데이터 컷오프 시점을 기준으로 했으며, 그 시점까지 61명(48.4%)의 환자가 TFR 단계에서 중단되었습니다. 58명(46.0%)은 MMR 소실 또는 MR4.0의 확인된 소실로 인해, 2명(1.6%)은 피험자/보호자의 결정으로 인해, 1명(0.8%)은 임신으로 인해 중단되었습니다. MR4.0의 확인된 소실 또는 MMR 소실로 인해 TFR 단계에서 중단된 58명의 환자 중 56명은 Tasigna 치료를 재개했고 2명은 연구에서 영구적으로 중단되었습니다.
96주 데이터 컷오프 시점까지, TFR 단계에서 MR4.0의 확인된 소실 또는 MMR 소실로 인해 Tasigna 치료를 재개한 56명의 환자 중 52명(92.9%)이 MR4.0 및 MR4.5를 회복했고, 4명(7.1%)은 컷오프 시점까지 MR4.0을 회복하지 못했습니다. 치료 재개 후 48주까지 회복된 MR4 및 MR4.5의 누적률은 각각 92.9%(56명 중 52명) 및 91.1%(56명 중 51명)였습니다.
| 약어: CI, 신뢰 구간. 1지정된 TFR 단계 시점까지 MMR 소실 또는 MR4의 확인된 소실이 없는 환자. 2TFR 단계 동안 사건 발생 시간(MMR 소실 또는 MR4의 확인된 소실) 데이터를 기반으로 함. |
|||
| 치료 중단 무반응(TFR) 단계에 진입한 환자 (전체 분석 집합, N = 126) | |||
| 지정된 시점에서 TFR 단계에 있는 환자1 |
지정된 시점까지 MMR 소실 또는 MR4의 확인된 소실2 |
||
| % | 95% CI | % | |
| 24주 | 60.3 | (51.2, 68.9) | 38.9 |
| 48주 | 57.9 | (48.8, 66.7) | 41.3 |
| 96주 | 53.2 | (44.1, 62.1) | 43.7 |
TFR 단계의 126명 환자 중 61명(48.4%)은 96개월 기준일자 이전에 치료 중단(어떤 이유로든 TFR 단계 중단, MMR 소실, MR4 소실 확인, 사망, TFR 단계 종료 시까지 AP/BC로 진행 또는 연구에서 어떤 이유로든 치료 재개)을 포함하는 치료 무사건 생존(TFS) 사건을 경험했습니다.
그림 2: TFR 시작 후 치료 무사건 생존의 Kaplan-Meier 추정치(전체 분석 집합 ENESTop)
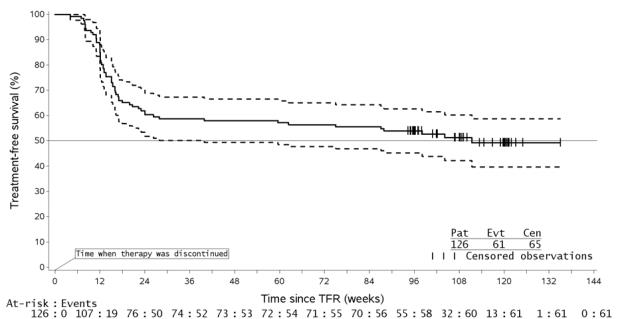
- 주어진 시점에서, 점선 곡선의 점은 실선 곡선의 관련 KM 추정치에 대한 95% 신뢰 구간을 나타냅니다.
14.5
신규 진단 Ph+ CML-CP 또는 내성 또는 불내성 Ph+ CML-CP 소아 환자
Ph+ CML-CP 소아 환자에서 Tasigna의 안전성 및 효능은 두 가지 연구에서 조사되었습니다. 이매티닙 또는 다사티닙에 내성 또는 불내성인 Ph+ CML 소아 환자에서 Tasigna의 약동학, 안전성 및 예비 효능을 평가한 개방형, 단일군, 다기관 연구인 연구 CAMN107A2120 (NCT01077544)(n = 11)과, 이매티닙 또는 다사티닙에 내성 또는 불내성인 Ph+ CML-CP 소아 환자(2~18세 미만, n = 33) 및 신규 진단 Ph+ CML-CP 소아 환자(n = 25)에서 Tasigna의 효능 및 안전성을 평가한 개방형, 단일군, 다기관 연구인 연구 CAMN107A2203 (NCT01844765)입니다. 두 연구 모두에서 환자는 1일 2회 230 mg/m2 용량의 Tasigna 치료를 받았으며, 가장 가까운 50mg 용량으로 반올림했습니다(최대 단일 용량 400mg). 신규 진단 Ph+ CML-CP(n = 25; 2~12세 미만 어린이 6명, 12~18세 미만 청소년 19명) 또는 이매티닙/다사티닙 내성 또는 불내성 Ph+ CML-CP(n = 44; 2~12세 미만 어린이 18명, 12~18세 미만 청소년 26명) 환자 총 69명(2~18세 미만)의 최대 12주기 데이터를 풀링했습니다.
내성 또는 불내성 CML 환자의 경우, 주요 분자 반응[(MMR); BCR-ABL/ABL ≤ 0.1% IS]률은 12주기(주기당 28일) 시점에 40.9%(18/44, 95% CI: 26.3%, 56.8%)였습니다. 신규 진단 CML 환자의 경우, MMR률은 12주기 시점에 60.0%(15/25, 95% CI: 38.7%, 78.9%)였습니다. 내성 또는 불내성 CML 환자의 경우, 누적 MMR률은 12주기까지 47.7%(21/44)였습니다. 신규 진단 CML 환자의 경우, 누적 MMR률은 12주기까지 64.0%(16/25)였습니다.
치료 중 언제든지 MMR에 도달했던 내성 또는 불내성 CML 환자 21명 중 최초 MMR까지의 중앙값 시간은 2.8개월(범위, 0.0~11.3)이었습니다. MMR을 달성한 신규 진단 CML 환자 17명의 경우, 최초 MMR까지의 중앙값 시간은 5.6개월(범위, 2.7~16.6)이었습니다.
연구 CAMN107A2203은 약 5년의 추적 관찰을 포함한 장기 데이터를 제공했습니다.
최종 분석 시점에서, Tasigna 치료 기간의 중앙값은 신규 진단 CML 환자의 경우 51.9개월(범위, 1.4~61.2개월), 내성 또는 불내성 CML 환자의 경우 60.5개월(범위: 0.7~63.5개월)이었습니다.
내성 또는 불내성 CML 환자의 경우, 주요 분자 반응(MMR; BCR-ABL/ABL ≤0.1% IS)률은 각각 24주기 및 36주기 시점에 57.6%, 57.6%였습니다. MMR률은 48주기까지 60.6%로 증가했으며 연구 종료(66주기)까지 동일했습니다. 신규 진단 CML 환자의 경우, MMR률은 24주기 시점에 68.0%였습니다. MMR률은 36주기까지 76.0%로 증가했으며 연구 종료(66주기)까지 동일했습니다.
내성 또는 불내성 CML 환자 중 12.1%는 66주기까지 BCR-ABL/ABL ≤ 0.0032% IS(MR4.5)를 달성했습니다. 신규 진단 CML 환자 중 MR4.5를 달성한 환자의 비율은 44%였습니다.
66주기까지 치료 중 언제든지 MMR을 달성했던 내성 또는 불내성 CML 환자 20명 중 66주기 종료 시점 또는 조기 중단 시점까지 MMR 소실이 확인된 환자는 없었습니다. 66주기 종료 시점까지 치료 중 언제든지 MMR을 달성했던 신규 진단 CML 환자 19명 중 3명은 MMR 소실이 확인되었습니다. 반응자의 절반 이상이 연구 종료 시점까지 반응 소실이 확인되지 않았기 때문에 MMR 기간의 중앙값은 어느 집단에서도 추정할 수 없었습니다. 내성 또는 불내성 CML 환자의 반응 기간 범위는 0.03~61개월이었고, 신규 진단 CML 환자의 경우 2.8~57.9개월이었습니다. 내성 또는 불내성 CML 환자 1명은 치료 10.1개월 후 AP/BC로 진행되었습니다.
16 제공/보관 및 취급 방법
Tasigna (닐로티닙) 50mg 캡슐은 적색 불투명 캡과 연황색 불투명 바디의 4호 경질 젤라틴 캡슐이며, 검정색 방사형 각인 “NVR/ABL”이 있습니다. Tasigna (닐로티닙) 150mg 캡슐은 적색 불투명 경질 젤라틴 캡슐이며, 1호 크기이고 검정색 축 방향 각인 “NVR/BCR”이 있습니다. Tasigna (닐로티닙) 200mg 캡슐은 연황색 불투명 경질 젤라틴 캡슐이며, 0호 크기이고 적색 축 방향 각인 “NVR/TKI”이 있습니다. Tasigna 50mg 캡슐은 병에 포장되어 있으며, Tasigna 150mg 및 200mg 캡슐은 블리스터 포장으로 공급됩니다.
50 mg
120캡슐 병………………………………………………………………NDC 0078-0951-66
150 mg
(4×28) 블리스터 팩 4개들이 카톤…………………………………………………NDC 0078-0592-87
28캡슐 블리스터………………………………………………………………NDC 0078-0592-51
200 mg
(4×28) 블리스터 팩 4개들이 카톤…………………………………………………NDC 0078-0526-87
28캡슐 블리스터………………………………………………………………NDC 0078-0526-51
Tasigna (닐로티닙) 캡슐은 20°C~25°C (68°F~77°F)에 보관해야 하며, 15°C~30°C (59°F~86°F)의 온도 편차는 허용됩니다 [USP 제어 실온 참조].
17 환자 상담 정보
FDA 승인 환자용 설명서(Medication Guide)를 읽도록 환자에게 알려주십시오.
Tasigna와 함께 제공해야 하는 Medication Guide입니다. 이 문서의 끝에 Medication Guide의 전체 내용이 재인쇄되어 있습니다.
골수억제
Tasigna 치료는 심각한 혈소판 감소증, 호중구 감소증 및 빈혈을 유발할 수 있다고 환자에게 알려주십시오. 발열, 오한 또는 기타 감염 징후, 설명할 수 없는 출혈 또는 멍, 또는 설명할 수 없는 쇠약 또는 숨가쁨과 같은 낮은 혈구 수를 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.1)].
QT 연장
Tasigna는 생명을 위협할 수 있는 비정상적인 심장 박동을 유발할 수 있다고 환자에게 알려주십시오. 어지러움, 실신 또는 불규칙적인 심장 박동과 같은 비정상적인 심장 박동 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.2)].
심혈관 및 동맥 혈관 폐쇄성 질환
심혈관 질환(허혈성 심장 질환, 말초 동맥 폐쇄성 질환 및 허혈성 뇌혈관 질환 포함)이 보고되었다고 환자에게 알려주십시오. 흉통 또는 다리 통증, 마비 또는 쇠약, 또는 보행 또는 말하기 문제가 갑자기 발생하는 등 심혈관 질환을 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.4)].
췌장염 및 상승된 혈청 리파제
Tasigna는 췌장염의 위험을 증가시킬 수 있으며 이전에 췌장염 병력이 있는 환자는 위험이 더 클 수 있다고 환자에게 알려주십시오. 갑작스러운 위 통증과 함께 메스꺼움과 구토가 동반되는 등 췌장염을 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.5)].
간독성
Tasigna는 간독성의 위험을 증가시킬 수 있으며 이전에 간 질환 병력이 있는 환자는 위험할 수 있다고 환자에게 알려주십시오. 위통, 황달 및 짙은 색 소변과 같은 간독성을 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.6)].
종양 용해 증후군
Tasigna는 TLS를 유발할 수 있으며 비정상적인 심장 박동 또는 소변 배출량 감소와 같은 TLS를 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.8)].
출혈
Tasigna로 치료받은 CML 환자에서 치명적인 사례를 포함한 심각한 출혈 사례가 발생했다고 환자에게 알려주십시오. 조절되지 않는 출혈, 시력 변화, 의식 상실 또는 갑작스러운 두통 또는 주변 환경에 대한 갑작스러운 혼란과 같은 출혈을 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.9)].
체액 저류
Tasigna는 체액 저류를 유발할 수 있으며 숨가쁨, 급격한 체중 증가 또는 부종과 같은 체액 저류를 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 알려주십시오 [경고 및 주의 사항 (5.13)].
소아 환자의 성장 및 발달에 대한 영향
소아 환자와 그 보호자에게 성장 이상이 발생할 가능성을 알려주십시오. Tasigna로 치료받은 소아 환자에서 성장 지연이 보고되었습니다. 따라서 소아 환자의 성장과 발달을 모니터링하십시오 [경고 및 주의 사항 (5.14)].
치료 중단 후 관해(TFR)
TFR을 시도하는 경우 관해 상실 가능성을 감지하기 위해 빈번한 모니터링이 필요하다고 환자에게 알려주십시오. 치료 중단 전보다 근육통, 사지 통증, 관절통, 골통 또는 척추 통증과 같은 근골격계 증상이 더 자주 발생할 수 있다고 환자에게 알려주십시오 [경고 및 주의 사항 (5.16)].
배아-태아 독성
임신부에게 태아에 대한 잠재적 위험을 알려주십시오. 임신 가능성이 있는 여성에게 알려진 또는 의심되는 임신 사실을 의료 제공자에게 알리도록 알려주십시오 [경고 및 주의 사항 (5.15), 특정 집단에서의 사용 (8.1)].
임신 가능성이 있는 여성에게 치료 중 및 Tasigna의 마지막 복용 후 14일 동안 효과적인 피임법을 사용하도록 알려주십시오 [특정 집단에서의 사용 (8.3)].
수유
Tasigna 치료 중 및 마지막 복용 후 14일 동안 모유 수유를 하지 않도록 여성에게 알려주십시오 [특정 집단에서의 사용 (8.2)].
약물 상호작용
Tasigna와 특정 다른 약물, 일반 의약품 또는 허브 보충제(예: 세인트 존스 워트)가 서로 상호 작용할 수 있다고 환자에게 알려주십시오 [약물 상호작용 (7)].
Tasigna 복용
Tasigna 용량을 하루 두 번 약 12시간 간격으로 복용하도록 환자에게 알려주십시오. 캡슐은 물과 함께 통째로 삼켜야 합니다.
공복에 Tasigna를 복용하도록 환자에게 알려주십시오. 복용 2시간 전과 복용 1시간 후에는 음식을 섭취해서는 안 됩니다. 환자는 Tasigna 치료 중 언제든지 자몽 제품 및 CYP3A4를 억제하는 것으로 알려진 기타 식품을 섭취해서는 안 됩니다 [용법 및 용량 (2.1), 약물 상호작용 (7.1, 7.2)].
Tasigna 복용량을 놓친 경우 다음 예정된 복용량을 정해진 시간에 복용해야 합니다. 동시에 두 번 복용해서는 안 됩니다.
캡슐을 삼킬 수 없는 경우 각 캡슐의 내용물을 애플소스 한 티스푼에 섞어 즉시(15분 이내) 삼킬 수 있습니다.
복약 준수
환자에게 다음 사항을 알려주십시오.
- 의사가 지시하는 한 매일 Tasigna를 계속 복용하십시오.
- 이것은 장기 치료입니다.
- 의사와 상담하지 않고 용량을 변경하거나 Tasigna 복용을 중단하지 마십시오.
- 복용량을 놓친 경우 다음 예정된 복용량을 복용하십시오. 놓친 캡슐을 보충하기 위해 두 배 용량을 복용하지 마십시오.
판매원:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
T2024-08
약물 안내문
| 본 의약품 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2021년 9월 | |
| 의약품 설명서 TASIGNA® (타시그나) (닐로티닙) 캡슐 |
||
| 타시그나에 대해 가장 중요한 정보는 무엇입니까? 타시그나는 QTc 연장이라는 생명을 위협할 수 있는 심장 문제를 일으킬 수 있습니다. QTc 연장은 불규칙한 심장 박동을 유발하여 돌연사로 이어질 수 있습니다. 의료 제공자는 심전도(ECG)라는 검사를 통해 심장의 전기적 활동을 확인해야 합니다. |
||
| • 타시그나 복용 시작 전 • 타시그나 복용 시작 후 7일 |
• 용량 변경 시 • 타시그나 치료 중 정기적으로 |
|
다음과 같은 경우 타시그나로 인한 QTc 연장 가능성을 낮출 수 있습니다.
타시그나 치료 중 어지러움, 실신 또는 불규칙한 심장 박동이 느껴지면 즉시 의료 제공자에게 연락하십시오. 이러한 증상은 QTc 연장의 증상일 수 있습니다. |
||
| 타시그나란 무엇입니까? 타시그나는 다음을 치료하는 처방약입니다.
만성기 Ph+ CML이 새롭게 진단되었거나, 내성이 있거나, 내약성이 있는 1세 미만 어린이에게 타시그나가 안전하고 효과적인지 여부는 알려져 있지 않습니다. 장기간에 걸쳐 어린이를 타시그나로 치료하는 장기적인 영향은 알려져 있지 않습니다. |
||
| 누가 타시그나를 복용해서는 안 됩니까? 다음과 같은 경우 복용하지 마십시오.
|
||
Tasigna 복용 전, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
임신 가능한 여성의 경우:
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. 제산제(속쓰림 치료제)를 복용해야 하는 경우 Tasigna와 동시에 복용하지 마십시오. 다음을 복용하는 경우:
Tasigna는 많은 약물 및 보충제와 상호 작용하여 심각하고 생명을 위협하는 부작용의 위험을 증가시킬 수 있습니다. “Tasigna에 대해 가장 중요한 정보는 무엇입니까?”를 참조하십시오. |
||
Tasigna는 어떻게 복용해야 합니까?
의료 제공자가 복용량을 변경할 수 있습니다. 부작용이 있는 경우 의료 제공자가 Tasigna 복용을 일시적으로 중단하거나 복용량을 줄일 수 있습니다.
|
||
| Tasigna의 가능한 부작용은 무엇입니까? Tasigna는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
|
||
|
|
|
|
||
| 성인과 어린이에서 Tasigna의 가장 흔한 부작용은 다음과 같습니다. | ||
| • 메스꺼움 • 발진 • 두통 • 피로 • 가려움증 • 구토 |
• 설사 • 기침 • 변비 • 근육 및 관절 통증 • 콧물 또는 코막힘, 재채기, 인후통 • 발열 • 밤에 땀을 많이 흘림 |
|
|
치료 중단 후 무치료 관해를 시도하는 성인 환자의 부작용: |
||
| • 근육통 • 팔다리 통증 • 관절통 |
• 골통 • 척추 통증 |
|
|
귀하 또는 귀하의 자녀에게 불편함을 주거나 사라지지 않는 부작용이 있는 경우 의료 제공자에게 알리십시오. 이것들은 Tasigna의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
||
Tasigna는 어떻게 보관해야 합니까?
Tasigna 및 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||
| Tasigna의 안전하고 효과적인 사용에 대한 일반 정보. 약은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 Tasigna를 사용하지 마십시오. 귀하와 같은 증상이 있는 다른 사람에게 Tasigna를 제공하지 마십시오. 해를 끼칠 수 있습니다. 약사 또는 의료 제공자에게 의료 전문가를 위해 작성된 Tasigna에 대한 정보를 요청할 수 있습니다. |
||
| Tasigna의 성분은 무엇입니까? 활성 성분: nilotinib 비활성 성분: colloidal silicon dioxide, crospovidone, lactose monohydrate, magnesium stearate 및 poloxamer 188. 캡슐에는 젤라틴, 산화철(적색), 산화철(황색), 산화철(흑색) 및 이산화티타늄이 포함되어 있습니다. 판매원: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936 © Novartis 자세한 내용은 www.Tasigna.com을 방문하거나 1-866-411-8274로 전화하십시오. |
||
T2021-128
주요 표시 패널
NDC 0078-0951-66
120 캡슐
처방전 전용
Tasigna®
(nilotinib) 캡슐
50 mg
복약 안내서와 함께 제공
NOVARTIS
주요 표시 패널
NDC 0078-0592-87
Tasigna®
(nilotinib) capsules
150 mg
per capsule
투약 가이드와 함께 조제하십시오.
또는 별도로 제공하십시오.
NOVARTIS
주요 표시 패널
NDC 0078-0526-87
Tasigna®
(nilotinib) capsules
200 mg
per capsule
투약 가이드와 함께 조제하십시오.
또는 별도로 제공하십시오.
NOVARTIS


