의약품 제조업체: Gilead Sciences, Inc. (Updated: 2024-12-26)
처방 정보 하이라이트
SOVALDI® (소포스부비르) 정제, 경구용
SOVALDI® (소포스부비르) 경구용 과립
미국 최초 승인: 2013
경고: HCV 및 HBV에 동시 감염된 환자에서 B형 간염 바이러스 재활성화 위험
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
일부 경우에는 급성 간염, 간부전 및 사망으로 이어지는 B형 간염 바이러스(HBV) 재활성화가 보고되었습니다. (5.1)
적응증 및 용법
용법 및 용량
- 치료 시작 전 검사: HBsAg 및 anti-HBc 측정을 통해 모든 환자의 HBV 감염 여부를 검사합니다. (2.1)
- 성인 권장 용량: 음식과 함께 또는 음식 없이 1일 1회 400mg 정제 1정을 복용합니다. (2.2)
- 3세 이상 소아 환자의 권장 용량: SOVALDI 정제 또는 경구용 과립을 사용하는 2형 또는 3형 HCV 감염 3세 이상 소아 환자의 SOVALDI 권장 용량은 체중에 따라 결정됩니다. 체중에 따른 구체적인 용량 지침은 전체 처방 정보의 표 3을 참조하십시오. (2.3)
- HCV/HIV-1 동시 감염: HCV/HIV-1 동시 감염 성인 및 소아 환자의 경우 아래 표의 용량 권장 사항을 각각 따릅니다. (2.2, 2.3)
- 권장 성인 치료 요법 및 기간: (2.2)
| 성인 환자군 | 요법 및 기간 | |
|---|---|---|
| 1형 또는 4형 | 비대상성 간경변 또는 보상성 간경변(Child-Pugh A)이 없는 치료 경험이 없는 환자 | SOVALDI + 페그인터페론 알파 + 리바비린 12주 |
| 2형 | 비대상성 간경변 또는 보상성 간경변(Child-Pugh A)이 없는 치료 경험이 있는 및 없는 환자 | SOVALDI + 리바비린 12주 |
| 3형 | 비대상성 간경변 또는 보상성 간경변(Child-Pugh A)이 없는 치료 경험이 있는 및 없는 환자 | SOVALDI + 리바비린 24주 |
- 인터페론 치료가 불가능한 1형 감염 성인 환자의 경우 24주 동안 리바비린과 병용한 SOVALDI를 고려할 수 있습니다. (2.2)
- 간 이식을 기다리는 간세포암 환자의 HCV 치료를 위해 최대 48주 또는 간 이식 시점 중 먼저 도달하는 시점까지 리바비린과 병용하여 사용해야 합니다. (2.2)
- 3세 이상 소아 환자에 대한 권장 치료 요법 및 기간: (2.3, 2.4)
| 3세 이상 소아 환자군 | 요법 및 기간 | |
|---|---|---|
| 2형 | 비대상성 간경변 또는 보상성 간경변(Child-Pugh A)이 없는 치료 경험이 있는 및 없는 환자 | SOVALDI + 리바비린 12주 |
| 3형 | 비대상성 간경변 또는 보상성 간경변(Child-Pugh A)이 없는 치료 경험이 있는 및 없는 환자 | SOVALDI + 리바비린 24주 |
금기
- 페그인터페론 알파/리바비린 병용 또는 리바비린 단독 요법과 함께 사용하는 경우, 페그인터페론 알파 및/또는 리바비린에 대한 모든 금기 사항이 SOVALDI 병용 요법에도 적용됩니다. (4)
경고 및 주의사항
- B형 간염 바이러스 재활성화 위험: HCV 치료 시작 전에 모든 환자에 대해 현재 또는 과거 HBV 감염 증거를 검사합니다. HCV 치료 중 및 치료 후 추적 관찰 동안 HCV/HBV 동시 감염 환자의 HBV 재활성화 및 간염 악화를 모니터링합니다. 임상적으로 필요한 경우 HBV 감염에 대한 적절한 환자 관리를 시작합니다. (5.1)
- 아미오다론 병용 투여 시 서맥: 특히 베타 차단제를 함께 복용하거나 기저 심장 동반 질환 및/또는 진행성 간 질환이 있는 환자의 경우, 소포스부비르 함유 요법과 아미오다론을 함께 복용하는 환자에게 심각한 증상성 서맥이 발생할 수 있습니다. 아미오다론과 SOVALDI의 병용 투여는 권장되지 않습니다. 대체 가능한 치료 옵션이 없는 환자의 경우 심장 모니터링을 권장합니다. (5.2, 6.2, 7.1)
유해 반응
- 리바비린과 병용하여 SOVALDI를 사용했을 때 관찰된 가장 흔한 유해 사건(발생률 20% 이상, 모든 등급)은 피로와 두통이었습니다. 페그인터페론 알파와 리바비린과 병용하여 SOVALDI를 사용했을 때 관찰된 가장 흔한 유해 사건은 피로, 두통, 메스꺼움, 불면증 및 빈혈이었습니다. (6.1). 소아 환자에서 리바비린 경구 용액과 병용하여 SOVALDI를 사용했을 때 관찰된 가장 흔한 유해 사건은 식욕 감퇴였습니다. (6.1)
의심되는 유해 반응을 보고하려면 1-800-GILEAD-5로 Gilead Sciences, Inc.에 연락하거나 1-800-FDA-1088 또는 www.fda.gov/medwatch로 FDA에 연락하십시오.
약물 상호작용
- 소포스부비르 함유 요법과 아미오다론을 병용 투여하면 심각한 증상성 서맥이 발생할 수 있습니다. (5.2, 6.2, 7.1)
- 장관 P-gp 유도제(예: 리팜핀, 세인트 존스 워트)는 소포스부비르 농도를 변경할 수 있습니다. (5.3, 7, 12.3)
- 잠재적인 약물-약물 상호작용에 대해서는 사용 전에 전체 처방 정보를 참조하십시오. (5.2, 5.3, 7, 12.3)
- 직접 작용 항바이러스제를 이용한 HCV 감염의 제거는 간 기능의 변화를 초래할 수 있으며, 이는 동시 투여되는 약물의 안전하고 효과적인 사용에 영향을 미칠 수 있습니다. 관련 실험실 매개변수(INR 또는 혈당)의 빈번한 모니터링과 특정 동시 투여 약물의 용량 조절이 필요할 수 있습니다. (7.1)
특정 환자군에서의 사용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17항을 참조하십시오.
개정: 2024년 12월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
경고: HCV 및 HBV 동시 감염 환자에서 B형 간염 바이러스 재활성화 위험
1 적응증 및 용법
2 용량 및 투여
2.1 치료 시작 전 검사
2.2 성인 권장 용량
2.3 유전자형 2 또는 3 HCV를 가진 3세 이상 소아 환자의 권장 용량
2.4 경구용 펠릿 제조 및 투여
2.5 용량 조절
2.6 투약 중단
2.7 중증 신장애 및 말기 신질환
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 HCV 및 HBV 동시 감염 환자에서 B형 간염 바이러스 재활성화 위험
5.2 Amiodarone과 병용 투여 시 심각한 증상성 서맥
5.3 P-gp 유도제 사용으로 인한 치료 효과 감소 위험
5.4 병용 요법과 관련된 위험
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 잠재적으로 유의미한 약물 상호작용
7.2 SOVALDI와 임상적으로 유의미한 상호작용이 없는 약물
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아에서의 사용
8.5 노인에서의 사용
8.6 신장애
8.7 간장애
8.8 간 이식을 기다리는 간세포암 환자
8.9 간 이식 후 환자
8.10 유전자형 5 또는 6 HCV 감염 환자
10 과다복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.4 미생물학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 장애
14 임상 연구
14.1 임상시험 설명
14.2 유전자형 1 또는 4 HCV 감염 환자를 대상으로 한 임상시험
14.3 유전자형 2 또는 3 HCV 감염 환자를 대상으로 한 임상시험
14.4 HCV 및 HIV-1 동시 감염 성인 환자를 대상으로 한 임상시험 ─ Photon-1 (연구 0123)
14.5 소아 임상시험 (연구 1112)
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: HCV 및 HBV 동시 감염 환자에서의 B형 간염 바이러스 재활성화 위험
SOVALDI 치료를 시작하기 전에 모든 환자에게 현재 또는 과거 B형 간염 바이러스(HBV) 감염의 증거를 검사하십시오. HCV 직접 작용 항바이러스제 치료를 받고 있거나 완료한 HCV/HBV 동시 감염 환자에서 HBV 항바이러스 요법을 받지 않은 경우 HBV 재활성화가 보고되었습니다. 일부 경우에는 급성 간염, 간부전 및 사망으로 이어졌습니다. HCV 치료 중 및 치료 후 추적 관찰 동안 HCV/HBV 동시 감염 환자의 간염 악화 또는 HBV 재활성화를 모니터링하십시오. 임상적으로 필요한 경우 HBV 감염에 대한 적절한 환자 관리를 시작하십시오 [경고 및 주의 사항 (5.1) 참조].
1 적응증 및 사용법
성인 환자:
SOVALDI는 복합 항바이러스 치료 요법의 구성 요소로서 만성 C형 간염 바이러스(HCV) 감염 성인 환자 치료에 사용됩니다 [용법 및 용량 (2.2) 및 임상 연구 (14) 참조]:
- 페길화 인터페론 및 리바비린 병용 요법으로 사용되는 비대상성 간경변 또는 보상성 간경변이 있는 1형 또는 4형 감염 환자
- 리바비린 병용 요법으로 사용되는 비대상성 간경변 또는 보상성 간경변이 있는 2형 또는 3형 감염 환자.
소아 환자:
SOVALDI는 리바비린 병용 요법으로 사용되는 비대상성 간경변 또는 보상성 간경변이 있는 3세 이상 소아 환자의 만성 HCV 2형 또는 3형 감염 치료에 사용됩니다 [용법 및 용량 (2.3) 및 임상 연구 (14.5) 참조].
2 용법 및 투여
2.1 치료 시작 전 검사
SOVALDI로 HCV 치료를 시작하기 전에 모든 환자에게 B형 간염 표면 항원(HBsAg)과 B형 간염 핵심 항체(anti-HBc)를 측정하여 현재 또는 과거 HBV 감염 증거를 검사하십시오. [경고 및 주의사항 (5.1) 참조].
2.2 성인 권장 복용량
SOVALDI의 권장 복용량은 400mg 정제 1정을 음식과 함께 또는 음식 없이 1일 1회 경구 복용하는 것입니다. [임상 약리학 (12.3) 참조].
HCV 치료를 위해 SOVALDI를 리바비린과 병용하거나 페길화 인터페론 및 리바비린과 병용하여 투여하십시오. SOVALDI 병용 요법의 권장 치료 요법 및 기간은 표 1에 나와 있습니다.
HCV/HIV-1 동시 감염 환자의 경우 표 1의 복용량 권장 사항을 따르십시오. 병용 HIV-1 항바이러스 약물에 대한 복용량 권장 사항은 약물 상호 작용 (7)을 참조하십시오.
| 환자 집단 | 치료 요법 및 기간 | |
|---|---|---|
| 유전자형 1 또는 4 | 간경변이 없거나 보상성 간경변(Child-Pugh A)이 있는 치료 경험이 없는 환자 | SOVALDI + 페그인터페론 알파* + 리바비린† 12주 |
| 유전자형 2 | 간경변이 없거나 보상성 간경변(Child-Pugh A)이 있는 치료 경험이 있거나 없는 환자‡ | SOVALDI + 리바비린† 12주 |
| 유전자형 3 | 간경변이 없거나 보상성 간경변(Child-Pugh A)이 있는 치료 경험이 있거나 없는 환자‡ | SOVALDI + 리바비린† 24주 |
인터페론 기반 요법을 받을 수 없는 유전자형 1형 HCV 환자
24주 동안 리바비린과 병용하는 SOVALDI는 인터페론 기반 요법을 받을 수 없는 유전자형 1형 감염 환자에게 치료 옵션으로 고려될 수 있습니다 [임상 연구 (14.4) 참조]. 치료 결정은 개별 환자의 잠재적 이점과 위험 평가를 통해 이루어져야 합니다.
간 이식을 기다리는 간세포암 환자
이식 후 HCV 재감염을 예방하기 위해 최대 48주 또는 간 이식 시까지 SOVALDI를 리바비린과 병용 투여합니다 [특정 집단에서의 사용 (8.8) 참조].
2.3 유전자형 2형 또는 3형 HCV를 가진 3세 이상 소아 환자의 권장 복용량
SOVALDI 병용 요법의 권장 치료 요법, 기간 및 권장 복용량은 표 2와 표 3에 나와 있습니다. 표 4는 소아 환자에게 SOVALDI와 병용할 때 리바비린의 체중 기반 복용량을 제공합니다. HCV/HIV-1 동시 감염 환자의 경우 표 3과 표 4의 복용량 권장 사항을 따르십시오. 병용 HIV-1 항바이러스 약물에 대한 복용량 권장 사항은 약물 상호 작용 (7)을 참조하십시오. 간 이식을 기다리는 간세포암 소아 환자의 경우 이식 후 HCV 재감염을 예방하기 위해 최대 48주 또는 간 이식 시까지 SOVALDI를 리바비린과 병용 투여합니다 [특정 집단에서의 사용 (8.8) 참조].
| 환자 집단 | 치료 요법 및 기간 | |
|---|---|---|
| 유전자형 2형 | 간경변이 없거나 보상성 간경변(Child-Pugh A)이 있는 치료 경험이 없거나 치료 경험이 있는 환자* | SOVALDI + 리바비린† 12주 |
| 유전자형 3형 | 간경변이 없거나 보상성 간경변(Child-Pugh A)이 있는 치료 경험이 없거나 치료 경험이 있는 환자* | SOVALDI + 리바비린† 24주 |
SOVALDI 정제 또는 경구용 펠렛(음식과 함께 또는 음식 없이)을 사용하는 유전자형 2형 또는 3형 HCV를 가진 3세 이상 소아 환자의 권장 SOVALDI 복용량은 체중을 기준으로 하며(표 3), 리바비린과 병용하여 1일 1회 경구 복용합니다 [복용량 및 투여 (2.4), 특정 집단에서의 사용 (8.4), 임상 약리학 (12.3), 임상 연구 (14.5) 참조]. 정제를 삼킬 수 없는 소아 환자는 SOVALDI 펠렛을 복용할 수 있습니다 [복용량 및 투여 (2.4) 참조].
| 체중 (kg) | SOVALDI 정제 또는 경구용 펠렛 복용량 | SOVALDI 1일 복용량 |
|---|---|---|
| 35 이상 | 400mg 정제 1일 1회 또는 200mg 정제 2정 1일 1회 또는 200mg 펠렛 2포 1일 1회 |
1일 400mg |
| 17 ~ 35 미만 | 200mg 정제 1일 1회 또는 200mg 펠렛 1포 1일 1회 |
1일 200mg |
| 17 미만 | 150mg 펠렛 1포 1일 1회 | 1일 150mg |
| 체중 (kg) | 경구 리바비린 1일 복용량* |
|---|---|
|
|
| 47 미만 | 1일 1kg당 15mg (아침 및 저녁 분할 복용) |
| 47–49 | 1일 600mg (아침 200mg 1회, 저녁 200mg 2회) |
| 50–65 | 1일 800mg (아침 200mg 2회, 저녁 200mg 2회) |
| 66–80 | 1일 1000mg (아침 200mg 2회, 저녁 200mg 3회) |
| 80 초과 | 1일 1200mg (아침 200mg 3회, 저녁 200mg 3회) |
2.4 경구용 펠렛의 준비 및 투여
SOVALDI 펠렛의 준비 및 투여에 대한 자세한 내용은 SOVALDI 경구용 펠렛의 전체 사용 설명서를 참조하십시오.
SOVALDI 펠렛을 씹지 마십시오. SOVALDI 펠렛을 음식과 함께 투여하는 경우, 실온 이하의 비산성 연질 식품 한 스푼 이상에 펠렛을 뿌립니다. 비산성 식품의 예로는 푸딩, 초콜릿 시럽, 으깬 감자, 아이스크림 등이 있습니다. SOVALDI 펠렛을 음식과 부드럽게 섞은 후 30분 이내에 섭취하고 쓴 뒷맛을 피하기 위해 씹지 않고 전체 내용물을 삼키십시오.
2.5 복용량 수정
SOVALDI의 복용량 감량은 권장하지 않습니다.
환자가 페그인터페론 알파 및/또는 리바비린과 관련이 있을 수 있는 심각한 부작용이 있는 경우, 부작용이 완화되거나 심각도가 감소할 때까지 페그인터페론 알파 및/또는 리바비린 복용량을 줄이거나 중단해야 합니다. 페그인터페론 알파 및/또는 리바비린 복용량을 줄이고/또는 중단하는 방법에 대한 자세한 내용은 페그인터페론 알파 및 리바비린 처방 정보를 참조하십시오.
2.7 중증 신장애 및 말기 신질환
주요 sofosbuvir 대사산물의 노출 증가(최대 20배)로 인해 중증 신장애(사구체 여과율[eGFR] 30mL/min/1.73m2 미만) 또는 말기 신질환(ESRD) 환자에게는 복용량을 권장할 수 없습니다 [특정 집단에서의 사용(8.6) 및 임상 약리학(12.3) 참조].
3 제형 및 함량
SOVALDI는 경구용 정제 또는 과립으로 제공됩니다. 각 제형은 두 가지 용량으로 제공됩니다.
- 400mg 정제: 400mg 소포스부비르; 노란색, 캡슐 모양, 필름 코팅 정제로 한쪽에는 “GSI”, 다른 쪽에는 “7977”이 각인되어 있습니다.
- 200mg 정제: 200mg 소포스부비르; 노란색, 타원형, 필름 코팅 정제로 한쪽에는 “GSI”, 다른 쪽에는 “200”이 각인되어 있습니다.
- 200mg 과립: 200mg 소포스부비르; 백색에서 미황색 과립으로 단위 용량 포장되어 있습니다.
- 150mg 과립: 150mg 소포스부비르; 백색에서 미황색 과립으로 단위 용량 포장되어 있습니다.
4 금기 사항
SOVALDI를 리바비린 또는 페그인터페론 알파/리바비린과 병용하는 경우, 해당 약제에 적용되는 금기사항이 병용 요법에도 적용됩니다. 페그인터페론 알파와 리바비린의 금기사항 목록은 해당 처방 정보를 참조하십시오.
5 경고 및 주의사항
5.1 HCV 및 HBV 동시 감염 환자에서의 B형 간염 바이러스 재활성화 위험
HCV/HBV 동시 감염 환자에서 HCV 직접 작용 항바이러스제 치료 중이거나 치료를 완료한 환자 중 HBV 항바이러스 요법을 받지 않은 환자에서 B형 간염 바이러스(HBV) 재활성화가 보고되었습니다. 일부 경우에는 급성 간염, 간부전 및 사망으로 이어졌습니다. HBsAg 양성 환자와 세로 역학적 증거에 의해 HBV 감염이 해결된 환자(즉, HBsAg 음성 및 anti-HBc 양성)에서도 사례가 보고되었습니다. 특정 면역억제제 또는 항암제를 투여받는 환자에서도 HBV 재활성화가 보고되었습니다. HCV 직접 작용 항바이러스제 치료와 관련된 HBV 재활성화 위험은 이러한 환자에서 증가할 수 있습니다.
HBV 재활성화는 혈청 HBV DNA 수치의 급격한 증가로 나타나는 HBV 복제의 급격한 증가로 특징지어집니다. HBV 감염이 해결된 환자의 경우 HBsAg가 다시 나타날 수 있습니다. HBV 복제의 재활성화는 간염, 즉 아미노트랜스퍼라제 수치 증가를 동반할 수 있으며, 심한 경우에는 빌리루빈 수치 증가, 간부전 및 사망이 발생할 수 있습니다.
SOVALDI를 사용한 HCV 치료를 시작하기 전에 HBsAg와 anti-HBc를 측정하여 현재 또는 과거 HBV 감염의 증거가 있는지 모든 환자를 검사하십시오. HBV 감염의 세로 역학적 증거가 있는 환자의 경우, SOVALDI를 사용한 HCV 치료 중 및 치료 후 추적 관찰 중에 간염 발병 또는 HBV 재활성화의 임상적 및 실험실적 징후를 모니터링하십시오. 임상적으로 필요한 경우 HBV 감염에 대한 적절한 환자 관리를 시작하십시오.
5.2 아미오다론과 병용 투여 시 심각한 증상성 서맥
소포스부비르 함유 요법과 아미오다론을 병용 투여했을 때 증상성 서맥 및 심박조율기 시술이 필요한 사례가 시판 후 조사에서 보고되었습니다. 아미오다론을 복용 중인 환자에게 소포스부비르 함유 요법(HARVONI [레디파스비르/소포스부비르])을 병용 투여한 환자에서 치명적인 심정지가 보고되었습니다. 서맥은 일반적으로 수 시간에서 수일 이내에 발생했지만, HCV 치료 시작 후 최대 2주까지 관찰된 사례도 있습니다. 베타 차단제를 복용 중이거나 기저 심장 질환 및/또는 진행된 간 질환이 있는 환자는 아미오다론 병용 투여 시 증상성 서맥 위험이 증가할 수 있습니다. 서맥은 일반적으로 HCV 치료 중단 후 해소되었습니다. 이러한 효과의 기전은 알려져 있지 않습니다.
아미오다론과 SOVALDI의 병용 투여는 권장되지 않습니다. 다른 대안적인 치료법이 없는 아미오다론을 복용 중인 환자에게 SOVALDI를 병용 투여해야 하는 경우:
- 심각한 증상성 서맥의 위험에 대해 환자에게 알려주십시오.
- 병용 투여 첫 48시간 동안 입원 환경에서 심장 모니터링을 권장하며, 그 후에는 최소 치료 첫 2주 동안 매일 외래 또는 자가 심박수 모니터링을 실시해야 합니다.
다른 대안적인 치료법이 없어 아미오다론 치료를 시작해야 하는 SOVALDI 복용 환자는 위에 설명된 것과 같은 심장 모니터링을 받아야 합니다.
SOVALDI 복용을 시작하기 직전에 아미오다론을 중단한 환자도 위에 설명된 것과 같은 심장 모니터링을 받아야 합니다(아미오다론의 긴 반감기 때문입니다).
서맥의 징후나 증상이 나타나는 환자는 즉시 의학적 평가를 받아야 합니다. 증상에는 실신 또는 거의 실신, 어지러움 또는 현기증, 권태감, 쇠약, 과도한 피로, 호흡 곤란, 가슴 통증, 혼란 또는 기억 문제가 포함될 수 있습니다 [유해 반응 (6.2), 약물 상호작용 (7.1) 참조].
5.3 P-gp 유도제 사용으로 인한 치료 효과 감소 위험
장내 P-gp 유도제(예: 리팜핀, 세인트 존스 워트)는 소포스부비르 혈장 농도를 상당히 감소시켜 SOVALDI의 치료 효과를 감소시킬 수 있습니다. 리팜핀과 세인트 존스 워트를 SOVALDI와 함께 사용하는 것은 권장되지 않습니다 [약물 상호작용 (7.1) 참조].
5.4 병용 요법과 관련된 위험
SOVALDI는 HCV 감염 치료를 위해 다른 항바이러스제와 병용하여 사용되므로, SOVALDI와 병용되는 이러한 약물의 처방 정보를 참조하십시오. 이러한 약물과 관련된 경고 및 주의 사항은 SOVALDI 병용 요법에서의 사용에도 적용됩니다.
6 부작용 반응
다음과 같은 심각한 이상 반응이 아래 및 다른 라벨링 부분에 설명되어 있습니다.
- 아미오다론과 병용 투여 시 심각한 증상성 서맥 [경고 및 주의사항 (5.2) 참조 ].
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
SOVALDI를 리바비린 또는 페그인터페론 알파/리바비린과 함께 투여하는 경우, 해당 약물 사용과 관련된 이상 반응에 대한 설명은 각각의 처방 정보를 참조하십시오.
성인 대상자의 이상 반응
SOVALDI의 안전성 평가는 다음을 포함한 통합 3상 임상 시험 데이터(대조군 및 비대조군 모두)를 기반으로 했습니다.
- 12주 동안 SOVALDI + 리바비린(RBV) 병용 요법을 받은 대상자 650명,
- 16주 동안 SOVALDI + 리바비린 병용 요법을 받은 대상자 98명,
- 24주 동안 SOVALDI + 리바비린 병용 요법을 받은 대상자 250명,
- 12주 동안 SOVALDI + 페그인터페론(Peg-IFN) 알파 + 리바비린 병용 요법을 받은 대상자 327명,
- 24주 동안 페그인터페론 알파 + 리바비린을 받은 대상자 243명 및
- 12주 동안 위약(PBO)을 받은 대상자 71명 [임상 연구 (14) 참조 ].
이상 사례로 인해 치료를 영구적으로 중단한 대상자의 비율은 위약 투여군에서는 4%, 12주 동안 SOVALDI + 리바비린 투여군에서는 1%, 24주 동안 SOVALDI + 리바비린 투여군에서는 1% 미만, 24주 동안 페그인터페론 알파 + 리바비린 투여군에서는 11%, 12주 동안 SOVALDI + 페그인터페론 알파 + 리바비린 투여군에서는 2%였습니다.
위에 설명된 3상 임상 시험에서 대상자의 15% 이상에서 관찰된 이상 사례는 표 5에 제시되어 있습니다. 제시를 간소화하기 위해 나란히 표를 표시했습니다. 시험 설계가 다르기 때문에 시험 간에 직접 비교해서는 안 됩니다.
SOVALDI + 리바비린 병용 요법의 가장 흔한 이상 사례(20% 이상)는 피로와 두통이었습니다. SOVALDI + 페그인터페론 알파 + 리바비린 병용 요법의 가장 흔한 이상 사례(20% 이상)는 피로, 두통, 메스꺼움, 불면증 및 빈혈이었습니다.
| 인터페론 무함유 요법 | 인터페론 함유 요법 | ||||||
|---|---|---|---|---|---|---|---|
| 위약 12주 |
SOVALDI + RBV* 12주 |
SOVALDI + RBV* 24주 |
Peg-IFN 알파 + RBV† 24주 |
SOVALDI + Peg-IFN 알파 + RBV* 12주 |
|||
| N=71 | N=650 | N=250 | N=243 | N=327 | |||
| 피로 | 24% | 38% | 30% | 55% | 59% | ||
| 두통 | 20% | 24% | 30% | 44% | 36% | ||
| 메스꺼움 | 18% | 22% | 13% | 29% | 34% | ||
| 불면증 | 4% | 15% | 16% | 29% | 25% | ||
| 가려움증 | 8% | 11% | 27% | 17% | 17% | ||
| 빈혈 | 0% | 10% | 6% | 12% | 21% | ||
| 쇠약 | 3% | 6% | 21% | 3% | 5% | ||
| Rash | 8% | 8% | 9% | 18% | 18% |
| 식욕 감퇴 | 10% | 6% | 6% | 18% | 18% |
| 오한 | 1% | 2% | 2% | 18% | 17% |
| 인플루엔자 유사 질환 | 3% | 3% | 6% | 18% | 16% |
| 발열 | 0% | 4% | 4% | 14% | 18% |
| 설사 | 6% | 9% | 12% | 17% | 12% |
| 호중구 감소증 | 0% | <1% | <1% | 12% | 17% |
| 근육통 | 0% | 6% | 9% | 16% | 14% |
| 과민성 | 1% | 10% | 10% | 16% | 13% |
빈혈과 호중구감소증을 제외하고, 표 5에 제시된 대부분의 사례는 SOVALDI 함유 요법에서 1등급의 중증도로 발생했습니다.
임상 시험에서 보고된 흔하지 않은 이상 반응(1% 미만): 다음 이상 반응은 임상 시험에서 병용 요법으로 SOVALDI를 투여받은 대상자 중 1% 미만에서 발생했습니다. 이러한 사례는 중증도 또는 잠재적 인과 관계 평가 때문에 포함되었습니다.
혈액학적 영향: 범혈구감소증(특히 페길화 인터페론을 병용 투여받은 대상자에서).
정신 장애: 중증 우울증(특히 기존 정신 질환 병력이 있는 대상자에서), 자살 생각 및 자살 포함.
실험실 검사 이상:
선택된 혈액학적 매개변수의 변화는 표 6에 설명되어 있습니다. 제시를 간소화하기 위해 나란히 표를 표시했습니다. 시험 설계가 다르기 때문에 시험 간 직접 비교는 하지 않아야 합니다.
| 혈액학적 매개변수 | 인터페론 무함유 요법 | 인터페론 함유 요법 | |||
|---|---|---|---|---|---|
| PBO 12주 |
SOVALDI + RBV* 12주 |
SOVALDI + RBV* 24주 |
Peg-IFN + RBV† 24주 |
SOVALDI + Peg-IFN + RBV* 12주 |
|
| N=71 | N=647 | N=250 | N=242 | N=327 | |
| 헤모글로빈 (g/dL) | |||||
| <10 | 0 | 8% | 6% | 14% | 23% |
| <8.5 | 0 | 1% | <1% | 2% | 2% |
| 호중구 (×109/L) | |||||
| ≥0.5 – <0.75 | 1% | <1% | 0 | 12% | 15% |
| <0.5 | 0 | <1% | 0 | 2% | 5% |
| 혈소판 (×109/L) | |||||
| ≥25 – <50 | 3% | <1% | 1% | 7% | <1% |
| <25 | 0 | 0 | 0 | 0 | 0 |
빌리루빈 수치 상승
SOVALDI + 페그인터페론 알파 + 리바비린 12주 투여군에서는 2.5×ULN을 초과하는 총 빌리루빈 수치 상승이 어떤 피험자에게서도 관찰되지 않았으며, 페그인터페론 알파 + 리바비린 24주 투여군, SOVALDI + 리바비린 12주 투여군 및 SOVALDI + 리바비린 24주 투여군에서는 각각 1%, 3%, 3%의 피험자에게서 관찰되었습니다. 빌리루빈 수치는 치료 시작 후 1~2주 동안 최고치에 달한 후 감소하여 치료 후 4주차에 기준 수치로 돌아왔습니다. 이러한 빌리루빈 수치 상승은 트랜스아미나제 수치 상승과 관련이 없었습니다.
크레아틴 키나제 수치 상승
크레아틴 키나제는 FISSION 및 NEUTRINO 시험에서 평가되었습니다. 10×ULN 이상의 분리된 무증상 크레아틴 키나제 수치 상승은 페그인터페론 알파 + 리바비린 24주 투여군, SOVALDI + 페그인터페론 알파 + 리바비린 12주 투여군 및 SOVALDI + 리바비린 12주 투여군에서 각각 1% 미만, 1%, 2%의 피험자에게서 관찰되었습니다.
리파제 수치 상승
3×ULN을 초과하는 분리된 무증상 리파제 수치 상승은 SOVALDI + 페그인터페론 알파 + 리바비린 12주 투여군, SOVALDI + 리바비린 12주 투여군, SOVALDI + 리바비린 24주 투여군 및 페그인터페론 알파 + 리바비린 24주 투여군에서 각각 1% 미만, 2%, 2%, 2%의 피험자에게서 관찰되었습니다.
HCV/HIV-1 동시 감염 환자
리바비린과 병용한 SOVALDI는 223명의 HCV/HIV-1 동시 감염 피험자에서 평가되었습니다 [임상 연구 (14.4) 참조]. HCV/HIV-1 동시 감염 피험자의 안전성 프로파일은 HCV 단독 감염 피험자에서 관찰된 안전성 프로파일과 유사했습니다. 항레트로바이러스 요법의 일부로 아타자나비르를 투여받은 30/32명(94%)의 피험자에게서 총 빌리루빈 수치 상승(3등급 또는 4등급)이 관찰되었습니다. 어떤 피험자도 동반된 트랜스아미나제 증가를 보이지 않았습니다. 아타자나비르를 복용하지 않은 피험자 중에서는 2명(1.5%)의 피험자에게서 3등급 또는 4등급의 총 빌리루빈 수치 상승이 관찰되었는데, 이는 3상 시험에서 SOVALDI + 리바비린을 투여받은 HCV 단독 감염 피험자에게서 관찰된 비율과 유사했습니다.
3세 이상 소아 피험자에서의 이상 반응
3세 이상 소아 피험자에서의 SOVALDI 안전성 평가는 2상 공개 표지 임상 시험에서 12주(2형 유전형 피험자) 또는 24주(3형 유전형 피험자) 동안 SOVALDI와 리바비린을 병용하여 치료받은 106명의 피험자에 대한 데이터를 기반으로 합니다. 관찰된 이상 반응은 성인에서 SOVALDI와 리바비린 병용 임상 연구에서 관찰된 이상 반응과 일치했습니다. 리바비린 경구용액과 병용하여 SOVALDI를 복용한 3세 이상 12세 미만 소아 피험자 중 13%(7/54)에서 식욕 감퇴가 관찰되었습니다 [임상 연구 14.5) 참조].
5년 추적 연구에서, 2상 공개 표지 임상 시험(연구 1112)의 106명의 피험자 중 88명을 중앙값(Q1, Q3) 239(179, 244)주 동안 추적 관찰했습니다. 연구 종료 시까지 기준치로부터의 변화를 평가하여 키, 체중, BMI 백분위수 및 모든 연령대의 Z 점수에 대한 성장에 대한 현저한 영향은 관찰되지 않았습니다. 연구 종료 시까지 기준치로부터의 변화를 평가하여 Tanner 사춘기 단계에서 피험자의 2차 성징 발달에 대한 현저한 영향은 관찰되지 않았습니다 [특정 집단에서의 사용 (8.4) 참조].
6.2 시판 후 경험
다음 이상 반응은 SOVALDI의 시판 후 사용 중에 확인되었습니다. 시판 후 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
심장 질환
소포스부비르 함유 요법 치료를 시작하는 아미오다론을 복용하는 환자에게서 심각한 증상성 서맥이 보고되었습니다 [경고 및 주의 사항 (5.2), 약물 상호작용 (7.1) 참조].
7 약물 상호 작용
7.1 잠재적으로 중요한 약물 상호작용
소포스부비르는 약물 수송체 P-gp 및 유방암 저항 단백질(BCRP)의 기질이지만, 주요 순환 대사체 GS-331007은 그렇지 않습니다. 장에서 P-gp 유도체인 약물(예: 리팜핀 또는 세인트 존스 워트)은 소포스부비르 혈장 농도를 감소시켜 SOVALDI의 치료 효과를 감소시킬 수 있으므로, SOVALDI와의 병용 투여는 권장되지 않습니다 [경고 및 주의 사항 (5.3) 참조].
직접 작용 항바이러스제를 사용한 C형 간염 감염의 제거는 간 기능의 변화를 초래할 수 있으며, 이는 병용 약물의 안전하고 효과적인 사용에 영향을 미칠 수 있습니다. 예를 들어, 시판 후 보고 및 발표된 역학 연구에서 당뇨병 환자에게 심각한 증상이 있는 저혈당을 초래하는 알테드 혈당 조절이 보고되었습니다. 이러한 경우 저혈당 관리에는 당뇨병 치료에 사용되는 병용 약물의 중단 또는 용량 조절이 필요했습니다.
안전하고 효과적인 사용을 보장하기 위해 관련 실험실 매개변수(예: 와파린을 복용하는 환자의 국제 표준화 비율[INR], 당뇨병 환자의 혈당 수치) 또는 좁은 치료 지수를 가진 시토크롬 P450 기질과 같은 병용 약물의 약물 농도(예: 특정 면역억제제)를 자주 모니터링하는 것이 권장됩니다. 병용 약물의 용량 조절이 필요할 수 있습니다.
SOVALDI와의 잠재적인 약물 상호작용에 대한 정보는 표 7에 요약되어 있습니다. 이 표는 모든 것을 포함하는 것은 아닙니다 [경고 및 주의 사항 (5.2), 5.3) 및 임상 약리학 (12.3) 참조].
| 병용 약물 종류: 약물 이름 | 농도에 대한 영향† | 임상적 의견 |
|---|---|---|
| 항부정맥제: 아미오다론 |
아미오다론 및 소포스부비르 농도에 대한 영향 불명 | 소포스부비르 함유 요법과 아미오다론의 병용 투여는 심각한 증상이 있는 서맥을 초래할 수 있습니다. 이 효과의 메커니즘은 알려져 있지 않습니다. SOVALDI와 아미오다론의 병용 투여는 권장되지 않습니다. 병용 투여가 필요한 경우 심장 모니터링을 권장합니다 [경고 및 주의 사항 (5.2), 유해 반응 (6.2) 참조]. |
| 항경련제: 카르바마제핀 페니토인 페노바르비탈 옥스카르바제핀 |
소포스부비르 감소 GS-331007 감소 |
카르바마제핀, 페니토인, 페노바르비탈 또는 옥스카르바제핀과 SOVALDI의 병용 투여는 소포스부비르의 농도를 감소시켜 SOVALDI의 치료 효과를 감소시킬 것으로 예상됩니다. 병용 투여는 권장되지 않습니다. |
| 항결핵제: 리파부틴 리팜핀 리파펜틴 |
소포스부비르 감소 GS-331007 감소 |
리파부틴 또는 리파펜틴과 SOVALDI의 병용 투여는 소포스부비르의 농도를 감소시켜 SOVALDI의 치료 효과를 감소시킬 것으로 예상됩니다. 병용 투여는 권장되지 않습니다. 장 P-gp 유도체인 리팜핀과 SOVALDI의 병용 투여는 권장되지 않습니다 [경고 및 주의 사항 (5.3) 참조]. |
| 허브 보충제: 세인트 존스 워트 (Hypericum perforatum) |
소포스부비르 감소 GS-331007 감소 |
장 P-gp 유도체인 세인트 존스 워트와 SOVALDI의 병용 투여는 권장되지 않습니다 [경고 및 주의 사항 (5.3) 참조]. |
| HIV 프로테아제 억제제: 티프라나비르/리토나비르 |
소포스부비르 감소 GS-331007 감소 |
티프라나비르/리토나비르와 SOVALDI의 병용 투여는 소포스부비르의 농도를 감소시켜 SOVALDI의 치료 효과를 감소시킬 것으로 예상됩니다. 병용 투여는 권장되지 않습니다. |
7.2 SOVALDI와 임상적으로 유의미한 상호작용이 없는 약물
SOVALDI를 사용하여 수행된 약물 상호작용 연구에 따르면, SOVALDI가 다음 약물과 병용될 때 임상적으로 유의미한 약물 상호작용이 관찰되지 않았거나 예상되지 않습니다 [임상 약리학 (12.3) 참조]: 시클로스포린, 다루나비르/리토나비르, 에파비렌즈, 엠트리시타빈, 메타돈, 경구 피임약, 랄테그라비르, 릴피비린, 타크로리무스 또는 테노포비르 디소프록실 푸마르산염.
8 특정 집단에서의 사용
8.1 임신
위험 요약
SOVALDI를 리바비린 또는 페그인터페론 알파 및 리바비린과 함께 투여하는 경우, 병용 요법은 임산부와 여성 파트너가 임신한 남성에게 금기입니다. 임신 중 리바비린 및 페그인터페론 알파 사용과 관련된 위험에 대한 자세한 내용은 리바비린 및/또는 페그인터페론 알파 처방 정보를 참조하십시오.
SOVALDI가 임신 결과에 위험을 초래하는지 여부를 확인할 수 있는 적절한 인체 데이터가 없습니다. 동물 생식 연구에서 권장 인체 용량(RHD)에서 인체보다 높은 노출에서 소포스부비르로 인한 이상 발생 결과에 대한 증거는 관찰되지 않았습니다 [데이터 참조]. 랫드와 토끼의 기관 형성 과정에서 소포스부비르의 주요 순환 대사산물(GS-331007)에 대한 전신 노출(AUC)은 RHD에서 인체 노출의 ≥5배(랫드) 및 12배(토끼)였습니다. 랫드의 출산 전/후 발달 연구에서 GS-331007에 대한 모체 전신 노출(AUC)은 RHD에서 인체 노출의 ≥6배였습니다.
표시된 집단의 주요 선천적 결손 및 유산에 대한 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인지된 임신의 주요 선천적 결손 및 유산에 대한 추정 배경 위험은 각각 2–4% 및 15–20%입니다.
데이터
동물 데이터
소포스부비르는 임신한 랫드(최대 500mg/kg/일)와 토끼(최대 300mg/kg/일)에게 각각 임신 6~18일과 6~19일에 경구 투여되었으며, 랫드(경구 용량 최대 500mg/kg/일)에게는 임신 6일부터 수유/산후 20일까지 투여되었습니다. 테스트된 최고 용량에서 배아-태아(랫드 및 토끼) 또는 출산 전/후(랫드) 발달에 대한 유의미한 영향은 관찰되지 않았습니다. 소포스부비르의 주요 순환 대사산물(GS-331007)에 대한 전신 노출(AUC)은 RHD에서 인체 노출의 ≥5배(랫드) 및 12배(토끼)였으며, 임신 중 노출은 RHD에서 인체 노출의 약 5~10배(랫드) 및 12~28배(토끼)로 증가했습니다.
8.2 수유
위험 요약
소포스부비르 또는 그 대사산물이 모유에 존재하는지, 모유 생산에 영향을 미치는지 또는 모유 수유 유아에게 영향을 미치는지는 알려져 있지 않습니다. 소포스부비르의 주요 순환 대사산물(GS-331007)은 수유 랫드의 젖에서 관찰된 주요 성분이었으며, 수유 새끼에게는 영향을 미치지 않았습니다 [데이터 참조].
모유 수유의 발달 및 건강상의 이점은 SOVALDI에 대한 산모의 임상적 필요성 및 SOVALDI 또는 기저 모체 질환으로 인한 모유 수유 유아에 대한 잠재적인 부작용과 함께 고려해야 합니다.
SOVALDI를 리바비린과 함께 투여하는 경우, 수유부에 대한 리바비린 정보는 이 병용 요법에도 적용됩니다. 수유 중 사용에 대한 자세한 내용은 리바비린 처방 정보를 참조하십시오.
데이터
동물 데이터
랫드에서 테스트된 최고 용량에서 수유 새끼의 성장 및 출산 후 발달에 대한 소포스부비르의 영향은 관찰되지 않았습니다. 소포스부비르의 주요 순환 대사산물(GS-331007)에 대한 모체 전신 노출(AUC)은 RHD에서 인체 노출의 약 12배였으며, 수유 10일째 수유 새끼에서 관찰된 노출은 모체 노출의 약 2%였습니다. 수유 연구에서 소포스부비르 대사산물(주로 GS-331007)은 수유 2일째에 소포스부비르(20mg/kg)를 단일 경구 투여한 후 수유 랫드의 젖으로 배설되었으며, 투여 1시간 후 관찰된 젖 농도는 모체 혈장 농도의 약 10%였습니다.
8.3 생식 가능한 여성 및 남성
SOVALDI를 리바비린 또는 페그인터페론 및 리바비린과 함께 투여하는 경우, 임신 검사, 피임 및 불임과 관련된 리바비린 및 페그인터페론에 대한 정보는 이러한 병용 요법에도 적용됩니다. 자세한 내용은 리바비린 및/또는 페그인터페론 처방 정보를 참조하십시오.
8.4 소아 사용
유전자형 2 및 3 감염이 있는 3세 이상 소아 환자에서 SOVALDI의 안전성, 약동학 및 효능이 확립되었습니다. SOVALDI는 3세 이상의 피험자 106명(유전자형 2: 31명, 유전자형 3: 75명)을 포함한 공개 라벨 임상 시험(연구 1112)에서 평가되었습니다. 안전성, 약동학 및 효능은 성인에서 관찰된 것과 비슷했습니다 [용법 및 용량(2.3), 이상 반응(6.1), 임상 약리학(12.3) 및 임상 연구(14.5) 참조].
보상성 간경변이 있는 3세 이상 소아 환자에서 SOVALDI의 안전성 및 효능은 1) 간경변이 없는 성인 및 소아 환자와 2) 간경변이 없는 성인과 보상성 간경변이 있는 성인 간의 유사한 소포스부비르 및 GS-331007 노출에 의해 뒷받침됩니다. 따라서 보상성 간경변이 있는 소아 환자의 경우 보상성 간경변이 있는 성인과 유사한 효능이 예상됩니다.
HCV 유전자형 2 또는 3이 있는 3세 미만 소아 환자에서 SOVALDI의 안전성 및 효능은 확립되지 않았습니다. HCV 유전자형 1 또는 4가 있는 소아 환자에서 SOVALDI의 안전성 및 효능은 확립되지 않았습니다.
5년 추적 관찰 연구에서 1112번 연구에서 SOVALDI로 치료받은 3세 이상의 소아 환자 88명을 대상으로 SOVALDI의 소아 성장에 대한 장기적인 영향을 평가했습니다. 기준치에서 연구 종료까지 성장에 대한 주목할 만한 영향은 관찰되지 않았습니다[see Adverse Reactions (6.1)]. SVR12를 달성한 모든 환자는 연구 종료까지 SVR을 유지했습니다.
8.5 노인 환자에 대한 사용
SOVALDI는 65세 이상의 환자 90명에게 투여되었습니다. 65세 이상 환자에서 관찰된 반응률은 모든 치료군에서 젊은 환자의 반응률과 유사했습니다. 노인 환자의 경우 SOVALDI 용량 조정이 필요하지 않습니다 [see Clinical Pharmacology (12.3)].
8.6 신장애
경증 또는 중등도 신장애 환자의 경우 SOVALDI 용량 조정이 필요하지 않습니다. 중증 신장애(eGFR 30mL/min/1.73m2 미만) 또는 혈액투석이 필요한 ESRD 환자에서 SOVALDI의 안전성과 유효성은 확립되지 않았습니다. 중증 신장애 또는 ESRD 환자에게는 용량 권장 사항을 제공할 수 없습니다 [see Dosage and Administration (2.7) and Clinical Pharmacology (12.3)]. CrCl이 50mL/min 미만인 환자의 경우 리바비린 및 페그인터페론 알파 처방 정보도 참조하십시오.
8.7 간장애
경증, 중등도 또는 중증 간장애(Child-Pugh 등급 A, B 또는 C) 환자의 경우 SOVALDI 용량 조정이 필요하지 않습니다 [see Clinical Pharmacology (12.3)]. 비대상성 간경변 환자에서 SOVALDI의 안전성과 유효성은 확립되지 않았습니다. 간 기능 부전에 대한 금기 사항은 페그인터페론 알파 처방 정보를 참조하십시오.
8.8 간 이식을 기다리는 간세포암 환자
SOVALDI는 공개형 임상 시험에서 이식 후 HCV 재감염을 예방하기 위해 이식 전에 투여되는 SOVALDI와 리바비린의 안전성과 유효성을 평가하기 위해 간 이식 전 간세포암이 있는 HCV 감염 성인 환자를 대상으로 연구되었습니다. 이 시험의 주요 평가 변수는 이식 후 12주째에 HCV RNA가 정량 하한(LLOQ) 미만인 것으로 정의된 이식 후 바이러스 반응(pTVR)이었습니다. MILAN 기준(단일 간세포암 환자에서 직경 5cm 이하의 종양이 있는 경우, 다발성 종양 환자에서 각각 직경 3cm 이하의 종양 결절이 3개 이하이고 암의 간외 전이 또는 종양의 혈관 침범 증거가 없는 경우로 정의됨)을 충족하는 유전자형에 관계없이 간세포암(HCC)이 있는 HCV 감염 환자는 24~48주 동안 또는 간 이식 시까지 매일 400mg의 SOVALDI와 체중 기반 1000~1200mg의 리바비린을 투여받았습니다. SOVALDI와 리바비린을 투여받은 61명의 환자를 대상으로 중간 분석을 수행했습니다. 45명의 환자는 HCV 유전자형 1을 가지고 있었고, 44명의 환자는 기준 CPT 점수가 7 미만이었으며, 모든 환자는 기준 보정되지 않은 MELD 점수가 최대 14였습니다. 이 61명의 환자 중 41명은 최대 48주 동안 SOVALDI와 리바비린으로 치료한 후 간 이식을 받았습니다. 37명은 이식 시 HCV RNA가 LLOQ 미만이었습니다. 37명의 환자 중 이식 후 바이러스 반응(pTVR)률은 이식 후 12주 시점에 도달한 평가 가능한 환자 36명 중 64%(23/36)입니다. 간 이식 전 HCV 감염 환자에서 SOVALDI와 리바비린의 안전성 프로파일은 3상 임상 시험에서 SOVALDI와 리바비린으로 치료받은 환자에서 관찰된 것과 비슷했습니다.
10 과다 복용
소포스부비르의 가장 높은 기록된 용량은 59명의 건강한 피험자에게 투여된 1200mg의 소포스부비르 단회 용량(권장 용량의 3배)이었습니다. 그 시험에서 이 용량 수준에서는 어떠한 불리한 영향도 관찰되지 않았으며, 이상 반응은 위약 및 소포스부비르 400mg 치료군에서 보고된 것과 빈도 및 중증도가 유사했습니다. 더 높은 용량의 효과는 알려져 있지 않습니다.
SOVALDI 과다 복용에 대한 특별한 해독제는 없습니다. 과다 복용이 발생하면 환자의 독성 증거를 모니터링해야 합니다. SOVALDI 과다 복용 치료는 활력 징후 모니터링 및 환자의 임상 상태 관찰을 포함한 일반적인 지지 요법으로 구성됩니다. 4시간의 혈액 투석 세션에서 투여 용량의 18%가 제거되었습니다.
11 설명
SOVALDI (소포스부비르)는 HCV NS5B 폴리머라제의 뉴클레오티드 유사체 억제제입니다.
소포스부비르의 IUPAC 명칭은 (S)-isopropyl 2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo-3,4-dihydropyrimidin-1(2H)-yl)-4-fluoro-3-hydroxy-4-methyltetrahydrofuran-2-yl)methoxy)-(phenoxy)phosphorylamino)propanoate입니다. 분자식은 C22H29FN3O9P이고 분자량은 529.45입니다. 다음과 같은 구조식을 가지고 있습니다.
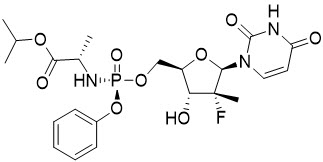
소포스부비르는 백색에서 미황색의 결정성 고체이며, 37 °C에서 pH 2~7.7 범위에서 ≥ 2 mg/mL의 용해도를 가지며 물에 약간 용해됩니다.
SOVALDI 정제 200 mg 또는 400 mg은 경구 투여용입니다. 각 정제는 200 mg 또는 400 mg의 소포스부비르를 함유하고 있습니다. 정제에는 다음과 같은 불활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 크로스카멜로스나트륨, 마그네슘스테아레이트, 만니톨, 미결정 셀룰로스. 정제는 다음과 같은 불활성 성분을 함유하는 코팅 물질로 필름 코팅되어 있습니다: 폴리에틸렌글리콜, 폴리비닐알코올, 활석, 이산화티타늄, 황색 산화철.
SOVALDI 펠릿 150 mg 또는 200 mg은 경구 투여용이며, 단위 용량 포장에 백색에서 미황색의 펠릿으로 제공됩니다. 각 단위 용량 포장에는 150 mg 또는 200 mg의 소포스부비르가 포함되어 있습니다. 펠릿에는 다음과 같은 불활성 성분이 포함되어 있습니다: 아미노 메타크릴레이트 공중합체, 콜로이드성 이산화규소, 크로스카멜로스나트륨, 히드록시프로필 셀룰로스, 히프로멜로스, 유당 일수화물, 미결정 셀룰로스, 폴리에틸렌글리콜, 이산화규소, 라우릴황산나트륨, 스테아릴푸마르산나트륨, 스테아르산, 활석.
12 약물동력학
12.3 약동학
흡수
건강한 성인 피험자와 만성 C형 간염 환자에서 소포스부비르와 주요 순환 대사체 GS-331007의 약동학적 특성이 평가되었습니다. SOVALDI의 경구 투여 후, 소포스부비르는 용량 수준에 관계없이 투여 후 약 0.5~2시간에 최고 혈장 농도가 관찰되는 것으로 흡수되었습니다. GS-331007의 최고 혈장 농도는 투여 후 2~4시간 사이에 관찰되었습니다. 리바비린을 병용 투여(페길화 인터페론 유무에 관계없이)받은 1형에서 6형 HCV 감염 환자를 대상으로 한 집단 약동학 분석에 따르면, 소포스부비르의 기하 평균 정상 상태 AUC0–24는 969 ng∙hr/mL (N=838)이고 GS-331007의 기하 평균 정상 상태 AUC0–24는 6790 ng∙hr/mL (N=1695)였습니다. 소포스부비르만을 투여받은 건강한 피험자(N=272)에 비해, HCV 감염 환자의 소포스부비르 AUC0–24는 60% 더 높았고, GS-331007 AUC0–24는 각각 39% 더 낮았습니다. 소포스부비르와 GS-331007의 AUC는 200mg에서 1200mg의 용량 범위에서 용량에 거의 비례합니다.
음식의 영향
단식 상태와 비교하여, 표준화된 고지방 식사와 함께 SOVALDI를 단회 투여하는 것은 소포스부비르 Cmax 또는 AUC0–inf에 실질적으로 영향을 미치지 않았습니다. 고지방 식사가 있는 경우 GS-331007의 노출은 변하지 않았습니다. 따라서 SOVALDI는 음식과 관계없이 투여할 수 있습니다.
분포
소포스부비르는 인체 혈장 단백질에 약 61~65% 결합하며, 결합은 1 마이크로그램/mL에서 20 마이크로그램/mL의 범위에서 약물 농도에 무관합니다. 인체 혈장에서 GS-331007의 단백질 결합은 최소였습니다. 건강한 피험자에게 [14C]-소포스부비르를 400mg 단회 투여한 후, 14C 방사능의 혈액 대 혈장 비율은 약 0.7이었습니다.
대사
소포스부비르는 간에서 광범위하게 대사되어 약리학적으로 활성인 뉴클레오시드 유사체 트리포스페이트 GS-461203을 형성합니다. 대사 활성화 경로에는 인체 카텝신 A (CatA) 또는 카르복실에스테라아제 1 (CES1)에 의해 촉매되는 카르복실 에스터 부분의 순차적 가수분해와 히스티딘 트리아드 뉴클레오티드 결합 단백질 1 (HINT1)에 의한 포스포라미데이트 절단, 그리고 피리미딘 뉴클레오티드 생합성 경로에 의한 인산화가 포함됩니다. 탈인산화는 효율적으로 재인산화될 수 없고 in vitro에서 항-HCV 활성이 없는 뉴클레오시드 대사체 GS-331007의 형성을 초래합니다.
[14C]-소포스부비르 400mg을 단회 경구 투여한 후, 소포스부비르와 GS-331007은 각각 약물 관련 물질(소포스부비르 및 그 대사체의 분자량 조정 AUC의 합계) 전신 노출의 약 4%와 90% 이상을 차지했습니다.
배설
[14C]-소포스부비르 400mg을 단회 경구 투여한 후, 용량의 평균 총 회수율은 92% 이상이었으며, 이는 소변에서 약 80%, 대변에서 14%, 그리고 호기에서 2.5%가 회수된 것으로 구성되었습니다. 소변에서 회수된 소포스부비르 용량의 대부분은 GS-331007 (78%)이었고, 3.5%는 소포스부비르로 회수되었습니다. 이러한 데이터는 신장 청소가 GS-331007의 주요 배설 경로임을 나타냅니다. 소포스부비르와 GS-331007의 중앙값 최종 반감기는 각각 0.4시간과 27시간이었습니다.
특정 집단
소아 환자
표 8에 설명된 대로 매일 SOVALDI를 투여받은 3세 이상의 HCV 2형 또는 3형 감염 소아 환자에서 소포스부비르와 GS-331007의 약동학이 결정되었습니다. 소아 환자의 노출은 성인에서 관찰된 노출과 유사했습니다.
| 체중 그룹 | 용량 | 약동학적 매개변수 | 기하 평균 (%CV) | |
|---|---|---|---|---|
| 소포스부비르 | GS-331007 | |||
| ≥35 kg† | 400 mg | AUCtau (ng∙hr/mL) | 1060 (50.6) | 7570 (32.8) |
| Cmax (ng/mL) | 472 (53.0) | 572 (40.7) | ||
| 17 to <35 kg‡ | 200 mg | AUCtau (ng∙hr/mL) | 891 (36.1) | 10400 (31.6) |
| Cmax (ng/mL) | 438 (26.4) | 866 (27.1) | ||
| <17 kg§ | 150 mg | AUCtau (ng∙hr/mL) | 851 (41.7) | 9060 (37.6) |
| Cmax (ng/mL) | 418 (26.8) | 767 (28.3) | ||
소포스부비르와 GS-331007의 약동학적 특성은 3세 미만 소아에서 확립되지 않았습니다 [특정 집단에서의 사용 (8.4) 및 임상 연구 (14.5) 참조].
노인 환자
C형 간염 감염 환자를 대상으로 한 집단 약동학 분석 결과, 분석된 연령 범위(19~75세) 내에서 연령은 소포스부비르와 GS-331007 노출에 임상적으로 관련된 영향을 미치지 않았습니다 [특정 집단에서의 사용 (8.5) 참조].
신장애 환자
경도(eGFR 50~80 mL/min/1.73m2 미만), 중등도(eGFR 30~50 mL/min/1.73m2 미만), 중증 신장애(eGFR 30 mL/min/1.73m2 미만) 및 투석이 필요한 말기 신부전(ESRD) 환자를 포함한 C형 간염 음성 대상자에서 단회 400mg 소포스부비르 투여 후 소포스부비르의 약동학적 특성을 연구했습니다. 정상 신기능(eGFR 80 mL/min/1.73m2 초과) 대상자와 비교하여, 경도, 중등도 및 중증 신장애 환자의 소포스부비르 AUC0–inf는 각각 61%, 107%, 171% 증가하였고, GS-331007 AUC0–inf는 각각 55%, 88%, 451% 증가하였습니다. ESRD 환자의 경우, 정상 신기능 대상자와 비교하여, 소포스부비르 투여 후 1시간 이내에 투석을 실시한 경우 소포스부비르와 GS-331007 AUC0–inf는 각각 28% 및 1280% 증가하였고, 소포스부비르 투여 후 1시간 후에 투석을 실시한 경우 각각 60% 및 2070% 증가하였습니다. 4시간 투석으로 투여 용량의 약 18%가 제거되었습니다. 경도 또는 중등도 신장애 환자의 경우 용량 조절이 필요하지 않습니다. 중증 신장애 또는 ESRD 환자에 대한 SOVALDI의 안전성 및 유효성은 확립되지 않았습니다. 중증 신장애 또는 ESRD 환자에 대한 용량 권장 사항은 제시할 수 없습니다 [투여 및 투약 방법 (2.6) 및 특정 집단에서의 사용 (8.6) 참조].
간장애 환자
중등도 및 중증 간장애(Child-Pugh B등급 및 C등급) C형 간염 감염 환자에서 7일간 400mg 소포스부비르 투여 후 소포스부비르의 약동학적 특성을 연구했습니다. 정상 간 기능 대상자와 비교하여, 중등도 및 중증 간장애 환자의 소포스부비르 AUC0–24는 각각 126% 및 143% 증가하였고, GS-331007 AUC0–24는 각각 18% 및 9% 증가하였습니다. C형 간염 감염 환자를 대상으로 한 집단 약동학 분석 결과, 간경변증은 소포스부비르와 GS-331007 노출에 임상적으로 관련된 영향을 미치지 않았습니다. 경도, 중등도 또는 중증 간장애 환자의 경우 SOVALDI 용량 조절을 권장하지 않습니다 [특정 집단에서의 사용 (8.7) 참조].
약물 상호작용 평가
소포스부비르는 약물 수송체 P-gp 및 유방암 저항성 단백질(BCRP)의 기질이지만 GS-331007은 그렇지 않습니다. 장내 P-gp 유도제(예: 리팜핀 또는 세인트 존스 워트)는 소포스부비르 혈장 농도를 감소시켜 SOVALDI의 치료 효과를 감소시킬 수 있으므로, SOVALDI와의 병용 투여는 권장되지 않습니다 [경고 및 주의사항 (5.3) 및 약물 상호작용 (7.1) 참조].
P-gp 및/또는 BCRP 억제제와 SOVALDI를 병용 투여하면 GS-331007 혈장 농도를 증가시키지 않고 소포스부비르 혈장 농도를 증가시킬 수 있습니다. 따라서 SOVALDI는 P-gp 및/또는 BCRP 억제제와 병용 투여할 수 있습니다. 소포스부비르와 GS-331007은 P-gp 및 BCRP의 억제제가 아니므로 이러한 수송체의 기질인 약물의 노출을 증가시키지 않을 것으로 예상됩니다.
소포스부비르의 세포 내 대사 활성화 경로는 일반적으로 저 친화성 및 고 용량 가수분해 효소 및 뉴클레오티드 인산화 경로에 의해 매개되며, 병용 약물의 영향을 받을 가능성이 적습니다.
병용 투여 약물이 소포스부비르와 GS-331007 노출에 미치는 영향은 표 9에 나와 있습니다. 소포스부비르가 병용 투여 약물의 노출에 미치는 영향은 표 10에 나와 있습니다 [약물 상호작용 (7.1), 7.2) 참조].
| 병용 투여 약물 | 병용 투여 약물 용량 (mg) | 소포스부비르 용량 (mg) | N | 병용 약물 유무에 따른 소포스부비르 및 GS-331007 PK의 평균 비율 (90% CI) 무효과=1.00 |
|||
|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||||
| NA = 해당 없음 | |||||||
| 시클로스포린 | 600 단회 용량 | 400 단회 용량 | 19 | sofosbuvir | 2.54 (1.87, 3.45) |
4.53 (3.26, 6.30) |
NA |
| GS-331007 | 0.60 (0.53, 0.69) |
1.04 (0.90, 1.20) |
NA | ||||
| 다루나비르 (리토나비르 증강) |
800/100 일 1회 | 400 단회 용량 | 18 | sofosbuvir | 1.45 (1.10, 1.92) |
1.34 (1.12, 1.59) |
NA |
| GS-331007 | 0.97 (0.90, 1.05) |
1.24 (1.18, 1.30) |
NA | ||||
| 에파비렌즈† | 600 일 1회 | 400 단회 용량 | 16 | sofosbuvir | 0.81 (0.60, 1.10) |
0.94 (0.76, 1.16) |
NA |
| 엠트리시타빈† | 200 일 1회 | ||||||
| 테노포비르 디소프록실푸마르산염† | 300 일 1회 | GS-331007 | 0.77 (0.70, 0.84) |
0.84 (0.76, 0.92) | NA | ||
| 메타돈 | 30~130 일 1회 | 400 일 1회 | 14 | sofosbuvir | 0.95‡ (0.68, 1.33) |
1.30‡ (1.00, 1.69) |
NA |
| GS-331007 | 0.73‡ (0.65, 0.83) |
1.04‡ (0.89, 1.22) |
NA | ||||
| 릴피비린 | 25 일 1회 | 400 단회 용량 | 17 | sofosbuvir | 1.21 (0.90, 1.62) |
1.09 (0.94, 1.27) |
NA |
| GS-331007 | 1.06 (0.99, 1.14) |
1.01 (0.97, 1.04) |
NA | ||||
| 타크로리무스 | 5 단회 용량 | 400 단회 용량 | 16 | sofosbuvir | 0.97 (0.65, 1.43) |
1.13 (0.81, 1.57) |
NA |
| GS-331007 | 0.97 (0.83, 1.14) |
1.00 (0.87, 1.13) |
NA | ||||
랄테그라비르와 함께 투여했을 때 소포스부비르와 GS-331007의 약동학적 매개변수에 대한 영향은 관찰되지 않았습니다.
| 병용 투여 약물 | 병용 투여 약물 용량 (mg) | 소포스부비르 용량 (mg) | N | 소포스부비르 유무에 따른 병용 투여 약물 PK의 평균 비율 (90% CI) 영향 없음=1.00 |
||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| NA = 사용 불가/해당 없음 | ||||||
| 노렐게스트로민 | 노르게스티메이트 0.18/0.215/0.25/ 에티닐에스트라디올 0.025 1일 1회 | 400 1일 1회 | 15 | 1.07 (0.94, 1.22) |
1.06 (0.92, 1.21) |
1.07 (0.89, 1.28) |
| 노르게스트렐 | 1.18 (0.99, 1.41) |
1.19 (0.98, 1.45) |
1.23 (1.00, 1.51) |
|||
| 에티닐에스트라디올 | 1.15 (0.97, 1.36) |
1.09 (0.94, 1.26) |
0.99 (0.80, 1.23) |
|||
| 랄테그라비르 | 400 1일 2회 | 400 단회 용량 | 19 | 0.57 (0.44, 0.75) |
0.73 (0.59, 0.91) |
0.95 (0.81, 1.12) |
| 타크로리무스 | 5 단회 용량 | 400 단회 용량 | 16 | 0.73 (0.59, 0.90) |
1.09 (0.84, 1.40) |
NA |
| 테노포비르 디소프록실푸마르산염† | 300 1일 1회 | 400 단회 용량 | 16 | 1.25 (1.08, 1.45) |
0.98 (0.91, 1.05) |
0.99 (0.91, 1.07) |
소포스부비르와 병용 투여된 다음 약물의 약동학적 매개변수에 대한 영향은 관찰되지 않았습니다: 시클로스포린, 다루나비르/리토나비르, 에파비렌즈, 엠트리시타빈, 메타돈 또는 릴피비린.
12.4 미생물학
작용 기전
소포스부비르는 바이러스 복제에 필수적인 HCV NS5B RNA 의존성 RNA 중합효소의 억제제입니다. 소포스부비르는 세포 내 대사를 거쳐 약리학적으로 활성인 유리딘 유사체 트리포스페이트(GS-461203)를 형성하는 뉴클레오티드 프로드러그로, NS5B 중합효소에 의해 HCV RNA에 통합될 수 있으며 사슬 종결제 역할을 합니다. 생화학적 분석에서 GS-461203은 HCV 유전형 1b, 2a, 3a 및 4a의 재조합 NS5B의 중합효소 활성을 0.7~2.6 마이크로몰 범위의 IC50 값으로 억제했습니다. GS-461203은 인간 DNA 및 RNA 중합효소의 억제제도 아니며 미토콘드리아 RNA 중합효소의 억제제도 아닙니다.
항바이러스 활성
HCV 레플리콘 분석에서 유전형 1a, 1b, 2a, 3a 및 4a의 전체 길이 레플리콘과 유전형 2b, 5a 또는 6a의 NS5B를 코딩하는 키메라 1b 레플리콘에 대한 소포스부비르의 EC50 값은 0.014~0.11 마이크로몰 범위였습니다. 임상 분리주에서 NS5B 서열을 코딩하는 키메라 레플리콘에 대한 소포스부비르의 중앙값 EC50 값은 유전형 1a의 경우 0.062 마이크로몰(범위 0.029~0.128 마이크로몰; N=67), 유전형 1b의 경우 0.102 마이크로몰(범위 0.045~0.170 마이크로몰; N=29), 유전형 2의 경우 0.029 마이크로몰(범위 0.014~0.081 마이크로몰; N=15), 유전형 3a의 경우 0.081 마이크로몰(범위 0.024~0.181 마이크로몰; N=106)이었습니다. 감염성 바이러스 분석에서 유전형 1a 및 2a에 대한 소포스부비르의 EC50 값은 각각 0.03 및 0.02 마이크로몰이었습니다. 40% 인간 혈청의 존재는 소포스부비르의 항-HCV 활성에 영향을 미치지 않았습니다. 인터페론 알파 또는 리바비린과 병용한 소포스부비르의 평가 결과 레플리콘 세포에서 HCV RNA 수준을 감소시키는 데 길항 작용이 나타나지 않았습니다.
내성
세포 배양에서
소포스부비르에 대한 감수성이 감소된 HCV 레플리콘은 1b, 2a, 2b, 3a, 4a, 5a 및 6a를 포함한 여러 유전형에 대해 세포 배양에서 선택되었습니다. 소포스부비르에 대한 감수성 감소는 조사된 모든 레플리콘 유전형에서 주요 NS5B 치환 S282T와 관련이 있었습니다. 유전형 2a, 5 및 6 레플리콘에서는 S282T 치환과 함께 M289L 치환이 발생했습니다. 8가지 유전형의 레플리콘에서 S282T 치환의 부위 지정 돌연변이 유발은 소포스부비르에 대한 감수성을 2~18배 감소시켰고 해당 야생형과 비교하여 바이러스 복제 능력을 89%~99% 감소시켰습니다. 생화학적 분석에서 유전형 1b, 2a, 3a 및 4a의 S282T 치환을 발현하는 재조합 NS5B 중합효소는 각각의 야생형과 비교하여 GS-461203에 대한 감수성이 감소했습니다.
임상 시험에서
3상 시험에서 SOVALDI를 투여받은 982명의 피험자에 대한 풀링 분석에서 224명의 피험자가 차세대 뉴클레오티드 시퀀싱(검정 기준 1%)을 통해 기준 이후 NS5B 유전형 데이터를 보유했습니다.
3상 시험에서 GT3a 감염 피험자의 기준 이후 샘플에서 치료로 인해 발생한 치환 L159F(n=6) 및 V321A(n=5)가 검출되었습니다. L159F 또는 V321A 치환이 있는 피험자 분리주의 소포스부비르에 대한 표현형 감수성의 변화는 관찰되지 않았습니다. 소포스부비르 관련 내성 치환 S282T는 3상 시험의 기준 또는 실패 분리주에서 검출되지 않았습니다. 그러나 2상 시험 P7977-0523 [ELECTRON]에서 12주간의 소포스부비르 단독 요법 후 4주차 치료 후 재발한 유전형 2b 피험자 1명에서 S282T 치환이 검출되었습니다. 이 피험자의 분리주는 소포스부비르에 대한 평균 13.5배 감소된 감수성을 나타냈습니다. 이 피험자의 경우 S282T 치환은 치료 후 12주차에 검정 기준 1%의 차세대 시퀀싱으로 더 이상 검출되지 않았습니다.
간 이식을 기다리는 간세포암 환자를 대상으로 최대 48주 동안 소포스부비르와 리바비린을 투여받은 시험에서 L159F 치환은 바이러스학적 실패(돌파 및 재발)를 경험한 GT1a 또는 GT2b HCV 감염 다수 피험자에게서 나타났습니다. 또한 기준 시점에서 L159F 및/또는 C316N 치환의 존재는 GT1b HCV에 감염된 다수 피험자의 이식 후 소포스부비르 돌파 및 재발과 관련이 있었습니다. 또한 부분적 치료 반응을 보인 GT1a HCV에 감염된 피험자에서 차세대 시퀀싱을 통해 치료 중 S282R 및 L320F 치환이 검출되었습니다.
이러한 치환의 임상적 중요성은 알려져 있지 않습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
발암성 및 돌연변이원성
리바비린 및/또는 페그인터페론 알파와 병용: 발암성 및 돌연변이원성에 대한 정보는 리바비린 및/또는 페그인터페론 알파 처방 정보를 참조하십시오.
소포스부비르는 세균 돌연변이 유발성, 인간 말초혈액 림프구를 사용한 염색체 이상 및 in vivo 마우스 소핵 분석을 포함한 일련의 in vitro 또는 in vivo 분석에서 유전독성이 없었습니다.
소포스부비르를 사용하여 마우스와 랫드에서 2년간의 발암성 연구를 수행했습니다. 마우스에는 수컷 200mg/kg/일, 암컷 600mg/kg/일까지의 용량을 투여했고, 랫드에는 수컷과 암컷 모두 750mg/kg/일까지의 용량을 투여했습니다. 마우스와 랫드에서 가장 높은 용량으로 시험했을 때 약물 관련 신생물 발생률의 증가는 관찰되지 않았으며, 이는 주요 순환 대사체인 GS-331007에 대한 AUC 노출이 권장 임상 용량에서 사람의 노출량보다 마우스에서 각각 약 7배 및 30배, 랫드에서 각각 약 13배 및 17배였음을 나타냅니다.
14 CLINICAL STUDIES
14.1 임상시험 설명
SOVALDI의 안전성 및 유효성은 1형에서 6형까지의 만성 C형 간염 바이러스에 감염된 총 1724명의 HCV 단독 감염 대상자를 대상으로 한 5건의 3상 시험, 1형, 2형 또는 3형 HCV에 감염된 223명의 HCV/HIV-1 동시 감염 대상자를 대상으로 한 1건의 3상 시험, 그리고 3세 이상의 2형 또는 3형 HCV에 감염된 106명의 소아 대상자를 대상으로 한 1건의 시험에서 평가되었으며, 이는 표 11에 요약되어 있습니다 [임상 연구 (14.2), 14.3, 14.4 및 14.5) 참조].
| 시험 | 모집단 | 연구군 (치료받은 대상자 수) |
|---|---|---|
| NEUTRINO * (NCT01641640) |
치료 경험 없는 대상자 (TN) (1형, 4형, 5형 또는 6형) | SOVALDI+Peg-IFN 알파+RBV 12주 (327명) |
| FISSION * (NCT01497366) |
TN (2형 또는 3형) | SOVALDI+RBV 12주 (256명) Peg-IFN 알파+RBV 24주 (243명) |
| POSITRON † (NCT01542788) |
인터페론에 대한 내성이 있거나, 인터페론 치료 자격이 없거나, 인터페론 치료를 원하지 않는 대상자 (2형 또는 3형) | SOVALDI+RBV 12주 (207명) 위약 12주 (71명) |
| FUSION † (NCT01604850) |
이전 인터페론 재발 또는 무반응 대상자 (2형 또는 3형) | SOVALDI+RBV 12주 (103명) SOVALDI+RBV 16주 (98명) |
| VALENCE † (NCT01682720) |
TN 또는 이전 인터페론 재발 또는 무반응 대상자 (2형 또는 3형) | 2형에 대한 SOVALDI+RBV 12주 (73명) 3형에 대한 SOVALDI+RBV 12주 (11명) 3형에 대한 SOVALDI+RBV 24주 (250명) 위약 12주 (85명) |
| PHOTON-1 * (NCT01667731) |
|
1형에 대한 SOVALDI+RBV 24주 (114명) 2형 또는 3형 TN에 대한 SOVALDI+RBV 12주 (68명) 2형 또는 3형 이전 인터페론 재발 또는 무반응 대상자에 대한 SOVALDI+RBV 24주 (41명) |
| 1112 (NCT02175758)* |
3세 이상의 2형 또는 3형 소아 대상자 | 2형에 대한 SOVALDI+RBV 12주 (31명) 3형에 대한 SOVALDI+RBV 24주 (75명) |
성인 대상 임상시험의 피험자들은 간경변이 없거나 보상성 간경변을 가진 경우였습니다. SOVALDI는 1일 1회 400mg의 용량으로 투여되었습니다. 성인 피험자에 대한 리바비린(RBV) 용량은 SOVALDI와 병용했을 때 체중에 따라 1일 1000~1200mg으로 2회 분할 투여되었으며, 해당되는 경우 페그인터페론 알파 2a 용량은 주 180마이크로그램이었습니다. 치료 기간은 각 시험에서 고정되었으며 피험자의 HCV RNA 수치에 따라 조정되지 않았습니다(반응 지침 알고리즘 없음). 혈장 HCV RNA 값은 High Pure System과 함께 사용하기 위한 COBAS TaqMan HCV 검사(버전 2.0)를 사용하여 임상 시험 중에 측정되었습니다. 이 분석법의 정량 하한(LLOQ)은 mL당 25 IU였습니다. 지속적인 바이러스학적 반응(SVR12)은 치료 종료 후 12주 시점에서 HCV RNA가 LLOQ 미만인 것으로 정의된 1차 종점이었습니다.
14.2 1형 또는 4형 HCV 감염 환자 대상 임상 시험
치료 경험 없는 성인 ─ NEUTRINO (연구 110)
NEUTRINO는 페그인터페론 알파 2a 및 리바비린과 병용한 SOVALDI로 12주간 치료를 받은 1형, 4형, 5형 또는 6형 HCV 감염 치료 경험 없는 피험자를 사전에 지정된 과거 대조군과 비교 평가한 공개, 단일군 시험이었습니다.
치료받은 피험자(N=327)의 중앙값 연령은 54세(범위: 19~70세)였으며, 피험자의 64%가 남성이었고, 79%가 백인, 17%가 흑인, 14%가 히스패닉 또는 라틴계였습니다. 평균 체질량 지수는 29kg/m2(범위: 18~56kg/m2)였으며, 78%가 기준 HCV RNA가 mL당 6 log10 IU를 초과했고, 17%가 간경변을 가지고 있었으며, 89%가 HCV 1형, 9%가 HCV 4형, 2%가 HCV 5형 또는 6형이었습니다. 표 12는 1형 또는 4형 HCV를 가진 피험자에서 SOVALDI + 페그인터페론 알파 + 리바비린 병용 치료군의 SVR12를 보여줍니다. 12주 동안 SOVALDI + 페그인터페론 알파 + 리바비린으로 치료받은 5형 또는 6형 HCV 감염 피험자에 대한 데이터는 용량 권장 사항에 충분하지 않았으므로 이러한 결과는 표 12에 제시되지 않았습니다 [특정 집단에서의 사용 (8.10) 참조].
| SOVALDI + Peg-IFN 알파 + RBV 12주 | |
|---|---|
| N=320 | |
| 전체 SVR | 90% (289/320) |
| 1형* | 90% (262/292) |
| 1a형 | 92% (206/225) |
| 1b형 | 83% (55/66) |
| 4형 | 96% (27/28) |
| SVR을 달성하지 못한 피험자의 결과 | |
| 치료 중 바이러스학적 실패 | 0/320 |
| 재발† | 9% (28/319) |
| 기타‡ | 1% (3/320) |
선택된 하위 그룹의 SVR12는 표 13에 제시되어 있습니다.
| SOVALDI + Peg-IFN 알파 + RBV 12주 | |
|---|---|
| 간경변 | |
| 없음 | 93% (247/267) |
| 있음 | 79% (42/53) |
| 인종 | |
| 흑인 | 87% (47/54) |
| 흑인이 아닌 | 91% (242/266) |
| 여러 기준 요인 | |
| 1형, Metavir F3/F4 섬유화, IL28B 비-C/C, HCV RNA >800,000 IU/mL | 71% (37/52) |
1형 또는 4형 HCV 감염 환자이면서 기저 IL28B C/C 대립유전자를 가진 대상자의 SVR12 비율은 99%(89/90)였고, 1형 또는 4형 HCV 감염 환자이면서 기저 IL28B 비-C/C 대립유전자를 가진 대상자의 SVR12 비율은 87%(200/230)였습니다.
이전에 페길화 인터페론 및 리바비린 치료에 실패한 환자의 SVR12는 전통적으로 인터페론 기반 치료에 대한 반응률이 낮은 것과 관련된 여러 기저 요인을 가진 NEUTRINO 연구 대상자에서 관찰된 SVR12와 유사할 것으로 추정됩니다(표 13).
IL28B 비-C/C 대립유전자, 800,000 IU/mL 초과의 HCV RNA 및 Metavir F3/F4 섬유화를 가진 1형 대상자의 NEUTRINO 시험에서 SVR12 비율은 71%(37/52)였습니다.
14.3 2형 또는 3형 HCV 감염 대상자에 대한 임상 시험
치료 경험이 없는 성인 ─ FISSION (연구 1231)
FISSION은 2형 및 3형 HCV 감염 환자를 대상으로 SOVALDI와 리바비린으로 12주간 치료하는 것과 페길화 인터페론 알파 2a와 리바비린으로 24주간 치료하는 것을 비교 평가한 무작위 배정, 공개, 활성 대조군 시험이었습니다. SOVALDI + 리바비린군과 페길화 인터페론 알파 2a + 리바비린군에서 사용된 리바비린 용량은 각각 체중 기반 1000–1200 mg/일과 체중에 관계없이 800 mg/일이었습니다. 대상자는 1:1 비율로 무작위 배정되었으며, 간경변(유무), HCV 유전형(2형 대 3형) 및 기저 HCV RNA 수치(6 log10 IU/mL 미만 대 6 log10 IU/mL 이상)에 따라 계층화되었습니다. 2형 또는 3형 HCV 감염 환자는 약 1:3 비율로 등록되었습니다.
치료받은 대상자(N=499)의 중앙값 연령은 50세(범위: 19~77세)였으며, 대상자의 66%가 남성이었고, 87%가 백인, 3%가 흑인, 14%가 히스패닉 또는 라틴계였으며, 평균 체질량 지수는 28 kg/m2(범위: 17~52 kg/m2)였습니다. 기저 HCV RNA 수치가 6 log10 IU/mL를 초과한 대상자는 57%, 간경변이 있는 대상자는 20%, HCV 3형 감염 환자는 72%였습니다. 표 14는 2형 HCV 감염 환자에서 SOVALDI + 리바비린군과 페길화 인터페론 알파 + 리바비린군의 SVR12를 보여줍니다. 12주 동안 SOVALDI + 리바비린으로 치료받은 3형 감염 환자의 SVR12는 최적이 아니었으므로 이러한 결과는 표 14에 제시되지 않습니다.
| SOVALDI + RBV 12주 | Peg-IFN 알파 + RBV 24주 | |
|---|---|---|
| N=73* | N=67* | |
| SVR12 | 95% (69/73) | 78% (52/67) |
| SVR12를 달성하지 못한 대상자의 결과 | ||
| 치료 중 바이러스학적 실패 | 0/73 | 4% (3/67) |
| 재발† | 5% (4/73) | 15% (9/62) |
| 기타‡ | 0/73 | 4% (3/67) |
기저 간경변이 있는 2형 HCV 감염 환자의 SVR12는 표 15에 제시되어 있습니다.
| SOVALDI + RBV 12주 |
Peg-IFN 알파 + RBV 24주 |
|
|---|---|---|
| N=73 | N=67 | |
| 간경변 | ||
| 없음 | 97% (59/61) | 81% (44/54) |
| 있음 | 83% (10/12) | 62% (8/13) |
인터페론에 대한 내약성이 없거나, 인터페론 치료가 적절하지 않거나, 원하지 않는 성인 ─ POSITRON (연구 0107)
POSITRON은 인터페론에 대한 내약성이 없거나, 인터페론 치료가 적절하지 않거나, 원하지 않는 피험자에서 SOVALDI와 리바비린(N=207)으로 12주간 치료한 경우와 위약(N=71)을 비교 평가한 무작위 배정, 이중맹검, 위약 대조 시험이었습니다. 피험자는 3:1의 비율로 무작위 배정되었으며, 간경변증 유무에 따라 계층화되었습니다.
치료받은 피험자(N=278)의 중앙값 연령은 54세(범위: 21~75세)였으며, 54%가 남성이었고, 91%가 백인, 5%가 흑인, 11%가 히스패닉 또는 라틴계였습니다. 평균 체질량 지수는 28 kg/m2(범위: 18~53 kg/m2)였으며, 70%가 기준 HCV RNA 수치가 6 log10 IU/mL보다 높았고, 16%가 간경변증이 있었으며, 49%가 HCV 3형이었습니다. 인터페론에 대한 내약성이 없거나, 인터페론 치료가 적절하지 않거나, 원하지 않는 피험자의 비율은 각각 9%, 44%, 47%였습니다. 대부분의 피험자는 이전에 HCV 치료를 받은 적이 없었습니다(81%). 표 16은 2형 HCV를 가진 피험자에서 SOVALDI + 리바비린과 위약 치료군의 SVR12를 보여줍니다. SOVALDI + 리바비린으로 12주간 치료받은 3형 피험자의 SVR12는 최적이 아니었으므로, 이러한 결과는 표 16에 제시되지 않았습니다.
| SOVALDI + RBV 12주 | 위약 12주 | |
|---|---|---|
| N=109 | N= 34 | |
| SVR12 | 93% (101/109) | 0/34 |
| SVR12를 달성하지 못한 피험자의 결과 | ||
| 치료 중 바이러스학적 실패 | 0/109 | 97% (33/34) |
| 재발* | 5% (5/107) | 0/0 |
| 기타† | 3% (3/109) | 3% (1/34) |
표 17은 2형 HCV를 가진 피험자에서 간경변증 및 인터페론 분류에 대한 하위 그룹 분석을 보여줍니다.
| SOVALDI + RBV 12주 | |
|---|---|
| N=109 | |
| 간경변증 | |
| 없음 | 92% (85/92) |
| 있음 | 94% (16/17) |
| 인터페론 분류 | |
| 적절하지 않음 | 88% (36/41) |
| 내약성 없음 | 100% (9/9) |
| 원하지 않음 | 95% (56/59) |
이전 치료 경험이 있는 성인 ─ FUSION (연구 0108)
FUSION은 이전 인터페론 기반 치료로 SVR을 달성하지 못한 대상자(재발 및 무반응자)에서 SOVALDI와 리바비린으로 12주 또는 16주 치료를 평가한 무작위 배정, 이중맹검 시험이었습니다. 대상자는 1:1 비율로 무작위 배정되었으며, 간경변(유무) 및 HCV 유전형(2 대 3)에 따라 계층화되었습니다.
치료받은 대상자(N=201)의 중앙값 연령은 56세(범위: 24~70세)였으며, 대상자의 70%가 남성이었고, 87%가 백인이었고, 3%가 흑인이었고, 9%가 히스패닉 또는 라틴계였으며, 평균 체질량 지수는 29 kg/m2(범위: 19~44 kg/m2)였습니다. 기준 HCV RNA 수치가 6 log10 IU/mL보다 높은 대상자는 73%였고, 간경변이 있는 대상자는 34%였고, HCV 유전형 3인 대상자는 63%였고, 이전에 재발한 대상자는 75%였습니다. 표 18에는 유전형 2 HCV를 가진 대상자에서 12주 동안 SOVALDI + 리바비린 치료군의 SVR12가 제시되어 있습니다. 유전형 2 HCV를 가진 대상자에서 16주 치료는 12주 치료에서 관찰된 SVR12를 증가시키는 것으로 나타나지 않았습니다. 유전형 3 대상자에서 12주 또는 16주 동안 SOVALDI + 리바비린으로 치료한 SVR12는 최적이 아니었으므로 이러한 결과는 표 18에 제시되지 않습니다.
| SOVALDI + RBV 12주 |
|
|---|---|
| N=39* | |
| SVR12 | 82% (32/39) |
| SVR12를 달성하지 못한 대상자의 결과 | |
| 치료 중 바이러스학적 실패 | 0/39 |
| 재발† | 18% (7/39) |
| 기타‡ | 0/39 |
표 19에는 유전형 2 HCV를 가진 대상자에서 간경변 및 이전 HCV 치료에 대한 반응에 대한 하위 그룹 분석이 제시되어 있습니다.
| SOVALDI + RBV 12주 | |
|---|---|
| N=39 | |
| 간경변 | |
| 없음 | 90% (26/29) |
| 있음 | 60% (6/10) |
| 이전 HCV 치료에 대한 반응 | |
| 재발/돌파 감염 | 86% (25/29) |
| 무반응 | 70% (7/10) |
치료 경험이 없는 및 이전에 치료받은 성인 ─ VALENCE (연구 0133)
VALENCE 시험은 보상성 간경변증이 있는 대상을 포함하여 이전에 인터페론 기반 치료를 받지 않은 대상 또는 이전 인터페론 기반 치료로 SVR을 달성하지 못한 대상에서 2형 또는 3형 HCV 감염 치료를 위해 리바비린 체중 기반 병용 요법과 함께 SOVALDI를 평가했습니다. 원래 시험 설계는 12주 동안 SOVALDI + 리바비린 또는 위약에 대한 4:1 무작위 배정이었습니다. 새로운 데이터를 바탕으로 이 시험은 눈가림이 해제되었으며 모든 2형 HCV 감염 대상은 원래 계획된 치료를 계속했으며 12주 동안 SOVALDI + 리바비린을 투여받았고, 3형 HCV 감염 대상의 SOVALDI + 리바비린 치료 기간은 24주로 연장되었습니다. 수정 당시 11명의 3형 대상이 이미 12주 동안 SOVALDI + 리바비린을 완료했습니다.
치료받은 대상(N=419)의 중앙값 연령은 51세(범위: 19~74세)였습니다. 대상의 60%가 남성이었고, 평균 체질량 지수는 26kg/m2(범위: 17~44kg/m2)였으며, 평균 기준 HCV RNA 수치는 6.4 log10 IU/mL였습니다. 78%가 HCV 3형이었고, 대상의 58%가 치료 경험이 있었으며, 그중 65%가 이전 HCV 치료에 재발/돌파를 경험했습니다.
표 20은 12주 및 24주 동안 SOVALDI + 리바비린 치료군의 SVR12를 보여줍니다.
| 2형 SOVALDI + RBV 12주 | 3형 SOVALDI + RBV 24주 | |
|---|---|---|
| N=73 | N=250 | |
| 전체 SVR | 93% (68/73) | 84% (210/250) |
| SVR이 없는 대상의 결과 | ||
| 치료 중 바이러스학적 실패 | 0% (0/73) | <1% (1/250) |
| 재발† | 7% (5/73) | 14% (34/249) |
| 치료 경험이 없는 | 3% (1/32) | 5% (5/105) |
| 치료 경험이 있는 | 10% (4/41) | 20% (29/144) |
| 기타‡ | 0% (0/73) | 2% (5/250) |
표 21은 간경변증 및 이전 HCV 치료 경험에 따른 아형 분석을 보여줍니다.
| 2형 SOVALDI + RBV 12주 | 3형 SOVALDI + RBV 24주 | |
|---|---|---|
| N=73 | N=250 | |
| 치료 경험이 없는 | 97% (31/32) | 93% (98/105) |
| 비간경변증 | 97% (29/30) | 93% (86/92) |
| 간경변증 | 100% (2/2) | 92% (12/13) |
| 치료 경험이 있는 | 90% (37/41) | 77% (112/145) |
| 비간경변증 | 91% (30/33) | 85% (85/100) |
| 간경변증 | 88% (7/8) | 60% (27/45) |
14.4 HCV 및 HIV-1 동시 감염 성인 대상 임상 시험 ─ Photon-1 (연구 0123)
SOVALDI는 HIV-1 동시 감염된 1형, 2형 또는 3형 만성 C형 간염 성인 대상에서 SOVALDI와 리바비린 병용 12주 또는 24주 치료의 안전성 및 유효성을 평가하는 공개 임상 시험(PHOTON-1 연구)에서 연구되었습니다. 2형 및 3형 대상자는 HCV 치료 경험이 없는 경우 또는 있는 경우였으며, 1형 대상자는 모두 치료 경험이 없었습니다. 대상자는 유전형 및 이전 치료 병력에 따라 12주 또는 24주 동안 매일 400mg SOVALDI와 체중 기반 리바비린(체중이 75kg 미만인 대상자의 경우 1000mg 또는 체중이 75kg 이상인 대상자의 경우 1200mg)을 투여받았습니다. 대상자는 CD4+ 세포 수가 500 cells/mm3 초과인 항레트로바이러스 치료를 받지 않거나, CD4+ 세포 수가 200 cells/mm3 초과인 바이러스학적으로 억제된 HIV-1을 가진 대상자였습니다. 210명의 대상자에 대한 치료 후 12주 유효성 데이터를 확인할 수 있습니다(표 22 참조).
| HCV 1형 | HCV 2형 | HCV 3형 | |
|---|---|---|---|
| SOVALDI + RBV 24주 TN (N=114) |
SOVALDI + RBV 12주 TN (N=26) |
SOVALDI + RBV 24주 TE (N=13) |
|
| TN = 치료 경험 없음; TE = 치료 경험 있음 | |||
| 전체 | 76% (87/114) | 88% (23/26) | 92% (12/13) |
| SVR12가 아닌 대상자의 결과 | |||
| 치료 중 바이러스학적 실패 | 1% (1/114) | 4% (1/26) | 0/13 |
| 재발† | 22% (25/113) | 0/25 | 8% (1/13) |
| 기타‡ | 1% (1/114) | 8% (2/26) | 0/13 |
C형 간염 바이러스(HCV) 1형 감염 환자에서 1a형 감염 환자의 SVR12 비율은 82%(74/90)였고, 1b형 감염 환자의 SVR12 비율은 54%(13/24)였으며, 재발이 치료 실패의 대부분을 차지했습니다. HCV 1형 감염 환자의 SVR12 비율은 기준 IL28B C/C 대립유전자를 가진 환자의 경우 80%(24/30), 기준 IL28B 비-C/C 대립유전자를 가진 환자의 경우 75%(62/83)였습니다.
HIV-1 동시 감염이 있는 223명의 HCV 환자에서 CD4+ 세포의 백분율은 치료 중 변화가 없었습니다. SOVALDI + 리바비린으로 각각 12주 또는 24주 동안 치료 후 치료 종료 시 중앙값 CD4+ 세포 수는 각각 85 cells/mm3 및 84 cells/mm3 감소했습니다. SOVALDI + 리바비린 치료 중 항레트로바이러스 요법을 받는 2명의 환자(0.9%)에서 HIV-1 재발이 발생했습니다.
14.5 소아 임상 시험 (연구 1112)
3세 이상의 HCV 감염 소아 환자에서 SOVALDI의 효능은 2상 공개 임상 시험에서 HCV 2형(N = 31) 또는 3형(N = 75) 감염 환자 106명을 대상으로 평가되었습니다. 시험에서 HCV 2형 또는 3형 감염 환자는 각각 12주 또는 24주 동안 SOVALDI와 체중 기반 리바비린으로 치료받았습니다 [용법 및 용량 (2.3) 참조].
12세 이상 <18세 환자: SOVALDI는 HCV 2형(N = 13) 또는 3형(N = 39) 감염이 있는 12세 이상 <18세 환자 52명에서 평가되었습니다. 중앙값 연령은 15세(범위: 12~17세)였으며, 환자의 40%가 여성이었고, 90%가 백인, 4%가 흑인, 2%가 아시아인이었으며, 4%가 히스패닉/라틴계였습니다. 평균 체질량 지수는 22 kg/m2(범위: 16~32 kg/m2)였고, 평균 체중은 60kg(범위: 30~101kg)이었습니다. 17%는 치료 경험이 있었고, 65%는 기준 HCV RNA 수치가 800,000 IU/mL 이상이었으며, 간경변이 있는 환자는 없었습니다. 대부분의 환자(71%)는 수직 감염을 통해 감염되었습니다.
2형 환자의 SVR12 비율은 100%[13/13]였고, 3형 환자의 SVR12 비율은 97%[38/39]였습니다. 치료 중 바이러스학적 실패 또는 재발을 경험한 환자는 없었습니다.
6세 이상 <12세 환자: SOVALDI는 HCV 2형(N = 13) 또는 3형(N = 28) 감염이 있는 6세 이상 <12세 환자 41명에서 평가되었습니다. 중앙값 연령은 9세(범위: 6~11세)였으며, 환자의 73%가 여성이었고, 71%가 백인, 20%가 아시아인이었으며, 15%가 히스패닉/라틴계였습니다. 평균 체질량 지수는 19 kg/m2(범위: 13~32 kg/m2)였고, 평균 체중은 34kg(범위: 15~80kg)이었습니다. 98%는 치료 경험이 없었고, 46%는 기준 HCV RNA 수치가 800,000 IU/mL 이상이었으며, 간경변이 있는 환자는 없었습니다. 대부분의 환자(98%)는 수직 감염을 통해 감염되었습니다.
2형 환자의 SVR12 비율은 100%(13/13)였고, 3형 환자의 SVR12 비율은 100%(28/28)였습니다. 치료 중 바이러스학적 실패 또는 재발을 경험한 환자는 없었습니다.
3세 이상 <6세 환자: SOVALDI는 HCV 2형(N = 5) 또는 3형(N = 8) 감염이 있는 3세 이상 <6세 환자 13명에서 평가되었습니다. 중앙값 연령은 4세(범위: 3~5세)였으며, 환자의 77%가 여성이었고, 69%가 백인, 8%가 흑인, 8%가 아시아인이었으며, 8%가 히스패닉/라틴계였습니다. 평균 체질량 지수는 15 kg/m2(범위: 13~17 kg/m2)였고, 평균 체중은 17kg(범위: 13~19kg)이었습니다. 100%는 치료 경험이 없었고, 23%는 기준 HCV RNA 수치가 800,000 IU/mL 이상이었으며, 간경변이 있는 환자는 없었습니다. 대부분의 환자(85%)는 수직 감염을 통해 감염되었습니다.
2형 환자의 SVR12 비율은 80%(4/5)였고, 3형 환자의 SVR12 비율은 100%(8/8)였습니다. 치료 중 바이러스학적 실패 또는 재발을 경험한 환자는 없었습니다. 한 명의 환자가 이상 반응으로 인해 연구 치료를 조기에 중단했습니다.
16 제공/보관 및 취급 방법
정제
SOVALDI 정제 400mg은 한쪽 면에는 “GSI”, 다른 면에는 “7977”이라고 각인된 노란색의 캡슐 모양 필름 코팅 정제로, 소포스부비르 400mg을 함유하고 있습니다. 각 병에는 28정 (NDC 61958-1501-1), 실리카겔 건조제 및 폴리에스터 코일이 어린이 안전 마개와 함께 들어 있습니다.
SOVALDI 정제 200mg은 한쪽 면에는 “GSI”, 다른 면에는 “200”이라고 각인된 노란색의 타원형 필름 코팅 정제로, 소포스부비르 200mg을 함유하고 있습니다. 각 병에는 28정 (NDC 61958-1503-1) 및 폴리에스터 코일이 어린이 안전 마개와 함께 들어 있습니다.
경구용 과립
SOVALDI 과립 150mg은 상자에 단위 용량 포장으로 제공되는 백색에서 미백색 과립입니다. 각 상자에는 28포가 들어 있습니다 (NDC 61958-1504-1).
SOVALDI 과립 200mg은 상자에 단위 용량 포장으로 제공되는 백색에서 미백색 과립입니다. 각 상자에는 28포가 들어 있습니다 (NDC 61958-1505-1).
- 30°C (86°F) 이하에 보관하십시오.
- 상자의 훼손 방지 또는 포장 밀봉이 파손되거나 손상된 경우 사용하지 마십시오.
17 환자 상담 정보
FDA 승인 환자용 설명서(Patient Information and Instructions for Use)를 읽도록 환자에게 알려주십시오.
HCV 및 HBV 동시 감염 환자에서의 B형 간염 바이러스 재활성화 위험
HBV와 동시 감염된 환자의 경우 HCV 감염 치료 중 또는 치료 후에 HBV 재활성화가 발생할 수 있음을 환자에게 알려주십시오. HBV 감염력이 있는 병력이 있는 경우 의료 제공자에게 알리도록 환자에게 알려주십시오 [경고 및 주의사항 (5.1) 참조].
아미오다론과 병용 투여 시 심각한 증상성 서맥
실신 또는 거의 실신, 어지러움 또는 현기증, 권태감, 쇠약, 과도한 피로, 호흡 곤란, 가슴 통증, 혼란 또는 기억 문제와 같은 서맥 증상이 나타나면 즉시 의학적 평가를 받도록 환자에게 알려주십시오 [경고 및 주의사항 (5.2), 유해 반응 (6.2) 및 약물 상호작용 (7.1) 참조].
임신
SOVALDI와 리바비린 병용 요법 또는 SOVALDI와 페그인터페론 및 리바비린 병용 요법 중에는 임신을 피하도록 환자에게 알려주십시오. 임신이 발생하는 경우 즉시 의료 제공자에게 알리도록 환자에게 알려주십시오 [특정 집단에서의 사용 (8.1) 참조].
약물 상호작용
SOVALDI는 일부 약물과 상호 작용할 수 있으므로 환자는 처방약, 일반의약품 또는 허브 제품 사용을 의료 제공자에게 보고하도록 해야 함을 환자에게 알려주십시오 [경고 및 주의사항 (5.3) 및 약물 상호작용 (7.1) 참조].
C형 간염 바이러스 전파
C형 간염 감염 치료의 전파에 대한 효과는 알려져 있지 않으며, 치료 중 또는 치료 실패 시 C형 간염 바이러스 전파를 예방하기 위한 적절한 예방 조치를 취해야 함을 환자에게 알려주십시오.
투여
환자에게 SOVALDI를 매일 정기적으로 예정된 시간에 음식과 함께 또는 음식 없이 복용하도록 알려주십시오. 복용량을 놓치거나 건너뛰지 말고 의사가 권장하는 기간 동안 SOVALDI를 복용하는 것이 중요함을 환자에게 알려주십시오.
SOVALDI 경구 펠릿의 경우, 환자 또는 보호자에게 올바른 용량을 준비하기 위한 사용 지침을 읽고 따르도록 알려주십시오.
리바비린 또는 페그인터페론 및 리바비린과의 병용 투여에 대한 중요 정보
1형 또는 4형 HCV 감염 환자의 경우 권장 요법은 페그인터페론 알파와 리바비린과 병용 투여하는 SOVALDI이며, 2형 또는 3형 HCV 감염 환자의 경우 권장 요법은 리바비린과 병용 투여하는 SOVALDI임을 환자에게 알려주십시오. 페그인터페론 및/또는 리바비린이 영구적으로 중단되면 SOVALDI도 중단해야 합니다.
SPL 미분류 섹션
제조 및 유통:
Gilead Sciences, Inc.
Foster City, CA 94404
SOVALDI 및 HARVONI는 Gilead Sciences, Inc. 또는 그 관련 회사의 상표입니다. 여기에 언급된 다른 모든 상표는 각 소유자의 자산입니다.
©2024 Gilead Sciences, Inc. All rights reserved.
204671-GS-0011
환자 사용 설명서
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2020년 3월 | |||
| 환자 정보 | ||||
| SOVALDI® (소-발-디) (sofosbuvir) 정제 |
SOVALDI® (소-발-디) (sofosbuvir) 경구용 과립 |
|||
| 중요: SOVALDI는 다른 항바이러스제와 병용하여 사용됩니다. 리바비린과 함께 SOVALDI를 복용하거나 페그인터페론 알파와 리바비린 병용 요법으로 SOVALDI를 복용하는 경우 해당 약물 안내서도 읽어야 합니다. 본 환자 정보서는 리바비린과 함께 또는 페그인터페론 알파와 리바비린 병용 요법으로 SOVALDI를 사용하는 경우에 대한 정보를 제공합니다. | ||||
| SOVALDI에 대해 가장 중요한 정보는 무엇입니까? SOVALDI는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
부작용에 대한 자세한 내용은 “SOVALDI의 가능한 부작용은 무엇입니까?” 섹션을 참조하십시오. |
||||
| SOVALDI란 무엇입니까? SOVALDI는 다른 항바이러스제와 함께 사용하여 만성(장기간 지속) C형 간염 바이러스(HCV) 성인 환자를 치료하는 처방약입니다.
SOVALDI는 리바비린과 병용하여 간경변이 없는 경우 또는 간경변이 보상된 경우 3세 이상의 만성 HCV 2형 또는 3형 감염 소아를 치료하는 데 사용됩니다. |
||||
SOVALDI를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. SOVALDI와 다른 약물은 서로 영향을 미칠 수 있습니다. 이로 인해 체내 SOVALDI 또는 다른 약물의 양이 너무 많거나 부족할 수 있습니다. 이는 SOVALDI 또는 다른 약물의 작용 방식에 영향을 미치거나 부작용을 유발할 수 있습니다.
|
||||
SOVALDI는 어떻게 복용해야 합니까?
|
||||
| 소발디 구강용 과립을 어떻게 아이에게 투여해야 하나요? 소발디 구강용 과립의 복용량에 대한 자세한 사용법은 사용 설명서를 참조하십시오.
|
||||
| 소발디의 가능한 부작용은 무엇입니까? 소발디는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
|
||||
|
|
|
||
| 리바비린과 병용하여 사용할 때 소발디의 가장 흔한 부작용은 다음과 같습니다. | ||||
|
|
|||
| 페그인터페론 알파와 리바비린과 병용하여 사용할 때 소발디의 가장 흔한 부작용은 다음과 같습니다. | ||||
|
|
|
||
| 이것들은 소발디의 모든 가능한 부작용이 아닙니다. 자세한 내용은 의료 제공자 또는 약사에게 문의하십시오. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고하려면 1-800-FDA-1088로 전화하십시오. |
||||
소발디는 어떻게 보관해야 합니까?
소발디 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||||
| 소발디의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 설명서에 나열된 목적 이외의 목적으로 처방됩니다. 소발디는 처방받지 않은 질환에 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 소발디를 제공하지 마십시오. 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 소발디에 대한 정보는 의료 제공자 또는 약사에게 문의하십시오. 자세한 내용은 1-800-445-3235로 전화하거나 www.SOVALDI.com을 방문하십시오. |
||||
| 소발디의 성분은 무엇입니까? 활성 성분: 소포스부비르 비활성 성분, 정제: 콜로이드성 이산화규소, 크로스카멜로스나트륨, 스테아린산마그네슘, 만니톨, 미정질셀룰로스. 정제 필름 코팅에는 폴리에틸렌글리콜, 폴리비닐알코올, 활석, 이산화티타늄 및 황색 산화철이 포함되어 있습니다. 비활성 성분, 구강용 과립: 아미노메타크릴레이트 공중합체, 콜로이드성 이산화규소, 크로스카멜로스나트륨, 히드록시프로필셀룰로스, 히프로멜로스, 유당일수화물, 미정질셀룰로스, 폴리에틸렌글리콜, 이산화규소, 라우릴황산나트륨, 스테아릴퓨마르산나트륨, 스테아르산 및 활석. 길리어드 사이언시즈, 인크., 포스터 시티, CA 94404 자세한 내용은 1-800-445-3235로 전화하거나 www.SOVALDI.com을 방문하십시오. 소발디는 길리어드 사이언시즈, 인크. 또는 그 관련 회사의 상표입니다. 여기에 언급된 다른 모든 상표는 해당 소유자의 자산입니다. ©2024 길리어드 사이언시즈, 인크. 판권 소유. 204671-GS-011 |
||||
사용 설명서
SOVALDI® (소발디)
(sofosbuvir)
펠렛, 경구용
SOVALDI 경구용 펠렛에 대한 중요한 정보는 SOVALDI와 함께 제공되는 환자 정보를 읽으십시오.
이 사용 설명서에는 SOVALDI 경구용 펠렛 복용 방법에 대한 정보가 포함되어 있습니다. 지침을 이해하고 따르십시오. 질문이 있으면 의료 서비스 제공자 또는 약사에게 문의하십시오.
SOVALDI 경구용 펠렛 복용 전 알아야 할 중요 정보
- 경구 복용 전용 (음식과 함께 또는 음식 없이 경구 복용).
- 사용할 준비가 될 때까지 SOVALDI 경구용 펠렛 패킷을 열지 마십시오.
- SOVALDI 경구용 펠렛은 흰색에서 미색의 펠렛으로, 한 번 사용하는 패킷으로 상자에 제공됩니다. 각 상자에는 28개의 패킷이 들어 있습니다.
- 상자의 탬퍼 방지 씰 또는 펠렛 패킷 씰이 파손되었거나 손상된 경우 SOVALDI 경구용 펠렛을 사용하지 마십시오.
| 음식과 함께 복용할 SOVALDI 경구용 펠렛 용량 준비: |
음식과 함께 복용할 SOVALDI 경구용 펠렛 용량을 준비하기 전에 다음 용품을 준비하십시오.
- 의료 서비스 제공자가 처방한 일일 SOVALDI 경구용 펠렛 패킷
- 푸딩, 초콜릿 시럽, 으깬 감자 또는 아이스크림과 같은 비산성 연질 식품 한 스푼 이상
- 그릇
- 숟가락
- 가위 (선택 사항)
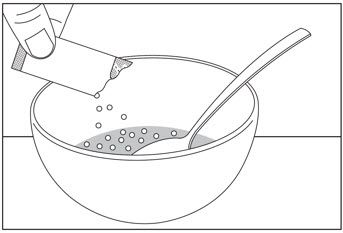
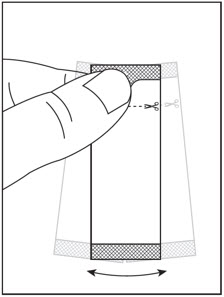
1단계: 먼저 그릇에 비산성 연질 식품 한 스푼 이상을 넣습니다.
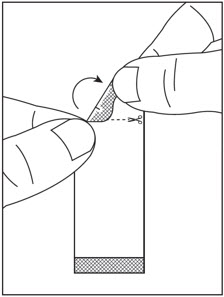
| 2단계: 절단선이 위로 오도록 SOVALDI 경구용 펠렛 패킷을 잡습니다( 그림 A 참조). | 3단계: 패킷을 부드럽게 흔들어 펠렛을 패킷 바닥에 가라앉힙니다( 그림 B 참조). | |
| 그림 A | 그림 B |
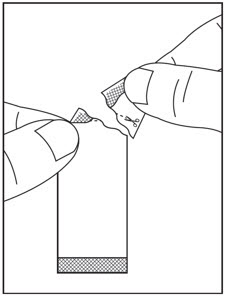
4단계: 가위로 절단선을 따라 패킷을 자르거나( 그림 C 참조), 절취선에서 패킷을 뒤로 접어서( 그림 D 참조) 찢어서 엽니다( 그림 E 참조).
5단계: 처방된 수의 SOVALDI 경구용 펠렛 패킷의 전체 내용물을 그릇에 담긴 음식 위에 조심스럽게 붓고 숟가락으로 부드럽게 섞습니다( 그림 F 참조). SOVALDI 경구용 펠렛이 패킷에 남아 있지 않도록 하십시오.
6단계: 쓴맛을 피하기 위해 SOVALDI 경구용 펠렛과 음식 혼합물을 30분 이내에 씹지 않고 복용하십시오. SOVALDI 경구용 펠렛을 모두 복용했는지 확인하십시오.
| 음식 없이 복용할 SOVALDI 경구용 펠렛 용량 준비: |
음식 없이 복용할 SOVALDI 경구용 펠렛의 복용량을 준비하기 전에 다음 용품을 준비하십시오.
- 의료 서비스 제공자가 처방한 대로 1일 SOVALDI 경구용 펠렛 패킷
- 가위 (선택 사항)
- 물 (선택 사항)
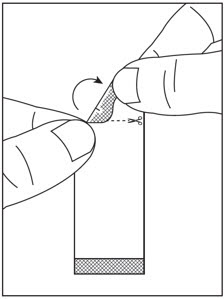
| 1단계: 절취선이 위로 오도록 SOVALDI 경구용 펠렛 패킷을 잡습니다( 그림 G 참조). | 2단계: 패킷을 부드럽게 흔들어 펠렛을 패킷 바닥에 가라앉힙니다( 그림 H 참조). | |
| 그림 G | 그림 H |
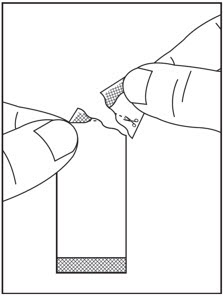
3단계: 가위로 절취선을 따라 패킷을 자르거나( 그림 I 참조), 절취선에서 패킷을 뒤로 접어( 그림 J 참조) 찢어서 엽니다( 그림 K 참조).
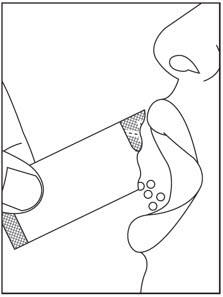
4단계: SOVALDI 경구용 펠렛 패킷의 전체 내용물을 입에 직접 붓고 쓴맛을 피하기 위해 씹지 않고 삼킵니다( 그림 L 참조). 필요한 경우 펠렛을 삼킨 후 물을 마실 수 있습니다. SOVALDI 경구용 펠렛이 패킷에 남아 있지 않도록 하십시오. 의료 서비스 제공자가 SOVALDI 경구용 펠렛 패킷을 두 개 이상 처방한 경우 1~4단계를 반복합니다.
SOVALDI 경구용 펠렛 보관
- SOVALDI 펠렛은 30°C(86°F) 미만에서 보관하십시오.
- SOVALDI 경구용 펠렛과 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
SOVALDI 경구용 펠렛 폐기
- 사용하지 않은 부분은 버리십시오. 남은 SOVALDI 혼합물(음식과 혼합된 펠렛)을 보관하거나 재사용하지 마십시오.
자세한 내용은 1-800-445-3235로 전화하거나 www.SOVALDI.com을 방문하십시오.
제조 및 유통: Gilead Sciences, Inc., Foster City, CA 94404
SOVALDI는 Gilead Sciences, Inc. 또는 관련 회사의 상표입니다.
© 2024 Gilead Sciences, Inc. All rights reserved.
204671-GS-011
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
발행일: 2020년 3월
주표시면 – 400mg 정제 병 라벨
NDC 61958-1501-1
28정
Sovaldi®
(sofosbuvir) 정제
400 mg
1일 1정 복용
약사를 위한 참고:
약국 라벨로 경고 상자를 가리지 마십시오.
경고: Sovaldi와 함께 복용해서는 안 되는 약에 대해 알아보십시오.
주요 표시면 – 200mg 정제 병 라벨
NDC 61958-1503-1
정제 28정
Sovaldi®
(sofosbuvir) 정제
200 mg
1일 1정 복용
약사를 위한 참고:
약국 라벨로 경고 상자를 가리지 마십시오.
경고: Sovaldi와 함께 복용해서는 안 되는 약에 대해 알아보십시오.

주요 표시 패널 – 150mg 펠릿 포장 상자 라벨
NDC 61958-1504-1
28 packets
Sovaldi®
(sofosbuvir) oral pellets
150 mg per packet
처방전 의약품
약사 참고: 경고 상자를 약국 라벨로 덮지 마십시오.
경고: Sovaldi와 함께 복용해서는 안 되는 약에 대해 알아보십시오.
주요 표시 패널 – 200mg 펠릿 포장 상자 라벨
NDC 61958-1505-1
28 패킷
Sovaldi®
(sofosbuvir) 경구용 펠렛
패킷당 200 mg
처방전 전용
약사에게 알림: 약국 라벨로 ALERT 상자를 가리지 마십시오.
경고: Sovaldi와 함께 복용해서는 안 되는 약물에 대해 알아보십시오.