의약품 제조업체: Janssen Biotech, Inc. (Updated: 2025-02-07)
처방 정보 하이라이트
SIMPONI ARIA
®(골리무맙) 주사제, 정맥 투여용
미국 최초 승인: 2009년
경고: 심각한 감염 및 악성 종양
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
-
결핵(TB), 세균성 패혈증, 침윤성 진균 감염(히스토플라스마증 등) 및 기타 기회 감염을 포함한 입원 또는 사망으로 이어지는 심각한 감염이 SIMPONI ARIA를 투여받은 환자에게서 발생했습니다 (
5.1).
-
환자에게 심각한 감염 또는 패혈증이 발생하면 SIMPONI ARIA 투여를 중단하십시오 (
5.1).
-
잠복성 결핵 검사를 실시하고, 양성인 경우 SIMPONI ARIA 투여를 시작하기 전에 결핵 치료를 시작하십시오 (
5.1).
-
초기 잠복성 결핵 검사 결과가 음성이더라도 치료 기간 동안 모든 환자의 활동성 결핵을 모니터링하십시오 (
5.1).
-
TNF 억제제(SIMPONI ARIA 포함)로 치료받은 소아 및 청소년 환자에게서 치명적인 경우도 있는 림프종 및 기타 악성 종양이 보고되었습니다 (
5.2).
적응증 및 용법
용법 및 용량
제형 및 강도
- 주사제: 1회용 바이알에 50 mg/4 mL (12.5 mg/mL) 용액 (
3)
금기 사항
- 없음 (
4)
경고 및 주의 사항
- 심각한 감염: 활동성 감염 중에는 SIMPONI ARIA를 시작하지 마십시오. 감염이 발생하면 주의 깊게 모니터링하고 감염이 심각해지면 SIMPONI ARIA 투여를 중단하십시오 (
5.1).
- 침윤성 진균 감염: SIMPONI ARIA 투여 중 전신 질환이 발생한 환자의 경우, 진균증이 풍토병인 지역에 거주하거나 여행한 환자에게는 경험적 항진균 요법을 고려하십시오 (
5.1).
- B형 간염 재활성화: 치료 중 및 치료 후 몇 달 동안 HBV 보균자를 모니터링하십시오. 재활성화가 발생하면 SIMPONI ARIA 투여를 중단하고 항바이러스 요법을 시작하십시오 (
5.1).
- 악성 종양: 대조군 환자에 비해 TNF 억제제를 투여받은 환자에서 림프종 발생률이 더 높았습니다. TNF 억제제를 투여받은 환자에서 다른 악성 종양 발생 사례도 관찰되었습니다 (
5.2).
- 울혈성 심부전: 악화 또는 새롭게 발생할 수 있습니다. 새로운 증상 또는 증상이 악화되면 SIMPONI ARIA 투여를 중단하십시오 (
5.3).
- 탈수초 질환: 악화 또는 새롭게 발생할 수 있습니다 (
5.4).
- 루푸스 유사 증후군: 증상이 나타나면 SIMPONI ARIA 투여를 중단하십시오 (
5.5).
- 과민반응: 아나필락시스를 포함한 심각한 전신 과민반응이 발생할 수 있습니다 (
5.11).
유해 반응
가장 흔한 유해 반응(발생률 ≥ 3%)은 상기도 감염, 알라닌 아미노전달효소 증가, 바이러스 감염, 아스파르트산 아미노전달효소 증가, 호중구 수 감소, 기관지염, 고혈압 및 발진입니다 (
6.1).
의심되는 유해 반응을 보고하려면 Janssen Biotech, Inc.에 1-800-JANSSEN (1-800-526-7736) 또는 FDA에 1-800-FDA-1088로 연락하거나
www.fda.gov/medwatch를 방문하십시오.
약물 상호작용
환자에 대한 정보 및 의약품 안내서에 대한 자세한 내용은 17번을 참조하십시오.
개정: 2023년 7월
목차
전문 정보: 목차*
경고: 심각한 감염 및 악성종양
1 적응증 및 용법
1.1 류마티스 관절염 (RA)
1.2 건선성 관절염 (PsA)
1.3 강직성 척추염 (AS)
1.4 다관절 소아 특발성 관절염 (pJIA)
2 용법 및 용량
2.1 류마티스 관절염, 건선성 관절염 및 강직성 척추염 성인 환자의 용량
2.2 다관절 소아 특발성 관절염 및 건선성 관절염 소아 환자의 용량
2.3 투약 전 결핵 및 B형 간염 평가
2.4 중요한 투여 지침
3 제형 및 함량
4 금기사항
5 경고 및 주의사항
5.1 심각한 감염
5.2 악성종양
5.3 울혈성 심부전
5.4 탈수초 질환
5.5 자가면역
5.6 아바타셉트 병용
5.7 아나킨라 병용
5.8 생물학적 질병 조절 항류마티스제 (DMARDs) 전환
5.9 혈액 세포 감소증
5.10 예방 접종/치료용 감염성 약제
5.11 과민반응
6 이상반응
6.1 임상시험 경험
6.2 면역원성
6.3 시판 후 경험
7 약물 상호작용
7.1 메토트렉세이트
7.2 RA, PsA, AS 및 pJIA 생물학적 제제
7.3 생백신/치료용 감염성 약제
7.4 시토크롬 P450 기질
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 일반적 특성
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 약리학
13.1 발암성, 돌연변이원성, 생식능력 저하
14 임상 연구
14.1 류마티스 관절염
14.2 건선성 관절염
14.3 강직성 척추염
14.4 다관절 소아 특발성 관절염 (pJIA)
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분 또는 소분류는 나열되지 않았습니다.
박스형 경고
경고: 심각한 감염 및 악성종양
심각한 감염
SIMPONI ARIA로 치료받는 환자는 입원 또는 사망으로 이어질 수 있는 심각한 감염이 발생할 위험이 증가합니다.
[
경고 및 주의사항 (5.1) 참조]
. 이러한 감염이 발생한 환자 대부분은 메토트렉세이트 또는 코르티코스테로이드와 같은 면역억제제를 병용 투여 받았습니다.
환자에게 심각한 감염이 발생하면 SIMPONI ARIA 투여를 중단하십시오.
SIMPONI ARIA가 속한 TNF 억제제와 관련하여 보고된 감염에는 다음이 포함됩니다.
- 잠재성 결핵의 재활성화를 포함한 활동성 결핵. 결핵 환자는 종종 전신성 또는 폐외 질환으로 나타났습니다. SIMPONI ARIA 사용 전과 치료 중에 잠재성 결핵 검사를 실시하십시오. SIMPONI ARIA 사용 전에 잠재성 결핵 치료를 시작하십시오.
- 히스토플라스마증, 코시디오이도미코시스, 칸디다증, 아스퍼질루스증, 블라스토미코시스 및 폐렴구균증을 포함한 침윤성 진균 감염. 히스토플라스마증 또는 기타 침윤성 진균 감염 환자는 국소화된 질환이 아닌 전신성 질환으로 나타날 수 있습니다. 활동성 감염이 있는 일부 환자의 경우 히스토플라스마증 항원 및 항체 검사가 음성일 수 있습니다. 침윤성 진균 감염 위험이 있는 환자에서 심각한 전신 질환이 발생하는 경우 경험적 항진균 요법을 고려하십시오.
- 레지오넬라 및 리스테리아를 포함한 기회 감염균으로 인한 세균성, 바이러스성 및 기타 감염.
만성 또는 재발 감염 환자에서 치료를 시작하기 전에 SIMPONI ARIA 치료의 위험과 이점을 고려하십시오.
SIMPONI ARIA 치료 중 및 치료 후 감염의 징후와 증상이 발생하는지 면밀히 모니터링하십시오. 여기에는 치료 시작 전에 잠재성 결핵 감염 검사에서 음성으로 판정된 환자에서 결핵이 발생할 가능성도 포함됩니다.
[
경고 및 주의사항 (5.1) 참조]
.
악성종양
SIMPONI ARIA가 속한 TNF 억제제로 치료받은 소아 및 청소년 환자에서 일부는 치명적인 림프종 및 기타 악성종양이 보고되었습니다.
[
경고 및 주의사항 (5.2) 참조]
.
1 적응증 및 사용법
2 용법 및 투여
2.1 성인 류마티스 관절염, 건선성 관절염 및 강직성 척추염 환자의 용량
SIMPONI ARIA의 용량 요법은 0주차와 4주차에 30분 동안 정맥 주입으로 체중 kg당 2mg을 투여하고, 그 이후에는 8주마다 투여하는 것입니다. SIMPONI ARIA의 희석 및 투여 지침을 따르십시오.
[
.
류마티스 관절염(RA) 환자의 경우 SIMPONI ARIA는 메토트렉세이트와 병용하여 투여해야 합니다.
정맥 및 피하 제제 및 투여 경로 간 전환의 효능 및 안전성은 확립되지 않았습니다.
2.2 소아 다관절 특발성 관절염 및 건선성 관절염 환자의 용량
체표면적(BSA)을 기준으로 한 SIMPONI ARIA의 용량 요법은 0주차와 4주차에 30분 동안 정맥 주입으로 80 mg/m
2입니다. 그 이후에는 8주마다 투여합니다. SIMPONI ARIA의 희석 및 투여 지침을 따르십시오.
[
.
2.3 용량 투여 전 결핵 및 B형 간염 평가
SIMPONI ARIA 투여를 시작하기 전과 치료 중 주기적으로 활동성 결핵 여부를 평가하고 잠복 감염 여부를 검사하십시오.
[
. SIMPONI ARIA 투여를 시작하기 전에 B형 간염 바이러스 감염 여부를 검사하십시오.
[
.
2.4 중요한 투여 지침
정맥 주입용 SIMPONI ARIA 용액은 의료 전문가가 다음과 같이 무균 기법을 사용하여 희석해야 합니다.
- RA, PsA 및 AS의 경우 성인 권장 용량인 체중 kg당 2mg과 환자 체중을 기준으로 용량과 필요한 SIMPONI ARIA 바이알 수를 계산합니다. pJIA 및 소아 건선성 관절염 환자의 경우 소아 권장 용량인 80 mg/m
2과 환자의 체표면적(BSA)을 기준으로 용량과 필요한 SIMPONI ARIA 바이알 수를 계산합니다. SIMPONI ARIA 4mL 바이알 하나에는 50mg의 golimumab이 포함되어 있습니다.
- 각 바이알의 용액이 무색에서 연한 노란색인지 확인합니다. golimumab은 단백질이므로 용액에 미세한 반투명 입자가 생길 수 있습니다. 불투명한 입자, 변색 또는 기타 이물질이 있는 경우 사용하지 마십시오.
- SIMPONI ARIA 용액의 총량을 USP 0.9% 염화나트륨 주사액으로 최종 부피 100mL가 되도록 희석합니다. 예를 들어, 100mL 주입 백 또는 병에서 SIMPONI ARIA의 총량과 같은 양의 USP 0.9% 염화나트륨 주사액을 빼낼 수 있습니다. SIMPONI ARIA 용액의 총량을 100mL 주입 백 또는 병에 천천히 넣습니다. 부드럽게 섞습니다. 바이알에 남아 있는 사용하지 않은 용액은 버립니다. 또는 위에서 설명한 방법과 동일한 방법으로 USP 0.45% 염화나트륨 주사액을 사용하여 SIMPONI ARIA를 희석할 수 있습니다.
- 주입 전에 희석된 SIMPONI ARIA 용액에 이물질이나 변색이 있는지 육안으로 검사합니다. 이러한 것이 있는 경우 사용하지 마십시오.
- 인라인, 무균, 비발열성, 저단백질 결합 필터(공극 크기 0.22 마이크로미터 이하)가 있는 주입 세트만 사용하십시오.
- 다른 약제와 동일한 정맥 라인에 SIMPONI ARIA를 동시에 주입하지 마십시오. 동일한 정맥 라인에서 다른 정맥 약제와 SIMPONI ARIA를 함께 사용하는 것을 평가하기 위한 물리적 생화학적 적합성 연구는 수행되지 않았습니다.
- 희석된 용액을 30분 동안 주입합니다.
- 희석 후 주입 용액은 실온에서 최대 4시간까지 보관할 수 있습니다.
3 제형 및 함량
주사제: 50 mg/4 mL (12.5 mg/mL) 무색 또는 연한 황색 용액 1회용 바이알.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 중증 감염증
SIMPONI ARIA로 치료받은 환자는 입원이나 사망으로 이어질 수 있는 다양한 장기 시스템 및 부위와 관련된 중증 감염 발생 위험이 증가합니다.
아스페르길루스증, 분아균증, 칸디다증, 콕시디오이데스진균증, 히스토플라스마증, 레지오넬라증, 리스테리아증, 폐포자충증, 결핵을 포함한 세균성, 마이코박테리아성, 침습성 진균, 바이러스성 또는 기생충성 유기체로 인한 기회 감염이 TNF 차단제에서 보고되었습니다. 환자는 종종 국소 질환보다는 파종성 질환을 보입니다. TNF 차단제와 아바타셉트 또는 아나킨라의 병용 사용은 중증 감염 위험 증가와 관련이 있습니다. 따라서 SIMPONI ARIA와 이러한 생물학적 제제의 병용 사용은 권장되지 않습니다
[see
Warnings and Precautions (5.6,
5.7)and
.
임상적으로 중요한 국소 감염을 포함하여 활동성 감염이 있는 환자에게는 SIMPONI ARIA 치료를 시작해서는 안 됩니다. 65세 이상의 환자, 동반 질환이 있는 환자 및/또는 코르티코스테로이드 또는 메토트렉세이트와 같은 면역억제제를 병용 투여하는 환자는 감염 위험이 더 높을 수 있습니다. 다음과 같은 환자에서 SIMPONI ARIA 치료를 시작하기 전에 치료의 위험과 이점을 고려하십시오.
- 만성 또는 재발성 감염이 있는 환자;
- 결핵에 노출된 환자;
- 기회 감염 병력이 있는 환자;
- 히스토플라스마증, 콕시디오이데스진균증 또는 분아균증과 같은 풍토성 결핵 또는 풍토성 진균증 지역에 거주하거나 여행한 환자; 또는
- 감염에 걸리기 쉬운 기저 질환이 있는 환자.
모니터링
SIMPONI ARIA 치료 중 및 치료 후 감염 징후 및 증상 발생에 대해 환자를 면밀히 모니터링하십시오. 환자에게 중증 감염, 기회 감염 또는 패혈증이 발생하면 SIMPONI ARIA를 중단하십시오. SIMPONI ARIA 치료 중 새로운 감염이 발생한 환자의 경우 면역 저하 환자에게 적합한 신속하고 완전한 진단 검사를 수행하고 적절한 항균 요법을 시작하고 면밀히 모니터링하십시오.
결핵
잠복 결핵 또는 활동성 결핵 치료를 이전에 받은 환자를 포함하여 TNF 차단제를 투여받은 환자에서 결핵 재활성화 또는 새로운 결핵 감염 사례가 관찰되었습니다. SIMPONI ARIA 치료를 시작하기 전과 치료 중 정기적으로 환자의 결핵 위험 요인을 평가하고 잠복 감염 검사를 수행하십시오.
TNF 차단제 치료 전 잠복 결핵 감염 치료는 치료 중 결핵 재활성화 위험을 줄이는 것으로 나타났습니다. SIMPONI ARIA 치료를 시작하기 전에 잠복 결핵 치료가 필요한지 평가하십시오. 5mm 이상의 경결은 이전에 BCG(Bacille Calmette-Guerin)로 예방 접종을 받은 환자라도 투베르쿨린 피부 검사 양성입니다.
적절한 치료 과정을 확인할 수 없는 잠복 결핵 또는 활동성 결핵 병력이 있는 환자와 잠복 결핵 검사는 음성이지만 결핵 감염 위험 요인이 있는 환자의 경우 SIMPONI ARIA 치료 시작 전에 항결핵 치료를 고려하십시오. 개별 환자에게 항결핵 치료 시작이 적절한지 여부를 결정하는 데 도움이 되도록 결핵 치료 전문의와 상담하는 것이 좋습니다.
잠복 결핵 치료 중 및 치료 후 골리무맙 피하 제형으로 치료받은 환자에서 활동성 결핵 사례가 발생했습니다. 치료 시작 전 잠복 결핵 감염 검사에서 음성이었던 환자, 잠복 결핵 치료를 받고 있는 환자 또는 이전에 결핵 감염 치료를 받은 환자를 포함하여 결핵 징후 및 증상 발생에 대해 환자를 모니터링하십시오.
특히 이전에 또는 최근에 결핵 유병률이 높은 국가를 여행했거나 활동성 결핵 환자와 긴밀히 접촉한 환자의 경우 SIMPONI ARIA 치료 중 새로운 감염이 발생한 환자의 감별 진단에서 결핵을 고려하십시오.
침습성 진균 감염
환자에게 심각한 전신 질환이 발생하고 진균증이 풍토병인 지역에 거주하거나 여행하는 경우 감별 진단에서 침습성 진균 감염을 고려하십시오. 적절한 경험적 항진균 요법을 고려하고 진단 검사를 수행하는 동안 심각한 진균 감염 위험과 항진균 요법의 위험을 모두 고려하십시오. 활동성 감염이 있는 일부 환자에서 히스토플라스마증에 대한 항원 및 항체 검사가 음성일 수 있습니다. 이러한 환자의 관리를 돕기 위해 침습성 진균 감염 진단 및 치료 전문의와 상담하는 것이 좋습니다.
B형 간염 바이러스 재활성화
SIMPONI ARIA가 속한 TNF 차단제의 사용은 만성 B형 간염 보균자(즉, 표면 항원 양성)인 환자에서 B형 간염 바이러스(HBV)의 재활성화와 관련이 있습니다. 경우에 따라 TNF 차단제 치료와 함께 발생하는 HBV 재활성화는 치명적이었습니다. 이러한 보고의 대부분은 면역억제제를 병용 투여받은 환자에서 발생했습니다.
모든 환자는 TNF 차단제 치료를 시작하기 전에 HBV 감염 검사를 받아야 합니다. B형 간염 표면 항원 검사에서 양성 반응을 보이는 환자의 경우 TNF 차단제 치료를 시작하기 전에 B형 간염 치료 전문의와 상담하는 것이 좋습니다. HBV 보균자에게 SIMPONI ARIA를 포함한 TNF 차단제를 처방하기 전에 치료의 위험과 이점을 고려해야 합니다. 항바이러스 치료가 TNF 차단제로 치료받는 HBV 보균자의 HBV 재활성화 위험을 줄일 수 있는지에 대한 충분한 데이터는 없습니다. HBV 보균자이고 TNF 차단제로 치료해야 하는 환자는 치료 기간 내내 그리고 치료 종료 후 몇 개월 동안 활동성 HBV 감염의 임상적 및 실험실적 징후를 면밀히 모니터링해야 합니다.
HBV 재활성화가 발생한 환자의 경우 TNF 차단제를 중단하고 적절한 지원 치료와 함께 항바이러스 치료를 시작해야 합니다. HBV 재활성화가 통제된 후 TNF 차단제를 재개하는 것의 안전성은 알려져 있지 않습니다. 따라서 처방의는 이러한 상황에서 TNF 차단제 재개를 고려할 때 주의를 기울이고 환자를 면밀히 모니터링해야 합니다.
5.2 악성 종양
소아 환자의 악성 종양
골리무맙을 포함한 TNF 차단제로 치료받은 어린이, 청소년 및 청년(치료 시작 ≤ 18세)에서 일부 치명적인 악성 종양이 보고되었습니다. 약 절반의 사례는 호지킨 림프종과 비호지킨 림프종을 포함한 림프종이었습니다. 다른 사례는 일반적으로 면역억제와 관련된 드문 악성 종양과 어린이 및 청소년에게서는 일반적으로 관찰되지 않는 악성 종양을 포함하여 다양한 악성 종양을 나타냅니다. 악성 종양은 TNF 차단제 치료 첫 번째 용량 투여 후 평균 30개월(범위 1~84개월) 후에 발생했습니다. 대부분의 환자는 병용 면역억제제를 투여받고 있었습니다. 대부분의 사례는 시판 후 보고되었으며 등록 및 자발적인 시판 후 보고를 포함한 다양한 출처에서 파생되었습니다.
성인 환자의 악성 종양
SIMPONI ARIA를 포함한 TNF 차단제 치료의 위험과 이점은 성공적으로 치료된 비흑색종 피부암(NMSC) 이외의 알려진 악성 종양이 있는 환자에서 치료를 시작하기 전 또는 악성 종양이 발생한 환자에서 TNF 차단제를 계속할지 고려할 때 고려해야 합니다.
골리무맙 피하 제형을 포함한 TNF 차단제의 임상 시험의 통제된 부분에서 대조군의 환자에 비해 항-TNF 치료를 받은 환자에서 더 많은 림프종 사례가 관찰되었습니다. 특히 질병 활동성이 높고/거나 면역억제 치료에 만성적으로 노출된 환자와 같은 RA 및 기타 만성 염증성 질환 환자는 TNF 차단 치료가 없더라도 일반 인구보다 림프종 발생 위험이 더 높을 수 있습니다(최대 수 배). 류마티스 관절염 및 기타 적응증에서 SIMPONI ARIA를 포함한 TNF 차단제 사용으로 급성 및 만성 백혈병 사례가 보고되었습니다. TNF 차단제 치료가 없더라도 류마티스 관절염 환자는 일반 인구보다 백혈병 발생 위험이 더 높을 수 있습니다(약 2배).
TNF 차단제로 치료받은 환자에서 간비장 T 세포 림프종(HSTCL)의 드문 시판 후 사례가 보고되었습니다. 이러한 드문 유형의 T 세포 림프종은 매우 공격적인 질병 경과를 보이며 일반적으로 치명적입니다. 보고된 TNF 차단제 관련 사례의 거의 전부는 크론병 또는 궤양성 대장염 환자에서 발생했습니다. 대다수는 청소년 및 청년 남성이었습니다. 거의 모든 환자는 진단 시 또는 진단 전에 TNF 차단제와 함께 아자티오프린(AZA) 또는 6-메르캅토퓨린(6-MP)으로 치료받았습니다. TNF 차단제로 치료받은 환자에서 간비장 T 세포 림프종 발생 위험을 배제할 수 없습니다.
SIMPONI ARIA를 포함한 TNF 차단제로 치료받은 환자에서 흑색종과 메르켈 세포 암종이 보고되었습니다. 모든 환자, 특히 피부암 위험 요소가 있는 환자는 정기적인 피부 검사를 받는 것이 좋습니다.
악성 종양 위험이 더 높은 환자(예: 만성 폐쇄성 폐 질환[COPD] 환자, 병용 시클로포스파미드로 치료받은 베게너 육아종증 환자)에서 다른 TNF 차단제의 대조 시험에서 대조군에 비해 TNF 차단제 그룹에서 더 많은 악성 종양이 발생했습니다. 중증 지속성 천식 환자에서 골리무맙 피하 제형의 사용을 평가하는 탐색적 임상 시험에서 대조군 환자에 비해 골리무맙으로 치료받은 환자에서 더 많은 악성 종양이 보고되었습니다. 이러한 발견의 중요성은 알려져 있지 않습니다.
SIMPONI ARIA에 대한 RA 3상 시험의 통제된 부분 동안 100 환자-년 추적 관찰당 림프종 및 NMSC 이외의 악성 종양 발생률은 SIMPONI ARIA 그룹에서 0.56(95% CI: 0.01, 3.11)이었으며, 위약 그룹에서는 0(95% CI: 0.00, 3.79)이었습니다.
5.3 울혈성 심부전
SIMPONI ARIA를 포함한 TNF 차단제로 울혈성 심부전(CHF) 악화 및 새로 발생한 CHF 사례가 보고되었습니다. 일부 사례는 치명적인 결과를 초래했습니다. CHF 치료에서 다른 TNF 차단제의 여러 탐색적 시험에서 입원이나 사망률 증가를 요구하는 CHF 악화를 경험한 TNF 차단제 치료 환자의 비율이 더 높았습니다. SIMPONI ARIA는 CHF 병력이 있는 환자에서 연구되지 않았으며 CHF 환자에게는 SIMPONI ARIA를 주의해서 사용해야 합니다. CHF 환자에게 SIMPONI ARIA를 투여하기로 결정한 경우 치료 중 이러한 환자를 면밀히 모니터링해야 하며 CHF의 새로운 증상이나 악화되는 증상이 나타나면 SIMPONI ARIA를 중단해야 합니다.
5.4 탈수초성 질환
SIMPONI ARIA를 포함한 TNF 차단제 사용은 다발성 경화증(MS)을 포함한 중추 신경계(CNS) 탈수초성 질환의 새로운 발병 또는 악화와 길랑-바레 증후군을 포함한 말초 탈수초성 질환의 드문 사례와 관련이 있습니다. 골리무맙으로 치료받은 환자에서 중추 탈수초, MS, 시신경염 및 말초 탈수초성 다발신경병증 사례가 드물게 보고되었습니다. 처방자는 중추 또는 말초 신경계 탈수초성 질환이 있는 환자에게 SIMPONI ARIA를 포함한 TNF 차단제 사용을 고려할 때 주의해야 합니다. 이러한 질환이 발생하면 SIMPONI ARIA의 중단을 고려해야 합니다.
5.5 자가면역
SIMPONI ARIA를 포함한 TNF 차단제 치료는 항핵 항체(ANA)의 형성을 초래할 수 있습니다. 드물게 TNF 차단제 치료는 루푸스 유사 증후군의 발생을 초래할 수 있습니다
[see
. 환자가 SIMPONI ARIA 치료 후 루푸스 유사 증후군을 시사하는 증상이 나타나면 치료를 중단해야 합니다.
5.6 아바타셉트와 병용
대조 시험에서 다른 TNF 차단제와 아바타셉트의 병용 투여는 TNF 차단제 단독 사용보다 심각한 감염 비율이 더 높았습니다. 그리고 병용 요법은 TNF 차단제 단독 사용에 비해 RA 치료에서 임상적 이점이 개선되지 않았습니다. 따라서 SIMPONI ARIA를 포함한 TNF 차단제와 아바타셉트의 병용은 권장되지 않습니다.
[see
.
5.7 아나킨라와 병용
아나킨라(인터루킨-1 길항제)와 다른 TNF 차단제의 병용 투여는 TNF 차단제 단독에 비해 심각한 감염 및 호중구 감소증의 비율이 더 높았으며 추가적인 이점은 없었습니다. 따라서 SIMPONI ARIA를 포함한 TNF 차단제와 아나킨라의 병용은 권장되지 않습니다.
[see
.
5.8 생물학적 질병 조절 항류마티스 약물(DMARD) 간 전환
생물학적 제제에서 다른 생물학적 제제로 전환할 때 중복되는 생물학적 활성이 감염 위험을 더욱 증가시킬 수 있으므로 주의해야 합니다.
5.9 혈액학적 세포감소증
골리무맙을 투여받은 환자에서 범혈구감소증, 백혈구 감소증, 호중구 감소증, 무과립구증, 재생불량성 빈혈 및 혈소판 감소증이 보고되었습니다. 심각한 세포감소증이 있거나 있었던 환자에게 SIMPONI ARIA를 포함한 TNF 차단제를 사용할 때 주의해야 합니다.
5.10 예방 접종/치료 감염원
생백신
SIMPONI ARIA로 치료받는 환자에게 생백신을 접종하지 마십시오. 항-TNF 요법을 받는 환자의 경우 생백신에 대한 반응 또는 생백신에 의한 감염의 2차 전파에 대한 데이터는 제한적입니다. 생백신을 사용하면 파종성 감염을 포함한 임상 감염이 발생할 수 있습니다.
자궁 내 SIMPONI ARIA에 노출된 영아에게 생백신을 투여하는 것은 임신 중 산모의 마지막 SIMPONI ARIA 주입 후 6개월 동안 권장되지 않습니다.
[see
Use in Specific Populations (8.1)]
.
가능하면 면역억제제를 투여받는 환자의 현재 예방 접종 지침에 따라 SIMPONI ARIA 치료를 시작하기 전에 예방 접종을 업데이트하십시오. 환자에게 예방 접종을 받기 전에 의사와 상의하도록 조언하십시오.
5.11 과민 반응
시판 후 경험에서 SIMPONI ARIA를 포함한 골리무맙의 피하 및 정맥 주사 제형 투여 후 심각한 전신 과민 반응(아나필락시스 포함)이 보고되었습니다. 두드러기, 가려움증, 호흡곤란 및 메스꺼움을 포함한 과민 반응이 주입 중 그리고 일반적으로 주입 후 1시간 이내에 보고되었습니다. 이러한 반응 중 일부는 골리무맙의 첫 번째 투여 후 발생했습니다. 아나필락시스 또는 기타 심각한 알레르기 반응이 발생하면 SIMPONI ARIA 투여를 즉시 중단하고 적절한 치료를 시작해야 합니다.
6 부작용 반응
가장 심각한 이상 반응은 다음과 같습니다.
- 중증 감염
[경고 및 주의사항 (5.1) 참조
Warnings and Precautions (5.1)]
- 악성 종양
[경고 및 주의사항 (5.2) 참조
Warnings and Precautions (5.2)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 특정 약물의 임상 시험에서 관찰된 이상 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실제에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
아래에 설명된 안전성 데이터는 정맥 주입으로 SIMPONI ARIA를 투여받은 RA 환자를 대상으로 한 무작위, 이중 맹검, 대조군 3상 시험 하나를 기반으로 합니다(Trial RA). 이 프로토콜에는 위약을 투여받은 환자가 16주차 또는 24주차에 환자 반응(조절되지 않은 질병 활동 기준) 또는 연구 설계에 따라 SIMPONI ARIA 치료를 받도록 하는 조항이 포함되어 있으므로, 이상 사례를 항상 특정 치료에 명확하게 귀속시킬 수는 없습니다. 위약과 SIMPONI ARIA 간의 비교는 최초 24주간의 노출을 기준으로 했습니다.
Trial RA에는 대조군 치료 환자 197명과 SIMPONI ARIA 치료 환자 463명(16주차에 SIMPONI ARIA로 전환한 대조군 치료 환자 포함)이 포함되었습니다. Trial RA의 대조군 단계에서 24주차까지 이상 반응으로 인해 치료를 중단한 환자의 비율은 SIMPONI ARIA 치료 환자의 경우 3.5%, 위약 치료 환자의 경우 0.5%였습니다. 상기도 감염은 24주차까지 시험에서 보고된 가장 흔한 이상 반응으로, SIMPONI ARIA 치료 환자의 6.5%에서 발생한 반면, 대조군 치료 환자에서는 7.6%에서 발생했습니다.
감염
SIMPONI ARIA 치료 환자에서 관찰된 중증 감염에는 패혈증, 폐렴, 봉와직염, 농양, 기회 감염, 결핵(TB) 및 침윤성 진균 감염이 포함됩니다. 결핵 사례에는 폐 결핵 및 폐외 결핵이 포함됩니다. 대부분의 결핵 사례는 결핵 발생률이 높은 국가에서 발생했습니다.
[경고 및 주의사항 (5.1) 참조
Warnings and Precautions (5.1)]
.
Trial RA의 대조군 단계에서 24주차까지 감염은 SIMPONI ARIA 치료 환자의 27%에서 관찰된 반면, 대조군 치료 환자에서는 24%에서 관찰되었으며, 중증 감염은 SIMPONI ARIA 치료 환자의 0.9%와 대조군 치료 환자의 0.0%에서 관찰되었습니다. 24주차까지 환자-연당 중증 감염 발생률은 SIMPONI ARIA 군의 경우 2.2(95% CI 0.61, 5.71), 위약 군의 경우 0(0.00, 3.79)이었습니다. Trial RA의 대조군 및 비대조군 부분에서 958명의 환자-연 추적 관찰(중앙값 추적 관찰 기간 약 92주)을 통해 모든 중증 감염의 환자-연당 발생률은 SIMPONI ARIA를 투여받은 환자에서 4.07(95% CI: 2.90, 5.57)이었습니다.
[경고 및 주의사항 (5.1) 참조
Warnings and Precautions (5.1)]
. Trial RA의 대조군 및 비대조군 부분에서 SIMPONI ARIA 치료 환자의 활동성 결핵 환자-연당 발생률은 0.31(95% CI: 0.06; 0.92)이었고, 기타 기회 감염의 환자-연당 발생률은 0.42(95% CI: 0.11, 1.07)이었습니다.
악성 종양
Trial RA의 대조군 단계에서 24주차까지 SIMPONI ARIA와 관련하여 림프종 및 비흑색종 피부암(NMSC)을 제외한 악성 종양이 1건 보고되었습니다. 약 92주까지의 대조군 및 비대조군 부분에서 SIMPONI ARIA 치료 환자의 림프종 및 비흑색종 피부암을 제외한 악성 종양의 환자-연당 발생률은 0.31(95% CI: 0.06, 0.92)이었고, 비흑색종 피부암의 발생률은 0.1(95% CI: 0.00, 0.58)이었습니다.
간 효소 수치 상승
TNF 억제제를 투여받은 환자에서 급성 간부전을 포함한 중증 간 반응이 보고되었습니다.
Trial RA의 대조군 단계에서 24주차까지 ALT 수치가 ULN의 5배 이상 상승한 경우는 SIMPONI ARIA 치료 환자의 0.8%와 대조군 치료 환자의 0%에서 발생했으며, ALT 수치가 ULN의 3배 이상 상승한 경우는 SIMPONI ARIA 치료 환자의 2.3%와 대조군 치료 환자의 2.5%에서 발생했습니다.
Trial PsA의 대조군 단계에서 24주차까지 ALT 수치가 ULN의 5배 이상 상승한 경우는 SIMPONI ARIA 치료 환자의 1.7%와 위약 치료 환자의 1% 미만에서 발생했으며, ALT 수치가 ULN의 3배 이상 5배 미만으로 상승한 경우는 SIMPONI ARIA 치료 환자의 2.9%와 위약 치료 환자의 1% 미만에서 발생했습니다.
3상 시험의 많은 환자가 간 효소 수치 상승을 유발하는 약물(예: 비스테로이드성 항염증제[NSAID], MTX 또는 이소니아지드 예방 요법)을 복용하고 있었기 때문에, SIMPONI ARIA와 간 효소 수치 상승 간의 관계는 명확하지 않습니다.
자가면역 질환 및 자가항체
Trial RA에서 20주차에 SIMPONI ARIA 치료 환자의 17%와 대조군 환자의 13%에서 새로운 항핵 항체(ANA) 양성 반응이 나타났습니다. 이러한 환자 중 SIMPONI ARIA 치료 환자 1명과 대조군 치료 환자는 새로운 항-dsDNA 항체 양성 반응을 보였습니다.
[경고 및 주의사항 (5.5) 참조
Warnings and Precautions (5.5)]
.
투여 반응
Trial RA의 대조군 단계에서 24주차까지 SIMPONI ARIA 주입의 1.1%가 주입 반응과 관련이 있었던 반면, 대조군에서는 0.2%였습니다. SIMPONI ARIA 치료 환자에서 가장 흔한 주입 반응은 발진이었습니다. 심각한 주입 반응은 보고되지 않았습니다.
기타 이상 반응
표 1은 Trial RA의 대조군 기간 동안 24주차까지 SIMPONI ARIA + MTX 군에서 발생률이 위약 + MTX 군보다 높았던 이상 약물 반응을 요약한 것입니다.
| 위약 + MTX | SIMPONI ARIA + MTX | |
|---|---|---|
| 치료받은 환자 | 197 | 463 |
| 이상 반응 | ||
| 감염 및 감염증 | ||
| 상기도 감염 (상기도 감염, 비인두염, 인두염, 후두염, 비염 등) | 12% | 13% |
| 바이러스 감염 (인플루엔자 및 헤르페스 등) | 3% | 4% |
| 세균 감염 | 0% | 1% |
| 기관지염 | 1% | 3% |
| 혈관 장애 | ||
| 고혈압 | 2% | 3% |
| 피부 및 피하 조직 장애 | ||
| 발진 | 1% | 3% |
| 전신 장애 및 투여 부위 이상 | ||
| 발열 | 1% | 2% |
| 혈액 및 림프계 장애 | ||
| 백혈구 감소증 | 0% | 1% |
기타 흔하지 않은 임상 시험 이상 약물 반응
표 1에 나타나지 않거나, 주의 및 예방 조치 섹션에 나타나지 않는 SIMPONI ARIA 치료 환자에서 24주까지의 RA 시험 동안 1% 미만으로 발생한 이상 약물 반응에는 다음과 같은 시스템 기관 분류별 이벤트가 포함됩니다.
감염 및 감염증:표재성 진균 감염, 부비동염, 농양, 하기도 감염(폐렴), 신우신염
검사:알라닌 아미노전이효소(ALT) 증가, 아스파르테이트 아미노전이효소(AST) 증가, 호중구 수 감소
신경계 장애:현기증, 감각 이상
위장관 장애:변비
건선성 관절염
PsA 시험에서는 480명의 환자를 평가했습니다.
[
임상 연구(14.2) 참조]
. 이상 반응은 RA 환자에서 관찰된 것과 유사했으며, SIMPONI ARIA 치료 환자의 1% 미만에서 발생한 건선(새로 발생 또는 악화, 손바닥/발바닥 및 농포성)은 예외였습니다. PsA 시험에서 보고된 이상 반응의 발생률은 RA 시험과 유사했으며, SIMPONI ARIA에서 ALT 증가(7.9% vs. 위약 2.1%), AST 증가(5.4% vs. 위약 2.1%), 호중구 수 감소(4.6% vs. 위약 2.1%)의 발생률이 더 높았다는 점은 예외였습니다.
강직성 척추염
AS 시험에서는 208명의 환자를 평가했습니다.
[
임상 연구(14.3) 참조]
. 이상 반응은 RA 환자에서 보고된 것과 유사했으며, 위약 치료 환자에서는 발생하지 않은 반면 SIMPONI ARIA 치료 환자의 2.9%에서 발생한 ALT 증가 발생률이 더 높았다는 점은 예외였습니다.
다관절형 소아 특발성 관절염 및 건선성 관절염 소아 환자
pJIA 시험에서는 활동성 다발성 관절염이 있는 JIA 환자 127명을 평가했습니다.
[
임상 연구(14.4) 참조].
관찰된 이상 반응은 RA 및 PsA 성인 환자에서 SIMPONI ARIA의 확립된 안전성 프로파일과 일치했습니다.
6.2 면역원성
모든 치료용 단백질과 마찬가지로 면역원성의 가능성이 있습니다. 항체 형성의 검출은 분석의 민감도와 특이도에 따라 크게 달라집니다. 또한, 분석에서 관찰된 항체(중화 항체 포함) 양성률은 분석 방법, 샘플 처리, 샘플 수집 시기, 병용 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 아래에 설명된 시험에서 골리무맙에 대한 항체 발생률을 다른 시험 또는 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
효소 면역 분석(EIA) 방법을 사용하여 RA 시험의 24주까지 MTX와 병용하여 SIMPONI ARIA를 IV 투여한 후 골리무맙 치료 환자 13명(3%)에서 골리무맙에 대한 항체가 검출되었으며, 이들 모두 중화 항체였습니다.
골리무맙에 대한 항체를 검출하기 위한 약물 내성 효소 면역 분석(약물 내성 EIA) 방법이 개발되고 검증되었습니다. 이 방법은 혈청에서 골리무맙의 간섭이 적고 기존 EIA 방법보다 약 16배 더 민감합니다. 약 6개월 동안 RA, PsA, AS 및 pJIA 시험에서 약물 내성 EIA 방법을 사용한 골리무맙에 대한 항체 발생률은 각각 21%, 19%, 19% 및 31%였습니다. 검사한 경우 약 3분의 1에서 2분의 1이 중화되었습니다.
골리무맙에 대한 항체가 발생한 RA, PsA, AS 및 pJIA 환자는 일반적으로 골리무맙의 최저 혈청 농도가 낮았습니다.
[
임상 약리학(12.3) 참조].
6.3 시판 후 경험
골리무맙의 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 발생 빈도를 확실하게 추정하거나 골리무맙 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
전신 장애 및 투여 부위 상태:주입 관련 반응
[
경고 및 주의사항(5.11) 참조]
양성 및 악성 신생물:흑색종, 메르켈 세포 암종
[
경고 및 주의사항(5.2) 참조]
면역 체계 장애:심각한 전신 과민 반응(아나필락시스 반응 포함)
[
경고 및 주의사항(5.11) 참조]
, 사르코이드증
호흡기, 흉부 및 종격 장애:간질성 폐 질환
피부 및 피하 조직 장애:피부 박리, 유사태선 반응, 수포성 피부 반응
7 약물 상호 작용
7.1 메토트렉세이트
SIMPONI ARIA는 RA 치료에 MTX와 함께 사용되어야 합니다.
[참조:
. 정맥 투여 후, 메토트렉세이트의 병용 투여는 집단 약물동태(PK) 분석에 기초하여 SIMPONI ARIA의 청소율을 약 9% 감소시킵니다. 또한, 메토트렉세이트의 병용 투여는 골리무맙에 대한 항체 생성 감소를 통해 SIMPONI ARIA의 청소율을 감소시킵니다.
7.2 RA, PsA, AS 및 pJIA 치료용 생물학적 제제
아나킨라 또는 아바타셉트와 병용하여 사용된 다른 TNF 차단제의 임상 RA 연구에서 심각한 감염 위험이 증가한 것으로 나타났으며, 추가적인 이점은 없었습니다. 따라서, 아바타셉트 또는 아나킨라를 포함한 다른 생물학적 제제와 SIMPONI ARIA를 함께 사용하는 것은 권장되지 않습니다.
[참조:
5.7)]
. 리툭시맙으로 치료받은 RA 환자에서 이후 TNF 차단제로 치료받은 경우 심각한 감염 발생률이 더 높은 것으로 관찰되었습니다. 감염 위험 증가 가능성으로 인해 RA, PsA, AS 및 pJIA 치료에 승인된 생물학적 제제와 SIMPONI ARIA의 병용 사용은 권장되지 않습니다.
7.3 생백신/치료용 감염성 물질
생백신은 SIMPONI ARIA와 동시에 투여해서는 안 됩니다.
[참조:
.
치료용 감염성 물질은 SIMPONI ARIA와 동시에 투여해서는 안 됩니다.
[참조:
.
임신 중 SIMPONI ARIA로 치료받은 여성에게서 태어난 유아는 최대 6개월 동안 감염 위험이 증가할 수 있습니다. 자궁 내 SIMPONI ARIA에 노출된 유아에게 생백신을 투여하는 것은 임신 중 어머니의 마지막 SIMPONI ARIA 주입 후 6개월 동안 권장되지 않습니다.
in utero
[참조:
.
7.4 시토크롬 P450 기질
만성 염증 동안 사이토카인(예: TNFα) 수치 증가에 의해 CYP450 효소의 생성이 억제될 수 있습니다. 따라서 골리무맙과 같이 사이토카인 활성을 길항하는 분자의 경우 CYP450 효소의 생성이 정상화될 것으로 예상됩니다. 좁은 치료 지수를 가진 CYP450 기질로 치료받는 환자에서 SIMPONI ARIA의 투여 시작 또는 중단 시, 효과(예: 와파린) 또는 약물 농도(예: 시클로스포린 또는 테오필린) 모니터링을 권장하며, 필요에 따라 약물 제제의 개별 용량을 조정할 수 있습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 여성에 대한 SIMPONI ARIA의 적절하고 잘 통제된 시험은 없습니다. 골리무맙과 같은 단클론 항체는 임신 3분기에 태반을 통과하여 자궁 내 노출된 영아의 면역 반응에 영향을 미칠 수 있습니다. 임신 여성에게 SIMPONI ARIA를 사용하는 데는 임상적 고려 사항이 있습니다.
[임상적 고려 사항 참조]. 동물 생식 연구에서, 기관 형성 기간 동안 임신 원숭이에게 피하 투여된 골리무맙은 최대 권장 인체 용량(MRHD)의 약 200배에 해당하는 노출량을 생성했지만 태아에 대한 유해한 영향은 없었습니다.
모든 임신에는 선천적 기형, 유산 또는 기타 유해한 결과의 배경 위험이 있습니다. 지정된 모집단에 대한 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
임상적 고려 사항
태아/신생아 유해 반응
골리무맙은 임신 중 태반을 통과합니다. 임신 중 투여된 또 다른 TNF 차단 단클론 항체는 영아의 혈청에서 최대 6개월까지 검출되었습니다. 따라서 이러한 영아는 감염 위험이 증가할 수 있습니다. SIMPONI ARIA에 자궁 내 노출된 영아에게 생백신을 투여하는 것은 임신 중 어머니의 마지막 SIMPONI ARIA 주입 후 6개월 동안 권장되지 않습니다.
[경고 및 예방 조치 (5.10) 및 약물 상호 작용 (7.3) 참조].
데이터
인체 데이터
관찰 연구, 발표된 증례 보고서 및 시판 후 감시에서 얻은 임신 여성에 대한 SIMPONI ARIA 사용에 대한 제한된 데이터는 약물 관련 위험을 알리는 데 충분하지 않습니다.
동물 데이터
임신 시노몰구스 원숭이에게 기관 형성 기간(임신 20일~51일) 동안 골리무맙을 투여한 배자-태아 발생 독성 연구에서, MRHD(최대 혈중 농도(C
max) 기준으로 주 2회 최대 50mg/kg의 모체 피하 투여량으로)의 노출량보다 최대 200배 더 큰 노출량을 생성했지만 태아 기형이나 배자 독성의 증거는 없었습니다. 모체 독성의 증거도 없었습니다. 2분기 말에 채취한 제대혈 샘플은 태아가 임신 중 골리무맙에 노출되었음을 보여주었습니다.
임신 50일부터 분만 후 33일까지 임신 시노몰구스 원숭이에게 골리무맙을 투여한 출산 전후 발달 연구에서, MRHD(최대 혈중 농도(C
max) 기준으로 주 2회 최대 50mg/kg의 모체 피하 투여량으로 정상 상태에서)보다 최대 33배 더 큰 최대 약물 농도는 영아의 발달 결함과 관련이 없었습니다. 모체 독성의 증거도 없었습니다. 골리무맙은 2분기 말 태아 혈청과 출생 시점부터 분만 후 최대 6개월까지 신생아 혈청에서 검출되었습니다.
8.2 수유
8.4 소아 사용
활동성 다관절 소아 특발성 관절염 및 건선성 관절염에 대한 SIMPONI ARIA의 안전성 및 유효성은 2세 이상의 소아 환자에서 입증되었습니다.
이러한 연령대에서 SIMPONI ARIA의 사용은 활동성 다관절염을 가진 성인 RA 및 PsA 환자에 대한 SIMPONI ARIA의 적절하고 잘 통제된 연구, RA 및 PsA를 가진 성인 환자와 활동성 다관절염을 가진 소아 JIA 환자의 약동학적 데이터, 활동성 다관절염을 가진 2세~18세 미만의 소아 JIA 환자 127명을 대상으로 한 임상 연구의 안전성 데이터를 바탕으로 합니다. 관찰된 투여 전(골) 농도는 일반적으로 RA 및 PsA를 가진 성인과 활동성 다관절염을 가진 소아 JIA 환자 간에 비슷하며, 약동학적 노출은 성인 PsA 환자와 PsA를 가진 소아 환자 간에 비슷할 것으로 예상됩니다.
[유해 반응 (6.1), 임상 약리학 (12.3) 및 임상 연구 (14.2, 14.4) 참조].
골리무맙 및 기타 TNF 차단제로 치료받은 어린이, 청소년 및 젊은 성인에서 일부 치명적인 악성 종양이 보고되었습니다.
[경고 및 예방 조치 (5.2) 참조].
2세 미만 소아 환자에 대한 안전성 및 유효성은 pJIA 또는 PsA에서 확립되지 않았습니다. pJIA 및 PsA 이외의 질환을 가진 소아 환자에 대한 SIMPONI ARIA의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
Trial RA에서 65세 이상 환자의 수는 젊은 SIMPONI ARIA 치료 환자와 비교하기에는 너무 적었습니다. 일반적으로 노인 인구에서 감염 발생률이 더 높기 때문에 노인 환자를 SIMPONI ARIA로 치료할 때는 주의해야 합니다.
10 과다 복용
임상 연구에서 5명의 환자에게 최대 1000mg의 SIMPONI ARIA를 단일 주입했으며, 심각한 부작용이나 다른 유의미한 반응은 나타나지 않았습니다.
11 설명
골리무맙은 인간 종양괴사인자 알파(TNFα)에 특이적인 인간 IgG1κ 단클론 항체이며, 약 150~151 kDa의 분자량을 갖는 여러 가지 당형태를 나타냅니다. 골리무맙은 인간 TNF로 면역된 유전자 조작 마우스를 사용하여 생성되었으며, 인간 유래 항체 가변 및 불변 영역을 갖는 항체입니다. 골리무맙은 연속 관류 배양된 재조합 세포주에 의해 생산되며, 바이러스 불활성화 및 제거 조치를 포함하는 일련의 단계를 통해 정제됩니다.
SIMPONI ARIA
®(골리무맙) 주사제는 정맥 주입을 위한 4mL 유리 바이알에 제공되는 골리무맙 항체의 무균 용액입니다.
SIMPONI ARIA는 보존제가 없는 무색에서 연한 황색 용액이며, pH는 약 5.5입니다. SIMPONI ARIA는 천연 고무 라텍스를 사용하지 않고 제조되었습니다. SIMPONI ARIA 4mL 바이알 1개에는 골리무맙 50mg, L-히스티딘(1.14mg), L-히스티딘 일염산염 일수화물(6.42mg), 폴리소르베이트 80(0.6mg), 소르비톨(180mg) 및 주사용수가 포함되어 있습니다.
12 약물동력학
12.1 작용 기전
골리무맙은 사람 TNFα의 가용성 및 막관통 생물학적 활성 형태 모두에 결합하는 사람 단클론 항체입니다. 이러한 상호작용은 TNFα가 수용체에 결합하는 것을 방지하여 TNFα(사이토카인 단백질)의 생물학적 활성을 억제합니다. 골리무맙 항체가 다른 TNF 수퍼패밀리 리간드에 결합한다는 증거는 없었습니다. 특히, 골리무맙 항체는 사람 림포톡신에 결합하거나 중화시키지 않았습니다. 골리무맙은 보체 또는 효과 세포의 존재 하에 막관통 TNF를 발현하는 사람 단핵구를 용해시키지 않았습니다.
혈액, 활액 및 관절에서 TNFα 수치가 상승하는 것은 류마티스 관절염, 건선성 관절염 및 강직성 척추염과 같은 여러 만성 염증 질환의 병태생리에 관여하는 것으로 나타났습니다. TNFα는 이러한 질환의 특징인 관절 염증의 중요한 매개체입니다. 골리무맙은 백혈구 침윤에 책임이 있는 부착 단백질(E-셀렉틴, ICAM-1 및 VCAM-1)의 발현과 염증성 사이토카인(IL-6, IL-8, G-CSF 및 GM-CSF)의 분비를 포함한 여러 생체 분석법에서 TNF에 의해 매개되는 in vitro 생물학적 효과를 조절했습니다. 이러한 결과의 임상적 관련성은 알려져 있지 않습니다.
12.2 약력학
RA 환자에서 SIMPONI ARIA 치료 후 기준치에서 감소가 관찰되었습니다. 조직 금속단백질분해효소 억제제-1(TIMP-1), 기질 금속단백질분해효소-1(MMP-1), 기질 금속단백질분해효소-3(MMP-3), 레지스틴, 인터루킨-6(IL-6), 대식세포 염증성 단백질-1(MIP-1b), 혈관내피 성장 인자(VEGF), 혈청 아밀로이드 A(SAA), S100A12 및 고감도 C-반응성 단백질(hsCRP)에서 감소가 관찰되었습니다. 반대로, 타르타르산 저항성 산성 포스파타제(TRAP-5b)에서는 기준치에서 증가가 관찰되었습니다. 이 정보의 임상적 관련성은 알려져 있지 않습니다.
12.3 약동학
골리무맙은 단일 정맥내 투여 후 0.1~10.0mg/kg의 용량 범위에서 RA 환자에게서 거의 용량 비례 약동학을 나타냈습니다.
흡수
2mg/kg SIMPONI ARIA의 단일 정맥내 투여 후, RA 환자에서 평균 Cmax 44.4 ± 11.3 mcg/mL가 관찰되었습니다. 2mg/kg 정맥내 투여와 50mg 피하 투여를 직접 비교한 데이터는 없습니다.
분포
2mg/kg SIMPONI ARIA의 단일 정맥내 투여 후, 건강한 피험자의 평균 분포 용적은 115 ± 19 mL/kg으로 추정되었고, RA 환자의 경우 151 ± 61 mL/kg으로 추정되었습니다. 골리무맙의 분포 용적은 골리무맙이 주로 순환계에 분포하고 혈관외 분포는 제한적임을 나타낼 수 있습니다.
배설
2mg/kg SIMPONI ARIA의 단일 정맥내 투여 후, 건강한 피험자의 골리무맙 전신 청소율은 6.9 ± 2.0 mL/day/kg으로 추정되었고, RA 환자의 경우 7.6 ± 2.0 mL/day/kg으로 추정되었습니다. 건강한 피험자의 평균 최종 반감기는 12 ± 3일로 추정되었고, RA 환자의 평균 최종 반감기는 14 ± 4일이었습니다.
반복 투여
RA 환자에게 2mg/kg SIMPONI ARIA를 0주, 4주, 그 이후 8주마다 정맥내 투여했을 때, 혈청 농도는 12주까지 정상 상태에 도달했습니다. MTX를 병용 사용한 경우, 8주마다 2mg/kg 골리무맙으로 치료하면 활동성 RA 환자의 평균 정상 상태 골 혈청 농도는 약 0.4 ± 0.4 mcg/mL였습니다. PsA 환자의 평균 정상 상태 골 혈청 농도는 0.7 ± 0.6 mcg/mL였습니다. AS 환자의 평균 정상 상태 골 혈청 농도는 0.8 ± 0.6 mcg/mL였습니다.
골리무맙에 대한 항체가 생성된 RA, PsA 및 AS 환자는 일반적으로 골리무맙의 정상 상태 골 혈청 농도가 더 낮았습니다.[유해 반응 (6.2) 참조].
특정 집단
골리무맙의 약동학에 대한 신장 또는 간 손상의 영향에 대한 공식적인 연구는 수행되지 않았습니다.
체중
정맥내 투여 후, 체중이 더 높은 환자는 골리무맙을 mg/kg(체중) 기준으로 투여했을 때 체중이 더 낮은 환자보다 혈청 골리무맙 농도가 약간 더 높은 경향이 있었습니다. 그러나 집단 약동학 분석에 따르면, 다양한 체중 범위의 성인 환자에서 2mg/kg SIMPONI ARIA를 정맥내 투여한 후 골리무맙 노출에는 임상적으로 관련된 차이가 없었습니다.
소아
활동성 다관절염이 있는 JIA 환자에게 80mg/m2 SIMPONI ARIA를 0주, 4주, 그 이후 8주마다 정맥내 투여했을 때, 혈청 농도는 12주까지 정상 상태에 도달했습니다. MTX를 병용 사용한 경우, 80mg/m2 SIMPONI ARIA로 치료하면 활동성 다관절염이 있는 JIA 환자의 평균 정상 상태 골 혈청 골리무맙 농도는 약 0.5 ± 0.4 mcg/mL였고, 평균 정상 상태 AUC는 425 ± 125 mcg∙day/mL였습니다. 전반적으로, 활동성 다관절염이 있는 JIA 환자에서 관찰된 정상 상태 골리무맙 골 농도는 SIMPONI ARIA 투여 후 성인 RA 및 PsA에서 관찰된 농도 범위 내에 있었습니다.
성인 RA 환자의 정맥내 데이터와 일치하게, pJIA에서 정맥내 SIMPONI ARIA에 대한 집단 약동학 분석 결과, 다양한 연령 및 체중 범위의 소아 환자에서 80mg/m2 SIMPONI ARIA를 정맥내 투여한 후 골리무맙 노출에는 임상적으로 관련된 차이가 없었습니다. 활동성 다관절염이 있는 JIA 환자의 골리무맙 청소율에 대한 면역 반응 효과는 RA 성인과 비슷했습니다.
13 비임상 독성학
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
golimumab의 발암 가능성을 평가하기 위한 장기 동물 연구는 수행되지 않았습니다. golimumab을 사용한 돌연변이 유발성 연구는 수행되지 않았습니다. 유사한 항마우스 TNFα 항체를 최대 40mg/kg의 용량으로 일주일에 한 번 정맥 투여하여 마우스에서 수행된 생식력 연구에서는 생식력 손상이 나타나지 않았습니다.
14 CLINICAL STUDIES
14.1 류마티스 관절염
SIMPONI ARIA의 효능 및 안전성은 다기관, 무작위 배정, 이중맹검, 대조 시험(시험 RA, NCT00973479)에서 평가되었으며, 이 시험에는 동시 MTX 요법에도 불구하고 중등도에서 중증의 활동성 RA를 가진 18세 이상의 환자 592명이 참여했고, 이전에 생물학적 TNF 차단제로 치료받은 적이 없었습니다. 환자는 미국 류마티스 대학(ACR) 기준에 따라 진단되었으며, 연구 약물 투여 3개월 전에 적어도 6개의 붓고 아픈 관절이 있어야 했습니다. 환자는 SIMPONI ARIA 2 mg/kg(N=395) 또는 위약(N=197)을 30분 동안 정맥 주입으로 0주차, 4주차, 그 이후 8주마다 추가로 매주 유지 MTX 용량(15–25 mg)과 함께 투여받도록 무작위 배정되었습니다. 위약 + MTX를 투여받은 모든 환자는 24주차 이후 SIMPONI ARIA + MTX를 투여받았지만, 모든 환자가 108주간의 치료를 완료할 때까지 시험은 맹검 상태를 유지했습니다. 효능 데이터는 52주차까지 수집 및 분석되었습니다. 환자는 동시에 저용량 코르티코스테로이드(1일 최대 10mg의 프레드니손에 해당) 및/또는 NSAIDs의 안정적인 용량을 계속 복용할 수 있었습니다. 세포독성 약물 또는 기타 생물학적 제제를 포함한 다른 DMARD의 사용은 금지되었습니다.
시험 RA의 1차 종점은 14주차에 ACR 20 반응을 달성한 환자의 비율이었습니다. 시험 RA에서 피험자의 대부분은 여성(82%)이었고 백인(80%)이었으며, 중앙값 연령은 52세, 중앙값 체중은 70kg이었습니다. 중앙값 질병 기간은 4.7년이었고, 환자의 50%는 과거에 MTX 이외의 DMARD를 하나 이상 사용했습니다. 기준선에서 환자의 81%는 동시에 NSAIDs를 복용했고, 81%는 저용량 코르티코스테로이드(1일 최대 10mg의 프레드니손에 해당)를 복용했습니다. 중앙값 기준선 DAS28-CRP는 5.9였고, 기준선에서 중앙값 van der Heijde-Sharp 점수는 28.5였습니다.
임상 반응
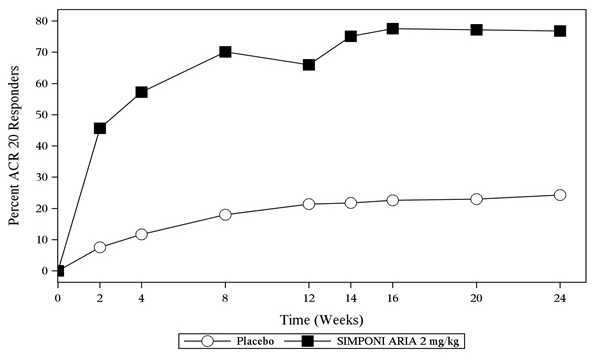
SIMPONI ARIA + MTX 병용 요법으로 치료받은 환자의 더 높은 비율이 위약 + MTX로 치료받은 환자보다 14주차에 ACR 20 및 24주차에 ACR 50을 달성했습니다(표 2 참조). 시험 RA에 대한 방문별 ACR 20 반응 달성 환자 비율은 그림 1에 나와 있습니다.
| 시험 RA MTX에도 불구하고 활동성 RA |
|||
|---|---|---|---|
| 위약 + MTX | SIMPONI ARIA + MTX | 95% CI | |
| N | 197 | 395 | |
| ACR 20 | |||
| 14주차 | 25% | 59% | 25.9, 41.4 |
| 24주차 | 32% | 63% | 23.3, 39.4 |
| ACR 50 | |||
| 14주차 | 9% | 30% | 15.3, 27.2 |
| 24주차 | 13% | 35% | 15.1, 28.4 |
| ACR 70 | |||
| 14주차 | 3% | 12% | 5.3, 13.4 |
| 24주차 | 4% | 18% | 8.8, 18.1 |
 |
||
| 이 분석은 치료 의도 집단을 기반으로 합니다. 누락된 데이터에는 마지막 관찰값을 전향적으로 적용했습니다. 효능 부족으로 치료를 중단한 환자는 반응하지 않은 환자로 계산되었으며, 금지된 약물을 시작하거나 16주차에 관절 수의 개선이 10% 이상 달성하지 못한 환자도 마찬가지였습니다. |
표 3에 제시된 바와 같이, 시험 RA에서 SIMPONI ARIA + MTX군의 ACR 반응 기준 모든 구성 요소의 개선은 위약 + MTX군에 비해 더 컸습니다.
| 시험 RA MTX에도 불구하고 활동성 RA |
||
|---|---|---|
| 위약 + MTX | SIMPONI ARIA + MTX | |
| 참고: 모든 값은 평균값입니다. | ||
|
||
| N | 197 | 395 |
| 부어오른 관절 수 (0–66) | ||
| 기준 | 15 | 15 |
| 14주차 | 11 | 6 |
| 압통 관절 수 (0–68) | ||
| 기준 | 26 | 26 |
| 14주차 | 20 | 13 |
| 환자의 통증 평가 (0–10) | ||
| 기준 | 6.5 | 6.5 |
| 14주차 | 5.6 | 3.9 |
| 환자의 전반적 질병 활동성 평가 (0–10) | ||
| 기준 | 6.5 | 6.5 |
| 14주차 | 5.5 | 4.0 |
| 의사의 전반적 질병 활동성 평가 (0–10) | ||
| 기준 | 6.3 | 6.2 |
| 14주차 | 4.9 | 3.1 |
| HAQ 점수 (0–3) | ||
| 기준 | 1.6 | 1.6 |
| 14주차 | 1.4 | 1.1 |
| CRP (mg/dL) (0–1) | ||
| 기준 | 2.2 | 2.8 |
| 14주차 | 1.8 | 0.9 |
14주차에, SIMPONI ARIA + MTX로 치료받은 환자군에서 DAS28-CRP 2.6 미만의 낮은 질병 활동 수준을 달성한 비율이 위약 + MTX군에 비해 더 높았습니다 (15% 대 5%; 차이의 95% CI [6.3%, 15.5%]).
방사선학적 반응
RA 시험에서 관절 구조 손상은 방사선학적으로 평가되었으며, 기준선과 비교하여 24주차에 van der Heijde-Modified Sharp Score (vdH-S) 및 그 구성 요소인 침식 점수와 관절 간격 협착(JSN) 점수의 변화로 나타냈습니다. 표 4에 나타난 바와 같이, SIMPONI ARIA + MTX 치료군은 총 vdH-S 점수로 평가했을 때 위약 + MTX에 비해 구조적 손상의 진행을 억제했습니다.
| 위약 + MTX (N=197) |
SIMPONI ARIA + MTX (N=395) |
|
|---|---|---|
| 평균 | 평균 | |
| 총 vdH-S 점수 변화 | 1.1 | 0.03 |
| 침식 점수 변화 | 0.5 | -0.1 |
| JSN 점수 변화 | 0.6 | 0.1 |
24주차에, SIMPONI ARIA + MTX군에서는 더 많은 비율의 환자(71%)가 구조적 손상의 진행이 없었던 반면(총 vdH-S 점수 변화 ≤ 0), 위약 + MTX군에서는 57%의 환자에게서 이러한 결과가 나타났습니다. 52주차에, 16주차 또는 24주차에 위약 + MTX군에서 SIMPONI ARIA + MTX로 변경된 환자의 총 vdH-S 점수의 기준치 대비 평균 변화는 1.2였고, 활성 치료를 계속 유지한 SIMPONI ARIA + MTX군 환자의 경우 0.1이었습니다.
14.2 건선성 관절염
NSAID 또는 DMARD 치료에도 불구하고 활동성 건선성 관절염을 가진 18세 이상의 480명의 환자를 대상으로 다기관, 무작위, 이중맹검, 위약 대조 시험에서 SIMPONI ARIA의 효능과 안전성을 평가했습니다(Trial PsA, NCT02181673). 생물학적 제제의 이전 치료는 허용되지 않았습니다. 이 시험의 환자들은 최소 6개월 동안 건선성 관절염 진단을 받았고, 활동성 질병의 증상을 보였습니다([≥5개의 부어오른 관절 및 ≥5개의 압통이 있는 관절 및 ≥0.6 mg/dL의 CRP 수치]. 환자들은 0주차, 4주차, 12주차 및 20주차에 30분간의 정맥 주입으로 SIMPONI ARIA 2 mg/kg(N=241) 또는 위약(N=239)을 투여받도록 무작위 배정되었습니다. 위약을 투여받은 모든 환자는 24주차, 28주차 및 그 이후 52주차까지 8주마다 SIMPONI ARIA를 투여받았습니다. SIMPONI ARIA 치료군 환자는 28주차 및 그 이후 52주차까지 8주마다 SIMPONI ARIA 주입을 계속 받았습니다.
시험 기간 동안 환자는 MTX, NSAID 및 저용량 경구 코르티코스테로이드(1일 최대 10mg의 프레드니손에 해당)의 안정적인 용량을 계속 복용할 수 있었습니다. 세포독성 약물 또는 기타 생물학적 제제를 포함한 다른 DMARD의 사용은 금지되었습니다.
주요 평가변수는 14주차에 ACR 20 반응을 달성한 환자의 비율이었습니다.
류마티스 결절이 없는 다관절염(44%), 비대칭 말초 관절염(19%), 원위 지간 관절 병변(8.1%), 말초 관절염을 동반한 척추염(25%) 및 관절 파괴(4.8%)를 포함하여 각 건선성 관절염 하위 유형의 환자들이 등록되었습니다. 건선성 관절염 질환의 중앙값 기간은 3.5년이었고, 86%의 환자가 이전에 MTX를 사용했으며, 35%의 환자가 과거에 적어도 하나의 다른 DMARD를 투여받았습니다. 기준 시점에서 환자의 76%와 54%가 각각 건염과 지염을 보였습니다. 기준 시점의 수정된 총 vdH-S 점수 중앙값은 15.5였습니다. 시험 기간 동안 사용된 동반 약물에는 MTX(70%), 경구 코르티코스테로이드(28%) 및 NSAID(71%)가 포함되었습니다.
임상 반응
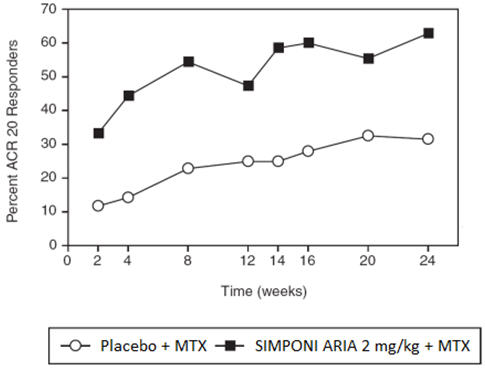
Trial PsA에서 SIMPONI ARIA 치료는 위약과 비교하여 14주차 ACR 20 반응 환자 비율로 나타난 바와 같이 징후 및 증상의 유의미한 개선을 가져왔습니다(
표 5 참조). 서로 다른 건선성 관절염 하위 유형의 환자에서 24주차에 유사한 ACR 20 반응이 관찰되었습니다. SIMPONI ARIA 치료군에서 관찰된 ACR 20 반응은 동반 MTX를 투여받았거나 투여받지 않은 환자에서 유사했습니다.
| 위약 | SIMPONI ARIA | 위약 대비 차이 (95% CI) |
|
|---|---|---|---|
| (N
*=239) |
(N
*=241) |
||
| 참고: 이 분석은 치료 의도 집단을 기반으로 합니다. 부분적으로 누락된 데이터에는 마지막 관찰값을 전달했고, 완전히 누락된 데이터에는 비반응자 대입을 수행했습니다. 효능 부족으로 치료를 중단한 환자는 비반응자로 대입되었으며, 금지된 약물을 시작하거나 코르티코스테로이드 또는 MTX를 증량했거나 16주차에 관절 수의 개선이 5% 미만이었고 동반 약물 중재(코르티코스테로이드, MTX 또는 NSAID)를 받은 환자도 비반응자로 대입되었습니다. | |||
| ACR 20 반응 | |||
| 14주차 | 22% | 75% | 53%
†
|
| 24주차 | 24% | 77% | 53% (45, 60) |
| ACR 50 반응 | |||
| 14주차 | 6.3% | 44% | 37% (30, 44) |
| 24주차 | 6.3% | 54% | 47% (40, 54) |
| ACR 70 반응 | |||
| 14주차 | 2.1% | 25% | 22% (17, 28) |
| 24주차 | 3.3% | 33% | 29% (23, 36) |
시험 PsA에 대한 24주차까지 방문을 통한 ACR20 반응에 도달한 환자의 비율은 그림 2에 나와 있습니다.
| 그림 2: 시험 PsA – 24주차까지 ACR20 반응에 도달한 환자 비율 | |
|
|
|
| 이 분석은 치료 의도 집단을 기반으로 합니다. 부분적으로 누락된 데이터에는 마지막 관찰값을 전달하는 방법을 사용했고, 완전히 누락된 데이터에는 무반응자 대입을 수행했습니다. 효능 부족으로 치료를 중단한 환자는 무반응자로 대입되었으며, 금지된 약물을 시작하거나 코르티코스테로이드 또는 MTX를 증량했거나 16주차에 관절 수의 개선이 5% 미만이었고 동반 약물 중재(코르티코스테로이드, MTX 또는 NSAIDs)를 받은 환자도 무반응자로 대입되었습니다. | |
표 6은 시험 PsA에서 SIMPONI ARIA 및 플라시보 그룹에 대한 ACR 반응 기준의 개별 구성 요소의 개선 사항을 보여줍니다.
| 플라시보 N *=239 |
SIMPONI ARIA N *=241 |
|||
|---|---|---|---|---|
| 기준 | 기준 대비 14주차 변화 | 기준 | 기준 대비 14주차 변화 | |
| 참고: 모든 값은 평균입니다. | ||||
| ACR 구성 요소 | ||||
| 부종 관절 수 (0–66) | 14 | -2.9 | 14 | -11 |
| 압통 관절 수 (0–68) | 26 | -4.2 | 25 | -15 |
| 환자의 통증 평가 (0–100mm) | 64 | -11 | 63 | -31 |
| 환자 전반적 평가 (0–100mm) | 63 | -11 | 65 | -32 |
| 의사 전반적 평가 (0–100mm) | 64 | -13 | 62 | -39 |
| 장애 지수 (HAQ) (0–3) | 1.3 | -0.13 | 1.3 | -0.60 |
| hsCRP (mg/L) | 20 | -2.9 | 19 | -16 |
기준 시점에 족저근막염이 있었던 환자는 0~6 척도의 Leeds Enthesitis Index (LEI)를 사용하여 평균 개선 정도를 평가받았습니다. SIMPONI ARIA 치료 환자는 14주차에 위약 치료 환자의 평균 감소치 0.8에 비해 평균 1.8 감소치로 족저근막염의 개선이 유의하게 더 컸습니다. 기준 시점에 지골염이 있었던 환자는 0~60 척도를 사용하여 평균 개선 정도를 평가받았습니다. SIMPONI ARIA 치료 환자는 14주차에 위약 치료 환자의 평균 감소치 2.8에 비해 평균 7.8 감소치로 유의하게 더 큰 개선을 보였습니다.
방사선학적 반응
Trial PsA에서 구조적 관절 손상은 방사선학적으로 평가되었으며, 24주차 기준선 대비 변화로서 총 수정 vdH-S 점수 및 그 구성 요소인 침식 점수와 JSN 점수로 표현되었습니다. 표 7에 나와 있는 바와 같이 SIMPONI ARIA는 총 수정 vdH-S 점수로 평가했을 때 위약과 비교하여 구조적 손상의 진행을 억제했습니다.
| 위약 N *=237 |
SIMPONI ARIA N *=237 |
위약과의 차이 (95% CI) |
|
|---|---|---|---|
| 평균 | 평균 | ||
| 참고: 모든 값은 평균입니다. | |||
|
|||
| 총 수정 vdH-S 점수 변화 | 2.0 | -0.4 | -2.3 (-2.9, -1.7) |
24주차에, SIMPONI ARIA 투여군(72%)에서는 위약군(43%)에 비해 구조적 손상의 진행이 없는 환자(변형된 총 vdH-S 점수 변화 ≤ 0)의 비율이 더 높았습니다.
신체 기능 및 반응
건강평가 설문지 장애 지수(HAQ-DI)로 평가한 신체 기능 개선은 14주차에 기준치 대비 HAQ-DI 점수가 ≥ 0.3만큼 임상적으로 의미 있는 개선을 달성한 환자의 비율이 SIMPONI ARIA 투여군에서 위약군에 비해 더 높았음을 보여줍니다(69% 대 32%).
기타 건강 관련 결과
일반적인 건강 상태는 36항목 단축형 건강 설문조사(SF-36)로 평가했습니다. Trial PsA에서 SIMPONI ARIA를 투여받은 환자는 위약군에 비해 신체 구성 요소 요약 점수, 정신 구성 요소 요약 점수 및 SF-36의 모든 8개 영역에서 기준치 대비 개선이 더 크게 나타났습니다.
Trial PsA에서 만성 질환 치료 피로 기능 평가 점수(FACIT-F)로 피로를 평가했습니다. SIMPONI ARIA 치료는 FACIT-F로 측정한 피로 개선으로 이어졌습니다.
14.3 강직성 척추염
SIMPONI ARIA의 효능 및 안전성은 활동성 강직성 척추염(AS)이 있고 NSAIDs에 대한 반응이 불충분하거나 내약성이 없는 208명의 18세 이상 환자를 대상으로 한 다기관, 무작위, 이중맹검, 위약 대조 시험(Trial AS, NCT02186873)에서 평가했습니다. 환자는 수정된 뉴욕 기준에 따라 최소 3개월 동안 확진된 AS 진단을 받았습니다. 환자는 활동성 질병 증상이 있었습니다[Bath AS 질병 활동 지수(BASDAI) ≥ 4, 총 요통에 대한 VAS ≥ 4, 0~10cm(0~100mm) 척도, 그리고 hsCRP 수치 ≥ 0.3mg/dL(3mg/L)]. 환자는 0주차, 4주차 및 12주차에 30분 정맥 주입으로 SIMPONI ARIA 2mg/kg(N=105) 또는 위약(N=103)을 투여받도록 무작위 배정되었습니다. 위약을 투여받은 모든 환자는 16주차, 20주차 및 그 이후 8주마다 52주차까지 SIMPONI ARIA를 투여받았습니다. SIMPONI ARIA 치료군 환자는 20주차 및 그 이후 8주마다 52주차까지 SIMPONI ARIA 주입을 계속 받았습니다. 시험 기간 동안 환자는 동반 MTX, SSZ, 히드록시클로로퀸(HCQ), 저용량 경구 코르티코스테로이드(1일 최대 프레드니손 10mg에 해당) 및/또는 NSAIDs의 안정적인 용량을 계속 복용할 수 있었습니다. 세포독성 약물 또는 기타 생물학적 제제를 포함한 기타 DMARDs의 사용은 금지되었습니다.
주요 평가변수는 16주차에 강직성 척추염 평가(ASAS) 20 반응을 달성한 환자의 비율이었습니다.
Trial AS에서 AS 질병의 중앙값 기간은 2.8년이었고, 염증성 요통의 중앙값 기간은 8년이었으며, 90%가 HLA-B27 양성이었고, 8.2%가 이전에 관절 수술이나 시술을 받았고, 5.8%가 척추의 완전 강직이 있었고, 14%가 이전에 한 가지 생물학적 TNF 억제제(골리무맙 제외) 치료를 받았고 효능 부족 이외의 이유로 치료 첫 16주 이내에 중단되었으며(1차 실패), 76%가 과거에 최소 한 가지 DMARD를 투여받았습니다. 시험 기간 동안 동반 약물 사용은 NSAIDs(88%), SSZ(38%), 코르티코스테로이드(26%), MTX(18%) 및 HCQ(0.5%)였습니다.
임상 반응
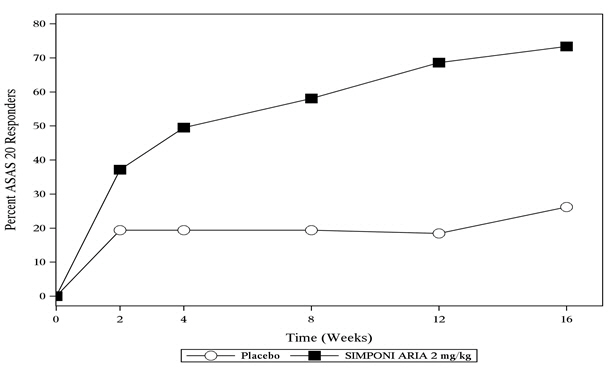
Trial AS에서 위약과 비교하여 SIMPONI ARIA 치료는 16주차에 ASAS 20 반응을 보인 환자의 비율로 나타낸 바와 같이 징후 및 증상의 유의미한 개선으로 이어졌습니다(
표 8 참조).
| 위약 N *=103 |
SIMPONI ARIA N *=105 |
치료 차이 (95% CI) |
|
|---|---|---|---|
| 참고: 이 분석은 치료 의도 집단을 기반으로 합니다. 부분적으로 누락된 데이터에는 마지막 관찰값을 전달했고, 완전히 누락된 데이터에는 비반응자 대입을 수행했습니다. | |||
| 반응자 | |||
| ASAS 20 | 26% | 73% | 47%
†
|
| ASAS 40 | 8.7% | 48% | 39% (28, 50) |
시험 AS에서 16주차까지 ASAS 20 반응을 달성한 환자의 비율은 그림 3에 나와 있습니다.
| 그림 3: 시험 AS – 16주차까지 ASAS 20 반응을 달성한 환자의 비율 | |
|
|
|
| 이 분석은 치료 의도 집단을 기반으로 합니다. 부분적으로 누락된 데이터에는 마지막 관찰값을 전달했고, 완전히 누락된 데이터에는 무반응값을 대입했습니다. | |
표 9는 시험 AS에서 SIMPONI ARIA군과 위약군의 ASAS 반응 기준 구성 요소 및 질병 활동의 다른 측정치의 개선 사항을 보여줍니다.
| 위약 N *=103 |
SIMPONI ARIA N *=105 |
|||
|---|---|---|---|---|
| 기준 | 기준 대비 16주차 변화 | 기준 | 기준 대비 16주차 변화 | |
| 참고: 모든 값은 평균입니다. | ||||
| ASAS 20 반응 기준 | ||||
| 환자 전반적 질병 활동 평가(0–100mm) | 71 | -8.3 | 73 | -34 |
| 요통(0–100mm) | 73 | -12 | 72 | -32 |
| BASFI (0–10) | 6.1 | -0.5 | 6.3 | -2.4 |
| 염증(0–10) | 7.4 | -1.1 | 7.3 | -3.6 |
| BASDAI 점수 | 7.1 | -1.1 | 7.1 | -3.1 |
| BASMI | 5.0 | -0.1 | 5.0 | -0.4 |
| hsCRP (mg/L) | 19 | -2.3 | 20 | -17 |
16주차에, SIMPONI ARIA로 치료받은 환자군에서 질병 활동도가 낮은 수준(<2 [0~10cm 척도에서])에 도달한 비율이 위약 치료 환자군에 비해 더 높았습니다 (16.2% 대 3.9%).
14.4 다관절 소아 특발성 관절염 (pJIA)
소아 pJIA 환자에서 SIMPONI ARIA의 효능은 약동학적 노출 및 RA 환자에서 SIMPONI ARIA의 확립된 효능의 외삽에 근거합니다. SIMPONI ARIA의 효능은 또한 MTX로 최소 2개월 이상 치료에도 불구하고 활동성 다관절염을 보이는 127명의 소아(2세~<18세)를 대상으로 한 다기관, 공개, 단일군 연구(Trial pJIA, NCT02277444)에서도 평가되었습니다. 연구 시작 시 다관절 JIA 환자 아형은 다음과 같습니다. 류마티스 인자 음성(43%), 류마티스 인자 양성(35%), 건염 관련 관절염(9%), 과소 관절 확장(6%), 소아 건선 관절염(4%), 전신 증상 없는 전신성 JIA(3%). 모든 환자는 0주차, 4주차, 그리고 52주차까지 8주마다 SIMPONI ARIA 80 mg/m
2를 정맥 주입으로 투여받았습니다. 환자들은 28주차까지 매주 안정적인 MTX 용량을 계속 투여받았습니다. 28주차 이후에는 MTX 용량 변경이 허용되었습니다. 효능은 52주차까지 보조적 평가변수로 평가되었습니다. 효능은 일반적으로 RA 환자의 반응과 일치했습니다.
16 제공/보관 및 취급 방법
SIMPONI ARIA
®(golimumab) 주사는 무색에서 옅은 노란색 용액이며, 1 바이알 NDC 57894-350-01 팩으로 제공됩니다.
Storage and Handling (보관 및 취급)
SIMPONI ARIA는 36ºF ~ 46ºF (2ºC ~ 8ºC)에서 냉장 보관하고 빛으로부터 보호하십시오. 사용 시까지 빛으로부터 보호하기 위해 원래 상자에 제품을 보관하십시오. 얼리지 마십시오. 흔들지 마십시오.
필요한 경우, SIMPONI ARIA는 빛으로부터 보호하기 위해 원래 상자에 담아 최대 30일 동안 실온 (77ºF/25ºC)에서 보관할 수 있습니다. SIMPONI ARIA를 실온에 보관한 후에는 냉장고에 다시 넣지 마십시오. 실온에서 30일 이내에 사용하지 않으면 SIMPONI ARIA를 폐기하십시오.
17 환자 상담 정보
See
FDA-approved patient labeling (Medication Guide).
SIMPONI ARIA의 잠재적 이점과 위험에 대해 환자에게 알리십시오. SIMPONI ARIA 치료를 시작하기 전에 환자에게 Medication Guide를 읽도록 지시하고 처방이 갱신될 때마다 읽도록 지시하십시오. (Advise patients of the potential benefits and risks of SIMPONI ARIA. Instruct patients to read the Medication Guide before starting SIMPONI ARIA therapy and to read it each time the prescription is renewed.)
감염 (Infections)
SIMPONI ARIA가 감염에 대항하는 면역 체계의 능력을 저하시킬 수 있음을 환자에게 알리십시오. 결핵, 침습성 진균 감염, B형 간염 재활성화 등 감염 증상이 나타나면 의사에게 연락하는 것이 중요함을 환자에게 알리십시오. (Inform patients that SIMPONI ARIA may lower the ability of their immune system to fight infections. Instruct the patient of the importance of contacting their doctor if they develop any symptoms of infection, including tuberculosis, invasive fungal infections, and hepatitis B reactivation.)
악성 종양 (Malignancies)
SIMPONI ARIA를 투여받는 동안 림프종 및 기타 악성 종양의 위험에 대해 환자에게 상담해야 합니다. 모든 환자, 특히 피부암 위험 요인이 있는 환자는 정기적인 피부 검사를 받는 것이 좋습니다. (Patients should be counseled about the risk of lymphoma and other malignancies while receiving SIMPONI ARIA. Periodic skin examination is recommended for all patients, particularly those with risk factors for skin cancer.)
기타 질환 (Other Medical Conditions)
울혈성 심부전, 탈수초성 질환, 자가면역 질환, 간 질환, 세포감소증 또는 건선과 같은 새롭거나 악화되는 질환의 징후가 나타나면 보고하도록 환자에게 알리십시오. (Advise patients to report any signs of new or worsening medical conditions such as congestive heart failure, demyelinating disorders, autoimmune diseases, liver disease, cytopenias, or psoriasis.)
예방 접종 (Vaccinations)
SIMPONI ARIA는 감염에 대항하는 면역 체계의 능력을 저하시킬 수 있으므로 생백신을 접종해서는 안 된다는 점을 환자에게 알리십시오. 임신 중에 SIMPONI ARIA를 투여받는 임산부에게는 출산 후 6개월 동안 영아에게 생백신을 접종해서는 안 된다는 점을 알리십시오. 임신 중에 SIMPONI ARIA를 투여받은 여성의 환자와 영아는 예방 접종을 받기 전에 의사와 상담하도록 권고하십시오. (Inform patients that because SIMPONI ARIA may lower the ability of their immune system to fight infections, they should avoid live vaccines. Inform pregnant patients receiving SIMPONI ARIA that their infants should not receive live vaccines for 6 months following the last infusion of SIMPONI ARIA during pregnancy. Advise patients and infants of women who received SIMPONI ARIA during pregnancy to consult a physician before receiving any immunizations.)
SPL 미분류 섹션
제조:
Janssen Biotech, Inc.
Horsham, PA 19044
US License No. 1864
© 2017, 2020 Janssen Pharmaceutical Companies
약물 정보 안내
| 의약품 안내서 SIMPONI ARIA ®( 심포니 아리아 ) |
|||
| SIMPONI ARIA에 대해 가장 중요한 정보는 무엇입니까? | |||
| SIMPONI ARIA는 면역 체계에 영향을 미치는 약물입니다. SIMPONI ARIA는 감염과 싸우는 면역 체계의 능력을 낮출 수 있습니다. 일부 사람들은 SIMPONI ARIA를 투여받는 동안 결핵(TB)을 포함한 심각한 감염과 신체 전체로 퍼지는 박테리아, 곰팡이 또는 바이러스에 의한 감염을 경험했습니다. 이러한 심각한 감염으로 사망한 사람들도 있습니다. | |||
|
|||
| 의사가 지시하지 않는 한 감염이 있는 경우 SIMPONI ARIA 투여를 시작해서는 안 됩니다. | |||
| SIMPONI ARIA 투여 전에 의사에게 알려야 할 사항은 다음과 같습니다. | |||
|
|||
|
|
||
|
|||
| SIMPONI ARIA 투여 후 감염 증상이 나타나면 즉시 의사에게 연락하십시오. SIMPONI ARIA는 감염에 걸릴 가능성을 높이거나 기존 감염을 악화시킬 수 있습니다. | |||
| 암 | |||
|
|||
| SIMPONI ARIA는 무엇입니까? | |||
SIMPONI ARIA는 TNF 차단제라고 하는 처방약입니다. SIMPONI ARIA는 다음 질환의 치료에 사용됩니다.
|
|||
| 2세 미만의 PsA 및 pJIA 어린이 또는 PsA 및 pJIA 이외의 질환이 있는 어린이에게 SIMPONI ARIA가 안전하고 효과적인지 여부는 알려져 있지 않습니다. | |||
| SIMPONI ARIA 치료를 시작하기 전에 의사에게 알려야 할 사항은 무엇입니까? | |||
| ”
SIMPONI ARIA에 대해 가장 중요한 정보는 무엇입니까?“를 참조하십시오. |
|||
| SIMPONI ARIA를 시작하기 전에 다음과 같은 모든 의학적 상태에 대해 의사에게 알리십시오. | |||
|
|||
| 복용하는 모든 약(처방약 및 일반의약품, 비타민 및 한약 포함)에 대해 의사에게 알려주십시오. | |||
| 특히, 다음과 같은 경우 의사에게 알려주십시오. | |||
|
|||
| 잘 모르는 경우 의사 또는 약사에게 이러한 약물 목록을 문의하십시오. | |||
| 새로운 약을 받을 때마다 의사와 약사에게 보여줄 수 있도록 모든 약물 목록을 가지고 다니십시오. | |||
| SIMPONI ARIA는 어떻게 투여받아야 합니까? | |||
|
|||
|
|||
|
|||
| SIMPONI ARIA의 가능한 부작용은 무엇입니까? | |||
| SIMPONI ARIA는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. | |||
| “”
SIMPONI ARIA에 대해 가장 중요한 정보는 무엇입니까?” |
|||
|
|||
|
|
||
|
|||
|
|
||
| 혈액 내 바이러스를 보유한 사람의 B형 간염 감염.B형 간염 바이러스(간에 영향을 미치는 바이러스) 보균자인 경우 SIMPONI ARIA를 사용하는 동안 바이러스가 활성화될 수 있습니다. 의사는 SIMPONI ARIA 치료를 시작하기 전과 치료 중에 혈액 검사를 실시해야 합니다. | |||
|
|||
|
|
||
| 심부전, 기존 심부전의 악화 또는 새로운 심부전은 SIMPONI ARIA를 포함한 TNF 차단제 약물을 사용하는 사람들에게 발생할 수 있습니다.SIMPONI ARIA를 사용 중에 새로운 심부전이 발생하거나 심부전이 악화되면 병원 치료가 필요할 수 있으며 사망에 이를 수도 있습니다. | |||
|
|||
| 신경계 문제.SIMPONI ARIA를 포함한 TNF 차단제 약물을 투여받는 사람들에게는 드물게 다발성 경화증이나 길랭-바레 증후군과 같은 신경계 문제가 발생할 수 있습니다. 다음 증상 중 하나라도 나타나면 즉시 의사에게 알리십시오. | |||
|
|
||
| 면역 체계 문제.TNF 차단제 약물을 투여받는 사람들에게는 드물게 루푸스 증상과 유사한 증상이 나타날 수 있습니다. 다음 증상 중 하나라도 나타나면 의사에게 알리십시오. | |||
|
|
||
| 간 문제.SIMPONI ARIA를 포함한 TNF 차단제 약물을 투여받는 사람들에게 간 문제가 발생할 수 있습니다. 이러한 문제는 간부전과 사망으로 이어질 수 있습니다. 다음 증상 중 하나라도 나타나면 즉시 의사에게 연락하십시오. | |||
|
|
||
| 혈액 문제.SIMPONI ARIA와 관련하여 혈구 감소가 관찰되었습니다. 감염과 싸우거나 출혈을 멈추는 데 도움이 되는 혈구가 충분히 생성되지 않을 수 있습니다. 증상으로는 발열, 쉽게 멍이 들거나 출혈, 창백 등이 있습니다. 의사는 SIMPONI ARIA 치료 전과 치료 중에 혈구 수를 확인할 것입니다. | |||
| 알레르기 반응.SIMPONI ARIA를 포함한 TNF 차단제 약물을 투여받는 사람들에게 알레르기 반응이 발생할 수 있습니다. 일부 반응은 심각하고 생명을 위협할 수 있습니다. 이러한 반응 중 일부는 SIMPONI ARIA 첫 투여 후 발생할 수 있습니다. 알레르기 반응 증상이 나타나면 즉시 의사에게 연락하십시오. | |||
|
|
||
| SIMPONI ARIA의 가장 흔한 부작용은 다음과 같습니다. | |||
|
|||
| 이것들은 SIMPONI ARIA의 모든 가능한 부작용이 아닙니다. | |||
| 귀찮거나 사라지지 않는 부작용에 대해서는 의사에게 알리십시오. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. 부작용은 FDA에 1-800-FDA-1088로 보고할 수 있습니다. | |||
| SIMPONI ARIA의 안전하고 효과적인 사용에 대한 일반 정보. | |||
| 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방되기도 합니다. | |||
| 의료 전문가를 위해 작성된 SIMPONI ARIA에 대한 정보는 의사 또는 약사에게 문의하십시오. | |||
| SIMPONI ARIA의 성분은 무엇입니까? | |||
| 활성 성분: golimumab. | |||
| 비활성 성분: L-히스티딘, L-히스티딘 일염산염 일수화물, 폴리소르베이트 80, 소르비톨 및 주사용수. SIMPONI ARIA는 방부제가 없으며 천연 고무 라텍스로 만들어지지 않았습니다. | |||
| 제조사: Janssen Biotech, Inc. Horsham, PA 19044 US License No. 1864 © 2017, 2020 Janssen Pharmaceutical Companies | |||
| 자세한 내용은 www.SIMPONIARIA.com을 방문하거나 1-800-JANSSEN(1-800-526-7736)으로 전화하십시오. | |||
| 이 의약품 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2020년 9월 | ||
주요 표시면 – 4mL 바이알 상자
NDC 57894-350-01
심포니 아리아
®
golimumab
50 mg/4 mL
(12.5 mg/mL)
정맥 주사용
1회용 바이알.
사용하지 않은 부분은 버리십시오.
처방전 의약품
동봉된 약물 사용 설명서를 각 환자에게 제공하십시오.