의약품 제조업체: AbbVie Inc. (Updated: 2024-04-26)
처방 정보 하이라이트
RINVOQ® (업다시티닙) 확장 방출 정제, 경구 투여용 RINVOQ® LQ (업다시티닙) 경구 용액
미국 최초 승인: 2019
경고: 심각한 감염, 사망, 악성 종양, 주요 심혈관계 사건(MACE) 및 혈전증
전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.
-
증가된 심각한 세균성, 진균성, 바이러스성 및 기회 감염 위험으로 인해 입원 또는 사망, 결핵(TB) 포함. 감염이 조절될 때까지 RINVOQ/RINVOQ LQ 치료를 중단하십시오. 심각한 감염이 발생하면 치료를 중단하십시오. 잠복성 TB를 치료 전과 치료 중에 검사하십시오. 잠복성 TB를 사용하기 전에 치료하십시오. 치료 중에 모든 환자를 활동성 TB에 대해 모니터링하십시오. 초기 음성, 잠복성 TB 검사를 받은 환자도 마찬가지입니다. (5.1)
-
류마티스 관절염(RA) 환자에서 다른 야누스 키나아제(JAK) 억제제와 비교하여 종양 괴사 인자(TNF) 차단제와 비교하여 모든 원인 사망률, 갑작스러운 심혈관 사망 포함이 더 높습니다. (5.2)
-
RINVOQ로 치료받은 환자에서 악성 종양이 발생했습니다. RA 환자에서 다른 JAK 억제제와 비교하여 TNF 차단제와 비교하여 림프종 및 폐암 발생률이 더 높습니다. (5.3)
-
RA 환자에서 다른 JAK 억제제와 비교하여 TNF 차단제와 비교하여 MACE(심혈관 사망, 심근 경색 및 뇌졸중으로 정의) 발생률이 더 높습니다. (5.4)
- RINVOQ로 치료받은 환자에서 혈전증이 발생했습니다. 다른 JAK 억제제와 비교하여 TNF 차단제와 비교하여 폐색전증, 정맥 및 동맥 혈전증 발생률이 증가했습니다. (5.5)
처방 정보 주요 사항
RINVOQ/RINVOQ LQ는 Janus kinase (JAK) 억제제입니다.
- RINVOQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 류마티스 관절염 성인 환자의 치료에 사용됩니다. (1.1)
사용 제한
RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.1) - RINVOQ/RINVOQ LQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 활동성 건선성 관절염 성인 및 2세 이상 소아 환자의 치료에 사용됩니다. (1.2)
사용 제한
RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.2) - RINVOQ는 생물학적 제제를 포함한 다른 전신 약물로 질병이 적절히 조절되지 않거나 해당 치료법의 사용이 부적절한 난치성 중등도에서 중증의 아토피 피부염 12세 이상 성인 및 소아 환자의 치료에 사용됩니다. (1.3)
사용 제한
RINVOQ는 다른 JAK 억제제, 생물학적 면역 조절제 또는 다른 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.3) - RINVOQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 궤양성 대장염 성인 환자의 치료에 사용됩니다. (1.4)
사용 제한
RINVOQ는 다른 JAK 억제제, 궤양성 대장염에 대한 생물학적 치료 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.4) - RINVOQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 크론병 성인 환자의 치료에 사용됩니다. (1.5)
사용 제한
RINVOQ는 다른 JAK 억제제, 크론병에 대한 생물학적 치료 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.5) - RINVOQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 활동성 강직성 척추염 성인 환자의 치료에 사용됩니다. (1.6)
사용 제한
RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.6) - RINVOQ는 TNF 억제제 치료에 대한 반응이 불충분하거나 내약성이 없는 염증의 객관적인 징후가 있는 활동성 비방사선성 축성 척추 관절염 성인 환자의 치료에 사용됩니다. (1.7)
사용 제한
RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.7) - RINVOQ/RINVOQ LQ는 하나 이상의 TNF 억제제에 대한 반응이 불충분하거나 내약성이 없는 활동성 다관절 소아 특발성 관절염 2세 이상 환자의 치료에 사용됩니다. (1.8)
사용 제한
RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역 억제제와 병용하여 사용하는 것은 권장되지 않습니다. (1.8)
투여 및 관리
- RINVOQ LQ 경구 용액은 RINVOQ 서방형 정제와 교체할 수 없습니다. (2.2, 2.10).
- RINVOQ LQ 경구 용액과 RINVOQ 서방형 정제 간의 변경은 의료 서비스 제공자에 의해 이루어져야 합니다.
- 치료 전에 예방 접종을 업데이트하고 활동성 및 잠복성 결핵, 바이러스성 간염, 간 기능 및 임신 상태를 평가하는 것을 고려하십시오. (2.1)
- 절대 림프구 수가 500 cells/mm3 미만, 절대 호중구 수가 1000 cells/mm3 미만 또는 헤모글로빈 수준이 8 g/dL 미만인 경우 RINVOQ/RINVOQ LQ의 투여를 시작하거나 중단하십시오. (2.1, 2.13)
류마티스 관절염, 강직성 척추염 및 비방사선성 축성 척추 관절염
건선성 관절염
아토피 피부염
-
12세 이상 체중 40kg 이상 소아 환자 및 65세 미만 성인: RINVOQ 15mg을 1일 1회 경구 투여로 치료를 시작합니다. 적절한 반응이 나타나지 않으면 1일 1회 경구 투여량을 30mg으로 증량하는 것을 고려합니다. (2.5)
- 65세 이상 성인: RINVOQ의 권장 용량은 1일 1회 15mg입니다. (2.5)
- 중증 신장애: RINVOQ의 권장 용량은 1일 1회 15mg입니다. (2.11)
궤양성 대장염
- 성인: RINVOQ의 권장 유도 용량은 8주 동안 1일 1회 45mg입니다. RINVOQ의 권장 유지 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위 질환 환자의 경우 1일 1회 30mg의 유지 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다. (2.6)
- 신장애 또는 간장애 환자의 권장 용량 및 약물 상호 작용으로 인한 용량 조절에 대한 자세한 내용은 전체 처방 정보를 참조하십시오. (2.11, 2.12)
크론병
- 성인: RINVOQ의 권장 유도 용량은 12주 동안 1일 1회 45mg입니다. RINVOQ의 권장 유지 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위 질환 환자의 경우 1일 1회 30mg의 유지 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다. (2.7)
- 신장애 또는 간장애 환자의 권장 용량 및 약물 상호 작용으로 인한 용량 조절에 대한 자세한 내용은 전체 처방 정보를 참조하십시오. (2.11, 2.12)
다관절 소아 특발성 관절염
- 권장 용량은 체중을 기준으로 합니다. (2.10)
금기 사항
업다시티닙 또는 RINVOQ/RINVOQ LQ의 어떤 성분에 대해서도 알려진 과민증. (4, 5.6)
처방 정보 주요 사항
- 중증 감염: 활동성 중증 감염(국소 감염 포함)이 있는 환자에게는 사용하지 마십시오. (5.1)
- 과민 반응: 중증 과민 반응(예: 아나필락시스)이 보고되었습니다. 중증 과민 반응이 발생하면 투약을 중단하십시오. (5.6)
- 위장관 (GI) 천공: 위장관 천공 위험이 있는 환자를 모니터링하고 증상이 있는 환자는 즉시 평가하십시오. (5.7)
- 검사실 이상: 림프구, 호중구, 헤모글로빈, 간 효소 및 지질의 잠재적인 변화로 인해 모니터링이 권장됩니다. (5.8)
- 태아 독성: 동물 연구에 따르면 태아에 해를 끼칠 수 있습니다. 임신 가능성이 있는 여성 환자에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임을 사용하도록 조언하십시오. (5.9, 8.1, 8.3)
- 예방 접종: 생백신과 함께 사용하지 마십시오. (5.10)
- 변에서 약물 잔여물: 위장관 통과 시간이 단축된 환자의 변이나 장루 배출물에서 관찰되었습니다. 임상적으로 환자를 모니터링하고 치료 반응이 불충분하면 대체 치료를 고려하십시오. (5.11)
부작용
- 류마티스 관절염, 건선성 관절염, 강직성 척추염, 및 비방사선성 축성 척추관절염: 부작용(≥ 1%)은 다음과 같습니다. 상기도 감염, 대상포진, 단순 포진, 기관지염, 메스꺼움, 기침, 발열, 여드름, 두통. (6.1)
- 아토피성 피부염: 부작용(≥ 1%)은 다음과 같습니다. 상기도 감염, 여드름, 단순 포진, 두통, 혈중 크레아틴 인산화효소 증가, 기침, 과민 반응, 모낭염, 메스꺼움, 복통, 발열, 체중 증가, 대상포진, 인플루엔자, 피로, 호중구 감소증, 근육통, 인플루엔자 유사 질환. (6.1)
- 궤양성 대장염: 유도 또는 유지 요법 중 보고된 부작용(≥ 5%)은 다음과 같습니다. 상기도 감염, 혈중 크레아틴 인산화효소 증가, 여드름, 호중구 감소증, 간 효소 상승, 발진. (6.1)
- 크론병: 유도 또는 유지 요법 중 보고된 부작용(≥ 5%)은 다음과 같습니다. 상기도 감염, 빈혈, 발열, 여드름, 대상포진, 두통. (6.1)
의심되는 부작용을 보고하려면 AbbVie Inc.에 1-800-633-9110 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
특정 인구 집단에서의 사용
환자 상담 정보 및 약물 안내서에 대한 자세한 내용은 17을 참조하십시오.
개정: 2024년 4월
목차
전문 정보: 내용*
경고: 심각한 감염, 사망, 악성 종양, 주요 심혈관계 사건 및 혈전증
1 적응증 및 사용법
1.1 류마티스 관절염
1.2 건선성 관절염
1.3 아토피 피부염
1.4 궤양성 대장염
1.5 크론병
1.6 강직성 척추염
1.7 비방사선성 축상 척추 관절염
1.8 다관절형 소아 특발성 관절염
2 용법 및 용량
2.1 치료 시작 전 권장 평가 및 예방 접종
2.2 중요한 투여 지침
2.3 류마티스 관절염에 권장되는 용량
2.4 건선성 관절염에 권장되는 용량
2.5 아토피 피부염에 권장되는 용량
2.6 궤양성 대장염에 권장되는 용량
2.7 크론병에 권장되는 용량
2.8 강직성 척추염에 권장되는 용량
2.9 비방사선성 축상 척추 관절염에 권장되는 용량
2.10 다관절형 소아 특발성 관절염에 권장되는 용량
2.11 신장애 또는 간장애 환자에 권장되는 용량
2.12 약물 상호 작용으로 인한 용량 조절
2.13 용량 중단
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 심각한 감염
5.2 사망
5.3 악성 종양 및 림프 증식성 질환
5.4 주요 심혈관계 사건
5.5 혈전증
5.6 과민 반응
5.7 위장관 천공
5.8 실험실 검사 이상
5.9 태아 독성
5.10 예방 접종s
5.11 대변 내 약물 잔류물
6 이상 반응
6.1 임상 시험 경험
7 약물 상호 작용
7.1 강력한 CYP3A4 억제제
7.2 강력한 CYP3A4 유도제
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 류마티스 관절염
14.2 건선성 관절염
14.3 아토피 피부염
14.4 궤양성 대장염
14.5 크론병
14.6 강직성 척추염
14.7 비방사선성 축성 척추 관절염
14.8 다관절형 소아 특발성 관절염
16 포장/보관 및 취급
17 환자 상담 정보
-
*
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
경고 사항
경고: 심각한 감염, 사망, 악성 종양, 주요 심혈관계 사건 및 혈전증
심각한 감염
RINVOQ/RINVOQ LQ로 치료받은 환자는 입원 또는 사망으로 이어질 수 있는 심각한 감염 위험이 증가합니다. [경고 및 주의 사항 (5.1), 이상 반응 (6.1)] 이러한 감염이 발생한 환자 대부분은 메토트렉세이트 또는 코르티코스테로이드와 같은 면역 억제제를 병용했습니다.
심각한 감염이 발생하면 감염이 조절될 때까지 RINVOQ/RINVOQ LQ를 중단하십시오.
보고된 감염에는 다음이 포함됩니다.
-
폐 또는 폐 외 질환으로 나타날 수 있는 활동성 결핵. 환자는 RINVOQ/RINVOQ LQ 사용 전과 치료 중에 잠복 결핵 검사를 받아야 합니다. RINVOQ/RINVOQ LQ 사용 전에 잠복 감염 치료를 고려해야 합니다.
-
크립토코쿠스증 및 폐렴구균증을 포함한 침윤성 진균 감염.
-
박테리아, 바이러스(대상포진 포함) 및 기타 기회 감염균으로 인한 감염.
만성 또는 재발성 감염이 있는 환자의 경우 RINVOQ/RINVOQ LQ 치료의 위험과 이점을 신중하게 고려해야 합니다.
환자는 RINVOQ/RINVOQ LQ 치료 중 및 후에 감염의 징후와 증상(치료 시작 전에 잠복 결핵 감염 검사에서 음성 판정을 받은 환자에서 결핵 발생 가능성 포함)이 나타나는지 면밀히 모니터링해야 합니다. [경고 및 주의 사항 (5.1)]
사망
심혈관 위험 요인이 하나 이상 있는 50세 이상의 류마티스 관절염(RA) 환자를 대상으로 한 대규모 무작위 배정 후시판매 안전성 연구에서 다른 JAK 억제제를 종양 괴사 인자(TNF) 차단제와 비교한 결과, JAK 억제제에서 모든 원인 사망(돌연 심장 사망 포함) 비율이 더 높았습니다. [경고 및 주의 사항 (5.2)].
악성 종양
RINVOQ로 치료받은 환자에서 림프종 및 기타 악성 종양이 관찰되었습니다. 다른 JAK 억제제로 치료받은 RA 환자에서 TNF 차단제와 비교했을 때 악성 종양(비흑색종 피부암(NMSC) 제외) 발생률이 더 높았습니다. 현재 또는 과거 흡연자는 추가적으로 위험이 증가합니다. [경고 및 주의 사항 (5.3)].
주요 심혈관계 사건
심혈관 위험 요인이 하나 이상 있는 50세 이상의 RA 환자에서 다른 JAK 억제제로 치료받은 경우, TNF 차단제와 비교했을 때 주요 심혈관계 사건(MACE)(심혈관 사망, 심근 경색 및 뇌졸중으로 정의) 발생률이 더 높았습니다. 현재 또는 과거 흡연자는 추가적으로 위험이 증가합니다. 심근 경색 또는 뇌졸중을 경험한 환자는 RINVOQ/RINVOQ LQ를 중단하십시오. [경고 및 주의 사항 (5.4)].
혈전증
심각한 염증성 질환 치료에 사용되는 JAK 억제제로 치료받은 환자에서 심부 정맥 혈전증, 폐색전증 및 동맥 혈전증을 포함한 혈전증이 발생했습니다. 이러한 이상 반응 중 상당수는 심각했으며 일부는 사망으로 이어졌습니다. RA 환자 50세 이상의 심혈관 위험 요인이 하나 이상 있는 환자에서 다른 JAK 억제제로 치료받은 경우, TNF 차단제와 비교했을 때 혈전증 발생률이 더 높았습니다. 위험이 있는 환자는 RINVOQ/RINVOQ LQ를 피하십시오. 혈전증 증상이 있는 환자는 RINVOQ/RINVOQ LQ를 중단하고 즉시 평가를 받아야 합니다. [경고 및 주의 사항 (5.5)].
1 적응증 및 용법
1.1 류마티스 관절염
RINVOQ®는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 류마티스 관절염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 질병 조절 항류마티스제(DMARDs) 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.2 건선성 관절염
RINVOQ/RINVOQ LQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 만 2세 이상의 소아 환자 및 성인의 활동성 건선성 관절염 치료에 사용됩니다.
● 사용 제한: RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.3 아토피 피부염
RINVOQ는 생물학적 제제를 포함한 다른 전신 약물로 질환이 적절하게 조절되지 않거나 이러한 치료법을 사용하는 것이 권장되지 않는, 난치성의 중등증에서 중증의 아토피 피부염을 앓고 있는 만 12세 이상의 소아 환자 및 성인의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 면역 조절제 또는 다른 면역억제제와 병용하지 않는 것이 좋습니다.
1.4 궤양성 대장염
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 궤양성 대장염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 궤양성 대장염에 대한 생물학적 치료법 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.5 크론병
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 크론병 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 크론병에 대한 생물학적 치료법 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.6 강직성 척추염
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 활동성 강직성 척추염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.7 방사선 비관찰적 축성 척추관절염
RINVOQ는 TNF 차단제 치료에 대한 반응이 불충분하거나 내약성이 없는 객관적인 염증 징후가 있는 활동성 방사선 비관찰적 축성 척추관절염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.8 다관절 소아 특발성 관절염
RINVOQ/RINVOQ LQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 만 2세 이상의 활동성 다관절 소아 특발성 관절염(pJIA) 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
2. 용량 및 투여
2.1 치료 시작 전 권장 평가 및 예방 접종
RINVOQ/RINVOQ LQ 치료 시작 전에 다음 평가를 고려하십시오.
● 활동성 및 잠복 결핵(TB) 감염 평가 – 양성인 경우 RINVOQ/RINVOQ LQ 사용 전에 결핵을 치료하십시오 [경고 및 주의 사항 (5.1)].
● 임상 지침에 따라 바이러스성 간염 검사 – 활동성 B형 간염 또는 C형 간염이 있는 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [경고 및 주의 사항 (5.1)].
● 완전 혈구 수 – 절대 림프구 수가 500 cells/mm3 미만, 절대 호중구 수가 1000 cells/mm3 미만 또는 헤모글로빈 수치가 8 g/dL 미만인 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [용법 및 용량 (2.13) 및 경고 및 주의 사항 (5.8)].
● 기준 간 기능: 중증 간 기능 장애(Child-Pugh C)가 있는 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [특정 환자군에서의 사용 (8.7) 및 임상 약리 (12.3)].
● 임신 상태: 치료 시작 전에 임신 가능성이 있는 여성의 임신 상태를 확인하십시오 [경고 및 주의 사항 (5.9) 및 특정 환자군에서의 사용 (8.1, 8.3)].
현재 예방 접종 지침에 따라 예방 접종을 업데이트하십시오 [경고 및 주의 사항 (5.10)].
2.2 중요한 투약 지침
● RINVOQ LQ 경구 용액은 RINVOQ 서방형 정제와 교체할 수 없습니다 [용법 및 용량 (2.4, 2.10)].
● RINVOQ LQ 경구 용액과 RINVOQ 서방형 정제 간의 변경은 의료 서비스 제공자가 해야 합니다.
● RINVOQ/RINVOQ LQ는 음식과 함께 또는 음식 없이 경구로 복용해야 합니다 [임상 약리 (12.3)].
● RINVOQ 정제는 통째로 삼켜야 합니다. RINVOQ 정제는 분할, 분쇄 또는 씹어서는 안 됩니다.
● RINVOQ LQ는 제공된 눌러서 끼우는 병 어댑터와 경구 투약 주사기를 사용하여 투여해야 합니다 [사용 지침 참조].
2.4 건선성 관절염에서의 권장 용량
2세 이상 18세 미만 소아 환자
권장 용량은 체중을 기준으로 합니다(표 1).
표 1: 건선성 관절염이 있는 2세 이상 18세 미만 소아 환자를 위한 RINVOQ/RINVOQ LQ 용량
환자 체중
RINVOQ LQ
RINVOQ
10kg 미만 20kg
하루 두 번 3mg(경구 용액 3mL)
권장하지 않음
20kg 미만 30kg
하루 두 번 4mg(경구 용액 4mL)
권장하지 않음
30kg 이상
하루 두 번 6mg(경구 용액 6mL)
하루 1회 15mg(15mg 정제 1정)
2.1 투여 및 관리
RINVOQ LQ 경구용액은 RINVOQ 서방형 정제와 교체할 수 없습니다. RINVOQ LQ 경구용액과 RINVOQ 서방형 정제 간의 변경은 의료 서비스 제공자에 의해 이루어져야 합니다.
18세 이상 성인
RINVOQ의 권장 용량은 1일 1회 15mg입니다.
2.5 아토피 피부염에서의 권장 용량
체중이 40kg 이상인 12세 이상 소아 환자 및 65세 미만 성인
RINVOQ 1일 1회 15mg으로 치료를 시작합니다. 적절한 반응이 나타나지 않으면 용량을 1일 1회 30mg으로 증량하는 것을 고려합니다. 30mg 용량으로 적절한 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
65세 이상 성인
RINVOQ의 권장 용량은 1일 1회 15mg입니다.
2.6 궤양성 대장염에서의 권장 용량
성인 환자: 유도
RINVOQ의 권장 유도 용량은 8주 동안 1일 1회 45mg입니다.
성인 환자: 유지
RINVOQ의 권장 유지 치료 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위한 질환이 있는 환자의 경우 1일 1회 30mg 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
2.7 크론병에서의 권장 용량
성인 환자: 유도
RINVOQ의 권장 유도 용량은 12주 동안 1일 1회 45mg입니다.
성인 환자: 유지
RINVOQ의 권장 유지 치료 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위한 질환이 있는 환자의 경우 1일 1회 30mg 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
2.10 다관절형 소아 특발성 관절염에서의 권장 용량
권장 용량은 체중을 기반으로 합니다(표 2).
표 2: pJIA 환자(2세 이상)에 대한 RINVOQ/RINVOQ LQ 용량
환자 체중
RINVOQ LQ
RINVOQ
10kg 이상 20kg 미만
1일 2회 3mg(3mL 경구용액)
권장하지 않음
20kg 이상 30kg 미만
1일 2회 4mg(4mL 경구용액)
권장하지 않음
30kg 이상
1일 2회 6mg(6mL 경구용액)
1일 1회 15mg(15mg 정제 1정)
2.11 신장애 또는 간장애 환자에서의 권장 용량
신장애
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염:
● 경증, 중등증 또는 중증 신장애 환자의 경우 용량 조절이 필요하지 않습니다.
아토피 피부염:
● 중증 신장애 환자 [추정 사구체 여과율 (eGFR) 15~< 30 mL/min/1.73m2]의 경우 RINVOQ의 권장 용량은 1일 1회 15mg입니다 [특정 집단에서의 사용 (8.6) 참조].
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
궤양성 대장염:
● 중증 신장애 환자 (eGFR 15~< 30 mL/min/1.73m2)의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 8주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
크론병:
● 중증 신장애 환자 (eGFR 15~< 30 mL/min/1.73m2)의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
간장애
RINVOQ/RINVOQ LQ는 중증 간장애 환자 (Child-Pugh C)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.7) 참조].
류마티스 관절염, 건선성 관절염, 아토피 피부염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염:
경증 또는 중등증 간장애 환자 (Child-Pugh A 또는 B)의 경우 용량 조절이 필요하지 않습니다.
궤양성 대장염:
경증에서 중등증 간장애 (Child-Pugh A 또는 B) 환자의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
-
유도: 8주 동안 1일 1회 30mg
-
유지: 1일 1회 15mg
크론병:
경증에서 중등증 간장애 (Child-Pugh A 또는 B) 환자의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
2.12 약물 상호 작용으로 인한 용량 조절
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염
강력한 CYP3A4 억제제를 투여받는 환자의 경우 용량 조절이 필요하지 않습니다 [약물 상호 작용 (7.1) 참조].
아토피 피부염
강력한 CYP3A4 억제제를 투여받는 환자의 경우 RINVOQ의 권장 용량은 1일 1회 15mg입니다 [약물 상호 작용 (7.1) 참조].
궤양성 대장염
강력한 CYP3A4 억제제를 투여받는 궤양성 대장염 환자에서 RINVOQ의 권장 용량은 다음과 같습니다 [약물 상호 작용 (7.1)]:
-
유도: 8주 동안 1일 1회 30mg
-
유지: 1일 1회 15mg
크론병
강력한 CYP3A4 억제제를 투여받는 크론병 환자에서 RINVOQ의 권장 용량은 다음과 같습니다 [약물 상호 작용 (7.1)]:
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
2.13 용량 중단
감염
환자가 심각한 감염, 심각한 기회 감염을 포함하여 발생하는 경우, 감염이 조절될 때까지 RINVOQ/RINVOQ LQ 치료를 중단합니다 [경고 및 주의 사항 (5.1)].
실험실 검사 이상
표 3에 설명된 바와 같이 실험실 검사 이상을 관리하기 위해 투약을 중단해야 할 수 있습니다 [경고 및 주의 사항 (5.8)].
표 3: 실험실 검사 이상에 대한 권장 용량 중단
실험실 측정
조치
절대 호중구 수 (ANC)
ANC가 1000 cells/mm3 미만인 경우 치료를 중단합니다. ANC가 이 값을 초과하면 치료를 재개할 수 있습니다.
절대 림프구 수 (ALC)
ALC가 500 cells/mm3 미만인 경우 치료를 중단합니다. ALC가 이 값을 초과하면 치료를 재개할 수 있습니다.
헤모글로빈 (Hb)
Hb가 8 g/dL 미만인 경우 치료를 중단합니다. Hb가 이 값을 초과하면 치료를 재개할 수 있습니다.
간 transaminases
약물 유발성 간 손상이 의심되는 경우, 이 진단이 배제될 때까지 치료를 중단합니다.
3가지 제형 및 함량
RINVOQ 연장 방출 정제 :
- 15mg upadacitinib : 보라색, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a15’가 음각으로 새겨져 있습니다.
- 30mg upadacitinib : 빨간색, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a30’가 음각으로 새겨져 있습니다.
- 45mg upadacitinib : 노란색에서 비늘 모양의 노란색까지의 색상, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a45’가 음각으로 새겨져 있습니다.
RINVOQ LQ 경구용 용액 :
- 1mg/mL upadacitinib ; 투명, 무색에서 옅은 노란색 용액, 180mL 병에 담겨 있습니다.
4 금기 사항
RINVOQ/RINVOQ LQ는 업다시티닙 또는 그 첨가제에 대한 과민 반응이 있는 환자에게는 금기입니다 [경고 및 주의 사항 (5.6)].
5. 경고 및 주의 사항
5.1 심각한 감염
RINVOQ를 투여받은 환자에서 심각하고 때로는 치명적인 감염이 보고되었습니다. RINVOQ와 관련하여 보고된 가장 흔한 심각한 감염에는 폐렴과 봉와직염이 포함되었습니다 [부작용 (6.1)]. 기회 감염 중 결핵, 다발성 피부 포진, 구강/식도 칸디다증 및 크립토코쿠스증이 RINVOQ와 관련하여 보고되었습니다. RINVOQ 30mg에서 RINVOQ 15mg에 비해 심각한 감염 발생률이 더 높았습니다.
활동성 심각한 감염(국소 감염 포함)이 있는 환자에게는 RINVOQ/RINVOQ LQ를 사용하지 마십시오. 다음 환자의 경우 RINVOQ/RINVOQ LQ를 시작하기 전에 치료의 위험과 이점을 고려하십시오.
- 만성 또는 재발성 감염이 있는 환자
- 결핵에 노출된 환자
- 심각한 감염 또는 기회 감염의 병력이 있는 환자
- 결핵이 풍토병인 지역에 거주하거나 여행한 환자 또는
- 감염에 취약하게 만드는 기저 질환이 있는 환자.
RINVOQ/RINVOQ LQ 치료 중 및 치료 후에 감염의 징후와 증상이 나타나는지 환자를 면밀히 모니터링하십시오. 환자에게 심각한 감염 또는 기회 감염이 발생하면 RINVOQ/RINVOQ LQ를 중단하십시오.
RINVOQ/RINVOQ LQ 치료 중에 새로운 감염이 발생하는 환자는 면역 저하 환자에게 적합한 신속하고 완전한 진단 검사를 받아야 합니다. 적절한 항균 요법을 시작하고 환자를 면밀히 모니터링해야 하며, 환자가 항균 요법에 반응하지 않으면 RINVOQ/RINVOQ LQ를 중단해야 합니다. 감염이 조절되면 RINVOQ/RINVOQ LQ를 재개할 수 있습니다.
결핵
RINVOQ/RINVOQ LQ를 투여하기 전에 환자를 대상으로 잠복 결핵(TB) 감염 및 활동성 결핵 감염을 평가하고 검사하십시오. 잠복 TB가 있는 환자는 RINVOQ/RINVOQ LQ를 시작하기 전에 표준 항결핵 요법을 받아야 합니다. 활동성 TB가 있는 환자에게는 RINVOQ/RINVOQ LQ를 투여해서는 안 됩니다. 이전에 치료받지 않은 잠복 TB가 있는 환자 또는 적절한 치료 과정을 확인할 수 없는 활동성 TB가 있는 환자, 그리고 잠복 TB에 대한 검사 결과가 음성이지만 TB 감염 위험 요인이 있는 환자의 경우 RINVOQ/RINVOQ LQ를 시작하기 전에 항결핵 요법을 고려하십시오.
개별 환자에게 항결핵 요법을 시작하는 것이 적절한지 여부를 결정하는 데 도움이 되도록 결핵 치료 전문의와 상담하는 것이 좋습니다.
RINVOQ/RINVOQ LQ를 사용하는 동안, 치료를 시작하기 전에 잠복 TB 감염에 대한 검사 결과가 음성인 환자를 포함하여 환자를 대상으로 결핵의 징후와 증상이 나타나는지 모니터링하십시오.
바이러스재활성화
RINVOQ 임상 시험에서 헤르페스 바이러스 재활성화(예: 대상 포진) 및 B형 간염 바이러스 재활성화를 포함한 바이러스 재활성화가 보고되었습니다 [부작용 (6.1)]. 일본에서 RINVOQ로 치료받은 환자의 경우 대상 포진 위험이 더 높은 것으로 나타났습니다. 환자에게 대상 포진이 발생하면 증상이 해결될 때까지 RINVOQ/RINVOQ LQ를 일시적으로 중단하는 것을 고려하십시오.
RINVOQ/RINVOQ LQ 치료를 시작하기 전과 치료 중에 바이러스성 간염 검사를 실시하고 재활성화를 모니터링해야 합니다. C형 간염 항체 및 C형 간염 바이러스 RNA가 양성인 환자는 임상 시험에서 제외되었습니다. B형 간염 표면 항원 또는 B형 간염 바이러스 DNA가 양성인 환자는 임상 시험에서 제외되었습니다. 그러나 RINVOQ의 3상 임상 시험에 등록된 환자에서 B형 간염 재활성화 사례가 여전히 보고되었습니다. RINVOQ/RINVOQ LQ를 투여받는 동안 B형 간염 바이러스 DNA가 검출되면 간 전문의와 상담해야 합니다.
5.2 사망률
심혈관 위험 요인이 하나 이상 있는 50세 이상의 RA 환자를 대상으로 한 또 다른 JAK 억제제에 대한 대규모 무작위 배정 후 시판 후 안전성 연구에서 JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 모든 원인 사망률(돌연 심혈관 사망 포함)이 더 높은 것으로 나타났습니다.
RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에 개별 환자의 이점과 위험을 고려하십시오.
5.3 악성 종양 및 림프 증식성 질환
RINVOQ 임상 시험에서 림프종을 포함한 악성 종양이 관찰되었습니다 [부작용 (6.1)].
RA 환자를 대상으로 한 또 다른 JAK 억제제에 대한 대규모 무작위 배정 후 시판 후 안전성 연구에서 JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 악성 종양(비흑색종 피부암 제외) 발생률이 더 높은 것으로 나타났습니다. JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 림프종 발생률이 더 높은 것으로 나타났습니다. JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 현재 또는 과거 흡연자의 경우 폐암 발생률이 더 높은 것으로 나타났습니다. 이 연구에서 현재 또는 과거 흡연자는 전체 악성 종양 위험이 추가로 증가했습니다.
특히 알려진 악성 종양(성공적으로 치료된 비흑색종 피부암 제외)이 있는 환자, 치료 중에 악성 종양이 발생하는 환자, 현재 또는 과거 흡연자인 환자의 경우 RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에 개별 환자의 이점과 위험을 고려하십시오.
비흑색종 피부암
RINVOQ로 치료받은 환자에서 비흑색종 피부암이 보고되었습니다. 피부암 위험이 높은 환자는 정기적으로 피부 검사를 받는 것이 좋습니다.
보호 의복을 착용하고 광범위 자외선 차단제를 사용하여 햇빛과 자외선에 대한 노출을 제한해야 합니다.
5.4 주요 심혈관계 이상 사례
RA 환자에서 다른 JAK 억제제에 대한 대규모 무작위 배정, 시판 후 안전성 연구에서 심혈관계 위험 요인이 하나 이상 있는 50세 이상의 환자에서 심혈관계 사망, 비치명적 심근 경색(MI) 및 비치명적 뇌졸중으로 정의된 주요 심혈관계 이상 사례(MACE) 발생률이 TNF 억제제로 치료받은 환자에 비해 더 높았습니다. 현재 흡연자 또는 과거 흡연자는 추가적으로 위험이 증가합니다.
RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에, 특히 현재 흡연자 또는 과거 흡연자 및 다른 심혈관계 위험 요인이 있는 환자의 경우 개별 환자에 대한 이점과 위험을 고려하십시오. 환자는 심각한 심혈관계 이상 사례의 증상과 발생 시 취해야 할 조치에 대해 알려야 합니다. 심근 경색 또는 뇌졸중을 경험한 환자는 RINVOQ/RINVOQ LQ를 중단하십시오.
5.5 혈전증
심부 정맥 혈전증(DVT), 폐색전증(PE) 및 동맥 혈전증을 포함한 혈전증이 RINVOQ를 포함한 JAK 억제제로 염증성 질환을 치료받은 환자에서 발생했습니다. 이러한 이상 사례 중 상당수는 심각했으며 일부는 사망으로 이어졌습니다.
RA 환자에서 다른 JAK 억제제에 대한 대규모 무작위 배정, 시판 후 안전성 연구에서 심혈관계 위험 요인이 하나 이상 있는 50세 이상의 환자에서 전체 혈전증, DVT 및 PE 발생률이 TNF 억제제로 치료받은 환자에 비해 더 높았습니다.
혈전증 증상이 나타나면 환자는 RINVOQ/RINVOQ LQ를 중단하고 즉시 평가를 받아 적절한 치료를 받아야 합니다. 혈전증 위험이 높을 수 있는 환자는 RINVOQ/RINVOQ LQ를 피하십시오.
5.6 과민 반응
임상 시험에서 RINVOQ를 투여받은 환자에서 아나필락시스 및 안지오에데마와 같은 심각한 과민 반응이 보고되었습니다. 임상적으로 유의미한 과민 반응이 발생하면 RINVOQ/RINVOQ LQ를 중단하고 적절한 치료를 시작하십시오 [이상 반응 (6.1)].
5.7 위장 천공
RINVOQ 임상 시험에서 위장 천공이 보고되었습니다 [이상 반응 (6.1)].
위장 천공 위험이 있는 환자(예: 과거에 맹장염 병력이 있는 환자 및 NSAID 또는 코르티코스테로이드를 동시에 복용하는 환자)는 RINVOQ/RINVOQ LQ로 치료받는 환자를 모니터링하십시오. 위장 천공을 조기에 발견하기 위해 새롭게 발생한 복통을 보이는 환자를 즉시 평가하십시오.
5.8 검사실 이상
호중구 감소증
RINVOQ 치료는 호중구 감소증(ANC 1000개/mm3 미만) 발생률 증가와 관련이 있었습니다.
기준선에서 호중구 수를 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 호중구 수가 낮은 환자(즉, ANC 1000개/mm3 미만)는 RINVOQ/RINVOQ LQ 투여를 피하고 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
림프구 감소증
임상 시험에서 RINVOQ로 치료받은 환자에서 ALC 500개/mm3 미만이 보고되었습니다.
기준선에서 림프구 수를 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 림프구 수가 낮은 환자(즉, 500개/mm3 미만)는 RINVOQ/RINVOQ LQ 투여를 피하거나 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
빈혈
임상 시험에서 RINVOQ로 치료받은 환자에서 헤모글로빈 수치가 8g/dL 미만으로 감소했습니다.
기준선에서 헤모글로빈을 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 헤모글로빈 수치가 낮은 환자(즉, 8g/dL 미만)는 RINVOQ/RINVOQ LQ 투여를 피하거나 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
지질
RINVOQ 치료는 총 콜레스테롤, 저밀도 지단백(LDL) 콜레스테롤 및 고밀도 지단백(HDL) 콜레스테롤을 포함한 지질 매개변수 증가와 관련이 있었습니다 [이상 반응 (6.1)]. 스타틴 요법에 대한 반응으로 LDL 콜레스테롤 상승은 치료 전 수준으로 감소했습니다. 이러한 지질 매개변수 상승이 심혈관계 질환의 발병률 및 사망률에 미치는 영향은 밝혀지지 않았습니다.
치료 시작 후 약 12주 후에 지질 매개변수를 평가하고 그 후에는 고지혈증에 대한 임상 지침에 따라 평가하십시오. 고지혈증 관리에 대한 임상 지침에 따라 환자를 관리하십시오.
간 효소 상승
RINVOQ 치료는 위약 치료에 비해 간 효소 상승 발생률이 증가했습니다.
기저선에서 간 효소를 평가하고 이후에는 일상적인 환자 관리에 따라 평가합니다. 약물 유발성 간 손상의 잠재적 사례를 식별하기 위해 간 효소 상승의 원인을 신속하게 조사하는 것이 좋습니다.
일상적인 환자 관리 중에 ALT 또는 AST가 증가하는 것이 관찰되고 약물 유발성 간 손상이 의심되는 경우, 이 진단이 배제될 때까지 RINVOQ/RINVOQ LQ를 중단해야 합니다.
5.9 태아 독성
동물 연구 결과를 바탕으로 RINVOQ/RINVOQ LQ는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 기관 형성 과정 동안 랫드와 토끼에게 업다시티닙을 투여하면 태아 기형이 증가했습니다. 치료를 시작하기 전에 생식 능력이 있는 환자의 임신 상태를 확인하십시오. 생식 능력이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 RINVOQ/RINVOQ LQ 치료 중 및 치료 종료 후 4주 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 인구 집단에서의 사용 참조 (8.1, 8.3)].
5.10 예방 접종
RINVOQ/RINVOQ LQ 치료 시작 중 또는 직전에 생백신 사용을 피하십시오. RINVOQ/RINVOQ LQ 치료를 시작하기 전에 환자는 현재 예방 접종 지침에 따라 예방 접종을 모두 받았는지 확인해야 합니다. 여기에는 예방 접종 수두 또는 대상 포진 백신이 포함됩니다.
5.11 대변 중 약물 잔여물
RINVOQ를 복용하는 환자에서 대변 또는 장루 배출물에서 약물 잔여물이 발견되었다는 보고가 있습니다. 대부분의 보고는 해부학적(예: 회장루, 결장루, 장 절제술) 또는 기능적 위장관 상태로 위장관 통과 시간이 단축된 경우를 설명했습니다. 약물 잔여물이 반복적으로 관찰되면 환자에게 의료 서비스 제공자에게 연락하도록 지시하십시오. 환자를 임상적으로 모니터링하고 치료 반응이 불충분한 경우 대체 치료를 고려하십시오.
6. 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 부분에서 설명되어 있습니다.
- 중증 감염 [경고 및 주의 사항 (5.1)]
- 사망 [경고 및 주의 사항 (5.2)]
- 악성 종양 및 림프 증식성 질환 [경고 및 주의 사항 (5.3)]
- 중대한 심혈관계 사건 [경고 및 주의 사항 (5.4)]
- 혈전증 [경고 및 주의 사항 (5.5)]
- 과민 반응 [경고 및 주의 사항 (5.6)]
- 위장관 천공 [경고 및 주의 사항 (5.7)]
- 검사실 이상 [경고 및 주의 사항 (5.8)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
류마티스 관절염 환자의 유해 반응
3상 임상 시험에서 RINVOQ 15mg 또는 업다시티닙 30mg 정제를 1일 1회 투여한 류마티스 관절염 성인 환자 3833명 중 2806명이 1년 이상 노출되었습니다.
환자는 시험 설계에 따라 12주부터 위약에서 RINVOQ 15mg으로 진행하거나 전환하거나, 활성 비교군 또는 위약에서 RINVOQ로 구제를 받을 수 있었습니다.
총 2630명의 환자가 RINVOQ 15mg을 최소 1회 투여 받았으며, 그 중 1860명이 1년 이상 노출되었습니다. RA-I, RA-II, RA-III 및 RA-V 시험에서 1213명의 환자가 RINVOQ 15mg을 최소 1회 투여 받았으며, 그 중 986명이 1년 이상 노출되었고, 1203명의 환자가 업다시티닙 30mg을 최소 1회 투여 받았으며, 그 중 946명이 1년 이상 노출되었습니다.
표 4: 위약 대조 임상 시험에서 RINVOQ 15mg으로 치료받은 류마티스 관절염 환자의 1% 이상에서 보고된 유해 반응
유해 반응
위약
RINVOQ
15 mg
N = 1042
(%)
N = 1035
(%)
상기도 감염 (URTI)*
9.5
13.5
메스꺼움
2.2
3.5
기침
1.0
2.2
발열
0
1.2
*URTI에는 다음이 포함됩니다. 급성 축농증, 후두염, 비인두염, 구인두 통증,
인두염, 인두 편도염, 비염, 축농증, 편도염, 바이러스성 상기도 감염
RINVOQ 15mg군에서 12주까지 위약군보다 높은 비율로 1% 미만의 환자에게 보고된 다른 이상 반응에는 폐렴, 대상포진, 단순포진(구강 포진 포함), 구강 칸디다증이 포함됩니다.
4개의 통합 데이터 세트가 특정 이상 반응 섹션에 제시됩니다.
위약 대조 시험: 시험 RA-III, RA-IV 및 RA-V는 위약(n=1042) 및 RINVOQ 15mg(n=1035)에 대한 12/14주까지의 안전성을 나타내기 위해 통합되었습니다. 시험 RA-III 및 RA-V는 위약(n=390), RINVOQ 15mg(n=385) 및 업다시티닙 30mg(n=384)에 대한 12주까지의 안전성을 나타내기 위해 통합되었습니다. 시험 RA-IV는 30mg 용량을 포함하지 않았으므로 업다시티닙 30mg에 대한 안전성 데이터는 시험 RA-III 및 RA-V를 풀링한 위약 및 RINVOQ 15mg 비율과만 비교할 수 있습니다.
MTX 대조 시험: 시험 RA-I 및 RA-II는 MTX(n=530), RINVOQ 15mg(n=534) 및 업다시티닙 30mg(n=529)에 대한 12/14주까지의 안전성을 나타내기 위해 통합되었습니다.
12개월 노출 데이터 세트: 시험 RA-I, II, III 및 V는 RINVOQ 15mg(n=1213) 및 업다시티닙 30mg(n=1203)의 장기 안전성을 나타내기 위해 통합되었습니다.
노출 조정 발생률은 이 섹션에 보고된 모든 이상 사건에 대해 시험별로 조정되었습니다.
특정 이상 반응
감염
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 감염은 위약으로 치료받은 환자 218명(100 환자-년당 95.7명)과 RINVOQ 15mg으로 치료받은 환자 284명(100 환자-년당 127.8명)에게 보고되었습니다. RA-III 및 RA-V에서 감염은 위약으로 치료받은 환자 99명(100 환자-년당 136.5명), RINVOQ 15mg으로 치료받은 환자 118명(100 환자-년당 164.5명) 및 업다시티닙 30mg으로 치료받은 환자 126명(100 환자-년당 180.3명)에게 보고되었습니다.
MTX 대조 시험: 감염은 MTX 단독 요법으로 치료받은 환자 127명(100 환자-년당 119.5명), RINVOQ 15mg 단독 요법으로 치료받은 환자 104명(100 환자-년당 91.8명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 128명(100 환자-년당 115.1명)에게 보고되었습니다.
12개월 노출 데이터 세트: 감염은 RINVOQ 15mg으로 치료받은 환자 615명(100 환자-년당 83.8명)과 업다시티닙 30mg으로 치료받은 환자 674명(100 환자-년당 99.7명)에게 보고되었습니다.
중증 감염
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 중증 감염은 위약으로 치료받은 환자 6명(100 환자-년당 2.3명)과 RINVOQ 15mg으로 치료받은 환자 12명(100 환자-년당 4.6명)에게 보고되었습니다. RA-III 및 RA-V에서 중증 감염은 위약으로 치료받은 환자 1명(100 환자-년당 1.2명), RINVOQ 15mg으로 치료받은 환자 2명(100 환자-년당 2.3명) 및 업다시티닙 30mg으로 치료받은 환자 7명(100 환자-년당 8.2명)에게 보고되었습니다.
MTX 대조 시험: 중증 감염은 MTX 단독 요법으로 치료받은 환자 2명(100 환자-년당 1.6명), RINVOQ 15mg 단독 요법으로 치료받은 환자 3명(100 환자-년당 2.4명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 8명(100 환자-년당 6.4명)에게 보고되었습니다.
12개월 노출 데이터 세트: 중증 감염은 RINVOQ 15mg으로 치료받은 환자 38명(100 환자-년당 3.5명)과 업다시티닙 30mg으로 치료받은 환자 59명(100 환자-년당 5.6명)에게 보고되었습니다.
가장 흔하게 보고된 중증 감염은 폐렴과 봉와직염이었습니다.
결핵
위약 대조 시험 및 MTX 대조 시험: 위약 대조 기간 동안 위약, RINVOQ 15mg 및 업다시티닙 30mg 그룹에서 활동성 결핵 사례가 보고되지 않았습니다. MTX 대조 기간 동안 MTX 단독 요법, RINVOQ 15mg 단독 요법 및 업다시티닙 30mg 단독 요법 그룹에서 활동성 결핵 사례가 보고되지 않았습니다.
12개월 노출 데이터 세트: 활동성 결핵은 RINVOQ 15mg으로 치료받은 환자 2명과 업다시티닙 30mg으로 치료받은 환자 1명에게 보고되었습니다. 폐외 결핵 사례가 보고되었습니다.
기회 감염(결핵 제외)
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 기회 감염은 위약으로 치료받은 환자 3명(100 환자-년당 1.2명)과 RINVOQ 15mg으로 치료받은 환자 5명(100 환자-년당 1.9명)에게 보고되었습니다. RA-III 및 RA-V에서 기회 감염은 위약으로 치료받은 환자 1명(100 환자-년당 1.2명), RINVOQ 15mg으로 치료받은 환자 2명(100 환자-년당 2.3명) 및 업다시티닙 30mg으로 치료받은 환자 6명(100 환자-년당 7.1명)에게 보고되었습니다.
MTX 대조 시험: 기회 감염은 MTX 단독 요법으로 치료받은 환자 1명(100 환자-년당 0.8명), RINVOQ 15mg 단독 요법으로 치료받은 환자 0명 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 4명(100 환자-년당 3.2명)에게 보고되었습니다.
12개월 노출 데이터 세트: 기회 감염은 RINVOQ 15mg으로 치료받은 환자 7명(100 환자-년당 0.6명)과 업다시티닙 30mg으로 치료받은 환자 15명(100 환자-년당 1.4명)에게 보고되었습니다.
악성 종양
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 NMSC를 제외한 악성 종양은 위약으로 치료받은 환자 1명(100 환자-년당 0.4명)과 RINVOQ 15mg으로 치료받은 환자 1명(100 환자-년당 0.4명)에게 보고되었습니다. RA-III 및 RA-V에서 NMSC를 제외한 악성 종양은 위약으로 치료받은 환자 0명, RINVOQ 15mg으로 치료받은 환자 1명(100 환자-년당 1.1명) 및 업다시티닙 30mg으로 치료받은 환자 3명(100 환자-년당 3.5명)에게 보고되었습니다.
MTX 대조 시험: NMSC를 제외한 악성 종양은 MTX 단독 요법으로 치료받은 환자 1명(100 환자-년당 0.8명), RINVOQ 15mg 단독 요법으로 치료받은 환자 3명(100 환자-년당 2.4명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 0명에게 보고되었습니다.
12개월 노출 데이터 세트: NMSC를 제외한 악성 종양은 RINVOQ 15mg으로 치료받은 환자 13명(100 환자-년당 1.2명)과 업다시티닙 30mg으로 치료받은 환자 14명(100 환자-년당 1.3명)에게 보고되었습니다.
위장관 천공
위약 대조 시험: 위약, RINVOQ 15mg 및 업다시티닙 30mg으로 치료받은 환자에서 위장관 천공(의학적 검토 기반)이 보고되지 않았습니다.
MTX 대조 시험: 12/14주까지 MTX 및 RINVOQ 15mg 그룹에서 위장관 천공 사례가 보고되지 않았습니다. 업다시티닙 30mg 그룹에서 위장관 천공 사례 2건이 관찰되었습니다.
12개월 노출 데이터 세트: 위장관 천공은 RINVOQ 15mg으로 치료받은 환자 1명과 업다시티닙 30mg으로 치료받은 환자 4명에게 보고되었습니다.
혈전증
위약 대조 시험: RA-IV에서 정맥 혈전증(폐색전증 또는 심부 정맥 혈전증)은 위약 치료를 받은 환자 1명과 RINVOQ 15mg 치료를 받은 환자 1명에서 관찰되었습니다. RA-V에서 정맥 혈전증은 RINVOQ 15mg 치료를 받은 환자 1명에서 관찰되었습니다. RA-III에서는 정맥 혈전증이 보고된 사례가 없었습니다. 동맥 혈전증은 12/14주까지 관찰되지 않았습니다.
MTX 대조 시험: RA-II에서 정맥 혈전증은 14주까지 MTX 단독 요법을 받은 환자 0명, RINVOQ 15mg 단독 요법을 받은 환자 1명, 업다시티닙 30mg 단독 요법을 받은 환자 0명에서 관찰되었습니다. RA-II에서 동맥 혈전증은 12/14주까지 관찰되지 않았습니다. RA-I에서 정맥 혈전증은 24주까지 MTX를 받은 환자 1명, RINVOQ 15mg을 받은 환자 0명, 업다시티닙 30mg을 받은 환자 1명에서 관찰되었습니다. RA-I에서 동맥 혈전증은 24주까지 업다시티닙 30mg을 받은 환자 1명에서 관찰되었습니다.
12개월 노출 데이터 세트: 정맥 혈전증 사건은 RINVOQ 15mg 치료를 받은 환자 5명(100 환자-년당 0.5명)과 업다시티닙 30mg 치료를 받은 환자 4명(100 환자-년당 0.4명)에서 보고되었습니다. 동맥 혈전증 사건은 RINVOQ 15mg 치료를 받은 환자 0명과 업다시티닙 30mg 치료를 받은 환자 2명(100 환자-년당 0.2명)에서 보고되었습니다.
실험실 이상
간 전이효소 상승
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 알라닌 아미노 전이효소(ALT) 및 아스파르테이트 아미노 전이효소(AST) 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 2.1% 및 1.5%, 위약 치료를 받은 환자의 경우 각각 1.5% 및 0.7%였습니다. RA-III 및 RA-V에서 ALT 및 AST 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 0.8% 및 1.0%, 업다시티닙 30mg 치료를 받은 환자의 경우 각각 1.0% 및 0%, 위약 치료를 받은 환자의 경우 각각 1.3% 및 1.0%였습니다.
MTX 대조 시험에서 최대 12/14주까지 ALT 및 AST 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 0.8% 및 0.4%, 업다시티닙 30mg 치료를 받은 환자의 경우 각각 1.7% 및 1.3%, MTX 치료를 받은 환자의 경우 각각 1.9% 및 0.9%였습니다.
지질 상승
업다시티닙 치료는 총 콜레스테롤, 트리글리세리드 및 LDL 콜레스테롤의 용량 의존적 증가와 관련이 있었습니다. 업다시티닙은 HDL 콜레스테롤 증가와도 관련이 있었습니다. LDL 및 HDL 콜레스테롤의 상승은 8주까지 최고조에 달했고 그 이후로 안정되었습니다. 대조 시험에서 최대 12/14주까지 RINVOQ 15mg 및 업다시티닙 30mg 치료를 받은 환자의 지질 매개변수 기준선 변화는 아래에 요약되어 있습니다.
- 평균 LDL 콜레스테롤은 14.81mg/dL 및 17.17mg/dL 증가했습니다.
- 평균 HDL 콜레스테롤은 8.16mg/dL 및 9.01mg/dL 증가했습니다.
- 평균 LDL/HDL 비율은 안정적으로 유지되었습니다.
- 평균 트리글리세리드는 13.55mg/dL 및 14.44mg/dL 증가했습니다.
크레아틴 키나아제 상승
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 크레아틴 키나아제(CPK) 값의 용량 의존적 증가가 관찰되었습니다. CPK 상승은 RINVOQ 15mg 그룹의 경우 12/14주 동안 환자의 1.0%, 위약 그룹의 경우 0.3%에서 정상 상한치(ULN)의 5배 이상으로 보고되었습니다. 정상 상한치(ULN)의 5배 이상인 대부분의 상승은 일시적이었으며 치료 중단을 요구하지 않았습니다. RA-III 및 RA-V에서 CPK 상승은 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 치료를 받은 환자의 1.6%, 업다시티닙 30mg 치료를 받은 환자의 경우 0%에서 정상 상한치(ULN)의 5배 이상으로 관찰되었습니다.
호중구 감소증
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 호중구 수의 용량 의존적 감소는 최소한 한 번의 측정에서 1000세포/mm3 미만으로 발생했으며, RINVOQ 15mg 그룹의 경우 환자의 1.1%, 위약 그룹의 경우 환자의 <0.1%였습니다. RA-III 및 RA-V에서 호중구 수의 감소는 최소한 한 번의 측정에서 1000세포/mm3 미만으로 발생했으며, 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 치료를 받은 환자의 1.3%, 업다시티닙 30mg 치료를 받은 환자의 2.4%였습니다. 임상 시험에서 ANC가 1000세포/mm3 미만으로 감소하면 치료가 중단되었습니다.
림프구 감소증
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 림프구 수의 용량 의존적 감소는 최소한 한 번의 측정에서 500세포/mm3 미만으로 발생했으며, RINVOQ 15mg 그룹의 경우 환자의 0.9%, 위약 그룹의 경우 환자의 0.7%였습니다. RA-III 및 RA-V에서 림프구 수의 감소는 최소한 한 번의 측정에서 500세포/mm3 미만으로 발생했으며, 위약 치료를 받은 환자의 0.5%, RINVOQ 15mg 치료를 받은 환자의 0.5%, 업다시티닙 30mg 치료를 받은 환자의 2.4%였습니다.
빈혈
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 헤모글로빈 감소는 최소한 한 번의 측정에서 8g/dL 미만으로 발생했으며, RINVOQ 15mg 그룹과 위약 그룹 모두에서 환자의 <0.1%였습니다. RA-III 및 RA-V에서 헤모글로빈 감소는 최소한 한 번의 측정에서 8g/dL 미만으로 관찰되었으며, 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 및 업다시티닙 30mg 치료를 받은 환자의 경우 0%였습니다.
건선성 관절염 환자의 이상 반응
임상 시험에서 총 1827명의 성인 건선성 관절염 환자가 매일 1회 RINVOQ 15mg 또는 업다시티닙 30mg 정제로 치료를 받았으며, 이는 1639.2 환자-년의 노출을 나타내며, 그중 722명이 업다시티닙에 1년 이상 노출되었습니다. 2개의 3상 시험에서 907명의 환자가 RINVOQ 15mg을 최소한 1회 복용했으며, 그중 359명이 1년 이상 노출되었습니다.
RINVOQ 15mg의 안전성을 위약과 비교하여 평가하기 위해 2개의 위약 대조 시험(RINVOQ 15mg을 매일 1회 복용한 환자 640명과 위약을 복용한 환자 635명)이 통합되었습니다. 치료 시작 후 최대 24주까지.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 건선성 관절염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염 환자에서 관찰된 안전성 프로파일과 일치했습니다. 24주 위약 대조 기간 동안 대상포진 및 단순 포진의 빈도는 RINVOQ 15mg의 경우 ≥1%(각각 1.1% 및 1.4%), 위약의 경우 각각 0.8% 및 1.3%였습니다. 여드름 및 기관지염의 발생률도 RINVOQ 15mg 치료를 받은 환자(각각 1.3% 및 3.9%)에서 위약 치료를 받은 환자(각각 0.3% 및 2.7%)보다 높았습니다.
아토피 피부염 환자의 이상 반응
3상(AD-1, AD-2 및 AD-3) 및 1상 2b상(AD-4) 무작위 배정, 이중 맹검, 위약 대조, 다기관 시험에서 중등도에서 중증의 아토피 피부염 환자에서 RINVOQ의 안전성을 평가했습니다. 환자의 대부분은 백인(68%)이었고 남성(57%)이었습니다. 평균 연령은 34세(12세에서 75세)였으며 환자의 13%는 12세에서 18세 미만이었습니다. 이 4개의 시험에서 2612명의 환자가 RINVOQ 15mg 정제 또는 30mg 정제를 1일 1회 경구 투여 받았으며, 국소 코르티코스테로이드(TCS)를 병용하거나 병용하지 않았습니다.
3상 임상 시험(AD-1, AD-2 및 AD-3)에서 총 1239명의 환자가 RINVOQ 15mg을 투여 받았으며, 그 중 791명은 1년 이상 노출되었고 1246명의 환자가 RINVOQ 30mg을 투여 받았으며, 그 중 826명은 1년 이상 노출되었습니다.
시험 AD-1, AD-2 및 AD-4는 16주까지 RINVOQ 단독 요법의 안전성을 위약과 비교했습니다. 시험 AD-3는 16주까지 RINVOQ + TCS의 안전성을 위약 + TCS와 비교했습니다.
0주에서 16주(시험 AD-1에서 AD-4)
TCS를 병용하거나 병용하지 않은 RINVOQ 시험(시험 AD-1, 2, 3 및 4)에서 16주까지 RINVOQ 15mg, 30mg 및 위약군에서 부작용으로 인해 치료를 중단한 환자의 비율은 각각 2.3%, 2.9% 및 3.8%였습니다. 표 5는 치료 첫 16주 동안 RINVOQ 15mg 또는 30mg군에서 1% 이상 발생한 부작용을 요약합니다.
표 5: RINVOQ 15mg 또는 30mg으로 치료받은 아토피 피부염 환자의 1% 이상에서 보고된 부작용
부작용
위약
RINVOQ
15 mg
RINVOQ
30 mg
N = 902
(%)
N = 899
(%)
N = 906
(%)
상기도 감염(URTI)*
17
23
25
여드름**
2
10
16
단순 포진***
2
4
8
두통
4
6
6
혈중 크레아틴 인산화효소 증가
2
5
6
기침
1
3
3
과민 반응****
2
2
3
모낭염
1
2
3
메스꺼움
1
3
3
복통*****
1
3
2
발열
1
2
2
체중 증가
1
2
2
대상포진******
1
2
2
인플루엔자
<1
2
2
피로
1
1
2
호중구 감소증
<1
1
2
근육통
1
1
2
인플루엔자 유사 질환
1
1
2
* 포함: 후두염, 바이러스성 후두염, 비인두염, 인후통, 인두 농양, 인두염, 연쇄상 구균성 인두염, 인두 편도염, 호흡기 감염, 바이러스성 호흡기 감염, 비염, 비후두염, 축농증, 편도염, 세균성 편도염, 상기도 감염, 바이러스성 인두염, 바이러스성 상기도 감염
** 포함: 여드름 및 여드름 모양 피부염
*** 포함: 생식기 헤르페스, 단순 생식기 헤르페스, 헤르페스 피부염, 안구 헤르페스, 단순 헤르페스, 비강 헤르페스, 안구 단순 헤르페스, 헤르페스 바이러스 감염, 구강 헤르페스
**** 포함: 아나필락시스 반응, 아나필락시스 쇼크, 혈관 부종, 전신 박탈성 피부염, 약물 과민 반응, 눈꺼풀 부종, 얼굴 부종, 과민 반응, 안와 주위 부종, 인두 부종, 얼굴 부종, 독성 피부 발진, I형 과민 반응, 두드러기
***** 포함: 복통 및 상복부 통증
****** 포함: 대상 포진 및 수두
RINVOQ 15mg 및/또는 30mg 그룹의 환자 중 1% 미만에서 보고되었고 위약 그룹보다 높은 비율로 16주까지 보고된 다른 이상 반응에는 빈혈, 구강 칸디다증, 폐렴, 비흑색종 피부암 및 망막 박리가 포함되었습니다.
52주까지 RINVOQ의 안전성 프로파일은 일반적으로 16주에 관찰된 안전성 프로파일과 일치했습니다.
전반적으로 RINVOQ로 치료받은 AD 환자에서 관찰된 안전성 프로파일은 RA 환자의 안전성 프로파일과 유사했습니다. AD 환자에서 보고된 다른 특정 이상 반응에는 헤르페스 피부염/카포시 봉상 발진이 포함되었습니다.
헤르페스 피부염/카포시 봉상 발진
위약 대조 기간(16주): 헤르페스 피부염은 위약으로 치료받은 환자 4명(100 환자-년당 1.6명), RINVOQ 15mg으로 치료받은 환자 6명(100 환자-년당 2.2명), RINVOQ 30mg으로 치료받은 환자 7명(100 환자-년당 2.6명)에서 보고되었습니다.
12개월 노출(0주~52주): 헤르페스 피부염은 RINVOQ 15mg으로 치료받은 환자 18명(100 환자-년당 1.6명)과 RINVOQ 30mg으로 치료받은 환자 17명(100 환자-년당 1.5명)에서 보고되었습니다.
궤양성 대장염 환자의 이상 반응
RINVOQ는 두 개의 무작위 배정, 이중 맹검, 위약 대조 유도 연구(UC-1, UC-2)와 무작위 배정, 이중 맹검, 위약 대조, 용량 찾기 연구(UC-4; NCT02819635)에서 중등도에서 중증의 활동성 궤양성 대장염 환자를 대상으로 최대 8주까지 연구되었습니다. 무작위 배정, 이중 맹검, 위약 대조 유지 연구(UC-3)와 장기 연장 연구에서 유도 요법에 반응한 환자를 대상으로 최대 52주까지 장기 안전성을 평가했습니다. [임상 연구(14.4)].
두 개의 유도 연구(UC-1, UC-2)와 용량 찾기 연구(UC-4)에서 1097명의 환자가 등록되었으며, 그 중 719명의 환자가 RINVOQ 45mg 정제를 1일 1회 복용했습니다.
유지 연구(UC-3)에서 746명의 환자가 등록되었으며, 그 중 250명의 환자가 RINVOQ 15mg 정제를 1일 1회 복용하고 251명의 환자가 RINVOQ 30mg 정제를 1일 1회 복용했습니다.
유도 및 유지 연구에서 모든 치료군의 환자 중 ≥2%에서 보고된 이상 반응은 각각 표 6과 7에 나와 있습니다.
표 6: 위약 대조 유도 연구(UC-1, UC-2 및 UC-4)에서 RINVOQ 45mg으로 치료받은 궤양성 대장염 환자의 ≥2%에서 보고된 이상 반응
이상 반응
위약
RINVOQ
45mg 1일 1회
N = 378
(%)
N = 719
(%)
상기도 감염*
7
9
여드름*
1
6
혈청 크레아틴 키나아제 증가
1
5
호중구 감소증*
<1
5
발진*
1
4
간 효소 상승**
2
3
림프구 감소증*
1
3
모낭염
1
2
단순 헤르페스*
<1
2
* 여러 유사한 용어로 구성됨
** 간 효소 상승은 ALT, AST, GGT, ALP, 간 트랜스아미나제, 간 효소, 빌리루빈, 약물 유발 간 손상 및 담즙 정체로 구성됩니다.
RINVOQ 45mg군에서 8주까지 위약군보다 높은 비율로 2% 미만의 환자에게 보고된 다른 이상 반응에는 대상포진과 폐렴이 포함되었습니다.
표 7: 위약 대조 유지 연구(UC-3)에서 RINVOQ 15mg 또는 30mg으로 치료받은 궤양성 대장염 환자의 ≥2%에서 보고된 이상 반응1
이상 반응
위약
RINVOQ
15 mg 1일 1회
RINVOQ
30 mg 1일 1회
N = 245
(%)
N = 250
(%)
N = 251
(%)
상기도 감염*
18
16
20
혈중 크레아틴 키나아제 증가
2
6
8
호중구 감소증*
2
3
6
간 효소 상승**
1
6
4
발진*
4
5
5
대상포진
0
4
4
모낭염
2
2
4
고콜레스테롤혈증*
1
2
4
인플루엔자
1
3
3
단순포진*
1
2
3
림프구 감소증*
2
3
2
고지혈증*
0
2
2
1 RINVOQ 45mg 1일 1회 유도 요법에 반응한 환자
* 여러 유사 용어로 구성됨
** 간 효소 상승은 ALT, AST, GGT, ALP, 간 트랜스아미나제, 간 효소, 빌리루빈, 약물 유발 간 손상 및 담즙 정체로 구성됩니다.
비흑색종 피부암의 부작용은 52주까지 RINVOQ 30mg 그룹 환자의 1%에서 보고되었으며, RINVOQ 15mg 또는 위약 그룹 환자에서는 보고되지 않았습니다.
장기 연장 연구에서 RINVOQ의 안전성 프로파일은 위약 대조 유도 및 유지 기간에 관찰된 안전성 프로파일과 유사했습니다.
전반적으로 RINVOQ로 치료받은 궤양성 대장염 환자에서 관찰된 안전성 프로파일은 일반적으로 RA 및 AD 환자의 안전성 프로파일과 유사했습니다.
특정 부작용
중증 감염
유도 연구: UC-1, UC-2 및 UC-4에서 8주까지 위약으로 치료받은 환자 5명(100 환자-연당 8.4명)과 RINVOQ 45mg으로 치료받은 환자 9명(100 환자-연당 8.4명)에서 중증 감염이 보고되었습니다.
위약 대조 유지 연구: UC-3에서 52주까지 위약으로 치료받은 환자 8명(100 환자-연당 6.3명), RINVOQ 15mg으로 치료받은 환자 8명(100 환자-연당 4.5명) 및 RINVOQ 30mg으로 치료받은 환자 6명(100 환자-연당 3.1명)에서 중증 감염이 보고되었습니다.
실험실 이상
간 전이효소 상승
UC-1, UC-2 및 UC-4 연구에서 8주 동안 RINVOQ 45mg으로 치료받은 환자의 1.5%에서 적어도 한 번의 측정에서 ALT가 ≥ 3 x ULN으로 상승한 것이 관찰되었고, 위약으로 치료받은 환자에서는 0%였습니다. AST는 RINVOQ 45mg으로 치료받은 환자의 1.5%에서 ≥ 3 x ULN으로 상승했고, 위약으로 치료받은 환자의 0.3%에서 상승했습니다. ALT는 RINVOQ 45mg으로 치료받은 환자의 0.4%에서 ≥ 5 x ULN으로 상승했고, 위약으로 치료받은 환자에서는 0%였습니다.
UC-3에서 52주 동안 RINVOQ 30mg으로 치료받은 환자의 4%, RINVOQ 15mg으로 치료받은 환자의 2% 및 위약으로 치료받은 환자의 0.8%에서 적어도 한 번의 측정에서 ALT가 ≥ 3 x ULN으로 상승한 것이 관찰되었습니다. 52주 동안 RINVOQ 30mg으로 치료받은 환자의 2%, RINVOQ 15mg으로 치료받은 환자의 1.6% 및 위약으로 치료받은 환자의 0.4%에서 적어도 한 번의 측정에서 AST가 ≥ 3 x ULN으로 상승한 것이 관찰되었습니다. ALT는 30mg으로 치료받은 환자의 0.8%, 15mg으로 치료받은 환자의 0.4% 및 위약으로 치료받은 환자의 0.4%에서 ≥ 5 x ULN으로 상승한 것이 관찰되었습니다.
전반적으로 RINVOQ로 치료받은 궤양성 대장염 환자에서 관찰된 실험실 이상은 RA 환자에서 설명된 것과 유사했습니다.
크론병 환자의 부작용
RINVOQ는 두 건의 무작위 배정, 이중 맹검, 위약 대조 유도 연구(CD-1, CD-2)에서 중등도에서 중증의 활동성 CD 환자를 대상으로 최대 12주 동안 연구되었습니다. 최대 52주까지의 장기 안전성은 무작위 배정, 이중 맹검, 위약 대조 유지 연구(CD-3)에서 유도 요법에 반응한 환자를 대상으로 평가되었으며, 장기 연장(LTE) 기간의 추가 데이터가 제공되었습니다. [임상 연구(14.5)].
두 건의 유도 연구(CD-1, CD-2)에서 1021명의 환자가 등록되었으며, 그중 674명의 환자가 위약 대조 기간 동안 하루에 한 번 RINVOQ 45mg 정제를 투여받았습니다.
유지 연구(CD-3)에서 673명의 환자가 등록되었으며, 그중 221명의 환자가 무작위 배정, 위약 대조 기간 동안 하루에 한 번 RINVOQ 15mg 정제를 투여받았고, 229명의 환자가 하루에 한 번 RINVOQ 30mg 정제를 투여받았습니다.
전반적으로 RINVOQ로 치료받은 크론병 환자에서 관찰된 안전성 프로파일은 다른 적응증에서 RINVOQ에 대한 알려진 안전성 프로파일과 일치했습니다.
유도 및 유지 연구에서 RINVOQ로 치료받은 환자의 ≥2%에서 보고되었고 위약보다 높은 비율로 보고된 부작용은 각각 표 8 및 9에 나와 있습니다.
표 8: 위약 대조 유도 연구(CD-1 및 CD-2)에서 RINVOQ 45mg으로 치료받은 크론병 환자의 ≥2%에서 보고된 부작용
부작용
위약
RINVOQ
45mg 하루에 한 번
N = 347
(%)
N = 674
(%)
상기도 감염*
8
13
빈혈*
6
7
여드름*
2
6
발열
3
4
혈중 크레아틴 키나아제 증가
1
3
인플루엔자
1
3
단순 포진*
1
3
백혈구 감소증*
1
2
호중구 감소증*
<1
2
대상 포진
0
2
* 여러 유사한 용어로 구성됨
RINVOQ 45mg군에서 12주까지 위약군보다 높은 비율로 2% 미만의 환자에게 보고된 부작용에는 여드름, 고콜레스테롤혈증, 기관지염, 폐렴, 구강 칸디다증 및 고지혈증이 포함되었습니다.
표 9: 위약 대조 유지 연구(CD-3)에서 RINVOQ 15mg 또는 30mg으로 치료받은 크론병 환자의 ≥2%에서 보고된 부작용1
부작용
위약
RINVOQ
15 mg 1일 1회
RINVOQ
30 mg 1일 1회
N = 223
(%)
N = 221
(%)
N = 229
(%)
상기도 감염*
11
14
12
발열
2
3
7
대상포진*
2
3
5
두통*
1
3
5
여드름*
3
2
5
위장염*
2
3
3
피로
2
3
3
혈중 크레아틴 키나아제 증가
1
2
3
간 효소 상승2
<1
2
3
백혈구 감소증*
<1
1
2
호중구 감소증*
<1
1
2
기관지염*
0
1
2
폐렴*
1
4
1
기침
2
3
1
1 RINVOQ 45mg을 1일 1회 투여하여 12주 유도 요법에 반응한 환자.
2 간 효소 상승에는 알라닌 아미노트랜스퍼라제 증가, 아스파르테이트 아미노트랜스퍼라제 증가, 혈액 알칼리성 포스파타제 증가, 트랜스아미나제 증가, 혈액 빌리루빈 증가가 포함됩니다.
* 여러 유사한 용어로 구성됨
RINVOQ 15mg 또는 30mg 그룹에서 2% 미만의 환자에게 보고되었고 52주까지 위약 그룹보다 더 높은 비율로 보고된 이상 반응에는 고지혈증, 구강 칸디다증 및 고콜레스테롤혈증이 포함됩니다.
장기 연장 연구에서 RINVOQ의 안전성 프로파일은 위약 대조 유도 및 유지 기간에 관찰된 안전성 프로파일과 유사했습니다.
특정 이상 반응
중증 감염
유도 연구: CD-1 및 CD-2에서 위약 대조 기간 12주 동안 위약으로 치료받은 환자 6명(100 환자-년당 8명)과 RINVOQ 45mg으로 치료받은 환자 13명(100 환자-년당 9명)에게 중증 감염이 보고되었습니다.
유지 연구/LTE: 장기 위약 대조 기간 동안 위약으로 치료받은 환자 10명(100 환자-년당 7명), RINVOQ 15mg으로 치료받은 환자 7명(100 환자-년당 4명), RINVOQ 30mg으로 치료받은 환자 13명(100 환자-년당 6명)에게 중증 감염이 보고되었습니다.
위장 천공
유도 연구: 모든 RINVOQ 45mg 치료 환자(N=938)에서 유도 연구 동안 위장 천공이 4명의 환자(100 환자-년당 2명)에게 보고되었습니다. 위약 대조 유도 기간 동안 CD-1 및 CD-2에서 위약으로 치료받은 환자(N=347)에게는 위장 천공이 보고되지 않았고, RINVOQ 45mg(N=674)으로 치료받은 환자 1명(100 환자-년당 1명)에게는 12주 동안 위장 천공이 보고되었습니다.
유지 연구/LTE: 장기 위약 대조 기간 동안 위약으로 치료받은 환자 1명(100 환자-년당 1명), RINVOQ 15mg으로 치료받은 환자 1명(<100 환자-년당 1명), RINVOQ 30mg으로 치료받은 환자 1명(<100 환자-년당 1명)에게 위장 천공이 보고되었습니다.
유지 요법을 위해 위약 또는 RINVOQ 15mg을 받았고 반응을 잃은 환자는 구제 RINVOQ 30mg(N=336)으로 치료받았습니다. 이러한 환자 중 장기 치료를 통해 3명의 환자(100 환자-년당 1명)에게 위장 천공이 보고되었습니다.
강직성 척추염 환자의 이상 반응
강직성 척추염 환자 596명이 두 건의 임상 시험에서 RINVOQ 15mg 정제로 치료받았으며, 이는 577.3 환자-년의 노출을 나타내며, 그중 220명이 RINVOQ 15mg에 1년 이상 노출되었습니다.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 강직성 척추염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염 및 건선성 관절염 환자에서 관찰된 안전성 프로파일과 일치했습니다. 시험 AS-I의 14주 위약 대조 기간 동안 두통의 빈도는 RINVOQ 15mg에서 5.4%였고 위약에서 2.1%였습니다. 시험 AS-II의 14주 위약 대조 기간 동안 두통의 빈도는 RINVOQ 15mg에서 3.3%였고 위약에서 1.4%였습니다.
비방사선학적 축성 척추 관절염 환자의 이상 반응
비방사선학적 축성 척추 관절염 환자 187명이 임상 시험에서 RINVOQ 15mg 정제로 치료받았으며, 이는 116.6 환자-년의 노출을 나타내며, 그중 31명이 RINVOQ 15mg에 1년 이상 노출되었습니다.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 비방사선학적 축성 척추 관절염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염, 건선성 관절염 및 강직성 척추염 환자에서 관찰된 안전성 프로파일과 일치했습니다.
다관절 소아 특발성 관절염 환자의 이상 반응
활동성 다관절염이 있는 소아 특발성 관절염(JIA) 환자 83명이 임상 시험에서 RINVOQ/RINVOQ LQ로 치료받았으며, 이는 123.7 환자-년의 노출을 나타내며, 그중 48명이 RINVOQ/RINVOQ LQ에 1년 이상 노출되었습니다.
전반적으로 RINVOQ/RINVOQ LQ로 치료받은 활동성 다관절염이 있는 JIA 소아 환자에서 관찰된 안전성 프로파일은 RINVOQ의 알려진 안전성 프로파일과 일치했습니다.
7. 약물 상호 작용
7.1 강력한 CYP3A4 억제제
케토코나졸, 클라리스로마이신 및 자몽과 같은 강력한 CYP3A4 억제제와 함께 투여하면 업다시티닙 노출이 증가하여 부작용 위험이 증가할 수 있습니다 [임상 약리학 (12.3)]. 류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염 또는 pJIA 환자의 경우 RINVOQ/RINVOQ LQ를 강력한 CYP3A4 억제제와 함께 투여할 때 부작용을 면밀히 모니터링하십시오. RINVOQ/RINVOQ LQ 치료 중에는 자몽이 함유된 음식이나 음료를 피해야 합니다.
아토피 피부염 환자의 경우 RINVOQ 30mg을 1일 1회 강력한 CYP3A4 억제제와 함께 투여하는 것은 권장하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 강력한 CYP3A4 억제제를 복용하는 경우 RINVOQ 유도 용량을 1일 1회 30mg으로 줄이십시오. 권장 유지 용량은 1일 1회 15mg입니다 [용량 및 투여 (2.12)].
7.2 강력한 CYP3A4 유도제
리팜핀과 같은 강력한 CYP3A4 유도제와 함께 투여하면 업다시티닙 노출이 감소하여 치료 효과가 감소할 수 있습니다 [임상 약리학 (12.3)]. RINVOQ/RINVOQ LQ를 강력한 CYP3A4 유도제와 함께 투여하는 것은 권장하지 않습니다.
8 특정 인구 집단에서의 사용
8.1 임신
임신 감시 프로그램
RINVOQ/RINVOQ LQ에 노출된 여성의 임신 결과를 모니터링하는 RINVOQ/RINVOQ LQ에 대한 임신 감시 프로그램이 있습니다. 임신 중에 RINVOQ/RINVOQ LQ에 노출된 경우 의료 서비스 제공자 또는 환자는 1-800-633-9110으로 전화하여 임신 사실을 보고해야 합니다.
위험 요약
임산부에서 RINVOQ 사용에 대한 시판 후 안전성 데이터베이스 및 시판 후 사례 보고에서 얻은 가용 데이터는 주요 선천적 기형 또는 유산에 대한 약물 관련 위험을 평가하기에 충분하지 않습니다. 동물 연구에 따르면 RINVOQ/RINVOQ LQ는 태아에게 악영향을 미칠 가능성이 있습니다. 가임 여성 및 임산부에게 태아에 대한 잠재적 위험을 알리십시오.
동물의 배아-태아 발달 연구에서 임신한 쥐와 토끼에게 15mg 정제 용량의 약 1.6배 및 15배, 30mg 정제 용량의 0.8배 및 7.6배, 최대 권장 용량의 0.6배 및 5.6배에 해당하는 용량의 경구용 upadacitinib을 투여한 결과(AUC 기준) 용량 관련 골격 기형 증가(쥐만 해당), 심혈관 기형 발생률 증가(토끼만 해당), 착상 후 손실 증가(토끼만 해당), 쥐와 토끼 모두에서 태아 체중 감소가 나타났습니다. 기관 형성 중에 15mg 용량의 약 0.29배 및 2.2배, 30mg 용량의 0.15배 및 1.1배, 최대 권장 용량의 0.11배 및 0.82배(AUC 기준)에 해당하는 용량의 경구용 upadacitinib으로 치료한 임신한 쥐와 토끼에서는 발달 독성이 관찰되지 않았습니다. 임신한 암컷 쥐를 대상으로 한 출산 전 및 출산 후 발달 연구에서 15mg 용량의 약 3배, 30mg 용량의 1.4배, 최대 권장 용량과 동일한 용량(AUC 기준)의 경구용 upadacitinib을 투여한 결과 모체 또는 발달 독성이 나타나지 않았습니다( 데이터 참조).
적응증 집단에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 전체 인구에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 배아/태아 위험
발표된 데이터에 따르면 류마티스 관절염이나 염증성 장 질환이 있는 여성의 경우 질병 활동 증가가 부작용이 있는 임신 결과의 위험 증가와 관련이 있는 것으로 나타났습니다. 부작용이 있는 임신 결과에는 조산(임신 37주 전), 저체중(2500g 미만) 출산, 재태 연령별 저체중이 포함됩니다.
데이터
동물 데이터
경구용 배아-태아 발달 연구에서 임신한 쥐에게 임신 6일에서 17일까지의 기관 형성 기간 동안 5, 25, 75mg/kg/일 용량의 upadacitinib을 투여했습니다. Upadacitinib은 15mg 정제 용량의 약 1.7배, 30mg 정제 용량의 0.9배, 최대 권장 용량의 0.6배 이상의 용량(모체 경구 용량 5mg/kg/일 이상에서 AUC 기준)에서 기형 발생(기형 상완골과 굽은 견갑골로 구성된 골격 기형)을 유발했습니다. 15mg 용량의 약 84배, 30mg 용량의 43배, 최대 권장 용량의 31배(모체 경구 용량 75mg/kg/일에서 AUC 기준)에 해당하는 용량에서 모체 독성 없이 추가 골격 기형(굽은 앞다리/뒷다리 및 갈비뼈/척추 기형)과 태아 체중 감소가 관찰되었습니다.
두 번째 경구용 배아-태아 발달 연구에서 임신한 쥐에게 임신 6일에서 17일까지의 기관 형성 기간 동안 1.5 및 4mg/kg/일 용량의 upadacitinib을 투여했습니다. Upadacitinib은 15mg 용량의 약 1.6배, 30mg 용량의 0.8배, 최대 권장 용량의 0.6배(모체 경구 용량 4mg/kg/일에서 AUC 기준)에 해당하는 용량에서 기형 발생(굽은 상완골과 견갑골을 포함한 골격 기형)을 유발했습니다. 15mg 정제 용량의 약 0.29배, 30mg 정제 용량의 0.15배, 최대 권장 용량의 0.11배(모체 경구 용량 1.5mg/kg/일에서 AUC 기준)에 해당하는 용량에서 쥐의 발달 독성은 관찰되지 않았습니다.
경구용 배아-태아 발달 연구에서 임신한 토끼에게 임신 7일에서 19일까지의 기관 형성 기간 동안 2.5, 10, 25mg/kg/일 용량의 upadacitinib을 투여했습니다. 15mg 정제 용량의 약 15배, 30mg 정제 용량의 7.6배, 최대 권장 용량의 5.6배(모체 경구 용량 25mg/kg/일에서 AUC 기준)에 해당하는 용량에서 모체 독성과 함께 배아 사망, 태아 체중 감소, 심혈관 기형이 관찰되었습니다. 배아 사망은 총 재흡수 및 초기 재흡수 발생률 증가로 인한 착상 후 손실 증가로 구성되었습니다. 15mg 정제 용량의 약 2.2배, 30mg 정제 용량의 1.1배, 최대 권장 용량의 0.82배(모체 경구 용량 10mg/kg/일에서 AUC 기준)에 해당하는 용량에서 토끼의 발달 독성은 관찰되지 않았습니다.
경구용 출산 전 및 출산 후 발달 연구에서 임신한 암컷 쥐에게 임신 6일부터 수유 20일까지 2.5, 5, 10mg/kg/일 용량의 upadacitinib을 투여했습니다. 15mg 정제 용량의 약 3배, 30mg 정제 용량의 1.4배, 최대 권장 용량과 거의 동일한 용량(모체 경구 용량 10mg/kg/일에서 AUC 기준)에서 어미 또는 새끼 모두에서 각각 모체 독성이나 발달 독성이 관찰되지 않았습니다.
8.2 수유
위험 요약
모유에서의 upadacitinib의 존재, 모유 수유 영아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 동물의 약력학/독성학 데이터에 따르면 우유에서 upadacitinib이 배설되는 것으로 나타났습니다 (데이터 참조). 동물의 우유에 약물이 존재하는 경우 해당 약물은 모유에도 존재할 가능성이 높습니다. 모유 수유 영아에서 심각한 부작용이 발생할 가능성이 있으므로 환자에게 RINVOQ/RINVOQ LQ 치료 중 및 마지막 용량 투여 후 6일(약 10회의 반감기) 동안 모유 수유를 하지 않는 것이 좋습니다.
데이터
수유 중인 암컷 스프라그-돌리 쥐에게 출산 후 7~8일에 10mg/kg의 방사성 표지 upadacitinib 단회 경구 용량을 투여했습니다. AUC0-t 값을 기준으로 우유의 약물 노출은 모체 혈장보다 약 30배 더 높았습니다. 우유에 함유된 약물 관련 물질의 약 97%는 모 약물이었습니다.
8.3 가임 여성 및 남성
임신 검사
RINVOQ/RINVOQ LQ로 치료를 시작하기 전에 가임 여성의 임신 여부를 확인하십시오. [특정 환자군에서의 사용(8.1)]
피임
여성
동물 연구에 따르면, upadacitinib은 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. [특정 환자군에서의 사용(8.1)]. 가임 여성 환자에게 RINVOQ/RINVOQ LQ 치료 중 및 마지막 복용 후 4주 동안 효과적인 피임법을 사용하도록 권고하십시오.
8.4 소아에 대한 사용
강직성 척추염, 방사선 비증명 축성 척추관절염, 궤양성 대장염 및 크론병
강직성 척추염, 방사선 비증명 축성 척추관절염, 궤양성 대장염 또는 크론병 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
다관절형 소아 특발성 관절염 및 건선성 관절염
pJIA 및 건선성 관절염이 있는 2세 이상 18세 미만 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성이 확립되었습니다.
이러한 연령대에서 RINVOQ/RINVOQ LQ의 사용은 류마티스 관절염 및 건선성 관절염 성인 환자를 대상으로 한 잘 통제된 RINVOQ 연구, 류마티스 관절염 및 건선성 관절염 성인 환자 및 활동성 다관절염이 있는 소아 JIA 환자 51명의 약동학 데이터, 활동성 다관절염이 있는 2세 이상 18세 미만 소아 JIA 환자 83명의 안전성 데이터에서 얻은 근거에 의해 뒷받침됩니다. 권장 복용량에서 pJIA 및 건선성 관절염 소아 환자의 Upadacitinib 혈장 노출은 모집단 약동학 모델링 및 시뮬레이션을 기반으로 류마티스 관절염 및 건선성 관절염 성인에서 관찰된 것과 비슷할 것으로 예상됩니다. [용량 및 투여(2.4, 2.10), 이상반응(6.1), 임상 약리학(12.3) 및 임상 연구(14.8)].
pJIA 또는 건선성 관절염이 있는 2세 미만 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
아토피 피부염
아토피 피부염이 있는 12세 이상, 체중 40kg 이상의 소아 환자에서 RINVOQ의 안전성 및 유효성이 확립되었습니다. 중등도에서 중증의 아토피 피부염이 있는 12~17세 소아 환자 344명이 세 가지 임상시험(AD-1, AD-2 및 AD-3)에 무작위 배정되어 단독 요법 또는 국소 코르티코스테로이드와 병용하여 RINVOQ 15mg(N=114) 또는 30mg(N=114) 또는 일치하는 위약(N=116)을 투여받았습니다. 유효성은 소아 환자와 성인 환자 사이에서 일관되었습니다 [임상 연구(14.3)]. 소아 환자의 이상반응 프로파일은 성인과 유사했습니다 [이상반응(6.1)].
아토피 피부염이 있는 12세 미만 소아 환자에서 RINVOQ의 안전성 및 유효성은 확립되지 않았습니다.
아토피 피부염 소아 환자에서 RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인에 대한 사용
류마티스 관절염 및 건선성 관절염
5건의 임상시험에서 치료받은 4,381명의 환자 중 총 906명의 류마티스 관절염 환자가 65세 이상이었으며, 이 중 146명은 75세 이상이었습니다. 2건의 건선성 관절염 3상 임상시험에서 치료받은 1,827명의 환자 중 총 274명이 65세 이상이었으며, 이 중 34명은 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 유효성의 차이는 관찰되지 않았습니다. 그러나 65세 이상의 환자에서 심각한 감염을 포함한 전체 이상반응 발생률이 더 높았습니다.
아토피 피부염
3건의 3상 임상시험에서 치료받은 2,583명의 환자 중 총 120명의 아토피 피부염 환자가 65세 이상이었으며, 이 중 6명은 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 유효성의 차이는 관찰되지 않았습니다. 그러나 장기 임상시험에서 30mg 복용군의 65세 이상 환자에서 심각한 감염 및 악성 종양 발생률이 더 높았습니다.
궤양성 대장염
대조 임상시험에서 치료받은 1,097명의 환자 중 총 95명 의 궤양성 대장염 환자가 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 궤양성 대장염 환자가 충분히 포함되지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없습니다.
크론병
대조 유도 임상시험에서 치료받은 1,021명의 환자 중 총 39명의 크론병 환자가 65세 이상이었으며, 75세 이상인 환자는 없었습니다. RINVOQ 임상 연구에는 65세 이상의 크론병 환자가 충분히 포함되지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없습니다.
강직성 척추염
8 USE IN SPECIFIC POPULATIONS
대조 임상 시험에서 치료받은 607명의 환자 중 총 32명 의 강직성 척추염 환자는 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 강직성 척추염 환자가 충분히 포함되지 않아 고령 환자의 반응이 젊은 성인 환자와 다른지 여부를 확인할 수 없습니다.
방사선 비관찰형 축성 척추관절염
3상 임상 시험에서 치료받은 313명의 환자 중 총 9명 의 방사선 비관찰형 축성 척추관절염 환자는 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 방사선 비관찰형 축성 척추관절염 환자가 충분히 포함되지 않아 고령 환자의 반응이 젊은 성인 환자와 다른지 여부를 확인할 수 없습니다.
8.6 신장애
류마티스 관절염, 건선성 관절염, 강직성 척추염, 방사선 비관찰형 축성 척추관절염 또는 소아 특발성 관절염 환자의 경우 경도(eGFR 60 ~ < 90mL/min/1.73m2), 중등도(eGFR 30 ~ < 60mL/min/1.73m2) 또는 중증(eGFR 15 ~ < 30mL/min/1.73m2) 신장애 환자에서 용량 조절이 필요하지 않습니다.
아토피 피부염 환자의 경우 중증 신장애 환자에 대한 RINVOQ의 최대 권장 용량은 1일 1회 15mg입니다. 경도 또는 중등도 신장애 환자의 경우 용량 조절이 필요하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 중증 신장애에 대한 RINVOQ의 권장 용량은 유도 요법의 경우 1일 1회 30mg이고 유지 요법의 경우 1일 1회 15mg입니다. 경도 또는 중등도 신장애 환자의 경우 용량 조절이 필요하지 않습니다 [용량 및 투여 방법(2.11) 참조].
RINVOQ/RINVOQ LQ는 말기 신장 질환(eGFR <15mL/min/1.73m2) 환자에서 연구된 바 없습니다. 말기 신장 질환이 있는 아토피 피부염, 궤양성 대장염 또는 크론병 환자에게는 사용하지 않는 것이 좋습니다 [임상 약리학(12.3) 참조].
8.7 간장애
RINVOQ/RINVOQ LQ는 중증 간장애(Child Pugh C) 환자에서 연구된 바 없으므로 권장하지 않습니다 [용량 및 투여 방법(2.11) 및 임상 약리학(12.3) 참조].
류마티스 관절염, 건선성 관절염, 아토피 피부염, 강직성 척추염, 방사선 비관찰형 축성 척추관절염 또는 소아 특발성 관절염 환자의 경우 경도(Child Pugh A) 또는 중등도(Child Pugh B) 간장애 환자에서 용량 조절이 필요하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 경도에서 중등도 간장애에 대한 RINVOQ의 권장 용량은 유도 요법의 경우 1일 1회 30mg이고 유지 요법의 경우 1일 1회 15mg입니다 [용량 및 투여 방법(2.11) 참조].
11. 성분
RINVOQ 및 RINVOQ LQ는 JAK 억제제인 upadacitinib으로 제형화되었습니다.
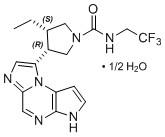
Upadacitinib의 화학적 이름은 다음과 같습니다: (3S,4R)-3-Ethyl-4-(3H-imidazo[1,2-a]pyrrolo[2,3-e]pyrazin-8-yl)-N-(2,2,2-trifluoroethyl)pyrrolidine-1-carboxamide hydrate (2:1).
Upadacitinib의 약효는 무수 upadacitinib을 기반으로 합니다. 37 oC에서 pH 2 ~ 9 범위에서 물에서 upadacitinib의 용해도는 38에서 0.2 mg/mL 미만입니다.
Upadacitinib의 분자량은 389.38g/mol이며 분자식은 C17H19F3N6O • ½ H2O입니다. Upadacitinib의 화학 구조는 다음과 같습니다:
RINVOQ 15mg 경구 투여용 서방성 정제는 자주색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a15’가 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 제로소철산화물, 하이프로멜로오스, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ 30 mg 경구 투여용 서방성 정제는 빨강색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a30’이 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 하이프로멜로오스, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ 45mg 경구 투여용 서방성 정제는 노랑색에서 얼룩진 노랑색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a45’가 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 하이프로멜로오스, 산화철황색, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ LQ 경구용 용액은 1mg/mL 투명하며, 무색에서 옅은 황색 용액입니다. 1 mL의 RINVOQ LQ마다 upadacitinib의 자유 염기 1mg(upadacitinib 반수화물 1.02mg에 해당) 및 다음과 같은 비활성 성분이 포함되어 있습니다. 무수 구연산, 정제수, 벤조산나트륨, 시트르산나트륨 이수화물 및 수크랄로스.
12. 임상 약리학
12.1 작용 기전
Upadacitinib는 야누스 키나제(JAK) 억제제입니다. JAK는 세포막에서 사이토카인 또는 성장 인자-수용체 상호 작용으로 발생하는 신호를 전달하여 조혈 및 면역 세포 기능의 세포 과정에 영향을 미치는 세포 내 효소입니다. 신호 전달 경로 내에서 JAK는 유전자 발현을 포함한 세포 내 활성을 조절하는 신호 변환기 및 전사 활성화 인자(STAT)를 인산화하고 활성화합니다. Upadacitinib는 JAK 지점에서 신호 전달 경로를 조절하여 STAT의 인산화 및 활성화를 방지합니다.
JAK 효소는 쌍을 이루어 사이토카인 신호를 전달합니다(예: JAK1/JAK2, JAK1/JAK3, JAK1/TYK2, JAK2/JAK2, JAK2/TYK2). 세포가 없는 분리된 효소 분석에서 upadacitinib는 JAK3 및 TYK2에 비해 JAK1 및 JAK2에서 더 큰 억제 효능을 보였습니다. 인간 백혈구 세포 분석에서 upadacitinib는 JAK2/JAK2 매개 STAT 인산화보다 JAK1 및 JAK1/JAK3에 의해 매개되는 사이토카인 유도 STAT 인산화를 더 강력하게 억제했습니다. 치료 효과에 대한 특정 JAK 효소 억제의 관련성은 현재 알려져 있지 않습니다.
12.2 약력학
IL-6 에 의한 STAT3 및 IL-7 에 의한 STAT5 인산화 억제
건강한 지원자에서 upadacitinib(속방성 제형)를 투여한 결과 전혈에서 IL-6(JAK1/JAK2)에 의해 유도된 STAT3 및 IL-7(JAK1/JAK3)에 의해 유도된 STAT5 인산화가 용량 및 농도 의존적으로 억제되었습니다. 최대 억제는 투여 1시간 후에 관찰되었으며 투여 간격이 끝날 무렵 기준치에 가깝게 돌아왔습니다.
림프구
류마티스 관절염 환자에서 upadacitinib 치료는 36주까지 기준치에서 평균 ALC가 약간 일시적으로 증가하는 것과 관련이 있었으며, 이는 지속적인 치료로 점차 기준치 수준 또는 그 근처로 돌아왔습니다.
면역글로불린
류마티스 관절염 환자에서 대조군 기간 동안 upadacitinib 치료를 받은 경우 평균 IgG 및 IgM 수치가 기준치에서 약간 감소한 것으로 나타났습니다. 그러나 기준치 및 모든 방문에서 평균값은 정상 참조 범위 내에 있었습니다.
심장 전기 생리학
1일 1회 최대 치료 용량인 45mg의 평균 노출량의 2.5배에서 QTc 간격에 대한 임상적으로 관련된 영향은 없었습니다.
12.3 약동학
Upadacitinib 혈장 노출은 치료 용량 범위에서 용량에 비례합니다. 건강한 피험자에게 공복 상태에서 RINVOQ 15mg, 30mg, 45mg 정제를 단회 투여한 후 평균 Cmax는 각각 31.6ng/mL, 71.8ng/mL, 90.7ng/mL였으며 평균 AUCinf는 각각 265ng·h/mL, 543ng·h/mL, 752ng·h/mL였습니다. 1일 1회 투여 후 최소한의 축적으로 4일 이내에 항정 상태 혈장 농도에 도달합니다. pJIA 및 건선성 관절염 환자에게 권장되는 소아 용량(표 1, 표 2)을 투여한 후 평균 항정 상태 Cmax는 47.6ng/mL로 예측되고 평균 항정 상태 AUC0-24는 342ng·h/mL로 예측됩니다. Upadacitinib 약동학은 류마티스 관절염, 건선성 관절염, 아토피 피부염, 궤양성 대장염, 크론병, 강직성 척추염 및 방사선학적 음성 축성 척추관절염 환자 간에 비슷합니다.
RINVOQ 정제와 RINVOQ LQ는 생물학적 동등성이 없습니다. 따라서 2가지 제형은 밀리그램당 밀리그램 기준으로 교체할 수 없습니다 [2.2 용법 및 용량 참조].
흡수
RINVOQ 서방형 정제를 경구 투여한 후 upadacitinib는 2~4시간의 중앙값 Tmax로 흡수됩니다. 6mg RINVOQ LQ를 경구 투여한 후 upadacitinib는 1시간의 중앙값 Tmax로 흡수됩니다.
RINVOQ 정제를 고지방/고칼로리 식사와 함께 투여해도 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않았습니다(AUCinf는 29%, Cmax는 39~60% 증가). RINVOQ LQ를 음식과 함께 투여해도 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않을 것으로 예상됩니다 [2.2 용법 및 용량 참조].
분포
Upadacitinib는 혈장 단백질에 52% 결합합니다. Upadacitinib는 혈액 대 혈장 비율이 1.0인 혈장과 혈액 세포 성분 사이에 유사하게 분포합니다.
제거
대사
Upadacitinib 대사는 주로 CYP3A4에 의해 매개되며 CYP2D6의 기여는 적습니다. upadacitinib의 약리학적 활성은 모체 분자에 기인합니다. 인간 방사성 표지 연구에서 변하지 않은 upadacitinib는 혈장에서 총 방사능의 79%를 차지했으며, 검출된 주요 대사 산물(모노옥시게나아제에 이은 글루쿠론산화 생성물)은 총 혈장 방사능의 13%를 차지했습니다. upadacitinib의 활성 대사 산물은 확인되지 않았습니다.
배설
[14C]-upadacitinib 속방성 용액을 단회 투여한 후 upadacitinib는 주로 변하지 않은 모체 약물로 소변(24%)과 대변(38%)으로 배설되었습니다. upadacitinib 용량의 약 34%가 대사 산물로 배설되었습니다. Upadacitinib의 평균 말기 제거 반감기는 8~14시간이었습니다.
특정 집단
체중, 성별 및 인종
체중, 성별, 인종 및 민족은 성인 환자 집단에서 upadacitinib 노출에 임상적으로 의미 있는 영향을 미치지 않았습니다.
소아 환자
활동성 다발성 관절염이 있는 소아 JIA 환자에서, upadacitinib 청소율은 체중 증가에 따라 증가했습니다. 연령(2~<18세)은 체중의 영향을 고려한 후 upadacitinib 약동학에 추가적인 영향을 미치지 않았습니다. 권장 소아 용량을 투여한 후 pJIA 및 건선성 관절염 소아 환자의 upadacitinib 혈장 노출은 각각 류마티스 관절염 및 건선성 관절염 성인 환자에서 관찰된 것과 유사할 것으로 예상됩니다.
12세 이상, 체중 40kg 이상의 아토피 피부염 소아 환자에서 성인과 비교하여 upadacitinib의 전신 노출에서 유의미한 차이가 관찰되지 않았습니다.
노인 환자
노인 환자(≥65세)에서 젊은 성인 환자와 비교하여 upadacitinib의 약동학에서 임상적으로 유의미한 차이가 관찰되지 않았습니다.
신장애 환자
15mg upadacitinib 정제를 단회 투여한 후 upadacitinib 평균 AUCinf는 경도(eGFR 60~<90mL/min/1.73m2), 중등도(eGFR 30~<60mL/min/1.73m2) 및 중증(eGFR 15~<30mL/min/1.73m2) 신장애 환자에서 정상 신기능(eGFR ≥90mL/min/1.73m2)을 가진 피험자에 비해 각각 18%, 33% 및 44% 더 높았습니다. Upadacitinib 평균 Cmax는 정상 신기능 및 신장애 환자에서 유사했습니다. RINVOQ/RINVOQ LQ를 투여받는 환자에서 경도 및 중등도 신장애는 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않을 것으로 예상됩니다[용량 및 투여 방법(2.11) 및 특정 집단에서의 사용(8.6) 참조] .
간장애 환자
15mg upadacitinib 정제를 단회 투여한 후 upadacitinib 평균 AUCinf는 경도(Child-Pugh A) 및 중등도(Child-Pugh B) 간장애 환자에서 정상 간기능을 가진 피험자에 비해 각각 28% 및 24% 더 높았습니다. Upadacitinib 평균 Cmax는 경도 간장애 환자에서 변화가 없었고 중등도 간장애 환자에서 정상 간기능을 가진 피험자에 비해 43% 더 높았습니다. Upadacitinib은 중증 간장애(Child-Pugh C) 환자에서 연구되지 않았습니다[용량 및 투여 방법(2.11) 및 특정 집단에서의 사용(8.7) 참조] .
약물 상호 작용 연구
다른 약물이 Upadacitinib의 약동학에 영향을 미칠 가능성
Upadacitinib은 CYP2D6의 경미한 기여와 함께 CYP3A4에 의해 in vitro에서 대사됩니다. 병용 투여되는 약물이 upadacitinib 혈장 노출에 미치는 영향은 표 10에 나와 있습니다[약물 상호 작용(7) 참조] .
표 10: 병용 투여되는 약물 존재 시 Upadacitinib의 약동학적 변화
병용
투여되는
약물
병용
투여되는
약물의
요법
비율
(90% CI)a
Cmax
AUC
Methotrexate
10~25mg/주
0.97
(0.86-1.09)
0.99
(0.93-1.06)
강력한 CYP3A4 억제제:
Ketoconazole
400mg 1일 1회
x 6일
1.70
(1.55-1.89)
1.75
(1.62-1.88)
강력한 CYP3A4 유도제:
Rifampin
600mg 1일 1회
x 9일
0.49
(0.44-0.55)
0.39
(0.37-0.42)
OATP1B 억제제:
Rifampin
600mg 단회 투여
1.14
(1.02-1.28)
1.07
(1.01-1.14)
CI: 신뢰 구간
a Cmax 및 AUC에 대한 비율은 upadacitinib과 약물의 병용 투여 대 upadacitinib 단독 투여를 비교한 것입니다.
pH modifying medications (e.g., antacids or proton pump inhibitors)는 in vitro 평가 및 모집단 약동학 분석에 근거하여 upadacitinib 혈장 노출에 영향을 미치지 않을 것으로 예상됩니다. CYP2D6 대사 표현형은 upadacitinib 약동학에 영향을 미치지 않았습니다(모집단 약동학 분석 기준). 이는 CYP2D6 억제제가 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않음을 나타냅니다.
Upadacitinib이 다른 약물의 약동학에 미치는 영향 가능성
In vitro 연구에 따르면 upadacitinib은 임상적으로 관련된 농도에서 사이토크롬 P450(CYP) 효소(CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4)의 활성을 억제하지 않습니다. In vitro 연구에 따르면 upadacitinib은 CYP3A4를 유도하지만 임상적으로 관련된 농도에서 CYP2B6 또는 CYP1A2를 유도하지 않습니다. In vitro 연구에 따르면 upadacitinib은 임상적으로 관련된 농도에서 P-gp, BCRP, OATP1B1, OATP1B3, OCT1, OCT2, OAT1, OAT3, MATE1, MATE2K 수송체를 억제하지 않습니다.
임상 연구에 따르면 upadacitinib은 병용되는 약물의 약동학에 임상적으로 관련된 영향을 미치지 않습니다. upadacitinib 30mg 및 45mg 정제를 1일 1회 투여한 후 CYP2D6에 대한 영향을 제외하고 각 CYP 효소(CYP1A2, CYP3A, CYP2C9, CYP2C19)에 대한 영향은 두 용량 간에 유사했습니다. upadacitinib 30mg 및 45mg 정제를 1일 1회 투여한 후 CYP3A4의 약한 유도가 관찰되었습니다. CYP2D6의 약한 억제는 upadacitinib 45mg에서 관찰되었지만 30mg에서는 관찰되지 않았습니다. upadacitinib이 다른 약물에 미치는 영향을 평가한 임상 연구 결과 요약은 표 11에 나와 있습니다.
표 11: Upadacitinib 존재 하에 병용되는 약물 또는 CYP 활성의 생체 내 마커의 약동학적 변화
병용되는
약물 또는 CYP
활성 마커
다회 투여
요법
Upadacitinib
비율
(90% CI)a
Cmax
AUC
Methotrexate
6mg~24mg BIDb
1.03
(0.86-1.23)
1.14
(0.91-1.43)
민감한 CYP1A2 기질:
카페인
45mg QDc
1.05
(0.97-1.14)
1.04
(0.95-1.13)
민감한 CYP3A 기질:
Midazolam
30mg QDc
0.74
(0.68-0.80)
0.74
(0.68-0.80)
민감한 CYP3A 기질:
Midazolam
45mg QDc
0.75
(0.69 -0.83)
0.76
(0.69 -0.83)
민감한 CYP2D6 기질:
Dextromethorphan
30mg QDc
1.09
(0.98-1.21)
1.07
(0.95-1.22)
민감한 CYP2D6 기질:
Dextromethorphan
45mg QDc
1.30
(1.13-1.50)
1.35
(1.18-1.54)
민감한 CYP2C9 기질:
S-Warfarin
45mg QDc
1.18
(1.05-1.33)
1.12
(1.05-1.20)
민감한 CYP2C19 마커:
5-OH Omeprazole 대
Omeprazole 대사 비율
45mg QDc
—
0.96
(0.90-1.02)
CYP2B6 기질:
Bupropion
30mg QDc
0.87
(0.79-0.96)
0.92
(0.87-0.98)
Rosuvastatin
30mg QDc
0.77
(0.63-0.94)
0.67
(0.56-0.82)
Atorvastatin
30mg QDc
0.88
(0.79-0.97)
0.77
(0.70-0.85)
Ethinylestradiol
30mg QDc
0.96
(0.89-1.02)
1.11
(1.04-1.19)
Levonorgestrel
30mg QDc
0.96
(0.87-1.06)
0.96
(0.85-1.07)
CYP: 시토크롬 P450; CI: 신뢰 구간; BID: 하루 2회; QD: 하루 1회
a Cmax 및 AUC 비율은 우파다시티닙과 함께 투여한 약물과 약물 단독 투여를 비교합니다.
b 즉시 방출 제형
c 지속 방출 정제 제형
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
업다시티닙의 발암 가능성은 Sprague-Dawley 랫트와 Tg.rasH2 마우스에서 평가되었습니다. 최대 101주 동안 경구 투여량이 각각 최대 15 또는 20 mg/kg/day인 수컷 또는 암컷 랫트에서 종양 발생 증거는 관찰되지 않았습니다(각각 15 mg 정제 투여량의 약 4배 및 10배, 30 mg 정제 투여량의 2배 및 5배, 그리고 AUC 기준으로 45 mg의 최대 권장 인체 투여량(MRHD)의 1.6배 및 4배). 최대 26주 동안 경구 투여량이 최대 20 mg/kg/day인 수컷 또는 암컷 Tg.rasH2 마우스에서 종양 발생 증거는 관찰되지 않았습니다.
돌연변이 유발성
업다시티닙은 다음 유전 독성 검사에서 음성으로 판명되었습니다. in vitro 박테리아 돌연변이 유발성 검사(Ames 검사), in vitro 인간 말초 혈액 림프구의 염색체 이상 검사, 그리고 in vivo 랫트 골수 미세핵 검사.
생식능력 저해
업다시티닙은 수컷의 경우 최대 50 mg/kg/day, 암컷의 경우 최대 75 mg/kg/day의 경구 투여량에서 수컷 또는 암컷 랫트의 생식력에 영향을 미치지 않았습니다(각각 15 mg 투여량의 약 42배 및 84배, 30 mg 투여량의 22배 및 43배, 그리고 AUC 기준으로 MRHD의 16배 및 31배). 그러나, 임신 유지가 25 mg/kg/day 및 75 mg/kg/day의 경구 투여량에서 불리하게 영향을 받았습니다. 이는 투여량 관련 증가된 착상 후 손실(증가된 흡수) 및 1 마리당 평균 생존 배아 수 감소(각각 15 mg 정제 투여량의 약 22배 및 84배, 30 mg 정제 투여량의 11배 및 43배, 그리고 AUC 기준으로 MRHD의 8배 및 31배)의 발견에 근거합니다. 5 mg/kg/day의 경구 투여량으로 업다시티닙을 투여받고 같은 투여량을 투여받은 수컷과 교배된 암컷 랫트에서 생존 배아 수는 영향을 받지 않았습니다(각각 15 mg 투여량의 약 2배, 30 mg 투여량의 0.9배, 그리고 AUC 기준으로 MRHD의 0.6배).
14 임상 연구
14.1 류마티스 관절염
RINVOQ 15 mg 1일 1회 용량의 유효성 및 안전성은 중등도 내지 중증의 활동성 류마티스 관절염이 있고 ACR/EULAR 2010 분류 기준을 충족하는 환자를 대상으로 한 5건의 무작위배정, 이중맹검, 다기관 3상 임상시험에서 평가되었습니다. 18세 이상의 환자가 참여할 수 있었습니다. 기저 시점에 최소 6개의 압통 관절과 6개의 종창 관절이 있고 hsCRP 상승에 근거한 전신 염증의 증거가 요구되었습니다. 다른 용량도 연구되었지만, 권장 RINVOQ 용량은 1일 1회 15mg입니다.
RA-I 임상시험(NCT02706873)은 메토트렉세이트(MTX)를 투여한 적이 없는 중등도 내지 중증의 활동성 류마티스 관절염 환자 947명을 대상으로 한 24주간의 단독 요법 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 경구 투여받거나 MTX를 단독 요법으로 투여받았습니다. 26주차에 우파다시티닙을 투여받은 반응이 없는 환자는 MTX를 추가하여 rescue할 수 있었고, MTX를 투여받은 환자는 맹검된 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 추가하여 rescue할 수 있었습니다. 1차 평가변수는 12주차에 ACR50 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 질병 활성도 점수(DAS28-CRP) ≤3.2, 24주차에 DAS28-CRP <2.6, 12주차에 HAQ-DI의 기저 시점 대비 변화, 24주차에 van der Heijde 수정 총 Sharp 점수(mTSS)의 기저 시점 대비 변화가 포함되었습니다.
RA-II 임상시험(NCT02706951)은 MTX에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 648명을 대상으로 한 14주간의 단독 요법 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 단독 요법으로 투여받거나 안정적인 용량의 MTX 단독 요법을 계속 투여받았습니다. 14주차에 MTX 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 단독 요법으로 전환되었습니다. 1차 평가변수는 14주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 14주차에 DAS28-CRP ≤3.2, DAS28-CRP <2.6, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
RA-III 임상시험(NCT02675426)은 기존의 질병 조절 항류마티스제(cDMARD)에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 661명을 대상으로 한 12주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 투여받거나 위약을 배경 cDMARD 요법에 추가하여 투여받았습니다. 12주차에 위약 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, DAS28-CRP<2.6, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
RA-IV 임상시험(NCT02629159)은 MTX에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 1,629명을 대상으로 한 48주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 1일 1회, 활성 비교제 또는 위약을 배경 MTX에 추가하여 투여받았습니다. 14주차부터 RINVOQ 15mg을 투여받은 반응이 없는 환자는 맹검 방식으로 활성 비교제로 rescue할 수 있었고, 활성 비교제 또는 위약을 투여받은 반응이 없는 환자는 맹검 방식으로 RINVOQ 15mg으로 rescue할 수 있었습니다. 26주차에 위약 무작위배정을 받은 모든 환자들은 맹검 방식으로 RINVOQ 15mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 위약 대비 ACR20 반응을 달성한 환자의 비율이었습니다. 위약 대비 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, DAS28-CRP <2.6, HAQ-DI의 기저 시점 대비 변화, 26주차에 mTSS의 기저 시점 대비 변화가 포함되었습니다.
RA-V 임상시험(NCT02706847)은 생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도 내지 중증의 활동성 류마티스 관절염 환자 499명을 대상으로 한 12주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 투여받거나 위약을 배경 cDMARD 요법에 추가하여 투여받았습니다. 12주차에 위약 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
임상 반응
모든 임상시험에서 ACR20, ACR50 및 ACR70 반응과 DAS28(CRP) < 2.6을 달성한 RINVOQ 치료 환자의 비율은 표 12에 나와 있습니다.
단독으로 또는 cDMARD와 병용하여 RINVOQ 15mg으로 치료받은 환자는 1차 유효성 평가 시점에 각각 MTX 단독 요법 또는 위약에 비해 더 높은 ACR 반응률을 달성했습니다(표 12).
임상시험 IV에서 방문별 ACR20 반응을 달성한 환자의 비율은 그림 1에 나와 있습니다.
RA-III 및 RA-V 임상시험에서 RINVOQ 15mg을 투여받은 환자는 위약군에 비해 1주차에 더 높은 ACR20 반응률을 보였습니다.
단독으로 또는 cDMARD와 병용한 RINVOQ 15mg 치료는 1차 유효성 평가 시점에 MTX 또는 위약에 비해 ACR 구성 요소에서 더 큰 개선을 가져왔습니다(표 13).
표 12: RA-I, RA-II, RA-III, RA-IV 및 RA V 임상시험의 RA 환자에 대한 임상 반응
RA-I 임상시험
MTX-Naïve
RA-II 임상시험
MTX-IR
RA-III 임상시험
cDMARD-IR
RA-IV 임상시험
MTX-IR
RA-V 임상시험
bDMARD-IR
단독 요법
단독 요법
배경
cDMARD
배경
MTX
배경
cDMARD
MTX
RINVOQ
15 mg
%
Δ (95% CI)
MTX
RINVOQ
15 mg
%
Δ (95% CI)
PBO
RINVOQ
15 mg
%
Δ (95% CI)
PBO
RINVOQ
15 mg
%
Δ (95% CI)
PBO
RINVOQ
15 mg
%
Δ (95% CI)
N
314
317
216
217
221
221
651
651
169
164
주
ACR20
12a/14b
54
76
22 (14, 29)
41
68
26 (17, 36)
36
64
28 (19, 37)
36
71
34 (29, 39)
28
65
36 (26, 46)
24c/26d
59
79
20 (13, 27)
36
67
32 (27, 37)
ACR50
12a/14b
28
52
24 (16, 31)
15
42
27 (18, 35)
15
38
23 (15, 31)
15
45
30 (26, 35)
12
34
22 (14, 31)
24c/26d
33
60
27 (19, 34)
21
54
33 (28, 38)
ACR70
12a/14b
14
32
18 (12, 25)
3
23
20 (14, 26)
6
21
15 (9, 21)
5
25
20 (16, 24)
7
12
5 (-1, 11)
24c/26d
18
44
26 (19, 33)
10
35
25 (21, 29)
DAS28-CRP <2.6
12a/14b
14
36
22 (15, 28)
8
28
20 (13, 27)
10
31
21 (14, 28)
6
29
23 (19, 27)
9
29
19 (11, 27)
24c/26d
18
48
30 (23, 37)
9
41
32 (27, 36)
약어: ACR20(또는 50 또는 70) = 미국 류마티스 학회 ≥20%(또는 ≥50% 또는 ≥70%) 개선; bDMARD = 생물학적 질병 조절 항류마티스제; CRP = C-반응성 단백질; DAS28 = 28개 관절 질병 활성도 점수; cDMARD = 기존의 질병 조절 항류마티스제; MTX = 메토트렉세이트; PBO = 위약; IR = 불충분한 반응자
무작위 배정 치료를 중단했거나, 무작위 배정 치료 간에 교차했거나, 평가 주에 데이터가 없는 환자는 분석에서 무반응자로 대체되었습니다.
a 임상시험 RA-I, 임상시험 RA-III, 임상시험 RA-IV, 임상시험 RA-V
b 임상시험 RA-II
c 임상시험 RA-I
d 임상시험 RA-IV
표 13: 1차 유효성 평가 시점에서 ACR 반응 구성 요소a
시험 RA-I
MTX-Naïve
시험 RA-IIb
MTX-IR
시험 RA-III
cDMARD-IR
시험 RA-IV
MTX-IR
시험 RA-V
bDMARD-IR
단독 요법
단독 요법
배경
cDMARD
배경
MTX
배경
cDMARD
MTX
RINVOQ
15 mg
MTX
RINVOQ
15 mg
PBO
RINVOQ
15 mg
PBO
RINVOQ
15 mg
PBO
RINVOQ
15 mg
N
314
317
216
217
221
221
651
651
169
164
압통 관절 수(0-68)
기준선
26
(16)
25
(14)
25
(16)
24
(15)
25
(15)
25
(14)
26
(14)
26
(15)
28
(15)
28
(16)
12/14주차
13
(15)
9
(12)
15
(16)
10
(13)
16
(17)
12
(14)
16
(15)
10
(13)
18
(17)
11
(14)
종창 관절 수(0-66)
기준선
17
(11)
17
(10)
17
(12)
16
(11)
15
(9)
16
(10)
16
(9)
17
(10)
16
(10)
17
(11)
12/14주차
6
(8)
5
(7)
9
(11)
6
(9)
9
(10)
7
(10)
9
(9)
5
(7)
9
(10)
6
(8)
통증c
기준선
66
(21)
68
(21)
63
(21)
62
(23)
62
(21)
64
(19)
65
(21)
66
(21)
69
(21)
68
(20)
12/14주차
41
(25)
31
(25)
49
(25)
36
(27)
51
(26)
33
(24)
49
(25)
33
(24)
55
(28)
41
(28)
환자 전체 평가c
기준선
66
(21)
67
(22)
60
(22)
62
(22)
60
(20)
63
(22)
64
(21)
64
(22)
66
(23)
67
(20)
12/14주차
42
(25)
31
(24)
48
(26)
37
(27)
50
(26)
32
(24)
48
(24)
33
(24)
54
(28)
40
(26)
장애 지수(HAQ-DI)d
기준선
1.60
(0.67)
1.60
(0.67)
1.47
(0.66)
1.47
(0.66)
1.42
(0.63)
1.48
(0.61)
1.61
(0.61)
1.63
(0.64)
1.56
(0.60)
1.67
(0.64)
12/14주차
1.08
(0.72)
0.76
(0.69)
1.19
(0.69)
0.86
(0.67)
1.13
(0.70)
0.85
(0.66)
1.28
(0.67)
0.98
(0.68)
1.33
(0.66)
1.24
(0.77)
의사 전체 평가c
기준선
69
(16)
67
(17)
62
(17)
66
(18)
64
(18)
64
(16)
66
(18)
66
(17)
67
(17)
69
(17)
12/14주차
32
(22)
22
(19)
37
(24)
26
(21)
41
(24)
26
(21)
41
(25)
27
(21)
39
(25)
29
(22)
CRP (mg/L)
기준선
21.2
(22.1)
23.0
(27.4)
14.5
(17.3)
14.0
(16.5)
12.6
(14.0)
16.6
(19.2)
18.0
(21.5)
17.9
(22.5)
16.3
(21.1)
16.3
(18.6)
12/14주차
10.9
(14.9)
4.2
(8.8)
12.8
(21.4)
3.7
(7.8)
13.1
(15.5)
4.6
(9.6)
16.2
(19.8)
5.5
(10.9)
13.9
(17.3)
5.0
(14.0)
약어: ACR = 미국 류마티스 학회, bDMARD = 생물학적 질병 조절 항류마티스제, CRP = C-반응성 단백질, cDMARD = 기존의 질병 조절 항류마티스제, HAQ-DI = 건강 평가 설문지 장애 지수, IR = 불충분한 반응자, MTX = 메토트렉세이트, PBO = 위약
a 표시된 데이터는 평균(표준 편차)입니다.
b 1차 유효성 평가 시점은 14주차입니다.
c 시각 아날로그 척도: 0 = 최상, 100 = 최악.
d 건강 평가 설문지-장애 지수: 0=최상, 3=최악, 20개 문항, 8개 범주: 옷 입기 및 몸단장, 일어서기, 식사, 걷기, 위생, 뻗기, 잡기 및 활동.
그림 1. RA-IV 임상시험에서 ACR20에 도달한 환자의 비율
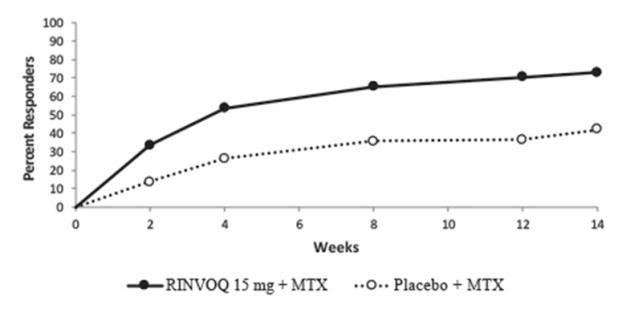
약어: ACR20 = 미국 류마티스 학회 ≥20% 개선; MTX = 메토트렉세이트
무작위 배정 치료를 중단했거나, ACR20 결과가 누락되었거나, 추적 관찰이 손실되었거나, 임상시험에서 철회된 환자는 반응하지 않은 것으로 간주되었습니다.
RA-I 및 RA-IV에서 1차 유효성 평가 시점에 MTX 또는 위약에 비해 RINVOQ 15mg을 단독으로 또는 MTX와 병용하여 치료받은 환자의 비율이 DAS28-CRP < 2.6에 도달했습니다(표 14).
표 14: 1차 유효성 평가 시점에 잔여 활성 관절 수를 가진 DAS28-CRP가 2.6 미만인 환자의 비율
임상시험 RA-I
MTX-naïve
단독 요법
DAS28-CRP 2.6 미만
MTX
N = 314
RINVOQ 15mg
N = 317
12주차 반응자 비율(n)
14%(43)
36%(113)
반응자 중 활성 관절이 0개인 비율(n)
51%(22)
45%(51)
반응자 중 활성 관절이 1개인 비율(n)
35%(15)
23%(26)
반응자 중 활성 관절이 2개인 비율(n)
9%(4)
17%(19)
반응자 중 활성 관절이 3개 이상인 비율(n)
5%(2)
15%(17)
임상시험 RA-IV
MTX-IR
배경 MTX
DAS28-CRP 2.6 미만
PBO
N = 651
RINVOQ 15mg
N = 651
12주차 반응자 비율(n)
6%(40)
29%(187)
반응자 중 활성 관절이 0개인 비율(n)
60%(24)
48%(89)
반응자 중 활성 관절이 1개인 비율(n)
20%(8)
23%(43)
반응자 중 활성 관절이 2개인 비율(n)
15%(6)
13%(25)
반응자 중 활성 관절이 3개 이상인 비율(n)
5%(2)
16%(30)
약어: CRP = C-반응성 단백질; DAS28 = 28개 관절 질병 활성도 점수; MTX = 메토트렉세이트; PBO = 위약; IR = 불충분한 반응자
방사선학적 반응
Trial RA-IV의 26주차와 Trial RA-I의 24주차에 수정 총 Sharp 점수(mTSS)와 그 구성 요소인 미란 점수 및 관절 간격 협착 점수를 사용하여 구조적 관절 손상 진행 억제를 평가했습니다. 방사선학적 진행이 없는 환자의 비율(기준치 대비 mTSS 변화 ≤ 0)도 평가했습니다.
Trial RA-IV에서 RINVOQ 15mg을 투여한 경우 26주차에 cDMARD와 병용했을 때 위약에 비해 구조적 관절 손상의 진행을 억제했습니다(표 15). 미란 및 관절 간격 협착 점수 분석 결과는 전체 결과와 일치했습니다.
위약 + MTX군에서는 환자의 76%가 26주차에 방사선학적 진행을 보이지 않은 반면, RINVOQ 15mg을 투여받은 환자는 83%가 방사선학적 진행을 보이지 않았습니다.
Trial RA-I에서 RINVOQ 15mg 단독 요법을 투여한 경우 24주차에 MTX 단독 요법에 비해 구조적 관절 손상의 진행을 억제했습니다(표 15). 미란 및 관절 간격 협착 점수 분석 결과는 전체 결과와 일치했습니다.
MTX 단독 요법군에서는 환자의 78%가 24주차에 방사선학적 진행을 보이지 않은 반면, RINVOQ 15mg 단독 요법을 투여받은 환자는 87%가 방사선학적 진행을 보이지 않았습니다.
표 15: 방사선학적 변화
시험 RA-IV
MTX-IR
배경 MTX
mTSS
PBO
(N=651)
평균(SD)
RINVOQ 15mg
(N=651)
평균(SD)
26주차에서 PBO 대비 추정 차이
(95% CI)a
기준치
35.9(52)
34.0(50)
26주차b
0.78(0.1)
0.15(0.1)
-0.63(-0.92, -0.34)
시험 RA-I
MTX-naïve
단독 요법
MTX
(N=309)
평균(SD)
RINVOQ 15mg
(N=309)
평균(SD)
24주차에서 MTX 대비 추정 차이
(95% CI)c
기준치
13.3(31)
18.1(38)
24주차d
0.67(2.8)
0.14(1.4)
-0.53(-0.85, -0.20)
약어: mTSS = 수정 총 Sharp 점수, MTX = 메토트렉세이트, PBO = 위약, SD = 표준 편차, IR = 불충분한 반응자, bDMARD = 생물학적 질환 조절 항류마티스제, LS = 최소 제곱, CI = 신뢰 구간
a 시간, 치료군, 이전 bDMARD 사용, 치료군별 시간 상호 작용에 따라 조정하고 무작위 기울기와 무작위 절편을 사용하여 mTSS 값에 맞는 무작위 계수 모형을 기반으로 한 LS 평균 및 95% CI입니다.
b 26주차까지의 구조적 진행의 추정 선형 비율과 표준 오차가 표시되어 있습니다.
c 치료군, 기준치 mTSS 및 지역에 따라 조정하여 기준치 대비 mTSS 변화에 맞는 선형 회귀 모형을 기반으로 한 LS 평균 및 95% CI입니다.
d 기준치 대비 평균 변화량과 표준 편차가 표시되어 있습니다.
신체 기능 반응
단독 또는 cDMARD와 병용하여 RINVOQ 15mg으로 치료한 결과, HAQ-DI로 측정했을 때 모든 비교군에 비해 12/14주차에 신체 기능이 더 크게 개선되었습니다.
기타 건강 관련 결과
RA-V 시험을 제외한 모든 시험에서 RINVOQ 15mg을 투여받은 환자는 cDMARD 또는 MTX 단독 요법과 병용하여 위약을 투여받은 환자에 비해 12/14주차에 신체 구성 요약(PCS) 점수, 정신 구성 요약(MCS) 점수 및 단축형 건강 설문(SF-36)의 8가지 모든 영역에서 기준치 대비 더 큰 개선을 보였습니다.
피로는 RA-I, RA-III 및 RA-IV 시험에서 만성 질환 치료 기능 평가-피로 점수(FACIT-F)로 평가했습니다. cDMARD 또는 MTX 단독 요법과 병용하여 위약을 투여받은 환자에 비해 RINVOQ 15mg으로 치료받은 환자에서 12주차에 피로 개선이 관찰되었습니다.
14.2 건선성 관절염
중등도에서 중증의 활동성 건선성 관절염이 있는 18세 이상의 환자를 대상으로 한 두 건의 3상 무작위배정, 이중맹검, 다기관, 위약 대조 시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다. 모든 환자는 건선성 관절염 분류 기준(CASPAR)에 따라 최소 6개월 동안 활동성 건선성 관절염을 앓았고, 최소 3개의 압통 관절과 최소 3개의 종창 관절이 있었으며, 활동성 판상 건선 또는 판상 건선 병력이 있었습니다. 다른 용량도 연구되었지만, 건선성 관절염에 권장되는 RINVOQ 용량은 1일 1회 15mg입니다.
PsA-I 시험(NCT03104400)은 하나 이상의 비생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 건선성 관절염 환자 1705명을 대상으로 한 24주간의 시험이었습니다. 환자들은 RINVOQ 15mg 또는 upadacitinib 30mg을 1일 1회, adalimumab 또는 위약을 단독으로 또는 배경 비생물학적 DMARD와 병용하여 투여받았습니다. 24주차에 위약을 무작위로 배정받은 모든 환자는 맹검 방식으로 RINVOQ 15mg 또는 upadacitinib 30mg 1일 1회로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다.
PsA-II 시험(NCT03104374)은 하나 이상의 생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 건선성 관절염 환자 642명을 대상으로 한 24주간의 시험이었습니다. 환자들은 RINVOQ 15mg 또는 upadacitinib 30mg을 1일 1회 또는 위약을 단독으로 또는 배경 비생물학적 DMARD와 병용하여 투여받았습니다. 24주차에 위약을 무작위로 배정받은 모든 환자는 맹검 방식으로 RINVOQ 15mg 또는 upadacitinib 30mg 1일 1회로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다.
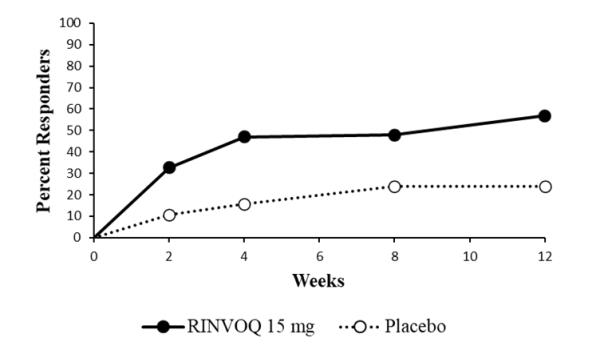
임상 반응
두 시험 모두에서 RINVOQ 15mg으로 치료받은 환자는 12주차에 위약에 비해 유의하게 더 높은 ACR20 반응을 달성했습니다(표 16, 그림 2). 위약에 비해 RINVOQ 15mg으로 치료받은 환자의 비율이 더 높았습니다. 12주차에 ACR50 및 ACR70 반응을 달성했습니다.
RINVOQ 15mg으로 치료한 결과 1차 유효성 평가 시점에 위약에 비해 ACR 구성 요소가 개선되었습니다(표 17).
표 16: 임상 반응
시험
시험 PsA-I
비생물학적 DMARD-IR
시험 PsA-II
bDMARD-IR
치료군
PBO
%
RINVOQ
15mg
%
Δ (95% CI)
PBO
%
RINVOQ
15mg
%
Δ (95% CI)
N
423
429
212
211
ACR20
12주차
36
71
35 (28, 41)
24
57
33 (24, 42)
ACR50
12주차
13
38
24 (19, 30)
5
32
27 (20, 34)
ACR70
12주차
2
16
13 (10, 17)
1
9
8 (4, 12)
약어: ACR20(또는 50 또는 70) = 미국 류마티스 학회 ≥20%(또는 ≥50% 또는 ≥70%) 개선, bDMARD = 생물학적 질병 조절 항류마티스제; IR = 불충분한 반응자; PBO = 위약
무작위 치료를 중단했거나 평가 주에 데이터가 없는 환자는 분석에서 무반응자로 대체되었습니다.
표 17: ACR 반응의 구성 요소a
시험
시험 PsA-I
비생물학적 DMARD-IR
시험 PsA-II
bDMARD-IR
치료군
PBO
(N=423)
RINVOQ
15 mg
(N=429)
PBO
(N=212)
RINVOQ
15 mg
(N=211)
압통/통증 관절 수(0-68)
기준선
20.0 (14.3)
20.4 (14.7)
25.3 (17.6)
24.9 (17.3)
12주차
12.5 (13.3)
8.8 (12.5)
19.3 (18.5)
12.6 (15.6)
부종 관절 수(0-66)
기준선
11.0 (8.2)
11.6 (9.3)
12.0 (8.9)
11.3 (8.2)
12주차
5.6 (7.2)
3.5 (6.0)
7.3 (9.4)
4.4 (5.7)
환자 통증 평가b
기준선
6.1 (2.1)
6.2 (2.1)
6.6 (2.1)
6.4 (2.1)
12주차
5.1 (2.3)
3.8 (2.4)
5.9 (2.3)
4.4 (2.5)
환자의 전반적 평가b
기준선
6.3 (2.0)
6.6 (2.0)
6.8 (2.0)
6.8 (1.9)
12주차
5.2 (2.2)
3.8 (2.3)
6.1 (2.3)
4.5 (2.5)
장애 지수(HAQ-DI)c
기준선
1.1 (0.6)
1.2 (0.7)
1.2 (0.7)
1.1 (0.6)
12주차
1.0 (0.7)
0.7 (0.6)
1.1 (0.6)
0.8 (0.7)
의사의 전반적 평가b
기준선
6.5 (1.6)
6.7 (1.6)
6.5 (1.8)
6.5 (1.8)
12주차
4.3 (2.2)
3.1 (2.0)
5.0 (2.2)
3.4 (2.1)
hsCRP(mg/L)
기준선
11.5 (15.8)
11.0 (14.9)
10.4 (18.5)
11.2 (18.6)
12주차
10.1 (15.2)
4.2 (9.9)
9.4 (13.4)
4.3 (7.9)
약어: ACR = 미국 류마티스 학회, hsCRP = 고감도 C-반응성 단백질, HAQ-DI = 건강 평가 설문지-장애 지수, IR = 불충분한 반응자, PBO = 위약
a 표시된 데이터는 평균(표준 편차)입니다.
b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악
c 건강 평가 설문지-장애 지수: 0=최상, 3=최악, 20개 문항, 8개 범주: 옷 입기 및 몸단장, 일어서기, 식사, 걷기, 위생, 뻗기, 잡기, 활동.
방문별 ACR20 반응을 달성한 환자의 비율은 그림 2에 나와 있습니다.
그림 2. 시험 PsA-II에서 ACR20을 달성한 환자의 비율
약어: ACR20 = 미국 류마티스 학회 ≥20% 개선 무작위 배정 치료를 중단했거나 ACR20 결과가 누락되었거나 추적 불가능 또는 시험에서 철회된 환자는 무반응자로 귀속되었습니다.
RINVOQ 15mg으로 치료하면 이전에 수지염이나 관절염이 있었던 환자의 수지염과 관절염이 개선되었습니다.
RINVOQ 15mg으로 치료하면 PsA 환자의 피부 증상이 개선되었습니다. 그러나 RINVOQ는 판상 건선 치료에 대해 연구되지 않았으며 적응증이 없습니다.
신체 기능 반응
두 시험 모두에서 RINVOQ 15mg으로 치료받은 환자는 12주차에 HAQ-DI로 평가한 바와 같이 위약에 비해 기준치에서 신체 기능이 크게 개선되었습니다(표 16). 12주차에 기준치에서 HAQ-DI 변화의 위약과의 평균 차이(95% CI)는 시험 PsA-I에서 -0.28(-0.35, -0.22)였고 시험 PsA-II에서 -0.21(-0.30, -0.12)였습니다.
시험 PsA-I 및 시험 PsA-II에서 12주차에 HAQ-DI 반응자(HAQ-DI 점수에서 기준치에서 ≥ 0.35 개선)의 비율은 RINVOQ 15mg을 투여받은 환자에서 각각 58% 및 45%였고 위약을 투여받은 환자에서 각각 33% 및 27%였습니다.
방사선학적 반응
시험 PsA-I에서 구조적 손상 진행의 억제는 방사선학적으로 평가되었으며 24주차에 수정된 총 Sharp 점수(mTSS) 및 그 구성 요소인 미란 점수 및 관절 간격 협착 점수의 기준치에서의 변화로 표현되었습니다.
RINVOQ 15mg으로 치료하면 24주차에 위약에 비해 구조적 관절 손상의 진행이 억제되었습니다(표 18). 미란 및 관절 간격 협착 점수에 대한 분석은 전체 결과와 일치했습니다. 24주차에 방사선학적 진행이 없는(mTSS 변화 ≤ 0) 환자의 비율은 RINVOQ 15mg을 투여받은 환자에서 93%였고 위약을 투여받은 환자에서 89%였습니다.
표 18: 시험 PsA-I의 방사선학적 변화
PBO
(N=392)
평균(SD)
RINVOQ 15mg
(N=407)
평균(SD)
24주차에 PBO 대비 추정 차이
(95% CI)a
mTSS
기준치
13.32(31.2)
13.14(42.4)
24주차b
0.23(0.07)
-0.02(0.04)
-0.25(-0.41, -0.09)
약어: CI = 신뢰 구간, LS = 최소 제곱, mTSS = 수정된 총 Sharp 점수, PBO = 위약, SD = 표준 편차
a 시간, 치료군, 현재 DMARD 사용(예/아니오), 치료군별 시간 상호 작용에 대해 조정된 mTSS 값에 대한 무작위 계수 모델 적합을 기반으로 하는 LS 평균 및 95% CI, 무작위 기울기 및 무작위 절편 포함.
b 24주차까지의 구조적 진행의 추정 선형 비율과 표준 오차가 제시됩니다.
기타 건강 관련 결과
건강 관련 삶의 질은 SF-36에 의해 평가되었습니다. 두 번의 시험에서 모두, 12주에 RINVOQ 15mg를 복용한 환자들은 플라시보와 비교하여 신체적 구성 요소 종합 점수에서 기저선으로부터 유의하게 더 큰 개선을 보였습니다. 정신적 구성 요소 종합 점수와 SF-36의 모든 8개 영역에서도 플라시보와 비교하여 더 큰 개선이 관찰되었습니다.
12주에 RINVOQ 15mg를 복용한 환자들은 FACIT-F 점수로 측정된 피로에서 플라시보와 비교하여 기저선으로부터 더 큰 개선을 보였습니다.
14.3 아토픽 피부염
RINVOQ 15mg 및 30mg의 1일 1회 투여 효능은 3가지 3상 무작위, 이중맹검, 다기관 시험(AD-1, AD-2, AD-3; NCT03569293, NCT03607422 및 NCT03568318)에 총 2584명의 환자(12세 이상)에서 평가되었습니다. RINVOQ는 344명의 소아 환자 및 2240명의 중등도에서 중증의 아토픽 피부염(AD)으로 국소 치료제로 적절히 조절되지 않은 성인 환자에서 평가되었습니다.
기저선에서 질병의 중증도는 검증된 연구자의 전반적인 AD 평가에서 유효한 연구자의 전역적 평가(vIGA-AD) 점수 ≥3(0-4의 중증도 척도), 습진 부위 및 중증도 지수(EASI) 점수 ≥16, 최소 체표면적(BSA) 참여 ≥10%, 및 주별 평균 최악 가려움 수치 평가 척도(NRS) 점수 ≥4로 정의되었습니다. 전반적으로 환자의 57%는 남성이었고 69%는 백인이었습니다. 기저선의 평균 연령은 34세(12세부터 75세까지)였고 환자의 13%는 12세 미만 18세 이하이었습니다. 기저선에서 49%의 환자는 vIGA-AD 점수 3(중등도 AD)을 가지고 있으며 51%의 환자는 vIGA-AD 점수 4(중증 AD)를 가지고 있었습니다. 기저선의 평균 EASI 점수는 29였고 기저선의 주별 평균 최악 가려움 NRS 점수는 7이었습니다. 환자의 약 52%가 과거 전신 AD 치료 경험이 있었습니다.
모든 3개의 시험에서 환자는 16주 동안 RINVOQ를 1일 1회 15mg, 30mg 또는 매칭된 플라시보를 복용했습니다. 시험 AD-3에서 환자들은 또한 16주 동안 RINVOQ 또는 플라시보와 동시에 국소 코르티코스테로이드(TCS)를 사용했습니다.
모든 3개 시험은 vIGA-AD 점수가 0(깨끗함) 또는 1(거의 깨끗함)이며 적어도 2점 개선을 보이면서 EASI-75(기저선과 비교하여 EASI 점수에서 적어도 75%의 개선)를 보이는 환자의 비율을 공동 일차 종점으로 평가했습니다. 이차 종점에는 16주에 EASI-90 및 EASI-100, 그리고 1주, 4주 및 16주에 가려움 감소(최악 가려움 NRS에서 기저선에서 ≥4점의 개선)가 있는 환자의 비율이 포함되었습니다. AD-1 및 AD-2 시험에서 16주에 통증 감소(아토픽 피부염 증상 척도[ADerm-SS] 피부 통증 NRS에서 기저선에서 ≥4점 개선)하는 환자의 비율은 이차 종점이었습니다.
임상 반응
단일요법 시험(AD-1 및 AD-2)
RINVOQ의 단일요법 시험(AD-1 및 AD-2)의 결과는 표 19에 제시됩니다. 도 3은 AD-1 및 AD-2 시험에서 1주, 4주 및 16주에 최악 가려움 NRS에서 ≥ 4점의 개선을 보이는 환자의 비율을 제시합니다.
표 19: 중등도에서 중증 AD 환자의 16주에서의 단일요법 시험의 효능 결과
시험 AD-1
시험 AD-2
PBO
RINVOQ
15 mg
RINVOQ
30 mg
PBO
RINVOQ
15 mg
RINVOQ
30 mg
무작위 배정된 환자의 수
281
281
285
278
276
282
vIGA-AD 0/1a,b
8%
48%
62%
5%
39%
52%
PBO와의 차이 (95% CI)
40%
(33%, 46%)
54%
(47%, 60%)
34%
(28%, 40%)
47%
(41%, 54%)
EASI-75a
16%
70%
80%
13%
60%
73%
PBO와의 차이 (95% CI)
53%
(46%, 60%)
63%
(57%, 70%)
47%
(40%, 54%)
60%
(53%, 66%)
EASI-90a
8%
53%
66%
5%
42%
58%
PBO와의 차이 (95% CI)
45%
(39%, 52%)
58%
(51%, 64%)
37%
(31%, 43%)
53%
(47%, 59%)
EASI-100a
2%
17%
27%
1%
14%
19%
PBO 대비 차이
(95% CI)
15%
(10%, 20%)
25%
(20%, 31%)
13%
(9%, 18%)
18%
(13%, 23%)
기준 Worst Pruritus NRS 점수가 ≥ 4인 환자 수
272
274
280
274
270
280
Worst Pruritus NRS에서 ≥ 4점 개선c
12%
52%
60%
9%
42%
60%
PBO 대비 차이
(95% CI)
40%
(33%, 48%)
48%
(41%, 55%)
33%
(26%, 39%)
50%
(44%, 57%)
기준 ADerm-SS Skin Pain NRS 점수가 ≥ 4인 환자 수
233
237
249
247
237
238
ADerm-SS Skin Pain NRS에서 ≥ 4점 개선d
15%
54%
63%
13%
49%
65%
PBO 대비 차이
(95% CI)
39%
(31%, 47%)
49%
(41%, 56%)
36%
(28%, 43%)
52%
(44%, 59%)
약어: ADerm-SS = 아토피 피부염 증상 점수 척도, PBO = 위약
a 무작위 배정된 환자 수 기준
b 반응자는 0-4 순서형 척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다.
c 기준 Worst Pruritus NRS가 ≥ 4인 환자 수 기준
d 기준 ADerm-SS Skin Pain NRS가 ≥ 4인 환자 수 기준
그림 3. 단독 요법 임상 시험에서 최악의 가려움증 NRS에서 ≥4점 개선을 보인 중등도에서 중증 AD 환자 비율
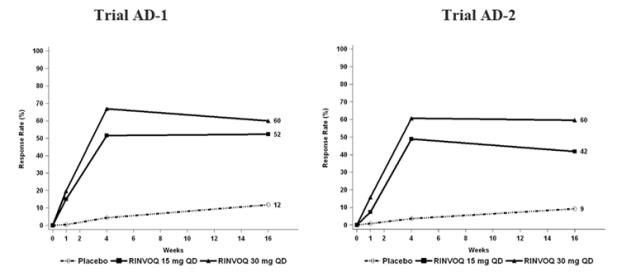
연령, 성별, 인종, 체중, 이전의 면역억제제를 사용한 전신 치료에 대한 조사에서 AD-1 및 AD-2 임상 시험의 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 확인되지 않았습니다.
병용 TCS 임상 시험(AD-3)
병용 TCS를 사용한 RINVOQ 임상 시험(AD-3)의 결과는 표 20에 나와 있습니다. 그림 4는 AD-3 임상 시험에서 1주, 4주 및 16주차에 최악의 가려움증 NRS에서 ≥4점 개선을 보인 환자의 비율을 보여줍니다.
표 20: 중등도에서 중증 AD 환자에서 16주차에 병용 TCS를 사용한 효능 결과
AD-3 임상 시험
PBO + TCS
RINVOQ 15 mg
+ TCS
RINVOQ 30 mg
+ TCS
무작위 배정된 환자 수
304
300
297
vIGA-AD 0/1a,b
11%
40%
59%
PBO와의 차이(95% CI)
29%
(22%, 35%)
48%
(41%, 54%)
EASI-75a,
26%
65%
77%
PBO와의 차이(95% CI)
38%
(31%, 45%)
51%
(44%, 57%)
EASI-90a
13%
43%
63%
PBO와의 차이(95% CI)
30%
(23%, 36%)
50%
(43%, 56%)
EASI-100a
1%
12%
23%
PBO와의 차이(95% CI)
11%
(7%, 14%)
21%
(16%, 26%)
기준 최악의 가려움증 NRS 점수가 ≥ 4인 환자 수
294
288
291
최악의 가려움증 NRS에서 ≥4점 개선c
15%
52%
64%
PBO와의 차이(95% CI)
37%
(30%, 44%)
49%
(42%, 56%)
약어: PBO = 위약
a 무작위 배정된 환자 수 기준
b 반응자는 0-4순위 척도에서 ≥2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다.
c 기준 최악의 가려움증 NRS가 ≥4인 환자 수 기준
그림 4. 병용 TCS 임상시험에서 최악의 Pruritus NRS에서 ≥4점 개선된 중등도에서 중증 AD 환자의 비율
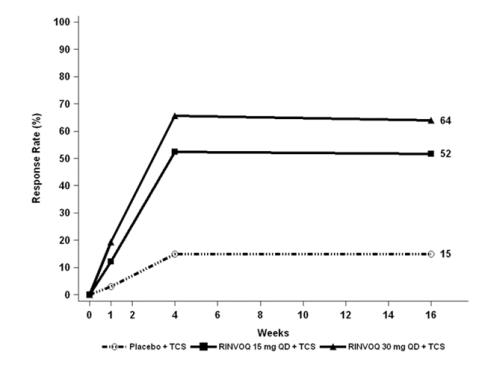
연령, 성별, 인종, 체중 및 이전 면역억제제를 사용한 전신 치료에 대한 조사에서 AD-3 임상시험의 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 확인되지 않았습니다.
소아 환자 모집단
12세 이상 소아 환자를 대상으로 한 RINVOQ 단독 요법 임상시험(AD-1 및 AD-2)과 RINVOQ 병용 TCS 임상시험(AD-3)의 16주차 효능 결과는 각각 표 21과 표 22에 나와 있습니다.
표 21: 16주차에 중등도에서 중증 AD 소아 환자(12세 이상)를 대상으로 한 단독 요법 임상시험의 효능 결과
AD-1 임상시험
AD-2 임상시험
PBO
RINVOQ
15 mg
RINVOQ
30 mg
PBO
RINVOQ
15 mg
RINVOQ
30 mg
무작위 배정된 소아 환자 수
40
42
42
36
33
35
vIGA-AD 0/1a,b
8%
38%
69%
3%
42%
62%
PBO와의 차이
(95% CI)
31%
(14%, 47%)
62%
(45%, 78%)
40%
(22%, 57%)
60%
(42%, 77%)
EASI-75a
8%
71%
83%
14%
67%
74%
PBO와의 차이
(95% CI)
63%
(47%, 79%)
75%
(61%, 89%)
53%
(33%, 72%)
61%
(42%, 79%)
기준 최악의 Pruritus NRS 점수가 ≥ 4인 소아 환자 수
39
40
42
36
30
34
최악의 Pruritus NRS에서 ≥ 4점 개선c
15%
45%
55%
3%
33%
50%
PBO와의 차이
(95% CI)
30%
(10%, 49%)
39%
(21%, 58%)
31%
(13%, 48%)
47%
(30%, 65%)
약어: PBO = 위약
a 무작위 배정된 소아 환자 수 기준
b 반응자는 0-4순서척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다.
c 기준 최악의 Pruritus NRS가 ≥ 4인 소아 환자 수 기준
표 22: 16주차에 중등도에서 중증의 AD를 가진 12세 이상 소아 환자에 대한 병용 TCS의 효능 결과
시험 AD-3
PBO + TCS
RINVOQ 15 mg
+ TCS
RINVOQ 30 mg
+ TCS
무작위 배정된 소아 환자 수
40
39
37
vIGA-AD 0/1a,b
8%
31%
65%
PBO와의 차이
(95% CI)
23%
(7%, 40%)
57%
(40%, 75%)
EASI-75a
30%
56%
76%
PBO와의 차이
(95% CI)
26%
(5%, 47%)
46%
(26%, 65%)
기준선 최악의 가려움증 NRS 점수가 ≥ 4인 소아 환자 수
38
36
33
최악의 가려움증 NRS에서 ≥ 4점 개선c
13%
42%
55%
PBO와의 차이
(95% CI)
29%
(9%, 48%)
41%
(21%, 61%)
약어: PBO = 위약
a 무작위 배정된 소아 환자 수 기준
b 반응자는 0-4 순서척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다.
c 기준선 최악의 가려움증 NRS가 ≥ 4인 소아 환자 수 기준
14.4 궤양성 대장염
유도 연구(UC-1 연구 및 UC-2 연구)
두 건의 동일한 유도 연구(UC-1, NCT02819635 및 UC-2, NCT03653026)에서 환자들을 2:1의 비율로 무작위 배정하여 RINVOQ 45mg을 1일 1회 또는 위약을 8주 동안 투여받도록 했습니다. 두 연구에 걸쳐 총 988명의 환자를 분석했습니다. 이러한 연구에는 경도에서 중증도의 활동성 궤양성 대장염 환자 중 경구용 아미노살리실산염, 코르티코스테로이드, 면역억제제 및/또는 생물학적 제제에 대한 반응이 불충분하거나, 반응이 소실되었거나, 또는 내약성이 없는 성인 환자가 포함되었습니다. 등록된 환자는 안정적인 용량의 경구용 아미노살리실산염, 메토트렉세이트, 궤양성 대장염 관련 항생제 및/또는 경구용 코르티코스테로이드(프레드니손 30mg/일 이하 또는 이에 상응하는 용량)를 사용할 수 있었습니다. 베이스라인에서 환자의 38%는 코르티코스테로이드를 투여받고 있었고, 68%는 아미노살리실산염을 투여받고 있었습니다. 병용 생물학적 제제, 아자티오프린, 6-머캅토퓨린, 정맥 내 또는 직장 코르티코스테로이드는 금지되었습니다. 환자의 총 51%가 이전에 하나 이상의 생물학적 제제로 치료를 받았으나 실패했거나 내약성이 없는 것으로 나타났습니다. RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 환자에게 사용하도록 승인되었습니다[사용상의 주의사항 및 적용 환자(1.4) 참조].
질병 활성도는 수정된 Mayo 점수(mMS)를 사용하여 평가했습니다. mMS는 3가지 요소로 구성된 Mayo 점수(0~9점)로, 배변 횟수(SFS), 직장 출혈(RBS), 중앙 판독 내시경 검사 점수(ES)(각 하위 점수는 0~3점)의 하위 점수로 구성됩니다. ES 2점은 현저한 홍반, 혈관 패턴 부족, 취약성 및/또는 미란으로 정의되었으며, 3점은 자발적 출혈 및 궤양으로 정의되었습니다. 등록된 환자의 mMS는 5~9점이었고 ES는 2~3점이었습니다. 베이스라인에서 mMS 중앙값은 7점이었고, 환자의 61%는 베이스라인 mMS가 5~7점이었고 39%는 8~9점이었습니다.
베이스라인에서 UC-1 및 UC-2에서 각각 환자의 39% 및 37%가 코르티코스테로이드를 투여받았고, 1% 및 1%가 메토트렉세이트를 투여받았으며, 68% 및 69%가 아미노살리실산염을 투여받았습니다. UC-1 및 UC-2에서 환자 질병 활성도는 각각 61% 및 60%의 환자에서 중등도(mMS ≤7)였고 39% 및 40%의 환자에서 중증(mMS >7)이었습니다.
1차 평가변수는 8주차에 mMS를 사용하여 정의된 임상적 관해였습니다. 2차 평가변수에는 임상 반응, 내시경적 개선 및 조직학적 내시경적 점막 개선이 포함되었습니다(표 23 및 표 24 참조).
표 23: 8주차에 1차 및 주요 2차 유효성 평가변수를 충족한 환자의 비율 – UC-1 연구
UC-1 연구
평가변수
위약
RINVOQ
45mg 1일 1회
위약 대비 치료 차이
(95% CI)
임상적 관해a
전체 환자군
N=154
5%
N=319
26%
22%b
(16, 27)
과거 생물학적 제제 치료 실패c
N=78
< 1%
N=168
18%
과거 생물학적 제제 치료 실패 없음
N=76
9%
N=151
35%
임상 반응d
전체 환자군
N=154
27%
N=319
73%
46%b
(38, 54)
과거 생물학적 제제 치료 실패c
N=78
13%
N=168
64%
과거 생물학적 제제 치료 실패 없음
N=76
42%
N=151
82%
내시경적 개선e
전체 환자군
N=154
7%
N=319
36%
29%b
(23, 36)
과거 생물학적 제제 치료 실패c
N=78
2%
N=168
27%
과거 생물학적 제제 치료 실패 없음
N=76
13%
N=151
47%
조직학적 내시경적 점막 개선f
전체 환자군
N=154
7%
N=319
30%
24%b
(17, 30)
Prior biologic failurec
N=78
1%
N=168
23%
이전 생물학적제제 실패 경험 없음
N=76
12%
N=151
38%
a mMS 기준: SFS ≤1 및 기준치 이하, RBS = 0, 취약성 없는 ES ≤ 1
b p <0.001, 무작위 배정 계층화 요인에 따라 Cochran-Mantel-Haenszel 방법으로 조정된 조정 치료 차이(95% CI)
c 이전 생물학적제제 실패에는 궤양성 대장염에 대한 하나 이상의 생물학적 치료에 대한 불충분한 반응, 반응 소실 또는 불내성이 포함됩니다.
d mMS 기준: 기준치에서 ≥ 2점 및 ≥ 30% 감소, 기준치에서 RBS ≥ 1 감소 또는 절대 RBS ≤1
e 취약성 없는 ES ≤ 1
f 취약성 없는 ES ≤1 및 Geboes 점수 ≤ 3.1(음와의 <5%에서 호중구 침윤을 나타내며 음와 파괴, 미란, 궤양 또는 육아 조직 없음)
표 24: 8주차에 1차 및 주요 2차 유효성 평가변수를 충족한 환자의 비율 – 연구 UC-2
연구 UC-2
평가변수
위약
RINVOQ
45mg 1일 1회
위약 대비 치료 차이
(95% CI)
임상적 관해a
전체 모집단
N=174
4%
N=341
33%
29%b
(23, 35)
이전 생물학적제제 실패c
N=89
2%
N=173
30%
이전 생물학적제제 실패 없음
N=85
6%
N=168
38%
임상적 반응d
전체 모집단
N=174
25%
N=341
74%
49%b
(42, 57)
이전 생물학적제제 실패c
N=89
19%
N=173
69%
이전 생물학적제제 실패 없음
N=85
32%
N=168
80%
내시경적 개선e
전체 모집단
N=174
8%
N=341
44%
35%b
(29, 42)
이전 생물학적제제 실패c
N=89
5%
N=173
37%
이전 생물학적제제 실패 없음
N=85
12%
N=168
51%
조직학적 내시경적 점막 개선f
전체 모집단
N=174
6%
N=341
37%
30%b
(24, 36)
이전 생물학적제제 실패c
N=89
5%
N=173
31%
이전 생물학적제제 실패 없음
N=85
7%
N=168
43%
a mMS 기준: SFS ≤ 1 및 기준치보다 높지 않음, RBS = 0, 취약성 없는 ES ≤ 1
b p <0.001, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI)
c 이전 생물학적제제 실패에는 궤양성 대장염에 대한 하나 이상의 생물학적 치료에 대한 불충분한 반응, 반응 손실 또는 불내성이 포함됩니다.
d mMS 기준: 기준치에서 ≥ 2점 및 ≥ 30% 감소, 기준치에서 RBS ≥ 1 감소 또는 절대 RBS ≤1
e 취약성 없는 ES ≤ 1
f 취약성 없는 ES ≤1 및 Geboes 점수 ≤ 3.1(crypt의 <5%에서 호중구 침윤을 나타내며, crypt 파괴, 미란, 궤양 또는 육아 조직 없음)
UC-1 연구와 UC-2 연구는 8주차에 내시경적 점막 개선과 질병 진행 및 장기 결과와의 관계를 평가하도록 설계되지 않았습니다.
직장 출혈 및 배변 빈도 하위 점수
임상 반응의 시작은 SFS 및 RBS(부분 수정 메이요 점수[pmMS])를 사용하여 평가했습니다. 초기 반응은 pmMS에서 기준치보다 ≥1점 및 ≥30% 감소하고 RBS에서 ≥1 감소 또는 절대 RBS≤1로 정의했습니다. 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자에게서 2주차에 반응이 나타났습니다.
내시경적 및 조직학적 평가
점막의 내시경적 모양 정상화(내시경적 관해)는 0의 ES로 정의했습니다. 8주차에 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 내시경적 관해를 달성했습니다(UC-1: 14% 대 1%, UC-2: 18% 대 2%). 8주차에 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 Geboes 조직학적 점수 < 2.0(crypt 또는 lamina propria에 호중구가 없고 호산구 증가가 없으며 crypt 파괴가 없으며 미란, 궤양 또는 육아 조직이 없는 것을 나타냄)으로 내시경적 관해를 달성했습니다(UC-1: 11% 대 1%, UC-2: 13% 대 2%).
복통 및 배변 긴박감
위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 8주차에 복통이 없었고(UC-1: 47% 대 23%, UC-2: 54% 대 24%), 배변 긴박감이 없었습니다(UC-1: 48% 대 21%, UC-2: 54% 대 26%).
피로
UC-1 연구와 UC-2 연구에서 RINVOQ를 투여받은 환자는 위약 투여 환자에 비해 8주차에 FACIT-F 점수의 기준치 대비 변화로 평가한 피로가 임상적으로 유의미하게 개선되었습니다. 8주 유도 후 피로 개선에 대한 RINVOQ의 효과는 확립되지 않았습니다.
유지 관리 연구 UC-3
UC-3(NCT02819635)에서 UC-1, UC-2 또는 UC-4에서 RINVOQ 45mg을 1일 1회 투여받고 임상 반응을 달성한 총 451명의 환자를 최대 52주 동안 RINVOQ 15mg, 30mg 또는 위약을 1일 1회 투여받도록 무작위 배정했습니다.
1차 평가 변수는 52주차에 mMS를 사용하여 정의한 임상적 관해였습니다. 2차 평가 변수에는 코르티코스테로이드 없이 임상적 관해, 내시경적 개선 및 조직학적 내시경적 점막 개선이 포함되었습니다(표 25 참조).
표 25: 유지 관리 연구 UC-3에서 52주차에 1차 및 주요 2차 유효성 평가 변수를 충족한 환자의 비율
평가 변수
위약
RINVOQ
15mg
1일 1회
치료 차이
15mg 대 위약
(95% CI)
RINVOQ
30mg
1일 1회
30mg 대 위약 치료 차이
(95% CI)
임상적 관해a
전체 모집단
N=149
12%
N=148
42%
31%b
(22, 40)
N=154
52%
39%b
(30, 48)
이전 생물학적제제 실패c
N=81
7%
N=71
41%
N=73
49%
이전 생물학적제제 실패 없음
N=68
18%
N=77
44%
N=81
54%
코르티코스테로이드 없이 임상적 관해d
전체 모집단
N=54
22%
N=47
57%
35%b
(18, 53)
N=58
68%
45%b
(29, 62)
이전 생물학적제제 실패c
N=22
14%
N=17
71%
N=20
73%
이전 생물학적제제 실패 없음
N=32
28%
N=30
49%
N=38
65%
내시경적 개선e
전체 모집단
N=149
14%
N=148
49%
34%b
(25, 44)
N=154
62%
46%b
(37, 56)
Prior biologic failurec
N=81
8%
N=71
43%
N=73
56%
사전 생물학적 제제 치료 실패 경험 없음
N=68
22%
N=77
54%
N=81
67%
조직학적 내시경적 점막 개선f
전체 모집단
N=149
12%
N=148
35%
24%b
(15, 33)
N=154
50%
37%b
(28, 47)
Prior biologic failurec
N=81
5%
N=71
33%
N=73
48%
사전 생물학적 제제 치료 실패 경험 없음
N=68
20%
N=77
37%
N=81
52%
a mMS 기준: SFS ≤1 및 기준치 이하, RBS = 0, ES ≤1(취약성 없음)
b p <0.001, 무작위 배정 층화 요인에 대해 보정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 보정된 치료 차이(95% CI)
c Prior biologic failure includes inadequate response, loss of response, or intolerance to one or more biologic treatments for ulcerative colitis.
d 유도 치료 종료 시 임상적 관해를 달성한 환자 중 52주차에 mMS 기준으로 임상적 관해를 보이고 52주차 이전에 ≥90일 동안 코르티코스테로이드를 사용하지 않은 경우
e ES ≤ 1(취약성 없음)
f ES ≤1(취약성 없음) 및 Geboes 점수 ≤ 3.1(<5%의 crypt에서 호중구 침윤을 나타내고, crypt 파괴가 없으며, 미란, 궤양 또는 육아 조직이 없음)
52주차의 조직학적 내시경 점막 개선과 52주차 이후의 질병 진행 및 장기 결과 간의 관계는 연구 UC-3에서 평가되지 않았습니다.
내시경 및 조직학적 평가
점막의 내시경적 모양의 정상화(내시경적 관해)는 0의 ES로 정의되었습니다. UC-3에서 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(24% 및 26% 대 6%). 52주차에 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(18% 및 19% 대 5%).
복통 및 배변 긴박감
52주차에 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(각각 46%, 55% 및 21%, 각각 56%, 64% 및 17%).
14.5 크론병
유도 연구(연구 CD-1 및 CD-2)
두 번의 유도 연구인 CD-1(NCT03345836)과 CD-2(NCT03345849)에서 환자들은 12주 동안 RINVOQ 45mg 또는 위약을 1일 1회 투여받도록 2:1로 무작위 배정되었습니다. 효능은 기준선 Crohn’s Disease Activity Index(CDAI) 점수가 220점 이상이고 중앙에서 검토한 Crohn’s Disease에 대한 Simple Endoscopic Score(SES-CD)가 6점 이상이거나, 협착 성분을 제외한 고립 장 회장 질환의 경우 4점 이상인 중등도에서 중증의 활동성 크론병(CD) 환자 857명(CD-1에서 419명, CD-2에서 438명)을 대상으로 평가되었습니다. CD-1에서 모든 환자는 하나 이상의 생물학적 요법에 대한 반응이 불충분하거나 내약성이 없었습니다(이전 생물학적 요법 실패). CD-2에서 환자의 45%(197/438)는 하나 이상의 생물학적 요법에 대한 반응이 불충분하거나 내약성이 없었습니다(이전 생물학적 요법 실패). 두 연구에 등록된 환자는 안정적인 용량의 CD 관련 항생제, 아미노살리실산염 또는 메토트렉세이트를 사용할 수 있었습니다. 등록 시 병용 코르티코스테로이드(최대 30mg/일 프레드니손 또는 동등한 용량)가 허용되었으며, 4주차에 감량을 시작했습니다.
CD-1에서 환자의 평균 연령은 37세(범위 18~74세)였으며, 46%는 여성이었고, 72%는 백인, 21%는 아시아인, 6%는 흑인 또는 아프리카계 미국인, 0.5%는 아메리카 인디언 또는 알래스카 원주민, 0.5%는 여러 인종 집단으로 확인되었습니다. CD-2에서 환자의 평균 연령은 40세(범위 18~74세)였으며, 45%는 여성이었고, 74%는 백인, 20%는 아시아인, 4%는 흑인 또는 아프리카계 미국인, 2%는 여러 인종 집단으로 확인되었습니다.
기준선에서 CD-1과 CD-2에서 각각 환자의 36%와 37%는 코르티코스테로이드를, 7%와 3%는 메토트렉세이트를, 15%와 24%는 아미노살리실산염을, 2%와 1%는 CD 관련 항생제를 투여받았습니다.
공동 1차 평가변수는 12주차에 임상적 관해(CDAI 기준)를 달성한 환자의 비율과 12주차에 내시경적 반응(SES-CD 기준)을 달성한 환자의 비율이었습니다. 2차 효능 평가변수에는 임상적 반응, 코르티코스테로이드 없이 관해, 내시경적 관해가 포함되었습니다(표 26 및 표 27 참조).
표 26: 유도 연구 CD-1에서 1차 및 추가 효능 평가변수를 충족한 환자의 비율
CD-1
평가변수
위약
RINVOQ
45mg 1일 1회
위약 대비 치료 차이
(95% CI)
12주차의 공동 1차 평가변수
임상적 관해a
N=146
18%
N=273
36%
17%
(9, 25)*
내시경적 반응b
N=146
3%
N=273
34%
30%
(24, 36)*
12주차의 추가 평가변수
임상적 반응(CR-100)c
N=146
31%
N=273
54%
22%
(13, 31)*
기준선에서 코르티코스테로이드를 투여받은 환자에서 코르티코스테로이드 없이 임상적 관해a,d
N=53
11%
N=96
30%
17%
(5, 29)**
내시경적 관해e
N=146
3%
N=273
19%
15%
(10, 21)*
* p < 0.001, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI)
** p < 0.01, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI)
a CDAI < 150
b 유도 연구 기준치에서 SES-CD가 50% 이상 감소(또는 유도 연구 기준치에서 SES-CD가 4인 환자의 경우 유도 연구 기준치에서 최소 2점 감소)
c 기준치에서 CDAI가 100점 이상 감소
d 기준치에서 코르티코스테로이드를 투여받은 환자 중 코르티코스테로이드 중단 및 임상적 관해 달성
e SES-CD ≤ 4이고 개별 변수에서 개별 하위 점수가 >1이 아님
표 27: 유도 연구 CD-2에서 1차 및 추가 유효성 평가변수를 충족하는 환자의 비율
CD-2
평가변수
위약
RINVOQ
45mg 1일 1회
위약 대비 치료 차이
(95% CI)
12주차의 공동 1차 평가변수
임상적 관해a
전체 환자군
N=143
23%
N=295
46%
24%
(15, 32)*
이전 생물학적제제 실패
N=62
7%
N=135
42%
이전 생물학적제제 비실패
N=81
35%
N=160
50%
내시경적 반응b
전체 환자군
N=143
13%
N=295
46%
33%
(26, 41)*
이전 생물학적제제 실패
N=62
10%
N=135
39%
이전 생물학적제제 비실패
N=81
15%
N=160
51%
12주차의 추가 평가변수
임상적 반응(CR-100)c
전체 환자군
N=143
40%
N=295
64%
24%
(15, 33)*
이전 생물학적제제 실패
N=62
25%
N=135
66%
이전 생물학적제제 비실패
N=81
52%
N=160
62%
기준 시점에서 CS를 투여받은 환자에서 코르티코스테로이드 무사용 임상적 관해a,d
전체 환자군
N=54
13%
N=108
40%
27%
(14, 39)*
이전 생물학적제제 실패
N=29
7%
N=60
35%
이전 생물학적제제 비실패
N=25
20%
N=48
46%
내시경적 관해e
전체 환자군
N=143
8%
N=295
30%
22%
(16, 29)*
이전 생물학적제제 실패
N=62
3%
N=135
22%
이전 생물학적제제 비실패
N=81
11%
N=160
37%
* p < 0.001, 무작위 배정 계층화 요인에 따라 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI)
a CDAI < 150
b 유도 연구 기준 시점 대비 SES-CD 50% 이상 감소(또는 유도 연구 기준 시점에서 SES-CD가 4인 환자의 경우 유도 연구 기준 시점 대비 최소 2점 감소)
c 기준 시점 대비 CDAI 100점 이상 감소
d 기준 시점에서 코르티코스테로이드를 투여받은 환자 중 코르티코스테로이드 중단 및 임상적 관해 달성
e SES-CD ≤ 4이며 개별 변수에서 개별 하위 점수가 >1이 아님
CD-1 연구와 CD-2 연구에서 CDAI를 기준으로 한 임상 반응은 2주 만에 나타났으며, 2주차에 임상 반응을 보인 환자 비율은 위약군보다 RINVOQ 치료군에서 더 높았습니다.
CD-1 연구와 CD-2 연구에서 12주차에 배변 횟수와 복통이 감소한 환자 비율은 위약군보다 RINVOQ 45mg 유도 요법 치료군에서 더 높았습니다.
CD-1 연구와 CD-2 연구에서 RINVOQ 치료를 받은 환자는 12주차에 FACIT-F 점수의 기준치 대비 변화로 평가한 피로도에서 위약 치료를 받은 환자에 비해 임상적으로 유의미한 개선을 경험했습니다. 12주간의 유도 후 피로도를 개선하는 RINVOQ의 효과는 확립되지 않았습니다.
유지 관리 연구(CD-3)
CD-3(NCT03345823)에 대한 효능 분석에서는 12주 동안 RINVOQ 45mg 1일 1회 유도 치료에 반응을 보인 343명의 환자를 평가했습니다. 환자들은 총 64주 이상의 치료 기간을 나타내는 52주 동안 RINVOQ 15mg 또는 30mg 1일 1회 유지 관리 요법이나 위약을 무작위로 배정받았습니다.
임상적 관해(CDAI 기준) 및 내시경적 반응(SES-CD 기준)의 공동 1차 평가변수는 52주차에 평가했습니다. 2차 효능 평가변수에는 52주차에 코르티코스테로이드를 사용하지 않은 임상적 관해, 임상적 관해 유지, 내시경적 관해, 임상적 관해와 내시경적 관해 동시 달성이 포함되었습니다(표 28 참조).
표 28: 유지 관리 연구 CD-3에서 52주차에 1차 및 추가 효능 평가변수를 충족한 환자 비율
평가변수
위약+
RINVOQ
15mg
1일 1회
RINVOQ
30mg 1일 1회
치료 차이
15mg 대
위약
(95% CI)
치료
차이
30mg 대
위약
(95% CI)
공동 1차 평가변수
임상적 관해a
전체 환자군
N=111
14%
N=113
42%
N=119
55%
29%
(18, 39)*
40%
(29, 51)*
이전 생물학적제제 실패
N=87
13%
N=85
35%
N=90
54%
이전 생물학적제제
실패 없음
N=24
21%
N=28
61%
N=29
55%
내시경적 반응b
전체 환자군
N=111
7%
N=113
28%
N=119
41%
22%
(13, 32)*
34%
(25, 44)*
이전 생물학적제제 실패
N=87
5%
N=85
22%
N=90
42%
이전 생물학적제제
실패 없음
N=24
17%
N=28
45%
N=29
38%
추가 평가변수
코르티코스테로이드를 사용하지 않은 임상적 관해c
전체 환자군
N=111
14%
N=113
42%
N=119
53%
29%
(18, 39)*
38%
(27, 49)*
이전 생물학적제제 실패
N=87
13%
N=85
35%
N=90
52%
이전 생물학적제제
실패 없음
N=24
21%
N=28
61%
N=29
55%
임상적 관해 유지d
전체 모집단
N=73
22%
N=72
51%
N=79
67%
32%
(18, 46)*
43%
(29, 57)*
이전 생물학적제제 실패
N=56
20%
N=50
46%
N=55
69%
이전 생물학적제제
실패 없음
N=17
29%
N=22
64%
N=24
63%
내시경적 관해e
전체 모집단
N=111
5%
N=113
19%
N=119
30%
14%
(6, 22)*
25%
(15, 34)*
이전 생물학적제제 실패
N=87
3%
N=85
14%
N=90
30%
이전 생물학적제제
실패 없음
N=24
13%
N=28
32%
N=29
31%
임상적 및 내시경적 관해
전체 모집단
N=111
4%
N=113
16%
N=119
26%
13%
(6, 21)*
22%
(14, 31)*
이전 생물학적제제 실패
N=87
2%
N=85
13%
N=90
26%
이전 생물학적제제
실패 없음
N=24
8%
N=28
25%
N=29
28%
+ 위약군은 유도 연구 종료 시점에 RINVOQ 45mg으로 CDAI에 따라 임상 반응을 달성하고 유지 요법 시작 시 위약을 투여받도록 무작위 배정된 환자로 구성되었습니다.
* p < 0.001, 무작위 배정 계층화 요인에 따라 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI)
a CDAI < 150
b 유도 연구 기준치에서 SES-CD가 50% 이상 감소(또는 유도 연구 기준치에서 SES-CD가 4인 환자의 경우 유도 연구 기준치에서 최소 2점 감소)
c 52주차까지 90일 동안 코르티코스테로이드를 투여하지 않고 임상적 관해를 달성했습니다. 유도 기준치에서 코르티코스테로이드를 투여받은 환자 하위 집단 중 RINVOQ 15mg군의 48%(N=44), RINVOQ 30mg군의 44%(N=45), 위약군의 7%(N=46)가 52주차까지 90일 동안 코르티코스테로이드를 투여하지 않고 임상적 관해를 달성했습니다.
d 유지 연구 참여 시점에 임상적 관해를 달성한 환자에서 52주차에 임상적 관해를 달성한 것으로 정의됩니다.
e SES-CD ≤ 4이고 개별 변수에서 점수가 1점을 초과하는 하위 점수 없음
52주차에 RINVOQ 15mg 및 30mg으로 치료받은 환자에서 위약군에 비해 설사 빈도 및 복통 감소가 더 많이 관찰되었습니다.
14.6 강직성 척추염
Bath 강직성 척추염 질병 활성도 지수(BASDAI) ≥4 및 환자의 총 요통 점수 ≥4를 기준으로 활동성 강직성 척추염 환자 18세 이상을 대상으로 한 두 건의 무작위배정, 이중맹검, 다기관, 위약 대조 임상시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다.
AS-I 임상시험(NCT03178487)은 최소 2가지 비스테로이드성 항염증제(NSAID)에 대해 불충분한 반응을 보였거나 NSAID에 대한 내약성이 없거나 금기인 187명의 강직성 척추염 환자를 대상으로 한 14주간의 임상시험이었으며, 이전에 생물학적 DMARD에 노출된 적이 없었습니다. 기준선에서 환자들은 평균 14.4년 동안 강직성 척추염 증상이 있었고, 약 16%의 환자가 병용 cDMARD를 투여받고 있었습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 14주차에 위약군에 무작위 배정된 모든 환자는 RINVOQ 15mg 1일 1회로 전환되었습니다. 1차 평가변수는 14주차에 SpondyloArthritis international Society 40(ASAS40) 반응을 달성한 환자의 비율이었습니다.
AS-II 임상시험(NCT 04169373)은 1~2가지 생물학적 DMARD에 대해 불충분한 반응을 보인 420명의 강직성 척추염 환자를 대상으로 한 14주간의 임상시험이었습니다. 기준선에서 환자들은 평균 12.8년 동안 강직성 척추염 증상이 있었고, 약 31%의 환자가 병용 cDMARD를 투여받고 있었습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 14주차에 위약군에 무작위 배정된 모든 환자는 RINVOQ 15mg 1일 1회로 전환되었습니다. 1차 평가변수는 14주차에 SpondyloArthritis international Society 40(ASAS40) 반응을 달성한 환자의 비율이었습니다.
임상 반응
두 임상시험 모두에서 14주차에 RINVOQ 15mg으로 치료받은 환자의 유의하게 더 많은 비율이 위약군에 비해 ASAS40 반응을 달성했습니다(표 29, 그림 5).
성별, 기준선 체질량 지수(BMI) 및 기준선 hsCRP 검사에서 14주차에 이러한 하위 그룹 간의 RINVOQ에 대한 반응 차이가 확인되지 않았습니다.
표 29: 14주차의 임상 반응
AS-I 임상시험
bDMARD-naïve
AS-II 임상시험
bDMARD-IR
PBO
(N=94)
RINVOQ 15mg
(N=93)
PBO 대비 차이
(95% CI)
PBO
(N=209)
RINVOQ 15mg
(N=211)
PBO 대비 차이
(95% CI)
ASAS40a (%)
25.5
50.5
25 (12, 38)
18.2
44.5
26 (18, 35)
ASAS20a (%)
39.4
63.4
24 (10, 38)
38.3
65.4
27 (18, 36)
약어: ASAS20(또는 40) = SpondyloArthritis international Society ≥20%(또는 ≥40%) 개선; bDMARD = 생물학적 질병 조절 항류마티스제; IR = 불충분한 반응자; PBO = 위약
a ASAS20(ASAS40) 반응은 4개 영역(환자 전반, 총 요통, 기능 및 염증) 중 ≥3개에서 ≥20%(≥40%) 개선 및 기준선 대비 ≥1(≥2) 단위(범위 0~10)의 절대적 개선으로 정의되며, 잠재적으로 남아 있는 영역(ASAS20의 경우 ≥20% 및 ≥1 단위 악화로 정의되거나 ASAS40의 경우 > 0 단위 악화로 정의됨)에서 악화가 없습니다.
이분형 평가변수의 경우 14주차 결과는 무반응자 대체(AS-I 임상시험) 및 다중 대체와 함께 무반응자 대체(AS-II 임상시험)를 기반으로 합니다.
RINVOQ 15mg 치료는 위약 대비 ASAS40 반응 기준의 개별 구성 요소에서 개선을 보였습니다(표 30).
표 30: ASAS 구성 요소 및 기타 질병 활성도 측정a
시험 AS-I
bDMARD-naïve
시험 AS-II
bDMARD-IR
치료군
PBO
RINVOQ
15 mg
PBO
RINVOQ
15 mg
N
94
93
209
211
환자의 질병 활성도에 대한 전반적 평가b
기준선
6.8 (1.66)
6.6 (1.81)
7.2 (1.40)
7.4 (1.48)
14주차
5.4 (1.97)
3.8 (2.44)
5.9 (2.13)
4.3 (2.36)
총 요통b
기준선
6.7 (1.78)
6.8 (1.77)
7.4 (1.43)
7.5 (1.48)
14주차
5.0 (2.27)
3.7 (2.39)
5.9 (2.09)
4.4 (2.48)
BASFIb
기준선
5.54 (2.17)
5.35 (2.36)
6.18 (1.87)
6.28 (2.03)
14주차
4.21 (2.26)
3.14 (2.37)
5.09 (2.21)
3.98 (2.45)
염증c
기준선
6.66 (1.90)
6.51 (1.99)
6.75 (1.55)
6.88 (1.84)
14주차
4.61 (2.13)
3.40 (2.16)
5.11 (2.30)
3.87 (2.50)
hsCRP (mg/L)
기준선
11.02 (10.85)
8.90 (12.42)
14.71 (17.54)
15.30 (20.53)
14주차
11.72 (15.93)
2.23 (3.56)
15.31 (17.55)
3.82 (8.26)
약어: ASAS = Assessment of SpondyloArthritis international Society; BASFI = Bath Ankylosing Spondylitis Functional Index; bDMARD = biologic disease modifying anti-rheumatic drug; hsCRP = high sensitivity C-reactive protein; IR = inadequate responder; PBO = placebo; BASDAI = Bath Ankylosing Spondylitis Disease Activity Index
결과는 기준선 관찰이 있는 환자의 관찰된 데이터를 기반으로 합니다.
a 표시된 데이터는 평균(표준 편차)입니다.
b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악
c 아침 강직의 심각도 및 지속 시간을 평가하는 BASDAI 질문 5 및 6의 평균: 0 = 최상, 10 = 최악
그림 5. AS-II* 임상시험에서 ASAS40에 도달한 환자의 비율
*결과는 다중 대체와 함께 무반응자 대체를 기반으로 합니다.
기타 건강 관련 결과
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 환자는 14주차에 위약과 비교하여 강직성 척추염 삶의 질(ASQoL)로 측정했을 때 건강 관련 삶의 질이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 ASQoL의 개선이 관찰되었습니다.
관절염
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 기존 관절염이 있는 환자는 14주차에 마스트리흐트 강직성 척추염 관절염 점수(MASES)의 기준치 대비 변화로 측정했을 때 위약과 비교하여 관절염이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 MASES의 개선이 관찰되었습니다.
척추 이동성
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 환자는 14주차에 바스 강직성 척추염 계측 지수(BASMI)의 기준치 대비 변화로 측정했을 때 위약과 비교하여 척추 이동성이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 BASMI의 개선이 관찰되었습니다.
14.7 방사선 비투과성 축성 척추관절염
활동성 방사선 비투과성 축성 척추관절염이 있는 18세 이상의 환자를 대상으로 한 무작위, 이중맹검, 다기관, 위약 대조 임상시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다. nr-axSpA 임상시험(NCT04169373)은 최소 2개의 비스테로이드성 항염증제(NSAID)에 대한 반응이 불충분하거나 NSAID에 대한 불내성 또는 금기증이 있는 활동성 방사선 비투과성 축성 척추관절염 환자 314명(이 중 313명이 연구 치료를 받음)을 대상으로 한 52주간의 위약 대조 임상시험이었습니다. 환자는 C-반응성 단백질(CRP) 상승(정상 상한 >으로 정의), 자기공명영상(MRI)에서 천장관절염으로 나타나는 객관적인 염증 징후가 있어야 하며, 천장관절에 대한 명확한 방사선학적 구조적 손상 증거가 없어야 합니다. 환자는 스크리닝 및 기준선 방문 시 바스 강직성 척추염 질병 활동 지수(BASDAI) ≥4 및 0~10점 숫자 등급 척도(NRS)를 기준으로 한 환자의 총 요통 평가 점수 ≥ 4로 정의된 활동성 질환이 있어야 했습니다. 기준선에서 환자의 약 29.1%가 병용 cDMARD를 투여받고 있었습니다. 환자의 32.9%는 bDMARD 치료에 대한 반응이 불충분하거나 불내성을 보였습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 1차 평가변수는 14주차에 척추관절염 국제 학회 40(ASAS40) 반응에 도달한 환자의 비율이었습니다.
임상 반응
nr-axSpA 임상시험에서 14주차에 RINVOQ 15mg으로 치료받은 환자의 상당히 많은 비율이 위약과 비교하여 ASAS40 반응에 도달했습니다(표 31, 그림 6).
성별, 기준선 BMI, 방사선 비투과성 축성 척추관절염 증상 기간, 기준선 hsCRP, MRI 천장관절염 및 이전 bDMARD 사용에 대한 검사 결과 14주차에 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 나타나지 않았습니다.
표 31: 14주차의 임상 반응
PBO
(N=157)
RINVOQ 15 mg
(N=156)
위약 대비 차이(95% CI)
ASAS40a (%)
22.3
44.9
22.5
(12.4, 32.5)
ASAS20a (%)
43.3
66.7
23.2
(12.6, 33.8)
약어: ASAS20(또는 40) = 척추관절염 국제 학회 ≥20%(또는 ≥40%) 개선; PBO = 위약
a ASAS20(ASAS40) 반응은 4개 영역(환자 전반, 총 요통, 기능 및 염증) 중 ≥3개에서 ≥20%(≥40%) 개선 및 기준치 대비 ≥1(≥2) 단위(범위 0~10)의 절대적 개선으로 정의되며, 잠재적인 나머지 영역에서 악화는 없습니다(ASAS20의 경우 ≥20% 및 ≥1 단위 악화 또는 ASAS40의 경우 > 0 단위 악화로 정의).
이분형 평가변수의 경우 결과는 다중 대체와 함께 무반응자 대체를 기반으로 합니다.
RINVOQ 15mg 치료는 위약군과 비교하여 ASAS40 반응 기준의 개별 구성 요소에서 개선을 보였습니다(표 32).
표 32: ASAS 구성 요소 및 기타 질병 활성 측정a
치료군
PBO
(N=157)
RINVOQ 15 mg
(N=156)
환자의 질병 활성도에 대한 전반적인 평가b
기준선
7.30 (1.38)
6.99 (1.62)
14주차
5.35 (2.31)
4.16 (2.38)
총 요통b
기준선
7.29 (1.39)
7.23 (1.55)
14주차
5.27 (2.36)
4.29 (2.49)
BASFIb
기준선
5.99 (2.14)
5.89 (2.08)
14주차
4.47 (2.42)
3.33 (2.39)
염증c
기준선
6.68 (1.67)
6.60 (1.83)
14주차
4.69 (2.36)
3.48 (2.51)
hsCRP (mg/L)
기준선
8.75 (12.91)
9.93 (16.17)
14주차
7.25 (10.61)
2.84 (4.90)
약어: ASAS = 국제 강직성 척추염 평가 학회(Assessment of SpondyloArthritis international Society), BASFI = Bath 강직성 척추염 기능 지수(Bath Ankylosing Spondylitis Functional Index), hsCRP = 고감도 C-반응성 단백질(high sensitivity C-Reactive Protein), PBO = 위약
a 표시된 데이터는 평균(표준 편차)입니다.
b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악
c 아침 скованность 심각도 및 지속 시간을 평가하는 Bath 강직성 척추염 질병 활성도 지수(BASDAI) 질문 5 및 6의 평균: 0 = 최상, 10 = 최악
그림 6. ASAS40*를 달성한 환자의 비율
*결과는 다중 대입과 함께 비반응자 대입을 기반으로 합니다.
기타 건강 관련 결과
RINVOQ 15mg으로 치료받은 환자는 14주차에 위약군에 비해 강직성 척추염 삶의 질(ASQoL)로 측정한 건강 관련 삶의 질이 크게 개선되었습니다.
14.8 다관절형 소아 특발성 관절염
활동성 다관절형 JIA 소아 환자에서 RINVOQ/RINVOQ LQ의 효능은 류마티스 관절염 환자에서 확립된 RINVOQ의 효능에 대한 노출-매칭 외삽법을 기반으로 합니다. RINVOQ/RINVOQ LQ의 안전성 및 유효성은 또한 활동성 다관절형 JIA(NCT03725007)를 가진 83명의 어린이(2세~<18세)를 대상으로 한 다기관, 공개 라벨, 단일군 연구에서 평가되었습니다. 연구 참여 시 pJIA 환자 아형에는 류마티스 인자 음성 다관절형(68.7%), 류마티스 인자 양성 다관절형(15.7%), 연장된 소수 관절형(13.3%) 및 전신 증상이 없는 전신성 JIA(2.4%)가 포함되었습니다. 모든 환자는 최대 156주 동안 체중에 따라 RINVOQ LQ 또는 RINVOQ 정제 용량을 투여받았습니다. 안정적인 용량의 MTX로 치료받은 환자는 연구에 참여할 수 있었습니다. 연구 중에 MTX 용량 변경이 허용되었습니다. 유효성은 48주까지 지원적 종료점으로 평가되었습니다. 유효성은 일반적으로 류마티스 관절염 환자의 반응과 일치했습니다.
16 공급/보관 및 취급 방법
공급 방법
RINVOQ 지속 방출 정제는 다음과 같이 공급됩니다.
- 15 mg: 보라색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a15’가 새겨져 있습니다.
병에 30정; NDC: 0074-2306-30
- 30 mg: 빨간색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a30’이 새겨져 있습니다.
병에 30정; NDC: 0074-2310-30
- 45 mg: 노란색에서 얼룩진 노란색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a45’가 새겨져 있습니다.
병에 28정; NDC: 0074-1043-28
RINVOQ LQ 경구용액은 다음과 같이 공급됩니다.
- 아동용 내성 캡이 있는 HDPE 병에 1 mg/mL 경구용액. 각 병에는 투명하고 무색에서 연한 노란색 용액 180 mL가 들어 있습니다. 병은 1개의 프레스인 병 어댑터와 1개의 10 mL 경구 투여 주사기가 있는 판지 상자에 포장되어 있습니다. NDC: 0074-2320-01
보관 및 취급
RINVOQ 지속 방출 정제
- 2˚C에서 25˚C(36˚F에서 77˚F)에서 보관합니다.
- 습기로부터 보호하기 위해 원래 병에 보관합니다.
RINVOQ LQ 경구용액
- 2°C에서 30°C(36°F에서 86°F) 사이에서 보관합니다.
- 병을 연 후 60일 후에 남은 경구용액을 폐기합니다.
17 환자 상담 정보
환자와 보호자에게 FDA 승인 환자 라벨(약물 안내 및 사용 지침)을 읽도록 알려주십시오.
중증 감염
환자에게 RINVOQ/RINVOQ LQ를 복용하면 감염이 발생할 가능성이 더 높아질 수 있다고 알려주십시오. 치료 중에 감염의 징후나 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오. [경고 및 주의 사항 (5.1)].
환자에게 RINVOQ/RINVOQ LQ를 복용하는 환자의 경우 대상포진 위험이 증가하며, 경우에 따라 심각할 수 있다고 알려주십시오. [경고 및 주의 사항 (5.1)].
악성 종양
환자에게 RINVOQ/RINVOQ LQ는 특정 암의 위험을 증가시킬 수 있으며, RINVOQ/RINVOQ LQ를 사용하는 동안 정기적인 피부 검사를 실시해야 한다고 알려주십시오.
환자에게 햇빛과 자외선에 대한 노출은 보호 의복을 착용하고 광범위 자외선 차단제를 사용하여 제한해야 한다고 알려주십시오. [경고 및 주의 사항 (5.3)].
중대한 심혈관계 사건
환자에게 RINVOQ/RINVOQ LQ는 심근 경색, 뇌졸중 및 심혈관 사망을 포함한 중대한 심혈관계 사건(MACE)의 위험을 증가시킬 수 있다고 알려주십시오. 모든 환자, 특히 현재 또는 과거 흡연자 또는 다른 심혈관 위험 요인이 있는 환자는 심혈관 사건의 징후와 증상이 나타나는지 주의하도록 지시하십시오. [경고 및 주의 사항 (5.4)].
혈전증
환자에게 RINVOQ 임상 시험에서 심부 정맥 혈전증 및 폐색전증 사례가 보고되었다고 알려주십시오. 환자에게 DVT 또는 PE의 징후나 증상이 나타나면 즉시 의료 서비스를 받도록 지시하십시오. [경고 및 주의 사항 (5.5)].
과민 반응
환자에게 알레르기 반응의 징후나 증상이 나타나면 RINVOQ/RINVOQ LQ를 중단하고 즉시 의료 서비스를 받도록 알려주십시오. [경고 및 주의 사항 (5.6)].
위장관 천공
환자에게 RINVOQ 임상 시험에서 위장관 천공이 보고되었으며, 위험 요인으로는 NSAID, 코르티코스테로이드 사용 또는 과민성 대장염 병력이 있다고 알려주십시오. 환자에게 복통, 발열, 오한, 메스꺼움 또는 구토가 새롭게 발생하면 즉시 의료 서비스를 받도록 지시하십시오. [경고 및 주의 사항 (5.7)].
망막 박리
환자에게 RINVOQ 임상 시험에서 망막 박리가 보고되었다고 알려주십시오. 환자에게 RINVOQ/RINVOQ LQ를 투여받는 동안 시력에 갑작스러운 변화가 나타나면 즉시 의료 서비스 제공자에게 알리도록 알려주십시오. [부작용 (6.1)].
실험실 이상
환자에게 RINVOQ/RINVOQ LQ는 특정 실험실 검사에 영향을 미칠 수 있으며, RINVOQ/RINVOQ LQ 치료 전후에 혈액 검사가 필요하다고 알려주십시오. [경고 및 주의 사항 (5.8)].
예방 접종
환자에게 RINVOQ/RINVOQ LQ와 함께 생백신을 사용하지 않도록 알려주십시오. 환자에게 예방 접종을 받기 전에 RINVOQ/RINVOQ LQ를 복용하고 있음을 의료 서비스 제공자에게 알리도록 지시하십시오. [경고 및 주의 사항 (5.10)].
태아 독성
임산부 및 임신 가능성이 있는 여성에게 임신 중 RINVOQ/RINVOQ LQ에 노출되면 태아에게 해를 끼칠 수 있다고 알려주십시오. 여성에게 임신 사실을 알고 있거나 의심되는 경우 의료 서비스 제공자에게 알리도록 알려주십시오. [경고 및 주의 사항 (5.9) 및 특정 인구 집단에서의 사용 (8.1)].
임신 가능성이 있는 여성에게 치료 중 및 RINVOQ/RINVOQ LQ의 마지막 복용 후 4주 동안 효과적인 피임법을 사용해야 한다고 알려주십시오. [특정 인구 집단에서의 사용 (8.3)].
임신 중 RINVOQ/RINVOQ LQ에 노출된 여성에게 임신 결과를 모니터링하는 임신 감시 프로그램이 있다고 알려주십시오. [특정 인구 집단에서의 사용 (8.1)].
수유
여성에게 RINVOQ/RINVOQ LQ로 치료하는 동안 및 마지막 복용 후 6일 동안 모유 수유를 하지 않도록 알려주십시오. [특정 인구 집단에서의 사용 (8.2)].
투여
환자에게 RINVOQ 정제는 RINVOQ LQ와 대체할 수 없다고 알려주십시오. [투여 및 관리 (2.2)].
환자에게 RINVOQ 정제를 씹거나, 부수거나, 분할하지 않도록 알려주십시오. [투여 및 관리 (2.2)].
RINVOQ LQ의 경우 환자와 보호자에게 적절한 준비, 투여, 보관 및 폐기 방법에 대한 사용 지침을 읽고 따르도록 지시하십시오. [투여 및 관리 (2.1)].
환자에게 RINVOQ/RINVOQ LQ로 치료하는 동안 자몽을 함유한 음식이나 음료를 피하도록 알려주십시오. [약물 상호 작용 (7.1)].
변에서 약물 잔여물
환자에게 변이나 장루 배출물에서 약물 잔여물(예: 온전한 RINVOQ 정제 또는 조각)이 반복적으로 발견되면 의료 서비스 제공자에게 알리도록 지시하십시오. [경고 및 주의 사항 (5.11)].
제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
20080260 2024년 4월
약물 안내문
MEDICATION GUIDE
RINVOQ® (RIN-VOKE)
(upadacitinib)
extended-release tablets, for oral use
RINVOQ® LQ (RIN-VOKE EL-CUE)
(upadacitinib)
oral solution
RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
RINVOQ/RINVOQ LQ는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
1. 심각한 감염.
RINVOQ/RINVOQ LQ는 면역 체계에 영향을 미치는 약물입니다. RINVOQ/RINVOQ LQ는 면역 체계가 감염과 싸우는 능력을 떨어뜨릴 수 있습니다. 일부 사람들은 결핵(TB)을 포함하여 RINVOQ를 복용하는 동안 심각한 감염을 겪었으며, 박테리아, 곰팡이 또는 바이러스로 인한 감염은 신체 전체로 퍼질 수 있습니다. 이러한 감염으로 사망한 사람도 있습니다.
- 의료 서비스 제공자는 RINVOQ/RINVOQ LQ 치료를 시작하기 전에 결핵(TB) 검사를 해야 합니다.
- 의료 서비스 제공자는 RINVOQ/RINVOQ LQ 치료 중에 결핵(TB)의 징후와 증상을 주의 깊게 관찰해야 합니다.
- 의료 서비스 제공자가 안전하다고 말하지 않는 한 감염이 있는 경우 RINVOQ/RINVOQ LQ 복용을 시작해서는 안 됩니다. 대상포진(헤르페스 조스터)이 발생할 위험이 더 높을 수 있습니다.
-
RINVOQ/RINVOQ LQ를 시작하기 전에 의료 서비스 제공자에게 다음 사항을 알려주십시오.:
○ 감염 치료를 받고 있는 경우.
○ 사라지지 않거나 계속 재발하는 감염이 있었던 경우.
○ 당뇨병, 만성 폐 질환, HIV 또는 면역 체계가 약한 경우.
○ 결핵(TB)이 있거나 결핵(TB) 환자와 밀접하게 접촉한 경우.
○ 대상포진(헤르페스 조스터)이 있었던 경우.
○ B형 또는 C형 간염이 있거나 있었던 경우.
○ 특정 종류의 곰팡이 감염이 발생할 가능성이 높은 국가(오하이오 강과 미시시피 강 유역 및 남서부와 같은)에 살거나 살았거나 여행을 간 경우. 이러한 감염은 RINVOQ/RINVOQ LQ를 사용하면 발생하거나 더 심해질 수 있습니다. 이러한 감염이 흔한 지역에 살았는지 모르는 경우 의료 서비스 제공자에게 문의하십시오.
○ 감염이 있거나 감염 증상이 있는 경우(예:):
- 발열, 발한 또는 오한
- 호흡 곤란
- 따뜻하고 붉거나 통증이 있는 피부 또는 신체의 궤양
- 근육통
- 피로감
- 가래에 피가 섞여 나오는 경우
- 설사 또는 복통
- 기침
- 체중 감소
- 소변을 볼 때 따끔거림 또는 평소보다 자주 소변을 보는 경우
RINVOQ/RINVOQ LQ를 복용하기 시작한 후 감염 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하십시오. RINVOQ/RINVOQ LQ는 감염에 걸릴 가능성을 높이거나 이미 있는 감염을 악화시킬 수 있습니다. 심각한 감염이 발생하면 의료 서비스 제공자는 감염이 조절될 때까지 RINVOQ/RINVOQ LQ 치료를 중단할 수 있습니다.
2. 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있고 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우 사망 위험 증가. RINVOQ/RINVOQ LQ는 JAK 억제제 약물입니다.
3. 암 및 면역 체계 문제.
RINVOQ/RINVOQ LQ는 면역 체계 작용 방식을 변경하여 특정 암의 위험을 높일 수 있습니다.
림프종 및 피부암을 포함한 다른 암은 RINVOQ/RINVOQ LQ를 복용하는 사람들에게 발생할 수 있습니다. 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 사람들은 특히 현재 또는 과거 흡연자인 경우 림프종 및 폐암을 포함한 특정 암에 걸릴 위험이 더 높습니다.
과거에 어떤 종류의 암에 걸린 적이 있는지 의료 서비스 제공자에게 알리십시오. RINVOQ/RINVOQ LQ 치료 중에 피부암 검사를 받는 것에 대한 의료 서비스 제공자의 조언을 따르십시오. 햇빛에 노출되는 시간을 제한하십시오. 태닝 베드나 선램프 사용을 피하십시오. 햇볕에 나갈 때는 보호 의복을 착용하고 높은 보호 지수(SPF 30 이상)의 자외선 차단제를 사용하십시오. 이는 특히 피부가 매우 밝거나 가족력에 피부암이 있는 경우 중요합니다.
4. 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있고 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우, 특히 현재 또는 과거 흡연자인 경우 심장마비, 뇌졸중 또는 사망과 같은 주요 심혈관 사건 위험 증가.
RINVOQ/RINVOQ LQ를 복용하는 동안 심장마비 또는 뇌졸중 증상이 나타나면 즉시 응급 처치를 받으십시오. 여기에는 다음이 포함됩니다.
- 몇 분 이상 지속되거나 사라졌다가 다시 나타나는 가슴 중앙의 불편함
- 가슴, 목, 목, 턱에 심한 조임, 통증, 압박감 또는 무거움
- 팔, 등, 목, 턱 또는 위의 통증이나 불편함
- 가슴 불편함 유무와 관계없이 숨가쁨
- 차가운 땀을 흘림
- 메스꺼움 또는 구토
- 현기증
- 신체의 한 부분 또는 한쪽에 힘이 약해짐
- 말이 어눌해짐
5. 혈전(혈전증).
다리 정맥(심부 정맥 혈전증, DVT) 또는 폐(폐색전증, PE) 및 동맥(동맥 혈전증)의 혈전은 RINVOQ/RINVOQ LQ를 복용하는 일부 사람들에게 발생할 수 있습니다. 이는 생명을 위협하고 사망을 초래할 수 있습니다. 다리 정맥(DVT) 및 폐(PE)의 혈전은 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있는 사람들에게 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우 더 자주 발생했습니다.
- 과거에 다리 또는 폐의 정맥에 혈전이 생긴 적이 있는지 의료 서비스 제공자에게 알리십시오.
- RINVOQ/RINVOQ LQ 치료 중에 혈전 증상이 나타나면 즉시 의료 서비스를 받으십시오. 여기에는 다음이 포함됩니다.
○ 부기
○ 한쪽 또는 양쪽 다리의 통증 또는 압통
○ 갑작스럽고 설명할 수 없는 가슴 또는 등 상부 통증
○ 숨가쁨 또는 호흡 곤란
6. 알레르기 반응. RINVOQ를 복용하는 사람들에게 발진(두드러기), 호흡 곤란, 실신 또는 현기증, 입술, 혀 또는 목의 부기와 같은 알레르기 반응이 있을 수 있음을 나타내는 증상이 관찰되었습니다. 이러한 반응 중 일부는 심각했습니다. RINVOQ/RINVOQ LQ 치료 중에 이러한 증상이 나타나면 RINVOQ/RINVOQ LQ 복용을 중단하고 즉시 응급 의료 서비스를 받으십시오.
7. 위 또는 장의 파열(천공).
- 과거에 궤양성 대장염(대장의 일부에 염증) 또는 위 또는 장의 궤양이 있었는지 의료 서비스 제공자에게 알리십시오. RINVOQ/RINVOQ LQ를 복용하는 일부 사람들은 위 또는 장에 파열이 생길 수 있습니다. 이는 비스테로이드성 항염증제(NSAIDs) 또는 코르티코스테로이드를 복용하는 사람들에게 가장 자주 발생합니다.
- 위 부위 통증, 발열, 오한, 메스꺼움 또는 구토가 발생하면 즉시 의료 서비스를 받으십시오.
8. 특정 실험실 검사 결과의 변화.
의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용하기 전과 복용하는 동안 다음을 확인하기 위해 혈액 검사를 실시해야 합니다.
-
호중구 및 림프구 수 감소. 호중구 및 림프구는 신체가 감염과 싸우는 데 도움이 되는 백혈구의 일종입니다.
-
적혈구 수 감소. 적혈구는 산소를 운반합니다. 적혈구 수가 적으면 빈혈이 생길 수 있으며, 이로 인해 쇠약감과 피로감을 느낄 수 있습니다.
-
콜레스테롤 수치 증가. 의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용하기 시작한 후 약 12주 후에 콜레스테롤 수치를 확인하기 위해 혈액 검사를 실시해야 하며 필요에 따라 추가 검사를 실시해야 합니다.
-
간 효소 상승. 간 효소는 간이 정상적으로 기능하는지 여부를 알려줍니다. 간 효소가 상승하면 의료 서비스 제공자가 간에 대한 추가 검사를 실시해야 할 수 있습니다.
호중구 수, 림프구 수 또는 적혈구 수가 너무 낮거나 간 검사 결과가 너무 높으면 RINVOQ/RINVOQ LQ를 복용해서는 안 됩니다. 이러한 혈액 검사 결과의 변화로 인해 의료 서비스 제공자는 필요에 따라 RINVOQ/RINVOQ LQ 치료를 일시적으로 중단할 수 있습니다.
부작용에 대한 자세한 내용은 “RINVOQ/RINVOQ LQ의 가능한 부작용은 무엇입니까?”를 참조하십시오.
RINVOQ/RINVOQ LQ는 무엇입니까?
RINVOQ/RINVOQ LQ는 Janus kinase (JAK) 억제제인 처방약입니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 류마티스 관절염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 건선성 관절염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 이전 치료에 반응하지 않았고 다른 알약이나 주사제(생물학적 약물 포함)로 습진이 잘 조절되지 않거나 다른 알약이나 주사제를 사용하는 것이 권장되지 않는 중등도에서 중증의 습진(아토피 피부염)이 있는 12세 이상의 성인과 어린이를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 궤양성 대장염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 크론병 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 강직성 척추염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 종양괴사인자(TNF) 차단제 약물을 사용했지만 효과가 없거나 내약성이 없었던 객관적인 염증 징후가 있는 활동성 비방사선학적 축성 척추관절염이 있는 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ/RINVOQ LQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 다관절 관절염 소아 특발성 관절염(pJIA)이 있는 2세 이상의 어린이를 치료하는 데 사용됩니다.
- RINVOQ/RINVOQ LQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 건선성 관절염이 있는 2세에서 18세 미만의 어린이를 치료하는 데 사용됩니다.
RINVOQ/RINVOQ LQ가 강직성 척추염, 비방사선학적 축성 척추관절염, 궤양성 대장염 또는 크론병이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ가 12세 미만의 아토피 피부염이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ LQ가 아토피 피부염이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ/RINVOQ LQ가 pJIA 또는 건선성 관절염이 있는 2세 미만의 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
다음과 같은 경우 RINVOQ/RINVOQ LQ를 복용하지 마십시오. upadacitinib 또는 RINVOQ/RINVOQ LQ의 성분에 알레르기가 있는 경우. RINVOQ/RINVOQ LQ의 성분 전체 목록은 이 약물 안내서의 끝부분을 참조하십시오.
RINVOQ/RINVOQ LQ를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
- 다음을 참조하십시오. “RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”
- 감염이 있는 경우.
- 현재 또는 과거 흡연자인 경우.
- 심장마비, 다른 심장 문제 또는 뇌졸중이 있었던 경우.
- 간 문제가 있는 경우.
- 신장 문제가 있는 경우.
- 설명할 수 없는 위(복부) 통증이 있거나, 과거에 맹장염이나 위 또는 장의 궤양이 있었거나, NSAID를 복용하고 있는 경우.
- 적혈구 또는 백혈구 수가 낮은 경우.
- 최근에 예방 접종(백신)을 받았거나 예방 접종을 받을 예정인 경우. RINVOQ/RINVOQ LQ를 복용하는 사람은 생백신을 접종해서는 안 됩니다.
- 임신 중이거나 임신을 계획하고 있는 경우. 동물 연구에 따르면 RINVOQ/RINVOQ LQ는 태아에게 해를 끼칠 수 있습니다.
임신 가능성이 있는 여성:
- 의료 서비스 제공자는 RINVOQ/RINVOQ LQ 치료를 시작하기 전에 임신 여부를 확인합니다.
- RINVOQ/RINVOQ LQ 치료 중에는 임신을 피하기 위해 효과적인 피임(피임)을 사용해야 하며, 마지막 RINVOQ/RINVOQ LQ 복용 후 4주 동안은 피임을 계속해야 합니다.
- RINVOQ/RINVOQ LQ 치료 중에 임신했거나 임신했다고 생각되면 의료 서비스 제공자에게 알리십시오.
- RINVOQ/RINVOQ LQ에 대한 임신 감시 프로그램이 있습니다. 이 프로그램의 목적은 귀하와 귀하의 아기의 건강에 대한 정보를 수집하는 것입니다. RINVOQ/RINVOQ LQ를 복용하는 동안 임신하면 1-800-633-9110으로 전화하여 임신 사실을 보고하는 것이 좋습니다.
- 모유 수유 중이거나 모유 수유를 계획하고 있는 경우. RINVOQ/RINVOQ LQ는 모유로 이행될 수 있습니다. 귀하와 의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용할지 아니면 모유 수유를 할지 결정해야 합니다. 하지 마십시오. RINVOQ/RINVOQ LQ 치료 중에는 모유 수유를 하지 말고 마지막 RINVOQ/RINVOQ LQ 복용 후 6일 동안은 모유 수유를 하지 마십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. RINVOQ/RINVOQ LQ와 다른 약물은 서로 영향을 미쳐 부작용을 일으킬 수 있습니다.
특히 다음을 복용하는 경우 의료 서비스 제공자에게 알리십시오.
- 진균 감염 치료제(케토코나졸, 이트라코나졸, 포사코나졸 또는 보리코나졸과 같은) 또는 클라리스로마이신(세균 감염 치료제)과 같은 약물은 혈액 내 RINVOQ/RINVOQ LQ의 양을 증가시킬 수 있습니다.
- 리팜핀(세균 감염 치료제) 또는 페니토인(신경 질환 치료제)과 같은 약물은 RINVOQ/RINVOQ LQ의 효과를 감소시킬 수 있습니다.
- 면역 체계에 영향을 미치는 약물(아자티오프린 및 사이클로스포린과 같은)은 감염 위험을 증가시킬 수 있습니다.
이러한 약물을 복용하고 있는지 확실하지 않으면 의료 서비스 제공자나 약사에게 문의하십시오.
복용하는 약물을 알고 있어야 합니다. 새 약을 받을 때 의료 서비스 제공자와 약사에게 보여줄 수 있도록 약물 목록을 보관하십시오.
RINVOQ/RINVOQ LQ는 어떻게 복용해야 하나요?
- RINVOQ/RINVOQ LQ는 의료 서비스 제공자의 지시에 따라 정확하게 복용하십시오.
- RINVOQ LQ는 하루 2회 식사와 관계없이 복용하십시오.
- RINVOQ 정제는 하루 1회 식사와 관계없이 복용하십시오.
- RINVOQ 정제는 통째로 삼키십시오. 정제를 쪼개거나, 부수거나, 씹지 마십시오.
- RINVOQ LQ는 RINVOQ 정제와 다릅니다. 의료 서비스 제공자가 변경하지 않는 한 RINVOQ LQ와 RINVOQ 정제를 바꿔서 복용하지 마십시오.
- RINVOQ/RINVOQ LQ를 과량 복용한 경우 의료 서비스 제공자 또는 독극물 관리 센터(1-800-222-1222)에 전화하거나 가장 가까운 병원 응급실로 즉시 가십시오.
RINVOQ/RINVOQ LQ 복용 중에 무엇을 피해야 하나요?
RINVOQ/RINVOQ LQ 치료 중에는 자몽을 함유한 음식이나 음료를 피하십시오. 자몽이나 자몽 주스를 섭취하면 부작용 위험이 증가할 수 있습니다.
RINVOQ/RINVOQ LQ의 가능한 부작용은 무엇인가요?
RINVOQ/RINVOQ LQ는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
- “RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇인가요?”를 참조하십시오.
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선성 축상 척추 관절염, pJIA 치료를 받은 사람들에게서 RINVOQ/RINVOQ LQ의 가장 흔한 부작용은 다음과 같습니다.
• 상기도 감염(흔한 감기, 부비강염)
• 대상포진(수두 대상포진 바이러스)
• 단순 포진 바이러스 감염, 입술 포진 포함
• 기관지염
• 메스꺼움
• 기침
• 발열
• 여드름
• 두통
아토피 피부염 치료를 받은 사람들에게서 RINVOQ의 가장 흔한 부작용은 다음과 같습니다.
• 상기도 감염(흔한 감기, 부비강염)
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 두통
• 크레아틴 키나아제 혈중 농도 증가
• 기침
• 알레르기 반응
• 모낭염
• 메스꺼움
• 복통(복부)
• 발열
• 체중 증가
• 대상포진(수두 대상포진 바이러스)
• 독감
• 피로
• 백혈구 감소증(호중구 감소증)
• 근육통
• 독감 유사 증상
궤양성 대장염 치료를 받은 사람들에게서 RINVOQ의 가장 흔한 부작용은 다음과 같습니다.
• 상기도 감염(흔한 감기, 부비강염)
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 모낭염
• 발진
• 독감
• 대상포진(수두 대상포진 바이러스)
• 혈중 콜레스테롤 수치 증가
• 크레아틴 키나아제 혈중 농도 증가
• 간 효소 수치 증가
• 특정 유형의 백혈구 수 감소(호중구 감소증, 림프구 감소증)
크론병 치료를 받은 사람들에게서 RINVOQ의 가장 흔한 부작용은 다음과 같습니다.
• 상기도 감염(흔한 감기, 부비강염)
• 기관지염
• 폐렴
• 독감
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 피로
• 기침
• 발열
• 대상포진(수두 대상포진 바이러스)
• 두통
• 크레아틴 키나아제 혈중 농도 증가
• 간 효소 수치 증가
• 적혈구 수 감소(빈혈)
• 백혈구 수 감소(호중구 감소증, 백혈구 감소증)
• 위장염(위장 감염)
아토피 피부염 치료를 받은 사람들에게서 RINVOQ를 복용한 후 눈 뒤쪽의 안쪽 막이 분리되거나 찢어지는(망막 박리) 경우가 발생했습니다. RINVOQ/RINVOQ LQ 치료 중에 시력이 갑자기 변하면 즉시 의료 서비스 제공자에게 전화하십시오.
RINVOQ를 복용하는 일부 사람들은 대변에서 약물 잔여물(정제 전체 또는 정제 조각)을 볼 수 있습니다. 이런 경우 의료 서비스 제공자에게 전화하십시오.
이것들은 RINVOQ/RINVOQ LQ의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088.
RINVOQ/RINVOQ LQ는 어떻게 보관해야 하나요?
- RINVOQ 정제는 36°F~77°F(2°C~25°C)에서 보관하십시오.
- RINVOQ 정제는 원래 병에 보관하여 습기로부터 보호하십시오.
- RINVOQ LQ는 36°F~86°F(2°C~30°C)에서 보관하십시오.
- 병을 개봉한 후 60일이 지나면 남은 RINVOQ LQ는 버리십시오.
-
RINVOQ/RINVOQ LQ와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
RINVOQ/RINVOQ LQ의 안전하고 효과적인 사용에 대한 일반 정보.
의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 RINVOQ/RINVOQ LQ를 사용하지 마십시오.
RINVOQ/RINVOQ LQ를 자신과 동일한 증상이 있는 다른 사람에게 제공하지 마십시오. 해를 입힐 수 있습니다.
RINVOQ/RINVOQ LQ에 대한 정보는 약사 또는 의료 서비스 제공자에게 문의하십시오.
RINVOQ 15mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, ferrosoferric oxide, hypromellose, iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ 30mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, hypromellose, iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ 45mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, hypromellose, iron oxide yellow and iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ LQ의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: citric acid anhydrous, purified water, sodium benzoate, sodium citrate dihydrate and sucralose.
제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
자세한 내용은 1-800 2-RINVOQ(1-800-274-6867)로 전화하거나 www.RINVOQ.com을 방문하십시오.
이 의약품 안내서는 미국 식품의약국에서 승인했습니다.
20081173
개정: 4/2024
사용 지침
사용 지침
RINVOQ® LQ [RIN-VOKE EL-CUE]
(upadacitinib)
경구용 용액
이 사용 지침에는 RINVOQ LQ 경구용 용액을 준비하고 투여하는 방법에 대한 정보가 포함되어 있습니다.
RINVOQ LQ를 자녀에게 투여하기 전에 그리고 재충전을 받을 때마다 이 사용 지침을 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 자녀의 의학적 상태 또는 치료에 대해 의료 서비스 제공자와 상담하는 것을 대신할 수 없습니다.
RINVOQ LQ를 투여하기 전에 알아야 할 중요한 정보
병과 용품을 어린이의 눈에 띄지 않고 손이 닿지 않는 곳에 보관하십시오.
제공된 주사기를 사용하십시오. 사용하지 마십시오 다른 사람과 주사기를 공유하거나 다른 약물에 사용하십시오.
RINVOQ LQ를 올바르게 투여하는 방법에 대한 도움이 필요하거나 질문이 있으면 의료 서비스 제공자 또는 1-800-2-RINVOQ 또는 1-800-274-6867로 전화하십시오.
자녀가 경구용 용액을 너무 많이 복용하거나 전체 용량을 받지 못한 경우 의료 서비스 제공자에게 연락하십시오.
- 병을 개봉한 후 60일 이내에 RINVOQ LQ를 사용하십시오. 기억을 돕기 위해 병을 개봉한 날짜를 상자에 적으십시오.
-
사용하지 마십시오 이전 병을 비우기 전에 새로운 병의 RINVOQ LQ를 개봉하십시오. 새로운 병을 개봉할 때는 새 주사기를 사용하십시오.
- RINVOQ LQ 경구용 용액은 투명하고 무색에서 연한 노란색입니다.
- 이 지침과 RINVOQ LQ 경구용 용액과 용품이 들어 있는 상자를 나중에 사용할 수 있도록 보관하십시오.
각 상자에 포함된 용품
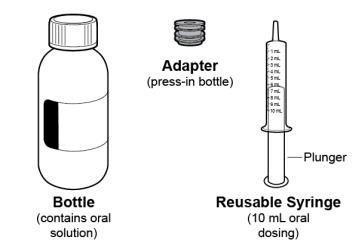
그림 A
RINVOQ LQ 폐기
병을 비우거나 개봉 후 60일이 지나면 주사기와 병을 폐기하십시오.
- 사용하지 않은 약물을 올바르게 폐기하는 방법은 약사에게 문의하십시오.
- 주사기를 헹군 다음 가정 쓰레기통에 버리십시오.
RINVOQ LQ 준비
1. 처방된 용량을 확인하십시오.
a. 자녀의 처방된 용량을 밀리리터(mL)로 확인하고 주사기에서 이 mL 눈금을 찾으십시오.
b. 처방된 용량을 투여하기 위해 제공된 주사기만 사용하십시오.
2. 유효 기간을 확인하십시오.
a. 병을 확인하고 유효 기간이 지나지 않았는지 확인하십시오(그림 B 참조).
사용하지 마십시오 상자와 병에 인쇄된 유효 기간이 지난 후 “EXP” 이후의 RINVOQ LQ를 사용하십시오.
그림 B
3. 용품을 확인하십시오.
a. 용품을 확인하고 손상되지 않았는지 확인하십시오(그림 C 참조).
b. 주사기가 깨끗하고 마른 경우에만 사용하십시오.
c. 플런저가 주사기 안으로 완전히 들어갔는지 확인하십시오.
 사용하지 마십시오 용품이 젖었거나 손상되었거나 변조된 것으로 보이는 경우.
사용하지 마십시오 용품이 젖었거나 손상되었거나 변조된 것으로 보이는 경우.
그림 C
4. 병을 개봉하십시오.
a. 뚜껑을 눌러 돌려서 병에서 빼십시오(그림 D 참조). 버리지 마십시오 뚜껑을 버리십시오.
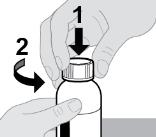
그림 D
5. 어댑터를 삽입하십시오(처음 사용하는 경우만).
a. 병을 단단히 잡고 엄지손가락으로 어댑터를 병 가장자리까지 완전히 밀어 넣으십시오(그림 E 참조).
참고: 어댑터에 압력을 가해야 할 수 있습니다.
사용하지 마십시오 어댑터를 삽입한 후 제거하십시오.
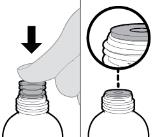
그림 E
용량 측정
6. 주사기를 병에 삽입한 다음 거꾸로 뒤집으십시오.
a. 주사기 끝을 어댑터에 삽입하십시오.
b. 주사기가 병에 연결된 상태에서 병을 거꾸로 뒤집으십시오(그림 F 참조).
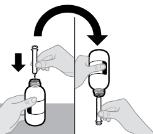
그림 F
7. 경구용 용액을 주사기에 넣으십시오.
a. 플런저를 천천히 아래로 당기십시오(그림 G 참조).
b. 주사기에 기포가 있는지 확인하십시오.
참고: 플런저를 당길 때 압력을 느낄 수 있습니다.
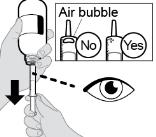
그림 G
8. 큰 기포 제거 (그림 H 참조).
a. 병을 잡고 주사기 측면을 가볍게 두드려 큰 기포를 주사기 끝으로 보냅니다.
b. 주사기가 병에 연결된 상태에서 플런저를 위아래로 움직여 기포를 병으로 되돌립니다.
c. 큰 기포가 사라질 때까지 8단계를 반복합니다.
참고: 작은 기포는 정상입니다.
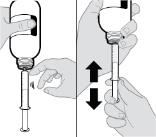
그림 H
9. 용량 측정.
a. 큰 기포가 제거된 후 플런저를 용량 표시와 일치하도록 움직입니다 ( 그림 I 참조).
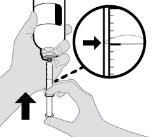
그림 I
10. 병을 똑바로 세우고 주사기를 제거합니다.
a. 주사기가 병에 연결된 상태에서 병을 똑바로 세웁니다.
b. 주사기 중간을 잡고 병에서 조심스럽게 제거합니다 ( 그림 J 참조).
만지지 마세요 약을 투여할 준비가 되기 전에 주사기에서 경구용액이 실수로 나오는 것을 방지하기 위해 플런저를 만지지 마세요.
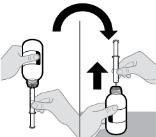
그림 J
RINVOQ LQ 투여
11. 용량 확인.
a. 주사기에 정확한 용량의 경구용액이 있는지 확인합니다 ( 그림 K 참조).
b. 주사기에 큰 기포가 있는지 확인합니다.
c. 용량이 정확하지 않거나 큰 기포가 보이면 6단계로 돌아갑니다.
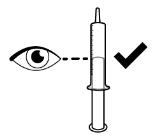
그림 K
12. 경구용액 투여.
a. 주사기를 아이의 볼 안쪽에 대십시오.
b. 플런저를 눌러 아이의 입에 전체 용량을 투여합니다 ( 그림 L 참조).
c. 아이에게 물을 마시게 합니다.
참고: 경구용액은 주사기를 채운 후 1시간 이내에 투여해야 합니다.
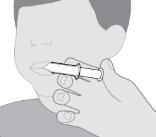
그림 L
RINVOQ LQ 보관
13. 병을 닫고 보관합니다.
a. 어댑터가 병에 삽입된 상태에서 뚜껑을 병에 다시 끼워 밀봉합니다 ( 그림 M 참조).
b. 사용하지 않을 때는 병을 상자에 똑바로 세워 보관합니다.
c. 병을 상자에 넣어 서늘하고 어두운 곳에 36°F~86°F(2°C~30°C)에서 보관합니다.
d. 병, 용품 및 모든 약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
그림 M
14. 주사기를 헹구고 보관합니다.
a. 주사기에서 플런저를 제거한 다음 두 부분을 물로 헹굽니다 ( 그림 N 참조).
사용하지 마세요 비누를 사용하거나 주사기를 식기 세척기에 넣어 청소하지 마세요.
b. 분리된 부분을 깨끗한 표면에 말립니다.
c. 주사기를 깨끗하고 건조한 곳에 보관합니다.
그림 N
15. 병을 다 사용했으면 “RINVOQ LQ 폐기”를 참조하십시오.

제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
이 사용 설명서는 미국 식품의약국에서 승인했습니다.
발행: 2024년 4월
20081174 R1
주요 표시 패널
NDC 0074-2306-30
RINVOQ™
우파다시티닙
연장 방출용 정제 15mg
원래 포장으로 조제
캡을 뒤집어 포일을 자르세요
뒤집어서 설명을 읽어보세요
정제 30알
의사 처방전만 유효
abbvie

주요 표시 패널
NDC 0074-2310-30
RINVOQ®
upadacitinib
연장 방출 정제
30mg
원래 포장에서 약을 분배하다
캡을 뒤집어 포일을 자르기
뒤로 벗겨 사용법 확인
30 정제
처방전 전용
abbvie
주요 표시 패널
NDC 0074-1043-28
RINVOQ®
upadacitinib
연장-방출 정제
45 mg
투약 안내서와 함께 제공
캡을 뒤집어 호일을 자르세요
뒤집어 설명을 확인하세요
정제 28 개
전문의 처방전만
abbvie
주요 표시 패널
NDC 0074-2320-01
RINVOQ®LQ
업다시티닙
경구용 용액
1 mg/mL
RINVOQ LQ 및 RINVOQ
대체할 수 없습니다.
첫 사용 시 병 어댑터를 삽입하세요.
삽입 후 제거하지 마세요.
병 1 개당 180 mL
전문의 처방전에 의해서만
abbvie
Tags: P2RY12
1.1 류마티스 관절염
RINVOQ®는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 류마티스 관절염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 질병 조절 항류마티스제(DMARDs) 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.2 건선성 관절염
RINVOQ/RINVOQ LQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 만 2세 이상의 소아 환자 및 성인의 활동성 건선성 관절염 치료에 사용됩니다.
● 사용 제한: RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.3 아토피 피부염
RINVOQ는 생물학적 제제를 포함한 다른 전신 약물로 질환이 적절하게 조절되지 않거나 이러한 치료법을 사용하는 것이 권장되지 않는, 난치성의 중등증에서 중증의 아토피 피부염을 앓고 있는 만 12세 이상의 소아 환자 및 성인의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 면역 조절제 또는 다른 면역억제제와 병용하지 않는 것이 좋습니다.
1.4 궤양성 대장염
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 궤양성 대장염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 궤양성 대장염에 대한 생물학적 치료법 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.5 크론병
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 중등증에서 중증의 활동성 크론병 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 크론병에 대한 생물학적 치료법 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.6 강직성 척추염
RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 활동성 강직성 척추염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.7 방사선 비관찰적 축성 척추관절염
RINVOQ는 TNF 차단제 치료에 대한 반응이 불충분하거나 내약성이 없는 객관적인 염증 징후가 있는 활동성 방사선 비관찰적 축성 척추관절염 성인 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
1.8 다관절 소아 특발성 관절염
RINVOQ/RINVOQ LQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 만 2세 이상의 활동성 다관절 소아 특발성 관절염(pJIA) 환자의 치료에 사용됩니다.
● 사용 제한: RINVOQ/RINVOQ LQ는 다른 JAK 억제제, 생물학적 DMARD 또는 아자티오프린 및 사이클로스포린과 같은 강력한 면역억제제와 병용하지 않는 것이 좋습니다.
2.1 치료 시작 전 권장 평가 및 예방 접종
RINVOQ/RINVOQ LQ 치료 시작 전에 다음 평가를 고려하십시오.
● 활동성 및 잠복 결핵(TB) 감염 평가 – 양성인 경우 RINVOQ/RINVOQ LQ 사용 전에 결핵을 치료하십시오 [경고 및 주의 사항 (5.1)].
● 임상 지침에 따라 바이러스성 간염 검사 – 활동성 B형 간염 또는 C형 간염이 있는 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [경고 및 주의 사항 (5.1)].
● 완전 혈구 수 – 절대 림프구 수가 500 cells/mm3 미만, 절대 호중구 수가 1000 cells/mm3 미만 또는 헤모글로빈 수치가 8 g/dL 미만인 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [용법 및 용량 (2.13) 및 경고 및 주의 사항 (5.8)].
● 기준 간 기능: 중증 간 기능 장애(Child-Pugh C)가 있는 환자의 경우 RINVOQ/RINVOQ LQ 시작을 권장하지 않습니다 [특정 환자군에서의 사용 (8.7) 및 임상 약리 (12.3)].
● 임신 상태: 치료 시작 전에 임신 가능성이 있는 여성의 임신 상태를 확인하십시오 [경고 및 주의 사항 (5.9) 및 특정 환자군에서의 사용 (8.1, 8.3)].
현재 예방 접종 지침에 따라 예방 접종을 업데이트하십시오 [경고 및 주의 사항 (5.10)].
2.2 중요한 투약 지침
● RINVOQ LQ 경구 용액은 RINVOQ 서방형 정제와 교체할 수 없습니다 [용법 및 용량 (2.4, 2.10)].
● RINVOQ LQ 경구 용액과 RINVOQ 서방형 정제 간의 변경은 의료 서비스 제공자가 해야 합니다.
● RINVOQ/RINVOQ LQ는 음식과 함께 또는 음식 없이 경구로 복용해야 합니다 [임상 약리 (12.3)].
● RINVOQ 정제는 통째로 삼켜야 합니다. RINVOQ 정제는 분할, 분쇄 또는 씹어서는 안 됩니다.
● RINVOQ LQ는 제공된 눌러서 끼우는 병 어댑터와 경구 투약 주사기를 사용하여 투여해야 합니다 [사용 지침 참조].
2.4 건선성 관절염에서의 권장 용량
2세 이상 18세 미만 소아 환자
권장 용량은 체중을 기준으로 합니다(표 1).
| 환자 체중 | RINVOQ LQ | RINVOQ |
| 10kg 미만 20kg | 하루 두 번 3mg(경구 용액 3mL) | 권장하지 않음 |
| 20kg 미만 30kg | 하루 두 번 4mg(경구 용액 4mL) | 권장하지 않음 |
| 30kg 이상 | 하루 두 번 6mg(경구 용액 6mL) | 하루 1회 15mg(15mg 정제 1정) |
2.1 투여 및 관리
RINVOQ LQ 경구용액은 RINVOQ 서방형 정제와 교체할 수 없습니다. RINVOQ LQ 경구용액과 RINVOQ 서방형 정제 간의 변경은 의료 서비스 제공자에 의해 이루어져야 합니다.
18세 이상 성인
RINVOQ의 권장 용량은 1일 1회 15mg입니다.
2.5 아토피 피부염에서의 권장 용량
체중이 40kg 이상인 12세 이상 소아 환자 및 65세 미만 성인
RINVOQ 1일 1회 15mg으로 치료를 시작합니다. 적절한 반응이 나타나지 않으면 용량을 1일 1회 30mg으로 증량하는 것을 고려합니다. 30mg 용량으로 적절한 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
65세 이상 성인
RINVOQ의 권장 용량은 1일 1회 15mg입니다.
2.6 궤양성 대장염에서의 권장 용량
성인 환자: 유도
RINVOQ의 권장 유도 용량은 8주 동안 1일 1회 45mg입니다.
성인 환자: 유지
RINVOQ의 권장 유지 치료 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위한 질환이 있는 환자의 경우 1일 1회 30mg 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
2.7 크론병에서의 권장 용량
성인 환자: 유도
RINVOQ의 권장 유도 용량은 12주 동안 1일 1회 45mg입니다.
성인 환자: 유지
RINVOQ의 권장 유지 치료 용량은 1일 1회 15mg입니다. 난치성, 중증 또는 광범위한 질환이 있는 환자의 경우 1일 1회 30mg 용량을 고려할 수 있습니다. 30mg 용량으로 적절한 치료 반응이 나타나지 않으면 RINVOQ를 중단합니다. 반응을 유지하는 데 필요한 최소 유효 용량을 사용합니다.
2.10 다관절형 소아 특발성 관절염에서의 권장 용량
권장 용량은 체중을 기반으로 합니다(표 2).
| 환자 체중 | RINVOQ LQ | RINVOQ |
| 10kg 이상 20kg 미만 | 1일 2회 3mg(3mL 경구용액) | 권장하지 않음 |
| 20kg 이상 30kg 미만 | 1일 2회 4mg(4mL 경구용액) | 권장하지 않음 |
| 30kg 이상 | 1일 2회 6mg(6mL 경구용액) | 1일 1회 15mg(15mg 정제 1정) |
2.11 신장애 또는 간장애 환자에서의 권장 용량
신장애
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염:
● 경증, 중등증 또는 중증 신장애 환자의 경우 용량 조절이 필요하지 않습니다.
아토피 피부염:
● 중증 신장애 환자 [추정 사구체 여과율 (eGFR) 15~< 30 mL/min/1.73m2]의 경우 RINVOQ의 권장 용량은 1일 1회 15mg입니다 [특정 집단에서의 사용 (8.6) 참조].
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
궤양성 대장염:
● 중증 신장애 환자 (eGFR 15~< 30 mL/min/1.73m2)의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 8주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
크론병:
● 중증 신장애 환자 (eGFR 15~< 30 mL/min/1.73m2)의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
● 경증 또는 중등증 신장애 환자 (eGFR ≥ 30 mL/min/1.73m2)의 경우 용량 조절이 필요하지 않습니다.
● RINVOQ는 말기 신장 질환 환자 (eGFR < 15 mL/min/1.73m2)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.6) 참조].
간장애
RINVOQ/RINVOQ LQ는 중증 간장애 환자 (Child-Pugh C)에게는 권장되지 않습니다 [특정 집단에서의 사용 (8.7) 참조].
류마티스 관절염, 건선성 관절염, 아토피 피부염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염:
경증 또는 중등증 간장애 환자 (Child-Pugh A 또는 B)의 경우 용량 조절이 필요하지 않습니다.
궤양성 대장염:
경증에서 중등증 간장애 (Child-Pugh A 또는 B) 환자의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
- 유도: 8주 동안 1일 1회 30mg
- 유지: 1일 1회 15mg
크론병:
경증에서 중등증 간장애 (Child-Pugh A 또는 B) 환자의 경우 RINVOQ의 권장 용량은 다음과 같습니다.
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
2.12 약물 상호 작용으로 인한 용량 조절
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염, 및 소아 특발성 관절염
강력한 CYP3A4 억제제를 투여받는 환자의 경우 용량 조절이 필요하지 않습니다 [약물 상호 작용 (7.1) 참조].
아토피 피부염
강력한 CYP3A4 억제제를 투여받는 환자의 경우 RINVOQ의 권장 용량은 1일 1회 15mg입니다 [약물 상호 작용 (7.1) 참조].
궤양성 대장염
강력한 CYP3A4 억제제를 투여받는 궤양성 대장염 환자에서 RINVOQ의 권장 용량은 다음과 같습니다 [약물 상호 작용 (7.1)]:
- 유도: 8주 동안 1일 1회 30mg
- 유지: 1일 1회 15mg
크론병
강력한 CYP3A4 억제제를 투여받는 크론병 환자에서 RINVOQ의 권장 용량은 다음과 같습니다 [약물 상호 작용 (7.1)]:
• 유도: 12주 동안 1일 1회 30mg
• 유지: 1일 1회 15mg
2.13 용량 중단
감염
환자가 심각한 감염, 심각한 기회 감염을 포함하여 발생하는 경우, 감염이 조절될 때까지 RINVOQ/RINVOQ LQ 치료를 중단합니다 [경고 및 주의 사항 (5.1)].
실험실 검사 이상
표 3에 설명된 바와 같이 실험실 검사 이상을 관리하기 위해 투약을 중단해야 할 수 있습니다 [경고 및 주의 사항 (5.8)].
| 실험실 측정 | 조치 |
| 절대 호중구 수 (ANC) | ANC가 1000 cells/mm3 미만인 경우 치료를 중단합니다. ANC가 이 값을 초과하면 치료를 재개할 수 있습니다. |
| 절대 림프구 수 (ALC) | ALC가 500 cells/mm3 미만인 경우 치료를 중단합니다. ALC가 이 값을 초과하면 치료를 재개할 수 있습니다. |
| 헤모글로빈 (Hb) | Hb가 8 g/dL 미만인 경우 치료를 중단합니다. Hb가 이 값을 초과하면 치료를 재개할 수 있습니다. |
| 간 transaminases | 약물 유발성 간 손상이 의심되는 경우, 이 진단이 배제될 때까지 치료를 중단합니다. |
3가지 제형 및 함량
RINVOQ 연장 방출 정제 :
- 15mg upadacitinib : 보라색, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a15’가 음각으로 새겨져 있습니다.
- 30mg upadacitinib : 빨간색, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a30’가 음각으로 새겨져 있습니다.
- 45mg upadacitinib : 노란색에서 비늘 모양의 노란색까지의 색상, 이중 볼록한 직사각형, 크기 14 x 8mm이고 한쪽에 ‘a45’가 음각으로 새겨져 있습니다.
RINVOQ LQ 경구용 용액 :
- 1mg/mL upadacitinib ; 투명, 무색에서 옅은 노란색 용액, 180mL 병에 담겨 있습니다.
4 금기 사항
RINVOQ/RINVOQ LQ는 업다시티닙 또는 그 첨가제에 대한 과민 반응이 있는 환자에게는 금기입니다 [경고 및 주의 사항 (5.6)].
5. 경고 및 주의 사항
5.1 심각한 감염
RINVOQ를 투여받은 환자에서 심각하고 때로는 치명적인 감염이 보고되었습니다. RINVOQ와 관련하여 보고된 가장 흔한 심각한 감염에는 폐렴과 봉와직염이 포함되었습니다 [부작용 (6.1)]. 기회 감염 중 결핵, 다발성 피부 포진, 구강/식도 칸디다증 및 크립토코쿠스증이 RINVOQ와 관련하여 보고되었습니다. RINVOQ 30mg에서 RINVOQ 15mg에 비해 심각한 감염 발생률이 더 높았습니다.
활동성 심각한 감염(국소 감염 포함)이 있는 환자에게는 RINVOQ/RINVOQ LQ를 사용하지 마십시오. 다음 환자의 경우 RINVOQ/RINVOQ LQ를 시작하기 전에 치료의 위험과 이점을 고려하십시오.
- 만성 또는 재발성 감염이 있는 환자
- 결핵에 노출된 환자
- 심각한 감염 또는 기회 감염의 병력이 있는 환자
- 결핵이 풍토병인 지역에 거주하거나 여행한 환자 또는
- 감염에 취약하게 만드는 기저 질환이 있는 환자.
RINVOQ/RINVOQ LQ 치료 중 및 치료 후에 감염의 징후와 증상이 나타나는지 환자를 면밀히 모니터링하십시오. 환자에게 심각한 감염 또는 기회 감염이 발생하면 RINVOQ/RINVOQ LQ를 중단하십시오.
RINVOQ/RINVOQ LQ 치료 중에 새로운 감염이 발생하는 환자는 면역 저하 환자에게 적합한 신속하고 완전한 진단 검사를 받아야 합니다. 적절한 항균 요법을 시작하고 환자를 면밀히 모니터링해야 하며, 환자가 항균 요법에 반응하지 않으면 RINVOQ/RINVOQ LQ를 중단해야 합니다. 감염이 조절되면 RINVOQ/RINVOQ LQ를 재개할 수 있습니다.
결핵
RINVOQ/RINVOQ LQ를 투여하기 전에 환자를 대상으로 잠복 결핵(TB) 감염 및 활동성 결핵 감염을 평가하고 검사하십시오. 잠복 TB가 있는 환자는 RINVOQ/RINVOQ LQ를 시작하기 전에 표준 항결핵 요법을 받아야 합니다. 활동성 TB가 있는 환자에게는 RINVOQ/RINVOQ LQ를 투여해서는 안 됩니다. 이전에 치료받지 않은 잠복 TB가 있는 환자 또는 적절한 치료 과정을 확인할 수 없는 활동성 TB가 있는 환자, 그리고 잠복 TB에 대한 검사 결과가 음성이지만 TB 감염 위험 요인이 있는 환자의 경우 RINVOQ/RINVOQ LQ를 시작하기 전에 항결핵 요법을 고려하십시오.
개별 환자에게 항결핵 요법을 시작하는 것이 적절한지 여부를 결정하는 데 도움이 되도록 결핵 치료 전문의와 상담하는 것이 좋습니다.
RINVOQ/RINVOQ LQ를 사용하는 동안, 치료를 시작하기 전에 잠복 TB 감염에 대한 검사 결과가 음성인 환자를 포함하여 환자를 대상으로 결핵의 징후와 증상이 나타나는지 모니터링하십시오.
바이러스재활성화
RINVOQ 임상 시험에서 헤르페스 바이러스 재활성화(예: 대상 포진) 및 B형 간염 바이러스 재활성화를 포함한 바이러스 재활성화가 보고되었습니다 [부작용 (6.1)]. 일본에서 RINVOQ로 치료받은 환자의 경우 대상 포진 위험이 더 높은 것으로 나타났습니다. 환자에게 대상 포진이 발생하면 증상이 해결될 때까지 RINVOQ/RINVOQ LQ를 일시적으로 중단하는 것을 고려하십시오.
RINVOQ/RINVOQ LQ 치료를 시작하기 전과 치료 중에 바이러스성 간염 검사를 실시하고 재활성화를 모니터링해야 합니다. C형 간염 항체 및 C형 간염 바이러스 RNA가 양성인 환자는 임상 시험에서 제외되었습니다. B형 간염 표면 항원 또는 B형 간염 바이러스 DNA가 양성인 환자는 임상 시험에서 제외되었습니다. 그러나 RINVOQ의 3상 임상 시험에 등록된 환자에서 B형 간염 재활성화 사례가 여전히 보고되었습니다. RINVOQ/RINVOQ LQ를 투여받는 동안 B형 간염 바이러스 DNA가 검출되면 간 전문의와 상담해야 합니다.
5.2 사망률
심혈관 위험 요인이 하나 이상 있는 50세 이상의 RA 환자를 대상으로 한 또 다른 JAK 억제제에 대한 대규모 무작위 배정 후 시판 후 안전성 연구에서 JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 모든 원인 사망률(돌연 심혈관 사망 포함)이 더 높은 것으로 나타났습니다.
RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에 개별 환자의 이점과 위험을 고려하십시오.
5.3 악성 종양 및 림프 증식성 질환
RINVOQ 임상 시험에서 림프종을 포함한 악성 종양이 관찰되었습니다 [부작용 (6.1)].
RA 환자를 대상으로 한 또 다른 JAK 억제제에 대한 대규모 무작위 배정 후 시판 후 안전성 연구에서 JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 악성 종양(비흑색종 피부암 제외) 발생률이 더 높은 것으로 나타났습니다. JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 림프종 발생률이 더 높은 것으로 나타났습니다. JAK 억제제로 치료받은 환자에서 TNF 억제제로 치료받은 환자에 비해 현재 또는 과거 흡연자의 경우 폐암 발생률이 더 높은 것으로 나타났습니다. 이 연구에서 현재 또는 과거 흡연자는 전체 악성 종양 위험이 추가로 증가했습니다.
특히 알려진 악성 종양(성공적으로 치료된 비흑색종 피부암 제외)이 있는 환자, 치료 중에 악성 종양이 발생하는 환자, 현재 또는 과거 흡연자인 환자의 경우 RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에 개별 환자의 이점과 위험을 고려하십시오.
비흑색종 피부암
RINVOQ로 치료받은 환자에서 비흑색종 피부암이 보고되었습니다. 피부암 위험이 높은 환자는 정기적으로 피부 검사를 받는 것이 좋습니다.
보호 의복을 착용하고 광범위 자외선 차단제를 사용하여 햇빛과 자외선에 대한 노출을 제한해야 합니다.
5.4 주요 심혈관계 이상 사례
RA 환자에서 다른 JAK 억제제에 대한 대규모 무작위 배정, 시판 후 안전성 연구에서 심혈관계 위험 요인이 하나 이상 있는 50세 이상의 환자에서 심혈관계 사망, 비치명적 심근 경색(MI) 및 비치명적 뇌졸중으로 정의된 주요 심혈관계 이상 사례(MACE) 발생률이 TNF 억제제로 치료받은 환자에 비해 더 높았습니다. 현재 흡연자 또는 과거 흡연자는 추가적으로 위험이 증가합니다.
RINVOQ/RINVOQ LQ 치료를 시작하거나 계속하기 전에, 특히 현재 흡연자 또는 과거 흡연자 및 다른 심혈관계 위험 요인이 있는 환자의 경우 개별 환자에 대한 이점과 위험을 고려하십시오. 환자는 심각한 심혈관계 이상 사례의 증상과 발생 시 취해야 할 조치에 대해 알려야 합니다. 심근 경색 또는 뇌졸중을 경험한 환자는 RINVOQ/RINVOQ LQ를 중단하십시오.
5.5 혈전증
심부 정맥 혈전증(DVT), 폐색전증(PE) 및 동맥 혈전증을 포함한 혈전증이 RINVOQ를 포함한 JAK 억제제로 염증성 질환을 치료받은 환자에서 발생했습니다. 이러한 이상 사례 중 상당수는 심각했으며 일부는 사망으로 이어졌습니다.
RA 환자에서 다른 JAK 억제제에 대한 대규모 무작위 배정, 시판 후 안전성 연구에서 심혈관계 위험 요인이 하나 이상 있는 50세 이상의 환자에서 전체 혈전증, DVT 및 PE 발생률이 TNF 억제제로 치료받은 환자에 비해 더 높았습니다.
혈전증 증상이 나타나면 환자는 RINVOQ/RINVOQ LQ를 중단하고 즉시 평가를 받아 적절한 치료를 받아야 합니다. 혈전증 위험이 높을 수 있는 환자는 RINVOQ/RINVOQ LQ를 피하십시오.
5.6 과민 반응
임상 시험에서 RINVOQ를 투여받은 환자에서 아나필락시스 및 안지오에데마와 같은 심각한 과민 반응이 보고되었습니다. 임상적으로 유의미한 과민 반응이 발생하면 RINVOQ/RINVOQ LQ를 중단하고 적절한 치료를 시작하십시오 [이상 반응 (6.1)].
5.7 위장 천공
RINVOQ 임상 시험에서 위장 천공이 보고되었습니다 [이상 반응 (6.1)].
위장 천공 위험이 있는 환자(예: 과거에 맹장염 병력이 있는 환자 및 NSAID 또는 코르티코스테로이드를 동시에 복용하는 환자)는 RINVOQ/RINVOQ LQ로 치료받는 환자를 모니터링하십시오. 위장 천공을 조기에 발견하기 위해 새롭게 발생한 복통을 보이는 환자를 즉시 평가하십시오.
5.8 검사실 이상
호중구 감소증
RINVOQ 치료는 호중구 감소증(ANC 1000개/mm3 미만) 발생률 증가와 관련이 있었습니다.
기준선에서 호중구 수를 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 호중구 수가 낮은 환자(즉, ANC 1000개/mm3 미만)는 RINVOQ/RINVOQ LQ 투여를 피하고 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
림프구 감소증
임상 시험에서 RINVOQ로 치료받은 환자에서 ALC 500개/mm3 미만이 보고되었습니다.
기준선에서 림프구 수를 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 림프구 수가 낮은 환자(즉, 500개/mm3 미만)는 RINVOQ/RINVOQ LQ 투여를 피하거나 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
빈혈
임상 시험에서 RINVOQ로 치료받은 환자에서 헤모글로빈 수치가 8g/dL 미만으로 감소했습니다.
기준선에서 헤모글로빈을 평가하고 그 후에는 환자 관리 루틴에 따라 평가하십시오. 헤모글로빈 수치가 낮은 환자(즉, 8g/dL 미만)는 RINVOQ/RINVOQ LQ 투여를 피하거나 RINVOQ/RINVOQ LQ 치료를 중단하십시오 [투여 및 투약 (2.1, 2.13)].
지질
RINVOQ 치료는 총 콜레스테롤, 저밀도 지단백(LDL) 콜레스테롤 및 고밀도 지단백(HDL) 콜레스테롤을 포함한 지질 매개변수 증가와 관련이 있었습니다 [이상 반응 (6.1)]. 스타틴 요법에 대한 반응으로 LDL 콜레스테롤 상승은 치료 전 수준으로 감소했습니다. 이러한 지질 매개변수 상승이 심혈관계 질환의 발병률 및 사망률에 미치는 영향은 밝혀지지 않았습니다.
치료 시작 후 약 12주 후에 지질 매개변수를 평가하고 그 후에는 고지혈증에 대한 임상 지침에 따라 평가하십시오. 고지혈증 관리에 대한 임상 지침에 따라 환자를 관리하십시오.
간 효소 상승
RINVOQ 치료는 위약 치료에 비해 간 효소 상승 발생률이 증가했습니다.
기저선에서 간 효소를 평가하고 이후에는 일상적인 환자 관리에 따라 평가합니다. 약물 유발성 간 손상의 잠재적 사례를 식별하기 위해 간 효소 상승의 원인을 신속하게 조사하는 것이 좋습니다.
일상적인 환자 관리 중에 ALT 또는 AST가 증가하는 것이 관찰되고 약물 유발성 간 손상이 의심되는 경우, 이 진단이 배제될 때까지 RINVOQ/RINVOQ LQ를 중단해야 합니다.
5.9 태아 독성
동물 연구 결과를 바탕으로 RINVOQ/RINVOQ LQ는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 기관 형성 과정 동안 랫드와 토끼에게 업다시티닙을 투여하면 태아 기형이 증가했습니다. 치료를 시작하기 전에 생식 능력이 있는 환자의 임신 상태를 확인하십시오. 생식 능력이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 RINVOQ/RINVOQ LQ 치료 중 및 치료 종료 후 4주 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 인구 집단에서의 사용 참조 (8.1, 8.3)].
5.10 예방 접종
RINVOQ/RINVOQ LQ 치료 시작 중 또는 직전에 생백신 사용을 피하십시오. RINVOQ/RINVOQ LQ 치료를 시작하기 전에 환자는 현재 예방 접종 지침에 따라 예방 접종을 모두 받았는지 확인해야 합니다. 여기에는 예방 접종 수두 또는 대상 포진 백신이 포함됩니다.
5.11 대변 중 약물 잔여물
RINVOQ를 복용하는 환자에서 대변 또는 장루 배출물에서 약물 잔여물이 발견되었다는 보고가 있습니다. 대부분의 보고는 해부학적(예: 회장루, 결장루, 장 절제술) 또는 기능적 위장관 상태로 위장관 통과 시간이 단축된 경우를 설명했습니다. 약물 잔여물이 반복적으로 관찰되면 환자에게 의료 서비스 제공자에게 연락하도록 지시하십시오. 환자를 임상적으로 모니터링하고 치료 반응이 불충분한 경우 대체 치료를 고려하십시오.
6. 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 부분에서 설명되어 있습니다.
- 중증 감염 [경고 및 주의 사항 (5.1)]
- 사망 [경고 및 주의 사항 (5.2)]
- 악성 종양 및 림프 증식성 질환 [경고 및 주의 사항 (5.3)]
- 중대한 심혈관계 사건 [경고 및 주의 사항 (5.4)]
- 혈전증 [경고 및 주의 사항 (5.5)]
- 과민 반응 [경고 및 주의 사항 (5.6)]
- 위장관 천공 [경고 및 주의 사항 (5.7)]
- 검사실 이상 [경고 및 주의 사항 (5.8)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
류마티스 관절염 환자의 유해 반응
3상 임상 시험에서 RINVOQ 15mg 또는 업다시티닙 30mg 정제를 1일 1회 투여한 류마티스 관절염 성인 환자 3833명 중 2806명이 1년 이상 노출되었습니다.
환자는 시험 설계에 따라 12주부터 위약에서 RINVOQ 15mg으로 진행하거나 전환하거나, 활성 비교군 또는 위약에서 RINVOQ로 구제를 받을 수 있었습니다.
총 2630명의 환자가 RINVOQ 15mg을 최소 1회 투여 받았으며, 그 중 1860명이 1년 이상 노출되었습니다. RA-I, RA-II, RA-III 및 RA-V 시험에서 1213명의 환자가 RINVOQ 15mg을 최소 1회 투여 받았으며, 그 중 986명이 1년 이상 노출되었고, 1203명의 환자가 업다시티닙 30mg을 최소 1회 투여 받았으며, 그 중 946명이 1년 이상 노출되었습니다.
| 유해 반응 | 위약 | RINVOQ 15 mg |
| N = 1042 (%) |
N = 1035 (%) |
|
| 상기도 감염 (URTI)* | 9.5 | 13.5 |
| 메스꺼움 | 2.2 | 3.5 |
| 기침 | 1.0 | 2.2 |
| 발열 | 0 | 1.2 |
| *URTI에는 다음이 포함됩니다. 급성 축농증, 후두염, 비인두염, 구인두 통증, 인두염, 인두 편도염, 비염, 축농증, 편도염, 바이러스성 상기도 감염 |
||
RINVOQ 15mg군에서 12주까지 위약군보다 높은 비율로 1% 미만의 환자에게 보고된 다른 이상 반응에는 폐렴, 대상포진, 단순포진(구강 포진 포함), 구강 칸디다증이 포함됩니다.
4개의 통합 데이터 세트가 특정 이상 반응 섹션에 제시됩니다.
위약 대조 시험: 시험 RA-III, RA-IV 및 RA-V는 위약(n=1042) 및 RINVOQ 15mg(n=1035)에 대한 12/14주까지의 안전성을 나타내기 위해 통합되었습니다. 시험 RA-III 및 RA-V는 위약(n=390), RINVOQ 15mg(n=385) 및 업다시티닙 30mg(n=384)에 대한 12주까지의 안전성을 나타내기 위해 통합되었습니다. 시험 RA-IV는 30mg 용량을 포함하지 않았으므로 업다시티닙 30mg에 대한 안전성 데이터는 시험 RA-III 및 RA-V를 풀링한 위약 및 RINVOQ 15mg 비율과만 비교할 수 있습니다.
MTX 대조 시험: 시험 RA-I 및 RA-II는 MTX(n=530), RINVOQ 15mg(n=534) 및 업다시티닙 30mg(n=529)에 대한 12/14주까지의 안전성을 나타내기 위해 통합되었습니다.
12개월 노출 데이터 세트: 시험 RA-I, II, III 및 V는 RINVOQ 15mg(n=1213) 및 업다시티닙 30mg(n=1203)의 장기 안전성을 나타내기 위해 통합되었습니다.
노출 조정 발생률은 이 섹션에 보고된 모든 이상 사건에 대해 시험별로 조정되었습니다.
특정 이상 반응
감염
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 감염은 위약으로 치료받은 환자 218명(100 환자-년당 95.7명)과 RINVOQ 15mg으로 치료받은 환자 284명(100 환자-년당 127.8명)에게 보고되었습니다. RA-III 및 RA-V에서 감염은 위약으로 치료받은 환자 99명(100 환자-년당 136.5명), RINVOQ 15mg으로 치료받은 환자 118명(100 환자-년당 164.5명) 및 업다시티닙 30mg으로 치료받은 환자 126명(100 환자-년당 180.3명)에게 보고되었습니다.
MTX 대조 시험: 감염은 MTX 단독 요법으로 치료받은 환자 127명(100 환자-년당 119.5명), RINVOQ 15mg 단독 요법으로 치료받은 환자 104명(100 환자-년당 91.8명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 128명(100 환자-년당 115.1명)에게 보고되었습니다.
12개월 노출 데이터 세트: 감염은 RINVOQ 15mg으로 치료받은 환자 615명(100 환자-년당 83.8명)과 업다시티닙 30mg으로 치료받은 환자 674명(100 환자-년당 99.7명)에게 보고되었습니다.
중증 감염
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 중증 감염은 위약으로 치료받은 환자 6명(100 환자-년당 2.3명)과 RINVOQ 15mg으로 치료받은 환자 12명(100 환자-년당 4.6명)에게 보고되었습니다. RA-III 및 RA-V에서 중증 감염은 위약으로 치료받은 환자 1명(100 환자-년당 1.2명), RINVOQ 15mg으로 치료받은 환자 2명(100 환자-년당 2.3명) 및 업다시티닙 30mg으로 치료받은 환자 7명(100 환자-년당 8.2명)에게 보고되었습니다.
MTX 대조 시험: 중증 감염은 MTX 단독 요법으로 치료받은 환자 2명(100 환자-년당 1.6명), RINVOQ 15mg 단독 요법으로 치료받은 환자 3명(100 환자-년당 2.4명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 8명(100 환자-년당 6.4명)에게 보고되었습니다.
12개월 노출 데이터 세트: 중증 감염은 RINVOQ 15mg으로 치료받은 환자 38명(100 환자-년당 3.5명)과 업다시티닙 30mg으로 치료받은 환자 59명(100 환자-년당 5.6명)에게 보고되었습니다.
가장 흔하게 보고된 중증 감염은 폐렴과 봉와직염이었습니다.
결핵
위약 대조 시험 및 MTX 대조 시험: 위약 대조 기간 동안 위약, RINVOQ 15mg 및 업다시티닙 30mg 그룹에서 활동성 결핵 사례가 보고되지 않았습니다. MTX 대조 기간 동안 MTX 단독 요법, RINVOQ 15mg 단독 요법 및 업다시티닙 30mg 단독 요법 그룹에서 활동성 결핵 사례가 보고되지 않았습니다.
12개월 노출 데이터 세트: 활동성 결핵은 RINVOQ 15mg으로 치료받은 환자 2명과 업다시티닙 30mg으로 치료받은 환자 1명에게 보고되었습니다. 폐외 결핵 사례가 보고되었습니다.
기회 감염(결핵 제외)
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 기회 감염은 위약으로 치료받은 환자 3명(100 환자-년당 1.2명)과 RINVOQ 15mg으로 치료받은 환자 5명(100 환자-년당 1.9명)에게 보고되었습니다. RA-III 및 RA-V에서 기회 감염은 위약으로 치료받은 환자 1명(100 환자-년당 1.2명), RINVOQ 15mg으로 치료받은 환자 2명(100 환자-년당 2.3명) 및 업다시티닙 30mg으로 치료받은 환자 6명(100 환자-년당 7.1명)에게 보고되었습니다.
MTX 대조 시험: 기회 감염은 MTX 단독 요법으로 치료받은 환자 1명(100 환자-년당 0.8명), RINVOQ 15mg 단독 요법으로 치료받은 환자 0명 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 4명(100 환자-년당 3.2명)에게 보고되었습니다.
12개월 노출 데이터 세트: 기회 감염은 RINVOQ 15mg으로 치료받은 환자 7명(100 환자-년당 0.6명)과 업다시티닙 30mg으로 치료받은 환자 15명(100 환자-년당 1.4명)에게 보고되었습니다.
악성 종양
위약 대조 시험: RA-III, RA-IV 및 RA-V에서 NMSC를 제외한 악성 종양은 위약으로 치료받은 환자 1명(100 환자-년당 0.4명)과 RINVOQ 15mg으로 치료받은 환자 1명(100 환자-년당 0.4명)에게 보고되었습니다. RA-III 및 RA-V에서 NMSC를 제외한 악성 종양은 위약으로 치료받은 환자 0명, RINVOQ 15mg으로 치료받은 환자 1명(100 환자-년당 1.1명) 및 업다시티닙 30mg으로 치료받은 환자 3명(100 환자-년당 3.5명)에게 보고되었습니다.
MTX 대조 시험: NMSC를 제외한 악성 종양은 MTX 단독 요법으로 치료받은 환자 1명(100 환자-년당 0.8명), RINVOQ 15mg 단독 요법으로 치료받은 환자 3명(100 환자-년당 2.4명) 및 업다시티닙 30mg 단독 요법으로 치료받은 환자 0명에게 보고되었습니다.
12개월 노출 데이터 세트: NMSC를 제외한 악성 종양은 RINVOQ 15mg으로 치료받은 환자 13명(100 환자-년당 1.2명)과 업다시티닙 30mg으로 치료받은 환자 14명(100 환자-년당 1.3명)에게 보고되었습니다.
위장관 천공
위약 대조 시험: 위약, RINVOQ 15mg 및 업다시티닙 30mg으로 치료받은 환자에서 위장관 천공(의학적 검토 기반)이 보고되지 않았습니다.
MTX 대조 시험: 12/14주까지 MTX 및 RINVOQ 15mg 그룹에서 위장관 천공 사례가 보고되지 않았습니다. 업다시티닙 30mg 그룹에서 위장관 천공 사례 2건이 관찰되었습니다.
12개월 노출 데이터 세트: 위장관 천공은 RINVOQ 15mg으로 치료받은 환자 1명과 업다시티닙 30mg으로 치료받은 환자 4명에게 보고되었습니다.
혈전증
위약 대조 시험: RA-IV에서 정맥 혈전증(폐색전증 또는 심부 정맥 혈전증)은 위약 치료를 받은 환자 1명과 RINVOQ 15mg 치료를 받은 환자 1명에서 관찰되었습니다. RA-V에서 정맥 혈전증은 RINVOQ 15mg 치료를 받은 환자 1명에서 관찰되었습니다. RA-III에서는 정맥 혈전증이 보고된 사례가 없었습니다. 동맥 혈전증은 12/14주까지 관찰되지 않았습니다.
MTX 대조 시험: RA-II에서 정맥 혈전증은 14주까지 MTX 단독 요법을 받은 환자 0명, RINVOQ 15mg 단독 요법을 받은 환자 1명, 업다시티닙 30mg 단독 요법을 받은 환자 0명에서 관찰되었습니다. RA-II에서 동맥 혈전증은 12/14주까지 관찰되지 않았습니다. RA-I에서 정맥 혈전증은 24주까지 MTX를 받은 환자 1명, RINVOQ 15mg을 받은 환자 0명, 업다시티닙 30mg을 받은 환자 1명에서 관찰되었습니다. RA-I에서 동맥 혈전증은 24주까지 업다시티닙 30mg을 받은 환자 1명에서 관찰되었습니다.
12개월 노출 데이터 세트: 정맥 혈전증 사건은 RINVOQ 15mg 치료를 받은 환자 5명(100 환자-년당 0.5명)과 업다시티닙 30mg 치료를 받은 환자 4명(100 환자-년당 0.4명)에서 보고되었습니다. 동맥 혈전증 사건은 RINVOQ 15mg 치료를 받은 환자 0명과 업다시티닙 30mg 치료를 받은 환자 2명(100 환자-년당 0.2명)에서 보고되었습니다.
실험실 이상
간 전이효소 상승
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 알라닌 아미노 전이효소(ALT) 및 아스파르테이트 아미노 전이효소(AST) 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 2.1% 및 1.5%, 위약 치료를 받은 환자의 경우 각각 1.5% 및 0.7%였습니다. RA-III 및 RA-V에서 ALT 및 AST 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 0.8% 및 1.0%, 업다시티닙 30mg 치료를 받은 환자의 경우 각각 1.0% 및 0%, 위약 치료를 받은 환자의 경우 각각 1.3% 및 1.0%였습니다.
MTX 대조 시험에서 최대 12/14주까지 ALT 및 AST 상승은 최소한 한 번의 측정에서 정상 상한치(ULN)의 3배 이상으로 관찰되었으며, RINVOQ 15mg 치료를 받은 환자의 경우 각각 0.8% 및 0.4%, 업다시티닙 30mg 치료를 받은 환자의 경우 각각 1.7% 및 1.3%, MTX 치료를 받은 환자의 경우 각각 1.9% 및 0.9%였습니다.
지질 상승
업다시티닙 치료는 총 콜레스테롤, 트리글리세리드 및 LDL 콜레스테롤의 용량 의존적 증가와 관련이 있었습니다. 업다시티닙은 HDL 콜레스테롤 증가와도 관련이 있었습니다. LDL 및 HDL 콜레스테롤의 상승은 8주까지 최고조에 달했고 그 이후로 안정되었습니다. 대조 시험에서 최대 12/14주까지 RINVOQ 15mg 및 업다시티닙 30mg 치료를 받은 환자의 지질 매개변수 기준선 변화는 아래에 요약되어 있습니다.
- 평균 LDL 콜레스테롤은 14.81mg/dL 및 17.17mg/dL 증가했습니다.
- 평균 HDL 콜레스테롤은 8.16mg/dL 및 9.01mg/dL 증가했습니다.
- 평균 LDL/HDL 비율은 안정적으로 유지되었습니다.
- 평균 트리글리세리드는 13.55mg/dL 및 14.44mg/dL 증가했습니다.
크레아틴 키나아제 상승
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 크레아틴 키나아제(CPK) 값의 용량 의존적 증가가 관찰되었습니다. CPK 상승은 RINVOQ 15mg 그룹의 경우 12/14주 동안 환자의 1.0%, 위약 그룹의 경우 0.3%에서 정상 상한치(ULN)의 5배 이상으로 보고되었습니다. 정상 상한치(ULN)의 5배 이상인 대부분의 상승은 일시적이었으며 치료 중단을 요구하지 않았습니다. RA-III 및 RA-V에서 CPK 상승은 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 치료를 받은 환자의 1.6%, 업다시티닙 30mg 치료를 받은 환자의 경우 0%에서 정상 상한치(ULN)의 5배 이상으로 관찰되었습니다.
호중구 감소증
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 호중구 수의 용량 의존적 감소는 최소한 한 번의 측정에서 1000세포/mm3 미만으로 발생했으며, RINVOQ 15mg 그룹의 경우 환자의 1.1%, 위약 그룹의 경우 환자의 <0.1%였습니다. RA-III 및 RA-V에서 호중구 수의 감소는 최소한 한 번의 측정에서 1000세포/mm3 미만으로 발생했으며, 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 치료를 받은 환자의 1.3%, 업다시티닙 30mg 치료를 받은 환자의 2.4%였습니다. 임상 시험에서 ANC가 1000세포/mm3 미만으로 감소하면 치료가 중단되었습니다.
림프구 감소증
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 림프구 수의 용량 의존적 감소는 최소한 한 번의 측정에서 500세포/mm3 미만으로 발생했으며, RINVOQ 15mg 그룹의 경우 환자의 0.9%, 위약 그룹의 경우 환자의 0.7%였습니다. RA-III 및 RA-V에서 림프구 수의 감소는 최소한 한 번의 측정에서 500세포/mm3 미만으로 발생했으며, 위약 치료를 받은 환자의 0.5%, RINVOQ 15mg 치료를 받은 환자의 0.5%, 업다시티닙 30mg 치료를 받은 환자의 2.4%였습니다.
빈혈
최대 12/14주까지 배경 DMARD를 사용한 위약 대조 시험(RA-III, RA-IV 및 RA-V)에서 헤모글로빈 감소는 최소한 한 번의 측정에서 8g/dL 미만으로 발생했으며, RINVOQ 15mg 그룹과 위약 그룹 모두에서 환자의 <0.1%였습니다. RA-III 및 RA-V에서 헤모글로빈 감소는 최소한 한 번의 측정에서 8g/dL 미만으로 관찰되었으며, 위약 치료를 받은 환자의 0.3%, RINVOQ 15mg 및 업다시티닙 30mg 치료를 받은 환자의 경우 0%였습니다.
건선성 관절염 환자의 이상 반응
임상 시험에서 총 1827명의 성인 건선성 관절염 환자가 매일 1회 RINVOQ 15mg 또는 업다시티닙 30mg 정제로 치료를 받았으며, 이는 1639.2 환자-년의 노출을 나타내며, 그중 722명이 업다시티닙에 1년 이상 노출되었습니다. 2개의 3상 시험에서 907명의 환자가 RINVOQ 15mg을 최소한 1회 복용했으며, 그중 359명이 1년 이상 노출되었습니다.
RINVOQ 15mg의 안전성을 위약과 비교하여 평가하기 위해 2개의 위약 대조 시험(RINVOQ 15mg을 매일 1회 복용한 환자 640명과 위약을 복용한 환자 635명)이 통합되었습니다. 치료 시작 후 최대 24주까지.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 건선성 관절염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염 환자에서 관찰된 안전성 프로파일과 일치했습니다. 24주 위약 대조 기간 동안 대상포진 및 단순 포진의 빈도는 RINVOQ 15mg의 경우 ≥1%(각각 1.1% 및 1.4%), 위약의 경우 각각 0.8% 및 1.3%였습니다. 여드름 및 기관지염의 발생률도 RINVOQ 15mg 치료를 받은 환자(각각 1.3% 및 3.9%)에서 위약 치료를 받은 환자(각각 0.3% 및 2.7%)보다 높았습니다.
아토피 피부염 환자의 이상 반응
3상(AD-1, AD-2 및 AD-3) 및 1상 2b상(AD-4) 무작위 배정, 이중 맹검, 위약 대조, 다기관 시험에서 중등도에서 중증의 아토피 피부염 환자에서 RINVOQ의 안전성을 평가했습니다. 환자의 대부분은 백인(68%)이었고 남성(57%)이었습니다. 평균 연령은 34세(12세에서 75세)였으며 환자의 13%는 12세에서 18세 미만이었습니다. 이 4개의 시험에서 2612명의 환자가 RINVOQ 15mg 정제 또는 30mg 정제를 1일 1회 경구 투여 받았으며, 국소 코르티코스테로이드(TCS)를 병용하거나 병용하지 않았습니다.
3상 임상 시험(AD-1, AD-2 및 AD-3)에서 총 1239명의 환자가 RINVOQ 15mg을 투여 받았으며, 그 중 791명은 1년 이상 노출되었고 1246명의 환자가 RINVOQ 30mg을 투여 받았으며, 그 중 826명은 1년 이상 노출되었습니다.
시험 AD-1, AD-2 및 AD-4는 16주까지 RINVOQ 단독 요법의 안전성을 위약과 비교했습니다. 시험 AD-3는 16주까지 RINVOQ + TCS의 안전성을 위약 + TCS와 비교했습니다.
0주에서 16주(시험 AD-1에서 AD-4)
TCS를 병용하거나 병용하지 않은 RINVOQ 시험(시험 AD-1, 2, 3 및 4)에서 16주까지 RINVOQ 15mg, 30mg 및 위약군에서 부작용으로 인해 치료를 중단한 환자의 비율은 각각 2.3%, 2.9% 및 3.8%였습니다. 표 5는 치료 첫 16주 동안 RINVOQ 15mg 또는 30mg군에서 1% 이상 발생한 부작용을 요약합니다.
| 부작용 | 위약 | RINVOQ 15 mg |
RINVOQ 30 mg |
| N = 902 (%) |
N = 899 (%) |
N = 906 (%) |
|
| 상기도 감염(URTI)* | 17 | 23 | 25 |
| 여드름** | 2 | 10 | 16 |
| 단순 포진*** | 2 | 4 | 8 |
| 두통 | 4 | 6 | 6 |
| 혈중 크레아틴 인산화효소 증가 | 2 | 5 | 6 |
| 기침 | 1 | 3 | 3 |
| 과민 반응**** | 2 | 2 | 3 |
| 모낭염 | 1 | 2 | 3 |
| 메스꺼움 | 1 | 3 | 3 |
| 복통***** | 1 | 3 | 2 |
| 발열 | 1 | 2 | 2 |
| 체중 증가 | 1 | 2 | 2 |
| 대상포진****** | 1 | 2 | 2 |
| 인플루엔자 | <1 | 2 | 2 |
| 피로 | 1 | 1 | 2 |
| 호중구 감소증 | <1 | 1 | 2 |
| 근육통 | 1 | 1 | 2 |
| 인플루엔자 유사 질환 | 1 | 1 | 2 |
** 포함: 여드름 및 여드름 모양 피부염
*** 포함: 생식기 헤르페스, 단순 생식기 헤르페스, 헤르페스 피부염, 안구 헤르페스, 단순 헤르페스, 비강 헤르페스, 안구 단순 헤르페스, 헤르페스 바이러스 감염, 구강 헤르페스
**** 포함: 아나필락시스 반응, 아나필락시스 쇼크, 혈관 부종, 전신 박탈성 피부염, 약물 과민 반응, 눈꺼풀 부종, 얼굴 부종, 과민 반응, 안와 주위 부종, 인두 부종, 얼굴 부종, 독성 피부 발진, I형 과민 반응, 두드러기
***** 포함: 복통 및 상복부 통증
****** 포함: 대상 포진 및 수두
RINVOQ 15mg 및/또는 30mg 그룹의 환자 중 1% 미만에서 보고되었고 위약 그룹보다 높은 비율로 16주까지 보고된 다른 이상 반응에는 빈혈, 구강 칸디다증, 폐렴, 비흑색종 피부암 및 망막 박리가 포함되었습니다.
52주까지 RINVOQ의 안전성 프로파일은 일반적으로 16주에 관찰된 안전성 프로파일과 일치했습니다.
전반적으로 RINVOQ로 치료받은 AD 환자에서 관찰된 안전성 프로파일은 RA 환자의 안전성 프로파일과 유사했습니다. AD 환자에서 보고된 다른 특정 이상 반응에는 헤르페스 피부염/카포시 봉상 발진이 포함되었습니다.
헤르페스 피부염/카포시 봉상 발진
위약 대조 기간(16주): 헤르페스 피부염은 위약으로 치료받은 환자 4명(100 환자-년당 1.6명), RINVOQ 15mg으로 치료받은 환자 6명(100 환자-년당 2.2명), RINVOQ 30mg으로 치료받은 환자 7명(100 환자-년당 2.6명)에서 보고되었습니다.
12개월 노출(0주~52주): 헤르페스 피부염은 RINVOQ 15mg으로 치료받은 환자 18명(100 환자-년당 1.6명)과 RINVOQ 30mg으로 치료받은 환자 17명(100 환자-년당 1.5명)에서 보고되었습니다.
궤양성 대장염 환자의 이상 반응
RINVOQ는 두 개의 무작위 배정, 이중 맹검, 위약 대조 유도 연구(UC-1, UC-2)와 무작위 배정, 이중 맹검, 위약 대조, 용량 찾기 연구(UC-4; NCT02819635)에서 중등도에서 중증의 활동성 궤양성 대장염 환자를 대상으로 최대 8주까지 연구되었습니다. 무작위 배정, 이중 맹검, 위약 대조 유지 연구(UC-3)와 장기 연장 연구에서 유도 요법에 반응한 환자를 대상으로 최대 52주까지 장기 안전성을 평가했습니다. [임상 연구(14.4)].
두 개의 유도 연구(UC-1, UC-2)와 용량 찾기 연구(UC-4)에서 1097명의 환자가 등록되었으며, 그 중 719명의 환자가 RINVOQ 45mg 정제를 1일 1회 복용했습니다.
유지 연구(UC-3)에서 746명의 환자가 등록되었으며, 그 중 250명의 환자가 RINVOQ 15mg 정제를 1일 1회 복용하고 251명의 환자가 RINVOQ 30mg 정제를 1일 1회 복용했습니다.
유도 및 유지 연구에서 모든 치료군의 환자 중 ≥2%에서 보고된 이상 반응은 각각 표 6과 7에 나와 있습니다.
| 이상 반응 | 위약 | RINVOQ 45mg 1일 1회 |
| N = 378 (%) |
N = 719 (%) |
|
| 상기도 감염* | 7 | 9 |
| 여드름* | 1 | 6 |
| 혈청 크레아틴 키나아제 증가 | 1 | 5 |
| 호중구 감소증* | <1 | 5 |
| 발진* | 1 | 4 |
| 간 효소 상승** | 2 | 3 |
| 림프구 감소증* | 1 | 3 |
| 모낭염 | 1 | 2 |
| 단순 헤르페스* | <1 | 2 |
| * 여러 유사한 용어로 구성됨 ** 간 효소 상승은 ALT, AST, GGT, ALP, 간 트랜스아미나제, 간 효소, 빌리루빈, 약물 유발 간 손상 및 담즙 정체로 구성됩니다. |
||
RINVOQ 45mg군에서 8주까지 위약군보다 높은 비율로 2% 미만의 환자에게 보고된 다른 이상 반응에는 대상포진과 폐렴이 포함되었습니다.
| 이상 반응 | 위약 | RINVOQ 15 mg 1일 1회 |
RINVOQ 30 mg 1일 1회 |
| N = 245 (%) |
N = 250 (%) |
N = 251 (%) |
|
| 상기도 감염* | 18 | 16 | 20 |
| 혈중 크레아틴 키나아제 증가 | 2 | 6 | 8 |
| 호중구 감소증* | 2 | 3 | 6 |
| 간 효소 상승** | 1 | 6 | 4 |
| 발진* | 4 | 5 | 5 |
| 대상포진 | 0 | 4 | 4 |
| 모낭염 | 2 | 2 | 4 |
| 고콜레스테롤혈증* | 1 | 2 | 4 |
| 인플루엔자 | 1 | 3 | 3 |
| 단순포진* | 1 | 2 | 3 |
| 림프구 감소증* | 2 | 3 | 2 |
| 고지혈증* | 0 | 2 | 2 |
| 1 RINVOQ 45mg 1일 1회 유도 요법에 반응한 환자 * 여러 유사 용어로 구성됨 ** 간 효소 상승은 ALT, AST, GGT, ALP, 간 트랜스아미나제, 간 효소, 빌리루빈, 약물 유발 간 손상 및 담즙 정체로 구성됩니다. |
|||
비흑색종 피부암의 부작용은 52주까지 RINVOQ 30mg 그룹 환자의 1%에서 보고되었으며, RINVOQ 15mg 또는 위약 그룹 환자에서는 보고되지 않았습니다.
장기 연장 연구에서 RINVOQ의 안전성 프로파일은 위약 대조 유도 및 유지 기간에 관찰된 안전성 프로파일과 유사했습니다.
전반적으로 RINVOQ로 치료받은 궤양성 대장염 환자에서 관찰된 안전성 프로파일은 일반적으로 RA 및 AD 환자의 안전성 프로파일과 유사했습니다.
특정 부작용
중증 감염
유도 연구: UC-1, UC-2 및 UC-4에서 8주까지 위약으로 치료받은 환자 5명(100 환자-연당 8.4명)과 RINVOQ 45mg으로 치료받은 환자 9명(100 환자-연당 8.4명)에서 중증 감염이 보고되었습니다.
위약 대조 유지 연구: UC-3에서 52주까지 위약으로 치료받은 환자 8명(100 환자-연당 6.3명), RINVOQ 15mg으로 치료받은 환자 8명(100 환자-연당 4.5명) 및 RINVOQ 30mg으로 치료받은 환자 6명(100 환자-연당 3.1명)에서 중증 감염이 보고되었습니다.
실험실 이상
간 전이효소 상승
UC-1, UC-2 및 UC-4 연구에서 8주 동안 RINVOQ 45mg으로 치료받은 환자의 1.5%에서 적어도 한 번의 측정에서 ALT가 ≥ 3 x ULN으로 상승한 것이 관찰되었고, 위약으로 치료받은 환자에서는 0%였습니다. AST는 RINVOQ 45mg으로 치료받은 환자의 1.5%에서 ≥ 3 x ULN으로 상승했고, 위약으로 치료받은 환자의 0.3%에서 상승했습니다. ALT는 RINVOQ 45mg으로 치료받은 환자의 0.4%에서 ≥ 5 x ULN으로 상승했고, 위약으로 치료받은 환자에서는 0%였습니다.
UC-3에서 52주 동안 RINVOQ 30mg으로 치료받은 환자의 4%, RINVOQ 15mg으로 치료받은 환자의 2% 및 위약으로 치료받은 환자의 0.8%에서 적어도 한 번의 측정에서 ALT가 ≥ 3 x ULN으로 상승한 것이 관찰되었습니다. 52주 동안 RINVOQ 30mg으로 치료받은 환자의 2%, RINVOQ 15mg으로 치료받은 환자의 1.6% 및 위약으로 치료받은 환자의 0.4%에서 적어도 한 번의 측정에서 AST가 ≥ 3 x ULN으로 상승한 것이 관찰되었습니다. ALT는 30mg으로 치료받은 환자의 0.8%, 15mg으로 치료받은 환자의 0.4% 및 위약으로 치료받은 환자의 0.4%에서 ≥ 5 x ULN으로 상승한 것이 관찰되었습니다.
전반적으로 RINVOQ로 치료받은 궤양성 대장염 환자에서 관찰된 실험실 이상은 RA 환자에서 설명된 것과 유사했습니다.
크론병 환자의 부작용
RINVOQ는 두 건의 무작위 배정, 이중 맹검, 위약 대조 유도 연구(CD-1, CD-2)에서 중등도에서 중증의 활동성 CD 환자를 대상으로 최대 12주 동안 연구되었습니다. 최대 52주까지의 장기 안전성은 무작위 배정, 이중 맹검, 위약 대조 유지 연구(CD-3)에서 유도 요법에 반응한 환자를 대상으로 평가되었으며, 장기 연장(LTE) 기간의 추가 데이터가 제공되었습니다. [임상 연구(14.5)].
두 건의 유도 연구(CD-1, CD-2)에서 1021명의 환자가 등록되었으며, 그중 674명의 환자가 위약 대조 기간 동안 하루에 한 번 RINVOQ 45mg 정제를 투여받았습니다.
유지 연구(CD-3)에서 673명의 환자가 등록되었으며, 그중 221명의 환자가 무작위 배정, 위약 대조 기간 동안 하루에 한 번 RINVOQ 15mg 정제를 투여받았고, 229명의 환자가 하루에 한 번 RINVOQ 30mg 정제를 투여받았습니다.
전반적으로 RINVOQ로 치료받은 크론병 환자에서 관찰된 안전성 프로파일은 다른 적응증에서 RINVOQ에 대한 알려진 안전성 프로파일과 일치했습니다.
유도 및 유지 연구에서 RINVOQ로 치료받은 환자의 ≥2%에서 보고되었고 위약보다 높은 비율로 보고된 부작용은 각각 표 8 및 9에 나와 있습니다.
| 부작용 | 위약 | RINVOQ 45mg 하루에 한 번 |
| N = 347 (%) |
N = 674 (%) |
|
| 상기도 감염* | 8 | 13 |
| 빈혈* | 6 | 7 |
| 여드름* | 2 | 6 |
| 발열 | 3 | 4 |
| 혈중 크레아틴 키나아제 증가 | 1 | 3 |
| 인플루엔자 | 1 | 3 |
| 단순 포진* | 1 | 3 |
| 백혈구 감소증* | 1 | 2 |
| 호중구 감소증* | <1 | 2 |
| 대상 포진 | 0 | 2 |
| * 여러 유사한 용어로 구성됨 | ||
RINVOQ 45mg군에서 12주까지 위약군보다 높은 비율로 2% 미만의 환자에게 보고된 부작용에는 여드름, 고콜레스테롤혈증, 기관지염, 폐렴, 구강 칸디다증 및 고지혈증이 포함되었습니다.
| 부작용 | 위약 | RINVOQ 15 mg 1일 1회 |
RINVOQ 30 mg 1일 1회 |
| N = 223 (%) |
N = 221 (%) |
N = 229 (%) |
|
| 상기도 감염* | 11 | 14 | 12 |
| 발열 | 2 | 3 | 7 |
| 대상포진* | 2 | 3 | 5 |
| 두통* | 1 | 3 | 5 |
| 여드름* | 3 | 2 | 5 |
| 위장염* | 2 | 3 | 3 |
| 피로 | 2 | 3 | 3 |
| 혈중 크레아틴 키나아제 증가 | 1 | 2 | 3 |
| 간 효소 상승2 | <1 | 2 | 3 |
| 백혈구 감소증* | <1 | 1 | 2 |
| 호중구 감소증* | <1 | 1 | 2 |
| 기관지염* | 0 | 1 | 2 |
| 폐렴* | 1 | 4 | 1 |
| 기침 | 2 | 3 | 1 |
| 1 RINVOQ 45mg을 1일 1회 투여하여 12주 유도 요법에 반응한 환자. 2 간 효소 상승에는 알라닌 아미노트랜스퍼라제 증가, 아스파르테이트 아미노트랜스퍼라제 증가, 혈액 알칼리성 포스파타제 증가, 트랜스아미나제 증가, 혈액 빌리루빈 증가가 포함됩니다. * 여러 유사한 용어로 구성됨 |
|||
RINVOQ 15mg 또는 30mg 그룹에서 2% 미만의 환자에게 보고되었고 52주까지 위약 그룹보다 더 높은 비율로 보고된 이상 반응에는 고지혈증, 구강 칸디다증 및 고콜레스테롤혈증이 포함됩니다.
장기 연장 연구에서 RINVOQ의 안전성 프로파일은 위약 대조 유도 및 유지 기간에 관찰된 안전성 프로파일과 유사했습니다.
특정 이상 반응
중증 감염
유도 연구: CD-1 및 CD-2에서 위약 대조 기간 12주 동안 위약으로 치료받은 환자 6명(100 환자-년당 8명)과 RINVOQ 45mg으로 치료받은 환자 13명(100 환자-년당 9명)에게 중증 감염이 보고되었습니다.
유지 연구/LTE: 장기 위약 대조 기간 동안 위약으로 치료받은 환자 10명(100 환자-년당 7명), RINVOQ 15mg으로 치료받은 환자 7명(100 환자-년당 4명), RINVOQ 30mg으로 치료받은 환자 13명(100 환자-년당 6명)에게 중증 감염이 보고되었습니다.
위장 천공
유도 연구: 모든 RINVOQ 45mg 치료 환자(N=938)에서 유도 연구 동안 위장 천공이 4명의 환자(100 환자-년당 2명)에게 보고되었습니다. 위약 대조 유도 기간 동안 CD-1 및 CD-2에서 위약으로 치료받은 환자(N=347)에게는 위장 천공이 보고되지 않았고, RINVOQ 45mg(N=674)으로 치료받은 환자 1명(100 환자-년당 1명)에게는 12주 동안 위장 천공이 보고되었습니다.
유지 연구/LTE: 장기 위약 대조 기간 동안 위약으로 치료받은 환자 1명(100 환자-년당 1명), RINVOQ 15mg으로 치료받은 환자 1명(<100 환자-년당 1명), RINVOQ 30mg으로 치료받은 환자 1명(<100 환자-년당 1명)에게 위장 천공이 보고되었습니다.
유지 요법을 위해 위약 또는 RINVOQ 15mg을 받았고 반응을 잃은 환자는 구제 RINVOQ 30mg(N=336)으로 치료받았습니다. 이러한 환자 중 장기 치료를 통해 3명의 환자(100 환자-년당 1명)에게 위장 천공이 보고되었습니다.
강직성 척추염 환자의 이상 반응
강직성 척추염 환자 596명이 두 건의 임상 시험에서 RINVOQ 15mg 정제로 치료받았으며, 이는 577.3 환자-년의 노출을 나타내며, 그중 220명이 RINVOQ 15mg에 1년 이상 노출되었습니다.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 강직성 척추염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염 및 건선성 관절염 환자에서 관찰된 안전성 프로파일과 일치했습니다. 시험 AS-I의 14주 위약 대조 기간 동안 두통의 빈도는 RINVOQ 15mg에서 5.4%였고 위약에서 2.1%였습니다. 시험 AS-II의 14주 위약 대조 기간 동안 두통의 빈도는 RINVOQ 15mg에서 3.3%였고 위약에서 1.4%였습니다.
비방사선학적 축성 척추 관절염 환자의 이상 반응
비방사선학적 축성 척추 관절염 환자 187명이 임상 시험에서 RINVOQ 15mg 정제로 치료받았으며, 이는 116.6 환자-년의 노출을 나타내며, 그중 31명이 RINVOQ 15mg에 1년 이상 노출되었습니다.
전반적으로 RINVOQ 15mg으로 치료받은 활동성 비방사선학적 축성 척추 관절염 환자에서 관찰된 안전성 프로파일은 류마티스 관절염, 건선성 관절염 및 강직성 척추염 환자에서 관찰된 안전성 프로파일과 일치했습니다.
다관절 소아 특발성 관절염 환자의 이상 반응
활동성 다관절염이 있는 소아 특발성 관절염(JIA) 환자 83명이 임상 시험에서 RINVOQ/RINVOQ LQ로 치료받았으며, 이는 123.7 환자-년의 노출을 나타내며, 그중 48명이 RINVOQ/RINVOQ LQ에 1년 이상 노출되었습니다.
전반적으로 RINVOQ/RINVOQ LQ로 치료받은 활동성 다관절염이 있는 JIA 소아 환자에서 관찰된 안전성 프로파일은 RINVOQ의 알려진 안전성 프로파일과 일치했습니다.
7. 약물 상호 작용
7.1 강력한 CYP3A4 억제제
케토코나졸, 클라리스로마이신 및 자몽과 같은 강력한 CYP3A4 억제제와 함께 투여하면 업다시티닙 노출이 증가하여 부작용 위험이 증가할 수 있습니다 [임상 약리학 (12.3)]. 류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선학적 축성 척추 관절염 또는 pJIA 환자의 경우 RINVOQ/RINVOQ LQ를 강력한 CYP3A4 억제제와 함께 투여할 때 부작용을 면밀히 모니터링하십시오. RINVOQ/RINVOQ LQ 치료 중에는 자몽이 함유된 음식이나 음료를 피해야 합니다.
아토피 피부염 환자의 경우 RINVOQ 30mg을 1일 1회 강력한 CYP3A4 억제제와 함께 투여하는 것은 권장하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 강력한 CYP3A4 억제제를 복용하는 경우 RINVOQ 유도 용량을 1일 1회 30mg으로 줄이십시오. 권장 유지 용량은 1일 1회 15mg입니다 [용량 및 투여 (2.12)].
7.2 강력한 CYP3A4 유도제
리팜핀과 같은 강력한 CYP3A4 유도제와 함께 투여하면 업다시티닙 노출이 감소하여 치료 효과가 감소할 수 있습니다 [임상 약리학 (12.3)]. RINVOQ/RINVOQ LQ를 강력한 CYP3A4 유도제와 함께 투여하는 것은 권장하지 않습니다.
8 특정 인구 집단에서의 사용
8.1 임신
임신 감시 프로그램
RINVOQ/RINVOQ LQ에 노출된 여성의 임신 결과를 모니터링하는 RINVOQ/RINVOQ LQ에 대한 임신 감시 프로그램이 있습니다. 임신 중에 RINVOQ/RINVOQ LQ에 노출된 경우 의료 서비스 제공자 또는 환자는 1-800-633-9110으로 전화하여 임신 사실을 보고해야 합니다.
위험 요약
임산부에서 RINVOQ 사용에 대한 시판 후 안전성 데이터베이스 및 시판 후 사례 보고에서 얻은 가용 데이터는 주요 선천적 기형 또는 유산에 대한 약물 관련 위험을 평가하기에 충분하지 않습니다. 동물 연구에 따르면 RINVOQ/RINVOQ LQ는 태아에게 악영향을 미칠 가능성이 있습니다. 가임 여성 및 임산부에게 태아에 대한 잠재적 위험을 알리십시오.
동물의 배아-태아 발달 연구에서 임신한 쥐와 토끼에게 15mg 정제 용량의 약 1.6배 및 15배, 30mg 정제 용량의 0.8배 및 7.6배, 최대 권장 용량의 0.6배 및 5.6배에 해당하는 용량의 경구용 upadacitinib을 투여한 결과(AUC 기준) 용량 관련 골격 기형 증가(쥐만 해당), 심혈관 기형 발생률 증가(토끼만 해당), 착상 후 손실 증가(토끼만 해당), 쥐와 토끼 모두에서 태아 체중 감소가 나타났습니다. 기관 형성 중에 15mg 용량의 약 0.29배 및 2.2배, 30mg 용량의 0.15배 및 1.1배, 최대 권장 용량의 0.11배 및 0.82배(AUC 기준)에 해당하는 용량의 경구용 upadacitinib으로 치료한 임신한 쥐와 토끼에서는 발달 독성이 관찰되지 않았습니다. 임신한 암컷 쥐를 대상으로 한 출산 전 및 출산 후 발달 연구에서 15mg 용량의 약 3배, 30mg 용량의 1.4배, 최대 권장 용량과 동일한 용량(AUC 기준)의 경구용 upadacitinib을 투여한 결과 모체 또는 발달 독성이 나타나지 않았습니다( 데이터 참조).
적응증 집단에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 전체 인구에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 배아/태아 위험
발표된 데이터에 따르면 류마티스 관절염이나 염증성 장 질환이 있는 여성의 경우 질병 활동 증가가 부작용이 있는 임신 결과의 위험 증가와 관련이 있는 것으로 나타났습니다. 부작용이 있는 임신 결과에는 조산(임신 37주 전), 저체중(2500g 미만) 출산, 재태 연령별 저체중이 포함됩니다.
데이터
동물 데이터
경구용 배아-태아 발달 연구에서 임신한 쥐에게 임신 6일에서 17일까지의 기관 형성 기간 동안 5, 25, 75mg/kg/일 용량의 upadacitinib을 투여했습니다. Upadacitinib은 15mg 정제 용량의 약 1.7배, 30mg 정제 용량의 0.9배, 최대 권장 용량의 0.6배 이상의 용량(모체 경구 용량 5mg/kg/일 이상에서 AUC 기준)에서 기형 발생(기형 상완골과 굽은 견갑골로 구성된 골격 기형)을 유발했습니다. 15mg 용량의 약 84배, 30mg 용량의 43배, 최대 권장 용량의 31배(모체 경구 용량 75mg/kg/일에서 AUC 기준)에 해당하는 용량에서 모체 독성 없이 추가 골격 기형(굽은 앞다리/뒷다리 및 갈비뼈/척추 기형)과 태아 체중 감소가 관찰되었습니다.
두 번째 경구용 배아-태아 발달 연구에서 임신한 쥐에게 임신 6일에서 17일까지의 기관 형성 기간 동안 1.5 및 4mg/kg/일 용량의 upadacitinib을 투여했습니다. Upadacitinib은 15mg 용량의 약 1.6배, 30mg 용량의 0.8배, 최대 권장 용량의 0.6배(모체 경구 용량 4mg/kg/일에서 AUC 기준)에 해당하는 용량에서 기형 발생(굽은 상완골과 견갑골을 포함한 골격 기형)을 유발했습니다. 15mg 정제 용량의 약 0.29배, 30mg 정제 용량의 0.15배, 최대 권장 용량의 0.11배(모체 경구 용량 1.5mg/kg/일에서 AUC 기준)에 해당하는 용량에서 쥐의 발달 독성은 관찰되지 않았습니다.
경구용 배아-태아 발달 연구에서 임신한 토끼에게 임신 7일에서 19일까지의 기관 형성 기간 동안 2.5, 10, 25mg/kg/일 용량의 upadacitinib을 투여했습니다. 15mg 정제 용량의 약 15배, 30mg 정제 용량의 7.6배, 최대 권장 용량의 5.6배(모체 경구 용량 25mg/kg/일에서 AUC 기준)에 해당하는 용량에서 모체 독성과 함께 배아 사망, 태아 체중 감소, 심혈관 기형이 관찰되었습니다. 배아 사망은 총 재흡수 및 초기 재흡수 발생률 증가로 인한 착상 후 손실 증가로 구성되었습니다. 15mg 정제 용량의 약 2.2배, 30mg 정제 용량의 1.1배, 최대 권장 용량의 0.82배(모체 경구 용량 10mg/kg/일에서 AUC 기준)에 해당하는 용량에서 토끼의 발달 독성은 관찰되지 않았습니다.
경구용 출산 전 및 출산 후 발달 연구에서 임신한 암컷 쥐에게 임신 6일부터 수유 20일까지 2.5, 5, 10mg/kg/일 용량의 upadacitinib을 투여했습니다. 15mg 정제 용량의 약 3배, 30mg 정제 용량의 1.4배, 최대 권장 용량과 거의 동일한 용량(모체 경구 용량 10mg/kg/일에서 AUC 기준)에서 어미 또는 새끼 모두에서 각각 모체 독성이나 발달 독성이 관찰되지 않았습니다.
8.2 수유
위험 요약
모유에서의 upadacitinib의 존재, 모유 수유 영아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 동물의 약력학/독성학 데이터에 따르면 우유에서 upadacitinib이 배설되는 것으로 나타났습니다 (데이터 참조). 동물의 우유에 약물이 존재하는 경우 해당 약물은 모유에도 존재할 가능성이 높습니다. 모유 수유 영아에서 심각한 부작용이 발생할 가능성이 있으므로 환자에게 RINVOQ/RINVOQ LQ 치료 중 및 마지막 용량 투여 후 6일(약 10회의 반감기) 동안 모유 수유를 하지 않는 것이 좋습니다.
데이터
수유 중인 암컷 스프라그-돌리 쥐에게 출산 후 7~8일에 10mg/kg의 방사성 표지 upadacitinib 단회 경구 용량을 투여했습니다. AUC0-t 값을 기준으로 우유의 약물 노출은 모체 혈장보다 약 30배 더 높았습니다. 우유에 함유된 약물 관련 물질의 약 97%는 모 약물이었습니다.
8.3 가임 여성 및 남성
임신 검사
RINVOQ/RINVOQ LQ로 치료를 시작하기 전에 가임 여성의 임신 여부를 확인하십시오. [특정 환자군에서의 사용(8.1)]
피임
여성
동물 연구에 따르면, upadacitinib은 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. [특정 환자군에서의 사용(8.1)]. 가임 여성 환자에게 RINVOQ/RINVOQ LQ 치료 중 및 마지막 복용 후 4주 동안 효과적인 피임법을 사용하도록 권고하십시오.
8.4 소아에 대한 사용
강직성 척추염, 방사선 비증명 축성 척추관절염, 궤양성 대장염 및 크론병
강직성 척추염, 방사선 비증명 축성 척추관절염, 궤양성 대장염 또는 크론병 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
다관절형 소아 특발성 관절염 및 건선성 관절염
pJIA 및 건선성 관절염이 있는 2세 이상 18세 미만 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성이 확립되었습니다.
이러한 연령대에서 RINVOQ/RINVOQ LQ의 사용은 류마티스 관절염 및 건선성 관절염 성인 환자를 대상으로 한 잘 통제된 RINVOQ 연구, 류마티스 관절염 및 건선성 관절염 성인 환자 및 활동성 다관절염이 있는 소아 JIA 환자 51명의 약동학 데이터, 활동성 다관절염이 있는 2세 이상 18세 미만 소아 JIA 환자 83명의 안전성 데이터에서 얻은 근거에 의해 뒷받침됩니다. 권장 복용량에서 pJIA 및 건선성 관절염 소아 환자의 Upadacitinib 혈장 노출은 모집단 약동학 모델링 및 시뮬레이션을 기반으로 류마티스 관절염 및 건선성 관절염 성인에서 관찰된 것과 비슷할 것으로 예상됩니다. [용량 및 투여(2.4, 2.10), 이상반응(6.1), 임상 약리학(12.3) 및 임상 연구(14.8)].
pJIA 또는 건선성 관절염이 있는 2세 미만 소아 환자에서 RINVOQ/RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
아토피 피부염
아토피 피부염이 있는 12세 이상, 체중 40kg 이상의 소아 환자에서 RINVOQ의 안전성 및 유효성이 확립되었습니다. 중등도에서 중증의 아토피 피부염이 있는 12~17세 소아 환자 344명이 세 가지 임상시험(AD-1, AD-2 및 AD-3)에 무작위 배정되어 단독 요법 또는 국소 코르티코스테로이드와 병용하여 RINVOQ 15mg(N=114) 또는 30mg(N=114) 또는 일치하는 위약(N=116)을 투여받았습니다. 유효성은 소아 환자와 성인 환자 사이에서 일관되었습니다 [임상 연구(14.3)]. 소아 환자의 이상반응 프로파일은 성인과 유사했습니다 [이상반응(6.1)].
아토피 피부염이 있는 12세 미만 소아 환자에서 RINVOQ의 안전성 및 유효성은 확립되지 않았습니다.
아토피 피부염 소아 환자에서 RINVOQ LQ의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인에 대한 사용
류마티스 관절염 및 건선성 관절염
5건의 임상시험에서 치료받은 4,381명의 환자 중 총 906명의 류마티스 관절염 환자가 65세 이상이었으며, 이 중 146명은 75세 이상이었습니다. 2건의 건선성 관절염 3상 임상시험에서 치료받은 1,827명의 환자 중 총 274명이 65세 이상이었으며, 이 중 34명은 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 유효성의 차이는 관찰되지 않았습니다. 그러나 65세 이상의 환자에서 심각한 감염을 포함한 전체 이상반응 발생률이 더 높았습니다.
아토피 피부염
3건의 3상 임상시험에서 치료받은 2,583명의 환자 중 총 120명의 아토피 피부염 환자가 65세 이상이었으며, 이 중 6명은 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 유효성의 차이는 관찰되지 않았습니다. 그러나 장기 임상시험에서 30mg 복용군의 65세 이상 환자에서 심각한 감염 및 악성 종양 발생률이 더 높았습니다.
궤양성 대장염
대조 임상시험에서 치료받은 1,097명의 환자 중 총 95명 의 궤양성 대장염 환자가 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 궤양성 대장염 환자가 충분히 포함되지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없습니다.
크론병
대조 유도 임상시험에서 치료받은 1,021명의 환자 중 총 39명의 크론병 환자가 65세 이상이었으며, 75세 이상인 환자는 없었습니다. RINVOQ 임상 연구에는 65세 이상의 크론병 환자가 충분히 포함되지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없습니다.
강직성 척추염
8 USE IN SPECIFIC POPULATIONS
대조 임상 시험에서 치료받은 607명의 환자 중 총 32명 의 강직성 척추염 환자는 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 강직성 척추염 환자가 충분히 포함되지 않아 고령 환자의 반응이 젊은 성인 환자와 다른지 여부를 확인할 수 없습니다.
방사선 비관찰형 축성 척추관절염
3상 임상 시험에서 치료받은 313명의 환자 중 총 9명 의 방사선 비관찰형 축성 척추관절염 환자는 65세 이상이었습니다. RINVOQ 임상 연구에는 65세 이상의 방사선 비관찰형 축성 척추관절염 환자가 충분히 포함되지 않아 고령 환자의 반응이 젊은 성인 환자와 다른지 여부를 확인할 수 없습니다.
8.6 신장애
류마티스 관절염, 건선성 관절염, 강직성 척추염, 방사선 비관찰형 축성 척추관절염 또는 소아 특발성 관절염 환자의 경우 경도(eGFR 60 ~ < 90mL/min/1.73m2), 중등도(eGFR 30 ~ < 60mL/min/1.73m2) 또는 중증(eGFR 15 ~ < 30mL/min/1.73m2) 신장애 환자에서 용량 조절이 필요하지 않습니다.
아토피 피부염 환자의 경우 중증 신장애 환자에 대한 RINVOQ의 최대 권장 용량은 1일 1회 15mg입니다. 경도 또는 중등도 신장애 환자의 경우 용량 조절이 필요하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 중증 신장애에 대한 RINVOQ의 권장 용량은 유도 요법의 경우 1일 1회 30mg이고 유지 요법의 경우 1일 1회 15mg입니다. 경도 또는 중등도 신장애 환자의 경우 용량 조절이 필요하지 않습니다 [용량 및 투여 방법(2.11) 참조].
RINVOQ/RINVOQ LQ는 말기 신장 질환(eGFR <15mL/min/1.73m2) 환자에서 연구된 바 없습니다. 말기 신장 질환이 있는 아토피 피부염, 궤양성 대장염 또는 크론병 환자에게는 사용하지 않는 것이 좋습니다 [임상 약리학(12.3) 참조].
8.7 간장애
RINVOQ/RINVOQ LQ는 중증 간장애(Child Pugh C) 환자에서 연구된 바 없으므로 권장하지 않습니다 [용량 및 투여 방법(2.11) 및 임상 약리학(12.3) 참조].
류마티스 관절염, 건선성 관절염, 아토피 피부염, 강직성 척추염, 방사선 비관찰형 축성 척추관절염 또는 소아 특발성 관절염 환자의 경우 경도(Child Pugh A) 또는 중등도(Child Pugh B) 간장애 환자에서 용량 조절이 필요하지 않습니다.
궤양성 대장염 또는 크론병 환자의 경우 경도에서 중등도 간장애에 대한 RINVOQ의 권장 용량은 유도 요법의 경우 1일 1회 30mg이고 유지 요법의 경우 1일 1회 15mg입니다 [용량 및 투여 방법(2.11) 참조].
11. 성분
RINVOQ 및 RINVOQ LQ는 JAK 억제제인 upadacitinib으로 제형화되었습니다.
Upadacitinib의 화학적 이름은 다음과 같습니다: (3S,4R)-3-Ethyl-4-(3H-imidazo[1,2-a]pyrrolo[2,3-e]pyrazin-8-yl)-N-(2,2,2-trifluoroethyl)pyrrolidine-1-carboxamide hydrate (2:1).
Upadacitinib의 약효는 무수 upadacitinib을 기반으로 합니다. 37 oC에서 pH 2 ~ 9 범위에서 물에서 upadacitinib의 용해도는 38에서 0.2 mg/mL 미만입니다.
Upadacitinib의 분자량은 389.38g/mol이며 분자식은 C17H19F3N6O • ½ H2O입니다. Upadacitinib의 화학 구조는 다음과 같습니다:

RINVOQ 15mg 경구 투여용 서방성 정제는 자주색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a15’가 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 제로소철산화물, 하이프로멜로오스, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ 30 mg 경구 투여용 서방성 정제는 빨강색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a30’이 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 하이프로멜로오스, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ 45mg 경구 투여용 서방성 정제는 노랑색에서 얼룩진 노랑색, 쌍볼록 장원형으로 가로 14 x 세로 8mm이며 한쪽면에 ‘a45’가 각인되어 있습니다. 각 정제에는 다음과 같은 비활성 성분이 포함되어 있습니다: 콜로이드성 이산화규소, 하이프로멜로오스, 산화철황색, 산화철적색, 마그네슘스테아레이트, 만니톨, 미세결정질 셀룰로오스, 폴리비닐알코올, 폴리에틸렌글리콜, 타르타르산 및 이산화티타늄.
RINVOQ LQ 경구용 용액은 1mg/mL 투명하며, 무색에서 옅은 황색 용액입니다. 1 mL의 RINVOQ LQ마다 upadacitinib의 자유 염기 1mg(upadacitinib 반수화물 1.02mg에 해당) 및 다음과 같은 비활성 성분이 포함되어 있습니다. 무수 구연산, 정제수, 벤조산나트륨, 시트르산나트륨 이수화물 및 수크랄로스.
12. 임상 약리학
12.1 작용 기전
Upadacitinib는 야누스 키나제(JAK) 억제제입니다. JAK는 세포막에서 사이토카인 또는 성장 인자-수용체 상호 작용으로 발생하는 신호를 전달하여 조혈 및 면역 세포 기능의 세포 과정에 영향을 미치는 세포 내 효소입니다. 신호 전달 경로 내에서 JAK는 유전자 발현을 포함한 세포 내 활성을 조절하는 신호 변환기 및 전사 활성화 인자(STAT)를 인산화하고 활성화합니다. Upadacitinib는 JAK 지점에서 신호 전달 경로를 조절하여 STAT의 인산화 및 활성화를 방지합니다.
JAK 효소는 쌍을 이루어 사이토카인 신호를 전달합니다(예: JAK1/JAK2, JAK1/JAK3, JAK1/TYK2, JAK2/JAK2, JAK2/TYK2). 세포가 없는 분리된 효소 분석에서 upadacitinib는 JAK3 및 TYK2에 비해 JAK1 및 JAK2에서 더 큰 억제 효능을 보였습니다. 인간 백혈구 세포 분석에서 upadacitinib는 JAK2/JAK2 매개 STAT 인산화보다 JAK1 및 JAK1/JAK3에 의해 매개되는 사이토카인 유도 STAT 인산화를 더 강력하게 억제했습니다. 치료 효과에 대한 특정 JAK 효소 억제의 관련성은 현재 알려져 있지 않습니다.
12.2 약력학
IL-6 에 의한 STAT3 및 IL-7 에 의한 STAT5 인산화 억제
건강한 지원자에서 upadacitinib(속방성 제형)를 투여한 결과 전혈에서 IL-6(JAK1/JAK2)에 의해 유도된 STAT3 및 IL-7(JAK1/JAK3)에 의해 유도된 STAT5 인산화가 용량 및 농도 의존적으로 억제되었습니다. 최대 억제는 투여 1시간 후에 관찰되었으며 투여 간격이 끝날 무렵 기준치에 가깝게 돌아왔습니다.
림프구
류마티스 관절염 환자에서 upadacitinib 치료는 36주까지 기준치에서 평균 ALC가 약간 일시적으로 증가하는 것과 관련이 있었으며, 이는 지속적인 치료로 점차 기준치 수준 또는 그 근처로 돌아왔습니다.
면역글로불린
류마티스 관절염 환자에서 대조군 기간 동안 upadacitinib 치료를 받은 경우 평균 IgG 및 IgM 수치가 기준치에서 약간 감소한 것으로 나타났습니다. 그러나 기준치 및 모든 방문에서 평균값은 정상 참조 범위 내에 있었습니다.
심장 전기 생리학
1일 1회 최대 치료 용량인 45mg의 평균 노출량의 2.5배에서 QTc 간격에 대한 임상적으로 관련된 영향은 없었습니다.
12.3 약동학
Upadacitinib 혈장 노출은 치료 용량 범위에서 용량에 비례합니다. 건강한 피험자에게 공복 상태에서 RINVOQ 15mg, 30mg, 45mg 정제를 단회 투여한 후 평균 Cmax는 각각 31.6ng/mL, 71.8ng/mL, 90.7ng/mL였으며 평균 AUCinf는 각각 265ng·h/mL, 543ng·h/mL, 752ng·h/mL였습니다. 1일 1회 투여 후 최소한의 축적으로 4일 이내에 항정 상태 혈장 농도에 도달합니다. pJIA 및 건선성 관절염 환자에게 권장되는 소아 용량(표 1, 표 2)을 투여한 후 평균 항정 상태 Cmax는 47.6ng/mL로 예측되고 평균 항정 상태 AUC0-24는 342ng·h/mL로 예측됩니다. Upadacitinib 약동학은 류마티스 관절염, 건선성 관절염, 아토피 피부염, 궤양성 대장염, 크론병, 강직성 척추염 및 방사선학적 음성 축성 척추관절염 환자 간에 비슷합니다.
RINVOQ 정제와 RINVOQ LQ는 생물학적 동등성이 없습니다. 따라서 2가지 제형은 밀리그램당 밀리그램 기준으로 교체할 수 없습니다 [2.2 용법 및 용량 참조].
흡수
RINVOQ 서방형 정제를 경구 투여한 후 upadacitinib는 2~4시간의 중앙값 Tmax로 흡수됩니다. 6mg RINVOQ LQ를 경구 투여한 후 upadacitinib는 1시간의 중앙값 Tmax로 흡수됩니다.
RINVOQ 정제를 고지방/고칼로리 식사와 함께 투여해도 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않았습니다(AUCinf는 29%, Cmax는 39~60% 증가). RINVOQ LQ를 음식과 함께 투여해도 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않을 것으로 예상됩니다 [2.2 용법 및 용량 참조].
분포
Upadacitinib는 혈장 단백질에 52% 결합합니다. Upadacitinib는 혈액 대 혈장 비율이 1.0인 혈장과 혈액 세포 성분 사이에 유사하게 분포합니다.
제거
대사
Upadacitinib 대사는 주로 CYP3A4에 의해 매개되며 CYP2D6의 기여는 적습니다. upadacitinib의 약리학적 활성은 모체 분자에 기인합니다. 인간 방사성 표지 연구에서 변하지 않은 upadacitinib는 혈장에서 총 방사능의 79%를 차지했으며, 검출된 주요 대사 산물(모노옥시게나아제에 이은 글루쿠론산화 생성물)은 총 혈장 방사능의 13%를 차지했습니다. upadacitinib의 활성 대사 산물은 확인되지 않았습니다.
배설
[14C]-upadacitinib 속방성 용액을 단회 투여한 후 upadacitinib는 주로 변하지 않은 모체 약물로 소변(24%)과 대변(38%)으로 배설되었습니다. upadacitinib 용량의 약 34%가 대사 산물로 배설되었습니다. Upadacitinib의 평균 말기 제거 반감기는 8~14시간이었습니다.
특정 집단
체중, 성별 및 인종
체중, 성별, 인종 및 민족은 성인 환자 집단에서 upadacitinib 노출에 임상적으로 의미 있는 영향을 미치지 않았습니다.
소아 환자
활동성 다발성 관절염이 있는 소아 JIA 환자에서, upadacitinib 청소율은 체중 증가에 따라 증가했습니다. 연령(2~<18세)은 체중의 영향을 고려한 후 upadacitinib 약동학에 추가적인 영향을 미치지 않았습니다. 권장 소아 용량을 투여한 후 pJIA 및 건선성 관절염 소아 환자의 upadacitinib 혈장 노출은 각각 류마티스 관절염 및 건선성 관절염 성인 환자에서 관찰된 것과 유사할 것으로 예상됩니다.
12세 이상, 체중 40kg 이상의 아토피 피부염 소아 환자에서 성인과 비교하여 upadacitinib의 전신 노출에서 유의미한 차이가 관찰되지 않았습니다.
노인 환자
노인 환자(≥65세)에서 젊은 성인 환자와 비교하여 upadacitinib의 약동학에서 임상적으로 유의미한 차이가 관찰되지 않았습니다.
신장애 환자
15mg upadacitinib 정제를 단회 투여한 후 upadacitinib 평균 AUCinf는 경도(eGFR 60~<90mL/min/1.73m2), 중등도(eGFR 30~<60mL/min/1.73m2) 및 중증(eGFR 15~<30mL/min/1.73m2) 신장애 환자에서 정상 신기능(eGFR ≥90mL/min/1.73m2)을 가진 피험자에 비해 각각 18%, 33% 및 44% 더 높았습니다. Upadacitinib 평균 Cmax는 정상 신기능 및 신장애 환자에서 유사했습니다. RINVOQ/RINVOQ LQ를 투여받는 환자에서 경도 및 중등도 신장애는 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않을 것으로 예상됩니다[용량 및 투여 방법(2.11) 및 특정 집단에서의 사용(8.6) 참조] .
간장애 환자
15mg upadacitinib 정제를 단회 투여한 후 upadacitinib 평균 AUCinf는 경도(Child-Pugh A) 및 중등도(Child-Pugh B) 간장애 환자에서 정상 간기능을 가진 피험자에 비해 각각 28% 및 24% 더 높았습니다. Upadacitinib 평균 Cmax는 경도 간장애 환자에서 변화가 없었고 중등도 간장애 환자에서 정상 간기능을 가진 피험자에 비해 43% 더 높았습니다. Upadacitinib은 중증 간장애(Child-Pugh C) 환자에서 연구되지 않았습니다[용량 및 투여 방법(2.11) 및 특정 집단에서의 사용(8.7) 참조] .
약물 상호 작용 연구
다른 약물이 Upadacitinib의 약동학에 영향을 미칠 가능성
Upadacitinib은 CYP2D6의 경미한 기여와 함께 CYP3A4에 의해 in vitro에서 대사됩니다. 병용 투여되는 약물이 upadacitinib 혈장 노출에 미치는 영향은 표 10에 나와 있습니다[약물 상호 작용(7) 참조] .
| 병용 투여되는 약물 |
병용 투여되는 약물의 요법 |
비율 (90% CI)a |
|
| Cmax | AUC | ||
| Methotrexate | 10~25mg/주 | 0.97 (0.86-1.09) |
0.99 (0.93-1.06) |
| 강력한 CYP3A4 억제제: Ketoconazole |
400mg 1일 1회 x 6일 |
1.70 (1.55-1.89) |
1.75 (1.62-1.88) |
| 강력한 CYP3A4 유도제: Rifampin |
600mg 1일 1회 x 9일 |
0.49 (0.44-0.55) |
0.39 (0.37-0.42) |
| OATP1B 억제제: Rifampin |
600mg 단회 투여 | 1.14 (1.02-1.28) |
1.07 (1.01-1.14) |
| CI: 신뢰 구간 a Cmax 및 AUC에 대한 비율은 upadacitinib과 약물의 병용 투여 대 upadacitinib 단독 투여를 비교한 것입니다. |
|||
pH modifying medications (e.g., antacids or proton pump inhibitors)는 in vitro 평가 및 모집단 약동학 분석에 근거하여 upadacitinib 혈장 노출에 영향을 미치지 않을 것으로 예상됩니다. CYP2D6 대사 표현형은 upadacitinib 약동학에 영향을 미치지 않았습니다(모집단 약동학 분석 기준). 이는 CYP2D6 억제제가 upadacitinib 노출에 임상적으로 관련된 영향을 미치지 않음을 나타냅니다.
Upadacitinib이 다른 약물의 약동학에 미치는 영향 가능성
In vitro 연구에 따르면 upadacitinib은 임상적으로 관련된 농도에서 사이토크롬 P450(CYP) 효소(CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP3A4)의 활성을 억제하지 않습니다. In vitro 연구에 따르면 upadacitinib은 CYP3A4를 유도하지만 임상적으로 관련된 농도에서 CYP2B6 또는 CYP1A2를 유도하지 않습니다. In vitro 연구에 따르면 upadacitinib은 임상적으로 관련된 농도에서 P-gp, BCRP, OATP1B1, OATP1B3, OCT1, OCT2, OAT1, OAT3, MATE1, MATE2K 수송체를 억제하지 않습니다.
임상 연구에 따르면 upadacitinib은 병용되는 약물의 약동학에 임상적으로 관련된 영향을 미치지 않습니다. upadacitinib 30mg 및 45mg 정제를 1일 1회 투여한 후 CYP2D6에 대한 영향을 제외하고 각 CYP 효소(CYP1A2, CYP3A, CYP2C9, CYP2C19)에 대한 영향은 두 용량 간에 유사했습니다. upadacitinib 30mg 및 45mg 정제를 1일 1회 투여한 후 CYP3A4의 약한 유도가 관찰되었습니다. CYP2D6의 약한 억제는 upadacitinib 45mg에서 관찰되었지만 30mg에서는 관찰되지 않았습니다. upadacitinib이 다른 약물에 미치는 영향을 평가한 임상 연구 결과 요약은 표 11에 나와 있습니다.
| 병용되는 약물 또는 CYP 활성 마커 |
다회 투여 요법 Upadacitinib |
비율 (90% CI)a |
|
| Cmax | AUC | ||
| Methotrexate | 6mg~24mg BIDb | 1.03 (0.86-1.23) |
1.14 (0.91-1.43) |
| 민감한 CYP1A2 기질: 카페인 |
45mg QDc | 1.05 (0.97-1.14) |
1.04 (0.95-1.13) |
| 민감한 CYP3A 기질: Midazolam |
30mg QDc | 0.74 (0.68-0.80) |
0.74 (0.68-0.80) |
| 민감한 CYP3A 기질: Midazolam |
45mg QDc | 0.75 (0.69 -0.83) |
0.76 (0.69 -0.83) |
| 민감한 CYP2D6 기질: Dextromethorphan |
30mg QDc | 1.09 (0.98-1.21) |
1.07 (0.95-1.22) |
| 민감한 CYP2D6 기질: Dextromethorphan |
45mg QDc | 1.30 (1.13-1.50) |
1.35 (1.18-1.54) |
| 민감한 CYP2C9 기질: S-Warfarin |
45mg QDc | 1.18 (1.05-1.33) |
1.12 (1.05-1.20) |
| 민감한 CYP2C19 마커: 5-OH Omeprazole 대 Omeprazole 대사 비율 |
45mg QDc | — | 0.96 (0.90-1.02) |
| CYP2B6 기질: Bupropion |
30mg QDc | 0.87 (0.79-0.96) |
0.92 (0.87-0.98) |
| Rosuvastatin | 30mg QDc | 0.77 (0.63-0.94) |
0.67 (0.56-0.82) |
| Atorvastatin | 30mg QDc | 0.88 (0.79-0.97) |
0.77 (0.70-0.85) |
| Ethinylestradiol | 30mg QDc | 0.96 (0.89-1.02) |
1.11 (1.04-1.19) |
| Levonorgestrel | 30mg QDc | 0.96 (0.87-1.06) |
0.96 (0.85-1.07) |
| CYP: 시토크롬 P450; CI: 신뢰 구간; BID: 하루 2회; QD: 하루 1회 a Cmax 및 AUC 비율은 우파다시티닙과 함께 투여한 약물과 약물 단독 투여를 비교합니다. b 즉시 방출 제형 c 지속 방출 정제 제형 |
|||
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
업다시티닙의 발암 가능성은 Sprague-Dawley 랫트와 Tg.rasH2 마우스에서 평가되었습니다. 최대 101주 동안 경구 투여량이 각각 최대 15 또는 20 mg/kg/day인 수컷 또는 암컷 랫트에서 종양 발생 증거는 관찰되지 않았습니다(각각 15 mg 정제 투여량의 약 4배 및 10배, 30 mg 정제 투여량의 2배 및 5배, 그리고 AUC 기준으로 45 mg의 최대 권장 인체 투여량(MRHD)의 1.6배 및 4배). 최대 26주 동안 경구 투여량이 최대 20 mg/kg/day인 수컷 또는 암컷 Tg.rasH2 마우스에서 종양 발생 증거는 관찰되지 않았습니다.
돌연변이 유발성
업다시티닙은 다음 유전 독성 검사에서 음성으로 판명되었습니다. in vitro 박테리아 돌연변이 유발성 검사(Ames 검사), in vitro 인간 말초 혈액 림프구의 염색체 이상 검사, 그리고 in vivo 랫트 골수 미세핵 검사.
생식능력 저해
업다시티닙은 수컷의 경우 최대 50 mg/kg/day, 암컷의 경우 최대 75 mg/kg/day의 경구 투여량에서 수컷 또는 암컷 랫트의 생식력에 영향을 미치지 않았습니다(각각 15 mg 투여량의 약 42배 및 84배, 30 mg 투여량의 22배 및 43배, 그리고 AUC 기준으로 MRHD의 16배 및 31배). 그러나, 임신 유지가 25 mg/kg/day 및 75 mg/kg/day의 경구 투여량에서 불리하게 영향을 받았습니다. 이는 투여량 관련 증가된 착상 후 손실(증가된 흡수) 및 1 마리당 평균 생존 배아 수 감소(각각 15 mg 정제 투여량의 약 22배 및 84배, 30 mg 정제 투여량의 11배 및 43배, 그리고 AUC 기준으로 MRHD의 8배 및 31배)의 발견에 근거합니다. 5 mg/kg/day의 경구 투여량으로 업다시티닙을 투여받고 같은 투여량을 투여받은 수컷과 교배된 암컷 랫트에서 생존 배아 수는 영향을 받지 않았습니다(각각 15 mg 투여량의 약 2배, 30 mg 투여량의 0.9배, 그리고 AUC 기준으로 MRHD의 0.6배).
14 임상 연구
14.1 류마티스 관절염
RINVOQ 15 mg 1일 1회 용량의 유효성 및 안전성은 중등도 내지 중증의 활동성 류마티스 관절염이 있고 ACR/EULAR 2010 분류 기준을 충족하는 환자를 대상으로 한 5건의 무작위배정, 이중맹검, 다기관 3상 임상시험에서 평가되었습니다. 18세 이상의 환자가 참여할 수 있었습니다. 기저 시점에 최소 6개의 압통 관절과 6개의 종창 관절이 있고 hsCRP 상승에 근거한 전신 염증의 증거가 요구되었습니다. 다른 용량도 연구되었지만, 권장 RINVOQ 용량은 1일 1회 15mg입니다.
RA-I 임상시험(NCT02706873)은 메토트렉세이트(MTX)를 투여한 적이 없는 중등도 내지 중증의 활동성 류마티스 관절염 환자 947명을 대상으로 한 24주간의 단독 요법 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 경구 투여받거나 MTX를 단독 요법으로 투여받았습니다. 26주차에 우파다시티닙을 투여받은 반응이 없는 환자는 MTX를 추가하여 rescue할 수 있었고, MTX를 투여받은 환자는 맹검된 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 추가하여 rescue할 수 있었습니다. 1차 평가변수는 12주차에 ACR50 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 질병 활성도 점수(DAS28-CRP) ≤3.2, 24주차에 DAS28-CRP <2.6, 12주차에 HAQ-DI의 기저 시점 대비 변화, 24주차에 van der Heijde 수정 총 Sharp 점수(mTSS)의 기저 시점 대비 변화가 포함되었습니다.
RA-II 임상시험(NCT02706951)은 MTX에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 648명을 대상으로 한 14주간의 단독 요법 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 단독 요법으로 투여받거나 안정적인 용량의 MTX 단독 요법을 계속 투여받았습니다. 14주차에 MTX 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 단독 요법으로 전환되었습니다. 1차 평가변수는 14주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 14주차에 DAS28-CRP ≤3.2, DAS28-CRP <2.6, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
RA-III 임상시험(NCT02675426)은 기존의 질병 조절 항류마티스제(cDMARD)에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 661명을 대상으로 한 12주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 투여받거나 위약을 배경 cDMARD 요법에 추가하여 투여받았습니다. 12주차에 위약 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, DAS28-CRP<2.6, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
RA-IV 임상시험(NCT02629159)은 MTX에 대한 반응이 불충분한 중등도 내지 중증의 활동성 류마티스 관절염 환자 1,629명을 대상으로 한 48주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 1일 1회, 활성 비교제 또는 위약을 배경 MTX에 추가하여 투여받았습니다. 14주차부터 RINVOQ 15mg을 투여받은 반응이 없는 환자는 맹검 방식으로 활성 비교제로 rescue할 수 있었고, 활성 비교제 또는 위약을 투여받은 반응이 없는 환자는 맹검 방식으로 RINVOQ 15mg으로 rescue할 수 있었습니다. 26주차에 위약 무작위배정을 받은 모든 환자들은 맹검 방식으로 RINVOQ 15mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 위약 대비 ACR20 반응을 달성한 환자의 비율이었습니다. 위약 대비 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, DAS28-CRP <2.6, HAQ-DI의 기저 시점 대비 변화, 26주차에 mTSS의 기저 시점 대비 변화가 포함되었습니다.
RA-V 임상시험(NCT02706847)은 생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도 내지 중증의 활동성 류마티스 관절염 환자 499명을 대상으로 한 12주간의 임상시험이었습니다. 환자들은 RINVOQ 15mg 또는 우파다시티닙 30mg을 1일 1회 투여받거나 위약을 배경 cDMARD 요법에 추가하여 투여받았습니다. 12주차에 위약 무작위배정을 받은 환자들은 기저 시점에 미리 결정된 배정에 따라 맹검 방식으로 RINVOQ 15mg 또는 우파다시티닙 30mg 1일 1회 용량으로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다. 주요 2차 평가변수에는 12주차에 DAS28-CRP ≤3.2, HAQ-DI의 기저 시점 대비 변화가 포함되었습니다.
임상 반응
모든 임상시험에서 ACR20, ACR50 및 ACR70 반응과 DAS28(CRP) < 2.6을 달성한 RINVOQ 치료 환자의 비율은 표 12에 나와 있습니다.
단독으로 또는 cDMARD와 병용하여 RINVOQ 15mg으로 치료받은 환자는 1차 유효성 평가 시점에 각각 MTX 단독 요법 또는 위약에 비해 더 높은 ACR 반응률을 달성했습니다(표 12).
임상시험 IV에서 방문별 ACR20 반응을 달성한 환자의 비율은 그림 1에 나와 있습니다.
RA-III 및 RA-V 임상시험에서 RINVOQ 15mg을 투여받은 환자는 위약군에 비해 1주차에 더 높은 ACR20 반응률을 보였습니다.
단독으로 또는 cDMARD와 병용한 RINVOQ 15mg 치료는 1차 유효성 평가 시점에 MTX 또는 위약에 비해 ACR 구성 요소에서 더 큰 개선을 가져왔습니다(표 13).
| RA-I 임상시험 MTX-Naïve |
RA-II 임상시험 MTX-IR |
RA-III 임상시험 cDMARD-IR |
RA-IV 임상시험 MTX-IR |
RA-V 임상시험 bDMARD-IR |
||||||
| 단독 요법 | 단독 요법 | 배경 cDMARD |
배경 MTX |
배경 cDMARD |
||||||
| MTX | RINVOQ 15 mg % Δ (95% CI) |
MTX | RINVOQ 15 mg % Δ (95% CI) |
PBO | RINVOQ 15 mg % Δ (95% CI) |
PBO | RINVOQ 15 mg % Δ (95% CI) |
PBO | RINVOQ 15 mg % Δ (95% CI) |
|
| N | 314 | 317 | 216 | 217 | 221 | 221 | 651 | 651 | 169 | 164 |
| 주 | ||||||||||
| ACR20 | ||||||||||
| 12a/14b | 54 | 76 22 (14, 29) |
41 | 68 26 (17, 36) |
36 | 64 28 (19, 37) |
36 | 71 34 (29, 39) |
28 | 65 36 (26, 46) |
| 24c/26d | 59 | 79 20 (13, 27) |
36 | 67 32 (27, 37) |
||||||
| ACR50 | ||||||||||
| 12a/14b | 28 | 52 24 (16, 31) |
15 | 42 27 (18, 35) |
15 | 38 23 (15, 31) |
15 | 45 30 (26, 35) |
12 | 34 22 (14, 31) |
| 24c/26d | 33 | 60 27 (19, 34) |
21 | 54 33 (28, 38) |
||||||
| ACR70 | ||||||||||
| 12a/14b | 14 | 32 18 (12, 25) |
3 | 23 20 (14, 26) |
6 | 21 15 (9, 21) |
5 | 25 20 (16, 24) |
7 | 12 5 (-1, 11) |
| 24c/26d | 18 | 44 26 (19, 33) |
10 | 35 25 (21, 29) |
||||||
| DAS28-CRP <2.6 | ||||||||||
| 12a/14b | 14 | 36 22 (15, 28) |
8 | 28 20 (13, 27) |
10 | 31 21 (14, 28) |
6 | 29 23 (19, 27) |
9 | 29 19 (11, 27) |
| 24c/26d | 18 | 48 30 (23, 37) |
9 | 41 32 (27, 36) |
||||||
| 약어: ACR20(또는 50 또는 70) = 미국 류마티스 학회 ≥20%(또는 ≥50% 또는 ≥70%) 개선; bDMARD = 생물학적 질병 조절 항류마티스제; CRP = C-반응성 단백질; DAS28 = 28개 관절 질병 활성도 점수; cDMARD = 기존의 질병 조절 항류마티스제; MTX = 메토트렉세이트; PBO = 위약; IR = 불충분한 반응자 무작위 배정 치료를 중단했거나, 무작위 배정 치료 간에 교차했거나, 평가 주에 데이터가 없는 환자는 분석에서 무반응자로 대체되었습니다. a 임상시험 RA-I, 임상시험 RA-III, 임상시험 RA-IV, 임상시험 RA-V b 임상시험 RA-II c 임상시험 RA-I d 임상시험 RA-IV |
||||||||||
| 시험 RA-I MTX-Naïve |
시험 RA-IIb MTX-IR |
시험 RA-III cDMARD-IR |
시험 RA-IV MTX-IR |
시험 RA-V bDMARD-IR |
||||||
| 단독 요법 | 단독 요법 | 배경 cDMARD |
배경 MTX |
배경 cDMARD |
||||||
| MTX | RINVOQ 15 mg |
MTX | RINVOQ 15 mg |
PBO | RINVOQ 15 mg |
PBO | RINVOQ 15 mg |
PBO | RINVOQ 15 mg |
|
| N | 314 | 317 | 216 | 217 | 221 | 221 | 651 | 651 | 169 | 164 |
| 압통 관절 수(0-68) | ||||||||||
| 기준선 | 26 (16) |
25 (14) |
25 (16) |
24 (15) |
25 (15) |
25 (14) |
26 (14) |
26 (15) |
28 (15) |
28 (16) |
| 12/14주차 | 13 (15) |
9 (12) |
15 (16) |
10 (13) |
16 (17) |
12 (14) |
16 (15) |
10 (13) |
18 (17) |
11 (14) |
| 종창 관절 수(0-66) | ||||||||||
| 기준선 | 17 (11) |
17 (10) |
17 (12) |
16 (11) |
15 (9) |
16 (10) |
16 (9) |
17 (10) |
16 (10) |
17 (11) |
| 12/14주차 | 6 (8) |
5 (7) |
9 (11) |
6 (9) |
9 (10) |
7 (10) |
9 (9) |
5 (7) |
9 (10) |
6 (8) |
| 통증c | ||||||||||
| 기준선 | 66 (21) |
68 (21) |
63 (21) |
62 (23) |
62 (21) |
64 (19) |
65 (21) |
66 (21) |
69 (21) |
68 (20) |
| 12/14주차 | 41 (25) |
31 (25) |
49 (25) |
36 (27) |
51 (26) |
33 (24) |
49 (25) |
33 (24) |
55 (28) |
41 (28) |
| 환자 전체 평가c | ||||||||||
| 기준선 | 66 (21) |
67 (22) |
60 (22) |
62 (22) |
60 (20) |
63 (22) |
64 (21) |
64 (22) |
66 (23) |
67 (20) |
| 12/14주차 | 42 (25) |
31 (24) |
48 (26) |
37 (27) |
50 (26) |
32 (24) |
48 (24) |
33 (24) |
54 (28) |
40 (26) |
| 장애 지수(HAQ-DI)d | ||||||||||
| 기준선 | 1.60 (0.67) |
1.60 (0.67) |
1.47 (0.66) |
1.47 (0.66) |
1.42 (0.63) |
1.48 (0.61) |
1.61 (0.61) |
1.63 (0.64) |
1.56 (0.60) |
1.67 (0.64) |
| 12/14주차 | 1.08 (0.72) |
0.76 (0.69) |
1.19 (0.69) |
0.86 (0.67) |
1.13 (0.70) |
0.85 (0.66) |
1.28 (0.67) |
0.98 (0.68) |
1.33 (0.66) |
1.24 (0.77) |
| 의사 전체 평가c | ||||||||||
| 기준선 | 69 (16) |
67 (17) |
62 (17) |
66 (18) |
64 (18) |
64 (16) |
66 (18) |
66 (17) |
67 (17) |
69 (17) |
| 12/14주차 | 32 (22) |
22 (19) |
37 (24) |
26 (21) |
41 (24) |
26 (21) |
41 (25) |
27 (21) |
39 (25) |
29 (22) |
| CRP (mg/L) | ||||||||||
| 기준선 | 21.2 (22.1) |
23.0 (27.4) |
14.5 (17.3) |
14.0 (16.5) |
12.6 (14.0) |
16.6 (19.2) |
18.0 (21.5) |
17.9 (22.5) |
16.3 (21.1) |
16.3 (18.6) |
| 12/14주차 | 10.9 (14.9) |
4.2 (8.8) |
12.8 (21.4) |
3.7 (7.8) |
13.1 (15.5) |
4.6 (9.6) |
16.2 (19.8) |
5.5 (10.9) |
13.9 (17.3) |
5.0 (14.0) |
| 약어: ACR = 미국 류마티스 학회, bDMARD = 생물학적 질병 조절 항류마티스제, CRP = C-반응성 단백질, cDMARD = 기존의 질병 조절 항류마티스제, HAQ-DI = 건강 평가 설문지 장애 지수, IR = 불충분한 반응자, MTX = 메토트렉세이트, PBO = 위약
a 표시된 데이터는 평균(표준 편차)입니다. |
||||||||||
그림 1. RA-IV 임상시험에서 ACR20에 도달한 환자의 비율

약어: ACR20 = 미국 류마티스 학회 ≥20% 개선; MTX = 메토트렉세이트
무작위 배정 치료를 중단했거나, ACR20 결과가 누락되었거나, 추적 관찰이 손실되었거나, 임상시험에서 철회된 환자는 반응하지 않은 것으로 간주되었습니다.
RA-I 및 RA-IV에서 1차 유효성 평가 시점에 MTX 또는 위약에 비해 RINVOQ 15mg을 단독으로 또는 MTX와 병용하여 치료받은 환자의 비율이 DAS28-CRP < 2.6에 도달했습니다(표 14).
| 임상시험 RA-I MTX-naïve |
||
| 단독 요법 | ||
| DAS28-CRP 2.6 미만 | MTX N = 314 |
RINVOQ 15mg N = 317 |
| 12주차 반응자 비율(n) | 14%(43) | 36%(113) |
| 반응자 중 활성 관절이 0개인 비율(n) | 51%(22) | 45%(51) |
| 반응자 중 활성 관절이 1개인 비율(n) | 35%(15) | 23%(26) |
| 반응자 중 활성 관절이 2개인 비율(n) | 9%(4) | 17%(19) |
| 반응자 중 활성 관절이 3개 이상인 비율(n) | 5%(2) | 15%(17) |
| 임상시험 RA-IV MTX-IR |
||
| 배경 MTX | ||
| DAS28-CRP 2.6 미만 | PBO N = 651 |
RINVOQ 15mg N = 651 |
| 12주차 반응자 비율(n) | 6%(40) | 29%(187) |
| 반응자 중 활성 관절이 0개인 비율(n) | 60%(24) | 48%(89) |
| 반응자 중 활성 관절이 1개인 비율(n) | 20%(8) | 23%(43) |
| 반응자 중 활성 관절이 2개인 비율(n) | 15%(6) | 13%(25) |
| 반응자 중 활성 관절이 3개 이상인 비율(n) | 5%(2) | 16%(30) |
| 약어: CRP = C-반응성 단백질; DAS28 = 28개 관절 질병 활성도 점수; MTX = 메토트렉세이트; PBO = 위약; IR = 불충분한 반응자 | ||
방사선학적 반응
Trial RA-IV의 26주차와 Trial RA-I의 24주차에 수정 총 Sharp 점수(mTSS)와 그 구성 요소인 미란 점수 및 관절 간격 협착 점수를 사용하여 구조적 관절 손상 진행 억제를 평가했습니다. 방사선학적 진행이 없는 환자의 비율(기준치 대비 mTSS 변화 ≤ 0)도 평가했습니다.
Trial RA-IV에서 RINVOQ 15mg을 투여한 경우 26주차에 cDMARD와 병용했을 때 위약에 비해 구조적 관절 손상의 진행을 억제했습니다(표 15). 미란 및 관절 간격 협착 점수 분석 결과는 전체 결과와 일치했습니다.
위약 + MTX군에서는 환자의 76%가 26주차에 방사선학적 진행을 보이지 않은 반면, RINVOQ 15mg을 투여받은 환자는 83%가 방사선학적 진행을 보이지 않았습니다.
Trial RA-I에서 RINVOQ 15mg 단독 요법을 투여한 경우 24주차에 MTX 단독 요법에 비해 구조적 관절 손상의 진행을 억제했습니다(표 15). 미란 및 관절 간격 협착 점수 분석 결과는 전체 결과와 일치했습니다.
MTX 단독 요법군에서는 환자의 78%가 24주차에 방사선학적 진행을 보이지 않은 반면, RINVOQ 15mg 단독 요법을 투여받은 환자는 87%가 방사선학적 진행을 보이지 않았습니다.
| 시험 RA-IV MTX-IR |
|||
| 배경 MTX | |||
| mTSS | PBO (N=651) 평균(SD) |
RINVOQ 15mg (N=651) 평균(SD) |
26주차에서 PBO 대비 추정 차이 (95% CI)a |
| 기준치 | 35.9(52) | 34.0(50) | |
| 26주차b | 0.78(0.1) | 0.15(0.1) | -0.63(-0.92, -0.34) |
| 시험 RA-I MTX-naïve |
|||
| 단독 요법 | |||
| MTX (N=309) 평균(SD) |
RINVOQ 15mg (N=309) 평균(SD) |
24주차에서 MTX 대비 추정 차이 (95% CI)c |
|
| 기준치 | 13.3(31) | 18.1(38) | |
| 24주차d | 0.67(2.8) | 0.14(1.4) | -0.53(-0.85, -0.20) |
| 약어: mTSS = 수정 총 Sharp 점수, MTX = 메토트렉세이트, PBO = 위약, SD = 표준 편차, IR = 불충분한 반응자, bDMARD = 생물학적 질환 조절 항류마티스제, LS = 최소 제곱, CI = 신뢰 구간 a 시간, 치료군, 이전 bDMARD 사용, 치료군별 시간 상호 작용에 따라 조정하고 무작위 기울기와 무작위 절편을 사용하여 mTSS 값에 맞는 무작위 계수 모형을 기반으로 한 LS 평균 및 95% CI입니다. b 26주차까지의 구조적 진행의 추정 선형 비율과 표준 오차가 표시되어 있습니다. c 치료군, 기준치 mTSS 및 지역에 따라 조정하여 기준치 대비 mTSS 변화에 맞는 선형 회귀 모형을 기반으로 한 LS 평균 및 95% CI입니다. d 기준치 대비 평균 변화량과 표준 편차가 표시되어 있습니다. |
|||
신체 기능 반응
단독 또는 cDMARD와 병용하여 RINVOQ 15mg으로 치료한 결과, HAQ-DI로 측정했을 때 모든 비교군에 비해 12/14주차에 신체 기능이 더 크게 개선되었습니다.
기타 건강 관련 결과
RA-V 시험을 제외한 모든 시험에서 RINVOQ 15mg을 투여받은 환자는 cDMARD 또는 MTX 단독 요법과 병용하여 위약을 투여받은 환자에 비해 12/14주차에 신체 구성 요약(PCS) 점수, 정신 구성 요약(MCS) 점수 및 단축형 건강 설문(SF-36)의 8가지 모든 영역에서 기준치 대비 더 큰 개선을 보였습니다.
피로는 RA-I, RA-III 및 RA-IV 시험에서 만성 질환 치료 기능 평가-피로 점수(FACIT-F)로 평가했습니다. cDMARD 또는 MTX 단독 요법과 병용하여 위약을 투여받은 환자에 비해 RINVOQ 15mg으로 치료받은 환자에서 12주차에 피로 개선이 관찰되었습니다.
14.2 건선성 관절염
중등도에서 중증의 활동성 건선성 관절염이 있는 18세 이상의 환자를 대상으로 한 두 건의 3상 무작위배정, 이중맹검, 다기관, 위약 대조 시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다. 모든 환자는 건선성 관절염 분류 기준(CASPAR)에 따라 최소 6개월 동안 활동성 건선성 관절염을 앓았고, 최소 3개의 압통 관절과 최소 3개의 종창 관절이 있었으며, 활동성 판상 건선 또는 판상 건선 병력이 있었습니다. 다른 용량도 연구되었지만, 건선성 관절염에 권장되는 RINVOQ 용량은 1일 1회 15mg입니다.
PsA-I 시험(NCT03104400)은 하나 이상의 비생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 건선성 관절염 환자 1705명을 대상으로 한 24주간의 시험이었습니다. 환자들은 RINVOQ 15mg 또는 upadacitinib 30mg을 1일 1회, adalimumab 또는 위약을 단독으로 또는 배경 비생물학적 DMARD와 병용하여 투여받았습니다. 24주차에 위약을 무작위로 배정받은 모든 환자는 맹검 방식으로 RINVOQ 15mg 또는 upadacitinib 30mg 1일 1회로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다.
PsA-II 시험(NCT03104374)은 하나 이상의 생물학적 DMARD에 대한 반응이 불충분하거나 내약성이 없는 중등도에서 중증의 활동성 건선성 관절염 환자 642명을 대상으로 한 24주간의 시험이었습니다. 환자들은 RINVOQ 15mg 또는 upadacitinib 30mg을 1일 1회 또는 위약을 단독으로 또는 배경 비생물학적 DMARD와 병용하여 투여받았습니다. 24주차에 위약을 무작위로 배정받은 모든 환자는 맹검 방식으로 RINVOQ 15mg 또는 upadacitinib 30mg 1일 1회로 전환되었습니다. 1차 평가변수는 12주차에 ACR20 반응을 달성한 환자의 비율이었습니다.
임상 반응
두 시험 모두에서 RINVOQ 15mg으로 치료받은 환자는 12주차에 위약에 비해 유의하게 더 높은 ACR20 반응을 달성했습니다(표 16, 그림 2). 위약에 비해 RINVOQ 15mg으로 치료받은 환자의 비율이 더 높았습니다. 12주차에 ACR50 및 ACR70 반응을 달성했습니다.
RINVOQ 15mg으로 치료한 결과 1차 유효성 평가 시점에 위약에 비해 ACR 구성 요소가 개선되었습니다(표 17).
| 시험 | 시험 PsA-I 비생물학적 DMARD-IR |
시험 PsA-II bDMARD-IR |
||
| 치료군 | PBO
% |
RINVOQ 15mg % Δ (95% CI) |
PBO
% |
RINVOQ 15mg % Δ (95% CI) |
| N | 423 | 429 | 212 | 211 |
| ACR20 | ||||
| 12주차 | 36 | 71 35 (28, 41) |
24 | 57 33 (24, 42) |
| ACR50 | ||||
| 12주차 | 13 | 38 24 (19, 30) |
5 | 32 27 (20, 34) |
| ACR70 | ||||
| 12주차 | 2 | 16 13 (10, 17) |
1 | 9 8 (4, 12) |
| 약어: ACR20(또는 50 또는 70) = 미국 류마티스 학회 ≥20%(또는 ≥50% 또는 ≥70%) 개선, bDMARD = 생물학적 질병 조절 항류마티스제; IR = 불충분한 반응자; PBO = 위약 무작위 치료를 중단했거나 평가 주에 데이터가 없는 환자는 분석에서 무반응자로 대체되었습니다. |
||||
| 시험 | 시험 PsA-I 비생물학적 DMARD-IR |
시험 PsA-II bDMARD-IR |
||
| 치료군 | PBO
(N=423) |
RINVOQ 15 mg (N=429) |
PBO
(N=212) |
RINVOQ 15 mg (N=211) |
| 압통/통증 관절 수(0-68) | ||||
| 기준선 | 20.0 (14.3) | 20.4 (14.7) | 25.3 (17.6) | 24.9 (17.3) |
| 12주차 | 12.5 (13.3) | 8.8 (12.5) | 19.3 (18.5) | 12.6 (15.6) |
| 부종 관절 수(0-66) | ||||
| 기준선 | 11.0 (8.2) | 11.6 (9.3) | 12.0 (8.9) | 11.3 (8.2) |
| 12주차 | 5.6 (7.2) | 3.5 (6.0) | 7.3 (9.4) | 4.4 (5.7) |
| 환자 통증 평가b | ||||
| 기준선 | 6.1 (2.1) | 6.2 (2.1) | 6.6 (2.1) | 6.4 (2.1) |
| 12주차 | 5.1 (2.3) | 3.8 (2.4) | 5.9 (2.3) | 4.4 (2.5) |
| 환자의 전반적 평가b | ||||
| 기준선 | 6.3 (2.0) | 6.6 (2.0) | 6.8 (2.0) | 6.8 (1.9) |
| 12주차 | 5.2 (2.2) | 3.8 (2.3) | 6.1 (2.3) | 4.5 (2.5) |
| 장애 지수(HAQ-DI)c | ||||
| 기준선 | 1.1 (0.6) | 1.2 (0.7) | 1.2 (0.7) | 1.1 (0.6) |
| 12주차 | 1.0 (0.7) | 0.7 (0.6) | 1.1 (0.6) | 0.8 (0.7) |
| 의사의 전반적 평가b | ||||
| 기준선 | 6.5 (1.6) | 6.7 (1.6) | 6.5 (1.8) | 6.5 (1.8) |
| 12주차 | 4.3 (2.2) | 3.1 (2.0) | 5.0 (2.2) | 3.4 (2.1) |
| hsCRP(mg/L) | ||||
| 기준선 | 11.5 (15.8) | 11.0 (14.9) | 10.4 (18.5) | 11.2 (18.6) |
| 12주차 | 10.1 (15.2) | 4.2 (9.9) | 9.4 (13.4) | 4.3 (7.9) |
| 약어: ACR = 미국 류마티스 학회, hsCRP = 고감도 C-반응성 단백질, HAQ-DI = 건강 평가 설문지-장애 지수, IR = 불충분한 반응자, PBO = 위약 a 표시된 데이터는 평균(표준 편차)입니다. b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악 c 건강 평가 설문지-장애 지수: 0=최상, 3=최악, 20개 문항, 8개 범주: 옷 입기 및 몸단장, 일어서기, 식사, 걷기, 위생, 뻗기, 잡기, 활동. |
||||
방문별 ACR20 반응을 달성한 환자의 비율은 그림 2에 나와 있습니다.
그림 2. 시험 PsA-II에서 ACR20을 달성한 환자의 비율
약어: ACR20 = 미국 류마티스 학회 ≥20% 개선 무작위 배정 치료를 중단했거나 ACR20 결과가 누락되었거나 추적 불가능 또는 시험에서 철회된 환자는 무반응자로 귀속되었습니다.
RINVOQ 15mg으로 치료하면 이전에 수지염이나 관절염이 있었던 환자의 수지염과 관절염이 개선되었습니다.
RINVOQ 15mg으로 치료하면 PsA 환자의 피부 증상이 개선되었습니다. 그러나 RINVOQ는 판상 건선 치료에 대해 연구되지 않았으며 적응증이 없습니다.
신체 기능 반응
두 시험 모두에서 RINVOQ 15mg으로 치료받은 환자는 12주차에 HAQ-DI로 평가한 바와 같이 위약에 비해 기준치에서 신체 기능이 크게 개선되었습니다(표 16). 12주차에 기준치에서 HAQ-DI 변화의 위약과의 평균 차이(95% CI)는 시험 PsA-I에서 -0.28(-0.35, -0.22)였고 시험 PsA-II에서 -0.21(-0.30, -0.12)였습니다.
시험 PsA-I 및 시험 PsA-II에서 12주차에 HAQ-DI 반응자(HAQ-DI 점수에서 기준치에서 ≥ 0.35 개선)의 비율은 RINVOQ 15mg을 투여받은 환자에서 각각 58% 및 45%였고 위약을 투여받은 환자에서 각각 33% 및 27%였습니다.
방사선학적 반응
시험 PsA-I에서 구조적 손상 진행의 억제는 방사선학적으로 평가되었으며 24주차에 수정된 총 Sharp 점수(mTSS) 및 그 구성 요소인 미란 점수 및 관절 간격 협착 점수의 기준치에서의 변화로 표현되었습니다.
RINVOQ 15mg으로 치료하면 24주차에 위약에 비해 구조적 관절 손상의 진행이 억제되었습니다(표 18). 미란 및 관절 간격 협착 점수에 대한 분석은 전체 결과와 일치했습니다. 24주차에 방사선학적 진행이 없는(mTSS 변화 ≤ 0) 환자의 비율은 RINVOQ 15mg을 투여받은 환자에서 93%였고 위약을 투여받은 환자에서 89%였습니다.
| PBO (N=392) 평균(SD) |
RINVOQ 15mg (N=407) 평균(SD) |
24주차에 PBO 대비 추정 차이 (95% CI)a |
|
| mTSS | |||
| 기준치 | 13.32(31.2) | 13.14(42.4) | |
| 24주차b | 0.23(0.07) | -0.02(0.04) | -0.25(-0.41, -0.09) |
| 약어: CI = 신뢰 구간, LS = 최소 제곱, mTSS = 수정된 총 Sharp 점수, PBO = 위약, SD = 표준 편차 a 시간, 치료군, 현재 DMARD 사용(예/아니오), 치료군별 시간 상호 작용에 대해 조정된 mTSS 값에 대한 무작위 계수 모델 적합을 기반으로 하는 LS 평균 및 95% CI, 무작위 기울기 및 무작위 절편 포함. b 24주차까지의 구조적 진행의 추정 선형 비율과 표준 오차가 제시됩니다. |
|||
기타 건강 관련 결과
건강 관련 삶의 질은 SF-36에 의해 평가되었습니다. 두 번의 시험에서 모두, 12주에 RINVOQ 15mg를 복용한 환자들은 플라시보와 비교하여 신체적 구성 요소 종합 점수에서 기저선으로부터 유의하게 더 큰 개선을 보였습니다. 정신적 구성 요소 종합 점수와 SF-36의 모든 8개 영역에서도 플라시보와 비교하여 더 큰 개선이 관찰되었습니다.
12주에 RINVOQ 15mg를 복용한 환자들은 FACIT-F 점수로 측정된 피로에서 플라시보와 비교하여 기저선으로부터 더 큰 개선을 보였습니다.
14.3 아토픽 피부염
RINVOQ 15mg 및 30mg의 1일 1회 투여 효능은 3가지 3상 무작위, 이중맹검, 다기관 시험(AD-1, AD-2, AD-3; NCT03569293, NCT03607422 및 NCT03568318)에 총 2584명의 환자(12세 이상)에서 평가되었습니다. RINVOQ는 344명의 소아 환자 및 2240명의 중등도에서 중증의 아토픽 피부염(AD)으로 국소 치료제로 적절히 조절되지 않은 성인 환자에서 평가되었습니다.
기저선에서 질병의 중증도는 검증된 연구자의 전반적인 AD 평가에서 유효한 연구자의 전역적 평가(vIGA-AD) 점수 ≥3(0-4의 중증도 척도), 습진 부위 및 중증도 지수(EASI) 점수 ≥16, 최소 체표면적(BSA) 참여 ≥10%, 및 주별 평균 최악 가려움 수치 평가 척도(NRS) 점수 ≥4로 정의되었습니다. 전반적으로 환자의 57%는 남성이었고 69%는 백인이었습니다. 기저선의 평균 연령은 34세(12세부터 75세까지)였고 환자의 13%는 12세 미만 18세 이하이었습니다. 기저선에서 49%의 환자는 vIGA-AD 점수 3(중등도 AD)을 가지고 있으며 51%의 환자는 vIGA-AD 점수 4(중증 AD)를 가지고 있었습니다. 기저선의 평균 EASI 점수는 29였고 기저선의 주별 평균 최악 가려움 NRS 점수는 7이었습니다. 환자의 약 52%가 과거 전신 AD 치료 경험이 있었습니다.
모든 3개의 시험에서 환자는 16주 동안 RINVOQ를 1일 1회 15mg, 30mg 또는 매칭된 플라시보를 복용했습니다. 시험 AD-3에서 환자들은 또한 16주 동안 RINVOQ 또는 플라시보와 동시에 국소 코르티코스테로이드(TCS)를 사용했습니다.
모든 3개 시험은 vIGA-AD 점수가 0(깨끗함) 또는 1(거의 깨끗함)이며 적어도 2점 개선을 보이면서 EASI-75(기저선과 비교하여 EASI 점수에서 적어도 75%의 개선)를 보이는 환자의 비율을 공동 일차 종점으로 평가했습니다. 이차 종점에는 16주에 EASI-90 및 EASI-100, 그리고 1주, 4주 및 16주에 가려움 감소(최악 가려움 NRS에서 기저선에서 ≥4점의 개선)가 있는 환자의 비율이 포함되었습니다. AD-1 및 AD-2 시험에서 16주에 통증 감소(아토픽 피부염 증상 척도[ADerm-SS] 피부 통증 NRS에서 기저선에서 ≥4점 개선)하는 환자의 비율은 이차 종점이었습니다.
임상 반응
단일요법 시험(AD-1 및 AD-2)
RINVOQ의 단일요법 시험(AD-1 및 AD-2)의 결과는 표 19에 제시됩니다. 도 3은 AD-1 및 AD-2 시험에서 1주, 4주 및 16주에 최악 가려움 NRS에서 ≥ 4점의 개선을 보이는 환자의 비율을 제시합니다.
| 시험 AD-1 | 시험 AD-2 | |||||
| PBO | RINVOQ 15 mg |
RINVOQ 30 mg |
PBO | RINVOQ 15 mg |
RINVOQ 30 mg |
|
| 무작위 배정된 환자의 수 |
281 | 281 | 285 | 278 | 276 | 282 |
| vIGA-AD 0/1a,b | 8% | 48% | 62% | 5% | 39% | 52% |
| PBO와의 차이 (95% CI) | 40% (33%, 46%) |
54% (47%, 60%) |
34% (28%, 40%) |
47% (41%, 54%) |
||
| EASI-75a | 16% | 70% | 80% | 13% | 60% | 73% |
| PBO와의 차이 (95% CI) | 53% (46%, 60%) |
63% (57%, 70%) |
47% (40%, 54%) |
60% (53%, 66%) |
||
| EASI-90a | 8% | 53% | 66% | 5% | 42% | 58% |
| PBO와의 차이 (95% CI) | 45% (39%, 52%) |
58% (51%, 64%) |
37% (31%, 43%) |
53% (47%, 59%) |
||
| EASI-100a | 2% | 17% | 27% | 1% | 14% | 19% |
| PBO 대비 차이 (95% CI) |
15% (10%, 20%) |
25% (20%, 31%) |
13% (9%, 18%) |
18% (13%, 23%) |
||
| 기준 Worst Pruritus NRS 점수가 ≥ 4인 환자 수 | 272 | 274 | 280 | 274 | 270 | 280 |
| Worst Pruritus NRS에서 ≥ 4점 개선c | 12% | 52% | 60% | 9% | 42% | 60% |
| PBO 대비 차이 (95% CI) |
40% (33%, 48%) |
48% (41%, 55%) |
33% (26%, 39%) |
50% (44%, 57%) |
||
| 기준 ADerm-SS Skin Pain NRS 점수가 ≥ 4인 환자 수 | 233 | 237 | 249 | 247 | 237 | 238 |
| ADerm-SS Skin Pain NRS에서 ≥ 4점 개선d | 15% | 54% | 63% | 13% | 49% | 65% |
| PBO 대비 차이 (95% CI) |
39% (31%, 47%) |
49% (41%, 56%) |
36% (28%, 43%) |
52% (44%, 59%) |
||
| 약어: ADerm-SS = 아토피 피부염 증상 점수 척도, PBO = 위약 a 무작위 배정된 환자 수 기준 b 반응자는 0-4 순서형 척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다. c 기준 Worst Pruritus NRS가 ≥ 4인 환자 수 기준 d 기준 ADerm-SS Skin Pain NRS가 ≥ 4인 환자 수 기준 |
||||||
그림 3. 단독 요법 임상 시험에서 최악의 가려움증 NRS에서 ≥4점 개선을 보인 중등도에서 중증 AD 환자 비율

연령, 성별, 인종, 체중, 이전의 면역억제제를 사용한 전신 치료에 대한 조사에서 AD-1 및 AD-2 임상 시험의 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 확인되지 않았습니다.
병용 TCS 임상 시험(AD-3)
병용 TCS를 사용한 RINVOQ 임상 시험(AD-3)의 결과는 표 20에 나와 있습니다. 그림 4는 AD-3 임상 시험에서 1주, 4주 및 16주차에 최악의 가려움증 NRS에서 ≥4점 개선을 보인 환자의 비율을 보여줍니다.
| AD-3 임상 시험 | |||
| PBO + TCS | RINVOQ 15 mg + TCS |
RINVOQ 30 mg + TCS |
|
| 무작위 배정된 환자 수 |
304 | 300 | 297 |
| vIGA-AD 0/1a,b | 11% | 40% | 59% |
| PBO와의 차이(95% CI) | 29% (22%, 35%) |
48% (41%, 54%) |
|
| EASI-75a, | 26% | 65% | 77% |
| PBO와의 차이(95% CI) | 38% (31%, 45%) |
51% (44%, 57%) |
|
| EASI-90a | 13% | 43% | 63% |
| PBO와의 차이(95% CI) | 30% (23%, 36%) |
50% (43%, 56%) |
|
| EASI-100a | 1% | 12% | 23% |
| PBO와의 차이(95% CI) | 11% (7%, 14%) |
21% (16%, 26%) |
|
| 기준 최악의 가려움증 NRS 점수가 ≥ 4인 환자 수 | 294 | 288 | 291 |
| 최악의 가려움증 NRS에서 ≥4점 개선c | 15% | 52% | 64% |
| PBO와의 차이(95% CI) | 37% (30%, 44%) |
49% (42%, 56%) |
|
| 약어: PBO = 위약 a 무작위 배정된 환자 수 기준 b 반응자는 0-4순위 척도에서 ≥2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다. c 기준 최악의 가려움증 NRS가 ≥4인 환자 수 기준 |
|||
그림 4. 병용 TCS 임상시험에서 최악의 Pruritus NRS에서 ≥4점 개선된 중등도에서 중증 AD 환자의 비율

연령, 성별, 인종, 체중 및 이전 면역억제제를 사용한 전신 치료에 대한 조사에서 AD-3 임상시험의 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 확인되지 않았습니다.
소아 환자 모집단
12세 이상 소아 환자를 대상으로 한 RINVOQ 단독 요법 임상시험(AD-1 및 AD-2)과 RINVOQ 병용 TCS 임상시험(AD-3)의 16주차 효능 결과는 각각 표 21과 표 22에 나와 있습니다.
| AD-1 임상시험 | AD-2 임상시험 | |||||
| PBO | RINVOQ 15 mg |
RINVOQ 30 mg |
PBO | RINVOQ 15 mg |
RINVOQ 30 mg |
|
| 무작위 배정된 소아 환자 수 | 40 | 42 | 42 | 36 | 33 | 35 |
| vIGA-AD 0/1a,b | 8% | 38% | 69% | 3% | 42% | 62% |
| PBO와의 차이 (95% CI) |
31% (14%, 47%) |
62% (45%, 78%) |
40% (22%, 57%) |
60% (42%, 77%) |
||
| EASI-75a | 8% | 71% | 83% | 14% | 67% | 74% |
| PBO와의 차이 (95% CI) |
63% (47%, 79%) |
75% (61%, 89%) |
53% (33%, 72%) |
61% (42%, 79%) |
||
| 기준 최악의 Pruritus NRS 점수가 ≥ 4인 소아 환자 수 | 39 | 40 | 42 | 36 | 30 | 34 |
| 최악의 Pruritus NRS에서 ≥ 4점 개선c | 15% | 45% | 55% | 3% | 33% | 50% |
| PBO와의 차이 (95% CI) |
30% (10%, 49%) |
39% (21%, 58%) |
31% (13%, 48%) |
47% (30%, 65%) |
||
| 약어: PBO = 위약 a 무작위 배정된 소아 환자 수 기준 b 반응자는 0-4순서척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다. c 기준 최악의 Pruritus NRS가 ≥ 4인 소아 환자 수 기준 |
||||||
| 시험 AD-3 | |||
| PBO + TCS | RINVOQ 15 mg + TCS |
RINVOQ 30 mg + TCS |
|
| 무작위 배정된 소아 환자 수 | 40 | 39 | 37 |
| vIGA-AD 0/1a,b | 8% | 31% | 65% |
| PBO와의 차이 (95% CI) |
23% (7%, 40%) |
57% (40%, 75%) |
|
| EASI-75a | 30% | 56% | 76% |
| PBO와의 차이 (95% CI) |
26% (5%, 47%) |
46% (26%, 65%) |
|
| 기준선 최악의 가려움증 NRS 점수가 ≥ 4인 소아 환자 수 | 38 | 36 | 33 |
| 최악의 가려움증 NRS에서 ≥ 4점 개선c | 13% | 42% | 55% |
| PBO와의 차이 (95% CI) |
29% (9%, 48%) |
41% (21%, 61%) |
|
| 약어: PBO = 위약 a 무작위 배정된 소아 환자 수 기준 b 반응자는 0-4 순서척도에서 ≥ 2점 감소하여 vIGA-AD 0 또는 1(“깨끗함” 또는 “거의 깨끗함”)인 환자로 정의되었습니다. c 기준선 최악의 가려움증 NRS가 ≥ 4인 소아 환자 수 기준 |
|||
14.4 궤양성 대장염
유도 연구(UC-1 연구 및 UC-2 연구)
두 건의 동일한 유도 연구(UC-1, NCT02819635 및 UC-2, NCT03653026)에서 환자들을 2:1의 비율로 무작위 배정하여 RINVOQ 45mg을 1일 1회 또는 위약을 8주 동안 투여받도록 했습니다. 두 연구에 걸쳐 총 988명의 환자를 분석했습니다. 이러한 연구에는 경도에서 중증도의 활동성 궤양성 대장염 환자 중 경구용 아미노살리실산염, 코르티코스테로이드, 면역억제제 및/또는 생물학적 제제에 대한 반응이 불충분하거나, 반응이 소실되었거나, 또는 내약성이 없는 성인 환자가 포함되었습니다. 등록된 환자는 안정적인 용량의 경구용 아미노살리실산염, 메토트렉세이트, 궤양성 대장염 관련 항생제 및/또는 경구용 코르티코스테로이드(프레드니손 30mg/일 이하 또는 이에 상응하는 용량)를 사용할 수 있었습니다. 베이스라인에서 환자의 38%는 코르티코스테로이드를 투여받고 있었고, 68%는 아미노살리실산염을 투여받고 있었습니다. 병용 생물학적 제제, 아자티오프린, 6-머캅토퓨린, 정맥 내 또는 직장 코르티코스테로이드는 금지되었습니다. 환자의 총 51%가 이전에 하나 이상의 생물학적 제제로 치료를 받았으나 실패했거나 내약성이 없는 것으로 나타났습니다. RINVOQ는 하나 이상의 TNF 차단제에 대한 반응이 불충분하거나 내약성이 없는 환자에게 사용하도록 승인되었습니다[사용상의 주의사항 및 적용 환자(1.4) 참조].
질병 활성도는 수정된 Mayo 점수(mMS)를 사용하여 평가했습니다. mMS는 3가지 요소로 구성된 Mayo 점수(0~9점)로, 배변 횟수(SFS), 직장 출혈(RBS), 중앙 판독 내시경 검사 점수(ES)(각 하위 점수는 0~3점)의 하위 점수로 구성됩니다. ES 2점은 현저한 홍반, 혈관 패턴 부족, 취약성 및/또는 미란으로 정의되었으며, 3점은 자발적 출혈 및 궤양으로 정의되었습니다. 등록된 환자의 mMS는 5~9점이었고 ES는 2~3점이었습니다. 베이스라인에서 mMS 중앙값은 7점이었고, 환자의 61%는 베이스라인 mMS가 5~7점이었고 39%는 8~9점이었습니다.
베이스라인에서 UC-1 및 UC-2에서 각각 환자의 39% 및 37%가 코르티코스테로이드를 투여받았고, 1% 및 1%가 메토트렉세이트를 투여받았으며, 68% 및 69%가 아미노살리실산염을 투여받았습니다. UC-1 및 UC-2에서 환자 질병 활성도는 각각 61% 및 60%의 환자에서 중등도(mMS ≤7)였고 39% 및 40%의 환자에서 중증(mMS >7)이었습니다.
1차 평가변수는 8주차에 mMS를 사용하여 정의된 임상적 관해였습니다. 2차 평가변수에는 임상 반응, 내시경적 개선 및 조직학적 내시경적 점막 개선이 포함되었습니다(표 23 및 표 24 참조).
| UC-1 연구 | |||
| 평가변수 | 위약 | RINVOQ 45mg 1일 1회 |
위약 대비 치료 차이 (95% CI) |
| 임상적 관해a | |||
| 전체 환자군 | N=154 5% |
N=319 26% |
22%b (16, 27) |
| 과거 생물학적 제제 치료 실패c | N=78 < 1% |
N=168 18% |
|
| 과거 생물학적 제제 치료 실패 없음 | N=76 9% |
N=151 35% |
|
| 임상 반응d | |||
| 전체 환자군 | N=154 27% |
N=319 73% |
46%b (38, 54) |
| 과거 생물학적 제제 치료 실패c | N=78 13% |
N=168 64% |
|
| 과거 생물학적 제제 치료 실패 없음 | N=76 42% |
N=151 82% |
|
| 내시경적 개선e | |||
| 전체 환자군 | N=154 7% |
N=319 36% |
29%b (23, 36) |
| 과거 생물학적 제제 치료 실패c | N=78 2% |
N=168 27% |
|
| 과거 생물학적 제제 치료 실패 없음 | N=76 13% |
N=151 47% |
|
| 조직학적 내시경적 점막 개선f | |||
| 전체 환자군 | N=154 7% |
N=319 30% |
24%b (17, 30) |
| Prior biologic failurec | N=78 1% |
N=168 23% |
|
| 이전 생물학적제제 실패 경험 없음 | N=76 12% |
N=151 38% |
|
| a mMS 기준: SFS ≤1 및 기준치 이하, RBS = 0, 취약성 없는 ES ≤ 1 b p <0.001, 무작위 배정 계층화 요인에 따라 Cochran-Mantel-Haenszel 방법으로 조정된 조정 치료 차이(95% CI) c 이전 생물학적제제 실패에는 궤양성 대장염에 대한 하나 이상의 생물학적 치료에 대한 불충분한 반응, 반응 소실 또는 불내성이 포함됩니다. d mMS 기준: 기준치에서 ≥ 2점 및 ≥ 30% 감소, 기준치에서 RBS ≥ 1 감소 또는 절대 RBS ≤1 e 취약성 없는 ES ≤ 1 f 취약성 없는 ES ≤1 및 Geboes 점수 ≤ 3.1(음와의 <5%에서 호중구 침윤을 나타내며 음와 파괴, 미란, 궤양 또는 육아 조직 없음) |
|||
| 연구 UC-2 | |||
| 평가변수 | 위약 | RINVOQ 45mg 1일 1회 |
위약 대비 치료 차이 (95% CI) |
| 임상적 관해a | |||
| 전체 모집단 | N=174 4% |
N=341 33% |
29%b (23, 35) |
| 이전 생물학적제제 실패c | N=89 2% |
N=173 30% |
|
| 이전 생물학적제제 실패 없음 | N=85 6% |
N=168 38% |
|
| 임상적 반응d | |||
| 전체 모집단 | N=174 25% |
N=341 74% |
49%b (42, 57) |
| 이전 생물학적제제 실패c | N=89 19% |
N=173 69% |
|
| 이전 생물학적제제 실패 없음 | N=85 32% |
N=168 80% |
|
| 내시경적 개선e | |||
| 전체 모집단 | N=174 8% |
N=341 44% |
35%b (29, 42) |
| 이전 생물학적제제 실패c | N=89 5% |
N=173 37% |
|
| 이전 생물학적제제 실패 없음 | N=85 12% |
N=168 51% |
|
| 조직학적 내시경적 점막 개선f | |||
| 전체 모집단 | N=174 6% |
N=341 37% |
30%b (24, 36) |
| 이전 생물학적제제 실패c | N=89 5% |
N=173 31% |
|
| 이전 생물학적제제 실패 없음 | N=85 7% |
N=168 43% |
|
| a mMS 기준: SFS ≤ 1 및 기준치보다 높지 않음, RBS = 0, 취약성 없는 ES ≤ 1 b p <0.001, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI) c 이전 생물학적제제 실패에는 궤양성 대장염에 대한 하나 이상의 생물학적 치료에 대한 불충분한 반응, 반응 손실 또는 불내성이 포함됩니다. d mMS 기준: 기준치에서 ≥ 2점 및 ≥ 30% 감소, 기준치에서 RBS ≥ 1 감소 또는 절대 RBS ≤1 e 취약성 없는 ES ≤ 1 f 취약성 없는 ES ≤1 및 Geboes 점수 ≤ 3.1(crypt의 <5%에서 호중구 침윤을 나타내며, crypt 파괴, 미란, 궤양 또는 육아 조직 없음) |
|||
UC-1 연구와 UC-2 연구는 8주차에 내시경적 점막 개선과 질병 진행 및 장기 결과와의 관계를 평가하도록 설계되지 않았습니다.
직장 출혈 및 배변 빈도 하위 점수
임상 반응의 시작은 SFS 및 RBS(부분 수정 메이요 점수[pmMS])를 사용하여 평가했습니다. 초기 반응은 pmMS에서 기준치보다 ≥1점 및 ≥30% 감소하고 RBS에서 ≥1 감소 또는 절대 RBS≤1로 정의했습니다. 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자에게서 2주차에 반응이 나타났습니다.
내시경적 및 조직학적 평가
점막의 내시경적 모양 정상화(내시경적 관해)는 0의 ES로 정의했습니다. 8주차에 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 내시경적 관해를 달성했습니다(UC-1: 14% 대 1%, UC-2: 18% 대 2%). 8주차에 위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 Geboes 조직학적 점수 < 2.0(crypt 또는 lamina propria에 호중구가 없고 호산구 증가가 없으며 crypt 파괴가 없으며 미란, 궤양 또는 육아 조직이 없는 것을 나타냄)으로 내시경적 관해를 달성했습니다(UC-1: 11% 대 1%, UC-2: 13% 대 2%).
복통 및 배변 긴박감
위약군에 비해 RINVOQ 45mg을 1일 1회 투여받은 환자군에서 더 많은 비율의 환자가 8주차에 복통이 없었고(UC-1: 47% 대 23%, UC-2: 54% 대 24%), 배변 긴박감이 없었습니다(UC-1: 48% 대 21%, UC-2: 54% 대 26%).
피로
UC-1 연구와 UC-2 연구에서 RINVOQ를 투여받은 환자는 위약 투여 환자에 비해 8주차에 FACIT-F 점수의 기준치 대비 변화로 평가한 피로가 임상적으로 유의미하게 개선되었습니다. 8주 유도 후 피로 개선에 대한 RINVOQ의 효과는 확립되지 않았습니다.
유지 관리 연구 UC-3
UC-3(NCT02819635)에서 UC-1, UC-2 또는 UC-4에서 RINVOQ 45mg을 1일 1회 투여받고 임상 반응을 달성한 총 451명의 환자를 최대 52주 동안 RINVOQ 15mg, 30mg 또는 위약을 1일 1회 투여받도록 무작위 배정했습니다.
1차 평가 변수는 52주차에 mMS를 사용하여 정의한 임상적 관해였습니다. 2차 평가 변수에는 코르티코스테로이드 없이 임상적 관해, 내시경적 개선 및 조직학적 내시경적 점막 개선이 포함되었습니다(표 25 참조).
| 평가 변수 | 위약 |
RINVOQ 15mg 1일 1회 |
치료 차이 15mg 대 위약 (95% CI) |
RINVOQ 30mg 1일 1회 |
30mg 대 위약 치료 차이 (95% CI) |
| 임상적 관해a | |||||
| 전체 모집단 | N=149 12% |
N=148 42% |
31%b (22, 40) |
N=154 52% |
39%b (30, 48) |
| 이전 생물학적제제 실패c | N=81 7% |
N=71 41% |
N=73 49% |
||
| 이전 생물학적제제 실패 없음 | N=68 18% |
N=77 44% |
N=81 54% |
||
| 코르티코스테로이드 없이 임상적 관해d | |||||
| 전체 모집단 | N=54 22% |
N=47 57% |
35%b (18, 53) |
N=58 68% |
45%b (29, 62) |
| 이전 생물학적제제 실패c | N=22 14% |
N=17 71% |
N=20 73% |
||
| 이전 생물학적제제 실패 없음 | N=32 28% |
N=30 49% |
N=38 65% |
||
| 내시경적 개선e | |||||
| 전체 모집단 | N=149 14% |
N=148 49% |
34%b (25, 44) |
N=154 62% |
46%b (37, 56) |
| Prior biologic failurec | N=81 8% |
N=71 43% |
N=73 56% |
||
| 사전 생물학적 제제 치료 실패 경험 없음 | N=68 22% |
N=77 54% |
N=81 67% |
||
| 조직학적 내시경적 점막 개선f | |||||
| 전체 모집단 | N=149 12% |
N=148 35% |
24%b (15, 33) |
N=154 50% |
37%b (28, 47) |
| Prior biologic failurec | N=81 5% |
N=71 33% |
N=73 48% |
||
| 사전 생물학적 제제 치료 실패 경험 없음 | N=68 20% |
N=77 37% |
N=81 52% |
||
| a mMS 기준: SFS ≤1 및 기준치 이하, RBS = 0, ES ≤1(취약성 없음) b p <0.001, 무작위 배정 층화 요인에 대해 보정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 보정된 치료 차이(95% CI) c Prior biologic failure includes inadequate response, loss of response, or intolerance to one or more biologic treatments for ulcerative colitis. d 유도 치료 종료 시 임상적 관해를 달성한 환자 중 52주차에 mMS 기준으로 임상적 관해를 보이고 52주차 이전에 ≥90일 동안 코르티코스테로이드를 사용하지 않은 경우 e ES ≤ 1(취약성 없음) f ES ≤1(취약성 없음) 및 Geboes 점수 ≤ 3.1(<5%의 crypt에서 호중구 침윤을 나타내고, crypt 파괴가 없으며, 미란, 궤양 또는 육아 조직이 없음) |
|||||
52주차의 조직학적 내시경 점막 개선과 52주차 이후의 질병 진행 및 장기 결과 간의 관계는 연구 UC-3에서 평가되지 않았습니다.
내시경 및 조직학적 평가
점막의 내시경적 모양의 정상화(내시경적 관해)는 0의 ES로 정의되었습니다. UC-3에서 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(24% 및 26% 대 6%). 52주차에 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(18% 및 19% 대 5%).
복통 및 배변 긴박감
52주차에 위약에 비해 RINVOQ 15mg 및 30mg을 1일 1회 투여받은 환자의 비율이 더 높았습니다(각각 46%, 55% 및 21%, 각각 56%, 64% 및 17%).
14.5 크론병
유도 연구(연구 CD-1 및 CD-2)
두 번의 유도 연구인 CD-1(NCT03345836)과 CD-2(NCT03345849)에서 환자들은 12주 동안 RINVOQ 45mg 또는 위약을 1일 1회 투여받도록 2:1로 무작위 배정되었습니다. 효능은 기준선 Crohn’s Disease Activity Index(CDAI) 점수가 220점 이상이고 중앙에서 검토한 Crohn’s Disease에 대한 Simple Endoscopic Score(SES-CD)가 6점 이상이거나, 협착 성분을 제외한 고립 장 회장 질환의 경우 4점 이상인 중등도에서 중증의 활동성 크론병(CD) 환자 857명(CD-1에서 419명, CD-2에서 438명)을 대상으로 평가되었습니다. CD-1에서 모든 환자는 하나 이상의 생물학적 요법에 대한 반응이 불충분하거나 내약성이 없었습니다(이전 생물학적 요법 실패). CD-2에서 환자의 45%(197/438)는 하나 이상의 생물학적 요법에 대한 반응이 불충분하거나 내약성이 없었습니다(이전 생물학적 요법 실패). 두 연구에 등록된 환자는 안정적인 용량의 CD 관련 항생제, 아미노살리실산염 또는 메토트렉세이트를 사용할 수 있었습니다. 등록 시 병용 코르티코스테로이드(최대 30mg/일 프레드니손 또는 동등한 용량)가 허용되었으며, 4주차에 감량을 시작했습니다.
CD-1에서 환자의 평균 연령은 37세(범위 18~74세)였으며, 46%는 여성이었고, 72%는 백인, 21%는 아시아인, 6%는 흑인 또는 아프리카계 미국인, 0.5%는 아메리카 인디언 또는 알래스카 원주민, 0.5%는 여러 인종 집단으로 확인되었습니다. CD-2에서 환자의 평균 연령은 40세(범위 18~74세)였으며, 45%는 여성이었고, 74%는 백인, 20%는 아시아인, 4%는 흑인 또는 아프리카계 미국인, 2%는 여러 인종 집단으로 확인되었습니다.
기준선에서 CD-1과 CD-2에서 각각 환자의 36%와 37%는 코르티코스테로이드를, 7%와 3%는 메토트렉세이트를, 15%와 24%는 아미노살리실산염을, 2%와 1%는 CD 관련 항생제를 투여받았습니다.
공동 1차 평가변수는 12주차에 임상적 관해(CDAI 기준)를 달성한 환자의 비율과 12주차에 내시경적 반응(SES-CD 기준)을 달성한 환자의 비율이었습니다. 2차 효능 평가변수에는 임상적 반응, 코르티코스테로이드 없이 관해, 내시경적 관해가 포함되었습니다(표 26 및 표 27 참조).
| CD-1 | |||
| 평가변수 | 위약 |
RINVOQ 45mg 1일 1회 |
위약 대비 치료 차이 (95% CI) |
| 12주차의 공동 1차 평가변수 | |||
| 임상적 관해a | N=146 18% |
N=273 36% |
17% (9, 25)* |
| 내시경적 반응b | N=146 3% |
N=273 34% |
30% (24, 36)* |
| 12주차의 추가 평가변수 | |||
| 임상적 반응(CR-100)c | N=146 31% |
N=273 54% |
22% (13, 31)* |
| 기준선에서 코르티코스테로이드를 투여받은 환자에서 코르티코스테로이드 없이 임상적 관해a,d | N=53 11% |
N=96 30% |
17% (5, 29)** |
| 내시경적 관해e | N=146 3% |
N=273 19% |
15% (10, 21)* |
| * p < 0.001, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI) ** p < 0.01, 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI) a CDAI < 150 b 유도 연구 기준치에서 SES-CD가 50% 이상 감소(또는 유도 연구 기준치에서 SES-CD가 4인 환자의 경우 유도 연구 기준치에서 최소 2점 감소) c 기준치에서 CDAI가 100점 이상 감소 d 기준치에서 코르티코스테로이드를 투여받은 환자 중 코르티코스테로이드 중단 및 임상적 관해 달성 e SES-CD ≤ 4이고 개별 변수에서 개별 하위 점수가 >1이 아님 |
|||
| CD-2 | |||
| 평가변수 | 위약 |
RINVOQ 45mg 1일 1회 |
위약 대비 치료 차이 (95% CI) |
| 12주차의 공동 1차 평가변수 | |||
| 임상적 관해a | |||
| 전체 환자군 | N=143 23% |
N=295 46% |
24% (15, 32)* |
| 이전 생물학적제제 실패 | N=62 7% |
N=135 42% |
|
| 이전 생물학적제제 비실패 | N=81 35% |
N=160 50% |
|
| 내시경적 반응b | |||
| 전체 환자군 | N=143 13% |
N=295 46% |
33% (26, 41)* |
| 이전 생물학적제제 실패 | N=62 10% |
N=135 39% |
|
| 이전 생물학적제제 비실패 | N=81 15% |
N=160 51% |
|
| 12주차의 추가 평가변수 | |||
| 임상적 반응(CR-100)c | |||
| 전체 환자군 | N=143 40% |
N=295 64% |
24% (15, 33)* |
| 이전 생물학적제제 실패 | N=62 25% |
N=135 66% |
|
| 이전 생물학적제제 비실패 | N=81 52% |
N=160 62% |
|
| 기준 시점에서 CS를 투여받은 환자에서 코르티코스테로이드 무사용 임상적 관해a,d | |||
| 전체 환자군 | N=54 13% |
N=108 40% |
27% (14, 39)* |
| 이전 생물학적제제 실패 | N=29 7% |
N=60 35% |
|
| 이전 생물학적제제 비실패 | N=25 20% |
N=48 46% |
|
| 내시경적 관해e |
|||
| 전체 환자군 | N=143 8% |
N=295 30% |
22% (16, 29)* |
| 이전 생물학적제제 실패 | N=62 3% |
N=135 22% |
|
| 이전 생물학적제제 비실패 | N=81 11% |
N=160 37% |
|
| * p < 0.001, 무작위 배정 계층화 요인에 따라 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI) a CDAI < 150 b 유도 연구 기준 시점 대비 SES-CD 50% 이상 감소(또는 유도 연구 기준 시점에서 SES-CD가 4인 환자의 경우 유도 연구 기준 시점 대비 최소 2점 감소) c 기준 시점 대비 CDAI 100점 이상 감소 d 기준 시점에서 코르티코스테로이드를 투여받은 환자 중 코르티코스테로이드 중단 및 임상적 관해 달성 e SES-CD ≤ 4이며 개별 변수에서 개별 하위 점수가 >1이 아님 |
|||
CD-1 연구와 CD-2 연구에서 CDAI를 기준으로 한 임상 반응은 2주 만에 나타났으며, 2주차에 임상 반응을 보인 환자 비율은 위약군보다 RINVOQ 치료군에서 더 높았습니다.
CD-1 연구와 CD-2 연구에서 12주차에 배변 횟수와 복통이 감소한 환자 비율은 위약군보다 RINVOQ 45mg 유도 요법 치료군에서 더 높았습니다.
CD-1 연구와 CD-2 연구에서 RINVOQ 치료를 받은 환자는 12주차에 FACIT-F 점수의 기준치 대비 변화로 평가한 피로도에서 위약 치료를 받은 환자에 비해 임상적으로 유의미한 개선을 경험했습니다. 12주간의 유도 후 피로도를 개선하는 RINVOQ의 효과는 확립되지 않았습니다.
유지 관리 연구(CD-3)
CD-3(NCT03345823)에 대한 효능 분석에서는 12주 동안 RINVOQ 45mg 1일 1회 유도 치료에 반응을 보인 343명의 환자를 평가했습니다. 환자들은 총 64주 이상의 치료 기간을 나타내는 52주 동안 RINVOQ 15mg 또는 30mg 1일 1회 유지 관리 요법이나 위약을 무작위로 배정받았습니다.
임상적 관해(CDAI 기준) 및 내시경적 반응(SES-CD 기준)의 공동 1차 평가변수는 52주차에 평가했습니다. 2차 효능 평가변수에는 52주차에 코르티코스테로이드를 사용하지 않은 임상적 관해, 임상적 관해 유지, 내시경적 관해, 임상적 관해와 내시경적 관해 동시 달성이 포함되었습니다(표 28 참조).
| 평가변수 |
위약+ | RINVOQ 15mg 1일 1회 |
RINVOQ 30mg 1일 1회 |
치료 차이 15mg 대 위약 (95% CI) |
치료 차이 30mg 대 위약 (95% CI) |
| 공동 1차 평가변수 | |||||
| 임상적 관해a | |||||
| 전체 환자군 | N=111 14% |
N=113 42% |
N=119 55% |
29% (18, 39)* |
40% (29, 51)* |
| 이전 생물학적제제 실패 | N=87 13% |
N=85 35% |
N=90 54% |
||
| 이전 생물학적제제 실패 없음 |
N=24 21% |
N=28 61% |
N=29 55% |
||
| 내시경적 반응b | |||||
| 전체 환자군 | N=111 7% |
N=113 28% |
N=119 41% |
22% (13, 32)* |
34% (25, 44)* |
| 이전 생물학적제제 실패 | N=87 5% |
N=85 22% |
N=90 42% |
||
| 이전 생물학적제제 실패 없음 |
N=24 17% |
N=28 45% |
N=29 38% |
||
| 추가 평가변수 | |||||
| 코르티코스테로이드를 사용하지 않은 임상적 관해c |
|||||
| 전체 환자군 | N=111 14% |
N=113 42% |
N=119 53% |
29% (18, 39)* |
38% (27, 49)* |
| 이전 생물학적제제 실패 | N=87 13% |
N=85 35% |
N=90 52% |
||
| 이전 생물학적제제 실패 없음 |
N=24 21% |
N=28 61% |
N=29 55% |
||
| 임상적 관해 유지d | |||||
| 전체 모집단 | N=73 22% |
N=72 51% |
N=79 67% |
32% (18, 46)* |
43% (29, 57)* |
| 이전 생물학적제제 실패 | N=56 20% |
N=50 46% |
N=55 69% |
||
| 이전 생물학적제제 실패 없음 |
N=17 29% |
N=22 64% |
N=24 63% |
||
| 내시경적 관해e | |||||
| 전체 모집단 | N=111 5% |
N=113 19% |
N=119 30% |
14% (6, 22)* |
25% (15, 34)* |
| 이전 생물학적제제 실패 | N=87 3% |
N=85 14% |
N=90 30% |
||
| 이전 생물학적제제 실패 없음 |
N=24 13% |
N=28 32% |
N=29 31% |
||
| 임상적 및 내시경적 관해 | |||||
| 전체 모집단 | N=111 4% |
N=113 16% |
N=119 26% |
13% (6, 21)* |
22% (14, 31)* |
| 이전 생물학적제제 실패 | N=87 2% |
N=85 13% |
N=90 26% |
||
| 이전 생물학적제제 실패 없음 |
N=24 8% |
N=28 25% |
N=29 28% |
||
| + 위약군은 유도 연구 종료 시점에 RINVOQ 45mg으로 CDAI에 따라 임상 반응을 달성하고 유지 요법 시작 시 위약을 투여받도록 무작위 배정된 환자로 구성되었습니다. * p < 0.001, 무작위 배정 계층화 요인에 따라 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이(95% CI) a CDAI < 150 b 유도 연구 기준치에서 SES-CD가 50% 이상 감소(또는 유도 연구 기준치에서 SES-CD가 4인 환자의 경우 유도 연구 기준치에서 최소 2점 감소) c 52주차까지 90일 동안 코르티코스테로이드를 투여하지 않고 임상적 관해를 달성했습니다. 유도 기준치에서 코르티코스테로이드를 투여받은 환자 하위 집단 중 RINVOQ 15mg군의 48%(N=44), RINVOQ 30mg군의 44%(N=45), 위약군의 7%(N=46)가 52주차까지 90일 동안 코르티코스테로이드를 투여하지 않고 임상적 관해를 달성했습니다. d 유지 연구 참여 시점에 임상적 관해를 달성한 환자에서 52주차에 임상적 관해를 달성한 것으로 정의됩니다. e SES-CD ≤ 4이고 개별 변수에서 점수가 1점을 초과하는 하위 점수 없음 |
|||||
52주차에 RINVOQ 15mg 및 30mg으로 치료받은 환자에서 위약군에 비해 설사 빈도 및 복통 감소가 더 많이 관찰되었습니다.
14.6 강직성 척추염
Bath 강직성 척추염 질병 활성도 지수(BASDAI) ≥4 및 환자의 총 요통 점수 ≥4를 기준으로 활동성 강직성 척추염 환자 18세 이상을 대상으로 한 두 건의 무작위배정, 이중맹검, 다기관, 위약 대조 임상시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다.
AS-I 임상시험(NCT03178487)은 최소 2가지 비스테로이드성 항염증제(NSAID)에 대해 불충분한 반응을 보였거나 NSAID에 대한 내약성이 없거나 금기인 187명의 강직성 척추염 환자를 대상으로 한 14주간의 임상시험이었으며, 이전에 생물학적 DMARD에 노출된 적이 없었습니다. 기준선에서 환자들은 평균 14.4년 동안 강직성 척추염 증상이 있었고, 약 16%의 환자가 병용 cDMARD를 투여받고 있었습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 14주차에 위약군에 무작위 배정된 모든 환자는 RINVOQ 15mg 1일 1회로 전환되었습니다. 1차 평가변수는 14주차에 SpondyloArthritis international Society 40(ASAS40) 반응을 달성한 환자의 비율이었습니다.
AS-II 임상시험(NCT 04169373)은 1~2가지 생물학적 DMARD에 대해 불충분한 반응을 보인 420명의 강직성 척추염 환자를 대상으로 한 14주간의 임상시험이었습니다. 기준선에서 환자들은 평균 12.8년 동안 강직성 척추염 증상이 있었고, 약 31%의 환자가 병용 cDMARD를 투여받고 있었습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 14주차에 위약군에 무작위 배정된 모든 환자는 RINVOQ 15mg 1일 1회로 전환되었습니다. 1차 평가변수는 14주차에 SpondyloArthritis international Society 40(ASAS40) 반응을 달성한 환자의 비율이었습니다.
임상 반응
두 임상시험 모두에서 14주차에 RINVOQ 15mg으로 치료받은 환자의 유의하게 더 많은 비율이 위약군에 비해 ASAS40 반응을 달성했습니다(표 29, 그림 5).
성별, 기준선 체질량 지수(BMI) 및 기준선 hsCRP 검사에서 14주차에 이러한 하위 그룹 간의 RINVOQ에 대한 반응 차이가 확인되지 않았습니다.
| AS-I 임상시험 bDMARD-naïve |
AS-II 임상시험 bDMARD-IR |
|||||
| PBO (N=94) |
RINVOQ 15mg (N=93) |
PBO 대비 차이 (95% CI) |
PBO (N=209) |
RINVOQ 15mg (N=211) |
PBO 대비 차이 (95% CI) |
|
| ASAS40a (%) | 25.5 | 50.5 | 25 (12, 38) | 18.2 | 44.5 | 26 (18, 35) |
| ASAS20a (%) | 39.4 | 63.4 | 24 (10, 38) | 38.3 | 65.4 | 27 (18, 36) |
| 약어: ASAS20(또는 40) = SpondyloArthritis international Society ≥20%(또는 ≥40%) 개선; bDMARD = 생물학적 질병 조절 항류마티스제; IR = 불충분한 반응자; PBO = 위약 a ASAS20(ASAS40) 반응은 4개 영역(환자 전반, 총 요통, 기능 및 염증) 중 ≥3개에서 ≥20%(≥40%) 개선 및 기준선 대비 ≥1(≥2) 단위(범위 0~10)의 절대적 개선으로 정의되며, 잠재적으로 남아 있는 영역(ASAS20의 경우 ≥20% 및 ≥1 단위 악화로 정의되거나 ASAS40의 경우 > 0 단위 악화로 정의됨)에서 악화가 없습니다. 이분형 평가변수의 경우 14주차 결과는 무반응자 대체(AS-I 임상시험) 및 다중 대체와 함께 무반응자 대체(AS-II 임상시험)를 기반으로 합니다. |
||||||
RINVOQ 15mg 치료는 위약 대비 ASAS40 반응 기준의 개별 구성 요소에서 개선을 보였습니다(표 30).
| 시험 AS-I bDMARD-naïve |
시험 AS-II bDMARD-IR |
|||
| 치료군 | PBO | RINVOQ 15 mg |
PBO | RINVOQ 15 mg |
| N | 94 | 93 | 209 | 211 |
| 환자의 질병 활성도에 대한 전반적 평가b | ||||
| 기준선 | 6.8 (1.66) | 6.6 (1.81) | 7.2 (1.40) | 7.4 (1.48) |
| 14주차 | 5.4 (1.97) | 3.8 (2.44) | 5.9 (2.13) | 4.3 (2.36) |
| 총 요통b | ||||
| 기준선 | 6.7 (1.78) | 6.8 (1.77) | 7.4 (1.43) | 7.5 (1.48) |
| 14주차 | 5.0 (2.27) | 3.7 (2.39) | 5.9 (2.09) | 4.4 (2.48) |
| BASFIb | ||||
| 기준선 | 5.54 (2.17) | 5.35 (2.36) | 6.18 (1.87) | 6.28 (2.03) |
| 14주차 | 4.21 (2.26) | 3.14 (2.37) | 5.09 (2.21) | 3.98 (2.45) |
| 염증c | ||||
| 기준선 | 6.66 (1.90) | 6.51 (1.99) | 6.75 (1.55) | 6.88 (1.84) |
| 14주차 | 4.61 (2.13) | 3.40 (2.16) | 5.11 (2.30) | 3.87 (2.50) |
| hsCRP (mg/L) | ||||
| 기준선 | 11.02 (10.85) | 8.90 (12.42) | 14.71 (17.54) | 15.30 (20.53) |
| 14주차 | 11.72 (15.93) | 2.23 (3.56) | 15.31 (17.55) | 3.82 (8.26) |
| 약어: ASAS = Assessment of SpondyloArthritis international Society; BASFI = Bath Ankylosing Spondylitis Functional Index; bDMARD = biologic disease modifying anti-rheumatic drug; hsCRP = high sensitivity C-reactive protein; IR = inadequate responder; PBO = placebo; BASDAI = Bath Ankylosing Spondylitis Disease Activity Index 결과는 기준선 관찰이 있는 환자의 관찰된 데이터를 기반으로 합니다. a 표시된 데이터는 평균(표준 편차)입니다. b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악 c 아침 강직의 심각도 및 지속 시간을 평가하는 BASDAI 질문 5 및 6의 평균: 0 = 최상, 10 = 최악 |
||||
그림 5. AS-II* 임상시험에서 ASAS40에 도달한 환자의 비율
*결과는 다중 대체와 함께 무반응자 대체를 기반으로 합니다.
기타 건강 관련 결과
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 환자는 14주차에 위약과 비교하여 강직성 척추염 삶의 질(ASQoL)로 측정했을 때 건강 관련 삶의 질이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 ASQoL의 개선이 관찰되었습니다.
관절염
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 기존 관절염이 있는 환자는 14주차에 마스트리흐트 강직성 척추염 관절염 점수(MASES)의 기준치 대비 변화로 측정했을 때 위약과 비교하여 관절염이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 MASES의 개선이 관찰되었습니다.
척추 이동성
AS-II 임상시험에서 RINVOQ 15mg으로 치료받은 환자는 14주차에 바스 강직성 척추염 계측 지수(BASMI)의 기준치 대비 변화로 측정했을 때 위약과 비교하여 척추 이동성이 유의미하게 개선되었습니다. AS-I 임상시험에서도 위약과 비교하여 BASMI의 개선이 관찰되었습니다.
14.7 방사선 비투과성 축성 척추관절염
활동성 방사선 비투과성 축성 척추관절염이 있는 18세 이상의 환자를 대상으로 한 무작위, 이중맹검, 다기관, 위약 대조 임상시험에서 RINVOQ 15mg 1일 1회의 유효성 및 안전성을 평가했습니다. nr-axSpA 임상시험(NCT04169373)은 최소 2개의 비스테로이드성 항염증제(NSAID)에 대한 반응이 불충분하거나 NSAID에 대한 불내성 또는 금기증이 있는 활동성 방사선 비투과성 축성 척추관절염 환자 314명(이 중 313명이 연구 치료를 받음)을 대상으로 한 52주간의 위약 대조 임상시험이었습니다. 환자는 C-반응성 단백질(CRP) 상승(정상 상한 >으로 정의), 자기공명영상(MRI)에서 천장관절염으로 나타나는 객관적인 염증 징후가 있어야 하며, 천장관절에 대한 명확한 방사선학적 구조적 손상 증거가 없어야 합니다. 환자는 스크리닝 및 기준선 방문 시 바스 강직성 척추염 질병 활동 지수(BASDAI) ≥4 및 0~10점 숫자 등급 척도(NRS)를 기준으로 한 환자의 총 요통 평가 점수 ≥ 4로 정의된 활동성 질환이 있어야 했습니다. 기준선에서 환자의 약 29.1%가 병용 cDMARD를 투여받고 있었습니다. 환자의 32.9%는 bDMARD 치료에 대한 반응이 불충분하거나 불내성을 보였습니다. 환자들은 RINVOQ 15mg 1일 1회 또는 위약을 투여받았습니다. 1차 평가변수는 14주차에 척추관절염 국제 학회 40(ASAS40) 반응에 도달한 환자의 비율이었습니다.
임상 반응
nr-axSpA 임상시험에서 14주차에 RINVOQ 15mg으로 치료받은 환자의 상당히 많은 비율이 위약과 비교하여 ASAS40 반응에 도달했습니다(표 31, 그림 6).
성별, 기준선 BMI, 방사선 비투과성 축성 척추관절염 증상 기간, 기준선 hsCRP, MRI 천장관절염 및 이전 bDMARD 사용에 대한 검사 결과 14주차에 이러한 하위 그룹 간에 RINVOQ에 대한 반응의 차이가 나타나지 않았습니다.
| PBO (N=157) |
RINVOQ 15 mg (N=156) |
위약 대비 차이(95% CI) | |
| ASAS40a (%) | 22.3 | 44.9 | 22.5 (12.4, 32.5) |
| ASAS20a (%) | 43.3 | 66.7 | 23.2 (12.6, 33.8) |
| 약어: ASAS20(또는 40) = 척추관절염 국제 학회 ≥20%(또는 ≥40%) 개선; PBO = 위약 a ASAS20(ASAS40) 반응은 4개 영역(환자 전반, 총 요통, 기능 및 염증) 중 ≥3개에서 ≥20%(≥40%) 개선 및 기준치 대비 ≥1(≥2) 단위(범위 0~10)의 절대적 개선으로 정의되며, 잠재적인 나머지 영역에서 악화는 없습니다(ASAS20의 경우 ≥20% 및 ≥1 단위 악화 또는 ASAS40의 경우 > 0 단위 악화로 정의). 이분형 평가변수의 경우 결과는 다중 대체와 함께 무반응자 대체를 기반으로 합니다. |
|||
RINVOQ 15mg 치료는 위약군과 비교하여 ASAS40 반응 기준의 개별 구성 요소에서 개선을 보였습니다(표 32).
| 치료군 | PBO (N=157) |
RINVOQ 15 mg (N=156) |
| 환자의 질병 활성도에 대한 전반적인 평가b | ||
| 기준선 | 7.30 (1.38) | 6.99 (1.62) |
| 14주차 | 5.35 (2.31) | 4.16 (2.38) |
| 총 요통b | ||
| 기준선 | 7.29 (1.39) | 7.23 (1.55) |
| 14주차 | 5.27 (2.36) | 4.29 (2.49) |
| BASFIb | ||
| 기준선 | 5.99 (2.14) | 5.89 (2.08) |
| 14주차 | 4.47 (2.42) | 3.33 (2.39) |
| 염증c | ||
| 기준선 | 6.68 (1.67) | 6.60 (1.83) |
| 14주차 | 4.69 (2.36) | 3.48 (2.51) |
| hsCRP (mg/L) | ||
| 기준선 | 8.75 (12.91) | 9.93 (16.17) |
| 14주차 | 7.25 (10.61) | 2.84 (4.90) |
| 약어: ASAS = 국제 강직성 척추염 평가 학회(Assessment of SpondyloArthritis international Society), BASFI = Bath 강직성 척추염 기능 지수(Bath Ankylosing Spondylitis Functional Index), hsCRP = 고감도 C-반응성 단백질(high sensitivity C-Reactive Protein), PBO = 위약 a 표시된 데이터는 평균(표준 편차)입니다. b 숫자 등급 척도(NRS): 0 = 최상, 10 = 최악 c 아침 скованность 심각도 및 지속 시간을 평가하는 Bath 강직성 척추염 질병 활성도 지수(BASDAI) 질문 5 및 6의 평균: 0 = 최상, 10 = 최악 |
||
그림 6. ASAS40*를 달성한 환자의 비율
*결과는 다중 대입과 함께 비반응자 대입을 기반으로 합니다.
기타 건강 관련 결과
RINVOQ 15mg으로 치료받은 환자는 14주차에 위약군에 비해 강직성 척추염 삶의 질(ASQoL)로 측정한 건강 관련 삶의 질이 크게 개선되었습니다.
14.8 다관절형 소아 특발성 관절염
활동성 다관절형 JIA 소아 환자에서 RINVOQ/RINVOQ LQ의 효능은 류마티스 관절염 환자에서 확립된 RINVOQ의 효능에 대한 노출-매칭 외삽법을 기반으로 합니다. RINVOQ/RINVOQ LQ의 안전성 및 유효성은 또한 활동성 다관절형 JIA(NCT03725007)를 가진 83명의 어린이(2세~<18세)를 대상으로 한 다기관, 공개 라벨, 단일군 연구에서 평가되었습니다. 연구 참여 시 pJIA 환자 아형에는 류마티스 인자 음성 다관절형(68.7%), 류마티스 인자 양성 다관절형(15.7%), 연장된 소수 관절형(13.3%) 및 전신 증상이 없는 전신성 JIA(2.4%)가 포함되었습니다. 모든 환자는 최대 156주 동안 체중에 따라 RINVOQ LQ 또는 RINVOQ 정제 용량을 투여받았습니다. 안정적인 용량의 MTX로 치료받은 환자는 연구에 참여할 수 있었습니다. 연구 중에 MTX 용량 변경이 허용되었습니다. 유효성은 48주까지 지원적 종료점으로 평가되었습니다. 유효성은 일반적으로 류마티스 관절염 환자의 반응과 일치했습니다.
16 공급/보관 및 취급 방법
공급 방법
RINVOQ 지속 방출 정제는 다음과 같이 공급됩니다.
- 15 mg: 보라색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a15’가 새겨져 있습니다.
병에 30정; NDC: 0074-2306-30 - 30 mg: 빨간색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a30’이 새겨져 있습니다.
병에 30정; NDC: 0074-2310-30 - 45 mg: 노란색에서 얼룩진 노란색, 양면 볼록한 타원형, 크기는 14 x 8 mm이고 한쪽에 ‘a45’가 새겨져 있습니다.
병에 28정; NDC: 0074-1043-28
RINVOQ LQ 경구용액은 다음과 같이 공급됩니다.
- 아동용 내성 캡이 있는 HDPE 병에 1 mg/mL 경구용액. 각 병에는 투명하고 무색에서 연한 노란색 용액 180 mL가 들어 있습니다. 병은 1개의 프레스인 병 어댑터와 1개의 10 mL 경구 투여 주사기가 있는 판지 상자에 포장되어 있습니다. NDC: 0074-2320-01
보관 및 취급
RINVOQ 지속 방출 정제
- 2˚C에서 25˚C(36˚F에서 77˚F)에서 보관합니다.
- 습기로부터 보호하기 위해 원래 병에 보관합니다.
RINVOQ LQ 경구용액
- 2°C에서 30°C(36°F에서 86°F) 사이에서 보관합니다.
- 병을 연 후 60일 후에 남은 경구용액을 폐기합니다.
17 환자 상담 정보
환자와 보호자에게 FDA 승인 환자 라벨(약물 안내 및 사용 지침)을 읽도록 알려주십시오.
중증 감염
환자에게 RINVOQ/RINVOQ LQ를 복용하면 감염이 발생할 가능성이 더 높아질 수 있다고 알려주십시오. 치료 중에 감염의 징후나 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오. [경고 및 주의 사항 (5.1)].
환자에게 RINVOQ/RINVOQ LQ를 복용하는 환자의 경우 대상포진 위험이 증가하며, 경우에 따라 심각할 수 있다고 알려주십시오. [경고 및 주의 사항 (5.1)].
악성 종양
환자에게 RINVOQ/RINVOQ LQ는 특정 암의 위험을 증가시킬 수 있으며, RINVOQ/RINVOQ LQ를 사용하는 동안 정기적인 피부 검사를 실시해야 한다고 알려주십시오.
환자에게 햇빛과 자외선에 대한 노출은 보호 의복을 착용하고 광범위 자외선 차단제를 사용하여 제한해야 한다고 알려주십시오. [경고 및 주의 사항 (5.3)].
중대한 심혈관계 사건
환자에게 RINVOQ/RINVOQ LQ는 심근 경색, 뇌졸중 및 심혈관 사망을 포함한 중대한 심혈관계 사건(MACE)의 위험을 증가시킬 수 있다고 알려주십시오. 모든 환자, 특히 현재 또는 과거 흡연자 또는 다른 심혈관 위험 요인이 있는 환자는 심혈관 사건의 징후와 증상이 나타나는지 주의하도록 지시하십시오. [경고 및 주의 사항 (5.4)].
혈전증
환자에게 RINVOQ 임상 시험에서 심부 정맥 혈전증 및 폐색전증 사례가 보고되었다고 알려주십시오. 환자에게 DVT 또는 PE의 징후나 증상이 나타나면 즉시 의료 서비스를 받도록 지시하십시오. [경고 및 주의 사항 (5.5)].
과민 반응
환자에게 알레르기 반응의 징후나 증상이 나타나면 RINVOQ/RINVOQ LQ를 중단하고 즉시 의료 서비스를 받도록 알려주십시오. [경고 및 주의 사항 (5.6)].
위장관 천공
환자에게 RINVOQ 임상 시험에서 위장관 천공이 보고되었으며, 위험 요인으로는 NSAID, 코르티코스테로이드 사용 또는 과민성 대장염 병력이 있다고 알려주십시오. 환자에게 복통, 발열, 오한, 메스꺼움 또는 구토가 새롭게 발생하면 즉시 의료 서비스를 받도록 지시하십시오. [경고 및 주의 사항 (5.7)].
망막 박리
환자에게 RINVOQ 임상 시험에서 망막 박리가 보고되었다고 알려주십시오. 환자에게 RINVOQ/RINVOQ LQ를 투여받는 동안 시력에 갑작스러운 변화가 나타나면 즉시 의료 서비스 제공자에게 알리도록 알려주십시오. [부작용 (6.1)].
실험실 이상
환자에게 RINVOQ/RINVOQ LQ는 특정 실험실 검사에 영향을 미칠 수 있으며, RINVOQ/RINVOQ LQ 치료 전후에 혈액 검사가 필요하다고 알려주십시오. [경고 및 주의 사항 (5.8)].
예방 접종
환자에게 RINVOQ/RINVOQ LQ와 함께 생백신을 사용하지 않도록 알려주십시오. 환자에게 예방 접종을 받기 전에 RINVOQ/RINVOQ LQ를 복용하고 있음을 의료 서비스 제공자에게 알리도록 지시하십시오. [경고 및 주의 사항 (5.10)].
태아 독성
임산부 및 임신 가능성이 있는 여성에게 임신 중 RINVOQ/RINVOQ LQ에 노출되면 태아에게 해를 끼칠 수 있다고 알려주십시오. 여성에게 임신 사실을 알고 있거나 의심되는 경우 의료 서비스 제공자에게 알리도록 알려주십시오. [경고 및 주의 사항 (5.9) 및 특정 인구 집단에서의 사용 (8.1)].
임신 가능성이 있는 여성에게 치료 중 및 RINVOQ/RINVOQ LQ의 마지막 복용 후 4주 동안 효과적인 피임법을 사용해야 한다고 알려주십시오. [특정 인구 집단에서의 사용 (8.3)].
임신 중 RINVOQ/RINVOQ LQ에 노출된 여성에게 임신 결과를 모니터링하는 임신 감시 프로그램이 있다고 알려주십시오. [특정 인구 집단에서의 사용 (8.1)].
수유
여성에게 RINVOQ/RINVOQ LQ로 치료하는 동안 및 마지막 복용 후 6일 동안 모유 수유를 하지 않도록 알려주십시오. [특정 인구 집단에서의 사용 (8.2)].
투여
환자에게 RINVOQ 정제는 RINVOQ LQ와 대체할 수 없다고 알려주십시오. [투여 및 관리 (2.2)].
환자에게 RINVOQ 정제를 씹거나, 부수거나, 분할하지 않도록 알려주십시오. [투여 및 관리 (2.2)].
RINVOQ LQ의 경우 환자와 보호자에게 적절한 준비, 투여, 보관 및 폐기 방법에 대한 사용 지침을 읽고 따르도록 지시하십시오. [투여 및 관리 (2.1)].
환자에게 RINVOQ/RINVOQ LQ로 치료하는 동안 자몽을 함유한 음식이나 음료를 피하도록 알려주십시오. [약물 상호 작용 (7.1)].
변에서 약물 잔여물
환자에게 변이나 장루 배출물에서 약물 잔여물(예: 온전한 RINVOQ 정제 또는 조각)이 반복적으로 발견되면 의료 서비스 제공자에게 알리도록 지시하십시오. [경고 및 주의 사항 (5.11)].
제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
20080260 2024년 4월
약물 안내문
| MEDICATION GUIDE | ||||||
| RINVOQ® (RIN-VOKE) (upadacitinib) extended-release tablets, for oral use |
RINVOQ® LQ (RIN-VOKE EL-CUE) (upadacitinib) oral solution |
|||||
| RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇입니까? RINVOQ/RINVOQ LQ는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다. 1. 심각한 감염. RINVOQ/RINVOQ LQ는 면역 체계에 영향을 미치는 약물입니다. RINVOQ/RINVOQ LQ는 면역 체계가 감염과 싸우는 능력을 떨어뜨릴 수 있습니다. 일부 사람들은 결핵(TB)을 포함하여 RINVOQ를 복용하는 동안 심각한 감염을 겪었으며, 박테리아, 곰팡이 또는 바이러스로 인한 감염은 신체 전체로 퍼질 수 있습니다. 이러한 감염으로 사망한 사람도 있습니다.
|
||||||
|
|
|
||||
2. 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있고 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우 사망 위험 증가. RINVOQ/RINVOQ LQ는 JAK 억제제 약물입니다.
3. 암 및 면역 체계 문제.
RINVOQ/RINVOQ LQ는 면역 체계 작용 방식을 변경하여 특정 암의 위험을 높일 수 있습니다.
림프종 및 피부암을 포함한 다른 암은 RINVOQ/RINVOQ LQ를 복용하는 사람들에게 발생할 수 있습니다. 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 사람들은 특히 현재 또는 과거 흡연자인 경우 림프종 및 폐암을 포함한 특정 암에 걸릴 위험이 더 높습니다.
과거에 어떤 종류의 암에 걸린 적이 있는지 의료 서비스 제공자에게 알리십시오. RINVOQ/RINVOQ LQ 치료 중에 피부암 검사를 받는 것에 대한 의료 서비스 제공자의 조언을 따르십시오. 햇빛에 노출되는 시간을 제한하십시오. 태닝 베드나 선램프 사용을 피하십시오. 햇볕에 나갈 때는 보호 의복을 착용하고 높은 보호 지수(SPF 30 이상)의 자외선 차단제를 사용하십시오. 이는 특히 피부가 매우 밝거나 가족력에 피부암이 있는 경우 중요합니다.
4. 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있고 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우, 특히 현재 또는 과거 흡연자인 경우 심장마비, 뇌졸중 또는 사망과 같은 주요 심혈관 사건 위험 증가.
RINVOQ/RINVOQ LQ를 복용하는 동안 심장마비 또는 뇌졸중 증상이 나타나면 즉시 응급 처치를 받으십시오. 여기에는 다음이 포함됩니다.
- 몇 분 이상 지속되거나 사라졌다가 다시 나타나는 가슴 중앙의 불편함
- 가슴, 목, 목, 턱에 심한 조임, 통증, 압박감 또는 무거움
- 팔, 등, 목, 턱 또는 위의 통증이나 불편함
- 가슴 불편함 유무와 관계없이 숨가쁨
- 차가운 땀을 흘림
- 메스꺼움 또는 구토
- 현기증
- 신체의 한 부분 또는 한쪽에 힘이 약해짐
- 말이 어눌해짐
5. 혈전(혈전증).
다리 정맥(심부 정맥 혈전증, DVT) 또는 폐(폐색전증, PE) 및 동맥(동맥 혈전증)의 혈전은 RINVOQ/RINVOQ LQ를 복용하는 일부 사람들에게 발생할 수 있습니다. 이는 생명을 위협하고 사망을 초래할 수 있습니다. 다리 정맥(DVT) 및 폐(PE)의 혈전은 만 50세 이상의 사람들 중 심장병(심혈관) 위험 요인이 최소한 1개 이상 있는 사람들에게 야누스 키나아제(JAK) 억제제라는 약물 종류를 복용하는 경우 더 자주 발생했습니다.
- 과거에 다리 또는 폐의 정맥에 혈전이 생긴 적이 있는지 의료 서비스 제공자에게 알리십시오.
- RINVOQ/RINVOQ LQ 치료 중에 혈전 증상이 나타나면 즉시 의료 서비스를 받으십시오. 여기에는 다음이 포함됩니다.
○ 한쪽 또는 양쪽 다리의 통증 또는 압통
○ 숨가쁨 또는 호흡 곤란
- 과거에 궤양성 대장염(대장의 일부에 염증) 또는 위 또는 장의 궤양이 있었는지 의료 서비스 제공자에게 알리십시오. RINVOQ/RINVOQ LQ를 복용하는 일부 사람들은 위 또는 장에 파열이 생길 수 있습니다. 이는 비스테로이드성 항염증제(NSAIDs) 또는 코르티코스테로이드를 복용하는 사람들에게 가장 자주 발생합니다.
- 위 부위 통증, 발열, 오한, 메스꺼움 또는 구토가 발생하면 즉시 의료 서비스를 받으십시오.
의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용하기 전과 복용하는 동안 다음을 확인하기 위해 혈액 검사를 실시해야 합니다.
- 호중구 및 림프구 수 감소. 호중구 및 림프구는 신체가 감염과 싸우는 데 도움이 되는 백혈구의 일종입니다.
- 적혈구 수 감소. 적혈구는 산소를 운반합니다. 적혈구 수가 적으면 빈혈이 생길 수 있으며, 이로 인해 쇠약감과 피로감을 느낄 수 있습니다.
- 콜레스테롤 수치 증가. 의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용하기 시작한 후 약 12주 후에 콜레스테롤 수치를 확인하기 위해 혈액 검사를 실시해야 하며 필요에 따라 추가 검사를 실시해야 합니다.
- 간 효소 상승. 간 효소는 간이 정상적으로 기능하는지 여부를 알려줍니다. 간 효소가 상승하면 의료 서비스 제공자가 간에 대한 추가 검사를 실시해야 할 수 있습니다.
호중구 수, 림프구 수 또는 적혈구 수가 너무 낮거나 간 검사 결과가 너무 높으면 RINVOQ/RINVOQ LQ를 복용해서는 안 됩니다. 이러한 혈액 검사 결과의 변화로 인해 의료 서비스 제공자는 필요에 따라 RINVOQ/RINVOQ LQ 치료를 일시적으로 중단할 수 있습니다.
부작용에 대한 자세한 내용은 “RINVOQ/RINVOQ LQ의 가능한 부작용은 무엇입니까?”를 참조하십시오.
RINVOQ/RINVOQ LQ는 Janus kinase (JAK) 억제제인 처방약입니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 류마티스 관절염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 건선성 관절염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 이전 치료에 반응하지 않았고 다른 알약이나 주사제(생물학적 약물 포함)로 습진이 잘 조절되지 않거나 다른 알약이나 주사제를 사용하는 것이 권장되지 않는 중등도에서 중증의 습진(아토피 피부염)이 있는 12세 이상의 성인과 어린이를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 궤양성 대장염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 중등도에서 중증의 크론병 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 강직성 척추염 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ는 종양괴사인자(TNF) 차단제 약물을 사용했지만 효과가 없거나 내약성이 없었던 객관적인 염증 징후가 있는 활동성 비방사선학적 축성 척추관절염이 있는 성인 환자를 치료하는 데 사용됩니다.
- RINVOQ/RINVOQ LQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 다관절 관절염 소아 특발성 관절염(pJIA)이 있는 2세 이상의 어린이를 치료하는 데 사용됩니다.
- RINVOQ/RINVOQ LQ는 1개 이상의 종양괴사인자(TNF) 차단제라고 불리는 약물을 사용했지만 효과가 없거나 내약성이 없었던 활동성 건선성 관절염이 있는 2세에서 18세 미만의 어린이를 치료하는 데 사용됩니다.
RINVOQ/RINVOQ LQ가 강직성 척추염, 비방사선학적 축성 척추관절염, 궤양성 대장염 또는 크론병이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ가 12세 미만의 아토피 피부염이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ LQ가 아토피 피부염이 있는 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ/RINVOQ LQ가 pJIA 또는 건선성 관절염이 있는 2세 미만의 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
RINVOQ/RINVOQ LQ를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
- 다음을 참조하십시오. “RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”
- 감염이 있는 경우.
- 현재 또는 과거 흡연자인 경우.
- 심장마비, 다른 심장 문제 또는 뇌졸중이 있었던 경우.
- 간 문제가 있는 경우.
- 신장 문제가 있는 경우.
- 설명할 수 없는 위(복부) 통증이 있거나, 과거에 맹장염이나 위 또는 장의 궤양이 있었거나, NSAID를 복용하고 있는 경우.
- 적혈구 또는 백혈구 수가 낮은 경우.
- 최근에 예방 접종(백신)을 받았거나 예방 접종을 받을 예정인 경우. RINVOQ/RINVOQ LQ를 복용하는 사람은 생백신을 접종해서는 안 됩니다.
- 임신 중이거나 임신을 계획하고 있는 경우. 동물 연구에 따르면 RINVOQ/RINVOQ LQ는 태아에게 해를 끼칠 수 있습니다.
임신 가능성이 있는 여성:
- 의료 서비스 제공자는 RINVOQ/RINVOQ LQ 치료를 시작하기 전에 임신 여부를 확인합니다.
- RINVOQ/RINVOQ LQ 치료 중에는 임신을 피하기 위해 효과적인 피임(피임)을 사용해야 하며, 마지막 RINVOQ/RINVOQ LQ 복용 후 4주 동안은 피임을 계속해야 합니다.
- RINVOQ/RINVOQ LQ 치료 중에 임신했거나 임신했다고 생각되면 의료 서비스 제공자에게 알리십시오.
- RINVOQ/RINVOQ LQ에 대한 임신 감시 프로그램이 있습니다. 이 프로그램의 목적은 귀하와 귀하의 아기의 건강에 대한 정보를 수집하는 것입니다. RINVOQ/RINVOQ LQ를 복용하는 동안 임신하면 1-800-633-9110으로 전화하여 임신 사실을 보고하는 것이 좋습니다.
- 모유 수유 중이거나 모유 수유를 계획하고 있는 경우. RINVOQ/RINVOQ LQ는 모유로 이행될 수 있습니다. 귀하와 의료 서비스 제공자는 RINVOQ/RINVOQ LQ를 복용할지 아니면 모유 수유를 할지 결정해야 합니다. 하지 마십시오. RINVOQ/RINVOQ LQ 치료 중에는 모유 수유를 하지 말고 마지막 RINVOQ/RINVOQ LQ 복용 후 6일 동안은 모유 수유를 하지 마십시오.
특히 다음을 복용하는 경우 의료 서비스 제공자에게 알리십시오.
- 진균 감염 치료제(케토코나졸, 이트라코나졸, 포사코나졸 또는 보리코나졸과 같은) 또는 클라리스로마이신(세균 감염 치료제)과 같은 약물은 혈액 내 RINVOQ/RINVOQ LQ의 양을 증가시킬 수 있습니다.
- 리팜핀(세균 감염 치료제) 또는 페니토인(신경 질환 치료제)과 같은 약물은 RINVOQ/RINVOQ LQ의 효과를 감소시킬 수 있습니다.
- 면역 체계에 영향을 미치는 약물(아자티오프린 및 사이클로스포린과 같은)은 감염 위험을 증가시킬 수 있습니다.
이러한 약물을 복용하고 있는지 확실하지 않으면 의료 서비스 제공자나 약사에게 문의하십시오.
복용하는 약물을 알고 있어야 합니다. 새 약을 받을 때 의료 서비스 제공자와 약사에게 보여줄 수 있도록 약물 목록을 보관하십시오.
- RINVOQ/RINVOQ LQ는 의료 서비스 제공자의 지시에 따라 정확하게 복용하십시오.
- RINVOQ LQ는 하루 2회 식사와 관계없이 복용하십시오.
- RINVOQ 정제는 하루 1회 식사와 관계없이 복용하십시오.
- RINVOQ 정제는 통째로 삼키십시오. 정제를 쪼개거나, 부수거나, 씹지 마십시오.
- RINVOQ LQ는 RINVOQ 정제와 다릅니다. 의료 서비스 제공자가 변경하지 않는 한 RINVOQ LQ와 RINVOQ 정제를 바꿔서 복용하지 마십시오.
- RINVOQ/RINVOQ LQ를 과량 복용한 경우 의료 서비스 제공자 또는 독극물 관리 센터(1-800-222-1222)에 전화하거나 가장 가까운 병원 응급실로 즉시 가십시오.
RINVOQ/RINVOQ LQ 복용 중에 무엇을 피해야 하나요?
RINVOQ/RINVOQ LQ 치료 중에는 자몽을 함유한 음식이나 음료를 피하십시오. 자몽이나 자몽 주스를 섭취하면 부작용 위험이 증가할 수 있습니다.
RINVOQ/RINVOQ LQ의 가능한 부작용은 무엇인가요?
RINVOQ/RINVOQ LQ는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
- “RINVOQ/RINVOQ LQ에 대해 알아야 할 가장 중요한 정보는 무엇인가요?”를 참조하십시오.
류마티스 관절염, 건선성 관절염, 강직성 척추염, 비방사선성 축상 척추 관절염, pJIA 치료를 받은 사람들에게서 RINVOQ/RINVOQ LQ의 가장 흔한 부작용은 다음과 같습니다.
• 대상포진(수두 대상포진 바이러스)
• 단순 포진 바이러스 감염, 입술 포진 포함
• 기관지염
• 기침
• 발열
• 여드름
• 두통
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 두통
• 크레아틴 키나아제 혈중 농도 증가
• 기침
• 알레르기 반응
• 모낭염
• 메스꺼움
• 발열
• 체중 증가
• 대상포진(수두 대상포진 바이러스)
• 독감
• 피로
• 백혈구 감소증(호중구 감소증)
• 근육통
• 독감 유사 증상
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 모낭염
• 발진
• 독감
• 혈중 콜레스테롤 수치 증가
• 크레아틴 키나아제 혈중 농도 증가
• 간 효소 수치 증가
• 특정 유형의 백혈구 수 감소(호중구 감소증, 림프구 감소증)
• 기관지염
• 폐렴
• 독감
• 여드름
• 단순 포진 바이러스 감염, 입술 포진 포함
• 피로
• 기침
• 대상포진(수두 대상포진 바이러스)
• 두통
• 크레아틴 키나아제 혈중 농도 증가
• 간 효소 수치 증가
• 적혈구 수 감소(빈혈)
• 백혈구 수 감소(호중구 감소증, 백혈구 감소증)
• 위장염(위장 감염)
RINVOQ를 복용하는 일부 사람들은 대변에서 약물 잔여물(정제 전체 또는 정제 조각)을 볼 수 있습니다. 이런 경우 의료 서비스 제공자에게 전화하십시오.
이것들은 RINVOQ/RINVOQ LQ의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088.
RINVOQ/RINVOQ LQ는 어떻게 보관해야 하나요?
- RINVOQ 정제는 36°F~77°F(2°C~25°C)에서 보관하십시오.
- RINVOQ 정제는 원래 병에 보관하여 습기로부터 보호하십시오.
- RINVOQ LQ는 36°F~86°F(2°C~30°C)에서 보관하십시오.
- 병을 개봉한 후 60일이 지나면 남은 RINVOQ LQ는 버리십시오.
- RINVOQ/RINVOQ LQ와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 RINVOQ/RINVOQ LQ를 사용하지 마십시오.
RINVOQ/RINVOQ LQ를 자신과 동일한 증상이 있는 다른 사람에게 제공하지 마십시오. 해를 입힐 수 있습니다.
RINVOQ/RINVOQ LQ에 대한 정보는 약사 또는 의료 서비스 제공자에게 문의하십시오.
RINVOQ 15mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, ferrosoferric oxide, hypromellose, iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ 30mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, hypromellose, iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ 45mg 정제의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: colloidal silicon dioxide, hypromellose, iron oxide yellow and iron oxide red, magnesium stearate, mannitol, microcrystalline cellulose, polyvinyl alcohol, polyethylene glycol, talc, tartaric acid and titanium dioxide.
RINVOQ LQ의 성분은 무엇입니까?
활성 성분: upadacitinib
비활성 성분: citric acid anhydrous, purified water, sodium benzoate, sodium citrate dihydrate and sucralose.
제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
자세한 내용은 1-800 2-RINVOQ(1-800-274-6867)로 전화하거나 www.RINVOQ.com을 방문하십시오.
20081173
사용 지침
사용 지침
RINVOQ® LQ [RIN-VOKE EL-CUE]
(upadacitinib)
경구용 용액
이 사용 지침에는 RINVOQ LQ 경구용 용액을 준비하고 투여하는 방법에 대한 정보가 포함되어 있습니다.
RINVOQ LQ를 자녀에게 투여하기 전에 그리고 재충전을 받을 때마다 이 사용 지침을 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 자녀의 의학적 상태 또는 치료에 대해 의료 서비스 제공자와 상담하는 것을 대신할 수 없습니다.
RINVOQ LQ를 투여하기 전에 알아야 할 중요한 정보
병과 용품을 어린이의 눈에 띄지 않고 손이 닿지 않는 곳에 보관하십시오.
제공된 주사기를 사용하십시오. 사용하지 마십시오 다른 사람과 주사기를 공유하거나 다른 약물에 사용하십시오.
RINVOQ LQ를 올바르게 투여하는 방법에 대한 도움이 필요하거나 질문이 있으면 의료 서비스 제공자 또는 1-800-2-RINVOQ 또는 1-800-274-6867로 전화하십시오.
자녀가 경구용 용액을 너무 많이 복용하거나 전체 용량을 받지 못한 경우 의료 서비스 제공자에게 연락하십시오.
- 병을 개봉한 후 60일 이내에 RINVOQ LQ를 사용하십시오. 기억을 돕기 위해 병을 개봉한 날짜를 상자에 적으십시오.
- 사용하지 마십시오 이전 병을 비우기 전에 새로운 병의 RINVOQ LQ를 개봉하십시오. 새로운 병을 개봉할 때는 새 주사기를 사용하십시오.
- RINVOQ LQ 경구용 용액은 투명하고 무색에서 연한 노란색입니다.
- 이 지침과 RINVOQ LQ 경구용 용액과 용품이 들어 있는 상자를 나중에 사용할 수 있도록 보관하십시오.
각 상자에 포함된 용품

그림 A
RINVOQ LQ 폐기
병을 비우거나 개봉 후 60일이 지나면 주사기와 병을 폐기하십시오.
- 사용하지 않은 약물을 올바르게 폐기하는 방법은 약사에게 문의하십시오.
- 주사기를 헹군 다음 가정 쓰레기통에 버리십시오.
RINVOQ LQ 준비
1. 처방된 용량을 확인하십시오.
a. 자녀의 처방된 용량을 밀리리터(mL)로 확인하고 주사기에서 이 mL 눈금을 찾으십시오.
b. 처방된 용량을 투여하기 위해 제공된 주사기만 사용하십시오.
2. 유효 기간을 확인하십시오.
a. 병을 확인하고 유효 기간이 지나지 않았는지 확인하십시오(그림 B 참조).
사용하지 마십시오 상자와 병에 인쇄된 유효 기간이 지난 후 “EXP” 이후의 RINVOQ LQ를 사용하십시오.

그림 B
3. 용품을 확인하십시오.
a. 용품을 확인하고 손상되지 않았는지 확인하십시오(그림 C 참조).
b. 주사기가 깨끗하고 마른 경우에만 사용하십시오.
c. 플런저가 주사기 안으로 완전히 들어갔는지 확인하십시오.
 사용하지 마십시오 용품이 젖었거나 손상되었거나 변조된 것으로 보이는 경우.
사용하지 마십시오 용품이 젖었거나 손상되었거나 변조된 것으로 보이는 경우.

그림 C
4. 병을 개봉하십시오.
a. 뚜껑을 눌러 돌려서 병에서 빼십시오(그림 D 참조). 버리지 마십시오 뚜껑을 버리십시오.

그림 D
5. 어댑터를 삽입하십시오(처음 사용하는 경우만).
a. 병을 단단히 잡고 엄지손가락으로 어댑터를 병 가장자리까지 완전히 밀어 넣으십시오(그림 E 참조).
참고: 어댑터에 압력을 가해야 할 수 있습니다.
사용하지 마십시오 어댑터를 삽입한 후 제거하십시오.

그림 E
용량 측정
6. 주사기를 병에 삽입한 다음 거꾸로 뒤집으십시오.
a. 주사기 끝을 어댑터에 삽입하십시오.
b. 주사기가 병에 연결된 상태에서 병을 거꾸로 뒤집으십시오(그림 F 참조).

그림 F
7. 경구용 용액을 주사기에 넣으십시오.
a. 플런저를 천천히 아래로 당기십시오(그림 G 참조).
b. 주사기에 기포가 있는지 확인하십시오.
참고: 플런저를 당길 때 압력을 느낄 수 있습니다.

그림 G
8. 큰 기포 제거 (그림 H 참조).
a. 병을 잡고 주사기 측면을 가볍게 두드려 큰 기포를 주사기 끝으로 보냅니다.
b. 주사기가 병에 연결된 상태에서 플런저를 위아래로 움직여 기포를 병으로 되돌립니다.
c. 큰 기포가 사라질 때까지 8단계를 반복합니다.
참고: 작은 기포는 정상입니다.

그림 H
9. 용량 측정.
a. 큰 기포가 제거된 후 플런저를 용량 표시와 일치하도록 움직입니다 ( 그림 I 참조).

그림 I
10. 병을 똑바로 세우고 주사기를 제거합니다.
a. 주사기가 병에 연결된 상태에서 병을 똑바로 세웁니다.
b. 주사기 중간을 잡고 병에서 조심스럽게 제거합니다 ( 그림 J 참조).
만지지 마세요 약을 투여할 준비가 되기 전에 주사기에서 경구용액이 실수로 나오는 것을 방지하기 위해 플런저를 만지지 마세요.

그림 J
RINVOQ LQ 투여
11. 용량 확인.
a. 주사기에 정확한 용량의 경구용액이 있는지 확인합니다 ( 그림 K 참조).
b. 주사기에 큰 기포가 있는지 확인합니다.
c. 용량이 정확하지 않거나 큰 기포가 보이면 6단계로 돌아갑니다.

그림 K
12. 경구용액 투여.
a. 주사기를 아이의 볼 안쪽에 대십시오.
b. 플런저를 눌러 아이의 입에 전체 용량을 투여합니다 ( 그림 L 참조).
c. 아이에게 물을 마시게 합니다.
참고: 경구용액은 주사기를 채운 후 1시간 이내에 투여해야 합니다.

그림 L
RINVOQ LQ 보관
13. 병을 닫고 보관합니다.
a. 어댑터가 병에 삽입된 상태에서 뚜껑을 병에 다시 끼워 밀봉합니다 ( 그림 M 참조).
b. 사용하지 않을 때는 병을 상자에 똑바로 세워 보관합니다.
c. 병을 상자에 넣어 서늘하고 어두운 곳에 36°F~86°F(2°C~30°C)에서 보관합니다.
d. 병, 용품 및 모든 약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.

그림 M
14. 주사기를 헹구고 보관합니다.
a. 주사기에서 플런저를 제거한 다음 두 부분을 물로 헹굽니다 ( 그림 N 참조).
사용하지 마세요 비누를 사용하거나 주사기를 식기 세척기에 넣어 청소하지 마세요.
b. 분리된 부분을 깨끗한 표면에 말립니다.
c. 주사기를 깨끗하고 건조한 곳에 보관합니다.

그림 N
15. 병을 다 사용했으면 “RINVOQ LQ 폐기”를 참조하십시오.

제조사: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2019-2024 AbbVie Inc.
이 사용 설명서는 미국 식품의약국에서 승인했습니다.
발행: 2024년 4월
20081174 R1
주요 표시 패널
NDC 0074-2306-30
RINVOQ™
우파다시티닙
연장 방출용 정제 15mg
원래 포장으로 조제
캡을 뒤집어 포일을 자르세요
뒤집어서 설명을 읽어보세요
정제 30알
의사 처방전만 유효
abbvie

주요 표시 패널
NDC 0074-2310-30
RINVOQ®
upadacitinib
연장 방출 정제
30mg
원래 포장에서 약을 분배하다
캡을 뒤집어 포일을 자르기
뒤로 벗겨 사용법 확인
30 정제
처방전 전용
abbvie

주요 표시 패널
NDC 0074-1043-28
RINVOQ®
upadacitinib
연장-방출 정제
45 mg
투약 안내서와 함께 제공
캡을 뒤집어 호일을 자르세요
뒤집어 설명을 확인하세요
정제 28 개
전문의 처방전만
abbvie

주요 표시 패널
NDC 0074-2320-01
RINVOQ®LQ
업다시티닙
경구용 용액
1 mg/mL
RINVOQ LQ 및 RINVOQ
대체할 수 없습니다.
첫 사용 시 병 어댑터를 삽입하세요.
삽입 후 제거하지 마세요.
병 1 개당 180 mL
전문의 처방전에 의해서만
abbvie