의약품 제조업체: Otsuka America Pharmaceutical, Inc. (Updated: 2025-01-14)
처방 정보 하이라이트
REXULTI® (브렉시피프라졸) 정제, 경구용
미국 최초 승인: 2015
경고: 치매 관련 정신병이 있는 고령 환자의 사망률 증가 및 자살 생각 및 행동
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
적응증 및 용법
용법 및 용량
REXULTI는 음식과 함께 또는 음식 없이 1일 1회 경구 투여합니다. (2, 12.3)
| 적응증 | 시작 용량 | 권장 목표 용량 | 최대 용량 |
|---|---|---|---|
| MDD 성인 (2.2) |
0.5 mg/일 또는 1 mg/일 |
2 mg/일 | 3 mg/일 |
| 조현병 성인 (2.3) |
1 mg/일 | 2~4 mg/일 | 4 mg/일 |
| 소아 조현병 (13~17세) (2.3) |
0.5 mg/일 | 2~4 mg/일 | 4 mg/일 |
| 알츠하이머병으로 인한 치매와 관련된 불안 (2.4) |
0.5 mg/일 | 2 mg/일 | 3 mg/일 |
용법 및 용량
정제: 0.25mg, 0.5mg, 1mg, 2mg, 3mg 및 4mg (3)
금기
REXULTI 또는 그 구성 성분에 대한 알려진 과민증 (4)
경고 및 주의사항
- 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 이상 반응: 뇌혈관계 이상 반응 (예: 뇌졸중, 일과성 허혈 발작)의 발생률 증가 (5.3)
- 악성 신경이완제 증후군: 즉시 투여 중단 및 면밀한 모니터링으로 관리. (5.4)
- 지연성 운동 이상: 임상적으로 적절한 경우 투여 중단. (5.5)
- 대사 변화: 고혈당/당뇨병, 이상지질혈증 및 체중 증가를 모니터링. (5.6)
- 병적 도박 및 기타 강박 행동: 용량 감소 또는 투여 중단을 고려. (5.7)
- 백혈구 감소증, 호중구 감소증 및 무과립구증: 기존의 백혈구 수치가 낮거나 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자에게 완전 혈구 수치 (CBC) 검사를 실시하십시오. 다른 원인이 없는 경우 임상적으로 유의미한 WBC 감소가 발생하면 REXULTI 투여를 중단하는 것을 고려하십시오. (5.8)
- 기립성 저혈압 및 실신: 심박수와 혈압을 모니터링하고 알려진 심혈관 질환 또는 뇌혈관 질환 및 탈수 또는 실신 위험이 있는 환자에게 경고하십시오. (5.9)
- 발작: 발작 병력이 있거나 발작 역치를 낮추는 질환이 있는 환자에게는 신중하게 사용하십시오. (5.11)
- 인지 및 운동 장애 가능성: 기계 작동 시 주의하십시오. (5.14)
이상 반응
성인에서 가장 흔한 이상 반응은 다음과 같습니다. (6.1):
- MDD: 체중 증가, 졸음 및 아카시지아 (≥5% 및 위약 대비 최소 2배의 비율)
- 정신분열증: 체중 증가 (≥4% 및 위약 대비 최소 2배의 비율)
- 알츠하이머병으로 인한 치매와 관련된 불안: 비인두염, 현기증 (≥4% 및 위약 대비 최소 2배의 비율)
의심되는 이상 반응을 보고하려면 Otsuka America Pharmaceutical, Inc.에 1-800-438-9927 또는 FDA에 1-800-FDA-1088로 연락하거나 www.fda.gov/medwatch를 방문하십시오.
약물 상호작용
|
|
| 요인 | REXULTI에 대한 용량 조절 (2.7) |
| 강력한 CYP2D6* 또는 CYP3A4 억제제 | 권장 용량의 절반을 투여하십시오. |
| 강력한/중등도 CYP2D6 및 강력한/중등도 CYP3A4 억제제 | 권장 용량의 1/4을 투여하십시오. |
| 강력한/중등도 CYP3A4 억제제를 복용하는 알려진 CYP2D6 저대사자 | 권장 용량의 1/4을 투여하십시오. |
| 강력한 CYP3A4 유도제 | 권장 용량의 2배를 투여하고 임상 반응에 따라 추가로 조절하십시오. |
환자 상담 정보 및 약물 안내서에 대한 내용은 17번을 참조하십시오.
개정: 2024년 5월
목차
전문 정보: 목차*
경고: 치매 관련 정신병이 있는 고령 환자의 사망률 증가 및 자살 생각 및 행동
1 적응증 및 용법
2 용법 및 용량
2.1 투여 정보
2.2 주요 우울 장애의 병용 요법에 대한 권장 용량 (성인)
2.3 정신분열병에 대한 권장 용량 (성인 및 13~17세 소아 환자)
2.4 알츠하이머병으로 인한 치매와 관련된 불안에 대한 권장 용량
2.5 간 기능 손상 환자에 대한 권장 용량
2.6 신 기능 손상 환자에 대한 권장 용량
2.7 CYP2D6 저대사자 및 CYP 저해제 또는 유도제와 병용 투여에 대한 용량 조절
3 제형 및 강도
4 금기
5 경고 및 주의사항
5.1 치매 관련 정신병이 있는 고령 환자의 사망률 증가
5.2 소아, 청소년 및 젊은 성인의 자살 생각 및 행동
5.3 치매 관련 정신병이 있는 고령 환자의 뇌혈관계 이상 반응 (뇌졸중 포함)
5.4 악성 신경이완제 증후군 (NMS)
5.5 지연성 운동 이상증
5.6 대사 변화
5.7 병적 도박 및 기타 강박 행동
5.8 백혈구 감소증, 호중구 감소증 및 무과립구증
5.9 기립성 저혈압 및 실신
5.10 낙상
5.11 발작
5.12 체온 조절 장애
5.13 연하곤란
5.14 인지 및 운동 장애 가능성
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 REXULTI와 임상적으로 중요한 상호작용을 나타내는 약물
7.2 REXULTI와 임상적으로 중요한 상호작용을 나타내지 않는 약물
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 CYP2D6 저대사자
8.7 간 기능 손상
8.8 신 기능 손상
8.9 기타 특정 환자군
9 약물 남용 및 의존성
9.1 통제 약물
9.2 남용
9.3 의존성
10 과량 투여
11 약물 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 장애
14 임상 연구
14.1 주요 우울 장애의 병용 요법
14.2 정신분열병
14.3 알츠하이머병으로 인한 치매와 관련된 불안
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
박스형 경고
WARNING: 치매 관련 정신병 노인 환자의 사망률 증가 및 자살 생각과 행동
치매 관련 정신병 노인 환자의 사망률 증가
항정신병 약물로 치료받은 치매 관련 정신병 노인 환자는 사망 위험이 증가합니다. REXULTI는 알츠하이머병으로 인한 치매와 관련된 초조 증상이 없는 치매 관련 정신병 환자 치료에 대해 승인되지 않았습니다. [경고 및 주의사항 (5.1) 참조].
자살 생각 및 행동
단기 연구에서 항우울제는 소아 및 청소년 환자의 자살 생각 및 행동 위험을 증가시켰습니다. 모든 항우울제 치료를 받는 환자의 임상적 악화 및 자살 생각과 행동의 출현을 면밀히 모니터링하십시오. [경고 및 주의사항 (5.2) 참조]. REXULTI의 안전성과 유효성은 MDD 소아 환자에서 확립되지 않았습니다. [경고 및 주의사항 (5.2), 특정 집단에서의 사용 (8.4) 참조].
1 적응증 및 사용법
REXULTI는 다음 질환에 대해 사용됩니다:
- 성인 주요 우울 장애(MDD)의 보조 치료
- 성인 및 13세 이상 소아 환자의 조현병 치료
- 알츠하이머병으로 인한 치매 관련 초조 행동 치료
사용 제한:
REXULTI는 알츠하이머병으로 인한 치매 관련 초조 행동에 대한 필요시(“prn”) 치료제로는 적응증을 받지 않았습니다 [임상 연구 (14.3)] 참조].
2 용법 및 투여
2.2 주요 우울 장애의 추가 치료를 위한 권장 용량 (성인)
성인의 주요 우울 장애 추가 치료를 위한 권장 REXULTI 초기 용량은 1일 1회 경구 0.5mg 또는 1mg입니다. 1일 1회 1mg으로 증량한 후, 환자의 임상 반응 및 내약성에 따라(매주 간격으로 용량을 증가시켜) 1일 1회 2mg의 목표 용량으로 증량합니다. 최대 권장 1일 용량은 3mg입니다. 치료의 지속적인 필요성과 적절한 용량을 확인하기 위해 정기적으로 재평가합니다.
2.3 정신분열병에 대한 권장 용량 (성인 및 13~17세 소아 환자)
2.4 알츠하이머병으로 인한 치매 관련 불안에 대한 권장 용량
알츠하이머병으로 인한 치매 관련 불안 치료를 위한 권장 REXULTI 초기 용량은 1일차부터 7일차까지 1일 1회 경구 0.5mg입니다. 8일차부터 14일차까지 1일 1회 1mg으로 용량을 증가시키고, 15일차에는 1일 1회 2mg으로 증가시킵니다. 권장 목표 용량은 1일 1회 2mg입니다. 임상 반응 및 내약성에 따라 최소 14일 후 최대 권장 1일 용량인 1일 1회 3mg으로 용량을 증가시킬 수 있습니다.
2.5 간 손상 환자에서의 권장 용량
중등도에서 중증 간 손상 환자(Child-Pugh 점수 ≥7)의 최대 권장 용량은 [특정 집단에서의 사용 (8.7), 임상 약리학 (12.3) 참조]입니다.
주요 우울 장애 또는 알츠하이머병으로 인한 치매 관련 불안 환자의 경우 1일 1회 경구 2mg이며,
정신분열병 환자의 경우 1일 1회 경구 3mg입니다.
2.6 신장 손상 환자에서의 권장 용량
크레아티닌 청소율(CrCl)이 60 mL/분 미만인 환자의 최대 권장 용량은 [특정 집단에서의 사용 (8.8), 임상 약리학 (12.3) 참조]입니다.
주요 우울 장애 또는 알츠하이머병으로 인한 치매 관련 불안 환자의 경우 1일 1회 경구 2mg이며,
정신분열병 환자의 경우 1일 1회 경구 3mg입니다.
2.7 CYP2D6 저대사자 및 CYP 저해제 또는 유도제와 병용 사용에 대한 용량 조절
시토크롬 P450(CYP) 2D6 저대사자인 환자와 CYP3A4 저해제, CYP2D6 저해제 또는 강력한 CYP3A4 유도제를 병용 투여하는 환자에게는 용량 조절이 권장됩니다(표 1 참조). 병용 약물 투여를 중단하는 경우 REXULTI 용량을 원래 수준으로 조절합니다. 병용 CYP3A4 유도제 투여를 중단하는 경우 1~2주에 걸쳐 REXULTI 용량을 원래 수준으로 줄입니다 [약물 상호작용 (7.1), 임상 약리학 (12.3) 참조].
| 요인 | 조정된 REXULTI 용량 |
|---|---|
|
|
| CYP2D6 저대사자 | |
| CYP2D6 저대사자 | 권장 용량의 절반을 투여합니다. |
| 강력/중등도 CYP3A4 저해제를 복용하는 알려진 CYP2D6 저대사자 | 권장 용량의 4분의 1을 투여합니다. |
| CYP2D6 저해제 및/또는 CYP3A4 저해제를 복용하는 환자 | |
| 강력한 CYP2D6 저해제* | 권장 용량의 절반을 투여합니다. |
| 강력한 CYP3A4 저해제 | 권장 용량의 절반을 투여합니다. |
| 강력/중등도 CYP2D6 저해제와 강력/중등도 CYP3A4 저해제 병용 | 권장 용량의 4분의 1을 투여합니다. |
| CYP3A4 유도제를 복용하는 환자 | |
| 강력한 CYP3A4 유도제 | 1~2주에 걸쳐 권장 용량의 두 배를 투여합니다. |
3 제형 및 함량
REXULTI 정제는 6가지 용량으로 제공됩니다:
- 0.25 mg 정제: 연갈색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “0.25”가 새겨져 있습니다.
- 0.5 mg 정제: 연한 주황색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “0.5”가 새겨져 있습니다.
- 1 mg 정제: 연한 노란색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “1”이 새겨져 있습니다.
- 2 mg 정제: 연녹색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “2”가 새겨져 있습니다.
- 3 mg 정제: 연보라색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “3”이 새겨져 있습니다.
- 4 mg 정제: 흰색, 원형, 얕은 볼록형, 비스듬한 모서리 본체에 한쪽 면에 “BRX” 및 “4”가 새겨져 있습니다.
4 금기 사항
REXULTI는 브렉시피프라졸 또는 그 구성성분에 과민증이 있는 환자에게는 금기입니다. 반응에는 발진, 안면 부종, 두드러기 및 아나필락시스가 포함되었습니다.
5 경고 및 주의사항
5.1 치매 관련 정신병 환자의 사망률 증가
항정신병 약물로 치료받는 치매 관련 정신병 고령 환자는 사망 위험이 증가합니다. 대부분 비정형 항정신병 약물을 복용하는 환자를 대상으로 한 17건의 위약 대조 시험(최빈 지속 기간 10주) 분석 결과, 약물 치료 환자의 사망 위험이 위약 치료 환자보다 1.6배에서 1.7배 높은 것으로 나타났습니다. 일반적인 10주간의 대조 시험에서 약물 치료 환자의 사망률은 약 4.5%였던 반면, 위약군에서는 약 2.6%였습니다.
사망 원인은 다양했지만, 대부분 심혈관계(예: 심부전, 돌연사) 또는 감염성(예: 폐렴) 질환으로 인한 것으로 보였습니다. REXULTI는 알츠하이머병으로 인한 치매와 관련된 불안감이 없는 치매 관련 정신병 환자의 치료에는 허가되지 않았습니다 [경고, 경고 및 주의 사항 (5.3) 참조].
5.2 소아, 청소년 및 젊은 성인의 자살 생각 및 행동
약 77,000명의 성인 환자와 4,400명 이상의 소아 환자를 포함한 항우울제(SSRI 및 기타 항우울제 계열)의 위약 대조 시험의 통합 분석에서 24세 이하 환자의 자살 생각 및 행동 발생률은 항우울제 치료 환자에서 위약 치료 환자보다 더 높았습니다. 치료받은 환자 1,000명당 자살 생각 및 행동 사례 수의 약물-위약 차이는 표 2에 나와 있습니다.
소아 연구에서는 자살 사례가 발생하지 않았습니다. 성인 연구에서는 자살 사례가 있었지만, 항우울제의 자살에 대한 영향에 대한 결론을 내리기에 충분한 수치는 아니었습니다.
| 연령 범위 (세) | 치료받은 환자 1,000명당 자살 생각 또는 행동을 보인 환자 수의 약물-위약 차이 |
|---|---|
|
|
| 위약과 비교하여 증가 | |
| <18 | 환자 14명 증가 |
| 18~24 | 환자 5명 증가 |
| 위약과 비교하여 감소 | |
| 25~64 | 환자 1명 감소 |
| ≥65 | 환자 6명 감소 |
소아, 청소년 및 청년 성인에서의 자살 생각 및 행동의 위험이 4개월 이상의 장기 사용으로 확대되는지 여부는 알려져 있지 않습니다. 그러나 MDD 성인을 대상으로 한 위약 대조 유지 연구에서 항우울제가 우울증 재발을 지연시킨다는 상당한 증거가 있습니다.
특히 약물 치료 초기 몇 달 동안과 용량 변경 시점에 모든 항우울제 치료 환자의 임상적 악화 및 자살 생각 및 행동의 출현을 모니터링하십시오. 환자의 가족 구성원이나 간병인에게 행동 변화를 모니터링하고 의료 제공자에게 알리도록 지시하십시오. 우울증이 지속적으로 악화되거나 자살 생각이나 행동이 갑자기 나타나는 환자의 경우 REXULTI 중단을 포함하여 치료 요법을 변경하는 것을 고려하십시오.
5.3 치매 관련 정신병이 있는 노인 환자에서의 뇌혈관계 이상 반응(뇌졸중 포함)
치매 노인 환자를 대상으로 한 위약 대조 시험에서 리스페리돈, 아리피프라졸 및 올란자핀을 무작위 배정받은 환자는 뇌졸중 및 일과성 허혈 발작(치명적인 뇌졸중 포함)의 발생률이 더 높았습니다. REXULTI는 알츠하이머병으로 인한 치매와 관련된 불안이 없는 치매 관련 정신병 환자의 치료에는 승인되지 않았습니다 [경고, 경고 및 주의 사항 (5.1) 참조].
5.4 악성 신경이완제 증후군(NMS)
잠재적으로 치명적인 증상 복합체인 악성 신경이완제 증후군(NMS)이 REXULTI를 포함한 항정신병 약물 투여와 관련하여 보고되었습니다.
NMS의 임상적 징후는 고열, 근육 강직, 정신 상태 변화 및 자율 신경계 불안정의 증거(불규칙적인 맥박 또는 혈압, 빈맥, 발한 및 심장 부정맥)입니다. 추가적인 징후로는 크레아티닌 포스포키나제 상승, 횡문근 융해증(근육 붕괴), 급성 신부전이 포함될 수 있습니다.
NMS가 의심되는 경우 REXULTI를 즉시 중단하고 집중적인 증상 치료 및 모니터링을 제공하십시오.
5.5 지연성 운동 이상증
잠재적으로 비가역적인 불수의적 운동 이상을 특징으로 하는 지연성 운동 이상증이 항정신병 약물로 치료받는 환자에게서 발생할 수 있습니다. 위험은 노인, 특히 노년 여성에서 가장 높은 것으로 보이지만 어떤 환자가 이 증후군을 발병할지 예측하는 것은 불가능합니다. 항정신병 약물이 지연성 운동 이상증을 유발할 가능성이 서로 다른지 여부는 알려져 있지 않습니다.
지연성 운동 이상증의 위험과 그것이 비가역적으로 될 가능성은 치료 기간과 누적 용량이 증가함에 따라 증가하는 것으로 보입니다. 이 증후군은 비교적 짧은 치료 기간 후에 저용량으로 발생할 수 있습니다. 또한 치료 중단 후에도 발생할 수 있습니다.
항정신병 치료를 중단하면 지연성 운동 이상증이 부분적으로 또는 완전히 회복될 수 있습니다. 항정신병 치료 자체가 증후군의 징후와 증상을 억제(또는 부분적으로 억제)하여 기저 과정을 가릴 수 있습니다. 증상 억제가 지연성 운동 이상증의 장기적 경과에 미치는 영향은 알려져 있지 않습니다.
이러한 고려 사항을 고려하여 REXULTI는 지연성 운동 이상증의 발생을 줄일 가능성이 가장 높은 방식으로 처방해야 합니다. 만성 항정신병 치료는 일반적으로 1) 항정신병 약물에 반응하는 것으로 알려진 만성 질환을 앓고 있으며 2) 대체적으로 효과적이지만 잠재적으로 해가 적은 치료법을 사용할 수 없거나 적절하지 않은 환자에게만 예약해야 합니다. 만성 치료가 필요한 환자의 경우 만족스러운 임상적 반응을 얻는 데 필요한 최저 용량과 최단 기간의 치료를 사용하십시오. 치료 지속의 필요성을 주기적으로 재평가하십시오.
REXULTI로 치료받는 환자에게 지연성 운동 이상증의 징후와 증상이 나타나면 약물 중단을 고려해야 합니다. 그러나 일부 환자는 증후군이 있음에도 불구하고 REXULTI 치료가 필요할 수 있습니다.
5.6 대사 변화
REXULTI를 포함한 비정형 항정신병 약물은 고혈당, 당뇨병, 이상지질혈증 및 체중 증가를 포함한 대사 변화를 일으켰습니다. 현재까지 이 계열의 모든 약물이 일부 대사 변화를 일으키는 것으로 나타났지만 각 약물은 고유한 특정 위험 프로필을 가지고 있습니다.
고혈당 및 당뇨병
어떤 경우에는 극심하고 당뇨병성 케톤산증 고삼투성 혼수 또는 사망과 관련된 고혈당 및 당뇨병이 비정형 항정신병 약물로 치료받는 환자에게서 보고되었습니다. REXULTI로 치료받는 환자에게서 고혈당이 보고되었습니다. 항정신병 약물 투여 시작 전이나 시작 직후 공복 혈당을 평가하고 장기 치료 중에는 주기적으로 모니터링하십시오.
주요 우울 장애의 추가 치료: MDD 성인 환자를 대상으로 한 6주간의 위약 대조, 고정 용량 임상 연구에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL) 및 경계선(≥100 및 <126 mg/dL)에서 고혈당으로 변화한 환자의 비율은 REXULTI와 위약으로 치료받은 환자에서 유사했습니다. 장기간 개방형 우울증 연구에서 기준선 공복 혈당이 정상인 성인 환자의 5%가 REXULTI와 항우울제(ADT)를 복용하는 동안 고혈당으로 변화했습니다. 경계선 공복 혈당 환자의 25%가 고혈당으로 변화했습니다. 종합적으로, 공복 혈당이 정상 또는 경계선인 환자의 9%가 장기간 우울증 연구 중에 고혈당으로 변화했습니다.
조현병 (성인): 성인 조현병 환자를 대상으로 한 6주간의 위약 대조, 고정 용량 임상 연구에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL) 또는 경계선(≥100 및 <126 mg/dL)에서 고혈당으로 변화된 환자의 비율은 REXULTI 치료 환자와 위약 치료 환자에서 유사했습니다. 장기간 개방표지 조현병 연구에서 기준 공복 혈당이 정상이었던 성인 환자의 8%가 REXULTI 복용 중 정상에서 고혈당으로 변화되었고, 경계선 공복 혈당이었던 환자의 17%가 경계선에서 고혈당으로 변화되었습니다. 결합적으로, 정상 또는 경계선 공복 혈당이었던 환자의 10%가 장기간 조현병 연구 동안 고혈당으로 변화되었습니다.
소아 조현병 환자 (13~17세): 소아 조현병 환자를 대상으로 한 장기간 개방표지 연구에서 기준 공복 혈당이 정상이었던 소아 환자의 2.7%가 REXULTI 복용 중 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL)으로 변화되었습니다.
알츠하이머병으로 인한 치매 관련 불안: 알츠하이머병으로 인한 치매 관련 불안 환자(51~90세)를 대상으로 한 12주간의 위약 대조, 고정 용량 연구에서 공복 혈당이 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL) 또는 이상(>=100 및 <126 mg/dL)에서 고혈당으로 변화된 환자의 비율은 REXULTI 치료 환자(14%)와 위약 치료 환자(16%)에서 유사했습니다.
이전에 12주 동안 REXULTI로 치료받고 12주간의 활성 치료 연장 연구를 계속한 환자 중 기준 공복 혈당이 정상이었던 환자의 15%가 REXULTI 복용 중 정상(<100 mg/dL)에서 고혈당(≥126 mg/dL)으로 변화되었고, 공복 혈당이상이었던 환자의 30%가 공복 혈당 이상(≥100 및 <126 mg/dL)에서 고혈당으로 변화되었습니다. 결합적으로, 정상 또는 이상 공복 혈당이었던 환자의 20%가 고혈당으로 변화되었습니다.
이상지질혈증
비정형 항정신병약물은 지질에 부작용을 일으킵니다. 항정신병 약물 투여 시작 전 또는 시작 직후에 기준선에서 공복 지질 프로필을 얻고 치료 중에 주기적으로 모니터링하십시오.
주요 우울 장애의 병용 요법: 성인 MDD 환자를 대상으로 한 6주간의 위약 대조, 고정 용량 임상 연구에서 공복 총 콜레스테롤, LDL 콜레스테롤 및 HDL 콜레스테롤의 변화는 REXULTI 치료 환자와 위약 치료 환자에서 유사했습니다. 표 3은 공복 중성지방 변화 환자의 비율을 보여줍니다.
| 기준선에서 기준선 이후로 변화된 환자 비율 | ||||
|---|---|---|---|---|
| 중성지방 | 위약 | 1 mg/일 | 2 mg/일 | 3 mg/일 |
| n=변화가 있는 환자 수 | ||||
|
||||
| 정상에서 고혈당 (<150 mg/dL에서 ≥200 및 <500 mg/dL) |
6% (15/257)* |
5% (7/145)* |
13% (15/115)* |
9% (13/150)* |
| 정상/경계선에서 매우 고혈당 (<200 mg/dL에서 ≥500 mg/dL) |
0% (0/309)* |
0% (0/177)* |
0.7% (1/143)* |
0% (0/179)* |
장기간 공개 표지 우울증 연구에서, 정상 콜레스테롤 수치에서 고콜레스테롤 수치로 변화가 REXULTI 복용 환자의 9%(총 콜레스테롤), 3%(LDL 콜레스테롤)에서 보고되었고, 정상에서 저콜레스테롤 수치로 변화는 14%(HDL 콜레스테롤)에서 보고되었습니다. 정상 기저 트리글리세라이드 수치를 가진 환자 중 17%가 고트리글리세라이드 수치로 변화되었고, 0.2%는 매우 고트리글리세라이드 수치로 변화되었습니다. 정상 또는 경계선상의 공복 시 트리글리세라이드 수치를 가진 환자 중 0.6%에서 장기간 우울증 연구 기간 동안 매우 고농도의 공복 시 트리글리세라이드 수치로 변화되었습니다.
조현병 (성인): 성인 조현병 환자를 대상으로 한 6주간의 위약 대조, 고정 용량 임상 연구에서, 공복 시 총 콜레스테롤, LDL 콜레스테롤 및 HDL 콜레스테롤의 변화는 REXULTI 치료 환자와 위약 치료 환자에서 유사했습니다. 표 4는 공복 시 트리글리세라이드 변화가 있는 환자의 비율을 보여줍니다.
| 기저치에서 기저치 이후로 변화된 환자 비율 | ||||
|---|---|---|---|---|
| 트리글리세라이드 | 위약 | 1 mg/day | 2 mg/day | 4 mg/day |
| n=변화가 있는 환자 수 | ||||
|
||||
| 정상에서 고농도 (<150 mg/dL 에서 ≥200 and <500 mg/dL) |
6% (15/253)* |
10% (7/72)* |
8% (19/232)* |
10% (22/226)* |
| 정상/경계선에서 매우 고농도 (<200 mg/dL 에서 ≥500 mg/dL) |
0% (0/303)* |
0% (0/94)* |
0% (0/283)* |
0.4% (1/283)* |
성인 환자를 대상으로 한 장기간 개방표지 시험에서, REXULTI를 복용한 환자의 경우 기준 공복 콜레스테롤 수치가 정상에서 고콜레스테롤혈증으로 변화된 비율은 총 콜레스테롤 6%, LDL 콜레스테롤 2%였으며, 정상에서 저콜레스테롤혈증으로 변화된 비율은 HDL 콜레스테롤 17%였습니다. 기준 트리글리세라이드 수치가 정상이었던 환자 중 13%는 고트리글리세라이드혈증으로, 0.4%는 매우 고트리글리세라이드혈증으로 변화되었습니다. 장기간 정신분열병 시험에서 기준 또는 경계선상의 공복 트리글리세라이드 수치를 가진 환자 중 0.6%에서 매우 고트리글리세라이드혈증으로 변화되었습니다.
소아 및 청소년 정신분열병 환자 (13~17세): 소아 및 청소년 정신분열병 환자를 대상으로 한 장기간 개방표지 시험에서, REXULTI를 복용한 환자의 경우 기준 공복 총 콜레스테롤 수치가 정상에서 고콜레스테롤혈증 (<170 에서 ≥200 mg/dL)으로 변화된 비율은 7%였으며, 기준 HDL 콜레스테롤 수치가 정상에서 저콜레스테롤혈증 (≥40 에서 <40 mg/dL)으로 변화된 비율은 12.9%였습니다. 기준 트리글리세라이드 수치가 정상이었던 환자 중 8.5%는 정상에서 고트리글리세라이드혈증 (<150 에서 ≥200 mg/dL)으로 변화되었습니다.
알츠하이머병으로 인한 치매 관련 불안: 알츠하이머병으로 인한 치매 관련 불안 환자 (55~90세)를 대상으로 한 12주 위약 대조, 고정 용량 임상 시험에서, 총 콜레스테롤, LDL 콜레스테롤 및 HDL 콜레스테롤의 변화는 REXULTI 치료군과 위약 치료군에서 유사했습니다.
표 5는 REXULTI 치료군과 위약 치료군에서 공복 트리글리세라이드 변화를 보인 환자의 비율을 보여줍니다.
| 기준치에서 기준치 이후 변화를 보인 환자 비율 | ||||
|---|---|---|---|---|
| 트리글리세라이드 | 위약 | 1 mg/day | 2 mg/day | 3 mg/day |
| n=변화를 보인 환자 수 | ||||
|
||||
| 정상에서 고트리글리세라이드혈증 (<150 및 200~<500 mg/dL) |
6% (10/157)* |
9% (9/99)* |
13% (17/133)* |
6% (6/94)* |
| 경계선상에서 고트리글리세라이드혈증 (150 및 <200mg/dL 에서 200 및 <500 mg/dL) |
12% (3/26)* |
33% (2/6)* |
28% (7/25)* |
26% (6/23)* |
| 정상/경계선상에서 고트리글리세라이드혈증 (<200 mg/dL 에서 200 및 <500 mg/dL) |
7% (13/183)* |
11% (11/105)* |
15% (24/158)* |
10% (12/117)* |
12주 동안 REXULTI로 치료받고 12주 활성 치료 연장 연구에 참여한 환자 중 REXULTI를 복용한 환자의 9%는 기준 공복 총 콜레스테롤 수치가 정상(<200 mg/dL)에서 고지혈증(≥240 mg/dL)으로 변화되었고, 16%는 기준 HDL 콜레스테롤 수치가 정상에서 저하(≥40에서 <40 mg/dL)로 변화되었습니다. 기준 중성지방 수치가 정상인 환자 중 18%는 정상(<150 mg/dL)에서 고지혈증(200~<500 mg/dL)으로 변화되었습니다.
체중 증가
REXULTI를 포함한 비정형 항정신병약물로 치료받은 환자에서 체중 증가가 관찰되었습니다. 기준선에서 체중을 모니터링하고 그 이후로 자주 모니터링하십시오.
주요 우울 장애의 추가 치료: 표 6은 MDD 환자를 대상으로 한 6주 위약 대조, 고정 용량 임상 연구에서 최종 방문 시 체중 증가 데이터와 체중이 ≥7% 증가한 성인 환자의 비율을 보여줍니다.
| 위약 | 1 mg/일 | 2 mg/일 | 3 mg/일 | |
|---|---|---|---|---|
| n=407 | n=225 | n=187 | n=228 | |
| n=≥7% 변화가 있는 환자 수 | ||||
|
||||
| 최종 방문 시 기준선으로부터의 평균 변화 (kg) | ||||
| 모든 환자 | +0.3 | +1.3 | +1.6 | +1.6 |
| 어떤 방문에서든 체중이 ≥7% 증가한 환자의 비율 (kg) (*n/N) | ||||
| 2% | 5% | 5% | 2% | |
| (8/407)* | (11/225)* | (9/187)* | (5/228)* | |
장기간 개방표지 우울증 연구에서 체중 증가로 인해 4%의 환자가 약물 복용을 중단했습니다. REXULTI는 26주차에 기준치 대비 평균 체중 변화 2.9kg, 52주차에 3.1kg 증가와 관련이 있었습니다. 장기간 개방표지 우울증 연구에서 환자의 30%가 체중이 ≥7% 증가했고, 4%는 체중이 ≥7% 감소했습니다.
조현병 (성인): 표 7은 성인 조현병 환자를 대상으로 한 6주간 위약 대조, 고정 용량 임상 연구에서 마지막 방문 시 체중 증가 데이터와 체중이 ≥7% 증가한 성인 환자의 비율을 보여줍니다.
| 위약 | 1mg/일 | 2mg/일 | 4mg/일 | |
|---|---|---|---|---|
| n=362 | n=120 | n=362 | n=362 | |
| n=≥7% 변화를 보인 환자 수 | ||||
|
||||
| 마지막 방문 시 기준치 대비 평균 변화 (kg) | ||||
| 모든 환자 | +0.2 | +1.0 | +1.2 | +1.2 |
| 어떤 방문에서든 체중이 ≥7% 증가한 환자의 비율 (kg) (*n/N) | ||||
| 4% | 10% | 11% | 10% | |
| (15/362)* | (12/120)* | (38/362)* | (37/362)* | |
성인 환자를 대상으로 한 장기간 개방표지 스키조프레니아 연구에서 체중 증가로 인해 0.6%의 환자가 약물 복용을 중단했습니다. REXULTI는 26주차에 기준치 대비 평균 체중 변화가 1.3kg, 52주차에는 2.0kg이었습니다. 장기간 개방표지 스키조프레니아 연구에서 환자의 20%가 체중이 ≥7% 증가했고, 10%는 체중이 ≥7% 감소했습니다.
소아 및 청소년 환자(13~17세) 스키조프레니아: 소아 스키조프레니아 환자를 대상으로 한 장기간 개방표지 연구에서 체중 증가로 인해 0.5%의 환자가 약물 복용을 중단했습니다. 개방표지 연구 기준치부터 마지막 방문까지 평균 체중 증가량은 3.8kg이었습니다. 정상적인 성장을 고려하여 z-점수를 도출했습니다(표준편차[SD]로 측정). z-점수는 연령 및 성별에 맞는 인구 표준과 비교하여 소아 및 청소년의 자연적인 성장을 정규화합니다. z-점수 변화가 <0.5 SD인 경우 임상적으로 유의하지 않은 것으로 간주됩니다. 이 연구에서 개방표지 기준치부터 마지막 방문까지 체중의 평균 z-점수 변화는 0.10 SD였으며, 환자의 20%는 연령 및 성별을 고려한 체중 z-점수가 기준치보다 최소 0.5 SD 이상 증가했습니다. 소아 환자를 치료할 때는 체중 증가를 모니터링하고 정상적인 성장에 예상되는 체중 증가와 비교하여 평가해야 합니다.
알츠하이머병으로 인한 치매 관련 불안: 알츠하이머병으로 인한 치매 관련 불안 환자(51~90세)를 대상으로 한 12주간의 위약 대조, 고정 용량 임상 연구에서 어떤 방문에서든 체중이 ≥7%(kg) 증가한 환자의 비율은 REXULTI군에서 2%, 위약군에서 0%였습니다.
12주 동안 REXULTI로 치료받았고 12주간의 활성 치료 연장 연구에 참여한 환자의 경우, 기준치부터 마지막 방문까지 REXULTI와 관련된 평균 체중(kg) 변화는 없었습니다. 이 연장 연구에서 환자의 4%가 체중이 ≥7% 증가했고, 5%는 기준치부터 마지막 방문까지 체중이 ≥7% 감소했습니다.
5.7 병적 도박 및 기타 강박 행동
시판 후 사례 보고에 따르면 환자는 특히 도박에 대한 강렬한 충동을 경험하고 REXULTI를 복용하는 동안 이러한 충동을 조절할 수 없는 경우가 있습니다. 덜 빈번하게 보고된 다른 강박 충동에는 성적 충동, 쇼핑, 식사 또는 폭식 및 기타 충동적이거나 강박적인 행동이 포함됩니다. 환자는 이러한 행동이 비정상적이라는 것을 인식하지 못할 수 있으므로, 처방자는 환자 또는 보호자에게 REXULTI 치료 중 새로운 또는 강렬한 도박 충동, 강박적인 성적 충동, 강박적인 쇼핑, 폭식 또는 강박적인 식사 또는 기타 충동의 발생 여부를 구체적으로 질문하는 것이 중요합니다. 모든 경우는 아니지만, 일부 경우에는 용량을 줄이거나 약물 복용을 중단했을 때 충동이 사라졌다는 보고가 있었습니다. 강박 행동은 인식되지 않으면 환자와 다른 사람들에게 해를 끼칠 수 있습니다. 환자가 이러한 충동을 나타내는 경우 용량 감소 또는 약물 복용 중단을 고려하십시오.
5.8 백혈구 감소증, 호중구 감소증 및 무과립구증
항정신병제 치료 중 백혈구 감소증과 호중구 감소증이 보고되었습니다. 이 계열의 다른 약물에서 무과립구증(치명적인 경우 포함)이 보고되었습니다.
백혈구 감소증과 호중구 감소증의 가능한 위험 요인에는 기존의 백혈구 수 또는 절대 호중구 수(ANC)가 낮은 경우와 약물 유발 백혈구 감소증 또는 호중구 감소증의 병력이 포함됩니다. 기존의 백혈구 수 또는 ANC가 낮거나 약물 유발 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자의 경우, 치료 초기 몇 달 동안 자주 완전 혈구 수(CBC) 검사를 실시하십시오. 이러한 환자의 경우, 다른 원인이 없는 상황에서 백혈구 수가 임상적으로 유의하게 감소하는 첫 징후가 나타나면 REXULTI 복용 중단을 고려하십시오.
임상적으로 유의한 호중구 감소증이 있는 환자의 경우 발열 또는 기타 감염 증상이나 징후를 모니터링하고 이러한 증상이나 징후가 나타나면 즉시 치료하십시오. 절대 호중구 수가 <1000/mm3인 환자의 경우 REXULTI 복용을 중단하고 회복될 때까지 백혈구 수를 추적 관찰하십시오.
5.9 기립성 저혈압 및 실신
비정형 항정신병제는 기립성 저혈압과 실신을 유발합니다. 일반적으로 위험은 초기 용량 적정 중과 용량을 증가시킬 때 가장 큽니다. 성인 MDD 환자에서 REXULTI와 ADT 병용에 대한 단기간 위약 대조 임상 연구에서 REXULTI와 ADT 병용 치료 환자와 위약과 ADT 병용 치료 환자를 비교했을 때 기립성 저혈압 관련 이상 반응의 발생률은 다음과 같습니다. 어지러움(2% 대 2%)과 기립성 저혈압(0.1% 대 0%). 성인 스키조프레니아 환자에서 REXULTI에 대한 단기간 위약 대조 임상 연구에서 REXULTI 치료 환자와 위약 치료 환자를 비교했을 때 기립성 저혈압 관련 이상 반응의 발생률은 다음과 같습니다. 어지러움(2% 대 2%), 기립성 저혈압(0.4% 대 0.2%) 및 실신(0.1% 대 0%). 알츠하이머병으로 인한 치매 관련 불안 환자를 대상으로 한 12주간의 위약 대조 임상 연구에서 REXULTI 치료 환자와 위약 치료 환자를 비교했을 때 기립성 저혈압 관련 이상 반응의 발생률은 다음과 같습니다. 어지러움(3% 대 3%), 기립성 저혈압(1% 대 1%) 및 실신(0.2% 대 0.8%).
저혈압에 취약한 환자(예: 노인 환자, 탈수 환자, 저혈량 환자, 항고혈압제 병용 치료 환자), 알려진 심혈관 질환 환자(심근 경색, 허혈성 심장 질환, 심부전 또는 전도 이상 병력), 뇌혈관 질환 환자의 경우 기립성 활력 징후를 모니터링해야 합니다. REXULTI는 최근 심근 경색 또는 불안정한 심혈관 질환 병력이 있는 환자에게 평가되지 않았습니다. 이러한 환자는 시판 전 임상 연구에서 제외되었습니다.
5.10 낙상
REXULTI를 포함한 항정신병약은 졸음, 기립성 저혈압, 운동 및 감각 불안정을 유발할 수 있으며, 이는 낙상 및 그에 따른 골절 또는 기타 부상으로 이어질 수 있습니다. 이러한 효과를 악화시킬 수 있는 질병, 상태 또는 약물을 복용하는 환자의 경우, 항정신병 치료를 시작할 때 그리고 장기간 항정신병 치료를 받는 환자에게는 반복적으로 낙상 위험 평가를 완료하십시오.
5.11 발작
다른 항정신병 약물과 마찬가지로 REXULTI는 발작을 유발할 수 있습니다. 이러한 위험은 발작 병력이 있거나 발작 역치를 낮추는 상태를 가진 환자에게서 가장 큽니다. 발작 역치를 낮추는 상태는 고령 환자에서 더 흔할 수 있습니다.
5.12 체온 조절 장애
비정형 항정신병약은 신체의 심부 체온을 낮추는 능력을 손상시킬 수 있습니다. 격렬한 운동, 극심한 열에 대한 노출, 탈수 및 항콜린성 약물은 심부 체온 상승에 기여할 수 있습니다. 이러한 상태를 경험할 수 있는 환자에게는 REXULTI를 주의하여 사용하십시오.
5.14 인지 및 운동 장애 가능성
다른 항정신병 약물과 마찬가지로 REXULTI는 졸음을 유발할 수 있으며 판단력, 사고력 또는 운동 기술을 손상시킬 가능성이 있습니다. MDD 환자를 대상으로 한 6주간의 위약 대조 임상 연구에서 졸음(진정 및 과다수면 포함)은 REXULTI와 ADT 병용 치료 환자의 4%에서 보고된 반면, 위약과 ADT 병용 치료 환자에서는 1%에서 보고되었습니다.
성인 정신분열증 환자를 대상으로 한 6주간의 위약 대조 임상 연구에서 졸음(진정 및 과다수면 포함)은 REXULTI 치료 환자의 5%에서 보고된 반면, 위약 치료 환자에서는 3%에서 보고되었습니다.
알츠하이머병으로 인한 치매와 관련된 불안을 가진 환자(51~90세)를 대상으로 한 12주간의 위약 대조, 고정 용량 임상 연구에서 졸음(진정 포함)은 REXULTI로 치료받은 환자의 3%에서 보고된 반면, 위약으로 치료받은 환자에서는 1%에서 보고되었습니다.
REXULTI 치료가 자신에게 부정적인 영향을 미치지 않는다고 합리적으로 확신할 때까지 위험한 기계(자동차 포함)를 작동하지 않도록 환자에게 주의를 주어야 합니다.
6 부작용 반응
다음의 유해 반응은 이 약물 설명서의 다른 부분에서 더 자세히 설명되어 있습니다.
- 치매 관련 정신병이 있는 고령 환자의 사망률 증가 [경고, 경고 및 주의사항 (5.1) 참조]
- 청소년 및 젊은 성인의 자살 생각 및 행동 [경고, 경고 및 주의사항 (5.2) 참조]
- 치매 관련 정신병이 있는 고령 환자의 뇌혈관계 유해 반응(뇌졸중 포함) [경고 및 주의사항 (5.3) 참조]
- 악성 신경이완제 증후군(NMS) [경고 및 주의사항 (5.4) 참조]
- 지연성 운동 이상증 [경고 및 주의사항 (5.5) 참조]
- 대사 변화 [경고 및 주의사항 (5.6) 참조]
- 병적 도박 및 기타 강박 행동 [경고 및 주의사항 (5.7) 참조]
- 백혈구 감소증, 호중구 감소증 및 무과립구증 [경고 및 주의사항 (5.8) 참조]
- 기립성 저혈압 및 실신 [경고 및 주의사항 (5.9) 참조]
- 낙상 [경고 및 주의사항 (5.10) 참조]
- 발작 [경고 및 주의사항 (5.11) 참조]
- 체온 조절 장애 [경고 및 주의사항 (5.12) 참조]
- 연하곤란 [경고 및 주의사항 (5.13) 참조]
- 인지 및 운동 장애 가능성 [경고 및 주의사항 (5.14) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
주요 우울 장애(MDD)의 추가 치료
REXULTI의 안전성은 주요 우울 장애 진단을 받은 1054명의 성인 환자(18~65세)를 대상으로 평가되었습니다. 이 환자들은 지속적인 항우울제 치료에 추가적인 치료로 REXULTI를 1mg~3mg/일 용량으로 투여받은 6주간의 위약 대조, 고정 용량 임상 시험 2건에 참여했습니다. 위약군 환자는 계속해서 항우울제 치료를 받았습니다 [임상 연구 (14.1) 참조].
성인의 추가 MDD에 대한 REXULTI 연구에서 나타난 유해 반응
급성 치료(MDD 환자의 경우 최대 6주) 중 발생한 REXULTI의 추가 사용과 관련된 유해 반응(발생률 2% 이상 및 추가 REXULTI 발생률이 추가 위약보다 높음)은 표 8에 나와 있습니다.
| 위약 (N=411) % |
REXULTI | |||||
|---|---|---|---|---|---|---|
| 1mg/일 (N=226) % |
2mg/일 (N=188) % |
3mg/일 (N=229) % |
모든 REXULTI (N=643) % |
|||
| 위장관 장애 | ||||||
| 변비 | 1 | 3 | 2 | 1 | 2 | |
| 일반 장애 및 투여 부위 상태 | ||||||
| 피로 | 2 | 3 | 2 | 5 | 3 | |
| 감염 및 기생충 감염 | ||||||
| 비인두염 | 2 | 7 | 1 | 3 | 4 | |
| 검사 | ||||||
| 체중 증가 | 2 | 7 | 8 | 6 | 7 | |
| 혈액 코르티솔 감소 | 1 | 4 | 0 | 3 | 2 |
| 대사 및 영양 | |||||
| 식욕 증가 | 2 | 3 | 3 | 2 | 3 |
| 신경계 장애 | |||||
| 아카시시아 | 2 | 4 | 7 | 14 | 9 |
| 두통 | 6 | 9 | 4 | 6 | 7 |
| 졸음 | 0.5 | 4 | 4 | 6 | 5 |
| 떨림 | 2 | 4 | 2 | 5 | 4 |
| 현기증 | 1 | 1 | 5 | 2 | 3 |
| 정신 장애 | |||||
| 불안 | 1 | 2 | 4 | 4 | 3 |
| 불안정 | 0 | 2 | 3 | 4 | 3 |
추가 MDD 연구에서 용량 관련 이상 반응
연구 1과 2에서 REXULTI와 ADT 병용 치료 환자에게 발생한 이상 반응 중 발생률이 ≥2%인 경우, 아카시시아 및 불안의 발생률은 용량 증가에 따라 증가했습니다.
성인
REXULTI의 안전성은 조현병 진단을 받은 852명의 성인 환자(18~65세)를 대상으로 한 2건의 6주간 위약 대조, 고정 용량 임상 연구에서 평가되었으며, 이 연구에서 REXULTI는 1mg, 2mg 및 4mg의 일일 용량으로 투여되었습니다 [임상 연구 (14.2) 참조].
조현병 치료를 위해 REXULTI로 치료받은 환자에서 2% 이상의 발생률로 나타난 이상 반응
조현병 성인 환자를 대상으로 한 단기(최대 6주) 연구에서 REXULTI와 관련된 이상 반응(발생률 2% 이상 및 위약보다 REXULTI 발생률이 높음)은 표 9에 나와 있습니다.
| 위약 (N=368) % |
REXULTI | ||||
|---|---|---|---|---|---|
| 1mg/일 (N=120) % |
2mg/일 (N=368) % |
4mg/일 (N=364) % |
모든 REXULTI (N=852) % |
||
| 위장 장애 | |||||
| 소화 불량 | 2 | 6 | 2 | 3 | 3 |
| 설사 | 2 | 1 | 3 | 3 | 3 |
| 검사 | |||||
| 체중 증가 | 2 | 3 | 4 | 4 | 4 |
| 혈중 크레아틴 키나제 증가 | 1 | 4 | 2 | 2 | 2 |
| 신경계 장애 | |||||
| 아카시시아 | 5 | 4 | 5 | 7 | 6 |
| 진전 | 1 | 2 | 2 | 3 | 3 |
| 진정 | 1 | 2 | 2 | 3 | 2 |
알츠하이머병으로 인한 치매와 관련된 불안
REXULTI의 안전성은 알츠하이머병으로 인한 치매와 관련된 불안이라는 진단을 받은 503명의 환자(51~90세)를 대상으로 평가되었으며, 이 환자들은 REXULTI가 1일 2mg~3mg의 용량으로 투여된 2건의 12주 위약 대조, 고정 용량 임상 연구에 참여했습니다 [임상 연구(14.3) 참조].
유해 반응으로 인한 치료 중단
2건의 12주 위약 대조, 고정 용량 임상 연구에서 REXULTI로 치료받은 환자의 총 5.6%(28/503)와 위약으로 치료받은 환자의 4.8%(12/251)가 유해 반응으로 인해 치료를 중단했습니다.
알츠하이머병으로 인한 치매와 관련된 불안 치료를 위해 REXULTI로 치료받은 환자에서 2% 이상의 발생률로 나타난 유해 반응
알츠하이머병으로 인한 치매와 관련된 불안 치료를 위한 노인 환자에 대한 12주 고정 용량 임상 연구에서 REXULTI와 관련된 유해 반응(발생률 ≥2% 및 위약보다 높음)은 표 10에 나와 있습니다.
| 위약 (N=251) % |
REXULTI | ||||
|---|---|---|---|---|---|
| 1mg/일* (N=137) % |
2mg/일 (N=213) % |
3mg/일 (N=153) % |
모든 REXULTI (N=503) % |
||
|
|||||
| 감염 및 기생충 감염 | |||||
| 비인두염 | 2 | 4 | 2 | 3 | 3 |
| 요로 감염 | 1 | 2 | 3 | 3 | 3 |
| 신경계 장애 | |||||
| 어지러움† | 2 | 1 | 5 | 3 | 3 |
| 두통 | 8 | 9 | 9 | 7 | 8 |
| 졸음‡ | 1 | 2 | 3 | 4 | 3 |
| 정신 장애 | |||||
| 불면증§ | 3 | 5 | 5 | 2 | 4 |
추체외로 증상
주요 우울 장애의 병용 치료
아카시지아를 제외한 추체외로 증상(EPS) 관련 이상 반응의 발생률은 REXULTI와 ADT 병용 치료 환자군에서 6%, 위약과 ADT 병용 치료 환자군에서 3%였습니다. REXULTI와 ADT 병용 치료 환자군의 아카시지아 발생률은 9%였고, 위약과 ADT 병용 치료 환자군은 2%였습니다.
6주 위약 대조 MDD 연구에서 EPS에 대한 Simpson-Angus 등급 척도(SAS), 아카시지아에 대한 Barnes 아카시지아 등급 척도(BARS), 이상 운동에 대한 이상 자발 운동 점수(AIMS)에 대한 데이터가 객관적으로 수집되었습니다. SAS, BARS 및 AIMS에 대한 마지막 방문 시 기준선으로부터의 평균 변화는 REXULTI와 ADT 병용 치료 환자군과 위약 치료 환자군에서 비슷했습니다. BARS(4% 대 0.6%) 및 SAS(4% 대 3%)에 대해 정상에서 비정상으로 변화한 환자의 비율은 REXULTI와 ADT 병용 치료 환자군에서 위약과 ADT 병용 치료 환자군보다 더 높았습니다.
정신분열병
아카시지아를 제외한 보고된 EPS 관련 이상 반응의 발생률은 REXULTI 치료 환자군에서 5%, 위약 치료 환자군에서 4%였습니다. REXULTI 치료 환자군의 아카시지아 발생률은 6%였고, 위약 치료 환자군은 5%였습니다.
성인의 6주 위약 대조, 고정 용량 정신분열병 연구에서 EPS에 대한 Simpson-Angus 등급 척도(SAS), 아카시지아에 대한 Barnes 아카시지아 등급 척도(BARS), 이상 운동에 대한 이상 자발 운동 척도(AIMS)에 대한 데이터가 객관적으로 수집되었습니다. SAS, BARS 및 AIMS에 대한 마지막 방문 시 기준선으로부터의 평균 변화는 REXULTI 치료 환자군과 위약 치료 환자군에서 비슷했습니다. BARS(2% 대 1%) 및 SAS(7% 대 5%)에 대해 정상에서 비정상으로 변화한 환자의 비율은 REXULTI 치료 환자군에서 위약보다 더 높았습니다.
알츠하이머병으로 인한 치매와 관련된 불안
아카시지아를 제외한 보고된 EPS 관련 이상 반응의 발생률은 REXULTI 치료 환자군에서 3%, 위약 치료 환자군에서 2%였습니다. REXULTI 치료 환자군의 아카시지아 발생률은 1%였고, 위약 치료 환자군은 0%였습니다.
알츠하이머병으로 인한 치매와 관련된 불안에 대한 12주 위약 대조, 고정 용량 연구에서 EPS에 대한 Simpson-Angus 등급 척도(SAS), 아카시지아에 대한 Barnes 아카시지아 등급 척도(BARS), 이상 운동에 대한 이상 자발 운동 척도(AIMS)에 대한 데이터가 객관적으로 수집되었습니다. SAS, BARS 및 AIMS에 대한 마지막 방문 시 기준선으로부터의 평균 변화는 REXULTI 치료 환자군과 위약 치료 환자군에서 비슷했습니다. SAS(6% 대 2%)에 대해 정상에서 비정상으로 변화한 환자의 비율은 REXULTI 치료 환자군에서 위약보다 더 높았습니다.
이상 운동증
이상 운동증 증상은 치료 첫 며칠 동안 민감한 개인에게 발생할 수 있습니다. 이상 운동증 증상에는 경부 근육의 경련이 포함되며, 때로는 인후의 긴장, 삼키기 어려움, 호흡 곤란 및/또는 혀 돌출로 진행될 수 있습니다. 이러한 증상은 저용량에서 발생할 수 있지만, 고활성 및 고용량의 1세대 항정신병 약물에서 더 자주 그리고 더 심각하게 발생합니다. 급성 이상 운동증의 위험이 높은 것은 남성과 젊은 연령대에서 관찰됩니다.
REXULTI의 임상 시험 평가 중 관찰된 기타 이상 반응
MDD 및 정신분열병 성인 환자에 대한 단기간 위약 대조 시험에서 위약보다 발생 빈도가 높고(≥1%), 위약보다 높은 기타 이상 반응은 아래에 나와 있습니다. 다음 목록에는 다음과 같은 이상 반응이 포함되어 있지 않습니다. 1) 이전 표 또는 라벨의 다른 곳에 이미 나열된 것, 2) 약물 원인이 원격인 것, 3) 너무 일반적이어서 정보가 없는 것, 4) 임상적으로 중요한 의미가 없는 것으로 간주되지 않은 것, 또는 5) 위약과 동일하거나 그 이하의 비율로 발생한 것.
안과 질환: 시력 흐림
위장관 질환: 메스꺼움, 구강 건조, 타액 과다 분비, 복통, 팽만감
검사: 혈중 프로락틴 증가
근골격계 및 결합 조직 질환: 근육통
정신 질환: 이상 꿈
피부 및 피하 조직 질환: 다한증
소아 환자(13~17세)
13~17세 정신분열병 소아 환자를 대상으로 한 2년간의 지속적인 개방형 연구에서 안전성이 194명의 환자(그중 140명이 REXULTI를 6개월 이상 복용)에서 평가되었습니다. 이 연령대에 대한 임상 연구에서 보고된 이상 반응은 일반적으로 성인 환자에서 관찰된 것과 유사했습니다.
6.2 시판 후 경험
다음 이상 반응은 REXULTI의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
신경계 장애: 악성 신경이완제 증후군
7 약물 상호 작용
7.1 REXULTI와 임상적으로 중요한 상호작용이 있는 약물
REXULTI와 임상적으로 중요한 약물 상호작용에 대해서는 표 11을 참조하십시오.
|
|
| 강력한 CYP3A4 억제제 | |
| 임상적 영향: | REXULTI를 강력한 CYP3A4 억제제와 병용하면 REXULTI 단독 사용과 비교하여 브렉시피프라졸의 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 강력한 CYP3A4 억제제와 REXULTI를 병용하는 경우 REXULTI 용량을 줄입니다 [용법 및 용량 (2.7) 참조]. |
| 강력한 CYP2D6 억제제* | |
| 임상적 영향: | REXULTI를 강력한 CYP2D6 억제제와 병용하면 REXULTI 단독 사용과 비교하여 브렉시피프라졸의 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 강력한 CYP2D6 억제제와 REXULTI를 병용하는 경우 REXULTI 용량을 줄입니다 [용법 및 용량 (2.7) 참조]. |
| CYP3A4 억제제 및 CYP2D6 억제제 모두 | |
| 임상적 영향: | 1) 강력한 CYP3A4 억제제와 강력한 CYP2D6 억제제 또는 2) 중등도 CYP3A4 억제제와 강력한 CYP2D6 억제제 또는 3) 강력한 CYP3A4 억제제와 중등도 CYP2D6 억제제 또는 4) 중등도 CYP3A4 억제제와 중등도 CYP2D6 억제제와 REXULTI를 병용하면 REXULTI 단독 사용과 비교하여 브렉시피프라졸의 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 1) 강력한 CYP3A4 억제제와 강력한 CYP2D6 억제제 또는 2) 중등도 CYP3A4 억제제와 강력한 CYP2D6 억제제 또는 3) 강력한 CYP3A4 억제제와 중등도 CYP2D6 억제제 또는 4) 중등도 CYP3A4 억제제와 중등도 CYP2D6 억제제와 REXULTI를 병용하는 경우 REXULTI 용량을 감소시킵니다 [용법 및 용량 (2.7) 참조]. |
| 강력한 CYP3A4 유도제 | |
| 임상적 영향: | REXULTI와 강력한 CYP3A4 유도제를 병용하면 REXULTI 단독 사용과 비교하여 브렉시피프라졸의 노출이 감소했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 강력한 CYP3A4 유도제와 REXULTI를 병용하는 경우 REXULTI 용량을 증가시킵니다 [용법 및 용량 (2.7) 참조]. |
7.2 REXULTI와 임상적으로 중요한 상호작용이 없는 약물
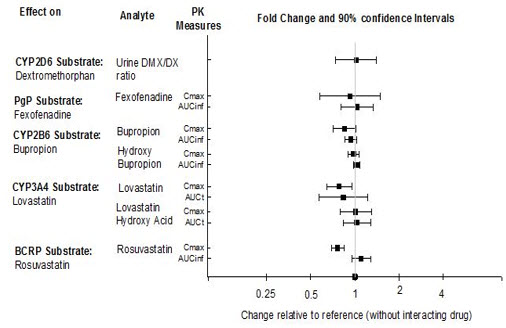
약동학적 연구에 따르면, CYP2B6 억제제(예: 티클로피딘) 또는 위산도 조절제(예: 오메프라졸)와 병용 투여 시 REXULTI의 용량 조절이 필요하지 않습니다. 또한, CYP2D6(예: 덱스트로메토르판), CYP3A4(예: 로바스타틴), CYP2B6(예: 부프로피온), BCRP(예: 로수바스타틴) 또는 P-gp(예: 펙소페나딘) 기질을 REXULTI와 병용 투여하는 경우 용량 조절이 필요하지 않습니다.
8 특정 집단에서의 사용
8.1 임신
임신 노출 등록
임신 중 REXULTI에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록이 있습니다. 자세한 내용은 1-866-961-2388로 전화하거나 http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/를 방문하여 전국 정신과 약물 임신 등록부에 문의하십시오.
위험 요약
임산부를 대상으로 REXULTI를 사용하여 약물 관련 위험을 알아보기 위한 적절하고 잘 통제된 연구는 수행되지 않았습니다. 그러나 임신 3분기에 REXULTI와 같은 항정신병 약물에 노출된 산모의 신생아는 추체외로 증상 및/또는 금단 증상의 위험이 있습니다. 동물 생식 연구에서, 기관 형성 중 임신한 랫트와 토끼에게 경구로 brexpiprazole을 투여했을 때 mg/m2 기준으로 하루 최대 4mg의 최대 권장 인체 용량(MRHD)의 각각 73배 및 146배에 해당하는 용량에서 기형 발생은 관찰되지 않았습니다. 그러나 임신한 랫트에게 기관 형성 기간부터 수유 기간까지 brexpiprazole을 투여했을 때, MRHD의 73배 용량에서 새끼의 출산 후 사망 수가 증가했습니다 [자료 참조]. 지정된 모집단의 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
자료
동물 자료
임신한 랫트에게 기관 형성 기간 동안 brexpiprazole을 mg/m2 기준으로 하루 3, 10 및 30mg/kg(MRHD의 7.3배, 24배 및 73배)의 경구 용량으로 처리했습니다. Brexpiprazole은 기형 유발 물질이 아니었으며 MRHD의 73배까지의 용량에서 유해한 발달 효과를 일으키지 않았습니다.
임신한 토끼에게 기관 형성 기간 동안 brexpiprazole을 mg/m2 기준으로 하루 10, 30 및 150mg/kg(MRHD의 49배, 146배 및 730배)의 경구 용량으로 처리했습니다. Brexpiprazole은 기형 유발 물질이 아니었으며 MRHD의 146배까지의 용량에서 유해한 발달 효과를 일으키지 않았습니다. 체중 감소, 골화 지연 및 내장 및 골격 변이 발생률 증가는 MRHD의 730배 용량(모체 독성을 유발하는 용량)에서 태아에서 관찰되었습니다.
임신한 랫트에게 기관 형성 기간부터 수유 기간까지 brexpiprazole을 하루 3, 10 및 30mg/kg(MRHD의 7.3배, 24배 및 73배)의 경구 용량으로 투여한 연구에서, MRHD의 73배 용량에서 생존 새끼 수가 감소하고 출산 후 조기 사망이 증가했습니다. 암컷의 수유 장애, 저체중 및 새끼의 체중 증가 감소는 MRHD의 73배에서 관찰되었지만 24배에서는 관찰되지 않았습니다.
8.4 소아 사용
조현병
13세 이상 소아 환자에서 조현병 치료를 위한 REXULTI의 안전성 및 유효성이 입증되었습니다. 이러한 환자군에서 REXULTI의 사용은 조현병 성인 환자를 대상으로 한 적절하고 잘 통제된 연구의 증거, 성인 및 소아 환자의 약동학적 데이터, 13~17세 소아 환자의 안전성 데이터에 의해 뒷받침됩니다 [경고 및 주의 사항 (5.6), 이상 반응 (6.1), 임상 약리학 (12.3) 참조].
13세 미만 소아 환자에서 조현병 치료를 위한 REXULTI의 안전성 및 유효성은 입증되지 않았습니다.
주요 우울 장애
소아 환자에서 주요 우울 장애 치료를 위한 REXULTI의 안전성 및 유효성은 입증되지 않았습니다. 항우울제는 소아 환자에서 자살 생각 및 행동의 위험을 증가시켰습니다 [경고, 경고 및 주의 사항 (5.2) 참조].
자폐 스펙트럼 장애와 관련된 과민성
소아 환자에서 자폐 스펙트럼 장애 관련 과민성 치료에 대한 REXULTI의 안전성 및 유효성은 확립되지 않았습니다. 자폐 스펙트럼 장애 관련 과민성을 가진 5세에서 17세 사이의 REXULTI 치료를 받은 119명의 소아 환자를 대상으로 실시한 8주 이중맹검, 위약 대조, 유연 용량 임상 연구에서 유효성이 입증되지 않았습니다(정신 질환의 진단 및 통계 편람 제5판 [DSM-5] 기준에 따라 진단됨). 이 연구에서 졸음(진정 포함)은 성인 및 노인 환자를 평가한 다른 REXULTI 연구에서 보고된 비율보다 더 높았습니다(REXULTI 치료를 받은 소아 환자의 경우 16% 대 위약의 경우 5%). 연령 및 성별을 보정한 기준치 대비 최종 방문 시 체중 z 점수의 평균 증가는 REXULTI 치료를 받은 환자의 경우 0.3, 위약 치료를 받은 환자의 경우 0.1이었습니다. 기준치 대비 연령 및 성별을 보정한 체중 z 점수가 0.5 SD 이상 증가한 경우는 REXULTI 치료를 받은 환자에서 위약보다 더 높았습니다(19% 대 5%).
이 연구의 119명 환자 중 95명의 환자가 공개 표지 치료 연구에 참여하여 최대 26주 동안 브렉시피프라졸로 매일 치료를 받았습니다. 공개 표지 치료 기간 동안 체중 증가로 인해 치료를 중단한 환자는 2%였습니다. 이전에 8주 동안 REXULTI로 치료받은 환자의 경우 공개 표지 연구 기준치 대비 최종 방문 시 체중 평균 증가는 4.5kg이었으며, 26%의 환자에서 연령 및 성별을 보정한 체중 z 점수가 기준치 대비 0.5 SD 이상 증가했습니다.
소년기 동물 연구
생후 21일(이유 후)부터 성체(생후 90일)까지 1일 1회 3, 10 및 20 mg/kg/일의 브렉시피프라졸 경구 용량을 소년기 랫트에 투여한 후 4주간 회복(무투여) 기간을 두었습니다. 결과는 8주령 청소년기 랫트에서 이전에 실시한 반복 투여 독성 연구에서 관찰된 결과와 유사했습니다. 20 mg/kg/일의 고용량에서 사망이 발생했으며, 수컷의 성적 성숙 지연 및 사육 및 운동 활동 감소가 나타났습니다. 신경 독성 또는 생식 기능에 대한 영향은 없었습니다. 생식 기관 및 유선의 조직 병리학적 변화는 모든 용량에서 발생했으며, 브렉시피프라졸의 약리 작용과 관련이 있었고 성체 랫트에서 관찰된 변화와 비슷했습니다. 모든 소견은 적어도 부분적으로 가역적이었습니다. 8주 또는 9주령부터 26주 동안 1일 1회 1, 3 및 30 mg/kg/일의 브렉시피프라졸 경구 용량을 소년기 개에 투여한 후 8주간 회복(무투여) 기간을 두었습니다. 30 mg/kg/일에서 체중 감소, 무기력증, 심박수 변화 및 미성숙 수컷 생식 기관이 관찰되었습니다. 이러한 소견은 적어도 부분적으로 가역적이었습니다.
8.5 노인 환자 사용
항정신병 약물은 치매 관련 정신병이 있는 노인 환자의 사망 위험을 증가시킵니다. REXULTI는 치매 관련 정신병 환자의 치료에는 승인되지 않았습니다 [경고 경고 사항, 경고 및 주의 사항 (5.1) 참조].
주요 우울 장애(MDD) 및 정신분열병의 보조 치료
MDD에 대한 항우울제 보조 요법 및 정신분열병에 대한 REXULTI 치료를 받은 환자의 총 수 중 248명(3%)이 65세 이상이었으며(여기에는 75세 이상 환자 45명(18%) 포함), 이러한 환자에 대한 REXULTI의 임상 연구에는 65세 이상 환자의 수가 충분하지 않아 젊은 성인 환자와 반응이 다른지 여부를 확인할 수 없었습니다. 일반적으로 노인 환자의 MDD 또는 정신분열병 치료를 위한 용량 선택은 신중해야 하며, 간, 신장 및 심장 기능 저하, 동반 질환 및 기타 약물 치료의 빈도가 더 높다는 점을 고려하여 일반적으로 용량 범위의 하한에서 시작해야 합니다.
알츠하이머병으로 인한 치매 관련 불안
알츠하이머병으로 인한 치매 관련 불안에 대한 임상 연구(연구 6 및 7)에서 REXULTI 치료를 받은 65세 이상 환자의 총 수는 448명(86%)이었으며, 여기에는 65세에서 74세 환자 170명(33%), 75세에서 84세 환자 228명(44%), 85세 이상 환자 50명(10%)이 포함됩니다 [임상 연구 (14.3) 참조].
알츠하이머병으로 인한 치매 관련 불안 치료를 위한 REXULTI의 임상 연구에는 65세 이상 환자의 반응이 젊은 성인 환자와 다른지 여부를 확인하기에 충분한 수의 젊은 성인 환자가 포함되지 않았습니다.
8.6 CYP2D6 저대사자
이 환자는 정상 CYP2D6 대사자보다 브렉시피프라졸 농도가 더 높기 때문에 알려진 CYP2D6 저대사자에게는 용량 조절이 권장됩니다. 코카시안의 약 8%와 흑인/아프리카계 미국인의 3~8%는 CYP2D6 기질을 대사할 수 없으며 저대사자로 분류됩니다 [용법 및 용량 (2.7), 임상 약리학 (12.3) 참조].
8.7 간 손상
중등도에서 중증 간 손상(Child-Pugh 점수 ≥7) 환자의 최대 권장 용량은 경도 간 손상 환자 및 정상 간 기능 환자보다 낮습니다 [용법 및 용량 (2.4) 참조]. 중등도에서 중증 간 손상 환자는 일반적으로 정상 간 기능 환자보다 브렉시피프라졸 노출량이 더 높았습니다 [임상 약리학 (12.3) 참조]. 노출량이 증가하면 REXULTI 관련 이상 반응의 위험이 증가할 수 있습니다 .
8.8 신장애
CrCl<60 mL/분인 환자의 권장 최대 용량은 경도 신장애 환자 및 정상 신장 기능 환자보다 낮습니다 [용법 및 용량 (2.6) 참조]. 신장애 환자는 정상 신장 기능 환자보다 브렉시피프라졸에 대한 노출이 더 높았습니다 [임상 약리학 (12.3) 참조]. 노출 증가는 REXULTI 관련 이상 반응의 위험을 증가시킬 수 있습니다.
9 약물 남용 및 의존성
9.3 Dependence
만성적으로 REXULTI를 투여받은 사람과 동물 모두 약물 중단 시 금단 증상을 보이지 않았습니다. 이는 REXULTI가 신체적 의존성을 유발하지 않음을 시사합니다.
10 과다 복용
REXULTI의 사람 과다 복용에 대한 임상 시험 경험은 제한적입니다.
REXULTI 과다 복용 처치는 보조 요법, 적절한 기도 유지, 산소 공급 및 환기, 증상 관리에 중점을 두어야 합니다. 환자가 회복될 때까지 면밀한 의학적 감독과 모니터링을 계속해야 합니다. 추가적인 과다 복용 관리 권장 사항은 Poison Help Line (1-800-222-1222) 또는 의료 독물학자에게 문의하십시오.
경구 REXULTI 섭취 1시간 후 투여된 경구 활성탄 및 소르비톨(50g/240mL)은 brexpiprazole의 Cmax 및 곡선하면적(AUC)을 각각 약 5%~23% 및 31%~39% 감소시켰습니다. 그러나 REXULTI 과다 복용 치료에서 활성탄의 치료 가능성에 대한 정보는 충분하지 않습니다.
REXULTI 과다 복용 치료에서 혈액 투석의 효과에 대한 정보는 없습니다. brexpiprazole은 혈장 단백질에 대한 결합력이 높기 때문에 혈액 투석은 효과가 없을 가능성이 높습니다.
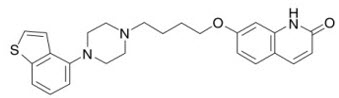
11 설명
비정형 항정신병약물인 브렉시피프라졸은 REXULTI® (브렉시피프라졸) 정제로 이용 가능합니다. 브렉시피프라졸은 7-{4-[4-(1-Benzothiophen-4-yl)piperazin-1-yl]butoxy}quinolin-2(1H)-one입니다. 실험식은 C25H27N3O2S이며, 분자량은 433.57입니다. 화학 구조는 다음과 같습니다.
 |
REXULTI 정제는 경구 투여용이며, 0.25mg, 0.5mg, 1mg, 2mg, 3mg 및 4mg의 강도로 이용 가능합니다. 불활성 성분에는 유당 일수화물, 옥수수 전분, 미결정 셀룰로오스, 히드록시프로필 셀룰로오스, 저치환 히드록시프로필 셀룰로오스, 마그네슘 스테아레이트, 히프로멜로오스 및 활석이 포함됩니다. 착색제에는 이산화티타늄, 산화철 및 페로페리산화철이 포함됩니다.
12 약물동력학
12.1 작용 기전
REXULTI의 주요 우울 장애 부가 치료, 알츠하이머병으로 인한 치매 관련 초조 치료 또는 조현병 치료에서의 작용 기전은 알려져 있지 않습니다. 그러나 REXULTI의 효능은 세로토닌 5-HT1A 및 도파민 D2 수용체에서의 부분 작용제 활성과 세로토닌 5-HT2A 수용체에서의 길항제 활성의 조합을 통해 매개될 수 있습니다.
12.2 약력학
Brexpiprazole은 세로토닌 5-HT1A (0.12 nM), 5-HT2A (0.47 nM), 5-HT2B (1.9 nM), 5-HT7 (3.7 nM), 도파민 D2 (0.30 nM), D3 (1.1 nM), 및 노르아드레날린 α1A (3.8 nM), α1B (0.17 nM), α1D (2.6 nM), α2C (0.59 nM) 수용체를 포함한 여러 모노아민성 수용체에 대한 친화도(Ki로 표시)를 가지고 있습니다. Brexpiprazole은 5-HT1A, D2, D3 수용체에서 부분 작용제로, 5-HT2A, 5-HT2B, 5-HT7, α1A, α1B, α1D, α2C 수용체에서 길항제로 작용합니다. Brexpiprazole은 또한 히스타민 H1 수용체(19 nM) 및 무스카린 M1 수용체(10 µM에서 67% 억제)에 대한 친화도를 나타냅니다.
12.3 약동학
흡수
REXULTI 정제를 단회 투여한 후, brexpiprazole의 최고 혈장 농도는 투여 후 4시간 이내에 나타났으며, 절대적 경구 생체이용률은 95%였습니다. Brexpiprazole의 정상 상태 농도는 투약 후 10~12일 이내에 도달했습니다.
REXULTI는 음식과 함께 또는 음식 없이 투여할 수 있습니다. 표준 고지방 식사와 함께 4mg REXULTI 정제를 투여해도 brexpiprazole의 Cmax 또는 AUC에 유의미한 영향을 미치지 않았습니다. 1일 1회 단회 및 반복 투여 후, brexpiprazole 노출(Cmax 및 AUC)은 투여된 용량에 비례하여 증가했습니다. 시험관내 brexpiprazole 연구에서는 brexpiprazole이 MDRI (P-gp) 및 BCRP와 같은 유출 수송체의 기질이 아님을 나타냈습니다.
분포
정맥 투여 후 brexpiprazole의 분포 용적은 높으며(1.56 ± 0.42 L/kg), 혈관외 분포를 나타냅니다. Brexpiprazole은 혈장에서 혈청 알부민 및 α1-산성 당단백질에 높은 단백질 결합률(99% 이상)을 보이며, 단백질 결합은 신장 또는 간 장애의 영향을 받지 않습니다. 시험관내 연구 결과에 따르면, brexpiprazole의 단백질 결합은 와파린, 디아제팜 또는 디기톡신의 영향을 받지 않습니다.
제거
대사
재조합 인간 시토크롬 P450(CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4)을 사용한 시험관내 brexpiprazole 대사 연구에 따르면, brexpiprazole의 대사는 주로 CYP3A4 및 CYP2D6에 의해 매개되는 것으로 나타났습니다.
생체내 brexpiprazole은 주로 CYP3A4 및 CYP2D6 효소에 의해 대사됩니다. 단회 및 반복 투여 후, brexpiprazole과 주요 대사체인 DM-3411은 전신 순환에서 주요 약물 성분이었습니다. 정상 상태에서 DM-3411은 혈장에서 brexpiprazole 노출(AUC)의 23%~48%를 차지했습니다. DM-3411은 brexpiprazole의 치료 효과에 기여하지 않는 것으로 간추려집니다.
시험관내 데이터에 따르면, brexpiprazole은 CYP450 동종효소를 거의 또는 전혀 억제하지 않았습니다.
배설
[14C]로 표지된 brexpiprazole을 단회 경구 투여한 후, 투여된 방사능의 약 25%와 46%가 각각 소변과 대변에서 회수되었습니다. 변하지 않은 brexpiprazole의 1% 미만이 소변으로 배설되었고, 경구 용량의 약 14%가 변하지 않은 상태로 대변에서 회수되었습니다. 1일 1회 투여 후 brexpiprazole 경구 정제의 겉보기 경구 청소율은 19.8 (±11.4) mL/h/kg입니다. REXULTI를 1일 1회 반복 투여한 후, brexpiprazole과 주요 대사체인 DM-3411의 최종 제거 반감기는 각각 91시간과 86시간이었습니다.
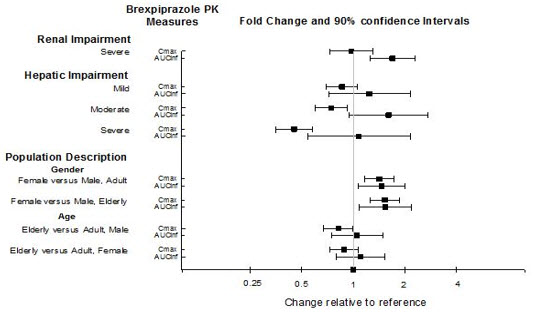
특정 집단 연구
특정 집단에서의 brexpiprazole 노출은 그림 1에 요약되어 있습니다. 모집단 약동학(PK) 분석에 따르면 중등도 신장애 환자에서 brexpiprazole의 노출은 정상 신기능 환자에 비해 더 높았습니다.
그림 1 내인성 요인이 Brexpiprazole 약동학에 미치는 영향
소아 환자
13세에서 17세 사이의 소아 환자 43명을 대상으로 다중 용량 PK 연구(0.5, 1, 2, 3 또는 4mg/일)가 수행되었습니다. 모집단 PK 분석 결과 13세에서 17세 사이의 소아 환자에서 브렉스피프라졸의 전신 노출(Cmax 및 AUC)은 0.5~4mg 용량 범위에서 성인 환자의 전신 노출과 비슷했습니다.
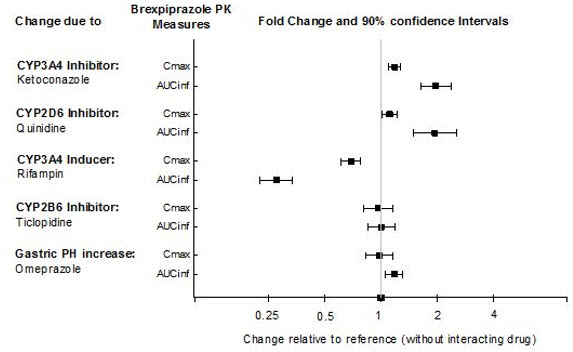
약물 상호작용 연구
브렉스피프라졸 노출에 대한 다른 약물의 영향은 그림 2에 요약되어 있습니다. 시뮬레이션에 따르면, 강력한 CYP2D6 및 CYP3A4 억제제와 함께 CYP2D6의 광범위한 대사자가 투여될 경우 정상 상태에서 AUC 값이 5.1배 증가할 것으로 예상됩니다. 강력한 CYP3A4 억제제가 투여된 CYP2D6의 불량 대사자의 경우 평균 AUC 값이 정상 상태에서 4.8배 증가할 것으로 예상됩니다 [see Drug Interactions (7.1)].
그림 2 브렉스피프라졸 약동학에 대한 다른 약물의 영향
다른 약물의 노출에 대한 REXULTI의 영향은 그림 3에 요약되어 있습니다.
그림 3 다른 약물의 약동학에 대한 REXULTI의 영향
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
발암성
ICR 마우스와 Sprague Dawley 랫드를 대상으로 평생 발암성 연구를 수행했습니다. 브렉시피프라졸은 수컷 및 암컷 마우스에게 0.75, 2, 및 5 mg/kg/day의 용량(mg/m2 체표면적 기준으로 4 mg/day의 경구 MRHD의 0.9~6.1배)으로, 수컷 및 암컷 랫드에게 각각 1, 3, 및 10 mg/kg/day와 3, 10, 및 30 mg/kg/day의 용량(경구 MRHD의 2.4~24배 및 7.3~73배, 수컷 및 암컷)으로 2년 동안 경구 투여되었습니다. 암컷 마우스의 경우 모든 용량에서 유선 선암의 발생률이 증가했으며, 2.4배 및 6.1배 MRHD에서 선편평상피암의 발생률이 증가했습니다. 수컷 마우스에서는 종양 발생률의 증가가 관찰되지 않았습니다. 랫드 연구에서 브렉시피프라졸은 MRHD의 최대 73배의 용량에서도 어느 성별에서도 발암성을 나타내지 않았습니다.
항정신병 약물의 만성 투여 후 설치류의 유선 및 뇌하수체에서 증식성 및/또는 신생물성 변화가 관찰되었으며, 이는 프로락틴 매개로 간주됩니다. 마우스와 랫드 모두에서 브렉시피프라졸의 혈청 프로락틴 수치 증가 가능성이 나타났습니다. 설치류에서 프로락틴 매개 내분비 종양 발견의 인체 위험성과의 관련성은 알려져 있지 않습니다.
돌연변이원성
in vitro 박테리아 역돌연변이 분석(Ames test)에서 브렉시피프라졸은 돌연변이원성이 아니었습니다. 브렉시피프라졸은 랫드의 in vivo 마이크로핵 분석에서 클라스토젠 활성에 대해 음성이었으며, 랫드의 in vivo/in vitro 예정 외 DNA 합성 분석에서 유전독성이 아니었습니다. 포유류 세포를 이용한 in vitro 실험에서 브렉시피프라졸은 세포독성을 유발하는 용량에서만 클라스토젠성을 나타냈습니다. 증거의 무게를 바탕으로 브렉시피프라졸은 인체에 유전독성 위험을 초래하는 것으로 간주되지 않습니다.
생식능력 저하
암컷 랫드는 처리되지 않은 수컷과의 교배 전부터 수정 및 착상까지 (mg/m2 기준으로 경구 MRHD의 0.7배, 7.3배 및 73배에 해당하는) 0.3, 3 또는 30 mg/kg/day의 경구 용량으로 처리되었습니다. 3 및 30 mg/kg/day에서 발정 주기 이상 및 생식력 감소가 관찰되었습니다. 30 mg/kg/day에서 교배 기간 연장 및 착상 전 손실 증가가 관찰되었습니다.
수컷 랫드는 처리되지 않은 암컷과의 교배 63일 전부터 14일간의 교배 기간 동안 (mg/m2 기준으로 경구 MRHD의 7.3배, 24배 및 240배에 해당하는) 3, 10 또는 100 mg/kg/day의 경구 용량으로 처리되었습니다. 어떤 용량의 브렉시피프라졸에서도 수컷의 교배 기간 또는 생식 지수에 차이가 관찰되지 않았습니다.
14 CLINICAL STUDIES
14.1 주요 우울 장애의 병용 치료
REXULTI의 주요 우울 장애(MDD) 병용 치료 효능은 불안 증상이 있거나 없는 성인 환자를 대상으로 한 2건의 6주 이중맹검, 위약 대조, 고정 용량 연구에서 평가되었습니다. 이 환자들은 DSM-IV-TR 기준에 따라 MDD 진단을 받았으며, 현재 에피소드에서 이전 항우울제 치료(1~3회)에 대한 반응이 부적절했고, 예상 항우울제 치료(escitalopram, fluoxetine, paroxetine controlled-release, sertraline, duloxetine delayed release 또는 venlafaxine extended release) 8주 동안에도 부적절한 반응을 보였습니다. 예상 항우울제 치료 단계에서의 부적절한 반응은 치료 과정 전반에 걸쳐 증상이 지속되고 상당한 개선이 없었던 것으로 정의되었습니다.
연구 1(NCT01360645)의 환자들은 REXULTI 2mg 1일 1회 또는 위약 투여군에 무작위 배정되었습니다. 연구 2(NCT01360632)의 환자들은 REXULTI 1mg 또는 3mg 1일 1회 또는 위약 투여군에 무작위 배정되었습니다. REXULTI 투여군 환자들은 모두 1주차에 0.5mg 1일 1회로 치료를 시작했습니다. 2주차에는 모든 치료군에서 REXULTI 용량이 1mg으로 증가되었고, 3주차부터 치료 배정에 따라 1mg으로 유지되거나 2mg 또는 3mg으로 1일 1회 증가되었습니다. 그 후 용량은 남은 4주 동안 유지되었습니다.
주요 평가변수는 몽고메리-아스베르그 우울증 평가 척도(MADRS)의 기준치부터 6주차까지의 변화였습니다. MADRS는 우울 증상의 정도를 평가하는 데 사용되는 10개 항목의 임상의 관련 척도이며, 0은 증상이 없음을, 60은 최악의 증상을 나타냅니다.
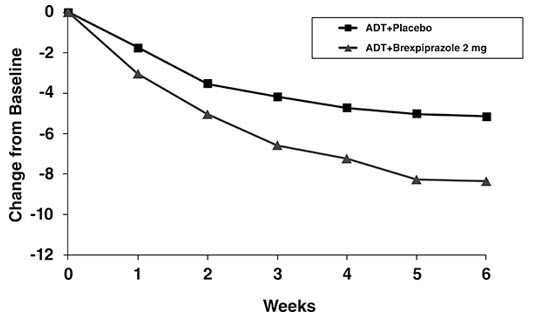
무작위 배정 시 평균 MADRS 총점은 27이었습니다. 연구 1과 2에서 REXULTI(ADT 병용) 2mg 1일 1회 및 3mg 1일 1회는 평균 MADRS 총점 감소에 있어 위약 + ADT보다 우수했습니다. 두 고정 용량 연구의 주요 효능 매개변수 결과는 아래 표 12에 나와 있습니다. 아래 그림 4는 연구 1에서 주요 효능 측정(MADRS)에 따른 반응의 시간 경과를 보여줍니다.
| 연구 | 치료군 | N | 평균 기준치 점수 (SD) | 기준치로부터 LS 평균 변화 (SE) | 위약 차이* (95% CI) |
|
|---|---|---|---|---|---|---|
| SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 조정되지 않은 신뢰 구간 | ||||||
| 1 | REXULTI (2mg/일) + ADT† | 175 | 26.9 (5.7) | -8.4 (0.6) | -3.2 (-4.9, -1.5) | |
| 위약 + ADT | 178 | 27.3 (5.6) | -5.2 (0.6) | — | ||
| 2 | REXULTI (1mg/일) + ADT | 211 | 26.5 (5.6) | -7.6 (0.5) | -1.3 (-2.7, 0.1) | |
| REXULTI (3mg/일) + ADT | 213 | 26.5 (5.3) | -8.3 (0.5) | -2.0 (-3.4, -0.5) | ||
| 위약 + ADT | 203 | 26.5 (5.2) | -6.3 (0.5) | — | ||
인구집단 하위 그룹에 대한 검토 결과 연령, 성별, 인종 또는 예상 항우울제 선택에 따른 반응 차이를 시사하는 결과는 없었습니다.
그림 4 성인 MDD 환자에서 연구 방문(주차)별 MADRS 총점의 기준치 변화 (연구 1)
14.2 조현병
성인 조현병 환자 치료에서 REXULTI의 효능은 DSM-IV-TR 기준에 부합하는 환자를 대상으로 한 6주 무작위 이중맹검 위약 대조 고정 용량 임상 연구 2건에서 입증되었습니다.
연구 3(NCT01396421)과 연구 4(NCT01393613) 모두에서 환자는 1일 1회 REXULTI 2mg 또는 4mg 또는 위약군에 무작위 배정되었습니다. REXULTI 투여군 환자는 1일차부터 4일차까지 1일 1회 1mg으로 치료를 시작했습니다. REXULTI 용량은 5일차부터 7일차까지 2mg으로 증량되었습니다. 그 후 용량은 치료 배정에 따라 1일 1회 2mg으로 유지되거나 1일 1회 4mg으로 증량되어 나머지 5주 동안 유지되었습니다.
두 연구 모두의 1차 효능 평가변수는 양성 및 음성 증상 척도(PANSS) 총점의 기준치 대비 6주차 변화였습니다. PANSS는 30개 항목으로 구성된 척도로, 조현병의 양성 증상(7개 항목), 조현병의 음성 증상(7개 항목) 및 일반적 정신병리(16개 항목)를 각각 1(없음)에서 7(극심함)까지의 척도로 측정하며, PANSS 총점은 30(최상)에서 210(최악)까지의 범위입니다.
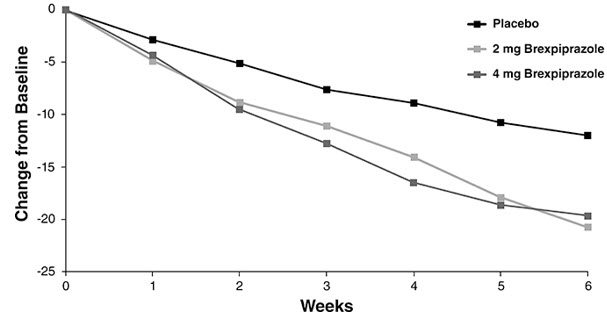
연구 3에서 1일 1회 2mg 및 1일 1회 4mg REXULTI는 모두 PANSS 총점에서 위약보다 우수했습니다. 연구 4에서 1일 1회 4mg REXULTI는 PANSS 총점에서 위약보다 우수했습니다(표 13). 그림 5는 연구 3에서 1차 효능 측정치(PANSS 총점의 기준치 변화)를 기준으로 한 반응의 시간 경과를 보여줍니다.
연령, 성별 및 인종을 기준으로 한 인구집단 하위 그룹 검토 결과 반응 차이를 시사하는 결과는 없었습니다.
| 연구 | 치료군 | N | 기준치 평균 점수 (SD) |
기준치 대비 LS 평균 변화 (SE) | 위약 차이* (95% CI) |
|---|---|---|---|---|---|
| SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 조정되지 않은 신뢰 구간 | |||||
| 3 | REXULTI (1일 2mg)† | 180 | 95.9 (13.8) | -20.7 (1.5) | -8.7 (-13.1, -4.4) |
| REXULTI (1일 4mg) † | 178 | 94.7 (12.1) | -19.7 (1.5) | -7.6 (-12.0, -3.1) | |
| 위약 | 178 | 95.7 (11.5) | -12.0 (1.6) | — | |
| 4 | REXULTI (1일 2mg) | 179 | 96.3 (12.9) | -16.6 (1.5) | -3.1 (-7.2, 1.1) |
| REXULTI (1일 4mg) † | 181 | 95.0 (12.4) | -20.0 (1.5) | -6.5 (-10.6, -2.4) | |
| 위약 | 180 | 94.6 (12.8) | -13.5 (1.5) | — | |
Figure 5 정신분열증 성인 환자에서 연구 방문(주차)별 PANSS 총점의 기준치 변화 (연구 3)
18세에서 65세 사이의 정신분열증 성인 환자에서 유지 치료제로서 REXULTI의 안전성 및 유효성은 무작위 중단 연구(연구 5, NCT01668797)의 유지 단계에서 입증되었습니다. 환자들은 REXULTI 1~4mg/일로 최소 12주 동안 안정화되었습니다 (N=202). 그런 다음 이중 눈가림 치료 단계에서 달성된 안정적인 용량으로 REXULTI를 계속 복용하거나(N=97) 위약으로 전환하도록 무작위 배정되었습니다(N=105).
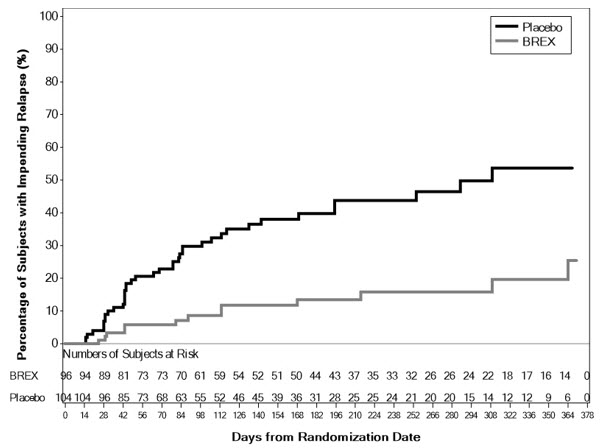
연구 5의 주요 평가변수는 이중 눈가림 단계 동안 재발 임박 시점까지의 시간이었으며, 다음과 같이 정의되었습니다. 1) 임상적 전반적 개선 점수 ≥5(최소 악화) 및 PANSS 개념적 해체, 환각 행동, 의심, 또는 비정상적인 사고 내용 항목에서 점수 >4로 증가, 특정 항목에서 ≥2 증가 또는 결합된 4개의 PANSS 항목에서 ≥4점 증가, 2) 정신병 증상 악화로 인한 입원, 3) 현재 자살 행동, 또는 4) 폭력적/공격적 행동.
사전에 지정된 중간 분석 결과 REXULTI 그룹에 무작위 배정된 환자는 위약 치료 환자에 비해 통계적으로 유의하게 더 긴 재발까지의 시간을 보였습니다. 유효성 유지가 입증되었기 때문에 연구는 그 후 조기에 종료되었습니다. REXULTI 및 위약 그룹에 대한 이중 눈가림 치료 단계 동안 재발 환자의 누적 비율에 대한 Kaplan-Meier 곡선은 그림 6에 나와 있습니다. 주요 2차 평가변수인 재발 임박 기준을 충족한 환자의 비율은 REXULTI 치료 환자에서 위약 그룹에 비해 통계적으로 유의하게 낮았습니다.
Figure 6 연구 5에서 재발 임박 백분율에 대한 Kaplan-Meier 추정
| Note: 총 202명의 환자가 무작위 배정되었습니다. 그중 위약 그룹의 한 환자는 연구 의약품을 복용하지 않았고 REXULTI 그룹의 한 환자는 무작위 배정 후 유효성 평가를 받지 못했습니다. 이 두 환자는 유효성 분석에서 제외되었습니다. |
 |
14.3 알츠하이머병으로 인한 치매와 관련된 불안
알츠하이머병으로 인한 치매와 관련된 불안 치료에서 REXULTI의 효능은 2건의 12주 무작위 이중맹검 위약대조 고정용량 연구(연구 6, NCT01862640 및 연구 7, NCT03548584)에서 입증되었습니다. 이러한 연구에서 환자는 다음을 충족해야 했습니다.
- NINCDS-ADRDA 기준에 따른 추정 알츠하이머병 진단,
- 최소 정신 상태 검사(MMSE) 점수가 ≥5 및 ≤22이고 NPI/NPI-NH의 불안/공격성 항목에 대한 총 점수가 ≥4인 경우,
- 다른 요인을 제외한 후 약물 요법의 사용을 정당화할 만큼 충분한 불안 행동을 보이는 경우.
환자:
- 연구 6에서는 REXULTI 1mg 1일 1회, REXULTI 2mg 1일 1회 또는 위약 중 하나에 대해 무작위 배정되었습니다. REXULTI 그룹의 환자는 모두 0.25mg을 1일 1회 약 3일 동안 복용한 후 0.5mg을 1일 1회 약 12일 동안 복용했습니다. 그 후 1mg 그룹의 환자는 12주 연구의 나머지 기간 동안 1mg을 1일 1회 복용했고, 2mg 그룹의 환자는 약 2주 동안 1mg을 1일 1회 복용한 후 연구의 나머지 기간 동안 2mg을 복용했습니다.
- 연구 7에서는 REXULTI 2mg 또는 3mg 1일 1회(병용 치료군) 또는 위약에 대해 무작위 배정되었습니다. REXULTI 그룹의 환자는 모두 0.5mg을 1일 1회 7일 동안 복용한 후 1mg을 1일 1회 7일 동안 복용하고, 그 후 2mg을 1일 1회 14일 동안 복용했습니다. 그 후 2mg 그룹의 환자는 12주 연구의 나머지 기간 동안 2mg을 1일 1회 복용했고, 3mg 그룹의 환자는 연구의 나머지 기간 동안 3mg을 1일 1회 복용했습니다.
연구 6에는 평균 연령이 74세(51세~90세), 남성 45%, 백인 96%, 흑인 또는 아프리카계 미국인 3%, 아시아인 1%, 라틴계/히스패닉 16%, 비라틴계/히스패닉 83%인 433명의 환자가 포함되었습니다. 연구 7에는 평균 연령이 74세(56세~90세), 남성 44%, 백인 95%, 흑인 또는 아프리카계 미국인 4%, 아시아인 1%, 라틴계/히스패닉 31%, 비라틴계/히스패닉 69%인 345명의 환자가 포함되었습니다.
이 두 연구의 1차 효능 평가변수는 12주차에 기준치에서 Cohen-Mansfield 불안 척도 총점(CMAI)의 변화였습니다. CMAI는 임상의가 평가하는 설문지로, 29개 항목으로 구성되어 있으며, 보호자의 의견을 바탕으로 노인 환자의 불안 행동 빈도를 평가합니다. CMAI 척도에서는 세 가지 특정 요인을 도출할 수 있습니다. 1) 공격적 행동(예: 고함 지르기, 물건 던지기, 욕설/언어적 공격, 발차기, 밀치기, 할퀴기, 자기 또는 타인에게 상해 입히기); 2) 신체적 비공격적 행동(예: 반복적인 버릇, 전반적인 불안, 서성거림); 3) 언어적 불안 행동(예: 불평, 반복적인 질문, 지속적인 관심 요구). 각 CMAI 행동은 1(결코 없음)에서 7(매우 빈번한 불안 행동)까지의 척도로 평가되었습니다. CMAI 총점은 29(최상)에서 203(최악)까지입니다. 음수 변화는 개선을 나타냅니다.
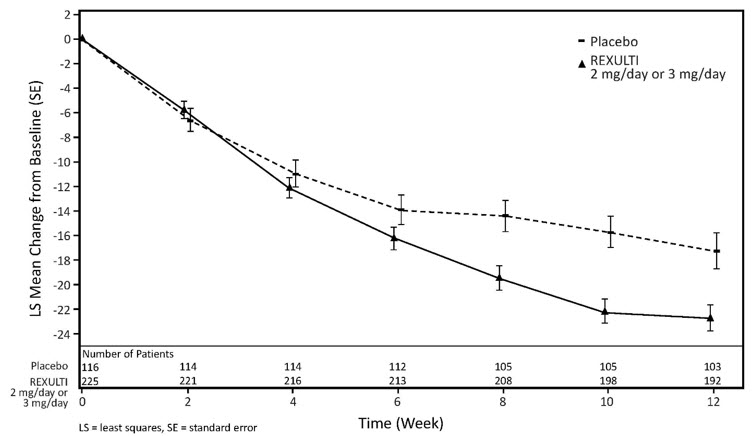
시험 6에서 REXULTI 2mg 그룹의 환자는 12주차에 위약 그룹의 환자에 비해 CMAI 총점이 개선되었습니다. 시험 7에서 REXULTI 2mg/3mg 그룹의 환자는 12주차에 위약 그룹의 환자에 비해 CMAI 총점이 개선되었습니다.
표 14와 그림 7에 나와 있는 바와 같이, 2mg/3mg REXULTI 그룹의 12주 후 CMAI 총점의 기준치 변화 평균은 위약 그룹보다 통계적으로 유의하게 우수했습니다. 이 환자군에서 1mg REXULTI 그룹은 위약 그룹에 비해 CMAI 총점의 기준치 변화 평균이 유의하게 크지 않았습니다. 1mg 1일 1회 REXULTI 용량은 승인되지 않았으며 알츠하이머병으로 인한 치매와 관련된 불안 치료에는 권장되지 않습니다 [용법 및 용량(2.4) 참조].
| 연구 | 치료 그룹 | N | 기준치 평균 점수 (SD) |
기준치 대비 LS 평균 변화 (SE) |
위약 차이† (95% CI) |
|---|---|---|---|---|---|
| SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 비조정 신뢰 구간 | |||||
| 6 | REXULTI 1mg/일 | 134 | 70.5 (16.0) | -17.6 (1.3) | 0.2 (-3.4, 3.9) |
| REXULTI 2 mg/day‡ | 138 | 71.0 (16.6) | -21.6 (1.3) | -3.8 (-7.4, -0.2) | |
| Placebo | 131 | 72.2 (17.9) | -17.8 (1.3) | — | |
| 7 | REXULTI 2 mg/day 또는 3 mg/day‡ | 225 | 80.6 (16.6) | -22.6 (1.1) | -5.3 (-8.8, -1.9) |
| Placebo | 116 | 79.2 (17.5) | -17.3 (1.4) | — |
Figure 7: 알츠하이머병으로 인한 치매 관련 불안 환자에서 연구 주차별 기준치 변화 대비 총 CMAI 점수 변화 (연구 7)
16 제공/보관 및 취급 방법
제품 정보
REXULTI (브렉시피프라졸) 정제는 한쪽 면에 표시가 있으며 다음과 같은 용량 및 포장 형태로 제공됩니다 (아래 참조).
- 0.25mg 정제는 연한 갈색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “0.25”가 각인되어 있습니다.
NDC 59148-035-13 30정 병입
- 0.5mg 정제는 연한 주황색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “0.5”가 각인되어 있습니다.
NDC 59148-036-13 30정 병입
- 1mg 정제는 연한 노란색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “1”이 각인되어 있습니다.
NDC 59148-037-13 30정 병입
- 2mg 정제는 연한 녹색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “2”가 각인되어 있습니다.
NDC 59148-038-13 30정 병입
- 3mg 정제는 연한 보라색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “3”이 각인되어 있습니다.
NDC 59148-039-13 30정 병입
- 4mg 정제는 흰색, 원형, 약간 볼록하며, 베벨 가장자리가 있으며 한쪽 면에 “BRX”와 “4”가 각인되어 있습니다.
NDC 59148-040-13 30정 병입
17 환자 상담 정보
환자 또는 보호자에게 FDA 승인 환자용 설명서(의약품 안내서)를 읽도록 알려주십시오.
자살 생각 및 행동
특히 치료 초기에 그리고 용량 조절 시 자살 충동의 발생 여부를 환자와 보호자에게 알려주고, 이러한 증상이 나타나면 의료 제공자에게 보고하도록 지시하십시오 [경고, 경고 및 주의사항 (5.2) 참조].
용법 및 용량
REXULTI는 음식과 함께 또는 음식 없이 복용할 수 있다고 환자에게 알려주십시오. 용량 증량 지침을 따르는 것이 중요하다는 점을 환자에게 알려주십시오 [용법 및 용량 (2) 참조].
악성 신경이완증후군 (NMS)
항정신병 약물 투여와 관련하여 보고된 잠재적으로 치명적인 유해 반응인 악성 신경이완증후군(NMS)에 대해 환자에게 알려주십시오. NMS의 징후나 증상이 나타나면 의료 제공자에게 연락하거나 응급실에 보고하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.4) 참조].
지연성 운동 이상증
지연성 운동 이상증의 징후와 증상에 대해 환자에게 알려주고, 이러한 비정상적인 움직임이 발생하면 의료 제공자에게 연락하도록 하십시오 [경고 및 주의사항 (5.5) 참조].
대사 변화
대사 변화의 위험, 고혈당 및 당뇨병의 증상을 인식하는 방법, 혈당, 지질 및 체중을 포함한 특정 모니터링의 필요성에 대해 환자를 교육하십시오 [경고 및 주의사항 (5.6) 참조].
병적인 도박 및 기타 강박 행동
REXULTI를 복용하는 동안 쇼핑에 대한 강박적인 충동, 도박에 대한 강렬한 충동, 강박적인 성적 충동, 폭식 및/또는 기타 강박적인 충동과 이러한 충동을 조절할 수 없는 가능성에 대해 환자와 보호자에게 알려주십시오. 모든 경우는 아니지만, 일부 경우에는 용량을 줄이거나 중단했을 때 충동이 사라졌다고 보고되었습니다 [경고 및 주의사항 (5.7) 참조].
백혈구 감소증, 호중구 감소증 및 무과립구증
기존의 낮은 백혈구 수 또는 약물 유발 백혈구 감소증/호중구 감소증의 병력이 있는 환자에게는 REXULTI 복용 중 CBC를 모니터링해야 한다고 알려주십시오 [경고 및 주의사항 (5.8) 참조].
인지 및 운동 장애 가능성
REXULTI 치료가 이러한 활동에 참여하는 능력에 부정적인 영향을 미치지 않는다고 합리적으로 확신할 때까지 위험한 기계 작동 또는 자동차 운전과 같은 정신적 각성이 필요한 활동을 수행하는 것에 대해 환자에게 주의를 주십시오 [경고 및 주의사항 (5.14) 참조].
병용 약물
임상적으로 중요한 상호작용이 발생할 가능성이 있으므로 현재 처방전 약물이나 일반 의약품의 변경 사항을 의료 제공자에게 알리도록 환자에게 알려주십시오 [약물 상호작용 (7.1) 참조].
임신
REXULTI의 3분기 사용은 신생아에게 추체외로 증상 및/또는 금단 증상을 유발할 수 있으며, 알려진 또는 의심되는 임신 사실을 의료 제공자에게 알리도록 환자에게 알려주십시오. 임신 중 REXULTI에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록 기관이 있다고 환자에게 알려주십시오 [특정 집단에서의 사용 (8.1) 참조].
SPL 미분류 섹션
제조: Otsuka Pharmaceutical Co., Ltd., Tokyo 101-8535, Japan
유통 및 판매: Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA
판매: Lundbeck, Deerfield, IL 60015 USA
©2024, Otsuka Pharmaceutical Co., Ltd., Tokyo 101-8535, Japan
약물 정보 안내
| 의약품 안내 REXULTI ® (REX-ul-TE) (brexpiprazole) 경구용 정제 |
|||
|---|---|---|---|
| 본 의약품 안내는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 5월 | ||
| REXULTI에 대해 가장 중요한 정보는 무엇입니까? REXULTI는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
|
|||
|
|
||
| 부작용에 대한 자세한 내용은 “REXULTI의 가능한 부작용은 무엇입니까?“를 참조하십시오. | |||
| REXULTI란 무엇입니까? REXULTI는 다음과 같은 경우에 처방되는 약물입니다.
REXULTI는 알츠하이머병으로 인한 치매로 인해 발생할 수 있는 불안감에 대한 “필요에 따라” 치료제로 사용해서는 안 됩니다. |
|||
| 누가 REXULTI를 복용해서는 안 됩니까? brexpiprazole 또는 REXULTI의 성분에 알레르기가 있는 경우 REXULTI를 복용하지 마십시오. REXULTI의 성분에 대한 전체 목록은 본 의약품 안내의 끝 부분을 참조하십시오. |
|||
REXULTI 복용 전, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. |
|||
REXULTI는 어떻게 복용해야 합니까?
|
|||
REXULTI 복용 중 피해야 할 사항은 무엇입니까?
|
|||
| REXULTI의 가능한 부작용은 무엇입니까? REXULTI는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
|||
|
|
||
|
|||
|
|
||
|
|||
REXULTI의 가장 흔한 부작용에는 체중 증가, 졸음, 어지러움, 감기 증상 및 불안감 또는 움직여야 할 것 같은 느낌(아카시시아)이 포함됩니다. |
|||
REXULTI는 어떻게 보관해야 합니까?
REXULTI 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||
| REXULTI의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 REXULTI를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 REXULTI를 제공하지 마십시오. 해를 끼칠 수 있습니다. 약사 또는 의료 제공자에게 의료 전문가를 위해 작성된 REXULTI에 대한 정보를 요청할 수 있습니다. |
|||
| REXULTI의 성분은 무엇입니까? 활성 성분: brexpiprazole 비활성 성분: 유당 일수화물, 옥수수 전분, 미결정 셀룰로오스, 히드록시프로필 셀룰로오스, 저치환 히드록시프로필 셀룰로오스, 마그네슘 스테아레이트, 히프로멜로오스 및 활석 색상을 위한 성분: 이산화티타늄, 산화철 및 페로페리산화철 오츠카 제약 주식회사, 도쿄 101-8535, 일본 제조 오츠카 아메리카 제약 주식회사, 록빌, MD 20850 미국 유통 및 판매 룬드벡, 디어필드, IL 60015 미국 판매 ©2024 REXULTI에 대한 자세한 내용은 www.REXULTI.com을 방문하거나 1-800-441-6763으로 전화하십시오. |
주요 표시 패널 – 0.25mg 정제 병 라벨
0.25 mg
정 30정
NDC 59148-035-13
REXULTI®
brexpiprazole
tablets
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
오츠카
룬드벡
주표시면 – 0.25mg 정제 병 포장
0.25 mg
정 30정
NDC 59148-035-13
REXULTI®
brexpiprazole
정
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오

주요 표시 패널 – 0.5mg 정제 병 라벨
0.5 mg
정 30정
NDC 59148-036-13
REXULTI®
brexpiprazole
tablets
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
오츠카
룬드벡
주표시면 – 0.5mg 정제 병 포장
0.5 mg
정 30정
NDC 59148-036-13
REXULTI®
brexpiprazole
정
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오

진열대 라벨 – 1mg 정제 병 라벨
1 mg
30정 (Tablets)
NDC 59148-037-13
REXULTI®
brexpiprazole
tablets (정제)
전문의약품 (Rx only)
어린이의 손이 닿지 않는 곳에 보관하십시오 (Keep out of the reach of children)
각 환자에게 첨부된
복약 안내서를
제공하십시오 (DISPENSE THE
ACCOMPANYING
MEDICATION GUIDE
TO EACH PATIENT)
Otsuka
Lundbeck
주요 표시 패널 – 1mg 정제 병 포장
1 mg
30정
NDC 59148-037-13
REXULTI®
brexpiprazole
정제
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
주요 표시 패널 – 2mg 정제 병 라벨
2 mg
정 30정
NDC 59148-038-13
REXULTI®
brexpiprazole
정
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
오츠카
룬드벡
주요 표시면 – 2mg 정제 병 상자
2 mg
30정
NDC 59148-038-13
REXULTI®
brexpiprazole
정제
처방전 의약품
어린이의 손이
닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오

주요 표시 패널 – 3mg 정제 병 라벨
3 mg
정 30정
NDC 59148-039-13
REXULTI®
brexpiprazole
정
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
오츠카
룬드벡
주요 표시 패널 – 3mg 정제 병 포장
3 mg
30정
NDC 59148-039-13
REXULTI®
brexpiprazole
정제
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
주표시면 – 4mg 정제 병 라벨
4 mg
정 30정
NDC 59148-040-13
REXULTI®
brexpiprazole
정
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오
오츠카
룬드벡
주요 표시 패널 – 4mg 정제 병 포장
4 mg
30정
NDC 59148-040-13
REXULTI®
brexpiprazole
정제
처방전 의약품
어린이의 손이 닿지 않는 곳에 보관하십시오
동봉된
약물 사용 설명서를
각 환자에게
제공하십시오