의약품 제조업체: E.R. Squibb & Sons, L.L.C. (Updated: 2024-12-13)
처방 정보 하이라이트
ORENCIA (abatacept) for injection, for intravenous use
ORENCIA (abatacept) injection, for subcutaneous use
Initial U.S. Approval: 2005
적응증 및 용법
ORENCIA는 선택적 T 세포 공동자극 조절제로 다음 질환에 대해 적응증을 가지고 있습니다.
- •
- 중등도에서 중증의 활동성 류마티스 관절염(RA) 성인 환자 치료. (1.1)
- •
- 중등도에서 중증의 활동성 다관절형 소아 특발성 관절염(pJIA)을 가진 2세 이상의 환자 치료. (1.2)
- •
- 활동성 건선성 관절염(PsA)을 가진 2세 이상의 환자 치료. (1.3)
- •
- 일치 또는 1개 대립유전자 불일치 비혈연 공여자로부터 조혈모세포 이식(HSCT)을 받는 2세 이상의 성인 및 소아 환자에서 칼시뉴린 억제제 및 메토트렉세이트와 병용하여 급성 이식편대숙주병(aGVHD) 예방. (1.4)
사용 제한:
ORENCIA를 다른 면역억제제[예: 생물학적 질병조절 항류마티스 약물(bDMARDS), 야누스 키나제(JAK) 억제제]와 병용하는 것은 권장되지 않습니다(1.5, 5.1).
용법 및 용량
성인 RA (2.1) 및 성인 PsA (2.3)에 대한 정맥 투여
- •
- 0, 2, 4주차에, 그리고 그 이후에는 4주마다 30분 동안 주입합니다.
| 환자 체중 | 용량 | 바이알 수 |
|---|---|---|
|
60kg 미만 |
500mg |
2 |
|
60~100kg |
750mg |
3 |
|
100kg 초과 |
1,000mg |
4 |
성인 RA (2.1)에 대한 피하 투여
- •
- 첫 번째 피하 투여 전에 위의 체중 범주에 따라 선택적으로 단일 정맥 주입으로 부하 용량을 투여할 수 있습니다.
- •
- 매주 1회(주입을 받은 경우 정맥 주입 후 하루 이내에) 125mg을 피하 주사합니다.
- •
- 정맥 투여에서 피하 투여로 전환하는 환자는 다음 예정된 정맥 투여 대신 첫 번째 피하 투여를 합니다.
6세 이상 소아 pJIA 환자에 대한 정맥 투여 (2.2)
- •
- 체중이 75kg 미만인 소아 환자에게는 10mg/kg을 정맥으로 투여하고, 체중이 75kg 이상인 소아 환자에게는 성인 정맥 투여 요법(최대 용량 1,000mg을 초과하지 않음)을 30분 동안 주입합니다.
- •
- 이후 2주 및 4주차에, 그리고 그 이후에는 4주마다 주입합니다.
2세 이상 소아 pJIA 및 PsA 환자에 대한 피하 투여 (2.2)
- •
- 정맥 부하 용량 없이 피하 투여합니다.
| 소아 환자 체중 | 용량(주 1회) |
|---|---|
|
10kg~25kg 미만 |
50mg |
|
25kg~50kg 미만 |
87.5mg |
|
50kg 이상 |
125mg |
성인 PsA에 대한 피하 사용 (2.3)
- •
- 정맥 주입 로딩 용량 없이 매주 1회 125mg을 피하 주사로 투여하십시오.
- •
- 정맥 주사에서 피하 주사로 전환하는 환자는 다음 예정된 정맥 주사 대신 첫 번째 피하 주사를 투여하십시오.
aGVHD 예방을 위한 정맥 주입 ((2.4)
- •
- 6세 이상 환자의 경우 이식 전날 10mg/kg 용량(최대 용량 1,000mg)을 60분 동안 주입하고, 이식 후 5일, 14일, 28일에 투여하십시오.
- •
- 2세 이상 6세 미만 환자의 경우 이식 전날 15mg/kg 용량을 60분 동안 주입하고, 이식 후 5일, 14일, 28일에 12mg/kg 용량을 60분 동안 주입하십시오.
투여 형태 및 함량
금기
- 없음. (4)
경고 및 주의사항
- •
- TNF 길항제와 병용하면 감염 및 심각한 감염의 위험이 증가할 수 있습니다. (5.1)
- •
- 과민증 및 아나필락시스가 발생했습니다. (5.2)
- •
- 심각한 감염이 보고되었습니다. 재발성 감염의 병력이 있거나 감염에 취약하게 하는 기저 질환이 있는 환자는 더 많은 감염을 경험할 수 있습니다. 심각한 감염이 발생하면 중단하십시오. (5.3)
- •
- 치료를 시작하기 전에 잠복 결핵 감염을 검사하십시오. 양성 반응을 보이는 환자는 ORENCIA 치료를 시작하기 전에 치료를 받아야 합니다. (5.3)
- •
- ORENCIA 치료를 시작하기 전에 바이러스성 간염 검사를 받으십시오. (5.3)
- •
- ORENCIA 치료를 시작하기 전에 예방 접종을 업데이트하십시오. 생백신은 ORENCIA 치료 중 또는 치료 중단 후 3개월 이내에 투여해서는 안 됩니다. ORENCIA는 일부 예방 접종의 효과를 약화시킬 수 있습니다. (5.4)
- •
- COPD 환자는 더 빈번한 호흡기 이상 반응이 발생할 수 있습니다. (5.5)
- •
- aGVHD 예방을 위해 치료받은 환자에서 사이토메갈로바이러스(CMV) 및 엡스타인-바 바이러스(EBV) 재활성화. (5.7)
이상 반응
- •
- RA에서 가장 흔한 이상 사례(≥10%)는 두통, 상기도 감염, 비인두염 및 메스꺼움입니다. (6.1)
- •
- aGVHD 예방에서 가장 흔한 이상 반응(≥10%)은 빈혈, 고혈압, CMV 재활성화/CMV 감염, 발열, 폐렴, 코피, CD4 림프구 감소, 고마그네슘혈증 및 급성 신장 손상입니다. (6.1)
의심되는 이상 반응을 보고하려면 Bristol-Myers Squibb(1-800-721-5072) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch에 문의하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정: 5/2024
목차
전문 정보: 목차*
1 적응증 및 용법
1.1 성인 류마티스 관절염
1.2 다관절 소아 특발성 관절염
1.3 건선 관절염
1.4 급성 이식편대숙주병 예방
1.5 사용상의 제한
2 용법 및 용량
2.1 성인 류마티스 관절염에서의 용량
2.2 다관절 소아 특발성 관절염에서의 용량
2.3 건선 관절염에서의 용량
2.4 성인 및 2세 이상 소아 환자에서 급성 이식편대숙주병 예방을 위한 용량
2.5 정맥 주입을 위한 조제 및 투여 지침
2.6 피하 투여 권장 사항
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 TNF 길항제, 기타 생물학적 RA/PsA 치료제 또는 JAK 억제제와 병용 시 감염 위험 증가
5.2 과민반응
5.3 감염
5.4 예방 접종
5.5 만성 폐쇄성 폐질환(COPD) 환자에서의 이상 반응 위험 증가
5.6 면역억제
5.7 조혈모세포 이식(HSCT) 후 aGVHD 예방에서의 거대세포바이러스(CMV) 및 에프스타인-바 바이러스(EBV) 재활성화
6 이상 반응
6.1 임상 시험 경험
6.2 면역원성
6.3 시판 후 경험
7 약물 상호작용
7.1 면역억제제
7.2 혈당 검사
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 약물 설명
12 임상 약리
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 장애
13.2 동물 독성 및/또는 약리학
14 임상 연구
14.1 성인 류마티스 관절염
14.2 다관절 소아 특발성 관절염
14.3 건선 관절염
14.4 급성 이식편대숙주병 예방
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분 또는 소분류는 나열되지 않았습니다.
1 적응증 및 사용법
1.4 급성 이식편대숙주병 예방
ORENCIA는 일치 또는 1개 대립유전자 불일치 비혈연 공여자로부터 조혈모세포 이식(HSCT)을 받는 성인 및 2세 이상 소아 환자에서 칼시뉴린 억제제 및 메토트렉세이트와 병용하여 급성 이식편대숙주병(aGVHD) 예방에 사용됩니다.
2 용법 및 투여
2.1 성인 류마티스 관절염 투여량
RA 성인 환자에게는 정맥 주입 또는 피하 주사로 투여합니다. ORENCIA는 단독 요법으로 또는 JAK 억제제 또는 bDMARD(예: TNF 길항제)를 제외한 질병 수정 항류마티스 약물(DMARD)과 병용하여 사용할 수 있습니다.
정맥 투여량
ORENCIA 동결 건조 분말을 재구성하고 희석 후 [투여 및 관리 (2.5) 참조] 표 1에 권장된 체중 범위 기반 투여량을 사용하여 30분 정맥 주입으로 투여합니다. 초기 정맥 주입 후에는 2주와 4주 후, 그 이후에는 4주마다 정맥 주입으로 투여합니다.
| 성인 환자 체중 | 용량 | 바이알 수a |
|---|---|---|
| a 각 바이알은 투여를 위해 250mg의 abatacept를 제공합니다. | ||
|
60kg 미만 |
500mg |
2 |
|
60~100kg |
750mg |
3 |
|
100kg 초과 |
1,000mg |
4 |
피하 투여량
첫 번째 피하 투여 전에 선택적으로 단일 정맥 주입으로 로딩 용량을 투여할 수 있습니다(표 1의 체중 범주에 따라). 정맥 로딩 용량을 사용하는 경우 주입 후 하루 이내에 첫 번째 피하 주사를 투여합니다. 사전 충전된 주사기 또는 ORENCIA ClickJect™ 자동 주입기를 사용하여 ORENCIA 125mg을 1주일에 한 번 피하 주사로 투여합니다 [투여 및 관리 (2.6) 참조].
ORENCIA 정맥 요법에서 피하 투여로 전환하는 환자의 경우 다음 예정된 정맥 투여 대신 첫 번째 피하 투여를 합니다.
2.2 다관절 소아 특발성 관절염 투여량
소아 특발성 다관절염(pJIA) 소아 환자에게는 정맥 주입(6세 이상 환자만 해당) 또는 피하 주사(2세 이상 환자만 해당)로 ORENCIA를 투여합니다 [특정 집단에서의 사용 (8.4) 참조]. ORENCIA는 단독 요법으로 또는 메토트렉세이트와 병용하여 사용할 수 있습니다.
정맥 투여량
체중에 따라 30분 정맥 주입으로 ORENCIA를 투여합니다 [투여 및 관리 (2.5) 참조]:
- •
- 체중이 75kg 미만인 경우 10mg/kg 용량을 투여합니다.
- •
- 체중이 75kg 이상인 경우 표 1의 권장 사항에 따라 투여합니다(성인 정맥 투여 요법을 따릅니다). 최대 용량은 1,000mg을 초과해서는 안 됩니다.
초기 정맥 주입 후에는 2주와 4주 후, 그 이후에는 4주마다 주입합니다. 바이알에 남은 사용하지 않은 부분은 즉시 버립니다.
피하 투여량
정맥 로딩 용량 없이 표 2에 권장된 체중 범위 기반 투여량을 사용하여 피하 주사용 ORENCIA를 투여합니다 [투여 및 관리 (2.6) 참조]. 그 후 1주일에 한 번 투여합니다.
| 소아 환자 체중 | 용량(1주일에 한 번) |
|---|---|
|
10~25kg 미만 |
50mg |
|
25~50kg 미만 |
87.5mg |
|
50kg 이상 |
125mg |
소아 특발성 관절염 환자는 ORENCIA를 직접 자가 주사하거나, 의료 전문가와 부모/법정 후견인이 적절하다고 판단하는 경우 환자의 보호자가 ORENCIA를 투여할 수 있습니다. 소아 환자의 오토인젝터를 이용한 자가 주사 능력은 검증되지 않았습니다.
2.3 건선성 관절염 투여량
성인 환자
건선성 관절염 성인 환자에게는 정맥 주입 또는 피하 주사로 투여합니다.
ORENCIA는 비생물학적 DMARD와 병용하거나 단독으로 사용할 수 있습니다.
정맥 투여량
표 1에 명시된 체중 범위 기반 투여량을 사용하여 ORENCIA를 30분 정맥 주입으로 투여합니다. 최초 정맥 투여 후에는 2주와 4주 후에 정맥 주입을 투여하고 그 이후에는 4주마다 투여합니다.
피하 투여량
ORENCIA 125mg을 1주일에 한 번 피하 주사로 투여합니다(정맥 로딩 용량은 필요하지 않습니다) [투여 및 투약 방법 (2.6) 참조].
ORENCIA 정맥 주입에서 피하 투여로 전환하는 환자의 경우, 다음 예정된 정맥 투여 대신 첫 번째 피하 투여를 합니다.
소아 환자
건선성 관절염이 있는 2세 이상 소아 환자에게는 ORENCIA를 피하 주사로 투여합니다 [특정 집단에서의 사용 (8.4) 참조]. ORENCIA는 단독 요법으로 또는 메토트렉세이트와 병용하여 사용할 수 있습니다. 소아 건선성 관절염 환자에 대한 정맥 투여는 승인되지 않았습니다.
피하 투여량
표 3에 권장된 체중 범위 기반 투여량을 사용하여 매주 피하 주사로 ORENCIA를 투여합니다 [투여 및 투약 방법 (2.6) 참조].
- 표 3:2세 이상 건선성 관절염 환자의 피하 투여를 위한 ORENCIA 용량
|
소아 환자 체중 |
용량 (매주 1회) |
||
|
10kg 이상 25kg 미만 |
50mg |
||
|
25kg 이상 50kg 미만 |
87.5mg |
||
|
50kg 이상 |
125mg |
건선 관절염 소아 환자는 ORENCIA를 스스로 주사하거나, 의료 전문가와 부모/법정 후견인이 적절하다고 판단하는 경우 환자의 보호자가 ORENCIA를 투여할 수 있습니다. 소아 환자가 오토인젝터를 사용하여 스스로 주사하는 능력은 테스트되지 않았습니다.
2.4 성인 및 2세 이상 소아 환자의 급성 이식편대숙주병 예방을 위한 용량
항바이러스 예방 치료
ORENCIA를 투여하기 전에 에프스타인-바 바이러스(EBV) 재활성화에 대한 권장 항바이러스 예방 치료를 실시하고, HSCT 후 6개월 동안 계속합니다. 또한, 치료 중 및 HSCT 후 6개월 동안 거대세포바이러스(CMV) 감염/재활성화에 대한 예방적 항바이러스제를 고려하십시오 [경고 및 주의 사항 (5.7) 참조].
정맥 투여 요법
6세 이상 환자의 경우, 이식 전날(Day -1)에 10 mg/kg(최대 용량 1,000 mg)의 ORENCIA를 60분 동안 정맥 주입하고, 이식 후 5일째, 14일째, 28일째에 투여합니다.
2세 이상 6세 미만 환자의 경우, 이식 전날(Day -1)에 15 mg/kg의 ORENCIA를 60분 동안 정맥 주입하고, 이식 후 5일째, 14일째, 28일째에 12 mg/kg을 60분 동안 정맥 주입합니다.
2.5 정맥 주입을 위한 조제 및 투여 지침
ORENCIA 용량, 필요한 재구성 용액의 총량 및 필요한 ORENCIA 바이알 수를 계산합니다. 전체 용량의 경우, 하나의 바이알의 전체 내용물보다 적거나 하나의 바이알보다 많은 양이 필요할 수 있습니다. 무균 기법을 사용하여 다음과 같이 ORENCIA를 재구성, 희석 및 투여합니다.
재구성
- 1)
- 진공이 있는 경우에만 바이알을 사용하십시오.
- 2)
- 공급된 ORENCIA 동결 건조 분말(각 바이알은 250mg의 abatacept를 제공) 각 바이알을 10mL의 주사용 무균수 USP로 재구성하여(바이알의 안쪽 벽을 향해 용액을 주입) 25 mg/mL의 농도를 얻습니다. 18~21 게이지 바늘이 있는 제공된 실리콘이 없는 주사기만 사용하십시오.
- a.
- 실리콘 처리된 주사기를 사용하여 ORENCIA 동결 건조 분말을 실수로 재구성한 경우, 용액에 몇 개의 반투명 입자가 생길 수 있습니다(실리콘 처리된 주사기를 사용하여 조제된 용액은 버립니다).
- b.
- 실리콘이 없는 일회용 주사기를 떨어뜨리거나 오염된 경우, 새로운 실리콘이 없는 일회용 주사기를 사용하십시오. 새로운 실리콘이 없는 주사기를 얻으려면 1-800-ORENCIA로 Bristol-Myers Squibb에 문의하십시오.
- 3)
- 거품 형성을 최소화하기 위해 바이알을 부드럽게 흔들어 내용물이 완전히 용해될 때까지 흔듭니다. 흔들지 마십시오. 장시간 또는 강하게 흔들지 마십시오.
- 4)
- 동결 건조 분말이 완전히 용해되면, 바늘로 바이알의 통풍구를 열어 존재할 수 있는 거품을 제거합니다.
- 5)
- 재구성된 용액을 눈으로 검사합니다(용액은 투명하고 무색에서 연한 노란색이어야 합니다). 불투명한 입자, 변색 또는 기타 이물질이 있는 경우 사용하지 마십시오.
- 6)
- 용량에 두 개, 세 개 또는 네 개의 바이알이 필요한 경우(표 1 참조) 2)단계부터 5)단계까지를 반복합니다.
희석
- 7)
- 재구성된 ORENCIA 용액을 다음과 같이 100mL로 추가 희석해야 합니다.
- a.
- 100mL 주입 백 또는 0.9% 염화나트륨 주사액 USP에서 환자 용량에 필요한 재구성된 ORENCIA 용액의 양과 같은 양을 꺼냅니다.
- b.
- 각 바이알에 제공된 실리콘이 없는 일회용 주사기를 사용하여 재구성된 ORENCIA 용액을 주입 백 또는 병에 천천히 첨가합니다.
- c.
- 부드럽게 섞습니다. 백이나 병을 흔들지 마십시오. 백이나 병에 있는 abatacept의 최종 농도는 첨가된 abatacept의 양에 따라 달라지지만 10mg/mL를 넘지 않습니다. ORENCIA 바이알에 남은 사용하지 않은 부분은 즉시 버립니다.
투여
- 8)
- 투여 전에 입자상 물질과 변색 여부를 확인하기 위해 ORENCIA 희석 용액을 눈으로 검사합니다. 입자상 물질이나 변색이 관찰되면 희석 용액을 버립니다.
- 9)
- 주입 세트와 무균성, 비발열성, 저단백질 결합 필터(공극 크기 0.2 μm~1.2 μm)를 사용하여 희석된 ORENCIA 용액 전체를 다음과 같이 투여합니다.
- •
- RA, pJIA 및 PsA 성인의 경우 30분
- •
- aGVHD 예방의 경우 60분
- 10)
- ORENCIA 바이알을 재구성한 후 24시간 이내에 희석된 ORENCIA 용액의 주입을 완료해야 합니다.
다른 약물과 동시에 같은 정맥 라인으로 ORENCIA를 주입하지 마십시오. ORENCIA와 다른 약물의 병용 투여를 평가하기 위한 물리적 또는 생화학적 적합성 연구는 수행되지 않았습니다.
희석된 ORENCIA 용액의 보관
사용 전 최대 24시간 동안 실온 또는 2ºC~8ºC(36ºF~46ºF)의 냉장 보관할 수 있습니다. 24시간 이내에 투여하지 않으면 희석된 용액을 버립니다.
2.6 피하 투여 권장 사항
ORENCIA 프리필드 시린지 및 ORENCIA ClickJect 오토인젝터는 다음을 위해 사용됩니다.
- •
- 피하 주사용으로만 사용하며 정맥 주입용이 아닙니다.
- •
- 의료 전문가의 지시에 따라 사용하십시오.
피하 주사 기술에 대한 적절한 교육을 받은 후, 의료 전문가가 적절하다고 판단하는 경우 환자 또는 환자의 보호자가 ORENCIA (ClickJect 자동주사기 또는 프리필드 시린지)의 피하 주사를 시행할 수 있습니다. 환자 및/또는 보호자에게 투여에 대한 자세한 내용은 사용 설명서의 지침을 따르도록 지시하십시오. 특히, 전체 양 (ORENCIA의 적절한 용량을 제공)을 주사하고, 주사 부위를 회전시키며, 피부가 압통, 멍, 붉거나 단단한 부위에는 주사하지 않도록 지시하십시오.
투여 전에 이물질 및 변색 여부를 눈으로 확인하십시오. 이물질이나 변색이 있는 ORENCIA 프리필드 시린지 또는 ORENCIA ClickJect 자동주사기는 사용하지 마십시오. ORENCIA는 무색에서 연한 황색까지 투명하거나 약간 유탁해야 합니다.
3 제형 및 함량
- •
- 정맥 주입
- 주사용: 1회용 바이알 당 250mg의 백색 동결건조 분말 [투여 및 투약 방법 (2.1), 2.2, 2.3, 2.5 참조].
- •
- 피하 사용
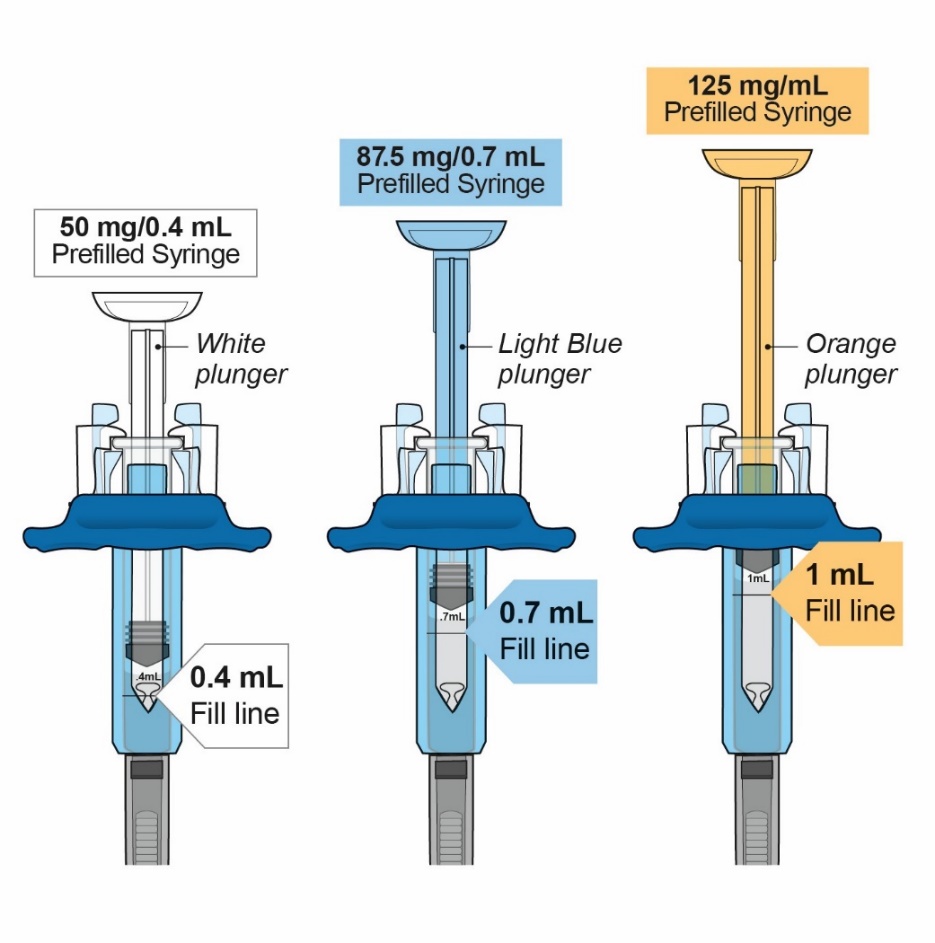
- 주사용: 1회용 프리필드 유리 주사기에 무색에서 연한 황색의 투명하거나 약간 유탁한 용액 50mg/0.4mL, 87.5mg/0.7mL 및 125mg/mL.
- 주사용: 1회용 프리필드 ClickJect 자동주사기에 무색에서 연한 황색의 투명하거나 약간 유탁한 용액 125mg/mL.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 TNF 억제제, 기타 생물학적 RA/PsA 치료제 또는 JAK 억제제 병용 시 감염 위험 증가
성인 RA 환자를 대상으로 한 대조 임상 시험에서, 동시에 정맥내 ORENCIA와 TNF 억제제 치료를 받은 환자는 TNF 억제제만으로 치료받은 환자에 비해 감염(63% 대 43%) 및 심각한 감염(4.4% 대 0.8%)이 더 많았습니다 [유해 반응 (6.1) 참조]. 이러한 시험에서는 ORENCIA와 TNF 억제제의 동시 투여에 의한 효능의 중요한 향상이 입증되지 않았습니다. 따라서 ORENCIA와 TNF 억제제의 병용 요법은 권장되지 않습니다. TNF 억제제 치료에서 ORENCIA 치료로 전환하는 동안 환자의 감염 징후를 모니터링해야 합니다. 또한 ORENCIA와 기타 생물학적 RA/PsA 치료제 또는 JAK 억제제의 병용 투여는 권장되지 않습니다.
5.2 과민반응
정맥내 ORENCIA로 치료받은 2688명의 성인 RA 환자에 대한 임상 시험에서, 2건(<0.1%)의 아나필락시스 반응이 있었습니다. 저혈압, 두드러기, 호흡곤란과 같이 약물 과민증과 관련이 있을 가능성이 있는 기타 반응은 각각 ORENCIA 치료 환자의 0.9% 미만에서 발생했습니다. 소아 특발성 관절염(pJIA) 임상 시험에서 ORENCIA로 치료받은 190명의 환자 중 과민반응이 1건(0.5%) 발생했습니다 [유해 반응 (6.1) 참조].
시판 후 경험에서, ORENCIA 첫 번째 주입 후 치명적인 아나필락시스 및 생명을 위협하는 안지오에데마 사례가 보고되었습니다. 안지오에데마는 ORENCIA 첫 번째 투여 후에 발생했을 뿐만 아니라 이후 투여에서도 발생했습니다. 안지오에데마 반응은 투여 후 몇 시간 이내에 발생했으며, 일부 경우에는 지연된 발병(즉, 수일)이 있었습니다.
과민반응 치료를 위한 적절한 의료 지원 조치는 반응 발생 시 즉시 사용할 수 있어야 합니다. 아나필락시스 또는 기타 심각한 알레르기 반응이 발생하는 경우, 적절한 치료를 시작하여 정맥내 또는 피하 ORENCIA 투여를 즉시 중단해야 하며, ORENCIA 사용을 영구적으로 중단해야 합니다.
5.3 감염
ORENCIA를 투여받은 환자에서 패혈증 및 폐렴을 포함한 심각한 감염이 보고되었습니다(정맥내 ORENCIA 및 플라시보로 치료받은 RA 환자에서 각각 3% 및 1.9%에서 심각한 감염이 보고됨) [유해 반응 (6.1) 참조]. 이러한 감염 중 일부는 치명적이었습니다. 많은 심각한 감염이 동시 면역억제 요법을 받고 있는 환자에게서 발생했는데, 이는 기저 질환 외에도 감염에 대한 추가적인 소인이 될 수 있습니다. 동시에 TNF 억제제와 ORENCIA로 치료받은 성인 RA 환자에서 ORENCIA 단독으로 치료받은 환자에 비해 심각한 감염 발생률이 더 높았습니다 [경고 및 주의사항 (5.1) 참조].
의료 제공자는 재발성 감염의 병력이 있는 환자, 감염에 대한 소인이 될 수 있는 기저 질환이 있는 환자 또는 만성, 잠복성 또는 국소 감염이 있는 환자의 경우 ORENCIA 사용을 고려할 때 주의해야 합니다. ORENCIA 치료 중 새로운 감염이 발생한 환자는 면밀히 모니터링해야 합니다. 환자에게 심각한 감염이 발생하는 경우 ORENCIA 투여를 중단해야 합니다.
ORENCIA 투여를 시작하기 전에, 현재 결핵(TB) 지침에 따라 잠복성 결핵 감염 여부를 선별 검사해야 합니다. ORENCIA는 양성 TB 선별 검사를 받은 환자에게서 연구되지 않았으며, 잠복성 TB 감염이 있는 사람에게서 ORENCIA의 안전성은 알려져 있지 않습니다. TB 선별 검사에서 양성 반응을 보인 환자는 ORENCIA 치료 전에 표준 의료 관행에 따라 치료해야 합니다.
항류마티스 치료는 B형 간염 재활성화와 관련이 있습니다. 따라서 ORENCIA 치료를 시작하기 전에 공표된 지침에 따라 바이러스성 간염 선별 검사를 실시해야 합니다. ORENCIA를 사용한 임상 연구에서, 간염 양성 반응을 보인 환자는 연구에서 제외되었습니다.
5.4 예방 접종
소아 및 성인 환자에서 ORENCIA 투여를 시작하기 전에, 현재 예방 접종 지침에 따라 예방 접종을 최신 상태로 유지해야 합니다. ORENCIA 치료를 받는 환자는 현재의 생백신이 아닌 백신을 접종받을 수 있습니다. 생백신은 ORENCIA와 동시에 또는 중단 후 3개월 이내에 투여해서는 안 됩니다. 생백신을 접종받은 사람으로부터 ORENCIA를 투여받는 환자에게 감염이 이차적으로 전파되는 것에 대한 데이터는 없습니다. 또한, 자궁 내 [특정 집단에서의 사용 (8.1) 참조] ORENCIA에 노출된 영아에게 생백신을 투여하는 것에 대한 임상적 고려 사항이 있습니다. 작용 기전을 바탕으로, ORENCIA는 일부 예방 접종의 효과를 감소시킬 수 있습니다.
5.5 만성 폐쇄성 폐 질환(COPD) 환자에서 사용 시 유해 반응 위험 증가
연구 V에서, RA에 대해 ORENCIA로 치료받은 성인 COPD 환자는 플라시보로 치료받은 환자보다 COPD 악화, 기침, 흉곽 천명음 및 호흡 곤란을 포함한 유해 반응이 더 자주 발생했습니다. ORENCIA로 치료받은 환자 중 더 높은 비율의 환자가 플라시보로 치료받은 환자에 비해 심각한 유해 사건이 발생했습니다(27% 대 6%) [임상 연구 (14.1) 및 유해 반응 (6.1) 참조]. COPD 환자에서 ORENCIA 사용은 주의해서 해야 하며, 이러한 환자는 호흡 상태 악화 여부를 모니터링해야 합니다.
5.6 면역억제
ORENCIA를 포함하여 T세포 활성을 억제하는 약물은 T세포가 세포성 면역 반응을 매개하기 때문에 감염 및 악성 종양에 대한 숙주 방어에 영향을 미칠 가능성이 있습니다. 성인 RA 환자를 대상으로 한 임상 시험에서 ORENCIA 치료 환자는 위약 치료 환자에 비해 감염률이 더 높았습니다 [경고 및 주의 사항 (5.3) 및 유해 반응 (6.1) 참조]. ORENCIA 치료가 악성 종양의 발생 및 경과에 미치는 영향은 완전히 이해되지 않았습니다 [유해 반응 (6.1) 참조]. ORENCIA를 투여받은 환자에서 피부암을 포함한 악성 종양이 보고되었습니다 [유해 반응 (6.3) 참조]. 모든 ORENCIA 치료 환자, 특히 피부암 위험 요소가 있는 환자에 대해서는 정기적인 피부 검사를 권장합니다.
5.7 조혈모세포 이식(HSCT) 후 aGVHD 예방에서의 거대세포바이러스(CMV) 및 에프스타인-바 바이러스(EBV) 재활성화
비혈연관계 HSCT 중 aGVHD 예방을 위해 ORENCIA를 투여받은 환자에게 이식 후 림프 증식성 질환(PTLD)이 발생했습니다. ORENCIA를 투여받은 116명의 환자 중 4명(3.4%)에게 PTLD가 발생했습니다. 모든 PTLD 사례는 에프스타인-바 바이러스(EBV) 감염과 관련이 있었습니다. 4명의 환자 중 3명은 기준 시점에서 EBV 혈청학 양성이었고, 1명의 환자는 기준 시점에서 EBV 혈청학 음성이었으며 공여자의 EBV 혈청학은 알 수 없었습니다. 4명의 환자 중 3명은 이식 후 30일에 아시클로버 예방 요법을 중단했습니다. 사례 발생까지의 기간은 이식 후 49일에서 89일이었습니다. 기관 관행에 따라 EBV 재활성화에 대해 환자를 모니터링하십시오. EBV 관련 PTLD를 예방하기 위해 이식 후 6개월 동안 EBV 감염에 대한 예방 요법을 제공하십시오 [투여 방법 (2.4) 참조].
비혈연관계 HSCT 중 aGVHD 예방을 위해 ORENCIA를 투여받은 환자에게 거대세포바이러스(CMV) 침습성 질환이 발생했습니다. ORENCIA를 투여받은 116명의 환자 중 7%가 이식 후 225일까지 CMV 침습성 질환을 경험했습니다. CMV 침습성 질환을 경험한 모든 환자는 기준 시점에서 CMV 혈청학 양성이었습니다. 사례 발생까지의 중앙값 기간은 이식 후 91일이었습니다. CMV 침습성 질환은 주로 위장관에 영향을 미쳤습니다 [유해 반응 (6.1) 참조].
공여자 및 수혜자의 이식 전 CMV 혈청학 결과에 관계없이 이식 후 6개월 동안 CMV 감염/재활성화에 대해 환자를 모니터링하십시오. CMV 감염/재활성화에 대한 예방 요법을 고려하십시오 [투여 방법 (2.4) 참조].
6 부작용 반응
다음과 같은 임상적으로 중요한 유해 반응은 라벨의 다른 곳에서 설명되어 있습니다.
- •
- TNF 길항제, 기타 생물학적 RA/PsA 치료제 또는 JAK 억제제와 병용 시 감염 위험 증가 [경고 및 주의 사항 (5.1) 참조]
- •
- 과민반응 [경고 및 주의 사항 (5.2) 참조]
- •
- 감염 [경고 및 주의 사항 (5.3) 참조]
- •
- 만성 폐쇄성 폐질환(COPD) 환자에서 사용 시 유해 반응 위험 증가 [경고 및 주의 사항 (5.5) 참조]
- •
- 면역억제 [경고 및 주의 사항 (5.6) 참조]
- •
- 조혈모세포 이식(HSCT) 후 aGVHD 예방에서 사이토메갈로바이러스(CMV) 및 에프스타인-바 바이러스(EBV) 재활성화 [경고 및 주의 사항 (5.7) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양하고 통제된 조건하에서 수행되기 때문에, 약물의 임상 시험에서 관찰된 유해 반응률은 다른 약물의 임상 시험에서 관찰된 비율과 직접 비교할 수 없으며, 임상 실제에서 더 넓은 환자군에서 관찰된 비율을 예측하지 못할 수도 있습니다.
RA 성인 환자의 유해 반응
정맥내 ORENCIA로 치료받은 RA 성인 환자의 유해 반응
여기에 설명된 위약 대조 연구의 데이터는 활성 RA 환자에서 정맥내 투여된 ORENCIA에 대한 노출을 반영합니다(ORENCIA 투여 환자 1955명, 위약 투여 환자 989명)(연구 I~VI) [임상 연구 (14.1) 참조]. 이 연구들은 6개월(ORENCIA 투여 환자 258명, 위약 투여 환자 133명) 또는 1년(ORENCIA 투여 환자 1697명, 위약 투여 환자 856명)의 이중맹검 위약 대조 기간을 가졌습니다. 이 환자의 하위 집단은 TNF 길항제와 같은 생물학적 DMARD 병용 요법을 받았습니다(ORENCIA 투여 환자 204명, 위약 투여 환자 134명). TNF 길항제와 ORENCIA의 병용 사용은 권장되지 않습니다 [적응증 및 용법 (1.5) 참조]. RA 임상 연구의 대부분의 환자는 ORENCIA와 함께 다음과 같은 하나 이상의 병용 약물을 복용했습니다. 메토트렉세이트, 비스테로이드성 항염증제(NSAID), 코르티코스테로이드, TNF 길항제, 아자티오프린, 클로로퀸, 금, 히드록시클로로퀸, 레플루노마이드, 설파살라진 및 아나킨라.
가장 심각한 유해 반응은 심각한 감염과 악성 종양이었습니다. 가장 흔하게 보고된 유해 사건(ORENCIA로 치료받은 환자의 ≥10%에서 발생)은 두통, 상기도 감염, 비인두염 및 메스꺼움이었습니다.
임상적 개입(ORENCIA 중단 또는 투여 중지)으로 가장 자주 이어지는 유해 반응은 감염 때문이었습니다. 용량 중단으로 이어지는 가장 흔하게 보고된 감염은 상기도 감염(1%), 기관지염(0.7%) 및 대상포진(0.7%)이었습니다. 투여 중지로 이어지는 가장 흔한 감염은 폐렴(0.2%), 국소 감염(0.2%) 및 기관지염(0.1%)이었습니다.
정맥내 ORENCIA로 치료받은 RA 성인 환자에서 가장 흔한 유해 반응
위약 대조 RA 연구 중에 환자의 3% 이상에서 발생하고 ORENCIA(정맥내)로 치료받은 환자에서 적어도 1% 더 자주 발생한 유해 반응은 표 4에 요약되어 있습니다.
| 정맥내 ORENCIA (n=1955)a |
위약 (n=989)b |
|
|---|---|---|
| * 환자의 ≥3%에서 발생하고 ORENCIA로 치료받은 환자에서 >1% 더 자주 발생했습니다. a 생물학적 DMARD(adalimumab, anakinra, etanercept 또는 infliximab)를 병용한 환자 204명 포함. b 생물학적 DMARD(adalimumab, anakinra, etanercept 또는 infliximab)를 병용한 환자 134명 포함. |
||
|
두통 |
18% |
13% |
|
비인두염 |
12% |
9% |
|
현기증 |
9% |
7% |
|
기침 |
8% |
7% |
|
요통 |
7% |
6% |
|
고혈압 |
7% |
4% |
|
소화불량 |
6% |
4% |
|
요로 감염 |
6% |
5% |
|
발진 |
4% |
3% |
|
사지 통증 |
3% |
2% |
정맥 ORENCIA 투여를 받은 성인 RA 환자의 감염
RA 환자를 대상으로 한 위약 대조 시험에서, 정맥 ORENCIA 투여 환자의 54%와 위약 투여 환자의 48%에서 감염이 보고되었습니다. 가장 흔하게 보고된 감염(환자의 5%-13%에서 보고됨)은 상기도 감염, 비인두염, 부비동염, 요로 감염, 인플루엔자 및 기관지염이었습니다. ORENCIA와 위약을 비교했을 때, 환자의 5% 미만에서 더 높은 빈도(>0.5%)로 보고된 기타 감염은 비염, 단순포진 및 폐렴이었습니다 [경고 및 주의 사항 (5.3) 참조].
ORENCIA 투여 환자의 3%와 위약 투여 환자의 1.9%에서 중증 감염이 보고되었습니다. ORENCIA와 관련하여 가장 흔하게(0.2%-0.5%) 보고된 중증 감염은 폐렴, 봉와직염, 요로 감염, 기관지염, 게실염 및 급성 신우신염이었습니다 [경고 및 주의 사항 (5.3) 참조].
정맥 ORENCIA 투여를 받은 성인 RA 환자의 악성 종양
임상 시험의 위약 대조 부분(중앙값 12개월 동안 ORENCIA로 RA 치료를 받은 1955명의 환자)에서, 악성 종양의 전반적인 빈도는 ORENCIA 투여 환자와 위약 투여 환자에서 유사했습니다(각각 1.3% 및 1.1%). 그러나 ORENCIA 투여 환자(4례, 0.2%)에서 위약 투여 환자(0례, 0%)보다 더 많은 폐암 사례가 관찰되었습니다. RA 환자에 대한 누적 정맥 ORENCIA 임상 시험(위약 대조 및 비대조, 공개 표지)에서 총 8례의 폐암(100 환자-연당 0.21례)과 4례의 림프종(100 환자-연당 0.10례)이 2688명의 환자(3827 환자-연)에서 관찰되었습니다. 림프종에 대해 관찰된 비율은 국립 암 연구소의 감시, 역학 및 결과 데이터베이스를 기반으로 연령 및 성별이 일치하는 일반 인구에서 예상되는 비율보다 약 3.5배 높습니다. 특히 질병 활성도가 높은 RA 환자는 림프종 발생 위험이 더 높습니다. 기타 악성 종양에는 피부암, 유방암, 담관암, 방광암, 자궁경부암, 자궁내막암, 림프종, 흑색종, 골수이형성 증후군, 난소암, 전립선암, 신장암, 갑상선암 및 자궁암이 포함됩니다 [경고 및 주의 사항 (5.6) 참조]. 인간에서 악성 종양 발생에 대한 ORENCIA의 잠재적 역할은 알려져 있지 않습니다.
정맥 ORENCIA 투여를 받은 성인 RA 환자의 주입 관련 반응 및 과민 반응
연구 III, IV 및 V [임상 연구 (14.1) 참조]에서 급성 주입 관련 사건(주입 시작 후 1시간 이내에 발생하는 이상 반응)은 ORENCIA 투여 환자에서 위약 투여 환자보다 더 흔했습니다(ORENCIA의 경우 9%, 위약의 경우 6%). 가장 빈번하게 보고된 사건(1%-2%)은 어지러움, 두통 및 고혈압이었습니다.
ORENCIA 투여 환자의 >0.1% 및 ≤1%에서 보고된 급성 주입 관련 사건에는 저혈압, 혈압 상승 및 호흡 곤란과 같은 심폐 증상이 포함되었습니다. 기타 증상으로는 메스꺼움, 홍조, 두드러기, 기침, 과민증, 가려움증, 발진 및 천명이 포함되었습니다. 이러한 반응의 대부분은 경증(68%)에서 중등도(28%)였습니다. 급성 주입 관련 사건으로 인해 ORENCIA 투여 환자의 1% 미만이 투약을 중단했습니다. 대조 시험에서, 급성 주입 관련 사건으로 인해 ORENCIA 투여 환자 6명과 위약 투여 환자 2명이 연구 치료를 중단했습니다.
정맥 ORENCIA로 치료받은 2688명의 성인 RA 환자에 대한 임상 시험에서, 2례(<0.1%)의 아나필락시스가 있었습니다. 저혈압, 두드러기 및 호흡 곤란과 같은 약물 과민증과 잠재적으로 관련된 기타 반응은 각각 ORENCIA 투여 환자의 0.9% 미만에서 발생했으며 일반적으로 ORENCIA 주입 후 24시간 이내에 발생했습니다. 반응이 발생하는 경우 과민 반응 치료를 위한 적절한 의료 지원 조치를 즉시 사용할 수 있어야 합니다 [경고 및 주의 사항 (5.2) 참조].
정맥 ORENCIA로 RA 치료를 받은 COPD 환자의 이상 반응
연구 V [임상 연구 (14.1) 참조]에서, 만성 폐쇄성 폐 질환(COPD)이 있는 환자는 ORENCIA와 위약으로 각각 RA 치료를 받은 환자 37명과 17명이 있었습니다. RA 치료를 위해 ORENCIA를 투여받은 COPD 환자는 위약 투여 환자보다 이상 사건이 더 자주 발생했습니다(각각 97% 대 88%). 호흡기 질환은 COPD 악화, 기침, 잡음 및 호흡 곤란을 포함하여 ORENCIA 투여 환자에서 위약 투여 환자보다 더 자주 발생했습니다(각각 43% 대 24%). ORENCIA 투여 환자 중 더 높은 비율이 위약 투여 환자보다 중증 이상 사건을 경험했습니다(27% 대 6%). 여기에는 COPD 악화[37명 중 3명(8%)] 및 폐렴[37명 중 1명(3%)]이 포함됩니다 [경고 및 주의 사항 (5.5) 참조].
정맥 ORENCIA 투여를 받은 메토트렉세이트 미경험 RA 환자의 이상 반응
연구 VI는 메토트렉세이트 미경험 환자를 대상으로 한 활성 대조 임상 시험이었습니다 [임상 연구 (14.1) 참조]. 이러한 환자의 안전성 경험은 연구 I-V의 환자와 일치했습니다.
피하 또는 정맥내 ORENCIA로 치료받은 성인 RA 환자에서의 이상 반응
아래에 설명된 데이터는 연구 SC-1에서 얻어졌습니다. 연구 SC-1은 피하 또는 정맥내 투여된 ORENCIA의 안전성을 비교한 무작위, 이중맹검, 이중가짜약, 비열등성 연구로, 메토트렉세이트 배경 치료를 받고 메토트렉세이트에 대한 반응이 불충분한(MTX-IR) RA 환자 1457명을 대상으로 했습니다 [임상 연구(14.1) 참조]. 피하 ORENCIA로 치료받은 환자의 이상 반응 프로파일은 정맥내 ORENCIA로 치료받은 환자의 이상 반응 프로파일과 유사했으며, 연구 I-VI에서 투여된 정맥내 ORENCIA와 일치했습니다.
피하 ORENCIA로 치료받은 성인 RA 환자에서의 주사 부위 반응
연구 SC-1에서 주사 부위 반응의 전반적인 빈도는 피하 ORENCIA군에서 2.6%(19/736), 피하 플라세보군(정맥내 ORENCIA 투여)에서 2.5%(18/721)였습니다 [임상 연구(14.1) 참조]. 이러한 모든 주사 부위 반응(혈종, 가려움증, 홍반 포함)은 중증도가 경증(83%)에서 중등도(17%)였으며, 약물 중단을 필요로 하는 경우는 없었습니다.
성인 PsA 환자에서의 이상 반응
정맥내 또는 피하 ORENCIA로 치료받은 성인 PsA 환자에서의 이상 반응
ORENCIA의 안전성은 두 건의 무작위, 이중맹검, 플라세보 대조 시험에서 PsA 환자 594명(ORENCIA 투여 환자 341명, 플라세보 투여 환자 253명)을 대상으로 평가되었습니다 [임상 연구(14.3) 참조]. ORENCIA를 투여받은 341명의 환자 중 128명은 정맥내 ORENCIA(PsA-I)를, 213명은 피하 ORENCIA(PsA-II)를 투여받았습니다. 안전성 프로파일은 연구 PsA-I에서 정맥내 투여된 ORENCIA와 연구 PsA-II에서 피하 투여된 ORENCIA 간에 비교 가능했으며, RA 환자에서 ORENCIA의 안전성 프로파일과도 일치했습니다 [경고 및 주의사항(5), 이상 반응(6.1) 참조].
정맥내 ORENCIA로 치료받은 pJIA 환자에서의 이상 반응
일반적으로 정맥내 ORENCIA로 치료받은 소아 다관절 JIA(pJIA) 환자의 이상 사례는 빈도와 유형 면에서 정맥내 ORENCIA로 치료받은 성인 RA 환자에서 관찰된 것과 유사했습니다 [경고 및 주의사항(5) 및 이상 반응(6) 참조].
연구 JIA-1은 개방표지 확장 연구를 포함한 3부 연구로, 6~17세 pJIA 소아 환자 190명에서 정맥내 ORENCIA의 안전성을 평가했습니다. 연구의 4개월 리드인 개방표지 기간 동안 이상 사례의 전반적인 빈도는 70%였으며, 감염은 36%의 빈도로 발생했습니다 [임상 연구(14.2) 참조]. 가장 흔한 감염은 상기도 감염과 비인두염이었습니다. 감염은 후유증 없이 해결되었으며, 감염 유형은 외래 소아 인구에서 일반적으로 관찰되는 것과 일치했습니다. 5% 이상의 유병률로 발생한 다른 사례는 두통, 메스꺼움, 설사, 기침, 발열 및 복통이었습니다.
정맥내 ORENCIA로 4개월간의 초기 치료 기간 동안 총 6건의 중대한 이상 사례(급성 림프구성 백혈병, 난소낭종, 수두 감염, 질병 악화(2건), 관절 마모)가 보고되었습니다.
임상 시험에서 정맥내 ORENCIA로 치료받은 pJIA 소아 환자 190명 중 과민반응 사례는 1건(0.5%)이었습니다. A, B 및 C 기간 동안 급성 주입 관련 반응은 각각 4%, 2% 및 3%의 빈도로 발생했으며, 성인에게서 보고된 사례 유형과 일치했습니다.
개방표지 확장 기간 동안 지속적인 치료 시, 이상 사례의 유형은 빈도와 유형 면에서 성인 환자에서 관찰된 것과 유사했지만, 개방표지 치료 중 다발성 경화증 진단을 받은 환자 1명을 제외했습니다.
피하 ORENCIA로 치료받은 pJIA 환자에서의 이상 반응
연구 JIA-2는 4개월 단기 기간과 장기 확장 기간을 포함하는 개방표지 연구로, 2~17세 pJIA 소아 환자 205명에서 피하 ORENCIA의 안전성을 평가했습니다. 연구 JIA-2에서 피하 투여된 ORENCIA로 치료받은 pJIA 환자의 이상 반응 프로파일은 연구 JIA-1에서 정맥내 투여받은 pJIA 환자의 이상 반응 프로파일과 일치했습니다.
과민반응 사례는 보고되지 않았습니다. 국소 주사 부위 반응은 4.4%의 빈도로 발생했습니다.
정맥 ORENCIA 투여를 받는 비혈연자 조혈모세포 이식(HSCT) 환자에서의 이상 반응
여기에 기술된 자료는 혈액 악성 종양이 있는 6세 이상의 환자에서 aGVHD 예방을 위한 ORENCIA (GVHD-1)에 대한 한 임상 연구(모든 환자는 aGVHD 예방을 위한 표준 치료로 칼시뉴린 억제제와 메토트렉세이트를 투여받음)의 결과입니다 [임상 연구(14.4) 참조]. 이식 전날(Day-1)에 60분 동안 정맥 주입으로 10 mg/kg(최대 용량 1,000 mg)으로 투여한 후 이식 후 5일째, 14일째, 28일째 투여하는 두 개의 코호트를 연구했습니다:
1) 비혈연자로부터 7/8 인간 백혈구 항원(HLA) 일치 HSCT를 받은 ORENCIA 치료 환자(n=43)의 단일군 코호트(7/8 코호트) 및
2) 비혈연자로부터 8/8 HLA 일치 HSCT를 받은 ORENCIA 치료 환자(n=73)와 위약 치료 환자(n=69)로 구성된 무작위 코호트(8/8 코호트).
ORENCIA를 투여받은 116명의 환자 중 27명(23%)이 6세 이상 17세 미만이었습니다 [특정 집단에서의 사용(8.4) 참조].
이 연구에서 ORENCIA의 첫 번째 투여일부터 이식 후 225일까지의 안전성 정보가 아래에 제시되어 있습니다. 이상 반응의 발생률은 두 연구 코호트(n=116)의 ORENCIA 치료 환자의 통합 데이터를 기반으로 결정되었습니다.
칼시뉴린 억제제와 메토트렉세이트 병용 투여 시 ORENCIA를 투여받은 환자의 5% 이상에서 보고된 중대한 이상 반응에는 발열(20%), 폐렴(8%), 급성 신손상(7%), 설사(6%), 저산소증(5%) 및 오심(5%)이 포함됩니다.
이상 반응으로 인한 ORENCIA의 영구 중단은 폐렴 1건과 알레르기 반응 1건으로 각각 2명의 환자(1.7%)에서 발생했습니다.
ORENCIA 치료 환자에서 가장 흔한(≥10%) 이상 반응은 빈혈, 고혈압, CMV 재활성화/CMV 감염, 발열, 폐렴, 코피, CD4 림프구 감소, 고마그네슘혈증 및 급성 신손상이었습니다.
표 5는 GVHD-1에서 ORENCIA에 대한 연구에서 보고된 이상 반응의 빈도를 요약한 것입니다.
| 7/8 코호트 | 8/8 코호트 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 이상 반응 | ORENCIA (+CNI 및 MTX) (N=43) |
ORENCIA (+CNI 및 MTX) (N=73) |
위약 (+CNI 및 MTX) (N=69) |
|||||||||
|
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|||||||
|
혈액 및 림프계 장애 |
||||||||||||
|
빈혈 |
56 |
56 |
69 |
69 |
57 |
57 |
||||||
|
CD4 림프구 감소 |
14 |
14 |
14 |
14 |
9 |
9 |
||||||
|
혈관 장애 |
||||||||||||
|
고혈압 |
49 |
49 |
43 |
43 |
38 |
38 |
||||||
|
일반 장애 및 투여 부위 상태 |
||||||||||||
|
발열 |
28 |
9 |
19 |
10 |
20 |
4 |
||||||
|
감염 |
||||||||||||
|
CMV 재활성화/CMV 감염 |
26 |
26 |
32 |
32 |
22 |
22 |
||||||
|
폐렴 |
19 |
19 |
12 |
12 |
10 |
9 |
||||||
|
호흡기 및 종격동 장애 |
||||||||||||
|
코피 |
12 |
12 |
16 |
16 |
10 |
10 |
||||||
|
신장 및 비뇨기 장애 |
||||||||||||
|
급성 신손상 |
9 |
7 |
15 |
15 |
10 |
10 |
|
대사 및 영양 장애 |
||||||
|
고마그네슘혈증 |
5 |
5 |
18 |
18 |
10 |
10 |
Study GVHD-1에서 칼시뉴린 억제제 및 메토트렉세이트와 병용하여 ORENCIA를 투여받은 환자의 <10%에서 임상적으로 관련성 있는 유해 반응으로 EBV 재활성화가 포함되었습니다.
6.2 면역원성
모든 치료용 단백질과 마찬가지로 면역원성이 있을 가능성이 있습니다. 항체 형성의 검출은 분석법의 민감도와 특이성에 크게 의존합니다. 또한, 분석법에서 관찰된 항체(중화 항체 포함) 양성의 발생률은 분석법, 샘플 취급, 샘플 수집 시기, 병용 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 아래에 설명된 연구에서 항체 발생률을 다른 연구의 항체 발생률 또는 다른 아바타셉트 제품과 비교하는 것은 오해의 소지가 있을 수 있습니다.
정맥 ORENCIA로 치료받은 성인 RA 환자의 면역원성
정맥 ORENCIA로 반복 치료 후 최대 2년 동안 RA 환자에서 ELISA 분석법으로 전체 아바타셉트 분자 또는 아바타셉트의 CTLA-4 부분에 대한 항체를 평가했습니다. 1993명 중 34명(2%)의 환자가 전체 아바타셉트 분자 또는 아바타셉트의 CTLA-4 부분에 대한 결합 항체를 생성했습니다. 아바타셉트의 골 농도가 분석 결과에 영향을 줄 수 있으므로 하위 집단 분석을 수행했습니다. 하위 집단 분석에서 정맥 ORENCIA 치료를 56일 이상 중단한 154명 중 9명(6%)의 환자가 항체를 생성했습니다. CTLA-4에 대한 결합 활성이 확인된 샘플은 세포 기반 루시퍼라제 리포터 분석법으로 중화 항체의 존재 여부를 평가했습니다. 9명 중 6명(67%)의 평가 가능한 환자에게 중화 항체가 있는 것으로 나타났습니다. 그러나 분석법의 민감도 부족으로 인해 중화 항체의 발생이 과소 보고될 수 있습니다.
항-아바타셉트 항체 발생과 임상 반응 또는 유해 사건 간의 상관 관계는 관찰되지 않았습니다.
피하 또는 정맥 ORENCIA로 치료받은 성인 RA 환자의 면역원성
Study SC-1은 피하 또는 정맥 ORENCIA 투여 후 아바타셉트에 대한 면역원성을 비교했습니다. 아바타셉트에 대한 전반적인 면역원성 빈도는 피하 그룹의 경우 1%(8/725), 정맥 그룹의 경우 2%(16/710)였습니다. 이 비율은 이전 경험과 일치하며, 면역원성과 약동학, 안전성 또는 효능에 대한 영향 간에는 상관 관계가 없었습니다.
피하 ORENCIA 단독 요법으로 치료받은 성인 RA 환자의 면역원성
Study SC-2는 이전에 ORENCIA 또는 다른 CTLA4Ig를 투여받은 적이 없는 100명의 RA 환자에서 ORENCIA의 피하 단독 요법 사용(정맥 로딩 용량 없이)이 면역원성에 미치는 영향을 확인하기 위해 수행되었습니다. 이 연구의 환자는 피하 ORENCIA + 메토트렉세이트(n=51) 또는 피하 ORENCIA 단독 요법(n=49)을 투여받았습니다. 두 그룹 모두 4개월 치료 후 항-아바타셉트 항체가 생성된 환자는 없었습니다. 이 연구에서 관찰된 안전성은 다른 피하 연구에서 관찰된 안전성과 일치했습니다.
피하 ORENCIA 치료 후 중단 및 재개 후 성인 RA 환자의 면역원성
Study SC-3은 성인 RA 환자에서 치료 후, 중단(3개월), 그리고 ORENCIA 피하 치료 재개(환자는 메토트렉세이트와 병용 치료) 후 면역원성을 조사하기 위해 수행되었습니다. 첫 3개월 치료 기간에 167명의 환자가 등록되었고, 반응자(n=120)는 두 번째 3개월 기간(중단 기간) 동안 피하 ORENCIA 또는 위약 중 하나에 무작위 배정되었습니다. 이 기간의 환자는 그 후 연구의 마지막 3개월 기간(3기)에 공개 표지 ORENCIA 치료를 받았습니다. 중단 기간이 끝날 때, 피하 ORENCIA를 계속 투여받은 환자 38명 중 0명(0%)이 항-아바타셉트 항체를 생성한 반면, 이 기간 동안 피하 ORENCIA를 중단한 환자 73명 중 7명(10%)이 항체를 생성했습니다. 중단 기간 동안 피하 위약을 투여받은 환자의 절반은 3기 시작 시 ORENCIA의 단일 정맥 주입을 받았고, 절반은 정맥 위약을 받았습니다. 모든 환자가 다시 피하 ORENCIA를 투여받은 3기 말에, 면역원성 비율은 전 기간 동안 피하 ORENCIA를 투여받은 그룹에서 1/38(3%), 중단 기간 동안 위약을 투여받은 그룹에서 2/73(3%)였습니다. 치료를 재개할 때, 최대 3개월 동안 피하 치료를 중단한 환자와 피하 치료를 계속한 환자 간에 주사 반응이나 치료 반응의 차이가 없었습니다(이러한 결과는 정맥 로딩 용량을 투여받았거나 투여받지 않은 환자 모두에서 발생했습니다). 이 연구에서 관찰된 안전성은 다른 연구에서 관찰된 안전성과 일치했습니다.
정맥 ORENCIA로 치료받은 pJIA 환자의 면역원성
공개 표지 기간 동안 정맥 ORENCIA로 반복 치료 후 pJIA 환자에서 ELISA 분석법으로 전체 아바타셉트 분자 또는 아바타셉트의 CTLA-4 부분에 대한 항체를 평가했습니다. 이중 눈가림 기간 동안 최대 6개월 동안 치료를 중단한 환자의 경우 분자의 CTLA-4 부분에 대한 항체 형성률은 41%(22/54)였고, 치료를 계속한 환자의 경우 13%(7/54)였습니다. 이러한 환자 중 20명은 중화 활성이 있는 항체에 대해 검사할 수 있는 샘플을 보유하고 있었으며, 이 중 8명(40%)의 환자에게 중화 항체가 있는 것으로 나타났습니다.
항체의 존재는 일반적으로 일시적이었으며, 역가는 낮았습니다. 항체의 존재는 유해 사건, 효능 변화 또는 아바셉트 혈청 농도에 대한 영향과 관련이 없었습니다. 이중맹검 기간 동안 최대 6개월 동안 ORENCIA 투여를 중단한 환자의 경우, ORENCIA 치료 재개 시 심각한 급성 주입 관련 사건은 관찰되지 않았습니다.
정맥 ORENCIA를 사용한 aGVHD 예방 치료를 받은 환자의 면역원성
면역원성은 HSCT를 받는 환자에서 평가되었습니다. 전반적으로, 이 연구에서 사용된 4회 용량의 정맥 ORENCIA 요법으로부터 면역원성 발생률 및 관련 항체 역가는 낮았습니다. ORENCIA군의 면역원성 평가 가능 대상자 114명 중 ORENCIA 치료 기간(이식 후 Day -1부터 Day 28까지) 동안 양성인 대상자는 없었습니다. 치료 중단 기간(이식 후 Day 29부터 Day 180까지) 동안; 면역원성 평가 가능 대상자 91명 중 6명(6.6%)이 CTLA4 및 가능한 Ig에 대해 양성이었습니다. 6명의 양성 대상자 중 4명은 중화 활성을 가진 양성 샘플을 하나 이상 가지고 있는 것으로 나타났습니다. 이 연구에서 면역원성 양성 대상자는 Day 180(치료 중단 기간)에만 ADA 양성 샘플을 가지고 있었으며, 따라서 반응 시기로 인해 PK, 안전성 또는 효능에 대한 영향을 확인할 수 없었습니다.
6.3 시판 후 경험
ORENCIA의 시판 후 사용 중 유해 반응이 보고되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 ORENCIA와의 인과 관계를 확립할 수 있는 것은 아닙니다. ORENCIA에 대한 시판 후 경험을 바탕으로 다음과 같은 유해 반응이 확인되었습니다.
- •
- 혈관염(피부 혈관염 및 백혈구 파괴성 혈관염 포함)
- •
- 새로운 또는 악화된 건선
- •
- 비흑색종 피부암(기저 세포 암종 및 편평 세포 암종)
- •
- 안지오에데마 반응 [경고 및 주의 사항 (5.2) 참조]
정맥 ORENCIA에 대한 시판 후 경험에서 전신 주입 반응은 치명적인 아나필락시스 한 건을 제외하고 정맥 ORENCIA에 대한 임상 시험 경험에서 관찰된 것과 유사했습니다 [경고 및 주의 사항 (5.2) 참조]. 피하 ORENCIA 사용 후 전신 주사 반응(예: 가려움증, 인후 압박감, 호흡 곤란)에 대한 시판 후 보고가 있었습니다.
7 약물 상호 작용
7.1 면역억제제
ORENCIA와 TNF 억제제의 병용 투여는 심각한 감염 위험 증가와 관련이 있으며, TNF 억제제 단독 사용에 비해 유의미한 추가 효능은 없습니다. ORENCIA와 TNF 억제제의 병용 요법은 권장되지 않습니다. [see Warnings and Precautions (5.1)].
anakinra와 같은 다른 생물학적 RA 치료제 또는 다른 생물학적 PsA 치료제, 그리고 JAK 억제제와 ORENCIA를 병용 투여하는 것의 안전성과 유효성을 평가하기 위한 경험이 불충분하므로 이러한 병용 사용은 권장되지 않습니다. [see Warnings and Precautions (5.1)].
7.2 혈당 검사
말토오스를 함유한 비경구 약물은 glucose dehydrogenase pyrroloquinoline quinone (GDH-PQQ)이 포함된 검사지를 사용하는 혈당 측정기의 측정값을 방해할 수 있습니다. GDH-PQQ 기반 혈당 모니터링 시스템은 ORENCIA 정맥 주사에 존재하는 말토오스와 반응하여 주입 당일 혈당 수치가 잘못 높게 측정될 수 있습니다. 정맥 주사용 ORENCIA를 투여받는 환자 중 혈당 모니터링이 필요한 환자는 glucose dehydrogenase nicotine adenine dinucleotide (GDH-NAD), glucose oxidase 또는 glucose hexokinase 검사법과 같이 말토오스와 반응하지 않는 방법을 고려하도록 권고해야 합니다.
피하 주사용 ORENCIA는 말토오스를 함유하지 않으므로 환자는 혈당 모니터링 방법을 변경할 필요가 없습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 여성에서의 ORENCIA 사용에 대한 데이터는 약물 관련 위험을 알려주기에 충분하지 않습니다. 그러나 자궁 내(임신 중) ORENCIA에 노출된 영아에게 생백신을 투여하는 것에 대한 임상적 고려 사항이 있습니다(임상적 고려 사항 참조). 랫트와 토끼의 생식 독성 연구에서, 최대 권장 인체 용량(MRHD) 10mg/kg/월의 AUC 기준 약 29배의 노출을 유발하는 용량으로 기관 형성 중 정맥 투여 시 태아 기형은 관찰되지 않았습니다. 그러나 랫트의 출생 전후 발달 연구에서, ORENCIA는 AUC 기준 MRHD의 11배에서 암컷 랫트의 면역 기능을 변화시켰습니다.
임상적 고려 사항
영아 및 생백신 투여
임신 중 여성이 ORENCIA로 치료받는 동안 abatacept가 태반을 통과하여 태아에게 전달될 수 있는지 여부는 알려져 있지 않습니다. Abatacept는 면역 조절제입니다. 자궁 내 abatacept에 노출된 후 생백신을 투여받은 영아의 면역 반응에 영향을 미치는지 여부는 알려져 있지 않습니다. 이러한 영아에게 백신을 접종하기 전에 위험과 이점을 고려해야 합니다 [경고 및 주의 사항 (5.4) 참조].
데이터
인체 데이터
임신 여성에서의 ORENCIA 사용에 대한 적절하고 잘 통제된 연구는 없습니다. 임신 여성에서의 ORENCIA 사용에 대한 데이터는 약물 관련 위험을 알려주기에 충분하지 않습니다.
동물 데이터
기관 형성 중 마우스(10, 55 또는 300 mg/kg/일), 랫트(10, 45 또는 200 mg/kg/일) 및 토끼(10, 45 또는 200 mg/kg 3일마다)에 대한 abatacept의 정맥 투여는 랫트와 토끼에서 AUC 기준 MRHD의 약 29배에 해당하는 노출을 유발했으며(랫트와 토끼에서 모체 용량 200mg/kg/일), 어떤 종에서도 배아 독성이나 태아 기형은 관찰되지 않았습니다.
랫트의 출생 전후 발달 연구(임신 6일부터 수유 21일까지 10, 45 또는 200mg/kg 3일마다)에서, 생후 56일(PND)에 대조군에 비해 T세포 의존성 항체 반응이 9배 증가하고 생후 112일(PND)에 단일 암컷 새끼에서 갑상선염이 발생하는 등 암컷 자손의 면역 기능 변화가 AUC 기준 MRHD의 약 11배에서 발생했습니다(모체 용량 200mg/kg). MRHD의 약 3배(모체 용량 45mg/kg)에서는 부작용이 관찰되지 않았습니다. 랫트의 면역 교란이 자궁 내 abatacept에 노출된 사람에서 자가 면역 질환 발생 위험에 대한 관련 지표인지 여부는 알려져 있지 않습니다. 인간의 태아 면역 체계 상태를 더 잘 나타낼 수 있는 어린 랫트에서의 abatacept 노출은 갑상선과 췌장의 염증을 포함한 면역 체계 이상을 초래했습니다 [비임상 독성학 (13.2) 참조].
8.4 소아 사용
다관절 소아 특발성 관절염
중등도에서 중증으로 활동적인 다관절 소아 특발성 관절염(pJIA) 환자에서 2세 이상의 환자의 징후 및 증상을 감소시키는 ORENCIA의 안전성 및 유효성이 확립되었습니다(ORENCIA는 단독 요법으로 또는 메토트렉세이트와 병용하여 사용할 수 있습니다). 이러한 적응증에 대한 ORENCIA의 사용은 다음 연구의 증거에 의해 뒷받침됩니다.
- 정맥내 투여: pJIA를 가진 6세에서 17세 사이의 소아 환자 190명을 대상으로 한 무작위 중단 효능, 안전성 및 약동학 연구 [임상 약리학 (12.3) 및 임상 연구 (14.2) 참조]. 정맥내 ORENCIA 투여 후 집단 약동학(PK) 분석 결과 abatacept의 청소율이 기준 체중에 따라 증가하는 것으로 나타났으므로, 정맥내 ORENCIA는 체중 기반 또는 체중 범위 기반으로 투여됩니다 [용법 및 용량 (2.2) 참조]. 6세 미만 환자에 대한 정맥내 ORENCIA 투여는 연구되지 않았습니다.
- 피하 투여: pJIA를 가진 2세에서 17세 사이의 소아 환자 205명을 대상으로 한 ORENCIA 피하 투여에 대한 공개 표지 PK 및 안전성 연구, pJIA 환자에서 정맥내 ORENCIA의 효과 및 RA 환자에서 피하 ORENCIA의 효과 외삽 [임상 약리학 (12.3) 및 임상 연구 (14.2) 참조]. pJIA 환자에서 피하 ORENCIA 주사 후 집단 PK 분석 결과 체중 증가에 따라 abatacept의 청소율이 증가하는 경향이 있었으므로, 피하 ORENCIA 용량은 체중 범위 기반입니다 [용법 및 용량 (2.2) 참조].
2세 미만 소아 환자에서 pJIA에 대한 ORENCIA 사용의 안전성 및 유효성은 확립되지 않았습니다.
급성 이식편대숙주병 예방
2세 이상의 소아 환자에서 일치하는 또는 1개의 대립 유전자 불일치 비혈연 공여자로부터 HSCT를 받는 경우, 칼시뉴린 억제제 및 메토트렉세이트와 병용하여 급성 이식편대숙주병(aGVHD) 예방을 위한 ORENCIA의 안전성 및 유효성이 확립되었습니다. 이 적응증에 대한 ORENCIA의 사용은 다음 증거에 의해 뒷받침됩니다.
- •
- 6세 이상의 성인 및 소아 환자를 대상으로 한 적절하고 잘 통제된 연구에서 이식 전날 10mg/kg을 정맥내 투여하고 이식 후 5일, 14일 및 28일에 10mg/kg을 정맥내 투여하였으며,
- •
- 이식 전날 15mg/kg을 정맥내 투여하고 이식 후 5일, 14일 및 28일에 12mg/kg을 정맥내 투여한 2세에서 6세 미만의 소아 환자에 대한 abatacept 노출에 대한 약동학적 모델링 및 시뮬레이션.
또한, 2세에서 6세 미만의 소아 환자에서 질병 경과는 6세 이상의 환자와 충분히 유사하여 더 어린 소아 환자에게 데이터를 외삽할 수 있습니다 [임상 약리학 (12.3) 및 임상 연구 (14.4) 참조]. 연구 GVHD-1에서 6세 이상의 소아 환자에게 새로운 안전성 신호는 관찰되지 않았습니다.
이 적응증에 대한 ORENCIA의 안전성 및 유효성은 2세 미만의 소아 환자에서는 확립되지 않았습니다.
건선성 관절염
피하 투여
2세에서 17세 사이의 소아 환자의 건선성 관절염 치료를 위한 피하 ORENCIA의 안전성 및 유효성이 확립되었습니다.
이 연령대에서 ORENCIA의 사용은 PsA 성인 환자에 대한 ORENCIA의 적절하고 잘 통제된 연구, RA 성인 환자, PsA 성인 환자 및 pJIA 소아 환자의 약동학적 데이터, 그리고 피하 제제를 사용한 pJIA 2세에서 17세 사이의 소아 환자에 대한 임상 연구의 안전성 데이터를 바탕으로 뒷받침됩니다.
관찰된 투여 전(골) 농도는 일반적으로 RA 및 PsA 성인 환자와 활동성 다관절염을 가진 JIA 소아 환자 간에 비교적 유사하며, PK 노출은 성인 PsA 환자와 PsA 소아 환자 간에 비슷할 것으로 예상됩니다. [유해 반응 (6.1), 임상 약리학 (12.3), 및 임상 연구 (14.1, 14.2, 14.3) 참조].
건선성 관절염을 가진 2세 미만의 소아 환자에서 피하 ORENCIA의 안전성 및 유효성은 확립되지 않았습니다.
정맥내 투여
건선성 관절염 소아 환자에서 정맥내 ORENCIA의 안전성 및 유효성은 확립되지 않았습니다.
소아 동물 독성 자료
4일에서 94일령(면역 체계 성숙 전)의 랫드에 abatacept를 투여한 소아 동물 연구에서 대조군과 비교하여 모든 용량에서 사망으로 이어지는 감염 발생률이 증가했습니다. 증가된 T 보조 세포와 감소된 T 조절 세포를 포함한 변경된 T 세포 하위 집합이 관찰되었습니다. 또한, T 세포 의존성 항체 반응(TDAR)의 억제가 관찰되었습니다. 이러한 동물을 성체가 될 때까지 추적 관찰한 결과, 갑상선 및 췌장 소도의 림프구성 염증이 관찰되었습니다. 반대로, 성체 마우스 및 원숭이에 대한 연구에서는 유사한 결과가 나타나지 않았습니다. 랫드의 면역 체계는 출생 후 처음 몇 주 동안 미성숙하기 때문에 이러한 결과의 인체에 대한 관련성은 알 수 없습니다.
8.5 노인 사용
류마티스 관절염
총 323명의 65세 이상 환자(75세 이상 환자 53명 포함)가 임상 연구에서 ORENCIA를 투여받았습니다. 노인 환자(65세 이상)와 젊은 성인 간에 안전성 또는 효과의 전반적인 차이는 관찰되지 않았으며, 다른 보고된 임상 경험에서도 노인 환자와 젊은 성인 간 반응의 차이가 확인되지 않았지만, 일부 노인 환자의 민감도가 더 높을 가능성을 배제할 수는 없습니다. 65세 이상 ORENCIA 투여 환자에서 심각한 감염 및 악성 종양의 빈도는 65세 미만 환자보다 높았습니다. 일반적으로 노인 인구에서 감염 및 악성 종양의 발생률이 더 높기 때문에 노인 환자를 치료할 때는 주의해야 합니다.
급성 이식편대숙주병 예방
aGVHD 예방을 위해 10mg/kg 용량으로 ORENCIA를 투여받은 GVHD-1 연구의 116명 환자 중 12명(10%)이 65세 이상이었고, 2명(2%)의 환자가 75세 이상이었습니다 [임상 연구 (14.4) 참조]. aGVHD에 대한 ORENCIA의 임상 연구에는 65세 이상 환자가 충분히 포함되지 않아 젊은 성인 환자와 반응이 다른지 여부를 확인할 수 없었습니다.
10 과다 복용
ORENCIA 최대 50mg/kg 용량 (6세 이상 환자에게 권장되는 최대 용량의 5배, 2세 이상 6세 미만 환자에게 권장되는 최대 용량의 3.3배)을 정맥 주사했을 때 명백한 독성 효과는 나타나지 않았습니다. 과다 복용 시 환자의 이상반응 징후 또는 증상을 모니터링하고 적절한 대증 요법을 실시하는 것이 좋습니다.
11 설명
Abatacept는 선택적 T세포 공동자극 조절제입니다. Abatacept는 사람 세포독성 T림프구 관련 항원 4 (CTLA-4)의 세포외 영역이 사람 면역글로불린 G1 (IgG1)의 변형된 Fc (힌지, CH2 및 CH3 도메인) 부분에 연결된 가용성 융합 단백질입니다. Abatacept는 포유동물 세포 발현 시스템에서 재조합 DNA 기술에 의해 생산됩니다. Abatacept의 겉보기 분자량은 92킬로달톤입니다.
주사용 ORENCIA (abatacept)는 정맥 주입 전 재구성 및 희석을 위한 무방부제 멸균 백색 동결건조 분말입니다. USP 주사용 멸균수 10mL로 동결건조 분말을 재구성하면, 재구성된 ORENCIA 용액은 투명하고 무색에서 연한 황색이며, 농도는 25mg/mL이고 pH 범위는 7.2~7.8입니다. ORENCIA 단회용 바이알 각각에는 abatacept 250mg, 말토스 (500mg), 인산일수소나트륨 (17.2mg) 및 염화나트륨 (14.6mg)이 들어 있습니다.
주사용 ORENCIA (abatacept)는 피하 투여를 위한 무방부제 멸균, 투명 또는 약간 유탁한, 무색에서 연한 황색 용액이며, pH 범위는 6.8~7.4입니다. ORENCIA 주사제는 단회용 프리필드 시린지 또는 단회용 ClickJect 오토인젝터로 제공됩니다 (표 6 참조).
| 제형 | 활성 성분 양 및 용량 | 불활성 성분 함량 |
|---|---|---|
|
ORENCIA 주사제 50mg/0.4mL 프리필드 시린지 |
0.4mL 용액 중 abatacept 50mg |
무수 인산이수소나트륨 (0.335mg) 일수화 인산일수소나트륨 (0.114mg) 폴록사머 188 (3.2mg) 수크로스 (68mg) USP 주사용수를 0.4mL로 조정 |
|
ORENCIA 주사제 87.5mg/0.7mL 프리필드 시린지 |
0.7mL 용액 중 abatacept 87.5mg |
무수 인산이수소나트륨 (0.587mg) 일수화 인산일수소나트륨 (0.200mg) 폴록사머 188 (5.6mg) 수크로스 (119mg) USP 주사용수를 0.7mL로 조정 |
|
ORENCIA 주사제 125mg/mL 프리필드 시린지 및 ClickJect 오토인젝터 |
1mL 용액 중 abatacept 125mg |
무수 인산이수소나트륨 (0.838mg) 일수화 인산일수소나트륨 (0.286mg) 폴록사머 188 (8mg) 수크로스 (170mg) USP 주사용수를 1mL로 조정 |
정맥 투여용 동결건조 제형과 달리, 피하 투여용 ORENCIA 용액에는 말토스가 포함되어 있지 않습니다.
12 약물동력학
12.1 작용 기전
선택적 동자극 조절제인 아바타셉트는 CD80 및 CD86에 결합하여 T 세포(T 림프구) 활성을 억제함으로써 CD28과의 상호작용을 차단합니다. 이 상호작용은 T 림프구의 완전한 활성화에 필요한 동자극 신호를 제공합니다. 활성화된 T 림프구는 RA, 소아 특발성 관절염(pJIA) 및 건선 관절염(PsA)의 발병 기전에 관여하며 RA, pJIA 및 PsA 환자의 활액에서 발견됩니다.
시험관 내에서 아바타셉트는 T 세포 증식을 감소시키고 TNF 알파(TNFα), 인터페론-γ 및 인터루킨-2의 생성을 억제합니다. 랫트 콜라겐 유도 관절염 모델에서 아바타셉트는 염증을 억제하고 항콜라겐 항체 생성을 감소시키며 인터페론-γ의 항원 특이적 생성을 감소시킵니다. 이러한 생물학적 반응 마커와 ORENCIA가 임상 효과를 발휘하는 기전과의 관계는 알려져 있지 않습니다.
12.2 약력학
ORENCIA를 10mg/kg에 가까운 용량으로 투여한 임상 시험에서 용해성 인터루킨-2 수용체(sIL-2R), 인터루킨-6(IL-6), 류마티스 인자(RF), C-반응성 단백질(CRP), 기질 금속단백질 분해효소-3(MMP3) 및 TNFα의 혈청 수치가 감소하는 것으로 나타났습니다. 이러한 생물학적 반응 마커와 ORENCIA가 임상 효과를 발휘하는 기전과의 관계는 알려져 있지 않습니다.
aGVHD 예방을 위해 ORENCIA를 투여받은 환자에 대한 생물학적 반응 마커의 공식적인 약력학 분석은 수행되지 않았습니다.
12.3 약동학
건강한 성인 및 성인 RA – 정맥 투여
아바타셉트의 약동학은 건강한 성인 피험자에게 10mg/kg의 단회 정맥 주입 후 그리고 RA 환자에게 10mg/kg의 ORENCIA 반복 정맥 주입 후 연구되었습니다(표 7 참조).
| 약동학적 매개변수 | 건강한 피험자 (10mg/kg 단회 용량 투여 후) n=13 |
RA 환자 (10mg/kg 반복 용량a 투여 후) n=14 |
|---|---|---|
| a ORENCIA의 반복 정맥 주입은 1일차, 15일차, 30일차 및 그 이후 매월 투여되었습니다. | ||
|
최고 농도(Cmax) [mcg/mL] |
292 (175-427) |
295 (171-398) |
|
최종 반감기(t1/2) [일] |
16.7 (12-23) |
13.1 (8-25) |
|
전신 청소율(CL) [mL/h/kg] |
0.23 (0.16-0.30) |
0.22 (0.13-0.47) |
|
분포 용적(Vss) [L/kg] |
0.09 (0.06-0.13) |
0.07 (0.02-0.13) |
류마티스 관절염 환자와 건강한 피험자에서 아바타셉의 약동학적 특성은 비슷한 것으로 나타났습니다. 류마티스 관절염 환자의 경우, 여러 차례 정맥 주입 후 아바타셉의 약동학적 특성은 2 mg/kg에서 10 mg/kg의 용량 범위에 걸쳐 Cmax와 AUC가 용량에 비례하여 증가하는 것을 보였습니다. 10 mg/kg에서 혈청 농도는 60일째에 평균(범위) 최저 농도 24 mcg/mL (1~66 mcg/mL)로 정상 상태에 도달하는 것으로 나타났습니다. 류마티스 관절염 환자에서 매달 10 mg/kg으로 반복 투여를 지속했을 때 아바타셉의 전신 축적은 발생하지 않았습니다.
류마티스 관절염 환자에 대한 집단 약동학 분석 결과, 체중 증가에 따라 아바타셉의 청소율이 높아지는 경향이 있는 것으로 나타났습니다. 연령 및 성별(체중을 보정한 경우)은 청소율에 영향을 미치지 않았습니다. 메토트렉세이트, NSAIDs, 코르티코스테로이드 및 TNF 길항제 병용 투여는 아바타셉의 청소율에 영향을 미치지 않았습니다.
신장애 또는 간장애가 아바타셉의 약동학에 미치는 영향을 조사하기 위한 공식적인 연구는 수행되지 않았습니다.
성인 류마티스 관절염 – 피하 투여
아바타셉은 피하 투여 후 선형 약동학적 특성을 나타냈습니다. 85일간의 치료 후 관찰된 정상 상태의 Cmin 및 Cmax의 평균(범위)은 각각 32.5 mcg/mL (6.6~113.8 mcg/mL) 및 48.1 mcg/mL (9.8~132.4 mcg/mL)였습니다. 정맥 투여에 대한 피하 투여 후 아바타셉의 생체 이용률은 79%였습니다. 전신 청소율 (0.28 mL/h/kg), 분포 용적 (0.11 L/kg) 및 최종 반감기 (14.3일)의 평균 추정치는 피하 투여와 정맥 투여 간에 비슷했습니다.
100명의 류마티스 관절염 환자에서 ORENCIA의 피하 단독 요법 사용이 면역원성에 미치는 영향을 확인하기 위해 (정맥 로딩 용량 없이) 연구 SC-2가 수행되었습니다 [유해 반응 (6.3) 참조]. 이 연구에서, 2주 투여 후 평균 최저 농도는 12.6 mcg/mL에 도달했습니다.
정맥 투여 데이터와 일치하게, 류마티스 관절염 환자의 피하 ORENCIA에 대한 집단 약동학 분석 결과, 체중 증가에 따라 아바타셉의 청소율이 높아지는 경향이 있는 것으로 나타났습니다 [용법 및 용량 (2.1) 참조]. 연령 및 성별(체중을 보정한 경우)은 명백한 청소율에 영향을 미치지 않았습니다. 메토트렉세이트, 코르티코스테로이드 및 NSAIDs와 같은 병용 약물은 아바타셉의 명백한 청소율에 영향을 미치지 않았습니다.
다관절 소아 특발성 관절염 – 정맥 투여
6세에서 17세 사이의 환자를 대상으로 한 연구 JIA-1에서 아바타셉의 평균(범위) 정상 상태 혈청 최고 농도 및 최저 농도는 217 mcg/mL (57~700 mcg/mL) 및 11.9 mcg/mL (0.15~44.6 mcg/mL)였습니다 [임상 연구 (14.2) 참조]. 혈청 농도 데이터에 대한 집단 약동학 분석 결과, 아바타셉의 청소율은 기준 체중에 따라 증가하는 것으로 나타났습니다 [용법 및 용량 (2.2) 참조]. 소아 특발성 관절염 환자에서 아바타셉의 추정 평균(범위) 청소율은 0.4 mL/h/kg (0.20~1.12 mL/h/kg)였습니다. 체중의 영향을 고려한 후, 아바타셉의 청소율은 연령 및 성별과 관련이 없었습니다. 메토트렉세이트, 코르티코스테로이드 및 NSAIDs 병용 투여도 아바타셉의 청소율에 영향을 미치지 않는 것으로 나타났습니다.
다관절 소아 특발성 관절염 – 피하 투여
2세에서 17세 사이의 환자를 대상으로 한 연구 JIA-2에서, 주 1회 체중 기반 계층별 피하 ORENCIA 투여 후 85일째에 아바타셉의 정상 상태에 도달했습니다 [임상 연구 (14.2) 참조]. 체중 기반 계층별 피하 투여 요법에 의해 체중 계층 및 연령대에 걸쳐 비슷한 최저 농도가 달성되었습니다. 113일째 아바타셉의 평균(범위) 최저 농도는 소아 JIA 환자에서 체중이 10kg 미만 25kg, 25kg 미만 50kg, 50kg 이상인 경우 각각 44.4 mcg/mL (13.4~88.1 mcg/mL), 46.6 mcg/mL (22.4~97.0 mcg/mL), 38.5 mcg/mL (9.3~73.2 mcg/mL)였습니다.
정맥 투여 데이터와 일치하게, JIA 환자의 피하 ORENCIA에 대한 집단 약동학 분석 결과, 체중 증가에 따라 아바타셉의 청소율이 높아지는 경향이 있는 것으로 나타났습니다 [용법 및 용량 (2.2) 참조]. 연령 및 성별(체중을 보정한 경우)은 명백한 청소율에 영향을 미치지 않았습니다. 메토트렉세이트, 코르티코스테로이드 및 NSAIDs와 같은 병용 약물은 아바타셉의 명백한 청소율에 영향을 미치지 않았습니다.
성인 건선성 관절염 – 정맥 및 피하 투여
용량 범위 연구인 연구 PsA-I에서, 정맥 ORENCIA는 3 mg/kg으로 투여되었으며, 체중 범위 기반 투여량은 다음과 같습니다. 체중이 60kg 미만인 환자의 경우 500mg, 체중이 60kg 이상 100kg 미만인 환자의 경우 750mg, 체중이 100kg 초과인 환자의 경우 1,000mg 또는 1일차와 15일차에 30 mg/kg 용량을 투여한 후 체중 범위 기반 투여 [임상 연구 (14.3) 참조]. 매달 정맥 ORENCIA 투여 후, 아바타셉은 이 연구에서 용량 범위에 걸쳐 선형 PK를 나타냈습니다. 체중 범위 기반 투여(상기 참조)에서 아바타셉의 정상 상태는 57일째에 도달했으며, 기하 평균(CV%) 최저 농도(Cmin)는 169일째 24.3 mcg/mL (40.8%)였습니다. 연구 PsA-II에서 주 1회 125mg의 피하 ORENCIA 투여 후, 아바타셉의 정상 상태는 57일째에 도달했으며, 기하 평균(CV%) Cmin은 169일째 25.6 mcg/mL (47.7%)였습니다.
RA 결과와 일치하게, PsA 환자에서의 abatacept에 대한 집단 약동학 분석 결과 체중 증가에 따라 abatacept의 청소율(L/h)이 증가하는 경향이 있음이 밝혀졌습니다 [투여 및 투약 방법 (2.3)]. 또한, 같은 체중의 RA 환자와 비교하여 PsA 환자의 abatacept 청소율은 약 8% 낮았으며, 이는 PsA 환자에서 abatacept 노출량이 더 높다는 것을 의미합니다. 그러나 이러한 노출량의 약간의 차이는 임상적으로 의미 있는 것으로 간주되지 않습니다.
급성 이식편대숙주병 예방 – 정맥내 투여
| a 치료 기간 5일에 관찰된 Cmin; 7/8 코호트의 경우 n = 18; 8/8 코호트의 경우 n = 32. Cmax, t1/2, CL 및 Vss는 첫 번째 10 mg/kg ORENCIA 정맥 주입 후 모델 예측값입니다. |
||
|
약동학적 매개변수 |
7/8 코호트 |
8/8 코호트 |
|
최저 농도 (Cmin) a [mcg/mL] |
59 (26-112) |
43 (25-73) |
|
최고 농도 (Cmax) [mcg/mL] |
221 (163-292) |
172 (107-254) |
|
최종 반감기 (t1/2) [일] |
20.6 (6-43) |
20.8 (12-38) |
|
전신 청소율 (CL) [mL/h/kg] |
0.26 (0.15-0.65) |
0.32 (0.18-0.56) |
|
분포 용적 (Vss) [L/kg] |
0.13 (0.08-0.27) |
0.17 (0.11-0.26) |
6세 이상의 급성 이식편대숙주병(aGVHD) 예방을 위해 ORENCIA를 투여받은 환자 연구에서, 이식 전날(Day -1)에 체중 기반 투여량 10 mg/kg(최대 용량 1,000 mg)을 투여한 후 이식 후 5일, 14일, 28일에 투여하는 4회 투여 후 이식 후 63일째 abatacept의 기하 평균(%CV) 골농도(Cmin)는 비혈연 공여자(URD)로부터 8/8 인간 백혈구 항원(HLA) 일치 HSCT를 받은 수혜자의 경우 22.5 mcg/mL(243.9 %CV)였고, 비혈연 공여자(URD)로부터 7/8 HLA 일치 HSCT를 받은 수혜자의 경우 31.1 mcg/mL(114.4 %CV)였습니다.
aGVHD 환자에 대한 집단 약동학 분석 결과 7/8 HLA 일치 HSCT 수혜자의 청소율은 8/8 HLA 일치 HSCT 수혜자보다 29% 낮았습니다. 이전 데이터와 일치하게, 체중 증가는 abatacept의 청소율 증가와 관련이 있었지만, 연령(체중을 보정한 경우)은 명백한 청소율에 영향을 미치지 않았습니다. 메토트렉세이트 및 칼시뉴린 억제제(예: 시클로스포린 및 타크로리무스)와 같은 병용 약물은 abatacept의 청소율에 영향을 미치지 않았습니다.
6세 이상 환자의 데이터를 사용한 집단 PK 모델링 및 시뮬레이션을 기반으로, 이식 전날(Day -1)에 60분 정맥 주입으로 15 mg/kg의 ORENCIA를 투여한 후 5일, 14일, 28일에 60분 정맥 주입으로 12 mg/kg을 투여받은 2세 이상 6세 미만 소아 대상자에서 첫 번째 및 마지막 용량 투여 후 abatacept의 시뮬레이션된 노출량은 이식 전날(Day -1), 5일, 14일, 28일에 60분 정맥 주입으로 10 mg/kg을 투여받은 6세 이상 17세 미만 소아 환자 및 성인 환자의 노출량과 비슷합니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저해
마우스 발암성 연구에서, 수컷에는 최대 84주, 암컷에는 88주 동안 주 1회 20, 65 또는 200 mg/kg의 아바타셉을 피하 주사한 결과, 악성 림프종(모든 용량) 및 유선 종양(암컷의 중간 및 고용량) 발생률 증가와 관련이 있었습니다. 이 연구의 마우스는 Murine leukemia virus와 Mouse mammary tumor virus에 감염되었습니다. 이 바이러스는 면역억제 마우스에서 각각 림프종과 유선 종양의 발생률 증가와 관련이 있습니다. 이러한 연구에 사용된 용량은 AUC(시간-농도 곡선 아래 면적) 기준으로 10 mg/kg의 최대 권장 인체 용량(MRHD)과 관련된 노출량보다 각각 0.8배, 2.0배, 3.0배 더 높았습니다. 이러한 결과가 ORENCIA의 임상적 사용과 관련이 있는지는 알 수 없습니다.
시노몰구스 원숭이를 대상으로 한 1년간의 독성 연구에서, 아바타셉을 AUC 기준으로 MRHD 노출량의 9배에 해당하는 최대 50 mg/kg의 용량으로 주 1회 정맥 주사했습니다. 아바타셉은 어떠한 중요한 약물 관련 독성과도 관련이 없었습니다. 가역적 약리학적 효과는 혈청 IgG의 최소 일시적 감소와 비장 및/또는 림프절의 생식 중심의 최소에서 중증의 림프구 고갈로 구성되었습니다. 이 연구 기간 내에 면역억제 원숭이에서 이러한 병변을 유발하는 것으로 알려진 바이러스(림프구암 바이러스)가 존재했음에도 불구하고, 림프종이나 전암성 형태학적 변화의 증거는 관찰되지 않았습니다. 이러한 결과가 ORENCIA의 임상적 사용과 관련이 있는지는 알 수 없습니다.
대사 활성화 유무에 관계없이 in vitro 세균 역돌연변이(Ames) 또는 중국 햄스터 난소/히포잔틴 구아닌 인산 리보실 전이효소(CHO/HGPRT) 순방향 점 돌연변이 분석에서 아바타셉의 돌연변이원성 잠재력은 관찰되지 않았으며, 대사 활성화 유무에 관계없이 아바타셉으로 처리된 인간 림프구에서 염색체 이상은 관찰되지 않았습니다.
아바타셉은 AUC 기준으로 MRHD 노출량의 11배에 해당하는 200 mg/kg의 용량으로 3일마다 투여했을 때 랫드의 수컷 또는 암컷 생식능력에 악영향을 미치지 않았습니다.
13.2 동물 독성 및/또는 약리학
성체 마우스와 원숭이에 대한 연구에서 TDAR 억제가 명백했습니다. 그러나 감염 및 사망률, T 도움 세포의 변화, 갑상선 및 췌장의 염증은 관찰되지 않았습니다.
14 CLINICAL STUDIES
14.1 성인 류마티스 관절염
RA 환자 치료를 위한 정맥내 ORENCIA의 임상 연구 설명
정맥 투여 ORENCIA의 효능 및 안전성은 미국 류마티스 대학(ACR) 기준에 따라 활동성 RA로 진단받은 18세 이상 환자를 대상으로 한 6건의 무작위, 이중맹검, 대조 연구(5건의 위약 대조 연구 및 1건의 활성 대조 연구)에서 평가되었습니다. 연구 I, II, III, IV 및 VI에서는 무작위 배정 시 압통 관절이 12개 이상, 종창 관절이 10개 이상인 환자를 필요로 했으며, 연구 V에서는 특정 수의 압통 관절 또는 종창 관절을 필요로 하지 않았습니다. 연구 I, II, III, IV 및 VI에서는 0주, 2주 및 4주에 정맥내로 ORENCIA 또는 위약을 투여한 후 4주마다 투여했습니다.
- •
- 연구 I (NCT00279760)에서는 비생물학적 DMARD 또는 에타너셉트를 1개 이상 실패한 활동성 RA 환자 122명에서 ORENCIA 단독 요법을 평가했습니다.
- •
- 연구 II (NCT00162266) 및 연구 III (NCT00048568)에서는 MTX에 대한 반응이 불충분한 환자에서 MTX의 안정적인 용량을 계속 투여하면서 ORENCIA의 효능을 평가했습니다.
- •
- 연구 IV (NCT00048581)에서는 TNF 길항제에 대한 반응이 불충분한 환자에서 무작위 배정 전에 TNF 길항제를 중단하고 ORENCIA의 효능을 평가했습니다. 다른 DMARD는 허용되었습니다.
- •
- 연구 V (NCT00048932)에서는 DMARD 치료에도 불구하고 추가적인 중재가 필요한 활동성 RA 환자의 안전성을 주로 평가했습니다. 등록 시 사용된 모든 DMARD는 계속 투여되었습니다. 연구 V의 환자는 동반 질환으로 제외되지 않았습니다.
- •
- 연구 VI (NCT00122382)에서는 질병 기간이 2년 미만인 메토트렉세이트 미경험 RA 환자에서 ORENCIA의 효능 및 안전성을 평가했습니다. 연구 VI에서는 이전에 메토트렉세이트를 경험하지 않은 환자를 ORENCIA + 메토트렉세이트 또는 메토트렉세이트 + 위약을 투여받도록 무작위 배정했습니다.
연구 I 환자는 8주차에 끝나는 ORENCIA의 세 가지 용량(0.5, 2 또는 10mg/kg) 또는 위약 중 하나를 투여받도록 무작위 배정되었습니다. 연구 II 환자는 12개월 동안 ORENCIA 2 또는 10mg/kg 또는 위약을 투여받도록 무작위 배정되었습니다. 연구 III, IV, V 및 VI 환자는 12개월(연구 III, V 및 VI) 또는 6개월(연구 IV) 동안 체중 범위에 따라 ORENCIA 용량 또는 위약을 투여받도록 무작위 배정되었습니다. ORENCIA의 용량은 체중이 60kg 미만인 환자의 경우 500mg, 60~100kg인 환자의 경우 750mg, 100kg 초과인 환자의 경우 1,000mg이었습니다.
성인 RA 환자 치료를 위한 피하 또는 정맥내 ORENCIA의 임상 연구 설명
피하 투여 ORENCIA의 효능은 연구 SC-1 (NCT00559585)에서 평가되었습니다. 이 연구는 메토트렉세이트(MTX)를 배경으로 투여받고 메토트렉세이트에 대한 반응이 불충분한(MTX-IR) 중등도에서 중증의 활동성 RA 환자 1457명에서 피하 투여 ORENCIA와 정맥내 투여 ORENCIA를 비교한 무작위, 이중맹검, 이중가짜약, 비열등성 연구였습니다. 연구 SC-1에서 환자는 체중에 따라 계층화하여(<60kg, 60~100kg, >100kg) (1) 체중에 따른 ORENCIA 단회 정맥내 로딩 용량 후 주 1회 ORENCIA 125mg 피하 주사 또는 (2) 1일차, 15일차, 29일차 및 그 이후 4주마다 정맥내 ORENCIA를 투여받도록 무작위 배정되었습니다. 대상자는 무작위 배정일부터 현재 MTX 용량을 계속 복용했습니다.
성인 RA 환자의 임상 반응
연구 I, III, IV 및 VI에서 ORENCIA 치료 환자 중 ACR 20, 50 및 70 반응 및 주요 임상 반응을 달성한 비율은 표 9에 나와 있습니다. ORENCIA 치료 환자는 위약 치료 환자에 비해 6개월 시점에 ACR 20, 50 및 70 반응률이 더 높았습니다. 연구 II의 10mg/kg 그룹의 6개월 ACR 반응률은 연구 III의 ORENCIA 그룹과 유사했습니다.
연구 III 및 IV에서 위약 대비 ACR 20 반응률 개선은 일부 환자에서 15일 이내에, 연구 VI에서는 MTX 대비 29일 이내에 관찰되었습니다. 연구 II, III 및 VI에서 ORENCIA 치료 환자의 ACR 반응률은 12개월까지 유지되었습니다. ACR 반응은 연구 II의 공개 라벨 연장 연구에서 최대 3년까지 유지되었습니다. 연구 III에서 ORENCIA 치료 환자는 위약 치료 환자보다 아침 경직도가 더 크게 개선되었습니다.
연구 VI에서 ORENCIA + MTX로 치료받은 환자 중 더 많은 비율이 12개월 시점에 DAS28-CRP 2.6 미만으로 측정된 낮은 수준의 질병 활동을 달성한 반면, MTX + 위약으로 치료받은 환자는 그렇지 않았습니다(표 9). ORENCIA + MTX로 치료받고 DAS28-CRP 2.6 미만을 달성한 환자 중 54%는 활동성 관절이 없었고, 17%는 활동성 관절이 1개였고, 7%는 활동성 관절이 2개였고, 22%는 활동성 관절이 3개 이상이었습니다. 여기서 활동성 관절이란 압통 또는 종창 또는 둘 다로 평가된 관절을 의미합니다.
연구 SC-1에서 주요 결과 측정 항목은 6개월 시점의 ACR 20이었습니다. 사전에 지정된 비열등성 한계는 -7.5%의 치료 차이였습니다. 표 10에 나와 있는 바와 같이, 이 연구는 최대 6개월의 치료 기간 동안 ACR 20 반응과 관련하여 피하 투여 ORENCIA의 정맥내 주입 ORENCIA에 대한 비열등성을 입증했습니다. ACR 50 및 70 반응도 표 9에 나와 있습니다. 체중 범주(60kg 미만, 60~100kg, 100kg 초과; 데이터 미제시)에 따른 하위 그룹에서 정맥내 치료 그룹과 피하 치료 그룹 간에 ACR 반응에 큰 차이가 관찰되지 않았습니다.
| 환자 비율 (%) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 정맥 투여 | 피하 또는 정맥 투여 | |||||||||||
| DMARDs에 대한 불충분한 반응 |
메토트렉세이트 (MTX)에 대한 불충분한 반응 |
TNF 길항제에 대한 불충분한 반응 | MTX 미경험 | MTX에 대한 불충분한 반응 | ||||||||
| 연구 I | 연구 III | 연구 IV | 연구 VI | 연구 SC-1 | ||||||||
| * p<0.05, ORENCIA (ORN) vs 위약 (PBO) 또는 MTX. † p<0.01, ORENCIA vs 위약 또는 MTX. ‡ p<0.001, ORENCIA vs 위약 또는 MTX. § 95% CI: −4.2, 4.8 (비열등성에 대한 사전 설정 기준 −7.5% 기준). a 10 mg/kg. b 체중 범위에 따른 투여량 [용법 및 용량 (2.1) 참조]. c 주요 임상 반응은 6개월 연속 ACR 70 반응 달성으로 정의됩니다. d 잔여 관절 활동에 대한 추가 설명은 본문을 참조하십시오. e 표에는 프로토콜에 따른 데이터가 제시되어 있습니다. ITT의 경우; SC 및 IV ORENCIA에 대해 각각 n=736, 721. |
||||||||||||
|
반응률 |
ORNa |
PBO |
ORNb |
PBO |
ORNb + |
PBO + |
ORNb |
PBO |
ORNe |
ORNe |
||
|
ACR 20 |
|
|
|
|
||||||||
|
3개월 |
53% |
31% |
62%‡ |
37% |
46%‡ |
18% |
64%* |
53% |
68% |
69% |
||
|
6개월 |
NA |
NA |
68%‡ |
40% |
50%‡ |
20% |
75%† |
62% |
76%§ |
76% |
||
|
12개월 |
NA |
NA |
73%‡ |
40% |
NA |
NA |
76%‡ |
62% |
NA |
NA |
||
|
ACR 50 |
|
|
|
|
|
|||||||
|
3개월 |
16% |
6% |
32%‡ |
8% |
18%† |
6% |
40%‡ |
23% |
33% |
39% |
||
|
6개월 |
NA |
NA |
40%‡ |
17% |
20%‡ |
4% |
53%‡ |
38% |
52% |
50% |
||
|
12개월 |
NA |
NA |
48%‡ |
18% |
NA |
NA |
57%‡ |
42% |
NA |
NA |
||
|
ACR 70 |
|
|
|
|
|
|||||||
|
3개월 |
6% |
0 |
13%‡ |
3% |
6%* |
1% |
19%† |
10% |
13% |
16% |
||
|
6개월 |
NA |
NA |
20%‡ |
7% |
10%† |
2% |
32%† |
20% |
26% |
25% |
||
|
12개월 |
NA |
NA |
29%‡ |
6% |
NA |
NA |
43%‡ |
27% |
NA |
NA |
|
주요 |
NA |
NA |
14%‡ |
2% |
NA |
NA |
27%‡ |
12% |
NA |
NA |
|
DAS28-CRP |
|
|
|
|
|
|||||
|
12개월 |
NA |
NA |
NA |
NA |
NA |
NA |
41%‡ |
23% |
NA |
NA |
연구 III, IV 및 SC-1에 대한 ACR 반응 기준 구성 요소의 결과는 표 10(기준[BL] 및 6개월[6 M] 결과)에 나와 있습니다. ORENCIA 치료 환자의 경우, 위약 치료 환자보다 6개월 및 12개월까지 모든 ACR 반응 기준 구성 요소에서 더 큰 개선이 관찰되었습니다.
| 정맥 투여 | 피하 또는 정맥 투여 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MTX에 대한 부적절한 반응 |
TNF 길항제에 대한 부적절한 반응 |
MTX에 대한 부적절한 반응 |
||||||||||
| 연구 III | 연구 IV | 연구 SC-1c | ||||||||||
| † p<0.01, ORENCIA (ORN) 대 위약(PBO), 기준치 대비 평균 백분율 변화 기준 ‡ p<0.001, ORENCIA 대 위약, 기준치 대비 평균 백분율 변화 기준 a 시각 아날로그 척도: 0 = 최상, 100 = 최악 b 건강 평가 설문지: 0 = 최상, 3 = 최악; 질문 20개; 8개 범주: 옷 입고 몸 단장하기, 일어나기, 식사하기, 걷기, 위생, 손 뻗기, 쥐기, 활동 c SC-1은 비열등성 연구입니다. 표에는 프로토콜에 따른 데이터가 제시되어 있습니다. |
||||||||||||
|
|
ORN |
PBO |
ORN |
PBO |
ORN SC |
ORN IV |
||||||
|
구성 요소 |
BL |
6 M |
BL |
6 M |
BL |
6 M |
BL |
6 M |
BL |
6 M |
BL |
6 M |
|
압통 관절 수 |
28 |
7‡ |
31 |
14 |
30 |
13‡ |
31 |
24 |
27 |
5 |
27 |
6 |
|
부기 관절 수 |
19 |
5‡ |
20 |
11 |
21 |
10‡ |
20 |
14 |
18 |
4 |
18 |
3 |
|
통증a |
67 |
27‡ |
70 |
50 |
73 |
43† |
74 |
64 |
71 |
25 |
70 |
28 |
|
환자 전반적 평가 |
66 |
29‡ |
64 |
48 |
71 |
44‡ |
73 |
63 |
70 |
26 |
68 |
27 |
|
장애 |
1.75 |
1.13‡ |
1.75 |
1.38 |
1.88 |
1.38‡ |
2.00 |
1.75 |
1.88 |
1.00 |
1.75 |
1.00 |
|
의사 전반적 평가a |
69 |
21‡ |
68 |
40 |
71 |
32‡ |
69 |
54 |
65 |
16 |
65 |
15 |
|
CRP (mg/dL) |
2.2 |
0.9‡ |
2.1 |
1.8 |
3.4 |
1.3‡ |
2.8 |
2.3 |
1.6 |
0.7 |
1.8 |
0.7 |
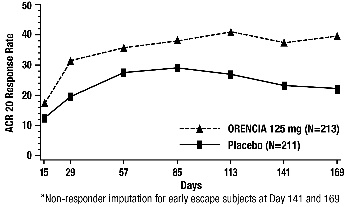
연구 III에서 방문별 ACR 50 반응을 달성한 환자의 비율은 그림 1에 나와 있습니다. 연구 VI의 ORENCIA군의 시간 경과는 연구 III과 유사했습니다.
그림 1: 방문별 ACR 50 반응 달성 환자 비율*(연구 III)
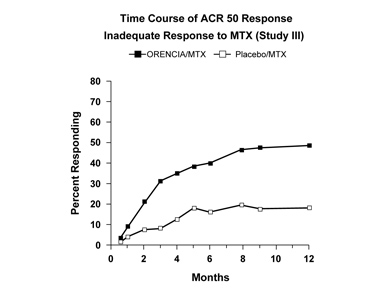
*각 시점에서 동일한 환자가 반응을 보였을 수는 없습니다.
ORENCIA 피하(SC) 및 정맥(IV) 치료군에서 연구 SC-1의 ACR 50 반응을 달성한 환자의 비율은 각 치료 방문 시 다음과 같았습니다: 15일차—SC 3%, IV 5%; 29일차—SC 11%, IV 14%; 57일차—SC 24%, IV 30%; 85일차—SC 33%, IV 38%; 113일차—SC 39%, IV 41%; 141일차—SC 46%, IV 47%; 169일차—SC 51%, IV 50%.
성인 RA 환자의 방사선학적 반응
연구 III 및 연구 VI에서 구조적 관절 손상은 방사선학적으로 평가되었으며, Genant 수정 총 Sharp 점수(TSS) 및 그 구성 요소인 침식 점수(ES)와 관절 간격 협착(JSN) 점수의 기준선 대비 변화로 표현되었습니다. 표 11에 나와 있는 바와 같이, ORENCIA/MTX는 12개월 치료 후 위약/MTX에 비해 구조적 손상의 진행을 늦추었습니다.
| 변수 | ORENCIA/MTX | 위약/MTX | 차이 | P-값d |
|---|---|---|---|---|
| a MTX에 대한 반응이 불충분한 환자. b MTX-naive 환자. c 1년 동안 위약/MTX를 투여받은 후 1년 동안 ORENCIA/MTX를 투여받은 환자. d 비모수적 ANCOVA 모델 기반. |
||||
|
연구 III |
|
|
|
|
|
1년차 |
||||
|
TSS |
1.07 |
2.43 |
1.36 |
<0.01 |
|
ES |
0.61 |
1.47 |
0.86 |
<0.01 |
|
JSN 점수 |
0.46 |
0.97 |
0.51 |
<0.01 |
|
2년차 |
||||
|
TSS |
0.48 |
0.74c |
– |
– |
|
ES |
0.23 |
0.22c |
– |
– |
|
JSN 점수 |
0.25 |
0.51c |
– |
– |
|
연구 VI |
|
|
|
|
|
1년차 |
|
|
|
|
|
TSS |
0.6 |
1.1 |
0.5 |
0.04 |
연구 III의 공개 표지 확장 연구에서, ORENCIA/MTX군에 무작위 배정된 환자의 75%와 위약/MTX군에 무작위 배정된 환자의 65%가 2년차에 방사선학적으로 평가되었습니다. 표 11에 나타난 바와 같이, ORENCIA/MTX 치료 환자의 구조적 손상 진행은 2년차 치료에서 더 감소되었습니다.
ORENCIA/MTX로 2년간 치료 후, 기준치와 비교하여 TSS 변화가 0 이하인 것으로 정의된 구조적 손상 진행이 없는 환자는 51%였습니다. ORENCIA/MTX 치료 환자의 56%는 1년차에 진행이 없었던 반면, 위약/MTX 치료 환자는 45%였습니다. ORENCIA/MTX로 2년차 치료에서, 1년차보다 진행이 없는 환자가 더 많았습니다 (65% vs 56%).
성인 RA 환자의 신체 기능 반응 및 건강 관련 결과
신체 기능의 개선은 건강 평가 설문지 장애 지수(HAQ-DI)로 측정되었습니다. HAQ-DI에서 ORENCIA는 연구 II-V에서는 위약 대비, 연구 VI에서는 MTX 대비 기준치 대비 더 큰 개선을 보였습니다. 연구 SC-1에서, 6개월 시점 및 경과 시간에 따른 HAQ-DI로 측정된 기준치 대비 개선은 피하 및 정맥내 ORENCIA 투여 간에 유사했습니다. 연구 II 및 III의 결과는 표 12에 나와 있습니다. 위약과 비교한 연구 V 및 MTX와 비교한 연구 VI에서도 유사한 결과가 관찰되었습니다. 연구 II의 공개 표지 기간 동안, 신체 기능의 개선은 최대 3년까지 유지되었습니다.
| 메토트렉세이트에 대한 불충분한 반응 | ||||
|---|---|---|---|---|
| 연구 II | 연구 III | |||
| *** p<0.001, ORENCIA 대 위약. a 10 mg/kg. b 체중 범위에 따른 투여량 [참조 투여 및 투약 방법 (2.1)]. c 수정된 건강 평가 설문지: 0 = 최상, 3 = 최악; 8개 질문; 8개 범주: 의복 착용 및 손질, 일어서기, 식사, 걷기, 위생, 닿기, 잡기 및 활동. d 건강 평가 설문지: 0 = 최상, 3 = 최악; 20개 질문; 8개 범주: 의복 착용 및 손질, 일어서기, 식사, 걷기, 위생, 닿기, 잡기 및 활동. |
||||
|
HAQ 장애 지수 |
ORENCIAa |
위약 |
ORENCIAb |
위약 |
|
기준치 (평균) |
0.98c |
0.97c |
1.69d |
1.69d |
|
평균 개선 |
|
|
|
|
연구 II, III, IV에서는 6개월 시점에, 연구 II, III에서는 12개월 시점에 SF-36 설문지를 사용하여 건강 관련 삶의 질을 평가했습니다. 이러한 연구에서 ORENCIA군은 위약군에 비해 SF-36의 모든 8개 영역뿐만 아니라 신체적 구성 요소 요약(PCS) 및 정신적 구성 요소 요약(MCS)에서도 개선이 관찰되었습니다.
14.2 다관절 소아 특발성 관절염
다관절 소아 특발성 관절염 – 정맥내 투여
정맥내 투여 ORENCIA의 안전성 및 유효성은 소아 다관절 특발성 관절염(pJIA) 환자를 대상으로 한 개방표지 확장 연구를 포함하는 3부 연구인 연구 JIA-1 (NCT00095173)에서 평가되었습니다. 중등도에서 중증의 활동성 pJIA를 가진 6세에서 17세 사이의 환자(n=190) 중 MTX 또는 TNF 길항제와 같은 하나 이상의 DMARD에 대한 반응이 불충분한 환자를 치료했습니다. 환자들은 연구 시작 시 활동성 관절 수(평균 16개)와 운동 범위 제한이 있는 관절 수(평균 16개)에 따라 결정된 중등도에서 중증의 활동성 질병을 가진 약 4년의 질병 기간을 가졌습니다. 환자들은 상승된 C-반응성 단백질(CRP) 수치(평균 3.2 mg/dL)와 ESR(평균 32 mm/h)을 가졌습니다. 등록된 환자들은 질병 발병 시에 올리고관절성(16%), 다관절성(64%; 20%는 류마티스 인자 양성), 전신 증상이 없는 전신성 JIA(20%)를 포함하는 JIA 아형을 가졌습니다. 연구 시작 시 환자의 74%가 MTX(평균 용량, 주당 13.2 mg/m2)를 투여받고 있었고 MTX의 안정적인 용량을 유지했습니다(MTX를 투여받지 않은 환자는 연구 기간 동안 MTX 치료를 시작하지 않았습니다).
A 기간(개방표지, 리드인)에서 환자는 1일차, 15일차, 29일차, 그 이후 매달 10 mg/kg(최대 1,000 mg/회)을 정맥내 투여받았습니다. 반응은 ACR 소아 30 개선 정의를 사용하여 평가되었으며, 이는 6개의 JIA 핵심 변수 중 3개 이상에서 ≥30% 개선 및 6개의 JIA 핵심 변수 중 1개 이하에서 ≥30% 악화로 정의됩니다. A 기간 말에 ACR Pedi 30 반응을 보인 환자는 이중맹검 단계(B 기간)에 무작위 배정되었으며 6개월 동안 또는 질병 악화까지 ORENCIA 또는 위약을 투여받았습니다. 질병 악화는 6개의 JIA 핵심 변수 중 3개 이상에서 ≥30% 악화 및 6개의 JIA 핵심 변수 중 1개 이하에서 ≥30% 개선으로 정의되었습니다. 의사 또는 부모 전반적 평가의 ≥2cm 악화가 3개의 JIA 핵심 변수 중 하나로 사용된 경우 악화를 정의하는 데 필요했으며, 활동성 관절 수 또는 운동 제한이 있는 관절 수가 3개의 JIA 핵심 변수 중 하나로 사용된 경우 ≥2개 관절의 악화가 필요했습니다.
A 기간 종료 시 소아 ACR 30/50/70 반응은 각각 65%, 50%, 28%였습니다. 소아 ACR 30 반응은 연구된 모든 JIA 아형에서 유사했습니다.
이중맹검 무작위 중단 단계(B 기간)에서 ORENCIA 치료 환자(정맥내)는 위약 치료 환자(20% 대 53%)에 비해 질병 악화가 현저히 적었습니다. 차이의 95% CI(15%, 52%). 정맥내 ORENCIA를 계속 투여받은 환자의 질병 악화 위험은 정맥내 ORENCIA 치료를 중단한 환자에 비해 3분의 1 미만이었습니다(위험 비율=0.31, 95% CI [0.16, 0.59]). 연구 전반(A 기간, B 기간 및 개방표지 확장 기간 C)에 걸쳐 정맥내 ORENCIA를 투여받은 환자 중 소아 ACR 30/50/70 반응자의 비율은 1년 동안 일관되게 유지되었습니다.
다관절 소아 특발성 관절염 – 피하 투여
정맥내 로딩 용량 없이 피하 투여를 위한 ORENCIA는 2세에서 17세 사이의 소아 환자(n=205)를 포함하는 2기 개방표지 연구인 연구 JIA-2 (NCT01844518)에서 평가되었습니다. 환자들은 연구 당시 활동성 다관절 질환을 가지고 있었고 적어도 하나의 비생물학적 또는 생물학적 DMARD에 대한 반응이 불충분했습니다. 연구 시작 시 JIA 환자 아형에는 다관절성(79%; 22%는 류마티스 인자 양성), 확장 및 지속성 올리고관절성(14%), 염증 관련 관절염(1%) 및 전신 증상이 없는 전신성 JIA(2%)가 포함되었습니다. 환자들은 활동성 관절(평균 11.9개), 운동 범위 제한이 있는 관절(평균 10.4개) 및 상승된 C-반응성 단백질(CRP) 수치(평균 1.2 mg/dL)를 가진 평균 2.5년의 질병 기간을 가졌습니다. 연구 시작 시 환자의 80%가 MTX를 투여받고 있었고 MTX의 안정적인 용량을 유지했습니다. 환자는 체중에 따라 용량이 조정된 요법으로 매주 개방표지 ORENCIA를 피하 투여받았습니다. 이 연구의 주요 목표는 ORENCIA 노출에 기반한 유효성 외삽을 뒷받침하는 PK 평가였으며, 이는 기술적 유효성에 의해 뒷받침됩니다 [임상 약리학(12.3) 참조].
피하 ORENCIA로 치료받은 2세에서 17세 사이의 환자에서 4개월에 평가된 JIA ACR 30/50/70 반응은 연구 JIA-1의 정맥내 ORENCIA 결과와 일치했습니다.
14.3 건선성 관절염
ORENCIA의 유효성은 두 건의 무작위 이중맹검 위약 대조 연구(연구 PsA-I [NCT00534313] 및 PsA-II [NCT01860976])에서 건선성 관절염(PsA)이 있는 594명의 성인 환자(18세 이상)를 대상으로 평가되었습니다. 환자들은 DMARD 요법으로 사전 치료에도 불구하고 활동성 PsA(≥3개의 부어오른 관절 및 ≥3개의 압통이 있는 관절)를 가지고 있었고 지름이 최소 2cm인 하나의 적격 건선성 피부 병변을 가지고 있었습니다. PsA-I 및 PsA-II에서 각각 37% 및 61%의 환자가 이전에 TNF 길항제로 치료받았습니다.
연구 PsA-I의 초기 24주 이중맹검 기간 동안 170명의 환자는 1일차, 15일차, 29일차, 그 후 28일마다 정맥내 치료를 받도록 무작위 배정되었습니다(24주 기간 동안 이탈은 없었습니다).
- •
- 플라시보
- •
- ORENCIA 3 mg/kg
- •
- 체중이 60kg 미만인 환자의 경우 ORENCIA 500 mg, 체중이 60~100kg인 환자의 경우 ORENCIA 750 mg, 체중이 100kg 초과인 환자의 경우 ORENCIA 1,000 mg (체중 범위 기반 용량), 또는
- •
- 1일차 및 15일차에 ORENCIA 30 mg/kg을 투여한 후 체중 범위 기반 ORENCIA 용량 (즉, 체중이 60kg 미만인 환자의 경우 500 mg, 체중이 60~100kg인 환자의 경우 750 mg, 체중이 100kg 초과인 환자의 경우 1,000 mg)으로 투여.
PsA-I 연구에서 24주 이중맹검 기간 후, 환자들은 28일마다 오픈라벨 정맥내 ORENCIA를 투여받았습니다.
시험 기간 동안 환자들은 병용 MTX, 저용량 코르티코스테로이드 (프레드니손 ≤10mg에 해당하는 용량) 및/또는 NSAIDs의 안정적인 용량을 투여받을 수 있었습니다. 등록 당시 환자의 약 60%가 MTX를 투여받고 있었습니다. 기준 시점에서 ORENCIA IV의 평균 (SD) CRP는 17 mg/L (33.0)이었고, 압통 관절 및 종창 관절의 평균 수 (SD)는 각각 22.2 (14.3) 및 10.9 (7.6)이었습니다.
PsA-II에서는 424명의 환자를 1:1로 무작위 배정하여 24주 동안 이중맹검 방식으로 로딩 용량 없이 플라시보 또는 ORENCIA 125 mg을 매주 피하 투여하였으며, 그 후 오픈라벨 피하 ORENCIA 125 mg을 매주 투여하였습니다. 시험 기간 동안 환자들은 병용 MTX, 설파살라진, 레플루노마이드, 히드록시클로로퀸, 저용량 코르티코스테로이드 (프레드니손 ≤10mg에 해당하는 용량) 및/또는 NSAIDs의 안정적인 용량을 투여받을 수 있었습니다. 무작위 배정 시 환자의 60%가 MTX를 투여받고 있었습니다. 기준 질병 특징에는 X선 상 관절 침식이 84% (341/407)에서 나타났으며, 평균 (SD) PsA 수정 Sharp van der Heijde 침식 점수 (SHS)는 10.8 (24.2)이었습니다. 혈청 C 반응성 단백질 (CRP) 상승은 66% [277/421]에서 나타났으며, 평균 (SD)은 14.1 mg/L (25.9)이었습니다. 다관절 질환은 환자의 98% (416/424)에서 나타났으며, 평균 수 (SD) 압통 관절 및 종창 관절은 각각 20.2 (13.3) 및 11.6 (7.5)이었습니다. 16주차까지 압통 및 종창 관절 수에서 기준치 대비 20% 이상의 개선을 보이지 않은 환자는 오픈라벨 피하 ORENCIA 125 mg 매주 투여로 전환되었습니다.
PsA-I 및 PsA-II 모두의 1차 종점은 24주차 (169일차)에 ACR 20 반응을 달성한 환자의 비율이었습니다.
PsA 성인 환자의 임상 반응
PsA-I 연구에서 플라시보와 비교하여 정맥내 ORENCIA (상기 설명된 체중 범위 기반 용량) 치료 후 PsA 성인 환자에서 ACR 20 반응을 달성한 비율이 더 높았고, PsA-II 연구에서 플라시보와 비교하여 피하 125 mg 치료 후 PsA 성인 환자에서 24주차에 ACR 20 반응을 달성한 비율이 더 높았습니다. 이러한 반응은 이전 TNF 길항제 치료 여부 및 병용 비생물학적 DMARD 치료 여부에 관계없이 나타났습니다. PsA-I 및 PsA-II 연구에서 ACR 20, 50 또는 70 반응을 달성한 환자의 비율은 아래 표 13에 제시되어 있습니다.
| PsA-I | PsA-II | |||
|---|---|---|---|---|
| * 플라시보 대비 p<0.05. a 16주차에 압통 또는 종창 관절 수에서 20% 미만의 개선을 보인 환자는탈락 기준을 충족하였으며, 비반응자로 간주되었습니다. b 체중 범위 기반 정맥내 투여: 체중이 60kg 미만인 환자의 경우 ORENCIA 500 mg, 체중이 60~100kg인 환자의 경우 ORENCIA 750 mg, 체중이 100kg 초과인 환자의 경우 ORENCIA 1,000 mg. |
||||
|
ORENCIA |
|
ORENCIA 125 mg |
|
|
|
ACR 20 |
47.5%* |
19.0% |
39.4%* |
22.3% |
|
ACR 50 |
25.0% |
2.4% |
19.2% |
12.3% |
|
ACR 70 |
12.5% |
0% |
10.3% |
6.6% |
PsA-II에서 24주차까지 ACR 20 반응을 달성한 환자의 비율은 아래 그림 2에 나와 있습니다.
그림 2: PsA-II 연구에서 24주차(169일차)까지 ACR 20 반응a을 달성한 환자의 비율
PsA-I 및 PsA-II 연구에서 ACR 구성 요소 전반에 걸쳐 결과는 일반적으로 일관되었습니다.
PsA-I 및 PsA-II 모두에서 24주차에 ORENCIA 치료를 통해 건염 및 지염의 개선이 관찰되었습니다.
PsA 성인 환자의 신체 기능 반응
PsA-I 연구에서 24주차에 기준치 대비 건강평가설문지-장애지수(HAQ-DI) 점수가 0.30 이상 감소한 환자의 비율이 위에서 설명한 ORENCIA 체중 범위 기반 투여량(45%) 대비 위약(19%)에서 26.1(95% 신뢰 구간: 6.8, 45.5)로 더 높았습니다. PsA-II 연구에서 ORENCIA 투여 환자의 기준치 대비 HAQ-DI가 0.35 이상 감소한 환자의 비율은 31%였으며, 이는 위약 투여 환자(24%)와 비교했을 때(추정 차이: 7%; 95% 신뢰 구간: -1%, 16%) 더 높았습니다. 24주차에 ORENCIA 투여군(-0.33) 대비 위약 투여군(-0.20)에서 HAQ-DI의 기준치 대비 조정된 평균 변화가 더 높았으며, 추정 차이는 -0.13(95% 신뢰 구간: -0.25, -0.01)이었습니다.
14.4 급성 이식편대숙주병 예방
GVHD-1 연구
칼시뉴린 억제제(CNI)와 메토트렉세이트(MTX) 병용 투여 시 급성 이식편대숙주병(aGVHD) 예방에 대한 ORENCIA의 효능은 일치하거나 1개의 대립 유전자 불일치가 있는 비혈연 공여자(URD)로부터 조혈모세포 이식(HSCT)을 받은 6세 이상 환자를 대상으로 다기관 2 코호트 임상 연구(GVHD-1, NCT01743131)에서 평가되었습니다. GVHD-1의 두 코호트는 다음과 같습니다.
- 1)
- 7개의 8개 인간 백혈구 항원(HLA) 일치 HSCT를 받은 43명의 환자를 대상으로 한 공개 표지, 단일군 연구(7/8 코호트); 그리고
- 2)
- 8개의 8개 HLA 일치 HSCT를 받은 환자를 대상으로 CNI와 MTX 병용 투여 시 ORENCIA 또는 위약을 투여받은 무작위(1:1), 이중맹검, 위약 대조 연구(8/8 코호트).
7/8 코호트와 8/8 코호트 모두에서 ORENCIA는 이식 전날(Day -1)부터 시작하여 이식 후 5일, 14일 및 28일에 60분 동안 정맥 주입으로 10mg/kg(최대 1,000mg)의 용량으로 투여되었습니다. 7/8 코호트와 8/8 코호트의 기준 인구통계학적 특징과 임상적 특징은 아래 표 14에 요약되어 있습니다.
|
7/8 코호트 |
8/8 코호트 |
||
|
ORENCIA (+ CNI 및 MTX) N=43 |
ORENCIA (+ CNI 및 MTX) N=73 |
위약 (+CNI 및 MTX) N=69 |
|
|
연령 – 중앙값 |
38 |
44 |
40 |
|
연령 – 범위 |
6-76 |
6-71 |
7-74 |
|
성별 – 남성 |
27 (63) |
41 (56) |
37 (54) |
|
백인 |
31 (72) |
63 (86) |
61 (88) |
|
흑인 또는 아프리카계 미국인 |
7 (16) |
3 (4.1) |
2 (2.9) |
|
아시아인 |
2 (4.7) |
4 (6) |
2 (2.9) |
|
히스패닉 |
7 (16) |
4 (6) |
2 (2.9) |
|
악성 종양 유형 |
|||
|
급성 골수성 백혈병 (AML) |
15 (35) |
30 (41) |
22 (32) |
|
골수이형성 증후군 (MDS) |
11 (26) |
15 (21) |
12 (17) |
|
급성 림프구성 백혈병 (ALL) |
8 (19) |
20 (27) |
22 (32) |
|
급성 백혈병 또는 모호한 계통 |
1 (2.3) |
0 |
1 (1.4) |
|
호지킨 및 비호지킨 림프종 |
1 (2.3) |
1 (1.4) |
1 (1.4) |
|
2차 이상 완전 관해의 급성 림프구성 림프종 |
1 (2.3) |
4 (6) |
1 (1.4) |
|
만성 골수단핵구성 백혈병 |
1 (2.3) |
1 (1.4) |
4 (6) |
|
만성 골수성 백혈병 |
4 (9) |
1 (1.4) |
5 (7) |
|
보고되지 않음 |
1 (2.3) |
1 (1.4) |
1 (1.4) |
|
GVHD 예방 |
|||
|
시클로스포린 |
16 (37) |
11 (15) |
11 (16) |
|
타크로리무스 |
27 (63) |
62 (85) |
58 (84) |
|
이식 유형 |
|||
|
골수 |
21 (49) |
33 (45) |
26 (38) |
|
사이토카인 동원 말초혈액 (PBSC) |
22 (51) |
40 (55) |
43 (62) |
|
컨디셔닝 요법 |
|||
|
TBI 및 화학 요법 |
11 (26) |
20 (27) |
26 (38) |
|
Busulfan 및 Cyclophosphamide |
13 (30) |
28 (38) |
21 (30) |
|
Busulfan 및 Fludarabine |
8 (19) |
7 (10) |
2 (2.9) |
|
Melphalan 및 Fludarabine |
11 (26) |
18 (25) |
20 (29) |
효능은 이식 후 180일째 평가된 전체 생존율(OS) 및 II-IV등급 aGVHD 무사망 생존율(GFS) 결과를 기반으로 확립되었습니다. ORENCIA + CNI 및 MTX는 이식 후 180일째 플라시보 + CNI 및 MTX 대비 III-IV등급 GFS를 유의하게 개선하지 못했습니다. GVHD-1 8/8 코호트의 효능 결과는 표 15에 나와 있습니다.
| a III-IV등급 aGVHD 무사망 생존율은 이식일부터 문서화된 III-IV등급 aGVHD 발생 또는 이식 후 180일까지의 모든 원인에 의한 사망 시점까지 측정되었습니다. b II-IV등급 aGVHD 무사망 생존율은 이식일부터 문서화된 II-IV등급 aGVHD 발생 또는 이식 후 180일까지의 모든 원인에 의한 사망 시점까지 측정되었습니다. |
||
|
종점 |
ORENCIA (+CNI 및 MTX) n=73 |
플라시보 (+CNI 및 MTX) n=69 |
|
III-IV등급 aGVHD 무사망 생존율a 비율 (95% CI) |
87% (77%, 93%) |
75% (63%, 84%) |
|
위험비 (95% CI) |
0.55 (0.26, 1.18) |
|
|
II-IV등급 aGVHD 무사망 생존율b 비율 (95% CI) |
50% (38%, 61%) |
32% (21%, 43%) |
|
위험비 (95% CI) |
0.54 (0.35, 0.83) |
|
|
전체 생존율 비율 (95% CI) |
97% (89%, 99%) |
84% (73%, 91%) |
|
위험비 (95% CI) |
0.33 (0.12, 0.93) |
|
ORENCIA 치료 환자 7/8 코호트(n=43)에 대한 탐색적 분석에서 이식 후 180일째 III-IV등급 GVHD 무사망 생존율, II-IV등급 GVHD 무사망 생존율 및 전체 생존율은 각각 95%(95% CI 83%, 99%), 53%(95% CI 38%, 67%), 98%(95% CI 85%, 100%)였습니다.
연구 GVHD-2
GVHD-2(NCT05421299)는 국제 혈액 및 골수 이식 연구 센터(CIBMTR)의 데이터를 사용한 임상 연구였습니다. 이 연구는 2011년부터 2018년까지 1개의 대립 유전자 불일치 URD로부터 HSCT를 받은 6세 이상의 환자에서 aGVHD 예방을 위해 CNI 및 MTX와 병용한 ORENCIA와 CNI 및 MTX 단독 요법의 결과를 분석했습니다. ORENCIA + CNI 및 MTX 치료군(n=54)에는 GVHD-1의 환자 42명과 GVHD-1 이외에서 ORENCIA로 치료받은 환자 12명이 포함되었습니다. 비교군(n=162)은 연구 기간 동안 ORENCIA를 투여받지 않은 환자 중 CIBMTR 등록부에서 ORENCIA 치료군에 대해 3:1의 비율로 무작위로 선택되었습니다. 분석에는 선택 편향의 영향을 해결하기 위해 경향성 점수 매칭 및 치료 가중치의 역확률이 사용되었습니다.
효능은 HSCT 후 180일째 전체 생존율(OS)을 기반으로 했습니다. CNI 및 MTX와 병용한 ORENCIA군의 180일째 OS 비율은 98%(95% CI: 78, 100)였으며, CNI 및 MTX군의 180일째 OS 비율은 75%(95% CI: 67, 82)였습니다.
16 제공/보관 및 취급 방법
정맥 주입용
ORENCIA® (abatacept) injection은 재구성 및 희석 후 정맥 주입을 위한 백색 동결건조 분말입니다. 개별 포장된 1회용 바이알(바이알의 내용물을 전부 사용하지 않거나 여러 바이알을 사용할 수 있음)과 실리콘이 없는 일회용 주사기로 제공되며, 250mg의 abatacept를 함유합니다:
NDC 0003-2187-10: 클램셸 포장
NDC 0003-2187-13: 카톤 포장
피하 사용
ORENCIA® (abatacept) injection과 ORENCIA® ClickJect (abatacept) injection은 피하 투여를 위한 무색에서 연한 황색의 투명하거나 약간 불투명한 용액입니다.
사전 충전 주사기
ORENCIA (abatacept) injection, 50 mg/0.4 mL, 87.5 mg/0.7 mL, 및 125 mg/mL은 BD UltraSafe Passive™ 니들 가드 및 플랜지 익스텐더가 있는 1회용 사전 충전 유리 주사기로 제공됩니다.
Type I 유리 주사기는 코팅된 마개와 고정된 스테인리스 스틸 니들(5 베벨, 29 게이지 박벽, ½인치 니들)을 가지고 있으며, 단단한 니들 실드로 덮여 있습니다. 사전 충전 주사기는 다음과 같은 포장으로 ORENCIA를 제공합니다:
NDC 0003-2814-11 (50 mg/0.4 mL): 수동 니들 안전 가드가 있는 4개 주사기 포장
NDC 0003-2818-11 (87.5 mg/0.7 mL): 수동 니들 안전 가드가 있는 4개 주사기 포장
NDC 0003-2188-11 (125 mg/mL): 수동 니들 안전 가드가 있는 4개 주사기 포장
보관
바이알에 제공되는 ORENCIA 동결건조 분말은 2°C~8°C(36°F~46°F)에서 냉장 보관하십시오. 바이알의 유효기간이 지난 후에는 사용하지 마십시오. 사용할 때까지 원래 포장에 보관하여 빛으로부터 보호하십시오.
사전 충전 주사기 또는 ClickJect 자동 주사기에 제공되는 ORENCIA 용액은 2°C~8°C(36°F~46°F)에서 냉장 보관하십시오. 사전 충전 주사기 또는 자동 주사기의 유효기간이 지난 후에는 사용하지 마십시오. 사용할 때까지 원래 포장에 보관하여 빛으로부터 보호하십시오. 사전 충전 주사기 또는 자동 주사기가 얼지 않도록 하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자용 라벨(환자 정보 및 사용 지침)을 읽도록 알려주십시오.
RA 치료를 위한 면역억제제 병용 시 감염 위험 증가
다른 면역억제제(예: 생물학적 DMARD, JAK 억제제)와의 병용 투여는 권장되지 않는다는 점을 환자에게 알려주십시오 [경고 및 주의 사항 (5.1) 및 약물 상호작용 (7.1) 참조].
예방 접종
생백신은 ORENCIA와 동시에 또는 ORENCIA 투여 중단 후 3개월 이내에 투여해서는 안 된다는 점을 환자에게 알려주십시오 [경고 및 주의 사항 (5.4) 참조].
혈당 검사
정맥 투여용 ORENCIA에는 말토스가 포함되어 있으며, ORENCIA 주입 당일 특정 혈당 측정기로 혈당치가 허위로 높게 측정될 수 있습니다. 포도당 모니터링에 GDH-PQQ 기반 시스템(예: 당뇨병 환자)을 사용하는 정맥 투여 ORENCIA 치료 환자에게는 다른 포도당 모니터링 방법을 고려하도록 조언하십시오. 이 권장 사항은 피하 투여 ORENCIA 치료 환자에게는 적용되지 않습니다 [약물 상호작용 (7.2) 참조].
SPL 미분류 섹션
Bristol-Myers Squibb Company
프린스턴, 뉴저지 08543 미국
미국 허가 번호 1713
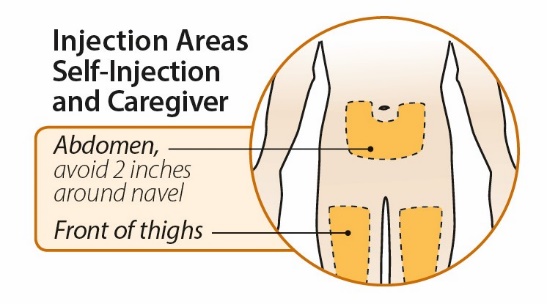
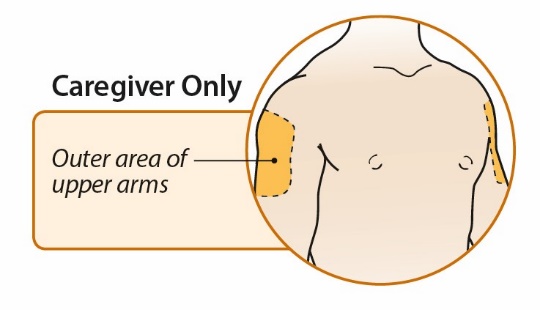
환자 사용 설명서
|
환자 정보
ORENCIA®(오렌시아) |
|||||
|
ORENCIA란 무엇입니까?
ORENCIA는 또한 일치하는 또는 1개의 대립유전자 불일치 비혈연 공여자로부터의 조혈모세포 이식(HSCT) 중 칼시뉴린 억제제 및 메토트렉세이트와 병용하여 다음 환자의 급성 이식편대숙주병(aGVHD) 예방 치료에도 사용됩니다.
2세 미만 소아의 pJIA 치료에 ORENCIA가 안전하고 효과적인지 여부는 알려져 있지 않습니다. 2세 미만 소아의 PsA 치료에 ORENCIA가 안전하고 효과적인지 여부는 알려져 있지 않습니다. 2세 미만 소아의 aGVHD 예방 치료에 ORENCIA가 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|||||
|
ORENCIA를 투여받거나 사용하기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
|
|||||
|
|
||||
|
|||||
|
|||||
|
|||||
|
|||||
|
처방약과 일반의약품, 비타민 및 한약 성분을 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. ORENCIA는 다른 약물의 작용 방식에 영향을 미칠 수 있으며, 다른 약물은 ORENCIA의 작용 방식에 영향을 미쳐 심각한 부작용을 일으킬 수 있습니다. 특히 면역 체계에 영향을 미칠 수 있는 다른 생물학적 약제를 복용하는 경우 의료 제공자에게 알리십시오. 예를 들어: |
|||||
|
|
|
|||
|
면역 체계에 영향을 줄 수 있는 다른 생물학적 의약품과 함께 ORENCIA를 복용하면 심각한 감염에 걸릴 가능성이 더 높아질 수 있습니다. 복용하는 약을 알고 있어야 합니다. 새로운 처방전을 받을 때 의료 제공자와 약사에게 보여줄 수 있도록 약물 목록을 보관하십시오. |
|||||
|
ORENCIA는 어떻게 투여 또는 사용할까요? RA, pJIA 또는 PsA 치료의 경우:
가정에서 ORENCIA 주사를 준비하고 투여하는 올바른 방법에 대한 지침은 이 환자 정보 설명서 끝에 있는 사용 지침을 참조하십시오. aGVHD 예방 치료의 경우:
|
|||||
|
ORENCIA의 가능한 부작용은 무엇입니까? ORENCIA는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
|||||
|
|
||||
|
|||||
|
|
||||
|
|||||
|
|
||||
RA 환자에서 ORENCIA의 가장 흔한 부작용은 다음과 같습니다. |
|||||
|
|
||||
|
소아 및 청소년에서 나타날 수 있는 다른 부작용은 다음과 같습니다: |
|||||
|
|
||||
|
aGVHD 예방을 위한 ORENCIA의 가장 흔한 부작용은 다음과 같습니다: |
|||||
|
|
||||
|
이것들은 ORENCIA의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다(1-800-FDA-1088). |
|||||
|
ORENCIA는 어떻게 보관해야 합니까?
ORENCIA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||||
|
ORENCIA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 설명서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 ORENCIA를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 ORENCIA를 제공하지 마십시오. 해를 끼칠 수 있습니다. 약사 또는 의료 제공자에게 의료 전문가를 위해 작성된 ORENCIA에 대한 정보를 문의할 수 있습니다. |
|||||
|
ORENCIA의 성분은 무엇입니까? 활성 성분: abatacept 정맥 내 불활성 성분: maltose, monobasic sodium phosphate, sodium chloride for administration 피하 불활성 성분: sucrose, poloxamer 188, monobasic sodium phosphate monohydrate, dibasic sodium phosphate anhydrous, water for injection. |
|||||
|
Bristol-Myers Squibb Company 기타 모든 상표는 해당 소유자의 자산입니다. 자세한 내용은 www.ORENCIA.com을 방문하거나 1-800-ORENCIA로 전화하십시오. |
|||||
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2024년 5월
사용 지침
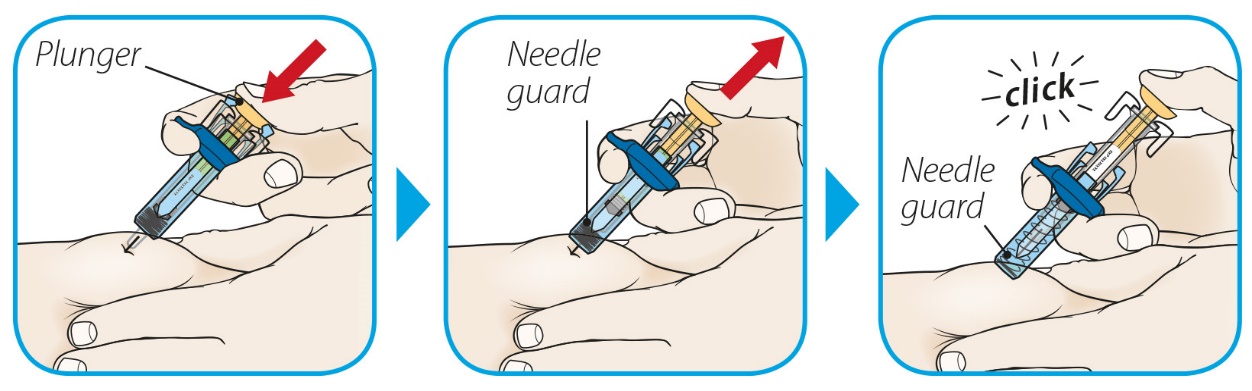
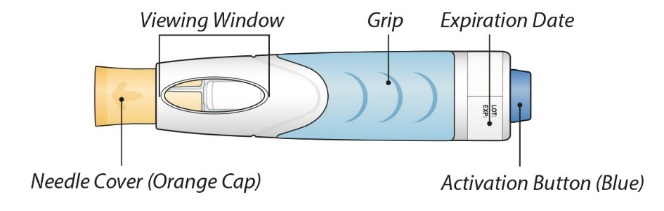
ORENCIA®(오렌시아)
(abatacept)
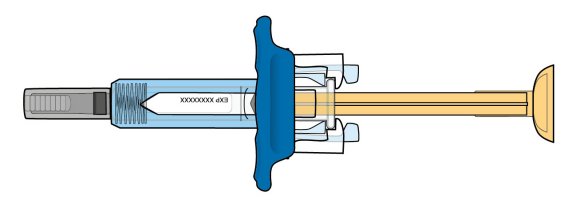
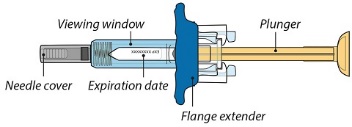
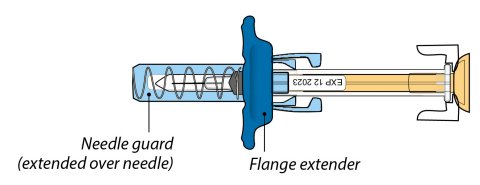
Prefilled syringe with BD UltraSafe Passive™ needle guard
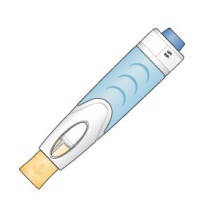
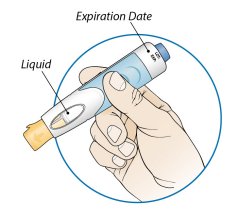
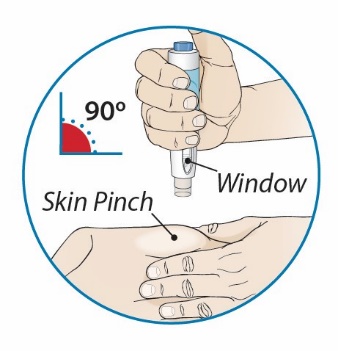
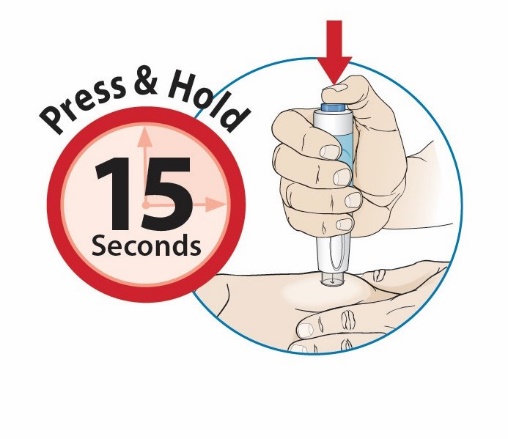
1단계: ORENCIA 주사 준비
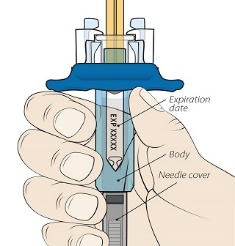
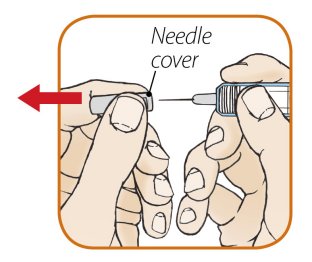
2단계: 사전 충전된 주사기 검사
3단계: 사전 충전된 주사기의 용량 확인
|
주사기를 눈높이에 맞춥니다. 사전 충전된 주사기의 액체량이 처방된 용량의 충전선 또는 그 바로 위에 있는지 자세히 확인하십시오. |
 |
|
사전 충전된 주사기에 올바른 양의 액체가 들어 있지 않으면 사용하지 마십시오. 즉시 약사에게 전화하십시오. |
|
4단계로 이동 |
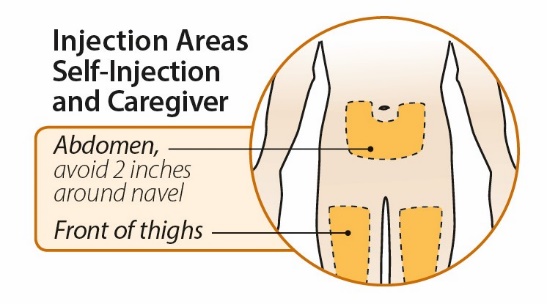
4단계: 주사 부위 선택 및 준비
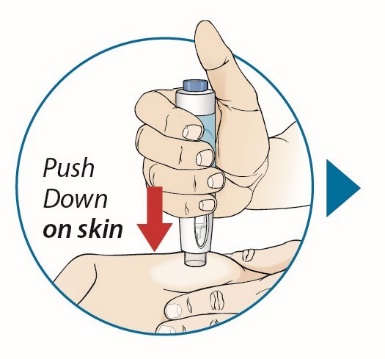
5단계: ORENCIA 용량 주사
6단계: 주사 후
|
주사 부위 관리:
|
 |
||
|
사용한 사전 충진 주사기 폐기:
|
|||
|
|
|
||
|
|||
|
자주 묻는 질문에서 추가 폐기 정보를 참조하십시오. 주사를 간병인이 투여하는 경우, 이 사람도 부주의로 바늘에 찔리는 부상과 감염 확산 가능성을 방지하기 위해 주사기를 조심스럽게 다루어야 합니다. ORENCIA 사전 충진 주사기와 sharps 폐기 용기를 어린이의 손이 닿지 않는 곳에 보관하십시오. |
 |
||
|
ORENCIA 사전 충진 주사기 보관 방법
|
|||
|
다음 페이지로 이동 |
|||
|
자주 묻는 질문 |
|||
|
질문. |
주사하기 전에 사전 충진 주사기를 30분 동안 실온에서 데워야 하는 이유는 무엇입니까? |
||
|
답변. |
이 단계는 주로 편안함을 위한 것입니다. 전자레인지를 사용하거나 주사기를 따뜻한 물에 담는 등 어떤 방법으로도 데우는 과정을 빠르게 하려고 하지 마십시오. |
||
|
질문. |
주사하는 동안 내내 피부를 집어야 합니까? |
||
|
답변. |
바늘을 삽입하는 동안 피부를 집어야 하지만, 편안함을 위해 주사하는 동안 피부를 놓을 수 있습니다. |
||
|
질문. |
사전 충진 주사기가 파손되거나 손상된 것처럼 보이면 어떻게 해야 합니까? |
||
|
답변. |
사전 충진 주사기를 사용하지 마십시오. 추가 지침을 위해 의료 서비스 제공자 또는 약사에게 문의하십시오. |
||
|
질문. |
주사기 안의 액체가 잘 보이지 않으면 어떻게 해야 합니까? |
||
|
답변. |
주사기를 눈높이로 들어 올려 빛에 비추어 자세히 살펴보십시오. 약물 용액을 더 잘 보기 위해 주사기를 천천히 기울일 수 있습니다. 그래도 문제가 있는 경우 추가 지침을 위해 의료 서비스 제공자 또는 약사에게 문의하십시오. |
||
|
질문. |
주사하는 동안 약간의 작열감이나 통증을 느끼는 것이 정상입니까? |
||
|
A. |
바늘이 찔리는 것을 느낄 수 있습니다. 때때로 약물이 주사 부위 근처에 약간의 자극을 유발할 수 있습니다. 불편함은 경증에서 중등도여야 합니다. 주사 부위 근처의 통증, 부기 또는 변색을 포함한 부작용이 있는 경우 의료 서비스 제공자에게 문의하십시오. |
||
|
다음 페이지로 이동 |
|||
|
자주 묻는 질문 |
|||
|
Q. |
사용한 사전 충전형 주사기를 어떻게 폐기해야 합니까? |
||
|
A. |
FDA 승인 sharps 폐기 용기에 사용한 사전 충전형 주사기를 넣으십시오. sharps 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
|
||
|
Q. |
여행 중에 사전 충전형 주사기를 어떻게 시원하게 유지해야 합니까? |
||
|
A. |
2ºC~8ºC(36ºF~46ºF) 사이의 온도에서 시원한 용기에 보관하십시오. |
||
|
Q. |
사전 충전형 주사기를 비행기에 가지고 탈 수 있습니까? |
||
|
A. |
일반적으로 사전 충전형 주사기를 비행기에 가지고 탈 수 있습니다. 위탁 수하물에 넣지 마십시오. 2ºC~8ºC(36ºF~46ºF) 온도의 여행용 쿨러에 사전 충전형 주사기를 휴대해야 합니다. 사전 충전형 주사기를 원래 상자에 원래 사전 인쇄된 라벨과 함께 넣어 빛으로부터 보호하십시오. |
||
|
Q. |
사전 충전형 주사기가 장시간 동안 시원하게 유지되지 않으면 어떻게 됩니까? 사용하는 것이 위험합니까? |
||
|
A. |
자세한 내용은 1-800-673-6242로 문의하십시오. |
||
|
뒷표지로 이동 |
|||
|
사전 충전형 주사기에 대해 질문이나 우려 사항이 있는 경우 의료 서비스 제공자에게 문의하거나 수신자 부담 헬프 라인 1-800-673-6242로 전화하십시오. |
|||
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA, U.S. License Number 1713
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
ORENCIA는 Bristol-Myers Squibb Company의 등록 상표입니다.
BD UltraSafe Passive™는 Becton, Dickinson, and Company의 상표입니다.
2023년 10월 개정
사용 지침
ORENCIA® ClickJect™(오렌시아)
(abatacept)
프리필드 오토인젝터
1단계: 오토인젝터 준비
2단계: 주사 준비
3단계: 약물 투여
4단계: 주사 후
|
주사 부위 관리:
|
  |
||
|
사용한 ClickJect 자동주사기를 버리는 방법:
|
|||
|
|
|
||
|
|||
|
추가적인 폐기 정보는 자주 묻는 질문을 참조하십시오. 간병인이 주사를 투여하는 경우, 간병인도 우발적인 바늘 찔림 사고와 감염 확산을 방지하기 위해 자동주사기를 주의해서 다뤄야 합니다. |
 |
||
|
자동주사기와 날카로운 물건 처리 용기를 어린이의 손이 닿지 않는 곳에 보관하십시오. ORENCIA ClickJect 자동주사기 보관 방법
|
|||
|
다음 페이지에 계속 |
|||
|
|
|||
|
자주 묻는 질문 |
|||
|
Q. |
주사하기 전에 자동주사기를 실온에서 30분 동안 예열해야 하는 이유는 무엇입니까? |
||
|
A. |
이 단계는 주로 편의를 위해 마련된 것입니다. 약이 차가우면 주사 시간이 15초보다 길어질 수 있습니다. 전자레인지 사용이나 자동주사기를 따뜻한 물에 넣는 등 어떤 방법으로도 예열 과정을 서두르려고 하지 마십시오. |
||
|
Q. |
자동주사기를 사용할 준비가 되기 전에 실수로 바늘 덮개(주황색 캡)를 제거하면 어떻게 해야 합니까? |
||
|
A. |
사용할 준비가 되기 전에 덮개를 제거한 경우 주의하십시오. 덮개를 다시 끼우려고 하지 마십시오. 자동주사기를 가능한 한 빨리 사용하십시오. 주사 준비를 하는 동안 깨끗하고 평평한 표면에 자동주사기를 옆으로 조심스럽게 놓으십시오. 자동주사기를 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||
|
Q. |
자동주사기가 고장난 것 같거나 손상된 것 같으면 어떻게 해야 합니까? |
||
|
A. |
자동주사기를 사용하지 마십시오. 추가 지침을 위해 의료 서비스 제공자 또는 약사에게 문의하십시오. |
||
|
Q. |
주사가 작동되지 않으면 어떻게 해야 합니까? |
||
|
A. |
주사를 시작하려면 먼저 기기를 잠금 해제해야 합니다. 잠금을 해제하려면 버튼을 누르지 않고 오토인젝터를 피부에 단단히 누릅니다. 정지점이 느껴지면 기기가 잠금 해제되고 버튼을 눌러 작동할 수 있습니다. |
||
|
Q. |
주사하는 동안 약간의 화끈거림이나 통증이 느껴집니다. 정상적인 현상인가요? |
||
|
A. |
주사를 할 때 바늘에 찔리는 느낌이 들 수 있습니다. 때때로 약물이 주사 부위 근처에 약간의 자극을 유발할 수 있습니다. 이러한 경우 불편감은 경미하거나 중등도여야 합니다. 주사 부위 근처에 통증, 부기 또는 변색을 포함한 어떤 부작용이라도 발생하면 즉시 의료 제공자 또는 약사에게 문의하십시오. 처방약의 부작용은 FDA에 보고하는 것이 좋습니다. www.fda.gov/medwatch를 방문하거나 1-800-FDA-1088로 전화하십시오. |
||
|
Q. |
전량 투여되었는지 어떻게 알 수 있나요? |
||
|
A. |
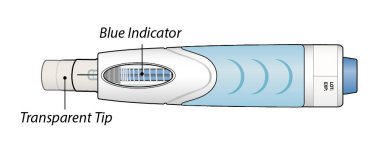
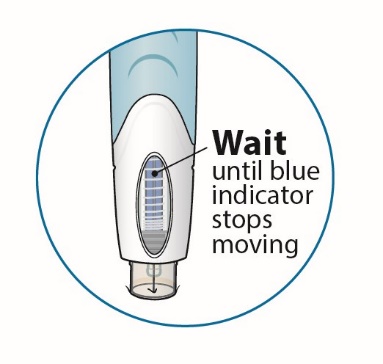
오토인젝터를 주사 부위에서 들어 올리기 전에 파란색 표시등이 움직임을 멈췄는지 확인하십시오. 그런 다음 오토인젝터를 버리기 전에 투명한 창 아래쪽을 확인하여 액체가 남아 있지 않은지 확인하십시오. 약물이 완전히 주입되지 않은 경우 의료 제공자 또는 약사와 상담하십시오. |
||
|
다음 페이지로 계속 |
|||
|
자주 묻는 질문 |
|||
|
Q. |
사용한 오토인젝터는 어떻게 버려야 하나요? |
||
|
A. |
사용한 오토인젝터는 사용 직후 FDA 승인을 받은 날카로운 물건 처리 용기에 넣으십시오.
|
||
|
|||
|
|||
|
Q. |
여행 중 오토인젝터를 시원하게 보관하려면 어떻게 해야 하나요? |
||
|
A. |
의료 제공자 또는 약사는 주사 가능한 의약품을 위한 특수 휴대용 케이스에 대해 잘 알고 있을 수 있습니다. 냉장고에 36°F~46°F(2°C~8°C)에서 보관하십시오. 냉동하지 마십시오. 직사광선을 피하십시오. |
||
|
Q. |
오토인젝터를 비행기에 가지고 탑승할 수 있나요? |
||
|
A. |
일반적으로 허용됩니다. 오토인젝터를 기내 수하물에 넣고 위탁 수하물에는 넣지 마십시오. 사용할 준비가 될 때까지 36°F~46°F(2°C~8°C)의 온도로 여행용 냉장고에 보관하십시오. 공항 보안 절차와 항공사 정책은 수시로 변경되므로 특별 규정에 대해 공항 당국과 항공사에 문의하는 것이 가장 좋습니다. 비행 전에 의료 제공자에게서 바늘이 있는 기기를 사용하는 처방약을 가지고 여행한다는 내용의 편지를 받으십시오. 기내 수하물에 날카로운 물건 용기를 휴대하는 경우 공항 검색 요원에게 알리십시오. |
||
|
Q. |
오토인젝터가 장시간 시원하게 유지되지 않으면 어떻게 되나요? 사용해도 위험한가요? |
||
|
A. |
자세한 내용은 1-800-673-6242로 문의하십시오. |
||
|
|
|||
|
오토인젝터에 대해 질문이나 우려 사항이 있는 경우 의료 제공자에게 문의하거나 무료 헬프라인 1-800-673-6242로 전화하십시오. |
|||
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA, U.S. License Number 1713
본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
ORENCIA는 Bristol-Myers Squibb Company의 등록 상표이며 ClickJect는 Bristol-Myers Squibb Company의 상표입니다.
2024년 1월 개정
오렌시아 250mg/바이알 주사용 대표 포장
사용 가능한 ORENCIA 포장의 전체 목록은 포장 단위 섹션을 참조하십시오.
처방전 의약품
NDC 0003-2187-13
ORENCIA®
(abatacept)
IV 주입용 동결건조 분말
250 mg/바이알
재구성에는 포장에 포함된 실리콘 없는 일회용 주사기를 사용하십시오.
Bristol-Myers Squibb Company
Princeton, New Jersey 08543 USA
미국 허가 번호 1713
오렌시아 50mg/0.4mL 주사제 대표 포장
Bristol-Myers Squibb
NDC 0003-2814-11
BD UltraSafe Passive™ Needle Guard가 장착된 1회용 프리필드 시린지 4개
ORENCIA®
(abatacept)
주사제
50 mg/0.4mL
BD UltraSafe Passive™ Needle Guard가 장착된 1회용 프리필드 시린지
피하 사용 전용
경고: 어린이의 손이 닿지 않는 곳에 보관하십시오
사용 후 각 시린지를 폐기하십시오
처방전 의약품
오렌시아 87.5mg/0.7mL 주사제 대표 포장
Bristol-Myers Squibb
NDC 0003-2818-11
4개입 일회용 사전 충전형 주사기 (BD UltraSafe Passive™ 니들 가드 포함)
ORENCIA®
(abatacept)
주사
87.5 mg/0.7mL
일회용 사전 충전형 주사기 (BD UltraSafe Passive™ 니들 가드 포함)
피하 주사용
경고: 어린이의 손이 닿지 않는 곳에 보관하십시오
사용 후 각 주사기를 폐기하십시오
처방전에 의해서만
오렌시아 125mg/mL 주사액 대표 포장
Bristol-Myers Squibb
NDC 0003-2188-11
BD UltraSafe Passive™ 니들 가드가 장착된 1회용 프리필드 시린지 4개
ORENCIA®
(abatacept)
주사제
125 mg/mL
BD UltraSafe Passive™ 니들 가드가 장착된 1회용 프리필드 시린지
피하 사용 전용
경고: 어린이의 손이 닿지 않는 곳에 보관하십시오
사용 후 각 시린지를 폐기하십시오
처방전 의약품
오렌시아 125mg/mL 클릭젝트 대표 포장
Bristol-Myers Squibb
NDC 0003-2188-51
4개의 1회용 프리필드 오토인젝터
ORENCIA® ClickJect™
(abatacept)
주사제
125 mg/mL
1회용 오토인젝터
피하 사용 전용
즉시 냉장 보관
경고: 어린이의 손이 닿지 않는 곳에 보관하십시오
사용 후 각 오토인젝터를 폐기하십시오
이쪽에서 개봉 처방전 의약품