의약품 제조업체: Actelion Pharmaceuticals US, Inc. (Updated: 2024-04-02)
처방 정보 주요 내용
OPSUMIT
®(macitentan) 정제, 필름 코팅
미국 최초 승인: 2013
경고: 태아 독성
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
적응증 및 사용법
OPSUMIT는 폐동맥 고혈압(PAH, WHO Group I)의 질병 진행 및 PAH 입원 위험을 줄이기 위해 사용되는 엔도텔린 수용체 길항제(ERA)입니다 (
1.1).
투여량 및 투여 방법
- 1일 1회 10mg
.PAH 환자에서 1일 1회 10mg보다 높은 용량은 연구되지 않았으며 권장되지 않습니다 (
2.1).
투여 형태 및 강도
- 정제: 10mg (
3)
경고 및 주의 사항
부작용
가장 흔한 부작용(위약보다 ≥3% 더 빈번하게 발생)은 빈혈, 비인두염/인두염, 기관지염, 두통, 인플루엔자 및 요로 감염입니다 (
6.1).
의심되는 부작용을 보고하려면 Janssen에 1-800-526-7736(1-800-JANSSEN) 또는 FDA에 1-800-FDA-1088 또는
www.fda.gov/medwatch.
약물 상호 작용
- 강력한 CYP3A4 유도제(리팜핀)는 macitentan에 대한 노출을 감소시킵니다. OPSUMIT와의 병용 투여를 피하십시오 (
7.1,
12.3).
- 강력한 CYP3A4 억제제(케토코나졸, 리토나비르)는 macitentan에 대한 노출을 증가시킵니다. OPSUMIT와의 병용 투여를 피하십시오 (
7.2,
12.3)
.
- 중등도 이중 CYP3A4 및 CYP2C9 억제제(플루코나졸, 아미오다론) 또는 CYP3A4 및 CYP2C9 억제제의 병용 사용은 macitentan에 대한 노출을 증가시킬 수 있습니다. OPSUMIT와의 병용 투여를 피하십시오 (
7.3,
12.3).
환자 상담 정보 및 약물 안내는 17을 참조하십시오.
개정: 2024년 3월
목차
전문 정보: 내용*
경고: 태아 독성
1 적응증 및 사용법
1.1 폐동맥 고혈압
2 용법 및 용량
2.1 권장 용량
2.2 생식 가능 여성의 임신 검사
3 제형 및 강도
4 금기 사항
4.1 임신
4.2 과민증
5 경고 및 주의 사항
5.1 태아 독성
5.2 Macitentan 함유 제품 REMS
5.3 간 독성
5.4 체액 저류
5.5 헤모글로빈 감소
5.6 폐 정맥 폐쇄 질환(PVOD)과 관련된 폐 부종
5.7 정자 수 감소
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 강력한 CYP3A4 유도제
7.2 강력한 CYP3A4 억제제
7.3 중등도 이중 또는 복합 CYP3A4 및 CYP2C9 억제제
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 가능 여성 및 남성
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
13.2 동물 독성학
14 임상 연구
14.1 폐동맥 고혈압
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
경고 사항
경고: 태아 독성
-
OPSUMIT는 태아에게 해를 입힐 수 있으므로 임산부에게 투여하지 마십시오.
[참조
-
생식 가능 여성: 치료 시작 전, 치료 중 매월, 그리고 치료 중단 후 1개월 동안 임신 여부를 확인하십시오. 치료 중 및 치료 중단 후 1개월 동안은 적절한 피임 방법을 사용하여 임신을 예방하십시오.
[참조
-
모든 여성 환자의 경우, OPSUMIT는 Macitentan-Containing Products Risk Evaluation and Mitigation Strategy (REMS)라는 제한된 프로그램을 통해서만 제공됩니다.
[참조
.
1 적응증 및 용법
1.1 폐동맥 고혈압
OPSUMIT은 PAH 질환 진행 및 입원 위험 감소를 위해 폐동맥 고혈압(PAH, WHO Group I) 치료에 사용되는 엔도텔린 수용체 길항제(ERA)입니다.
유효성은 평균 2년 동안 치료받은 WHO 기능 등급 II–III 증상의 PAH 환자를 대상으로 한 장기 연구에서 확립되었습니다. 환자들은 특발성 및 유전성 PAH(57%), 결합 조직 질환으로 인한 PAH(31%), 및 교정된 단락을 동반한 선천성 심장 질환으로 인한 PAH(8%)를 가지고 있었습니다.
[
참조]
.
2. 용량 및 투여
2.2 생식 가능 여성의 임신 검사
OPSUMIT 치료 전, 치료 중 매월, 그리고 OPSUMIT 중단 후 1개월 동안 생식 가능 여성에게 임신 검사를 실시하십시오. 임신 검사 결과가 음성인 생식 가능 여성에게만 OPSUMIT 치료를 시작하십시오.
[참조
경고,
경고 및 주의 사항 (5.1), 그리고
.
3. 제형 및 함량
정제 : 10mg, 양면 볼록한 필름 코팅된 둥근 흰색이며 양면에 “10”이 각인되어 있습니다.
4 금기 사항
4.1 임신
임산부에게 OPSUMIT를 투여하면 태아에게 해를 끼칠 수 있습니다. OPSUMIT는 임신한 여성에게는 금기입니다. OPSUMIT는 동물에게 투여했을 때 기형 유발 효과가 일관되게 나타났습니다. 임신 중에 OPSUMIT를 사용하는 경우 태아에 대한 잠재적 위험을 환자에게 알려야 합니다.
[
경고 및 주의 사항 (5.1) 및
특정 집단에서의 사용 (8.1) 참조
.
5. 경고 및 주의 사항
5.1 태아 독성
OPSUMIT는 임신 중 투여 시 태아에게 해를 끼칠 수 있으며 임신한 여성에게는 사용이 금지되어 있습니다. 임신 가능성이 있는 여성의 경우, 치료 시작 전에 임신 여부를 확인하고, 허용 가능한 피임 방법을 사용하고, 매달 임신 검사를 받아야 합니다.
[
8.3) 참조]
.
OPSUMIT는 Macitentan-Containing Products REMS를 통해 여성에게 제공됩니다. 이는 제한된 유통 프로그램입니다.
[
경고 및 주의 사항 (5.2) 참조]
.
5.2 Macitentan-Containing Products REMS
모든 여성의 경우, OPSUMIT는 태아 독성 위험으로 인해 Macitentan-Containing Products REMS라는 제한된 프로그램을 통해서만 제공됩니다.
[
8.3) 참조]
.
Macitentan-Containing Products REMS의 주요 요구 사항은 다음과 같습니다.
- 처방 의사는 등록하고 교육을 완료하여 Macitentan-Containing Products REMS에 인증을 받아야 합니다.
- 모든 여성은 임신 가능성과 관계없이 OPSUMIT를 시작하기 전에 Macitentan-Containing Products REMS에 등록해야 합니다. 남성 환자는 REMS에 등록하지 않습니다.
- 임신 가능성이 있는 여성은 임신 검사 및 피임 요구 사항을 준수해야 합니다.
[
.
- 약국은 Macitentan-Containing Products REMS에 인증을 받아야 하며, OPSUMIT를 받을 자격이 있는 환자에게만 약품을 제공해야 합니다.
자세한 내용은 www.MacitentanREMS.com 또는 1-888-572-2934에서 확인할 수 있습니다. Macitentan-Containing Products REMS 인증 약국 또는 도매업체에 대한 정보는 1-888-572-2934에서 확인할 수 있습니다.
5.3 간 독성
ERAs는 아미노트랜스퍼라제 상승, 간 독성 및 간부전을 유발할 수 있습니다. PAH 환자에서 OPSUMIT 연구에서 아미노트랜스퍼라제 상승 발생률은 표 1에 나와 있습니다.
| OPSUMIT 10 mg (N=242) |
위약 (N=249) |
|
|---|---|---|
| >3 × ULN | 3.4% | 4.5% |
| >8 × ULN | 2.1% | 0.4% |
OPSUMIT의 위약 대조 연구에서 간 부작용으로 인한 중단은 OPSUMIT 10 mg 그룹에서 3.3%, 위약 그룹에서 1.6%였습니다.
OPSUMIT를 시작하기 전에 간 효소 검사를 실시하고 임상적으로 필요한 경우 치료 중에 반복적으로 검사를 실시해야 합니다.
[
부작용 (6.2) 참조]
.
환자에게 간 손상을 시사하는 증상(메스꺼움, 구토, 우측 상복부 통증, 피로, 식욕 부진, 황달, 짙은 소변, 발열 또는 가려움증)을 보고하도록 지시하십시오. 임상적으로 관련성 있는 아미노트랜스퍼라제 상승이 발생하거나, 상승이 빌리루빈 >2 × ULN 증가 또는 간 독성의 임상 증상을 동반하는 경우 OPSUMIT를 중단하십시오. 간 독성의 임상 증상을 경험하지 않은 환자의 경우, 간 효소 수치가 정상화되면 OPSUMIT를 재투여하는 것을 고려하십시오.
5.4 체액 저류
말초 부종 및 체액 저류는 PAH의 알려진 임상적 결과이며 ERAs의 알려진 효과입니다. PAH 환자에서 OPSUMIT의 위약 대조 연구에서 부종 발생률은 OPSUMIT 10 mg 그룹에서 21.9%, 위약 그룹에서 20.5%였습니다.
기저 심실 기능 장애가 있는 환자는 ERA 치료 시작 후 심각한 체액 저류가 발생할 위험이 높을 수 있습니다. 좌심실 기능 장애로 인한 폐 고혈압 환자를 대상으로 한 소규모 OPSUMIT 연구에서 OPSUMIT 그룹의 환자는 위약 그룹에 비해 심각한 체액 저류가 더 많이 발생했고 심장 기능 악화로 인한 입원이 더 많았습니다. OPSUMIT를 시작한 후 몇 주 안에 부종 및 체액 저류가 발생했다는 시판 후 보고가 있었으며, 일부는 이뇨제 치료 또는 심장 기능 저하로 인한 입원이 필요했습니다.
[
부작용 (6.2) 참조]
.
OPSUMIT를 시작한 후 체액 저류 징후를 모니터링하십시오. 임상적으로 유의미한 체액 저류가 발생하면 OPSUMIT 또는 기저 심장 기능 저하와 같은 원인을 확인하고 OPSUMIT를 중단할 필요성을 평가하십시오.
5.5 헤모글로빈 감소
다른 ERAs를 투여한 후 헤모글로빈 농도 및 헤마토크릿 감소가 발생했으며, OPSUMIT의 임상 연구에서도 관찰되었습니다. 이러한 감소는 초기에는 발생했지만 그 후 안정화되었습니다. PAH 환자에서 OPSUMIT의 위약 대조 연구에서 OPSUMIT 10 mg은 기준선에서 최대 18개월까지 헤모글로빈이 평균 1.0 g/dL 감소한 반면, 위약 그룹에서는 변화가 없었습니다. 헤모글로빈이 10.0 g/dL 미만으로 감소한 것은 OPSUMIT 10 mg 그룹에서 8.7%, 위약 그룹에서 3.4%였습니다. 헤모글로빈 감소는 수혈이 거의 필요하지 않습니다. 심한 빈혈 환자의 경우 OPSUMIT를 시작하는 것이 권장되지 않습니다. 치료를 시작하기 전에 헤모글로빈을 측정하고 임상적으로 필요한 경우 치료 중에 반복적으로 측정해야 합니다.
[
부작용 (6.1) 참조]
.
5.7 정자 수 감소
OPSUMIT는 다른 ERAs와 마찬가지로 정자 형성에 부작용을 미칠 수 있습니다. 남성에게 생식 능력에 대한 잠재적 영향에 대해 상담하십시오.
[
특정 환자군에 대한 사용 (8.3) 및
비임상 독성 (13.1) 참조]
.
6 이상반응
라벨의 다른 섹션에 나타나는 임상적으로 유의미한 이상반응은 다음과 같습니다.
- 태아 독성
[참조
- 간독성
[참조
- 체액 저류
[참조
- 헤모글로빈 감소
[참조
6.1 임상시험 경험
임상시험은 매우 다양한 조건에서 수행되므로, 특정 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
OPSUMIT에 대한 안전성 데이터는 주로 PAH 환자 742명을 대상으로 한 위약 대조 임상 연구(SERAPHIN 연구)에서 얻었습니다.
[참조
이 시험에서 OPSUMIT에 대한 노출 기간은 최대 3.6년이었고, 평균 노출 기간은 약 2년이었습니다(1년 동안 N=542, 2년 동안 N=429, 3년 이상 동안 N=98). 이상반응으로 인한 치료 중단의 전반적인 발생률은 OPSUMIT 10mg 치료군과 위약 치료군에서 유사했습니다(약 11%).
표 2는 OPSUMIT에서 위약보다 ≥3% 더 자주 발생한 이상반응을 보여줍니다.
| 이상반응 | OPSUMIT 10 mg (N=242) (%) |
위약 (N=249) (%) |
|---|---|---|
| 빈혈 | 13 | 3 |
| 비인두염/인두염 | 20 | 13 |
| 기관지염 | 12 | 6 |
| 두통 | 14 | 9 |
| 인플루엔자 | 6 | 2 |
| 요로 감염 | 9 | 6 |
6.2 시판 후 경험
다음과 같은 이상반응은 OPSUMIT의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애:과민 반응(혈관부종, 가려움증 및 발진)
혈관 장애:홍조
호흡기, 흉부 및 종격동 장애:코막힘
위장관 장애:OPSUMIT 사용 시 간 아미노전이효소(ALT, AST)의 상승 및 간 손상이 보고되었습니다. 대부분의 경우 심부전, 간 울혈, 자가면역성 간염과 같은 다른 원인이 확인될 수 있습니다. 엔도텔린 수용체 길항제는 아미노전이효소의 상승, 간독성 및 간부전 사례와 관련이 있습니다.
[참조
경고 및 주의사항 (5.3)]
.
전신 장애 및 투여 부위 상태:부종/체액 저류. 부종 및 체액 저류 사례는 OPSUMIT 시작 후 몇 주 이내에 발생했으며, 일부는 이뇨제, 체액 관리 또는 비대 보상성 심부전으로 인한 입원 치료가 필요했습니다.
[참조
경고 및 주의사항 (5.4)].
심장 장애:증상성 저혈압
7. 약물 상호 작용
7.1 강력한 CYP3A4 유도제
리팜핀과 같은 강력한 CYP3A4 유도제는 마시텐탄 노출을 현저히 감소시킵니다. OPSUMIT와 강력한 CYP3A4 유도제의 병용은 피해야 합니다.
[
.
7.2 강력한 CYP3A4 억제제
케토코나졸과 같은 강력한 CYP3A4 억제제와의 병용은 마시텐탄 노출을 약 2배 증가시킵니다. 리토나비르와 같은 많은 HIV 약물은 강력한 CYP3A4 억제제입니다. OPSUMIT와 강력한 CYP3A4 억제제의 병용은 피해야 합니다.
[
. HIV 치료의 일환으로 강력한 CYP3A4 억제제가 필요한 경우 다른 PAH 치료 옵션을 사용하십시오.
[
.
7.3 중등도 CYP3A4 및 CYP2C9 이중 또는 복합 억제제
플루코나졸과 같은 CYP3A4 및 CYP2C9의 중등도 이중 억제제와의 병용은 생리 기반 약동학 (PBPK) 모델링에 따르면 마시텐탄 노출을 약 4배 증가시키는 것으로 예상됩니다. OPSUMIT와 CYP3A4 및 CYP2C9의 중등도 이중 억제제 (플루코나졸 및 아미오다론과 같은)의 병용은 피해야 합니다.
[
.
OPSUMIT와 중등도 CYP3A4 억제제 및 중등도 CYP2C9 억제제를 모두 병용하는 것도 피해야 합니다.
[
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
동물 생식 연구 결과에 따르면, OPSUMIT는 임신한 여성에게 투여될 경우 태아 독성, 기형 및 태아 사망을 유발할 수 있으며, 임신 중에는 금기입니다. 임신 중 폐동맥 고혈압과 관련된 모체 및 태아 위험이 있습니다.
[
임상적 고려 사항 참조
. OPSUMIT를 임신한 여성에게 사용한 데이터는 제한적입니다. Macitentan은 모든 시험 용량에서 토끼와 쥐에서 기형 유발 물질이었습니다. 이 약물을 임신 중에 사용하거나 이 약물을 복용하는 동안 임신이 발생하면 태아에 대한 위험을 환자에게 알려야 합니다.
[
금기 사항 (4.1) 참조
.
지정된 인구 집단의 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
8.3 생식 능력이 있는 여성 및 남성
임신 검사
OPSUMIT를 시작하기 전, 치료 중 매월, 그리고 OPSUMIT 치료를 중단한 후 1개월 동안 생식 능력이 있는 여성의 임신 상태를 확인하십시오. 월경 시작이 지연되거나 임신이 의심되는 경우 환자는 즉시 임신 검사를 위해 의사에게 연락해야 합니다. 임신 검사 결과가 양성이면 의사와 환자는 환자, 임신 및 태아에 대한 위험을 논의해야 합니다.
[
경고 및 주의 사항 (5.1),
투여량 및 투여 방법 (2.2) 및
금기 사항 (4.1) 참조
.
피임
생식 능력이 있는 여성 환자는 OPSUMIT 치료 중 및 OPSUMIT 치료 후 1개월 동안 허용 가능한 피임 방법을 사용해야 합니다. 환자는 고효율 피임 방법(자궁 내 장치(IUD), 피임 이식 또는 난관 결찰) 또는 복합 방법(호르몬 방법과 장벽 방법 또는 두 가지 장벽 방법)을 선택할 수 있습니다. 파트너의 정관 수술이 피임 방법으로 선택된 경우, 이 방법과 함께 호르몬 또는 장벽 방법을 사용해야 합니다. 환자에게 응급 피임을 포함한 임신 계획 및 예방에 대한 상담을 제공하거나 피임 상담을 받은 다른 의료 제공자에게 상담을 지정하십시오.
[
.
불임
동물에서 얻은 결과에 따르면 OPSUMIT는 생식 능력이 있는 남성의 생식 능력을 손상시킬 수 있습니다. 생식 능력에 대한 영향이 회복 가능한지 여부는 알려져 있지 않습니다.
[
경고 및 주의 사항 (5.7),
부작용 (6.1) 및
비임상 독성 (13.1) 참조
.
8.5 노인 사용
PAH에 대한 OPSUMIT 임상 연구에 참여한 총 대상자 중 14%가 65세 이상이었습니다. 이러한 대상자와 젊은 대상자 간에 안전성 또는 유효성에 대한 전반적인 차이가 관찰되지 않았습니다.
10. 과량 투여
OPSUMIT는 건강한 피험자에게 최대 600mg(승인된 용량의 60배)까지 단일 용량으로 투여되었습니다. 두통, 메스꺼움 및 구토의 부작용이 관찰되었습니다. 과량 투여의 경우 필요에 따라 표준적 지지 요법을 실시해야 합니다. macitentan은 단백질 결합률이 높기 때문에 투석은 효과적이지 않을 가능성이 높습니다.
11. 설명
OPSUMIT
® (마시텐탄)은 엔도텔린 수용체 길항제입니다. 마시텐탄의 화학명은 N-[5-(4-브로모페닐)-6-[2-[(5-브로모-2-피리미딘일)옥시]에톡시]-4-피리미디닐]-N’-프로필술파미드입니다. 그 분자식은 C
19H
20Br
2N
6O
4S이며 분자량은 588.27입니다. 마시텐탄은 키랄성이 없으며 다음과 같은 구조식을 가지고 있습니다:
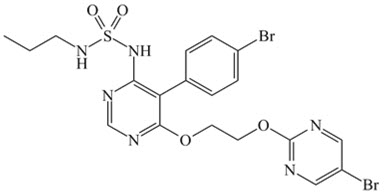
마시텐탄은 결정성 분말로서 물에 불용성입니다. 고체 상태에서 마시텐탄은 매우 안정하며 습기를 흡수하지 않고 빛에 민감하지 않습니다.
OPSUMIT는 10mg 필름 코팅 정제로 1일 1회 경구 투여용으로 제공됩니다. 정제에는 다음과 같은 비활성 성분이 포함됩니다: 락토스 일수화물, 마그네슘 스테아레이트, 미세결정성 셀룰로오스, 폴리소르베이트 80, 포비돈 및 나트륨 전분 글리콜레이트 A형. 정제는 폴리비닐 알코올, 대두 레시틴, talc, 이산화티타늄 및 잔탄 검을 포함하는 코팅 물질로 필름 코팅되었습니다.
12. 임상 약리
12.1 작용 기전
엔도텔린(ET)-1과 그 수용체(ET
A 및 ET
B)는 혈관 수축, 섬유화, 증식, 비대 및 염증과 같은 다양한 유해한 효과를 매개합니다. 폐동맥 고혈압(PAH)과 같은 질병 상태에서 국소 ET 시스템은 상향 조절되며 혈관 비대 및 기관 손상에 관여합니다.
마시텐탄은 ET
A 및 ET
B 수용체 모두에 대한 ET-1의 결합을 억제하는 엔도텔린 수용체 길항제입니다. 마시텐탄은 인간 폐동맥 평활근 세포에서 ET 수용체에 대한 높은 친화력과 지속적인 점유를 보입니다. 마시텐탄의 대사 산물 중 하나는 ET 수용체에서 약리학적으로 활성이 있으며, 모 약물보다 약 20% 정도 약효가 낮은 것으로 추정됩니다.
in vitro. 이중 엔도텔린 차단의 임상적 영향은 알려져 있지 않습니다.
12.2 약력학
12.3 약동학
마시텐탄과 그 활성 대사 산물의 약동학은 주로 건강한 피험자에서 연구되었습니다. 마시텐탄의 약동학은 1일 1회 투여 후 1mg에서 30mg까지의 범위에서 용량에 비례합니다.
교차 연구 비교 결과 PAH 환자에서 마시텐탄과 그 활성 대사 산물에 대한 노출은 건강한 피험자에서 관찰된 노출과 유사합니다.
흡수 및 분포
마시텐탄의 최대 혈장 농도는 경구 투여 후 약 8시간에 도달합니다. 경구 투여 후 절대 생체 이용률은 알려져 있지 않습니다. 건강한 피험자를 대상으로 한 연구에서 고지방 아침 식사 후 마시텐탄과 그 활성 대사 산물에 대한 노출은 변하지 않았습니다. 따라서 마시텐탄은 식사와 관계없이 복용할 수 있습니다.
마시텐탄과 그 활성 대사 산물은 혈장 단백질에 매우 높게 결합(99% 이상)하며, 주로 알부민에 결합하고 알파-1-산성 글리코단백질에 약간 결합합니다. 건강한 피험자에서 마시텐탄과 그 활성 대사 산물의 명백한 분포 용적(Vss/F)은 각각 약 50L 및 40L였습니다.
대사 및 배설
경구 투여 후 마시텐탄과 그 활성 대사 산물의 명백한 반감기는 각각 약 16시간 및 48시간입니다. 마시텐탄은 주로 술파마이드의 산화적 탈프로필화를 통해 약리학적으로 활성인 대사 산물을 형성하여 대사됩니다. 이 반응은 시토크롬 P450(CYP) 시스템, 주로 CYP3A4에 의존하며 CYP2C8, CYP2C9 및 CYP2C19의 기여가 미미합니다. PAH 환자에서 정상 상태에 도달하면 활성 대사 산물에 대한 전신 노출은 마시텐탄에 대한 노출의 3배이며, 총 약리학적 활성의 약 40%를 차지할 것으로 예상됩니다. 방사성 동위원소로 표지된 마시텐탄을 사용한 건강한 피험자를 대상으로 한 연구에서 방사성 약물 물질의 약 50%가 소변으로 배설되었지만, 변하지 않은 약물이나 활성 대사 산물 형태로는 배설되지 않았습니다. 방사성 약물 물질의 약 24%가 대변에서 회수되었습니다.
특수 집단
마시텐탄과 그 활성 대사 산물의 약동학에 대한 연령, 성별 또는 인종의 임상적으로 유의미한 영향은 없습니다.
약물 상호 작용
시험관 내 연구
1일 1회 10mg 투여로 얻은 혈장 수준에서 마시텐탄은 CYP 효소에 대한 유의미한 억제 또는 유도 효과를 나타내지 않습니다. 마시텐탄은 다중 약물 내성 단백질(P-gp, MDR-1)의 기질 또는 억제제가 아닙니다. 마시텐탄의 활성 대사 산물 또한 임상적으로 유의미한 농도에서 P-gp/MDR-1의 억제제가 아닙니다.
마시텐탄과 그 활성 대사 산물은 임상적으로 유의미한 혈장 농도에서 유기 음이온 수송 다당체(OATP1B1, OATP1B3), 다중 약물 및 독소 배출 단백질(MATE-1, MATE-2K), 담즙산 수출 펌프(BSEP), 나트륨-타우로콜레이트 공동 수송 다당체(NTCP), 유기 양이온 수송체(OCT-1, OCT-3), 유기 음이온 수송체(OAT-1, OAT-3) 또는 BCRP 수송체와 유의미한 상호 작용을 할 것으로 예상되지 않습니다.
생체 내 연구
다른 약물의 마시텐탄에 대한 영향
건강한 피험자에서 마시텐탄 및 그 활성 대사체에 대한 다른 약물의 영향을 연구했으며, 그 결과는 아래 그림 1에 나와 있습니다.
그림 1
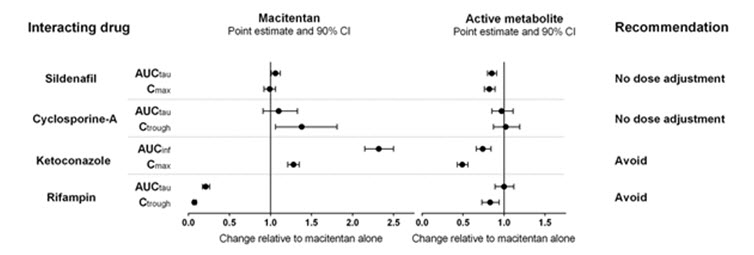
리토나비르와 같은 다른 강력한 CYP3A4 억제제의 마시텐탄에 대한 영향은 연구되지 않았지만, 케토코나졸에서 관찰된 것과 유사하게 마시텐탄 노출이 정상 상태에서 증가할 가능성이 있습니다.
[참조
.
PBPK 모델링 및 시뮬레이션 기반 분석 결과, 플루코나졸(1일 1회 400mg)과 같은 CYP3A4 및 CYP2C9의 중등도 이중 억제제는 활성 대사체에 대한 노출에는 영향을 미치지 않고 마시텐탄 노출을 약 4배 증가시키는 것으로 예측됩니다.
[참조
.
13. 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
2년 동안의 발암성 연구에서 수컷 쥐의 경우 사람 노출량(AUC 기준)의 75배, 암컷 쥐의 경우 140배, 수컷 랫드의 경우 8.3배, 암컷 랫드의 경우 42배 노출량에서 발암 가능성이 나타나지 않았습니다.
돌연변이 유발성
마시텐탄은 박테리아 역돌연변이 분석, 마우스 림프종 세포에서의 유전자 돌연변이 분석, 인간 림프구에서의 염색체 이상 검사, 랫드에서의
in vivo 마이크로뉴클레우스 검사를 포함한 표준
in vitro 및
in vivo 분석 배터리에서 유전독성을 나타내지 않았습니다.
생식능력 저해
출생 후 4일부터 114일까지 어린 랫드를 치료한 결과, 사람 노출량의 7배 노출량에서 체중 증가 감소와 고환 세관 위축이 나타났습니다. 생식능력에는 영향을 미치지 않았습니다.
랫드의 경우 사람 노출량의 7배 이상, 개의 경우 23배 이상 노출량에서 만성 독성 연구에서 가역적인 고환 세관 확장이 관찰되었습니다. 2년간의 치료 후, 랫드의 경우 사람 노출량의 4배 노출량에서 세관 위축이 관찰되었습니다. 마시텐탄은 사람 노출량의 각각 19배에서 44배에 이르는 노출량에서 수컷 또는 암컷의 생식능력에 영향을 미치지 않았으며, 수컷 랫드의 정자 수, 운동성 및 형태에 영향을 미치지 않았습니다. 2년까지 치료 후 쥐에서 고환 이상은 관찰되지 않았습니다.
13.2 동물 독성학
개에서 마시텐탄은 치료적 사람 노출량과 유사한 노출량에서 혈압을 감소시켰습니다. 4주에서 39주 동안의 치료 후 사람 노출량의 17배 노출량에서 관상 동맥의 내막 두꺼워짐이 관찰되었습니다. 종 특이적 민감성과 안전 여유를 고려할 때, 이러한 발견은 사람에게는 관련이 없는 것으로 간주됩니다.
마우스, 랫드 및 개에서 사람 노출량의 12배에서 116배에 이르는 노출량에서 수행된 장기 연구에서 간에 대한 부작용은 없었습니다.
14. 임상 연구
14.1 폐동맥 고혈압
맥시텐탄의 PAH 진행에 대한 효과는 증상이 있는 (WHO 기능 등급 (FC) II–IV) PAH 환자 742명을 대상으로 한 다기관, 장기 (평균 노출 기간 약 2년) 위약 대조 연구에서 입증되었습니다. 환자들은 매일 1회 위약 (n=250), 맥시텐탄 3mg (n=250) 또는 맥시텐탄 10mg (n=242)으로 무작위 배정되었습니다. 환자들은 OPSUMIT 단독 요법 또는 인산디에스테라제-5 억제제 또는 흡입 프로스타노이드와 병용하여 치료를 받았습니다.
주요 연구 종료점은 이중맹검 치료 기간 동안 사망, 심각한 질병 발생 사건 (심방 중격 절개술, 폐 이식, IV 또는 피하 (SC) 프로스타노이드 시작 또는 “PAH 악화”) 발생까지의 시간이었습니다. 악화는 다음과 같은 모든 경우에 해당되었습니다. 1) 기준선 대비 6분 보행 거리 (6MWD)가 지속적으로 ≥15% 감소, 2) PAH 증상 악화 (WHO FC 악화), 3) PAH 치료를 위한 추가 치료 필요. 이러한 모든 악화 사건은 치료 배정을 모르는 독립적인 심사 위원회에서 확인했습니다. 중요한 2차 종료점은 PAH 사망 또는 PAH 입원까지의 시간이었습니다.
평균 환자 연령은 46세였습니다 (14%는 65세 이상이었습니다). 대부분의 환자는 백인 (55%) 또는 아시아인 (29%)이었고 여성 (77%)이었습니다. 약 52%, 46%, 2%의 환자가 각각 WHO FC II, III, IV에 있었습니다.
특발성 또는 유전성 PAH는 연구 대상 인구에서 가장 흔한 원인 (57%)이었으며, 그 다음으로 결합 조직 질환으로 인한 PAH (31%), 수술된 션트가 있는 선천성 심장 질환으로 인한 PAH (8%), 기타 원인으로 인한 PAH [약물 및 독소 (3%) 및 HIV (1%)]가 뒤를 이었습니다.
기준선에서 등록된 환자의 대부분 (64%)은 경구 인산디에스테라제 억제제 (61%) 및/또는 흡입/경구 프로스타노이드 (6%)를 포함하여 PAH에 대한 안정적인 용량의 특정 치료를 받고 있었습니다.
연구 결과는 위약과 OPSUMIT 10mg 그룹에 대해 설명됩니다. 위약과 OPSUMIT 10mg 그룹의 중간 치료 기간은 각각 101주와 118주였으며 최대 188주까지였습니다.
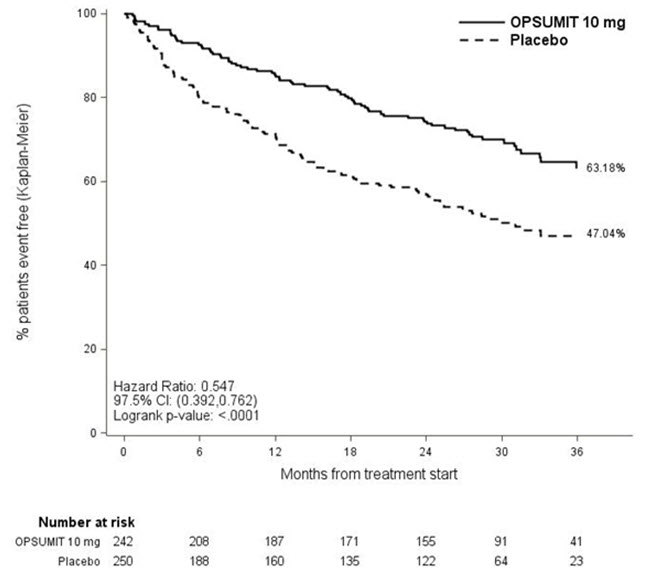
OPSUMIT 10mg으로 치료하면 이중맹검 치료 종료까지 주요 종료점 발생이 위약에 비해 45% 감소했습니다 (HR 0.55, 97.5% CI 0.39–0.76; 로그랭크 p<0.0001) (표 3 및 그림 2). OPSUMIT 10mg의 유익한 효과는 주로 임상 악화 사건 (6MWD 악화 및 PAH 증상 악화 및 추가 PAH 치료 필요) 감소에 기인했습니다.
그림 2 SERAPHIN 연구에서 주요 종료점 사건 발생에 대한 Kaplan-Meier 추정치
| 위약 N=250 n (%) |
OPSUMIT 10mg N=242 n (%) |
|
|---|---|---|
|
||
| 주요 종료점 사건이 발생한 환자 | 116 (46.4) | 76 (31.4) |
| 첫 번째 사건으로서의 구성 요소 | ||
| PAH 악화 | 93 (37.2) | 59 (24.4) |
| 사망 | 17 (6.8) | 16 (6.6) |
| IV/SC 프로스타노이드 | 6 (2.4) | 1 (0.4) |
하위 그룹 분석은 그림 3에 표시된 것처럼 결과에 대한 영향을 조사하기 위해 수행되었습니다. OPSUMIT 10mg의 주요 종료점에 대한 일관된 효능은 연령, 성별, 인종, 원인, 단독 요법 또는 다른 PAH 치료와의 병용, 기준선 6MWD 및 기준선 WHO FC 하위 그룹에서 관찰되었습니다.
그림 3 SERAPHIN 연구의 하위 그룹 분석
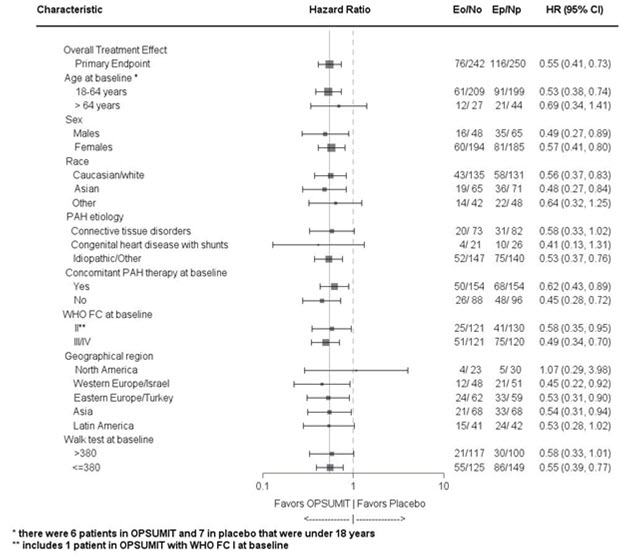
Eo = OPSUMIT 10mg의 사건 수; No = OPSUMIT 10mg에 무작위 배정된 환자 수
Ep = 위약의 사건 수; Np = 위약에 무작위 배정된 환자 수
PAH 관련 사망 또는 PAH로 인한 입원은 2차 종료점으로 평가되었습니다. OPSUMIT 10mg을 투여받은 환자의 PAH 관련 사망 또는 PAH로 인한 입원 위험은 위약에 비해 50% 감소했습니다 (HR 0.50, 97.5% CI 0.34–0.75; 로그랭크 p<0.0001) (표 4 및 그림 4).
그림 4 SERAPHIN에서 PAH로 인한 사망 또는 PAH로 인한 입원 발생에 대한 Kaplan-Meier 추정치
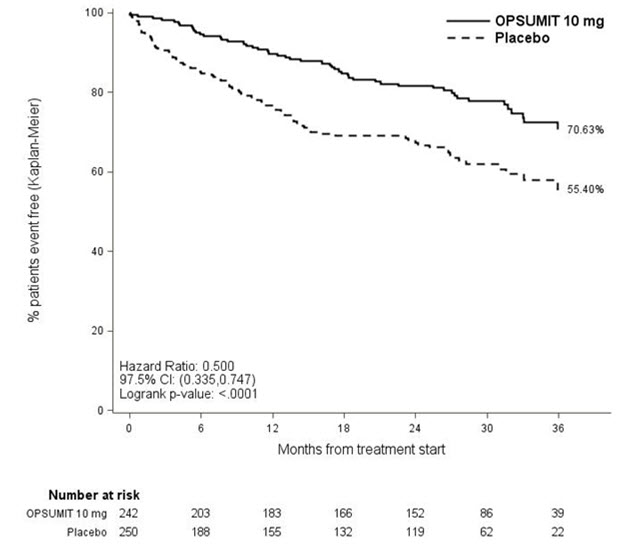
| 위약 (N=250) n (%) |
OPSUMIT 10mg (N=242) n (%) |
|
|---|---|---|
| PAH로 인한 사망 또는 PAH로 인한 입원 | 84 (33.6) | 50 (20.7) |
| 첫 번째 사건으로서의 구성 요소 | ||
| PAH로 인한 사망 | 5 (2.0) | 5 (2.1) |
| PAH로 인한 입원 | 79 (31.6) | 45 (18.6) |
OPSUMIT 10mg으로 치료하면 6개월에 위약 교정 평균 6MWD가 22미터 증가했습니다 (97.5% CI 3–41; p=0.0078). 3개월에 6MWD가 유의하게 개선되었습니다. 6MWD는 기준선 WHO 기능 등급이 더 나쁜 환자에서 더 증가했습니다 (WHO FC III/IV 및 FC I/II에서 각각 37미터 및 12미터 위약 교정 평균 증가). OPSUMIT으로 달성된 6MWD 증가는 연구 기간 동안 유지되었습니다.
OPSUMIT 10mg으로 치료하면 6개월에 환자의 22%에서 위약으로 치료받은 환자의 13%에 비해 WHO 기능 등급이 하나 이상 개선되었습니다.
16 공급/보관 및 취급 방법
OPSUMIT
® (macitentan) 정제는 양면에 “10”이라고 새겨진 10mg의 흰색 필름 코팅된 양볼록형이며 다음과 같이 제공됩니다.
카톤에 든 15정/PVC/ PE/PVDC 알루미늄 호일 블리스터 (NDC 66215-501-15)
카톤에 든 30정 백색 고밀도 폴리에틸렌 병 (NDC 66215-501-30)
20ºC~25ºC(68ºF~77ºF)에서 보관하십시오. 15°C~30°C(59°F~86°F) 사이에서의 일시적인 온도 이탈은 허용됩니다.
[USP Controlled Room Temperature 참조].
어린이의 손이 닿지 않는 곳에 보관하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨링(복약 안내서)을 읽도록 권고하십시오.
배아-태아 독성
가임 여성 환자에게 OPSUMIT 치료 중 및 치료 중단 후 한 달 동안 확실한 피임법을 사용해야 할 필요성에 대해 상담하십시오. 가임 여성은 OPSUMIT 복용 중 및 OPSUMIT 중단 후 한 달 동안 매달 임신 검사를 받고 확실한 피임법을 사용해야 합니다.
[
특정 집단에서의 사용(8.1) 참조]
.
마시텐탄 함유 제품 REMS
여성 환자의 경우 OPSUMIT는 마시텐탄 함유 제품 REMS라는 제한된 프로그램을 통해서만 사용할 수 있습니다.
[
경고 및 주의사항(5.2) 참조]
. 남성 환자는 마시텐탄 함유 제품 REMS에 등록되지 않습니다.
환자는 한 가지 매우 효과적인 피임법(자궁 내 장치(IUD), 피임 임플란트 또는 난관 결찰) 또는 방법의 조합(호르몬 방법과 장벽 방법 또는 두 가지 장벽 방법)을 선택할 수 있습니다.
환자는 임신 가능성이 의심되는 경우 의사에게 연락하도록 지시받아야 합니다. 환자는 필요에 따라 산부인과 의사 또는 유사한 전문가에게 추가 피임 조언을 구해야 합니다.
가임 여성 환자(및 해당되는 경우 보호자)에게 다음과 같은 주목할 만한 요구 사항을 알리십시오.
- 가임 여성 환자는 등록 양식에 서명해야 합니다.
- 가임 여성 환자는 임신 검사 및 피임 요구 사항을 준수해야 합니다.
[
특정 집단에서의 사용(8.3) 참조]
.
가임 여성에게 피임 실패 또는 무방비 성관계 시 응급 피임법 사용에 대해 교육하고 상담하십시오.
사춘기 이전 여성에게는 생식 상태에 변화가 있을 경우 즉시 처방 의사에게 보고하도록 조언하십시오.
가임 여성 환자와 함께 복약 안내서 및 REMS 교육 자료를 검토하십시오.
간독성
이 약리학적 분류의 일부 구성원은 간독성이 있습니다. 환자에게 간독성의 징후에 대해 교육하십시오. 설명할 수 없는 메스꺼움, 구토, 우상복부 통증, 피로, 식욕 부진, 황달, 짙은 소변, 발열 또는 가려움증이 있는 경우 의사에게 연락하도록 환자에게 조언하십시오.
비분류 섹션
제조사:
Actelion Pharmaceuticals US, Inc.,
a Janssen Pharmaceutical Company
Titusville, NJ 08560, USA
특허 정보: www.janssenpatents.com
© 2013 – 2019 Actelion Pharmaceuticals US, Inc. All rights reserved.
약물 안내
| MEDICATION GUIDE OPSUMIT ® (OP-sum-it) (macitentan) tablets |
||
|---|---|---|
| This Medication Guide has been approved by the U.S. Food and Drug Administration. | Revised: 03/2024 | |
| OPSUMIT 복용을 시작하기 전과 재충전할 때마다 이 약물 안내서를 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 약물 안내서는 의료 서비스 제공자와 귀하의 건강 상태 또는 치료에 대해 이야기하는 것을 대신할 수 없습니다. | ||
|
OPSUMIT에 대해 알아야 할 가장 중요한 정보는 무엇입니까? |
||
|
||
| 임신 중에 OPSUMIT를 복용하면 심각한 선천적 기형이 발생할 수 있습니다. | ||
|
||
| 임신 가능성이 있는 여성은 OPSUMIT 치료 중에 그리고 OPSUMIT 중단 후 1개월 동안 약물이 몸에 남아 있을 수 있으므로 두 가지 허용되는 피임 방법을 사용해야 합니다. | ||
|
||
| OPSUMIT 치료 중에 허용되는 피임 방법에 대한 아래 차트를 참조하십시오. 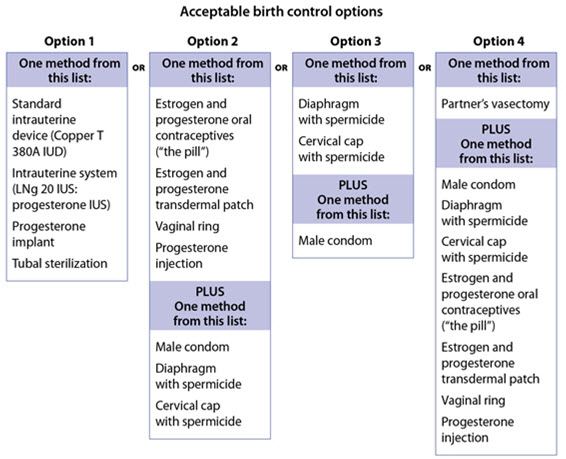 |
||
|
||
| 사춘기에 접어들기 전에 OPSUMIT를 복용하기 시작한 여성 자녀의 부모 또는 보호자라면 자녀가 사춘기 징후를 보이는지 정기적으로 확인해야 합니다. 유방 몽우리가 생기거나 음모가 나는 것을 발견하면 즉시 의료 서비스 제공자에게 알리십시오. 의료 서비스 제공자는 자녀가 사춘기에 접어들었는지 결정해야 합니다. 자녀는 첫 월경이 시작되기 전에 사춘기에 접어들 수 있습니다. |
||
| 여성은 Macitentan-Containing Products Risk Evaluation and Mitigation Strategy(REMS)라는 제한된 프로그램을 통해서만 OPSUMIT를 받을 수 있습니다. 임신 가능성이 있는 여성이라면 의료 서비스 제공자와 상담하고 OPSUMIT의 이점과 위험을 이해하고 Macitentan-Containing Products REMS의 모든 지침에 동의해야 합니다. | ||
| 남성은 Macitentan-Containing Products REMS에 참여하지 않고도 OPSUMIT를 받을 수 있습니다. | ||
| OPSUMIT는 무엇입니까? | ||
|
||
| 누가 OPSUMIT를 복용해서는 안 됩니까? | ||
| 임신 중이거나 임신을 계획하고 있거나 OPSUMIT 치료 중 임신한 경우 OPSUMIT를 복용하지 마십시오. OPSUMIT는 심각한 선천적 기형을 유발할 수 있습니다. (위의 약물 안내서 섹션 ” OPSUMIT에 대해 가장 중요한 정보는 무엇입니까?” 참조). macitentan 또는 OPSUMIT의 성분에 알레르기가 있는 경우 OPSUMIT를 복용하지 마십시오. OPSUMIT의 성분 목록은 이 약물 안내서의 끝 부분을 참조하십시오. |
||
| 처방약, 일반의약품, 비타민 및 허브 보충제를 포함하여 모든 의학적 상태와 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. OPSUMIT 및 기타 약물은 서로 영향을 미쳐 부작용을 일으킬 수 있습니다. 의료 서비스 제공자와 상담하기 전에 새로운 약물을 복용하지 마십시오. | ||
| 특히 HIV 약물을 복용하는 경우 의료 서비스 제공자에게 알리십시오. | ||
| OPSUMIT는 어떻게 복용해야 합니까? | ||
| OPSUMIT는 전문 약국에서 우편으로 배송됩니다. 의료 서비스 제공자가 자세한 내용을 알려드릴 것입니다. | ||
|
||
| OPSUMIT 복용 중에 무엇을 피해야 합니까? | ||
|
||
| OPSUMIT의 가능한 부작용은 무엇입니까? | ||
| OPSUMIT는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. | ||
|
||
|
|
|
|
||
| OPSUMIT의 가장 흔한 부작용은 다음과 같습니다. | ||
|
||
| 귀찮거나 사라지지 않는 부작용이 발생하면 의료 서비스 제공자에게 알리십시오. 이것들은 OPSUMIT의 모든 가능한 부작용이 아닙니다. 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. | ||
| 부작용에 대한 의학적 조언은 의료 서비스 제공자에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088로 전화하십시오. | ||
| OPSUMIT는 어떻게 보관해야 합니까? | ||
|
||
| OPSUMIT에 대한 일반 정보 | ||
| 약물은 때때로 약물 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 상태에 OPSUMIT를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 OPSUMIT를 제공하지 마십시오. 해를 입힐 수 있습니다. | ||
| 이 약물 안내서는 OPSUMIT에 대한 가장 중요한 정보를 요약한 것입니다. 자세한 내용은 의료 서비스 제공자와 상담하십시오. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 OPSUMIT에 대한 정보를 요청할 수 있습니다. 자세한 내용은 1-800-526-7736(1-800-JANSSEN)으로 전화하거나 www.OPSUMIT.com을 방문하십시오. | ||
| OPSUMIT에 들어 있는 성분은 무엇입니까? | ||
| 활성 성분: macitentan | ||
| 비활성 성분: 유당 일수화물, 마그네슘 스테아레이트, 미결정 셀룰로오스, 폴리소르베이트 80, 포비돈 및 나트륨 전분 글리콜레이트 A형. 정제는 폴리비닐 알코올, 대두 레시틴, 활석, 이산화티탄 및 잔탄 검을 함유하는 코팅 재료로 필름 코팅되어 있습니다. | ||
| 제조사: Actelion Pharmaceuticals US, Inc., a Janssen Pharmaceutical Company Titusville, NJ 08560, USA 특허 정보: www.janssenpatents.com © 2013 – 2019 Actelion Pharmaceuticals US, Inc. All rights reserved. |
||
주요 표시면 – 10mg 정제병 상자
NDC 66215-501-30
Opsumit
®
(macitentan) tablets
10 mg
각 환자에게
동봉된
복약 안내서를
제공하십시오
처방전 의약품
필름 코팅 정제 30정
janssen