의약품 제조업체: Boehringer Ingelheim Pharmaceuticals, Inc. (Updated: 2024-10-15)
처방 정보의 주요 내용
OFEV® (nintedanib capsules), 경구 투여
미국 최초 승인: 2014
적응증 및 사용법
투여량 및 투여 방법
투여 형태 및 강도
캡슐: 150mg 및 100mg (3)
금기 사항
없음 (4)
경고 및 주의 사항
- 간 기능 장애: OFEV는 중등도 또는 중증 간 기능 장애 환자에게 사용하지 않는 것이 좋습니다. 경도 간 기능 장애(Child Pugh A) 환자의 경우 권장 용량은 음식과 함께 하루 2회, 약 12시간 간격으로 경구 투여 100mg입니다. 이러한 환자의 경우 유해 반응 관리를 위해 치료 중단 또는 중단을 고려하십시오. (2.3, 2.4, 5.1, 8.6, 12.3)
- 간 효소 상승 및 약물 유발성 간 손상: OFEV를 사용하면 ALT, AST 및 빌리루빈 수치가 상승할 수 있으며, 약물 유발성 간 손상 사례도 보고되었습니다. 시판 후 조사 결과, 치명적인 결과를 초래하는 심각한 간 손상을 포함하여 약물 유발성 간 손상의 중증도가 낮은 사례와 중증도가 높은 사례가 보고되었습니다. 대부분의 간 관련 사건은 치료 시작 후 3개월 이내에 발생합니다. 대부분의 경우 용량 조절 또는 중단으로 간 효소 및 빌리루빈 수치가 회복되었습니다. 치료 시작 전, 치료 시작 후 3개월 동안 정기적으로, 그리고 그 이후에 임상적으로 필요한 경우 정기적으로 ALT, AST 및 빌리루빈 수치를 모니터링하십시오. 일시적인 용량 감소 또는 중단이 필요할 수 있습니다. (2.1, 2.4, 5.2)
- 위장관 장애: OFEV를 사용하면 설사, 메스꺼움 및 구토가 발생할 수 있습니다. 적절한 수분 공급과 설사 치료제(예: 로페라미드) 또는 구토 방지제로 첫 증상이 나타나면 환자를 치료하십시오. 증상 치료에도 불구하고 심한 설사, 메스꺼움 또는 구토가 지속되면 OFEV를 중단하십시오. (5.3)
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 생식 가능 여성에게 태아에 대한 잠재적인 위험을 알리고 고효율 피임법을 사용하도록 조언하십시오. 구토, 설사 또는 약물 흡수가 감소될 수 있는 다른 상태를 경험하는 경구 호르몬 피임제를 복용하는 여성에게는 다른 고효율 피임법을 사용하도록 조언하십시오. (5.4, 8.1, 8.3)
- 동맥색전증 사건이 보고되었습니다. 알려진 관상 동맥 질환을 포함하여 심혈관 위험이 높은 환자를 치료할 때는 주의하십시오. (5.5)
- 출혈 사건이 보고되었습니다. 알려진 출혈 위험이 있는 환자에게는 예상되는 이점이 잠재적인 위험보다 큰 경우에만 OFEV를 사용하십시오. (5.6)
- 위장관 천공이 보고되었습니다. 최근 복부 수술을 받았거나 이전에 맹장염 병력이 있거나 동시에 코르티코스테로이드 또는 NSAID를 투여받는 환자를 치료할 때는 OFEV를 주의하여 사용하십시오. 위장관 천공이 발생하는 환자는 OFEV를 중단하십시오. 알려진 위장관 천공 위험이 있는 환자에게는 예상되는 이점이 잠재적인 위험보다 큰 경우에만 OFEV를 사용하십시오. (5.7)
- 신증후군 범위 단백뇨가 보고되었습니다. 새로운 단백뇨가 발생하거나 악화되는 환자는 치료 중단을 고려하십시오. (5.8)
유해 반응
가장 흔한 유해 반응(≥5%)은 설사, 메스꺼움, 복통, 구토, 간 효소 상승, 식욕 감소, 두통, 체중 감소 및 고혈압입니다. (6.1)
의심되는 유해 반응을 보고하려면 Boehringer Ingelheim Pharmaceuticals, Inc.에 (800) 542-6257로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
DRUG INTERACTIONS
- P-gp 및 CYP3A4 억제제와의 병용 투여는 닌테다닙 노출을 증가시킬 수 있습니다. OFEV의 내약성에 대해 환자를 면밀히 모니터링하십시오. (7.1)
USE IN SPECIFIC POPULATIONS
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2024년 10월
목차
전문 정보: 목차*
1 적응증 및 사용법
1.1 특발성 폐섬유증
1.2 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환
1.3 전신 경화증 관련 간질성 폐 질환
2 용법 및 용량
2.1 OFEV 투여 전 검사
2.2 권장 용량
2.3 간 기능 장애 환자의 권장 용량
2.4 유해 반응으로 인한 용량 조절
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 간 기능 장애
5.2 상승된 간 효소 및 약물 유발성 간 손상
5.3 위장관 장애
5.4 배아-태아 독성
5.5 동맥색전증
5.6 출혈 위험
5.7 위장관 천공
5.8 신증후군 범위 단백뇨
6 유해 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 P-glycoprotein (P-gp) 및 CYP3A4 억제제 및 유도제
7.2 항응고제
7.3 피르페니돈
7.4 보센탄
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간 기능 장애
8.7 신장 기능 장애
8.8 흡연자
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 특발성 폐섬유증
14.2 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환
14.3 전신 경화증 관련 간질성 폐 질환
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.2 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환
OFEV는 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환(ILD) 성인 환자의 치료에 사용됩니다 [임상 연구 (14.2) 참조].
2 투여 및 관리
2.1 OFEV 투여 전 검사
OFEV 치료를 시작하기 전에 모든 환자의 간 기능 검사와 가임기 여성의 임신 검사를 실시하십시오. [see Warnings and Precautions (5.2, 5.4)].
2.2 권장 복용량
OFEV의 권장 복용량은 150mg을 경구로 1일 2회, 약 12시간 간격으로 복용하는 것입니다.
투여 정보
OFEV 캡슐은 음식과 함께 복용해야 하며 [see Clinical Pharmacology (12.3)] 액체와 함께 통째로 삼켜야 합니다. OFEV 캡슐은 쓴맛 때문에 씹어서는 안 됩니다.
OFEV 캡슐을 열거나 부수지 마십시오. 캡슐 내용물에 접촉된 경우 즉시 손을 깨끗이 씻으십시오. 캡슐을 씹거나 부수는 것이 nintedanib의 약동학에 미치는 영향은 알려져 있지 않습니다.
2.3 간 장애 환자의 권장 복용량
경증 간 장애
경증 간 장애(Child Pugh A) 환자의 경우 OFEV의 권장 복용량은 100mg을 경구로 1일 2회, 약 12시간 간격으로 음식과 함께 복용하는 것입니다. [see Use in Specific Populations (8.6)].
중등도 또는 중증 간 장애
OFEV 치료는 권장되지 않습니다. [see Warnings and Precautions (5.1) and Use in Specific Populations (8.6)].
2.4 이상 반응으로 인한 복용량 수정
증상 치료 외에도 해당되는 경우 OFEV의 이상 반응을 관리하기 위해 특정 이상 반응이 치료를 계속할 수 있는 수준으로 해결될 때까지 복용량을 줄이거나 일시적으로 중단해야 할 수 있습니다. OFEV 치료는 전체 복용량(1일 2회 150mg) 또는 감량된 복용량(1일 2회 100mg)으로 다시 시작할 수 있으며, 이후 전체 복용량으로 늘릴 수 있습니다. 환자가 1일 2회 100mg을 견딜 수 없는 경우 OFEV 치료를 중단하십시오. [see Warnings and Precautions (5.2, 5.3, 5.5, 5.7) and Adverse Reactions (6.1)].
간 효소 상승
간 효소 상승의 경우 복용량 수정 또는 중단이 필요할 수 있습니다. OFEV 치료 시작 전, 치료 첫 3개월 동안 정기적으로, 그리고 그 이후 주기적으로 또는 임상적으로 필요에 따라 간 기능 검사(AST(아스파르테이트 아미노전달효소), ALT(알라닌 아미노전달효소), 빌리루빈)를 실시하십시오. 피로, 식욕 부진, 우상복부 불편감, 짙은 소변 또는 황달 등 간 손상을 나타낼 수 있는 증상을 보고하는 환자의 간 검사를 즉시 측정하십시오. 간 손상 징후 또는 증상과 함께 AST 또는 ALT가 정상 상한치(ULN)의 3배 이상인 환자와 AST 또는 ALT 상승이 정상 상한치의 5배 이상인 환자의 경우 OFEV를 중단하십시오. 간 손상 징후 없이 AST 또는 ALT가 정상 상한치의 3배 이상 5배 미만인 경우 치료를 중단하거나 OFEV를 1일 2회 100mg으로 줄이십시오. 간 효소가 기준치로 돌아오면 OFEV 치료를 감량된 복용량(1일 2회 100mg)으로 다시 시작할 수 있으며, 이후 전체 복용량(1일 2회 150mg)으로 늘릴 수 있습니다. [see Warnings and Precautions (5.2) and Adverse Reactions (6.1)].
경증 간 장애(Child Pugh A) 환자의 경우 이상 반응 관리를 위해 치료 중단 또는 중단을 고려하십시오.
3 제형 및 함량
캡슐:
- 150 mg, 갈색, 불투명, 장방형, 연질 캡슐, Boehringer Ingelheim 회사 기호와 “150”이 검은색으로 각인되어 있습니다.
- 100 mg, 복숭아색, 불투명, 장방형, 연질 캡슐, Boehringer Ingelheim 회사 기호와 “100”이 검은색으로 각인되어 있습니다.
4 금기사항
없음
5 경고 및 주의사항
5.1 간 기능 저하
중등도(Child Pugh B) 또는 중증(Child Pugh C) 간 기능 저하 환자의 경우 OFEV 치료를 권장하지 않습니다 [특정 집단에서의 사용 (8.6) 및 임상 약리학 (12.3) 참조]. 경증 간 기능 저하(Child Pugh A) 환자는 OFEV의 감소된 용량으로 치료할 수 있습니다 [용량 및 투여 (2.3) 참조].
5.2 상승된 간 효소 및 약물 유발성 간 손상
OFEV 치료와 관련하여 약물 유발성 간 손상(DILI) 사례가 관찰되었습니다. 임상 시험 및 시판 후 기간 동안 DILI의 중증도가 아닌 사례와 중증 사례가 보고되었습니다. 시판 후 기간 동안 치명적인 결과를 초래하는 중증 간 손상 사례가 보고되었습니다. 대부분의 간 관련 사건은 치료 시작 후 처음 3개월 이내에 발생합니다. 임상 시험에서 OFEV 투여는 간 효소(ALT, AST, ALKP, GGT) 및 빌리루빈 수치 상승과 관련이 있었습니다. 대부분의 경우 간 효소 및 빌리루빈 수치 상승은 용량 조절 또는 중단으로 회복되었습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 ALT 및/또는 AST 수치 상승을 보인 환자의 대부분(94%)은 ULN의 5배 미만으로 상승했고 빌리루빈 수치 상승을 보인 환자의 대부분(95%)은 ULN의 2배 미만으로 상승했습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 ALT 및/또는 AST 수치 상승을 보인 환자의 대부분(95%)은 ULN의 5배 미만으로 상승했고 빌리루빈 수치 상승을 보인 환자의 대부분(94%)은 ULN의 2배 미만으로 상승했습니다. SSc-ILD 연구(연구 4)에서 OFEV 그룹 환자의 4.9%와 위약 그룹 환자의 0.7%에서 ULN의 3배 이상인 최대 ALT 및/또는 AST 수치가 관찰되었습니다 [특정 집단에서의 사용 (8.6) 및 임상 약리학 (12.3) 참조]. 체중이 적은(65kg 미만), 아시아인 및 여성 환자는 간 효소 수치 상승 위험이 더 높을 수 있습니다. 닌테다닙 노출은 환자의 나이가 증가함에 따라 증가했으며, 이는 간 효소 수치 상승 위험이 더 높아질 수도 있습니다 [임상 약리학 (12.3) 참조].
OFEV 치료를 시작하기 전에 간 기능 검사(ALT, AST 및 빌리루빈)를 실시하고 치료 시작 후 처음 3개월 동안 정기적으로, 그 이후에는 주기적으로 또는 임상적으로 필요에 따라 실시합니다. 피로, 식욕 부진, 우측 상복부 불편감, 짙은 소변 또는 황달과 같은 간 손상을 나타낼 수 있는 증상을 호소하는 환자의 경우 간 기능 검사를 즉시 실시합니다. 간 효소 수치 상승의 경우 용량 조절 또는 중단이 필요할 수 있습니다 [용량 및 투여 (2.1, 2.4) 참조].
5.3 위장관 장애
설사
임상 시험에서 설사는 보고된 가장 흔한 위장관 사건이었습니다. 대부분의 환자에서 사건은 경증에서 중등도였으며 치료 시작 후 처음 3개월 이내에 발생했습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 설사는 OFEV로 치료받은 환자의 62%에서 보고된 반면 위약으로 치료받은 환자의 경우 18%에서 보고되었습니다 [유해 반응 (6.1) 참조]. 설사는 OFEV로 치료받은 환자의 11%에서 영구적인 용량 감소로 이어진 반면 위약으로 치료받은 환자의 경우 0%에서 이어졌습니다. 설사는 OFEV로 치료받은 환자의 5%에서 치료 중단으로 이어진 반면 위약으로 치료받은 환자의 경우 1% 미만에서 이어졌습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 설사는 OFEV로 치료받은 환자의 67%에서 보고된 반면 위약으로 치료받은 환자의 경우 24%에서 보고되었습니다 [유해 반응 (6.1) 참조]. 설사는 OFEV로 치료받은 환자의 16%에서 영구적인 용량 감소로 이어진 반면 위약으로 치료받은 환자의 경우 1% 미만에서 이어졌습니다. 설사는 OFEV로 치료받은 환자의 6%에서 치료 중단으로 이어진 반면 위약으로 치료받은 환자의 경우 1% 미만에서 이어졌습니다. SSc-ILD 연구(연구 4)에서 설사는 OFEV로 치료받은 환자의 76%에서 보고된 반면 위약으로 치료받은 환자의 경우 32%에서 보고되었습니다 [유해 반응 (6.1) 참조]. 설사는 OFEV로 치료받은 환자의 22%에서 영구적인 용량 감소로 이어진 반면 위약으로 치료받은 환자의 경우 1%에서 이어졌습니다. 설사는 OFEV로 치료받은 환자의 7%에서 치료 중단으로 이어진 반면 위약으로 치료받은 환자의 경우 0.3%에서 이어졌습니다.
설사의 유해 반응이 있는 환자의 경우 용량 조절 또는 치료 중단이 필요할 수 있습니다. 설사의 첫 징후가 나타나면 적절한 수분 공급과 지사제(예: 로페라미드)로 치료하고 설사가 지속되면 용량 감소 또는 치료 중단을 고려하십시오 [용량 및 투여 (2.4) 참조]. OFEV 치료는 전체 용량(1일 2회 150mg) 또는 감소된 용량(1일 2회 100mg)으로 재개할 수 있으며, 이후 전체 용량으로 증가시킬 수 있습니다. 증상 치료에도 불구하고 심한 설사가 지속되면 OFEV 치료를 중단하십시오.
메스꺼움 및 구토
IPF 연구(연구 1, 연구 2 및 연구 3)에서 오심은 OFEV 치료군의 24%에서, 위약군의 7%에서 보고되었으며, 구토는 OFEV 치료군의 12%에서, 위약군의 3%에서 보고되었습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 오심은 OFEV 치료군의 29%에서, 위약군의 9%에서 보고되었으며, 구토는 OFEV 치료군의 18%에서, 위약군의 5%에서 보고되었습니다. SSc-ILD 연구(연구 4)에서 오심은 OFEV 치료군의 32%에서, 위약군의 14%에서 보고되었으며, 구토는 OFEV 치료군의 25%에서, 위약군의 10%에서 보고되었습니다 [부작용 (6.1) 참조]. 대부분의 환자에서 이러한 사건은 경증에서 중등도의 강도였습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 오심으로 인해 OFEV 투여를 중단한 환자는 2%, 구토로 인해 OFEV 투여를 중단한 환자는 1%였습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 오심으로 인해 OFEV 투여를 중단한 환자는 1% 미만이었고, 구토로 인해 OFEV 투여를 중단한 환자는 1%였습니다. SSc-ILD 연구(연구 4)에서 오심으로 인해 OFEV 투여를 중단한 환자는 2%, 구토로 인해 OFEV 투여를 중단한 환자는 1%였습니다.
항구토제 치료를 포함한 적절한 지지 치료에도 불구하고 지속되는 오심 또는 구토의 경우, 용량 감소 또는 치료 중단이 필요할 수 있습니다 [용법 및 용량 (2.4) 참조]. OFEV 치료는 전체 용량(1일 2회 150mg) 또는 감소된 용량(1일 2회 100mg)으로 재개할 수 있으며, 이후 전체 용량으로 증량할 수 있습니다. 심한 오심 또는 구토가 해결되지 않으면 OFEV 치료를 중단하십시오.
5.4 태아 독성
동물 연구 결과 및 작용 기전을 바탕으로, OFEV는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 닌테다닙은 기관 형성 과정 중에 성인의 최대 권장 용량(MRHD)보다 낮은(쥐) 및 약 5배(토끼)의 용량으로 투여되었을 때 쥐와 토끼에서 태아 사망 및 구조적 기형을 유발했습니다. 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다. 임신 가능성이 있는 여성에게는 OFEV 치료를 받는 동안 임신을 피하고 OFEV 첫 투여 시, 치료 기간 동안, 그리고 마지막 투여 후 최소 3개월 동안 고효율 피임법을 사용하도록 조언하십시오. 닌테다닙은 SSc-ILD 환자에서 에티닐에스트라디올과 레보노르게스트렐을 함유한 경구 피임약의 노출을 변화시키지 않습니다. 그러나 경구 호르몬 피임약의 효능은 구토 및/또는 설사 또는 약물 흡수가 감소될 수 있는 다른 상태로 인해 저해될 수 있습니다. 이러한 상태를 경험하는 경구 호르몬 피임약을 복용하는 여성에게는 다른 고효율 피임법을 사용하도록 조언하십시오. OFEV 치료 시작 전과 치료 중에 적절히 임신 여부를 확인하십시오 [특정 환자군에서의 사용 (8.1, 8.3) 및 임상 약리학 (12.1, 12.3) 참조].
5.5 동맥색전증
OFEV를 복용하는 환자에서 동맥색전증이 보고되었습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 동맥색전증은 OFEV 치료군의 2.5%에서, 위약군의 1% 미만에서 보고되었습니다. 심근 경색은 동맥색전증 하에서 가장 흔한 부작용으로, OFEV 치료군의 1.5%에서 발생한 반면, 위약군에서는 1% 미만에서 발생했습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 동맥색전증은 두 치료군 모두에서 1% 미만의 환자에게서 보고되었습니다. 심근 경색은 두 치료군 모두에서 1% 미만의 환자에게서 관찰되었습니다. SSc-ILD 연구(연구 4)에서 동맥색전증은 두 치료군 모두에서 0.7%의 환자에게서 보고되었습니다. OFEV 치료군에서는 심근 경색이 0건이었던 반면, 위약군에서는 0.7%의 환자에게서 발생했습니다.
알려진 관상 동맥 질환을 포함하여 심혈관 위험이 높은 환자를 치료할 때는 주의하십시오. 급성 심근 허혈의 징후 또는 증상이 나타나는 환자의 경우 치료 중단을 고려하십시오.
5.6 출혈 위험
작용 기전(VEGFR 억제)을 바탕으로, OFEV는 출혈 위험을 증가시킬 수 있습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 출혈 사건은 OFEV 치료군의 10%에서, 위약군의 7%에서 보고되었습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 출혈 사건은 OFEV 치료군의 11%에서, 위약군의 13%에서 보고되었습니다. SSc-ILD 연구(연구 4)에서 출혈 사건은 OFEV 치료군의 11%에서, 위약군의 8%에서 보고되었습니다. 임상 시험에서 코피가 가장 흔하게 보고된 출혈 사건이었습니다.
시판 후 조사에서 일부는 치명적인 비중증 및 중증 출혈 사건이 관찰되었습니다.
알려진 출혈 위험이 있는 환자에게는 예상되는 이점이 잠재적 위험보다 큰 경우에만 OFEV를 사용하십시오.
5.7 위장관 천공
작용 기전을 바탕으로, OFEV는 위장관 천공 위험을 증가시킬 수 있습니다. IPF 연구(연구 1, 연구 2 및 연구 3)에서 위장관 천공은 OFEV 치료군의 1% 미만에서 보고된 반면, 위약군에서는 0건이었습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 연구(연구 5)에서 위장관 천공은 어떤 치료군에서도 어떤 환자에게서도 보고되지 않았습니다. SSc-ILD 연구(연구 4)에서 위장관 천공은 OFEV 치료군 또는 위약군 환자에게서 보고되지 않았습니다.
시판 후 조사에서 일부는 치명적인 위장관 천공 사례가 보고되었습니다.
최근 복부 수술을 받았거나, 이전에 만성 궤양성 질환 병력이 있거나, 동시에 코르티코스테로이드 또는 NSAID를 복용하는 환자를 치료할 때는 주의하십시오. 위장관 천공이 발생하는 환자의 경우 OFEV 치료를 중단하십시오. 알려진 위장관 천공 위험이 있는 환자에게는 예상되는 이점이 잠재적 위험보다 큰 경우에만 OFEV를 사용하십시오.
5.8 신증후군 범위 단백뇨
시판 후 단백뇨가 신증후군 범위 내에서 보고되었습니다. 조직학적 소견은 가능한 경우, 신장 혈전 유무와 관계없이 사구체 미세혈관병증과 일치했습니다. OFEV 투여를 중단한 후 단백뇨가 개선되었지만, 일부 경우에는 잔여 단백뇨가 지속되었습니다. 새롭게 발생하거나 악화되는 단백뇨가 나타나는 환자의 경우 치료 중단을 고려하십시오.
6 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 섹션에서 자세히 설명됩니다.
- 상승된 간 효소 및 약물 유발성 간 손상 [경고 및 주의 사항 (5.2) 참조]
- 위장관 장애 [경고 및 주의 사항 (5.3) 참조]
- 태아 독성 [경고 및 주의 사항 (5.4) 참조]
- 동맥색전증 [경고 및 주의 사항 (5.5) 참조]
- 출혈 위험 [경고 및 주의 사항 (5.6) 참조]
- 위장관 천공 [경고 및 주의 사항 (5.7) 참조]
- 신증후군 범위 단백뇨 [경고 및 주의 사항 (5.8) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
OFEV의 안전성은 1,000명 이상의 IPF 환자, 진행성 표현형을 가진 만성 섬유화성 ILD 환자 332명, SSc-ILD 환자 280명 이상에서 평가되었습니다. 200명 이상의 IPF 환자가 임상 시험에서 2년 이상 OFEV에 노출되었습니다.
특발성 폐 섬유증
OFEV는 3개의 무작위 배정, 이중 맹검, 위약 대조, 52주 임상 시험에서 연구되었습니다. 2상(연구 1) 및 3상(연구 2 및 연구 3) 임상 시험에서 IPF 환자 723명은 OFEV 150mg을 1일 2회 투여받았고, 508명은 위약을 투여받았습니다. OFEV 투여군의 중간 노출 기간은 10개월, 위약 투여군의 중간 노출 기간은 11개월이었습니다. 피험자의 연령은 42세에서 89세(중간 연령 67세)였습니다. 대부분의 환자는 남성(79%)이었고 백인(60%)이었습니다.
OFEV 투여군에서 위약 투여군보다 더 많이 보고된 가장 흔한 중대한 유해 반응은 기관지염(1.2% 대 0.8%)과 심근 경색(1.5% 대 0.4%)이었습니다. OFEV 투여군에서 위약 투여군보다 더 많이 보고된 사망으로 이어진 가장 흔한 유해 사건은 폐렴(0.7% 대 0.6%), 악성 폐 종양(0.3% 대 0%), 심근 경색(0.3% 대 0.2%)이었습니다. MI를 포함한 주요 심혈관 사건(MACE)의 사전 정의된 범주에서 사망 사건은 OFEV 투여군의 0.6%와 위약 투여군의 1.8%에서 보고되었습니다.
영구적인 용량 감소로 이어진 유해 반응은 OFEV 투여군의 16%와 위약 투여군의 1%에서 보고되었습니다. OFEV 투여군에서 영구적인 용량 감소로 이어진 가장 흔한 유해 반응은 설사(11%)였습니다.
투약 중단으로 이어진 유해 반응은 OFEV 투여군의 21%와 위약 투여군의 15%에서 보고되었습니다. OFEV 투여군에서 투약 중단으로 이어진 가장 흔한 유해 반응은 설사(5%), 메스꺼움(2%), 식욕 감소(2%)였습니다.
OFEV 투여군에서 위약 투여군보다 더 흔하게 발생하는 발생률이 5% 이상인 가장 흔한 유해 반응은 표 1에 나와 있습니다.
| 유해 반응 | OFEV, 150mg n=723 |
위약 n=508 |
|---|---|---|
| a 복통, 상복부 통증, 하복부 통증, 위장관 통증 및 복부 압통 포함. b 감마-글루타밀 전이효소 증가, 간 효소 증가, 알라닌 아미노 전이효소 증가, 아스파르트산 아미노 전이효소 증가, 간 기능 이상, 간 기능 검사 이상, 트랜스아미나제 증가, 혈액 알칼리성 포스파타제 증가, 알라닌 아미노 전이효소 이상, 아스파르트산 아미노 전이효소 이상 및 감마-글루타밀 전이효소 이상 포함. c 고혈압, 혈압 상승, 고혈압 위기 및 고혈압성 심근병증 포함. |
||
| 위장관 장애 | ||
| 설사 | 62% | 18% |
| 메스꺼움 | 24% | 7% |
| 복통a | 15% | 6% |
| 구토 | 12% | 3% |
| 간담도계 장애 | ||
| 간 효소 상승b | 14% | 3% |
| 대사 및 영양 장애 | ||
| 식욕 감소 | 11% | 5% |
| 신경계 장애 | ||
| 두통 | 8% | 5% |
| 검사 | ||
| 체중 감소 | 10% | 3% |
| 혈관 장애 | ||
| 고혈압c | 5% | 4% |
피르페니돈과의 병용
니텐다닙 150mg 1일 2회 투여와 피르페니돈 추가 투여(1일 3회 801mg까지 적정)를 비교한 니텐다닙 150mg 1일 2회 투여 단독 요법의 탐색적 개방표지 무작위 배정(1:1) 시험(105명의 무작위 배정 환자 대상, 12주)에서 니텐다닙과 피르페니돈의 병용 치료를 조사했습니다. 일차 평가변수는 기준선부터 12주까지 위장계 이상 반응을 보인 환자의 비율이었습니다. 위장계 이상 반응은 각 성분의 확립된 안전성 프로필과 일치했으며, 니텐다닙에 피르페니돈을 추가 투여한 환자 37명(70%)에서 니텐다닙 단독 투여 환자 27명(53%)에 비해 더 많이 나타났습니다.
설사, 메스꺼움, 구토 및 복통(상복통, 복부 불편감 및 복통 포함)은 니텐다닙에 피르페니돈을 추가 투여한 환자 20명(38%)에서 니텐다닙 단독 투여 환자 16명(31%), 22명(42%)에서 6명(12%), 15명(28%)에서 6명(12%), 15명(28%)에서 7명(14%)에서 각각 더 많이 보고되었습니다. 니텐다닙 단독 투여(n=0)에 비해 니텐다닙과 병용하여 피르페니돈을 사용할 때 AST 또는 ALT 상승(정상 상한치의 3배 이상)을 보고한 피험자가 더 많았습니다(n=3(6%)) [경고 및 주의 사항(5.2, 5.3) 참조].
진행성 표현형을 가진 만성 섬유화 간질성 폐 질환
OFEV는 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환 환자 663명을 대상으로 한 3상 이중맹검 위약 대조 시험(연구 5)에서 연구되었습니다. 이 환자들은 OFEV 150mg 1일 2회(n=332) 또는 위약(n=331)을 최소 52주 동안 무작위 배정받았습니다. 52주 시점에 두 치료군 모두 환자의 중간 노출 기간은 12개월이었습니다. 피험자의 연령은 27세에서 87세(중간 연령 67세)였습니다. 환자의 대부분은 백인(74%) 또는 아시아인(25%)이었습니다. 환자의 대부분은 남성(54%)이었습니다.
OFEV 투여 환자에서 위약보다 더 많이 보고된 가장 흔한 중대한 이상 반응은 폐렴(4% 대 3%)이었습니다. OFEV 투여 환자의 3%와 위약 투여 환자의 5%에서 사망으로 이어진 이상 반응이 보고되었습니다. 사망으로 이어진 이상 반응에서 특정 패턴은 확인되지 않았습니다.
영구적인 용량 감소로 이어진 이상 반응은 OFEV 투여 환자의 33%와 위약 투여 환자의 4%에서 보고되었습니다. OFEV 투여 환자에서 영구적인 용량 감소로 이어진 가장 흔한 이상 반응은 설사(16%)였습니다.
투약 중단으로 이어진 이상 반응은 OFEV 투여 환자의 20%와 위약 투여 환자의 10%에서 보고되었습니다. OFEV 투여 환자에서 투약 중단으로 이어진 가장 흔한 이상 반응은 설사(6%)였습니다.
진행성 표현형을 가진 만성 섬유화 간질성 폐 질환 환자에서 OFEV로 치료한 경우 안전성 프로필은 IPF 환자에서 관찰된 프로필과 일치했습니다. 또한, 다음 이상 반응은 만성 진행성 섬유화 간질성 폐 질환에서 OFEV 투여 환자에서 위약보다 더 많이 보고되었습니다. 비인두염(13% 대 12%), 상기도 감염(7% 대 6%), 요로 감염(6% 대 4%), 피로(10% 대 6%), 요통(6% 대 5%).
전신성 경화증 관련 간질성 폐 질환
OFEV는 SSc-ILD 환자 576명을 대상으로 한 3상 무작위 배정 이중맹검 위약 대조 시험(연구 4)에서 연구되었습니다. 이 환자들은 OFEV 150mg 1일 2회(n=288) 또는 위약(n=288)을 최소 52주 동안 투여받았습니다. 개별 환자는 최대 100주 동안 치료를 받았습니다. OFEV 투여 환자의 중간 노출 기간은 15개월이었고, 위약 투여 환자의 중간 노출 기간은 16개월이었습니다. 피험자의 연령은 20세에서 79세(중간 연령 55세)였습니다. 환자의 대부분은 여성(75%)이었습니다. 환자의 대부분은 백인(67%), 아시아인(25%) 또는 흑인(6%)이었습니다. 기준선 시점에 환자의 49%는 미코페놀레이트로 안정적인 치료를 받고 있었습니다.
OFEV 투여 환자에서 위약보다 더 많이 보고된 가장 흔한 중대한 이상 반응은 간질성 폐 질환(니텐다닙 2.4% 대 위약 1.7%)과 폐렴(니텐다닙 2.8% 대 위약 0.3%)이었습니다. 52주 이내에 OFEV 투여 환자 5명(1.7%)과 위약 투여 환자 4명(1.4%)이 사망했습니다. 두 치료군 모두 사망으로 이어진 이상 반응에서 특정 패턴은 확인되지 않았습니다.
영구적인 용량 감소로 이어진 이상 반응은 OFEV 투여 환자의 34%와 위약 투여 환자의 4%에서 보고되었습니다. OFEV 투여 환자에서 영구적인 용량 감소로 이어진 가장 흔한 이상 반응은 설사(22%)였습니다.
투약 중단으로 이어진 이상 반응은 OFEV 투여 환자의 16%와 위약 투여 환자의 9%에서 보고되었습니다. OFEV 투여 환자에서 투약 중단으로 이어진 가장 흔한 이상 반응은 설사(7%), 메스꺼움(2%), 구토(1%), 복통(1%) 및 간질성 폐 질환(1%)이었습니다.
기준선 시점에 미코페놀레이트를 투여받은 환자와 투여받지 않은 환자에서 OFEV로 치료한 경우 안전성 프로필은 유사했습니다.
OFEV 투여 환자에서 발생 빈도가 5% 이상이고 위약보다 더 흔하게 나타난 가장 흔한 이상 반응은 표 2에 나와 있습니다.
| 이상 반응 | OFEV, 150mg n=288 |
위약 n=288 |
|---|---|---|
| a 복통, 상복통, 하복통 및 식도 통증 포함. | ||
| b Includes alanine aminotransferase increased, gamma-glutamyltransferase increased, aspartate aminotransferase increased, hepatic enzyme increased, blood alkaline phosphatase increased, transaminase increased, and hepatic function abnormal. | ||
| c Includes hypertension, blood pressure increased, and hypertensive crisis. | ||
| Diarrhea | 76% | 32% |
| Nausea | 32% | 14% |
| Vomiting | 25% | 10% |
| Skin ulcer | 18% | 17% |
| Abdominal paina | 18% | 11% |
| Liver enzyme elevationb | 13% | 3% |
| Weight decreased | 12% | 4% |
| Fatigue | 11% | 7% |
| Decreased appetite | 9% | 4% |
| Headache | 9% | 8% |
| Pyrexia | 6% | 5% |
| Back pain | 6% | 4% |
| Dizziness | 6% | 4% |
| Hypertensionc | 5% | 2% |
In addition, alopecia was reported in patients treated with OFEV, more than placebo (1.4% vs. 1.0%).
6.2 Postmarketing Experience
The following adverse reactions have been identified during postapproval use of OFEV. Because these reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to drug exposure.
Blood and Lymphatic System Disorders: Thrombocytopenia
Gastrointestinal Disorders: Pancreatitis
Hepatobiliary Disorders: Drug-induced liver injury
Nervous System Disorders: Posterior reversible encephalopathy syndrome
Renal and Urinary Disorders: Proteinuria
Skin and Subcutaneous Tissue Disorders: Pruritus, rash
Vascular Disorders: Non-serious and serious bleeding events, some of which were fatal
7 약물 상호작용
7.1 P-glycoprotein (P-gp) 및 CYP3A4 억제제 및 유도제
Nintedanib는 P-gp의 기질이며, 미미한 수준으로 CYP3A4의 기질입니다 [임상 약리학 (12.3) 참조]. P-gp 및 CYP3A4 억제제인 케토코나졸의 경구 용량과 병용 투여하면 nintedanib의 노출량이 60% 증가했습니다. OFEV와 함께 P-gp 및 CYP3A4 억제제(예: 에리스로마이신)를 병용하면 nintedanib의 노출량이 증가할 수 있습니다 [임상 약리학 (12.3) 참조]. 이러한 경우 환자는 OFEV의 내약성을 면밀히 모니터링해야 합니다. 부작용 관리에는 OFEV 치료 중단, 용량 감소 또는 치료 중단이 필요할 수 있습니다 [용법 및 용량 (2.4) 참조].
P-gp 및 CYP3A4 유도제인 리팜핀의 경구 용량과 병용 투여하면 nintedanib의 노출량이 50% 감소했습니다. OFEV와 함께 P-gp 및 CYP3A4 유도제(예: 카르바마제핀, 페니토인 및 세인트 존스 워트)를 병용하는 것은 이러한 약물이 nintedanib의 노출량을 감소시킬 수 있으므로 피해야 합니다 [임상 약리학 (12.3) 참조].
7.2 항응고제
Nintedanib는 VEGFR 억제제이며 출혈 위험을 증가시킬 수 있습니다. 완전 항응고제 치료를 받는 환자는 출혈을 면밀히 모니터링하고 필요에 따라 항응고제 치료를 조정해야 합니다 [경고 및 주의 사항 (5.6) 참조].
7.3 피르페니돈
nintedanib와 피르페니돈의 병용 치료에 대한 약동학적 효과를 평가하기 위해 수행된 다중 용량 연구에서 nintedanib와 피르페니돈의 병용 투여는 두 약물의 노출량을 변경하지 않았습니다 [임상 약리학 (12.3) 참조]. 따라서 nintedanib와 피르페니돈의 병용 투여 중에는 용량 조정이 필요하지 않습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과 및 작용 기전 [임상 약리학 (12.1) 참조]에 따르면, OFEV는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 임신 중 OFEV 사용에 대한 데이터는 없습니다. 기관 형성 과정 중에 임신한 랫트와 토끼에게 nintedanib를 투여한 동물 연구에서, nintedanib는 최대 권장 인체 용량의 (랫트의 경우) 미만 및 (토끼의 경우) 약 5배에서 배아-태아 사망 및 구조적 기형을 유발했습니다. [데이터 참조] 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
지정된 모집단에 대한 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 모집단에서 주요 선천적 기형의 추정 배경 위험은 2%에서 4%이며, 임상적으로 인지된 임신에서 유산은 15%에서 20%입니다.
데이터
동물 데이터
동물 생식 독성 연구에서, nintedanib는 성인의 최대 권장 인체 용량(MRHD)의 미만 및 약 5배에서 랫트와 토끼에서 배아-태아 사망 및 구조적 기형을 유발했습니다(성인의 경우, 랫트와 토끼에서 각각 2.5 및 15 mg/kg/day의 모체 경구 투여량에서 플라즈마 AUC 기준). 기형에는 혈관, 비뇨생식기 및 골격계의 기형이 포함되었습니다. 혈관 기형에는 주요 혈관의 결손 또는 추가가 포함되었습니다. 골격 기형에는 흉추, 요추 및 미골 척추(예: 반추골, 결손 또는 비대칭 골화), 갈비뼈(갈라짐 또는 융합) 및 흉골(융합, 분리 또는 일측 골화)의 기형이 포함되었습니다. 일부 태아에서 비뇨생식기계의 기관이 결손되었습니다. 토끼에서, 성인의 MRHD의 약 15배에서 태아의 성비에 유의미한 변화가 관찰되었습니다(성별 비율은 약 71%:29%)(모체 경구 투여량 60 mg/kg/day에서 AUC 기준). nintedanib는 암컷이 MRHD 미만에 노출되었을 때(모체 경구 투여량 10 mg/kg/day에서 AUC 기준) 출생 후 첫 4일 동안 랫트 새끼의 출생 후 생존율을 감소시켰습니다.
8.2 수유
위험 요약
모유 중 nintedanib의 존재, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다. nintedanib 및/또는 그 대사산물은 수유 랫트의 모유에 존재합니다. [데이터 참조] OFEV로 인한 모유 수유 아기의 심각한 부작용 가능성으로 인해, OFEV 치료 중에는 모유 수유를 권장하지 않는다는 것을 여성에게 알려야 합니다.
8.3 생식 능력이 있는 여성 및 남성
동물 연구 결과 및 작용 기전에 따르면, OFEV는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있으며, 생식 능력이 있는 여성의 생식력을 감소시킬 수 있습니다. [특정 모집단에서의 사용 (8.1), 임상 약리학 (12.1), 12.3) 및 비임상 독성학 (13.1) 참조] 환자에게 임신 예방 및 계획에 대해 상담해야 합니다.
임신 검사
OFEV 치료 전 및 치료 중 적절한 시기에 생식 능력이 있는 여성의 임신 여부를 확인해야 합니다. [투여량 및 투여 방법 (2.1), 경고 및 주의 사항 (5.4) 및 특정 모집단에서의 사용 (8.1) 참조]
피임
OFEV는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 생식 능력이 있는 여성에게 OFEV 치료를 받는 동안 임신을 피하도록 조언해야 합니다. 생식 능력이 있는 여성에게 OFEV의 마지막 투여 후 최소 3개월 동안 OFEV 치료 시작 시, 치료 중 및 치료 후 최소 3개월 동안 고효율 피임법을 사용하도록 조언해야 합니다. nintedanib는 SSc-ILD 환자에서 에티닐에스트라디올과 레보노르게스트렐을 함유한 경구 피임약의 노출을 변화시키지 않습니다. 그러나 구토 및/또는 설사 또는 약물 흡수가 감소될 수 있는 다른 상태와 같은 경구 호르몬 피임약의 효능은 손상될 수 있습니다. 이러한 상태를 경험하는 경구 호르몬 피임약을 복용하는 여성에게는 대체 고효율 피임법을 사용하도록 조언해야 합니다.
8.4 소아 사용
섬유화 간질성 폐 질환 치료를 위한 소아 환자에서 OFEV의 안전성 및 유효성은 확립되지 않았습니다. 섬유화 간질성 폐 질환이 있는 6세에서 17세 사이의 OFEV 치료를 받은 26명의 소아 환자를 대상으로 체중에 따라 OFEV를 투여한 무작위 배정, 이중 맹검, 위약 대조 연구에서 유효성이 입증되지 않았습니다.
8.5 노인에서의 사용
IPF에 대한 OFEV의 2상 및 3상 임상 연구(연구 1, 연구 2 및 연구 3)에 참여한 총 대상자 중 61%가 65세 이상이었고, 16%가 75세 이상이었습니다. 진행성 표현형을 가진 만성 섬유화성 ILD 임상 연구(연구 5)에서 61%가 65세 이상이었고, 19%가 75세 이상이었습니다. SSc-ILD(연구 4)에서 21.4%가 65세 이상이었고, 1.9%가 75세 이상이었습니다. 3상 연구에서 65세 이상 대상자와 젊은 대상자 간에 효과의 전반적인 차이가 관찰되지 않았으며, 65세 이상 또는 75세 이상 대상자와 젊은 대상자 간에 안전성의 전반적인 차이가 관찰되지 않았지만, 일부 노인의 민감성이 더 높을 가능성을 배제할 수 없습니다.
8.6 간 기능 장애
닌테다닙은 주로 담즙/대변 배설(90% 이상)을 통해 배설됩니다. 간 기능 장애 환자(Child Pugh A, Child Pugh B)에서 수행된 PK 연구에서 닌테다닙에 대한 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. 경증 간 기능 장애(Child Pugh A) 환자의 경우 OFEV 권장 용량은 1일 2회 100mg입니다 [용법 및 용량 (2.3) 참조]. 이러한 환자에서 이상 반응을 모니터링하고 이상 반응 관리를 위해 치료 중단 또는 중단을 고려하십시오 [용법 및 용량 (2.4) 참조]. 중등도(Child Pugh B) 및 중증(Child Pugh C) 간 기능 장애 환자에 대한 OFEV 치료는 권장되지 않습니다 [경고 및 주의 사항 (5.1) 참조].
8.7 신장 기능 장애
단일 투여 연구에 따르면 닌테다닙 총 투여량의 1% 미만이 신장을 통해 배설됩니다 [임상 약리학 (12.3) 참조]. 경증에서 중등도 신장 기능 장애 환자의 경우 초기 용량 조절이 필요하지 않습니다. 닌테다닙의 안전성, 효능 및 약동학은 중증 신장 기능 장애(CrCl 30mL/min 미만) 및 말기 신장 질환 환자에서 연구되지 않았습니다.
8.8 흡연자
흡연은 OFEV에 대한 노출 감소와 관련이 있었으며 [임상 약리학 (12.3) 참조], 이는 OFEV의 효능 프로필을 변경할 수 있습니다. 환자는 OFEV 치료 전에 금연을 권장하고 OFEV를 사용하는 동안 금연해야 합니다.
10 과다 복용
IPF 임상 시험에서 한 환자는 실수로 21일 동안 총 600mg을 매일 복용했습니다. 심각하지 않은 이상 반응(비인두염)이 발생했으며, 잘못된 복용 기간 동안 해결되었으며, 다른 보고된 사건은 발생하지 않았습니다. 과량 복용은 또한 최대 8일 동안 최대 600mg을 1일 2회 복용한 종양학 연구의 두 환자에게서 보고되었습니다. 보고된 이상 반응은 OFEV의 기존 안전성 프로필과 일치했습니다. 두 환자 모두 회복되었습니다. 과량 복용의 경우, 치료를 중단하고 적절한 일반적인 지지 치료를 시작하십시오.
11 설명
OFEV 캡슐은 키나아제 억제제인 닌테다닙을 함유하고 있습니다 [작용 기전 (12.1) 참조]. 닌테다닙은 에탄설포네이트 염(에실레이트)으로 제공되며, 화학명은 1H-인돌-6-카르복실산, 2,3-디하이드로-3-[[[4-[메틸[(4-메틸-1-피페라지닐)아세틸]아미노]페닐]아미노]페닐메틸렌]-2-옥소-,메틸 에스터, (3Z)-, 에탄설포네이트 (1:1)입니다.
구조식은 다음과 같습니다.
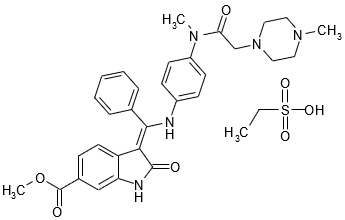
닌테다닙 에실레이트는 밝은 노란색 분말이며, 경험적 공식은 C31H33N5O4∙C2H6O3S이고 분자량은 649.76 g/mol입니다.
경구 투여용 OFEV 캡슐은 닌테다닙 100mg 또는 150mg(각각 닌테다닙 에탄설포네이트 120.40mg 또는 180.60mg에 해당)을 함유하는 2가지 용량으로 제공됩니다. OFEV의 비활성 성분은 다음과 같습니다. 충전재: 트리글리세라이드, 경화유, 레시틴. 캡슐 껍질: 젤라틴, 글리세롤, 이산화티타늄, 적색 산화철, 황색 산화철, 검은색 잉크.
12 임상약리학
12.1 작용 기전
Nintedanib는 여러 수용체 티로신 키나아제(RTK)와 비수용체 티로신 키나아제(nRTK)를 억제하는 저분자 물질입니다. Nintedanib는 혈소판 유래 성장 인자 수용체(PDGFR) α 및 β, 섬유아세포 성장 인자 수용체(FGFR) 1-3, 혈관 내피 성장 인자 수용체(VEGFR) 1-3, 콜로니 자극 인자 1 수용체(CSF1R) 및 Fms 유사 티로신 키나아제-3(FLT-3)와 같은 RTK를 억제합니다. FLT-3를 제외한 이러한 키나아제는 간질성 폐 질환(ILD)의 발병 기전에 관여하는 것으로 알려져 있습니다. Nintedanib는 이러한 키나아제의 아데노신 삼인산(ATP) 결합 포켓에 경쟁적으로 결합하여 ILD에서 섬유성 조직 리모델링의 발병 기전에 관여하는 것으로 입증된 세포 내 신호 전달 경로를 차단합니다. Nintedanib는 또한 Lck, Lyn 및 Src 키나아제와 같은 nRTK를 억제합니다. FLT-3 및 nRTK 억제가 ILD에서 nintedanib 효능에 미치는 영향은 알려져 있지 않습니다.
12.3 약동학
Nintedanib의 약동학적 특성은 건강한 지원자, IPF 환자, 진행성 표현형을 가진 만성 섬유화 ILD 환자, SSc-ILD 환자 및 암 환자에서 유사했습니다. Nintedanib의 약동학은 선형입니다. 용량 비례성은 증가하는 용량(1일 1회 50~450mg 및 1일 2회 150~300mg 용량 범위)에 따라 nintedanib 노출 증가로 나타났습니다. IPF 환자에서 다중 투여 시 AUC에 대한 축적은 1.76배였습니다. 정상 상태 혈장 농도는 투약 후 1주일 이내에 도달했습니다. Nintedanib 최저 농도는 1년 이상 안정적으로 유지되었습니다. Nintedanib 약동학의 개체 간 변동성은 중도에서 높았으며(표준 약동학적 매개변수의 변동 계수 30%~70% 범위), 개체 내 변동성은 낮거나 중간 정도였습니다(변동 계수 40% 미미만).
흡수
Nintedanib는 식후 연질 젤라틴 캡슐로 경구 투여 후 약 2~4시간 후에 최대 혈장 농도에 도달했습니다. 건강한 지원자에서 100mg 용량의 절대 생체이용률은 4.7%(90% CI: 3.62~6.08)였습니다. 흡수 및 생체이용률은 운반체 효과 및 상당한 초기 대사에 의해 감소합니다.
음식 섭취 후, nintedanib 노출은 공복 상태에서 투여했을 때보다 약 20% 증가했으며(90% CI: 95.3%~152.5%), 음식 종류에 관계없이 흡수가 지연되었습니다(공복 시 tmax 중앙값: 2.00시간; 식후: 3.98시간).
분포
Nintedanib는 2상 배출 동력학을 따릅니다. 정맥 주입 후, 총 체액량보다 큰 높은 분포량(Vss: 1050L)이 관찰되었습니다.
시험관 내에서 사람 혈장에서 nintedanib의 단백질 결합은 높았으며, 결합 분획은 97.8%였습니다. 혈청 알부민이 주요 결합 단백질로 간주됩니다. Nintedanib는 0.87의 혈액 대 혈장 비율로 혈장에 우선적으로 분포합니다.
제거
IPF 환자에서 nintedanib의 유효 반감기는 9.5시간(gCV 31.9%)이었습니다. 정맥 주입 후 총 혈장 청소율은 높았습니다(CL: 1390mL/분; gCV 28.8%). 48시간 이내에 변하지 않은 약물의 요 배설은 경구 투여 후 용량의 약 0.05%, 정맥 투여 후 용량의 약 1.4%였습니다. 신장 청소율은 20mL/분이었습니다.
대사
Nintedanib의 주요 대사 반응은 에스테라아제에 의한 가수 분해 절단으로 유리 산 모이어티 BIBF 1202가 생성됩니다. BIBF 1202는 이후 UGT 효소, 즉 UGT 1A1, UGT 1A7, UGT 1A8 및 UGT 1A10에 의해 글루쿠론산화되어 BIBF 1202 글루쿠로나이드가 됩니다. Nintedanib의 생체 변환은 CYP 경로가 소량만 차지했으며, CYP3A4가 관련된 주요 효소였습니다. 주요 CYP 의존성 대사산물은 사람 흡수, 분포, 대사 및 제거 연구에서 혈장에서 검출되지 않았습니다. 시험관 내에서 CYP 의존성 대사는 약 25%의 에스테르 절단에 비해 약 5%를 차지했습니다.
특정 집단
연령, 체중 및 성별
모집단 약동학 분석에 따르면 연령과 체중은 nintedanib 노출과 관련이 있었습니다. 그러나 노출에 대한 영향은 용량 조정을 보장할 만큼 충분하지 않습니다. 성별은 nintedanib 노출에 영향을 미치지 않았습니다.
신장애 환자
933명의 IPF 환자 데이터에 대한 모집단 PK 분석에 따르면, 경증 (CrCl: 60~90mL/min; n=399) 또는 중등도 (CrCl: 30~60mL/min; n=116) 신장애가 있는 환자에서 nintedanib의 노출에 영향을 미치지 않았습니다. 중증 신장애 (CrCl 30mL/min 미만) 환자에 대한 데이터는 제한적입니다.
간 장애 환자
OFEV의 단회 투여 1상 약동학 연구에서 경증 간 장애 (Child Pugh A) 환자 8명과 중등도 간 장애 (Child Pugh B) 환자 8명을 정상 간 기능 환자 17명과 비교했습니다. 경증 간 장애 환자에서 nintedanib의 평균 노출량은 Cmax를 기준으로 2.4배 높았고 (90% CI: 1.6~3.6), AUC0-inf를 기준으로 2.2배 높았습니다 (90% CI: 1.4~3.5). 중등도 간 장애 환자에서 노출량은 Cmax를 기준으로 6.9배 높았고 (90% CI: 4.4~11.0), AUC0-inf를 기준으로 7.6배 높았습니다 (90% CI: 5.1~11.3). 중증 간 장애 (Child Pugh C) 환자에 대한 연구는 진행되지 않았습니다.
약물 상호작용 연구
Nintedanib가 다른 약물에 미치는 영향
pirfenidone의 AUC 및 Cmax에 대한 nintedanib 병용 투여의 영향을 다중 투여 연구에서 평가했습니다. Nintedanib는 pirfenidone의 노출에 영향을 미치지 않았습니다.
SSc-ILD를 가진 여성 환자 15명에게 150mg nintedanib를 1일 2회 최소 10일 동안 투여하기 전과 후에 30mcg ethinylestradiol과 150mcg levonorgestrel의 병용 단회 투여를 받았습니다. Nintedanib 병용 투여는 ethinylestradiol 및 levonorgestrel의 노출을 변화시키지 않았습니다 [see Warnings and Precautions (5.4) and Use in Specific Populations (8.3)].
In vitro 연구에서 nintedanib는 OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 또는 MRP-2의 억제제가 아닌 것으로 나타났습니다. In vitro 연구에서 nintedanib는 OCT-1, BCRP 및 P-gp에 대한 약한 억제 가능성을 보였으며, 이러한 결과는 임상적 관련성이 낮은 것으로 간주됩니다. Nintedanib와 그 대사체인 BIBF 1202 및 BIBF 1202 glucuronide는 in vitro에서 CYP 효소를 억제하거나 유도하지 않았습니다.
다른 약물이 Nintedanib에 미치는 영향
Nintedanib는 P-gp의 기질이며, CYP3A4의 기질이기도 합니다. P-gp 및 CYP3A4 억제제인 ketoconazole과의 병용 투여는 전용 약물-약물 상호작용 연구에서 AUC를 기준으로 nintedanib 노출을 1.61배, Cmax를 기준으로 1.83배 증가시켰습니다. P-gp 및 CYP3A4 유도제인 rifampicin을 사용한 약물-약물 상호작용 연구에서 nintedanib의 노출은 rifampicin과 병용 투여 시 nintedanib 단독 투여에 비해 AUC를 기준으로 50.3%, Cmax를 기준으로 60.3% 감소했습니다.
nintedanib의 AUC 및 Cmax에 대한 pirfenidone 병용 투여의 영향을 다중 투여 약물-약물 상호작용 연구에서 평가했습니다. Pirfenidone은 nintedanib의 노출에 영향을 미치지 않았습니다. Nintedanib와 pirfenidone의 병용 치료는 또 다른 임상시험에서 조사되었는데, 이는 105명의 무작위 배정 환자를 대상으로 12주 동안 nintedanib 150mg 1일 2회 단독 투여와 비교하여 nintedanib 150mg 1일 2회에 pirfenidone 추가 투여 (801mg 1일 3회까지 증량)를 비교한 탐색적 공개 라벨, 무작위 배정 (1:1) 임상시험이었습니다. Nintedanib 단독 투여 환자와 nintedanib에 pirfenidone 추가 투여 환자를 비교했을 때 유사한 nintedanib 최저 혈장 농도가 관찰되었습니다.
건강한 지원자는 125mg bosentan을 1일 2회 정상 상태에서 다중 투여하기 전과 후에 150mg nintedanib를 단회 투여 받았습니다. Nintedanib와 bosentan의 병용 투여는 nintedanib의 약동학을 변화시키지 않았습니다.
Nintedanib는 pH 의존적 용해도 프로파일을 나타내며, 산성 pH 3 미만에서 용해도가 증가합니다. 그러나 임상시험에서 양성자 펌프 억제제 또는 히스타민 H2 길항제와의 병용 투여는 nintedanib의 노출 (최저 농도)에 영향을 미치지 않았습니다.
In vitro 연구에서 nintedanib는 OATP-1B1, OATP-1B3, OATP-2B1, OCT-2, MRP-2 또는 BCRP의 기질이 아닌 것으로 나타났습니다. In vitro 연구에서 nintedanib는 OCT-1의 기질인 것으로 나타났으며, 이러한 결과는 임상적 관련성이 낮은 것으로 간주됩니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
랫트와 마우스에서 닌테다닙의 2년 경구 발암성 연구에서 발암 가능성에 대한 증거는 발견되지 않았습니다. 닌테다닙은 랫트와 마우스에서 각각 최대 10mg/kg/일과 30mg/kg/일까지 투여되었습니다. 이러한 용량은 플라즈마 약물 AUC 기준으로 MRHD보다 낮았고 약 4배였습니다.
닌테다닙은 in vitro 박테리아 역돌연변이 분석, 마우스 림프종 세포 순방향 돌연변이 분석 및 in vivo 랫트 미세핵 분석에서 유전독성이 음성이었습니다.
랫트에서 닌테다닙은 MRHD의 약 3배(경구 용량 100mg/kg/일에서 AUC 기준) 노출 수준에서 암컷 생식력을 감소시켰습니다. 효과에는 흡수 증가 및 착상 후 손실 증가, 임신 지수 감소가 포함되었습니다. 랫트와 마우스에서 만성 독성 연구에서 난소의 황체 수와 크기의 변화가 관찰되었습니다. MRHD(경구 용량 20mg/kg/일에서 AUC 기준)와 거의 같은 노출 수준에서 흡수만 있는 암컷 수의 증가가 관찰되었습니다. 닌테다닙은 랫트에서 MRHD의 약 3배(경구 용량 100mg/kg/일에서 AUC 기준) 노출 수준에서 수컷 생식력에 영향을 미치지 않았습니다.
14 임상 연구
14.1 특발성 폐섬유증
OFEV의 임상적 효능은 1상 2상 연구(연구 1 [NCT00514683])와 2건의 3상 연구(연구 2 [NCT01335464] 및 연구 3 [NCT01335477])에서 IPF 환자 1231명을 대상으로 연구되었습니다. 이 연구들은 OFEV 150mg 1일 2회 투여와 위약을 52주 동안 비교하는 무작위, 이중맹검, 위약대조 연구였습니다.
연구 2와 연구 3은 설계가 동일했습니다. 연구 1은 설계가 매우 유사했습니다. 환자들은 3:2 비율(연구 1의 경우 1:1)로 OFEV 150mg 또는 위약을 52주 동안 1일 2회 무작위 배정되었습니다. 연구 1에는 추가로 논의되지 않은 다른 치료군(50mg 1일 1회, 50mg 1일 2회, 100mg 1일 2회)도 포함되었습니다. 1차 평가변수는 Forced Vital Capacity(FVC)의 연간 감소율이었습니다. 첫 번째 급성 IPF 악화까지의 시간은 연구 2와 연구 3의 주요 2차 평가변수였으며 연구 1의 2차 평가변수였습니다. 예측된 FVC 백분율의 기준치 대비 변화량과 생존율은 모든 연구에서 추가적인 2차 평가변수였습니다.
환자들은 5년 미만 동안 IPF(ATS/ERS/JRS/ALAT 기준) 진단을 받아야 했습니다. 진단은 방사선학적 그리고 해당되는 경우 조직병리학적 확인을 기반으로 중앙에서 판정되었습니다. 환자는 40세 이상이어야 하며 예측 FVC가 50% 이상이고 일산화탄소 확산능(DLCO, 헤모글로빈에 대해 보정됨)이 예측값의 30%~79%여야 했습니다. 관련 기도 폐쇄(즉, 기관지확장제 사용 전 FEV1/FVC가 0.7 미만)가 있거나 연구자의 의견으로는 연구 기간 동안 폐 이식을 받을 가능성이 있는 환자는 제외되었습니다(폐 이식 대기자 명단에 있는 것은 포함 기준에 부합했습니다). ALT, AST 또는 빌리루빈이 ULN의 1.5배 이상인 환자, 출혈 위험 또는 소인이 알려진 환자, 항응고 치료를 전량 투여받는 환자, 최근 심근경색 또는 뇌졸중 병력이 있는 환자는 연구에서 제외되었습니다. 또한 다른 연구용 치료제, 아자티오프린, 사이클로포스파미드 또는 사이클로스포린 A를 이 시험 참여 8주 이내에 투여받았거나 n-아세틸 시스테인과 프레드니손(15mg/일 이상 또는 동등량)을 2주 이내에 투여받은 환자도 제외되었습니다. 대부분의 환자는 백인(60%) 또는 아시아인(30%)이었고 남성(79%)이었습니다. 환자의 평균 연령은 67세였고 평균 예측 FVC 백분율은 80%였습니다.
FVC의 연간 감소율
성별, 키, 나이를 보정한 무작위 계수 회귀 모형을 기반으로 OFEV를 투여받은 환자에서 위약을 투여받은 환자에 비해 FVC(mL)의 연간 감소율이 통계적으로 유의하게 감소한 것으로 나타났습니다. FVC에 대한 치료 효과는 3건의 연구 모두에서 일관되었습니다. 개별 연구 결과는 표 3을 참조하십시오.
| 연구 1 | 연구 2 | 연구 3 | ||||
|---|---|---|---|---|---|---|
| OFEV 150 mg 1일 2회 |
위약 | OFEV 150 mg 1일 2회 |
위약 | OFEV 150 mg 1일 2회 |
위약 | |
| a연구 1의 무작위 배정 세트, 연구 2 및 연구 3의 치료 세트 b무작위 계수 회귀 모형을 기반으로 추정 |
||||||
| 분석된 환자 수 | 84 | 83 | 309 | 204 | 329 | 219 |
| 52주 동안의 감소율a | -60 | -191 | -115 | -240 | -114 | -207 |
| 위약 대비 비교 | ||||||
| 차이b | 131 | 125 | 94 | |||
| 95% CI | (27, 235) | (78, 173) | (45, 143) | |||
그림 1은 연구 2에서 두 치료군에 대한 기준선으로부터의 시간 경과에 따른 변화를 보여줍니다. 기준선으로부터 관찰된 평균 FVC 변화를 시간에 따라 플롯팅했을 때, 주 52까지의 모든 시점에서 곡선이 분기되었습니다. 연구 1 및 연구 3에서도 유사한 플롯이 관찰되었습니다.
그림 1 연구 2에서 기준선으로부터의 평균(SEM) 관찰된 FVC 변화(mL) 시간 경과에 따른
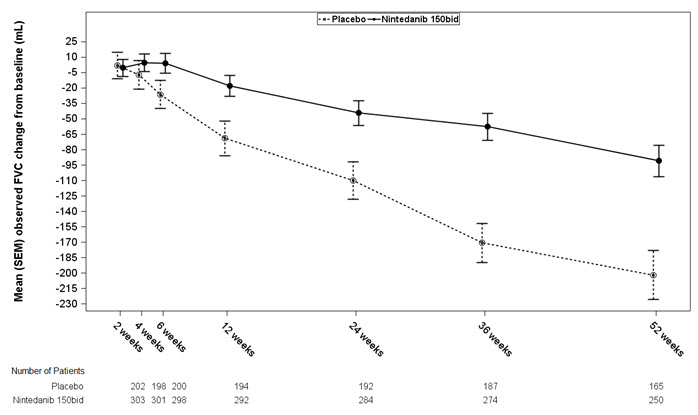
bid = 1일 2회
강제적 호기량 백분율의 기준선으로부터의 변화
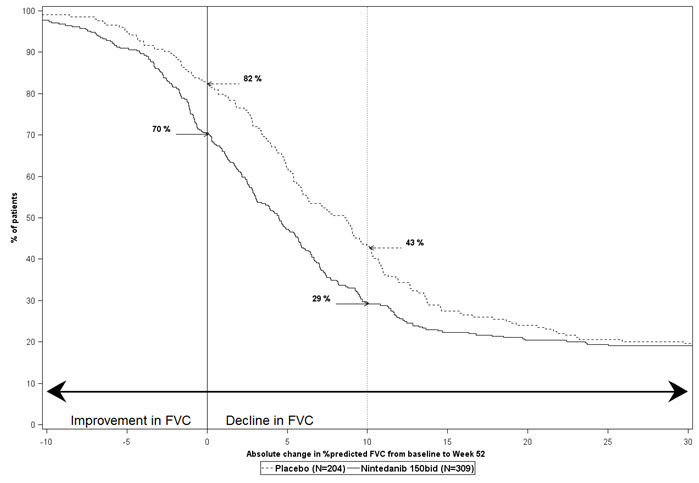
그림 2는 연구 2에서 주 52에 대한 FVC 백분율 예측에서 기준선으로부터의 변화에 대한 모든 컷오프에 대한 누적 분포를 제시합니다. 폐 기능의 모든 범주적 감소에 대해, OFEV를 사용한 환자의 감소 비율은 위약군보다 낮았습니다. 연구 3에서도 유사한 결과가 나타났습니다.
첫 번째 급성 IPF 악화까지의 시간
급성 IPF 악화는 30일 이내에 설명할 수 없는 호흡곤란 악화 또는 발생, 흉부 X선에서 새로운 미만성 폐 침윤, 및/또는 기흉이나 흉막삼출이 없는 새로운 고해상도 CT 실질 이상, 그리고 다른 원인의 배제로 정의되었습니다. 급성 IPF 악화는 연구 2와 연구 3에서 심사되었습니다. 연구 1(연구자 보고) 및 연구 3(심사)에서 52주 동안 첫 번째 급성 IPF 악화 위험은 위약에 비해 OFEV를 투여받은 환자에서 유의하게 감소했습니다(위험 비율[HR]: 0.16, 95% CI: 0.04, 0.71 및 (HR: 0.20, 95% CI: 0.07, 0.56). 연구 2(심사)에서는 치료군 간에 차이가 없었습니다(HR: 0.55, 95% CI: 0.20, 1.54).
생존
1차 평가변수(FVC)를 뒷받침하기 위한 탐색적 분석으로 연구 2와 연구 3에서 OFEV와 위약을 비교하여 생존을 평가했습니다. 사망 원인 및 환자가 치료를 계속했는지 여부에 관계없이 연구 기간 및 이용 가능한 추적 기간 동안 모든 원인으로 인한 사망률을 평가했습니다. 모든 원인으로 인한 사망률은 통계적으로 유의미한 차이를 보이지 않았습니다(그림 3 참조).
그림 3 생존 상태에서 모든 원인으로 인한 사망률의 Kaplan-Meier 추정치 – 연구 종료: 연구 2 및 연구 3
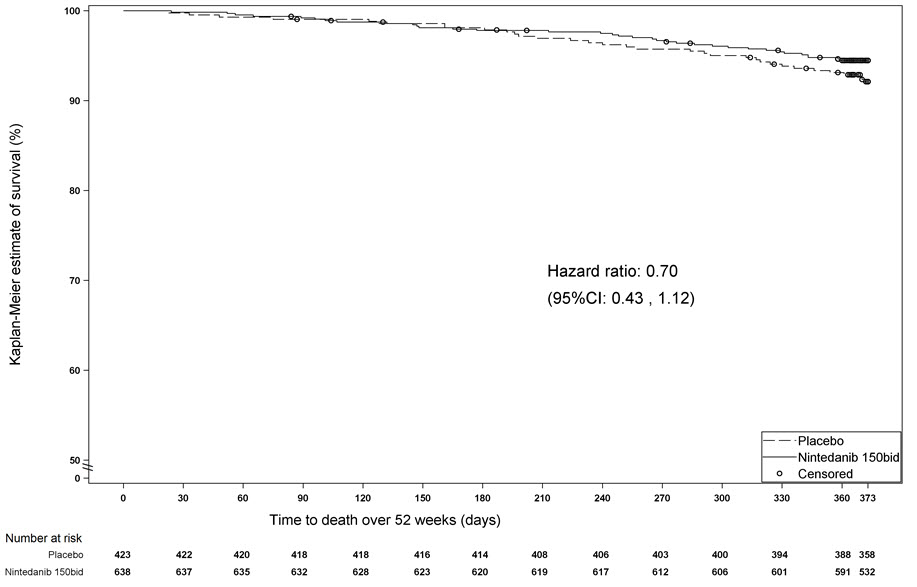
bid = 1일 2회
14.2 진행성 표현형을 가진 만성 섬유화 간질성 폐 질환
OFEV의 임상적 효능은 무작위, 이중맹검, 위약 대조 3상 시험(연구 5 [NCT02999178])에서 진행성 표현형을 가진 만성 섬유화 ILD 환자를 대상으로 연구되었습니다. 총 663명의 환자가 1:1 비율로 무작위 배정되어 최소 52주 동안 OFEV 150mg 1일 2회 또는 일치하는 위약을 투여받았습니다. 무작위 배정은 중앙 판독자가 평가한 고해상도 컴퓨터 단층촬영(HRCT) 섬유화 패턴을 기반으로 계층화되었습니다. UIP 유사 HRCT 패턴을 가진 환자 412명과 다른 HRCT 섬유화 패턴을 가진 환자 251명이 무작위 배정되었습니다. 이 시험의 분석을 위해 정의된 2개의 공동 1차 모집단이 있었습니다. 모든 환자(전체 모집단) 및 HRCT에서 UIP 유사 HRCT 섬유화 패턴을 가진 환자.
1차 평가변수는 52주 동안 FVC의 연간 감소율(mL)이었습니다. 다른 평가변수에는 첫 번째 급성 ILD 악화까지의 시간 및 사망까지의 시간이 포함되었습니다.
만성 섬유화 ILD의 임상적 진단을 받은 환자는 HRCT에서 관련 섬유화(섬유화 특징 10% 초과)가 있고 진행의 임상적 징후(스크리닝 전 24개월 동안 FVC 감소 ≥10%, FVC 감소 ≥5% 및 <10%와 증상 또는 영상 악화, 또는 증상 악화 및 영상 악화 모두로 정의됨)를 보이는 경우 선택되었습니다. 환자는 예측 FVC의 45% 이상 및 예측 DLCO의 30%~80% 미만을 가져야 했습니다. 환자는 연구자가 환자의 관련 ILD에 대해 임상적으로 적절하다고 판단한 관리에도 불구하고 진행된 상태여야 했습니다.
IPF, 관련 기도 폐쇄(즉, 기관지확장제 사용 전 FEV1/FVC 0.7 미만) 또는 유의미한 폐고혈압이 있는 환자는 시험에서 제외되었습니다. ALT, AST 또는 빌리루빈이 ULN의 1.5배를 초과하는 환자, 출혈 위험 또는 소인이 알려진 환자, 전량의 항응고 치료를 받는 환자, 그리고 최근 심근경색 또는 뇌졸중 병력이 있는 환자는 제외되었습니다. 또한 다른 시험용 치료제, 아자티오프린, 사이클로스포린, 마이코페놀레이트 모페틸, 타크로리무스, 경구 코르티코스테로이드 20mg/일 초과, 또는 무작위 배정 4주 이내에 경구 코르티코스테로이드 + 아자티오프린 + n-아세틸시스테인 병용, 무작위 배정 8주 전 사이클로포스파미드, 6개월 이내 리툭시맙, 또는 이전에 니intedanib 또는 피르페니돈 치료를 받은 환자도 제외되었습니다.
대부분의 환자는 백인(74%) 또는 아시아인(25%)이었습니다. 환자는 대부분 남성(54%)이었고 평균 연령은 66세였으며 평균 예측 FVC 백분율은 69%였으며 49%는 비흡연자였습니다. 시험에 참여한 그룹의 기저 임상 ILD 진단은 과민성 폐렴(26%), 자가면역 ILD(26%), 특발성 비특이성 간질성 폐렴(19%), 분류불가능 특발성 간질성 폐렴(17%) 및 기타 ILD(12%)였습니다.
FVC의 연간 감소율
위약을 투여받은 환자에 비해 OFEV를 투여받은 환자에서 52주 동안 FVC의 연간 감소율(mL)이 통계적으로 유의하게 감소했습니다. 52주 동안 FVC의 연간 감소율(mL)은 위약을 투여받은 환자에 비해 OFEV를 투여받은 환자에서 107mL 유의하게 감소했습니다. UIP 유사 섬유화 패턴을 가진 환자 및 다른 섬유화 패턴을 가진 환자(기타 HRCT) 하위 모집단의 결과는 표 4의 전체 모집단에 포함되어 있습니다.
| 전체 | UIP 유사 하위 모집단 | 기타 HRCT 하위 모집단 | ||||
|---|---|---|---|---|---|---|
| OFEV | 위약 | OFEV | 위약 | OFEV | 위약 | |
| a치료의 고정 범주 효과, HRCT 패턴, 시간의 고정 연속 효과, 기준선 FVC (mL) 및 시간별 치료 및 시간별 기준선 상호 작용을 포함하는 무작위 계수 회귀 모델을 기반으로 함 | ||||||
| 분석된 환자 수 | 331 | 331 | 206 | 206 | 125 | 125 |
| 52주 동안 조정된 연간 감소율 | -81 | -188 | -83 | -211 | -79 | -154 |
| 위약 대비 차이a | 107 | 128 | 75* | |||
| 95% CI | (65, 148) | (71, 186) | (16, 135)* | |||
| *기타 HRCT 하위 모집단을 기반으로 한 비교는 다중 검정 절차에 포함되지 않았습니다. 여기에 표시된 값은 설명을 위한 것입니다. | ||||||
ILD 진단별 사후 탐색 분석이 수행되었으며 그림 4에 나와 있습니다. ILD 진단 전반에 걸친 치료 반응은 FVC에 대해 일관되었습니다.
그림 4 연구 5에서 기저 ILD 진단에 따른 52주 동안의 FVC(mL) 연간 감 decline률*
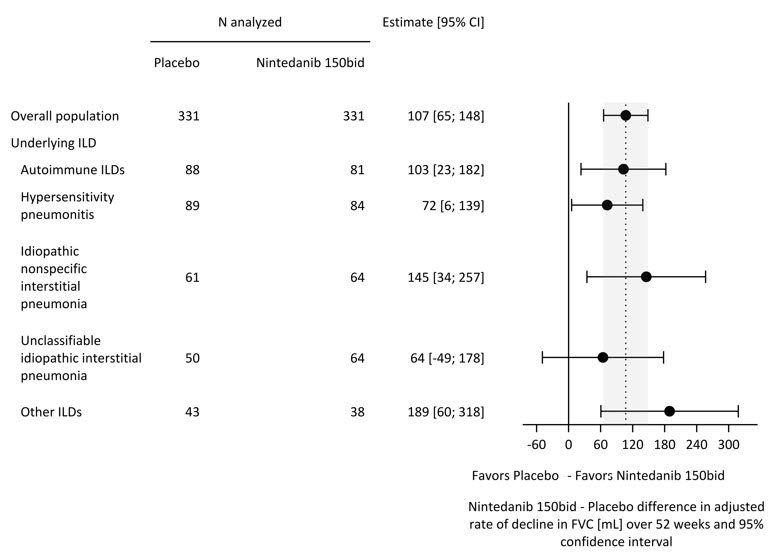
ILD = 간질성 폐 질환; 자가면역 ILD: 류마티스 관절염 관련 ILD, 혼합 결합 조직 질환, 전신 경화증 관련 ILD 및 기타 용어 포함; 기타 ILD: 자가면역 ILD, 과민성 폐렴, 특발성 비특이적 간질성 폐렴 또는 분류 불가능한 특발성 간질성 폐렴으로 분류되지 않은 섬유화 ILD 포함. 이 범주에서 가장 흔한 세 가지 ILD는 노출 관련 ILD, 사르코이드증 및 흉막-실질 섬유탄력증입니다.
*이 결과는 사후 탐색 분석에서 나온 것입니다. 여기에 표시된 값은 설명을 위한 것입니다.
그림 5는 치료 그룹에서 시간 경과에 따른 기준선에서 FVC의 변화를 보여줍니다. 기준선에서 관찰된 평균 FVC 변화를 시간 경과에 따라 표시했을 때, 곡선은 52주까지 모든 시점에서 분기되었습니다.
그림 5 연구 5에서 52주 동안 기준선(mL)에서 관찰된 평균(SEM) FVC 변화
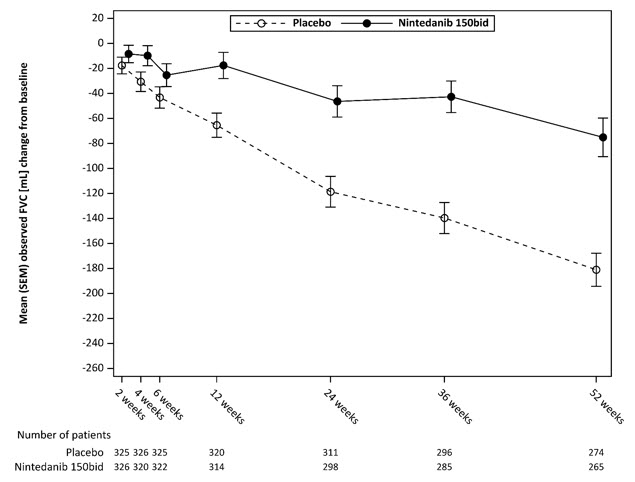
bid = 1일 2회
기준선에서 강제 폐활량의 백분율 변화
그림 6은 연구 5에서 52주차에 mL 단위로 FVC의 기준선 대비 백분율 변화를 나타냅니다. 대부분의 환자에서 폐 기능 감소는 위약보다 OFEV에서 더 적었습니다.
그림 6 5% 증가 또는 감소에 따른 기준선에서 52주차까지 FVC(mL)의 백분율 변화 히스토그램(연구 5)a
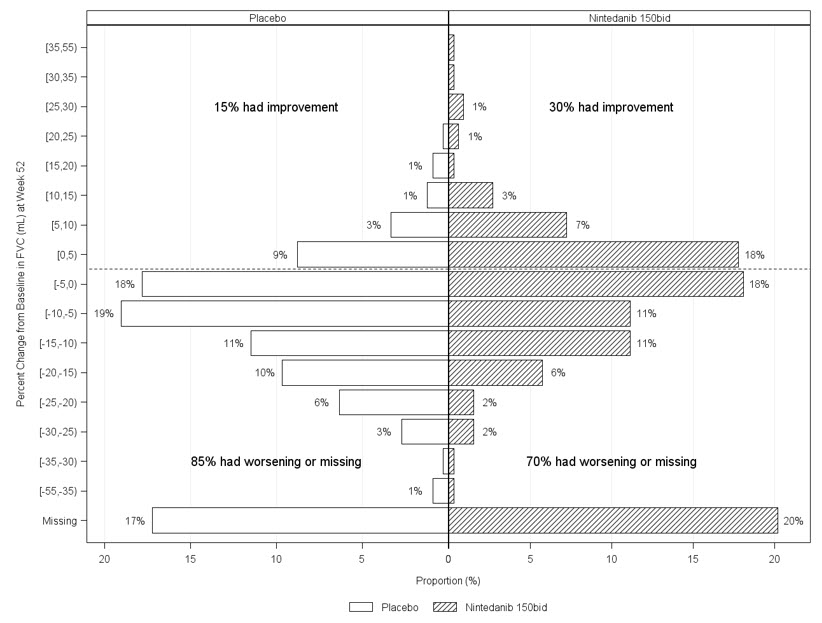
a 52주차에 FVC 데이터가 누락된 것으로 분류된 환자는 310일에서 373일 사이에 FVC 평가를 받지 않은 환자입니다.
bid = 1일 2회
첫 번째 급성 ILD 악화까지의 시간
급성 ILD 악화는 30일 이내에 설명할 수 없는 호흡곤란 악화 또는 발생, 흉부 X선에서 새로운 미만성 폐 침윤 및/또는 기흉이나 흉막 삼출이 없는 새로운 HRCT 실질 이상, 그리고 다른 원인의 배제로 정의되었습니다. 급성 ILD 악화는 심사되지 않았습니다.
첫 번째 급성 ILD 악화 위험은 위약과 비교하여 OFEV 그룹 간에 통계적으로 유의미한 차이를 보이지 않았습니다(52주 치료 기간: HR 0.72, (95% CI: 0.38, 1.37); 전체 시험: HR 0.63 (95% CI: 0.37, 1.07)).
14.3 전신 경화증 관련 간질성 폐 질환
닌테다닙의 임상 효능은 무작위, 이중맹검, 위약 대조 3상 시험(연구 4 [NCT02597933])에서 SSc-ILD 환자를 대상으로 연구되었습니다. 총 580명의 환자가 1:1 비율로 무작위 배정되어 OFEV 150mg을 1일 2회 또는 일치하는 위약을 최소 52주 동안 투여받았으며, 이 중 576명의 환자가 치료를 받았습니다. 무작위 배정은 항-토포이소머라제 항체(ATA) 상태에 따라 계층화되었습니다. 개별 환자는 최대 100주 동안 맹검 시험 치료를 받았습니다. 1차 평가변수는 52주 동안 FVC의 연간 감소율이었습니다. 52주차에 수정된 Rodnan 피부 점수(mRSS)의 기준선 대비 절대 변화는 주요 2차 평가변수였습니다. 전체 시험 기간 동안의 사망률은 추가 2차 평가변수였습니다.
환자는 7년 미만의 질병 발병(첫 번째 비 레이노 증상) 및 지난 12개월 이내에 실시된 흉부 고해상도 컴퓨터 단층촬영(HRCT) 스캔에서 10% 이상의 섬유증을 보이는 2013년 미국 류마티스 학회/유럽 류마티스퇴치연맹의 SSc 분류 기준에 따라 SSc-ILD로 진단되었습니다. 환자는 예측값의 40% 이상의 FVC와 예측값의 30-89%의 DLCO를 가져야 했습니다. 관련 기도 폐쇄(즉, 기관지확장제 사용 전 FEV1/FVC가 0.7 미만) 또는 이전 또는 계획된 조혈모세포 이식을 받은 환자는 시험에서 제외되었습니다. ALT, AST 또는 빌리루빈이 ULN의 1.5배를 초과하는 환자, 출혈 위험 또는 소인이 알려진 환자, 전량의 항응고 치료를 받는 환자, 그리고 최근 심근경색 또는 뇌졸중 병력이 있는 환자는 연구에서 제외되었습니다. 유의미한 폐동맥 고혈압, 3개 이상의 손가락 끝 궤양, 입원이 필요한 중증 손가락 괴사 병력 또는 경피증 신장 위기 병력이 있는 환자는 제외되었습니다. 또한 다른 연구용 치료제, 무작위 배정 전 8주 이내에 아자티오프린, 무작위 배정 전 6개월 이내에 시클로포스파미드 또는 시클로스포린 A를 투여받았거나 이전에 닌테다닙 또는 피르페니돈으로 치료받은 환자도 제외되었습니다.
대부분의 환자는 여성(75%)이었습니다. 환자는 대부분 백인(67%), 아시아인(25%) 또는 흑인(6%)이었습니다. 평균 연령은 54세였습니다. 전체적으로 환자의 52%는 미만성 피부 전신 경화증(SSc)을, 48%는 제한적 피부 SSc를 가지고 있었습니다. 레이노 증상이 처음 나타난 이후 평균 시간은 3.49년이었습니다. 기준선에서 환자의 49%는 마이코페놀레이트로 안정적인 치료를 받고 있었습니다.
FVC의 연간 감소율
52주 동안 FVC(mL)의 연간 감소율은 위약을 투여받은 환자에 비해 OFEV를 투여받은 환자에서 41mL만큼 유의하게 감소했으며, 이는 44%의 상대적 치료 효과에 해당합니다. 표 5를 참조하십시오.
| OFEV 150 mg 1일 2회 |
위약 | |
|---|---|---|
| a성별, 키, 나이, ATA 상태, 기준 FVC, 기준 FVC-시간별을 보정한 무작위 계수 회귀 모형 기반 | ||
| 분석된 환자 수 | 287 | 288 |
| 52주 동안 보정된 감소율 | -52 | -93 |
| 위약 대비 비교 | ||
| 차이a | 41 | |
| 95% CI | (3, 79) | |
그림 7은 두 치료군 모두에서 시간 경과에 따른 기준선으로부터의 변화를 보여줍니다. 기준선으로부터 관찰된 평균 FVC 변화를 시간 경과에 따라 표시했을 때, 곡선은 52주까지 모든 시점에서 분기되었습니다. 평균값의 분리는 치료 12주 후에 나타납니다.
그림 7 4상 연구에서 시간 경과에 따른 기준선으로부터의 평균(SEM) 관찰된 FVC 변화(mL)
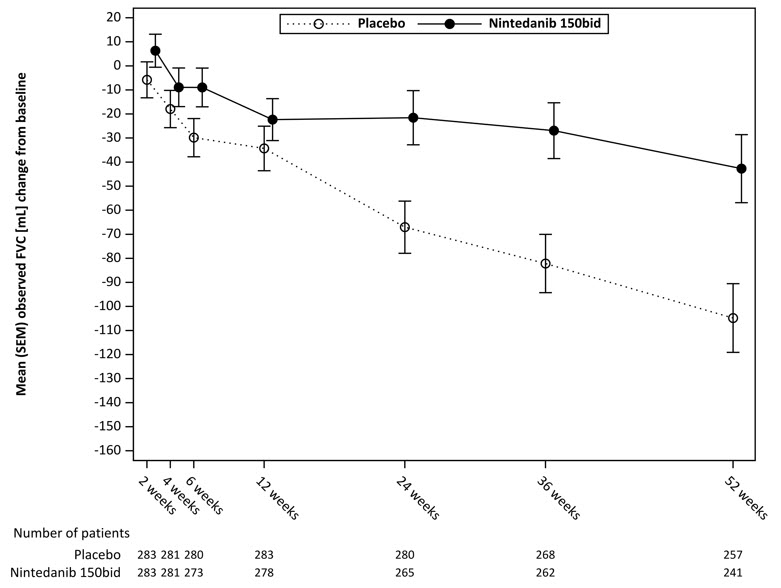
bid = 1일 2회
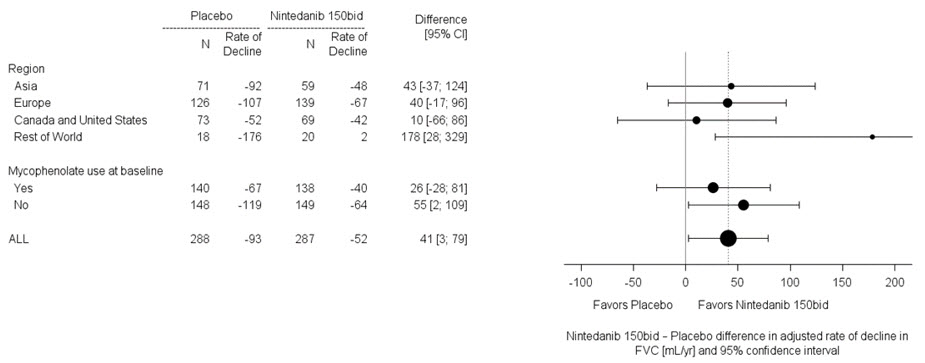
사전 지정된 두 가지 하위군 효능 분석에서 지역 및 마이코페놀레이트 사용에 따른 환자의 52주차 FVC 감소의 평균 치료 차이를 조사했습니다(그림 8).
그림 8 지역 및 마이코페놀레이트 사용에 따른 52주차 FVC(mL) 감소의 평균 치료 차이에 대한 하위군 분석(4상 연구)
강제 폐활량의 기준선 대비 백분율 변화
그림 9는 4상 연구에서 52주차 FVC(mL)의 기준선 대비 백분율 변화를 나타냅니다. 대다수의 환자에서 폐 기능 감소는 위약보다 OFEV에서 더 적었습니다.
16 제공/보관 및 취급 방법
150 mg: 갈색의 불투명한 직사각형 연질 캡슐로, Boehringer Ingelheim 회사 심볼과 “150”이 검은색으로 인쇄되어 있습니다. 아동 보호용 뚜껑이 있는 HDPE 병에 다음과 같이 포장되어 있습니다.
| 60정 병입 | NDC: 0597-0145-60 |
100 mg: 복숭아색의 불투명한 직사각형 연질 캡슐로, Boehringer Ingelheim 회사 심볼과 “100”이 검은색으로 인쇄되어 있습니다. 아동 보호용 뚜껑이 있는 HDPE 병에 다음과 같이 포장되어 있습니다.
| 60정 병입 | NDC: 0597-0143-60 |
보관
20°C ~ 25°C (68°F ~ 77°F)에 보관하십시오. 15°C ~ 30°C (59°F ~ 86°F)까지의 온도 변화는 허용됩니다 [USP Controlled Room Temperature 참조]. 높은 습도에 노출되지 않도록 하고 과도한 열을 피하십시오. 재포장하는 경우 USP 밀폐 용기를 사용하십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(환자 정보)을 읽도록 알려주십시오.
상승된 간 효소 및 약물 유발 간 손상
환자에게 정기적으로 간 기능 검사를 받아야 한다고 알려주십시오. 환자에게 간 문제의 증상(예: 피부 또는 눈의 흰자위가 노랗게 변함, 소변이 어둡거나 갈색(차색)으로 변함, 오른쪽 복부 통증, 평소보다 쉽게 출혈 또는 멍이 듦, 무기력, 식욕 부진)이 나타나면 즉시 보고하도록 알려주십시오. [경고 및 주의 사항 (5.2) 참조].
위장관 장애
환자에게 OFEV를 투여받은 환자에서 가장 흔하게 보고된 위장관 사건인 설사, 메스꺼움 및 구토와 같은 위장관 장애에 대해 알려주십시오. 환자에게 의료 서비스 제공자가 이러한 부작용을 치료하기 위해 수분 공급, 설사 치료제(예: 로페라미드) 또는 구토 방지제를 권장할 수 있다고 알려주십시오. 일시적인 용량 감소 또는 중단이 필요할 수 있습니다. 환자에게 설사의 첫 징후가 나타나거나 심하거나 지속적인 설사, 메스꺼움 또는 구토가 발생하면 의료 서비스 제공자에게 연락하도록 지시하십시오. [경고 및 주의 사항 (5.3) 및 부작용 (6.1) 참조].
태아-태아 독성
환자에게 임신 예방 및 계획에 대해 상담하십시오. 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알려주고 OFEV 치료를 받는 동안 임신을 피하도록 알려주십시오. 임신 가능성이 있는 여성에게 OFEV의 마지막 복용 후 최소 3개월 동안 OFEV 치료를 시작할 때, 치료 중 및 치료 후 최소 3개월 동안 고효율 피임법을 사용하도록 알려주십시오. 구토 및/또는 설사 또는 약물 흡수가 감소될 수 있는 다른 상태를 경험하는 경구 호르몬 피임약을 복용하는 여성에게는 고효율 피임법의 대안에 대해 논의하기 위해 의사에게 연락하도록 알려주십시오. 여성 환자에게 OFEV 치료 중 임신이 되었거나 임신했을 가능성이 있는 경우 의사에게 알리도록 알려주십시오. [경고 및 주의 사항 (5.4) 및 특정 인구에 대한 사용 (8.1, 8.3) 참조].
동맥 색전증
환자에게 급성 심근 허혈 및 기타 동맥 색전증의 징후와 증상 및 이러한 상태에 대한 즉각적인 의료 치료를 받아야 할 긴급성에 대해 알려주십시오. [경고 및 주의 사항 (5.5) 참조].
신증후군 범위 단백뇨
신증후군 범위 단백뇨가 보고되었습니다. 환자에게 단백뇨의 징후와 증상(예: 체액 저류, 거품뇨)을 보고하도록 알려주십시오. [경고 및 주의 사항 (5.8)].
투여
환자에게 OFEV를 음식과 함께 복용하고, OFEV 캡슐을 액체와 함께 통째로 삼키고, 쓴맛 때문에 캡슐을 씹지 말라고 지시하십시오. . 환자 또는 보호자에게 OFEV 캡슐을 열거나 부수지 말고, 캡슐 내용물과 접촉한 경우 즉시 손을 깨끗이 씻으라고 알려주십시오. 환자에게 놓친 복용량을 보충하지 말라고 알려주십시오. [용량 및 투여 (2.2) 참조].
SPL 미분류 섹션
판매원:
Boehringer Ingelheim Pharmaceuticals, Inc.
Ridgefield, CT 06877 USA
라이선스 제공:
Boehringer Ingelheim International GmbH
OFEV는 Boehringer Ingelheim International GmbH의 등록 상표이며 라이선스 하에 사용됩니다.
Copyright © 2024 Boehringer Ingelheim International GmbH
모든 권리 보유
COL9114IJ042024
SPL9116H
환자 안내문
| This Patient Information has been approved by the U.S. Food and Drug Administration. | Revised: October 2024 |
| 환자 정보 OFEV® (오페브) (nintedanib capsules, 닌테다닙 캡슐) |
|
OFEV에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
|
|
OFEV는 무엇입니까?
|
|
| OFEV를 복용하기 전에 의사에게 무엇을 알려야 합니까? OFEV를 복용하기 전에 다음을 포함한 모든 건강 상태에 대해 의사에게 알리십시오.
처방약과 일반 의약품, 비타민, 세인트존스워트와 같은 허브 보충제를 포함하여 복용하는 모든 약에 대해 의사에게 알리십시오. 복용하는 약 목록을 보관하고 새 약을 받을 때 의사와 약사에게 보여주십시오. |
|
OFEV는 어떻게 복용해야 합니까?
|
|
| OFEV의 가능한 부작용은 무엇입니까? OFEV는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
OFEV의 가장 흔한 부작용은 설사, 메스꺼움, 복통, 구토, 간 문제, 식욕 감소, 두통, 체중 감소 및 고혈압입니다. |
|
OFEV는 어떻게 보관해야 합니까?
OFEV와 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
| OFEV의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 전단지에 나열된 목적 이외의 목적으로 처방되는 경우가 있습니다. 처방되지 않은 질환에 OFEV를 사용하지 마십시오. 다른 사람에게 OFEV를 제공하지 마십시오. 증상이 같더라도 다른 사람에게 해를 끼칠 수 있습니다. 이 환자 정보 전단지는 OFEV에 대한 가장 중요한 정보를 요약한 것입니다. 자세한 내용은 의사와 상담하십시오. 의료 전문가를 위해 작성된 OFEV에 대한 정보는 약사 또는 의사에게 문의할 수 있습니다. 현재 처방 정보 및 환자 지원을 포함한 OFEV에 대한 자세한 내용은 www.ofev.com/support를 방문하거나 Boehringer Ingelheim Pharmaceuticals, Inc.에 1-800-542-6257로 전화하거나 코드를 스캔하여 www.ofev.com/support로 이동하십시오. |
|
|
|
|
| OFEV의 성분은 무엇입니까? 활성 성분: nintedanib 비활성 성분: 충전재: 트리글리세리드, 경질 지방, 레시틴. 캡슐 껍질: 젤라틴, 글리세롤, 이산화티타늄, 적색 산화철, 황색 산화철, 검은색 잉크 유통: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA 라이선스 제공: Boehringer Ingelheim International GmbH OFEV는 Boehringer Ingelheim International GmbH의 등록 상표이며 라이선스 하에 사용됩니다. Copyright © 2024 Boehringer Ingelheim International GmbH, 모든 권리 보유 COL9114IJ042024 |
|
주요 표시 패널 – 150mg 캡슐 병 포장
NDC 0597-0145-60
Ofev®
(nintedanib
capsules)
150 mg
Rx only
60 capsules
Boehringer
Ingelheim
주요 표시면 – 100mg 캡슐 병 포장
NDC 0597-0143-60
Ofev®
(nintedanib capsules)
100 mg
Rx only
60 capsules
Boehringer
Ingelheim