의약품 제조업체: Octapharma USA Inc (Updated: 2024-12-26)
처방 정보 하이라이트
NUWIQ®, 항혈우병인자 (재조합)
정맥 주사용 용액용 동결건조 분말
미국 최초 승인: 2015
적응증 및 용법
투여량 및 투여 방법
재구성 후 정맥 내 사용
•
각 NUWIQ 바이알에는 국제 단위(IU)로 표시된 실제 VIII 인자 역가가 표시되어 있습니다. (
2.1
)
•
청소년 및 성인의 경우 다음 공식을 사용하여 용량을 결정합니다. (
2.1
)
필요 IU = 체중 (kg) x 원하는 VIII 인자 상승 (%) (IU/dL) x 0.5 (IU/kg 당 IU/dL)
•
치료 용량 및 기간은 FVIII 결핍의 중증도, 출혈의 위치 및 정도, FVIII 수치 및 환자의 임상 상태에 따라 달라집니다. (
2.1
)
•
일상적 예방 요법의 용량: (
2.1
)
| 환자 | 용량 (IU/kg) | 주입 빈도 |
| 성인 및 12~17세 청소년 | 30~40 | 격일 |
| 2~11세 어린이 | 30~50 | 격일 또는 주 3회 |
| 2세 미만 어린이 | 20~50 | 주 1회~격일 |
제형 및 함량
NUWIQ는 명목상 250, 500, 1000, 1500, 2000, 2500, 3000 또는 4000 IU의 VIII 인자 역가를 함유하는 1회용 바이알에 들어있는 백색의 무균성, 비발열성 동결건조 분말로 제공됩니다. (
3
)
금기 사항
NUWIQ는 제품 또는 그 구성 성분에 대해 아나필락시스를 포함한 생명을 위협하는 과민 반응을 나타낸 환자에게는 금기입니다. (
4
)
경고 및 주의 사항
유해 반응
임상 시험에서 가장 흔하게 발생한 유해 반응 (≥5%)은 상기도 감염, 두통, 발열, 기침, 하기도 감염, 비염, 오한, 복통, 관절통, 빈혈 및 인두염이었습니다. (
6
)
의심되는 유해 반응을 보고하려면 Octapharma USA Inc.에 1-866-766-4860 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
특정 집단에서의 사용
소아 사용:
≤
12세 어린이의 경우 회복률이 낮고 반감기가 짧으며 청소율이 빠릅니다.
<
5세 소아 환자의 경우 예방적 치료를 위해 더 높은 용량 및/또는 더 빈번한 투여 일정을 고려해야 합니다. (
8.4
).
환자 상담 정보 및 FDA 승인 환자 라벨링은 17번을 참조하십시오.
개정: 2024년 12월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법 (INDICATIONS AND USAGE)
2 용량 및 투여 (DOSAGE AND ADMINISTRATION)
2.1 용량 (Dose)
2.2 준비 및 재구성 (Preparation and Reconstitution)
2.3 투여 (Administration)
3 제형 및 함량 (DOSAGE FORMS AND STRENGTHS)
4 금기 (CONTRAINDICATIONS)
5 경고 및 주의사항 (WARNINGS AND PRECAUTIONS)
5.1 과민 반응 (Hypersensitivity Reactions)
5.2 중화 항체 (Neutralizing Antibodies)
5.3 모니터링 및 실험실 검사 (Monitoring and Laboratory Tests)
6 이상반응 (ADVERSE REACTIONS)
6.1 임상 시험 경험 (Clinical Trials Experience)
6.2 면역원성 (Immunogenicity)
8 특정 집단에서의 사용 (USE IN SPECIFIC POPULATIONS)
8.1 임신 (Pregnancy)
8.2 수유 (Lactation)
8.4 소아에서의 사용 (Pediatric Use)
8.5 노인에서의 사용 (Geriatric Use)
11 설명 (DESCRIPTION)
12 임상 약리학 (CLINICAL PHARMACOLOGY)
12.1 작용 기전 (Mechanism of Action)
12.2 약력학 (Pharmacodynamics)
12.3 약동학 (Pharmacokinetics)
13 비임상 독성학 (NONCLINICAL TOXICOLOGY)
13.1 발암성, 돌연변이 유발성, 생식능력 장애 (Carcinogenesis, Mutagenesis, Impairment of Fertility)
13.2 동물 독성학 및/또는 약리학 (Animal Toxicology and/or Pharmacology)
14 임상 연구 (CLINICAL STUDIES)
16 공급/보관 및 취급 방법 (HOW SUPPLIED/STORAGE AND HANDLING)
17 환자 상담 정보 (PATIENT COUNSELING INFORMATION)
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
SPL 미분류 섹션
1 적응증 및 사용법
NUWIQ는 재조합 항혈우병인자 [혈액 응고 인자 VIII (Factor VIII)]로서, 다음과 같은 경우 소아 및 성인 혈우병 A 환자에게 사용됩니다.
- 출혈 발생의 필요에 따른 치료 및 조절
- 수술 중 출혈 관리
- 출혈 발생 빈도 감소를 위한 예방적 투여
NUWIQ는 폰 빌레브란트병 치료에는 적응증이 없습니다.
2 용법 및 투여
재구성 후 정맥 주사용
2.1 용량
- NUWIQ 바이알에는 국제단위(IU)로 표시된 실제 Factor VIII 효능이 표시되어 있습니다. Factor VIII 활성 1IU는 정상 인간 풀링 혈장 1mL에 있는 Factor VIII의 양으로 정의됩니다. 필요한 Factor VIII 용량의 계산은 체중 kg당 Factor VIII 1IU가 단일 단계 응고 분석을 사용하여 평가할 때 정상 활성의 약 2% 또는 2IU/dL만큼 혈장 Factor VIII 활성을 높인다는 경험적 발견에 기초합니다. 필요한 용량을 결정하려면 다음 공식을 사용하십시오.
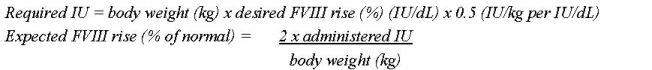
- 치료의 용량 및 기간은 Factor VIII 결핍의 중증도, 출혈의 위치 및 정도, FVIII 수치 및 환자의 임상 상태에 따라 달라집니다.
요청 시 치료 및 출혈 발생 조절
요청 시 치료 및 출혈 발생 조절을 위한 NUWIQ 투여에 대한 안내는
표 1
에 나와 있습니다. 선택된 투여 요법은 표에 명시된 혈장 수치(정상의 % 또는 IU/dL) 이상의 혈장 Factor VIII 활성 수치를 유지해야 합니다.
표 1: 출혈 발생 치료 및 조절을 위한 투여량
출혈 발생 유형 |
필요한 주입 후 Factor VIII 활성 피크 (정상의 % 또는 IU/dL) |
투여 빈도 (시간) |
치료 기간 (일) |
경미한: 표재성 근육 또는 연조직 및 구강 출혈 |
20–40 | 12-24 | 출혈 발생이 해결될 때까지 최소 1일. |
중등도~중증: 근육, 구강, 관절내 출혈, 알려진 외상 |
30–60 | 12-24 | 출혈 발생이 해결될 때까지 3~4일 이상. |
생명을 위협하는: 두개내, 복강내, 위장관 또는 흉강내 출혈, 중추 신경계 출혈, 인두 후강 또는 장골근막초 출혈, 눈/망막, 골절 또는 두부 외상 |
60–100 | 8-24 | 출혈 위험이 해결될 때까지. |
수술 전후 관리
수술 중 NUWIQ 투여(수술 전후 관리)에 대한 안내는
표 2
에 나와 있습니다. 투여는 표에 명시된 혈장 수치(정상의 % 또는 IU/dL) 이상의 혈장 Factor VIII 활성 수치를 유지하는 것을 목표로 해야 합니다.
표 2: 수술 전후 관리를 위한 투여량
수술 유형 |
필요한 주입 후 Factor VIII 활성 (정상의 % 또는 IU/dL) |
투여 빈도 (시간) |
치료 기간 (일) |
경미한 치아 발치 포함 |
30–60 (수술 전후) |
24 | 치유가 될 때까지 최소 1일. |
중증 두개내, 복강내 또는 관절 치환술 |
80–100 (수술 전후) |
8-24 | 적절한 상처 치유가 될 때까지, 그런 다음 Factor VIII 활성 30%~60%(IU/dL)를 유지하기 위해 최소 7일 동안 치료를 계속합니다. |
일상적 예방요법
출혈 빈도 감소를 위한 일상적 예방요법 시 NUWIQ 투여에 대한 지침은
표 3에 제시되어 있습니다. 정확한 용량은 환자의 임상 상태 및 반응에 따라 결정되어야 합니다.
표 3: 일상적 예방요법을 위한 용량
환자 |
용량 (IU/kg) |
주입 빈도 |
| 성인 및 12-17세 청소년 | 30-40 | 격일 |
| 2-11세 어린이 | 30-50 | 격일 또는 주 3회 |
| 2세 미만 어린이 | 20-50 | 주 1회~격일 |
치료 의사의 재량에 따라 투여 빈도를 더 자주 또는 덜 자주 하도록 요법을 개별적으로 조정할 수 있습니다.
2.2 조제 및 용해
NUWIQ 포장 내용물:
- NUWIQ 농축액 1회용 바이알
- 2.5mL 주사용 멸균수가 들어있는 프리필드 시린지
- 바이알 어댑터
- 버터플라이 니들
- 알코올 솜 두 개.
- 항상 깨끗한 표면에서 작업하고 시술 전에 손을 씻으십시오.
- NUWIQ 바이알과 프리필드 시린지를 실온에 두십시오.
- 고무 마개를 드러내도록 NUWIQ 바이알에서 플라스틱 플립탑 캡을 제거합니다. (그림 A).
- 알코올 솜으로 바이알 상단을 닦고 바이알의 고무 마개가 마르도록 합니다.
- 어댑터를 포장에서 제거하지 않고 어댑터 스파이크를 드러내도록 바이알 어댑터 포장에서 종이 덮개를 벗겨냅니다 (그림 B).
- 농축액 바이알을 평평한 표면에 놓고 고무 마개에 어댑터 스파이크를 삽입합니다. 완료되면 어댑터가 바이알에 고정됩니다 (그림 C).
- 프리필드 시린지 포장에서 종이 덮개를 벗겨냅니다. 플런저 로드의 나사산 끝을 용매 시린지에 부착하여 약간의 저항이 느껴질 때까지 시계 방향으로 돌립니다 (그림 D). 샤프트와의 접촉은 피하십시오.
- 캡의 천공을 꺾어 시린지에서 훼손 방지 플라스틱 팁을 부러뜨립니다. 캡 안쪽이나 시린지 팁을 만지지 마십시오 (그림 E).
- 어댑터 포장을 제거하고 저항이 느껴질 때까지 시계 방향으로 돌려 시린지를 바이알 어댑터에 연결합니다 (그림 F).
- 시린지의 모든 액체를 농축액 바이알에 천천히 주입합니다 (그림 G).
- 시린지를 제거하지 않고 몇 번 부드럽게 움직이거나 흔들어 바이알에 농축 분말을 용해시킵니다. 흔들지 마십시오. 모든 분말이 완전히 용해될 때까지 기다립니다.
- 입자의 최종 용액을 검사합니다. 용액은 투명하고 무색이며 눈에 보이는 입자가 없어야 합니다. 용액이 흐리거나 입자가 있는 경우 사용하지 마십시오.
- 바이알과 시린지를 거꾸로 뒤집습니다 (여전히 부착된 상태).
- 용액을 시린지에 천천히 흡입합니다. 모든 액체가 시린지로 옮겨졌는지 확인합니다 (그림 H).
- 시계 반대 방향으로 돌려 채워진 시린지를 바이알 어댑터에서 분리합니다.
재구성 후 용액을 냉장 보관하지 마십시오. 재구성 후 3시간 이내에 용액을 사용하십시오. 이 기간 내에 용액을 사용하지 않을 경우, 훼손 방지 플라스틱 팁으로 채워진 시린지를 닫고 버립니다.
2.3 투여
재구성 후 정맥 주사용으로만 사용
- 투여 전에 재구성된 NUWIQ 용액에 눈에 보이는 이물질이나 변색이 있는지 검사합니다. 이물질이나 변색이 관찰되는 경우 사용하지 마십시오.
- 다른 약물과 같은 튜브나 용기에 NUWIQ를 투여하지 마십시오.
- 알코올 솜으로 선택한 주사 부위를 깨끗이 합니다.
- 제공된 주입 세트를 시린지에 연결합니다. 주입 세트의 바늘을 선택한 정맥에 삽입합니다.
- 정맥 볼루스 주입을 실시합니다. 투여 속도는 환자의 편안함 수준에 따라 결정되어야 하며, 최대 분당 4mL입니다.
- NUWIQ를 주입한 후 주입 세트를 제거하고 적절히 버립니다. 주입 후, 팩터 농축액 바이알에서 배치 번호가 포함된 벗겨내는 라벨을 제거하고 기록을 위해 기록부에 보관합니다.
3 제형 및 함량
NUWIQ는 명목상 250, 500, 1000, 1500, 2000, 2500, 3000 또는 4000 IU Factor VIII 효능을 가진 1회 용량 바이알에 재구성하기 위한 백색의, 멸균된, 비발열성의, 동결건조 분말로 제공됩니다. 실제 Factor VIII 효능은 각 NUWIQ 바이알에 표시되어 있습니다.
4 금기 사항
NUWIQ는 제품 또는 그 구성성분에 대해 아나필락시스를 포함한 생명을 위협하는 과민반응을 나타낸 환자에게는 금기입니다.
5 경고 및 주의사항
5.1 과민반응
NUWIQ 투여 시 아나필락시스를 포함한 과민반응이 발생할 수 있습니다. 아나필락시스로 진행될 수 있는 과민반응의 초기 증상으로는 안면부종, 흉부 압박감, 호흡곤란, 천명, 두드러기 또는 가려움증이 포함될 수 있습니다. 과민반응이 발생하면 즉시 투여를 중단하고 적절한 치료를 시작하십시오.
5.2 중화항체
NUWIQ 투여 후 VIII 인자에 대한 중화항체(억제제)가 생성될 수 있습니다. 적절한 임상 관찰 및 실험실 검사를 통해 모든 환자에서 VIII 인자 억제제 발생 여부를 모니터링하십시오. 혈장 VIII 인자 수치가 예상대로 증가하지 않거나 NUWIQ 투여 후 출혈이 조절되지 않으면 억제제(중화항체)의 존재를 의심해야 합니다
[
경고 및 주의사항 (5.3)
참조]
.
5.3 모니터링 및 실험실 검사
-
적절한 VIII 인자 수치가 달성되고 유지되었는지 확인하기 위해 검증된 검사(예: 1단계 응고 분석)를 수행하여 혈장 VIII 인자 활성도를 모니터링하십시오
[
투여 방법 (2.1)
참조]
. - VIII 인자 억제제 발생 여부를 모니터링하십시오. 예상되는 VIII 인자 혈장 수치에 도달하지 않거나 예상되는 NUWIQ 용량으로 출혈이 조절되지 않는 경우 Bethesda 억제제 분석을 수행하십시오. 억제제 수치는 Bethesda 단위(BU)로 보고하십시오.
6 부작용 반응
임상 시험에서 보고된 가장 흔한 이상 반응(>5% 환자)은 상기도 감염, 두통, 발열, 기침, 하기도 감염, 비염, 오한, 복통, 관절통, 빈혈 및 인두염이었습니다.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되기 때문에, 약물의 임상 시험에서 관찰된 이상 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
NUWIQ의 안전성 프로파일은 이전에 치료받은 환자(PTPs – 청소년 및 성인의 경우 ≥150일 노출일(EDs), 12세 미만 환자의 경우 ≥50 EDs 동안 Factor VIII 함유 제품에 노출된 환자)에서 중증 A형 혈우병(Factor VIII ≤ 1%) 환자를 대상으로 한 7건의 전향적, 공개 표지 임상 연구에서 평가되었습니다. Factor VIII 억제제 병력이 있거나, 중증 간 질환 또는 신장 질환이 있거나, 면역 기능이 저하된(CD4+ 수 <200/µL) 환자 또는 면역 조절 약물을 투여받을 예정인 환자는 제외되었습니다.
모든 임상 연구에서 190명의 환자가 계층화되었으며, 그중 129명은 성인, 12세에서 17세 사이의 청소년은 3명, 2세에서 11세 사이의 소아 환자는 58명이었습니다. 총 182명(95.8%)의 환자가 최소 180일 동안 치료를 받았습니다. 환자들은 총 24,005 IU에서 212만 IU(555~34,713 IU/kg)를 14회에서 918회의 주입을 통해 14일에서 896일의 노출 기간 동안 투여받았습니다. 노출일은 적어도 한 번의 주입이 시작된 날로 정의되었습니다.
총 43,264회의 주입과 42,808 EDs에서 190명의 환자 중 5명 이상(2.6%)에서 보고된 이상 반응은 상기도 감염(22%), 두통(11%), 발열(10%), 기침(9.5%), 하기도 감염(8.4%), 비염(7.9%), 오한(6.8%), 복통(5.3%), 관절통(5.3%), 인두염(5.3%), 설사(4.7%), 수두(4.2%), 기기 관련 문제(4.2%), 요통(3.7%), 사지 통증(3.7%), 치통(3.2%), 구토(3.2%), 두부 손상(2.6%), 부상(2.6%), 발진(2.6%), 편도선염(2.6%) 및 치아 농양(2.6%)이었습니다. 특히, 어지러움은 4명(2.1%)의 환자에서 보고되었고; 호흡곤란, 불면증 및 권태감은 각각 2명(1.1%)의 환자에서 보고되었으며; 주사 부위 통증, 주사 부위 염증, 양성 신장 신생물, 신경 기능/행동 악화 및 실신은 각각 1명(0.5%)의 환자에서 보고되었습니다.
초기 등록 당시 2~12세인 59명의 소아 환자군만 고려하면, 그중 48명이 장기 연장 연구에 참여를 계속했으며, 총 1,019,528 IU/kg의 NUWIQ가 26,311회 주입되었습니다. 가장 흔하게 보고된 이상 반응(>10%의 59명 환자)은 상기도 감염(49%), 하기도 감염(24%), 기침(20%), 발열(20%), 비염(19%), 인두염(19%), 오한(15%), 수두(14%), 두통(12%), 복통(10%) 및 사지 통증(10%)이었습니다. 어지러움은 2명(3.4%)의 환자에서 보고되었고, 신경 기능/행동 악화, 불면증 및 실신은 각각 1명(1.7%)의 환자에서 보고되었습니다.
6.2 면역원성
모든 임상 시험 환자(N = 190)는 모든 연구에서 NUWIQ의 첫 번째 주입 전에 채취한 혈액 샘플을 사용하여 수정된 Bethesda 분석법으로 Factor VIII에 대한 중화 항체(억제제)를 모니터링했습니다. 5개 연구에서는 정해진 간격(ED 10~15, 3개월, 그리고 그 이후 3개월마다)으로, 1개 연구에서는 3개월마다, 그리고 모든 연구에서 종료 방문 시에 모니터링했습니다. Factor VIII에 대한 중화 항체가 발생한 환자는 없었습니다.
(수정된 Bethesda 분석법으로 측정했을 때 억제 활성이 없는) 비중화 항-Factor VIII 항체는 검사를 받은 135명의 환자 중 4명에서 보고되어 3%의 비율을 나타냈습니다. 4명 중 3명의 환자는 NUWIQ 노출 전에 기존의 비중화 항체를 가지고 있었습니다. 이 세 명 중 두 명의 환자에서 결합 항체는 일시적이었습니다. 선별 검사에서 음성으로 판정된 한 환자의 경우, 비중화 항체는 연구 종료 시 한 번 측정되었습니다.
이전에 치료받지 않은 환자 110명(연령 범위 0~146개월, FVIII 농축액 또는 FVIII 함유 기타 혈액 제제로 이전 치료를 받지 않음)을 등록한 임상 시험에서, NUWIQ 치료 후 108명의 환자에 대한 평가 가능한 데이터가 있었습니다. ED1 이후 적어도 한 번의 억제제 분석을 실시한 105명의 환자 중 28명(26.7%; 95% CI: 18.5-36.2)에서 연구의 주요 평가 지표인 억제제 형성이 나타났습니다. 17명의 환자(16.2%; 95% CI: 9.7-24.7)가 고역가 억제제를 생성했고, 11명(10.5%; 95% CI: 5.3-18)이 저역가 억제제를 생성했으며, 그중 5명은 일시적인 억제제를 생성했습니다. 억제제를 생성한 28명의 환자 중 25명은 검출 전에 ≤20 EDs를 가졌습니다. 모든 억제제는 34 ED 이내에 생성되었습니다.
항체 형성의 검출은 분석법의 민감도와 특이성에 크게 의존합니다. 또한, 분석법에서 관찰된 항체(중화 항체 포함) 양성의 발생률은 분석법, 샘플 취급, 샘플 채취 시기, 병용 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 NUWIQ에 대한 항체 발생률과 다른 제품에 대한 항체 발생률을 비교하는 것은 오해의 소지가 있을 수 있습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임산부에 대한 NUWIQ 사용에 대한 자료가 없어 약물 관련 위험을 알 수 없습니다. NUWIQ를 사용한 동물 생식 연구는 수행되지 않았습니다. 임산부에게 NUWIQ를 투여했을 때 태아에게 해를 끼칠 수 있는지 또는 생식 능력에 영향을 미칠 수 있는지 알 수 없습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 배경 위험은 각각 2-4% 및 15-20%로 추정됩니다.
8.2 수유
위험 요약
모유 내 NUWIQ의 존재 여부, 수유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 정보는 없습니다. 모유 수유의 발달적 및 건강상의 이점은 어머니의 NUWIQ에 대한 임상적 필요성과 NUWIQ 또는 기저 질환으로 인한 수유아에 대한 잠재적 유해 작용과 함께 고려해야 합니다.
8.4 소아 사용
NUWIQ의 안전성 및 유효성은 이전에 치료받은 소아 환자 59명(58명의 환자는 2~11세)에서 평가되었으며, 이들은 정기적 예방을 위해 NUWIQ를 최소 1회 이상 투여받았습니다. 정기적 예방 및 출혈 에피소드의 필요에 따른 치료에서의 안전성 및 유효성은 소아와 성인 간에 비슷합니다
[
유해 반응 (6.1)
및
임상 연구 (14)
참조]
. NUWIQ의 소아 약동학적 데이터는 2~5세 어린이 29명과 6~12세 어린이 30명에서 얻었습니다. 반감기 (T
1/2
) 및 증분
생체 내
회복률 (IVR)은 소아에서 성인보다 낮으며, 전신 약물 청소율은 2~5세 소아 연령대에서 성인에 비해 상당히 높습니다. 2세 미만 소아 환자의 IVR은 다른 모든 연령대보다 낮습니다
[
임상 약리학 (12.3)
참조]
. 5세 미만 소아 환자의 경우 예방적 치료를 위해 더 높은 용량 및/또는 더 빈번한 투약 일정을 고려해야 합니다.
NUWIQ의 안전성 및 유효성은 이전에 치료받지 않은 소아 환자(PUP, 연령 범위 0~146개월) 110명을 대상으로 한 연구에서 평가되었습니다. 110명의 PUP 중 108명은 평가 가능한 데이터를 가지고 있으며, NUWIQ의 면역원성을 확인하기 위해 조사되었습니다
[
유해 반응 (6.2)
참조]
(주요 평가 지표). 2차 평가 지표는 예방, 필요에 따른 치료 및 수술 예방 중 유효성, 안전성 및 내약성이었습니다
[
유해 반응 (6.1)
참조]
.
11 설명
NUWIQ (항혈우인자-재조합 키트)는 정맥 주사를 위한 무균성, 비발열성 동결건조 분말입니다. 이 제품은 250, 500, 1000, 1500, 2000, 2500, 3000 또는 4000 IU의 명목상 VIII 인자 역가를 포함하는 1회용 바이알로 제공됩니다. 2.5mL의 용매(주사용 무균수)로 재구성하면 각각의 명목상 농도는 100, 200, 400, 600, 800, 1000, 1200 또는 1600 IU/mL입니다. 재구성된 제품은 mL당 다음과 같은 첨가제를 포함합니다: 염화나트륨 18mg, 자당 5.4mg, L-아르기닌염산염 5.4mg, 염화칼슘이수화물 0.3mg, 폴록사머 188 1.2mg, 구연산나트륨이수화물 1.2mg. 모든 역가에 대해 각 첨가제의 농도는 동일합니다. NUWIQ에는 방부제가 포함되어 있지 않습니다. 각 NUWIQ 바이알에는 세계보건기구(WHO) VIII 인자 농축액 국제표준에 대해 교정된 기준 물질을 사용하는 단일 단계 응고 분석법을 사용하여 결정된 실제 VIII 인자 역가(IU)가 표시되어 있습니다. WHO 인간 VIII 인자 농축액 표준에 정의된 1IU는 약 1mL의 신선한 풀링된 정상 인간 혈장 내 VIII 인자 활성 수준과 거의 같습니다. NUWIQ의 평균 비활성은 8124 IU/mg 총 단백질입니다.
B-도메인 결손 재조합 응고 인자 VIII (BDD-rFVIII)는 NUWIQ의 활성 성분입니다. BDD-rFVIII은 약 170 kDa의 분자량을 가진 재조합 당단백질(이량체)로, VIII 인자 도메인 A1-A2(소위 중쇄, ~90 kDa)와 A3-C1-C2(소위 경쇄, ~80 kDa)로 구성되며, 전장 혈장 유래 VIII 인자에 존재하는 B-도메인은 삭제되었습니다. 정제된 단백질은 1440개의 아미노산으로 구성됩니다. 아미노산 서열은 인간 혈장 VIII 인자의 B-도메인 결손 형태(90 + 80 kDa)와 비슷합니다.
BDD-rFVIII은 유전자 변형 인간 배아 신장(HEK) 293F 세포에서 재조합 DNA 기술을 사용하여 생산되며, 제조 과정이나 최종 제품에 동물 또는 인간 유래 물질이 첨가되지 않습니다. NUWIQ는 인간 세포주를 사용하여 생산되므로 인간 혈장 유래 VIII 인자와 비슷한 번역 후 변형을 포함하며, 동물 세포에서 생산된 제품에 존재할 수 있는 Neu5Gc 또는 α-1,3-Gal 에피토프가 없습니다. 또한, BDD-rFVIII은 Tyr1680에서 완전히 설페이트화됩니다. 활성 물질은 일련의 크로마토그래피 단계를 통해 농축 및 정제되며, 여기에는 두 가지 전용 바이러스 제거 단계도 포함됩니다. 바이러스 불활성화를 위한 용매/세제(S/D) 처리 및 바이러스 제거를 위한 20nm 나노 여과.
12 약물동력학
12.2 약물역학
A형 혈우병은 활성 부분 트롬보플라스틴 시간(aPTT) 검사로 측정했을 때 기능성 응고 인자 VIII 결핍으로 인해 혈장 응고 시간이 길어지는 것을 특징으로 하는 출혈 장애입니다. NUWIQ 치료는 유효 투여 기간 동안 aPTT를 정상화합니다.
12.3 약물동력학
NUWIQ의 약물동력학(PK)은 이전에 치료받은 환자(PTP)인 중증 A형 혈우병 환자 22명(성인 20명, 청소년 2명)을 대상으로 한 개방표지, 다기관 임상 연구에서 평가되었습니다. PK 매개변수(
표 4
)는 50 IU/kg 단회 정맥 주입 후 단일 단계 응고 분석으로 측정한 혈장 인자 VIII 활성을 기준으로 했습니다.
6개월간 반복 투여 후 얻은 PK 프로파일은 첫 번째 투여 후 얻은 PK 프로파일과 비슷했습니다.
표 4: 22명의 PTP 성인/청소년에서 NUWIQ의 약물동력학적 매개변수 (용량: 50 IU/kg)
PK 매개변수 |
평균 ± 표준편차 |
| AUC (h·IU/mL) | 18.0 ± 5.6 |
|
AUC norm (h·IU/mL/(IU/kg)) |
0.4 ± 0.1 |
|
C maxnorm (IU/mL/(IU/kg)) |
0.022 ± 0.003 |
|
T 1/2 (h) |
17.1 ± 11.2* |
| IVR (%/IU/kg) | 2.1 ± 0.3 |
| MRT (h) | 22.5 ± 14.2 |
| CL (mL/h/kg) | 3.0 ± 1.0 |
|
V ss (mL/kg) |
59.8 ± 19.8 |
AUC = 곡선하면적 (Factor VIII:C); AUCnorm = AUC/투여량; Cmaxnorm = 최대 혈장 농도/투여량; CL = 청소율; Factor VIII:C = Factor VIII 응고 활성; IVR = 증가된 생체내 회복률; MRT = 평균 체류 시간; PK = 약물동력학; SD = 표준편차; T1/2 = 최종 반감기; Vss = 정상 상태 분포 용적; *중앙값, 하위/상위 사분위수: 13.7, 12.0/17.5
소아 약물동력학
소아 환자의 PK는 2~5세 및 6~12세 연령대에 대해 표 5에 제시되어 있습니다. 이는 단일 정맥 주사 50 IU/kg 용량 투여 후 단일 단계 응고 분석으로 측정된 혈장 Factor VIII 활성을 기반으로 합니다. 성인 및 청소년과 비교하여 2~5세 어린이의 IVR 및 T
1/2
는 더 낮았고 전신 약물 청소율(체중 kg당)은 상당히 높았습니다.
예방적 치료 3개월 및 6개월 후 IVR 분석 결과는 첫 번째 용량 투여 후 IVR과 유사한 결과를 나타냈습니다.
성인 집단과 마찬가지로 크로모젠 분석 및 단일 단계 분석을 사용하여 유사한 PK 값을 얻었습니다.
표 5
의 값은 단일 단계 분석을 사용하여 얻은 값을 반영합니다.
표 5: 2~5세 및 6~12세 소아 26명의 NUWIQ 약물동력학적 매개변수 (용량: 50 IU/kg)
PK 매개변수 |
2~5세 (N = 13) 평균 ± SD |
6~12세 (N = 13) 평균 ± SD |
| AUC (h·IU/mL) | 10.1 ± 4.6 | 11.8 ± 2.7 |
|
AUC norm (h·IU/mL/(IU/kg)) |
0.2 ± 0.1 | 0.3 ± 0.1 |
|
C maxnorm (IU/mL/(IU/kg)) |
0.016 ± 0.002 | 0.017 ± 0.004 |
|
T 1/2 (h) |
11.9 ± 5.4 * |
13.1 ± 2.6 # |
| IVR (%/IU/kg) | 1.6 ± 0.2 | 1.6 ± 0.4 |
| MRT (h) | 15.1 ± 7.4 | 16.5 ± 2.9 |
| CL (mL/h/kg) | 5.4 ± 2.3 | 4.1 ± 0.9 |
|
V ss (mL/kg) |
68.3 ± 10.4 | 66.1 ± 16.0 |
AUC = 곡선하면적 (Factor VIII:C); AUC
norm
= AUC/투여량; C
maxnorm
= 최대 혈장 농도/투여량; CL = 청소율; Factor VIII:C = Factor VIII 응고 활성; IVR = 증가된 생체내 회복률; MRT = 평균 체류 시간; PK = 약물동력학; SD = 표준편차; T
1/2
= 최종 반감기; V
ss
= 정상 상태 분포 용적;
*
중앙값, 하위/상위 사분위수: 10.1, 9.4/13.7;
#
중앙값, 하위/상위 사분위수: 12.8, 11.2/15.9
39명의 2세 미만 영유아에서 회복률 측정을 위해 40 IU FVIII/kg 체중 용량을 투여했습니다. 2세 미만 어린이의 평균 IVR은 1.1 %/IU/kg으로 성인 및 청소년(IVR 2.1 %/IU/kg)과 2~11세 어린이(IVR 1.6 %/IU/kg)보다 낮았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
NUWIQ의 발암 가능성을 평가하기 위한 동물 대상 장기 연구 또는 NUWIQ의 유전독성 또는 생식능력에 대한 영향을 결정하기 위한 연구는 수행되지 않았습니다.
14 CLINICAL STUDIES
NUWIQ의 효능은 중증 A형 혈우병 환자(PTP)를 대상으로 한 3건의 다기관, 공개, 전향적 임상 시험에서 평가되었습니다. 일상적 예방요법의 경우, NUWIQ의 효능은 성인 환자(n = 32)를 대상으로 한 한 건의 다기관 연구와 소아 환자(n = 59)를 대상으로 한 한 건의 다기관 연구, 총 두 건의 다기관 연구에서 평가되었습니다. 출혈 발생 치료의 경우, 효능은 필요에 따라 치료받은 청소년(n = 2) 및 성인(n = 20)을 대상으로 한 한 건의 다기관 연구와 두 예방 연구에서 돌발 출혈 발생 환자를 대상으로 평가되었습니다. 모든 연구에서 수술 절차를 받은 환자에 대해 수술 전후 관리 중 지혈 효능을 평가했습니다.
필요에 따른 치료 및 출혈 발생 조절
총 69명의 환자(성인 35명, 청소년 2명, 소아 32명)에서 총 1124건의 출혈 발생이 NUWIQ로 치료되었습니다. 각 치료에 대한 반응은 환자가 우수(단일 주입 후 약 8시간 이내에 급격한 통증 완화 및/또는 출혈의 객관적인 징후의 명확한 개선), 양호(주입 후 약 8~12시간 이내에 확실한 통증 완화 및/또는 출혈 징후의 개선, 완전한 회복을 위해 최대 2회의 주입 필요), 중간(최초 주입 후 약 12시간 이내에 가능성이 있거나 약간의 유익한 효과, 완전한 회복을 위해 2회 이상의 주입 필요), 또는 없음(12시간 이내에 개선 없음 또는 증상 악화, 완전한 회복을 위해 2회 이상의 주입 필요)의 서열척도를 사용하여 평가했습니다.
치료된 출혈 발생의 대부분(n = 986)은 환자가 필요에 따라서만 치료를 받은 연구에서 나온 것입니다. 642건(65%)의 출혈 발생은 자발적으로 발생했고, 341건(35%)은 외상성이었으며, 3건(0.3%)의 출혈 발생은 다른 원인 때문이었습니다. 출혈 발생 치료에 사용된 평균 주입 용량은 32 IU/kg이었습니다. NUWIQ 치료에 대한 지혈 효능은 출혈의 94%에서 우수 또는 양호로 평가되었고, 6%에서 중간으로 평가되었습니다.
돌발 출혈 발생의 경우, 출혈 발생 치료에 사용된 평균 주입 용량은 성인의 경우 33.3 IU/kg(30건의 출혈 발생이 있는 15명의 환자)이었고, 소아 환자의 경우 45 IU/kg(108건의 출혈 발생이 있는 32명의 환자)이었습니다. 출혈 발생 치료에 필요한 중앙값 주입 횟수는 1회였습니다. 지혈 효능은 성인의 경우 출혈의 100%에서 우수 또는 양호했고, 소아 환자의 경우 출혈의 82%에서 우수 또는 양호했습니다.
수술 중 출혈 관리
모든 연구에서 수술 예방 목적 NUWIQ의 효능은 총 36명의 환자에서 60건의 수술 절차에서 평가되었습니다. 16명의 환자에서 32건의 절차는 경미한 것으로 분류되었고, 23명의 환자에서 28건의 절차는 중대한 것으로 분류되었습니다. NUWIQ 수술 전 투여량은 주입 당 33 IU/kg에서 90 IU/kg까지 다양했습니다. 투여된 총 주입 횟수는 경미한 절차의 경우 1회에서 19회까지, 중대한 절차의 경우 3회에서 76회까지 다양했습니다. 3건의 절차는 수술 중 NUWIQ 주사가 필요했습니다.
수술 예방의 효능은 수술 전후 평가를 모두 고려하여 외과의와 혈액학자에 의해 각 경우에 대해 평가되었습니다. 지혈 효능은 수술 종료 시 외과의에 의해, 그리고 수술 후에는 외과의와 혈액학자에 의해 다음과 같은 서열척도를 사용하여 평가되었습니다.
- 우수: 수술 중: 정상 지혈 기능을 가진 환자에서 시행된 절차 유형에 대한 평균 예상 출혈량 이하의 수술 중 출혈량; 수술 후: 수술 합병증으로 인한 것이 아닌 수술 후 출혈이나 삼출이 없음. 모든 수술 후 출혈(수술 합병증으로 인한)은 절차 유형에 예상되는 대로 NUWIQ로 조절됨.
- 양호: 수술 중: 수술 중 출혈량이 평균 예상 출혈량보다 높았지만 정상 지혈 기능을 가진 환자에서 시행된 절차 유형에 대한 최대 예상 출혈량 이하였음; 수술 후: 수술 합병증으로 인한 것이 아닌 수술 후 출혈이나 삼출이 없음. 수술 합병증으로 인한 수술 후 출혈 조절에는 절차 유형에 대해 원래 예상되지 않았던 NUWIQ의 증량 또는 추가 주입이 필요함.
- 중간: 수술 중: 수술 중 출혈량이 정상 지혈 기능을 가진 환자에서 시행된 절차 유형에 대한 최대 예상 출혈량보다 높았지만 지혈이 조절됨. 수술 후: 수술 합병증으로 인한 것이 아닌 일부 수술 후 출혈 및 삼출; 수술 후 출혈 조절에는 절차 유형에 대해 원래 예상되지 않았던 NUWIQ의 증량 또는 추가 주입이 필요함.
- 없음: 수술 중: 지혈이 조절되지 않아 응고 인자 대체 요법 변경이 필요함. 수술 후: 광범위하고 조절되지 않은 수술 후 출혈 및 삼출. 수술 후 출혈 조절에는 대체 FVIII 농축액 사용이 필요함.
28건의 중대한 수술에 대한 효능은 23건(82%)에서 우수, 4건(14%)에서 양호, 1건(4%)에서 중간으로 평가되었습니다. 평가된 30건의 경미한 수술 모두의 효능은 우수했습니다.
일상적 예방 및 출혈 조절
32명의 성인 환자(백인 29명, 아시아인 3명)에서 NUWIQ의 일상적 예방 목적 효능 및 안전성을 평가한 연구에서, 이 제품은 최소 6개월 동안 30-40 IU/kg의 용량으로 하루 걸러 투여되었습니다. 2세에서 12세 사이의 59명의 소아 환자(모두 백인, 29명은 2세에서 5세, 30명은 6세에서 12세)에서 안전성, 면역원성 및 지혈 효능을 평가한 또 다른 연구에서, 환자들은 최소 6개월 동안 하루 걸러 또는 주 3회 예방적으로 NUWIQ를 투여받았습니다. 임상 결과는
표 6에 요약되어 있습니다.
| 성인 (N=32) | 소아 (N=59) | ||
| 평균 용량(± 표준 편차) | 32.8 ± 2.8 IU/kg | 38.9 ± 7.2 IU/kg |
| 출혈 발생이 0건인 환자 | 16 (50.0%) | 20 (33.9%) |
| 출혈 발생이 1건인 환자 | 11 (34.4%) | 14 (23.7%) |
| 출혈 발생이 2건인 환자 | – | 3 (5.1%) |
| 출혈 발생이 3건 이상인 환자 | – | 22 (37.3%) |
| 출혈 발생이 5건 이상인 환자 | 5 (15.6%) | |
| 연간 출혈율 (환자당) – 자발적 출혈 | 1.16 ± 2.57 (중앙값 0, 범위 0-8.6) | 1.50 ± 3.32 (중앙값 0, 범위 0-13.8) |
| 모든 유형의 출혈에 대한 연간 출혈율 (환자당) | 2.28 ± 3.73 (중앙값 0.9, 범위 0-14.7) | 4.12 ± 5.22 (중앙값 1.90, 범위 0-20.7) |
| 다른 연구*에서 필요에 따른 치료와 비교한 연간 출혈율 감소 | 96% | 93% |
성인의 출혈 중증도 (%): 중증 16 (36.4%), 경증 – 28 (63.6%), 생명을 위협하는 수준 0. 소아의 출혈 중증도: 중등도 또는 중증 64 (42.6%), 경증 61 (56.5%), 불명 1 (0.9%), 생명을 위협하는 수준 0. * 음의 이항 모델 기반.
이전에 치료받은 2~12세 소아 환자 59명을 대상으로 한 연구에서, 총 5746회의 주입이 이루어졌습니다. 이 중 5316회 (93%)는 예방 목적, 216회 (4%)는 출혈 발생 치료, 41회 (0.7%)는 수술 전후 관리, 173회 (3%)는 약동학(PK) 및 회복 평가를 위한 것이었습니다.
소아 연구의 연장 연구에서, 원래 소아 연구를 완료한 49명의 소아 (2~5세 [N=26] 및 6~12세 [N=23])가 추가로 평균 29.4개월 동안 총 20,518회의 NUWIQ 주입을 받았습니다. 두 연구를 통틀어 총 26,289회의 주입과 33,724,769 IU (990,927 IU/kg)가 투여되었습니다. 이 중 25,040회 (95.2%)는 예방 목적, 700회 (2.7%)는 출혈 발생 치료, 304회 (1.2%)는 수술 전후 관리, 247회 (0.9%)는 회복 평가, 189회 (0.7%)는 약동학 분석을 위한 것이었습니다. 예방적 주입 당 중앙값 용량은 37 IU/kg (범위 12.8-124 IU/kg)이었습니다.
평균 연간 출혈율은 3.5 ± 4.4 (중앙값 2.2, 범위 0.0 – 24.7)였습니다. 59명의 소아 중 8명 (14%)은 출혈이 없었습니다.
16 제공/보관 및 취급 방법
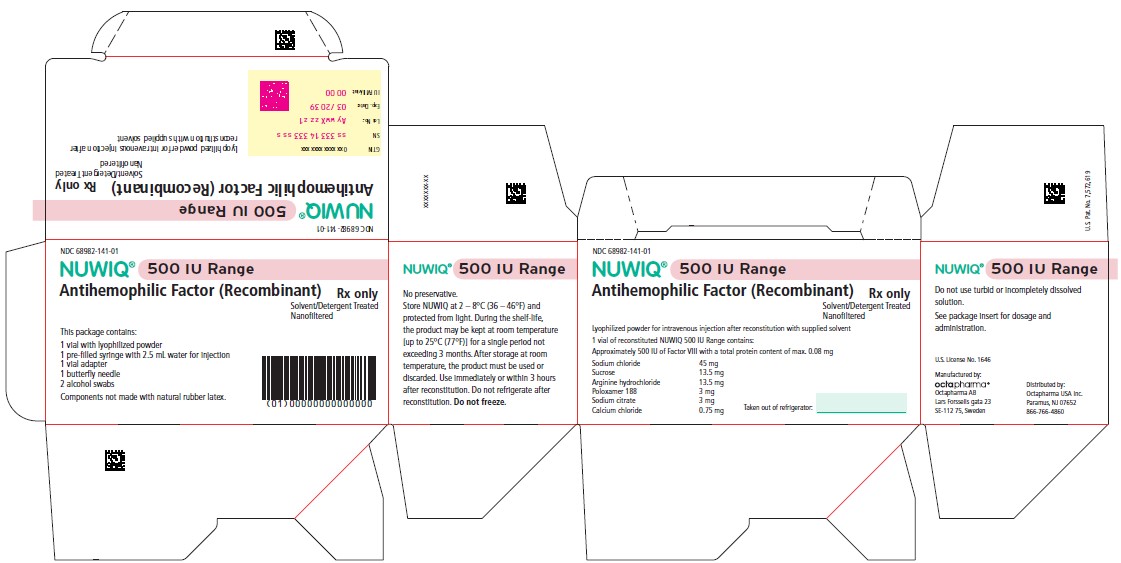
포장 단위
- NUWIQ는 약 250, 500, 1000, 2000, 2500, 3000 또는 4000 국제단위(IU)의 VIII 인자 효능을 함유한 1회용 바이알, 2.5mL 용매(주사용수)가 들어있는 프리필드 시린지, 바이알 어댑터, 버터플라이 니들 및 알코올 솜 두 개가 포함된 포장 단위로 공급됩니다. IU 단위의 NUWIQ 실제 함량은 각 카톤과 바이알에 명시되어 있습니다.
- NUWIQ 포장에 사용된 구성품은 천연 고무 라텍스로 만들어지지 않았습니다.
| 색상 | 명목상 함량 | 용기 NDC | 카톤 NDC |
| 연한 파란색 | NUWIQ 250 IU | 68982-140-01 | 68982-139-01 |
| 연한 분홍색 | NUWIQ 500 IU | 68982-142-01 | 68982-141-01 |
| 청록색 | NUWIQ 1000 IU | 68982-144-01 | 68982-143-01 |
| 보라색 | NUWIQ 1500 IU | 68982-154-01 | 68982-153-01 |
| 오렌지색 | NUWIQ 2000 IU | 68982-146-01 | 68982-145-01 |
| 갈색 | NUWIQ 2500 IU | 68982-148-01 | 68982-147-01 |
| 짙은 회색 | NUWIQ 3000 IU | 68982-150-01 | 68982-149-01 |
| 짙은 녹색 | NUWIQ 4000 IU | 68982-152-01 | 68982-151-01 |
보관 및 취급
- NUWIQ 바이알을 빛으로부터 보호하기 위해 원래 포장 상태로 보관하십시오.
- 분말 형태의 NUWIQ는 2~8°C(35~46°F)에서 최대 24개월 동안 보관하십시오. 동결하지 마십시오.
- 유효기간 동안 제품은 최대 3개월을 초과하지 않는 단일 기간 동안 실온[최대 25°C(77°F)]에서 보관할 수 있습니다. 실온 보관 후에는 제품을 냉장고에 다시 넣지 마십시오.
- 유효기간이 지난 후에는 사용하지 마십시오.
- 재구성된 용액은 실온에서 보관하십시오. 재구성 후에는 냉장하지 마십시오. 재구성 후 즉시 또는 3시간 이내에 사용하십시오. 남은 용액은 버리십시오.
17 환자 상담 정보
-
환자들에게 FDA 승인 환자용 라벨 (
환자 정보
및
사용법
)을 읽도록 알려주십시오. - NUWIQ를 사용하면 과민반응이 발생할 수 있으므로, 두드러기, 전신 두드러기, 가슴 답답함, 쌕쌕거림, 저혈압 및 아나필락시스를 포함한 과민반응의 초기 증상에 대해 환자에게 알려주십시오. 이러한 증상이 나타나면 주사를 중단하고 의사에게 연락하여 즉시 응급 치료를 받도록 환자에게 알려주십시오.
- 8인자 대체 요법에 대한 임상적 반응이 부족한 경우, 이는 억제제의 징후일 수 있으므로 환자에게 추가 치료 및/또는 평가를 위해 의사 또는 치료 센터에 연락하도록 알려주십시오.
- 여행 전에 의료 제공자와 상담하도록 환자에게 알려주십시오. 여행 중에는 현재 치료 요법에 따라 충분한 양의 NUWIQ를 휴대하도록 환자에게 알려주십시오.
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646
판매원:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
환자 사용 설명서
FDA 승인 환자용 설명서
환자 정보
NUWIQ
/nu’ veek /
항혈우인자 (재조합)
NUWIQ를 사용하기 전과 재조제를 받을 때마다 새로운 정보가 있을 수 있으므로 이 환자 정보를 주의 깊게 읽어주십시오. 이 환자 정보는 의료 상태 또는 치료에 대해 의료 제공자와 상담하는 것을 대체할 수 없습니다.
NUWIQ
이란 무엇입니까?
NUWIQ는 A형 혈우병(선천성 응고인자 VIII 결핍) 성인 및 어린이의 출혈 치료 및 조절에 사용되는 주사제입니다. NUWIQ는 정기적으로 사용(예방)하는 경우 어린이와 성인의 출혈 횟수를 줄일 수 있습니다. 일반적으로 A형 혈우병 치료는 평생 지속됩니다.
수술을 받는 경우 의료 제공자가 NUWIQ를 투여할 수도 있습니다.
NUWIQ는 폰 빌레브란트병 치료에는 사용되지 않습니다.
누가 NUWIQ
를 사용해서는 안 됩니까?
과거에 NUWIQ에 알레르기 반응이 있었던 경우 NUWIQ를 사용해서는 안 됩니다.
임신 중이거나(또는 임신을 계획 중이거나) 수유 중인 경우 의료 제공자에게 알려주십시오. NUWIQ가 적합하지 않을 수 있기 때문입니다.
NUWIQ
를 사용하기 전에 의료 제공자에게 무엇을 알려야 합니까?
VIII 인자에 대한 억제제가 있다는 말을 들었는지 여부를 포함하여 가지고 있거나 가지고 있었던 모든 의학적 상태에 대해 의료 제공자와 상담하십시오. NUWIQ가 효과가 없을 수 있기 때문입니다.
처방전 없이 구입할 수 있는 의약품, 건강 보조 식품 및/또는 한약을 포함하여 복용하는 모든 처방약과 일반 의약품에 대해 의료 제공자에게 알려주십시오.
NUWIQ
는 어떻게 사용해야 합니까?
NUWIQ는 정맥 주입으로 투여됩니다. NUWIQ는 바이알에 분말 형태로 판매됩니다. 분말은 미리 채워진 주사기에 제공되는 무균수와 혼합됩니다. NUWIQ의 재구성 및 주사에 대한 지침을 참조하십시오.
의료 제공자는 가족 구성원의 도움을 받아 스스로 재구성 및 주입하는 방법을 지시합니다. 의료 제공자는 첫 번째 NUWIQ 투여를 직접 관찰할 수 있습니다.
치료가 최적으로 작용하도록 의료 제공자의 NUWIQ 주입 용량 및 일정에 대한 지침을 주의 깊게 따라야 합니다.
NUWIQ는 다양한 용량으로 제공됩니다. 바이알에 들어 있는 VIII 인자의 실제 국제 단위(IU) 수는 라벨과 상자에 인쇄되어 있습니다. 의료 제공자가 처방한 용량을 사용하고 있는지 확인하려면 항상 라벨에 인쇄된 VIII 인자의 실제 IU 수를 확인하십시오.
NUWIQ 사용 후에도 출혈이 조절되지 않으면 즉시 의료 제공자에게 연락하십시오.
여행 전에 의료 제공자와 상담하십시오. 이 기간 동안 치료에 필요한 충분한 NUWIQ를 준비하십시오.
의료 제공자와 상담하지 않고 NUWIQ 사용을 중단하지 마십시오.
NUWIQ
의 가능한 부작용은 무엇입니까?
NUWIQ를 사용하면 알레르기 반응이 발생할 수 있습니다. 어지러움, 의식 상실, 호흡 곤란, 천명음, 흉부 압박감, 입술과 혀의 부기, 발진 또는 두드러기와 같은 증상이 나타나면 즉시 주사를 중단하고 의료 제공자 또는 응급실에 즉시 전화하십시오.
신체는 VIII 인자에 대한 항체(억제제라고 함)를 생성할 수 있으며, 이는 NUWIQ가 제대로 작용하지 못하게 할 수 있습니다. 의료 제공자는 정기적으로 억제제를 확인하기 위해 혈액 검사를 할 수 있습니다.
NUWIQ와 관련하여 보고된 부작용으로는 주사 부위 염증, 주사 부위 통증, 따끔거림 또는 저림, 두통, 요통, 어지러움 및 구강 건조가 있습니다.
이것들은 NUWIQ의 모든 가능한 부작용이 아닙니다. 귀찮거나 사라지지 않는 부작용에 대해서는 의료 제공자와 상담하십시오.
NUWIQ
는 어떻게 보관해야 합니까?
빛에 노출되지 않도록 NUWIQ를 원래 상자에 보관하십시오. NUWIQ를 동결하지 마십시오.
NUWIQ는 2-8°C(36-46°F)에서 최대 24개월 동안 냉장 보관할 수 있습니다. NUWIQ는 최대 25°C(77°F)의 실온에서 3개월을 초과하지 않는 단일 기간 동안 보관할 수 있습니다(냉장고에서 제품을 꺼낸 날짜를 상자에 적어 두십시오). 실온에서 보관한 후에는 제품을 사용하거나 폐기해야 하며 냉장고에 다시 넣어서는 안 됩니다.
바이알에 인쇄된 유효 기간이 지난 NUWIQ는 사용하지 마십시오.
재구성된 용액이 흐리거나 입자가 포함되어 있거나 무색이 아닌 경우 NUWIQ를 사용하지 마십시오.
NUWIQ는 재구성 후 가능한 한 빨리 사용해야 합니다. 재구성된 NUWIQ는 빛과 25°C(77°F)를 초과하는 온도로부터 보호하십시오. 3시간 이내에 사용하지 않은 제품은 폐기하십시오.
사용하지 않은 NUWIQ를 포함한 모든 재료는 적절한 용기에 버리십시오.
NUWIQ
에 대해 알아야 할 다른 사항은 무엇입니까?
처방되지 않은 질병에 NUWIQ를 사용하지 마십시오. 동일한 진단 및 증상이 있는 경우에도 다른 사람과 NUWIQ를 공유하지 마십시오.
환자에게 제공되는 Octapharma의 자료
NUWIQ에 대한 자세한 제품 정보는 www.NUWIQ.com을 방문하십시오.
사용 가능한 환자 지원 프로그램에 대한 자세한 내용은 Octapharma 환자 지원 센터(1-800-554-4440)에 문의하십시오.
추가 Octapharma 환자 자료에 대한 자세한 내용은 www.NUWIQ.com을 방문하십시오.
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
미국 허가 번호 1646
판매원:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
NUWIQ는 Octapharma의 등록 상표입니다.
사용 지침
NUWIQ
/nu’ veek /
Antihemophilic Factor (Recombinant)
NUWIQ를 처음 사용하기 전에 이 사용 설명서를 주의 깊게 읽으십시오. NUWIQ의 자가 주입을 시도하기 전에 의료 서비스 제공자 또는 혈우병 치료 센터로부터 적절한 교육을 받았는지 확인해야 합니다. 의료 서비스 제공자가 지시한 용량과 구체적인 지침을 항상 따라야 합니다. NUWIQ의 혼합 및 주입에 대한 일반적인 지침은 아래에 나와 있습니다. 이 단계 중 어떤 단계든 불확실한 경우 NUWIQ를 사용하기 전에 의료 서비스 제공자에게 문의하십시오.
NUWIQ 혼합 지침
- 절차를 수행하기 전에 항상 깨끗한 표면에서 작업하고 손을 씻으십시오.
- NUWIQ 바이알과 사전 충전된 주사기를 실온에 두십시오.
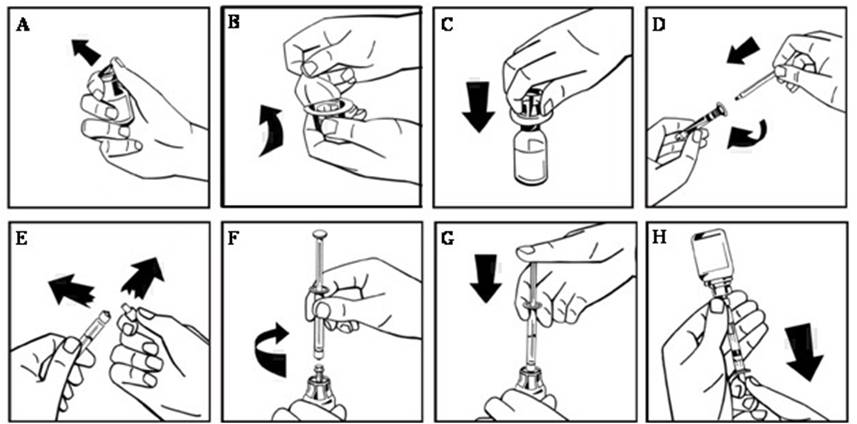
- 고무 마개를 노출시키기 위해 NUWIQ 바이알에서 플라스틱 플립탑 캡을 제거합니다(그림 A).
- 알코올 스왑으로 바이알 상단을 닦고 바이알의 고무 마개가 마르도록 합니다.
- 어댑터를 포장에서 제거하지 않고 어댑터 스파이크를 드러내도록 바이알 어댑터 포장에서 종이 덮개를 벗겨냅니다(그림 B).
- 바이알을 평평한 표면에 놓고 고무 마개에 어댑터 스파이크를 삽입합니다. 완료되면 어댑터가 바이알에 고정됩니다(그림 C).
- 사전 충전된 주사기 포장에서 종이 덮개를 벗겨냅니다. 플런저 로드의 나사산 끝을 용매 주사기에 부착하여 약간의 저항이 느껴질 때까지 시계 방향으로 돌립니다(그림 D). 플런저 로드의 샤프트와 접촉하지 않도록 합니다.
- 캡의 천공을 꺾어 주사기에서 훼손 방지 플라스틱 팁을 부러뜨립니다. 캡의 안쪽이나 주사기 팁을 만지지 마십시오(그림 E).
- 어댑터 포장을 제거하고 저항이 느껴질 때까지 시계 방향으로 돌려 주사기를 바이알 어댑터에 연결합니다(그림 F).
- 주사기에서 모든 액체를 농축액 바이알에 천천히 주입합니다(그림 G).
- 주사기를 제거하지 않고 몇 번 부드럽게 움직이거나 흔들어 바이알에 농축 분말을 녹입니다. 흔들지 마십시오. 모든 분말이 완전히 녹을 때까지 기다립니다.
- 입자의 최종 용액을 검사합니다. 용액은 투명하고 무색이며 눈에 보이는 입자가 없어야 합니다. 용액이 흐리거나 눈에 보이는 입자가 있는 경우 사용하지 마십시오.
- 바이알과 주사기를 거꾸로 돌립니다(여전히 부착됨).
- 용액을 주사기에 천천히 흡입합니다. 모든 액체가 주사기로 옮겨졌는지 확인합니다(그림 H).
- 시계 반대 방향으로 돌려 채워진 주사기를 바이알 어댑터에서 분리합니다.
- 재구성 후 용액을 냉장하지 마십시오. 재구성 후 3시간 이내에 용액을 사용하십시오. 이 기간 내에 용액을 사용하지 않을 경우, 훼손 방지 플라스틱 팁으로 채워진 주사기를 닫고 주사기를 버립니다.
NUWIQ 주입 지침
재구성 후 정맥 주사용입니다.
- 투여 전에 재구성된 NUWIQ 용액에 눈에 보이는 이물질과 변색이 있는지 검사합니다. 입자 및/또는 변색이 관찰되는 경우 사용하지 마십시오.
- 다른 약물과 같은 튜브 또는 용기에 NUWIQ를 투여하지 마십시오.
- 선택한 주사 부위를 알코올 스왑으로 닦습니다.
- 제공된 주입 세트를 주사기에 부착합니다. 주입 세트의 바늘을 선택한 정맥에 삽입합니다.
- 정맥 볼루스 주입을 수행합니다. 투여 속도는 환자의 편안함 수준에 따라 결정되어야 하며, 최대 분당 4mL입니다.
- NUWIQ를 주입한 후 주입 세트를 제거하고 적절하게 버립니다. 주입 후, 팩터 농축액 바이알에서 배치 번호가 포함된 벗겨내는 라벨을 제거하고 기록 보관을 위해 기록부에 붙입니다. 빈 바이알을 버립니다.
제조원:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646
판매원:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
NUWIQ는 Octapharma의 등록 상표입니다.
2020년 9월 발행.
포장 라벨 – 주요 표시 패널
카톤 라벨 – 주요 표시 패널
250 IU 범위
NDC 68982-139-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646

카톤 라벨 – 주요 표시 패널
500 IU 범위
NDC 68982-141-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646
카톤 라벨 – 주요 표시 패널
1000 IU 범위
NDC 68982-143-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646

카톤 라벨 – 주요 표시 패널
1500 IU 범위
NDC 68982-153-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646
카톤 라벨 – 주요 표시 패널
2000 IU 범위
NDC 68982-145-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646

카톤 라벨 – 주요 표시 패널
2500 IU 범위
NDC 68982-147-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646

카톤 라벨 – 주요 표시 패널
3000 IU 범위
NDC 68982-149-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646

카톤 라벨 – 주요 표시 패널
4000 IU 범위
NDC 68982-151-01
NUWIQ
®
Antihemophilic Factor (Recombinant)
Lyophilized Powder for Solution for Intravenous Injection
제조사:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Sweden
U.S. License No. 1646


