의약품 제조업체: GlaxoSmithKline LLC (Updated: 2023-03-08)
처방 정보 요약
피하 주사용 NUCALA (메폴리주맙) 주사제
피하 주사용 NUCALA (메폴리주맙) 주사제
미국 최초 승인: 2015
적응증 및 사용
NUCALA는 인터루킨-5 (IL-5) 길항제 단일클론 항체 (IgG1 카파)로 다음과 같은 경우에 사용됩니다.
- •
- 호산구 표현형을 가진 중증 천식 성인 및 6세 이상 소아 환자의 추가 유지 치료. (1.1)
- •
- 18세 이상 성인 환자의 비강용종을 동반한 만성 비부비동염 (CRSwNP)의 추가 유지 치료. (1.2)
- •
- 호산구 육아종 혈관염 (EGPA) 성인 환자의 치료. (1.3)
- •
- 식별 가능한 비혈액학적 이차적 원인이 없는 ≥6개월 동안 지속되는 과호산구 증후군 (HES) 성인 및 12세 이상 소아 환자의 치료. (1.4)
사용 제한: 급성 기관지 경련 또는 천식 발작의 완화를 위한 것이 아닙니다. (1.1)
투여량 및 투여 방법
투여 형태 및 강도
금기 사항
메폴리주맙 또는 제제의 첨가제에 대한 과민 반응의 병력. (4)
경고 및 주의 사항
- •
- NUCALA 투여 후 과민 반응 (예: 아나필락시스, 혈관 부종, 기관지 경련, 저혈압, 두드러기, 발진)이 발생했습니다. 과민 반응이 발생하면 NUCALA 투여를 중단하십시오. (5.1)
- •
- 급성 기관지 경련 또는 천식 발작의 치료에는 사용하지 마십시오. (5.2)
- •
- NUCALA를 투여받은 환자에서 대상포진 감염이 발생했습니다. 의학적으로 적절하다면 예방 접종을 고려하십시오. (5.3)
- •
- NUCALA 치료를 시작할 때 전신 또는 흡입 코르티코스테로이드를 갑자기 중단하지 마십시오. 적절하다면 코르티코스테로이드를 점차적으로 감소시키십시오. (5.4)
- •
- NUCALA 치료 전에 기존의 기생충 감염이 있는 환자를 치료하십시오. NUCALA 치료를 받는 동안 환자가 감염되고 항기생충 치료에 반응하지 않으면 기생충 감염이 해결될 때까지 NUCALA 투여를 중단하십시오. (5.5)
부작용
가장 흔한 부작용 (발생률 ≥5%):
- •
- 천식: 두통, 주사 부위 반응, 요통 및 피로. (6.1)
- •
- CRSwNP: 인두통 및 관절통. (6.2)
- •
- EGPA 및 HES: 가장 흔한 부작용은 천식과 유사합니다. (6.3, 6.4)
의심되는 부작용을 보고하려면 GlaxoSmithKline에 1-888-825-5249 또는 FDA에 1-800-FDA-1088로 연락하거나 www.fda.gov/medwatch.
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2023년 3월
목차
전문 정보: 내용*
1 적응증 및 사용법
1.1 중증 천식의 유지 치료
1.2 비강용종을 동반한 만성 비부비동염의 유지 치료
1.3 호산구성 육아종성 폴리안지이티스
1.4 호산구 증가증
2 용법 및 용량
2.1 중증 천식
2.2 비강용종을 동반한 만성 비부비동염
2.3 호산구성 육아종성 폴리안지이티스
2.4 호산구 증가증
2.5 NUCALA 주사용 바이알의 준비 및 투여
2.6 NUCALA 주사용 미리 채워진 자동 주사기 및 미리 채워진 주사기의 준비 및 투여
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 급성 천식 증상 또는 악화되는 질병
5.3 기회 감염: 대상포진
5.4 코르티코스테로이드 용량 감소
5.5 기생충 (회충) 감염
6 이상 반응
6.1 중증 천식 임상 시험 경험
6.2 비강용종을 동반한 만성 비부비동염 임상 시험 경험
6.3 호산구성 육아종성 폴리안지이티스 임상 시험 경험
6.4 호산구 증가증 임상 시험 경험
6.5 면역원성
6.6 시판 후 경험
7 약물 상호 작용
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 중증 천식
14.2 비강용종을 동반한 만성 비부비동염
14.3 호산구성 육아종성 폴리안지이티스
14.4 호산구 증가증
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1 중증 천식의 유지 요법
NUCALA는 호산구 표현형을 가진 6세 이상의 소아 및 성인 중증 천식 환자의 추가 유지 요법에 사용됩니다 [특정 인구 집단에서의 사용 (8.4), 임상 연구 (14.1)].
사용 제한
NUCALA는 급성 기관지 경련 또는 천식 발작의 완화에 사용되지 않습니다.
1.2 비강용종을 동반한 만성 비부비동염의 유지 요법
NUCALA는 비강 코르티코스테로이드에 대한 반응이 불충분한 18세 이상의 성인 환자의 비강용종을 동반한 만성 비부비동염(CRSwNP)의 추가 유지 요법에 사용됩니다.
1.4 호산구 증가증 증후군
NUCALA는 확인되지 않은 비혈액학적 이차적 원인이 있는 ≥6개월 동안 호산구 증가증 증후군(HES)을 가진 12세 이상의 소아 및 성인 환자의 치료에 사용됩니다.
2. 용법 및 용량
NUCALA는 피하 주사로만 투여해야 합니다.
2.1 중증 천식
성인 및 12세 이상 청소년
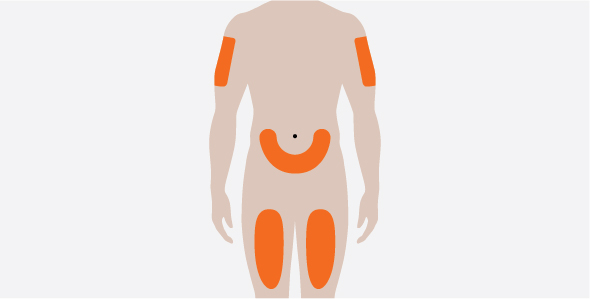
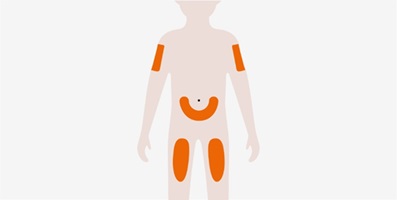
성인 및 12세 이상 청소년의 NUCALA 권장 용량은 100mg이며, 4주마다 한 번씩 상완, 허벅지 또는 복부에 피하 주사로 투여합니다. [용법 및 투여 참조 (2.5, 2.6)].
6세에서 11세까지의 소아 환자
6세에서 11세까지의 소아 환자의 NUCALA 주사 권장 용량은 40mg이며, 4주마다 한 번씩 상완, 허벅지 또는 복부에 피하 주사로 투여합니다. [용법 및 투여 참조 (2.5, 2.6)].
2.2 비강용종을 동반한 만성 비부비동염
NUCALA의 권장 용량은 100mg이며, 4주마다 한 번씩 상완, 허벅지 또는 복부에 피하 주사로 투여합니다. [용법 및 투여 참조 (2.5, 2.6)].
2.3 호산구성 육아종성 폴리장염
NUCALA의 권장 용량은 300mg이며, 4주마다 한 번씩 상완, 허벅지 또는 복부에 100mg씩 3회 분리하여 피하 주사로 투여합니다. [용법 및 투여 참조 (2.5, 2.6)]. 개별 100mg 주사는 최소 5cm(약 2인치) 간격으로 투여합니다.
2.4 호산구 증다증
NUCALA의 권장 용량은 300mg이며, 4주마다 한 번씩 상완, 허벅지 또는 복부에 100mg씩 3회 분리하여 피하 주사로 투여합니다. [용법 및 투여 참조 (2.5, 2.6)]. 개별 100mg 주사는 최소 5cm(약 2인치) 간격으로 투여합니다.
2.5 NUCALA 주사용 바이알의 준비 및 투여
NUCALA 주사는 의료 전문가가 재구성하고 투여해야 합니다. 임상 관행에 따라 생물학적 제제 투여 후 환자 모니터링을 권장합니다. [경고 및 주의 사항 참조 (5.1)].
재구성 지침
- 1.
- NUCALA 주사용 바이알을 USP 주사용 무균수 1.2mL로 재구성합니다. 바람직하게는 2mL 또는 3mL 주사기와 21게이지 바늘을 사용합니다. 재구성된 용액은 100mg/mL 메폴리주맙 농도를 포함합니다. 다른 약물과 혼합하지 마십시오.
- 2.
- 케이크 모양일 수 있는 동결 건조된 분말의 중앙에 USP 주사용 무균수를 수직으로 흘려줍니다. 분말이 용해될 때까지 15초 간격으로 10초 동안 원형 운동으로 바이알을 부드럽게 흔듭니다.
참고: 이 과정에서 재구성된 용액을 흔들지 마십시오. 그러면 제품이 거품이 나거나 침전될 수 있습니다. 재구성은 일반적으로 USP 주사용 무균수를 첨가한 후 5분 이내에 완료되지만 추가 시간이 걸릴 수 있습니다. - 3.
- NUCALA 주사를 재구성하는 데 기계적 재구성 장치(스월러)를 사용하는 경우 10분을 초과하지 않고 450rpm으로 흔듭니다. 또는 5분을 초과하지 않고 1,000rpm으로 흔드는 것도 허용됩니다.
- 4.
- 사용 전에 재구성된 용액을 시각적으로 검사하여 이물질과 맑은 정도를 확인합니다. 용액은 맑거나 불투명하며 무색에서 옅은 노란색 또는 옅은 갈색이어야 하며, 기본적으로 입자가 없어야 합니다. 그러나 작은 기포는 예상되며 허용됩니다. 용액에 입자가 남아 있거나 용액이 흐리거나 우유빛으로 보이는 경우 용액을 투여해서는 안 됩니다.
- 5.
- 재구성된 용액을 즉시 사용하지 않는 경우:
- •
- 30°C(86°F) 이하로 보관합니다.
- •
- 냉동하지 마십시오.
- •
- 재구성 후 8시간 이내에 사용하지 않으면 폐기합니다.
100mg 용량 투여
- 1.
- 피하 투여의 경우, 바람직하게는 일회용 21~27게이지 x 0.5인치(13mm) 바늘이 장착된 1mL 폴리프로필렌 주사기를 사용합니다.
- 2.
- 투여 직전에 재구성된 NUCALA 주사 1mL를 제거합니다. 이 과정에서 재구성된 용액을 흔들지 마십시오. 그러면 제품이 거품이 나거나 침전될 수 있습니다.
- 3.
- 1mL 주사(메폴리주맙 100mg에 해당)를 상완, 허벅지 또는 복부에 피하 주사합니다.
40mg 용량 투여
- 1.
- 피하 투여의 경우, 바람직하게는 일회용 21~27게이지 x 0.5인치(13mm) 바늘이 장착된 1mL 폴리프로필렌 주사기를 사용합니다.
- 2.
- 투여 직전에 재구성된 NUCALA 주사 0.4mL를 제거합니다. 이 과정에서 재구성된 용액을 흔들지 마십시오. 그러면 제품이 거품이 나거나 침전될 수 있습니다.
- 3.
- 0.4mL 주사(메폴리주맙 40mg에 해당)를 상완, 허벅지 또는 복부에 피하 주사합니다.
NUCALA 주사용 바이알은 한 명의 환자에게만 사용해야 하며, 남은 내용물은 폐기해야 합니다.
2.6 NUCALA 주사용 사전 충전 오토인젝터 및 사전 충전 주사기의 준비 및 투여
NUCALA 주사는 의료 전문가의 지시에 따라 사용해야 합니다.
100mg/mL 사전 충전 자동 주사기 및 100mg/mL 사전 충전 주사기는 성인 및 12세 이상 청소년에게만 사용됩니다. 환자는 의료 서비스 제공자가 적절하다고 판단한 후에 NUCALA 주사액 100mg/mL를 피하 주사할 수 있습니다. 환자 또는 환자 보호자는 NUCALA 주사액을 피하 주사할 수 있습니다.
40mg/0.4mL 사전 충전 주사기는 6세에서 11세 사이의 어린이에게만 사용해야 하며 의료 서비스 제공자 또는 환자 보호자가 투여해야 합니다. 환자 보호자는 의료 서비스 제공자가 적절하다고 판단한 후에 NUCALA 주사액 40mg/0.4mL를 피하 주사할 수 있습니다.
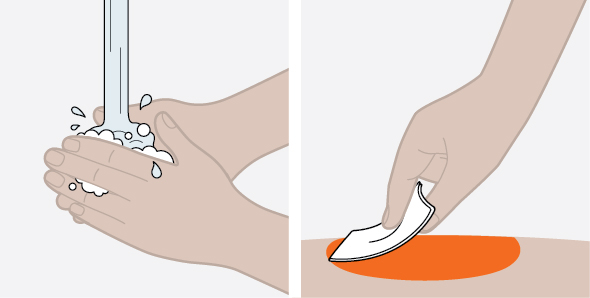
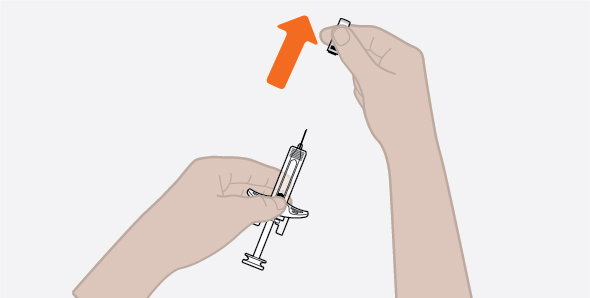
사용 전에 피하 주사 기술 및 NUCALA 주사액의 준비 및 투여에 대한 적절한 교육을 제공하십시오 [사용 지침 참조].
- 1.
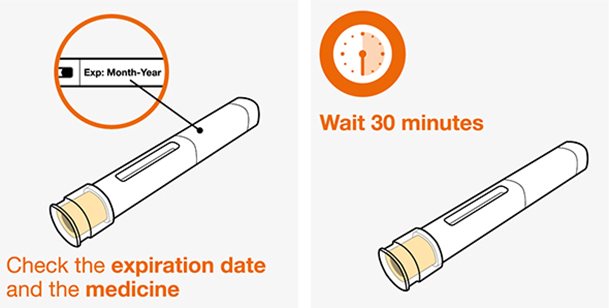
- 사전 충전 자동 주사기 또는 사전 충전 주사기를 냉장고에서 꺼내 주사하기 전에 실온에서 30분 동안 방치하십시오. NUCALA 주사액을 다른 방법으로 데우지 마십시오.
- 2.
- 투여 전에 사전 충전 자동 주사기 또는 사전 충전 주사기의 창을 시각적으로 검사하여 이물질이나 변색이 있는지 확인하십시오. NUCALA 주사액은 투명에서 유백색, 무색에서 옅은 노란색에서 옅은 갈색이어야 합니다. 제품이 변색, 흐림 또는 이물질이 있는 경우 NUCALA 주사액을 사용하지 마십시오. NUCALA 사전 충전 자동 주사기 또는 사전 충전 주사기를 딱딱한 표면에 떨어뜨린 경우 사용하지 마십시오.
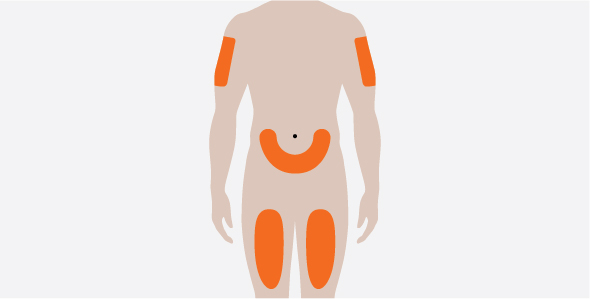
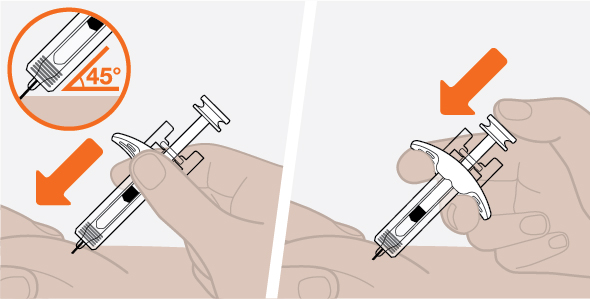
- 3.
- 배꼽 주변 5cm(약 2인치)를 피하여 허벅지 또는 복부에 피하 주사하십시오. 보호자가 피하 주사를 투여하는 경우 팔뚝에도 사용할 수 있습니다.
- 4.
- EGPA 및 HES에 사용하는 경우 각 피하 주사의 주사 부위를 최소 5cm(약 2인치) 떨어뜨리십시오.
- 5.
- 피부가 부드럽거나 멍이 들거나 붉거나 단단한 부위에는 절대 주사하지 마십시오.
- 6.
- 복용량을 놓친 경우 가능한 한 빨리 복용하십시오. 그 후 환자는 일반적인 투여일에 투여를 재개할 수 있습니다. 다음 복용량이 이미 지정된 경우 계획대로 투여하십시오.
3 제형 및 함량
주사용
- •
- 재구성을 위한 단회용 바이알에 100mg의 백색에서 거의 백색의 동결 건조 분말.
주사
- •
- 단회용 미리 채워진 자동 주사기에 투명에서 반투명, 무색에서 옅은 노란색에서 옅은 갈색 용액으로 100 mg/mL.
- •
- 단회용 미리 채워진 유리 주사기에 투명에서 반투명, 무색에서 옅은 노란색에서 옅은 갈색 용액으로 100 mg/mL.
- •
- 단회용 미리 채워진 유리 주사기에 투명에서 반투명, 무색에서 옅은 노란색에서 옅은 갈색 용액으로 40 mg/0.4 mL.
4 금기 사항
NUCALA는 메폴리주맙 또는 제제의 첨가제에 대한 과민 반응의 병력이 있는 환자에게 금기입니다 [경고 및 주의 사항 (5.1), 설명 (11)].
5 경고 및 주의사항
5.1 과민 반응
NUCALA 투여 후 과민 반응(예: 아나필락시스, 혈관부종, 기관지경련, 저혈압, 두드러기, 발진)이 발생했습니다. 이러한 반응은 일반적으로 투여 후 몇 시간 이내에 발생하지만 경우에 따라 지연되어 나타날 수 있습니다(예: 며칠). 과민 반응이 발생할 경우 NUCALA를 중단해야 합니다 [금기(4) 참조].
5.2 급성 천식 증상 또는 악화되는 질환
NUCALA는 급성 천식 증상 또는 급성 악화를 치료하는 데 사용해서는 안 됩니다. 급성 기관지경련 또는 천식 지속증을 치료하기 위해 NUCALA를 사용하지 마십시오. NUCALA로 치료를 시작한 후 천식이 계속 조절되지 않거나 악화되는 경우 환자는 의사의 진료를 받아야 합니다.
5.3 기회 감염: 대상포진
대조 임상 시험에서 NUCALA 100mg을 투여받은 환자에서 대상포진이 발생했습니다 [이상반응(6.1) 참조]. 의학적으로 적절한 경우 예방 접종을 고려하십시오.
5.4 코르티코스테로이드 용량 감소
NUCALA로 치료를 시작할 때 전신 또는 흡입 코르티코스테로이드(ICS)를 갑자기 중단하지 마십시오. 코르티코스테로이드 용량 감소는 적절한 경우 점진적으로 수행해야 하며 의사의 직접 감독 하에 수행해야 합니다. 코르티코스테로이드 용량 감소는 전신 금단 증상 및/또는 이전에 전신 코르티코스테로이드 치료로 억제되었던 질환의 재발과 관련될 수 있습니다.
5.5 기생충(선충) 감염
호산구는 일부 선충 감염에 대한 면역 반응에 관여할 수 있습니다. 알려진 기생충 감염 환자는 임상 시험 참여에서 제외되었습니다. NUCALA가 기생충 감염에 대한 환자의 반응에 영향을 미치는지는 알려져 있지 않습니다. NUCALA로 치료를 시작하기 전에 기존 선충 감염이 있는 환자를 치료하십시오. NUCALA로 치료받는 동안 환자가 감염되었는데 구충제 치료에 반응하지 않으면 감염이 해결될 때까지 NUCALA 치료를 중단하십시오.
6. 부작용
다음 부작용은 다른 섹션에서 자세히 설명되어 있습니다.
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 부작용 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
6.1 중증 천식에 대한 임상 시험 경험
12세 이상 성인 및 청소년 환자
총 1,327명의 중증 천식 환자가 24주에서 52주 동안 지속되는 3개의 무작위 배정, 위약 대조, 다기관 임상 시험(시험 1, NCT01000506; 시험 2, NCT01691521; 및 시험 3, NCT01691508)에서 평가되었습니다. 이 중 1,192명은 고용량 ICS와 추가 조절제(들)를 정기적으로 사용했음에도 불구하고 등록 전 1년 동안 2회 이상의 악화를 경험했으며(시험 1과 2), 135명의 환자는 천식 조절을 유지하기 위해 고용량 ICS와 추가 조절제(들)를 정기적으로 사용하는 것 외에 매일 경구 코르티코스테로이드(OCS)를 필요로 했습니다(시험 3). 모든 환자는 호산구성 기도 염증의 마커를 가지고 있었습니다 [임상 연구 (14.1)] 참조. 등록된 환자 중 59%는 여성이었고, 85%는 백인이었으며, 연령은 12세에서 82세까지였습니다. 메폴리주맙은 4주마다 한 번씩 피하 또는 정맥 주사로 투여되었습니다. 263명의 환자가 NUCALA(메폴리주맙 100mg 피하)를 최소 24주 동안 투여받았습니다. NUCALA 100mg(n=263)을 투여받은 환자보다 위약(n=257)을 투여받은 환자에게서 더 많은 환자에게서 발생했고, 1명 이상의 환자에게서 발생한 중대한 부작용에는 1건의 사건, 대상포진(각각 2명의 환자 대 0명의 환자)이 포함되었습니다. NUCALA 100mg을 투여받은 환자의 약 2%가 부작용으로 인해 임상 시험에서 탈퇴한 반면, 위약을 투여받은 환자의 3%가 탈퇴했습니다.
NUCALA 100mg을 사용한 2개의 확증적 유효성 및 안전성 시험(시험 2와 3)에서 치료 첫 24주 동안의 부작용 발생률은 표 1에 나와 있습니다.
|
부작용 |
NUCALA (메폴리주맙 100mg 피하) (n = 263) % |
위약 (n = 257) % |
|
두통 |
19 |
18 |
|
주사 부위 반응 |
8 |
3 |
|
요통 |
5 |
4 |
|
피로 |
5 |
4 |
|
인플루엔자 |
3 |
2 |
|
요로 감염 |
3 |
2 |
|
상복부 통증 |
3 |
2 |
|
가려움증 |
3 |
2 |
|
습진 |
3 |
<1 |
|
근육 경련 |
3 |
<1 |
52주 시험: 메폴리주맙 75mg 정맥 주사(IV) (n = 153) 또는 위약(n = 155)로 52주 동안 치료한 시험 1에서 발생한 이상 반응으로, 발생률이 3% 이상이고 위약보다 흔하며 표 1에 나타나지 않은 것은 다음과 같습니다. 복통, 알레르기성 비염, 무력증, 기관지염, 방광염, 현기증, 호흡곤란, 귀 감염, 위장염, 하부 호흡기 감염, 근골격계 통증, 비충혈, 비인두염, 메스꺼움, 인두염, 발열, 발진, 치통, 바이러스 감염, 바이러스성 호흡기 감염 및 구토. 또한, 메폴리주맙 75mg IV를 투여받은 환자에서 3건의 대상포진이 발생한 반면, 위약군에서는 2명의 환자에서 발생했습니다.
전신 반응, 과민 반응 포함: 위에서 설명한 시험 1, 2 및 3에서 전신(알레르기 및 비알레르기) 반응을 경험한 환자의 비율은 NUCALA 100mg을 투여받은 그룹에서 3%, 위약군에서 5%였습니다. NUCALA 100mg을 투여받은 그룹의 환자 중 1%에서 전신 알레르기/과민 반응이 보고되었고, 위약군의 환자 중 2%에서 보고되었습니다. NUCALA 100mg을 투여받은 그룹에서 보고된 전신 알레르기/과민 반응의 가장 흔한 증상은 발진, 가려움증, 두통 및 근육통이었습니다. NUCALA 100mg을 투여받은 그룹의 환자 중 2%에서 전신 비알레르기 반응이 보고되었고, 위약군의 환자 중 3%에서 보고되었습니다. NUCALA 100mg을 투여받은 그룹에서 보고된 전신 비알레르기 반응의 가장 흔한 증상은 발진, 홍조 및 근육통이었습니다. NUCALA 100mg을 투여받은 환자에서 발생한 전신 반응의 대부분(5/7)은 투약일에 경험했습니다.
주사 부위 반응: NUCALA 100mg을 투여받은 환자의 8%에서 주사 부위 반응(예: 통증, 홍반, 부종, 가려움증, 작열감)이 발생한 반면, 위약을 투여받은 환자의 3%에서 발생했습니다.
장기 안전성: 998명의 환자가 진행 중인 오픈 라벨 연장 연구에서 NUCALA 100mg을 투여받았으며, 이 기간 동안 추가적인 대상포진 사례가 보고되었습니다. 전반적인 이상 사례 프로파일은 위에서 설명한 중증 천식 시험과 유사했습니다.
6세에서 11세까지의 소아 환자
NUCALA의 안전성 데이터는 중증 천식이 있는 6세에서 11세까지의 환자 36명을 모집한 1건의 오픈 라벨 임상 시험을 기반으로 합니다. 환자는 4주마다 1회 피하 주사로 NUCALA 40mg(체중이 40kg 미만인 경우) 또는 100mg(체중이 40kg 이상인 경우)을 투여받았습니다. 환자는 12주 동안 NUCALA를 투여받았습니다(초기 단기 단계). 8주 동안 치료를 중단한 후, 30명의 환자가 52주 동안 NUCALA를 추가로 투여받았습니다(장기 단계). 6세에서 11세까지의 환자의 이상 반응 프로파일은 12세 이상의 환자에서 관찰된 프로파일과 유사했습니다.
6.2 만성 비강 용종을 동반한 부비동염에서의 임상 시험 경험
만성 비강 용종을 동반한 부비동염(CRSwNP) 환자 407명을 대상으로 무작위 배정, 위약 대조, 다기관, 52주 치료 시험을 실시했습니다. 환자는 4주마다 1회 피하 주사로 NUCALA 100mg 또는 위약을 투여받았습니다. 환자는 이전 수술 경험이 있는 재발성 CRSwNP를 앓고 있었으며, 선별 검사 전 최소 8주 동안 비강 코르티코스테로이드를 사용했습니다. [임상 연구 참조 (14.2)]. 등록된 환자 중 35%는 여성이었고, 93%는 백인이었으며, 연령은 18세에서 82세까지였습니다. NUCALA 100mg을 투여받은 환자의 약 2%가 이상 사례로 인해 연구 치료에서 탈락한 반면, 위약을 투여받은 환자의 2%가 탈락했습니다.
표 2는 CRSwNP 시험에서 NUCALA 치료를 받은 환자의 3% 이상에서 발생했고 위약 치료를 받은 환자보다 더 흔하게 발생한 이상 반응을 요약합니다.
| CRSwNP = 만성 비강 용종을 동반한 부비동염. | ||
|
이상 반응 |
NUCALA (메폴리주맙 100mg 피하) (n = 206) % |
위약 (n = 201) % |
|
인두 통증 |
8 |
5 |
|
관절통 |
6 |
2 |
|
상복부 통증 |
3 |
2 |
|
설사 |
3 |
2 |
|
발열 |
3 |
2 |
|
비강 건조 |
3 |
<1 |
|
발진 |
3 |
<1 |
전신 반응, 과민 반응 포함
52주 시험에서 NUCALA 100mg을 투여받은 그룹에서 전신 (알레르기 [I형 과민 반응] 및 기타) 반응을 경험한 환자의 비율은 <1%였고, 위약 그룹에서는 <1%였습니다. NUCALA 100mg을 투여받은 그룹에서는 <1%의 환자에게 전신 알레르기 (I형 과민 반응) 반응이 보고되었고, 위약 그룹에서는 보고된 환자가 없었습니다. 전신 알레르기 (I형 과민 반응) 반응의 증상으로는 두드러기, 홍반, 발진이 있었으며, 3가지 반응 중 1가지는 투약일에 발생했습니다. NUCALA 100mg을 투여받은 그룹에서는 다른 전신 반응이 보고된 환자가 없었고, 위약 그룹에서는 <1%의 환자에게 보고되었습니다.
주사 부위 반응
주사 부위 반응 (예: 홍반, 가려움증)은 NUCALA 100mg을 투여받은 환자의 2%에서 발생한 반면, 위약을 투여받은 환자에서는 <1%에서 발생했습니다.
6.3 호산구성 육아종성 폴리장염에 대한 임상 시험 경험
EGPA 환자 136명을 대상으로 무작위 배정, 위약 대조, 다기관, 52주 치료 시험을 실시했습니다. 환자들은 NUCALA 300mg 또는 위약을 4주마다 한 번씩 피하 주사로 투여받았습니다. 등록된 환자들은 등록 전 최소 6개월 동안 EGPA 진단을 받았으며, 재발성 또는 난치성 질환의 병력이 있었고, 등록 전 최소 4주 동안 안정적인 경구용 프레드니솔론 또는 프레드니손 용량을 7.5mg/일 이상(단, 50mg/일 이하) 투여받았습니다. [임상 연구(14.3)] 참조. 등록된 환자 중 59%가 여성이었고, 92%가 백인이었으며, 연령은 20세에서 71세까지였습니다. 중증 천식 시험에서 보고된 것 외에 추가적인 부작용은 확인되지 않았습니다.
전신 반응, 과민 반응 포함
52주 시험에서 NUCALA 300mg을 투여받은 그룹에서 전신 (알레르기 및 비알레르기) 반응을 경험한 환자의 비율은 6%였고, 위약 그룹에서는 1%였습니다. NUCALA 300mg을 투여받은 그룹에서는 4%의 환자에게 전신 알레르기/과민 반응이 보고되었고, 위약 그룹에서는 1%의 환자에게 보고되었습니다. NUCALA 300mg을 투여받은 그룹에서 보고된 전신 알레르기/과민 반응의 증상으로는 발진, 가려움증, 홍조, 피로, 고혈압, 몸통과 목의 열감, 사지 냉감, 호흡 곤란, 천명이 있었습니다. NUCALA 300mg을 투여받은 그룹에서는 1명(1%)의 환자에게 전신 비알레르기 반응이 보고되었고, 위약 그룹에서는 보고된 환자가 없었습니다. NUCALA 300mg을 투여받은 그룹에서 보고된 전신 비알레르기 반응의 증상은 안면 부종이었습니다. NUCALA 300mg을 투여받은 환자의 전신 반응 중 절반(2/4)은 투약일에 발생했습니다.
주사 부위 반응
주사 부위 반응 (예: 통증, 홍반, 부종)은 NUCALA 300mg을 투여받은 환자의 15%에서 발생한 반면, 위약을 투여받은 환자에서는 13%에서 발생했습니다.
6.4 호산구 증다증에 대한 임상 시험 경험
12세 이상의 성인 및 청소년 HES 환자 108명을 대상으로 무작위 배정, 위약 대조, 다기관, 32주 치료 시험을 실시했습니다. 비혈액학적 이차 HES 또는 FIP1L1‑PDGFRα 키나아제 양성 HES 환자는 시험에서 제외되었습니다. 환자들은 NUCALA 300mg 또는 위약을 4주마다 한 번씩 피하 주사로 투여받았습니다. 환자들은 무작위 배정 전 4주 동안 안정적인 기저 HES 치료 용량을 유지해야 했습니다. [임상 연구(14.4)] 참조. 등록된 환자 중 53%가 여성이었고, 93%가 백인이었으며, 연령은 12세에서 82세까지였습니다. 중증 천식 시험에서 보고된 것 외에 추가적인 부작용은 확인되지 않았습니다.
전신 반응, 과민 반응 포함
시험에서 전신 알레르기 (I형 과민 반응) 반응은 보고되지 않았습니다. NUCALA 300mg을 투여받은 그룹에서는 1명(2%)의 환자에게 다른 전신 반응이 보고되었고, 위약 그룹에서는 보고된 환자가 없었습니다. 보고된 다른 전신 반응의 증상은 투약일에 발생한 다초점성 피부 반응이었습니다.
주사 부위 반응
주사 부위 반응 (예: 화끈거림, 가려움증)은 NUCALA 300mg을 투여받은 환자의 7%에서 발생한 반면, 위약을 투여받은 환자에서는 4%에서 발생했습니다.
6.5 면역원성
NUCALA 100mg을 투여받은 중증 천식 성인 및 청소년 환자 260명 중 15명(6%)에게 메폴리주맙에 대한 항체가 검출되었습니다. NUCALA 100mg을 투여받은 천식 환자 1명에게서 중화 항체가 검출되었습니다. 메폴리주맙에 대한 항체는 메폴리주맙의 청소율을 약간 증가시켰습니다(약 20%). 메폴리주맙에 대한 항체 역가와 호산구 수치 변화 사이의 상관 관계는 확인되지 않았습니다. 메폴리주맙에 대한 항체 존재의 임상적 중요성은 알려져 있지 않습니다. NUCALA 40mg 또는 100mg을 투여받은 중증 천식 6세에서 11세 어린이를 대상으로 한 임상 시험에서 35명 중 2명(6%)에게 시험의 초기 단기 단계 동안 메폴리주맙에 대한 항체가 검출되었습니다. 시험의 장기 단계 동안 어린이에게는 메폴리주맙에 대한 항체가 검출되지 않았습니다.
NUCALA 100mg을 투여받은 CRSwNP 환자 196명 중 6명(3%)에게 메폴리주맙에 대한 항체가 검출되었습니다. CRSwNP 환자에게는 중화 항체가 검출되지 않았습니다.
NUCALA 300mg을 투여받은 EGPA 환자 68명 중 1명(<2%)에게 메폴리주맙에 대한 항체가 검출되었습니다. EGPA 환자에게는 중화 항체가 검출되지 않았습니다.
NUCALA 300mg을 투여받은 성인 및 청소년 HES 환자 53명 중 1명(2%)에게 메폴리주맙에 대한 항체가 검출되었습니다. HES 환자에게는 중화 항체가 검출되지 않았습니다.
보고된 메폴리주맙에 대한 항체 빈도는 높은 약물 농도가 존재할 경우 분석 감도가 낮아 실제 빈도를 과소평가할 수 있습니다. 데이터는 특정 분석에서 메폴리주맙에 대한 항체 검사 결과가 양성인 환자의 비율을 반영합니다. 분석에서 관찰된 항체 양성률은 분석 감도 및 특이도, 분석 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인에 크게 의존합니다.
6.6 시판 후 경험
임상 시험에서 보고된 이상 반응 외에, NUCALA 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다. 이러한 사건은 심각성, 보고 빈도, NUCALA와의 인과 관계 또는 이러한 요인의 조합으로 인해 포함되었습니다.
면역 체계 장애
과민 반응, 아나필락시스 포함.
7 약물 상호작용
NUCALA에 대한 공식적인 약물 상호작용 시험은 수행되지 않았습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 노출에 대한 데이터는 약물 관련 위험을 알리기에 충분하지 않습니다. 메폴리주맙과 같은 단일클론 항체는 임신이 진행됨에 따라 태반을 통해 선형적으로 이동합니다. 따라서 태아에 대한 잠재적 영향은 임신 2분기와 3분기에 더 클 가능성이 높습니다. 시노몰구스 원숭이에서 수행된 태아 및 출생 후 발달 연구에서, 임신 기간 동안 최대 권장 인간 용량(MRHD) 300mg 피하 주사의 약 9배에 해당하는 노출을 유발하는 용량으로 IV 투여한 경우 태아에 대한 해로운 영향의 증거가 없었습니다. (데이터 참조).
미국 일반 인구에서 임상적으로 인식되는 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 태아 위험: 천식이 잘 조절되지 않거나 중등도로 조절되는 여성의 경우, 모체의 자간전증 및 신생아의 조산, 저체중 출산 및 재태 연령에 비해 작은 위험이 증가한다는 증거가 있습니다. 임산부의 천식 조절 수준을 면밀히 모니터링하고 최적의 조절을 유지하기 위해 치료를 필요에 따라 조정해야 합니다.
데이터
동물 데이터: 태아 및 출생 후 발달 연구에서, 임신한 시노몰구스 원숭이에게 임신 20일부터 140일까지 MRHD(모체 IV 용량 최대 100mg/kg, 4주마다 1회)의 약 9배에 해당하는 노출을 유발하는 용량으로 메폴리주맙을 투여했습니다. 메폴리주맙은 출생 후 9개월까지 태아 또는 신생아의 성장(면역 기능 포함)에 부작용을 일으키지 않았습니다. 내부 또는 골격 기형에 대한 검사는 수행되지 않았습니다. 메폴리주맙은 시노몰구스 원숭이의 태반을 통과했습니다. 메폴리주맙의 농도는 출산 후 178일까지 영아에서 모체보다 약 2.4배 높았습니다. 모유에서 메폴리주맙 수치는 모체 혈청 농도의 0.5% 이하였습니다.
생식, 초기 배아 및 배아 태아 발달 연구에서, 임신한 CD-1 마우스에게 임신 기간 동안 전체에 걸쳐 50mg/kg의 IV 용량으로 1주일에 한 번씩 뮤린 인터루킨-5(IL-5)의 활성을 억제하는 유사한 항체를 투여했습니다. 유사한 항체는 마우스에서 기형 유발 물질이 아니었습니다. IL-5 결핍 마우스의 배아 태아 발달은 일반적으로 야생형 마우스에 비해 영향을 받지 않는 것으로 보고되었습니다.
8.2 수유
위험 요약
모유에서 메폴리주맙의 존재, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 정보는 없습니다. 그러나 메폴리주맙은 인간화된 단일클론 항체(IgG1 카파)이며, 면역글로불린 G(IgG)는 소량으로 모유에 존재합니다. 메폴리주맙은 임신 중 투여 후 출산 후 시노몰구스 원숭이의 모유에 존재했습니다. [특정 인구에서의 사용(8.1) 참조]. 모유 수유의 발달적 및 건강상 이점은 모체의 NUCALA에 대한 임상적 필요와 메폴리주맙 또는 기저 모체 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
중증 천식
중증 천식 및 호산구 표현형이 있는 소아 환자에서 NUCALA의 안전성과 유효성은 6세 이상의 소아 환자에서 확립되었습니다.
12세에서 17세 사이의 청소년에서 NUCALA의 사용은 성인 및 청소년에서 수행된 적절하고 잘 통제된 시험의 증거에 의해 뒷받침됩니다. 중증 천식이 있는 12세에서 17세 사이의 청소년 28명이 3상 천식 시험에 등록되었습니다. 이 중 25명은 32주 악화 시험(시험 2, NCT01691521)에 등록되었으며 평균 연령은 14.8세였습니다. 환자는 중간 또는 고용량 ICS와 추가 조절제(OCS 포함 또는 제외)를 정기적으로 사용했음에도 불구하고 이전 1년 동안 2회 이상 악화된 병력이 있었고, 선별 시 혈액 호산구가 ≥150개/mcL이거나 등록 전 12개월 이내에 ≥300개/mcL이었습니다. [임상 연구(14.1) 참조]. 환자는 NUCALA에 유리하게 악화율이 감소했습니다. NUCALA를 투여받은 19명의 청소년 중 9명은 100mg을 투여받았으며, 이러한 환자의 평균 명백한 청소율은 성인보다 35% 낮았습니다. 청소년에서 관찰된 안전성 프로파일은 일반적으로 3상 연구의 전체 인구와 유사했습니다. [부작용(6.1) 참조].
6세에서 11세 사이의 소아 환자에서 중증 천식 및 호산구 표현형이 있는 NUCALA의 사용은 성인 및 청소년에서 수행된 적절하고 잘 통제된 시험의 증거에 의해 뒷받침되며, 6세에서 11세 사이의 어린이에 대한 추가 약동학, 약력학 및 안전성 데이터가 있습니다. 6세에서 11세 사이의 어린이(평균 연령: 8.6세, 여성 31%) 36명을 대상으로 단일 공개 표지 임상 시험(NCT02377427)이 수행되었습니다. 등록 기준은 32주 악화 시험(시험 2)의 청소년과 동일했습니다. 이 시험의 약동학 데이터를 기반으로, 4주마다 40mg 피하 주사 용량은 100mg 피하 주사 용량을 투여받은 성인 및 청소년과 유사한 노출을 갖는 것으로 결정되었습니다. [임상 약리학(12.3) 참조].
6세에서 11세 사이의 소아 환자에서 NUCALA의 유효성은 6세에서 11세 사이의 어린이에게 4주마다 40mg 피하 주사를 투여한 경우 성인 및 청소년과 유사한 약물 노출 수준을 보여주는 약동학 분석의 지원을 받아 성인 및 청소년의 유효성에서 추론됩니다. [임상 약리학(12.3) 참조]. 이 시험에서 6세에서 11세 사이의 어린이에게 관찰된 안전성 프로파일과 약력학적 반응은 성인 및 청소년에서 관찰된 것과 유사했습니다. [부작용(6.1), 임상 약리학(12.2) 참조].
6세 미만의 소아 환자에서 중증 천식에 대한 안전성과 유효성은 확립되지 않았습니다.
비강용종을 동반한 만성 비부비동염
CRSwNP 환자 중 18세 미만의 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
다발혈관염을 동반한 호산구성 육아종증
EGPA 환자 중 18세 미만의 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
호산구 증가증
NUCALA의 HES에 대한 안전성 및 유효성은 12세 이상의 청소년 환자에서 확립되었습니다. HES 환자 중 12세 미만의 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다.
이 적응증에 대한 NUCALA의 사용은 성인 및 청소년을 대상으로 한 적절하고 잘 통제된 연구(NCT02836496) 및 개방형 연장 연구(NCT03306043)의 증거에 의해 뒷받침됩니다. 한 명의 청소년이 통제된 연구 중에 NUCALA를 투여받았으며, 이 환자와 추가로 3명의 청소년이 개방형 연장 연구 중에 NUCALA를 투여받았습니다 [임상 연구(14.4) 참조]. 32주 시험에서 NUCALA로 치료받은 1명의 청소년은 HES 악화 또는 보고된 이상 반응이 없었습니다. 모든 청소년은 개방형 연장에서 20주 동안 300mg의 NUCALA를 투여받았습니다.
8.5 노인에서의 사용
NUCALA의 임상 시험에는 NUCALA를 투여받은 65세 이상의 환자(n = 79)가 충분하지 않아 이들이 젊은 환자와 다르게 반응하는지 여부를 확인할 수 없었습니다. 다른 보고된 임상 경험에서는 노인과 젊은 환자 간에 반응의 차이가 확인되지 않았습니다. 일반적으로 노인 환자의 경우 투약량 선택은 신중해야 하며, 간, 신장 또는 심장 기능 저하 및 동반 질환 또는 다른 약물 치료의 빈도가 높기 때문에 일반적으로 투약 범위의 하한에서 시작해야 합니다. 사용 가능한 데이터를 기반으로 노인 환자의 경우 NUCALA 투약량 조정이 필요하지 않지만 일부 노인의 경우 민감도가 높을 수 있습니다.
10 과량 투여
메폴리주맙 과량 투여에 대한 특정 치료법은 없습니다. 과량 투여가 발생하면 환자는 필요에 따라 적절한 모니터링을 통해 지지 요법을 받아야 합니다.
11. 성분 및 구성
메폴리주맙은 인간화된 IL-5 길항 모노클로날 항체입니다. 메폴리주맙은 중국 햄스터 난소 세포에서 재조합 DNA 기술로 생산됩니다. 메폴리주맙의 분자량은 약 149 kDa입니다.
NUCALA 주사제는 멸균, 방부제가 없고 흰색에서 회백색의 동결건조 분말로 단회 투여용 바이알로, 재구성 후 피하 주사용입니다. USP용 멸균 주사용수 1.2 mL로 재구성하면 생성된 농도는 100 mg/mL이며 1 mL를 제공합니다. [용법 및 투여량 참조(2.5)]. 각 바이알에는 메폴리주맙 100mg, 폴리소르베이트 80(0.67mg), 이수소인산나트륨 7수화물(7.14mg), 슈크로스(160mg)가 들어 있으며, pH는 7.0입니다.
바이알 마개는 천연 고무 라텍스로 제조되지 않았습니다.
NUCALA 주사는 멸균, 방부제가 없고 투명에서 유백색, 무색에서 옅은 노랑색에서 옅은 갈색의 피하용 용액입니다.
NUCALA 주사는 단회 투여용 1-mL 자가주입기(고정된 29게이지, 반인치 바늘)와 단회 투여용 1-mL 사전충전 주사기(고정된 29게이지, 반인치 바늘과 바늘 보호대)가 있습니다. 각각의 1 mL에는 메폴리주맙 100mg, 시트르산 일수화물(0.95mg), EDTA 이수소나트륨 2수화물(0.019mg), 폴리소르베이트 80(0.20mg), 이수소인산나트륨 7수화물(4.16mg), 슈크로스(120mg)가 들어 있으며, pH는 6.3입니다.
NUCALA 주사는 단회 투여용 0.4-mL 사전충전 주사기(고정된 29게이지, 반인치 바늘과 바늘 보호대)가 있습니다. 각각의 0.4 mL에는 메폴리주맙 40mg, 시트르산 일수화물(0.38mg), EDTA 이수소나트륨 2수화물(0.0074mg), 폴리소르베이트 80(0.08mg), 이수소인산나트륨 7수화물(1.66mg), 슈크로스(48mg)가 들어 있으며, pH는 6.3입니다.
사전충전된 자가주입기와 사전충전된 주사기는 천연 고무 라텍스로 제조되지 않았습니다.
12. 임상 약리
12.1 작용 기전
Mepolizumab는 IL-5 길항제(IgG1 카파)입니다. IL-5는 호산구의 성장 및 분화, 유주, 활성화 및 생존을 담당하는 주요 사이토카인입니다. Mepolizumab는 100pM의 해리 상수로 IL-5에 결합하여, 호산구 세포 표면에서 발현되는 IL-5 수용체 복합체의 알파 사슬에 대한 결합을 차단함으로써 IL-5의 생물학적 활성을 억제합니다. 염증은 천식, CRSwNP, EGPA 및 HES의 발병 기전에서 중요한 요소입니다. 여러 세포 유형(예: 비만 세포, 호산구, 호중구, 대식세포, 림프구) 및 매개체(예: 히스타민, 에이코사노이드, 류코트리엔, 사이토카인)가 염증에 관여합니다. Mepolizumab는 IL-5 신호 전달을 억제함으로써 호산구의 생성 및 생존을 감소시킵니다. 그러나 천식, CRSwNP, EGPA 및 HES에서 mepolizumab의 작용 기전은 아직 명확하게 밝혀지지 않았습니다.
12.2 약력학
혈액 호산구 수치가 200cells/mcL 초과인 천식 성인 환자에서 피하 또는 정맥으로 반복 투여한 mepolizumab에 대한 약동학적 반응(혈액 호산구 감소)을 평가했습니다. 환자들은 4가지 mepolizumab 치료법(28일마다 총 3회 투여) 중 하나를 받았습니다. 12.5mg 피하 주사, 125mg 피하 주사, 250mg 피하 주사 또는 75mg IV. 무작위 배정된 70명의 환자 중 66명이 시험을 완료했습니다. 기준치와 비교하여 혈액 호산구는 용량 의존적으로 감소했습니다. 3일째(투여 후 48시간)에 모든 치료군에서 혈액 호산구 수치 감소가 관찰되었습니다. 84일째(마지막 투여 후 4주)에 관찰된 혈액 호산구의 기준치 대비 기하 평균 감소는 12.5mg 피하 주사군, 75mg IV군, 125mg 피하 주사군 및 250mg 피하 주사군에서 각각 64%, 78%, 84% 및 90%였습니다. 84일째에 혈액 호산구를 최대 감소시키는 예측된 피하 주사 용량은 각각 11mg과 99mg으로 추정되었습니다. 이러한 결과와 중증 천식 성인 및 청소년 환자를 대상으로 한 용량 범위 악화 시험(시험 1)의 임상 효능 데이터는 확증적 중증 천식 시험에서 mepolizumab 75mg IV 및 100mg 피하 주사를 평가하는 데 뒷받침이 되었습니다. [임상 연구 참조 (14.1)]. 중증 천식 성인 및 청소년 환자를 대상으로 32주 동안 4주마다 mepolizumab 100mg을 피하 투여한 후(시험 2), 혈액 호산구는 기하 평균 40cells/mcL로 감소했으며, 이는 위약에 비해 기하 평균 84% 감소에 해당합니다.
또한 중증 천식이 있는 6~11세 소아에서 약력학적 반응(혈액 호산구 감소)을 평가했습니다. 52주 동안 4주마다 mepolizumab 40mg을 피하 투여한 후 혈액 호산구는 기하 평균 48cells/mcL로 감소했습니다. 이는 기준치에서 85%의 기하 평균 감소에 해당합니다.
성인, 청소년 및 소아에서 감소 정도는 치료 4주 이내에 관찰되었으며 치료 기간 내내 유지되었습니다.
CRSwNP 성인의 경우 52주 동안 4주마다 mepolizumab 100mg을 피하 투여한 후 혈액 호산구는 기하 평균 60cells/mcL로 감소했습니다. 위약에 비해 기하 평균 83% 감소했습니다. 이러한 감소 정도는 치료 4주 이내에 관찰되었으며 치료 기간 내내 유지되었습니다. [임상 연구 참조 (14.2)].
EGPA 성인의 경우 52주 동안 4주마다 mepolizumab 300mg을 피하 투여한 후 혈액 호산구는 기하 평균 38cells/mcL로 감소했습니다. 위약에 비해 기하 평균 83% 감소했으며, 이러한 감소 정도는 치료 4주 이내에 관찰되었습니다. [임상 연구 참조 (14.3)].
HES 청소년 및 성인의 경우 32주 동안 4주마다 mepolizumab 300mg을 피하 투여한 후 혈액 호산구는 기하 평균 70cells/mcL로 감소했습니다. 위약에 비해 기하 평균 92% 감소했습니다. [임상 연구 참조 (14.4)].
12.3 약동학
천식 성인 환자에게 피하 투여한 후 mepolizumab는 12.5~250mg의 용량 범위에서 용량에 비례하는 약동학을 보였습니다. CRSwNP(성인), EGPA(성인) 또는 HES(청소년 및 성인) 환자에서 관찰된 mepolizumab의 약동학적 특성은 중증 천식(청소년 및 성인) 환자에서 관찰된 약동학적 특성과 유사했습니다.
Mepolizumab 300mg을 피하 투여한 경우 mepolizumab 100mg을 투여한 경우보다 전신 노출이 약 3배 증가했습니다.
흡수
천식 청소년 및 성인 환자의 상완에 100mg을 피하 투여한 후 mepolizumab의 생체 이용률은 약 80%로 추정되었습니다.
4주마다 1회 반복 피하 투여한 후 항정 상태에서 약 2배의 축적이 나타났습니다.
분포
천식 성인 환자에서 mepolizumab의 모집단 중심 분포 용적은 70kg 개인의 경우 3.6L로 추정됩니다.
제거
천식 성인 환자에게 mepolizumab를 피하 투여한 후 평균 말기 반감기(t1/2)는 16~22일이었습니다. 천식 청소년 및 성인 환자에서 mepolizumab의 모집단 외관상 전신 청소율은 70kg 개인의 경우 0.28L/일로 추정됩니다.
대사: Mepolizumab는 신체에 널리 분포되어 있으며 간 조직에 국한되지 않은 단백질 분해 효소에 의해 분해되는 인간화 IgG1 단일클론 항체입니다.
특정 집단
인종 그룹 및 남성 및 여성 환자: 모집단 약동학 분석 결과 인종 및 성별이 mepolizumab 청소율에 미치는 영향은 유의미하지 않은 것으로 나타났습니다.
연령: 모집단 약동학 분석 결과 연령이 mepolizumab 청소율에 미치는 영향은 유의미하지 않은 것으로 나타났습니다.
소아 환자: 중증 천식이 있는 6~11세 피험자를 대상으로 한 공개 임상시험의 초기 12주 치료 단계에서 피하 투여 후 메폴리주맙 약동학을 조사했습니다. 40mg(체중 40kg 미만 소아) 또는 100mg(체중 40kg 이상 소아)을 피하 투여한 후 노출(AUC)은 100mg을 투여받은 성인 및 청소년에서 관찰된 것에 비해 각각 1.32배 및 1.97배 더 높았습니다. 이러한 결과를 바탕으로 체중과 관계없이 6~11세 소아에게 4주마다 40mg을 피하 투여한 경우 성인 및 청소년에서 관찰된 것과 유사한 예상 노출을 보였습니다.
신장애 환자: 메폴리주맙의 약동학에 대한 신장애의 영향을 조사하기 위한 임상시험은 수행된 바 없습니다. 모집단 약동학 분석에 따르면 크레아티닌 청소율이 50~80mL/min인 피험자와 신기능이 정상인 환자 간에 메폴리주맙 청소율은 유사했습니다. 크레아티닌 청소율이 50mL/min 미만인 피험자에 대한 데이터는 제한적이지만, 메폴리주맙은 신장을 통해 제거되지 않습니다.
간장애 환자: 메폴리주맙의 약동학에 대한 간장애의 영향을 조사하기 위한 임상시험은 수행된 바 없습니다. 메폴리주맙은 간 조직에 국한되지 않고 광범위하게 분포된 단백질 분해 효소에 의해 분해되기 때문에 간 기능의 변화는 메폴리주맙의 제거에 영향을 미치지 않을 것으로 예상됩니다.
약물 상호작용 연구
메폴리주맙에 대한 공식적인 약물 상호작용 연구는 수행된 바 없습니다. 3상 연구의 모집단 약동학 분석에서 일반적으로 병용되는 저분자 약물이 메폴리주맙 노출에 미치는 영향에 대한 증거는 없었습니다.
13. 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
메폴리주맙의 발암 가능성을 평가하기 위한 장기 동물 연구는 수행되지 않았습니다. 동물 모델을 사용한 출판된 문헌에 따르면 IL-5와 호산구는 종양 발생 부위에서 초기 염증 반응의 일부이며 종양 거부를 촉진할 수 있습니다. 그러나 다른 보고서는 종양으로의 호산구 침윤이 종양 성장을 촉진할 수 있음을 나타냅니다. 따라서 메폴리주맙과 같은 IL-5 항체로 인한 인간의 악성 종양 위험은 알려져 있지 않습니다.
4주마다 1회 최대 100mg/kg의 IV 용량으로 6개월 동안 메폴리주맙을 투여받은 붉은털원숭이의 생식 기관에서 부작용이 있는 조직 병리학적 소견이 나타나지 않아 수컷과 암컷의 생식력에 영향을 미치지 않았습니다(AUC 기준으로 300mg의 MRHD의 약 20배). 쥐 IL-5의 활성을 억제하는 유사한 항체를 1주일에 1회 50mg/kg의 IV 용량으로 투여받은 수컷과 암컷 CD-1 마우스의 교미 및 생식 성능에 영향을 미치지 않았습니다.
14개 임상 연구
14.1 중증 천식
12세 이상 환자에서 NUCALA의 천식 개발 프로그램에는 3개의 이중맹검, 무작위 배정, 위약 대조 시험이 포함되었습니다. 1개의 용량 범위 및 악화 시험(시험 1, NCT01000506)과 2개의 확인 시험(시험 2, NCT01691521 및 시험 3, NCT01691508)입니다. 메폴리주맙은 3개의 모든 시험에서 배경 치료에 추가하여 4주마다 투여되었습니다. 모든 환자는 시험 기간 동안 배경 천식 치료를 계속했습니다.
용량 범위 및 악화 시험
시험 1은 고용량 ICS와 추가 조절제(OCS 포함 또는 제외)를 정기적으로 사용했음에도 불구하고 이전 1년 동안 2회 이상 악화된 병력이 있는 중증 천식 환자를 대상으로 한 52주 용량 범위 및 악화 감소 시험이었습니다. 이 시험에 등록된 환자는 이전 12개월 동안 다음 4가지 사전 지정된 기준 중 하나 이상을 충족해야 했습니다. 혈액 호산구 수 ≥300개/mcL, 객담 호산구 수 ≥3%, 호기 일산화 질소 농도 ≥50ppb 또는 정기적인 유지 ICS/OCS를 25% 이하로 감소시킨 후 천식 조절 악화. 4주마다 1회 투여되는 메폴리주맙의 3가지 IV 용량(75, 250 및 750mg)을 위약과 비교하여 평가했습니다. 이 시험과 약력학 연구의 결과는 후속 시험에서 메폴리주맙 75mg IV 및 100mg 피하를 평가하는 것을 뒷받침했습니다. [임상 약리학(12.2) 참조]. NUCALA는 IV 사용에 적응증이 없으며 피하 투여로만 투여해야 합니다.
확인 시험
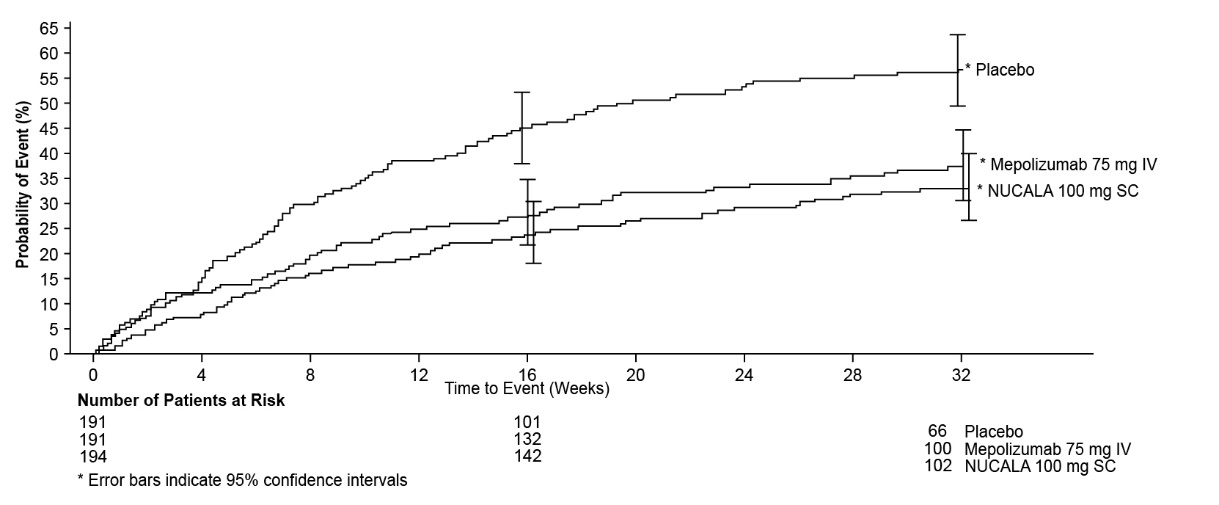
2개의 확인 시험(시험 2 및 3)에서 총 711명의 중증 천식 환자를 연구했습니다. 이 2개의 시험에서 환자는 선별 검사 시(투약 6주 이내) 혈액 호산구 수 ≥150개/mcL 또는 등록 후 12개월 이내에 혈액 호산구 수 ≥300개/mcL을 가져야 했습니다. 선별 검사 혈액 호산구 수 ≥150개/mcL 기준은 시험 1의 데이터에 대한 탐색적 분석에서 도출되었습니다. 시험 2는 고용량 ICS와 추가 조절제(OCS 포함 또는 제외)를 정기적으로 사용했음에도 불구하고 이전 1년 동안 2회 이상 악화된 병력이 있는 중증 천식 환자를 대상으로 한 32주 위약 및 활성 대조 시험이었습니다. 환자는 32주 동안 4주마다 1회 메폴리주맙 75mg IV(n=191), NUCALA 100mg(n=194) 또는 위약(n=191)을 투여받았습니다.
시험 3은 정기적인 고용량 ICS와 추가 조절제를 사용했음에도 불구하고 천식 조절을 유지하기 위해 매일 OCS가 필요한 중증 천식 환자를 대상으로 한 24주 OCS 감소 시험이었습니다. 시험 3의 환자는 이전 1년 동안 악화된 병력이 있을 필요가 없었습니다. 환자는 24주 동안 4주마다 1회 NUCALA 100mg(n=69) 또는 위약(n=66)을 투여받았습니다. 기준선 평균 OCS 사용량은 2개의 치료 그룹에서 유사했습니다. 위약 그룹은 13.2mg, NUCALA 100mg을 투여받은 그룹은 12.4mg이었습니다.
이 3개의 시험의 인구 통계 및 기준선 특성은 표 3에 나와 있습니다.
| FEV1 = 1초 강제 호기량, SABA = 단기 작용 베타2-작용제, FVC = 강제 폐활량. | |||
|
시험 1 (N = 616) |
시험 2 (N = 576) |
시험 3 (N = 135) |
|
|
평균 연령, 년 |
49 |
50 |
50 |
|
여성, n (%) |
387 (63) |
328 (57) |
74 (55) |
|
백인, n (%) |
554 (90) |
450 (78) |
128 (95) |
|
천식 기간, 년, 평균 |
19 |
20 |
19 |
|
금연, n (%) |
483 (78) |
417 (72) |
82 (61) |
|
기준선 FEV1, L |
1.88 |
1.82 |
1.95 |
|
기준선 예측 FEV1의 % |
60 |
61 |
59 |
|
기준선 % 가역성 |
25 |
27 |
26 |
|
기준선 post-SABA FEV1/FVC |
0.67 |
0.66 |
0.66 |
|
기준선 기하 평균 호산구 수, cells/mcL |
250 |
290 |
240 |
|
이전 년도 평균 악화 횟수 |
3.6 |
3.6 |
3.1 |
악화
효능은 경구/전신 코르티코스테로이드 사용 및/또는 입원 및/또는 응급실 방문이 필요한 천식 악화의 빈도로 정의된 종점을 사용하여 시험 1 및 2에서 평가되었습니다. 유지 OCS를 복용하는 환자의 경우, OCS가 필요한 악화는 기존 용량의 최소 2배 이상의 경구/전신 코르티코스테로이드를 최소 3일 이상 사용하는 것으로 정의되었습니다. 위약과 비교하여 NUCALA 100mg 또는 메폴리주맙 75mg IV를 투여받은 환자는 악화가 현저히 적었습니다. 또한 위약과 비교하여 NUCALA 100mg으로 입원 및/또는 응급실 방문이 필요한 악화와 입원만 필요한 악화가 더 적었습니다(표 4).
| IV = 정맥, SC = 피하. | ||||||||
|
시험 |
치료 |
연간 악화 |
||||||
|
율 |
차이 |
율 비 (95% CI) |
||||||
|
모든 악화 |
||||||||
|
시험 1 |
위약 (n = 155) |
2.40 |
||||||
|
메폴리주맙 75mg IV (n = 153) |
1.24 |
1.16 |
0.52 (0.39, 0.69) |
|||||
|
시험 2 |
위약 (n = 191) |
1.74 |
||||||
|
메폴리주맙 75mg IV (n = 191) |
0.93 |
0.81 |
0.53 (0.40, 0.72) |
|||||
|
NUCALA 100mg SC (n = 194) |
0.83 |
0.91 |
0.47 (0.35, 0.64) |
|||||
|
입원/응급실 방문이 필요한 악화 |
||||||||
|
시험 1 |
위약 (n = 155) |
0.43 |
||||||
|
메폴리주맙 75mg IV (n = 153) |
0.17 |
0.26 |
0.40 (0.19, 0.81) |
|||||
|
시험 2 |
위약 (n = 191) |
0.20 |
||||||
|
메폴리주맙 75mg IV (n = 191) |
0.14 |
0.06 |
0.68 (0.33, 1.41) |
|||||
|
NUCALA 100mg SC (n = 194) |
0.08 |
0.12 |
0.39 (0.18, 0.83) |
|||||
|
입원이 필요한 악화 |
||||||||
|
시험 1 |
위약 (n = 155) |
0.18 |
||||||
|
메폴리주맙 75 mg IV (n = 153) |
0.11 |
0.07 |
0.61 (0.28, 1.33) |
|||||
|
시험 2 |
위약 (n = 191) |
0.10 |
||||||
|
메폴리주맙 75 mg IV (n = 191) |
0.06 |
0.04 |
0.61 (0.23, 1.66) |
|||||
|
NUCALA 100 mg SC (n = 194) |
0.03 |
0.07 |
0.31 (0.11, 0.91) |
|||||
시험 2에서 NUCALA 100mg 및 메폴리주맙 75mg IV를 투여받은 그룹은 위약군에 비해 첫 악화까지의 시간이 더 길었습니다(그림 1).
그림 1. 첫 악화까지의 시간에 대한 Kaplan-Meier 누적 발생률 곡선(중증 천식 시험 2)
IV = 정맥, SC = 피하.
시험 1 데이터를 탐색하여 NUCALA 치료로부터 이익을 볼 가능성이 있는 환자를 식별할 수 있는 기준을 결정했습니다. 탐색적 분석 결과 기준 혈액 호산구 수가 ≥150 cells/mcL인 경우 치료 효과를 예측할 수 있는 잠재적 지표임을 시사했습니다. 시험 2 데이터의 탐색적 분석 결과 기준 혈액 호산구 수(투약 시작 후 6주 이내에 측정)가 ≥150 cells/mcL인 경우 효능을 예측할 수 있는 잠재적 지표임을 시사했으며, 혈액 호산구 수가 증가할수록 악화로부터의 이익이 더 큰 경향을 보였습니다. 시험 2에서 이전 12개월 동안 기준 혈액 호산구 수가 ≥300 cells/mcL인 경우에만 등록되었지만 기준 혈액 호산구 수가 <150 cells/mcL인 환자는 NUCALA 100mg으로 치료한 후 위약군에 비해 악화로부터 거의 이익을 보지 못했습니다.
경구 코르티코스테로이드 감소
시험 3에서는 NUCALA 100mg이 유지용 OCS 사용을 줄이는 데 미치는 영향을 평가했습니다. 효능은 천식 조절을 유지하면서 기준 용량과 비교하여 20주에서 24주 동안 OCS 용량 감소율을 백분율로 나타낸 종말점을 사용하여 평가했습니다. 환자는 시험 중 OCS 사용 변화에 따라 다음과 같은 범주로 분류되었습니다. 90%에서 100% 감소, 75%에서 <90% 감소, 50%에서 <75% 감소, >0%에서 <50% 감소, 개선 없음(즉, 변화 없음 또는 증가 또는 천식 조절 실패 또는 치료 중단). 위약군과 비교하여 NUCALA 100mg을 투여받은 환자는 천식 조절을 유지하면서 일일 유지용 OCS 용량 감소율이 더 높았습니다. NUCALA 100mg을 투여받은 그룹의 16명(23%) 환자는 위약군의 7명(11%) 환자에 비해 OCS 용량이 90%에서 100% 감소했습니다. NUCALA 100mg을 투여받은 그룹의 25명(36%) 환자는 위약군의 37명(56%) 환자에 비해 OCS 용량에 대한 개선이 없는 것으로 분류되었습니다. 또한 NUCALA 100mg을 투여받은 환자의 54%는 위약군을 투여받은 환자의 33%에 비해 일일 프레드니손 용량이 최소 50% 감소했습니다(차이에 대한 95% CI: 4%, 37%). 시험 3에서 기준 및 선별 혈액 호산구 수가 평균 <150 cells/mcL인 29명의 환자 하위 그룹에 대한 탐색적 분석도 수행했습니다. NUCALA 100mg을 투여받은 그룹의 5명(29%) 환자는 위약군의 0명(0%) 환자에 비해 용량이 90%에서 100% 감소했습니다. NUCALA 100mg을 투여받은 그룹의 4명(24%) 환자는 위약군의 8명(67%) 환자에 비해 OCS 용량에 대한 개선이 없는 것으로 분류되었습니다. ACQ 및 SGRQ도 시험 3에서 평가했으며 시험 2와 유사한 결과를 보였습니다.
폐 기능
3개의 모든 시험에서 기준선 대비 평균 1초 강제 호기량(FEV1) 변화를 측정했으며 표 5에 제시되어 있습니다. 위약군과 비교하여 NUCALA 100mg은 기준선 대비 평균 FEV1 변화에 대한 일관된 개선을 제공하지 못했습니다.
| FEV1 = 1초 강제 호기량. a 용량 = 75mg 정맥. b 52주차 1초 강제 호기량(FEV1). c 용량 = 100mg 피하. d 32주차 FEV1. |
||||||||||||
|
시험 |
위약군과 비교한 기준선 대비 평균 FEV1 (mL) 변화 차이(95% CI) |
|||||||||||
|
12주차 |
24주차 |
32/52주차 |
||||||||||
|
1a |
10 (-87, 108) |
5 (-98, 108) |
61 (-39, 161)b |
|||||||||
|
2c |
52 (-30, 134) |
76 (-6, 159) |
98 (11, 184)d |
|||||||||
|
3c |
56 (-91, 203) |
114 (-42, 271) |
NA |
|||||||||
메폴리주맙의 폐 기능에 대한 효과는 증상과 폐 기능 저하가 있는 중등도 ICS를 복용하는 천식 환자를 대상으로 한 12주 위약 대조 시험에서도 연구되었습니다. 등록은 악화 병력이나 사전에 지정된 호산구 수에 의존하지 않았습니다. 12주차에 FEV1의 기준선 대비 변화는 메폴리주맙 치료군에서 위약군보다 수치상으로 낮았습니다.
14.2 비강용종을 동반한 만성 비부비동염
비강용종을 동반한 만성 비부비동염(CRSwNP) 환자 407명을 대상으로 무작위 배정, 이중 맹검, 위약 대조, 다기관, 52주 시험(NCT03085797)을 실시했습니다. 환자는 비강 코르티코스테로이드 요법을 지속하면서 4주마다 1회 피하 주사로 NUCALA 100mg 또는 위약을 투여받았습니다. 환자는 선별 검사 전 ≥8주 동안 배경 비강 코르티코스테로이드를 투여받아야 했습니다. 환자는 재발성 및 증상성 CRSwNP를 보였으며, 지난 10년 이내에 비강용종 제거 수술을 1회 이상 받았습니다. 환자는 시각적 아날로그 척도(VAS) 점수가 최대 점수 10점 중 5점 이상인 비강 폐쇄 증상이 있어야 했습니다. 환자는 또한 양측 비강용종 점수(NPS)가 8점 중 ≥5점이고 각 비강에서 NPS가 ≥2점이어야 했습니다. 환자는 0(없음)에서 100(상상할 수 있는 최악)까지 표시된 연속선에 표시를 하나만 하여 매일 비강 폐쇄 VAS 점수를 보고했습니다. 선을 따라 거리는 점수를 매기기 위해 0에서 10점 척도로 변환되었습니다. NPS의 경우, 코 양쪽의 용종은 범주형 척도(0 = 용종 없음, 1 = 중간 비강에 있는 작은 용종으로 중간 갑개의 하단 경계 아래에 도달하지 않음, 2 = 중간 비갑개의 하단 경계 아래에 도달하는 용종, 3 = 하단 비갑개의 하단 경계에 도달하는 큰 용종 또는 중간 갑개 내측에 있는 용종, 4 = 하단 비강을 거의 완전히 막는 큰 용종)로 등급이 매겨져 총 점수가 0에서 8점이 되었습니다. 부비동 CT 스캔은 기준선에서도 치료 중에도 부비동 불투명도를 평가하기 위해 수행되지 않았습니다.
공동 일차 종료점은 독립적인 맹검 평가자에 의해 등급이 매겨진 총 내시경 NPS(0에서 8점 척도)의 기준선 대비 52주차 변화와 49주차에서 52주차 동안 비강 폐쇄 VAS 점수(0에서 10점 척도)의 기준선 대비 변화였습니다. 주요 이차 종료점은 이 시험에서 52주차까지 첫 비강 수술(비강용종 절제술)까지의 시간이었습니다. 다른 이차 종료점은 49주차에서 52주차 동안 후각 상실 VAS 점수의 기준선 대비 변화와 52주차까지 비강용종에 대한 전신 스테로이드가 필요한 환자의 비율이었습니다. 모든 VAS 점수는 환자에 의해 매일 수집되었으며 0에서 10점 척도(0 = 없음, 10 = 상상할 수 있는 최악)로 보고되었습니다.
이 시험에 참여한 환자의 인구 통계학적 특징과 기준선 특징은 표 6에 나와 있습니다.
| CRSwNP = 비강용종을 동반한 만성 비부비동염, SD = 표준 편차, OCS = 경구 코르티코스테로이드, NPS = 비강용종 점수, VAS = 시각적 아날로그 척도, AERD = 아스피린 악화 호흡기 질환. a 독립적인 맹검 평가자에 의해 등급이 매겨짐. |
|
|
N = 407 |
|
|
평균 연령, 년 |
49 |
|
여성, n (%) |
143 (35) |
|
백인, n (%) |
379 (93) |
|
평균 CRSwNP 기간, 년(SD) |
11.4 (8.4) |
|
지난 10년 동안 ≥1회 수술을 받은 환자(%) |
407 (100) |
|
지난 10년 동안 ≥3회 수술을 받은 환자(%) |
124 (30) |
|
지난 12개월 동안 OCS 사용(≥1 코스), n (%) |
197 (48) |
|
평균 양측 내시경 NPSa, (SD), 범위 0-8 |
5.5 (1.29) |
|
평균 비강 폐쇄 VAS 점수, (SD), 범위 0-10 |
9.0 (0.83) |
|
혈액 호산구 세포/mcL의 기하 평균(95% CI) |
390 (360, 420) |
|
천식, n (%) |
289 (71) |
|
AERD, n (%) |
108 (27) |
내시경적 비강 용종 점수 및 비강 폐쇄 시각적 아날로그 척도 점수
NUCALA 100mg을 투여받은 환자는 52주 치료 기간이 끝나는 시점에 52주차에 양측 NPS에서 통계적으로 유의미한 개선(감소)을 보였으며, 49주에서 52주까지 비강 폐쇄 VAS 점수가 개선되었습니다(표 7).
| CRSwNP = 비강 용종을 동반한 만성 부비동염, SD = 표준 편차, SE = 표준 오차, NPS = 52주차 비강 용종 점수. a 비강 수술을 받은 환자는 비강 수술 후 기간 동안 최악의 점수를 받았습니다. 누락된 데이터는 치료군 전반에 걸쳐 사용 가능한 치료 중단 데이터를 기반으로 대입되었습니다. 대입은 방문별로 단계적으로 이루어졌으며, 분석 모델에 사용된 동일한 공변량을 사용하여 이전 방문의 데이터를 조건으로 했습니다. b 치료군, 지리적 지역, 기준선 점수 및 로그(e) 기준선 혈액 호산구 수, 방문, 방문별 기준선 및 방문별 치료에 대한 상호 작용 항을 공변량으로 사용하는 혼합 모델 반복 측정을 사용한 분석에서 추정된 최소 제곱 평균. |
|||||||
|
점수a (범위) |
위약 n = 201 |
NUCALA 100mg n = 206 |
위약 대비 평균 차이 |
||||
|
기준선 평균 (SD) |
평균 변화b (SE) |
기준선 평균 (SD) |
평균 변화b (SE) |
||||
|
NPS (0-8) |
5.6 (1.41) |
0.06 (0.14) |
5.4 (1.17) |
-0.87 (0.14) |
-0.93 (-1.31, -0.55) |
||
|
비강 폐쇄 (0-10) |
9.02 (0.83) |
-2.54 (0.25) |
8.92 (0.83) |
-4.40 (0.25) |
-1.86 (-2.53, -1.19) |
||
비강 용종 절제술
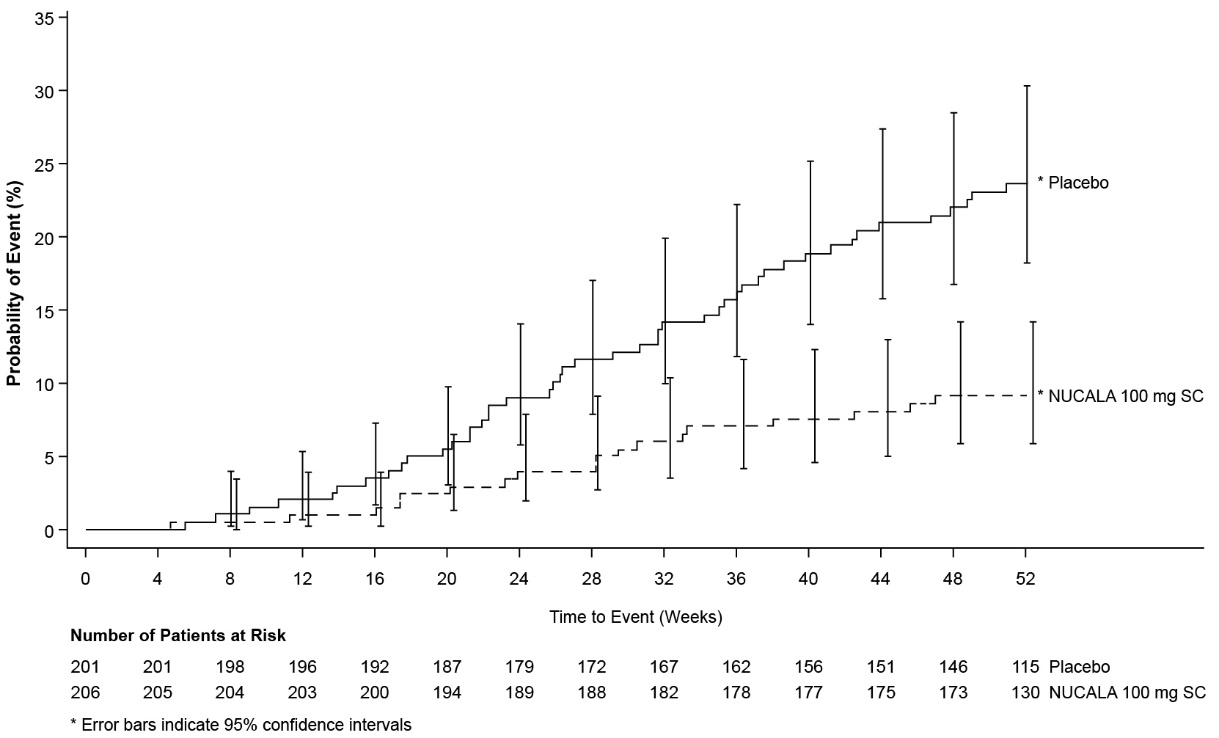
주요 2차 평가변수는 52주까지 최초 비강 수술(비강 용종 절제술)까지의 시간이었습니다. NUCALA 100mg으로 치료받은 그룹에서 수술을 받은 환자의 비율은 위약 그룹에 비해 57% 유의하게 감소했습니다(위험 비율: 0.43, 95% CI: 0.25, 0.76)(그림 2). 52주까지 NUCALA 100mg을 투여받은 환자 18명(9%)이 수술을 받은 반면 위약 그룹에서는 46명(23%)이 수술을 받았습니다.
그림 2. CRSwNP에서 최초 비강 수술까지의 시간에 대한 Kaplan-Meier 플롯
CRSwNP = 비강 용종을 동반한 만성 부비동염, SC = 피하.
추가 CRSwNP 증상 점수
NUCALA 100mg을 투여받은 환자의 경우 위약 그룹에 비해 후각 상실이 통계적으로 유의하게 개선되었으며, 52주 치료 기간 종료 전 4주 동안 위약 그룹 환자에 비해 개별 VAS 증상 점수도 개선되었습니다(표 8).
| VAS = 시각 아날로그 척도; SD = 표준 편차; SE = 표준 오차. a 비강 수술을 받은 환자는 비강 수술 후 기간에 대해 최악의 점수를 받았습니다. 누락된 데이터는 치료군 전반에 걸쳐 사용 가능한 치료 중단 데이터를 기반으로 대입되었습니다. 대입은 방문별로 단계적으로 수행되었으며 분석 모델에 사용된 동일한 공변량을 사용하여 이전 방문의 데이터를 조건으로 했습니다. b 치료군, 지리적 지역, 기준선 점수 및 로그(e) 기준선 혈액 호산구 수 방문, 방문별 기준선 및 방문별 치료에 대한 상호 작용 항을 공변량으로 사용하는 혼합 모델 반복 측정을 사용한 분석에서 얻은 최소 제곱 평균. c 이 평가변수는 다중성을 조정하기 위한 분석 계획에 사전에 지정되지 않았습니다. |
|||||||||||||
|
VAS 점수a (범위) |
위약 n = 201 |
NUCALA 100mg n = 206 |
위약 대비 평균 차이 (95% CI) |
||||||||||
|
기준선 평균 (SD) |
평균 변화b (SE) |
기준선 평균 (SD) |
평균 변화b (SE) |
||||||||||
|
후각 상실 (0-10) |
9.68 (0.60) |
-1.46 (0.24) |
9.63 (0.83) |
-2.92 (0.24) |
-1.46 (-2.11, -0.81) |
||||||||
|
비강 분비물c (0-10) |
8.78 (1.25) |
-2.49 (0.26) |
8.78 (1.07) |
-4.38 (0.25) |
-1.89 (-2.58, -1.20) |
||||||||
|
인후의 점액c (0-10) |
8.58 (1.63) |
-2.37 (0.26) |
8.51 (1.61) |
-4.07 (0.26) |
-1.70 (-2.41, -0.99) |
||||||||
|
안면 통증c (0-10) |
7.77 (2.72) |
-2.04 (0.28) |
7.76 (2.51) |
-3.73 (0.27) |
-1.69 (-2.43, -0.95) |
||||||||
14.3 호산구성 육아종성 혈관염
총 136명의 성인 EGPA 환자를 무작위 배정, 위약 대조, 다기관, 52주 시험(NCT02020889)에서 평가했습니다. 환자는 안정적인 OCS 요법을 계속하면서 4주마다 1회 피하 주사로 NUCALA 300mg 또는 위약을 투여받았습니다. 4주부터 연구자의 재량에 따라 치료 기간 동안 OCS를 감량했습니다. 이 시험에서 효능은 52주 치료 기간 동안 누적된 완화 기간의 총합으로 평가했으며, 이는 버밍햄 혈관염 활동 점수(BVAS) = 0(활성 혈관염 없음)과 프레드니솔론 또는 프레드니손 용량이 4mg/일 이하인 것으로 정의되었으며, 치료 36주차와 48주차에 완화 상태인 환자의 비율로 평가했습니다. BVAS는 다른 원인을 배제한 후 치료가 필요할 가능성이 있는 임상적으로 활성화된 혈관염을 평가하기 위해 임상의가 완료하는 도구입니다.
이 시험에서 환자의 인구 통계학적 특징과 기준선 특징은 표 9에 나와 있습니다.
| EGPA = 호산구성 육아종성 혈관염, SD = 표준 편차. a 프레드니손 또는 프레드니솔론 등가물. b 예: 아자티오프린, 메토트렉세이트, 미코페놀산. |
|
|
N = 136 |
|
|
평균 연령, 년 |
48.5 |
|
여성, n (%) |
80 (59) |
|
백인, n (%) |
125 (92) |
|
EGPA 기간, 년, 평균(SD) |
5.5 (4.63) |
|
지난 2년 동안 확인된 재발이 1회 이상인 병력, n (%) |
100 (74) |
|
난치성 질환, n (%) |
74 (54) |
|
EGPA 증상 재발, n (%) |
68 (50) |
|
유도 치료 실패, n (%) |
6 (4) |
|
기준선 경구 코르티코스테로이드a 일일 용량, mg, 중앙값(범위) |
12 (7.5-50) |
|
면역 억제 요법b 수령, n (%) |
72 (53) |
관해
NUCALA 300mg를 투여받은 환자는 위약군에 비해 관해 상태에 도달한 누적 시간이 유의하게 길었다. NUCALA 300mg를 투여받은 환자는 위약군에 비해 36주차와 48주차 모두에서 유의하게 더 많은 비율의 환자가 관해 상태에 도달했다(표 10 참조). 관해의 구성 요소에 대한 결과도 표 10에 나와 있다. 또한 NUCALA 300mg를 투여받은 환자는 위약군에 비해 52주 임상 시험 치료 기간 동안 첫 24주 안에 관해 상태에 도달하고 관해 상태를 유지한 환자가 유의하게 많았다(NUCALA 300mg 투여군 19% 대 위약군 1%; OR 19.7; 95% CI: 2.3, 167.9).
| EGPA = 호산구성 육아종성 혈관염, OCS = 경구용 코르티코스테로이드, BVAS = 버밍햄 혈관염 활동 점수. a 1보다 큰 승산비는 NUCALA를 지지한다. |
||||||||
|
관해 (OCS ≤4 mg/day + BVAS = 0) |
OCS ≤4 mg/day |
BVAS = 0 |
||||||
|
위약 n = 68 |
NUCALA 300 mg n = 68 |
위약 n = 68 |
NUCALA 300 mg n = 68 |
위약 n = 68 |
NUCALA 300 mg n = 68 |
|||
|
52주 동안 누적 기간, n (%) |
||||||||
|
0 |
55 (81) |
32 (47) |
46 (68) |
27 (40) |
6 (9) |
3 (4) |
||
|
>0 to <12주 |
8 (12) |
8 (12) |
12 (18) |
5 (7) |
15 (22) |
13 (19) |
||
|
12 to <24주 |
3 (4) |
9 (13) |
6 (9) |
12 (18) |
11 (16) |
5 (7) |
||
|
24 to <36주 |
0 |
10 (15) |
2 (3) |
10 (15) |
17 (25) |
2 (3) |
||
|
≥36주 |
2 (3) |
9 (13) |
2 (3) |
14 (21) |
19 (28) |
45 (66) |
||
|
승산비 (NUCALA/위약)a |
5.9 |
5.1 |
3.7 |
|||||
|
(95% CI) |
(2.7, 13.0) |
(2.5, 10.4) |
(1.8, 7.6) |
|||||
|
36주차와 48주차 모두에서 환자 비율 |
||||||||
|
환자, n (%) |
2 (3) |
22 (32) |
7 (10) |
28 (41) |
23 (34) |
34 (50) |
||
|
Odds ratio (NUCALA/위약)a |
16.7 |
6.6 |
1.9 |
|||||
|
(95% CI) |
(3.6, 77.6) |
(2.6, 17.1) |
(0.9, 4.2) |
|||||
또한, BVAS = 0 및 프레드니솔론/프레드니손 ≤7.5 mg/일에 대한 완화로 정의된 완화에 대해 통계적으로 유의미한 이점이 입증되었습니다.
재발
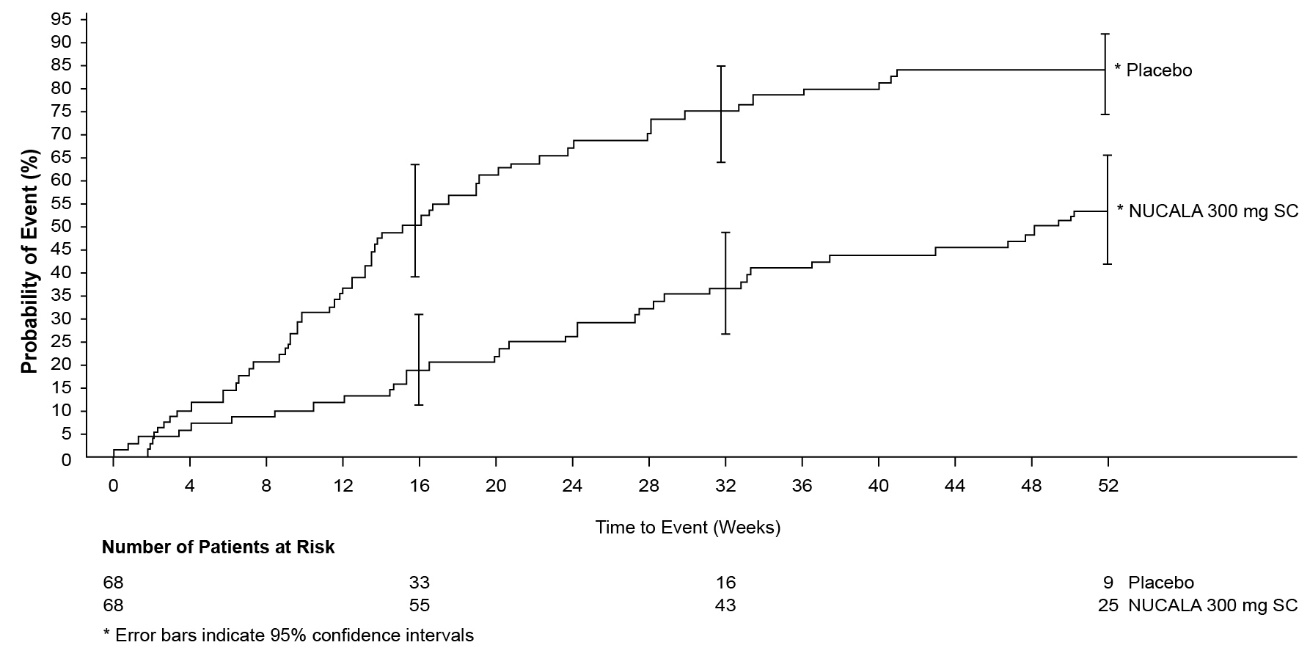
첫 번째 재발까지의 시간(혈관염, 천식 또는 비강 증상 악화로 인해 코르티코스테로이드 또는 면역 억제 요법의 용량 증가 또는 입원이 필요한 것으로 정의됨)은 300mg의 NUCALA를 투여받은 환자의 경우 위약을 투여받은 환자에 비해 유의하게 길었으며, 위험 비율은 0.32(95% CI: 0.21, 0.5)였습니다(그림 3). 또한, 300mg의 NUCALA를 투여받은 환자는 위약을 투여받은 환자에 비해 재발률이 감소했습니다(300 mg의 NUCALA를 투여받은 환자의 경우 위약에 비해 비율 비율 0.50; 95% CI: 0.36, 0.70). 재발 유형(혈관염, 천식, 비강)의 발생률과 수는 NUCALA를 투여받은 환자의 경우 위약을 투여받은 환자에 비해 수치적으로 낮았습니다.
그림 3. EGPA에서 첫 번째 재발까지의 시간에 대한 Kaplan-Meier 플롯
EGPA = 호산구성 육아종성 폴리안지이티스, SC = 피하.
코르티코스테로이드 감소
300 mg의 NUCALA를 투여받은 환자는 48주차부터 52주차까지 위약을 투여받은 환자에 비해 평균 일일 OCS 용량이 유의하게 감소했습니다(표 11).
| EGPA = 호산구성 육아종성 폴리안지이티스. a 치료 그룹, 기준선 경구 코르티코스테로이드 일일 용량, 기준선 버밍햄 혈관염 활동 점수 및 지역의 공변량을 사용하여 비례 확률 모델을 사용하여 분석했습니다. b Odds ratio <1은 NUCALA를 선호합니다. |
|||||||||||
|
환자 수 (%) |
|||||||||||
|
위약 n = 68 |
NUCALA 300 mg n = 68 |
||||||||||
|
0 |
2 (3) |
12 (18) |
|||||||||
|
>0 to ≤4.0 mg |
3 (4) |
18 (26) |
|||||||||
|
>4.0 to ≤7.5 mg |
18 (26) |
10 (15) |
|||||||||
|
>7.5 mg |
45 (66) |
28 (41) |
|||||||||
|
비교: NUCALA/위약a |
|||||||||||
|
Odds ratiob |
0.20 |
||||||||||
|
95% CI |
0.09, 0.41 |
||||||||||
14.4 과호산구증후군
만 12세 이상 성인 및 청소년 환자 108명을 대상으로 최소 6개월 이상 HES를 앓은 환자를 대상으로 무작위 배정, 이중 맹검, 위약 대조, 다기관, 32주 시험(NCT02836496)을 실시했습니다. 비혈액학적 이차 HES(예: 약물 과민 반응, 기생충성 선충 감염, HIV 감염, 비혈액학적 악성 종양) 또는 FIP1L1-PDGFRα 키나아제 양성 HES 환자는 시험에서 제외되었습니다. 환자는 안정적인 HES 치료를 계속하면서 4주마다 1회 NUCALA 300mg 또는 위약을 피하 주사했습니다. 시험에 참여한 환자는 선별 검사 중에 최소 2회 HES 악화가 발생했고 혈액 호산구 수가 1,000개/mcL 이상이었습니다. 시험 참여 기준에 따른 과거 HES 악화는 치료 강화가 필요한 HES 관련 임상 증상 악화 또는 혈액 호산구 수 증가로 정의되었습니다. 환자는 무작위 배정 전 4주 동안 안정적인 HES 치료를 받아야 했습니다. HES 치료에는 만성 또는 간헐적 OCS, 면역 억제제 또는 세포 독성 치료가 포함될 수 있습니다.
HES에서 NUCALA의 효능은 32주 치료 기간 동안 HES 악화를 경험한 환자의 비율을 기준으로 평가했습니다. HES 악화는 HES의 임상 징후 및 증상 악화 또는 호산구 증가(최소 2회)로 인해 OCS 증량 또는 세포 독성 또는 면역 억제 HES 치료 증량/추가가 필요한 경우로 정의했습니다.
이 시험에 참여한 환자의 인구 통계학적 특징 및 기준선 특징은 표 12에 나와 있습니다.
| HES = 과호산구증후군, SD = 표준 편차. | |
|
N = 108 |
|
|
평균 연령, 년(SD) |
46.0 (15.78) |
|
여성, n (%) |
57 (53) |
|
백인, n (%) |
100 (93) |
|
HES 평균 지속 기간, 년 |
5.55 |
악화
이 시험은 NUCALA 및 위약 치료 그룹에서 HES 악화를 경험하거나 시험에서 탈퇴한 환자의 비율을 비교했습니다(표 13). 32주 치료 기간 동안 치료 기간 동안 HES 악화 발생률은 위약 그룹에서 56%, NUCALA 치료 그룹에서 28%(50% 감소)였습니다.
| HES = 과호산구증후군, CMH = 코크란-맨텔-핸젤. a 분석은 ≥1회 HES 악화를 경험하거나 시험에서 조기에 탈퇴한 환자 수를 비교했습니다. b 오즈 비율 <1은 NUCALA에 유리합니다. |
||||
|
환자 수 (%) |
||||
|
위약 n = 54 |
NUCALA 300 mg n = 54 |
|||
|
≥1회 HES 악화를 경험하거나 시험에서 탈퇴한 환자 |
30 (56) |
15 (28) |
||
|
≥1회 HES 악화를 경험한 환자 |
28 (52) |
14 (26) |
||
|
HES 악화 없이 시험에서 탈퇴한 환자 |
2 (4) |
1 (2) |
||
|
비교: NUCALA/위약a |
||||
|
CMH P 값 |
0.002 |
|||
|
오즈 비율b |
0.28 |
|||
|
95% CI |
(0.12, 0.64) |
|||
최초 발병까지의 시간
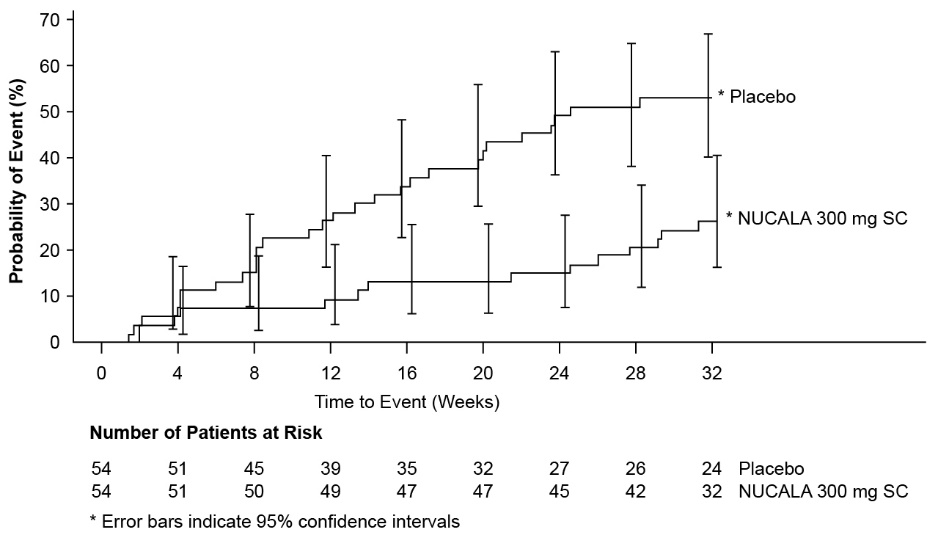
NUCALA군과 위약군 사이에 최초 HES 발병까지의 시간에 차이가 관찰되었습니다(그림 4). NUCALA로 치료받은 환자의 경우 위약군에 비해 치료 기간 동안 최초 HES 발병 위험이 66% 낮았습니다(위험 비율: 0.34; 95% CI 0.18, 0.67, P = 0.002).
그림 4. 최초 HES 발병까지의 시간에 대한 Kaplan-Meier 곡선
HES = 고호산구증후군, SC = 피하.
20주차부터 32주차까지 발병을 경험한 환자의 비율
20주차부터 32주차까지 NUCALA 300mg으로 치료받은 환자의 경우 위약군에 비해 HES 발병 또는 시험에서 탈퇴한 환자가 유의미하게 적었습니다(각각 17% 대 35%, P = 0.020; OR: 0.33; 95% CI: 0.13, 0.85).
발병률
NUCALA를 투여받은 환자는 32주 치료 기간 동안 위약군에 비해 HES 발병이 유의미하게 적었습니다(표 14). NUCALA 치료는 위약군에 비해 HES 발병의 연간 발생률을 통계적으로 유의미하게 66% 감소시켰습니다.
| a 사전에 지정된 종료점 계층 구조를 기반으로 조정된 P 값. b 비율 비율 <1은 NUCALA에 유리합니다. |
|||||||
|
환자 수 (%) |
|||||||
|
위약 n = 54 |
NUCALA 300 mg n = 54 |
||||||
|
0 |
26 (48) |
40 (74) |
|||||
|
1 |
15 (28) |
11 (20) |
|||||
|
2 |
7 (13) |
3 (6) |
|||||
|
3 |
5 (9) |
0 |
|||||
|
4 |
1 (2) |
0 |
|||||
|
≥5 |
0 |
0 |
|||||
|
비교: NUCALA/위약 |
|||||||
|
Wilcoxon P 값 (미조정/조정)a |
0.002/0.02 |
||||||
|
발생률/년 |
1.46 |
0.50 |
|||||
|
비율 비율b |
0.34 |
||||||
|
95% CI |
(0.19, 0.63) |
||||||
간단 피로 설문지
간단 피로 설문지(BFI) 항목 3은 환자에게 지난 24시간 동안 가장 심했던 피로/지침 정도를 기록하도록 요청합니다(척도: 0 = 피로 없음에서 10 = 상상할 수 있는 최악의 피로). 기준선에서 BFI 항목 3 점수 중앙값은 치료군 간에 유사했습니다(NUCALA 300mg의 경우 4.46, 위약의 경우 4.69). 32주차에 BFI 항목 3 점수는 위약에 비해 NUCALA로 개선되었습니다(P = 0.036). 32주차에 BFI 항목 3의 기준선 점수에서 중앙값 변화는 NUCALA로 치료받은 그룹의 경우 -0.66, 위약군의 경우 0.32였습니다.
16. 공급/보관 및 취급
주사용 NUCALA
주사용 NUCALA (메폴리주맙)는 재구성 및 피하 주사를 위한 멸균된 방부제가 없는 백색에서 거의 백색의 동결 건조 분말로, 플립 오프 씰이 있는 단회용 유리 바이알에 포장되어 있습니다. 바이알 마개는 천연 고무 라텍스로 만들어지지 않았습니다.
주사용 NUCALA는 다음과 같이 공급됩니다.
100mg 단회용 바이알, 1개들이 상자 (NDC 0173-0881-01).
바이알은 77°F (25°C) 이하에서 보관하십시오. 냉동하지 마십시오. 빛으로부터 보호하기 위해 원래 상자에 보관하십시오.
NUCALA 주사제
NUCALA (메폴리주맙) 주사제는 피하 주사용 멸균된 방부제가 없는 투명하거나 유백색의 무색에서 옅은 노란색 또는 옅은 갈색 용액입니다. 각 단회용 미리 채워진 자동 주사기는 1mL 용액에 메폴리주맙 100mg을 제공합니다. 각 단회용 미리 채워진 주사기는 1mL 용액에 메폴리주맙 100mg 또는 0.4mL 용액에 메폴리주맙 40mg을 제공합니다. 자동 주사기 및 주사기는 천연 고무 라텍스로 만들어지지 않았습니다.
NUCALA 주사제는 다음과 같이 공급됩니다.
- •
- 100mg/mL, 단회용, 미리 채워진 자동 주사기, 부착된 29게이지, 1/2인치 바늘, 1개들이 상자 (NDC 0173-0892-01).
- •
- 100mg/mL, 단회용, 미리 채워진 유리 주사기, 부착된 29게이지, 1/2인치 바늘, 바늘 보호대, 1개들이 상자 (NDC 0173-0892-42).
- •
- 40mg/0.4mL, 단회용, 미리 채워진 유리 주사기, 부착된 29게이지, 1/2인치 바늘, 바늘 보호대, 1개들이 상자 (NDC 0173-0904-42).
분배 전: 미리 채워진 자동 주사기 및 미리 채워진 주사기를 36°F에서 46°F (2°C에서 8°C) 사이의 온도에서 냉장 보관하십시오. 빛으로부터 보호하기 위해 제품을 원래 상자에 보관하십시오. 냉동하지 마십시오. 흔들지 마십시오. 열에 노출되지 않도록 하십시오.
분배 후: 미리 채워진 자동 주사기 및 미리 채워진 주사기를 36°F에서 46°F (2°C에서 8°C) 사이의 온도에서 냉장 보관하십시오. 사용할 때까지 제품을 빛으로부터 보호하기 위해 원래 상자에 보관하십시오. 냉동하지 마십시오. 흔들지 마십시오. 열에 노출되지 않도록 하십시오.
필요한 경우, 개봉하지 않은 상자는 최대 86°F (30°C)에서 최대 7일 동안 냉장고 외부에 보관할 수 있습니다. 냉장고 외부에 7일 이상 보관한 경우 폐기하십시오.
NUCALA 주사제는 상자에서 꺼낸 후 8시간 이내에 투여해야 합니다. 8시간 이내에 투여하지 않으면 폐기하십시오.
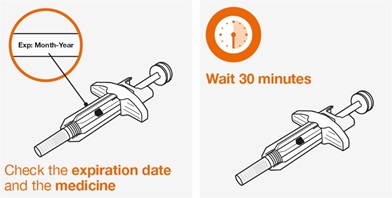
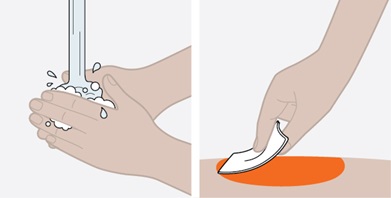
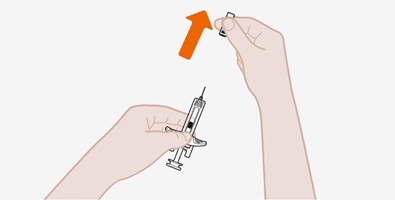
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 알려주십시오.
과민 반응
환자에게 NUCALA 투여 후 과민 반응(예: 아나필락시스, 안지오에데마, 기관지 경련, 저혈압, 두드러기, 발진)이 발생했음을 알려주십시오. 이러한 반응이 발생하면 의사에게 연락하도록 지시하십시오.
급성 증상 또는 악화되는 질병에 사용하지 마십시오
환자에게 NUCALA는 급성 천식 증상이나 급성 악화를 치료하지 않는다는 것을 알려주십시오. NUCALA 치료를 시작한 후 천식이 조절되지 않거나 악화되면 의사의 진료를 받도록 알려주십시오.
기회 감염: 대상포진
환자에게 NUCALA를 투여받은 환자에서 대상포진 감염이 발생했음을 알려주십시오. 의학적으로 적절한 경우 환자에게 예방 접종을 고려해야 함을 알려주십시오.
코르티코스테로이드 용량 감소
환자에게 의사의 직접적인 감독 하에서만 전신 또는 흡입 코르티코스테로이드를 중단하지 않도록 알려주십시오. 환자에게 코르티코스테로이드 용량 감소는 전신 금단 증상 및/또는 전신 코르티코스테로이드 요법으로 이전에 억제되었던 상태를 드러낼 수 있음을 알려주십시오.
상표는 GSK 그룹 회사의 소유 또는 라이선스를 받았습니다.
제조사
GlaxoSmithKline LLC
Philadelphia, PA 19104
미국 라이선스 번호 1727
판매원
GlaxoSmithKline
Durham, NC 27701
©2023 GSK 그룹 회사 또는 라이선스 제공자.
NCL:10PI
환자용 설명서
|
환자 정보 |
|
|
NUCALA (뉴칼라) (메폴리주맙) 주사제, 피하 주사용 |
NUCALA (뉴칼라) (메폴리주맙) 주사제, 피하 주사용 |
|
NUCALA는 무엇입니까?
NUCALA가 6세 미만의 중증 천식 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. NUCALA가 18세 미만의 CRSwNP 또는 EGPA 어린이 및 청소년에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. NUCALA가 12세 미만의 HES 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
|
NUCALA를 사용하지 마십시오 메폴리주맙 또는 NUCALA의 성분에 알레르기가 있는 경우. NUCALA의 성분 목록은 이 첨부 문서의 끝부분을 참조하십시오. |
|
|
NUCALA를 투여받기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료진에게 알리십시오.
|
|
|
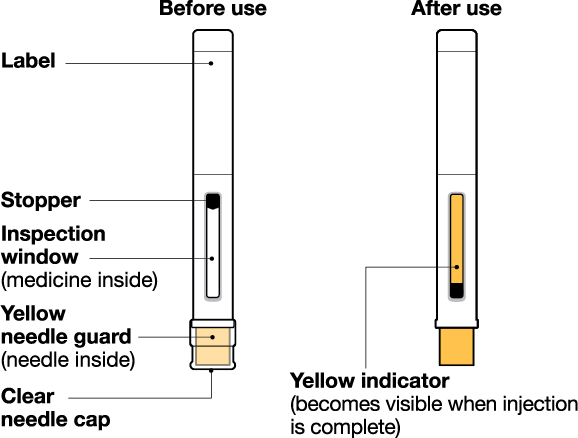
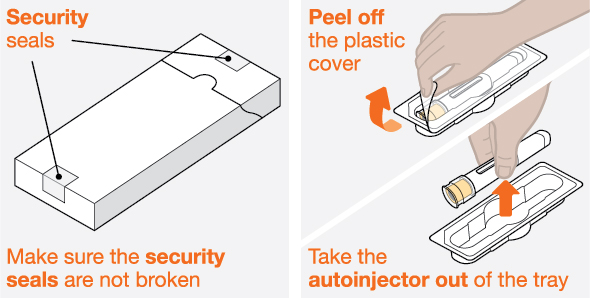
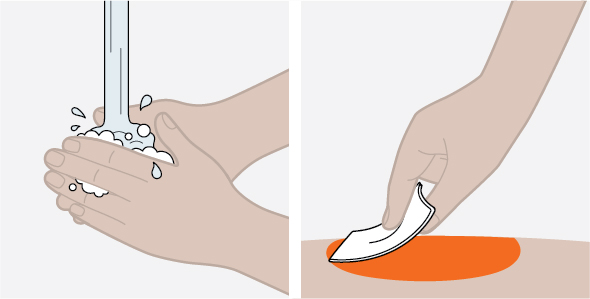
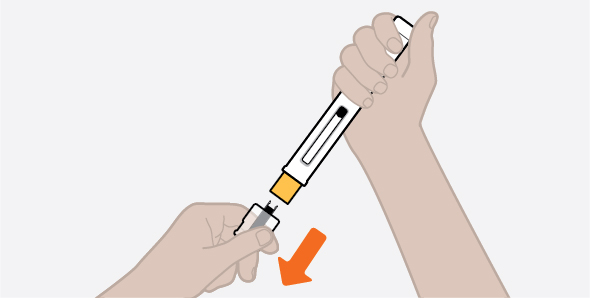
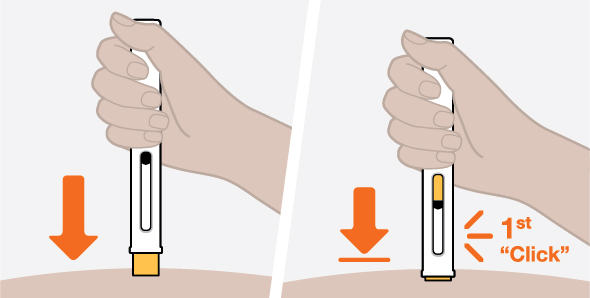
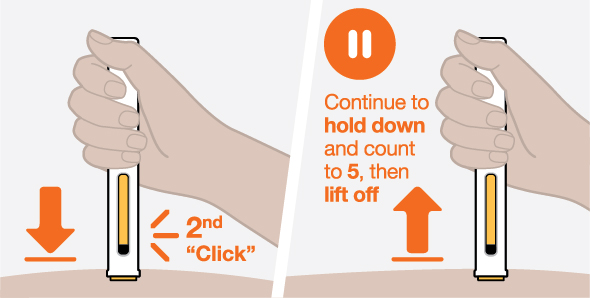
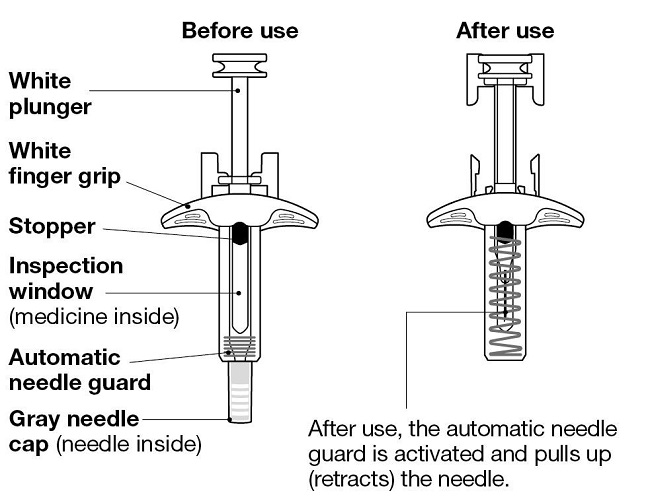
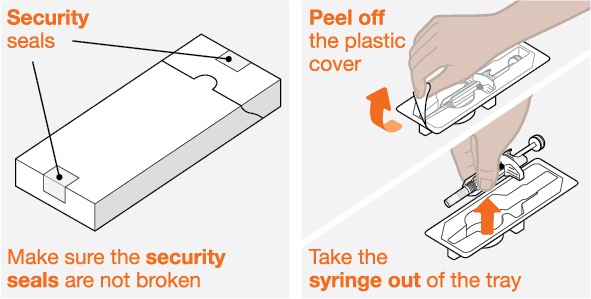
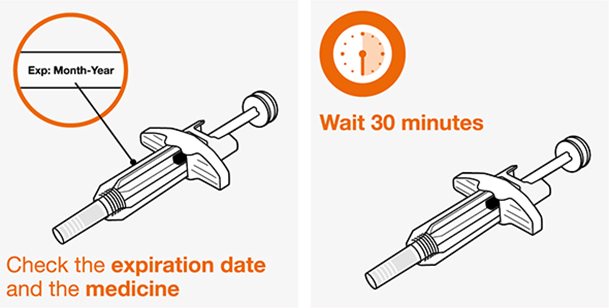
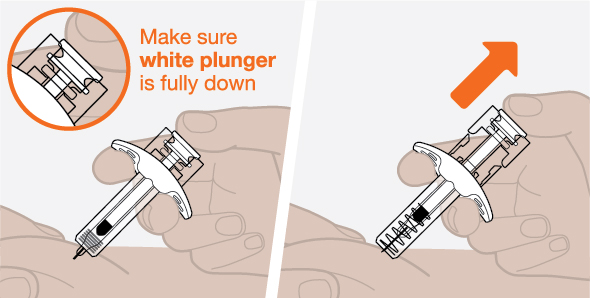
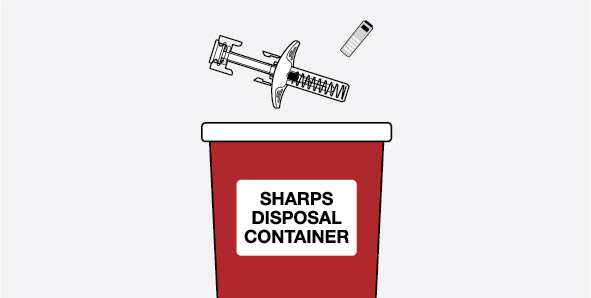
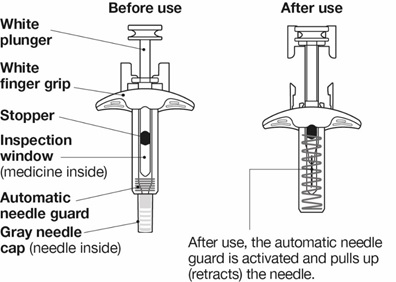
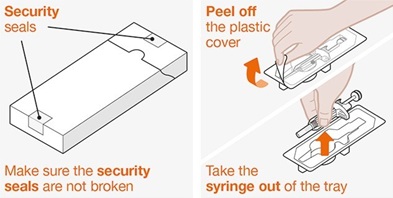
NUCALA는 어떻게 투여받습니까? 의료진은 치료받는 질환에 따라 적절한 용량을 처방할 것입니다. 의료진이 주사를 투여하는 경우:
환자 또는 환자 보호자가 사전 충전 주사기 또는 사전 충전 자동 주사기를 사용하여 주사를 투여하는 경우:
|
|
NUCALA의 가능한 부작용은 무엇입니까?
NUCALA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
- •
- 아나필락시스를 포함한 알레르기(과민반응). NUCALA 주사를 맞은 후 심각한 알레르기 반응이 발생할 수 있습니다. 알레르기 반응은 때때로 NUCALA 투여 후 몇 시간 또는 며칠 후에 발생할 수 있습니다. 알레르기 반응 증상이 나타나면 즉시 의료 서비스 제공자에게 알리거나 응급 처치를 받으십시오. 알레르기 반응 증상은 다음과 같습니다.
ο 얼굴, 입, 혀의 부기 ο 호흡 곤란
ο 실신, 현기증, 어지러움(저혈압) ο 발진
ο 두드러기
- •
- 대상포진 감염. 대상포진을 일으킬 수 있는 대상포진 감염은 NUCALA를 투여받은 사람들에게 발생했습니다.
NUCALA의 가장 흔한 부작용은 다음과 같습니다. 두통, 주사 부위 반응(주사 부위의 통증, 발적, 부기, 가려움증 또는 화끈거림), 요통 및 피로(피로). CRSwNP와 관련하여 입/목 통증 및 관절 통증이 보고되었습니다.
이것들은 NUCALA의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088.
NUCALA는 어떻게 보관해야 합니까?
- •
- 미리 채워진 자동 주사기와 미리 채워진 주사기를 냉장고에 36°F에서 46°F(2°C에서 8°C) 사이에 보관하십시오.
- •
- 빛으로부터 보호하기 위해 사용할 때까지 미리 채워진 자동 주사기와 미리 채워진 주사기를 원래 상자에 보관하십시오.
- •
- 냉동하지 마십시오. 흔들지 마십시오. 열기에서 멀리 보관하십시오.
- •
- 필요한 경우, 개봉하지 않은 상자는 최대 7일 동안 86°F(30°C)까지 냉장고 밖에 보관할 수 있습니다.
- •
- 개봉하지 않은 상자가 냉장고 밖에 7일 이상 보관된 경우 미리 채워진 자동 주사기와 미리 채워진 주사기를 안전하게 버리십시오.
- •
- 미리 채워진 자동 주사기와 미리 채워진 주사기는 상자에서 꺼낸 후 8시간 이내에 사용해야 합니다. 8시간 이내에 사용하지 않으면 안전하게 버리십시오.
- •
- 유효 기간이 지났거나 더 이상 필요하지 않은 약은 안전하게 버리십시오.
NUCALA와 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오.
NUCALA의 안전하고 효과적인 사용에 대한 일반 정보.
약은 때때로 환자 정보 전단에 나열된 목적 이외의 목적으로 처방됩니다. 동일한 증상이 있어도 다른 사람에게 NUCALA를 주지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 NUCALA에 대한 정보를 요청할 수 있습니다.
NUCALA의 성분은 무엇입니까?
활성 성분: mepolizumab.
비활성 성분(바이알): polysorbate 80, sodium phosphate dibasic heptahydrate 및 sucrose.
비활성 성분(미리 채워진 자동 주사기 및 미리 채워진 주사기): citric acid monohydrate, EDTA disodium dihydrate, polysorbate 80, sodium phosphate dibasic heptahydrate 및 sucrose.
NUCALA에 대한 자세한 내용은 1-888-825-5249로 전화하거나 웹사이트 www.NUCALA.com을 방문하십시오.
상표는 GSK 그룹 회사의 소유 또는 라이선스를 받았습니다.
제조사:
GlaxoSmithKline LLC, Philadelphia, PA 19104, U.S. License No. 1727
판매원:
GlaxoSmithKline, Durham, NC 27701
©2023 GSK 그룹 회사 또는 라이선스 제공자.
NCL:9PIL
- 이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2023년 3월
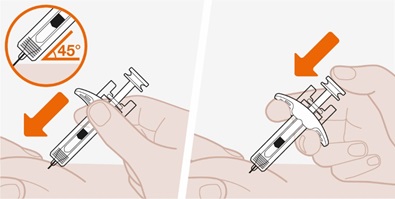
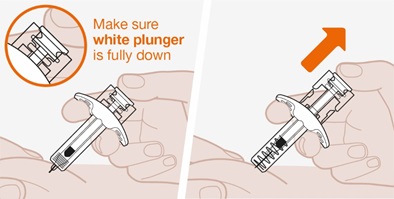
사용 설명서
포장/라벨 표시 패널
주요 디스플레이 패널
NDC 0173-0881-01
누칼라
(메폴리주맙)
주사용
100mg/바이알
전문의 처방전만 필요
GSK
재구성 후 피하 주사용.
재구성된 용액은 100mg/mL을 함유합니다.
단회용 바이알. 사용하지 않은 부분은 폐기
내용물: 각 바이알에는 메폴리주맙 100mg, 폴리소르베이트 80(0.67mg), 인산수소이칼륨 7수화물(7.14mg), 슈크로스(160mg)가 함유된다.
보존제 없음.
미국 표준 효능 없음.
1 바이알
접착된 카톤 씰이 파손된 경우 수용하지 마세요.
©2023 GSK 그룹 회사 또는 라이센스 제공자.
- Rev. 4/23
- 62000000087874
주요 표시 패널
주요 표시 패널
NDC 0173-0892-01
Nucala
(mepolizumab)
100 mg/mL
처방전 필요
GSK
사전 충전 자동 주사기
피하 주사 전용입니다.
내용물:
-1회용 1mL 사전 충전 자동 주사기
-사용 지침
-처방 정보
-환자 정보
©2023 GSK 그룹 계열사 또는 라이선스 제공자.
보안 씰이 없거나 손상된 경우 받지 마십시오.
- 62000000087671 Rev. 5/23
주요 표시 패널
주요 표시 패널
NDC 0173-0904-42
Nucala
(mepolizumab)
주사제
40mg/0.4 mL
처방전 필요
GSK
사전 충전 주사기
피하 주사 전용입니다.
내용물:
– 0.4mL 사전 충전 주사기 1개
– 사용 설명서
– 처방 정보
– 환자 정보
©2023 GSK 그룹 또는 라이선스 제공자.
보안 씰이 없거나 손상된 경우 받지 마십시오.
Rev. 4/23
62000000087781