의약품 제조업체: Novo Nordisk (Updated: 2020-07-10)
처방 정보의 주요 내용
NOVOSEVEN RT (coagulation Factor VIIa, recombinant)
정맥 주사용 용액용 동결 건조 분말
미국 최초 승인: 1999
적응증 및 사용법
투여량 및 투여 방법
정맥 주사 전용
출혈 에피소드 (2.1)
|
적응증 |
투여 권장 사항 |
|
억제제가 있는 선천적 혈우병 A 또는 B |
|
|
획득성 혈우병 |
|
|
선천적 Factor VII 결핍 |
|
|
Glanzmann’s Thrombasthenia |
|
수술 전 관리 (2.1)
|
적응증 |
투여 권장 사항 |
|
억제제가 있는 선천적 혈우병 A 또는 B |
경미한:
중증:
|
|
획득성 혈우병 |
|
|
선천적 Factor VII 결핍 |
|
|
Glanzmann’s Thrombasthenia |
|
제형 및 강도
1, 2, 5 또는 8 mg 재조합 응고 인자 VIIa(FVIIa)가 들어 있는 1회용 바이알의 동결 건조 분말로 제공됩니다. 지정된 부피의 히스티딘 희석액으로 재구성한 후 최종 용액은 재조합 FVIIa 1 mg/mL(1000 마이크로그램/mL)를 함유합니다. (3)
금기 사항
알려진 바 없음 (4)
경고 및 주의 사항
부작용
임상 시험에서 가장 흔하고 심각한 부작용은 혈전증입니다. 임상 시험에서 NOVOSEVEN 투여 후 혈전증 부작용은 후천성 혈우병 환자의 4%와 선천성 혈우병 환자의 출혈 에피소드 0.2%에서 발생했습니다. (6)
의심되는 부작용을 보고하려면 Novo Nordisk Inc.에 1-877-668-6777 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2020년 7월
목차
전문 처방 정보: 내용*
경고: 혈전증
1 적응증 및 용법
2 용량 및 투여
2.1 용량
2.2 재구성
2.3 투여
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 혈전증
5.2 과민 반응
5.3 제7인자 결핍 환자에서의 항체 형성
5.4 실험실 검사
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 손상
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 억제제가 있는 혈우병 A 또는 B
14.2 선천성 제7인자 결핍증
14.3 후천성 혈우병
14.4 Glanzmann 혈소판 무력증
15 참고 문헌
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전문 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
경고 사항
경고: 혈전증
- •
- NOVOSEVEN RT 투여 후 심각한 동맥 및 정맥 혈전증 사례가 보고되었습니다. [경고 및 주의 사항 (5.1)]
- •
- NOVOSEVEN RT를 투여받는 환자에게 혈전증 및 색전증의 위험과 증상을 설명하십시오. [경고 및 주의 사항 (5.1)]
- •
- 환자의 응고 시스템 활성화 및 혈전증 징후 또는 증상을 모니터링하십시오. [경고 및 주의 사항 (5.1)]
1 적응증 및 용법
NOVOSEVEN RT, Coagulation Factor VIIa (Recombinant)는 다음과 같은 경우에 사용됩니다.
- •
- 혈우병 A 또는 B 환자(인히비터가 있는 경우), 선천적 Factor VII (FVII) 결핍증 환자, 혈소판 수혈에 대한 반응이 없는 Glanzmann’s thrombasthenia 환자(혈소판에 대한 항체가 있는 경우 또는 없는 경우)의 출혈 에피소드 치료 및 수술 전 관리
- •
- 후천적 혈우병 환자의 출혈 에피소드 치료 및 수술 전 관리
2 투여 및 관리
정맥 주사로만 투여하십시오.
2.1 용량
- •
- NOVOSEVEN RT의 효과를 확인하고 NOVOSEVEN RT 치료 일정을 수정할 근거를 마련하기 위해 지혈 평가를 사용하십시오.
- •
- 응고 매개변수는 반드시 NOVOSEVEN RT의 효과와 상관관계가 있거나 예측하지 않습니다.
급성 출혈 에피소드 치료
급성 출혈 에피소드 치료를 위한 NOVOSEVEN RT 용량은 표 1에 나와 있습니다.
표 1: 급성 출혈 에피소드 치료를 위한 용량
| 용량* 및 빈도 |
치료 기간 | 추가 정보 |
|---|---|---|
|
||
|
억제제가 있는 선천성 혈우병 A 또는 B |
||
|
지혈 출혈의 심각도에 따라 조정 가능한 90 mcg/kg, 2시간마다 1회 지혈 후 심한 출혈의 경우 90 mcg/kg, 3-6시간마다 1회 |
지혈이 이루어질 때까지 또는 치료가 부적절하다고 판단될 때까지 지혈이 이루어진 후 지혈 마개를 유지하기 위해 |
지혈 후 적절한 투여 기간은 연구되지 않았습니다. |
|
후천성 혈우병 |
||
|
70-90 mcg/kg, 2-3시간마다 1회 |
지혈이 이루어질 때까지 |
|
|
선천성 제7인자 결핍증 |
||
|
15-30 mcg/kg, 4-6시간마다 1회 |
지혈이 이루어질 때까지 |
체중 kg당 10 마이크로그램만큼 낮은 용량으로 효과적인 치료가 이루어졌습니다. 각 환자에게 용량과 주사 빈도를 조정하십시오. |
|
글란츠만 혈소판 무력증 |
||
|
90 mcg/kg, 2-6시간마다 1회 |
전신 지혈 요법이 필요한 심한 출혈 에피소드의 경우 지혈이 이루어질 때까지 |
혈소판에 대한 내성이 없는 환자 또는 혈소판 특이적 항체가 없는 환자의 경우 혈소판 수혈이 글란츠만 혈소판 무력증 환자의 일차 치료입니다. |
억제제를 가진 선천성 혈우병 A 또는 B
- •
- 용량 및 투여 간격은 출혈의 심각도에 따라 개별 환자에게 조정될 수 있습니다.1
- •
- 관절 또는 근육 출혈 치료를 받은 환자의 경우, 대부분의 환자는 8회 투여 내에 결과에 대한 결정이 내려졌지만 심한 출혈의 경우 더 많은 투여가 필요했습니다. 부작용을 보고한 대부분의 환자는 12회 이상 투여를 받았습니다. 지혈 후 투여 기간을 모니터링하고 최소화하십시오.
수술 전 관리
수술적 개입 또는 침습적 절차(수술 전 관리)에서 출혈 예방을 위한 NOVOSEVEN RT 투여는 표 2에 나와 있습니다.
표 2: 수술 전 관리를 위한 투여
| 수술 유형 | 용량 및 빈도 | 추가 정보 |
|---|---|---|
|
||
|
억제제를 가진 선천성 혈우병 A 또는 B |
||
|
경미한 |
초기: 수술 후: 90 mcg/kg을 2시간마다 48시간 동안 투여한 후 치유가 될 때까지 2-6시간마다 투여 |
|
|
중증 |
초기: 수술 직전 90 mcg/kg을 투여하고 수술 기간 동안 2시간마다 반복 투여 수술 후: 90 mcg/kg을 2시간마다 5일 동안 투여한 후 치유가 될 때까지 4시간마다 또는 50 mcg/kg/hr로 연속 주입 |
추가 볼루스 용량을 투여할 수 있습니다. |
|
후천성 혈우병 |
||
|
경미하거나 중증 |
수술 직전 70-90 mcg/kg을 투여하고 수술 기간 동안 및 지혈이 될 때까지 2-3시간마다 반복 투여* |
|
|
선천성 제7인자 결핍증 |
||
|
경미하거나 중증 |
수술 직전 15-30 mcg/kg을 투여하고 수술 기간 동안 및 지혈이 될 때까지 4-6시간마다 반복 투여* 각 개별 환자에게 용량 및 주입 빈도를 조정하십시오. |
체중 kg당 10 마이크로그램만큼 낮은 용량이 효과적일 수 있습니다. |
|
글란츠만 혈소판 무력증 |
||
|
경미하거나 중증 |
초기: 수술 직전 90 mcg/kg을 투여하고 절차 기간 동안 2시간마다 반복 투여* 수술 후: 수술 후 출혈을 예방하기 위해 2-6시간마다 90 mcg/kg을 투여* |
혈소판 특이적 항체 유무에 관계없이 임상적 내성이 있는 수술 환자의 경우 100-140 마이크로그램/kg의 더 높은 용량을 사용할 수 있습니다. |
2.2 재구성
- •
- NOVOSEVEN RT의 준비 및 재구성을 위해 아래 절차를 따르십시오. 재구성에 대한 질문은 1-877-NOVO-777로 Novo Nordisk에 문의하십시오.
- •
- NOVOSEVEN RT 용량을 계산하고 1개의 히스티딘 희석제 바이알 또는 1개의 사전 충전된 히스티딘 희석제 주사기가 제공된 NOVOSEVEN RT 패키지 중 적절한 것을 선택하십시오.
- •
- NOVOSEVEN RT와 함께 제공된 히스티딘 희석제로만 재구성하십시오.
NOVOSEVEN RT 분말 1바이알과 히스티딘 희석제 1바이알이 포함된 NOVOSEVEN RT 패키지:
- 1.
- 항상 무균 기술을 사용하십시오.
- 2.
- NOVOSEVEN RT(흰색, 동결 건조 분말)와 지정된 양의 히스티딘(희석제)을 실온으로 가져오지만 37°C(98.6°F)를 초과하지 마십시오. NOVOSEVEN RT의 양에 해당하는 지정된 희석제의 양은 다음과 같습니다.
1 mg(1000 마이크로그램) 바이알 + 1.1 mL 히스티딘 희석제
2 mg(2000 마이크로그램) 바이알 + 2.1 mL 히스티딘 희석제
5 mg(5000 마이크로그램) 바이알 + 5.2 mL 히스티딘 희석제
8 mg(8000 마이크로그램) 바이알 + 8.1 mL 히스티딘 희석제 - 3.
- NOVOSEVEN RT 바이알에서 캡을 제거하여 고무 마개의 중앙 부분을 노출시킵니다. 고무 마개를 알코올 솜으로 닦고 사용하기 전에 말립니다.
- 4.
- 멸균 주사기(멸균 바늘 부착)의 플런저를 뒤로 당겨 주사기에 공기를 주입합니다. 게이지 크기가 20-26인 주사기 바늘을 사용하는 것이 좋습니다.
- 5.
- 주사기의 바늘을 히스티딘 희석제 바이알에 삽입합니다. 바이알에 공기를 주입하고 재구성에 필요한 양을 뽑아냅니다.
- 6.
- 희석제가 들어 있는 주사기 바늘을 고무 마개의 중앙을 통해 NOVOSEVEN RT 바이알에 삽입하여 바늘을 측면을 향하게 하여 액체가 바이알 벽을 따라 흘러내리도록 합니다(NOVOSEVEN RT 바이알에는 진공이 없습니다). 희석제를 NOVOSEVEN RT 분말에 직접 주입하지 마십시오.
- 7.
- 모든 물질이 용해될 때까지 바이알을 부드럽게 흔듭니다. 재구성된 용액은 투명하고 무색의 용액이며 재구성 후 실온 또는 냉장 보관하여 최대 3시간까지 보관할 수 있습니다. 지정된 양의 희석제로 재구성한 후 각 바이알에는 약 1mg/mL NOVOSEVEN RT(1000 마이크로그램/mL)가 들어 있습니다.
NOVOSEVEN RT 분말 1바이알과 바늘 없는 재구성을 위한 사전 충전된 히스티딘 희석제 주사기와 바이알 어댑터가 포함된 NOVOSEVEN RT 패키지:
- 1.
- 항상 무균 기술을 사용하십시오.
- 2.
- NOVOSEVEN RT(흰색, 동결 건조 분말)와 지정된 양의 히스티딘(희석제)을 실온으로 가져오지만 37°C(98.6°F)를 초과하지 마십시오. NOVOSEVEN RT의 양에 해당하는 지정된 희석제의 양은 다음과 같습니다.
1 mg(1000 마이크로그램) 바이알 + 1 mL 사전 충전된 주사기의 히스티딘 희석제
2 mg(2000 마이크로그램) 바이알 + 2 mL 사전 충전된 주사기의 히스티딘 희석제
5 mg(5000 마이크로그램) 바이알 + 5 mL 사전 충전된 주사기의 히스티딘 희석제
8 mg(8000 마이크로그램) 바이알 + 8 mL 사전 충전된 주사기의 히스티딘 희석제 - 3.
- NOVOSEVEN RT 바이알에서 캡을 제거합니다. 고무 마개를 알코올 솜으로 닦고 사용하기 전에 말립니다.
- 4.
- 바이알 어댑터에서 보호 용지를 벗겨냅니다. 바이알 어댑터를 포장에서 제거하지 마십시오.
- 5.
- NOVOSEVEN RT 바이알을 평평한 표면에 놓습니다. 바이알 어댑터 포장을 잡고 NOVOSEVEN RT 바이알 위에 바이알 어댑터를 놓고 바이알 어댑터 스파이크가 고무 마개를 관통할 때까지 포장을 단단히 누릅니다.
- 6.
- 플런저 로드를 주사기에 부착합니다. 플런저 로드를 사전 충전된 희석제 주사기 내부의 플런저에 시계 방향으로 돌려 저항이 느껴질 때까지 돌립니다. 사전 충전된 희석제 주사기에서 주사기 캡을 제거하고 바이알 어댑터에 나사로 고정합니다.
- 7.
- 플런저 로드를 밀어 천천히 모든 희석제를 바이알에 주입합니다. 플런저 로드를 계속 누르고 분말이 용해될 때까지 바이알을 부드럽게 흔듭니다. 재구성된 용액은 투명하고 무색의 용액이며 재구성 후 완전히 조립된 상태로 실온 또는 냉장 보관하여 최대 3시간까지 보관할 수 있습니다. 지정된 양의 희석제로 재구성한 후 각 바이알에는 약 1mg/mL NOVOSEVEN RT(1000 마이크로그램/mL)가 들어 있습니다.
2.3 투여
정맥 주사 전용
- •
- 용액과 용기가 허용하는 경우 투여 전에 재구성된 NOVOSEVEN RT를 시각적으로 검사하여 이물질과 변색이 있는지 확인하십시오. 이물질이나 변색이 관찰되면 사용하지 마십시오.
- •
- 재구성된 NOVOSEVEN RT를 냉동하거나 주사기에 보관하지 마십시오.
- •
- 재구성 후 3시간 이내에 투여하십시오.
- •
- 다른 주입 용액과 혼합하지 마십시오.
- •
- 사용하지 않은 용액은 버리십시오.
투여 직전에 다음 절차를 수행하십시오.
NOVOSEVEN RT 분말 1바이알과 히스티딘 희석제 1바이알이 포함된 NOVOSEVEN RT 패키지:
- 1. 항상 무균 기술을 사용하십시오.
- 2. 멸균 주사기(멸균 바늘 부착)의 플런저를 뒤로 당겨 주사기에 공기를 주입합니다.
- 3. 바늘을 재구성된 NOVOSEVEN RT 바이알에 삽입합니다. 바이알에 공기를 주입한 다음 주사기에 적절한 양의 재구성된 NOVOSEVEN RT를 뽑아냅니다.
- 4. 주사기에서 바늘을 제거하고 버립니다.
NOVOSEVEN RT 분말 1바이알과 바늘 없는 재구성을 위한 사전 충전된 히스티딘 희석제 주사기와 바이알 어댑터가 포함된 NOVOSEVEN RT 패키지:
- 1. 항상 무균 기법을 사용하십시오.
- 2. NOVOSEVEN RT 바이알을 뒤집습니다. 플런저 로드를 밀지 말고 혼합된 용액이 주사기에 채워질 때까지 스스로 움직이도록 합니다. 플런저 로드를 약간 아래로 당겨 혼합된 용액을 주사기에 채웁니다. 주사기를 두드려 기포를 제거하고 재구성된 NOVOSEVEN RT의 필요한 용량을 주사기에 뽑습니다.
- 3. 바이알 어댑터를 바이알에서 풀어냅니다. 바이알 어댑터가 부착된 빈 NOVOSEVEN RT 바이알을 버립니다.
주의:
- •
- 사전 충전된 희석제 주사기는 내부 팁 직경이 0.037인치인 유리로 만들어졌으며 표준 Luer-lock 커넥터와 호환됩니다.
- •
- 정맥 카테터용 일부 무침 커넥터는 유리 희석제 주사기와 호환되지 않습니다(예: Clave® /MicroClave®, InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior®, Bionector®와 같이 내부 스파이크가 있는 특정 커넥터). 이러한 커넥터를 사용하면 커넥터가 손상되어 투여에 영향을 미칠 수 있습니다. 호환되지 않는 무침 커넥터를 통해 제품을 투여하려면 재구성된 제품을 표준 10mL 멸균 Luer-lock 플라스틱 주사기에 뽑습니다.
- •
- 사전 충전된 히스티딘 희석제 주사기를 Luer lock 호환 장치에 부착하는 데 문제가 발생한 경우 Novo Nordisk(877) 668-6777로 연락하십시오.
다음 절차에 따라 NOVOSEVEN RT 볼루스 주입을 투여하십시오.
- 1. 투여된 용량에 따라 2~5분 동안 천천히 볼루스 주입으로 투여합니다.
- 2. NOVOSEVEN RT 투여 전후로 라인을 세척해야 하는 경우 0.9% 염화나트륨
- 주사, USP를 사용하십시오.
- 3. 재구성된 NOVOSEVEN RT는 3시간 후에 버립니다.
다음 절차에 따라 수술 전후 관리를 위해 NOVOSEVEN RT 연속 주입을 투여하십시오.
- 1.
- 주입 펌프를 사용하여 50 mcg/kg/hr의 속도로 연속 주입으로 투여합니다.
- 2.
- NOVOSEVEN RT 투여 전후로 라인을 세척해야 하는 경우 0.9% 염화나트륨 주사, USP를 사용하십시오.
3 제형 및 함량
NOVOSEVEN RT는 1mg(1000 마이크로그램), 2mg(2000 마이크로그램), 5mg(5000 마이크로그램), 또는 8mg(8000 마이크로그램)의 재조합 응고 인자 VIIa(rFVIIa)를 함유하는 단일 용량 바이알에서 하얀 동결건조 분말로 제공됩니다.
NOVOSEVEN RT를 재구성하기 위한 희석제는 주사용수에 10mmol의 L-히스티딘 용액입니다. 이는 투명하고 무색의 용액으로 바이알이나 미리 채워진 희석제 주사기에 제공되며 히스티딘 희석제라고 부릅니다.
히스티딘 희석제로 재구성한 후, 최종 용액은 mL당 약 1mg의 NOVOSEVEN RT(1000 마이크로그램/mL)를 함유합니다.
4 금기 사항
알려진 바 없음.
5 경고 및 주의 사항
5.1 혈전증
- •
- 임상 시험 및 시판 후 조사에서 심각한 동맥 및 정맥 혈전증 사례가 보고되었습니다.
- •
- 선천성 혈우병 환자에서 aPCC(활성화된 프로트롬빈 복합체 농축액)와 병용 치료를 받는 경우, 특히 후천성 혈우병이 있고 다른 지혈제를 투여받는 고령 환자 또는 심장, 혈관 질환 병력이 있거나 혈전증 발생 위험이 있는 환자는 혈전증 발생 위험이 증가할 수 있습니다 [부작용(6.1) 및 약물 상호 작용(7) 참조].
- •
- NOVOSEVEN RT를 투여받는 환자는 응고 시스템 활성화 또는 혈전증의 징후나 증상이 나타나는지 모니터링해야 합니다. 혈관 내 응고가 실험실적으로 확인되거나 임상적으로 혈전증이 있는 경우 환자의 상태에 따라 NOVOSEVEN RT의 용량을 줄이거나 치료를 중단해야 합니다.
5.2 과민 반응
NOVOSEVEN RT를 투여하면 아나필락시스를 포함한 과민 반응이 발생할 수 있습니다. 마우스, 햄스터 또는 소 단백질에 대한 과민 반응 병력이 있는 환자는 과민 반응 발생 위험이 높을 수 있습니다. 과민 반응이 발생하면 주입을 중단하고 적절한 치료를 실시해야 합니다.
5.3 제7인자 결핍 환자에서 항체 형성
제7인자 결핍 환자는 NOVOSEVEN RT 투여 전후로 프로트롬빈 시간(PT)과 제7인자 응고 활성을 모니터링해야 합니다. 제7인자a 활성이 예상 수준에 도달하지 않거나 프로트롬빈 시간이 교정되지 않거나 권장 용량으로 치료 후에도 출혈이 조절되지 않으면 항체 형성이 의심될 수 있으며 항체 검사를 실시해야 합니다.
5.4 실험실 검사
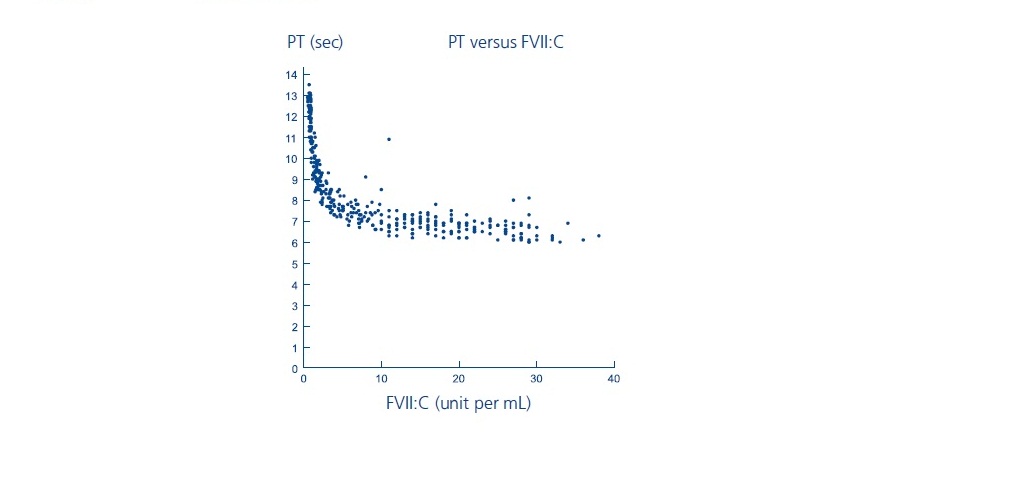
실험실 응고 지표(PT/INR, aPTT, FVII:C)는 지혈을 달성하는 것과 직접적인 상관관계가 없는 것으로 나타났습니다. 프로트롬빈 시간(PT/INR), 활성화 부분 트롬보플라스틴 시간(aPTT) 및 혈장 제7인자 응고 활성(FVII:C) 검사는 시약에 따라 다른 결과를 나타낼 수 있습니다. NOVOSEVEN 치료는 다음과 같은 특징을 나타내는 것으로 나타났습니다.
- PT: 아래와 같이 억제제가 있는 혈우병 A/B 환자의 경우 PT는 FVII:C 수준이 약 5단위/mL일 때 약 7초의 고원에 도달했습니다. FVII:C 수준이 5단위/mL를 초과하면 PT는 더 이상 변하지 않습니다. NOVOSEVEN RT 투여 후 프로트롬빈 시간 단축의 임상적 의미는 알려져 있지 않습니다.
- INR: NOVOSEVEN은 INR을 정상화할 수 있는 것으로 나타났습니다. 그러나 INR 값은 출혈 결과를 직접 예측하는 것으로 나타나지 않았으며, 와파린을 투여받은 건강한 자원봉사자에서 임상적으로 유도된 출혈 모델에서 출혈 시간/양에 대한 NOVOSEVEN의 영향을 입증할 수 없었습니다. 이때 실험실 지표(PT/INR, aPTT, 트롬보엘라스토그램)는 정상화되었습니다.
- aPTT: NOVOSEVEN 투여는 억제제가 있는 혈우병 A/B 환자에서 연장된 aPTT를 단축시키지만, 임상적 개선을 유도하는 것으로 나타난 용량에서는 일반적으로 정상화되지 않았습니다. 데이터에 따르면 임상적 개선은 aPTT가 15~20초 단축된 것과 관련이 있었습니다.
FVIIa:C: FVIIa:C 수준은 2시간 간격으로 2일간 투여한 후 체중 kg당 35마이크로그램과 90마이크로그램의 NOVOSEVEN 투여 후 2시간 후에 측정했습니다. 두 용량 수준에 대한 평균 정상 상태 수준은 각각 11단위/mL와 28단위/mL였습니다.
6 부작용
임상 시험에서 가장 흔하고 심각한 부작용은 혈전증입니다. 임상 시험에서 NOVOSEVEN 투여 후 혈전증 부작용은 후천성 혈우병 환자의 4%와 선천성 혈우병 환자의 출혈 에피소드의 0.2%에서 발생했습니다.
6.1 임상 시험 경험
임상 연구는 매우 다양한 조건에서 수행되므로, 의약품의 임상 시험에서 관찰된 부작용 발생률은 다른 의약품의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
아래에 설명된 부작용은 임상 시험과 레지스트리에서 수집된 데이터에서 보고되었습니다.
억제제가 있는 혈우병 A 또는 B 환자
억제제가 있는 혈우병 A 또는 B 환자를 대상으로 출혈 에피소드 치료를 위해 수행된 두 연구(N=298)에서, 1,939개의 출혈 에피소드에 대해 NOVOSEVEN으로 치료받은 환자의 2% 이상에서 부작용이 보고되었습니다(아래 표 3 참조).
표 3: 억제제가 있는 혈우병 A 또는 B 환자 298명 중 2% 이상에서 보고된 부작용
|
신체계 반응 |
부작용 수 (n=1,939 치료) |
환자 수 (n=298 환자) |
|
전신 |
||
|
발열 |
16 |
13 |
|
혈소판, 출혈 및 응고 |
||
|
혈장 피브리노겐 감소 |
10 |
5 |
|
심혈관 |
||
|
고혈압 |
9 |
6 |
심각한 부작용으로는 혈전증, 통증, 심부 정맥 혈전증, 폐색전증, 치료 반응 감소, 뇌혈관 장애, 협심증, DIC, 아나필락시스 쇼크 및 간 기능 이상이 포함되었습니다. DIC 및 치료 반응 감소의 심각한 부작용은 치명적인 결과를 초래했습니다.
억제제가 있는 혈우병 A 또는 B 환자에서 수술 전후 환경에서 NOVOSEVEN 투여의 안전성과 유효성을 평가한 두 건의 임상 시험(N=51)에서 다음과 같은 심각한 부작용이 보고되었습니다. 수술 후 급성 혈관절 출혈(n=1), 내경정맥 혈전증 부작용(n=1), 치료 반응 감소(n=4).
면역원성
동종 항체가 있는 선천성 혈우병 A 또는 B 환자에서 NOVOSEVEN 또는 FVII에 대한 억제 항체가 확인된 보고는 없습니다.
항체 형성의 발생률은 검사의 민감도와 특이도에 따라 달라집니다. 또한, 검사에서 관찰된 항체(중화 항체 포함) 양성 발생률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 NOVOSEVEN RT에 대한 항체 발생률을 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
선천성 제7인자 결핍증
연민적/긴급 사용 프로그램, 출판된 문헌, 약동학 연구 및 혈우병 및 혈전증 연구 협회2(HTRS) 레지스트리에서 수집된 데이터에 따르면 제7인자 결핍증이 있는 75명의 환자가 NOVOSEVEN을 투여받았습니다. 70명의 환자는 124개의 출혈 에피소드, 수술 또는 예방을 위해, 5명의 환자는 약동학 시험에 참여했습니다. 다음과 같은 부작용이 보고되었습니다. 두개 내 고혈압(n=1), rFVIIa 및 FVII에 대한 IgG 항체(n=1), 국소 정맥염(n=1).
면역원성
NOVOSEVEN RT로 치료받은 제7인자 결핍증이 있는 75명의 환자 중 1명은 rFVIIa 및 FVII에 대한 IgG 항체가 발생했습니다. NOVOSEVEN RT로 치료받은 제7인자 결핍증이 있는 환자는 제7인자 항체를 모니터링해야 합니다.
항체 형성의 발생률은 검사의 민감도와 특이도에 따라 달라집니다. 또한, 검사에서 관찰된 항체(중화 항체 포함) 양성 발생률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 NOVOSEVEN RT에 대한 항체 발생률을 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
후천성 혈우병
4개의 연민적 사용 프로그램, HTRS 레지스트리 및 출판된 문헌에서 수집된 데이터에 따르면 후천성 혈우병이 있는 139명의 환자가 204개의 출혈 에피소드, 수술 및 외상성 손상을 위해 NOVOSEVEN을 투여받았습니다. 이 139명의 환자 중 6명은 8개의 심각한 부작용을 경험했습니다. 심각한 부작용으로는 쇼크(n=1), 뇌졸중(n=1) 및 혈전색전증(n=6)이 포함되었으며, 여기에는 뇌동맥 폐쇄, 뇌 허혈, 협심증, 심근 경색, 폐색전증 및 심부 정맥 혈전증이 포함되었습니다. 심각한 부작용 중 3건은 치명적인 결과를 초래했습니다.
글란츠만 혈소판 무력증
글란츠만 혈소판 무력증 레지스트리(GTR) 및 HTRS 레지스트리에서 수집된 데이터에 따르면 글란츠만 혈소판 무력증이 있는 140명의 환자가 518개의 출혈 에피소드, 수술 또는 외상성 손상을 위해 NOVOSEVEN RT를 투여받았습니다. 다음과 같은 부작용이 보고되었습니다. 심부 정맥 혈전증(n=1), 두통(n=2), 발열(n=2), 메스꺼움(n=1) 및 호흡 곤란(n=1).
7 약물 상호작용
- •
- 활성화 프로트롬빈 복합 농축액의 동시 사용은 피하십시오.
- •
- NOVOSEVEN RT를 주입 용액과 혼합하지 마십시오.
- •
- NOVOSEVEN RT가 응고 인자 XIII과 동시에 투여되면 혈전증이 발생할 수 있습니다. [경고 및 주의사항 (5.1) 및 비임상 독성학 (13.2) 참조]
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
NOVOSEVEN RT를 사용한 임산부에 대한 적절하고 잘 통제된 연구가 없어 약물 관련 위험이 있는지 여부를 확인할 수 없습니다.
생식 연구에서 NOVOSEVEN으로 랫드와 토끼를 치료한 결과 각각 체중 kg당 6mg 및 5mg까지의 용량에서 사망과 관련이 있었습니다. 랫드에서 체중 kg당 6mg의 용량에서 유산율은 25마리 중 0마리였고, 토끼에서 체중 kg당 5mg의 용량에서 유산율은 25마리 중 2마리였습니다. 체중 kg당 6mg의 NOVOSEVEN을 투여받은 25마리의 암컷 랫드 중 23마리가 성공적으로 출산했지만, 23마리 중 2마리의 새끼가 수유 초기 단계에 사망했습니다. NOVOSEVEN 투여 후 기형 발생 증거는 관찰되지 않았습니다.
미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
8.2 수유
위험 요약
모유에서 NOVOSEVEN RT의 존재 여부, 모유 수유 아기에게 미치는 영향 및 모유 생산에 미치는 영향에 대한 정보가 없습니다. 모유 수유의 발달적 및 건강상 이점은 NOVOSEVEN RT에 대한 어머니의 임상적 필요와 NOVOSEVEN RT 또는 기저 모성 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
소아 환자를 대상으로 한 임상 시험은 나이에 따라가 아니라 체중에 따라 용량을 결정하여 수행되었습니다.
억제제가 있는 A형 또는 B형 혈우병
제품 개발의 조사 단계에서 NOVOSEVEN은 0세에서 2세 미만의 어린이 16명에게 151회의 출혈 에피소드, 2세에서 6세 미만의 어린이 27명에게 140회의 출혈 에피소드, 6세에서 12세 미만의 어린이 43명에게 375회의 출혈 에피소드, 12세에서 16세의 어린이 30명에게 446회의 출혈 에피소드에 사용되었습니다.
억제제 유무에 관계없이 A형 및 B형 혈우병 환자의 관절, 근육 및 점막 출혈 치료에 대한 NOVOSEVEN의 두 가지 용량 수준을 비교한 이중맹검, 무작위 배정 비교 시험에서 0세에서 12세 미만의 어린이 20명과 12세에서 16세의 어린이 8명이 kg당 35 또는 70 마이크로그램의 용량으로 NOVOSEVEN을 투여받았습니다. 치료는 효과적인 것으로 평가되었습니다(환자가 보고한 통증/압통의 확실한 완화 및/또는 출혈 크기의 측정 가능한 감소 및/또는 8시간 이내에 출혈이 멈춤[우수로 평가됨 = 51%], 8-14시간 이내[효과적임으로 평가됨 = 18%] 또는 14시간 후[부분적으로 효과적임으로 평가됨 = 25%]) 환자의 94%에서.
NOVOSEVEN은 수술에 대한 두 가지 시험에서 사용되었습니다. 용량 비교에서 0세에서 16세의 어린이 22명이 NOVOSEVEN을 투여받았습니다. 효과적인 수술 중 지혈(출혈이 완전히 멈추거나 상당히 감소한 것으로 정의됨[효과적임으로 평가됨 = 86%] 또는 출혈이 감소했지만 계속된 것으로 정의됨[부분적으로 효과적임으로 평가됨 = 9%])은 22명 중 21명(95%)의 환자에서 달성되었습니다. 90mcg/kg 용량 그룹에서는 10명 중 10명(100%)의 환자에서, 35mcg/kg 용량 그룹에서는 12명 중 10명(83%)의 환자에서 48시간에 효과적인 지혈이 달성되었습니다. 90mcg/kg 용량 그룹에서는 10명 중 10명(100%)의 환자에서, 35mcg/kg 용량 그룹에서는 12명 중 9명(75%)의 환자에서 5일째에 효과적인 지혈이 달성되었습니다.
볼루스(BI)와 연속 주입(CI)을 비교한 수술 시험에는 10세에서 15세의 어린이 6명이 참여했으며, 각 그룹에 3명이 있었습니다. 두 가지 요법 모두 수술 중, 첫 24시간 동안 및 5일째에 100% 효과적이었습니다(출혈이 완전히 멈추거나 상당히 감소한 것으로 정의됨). 연구 기간 종료 시(수술 후 10일째 또는 치료 중단) BI 그룹의 환자 2명에서 지혈이 효과적인 것으로 평가되었고, BI 그룹의 환자 1명에서 지혈이 비효과적인 것으로 평가되었습니다(출혈이 동일하거나 악화된 것으로 정의됨). CI 그룹의 환자 3명 모두에서 지혈이 효과적인 것으로 평가되었습니다.
소아 환자에서의 약물 부작용은 NOVOSEVEN으로 수행된 이전 임상 시험에서 보고된 것과 유사했으며, 여기에는 포트-어-캐스 설치 후 내경정맥 혈전증이 있는 4세 아동에서 혈전색전증 사건 1건이 포함되었으며, 이는 해결되었습니다.
선천적 제7인자 결핍증
선천적 제7인자 결핍증에서 NOVOSEVEN 사용에 대한 출판된 문헌, 연민적 사용 시험 및 레지스트리에서 NOVOSEVEN은 0세에서 12세 미만의 어린이 24명과 12세에서 16세의 어린이 7명에게 38회의 출혈 에피소드, 16건의 수술 및 8건의 예방 요법에 사용되었습니다. 치료는 출혈 에피소드의 95%(5%는 평가되지 않음) 및 수술의 100%에서 효과적이었습니다. 혈전색전증 사건은 보고되지 않았습니다. NOVOSEVEN과 다양한 혈장 제품에 노출된 7개월 된 아기가 FVII 및 rFVIIa에 대한 항체를 개발했습니다[참조 부작용(6.1) 및 과량 투여(10)].
글란츠만 혈소판 무력증
글란츠만 혈소판 무력증 레지스트리에서 NOVOSEVEN은 0세에서 12세의 어린이 43명에게 157회의 출혈 에피소드에 사용되었고, 0세에서 12세의 어린이 15명에게 19건의 수술 절차에 사용되었습니다. NOVOSEVEN은 또한 12세에서 16세의 어린이 8명에게 17회의 출혈 에피소드에 사용되었고, 12세에서 16세의 어린이 3명에게 3건의 수술 절차에 사용되었습니다. NOVOSEVEN을 포함한 요법의 효능은 독립적인 심사관에 의해 각각 0세에서 12세 및 12세에서 16세의 어린이에서 출혈 에피소드에 대해 93.6% 및 100%로 평가되었습니다. 수술 절차의 효능은 0세에서 16세의 어린이에서 모든 수술 절차에 대해 100%로 평가되었습니다. 글란츠만 혈소판 무력증 어린이에서 부작용은 보고되지 않았습니다.
[참조 임상 연구(14)]
8.5 노인 사용
선천적 인자 결핍증 및 글란츠만 혈소판 무력증에서 NOVOSEVEN RT에 대한 임상 연구에는 65세 이상의 피험자가 충분하지 않아 젊은 피험자와 다르게 반응하는지 여부를 확인할 수 없습니다.
10 과량투여
NOVOSEVEN RT의 용량 제한 독성은 임상 시험에서 조사되지 않았습니다. 다음은 우발적인 과다 복용의 예입니다.
- •
- 선천적 factor VII 결핍증이 있는 신생 여아에게 NOVOSEVEN(단회 투여: 체중 kg당 800마이크로그램)을 과량 투여했습니다. NOVOSEVEN 및 다양한 혈장 제제를 추가로 투여한 후 rFVIIa에 대한 항체가 검출되었지만 혈전성 합병증은 보고되지 않았습니다.
- •
- Factor VII 결핍 남성(83세, 111.1kg)이 체중 kg당 324마이크로그램(권장 용량의 10~20배)을 두 번 투여받았고 혈전성 사건(후두엽 뇌졸중)을 경험했습니다.
- •
- 한 명의 혈우병 B 환자(16세, 68kg)가 체중 kg당 352마이크로그램의 단회 용량을 받았고 한 명의 혈우병 A 환자(2세, 14.6kg)가 5일 연속 체중 kg당 246마이크로그램에서 986마이크로그램 범위의 용량을 받았습니다. 두 경우 모두 보고된 합병증은 없었습니다.
11 설명
NOVOSEVEN RT, 응고 인자 VIIa (재조합)는 정맥 주사용 재구성을 위한 재조합 인간 응고 인자 VIIa (rFVIIa)의 무균성 백색 동결 건조 분말입니다. 이 제품은 다음을 포함하는 단일 용량 바이알로 제공됩니다.
|
내용물 |
1 mg 바이알 |
2 mg 바이알 |
5 mg 바이알 |
8 mg 바이알 |
|
rFVIIa |
1000 마이크로그램 |
2000 마이크로그램 |
5000 마이크로그램 |
8000 마이크로그램 |
|
염화나트륨* |
2.34 mg |
4.68 mg |
11.7 mg |
18.72 mg |
|
염화칼슘 이수화물* |
1.47 mg |
2.94 mg |
7.35 mg |
11.76 mg |
|
글리실글리신 |
1.32 mg |
2.64 mg |
6.60 mg |
10.56 mg |
|
폴리소르베이트 80 |
0.07 mg |
0.14 mg |
0.35 mg |
0.56 mg |
|
만니톨 |
25 mg |
50 mg |
125 mg |
200 mg |
|
수크로스 |
10 mg |
20 mg |
50 mg |
80 mg |
|
메티오닌 |
0.5 mg |
1.0 mg |
2.5 mg |
4 mg |
|
*rFVIIa 1mg 당: 나트륨 0.4 mEq, 칼슘 0.01 mEq |
||||
NOVOSEVEN RT에는 제조 및 정제 공정에서 유래한 미량의 단백질, 예를 들어 마우스 IgG (최대 1.2 ng/mg), 소 IgG (최대 30 ng/mg) 및 BHK 세포 및 배지에서 유래한 단백질 (최대 19 ng/mg)이 포함되어 있습니다.
NOVOSEVEN RT 재구성을 위한 희석액은 주사용수 중 히스티딘 10 mmol 용액이며, 바이알 또는 사전 충전된 희석액 주사기로 제공됩니다. 적절한 양의 히스티딘 희석액으로 재구성한 후 각 바이알에는 약 1 mg/mL NOVOSEVEN RT (1000 마이크로그램/mL에 해당)가 포함됩니다. 재구성된 용액은 pH가 약 6.0인 무색 투명 용액이며 방부제가 포함되어 있지 않습니다.
NOVOSEVEN RT의 활성 성분인 재조합 응고 인자 VIIa (rFVIIa)는 약 50 kDa의 분자량을 가진 406개의 아미노산 잔기로 구성된 비타민 K 의존성 당단백질입니다. 이는 내인성 인간 응고 인자 VIIa와 구조적으로 유사합니다.
인간 응고 인자 VII (FVII)의 유전자는 클론화되어 베이비 햄스터 신장 세포 (BHK 세포)에서 발현됩니다. 재조합 FVII는 단일 사슬 형태로 배양 배지 (신생 송아지 혈청 포함)로 분비된 다음, 크로마토그래피 정제 과정에서 자동 촉매 작용에 의해 활성 이중 사슬 형태인 rFVIIa로 단백질 분해적으로 전환됩니다. 정제 과정은 외인성 바이러스 (MuLV, SV40, Pox 바이러스, Reo 바이러스, BEV, IBR 바이러스)를 제거하는 것으로 입증되었습니다. NOVOSEVEN RT의 생산 또는 제형에는 인간 혈청이나 다른 단백질이 사용되지 않습니다.
12 임상약리학
12.1 작용 기전
NOVOSEVEN RT는 재조합 Factor VIIa이며, 조직 인자와 복합체를 형성하면 응고 인자 X를 Factor Xa로 활성화시키고, 응고 인자 IX를 Factor IXa로 활성화시킬 수 있습니다. Factor Xa는 다른 인자와 복합체를 형성하여 프로트롬빈을 트롬빈으로 전환시키고, 이는 피브리노겐을 피브린으로 전환시켜 지혈 마개를 형성하여 국소 지혈을 유도합니다. 이 과정은 활성화된 혈소판 표면에서도 발생할 수 있습니다.
12.2 약력학
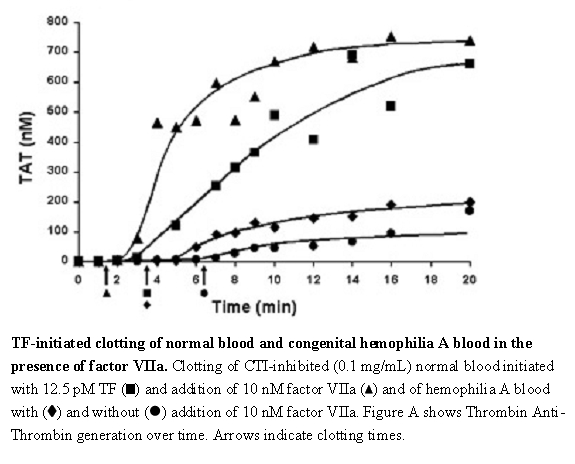
혈우병이 있는 환자 또는 없는 환자에서 NOVOSEVEN RT의 응고에 대한 효과는 다양한 모델 시스템에서 평가되었습니다. 조직 인자로 시작되는 혈액 응고의 in vitro 모델(그림 A)에서,3 rFVIIa를 첨가하면 정상 혈액과 혈우병 A 혈액에서 트롬빈 생성 속도와 수준이 모두 증가했으며, rFVIIa 농도가 10 nM만큼 낮아도 효과가 나타났습니다. 이 모델에서 신선한 인간 혈액은 혈액 응고의 접촉 경로를 차단하기 위해 옥수수 트립신 억제제(CTI)로 처리되었습니다. 조직 인자(TF)는 두 유형의 혈액에 대해 rFVIIa의 존재 유무에 관계없이 응고를 시작하기 위해 첨가되었습니다.
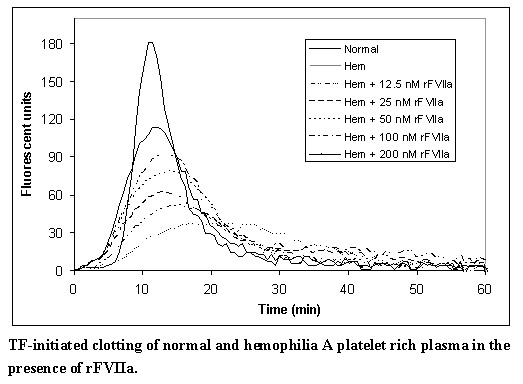
별도의 모델에서, 그리고 이전 보고서와 일치하여,4 혈우병 혈장에서 rFVIIa의 증가하는 용량은 트롬빈 생성의 용량 의존적 증가를 보여줍니다(그림 B). 이 모델에서 혈소판이 풍부한 정상 혈장과 혈우병 혈장은 자가 혈장으로 200,000 혈소판/마이크로리터로 조정되었습니다. 응고는 조직 인자와 CaCl2를 첨가하여 시작되었습니다. 트롬빈 생성은 트롬빈 기질의 존재 하에 다양한 첨가된 rFVIIa 농도에서 측정되었습니다.
그림 A
그림 B
12.3 약동학
건강한 피험자
NOVOSEVEN의 약동학은 용량 증가 연구에서 35명의 건강한 피험자(백인 17명, 일본인 18명, 남성 16명, 여성 19명)에서 조사되었습니다. 피험자는 NOVOSEVEN을 kg당 40, 80 및 160 마이크로그램으로 투여 받았습니다.5 NOVOSEVEN의 약동학에 대한 성별 또는 민족성의 영향은 관찰되지 않았습니다. 용량 그룹에 걸친 평균 PK 매개변수 범위는 표 4에 나와 있습니다.
NOVOSEVEN® 및 NOVOSEVEN® RT 제품은 두 제형을 모두 단일 용량으로 투여받은 22명의 환자를 대상으로 한 연구에서 약동학적으로 동등한 것으로 밝혀졌습니다.6 NOVOSEVEN® RT의 평균 PK 매개변수는 표 4에 나와 있습니다.
혈우병 A 또는 B
NOVOSEVEN(kg당 17.5, 35 및 70 마이크로그램)의 단일 용량 약동학은 출혈 상태와 비출혈 상태의 혈우병 A 또는 B가 있는 15명의 피험자에서 연구되었습니다.7 중앙값 PK 매개변수(비출혈 상태)는 표 4에 나와 있습니다.
볼루스 단일 용량 약동학 연구에서 6명의 성인 남성(kg당 90 마이크로그램)과 12명의 소아 남성(2-12세)(교차, kg당 90 및 180 마이크로그램)의 중증 혈우병 A 환자(18명 중 10명은 Factor VIII에 대한 억제제가 있음)가 NOVOSEVEN을 투여 받았습니다.8 성인과 비교하여 2-5세 및 6-12세 어린이의 체중 정규화된 NOVOSEVEN 청소율은 각각 82% 및 42% 높았습니다. 혈우병 어린이의 약동학적 매개변수는 표 5에 나와 있습니다.
선천적 Factor VII 결핍
kg당 15 및 30 마이크로그램의 용량으로 중증 선천적 Factor VII 결핍(<1%)이 있는 5명의 환자에서 NOVOSEVEN의 단일 용량 약동학은 두 용량 간에 유의미한 차이가 없음을 보여주었습니다. 두 용량의 평균 PK 매개변수는 표 4에 나와 있습니다.
표 4: 건강한 피험자, 혈우병 A 및 B 환자, FVII 결핍 환자의 단일 용량 약동학적 매개변수(평균(SD))
|
건강한 피험자 |
혈우병 A 또는 B |
FVII 결핍9 |
|||
|
제형 |
rFVIIa |
rFVIIa-25C |
rFVIIa |
rFVIIa |
rFVIIa |
|
연령 |
20-45 |
22-44 |
15-63 |
30-45 |
20-43 |
|
용량 (mcg/kg) |
40, 80, 160 |
90 |
17.5, 35, 70 |
90 |
30 |
|
AUC |
71.46, 76.91* |
113.26 (17.36)d |
53.31 (20.27)** |
2.45 (0.73) |
23.70 (7.23)d |
|
CL (mL/h) |
1953-2516 |
3077 (438) |
NA |
2767 (385) |
NA |
|
CL (mL/h/kg) |
33-37 |
40.43 (6.23) |
33.84 (11.72) |
37.6 (13.1) |
67.7 (17.9) |
|
t½ (h) |
3.9-6.0 |
3.54 (0.28) |
2.72 (0.54) |
3.2 (0.3) |
2.62 (0.63) |
|
Vss (mL/kg) |
130-165 |
122.96 (20.42) |
108.86 (37.15) |
121 (30) |
230 (70) |
|
MRT (h) |
3.66-4.98 |
3.05 (0.27) |
3.33 (0.64) |
3.31 (0.38) |
3.46 (0.64) |
|
IR ([U/dL]/[U/kg]) |
0.89-1.04 |
1.18 (0.16)c |
NA |
0.94 (0.16) |
0.53 (0.2)c |
- *80 mcg/kg 용량 기준
** 70 mcg/kg 용량 기준
NA: 해당 없음
AUC: 시간 0부터 무한대까지의 곡선 아래 면적; CL: 청소율; t ½: 최종 반감기; Vss: 정상 상태에서의 분포 용적; MRT: 평균 체류 시간; IR: 증분 회수율; rFVIIa: NOVOSEVEN® 원래 제형; rFVIIa-25C: NOVOSEVEN® RT
a: 결과는 남성과 여성 모두에 해당됩니다. 이 열은 민족 및 성별에 따른 범위를 나타냅니다.
b: 연구는 rFVIIa와 rFVIIa-25C(NOVOSEVEN® RT)의 생체 이용률 동등성을 입증했습니다. - c: 사용된 FVIIa 분석: IU 단위
- d: AUC는 h*IU/mL 단위
- e: 억제제가 있는 환자와 없는 환자를 모두 포함합니다.
표 5: 억제제가 있는 혈우병 A 환자와 없는 환자에서의 단일 용량 약동학적 매개변수 (평균 (SD))
|
혈우병 A |
||||||
|
제형/ 억제제 상태/ 연령대 |
rFVIIa, 억제제 없음, 연령 ≤5세 (n=3)8 |
rFVIIa, 억제제 있음 연령 ≤5세 (n=2)8 |
rFVIIa, 억제제 없음 연령 6-12세 (n=3)8 |
rFVIIa, 억제제 있음 연령 6-12세 (n=4)8 |
rFVIIa, 억제제 없음 성인 (n=2)8 |
rFVIIa, 억제제 있음 성인 (n=4)8 |
|
연령 (세) |
2-5 |
4 |
7-10 |
7-12 |
30-32 |
32-45 |
|
체중 (kg) |
14-17 |
22-26 |
25-38 |
25-68 |
72-97 |
54-89 |
|
용량 (mcg/kg) |
90, 180 |
90, 180 |
90, 180 |
90, 180 |
90 |
90 |
|
AUC (h*U/ mL) |
1.26 (0.09)* |
1.51 (0.25)* |
1.68 (0.24)* |
1.64 (0.31)* |
2.92 (0.80) |
2.13 (0.62) |
|
CL (mL/h) |
1131 (114) |
1387 (75) |
1878 (499) |
1668 (510) |
2477 (162) |
2960 (378) |
|
CL (mL/h/kg) |
73 (8) |
61 (9) |
55 (7) |
52 (12) |
30 (8) |
43 (15) |
|
t½ (h) |
2.6 (0.9) |
1.9 (0.6) |
3.0 (1.1) |
3.0 (0.5) |
3.3 (0.3) |
3.2 (0.3) |
|
Vss (mL/kg) |
191 (44) |
145 (1) |
173 (39) |
149 (22) |
108 (18) |
130 (37) |
|
MRT (h) |
2.6 (0.5) |
2.4 (0.4) |
3.1 (0.5) |
2.9 (0.3) |
3.62 (0.40) |
3.09 (0.20) |
|
IR ([IU/dL]/[U/kg]) |
0.59 (0.06) |
0.75 (0.12) |
0.75 (0.35) |
0.76 (0.20) |
1.01 (0.08) |
0.89 (0.20) |
- *90 mcg/kg 용량 기준
- AUC: 시간 0부터 무한대까지의 곡선 아래 면적; CL: 청소율; t ½: 최종 반감기; Vss: 정상 상태에서의 분포 용적; MRT: 평균 체류 시간; IR: 증분 회수율; rFVIIa: (NOVOSEVEN® 원래 제형)
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
두 건의 돌연변이 유발성 연구에서 NOVOSEVEN의 발암 가능성은 나타나지 않았습니다. NOVOSEVEN의 염색체 이상 유발 활성은 체외 연구(즉, 배양된 인간 림프구)와 체내 연구(즉, 마우스 소핵 시험) 모두에서 평가되었습니다. 이러한 연구 중 어느 것도 NOVOSEVEN의 염색체 이상 유발 활성을 나타내지 않았습니다. NOVOSEVEN RT를 사용한 다른 유전자 돌연변이 연구는 수행되지 않았습니다(예: 에임스 시험). NOVOSEVEN RT를 사용한 만성 발암성 연구는 수행되지 않았습니다.
최대 3.0mg/kg/일의 용량으로 수컷 및 암컷 쥐를 대상으로 실시한 생식 연구에서 교배 수행, 생식력 또는 새끼의 특성에 미치는 영향은 없었습니다.
생식 연구에서 쥐와 토끼에게 NOVOSEVEN을 투여한 결과 최대 6mg/kg 및 5mg/kg의 용량에서 사망률이 나타났습니다. 쥐에게 6mg/kg을 투여했을 때 25마리 중 낙태율은 0이었고, 토끼에게 5mg/kg을 투여했을 때 25마리 중 낙태율은 2였습니다. 6mg/kg의 NOVOSEVEN을 투여받은 25마리의 암컷 쥐 중 23마리가 성공적으로 출산했지만, 23마리 중 2마리는 수유 초기에 사망했습니다. NOVOSEVEN 투여 후 기형 발생의 증거는 관찰되지 않았습니다.
13.2 동물 독성학 및/또는 약리학
과도한 용량의 제XIII인자 A-서브유닛(재조합)(585IU/kg, 예상 사람 용량의 17배)과 rFVIIa(1000mcg/kg, 예상 사람 용량의 11배) 병용을 평가한 원숭이 심혈관계 안전성 약리학 모델에서 12마리 원숭이 중 1마리가 치료 4시간 후 혈전증으로 사망했습니다. 원숭이당 6개의 indwelling catheter 삽입 및 마취 유도를 포함한 혈전증 위험 인자가 연구 결과를 복잡하게 했을 수 있습니다. 사망이 한 가지 또는 두 가지 제품의 과다 복용 또는 그 사이의 특정 상호 작용과 관련이 있는지는 불분명합니다. 권장 사람 용량에서 rFXIII와 NOVOSEVEN RT 병용에 대한 비임상 및 임상 연구는 수행되지 않았습니다.
14 임상 연구
14.1 억제제가 있는 A형 또는 B형 혈우병
NOVOSEVEN을 투여받은 환자 중 가장 많은 수(N=483)는 1988년에 약동학 연구가 완료된 직후에 등록을 시작한 개방형 프로토콜 연구10,11,12 에 참여했습니다. 이 환자들은 억제제 유무에 관계없이 A형 또는 B형 혈우병 환자, VIII인자 또는 IX인자에 대한 후천적 억제제가 있는 환자, 그리고 소수의 FVII 결핍 환자를 포함했습니다. 임상 상황은 다양했으며 근육/관절 출혈, 점막 출혈, 수술 예방, 뇌내 출혈 및 기타 응급 상황을 포함했습니다.
억제제 유무에 관계없이 A형 및 B형 혈우병 환자의 관절, 근육 및 점막 출혈 치료에 대한 NOVOSEVEN의 두 가지 용량 수준을 비교한 이중맹검 무작위 대조 시험13은 출혈 후 4~18시간 이내에 치료 센터에서 NOVOSEVEN을 투여받은 78명의 환자를 대상으로 실시되었습니다. 35명의 환자는 35마이크로그램/kg 용량(관절 출혈 59건, 근육 출혈 15건, 점막 출혈 5건)으로 치료받았고, 43명의 환자는 70마이크로그램/kg 용량(관절 출혈 85건, 근육 출혈 14건)으로 치료받았습니다. 투약은 2.5시간 간격으로 반복되었지만 일부 환자의 경우 최대 4시간까지 연장되었습니다. 효능은 12±2시간 또는 치료 종료 시점 중 먼저 도달하는 시점에 평가했습니다. 연구자의 주관적 평가에 따르면 35 및 70마이크로그램/kg 그룹의 각 효능 비율은 다음과 같습니다. 우수(환자의 보고에 따른 통증/압통의 명확한 완화 및/또는 출혈 크기의 측정 가능한 감소 및/또는 8시간 이내 출혈 지혈) 59% 및 60%, 효과적(환자의 보고에 따른 통증/압통의 명확한 완화 및/또는 출혈 크기의 측정 가능한 감소 및/또는 8~14시간 이내 출혈 지혈) 12% 및 11%, 부분적으로 효과적(환자의 보고에 따른 통증/압통의 명확한 완화 및/또는 출혈 크기의 측정 가능한 감소 및/또는 14시간 후 출혈 지혈) 17% 및 20%. 지혈을 달성하는 데 필요한 평균 주입 횟수는 35 및 70마이크로그램/kg 그룹에서 각각 2.8회와 3.2회였습니다.
억제제가 있는 A형 또는 B형 혈우병 환자의 수술 중 및 수술 후 NOVOSEEN 투여의 안전성 및 효능을 평가하기 위해 두 건의 임상 시험이 실시되었습니다. 한 연구는 주요 또는 경미한 수술을 받는 억제제가 있는 A형 또는 B형 혈우병 환자 28명(FVIII에 대한 후천적 억제제가 있는 환자 1명 포함)을 대상으로 한 무작위 이중맹검 병행군 임상 시험이었습니다.14 환자는 수술 전에 볼루스 정맥 주사 NOVOSEVEN(35마이크로그램/kg, N=15 또는 90마이크로그램/kg, N=14)을 투여받았고, 필요에 따라 수술 중에 투여받았으며, 그 후 상처 봉합 시부터 다음 48시간 동안 2시간마다 투여받았습니다. 지혈을 유지하기 위해 추가 용량을 2~6시간 간격으로 최대 3일까지 추가로 투여했습니다. 이중맹검 치료를 최대 5일 동안 실시한 후, 필요한 경우 개방형 방식으로 치료를 계속할 수 있었습니다(90마이크로그램/kg NOVOSEVEN을 2~6시간 간격으로 투여)(표 6). 효능은 수술 중 기간과 상처 봉합 시점(0시간)부터 5일까지 수술 후에 평가했습니다.
표 6: 수술 유형별 투약
| 주요 수술 | 경미한 수술 | |||||||
|---|---|---|---|---|---|---|---|---|
|
||||||||
|
35 μg/kg* (n = 5) |
90 μg/kg (n = 6) |
35 μg/kg (n = 10) |
90 μg/kg (n = 8) |
|||||
|
15 (2-26) |
9.5 (8-17) |
4 (3-6) |
6 (3-13) |
||||
|
135 (11-186) |
81 (71-128) |
29.5 (24-44) |
39.5 (26-98) |
||||
|
656 (31-839) |
569 (107-698) |
45.5 (14-171) |
|
||||
수술 중 지혈은 29명 중 28명(97%)에서 달성되었습니다. 90 mcg/kg 용량군에서는 14명 중 14명(100%)에서, 35 mcg/kg 용량군에서는 15명 중 11명(73%)에서 48시간 후에 만족스러운 지혈이 달성되었습니다. 90 mcg/kg 용량군에서는 14명 중 13명(93%)에서, 35 mcg/kg 용량군에서는 15명 중 11명(73%)에서 5일 후에 만족스러운 지혈이 달성되었습니다. 23명의 환자가 전체 연구를 성공적으로 완료했으며, 90 mcg/kg 용량군에서는 14명 중 13명(93%)이 연구 완료(최대 26일)까지 성공적인 지혈을 달성했습니다.
NOVOSEVEN의 볼루스 정맥 주사(BI) 투여(N=12)와 연속 정맥 주사(CI) 투여(N=12)의 안전성과 유효성을 비교하기 위해 또 다른 공개 라벨, 무작위, 병행 시험이 억제제가 있는 혈우병 A 또는 B 환자 23명과 후천성 혈우병 환자 1명을 대상으로 선택적 주요 수술을 받는 동안 실시되었습니다. 표 7은 BI와 CI에 대한 치료군별 투여량 개요를 제공합니다.
표 7: 치료군별 투여량
| 볼루스 주사 | 연속 주입 | ||
|---|---|---|---|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14.1 임상 연구
a 획득성 혈우병 환자 1명 포함
b 10일 연구 기간 후 추적 관찰 기간 동안 투약 포함
수술 중 지혈은 BI 및 CI 치료를 받은 모든 환자에서 효과적인 것으로 보고되었습니다. BI 요법은 처음 24시간 동안 100% 효과적이었으며 5일째에는 92% 효과적이었습니다. CI 요법은 처음 24시간 동안 83% 효과적이었으며 5일째에는 83% 효과적이었습니다. 연구 기간 종료 시(수술 후 10일 또는 치료 중단 시), BI 및 CI 군의 지혈 효능은 각각 9/12(75%) 및 10/12(83%)였습니다.
14.2 선천성 제7인자 결핍증
NOVOSEVEN으로 치료받은 제7인자 결핍증 환자 70명에 대한 데이터는 출판된 문헌, 연민적 사용 시험 및 등록부에서 수집되었습니다. 이 환자 중 32명은 노보 노디스크에서 실시한 응급 및 연민적 사용 시험에 등록되었습니다(비수술적 출혈 43건, 수술 26건); 35명은 출판된 문헌에 보고되었습니다(수술 20건, 비수술적 출혈 10건, 제왕절개 또는 질식 출산 4건, 장기 예방 10건, 주문형 치료 1건); 3명은 혈우병 및 혈전증 연구 협회(HTRS)에서 유지 관리하는 등록부에서 나왔습니다(출혈 9건, 수술 1건). 투약량은 2-12시간마다(예방의 경우 하루 2회에서 주 2회까지 투약) 투여되는 체중 kg당 6-98 마이크로그램 범위였습니다. 환자는 평균 1-10회 투약을 받았습니다. 치료는 93%의 에피소드에서 효과적이었습니다(시험 환자의 경우 90%, 출판된 환자의 경우 98%, HTRS 등록부 환자의 경우 90%).(출혈이 멈추거나 치료가 의사에 의해 효과적인 것으로 평가됨)
14.3 획득성 혈우병
데이터는 노보 노디스크에서 실시한 연민적 사용 프로그램과 혈우병 및 혈전증 연구 협회(HTRS) 등록부의 4건의 연구에서 수집되었습니다. 이 연구들은 투약량을 선택하거나 다른 지혈제(구제 치료) 실패 후 사용했을 때의 1차 효능 또는 효능을 비교하도록 설계되지 않았습니다. 총 70명의 획득성 혈우병 환자가 113건의 출혈 에피소드, 수술 또는 외상으로 인한 부상으로 NOVOSEVEN으로 치료를 받았습니다. 이 환자 중 61명은 연민적 사용 프로그램에서 나왔으며 100건의 출혈 에피소드(비수술적 68건, 수술적 32건)가 있었고, 9명은 HTRS 등록부에서 나왔으며 13건의 출혈 에피소드(비수술적 8건, 수술적 3건, 기타로 분류된 2건)가 있었습니다. 다른 지혈제의 병용 사용은 29/70(41%)에서 발생했습니다. 13명(19%)은 2개 이상의 지혈제를 받았습니다. 가장 흔히 사용되는 지혈제는 항섬유소용해제, 제8인자 및 활성화된 프로트롬빈 복합체 농축액이었습니다.
투여된 NOVOSEVEN의 평균 투약량은 체중 kg당 90 마이크로그램(범위: 체중 kg당 31-197 마이크로그램)이었고, 하루 평균 주입 횟수는 6회(범위: 하루 1-10회 주입)였습니다. 전반적인 효능(즉, 효과적이고 부분적으로 효과적인 결과)은 87/112(78%)였으며, 연민적 사용 프로그램에서는 77/100(77%)의 효능을 보였고, HTRS 등록부에서는 10/12(83%)의 효능을 보였습니다. 연민적 사용 프로그램에서 1차 치료에 대한 전반적인 효능은 38/44(86%)였으며, 구제 치료로 사용했을 때는 39/56(70%)였습니다(표 8).
표 8: 연민적 사용 프로그램 및 HTRS 등록부에서 NOVOSEVEN의 효능
|
결과a |
|
|
효과적 |
|
|
부분적 |
|
|
비효과적 |
|
|
알 수 없음 |
|
|
출혈 에피소드 수 |
|
a 치료 종료 시 평가된 결과, 마지막 관찰 값을 전달했습니다.
b HTRS 레지스트리의 환자 1명은 출혈이 조절된 후 지혈을 유지하기 위해 NOVOSEVEN이 사용되었기 때문에 효능 분석에서 제외되었습니다.
14.4 글란츠만 혈소판 무력증
데이터는 글란츠만 혈소판 무력증 레지스트리(GTR), 지혈 및 혈전증 연구 협회(HTRS) 레지스트리 및 출판된 문헌에서 수집되었습니다. GTR은 관찰적이었으며 따라서 용량을 선택하도록 설계되지 않았습니다. GTR은 1073건의 출혈 및 수술 사건이 있는 글란츠만 혈소판 무력증 환자 218명에 대한 데이터를 수집했습니다. 독립적인 심사 위원회는 조사자의 과거 데이터, 치료 패턴 및 혈소판만 사용했을 때 치료 반응을 기반으로 임상적 내성 및 항체 상태를 평가했습니다. 심사자는 임상적 내성을 혈소판 반응 부족으로 정의했습니다. 혈소판에 대한 명백한 반응을 보인 환자는 조사자가 그렇게 코드화했더라도 내성이 없는 것으로 간주되었습니다. 항체 상태에는 GPIIb/IIIa, HLA 및 비특정 혈소판 특이적 항체가 포함되었습니다. 효능은 2점 척도(전반적인 치료 요법의 성공 또는 실패에 대한 임상적 평가, 조사자가 코드화한 결과에 대해 맹검 및 비맹검)로 평가되었으며, 전신 지혈 치료가 필요한 190명의 환자(151명의 환자에서 564건의 심각한 출혈 사건, 90명의 환자에서 192건의 수술, 1건의 사건은 둘 다로 분류됨)에서 평가되었습니다. 이 중 총 92명의 환자가 266건의 출혈 사건에 대해 NOVOSEVEN RT로 치료받았고 77명의 환자가 160건의 수술 절차에 대해 치료받았습니다. 많은 수의 출혈 사건이 NOVOSEVEN RT만으로 치료되었습니다(109/266(41%) 사건).
출혈 사건 및 수술 절차에 투여된 NOVOSEVEN RT의 중앙값 용량은 kg당 90마이크로그램이었고 용량 간 중앙값 간격은 3시간이었습니다.
모든 피험자의 경우 다른 지혈제의 동시 사용은 266건의 출혈 사건 중 157건(59%)과 160건의 수술 절차 중 94건(59%)에서 발생했습니다.
NOVOSEVEN RT로 치료받은 대부분의 출혈 사건은 소아 환자(65%; 어린이 및 청소년, 0-16세)였습니다.
NOVOSEVEN RT로 치료받은 266건의 출혈 사건 중 가장 흔한 유형의 출혈 사건은 코피(116건, 43.6%), 잇몸 출혈(48건, 18.0%), 월경 과다(36건, 13.5%), 치아/치과 발치 관련(29건, 10.9%) 및 위장관(23건, 8.6%)이었습니다.
NOVOSEVEN RT로 수술 절차를 치료받은 환자의 경우 86%가 성인(16세 이상)이었습니다. 주요 수술은 체강에 들어가거나, 중간막 장벽을 넘거나, 안면 평면을 열거나, 장기를 제거하거나, 정상 해부학을 수술적으로 변경하는 모든 침습적 수술 절차로 정의되었습니다. 경미한 수술은 피부, 점막 또는 표재성 결합 조직만 조작하는 모든 침습적 수술 절차로 정의되었습니다. NOVOSEVEN RT로 치료받은 수술 절차에는 경미한(134/160; 83.8%) 및 주요(26/160, 16.3%) 절차가 포함되었습니다. 치과 절차가 가장 흔했습니다(106건, 66.3%), 그 다음으로 내시경(12건, 7.5%), 비강 절차(8건, 5.0%), 절제(7건, 4.4%), 위장관 수술(7건, 4.4%) 및 정형외과 절차(6건, 3.8%)가 있었습니다. 대부분의 수술은 선택적이었습니다(147건, 91.9%), 몇몇은 응급(7건, 4.4%) 또는 명시되지 않음(6건)이었습니다.
전반적으로 NOVOSEVEN RT로 치료하면 출혈 사건의 94.4%(표 9)와 수술 절차의 99.4%(표 10)에서 성공적이었습니다. 심사자 평가 효능은 치료 요법, 출혈 및 수술 유형, 연령 및 내성/항체 상태 전반에 걸쳐 일관되었습니다. NOVOSEVEN RT로 치료하면 혈소판 특이적 항체 유무에 관계없이 임상적 내성이 있는 환자의 경우 출혈 사건의 94.9%와 수술 절차의 98.6%에서 성공적이었습니다. 내성이나 혈소판 특이적 항체가 없는 환자의 경우 NOVOSEVEN RT로 치료한 결과는 혈소판으로 치료한 결과와 유사했습니다.
표 9: GTR 데이터에 대한 출혈 사건의 효능에 대한 심사자 평가
|
환자 수c |
사건 수 |
성공 |
실패 |
데이터 부족 |
합의 없음 |
||
|
모든 NOVOSEVEN* |
92 |
266 |
251 (94.4) |
4 (1.5) |
6 (2.3) |
5 (1.9) |
|
|
치료 요법별 |
|||||||
|
NOVOSEVEN만 |
44 |
109 |
101 (92.7) |
2 (1.8) |
4 (3.7) |
2 (1.8) |
|
|
NOVOSEVEN ± 혈소판 ± 다른 지혈제 |
69 |
157 |
150 (95.5) |
2 (1.3) |
2 (1.3) |
3 (1.9) |
|
|
항체/내성 그룹별 |
|||||||
|
내성 ± 혈소판 특이적 항체a,d |
31 |
79 |
75 (94.9) |
2 (2.5) |
2 (2.5) |
0 (0.0) |
|
|
혈소판 특이적 항체a,d |
8 |
10 |
10 (100.0) |
0 (0.0) |
0 (0.0) |
NA |
|
|
없거나 알 수 없음b,d |
57 |
177 |
166 (93.8) |
2 (1.1) |
4 (2.3) |
5 (2.8) |
|
*NOVOSEVEN으로 치료를 포함한 모든 치료 요법
a GPIIb/IIIa, HLA 및 비특정 혈소판 특이적 항체 포함
b 보고된 혈소판 특이적 항체 또는 내성이 없거나 항체 및 내성 상태를 알 수 없음을 가정
c 환자 수는 합산되지 않습니다. 환자는 다른 치료 요법으로 인한 에피소드를 가질 수 있으며 하나 이상의 항체/내성 상태를 가질 수 있습니다.
d 치료는 NOVOSEVEN만으로 26/79 에피소드(항체 유무와 관계없이 내성), 2/10 에피소드(혈소판 특이적 항체만), 81/177 에피소드(없거나 알 수 없음)였습니다. 나머지는 NOVOSEVEN과 혈소판 및/또는 항섬유소 용해제를 함께 투여했습니다.
표 10: GTR 데이터에 대한 수술 절차의 효능 평가
|
치료 그룹 |
환자 수c |
절차 수 |
성공 |
데이터 부족d |
|
모든 NOVOSEVEN* |
77 |
160 |
159 (99.4) |
1 (0.6) |
|
치료 요법별 |
||||
|
NOVOSEVEN만 |
35 |
66 |
65 (98.5) |
1 (1.5) |
|
NOVOSEVEN ± 혈소판 ± 기타 지혈제 |
57 |
94 |
94 (100.0) |
0 (0.0) |
|
항체/내성 그룹별 |
||||
|
내성 ± 혈소판 특이적 항체a,e |
33 |
70 |
69 (98.6) |
|
|
혈소판 특이적 항체a,e |
11 |
24 |
24 (100.0) |
|
|
없거나 알 수 없음b,e |
36 |
66 |
66 (100) |
|
*NOVOSEVEN으로 치료를 포함한 모든 치료 요법
a GPIIb/IIIa, HLA 및 비특정 혈소판 특이적 항체 포함
b 보고된 혈소판 특이적 항체 또는 내성이 없거나 항체 및 내성 상태를 알 수 없음을 가정
c 환자 수는 합산되지 않습니다. 환자는 다른 치료 요법으로 인한 에피소드를 가질 수 있으며 하나 이상의 항체/내성 상태를 가질 수 있습니다.
d 실패 또는 합의 부족에 대한 보고가 없었습니다.
e 치료는 NOVOSEVEN만으로 22/70 에피소드(항체 유무와 관계없이 내성), 13/24 에피소드(혈소판 특이적 항체만), 31/66 에피소드(없거나 알 수 없음)였습니다. 나머지는 NOVOSEVEN과 혈소판 및/또는 항섬유소 용해제를 함께 투여했습니다.
HTRS에서 23회의 출혈 에피소드에 대해 NOVOSEVEN RT로 치료받은 환자는 7명이었습니다. 11회의 에피소드(10회의 에피소드에서 항섬유소 용해제)에 대해 동반 지혈제를 투여했습니다. 치료는 23회 중 21회(91.3%)의 에피소드에서 효과적인 것으로 보고되었습니다. 다른 2회의 에피소드에서 출혈은 느려지거나 개선되지 않았지만, 두 에피소드 모두에서 추가 치료가 보고되지 않았습니다. HTRS 레지스트리에서 보고된 수술 절차는 없었습니다.
15 참고 문헌
- 1. Hedner, U.: NOVOSEVEN ® 치료의 투약 및 모니터링, Haemostasis 1996; 26 (suppl 1): 102-108.
- 2. Parameswaran, R., et al.: 억제제가 있는 혈우병 환자의 치료에서 rFVIIa의 용량 효과 및 효능: 혈우병 및 혈전증 연구 협회 등록부 분석, Haemophilia 2005; 11: 100-106.
- 3.Butenas, S., et al.: 혈우병 혈액에서 factor VIIa 의존성 응고 메커니즘, Blood 2002; 99: 923-930. 그림 A 저작권 American Society of Hematology, 허가를 받아 사용.
- 4. Allen, G.A., et al.: 응고의 세포 기반 모델에서 트롬빈 생성 및 활성화된 factor VII의 응고 촉진 효과에 대한 factor X 수준의 영향, Blood Coagulation and Fibrinolysis 2000; 11 (suppl 1): 3-7.
- 5. Fridberg M.J., et al.: 건강한 백인 및 일본인 피험자에서 재조합 활성화된 factor VII의 약동학 및 안전성 연구, Blood Coagulation and Fibrinolysis 2005; 16 (4): 259-266.
- 6. Bysted B.V., et al.: 현재 재조합 활성화된 factor VII 제제와 새로운 강력한 25ºC 안정 제제의 생체 동등성을 입증하는 무작위 이중맹검 시험, Haemophilia 2007; 13, 527-532.
- 7. Lindley, C.M., et al.: 재조합 Factor VIIa의 약동학 및 약력학, Clinical Pharmacology & Therapeutics 1994; 55 (6): 638-648.
- 8.Villar, A., et al.: 혈우병 A가 있는 어린이와 성인에서 활성화된 재조합 응고 factor VIIa (NOVOSEVEN®)의 약동학, Haemophilia 2004; 10 (4):352-359.
- 9. Berretinni M.: 유전성 factor VII 결핍 환자에서 재조합 활성화된 factor VII의 약동학 평가. Haematologica 2001; 86:640-645.
- 10. Lusher, J., et al.: 재조합 Factor VIIa의 임상 경험, Blood Coagulation and Fibrinolysis 1998; 9: 119-128.
- 11. Bech, M.R.: 관절 및 근육 출혈 에피소드에서 재조합 Factor VIIa, Haemostasis 1996; 26 (suppl 1): 135-138.
- 12. Lusher, J.M.: Factor VIII 및 IX 억제제가 있는 환자의 내부 출혈 치료에서 재조합 Factor VIIa (NOVOSEVEN ® ), Haemostasis 1996; 26 (suppl 1): 124-130.
- 13. Lusher, J.M., et al.: 억제제 유무에 관계없이 혈우병 A 및 B 환자의 관절, 근육 및 점막 출혈 치료에서 재조합 factor VIIa의 두 가지 용량 수준을 비교한 무작위 이중맹검 연구, Haemophilia 1998; 4: 790-798.
- 14. Shapiro A.D., et al: 억제제가 있는 혈우병 환자의 수술 중 rFVIIa (NOVOSEVEN ® )의 두 가지 용량에 대한 전향적 무작위 시험, Thrombosis and Haemostasis 1998; 80: 773-778.
16 제공/보관 및 취급 방법
공급 형태
NOVOSEVEN RT, 응고 인자 VIIa (재조합), 단일 용량 바이알에 상온 안정성이 있는 흰색 동결건조 분말로 공급되며, 각 카톤에는 하나의 단일 용량 바이알이 있습니다. NOVOSEVEN RT의 재구성용 희석제는 주사용수에 L-히스티딘 10mmol 용액이며 투명 무색 용액으로 공급되며 히스티딘 희석제라고 부릅니다. 히스티딘 희석제는 바이알 또는 미리 채워진 희석제 주사기로 제공됩니다.
rFVIIa의 밀리그램 및 마이크로그램 양은 라벨에 명시되어 있습니다.
1 개의 NOVOSEVEN RT 분말 단일 용량 바이알 및 1 개의 히스티딘 희석제 바이알을 포함하는 NOVOSEVEN RT 패키지:
|
제시 형태 |
카톤 NDC 번호 |
구성품 |
|
1mg/바이알 (1000 마이크로그램/바이알) |
NDC 0169 7010 01 |
|
|
2mg/바이알 (2000 마이크로그램/바이알) |
NDC 0169 7020 01 |
|
|
5mg/바이알 (5000 마이크로그램/바이알) |
NDC 0169 7050 01 |
|
|
8mg/바이알 (8000 마이크로그램/바이알) |
NDC 0169 7040 01 |
|
NOVOSEVEN RT with MixPro® 패키지에는 NOVOSEVEN RT 분말 단일 용량 바이알 1 개와 무균 바이알 어댑터가 장착된 미리 채워진 히스티딘 희석제 주사기 1 개가 있으며, 이는 대안적인 무침uric 재구성 시스템입니다.
|
제시 형태 |
카톤 NDC 번호 |
구성품 |
|
1mg/바이알 (1000 마이크로그램/바이알) |
NDC 0169 7201 01 |
|
|
2mg/바이알 (2000 마이크로그램/바이알) |
NDC 0169 7202 01 |
|
|
5mg/바이알 (5000 마이크로그램/바이알) |
NDC 0169 7205 01 |
|
|
8mg/바이알 (8000 마이크로그램/바이알) |
NDC 0169 7208 01 |
|
NOVOSEVEN RT 및 히스티딘 희석제 바이알은 천연 라텍스가 없고 클로로부틸 고무 마개로 밀봉된 유리로 만들어져 있으며 알루미늄 캡으로 덮여 있습니다. 미리 채워진 희석제 주사기는 유리로 만들어지며 천연 라텍스가 없는 실리콘화된 브로모부틸 고무 피스톤이 있습니다. 밀봉된 바이알과 미리 채워진 희석제 주사기는 폴리프로필렌으로 만든 훼손 방지식 스냅-오프 캡이 장착되어 있습니다. 미리 채워진 희석제 주사기에는 25 마이크로미터 필터가 있는 바이알 어댑터가 제공됩니다.
보관 및 처리
재구성 전 NOVOSEVEN RT 분말 및 히스티딘 희석제를 2-25°C(36-77°F) 사이에 보관합니다. 동결하지 마십시오. 빛으로부터 보호하여 저장하세요. 유효기간이 지난 제품은 사용하지 마십시오.
재구성 후 NOVOSEVEN RT를 실온 또는 냉장에서 최대 3시간 동안 보관할 수 있습니다. 재구성된 NOVOSEVEN RT를 동결하거나 주사기에 보관하지 마십시오.
17. 환자 상담 정보
환자에게 다음 사항을 알리십시오.
- •
- FDA 승인 환자 라벨링(사용 지침)을 읽으십시오.
- •
- 두드러기, 흉부 조임, 천명, 저혈압 및 아나필락시스를 포함한 과민 반응의 초기 징후에 대해 알아두십시오.
- •
- 팔다리 또는 복부의 새로운 부종 및 통증, 새로운 흉통, 호흡 곤란, 감각 또는 운동 능력 상실, 의식 또는 언어 변화를 포함한 혈전증의 징후에 대해 알아두십시오.
- •
- 위의 징후나 증상이 나타나면 즉시 의사의 진료를 받으십시오.
- •
- 적절한 뾰족한 물건 폐기에 관하여 FDA 승인 환자 라벨링의 권장 사항을 따르십시오.
버전: 2020년 7월-V20
특허 정보: http://novonordisk-us.com/products/product-patents.html
Novo Nordisk®는 Novo Nordisk A/S의 등록 상표입니다.
NOVOSEVEN®는 Novo Nordisk Health Care AG의 등록 상표입니다.
MixPro®는 Novo Nordisk A/S의 등록 상표입니다.
Clave® 및 MicroClave®는 ICU Medical Inc.의 등록 상표입니다.
InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior®는 RyMed Technologies, Inc.의 등록 상표입니다.
Bionector®는 Vygon의 등록 상표입니다.
© 2020 Novo Nordisk
정보 문의:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536, USA
1-877-NOVO-777
제조:
Novo Nordisk A/S
2880 Bagsvaerd, Denmark
라이선스 번호: 1261
환자 안내문
FDA 승인 환자 라벨
사용 지침
NovoSeven RT
응고 인자 VIIa (재조합)
NovoSeven® RT 사용 방법
NOVOSEVEN® RT를 사용하기 전에 이 지침을 주의 깊게 읽으십시오.
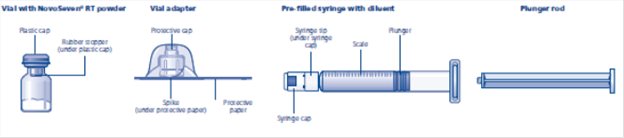
NovoSeven® RT는 분말 형태로 제공됩니다. 주사(투여) 전에 주사기에 제공된 액상 희석제와 혼합(재구성)해야 합니다. 액상 희석제는 히스티딘 용액입니다. 혼합된 NovoSeven® RT는 정맥에 주사해야 합니다(정맥 주사). 이 패키지의 장비는 NovoSeven® RT를 혼합하고 주사하도록 설계되었습니다.
또한 주입 세트(튜브 및 나비 바늘), 소독 알코올 솜, 거즈 패드 및 붕대가 필요합니다.
의사 또는 간호사의 적절한 교육 없이 장비를 사용하지 마십시오.
항상 깨끗하고 무균(무균) 기법을 사용하십시오. 손을 씻고 주변 환경이 깨끗한지 확인하는 것이 중요합니다.
사용할 준비가 될 때까지 장비를 열지 마십시오.
장비는 일회용입니다.
단회용 바이알. 사용하지 않은 부분은 버리십시오.
내용물
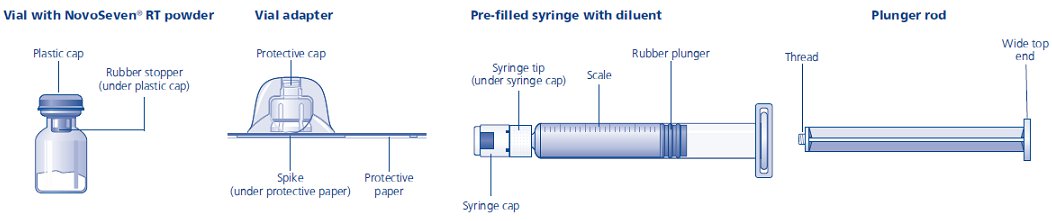
패키지에는 다음이 포함되어 있습니다.
• NovoSeven® RT 분말이 들어 있는 바이알
• 바이알 어댑터
• 희석제가 들어 있는 사전 충전 주사기
• 플런저 로드(주사기 아래에 배치)
- 개요
1. 바이알과 주사기를 준비하십시오
- •
- 필요한 수의 NovoSeven® RT 패키지를 꺼내십시오. 유효 기간을 확인하십시오.
- •
- 패키지의 이름과 색상을 확인하여 올바른 제품이 포함되어 있는지 확인하십시오.
- •
- 손을 씻고 깨끗한 타월로 완전히 말리거나 공기 건조하십시오.
- •
- 바이알, 바이알 어댑터 및 사전 충전 주사기를 상자에서 꺼내십시오. 플런저 로드는 상자에 그대로 두십시오.
- •
- 바이알과 사전 충전 주사기를 실온으로 가져오십시오(98.6°F(37°C)를 초과하지 않음). 손에 들고 손과 같은 온도가 될 때까지 기다리면 됩니다.
- •
- 바이알에서 플라스틱 캡을 제거하십시오. 플라스틱 캡이 느슨하거나 없으면 바이알을 사용하지 마십시오.
- •
- 바이알의 고무 마개를 소독 알코올 솜으로 닦고 사용하기 전에 몇 초 동안 말리십시오. 닦은 후에는 고무 마개를 만지지 마십시오.
장비가 떨어졌거나 손상된 경우 사용하지 마십시오. 대신 새 패키지를 사용하십시오.
장비가 유효 기간이 지난 경우 사용하지 마십시오. 대신 새 패키지를 사용하십시오. 유효 기간은 외부 상자와 바이알, 바이알 어댑터 및 사전 충전 주사기에 표시되어 있습니다.
혼합된 용액을 주사할 때까지는 품목을 버리지 마십시오.
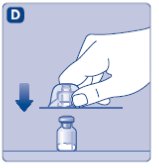
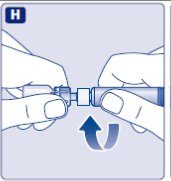
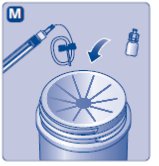
2. 바이알 어댑터를 부착하십시오
- •
- 바이알 어댑터에서 보호 용지를 제거하십시오.
- 바이알 어댑터를 보호 캡에서 꺼내지 마십시오.
- 보호 용지가 완전히 밀봉되지 않았거나 찢어진 경우 바이알 어댑터를 사용하지 마십시오.
- •
- 바이알을 평평하고 단단한 표면에 놓으십시오.
- •
- 보호 캡을 뒤집어 바이알 어댑터를 바이알에 끼웁니다.
- 바이알 어댑터의 스파이크를 만지지 마십시오.
- 부착되면 바이알 어댑터를 바이알에서 분리하지 마십시오.
- •
- 그림과 같이 엄지와 검지로 보호 캡을 가볍게 눌러주십시오.
- 보호 캡을 바이알 어댑터에서 제거하십시오.
- 보호 캡을 제거할 때 바이알 어댑터를 바이알에서 들어올리지 마십시오.
3. 플런저 로드와 주사기를 부착하십시오
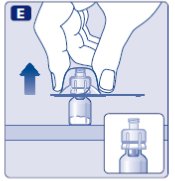
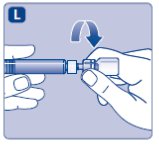
- •
- 플런저 로드를 넓은 윗부분을 잡고 상자에서 꺼내십시오. 플런저 로드의 측면이나 나사산을 만지지 않도록 주의하십시오. 플런저 로드를 넓은 윗부분을 잡고 계속 잡으십시오.
- •
- 즉시 플런저 로드를 사전 충전 주사기에 연결하여 저항이 느껴질 때까지 사전 충전 주사기 내부의 고무 플런저에 시계 방향으로 돌립니다.
- •
- 사전 충전 주사기에서 주사기 캡을 구멍이 뚫릴 때까지 아래로 구부려 제거하십시오.
- 주사기 캡 아래의 주사기 끝을 만지지 마십시오.
- 주사기 캡이 느슨하거나 없으면 사전 충전 주사기를 사용하지 마십시오.
- •
- 사전 충전 주사기를 바이알 어댑터에 단단히 고정시켜 저항이 느껴질 때까지 돌립니다.
플런저 로드의 측면을 절대 만지지 마십시오.
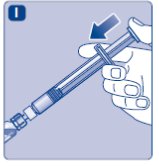
4. 분말을 희석제와 섞습니다
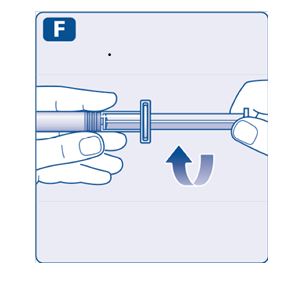
- •
- 미리 채워진 주사기를 약병이 아래를 향하도록 약간 기울여 잡습니다.
- •
- 플런저 로드를 밀어 희석제를 모두 약병에 주입합니다.
- •
- 플런저 로드를 계속 누른 상태로 분말이 완전히 녹을 때까지 약병을 부드럽게 돌립니다.
- 약병을 흔들지 마십시오. 거품이 생길 수 있습니다.
- •
- 혼합된 용액을 확인합니다. 용액은 투명하고 무색이어야 합니다. 눈에 띄는 입자나 변색이 보이면 사용하지 마십시오. 새 포장을 사용하십시오.
NovoSeven® RT는 혼합 후 즉시 사용하는 것이 좋습니다.
혼합된 NovoSeven® RT 용액을 즉시 사용할 수 없는 경우, 약병 어댑터와 주사기를 부착한 상태로 약병에 담아 실온 또는 냉장 보관하여 3시간 이내에 사용하십시오.
혼합된 NovoSeven® RT 용액을 냉동하거나 주사기에 보관하지 마십시오.
혼합된 NovoSeven® RT 용액을 직사광선에 노출시키지 마십시오.
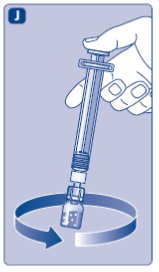
투여량이 여러 개의 약병을 필요로 하는 경우, 필요한 투여량이 될 때까지 추가 약병, 약병 어댑터 및 미리 채워진 주사기를 사용하여 단계 A부터 J까지 반복합니다.
- •
- 플런저 로드를 완전히 밀어 넣습니다.
- •
- 주사기를 약병을 거꾸로 뒤집어 잡습니다.
- •
- 플런저 로드를 누르는 것을 멈추고 혼합된 용액이 주사기에 채워질 때까지 플런저 로드가 스스로 돌아가도록 합니다.
- •
- 플런저 로드를 약간 아래로 당겨 혼합된 용액을 주사기에 흡입합니다. 전체 투여량의 일부만 필요한 경우, 의사 또는 간호사의 지시에 따라 주사기 눈금을 사용하여 흡입할 혼합된 용액의 양을 확인합니다.
- •
- 약병을 거꾸로 뒤집은 상태로 주사기를 부드럽게 두드려 공기 방울이 위로 올라오도록 합니다.
- •
- 플런저 로드를 공기 방울이 모두 사라질 때까지 천천히 밀어 넣습니다.
- •
- 약병 어댑터를 약병과 함께 풀어냅니다.
주의: 미리 채워진 희석제 주사기는 내경이 0.037인치인 유리로 만들어졌으며 표준 루어 록 커넥터와 호환됩니다.
정맥 카테터용 일부 무침 커넥터는 유리 희석제 주사기와 호환되지 않습니다(예: Clave® /MicroClave®, InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior®, Bionector®와 같이 내부 스파이크가 있는 특정 커넥터). 이러한 커넥터를 사용하면 커넥터가 손상되어 투여에 영향을 미칠 수 있습니다. 호환되지 않는 무침 커넥터를 통해 제품을 투여하려면 재구성된 제품을 표준 10mL 멸균 루어 록 플라스틱 주사기에 흡입합니다.
미리 채워진 히스티딘 희석제 주사기를 루어 록 호환 장치에 부착하는 데 문제가 발생한 경우 Novo Nordisk(877) 668-6777로 연락하십시오.
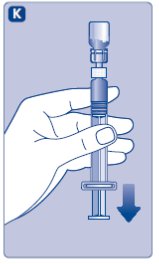
5. 혼합된 용액을 주입합니다
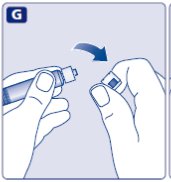
NovoSeven® RT는 이제 정맥에 주입할 준비가 되었습니다.
- •
- NovoSeven® RT를 다른 정맥 주입 또는 약물과 섞지 마십시오.
- •
- 의사 또는 간호사의 지시에 따라 혼합된 용액을 2~5분에 걸쳐 천천히 주입합니다.
중심 정맥 접근 장치(CVAD)를 통한 용액 주입(예: 중심 정맥 카테터 또는 피하 포트):
- •
- 깨끗하고 무균(무균) 기법을 사용하십시오. 의사 또는 간호사와 상담하여 커넥터 및 중심 정맥 접근 장치의 올바른 사용 지침을 따르십시오.
- •
- CVAD에 주입하려면 혼합된 용액을 흡입하고 주입하기 위해 멸균 10mL 플라스틱 주사기를 사용해야 할 수 있습니다.
- •
- 필요한 경우 NovoSeven® RT 주입 전후에 0.9% 염화나트륨 주사액, USP를 사용하여 CVAD 라인을 세척합니다.
NovoSeven® RT 약병에 있는 벗겨낼 수 있는 라벨을 사용하여 로트 번호를 기록할 수 있습니다.
폐기
- •
- 주입 후, 주사기와 주입 세트, 약병과 약병 어댑터, 사용하지 않은 NovoSeven® RT 및 기타 폐기물을 의사 또는 간호사의 지시에 따라 안전하게 폐기합니다.
- 일반 가정 쓰레기와 함께 버리지 마십시오.
폐기 전에 약병과 약병 어댑터를 분해하지 마십시오.
장비를 재사용하지 마십시오.
전체 처방 정보는 이 포장에 포함된 다른 삽입물을 참조하십시오.
개정: 2020년 7월
특허 정보: http://novonordisk-us.com/products/product-patents.html
Novo Nordisk®는 Novo Nordisk A/S의 등록 상표입니다.
NovoSeven® 는 Novo Nordisk Health Care AG의 등록 상표입니다.
Clave® 및 MicroClave®는 ICU Medical Inc.의 등록 상표입니다.
InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior®는 RyMed Technologies, Inc.의 등록 상표입니다.
Bionector®는 Vygon의 등록 상표입니다.
© 2020 Novo Nordisk
제조사:
Novo Nordisk A/S
2880 Bagsvaerd, 덴마크
허가 번호: 1261
버전: 20200710-v8
주요 디스플레이 패널
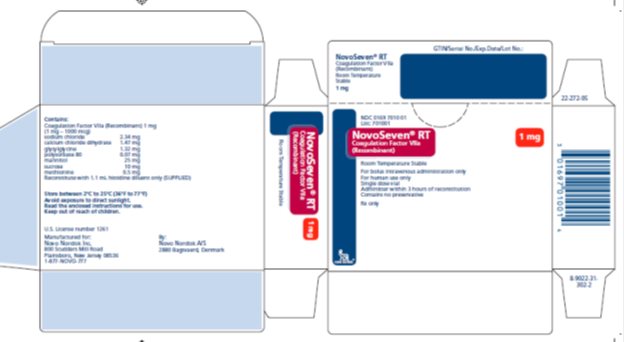
1mg 주요 표시 패널
NDC 0169 7010 01
목록: 701001
NovoSeven® RT
응고 인자 VIIa
(재조합)
실온 안정성
1mg
정맥 주사용만
인간 전용
단회 투여 바이알
재구성 후 3시간 이내 투여
보존제 없음
전문의 처방전만
novo nordisk®
주요 디스플레이 패널
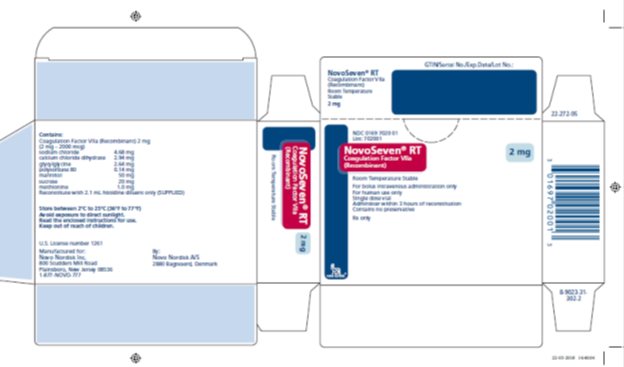
주요 표시 패널 2mg
NDC 0169 7020 01
목록: 702001
노보세븐® RT
응고 인자 VIIa
(재조합)
실온 안정
2mg
IV 투여용만
인간용만
단회 용량 바이알
재구성 후 3시간 이내에 투여
방부제 없음
Rx 전용
노보 노르디스크®
주요 디스플레이 패널
주요 표시 패널 5mg
NDC 0169 7050 01
리스트: 705001
NovoSeven® RT
응고 인자 VIIa
(재조합)
실온 안정
5mg
정맥 투여 전용
인간용 전용
단회용 바이알
재구성 후 3시간 이내에 투여
보존제 없음
Rx 전용
novo nordisk®
주요 표시 부분
주요 표시 부분 8 mg
NDC 0169 7040 01
List: 704001
NovoSeven® RT
Coagulation Factor VIIa
(재조합)
실온 보관 가능
8 mg
정맥 주사용
인체에만 사용
단회 투여 바이알
재구성 후 3시간 이내에 투여
방부제 없음
처방전 필요
novo nordisk®
주요 디스플레이 패널
PRINCIPAL DISPLAY PANEL 1 mg
NDC 0169-7201-01
- List: 720101 1 mg
- NovoSeven® RT
- Coagulation Factor VIIa (Recombinant)
실온 보관 가능
정맥 내 주사용. 인체용으로만 사용하세요.
단회용 약병. 혼합 후 3시간 이내에 투여하세요. 사용하지 않은 부분은 폐기하세요.
보존제가 없습니다.
전문의 처방전 필요
- MixPro® 포함
- 약병 어댑터 및 사전 채워진 용매 주사기
주요 디스플레이 패널
PRINCIPAL DISPLAY PANEL 2 mg
NDC 0169-7202-01
- List: 720201 2 mg
- NovoSeven® RT
- 혈액응고인자 VIIa (재조합)
실온 보관 가능
정맥 내 주사용. 인간용으로만 사용하세요.
단회용 약병. 혼합 후 3시간 이내에 투여하세요. 사용하지 않은 부분은 폐기하세요.
보존제가 없습니다.
전문의 처방전 필요
MixPro® 포함
약병 어댑터 및 사전 채운 용매 주사기
주요 디스플레이 패널
주요 디스플레이 패널 5mg
NDC 0169-7205-01
- 목록: 720501 5mg
- 노보세븐® RT
- 응고 인자 VIIa(재조합)
실온 안정화
정맥 주입용 볼루스용. 인간용 전용.
단회용 바이알. 재구성 후 3시간 이내에 투여하세요. 사용하지 않은 부분은 폐기하세요.
보존제 없음.
의사 처방전 전용
MixPro® 포함
주요 디스플레이 패널
주요 디스플레이 패널 8mg
NDC 0169-7208-01
- 목록: 720801 8mg
- NovoSeven® RT
- 응고인자 VIIa (재조합)
실온 안정화
정맥 주사용 돌출 투여. 인간 전용.
단회 용량 바이알. 재구성 후 3시간 이내 투여. 미사용 부분 폐기.
방부제 없음.
전문의 처방전만.
MixPro®
바이알 어댑터 및 미리 충전된 희석제 주사기
주요 디스플레이 패널 1.1 mL 히스티딘 라벨
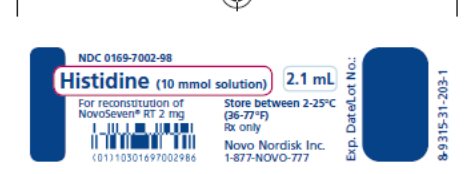
주요 표시판 2.1 mL 히스티딘 라벨
주요 표시 패널 5.2mL 히스티딘 라벨
주요 디스플레이 패널
주요 표시 패널 1 mL Histidine 라벨
주요 디스플레이 패널
주요 디스플레이 패널 2 mL 히스티딘 라벨
주요 디스플레이 패널
주요 표시면 5 mL Histidine
주요 표시 패널 8 mL 히스티딘
주요 표시 패널 1mg. 바이알
주요 디스플레이 패널 2mg. 바이알
주요 표시 패널 5mg. 바이알
주요 디스플레이 패널
주요 전시 패널 1mg. 바이알
주요 디스플레이 패널
주요 표시 패널 2mg. 바이알
주요 디스플레이 패널
주요 디스플레이 패널 5mg. 바이알
주요 디스플레이 패널
주요 표시 패널 8mg. 바이알