의약품 제조업체: Takeda Pharmaceuticals America, Inc. (Updated: 2024-09-09)
처방 정보의 주요 내용
NINLARO® (ixazomib) 캡슐, 경구 투여
미국 최초 승인: 2015
최근 주요 변경 사항
| 경고 및 주의 사항, 피부 반응 (5.5) | 3/2024 |
적응증 및 사용
투여량 및 투여 방법
투여 형태 및 강도
캡슐: 4mg, 3mg 및 2.3mg (3)
금기 사항
없음. (4)
경고 및 주의 사항
- 혈소판 감소증: 치료 중에 적어도 매월 혈소판 수를 모니터링하고 필요에 따라 용량을 조절하십시오. (2.2, 5.1)
- 위장계 독성: 심한 설사, 변비, 메스꺼움 및 구토의 경우 필요에 따라 용량을 조절하십시오. (2.2, 5.2)
- 말초 신경병증: 말초 신경병증 증상을 모니터링하고 필요에 따라 용량을 조절하십시오. (2.2, 5.3)
- 말초 부종: 체액 저류를 모니터링하십시오. 적절한 경우 기저 원인을 조사하십시오. 필요에 따라 용량을 조절하십시오. (2.2, 5.4)
- 피부 반응: 발진을 모니터링하고 필요에 따라 용량을 조절하십시오. (2.2, 5.5)
- 혈전성 미세혈관병증: 징후와 증상을 모니터링하십시오. 의심되는 경우 NINLARO를 중단하십시오. (5.6)
- 간 독성: 치료 중에 간 효소를 모니터링하십시오. (5.7)
- 태아 독성: NINLARO는 태아에게 해를 끼칠 수 있습니다. 환자에게 태아에 대한 잠재적 위험과 효과적인 비호르몬 피임법을 사용하도록 조언하십시오. (5.8, 8.1, 8.3)
- 유지 요법 설정에서 NINLARO로 치료받은 환자의 사망률 증가: 통제된 시험 외부에서 유지 요법 설정에서 다발성 골수종 환자를 NINLARO로 치료하는 것은 권장되지 않습니다. (5.9)
부작용
가장 흔한 부작용(≥20%)은 혈소판 감소증, 호중구 감소증, 설사, 변비, 말초 신경병증, 메스꺼움, 말초 부종, 발진, 구토 및 기관지염입니다. (6.1)
의심되는 부작용을 보고하려면 Takeda Pharmaceuticals에 1-844-617-6468 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
특정 인구 집단에서의 사용
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 7/2024
목차
전문 정보: 목차*
1 적응증 및 사용법
2 용법 및 용량
2.1 투약 및 투여 지침
2.2 용량 조절 지침
2.3 간 기능 장애 환자의 용량
2.4 신장 기능 장애 환자의 용량
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 혈소판 감소증
5.2 위장계 독성
5.3 말초 신경병증
5.4 말초 부종
5.5 피부 반응
5.6 혈전성 미세 혈관병증
5.7 간 독성
5.8 태아 독성
5.9 유지 요법 환경에서 NINLARO로 치료받은 환자의 사망률 증가
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 강력한 CYP3A 유도제
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간 기능 장애
8.7 신장 기능 장애
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 최소 1회 이상의 사전 치료를 받은 환자의 다발성 골수종
14.2 유지 요법 환경에서 NINLARO로 치료받은 환자의 사망률 증가
14.3 신규 진단된 다발성 골수종 환자의 효능 부족
15 참고 문헌
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
NINLARO는 이전에 최소한 1회 이상 치료를 받은 다발성 골수종 환자의 치료를 위해 레날리도마이드와 덱사메타손과 병용하여 사용됩니다.
사용 제한: NINLARO는 통제된 임상 시험 외부에서 레날리도마이드와 덱사메타손과 병용하여 유지 요법 또는 새로 진단된 다발성 골수종에 사용하는 것은 권장되지 않습니다 [경고 및 주의 사항 (5.9) 및 임상 연구 (14.2, 14.3) 참조].
2 투여 및 관리
2.1 투약 및 투여 지침
레날리도마이드 및 덱사메타손과 병용 투여되는 NINLARO
NINLARO의 권장 초기 용량은 28일 치료 주기의 1일, 8일 및 15일에 경구로 1회 4mg을 투여하는 것입니다.
레날리도마이드의 권장 초기 용량은 28일 치료 주기의 1일부터 21일까지 매일 25mg을 투여하는 것입니다.
덱사메타손의 권장 초기 용량은 28일 치료 주기의 1일, 8일, 15일 및 22일에 40mg을 투여하는 것입니다.
| 28일 주기 (4주 주기) | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1주차 | 2주차 | 3주차 | 4주차 | |||||
| 1일 | 2일~7일 | 8일 | 9일~14일 | 15일 | 16일~21일 | 22일 | 23일~28일 | |
| NINLARO | ✔ | ✔ | ✔ | |||||
| 레날리도마이드 | ✔ | ✔ 매일 | ✔ | ✔ 매일 | ✔ | ✔ 매일 | ||
| 덱사메타손 | ✔ | ✔ | ✔ | ✔ | ||||
레날리도마이드 및 덱사메타손에 대한 추가 정보는 처방 정보를 참조하십시오.
NINLARO는 4주 사이클의 첫 3주 동안 같은 요일에 대략 같은 시간에 일주일에 한 번 복용해야 합니다. 치료를 시작하는 환자에게는 모든 복용 지침을 주의 깊게 따르는 것이 중요하다는 점을 설명해야 합니다. 과량 복용으로 사망 사례가 보고되었으므로 환자에게 지시에 따라 권장 복용량을 복용하도록 지시하십시오. [과량 복용 (10) 참조].
NINLARO는 음식을 먹기 최소 1시간 전 또는 최소 2시간 후에 복용해야 합니다. [임상 약리학 (12.3) 참조]. 캡슐 전체를 물과 함께 삼켜야 합니다. 캡슐을 부수거나, 씹거나, 열지 마십시오. [포장 단위/보관 및 취급 (16) 참조].
NINLARO 복용량이 지연되거나 누락된 경우 다음 예정된 복용량이 72시간 이상 남아 있는 경우에만 복용해야 합니다. 누락된 복용량은 다음 예정된 복용량 72시간 이내에 복용해서는 안 됩니다. 누락된 복용량을 보충하기 위해 두 배의 복용량을 복용해서는 안 됩니다.
복용 후 구토가 발생하면 환자는 복용량을 반복해서는 안 됩니다. 환자는 다음 예정된 복용 시간에 복용을 재개해야 합니다.
새로운 치료 사이클을 시작하기 전에:
- 절대 호중구 수는 1,000/mm3 이상이어야 합니다.
- 혈소판 수는 75,000/mm3 이상이어야 합니다.
- 비혈액학적 독성은 의료 서비스 제공자의 재량에 따라 일반적으로 환자의 기준 상태 또는 1등급 또는 그 이하로 회복되어야 합니다.
질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 계속해야 합니다.
2.2 복용량 조정 지침
NINLARO 복용량 감소 단계는 표 2에 제시되어 있으며 복용량 조정 지침은 표 3에 제공됩니다.
|
|||
| 권장 시작 복용량* | 첫 번째 감소 | 두 번째 감소 | 중단 |
| 4 mg | 3 mg | 2.3 mg | |
혈소판 감소증, 호중구 감소증 및 발진에 대한 NINLARO 및 레날리도마이드의 교대 용량 조절 접근 방식은 표 3에 설명된 대로 권장됩니다. 레날리도마이드에 대한 용량 감소가 필요한 경우 레날리도마이드 처방 정보를 참조하십시오.
| 혈액학적 독성 | 권장 조치 |
| 혈소판 감소증 (혈소판 수) | |
| 혈소판 수 30,000/mm3 미만 |
|
| 호중구 감소증 (절대 호중구 수) | |
| 절대 호중구 수 500/mm3 미만 |
|
| 비혈액학적 독성 | 권장 조치 |
| 발진 | |
| 등급† 2 또는 3 |
|
| 등급 4 | 치료 요법을 중단합니다. |
| 말초 신경병증 | |
| 통증을 동반한 등급 1 말초 신경병증 또는 등급 2 말초 신경병증 |
|
| 통증을 동반한 등급 2 말초 신경병증 또는 등급 3 말초 신경병증 |
|
| 등급 4 말초 신경병증 | 치료 요법을 중단합니다. |
| 기타 비혈액학적 독성 | |
| 기타 등급 3 또는 4 비혈액학적 독성 |
|
2.3 간 기능 손상 환자에서의 용량
중등도 (총 빌리루빈 1.5-3 × ULN 초과) 또는 중증 (총 빌리루빈 3 × ULN 초과) 간 기능 손상 환자의 경우 NINLARO의 시작 용량을 3mg으로 감소시킵니다 [특정 인구 집단에서의 사용 (8.6) 및 임상 약리학 (12.3) 참조].
2.4 신장 기능 손상 환자에서의 용량
중증 신장 기능 손상 (크레아티닌 청소율 30 mL/min 미만) 또는 투석이 필요한 말기 신부전 (ESRD) 환자의 경우 NINLARO의 시작 용량을 3mg으로 감소시킵니다. NINLARO는 투석되지 않으므로 투석 시기에 관계없이 투여할 수 있습니다 [특정 인구 집단에서의 사용 (8.7) 및 임상 약리학 (12.3) 참조].
신장 기능 손상 환자의 용량 권장 사항은 레날리도마이드 처방 정보를 참조하십시오.
3 제형 및 함량
NINLARO는 다음과 같은 캡슐로 제공됩니다.
- 4 mg ixazomib: 캡슐 뚜껑에 검은색 잉크로 “Takeda”가, 캡슐 몸체에 검은색 잉크로 “4 mg”이 각인된 연한 주황색 젤라틴 캡슐.
- 3 mg ixazomib: 캡슐 뚜껑에 검은색 잉크로 “Takeda”가, 캡슐 몸체에 검은색 잉크로 “3 mg”이 각인된 연한 회색 젤라틴 캡슐.
- 2.3 mg ixazomib: 캡슐 뚜껑에 검은색 잉크로 “Takeda”가, 캡슐 몸체에 검은색 잉크로 “2.3 mg”이 각인된 연한 분홍색 젤라틴 캡슐.
4 금기사항
없음.
5 경고 및 주의사항
5.1 혈소판 감소증
NINLARO를 사용한 경우 혈소판 감소증이 보고되었으며, 일반적으로 28일 주기의 14~21일 사이에 혈소판 수치가 최저치에 도달하고 다음 주기가 시작될 때까지 기준치로 회복되었습니다 [이상반응(6.1) 참조]. NINLARO 요법군의 환자 중 17%에서 3등급 혈소판 감소증이 보고되었고, NINLARO 요법군의 13%에서 4등급 혈소판 감소증이 보고되었습니다. 혈소판 수혈 비율은 NINLARO 요법군에서 10%, 위약군에서 7%였습니다.
NINLARO 치료 중에는 최소한 매달 혈소판 수치를 모니터링해야 합니다. 처음 3주기 동안에는 더 자주 모니터링하는 것이 좋습니다. 표준 의료 지침에 따라 용량 조절 [용량 및 투여 방법(2.2) 참조] 및 혈소판 수혈로 혈소판 감소증을 관리하십시오.
5.2 위장관 독성
NINLARO를 사용한 경우 설사, 변비, 메스꺼움, 구토가 보고되었으며, 경우에 따라 지사제 및 진토제 사용과 지지 요법이 필요했습니다. 설사는 NINLARO 요법군 환자의 52%와 위약군 환자의 43%에서 보고되었고, 변비는 각각 35%와 28%, 메스꺼움은 각각 32%와 23%, 구토는 각각 26%와 13%에서 보고되었습니다. 설사로 인해 NINLARO 요법군 환자의 3%와 위약군 환자의 2%에서 세 가지 약물 중 하나 이상을 중단했습니다 [이상반응(6.1) 참조]. 3등급 또는 4등급 증상이 나타나면 용량을 조절하십시오 [용량 및 투여 방법(2.2) 참조].
5.3 말초 신경병증
말초 신경병증 이상반응의 대부분은 1등급(NINLARO 요법군 18%, 위약군 16%) 및 2등급(NINLARO 요법군 11%, 위약군 6%)이었습니다 [이상반응(6.1) 참조]. 3등급 말초 신경병증 이상반응은 두 요법군 모두에서 2%로 보고되었습니다.
가장 일반적으로 보고된 반응은 말초 감각 신경병증(NINLARO 요법군 24%, 위약군 17%)이었습니다. 말초 운동 신경병증은 두 요법군 모두에서 흔하게 보고되지 않았습니다(<1%). 말초 신경병증으로 인해 NINLARO 요법군 환자의 4%와 위약군 환자의 <1%에서 세 가지 약물 중 하나 이상을 중단했습니다. 환자에게서 신경병증 증상이 나타나는지 모니터링해야 합니다. 새로운 말초 신경병증이 나타나거나 악화되는 환자는 용량 조절이 필요할 수 있습니다 [용량 및 투여 방법(2.2) 참조].
5.4 말초 부종
말초 부종은 NINLARO 요법군 환자의 27%와 위약군 환자의 21%에서 보고되었습니다. 말초 부종 이상반응의 대부분은 1등급(NINLARO 요법군 17%, 위약군 14%) 및 2등급(NINLARO 요법군 7%, 위약군 6%)이었습니다.
3등급 말초 부종은 NINLARO 요법군 환자의 2%와 위약군 환자의 1%에서 보고되었습니다 [이상반응(6.1) 참조]. 말초 부종으로 인해 두 요법군 모두에서 <1%의 환자가 세 가지 약물 중 하나 이상을 중단했습니다. 필요에 따라 근본 원인을 평가하고 지지 요법을 제공하십시오. 덱사메타손의 경우 의약품 정보에 따라, NINLARO의 경우 3등급 또는 4등급 증상이 나타나면 용량을 조절하십시오 [용량 및 투여 방법(2.2) 참조].
5.5 피부 반응
발진은 NINLARO 요법군 환자의 27%와 위약군 환자의 16%에서 보고되었습니다. 발진 이상반응의 대부분은 1등급(NINLARO 요법군 15%, 위약군 9%) 또는 2등급(NINLARO 요법군 9%, 위약군 4%)이었습니다 [이상반응(6.1) 참조]. 3등급 발진은 NINLARO 요법군 환자의 3%와 위약군 환자의 2%에서 보고되었습니다. 중대한 발진 이상반응은 NINLARO 요법군 환자의 <1%에서 보고되었습니다. 두 요법군 모두에서 가장 흔하게 보고된 발진 유형은 반점구진성 발진과 반점성 발진이었습니다. 발진으로 인해 두 요법군 모두에서 <1%의 환자가 세 가지 약물 중 하나 이상을 중단했습니다. 2등급 이상인 경우 지지 요법이나 용량 조절로 발진을 관리하십시오 [용량 및 투여 방법(2.2) 참조].
NINLARO를 투여받은 환자에서 치명적인 사례를 포함하여 스티븐스-존슨 증후군 및 독성 표피 괴사 용해가 보고되었습니다 [이상반응(6.1, 6.2) 참조]. 스티븐스-존슨 증후군이나 독성 표피 괴사 용해가 발생하면 NINLARO 투여를 중단하고 임상적으로 필요에 따라 관리하십시오.
5.6 혈전성 혈소판 감소성 자반증
NINLARO를 투여받은 환자에서 혈전성 혈소판 감소성 자반증/용혈성 요독 증후군(TTP/HUS)을 포함하여 때때로 치명적인 혈전성 미세혈관병증 사례가 보고되었습니다 [이상반응(6.1) 참조]. TTP/HUS의 징후와 증상이 있는지 모니터링하십시오. 진단이 의심되면 NINLARO 투여를 중단하고 평가하십시오. TTP/HUS 진단이 배제되면 NINLARO 재투여를 고려하십시오. 이전에 TTP/HUS를 경험한 환자에게 NINLARO 치료를 다시 시작하는 것의 안전성은 알려져 있지 않습니다.
5.7 간독성
약물 유발 간 손상, 간세포 손상, 간 지방증, 담즙 정체성 간염 및 간독성이 NINLARO로 치료받은 환자의 <1%에서 각각 보고되었습니다 [이상반응 (6.1) 참조]. 간독성이 보고되었습니다(NINLARO 요법군 10% 및 위약 요법군 9%). 간 효소를 정기적으로 모니터링하고 3등급 또는 4등급 증상에 대해서는 용량을 조절하십시오 [용량 및 투여 방법 (2.2) 참조].
5.8 배아-태아 독성
NINLARO는 작용 기전 및 동물 연구 결과에 따라 임산부에게 투여 시 태아에게 해를 끼칠 수 있습니다. Ixazomib는 권장 용량을 투여받은 환자에서 관찰된 것보다 약간 높은 노출을 유발하는 용량에서 임신한 랫트 및 토끼에게 배아-태아 독성을 유발했습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 가임 여성에게는 NINLARO 치료 중 및 마지막 용량 투여 후 90일 동안 효과적인 비호르몬 피임법을 사용하도록 권고하십시오. 가임 여성 파트너가 있는 남성에게는 NINLARO 치료 중 및 마지막 용량 투여 후 90일 동안 효과적인 피임법을 사용하도록 권고하십시오 [약물 상호 작용 (7.1) 및 특정 집단에서의 사용 (8.1, 8.3) 참조].
5.9 유지 요법 환경에서 NINLARO로 치료받은 환자의 사망률 증가
유지 요법 환경에서 다발성 골수종에 대한 두 건의 전향적 무작위 임상 시험에서 NINLARO 치료는 사망 증가를 초래했습니다. 대조 임상 시험 이외의 유지 요법 환경에서 다발성 골수종 환자에 대한 NINLARO 치료는 권장되지 않습니다 [임상 연구 (14.2) 참조].
6 부작용
다음의 유해 반응은 처방 정보의 다른 섹션에서 자세히 설명되어 있습니다.
- 혈소판 감소증 [경고 및 주의 사항 (5.1) 참조 ]
- 위장계 독성 [경고 및 주의 사항 (5.2) 참조 ]
- 말초 신경병증 [경고 및 주의 사항 (5.3) 참조 ]
- 말초 부종 [경고 및 주의 사항 (5.4) 참조 ]
- 피부 반응 [경고 및 주의 사항 (5.5) 참조 ]
- 혈전성 미세 혈관 병증 [경고 및 주의 사항 (5.6) 참조 ]
- 간 독성 [경고 및 주의 사항 (5.7) 참조 ]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
재발성 및/또는 불응성 다발성 골수종 환자 720명을 대상으로 한 무작위 배정, 이중 맹검, 위약 대조 임상 연구의 안전성 모집단은 레날리도마이드와 덱사메타손과 병용하여 NINLARO를 투여받은 환자(NINLARO 요법; N=361) 또는 레날리도마이드와 덱사메타손과 병용하여 위약을 투여받은 환자(위약 요법; N=359)를 포함했습니다.
NINLARO 요법에서 가장 흔하게 보고된 유해 반응(위약과 비교하여 ≥20%의 발생률 차이가 있는 경우)은 혈소판 감소증, 호중구 감소증, 설사, 변비, 말초 신경병증, 오심, 말초 부종, 발진, 구토 및 기관지염이었습니다. NINLARO 요법에서 환자의 ≥2%에서 보고된 심각한 유해 반응에는 설사(3%), 혈소판 감소증(2%) 및 기관지염(2%)이 포함되었습니다. 말초 신경병증을 보고한 환자의 4%, 설사를 보고한 환자의 3%, 혈소판 감소증을 보고한 환자의 2%에서 3가지 약물 중 하나 이상을 영구적으로 중단했습니다. 유해 반응으로 인해 NINLARO를 영구적으로 중단한 환자는 10%였습니다.
표 4는 NINLARO 요법과 위약 요법 간에 최소 5%의 차이가 있는 환자의 5% 이상에서 발생한 비혈액학적 유해 반응을 요약합니다.
| 기관계/선호 용어 | NINLARO + 레날리도마이드 및 덱사메타손 N=361 |
위약 + 레날리도마이드 및 덱사메타손 N=359 |
||||
|---|---|---|---|---|---|---|
| % | % | |||||
| 모든 등급 | 3등급 | 4등급 | 모든 등급 | 3등급 | 4등급 | |
| 참고: 선호 용어로 포함된 유해 반응은 MedDRA 버전 23.0을 기반으로 합니다. | ||||||
| 위장관 장애 | ||||||
| 설사 | 52 | 10 | 0 | 43 | 3 | 0 |
| 변비 | 35 | <1 | 0 | 28 | <1 | 0 |
| 오심 | 32 | 2 | 0 | 23 | 0 | 0 |
| 구토 | 26 | 1 | 0 | 13 | <1 | 0 |
| 신경계 장애 | ||||||
| 말초 신경병증* | 32 | 2 | 0 | 24 | 2 | 0 |
| 근골격계 및 결합 조직 장애 | ||||||
| 허리 통증† | 27 | <1 | 0 | 24 | 3 | 0 |
| 감염 및 기생충 감염 | ||||||
| 상기도 감염† | 27 | 1 | 0 | 23 | 1 | 0 |
| 기관지염 | 22 | 2 | 0 | 17 | 2 | <1 |
| 피부 및 피하 조직 장애 | ||||||
| 발진* | 27 | 3 | 0 | 16 | 2 | 0 |
| 일반적인 장애 및 투여 부위 상태 | ||||||
| 말초 부종 | 27 | 2 | 0 | 21 | 1 | 0 |
표 5는 이상 사례 및 실험실 데이터에서 풀링된 정보를 나타냅니다.
| NINLARO + 레날리도마이드 및 덱사메타손 N=361 |
위약 + 레날리도마이드 및 덱사메타손 N=359 |
|||
|---|---|---|---|---|
| % | % | |||
| 모든 등급 | 3-4등급 | 모든 등급 | 3-4등급 | |
| 혈소판 감소증 | 85 | 30 | 67 | 14 |
| 호중구 감소증 | 74 | 34 | 70 | 37 |
대상포진
대상포진은 NINLARO 요법군 환자의 6%와 위약군 환자의 3%에서 보고되었습니다. 항바이러스 예방은 의료 서비스 제공자의 재량에 따라 허용되었습니다. 항바이러스 예방을 받은 NINLARO 요법군 환자는 예방을 받지 않은 환자(10%)에 비해 대상포진 감염 발생률이 낮았습니다(1%).
6.2 시판 후 경험
다음 이상 반응은 NINLARO의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애: 안지오에데마
피부 및 피하 조직 장애: 독성 표피 괴사 용해
7 약물 상호작용
7.1 강력한 CYP3A 유도제
NINLARO를 강력한 CYP3A 유도제(예: 리팜핀, 페니토인, 카르바마제핀 및 세인트 존스 워트)와 함께 투여하지 마십시오 [임상 약리학 (12.3) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
작용 기전 [임상 약리학 (12.1) 참조] 및 동물 생식 연구 결과를 바탕으로, NINLARO는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. NINLARO를 임산부에게 사용한 데이터가 없어 약물 관련 위험을 평가할 수 없습니다. Ixazomib는 임신한 랫드와 토끼에서 권장 용량을 투여받은 환자에게서 관찰된 노출량보다 약간 높은 노출량으로 태아 독성을 유발했습니다 (자료 참조). 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
자료
동물 자료
임신한 토끼에서 태아 발생 발달 연구에서 모체 독성이 있는 용량(≥0.3 mg/kg)에서 태아 골격 변이/기형(융합된 미골, 요추 수, 완전한 과잉 늑골)이 증가했습니다. 0.3 mg/kg에서 토끼의 노출량은 권장 용량 4 mg에서 임상 시간 평균 노출량의 1.9배였습니다. 랫드 용량 범위 찾기 태아 발생 발달 연구에서 모체 독성이 있는 용량에서 태아 체중 감소, 태아 생존율 감소 경향, 착상 후 손실 증가가 0.6 mg/kg에서 나타났습니다. 0.6 mg/kg 용량에서 랫드의 노출량은 권장 용량 4 mg에서 임상 시간 평균 노출량의 2.5배였습니다.
8.3 생식 능력이 있는 여성 및 남성
NINLARO는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 인구 집단에서의 사용 (8.1) 참조].
피임
여성
생식 능력이 있는 여성에게 NINLARO 치료 중 및 마지막 투여 후 90일 동안 효과적인 비호르몬 피임법을 사용하도록 조언하십시오. 덱사메타손은 CYP3A4뿐만 아니라 다른 효소 및 운반체의 약한 내지 중간 정도의 유도제로 알려져 있습니다. NINLARO는 덱사메타손과 함께 투여되므로 피임약의 효능이 감소될 위험을 고려해야 합니다 [약물 상호 작용 (7.1) 참조].
8.5 노인 사용
NINLARO의 임상 연구에 참여한 총 대상자 중 55%가 65세 이상이었고, 17%가 75세 이상이었습니다. 이러한 대상자와 젊은 대상자 사이에 안전성 또는 유효성에 대한 전반적인 차이가 관찰되지 않았으며, 다른 보고된 임상 경험에서 노인과 젊은 환자 사이에 반응에 차이가 있는 것으로 밝혀지지 않았지만, 일부 노인의 민감성이 더 높을 가능성을 배제할 수 없습니다.
8.6 간 기능 장애
중등도 또는 중증 간 기능 장애 환자의 경우 정상 간 기능 환자와 비교하여 평균 AUC가 20% 증가했습니다. 중등도 또는 중증 간 기능 장애 환자의 경우 NINLARO의 시작 용량을 줄여야 합니다 [투여량 및 투여 방법 (2.3), 임상 약리학 (12.3) 참조].
8.7 신장 기능 장애
중증 신장 기능 장애 또는 투석이 필요한 ESRD 환자의 경우 정상 신장 기능 환자와 비교하여 평균 AUC가 39% 증가했습니다. 중증 신장 기능 장애 또는 투석이 필요한 ESRD 환자의 경우 NINLARO의 시작 용량을 줄여야 합니다. NINLARO는 투석되지 않으므로 투석 시간에 관계없이 투여할 수 있습니다 [투여량 및 투여 방법 (2.4), 임상 약리학 (12.3) 참조].
10 과다 복용
NINLARO를 복용하는 환자에서 치명적인 과다 복용을 포함한 과다 복용이 보고되었습니다. 과다 복용의 증상에는 권장 복용량에서 보고된 이상 반응이 포함됩니다 [복용량 및 투여 방법 (2.1), 이상 반응 (6.1) 참조]. 과다 복용과 관련하여 보고된 심각한 이상 반응에는 심각한 메스꺼움, 구토, 설사, 흡인성 폐렴, 다발성 장기 부전 및 사망이 포함됩니다.
과다 복용 시 이상 반응을 모니터링하고 적절한 지지 요법을 제공하십시오. NINLARO는 투석되지 않습니다.
11 설명
Ixazomib는 프로테아좀 억제제입니다. 프로드럭인 Ixazomib 시트르산은 생리적 조건에서 빠르게 가수분해되어 생물학적으로 활성인 형태인 Ixazomib로 전환됩니다. Ixazomib 시트르산의 화학명은 1,3,2-dioxaborolane-4,4-diacetic acid, 2-[(1R)-1-[[2-[(2,5-dichlorobenzoyl)amino]acetyl]amino]-3-methylbutyl]-5-oxo-이며 구조식은 다음과 같습니다.
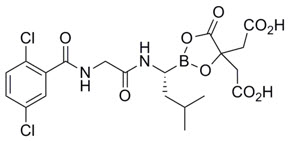
Ixazomib 시트르산의 분자식은 C20H23BCl2N2O9 이며 분자량은 517.12입니다. Ixazomib 시트르산은 하나의 키랄 중심을 가지고 있으며 R-입체 이성질체입니다. 37°C에서 0.1N HCl(pH 1.2)에 대한 Ixazomib 시트르산의 용해도는 0.61 mg/mL(Ixazomib로 보고됨)입니다. 용해도는 pH가 증가함에 따라 증가합니다.
NINLARO(ixazomib) 경구용 캡슐은 각각 5.7, 4.3 또는 3.3 mg의 Ixazomib 시트르산에 해당하는 4, 3 또는 2.3 mg의 Ixazomib를 함유하고 있습니다. 비활성 성분으로는 미결정 셀룰로오스, 마그네슘 스테아레이트 및 활석이 포함되어 있습니다. 캡슐 껍질에는 젤라틴과 이산화티탄이 포함되어 있습니다. 4 mg 캡슐 껍질에는 적색 및 황색 산화철이 포함되어 있으며, 3 mg 캡슐 껍질에는 흑색 산화철이 포함되어 있으며, 2.3 mg 캡슐 껍질에는 적색 산화철이 포함되어 있습니다. 인쇄 잉크에는 셸락, 프로필렌 글리콜, 수산화칼륨 및 흑색 산화철이 포함되어 있습니다.
12 임상약리학
12.1 작용 기전
이자조밉은 가역적 프로테아좀 억제제입니다. 이자조밉은 20S 프로테아좀의 베타 5 서브유닛의 키모트립신 유사 활성을 우선적으로 결합하고 억제합니다.
이자조밉은 시험관 내에서 다발성 골수종 세포주를 아폽토시스로 유도했습니다. 이자조밉은 보르테조밉, 레날리도마이드 및 덱사메타손을 포함한 여러 사전 치료 후 재발한 환자의 골수종 세포에 대한 시험관 내 세포독성을 보였습니다. 이자조밉과 레날리도마이드의 병용은 다발성 골수종 세포주에서 시너지 효과를 나타냈습니다. 생체 내에서 이자조밉은 마우스 다발성 골수종 종양 이종 이식 모델에서 항종양 활성을 보였습니다.
12.3 약동학
흡수
경구 투여 후 이자조밉 혈장 농도의 최고치에 도달하는 중간 시간은 1시간이었습니다. 모집단 PK 분석에 따르면 평균 절대 경구 생체 이용률은 58%였습니다. 이자조밉 AUC는 0.2~10.6mg의 용량 범위에서 용량에 비례하여 증가합니다.
단일 4mg 용량의 이자조밉을 투여한 환자를 대상으로 실시한 식품 효과 연구에 따르면 고지방 식사는 이자조밉 AUC를 28% 감소시키고 Cmax를 69% 감소시켰습니다 [용법 및 용량 (2.1) 참조].
배설
모집단 PK 분석에 따르면 전신 청소율은 약 1.9L/hr이며 개인 간 변동성은 44%였습니다. 이자조밉의 말단 반감기(t1/2)는 9.5일이었습니다. 주 1회 경구 투여 후 축적 비율은 2배로 결정되었습니다.
대사
방사성 동위원소 표지된 용량을 경구 투여한 후 이자조밉은 혈장에서 총 약물 관련 물질의 70%를 차지했습니다. 여러 CYP 효소와 비-CYP 단백질에 의한 대사는 이자조밉의 주요 청소 기전이 될 것으로 예상됩니다. 임상적으로 관련된 이자조밉 농도에서 인간 cDNA 발현 시토크롬 P450 동위 효소를 사용한 시험관 내 연구에 따르면 특정 CYP 동위 효소가 이자조밉 대사에 우선적으로 기여하지 않는 것으로 나타났습니다. 임상 농도보다 높은 농도에서 이자조밉은 여러 CYP 동위 효소에 의해 대사되었으며 추정되는 상대적 기여도는 3A4(42%), 1A2(26%), 2B6(16%), 2C8(6%), 2D6(5%), 2C19(5%) 및 2C9(<1%)였습니다.
특정 인구 집단
모집단 PK 분석에 따르면 나이(23~91세), 성별, 체표면적(1.2~2.7m2) 또는 인종은 이자조밉의 청소율에 임상적으로 의미 있는 영향을 미치지 않았습니다.
간 기능 장애 환자
모집단 PK 분석에 따르면 이자조밉의 PK는 정상 간 기능 환자와 경도 간 기능 장애 환자(총 빌리루빈 ≤ ULN 및 AST >ULN 또는 총 빌리루빈 >1-1.5 × ULN 및 모든 AST)에서 유사했습니다.
이자조밉의 PK는 정상 간 기능 환자에서 4mg(N=12), 중등도 간 기능 장애 환자에서 2.3mg(총 빌리루빈 >1.5-3 × ULN, N=13) 또는 중증 간 기능 장애 환자에서 1.5mg(총 빌리루빈 >3 × ULN, N=18)으로 특징지어졌습니다. 용량 정규화된 평균 AUC는 정상 간 기능 환자에 비해 중등도 또는 중증 간 기능 장애 환자에서 20% 더 높았습니다 [용법 및 용량 (2.3) 참조].
신장 기능 장애 환자
모집단 PK 분석에 따르면 이자조밉의 PK는 정상 신장 기능 환자와 경도 또는 중등도 신장 기능 장애 환자(크레아티닌 청소율 ≥30mL/min)에서 유사했습니다.
이자조밉의 PK는 정상 신장 기능 환자(크레아티닌 청소율 ≥90mL/min, N=18), 중증 신장 기능 장애 환자(크레아티닌 청소율 <30mL/min, N=14) 또는 투석이 필요한 ESRD 환자(N=6)에서 3mg 용량으로 특징지어졌습니다. 평균 AUC는 정상 신장 기능 환자에 비해 중증 신장 기능 장애 환자 또는 투석이 필요한 ESRD 환자에서 39% 더 높았습니다. 혈액 투석 세션 중에 측정된 이자조밉의 투석기 전후 농도는 유사하여 이자조밉이 투석 가능하지 않음을 시사합니다 [용법 및 용량 (2.4) 참조].
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
이자조밉은 박테리아 역돌연변이 분석(에임스 분석)에서 돌연변이 유발성이 없었습니다. 이자조밉은 인간 말초 혈액 림프구에서 시험관 내 염색체 이상 유발성 시험에서 양성으로 간주되었습니다. 그러나 생체 내에서 이자조밉은 마우스의 골수 미세핵 분석에서 염색체 이상 유발성이 없었고, 위와 간에서 평가한 마우스의 생체 내 혜성 분석에서 음성이었습니다. 이자조밉에 대한 발암성 연구는 수행되지 않았습니다.
랫트와 토끼에서의 발생 독성 연구는 이자조밉의 모체 독성 용량 이하에서 직접적인 배아-태아 독성을 보이지 않았습니다. 이자조밉을 사용한 생식력 및 초기 배아 발달 연구와 출산 전후 독성 연구는 수행되지 않았지만, 일반 독성 연구에서 생식 기관을 평가했습니다. 랫트에서 최대 6개월, 개에서 최대 9개월까지의 연구에서 이자조밉 치료로 인한 수컷 또는 암컷 생식 기관에 대한 영향은 없었습니다.
14 임상 연구
14.1 이전 치료를 1회 이상 받은 환자의 다발성 골수종
NINLARO와 레날리도마이드 및 덱사메타손 병용 요법의 효능 및 안전성은 이전 치료를 1회 이상 받은 재발성 및/또는 불응성 다발성 골수종 환자를 대상으로 한 무작위 배정, 이중 맹검, 위약 대조, 다기관 연구에서 평가되었습니다. 레날리도마이드 또는 프로테아좀 억제제에 불응성인 환자는 연구에서 제외되었습니다.
총 722명의 환자가 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 NINLARO, 레날리도마이드 및 덱사메타손 병용 요법(N=360; NINLARO 요법) 또는 위약, 레날리도마이드 및 덱사메타손 병용 요법(N=362; 위약 요법)을 1:1 비율로 무작위 배정 받았습니다. 무작위 배정은 이전 치료 횟수(1회 대 2회 또는 3회), 다발성 골수종 국제 병기 시스템(ISS)(1기 또는 2기 대 3기) 및 이전 프로테아좀 억제제 치료(노출 또는 미노출)에 따라 계층화되었습니다. 환자의 23%(N=166)는 경쇄 질환을 보였고, 환자의 12%(N=87)는 자유 경쇄 측정 가능 질환만 보였습니다.
레날리도마이드 처방 정보에 따라 두 치료군의 모든 환자에게 혈전 예방이 권장되었습니다. NINLARO 요법군 환자의 19%와 위약 요법군 환자의 12%에서 구토 방지제가 사용되었으며, 항바이러스제는 각각 64%와 60%, 항히스타민제는 각각 27%와 19%에서 사용되었습니다. 이러한 약물은 의료 서비스 제공자의 재량에 따라 예방 및/또는 증상 관리 목적으로 환자에게 투여되었습니다.
환자는 28일 주기의 1일, 8일 및 15일에 NINLARO 4mg 또는 위약을 투여 받았으며, 1일부터 21일까지 레날리도마이드(25mg)를 투여 받았고, 1일, 8일, 15일 및 22일에 덱사메타손(40mg)을 투여 받았습니다. 신장애가 있는 환자는 처방 정보에 따라 레날리도마이드의 시작 용량을 받았습니다. 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 계속했습니다.
표 6은 연구에서 기준 환자 및 질병 특성을 요약한 것입니다. 기준 인구 통계 및 질병 특성은 연구 요법 간에 균형을 이루었고 비교 가능했습니다.
| NINLARO + 레날리도마이드 및 덱사메타손 (N = 360) |
위약 + 레날리도마이드 및 덱사메타손 (N = 362) |
|
|---|---|---|
|
||
| 환자 특성 | ||
| 연령 중앙값(범위) | 66(38, 91) | 66(30, 89) |
| 성별(%) 남성/ 여성 | 58/42 | 56/44 |
| 연령대(% [<65/ ≥65세]) | 41/59 | 43/57 |
| 인종 n (%) | ||
| 백인 | 310 (86) | 301 (83) |
| 흑인 | 7 (2) | 6 (2) |
| 아시아인 | 30 (8) | 34 (9) |
| 기타 또는 명시되지 않음 | 13 (4) | 21 (6) |
| ECOG 수행 상태, n (%) | ||
| 0 또는 1 | 336 (93) | 334 (92) |
| 2 | 18 (5) | 24 (7) |
| 누락 | 6 (2) | 4 (1) |
| 크레아티닌 청소율, n (%) | ||
| <30 mL/min | 5 (1) | 5 (1) |
| 30-59 mL/min | 74 (21) | 95 (26) |
| ≥60 mL/min | 281 (78) | 261 (72) |
| 질병 특성 | ||
| 다발성 골수종 ISS 병기, n (%) | ||
| 1기 또는 2기 | 315 (87) | 320 (88) |
| 3기 | 45 (13) | 42 (12) |
| 이전 치료 횟수 n (%) | ||
| 중앙값(범위) | 1 (1, 3) | 1 (1,3) |
| 1 | 224 (62) | 217 (60) |
| 2 or 3 | 136 (38) | 145 (40) |
| Status at Baseline n (%) | ||
| Relapsed | 276 (77) | 280 (77) |
| Refractory* | 42 (12) | 40 (11) |
| Relapsed and Refractory | 41 (11) | 42 (12) |
| Type of Prior Therapy n (%) | ||
| Bortezomib containing | 248 (69) | 250 (69) |
| Carfilzomib containing | 1 (<1) | 4 (1) |
| Thalidomide containing | 157 (44) | 170 (47) |
| Lenalidomide containing | 44 (12) | 44 (12) |
| Melphalan containing | 293 (81) | 291 (80) |
| Stem cell transplantation | 212 (59) | 199 (55) |
| High risk (deletion (del) 17, t(4:14) and/or t(14:16) | 75 (21) | 62 (17) |
| deletion del (17) | 36 (10) | 33 (9) |
NINLARO의 효능은 2011년 국제 골수종 워킹 그룹(IMWG) 컨센서스 통일 반응 기준에 따라 중앙 실험실 결과를 기반으로 맹검 독립 검토 위원회(IRC)가 평가한 무진행 생존율(PFS)에 의해 평가되었습니다. 반응은 질병 진행까지 4주마다 평가되었습니다.
NINLARO의 승인은 위약 요법과 비교하여 NINLARO 요법의 PFS가 통계적으로 유의미하게 개선되었다는 사실에 근거했습니다. PFS 결과는 표 7에 요약되어 있으며 그림 1에 표시되어 있습니다.
| NINLARO + 레날리도마이드 및 덱사메타손 (N = 360) |
위약 + 레날리도마이드 및 덱사메타손 (N = 362) |
|
|---|---|---|
| NE: 평가 불가. | ||
| 무진행 생존율 | ||
| PFS 이벤트, n (%) | 129 (36) | 157 (43) |
| 중앙값(월) (95% CI) |
20.6 (17.0, NE) |
14.7 (12.9, 17.6) |
| 위험 비율* (95% CI) |
0.74 (0.59, 0.94) |
|
| p 값† | 0.012 | |
| 반응률 | ||
| 전반적인 반응률, n (%) | 282 (78) | 259 (72) |
| 완전 관해 | 42 (12) | 24 (7) |
| 매우 좋은 부분 관해 | 131 (36) | 117 (32) |
| 부분 관해 | 109 (30) | 118 (33) |
반응까지의 중간 시간은 NINLARO 요법군에서 1.1개월, 위약 요법군에서 1.9개월이었습니다. 반응 평가 가능 인구에서 반응자의 경우 반응 지속 기간의 중간값은 NINLARO 요법군에서 20.5개월, 위약 요법군에서 15개월이었습니다.
그림 1: 무진행 생존의 Kaplan-Meier 플롯
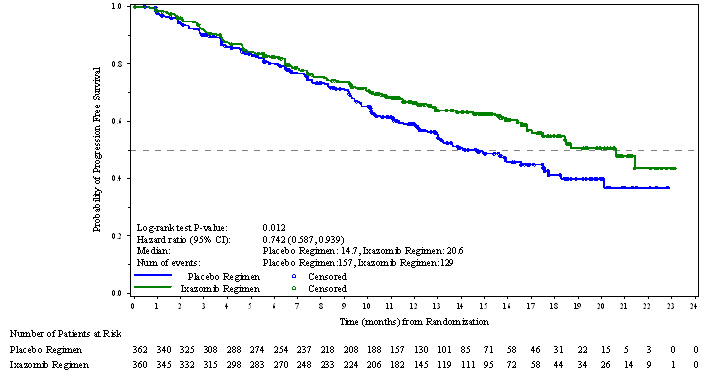
23개월의 중간 추적 관찰 기간 동안 372건의 PFS 사건을 대상으로 비추론적 PFS 분석을 실시했습니다. NINLARO 요법군 대비 위약 요법군의 PFS 위험 비율은 0.82(95% 신뢰 구간 [0.67, 1.0])였으며, 추정 중간 PFS는 NINLARO 요법군에서 20개월, 위약 요법군에서 15.9개월이었습니다.
약 85개월의 중간 추적 관찰 기간 동안 OS에 대한 최종 분석에서 ITT 인구의 중간 OS는 NINLARO 요법군 환자의 경우 53.6개월, 위약 요법군 환자의 경우 51.6개월이었습니다(HR = 0.94 [95% CI: 0.78, 1.13]).
14.2 유지 요법 환경에서 NINLARO로 치료받은 환자의 사망률 증가
C16019(NCT02181413)에서, 자가 조혈모세포 이식을 받은 새로 진단된 다발성 골수종 환자는 24개월 동안 유지 요법을 계속했습니다. NINLARO 군에서 27%(105/395)의 사망자가 발생한 반면, 위약 군에서는 26%(69/261)의 사망자가 발생했습니다. 전체 생존에 대한 위험 비율은 1.008(95% CI: 0.744 – 1.367)이었습니다.
C16021(NCT02312258)에서, 조혈모세포 이식을 받지 않고 부분 반응 이상을 달성한 새로 진단된 다발성 골수종 환자는 24개월 동안 유지 요법을 계속했습니다. NINLARO 군에서 30%(127/425)의 사망자가 발생한 반면, 위약 군에서는 27%(76/281)의 사망자가 발생했습니다. 전체 생존에 대한 위험 비율은 1.136(95% CI: 0.853 – 1.514)이었습니다.
NINLARO는 통제된 임상 시험 외부에서 다발성 골수종에 대한 유지 요법 환경에서 사용하는 것이 권장되지 않습니다 [적응증 및 사용법 (1) 및 경고 및 주의 사항 (5.9) 참조].
14.3 새로 진단된 다발성 골수종 환자의 효능 부족
새로 진단된 다발성 골수종 환자의 효능 부족은 전향적 무작위 대조 임상 시험에서 확인되었습니다.
C16014(NCT01850524)에서, 새로 진단된 다발성 골수종 환자의 경우, 연구는 PFS에 대한 사전 지정된 1차 종료점을 충족하지 못했습니다. NINLARO, 레날리도마이드 및 덱사메타손 군에서 136명(39%)의 사망자가 발생한 반면, 레날리도마이드 및 덱사메타손 군에서는 148명(42%)의 사망자가 발생했습니다. 전체 생존에 대한 위험 비율은 0.998(95% CI: 0.79 – 1.261)이었습니다.
NINLARO는 통제된 임상 시험 외부에서 새로 진단된 다발성 골수종에서 레날리도마이드 및 덱사메타손과 병용하여 사용하는 것이 권장되지 않습니다 [적응증 및 사용법 (1) 참조].
15 참고 문헌
- OSHA Hazardous Drugs. OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html
16 제공/보관 및 취급 방법
제품 공급
NINLARO는 다음과 같이 공급됩니다.
| 캡슐 당 용량 | 캡슐 설명 | 외곽 상자 | 3개들이 블리스터 팩 | 1개들이 블리스터 팩 | NDC |
|---|---|---|---|---|---|
| 4 mg | 연한 주황색, 크기 3, 캡슐 뚜껑에 “Takeda”, 캡슐 몸체에 “4 mg”이 검은색 잉크로 각인되어 있습니다. | 상자에 4 mg 캡슐 3개 | 각 블리스터 팩에 4 mg 캡슐 3개 | 각 블리스터 팩에 4 mg 캡슐 1개 | 외곽 상자 NDC 63020-400-02 3개들이 블리스터 팩 NDC 63020-400-03 1개들이 블리스터 팩 NDC 63020-400-01 |
| 3 mg | 연한 회색, 크기 4, 캡슐 뚜껑에 “Takeda”, 캡슐 몸체에 “3 mg”이 검은색 잉크로 각인되어 있습니다. | 상자에 3 mg 캡슐 3개 | 각 블리스터 팩에 3 mg 캡슐 3개 | 각 블리스터 팩에 3 mg 캡슐 1개 | 외곽 상자 NDC 63020-390-02 3개들이 블리스터 팩 NDC 63020-390-03 1개들이 블리스터 팩 NDC 63020-390-01 |
| 2.3 mg | 연한 분홍색, 크기 4, 캡슐 뚜껑에 “Takeda”, 캡슐 몸체에 “2.3 mg”이 검은색 잉크로 각인되어 있습니다. | 상자에 2.3 mg 캡슐 3개 | 각 블리스터 팩에 2.3 mg 캡슐 3개 | 각 블리스터 팩에 2.3 mg 캡슐 1개 | 외곽 상자 NDC 63020-230-02 3개들이 블리스터 팩 NDC 63020-230-03 1개들이 블리스터 팩 NDC 63020-230-01 |
캡슐은 PVC-알루미늄/알루미늄 블리스터에 개별 포장되어 있습니다.
취급 및 폐기
NINLARO는 위험 약물입니다. 적용 가능한 특수 취급 및 폐기 절차1를 따르십시오.
캡슐을 열거나 부수지 마십시오. 캡슐 내용물과 직접 접촉하지 마십시오. 캡슐이 파손된 경우 캡슐 내용물이 피부나 눈에 직접 닿지 않도록 주의하십시오. 피부에 닿았을 경우 비누와 물로 깨끗이 씻으십시오. 눈에 닿았을 경우 물로 충분히 씻어내십시오.
사용하지 않은 의약품이나 폐기물은 현지 규정에 따라 폐기해야 합니다.
17 환자 상담 정보
FDA 승인 환자 라벨(환자 정보)을 읽도록 환자에게 알려주십시오.
투약 지침
- 환자에게 NINLARO를 처방대로 정확하게 복용하도록 지시하십시오.
- 환자에게 4주 사이클의 첫 3주 동안 매주 같은 요일에, 거의 같은 시간에 NINLARO를 복용하도록 알려주십시오. 치료를 시작하는 환자에게는 모든 투약 지침을 주의 깊게 따르는 것이 중요하다는 점을 논의해야 합니다. 과량 복용으로 사망 사례가 발생했으므로 환자에게 지시된 대로 권장 용량을 복용하도록 알려주십시오. [과량 복용 (10) 참조].
- 환자에게 NINLARO를 식사 1시간 전 또는 식사 2시간 후에 복용하도록 알려주십시오.
- 환자에게 NINLARO와 덱사메타손을 동시에 복용하지 않도록 알려주십시오. 덱사메타손은 식사와 함께 복용해야 하고 NINLARO는 식사와 함께 복용해서는 안 됩니다.
- 환자에게 캡슐을 물과 함께 통째로 삼키도록 알려주십시오. 캡슐을 부수거나 씹거나 열어서는 안 됩니다.
- 환자에게 캡슐 내용물과의 직접적인 접촉을 피하도록 알려주십시오. 캡슐이 파손된 경우 캡슐 내용물이 피부나 눈에 직접 닿지 않도록 하십시오. 피부에 닿았을 경우 비누와 물로 깨끗이 씻으십시오. 눈에 닿았을 경우 물로 깨끗이 씻어내십시오.
- 환자가 복용량을 놓친 경우, 다음 예정된 복용량까지 72시간 이상 남았다면 놓친 복용량을 복용하도록 알려주십시오. 다음 예정된 복용량까지 72시간 이내라면 놓친 복용량을 복용하지 않도록 알려주십시오.
- 환자가 복용 후 구토를 한 경우, 복용량을 반복하지 말고 다음 예정된 복용 시간에 복용을 재개하도록 알려주십시오.
- 환자에게 캡슐을 원래 포장에 보관하고 NINLARO를 복용하기 직전까지 포장에서 꺼내지 않도록 알려주십시오.
[투약 및 투여 (2.1) 참조]
혈소판 감소증
환자에게 혈소판 수치가 낮아질 수 있다(혈소판 감소증). 혈소판 감소증의 징후에는 출혈과 멍이 잘 드는 것이 포함될 수 있습니다. [경고 및 주의 사항 (5.1) 참조].
위장계 독성
환자에게 설사, 변비, 메스꺼움 및 구토가 발생할 수 있으며, 이러한 부작용이 지속되면 의료 서비스 제공자에게 연락하도록 알려주십시오. [경고 및 주의 사항 (5.2) 참조].
말초 신경병증
환자에게 손가락이나 발의 저림, 마비, 통증, 화끈거림 또는 팔이나 다리의 약화와 같은 말초 신경병증의 새로운 증상이나 악화된 증상이 나타나면 의료 서비스 제공자에게 연락하도록 알려주십시오. [경고 및 주의 사항 (5.3) 참조].
기타 부작용
환자에게 급성 열성 호중구성 피부염(Sweet 증후군), 스티븐스-존슨 증후군, 횡단성 척수염, 후방 가역성 뇌병증 증후군, 종양 용해 증후군, 대상포진, 백내장, 안구 건조증, 시력 흐림, 결막염 및 혈전성 혈소판 감소성 자반증의 징후와 증상이 나타나면 의료 서비스 제공자에게 연락하도록 알려주십시오. [부작용 (6.1) 참조].
태아 독성
임산부와 임신 가능성이 있는 여성에게 태아에 대한 잠재적인 위험을 알려주십시오. 임신 가능성이 있는 여성에게 알려진 임신 또는 의심되는 임신을 의료 서비스 제공자에게 알리도록 알려주십시오. [경고 및 주의 사항 (5.8) 및 특정 인구 집단에서의 사용 (8.1) 참조].
임신 가능성이 있는 여성에게 NINLARO 치료 중 및 마지막 복용 후 90일 동안 효과적인 피임법을 사용하도록 알려주십시오. 호르몬 피임법을 사용하는 여성에게는 장벽 피임법도 함께 사용하도록 알려주십시오. [특정 인구 집단에서의 사용 (8.1) 참조].
임신 가능성이 있는 여성 파트너가 있는 남성에게 NINLARO 치료 중 및 마지막 복용 후 90일 동안 효과적인 피임법을 사용하도록 알려주십시오. [특정 인구 집단에서의 사용 (8.1) 참조].
SPL 미분류 섹션
판매원:
Takeda Pharmaceuticals America, Inc.
Cambridge, MA 02142
NINLARO는 Millennium Pharmaceuticals, Inc.의 등록 상표입니다.
©2024 Takeda Pharmaceuticals U.S.A., Inc. 판권 소유.
자세한 내용은 www.NINLARO.com을 방문하거나 1-844-617-6468로 전화하십시오.
IXB349 R10
환자 안내문
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 7월 | |
| 환자 정보 NINLARO® (닌-라-로) (ixazomib) 캡슐 |
||
| NINLARO는 REVLIMID® (레날리도마이드) 및 덱사메타손이라는 다른 두 가지 처방약과 함께 사용됩니다. REVLIMID® (레날리도마이드)와 함께 제공되는 약물 안내서를 읽으십시오. 덱사메타손에 대한 정보는 의료 서비스 제공자 또는 약사에게 문의하십시오. | ||
| NINLARO는 무엇입니까? NINLARO는 다발성 골수종 치료에 사용되는 처방약으로, 다발성 골수종 치료를 한 번 이상 받은 환자의 경우 REVLIMID® (레날리도마이드) 및 덱사메타손과 함께 사용됩니다. NINLARO는 다음과 같은 환자에게는 사용해서는 안 됩니다.
NINLARO가 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
||
NINLARO를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. 여기에는 처방약과 일반 의약품, 비타민 및 허브 보충제가 포함됩니다. NINLARO 치료 중에 새로운 약물을 복용하기 전에 의료 서비스 제공자와 상담하십시오. |
||
NINLARO는 어떻게 복용해야 합니까?
|
||
| NINLARO의 가능한 부작용은 무엇입니까? NINLARO는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
||
|
|
|
|
||
|
|
|
NINLARO의 기타 흔한 부작용은 다음과 같습니다. |
||
|
|
|
NINLARO 치료 중 다음과 같은 새로운 징후나 증상이 나타나거나 악화되면 의료 서비스 제공자에게 알리십시오:
이것들은 NINLARO의 모든 가능한 부작용이 아닙니다. |
||
NINLARO는 어떻게 보관해야 합니까?
NINLARO 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||
| NINLARO의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 팜플렛에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 NINLARO를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 NINLARO를 주지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 NINLARO에 대한 정보를 문의할 수 있습니다. |
||
| NINLARO의 성분은 무엇입니까? 활성 성분: ixazomib 비활성 성분: 미결정 셀룰로오스, 마그네슘 스테아레이트 및 활석 캡슐 껍질: 젤라틴 및 이산화티탄. 4mg 캡슐 껍질에는 적색 및 황색 산화철이 포함되어 있습니다. 3mg 캡슐 껍질에는 흑색 산화철이 포함되어 있습니다. 2.3mg 캡슐 껍질에는 적색 산화철이 포함되어 있습니다. 인쇄 잉크에는 셸락, 프로필렌 글리콜, 수산화칼륨 및 흑색 산화철이 포함되어 있습니다. |
||
|
판매원: Takeda Pharmaceuticals America, Inc. Cambridge, MA 02142 NINLARO는 Millennium Pharmaceuticals, Inc.의 등록 상표입니다. ©2024 Takeda Pharmaceuticals U.S.A., Inc. 판권 소유. 자세한 내용은 www.NINLARO.com을 방문하거나 1-844-617-6468로 전화하십시오. IXB349 R10 |
||
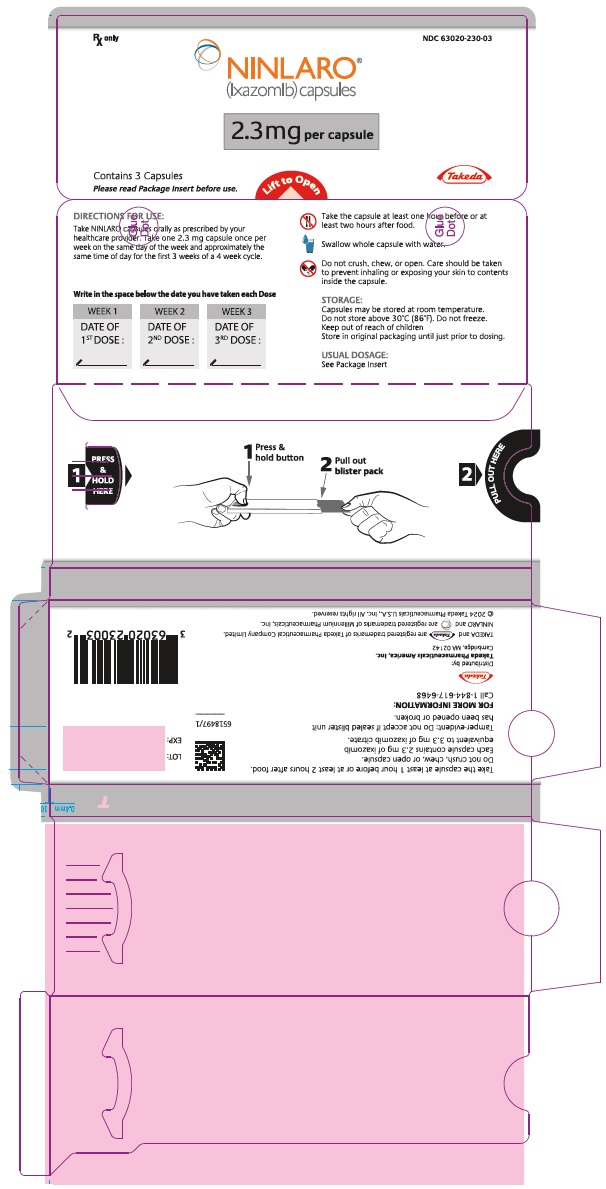
주요 표시면 – 4mg 캡슐 블리스터 포장
처방전에 의해서만 NDC 63020-400-03
NINLARO®
(ixazomib) capsules
캡슐당 4 mg
캡슐 3개 포함
사용 전에 포장 삽입 팸플릿을 읽어보십시오.
들어올려서 여십시오
Takeda
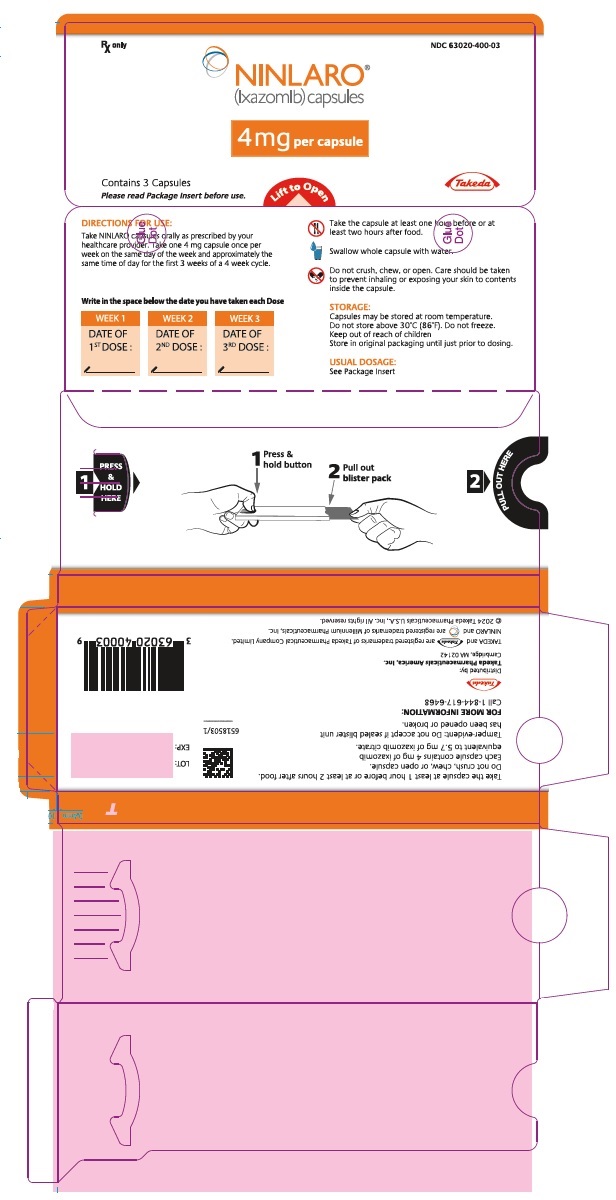
주요 표시면 – 3mg 캡슐 블리스터 포장
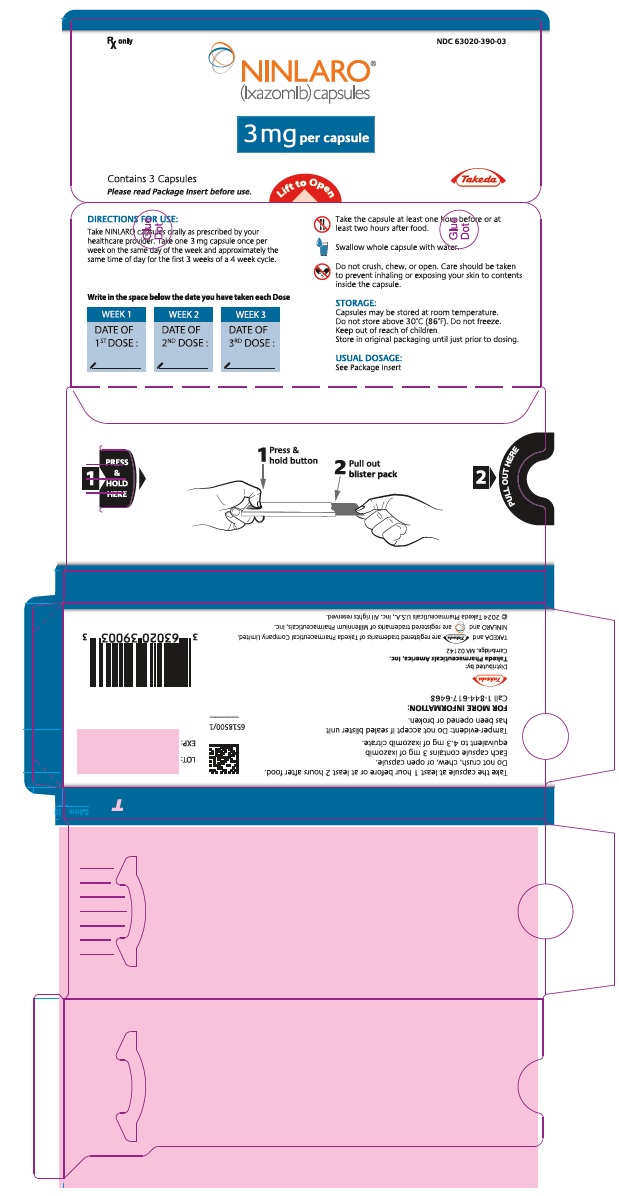
Rx only NDC 63020-390-03
NINLARO®
(ixazomib) capsules
3 mg per capsule
Contains 3 Capsules
사용 전에 포장 삽입물을 읽어보십시오.
들어올려서 열기
Takeda
주요 표시면 – 2.3mg 캡슐 블리스터 포장
처방전에 의해서만 NDC 63020-230-03
NINLARO®
(ixazomib) capsules
캡슐당 2.3 mg
캡슐 3개 포함
사용 전에 포장 삽입물을 읽어보십시오.
들어올려서 여십시오
Takeda