의약품 제조업체: Sumitomo Pharma America, Inc. (Updated: 2023-07-21)
처방 정보 요약
LATUDA (lurasidone hydrochloride) 정제, 경구용
미국 최초 승인: 2010
적응증 및 사용
투여량 및 투여 방법
LATUDA는 음식(최소 350칼로리)과 함께 복용해야 합니다. 음식과 함께 투여하면 LATUDA의 흡수가 크게 증가합니다 (2.3, 12.3).
| 적응증 | 시작 용량 | 권장 용량 |
| 정신분열증 – 성인 (2.1) | 하루 40mg | 하루 40mg~160mg |
| 정신분열증 – 청소년(13~17세) (2.1) | 하루 40mg | 하루 40mg~80mg |
| 조울증 – 성인 (2.2) | 하루 20mg | 하루 20mg~120mg |
| 조울증 – 소아 환자(10~17세) (2.2) | 하루 20mg | 하루 20mg~80mg |
- 중등도 및 중증 신장애: 권장 시작 용량은 하루 20mg이며, 권장 최대 용량은 하루 80mg입니다 (2.4, 8.6).
- 중등도 및 중증 간 손상: 권장 시작 용량은 하루 20mg입니다. 중등도 간 손상의 경우 권장 최대 용량은 하루 80mg이며, 중증 간 손상의 경우 권장 최대 용량은 하루 40mg입니다 (2.5, 8.7).
- CYP3A4 중등도 억제제 (예: 딜티아젬)와의 병용 투여:
- LATUDA 용량은 원래 용량의 절반으로 줄여야 합니다. 권장 시작 용량은 하루 20mg입니다. 권장 최대 용량은 하루 80mg입니다 (2.6, 7.1).
-
CYP3A4 중등도 유도제와의 병용 투여:
LATUDA 용량을 늘려야 할 수 있습니다 (2.6, 7.1).
제형 및 강도
정제: 20mg, 40mg, 60mg, 80mg 및 120mg (3)
금기 사항
경고 및 주의 사항
- 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 부작용: 뇌혈관계 부작용 (예: 뇌졸중, 일과성 허혈 발작)의 발생률 증가 (5.3).
- 악성 신경 이완 증후군: 즉시 중단하고 면밀히 모니터링 (5.4).
- 지연성 운동 장애: 임상적으로 적절한 경우 중단 (5.5).
- 대사 변화: 고혈당증/당뇨병, 이상지질혈증 및 체중 증가를 모니터링 (5.6).
- 고프롤락틴혈증: 프로락틴 수치 상승이 발생할 수 있습니다 (5.7).
- 백혈구 감소증, 호중구 감소증 및 무과립구증: 기존의 백혈구 수치가 낮거나 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자의 경우 완전 혈구 수 (CBC)를 실시합니다. 백혈구 수치가 다른 원인 요인 없이 임상적으로 유의미하게 감소하는 경우 LATUDA 투여를 중단하는 것을 고려하십시오 (5.8).
- 기립성 저혈압 및 실신: 심박수와 혈압을 모니터링하고 알려진 심혈관 질환 또는 뇌혈관 질환이 있거나 탈수증 또는 실신 위험이 있는 환자에게 주의하십시오 (5.9).
부작용
흔하게 관찰되는 부작용 (발생률 ≥ 5% 및 위약군의 발생률의 최소 2배)은 다음과 같습니다 (6.1):
- 조현병 성인 환자: 졸음, 불안정, 추체 외로 증상 및 메스꺼움
- 조현병 청소년 환자 (13-17세): 졸음, 메스꺼움, 불안정, EPS (불안정 제외), 비염 (80mg만 해당), 구토
- 조울증 성인 환자: 불안정, 추체 외로 증상 및 졸음
- 조울증 소아 환자 (10-17세): 메스꺼움, 체중 증가 및 불면증.
의심되는 부작용을 보고하려면 Sunovion Pharmaceuticals Inc.에 1-877-737-7226으로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 약물 안내는 17번을 참조하십시오.
개정: 2022년 5월
목차
전문 정보: 내용*
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가; 및 자살 생각 및 행동
1 적응증 및 사용법
2 용법 및 용량
2.1 조현병
2.2 조울증 1형과 관련된 우울증 에피소드
2.3 투약 정보
2.4 신장애 환자의 용량 조절
2.5 간장애 환자의 용량 조절
2.6 CYP3A4 억제제 및 CYP3A4 유도제의 약물 상호 작용으로 인한 용량 조절
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 치매 관련 정신병이 있는 노인 환자의 사망률 증가
5.2 소아 및 청소년 환자의 자살 생각 및 행동
5.3 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 부작용, 뇌졸중 포함
5.4 악성 신경 이완 증후군
5.5 지연성 운동 장애
5.6 대사 변화
5.7 고프롤락틴혈증
5.8 백혈구 감소증, 호중구 감소증 및 무과립구증
5.9 기립성 저혈압 및 실신
5.10 낙상
5.11 발작
5.12 인지 및 운동 장애 가능성
5.13 체온 조절 장애
5.14 조증/경조증 활성화
5.15 연하 곤란
5.16 파킨슨병 또는 루이 소체 치매 환자의 신경계 부작용
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 LATUDA와 임상적으로 중요한 상호 작용을 하는 약물
7.2 LATUDA와 임상적으로 중요한 상호 작용을 하지 않는 약물
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
8.8 기타 특정 환자군
9 약물 남용 및 의존성
9.1 마약류
9.2 남용
10 과량 복용
10.1 인체 경험
10.2 과량 복용 관리
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 조현병
14.2 조울증 1형과 관련된 우울증 에피소드
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
경고 사항
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가; 및 자살 생각 및 행동
치매 관련 정신병이 있는 노인 환자의 사망률 증가
항정신병 약물로 치료받는 치매 관련 정신병이 있는 노인 환자는 사망 위험이 증가합니다. LATUDA는 치매 관련 정신병 환자의 치료에 사용하도록 승인되지 않았습니다
[경고 및 주의 사항 (5.1) 참조].
자살 생각 및 행동
항우울제는 단기 연구에서 소아 및 청소년의 자살 생각 및 행동 위험을 증가시켰습니다. 모든 항우울제 치료 환자의 임상 악화 및 자살 생각 및 행동의 발생을 면밀히 모니터링하십시오 [경고 및 주의 사항 (5.2) 참조].
1 적응증 및 용법
LATUDA는 다음 질환에 사용됩니다.
- 성인 및 청소년 환자(13~17세)의 조현병 치료 [임상 연구 참조 (14.1)].
- 양극성 I 장애와 관련된 주요 우울증 에피소드(양극성 우울증)가 있는 성인 및 소아 환자(10~17세)의 단독 요법 치료 [임상 연구 참조 (14.2)].
- 양극성 I 장애와 관련된 주요 우울증 에피소드(양극성 우울증)가 있는 성인 환자의 리튬 또는 발프로산염 병용 요법 [임상 연구 참조 (14.2)].
2 복용량 및 투여 방법
2.1 정신분열증
성인
LATUDA의 권장 시작 용량은 1일 1회 40mg입니다. 초기 용량 적정은 필요하지 않습니다. LATUDA는 1일 40mg~160mg 용량 범위에서 효과적인 것으로 나타났습니다 [임상 연구 (14.1) 참조]. 권장 최대 용량은 1일 160mg입니다.
청소년(13~17세)
LATUDA의 권장 시작 용량은 1일 1회 40mg입니다. 초기 용량 적정은 필요하지 않습니다. LATUDA는 1일 40mg~80mg 용량 범위에서 효과적인 것으로 나타났습니다 [임상 연구 (14.1) 참조]. 권장 최대 용량은 1일 80mg입니다.
2.2 양극성 I 장애와 관련된 우울증 에피소드
성인
LATUDA의 권장 시작 용량은 단독 요법으로서 또는 리튬 또는 발프로에이트와의 보조 요법으로서 1일 1회 20mg을 투여하는 것입니다. 초기 용량 적정은 필요하지 않습니다. LATUDA는 단독 요법으로서 또는 리튬 또는 발프로에이트와의 보조 요법으로서 1일 20mg~120mg 용량 범위에서 효과적인 것으로 나타났습니다 [임상 연구 (14.2) 참조]. 단독 요법으로서 또는 리튬 또는 발프로에이트와의 보조 요법으로서 권장 최대 용량은 1일 120mg입니다. 단독 요법 연구에서, 고용량 범위(1일 80mg~120mg)는 저용량 범위(20~60mg)에 비해 평균적으로 추가적인 효능을 제공하지 않았습니다 [임상 연구 (14.2) 참조].
소아 환자(10~17세)
LATUDA의 권장 시작 용량은 단독 요법으로서 1일 1회 20mg을 투여하는 것입니다. 초기 용량 적정은 필요하지 않습니다. 용량은 임상 반응에 따라 1주일 후에 증량할 수 있습니다. LATUDA는 단독 요법으로서 1일 20mg~80mg 용량 범위에서 효과적인 것으로 나타났습니다. 임상 연구가 끝날 무렵, 대부분의 환자(67%)는 1일 1회 20mg 또는 40mg을 투여받았습니다 [임상 연구 (14.2) 참조]. 권장 최대 용량은 1일 80mg입니다.
양극성 장애와 관련된 조증 치료에 대한 LATUDA의 효능은 확립되지 않았습니다.
2.3 투여 정보
LATUDA는 음식과 함께(최소 350칼로리) 복용해야 합니다. 음식과 함께 투여하면 LATUDA의 흡수가 크게 증가합니다. 음식과 함께 투여하면 AUC가 약 2배 증가하고 Cmax가 약 3배 증가합니다. 임상 연구에서 LATUDA는 음식과 함께 투여되었습니다 [임상 약리학 (12.3) 참조].
6주 이상 장기간 LATUDA를 사용할 경우의 효과는 대조 연구에서 확립되지 않았습니다. 따라서 장기간 LATUDA를 사용하기로 선택한 의사는 개별 환자에 대한 약물의 장기적인 유용성을 주기적으로 재평가해야 합니다 [복용량 및 투여 방법 (2.1 및 2.2) 참조].
2.4 신장애 환자에 대한 용량 수정
중등도(크레아티닌 청소율: 30~<50mL/min) 및 중증 신장애(크레아티닌 청소율 <30mL/min) 환자의 경우 용량 조절이 권장됩니다. 권장 시작 용량은 1일 20mg입니다. 이러한 환자의 용량은 1일 80mg을 초과해서는 안 됩니다 [특정 집단에서의 사용 (8.6) 참조].
2.5 간장애 환자에 대한 용량 수정
중등도(Child-Pugh 점수 = 7~9) 및 중증 간장애(Child-Pugh 점수 = 10~15) 환자의 경우 용량 조절이 권장됩니다. 권장 시작 용량은 1일 20mg입니다. 중등도 간장애 환자의 용량은 1일 80mg을 초과해서는 안 되며, 중증 간장애 환자의 용량은 1일 40mg을 초과해서는 안 됩니다 [특정 집단에서의 사용 (8.7) 참조].
2.6 CYP3A4 억제제 및 CYP3A4 유도제와의 약물 상호 작용으로 인한 용량 수정
CYP3A4 억제제와의 병용
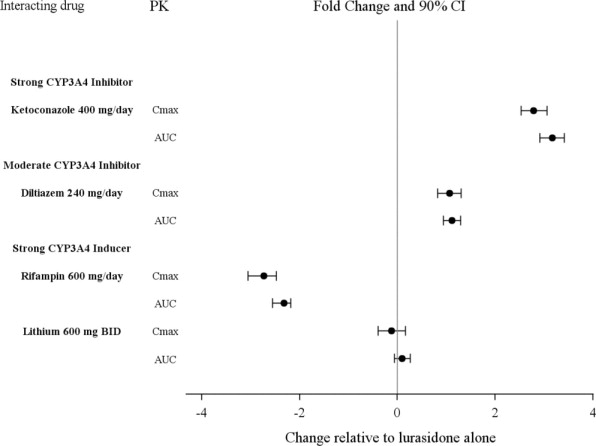
LATUDA는 강력한 CYP3A4 억제제(예: 케토코나졸, 클래리스로마이신, 리토나비르, 보리코나졸, 미베프라딜 등)와 병용해서는 안 됩니다 [금기 (4) 참조].
LATUDA를 처방받고 있는 경우 치료에 중등도 CYP3A4 억제제(예: 딜티아젬, 아타자나비르, 에리스로마이신, 플루코나졸, 베라파밀 등)를 추가하면 LATUDA 용량을 원래 용량 수준의 절반으로 줄여야 합니다. 마찬가지로, 중등도 CYP3A4 억제제를 처방받고 있는 경우 치료에 LATUDA를 추가하면 LATUDA의 권장 시작 용량은 1일 20mg이며, LATUDA의 권장 최대 용량은 1일 80mg입니다 [금기 (4), 약물 상호 작용 (7.1) 참조].
자몽과 자몽 주스는 CYP3A4를 억제하고 LATUDA 농도를 변경할 수 있으므로 LATUDA를 복용하는 환자는 피해야 합니다 [약물 상호 작용 (7.1) 참조].
3. 투여 형태 및 강도
LATUDA 정제는 다음과 같은 모양과 색상(표 1)으로 제공되며, 한쪽 면에 각각의 각인이 있습니다.
| 정제 강도 | 정제 색상/모양 | 정제 각인 |
| 20 mg | 흰색에서 약간 희미한 흰색의 원형 | L20 |
| 40 mg | 흰색에서 약간 희미한 흰색의 원형 | L40 |
| 60 mg | 흰색에서 약간 희미한 흰색의 장방형 | L60 |
| 80 mg | 연한 녹색 타원형 | L80 |
| 120 mg | 흰색에서 약간 희미한 흰색의 타원형 | L120 |
4 금기
- lurasidone HCl 또는 제형의 어떤 성분에 대해서도 알려진 과민증이 있는 경우. lurasidone에서 혈관부종이 관찰되었습니다. [부작용 (6.1) 참조].
- 강력한 CYP3A4 억제제 (예: ketoconazole, clarithromycin, ritonavir, voriconazole, mibefradil 등) [약물 상호 작용 (7.1) 참조].
- 강력한 CYP3A4 유도제 (예: rifampin, avasimibe, St. John’s wort, phenytoin, carbamazepine 등) [약물 상호 작용 (7.1) 참조].
5 경고 및 주의사항
5.1 치매 관련 정신병을 앓고 있는 노인 환자의 사망률 증가
항정신병 약물로 치료받은 치매 관련 정신병을 앓고 있는 노인 환자는 사망 위험이 증가합니다. 주로 비정형 항정신병 약물을 복용하는 환자를 대상으로 실시한 17건의 위약 대조 임상시험(평균 지속 기간 10주)에 대한 분석 결과, 약물 치료를 받은 환자의 사망 위험이 위약 치료를 받은 환자보다 1.6~1.7배 높은 것으로 나타났습니다. 일반적인 10주간의 대조 임상시험 기간 동안 약물 치료를 받은 환자의 사망률은 약 4.5%였던 반면, 위약군의 사망률은 약 2.6%였습니다. 사망 원인은 다양했지만 대부분 심혈관계(예: 심부전, 급사) 또는 감염(예: 폐렴)과 관련된 것으로 나타났습니다. LATUDA는 치매 관련 정신병 환자의 치료제로 승인되지 않았습니다 [경고, 경고 및 주의사항 (5.3) 참조].
5.2 소아 및 청소년 환자의 자살 충동 및 행동
약 77,000명의 성인 환자와 4,400명 이상의 소아 환자를 대상으로 실시한 항우울제(SSRI 및 기타 항우울제)에 대한 위약 대조 임상시험의 취합 분석 결과, 소아 및 청소년 환자의 자살 충동 및 행동 발생률은 위약 치료를 받은 환자보다 항우울제 치료를 받은 환자에서 더 높았습니다. 치료받은 환자 1,000명당 자살 충동 및 행동 사례 수에서 나타난 약물-위약 차이는 표 2에 나와 있습니다.
소아 연구에서는 자살이 발생하지 않았습니다. 성인 연구에서는 자살이 발생했지만, 항우울제가 자살에 미치는 영향에 대한 결론을 내릴 만큼 그 수가 충분하지 않았습니다.
| 연령대 | 치료받은 환자 1,000명당 자살 충동 또는 행동 환자 수의 약물-위약 차이 |
| 위약에 비해 증가 | |
| <18세 | 14명 추가 |
| 18~24세 | 5명 추가 |
| 위약에 비해 감소 | |
| 25~64세 | 1명 감소 |
| ≥65세 | 6명 감소 |
소아 및 청소년 환자에서 자살 생각 및 행동 위험이 4개월 이상, 즉 장기간 사용으로까지 확대되는지는 알려져 있지 않습니다. 그러나 성인의 주요 우울 장애에 대한 위약 대조 유지 연구에서 항우울제가 우울증의 재발을 지연시킨다는 상당한 증거가 있습니다.
모든 항우울제 치료를 받는 환자를 대상으로 임상적 악화 및 자살 생각 및 행동의 출현, 특히 약물 치료 초기 몇 개월 동안과 용량 변경 시기에 대해 모니터링합니다. 환자의 가족이나 간병인에게 행동 변화를 모니터링하고 의료 제공자에게 알리도록 교육합니다. 우울증이 지속적으로 악화되거나 자살 생각이나 행동이 새롭게 나타나는 환자의 경우 LATUDA 중단 가능성을 포함하여 치료 계획 변경을 고려합니다.
5.3 치매 관련 정신병 노인 환자에서 뇌졸중을 포함한 뇌혈관계 이상 반응
치매 노인 환자를 대상으로 한 리스페리돈, 아리피프라졸 및 올란자핀 위약 대조 임상시험에서 위약 치료 환자에 비해 사망을 포함한 뇌혈관계 이상 반응(뇌혈관계 사고 및 일과성 허혈 발작)의 발생률이 더 높았습니다. LATUDA는 치매 관련 정신병 환자의 치료제로 승인되지 않았습니다 [경고, 경고 및 주의사항 (5.1) 참조].
5.4 신경이완제 악성 증후군
때때로 신경이완제 악성 증후군(NMS)이라고 하는 잠재적으로 치명적인 증상 복합체가 LATUDA를 포함한 항정신병 약물 투여와 관련하여 보고되었습니다. NMS의 임상적 증상은 고열, 근육 강직, 정신 상태 변화 및 자율 신경 불안정 증거입니다. 추가 징후로는 크레아틴 포스포키나제 상승, 근육소변증(횡문근융해증) 및 급성 신부전이 있습니다.
NMS가 의심되는 경우 즉시 LATUDA를 중단하고 집중적인 대증 치료 및 모니터링을 제공합니다.
5.5 지연성 운동 장애
지연성 운동 장애는 항정신병 약물로 치료받은 환자에게서 발생할 수 있는 잠재적으로 비가역적이고 비자발적인 운동 이상 증후군입니다. 이 증후군의 유병률은 노인, 특히 노년 여성에서 가장 높은 것으로 보이지만 항정신병 치료 시작 시 유병률 추정치에 의존하여 어떤 환자가 이 증후군을 일으킬 가능성이 있는지 예측하는 것은 불가능합니다. 항정신병 약물 제품이 지연성 운동 장애를 유발할 가능성이 서로 다른지는 알려져 있지 않습니다.
지연성 운동 장애가 발생할 위험과 비가역적일 가능성은 치료 기간 및 환자에게 투여된 항정신병 약물의 총 누적 용량이 증가함에 따라 증가하는 것으로 여겨집니다. 그러나 이 증후군은 훨씬 덜 흔하지만 비교적 짧은 치료 기간 동안 저용량으로 발생하거나 치료 중단 후에도 발생할 수 있습니다.
항정신병 치료를 중단하면 증후군이 부분적으로 또는 완전히 완화될 수 있습니다. 그러나 항정신병 치료 자체가 증후군의 징후와 증상을 억제(또는 부분적으로 억제)하여 기저 과정을 가릴 수 있습니다. 증상 억제가 증후군의 장기 경과에 미치는 영향은 알려져 있지 않습니다.
이러한 고려 사항을 감안할 때 LATUDA는 지연성 운동 장애의 발생을 최소화할 가능성이 가장 높은 방식으로 처방되어야 합니다. 만성 항정신병 치료는 일반적으로 (1) 항정신병 약물에 반응하는 것으로 알려진 만성 질환을 앓고 있고 (2) 대안으로 효과적이지만 잠재적으로 덜 해로운 치료법을 사용할 수 없거나 적절하지 않은 환자를 위해 예약해야 합니다. 만성 치료가 필요한 환자의 경우 만족스러운 임상 반응을 나타내는 최소 용량과 최단 치료 기간을 찾아야 합니다. 지속적인 치료의 필요성은 주기적으로 재평가되어야 합니다.
LATUDA를 투여받는 환자에게 지연성 운동 장애의 징후와 증상이 나타나면 약물 중단을 고려해야 합니다. 그러나 일부 환자는 증후군이 나타나더라도 LATUDA로 치료해야 할 수 있습니다.
5.6 대사 변화
비정형 항정신병 약물은 심혈관/뇌혈관 위험을 증가시킬 수 있는 대사 변화와 관련이 있습니다. 이러한 대사 변화에는 고혈당증, 이상지질혈증 및 체중 증가가 포함됩니다. 이 부류의 모든 약물이 일부 대사 변화를 일으키는 것으로 나타났지만 각 약물에는 고유한 특정 위험 프로필이 있습니다.
고혈당증 및 당뇨병
경우에 따라 극심하고 케톤산증 또는 고삼투압성 혼수 또는 사망과 관련된 고혈당증이 비정형 항정신병제로 치료받은 환자에서 보고되었습니다. 비정형 항정신병제 사용과 포도당 이상 사이의 관계에 대한 평가는 조현병 환자에서 당뇨병의 배경 위험 증가 및 일반 인구에서 당뇨병 발생률 증가 가능성으로 인해 복잡합니다. 이러한 교란 요인을 감안할 때 비정형 항정신병제 사용과 고혈당증 관련 이상 사례 사이의 관계는 완전히 이해되지 않았습니다. 그러나 역학 연구에 따르면 비정형 항정신병제로 치료받은 환자에서 고혈당증 관련 이상 사례의 위험이 증가하는 것으로 나타났습니다.
비정형 항정신병제를 처음 복용하는 당뇨병 진단을 받은 환자는 혈당 조절 악화에 대해 정기적으로 모니터링해야 합니다. 비정형 항정신병제로 치료를 시작하는 당뇨병 위험 요인(예: 비만, 당뇨병 가족력)이 있는 환자는 치료 시작 시 및 치료 중 정기적으로 공복 혈당 검사를 받아야 합니다. 비정형 항정신병제로 치료받는 모든 환자는 다음을 포함한 고혈당증 증상을 모니터링해야 합니다. 다음, 다음, 다음 및 약점. 비정형 항정신병제로 치료하는 동안 고혈당증 증상이 나타나는 환자는 공복 혈당 검사를 받아야 합니다. 어떤 경우에는 비정형 항정신병제를 중단했을 때 고혈당증이 해결되었습니다. 그러나 일부 환자는 의심되는 약물을 중단했음에도 불구하고 항당뇨병 치료를 계속해야 했습니다.
조현병
성인
단기 위약 대조 조현병 연구에서 얻은 통합 데이터는 표 3에 제시되어 있습니다.
| LATUDA | ||||||
| 위약 | 20mg/일 | 40mg/일 | 80mg/일 | 120mg/일 | 160mg/일 | |
| 기준치 대비 평균 변화(mg/dL) | ||||||
| n=680 | n=71 | n=478 | n=508 | n=283 | n=113 | |
| 혈청 포도당 | -0.0 | -0.6 | +2.6 | -0.4 | +2.5 | + 2.5 |
| ≥ 126mg/dL로 이동한 환자 비율 | ||||||
| 혈청 포도당 (≥ 126mg/dL) |
8.3% (52/628) |
11.7% (7/60) |
12.7% ( 57/449) |
6.8% (32/472) |
10.0% (26/260) |
5.6% (6/108) |
비대조군, 장기 조현병 연구(주로 공개 연장 연구)에서 LATUDA는 24주차에 평균 +1.8mg/dL(n=355), 36주차에 +0.8mg/dL(n=299), 52주차에 +2.3mg/dL(n=307)의 포도당 변화와 관련이 있었습니다.
청소년
조현병을 앓고 있는 청소년과 성인을 대상으로 한 연구에서 공복 혈당의 변화는 유사했습니다. 단기 위약 대조 청소년 연구에서 공복 혈청 포도당 평균값은 위약의 경우 -1.3mg/dL(n=95), 40mg/일의 경우 +0.1mg/dL(n=90), 80mg/일의 경우 +1.8mg/dL(n=92)였습니다.
양극성 우울증
단독 요법
성인 단기, 유연 용량, 위약 대조 단독 요법 양극성 우울증 연구에서 얻은 데이터는 표 4에 제시되어 있습니다.
|
환자들은 LATUDA 20~60mg/일, LATUDA 80~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
|||
| LATUDA | |||
| 위약 | 20~60mg/일 | 80~120mg/일 | |
| 기준치 대비 평균 변화(mg/dL) | |||
| n=148 | n=140 | n=143 | |
| 혈청 포도당 | +1.8 | -0.8 | +1.8 |
| ≥ 126mg/dL로 이동한 환자 비율 | |||
| 혈청 포도당 (≥ 126mg/dL) |
4.3% (6/141) |
2.2% (3/138) |
6.4% (9/141) |
비통제형, 공개 라벨, 장기간 양극성 우울증 연구에서 단기 연구에서 LATUDA를 단독 요법으로 투여받고 장기 연구를 계속한 환자의 24주차 평균 포도당 변화는 +1.2mg/dL(n=129)였습니다.
리튬 또는 발프로산염을 이용한 보조 요법
성인 단기, 유연 용량, 위약 대조 보조 요법 양극성 우울증 연구의 데이터는 표 5에 나와 있습니다.
|
환자들은 리튬 또는 발프로산염을 이용한 보조 요법으로 LATUDA 20~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||
| LATUDA | ||
| 위약 | 20~120mg/일 | |
| 기준치 대비 평균 변화(mg/dL) | ||
| n=302 | n=319 | |
| 혈청 포도당 | -0.9 | +1.2 |
| ≥ 126mg/dL로 이동한 환자 비율 | ||
| 혈청 포도당 (≥ 126mg/dL) |
1.0% (3/290) |
1.3% (4/316) |
비조절, 공개 라벨, 장기간 양극성 우울증 연구에서 단기 연구에서 리튬 또는 발프로에이트와 함께 LATUDA를 보조 요법으로 투여받고 장기 연구를 계속한 환자의 경우 24주차에 포도당의 평균 변화는 +1.7mg/dL(n=88)였습니다.
소아 환자(10~17세)
양극성 우울증이 있는 10~17세 소아 환자 및 성인을 대상으로 한 연구에서 공복 혈당 변화는 유사했습니다. 양극성 우울증이 있는 소아 환자를 대상으로 한 6주간의 위약 대조 연구에서 공복 혈당의 평균 변화는 LATUDA 20~80mg/일 군에서 +1.6mg/dL(n=145), 위약군에서 -0.5mg/dL(n=145)였습니다.
소아 환자(6~17세)
조현병, 양극성 우울증 또는 자폐 장애가 있는 소아 환자를 대상으로 한 104주간의 공개 라벨 연구에서 기준 공복 혈당이 정상이었던 환자의 7%가 루라시돈 복용 중에 종료 시점에 높음으로 이동했습니다.
성인
단기, 위약 대조 조현병 연구의 취합 데이터는 표 6에 나와 있습니다.
| LATUDA | ||||||
| 위약 | 20mg/일 | 40mg/일 | 80mg/일 | 120mg/일 | 160mg/일 | |
| 기준치 대비 평균 변화(mg/dL) | ||||||
| n=660 | n=71 | n=466 | n=499 | n=268 | n=115 | |
| 총 콜레스테롤 | -5.8 | -12.3 | -5.7 | -6.2 | -3.8 | -6.9 |
| 트리글리세리드 | -13.4 | -29.1 | -5.1 | -13.0 | -3.1 | -10.6 |
| 이동이 있는 환자의 비율 | ||||||
| 총 콜레스테롤(≥ 240mg/dL) | 5.3% (30/571) |
13.8% (8/58) |
6.2% (25/402) |
5.3% (23/434) |
3.8% (9/238) |
4.0% (4/101) |
| 트리글리세리드 (≥ 200mg/dL) |
10.1% (53/526) |
14.3% (7/49) |
10.8% (41/379) |
6.3% (25/400) |
10.5% (22/209) |
7.0% (7/100) |
비조절, 장기간 조현병 연구(주로 공개 라벨 연장 연구)에서 라투다는 24주차에 총 콜레스테롤과 트리글리세리드의 평균 변화가 각각 -3.8(n=356)mg/dL 및 -15.1(n=357)mg/dL, 36주차에 -3.1(n=303)mg/dL 및 -4.8(n=303)mg/dL, 52주차에 -2.5(n=307)mg/dL 및 -6.9(n=307)mg/dL와 관련이 있었습니다.
청소년
청소년 단기, 위약 대조 연구에서 공복 혈청 콜레스테롤 평균값은 위약 -9.6mg/dL(n=95), 라투다 40mg/일 -4.4mg/dL(n=89), 라투다 80mg/일 +1.6mg/dL(n=92)였으며, 공복 혈청 트리글리세리드 평균값은 위약 +0.1mg/dL(n=95), 라투다 40mg/일 -0.6mg/dL(n=89), 라투다 80mg/일 +8.5mg/dL(n=92)였습니다.
단독 요법
성인 단기, 유연 용량, 위약 대조, 단독 요법 양극성 우울증 연구의 데이터는 표 7에 나와 있습니다.
|
환자들은 라투다 20~60mg/일, 라투다 80~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||||
| 라투다 | ||||
| 위약 | 20~60mg/일 | 80~120mg/일 | ||
| 기준치 대비 평균 변화(mg/dL) | ||||
| n=147 | n=140 | n=144 | ||
| 총 콜레스테롤 | -3.2 | +1.2 | -4.6 | |
| 트리글리세리드 | +6.0 | +5.6 | +0.4 | |
| 변화가 있는 환자 비율 | ||||
| 총 콜레스테롤(≥ 240mg/dL) | 4.2% (5/118) |
4.4% (5/113) |
4.4% (5/114) |
|
| 트리글리세리드 (≥ 200mg/dL) |
4.8% (6/126) |
10.1% (12/119) |
9.8% (12/122) |
|
비조절, 공개 라벨, 장기간 양극성 우울증 연구에서 단기간에 라투다를 단독 요법으로 투여받고 장기간 연구를 계속한 환자의 총 콜레스테롤과 트리글리세리드의 평균 변화는 24주차에 각각 -0.5mg/dL(n=130) 및 -1.0mg/dL(n=130)였습니다.
리튬 또는 발프로산염을 이용한 보조 요법
성인 단기, 유연 용량, 위약 대조, 보조 요법 양극성 우울증 연구의 데이터는 표 8에 나와 있습니다.
|
환자들은 리튬 또는 발프로산염을 이용한 보조 요법으로 라투다 20~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||
| 라투다 | ||
| 위약 | 20~120mg/일 | |
| 기준치 대비 평균 변화(mg/dL) | ||
| n=303 | n=321 | |
| 총 콜레스테롤 | -2.9 | -3.1 |
| 트리글리세리드 | -4.6 | +4.6 |
| 변화가 있는 환자 비율 | ||
| 총 콜레스테롤 (≥ 240mg/dL) |
5.7% (15/263) |
5.4% (15/276) |
| 트리글리세리드 (≥ 200mg/dL) |
8.6% (21/243) |
10.8% (28/260) |
비조절형, 공개 라벨, 장기 양극성 우울증 연구에서 단기 연구에서 리튬 또는 발프로에이트와 함께 LATUDA를 보조 요법으로 투여받고 장기 연구를 계속한 환자의 총 콜레스테롤 및 트리글리세리드의 평균 변화는 24주차에 각각 -0.9(n=88) 및 +5.3(n=88)mg/dL였습니다.
소아 환자(10~17세)
10~17세 소아 환자를 대상으로 한 6주간의 위약 대조 양극성 우울증 연구에서 공복 시 콜레스테롤의 평균 변화는 LATUDA 20~80mg/일군(n=144)에서 -6.3mg/dL, 위약군(n=145)에서 -1.4mg/dL였으며, 공복 시 트리글리세리드의 평균 변화는 LATUDA 20~80mg/일군(n=144)에서 -7.6mg/dL, 위약군(n=145)에서 +5.9mg/dL였습니다.
소아 환자(6~17세)
조현병, 양극성 우울증 또는 자폐 장애가 있는 소아 환자를 대상으로 한 104주간의 공개 라벨 연구에서 루라시돈을 복용한 환자의 12%(총 콜레스테롤), 3%(LDL 콜레스테롤)에서 기준치 대비 공복 시 콜레스테롤이 정상에서 높음으로, 27%(HDL 콜레스테롤)에서 정상에서 낮음으로 이동한 것으로 보고되었습니다. 기준치 대비 공복 시 트리글리세리드가 정상이었던 환자 중 12%에서 높음으로 이동한 것으로 나타났습니다.
성인
단기, 위약 대조 조현병 연구에서 얻은 통합 데이터는 표 9에 나와 있습니다. 평균 체중 증가는 LATUDA 치료 환자의 경우 +0.43kg인 반면 위약 치료 환자의 경우 -0.02kg이었습니다. 연구 3과 5에서 기준치 대비 체중 변화는 올란자핀의 경우 +4.15kg, 퀘티아핀 서방형의 경우 +2.09kg이었습니다 [14.1 임상 연구 참조]. 체중이 7% 이상 증가한 환자(종료 시점)의 비율은 LATUDA 치료 환자의 경우 4.8%, 위약 치료 환자의 경우 3.3%였습니다.
| LATUDA | ||||||
| 위약 (n=696) |
20mg/일 (n=71) |
40mg/일 (n=484) |
80mg/일 (n=526) |
120mg/일 (n=291) |
160mg/일 (n=114) |
|
| 모든 환자 | -0.02 | -0.15 | +0.22 | +0.54 | +0.68 | +0.60 |
비조절형, 장기 조현병 연구(주로 공개 라벨 연장 연구)에서 LATUDA는 24주차에 평균 체중 변화 -0.69kg(n=755), 36주차에 -0.59kg(n=443), 52주차에 -0.73kg(n=377)과 관련이 있었습니다.
청소년
단기, 위약 대조 청소년 조현병 연구에서 얻은 데이터는 표 10에 나와 있습니다. 평균 체중 증가 변화는 LATUDA 치료 환자의 경우 +0.5kg인 반면 위약 치료 환자의 경우 +0.2kg이었습니다. 체중이 7% 이상 증가한 환자(종료 시점)의 비율은 LATUDA 치료 환자의 경우 3.3%, 위약 치료 환자의 경우 4.5%였습니다.
|
위약 (n=111) |
LATUDA | ||
| 40mg/일 (n=109) |
80mg/일 (n=104) |
||
| 모든 환자 | +0.2 | +0.3 | +0.7 |
단독 요법
성인을 대상으로 한 단기간, 유연 용량, 위약 대조 단독 요법 양극성 우울증 연구에서 얻은 데이터는 표 11에 제시되어 있습니다. 체중 증가의 평균 변화는 LATUDA 치료 환자의 경우 +0.29kg인 반면 위약 치료 환자의 경우 -0.04kg였습니다. 체중이 ≥7% 증가한 환자(시험 종료 시점)의 비율은 LATUDA 치료 환자의 경우 2.4%였고 위약 치료 환자의 경우 0.7%였습니다.
|
환자들은 LATUDA 20~60mg/일, LATUDA 80~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||||
| LATUDA | ||||
| 위약 (n=151) |
20~60mg/일 (n=143) |
80~120mg/일 (n=147) |
||
| 모든 환자 | -0.04 | +0.56 | +0.02 | |
비대조군, 공개 라벨, 장기간 양극성 우울증 연구에서 단기간에 LATUDA를 단독 요법으로 투여받고 장기간 연구를 계속한 환자의 24주차 체중 변화 평균은 -0.02kg(n=130)이었습니다.
리튬 또는 발프로산염을 이용한 보조 요법
성인을 대상으로 한 단기간, 유연 용량, 위약 대조 보조 요법 양극성 우울증 연구에서 얻은 데이터는 표 12에 제시되어 있습니다. 체중 증가의 평균 변화는 LATUDA 치료 환자의 경우 +0.11kg인 반면 위약 치료 환자의 경우 +0.16kg였습니다. 체중이 ≥7% 증가한 환자(시험 종료 시점)의 비율은 LATUDA 치료 환자의 경우 3.1%였고 위약 치료 환자의 경우 0.3%였습니다.
|
환자들은 리튬 또는 발프로산염을 이용한 보조 요법으로 LATUDA 20~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||
| LATUDA | ||
| 위약 (n=307) |
20~120mg/일 (n=327) |
|
| 모든 환자 | +0.16 | +0.11 |
비대조군, 공개 라벨, 장기간 양극성 우울증 연구에서 단기간에 LATUDA를 리튬 또는 발프로산염을 이용한 보조 요법으로 투여받고 장기간 연구를 계속한 환자의 24주차 체중 변화 평균은 +1.28kg(n=86)이었습니다.
소아 환자(10~17세)
10~17세 환자를 대상으로 한 6주간의 위약 대조 양극성 우울증 연구에서 얻은 데이터는 표 13에 제시되어 있습니다. 체중 증가의 평균 변화는 LATUDA 치료 환자의 경우 +0.7kg인 반면 위약 치료 환자의 경우 +0.5kg였습니다. 체중이 ≥7% 증가한 환자(시험 종료 시점)의 비율은 LATUDA 치료 환자의 경우 4.0%였고 위약 치료 환자의 경우 5.3%였습니다.
| LATUDA | ||
| 위약 (n=170) |
20~80mg/일 (n=175) |
|
| 모든 환자 | +0.5 | +0.7 |
소아 환자 (6~17세)
단기 위약 대조 시험 3건에서 조현병, 양극성 우울증 또는 자폐 장애가 있는 소아 환자를 등록한 장기간 공개 라벨 연구에서 54%(378/701)가 루라시돈을 104주 동안 투여받았습니다. 공개 라벨 기준치에서 104주까지 체중의 평균 증가는 5.85kg이었습니다. 정상적인 성장을 조정하기 위해 연령 및 성별이 일치하는 모집단 표준과 비교하여 아동 및 청소년의 자연적인 성장을 정상화하는 표준 편차(SD)로 측정한 z-점수를 도출했습니다. z-점수 변화가 <0.5SD이면 임상적으로 유의하지 않은 것으로 간주됩니다. 이 시험에서 공개 라벨 기준치에서 104주까지 z-점수의 평균 변화는 체중의 경우 -0.06SD, 체질량 지수(BMI)의 경우 -0.13SD였으며, 이는 체중 증가에 대한 정규 분포 곡선에서 최소한의 편차를 나타냅니다.
5.7 고프로락틴혈증
도파민 D2 수용체를 길항하는 다른 약물과 마찬가지로 라투다는 프로락틴 수치를 상승시킵니다.
고프로락틴혈증은 시상하부 GnRH를 억제하여 뇌하수체 성선자극호르몬 분비를 감소시킬 수 있습니다. 이는 여성과 남성 환자 모두에서 생식선 스테로이드 생성을 손상시켜 생식 기능을 저해할 수 있습니다. 프로락틴 상승 화합물과 관련하여 유즙 분비, 무월경, 여성형 유방, 발기 부전이 보고되었습니다. 저성선 기능증과 관련된 장기간의 고프로락틴혈증은 여성과 남성 환자 모두에서 골밀도 감소로 이어질 수 있습니다 [부작용 (6) 참조].
조직 배양 실험에 따르면 인간 유방암의 약 3분의 1이 체외에서 프로락틴 의존성을 나타내며, 이는 이전에 유방암이 발견된 환자에게 이러한 약물의 처방을 고려할 때 잠재적으로 중요한 요소입니다. 프로락틴 방출을 증가시키는 화합물에서 흔히 나타나는 것처럼 랫과 마우스를 대상으로 루라시돈을 사용하여 실시한 발암성 연구에서 유선 신생물의 증가가 관찰되었습니다 [비임상 독성학 (13) 참조]. 현재까지 수행된 임상 연구나 역학 연구에서 이러한 약물의 만성 투여와 인간의 종양 발생 사이의 연관성이 밝혀지지 않았지만, 이용 가능한 증거는 결정적인 결론을 내리기에는 너무 제한적입니다.
성인
단기 위약 대조 조현병 연구에서 라투다 치료 환자의 기준치에서 종료점까지 프로락틴 수치의 평균 변화는 +0.4ng/mL였고 위약 치료 환자는 -1.9ng/mL였습니다. 남성의 경우 기준치에서 종료점까지 평균 변화는 +0.5ng/mL였고 여성의 경우 -0.2ng/mL였습니다. 용량별 프로락틴의 평균 변화는 표 14에 나와 있습니다.
| 라투다 | ||||||
| 위약 | 20mg/일 | 40mg/일 | 80mg/일 | 120mg/일 | 160mg/일 | |
| 모든 환자 | -1.9 (n=672) |
-1.1 (n=70) |
-1.4 (n=476) |
-0.2 (n=495) |
+3.3 (n=284) |
+3.3 (n=115) |
| 여성 | -5.1 (n=200) |
-0.7 (n=19) |
-4.0 (n=149) |
-0.2 (n=150) |
+6.7 (n=70) |
+7.1 (n=36) |
| 남성 | -1.3 (n=472) |
-1.2 (n=51) |
-0.7 (n=327) |
-0.2 (n=345) |
+3.1 (n=214) |
+2.4 (n=79) |
LATUDA 투여 환자의 2.8%에서 프로락틴 수치가 정상 상한치(ULN)의 ≥5배로 증가했으며, 위약 투여 환자의 경우 = 1.0%였습니다. 프로락틴 수치가 5x ULN 이상으로 증가한 여성 환자의 비율은 LATUDA 투여 환자의 경우 5.7%, 위약 투여 여성 환자의 경우 = 2.0%였습니다. 프로락틴 수치가 5x ULN 이상으로 증가한 남성 환자의 비율은 1.6%였으며, 위약 투여 남성 환자의 경우 0.6%였습니다.
비대조군 장기간 조현병 연구(주로 공개 연장 연구)에서 LATUDA는 24주차에 프로락틴의 평균 변화가 -0.9ng/mL(n=357), 36주차에 -5.3ng/mL(n=190), 52주차에 -2.2ng/mL(n=307)였습니다.
청소년
단기 위약 대조 청소년 조현병 연구에서 LATUDA 투여 환자의 프로락틴 수치는 기준치에서 종료 시점까지 평균 +1.1ng/mL 변화했으며, 위약 투여 환자의 경우 +0.1ng/mL 변화했습니다. LATUDA 투여 환자의 경우 남성의 프로락틴 수치는 기준치에서 종료 시점까지 평균 +1.0ng/mL 변화했으며, 여성의 경우 +2.6ng/mL 변화했습니다. 용량별 프로락틴의 평균 변화는 표 15에 나와 있습니다.
|
위약 |
LATUDA 40mg/일 |
LATUDA 80mg/일 |
|
| 모든 환자 | +0.10 (n=103) |
+0.75 (n=102) |
+1.20 (n=99) |
| 여성 | +0.70 (n=39) |
+0.60 (n=42) |
+4.40 (n=33) |
| 남성 | 0.00 (n=64) |
+0.75 (n=60) |
+1.00 (n=66) |
프로락틴 수치가 5x ULN 이상으로 증가한 환자의 비율은 LATUDA 투여 환자의 경우 0.5%, 위약 투여 환자의 경우 1.0%였습니다. 프로락틴 수치가 5x ULN 이상으로 증가한 여성 환자의 비율은 LATUDA 투여 환자의 경우 1.3%, 위약 투여 여성 환자의 경우 0%였습니다. 프로락틴 수치가 5x ULN 이상으로 증가한 남성 환자의 비율은 LATUDA 투여 환자의 경우 0%, 위약 투여 남성 환자의 경우 1.6%였습니다.
양극성 우울증
성인
단독 요법
단기 유연 용량 위약 대조 단독 요법 성인 양극성 우울증 연구에서 프로락틴 수치는 기준치에서 종료 시점까지 LATUDA 20~60mg/일 투여 시 평균 +1.7ng/mL, 80~120mg/일 투여 시 +3.5ng/mL 변화했으며, 이에 비해 위약 투여 환자의 경우 +0.3ng/mL 변화했습니다. 남성의 프로락틴 수치는 기준치에서 종료 시점까지 평균 +1.5ng/mL 변화했으며, 여성의 경우 +3.1ng/mL 변화했습니다. 용량 범위별 프로락틴의 평균 변화는 표 16에 나와 있습니다.
|
환자들은 LATUDA 20~60mg/일, LATUDA 80~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||||
| LATUDA | ||||
| 위약 | 20~60mg/일 | 80~120mg/일 | ||
| 모든 환자 | +0.3 (n=147) |
+1.7 (n=140) |
+3.5 (n=144) |
|
| 여성 | 0.0 (n=82) |
+1.8 (n=78) |
+5.3 (n=88) |
|
| 남성 | +0.4 (n=65) |
+1.2 (n=62) |
+1.9 (n=56) |
|
LATUDA 투여 환자의 0.4%와 위약 투여 환자의 0.0%에서 프로락틴 수치가 정상 상한치(ULN)의 ≥5배로 증가했습니다. 프로락틴 수치가 ULN의 ≥5배로 증가한 여성 환자의 비율은 LATUDA 투여 환자의 경우 0.6%, 위약 투여 여성 환자의 경우 0%였습니다. 프로락틴 수치가 ULN의 ≥5배로 증가한 남성 환자의 비율은 LATUDA 투여 환자와 위약 투여 남성 환자 모두 0%였습니다.
비대조군, 공개 라벨, 장기 양극성 우울증 연구에서 단기간에 LATUDA를 단독 요법으로 투여받고 장기 연구를 계속한 환자의 경우 24주차에 프로락틴의 평균 변화는 -1.15ng/mL였습니다(n=130).
리튬 또는 발프로산을 이용한 보조 요법
성인 단기, 유연 용량, 위약 대조, 보조 요법 양극성 우울증 연구에서 프로락틴 수치의 기준치 대비 종료점까지의 평균 변화는 LATUDA 20~120mg/일을 투여받은 경우 +2.8ng/mL였으며, 위약 투여 환자의 경우 0.0ng/mL였습니다. 남성의 경우 기준치 대비 종료점까지의 평균 변화는 +2.4ng/mL였으며, 여성의 경우 +3.2ng/mL였습니다. 용량 범위에 따른 프로락틴의 평균 변화는 표 17에 나와 있습니다.
|
환자들은 리튬 또는 발프로산을 이용한 보조 요법으로 LATUDA 20~120mg/일 또는 위약을 유연하게 투여받도록 무작위 배정되었습니다. |
||
| LATUDA | ||
| 위약 | 20~120mg/일 | |
| 모든 환자 | 0.0 (n=301) |
+2.8 (n=321) |
| 여성 | +0.4 (n=156) |
+3.2 (n=162) |
| 남성 | -0.1 (n=145) |
+2.4 (n=159) |
LATUDA 투여 환자의 0.0%와 위약 투여 환자의 0.0%에서 프로락틴 수치가 정상 상한치(ULN)의 ≥5배로 증가했습니다. 프로락틴 수치가 ULN의 ≥5배로 증가한 여성 환자의 비율은 LATUDA 투여 환자와 위약 투여 여성 환자 모두 0%였습니다. 프로락틴 수치가 ULN의 ≥5배로 증가한 남성 환자의 비율은 LATUDA 투여 환자와 위약 투여 남성 환자 모두 0%였습니다.
비대조군, 공개 라벨, 장기 양극성 우울증 연구에서 단기간에 리튬 또는 발프로산을 이용한 보조 요법으로 LATUDA를 투여받고 장기 연구를 계속한 환자의 경우 24주차에 프로락틴의 평균 변화는 -2.9ng/mL였습니다(n=88).
소아 환자(10~17세)
10~17세 소아 환자를 대상으로 한 6주간의 위약 대조 양극성 우울증 연구에서 프로락틴 수치의 기준치 대비 종료점까지의 평균 변화는 LATUDA 투여 환자의 경우 +1.10ng/mL였으며, 위약 투여 환자의 경우 +0.50ng/mL였습니다. LATUDA 투여 환자의 경우 남성의 기준치 대비 종료점까지의 평균 변화는 +0.85ng/mL였으며, 여성의 경우 +2.50ng/mL였습니다. 프로락틴의 평균 변화는 표 18에 나와 있습니다.
| LATUDA | ||
| 위약 | 20~80mg/일 | |
| 모든 환자 | +0.50 (n=157) |
+1.10 (n=165) |
| 여성 | +0.55 (n=78) |
+2.50 (n=83) |
| 남성 | +0.50 (n=79) |
+0.85 (n=82) |
LATUDA 치료를 받은 환자의 경우 프롤락틴 수치가 ≥5x ULN만큼 증가한 비율은 0%였고 위약 치료를 받은 환자의 경우 0.6%였습니다. 프롤락틴 수치가 ≥5x ULN만큼 증가한 여성 환자의 비율은 LATUDA 치료를 받은 환자의 경우 0%였고 위약 치료를 받은 여성 환자의 경우 1.3%였습니다. 위약 또는 LATUDA 치료군의 남성 환자 중 프롤락틴 수치가 ≥5x ULN만큼 증가한 환자는 없었습니다.
소아 환자 (6~17세)
조현병, 양극성 우울증 또는 자폐 장애가 있는 소아 환자를 대상으로 실시한 104주간의 공개 라벨 연구에서, 기준치에서 종료 시점까지 혈청 프롤락틴 수치의 평균 변화는 -0.20ng/mL(모든 환자), -0.30ng/mL(여성) 및 -0.05ng/mL(남성)였습니다. 공개 라벨 치료 중 어느 시점에서든 프롤락틴 수치가 현저히 높았던(≥정상 상한치의 5배) 환자의 비율은 2%(모든 환자), 3%(여성) 및 1%(남성)였습니다.
이 시험에서 여성에게서 나타난 잠재적으로 프롤락틴과 관련된 이상반응에는 유즙 분비(0.6%)가 포함됩니다. 이 연구의 남성 환자 중 성욕 감소가 1명(0.2%)에서 보고되었으며 발기 부전, 여성형 유방 또는 유즙 분비에 대한 보고는 없었습니다.
5.8 백혈구 감소증, 호중구 감소증 및 무과립구증
항정신병제 치료 중 백혈구 감소증/호중구 감소증이 보고되었습니다. 동일 계열의 다른 약제에서 무과립구증(치명적인 경우 포함)이 보고되었습니다.
백혈구 감소증/호중구 감소증의 위험 인자로는 기존 백혈구 수치 저하 및 약물 유발 백혈구 감소증/호중구 감소증 병력이 있습니다. 기존 백혈구 수치가 낮거나 약물 유발 백혈구 감소증/호중구 감소증 병력이 있는 환자는 치료 첫 몇 개월 동안 전체 혈구 수(CBC)를 자주 모니터링해야 하며, 다른 원인이 없는 경우 WBC 감소 징후가 처음 나타나면 LATUDA를 중단해야 합니다.
호중구 감소증이 있는 환자는 열 또는 기타 감염 징후나 증상이 있는지 주의 깊게 모니터링해야 하며, 이러한 징후나 증상이 나타나면 즉시 치료해야 합니다. 중증 호중구 감소증(절대 호중구 수 < 1000/mm3)이 있는 환자는 LATUDA를 중단하고 회복될 때까지 WBC를 추적 관찰해야 합니다.
5.9 기립성 저혈압 및 실신
LATUDA는 α1-아드레날린 수용체 길항 작용으로 인해 기립성 저혈압 및 실신을 유발할 수 있습니다. 관련 이상반응에는 어지러움, 현기증, 빈맥 및 서맥이 포함될 수 있습니다. 일반적으로 이러한 위험은 치료 시작 시와 용량 증량 중에 가장 큽니다. 이러한 이상반응 또는 저혈압으로 인한 합병증 발생 위험이 증가한 환자에는 탈수증, 저혈량증, 항고혈압제 치료, 심혈관 질환(예: 심부전, 심근 경색, 허혈 또는 전도 이상) 병력, 뇌혈관 질환 병력이 있는 환자뿐만 아니라 항정신병제를 처음 투여받는 환자도 포함됩니다. 이러한 환자의 경우 더 낮은 시작 용량과 더 느린 용량 조절을 고려하고 기립성 활력 징후를 모니터링하십시오.
활력 징후 측정으로 평가한 기립성 저혈압은 앉은 자세에서 선 자세로 또는 누운 자세에서 선 자세로 바뀔 때 수축기 혈압이 ≥ 20mmHg 감소하고 맥박이 ≥10bpm 증가하는 것으로 정의되었습니다.
성인
단기 위약 대조 조현병 연구에서 이상반응으로 보고된 기립성 저혈압 및 실신 발생률은 다음과 같습니다(LATUDA 발생률, 위약 발생률): 기립성 저혈압 [0.3%(5/1508), 0.1%(1/708)] 및 실신 [0.1%(2/1508), 0%(0/708)].
단기 조현병 임상 연구에서 활력 징후로 평가한 기립성 저혈압은 LATUDA 40mg의 경우 0.8%, LATUDA 80mg의 경우 2.1%, LATUDA 120mg의 경우 1.7%, LATUDA 160mg의 경우 0.8%의 빈도로 발생한 반면 위약의 경우 0.7%였습니다.
청소년
단기 위약 대조 청소년 조현병 연구에서 이상반응으로 보고된 기립성 저혈압 발생률은 LATUDA 치료를 받은 환자의 경우 0.5%(1/214)였고 위약 치료를 받은 환자의 경우 0%(0/112)였습니다. 실신 사례는 보고되지 않았습니다.
활력 징후로 평가한 기립성 저혈압은 LATUDA 40mg의 경우 0%, LATUDA 80mg의 경우 2.9%의 빈도로 발생한 반면 위약의 경우 1.8%였습니다.
성인
단일 요법
성인을 대상으로 실시한 단기 유연 용량 위약 대조 단일 요법 양극성 우울증 연구에서 기립성 저혈압 및 실신에 대한 이상반응은 보고되지 않았습니다.
활력 징후로 평가한 기립성 저혈압은 LATUDA 20~60mg의 경우 0.6%, LATUDA 80~120mg의 경우 0.6%의 빈도로 발생한 반면 위약의 경우 0%였습니다.
리튬 또는 발프로산을 병용한 보조 요법
성인을 대상으로 실시한 단기 유연 용량 위약 대조 보조 요법 양극성 우울증 치료 연구에서 기립성 저혈압 및 실신에 대한 이상반응은 보고되지 않았습니다. 활력 징후로 평가한 기립성 저혈압은 LATUDA 20~120mg의 경우 1.1%의 빈도로 발생한 반면 위약의 경우 0.9%였습니다.
소아 환자 (10~17세)
10~17세 소아 환자를 대상으로 실시한 6주간의 위약 대조 양극성 우울증 연구에서 기립성 저혈압 또는 실신에 대한 이상반응은 보고되지 않았습니다.
활력 징후로 평가한 기립성 저혈압은 LATUDA 20~80mg/일의 경우 1.1%의 빈도로 발생한 반면 위약의 경우 0.6%였습니다.
5.10 낙상
LATUDA는 졸음, 기립성 저혈압, 운동 및 감각 불안정을 유발할 수 있으며, 이로 인해 낙상 및 골절이나 기타 부상을 초래할 수 있습니다. 이러한 영향을 악화시킬 수 있는 질병, 질환 또는 약물이 있는 환자의 경우, 항정신병 치료를 시작할 때 낙상 위험 평가를 완료하고 장기간 항정신병 요법을 받는 환자의 경우 반복적으로 평가해야 합니다.
5.11 발작
다른 항정신병 약물과 마찬가지로 LATUDA는 발작 이력이 있거나 알츠하이머병과 같이 발작 역치를 낮추는 질환이 있는 환자에게는 주의해서 사용해야 합니다. 발작 역치를 낮추는 질환은 65세 이상의 환자에게 더 흔할 수 있습니다.
조현병
성인 단기 위약 대조 조현병 연구에서 발작/경련은 LATUDA로 치료받은 환자의 0.1%(2/1508명)에서 발생했으며, 위약 치료를 받은 환자는 0.1%(1/708명)였습니다.
5.12 인지 및 운동 장애 가능성
LATUDA는 다른 항정신병 약물과 마찬가지로 판단력, 사고력 또는 운동 능력을 저해할 가능성이 있습니다. LATUDA 치료가 자신에게 부정적인 영향을 미치지 않는다는 확신이 들 때까지 환자에게 자동차를 포함한 위험한 기계 작동에 대해 주의를 주십시오.
LATUDA를 사용한 임상 연구에서 졸음에는 과다 수면, 과다 졸음, 진정 및 졸음이 포함되었습니다.
성인
단기, 위약 대조 조현병 연구에서 졸음은 LATUDA로 치료받은 환자의 17.0%(256/1508명)(LATUDA 20mg 15.5%, LATUDA 40mg 15.6%, LATUDA 80mg 15.2%, LATUDA 120mg 26.5%, LATUDA 160mg/일 8.3%)에서 보고되었으며, 위약 환자는 7.1%(50/708명)였습니다.
청소년
단기, 위약 대조 청소년 조현병 연구에서 졸음은 LATUDA로 치료받은 환자의 14.5%(31/214명)(LATUDA 40mg 15.5%, LATUDA 80mg/일 13.5%)에서 보고되었으며, 위약 환자는 7.1%(8/112명)였습니다.
성인
단독 요법
성인을 대상으로 한 단기, 유연 용량, 위약 대조 단독 요법 양극성 우울증 연구에서 졸음은 LATUDA 20~60mg을 투여받은 환자의 7.3%(12/164명)와 80~120mg을 투여받은 환자의 13.8%(23/167명)에서 보고되었으며, 위약 환자는 6.5%(11/168명)였습니다.
리튬 또는 발프로산염을 이용한 보조 요법
성인을 대상으로 한 단기, 유연 용량, 위약 대조 보조 요법 양극성 우울증 연구에서 졸음은 LATUDA 20~120mg을 투여받은 환자의 11.4%(41/360명)에서 보고되었으며, 위약 환자는 5.1%(17/334명)였습니다.
5.13 체온 조절 장애
심부 체온을 낮추는 신체 능력의 붕괴는 항정신병 약물에 기인합니다. 격렬한 운동, 극심한 열에 대한 노출, 항콜린 활성이 있는 병용 약물 복용 또는 탈수 상태와 같이 심부 체온 상승에 기여할 수 있는 질환을 경험하게 될 환자에게 LATUDA를 처방할 때는 적절한 주의가 필요합니다.
5.16 파킨슨병 또는 레비소체 치매 환자에서의 신경계 이상반응
파킨슨병 또는 레비소체 치매 환자는 항정신병 약물에 대한 민감도가 증가하는 것으로 보고되었습니다. 이러한 민감도 증가의 징후에는 혼란, 의식 저하, 잦은 낙상을 동반한 자세 불안정, 추체외로 증상, 그리고 신경이완제 악성 증후군과 일치하는 임상적 특징이 포함됩니다.
6 부작용
다음 부작용은 라벨의 다른 섹션에서 자세히 설명됩니다.
- 치매 관련 정신병이 있는 노인 환자의 사망률 증가 [경고 및 주의 사항 (경고 및 5.1) 참조]
- 자살 생각 및 행동 [경고 및 주의 사항 (경고 및 5.2) 참조]
- 치매 관련 정신병이 있는 노인 환자의 뇌혈관 부작용, 뇌졸중 포함 [경고 및 주의 사항 (5.3) 참조]
- 악성 신경 이완 증후군 [경고 및 주의 사항 (5.4) 참조]
- 지연성 운동 장애 [경고 및 주의 사항 (5.5) 참조]
- 대사 변화 [경고 및 주의 사항 (5.6) 참조]
- 고프롤락틴혈증 [경고 및 주의 사항 (5.7) 참조]
- 백혈구 감소증, 호중구 감소증 및 무과립구증 [경고 및 주의 사항 (5.8) 참조]
- 기립성 저혈압 및 실신 [경고 및 주의 사항 (5.9) 참조]
- 낙상 [경고 및 주의 사항 (5.10) 참조]
- 발작 [경고 및 주의 사항 (5.11) 참조]
- 인지 및 운동 장애 가능성 [경고 및 주의 사항 (5.12) 참조]
- 체온 조절 장애 [경고 및 주의 사항 (5.13) 참조]
- 조증/경조증 활성화 [경고 및 주의 사항 (5.14) 참조]
- 연하 곤란 [경고 및 주의 사항 (5.15) 참조]
- 파킨슨병 또는 루이 소체 치매 환자의 신경계 부작용 [경고 및 주의 사항 (5.16) 참조]
6.1 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
성인
아래 정보는 LATUDA의 통합 임상 연구 데이터베이스에서 파생되었으며, 이 데이터베이스는 위약 대조 연구에서 정신분열증 및 양극성 우울증 치료를 위해 LATUDA를 1회 이상 투여받은 3799명의 성인 환자를 포함합니다. 이 경험은 총 1250.9 환자-년에 해당합니다. LATUDA 치료를 받은 총 1106명의 환자가 최소 24주 동안, LATUDA 치료를 받은 총 371명의 환자가 최소 52주 동안 노출되었습니다.
연구 치료 노출 중 부작용은 일반적인 문의 및 자발적으로 보고된 부작용 경험뿐만 아니라 신체 검사, 활력징후, 심전도, 체중 및 실험실 검사 결과를 통해 얻었습니다. 부작용은 임상 연구자들이 자신의 용어를 사용하여 기록했습니다. 부작용을 경험한 개인의 비율을 의미 있는 방식으로 추정하기 위해, 이벤트는 MedDRA 용어를 사용하여 표준화된 범주로 그룹화되었습니다.
치료 중단과 관련된 부작용: LATUDA 치료를 받은 환자의 총 9.5%(143/1508)와 위약 치료를 받은 환자의 9.3%(66/708)가 부작용으로 인해 치료를 중단했습니다. LATUDA 치료를 받은 대상자에서 위약군 발생률의 최소 2배 이상인 2% 이상의 치료 중단과 관련된 부작용은 없었습니다.
LATUDA 치료를 받은 환자에서 발생률이 2% 이상인 부작용: 급성 치료(정신분열증 환자의 경우 최대 6주) 중에 발생한 LATUDA 사용과 관련된 부작용(발생률 2% 이상, 가장 가까운 퍼센트로 반올림 및 LATUDA 발생률이 위약군보다 높음)은 표 19에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
|||||||
|
* 졸음에는 부작용 용어인 과도한 졸음, 졸음, 진정 및 졸음이 포함됩니다. |
|||||||
|
** 추체 외로 증상에는 부작용 용어인 서동증, 톱니바퀴 강직, 타액 분비, 근긴장증, 추체 외로 장애, 저운동증, 근육 강직, 안구 회전 발작, 구강 및 하악 근긴장증, 파킨슨증, 정신 운동 지연, 혀 경련, 사경, 떨림 및 개구 장애가 포함됩니다. |
|||||||
| 부작용을 보고한 환자 비율 | |||||||
| LATUDA | |||||||
| 신체계통 또는 기관계 |
위약 (N=708) (%) |
20 mg/day (N=71) (%) |
40 mg/day (N=487) (%) |
80 mg/day (N=538) (%) |
120 mg/day (N=291) (%) |
160 mg/day (N=121) (%) |
모든 LATUDA (N=1508) (%) |
| 위장관 장애 | |||||||
| 메스꺼움 | 5 | 11 | 10 | 9 | 13 | 7 | 10 |
| 구토 | 6 | 7 | 6 | 9 | 9 | 7 | 8 |
| 소화불량 | 5 | 11 | 6 | 5 | 8 | 6 | 6 |
| 타액 과다분비 |
<1 | 1 | 1 | 2 | 4 | 2 | 2 |
| 근골격계 및 결합조직 장애 | |||||||
| 요통 | 2 | 0 | 4 | 3 | 4 | 0 | 3 |
| 신경계 장애 | |||||||
| 졸음* | 7 | 15 | 16 | 15 | 26 | 8 | 17 |
| 불안정 | 3 | 6 | 11 | 12 | 22 | 7 | 13 |
| 추체외로계 장애** |
6 | 6 | 11 | 12 | 22 | 13 | 14 |
| 현기증 | 2 | 6 | 4 | 4 | 5 | 6 | 4 |
| 정신 장애 | |||||||
| 불면증 | 8 | 8 | 10 | 11 | 9 | 7 | 10 |
| 초조 | 4 | 10 | 7 | 3 | 6 | 5 | 5 |
| 불안 | 4 | 3 | 6 | 4 | 7 | 3 | 5 |
| 불안정 | 1 | 1 | 3 | 1 | 3 | 2 | 2 |
Dose-Related Adverse Reactions in the Schizophrenia Studies
Akathisia 및 추체외 증상은 용량 의존적이었습니다. Akathisia의 빈도는 LATUDA 20mg(5.6%), LATUDA 40mg(10.7%), LATUDA 80mg(12.3%), LATUDA 120mg(22.0%)에서 용량이 증가함에 따라 증가했습니다. Akathisia는 160mg/일을 투여받은 환자의 7.4%(9/121)에서 보고되었습니다. Akathisia는 위약을 투여받은 피험자의 3.0%에서 발생했습니다. 추체외 증상의 빈도는 LATUDA 20mg(5.6%), LATUDA 40mg(11.5%), LATUDA 80mg(11.9%), LATUDA 120mg(22.0%)에서 용량이 증가함에 따라 증가했습니다.
Bipolar Depression (Monotherapy)
다음 결과는 LATUDA가 20mg에서 120mg(n=331)까지의 일일 용량으로 투여된 양극성 우울증에 대한 성인 단기, 위약 대조군 시판 전 연구를 기반으로 합니다.
Commonly Observed Adverse Reactions: LATUDA로 치료받은 환자에서 가장 흔한 이상 반응(두 용량 그룹 중 하나에서 발생률 ≥5%이고 위약 발생률의 최소 2배)은 불안, 추체외 증상, 졸음, 메스꺼움, 구토, 설사 및 불안이었습니다.
Adverse Reactions Associated with Discontinuation of Treatment: LATUDA로 치료받은 환자의 6.0%(20/331)과 위약으로 치료받은 환자의 5.4%(9/168)가 이상 반응으로 인해 치료를 중단했습니다. LATUDA로 치료받은 피험자에서 위약 발생률의 최소 2배 이상인 2% 이상의 치료 중단과 관련된 이상 반응은 없었습니다.
Adverse Reactions Occurring at an Incidence of 2% or More in LATUDA-Treated Patients: 급성 치료(양극성 우울증 환자의 경우 최대 6주) 동안 발생한 LATUDA 사용과 관련된 이상 반응(발생률 2% 이상, 가장 가까운 백분율로 반올림하고 LATUDA 발생률이 위약보다 높음)은 표 20에 나와 있습니다.
|
Note: Figures rounded to the nearest integer |
||||||
|
*Extrapyramidal symptoms include adverse event terms: bradykinesia, cogwheel rigidity, drooling, dystonia, extrapyramidal disorder, glabellar reflex abnormal, hypokinesia, muscle rigidity, oculogyric crisis, oromandibular dystonia, parkinsonism, psychomotor retardation, tongue spasm, torticollis, tremor, and trismus |
||||||
|
** Somnolence includes adverse event terms: hypersomnia, hypersomnolence, sedation, and somnolence |
||||||
| Percentage of Patients Reporting Reaction | ||||||
| Body System or Organ Class Dictionary-derived Term |
Placebo (N=168) (%) |
LATUDA 20-60 mg/day (N=164) (%) |
LATUDA 80-120 mg/day (N=167) (%) |
All LATUDA(N=331) (%) |
||
| Gastrointestinal Disorders | ||||||
| Nausea | 8 | 10 | 17 | 14 | ||
| Dry Mouth | 4 | 6 | 4 | 5 | ||
| Vomiting | 2 | 2 | 6 | 4 | ||
| Diarrhea | 2 | 5 | 3 | 4 | ||
| Infections and Infestations | ||||||
| Nasopharyngitis | 1 | 4 | 4 | 4 | ||
| Influenza | 1 | <1 | 2 | 2 | ||
| Urinary Tract Infection | <1 | 2 | 1 | 2 | ||
| Musculoskeletal and Connective Tissue Disorders |
||||||
| Back Pain | <1 | 3 | <1 | 2 | ||
| 신경계 장애 | ||||||
| 추체외로 증상* | 2 | 5 | 9 | 7 | ||
| 불안정 | 2 | 8 | 11 | 9 | ||
| 졸음** | 7 | 7 | 14 | 11 | ||
| 정신 장애 | ||||||
| 불안 | 1 | 4 | 5 | 4 | ||
단일 요법 연구에서 용량 관련 이상 반응:
성인 단기, 위약 대조 연구(낮은 및 높은 LATUDA 용량 범위 포함) [임상 연구(14.2) 참조]에서 LATUDA로 치료받은 환자에서 모든 용량 그룹에서 5% 이상의 발생률을 보였고, 두 그룹 모두에서 위약보다 높은 발생률을 보인 이상 반응은 LATUDA 20~60mg/일 및 LATUDA 80~120mg/일에 대해 각각 메스꺼움(10.4%, 17.4%), 졸음(7.3%, 13.8%), 불안정(7.9%, 10.8%) 및 추체 외 증상(4.9%, 9.0%)이었다.
리튬 또는 발프로산과의 병용 요법
다음 결과는 LATUDA가 리튬 또는 발프로산과 병용 요법으로 20~120mg의 일일 용량으로 투여된 조울증에 대한 두 건의 성인 단기, 위약 대조 시판 전 연구(n=360)를 기반으로 한다.
치료 중단과 관련된 이상 반응: LATUDA로 치료받은 환자의 총 5.8%(21/360) 및 위약으로 치료받은 환자의 4.8%(16/334)가 이상 반응으로 인해 치료를 중단했다. LATUDA로 치료받은 피험자에서 위약 발생률의 최소 2배 이상인 2% 이상의 치료 중단과 관련된 이상 반응은 없었다.
LATUDA로 치료받은 환자에서 2% 이상의 발생률로 나타난 이상 반응: 조울증 환자에서 급성 치료(최대 6주) 동안 발생한 LATUDA 사용과 관련된 이상 반응(발생률 2% 이상, 가장 가까운 퍼센트로 반올림 및 LATUDA 발생률이 위약보다 높음)은 표 21에 나와 있다.
|
참고: 숫자는 가장 가까운 정수로 반올림됨 |
||
|
*추체 외 증상에는 다음과 같은 이상 사건 용어가 포함된다: 서동증, 기어 움직임 강직, 침 흘림, 디스토니아, 추체 외 장애, 전두엽 반사 이상, 저운동증, 근육 강직, 안구 회전 발작, 구강 및 하악 디스토니아, 파킨슨증, 정신 운동 지연, 혀 경련, 사경, 떨림 및 악관절 경련 |
||
|
** 졸음에는 다음과 같은 이상 사건 용어가 포함된다: 과도한 졸음, 과도한 졸음, 진정 및 졸음 |
||
| 반응을 보고한 환자 비율 | ||
| 신체계 또는 장기 계통 사전에 정의된 용어 |
위약 (N=334) (%) |
LATUDA 20~120mg/일 (N=360) (%) |
| 위장관 장애 | ||
| 메스꺼움 | 10 | 14 |
| 구토 | 1 | 4 |
| 일반 장애 | ||
| 피로 | 1 | 3 |
| 감염 및 기생충 감염 | ||
| 인두염 | 2 | 4 |
| 검사 | ||
| 체중 증가 | <1 | 3 |
| 대사 및 영양 장애 | ||
| 식욕 증가 | 1 | 3 |
| 신경계 장애 | ||
| 추체 외 증상* | 9 | 14 |
| 졸음** | 5 | 11 |
| 불안정 | 5 | 11 |
| 정신 장애 | ||
| 불안 | <1 | 4 |
흔히 관찰되는 유해 반응: LATUDA로 치료받은 청소년 환자(13~17세)에서 가장 흔한 유해 반응(발생률 ≥5% 및 위약군의 2배 이상)은 졸음, 메스꺼움, 불안정, 추체 외 증상(비불안정, 40mg만 해당), 구토 및 비루/비염(80mg만 해당)이었습니다.
LATUDA 치료 환자에서 2% 이상의 발생률로 나타나는 유해 반응: 조현병이 있는 청소년 환자에서 급성 치료(최대 6주) 동안 LATUDA 사용과 관련된 유해 반응(발생률 2% 이상, 가장 가까운 퍼센트로 반올림하고 LATUDA 발생률이 위약보다 높음)은 표 22에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||||
|
* 졸음에는 유해 사건 용어: 과도한 졸음, 진정 및 졸음이 포함됩니다. |
||||
|
** 바이러스 감염에는 유해 사건 용어: 비인두염, 인플루엔자, 바이러스 감염, 상기도 감염이 포함됩니다. |
||||
|
*** 비염에는 유해 사건 용어: 비염, 알레르기성 비염, 비루 및 비충혈이 포함됩니다. |
||||
| 반응을 보고한 환자 비율 | ||||
|
신체계 또는 기관 계통 사전에 정의된 용어 |
위약 (N=112) |
LATUDA 40mg/일 (N=110) |
LATUDA 80mg/일 (N=104) |
모든 LATUDA (N=214) |
| 위장 장애 | ||||
| 메스꺼움 | 3 | 13 | 14 | 14 |
| 구토 | 2 | 8 | 6 | 8 |
| 설사 | 1 | 3 | 5 | 4 |
| 구강 건조 | 0 | 2 | 3 | 2 |
| 감염 및 기생충 감염 | ||||
| 바이러스 감염** | 6 | 11 | 10 | 10 |
| 비염*** | 2 | <1 | 8 | 4 |
| 구인두 통증 | 0 | <1 | 3 | 2 |
| 빈맥 | 0 | 0 | 3 | 1 |
| 신경계 장애 | ||||
| 졸음* | 7 | 15 | 13 | 15 |
| 불안정증 | 2 | 9 | 9 | 9 |
| 현기증 | 1 | 5 | 5 | 5 |
조울증
다음 결과는 LATUDA가 20mg에서 80mg까지의 일일 용량으로 투여된 10세에서 17세의 소아 환자에서 조울증에 대한 위약 대조 6주 연구를 기반으로 합니다 (N=175).
흔히 관찰되는 유해 반응: LATUDA로 치료받은 소아 환자 (10세에서 17세)에서 가장 흔한 유해 반응 (발생률 ≥5% 및 위약군의 발생률의 최소 2배)은 메스꺼움, 체중 증가 및 불면증이었습니다.
LATUDA로 치료받은 환자에서 발생률이 2% 이상인 유해 반응: 급성 치료 (조울증이 있는 소아 환자에서 최대 6주) 동안 발생한 LATUDA 사용과 관련된 유해 반응 (발생률이 2% 이상, 가장 가까운 퍼센트로 반올림하고 LATUDA 발생률이 위약보다 높음)은 표 23에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||
|
*졸음은 다음과 같은 유해 사건 용어를 포함합니다: 과도한 졸음, 졸음, 진정 및 졸음 |
||
|
**EPS는 다음과 같은 유해 사건 용어를 포함합니다: 불안정, 톱니바퀴 강직, 운동 장애, 근긴장증, 과운동증, 관절 경직, 근육 강직, 근육 경련, 근골격계 경직, 안구 회전 발작, 파킨슨증, 지연성 운동 장애 및 떨림 |
||
| 반응을 보고한 환자 비율 | ||
| 신체계 또는 장기 계통 사전에 정의된 용어 |
위약 (N=172) |
LATUDA 20mg에서 80mg/일 (N=175) |
| 위장관 장애 | ||
| 메스꺼움 | 6 | 16 |
| 구토 | 4 | 6 |
| 상복부 통증 | 2 | 3 |
| 설사 | 2 | 3 |
| 복통 | 1 | 3 |
| 일반적인 장애 및 투여 부위 상태 | ||
| 피로 | 2 | 3 |
| 검사 | ||
| 체중 증가 | 2 | 7 |
| 대사 및 영양 장애 | ||
| 식욕 감소 | 2 | 4 |
| 신경계 장애 | ||
| 졸음* | 6 | 11 |
| 추체외로 증상** | 5 | 6 |
| 현기증 | 5 | 6 |
| 정신 장애 | ||
| 불면증 | 2 | 5 |
| 이상한 꿈 | 2 | 2 |
| 호흡기, 흉곽 및 종격동 장애 | ||
| 구강인두 통증 | 2 | 2 |
Adults
단기간 위약 대조군 조현병 연구에서 LATUDA 치료 환자의 경우, 불안 및 불안정을 제외한 추체외로 증상(EPS)과 관련된 보고된 사건의 발생률은 13.5%였으며 위약 치료 환자의 경우 5.8%였습니다. LATUDA 치료 환자의 불안 발생률은 12.9%였으며 위약 치료 환자의 경우 3.0%였습니다. 용량별 EPS 발생률은 표 24에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||||||
|
* 경련은 다음과 같은 이상 사례 용어를 포함합니다: 경련, 안구 회전 경련, 구강 악안면 경련, 혀 경련, 사경, 및 개구 장애 |
||||||
|
** 파킨슨증은 다음과 같은 이상 사례 용어를 포함합니다: 운동 완만, 톱니바퀴 강직, 타액 분비, 추체외로 장애, 운동 저하, 근육 강직, 파킨슨증, 정신 운동 지연, 및 진전 |
||||||
| LATUDA | ||||||
| 이상 사례 용어 | 위약 (N=708) (%) |
20 mg/day (N=71) (%) |
40 mg/day (N=487) (%) |
80 mg/day (N=538) (%) |
120 mg/day (N=291) (%) |
160 mg/day (N=121) (%) |
| 모든 EPS 사건 | 9 | 10 | 21 | 23 | 39 | 20 |
| 불안/불안정을 제외한 모든 EPS 사건 | 6 | 6 | 11 | 12 | 22 | 13 |
| 불안 | 3 | 6 | 11 | 12 | 22 | 7 |
| 경련* | <1 | 0 | 4 | 5 | 7 | 2 |
| 파킨슨증** | 5 | 6 | 9 | 8 | 17 | 11 |
| 불안정 | 1 | 1 | 3 | 1 | 3 | 2 |
청소년
청소년 조현병에 대한 단기간 위약 대조 연구에서, LATUDA 치료 환자의 EPS 발생률은 아카시시아 관련 사건을 제외하고 40mg (10%) 및 80mg (7.7%) 치료군에서 위약군 (3.6%)보다 높았습니다. 그리고 LATUDA 치료 환자의 아카시시아 관련 사건 발생률은 위약군 치료 환자의 1.8%에 비해 8.9%였습니다. 용량별 EPS 발생률은 표 25에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
|||
|
* 경련은 다음과 같은 이상 사례 용어를 포함합니다: 경련, 악관경련, 안구 회전 경련, 구강 및 하악 경련, 혀 경련 및 사경 |
|||
|
** 파킨슨증은 다음과 같은 이상 사례 용어를 포함합니다: 운동 완만, 타액 분비, 추체 외로 장애, 전두 이마 반사 이상, 운동 저하, 파킨슨증 및 정신 운동 지연 |
|||
| LATUDA | |||
| 이상 사례 용어 | 위약 (N=112) (%) |
40mg/일 (N=110) (%) |
80mg/일 (N=104) (%) |
| 모든 EPS 사건 | 5 | 14 | 14 |
| 아카시시아/불안을 제외한 모든 EPS 사건 | 4 | 7 | 7 |
| 아카시시아 | 2 | 9 | 9 |
| 파킨슨증** | <1 | 4 | 0 |
| 운동 장애 | <1 | <1 | 1 |
| 경련* | 0 | <1 | 1 |
단독 요법
성인 단기, 위약 대조 단독 요법 조울증 우울증 연구에서 LATUDA 치료 환자의 경우 아카시시아 및 불안을 제외한 EPS 관련 보고된 사건의 발생률은 6.9%였으며 위약 치료 환자의 경우 2.4%였습니다. LATUDA 치료 환자의 아카시시아 발생률은 9.4%였으며 위약 치료 환자의 경우 2.4%였습니다. 용량 그룹별 EPS 발생률은 표 26에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||||
|
* 경련은 다음과 같은 이상 사례 용어를 포함합니다. 경련, 안구 회전 발작, 구강 운동 장애, 혀 경련, 사경, 개구 장애 |
||||
|
** 파킨슨증은 다음과 같은 이상 사례 용어를 포함합니다. 운동 완만, 톱니바퀴 강직, 타액 분비 과다, 추체 외로 장애, 전두 이마 반사 이상, 운동 저하, 근육 강직, 파킨슨증, 정신 운동 지연, 떨림 |
||||
| LATUDA | ||||
| 이상 사례 용어 | 위약 (N=168) (%) |
20~60mg/일 (N=164) (%) |
80~120mg/일 (N=167) (%) |
|
| 모든 EPS 사건 | 5 | 12 | 20 | |
| 아카시시아/불안을 제외한 모든 EPS 사건 | 2 | 5 | 9 | |
| 아카시시아 | 2 | 8 | 11 | |
| 경련* | 0 | 0 | 2 | |
| 파킨슨증** | 2 | 5 | 8 | |
| 불안 | <1 | 0 | 3 | |
리튬 또는 발프로에이트와의 병용 요법
성인 단기, 위약 대조 병용 요법 양극성 우울증 연구에서 LATUDA 치료 환자의 경우 아카시스 및 불안을 제외한 EPS의 발생률은 위약에 대해 각각 13.9% 및 8.7%였습니다. LATUDA 치료 환자의 아카시스 발생률은 위약 치료 환자에 대해 각각 10.8% 및 4.8%였습니다. EPS 발생률은 표 27에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||
|
* 경련은 다음과 같은 이상 사례 용어를 포함합니다: 경련, 안구 회전 경련, 구강 운동 경련, 혀 경련, 사경, 및 악관 경련 |
||
|
** 파킨슨증은 다음과 같은 이상 사례 용어를 포함합니다: 운동 완만, 톱니바퀴 강직, 타액 분비 과다, 추체 외로 장애, 전두 이마 반사 이상, 운동 저하, 근육 강직, 파킨슨증, 정신 운동 지연, 및 진전 |
||
| 이상 사례 용어 | 위약 (N=334) (%) |
LATUDA 20 to 120 mg/day (N=360) (%) |
| 모든 EPS 사건 | 13 | 24 |
| 아카시스/불안을 제외한 모든 EPS 사건 | 9 | 14 |
| 아카시스 | 5 | 11 |
| 경련* | <1 | 1 |
| 파킨슨증** | 8 | 13 |
| 불안 | <1 | 4 |
단기간, 위약 대조군 조현병 및 양극성 우울증 연구에서, 추체외로 증상(EPS)에 대한 Simpson Angus 등급 척도(SAS), 불안정증에 대한 Barnes 불안정증 척도(BAS) 및 운동 장애에 대한 비정상적 자발 운동 척도(AIMS)에 대한 데이터가 객관적으로 수집되었습니다.
소아 환자(10~17세)
10~17세 소아 환자에서 양극성 우울증에 대한 6주간 위약 대조군 연구에서, LATUDA 치료 환자의 경우, 불안정증 관련 사건을 제외한 EPS의 발생률은 LATUDA 20~80mg/일(3.4%) 치료군과 위약(3.5%)에서 유사했습니다. 그리고 LATUDA 치료 환자의 경우 불안정증 관련 사건의 발생률은 위약 치료 환자의 경우 2.9% 대 3.5%였습니다. 용량별 EPS 발생률은 표 28에 나와 있습니다.
|
참고: 숫자는 가장 가까운 정수로 반올림되었습니다. |
||
|
* EPS에는 불안정증, 기어 톱 강직, 운동 장애, 근긴장증, 과운동증, 관절 경직, 근육 강직, 근육 경련, 근골격계 경직, 안구 회전 발작, 파킨슨증, 지연성 운동 장애 및 떨림과 같은 유해 사건 용어가 포함됩니다. |
||
|
** 파킨슨증에는 서동증, 타액 분비 과다, 추체외로 장애, 미간 반사 이상, 저운동증, 파킨슨증 및 정신 운동 지연과 같은 유해 사건 용어가 포함됩니다. |
||
|
***근긴장증에는 근긴장증, 안구 회전 발작, 구강 턱 근긴장증, 혀 경련, 사경 및 개구 장애와 같은 유해 사건 용어가 포함됩니다. |
||
| 유해 사건 용어 | 위약 (N=172) (%) |
LATUDA 20~80mg/일 (N=175) (%) |
| 모든 EPS 사건* | 5 | 6 |
| 불안정증/불안을 제외한 모든 EPS 사건 | 4 | 3 |
| 불안정증 | 4 | 3 |
| 파킨슨증** | <1 | <1 |
| 근긴장증*** | 1 | <1 |
| 타액 분비 과다 | <1 | <1 |
| 정신 운동 과잉 | 0 | <1 |
| 지연성 운동 장애 | <1 | 0 |
성인
LATUDA 치료 환자의 SAS, BAS 및 AIMS 기준선 대비 평균 변화는 Barnes Akathisia Scale 전반 점수(LATUDA, 0.1; 위약, 0.0)를 제외하고 위약 치료 환자와 유사했습니다. BAS(LATUDA, 14.4%; 위약, 7.1%), SAS(LATUDA, 5.0%; 위약, 2.3%) 및 AIMS(LATUDA, 7.4%; 위약, 5.8%)에서 정상에서 비정상으로 전환된 환자의 비율이 LATUDA 치료 환자와 위약에서 더 높았습니다.
청소년
청소년 조현병 환자의 LATUDA 치료 환자의 SAS, BAS 및 AIMS 기준선 대비 평균 변화는 위약 치료 환자와 유사했습니다. BAS(LATUDA, 7.0%; 위약, 1.8%), SAS(LATUDA, 8.3%; 위약, 2.7%) 및 AIMS(LATUDA, 2.8%; 위약, 0.9%)에서 정상에서 비정상으로 전환된 환자의 비율이 LATUDA 치료 환자와 위약에서 더 높았습니다.
단독 요법
LATUDA 치료 성인 환자의 SAS, BAS 및 AIMS 기준선 대비 평균 변화는 위약 치료 환자와 유사했습니다. BAS(LATUDA, 8.4%; 위약, 5.6%), SAS(LATUDA, 3.7%; 위약, 1.9%) 및 AIMS(LATUDA, 3.4%; 위약, 1.2%)에서 정상에서 비정상으로 전환된 환자의 비율이 LATUDA 치료 환자와 위약에서 더 높았습니다.
리튬 또는 발프로산과의 병용 요법
LATUDA 치료 성인 환자의 SAS, BAS 및 AIMS 기준선 대비 평균 변화는 위약 치료 환자와 유사했습니다. BAS(LATUDA, 8.7%; 위약, 2.1%), SAS(LATUDA, 2.8%; 위약, 2.1%) 및 AIMS(LATUDA, 2.8%; 위약, 0.6%)에서 정상에서 비정상으로 전환된 환자의 비율이 LATUDA 치료 환자와 위약에서 더 높았습니다.
소아 환자(10~17세)
조울증이 있는 10~17세 소아 환자의 LATUDA 치료 환자의 SAS, BAS 및 AIMS 기준선 대비 평균 변화는 위약 치료 환자와 유사했습니다. BAS(LATUDA, 4.6%; 위약, 2.4%), SAS(LATUDA, 0.6%; 위약, 0%)에서 정상에서 비정상으로 전환된 환자의 비율이 LATUDA 치료 환자와 위약에서 더 높았으며 AIMS(LATUDA, 0%; 위약, 0%)는 동일했습니다.
약물 계열 효과: 근긴장 이상 증상(근육 그룹의 지속적인 비정상적인 수축)은 치료 첫 며칠 동안 민감한 개인에게 발생할 수 있습니다. 근긴장 이상 증상에는 목 근육 경련, 때로는 목이 조이는 것으로 진행되어 목이 막히는 느낌, 삼키기 어려움, 호흡 곤란 및/또는 혀가 튀어나오는 것이 포함됩니다. 이러한 증상은 낮은 용량에서 발생할 수 있지만, 고강도 및 고용량의 1세대 항정신병 약물에서 더 자주 발생하고 더 심각하게 발생합니다. 급성 근긴장 이상의 위험이 높은 것은 남성과 젊은 연령대에서 관찰됩니다.
성인
단기간 위약 대조 조현병 임상 연구에서 근긴장 이상은 LATUDA 치료 대상자의 4.2%(LATUDA 20mg, 0.0%, LATUDA 40mg, 3.5%, LATUDA 80mg, 4.5%, LATUDA 120mg, 6.5% 및 LATUDA 160mg, 2.5%)에서 발생한 반면, 위약을 투여받은 대상자의 경우 0.8%에서 발생했습니다. 7명의 대상자(0.5%, 7/1508)가 근긴장 이상 사건으로 인해 임상 시험을 중단했습니다. 4명은 LATUDA 80mg/일을 투여받았고 3명은 LATUDA 120mg/일을 투여받았습니다.
청소년
단기간 위약 대조 청소년 조현병 연구에서 근긴장 이상은 LATUDA 치료 환자의 1%(LATUDA 40mg, 1% 및 LATUDA 80mg, 1%)에서 발생한 반면, 위약을 투여받은 환자의 경우 0%에서 발생했습니다. 근긴장 이상 사건으로 인해 임상 연구를 중단한 환자는 없었습니다.
단독 요법
성인 단기간 유연 용량 위약 대조 단독 요법 조울증 연구에서 근긴장 이상은 LATUDA 치료 대상자의 0.9%(LATUDA 20~60mg/일, 0.0% 및 LATUDA 80~120mg/일, 1.8%)에서 발생한 반면, 위약을 투여받은 대상자의 경우 0.0%에서 발생했습니다. 근긴장 이상 사건으로 인해 임상 연구를 중단한 대상자는 없었습니다.
리튬 또는 발프로산과의 병용 요법
성인 단기간 유연 용량 위약 대조 병용 요법 조울증 연구에서 근긴장 이상은 LATUDA 치료 대상자(20~120mg)의 1.1%에서 발생한 반면, 위약을 투여받은 대상자의 경우 0.6%에서 발생했습니다. 근긴장 이상 사건으로 인해 임상 연구를 중단한 대상자는 없었습니다.
소아 환자(10~17세)
10~17세 소아 환자를 대상으로 한 6주간 위약 대조 조울증 연구에서 근긴장 이상은 LATUDA 치료 환자의 0.6%에서 발생한 반면, 위약을 투여받은 환자의 경우 1.2%에서 발생했습니다. 근긴장 이상 사건으로 인해 임상 연구를 중단한 환자는 없었습니다.
LATUDA의 시판 전 평가 중 관찰된 기타 이상 반응
다음은 정신분열증 환자 2905명을 대상으로 한 시판 전 데이터베이스에서 LATUDA를 1일 1회 ≥ 20mg의 다양한 용량으로 치료받은 성인 환자에게서 보고된 이상 반응 목록입니다. 나열된 반응은 임상적으로 중요할 수 있는 반응과 약리학적 또는 기타 근거로 약물과 관련이 있을 가능성이 있는 반응입니다. 표 19에 나열된 반응 또는 LATUDA 라벨의 다른 곳에 나와 있는 반응은 포함되지 않습니다.
반응은 기관 계통별로 추가 분류되고 다음 정의에 따라 빈도 순으로 나열됩니다. 1/100명 이상의 환자에게서 발생하는 반응(빈번)(표에 나열된 위약 대조 연구 결과에 이미 나와 있지 않은 반응만 이 목록에 나타납니다.); 1/100명에서 1/1000명 사이의 환자에게서 발생하는 반응(드문); 1/1000명 미만의 환자에게서 발생하는 반응(희귀).
혈액 및 림프계 장애:
드문:
빈혈
심장 장애:
빈번:
빈맥;
드문:
1차 AV 블록, 협심증, 서맥
귀 및 미로 장애:
드문:
현기증
안과 장애:
빈번:
시력흐림
위장관 장애:
빈번:
복통, 설사;
드문:
위염
일반적인 장애 및 투여 부위 상태:
희귀:
돌연사
검사:
빈번:
CPK 증가
대사 및 영양 장애:
빈번:
식욕 감소
근골격계 및 결합 조직 장애:
희귀:
횡문근 융해증
신경계 장애:
드문:
뇌혈관 사고, 발음 장애
정신 장애:
드문:
이상 꿈, 공황 발작, 수면 장애
신장 및 요로 장애:
드문:
배뇨 곤란;
희귀:
신부전
생식 기관 및 유방 장애:
드문:
무월경, 월경통;
희귀:
유방 비대, 유방 통증, 유즙 분비, 발기 부전, 발기 지속
피부 및 피하 조직 장애:
빈번:
발진, 가려움증;
희귀:
혈관 부종
혈관 장애:
빈번:
고혈압
혈청 크레아티닌: 단기간 위약 대조 시험에서 혈청 크레아티닌의 기준선 대비 평균 변화는 LATUDA 치료 환자의 경우 +0.05mg/dL이었고 위약 치료 환자의 경우 +0.02mg/dL이었습니다. 정상에서 고혈압으로의 크레아티닌 변화는 LATUDA 치료 환자의 3.0%(43/1453)에서 발생했고 위약의 경우 1.6%(11/681)에서 발생했습니다. 고혈압 크레아티닌 값의 임계값은 각 연구의 중앙 실험실 정의에 따라 > 0.79에서 > 1.3mg/dL까지 다양했습니다(표 29).
| 실험실 매개변수 | 위약 (N=708) |
LATUDA 20 mg/day (N=71) |
LATUDA 40 mg/day (N=487) |
LATUDA 80 mg/day (N=538) |
LATUDA 120 mg/day (N=291) |
LATUDA 160 mg/day (N=121) |
| 혈청 크레아티닌 상승 | 2% | 1% | 2% | 2% | 5% | 7% |
혈청 크레아티닌: 단기간, 위약 대조, 청소년 조현병 연구에서, LATUDA 치료 환자의 혈청 크레아티닌 기준선 대비 평균 변화는 -0.009 mg/dL이었고, 위약 치료 환자는 +0.017 mg/dL이었습니다. 크레아티닌 수치가 정상에서 고농도로 변화(중앙 실험실 정의 기준)는 LATUDA 치료 환자의 7.2%(14/194)에서 발생했고, 위약 투여 환자는 2.9%(3/103)에서 발생했습니다(표 30).
| 검사 항목 | 위약 (N=103) |
LATUDA 40 mg/day (N=97) |
LATUDA 80 mg/day (N=97) |
| 혈청 크레아티닌 상승 | 2.9% | 7.2% | 7.2% |
혈청 크레아티닌: 성인 단기간, 유연 용량, 위약 대조 단독 요법 조울증 연구에서, LATUDA 치료 환자의 혈청 크레아티닌 기준선 대비 평균 변화는 +0.01 mg/dL이었고, 위약 치료 환자는 -0.02 mg/dL이었습니다. 크레아티닌 수치가 정상에서 고농도로 변화는 LATUDA 치료 환자의 2.8%(9/322)에서 발생했고, 위약 투여 환자는 0.6%(1/162)에서 발생했습니다(표 31).
| 검사 항목 | 위약 (N=168) |
LATUDA 20 to 60 mg/day (N=164) |
LATUDA 80 to 120 mg/day (N=167) |
| 혈청 크레아티닌 상승 | <1% | 2% | 4% |
리튬 또는 발프로산과의 병용 요법
혈청 크레아티닌: 성인 단기간, 위약 대조, 조울증에 대한 시판 전 병용 요법 연구에서, LATUDA 치료 환자의 혈청 크레아티닌 기준선 대비 평균 변화는 +0.04 mg/dL이었고, 위약 치료 환자는 -0.01 mg/dL이었습니다. 크레아티닌 수치가 정상에서 고농도로 변화는 LATUDA 치료 환자의 4.3%(15/360)에서 발생했고, 위약 투여 환자는 1.6%(5/334)에서 발생했습니다(표 32).
| 검사 항목 | 위약 (N=334) |
LATUDA 20 to 120 mg/day (N=360) |
| 혈청 크레아티닌 상승 | 2% | 4% |
소아 환자 (10~17세)
혈청 크레아티닌: 10~17세 소아 환자를 대상으로 한 6주간의 위약 대조군 양극성 우울증 연구에서, LATUDA 치료 환자의 혈청 크레아티닌 기준선 대비 평균 변화는 +0.021 mg/dL이었고, 위약 치료 환자는 +0.009 mg/dL이었습니다. 중앙 실험실 정의에 따라 정상에서 고혈압으로 크레아티닌 변화가 LATUDA 치료 환자의 6.7%(11/163)에서 발생했고, 위약 투여 환자의 4.5%(7/155)에서 발생했습니다(표 33).
| 실험실 매개변수 | 위약 (N=155) |
LATUDA 20~80 mg/day (N=163) |
| 혈청 크레아티닌 상승 | 4.5% | 6.7% |
6.2 시판 후 경험
LATUDA의 시판 후 사용 중 다음과 같은 유해 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
과민 반응: 두드러기, 목 부종, 혀 부종, 호흡 곤란, 발진.
대사 및 영양 장애: 저나트륨혈증
7 약물 상호 작용
7.1 LATUDA와 임상적으로 중요한 상호 작용을 하는 약물
| 강력한 CYP3A4 억제제 | |
| 임상적 영향: | LATUDA를 강력한 CYP3A4 억제제와 병용하면 LATUDA 단독 사용에 비해 루라시돈의 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | LATUDA는 강력한 CYP3A4 억제제와 병용해서는 안 됩니다 [금기 사항 (4) 참조]. |
| 예: | 케토코나졸, 클래리스로마이신, 리토나비르, 보리코나졸, 미베프라딜 |
| 보통 수준의 CYP3A4 억제제 | |
| 임상적 영향: | LATUDA를 보통 수준의 CYP3A4 억제제와 병용하면 LATUDA 단독 사용에 비해 루라시돈의 노출이 증가했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 보통 수준의 CYP3A4 억제제와 병용하는 경우 LATUDA 용량을 원래 용량의 절반으로 줄여야 합니다 [용량 및 투여 (2.6) 참조]. |
| 예: | 딜티아젬, 아타자나비르, 에리스로마이신, 플루코나졸, 베라파밀 |
| 강력한 CYP3A4 유도제 | |
| 임상적 영향: | LATUDA를 강력한 CYP3A4 유도제와 병용하면 LATUDA 단독 사용에 비해 루라시돈의 노출이 감소했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | LATUDA는 강력한 CYP3A4 유도제와 병용해서는 안 됩니다 [금기 사항 (4) 참조]. |
| 예: | 리팜핀, 아바시미브, 세인트 존스 워트, 페니토인, 카르바마제핀 |
| 보통 수준의 CYP3A4 유도제 | |
| 임상적 영향: | LATUDA를 보통 수준의 CYP3A4 유도제와 병용하면 LATUDA 단독 사용에 비해 루라시돈의 노출이 감소했습니다 [임상 약리학 (12.3) 참조]. |
| 개입: | 보통 수준의 CYP3A4 유도제와 병용하는 경우 LATUDA 용량을 늘려야 합니다 [용량 및 투여 (2.6) 참조]. |
| 예: | 보센탄, 에파비렌즈, 에트라비린, 모다피닐, 나프실린 |
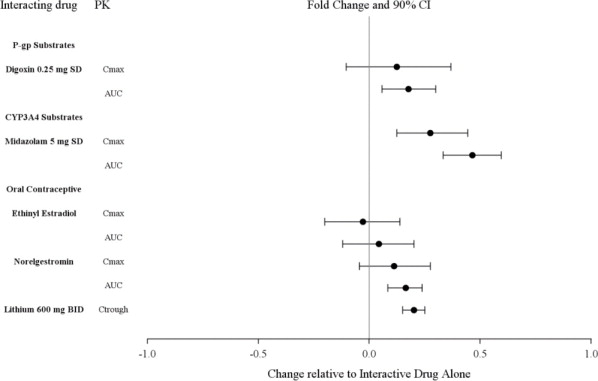
7.2 LATUDA와 임상적으로 중요한 상호 작용을 하지 않는 약물
약동학 연구에 따르면 리튬, 발프로에이트 또는 P-gp 또는 CYP3A4의 기질과 병용 투여할 때 LATUDA의 용량 조절은 필요하지 않습니다 [임상 약리학 (12.3) 참조].
8. 특정 환자군에서의 사용
8.1 임신
임신 노출 레지스트리
임신 중 LATUDA에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 레지스트리가 있습니다. 자세한 내용은 1-866-961-2388로 전화하거나 http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/를 방문하여 비정형 항정신성 약물에 대한 전국 임신 레지스트리에 문의하십시오.
위험 요약
임신 3분기에 항정신성 약물에 노출된 신생아는 출산 후 추체 외로 증상 및/또는 금단 증상의 위험이 있습니다 [임상적 고려 사항 참조]. 임산부에 대한 LATUDA 사용에 대한 연구는 없습니다. 제한된 이용 가능한 데이터는 기형 또는 유산의 약물 관련 위험을 알리기에 충분하지 않습니다. 동물 생식 연구에서, 기관 형성 기간 동안 최대 권장 인간 용량(MRHD)의 약 1.5배 및 6배에 해당하는 용량으로 루라시돈을 투여한 임신 쥐와 토끼에서 기형 유발 효과가 관찰되지 않았습니다. 각각 mg/m2 체표면적 기준 160mg/일 [데이터 참조].
지정된 모집단(들)에 대한 주요 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
태아/신생아 부작용
임신 3분기에 항정신성 약물에 노출된 신생아에서 불안, 고긴장, 저긴장, 떨림, 졸음, 호흡 곤란 및 수유 장애를 포함한 추체 외로 증상 및/또는 금단 증상이 보고되었습니다. 이러한 증상의 심각도는 다양했습니다. 일부 신생아는 특정 치료 없이 몇 시간 또는 며칠 내에 회복되었지만 다른 신생아는 장기 입원이 필요했습니다. 신생아를 추체 외로 증상 및/또는 금단 증상에 대해 모니터링하고 증상을 적절히 관리하십시오.
동물 데이터
임신 쥐에게 기관 형성 기간 동안 3, 10 및 25mg/kg/일의 경구 루라시돈을 투여했습니다. 이러한 용량은 mg/m2 체표면적 기준 160mg/일의 MRHD의 0.2, 0.6 및 1.5배입니다. mg/m2 기준 160mg/일의 MRHD의 1.5배까지 기형 유발 또는 배아-태아 효과가 관찰되지 않았습니다.
임신 토끼에게 기관 형성 기간 동안 2, 10 및 50mg/kg/일의 경구 루라시돈을 투여했습니다. 이러한 용량은 mg/m2 체표면적 기준 160mg/일의 MRHD의 0.2, 1.2 및 6배입니다. mg/m2 기준 160mg/일의 MRHD의 6배까지 기형 유발 또는 배아-태아 효과가 관찰되지 않았습니다.
임신 쥐에게 기관 형성 및 수유 기간 동안 0.4, 2 및 10mg/kg/일의 경구 루라시돈을 투여했습니다. 이러한 용량은 mg/m2 체표면적 기준 160mg/일의 MRHD의 0.02, 0.1 및 0.6배입니다. mg/m2 기준 160mg/일의 MRHD의 0.6배까지 출산 전 및 출산 후 발달 효과가 관찰되지 않았습니다.
8.4 소아 사용
조현병
청소년(13~17세)의 조현병 치료를 위한 LATUDA 40mg/일 및 80mg/일의 안전성 및 유효성은 326명의 청소년 환자를 대상으로 한 6주간의 위약 대조 임상 연구에서 확립되었습니다 [2.1 투여 및 투약, 6.1 부작용 및 14.1 임상 연구 참조].
LATUDA의 안전성 및 유효성은 조현병이 있는 13세 미만의 소아 환자에서 확립되지 않았습니다.
조울증
소아 환자(10~17세)의 조울증 치료를 위한 LATUDA 20~80mg/일의 안전성 및 유효성은 347명의 소아 환자를 대상으로 한 6주간의 위약 대조 임상 연구에서 확립되었습니다 [2.2 투여 및 투약, 6.1 부작용 및 14.2 임상 연구 참조].
LATUDA의 안전성 및 유효성은 조울증이 있는 10세 미만의 소아 환자에서 확립되지 않았습니다.
자폐 스펙트럼 장애와 관련된 과민성
자폐 스펙트럼 장애와 관련된 과민성 치료를 위한 소아 환자의 LATUDA 유효성은 확립되지 않았습니다.
LATUDA 20 mg/day 및 60 mg/day를 사용하여 진단 및 통계 매뉴얼 정신 장애, 제4판, 텍스트 개정판 [DSM-IV-TR] 기준에 따라 진단된 자폐 스펙트럼 장애와 관련된 과민성을 가진 6세에서 17세까지의 소아 환자를 대상으로 한 6주 연구에서 효능이 입증되지 않았습니다. 연구의 주요 목표는 종말점(6주차)에서 비정상 행동 체크리스트(ABC)의 과민성 하위 척도에서 기준선 대비 개선으로 측정되었으며, 충족되지 않았습니다. 총 149명의 환자가 LATUDA 또는 위약군에 무작위 배정되었습니다. 구토는 다른 LATUDA 연구에서 보고된 것보다 더 높은 비율로 발생했습니다(20 mg의 경우 4/49 또는 8%, 60 mg의 경우 14/51 또는 27%, 위약군의 경우 2/49 또는 4%), 특히 6세에서 12세 사이의 어린이(LATUDA를 복용한 18명의 환자 중 13명이 구토를 경험했습니다).
3개의 단기, 위약 대조 시험에서 조현병, 양극성 우울증 또는 자폐 스펙트럼 장애가 있는 소아 환자(6세에서 17세)를 모집한 장기, 개방 표지 연구에서 54%(378/701)가 104주 동안 루라시돈을 복용했습니다. 이 시험에서 약물과 관련이 있을 가능성이 있는 것으로 간주되는 부작용이 하나 발생했으며, 루라시돈을 복용한 성인에게는 보고되지 않았습니다. 10세 남자 어린이가 발기 부전과 일치하는 장기간 지속되는 고통스러운 발기를 경험했으며, 이로 인해 치료 중단이 발생했습니다.
이 시험에서 개방 표지 기준선에서 104주차까지 키의 평균 증가는 4.94cm였습니다. 정상 성장을 조정하기 위해 z-점수가 도출되었습니다(표준 편차[SD]로 측정됨). z-점수는 연령 및 성별 일치 인구 표준과 비교하여 어린이와 청소년의 자연 성장을 정규화합니다. z-점수 변화가 <0.5 SD인 경우 임상적으로 유의하지 않은 것으로 간주됩니다. 이 시험에서 개방 표지 기준선에서 104주차까지 키 z-점수의 평균 변화는 +0.05 SD였으며, 이는 정상 성장 곡선에서 최소한의 편차를 나타냅니다.
Juvenile animal studies
mg/m2 기준으로 MRHD의 0.2배만큼 낮은 용량에서 성장, 신체 및 신경 행동 발달에 부작용이 나타났습니다. 루라시돈은 출생 후 21일에서 91일까지(이 기간은 인간의 아동기, 청소년기 및 젊은 성인기에 해당됨) 랫트에게 경구 투여되었으며, 용량은 3, 30 및 150(수컷) 또는 300(암컷) mg/kg/day였으며, 이는 mg/m2 기준으로 최대 권장 성인 인간 용량(MRHD) 160 mg/day의 0.2배에서 10배(수컷) 및 20배(암컷)에 해당합니다. 부작용에는 mg/m2 기준으로 양성 모두에서 MRHD의 2배에서 대퇴골 길이, 골 무기질 함량, 체중 및 뇌 무게의 용량 의존적 감소, 그리고 양성 모두에서 MRHD의 0.2배 및 2배에서 운동 과잉 활동이 포함되었습니다. 암컷의 경우 MRHD의 2배에서 성적 성숙 달성이 지연되었으며, 이는 혈청 에스트로겐 감소와 관련이 있습니다. 사망은 이유 후 초기 기간에 양성 모두에서 발생했으며, 일부 수컷 이유 동물은 mg/m2 기준으로 MRHD의 2배만큼 낮은 용량에서 단 4회 치료 후 사망했습니다. 조직 병리학적 소견에는 mg/m2 기준으로 MRHD의 10배에서 수컷의 갑상선에서 콜로이드 증가 및 전립선 염증, 그리고 mg/m2 기준으로 MRHD의 0.2배만큼 낮은 용량에서 유선 증식, 질 점액화 증가 및 난소 폐쇄 난포 증가가 포함되었습니다. 이러한 소견 중 일부는 모든 용량에서 양성 모두에서 관찰된 일시적으로 상승된 혈청 프로락틴 때문인 것으로 밝혀졌습니다. 그러나 생식 매개변수(임신 능력, 임신 지수, 정자 형성, 발정 주기, 임신 기간, 분만, 태어난 새끼 수)에 대한 변화는 어떤 용량 수준에서도 관찰되지 않았습니다. 수컷의 신경 행동 변화에 대한 무효 용량은 mg/m2 기준으로 MRHD의 0.2배이며, 암컷에서는 결정할 수 없었습니다. 양성 모두에서 성장 및 신체 발달에 대한 무효 용량은 mg/m2 기준으로 MRHD의 0.2배입니다.
8.5 Geriatric Use
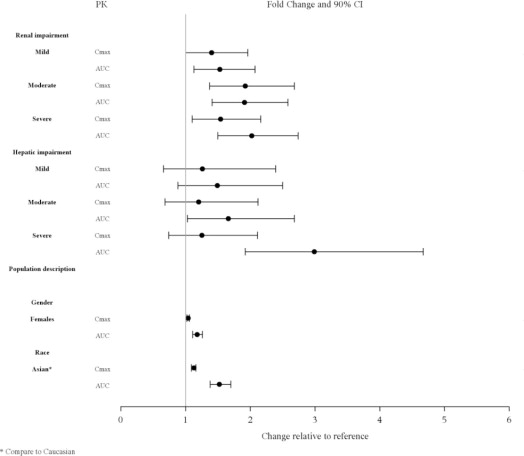
LATUDA에 대한 임상 연구에는 65세 이상 환자가 충분히 포함되지 않아 이들이 젊은 환자와 다르게 반응하는지 여부를 결정할 수 없었습니다. 정신병이 있는 노인 환자(65세에서 85세)의 경우 LATUDA 농도(20 mg/day)는 젊은 피험자의 농도와 유사했습니다. 나이만으로 용량 조절이 필요한지 여부는 알 수 없습니다.
LATUDA로 치료받은 치매 관련 정신병이 있는 노인 환자는 위약군에 비해 사망 위험이 높습니다. LATUDA는 치매 관련 정신병 환자의 치료에 승인되지 않았습니다 [Boxed Warning, 경고 및 주의 사항 (5.1, 5.3) 참조].
8.6 Renal Impairment
중등도 또는 중증 신장애 환자(CLcr<50 mL/분)의 경우 최대 권장 용량을 줄이십시오. 신장 기능이 저하된 환자(CLcr<50 mL/분)는 정상 신장 기능이 있는 환자보다 루라시돈에 대한 노출량이 더 높았습니다 [임상 약리학 (12.3) 참조]. 노출량이 증가하면 LATUDA와 관련된 부작용의 위험이 증가할 수 있습니다 [용량 및 투여 (2.4) 참조].
8.7 Hepatic Impairment
중등도에서 중증 간 기능 장애 환자(Child-Pugh 점수 ≥7)의 경우 최대 권장 용량을 줄이십시오. 중등도에서 중증 간 기능 장애 환자(Child-Pugh 점수 ≥7)는 일반적으로 정상 간 기능이 있는 환자보다 루라시돈에 대한 노출량이 더 높았습니다 [임상 약리학 (12.3) 참조]. 노출량이 증가하면 LATUDA와 관련된 부작용의 위험이 증가할 수 있습니다 [용량 및 투여 (2.5) 참조].
9. 약물 남용 및 의존성
9.2 남용
LATUDA는 남용, 신체적 의존성 또는 내성을 유발할 가능성에 대해 인간을 대상으로 체계적으로 연구된 적이 없습니다. LATUDA를 사용한 임상 연구에서 약물 추구 행동에 대한 경향이 나타나지는 않았지만 이러한 관찰은 체계적이지 않았으며, CNS에 작용하는 약물이 시판된 후 오용, 전용 및/또는 남용될 정도를 예측하는 것은 불가능합니다. 환자의 약물 남용 이력을 신중하게 평가해야 하며, 이러한 환자는 LATUDA의 오용 또는 남용 징후(예: 내성 발현, 약물 추구 행동, 용량 증가)를 주의 깊게 관찰해야 합니다.
10 과량 복용
10.1 인체 경험
시판 전 임상 연구에서 LATUDA의 우발적 또는 의도적 과량 복용은 추정 560mg의 LATUDA를 섭취한 환자 1명에게서 확인되었습니다. 이 환자는 후유증 없이 회복되었습니다. 이 환자는 2개월 동안 LATUDA 치료를 재개했습니다.
10.2 과량 복용 관리
LATUDA에 대한 특정 해독제는 알려져 있지 않습니다. 과량 복용을 관리할 때는 밀접한 의학적 감독 및 모니터링을 포함한 지지 치료를 제공하고 다중 약물 관여 가능성을 고려하십시오. 과량 복용이 발생하면 인증된 독극물 관리 센터(1-800-222-1222 또는 www.poison.org)에 문의하십시오.
심혈관 모니터링은 가능한 부정맥에 대한 지속적인 심전도 모니터링을 포함하여 즉시 시작해야 합니다. 항부정맥 치료를 시행하는 경우, 디소피라미드, 프로카이 나마이드 및 퀴니딘은 LATUDA의 급성 과량 복용 환자에게 투여할 때 QT 연장 효과를 더할 수 있는 이론적 위험이 있습니다. 마찬가지로 브레틸리움의 알파 차단 특성은 LATUDA의 알파 차단 특성에 더해져 문제가 되는 저혈압을 초래할 수 있습니다.
저혈압 및 순환 붕괴는 적절한 조치로 치료해야 합니다. 에피네프린과 도파민은 사용해서는 안 되며, LATUDA 유발 알파 차단의 설정에서 저혈압을 악화시킬 수 있으므로 베타 작용제 활성이 있는 다른 교감 신경 자극제도 사용해서는 안 됩니다. 심한 추체 외로 증상의 경우 항콜린성 약물을 투여해야 합니다.
환자가 의식이 없는 경우 기관 삽관 후 위 세척과 활성탄을 완하제와 함께 투여하는 것을 고려해야 합니다.
과량 복용 후 둔감, 발작 또는 경부의 디스토닉 반응 가능성은 유도된 구토로 인한 흡인 위험을 초래할 수 있습니다.
11. 설명
LATUDA는 벤즈이소티아졸 유도체 화학류에 속하는 비정형 항정신병제입니다.
그 화학적 명칭은 (3aR, 4S, 7R, 7aS)-2-{(1R, 2R)-2-[4-(1,2-벤즈이소티아졸-3-일)피페라진-1-일메틸]시클로헥실메틸}헥사히드로-4,7-메타노-2H-이소인돌-1,3-디온 염산염입니다. 그 분자식은 C28H36N4O2S•HCl이며 분자량은 529.14입니다.
화학 구조는:
루라시돈 염산염은 흰색에서 거의 흰색의 분말입니다. 물에는 거의 녹지 않고, 0.1 N HCl에서는 사실상 또는 전혀 녹지 않으며, 에탄올에는 약간 녹고, 메탄올에는 약간 녹고, 톨루엔에는 사실상 또는 전혀 녹지 않고, 아세톤에는 매우 약간 녹습니다.
LATUDA 정제는 구강 투여용으로만 설계되었습니다. 각 정제에는 20mg, 40mg, 60mg, 80mg 또는 120mg의 루라시돈 염산염이 포함되어 있습니다.
불활성 성분으로는 만니톨, 전분전월화 전분, 크로스카르멜로스 나트륨, 하이프로멜로스, 마그네슘 스테아레이트, Opadry® 및 카르나우바 왁스가 있습니다. 또한, 80mg 정제에는 노랑색 산화철 및 FD&C Blue No. 2 알루미늄 호수가 포함되어 있습니다.
12 임상 약리학
12.1 작용 기전
루라시돈의 조현병 및 양극성 우울증 치료에서의 작용 기전은 명확하지 않습니다. 그러나 조현병 및 양극성 우울증에서의 효능은 중추 도파민 D2 및 세로토닌 2형(5HT2A) 수용체 길항 작용의 조합을 통해 매개될 수 있습니다.
12.2 약력학
루라시돈은 도파민 D2 수용체(Ki 1nM), 세로토닌 5-HT2A(Ki 0.5nM) 및 5-HT7(Ki 0.5nM) 수용체에 높은 친화력으로 결합하는 길항제입니다. 또한 인간 α2C 아드레날린 수용체(Ki 11nM)에 중간 정도의 친화력으로 결합하며, 세로토닌 5-HT1A(Ki 6.4nM) 수용체의 부분적 작용제이며, α2A 아드레날린 수용체(Ki 41nM)의 길항제입니다. 루라시돈은 히스타민 H1 및 무스카린 M1 수용체(IC50 > 1,000nM)에 대한 친화력이 거의 없거나 전혀 없습니다.
ECG 변화
LATUDA의 QTc 간격에 대한 영향은 조현병 또는 조현병적 장애가 있는 43명의 환자를 대상으로 한 무작위 배정, 이중 맹검, 다중 용량, 병행 전용 심층 QT 연구에서 평가되었으며, 이 환자들은 LATUDA를 1일 120mg, 1일 600mg으로 투여받았고 연구를 완료했습니다. 개별 보정 방법(QTcI)을 기반으로 한 기준선 조정된 QTc 간격의 최대 평균(상한 1측, 95% CI) 증가는 120mg 용량군에서 7.5(11.7)ms, 600mg 용량군에서 4.6(9.5)ms였으며, 투약 후 2~4시간에 관찰되었습니다. 이 연구에서 명확한 용량(노출)-반응 관계는 없었습니다.
조현병 및 양극성 우울증에 대한 단기간 위약 대조 연구에서 LATUDA 또는 위약으로 치료받은 환자에서 기준선 이후 500msec를 초과하는 QT 연장은 보고되지 않았습니다.
12.3 약동학
성인
LATUDA의 활성은 주로 모 약물에 의해 나타납니다. LATUDA의 약동학은 총 일일 용량 범위 20mg~160mg에서 용량 비례적입니다. LATUDA의 정상 상태 농도는 LATUDA 투여를 시작한 후 7일 이내에 도달합니다.
LATUDA 40mg을 투여한 후 평균(%CV) 제거 반감기는 18(7)시간이었습니다.
흡수 및 분포: LATUDA는 흡수되어 약 1~3시간 후에 최고 혈청 농도에 도달합니다. 투여된 용량의 9~19%가 흡수되는 것으로 추정됩니다. LATUDA 40mg을 투여한 후 평균(%CV) 명백한 분포 용적은 6173(17.2)L였습니다. LATUDA는 혈청 단백질에 매우 높게 결합합니다(~99%).
식품 효과 연구에서 LATUDA의 평균 Cmax 및 AUC는 금식 상태에서 관찰된 수치에 비해 식사와 함께 투여했을 때 각각 약 3배 및 2배였습니다. LATUDA 노출은 식사 크기가 350칼로리에서 1000칼로리로 증가함에 따라 영향을 받지 않았으며, 식사 지방 함량과는 무관했습니다. [참조 용량 및 투여 방법 (2.3)].
LATUDA의 안전성 및 효능을 확립한 임상 연구에서 환자는 식사와 함께 매일 용량을 복용하도록 지시받았습니다. [참조 용량 및 투여 방법 (2.3)].
대사 및 배설: LATUDA는 주로 CYP3A4를 통해 대사됩니다. 주요 생체 변환 경로는 산화적 N-탈알킬화, 노르보르난 고리의 수산화 및 S-산화입니다. LATUDA는 두 가지 활성 대사체(ID-14283 및 ID-14326)와 두 가지 주요 비활성 대사체(ID-20219 및 ID-20220)로 대사됩니다. in vitro 연구에 따르면 LATUDA는 CYP1A1, CYP1A2, CYP2A6, CYP4A11, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 또는 CYP2E1 효소의 기질이 아닙니다. LATUDA는 CYP1A2의 기질이 아니므로 흡연은 LATUDA의 약동학에 영향을 미치지 않을 것으로 예상됩니다.
수송 단백질: In vitro 연구에 따르면 LATUDA는 OATP1B1 또는 OATP1B3의 기질이 아니지만, P-gp 및 BCRP의 기질일 가능성이 높습니다. In vitro 연구에 따르면 LATUDA는 임상적으로 관련된 농도에서 수송체 OATP1B1, OATP1B3, OCT1, OCT2, OAT1, OAT3, MATE1, MATE2-K 및 BSEP을 억제하지 않을 것으로 예상됩니다. LATUDA는 P-gp의 임상적으로 유의미한 억제제가 아닙니다. 그러나 BCRP를 억제할 수 있습니다.
[14C]-표지된 LATUDA를 단일 용량 투여한 후 소변과 대변에서 방사능의 총 배설량은 약 89%였으며, 대변에서 약 80%, 소변에서 약 9%가 회수되었습니다.
LATUDA 40mg을 투여한 후 평균(%CV) 명백한 청소율은 3902(18.0)mL/min이었습니다.
약물 상호 작용 연구
다른 약물이 루라시돈의 노출에 미치는 영향은 그림 1에 요약되어 있습니다. 모집단 PK 분석 결과, 최대 6주 동안 루라시돈과 함께 리튬 300~2400mg/일 또는 발프로산 300~2000mg/일을 병용 투여하면 루라시돈 노출에 미치는 영향이 최소화되는 것으로 나타났습니다.
LATUDA가 다른 약물의 노출에 미치는 영향은 그림 2에 요약되어 있습니다. 모집단 PK 분석 결과, 리튬 300~2400mg/일 또는 발프로산 300~2000mg/일과 병용 투여할 때 LATUDA를 병용 투여하면 리튬 및 발프로산 노출에 미치는 영향이 최소화되는 것으로 나타났습니다.
13. 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성: 루라시돈은 30, 100, 300 또는 650 mg/kg/일의 경구 투여량으로 투여된 암컷 마우스에서 유방암 및 뇌하수체 선종의 발생률을 증가시켰습니다. 가장 낮은 투여량은 160 mg/일의 MRHD를 투여받은 사람의 혈장 수준(AUC)과 거의 동일한 혈장 수준을 생성했습니다. 가장 높은 투여량까지 수컷 마우스에서 종양 증가는 관찰되지 않았으며, 이는 160 mg/일의 MRHD를 투여받은 사람의 혈장 수준의 14배에 해당하는 혈장 수준(AUC)을 생성했습니다.
루라시돈은 12 및 36 mg/kg/일의 경구 투여량으로 투여된 암컷 랫트에서 유방암의 발생률을 증가시켰습니다. 가장 낮은 투여량인 3 mg/kg/일은 160 mg/일의 MRHD를 투여받은 사람의 혈장 수준(AUC)의 0.4배에 해당하는 혈장 수준을 생성하는 무효 투여량입니다. 가장 높은 투여량까지 수컷 랫트에서 종양 증가는 관찰되지 않았으며, 이는 160 mg/일의 MRHD를 투여받은 사람의 혈장 수준의 6배에 해당하는 혈장 수준(AUC)을 생성했습니다.
항정신병 약물의 만성 투여 후 설치류의 유방 및 뇌하수체에서 증식성 및/또는 신생물성 변화가 관찰되었으며, 이는 프로락틴 매개로 여겨집니다 [경고 및 주의 사항 (5.7) 참조].
돌연변이 유발성: 루라시돈은 시험관 내 및 생체 내 시험 배터리에서 시험했을 때 돌연변이 또는 염색체 이상을 유발하지 않았습니다. 루라시돈은 에임스 유전자 돌연변이 시험, 중국 햄스터 폐(CHL) 세포 및 생체 내 마우스 골수 미세핵 시험에서 2000 mg/kg까지 음성이었으며, 이는 mg/m2 체표면적 기준으로 160 mg/일의 MRHD의 61배입니다.
생식능력 저해: 교미 전 15일, 교미 기간 동안, 그리고 임신 7일까지 1.5, 15 및 150 mg/kg/일의 루라시돈을 경구 투여한 랫트에서 발정 주기 불규칙성이 관찰되었습니다. mg/m2 기준으로 160 mg/일의 MRHD의 약 0.006배인 0.1 mg/kg의 가장 낮은 투여량에서는 효과가 관찰되지 않았습니다. 생식력은 가장 높은 투여량에서만 감소했으며, 이는 약물 투여 중단 후 14일 후에 회복되었습니다. 생식력 감소에 대한 무효 투여량은 mg/m2 기준으로 MRHD와 거의 동일했습니다.
루라시돈은 교미 전 64일 동안, 그리고 교미 기간 동안 mg/m2 기준으로 MRHD의 9배까지의 투여량으로 경구 투여한 수컷 랫트의 생식력에 영향을 미치지 않았습니다.
14건의 임상 연구
14.1 조현병
성인
LATUDA의 조현병 치료 효능은 DSM-IV 조현병 기준을 충족하는 성인 환자(평균 연령 38.4세, 범위 18-72세)를 대상으로 한 5건의 단기(6주) 위약 대조 연구에서 입증되었습니다. 두 연구에는 활성 대조군(올란자핀 또는 퀘티아핀 서방형)이 포함되어 분석 민감도를 평가했습니다.
이러한 연구에서는 정신과적 징후 및 증상을 평가하기 위해 여러 도구를 사용했습니다.
- 양성 및 음성 증후군 척도(PANSS)는 조현병의 약물 치료 효과를 평가하는 데 사용되는 일반적인 정신 병리학의 다중 항목 목록입니다. PANSS 총점은 30에서 210까지 가능합니다.
- 간략한 정신과 평가 척도 유도(BPRSd)는 PANSS에서 유도되었으며, PANSS가 조현병의 양성, 음성 및 기타 증상을 광범위하게 포함하는 반면, 주로 조현병의 양성 증상에 중점을 둔 다중 항목 목록입니다. BPRSd는 1(없음)에서 7(심각함)까지의 척도로 평가된 18개 항목으로 구성됩니다. BPRSd 점수는 18에서 126까지 가능합니다.
- 임상적 전반적 인상 심각도 척도(CGI-S)는 임상의가 평가하는 척도로, 1점에서 7점까지의 척도로 대상의 현재 질병 상태를 측정합니다.
각 도구와 관련된 종점은 6주차 말까지 총점의 기준선에서의 변화입니다. 이러한 변화는 그 후 약물 및 대조군에 대한 위약 변화와 비교됩니다.
연구 결과는 다음과 같습니다.
- 연구 1: LATUDA의 두 가지 고정 용량(40 또는 120mg/일)을 포함하는 6주 위약 대조 시험(N=145)에서, 종점에서 LATUDA의 두 용량 모두 위약보다 BPRSd 총점 및 CGI-S에서 우수했습니다.
- 연구 2: LATUDA의 고정 용량(80mg/일)을 포함하는 6주 위약 대조 시험(N=180)에서, 종점에서 LATUDA는 위약보다 BPRSd 총점 및 CGI-S에서 우수했습니다.
- 연구 3: LATUDA의 두 가지 고정 용량(40 또는 120mg/일)과 활성 대조군(올란자핀)을 포함하는 6주 위약 및 활성 대조 시험(N=473)에서, 종점에서 LATUDA의 두 용량과 활성 대조군 모두 위약보다 PANSS 총점 및 CGI-S에서 우수했습니다.
- 연구 4: LATUDA의 세 가지 고정 용량(40, 80 또는 120mg/일)을 포함하는 6주 위약 대조 시험(N=489)에서, 종점에서 LATUDA의 80mg/일 용량만 위약보다 PANSS 총점 및 CGI-S에서 우수했습니다.
- 연구 5: LATUDA의 두 가지 고정 용량(80 또는 160mg/일)과 활성 대조군(퀘티아핀 서방형)을 포함하는 6주 위약 및 활성 대조 시험(N=482)에서, 종점에서 LATUDA의 두 용량과 활성 대조군 모두 위약보다 PANSS 총점 및 CGI-S에서 우수했습니다.
따라서 40, 80, 120 및 160mg/일 용량에서 LATUDA의 효능이 입증되었습니다(표 35).
|
SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 신뢰 구간, 다중 비교에 대한 조정 없음. |
||||
|
a 기준선에서의 최소 제곱 평균 변화의 차이(약물 마이너스 위약). |
||||
|
b 분석 민감도를 위해 포함됨. |
||||
|
* 위약보다 통계적으로 유의하게 우수한 용량. |
||||
| 연구 | 치료군 | 주요 효능 측정: BPRSd | ||
| 평균 기준선 점수(SD) | 기준선에서의 LS 평균 변화(SE) | 위약 차감 차이a (95% CI) |
||
| 1
|
LATUDA (40mg/일)* | 54.2 (8.8) | -9.4 (1.6) | -5.6 (-9.8, -1.4) |
| LATUDA (120mg/일)* | 52.7 (7.6) | -11.0 (1.6) | -6.7 (-11.0, -2.5) | |
| 위약 | 54.7 (8.1) | -3.8 (1.6) | – | |
| 2 | LATUDA (80mg/일)* | 55.1 (6.0) | -8.9 (1.3) | -4.7 (-8.3, -1.1) |
| 위약 | 56.1 (6.8) | -4.2 (1.4) | – | |
| 주요 효능 측정: PANSS | ||||
| 3 | LATUDA (40mg/일)* | 96.6 (10.7) | -25.7 (2.0) | -9.7 (-15.3, -4.1) |
| LATUDA (120mg/일)* | 97.9 (11.3) | -23.6 (2.1) | -7.5 (-13.4, -1.7) | |
| 올란자핀 (15 mg/day)*b | 96.3 (12.2) | -28.7 (1.9) | -12.6 (-18.2, -7.9) | |
| 위약 | 95.8 (10.8) | -16.0 (2.1) | – | |
| 4 | LATUDA (40 mg/day) | 96.5 (11.5) | -19.2 (1.7) | -2.1 (-7.0, 2.8) |
| LATUDA (80 mg/day)* | 96.0 (10.8) | -23.4 (1.8) | -6.4 (-11.3, -1.5) | |
| LATUDA (120 mg/day) | 96.0 (9.7) | -20.5 (1.8) | -3.5 (-8.4, 1.4) | |
| 위약 | 96.8 (11.1) | -17.0 (1.8) | – | |
| 5 | LATUDA (80 mg/day)* | 97.7 (9.7) | -22.2 (1.8) | -11.9 (-16.9, -6.9) |
| LATUDA (160 mg/day)* | 97.5 (11.8) | -26.5 (1.8) | -16.2 (-21.2, -11.2) | |
| 퀘티아핀 서방형 (600 mg/day)*b | 97.7 (10.2) | -27.8 (1.8) | -17.5 (-22.5, -12.4) | |
| 위약 | 96.6 (10.2) | -10.3 (1.8) | – | |
나이(65세 이상 환자는 소수였음), 성별 및 인종에 따른 인구 하위 집단 검사 결과 차별적인 반응성에 대한 명확한 증거는 발견되지 않았습니다.
청소년(13-17세)
LATUDA의 효능은 DSM-IV-TR 기준에 따라 조현병으로 진단된 청소년(13~17세)(N=326)을 대상으로 한 6주간의 다기관, 무작위 배정, 이중맹검, 위약 대조 연구에서 확립되었습니다. 환자들은 LATUDA의 두 가지 고정 용량(40 또는 80 mg/day) 또는 위약 중 하나에 무작위 배정되었습니다.
정신과적 징후 및 증상을 평가하는 데 사용된 주요 평가 도구는 PANSS였습니다. 주요 이차 도구는 CGI-S였습니다.
두 용량 그룹 모두에서 LATUDA는 6주차에 PANSS 및 CGI-S 점수 감소에서 위약보다 우수했습니다. 평균적으로 80 mg/day 용량은 40 mg/day 용량에 비해 추가적인 이점을 제공하지 않았습니다.
주요 효능 결과는 표 36에 나와 있습니다.
|
SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 신뢰 구간, 다중 비교에 대한 조정 없음. |
||||
|
a 기준선에서의 최소 제곱 평균 변화의 차이(약물 마이너스 위약). |
||||
|
* 위약보다 통계적으로 유의하게 우수한 용량. |
||||
| 치료 그룹 | 주요 효능 측정: PANSS | |||
| 평균 기준선 점수(SD) | 기준선에서의 LS 평균 변화(SE) | 위약에서 뺀 차이a(95% CI) | ||
| LATUDA (40 mg/day)* | 94.5 (10.97) | -18.6 (1.59) | -8.0 (-12.4, -3.7) | |
| LATUDA (80 mg/day)* | 94.0 (11.12) | -18.3 (1.60) | -7.7 (-12.1, -3.4) | |
| 위약 | 92.8 (11.08) | -10.5 (1.59) | – | |
14.2 조울증 I형 장애와 관련된 우울증 에피소드
단독 요법
LATUDA의 단독 요법으로서의 효능은 DSM-IV-TR 기준에 따라 조울증 I형 장애와 관련된 주요 우울증 에피소드(급속 순환 유무와 관계없이, 정신병적 특징 없음)를 가진 성인 환자(평균 연령 41.5세, 범위 18~74세)를 대상으로 한 6주간의 다기관, 무작위 배정, 이중 맹검, 위약 대조 연구에서 확립되었습니다(N=485). 환자들은 LATUDA의 두 가지 유연한 용량 범위(20~60mg/일 또는 80~120mg/일) 또는 위약 중 하나에 무작위 배정되었습니다.
이 연구에서 우울 증상을 평가하는 데 사용된 주요 평가 도구는 몽고메리-아스베르그 우울증 평가 척도(MADRS)였으며, 이는 임상의가 평가하는 10개 항목으로 구성된 척도로 총 점수는 0(우울증 특징 없음)에서 60(최대 점수)까지입니다. 주요 종료점은 6주차에 MADRS 점수의 기준선 대비 변화였습니다. 주요 이차 도구는 임상적 전반적 인상-조울증-질병 심각도 척도(CGI-BP-S)였으며, 이는 임상의가 평가하는 척도로 7점 척도에서 피험자의 현재 질병 상태를 측정하며, 점수가 높을수록 질병 심각도가 높습니다.
두 용량 그룹 모두에서 LATUDA는 6주차에 MADRS 및 CGI-BP-S 점수 감소에서 위약보다 우수했습니다. 주요 효능 결과는 표 37에 나와 있습니다. 고용량 범위(80~120mg/일)는 저용량 범위(20~60mg/일)에 비해 평균적으로 추가적인 효능을 제공하지 않았습니다.
리튬 또는 발프로산과의 병용 요법
LATUDA의 리튬 또는 발프로산과의 병용 요법으로서의 효능은 DSM-IV-TR 기준에 따라 조울증 I형 장애와 관련된 주요 우울증 에피소드(급속 순환 유무와 관계없이, 정신병적 특징 없음)를 가진 성인 환자(평균 연령 41.7세, 범위 18~72세)를 대상으로 한 6주간의 다기관, 무작위 배정, 이중 맹검, 위약 대조 연구에서 확립되었습니다(N=340). 리튬 또는 발프로산으로 치료 후 증상이 지속된 환자들은 유연하게 용량이 조정된 LATUDA 20~120mg/일 또는 위약에 무작위 배정되었습니다.
이 연구에서 우울 증상을 평가하는 데 사용된 주요 평가 도구는 MADRS였습니다. 주요 종료점은 6주차에 MADRS 점수의 기준선 대비 변화였습니다. 주요 이차 도구는 CGI-BP-S 척도였습니다.
LATUDA는 리튬 또는 발프로산과의 병용 요법으로서 6주차에 MADRS 및 CGI-BP-S 점수 감소에서 위약보다 우수했습니다(표 37).
|
SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 신뢰 구간, 다중 비교에 대한 조정 없음. |
||||
|
a 기준선 대비 최소 제곱 평균 변화의 차이(약물 마이너스 위약). * 치료 그룹이 위약보다 통계적으로 유의하게 우수했습니다. |
||||
| 연구 |
치료 그룹 | 주요 효능 측정: MADRS | ||
| 평균 기준선 점수(SD) | 기준선 대비 LS 평균 변화(SE) | 위약에서 뺀 차이a (95% CI) |
||
| 단독 요법 연구
|
LATUDA (20-60mg/일)* | 30.3 (5.0) | -15.4 (0.8) | -4.6 (-6.9, -2.3) |
| LATUDA (80-120mg/일)* | 30.6 (4.9) | -15.4 (0.8) | -4.6 (-6.9, -2.3) | |
| 위약 | 30.5 (5.0) | -10.7 (0.8) | – | |
| 병용 요법 연구 | LATUDA (20-120mg/일)* + 리튬 또는 발프로산 | 30.6 (5.3) | -17.1 (0.9) | -3.6 (-6.0, -1.1) |
| 위약 + 리튬 또는 발프로산 | 30.8 (4.8) | -13.5 (0.9) | – | |
소아 환자 (10세에서 17세)
LATUDA의 효능은 DSM-5 기준에 따라 양극성 I 장애와 관련된 주요 우울증 에피소드를 가진 소아 환자 (10세에서 17세)를 대상으로 한 6주간의 다기관, 무작위 배정, 이중맹검, 위약 대조 연구에서 확립되었습니다. 이 연구는 빠른 순환 유무와 관계없이 정신병적 특징이 없는 환자를 대상으로 했습니다 (N=343). 환자는 유연하게 투여되는 LATUDA 20~80mg/일 또는 위약에 무작위 배정되었습니다. 임상 연구 종료 시 대부분의 환자 (67%)는 20mg/일 또는 40mg/일을 투여받았습니다.
이 연구에서 우울 증상을 평가하는 데 사용된 주요 평가 척도는 개정된 소아 우울증 평가 척도 (CDRS-R) 총점이었습니다. CDRS-R은 임상의가 평가하는 17개 항목 척도로 총점은 17에서 113까지입니다. 주요 종료점은 6주차에 CDRS-R 점수의 기준선 대비 변화였습니다. 주요 이차 종료점은 CGI-BP-S 우울증 점수의 기준선 대비 변화였습니다.
LATUDA는 6주차에 CDRS-R 총점과 CGI-BP-S 우울증 점수 감소에서 위약보다 우수했습니다. 주요 효능 결과는 표 38에 나와 있습니다.
|
SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 신뢰 구간, 다중 비교에 대한 조정 없음. |
||||
|
a 기준선 대비 최소 제곱 평균 변화의 차이 (약물 마이너스 위약). |
||||
|
* 치료군은 통계적으로 유의하게 위약보다 우수했습니다. |
||||
| 치료군 | 주요 효능 측정: CDRS-R | |||
| 평균 기준선 점수 (SD) | 기준선 대비 LS 평균 변화 (SE) | 위약에서 뺀 차이a (95% CI) |
||
| LATUDA (20~80mg/일)* | 59.2 (8.24) | -21.0 (1.06) | -5.7 (-8.4, -3.0) | |
| 위약 | 58.6 (8.26) | -15.3 (1.08) | – | |
16 공급/보관 및 취급 방법
LATUDA 정제는 흰색~회백색의 원형(20mg 또는 40mg), 흰색~회백색의 장방형(60mg), 연녹색의 타원형(80mg) 또는 흰색~회백색의 타원형(120mg)이며, 함량별로 한쪽 면에 “L20”(20mg), “L40”(40mg), “L80”(80mg) 또는 “L120”(120mg)이라고 새겨져 있습니다. 정제는 다음과 같은 함량 및 포장 구성으로 제공됩니다(표 39).
| 정제 함량 | 포장 구성 | NDC 코드 |
| 20 mg | 30정 병 | 63402-302-30 |
| 90정 병 | 63402-302-90 | |
| 500정 병 | 63402-302-50 | |
| 100정 상자(병원용 단위 투여 포장) 10정 블리스터 카드 10개 |
63402-302-10 상자 63402-302-01 블리스터 |
|
| 40 mg | 30정 병 | 63402-304-30 |
| 90정 병 | 63402-304-90 | |
| 500정 병 | 63402-304-50 | |
| 100정 상자(병원용 단위 투여 포장) 10정 블리스터 카드 10개 |
63402-304-10 상자 63402-304-01 블리스터 |
|
| 60 mg | 30정 병 | 63402-306-30 |
| 90정 병 | 63402-306-90 | |
| 500정 병 | 63402-306-50 | |
| 100정 상자(병원용 단위 투여 포장) 10정 블리스터 카드 10개 |
63402-306-10 상자 63402-306-01 블리스터 |
|
| 80 mg | 30정 병 | 63402-308-30 |
| 90정 병 | 63402-308-90 | |
| 500정 병 | 63402-308-50 | |
| 100정 상자(병원용 단위 투여 포장) 10정 블리스터 카드 10개 |
63402-308-10 상자 63402-308-01 블리스터 |
|
| 120 mg | 30정 병 | 63402-312-30 |
| 90정 병 | 63402-312-90 | |
| 500정 병 | 63402-312-50 | |
| 100정 상자(병원용 단위 투여 포장) 10정 블리스터 카드 10개 |
63402-312-10 상자 63402-312-01 블리스터 |
보관
LATUDA 정제는 25°C(77°F)에서 보관하십시오. 15°~30°C(59°~86°F)까지의 온도 변화는 허용됩니다. [USP Controlled Room Temperature]를 참조하십시오..
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨링(약물 안내)을 읽도록 지시하십시오.
자살 생각 및 행동
환자와 보호자에게 특히 치료 초기에 그리고 용량을 증가 또는 감소시킬 때 자살 경향의 발생 여부를 주시하도록 지시하고, 이러한 증상이 나타나면 의료 서비스 제공자에게 보고하도록 지시하십시오. [경고, 경고 및 주의 사항 (5.2) 참조]
악성 신경 이완제 증후군
환자에게 신경 이완제 악성 증후군(NMS)이라고 하는 잠재적으로 치명적인 부작용에 대해 상담하십시오. 환자, 가족 또는 보호자에게 NMS의 징후와 증상이 나타나면 의료 서비스 제공자에게 연락하거나 응급실에 보고하도록 지시하십시오. [경고 및 주의 사항 (5.4) 참조]
지연성 운동 장애
환자에게 지연성 운동 장애의 징후와 증상에 대해 상담하고, 이러한 비정상적인 움직임이 발생하면 의료 서비스 제공자에게 연락하도록 지시하십시오. [경고 및 주의 사항 (5.5) 참조]
대사 변화
환자에게 대사 변화의 위험, 고혈당 및 당뇨병의 증상을 인식하는 방법, 혈당, 지질 및 체중을 포함한 특정 모니터링의 필요성에 대해 교육하십시오. [see 경고 및 주의 사항 (5.6) 참조]
고프롤락틴혈증
환자에게 LATUDA의 만성 사용과 관련될 수 있는 고프롤락틴혈증의 징후와 증상에 대해 상담하십시오. 다음과 같은 증상이 나타나면 의료 서비스를 받도록 지시하십시오. 여성의 경우 무월경 또는 유즙 분비, 남성의 경우 발기 부전 또는 유방 비대 [경고 및 주의 사항 (5.7) 참조].
백혈구 감소증/호중구 감소증
기존의 낮은 WBC 또는 약물 유발 백혈구 감소증/호중구 감소증의 병력이 있는 환자에게 LATUDA를 복용하는 동안 CBC를 모니터링해야 한다고 알려주십시오. [see 경고 및 주의 사항 (5.8) 참조]
인지 및 운동 기능 저하
환자에게 LATUDA 치료가 자신에게 부정적인 영향을 미치지 않는다고 확신할 때까지 위험한 기계 조작 또는 자동차 운전과 같이 정신적 각성이 필요한 활동을 수행하는 것에 대해 주의를 기울이도록 지시하십시오. [경고 및 주의 사항 (5.12) 참조]
동반 약물
환자에게 약물 상호 작용의 가능성이 있으므로 처방약 또는 일반 의약품을 복용하고 있거나 복용할 계획이 있다면 의사에게 알리도록 지시하십시오. [약물 상호 작용 (7) 참조]
임신
환자에게 LATUDA가 신생아에게 추체외로 증상 및/또는 금단 증상을 유발할 수 있다고 알려주십시오. 환자에게 임신이 확인되거나 의심되는 경우 의료 서비스 제공자에게 알리도록 지시하십시오. [특정 인구 집단에서의 사용 (8.1) 참조] 환자에게 임신 중 LATUDA에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 레지스트리가 있다고 알려주십시오. [특정 인구 집단에서의 사용 (8.1) 참조]
SUNOVION
제조:
Sunovion Pharmaceuticals Inc.
Marlborough, MA 01752 USA
고객 서비스 문의: 1-888-394-7377.
의료 정보 문의: 1-800-739-0565.
의심되는 부작용 보고: 1-877-737-7226.
10092-03
LATUDA는 Sumitomo Pharma Co. Ltd.의 등록 상표입니다.
Sunovion Pharmaceuticals Inc.는 Sumitomo Pharma Co. Ltd.의 미국 자회사입니다.
© 2019 Sunovion Pharmaceuticals Inc.
복약 안내
|
이 의약품 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다. |
개정일: 2022년 5월 |
|
| 의약품 안내서 라투다(루-투-다) (루라시돈 염산염) 정제 |
||
|
라투다에 대해 제가 알아야 할 가장 중요한 정보는 무엇입니까?
|
||
|
|
|
| 라투다란 무엇입니까? 라투다는 다음과 같은 경우에 사용되는 처방약입니다.
|
||
다음과 같은 경우 라투다의 안전성과 효과는 알려져 있지 않습니다.
|
||
다음과 같은 경우 라투다를 복용하지 마십시오.
|
||
라투다를 복용하기 전에 다음을 포함한 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
|
||
| 복용하는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. 여기에는 처방전 및 일반 의약품, 비타민, 허브 보충제가 포함됩니다. LATUDA 및 기타 약물은 서로 영향을 미쳐 심각한 부작용을 일으킬 수 있습니다. LATUDA는 다른 약물의 작용 방식에 영향을 미칠 수 있으며 다른 약물은 LATUDA의 작용 방식에 영향을 미칠 수 있습니다. 의료 서비스 제공자는 다른 약물과 함께 LATUDA를 복용해도 안전한지 알려줄 수 있습니다. 먼저 의료 서비스 제공자와 상담하지 않고 LATUDA로 치료하는 동안 다른 약물 복용을 시작하거나 중단하지 마십시오. 복용하는 약을 알고 있어야 합니다. 새로운 약을 받으면 의료 서비스 제공자와 약사에게 보여줄 수 있도록 복용하는 약 목록을 보관하십시오. |
||
LATUDA는 어떻게 복용해야 합니까?
|
||
|
||
| LATUDA의 가능한 부작용은 무엇입니까? LATUDA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
||
|
|
|
|
||
|
|
|
|
||
|
||
|
|
|
|
||
LATUDA의 가장 흔한 부작용은 다음과 같습니다.
|
||
| 위에 나열된 것 외에도 LATUDA의 부작용이 있을 수 있습니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. 1-800-FDA-1088로 FDA에 부작용을 보고할 수 있습니다. |
||
LATUDA는 어떻게 보관해야 합니까?
|
||
| LATUDA의 안전하고 효과적인 사용에 대한 일반 정보 의약품은 때때로 의약품 가이드에 나열된 것 이외의 목적으로 처방되기도 합니다. 처방된 경우 이외의 경우에는 LATUDA를 사용하지 마십시오. 다른 사람에게 LATUDA를 주지 마십시오. 증상이 같더라도 해로울 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 LATUDA에 대한 정보를 요청할 수 있습니다. |
||
| LATUDA의 성분은 무엇입니까? 활성 성분: lurasidone hydrochloride 비활성 성분: mannitol, pregelatinized starch, croscarmellose sodium, hypromellose, magnesium stearate, Opadry® 및 carnauba wax. 또한 80mg 정제에는 황색 산화철 및 FD&C Blue No. 2 Aluminum Lake가 포함되어 있습니다. 제조: Sunovion Pharmaceuticals Inc. Marlborough, MA 01752 USA LATUDA는 Sumitomo Pharma Co. Ltd.의 등록 상표입니다. Sunovion Pharmaceuticals Inc.는 Sumitomo Pharma Co. Ltd.의 미국 자회사입니다. ©2019 Sunovion Pharmaceuticals Inc. 자세한 내용은 www.LATUDA.com을 방문하거나 1-888-394-7377로 문의하십시오. |
||
주요 표시 패널
포장 라벨 – 주요 표시 패널 – 20 mg, 30 정 라벨
NDC 63402-302-30
30 정
Latuda®
(lurasidone HCl) 정제
20 mg
조제자 주의: Latuda를
조제할 때마다 환자에게 동봉된
약물 안내서를 제공하십시오. www.latuda.com 또는 1-888-394-7377에서도 제공됩니다.
처방전에 의해서만
Sunovion
주요 표시 패널
포장 라벨 – 주요 표시 패널 – 40 mg, 30 정 라벨
NDC 63402-304-30
30 정
Latuda®
(lurasidone HCl) 정제
40 mg
주의: 조제사는 Latuda
를 조제할 때마다 환자에게 동봉된
약물 안내서를 제공해야 합니다. 약물 안내서는
www.latuda.com 또는 1-888-394-7377에서도 제공됩니다.
처방전에 의해서만
Sunovion
주요 표시 패널
포장 라벨 – 주요 표시 패널 – 60 mg, 30 정 라벨
NDC 63402-306-30
30 정
Latuda®
(lurasidone HCl) 정제
60 mg
조제자 주의: Latuda를
조제할 때마다 환자에게 동봉된
의약품 안내서를 제공하십시오. 또한
www.latuda.com 또는 1-888-394-7377에서 확인할 수 있습니다.
처방전에 의해서만
Sunovion
주요 표시면
포장 라벨 – 주요 표시면 – 60mg, 90정 라벨
NDC 63402-306-90
90정
Latuda®
(lurasidone HCl) tablets
60 mg
조제 약사 주의: Latuda를 조제할 때마다 환자에게 www.latuda.com 또는 1-888-394-7377에서 제공되는 동봉된 복약 안내서를 제공하십시오.
Rx Only
Sunovion
주 표시면
포장 라벨 – 주 표시면 – 60 mg, 500정 라벨
NDC 63402-306-50
500정
Latuda®
(lurasidone HCl) 정제
60 mg
조제 약사 주의: Latuda를 조제할 때마다 환자에게 www.latuda.com 또는 1-888-394-7377에서 제공되는 동봉된 복약 안내서를 제공하십시오.
Rx Only
Sunovion
주요 표시면
포장 라벨 – 주요 표시면 – 60 mg 블리스터
NDC 63402-306-07
7정
전문가 샘플
판매 또는 환불 불가
Latuda®
(lurasidone HCl) 정제
정제당 60 mg
Rx only
조제 시 주의사항: 동봉된 복약 안내서를 각 환자에게 제공하십시오.
Sunovion
주요 표시면
포장 라벨 – 주요 표시 패널 – 60 mg 카톤
NDC 63402-306-70
28 정 (4 카드, 각 7 정)
전문가 샘플
판매 또는 환불 불가
Latuda®
(lurasidone HCl) 정제
정제당 60 mg
처방전에 의해서만
조제자 주의: 동봉된 약물 안내서를 각 환자에게 제공하십시오.
Sunovion
주요 표시 패널
패키지 라벨 – 주요 표시 패널 – 60 mg 블리스터
NDC 63402-306-01
10 정
Latuda®
(lurasidone HCl) 정제
60 mg
유효기간: 로트:
Sunovion Pharmaceuticals Inc.
주요 제품 표시면
포장 라벨 – 주요 제품 표시면 – 60mg, HUD 상자
NDC 63402-306-10
100정 (10카드, 카드당 10정)
Latuda®
(lurasidone HCl) 정제
정제당 60mg
조제 약사 주의: Latuda를 조제할 때마다 환자에게 www.latuda.com 또는 1-888-394-7377에서 제공되는 동봉된 복약 안내서를 제공하십시오.
처방전 의약품
Sunovion
주요 표시면
포장 라벨 – 주요 표시면 – 80mg, 30정 라벨
NDC 63402-308-30
30정
Latuda®
(lurasidone HCl) 정제
80 mg
조제 시 주의사항: Latuda
를 조제할 때마다 환자에게 동봉된
복약 안내서를 제공하십시오. 복약 안내서는
www.latuda.com 또는 1-888-394-7377에서도 확인할 수 있습니다.
Rx Only
Sunovion
주요 표시면
포장 라벨 – 주요 표시면 – 120mg, 30정 라벨
NDC 63402-312-30
30정
Latuda®
(lurasidone HCl) 정제
120 mg
조제 약사 주의: Latuda
를 조제할 때마다 환자에게 동봉된
복약 안내서를 제공하십시오. 복약 안내서는
www.latuda.com 또는 1-888-394-7377에서도 확인할 수 있습니다.
처방전 의약품
Sunovion