의약품 제조업체: Boehringer Ingelheim Pharmaceuticals, Inc. (Updated: 2024-10-15)
처방 정보의 주요 내용
JARDIANCE® (엠파글리플로진 정제), 경구용
미국 최초 승인: 2014년
최근 주요 변경 사항
적응증 및 용법
자디앙은 나트륨-포도당 공동수송체 2(SGLT2) 억제제로 다음과 같은 경우에 사용됩니다.
- 심부전 성인 환자에서 심혈관 사망 및 심부전으로 인한 입원 위험 감소 (1)
- 진행 위험이 있는 만성 신장 질환 성인 환자에서 eGFR의 지속적인 감소, 말기 신장 질환, 심혈관 사망 및 입원 위험 감소 (1)
- 제2형 당뇨병과 확립된 심혈관 질환을 가진 성인 환자에서 심혈관 사망 위험 감소 (1)
- 제2형 당뇨병이 있는 성인 및 10세 이상 소아 환자에서 식이 요법 및 운동 요법의 보조제로서 혈당 조절 개선 (1)
사용 제한:
- 제1형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. 이러한 환자에서 당뇨병성 케톤산증의 위험을 증가시킬 수 있습니다. (1)
- eGFR이 30mL/min/1.73m2 미만인 제2형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. (1)
- 다낭성 신장 질환 환자 또는 정맥 주사용 면역억제제 치료를 받고 있거나 최근에 받았거나 신장 질환으로 인해 프레드니손 45mg 이상 또는 이에 상응하는 용량을 투여받은 환자의 만성 신장 질환 치료에는 권장되지 않습니다. 자디앙은 이러한 환자군에서 효과가 없을 것으로 예상됩니다. (1)
용량 및 투여
제형 및 함량
정제: 10mg, 25mg (3)
금기
- 엠파글리플로진 또는 자디앙의 부형제에 과민증이 있는 경우 (4)
경고 및 주의사항
- 제1형 당뇨병 환자의 당뇨병성 케톤산증 및 기타 케톤산증: 제1형 당뇨병 환자의 경우 케톤 모니터링을 고려하고 케톤산증 위험이 있는 다른 환자의 경우 필요에 따라 케톤 모니터링을 고려하십시오. 나타나는 혈당 수치와 관계없이 케톤산증을 평가하고 케톤산증이 의심되는 경우 자디앙 투여를 중단하십시오. 재투여하기 전에 케톤산증이 해결되었는지 환자를 모니터링하십시오. (5.1)
- 수분 고갈: 자디앙 투여를 시작하기 전에 신장 기능이 손상된 환자, 노인 환자 또는 루프 이뇨제를 투여받는 환자의 수분 상태 및 신장 기능을 평가하십시오. 치료 중에 징후와 증상을 모니터링하십시오. (5.2)
- 요로 패혈증 및 신우신염: 요로 감염의 징후와 증상이 있는지 환자를 평가하고 필요한 경우 즉시 치료하십시오. (5.3)
- 저혈당증: 인슐린 분비촉진제 또는 인슐린을 투여받는 성인 환자는 저혈당증 위험이 증가할 수 있습니다. 10세 이상 소아 환자의 경우 인슐린 사용 여부와 관계없이 저혈당증 위험이 더 높았습니다. 자디앙 투여를 시작할 때 저혈당증 위험을 줄이기 위해 인슐린 분비촉진제 또는 인슐린의 용량을 줄이는 것을 고려하십시오. (5.4)
- 회음부 괴사성 근막염(푸르니에 괴저): 여성과 남성 모두에서 심각하고 생명을 위협하는 사례가 발생했습니다. 생식기 또는 회음부 부위의 통증이나 압통, 홍반 또는 부기와 함께 열이나 권태감이 있는 환자를 평가하십시오. 의심되는 경우 즉시 치료를 시작하십시오. (5.5)
- 생식기 진균 감염: 모니터링하고 적절하게 치료하십시오. (5.6)
- 하지 절단: 하지 감염이나 궤양이 있는지 환자를 모니터링하고 적절한 치료를 시작하십시오. (5.7)
- 과민 반응: 자디앙 투여 시 심각한 과민 반응(예: 혈관부종)이 발생했습니다. 과민 반응이 발생하면 자디앙 투여를 중단하고 즉시 치료하고 징후와 증상이 해결될 때까지 모니터링하십시오. (5.8)
이상 반응
가장 흔한 이상 반응(발생률 5% 이상)은 요로 감염 및 여성 생식기 진균 감염이었습니다. (6.1)
의심되는 이상 반응을 보고하려면 베링거인겔하임 Pharmaceuticals, Inc.(1-800-542-6257) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch)에 문의하십시오.
약물 상호 작용
약물 상호 작용 및 자디앙이 실험실 검사에 미치는 영향에 대한 정보는 전체 처방 정보를 참조하십시오. (7)
특정 집단에서의 사용
환자 복약 지도 및 복약 안내서는 17을 참조하십시오.
개정일: 2023년 9월
목차
전문 정보: 목차*
1 적응증 및 사용법
2 투여량 및 투여 방법
2.1 JARDIANCE 투여 시작 전 검사
2.2 권장 용량
2.3 누락된 용량에 대한 권장 사항
2.4 수술을 위한 일시적 중단
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 1형 당뇨병 환자 및 기타 케톤산증 환자의 당뇨병성 케톤산증
5.2 혈액량 감소
5.3 요로 감염 및 신우신염
5.4 저혈당
5.5 회음부 괴사성 근막염 (포르니에 괴저)
5.6 생식기 진균 감염
5.7 하지 절단
5.8 과민 반응
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
10 과량 투여
11 설명
12 임상 약리
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 2형 당뇨병 성인 환자의 혈당 조절 시험
14.2 2형 당뇨병 10세에서 17세 소아 환자의 혈당 조절 시험
14.3 2형 당뇨병 및 죽상 동맥 경화성 심혈관 질환 성인 환자의 심혈관계 결과
14.4 성인 심부전 시험
14.5 성인 만성 신장 질환 시험
16 포장/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
JARDIANCE는 다음과 같은 경우에 사용됩니다.
- 심부전 성인 환자의 심혈관 사망 및 심부전으로 인한 입원 위험 감소
- 만성 신장 질환 진행 위험이 있는 성인 환자의 eGFR 지속적 감소, 말기 신장 질환, 심혈관 사망 및 입원 위험 감소
- 제2형 당뇨병과 확립된 심혈관 질환을 가진 성인의 심혈관 사망 위험 감소
- 제2형 당뇨병이 있는 성인 및 10세 이상 소아 환자의 식이요법 및 운동 요법의 보조제로서 혈당 조절 개선
사용 제한
JARDIANCE는 제1형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. 이러한 환자에서 당뇨병성 케톤산증의 위험을 증가시킬 수 있습니다 [경고 및 주의사항 (5.1) 참조].
JARDIANCE는 eGFR이 30mL/min/1.73m2 미만인 제2형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. JARDIANCE는 작용 기전에 따라 이러한 환경에서 효과적이지 않을 수 있습니다.
JARDIANCE는 다낭성 신장 질환 환자 또는 정맥 주사용 면역억제제 치료를 받고 있거나 최근에 받았거나 신장 질환으로 인해 프레드니손 45mg 이상 또는 이에 상응하는 용량을 투여받은 환자의 만성 신장 질환 치료에는 권장되지 않습니다 [임상 연구 (14.5) 참조]. JARDIANCE는 이러한 환자군에서 효과적이지 않을 것으로 예상됩니다.
2 투여 및 관리
2.1 JARDIANCE 투여 전 검사
- JARDIANCE 투여 전 및 임상적으로 필요한 경우 신장 기능을 평가하십시오 [경고 및 주의 사항 (5.2) 참조].
- eGFR이 30 mL/min/1.73 m2 미만인 환자의 경우 혈당 조절을 위한 사용은 권장되지 않습니다 [특정 환자군에서의 사용 (8.6) 참조].
- 체액 상태를 평가하십시오. 체액 부족 환자의 경우 JARDIANCE 투여 전에 이 상태를 교정하십시오 [경고 및 주의 사항 (5.2) 및 특정 환자군에서의 사용 (8.5), 8.6) 참조].
2.2 권장 용량
표 1은 성인 및 10세 이상 소아 환자에서 JARDIANCE의 권장 용량을 나타냅니다.
| 인구 집단 | 적응증 | 권장 용량 |
|---|---|---|
| 성인 | 심부전 환자에서 심혈관 사망 및 입원 위험 감소 |
|
| 진행 위험이 있는 만성 신장 질환 성인에서 eGFR의 지속적인 감소, 말기 신장 질환, 심혈관 사망 및 입원 위험 감소 | ||
| 확립된 심혈관 질환이 있는 2형 당뇨병 환자에서 심혈관 사망 위험 감소 | ||
| 2형 당뇨병에서 혈당 조절 |
|
|
| 10세 이상 소아 환자 | 2형 당뇨병에서 혈당 조절 |
|
2.4 수술을 위한 일시적인 중단
가능한 경우, 주요 수술 또는 장기간 금식과 관련된 절차 전에 최소 3일 동안 JARDIANCE를 중단하십시오. 환자가 임상적으로 안정되고 경구 섭취를 재개하면 JARDIANCE를 재개하십시오 [경고 및 주의 사항 (5.1) 및 임상 약리학 (12.2) 참조].
3 제형 및 함량
JARDIANCE 정제는 다음과 같이 제공됩니다.
- 10 mg 연한 노란색, 원형, 양면 볼록 및 베벨 가장자리, 필름 코팅 정제로 한쪽 면에는 “S 10″이, 다른 쪽 면에는 베링거 인겔하임 회사 심볼이 새겨져 있습니다.
- 25 mg 연한 노란색, 타원형, 양면 볼록, 필름 코팅 정제로 한쪽 면에는 “S 25″가, 다른 쪽 면에는 베링거 인겔하임 회사 심볼이 새겨져 있습니다.
4 금기사항
JARDIANCE는 다음 환자에게 금기입니다.
- 엠파글리플로진 또는 JARDIANCE의 첨가제에 과민증이 있는 환자, 혈관 부종과 같은 반응이 발생했습니다 [경고 및 주의 사항 (5.8) 참조].
5 경고 및 주의사항
5.1 1형 당뇨병 환자 및 기타 케톤산증 환자에서의 당뇨병성 케톤산증
1형 당뇨병 환자에서 JARDIANCE는 기저 발생률을 넘어 생명을 위협하는 사건인 당뇨병성 케톤산증의 위험을 현저히 증가시킵니다. 1형 당뇨병 환자를 대상으로 한 위약 대조 시험에서 케톤산증의 위험은 소듐-글루코스 공동 수송체 2(SGLT2) 억제제를 투여받은 환자에서 위약을 투여받은 환자에 비해 현저히 증가했으며, JARDIANCE와 관련하여 치명적인 케톤산증이 발생했습니다. JARDIANCE는 1형 당뇨병 환자의 혈당 조절에 적응증이 없습니다.
2형 당뇨병 및 췌장 장애(예: 췌장염 병력 또는 췌장 수술)도 케톤산증의 위험 요소입니다. JARDIANCE를 포함한 SGLT2 억제제를 사용하는 2형 당뇨병 환자에서 케톤산증으로 인한 치명적인 사건이 시판 후 보고되었습니다.
당뇨병성 케톤산증 또는 기타 케톤산증의 촉발 요인으로는 인슐린 용량 감소 또는 인슐린 용량 누락으로 인한 인슐린 저하, 급성 발열 질환, 칼로리 섭취 감소, 케토제닉 식단, 수술, 혈액량 감소 및 알코올 남용이 있습니다.
징후 및 증상은 탈수 및 심각한 대사성 산증과 일치하며, 메스꺼움, 구토, 복통, 전신 권태감 및 호흡 곤란이 포함됩니다. 발병 시 혈당 수치는 일반적으로 당뇨병성 케톤산증에서 예상되는 수치보다 낮을 수 있습니다(예: 250mg/dL 미만). 케톤산증 및 당뇨는 일반적으로 예상되는 것보다 더 오래 지속될 수 있습니다. JARDIANCE를 중단한 후 3일 동안 요당 배설이 지속됩니다. [임상 약리학(12.2) 참조]; 그러나 SGLT2 억제제 중단 후 6일 이상, 일부는 최대 2주까지 케톤산증 및/또는 당뇨가 지속되었다는 시판 후 보고가 있습니다.
1형 당뇨병 환자의 경우 케톤 모니터링을 고려하고, 임상 상황에 따라 케톤산증 위험이 있는 다른 환자의 경우 케톤 모니터링을 고려하십시오. 심각한 대사성 산증과 일치하는 징후 및 증상이 있는 환자의 경우 발병 시 혈당 수치에 관계없이 케톤산증을 평가하십시오. 케톤산증이 의심되는 경우 JARDIANCE를 중단하고, 즉시 평가하고, 확인되면 케톤산증을 치료하십시오. JARDIANCE를 재개하기 전에 케톤산증이 해소되었는지 모니터링하십시오.
가능한 경우, 환자를 케톤산증에 취약하게 할 수 있는 일시적인 임상 상황에서는 JARDIANCE를 중단하십시오. 환자가 임상적으로 안정되고 경구 섭취를 재개하면 JARDIANCE를 재개하십시오. [투약 및 투여(2.4) 참조].
모든 환자에게 케톤산증의 징후 및 증상에 대해 교육하고, 징후 및 증상이 나타나면 JARDIANCE를 중단하고 즉시 의료 서비스를 받도록 지시하십시오.
5.2 혈액량 감소
JARDIANCE는 때때로 증상성 저혈압 또는 크레아티닌의 급성 일시적 변화로 나타날 수 있는 혈관 내 혈액량 감소를 유발할 수 있습니다. [부작용(6.1) 참조]. JARDIANCE를 포함한 SGLT2 억제제를 투여받은 2형 당뇨병 환자에서 입원 및 투석이 필요한 경우도 있는 급성 신장 손상이 시판 후 보고되었습니다. 신장 기능이 저하된 환자(eGFR 60mL/min/1.73m2 미만), 노인 환자 또는 루프 이뇨제를 복용하는 환자는 혈액량 감소 또는 저혈압의 위험이 높을 수 있습니다. 이러한 특징 중 하나 이상이 있는 환자에게 JARDIANCE를 시작하기 전에 혈액량 상태 및 신장 기능을 평가하십시오. 혈액량 감소가 있는 환자의 경우 JARDIANCE를 시작하기 전에 이 상태를 교정하십시오. 치료를 시작한 후 혈액량 감소 및 신장 기능의 징후 및 증상을 모니터링하십시오.
5.3 요로 감염 및 신우신염
JARDIANCE를 투여받은 환자에서 입원이 필요한 요로 감염(요로 감염 및 신우신염 포함)이 심각하게 발생했다는 보고가 있습니다. JARDIANCE로 치료하면 요로 감염의 위험이 증가합니다. 환자의 요로 감염 징후 및 증상을 평가하고 필요한 경우 즉시 치료하십시오. [부작용(6) 참조].
5.4 저혈당
인슐린 및 인슐린 분비 촉진제는 저혈당을 유발하는 것으로 알려져 있습니다. 성인 환자의 경우 JARDIANCE를 인슐린 분비 촉진제(예: 설폰요소) 또는 인슐린과 함께 사용하면 저혈당의 위험이 증가할 수 있습니다. 10세 이상의 소아 환자의 경우 인슐린 사용 여부에 관계없이 JARDIANCE를 사용하면 저혈당의 위험이 더 높았습니다. [부작용(6.1) 참조].
설폰요소(또는 동시에 투여되는 다른 인슐린 분비 촉진제) 또는 인슐린의 용량을 줄이면 저혈당의 위험을 낮출 수 있습니다. 이러한 동반 약물을 사용하는 환자 및 소아 환자에게 저혈당의 위험을 알리고 저혈당의 징후 및 증상에 대해 교육하십시오.
5.5 회음부 괴사성 근막염(포르니에 괴사)
JARDIANCE를 포함한 SGLT2 억제제를 투여받은 당뇨병 환자에서 긴급한 외과적 개입이 필요한 드물지만 심각하고 생명을 위협하는 괴사성 감염인 회음부 괴사성 근막염(포르니에 괴사)이 보고되었습니다. 여성과 남성 모두에서 사례가 보고되었습니다. 심각한 결과로는 입원, 여러 번의 수술 및 사망이 포함됩니다.
JARDIANCE로 치료받는 환자에서 생식기 또는 회음부의 통증 또는 압통, 발적 또는 부종과 함께 발열 또는 권태감이 나타나면 괴사성 근막염을 평가해야 합니다. 의심되는 경우 광범위 항생제로 즉시 치료를 시작하고 필요한 경우 수술적 절개술을 시행합니다. JARDIANCE를 중단하고 혈당 수치를 면밀히 모니터링하며 혈당 조절을 위한 적절한 대체 요법을 제공합니다.
5.6 생식기 진균 감염
JARDIANCE는 생식기 진균 감염의 위험을 증가시킵니다 [부작용 (6.1) 참조]. 만성 또는 재발성 생식기 진균 감염의 병력이 있는 환자는 생식기 진균 감염이 발생할 가능성이 더 높았습니다. 적절히 모니터링하고 치료합니다.
5.7 하지 절단
SGLT2 억제제를 사용한 일부 임상 연구에서 하지 절단 발생률의 불균형이 관찰되었습니다. 4개의 JARDIANCE 결과 시험에서 하지 절단 사건 발생률은 위약군과 JARDIANCE 10mg 또는 25mg 투여군에서 각각 1,000 환자-년당 4.3건과 5.0건이었으며, HR은 1.05(95% CI) (0.81, 1.36)였습니다.
만성 신장 질환 환자를 대상으로 한 장기 심혈관-신장 결과 시험 [임상 연구 14.5 참조]에서 하지 절단 발생률은 위약군과 JARDIANCE 10mg 치료군에서 각각 1,000 환자-년당 2.9건과 4.3건으로 보고되었습니다. 발가락과 중족골 절단이 가장 흔했으며(하지 절단이 발생한 JARDIANCE 10mg 치료 환자 28명 중 21명), 무릎 위와 아래를 포함한 일부 절단이 있었습니다. 일부 환자는 여러 번 절단을 받았습니다.
말초 동맥 질환과 당뇨병성 발 감염(골수염 포함)은 절단이 필요한 가장 흔한 촉발 의학적 사건이었습니다. 절단 위험은 기저 당뇨병성 발, 말초 동맥 질환(이전 절단 포함) 또는 당뇨병 병력이 있는 환자에서 가장 높았습니다.
환자에게 정기적인 예방적 발 관리의 중요성을 알려줍니다. JARDIANCE를 투여받는 환자에서 당뇨병성 발 감염(골수염 포함), 새로운 통증 또는 압통, 하지를 포함한 궤양 또는 궤양의 징후와 증상을 모니터링하고 적절한 치료를 시행합니다.
5.8 과민 반응
JARDIANCE로 치료받는 환자에서 시판 후 심각한 과민 반응(예: 안지오에데마)이 보고되었습니다. 과민 반응이 발생하면 JARDIANCE를 중단하고 표준 치료에 따라 즉시 치료하고 징후와 증상이 해소될 때까지 모니터링합니다. JARDIANCE는 empagliflozin 또는 JARDIANCE의 첨가제에 대한 과민 반응이 있는 환자에게 금기입니다 [금기 사항 (4) 참조].
6 부작용
다음 중요한 유해 반응은 아래 및 라벨링의 다른 부분에서 설명됩니다.
- 1형 당뇨병 환자 및 기타 케톤산증 환자의 당뇨병성 케톤산증 [경고 및 주의 사항 (5.1) 참조]
- 용량 감소 [경고 및 주의 사항 (5.2) 참조]
- 요로 감염 및 신우신염 [경고 및 주의 사항 (5.3) 참조]
- 저혈당증 [경고 및 주의 사항 (5.4) 참조]
- 회음부 괴사성 근막염 (포르니에 괴저) [경고 및 주의 사항 (5.5) 참조]
- 생식기 진균 감염 [경고 및 주의 사항 (5.6) 참조]
- 과민 반응 [경고 및 주의 사항 (5.8) 참조]
6.1 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
JARDIANCE는 2형 당뇨병 성인 및 10세에서 17세 사이의 소아 환자, 심부전 성인 및 만성 신장 질환 성인을 대상으로 한 임상 시험에서 평가되었습니다. JARDIANCE의 전반적인 안전성 프로파일은 연구된 적응증 전반에 걸쳐 일반적으로 일관되었습니다.
2형 당뇨병 성인 대상 임상 시험
표 2의 데이터는 2형 당뇨병 성인 환자를 대상으로 한 4건의 24주 위약 대조 임상 시험과 인슐린을 사용한 위약 대조 임상 시험의 18주 데이터에서 얻은 것입니다. JARDIANCE는 한 건의 임상 시험에서 단독 요법으로 사용되었고, 4건의 임상 시험에서 병용 요법으로 사용되었습니다. [임상 연구 (14.1) 참조].
이러한 데이터는 JARDIANCE에 노출된 1,976명의 성인 환자를 반영하며, 평균 노출 기간은 약 23주입니다. 환자는 위약 (N=995), JARDIANCE 10mg (N=999) 또는 JARDIANCE 25mg (N=977)을 1일 1회 투여 받았습니다. 인구의 평균 연령은 56세였으며, 3%가 75세 이상이었습니다. 인구의 절반 이상 (55%)이 남성이었고, 46%가 백인, 50%가 아시아인, 3%가 흑인 또는 아프리카계 미국인이었습니다. 기준선에서 인구의 57%가 5년 이상 당뇨병을 앓았으며, 평균 헤모글로빈 A1c (HbA1c)는 8%였습니다. 기준선에서 당뇨병의 확립된 미세 혈관 합병증에는 당뇨병성 신증 (7%), 망막증 (8%) 또는 신경병증 (16%)이 포함되었습니다. 기준선 신장 기능은 환자의 91%에서 정상 또는 경도로 손상되었고, 9%에서 중등도로 손상되었습니다 (평균 eGFR 86.8 mL/min/1.73 m2).
표 2는 기준선에 존재하지 않았고, JARDIANCE 치료 환자에서 위약보다 더 흔하게 발생했으며, JARDIANCE 치료 환자의 2% 이상에서 발생한 유해 반응 (저혈당증 제외)을 보여줍니다.
| 유해 반응 | 위약 (%) N=995 |
JARDIANCE 10mg (%) N=999 |
JARDIANCE 25mg (%) N=977 |
|---|---|---|---|
| a사전 정의된 유해 사건 그룹화, 요로 감염, 무증상 세균뇨, 방광염 등을 포함하지만 이에 국한되지 않음 b여성 생식기 진균 감염은 다음과 같은 유해 반응을 포함합니다. 외음 질 진균 감염, 질 감염, 외음염, 외음 질 칸디다증, 생식기 감염, 생식기 칸디다증, 생식기 감염 진균, 비뇨 생식기 감염, 외음 질염, 자궁 경부염, 비뇨 생식기 감염 진균, 질염 박테리아. 각 그룹의 여성 피험자 수를 분모로 계산한 백분율: 위약 (N=481), JARDIANCE 10mg (N=443), JARDIANCE 25mg (N=420). c사전 정의된 유해 사건 그룹화, 다뇨증, 빈뇨증 및 야뇨증 등을 포함하지만 이에 국한되지 않음 d남성 생식기 진균 감염은 다음과 같은 유해 반응을 포함합니다. 포경염, 귀두염, 생식기 감염 진균, 비뇨 생식기 감염, 칸디다 귀두염, 음낭 농양, 음경 감염. 각 그룹의 남성 피험자 수를 분모로 계산한 백분율: 위약 (N=514), JARDIANCE 10mg (N=556), JARDIANCE 25mg (N=557). |
|||
| 요로 감염a | 7.6 | 9.3 | 7.6 |
| 여성 생식기 진균 감염b | 1.5 | 5.4 | 6.4 |
| 상기도 감염 | 3.8 | 3.1 | 4.0 |
| 빈뇨증c | 1.0 | 3.4 | 3.2 |
| 이상지질혈증 | 3.4 | 3.9 | 2.9 |
| 관절통 | 2.2 | 2.4 | 2.3 |
| 남성 생식기 진균 감염d | 0.4 | 3.1 | 1.6 |
| 메스꺼움 | 1.4 | 2.3 | 1.1 |
갈증(다갈증 포함)은 위약군에서 0%, JARDIANCE 10mg에서 1.7%, JARDIANCE 25mg에서 1.5%로 보고되었습니다.
용량 감소
JARDIANCE는 삼투성 이뇨 작용을 일으켜 혈관 내 용량 감소 및 용량 감소와 관련된 이상 반응을 유발할 수 있습니다. 성인 대상 5건의 위약 대조 임상 시험에서 용량 감소와 관련된 이상 반응(예: 혈압(외래) 감소, 수축기 혈압 감소, 탈수, 저혈압, 저혈량증, 기립성 저혈압, 실신)은 위약군에서 0.3%, JARDIANCE 10mg에서 0.5%, JARDIANCE 25mg에서 0.3%의 환자에게 보고되었습니다. JARDIANCE는 용량 감소 위험이 있는 환자에서 저혈압 위험을 증가시킬 수 있습니다. [특정 환자군에서의 사용(8.5, 8.6) 참조].
배뇨 증가
성인 대상 5건의 위약 대조 임상 시험에서 배뇨 증가(예: 다뇨증, 빈뇨증, 야뇨증)와 관련된 이상 반응은 JARDIANCE에서 위약군보다 더 빈번하게 발생했습니다(표 2 참조). 특히 야뇨증은 위약군에서 0.4%, JARDIANCE 10mg에서 0.3%, JARDIANCE 25mg에서 0.8%의 환자에게 보고되었습니다.
2형 당뇨병 성인의 혈당 조절을 위한 임상 시험에서의 저혈당
임상 시험별 성인의 저혈당 발생률은 표 3에 나와 있습니다. JARDIANCE를 인슐린 또는 설폰요소제와 함께 투여했을 때 저혈당 발생률이 증가했습니다.
| a전체 저혈당 사건: 혈장 또는 모세혈관 포도당이 70mg/dL 이하 b중증 저혈당 사건: 혈당에 관계없이 도움이 필요한 경우 c치료 집단(시험 약물을 최소한 1회 이상 투여받은 환자) d초기 18주 치료 기간 동안 인슐린 용량을 조정할 수 없었습니다. |
|||
| 단독 요법(24주) | 위약 (n=229) |
JARDIANCE 10mg (n=224) | JARDIANCE 25mg (n=223) |
| 전체 (%) | 0.4 | 0.4 | 0.4 |
| 중증 (%) | 0 | 0 | 0 |
| 메트포르민 병용 요법(24주) | 위약 + 메트포르민 (n=206) |
JARDIANCE 10mg + 메트포르민 (n=217) |
JARDIANCE 25mg + 메트포르민 (n=214) |
| 전체 (%) | 0.5 | 1.8 | 1.4 |
| 중증 (%) | 0 | 0 | 0 |
| 메트포르민 + 설폰요소제 병용 요법 (24주) |
위약 (n=225) | JARDIANCE 10mg + 메트포르민 + 설폰요소제 (n=224) | JARDIANCE 25mg + 메트포르민 + 설폰요소제 (n=217) |
| 전체 (%) | 8.4 | 16.1 | 11.5 |
| 중증 (%) | 0 | 0 | 0 |
| 피오글리타존 +/- 메트포르민 병용 요법 (24주) |
위약 (n=165) | JARDIANCE 10mg + 피오글리타존 +/- 메트포르민 (n=165) |
JARDIANCE 25mg + 피오글리타존 +/- 메트포르민 (n=168) |
| 전체 (%) | 1.8 | 1.2 | 2.4 |
| 중증 (%) | 0 | 0 | 0 |
| 기저 인슐린 +/- 메트포르민 병용 요법 (18주d) |
위약 (n=170) | JARDIANCE 10mg (n=169) |
JARDIANCE 25mg (n=155) |
| 전반 (%) | 20.6 | 19.5 | 28.4 |
| 심각 (%) | 0 | 0 | 1.3 |
| MDI 인슐린 +/- 메트포르민과 병용 (18주d) |
플라세보 (n=188) | JARDIANCE 10 mg (n=186) |
JARDIANCE 25 mg (n=189) |
| 전반 (%) | 37.2 | 39.8 | 41.3 |
| 심각 (%) | 0.5 | 0.5 | 0.5 |
성인 2형 당뇨병 환자의 혈당 조절을 위한 임상 시험에서 발생한 기타 이상 반응
-
생식기 진균 감염: 성인을 대상으로 한 5건의 위약 대조 임상 시험에서 생식기 진균 감염(예: 질 진균 감염, 질 감염, 생식기 감염 곰팡이, 외음 질 칸디다증, 외음염)의 발생률은 위약군에 비해 JARDIANCE로 치료받은 환자에서 증가하여 위약군, JARDIANCE 10mg 및 JARDIANCE 25mg에 무작위 배정된 환자의 각각 0.9%, 4.1% 및 3.7%에서 발생했습니다. 생식기 감염으로 인한 시험 중단은 위약 치료 환자의 0%와 JARDIANCE 10mg 또는 25mg으로 치료받은 환자의 0.2%에서 발생했습니다.
생식기 진균 감염은 남성 환자보다 여성 환자에서 더 자주 발생했습니다(표 2 참조).
포경은 위약군(0%)보다 JARDIANCE 10mg(0.1% 미만) 및 JARDIANCE 25mg(0.1%)으로 치료받은 남성 환자에서 더 자주 발생했습니다. -
요로 감염: 성인을 대상으로 한 5건의 위약 대조 임상 시험에서 요로 감염(예: 요로 감염, 무증상 세균뇨, 방광염)의 발생률은 위약군에 비해 JARDIANCE로 치료받은 환자에서 증가했습니다(표 2 참조). 만성 또는 재발성 요로 감염의 병력이 있는 환자는 요로 감염을 경험할 가능성이 더 높았습니다. 요로 감염으로 인한 치료 중단율은 위약군, JARDIANCE 10mg 및 JARDIANCE 25mg에서 각각 0.1%, 0.2% 및 0.1%였습니다.
요로 감염은 여성 환자에서 더 자주 발생했습니다. 위약군, JARDIANCE 10mg 및 JARDIANCE 25mg에 무작위 배정된 여성 환자의 요로 감염 발생률은 각각 16.6%, 18.4% 및 17.0%였습니다. 위약군, JARDIANCE 10mg 및 JARDIANCE 25mg에 무작위 배정된 남성 환자의 요로 감염 발생률은 각각 3.2%, 3.6% 및 4.1%였습니다 [특정 인구 집단에서의 사용 (8.5) 참조].
10세에서 17세까지의 소아 2형 당뇨병 환자를 대상으로 한 임상 시험
JARDIANCE는 10세에서 17세까지의 2형 당뇨병 환자 157명을 대상으로 한 시험에서 52명의 환자에게 투여되었으며, JARDIANCE에 대한 평균 노출 기간은 23.8주였습니다 [임상 연구 (14.2) 참조]. 식이 요법 및 운동에 대한 보조 요법으로 메트포르민(51%), 메트포르민과 인슐린 병용(40.1%), 인슐린(3.2%) 또는 없음(5.7%)이 포함되었습니다. 기준선에서 평균 HbA1c는 8.0%였으며 2형 당뇨병의 평균 지속 기간은 2.1년이었습니다. 평균 연령은 14.5세(범위: 10-17세)였으며 51.6%가 15세 이상이었습니다. 약 50%가 백인, 6%가 아시아인, 31%가 흑인 또는 아프리카계 미국인, 38%가 히스패닉 또는 라틴 아메리카인이었습니다. 평균 BMI는 36.0 kg/m2였으며 평균 BMI Z 점수는 3.0이었습니다. 시험 대상 인구의 약 25%가 미세 알부민뇨 또는 거대 알부민뇨를 보였습니다.
저혈당의 위험은 동반 인슐린 사용 여부에 관계없이 JARDIANCE로 치료받은 소아 환자에서 더 높았습니다. 저혈당은 혈당이 54mg/dL 미만으로 정의되었으며, JARDIANCE로 치료받은 환자 10명(19.2%)과 위약군으로 치료받은 환자 4명(7.5%)에서 발생했습니다. 심각한 저혈당 사건은 발생하지 않았습니다(심각한 저혈당은 다른 사람의 도움을 받아 능동적으로 탄수화물, 글루카곤을 투여하거나 다른 교정 조치를 취해야 하는 사건으로 정의됨).
만성 신장 질환 성인을 대상으로 한 임상 시험
만성 신장 질환 환자의 안전성 프로파일은 연구된 적응증 전반에서 관찰된 것과 일반적으로 일치했습니다. 장기 심혈관-신장 결과 시험 [임상 연구 14.5 참조]에서 만성 신장 질환 환자의 경우 하지 절단의 발생률이 위약군에서 1,000 환자-년당 2.9건, JARDIANCE 10mg 치료군에서 1,000 환자-년당 4.3건으로 보고되었습니다 [경고 및 주의 사항 (5.7) 참조].
임상 시험에서의 실험실 검사 이상
혈청 크레아티닌 증가 및 eGFR 감소
JARDIANCE를 시작하면 치료 시작 후 몇 주 안에 혈청 크레아티닌이 증가하고 eGFR이 감소하며, 그 후 이러한 변화는 안정화됩니다. 중등도 신장 장애가 있는 성인을 대상으로 한 시험에서 더 큰 평균 변화가 관찰되었습니다. 장기 심혈관 결과 시험에서 혈청 크레아티닌 증가 및 eGFR 감소는 일반적으로 4주차에 각각 0.1mg/dL 및 -9.0mL/min/1.73m2를 초과하지 않았으며, 치료 중단 후 역전되어 JARDIANCE로 관찰된 신장 기능 변화에 급성 혈역학적 변화가 역할을 할 수 있음을 시사합니다.
6.2 시판 후 경험
JARDIANCE의 시판 후 사용 중 추가적인 유해 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 일반적으로 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 불가능합니다.
위장관 장애: 변비
감염: 회음부 괴사성 근막염(포르니에 괴저), 요독증 및 신우신염
대사 및 영양 장애: 케톤산증
신장 및 요로 장애: 급성 신장 손상
피부 및 피하 조직 장애: 안지오에데마, 피부 반응(예: 발진, 두드러기)
7 약물 상호작용
JARDIANCE와 관련된 임상적으로 중요한 상호 작용은 표 4를 참조하십시오.
| 이뇨제 | |
|---|---|
| 임상적 영향 | 엠파글리플로진과 이뇨제를 병용 투여하면 소변량이 증가하고 배뇨 빈도가 증가하여 탈수 가능성이 높아질 수 있습니다. |
| 개입 | JARDIANCE를 투여하기 전에 체액량 상태와 신장 기능을 평가하십시오. 탈수증이 있는 환자의 경우 JARDIANCE를 투여하기 전에 이를 교정하십시오. 치료 시작 후 탈수증의 징후와 증상 및 신장 기능을 모니터링하십시오. |
| 인슐린 또는 인슐린 분비 촉진제 | |
| 임상적 영향 | JARDIANCE를 인슐린 분비 촉진제(예: 설폰닐우레아) 또는 인슐린과 함께 사용하면 저혈당 위험이 증가합니다. |
| 개입 | JARDIANCE를 인슐린 분비 촉진제(예: 설폰닐우레아) 또는 인슐린과 병용 투여하는 경우 저혈당 위험을 줄이기 위해 인슐린 분비 촉진제 또는 인슐린의 용량을 줄여야 할 수 있습니다. |
| 리튬 | |
| 임상적 영향 | SGLT2 억제제와 리튬을 병용하면 혈청 리튬 농도가 감소할 수 있습니다. |
| 개입 | JARDIANCE 투여 시작 및 용량 변경 시 혈청 리튬 농도를 더 자주 모니터링하십시오. |
| 양성 소변 포도당 검사 | |
| 임상적 영향 | SGLT2 억제제는 소변 포도당 배설을 증가시켜 양성 소변 포도당 검사 결과를 초래합니다. |
| 개입 | SGLT2 억제제를 복용하는 환자의 경우 소변 포도당 검사로 혈당 조절을 모니터링하는 것은 권장되지 않습니다. 혈당 조절을 모니터링하기 위해 다른 방법을 사용하십시오. |
| 1,5-안하이드로글루시톨(1,5-AG) 검사 방해 | |
| 임상적 영향 | SGLT2 억제제를 복용하는 환자의 경우 1,5-AG 측정은 혈당 조절을 평가하는 데 신뢰할 수 없습니다. |
| 개입 | 1,5-AG 검사로 혈당 조절을 모니터링하는 것은 권장되지 않습니다. 혈당 조절을 모니터링하기 위해 다른 방법을 사용하십시오. |
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 데이터에서 나타난 신장에 대한 부작용을 고려하여 JARDIANCE는 임신 2분기 및 3분기 동안 사용하지 않는 것이 좋습니다.
임산부에서 JARDIANCE에 대한 제한된 이용 가능한 데이터는 주요 선천적 기형 및 유산에 대한 약물 관련 위험을 결정하기에 충분하지 않습니다. 임신 중 당뇨병이 잘 조절되지 않으면 모체와 태아에 위험이 있습니다 [임상적 고려 사항 참조].
동물 연구에서, 임신 2분기 후반 및 3분기에 해당하는 신장 발달 기간 동안 empagliflozin을 투여한 쥐에서 신장 변화가 관찰되었습니다. 최대 임상 용량의 약 13배에 해당하는 용량은 가역적인 신장 골반 및 세뇨관 확장을 유발했습니다 [데이터 참조].
HbA1c >7인 임신 전 당뇨병 여성의 주요 선천적 기형의 추정 배경 위험은 6%에서 10%이며, HbA1c >10인 여성의 경우 20%에서 25%까지 보고되었습니다. 표시된 인구의 유산에 대한 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신의 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
데이터
동물 데이터
출생 후 21일(PND)부터 PND 90까지 1, 10, 30 및 100 mg/kg/day의 용량으로 어린 쥐에 직접 투여한 empagliflozin은 AUC 기준으로 최대 임상 용량 25 mg의 약 13배에 해당하는 100 mg/kg/day에서 신장 무게 증가 및 신장 세뇨관 및 골반 확장을 유발했습니다. 이러한 발견은 13주 동안 약물이 없는 회복 기간 후에는 관찰되지 않았습니다. 이러한 결과는 사람의 신장 발달의 2분기 후반 및 3분기에 해당하는 쥐의 신장 발달 기간 동안 약물 노출로 인해 발생했습니다.
쥐와 토끼에서의 배아-태아 발달 연구에서, empagliflozin은 사람의 기관 형성 기간인 1분기에 해당하는 기간 동안 투여되었습니다. AUC 기준으로 최대 임상 용량 25 mg의 약 48배(쥐) 및 128배(토끼)에 해당하는 300 mg/kg/day까지의 용량은 발달에 대한 부작용을 초래하지 않았습니다. 쥐에서, 모체 독성을 유발하는 더 높은 용량의 empagliflozin은 700 mg/kg/day 또는 25 mg 최대 임상 용량의 154배에서 태아의 사지 뼈 기형을 증가시켰습니다. Empagliflozin은 쥐에서 태반을 통과하여 태아 조직에 도달합니다. 토끼에서, 더 높은 용량의 empagliflozin은 700 mg/kg/day 또는 25 mg 최대 임상 용량의 139배에서 모체 및 태아 독성을 유발했습니다.
임신 쥐에서의 출산 전 및 출산 후 발달 연구에서, empagliflozin은 임신 6일부터 수유 20일(이유)까지 최대 100 mg/kg/day(25 mg 최대 임상 용량의 약 16배)까지 투여되었으며, 모체 독성은 나타나지 않았습니다. 25 mg 최대 임상 용량의 약 4배에 해당하는 30 mg/kg/day 이상에서 자손의 체중 감소가 관찰되었습니다.
8.2 수유
위험 요약
모유에서 JARDIANCE의 존재, JARDIANCE가 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 정보는 제한적입니다. Empagliflozin은 수유 쥐의 모유에 존재합니다 [데이터 참조]. 사람의 신장 성숙은 자궁 내에서 발생하며 수유 노출이 발생할 수 있는 생후 2년 동안 발생하기 때문에 발달 중인 사람의 신장에 위험이 있을 수 있습니다.
모유 수유 아기에게 empagliflozin이 출산 후 신장 발달에 영향을 미칠 가능성을 포함하여 심각한 부작용이 발생할 가능성이 있으므로, 환자에게 JARDIANCE를 모유 수유 중에 사용하지 않는 것이 좋다고 알려야 합니다.
데이터
임신 18일에 암컷에 단일 경구 용량을 투여한 후, empagliflozin은 쥐 태아 조직에서 낮은 수준으로 존재했습니다. 쥐의 모유에서, 모유 대 혈장 비율은 평균 0.634에서 5까지였으며, 투여 후 2시간에서 24시간까지 1보다 컸습니다. 평균 최대 모유 대 혈장 비율 5는 투여 후 8시간에 발생하여 모유에서 empagliflozin이 축적됨을 시사합니다. empagliflozin에 직접 노출된 어린 쥐는 성숙 과정에서 발달 중인 신장(신장 골반 및 세뇨관 확장)에 위험이 있음을 보였습니다.
8.4 소아 사용
2형 당뇨병 환자의 혈당 조절 개선을 위한 식이 요법 및 운동 보조제로서 JARDIANCE의 안전성 및 유효성은 10세 이상 소아 환자에서 확립되었습니다. 이 적응증에 대한 JARDIANCE의 사용은 2형 당뇨병이 있는 10세에서 17세까지의 157명의 소아 환자를 대상으로 한 26주 이중맹검, 위약 대조 임상 시험과 최대 52주까지의 이중맹검 활성 치료 안전성 연장 기간 및 소아 약동학 연구의 증거에 의해 뒷받침됩니다. [임상 약리학 (12.3) 및 임상 연구 (14.2) 참조]. JARDIANCE로 치료받은 소아 환자의 안전성 프로파일은 2형 당뇨병 성인에서 관찰된 프로파일과 유사했지만, 동반 인슐린 사용 여부에 관계없이 JARDIANCE로 치료받은 소아 환자에서 저혈당 위험이 더 높았습니다. [경고 및 주의 사항 (5.4) 및 유해 반응 (6.1) 참조].
2형 당뇨병 환자의 혈당 조절 개선을 위한 식이 요법 및 운동 보조제로서 JARDIANCE의 안전성 및 유효성은 10세 미만 소아 환자에서 확립되지 않았습니다.
다음과 같은 위험 감소를 위한 소아 환자에서 JARDIANCE의 안전성 및 유효성은 확립되지 않았습니다.
- 심부전 환자의 심혈관 사망 및 심부전 입원.
- 진행 위험이 있는 만성 신장 질환 환자의 지속적인 eGFR 감소, 말기 신장 질환, 심혈관 사망 및 입원.
- 확립된 심혈관 질환이 있는 2형 당뇨병 환자의 심혈관 사망.
8.5 노인 사용
2형 당뇨병 환자를 대상으로 한 혈당 조절 시험에서 JARDIANCE로 치료받은 총 2,721명(32%)의 환자가 65세 이상이었고, 491명(6%)이 75세 이상이었습니다. JARDIANCE는 신장 기능 저하가 있는 노인 환자에서 혈당 효능이 감소할 것으로 예상됩니다. [특정 인구 집단에서의 사용 (8.6) 참조]. 75세 이상 환자에서 용량 감소 관련 유해 반응 위험은 위약, JARDIANCE 10mg 및 JARDIANCE 25mg의 경우 각각 2.1%, 2.3% 및 4.4%로 증가했습니다. 75세 이상 환자에서 요로 감염 위험은 위약, JARDIANCE 10mg 및 JARDIANCE 25mg에 무작위 배정된 환자에서 각각 10.5%, 15.7% 및 15.1%로 증가했습니다. [경고 및 주의 사항 (5.2) 및 유해 반응 (6.1) 참조].
EMPEROR-Reduced, EMPEROR-Preserved 및 EMPA-KIDNEY 시험에서 65세 이상 환자와 젊은 성인 환자 간에 안전성 및 유효성에 대한 전반적인 차이가 관찰되지 않았습니다. EMPEROR-Reduced에는 JARDIANCE로 치료받은 65세 이상 환자 1,188명(64%)과 75세 이상 환자 503명(27%)이 포함되었습니다. EMPEROR-Preserved에는 JARDIANCE로 치료받은 65세 이상 환자 2,402명(80%)과 75세 이상 환자 1,281명(43%)이 포함되었습니다. EMPA-KIDNEY에는 JARDIANCE로 치료받은 65세 이상 환자 2,089명(32%)과 75세 이상 환자 1,518명(23%)이 포함되었습니다.
8.6 신장 기능 저하
경증 및 중등도 신장 기능 저하(eGFR 30~90 mL/min/1.73 m2 미만)가 있는 2형 당뇨병 성인 환자를 대상으로 한 시험에서 JARDIANCE의 효능 및 안전성을 평가했습니다. [임상 연구 (14.1) 참조]. 이 시험에서 JARDIANCE에 노출된 195명의 성인 환자의 eGFR은 60~90 mL/min/1.73 m2였고, JARDIANCE에 노출된 91명의 성인 환자의 eGFR은 45~60 mL/min/1.73 m2였으며, JARDIANCE에 노출된 97명의 환자의 eGFR은 30~45 mL/min/1.73 m2였습니다. JARDIANCE 25mg의 혈당 강하 효과는 신장 기능이 악화된 성인 환자에서 감소했습니다. 신장 기능 저하가 악화됨에 따라 신장 기능 저하, 용량 감소 관련 유해 반응 및 요로 감염 관련 유해 반응의 위험이 증가했습니다. [경고 및 주의 사항 (5.2) 참조]. 확립된 심혈관 질환이나 심혈관 위험 요인이 없는 환자에서 eGFR이 30 mL/min/1.73 m2 미만인 경우 혈당 조절을 위한 JARDIANCE의 사용은 권장되지 않습니다.
JARDIANCE는 EMPA-REG OUTCOME 시험에서 확립된 심혈관 질환이 있는 2형 당뇨병 성인 환자 7,020명(eGFR 30 mL/min/1.73 m2 이상), EMPEROR-Reduced 및 EMPEROR-Preserved 시험에서 총 9,718명의 심부전 환자(eGFR 20 mL/min/1.73 m2 이상), EMPA-KIDNEY 연구에서 만성 신장 질환 성인 환자 6,609명(eGFR 20~90 mL/min/1.73 m2)에서 평가되었습니다. 이러한 시험에서 eGFR 하위 그룹 전반에 걸친 안전성 프로파일은 알려진 안전성 프로파일과 일치했습니다. [유해 반응 (6.1) 및 임상 연구 (14.3, 14.4, 14.5) 참조].
JARDIANCE를 사용한 효능 및 안전성 시험에는 eGFR이 20 mL/min/1.73 m2 미만이거나 투석을 받는 성인 환자가 등록되지 않았습니다. EMPA-REG OUTCOME, EMPEROR-Reduced, EMPEROR-Preserved 및 EMPA-KIDNEY 시험에 등록된 성인 환자는 eGFR이 20 mL/min/1.73 m2 미만으로 악화되거나 투석을 시작하더라도 치료를 중단할 필요가 없었습니다. [임상 연구 (14.3, 14.4, 14.5) 참조].
10 과다 복용
JARDIANCE 과다 복용 시, Poison Help line (1-800-222-1222) 또는 의료 독성학자에게 연락하여 과다 복용 관리에 대한 추가 권장 사항을 문의하십시오. 혈액 투석을 통한 엠파글리플로진 제거는 연구되지 않았습니다.
11 설명
경구 투여용 JARDIANCE 정제는 SGLT2 억제제인 엠파글리플로진을 함유하고 있습니다.
엠파글리플로진의 화학명은 D-Glucitol,1,5-anhydro-1-C-[4-chloro-3-[[4-[[(3S)-tetrahydro-3-furanyl]oxy]phenyl]methyl]phenyl]-, (1S)입니다.
분자식은 C23H27ClO7이고 분자량은 450.91입니다. 구조식은 다음과 같습니다.
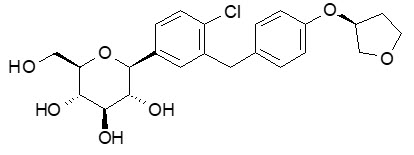
엠파글리플로진은 백색 내지 황색의 비흡습성 분말입니다. 물에는 매우 약간 용해되고, 메탄올에는 약간 용해되고, 에탄올과 아세토니트릴에는 약간 용해되고, 50% 아세토니트릴/물에는 용해되고, 톨루엔에는 거의 용해되지 않습니다.
JARDIANCE 필름 코팅 정제는 10mg 또는 25mg의 엠파글리플로진(유리 염기)과 다음의 비활성 성분을 함유하고 있습니다. 콜로이드성 이산화규소, 크로스카르멜로스 나트륨, 히드록시프로필 셀룰로오스, 락토오스 1수화물, 스테아르산마그네슘, 미결정 셀룰로오스. 또한 필름 코팅에는 히프로멜로스, 폴리에틸렌 글리콜, 탈크, 이산화티타늄, 황색 산화철과 같은 비활성 성분이 포함되어 있습니다.
12 임상약리학
12.1 작용 기전
엠파글리플로진은 사구체 여과액에서 순환계로 다시 흡수되는 포도당의 주요 운반체인 SGLT2의 억제제입니다. 엠파글리플로진은 SGLT2를 억제하여 여과된 포도당의 신장 재흡수를 감소시키고 포도당에 대한 신장 역치를 낮추어 소변으로의 포도당 배설을 증가시킵니다.
엠파글리플로진은 또한 나트륨 재흡수를 감소시키고 원위 세뇨관으로의 나트륨 전달을 증가시킵니다. 이는 사구체-세뇨관 피드백 증가 및 사구체 내압 감소, 심장의 전후 부하 감소 및 교감 신경 활성 감소를 포함하되 이에 국한되지 않는 여러 생리적 기능에 영향을 미칠 수 있습니다.
12.2 약력학
소변 포도당 배설
2형 당뇨병 환자에서 소변으로의 포도당 배설은 엠파글리플로진 투여 후 즉시 증가했으며, 4주 치료 기간 말에 평균적으로 1일 10mg 엠파글리플로진 투여 시 약 64g, 1일 25mg 엠파글리플로진 투여 시 약 78g으로 유지되었습니다. [임상 연구 (14) 참조]. 건강한 피험자에서 엠파글리플로진 단일 경구 투여에 대한 데이터는 평균적으로 10mg 및 25mg 투여량의 경우 소변으로의 포도당 배설 증가가 약 3일 만에 기준선으로 돌아온다는 것을 나타냅니다.
12.3 약동학
엠파글리플로진의 약동학은 건강한 자원봉사자와 2형 당뇨병 환자에서 특성이 규명되었으며, 두 집단 간에 임상적으로 관련성 있는 차이는 관찰되지 않았습니다. 엠파글리플로진 10mg 1일 1회 투여 시 정상 상태 평균 플라즈마 AUC 및 Cmax는 각각 1,870nmol∙h/L 및 259nmol/L였고, 엠파글리플로진 25mg 1일 1회 투여 시 각각 4,740nmol∙h/L 및 687nmol/L였습니다. 엠파글리플로진의 전신 노출은 치료적 투여 범위에서 용량에 비례하여 증가했습니다. 엠파글리플로진은 시간 의존적 약동학적 특징을 나타내지 않는 것으로 보입니다. 1일 1회 투여 후 정상 상태에서 플라즈마 AUC에 대해 최대 22%의 축적이 관찰되었습니다.
흡수
경구 투여 후 엠파글리플로진의 최고 혈장 농도는 투여 후 1.5시간에 도달했습니다. 고지방 및 고칼로리 식사 후 엠파글리플로진 25mg을 투여하면 노출이 약간 감소했습니다. AUC는 약 16% 감소했고 Cmax는 공복 상태에 비해 약 37% 감소했습니다. 엠파글리플로진 약동학에 대한 음식의 관찰된 영향은 임상적으로 관련성이 없는 것으로 간주되었으며, 엠파글리플로진은 음식과 함께 또는 음식 없이 투여할 수 있습니다.
분포
모집단 약동학 분석을 기반으로 추정된 명백한 정상 상태 분포 용적은 73.8L였습니다. 건강한 피험자에게 경구 [14C]-엠파글리플로진 용액을 투여한 후 적혈구 분할은 약 36.8%였고, 혈장 단백질 결합은 86.2%였습니다.
배설
모집단 약동학 분석을 기반으로 추정된 엠파글리플로진의 명백한 말단 제거 반감기는 12.4시간이었고, 명백한 경구 청소율은 10.6L/h였습니다.
특정 집단
소아 환자
2형 당뇨병이 있는 10세에서 17세 사이의 소아 환자에서 엠파글리플로진의 약동학 및 약력학을 조사했습니다. 엠파글리플로진을 10mg 및 25mg 경구 투여한 결과 성인 환자에서 관찰된 범위 내에서 노출이 나타났습니다.
연령, 체질량 지수, 성별 및 인종의 영향
연령, 체질량 지수(BMI), 성별 및 인종(아시아인 대 백인)은 엠파글리플로진의 약동학에 임상적으로 의미 있는 영향을 미치지 않습니다.
간 기능 장애 환자
Child-Pugh 분류에 따른 경증, 중등증 및 중증 간 기능 장애 성인 환자의 경우, 엠파글리플로진의 AUC는 정상 간 기능을 가진 피험자에 비해 약 23%, 47% 및 75% 증가했고, Cmax는 약 4%, 23% 및 48% 증가했습니다.
신장 기능 장애 환자
경증(eGFR: 60~90 mL/min/1.73 m2 미만), 중등증(eGFR: 30~60 mL/min/1.73 m2 미만) 및 중증(eGFR: 30 mL/min/1.73 m2 미만) 신장 기능 장애를 가진 2형 당뇨병 성인 환자와 신부전으로 인해 투석을 받는 환자의 경우, 엠파글리플로진의 AUC는 정상 신장 기능을 가진 피험자에 비해 약 18%, 20%, 66% 및 48% 증가했습니다. 엠파글리플로진의 최고 혈장 농도는 중등증 신장 기능 장애 환자와 신부전으로 인해 투석을 받는 환자에서 정상 신장 기능을 가진 피험자와 유사했습니다. 엠파글리플로진의 최고 혈장 농도는 경증 및 중증 신장 기능 장애 환자에서 정상 신장 기능을 가진 환자에 비해 약 20% 높았습니다. 모집단 약동학 분석 결과, eGFR 감소에 따라 엠파글리플로진의 겉보기 경구 청소율이 감소하여 약물 노출이 증가하는 것으로 나타났습니다. 그러나 소변에서 변화되지 않은 형태로 배설되는 엠파글리플로진의 비율과 소변 포도당 배설량은 eGFR 감소와 함께 감소했습니다.
약물 상호 작용 연구
시험관 내 약물 상호 작용 평가
엠파글리플로진은 CYP450 동위효소를 억제하거나 불활성화하거나 유도하지 않습니다. 시험관 내 데이터에 따르면 인간에서 엠파글리플로진의 주요 대사 경로는 유리딘 5′-디포스포-글루쿠로노실트랜스퍼라제 UGT1A3, UGT1A8, UGT1A9 및 UGT2B7에 의한 글루쿠로니드화입니다. 엠파글리플로진은 UGT1A1, UGT1A3, UGT1A8, UGT1A9 또는 UGT2B7을 억제하지 않습니다. 따라서 주요 CYP450 동위효소 또는 UGT1A1, UGT1A3, UGT1A8, UGT1A9 또는 UGT2B7의 기질인 동시에 투여되는 약물에 대한 엠파글리플로진의 영향은 예상되지 않습니다. 리팜핀 또는 기타 UGT 효소 유도제에 의한 유도와 같은 UGT 유도가 엠파글리플로진 노출에 미치는 영향은 평가되지 않았습니다.
엠파글리플로진은 P-당단백질(P-gp)과 유방암 저항 단백질(BCRP)의 기질이지만 치료 용량에서는 이러한 유출 수송체를 억제하지 않습니다. 시험관 내 연구에 따르면 엠파글리플로진은 P-gp 기질인 약물과 상호 작용을 일으킬 가능성이 낮은 것으로 간주됩니다. 엠파글리플로진은 인간 흡수 수송체 OAT3, OATP1B1 및 OATP1B3의 기질이지만 OAT1 및 OCT2의 기질은 아닙니다. 엠파글리플로진은 임상적으로 관련된 혈장 농도에서 이러한 인간 흡수 수송체를 억제하지 않으므로, 이러한 흡수 수송체의 기질인 동시에 투여되는 약물에 대한 엠파글리플로진의 영향은 예상되지 않습니다.
생체 내 약물 상호 작용 평가
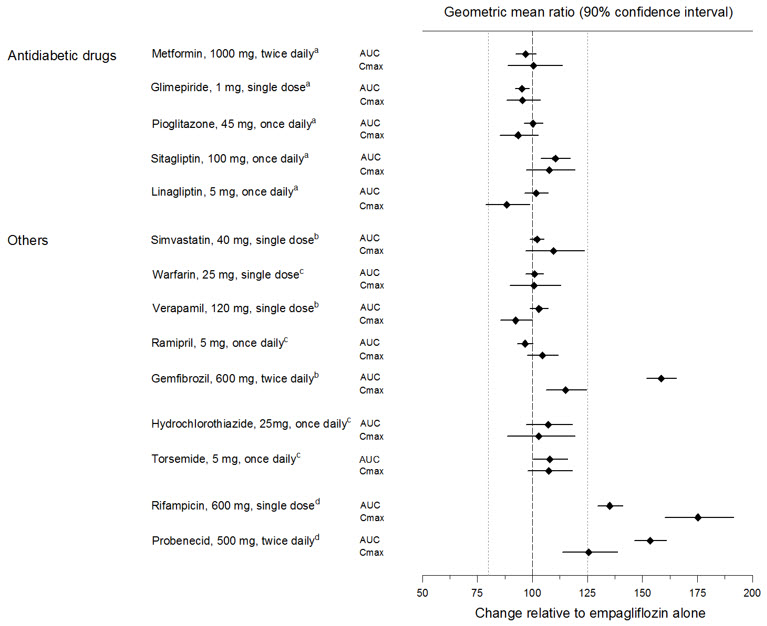
건강한 자원봉사자에서 메트포르민, 글리메피리드, 피오글리타존, 시타글립틴, 리나글립틴, 와파린, 베라파밀, 라미프릴 및 심바스타틴을 동시 투여하거나 동시 투여하지 않은 경우, 그리고 2형 당뇨병 환자에서 히드로클로로티아지드와 토르세미드를 동시 투여하거나 동시 투여하지 않은 경우 엠파글리플로진의 약동학은 유사했습니다(그림 1 참조). 정상 신장 기능을 가진 피험자에서 프로베네시드와 엠파글리플로진을 동시 투여하면 24시간 소변 포도당 배설량에 영향을 미치지 않고 소변으로 배설되는 엠파글리플로진의 비율이 30% 감소했습니다. 이 관찰 결과가 신장 기능 장애 환자에게 미치는 영향은 알 수 없습니다.
| a엠파글리플로진, 50mg, 1일 1회; b엠파글리플로진, 25mg, 단일 용량; c엠파글리플로진, 25mg, 1일 1회; d엠파글리플로진, 10mg, 단일 용량 |
 |
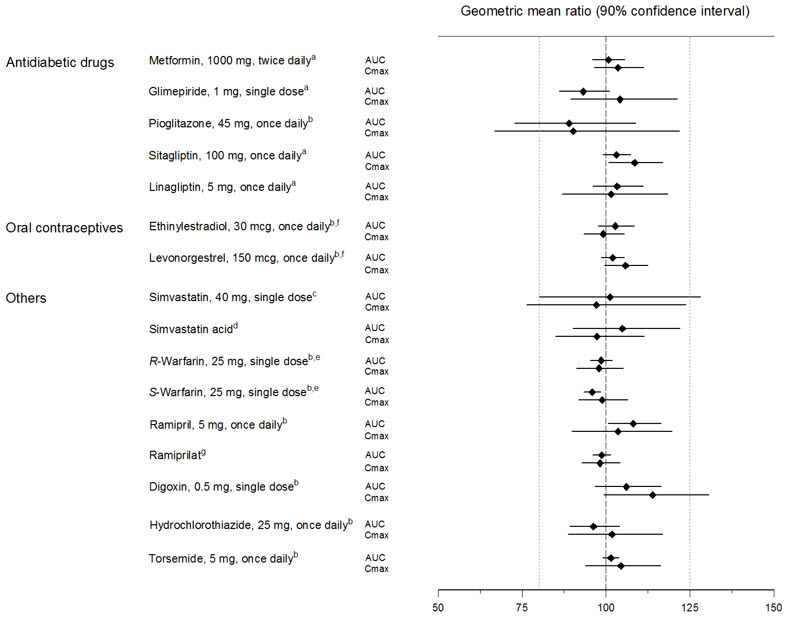
건강한 자원봉사자에게 공동 투여했을 때, 엠파글리플로진은 메트포르민, 글리메피리드, 피오글리타존, 시타글립틴, 리나글립틴, 와파린, 디곡신, 라미프릴, 심바스타틴, 히드로클로로티아지드, 토르세미드 및 경구 피임약의 약동학에 임상적으로 관련된 영향을 미치지 않았습니다( 그림 2 참조).
| a엠파글리플로진, 50mg, 1일 1회; b엠파글리플로진, 25mg, 1일 1회; c엠파글리플로진, 25mg, 단일 용량; d심바스타틴으로 투여; e와파린 라세미 혼합물로 투여; fMicrogynon®으로 투여; g라미프릴로 투여 |
 |
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
CD-1 마우스와 Wistar 랫드에서 수행된 2년 연구에서 발암성을 평가했습니다. 엠파글리플로진은 100, 300 또는 700 mg/kg/일(최대 임상 용량 25mg의 노출량의 최대 72배)의 용량으로 투여된 암컷 랫드에서 종양 발생률을 증가시키지 않았습니다. 수컷 랫드의 경우, 700 mg/kg/일 또는 임상 용량 25mg의 노출량의 약 42배에서 장간막 림프절의 혈관종이 유의하게 증가했습니다. 엠파글리플로진은 100, 300 또는 1,000 mg/kg/일(임상 용량 25mg의 노출량의 최대 62배)의 용량으로 투여된 암컷 마우스에서 종양 발생률을 증가시키지 않았습니다. 신장 세관 선종 및 암종은 수컷 마우스에서 1,000 mg/kg/일에서 관찰되었으며, 이는 임상 용량 25mg의 최대 노출량의 약 45배입니다. 이러한 종양은 수컷 마우스 신장에 주로 존재하는 대사 경로와 관련이 있을 수 있습니다.
14 임상 연구
14.1 2형 당뇨병 성인에서의 혈당 조절 시험
JARDIANCE는 단독 요법과 메트포르민, 설폰요소, 피오글리타존, 리나글립틴 및 인슐린과의 병용 요법으로 연구되었습니다. JARDIANCE는 또한 경증 또는 중등도 신장 장애가 있는 2형 당뇨병 환자에서 연구되었습니다.
2형 당뇨병 성인 환자에서 JARDIANCE 치료는 위약과 비교하여 헤모글로빈 A1c(HbA1c)를 감소시켰습니다. 위약과 비교한 JARDIANCE의 HbA1c 감소는 성별, 인종, 지리적 지역, 기준 BMI 및 질병 기간을 포함한 하위 그룹에서 관찰되었습니다.
단독 요법
2형 당뇨병 환자 986명이 JARDIANCE 단독 요법의 효능을 평가하기 위해 이중맹검, 위약 대조 시험에 참여했습니다.
불충분하게 조절된 2형 당뇨병의 치료 경험이 없는 환자는 2주 동안 개방형 위약 러닝인에 참여했습니다. 러닝인 기간이 끝날 때, 불충분하게 조절된 상태를 유지하고 HbA1c가 7%에서 10% 사이인 환자는 위약, JARDIANCE 10mg, JARDIANCE 25mg 또는 참조 비교군에 무작위 배정되었습니다.
24주차에 JARDIANCE 10mg 또는 25mg을 매일 투여하면 위약과 비교하여 HbA1c(p-값 <0.0001), 공복 혈당(FPG) 및 체중이 통계적으로 유의하게 감소했습니다(표 5 및 그림 3 참조).
| JARDIANCE 10 mg N=224 |
JARDIANCE 25 mg N=224 |
위약 N=228 |
|
|---|---|---|---|
| a수정된 의도적 치료 집단. 24주차에 누락된 데이터를 대입하기 위해 시험에서 마지막 관찰(LOCF)을 사용했습니다. 24주차에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 경우 각각 9.4%, 9.4% 및 30.7%가 대입되었습니다. bANCOVA 유도 p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준 HbA1c, 치료, 신장 기능 및 지역이 포함됩니다. 체중 및 FPG: HbA1c와 동일한 모델이 사용되지만 기준 체중/기준 FPG가 추가로 포함됩니다.) cFPG(mg/dL); JARDIANCE 10mg의 경우 n=223, JARDIANCE 25mg의 경우 n=223, 위약의 경우 n=226 |
|||
| HbA1c (%)a | |||
| 기준(평균) | 7.9 | 7.9 | 7.9 |
| 기준에서의 변화(조정된 평균) | -0.7 | -0.8 | 0.1 |
| 위약과의 차이(조정된 평균)(97.5% CI) | -0.7b (-0.9, -0.6) | -0.9b (-1.0, -0.7) | — |
| HbA1c <7%를 달성한 환자[n(%)] | 72 (35%) | 88 (44%) | 25 (12%) |
| FPG (mg/dL)c | |||
| 기준(평균) | 153 | 153 | 155 |
| 기준에서의 변화(조정된 평균) | -19 | -25 | 12 |
| 위약과의 차이(조정된 평균)(95% CI) | -31 (-37, -26) | -36 (-42, -31) | — |
| 체중 | |||
| 기준(평균) kg | 78 | 78 | 78 |
| 기준에서의 % 변화(조정된 평균) | -2.8 | -3.2 | -0.4 |
| 위약과의 차이(조정된 평균)(95% CI) | -2.5b (-3.1, -1.9) | -2.8b (-3.4, -2.2) | — |
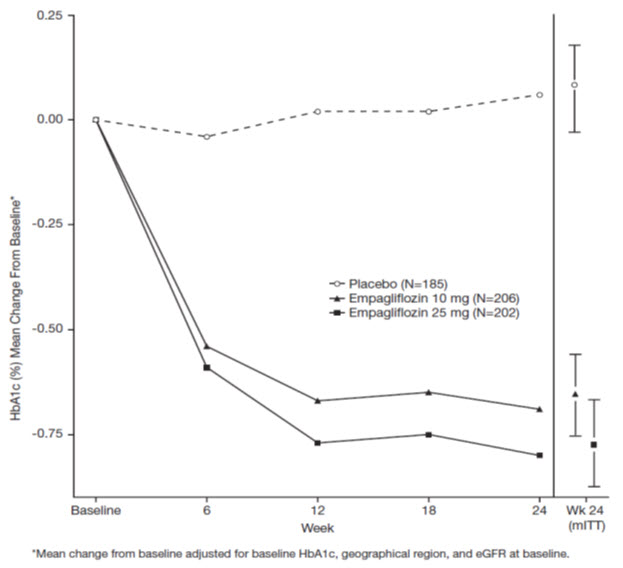 |
24주차에, JARDIANCE 10mg 투여군에서 위약 대비 -2.6 mmHg (위약 조정, p-값=0.0231), JARDIANCE 25mg 투여군에서 위약 대비 -3.4 mmHg (위약 조정, p-값=0.0028)로 수축기 혈압이 통계적으로 유의하게 감소했습니다.
메트포르민과의 병용 요법 추가
2형 당뇨병 환자 637명이 메트포르민과 병용한 JARDIANCE의 효능을 평가하기 위해 이중맹검, 위약 대조 시험에 참여했습니다.
메트포르민 1,500mg 이상으로 적절히 조절되지 않은 2형 당뇨병 환자는 2주간 위약 투여 기간을 거쳤습니다. 투여 기간 종료 시, 적절히 조절되지 않고 HbA1c가 7%에서 10% 사이인 환자는 위약, JARDIANCE 10mg 또는 JARDIANCE 25mg으로 무작위 배정되었습니다.
24주차에, JARDIANCE 10mg 또는 25mg을 매일 투여하면 위약과 비교하여 HbA1c (p-값 <0.0001), FPG 및 체중이 통계적으로 유의하게 감소했습니다 (표 6 참조).
| JARDIANCE 10 mg N=217 |
JARDIANCE 25 mg N=213 |
위약 N=207 |
|
|---|---|---|---|
| a수정된 ITT 모집단. 24주차에 누락된 데이터를 대체하기 위해 시험 마지막 관찰값(LOCF)을 사용했습니다. 24주차에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약 투여군에서 각각 9.7%, 14.1% 및 24.6%가 대체되었습니다. bANCOVA p-값 <0.0001 (HbA1c: ANCOVA 모델에는 기준 HbA1c, 치료, 신장 기능 및 지역이 포함됩니다. 체중 및 FPG: HbA1c와 동일한 모델을 사용하지만 기준 체중/기준 FPG가 추가로 포함됩니다.) cFPG (mg/dL); JARDIANCE 10mg의 경우 n=216, JARDIANCE 25mg의 경우 n=213, 위약의 경우 n=207 |
|||
| HbA1c (%)a | |||
| 기준 (평균) | 7.9 | 7.9 | 7.9 |
| 기준 대비 변화 (조정된 평균) | -0.7 | -0.8 | -0.1 |
| 위약 + 메트포르민 대비 차이 (조정된 평균) (95% CI) | -0.6b (-0.7, -0.4) | -0.6b (-0.8, -0.5) | — |
| HbA1c <7% 달성 환자 [n (%)] | 75 (38%) | 74 (39%) | 23 (13%) |
| FPG (mg/dL)c | |||
| 기준 (평균) | 155 | 149 | 156 |
| 기준 대비 변화 (조정된 평균) | -20 | -22 | 6 |
| 위약 + 메트포르민 대비 차이 (조정된 평균) | -26 | -29 | — |
| 체중 | |||
| 기준 평균 (kg) | 82 | 82 | 80 |
| 기준 대비 변화 (%) (조정된 평균) | -2.5 | -2.9 | -0.5 |
| 위약 대비 차이 (조정된 평균) (95% CI) | -2.0b (-2.6, -1.4) | -2.5b (-3.1, -1.9) | — |
24주차에, JARDIANCE 10mg는 -4.1 mmHg (위약 대비, p-값 <0.0001), JARDIANCE 25mg는 -4.8 mmHg (위약 대비, p-값 <0.0001)로 수축기 혈압이 통계적으로 유의하게 감소했습니다.
메트포르민과의 초기 병용 요법
2형 당뇨병 환자 1,364명이 메트포르민과 병용한 JARDIANCE의 효능을 해당 개별 성분과 비교하기 위해 이중맹검, 무작위 배정, 활성 대조군 시험에 참여했습니다.
2형 당뇨병이 적절히 조절되지 않은 치료 경험이 없는 환자는 2주 동안 개방형 위약 투여 기간을 거쳤습니다. 투여 기간 종료 시, 적절히 조절되지 않고 HbA1c가 7%에서 10.5% 사이인 환자는 8개의 활성 치료군 중 하나에 무작위 배정되었습니다. JARDIANCE 10mg 또는 25mg; 메트포르민 1,000mg 또는 2,000mg; JARDIANCE 10mg과 1,000mg 또는 2,000mg 메트포르민 병용; 또는 JARDIANCE 25mg과 1,000mg 또는 2,000mg 메트포르민 병용.
24주차에, 메트포르민과 병용한 JARDIANCE의 초기 요법은 개별 성분과 비교하여 HbA1c가 통계적으로 유의하게 감소했습니다(p-값 <0.01, 표 7 참조).
| JARDIANCE 10 mg + 메트포르민 1,000 mga N=161 |
JARDIANCE 10 mg + 메트포르민 2,000 mga N=167 |
JARDIANCE 25 mg + 메트포르민 1,000 mga N=165 |
JARDIANCE 25 mg + 메트포르민 2,000 mga N=169 |
JARDIANCE 10 mg N=169 |
JARDIANCE 25 mg N=163 |
메트포르민 1,000 mga N=167 |
메트포르민 2,000 mga N=162 |
|
|---|---|---|---|---|---|---|---|---|
| a메트포르민 총 일일 복용량, 하루에 2회 동일하게 나누어 복용합니다. bp-값 ≤0.0062 (수정된 ITT 모집단 [관찰된 사례] MMRM 모델에는 치료, 신장 기능, 지역, 방문, 치료별 방문 상호 작용 및 기준 HbA1c가 포함되었습니다). cp-값 ≤0.0056 (수정된 ITT 모집단 [관찰된 사례] MMRM 모델에는 치료, 신장 기능, 지역, 방문, 치료별 방문 상호 작용 및 기준 HbA1c가 포함되었습니다). |
||||||||
| HbA1c (%) | ||||||||
| 기준 (평균) | 8.7 | 8.7 | 8.8 | 8.7 | 8.6 | 8.9 | 8.7 | 8.6 |
| 기준 대비 변화 (조정된 평균) | -2.0 | -2.1 | -1.9 | -2.1 | -1.4 | -1.4 | -1.2 | -1.8 |
| JARDIANCE 대비 비교 (조정된 평균) (95% CI) | -0.6b (-0.9, -0.4) |
-0.7b (-1.0, -0.5) |
-0.6c (-0.8, -0.3) |
-0.7c (-1.0, -0.5) |
— | — | — | — |
| 메트포르민 대비 비교 (조정된 평균) (95% CI) | -0.8b (-1.0, -0.6) |
-0.3b (-0.6, -0.1) |
-0.8c (-1.0, -0.5) |
-0.3c (-0.6, -0.1) |
— | — | — | — |
메트포르민 및 설폰요소와의 병용 요법 추가
2형 당뇨병 환자 666명을 대상으로 메트포르민과 설폰요소 병용 요법과 함께 JARDIANCE의 효능을 평가하기 위한 이중맹검, 위약 대조 시험을 실시했습니다.
메트포르민 1,500mg/일 이상과 설폰요소를 복용하며 2형 당뇨병이 적절히 조절되지 않은 환자는 2주간의 오픈 라벨 위약 러닝인에 참여했습니다. 러닝인 종료 시, 적절히 조절되지 않고 HbA1c가 7%에서 10% 사이인 환자는 위약, JARDIANCE 10mg 또는 JARDIANCE 25mg에 무작위 배정되었습니다.
JARDIANCE 10mg 또는 25mg을 매일 투여하면 위약과 비교하여 HbA1c(p-값 <0.0001), FPG 및 체중이 통계적으로 유의하게 감소했습니다(표 8 참조).
| JARDIANCE 10 mg N=225 |
JARDIANCE 25 mg N=216 |
위약 N=225 |
|
|---|---|---|---|
| a수정된 ITT 모집단. 24주차에 누락된 데이터를 대체하기 위해 시험 마지막 관찰 값(LOCF)을 사용했습니다. 24주차에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 17.8%, 16.7% 및 25.3%가 각각 대체되었습니다. bANCOVA p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준 HbA1c, 치료, 신장 기능 및 지역이 포함됩니다. 체중 및 FPG: HbA1c와 동일한 모델을 사용하지만 기준 체중/기준 FPG를 추가로 포함합니다.) cFPG(mg/dL); JARDIANCE 10mg의 경우 n=225, JARDIANCE 25mg의 경우 n=215, 위약의 경우 n=224 |
|||
| HbA1c (%)a | |||
| 기준(평균) | 8.1 | 8.1 | 8.2 |
| 기준 대비 변화(조정된 평균) | -0.8 | -0.8 | -0.2 |
| 위약 대비 차이(조정된 평균)(95% CI) | -0.6b (-0.8, -0.5) | -0.6b (-0.7, -0.4) | — |
| HbA1c <7%를 달성한 환자[n(%)] | 55 (26%) | 65 (32%) | 20 (9%) |
| FPG (mg/dL)c | |||
| 기준(평균) | 151 | 156 | 152 |
| 기준 대비 변화(조정된 평균) | -23 | -23 | 6 |
| 위약 대비 차이(조정된 평균) | -29 | -29 | — |
| 체중 | |||
| 기준 평균(kg) | 77 | 78 | 76 |
| 기준 대비 변화율(조정된 평균) | -2.9 | -3.2 | -0.5 |
| 위약 대비 차이(조정된 평균)(95% CI) | -2.4b (-3.0, -1.8) | -2.7b (-3.3, -2.1) | — |
메트포르민 치료에 추가 요법으로서 리나글립틴과 병용
2형 당뇨병 환자 686명을 대상으로 JARDIANCE 10mg 또는 25mg을 리나글립틴 5mg과 병용한 경우와 각 성분을 단독으로 사용한 경우를 비교하는 이중맹검, 활성 대조군 시험을 실시했습니다.
메트포르민을 하루 1,500mg 이상 복용했음에도 불구하고 혈당 조절이 충분하지 않은 2형 당뇨병 환자는 2주 동안 단일맹검 위약 투여 기간을 거쳤습니다. 투여 기간 종료 시 혈당 조절이 충분하지 않고 HbA1c가 7%에서 10.5% 사이인 환자는 JARDIANCE 10mg 또는 25mg, 리나글립틴 5mg, 또는 리나글립틴 5mg을 JARDIANCE 10mg 또는 25mg과 병용한 고정 용량 복합제로 1:1:1:1:1 비율로 무작위 배정했습니다.
24주차에 메트포르민으로 혈당 조절이 충분하지 않았던 환자에서 리나글립틴 5mg과 병용한 JARDIANCE 10mg 또는 25mg은 각 성분을 단독으로 사용한 경우에 비해 HbA1c(p-값 <0.0001) 및 FPG(p-값 <0.001)가 통계적으로 유의하게 개선되었습니다. JARDIANCE/리나글립틴 25mg/5mg 또는 JARDIANCE/리나글립틴 10mg/5mg을 매일 투여한 경우에도 리나글립틴 5mg에 비해 체중이 통계적으로 유의하게 감소했습니다(p-값 <0.0001). JARDIANCE 단독 투여와 비교하여 체중에 통계적으로 유의한 차이는 없었습니다.
메트포르민과 병용한 글리메피리드에 대한 활성 대조군 시험
메트포르민 치료에도 불구하고 혈당 조절이 충분하지 않은 2형 당뇨병 환자 1,545명을 대상으로 이중맹검, 글리메피리드 대조군 시험에서 JARDIANCE의 효능을 평가했습니다.
2주 동안 투여 기간을 거친 후 혈당 조절이 충분하지 않고 HbA1c가 7%에서 10% 사이인 환자는 글리메피리드 또는 JARDIANCE 25mg으로 무작위 배정했습니다.
52주차에 JARDIANCE 25mg과 글리메피리드는 HbA1c와 FPG를 낮췄습니다(표 9, 그림 4 참조). JARDIANCE 25mg과 글리메피리드 간 관찰된 효과 크기의 차이는 사전에 정의된 비열등성 한계인 0.3%를 제외했습니다. 글리메피리드의 평균 일일 용량은 2.7mg이었으며 미국에서 승인된 최대 용량은 하루 8mg입니다.
| JARDIANCE 25mg N=765 |
글리메피리드 N=780 |
|
|---|---|---|
| a수정된 ITT 모집단. 52주차에 누락된 데이터는 시험 마지막 관찰 값(LOCF)을 사용하여 대체했습니다. 52주차에 JARDIANCE 25mg과 글리메피리드에 무작위 배정된 환자의 15.3%와 21.9%에 대해 각각 데이터를 대체했습니다. b비열등성, ANCOVA 모델 p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준 HbA1c, 치료, 신장 기능 및 지역이 포함됨) cANCOVA p-값 <0.0001(체중 및 FPG: HbA1c와 동일한 모델을 사용했지만 기준 체중/기준 FPG를 추가로 포함함) dFPG(mg/dL); JARDIANCE 25mg의 경우 n=764, 글리메피리드의 경우 n=779 |
||
| HbA1c (%)a | ||
| 기준(평균) | 7.9 | 7.9 |
| 기준 대비 변화(조정된 평균) | -0.7 | -0.7 |
| 글리메피리드와의 차이(조정된 평균)(97.5% CI) | -0.07b (-0.15, 0.01) | — |
| FPG (mg/dL)d | ||
| 기준(평균) | 150 | 150 |
| 기준 대비 변화(조정된 평균) | -19 | -9 |
| 글리메피리드와의 차이(조정된 평균) | -11 | — |
| 체중 | ||
| 기준 평균(kg) | 82.5 | 83 |
| 기준 대비 변화율(조정된 평균) | -3.9 | 2.0 |
| 글리메피리드와의 차이(조정된 평균)(95% CI) | -5.9c (-6.3, -5.5) | — |
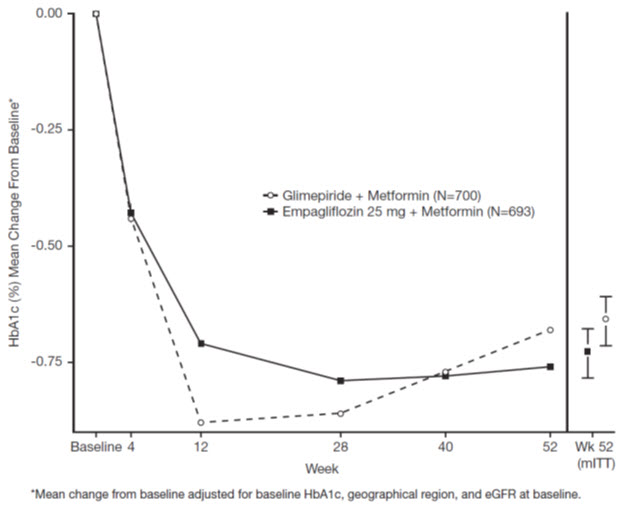 |
52주차에, 수축기 혈압의 기준선 대비 조정된 평균 변화는 -3.6 mmHg였으며, 글리메피리드의 경우 2.2 mmHg였습니다. 수축기 혈압에 대한 치료군 간 차이는 통계적으로 유의미했습니다(p-값 <0.0001).
104주차에, HbA1c의 기준선 대비 조정된 평균 변화는 JARDIANCE 25mg의 경우 -0.75%, 글리메피리드의 경우 -0.66%였습니다. 조정된 평균 치료 차이는 -0.09%였으며, 97.5% 신뢰 구간은 (-0.32%, 0.15%)로, 사전에 지정된 비열등성 한계인 0.3%를 제외했습니다. 글리메피리드의 평균 일일 복용량은 2.7mg이었으며, 미국에서 승인된 최대 복용량은 하루 8mg입니다. 104주차 분석에는 동반 당뇨병 치료제를 사용한 데이터와 사용하지 않은 데이터, 그리고 치료 중단 데이터가 포함되었습니다. 방문 시 정보를 제공하지 않은 환자의 누락된 데이터는 관찰된 치료 중단 데이터를 기반으로 대체되었습니다. 이 다중 대체 분석에서, JARDIANCE 25mg의 경우 데이터의 13.9%가 대체되었고, 글리메피리드의 경우 12.9%가 대체되었습니다.
104주차에, JARDIANCE 25mg을 매일 복용하면 글리메피리드에 비해 기준선 대비 체중 변화에 대한 통계적으로 유의미한 차이가 나타났습니다(JARDIANCE 25mg의 경우 -3.1kg, 글리메피리드의 경우 +1.3kg; ANCOVA-LOCF, p-값 <0.0001).
피오글리타존과 함께 또는 메트포르민과 함께 사용하는 추가 병용 요법
2형 당뇨병 환자 498명이 이중맹검, 위약 대조 시험에 참여하여 메트포르민과 함께 또는 메트포르민 없이 피오글리타존과 병용했을 때 JARDIANCE의 효능을 평가했습니다.
하루 1,500mg 이상의 메트포르민과 30mg 이상의 피오글리타존을 복용했음에도 불구하고 2형 당뇨병이 적절히 조절되지 않은 환자는 2주 동안 개방형 위약 유지 기간에 배정되었습니다. 유지 기간 후에 혈당 조절이 적절하지 않고 HbA1c가 7%에서 10% 사이인 환자는 위약, JARDIANCE 10mg 또는 JARDIANCE 25mg에 무작위 배정되었습니다.
JARDIANCE 10mg 또는 25mg을 매일 복용하면 위약에 비해 HbA1c(p-값 <0.0001), FPG 및 체중이 통계적으로 유의미하게 감소했습니다(표 10 참조).
| JARDIANCE 10 mg N=165 |
JARDIANCE 25 mg N=168 |
위약 N=165 |
|
|---|---|---|---|
| a수정된 ITT 모집단. 시험 종료 시 마지막 관찰 값(LOCF)을 사용하여 24주차의 누락된 데이터를 대체했습니다. 24주차에, JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 경우 각각 10.9%, 8.3% 및 20.6%가 대체되었습니다. bANCOVA p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준선 HbA1c, 치료, 신장 기능 및 배경 약물이 포함됩니다. 체중 및 FPG: HbA1c와 동일한 모델을 사용하지만 기준선 체중/기준선 FPG가 추가로 포함됩니다.) cFPG(mg/dL); JARDIANCE 10mg의 경우 n=163 |
|||
| HbA1c (%)a | |||
| 기준선(평균) | 8.1 | 8.1 | 8.2 |
| 기준선 대비 변화(조정된 평균) | -0.6 | -0.7 | -0.1 |
| 위약 + 피오글리타존 대비 차이(조정된 평균)(95% CI) | -0.5b (-0.7, -0.3) | -0.6b (-0.8, -0.4) | — |
| HbA1c <7%를 달성한 환자[n(%)] | 36 (24%) | 48 (30%) | 12 (8%) |
| FPG (mg/dL)c | |||
| 기준선(평균) | 152 | 152 | 152 |
| 기준선 대비 변화(조정된 평균) | -17 | -22 | 7 |
| 위약 + 피오글리타존 대비 차이(조정된 평균)(97.5% CI) | -23b (-31.8, -15.2) | -28b (-36.7, -20.2) | — |
| 체중 | |||
| 기준선 평균(kg) | 78 | 79 | 78 |
| 기준선 대비 변화(%) (조정된 평균) | -2.0 | -1.8 | 0.6 |
| 위약 대비 차이(조정된 평균)(95% CI) | -2.6b (-3.4, -1.8) | -2.4b (-3.2, -1.6) | — |
인슐린과 함께 또는 메트포르민 및/또는 설폰요소와 함께 사용하는 추가 조합
인슐린 또는 인슐린과 경구 약물의 조합으로 적절히 조절되지 않은 2형 당뇨병 환자 494명을 대상으로 78주 동안 JARDIANCE를 인슐린에 추가 요법으로 사용하는 효능을 평가하기 위한 이중맹검, 위약 대조 시험을 실시했습니다.
환자들은 메트포르민 및/또는 설폰요소 배경 요법과 함께 기저 인슐린(예: 인슐린 글라진, 인슐린 데테미르 또는 NPH 인슐린)을 사용하여 2주간 위약 적응 기간을 거쳤습니다. 적응 기간 후, 혈당 조절이 적절하지 않은 환자들은 JARDIANCE 10mg, JARDIANCE 25mg 또는 위약을 추가 투여하도록 무작위 배정되었습니다. 환자들은 등록 전, 적응 기간 동안, 그리고 치료 첫 18주 동안 안정적인 인슐린 용량을 유지했습니다. 나머지 60주 동안 인슐린은 조정될 수 있었습니다. JARDIANCE 10mg, 25mg 및 위약의 기준선 총 일일 인슐린 용량은 각각 45IU, 48IU 및 48IU였습니다.
인슐린(메트포르민 및/또는 설폰요소와 함께 또는 없이)과 함께 사용된 JARDIANCE는 치료 18주 및 78주 후 모두 위약과 비교하여 HbA1c 및 FPG를 통계적으로 유의하게 감소시켰습니다(표 11 참조). JARDIANCE 10mg 또는 25mg을 매일 사용하면 위약과 비교하여 체중 감소율이 통계적으로 유의하게 더 높았습니다.
| 18주 (인슐린 조정 없음) |
78주 (18주 후 인슐린 용량 조정 가능) |
|||||
|---|---|---|---|---|---|---|
| JARDIANCE 10mg N=169 |
JARDIANCE 25mg N=155 |
위약 N=170 |
JARDIANCE 10mg N=169 |
JARDIANCE 25mg N=155 |
위약 N=170 |
|
| a수정된 의도적 치료 집단. 시험에서 마지막 관찰(LOCF)을 사용하여 18주 및 78주에서 누락된 데이터를 대체했습니다. 18주에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 21.3%, 30.3% 및 21.8%가 각각 대체되었습니다. 78주에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 32.5%, 38.1% 및 42.4%가 각각 대체되었습니다. bANCOVA p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준선 HbA1c, 치료 및 지역이 포함됨; FPG: MMRM 모델에는 기준선 FPG, 기준선 HbA1c, 치료, 지역, 방문 및 방문별 치료 상호 작용이 포함됨. 체중: MMRM 모델에는 기준선 체중, 기준선 HbA1c, 치료, 지역, 방문 및 방문별 치료 상호 작용이 포함됨. cp-값=0.0049 dp-값=0.0052 ep-값=0.0463 |
||||||
| HbA1c (%)a | ||||||
| 기준선(평균) | 8.3 | 8.3 | 8.2 | 8.3 | 8.3 | 8.2 |
| 기준선에서의 변화(조정된 평균) | -0.6 | -0.7 | 0 | -0.4 | -0.6 | 0.1 |
| 위약과의 차이(조정된 평균)(97.5% CI) | -0.6b (-0.8, -0.4) |
-0.7b (-0.9, -0.5) |
— | -0.5b (-0.7, -0.3) |
-0.7b (-0.9, -0.5) |
— |
| HbA1c <7%를 달성한 환자(%) | 18.0 | 19.5 | 5.5 | 12.0 | 17.5 | 6.7 |
| FPG (mg/dL) | ||||||
| 기준선(평균) | 138 | 146 | 142 | 138 | 146 | 142 |
| 기준선에서의 변화(조정된 평균, SE) | -17.9 (3.2) | -19.1 (3.3) | 10.4 (3.1) | -10.1 (3.2) | -15.2 (3.4) | 2.8 (3.2) |
| 위약과의 차이 (조정된 평균) (95% CI) | -28.2b (-37.0, -19.5) |
-29.5b (-38.4, -20.6) |
— | -12.9c (-21.9, 3.9) |
-17.9b (-27.0, -8.8) |
— |
| 체중 | ||||||
| 기준선 평균 (kg) | 92 | 95 | 90 | 92 | 95 | 90 |
| 기준선 대비 % 변화 (조정된 평균) | -1.8 | -1.4 | -0.1 | -2.4 | -2.4 | 0.7 |
| 위약과의 차이 (조정된 평균) (95% CI) | -1.7d (-3.0, -0.5) |
-1.3e (-2.5, -0.0) |
— | -3.0b (-4.4, -1.7) |
-3.0b (-4.4, -1.6) |
— |
MDI 인슐린과 함께 또는 메트포르민과 함께 추가 병용 요법
2형 당뇨병 환자 563명(매일 다중 주사(MDI) 인슐린(총 일일 투여량 >60 IU)으로 단독 또는 메트포르민과 병용하여 적절히 조절되지 않은 환자)이 18주 동안 MDI 인슐린에 대한 추가 요법으로 JARDIANCE의 효능을 평가하기 위해 이중맹검, 위약 대조 시험에 참여했습니다.
환자는 메트포르민 배경 요법과 함께 또는 없이 MDI 인슐린에 대한 2주 위약 적응 기간에 들어갔습니다. 적응 기간 후, 혈당 조절이 적절하지 않은 환자는 JARDIANCE 10mg, JARDIANCE 25mg 또는 위약 추가 투여군에 무작위 배정되었습니다. 환자는 등록 전, 적응 기간 동안, 그리고 치료 첫 18주 동안 안정적인 인슐린 용량을 유지했습니다. JARDIANCE 10mg, JARDIANCE 25mg 및 위약의 기준선 평균 총 일일 인슐린 용량은 각각 88.6 IU, 90.4 IU 및 89.9 IU였습니다.
MDI 인슐린(메트포르민과 함께 또는 없이)과 병용하여 매일 JARDIANCE 10mg 또는 25mg을 사용하면 치료 18주 후 위약과 비교하여 HbA1c가 통계적으로 유의하게 감소했습니다(표 12 참조).
| JARDIANCE 10 mg N=186 |
JARDIANCE 25 mg N=189 |
위약 N=188 |
|
|---|---|---|---|
| a수정된 의도적 치료 집단. 시험에서 마지막 관찰(LOCF)을 사용하여 18주에 누락된 데이터를 대입했습니다. 18주에 JARDIANCE 10mg, JARDIANCE 25mg 및 위약에 무작위 배정된 환자의 경우 각각 23.7%, 22.8% 및 23.4%가 대입되었습니다. bANCOVA p-값 <0.0001(HbA1c: ANCOVA 모델에는 기준선 HbA1c, 치료, 신장 기능, 지리적 지역 및 배경 약물이 포함됨). |
|||
| HbA1c (%)a | |||
| 기준선 (평균) | 8.4 | 8.3 | 8.3 |
| 기준선 대비 변화 (조정된 평균) | -0.9 | -1.0 | -0.5 |
| 위약과의 차이 (조정된 평균) (95% CI) | -0.4b (-0.6, -0.3) | -0.5b (-0.7, -0.4) | — |
최대 52주까지 치료를 연장하는 기간 동안 인슐린은 정의된 혈당 목표 수준을 달성하기 위해 조정될 수 있습니다. HbA1c의 기준선 대비 변화는 JARDIANCE 10mg 및 25mg 모두에서 18주에서 52주까지 유지되었습니다. 52주 후, JARDIANCE 10mg 또는 25mg을 매일 복용하면 위약에 비해 체중 감소율이 통계적으로 더 높았습니다(p-값 <0.0001). JARDIANCE 10mg의 경우 기준선 대비 체중의 평균 변화는 -1.95kg이고, JARDIANCE 25mg의 경우 -2.04kg입니다.
신장애
2형 당뇨병 환자 중 기준선 eGFR이 90mL/min/1.73m2 미만인 738명의 환자가 무작위 배정, 이중맹검, 위약 대조, 병행군 시험에 참여하여 2형 당뇨병 및 신장애 환자에서 JARDIANCE의 효능을 평가했습니다. 시험 대상자는 경증 신장애(eGFR 60~90mL/min/1.73m2 미만) 환자 290명, 중등도 신장애(eGFR 30~60mL/min/1.73m2 미만) 환자 374명, 중증 신장애(eGFR 30mL/min/1.73m2 미만) 환자 74명으로 구성되었습니다. 중등도 신장애 환자 중 194명은 기준선 eGFR이 30~45mL/min/1.73m2 미만이었고, 180명은 기준선 eGFR이 45~60mL/min/1.73m2 미만이었습니다.
24주차에 JARDIANCE 25mg은 경증에서 중등도 신장애 환자에서 위약에 비해 HbA1c가 통계적으로 유의하게 감소했습니다(표 13 참조). JARDIANCE 25mg은 경증 [-0.7(95% CI: -0.9, -0.5)] 또는 중등도 [-0.4(95% CI: -0.6, -0.3)] 신장애 환자와 JARDIANCE 10mg은 경증 [-0.5(95% CI: -0.7, -0.3)] 신장애 환자에서 위약에 비해 통계적으로 유의하게 감소하는 것으로 나타났습니다.
JARDIANCE 25mg의 혈당 강하 효능은 경증에서 중등도 범위에서 신장 기능이 감소함에 따라 감소했습니다. 24주차의 최소 제곱 평균 HbA1c 변화는 기준선 eGFR이 각각 60~90mL/min/1.73m2, 45~60mL/min/1.73m2, 30~45mL/min/1.73m2 미만인 경우 -0.6%, -0.5%, -0.2%였습니다 [투여 및 투약 방법 (2) 및 특정 인구 집단에서의 사용 (8.6) 참조]. 위약의 경우 24주차의 최소 제곱 평균 HbA1c 변화는 기준선 eGFR이 각각 60~90mL/min/1.73m2, 45~60mL/min/1.73m2, 30~45mL/min/1.73m2 미만인 경우 0.1%, -0.1%, 0.2%였습니다.
| 경증 및 중등도 장애b | |
|---|---|
| JARDIANCE 25mg | |
| ap-값 <0.0001 (HbA1c: ANCOVA 모델에는 기준선 HbA1c, 치료, 신장 기능 및 배경 약물이 포함됨) beGFR 30~90mL/min/1.73m2 미만 – 수정된 ITT 모집단. 24주차의 누락된 데이터를 대체하기 위해 시험에서 마지막 관찰 값(LOCF)을 사용했습니다. 24주차에 JARDIANCE 25mg과 위약에 무작위 배정된 환자의 경우 각각 24.6%와 26.2%가 대체되었습니다. |
|
| HbA1c | |
| 환자 수 | n=284 |
| 위약 대비 비교(조정된 평균)(95% CI) | -0.5a (-0.6, -0.4) |
중증 신장애 환자의 경우 HbA1c 및 FPG 변화 분석 결과, JARDIANCE 25mg은 위약과 비교하여 뚜렷한 치료 효과를 보이지 않았습니다. [적응증 및 용법(1), 용법 및 용량(2.1), 2.2) 및 특정 집단에서의 사용(8.6) 참조].
14.2 2형 당뇨병이 있는 10세에서 17세까지의 소아 환자에서의 혈당 조절 시험
DINAMO(NCT03429543)는 JARDIANCE의 효능을 평가하기 위한 26주 이중맹검, 무작위 배정, 위약 대조, 병행군 시험으로, 52주까지 이중맹검 활성 치료 안전성 연장 기간이 있었습니다. 이 시험에는 혈당 조절이 불량한 2형 당뇨병(HbA1c 6.5%~10.5%)이 있는 10세에서 17세까지의 소아 환자가 등록되었습니다. 메트포르민(매일 1,000mg 이상 또는 최대 내약 용량)으로 치료받고 인슐린 치료를 병행하거나 메트포르민 치료에 대한 내약성이 있는 환자를 등록했습니다. 환자는 26주 동안 3개의 치료군(JARDIANCE 10mg, 디펩티딜 펩티다제-4(DPP-4) 억제제 또는 위약)에 무작위 배정되었습니다. 12주차에 HbA1c가 7.0% 미만에 도달하지 못한 JARDIANCE 10mg군 환자는 14주차에 10mg 용량을 유지하거나 25mg으로 증량하기 위해 두 번째 무작위 배정을 받았습니다. 위약군 환자는 26주차에 JARDIANCE 용량(10mg 또는 25mg) 또는 DPP-4 억제제 중 하나로 재무작위 배정되었습니다.
총 157명의 환자가 JARDIANCE(10mg 또는 25mg; N=52), DPP-4 억제제(N=52) 또는 위약(N=53)으로 치료받았습니다. 식이 요법 및 운동에 대한 보조 요법으로 메트포르민(51%), 메트포르민과 인슐린 병용(40.1%), 인슐린(3.2%) 또는 없음(5.7%)이 포함되었습니다. 기준선에서 평균 HbA1c는 8.0%였고 2형 당뇨병의 평균 기간은 2.1년이었습니다. 평균 연령은 14.5세(범위: 10~17세)였으며 51.6%가 15세 이상이었습니다. 백인이 약 50%, 아시아인이 6%, 흑인 또는 아프리카계 미국인이 31%, 히스패닉 또는 라틴 아메리카인이 38%였습니다. 평균 BMI는 36.0 kg/m2였고 평균 BMI Z 점수는 3.0이었습니다. eGFR이 60 mL/min/1.73 m2 미만인 환자는 시험에 등록되지 않았습니다. 연구 대상자의 약 25%가 미세 알부민뇨 또는 거대 알부민뇨를 보였습니다.
26주차에 JARDIANCE로 치료받은 환자는 위약과 비교하여 기준선에서 HbA1c 감소에 있어 우수했습니다(표 14 참조).
| JARDIANCE 10mg 및 25mg |
위약 | |
|---|---|---|
| a수정된 의도적 치료 집단(기준선 측정값이 있는 모든 무작위 배정 및 치료받은 환자). b위약 워시 아웃 접근 방식을 사용하여 500회 반복한 다중 대치. HbA1c에 대한 대치 (Jardiance N=5 (9.6%), 위약 N=3 (5.7%)), FPG에 대한 대치(Jardiance N=4 (8.3%), 위약 N=2 (3.8%)). c기준선 값 및 기준선 연령 계층(< 15세 대 15 세에서 < 18세)으로 조정된 공분산 분석(ANCOVA)의 최소 제곱 평균. d통계적 유의성에 대한 평가 없음, 순차적 검정 절차의 일부가 아님. ep-값=0.0116(양측) |
||
| HbA1c (%)b | ||
| 환자 수 | n=52 | n=53 |
| 기준선(평균) | 8.0 | 8.1 |
| 기준선에서의 변화c | -0.2 | 0.7 |
| 위약과의 차이c (95% CI) | -0.8e (-1.5, -0.2) | — |
| FPG (mg/dL)b,d | ||
| 환자 수 | n=48 | n=52 |
| 기준선(평균) | 154 | 159 |
| 기준선에서의 변화c | -19 | 17 |
| 위약과의 차이c (95% CI) | -36 (-60.7, -10.7) | — |
14.3 2형 당뇨병 및 죽상동맥경화성 심혈관 질환 성인의 심혈관계 결과
JARDIANCE의 심혈관(CV) 위험에 대한 효과는 EMPA-REG OUTCOME 시험에서 평가되었으며, 이 시험은 다기관, 다국적, 무작위 배정, 이중맹검 병행군 시험입니다. 이 시험은 2형 당뇨병 및 확립된 안정적인 죽상동맥경화성 CV 질환이 있는 성인 환자에서 JARDIANCE와 위약을 당뇨병 및 죽상동맥경화성 CV 질환의 표준 치료에 추가하여 동시에 사용했을 때 주요 심혈관계 사건(MACE) 발생 위험을 비교했습니다. 동반되는 항당뇨병 약물은 시험의 첫 12주 동안 안정적으로 유지되어야 했습니다. 그 후, 연구자의 재량에 따라 항당뇨병 및 죽상동맥경화성 치료를 조정하여 참가자가 이러한 질환에 대한 표준 치료를 받도록 할 수 있었습니다.
총 7,020명의 환자가 치료를 받았고(JARDIANCE 10mg = 2,345명; JARDIANCE 25mg = 2,342명; 위약 = 2,333명) 중앙값 3.1년 동안 추적 관찰했습니다. 시험 참여자의 약 72%는 백인, 22%는 아시아인, 5%는 흑인이었습니다. 평균 연령은 63세였으며 약 72%가 남성이었습니다.
시험에 참여한 모든 환자는 기준선에서 2형 당뇨병이 적절히 조절되지 않았습니다(HbA1c가 7% 이상). 기준선에서 평균 HbA1c는 8.1%였으며 참가자의 57%는 10년 이상 당뇨병을 앓았습니다. 약 31%, 22% 및 20%는 각각 연구자에게 신경병증, 망막병증 및 신장병의 과거력을 보고했으며 평균 eGFR은 74 mL/min/1.73 m2였습니다. 기준선에서 환자는 메트포르민(74%), 인슐린(48%) 및 설폰요소(43%)를 포함하여 하나(~30%) 또는 그 이상(~70%)의 항당뇨병 약물로 치료를 받았습니다.
모든 환자는 기준선에서 확립된 죽상동맥경화성 CV 질환을 가지고 있었으며 다음 중 하나(82%) 또는 그 이상(18%)을 포함했습니다. 관상동맥 질환(76%), 뇌졸중(23%) 또는 말초 동맥 질환(21%)의 기록된 병력. 기준선에서 평균 수축기 혈압은 136mmHg, 평균 이완기 혈압은 76mmHg, 평균 LDL은 86mg/dL, 평균 HDL은 44mg/dL, 평균 요중 알부민 대 크레아티닌 비율(UACR)은 175mg/g였습니다. 기준선에서 약 81%의 환자가 레닌 안지오텐신 시스템 억제제, 65%가 베타 차단제, 43%가 이뇨제, 77%가 스타틴, 86%가 항혈소판제(주로 아스피린)로 치료를 받았습니다.
EMPA-REG OUTCOME의 주요 종료점은 주요 심혈관계 사건(MACE)의 첫 발생 시간이었습니다. 주요 심혈관계 사건은 CV 사망 또는 비치명적인 심근 경색(MI) 또는 비치명적인 뇌졸중의 발생으로 정의되었습니다. 통계 분석 계획은 10mg 및 25mg 용량을 결합한다고 사전에 지정했습니다. MACE의 위험 비율에 대한 1.3의 사전 지정된 위험 한계에 대해 비열등성을 검정하고 비열등성이 입증되면 MACE에 대한 우월성을 검정하기 위해 Cox 비례 위험 모델을 사용했습니다. 계층적 검정 전략을 사용하여 다중 검정에 걸쳐 1종 오류를 제어했습니다.
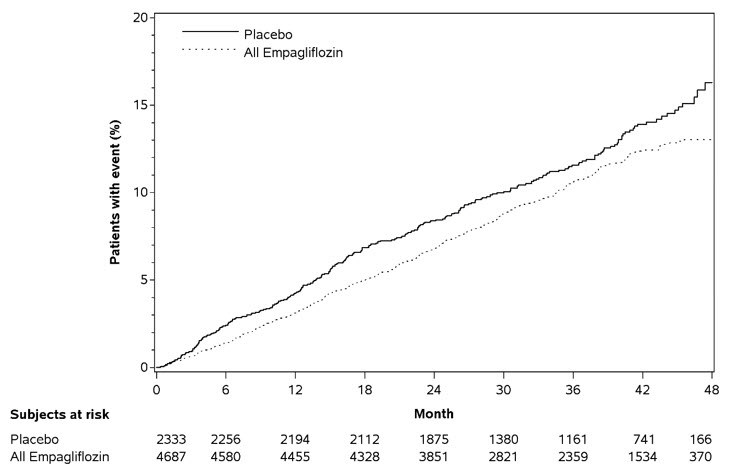
JARDIANCE는 CV 사망, 비치명적인 심근 경색 또는 비치명적인 뇌졸중의 주요 복합 종료점의 첫 발생 위험을 유의하게 감소시켰습니다(HR: 0.86; 95% CI: 0.74, 0.99). 치료 효과는 에파글리플로진을 무작위 배정받은 대상자에서 CV 사망 위험의 유의한 감소(HR: 0.62; 95% CI: 0.49, 0.77)로 인한 것이었으며, 비치명적인 심근 경색 또는 비치명적인 뇌졸중 위험에는 변화가 없었습니다(표 15 및 그림 5 및 6 참조). 10mg 및 25mg 에파글리플로진 용량에 대한 결과는 결합된 용량 그룹에 대한 결과와 일치했습니다.
| 위약 N=2,333 |
JARDIANCE N=4,687 |
위약 대비 위험 비율 (95% CI) |
|
|---|---|---|---|
| a치료 집합(시험 약물을 적어도 1회 이상 투여받은 환자) b우월성에 대한 p-값(양측) 0.04 c총 사건 수 |
|||
| CV 사망, 비치명적인 심근 경색, 비치명적인 뇌졸중의 복합(첫 발생 시간)b | 282 (12.1%) | 490 (10.5%) | 0.86 (0.74, 0.99) |
| 비치명적인 심근 경색c | 121 (5.2%) | 213 (4.5%) | 0.87 (0.70, 1.09) |
| 비치명적인 뇌졸중c | 60 (2.6%) | 150 (3.2%) | 1.24 (0.92, 1.67) |
| CV 사망c | 137 (5.9%) | 172 (3.7%) | 0.62 (0.49, 0.77) |
 |
 |
JARDIANCE의 CV 사망에 대한 효능은 주요 인구 통계 및 질병 하위 그룹에서 일반적으로 일관되었습니다.
시험에서 대상자의 99.2%에 대한 생존 상태가 확인되었습니다. EMPA-REG OUTCOME 시험 중에 총 463건의 사망이 기록되었습니다. 이러한 사망의 대부분은 CV 사망으로 분류되었습니다. 비-CV 사망은 사망의 매우 작은 비율이었으며 치료 그룹 간에 균형을 이루었습니다(JARDIANCE로 치료받은 환자의 경우 2.1%, 위약으로 치료받은 환자의 경우 2.4%).
14.4 성인의 심부전 시험
EMPEROR-Reduced(NCT03057977)는 좌심실 박출 분율(LVEF) ≤40%인 만성 심부전(뉴욕 심장 협회[NYHA] 기능 등급 II-IV) 성인을 대상으로 표준 심부전 치료에 대한 보조제로서 JARDIANCE의 효능을 평가하기 위해 실시된 이중맹검 시험이었습니다.
3,730명의 환자 중 1,863명이 JARDIANCE 10mg에 무작위 배정되었고 1,867명이 위약에 무작위 배정되었으며 중앙값 16개월 동안 추적 관찰되었습니다. 시험 모집단의 평균 연령은 67세(범위: 25~94세)였으며 남성이 76%, 여성이 24%, 75세 이상이 27%였습니다. 시험 모집단의 약 71%는 백인, 18%는 아시아인, 7%는 흑인 또는 아프리카계 미국인이었습니다. 기준선에서 환자의 50%는 2형 당뇨병을 앓고 있었습니다.
무작위 배정 시 환자의 75%는 NYHA 등급 II, 24%는 등급 III, 0.5%는 등급 IV였습니다. 평균 LVEF는 28%였습니다. 기준선에서 평균 eGFR은 62 mL/min/1.73 m2였으며 중앙값 소변 알부민 대 크레아티닌 비율(UACR)은 22 mg/g였습니다. 환자의 약 절반(52%)은 eGFR이 60 mL/min/1.73 m2 이상이었고, 24%는 eGFR이 45~60 mL/min/1.73 m2 미만이었고, 19%는 eGFR이 30~45 mL/min/1.73 m2 미만이었고, 5%는 eGFR이 20~30 mL/min/1.73 m2 미만이었습니다.
기준선에서 환자의 88%는 안지오텐신 전환 효소(ACE) 억제제, 안지오텐신 수용체 차단제(ARB) 또는 안지오텐신 수용체-네프릴리신 억제제(ARNI)로 치료받았고, 95%는 베타 차단제로, 71%는 미네랄 코르티코이드 수용체 길항제(MRA)로, 95%는 이뇨제로 치료받았습니다.
주요 종료점은 심혈관(CV) 사망 또는 심부전 입원(HHF) 중 첫 번째 사건 발생까지의 시간이었습니다. 첫 번째 및 재발성 HHF는 주요 2차 종료점으로 평가되었습니다.
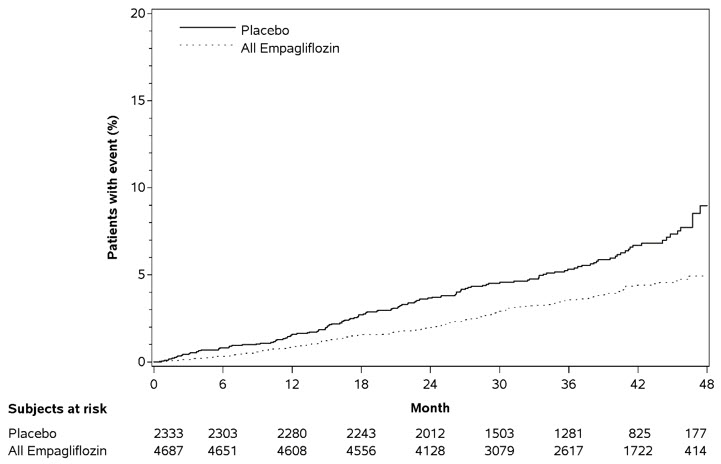
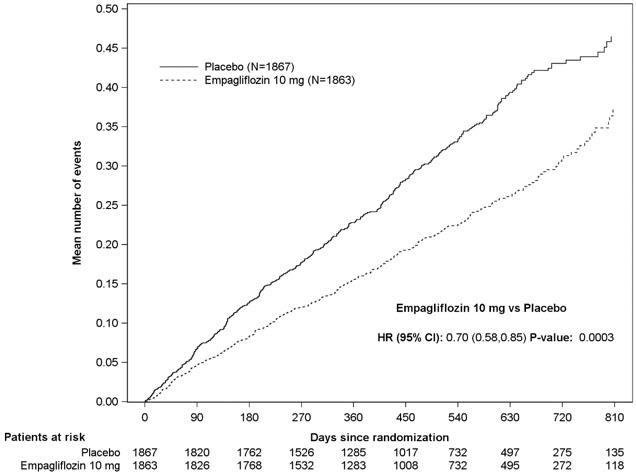
JARDIANCE는 위약과 비교하여 심혈관 사망 또는 심부전 입원의 주요 복합 종료점 위험을 감소시키는 데 우수했으며, 이는 주로 심부전 입원 감소를 통해 이루어졌습니다. JARDIANCE는 첫 번째 및 재발성 HHF 위험을 감소시켰습니다(표 16 및 그림 7 및 8 참조).
| 위약 N=1,867 |
JARDIANCE 10 mg N=1,863 |
위약 대비 위험 비율 (95% CI) |
p-값 | |
|---|---|---|---|---|
| 환자 수 (%) | ||||
| a첫 번째 사건 발생까지의 시간 b입원 후 사망 포함 cCV 사망을 고려한 공동 취약성 모델 |
||||
| CV 사망 또는 HHFa | 462 (24.7%) | 361 (19.4%) | 0.75 (0.65, 0.86) | <0.0001 |
| CV 사망a,b | 202 (10.8%) | 187 (10.0%) | 0.92 (0.75, 1.12) | |
| HHFa | 342 (18.3%) | 246 (13.2%) | 0.69 (0.59, 0.81) | |
| 사건 수 | ||||
| 첫 번째 및 재발성 HHFc | 553 | 388 | 0.70 (0.58, 0.85) | 0.0003 |
그림 7 심혈관 사망 또는 심부전 입원의 일차 복합 종말점 발생까지의 시간
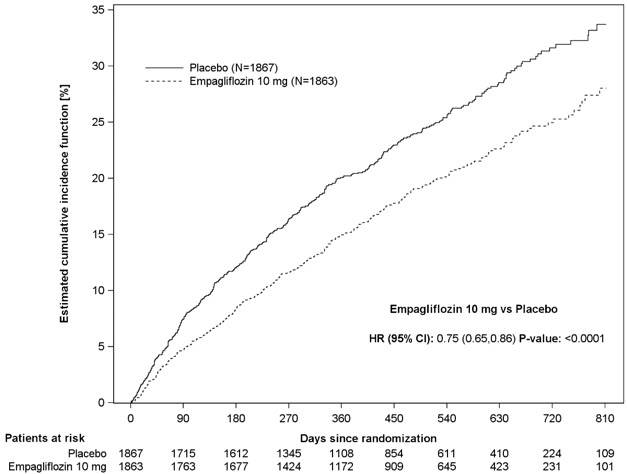
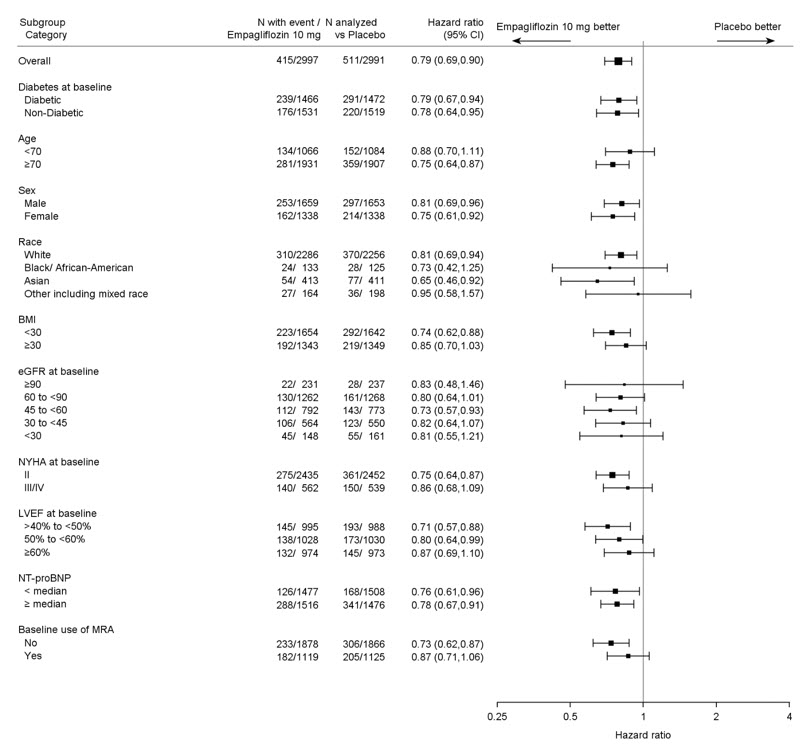
일차 복합 종말점의 결과는 사전에 지정된 하위 그룹에서 일반적으로 일관되었습니다(그림 9 참조).
그림 9 일차 복합 종말점(심혈관 사망 및 심부전 입원) 하위 그룹 분석(EMPEROR-Reduced)
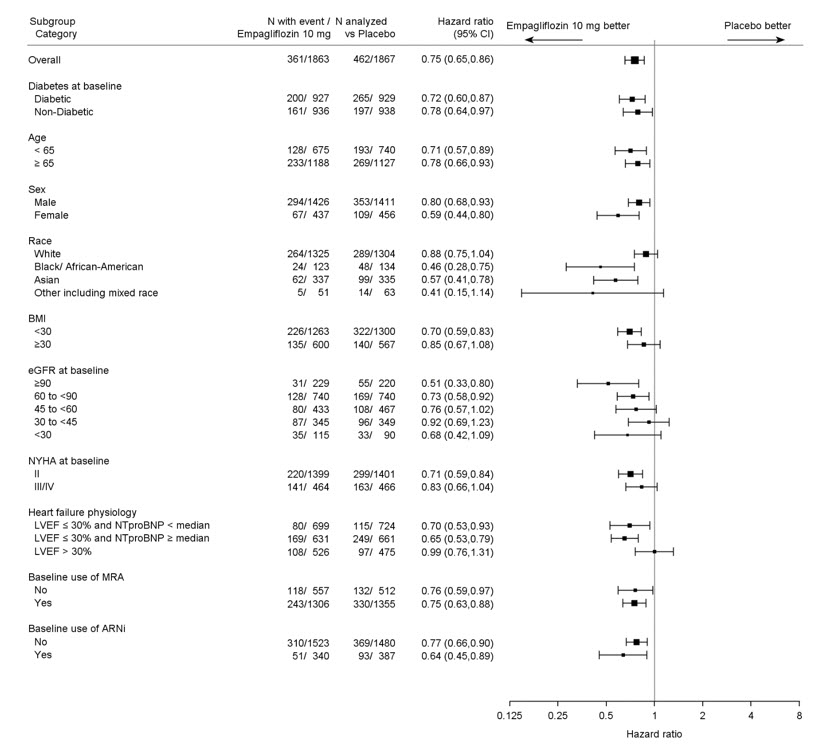
LVEF >30%: 중간 NT-proBNP 이상 및 미만 모두 포함됩니다. LVEF >30%인 환자는 LVEF ≤30%인 환자보다 더 높은 NT-proBNP 임계값을 충족해야 합니다. 단, 지난 12개월 이내에 HHF 병력이 있는 경우는 예외입니다.
EMPEROR-Preserved(NCT03057951)는 LVEF >40%인 만성 심부전 NYHA Class II-IV 환자를 대상으로 표준 치료 요법에 대한 보조 요법으로 JARDIANCE의 효능을 평가하기 위해 실시된 이중맹검 시험입니다.
5,988명의 환자 중 2,997명은 JARDIANCE 10mg에 무작위 배정되었고 2,991명은 위약에 무작위 배정되었으며 중간 26개월 동안 추적 관찰되었습니다. 시험군의 평균 연령은 72세(범위: 22~100세)였으며 남성이 55%, 여성이 45%, 75세 이상이 43%였습니다. 시험군의 약 76%는 백인, 14%는 아시아인, 4%는 흑인 또는 아프리카계 미국인이었습니다.
무작위 배정 시 환자의 82%는 NYHA class II, 18%는 class III, 0.3%는 class IV였습니다. EMPEROR-Preserved 시험군에는 LVEF <50%(33.1%), LVEF 50~<60%(34.4%) 및 LVEF ≥60%(32.5%)인 환자가 포함되었습니다. 기준선에서 평균 eGFR은 61 mL/min/1.73 m2였고 중간 소변 알부민 대 크레아티닌 비율(UACR)은 21 mg/g였습니다. 환자의 약 절반(50%)은 eGFR이 60 mL/min/1.73 m2 이상이었고, 26%는 eGFR이 45~60 mL/min/1.73 m2 미만이었고, 19%는 eGFR이 30~45 mL/min/1.73 m2 미만이었고, 5%는 eGFR이 20~30 mL/min/1.73 m2 미만이었습니다.
기준선에서 환자의 81%는 ACE 억제제, ARB 또는 ARNI로 치료받았고, 86%는 베타 차단제로 치료받았고, 38%는 MRA로 치료받았고, 86%는 이뇨제로 치료받았습니다.
일차 종말점은 심혈관 사망 또는 HHF 발생까지의 시간이었습니다. 최초 및 재발 HHF는 주요 이차 종말점으로 평가되었습니다.
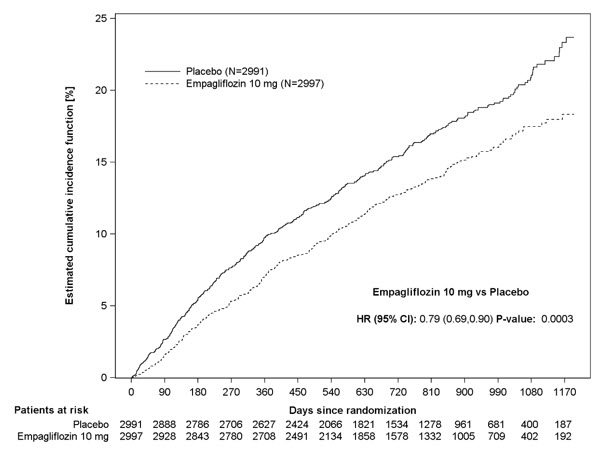
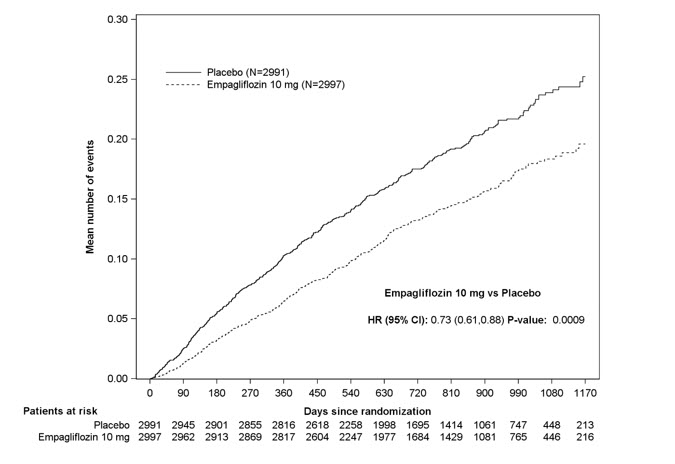
JARDIANCE는 위약과 비교하여 일차 복합 종말점 위험을 줄이는 데 우수했으며, 이는 주로 심부전 입원 감소를 통해 이루어졌습니다. JARDIANCE는 최초 및 재발 HHF 위험을 감소시켰습니다(표 17 및 그림 10 및 11 참조).
| 위약 N=2,991 |
JARDIANCE 10 mg N=2,997 |
위약 대비 위험 비율 (95% CI) |
p-값 | |
|---|---|---|---|---|
| 환자 수 (%) | ||||
| a최초 발생까지의 시간 b입원 후 사망 포함 c심혈관 사망을 고려한 공동 취약성 모델 |
||||
| 심혈관 사망 또는 HHFa | 511 (17.1%) | 415 (13.8%) | 0.79 (0.69, 0.90) | 0.0003 |
| 심혈관 사망a,b | 244 (8.2%) | 219 (7.3%) | 0.91 (0.76, 1.09) | |
| HHFa | 352 (11.8%) | 259 (8.6%) | 0.71 (0.60, 0.83) | |
| 사건 수 | ||||
| 최초 및 재발 HHFc | 541 | 407 | 0.73 (0.61, 0.88) | 0.0009 |
그림 10 심혈관 사망 또는 심부전 입원의 일차 복합 종말점 발생까지의 시간
일차 복합 종말점의 결과는 사전에 지정된 하위 그룹에서 일관되었습니다(그림 12 참조).
그림 12 일차 복합 종말점(심혈관 사망 또는 심부전 입원) 하위 그룹 분석에 대한 치료 효과(EMPEROR-보존)
14.5 성인의 만성 신장 질환 시험
EMPA-KIDNEY(NCT03594110)는 만성 신장 질환(eGFR ≥20 to <45 mL/min/1.73 m2; 또는 eGFR ≥45 to <90 mL/min/1.73 m2 with urine albumin to creatinine ratio [UACR] ≥200 mg/g)이 있는 성인을 대상으로 실시된 무작위 배정, 이중 맹검, 위약 대조 시험이었습니다. 이 시험은 다낭성 신장 질환 환자 또는 선별 검사 시점에 이전 3개월 동안 정맥 내 면역 억제 요법을 받았거나 >45 mg의 프레드니손(또는 동등한 양)을 복용한 환자를 제외했습니다. 이 시험의 일차 목표는 적절한 경우 RAS 억제제 요법을 포함한 표준 치료 요법에 부가하여 엠파글리플로진의 효과를 신장 질환 진행 또는 심혈관 사망까지의 시간에 대해 평가하는 것이었습니다.
총 6,609명의 환자가 JARDIANCE 10 mg 또는 위약에 무작위 배정되었으며 중앙값 24개월 동안 추적 관찰되었습니다.
연구 대상자의 평균 연령은 63세(범위: 18~94세)였으며 67%가 남성이었습니다. 연구 대상자의 약 58%는 백인, 36%는 아시아인, 4%는 흑인 또는 아프리카계 미국인이었습니다. 연구 대상자의 약 44%는 2형 당뇨병을 앓고 있었습니다.
기준선에서 평균 eGFR은 37 mL/min/1.73 m2였으며, 환자의 21%는 eGFR이 45 mL/min/1.73 m2 이상이었고, 44%는 eGFR이 30~45 mL/min/1.73 m2 미만이었으며, 35%는 eGFR이 30 mL/min/1.73 m2 미만이었습니다. 중앙값 UACR은 329 mg/g였으며, 환자의 20%는 UACR이 <30 mg/g였고, 28%는 UACR이 30~≤300mg/g였고, 52%는 UACR이 >300 mg/g였습니다. 기준선에서 환자의 약 1%는 1형 당뇨병을 앓고 있었습니다. CKD의 가장 흔한 원인은 당뇨병성 신증/당뇨병성 신장 질환(31%), 사구체 질환(25%), 고혈압/신혈관 질환(22%) 및 기타/알 수 없는 원인(22%)이었습니다.
기준선에서 환자의 85%는 ACE 억제제 또는 ARB로, 64%는 스타틴으로, 34%는 항혈소판제로 치료받았습니다.
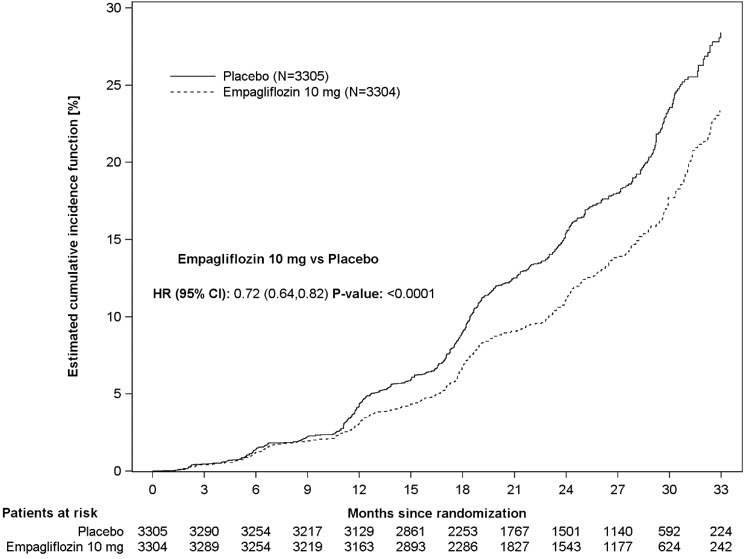
JARDIANCE는 지속적인 ≥40% eGFR 감소, 지속적인 eGFR <10 mL/min/1.73 m2, 말기 신장 질환으로의 진행 또는 심혈관 또는 신장 사망의 일차 복합 종말점 위험을 줄이는 데 위약보다 우수했습니다. 치료 효과는 지속적인 ≥40% eGFR 감소, 지속적인 eGFR <10 mL/min/1.73 m2, 말기 신장 질환으로의 진행 및 심혈관 사망 감소를 반영했습니다. 이 시험 동안 신장 사망은 거의 발생하지 않았습니다. JARDIANCE는 또한 최초 및 재발 입원 위험을 감소시켰습니다(표 18 및 그림 13 참조); 입원 사유에 대한 수집된 정보는 이점을 더 자세히 특성화하기에 충분하지 않았습니다.
| 위약 N=3,305 |
JARDIANCE 10 mg N=3,304 |
위약 대비 위험 비율 (95% CI) |
p-값 | |
|---|---|---|---|---|
| CV=심혈관, eGFR=추정 사구체 여과율, ESKD=말기 신장 질환 | ||||
| aESKD는 유지 요법 혈액 투석 시작 또는 신장 이식을 받은 것으로 정의됩니다. | ||||
| b신장 사망 사례가 너무 적어 신뢰할 수 있는 위험 비율을 계산할 수 없었습니다. | ||||
| c입원 사유에 대한 수집된 정보는 이점을 더 자세히 특성화하기에 충분하지 않았습니다. | ||||
| 환자 수 (%) | ||||
| 지속적인 ≥40% eGFR 감소, 지속적인 eGFR <10 mL/min/1.73 m2, ESKDa 또는 심혈관 또는 신장 사망의 복합(최초 발생까지의 시간) | 558 (16.9) | 432 (13.1) | 0.72 (0.64, 0.82) | <0.0001 |
| 지속적인 ≥40% eGFR 감소 | 474 (14.3) | 359 (10.9) | 0.70 (0.61, 0.81) | |
| ESKDa 또는 지속적인 eGFR <10 mL/min/1.73 m2 | 221 (6.7) | 157 (4.8) | 0.69 (0.56, 0.84) | |
| 신장 사망b | 4 (0.1) | 4 (0.1) | ||
| 심혈관 사망 | 69 (2.1) | 59 (1.8) | 0.84 (0.60, 1.19) | |
| 사건 수 | ||||
| 최초 및 재발 입원c | 1,895 | 1,611 | 0.86 (0.78, 0.95) | 0.0025 |
그림 13 1차 복합 종점, 지속적인 ≥40% eGFR 감소, 지속적인 eGFR <10 mL/min/1.73 m2, ESKD 또는 신장 사망 또는 심혈관 사망 발생까지의 시간
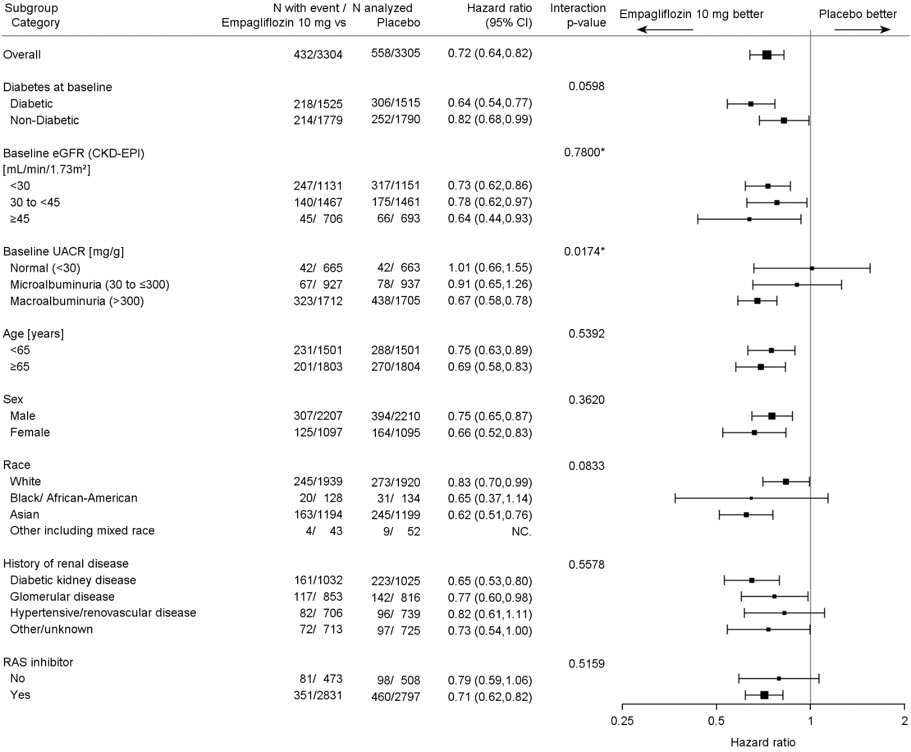
1차 복합 종점 결과는 eGFR 범주, 신장 질환의 기저 원인, 당뇨병 상태 또는 RAS 억제제의 배경 사용을 포함하여 사전에 지정된 하위 그룹에서 일반적으로 일관되었습니다( 그림 14 참조). JARDIANCE의 1차 복합 종점에 대한 치료 효과는 알부민뇨 수치가 매우 낮은 환자에게는 나타나지 않았지만, 이러한 환자에서는 사건 수가 적었습니다.
그림 14 1차 복합 종점(지속적인 ≥40% eGFR 감소, 지속적인 eGFR <10 mL/min/1.73 m2, ESKD 또는 신장 사망 또는 심혈관 사망) 하위 그룹 분석(EMPA-KIDNEY)
*=경향 검정
16 제공/보관 및 취급 방법
JARDIANCE 정제는 다음과 같이 제공됩니다.
10 mg 정제: 옅은 노란색의 원형, 양면 볼록형, 베벨-엣지 필름 코팅 정제로 한쪽 면에는 “S 10″이, 다른 쪽 면에는 베링거 인겔하임 회사 심볼이 새겨져 있습니다.
30정 병 (NDC 0597-0152-30)
90정 병 (NDC 0597-0152-90)
10정 블리스터 카드 3개가 들어 있는 상자 (3 × 10) (NDC 0597-0152-37), 기관용 팩.
25 mg 정제: 옅은 노란색의 타원형, 양면 볼록형 필름 코팅 정제로 한쪽 면에는 “S 25″가, 다른 쪽 면에는 베링거 인겔하임 회사 심볼이 새겨져 있습니다.
30정 병 (NDC 0597-0153-30)
90정 병 (NDC 0597-0153-90)
10정 블리스터 카드 3개가 들어 있는 상자 (3 × 10) (NDC 0597-0153-37), 기관용 팩.
USP에 정의된 대로 잘 닫힌 용기에 담아 보관하십시오.
보관
20°C ~ 25°C(68°F ~ 77°F)에서 보관하십시오. 15°C ~ 30°C(59°F ~ 86°F)까지의 일시적인 온도 변화는 허용됩니다. [USP Controlled Room Temperature 참조].
17 환자 상담 정보
FDA 승인 환자 라벨(약물 안내)을 읽도록 환자에게 알려주십시오.
1형 당뇨병 환자 및 기타 케톤산증 환자의 당뇨병성 케톤산증
1형 당뇨병 환자의 경우, JARDIANCE를 사용하면 생명을 위협하는 당뇨병성 케톤산증의 위험이 증가할 수 있으며, 치명적인 케톤산증이 발생했다는 점을 알려주십시오. 다른 모든 환자의 경우, JARDIANCE는 잠재적으로 치명적인 케톤산증을 유발할 수 있으며, 2형 당뇨병 및 췌장 장애(예: 췌장염 병력 또는 췌장 수술)는 위험 요소임을 알려주십시오.
모든 환자에게 케톤산증의 유발 요인(예: 인슐린 용량 감소 또는 인슐린 용량 누락, 감염, 칼로리 섭취 감소, 케토제닉 식단, 수술, 탈수, 알코올 남용) 및 케톤산증의 증상(예: 메스꺼움, 구토, 복통, 피로, 숨가쁨)에 대해 교육하십시오. 케톤산증이 있는 경우에도 혈당 수치가 정상일 수 있음을 환자에게 알려주십시오.
환자에게 케톤을 모니터링하도록 요청받을 수 있음을 알려주십시오. 케톤산증 증상이 나타나면 환자에게 JARDIANCE를 중단하고 즉시 의사의 진료를 받도록 지시하십시오 [경고 및 주의 사항(5.1) 참조].
용량 감소
환자에게 JARDIANCE를 사용하면 증상성 저혈압이 발생할 수 있음을 알려주고, 이러한 증상이 나타나면 의료 서비스 제공자에게 연락하도록 조언하십시오 [경고 및 주의 사항(5.2) 참조]. 탈수는 저혈압 위험을 증가시킬 수 있으므로 환자에게 충분한 수분을 섭취하도록 알려주십시오.
심각한 요로 감염
환자에게 심각할 수 있는 요로 감염의 가능성을 알려주십시오. 요로 감염의 증상에 대한 정보를 제공하십시오. 이러한 증상이 나타나면 의사의 진료를 받도록 조언하십시오 [경고 및 주의 사항(5.3) 참조].
저혈당
환자에게 JARDIANCE를 인슐린 분비 촉진제 또는 인슐린과 함께 사용하면 저혈당이 보고되었다고 알려주십시오. 저혈당은 동반 당뇨병 치료와 관계없이 소아 환자에게 발생할 수 있습니다. 환자 또는 보호자에게 저혈당의 징후와 증상에 대해 교육하십시오 [경고 및 주의 사항(5.4) 참조].
회음부 괴사성 근막염(푸르니에 괴사)
환자에게 JARDIANCE를 사용하면 회음부 괴사성 감염(푸르니에 괴사)이 발생했다고 알려주십시오. 환자에게 생식기 또는 생식기에서 항문까지의 부위에 통증 또는 압통, 발적 또는 부종과 함께 100.4°F 이상의 발열 또는 권태감이 나타나면 즉시 의사의 진료를 받도록 조언하십시오 [경고 및 주의 사항(5.5) 참조].
여성의 생식기 진균 감염(예: 외음 질염)
여성 환자에게 질 효모 감염이 발생할 수 있음을 알려주고, 질 효모 감염의 징후와 증상에 대한 정보를 제공하십시오. 치료 옵션과 의사의 진료를 받아야 할 때를 알려주십시오 [경고 및 주의 사항(5.6) 참조].
남성의 생식기 진균 감염(예: 포경염 또는 포경두염)
남성 환자에게 특히 포경하지 않은 남성과 만성 및 재발성 감염 환자의 경우 음경 효모 감염(예: 포경염 또는 포경두염)이 발생할 수 있음을 알려주십시오. 포경염 및 포경두염의 징후와 증상(음경 귀두 또는 포피의 발진 또는 발적)에 대한 정보를 제공하십시오. 치료 옵션과 의사의 진료를 받아야 할 때를 알려주십시오 [경고 및 주의 사항(5.6) 참조].
하퇴 절단
환자에게 일상적인 예방적 발 관리의 중요성을 알려주십시오. 환자에게 다리 또는 발에 새로운 통증 또는 압통, 궤양 또는 궤양, 또는 감염이 발생하는지 모니터링하고 이러한 징후 또는 증상이 나타나면 즉시 의사의 진료를 받도록 지시하십시오 [경고 및 주의 사항(5.7) 참조].
과민 반응
환자에게 JARDIANCE를 사용하면 두드러기 및 혈관 부종과 같은 심각한 과민 반응이 보고되었다고 알려주십시오. 환자에게 피부 반응 또는 혈관 부종이 나타나면 즉시 보고하고 처방 의료 서비스 제공자와 상담할 때까지 약물을 중단하도록 조언하십시오 [경고 및 주의 사항(5.8) 참조].
임신
임산부 및 임신 가능성이 있는 환자에게 JARDIANCE를 사용하면 태아에게 위험이 발생할 수 있음을 알려주십시오 [특정 인구 집단에서의 사용(8.1) 참조]. 환자에게 임신 사실을 가능한 한 빨리 의료 서비스 제공자에게 보고하도록 지시하십시오.
복용량 누락
환자에게 JARDIANCE를 처방대로만 복용하도록 지시하십시오. 복용량을 누락한 경우 기억하는 대로 즉시 복용해야 합니다. 환자에게 다음 복용량을 두 배로 복용하지 말라고 조언하십시오 [복용량 및 투여(2.3) 참조].
SPL 미분류 섹션
판매원:
Boehringer Ingelheim Pharmaceuticals, Inc.
Ridgefield, CT 06877 USA
마케팅:
Boehringer Ingelheim Pharmaceuticals, Inc.
Ridgefield, CT 06877 USA
및
Eli Lilly and Company
Indianapolis, IN 46285 USA
라이선스:
Boehringer Ingelheim International GmbH, Ingelheim, Germany
JARDIANCE는 Boehringer Ingelheim International GmbH의 등록 상표이며 라이선스 하에 사용됩니다.
Boehringer Ingelheim Pharmaceuticals, Inc.는 EMPA-REG OUTCOME®, EMPEROR-Reduced®, EMPEROR-Preserved®, 및 EMPA-KIDNEY® 상표를 소유하거나 라이선스 하에 사용합니다.
나열된 다른 브랜드는 각 소유자의 상표이며 Boehringer Ingelheim Pharmaceuticals, Inc.의 상표가 아닙니다.
Copyright © 2023 Boehringer Ingelheim International GmbH
모든 권리 보유
COL8914OI212023
SPL8934K
약물 안내문
| This Medication Guide has been approved by the U.S. Food and Drug Administration. | Revised: September 2023 | |||
| MEDICATION GUIDE JARDIANCE® (jar DEE ans) (empagliflozin tablets) for oral use |
||||
| What is the most important information I should know about JARDIANCE? JARDIANCE can cause serious side effects, including:
|
||||
|
|
|||
|
||||
|
|
|||
| Talk to your healthcare provider about what to do if you get symptoms of a yeast infection of the vagina or penis. Your healthcare provider may suggest you use an over-the-counter antifungal medicine. Talk to your healthcare provider right away if you use an over-the-counter antifungal medication and your symptoms do not go away. | ||||
| What is JARDIANCE? JARDIANCE is a prescription medicine used to:
JARDIANCE is not for use to lower blood sugar (glucose) in people with type 1 diabetes. It may increase their risk of diabetic ketoacidosis (increased ketones in blood or urine). |
||||
| JARDIANCE를 복용해서는 안 되는 사람은 누구입니까? 다음과 같은 경우 JARDIANCE를 복용하지 마십시오.
|
||||
| JARDIANCE를 복용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? JARDIANCE를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. 처방약과 일반 의약품, 비타민, 허브 보충제를 포함합니다. |
||||
JARDIANCE는 어떻게 복용해야 합니까?
|
||||
| JARDIANCE의 가능한 부작용은 무엇입니까? JARDIANCE는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
||||
|
|
|
|
|
|
||||
|
|
|
||
JARDIANCE의 가장 흔한 부작용은 다음과 같습니다.
이것들은 JARDIANCE의 모든 가능한 부작용이 아닙니다. 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. |
||||
JARDIANCE는 어떻게 보관해야 합니까?
|
||||
| JARDIANCE의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. JARDIANCE는 처방되지 않은 질환에 사용하지 마십시오. JARDIANCE를 다른 사람에게 주지 마십시오. 같은 증상이 있어도 해로울 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위한 JARDIANCE에 대한 정보를 요청할 수 있습니다. |
||||
| JARDIANCE의 성분은 무엇입니까? 활성 성분: empagliflozin 비활성 성분: 콜로이드성 실리카, 크로스카멜로스나트륨, 히드록시프로필셀룰로스, 유당일수화물, 마그네슘스테아레이트 및 미결정셀룰로스. 또한 필름 코팅에는 다음과 같은 비활성 성분이 포함되어 있습니다. 히프로멜로스, 폴리에틸렌글리콜, 활석, 이산화티타늄 및 황색 산화철. 판매원: Boehringer Ingelheim Pharmaceuticals, Inc.; Ridgefield, CT 06877 USA 판매원: Boehringer Ingelheim Pharmaceuticals, Inc.; Ridgefield, CT 06877 USA 및 Eli Lilly and Company, Indianapolis, IN 46285 USA 라이선스 제공: Boehringer Ingelheim International GmbH, Ingelheim, Germany JARDIANCE는 Boehringer Ingelheim International GmbH의 등록 상표이며 라이선스 하에 사용됩니다. Boehringer Ingelheim Pharmaceuticals, Inc.는 EMPA-REG OUTCOME®, EMPEROR-Reduced®, EMPEROR-Preserved® 및 EMPA-KIDNEY® 상표를 소유하거나 라이선스 하에 사용합니다. 나열된 다른 브랜드는 해당 소유자의 상표이며 Boehringer Ingelheim Pharmaceuticals, Inc.의 상표가 아닙니다. Copyright © 2023 Boehringer Ingelheim International GmbH 모든 권리 보유 COL8914OI212023 JARDIANCE에 대한 자세한 내용은 현재 처방 정보 및 의약품 안내서를 포함하여 www.jardiance.com을 방문하거나 코드를 스캔하거나 Boehringer Ingelheim Pharmaceuticals, Inc.에 1-800-542-6257로 전화하십시오.
|
||||
주요 표시면 – 10mg 정제 블리스터 카드 상자
NDC 0597-0152-37
동봉된 약물 안내서와 함께 제공하십시오
Jardiance®
(empagliflozin tablets)
10 mg
이 단일 용량 포장은 어린이 보호 기능이 없습니다. 외래 환자에게 제공되는 경우, 어린이 보호 용기가 사용되어야 합니다.
처방전에 의해서만
30 정
3개의 블리스터 카드. 각 카드에는 10정이 들어 있습니다.
Boehringer
Ingelheim
Lilly
주요 표시면 – 25mg 정제 블리스터 카드 상자
NDC 0597-0153-37
동봉된 약물 안내와 함께 제공하십시오
Jardiance®
(empagliflozin tablets)
25 mg
이 단일 용량 포장은 어린이 안전 포장이 아닙니다. 외래 환자에게 제공되는 경우, 어린이 안전 용기를 사용해야 합니다.
처방전에 의해서만
30 정
3개의 블리스터 카드. 각 카드에는 10정이 들어 있습니다.
Boehringer
Ingelheim
Lilly