의약품 제조업체: Merck Sharp & Dohme LLC (Updated: 2024-11-14)
처방 정보의 주요 내용
JANUVIA® (시타글립틴) 정제, 경구용
미국 최초 승인: 2006
적응증 및 용법
용법 및 용량
제형 및 강도
정제: 100mg, 50mg 및 25mg (3)
경고 및 주의사항
- 췌장염: 치명적인 혈액 또는 괴사성 췌장염을 포함한 급성 췌장염에 대한 시판 후 보고가 있습니다. 췌장염이 의심되는 경우 JANUVIA를 즉시 중단하십시오. (5.1)
- 심부전: DPP-4 억제제 계열의 다른 두 가지 약물에서 심부전이 관찰되었습니다. 심부전 위험 요인이 있는 환자의 경우 JANUVIA의 위험과 이점을 고려하십시오. 환자의 징후와 증상을 모니터링하십시오. (5.2)
- 급성 신부전: 시판 후 보고되었으며, 때로는 투석이 필요했습니다. JANUVIA 투여를 시작하기 전과 그 후 주기적으로 신장 기능 평가를 권장합니다. (5.3)
- 인슐린 또는 인슐린 분비 촉진제와 병용 시 저혈당증: 인슐린 및/또는 인슐린 분비 촉진제와 병용 시 저혈당증 위험이 증가합니다. 인슐린 또는 인슐린 분비 촉진제의 용량을 줄일 필요가 있을 수 있습니다. (5.4, 7.1)
- 과민반응: 아나필락시스, 안젤오에데마 및 스티븐스-존슨 증후군을 포함한 박탈성 피부 질환과 같은 JANUVIA로 치료받은 환자에서 심각한 알레르기 및 과민반응에 대한 시판 후 보고가 있습니다. JANUVIA를 즉시 중단하고 다른 잠재적 원인을 평가하며 적절한 모니터링 및 치료를 실시하십시오. (5.5, 6.2)
- 중증 및 장애성 관절통: DPP-4 억제제를 복용하는 환자에게서 보고되었습니다. 중증 관절통의 가능한 원인으로 고려하고 적절한 경우 약물을 중단하십시오. (5.6)
- 수포성 박리성 피부염: DPP-4 억제제를 복용하는 환자에서 입원이 필요한 시판 후 보고가 있습니다. 환자에게 수포 또는 침식이 발생하면 보고하도록 알리십시오. 수포성 박리성 피부염이 의심되는 경우 JANUVIA를 중단하십시오. (5.7)
유해 반응
JANUVIA로 치료받은 환자의 ≥5%에서 보고되었고 위약으로 치료받은 환자보다 더 흔하게 나타난 유해 반응은 상기도 감염, 비인두염 및 두통입니다. 설폰요소제 추가 및 인슐린 추가 연구에서 저혈당증 또한 위약에 비해 JANUVIA로 치료받은 환자에게서 더 흔하게 보고되었습니다. (6.1)
의심되는 유해 반응을 보고하려면 Merck Sharp & Dohme LLC에 1-877-888-4231 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 문의하십시오.
환자에 대한 정보 및 의약품 안내서에 대해서는 17항을 참조하십시오.
개정: 2023년 7월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법 (INDICATIONS AND USAGE)
2 용량 및 투여 (DOSAGE AND ADMINISTRATION)
2.1 권장 용량 (Recommended Dosing)
2.2 신장애 환자에 대한 권장 사항 (Recommendations for Use in Renal Impairment)
3 제형 및 함량 (DOSAGE FORMS AND STRENGTHS)
4 금기 (CONTRAINDICATIONS)
5 경고 및 주의사항 (WARNINGS AND PRECAUTIONS)
5.1 췌장염 (Pancreatitis)
5.2 심부전 (Heart Failure)
5.3 급성 신부전 (Acute Renal Failure)
5.4 인슐린 또는 인슐린 분비촉진제와 병용 시 저혈당증 (Hypoglycemia with Concomitant Use with Insulin or Insulin Secretagogues)
5.5 과민 반응 (Hypersensitivity Reactions)
5.6 중증 및 장애를 유발하는 관절통 (Severe and Disabling Arthralgia)
5.7 수포성 유천포창 (Bullous Pemphigoid)
6 이상반응 (ADVERSE REACTIONS)
6.1 임상시험 경험 (Clinical Trials Experience)
6.2 시판 후 경험 (Postmarketing Experience)
7 약물 상호작용 (DRUG INTERACTIONS)
7.1 인슐린 분비촉진제 또는 인슐린 (Insulin Secretagogues or Insulin)
8 특정 집단에서의 사용 (USE IN SPECIFIC POPULATIONS)
8.1 임신 (Pregnancy)
8.2 수유 (Lactation)
8.4 소아에서의 사용 (Pediatric Use)
8.5 노인에서의 사용 (Geriatric Use)
8.6 신장애 (Renal Impairment)
10 과다 복용 (OVERDOSAGE)
11 제품 설명 (DESCRIPTION)
12 임상 약리학 (CLINICAL PHARMACOLOGY)
12.1 작용 기전 (Mechanism of Action)
12.2 약력학 (Pharmacodynamics)
12.3 약동학 (Pharmacokinetics)
13 비임상 독성학 (NONCLINICAL TOXICOLOGY)
13.1 발암성, 돌연변이 유발성, 생식능력 손상 (Carcinogenesis, Mutagenesis, Impairment of Fertility)
14 임상 연구 (CLINICAL STUDIES)
14.1 단독 요법 (Monotherapy)
14.2 병용 요법 (Combination Therapy)
16 공급/보관 및 취급 방법 (HOW SUPPLIED/STORAGE AND HANDLING)
17 환자 상담 정보 (PATIENT COUNSELING INFORMATION)
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다. (Sections or subsections omitted from the full prescribing information are not listed.)
1 적응증 및 용법
JANUVIA®는 2형 당뇨병 성인 환자의 혈당 조절 개선을 위해 식이요법 및 운동 요법의 보조제로 사용됩니다.
사용상의 제한
JANUVIA는 1형 당뇨병 환자에게는 사용해서는 안 됩니다.
JANUVIA는 췌장염 병력이 있는 환자에 대해 연구되지 않았습니다. 췌장염 병력이 있는 환자가 JANUVIA를 사용하는 동안 췌장염 발생 위험이 증가하는지 여부는 알 수 없습니다. [경고 및 주의 사항 (5.1) 참조.]
2 투여 및 관리
2.2 신장애 환자에 대한 권장 사항
JANUVIA 투여 전과 그 후 정기적으로 신장 기능을 평가하십시오.
추정 사구체 여과율 [eGFR]이 45 mL/min/1.73 m2 이상 90 mL/min/1.73 m2 미만인 환자의 경우 JANUVIA 용량 조절이 필요하지 않습니다.
중등도 신장애 환자 (eGFR이 30 mL/min/1.73 m2 이상 45 mL/min/1.73 m2 미만인 경우)의 경우 JANUVIA 용량은 1일 1회 50mg입니다.
중증 신장애 환자 (eGFR이 30 mL/min/1.73 m2 미만인 경우) 또는 혈액 투석 또는 복막 투석이 필요한 말기 신부전 (ESRD) 환자의 경우 JANUVIA 용량은 1일 1회 25mg입니다. JANUVIA는 투석 시간과 관계없이 투여할 수 있습니다.
3 제형 및 함량
- 100 mg 정제는 베이지색 원형 필름 코팅 정제이며 한쪽 면에 “277”이 각인되어 있습니다.
- 50 mg 정제는 연베이지색 원형 필름 코팅 정제이며 한쪽 면에 “112”이 각인되어 있습니다.
- 25 mg 정제는 분홍색 원형 필름 코팅 정제이며 한쪽 면에 “221”이 각인되어 있습니다.
4 금기사항
sitagliptin에 대한 아나필락시스 또는 혈관부종과 같은 심각한 과민 반응의 병력. [See Warnings and Precautions (5.5); Adverse Reactions (6.2).]
5 경고 및 주의사항
5.1 췌장염
JANUVIA를 복용하는 환자에서 치명적 및 비치명적 출혈성 또는 괴사성 췌장염을 포함한 급성 췌장염의 시판 후 보고가 있었습니다. JANUVIA 투여 시작 후 환자에게 췌장염의 징후와 증상이 있는지 주의 깊게 관찰해야 합니다. 췌장염이 의심되는 경우 JANUVIA 투여를 즉시 중단하고 적절한 치료를 시작해야 합니다. 췌장염 병력이 있는 환자가 JANUVIA를 사용하는 동안 췌장염 발생 위험이 증가하는지는 알려져 있지 않습니다.
5.2 심부전
다른 두 가지 DPP-4 억제제 계열의 심혈관 결과 시험에서 dipeptidyl peptidase-4(DPP-4) 억제제 치료와 심부전 사이의 연관성이 관찰되었습니다. 이러한 시험은 제2형 당뇨병 및 죽상경화성 심혈관 질환이 있는 환자를 평가했습니다.
심부전 병력 및 신장애 병력과 같이 심부전 위험이 있는 환자에서 치료를 시작하기 전에 JANUVIA의 위험과 이점을 고려하고 치료 중 이러한 환자에게 심부전의 징후와 증상이 있는지 관찰하십시오. 환자에게 심부전의 특징적인 증상을 알리고 그러한 증상이 나타나면 즉시 보고하도록 조언하십시오. 심부전이 발생하면 현재 치료 기준에 따라 평가 및 관리하고 JANUVIA 중단을 고려하십시오.
5.3 급성 신부전
때때로 투석을 필요로 하는 급성 신부전을 포함하여 신기능 악화에 대한 시판 후 보고가 있었습니다. 이러한 보고의 일부는 신장애가 있는 환자와 관련이 있으며, 그중 일부는 부적절한 용량의 sitagliptin을 처방받았습니다. 지지 요법 및 잠재적인 원인 물질의 중단으로 신장애의 기준선 수준으로의 회복이 관찰되었습니다. 다른 원인이 급성 신기능 악화를 촉발했을 가능성이 있는 것으로 간주되는 경우 JANUVIA를 신중하게 다시 시작하는 것을 고려할 수 있습니다.
JANUVIA 투여 시작 전과 그 이후 정기적으로 신기능 평가를 권장합니다. 중등도 또는 중증 신장애 환자와 혈액 투석 또는 복막 투석이 필요한 ESRD 환자에서는 용량 조정이 권장됩니다. [복용량 및 투여(2.2); 특정 집단에서의 사용(8.6) 참조.]
5.4 인슐린 또는 인슐린 분비촉진제와 병용 투여 시 저혈당증
JANUVIA를 저혈당증을 유발하는 것으로 알려진 약물인 인슐린 또는 인슐린 분비촉진제(예: 설포닐우레아)와 병용 투여했을 때 저혈당증 발생률이 설포닐우레아 또는 인슐린과 병용 투여한 위약보다 증가했습니다. [이상반응(6.1) 참조.] 따라서 저혈당증의 위험을 줄이기 위해 더 낮은 용량의 설포닐우레아 또는 인슐린이 필요할 수 있습니다. [약물 상호작용(7.1) 참조.]
5.5 과민 반응
JANUVIA로 치료받은 환자에서 중증 과민 반응에 대한 시판 후 보고가 있었습니다. 이러한 반응에는 아나필락시스, 혈관부종, Stevens-Johnson 증후군을 포함한 박탈성 피부 질환이 포함됩니다. 이러한 반응의 발병은 JANUVIA 치료 시작 후 처음 3개월 이내에 발생했으며 일부 보고는 첫 번째 복용 후 발생했습니다. 과민 반응이 의심되는 경우 JANUVIA 투여를 중단하고 다른 잠재적 원인을 평가하고 당뇨병에 대한 대체 치료를 시작하십시오. [이상반응(6.2) 참조.]
혈관부종은 다른 DPP-4 억제제에서도 보고되었습니다. 다른 DPP-4 억제제로 혈관부종 병력이 있는 환자는 JANUVIA로 혈관부종이 발생하기 쉬운지는 알려져 있지 않으므로 주의해서 사용하십시오.
5.6 중증 및 장애를 유발하는 관절통
DPP-4 억제제를 복용하는 환자에서 중증 및 장애를 유발하는 관절통에 대한 시판 후 보고가 있었습니다. 약물 치료 시작 후 증상 발현까지의 시간은 하루에서 수년까지 다양했습니다. 환자들은 약물 투여 중단 시 증상이 완화되었습니다. 환자의 일부는 동일한 약물 또는 다른 DPP-4 억제제를 다시 시작할 때 증상이 재발했습니다. 중증 관절통의 가능한 원인으로 DPP-4 억제제를 고려하고 적절한 경우 약물 투여를 중단하십시오.
5.7 수포성 유천포창
DPP-4 억제제 사용으로 입원이 필요한 수포성 유천포창의 시판 후 사례가 보고되었습니다. 보고된 사례에서 환자는 일반적으로 국소 또는 전신 면역억제 치료 및 DPP-4 억제제 중단으로 회복되었습니다. 환자에게 JANUVIA를 투여하는 동안 물집이나 미란이 발생하면 보고하도록 알리십시오. 수포성 유천포창이 의심되는 경우 JANUVIA 투여를 중단하고 진단 및 적절한 치료를 위해 피부과 전문의에게 의뢰하는 것을 고려해야 합니다.
6 부작용
다음의 유해 반응은 이 약물 설명서의 다른 부분에서도 논의됩니다.
- 췌장염 [경고 및 주의사항 (5.1) 참조]
- 심부전 [경고 및 주의사항 (5.2) 참조]
- 급성 신부전 [경고 및 주의사항 (5.3) 참조]
- 인슐린 또는 인슐린 분비 촉진제와 병용 시 저혈당 [경고 및 주의사항 (5.4) 참조]
- 과민반응 [경고 및 주의사항 (5.5) 참조]
- 심하고 쇠약하게 하는 관절통 [경고 및 주의사항 (5.6) 참조]
- 수포성 박리성 피부염 [경고 및 주의사항 (5.7) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
단독 요법과 메트포르민, 피오글리타존 또는 로시글리타존 및 메트포르민 병용 요법 모두에서 대조군과 비교하여 JANUVIA의 전반적인 유해 반응 발생률, 저혈당 발생률 및 임상적 유해 반응으로 인한 치료 중단률은 유사했습니다. 메트포르민과 병용 또는 병용하지 않고 글리메피리드와 병용했을 때, JANUVIA의 전반적인 임상적 유해 반응 발생률은 위약보다 높았는데, 이는 저혈당 발생률이 높았기 때문입니다(표 3 참조). 임상적 유해 반응으로 인한 치료 중단률은 위약과 유사했습니다.
18주 및 24주 기간의 두 가지 위약 대조 단독 요법 연구에는 JANUVIA 100mg 1일 1회, JANUVIA 200mg 1일 1회 및 위약으로 치료받은 환자가 포함되었습니다. 또한 5가지 위약 대조 추가 병용 요법 연구가 수행되었습니다. 메트포르민 병용, 피오글리타존 병용, 메트포르민 및 로시글리타존 병용, 글리메피리드(메트포르민 병용 또는 병용하지 않음) 병용, 인슐린(메트포르민 병용 또는 병용하지 않음) 병용 연구입니다. 이러한 시험에서 안정적인 용량의 배경 치료로 충분한 혈당 조절이 되지 않은 환자는 JANUVIA 100mg 1일 1회 또는 위약으로 추가 요법을 받도록 무작위 배정되었습니다. JANUVIA 100mg 1일 1회로 치료받은 환자의 5% 이상에서 보고되었고 위약으로 치료받은 환자보다 더 흔하게 발생한 저혈당을 제외한 유해 반응은 최소 18주 기간의 임상 시험에 대한 표 1에 나와 있습니다. 저혈당 발생률은 표 3에 나와 있습니다.
| 환자 수 (%) | |||||||
|
|||||||
| 단독 요법 (18주 또는 24주) | JANUVIA 100mg | 위약 | |||||
| N = 443 | N = 363 | ||||||
| 비인두염 | 23 (5.2) | 12 (3.3) | |||||
| 피오글리타존 병용 (24
주) |
JANUVIA 100mg + 피오글리타존 |
위약 + 피오글리타존 |
|||||
| N = 175 | N = 178 | ||||||
| 상기도 감염 | 11 (6.3) | 6 (3.4) | |||||
| 두통 | 9 (5.1) | 7 (3.9) | |||||
| Metformin + Rosiglitazone 병용 (18주) |
JANUVIA 100 mg + Metformin |
Placebo + Metformin |
| N = 181 | N = 97 | |
| 상기도 감염 | 10 (5.5) | 5 (5.2) |
| 비인두염 | 11 (6.1) | 4 (4.1) |
| Glimepiride 병용 (+/- Metformin) (24주) |
JANUVIA 100 mg + Glimepiride (+/- Metformin) |
Placebo + Glimepiride (+/- Metformin) |
| N = 222 | N = 219 | |
| 비인두염 | 14 (6.3) | 10 (4.6) |
| 두통 | 13 (5.9) | 5 (2.3) |
메트포르민 병용 요법에 JANUVIA를 추가 투여한 환자를 대상으로 한 24주 연구에서, 연구자의 인과 관계 평가에 관계없이 ≥5%의 환자에서 보고되었고 위약 투여 환자보다 더 흔하게 나타난 이상 반응은 없었습니다.
인슐린(메트포르민 병용 또는 단독)에 JANUVIA를 추가 투여한 환자를 대상으로 한 24주 연구에서, 연구자의 인과 관계 평가에 관계없이 ≥5%의 환자에서 보고되었고 위약 투여 환자보다 더 흔하게 나타난 이상 반응은 저혈당증을 제외하고는 없었습니다(표 3 참조).
메트포르민 및 로시글리타존 병용 요법에 JANUVIA를 추가 투여한 연구(표 1)에서, 54주까지 JANUVIA로 치료받은 환자의 ≥5%에서 보고되었고 위약 투여 환자보다 더 흔하게 나타난 이상 반응은 상기도 감염(JANUVIA, 15.5%; 위약, 6.2%), 비인두염(11.0%, 9.3%), 말초 부종(8.3%, 5.2%) 및 두통(5.5%, 4.1%)이었습니다.
두 가지 단독 요법 연구, 메트포르민 추가 투여 연구 및 피오글리타존 추가 투여 연구의 통합 분석에서, JANUVIA로 치료받은 환자의 선택된 위장관계 이상 반응의 발생률은 다음과 같습니다. 복통(JANUVIA 100 mg, 2.3%; 위약, 2.1%), 오심(1.4%, 0.6%) 및 설사(3.0%, 2.3%).
메트포르민과 병용한 시타글립틴 초기 치료에 대한 추가적인 24주 위약 대조 인자 연구에서, ≥5%의 환자에게 보고된 이상 반응(연구자의 인과 관계 평가에 관계없이)은 표 2에 나와 있습니다.
| 환자 수 (%) | ||||
|
위약 |
시타글립틴
(JANUVIA) |
메트포르민 HCl 500 또는 1000 mg 1일 2회† |
시타글립틴 50 mg 1일 2회 + 메트포르민 HCl 500 또는 1000 mg 1일 2회† |
|
| N = 176 | N = 179 | N = 364† | N = 372† | |
| 상기도 감염 | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| 두통 | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
피오글리타존과 병용하여 JANUVIA로 초기 치료를 실시한 24주 연구에서, ≥5%의 환자에게서 보고된 이상 반응(연구자의 인과 관계 평가에 관계없이)은 없었으며, 피오글리타존 단독 투여 환자보다 더 흔하게 발생하지 않았습니다.
JANUVIA로 치료받은 환자에서 활력 징후 또는 ECG(QTc 간격 포함)의 임상적으로 의미 있는 변화는 관찰되지 않았습니다.
시타글립틴 100mg/일(N=5429) 또는 대조군(활성 또는 위약)(N=4817)을 무작위로 투여받은 10,246명의 환자 데이터를 포함한 19건의 이중맹검 임상 시험의 통합 분석에서, 급성 췌장염의 발생률은 각 군에서 100 환자-연당 0.1건이었습니다(시타글립틴의 경우 4708 환자-연 동안 4명의 환자에게서 사건 발생, 대조군의 경우 3942 환자-연 동안 4명의 환자에게서 사건 발생).
저혈당증
상기 연구(N=9)에서 저혈당증의 이상 반응은 모든 증상성 저혈당 보고를 기반으로 했습니다. 대부분(74%)의 저혈당 보고는 혈당 측정치 ≤70 mg/dL을 동반했지만, 동시 혈당 측정은 필요하지 않았습니다. JANUVIA를 설포닐우레아 또는 인슐린과 병용 투여했을 때, 적어도 하나의 저혈당증 이상 반응이 발생한 환자의 비율은 해당 위약군보다 높았습니다(표 3).
| 글리메피리드 추가 (+/- 메트포르민) (24주) |
JANUVIA 100 mg + 글리메피리드 (+/- 메트포르민) |
위약 + 글리메피리드 (+/- 메트포르민) |
| N = 222 | N = 219 | |
| 전체 (%) | 27 (12.2) | 4 (1.8) |
| 비율 (사건/환자-연)† | 0.59 | 0.24 |
| 중증 (%)‡ | 0 (0.0) | 0 (0.0) |
| 인슐린 추가 (+/- 메트포르민) (24주) |
JANUVIA 100 mg + 인슐린 (+/- 메트포르민) |
위약 + 인슐린 (+/- 메트포르민) |
| N = 322 | N = 319 | |
| 전체 (%) | 50 (15.5) | 25 (7.8) |
| 비율 (사건/환자-연)† | 1.06 | 0.51 |
| 중증 (%)‡ | 2 (0.6) | 1 (0.3) |
두 가지 단독 요법 연구, 메트포르민 병용 연구, 피오글리타존 병용 연구의 통합 분석 결과, JANUVIA 100mg 투여 환자의 저혈당 부작용 전반적인 발생률은 1.2%였고, 위약 투여 환자는 0.9%였습니다.
메트포르민 및 로시글리타존과 병용 요법으로 JANUVIA를 추가 투여한 연구에서, 18주차까지 JANUVIA 추가 투여 환자의 저혈당 전반적인 발생률은 2.2%였고, 위약 추가 투여 환자는 0.0%였습니다. 54주차까지, JANUVIA 추가 투여 환자의 저혈당 전반적인 발생률은 3.9%였고, 위약 추가 투여 환자는 1.0%였습니다.
메트포르민과 병용한 JANUVIA 초기 요법에 대한 24주 위약 대조 인자 연구에서, 위약 투여 환자의 저혈당 발생률은 0.6%, JANUVIA 단독 투여 환자는 0.6%, 메트포르민 단독 투여 환자는 0.8%, JANUVIA와 메트포르민 병용 투여 환자는 1.6%였습니다.
피오글리타존과 병용한 JANUVIA 초기 요법 연구에서, JANUVIA를 복용한 환자 1명이 중증 저혈당을 경험했습니다. 인슐린 병용 투여 연구를 제외한 다른 연구에서는 중증 저혈당 사례가 보고되지 않았습니다.
메트포르민으로 적절히 조절되지 않는 2형 당뇨병 환자를 대상으로 한 추가적인 30주 위약 대조 연구에서, 기저 인슐린 요법 시작 시 시타글립틴 100mg 유지와 시타글립틴 중단을 비교한 결과, 시타글립틴군과 위약군 간에 기록된 증상성 저혈당(혈당 측정치 ≤70 mg/dL)의 발생률과 빈도에 차이가 없었습니다.
검사실 검사
임상 연구 전반에 걸쳐, JANUVIA 100mg 투여 환자와 위약 투여 환자 간의 검사실 부작용 발생률은 유사했습니다. 호중구 증가로 인해 백혈구 수치(WBC)가 약간 증가했습니다. 이러한 WBC 증가(네 가지 통합 위약 대조 임상 연구에서 위약 대비 약 200 cells/microL 증가, 평균 기준 WBC 수치 약 6600 cells/microL)는 임상적으로 유의하지 않은 것으로 간주됩니다. 만성 신장 기능 저하 환자 91명을 대상으로 한 12주 연구에서, 중등도 신장 기능 저하 환자 37명은 매일 JANUVIA 50mg을 무작위 배정받았고, 동일한 정도의 신장 장애가 있는 환자 14명은 위약을 무작위 배정받았습니다. JANUVIA 투여 환자 [0.12 mg/dL (0.04)]와 위약 투여 환자 [0.07 mg/dL (0.07)]에서 혈청 크레아티닌의 평균(SE) 증가가 관찰되었습니다. 위약에 비해 이러한 혈청 크레아티닌 증가의 임상적 유의성은 알려져 있지 않습니다.
6.2 시판 후 경험
JANUVIA 단독 요법 및/또는 다른 항고혈당제와 병용 투여 시 시판 후 사용 중 추가적인 부작용이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 일반적으로 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것은 불가능합니다.
아나필락시스, 안젤오에데마, 발진, 두드러기, 피부 혈관염 및 스티븐스-존슨 증후군을 포함한 박탈성 피부 질환을 포함한 과민증 반응; 간 효소 상승; 치명적인 췌장염 및 치명적이지 않은 출혈성 및 괴사성 췌장염을 포함한 급성 췌장염 [적응증 및 용법 (1) 참조]; 급성 신부전(때로는 투석이 필요함) 및 세뇨관 간질성 신염을 포함한 신기능 악화; 심하고 쇠약하게 하는 관절통; 수포성 박리성 피부염; 변비; 구토; 두통; 근육통; 사지 통증; 요통; 가려움증; 구강 궤양; 구내염; 횡문근융해증.
7 약물 상호작용
7.1 Insulin Secretagogues 또는 Insulin
JANUVIA와 insulin secretagogue (예: sulfonylurea) 또는 insulin의 병용 투여는 저혈당 위험을 줄이기 위해 insulin secretagogue 또는 insulin의 저용량을 필요로 할 수 있습니다. [경고 및 주의사항 (5.4)를 참조하십시오.]
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 여성에서 JANUVIA에 대한 제한된 이용 가능한 자료는 주요 선천적 기형 및 유산에 대한 약물 관련 위험을 알리기에 충분하지 않습니다. 임신 중 당뇨병이 잘 조절되지 않으면 모체와 태아에 위험이 있습니다 [임상적 고려 사항 참조]. AUC 기준으로, 기관 형성 중에 임신 랫트와 토끼에게 최대 30배 및 20배(각각 100mg 임상 용량)의 경구 용량으로 시타글립틴을 투여했을 때, 유해한 발달 효과는 관찰되지 않았습니다 [자료 참조].
임신 전 당뇨병이 있고 헤모글로빈 A1c가 7% 초과인 여성의 주요 선천적 기형의 배경 위험은 6-10%이며, 헤모글로빈 A1c가 10% 초과인 여성의 경우 최대 20-25%로 보고되었습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 배경 위험은 각각 2-4% 및 15-20%로 추정됩니다.
자료
동물 자료
배아-태아 발달 연구에서, 기관 형성 중(임신 6일차~20일차) 임신 랫트와 토끼에게 AUC 기준으로 각각 최대 250mg/kg(100mg 임상 용량의 30배) 및 125mg/kg(100mg 임상 용량의 20배)의 경구 용량으로 시타글립틴을 투여했을 때 발달 결과에 악영향을 미치지 않았습니다. 모체 독성과 관련된 랫트의 더 높은 용량(1000mg/kg, 또는 AUC 기준으로 약 100배의 임상 용량)에서는 자손의 늑골 기형 발생률이 증가했습니다. 임신 랫트와 토끼에서 시타글립틴의 태반 이동이 관찰되었습니다.
임신 6일차부터 수유 21일차까지 암컷 랫트에게 시타글립틴을 투여했을 때, 최대 1000mg/kg의 용량에서 랫트 자손의 기능적 또는 행동적 독성은 발생하지 않았습니다.
8.2 수유
위험 요약
모유 내 JANUVIA의 존재 여부, 수유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 정보는 없습니다. 시타글립틴은 랫트의 모유에 존재하므로 인간의 모유에도 존재할 가능성이 있습니다 [자료 참조]. 수유의 발달적 및 건강상의 이점은 모체의 JANUVIA에 대한 임상적 필요성과 JANUVIA 또는 기저 모체 질환으로 인한 수유아에 대한 잠재적 유해 작용과 함께 고려해야 합니다.
8.4 소아 사용
소아 환자에서 JANUVIA의 안전성 및 유효성은 확립되지 않았습니다.
인슐린 치료 여부와 관계없이(인슐린 치료를 받지 않는 환자의 경우 HbA1c 6.5-10%, 인슐린 치료를 받는 환자의 경우 HbA1c 7-10%) 적절하게 조절되지 않은 2형 당뇨병이 있는 10세에서 17세 사이의 소아 환자 410명을 대상으로 각각 34주 연장 기간이 있는 3건의 20주 이중맹검, 위약 대조 연구가 수행되었습니다. 연구 1의 환자는 연구 시작 시 경구 항당뇨병제로 치료받지 않았습니다. 연구 2와 3의 환자는 최대 내약량의 메트포르민 요법을 받았습니다. 1차 유효성 평가변수는 치료 20주 후 HbA1c의 기준치 변화였습니다. 사전에 지정된 1차 유효성 분석에는 당화혈색소 구제 또는 치료 중단 여부와 관계없이 연구 1의 데이터와 연구 2 및 3의 통합 데이터가 포함되었습니다.
두 유효성 분석 모두에서 시타글립틴 치료의 효과는 위약과 유의하게 다르지 않았습니다. 연구 1에서 평균 기준 HbA1c는 7.5%였으며, 환자의 12%가 인슐린 치료를 받았습니다. 20주차에 JANUVIA로 치료받은 환자(N=95)의 HbA1c 기준치 변화는 0.06%였고, 위약으로 치료받은 환자(N=95)의 경우 0.23%였으며, 그 차이는 -0.17%(95% CI: -0.62, 0.28)였습니다. 연구 2와 3에서 평균 기준 HbA1c는 8.0%였으며, 환자의 15%가 인슐린을 사용했고 72%가 1일 1,500mg 이상의 메트포르민 HCl 용량을 사용했습니다. 20주차에 시타글립틴으로 치료받은 환자(N=107)의 HbA1c 기준치 변화는 -0.23%였고, 위약으로 치료받은 환자(N=113)의 경우 0.09%였으며, 그 차이는 -0.33%(95% CI: -0.70, 0.05)였습니다.
8.5 노인 사용
JANUVIA의 사전 승인 임상 안전성 및 유효성 연구에 참여한 총 피험자 수(N=3884) 중 725명의 환자가 65세 이상이었고, 61명의 환자가 75세 이상이었습니다. 65세 이상의 피험자와 더 젊은 피험자 간에 안전성 또는 유효성에 전반적인 차이는 관찰되지 않았습니다. 이 연구 및 기타 보고된 임상 경험에서 노인과 더 젊은 환자 간의 반응에 차이가 확인되지 않았지만, 일부 노인의 민감도가 더 높을 가능성을 배제할 수는 없습니다.
시타글립틴은 신장을 통해 상당히 배설되며, 노화는 신장 기능 저하와 관련될 수 있으므로, 노인 환자의 경우 신장 기능을 더 자주 평가해야 합니다 [용법 및 용량 (2.2), 경고 및 주의 사항 (5.3) 참조].
8.6 신장 장애
시타글립틴은 신장을 통해 배설되며, 신장 장애 환자의 경우 시타글립틴 노출이 증가합니다. eGFR이 45 mL/분/1.73 m2 미만인 환자(중등도 및 중증 신장 장애 환자뿐만 아니라 투석이 필요한 ESRD 환자)의 경우 더 낮은 용량을 권장합니다. [용법 및 용량 (2.2); 임상 약리학 (12.3) 참조].
10 과다 복용
JANUVIA 과다 복용 시에는 중독관리센터(Poison Control Center)에 연락하십시오.
과다 복용 시에는 보조적인 조치를 취하는 것이 합리적입니다. 예를 들어 위장관에서 흡수되지 않은 물질을 제거하고 임상 모니터링(심전도 검사 포함)을 실시하고 환자의 임상 상태에 따라 보조 요법을 시작합니다.
Sitagliptin은 약간 투석 가능합니다. 임상 연구에서 3~4시간의 혈액투석 동안 약 13.5%의 용량이 제거되었습니다. 임상적으로 적절한 경우 장기간 혈액투석을 고려할 수 있습니다. Sitagliptin이 복막 투석으로 투석 가능한지는 알려져 있지 않습니다.
11 설명
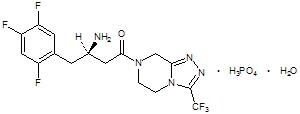
JANUVIA 정제는 경구 활성 디펩티딜 펩티다제-4 (DPP-4) 효소 억제제인 시타글립틴 인산염을 함유하고 있습니다.
시타글립틴 인산염 일수화물은 화학적으로 7-[(3R)-3-아미노-1-옥소-4-(2,4,5-트리플루오로페닐)부틸]-5,6,7,8-테트라히드로-3-(트리플루오로메틸)-1,2,4-트리아졸로[4,3-a]피라진 인산염 (1:1) 일수화물로 설명됩니다.
실험식은 C16H15F6N5O•H3PO4•H2O이며 분자량은 523.32입니다. 구조식은 다음과 같습니다:
 |
시타글립틴 인산염 일수화물은 백색에서 미백색의 결정성, 비흡습성 분말입니다. 물과 N,N-디메틸포름아미드에 용해되고; 메탄올에 약간 용해되고; 에탄올, 아세톤 및 아세토니트릴에는 매우 약간 용해되며; 이소프로판올 및 이소프로필 아세테이트에는 불용성입니다.
JANUVIA의 각 필름 코팅 정제는 시타글립틴 인산염 일수화물 32.13, 64.25 또는 128.5 mg을 함유하고 있으며, 이는 각각 유리염기 25, 50 또는 100 mg에 해당하며, 다음과 같은 불활성 성분을 포함합니다: 미결정 셀룰로오스, 무수 이염기성 인산칼슘, 크로스카멜로오스나트륨, 마그네슘스테아레이트, 스테아릴푸마르산나트륨 및 프로필갈레이트. 또한, 필름 코팅에는 다음과 같은 불활성 성분이 포함되어 있습니다: 폴리비닐알코올, 폴리에틸렌글리콜, 활석, 이산화티타늄, 적색 산화철 및 황색 산화철.
12 임상약리학
12.1 작용 기전
시타글립틴은 DPP-4 억제제로, 2형 당뇨병 환자에서 인크레틴 호르몬의 불활성화를 지연시킴으로써 작용하는 것으로 생각됩니다. 시타글립틴에 의해 활성화된 온전한 호르몬의 농도가 증가하여 이러한 호르몬의 작용이 증가하고 지속됩니다. 글루카곤 유사 펩타이드-1(GLP-1) 및 포도당 의존성 인슐린 자극 폴리펩타이드(GIP)를 포함한 인크레틴 호르몬은 하루 종일 장에서 방출되며, 식사에 대한 반응으로 수치가 증가합니다. 이러한 호르몬은 DPP-4 효소에 의해 빠르게 불활성화됩니다. 인크레틴은 포도당 항상성의 생리적 조절에 관여하는 내인성 시스템의 일부입니다. 혈당 농도가 정상이거나 상승하면 GLP-1과 GIP는 cAMP를 포함하는 세포 내 신호 전달 경로를 통해 췌장 베타 세포로부터 인슐린 합성 및 방출을 증가시킵니다. GLP-1은 또한 췌장 알파 세포로부터 글루카곤 분비를 감소시켜 간에서의 포도당 생성을 감소시킵니다. 시타글립틴은 활성 인크레틴 수치를 증가시키고 지속시킴으로써 포도당 의존적 방식으로 순환계에서 인슐린 방출을 증가시키고 글루카곤 수치를 감소시킵니다. 시타글립틴은 DPP-4에 대한 선택성을 나타내며 치료 용량으로부터 얻어지는 농도에서 in vitro DPP-8 또는 DPP-9 활성을 억제하지 않습니다.
12.2 약력학
일반
2형 당뇨병 환자에서 시타글립틴 투여는 24시간 동안 DPP-4 효소 활성을 억제했습니다. 경구 포도당 부하 또는 식사 후 이 DPP-4 억제는 순환하는 활성 GLP-1 및 GIP 수치의 2~3배 증가, 글루카곤 농도 감소 및 포도당에 대한 인슐린 방출 반응 증가를 초래하여 C-펩타이드 및 인슐린 농도가 증가했습니다. 글루카곤 감소와 함께 인슐린 증가는 공복 혈당 농도 감소 및 경구 포도당 부하 또는 식사 후 포도당 변화 감소와 관련이 있었습니다.
건강한 피험자를 대상으로 한 연구에서 시타글립틴은 혈당을 낮추거나 저혈당을 유발하지 않았습니다.
시타글립틴 및 메트포르민염산염 병용 투여
건강한 피험자를 대상으로 한 2일간의 연구에서 시타글립틴 단독 투여는 활성 GLP-1 농도를 증가시킨 반면, 메트포르민 단독 투여는 활성 및 총 GLP-1 농도를 유사한 정도로 증가시켰습니다. 시타글립틴과 메트포르민의 병용 투여는 활성 GLP-1 농도에 대한 상가적 효과를 나타냈습니다. 메트포르민이 아닌 시타글립틴은 활성 GIP 농도를 증가시켰습니다. 이러한 결과가 2형 당뇨병 환자의 혈당 조절 변화와 어떻게 관련되는지는 불분명합니다.
심장 전기 생리학
무작위, 위약 대조 교차 연구에서 79명의 건강한 피험자에게 시타글립틴 100mg 단회 경구 용량, 시타글립틴 800mg(권장 용량의 8배), 위약을 투여했습니다. 권장 용량인 100mg에서는 최고 혈장 농도에서 또는 연구 기간 동안 다른 어떤 시점에서도 QTc 간격에 영향을 미치지 않았습니다. 800mg 용량 투여 후 위약 보정된 QTc의 기준치로부터 평균 변화의 최대 증가는 투여 후 3시간에 관찰되었으며 8.0msec였습니다. 이러한 증가는 임상적으로 유의미한 것으로 간주되지 않습니다. 800mg 용량에서 최고 시타글립틴 혈장 농도는 100mg 용량 투여 후 최고 농도보다 약 11배 높았습니다.
시타글립틴 100mg(N=81) 또는 시타글립틴 200mg(N=63)을 매일 투여받은 2형 당뇨병 환자에서는 예상되는 최고 혈장 농도 시점에 얻은 심전도 데이터를 기반으로 QTc 간격에 의미 있는 변화가 없었습니다.
12.3 약동학
시타글립틴의 약동학은 건강한 피험자와 2형 당뇨병 환자에서 광범위하게 특성화되었습니다. 건강한 자원 봉사자에게 100mg 단회 경구 용량을 투여한 후 시타글립틴의 평균 혈장 AUC는 8.52 μM•hr, Cmax는 950 nM, 그리고 명백한 최종 반감기(t1/2)는 12.4시간이었습니다. 시타글립틴의 혈장 AUC는 용량에 비례하여 증가했으며, 첫 번째 용량에 비해 정상 상태에서 100mg 용량 투여 후 약 14% 증가했습니다. 시타글립틴 AUC에 대한 피험자 내 및 피험자 간 변동 계수는 작았습니다(5.8% 및 15.1%). 시타글립틴의 약동학은 건강한 피험자와 2형 당뇨병 환자에서 일반적으로 유사했습니다.
흡수
건강한 피험자에게 100mg 용량을 경구 투여한 후 시타글립틴은 빠르게 흡수되어 최고 혈장 농도(중앙값 Tmax)가 투여 후 1~4시간에 나타났습니다. 시타글립틴의 절대 생체 이용률은 약 87%입니다.
분포
건강한 피험자에게 시타글립틴 100mg 단회 정맥내 용량을 투여한 후 정상 상태에서 평균 분포 용적은 약 198리터입니다. 시타글립틴이 혈장 단백질에 가역적으로 결합하는 비율은 낮습니다(38%).
배설
시타글립틴의 약 79%가 변화되지 않은 상태로 소변으로 배설되며, 대사는 배설의 부차적인 경로입니다. 시타글립틴 100mg 경구 용량 투여 후 명백한 최종 t1/2는 약 12.4시간이었으며, 신장 청소율은 약 350 mL/min이었습니다.
대사
[14C]시타글립틴 경구 투여 후, 방사능의 약 16%가 시타글립틴 대사체로 배설되었습니다. 6가지 대사체가 미량으로 검출되었으며, 시타글립틴의 혈장 DPP-4 억제 활성에 기여할 것으로 예상되지 않습니다. In vitro 연구 결과 시타글립틴의 제한적인 대사에 대한 주요 효소는 CYP3A4이며, CYP2C8도 기여하는 것으로 나타났습니다.
배설
건강한 피험자에게 경구 [14C]시타글립틴을 투여한 후, 투여된 방사능의 약 100%가 투여 후 1주일 이내에 대변(13%) 또는 소변(87%)으로 배설되었습니다.
시타글립틴의 배설은 주로 신장 배설을 통해 일어나며, 활성 세뇨관 분비가 포함됩니다. 시타글립틴은 사람 유기 음이온 수송체-3(hOAT-3)의 기질이며, 이는 시타글립틴의 신장 배설에 관여할 수 있습니다. hOAT-3이 시타글립틴 수송에 미치는 임상적 관련성은 확립되지 않았습니다. 시타글립틴은 또한 P-glycoprotein (P-gp)의 기질이며, 이는 시타글립틴의 신장 배설을 매개하는 데에도 관여할 수 있습니다. 그러나 P-gp 억제제인 시클로스포린은 시타글립틴의 신장 청소율을 감소시키지 않았습니다.
특정 집단
신장애 환자
eGFR이 30~45 mL/min/1.73 m2 미만인 중등도 신장애 환자의 경우 시타글립틴의 혈장 AUC가 정상 건강 대조군에 비해 약 2배 증가했으며, ESRD로 투석을 받는 환자를 포함한 중증 신장애 환자의 경우 약 4배 증가했습니다.
약물 상호작용 연구
약물 상호작용의 In Vitro 평가
시타글립틴은 CYP 동종효소 CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 또는 2B6의 억제제가 아니며, CYP3A4의 유도제도 아닙니다. 시타글립틴은 P-gp 기질이지만 디곡신의 P-gp 매개 수송을 억제하지 않습니다. 이러한 결과를 바탕으로 시타글립틴은 이러한 경로를 이용하는 다른 약물과 상호작용을 일으킬 가능성이 낮은 것으로 간주됩니다.
시타글립틴은 혈장 단백질에 광범위하게 결합하지 않습니다. 따라서 시타글립틴이 혈장 단백질 결합 치환에 의해 매개되는 임상적으로 의미 있는 약물-약물 상호작용에 관여할 가능성은 매우 낮습니다.
약물 상호작용의 In Vivo 평가
시타글립틴의 다른 약물에 대한 영향
임상 연구에서 시타글립틴은 메트포르민, 글리부라이드, 심바스타틴, 로시글리타존, 디곡신, 와파린 또는 경구 피임약(에티닐 에스트라디올 및 노르에티인드론)(표 4)의 약동학을 의미 있게 변화시키지 않았으며, CYP3A4, CYP2C8, CYP2C9, P-gp 및 유기 양이온 수송체(OCT) 기질과의 약물 상호작용을 일으킬 가능성이 낮다는 in vivo 증거를 제공합니다.
| 병용 투여 약물 | 병용 투여 약물 용량* | 시타글립틴 용량* | 기하 평균 비율 (시타글립틴 유무 비율) 무효과 = 1.00 |
||
|---|---|---|---|---|---|
| AUC† | Cmax | ||||
| Digoxin | 0.25 mg‡ 1일 1회 10일간 | 100 mg‡ 1일 1회 10일간 | Digoxin | 1.11§ | 1.18 |
| Glyburide | 1.25 mg | 200 mg‡ 1일 1회 6일간 | Glyburide | 1.09 | 1.01 |
| Simvastatin | 20 mg | 200 mg‡ 1일 1회 5일간 | Simvastatin | 0.85¶ | 0.80 |
| Simvastatin Acid | 1.12¶ | 1.06 | |||
| Rosiglitazone | 4 mg | 200 mg‡ 1일 1회 5일간 | Rosiglitazone | 0.98 | 0.99 |
| Warfarin | 5일차 1회 30 mg | 200 mg‡ 1일 1회 11일간 | S(-) Warfarin | 0.95 | 0.89 |
| R(+) Warfarin | 0.99 | 0.89 | |||
| Ethinyl estradiol and norethindrone | 21일간 1일 1회 35 µg 에티닐 에스트라디올과 노르에티스테론 0.5 mg × 7일, 0.75 mg × 7일, 1.0 mg × 7일 | 200 mg‡ 1일 1회 21일간 | Ethinyl estradiol | 0.99 | 0.97 |
| Norethindrone | 1.03 | 0.98 | |||
| Metformin HCl | 1000 mg‡ 1일 2회 14일간 | 50 mg‡ 1일 2회 7일간 | Metformin | 1.02# | 0.97 |
다른 약물이 시타글립틴에 미치는 영향
아래에 설명된 임상 데이터는 시타글립틴이 동시 투여되는 약물에 의해 임상적으로 의미 있는 상호작용을 받지 않음을 시사합니다 (표 5).
13 비임상 독성학
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
수컷 및 암컷 쥐에게 50, 150, 500mg/kg/day의 sitagliptin 경구 투여를 하는 2년 발암성 연구가 수행되었습니다. 500mg/kg에서 수컷과 암컷 모두에서 간 선종/암종의 발생률 증가와 암컷에서 간암의 발생률 증가가 있었습니다. 이 용량은 AUC 비교를 기준으로 최대 권장 일일 성인 용량(MRHD)인 100mg/day에서의 사람 노출량의 약 60배에 해당합니다. MRHD에서 사람 노출량의 약 20배인 150mg/kg에서는 간 종양이 관찰되지 않았습니다. 수컷 및 암컷 마우스에게 50, 125, 250, 500mg/kg/day의 sitagliptin 경구 투여를 하는 2년 발암성 연구가 수행되었습니다. MRHD에서 사람 노출량의 약 70배인 500mg/kg까지 어떤 장기에서도 종양 발생률 증가가 없었습니다. Sitagliptin은 Ames 박테리아 돌연변이 유발 분석, 중국 햄스터 난소(CHO) 염색체 이상 분석, CHO에서의 in vitro 세포유전학 분석, in vitro 쥐 간세포 DNA 알칼리 용출 분석, in vivo 소핵 분석에서 대사 활성화 유무와 관계없이 돌연변이 유발성 또는 염색체 파괴성을 나타내지 않았습니다.
125, 250, 1000mg/kg의 경구 위관 영양법 용량을 사용한 쥐 생식력 연구에서, 수컷은 교배 4주 전부터 교배 기간 동안 예정된 종료 시점(총 약 8주)까지, 암컷은 교배 2주 전부터 임신 7일까지 치료를 받았습니다. 125mg/kg(AUC 비교를 기준으로 100mg/day의 MRHD에서 사람 노출량의 약 12배)에서는 생식력에 대한 부작용이 관찰되지 않았습니다. 더 높은 용량에서는 암컷에서 용량과 관련 없는 재흡수 증가가 관찰되었습니다(AUC 비교를 기준으로 MRHD에서 사람 노출량의 약 25배 및 100배).
14 임상 연구
시타글립틴의 혈당 조절 효과를 평가하기 위해 실시된 9건의 이중맹검, 위약 대조 임상 안전성 및 유효성 연구에는 2형 당뇨병 환자 약 5200명이 무작위 배정되었습니다. 이러한 연구 중 7건에 대한 통합 분석 결과, 인종/민족별 분포는 백인 약 59%, 히스패닉 약 20%, 아시아인 약 10%, 흑인 약 6%, 기타 약 6%였습니다. 환자의 평균 연령은 약 55세였으며(18세~87세), 메트포르민으로 혈당 조절이 불충분한 2형 당뇨병 환자 1172명을 대상으로 52주 동안 활성(글리피지드) 대조 연구도 실시되었습니다.
2형 당뇨병 환자에서 JANUVIA 치료는 위약과 비교하여 헤모글로빈 A1C, 공복 혈당(FPG) 및 식후 2시간 혈당(PPG)의 임상적으로 유의미한 개선을 가져왔습니다.
14.1 단독 요법
2형 당뇨병 환자 1262명이 18주 및 24주 기간의 이중맹검, 위약 대조 연구 2건에 참여하여 JANUVIA 단독 요법의 유효성 및 안전성을 평가했습니다. 두 단독 요법 연구 모두에서 현재 항고혈당제를 복용 중인 환자는 약제 복용을 중단하고 약 7주 동안 식이요법, 운동 및 약물 세척 기간을 거쳤습니다. 세척 기간 후 혈당 조절이 불충분한 환자(A1C 7%~10%)는 2주간의 단일맹검 위약 투여 기간을 마친 후 무작위 배정되었으며, 현재 항고혈당제를 복용하지 않는 환자(최소 8주간 약물 치료 중단)로 혈당 조절이 불충분한 환자(A1C 7%~10%)는 2주간의 단일맹검 위약 투여 기간을 마친 후 무작위 배정되었습니다. 18주 연구에서는 521명의 환자가 위약, JANUVIA 100mg 또는 JANUVIA 200mg에 무작위 배정되었고, 24주 연구에서는 741명의 환자가 위약, JANUVIA 100mg 또는 JANUVIA 200mg에 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 위약 또는 JANUVIA에 메트포르민을 추가하여 치료했습니다.
JANUVIA 100mg 1일 1회 투여는 위약과 비교하여 A1C, FPG 및 식후 2시간 PPG를 유의하게 개선했습니다(표 6). 18주 연구에서 JANUVIA 100mg을 투여받은 환자의 9%와 위약을 투여받은 환자의 17%가 구제 요법이 필요했습니다. 24주 연구에서 JANUVIA 100mg을 투여받은 환자의 9%와 위약을 투여받은 환자의 21%가 구제 요법이 필요했습니다. 위약과 비교한 A1C 개선은 성별, 연령, 인종, 이전 항고혈당제 치료 또는 기준 BMI의 영향을 받지 않았습니다. 2형 당뇨병 치료제 시험에서 일반적인 것처럼 JANUVIA를 사용한 A1C 감소량은 기준 A1C 상승 정도와 관련이 있는 것으로 나타났습니다. 이러한 18주 및 24주 연구에서 연구 시작 시 항고혈당제를 복용하지 않은 환자의 경우 JANUVIA를 투여받은 환자의 A1C 기준치 감소는 각각 -0.7% 및 -0.8%였고, 위약을 투여받은 환자의 경우 각각 -0.1% 및 -0.2%였습니다. 전반적으로 200mg 1일 1회 용량은 100mg 1일 1회 용량보다 더 큰 혈당 조절 효과를 나타내지 않았습니다. 지질 종말점에 대한 JANUVIA의 효과는 위약과 유사했습니다. 두 연구 모두에서 JANUVIA 치료로 기준치에서 체중이 증가하지 않았으며, 위약을 투여받은 환자에서는 약간 감소했습니다.
| 18주 연구 | 24주 연구 | ||||||
| JANUVIA 100 mg | 위약 | JANUVIA 100 mg | 위약 | ||||
| A1C (%) | N = 193 | N = 103 | N = 229 | N = 244 | |||
| 기준(평균) | 8.0 | 8.1 | 8.0 | 8.0 | |||
| 기준치 변화 (조정 평균†) | -0.5 | 0.1 | -0.6 | 0.2 |
| 플라시보와의 차이 (조정 평균†) (95% CI) |
-0.6‡ (-0.8, -0.4) |
-0.8‡ (-1.0, -0.6) |
||
| A1C <7% 달성 환자 (%) | 69 (36%) | 16 (16%) | 93 (41%) | 41 (17%) |
| FPG (mg/dL) | N = 201 | N = 107 | N = 234 | N = 247 |
| 기준치 (평균) | 180 | 184 | 170 | 176 |
| 기준치 변화 (조정 평균†) | -13 | 7 | -12 | 5 |
| 플라시보와의 차이 (조정 평균†) (95% CI) |
-20‡ (-31, -9) |
-17‡ (-24, -10) |
||
| 2시간 PPG (mg/dL) | § | § | N = 201 | N = 204 |
| 기준치 (평균) | 257 | 271 | ||
| 기준치 변화 (조정 평균†) | -49 | -2 | ||
| 플라시보와의 차이 (조정 평균†) (95% CI) |
-47‡ (-59, -34) |
추가 단독 요법 연구
2형 당뇨병 및 만성 신장 기능 저하(크레아티닌 청소율 <50 mL/min) 환자 91명을 대상으로 JANUVIA의 안전성 및 내약성을 평가하기 위한 다국가적, 무작위, 이중맹검, 위약 대조 연구도 수행되었습니다. 중등도 신장 기능 저하 환자는 JANUVIA 50mg을 1일 1회 복용하고, 중증 신장 기능 저하 환자 또는 혈액 투석 또는 복막 투석을 받는 말기 신부전 환자는 25mg을 1일 1회 복용했습니다. 이 연구에서 JANUVIA의 안전성 및 내약성은 일반적으로 위약과 유사했습니다. 위약 투여군에 비해 JANUVIA 투여군의 중등도 신장 기능 저하 환자에서 혈청 크레아티닌의 약간의 증가가 보고되었습니다. 또한, 위약에 비해 JANUVIA를 사용한 A1C 및 FPG 감소는 다른 단독 요법 연구에서 관찰된 것과 일반적으로 유사했습니다. [임상 약리학 (12.3) 참조.]
14.2 병용 요법
메트포르민 병용 추가 요법
JANUVIA의 메트포르민 병용 효능을 평가하기 위해 설계된 24주 무작위 이중맹검 위약 대조 연구에는 2형 당뇨병 환자 701명이 참여했습니다. 1일 최소 1500mg의 메트포르민 HCl을 복용 중인 환자(N=431명)는 2주간의 단일맹검 위약 투여 기간을 마친 후 무작위 배정되었습니다. 메트포르민과 다른 혈당 강하제를 복용 중인 환자(N=229명)와 혈당 강하제를 복용하지 않은 환자(최소 8주간 치료 중단, N=41명)는 단독 요법으로 메트포르민 HCl(1일 최소 1500mg)을 약 10주간 투여받은 후 무작위 배정되었습니다. 불충분한 혈당 조절(A1C 7%~10%) 환자는 1일 1회 JANUVIA 100mg 또는 위약을 추가 투여받도록 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 피오글리타존 구제 요법으로 치료되었습니다.
메트포르민과 병용한 JANUVIA는 위약과 메트포르민 병용에 비해 A1C, FPG 및 2시간 PPG를 유의하게 개선했습니다(표 7). JANUVIA 100mg 투여군에서는 5%, 위약 투여군에서는 14%의 환자에게 구제 혈당 요법이 사용되었습니다. 두 치료군 모두 체중 감소는 유사했습니다.
| JANUVIA 100mg + 메트포르민 | 위약 + 메트포르민 | ||||||
| A1C (%) | N = 453 | N = 224 | |||||
| 기준(평균) | 8.0 | 8.0 | |||||
| 기준치 변화(조정 평균†) | -0.7 | -0.0 | |||||
| 위약 + 메트포르민과의 차이(조정 평균†) (95% CI) |
-0.7‡ (-0.8, -0.5) |
||||||
| A1C <7% 달성 환자(%) | 213 (47%) | 41 (18%) | |||||
| FPG (mg/dL) | N = 454 | N = 226 | |||||
| 기준(평균) | 170 | 174 | |||||
| 기준치 변화(조정 평균†) | -17 | 9 | |||||
| 위약 + 메트포르민과의 차이(조정 평균†) (95% CI) |
-25‡ (-31, -20) |
||||||
| 2시간 PPG (mg/dL) | N = 387 | N = 182 |
| 기준치 (평균) | 275 | 272 |
| 기준치 변화 (조정 평균†) | -62 | -11 |
| 플라세보 + 메트포르민 대비 차이 (조정 평균†) (95% CI) |
-51‡ (-61, -41) |
메트포르민과의 초기 병용 요법
식이요법과 운동으로 혈당 조절이 불충분한 2형 당뇨병 환자 1091명이 시타글립틴의 메트포르민 병용 초기 요법의 효능을 평가하기 위해 설계된 24주 무작위 이중맹검 위약 대조 인자 연구에 참여했습니다. 항당뇨병제를 복용 중인 환자(N=541명)는 약제 복용을 중단하고 최대 12주 동안 식이요법, 운동 및 약물 세척 기간을 거쳤습니다. 세척 기간 후, 혈당 조절이 불충분한 환자(A1C 7.5%~11%)는 2주간의 단일맹검 위약 투여 기간을 마친 후 무작위 배정되었습니다. 연구 시작 시 항당뇨병제를 복용하지 않은 환자(N=550명) 중 혈당 조절이 불충분한 환자(A1C 7.5%~11%)는 즉시 2주간의 단일맹검 위약 투여 기간에 참여한 후 무작위 배정되었습니다. 거의 동일한 수의 환자가 위약, JANUVIA 100mg 1일 1회, 메트포르민 HCl 500mg 또는 1000mg 1일 2회, 또는 시타글립틴 50mg 1일 2회와 메트포르민 HCl 500mg 또는 1000mg 1일 2회 병용 투여를 초기 요법으로 받도록 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 글리부라이드(글리벤클라미드) 구제 요법으로 치료되었습니다.
JANUVIA와 메트포르민 병용 초기 요법은 위약, 메트포르민 단독 요법 및 JANUVIA 단독 요법에 비해 A1C, FPG 및 2시간 PPG에서 유의한 개선을 보였습니다(표 8, 그림 1). A1C의 기준치 대비 평균 감소량은 기준치 A1C 값이 높은 환자에서 일반적으로 더 컸습니다. 연구 시작 시 항당뇨병제를 복용하지 않은 환자의 경우 A1C의 기준치 대비 평균 감소량은 다음과 같습니다. JANUVIA 100mg 1일 1회, -1.1%; 메트포르민 HCl 500mg 1일 2회, -1.1%; 메트포르민 HCl 1000mg 1일 2회, -1.2%; 시타글립틴 50mg 1일 2회 + 메트포르민 HCl 500mg 1일 2회, -1.6%; 시타글립틴 50mg 1일 2회 + 메트포르민 HCl 1000mg 1일 2회, -1.9%; 위약 투여 환자는 -0.2%였습니다. 지질 효과는 일반적으로 중립적이었습니다. 메트포르민과 병용하여 시타글립틴을 투여받은 군의 체중 감소는 메트포르민 단독 또는 위약 투여 군과 유사했습니다.
|
위약 |
시타글립틴 (JANUVIA) 100 mg QD |
메트포르민 HCl 500 mg 1일 2회 |
메트포르민 HCl 1000 mg 1일 2회 |
시타글립틴 50 mg 1일 2회 + 메트포르민 HCl 500 mg 1일 2회 |
시타글립틴 50 mg 1일 2회 + 메트포르민 HCl 1000 mg 1일 2회 |
|
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| 기준치(평균) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| 기준치 대비 변화(조정 평균†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| 위약 대비 차이 (조정 평균†) (95% CI) | -0.8‡ (-1.1, -0.6) |
-1.0‡ (-1.2, -0.8) |
-1.3‡ (-1.5, -1.1) |
-1.6‡ (-1.8, -1.3) |
-2.1‡ (-2.3, -1.8) |
|
| A1C <7% 달성 환자 (%) | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| 구제 약물 투여 환자 (%) | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg/dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| 기준치 (평균) | 196 | 201 | 205 | 197 | 204 | 197 |
| 기준치 대비 변화 (조정 평균†) | 6 | -17 | -27 | -29 | -47 | -64 |
| 위약 대비 차이 (조정 평균†) (95% CI) | -23‡ (-33, -14) |
-33‡ (-43, -24) |
-35‡ (-45, -26) |
-53‡ (-62, -43) |
-70‡ (-79, -60) |
|
| 2시간 PPG (mg/dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| 기준치 (평균) | 277 | 285 | 293 | 283 | 292 | 287 |
| 기준치 대비 변화 (조정 평균†) | 0 | -52 | -53 | -78 | -93 | -117 |
| 위약 대비 차이 (조정 평균†) (95% CI) | -52‡ (-67, -37) |
-54‡ (-69, -39) |
-78‡ (-93, -63) |
-93‡ (-107, -78) |
-117‡ (-131, -102) |
|
|
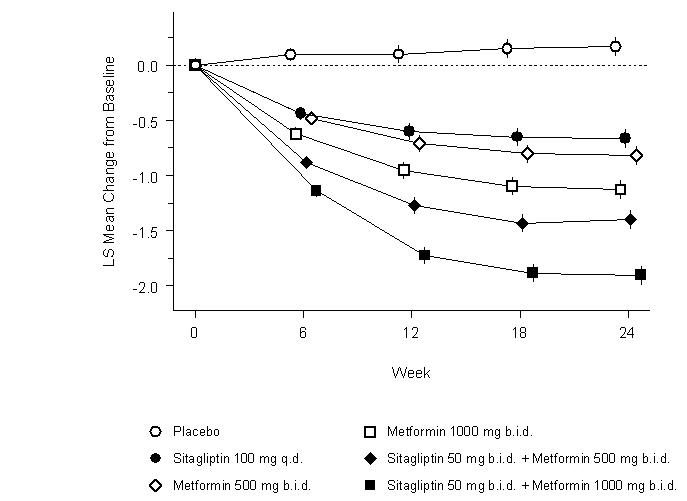 |
초기 병용 요법 또는 병용 요법 유지는 모든 환자에게 적절하지 않을 수 있습니다. 이러한 치료 옵션은 의료 제공자의 재량에 따라 결정됩니다.
메트포르민 병용 시 글리피지드와의 활성 대조 연구
JANUVIA의 효능은 2형 당뇨병 환자를 대상으로 한 52주 이중맹검 글리피지드 대조 비열등성 시험에서 평가되었습니다. 치료를 받지 않거나 다른 항고혈당제를 복용하는 환자는 최대 12주 동안 메트포르민 HCl 단독 요법(1일 ≥1500mg 용량)의 투여 기간에 진입했으며, 해당되는 경우 메트포르민 이외의 약물을 제외했습니다. 투여 기간 후, 불충분한 혈당 조절(A1C 6.5%~10%)을 보인 환자는 1:1로 무작위 배정되어 52주 동안 JANUVIA 1일 1회 100mg 또는 글리피지드를 추가 투여 받았습니다. 글리피지드를 투여받은 환자는 초기 용량으로 1일 5mg을 투여받았으며, 그 후 18주 동안 혈당 조절을 최적화하기 위해 필요에 따라 최대 1일 20mg까지 선택적으로 적정했습니다. 그 후, 저혈당을 예방하기 위한 용량 감소를 제외하고 글리피지드 용량은 일정하게 유지되었습니다. 적정 기간 후 글리피지드의 평균 용량은 10mg이었습니다.
52주 후, 의향-대-치료 분석(표 9)에서 JANUVIA와 글리피지드는 기준치 대비 A1C 감소율이 유사했습니다. 이러한 결과는 프로토콜 분석(그림 2)과 일치했습니다. JANUVIA의 글리피지드에 대한 비열등성을 지지하는 결론은 연구에 포함된 환자와 유사한 기준 A1C를 가진 환자로 제한될 수 있습니다(70% 이상의 환자가 기준 A1C <8%, 90% 이상이 A1C <9%).
| JANUVIA 100 mg | 글리피지드 | |
| A1C (%) | N = 576 | N = 559 |
| 기준치(평균) | 7.7 | 7.6 |
| 기준치 대비 변화 (조정 평균†) | -0.5 | -0.6 |
| FPG (mg/dL) | N = 583 | N = 568 |
| 기준치(평균) | 166 | 164 |
| 기준치 대비 변화 (조정 평균†) | -8 | -8 |
|
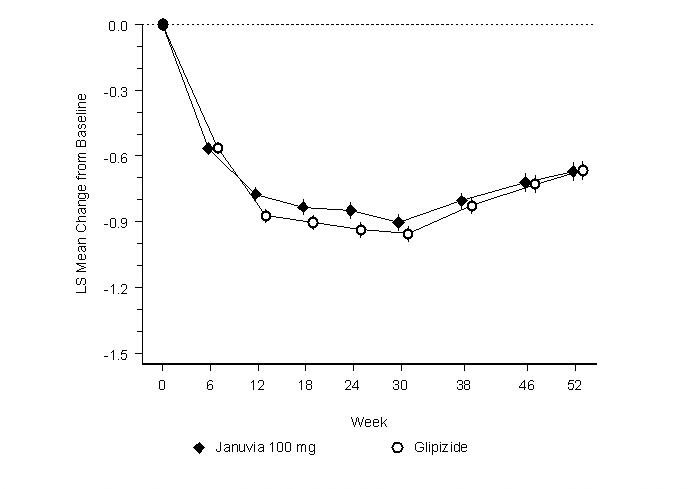 |
JANUVIA군(4.9%)의 저혈당 발생률은 글리피지드군(32.0%)보다 유의하게(p<0.001) 낮았습니다. JANUVIA로 치료받은 환자는 글리피지드를 투여받은 환자의 유의미한 체중 증가와 비교하여 기준치 대비 유의미한 체중 감소를 보였습니다(-1.5 kg 대 +1.1 kg).
피오글리타존 병용 추가 요법
2형 당뇨병 환자 353명이 JANUVIA의 피오글리타존 병용 효능을 평가하기 위해 설계된 24주 무작위 이중맹검 위약 대조 연구에 참여했습니다. 단독 요법으로 경구용 항고혈당제를 복용하는 환자(N=212) 또는 PPARγ 작용제 병용 요법을 복용하는 환자(N=106) 또는 항고혈당제를 복용하지 않는 환자(최소 8주간 치료 중단, N=34)는 피오글리타존 단독 요법(1일 30-45 mg)으로 전환되었고, 약 12주 동안 유도 기간을 완료했습니다. 피오글리타존 단독 요법 유도 기간 후, 불충분한 혈당 조절(A1C 7%~10%) 환자는 1일 1회 100 mg JANUVIA 또는 위약을 추가 투여하는 군으로 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 메트포르민 구제 요법으로 치료받았습니다. 측정된 혈당 종점은 A1C와 공복 혈당이었습니다.
피오글리타존과 병용한 JANUVIA는 피오글리타존과 위약 비교 시 A1C와 공복 혈당에서 유의미한 개선을 보였습니다(표 10). 구제 요법은 JANUVIA 100 mg로 치료받은 환자의 7%와 위약으로 치료받은 환자의 14%에서 사용되었습니다. JANUVIA와 위약 간 체중 변화에는 유의미한 차이가 없었습니다.
| JANUVIA 100 mg + 피오글리타존 | 위약 + 피오글리타존 | |
| A1C (%) | N = 163 | N = 174 |
| 기준치 (평균) | 8.1 | 8.0 |
| 기준치 대비 변화 (조정 평균†) | -0.9 | -0.2 |
| 위약 + 피오글리타존과의 차이 (조정 평균†) (95% CI) |
-0.7‡ (-0.9, -0.5) |
|
| A1C <7% 달성 환자 (%) | 74 (45%) | 40 (23%) |
| 공복 혈당 (mg/dL) | N = 163 | N = 174 |
| 기준치 (평균) | 168 | 166 |
| 기준치 대비 변화 (조정 평균†) | -17 | 1 |
| 위약 + 피오글리타존과의 차이 (조정 평균†) (95% CI) |
-18‡ (-24, -11) |
|
피오글리타존과의 초기 병용 요법
식이요법과 운동으로 혈당 조절이 불충분한 2형 당뇨병 환자 520명을 대상으로, 피오글리타존과 병용한 JANUVIA의 초기 치료 효능을 평가하기 위해 24주 동안 무작위 배정 이중맹검 연구를 실시했습니다. 연구 시작 시 항당뇨병제를 복용하지 않은 환자(지난 2년간 누적 치료 기간 <4주, 지난 4개월 동안 치료 없음)로 혈당 조절이 불충분한(A1C 8%~12%) 환자는 2주 동안 단일맹검 위약 투여 기간을 거친 후 무작위 배정되었습니다. 거의 동일한 수의 환자들이 1일 1회 100mg JANUVIA와 30mg 피오글리타존 병용 초기 치료 또는 1일 1회 30mg 피오글리타존 단독 요법을 받도록 무작위 배정되었습니다. 이 연구에는 혈당 개선 치료가 없었습니다.
JANUVIA와 피오글리타존 병용 초기 치료는 피오글리타존 단독 요법에 비해 A1C, FPG 및 2시간 PPG에서 유의미한 개선을 보였습니다(표 11). A1C 개선은 성별, 연령, 인종, 기준 BMI, 기준 A1C 또는 질병 기간으로 정의된 하위 그룹에서 전반적으로 일관되었습니다. 이 연구에서 피오글리타존과 병용하여 JANUVIA를 투여받은 환자는 피오글리타존 단독 투여 환자에 비해 체중이 평균 1.1kg 증가했습니다(3.0kg 대 1.9kg). 지질 효과는 일반적으로 중립적이었습니다.
| JANUVIA 100 mg + 피오글리타존 | 피오글리타존 | |
| A1C (%) | N = 251 | N = 246 |
| 기준(평균) | 9.5 | 9.4 |
| 기준치 변화(조정 평균†) | -2.4 | -1.5 |
| 피오글리타존과의 차이(조정 평균†)(95% CI) | -0.9‡ (-1.1, -0.7) |
|
| A1C <7% 달성 환자(%) | 151 (60%) | 68 (28%) |
| FPG (mg/dL) | N = 256 | N = 253 |
| 기준(평균) | 203 | 201 |
| 기준치 변화(조정 평균†) | -63 | -40 |
| 피오글리타존과의 차이(조정 평균†)(95% CI) | -23‡ (-30, -15) |
|
| 2시간 PPG (mg/dL) | N = 216 | N = 211 |
| 기준(평균) | 283 | 284 |
| 기준치 변화(조정 평균†) | -114 | -69 |
| 피오글리타존과의 차이(조정 평균†)(95% CI) | -45‡ (-57, -32) |
|
메트포르민 및 로시글리타존 병용 요법 추가
2형 당뇨병 환자 278명을 대상으로 메트포르민 및 로시글리타존과 병용한 JANUVIA의 효능을 평가하기 위해 설계된 54주 무작위 이중맹검 위약 대조 연구가 수행되었습니다. 메트포르민 HCl ≥1500mg/일 및 로시글리타존 ≥4mg/일 또는 메트포르민 HCl ≥1500mg/일 및 피오글리타존 ≥30mg/일(로시글리타존 ≥4mg/일로 전환)로 이중 요법을 받은 환자는 6주간의 용량 안정화 기간에 참여했습니다. 다른 이중 요법을 받은 환자는 최대 20주 동안 지속되는 용량 적정/안정화 기간에 메트포르민 HCl ≥1500mg/일 및 로시글리타존 ≥4mg/일로 전환되었습니다. 기간 종료 후, 불충분한 혈당 조절(A1C 7.5%~11%)을 보인 환자는 1일 1회 100mg JANUVIA 또는 위약을 추가 투여하는 2:1 비율로 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 글리피지드(또는 다른 설폰요소제) 구제 요법을 받았습니다. 혈당 매개변수 평가의 주요 시점은 18주차였습니다.
메트포르민 및 로시글리타존과 병용한 JANUVIA는 18주차에 위약과 메트포르민 및 로시글리타존 병용 투여군에 비해 A1C, FPG 및 2시간 PPG에서 유의한 개선을 보였습니다(표 12). 54주차에, 치료 의도 모집단을 기반으로 한 분석에서 JANUVIA 투여 환자의 A1C 평균 감소는 -1.0%였고 위약 투여 환자는 -0.3%였습니다. JANUVIA 100mg 투여 환자의 18%, 위약 투여 환자의 40%에서 구제 요법이 사용되었습니다. 체중 변화에 있어 JANUVIA와 위약 간에는 유의한 차이가 없었습니다.
| JANUVIA 100 mg + 메트포르민 + 로시글리타존 |
위약 + 메트포르민 + 로시글리타존 |
|
| A1C (%) | N = 176 | N = 93 |
| 기준(평균) | 8.8 | 8.7 |
| 기준치 변화(보정 평균†) | -1.0 | -0.4 |
| 위약 + 로시글리타존 + 메트포르민과의 차이(보정 평균†)(95% CI) | -0.7‡ (-0.9, -0.4) |
|
| A1C <7% 달성 환자(%) | 39 (22%) | 9 (10%) |
| FPG (mg/dL) | N = 179 | N = 94 |
| 기준(평균) | 181 | 182 |
| 기준치 변화(보정 평균†) | -30 | -11 |
| 위약 + 로시글리타존 + 메트포르민과의 차이(보정 평균†)(95% CI) | -18‡ (-26, -10) |
|
| 2시간 PPG (mg/dL) | N = 152 | N = 80 |
| 기준(평균) | 256 | 248 |
| 기준치 변화(보정 평균†) | -59 | -21 |
| 위약 + 로시글리타존 + 메트포르민 대비 차이 (조정 평균†) (95% CI) | -39‡ (-51, -26) |
|
글리메피리드 병용 요법, 메트포르민 병용 또는 단독 요법
2형 당뇨병 환자 441명을 대상으로, 글리메피리드 병용 또는 메트포르민 병용 시 JANUVIA의 효능을 평가하기 위해 24주 동안 무작위 배정, 이중맹검, 위약 대조 연구를 실시했습니다. 환자들은 글리메피리드(≥4 mg/일) 단독 또는 글리메피리드와 메트포르민 HCl(≥1500 mg/일) 병용 치료를 위한 투여 기간에 참여했습니다. 최대 16주 동안의 용량 적정 및 용량 안정 투여 기간과 2주간의 위약 투여 기간 후, 불충분한 혈당 조절(A1C 7.5%~10.5%) 환자는 1일 1회 100 mg의 JANUVIA 또는 위약을 추가 투여하는 그룹으로 무작위 배정되었습니다. 연구 중 특정 혈당 목표를 달성하지 못한 환자는 피오글리타존 구제 요법으로 치료했습니다.
글리메피리드 병용 또는 메트포르민 병용 시 JANUVIA는 위약과 비교하여 A1C 및 FPG에서 유의한 개선을 보였습니다(표 13). 전체 연구 대상자(글리메피리드와 JANUVIA 병용 환자 및 글리메피리드와 메트포르민 병용 환자)에서 위약과 비교하여 A1C는 -0.7%, FPG는 -20 mg/dL의 기준치 대비 평균 감소가 관찰되었습니다. JANUVIA 100 mg로 치료받은 환자의 12%, 위약으로 치료받은 환자의 27%에서 구제 요법이 사용되었습니다. 이 연구에서 JANUVIA로 치료받은 환자는 위약(+0.8 kg 대 -0.4 kg)과 비교하여 체중이 평균 1.1 kg 증가했습니다. 또한 저혈당 발생률이 증가했습니다. [경고 및 주의 사항 (5.4); 유해 반응 (6.1) 참조.]
| JANUVIA 100 mg + 글리메피리드 |
위약 + 글리메피리드 |
JANUVIA 100 mg + 글리메피리드 + 메트포르민 |
위약 + 글리메피리드 + 메트포르민 |
||||
| A1C (%) | N = 102 | N = 103 | N = 115 | N = 105 | |||
| 기준치(평균) | 8.4 | 8.5 | 8.3 | 8.3 | |||
| 기준치 대비 변화(조정 평균†) | -0.3 | 0.3 | -0.6 | 0.3 | |||
| 위약과의 차이(조정 평균†) (95% CI) |
-0.6‡ (-0.8, -0.3) |
-0.9‡ (-1.1, -0.7) |
|||||
| A1C <7% 달성 환자(%) | 11 (11%) | 9 (9%) | 26 (23%) | 1 (1%) | |||
| FPG (mg/dL) | N = 104 | N = 104 | N = 115 | N = 109 | |||
| 기준치 (평균) | 183 | 185 | 179 | 179 |
| 기준치 변화 (조정 평균†) | -1 | 18 | -8 | 13 |
| 플라시보와의 차이 (조정 평균†) (95% CI) |
-19§ (-32, -7) |
-21‡ (-32, -10) |
인슐린 병용 요법 추가 (메트포르민 병용 또는 단독)
2형 당뇨병 환자 641명을 대상으로 JANUVIA의 인슐린 요법 추가(메트포르민 병용 또는 단독) 효능을 평가하기 위해 설계된 24주 무작위 이중맹검 위약 대조 연구가 진행되었습니다. 이 연구의 인종 분포는 백인 약 70%, 아시아인 18%, 흑인 7%, 기타 5%였습니다. 이 연구 참가자의 약 14%는 히스패닉계였습니다. 환자들은 메트포르민 HCl(≥1500mg/일) 병용 또는 단독으로 2주간의 단일맹검 유도 치료 기간 동안 혼합형, 지속형 또는 중간형 인슐린을 투여받았습니다. 단기 작용 인슐린을 사용하는 환자는 단기 작용 인슐린이 혼합형 인슐린의 일부로 투여되지 않는 한 제외되었습니다. 유도 기간 후, 부적절한 혈당 조절(A1C 7.5%~11%) 환자는 1일 1회 100mg JANUVIA 또는 위약을 추가 투여받도록 무작위 배정되었습니다. 환자들은 등록 전 안정적인 인슐린 용량을 유지했으며 유도 기간 동안 인슐린 용량 변경은 허용되지 않았습니다. 이중맹검 치료 기간 동안 특정 혈당 목표를 달성하지 못한 환자는 구제 요법으로 기저 인슐린 용량을 증량하도록 했습니다.
기준 시점의 일일 인슐린 용량 중앙값은 JANUVIA 치료 환자의 경우 42단위, 위약 치료 환자의 경우 45단위였습니다. 연구 종료 시점의 일일 인슐린 용량 기준치 변화 중앙값은 두 그룹 모두 0이었습니다. 인슐린 병용(메트포르민 병용 또는 단독) 시 JANUVIA는 위약과 비교하여 A1C, FPG 및 2시간 PPG를 유의하게 개선했습니다(표 14). 두 치료 그룹 모두 24주차까지 기준치 대비 체중이 0.1kg 증가했습니다. JANUVIA 치료 환자에서 저혈당 발생률이 증가했습니다. [경고 및 주의 사항 (5.4) 참조; 유해 반응 (6.1).]
|
JANUVIA 100mg + 인슐린 (+/- 메트포르민) |
위약 + 인슐린 (+/- 메트포르민) |
|
| A1C (%) | N = 305 | N = 312 |
| 기준치(평균) | 8.7 | 8.6 |
| 기준치 변화(조정 평균†) | -0.6 | -0.1 |
| 위약과의 차이(조정 평균†,‡)(95% CI) | -0.6§ (-0.7, -0.4) | |
| A1C <7% 달성 환자(%) | 39 (12.8%) | 16 (5.1%) |
| FPG (mg/dL) | N = 310 | N = 313 |
| 기준치(평균) | 176 | 179 |
| 기준치 변화(조정 평균†) | -18 | -4 |
| 위약과의 차이(조정 평균†)(95% CI) | -15§ (-23, -7) | |
| 2시간 PPG (mg/dL) | N = 240 | N = 257 |
| 기준치 (평균) | 291 | 292 |
| 기준치 변화 (조정 평균†) | -31 | 5 |
| 플라시보와의 차이 (조정 평균†) (95% CI) | -36§ (-47, -25) | |
인슐린 글라르진 투여 개시 및 적정 시 JANUVIA 유지
2형 당뇨병 환자 746명(기준 HbA1C 평균 8.8%, 질병 기간 10.8년)이 인슐린 글라르진 투여 개시 및 증량 중 JANUVIA 지속 투여의 효능 및 안전성을 평가하기 위한 30주 무작위 이중맹검 플라시보 대조 연구에 참여했습니다. 메트포르민 HCl(≥1500mg/일)을 DPP-4 억제제 및/또는 설폰요소제와 병용 투여했지만, 혈당 조절이 불충분한(A1C 7.5%~11%) 환자를 연구에 등록했습니다. 메트포르민과 JANUVIA(100mg/일)를 복용하는 환자는 이중맹검 치료 기간에 직접 참여했고, 다른 DPP-4 억제제 및/또는 설폰요소제를 복용하는 환자는 메트포르민을 유지하고 JANUVIA(100mg)로 전환하는 4~8주 유도 기간에 참여했습니다. 다른 DPP-4 억제제와 설폰요소제는 중단되었습니다. 무작위 배정 시 환자는 JANUVIA를 계속 투여하거나 JANUVIA를 중단하고 일치하는 플라시보로 전환하도록 무작위 배정되었습니다. 무작위 배정 당일 저녁에 10단위의 인슐린 글라르진을 피하 주사로 투여하기 시작했습니다. 환자는 공복 혈당 측정 결과에 따라 저녁 인슐린 용량을 증량하여 72~100mg/dL의 목표치를 달성하도록 지시받았습니다.
30주차에 A1C 감소율은 시타글립틴 그룹이 플라시보 그룹보다 더 컸습니다(표 15). 시험 종료 시 시타글립틴 그룹의 27.3%와 플라시보 그룹의 27.3% 환자가 목표 범위 내의 공복 혈장 포도당(FPG)을 나타냈으며, 군 간 인슐린 용량에 유의미한 차이는 없었습니다.
| 시타글립틴 100mg +메트포르민 + 인슐린 글라르진 |
플라시보 +메트포르민 + 인슐린 글라르진 |
|
|---|---|---|
| A1C (%) | N = 373* | N = 370* |
| 기준치 (평균) | 8.8 | 8.8 |
| 30주차 (평균) | 6.9 | 7.3 |
| 기준치 변화 (조정 평균)† | -1.9 | -1.4 |
| 플라시보와의 차이 (조정 평균) (95% CI)† | -0.4 (-0.6, -0.3)‡ | |
| A1C <7%인 환자 (%) | 202 (54.2%) | 131 (35.4%) |
| FPG (mg/dL) | N = 373* | N = 370* |
| 기준치 (평균) | 199 | 201 |
| 30주차 (평균) | 118 | 123 |
| 기준치 변화 (조정 평균)† | -81 | -76 |
16 제공/보관 및 취급 방법
정제는 다음과 같이 공급됩니다:
| 함량 | 설명 | 포장단위 | NDC |
|---|---|---|---|
| 시타글립틴 25mg | 한쪽 면에 “221”이 새겨진 분홍색 원형 필름 코팅 정제 | 30정들이 단위 용기 90정들이 단위 용기 100정들이 단위 용량 블리스터 포장 |
NDC 0006-0221-31 NDC 0006-0221-54 NDC 0006-0221-28 |
| 시타글립틴 50mg | 한쪽 면에 “112”이 새겨진 연베이지색 원형 필름 코팅 정제 | 30정들이 단위 용기 90정들이 단위 용기 100정들이 단위 용량 블리스터 포장 |
NDC 0006-0112-31 NDC 0006-0112-54 NDC 0006-0112-28 |
| 시타글립틴 100mg | 한쪽 면에 “277”이 새겨진 베이지색 원형 필름 코팅 정제 | 30정들이 단위 용기 90정들이 단위 용기 30정들이 단위 용량 블리스터 캘린더 포장 30정들이 단위 용량 블리스터 캘린더 포장 100정들이 단위 용량 블리스터 포장 1000정들이 병. |
NDC 0006-0277-31 NDC 0006-0277-54 NDC 0006-0277-02 NDC 0006-0277-33 NDC 0006-0277-28 NDC 0006-0277-82 |
17 환자 상담 정보
FDA 승인 환자용 설명서(의약품 안내서)를 읽도록 환자에게 알려주십시오.
췌장염
JANUVIA의 시판 후 사용 중 급성 췌장염이 보고되었음을 환자에게 알려주십시오. 지속적인 심한 복통(때때로 등으로 방사될 수 있음)이 급성 췌장염의 특징적인 증상이며, 구토를 동반하거나 동반하지 않을 수 있음을 환자에게 알려주십시오. 지속적인 심한 복통이 발생하면 JANUVIA 복용을 즉시 중단하고 의사와 상담하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.1) 참조].
심부전
심부전의 징후와 증상에 대해 환자에게 알려주십시오. JANUVIA를 시작하기 전에 환자의 심부전 병력 또는 중등도에서 중증의 신장 손상을 포함한 심부전의 기타 위험 요인에 대해 문의하십시오. 숨가쁨이 증가하거나 체중이 급격히 증가하거나 발이 붓는 것을 포함한 심부전 증상이 나타나면 가능한 한 빨리 의료 제공자에게 연락하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.2) 참조].
저혈당증
JANUVIA를 설폰요소제 또는 인슐린에 추가하면 저혈당증의 발생률이 증가한다는 점을 환자에게 알려주십시오. 이러한 약물과 함께 JANUVIA를 복용하는 환자에게 저혈당증의 위험, 증상 및 치료법, 그리고 저혈당증 발생에 기여하는 상태에 대해 설명하십시오 [경고 및 주의사항 (5.4) 참조].
과민반응
JANUVIA의 시판 후 사용 중 알레르기 반응이 보고되었음을 환자에게 알려주십시오. 알레르기 반응(발진, 두드러기, 얼굴, 입술, 혀 및 목의 부종을 포함하며, 호흡 또는 삼키기 어려움을 유발할 수 있음) 증상이 나타나면 환자는 JANUVIA 복용을 중단하고 즉시 의학적 조언을 구해야 합니다 [경고 및 주의사항 (5.5) 참조].
심하고 쇠약하게 하는 관절통
이 약물 계열에서 심하고 쇠약하게 하는 관절통이 발생할 수 있음을 환자에게 알려주십시오. 증상이 나타나는 시간은 하루에서 수년까지 다양할 수 있습니다. 심한 관절통이 발생하면 의학적 조언을 구하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.6) 참조].
수포성 박리증
이 약물 계열에서 수포성 박리증이 발생할 수 있음을 환자에게 알려주십시오. 수포 또는 침식이 발생하면 의학적 조언을 구하도록 환자에게 지시하십시오 [경고 및 주의사항 (5.7) 참조].
SPL 미분류 섹션
판매원: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
특허 정보: www.msd.com/research/patent
Copyright © 2006-2023 Merck & Co., Inc., Rahway, NJ, USA 및 그 계열사.
모든 권리 보유.
uspi-mk0431-t-2307r029
약물 안내문
| 의약품 안내 JANUVIA® (자누비아) (시타글립틴) 경구용 정제 |
|||||||
|---|---|---|---|---|---|---|---|
| 본 의약품 안내는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2023년 7월 | ||||||
| JANUVIA를 복용하기 전에 그리고 재충전할 때마다 이 의약품 안내를 주의 깊게 읽으십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 의사와 자신의 질병 또는 치료에 대해 상담하는 것을 대신할 수 없습니다. JANUVIA에 대해 궁금한 점이 있으면 의사 또는 약사에게 문의하십시오. | |||||||
|
JANUVIA에 대해 가장 중요한 정보는 무엇입니까?
|
|||||||
|
|
|
|||||
| 심하고 사라지지 않는 복통(복부)이 있으면 JANUVIA 복용을 중단하고 즉시 의사에게 연락하십시오. 통증은 복부에서 등으로 이어질 수 있습니다. 구토를 동반하거나 동반하지 않을 수 있습니다. 이러한 증상은 췌장염의 증상일 수 있습니다. | |||||||
|
|||||||
이러한 증상은 심부전의 증상일 수 있습니다. |
|||||||
JANUVIA는 무엇입니까?
|
|||||||
|
누가 JANUVIA를 복용해서는 안 됩니까?
JANUVIA에 대한 심각한 알레르기 반응의 증상으로는 발진, 피부에 붉은 반점(두드러기)이 생기거나 얼굴, 입술, 혀 및 목이 붓는 것 등이 있으며, 이로 인해 호흡 또는 삼키기가 어려워질 수 있습니다. |
|||||||
| JANUVIA를 복용하기 전에 의사에게 무엇을 알려야 합니까? JANUVIA를 복용하기 전에 다음과 같은 경우를 포함하여 모든 질병에 대해 의사에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의사에게 알리십시오. |
|||||||
JANUVIA는 어떻게 복용해야 합니까?
|
|||||||
|
JANUVIA의 가능한 부작용은 무엇입니까?
|
|||||||
|
|
|
|
|
|||
JANUVIA의 가장 흔한 부작용으로는 상기도 감염, 코막힘 또는 콧물 및 인후통, 두통이 있습니다. |
|||||||
| JANUVIA는 어떻게 보관해야 합니까? JANUVIA는 섭씨 20~25도(화씨 68~77도)의 실온에 보관하십시오. JANUVIA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||||||
| JANUVIA의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 JANUVIA를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 JANUVIA를 제공하지 마십시오. 해를 끼칠 수 있습니다. 이 의약품 안내서는 JANUVIA에 대한 가장 중요한 정보를 요약한 것입니다. 자세한 내용을 알고 싶으면 의사와 상담하십시오. 의료 전문가를 위해 작성된 JANUVIA에 대한 정보는 의사 또는 약사에게 문의할 수 있습니다. |
|||||||
| JANUVIA의 성분은 무엇입니까? 활성 성분: sitagliptin 비활성 성분: 미정질 셀룰로오스, 무수 이염기성 인산칼슘, 크로스카멜로오스나트륨, 마그네슘스테아레이트, 스테아릴푸마르산나트륨 및 프로필갈레이트. 정제 필름 코팅에는 다음과 같은 비활성 성분이 포함되어 있습니다. 폴리비닐알코올, 폴리에틸렌글리콜, 활석, 이산화티타늄, 적색 산화철 및 황색 산화철. |
|||||||
| 판매원: Merck Sharp & Dohme LLC Rahway, NJ 07065, USA 자세한 내용은 www.JANUVIA.com을 방문하거나 1-800-622-4477로 전화하십시오. 특허 정보: www.msd.com/research/patent. 여기에 표시된 상표는 각 회사의 소유입니다. Copyright © 2010-2023 Merck & Co., Inc., Rahway, NJ, USA 및 그 계열사. 모든 권리 보유. usmg-mk0431-t-2307r020 |
|||||||
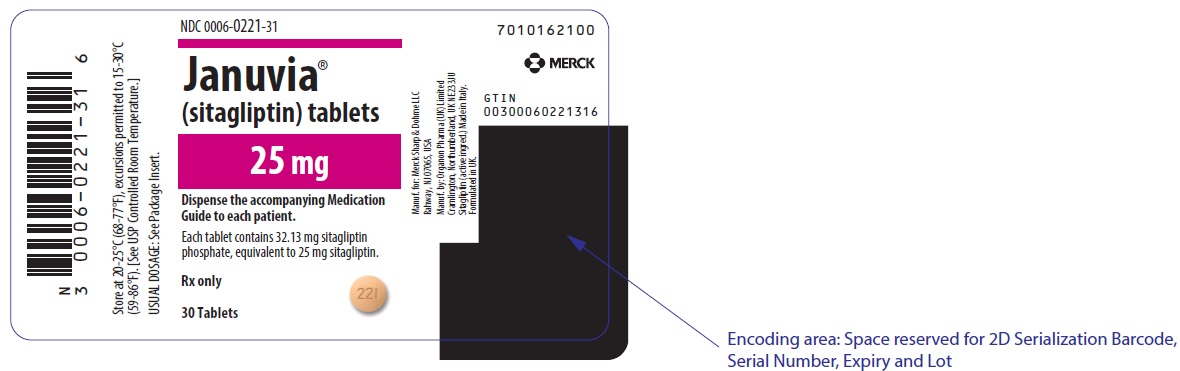
주표시면 – 25mg 정제 병 라벨
NDC 0006-0221-31
Januvia®
(sitagliptin) tablets
25 mg
각 환자에게 동봉된 약물 안내서를 함께 제공하십시오.
정제 1정에는 시타글립틴 인산염 32.13mg이 함유되어 있으며, 이는 시타글립틴 25mg에 해당합니다.
처방전 의약품
30정
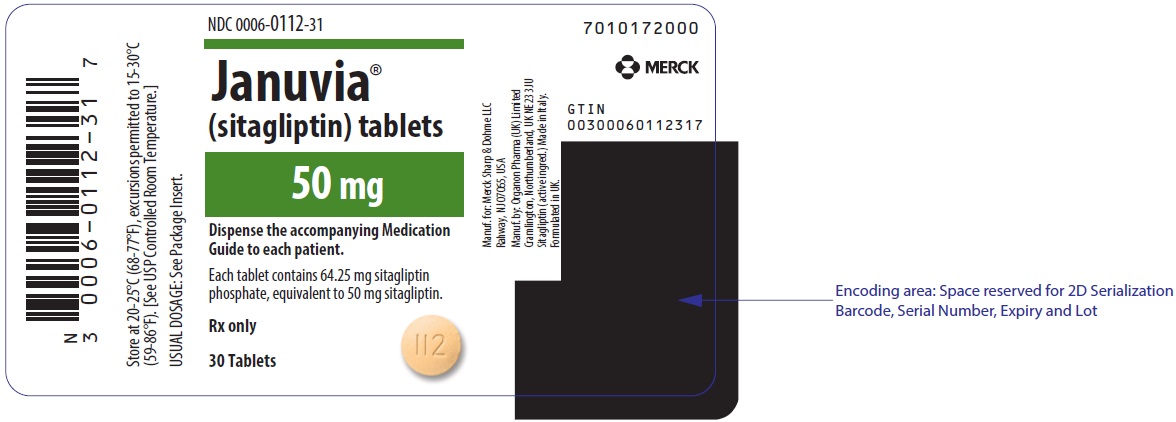
주요 표시 패널 – 50mg 정제 병 라벨
NDC 0006-0112-31
Januvia®
(sitagliptin) tablets
50 mg
동봉된 약물 안내서를 각 환자에게 제공하십시오.
정제 1정당 sitagliptin phosphate 64.25mg 함유 (sitagliptin 50mg에 해당)
처방전 의약품
30정
주요 표시 패널 – 100mg 정제 병 라벨
NDC 0006-0277-31
Januvia®
(sitagliptin) tablets
100 mg
동봉된 약물 안내서를 각 환자에게 제공하십시오.
정제 1정당 sitagliptin phosphate 128.5mg 함유
(sitagliptin 100mg에 해당)
처방전 의약품
30정