의약품 제조업체: Pfizer Laboratories Div Pfizer Inc (Updated: 2025-01-10)
처방 정보 하이라이트
INLYTA® (악시티닙) 정제, 필름 코팅 경구 투여
미국 최초 승인: 2012
적응증 및 용법
용법 및 용량
- •
- 아벨루맙 800mg을 2주마다 투여하는 경우, INLYTA 5mg을 1일 2회 경구 투여. (2.1)
- •
- 펨브롤리주맙 200mg을 3주마다 또는 400mg을 6주마다 투여하는 경우, INLYTA 5mg을 1일 2회 경구 투여. (2.1)
- •
- 단독 요법으로 INLYTA를 사용하는 경우, 초기 용량은 1일 2회 경구 투여 5mg입니다. (2.1)
- •
- 개별 안전성 및 내약성에 따라 용량 조절이 가능합니다. (2.2)
- •
- INLYTA는 약 12시간 간격으로 음식과 함께 또는 음식 없이 투여하십시오. (2.1)
- •
- INLYTA는 물 한 잔과 함께 통째로 삼켜야 합니다. (2.1)
- •
- 유해 반응에 대한 용량 변경에 대해서는 전체 처방 정보를 참조하십시오. (2.2)
- •
- 강력한 CYP3A4/5 억제제가 필요한 경우 INLYTA 용량을 약 절반으로 줄입니다. (2.2)
- •
- 중등도 간 장애 환자의 경우 초기 용량을 약 절반으로 줄입니다. (2.2)
제형 및 강도
1mg 및 5mg 정제 (3)
금기
없음. (4)
경고 및 주의사항
- •
- 고혈압: 고혈압, 고혈압 위기가 관찰되었습니다. INLYTA 투여를 시작하기 전에 혈압을 잘 조절해야 합니다. 고혈압을 모니터링하고 필요에 따라 치료하십시오. 고혈압의 중증도에 따라 INLYTA를 중단한 후 용량을 줄이거나 영구적으로 중단하십시오. (5.1)
- •
- 동맥 및 정맥 혈전색전증: 동맥 및 정맥 혈전색전증이 관찰되었으며 치명적일 수 있습니다. 이러한 사건의 위험이 증가된 환자에게는 주의하여 사용하십시오. 치료 중 동맥 혈전색전증이 발생하면 INLYTA를 영구적으로 중단하십시오. VTE의 중증도에 따라 INLYTA를 중단한 후 동일한 용량으로 재개하거나 영구적으로 중단하십시오. (5.2, 5.3)
- •
- 출혈: 치명적인 사례를 포함한 출혈 사건이 보고되었습니다. INLYTA는 치료되지 않은 뇌 전이 또는 최근 활동성 위장관 출혈의 증거가 있는 환자에게서 연구되지 않았으며 이러한 환자에게는 사용해서는 안 됩니다. 출혈의 중증도와 지속 시간에 따라 INLYTA를 중단한 후 용량을 줄이거나 중단하십시오. (5.4)
- •
- 심부전: 심부전이 관찰되었으며 치명적일 수 있습니다. INLYTA 치료 전반에 걸쳐 심부전의 징후나 증상을 모니터링하십시오. 심부전 관리에는 INLYTA의 용량 감소, 용량 중단 또는 영구 중단이 필요할 수 있습니다. (5.5)
- •
- 위장관 천공 및 누공 형성: 사망을 포함한 위장관 천공 및 누공이 발생했습니다. 위장관 천공 또는 누공 위험이 있는 환자에게는 주의하여 사용하십시오. (5.6)
- •
- 갑상선 기능 저하증: 갑상선 호르몬 대체 요법이 필요한 갑상선 기능 저하증이 보고되었습니다. INLYTA 투여 시작 전과 투여 전반에 걸쳐 주기적으로 갑상선 기능을 모니터링하십시오. (5.7)
- •
- 손상된 상처 치유: 선택적 수술 전 최소 2일 동안 INLYTA를 중단하십시오. 주요 수술 후 최소 2주 동안, 그리고 적절한 상처 치유가 될 때까지 투여하지 마십시오. 손상된 상처 치유의 중증도와 지속 시간에 따라 INLYTA를 감소된 용량으로 재개하거나 중단하십시오. 상처 치유 합병증 해결 후 INLYTA 재개의 안전성은 확립되지 않았습니다. (5.8)
- •
- 가역적 후방 백질뇌병증 증후군(RPLS): RPLS가 관찰되었습니다. RPLS의 징후나 증상이 나타나면 INLYTA를 영구적으로 중단하십시오. (5.9)
- •
- 단백뇨: INLYTA 투여 시작 전과 투여 전반에 걸쳐 주기적으로 단백뇨를 모니터링하십시오. 중등도에서 중증의 단백뇨의 경우 INLYTA를 중단한 후 용량을 줄이십시오. (5.10)
- •
- 간독성: 단독 요법으로 INLYTA로 치료하는 동안 간 효소 상승이 발생했습니다. INLYTA 투여 시작 전과 투여 전반에 걸쳐 주기적으로 ALT, AST 및 빌리루빈을 모니터링하십시오. avelumab 또는 pembrolizumab과 병용하여 사용하는 경우 3등급 및 4등급 ALT 및 AST 상승 빈도가 더 높을 수 있습니다. 간 효소를 더 자주 모니터링하는 것을 고려하십시오. 중증 또는 생명을 위협하는 간독성의 경우 INLYTA와 avelumab 또는 pembrolizumab을 중단하고 필요에 따라 코르티코스테로이드 요법을 시작하거나 병용 요법을 영구적으로 중단하십시오. (5.11)
- •
- 간 기능 손상 환자에서의 사용: 중등도 간 기능 손상 환자에게 사용하는 경우 INLYTA의 시작 용량을 줄이십시오. INLYTA는 중증 간 기능 손상 환자에게서 연구되지 않았습니다. (2.2, 5.12)
- •
- 주요 심혈관계 이상 반응(avelumab과 병용한 INLYTA): 심혈관 위험 요인 관리를 최적화하십시오. 3-4등급 사건의 경우 avelumab과 병용한 INLYTA를 영구적으로 중단하십시오. (5.13)
- •
- 배아-태아 독성: INLYTA는 태아에게 해를 끼칠 수 있습니다. 환자에게 태아에 대한 잠재적 위험과 효과적인 피임법을 사용하도록 조언하십시오. (5.14, 8.1, 8.3)
이상 반응
가장 흔한 이상 반응(≥20%)은 다음과 같습니다.
avelumab과 병용한 INLYTA: 설사, 피로, 고혈압, 근골격계 통증, 메스꺼움, 점막염, 수장족저 홍반각화증, 발성장애, 식욕 감퇴, 갑상선 기능 저하증, 발진, 간독성, 기침, 호흡 곤란, 복통 및 두통. (6.1)
pembrolizumab과 병용한 INLYTA: 설사, 피로/쇠약, 고혈압, 간독성, 갑상선 기능 저하증, 식욕 감퇴, 수장족저 홍반각화증, 메스꺼움, 구내염/점막 염증, 발성장애, 발진, 기침 및 변비. (6.1)
단독 요법으로 사용된 INLYTA: 설사, 고혈압, 피로, 식욕 감퇴, 메스꺼움, 발성장애, 수장족저 홍반각화증(손발 증후군), 체중 감소, 구토, 쇠약 및 변비. (6.1)
의심되는 이상 반응을 보고하려면 1-800-438-1985로 Pfizer Inc.에 연락하거나 1-800-FDA-1088로 FDA에 연락하거나 www.fda.gov/medwatch를 방문하십시오.
약물 상호작용
특정 집단에서의 사용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17항을 참조하십시오.
개정: 2024년 7월
목차
전문 정보: 목차*
1 적응증 및 용법
1.1 1차 진행성 신세포암
1.2 2차 진행성 신세포암
2 용법 및 용량
2.1 권장 용량
2.2 용량 조절 지침
2.3 약물 상호작용에 대한 용량 조절
2.4 간 손상에 대한 용량 조절
3 제형 및 강도
4 금기사항
5 경고 및 주의사항
5.1 고혈압
5.2 동맥색전증
5.3 정맥색전증
5.4 출혈
5.5 심부전
5.6 위장관 천공 및 누공 형성
5.7 갑상선 기능 장애
5.8 상처 치유 장애
5.9 가역적 후방 백질뇌병증 증후군
5.10 단백뇨
5.11 간독성
5.12 간 손상 환자에서의 사용
5.13 중대한 심혈관계 이상반응 (MACE)
5.14 배아-태아 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 CYP3A4/5 저해제
7.2 CYP3A4/5 유도제
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간 손상
8.7 신장 손상
10 과량 복용
11 성상
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상적 독성학
13.1 발암성, 돌연변이원성, 생식능력 저해
14 임상 연구
14.1 1차 진행성 RCC
14.2 2차 진행성 RCC
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분은 목록에 포함되어 있지 않습니다.
1 적응증 및 사용법
1.1 1차 진행성 신세포암
아벨루맙과 병용한 INLYTA는 진행성 신세포암(RCC) 환자의 1차 치료에 사용됩니다.
펨브롤리주맙과 병용한 INLYTA는 진행성 RCC 환자의 1차 치료에 사용됩니다.
2 용법 및 투여
2.1 권장 복용량
1차 진행성 신세포암 (RCC)
2.2 복용량 수정 지침
개별 안전성 및 내약성에 따라 복용량 증가 또는 감소가 권장됩니다.
권장 INLYTA 복용량 증가 및 감소는 표 1에 나와 있습니다.
치료 과정에서 2주 연속 이상의 기간 동안 2등급 이상의 이상반응(이상반응에 대한 일반적인 독성 기준[CTCAE]에 따름) 없이 INLYTA를 내약하고, 정상 혈압이며, 항고혈압제를 복용하지 않는 환자는 복용량을 증량할 수 있습니다.
| 복용량 수정 | 복용량 |
|---|---|
|
권장 시작 복용량 |
1일 2회 5mg |
|
복용량 증가 |
|
|
첫 번째 복용량 증가 |
1일 2회 7mg |
|
두 번째 복용량 증가 |
1일 2회 10mg |
|
복용량 감소* |
|
|
첫 번째 복용량 감소† |
1일 2회 3mg |
|
두 번째 복용량 감소 |
1일 2회 2mg |
INLYTA에 대한 이상반응 권장 용량 조정은 표 2에 나와 있습니다.
| 이상반응 | 중증도 | INLYTA 용량 조정 |
|---|---|---|
|
고혈압 [see Warnings and Precautions (5.1)] |
항고혈압제 치료에도 불구하고 SBP >150 mmHg 또는 DBP >100 mmHg |
|
|
SBP >160 mmHg 또는 DBP >105 mmHg |
|
|
|
4등급 또는 고혈압성 위기 |
|
|
|
출혈 [see Warnings and Precautions (5.4)] |
3등급 또는 4등급 |
|
|
심부전 [see Warnings and Precautions (5.5)] |
무증상 심근병증 (좌심실 박출률이 기준치보다 20% 이상이지만 50% 미만이거나 기준치를 얻지 못한 경우 정상 하한치 미만) |
|
|
임상적으로 나타나는 울혈성 심부전 |
|
|
|
상처 치유 장애 [see Warnings and Precautions (5.8)] |
모든 등급 |
|
|
가역적 후측 백질뇌병증 증후군 [see Warnings and Precautions (5.9)] |
모든 등급 |
|
|
단백뇨 [see Warnings and Precautions (5.10)] |
24시간 동안 2g 이상의 단백뇨 |
|
|
기타 이상반응 |
3등급 |
|
|
4등급 |
|
표 3은 INLYTA를 avelumab 또는 pembrolizumab와 병용 투여할 때 이상반응에 대한 추가 권장 용량 조정을 나타냅니다.
면역 매개 이상반응에 대한 용량 조정을 포함하여 avelumab 또는 pembrolizumab에 대한 추가 용량 정보는 전체 처방 정보를 참조하십시오.
| 치료 | 이상반응 | 중증도* | INLYTA 용량 조정 |
|---|---|---|---|
| ALT = alanine aminotransferase, AST = aspartate aminotransferase, ULN = 정상 상한치 | |||
|
INLYTA와 avelumab 또는 pembrolizumab 병용 |
간 효소 수치 상승† |
총 빌리루빈이 정상 상한치의 2배 이상이 아닌 경우 ALT 또는 AST가 정상 상한치의 3배 이상 10배 미만 |
|
|
총 빌리루빈이 정상 상한치의 2배 이상인 경우 ALT 또는 AST가 정상 상한치의 3배 이상으로 증가하거나 ALT 또는 AST가 정상 상한치의 10배 이상인 경우 |
|
||
|
설사 |
1-2등급 |
|
|
|
3등급 |
|
||
|
4등급 |
|
||
|
INLYTA와 avelumab 병용 |
주요 심혈관계 이상반응(MACE) |
3등급 또는 4등급 |
|
2.3 약물 상호작용에 대한 용량 수정
강력한 CYP3A4/5 억제제
강력한 CYP3A4/5 억제제(예: 케토코나졸, 이트라코나졸, 클래리트로마이신, 아타자나비르, 인디나비르, 네파조돈, 넬피나비르, 리토나비르, 사퀴나비르, 텔리트로마이신, 보리코나졸)와의 병용은 피해야 합니다. CYP3A4/5 억제 가능성이 없거나 최소한인 다른 병용 약물을 선택하는 것이 좋습니다. 강력한 CYP3A4/5 억제제를 투여받는 환자에서 INLYTA 용량 조정은 연구되지 않았지만, 강력한 CYP3A4/5 억제제를 병용 투여해야 하는 경우, 이 용량 감소가 억제제 없이 관찰된 범위로 axitinib의 혈장 농도 대 시간 곡선하면적(AUC)을 조정할 것으로 예상되므로 INLYTA 용량을 약 절반으로 줄이는 것이 좋습니다. 이후 용량은 개별 안전성 및 내약성에 따라 늘리거나 줄일 수 있습니다. 강력한 억제제의 병용 투여를 중단하는 경우, INLYTA 용량은 강력한 CYP3A4/5 억제제 투여 시작 전에 사용했던 용량으로 되돌려야 합니다 [약물 상호작용 (7.1) 및 임상 약리학 (12.3) 참조].
2.4 간 장애에 대한 용량 수정
경증의 간 장애(Child-Pugh 등급 A) 환자에게 INLYTA를 투여할 때 시작 용량 조정은 필요하지 않습니다. 약동학 데이터에 따라, 기준 중등도 간 장애(Child-Pugh 등급 B) 환자의 INLYTA 시작 용량은 약 절반으로 줄여야 합니다. 이후 용량은 개별 안전성 및 내약성에 따라 늘리거나 줄일 수 있습니다. INLYTA는 중증 간 장애(Child-Pugh 등급 C) 환자에서 연구되지 않았습니다 [경고 및 주의사항 (5.12), 특정 집단에서의 사용 (8.6), 및 임상 약리학 (12.3) 참조].
3 제형 및 함량
- •
- INLYTA 1 mg 정제: 빨간색 필름 코팅, 타원형 정제, 한쪽 면에는 “Pfizer”가, 다른 쪽 면에는 “1 XNB”가 새겨져 있습니다.
- •
- INLYTA 5 mg 정제: 빨간색 필름 코팅, 삼각형 정제, 한쪽 면에는 “Pfizer”가, 다른 쪽 면에는 “5 XNB”가 새겨져 있습니다.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 고혈압
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, INLYTA를 투여받은 359명 중 145명(40%)에서 고혈압이 보고되었고, 소라페닙을 투여받은 355명 중 103명(29%)에서 고혈압이 보고되었습니다. 3/4등급 고혈압은 INLYTA를 투여받은 359명 중 56명(16%), 소라페닙을 투여받은 355명 중 39명(11%)에서 관찰되었습니다. 고혈압 위기는 INLYTA를 투여받은 359명 중 2명(<1%)에서 보고되었고, 소라페닙을 투여받은 환자 중에는 보고되지 않았습니다. 고혈압(수축기 혈압 >150 mmHg 또는 이완기 혈압 >100 mmHg)의 중앙값 발병 시간은 INLYTA 치료 시작 후 첫 달 이내였으며, INLYTA 투여 시작 후 4일 만에 혈압 상승이 관찰되었습니다. 고혈압은 표준 항고혈압 치료로 관리되었습니다. 고혈압으로 인한 INLYTA 치료 중단은 INLYTA를 투여받은 359명 중 1명(<1%)에서 발생했고, 소라페닙을 투여받은 환자 중에는 발생하지 않았습니다 [유해 반응 (6.1) 참조].
INLYTA 투여를 시작하기 전에 혈압이 잘 조절되도록 하십시오. 고혈압에 대해 환자를 모니터링하고 필요에 따라 표준 항고혈압 치료를 실시하십시오. 고혈압의 중증도에 따라 INLYTA 투여를 중단한 후 용량을 감량하거나 영구적으로 중단합니다 [용법 및 용량 (2.2) 참조].
5.2 동맥 색전증
임상 시험에서 사망을 포함한 동맥 색전증이 보고되었습니다. RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 3/4등급 동맥 색전증은 INLYTA를 투여받은 359명 중 4명(1%), 소라페닙을 투여받은 355명 중 4명(1%)에서 보고되었습니다. 치명적인 뇌혈관 사고는 INLYTA를 투여받은 359명 중 1명(<1%)에서 보고되었고, 소라페닙을 투여받은 환자 중에는 보고되지 않았습니다 [유해 반응 (6.1) 참조].
INLYTA는 이전 12개월 이내에 동맥 색전증이 있었던 환자에게서 연구되지 않았습니다. INLYTA 임상 시험에서 일과성 허혈 발작, 뇌혈관 사고, 심근 경색 및 망막 동맥 폐색을 포함한 동맥 색전증이 715명 중 17명(2%)에서 보고되었으며, 뇌혈관 사고로 인한 사망이 2건 있었습니다.
치료 중 동맥 색전증이 발생하면 INLYTA를 영구적으로 중단하십시오.
5.3 정맥 색전증
임상 시험에서 사망을 포함한 정맥 색전증이 보고되었습니다. RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 정맥 색전증은 INLYTA를 투여받은 359명 중 11명(3%), 소라페닙을 투여받은 355명 중 2명(1%)에서 보고되었습니다. 3/4등급 정맥 색전증은 폐색전증, 심정맥 혈전증, 망막 정맥 폐색 및 망막 정맥 혈전증을 포함하여 INLYTA를 투여받은 359명 중 9명(3%)과 소라페닙을 투여받은 355명 중 2명(1%)에서 보고되었습니다. 치명적인 폐색전증은 INLYTA를 투여받은 359명 중 1명(<1%)에서 보고되었고, 소라페닙을 투여받은 환자 중에는 보고되지 않았습니다.
INLYTA는 이전 6개월 이내에 정맥 색전증이 있었던 환자에게서 연구되지 않았습니다. INLYTA 임상 시험에서 정맥 색전증이 715명 중 22명(3%)에서 보고되었으며, 폐색전증으로 인한 사망이 2건 있었습니다.
VTE 및 PE의 징후와 증상을 모니터링하십시오. VTE의 중증도에 따라 INLYTA 투여를 중단한 후 동일한 용량으로 재개하거나 영구적으로 중단합니다.
5.4 출혈
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 출혈 사건은 INLYTA를 투여받은 359명 중 58명(16%), 소라페닙을 투여받은 355명 중 64명(18%)에서 보고되었습니다. 3/4등급 출혈 사건은 뇌출혈, 혈뇨, 객혈, 하부 위장관 출혈 및 흑색 변을 포함하여 INLYTA를 투여받은 359명 중 5명(1%)과 소라페닙을 투여받은 355명 중 11명(3%)에서 보고되었습니다. 치명적인 출혈은 위 출혈을 포함하여 INLYTA를 투여받은 359명 중 1명(<1%)과 소라페닙을 투여받은 355명 중 3명(1%)에서 보고되었습니다.
INLYTA는 치료되지 않은 뇌 전이 또는 최근 활동성 위장관 출혈의 증거가 있는 환자에게서 연구되지 않았으며, 이러한 환자에게는 사용해서는 안 됩니다. 출혈의 중증도와 지속 시간에 따라 INLYTA 투여를 중단한 후 용량을 감량하거나 중단합니다.
5.5 심부전
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 심부전은 INLYTA를 투여받은 359명 중 6명(2%), 소라페닙을 투여받은 355명 중 3명(1%)에서 보고되었습니다. 3/4등급 심부전은 INLYTA를 투여받은 359명 중 2명(1%), 소라페닙을 투여받은 355명 중 1명(<1%)에서 관찰되었습니다. 치명적인 심부전은 INLYTA를 투여받은 359명 중 2명(1%), 소라페닙을 투여받은 355명 중 1명(<1%)에서 보고되었습니다. INLYTA 치료 전반에 걸쳐 심부전의 징후나 증상을 모니터링하십시오. 심부전 관리에는 INLYTA의 용량 감소, 투여 중단 또는 영구적인 중단이 필요할 수 있습니다 [용법 및 용량 (2.2) 참조].
5.6 위장관 천공 및 누공 형성
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 위장관 천공은 INLYTA를 투여받은 359명 중 1명(<1%)에서 보고되었고, 소라페닙을 투여받은 환자 중에는 보고되지 않았습니다. INLYTA 임상 시험에서 위장관 천공은 사망 1건을 포함하여 715명 중 5명(1%)에서 보고되었습니다. 위장관 천공 사례 외에도 누공이 715명 중 4명(1%)에서 보고되었습니다.
INLYTA 치료 전반에 걸쳐 위장관 천공 또는 누공의 증상을 주기적으로 모니터링하십시오.
5.7 갑상선 기능 장애
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, INLYTA를 투여받은 359명의 환자 중 69명(19%)에서 저갑상선증이 보고되었고, 소라페닙을 투여받은 355명의 환자 중 29명(8%)에서 저갑상선증이 보고되었습니다. INLYTA를 투여받은 359명의 환자 중 4명(1%)에서 갑상선 기능 항진증이 보고되었고, 소라페닙을 투여받은 355명의 환자 중 4명(1%)에서 갑상선 기능 항진증이 보고되었습니다. 치료 전 갑상선 자극 호르몬(TSH)이 5 μU/mL 미만이었던 환자에서, INLYTA를 투여받은 245명의 환자 중 79명(32%)과 소라페닙을 투여받은 232명의 환자 중 25명(11%)에서 TSH가 ≥10 μU/mL로 상승했습니다 [유해 반응 (6.1) 참조].
INLYTA 치료 시작 전과 치료 전 과정에서 주기적으로 갑상선 기능을 모니터링하십시오. 정상 갑상선 기능을 유지하기 위해 표준 의학적 방법에 따라 저갑상선증과 갑상선 기능 항진증을 치료하십시오.
5.8 손상된 상처 치유
혈관내피성장인자(VEGF) 신호 전달 경로를 억제하는 약물을 투여받는 환자에게서 상처 치유 장애가 발생할 수 있습니다. 따라서 INLYTA는 상처 치유에 악영향을 미칠 가능성이 있습니다.
선택적 수술 전 최소 2일 동안 INLYTA 투여를 중단하십시오. 주요 수술 후 최소 2주 동안, 그리고 적절한 상처 치유가 될 때까지 투여하지 마십시오. 상처 치유 장애의 중증도와 지속 기간에 따라 INLYTA를 감량하여 재투여하거나 투여를 중단하십시오. 상처 치유 합병증이 해결된 후 INLYTA 재투여의 안전성은 확립되지 않았습니다 [투여 및 투약 (2.2) 참조].
5.9 가역적 후방 백질뇌병증 증후군
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, INLYTA를 투여받은 359명의 환자 중 1명(<1%)에서 가역적 후방 백질뇌병증 증후군(RPLS)이 보고되었고, 소라페닙을 투여받은 환자 중에서는 보고되지 않았습니다 [유해 반응 (6.1) 참조]. INLYTA를 사용한 다른 임상 시험에서 RPLS에 대한 추가 보고가 두 건 있었습니다.
RPLS는 두통, 발작, 무기력증, 혼돈, 실명 및 기타 시각 및 신경 장애가 나타날 수 있는 신경 질환입니다. 경증에서 중증의 고혈압이 나타날 수 있습니다. RPLS 진단을 확인하려면 자기 공명 영상이 필요합니다. RPLS가 발생한 환자에게는 INLYTA 투여를 영구적으로 중단하십시오. 이전에 RPLS를 경험한 환자에서 INLYTA 치료를 재개하는 안전성은 알려져 있지 않습니다 [투여 및 투약 (2.2) 참조].
5.10 단백뇨
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, INLYTA를 투여받은 359명의 환자 중 39명(11%)에서 단백뇨가 보고되었고, 소라페닙을 투여받은 355명의 환자 중 26명(7%)에서 단백뇨가 보고되었습니다. INLYTA를 투여받은 359명의 환자 중 11명(3%)에서 3등급 단백뇨가 보고되었고, 소라페닙을 투여받은 355명의 환자 중 6명(2%)에서 3등급 단백뇨가 보고되었습니다 [유해 반응 (6.1) 참조].
INLYTA 치료 시작 전과 치료 전 과정에서 주기적으로 단백뇨를 모니터링하는 것이 권장됩니다. 중등도에서 중증의 단백뇨가 발생한 환자의 경우, INLYTA 투여를 중단한 후 용량을 감소시키십시오 [투여 및 투약 (2.2) 참조].
5.11 간독성
단독 요법으로서의 INLYTA
RCC 환자 치료를 위한 INLYTA의 대조 임상 연구에서, 모든 등급의 알라닌 아미노전달효소(ALT) 상승은 양쪽 군의 환자에서 22% 발생했으며, INLYTA 군의 환자 중 <1%에서 3/4등급 사건이 발생했습니다. 단독 요법으로 사용하는 경우, INLYTA 치료 시작 전과 치료 전 과정에서 주기적으로 ALT, 아스파르트산 아미노전달효소(AST) 및 빌리루빈을 모니터링하십시오.
아벨루맙 또는 펨브롤리주맙과 병용 투여되는 INLYTA
아벨루맙 또는 펨브롤리주맙과 병용 투여되는 INLYTA는 예상보다 높은 빈도의 3등급 및 4등급 ALT 및 AST 상승을 동반한 간독성을 유발할 수 있습니다. 치료 시작 전과 치료 전 과정에서 주기적으로 간 효소를 모니터링하십시오. 약물을 단독 요법으로 투여할 때와 비교하여 간 효소 모니터링을 더 자주 고려하십시오. 간 효소가 상승한 경우, INLYTA와 아벨루맙 또는 펨브롤리주맙 투여를 중단하거나 영구적으로 중단하고 필요에 따라 코르티코스테로이드를 투여하십시오 [투여 및 투약 (2.3) 참조].
INLYTA와 아벨루맙 병용 투여의 경우, 3등급 및 4등급 ALT 상승 및 AST 상승이 각각 환자의 9% 및 7%에서 보고되었습니다. ALT ≥3배 ULN(2~4등급, n=82)인 환자에서 ALT는 0~1등급으로 회복되었습니다(92%). 아벨루맙(n=3) 또는 악시티닙(n=25)을 단독 요법으로 또는 두 약물 모두(n=45)를 사용하여 재도전한 73명의 환자 중에서 아벨루맙을 투여받은 환자에서는 ALT ≥3배 ULN의 재발이 관찰되지 않았고, INLYTA를 투여받은 환자 6명과 아벨루맙과 INLYTA를 모두 투여받은 환자 15명에서 재발이 관찰되었습니다. ALT ≥3배 ULN 재발이 있었던 22명(88%)의 환자는 그 후 사건으로부터 0~1등급으로 회복되었습니다. 면역 매개성 간염은 4.9%가 3등급 또는 4등급 면역 매개성 간염인 환자의 7%에서 보고되었습니다. 간독성으로 인해 7%의 환자에서 치료가 영구적으로 중단되었고, 면역 매개성 간염으로 인해 아벨루맙 또는 INLYTA 투여가 5%의 환자에서 영구적으로 중단되었습니다. 34명의 환자에게 코르티코스테로이드가 투여되었고, 1명의 환자에게 비스테로이드성 면역억제제가 투여되었습니다. 데이터 컷오프 시점에 35명의 환자 중 31명에서 간염이 해결되었습니다.
INLYTA와 펨브롤리주맙 병용 투여 시 3등급 및 4등급 ALT 증가(20%) 및 AST 증가(13%)가 관찰되었습니다. ALT 증가 환자의 59%가 전신 코르티코스테로이드를 투여받았습니다. ALT ≥3배 ULN(2~4등급, n=116) 환자에서 94%가 ALT가 0~1등급으로 회복되었습니다. 단독 요법 또는 병용 요법으로 펨브롤리주맙(n=3) 또는 INLYTA(n=34) 재투여를 받은 92명의 환자 중 ALT ≥3배 ULN이 재발한 경우는 펨브롤리주맙 투여 환자 1명, INLYTA 투여 환자 16명, 펨브롤리주맙과 INLYTA 병용 투여 환자 24명에서 관찰되었습니다. ALT ≥3배 ULN이 재발한 모든 환자는 이후 회복되었습니다.
5.12 간 손상 환자에서의 사용
중등도 간 손상(Child-Pugh B등급) 환자에서 정상 간 기능 환자에 비해 악시티닙에 대한 전신 노출량이 더 높았습니다. 중등도 간 손상(Child-Pugh B등급) 환자에게 INLYTA를 투여할 경우 용량 감소가 권장됩니다. INLYTA는 중증 간 손상(Child-Pugh C등급) 환자에서 연구되지 않았습니다 [투여 및 투약 방법 (2.2), 특정 집단에서의 사용 (8.6), 및 임상 약리학 (12.3) 참조].
5.13 주요 심혈관계 이상 반응(MACE)
아벨루맙과 병용 투여한 INLYTA는 심각하고 치명적인 심혈관계 이상 반응을 유발할 수 있습니다. 좌심실 박출 분율에 대한 기준 및 주기적 평가를 고려하십시오. 심혈관계 이상 반응의 징후 및 증상을 모니터링하십시오. 고혈압, 당뇨병 또는 이상지질혈증과 같은 심혈관계 위험 인자의 관리를 최적화하십시오. 3~4등급 심혈관계 이상 반응의 경우 INLYTA와 아벨루맙을 영구적으로 중단하십시오.
무작위 대조 시험인 JAVELIN Renal 101에서 아벨루맙과 병용하여 INLYTA로 치료받은 진행성 RCC 환자의 7%에서 MACE가 발생한 반면, 수니티닙으로 치료받은 환자에서는 3.4%에서 발생했습니다. 이러한 이상 반응에는 심장 사건으로 인한 사망(1.4%), 3~4등급 심근 경색(2.8%) 및 3~4등급 울혈성 심부전(1.8%)이 포함되었습니다. MACE 발생까지의 중앙값 기간은 4.2개월(범위: 2일~24.5개월)이었습니다.
5.14 배자-태아 독성
작용 기전 및 동물 연구 결과를 바탕으로, INLYTA는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 약물 관련 위험을 알려주는 인체 데이터는 없습니다. 마우스에 대한 발생 독성 연구에서 악시티닙은 권장 임상 용량에서 인체 노출량보다 낮은 모체 노출량에서 기형 유발, 배자 독성 및 태아 독성을 나타냈습니다. 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 INLYTA 치료 중 및 마지막 투여 후 1주일 동안 효과적인 피임법을 사용하도록 조언하십시오. 임신 가능성이 있는 여성 파트너가 있는 남성에게 INLYTA 치료 중 및 마지막 투여 후 1주일 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 (8.1, 8.3), 임상 약리학 (12.1) 참조].
INLYTA를 아벨루맙 또는 펨브롤리주맙과 병용하여 사용하는 경우, 임신 및 피임 정보에 대해 아벨루맙 또는 펨브롤리주맙의 전체 처방 정보를 참조하십시오.
6 부작용 반응
다음과 같은 임상적으로 중요한 이상 반응은 라벨의 다른 부분에서 설명하고 있습니다 [경고 및 주의사항 (5) 참조]:
- •
- 고혈압 [경고 및 주의사항 (5.1) 참조]
- •
- 동맥색전증 [경고 및 주의사항 (5.2) 참조]
- •
- 정맥색전증 [경고 및 주의사항 (5.3) 참조]
- •
- 출혈 [경고 및 주의사항 (5.4) 참조]
- •
- 심부전 [경고 및 주의사항 (5.5) 참조]
- •
- 위장관 천공 및 누공 형성 [경고 및 주의사항 (5.6) 참조]
- •
- 갑상선 기능 장애 [경고 및 주의사항 (5.7) 참조]
- •
- 가역적 후방 백색질뇌병증 증후군 [경고 및 주의사항 (5.9) 참조]
- •
- 단백뇨 [경고 및 주의사항 (5.10) 참조]
- •
- 간독성 [경고 및 주의사항 (5.11) 참조]
- •
- 간 손상 [경고 및 주의사항 (5.12) 참조]
6.1 임상시험 경험
임상시험은 매우 다양한 조건하에서 수행되므로, 약물의 임상시험에서 관찰된 이상반응 발생률은 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실제에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
INLYTA의 안전성은 진행성 RCC 1차 치료를 위해 JAVELIN Renal 101에서 avelumab과 병용하여, KEYNOTE-426에서 pembrolizumab과 병용하여 평가되었습니다 [임상 연구 (14.1) 참조]. [이상 반응 (6.1) 참조]에 설명된 자료는 avelumab과 병용한 INLYTA에 노출된 434명의 환자와 pembrolizumab과 병용한 429명의 환자를 반영합니다 [임상 연구 (14.1) 참조].
INLYTA의 안전성은 2차 치료 단독 요법 연구에서 715명의 환자(진행성 RCC 환자 537명 포함)를 대상으로 평가되었습니다. [이상 반응 (6.1) 참조]에 설명된 자료는 sorafenib 대비 무작위 배정 임상 연구에 참여한 진행성 RCC 환자 359명의 INLYTA 노출을 반영합니다 [임상 연구 (14.2) 참조].
1차 진행성 RCC
Avelumab 병용 INLYTA
JAVELIN Renal 101에서 avelumab과 병용한 INLYTA의 안전성을 평가했습니다. 1형 당뇨병, 백반증, 건선 또는 면역억제 치료가 필요 없는 갑상선 질환을 제외한 다른 자가면역 질환 환자는 제외되었습니다. 환자들은 2일 1회 5mg의 INLYTA를 avelumab 10mg/kg(2주마다 투여) 또는 4주간 1일 1회 50mg의 sunitinib을 투여한 후 2주간 휴약하는 방식으로 병용 투여 받았습니다 (N=434 대 N=439).
JAVELIN Renal 101에서 avelumab + INLYTA군에서 70%가 6개월 이상 avelumab에 노출되었고 29%가 1년 이상 노출되었습니다 [임상 연구 (14.1) 참조].
avelumab과 병용한 INLYTA 치료를 받은 환자의 중앙값 연령은 62세(범위: 29~83세)였으며, 38%의 환자가 65세 이상이었고, 71%가 남성이었고, 75%가 백인이었으며, 동부 협력 종양학 그룹(ECOG) 수행 점수는 0(64%) 또는 1(36%)이었습니다.
avelumab과 병용한 INLYTA를 투여받은 환자 중 1.8%에서 치명적인 이상 반응이 발생했습니다. 여기에는 급사(1.2%), 뇌졸중(0.2%), 심근염(0.2%) 및 괴사성 췌장염(0.2%)이 포함됩니다.
avelumab과 병용한 INLYTA를 투여받은 환자 중 35%에서 중대한 이상 반응이 발생했습니다. 환자의 1% 이상에서 발생한 중대한 이상 반응에는 설사(2.5%), 호흡곤란(1.8%), 간독성(1.8%), 정맥혈전색전증(1.6%), 급성 신손상(1.4%) 및 폐렴(1.2%)이 포함됩니다.
INLYTA 또는 avelumab의 이상 반응으로 인한 영구적인 투약 중단은 환자의 22%에서 발생했습니다. avelumab만 19%, INLYTA만 13%, 두 약물 모두 8%였습니다. avelumab 또는 병용 요법의 영구적인 중단으로 이어진 가장 흔한 이상 반응(>1%)은 간독성(6%) 및 주입 관련 반응(1.8%)이었습니다.
주입 관련 반응으로 인한 avelumab 주입의 일시적인 중단을 제외한 이상 반응으로 인한 용량 중단 또는 감량은 avelumab과 병용한 INLYTA를 투여받은 환자의 76%에서 발생했습니다. 여기에는 환자의 50%에서 avelumab 중단이 포함됩니다. INLYTA는 환자의 66%에서 중단되었고 19%에서 용량이 감소되었습니다. avelumab 중단으로 이어진 가장 흔한 이상 반응(>10%)은 설사(10%)였습니다. INLYTA 중단 또는 용량 감소로 이어진 가장 흔한 이상 반응은 설사(19%), 고혈압(18%), 수장 홍반증(18%) 및 간독성(10%)이었습니다.
avelumab과 병용한 INLYTA를 투여받은 환자에서 가장 흔한 이상 반응(≥20%)은 설사, 피로, 고혈압, 근골격계 통증, 메스꺼움, 점막염, 수장 홍반증, 발성 장애, 식욕 감퇴, 저갑상선증, 발진, 간독성, 기침, 호흡곤란, 복통 및 두통이었습니다.
avelumab과 병용한 INLYTA 치료를 받은 환자 48명(11%)이 면역 매개 이상 반응에 대해 1일 최대 40mg에 해당하는 경구 프레드니손 용량을 투여받았습니다 [경고 및 주의사항 (5.12) 참조].
표 4는 avelumab과 병용한 INLYTA 치료를 받은 환자의 20% 이상에서 발생한 이상 반응을 요약한 것입니다.
| 이상 반응 | INLYTA + 아벨루맙 (N=434) | 수니티닙 (N=439) | ||
|---|---|---|---|---|
| 모든 등급 % |
3-4등급 % |
모든 등급 % |
3-4등급 % |
|
| 독성은 국립 암 연구소의 일반적인 이상 사례 용어 기준, 4.03 버전 (NCI CTCAE v4)에 따라 등급이 매겨졌습니다. | ||||
|
||||
|
위장관 장애 |
||||
|
설사† |
62 |
8 |
48 |
2.7 |
|
오심 |
34 |
1.4 |
39 |
1.6 |
|
점막염‡ |
34 |
2.8 |
35 |
2.1 |
|
간독성§ |
24 |
9 |
18 |
3.6 |
|
복통¶ |
22 |
1.4 |
19 |
2.1 |
|
일반 장애 및 투여 부위 상태 |
||||
|
피로# |
53 |
6 |
54 |
6 |
|
혈관 장애 |
||||
|
고혈압Þ |
50 |
26 |
36 |
17 |
|
근골격계 및 결합조직 장애 |
||||
|
근골격계 통증ß |
40 |
3.2 |
33 |
2.7 |
|
피부 및 피하조직 장애 |
||||
|
손바닥-발바닥 홍반각화증 |
33 |
6 |
34 |
4 |
|
발진à |
25 |
0.9 |
16 |
0.5 |
|
호흡기, 흉부 및 종격동 장애 |
||||
|
발성장애 |
31 |
0.5 |
3.2 |
0 |
|
호흡곤란è |
23 |
3.0 |
16 |
1.8 |
|
기침 |
23 |
0.2 |
19 |
0 |
|
대사 및 영양 장애 |
||||
|
식욕 감퇴 |
26 |
2.1 |
29 |
0.9 |
|
내분비 장애 |
||||
|
저갑상선증 |
25 |
0.2 |
14 |
0.2 |
|
신경계 장애 |
||||
|
두통 |
21 |
0.2 |
16 |
0.2 |
JAVELIN Renal 101 연구에서 20% 미만의 환자에게 발생한 다른 임상적으로 중요한 이상 반응에는 관절통, 체중 감소 및 오한이 포함됩니다.
환자는 각 주입 전에 항히스타민제와 아세트아미노펜으로 예방 약물을 투여받았습니다. 아벨루맙과 병용 투여된 INLYTA 치료 환자의 12%에서 주입 관련 반응이 발생했습니다(3등급: 1.6%; 4등급 없음).
표 5는 아벨루맙 병용 투여된 INLYTA 치료 환자의 ≥20%에서 발생한 선택된 실험실 이상 검사 결과를 요약한 것입니다.
| 실험실 이상 검사 결과 | INLYTA + 아벨루맙 | 수니티닙† | ||||
|---|---|---|---|---|---|---|
| 모든 등급 % |
3-4등급 % |
모든 등급 % |
3-4등급 % |
|||
|
화학 |
||||||
|
혈중 중성지방 증가 |
71 |
13 |
48 |
5 |
||
|
혈중 크레아티닌 증가 |
62 |
2.3 |
68 |
1.4 |
||
|
혈중 콜레스테롤 증가 |
57 |
1.9 |
22 |
0.7 |
||
|
알라닌 아미노전달효소 증가 (ALT) |
50 |
9 |
46 |
3.2 |
||
|
아스파르트산 아미노전달효소 증가 (AST) |
47 |
7 |
57 |
3.2 |
||
|
혈중 나트륨 감소 |
38 |
9 |
37 |
10 |
||
|
리파제 증가 |
37 |
14 |
25 |
7 |
||
|
혈중 칼륨 증가 |
35 |
3.0 |
28 |
3.9 |
||
|
혈중 빌리루빈 증가 |
21 |
1.4 |
23 |
1.4 |
||
|
혈액학적 이상 |
||||
|
혈소판 감소 |
27 |
0.7 |
80 |
1.5 |
|
헤모글로빈 감소 |
21 |
2.1 |
65 |
8 |
펨브롤리주맙 병용 요법의 INLYTA
펨브롤리주맙과 병용한 INLYTA의 안전성은 KEYNOTE-426에서 조사되었습니다 [임상 연구(14.1) 참조]. 전신 코르티코스테로이드 또는 기타 면역억제제가 필요한 의학적 상태가 있거나 1형 당뇨병, 백반증, 쇼그렌 증후군, 호르몬 대체 요법으로 안정된 저갑상선증을 제외한 중증 자가면역 질환의 병력이 있는 환자는 자격이 없었습니다. 환자는 1일 2회 경구로 INLYTA 5mg을 투여받았고, 펨브롤리주맙은 3주마다 200mg을 정맥 주사로 투여받았거나, 수니티닙은 1일 50mg을 4주 동안 1일 1회 투여받고 2주 동안 치료를 중단했습니다. INLYTA와 펨브롤리주맙 병용 요법에 대한 중앙값 노출 기간은 10.4개월(범위: 1일~21.2개월)이었습니다.
연구 대상자 특징은 다음과 같습니다. 중앙값 연령 62세(범위: 30~89세), 65세 이상 40%; 남성 71%; 백인 80%; 카노프스키 기능 상태(KPS) 90~100이 80%, KPS 70~80이 20%였습니다.
펨브롤리주맙과 병용한 INLYTA를 투여받은 환자의 3.3%에서 치명적인 이상 반응이 발생했습니다. 여기에는 심정지 3건, 폐색전증 2건, 심부전 1건, 원인 불명으로 인한 사망 1건, 중증근무력증 1건, 심근염 1건, 푸르니에 괴저 1건, 형질세포종 1건, 흉막 삼출 1건, 폐렴 1건, 호흡 부전 1건이 포함됩니다.
펨브롤리주맙과 병용한 INLYTA를 투여받은 환자의 40%에서 중대한 이상 반응이 발생했습니다. 펨브롤리주맙과 병용한 INLYTA를 투여받은 환자의 ≥1%에서 발생한 중대한 이상 반응에는 간독성(7%), 설사(4.2%), 급성 신손상(2.3%), 탈수(1%), 폐렴(1%)이 포함됩니다.
INLYTA 또는 펨브롤리주맙의 이상 반응으로 인한 영구적인 투약 중단은 환자의 31%에서 발생했습니다. 펨브롤리주맙만 13%, INLYTA만 13%, 두 약물 모두 8%였습니다. INLYTA, 펨브롤리주맙 또는 병용 요법의 영구적인 중단으로 이어지는 가장 흔한 이상 반응(>1%)은 간독성(13%), 설사/대장염(1.9%), 급성 신손상(1.6%), 뇌혈관 사고(1.2%)였습니다.
주입 관련 반응으로 인한 펨브롤리주맙 주입의 일시적인 중단을 제외한 이상 반응으로 인한 용량 중단 또는 감량은 INLYTA와 병용한 펨브롤리주맙을 투여받은 환자의 76%에서 발생했습니다. 여기에는 환자의 50%에서 펨브롤리주맙 중단이 포함됩니다. INLYTA는 환자의 64%에서 중단되었고, 용량은 22%에서 감량되었습니다. INLYTA 중단 또는 감량으로 이어지는 가장 흔한 이상 반응(>10%)은 간독성(21%), 설사(19%), 고혈압(18%)이었고, 펨브롤리주맙 중단으로 이어지는 가장 흔한 이상 반응(>10%)은 간독성(14%)과 설사(11%)였습니다.
INLYTA와 펨브롤리주맙을 투여받은 환자에서 가장 흔한 이상 반응(≥20%)은 설사, 피로/쇠약, 고혈압, 간독성, 저갑상선증, 식욕 감퇴, 수장 홍반 각화증, 메스꺼움, 구내염/점막 염증, 발성 장애, 발진, 기침, 변비였습니다.
펨브롤리주맙과 병용한 INLYTA로 치료받은 환자의 27%는 면역 매개 이상 반응에 대해 1일 40mg 이상의 경구 프레드니손 용량을 투여받았습니다.
표 6과 7은 각각 KEYNOTE-426에서 INLYTA와 펨브롤리주맙으로 치료받은 환자의 최소 20%에서 발생한 이상 반응과 실험실 이상을 요약한 것입니다.
| 이상 반응 | INLYTA + 펨브롤리주맙 N=429 | 수니티닙 N=425 | ||||
|---|---|---|---|---|---|---|
| 모든 등급* % |
3~4등급 % |
모든 등급 % |
3~4등급 % |
|||
|
||||||
|
위장관 장애 |
||||||
|
설사† |
56 |
11 |
45 |
5 |
|
메스꺼움 |
28 |
0.9 |
32 |
0.9 |
|
변비 |
21 |
0 |
15 |
0.2 |
|
일반적 |
||||
|
피로/권태감 |
52 |
5 |
51 |
10 |
|
혈관계 |
||||
|
고혈압‡ |
48 |
24 |
48 |
20 |
|
간담도계 |
||||
|
간독성§ |
39 |
20 |
25 |
4.9 |
|
내분비계 |
||||
|
저갑상선증 |
35 |
0.2 |
32 |
0.2 |
|
대사 및 영양 |
||||
|
식욕 감퇴 |
30 |
2.8 |
29 |
0.7 |
|
피부 및 피하조직 |
||||
|
손바닥-발바닥 홍반각화증후군 |
28 |
5 |
40 |
3.8 |
|
구내염/점막 염증 |
27 |
1.6 |
41 |
4 |
|
발진¶ |
25 |
1.4 |
21 |
0.7 |
|
호흡기, 흉부 및 종격동 |
||||
|
발성장애 |
25 |
0.2 |
3.3 |
0 |
|
기침 |
21 |
0.2 |
14 |
0.5 |
| 실험실 검사* | INLYTA + 펨브롤리주맙 | 수니티닙 | ||||
|---|---|---|---|---|---|---|
| 모든 등급† % |
3-4등급 % |
모든 등급 % |
3-4등급 % |
|||
|
화학 |
||||||
|
고혈당증 |
62 |
9 |
54 |
3.2 |
||
|
ALT 증가 |
60 |
20 |
44 |
5 |
||
|
AST 증가 |
57 |
13 |
56 |
5 |
||
|
크레아티닌 증가 |
43 |
4.3 |
40 |
2.4 |
||
|
저나트륨혈증 |
35 |
8 |
29 |
8 |
||
|
고칼륨혈증 |
34 |
6 |
22 |
1.7 |
||
|
저알부민혈증 |
32 |
0.5 |
34 |
1.7 |
||
|
고칼슘혈증 |
27 |
0.7 |
15 |
1.9 |
||
|
저인산혈증 |
26 |
6 |
49 |
17 |
||
|
알칼리성 인산가수분해효소 증가 |
26 |
1.7 |
30 |
2.7 |
||
|
Hypocalcemia‡ |
22 |
0.2 |
29 |
0.7 |
|
혈중 빌리루빈 증가 |
22 |
2.1 |
21 |
1.9 |
|
활성화 부분 트롬보플라스틴 시간 연장§ |
22 |
1.2 |
14 |
0 |
|
혈액학 |
||||
|
림프구 감소증 |
33 |
11 |
46 |
8 |
|
빈혈 |
29 |
2.1 |
65 |
8 |
|
혈소판 감소증 |
27 |
1.4 |
78 |
14 |
2차 진행성 RCC
INLYTA를 투여받은 환자의 중앙 치료 기간은 6.4개월(범위 0.03~22.0)이었고, 소라페닙을 투여받은 환자의 중앙 치료 기간은 5.0개월(범위 0.03~20.1)이었습니다. 유해 반응으로 인한 용량 조절 또는 일시적인 치료 지연은 INLYTA를 투여받은 359명 중 199명(55%), 소라페닙을 투여받은 355명 중 220명(62%)에서 발생했습니다. 유해 반응으로 인한 치료 영구 중단은 INLYTA를 투여받은 359명 중 34명(9%), 소라페닙을 투여받은 355명 중 46명(13%)에서 발생했습니다.
INLYTA 치료 후 관찰된 가장 흔한(≥20%) 유해 반응은 설사, 고혈압, 피로, 식욕 감퇴, 메스꺼움, 발성 장애, 수장 홍반증(손발 증후군), 체중 감소, 구토, 무력증 및 변비였습니다. 표 8은 INLYTA 또는 소라페닙을 투여받은 환자 중 ≥10%에서 보고된 유해 반응을 보여줍니다.
| 유해 반응* | INLYTA | 소라페닙 | ||||
|---|---|---|---|---|---|---|
| (N=359) | (N=355) | |||||
| 모든 등급† | 3/4등급 | 모든 등급† | 3/4등급 | |||
| % | % | % | % | |||
|
설사 |
55 |
11 |
53 |
7 |
||
|
고혈압 |
40 |
16 |
29 |
11 |
||
|
피로 |
39 |
11 |
32 |
5 |
||
|
식욕 감퇴 |
34 |
5 |
29 |
4 |
||
|
메스꺼움 |
32 |
3 |
22 |
1 |
||
|
발성 장애 |
31 |
0 |
14 |
0 |
||
|
수장 홍반증 증후군 |
27 |
5 |
51 |
16 |
||
|
체중 감소 |
25 |
2 |
21 |
1 |
||
|
구토 |
24 |
3 |
17 |
1 |
||
|
권태 |
21 |
5 |
14 |
3 |
||
|
변비 |
20 |
1 |
20 |
1 |
||
|
갑상선 기능 저하증 |
19 |
<1 |
8 |
0 |
||
|
기침 |
15 |
1 |
17 |
1 |
||
|
점막 염증 |
15 |
1 |
12 |
1 |
||
|
관절통 |
15 |
2 |
11 |
1 |
||
|
구내염 |
15 |
1 |
12 |
<1 |
||
|
호흡곤란 |
15 |
3 |
12 |
3 |
||
|
복통 |
14 |
2 |
11 |
1 |
||
|
두통 |
14 |
1 |
11 |
0 |
||
|
사지통 |
13 |
1 |
14 |
1 |
||
|
발진 |
13 |
<1 |
32 |
4 |
||
|
단백뇨 |
11 |
3 |
7 |
2 |
||
|
미각이상 |
11 |
0 |
8 |
0 |
|
건조한 피부 |
10 |
0 |
11 |
0 |
|
소화불량 |
10 |
0 |
2 |
0 |
|
가려움증 |
7 |
0 |
12 |
0 |
|
탈모 |
4 |
0 |
32 |
0 |
|
홍반 |
2 |
0 |
10 |
<1 |
INLYTA로 치료받은 환자의 <10%에서 보고된 선택된 유해 반응(모든 등급)에는 어지러움(9%), 상복부 통증(8%), 근육통(7%), 탈수(6%), 코피(6%), 빈혈(4%), 치질(4%), 혈뇨(3%), 이명(3%), 리파제 증가(3%), 설통(3%), 폐색전증(2%), 직장 출혈(2%), 객혈(2%), 심부 정맥 혈전증(1%), 망막 정맥 폐쇄/혈전증(1%), 다혈구증(1%) 및 일과성 허혈 발작(1%)이 포함되었습니다.
표 9는 INLYTA 또는 소라페닙을 투여받은 환자의 ≥10%에서 보고된 가장 흔한 실험실 이상을 보여줍니다.
| 실험실 이상 | N | INLYTA | N | Sorafenib | ||
|---|---|---|---|---|---|---|
| 모든 등급* | 3/4등급 | 모든 등급* | 3/4등급 | |||
| % | % | % | % | |||
| ALP: 알칼리성 인산분해효소; ALT: 알라닌 아미노전달효소; AST: 아스파르트산 아미노전달효소 | ||||||
|
||||||
|
혈액학 |
||||||
|
헤모글로빈 감소 |
320 |
35 |
<1 |
316 |
52 |
4 |
|
림프구(절대치) 감소 |
317 |
33 |
3 |
309 |
36 |
4 |
|
혈소판 감소 |
312 |
15 |
<1 |
310 |
14 |
0 |
|
백혈구 감소 |
320 |
11 |
0 |
315 |
16 |
<1 |
|
화학 |
||||||
|
크레아티닌 증가 |
336 |
55 |
0 |
318 |
41 |
<1 |
|
Bicarbonate decreased |
314 |
44 |
<1 |
291 |
43 |
0 |
|
Hypocalcemia |
336 |
39 |
1 |
319 |
59 |
2 |
|
ALP increased |
336 |
30 |
1 |
319 |
34 |
1 |
|
Hyperglycemia |
336 |
28 |
2 |
319 |
23 |
2 |
|
Lipase increased |
338 |
27 |
5 |
319 |
46 |
15 |
|
Amylase increased |
338 |
25 |
2 |
319 |
33 |
2 |
|
ALT increased |
331 |
22 |
<1 |
313 |
22 |
2 |
|
AST increased |
331 |
20 |
<1 |
311 |
25 |
1 |
|
Hypernatremia |
338 |
17 |
1 |
319 |
13 |
1 |
|
Hypoalbuminemia |
337 |
15 |
<1 |
319 |
18 |
1 |
|
Hyperkalemia |
333 |
15 |
3 |
314 |
10 |
3 |
|
저혈당 |
336 |
11 |
<1 |
319 |
8 |
<1 |
|
저나트륨혈증 |
338 |
13 |
4 |
319 |
11 |
2 |
|
저인산혈증 |
336 |
13 |
2 |
318 |
49 |
16 |
INLYTA로 치료받은 환자의 <10%에서 보고된 선택된 (모든 등급) 실험실 이상 검사 결과에는 헤모글로빈 증가(정상 상한치 초과)(INLYTA의 경우 9% 대 소라페닙의 경우 1%) 및 고칼슘혈증(INLYTA의 경우 6% 대 소라페닙의 경우 2%)이 포함되었습니다.
6.2 시판 후 경험
다음과 같은 이상 반응이 INLYTA의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
혈관 장애: 동맥(대동맥 포함), 동맥류, 박리 및 파열.
7 약물 상호 작용
7.1 CYP3A4/5 저해제
CYP3A4/5의 강력한 저해제인 케토코나졸의 병용 투여는 건강한 지원자에서 액시티닙의 혈장 노출을 증가시켰습니다. INLYTA와 강력한 CYP3A4/5 저해제의 병용 투여는 피해야 합니다. 자몽 또는 자몽 주스 또한 액시티닙 혈장 농도를 증가시킬 수 있으므로 피해야 합니다. CYP3A4/5 저해 잠재력이 없거나 최소한인 동시 약물의 선택이 권장됩니다. 강력한 CYP3A4/5 저해제를 병용 투여해야 하는 경우 INLYTA 용량을 줄여야 합니다 [용법 및 용량 (2.2) 및 임상 약리학 (12.3) 참조].
7.2 CYP3A4/5 유도제
CYP3A4/5의 강력한 유도제인 리팜핀의 병용 투여는 건강한 지원자에서 액시티닙의 혈장 노출을 감소시켰습니다. INLYTA와 강력한 CYP3A4/5 유도제(예: 리팜핀, 덱사메타손, 페니토인, 카르바마제핀, 리파부틴, 리파펜틴, 페노바르비탈 및 세인트 존스 워트)의 병용 투여는 피해야 합니다. CYP3A4/5 유도 잠재력이 없거나 최소한인 동시 약물의 선택이 권장됩니다 [용법 및 용량 (2.2), 임상 약리학 (12.3) 참조]. 중등도 CYP3A4/5 유도제(예: 보센탄, 에파비렌즈, 에트라비린, 모다피닐 및 나프실린)는 액시티닙의 혈장 노출을 감소시킬 수도 있으므로 가능하면 피해야 합니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과 및 작용 기전을 바탕으로, INLYTA는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 약물 관련 위험을 알려주는 인체 데이터는 없습니다. 발생 독성 연구에서, 액시티닙은 권장 초기 용량에서 인체 노출량보다 낮은 노출량에서 마우스에서 기형 유발, 배아 독성 및 태아 독성을 나타냈습니다 (자세한 내용은 데이터 참조). 생식 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알려주십시오.
해당 인구집단에서 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 그러나 미국 일반 인구에서 주요 선천적 기형의 배경 위험은 임상적으로 인지된 임신의 2%~4%이며, 유산의 배경 위험은 15%~20%입니다.
INLYTA를 아벨루맙 또는 펨브롤리주맙과 병용하는 경우, 임신 정보에 대해 아벨루맙 또는 펨브롤리주맙의 전체 처방 정보를 참조하십시오.
동물 데이터
교미 전과 임신 첫 주까지 암컷 마우스에 1일 2회 경구 투여된 액시티닙은 시험된 모든 용량(≥15 mg/kg/회, 권장 초기 용량에서 환자의 전신 노출량(AUC)의 약 10배)에서 착상 후 손실 증가를 유발했습니다. 배아-태아 발생 독성 연구에서, 임신한 마우스는 기관 형성 기간 동안 1일 2회 0.15, 0.5 및 1.5 mg/kg/회의 액시티닙 경구 용량을 투여받았습니다. 모체 독성이 없는 상태에서 관찰된 배아-태아 독성에는 1.5 mg/kg/회(권장 초기 용량에서 환자의 AUC의 약 0.5배)에서 기형(구개열)과 ≥0.5 mg/kg/회(권장 초기 용량에서 환자의 AUC의 약 0.15배)에서 골화 변화가 포함되었습니다.
8.3 생식 가능성이 있는 여성 및 남성
동물 연구 결과를 바탕으로, INLYTA는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 인구집단에서의 사용 (8.1) 참조]. INLYTA를 아벨루맙 또는 펨브롤리주맙과 병용하는 경우, 피임 정보에 대해 아벨루맙 또는 펨브롤리주맙의 전체 처방 정보를 참조하십시오.
8.4 소아 사용
소아 환자에서 INLYTA의 안전성 및 유효성은 확립되지 않았습니다.
INLYTA의 안전성 및 유효성은 두 건의 공개 표지 연구에서 평가되었지만 확립되지는 않았습니다. 하나는 재발성 또는 불응성 고형 종양이 있는 5세 미만~17세 미만의 소아 환자 17명을 대상으로 단독 요법으로 INLYTA의 용량을 찾는 연구(ADVL1315, NCT02164838)이고, 다른 하나는 7세 미만~17세 미만의 소아 환자 7명을 대상으로 단독 요법 또는 병용 요법으로 INLYTA를 무작위 배정하는 연구(AREN1721, NCT03595124)입니다.
이러한 연구에서 소아 환자에게 INLYTA를 사용하여 새로운 안전성 신호는 관찰되지 않았습니다.
최대 내약 용량으로 INLYTA를 투여받은 소아 환자의 노출량은 승인된 권장 초기 용량을 투여받은 성인에서 이전에 관찰된 노출량보다 낮았습니다.
미성숙 동물 독성 자료
1개월 이상 매일 2회 경구 axitinib를 투여받은 미성숙 마우스와 개에서 뼈와 치아의 독성이 관찰되었습니다. 뼈에 대한 영향은 마우스와 개에서 ≥15 mg/kg/회 용량에서(권장 초기 용량에서 환자의 전신 노출(AUC)의 각각 약 6배 및 15배) 성장판 비후로 나타났습니다. 자라는 앞니의 이상(치아 우식증, 부정교합 및 파손되거나/또는 결손된 치아 포함)은 ≥5 mg/kg/회 용량(권장 초기 용량에서 환자의 AUC의 약 1.5배)으로 매일 2회 경구 axitinib를 투여받은 마우스에서 관찰되었습니다. 소아 환자에게 잠재적으로 우려되는 기타 독성은 미성숙 동물에서 평가되지 않았습니다.
8.5 노인 사용
RCC 환자 치료를 위한 INLYTA에 대한 대조군 임상 연구에서 INLYTA로 치료받은 359명의 환자 중 123명(34%)이 65세 이상이었습니다. 일부 고령자에서 더 큰 민감도를 배제할 수는 없지만, 65세 이상 환자와 그 이하 환자 간에 INLYTA의 안전성 및 유효성에 전반적인 차이가 관찰되지 않았습니다.
JAVELIN Renal 101 시험에서 avelumab 10 mg/kg과 병용하여 1일 2회 5mg의 INLYTA를 투여받은 434명의 환자 중 38%가 65세 이상이었고 8%가 75세 이상이었습니다. 65세 이상 환자와 그 이하 환자 간에 안전성 또는 유효성에 전반적인 차이가 보고되지 않았습니다.
KEYNOTE-426 시험에서 pembrolizumab 200 mg과 병용하여 1일 2회 5mg의 INLYTA를 투여받은 432명의 환자 중 40%가 65세 이상이었습니다. 65세 이상 환자와 그 이하 환자 간에 안전성 또는 유효성에 전반적인 차이가 보고되지 않았습니다.
고령 환자에게는 용량 조절이 필요하지 않습니다 [용법 및 용량 (2.2), 임상 약리학 (12.3) 참조].
8.6 간 손상
전담 간 손상 시험에서 정상 간 기능을 가진 피험자와 비교하여 INLYTA 단회 용량 투여 후 전신 노출은 기저선이 경도 간 손상(Child-Pugh 등급 A)인 피험자에서 유사했고 기저선이 중등도 간 손상(Child-Pugh 등급 B)인 피험자에서 더 높았습니다.
경도 간 손상(Child-Pugh 등급 A) 환자에게 INLYTA를 투여할 때는 초기 용량 조절이 필요하지 않습니다. 중등도 간 손상(Child-Pugh 등급 B) 환자에게 INLYTA를 투여할 때는 초기 용량 감소가 권장됩니다 [용법 및 용량 (2.2), 경고 및 주의사항 (5.12), 임상 약리학 (12.3) 참조].
INLYTA는 중증 간 손상(Child-Pugh 등급 C) 피험자에서 연구되지 않았습니다.
8.7 신장 손상
axitinib에 대한 전담 신장 손상 시험은 실시되지 않았습니다. 모집단 약동학 분석에 따르면, 기존의 경도에서 중증 신장 손상(15 mL/min ≤ 크레아티닌 청소율 [CLcr] < 89 mL/min) 환자에서 axitinib 청소율에 유의미한 차이가 관찰되지 않았습니다 [임상 약리학 (12.3) 참조]. 기존의 경도에서 중증 신장 손상 환자에게는 초기 용량 조절이 필요하지 않습니다. 말기 신질환(CLcr < 15 mL/min) 환자에게는 주의해서 사용해야 합니다.
10 과다 복용
INLYTA 과다복용에 대한 특별한 치료법은 없습니다.
RCC 환자 치료를 위한 INLYTA의 통제된 임상 연구에서, 1명의 환자가 실수로 20mg을 1일 2회 4일간 복용하였고 어지럼증(1등급)을 경험했습니다.
INLYTA의 임상 용량 탐색 연구에서, 1일 2회 10mg 또는 20mg의 시작 용량을 투여받은 피험자들은 고혈압, 고혈압 관련 발작 및 치명적인 객혈을 포함한 유해 반응을 경험했습니다.
과다복용이 의심되는 경우, INLYTA 투여를 중단하고 지지 요법을 실시해야 합니다.
11 설명
INLYTA (액시티닙)는 키나제 억제제입니다. 액시티닙의 화학적 명칭은 N-메틸-2-[3-((E)-2-피리딘-2-일-비닐)-1H-인다졸-6-일술파닐]-벤즈아미드입니다. 분자식은 C22H18N4OS이며 분자량은 386.47 달톤입니다. 화학 구조는 다음과 같습니다.
액시티닙은 백색에서 담황색의 분말이며 pKa는 4.8입니다. pH 1.1~7.8 범위의 수성 매체에서 액시티닙의 용해도는 0.2 µg/mL을 초과합니다. 분배 계수 (n-옥탄올/물)는 3.5입니다.
INLYTA는 1mg 또는 5mg의 액시티닙과 미결정 셀룰로오스, 유당 일수화물, 크로스카멜로오스나트륨, 마그네슘 스테아레이트, 및 Opadry® II red 32K15441을 불활성 성분으로 함유하는 적색의 필름 코팅 정제로 제공됩니다. Opadry II red 32K15441 필름 코팅에는 유당 일수화물, HPMC 2910/Hypromellose 15cP, 이산화티타늄, 트리아세틴 (글리세롤 트리아세테이트), 및 적색 산화철이 포함되어 있습니다.
12 약물동력학
12.1 작용 기전
Axitinib은 치료 혈장 농도에서 혈관 내피 성장 인자 수용체(VEGFR)-1, VEGFR-2, VEGFR-3를 포함한 수용체 티로신 키나제를 억제하는 것으로 나타났습니다. 이러한 수용체는 병적인 혈관신생, 종양 성장 및 암 진행과 관련이 있습니다. VEGF 매개 내피 세포 증식 및 생존은 in vitro 및 마우스 모델에서 axitinib에 의해 억제되었습니다. Axitinib은 종양 이종이식 마우스 모델에서 종양 성장 및 VEGFR-2의 인산화를 억제하는 것으로 나타났습니다.
12.2 약력학
케토코나졸 400mg의 존재 및 부재 시 INLYTA(5mg) 단일 경구 용량의 QTc 간격에 대한 영향을 35명의 건강한 피험자를 대상으로 무작위, 단일맹검, 양방향 교차 연구에서 평가했습니다. 투여 후 최대 3시간까지 위약 대비 평균 QTc 간격의 큰 변화(즉, >20ms)는 감지되지 않았습니다. 그러나 평균 QTc 간격의 작은 증가(즉, <10ms)를 배제할 수 없습니다.
12.3 약동학
모집단 약동학 분석은 건강한 피험자와 암 환자를 대상으로 한 17건의 시험에서 얻은 데이터를 모았습니다. 1차 흡수 및 지연 시간을 갖는 2-구획 분포 모델은 axitinib 농도-시간 프로파일을 적절하게 설명합니다.
흡수 및 분포
단일 경구 5mg 용량 투여 후, 중앙값 Tmax는 2.5~4.1시간 범위였습니다. 혈장 반감기를 기준으로, 정상 상태는 투여 후 2~3일 이내에 예상됩니다. 1일 2회 5mg의 axitinib 투여는 단일 용량 투여에 비해 약 1.4배의 축적을 초래했습니다. 정상 상태에서 axitinib은 1mg~20mg 용량 범위 내에서 거의 선형 약동학을 나타냅니다. 경구 5mg 용량 후 axitinib의 평균 절대 생체이용률은 58%입니다.
밤새 금식에 비해, 중등도 지방 식사와 함께 INLYTA를 투여하면 AUC가 10% 낮아졌고, 고지방, 고칼로리 식사와 함께 투여하면 AUC가 19% 높아졌습니다. INLYTA는 음식과 함께 또는 음식 없이 투여할 수 있습니다 [용법 및 용량 (2.1) 참조].
Axitinib은 알부민에 우선적으로 결합하고 α1-산성 당단백질에 중등도로 결합하여 인간 혈장 단백질에 높은 결합률(>99%)을 보입니다. 진행성 RCC 환자(n=20)에서, 식후 상태에서 1일 2회 5mg 용량으로 기하 평균(CV%) Cmax 및 AUC0–24 는 각각 27.8(79%) ng/mL 및 265(77%) ng.h/mL였습니다. 기하 평균(CV%) 청소율 및 겉보기 분포량은 각각 38(80%) L/h 및 160(105%) L였습니다.
대사 및 배설
INLYTA의 혈장 반감기는 2.5~6.1시간입니다. Axitinib은 주로 간에서 CYP3A4/5에 의해 대사되고, CYP1A2, CYP2C19 및 UGT1A1에 의해 더 적은 정도로 대사됩니다. 5mg의 방사성 axitinib 경구 투여 후, 방사능의 약 41%가 대변에서 회수되었고 약 23%가 소변에서 회수되었습니다. 용량의 12%를 차지하는 미변화 axitinib은 대변에서 확인된 주요 성분이었습니다. 미변화 axitinib은 소변에서 검출되지 않았습니다. 카르복실산 및 설폭사이드 대사체는 소변에서 방사능의 대부분을 차지했습니다. 혈장에서 N-글루쿠로나이드 대사체는 주요 방사성 성분(순환 방사능의 50%)을 나타냈고, 미변화 axitinib 및 설폭사이드 대사체는 각각 순환 방사능의 약 20%를 차지했습니다.
설폭사이드 및 N-글루쿠로나이드 대사체는 axitinib에 비해 VEGFR-2에 대해 약 ≥400배 낮은 in vitro 효능을 보입니다.
약물 상호작용
다른 약물이 INLYTA에 미치는 영향
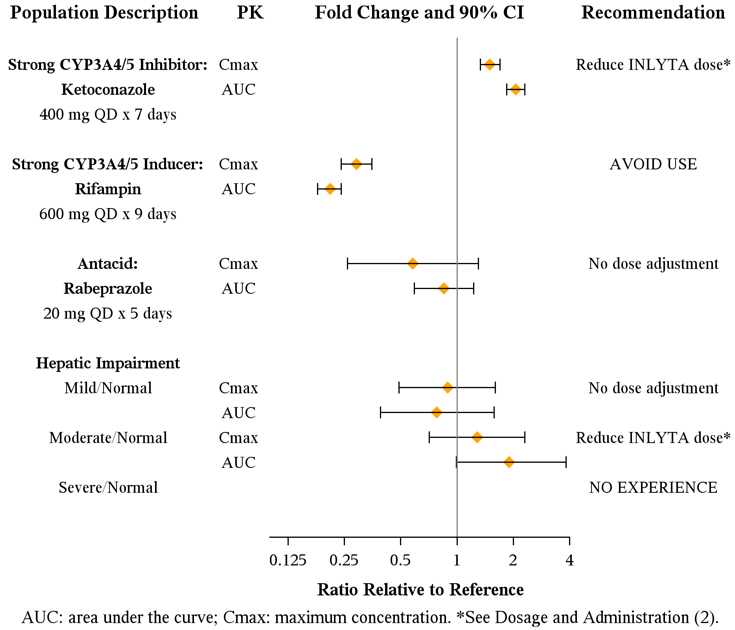
Axitinib은 주로 간에서 CYP3A4/5에 의해 대사됩니다. 또한, axitinib의 수용성은 pH 의존적이며, pH가 높을수록 용해도가 낮아집니다. 강력한 CYP3A4/5 억제제, 강력한 CYP3A4/5 유도제 및 제산제가 axitinib의 약동학에 미치는 영향은 그림 1에 나와 있습니다 [용법 및 용량 (2.2) 및 약물 상호작용 (7.1, 7.2) 참조].
그림 1. 병용 투여 약물 및 간 장애가 Axitinib 약동학에 미치는 영향
INLYTA가 다른 약물에 미치는 영향
In vitro 연구에서 axitinib은 CYP1A2 및 CYP2C8을 억제할 가능성이 있는 것으로 나타났습니다. 그러나 CYP2C8 기질인 paclitaxel과 axitinib을 병용 투여해도 환자의 혈장 paclitaxel 농도가 증가하지 않았습니다.
In vitro 연구에 따르면 axitinib은 치료 혈장 농도에서 CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 또는 UGT1A1을 억제하지 않습니다. 인간 간세포에 대한 in vitro 연구에 따르면 axitinib은 CYP1A1, CYP1A2 또는 CYP3A4/5를 유도하지 않습니다.
Axitinib은 in vitro에서 유출 수송체 P-당단백질(P-gp)의 억제제입니다. 그러나 INLYTA는 치료 혈장 농도에서 P-gp를 억제하지 않을 것으로 예상됩니다.
특정 집단
간 기능 장애 환자
axitinib의 약동학에 대한 간 기능 장애의 영향은 그림 1에 나와 있습니다. [복용량 및 투여 (2.2), 경고 및 주의사항 (5.12), 특정 집단에서의 사용 (8.6) 참조].
신장 기능 장애 환자
중증 신장 기능 장애 환자 5명(15mL/min ≤CLcr <29mL/min), 중등도 신장 기능 장애 환자 64명(30mL/min ≤CLcr <59mL/min), 경증 신장 기능 장애 환자 139명(60mL/min ≤CLcr <89mL/min)을 포함한 건강한 지원자 및 환자 590명을 대상으로 (기존 신장 기능을 기반으로) 모집단 약동학 분석을 수행했습니다. 경증에서 중증 신장 기능 장애는 axitinib의 약동학에 유의미한 영향을 미치지 않았습니다. 말기 신질환 환자 1명의 데이터만 있습니다. [특정 집단에서의 사용 (8.7) 참조].
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
악시티닙을 사용한 발암성 연구는 수행되지 않았습니다.
악시티닙은 시험관내 세균 역돌연변이(Ames) 분석에서 돌연변이원성이 없었으며, 시험관내 인간 림프구 염색체 이상 분석에서 염색체 이상 유발성이 없었습니다. 그러나 악시티닙은 생체내 마우스 골수 미세핵 분석에서 유전독성을 나타냈습니다.
INLYTA는 사람의 생식 기능 및 생식 능력을 손상시킬 가능성이 있습니다. 반복 투여 독성 연구에서, 수컷 생식 기관에서는 고환/부고환에서 (기관 무게 감소, 위축 또는 퇴행, 생식 세포 수 감소, 정자 감소증 또는 비정상적인 정자 형태, 정자 밀도 및 수 감소) 마우스에서 1일 2회 경구 투여 시 ≥15 mg/kg/dose (권장 시작 용량 환자의 전신 노출(AUC)의 약 7배) 및 개에서 1일 2회 경구 투여 시 ≥1.5 mg/kg/dose (권장 시작 용량 환자의 AUC의 약 0.1배)에서 관찰되었습니다. 마우스와 개에서 암컷 생식 기관에서 관찰된 결과는 ≥5 mg/kg/dose (각각 마우스와 개에서 권장 시작 용량 환자의 AUC의 약 1.5배 또는 0.3배)에서 지연된 성적 성숙, 황체 감소 또는 부재, 자궁 무게 감소 및 자궁 위축 징후를 포함했습니다.
마우스의 생식능력 연구에서, 악시티닙은 최소 70일 이상 투여 후(권장 시작 용량 환자의 AUC의 약 57배) 50 mg/kg/dose까지의 모든 시험 용량에서 수컷에게 1일 2회 경구 투여 시 교미 또는 생식률에 영향을 미치지 않았습니다. 암컷 마우스에서, 악시티닙으로 최소 15일 이상 치료 후(권장 시작 용량 환자의 AUC의 약 10배) 시험된 모든 용량(≥15 mg/kg/dose, 1일 2회 경구 투여)에서 생식능력 및 배아 생존율이 감소되었습니다.
14 CLINICAL STUDIES
14.1 1차 진행성 RCC
아벨루맙 병용 요법의 INLYTA
아벨루맙과 병용한 INLYTA의 효능 및 안전성은 무작위, 다기관, 공개 표지, 연구인 JAVELIN Renal 101 시험(NCT02684006)에서 입증되었으며, 종양 PD-L1 발현 여부에 관계없이 886명의 치료받지 않은 진행성 RCC 환자를 대상으로 INLYTA와 아벨루맙 병용 요법을 연구했습니다[intent-to-treat (ITT) 집단]. 자가면역 질환이 있거나 전신 면역억제제가 필요한 환자는 제외되었습니다.
무작위 배정은 동부 협력 종양학 그룹(ECOG) 수행 상태(PS)(0 대 1) 및 지역(미국 대 캐나다/서유럽 대 기타 지역)에 따라 계층화되었습니다. 환자는 다음 치료군 중 하나에 무작위 배정(1:1)되었습니다.
- •
- 1일 2회 경구 투여 INLYTA 5mg을 2주마다 10mg/kg 정맥 주입 아벨루맙과 병용 투여했습니다 (N=442). 2주 연속으로 2등급 이상의 INLYTA 관련 이상 반응 없이 1일 2회 INLYTA 5mg을 잘 견딘 환자는 7mg으로 증량한 후 10mg으로 증량할 수 있었습니다. 독성을 관리하기 위해 INLYTA를 중단하거나 1일 2회 3mg으로 감량한 후 1일 2회 2mg으로 감량할 수 있었습니다.
- •
- 4주 동안 1일 1회 경구 투여 수니티닙 50mg을 투여한 후 2주간 휴약했습니다 (N=444). 방사선학적 또는 임상적 진행 또는 용인할 수 없는 독성이 나타날 때까지 계속 투여했습니다.
INLYTA와 아벨루맙 치료는 맹검 독립 중앙 검토(BICR) 평가에 따른 RECIST v1.1 정의 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 계속되었습니다. 환자가 임상적으로 안정적이고 연구자가 임상적 이점을 얻고 있다고 판단한 경우 RECIST 정의 질병 진행 이후에도 INLYTA와 아벨루맙 투여가 허용되었습니다. 종양 상태 평가는 기준선, 무작위 배정 후 6주, 그 후 6주마다 무작위 배정 후 18개월까지, 그 후 12주마다 BICR에 의해 확인된 질병 진행이 문서화될 때까지 수행되었습니다.
기준 특성은 중앙값 연령 61세(범위: 27~88세), 65세 이상 환자 38%, 남성 75%, 백인 75%, ECOG PS는 각각 0(63%) 또는 1(37%)이었습니다. 국제 전이성 신세포암종 데이터베이스(IMDC) 위험군별 환자 분포는 유리한 군 21%, 중간 군 62%, 불량 군 16%였습니다.
주요 효능 결과 측정 항목은 RECIST v1.1을 사용한 BICR에 의해 평가된 무진행 생존 기간(PFS)과 임상 시험 분석을 사용한 PD-L1 양성 종양 환자의 전체 생존 기간(OS)(PD-L1 발현 수준 ≥1%)이었습니다. PFS가 PD-L1 양성 종양 환자에서 통계적으로 유의미했기 때문에 [HR 0.61 (95% CI: 0.48, 0.79)], ITT 집단에서도 검정되었고 ITT 집단에서 PFS의 통계적으로 유의미한 개선이 입증되었습니다.
19개월의 중앙값 전체 생존 기간 추적 관찰 결과, ITT 집단에서 27%의 사망률을 보이며 전체 생존 기간 데이터는 미성숙했습니다.
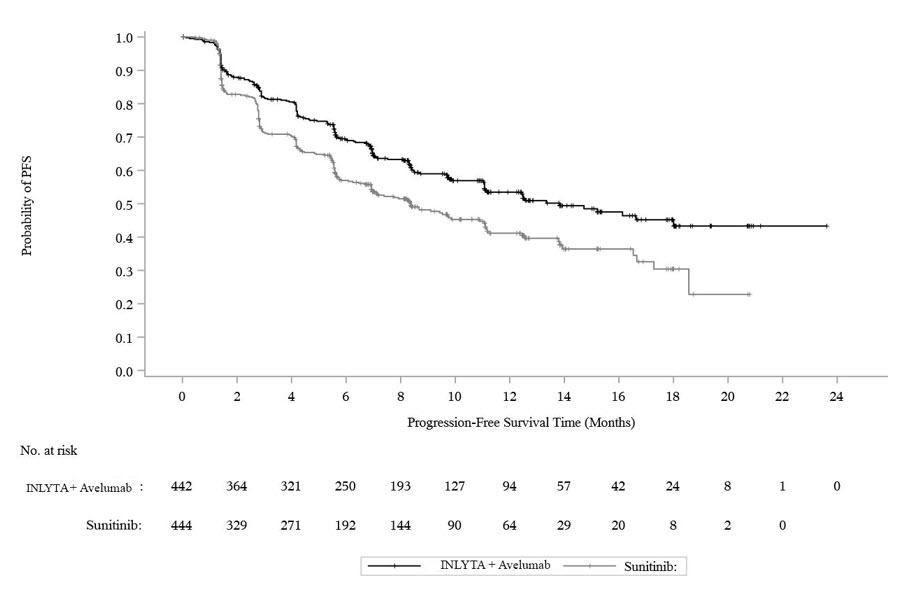
효능 결과는 표 10과 그림 2에 제시되어 있습니다.
| 효능 평가 지표 (BICR 평가 기준) | 아벨루맙 병용 INLYTA (N=422) |
수니티닙 (N=444) |
|---|---|---|
| BICR: 맹검 독립 중앙 검토; CI: 신뢰 구간; NE: 추정 불가. | ||
|
||
|
무진행 생존 기간(PFS) |
||
|
사건 (%) |
180 (41) |
216 (49) |
|
중앙값(월)(95% CI) |
13.8 (11.1, NE) |
8.4 (6.9, 11.1) |
|
위험비(95% CI) |
0.69 (0.56, 0.84) |
|
|
양측 p-값* |
0.0002 |
|
|
확인된 객관적 반응률(ORR) |
||
|
객관적 반응률 n (%) |
227 (51.4) |
114 (25.7) |
|
(95% CI) |
(46.6, 56.1) |
(21.7, 30.0) |
|
완전 관해(CR) n (%) |
15 (3.4) |
8 (1.8) |
|
부분관해 (PR) n (%) |
212 (48) |
106 (24) |
그림 2. BICR 평가 기반 PFS에 대한 K-M 추정치 – ITT
펨브롤리주맙 병용 요법의 INLYTA
펨브롤리주맙과 병용한 INLYTA의 효능은 전이성 신세포암(RCC)에 대해 전신 치료를 받지 않은 861명의 환자를 대상으로 실시된 무작위 배정, 다기관, 공개 표지 임상 시험인 KEYNOTE-426 (NCT02853331)에서 조사되었습니다. PD-L1 종양 발현 상태에 관계없이 환자를 등록했습니다. 지난 2년 이내에 전신 면역억제제가 필요한 활성 자가면역 질환이 있는 환자는 등록할 수 없었습니다. 무작위 배정은 국제 전이성 RCC 데이터베이스 컨소시엄(IMDC) 위험 범주(유리한 대 중간 대 불리한) 및 지리적 지역(북미 대 서유럽 대 “그 외 지역”)에 따라 계층화되었습니다.
환자는 다음 치료군 중 하나에 무작위 배정(1:1)되었습니다.
- •
- INLYTA 5mg을 1일 2회 경구 투여하고, 펨브롤리주맙 200mg을 3주마다 정맥 주사하여 최대 24개월 동안 병용 투여합니다. 2회 연속 사이클(6주) 동안 INLYTA 5mg을 1일 2회 투여한 것을 잘 견딘 환자는 7mg으로 증량한 후 10mg으로 증량할 수 있습니다. 독성을 관리하기 위해 INLYTA 투여를 중단하거나 1일 2회 3mg으로 감량한 후 1일 2회 2mg으로 감량할 수 있습니다.
- •
- 수니티닙 50mg을 1일 1회 경구 투여하고, 4주 후 2주간 휴약합니다.
INLYTA와 펨브롤리주맙 치료는 RECIST v1.1에 따라 정의된 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 계속되었습니다. 환자가 임상적으로 안정적이고 연구자가 임상적 이점을 얻고 있다고 판단한 경우 RECIST에 따라 정의된 질병 진행 이후에도 INLYTA와 펨브롤리주맙의 투여가 허용되었습니다. 종양 상태 평가는 기준선, 무작위 배정 후 12주차, 그 후 54주차까지 6주마다, 그 후 12주마다 수행되었습니다.
연구 대상 환자의 특징은 다음과 같습니다. 중앙값 연령 62세(범위: 26~90세); 65세 이상 38%; 남성 73%; 백인 79%, 아시아인 16%; 기준 KPS가 각각 70~80 및 90~100인 환자는 20% 및 80%; IMDC 위험 범주별 환자 분포는 유리한 31%, 중간 56%, 불리한 13%입니다.
주요 효능 결과 측정 항목은 RECIST v1.1에 따라 BICR이 평가한 OS 및 PFS이며, 최대 10개의 표적 병변과 장기당 최대 5개의 표적 병변을 따르도록 수정되었습니다. 추가적인 효능 결과 측정 항목에는 BICR이 평가한 ORR이 포함되었습니다. 사전에 지정된 중간 분석에서 INLYTA와 펨브롤리주맙 병용 요법을 투여받은 환자군은 수니티닙 투여군에 비해 OS가 통계적으로 유의하게 개선됨을 보였습니다. 이 임상 시험에서는 PFS와 ORR도 통계적으로 유의하게 개선됨을 보였습니다.
사전에 지정된 최종 분석을 위한 계획된 사망자 수를 기준으로 418명의 사망자가 관찰되었을 때 OS 분석이 업데이트되었습니다. 표 11과 그림 3은 KEYNOTE-426의 효능 결과를 요약한 것입니다.
| 종점 | INLYTA 및 펨브롤리주맙 N=432 |
수니티닙 N=429 |
||
|---|---|---|---|---|
| CI: 신뢰 구간; NR: 미달성; ORR: 객관적 반응률; OS: 전체 생존율; PFS: 무진행 생존율. | ||||
|
OS |
||||
|
사건 발생 환자 수 (%) |
59 (14%) |
97 (23%) |
||
|
중앙값(월)(95% CI) |
NR (NR, NR) |
NR (NR, NR) |
||
|
위험비* (95% CI) |
0.53 (0.38, 0.74) |
|||
|
p값 † |
<0.0001 ‡ |
|||
|
12개월 OS율 |
90% (86, 92) |
78% (74, 82) |
||
|
갱신된 전체 생존율(Updated OS) |
||
|
사건 발생 환자 수 (%) |
193 (45%) |
225 (52%) |
|
중앙값(월) (95% CI) |
45.7 (43.6, NR) |
40.1 (34.3, 44.2) |
|
위험비* (95% CI) |
0.73 (0.60, 0.88) |
|
|
무진행 생존율(PFS) |
||
|
사건 발생 환자 수 (%) |
183 (42%) |
213 (50%) |
|
중앙값(월) (95% CI) |
15.1 (12.6, 17.7) |
11.0 (8.7, 12.5) |
|
위험비* (95% CI) |
0.69 (0.56, 0.84) |
|
|
p-값 † |
0.0001§ |
|
|
전반적 반응률(ORR) |
||
|
전반적 확인된 반응률 (95% CI) |
59% (54, 64) |
36% (31, 40) |
|
완전 관해율 |
6% |
2% |
|
부분 관해율 |
53% |
34% |
|
p-값¶ |
<0.0001 |
|
그림 3. KEYNOTE-426의 전체 생존율에 대한 Kaplan-Meier 곡선
탐색적 분석에서, IMDC 유리, 중간, 중간/불량, 불량 위험군 환자의 OS에 대한 업데이트된 분석은 각각 HR 1.17 (95% CI: 0.76, 1.80), 0.67 (95% CI: 0.52, 0.86), 0.64 (95% CI: 0.52, 0.80), 0.51 (95% CI: 0.32, 0.81)을 나타냈습니다.
14.2 2차 진행성 RCC
INLYTA의 안전성 및 유효성은 무작위 배정, 공개, 다기관 3상 연구에서 평가되었습니다. 수니티닙, 베바시주맙, 템시롤리무스 또는 사이토카인 함유 요법을 포함한 1차 전신 치료 후 질병이 진행된 진행성 RCC 환자 (N=723명)는 INLYTA (N=361명) 또는 소라페닙 (N=362명)을 투여받도록 무작위 배정(1:1)되었습니다. 무작위 배정된 독립 중앙 검토 위원회에 의해 무진행 생존율(PFS)이 평가되었습니다. 다른 평가변수에는 객관적 반응률(ORR) 및 전체 생존율(OS)이 포함되었습니다.
이 연구에 등록된 환자 중 389명(54%)은 1차 수니티닙 기반 치료를, 251명(35%)은 1차 사이토카인 기반 치료(인터루킨-2 또는 인터페론-알파)를, 59명(8%)은 1차 베바시주맙 기반 치료를, 24명(3%)은 1차 템시롤리무스 기반 치료를 받았습니다. 연령(중앙값 61세), 성별(남성 72%), 인종(백인 75%, 아시아인 21%), 동부 협력 종양학 그룹(ECOG) 수행 상태(0 55%, 1 45%), 조직학(선암 99%)과 관련하여 INLYTA군과 소라페닙군 간의 기준 인구통계학적 특징 및 질병 특징은 유사했습니다.
PFS 평가변수에 대해 INLYTA는 소라페닙보다 통계적으로 유의미한 이점을 보였습니다 (표 12 및 그림 4 참조). OS 측면에서는 두 군 간에 통계적으로 유의미한 차이가 없었습니다.
| 평가변수/연구 대상군 | INLYTA | 소라페닙 | HR (95% CI) | P-값 |
|---|---|---|---|---|
| CI: 신뢰 구간; HR: 위험 비 (INLYTA/소라페닙); ITT: 치료 의도; ORR: 객관적 반응률; NS: 통계적으로 유의하지 않음; OS: 전체 생존율; PFS: 무진행 생존율 | ||||
|
||||
|
전체 ITT |
N= 361 |
N = 362 |
||
|
6.7 (6.3, 8.6) |
4.7 (4.6, 5.6) |
0.67 (0.54, 0.81) |
<0.0001‡ |
|
|
중앙값 OS (월) |
20.1 (16.7, 23.4) |
19.2 (17.5, 22.3) |
0.97 (0.80, 1.17) |
NS |
|
ORR % (95% CI) |
19.4 (15.4, 23.9) |
9.4 (6.6, 12.9) |
2.06§ (1.41, 3.00) |
–¶ |
|
이전 치료별 PFS |
||||
|
수니티닙 불응군 |
N=194 |
N=195 |
||
|
중앙값, 개월 (95% CI) |
4.8 (4.5, 6.4) |
3.4 (2.8, 4.7) |
0.74 (0.57, 0.96) |
–¶ |
|
사이토카인 불응군 |
N=126 |
N=125 |
||
|
중앙값, 개월 (95% CI) |
12.1 (10.1, 13.9) |
6.5 (6.3, 8.3) |
0.46 (0.32, 0.68) |
–¶ |
그림 4. 독립적 평가에 따른 무진행 생존율에 대한 Kaplan-Meier 곡선 (치료 의도 집단)
16 제공/보관 및 취급 방법
INLYTA 정제는 다음과 같이 공급됩니다.
- •
- 1 mg 정제는 한쪽 면에는 “Pfizer”가, 다른 면에는 “1 XNB”가 각인된 적색 필름 코팅된 타원형 정제이며, 180정들이 병에 포장되어 있습니다: NDC 0069-0145-01.
- •
- 5 mg 정제는 한쪽 면에는 “Pfizer”가, 다른 면에는 “5 XNB”가 각인된 적색 필름 코팅된 삼각형 정제이며, 60정들이 병에 포장되어 있습니다: NDC 0069-0151-11.
- •
- 20°C~25°C(68°F~77°F)에 보관하십시오. 15°C~30°C(59°F~86°F)의 일시적인 온도 변화는 허용됩니다 [USP 제어 실온 참조].
17 환자 상담 정보
FDA 승인 환자용 설명서(Patient Information)를 읽도록 환자에게 알려주십시오.
동맥/정맥 혈전색전증
INLYTA 치료 중 동맥 및 정맥 혈전색전증이 관찰되었으므로, 혈전색전증을 시사하는 증상이 나타나면 의사에게 알리도록 환자에게 알려주십시오 [경고 및 주의사항 (5.2, 5.3) 참조].
심부전
INLYTA 치료 중 심부전이 발생할 수 있으며, 치료 기간 동안 심부전의 징후 또는 증상을 정기적으로 모니터링해야 함을 환자에게 알려주십시오 [경고 및 주의사항 (5.5) 참조].
위장 장애
INLYTA 치료 중 설사, 메스꺼움, 구토 및 변비와 같은 위장 장애가 발생할 수 있으며, 지속적이거나 심한 복통이 발생하면 즉시 의료기관을 찾도록 환자에게 알려주십시오. INLYTA를 복용하는 환자에서 위장 천공 및 누공 사례가 보고되었기 때문입니다 [경고 및 주의사항 (5.6) 및 유해 반응 (6.1) 참조].
비정상적인 갑상선 기능
INLYTA 치료 중 비정상적인 갑상선 기능이 발생할 수 있으며, 비정상적인 갑상선 기능의 증상이 나타나면 의사에게 알리도록 환자에게 알려주십시오 [경고 및 주의사항 (5.7) 참조].
상처 치유 장애
INLYTA는 상처 치유를 손상시킬 수 있습니다. 예정된 수술 절차에 대해서는 의료 제공자에게 알리도록 환자에게 알려주십시오 [경고 및 주의사항 (5.8) 참조].
가역적 후방 백색질 뇌병증 증후군
RPLS (두통, 발작, 무기력증, 혼란, 실명 및 기타 시각 및 신경 장애)와 일치하는 신경 기능 악화가 발생하면 의사에게 알리도록 환자에게 알려주십시오 [경고 및 주의사항 (5.9) 참조].
간독성
간독성의 징후 및 증상에 대해 환자에게 알려주십시오. 간독성의 징후 또는 증상이 나타나면 즉시 의료 제공자에게 연락하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.11) 참조].
중대한 심혈관계 유해 사건
아벨루맙과 병용하여 INLYTA를 투여받는 환자는 새로운 또는 악화되는 흉통, 호흡 곤란 또는 말초 부종을 포함하되 이에 국한되지 않는 심혈관계 사건의 징후 또는 증상에 대해 즉시 의료 제공자에게 연락하도록 알려주십시오 [경고 및 주의사항 (5.13) 참조].
배아-태아 독성
임신 중이거나 임신하게 된 경우 의료 제공자에게 알리도록 여성에게 알려주십시오. 태아에 대한 위험과 임신 손실 가능성에 대해 여성 환자에게 알려주십시오 [특정 집단에서의 사용 (8.1) 참조].
생식 가능성이 있는 여성은 INLYTA 치료 중과 마지막 투여 후 1주일 동안 효과적인 피임법을 사용하도록 알려주십시오.
생식 가능성이 있는 여성 파트너가 있는 남성 환자는 치료 중과 마지막 투여 후 1주일 동안 효과적인 피임법을 사용하도록 알려주십시오 [경고 및 주의사항 (5.14) 및 특정 집단에서의 사용 (8.3) 참조].
INLYTA를 아벨루맙 또는 펨브롤리주맙과 병용하는 경우, 임신 및 피임 정보에 대해 아벨루맙 또는 펨브롤리주맙의 전체 처방 정보를 참조하십시오.
수유
INLYTA를 복용하는 동안과 마지막 투여 후 2주 동안은 모유 수유를 하지 않도록 환자에게 알려주십시오 [특정 집단에서의 사용 (8.2) 참조].
INLYTA를 아벨루맙 또는 펨브롤리주맙과 병용하는 경우, 수유 정보에 대해 아벨루맙 또는 펨브롤리주맙의 전체 처방 정보를 참조하십시오.
미분류 섹션
이 제품의 라벨이 업데이트되었을 수 있습니다. 가장 최신 처방 정보는 www.pfizer.com을 방문하십시오.
LAB-0561-8.0
환자 사용 설명서
|
환자 정보 |
|||
|
중요 정보: 의료 제공자가 아벨루맙 또는 펨브롤리주맙과 함께 복용하도록 INLYTA를 처방하는 경우, 아벨루맙 또는 펨브롤리주맙에 대한 약물 안내서도 읽으십시오. |
|||
|
INLYTA란 무엇입니까?
소아에서 INLYTA의 안전성 및 유효성은 알려져 있지 않습니다. |
|||
|
INLYTA를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
여성의 경우 다음과 같은 경우 의료 제공자에게 알리십시오.
임신이 가능한 여성 파트너가 있는 남성의 경우:
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. INLYTA와 특정 다른 약물은 서로 영향을 미쳐 심각한 부작용을 일으킬 수 있습니다. |
|||
|
INLYTA는 어떻게 복용해야 합니까?
|
|||
|
INLYTA를 복용하는 동안 무엇을 피해야 합니까?
|
|||
|
INLYTA의 가능한 부작용은 무엇입니까?
|
|||
|
|
||
|
|||
- o
- 예상치 못한 출혈 또는 오랫동안 지속되는 출혈 (예:
- •
- 잇몸에서의 비정상적인 출혈
- •
- 평소보다 심한 월경 또는 질 출혈
- •
- 심각하거나 조절할 수 없는 출혈
- •
- 분홍색 또는 갈색 소변
- •
- 붉은색 또는 검은색 변 (타르처럼 보임)
- •
- 알 수 없는 원인으로 발생하거나 커지는 멍
- •
- 피 또는 피 덩어리를 기침으로 배출
- •
- 피를 토하거나 토사물이 “커피 찌꺼기”처럼 보임
- o
- 예상치 못한 통증, 부기 또는 관절통
- o
- 두통, 어지러움 또는 쇠약감
- •
- 심부전. INLYTA 치료 중에 의료 제공자는 심부전의 징후나 증상을 정기적으로 확인해야 합니다. 심부전은 심각할 수 있으며 때로는 사망으로 이어질 수 있습니다. INLYTA 치료 중 다음 증상이 나타나면 의료 제공자에게 알리십시오:
- o
- 피로감
- o
- 복부, 다리 또는 발목의 부기
- o
- 호흡 곤란
- o
- 경정맥 돌출
- •
-
위 또는 장벽 파열 (천공). 위 또는 장벽 파열은 심각할 수 있으며 때로는 사망으로 이어질 수 있습니다. 다음 증상이 나타나면 즉시 의료 지원을 받으십시오:
- o
- 심한 복통 또는 사라지지 않는 복통
- o
- 피를 토함
- o
- 붉은색 또는 검은색 변
- •
- 갑상선 문제. 의료 제공자는 INLYTA 치료 전과 치료 중에 갑상선 기능을 확인하기 위해 혈액 검사를 실시해야 합니다. INLYTA 치료 중 다음 증상이 나타나면 의료 제공자에게 알리십시오:
- o
- 악화되거나 사라지지 않는 피로감
- o
- 열감 또는 추위
- o
- 목소리가 굵어짐
- o
- 체중 증가 또는 감소
- o
- 탈모
- o
- 근육 경련 및 통증
- •
-
상처 치유 문제 위험. INLYTA 치료 중에는 상처가 제대로 아물지 않을 수 있습니다. INLYTA 치료 시작 전이나 치료 중에 수술을 계획하고 있다면 의료 제공자에게 알리십시오.
- o
- 예정된 수술 최소 2일 전에 INLYTA 복용을 중단해야 합니다.
- o
- 의료 제공자는 수술 후 INLYTA 복용을 다시 시작할 수 있는 시기를 알려줄 것입니다.
- •
- 가역성 후방 백색질뇌병증 증후군 (RPLS). 가역성 후방 백색질뇌병증 증후군(RPLS)이라는 질환이 INLYTA 치료 중 발생할 수 있습니다. 다음 증상이 나타나면 즉시 의료 제공자에게 연락하십시오:
- o
- 두통
- o
- 발작
- o
- 쇠약
- o
- 혼란
- o
- 고혈압
- o
- 실명 또는 시력 변화
- o
- 사고력 문제
- •
- 소변 단백질. 의료 제공자는 INLYTA 치료 전과 치료 중에 소변의 단백질을 확인해야 합니다. 소변에 단백질이 생기면 의료 제공자는 INLYTA 용량을 줄이거나 치료를 중단할 수 있습니다.
- •
-
간 문제. 의료 제공자는 INLYTA 치료 전과 치료 중에 혈액 검사를 실시할 것입니다. 심각한 간 문제가 발생하면 의료 제공자는 INLYTA 치료를 지연시키거나 중단할 수 있습니다.
다음 증상이 나타나면 즉시 의료 제공자에게 알리십시오:
- o
- 피부 또는 눈의 흰자위 황변
- o
- 심한 메스꺼움 또는 구토
- o
- 복부 오른쪽 통증
- o
- 진한 소변 (차색)
- o
- 평소보다 쉽게 출혈 또는 멍이 듦
- •
- 심장 문제. INLYTA를 avelumab이라는 약물과 함께 사용하면 심각한 심장 문제가 발생하여 사망에 이를 수 있습니다. 의료 제공자는 INLYTA 치료 중 심장 문제를 확인할 것입니다. 다음 증상이 나타나면 즉시 의료 제공자에게 알리거나 의료 지원을 받으십시오:
- o
- 복부, 다리, 손, 발 또는 발목의 부기
- o
- 호흡 곤란
- o
- 메스꺼움 또는 구토
- o
- 새로운 또는 악화되는 흉통, 통증 또는 압박감 포함
- o
- 체중 증가
- o
- 팔, 등, 목 또는 턱의 통증 또는 불편함
- o
- 식은땀
- o
- 어지러움 또는 현기증
Avelumab과 함께 사용하는 INLYTA의 가장 흔한 부작용은 다음과 같습니다.
|
|
||
|
펨브롤리주맙과 함께 사용 시 INLYTA의 가장 흔한 부작용은 다음과 같습니다: |
|||
|
|
||
|
단독으로 사용 시 INLYTA의 가장 흔한 부작용은 다음과 같습니다: |
|||
|
|
||
|
INLYTA는 남성과 여성 모두에게 불임 문제를 일으킬 수 있으며, 이는 임신 능력에 영향을 미칠 수 있습니다. 이것이 우려되는 경우 의료 제공자와 상담하십시오. |
|||
|
INLYTA는 어떻게 보관해야 합니까? INLYTA는 섭씨 20°C~25°C(화씨 68°F~77°F)의 실온에 보관하십시오. INLYTA 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||
|
INLYTA의 안전하고 효과적인 사용에 대한 일반 정보. |
|||
|
INLYTA의 성분은 무엇입니까? |
|||
 |
LAB-0439-8.0 |
||
|
자세한 내용은 www.inlyta.com을 방문하거나 877-0744-5675로 전화하십시오. |
|||
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2024년 7월
진열대 라벨 – 1mg 정제 병 라벨
Pfizer
NDC 0069-0145-01
Inlyta®
(axitinib) tablets
1 mg
180 Tablets
Rx only
주 표시 패널 – 5mg 정제 병 라벨
Pfizer
NDC 0069-0151-11
Inlyta®
(axitinib) 정제
5 mg
60정
처방전 전용