의약품 제조업체: Pfizer Laboratories Div Pfizer Inc (Updated: 2024-12-27)
처방 정보 하이라이트
IBRANCE® (팔보시클립) 캡슐, 경구용
미국 최초 승인: 2015
적응증 및 용법
제형 및 강도
캡슐: 125mg, 100mg 및 75mg. (3)
금기
없음. (4)
경고 및 주의사항
- •
- 호중구 감소증: IBRANCE 치료 시작 전과 각 사이클 시작 시, 그리고 처음 2사이클의 15일에 그리고 임상적으로 필요한 경우 완전 혈구 수를 모니터링합니다. (2.2, 5.1)
- •
- 간질성 폐 질환(ILD)/폐렴: ILD/폐렴의 중증 및 치명적인 경우가 보고되었습니다. ILD/폐렴의 폐 증상을 모니터링합니다. ILD/폐렴이 의심되는 환자에게는 IBRANCE를 즉시 중단합니다. 중증 ILD/폐렴이 발생하는 경우 IBRANCE를 영구적으로 중단합니다. (5.2)
- •
- 배아-태아 독성: IBRANCE는 태아에게 해를 끼칠 수 있습니다. 환자에게 태아에 대한 잠재적 위험과 효과적인 피임법 사용에 대해 알립니다. (5.3, 8.1, 8.3)
유해 반응
가장 흔한 유해 반응(발생률 ≥10%)은 호중구 감소증, 감염, 백혈구 감소증, 피로, 메스꺼움, 구내염, 빈혈, 탈모, 설사, 혈소판 감소증, 발진, 구토, 식욕 감퇴, 권태감 및 발열이었습니다. (6)
의심되는 유해 반응을 보고하려면 Pfizer Inc에 1-800-438-1985 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 문의하십시오.
약물 상호작용
환자 상담 정보 및 FDA 승인 환자 라벨링은 17번을 참조하십시오.
개정: 2024년 12월
목차
전문 정보: 목차*
1 적응증 및 용법
2 용법 및 용량
2.1 권장 용량 및 투여 일정
2.2 용량 조절
3 제형 및 강도
4 금기사항
5 경고 및 주의사항
5.1 호중구 감소증
5.2 간질성 폐질환(ILD)/폐렴
5.3 배아-태아 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 팔보시클립 혈장 농도를 증가시킬 수 있는 약물
7.2 팔보시클립 혈장 농도를 감소시킬 수 있는 약물
7.3 팔보시클립에 의해 혈장 농도가 변할 수 있는 약물
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간 손상
8.7 신장 손상
10 과량 투여
11 일반적 특성
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상시험
16 포장단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분은 목록에 포함되지 않습니다.
1 적응증 및 사용법
IBRANCE는 다음과 병용하여 호르몬 수용체(HR) 양성, 사람 표피 성장 인자 수용체 2(HER2) 음성 진행성 또는 전이성 유방암 성인 환자 치료에 적응증이 있습니다.
- •
- 최초 내분비 기반 치료로서 아로마타제 억제제; 또는
- •
- 내분비 치료 후 질병 진행 환자에서 풀베스트란트.
2 용법 및 투여
2.1 권장 복용량 및 일정
IBRANCE의 권장 복용량은 125mg 캡슐을 21일 연속으로 1일 1회 경구 복용한 후 7일 동안 치료를 중단하여 28일의 전체 주기를 구성합니다. IBRANCE는 음식과 함께 복용해야 합니다. [see Clinical Pharmacology (12.3)].
IBRANCE와 함께 투여할 경우 권장되는 용량의 아로마타제 억제제를 투여하십시오. 사용 중인 아로마타제 억제제에 대한 전체 처방 정보를 참조하십시오.
IBRANCE와 함께 투여할 경우, 권장되는 fulvestrant 용량은 1일, 15일, 29일에 500mg을 투여하고 그 후 매달 1회 투여합니다. fulvestrant의 전체 처방 정보를 참조하십시오.
환자는 매일 거의 같은 시간에 IBRANCE를 복용하도록 권장해야 합니다.
환자가 구토를 하거나 복용량을 놓친 경우 추가 복용량을 복용해서는 안 됩니다. 다음 처방된 복용량은 평소 시간에 복용해야 합니다. IBRANCE 캡슐은 통째로 삼켜야 합니다(삼키기 전에 씹거나 부수거나 열지 마십시오). 캡슐이 파손되었거나 금이 갔거나 온전하지 않은 경우에는 섭취해서는 안 됩니다.
IBRANCE와 아로마타제 억제제 또는 fulvestrant 병용 요법으로 치료받는 사춘기 전/주변기 여성은 현재 임상 진료 기준에 따라 황체형성호르몬 방출 호르몬(LHRH) 작용제로 치료해야 합니다.
IBRANCE와 아로마타제 억제제 병용 요법으로 치료받는 남성의 경우, 현재 임상 진료 기준에 따라 LHRH 작용제 치료를 고려하십시오.
2.2 복용량 수정
부작용에 대한 권장 복용량 수정은 표 1, 2, 3에 나와 있습니다.
| 복용량 수준 | 복용량 |
|---|---|
|
|
|
권장 시작 복용량 |
125mg/일 |
|
첫 번째 복용량 감량 |
100mg/일 |
|
두 번째 복용량 감량 |
75mg/일* |
| CTCAE 4.0에 따른 등급 분류. CTCAE=Common Terminology Criteria for Adverse Events; LLN=정상 하한. |
|
|
IBRANCE 치료 시작 전과 각 주기 시작 시, 그리고 첫 2주기의 15일째에, 그리고 임상적으로 필요한 경우 전혈구 수를 모니터링합니다. |
|
|
CTCAE 등급 |
용량 수정 |
|
1등급 또는 2등급 |
용량 조정이 필요하지 않습니다. |
|
3등급 |
주기 1일째: |
|
3등급 호중구감소증†(발열 ≥38.5ºC 및/또는 감염 동반) |
언제든지: |
|
언제든지: |
|
| CTCAE 등급 | 용량 수정 |
|---|---|
| CTCAE 4.0에 따른 등급 분류. CTCAE=Common Terminology Criteria for Adverse Events. |
|
|
1등급 또는 2등급 |
용량 조정이 필요하지 않습니다. |
|
3등급 이상의 비혈액학적 독성(최적의 치료에도 불구하고 지속되는 경우) |
증상이 다음과 같이 해결될 때까지 투여를 중단합니다.
다음으로 낮은 용량으로 재개합니다. |
중증 간질성 폐질환(ILD)/폐렴 환자의 경우 IBRANCE 투여를 영구적으로 중단하십시오.
독성 발생 시 병용 내분비 요법 용량 조정 지침 및 기타 관련 안전 정보 또는 금기 사항은 전체 처방 정보를 참조하십시오.
강력한 CYP3A 억제제와 병용 시 용량 조정
강력한 CYP3A 억제제와의 병용을 피하고 CYP3A 억제 효과가 없거나 최소인 다른 병용 약물을 고려하십시오. 환자에게 강력한 CYP3A 억제제를 병용 투여해야 하는 경우 IBRANCE 용량을 1일 1회 75mg으로 줄이십시오. 강력한 억제제 투여를 중단하는 경우, 강력한 CYP3A 억제제 투여 시작 전에 사용했던 용량으로 IBRANCE 용량을 늘리십시오(억제제의 반감기 3~5회 후). [약물 상호 작용(7.1) 및 임상 약리학(12.3) 참조].
간 장애에 대한 용량 조정
경증 또는 중등도 간 장애(Child-Pugh 등급 A 및 B) 환자의 경우 용량 조정이 필요하지 않습니다. 중증 간 장애(Child-Pugh 등급 C) 환자의 경우 권장 IBRANCE 용량은 21일 연속 1일 1회 75mg 투여 후 7일 휴약하여 28일의 전체 주기를 구성하는 것입니다. [특정 집단에서의 사용(8.6) 및 임상 약리학(12.3) 참조].
3 제형 및 함량
125 mg capsules: 불투명하고 단단한 젤라틴 캡슐, 크기 0, 캐러멜 색상의 캡과 몸체, 캡에는 흰색 잉크로 “Pfizer”가 인쇄되어 있고, 몸체에는 “PBC 125″가 인쇄되어 있습니다.
100 mg capsules: 불투명하고 단단한 젤라틴 캡슐, 크기 1, 캐러멜 색상의 캡과 연한 주황색 몸체, 캡에는 흰색 잉크로 “Pfizer”가 인쇄되어 있고, 몸체에는 “PBC 100″가 인쇄되어 있습니다.
75 mg capsules: 불투명하고 단단한 젤라틴 캡슐, 크기 2, 연한 주황색 캡과 몸체, 캡에는 흰색 잉크로 “Pfizer”가 인쇄되어 있고, 몸체에는 “PBC 75″가 인쇄되어 있습니다.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 호중구감소증
PALOMA-2 연구에서 호중구감소증은 80%의 발생률로 가장 빈번하게 보고된 이상반응이었으며, PALOMA-3 연구에서는 83%의 발생률을 보였습니다. PALOMA-2 연구에서 레트로졸과 병용 투여받은 환자의 66%, PALOMA-3 연구에서 풀베스트란트와 병용 투여받은 환자의 66%에서 3등급 이상의 호중구 수 감소가 보고되었습니다. PALOMA-2 및 PALOMA-3 연구에서 모든 등급의 호중구감소증의 첫 번째 발병까지의 중앙값 기간은 15일이었고, 3등급 이상의 호중구감소증의 중앙값 기간은 7일이었습니다 [이상반응 (6.1) 참조].
IBRANCE 치료 시작 전과 각 치료주기 시작 시, 그리고 처음 2주기의 15일에, 그리고 임상적으로 필요한 경우에는 완전 혈구 수를 모니터링하십시오. 3등급 또는 4등급 호중구감소증이 발생한 환자에게는 용량 중단, 용량 감량 또는 치료 주기 시작 지연이 권장됩니다 [용법 및 용량 (2.2) 참조].
PALOMA-2 및 PALOMA-3 연구에서 IBRANCE에 노출된 환자 중 1.8%에서 발열성 호중구감소증이 보고되었습니다. PALOMA-3 연구에서 호중구 감소증으로 인한 패혈증으로 인한 사망이 1건 관찰되었습니다. 의사는 환자에게 발열 증상이 나타나면 즉시 보고하도록 알려야 합니다 [환자 상담 정보 (17) 참조].
5.2 간질성 폐질환(ILD)/폐렴
내분비 요법과 병용하여 사용되는 IBRANCE를 포함한 사이클린 의존성 키나아제 4/6(CDK4/6) 억제제로 치료받는 환자에게 심각하고 생명을 위협하거나 치명적인 간질성 폐질환(ILD) 및/또는 폐렴이 발생할 수 있습니다.
임상 시험(PALOMA-1, PALOMA-2, PALOMA-3) 전반에서 IBRANCE로 치료받은 환자의 1.0%에서 모든 등급의 ILD/폐렴이 발생했고, 0.1%에서 3등급 또는 4등급이 발생했으며 치명적인 경우는 보고되지 않았습니다. 시판 후 조사에서 추가적인 ILD/폐렴 사례가 관찰되었으며, 사망 사례가 보고되었습니다 [이상반응 (6.2) 참조].
ILD/폐렴을 나타내는 폐 증상(예: 저산소증, 기침, 호흡곤란)에 대해 환자를 모니터링하십시오. 새로운 호흡기 증상이 나타나거나 악화되어 폐렴이 발생한 것으로 의심되는 환자의 경우, IBRANCE를 즉시 중단하고 환자를 평가하십시오. 중증 ILD 또는 폐렴 환자의 경우 IBRANCE를 영구적으로 중단하십시오 [용법 및 용량 (2.2) 참조].
5.3 배아-태아 독성
동물 연구 결과와 작용 기전을 바탕으로, IBRANCE는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 동물 생식 연구에서, 기관 형성기에 임신한 랫트와 토끼에게 팔보시클립을 투여한 결과, 곡선 아래 면적(AUC)을 기준으로 한 사람의 임상 노출량보다 ≥4배 높은 모체 노출량에서 배아-태아 독성이 나타났습니다. 임신 여성에게 태아에 대한 잠재적 위험을 알리십시오. 생식 능력이 있는 여성에게는 IBRANCE 치료 기간 동안과 마지막 투여 후 최소 3주 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 집단에서의 사용 (8.1 및 8.3) 및 임상 약리학 (12.1) 참조].
6 부작용 반응
다음과 같은 임상적으로 중요한 이상 반응은 라벨링의 다른 곳에서 설명되어 있습니다.
- •
- 호중구 감소증 [경고 및 주의사항 (5.1) 참조]
- •
- ILD/폐렴 [경고 및 주의사항 (5.2) 참조]
6.1 임상 연구 경험
임상 시험은 다양한 조건 하에서 수행되므로 관찰된 이상 반응 발생률을 다른 시험의 발생률과 직접 비교할 수 없으며 임상 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
PALOMA-2: IBRANCE + Letrozole
초기 내분비 기반 치료를 위한 에스트로겐 수용체(ER) 양성, HER2 음성 진행성 또는 전이성 유방암 환자
PALOMA-2에서 IBRANCE (125 mg/day) + letrozole (2.5 mg/day)와 위약 + letrozole의 안전성을 평가했습니다. 아래에 설명된 데이터는 PALOMA-2에서 IBRANCE + letrozole을 1회 이상 투여받은 ER 양성, HER2 음성 진행성 유방암 환자 666명 중 444명의 IBRANCE 노출을 반영합니다. IBRANCE + letrozole 치료의 중앙값 기간은 19.8개월이었고 위약 + letrozole군의 중앙값 기간은 13.8개월이었습니다.
어떤 등급의 이상 반응으로 인한 용량 감소는 IBRANCE + letrozole을 투여받은 환자의 36%에서 발생했습니다. PALOMA-2에서는 letrozole에 대한 용량 감소가 허용되지 않았습니다.
이상 반응과 관련된 영구적 중단은 IBRANCE + letrozole을 투여받은 444명 중 43명(9.7%)의 환자와 위약 + letrozole을 투여받은 222명 중 13명(5.9%)의 환자에서 발생했습니다. IBRANCE + letrozole을 투여받은 환자의 영구적 중단으로 이어진 이상 반응에는 호중구 감소증(1.1%)과 알라닌 아미노전달효소 증가(0.7%)가 포함되었습니다.
IBRANCE + letrozole군 환자에서 보고된 모든 등급의 가장 흔한 이상 반응(≥10%)은 빈도 순으로 호중구 감소증, 감염, 백혈구 감소증, 피로, 메스꺼움, 탈모, 구내염, 설사, 빈혈, 발진, 권태, 혈소판 감소증, 구토, 식욕 감소, 건조한 피부, 발열 및 미각 이상이었습니다.
IBRANCE + letrozole을 투여받은 환자에서 가장 빈번하게 보고된 3등급 이상의 이상 반응(≥5%)은 빈도 순으로 호중구 감소증, 백혈구 감소증, 감염 및 빈혈이었습니다.
PALOMA-2에서 IBRANCE + letrozole 또는 위약 + letrozole을 투여받은 환자에게서 보고된 이상 반응(≥10%)은 표 4에 나와 있습니다.
| IBRANCE + Letrozole (N=444) |
위약 + Letrozole (N=222) |
|||||
|---|---|---|---|---|---|---|
| 이상 반응 | 모든 등급 % |
3등급 % |
4등급 % |
모든 등급 % |
3등급 % |
4등급 % |
| CTCAE 4.0에 따른 등급. CTCAE=이상 사례에 대한 일반 용어 기준; N=환자 수; N/A=해당 없음; |
||||||
|
||||||
|
감염 및 기생충 |
||||||
|
감염* |
60† |
6 |
1 |
42 |
3 |
0 |
|
혈액 및 림프계 장애 |
||||||
|
호중구 감소증 |
80 |
56 |
10 |
6 |
1 |
1 |
|
백혈구 감소증 |
39 |
24 |
1 |
2 |
0 |
0 |
|
빈혈 |
24 |
5 |
<1 |
9 |
2 |
0 |
|
혈소판 감소증 |
16 |
1 |
<1 |
1 |
0 |
0 |
|
대사 및 영양 장애 |
||||||
|
식욕 감퇴 |
15 |
1 |
0 |
9 |
0 |
0 |
|
신경계 장애 |
||||||
|
미각 이상 |
10 |
0 |
0 |
5 |
0 |
0 |
|
위장관 장애 |
||||||
|
구내염‡ |
30 |
1 |
0 |
14 |
0 |
0 |
|
오심 |
35 |
<1 |
0 |
26 |
2 |
0 |
|
설사 |
26 |
1 |
0 |
19 |
1 |
0 |
|
구토 |
16 |
1 |
0 |
17 |
1 |
0 |
|
피부 및 피하 조직 장애 |
||||||
|
탈모 |
33§ |
N/A |
N/A |
16¶ |
N/A |
N/A |
|
발진# |
18 |
1 |
0 |
12 |
1 |
0 |
|
건조한 피부 |
12 |
0 |
0 |
6 |
0 |
0 |
|
일반 장애 및 투여 부위 상태 |
||||||
|
피로 |
37 |
2 |
0 |
28 |
1 |
0 |
|
쇠약 |
17 |
2 |
0 |
12 |
0 |
0 |
|
발열 |
12 |
0 |
0 |
9 |
0 |
0 |
PALOMA-2 연구에서 이브랜스와 레트로졸 병용 투여군 환자의 10.0% 미만에서 발생한 추가적인 이상반응으로는 알라닌 아미노전이효소 증가(9.9%), 아스파르트산 아미노전이효소 증가(9.7%), 코피(9.2%), 눈물 분비 증가(5.6%), 안구건조(4.1%), 시력흐림(3.6%), 발열성 호중구감소증(2.5%)이 있었습니다.
| 이브랜스 + 레트로졸 (N=444) |
플라시보 + 레트로졸 (N=222) |
|||||
|---|---|---|---|---|---|---|
| 실험실 검사 이상 | 모든 등급 % |
3등급 % |
4등급 % |
모든 등급 % |
3등급 % |
4등급 % |
| N=환자 수; WBC=백혈구. | ||||||
|
WBC 감소 |
97 |
35 |
1 |
25 |
1 |
0 |
|
호중구 감소 |
95 |
56 |
12 |
20 |
1 |
1 |
|
빈혈 |
78 |
6 |
0 |
42 |
2 |
0 |
|
혈소판 감소 |
63 |
1 |
1 |
14 |
0 |
0 |
|
아스파르트산 아미노전이효소 증가 |
52 |
3 |
0 |
34 |
1 |
0 |
|
알라닌 아미노전이효소 증가 |
43 |
2 |
<1 |
30 |
0 |
0 |
PALOMA-3: IBRANCE + 풀베스트란트
이전 보조 또는 전이성 내분비 요법 후 질병 진행이 있었던 HR-양성, HER2-음성 진행성 또는 전이성 유방암 환자
PALOMA-3에서 위약 + 풀베스트란트 대비 IBRANCE (125 mg/day) + 풀베스트란트 (500 mg)의 안전성을 평가했습니다. 아래에 설명된 데이터는 PALOMA-3에서 IBRANCE + 풀베스트란트를 1회 이상 투여받은 HR-양성, HER2-음성 진행성 또는 전이성 유방암 환자 517명 중 345명의 IBRANCE 노출을 반영합니다. IBRANCE + 풀베스트란트 치료의 중앙값 기간은 10.8개월이었고, 위약 + 풀베스트란트군의 중앙값 기간은 4.8개월이었습니다.
어떤 등급의 이상 반응으로 인한 용량 감소는 IBRANCE + 풀베스트란트를 투여받은 환자의 36%에서 발생했습니다. PALOMA-3에서는 풀베스트란트에 대한 용량 감소가 허용되지 않았습니다.
이상 반응과 관련된 영구적 중단은 IBRANCE + 풀베스트란트를 투여받은 345명 중 19명 (6%), 위약 + 풀베스트란트를 투여받은 172명 중 6명 (3%)에서 발생했습니다. IBRANCE + 풀베스트란트를 투여받은 환자의 중단으로 이어진 이상 반응에는 피로 (0.6%), 감염 (0.6%) 및 혈소판 감소증 (0.6%)이 포함되었습니다.
IBRANCE + 풀베스트란트군 환자에서 보고된 모든 등급의 가장 흔한 이상 반응 (≥10%)은 빈도 순으로 감소하는 순서대로 호중구 감소증, 백혈구 감소증, 감염, 피로, 오심, 빈혈, 구내염, 설사, 혈소판 감소증, 구토, 탈모, 발진, 식욕 감소 및 발열이었습니다.
IBRANCE + 풀베스트란트를 투여받은 환자에서 가장 빈번하게 보고된 3등급 이상의 이상 반응 (≥5%)은 빈도 순으로 감소하는 순서대로 호중구 감소증과 백혈구 감소증이었습니다.
PALOMA-3에서 IBRANCE + 풀베스트란트 또는 위약 + 풀베스트란트를 투여받은 환자에게서 보고된 이상 반응 (≥10%)은 표 6에 나열되어 있습니다.
| 이상 반응 | IBRANCE + 풀베스트란트 (N=345) |
위약 + 풀베스트란트 (N=172) |
||||
|---|---|---|---|---|---|---|
| 모든 등급 | 3등급 | 4등급 | 모든 등급 | 3등급 | 4등급 | |
| % | % | % | % | % | % | |
| CTCAE 4.0에 따른 등급. CTCAE=이상 사례에 대한 일반 용어 기준; N=환자 수; N/A=해당 없음. |
||||||
|
||||||
|
감염 및 기생충 질환 |
||||||
|
감염* |
47† |
3 |
1 |
31 |
3 |
0 |
|
혈액 및 림프계 장애 |
||||||
|
호중구 감소증 |
83 |
55 |
11 |
4 |
1 |
0 |
|
백혈구 감소증 |
53 |
30 |
1 |
5 |
1 |
1 |
|
빈혈 |
30 |
4 |
0 |
13 |
2 |
0 |
|
혈소판 감소증 |
23 |
2 |
1 |
0 |
0 |
0 |
|
대사 및 영양 장애 |
||||||
|
식욕 감퇴 |
16 |
1 |
0 |
8 |
1 |
0 |
|
위장관 장애 |
||||||
|
오심 |
34 |
0 |
0 |
28 |
1 |
0 |
|
구내염‡ |
28 |
1 |
0 |
13 |
0 |
0 |
|
설사 |
24 |
0 |
0 |
19 |
1 |
0 |
|
구토 |
19 |
1 |
0 |
15 |
1 |
0 |
|
피부 및 피하 조직 장애 |
||||||
|
탈모 |
18§ |
N/A |
N/A |
6¶ |
N/A |
N/A |
|
Rash# |
17 |
1 |
0 |
6 |
0 |
0 |
|
General disorders and administration site conditions |
||||||
|
Fatigue |
41 |
2 |
0 |
29 |
1 |
0 |
|
Pyrexia |
13 |
<1 |
0 |
5 |
0 |
0 |
PALOMA-3 연구에서 이브랜스와 풀베스트란트 병용 투여군 환자의 10.0% 미만에서 발생한 추가적인 이상 반응으로는 무력증(7.5%), 아스파르트 아미노전이효소 증가(7.5%), 미각 이상(6.7%), 코피(6.7%), 눈물 분비 증가(6.4%), 건조한 피부(6.1%), 알라닌 아미노전이효소 증가(5.8%), 시력 흐림(5.8%), 안구건조증(3.8%) 및 발열성 호중구 감소증(0.9%)이 있었습니다.
| 검사치 이상 | 이브랜스 + 풀베스트란트 (N=345) |
플라시보 + 풀베스트란트 (N=172) |
||||
|---|---|---|---|---|---|---|
| 모든 등급 % |
3등급 % |
4등급 % |
모든 등급 % |
3등급 % |
4등급 % |
|
| N=환자 수; WBC=백혈구. | ||||||
|
WBC 감소 |
99 |
45 |
1 |
26 |
0 |
1 |
|
호중구 감소 |
96 |
56 |
11 |
14 |
0 |
1 |
|
빈혈 |
78 |
3 |
0 |
40 |
2 |
0 |
|
혈소판 감소 |
62 |
2 |
1 |
10 |
0 |
0 |
|
아스파르트 아미노전이효소 증가 |
43 |
4 |
0 |
48 |
4 |
0 |
|
알라닌 아미노전이효소 증가 |
36 |
2 |
0 |
34 |
0 |
0 |
기타 임상시험 경험
IBRANCE 투여 후 다음과 같은 이상 반응이 보고되었습니다: 정맥혈전색전증.
6.2 시판 후 경험
다음 이상 반응은 IBRANCE의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단으로부터 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
호흡기 질환: 간질성 폐 질환(ILD)/비감염성 폐렴
피부 및 피하 조직 장애: 손바닥-발바닥 홍반감각 이상 증후군(PPES)
7 약물 상호 작용
팔보시클립은 주로 CYP3A 및 설포전이효소(SULT)인 SULT2A1에 의해 대사됩니다. 생체 내에서 팔보시클립은 CYP3A의 시간 의존적 억제제입니다.
7.1 팔보시클립 혈장 농도를 증가시킬 수 있는 약물
CYP3A 억제제의 효과
강력한 CYP3A 억제제(이트라코나졸)를 병용 투여하면 건강한 피험자에서 팔보시클립의 혈장 노출량이 87% 증가했습니다. 강력한 CYP3A 억제제(예: 클라리스로마이신, 인디나비르, 이트라코나졸, 케토코나졸, 로피나비르/리토나비르, 네파조돈, 넬피나비르, 포사코나졸, 리토나비르, 사퀴나비르, 텔라프레비르, 텔리쓰로마이신 및 보리코나졸)의 병용 투여를 피하십시오. IBRANCE 치료 중 자몽 또는 자몽 주스를 섭취하지 마십시오. 만약 IBRANCE와 강력한 CYP3A 억제제의 병용 투여를 피할 수 없다면, IBRANCE의 용량을 줄이십시오 [용법 및 용량 (2.2) 및 임상 약리학 (12.3) 참조].
7.2 팔보시클립 혈장 농도를 감소시킬 수 있는 약물
CYP3A 유도제의 효과
강력한 CYP3A 유도제(리팜핀)를 병용 투여하면 건강한 피험자에서 팔보시클립의 혈장 노출량이 85% 감소했습니다. 강력한 CYP3A 유도제(예: 페니토인, 리팜핀, 카르바마제핀, 엔잘루타마이드 및 세인트 존스 워트)의 병용 투여를 피하십시오 [임상 약리학 (12.3) 참조].
7.3 팔보시클립에 의해 혈장 농도가 변할 수 있는 약물
건강한 피험자에서 IBRANCE를 여러 번 투여하면서 미다졸람을 병용 투여했을 때 미다졸람 단독 투여와 비교하여 미다졸람 혈장 노출량이 61% 증가했습니다. IBRANCE가 노출을 증가시킬 수 있으므로, 치료 지수가 좁은 민감한 CYP3A 기질(예: 알펜타닐, 시클로스포린, 디히드로에르고타민, 에르고타민, 에베롤리무스, 펜타닐, 피모지드, 키니딘, 시롤리무스 및 타크로리무스)의 용량을 줄여야 할 수 있습니다 [임상 약리학 (12.3) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과 및 작용 기전을 바탕으로, IBRANCE는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [임상 약리학 (12.1) 참조]. 약물 관련 위험을 알려주는 임산부에 대한 자료는 없습니다. 동물 생식 연구에서, 기관 형성 중 임신한 랫트와 토끼에게 palbociclib를 투여한 결과, AUC 기준 모체 노출량이 사람의 임상 노출량의 4배 이상인 경우 배아-태아 독성이 나타났습니다 [자료 참조]. 임산부에게 태아에 대한 잠재적 위험을 알려주십시오.
해당 모집단에서 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인지된 임신의 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%~4% 및 15%~20%입니다.
자료
동물 자료
암컷 랫트의 생식능 및 초기 배아 발달 연구에서, palbociclib는 교배 전 15일부터 임신 7일까지 경구 투여되었으며, 모체 전신 노출량이 권장 용량에서 사람의 노출량(AUC)의 약 4배인 300 mg/kg/day까지의 용량에서는 배아 독성을 유발하지 않았습니다.
랫트와 토끼의 배아-태아 발달 연구에서, 임신한 동물은 기관 형성 기간 동안 각각 최대 300 mg/kg/day 및 20 mg/kg/day의 palbociclib 경구 용량을 투여받았습니다. 300 mg/kg/day의 모체 독성 용량은 랫트에서 태아 독성을 유발하여 태아 체중 감소를 초래했습니다. 랫트에서 100 mg/kg/day 이상의 용량에서는 골격 변이(제7 경추에 늑골이 존재하는 빈도 증가)의 발생률이 증가했습니다. 토끼에서 20 mg/kg/day의 모체 독성 용량에서는 전지의 작은 지골을 포함한 골격 변이의 발생률이 증가했습니다. 랫트의 300 mg/kg/day와 토끼의 20 mg/kg/day에서 모체 전신 노출량은 권장 용량에서 사람의 노출량(AUC)의 약 4배 및 9배였습니다.
CDK4/6 이중 녹아웃 마우스는 심각한 빈혈로 인해 태아 발달 후기(임신 14.5일부터 출산까지)에 사망하는 것으로 보고되었습니다. 그러나 표적 억제 정도의 차이로 인해 녹아웃 마우스 데이터는 사람에게 미치는 영향을 예측하는 데 적합하지 않을 수 있습니다.
8.3 생식 잠재력이 있는 여성 및 남성
임신 검사
동물 연구에 따르면, IBRANCE는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 모집단에서의 사용 (8.1) 참조]. 생식 잠재력이 있는 여성은 IBRANCE 치료를 시작하기 전에 임신 검사를 받아야 합니다.
피임
여성
IBRANCE는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 모집단에서의 사용 (8.1) 참조]. 생식 잠재력이 있는 여성에게 IBRANCE 치료 중 및 마지막 투여 후 최소 3주 동안 효과적인 피임법을 사용하도록 권고하십시오.
남성
유전 독성 가능성으로 인해, 생식 잠재력이 있는 여성 파트너가 있는 남성 환자에게 IBRANCE 치료 중 및 마지막 투여 후 3개월 동안 효과적인 피임법을 사용하도록 권고하십시오 [비임상 독성학 (13.1) 참조].
8.4 소아 사용
소아 환자에 대한 IBRANCE의 안전성 및 유효성은 연구되지 않았습니다.
미성숙 랫트를 대상으로 한 27주 반복 투여 독성 연구에서 췌장(췌도 세포 공포화), 눈(백내장, 수정체 변성), 신장(세뇨관 공포화, 만성 진행성 신병증) 및 지방 조직(위축) 변화와 관련된 알테드 포도당 대사(당뇨병, 고혈당증, 인슐린 감소)가 확인되었으며, 이는 경구 팔보시클립 투여량 ≥30 mg/kg/일(권장 용량에서 성인의 노출량[AUC]의 약 11배)에서 수컷에서 가장 흔하게 나타났습니다. 이러한 결과 중 일부(당뇨병/고혈당증, 췌장 췌도 세포 공포화 및 신장 세뇨관 공포화)는 미성숙 랫트를 대상으로 한 15주 반복 투여 독성 연구에서 발생률과 중증도가 낮게 나타났습니다. 연구 시작 시 성숙한 랫트를 대상으로 한 27주 반복 투여 독성 연구와 최대 39주 동안 반복 투여 독성 연구를 실시한 개에서는 알테드 포도당 대사 또는 췌장, 눈, 신장 및 지방 조직의 관련 변화가 확인되지 않았습니다.
알테드 포도당 대사와 무관하게 랫트의 치아에서 독성이 관찰되었습니다. 27주 동안 100mg/kg의 팔보시클립을 투여(권장 용량에서 성인의 노출량[AUC]의 약 15배)하면 자라는 절치의 이상(변색, 법랑모세포 변성/괴사, 단핵구 침윤)이 발생했습니다. 소아 환자에게 우려되는 기타 독성은 어린 동물에서 평가되지 않았습니다.
8.5 노인 사용
PALOMA-2에서 IBRANCE를 투여받은 444명의 환자 중 181명(41%)이 65세 이상이었고, 48명(11%)이 75세 이상이었습니다. PALOMA-3에서 IBRANCE를 투여받은 347명의 환자 중 86명(25%)이 65세 이상이었고, 27명(8%)이 75세 이상이었습니다. 이러한 환자와 젊은 환자 간에 IBRANCE의 안전성 또는 효과에 전반적인 차이가 관찰되지 않았습니다.
8.6 간 손상
경도 또는 중등도 간 손상(Child-Pugh A 및 B등급) 환자의 경우 용량 조절이 필요하지 않습니다. 중증 간 손상(Child-Pugh C등급) 환자의 경우 IBRANCE 권장 용량은 21일 연속 1일 1회 75mg이며, 이후 7일간 치료를 중단하여 28일의 완전한 사이클을 구성합니다 [용법 및 용량(2.2) 참조]. 다양한 정도의 간 기능을 가진 피험자를 대상으로 한 약동학 시험에 따르면, 경도 간 손상(Child-Pugh A등급) 피험자의 경우 팔보시클립 결합되지 않은 노출량(결합되지 않은 AUCINF)이 17% 감소했고, 중등도(Child-Pugh B등급) 및 중증(Child-Pugh C등급) 간 손상 피험자의 경우 정상 간 기능을 가진 피험자에 비해 각각 34% 및 77% 증가했습니다. 최고 팔보시클립 결합되지 않은 노출량(결합되지 않은 Cmax)은 정상 간 기능을 가진 피험자에 비해 경도, 중등도 및 중증 간 손상의 경우 각각 7%, 38% 및 72% 증가했습니다 [임상 약리학(12.3) 참조].
간 손상과 관련된 용량 수정에 대한 아로마타제 억제제 또는 풀베스트란트에 대한 전체 처방 정보를 검토하십시오.
8.7 신장 손상
경도, 중등도 또는 중증 신장 손상(CrCl >15 mL/min) 환자의 경우 용량 조절이 필요하지 않습니다. 다양한 정도의 신장 기능을 가진 피험자를 대상으로 한 약동학 시험에 따르면, 정상 신장 기능을 가진 피험자에 비해 경도(60 mL/min ≤ CrCl <90 mL/min), 중등도(30 mL/min ≤ CrCl <60 mL/min) 및 중증(CrCl <30 mL/min) 신장 손상의 경우 총 팔보시클립 노출량(AUCINF)이 각각 39%, 42% 및 31% 증가했습니다. 최고 팔보시클립 노출량(Cmax)은 정상 신장 기능을 가진 피험자에 비해 경도, 중등도 및 중증 신장 손상의 경우 각각 17%, 12% 및 15% 증가했습니다. 팔보시클립의 약동학은 혈액 투석이 필요한 환자에서 연구되지 않았습니다 [임상 약리학(12.3) 참조].
10 과다 복용
IBRANCE의 해독제는 알려져 있지 않습니다. IBRANCE 과다 복용의 치료는 일반적인 지지 요법으로 구성되어야 합니다.
11 설명
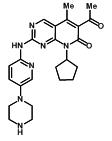
경구 투여용 IBRANCE 캡슐에는 125mg, 100mg 또는 75mg의 palbociclib(키나아제 억제제)이 함유되어 있습니다. Palbociclib의 분자식은 C24H29N7O2입니다. 분자량은 447.54달톤입니다. 화학명은 6-acetyl-8-cyclopentyl-5-methyl-2-{[5-(piperazin-1-yl)pyridin-2-yl]amino}pyrido[2,3-d]pyrimidin-7(8H)-one이며, 구조식은 다음과 같습니다.
Palbociclib는 노란색에서 주황색을 띠는 분말이며, pKa는 7.4(2차 피페라진 질소) 및 3.9(피리딘 질소)입니다. pH 4 이하에서 palbociclib는 높은 용해도를 가진 화합물처럼 작용합니다. pH 4 이상에서는 약물 물질의 용해도가 크게 감소합니다.
비활성 성분: 미결정 셀룰로오스, 락토오스 1수화물, 전분 글리콜산 나트륨, 콜로이드성 이산화규소, 스테아르산마그네슘 및 경질 젤라틴 캡슐 껍질. 밝은 주황색, 밝은 주황색/카라멜색 및 카라멜색 불투명 캡슐 껍질에는 젤라틴, 적색 산화철, 황색 산화철 및 이산화티타늄이 함유되어 있습니다. 인쇄 잉크에는 셸락, 이산화티타늄, 수산화암모늄, 프로필렌 글리콜 및 시메티콘이 함유되어 있습니다.
12 약물동력학
12.1 작용 기전
팔보시클립은 사이클린 의존성 키나아제(CDK) 4 및 6의 억제제입니다. 사이클린 D1 및 CDK4/6은 세포 증식으로 이어지는 신호 전달 경로의 하류에 있습니다. 시험관 내에서 팔보시클립은 세포 주기의 G1기에서 S기로의 진행을 차단함으로써 에스트로겐 수용체(ER) 양성 유방암 세포주에서 세포 증식을 감소시켰습니다. 팔보시클립과 항에스트로겐의 병용으로 유방암 세포주를 처리하면 레티노블라스토마(Rb) 단백질 인산화가 감소하여 E2F 발현 및 신호 전달이 감소하고 각 약물 단독으로 처리한 경우에 비해 성장 정지가 증가합니다. 시험관 내에서 팔보시클립과 항에스트로겐의 병용으로 ER 양성 유방암 세포주를 처리하면 각 약물 단독으로 처리한 경우에 비해 세포 노화가 증가했으며, 이는 팔보시클립 제거 후 최대 6일 동안 지속되었고 항에스트로겐 치료를 계속하면 더 컸습니다. 환자 유래 ER 양성 유방암 이종이식 모델을 사용한 생체 내 연구에서 팔보시클립과 레트로졸의 병용은 각 약물 단독으로 처리한 경우에 비해 Rb 인산화, 하류 신호 전달 및 종양 성장의 억제를 증가시켰습니다.
항에스트로겐의 존재 또는 부재 하에 시험관 내에서 팔보시클립으로 처리된 인간 골수 단핵구 세포는 노화되지 않았으며 팔보시클립 제거 후 증식을 재개했습니다.
12.3 약동학
진행성 유방암을 포함한 고형 종양 환자와 건강한 피험자에서 팔보시클립의 약동학(PK)을 특징으로 했습니다.
흡수
팔보시클립의 평균 최대 관찰 농도(Cmax)는 일반적으로 경구 투여 후 6~12시간(최대 농도에 도달하는 시간, Tmax) 사이에 관찰됩니다. 125mg 경구 용량 투여 후 IBRANCE의 평균 절대 생체 이용률은 46%입니다. 25mg~225mg의 용량 범위에서 AUC와 Cmax는 일반적으로 용량에 비례하여 증가했습니다. 반복적인 1일 1회 투여 후 8일 이내에 정상 상태에 도달했습니다. 반복적인 1일 1회 투여 시 팔보시클립은 중앙값 축적 비율 2.4(범위 1.5~4.2)로 축적되었습니다.
식품 효과: 공복 상태에서 약 13%의 인구에서 팔보시클립의 흡수와 노출이 매우 낮았습니다. 식사는 이 소수 인구에서 팔보시클립 노출을 증가시켰지만, 나머지 인구에서 팔보시클립 노출을 임상적으로 관련 있는 정도로 변경하지 않았습니다. 따라서 식사는 팔보시클립 노출의 개인 간 변동성을 감소시켰으며, 이는 음식과 함께 IBRANCE를 투여하는 것을 뒷받침합니다. 야간 공복 상태에서 투여된 IBRANCE와 비교하여 고지방, 고칼로리 음식(단백질, 탄수화물 및 지방에서 각각 약 150, 250 및 500~600칼로리로 약 800~1000칼로리)과 함께 투여했을 때 팔보시클립의 0부터 무한대까지의 농도-시간 곡선 아래 면적(AUCINF)과 Cmax는 각각 21%와 38% 증가했고, 저지방, 저칼로리 음식(단백질, 탄수화물 및 지방에서 각각 약 120, 250 및 28~35칼로리로 약 400~500칼로리)과 함께 투여했을 때 각각 12%와 27% 증가했으며, 중간 지방, 표준 칼로리 음식(단백질, 탄수화물 및 지방에서 각각 75~105, 250~350 및 175~245칼로리로 약 500~700칼로리)을 IBRANCE 투여 1시간 전과 2시간 후에 투여했을 때 각각 13%와 24% 증가했습니다.
분포
시험관 내에서 인간 혈장 단백질에 대한 팔보시클립의 결합은 약 85%였으며, 500ng/mL~5000ng/mL의 농도 범위에서 농도 의존성이 없었습니다. 생체 내 인간 혈장에서 팔보시클립의 평균 결합되지 않은 분율(fu)은 간 기능 악화와 함께 점진적으로 증가했습니다. 생체 내 인간 혈장에서 평균 팔보시클립 fu는 신장 기능 악화와 명확한 경향이 없었습니다. 기하 평균 명백 분포 용적(Vz/F)은 2583L이고 변동 계수(CV)는 26%였습니다.
대사
시험관 내 및 생체 내 연구 결과, 팔보시클립은 사람에게서 간 대사를 거치는 것으로 나타났습니다. 사람에게 [14C]팔보시클립 125mg 단회 경구 투여 후, 팔보시클립의 주요 대사 경로는 산화 및 설폰화였으며, 아실화 및 글루쿠론화는 부차적인 경로에 기여했습니다. 팔보시클립은 혈장 내 주요 순환 약물 유래 물질이었으며 (23%), 주요 순환 대사체는 팔보시클립의 글루쿠론산 접합체였지만, 배설물에서 투여 용량의 1.5%만을 차지했습니다. 팔보시클립은 광범위하게 대사되었으며, 변과 소변에서 각각 방사능의 2.3%와 6.9%가 변화되지 않은 약물이었습니다. 변에서는 팔보시클립의 설팜산 접합체가 주요 약물 관련 성분이었으며, 투여 용량의 26%를 차지했습니다. 사람 간세포, 간 세포질 및 S9 분획, 재조합 SULT 효소를 이용한 시험관 내 연구 결과, CYP3A 및 SULT2A1이 팔보시클립 대사에 주로 관여하는 것으로 나타났습니다.
Elimination
진행성 유방암 환자에서 팔보시클립의 기하 평균 겉보기 경구 청소율 (CL/F)은 63.1 L/hr (CV 29%)이었으며, 평균 (± 표준 편차) 혈장 제거 반감기는 29 (±5)시간이었습니다. 건강한 성인 남성 6명에게 [14C]팔보시클립을 단회 경구 투여한 경우, 총 투여 방사능량의 중앙값 91.6%가 15일 이내에 회수되었으며, 주요 배설 경로는 변 (투여량의 74.1%)이었고, 투여량의 17.5%가 소변에서 회수되었습니다. 대부분의 물질은 대사체로 배설되었습니다.
연령, 성별 및 체중
암 환자 183명 (남성 50명, 여성 133명, 연령 22~89세, 체중 37.9~123kg)을 대상으로 한 집단 약동학 분석 결과, 성별은 팔보시클립 노출에 영향을 미치지 않았으며, 연령 및 체중은 팔보시클립 노출에 임상적으로 중요한 영향을 미치지 않았습니다.
간 손상
다양한 정도의 간 손상이 있는 피험자를 대상으로 한 약동학 시험의 자료에 따르면, 경도 간 손상 (Child-Pugh A등급) 피험자의 경우 팔보시클립 결합되지 않은 AUCINF가 정상 간 기능을 가진 피험자에 비해 17% 감소했으며, 중등도 (Child-Pugh B등급) 및 중증 (Child-Pugh C등급) 간 손상 피험자의 경우 각각 34% 및 77% 증가했습니다. 팔보시클립 결합되지 않은 Cmax는 경도, 중등도 및 중증 간 손상의 경우 정상 간 기능을 가진 피험자에 비해 각각 7%, 38% 및 72% 증가했습니다. 또한, 183명의 환자 (국립 암 연구소 (NCI) 분류에 따른 경도 간 손상 환자 40명 포함, 총 빌리루빈 ≤ ULN 및 AST > ULN 또는 총 빌리루빈 >1.0~1.5 × ULN 및 임의의 AST)를 포함한 집단 약동학 분석 결과, 경도 간 손상은 팔보시클립 노출에 영향을 미치지 않았으며, 이는 전용 간 손상 연구 결과를 뒷받침합니다.
신장 손상
다양한 정도의 신장 손상이 있는 피험자를 대상으로 한 약동학 시험의 자료에 따르면, 경도 (60 mL/min ≤ CrCl < 90 mL/min), 중등도 (30 mL/min ≤ CrCl <60 mL/min) 및 중증 (CrCl <30 mL/min) 신장 손상의 경우 팔보시클립 AUCINF가 정상 신장 기능을 가진 피험자에 비해 각각 39%, 42% 및 31% 증가했습니다. 팔보시클립 최고 농도 (Cmax)는 경도, 중등도 및 중증 신장 손상의 경우 정상 신장 기능을 가진 피험자에 비해 각각 17%, 12% 및 15% 증가했습니다. 또한, 경도 신장 손상 환자 73명 및 중등도 신장 손상 환자 29명을 포함한 183명의 환자를 대상으로 한 집단 약동학 분석 결과, 경도 및 중등도 신장 손상은 팔보시클립 노출에 영향을 미치지 않았습니다. 팔보시클립의 약동학은 혈액 투석이 필요한 환자에서 연구되지 않았습니다.
약물 상호작용
시험관 내 자료에 따르면 CYP3A 및 SULT 효소 SULT2A1이 팔보시클립 대사에 주로 관여하는 것으로 나타났습니다. 팔보시클립은 사람에게 125mg을 매일 투여하여 정상 상태에 도달한 후 CYP3A의 약한 시간 의존적 억제제입니다. 시험관 내에서 팔보시클립은 임상적으로 관련성 있는 농도에서 CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19 및 2D6의 억제제가 아니며, CYP1A2, 2B6, 2C8 및 3A4의 유도제도 아닙니다.
CYP3A 억제제: 건강한 피험자 (N=12)를 대상으로 한 약물 상호작용 시험의 자료에 따르면, 이트라코나졸 200mg을 매일 다회 투여하면서 IBRANCE 125mg을 단회 투여한 경우, 팔보시클립 AUCINF 및 Cmax가 IBRANCE 125mg을 단독으로 투여한 경우에 비해 각각 약 87% 및 34% 증가했습니다 [약물 상호작용 (7.1) 참조].
CYP3A 유도제: 건강한 피험자(N=15)를 대상으로 한 약물 상호작용 시험의 자료에 따르면, 강력한 CYP3A 유도제인 리팜핀을 1일 600mg의 다회 용량으로 투여하면서 125mg의 IBRANCE 단회 용량을 병용 투여했을 때, 단독으로 125mg의 IBRANCE 용량을 투여했을 때에 비해 팔보시클립 AUCINF와 Cmax가 각각 85%와 70% 감소했습니다. 건강한 피험자(N=14)를 대상으로 한 약물 상호작용 시험의 자료에 따르면, 중등도 CYP3A 유도제인 모다피닐을 1일 400mg의 다회 용량으로 투여하면서 125mg의 IBRANCE 단회 용량을 병용 투여했을 때, 단독으로 125mg의 IBRANCE 용량을 투여했을 때에 비해 팔보시클립 AUCINF와 Cmax가 각각 32%와 11% 감소했습니다 [약물 상호작용 (7.2) 참조].
CYP3A 기질: 팔보시클립은 인체에서 125mg을 1일 1회 정상 상태에 도달할 때까지 투여하면 CYP3A의 약한 시간 의존적 억제제입니다. 건강한 피험자(N=26)를 대상으로 한 약물 상호작용 시험에서, IBRANCE의 다회 용량과 미다졸람을 병용 투여했을 때, 미다졸람 단독 투여에 비해 미다졸람 AUCINF와 Cmax 값이 각각 61%와 37% 증가했습니다 [약물 상호작용 (7.3) 참조].
위산도 증가 약물: 건강한 피험자를 대상으로 한 약물 상호작용 시험에서, 섭취 상태에서 125mg의 IBRANCE 단회 용량과 다회 용량의 프로톤 펌프 억제제(PPI)인 라베프라졸을 병용 투여했을 때, 단독으로 IBRANCE를 단회 투여했을 때와 비교하여 팔보시클립 Cmax가 41% 감소했지만, AUCINF에는 제한적인 영향(13% 감소)만 미쳤습니다. H2 수용체 길항제와 국소 제산제는 PPI에 비해 위산도에 대한 영향이 감소하므로, 이러한 종류의 산 감소제가 섭취 상태에서 팔보시클립 노출에 미치는 영향은 최소한일 것으로 예상됩니다. 섭취 상태에서는 PPI, H2 수용체 길항제 또는 국소 제산제가 팔보시클립 노출에 임상적으로 관련된 영향을 미치지 않습니다. 또 다른 건강한 피험자 연구에서, 공복 상태에서 1회 용량의 IBRANCE와 다회 용량의 PPI 라베프라졸을 병용 투여했을 때, 단독으로 IBRANCE를 단회 투여했을 때와 비교하여 팔보시클립 AUCINF와 Cmax가 각각 62%와 80% 감소했습니다.
아나스트로졸 또는 엑세메스탄: 아나스트로졸 또는 엑세메스탄과 팔보시클립 간의 약물 상호작용을 평가할 수 있는 임상 자료는 없습니다. 아나스트로졸, 엑세메스탄 및 팔보시클립의 대사 경로 또는 수송체 시스템에 대한 영향 분석을 바탕으로 아나스트로졸 또는 엑세메스탄과 팔보시클립 간의 임상적으로 유의미한 약물 상호작용은 예상되지 않습니다.
13 비임상 독성학
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
Palbociclib의 발암성은 6개월 유전자변형 마우스 연구와 2년 랫트 연구에서 평가되었습니다. 2년 동안 palbociclib을 경구 투여한 결과 30 mg/kg/day 용량(AUC 기준 사람 임상 노출량의 약 8배)에서 수컷 랫트의 중추 신경계에서 미세아교세포 종양 발생률이 증가했습니다. 최대 200 mg/kg/day 용량(AUC 기준 사람 임상 노출량의 약 5배)까지 암컷 랫트에서는 종양 소견이 없었습니다. 6개월 동안 수컷 및 암컷 rasH2 유전자변형 마우스에 palbociclib을 최대 60 mg/kg/day 용량까지 경구 투여한 결과 종양 발생률이 증가하지 않았습니다.
Palbociclib은 in vitro에서 중국 햄스터 난소 세포에서 이수성을 나타냈으며, 3주 동안 100 mg/kg/day 이상의 용량에서 수컷 랫트의 골수에서 이수성을 나타냈습니다. Palbociclib은 in vitro 박테리아 역돌연변이(Ames) 분석에서 돌연변이 유발성을 나타내지 않았으며, in vitro 사람 림프구 염색체 이상 분석에서 염색체이상 유발성을 나타내지 않았습니다.
암컷 랫트의 생식력 연구에서 palbociclib은 최대 300 mg/kg/day(AUC 기준 사람 임상 노출량의 약 4배)까지 어떤 용량에서도 교미 또는 생식력에 영향을 미치지 않았으며, 랫트에서 최대 300 mg/kg/day, 개에서 최대 3 mg/kg/day까지 반복 투여 독성 연구에서 암컷 생식 조직에 대한 부작용이 관찰되지 않았습니다(권장 용량에서 각각 사람 노출량[AUC]의 약 6배 및 유사).
수컷 생식 기능 및 생식력에 대한 palbociclib의 부작용은 랫트 및 개의 반복 투여 독성 연구와 수컷 랫트의 생식력 연구에서 관찰되었습니다. 반복 투여 독성 연구에서 랫트에서 30 mg/kg/day 이상, 개에서 0.2 mg/kg/day 이상에서 palbociclib 관련 고환, 부고환, 전립선 및 정낭 소견에는 장기 무게 감 giảm소, 위축 또는 변성, 정자감소증, 세관 내 세포 잔해 및 분비 감소가 포함되었습니다. 수컷 생식기 영향의 부분적인 회복은 각각 4주 및 12주 동안 투여하지 않은 기간 후 랫트와 개에서 관찰되었습니다. 랫트와 개에서 이러한 용량은 권장 용량에서 사람의 노출량[AUC]의 각각 약 10배 이상 및 0.1배에 해당했습니다. 수컷 랫트의 생식력 및 초기 배아 발달 연구에서 palbociclib은 교미에 영향을 미치지 않았지만, 권장 용량에서 사람의 노출량의 20배에 해당하는 예상 노출 수준[AUC]에서 100 mg/kg/day에서 정자 운동성 및 밀도 감소와 관련하여 생식력이 약간 감소했습니다.
14 CLINICAL STUDIES
PALOMA-2: IBRANCE + 레트로졸
초기 내분비 기반 요법을 받는 ER 양성, HER2 음성 진행성 또는 전이성 유방암 환자
PALOMA-2는 이전에 진행성 질환에 대한 전신 치료를 받지 않은 폐경 후 여성의 ER 양성, HER2 음성 진행성 유방암 환자를 대상으로 IBRANCE + 레트로졸 대 위약 + 레트로졸을 비교한 국제적, 무작위 배정, 이중 눈가림, 병행군, 다기관 연구였습니다. 총 666명의 환자가 IBRANCE + 레트로졸 또는 위약 + 레트로졸에 2:1로 무작위 배정되었습니다. 무작위 배정은 질병 부위(내장 대 비내장), 무병 기간(de novo 전이 대 보조 요법 종료 후 질병 재발까지 ≤12개월 대 보조 요법 종료 후 질병 재발까지 >12개월), 이전 (신)보조 항암 요법의 특성(이전 호르몬 요법 대 이전 호르몬 요법 없음)으로 계층화되었습니다. IBRANCE는 21일 연속 125mg의 용량으로 경구 투여되었으며, 이후 7일 동안 치료를 중단했습니다. 환자는 객관적인 질병 진행, 증상 악화, 허용할 수 없는 독성, 사망 또는 동의 철회 중 어느 것이 먼저 발생할 때까지 연구 치료를 받았습니다. 연구의 주요 효능 결과는 고형 종양 반응 평가 기준 버전 1.1(RECIST)에 따라 평가된 연구자 평가 무진행 생존(PFS)이었습니다. 추가 효능 결과 측정은 RECIST 버전 1.1에 따라 연구자가 평가한 확증된 전체 반응률(ORR) 및 전체 생존(OS)이었습니다.
이 연구에 등록된 환자의 평균 연령은 62세(범위 28~89세)였습니다. 대다수의 환자는 백인(78%)이었고, 대부분의 환자는 ECOG(Eastern Cooperative Oncology Group) 수행 상태(PS)가 0 또는 1(98%)이었습니다. 48%의 환자는 진행성 유방암 진단 전에 신보조 또는 보조 요법으로 화학 요법을 받았고 56%는 항호르몬 요법을 받았습니다. 37%의 환자는 신보조 또는 보조 요법으로 이전 전신 요법을 받지 않았습니다. 대다수의 환자(97%)는 전이성 질환이 있었습니다. 23%의 환자는 뼈에만 질병이 있었고 49%의 환자는 내장 질환이 있었습니다.
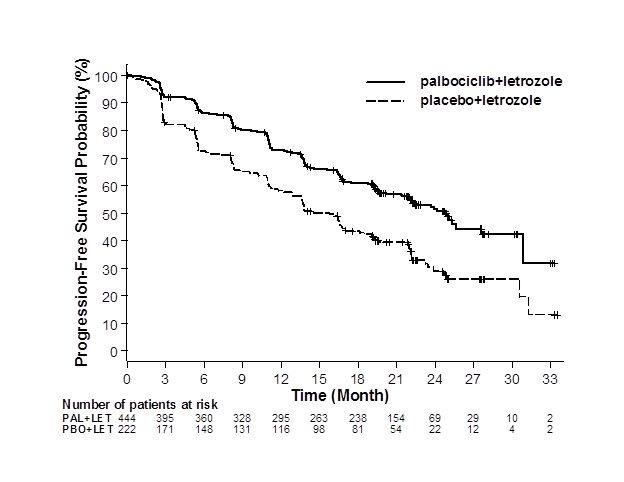
PALOMA-2의 주요 효능 결과는 표 8과 그림 1에 요약되어 있습니다. 무병 기간(DFI), 질병 부위 및 이전 요법의 환자 하위 그룹에서 일관된 결과가 관찰되었습니다. PFS에 대한 병용 요법의 치료 효과는 방사선 사진의 독립적인 검토에 의해서도 뒷받침되었습니다. 435건의 사건 이후에 수행된 사전 지정된 최종 OS 분석에 따르면 OS는 통계적으로 유의하지 않았습니다.
| IBRANCE + 레트로졸 | 위약 + 레트로졸 | |
|---|---|---|
| CI=신뢰 구간; ITT=치료 의도; N=환자 수; NE=추정 불가; OS=전체 생존; PFS=무진행 생존. | ||
|
ITT에 대한 무진행 생존(연구자 평가) |
N=444 |
N=222 |
|
PFS 사건 수 (%) |
194 (43.7) |
137 (61.7) |
|
중앙값 무진행 생존(개월, 95% CI) |
24.8 (22.1, NE) |
14.5 (12.9, 17.1) |
|
위험 비(95% CI) 및 p-값 |
||
|
측정 가능한 질병이 있는 환자의 객관적 반응(연구자 평가) |
N=338 |
N=171 |
|
객관적 반응률‡ (%, 95% CI) |
55.3 (49.9, 60.7) |
44.4 (36.9, 52.2) |
|
전체 ITT 전체 생존율 |
N=444 |
N=222 |
|
OS 발생 건수 (%) |
287 (64.6) |
148 (66.7) |
|
중앙값 OS (개월, 95% CI) |
53.8 (49.8, 59.2) |
49.8 (42.3, 56.4) |
|
위험 비율 (95% CI) 및 p-값 |
||
PALOMA-3: IBRANCE + 풀베스트란트
이전 보조 또는 전이 내분비 요법 중 또는 이후에 질병이 진행된 HR 양성, HER2 음성 진행성 또는 전이성 유방암 환자
PALOMA-3는 이전 내분비 요법 중 또는 이후에 질병이 진행된 폐경 상태와 관계없이 HR 양성, HER2 음성 진행성 유방암 여성을 대상으로 IBRANCE + 풀베스트란트 대 위약 + 풀베스트란트를 비교한 국제적, 무작위 배정, 이중 맹검, 병렬 그룹, 다기관 연구였습니다. 총 521명의 폐경 전/후 여성이 IBRANCE + 풀베스트란트 또는 위약 + 풀베스트란트에 2:1로 무작위 배정되었으며 이전 호르몬 요법에 대한 문서화된 민감성, 연구 참여 시 폐경 상태(폐경 전/주변기 대 폐경 후) 및 내장 전이의 존재 여부에 따라 계층화되었습니다. IBRANCE는 125mg의 용량으로 21일 연속 경구 투여 후 7일 동안 치료를 중단했습니다. 폐경 전/주변기 여성은 PALOMA-3 이전 및 PALOMA-3 기간 동안 최소 4주 동안 LHRH 작용제인 고세렐린을 투여받았습니다. 환자들은 객관적인 질병 진행, 증상 악화, 허용할 수 없는 독성, 사망 또는 동의 철회 중 어느 것이든 먼저 발생할 때까지 배정된 치료를 계속 받았습니다. 연구의 주요 효능 결과는 RECIST 1.1에 따라 평가된 연구자 평가 PFS였습니다.
이 연구에 등록된 환자의 평균 연령은 57세(범위 29~88세)였습니다. 연구 대상 환자의 대다수는 백인(74%)이었고, 모든 환자의 ECOG PS는 0 또는 1이었으며, 80%는 폐경 후였습니다. 모든 환자는 이전에 전신 요법을 받았으며, 75%의 환자는 이전에 화학 요법을 받았습니다. 25%의 환자는 전이성 질환 환경에서 이전 요법을 받지 않았고, 60%는 내장 전이가 있었고, 23%는 뼈에만 질환이 있었습니다.
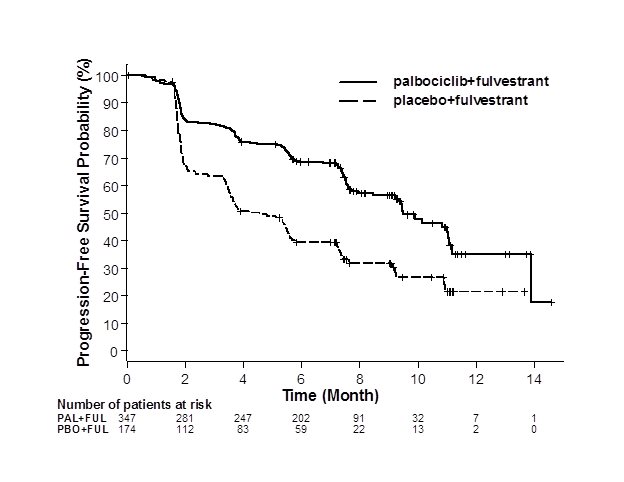
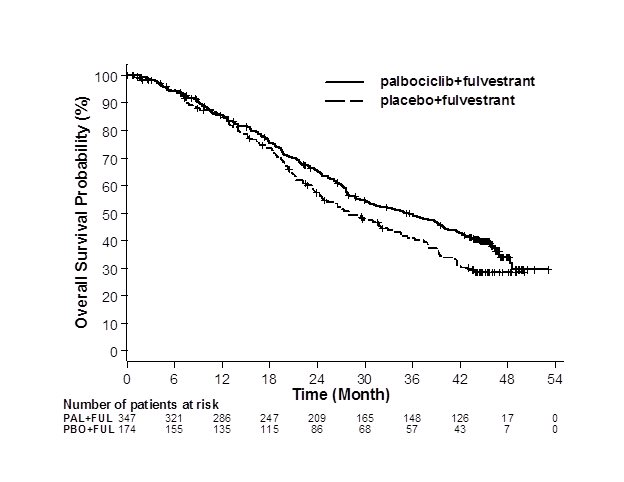
PALOMA-3의 연구자 평가 PFS 및 최종 OS 결과는 표 9에 요약되어 있습니다. 관련 Kaplan-Meier 플롯은 각각 그림 2와 3에 나와 있습니다. 질병 부위, 이전 호르몬 요법에 대한 민감성 및 폐경 상태의 환자 하위 그룹에서 일관된 PFS 결과가 관찰되었습니다. 45개월의 중앙값 추적 기간 후 최종 OS 결과는 통계적으로 유의하지 않았습니다.
| IBRANCE + 풀베스트란트 | 위약 + 풀베스트란트 | |
|---|---|---|
| CI=신뢰 구간; ITT=치료 의도; N=환자 수; OS=전체 생존; PFS=무진행 생존. | ||
|
ITT에 대한 무진행 생존 |
N=347 |
N=174 |
|
PFS 이벤트 수 (%) |
145 (41.8) |
114 (65.5) |
|
중앙값 PFS(개월, 95% CI) |
9.5 (9.2, 11.0) |
4.6 (3.5, 5.6) |
|
위험 비율(95% CI) 및 p-값 |
0.461 (0.360, 0.591), p<0.0001 |
|
|
측정 가능한 질병이 있는 환자의 객관적 반응 |
N=267 |
N=138 |
|
객관적 반응률* (%, 95% CI) |
24.6 (19.6, 30.2) |
10.9 (6.2, 17.3) |
|
ITT에 대한 전체 생존 |
N=347 |
N=174 |
|
OS 이벤트 수 (%) |
201 (57.9) |
109 (62.6) |
|
중앙값 OS (개월, 95% CI) |
34.9 (28.8, 40.0) |
28.0 (23.6, 34.6) |
|
위험 비 (95% CI) 및 p-값 |
||
16 제공/보관 및 취급 방법
IBRANCE는 다음과 같은 용량 및 포장 형태로 공급됩니다:
| IBRANCE 캡슐 | |||
|---|---|---|---|
| 포장 형태 | 캡슐 용량 (mg) | NDC | 캡슐 설명 |
|
21캡슐 병 |
125 |
NDC 0069-0189-21 |
불투명한 경질 젤라틴 캡슐, 0호 크기, 카라멜색 캡과 바디, 흰색 잉크로 캡에는 “Pfizer”, 바디에는 “PBC 125″라고 인쇄되어 있음 |
|
21캡슐 병 |
100 |
NDC 0069-0188-21 |
불투명한 경질 젤라틴 캡슐, 1호 크기, 카라멜색 캡과 연한 주황색 바디, 흰색 잉크로 캡에는 “Pfizer”, 바디에는 “PBC 100″라고 인쇄되어 있음 |
|
21캡슐 병 |
75 |
NDC 0069-0187-21 |
불투명한 경질 젤라틴 캡슐, 2호 크기, 연한 주황색 캡과 바디, 흰색 잉크로 캡에는 “Pfizer”, 바디에는 “PBC 75″라고 인쇄되어 있음 |
20 °C ~ 25 °C (68 °F ~ 77 °F)에 보관하십시오. 15 °C ~ 30 °C (59 °F ~ 86 °F)의 일시적인 온도 변화는 허용됩니다 [see USP Controlled Room Temperature].
17 환자 상담 정보
FDA 승인 환자용 설명서(Patient Information)를 읽도록 환자에게 알려주십시오.
골수억제/감염
- •
- 발열, 오한, 현기증, 호흡곤란, 쇠약 또는 출혈 및/또는 멍이 드는 경향이 증가하는 등 골수억제 또는 감염의 징후나 증상이 나타나면 즉시 보고하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.1) 참조].
약물 상호작용
- •
- 자몽은 IBRANCE와 상호작용할 수 있습니다. 환자는 IBRANCE 치료 중에 자몽 제품을 섭취해서는 안 됩니다.
- •
- 강력한 CYP3A 저해제 및 강력한 CYP3A 유도제를 피하도록 환자에게 알려주십시오.
- •
- 처방약, 일반의약품, 비타민 및 한약재를 포함한 모든 병용 약물에 대해 의료 제공자에게 알리도록 환자에게 알려주십시오 [약물 상호작용 (7) 참조].
투여량 및 투여 방법
- •
- 음식과 함께 IBRANCE를 복용하도록 환자에게 알려주십시오.
- •
- 환자가 구토하거나 복용량을 놓친 경우 추가 복용량을 복용해서는 안 됩니다. 다음 처방된 복용량을 평소 시간에 복용해야 합니다. IBRANCE 캡슐은 통째로 삼켜야 합니다(삼키기 전에 씹거나, 부수거나, 열지 마십시오). 캡슐이 부러지거나, 금이 가거나, 그렇지 않으면 손상된 경우에는 섭취해서는 안 됩니다.
- •
- IBRANCE로 치료받는 월경 전/폐경 전 여성은 LHRH 작용제로도 치료받아야 합니다 [투여량 및 투여 방법 (2.1) 참조].
임신, 수유 및 불임
- •
- 배아-태아 독성
- o
- 생식 능력이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 IBRANCE 치료 중 및 마지막 복용 후 최소 3주 동안 효과적인 피임법을 사용하도록 알려주십시오. 알려진 또는 의심되는 임신에 대해 의료 제공자에게 알리도록 여성에게 알려주십시오 [경고 및 주의사항 (5.3) 및 특정 집단에서의 사용 (8.1)과 8.3) 참조].
- o
- 생식 능력이 있는 여성 파트너가 있는 남성 환자에게 IBRANCE 치료 중 및 마지막 복용 후 최소 3개월 동안 효과적인 피임법을 사용하도록 알려주십시오 [특정 집단에서의 사용 (8.3) 참조].
- •
- 수유: IBRANCE 치료 중 및 마지막 복용 후 3주 동안 모유 수유를 하지 않도록 여성에게 알려주십시오 [특정 집단에서의 사용 (8.2) 참조].
- •
- 불임: IBRANCE가 불임을 유발할 수 있으며 IBRANCE 복용 전에 정자 보존을 고려하도록 생식 능력이 있는 남성에게 알려주십시오 [특정 집단에서의 사용 (8.3) 참조].
SPL 미분류 섹션
이 제품의 라벨링이 업데이트되었을 수 있습니다. 전체 처방 정보는 www.pfizer.com을 방문하십시오. IBRANCE에 대한 의학 정보는 www.pfizermedinfo.com을 방문하거나 1-800-438-1985로 전화하십시오.
LAB-0723-11.0
환자 사용 설명서
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2024년 12월 | ||
|
환자 정보 |
||
|
IBRANCE는 다음과 같은 심각한 부작용을 유발할 수 있습니다. 백혈구 감소증(호중구 감소증). IBRANCE 복용 시 백혈구 감소증은 매우 흔하며, 사망에 이를 수 있는 심각한 감염을 유발할 수 있습니다. 의료 제공자는 치료 전후로 백혈구 수치를 확인해야 합니다. IBRANCE 치료 중 백혈구 수치가 감소하면 의료 제공자는 치료를 중단하거나, 용량을 줄이거나, 치료 주기를 시작하기 전에 기다리라고 할 수 있습니다. 발열 및 오한과 같은 백혈구 감소증 또는 감염의 징후와 증상이 나타나면 즉시 의료 제공자에게 알리십시오. 폐 문제(폐렴). IBRANCE는 치료 중 사망에 이를 수 있는 심각하거나 생명을 위협하는 폐 염증을 유발할 수 있습니다. 다음과 같은 새로운 증상이나 악화되는 증상이 나타나면 즉시 의료 제공자에게 알리십시오.
증상이 심각한 경우 의료 제공자는 IBRANCE 치료를 중단하거나 완전히 중지할 수 있습니다. 부작용에 대한 자세한 내용은 “IBRANCE의 가능한 부작용은 무엇입니까?“를 참조하십시오. |
||
|
IBRANCE는 무엇입니까? IBRANCE는 다음과 병용하여 다른 신체 부위로 전이된(전이성) 호르몬 수용체(HR) 양성, 인간 표피 성장 인자 수용체 2(HER2) 음성 유방암 성인 환자 치료에 사용되는 처방약입니다.
IBRANCE가 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
||
|
IBRANCE 복용 전에 의료 제공자에게 무엇을 알려야 합니까? IBRANCE를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약 및 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. IBRANCE 및 기타 약물은 서로 영향을 미쳐 부작용을 일으킬 수 있습니다. 복용하는 약을 알고 있어야 합니다. 새로운 약을 받을 때 의료 제공자나 약사에게 보여줄 수 있도록 목록을 작성해 두십시오. |
||
|
IBRANCE는 어떻게 복용해야 합니까?
|
||
|
IBRANCE는 심각한 부작용을 유발할 수 있습니다. “IBRANCE에 대해 가장 중요한 정보는 무엇입니까?“를 참조하십시오. 가장 흔한 부작용 letrozole 또는 fulvestrant와 함께 사용되는 IBRANCE의 경우 다음과 같습니다.
|
- o
- 어지러움
- o
- 호흡곤란
- o
- 무력감
- o
- 출혈 또는 멍이 잘 생김
- o
- 코피
- •
- 감염 ( “IBRANCE에 대해 가장 중요한 정보는 무엇입니까?” 참조)
- •
- 피로감
- •
- 메스꺼움
- •
- 입 안이 아픔
- •
- 간 기능 수치 이상
- •
- 설사
- •
- 탈모 또는 머리카락 숱 감소
- •
- 구토
- •
- 발진
- •
- 식욕부진
IBRANCE는 남성의 생식능력에 문제를 일으킬 수 있습니다. 이는 자녀를 갖는 능력에 영향을 미칠 수 있습니다. 이것이 우려되는 경우 IBRANCE 복용을 시작하기 전에 가족 계획 옵션에 대해 의료 제공자와 상담하십시오.
귀찮거나 사라지지 않는 부작용이 있는 경우 의료 제공자에게 알리십시오.
이것들은 IBRANCE의 모든 가능한 부작용이 아닙니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088.
IBRANCE는 어떻게 보관해야 합니까?
- •
- IBRANCE는 20°C~25°C(68°F~77°F)에서 보관하십시오.
IBRANCE 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
IBRANCE의 안전하고 효과적인 사용에 대한 일반 정보
의약품은 때때로 환자 정보 설명서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 IBRANCE를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 IBRANCE를 제공하지 마십시오. 해를 끼칠 수 있습니다.
약사 또는 의료 제공자에게 의료 전문가를 위해 작성된 IBRANCE에 대한 자세한 정보를 문의할 수 있습니다.
IBRANCE의 성분은 무엇입니까?
활성 성분: palbociclib
비활성 성분: 미결정 셀룰로오스, 유당 일수화물, 나트륨 전분 글리콜레이트, 콜로이드성 이산화규소, 마그네슘 스테아레이트 및 경질 젤라틴 캡슐 껍질.
연한 주황색, 연한 주황색/카라멜색 및 카라멜색 불투명 캡슐 껍질에는 젤라틴, 적색 산화철, 황색 산화철 및 이산화티타늄이 포함되어 있습니다.
인쇄 잉크에는 셸락, 이산화티타늄, 수산화암모늄, 프로필렌글리콜 및 시메티콘이 포함되어 있습니다.
이 제품의 라벨이 업데이트되었을 수 있습니다. 최신 처방 정보는 www.pfizer.com을 방문하십시오.
LAB-0724-8.0
자세한 내용은 www.pfizer.com을 방문하거나 1-800-438-1985로 전화하십시오.
주표시면 – 75mg 캡슐 병 라벨
NDC 0069-0187-21
Pfizer
Ibrance®
(palbociclib)
capsules
75 mg
21 Capsules
Rx only
주요 표시 패널 – 100mg 캡슐 병 라벨
NDC 0069-0188-21
Pfizer
Ibrance®
(palbociclib)
capsules
100 mg
21 Capsules
Rx only
주요 표시면 – 125mg 캡슐 병 라벨
NDC 0069-0189-21
Pfizer
Ibrance®
(palbociclib)
캡슐
125 mg
21 캡슐
Rx only