의약품 제조업체: Merck Sharp & Dohme LLC (Updated: 2024-09-05)
처방 정보의 주요 내용
GARDASIL®9
(인유두종 바이러스 9가 백신, 재조합)
근육 내 주사용 현탁액
미국 최초 승인: 2014
적응증 및 사용
GARDASIL 9는 다음 질병 예방을 위해 9세에서 45세 사이의 여성 및 소녀에게 사용되는 백신입니다.
- 인유두종 바이러스(HPV) 16, 18, 31, 33, 45, 52 및 58형에 의한 자궁경부, 외음부, 질, 항문, 인두 및 기타 두경부암. (1.1)
- HPV 6 및 11형에 의한 생식기 사마귀(콘딜로마 아큐미나타). (1.1)
그리고 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58형에 의한 다음과 같은 전암성 또는 이형성 병변:
- 2/3등급 자궁경부 상피내 종양(CIN) 및 자궁경부 선암 in situ (AIS). (1.1)
- 1등급 자궁경부 상피내 종양(CIN). (1.1)
- 2등급 및 3등급 외음부 상피내 종양(VIN). (1.1)
- 2등급 및 3등급 질 상피내 종양(VaIN). (1.1)
- 1, 2 및 3등급 항문 상피내 종양(AIN). (1.1)
GARDASIL 9는 다음 질병 예방을 위해 9세에서 45세 사이의 남성 및 소년에게 사용되는 백신입니다.
- HPV 16, 18, 31, 33, 45, 52 및 58형에 의한 항문, 인두 및 기타 두경부암. (1.2)
- HPV 6 및 11형에 의한 생식기 사마귀(콘딜로마 아큐미나타). (1.2)
그리고 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58형에 의한 다음과 같은 전암성 또는 이형성 병변:
- 1, 2 및 3등급 항문 상피내 종양(AIN). (1.2)
인두 및 두경부암 적응증은 HPV 관련 생식기 질환 예방 효과를 기반으로 한 가속 승인에 따라 승인되었습니다. 본 적응증에 대한 지속적인 승인은 확증 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다(1).
사용 및 효과의 제한:
- GARDASIL 9 접종은 백신 접종자에게 의료 제공자가 권장하는 자궁경부, 외음부, 질, 항문, 인두 및 기타 두경부암 검사를 받을 필요성을 없애지 않습니다. (1.3, 17)
- GARDASIL 9는 다음에 의해 발생하는 질병에 대한 보호 효과가 있는 것으로 입증되지 않았습니다.
- 백신에 포함되지 않은 HPV 유형
- 성적 활동을 통해 이전에 노출된 HPV 유형. (1.3)
- 모든 외음부, 질, 항문, 인두 및 기타 두경부암이 HPV에 의해 발생하는 것은 아니며, GARDASIL 9는 HPV 16, 18, 31, 33, 45, 52 및 58에 의해 발생하는 외음부, 질, 항문, 인두 및 기타 두경부암만 예방합니다. (1.3)
- GARDASIL 9는 외생식기 병변, 자궁경부, 외음부, 질, 항문, 인두 및 기타 두경부암, CIN, VIN, VaIN 또는 AIN의 치료제가 아닙니다. (1.3)
- GARDASIL 9 접종은 모든 백신 접종자에게 보호 효과를 제공하지 않을 수 있습니다. (1.3)
투여량 및 투여 방법
근육 내 투여만 가능합니다. (2)
GARDASIL 9의 각 용량은 0.5mL입니다.
GARDASIL 9는 다음과 같이 투여하십시오. (2.1)
| 연령 | 요법 | 일정 |
|---|---|---|
| 9세에서 14세 | 2회 용량 | 0, 6개월에서 12개월* |
| 3회 용량 | 0, 2, 6개월 | |
| 15세에서 45세 | 3회 용량 | 0, 2, 6개월 |
WARNINGS AND PRECAUTIONS
접종자는 때때로 부상을 입히는 낙상으로 이어지는 실신을 경험할 수 있으므로 투여 후 15분 동안 관찰하는 것이 좋습니다. HPV 백신 접종 후 실신, 때때로 강직-간대성 경련 및 기타 발작과 유사한 활동과 관련하여 보고되었습니다. 실신이 강직-간대성 경련과 관련된 경우, 활동은 일반적으로 일시적이며, 일반적으로 앙와위 또는 트렌델렌부르크 자세를 유지하여 뇌 관류를 회복시키면 반응합니다. (5.1)
ADVERSE REACTIONS
보고된 가장 흔한(≥10%) 국소 및 전신 부작용:
- 16세에서 26세 사이의 소녀 및 여성: 주사 부위 통증(89.9%), 주사 부위 부종(40.0%), 주사 부위 발적(34.0%) 및 두통(14.6%). (6.1)
- 9세에서 15세 사이의 소녀: 주사 부위 통증(89.3%), 주사 부위 부종(47.8%), 주사 부위 발적(34.1%) 및 두통(11.4%). (6.1)
- 27세에서 45세 사이의 여성: 주사 부위 통증(82.8%), 주사 부위 부종(23.3%), 주사 부위 발적(16.9%) 및 두통(13.6%) (6.1)
- 16세에서 26세 사이의 소년 및 남성: 주사 부위 통증(63.4%), 주사 부위 부종(20.2%) 및 주사 부위 발적(20.7%). (6.1)
- 9세에서 15세 사이의 소년: 주사 부위 통증(71.5%), 주사 부위 부종(26.9%) 및 주사 부위 발적(24.9%). (6.1)
의심되는 부작용을 보고하려면 Merck Sharp & Dohme LLC에 1-877-888-4231 또는 VAERS에 1-800-822-7967 또는 www.vaers.hhs.gov 로 연락하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정됨: 2024년 3월
목차
전문 정보: 목차*
1 적응증 및 사용법
1.1 여성 및 소녀
1.2 남성 및 소년
1.3 사용 및 효능의 제한
2 투여량 및 투여 방법
2.1 투여량
2.2 투여 방법
2.3 GARDASIL®로 이전에 백신 접종을 받은 개인에게 GARDASIL 9 투여
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 실신
5.2 알레르기 반응 관리
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 전신 면역 억제제와의 병용
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 면역 저하 개인
11 설명
12 임상 약리학
12.1 작용 기전
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 GARDASIL에 대한 효능 및 효과 데이터
14.2 GARDASIL 9에 대한 임상 시험
14.3 16세에서 26세 사이의 여성 및 소녀에서 HPV 유형 31, 33, 45, 52 및 58에 대한 효능
14.4 GARDASIL 9로 백신 접종을 받은 개인에 대한 장기 추적
14.5 HPV 관련 인두 및 기타 두경부암 예방 효과
14.6 3회 투여 요법의 면역원성
14.7 9세에서 14세 사이의 개인에서 2회 투여 요법을 사용한 GARDASIL 9에 대한 면역 반응
14.8 Menactra 및 Adacel과의 연구
15 참고 문헌
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1 여성
GARDASIL®9는 9~45세 여성에서 다음 질병 예방을 위해 접종하는 백신입니다.
- Human Papillomavirus (HPV) 유형 16, 18, 31, 33, 45, 52, 58번으로 인한 자궁경부암, 외음부암, 질암, 항문암, 구인두암 및 기타 두경부암
- HPV 유형 6번과 11번으로 인한 생식기 사마귀(첨형 콘딜롬)
그리고 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52, 58번으로 인한 다음의 전암성 또는 이형성 병변:
- 자궁경부 상피내 종양(CIN) 2/3등급 및 자궁경부 상피내선암 in situ (AIS)
- 자궁경부 상피내 종양(CIN) 1등급
- 외음부 상피내 종양(VIN) 2등급 및 3등급
- 질 상피내 종양(VaIN) 2등급 및 3등급
- 항문 상피내 종양(AIN) 1, 2, 3등급
1.2 남성
GARDASIL 9는 9~45세 남성에서 다음 질병 예방을 위해 접종하는 백신입니다.
- HPV 유형 16, 18, 31, 33, 45, 52, 58번으로 인한 항문암, 구인두암 및 기타 두경부암
- HPV 유형 6번과 11번으로 인한 생식기 사마귀(첨형 콘딜롬)
그리고 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52, 58번으로 인한 다음의 전암성 또는 이형성 병변:
- 항문 상피내 종양(AIN) 1, 2, 3등급
구인두암 및 두경부암 적응증은 HPV 관련 항문생식기 질환 예방 효과를 근거로 신속 승인 절차에 따라 승인되었습니다. [임상 연구(14.5) 참조]. 이 적응증에 대한 지속적인 승인은 확증 임상시험에서 임상적 유익이 검증되고 설명되는지 여부에 따라 달라질 수 있습니다.
1.3 사용 및 효과의 제한
- GARDASIL 9를 접종받더라도 의료 서비스 제공자가 권장하는 자궁경부암, 외음부암, 질암, 항문암, 구인두암 및 기타 두경부암 검진을 받을 필요성이 없어지는 것은 아닙니다.
- GARDASIL 9는 다음으로 인한 질병에 대한 예방 효과가 입증되지 않았습니다.
- 백신에 포함되지 않은 HPV 유형 [설명(11) 참조],
- 이전에 성적 접촉을 통해 노출된 적이 있는 HPV 유형.
- 모든 외음부암, 질암, 항문암, 구인두암 및 기타 두경부암이 HPV로 인해 발생하는 것은 아니며, GARDASIL 9는 HPV 16, 18, 31, 33, 45, 52, 58번으로 인한 외음부암, 질암, 항문암, 구인두암 및 기타 두경부암만 예방합니다.
- GARDASIL 9는 외부 생식기 병변, 자궁경부암, 외음부암, 질암, 항문암, 구인두암 및 기타 두경부암, CIN, VIN, VaIN, AIN의 치료제가 아닙니다.
- GARDASIL 9를 접종받더라도 모든 접종자에게서 예방 효과가 나타나는 것은 아닙니다.
2 투여 및 관리
근육 내 주사만 가능
2.1 용량
GARDASIL 9의 각 용량은 0.5mL입니다.
GARDASIL 9는 다음과 같이 투여하십시오.
| 연령 | 요법 | 일정 |
|---|---|---|
|
||
| 9세에서 14세 | 2회 용량 | 0, 6개월에서 12개월* |
| 3회 용량 | 0, 2, 6개월 | |
| 15세에서 45세 | 3회 용량 | 0, 2, 6개월 |
2.2 투여 방법
- GARDASIL 9를 다른 백신과 희석하거나 혼합하지 마십시오.
- 백신 현탁액을 유지하기 위해 사용 직전에 잘 흔들어 주십시오.
- 용액과 용기가 허용하는 경우, 비경구 제제는 투여 전에 이물질과 변색 여부를 시각적으로 검사해야 합니다. 이물질이 있거나 변색된 경우 제품을 사용하지 마십시오. 충분히 흔든 후 GARDASIL 9는 흰색 탁한 액체입니다.
- 삼각근 또는 대퇴 전외측에 근육 내로 투여하십시오.
- 투여 후 15분 동안 환자를 관찰하십시오. [경고 및 주의 사항 (5) 참조].
2.3 GARDASIL®로 이전에 백신 접종을 받은 개인에게 GARDASIL 9 투여
GARDASIL 9로 3회 용량 백신 접종을 완료하고 이전에 GARDASIL로 3회 용량 백신 접종을 완료한 개인에서 안전성과 면역원성을 평가했습니다. [부작용 (6.1) 및 임상 연구 (14.6) 참조]. GARDASIL 9에 대한 상호 교환성을 평가하기 위해 HPV 백신의 혼합 요법을 사용한 연구는 수행되지 않았습니다.
3 제형 및 함량
GARDASIL 9는 0.5mL 단회용 바이알 및 미리 채워진 주사기에 제공되는 근육 내 주사용 현탁액입니다. [성분 목록은 설명 (11)]을 참조하십시오.
4 금기사항
효모(백신 성분)에 대한 심각한 알레르기 반응 또는 GARDASIL 9 또는 GARDASIL의 이전 투여 후 과민증을 포함하여 [설명 (11) 참조].
5 경고 및 주의사항
5.1 Syncope
백신 접종 후 실신이 발생할 수 있으며, 때로는 넘어져 부상을 입을 수 있으므로 접종 후 15분 동안 관찰하는 것이 좋습니다. HPV 백신 접종 후 실신이 보고되었으며, 때로는 강직-간대 경련과 같은 발작 증상과 관련이 있습니다. 강직-간대 경련과 관련된 실신의 경우, 활동은 일반적으로 일시적이며, 앙와위 또는 트렌델렌부르크 자세를 유지하여 뇌혈류를 회복시키면 일반적으로 호전됩니다.
6 부작용
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 백신의 임상 시험에서 관찰된 유해 반응 발생률은 다른 백신의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
GARDASIL 9의 안전성은 GARDASIL 9를 최소 1회 투여 받고 안전성 추적 관찰을 받은 15,703명의 개인을 포함한 7건의 임상 연구에서 평가되었습니다. 연구 1과 연구 3에는 대조군으로 GARDASIL을 최소 1회 투여 받고 안전성 추적 관찰을 받은 7,378명의 개인도 포함되었습니다. 백신은 등록 당일에 투여되었으며, 그 후 투여는 약 2개월과 6개월 후에 이루어졌습니다. 안전성은 GARDASIL 9 또는 GARDASIL의 각 주사 후 14일 동안 백신 보고 카드(VRC)를 이용한 감시를 통해 평가되었습니다.
VRC를 이용한 감시를 통해 모니터링된 개인은 GARDASIL 9를 투여 받은 등록 당시 16세에서 26세 사이의 여성 9,097명, 16세에서 26세 사이의 남성 1,394명, 그리고 9세에서 15세 사이의 여아와 남아 5,212명(여아 3,436명, 남아 1,776명)과 GARDASIL을 투여 받은 등록 당시 16세에서 26세 사이의 여성 7,078명과 9세에서 15세 사이의 여아 300명을 포함했습니다. GARDASIL 9에 대한 통합 안전성 모집단의 인종 분포는 16세에서 26세 사이의 여성(백인 56.8%, 기타 인종 또는 다인종 25.2%, 아시아계 14.1%, 흑인 3.9%), 9세에서 15세 사이의 여아와 남아(백인 62.0%, 기타 인종 또는 다인종 19.2%, 아시아계 13.5%, 흑인 5.4%), 그리고 16세에서 26세 사이의 남성(백인 62.1%, 기타 인종 또는 다인종 22.6%, 아시아계 9.8%, 흑인 5.5%) 사이에서 유사했습니다. GARDASIL 9의 안전성은 GARDASIL 군의 전반적인 인종 분포(백인 57.0%, 기타 인종 또는 다인종 26.3%, 아시아계 13.6%, 흑인 3.2%)가 GARDASIL 9 군과 유사한 두 연구(연구 1과 연구 3)에서 GARDASIL의 안전성과 직접 비교되었습니다.
27세에서 45세 사이의 여성에서 GARDASIL 9의 안전성은 27세에서 45세 사이의 여성 640명과 16세에서 26세 사이의 여성 570명을 비교한 임상 시험에서 평가되었습니다. 인종 분포는 27세에서 45세 사이의 여성(백인 97.7%, 아시아계 1.6%, 기타 또는 다인종 0.3%, 흑인 0.5%)과 16세에서 26세 사이의 여성(백인 94.6%, 아시아계 3.0%, 기타 또는 다인종 1.6%, 흑인 0.9%) 사이에서 유사했습니다.
27세에서 45세 사이의 남성에서 GARDASIL 9의 안전성은 9세에서 26세 사이의 남아와 남성과 9세에서 45세 사이의 여아와 여성에서 GARDASIL 9의 안전성 데이터와 9세에서 45세 사이의 개인에서 GARDASIL의 안전성 데이터를 통해 추론됩니다.
주사 부위 및 전신 유해 반응
주사 부위 반응(통증, 부기, 발적)과 구강 온도는 임상 연구 중 GARDASIL 9의 각 주사 후 5일 동안 VRC를 이용한 감시를 통해 조사되었습니다. 연구 1(16세에서 26세 사이의 여성)과 연구 3(9세에서 15세 사이의 여아)에서 GARDASIL 9의 각 투여 후 5일 이내에 발생한 이러한 조사된 유해 반응의 발생률과 심각도는 GARDASIL과 비교하여 표 1에 제시되어 있습니다. GARDASIL 9를 투여 받은 피험자 중 주사 부위 통증의 발생률은 3개의 보고 기간 동안 대략 동일했습니다. 주사 부위 부기와 주사 부위 발적의 발생률은 GARDASIL 9의 각 연속 투여 후 증가했습니다. GARDASIL 9를 투여 받은 사람은 GARDASIL을 투여 받은 사람에 비해 주사 부위 반응의 발생률이 수치적으로 높았습니다.
| GARDASIL 9 | GARDASIL | |||||||
|---|---|---|---|---|---|---|---|---|
| 1차 투여 후 | 2차 투여 후 | 3차 투여 후 | 모든 투여 후 | 1차 투여 후 | 2차 투여 후 | 3차 투여 후 | 모든 투여 후 | |
| 16세에서 26세 사이의 여성에 대한 데이터는 연구 1(NCT00543543)에서 가져왔으며, 9세에서 15세 사이의 여아에 대한 데이터는 연구 3(NCT01304498)에서 가져왔습니다. | ||||||||
| N=안전성 추적 관찰을 받은 백신 접종 피험자 수 | ||||||||
| n=온도 데이터가 있는 피험자 수 | ||||||||
| 통증, 모든=경증, 중등도, 중증 또는 강도 불명 | ||||||||
| 통증, 중증=작업이나 일상 활동을 할 수 없을 정도로 심각한 통증 | ||||||||
| 부기, 모든=모든 크기 또는 크기 불명 | ||||||||
| 부기, 중증=최대 크기가 2인치 이상 | ||||||||
| 발적, 모든=모든 크기 또는 크기 불명 | ||||||||
| 발적, 중증=최대 크기가 2인치 이상 | ||||||||
| 16세에서 26세 사이의 여성 | ||||||||
| 주사 부위 이상 반응 | N=7069 | N=6997 | N=6909 | N=7071 | N=7076 | N=6992 | N=6909 | N=7078 |
| 통증, 모든 | 70.7 | 73.5 | 71.6 | 89.9 | 58.2 | 62.2 | 62.6 | 83.5 |
| 통증, 심한 | 0.7 | 1.7 | 2.6 | 4.3 | 0.4 | 1.0 | 1.7 | 2.6 |
| 부기, 모든 | 12.5 | 23.3 | 28.3 | 40.0 | 9.3 | 14.6 | 18.7 | 28.8 |
| 부기, 심한 | 0.6 | 1.5 | 2.5 | 3.8 | 0.3 | 0.5 | 1.0 | 1.5 |
| 홍반, 모든 | 10.6 | 18.0 | 22.6 | 34.0 | 8.1 | 12.9 | 15.6 | 25.6 |
| 홍반, 심한 | 0.2 | 0.5 | 1.1 | 1.6 | 0.2 | 0.2 | 0.4 | 0.8 |
| 전신 이상 반응 | n=6995 | n=6913 | n=6743 | n=7022 | n=7003 | n=6914 | n=6725 | n=7024 |
| 체온 ≥100°F | 1.7 | 2.6 | 2.7 | 6.0 | 1.7 | 2.4 | 2.5 | 5.9 |
| 체온 ≥102°F | 0.3 | 0.3 | 0.4 | 1.0 | 0.2 | 0.3 | 0.3 | 0.8 |
| 9세에서 15세까지의 여자 | ||||||||
| 주사 부위 이상 반응 | N=300 | N=297 | N=296 | N=299 | N=299 | N=299 | N=294 | N=300 |
| 통증, 모든 | 71.7 | 71.0 | 74.3 | 89.3 | 66.2 | 66.2 | 69.4 | 88.3 |
| 통증, 심한 | 0.7 | 2.0 | 3.0 | 5.7 | 0.7 | 1.3 | 1.7 | 3.3 |
| Swelling, Any | 14.0 | 23.9 | 36.1 | 47.8 | 10.4 | 17.7 | 25.2 | 36.0 |
| Swelling, Severe | 0.3 | 2.4 | 3.7 | 6.0 | 0.7 | 2.7 | 4.1 | 6.3 |
| Erythema, Any | 7.0 | 15.5 | 21.3 | 34.1 | 9.7 | 14.4 | 18.4 | 29.3 |
| Erythema, Severe | 0 | 0.3 | 1.4 | 1.7 | 0 | 0.3 | 1.7 | 2.0 |
| Systemic Adverse Reactions | n=300 | n=294 | n=295 | n=299 | n=299 | n=297 | n=291 | n=300 |
| Temperature ≥100°F | 2.3 | 1.7 | 3.0 | 6.7 | 1.7 | 1.7 | 0 | 3.3 |
| Temperature ≥102°F | 0 | 0.3 | 1.0 | 1.3 | 0.3 | 0.3 | 0 | 0.7 |
GARDASIL 9 또는 GARDASIL을 접종받은 사람들 중 연구자에 의해 백신과 관련된 것으로 평가된, 자발적인 주사 부위 및 전신 이상 반응(Studies 1 및 3에서 1% 이상의 빈도로 관찰됨)은 표 2에 나와 있습니다. 백신(GARDASIL 9 = 0.1% 대 GARDASIL <0.1%)을 접종받은 후 이상 경험으로 인해 연구 참여를 중단한 사람은 거의 없었습니다.
| 16세에서 26세 사이의 여성 | 9세에서 15세 사이의 여성 | |||
|---|---|---|---|---|
| GARDASIL 9 N=7071 |
GARDASIL N=7078 |
GARDASIL 9 N=299 |
GARDASIL N=300 |
|
| 16세에서 26세 사이의 여성에 대한 데이터는 Study 1(NCT00543543)에서 가져온 것이며, 9세에서 15세 사이의 여성에 대한 데이터는 Study 3(NCT01304498)에서 가져온 것입니다. | ||||
| N=안전성 추적 관찰을 받은 대상자 수 | ||||
| 주사 부위 이상 반응 (접종 후 1일에서 5일, 모든 용량) | ||||
| 가려움증 | 5.5 | 4.0 | 4.0 | 2.7 |
| 멍 | 1.9 | 1.9 | 0 | 0 |
| 혈종 | 0.9 | 0.6 | 3.7 | 4.7 |
| 덩어리 | 1.3 | 0.6 | 0 | 0 |
| 출혈 | 1.0 | 0.7 | 1.0 | 2.0 |
| 경화 | 0.8 | 0.2 | 2.0 | 1.0 |
| 열감 | 0.8 | 0.5 | 0.7 | 1.7 |
| 반응 | 0.6 | 0.6 | 0.3 | 1.0 |
| 전신 이상 반응 (접종 후 1일에서 15일, 모든 용량) | ||||
| 두통 | 14.6 | 13.7 | 11.4 | 11.3 |
| 발열 | 5.0 | 4.3 | 5.0 | 2.7 |
| 메스꺼움 | 4.4 | 3.7 | 3.0 | 3.7 |
| 현기증 | 3.0 | 2.8 | 0.7 | 0.7 |
| 피로 | 2.3 | 2.1 | 0 | 2.7 |
| 설사 | 1.2 | 1.0 | 0.3 | 0 |
| 구강 인두 통증 | 1.0 | 0.6 | 2.7 | 0.7 |
| 근육통 | 1.0 | 0.7 | 0.7 | 0.7 |
| 상복부 통증 | 0.7 | 0.8 | 1.7 | 1.3 |
| 상기도 감염 | 0.1 | 0.1 | 0.3 | 1.0 |
639명의 남자 어린이와 1,878명의 여자 어린이(9~15세)를 대상으로 한 비대조군 임상 시험(연구 2)에서 GARDASIL 9의 각 용량 투여 후 유발된 유발 부작용의 발생률과 심각도는 남자 어린이와 여자 어린이 사이에 유사했습니다. 9~15세 남자 어린이의 유발 및 비유발 주사 부위 및 전신 부작용 발생률은 9~15세 여자 어린이의 발생률과 유사했습니다. 이 연구에서 남자 어린이에게 보고된 유발 및 비유발 부작용은 표 3에 나와 있습니다.
1,394명의 남자 어린이와 남자 성인 및 1,075명의 여자 어린이와 여자 성인(16~26세)을 대상으로 한 또 다른 비대조군 임상 시험(연구 7)에서 16~26세 여자 어린이와 여자 성인에게 GARDASIL 9의 각 용량 투여 후 유발 및 비유발 부작용 발생률은 연구 1에서 보고된 발생률과 유사했습니다. 이 연구에서 16~26세 남자 어린이와 남자 성인에게 보고된 유발 및 비유발 부작용 발생률은 표 3에 나와 있습니다.
640명의 27~45세 여성과 570명의 16~26세 여자 어린이와 여자 성인을 대상으로 한 비대조군 임상 시험(연구 9)에서 16~26세 여자 어린이와 여자 성인에게 GARDASIL 9의 각 용량 투여 후 유발 및 비유발 부작용 발생률은 연구 1에서 보고된 발생률과 유사했습니다. 이 연구에서 27~45세 여성에게 보고된 유발 및 비유발 부작용 발생률은 표 3에 나와 있습니다.
| GARDASIL 9 | |
|---|---|
| GARDASIL 9 9~15세 남자 어린이의 데이터는 연구 2(NCT00943722)에서 가져왔습니다. GARDASIL 9 16~26세 남자 어린이와 남자 성인의 데이터는 연구 7(NCT01651949)에서 가져왔습니다. 27~45세 여성의 데이터는 연구 9(NCT03158220)에서 가져왔습니다. | |
| N=안전성 추적 관찰을 받은 피험자 수 | |
| 통증, 모든 경우=경증, 중등증, 중증 또는 강도 불명 | |
| 통증, 중증=작업 또는 일상 활동을 할 수 없을 정도로 심한 통증 | |
| 부기, 모든 경우=모든 크기 또는 크기 불명 | |
| 부기, 중증=최대 크기가 2인치를 초과 | |
| 발적, 모든 경우=모든 크기 또는 크기 불명 | |
| 발적, 중증=최대 크기가 2인치를 초과 | |
| 16~26세 남자 어린이와 남자 성인 | N=1394 |
| 유발 부작용 (백신 접종 후 1~5일, 모든 용량) | |
| 주사 부위 통증, 모든 경우 | 63.4 |
| 주사 부위 통증, 중증 | 0.6 |
| 주사 부위 발적, 모든 경우 | 20.7 |
| 주사 부위 발적, 중증 | 0.4 |
| 주사 부위 부기, 모든 경우 | 20.2 |
| 주사 부위 부기, 중증 | 1.1 |
| 구강 온도 ≥100.0°F† | 4.4 |
| 구강 온도 ≥102°F | 0.6 |
| 비유발 주사 부위 부작용 (백신 접종 후 1~5일, 모든 용량) | |
| 주사 부위 과민 반응 | 1.0 |
| 주사 부위 가려움증 | 1.0 |
| 비유발 전신 부작용 (백신 접종 후 1~15일, 모든 용량) | |
| 두통 | 7.3 |
| 발열 | 2.4 |
| 피로 | 1.4 |
| 현기증 | 1.1 |
| 메스꺼움 | 1.0 |
| 9세에서 15세 사이의 남성 | N=639 |
| 요청된 부작용 (예방 접종 후 1-5일, 모든 용량) | |
| 주사 부위 통증, 모든 경우 | 71.5 |
| 주사 부위 통증, 심각한 경우 | 0.5 |
| 주사 부위 발적, 모든 경우 | 24.9 |
| 주사 부위 발적, 심각한 경우 | 1.9 |
| 주사 부위 부종, 모든 경우 | 26.9 |
| 주사 부위 부종, 심각한 경우 | 5.2 |
| 구강 온도 ≥100.0°F† | 10.4 |
| 구강 온도 ≥102°F | 1.4 |
| 요청되지 않은 주사 부위 부작용 (예방 접종 후 1-5일, 모든 용량) | |
| 주사 부위 혈종 | 1.3 |
| 주사 부위 경화 | 1.1 |
| 요청되지 않은 전신 부작용 (예방 접종 후 1-15일, 모든 용량) | |
| 두통 | 9.4 |
| 발열 | 8.9 |
| 메스꺼움 | 1.3 |
| 27세에서 45세 사이의 여성 | N=640 |
| 요청된 부작용 (예방 접종 후 1-5일, 모든 용량) | |
| 주사 부위 통증, 모든 경우 | 82.8 |
| 주사 부위 통증, 심각한 경우 | 1.9 |
| 주사 부위 발적, 모든 경우 | 16.9 |
| 주사 부위 발적, 심각한 경우 | 0.5 |
| 주사 부위 부종, 모든 경우 | 23.3 |
| 주사 부위 부종, 심각한 경우 | 1.9 |
| 구강 온도 ≥100.0°F† | 2.5 |
| 구강 온도 ≥102°F | 0.3 |
| 요청되지 않은 주사 부위 부작용 (예방 접종 후 1-5일, 모든 용량) | |
| 주사 부위 가려움증 | 1.6 |
| 주사 부위 혈종 | 1.3 |
| 요청되지 않은 전신 부작용 (예방 접종 후 1-15일, 모든 용량) | |
| 두통 | 13.6 |
| 피로 | 3.4 |
| 발열 | 1.7 |
| 메스꺼움 | 1.7 |
| 인후통 | 1.1 |
임상 연구에서의 심각한 이상 사례
GARDASIL 9에 대한 7개의 임상 연구에서 전체 연구 기간(마지막 투여 후 1개월에서 48개월) 동안 심각한 이상 사례를 수집했습니다. GARDASIL 9를 투여받고 안전성 추적 관찰을 받은 15,705명 중 354명이 심각한 이상 사례를 보고했으며, 이는 인구의 2.3%에 해당합니다. 비교를 위해 GARDASIL을 투여받고 안전성 추적 관찰을 받은 7,378명 중 185명이 심각한 이상 사례를 보고했으며, 이는 인구의 2.5%에 해당합니다. GARDASIL 9 투여자 4명은 각각 백신과 관련된 것으로 판명된 심각한 이상 사례를 1건 이상 보고했습니다. 백신과 관련된 심각한 이상 반응은 발열, 백신 알레르기, 천식 발작 및 두통이었습니다.
전체 연구 대상군에서의 사망
임상 연구에서 사망이 10건 발생했습니다(GARDASIL 9군과 GARDASIL군 각각 5건). 백신과 관련된 것으로 평가된 사례는 없었습니다. GARDASIL 9군의 사망 원인은 자동차 사고 1건, 자살 1건, 급성 림프구성 백혈병 1건, 저혈량 패혈성 쇼크 1건, GARDASIL 9 마지막 투여 후 678일 만에 발생한 원인 불명의 급사 1건이었습니다. GARDASIL 대조군의 사망 원인은 자동차 사고 1건, 비행기 추락 1건, 뇌출혈 1건, 총상 1건, 위 선암 1건이었습니다.
전신 자가 면역 질환
GARDASIL 9를 투여받은 모든 임상 시험에서 피험자들은 전신 자가 면역 질환을 나타낼 수 있는 새로운 의학적 상태에 대해 평가를 받았습니다. 총 2.2%(351/15,703)의 GARDASIL 9 투여자와 3.3%(240/7,378)의 GARDASIL 투여자가 전신 자가 면역 질환을 나타낼 수 있는 새로운 의학적 상태를 보고했으며, 이는 과거 임상 시험에서 GARDASIL, AAHS 대조군 또는 생리식염수 위약을 투여받은 후 보고된 비율과 유사했습니다.
GARDASIL을 이전에 접종받은 개인에 대한 GARDASIL 9의 임상 시험 경험
임상 연구(연구 4)는 이전에 GARDASIL 3회 접종을 받은 12세에서 26세 사이의 소녀와 여성에서 GARDASIL 9의 안전성을 평가했습니다. GARDASIL 마지막 접종과 GARDASIL 9 첫 번째 접종 사이의 시간 간격은 약 12개월에서 36개월이었습니다. 피험자들은 GARDASIL 9 또는 생리식염수 위약을 투여받았으며, 이러한 피험자에서 GARDASIL 9 또는 생리식염수 위약 각 접종 후 14일 동안 VRC 지원 감시를 사용하여 안전성을 평가했습니다. 모니터링된 피험자에는 GARDASIL 9를 투여받은 608명과 생리식염수 위약을 투여받은 305명이 포함되었습니다. GARDASIL 9를 투여받은 피험자 중 극소수(0.5%)만이 이상 반응으로 인해 연구를 중단했습니다. GARDASIL 9 투여자에서 1.0% 이상의 빈도로 관찰되었고 생리식염수 위약 투여자에서 관찰된 빈도보다 높은 빈도로 관찰된 백신과 관련된 이상 경험은 표 4에 나와 있습니다. 전반적으로 안전성 프로파일은 이전에 GARDASIL을 접종받은 GARDASIL 9 접종자와 HPV 백신을 처음 접종받은 사람 사이에서 유사했으며, 이전에 GARDASIL을 접종받은 사람에서 주사 부위 붓기와 발적 비율이 수치적으로 더 높았습니다(표 1과 4).
| GARDASIL 9 N=608 |
생리식염수 위약 N=305 |
|
|---|---|---|
| GARDASIL 9와 생리식염수 위약에 대한 데이터는 연구 4(NCT01047345)에서 가져왔습니다. | ||
| N=안전성 추적 관찰을 받은 피험자 수 | ||
| 요구된 이상 반응(접종 후 1-5일, 모든 용량) | ||
| 주사 부위 통증 | 90.3 | 38.0 |
| 주사 부위 발적 | 42.3 | 8.5 |
| 주사 부위 붓기 | 49.0 | 5.9 |
| 경구 온도 ≥100.0°F† | 6.5 | 3.0 |
| 요구되지 않은 주사 부위 이상 반응(접종 후 1-5일, 모든 용량) | ||
| 주사 부위 가려움증 | 7.7 | 1.3 |
| 주사 부위 혈종 | 4.8 | 2.3 |
| 주사 부위 반응 | 1.3 | 0.3 |
| 주사 부위 종괴 | 1.2 | 0.7 |
| 자발적 전신 이상 반응 (예방 접종 후 1-15일, 모든 용량) | ||
| 두통 | 19.6 | 18.0 |
| 발열 | 5.1 | 1.6 |
| 메스꺼움 | 3.9 | 2.0 |
| 현기증 | 3.0 | 1.6 |
| 상복부 통증 | 1.5 | 0.7 |
| 독감 | 1.2 | 1.0 |
Menactra 및 Adacel과의 병용 사용 시 안전성
연구 5에서, GARDASIL 9를 Menactra [수막구균 (A, C, Y 및 W-135 군) 다당류 디프테리아 독소 접합 백신] 및 Adacel [파상풍 독소, 감소된 디프테리아 독소 및 무세포 백일해 백신 흡착 (Tdap)]과 병용 투여했을 때의 안전성을 평균 연령 12.2세인 남아 (n = 620) 및 여아 (n = 621)를 대상으로 한 무작위 연구에서 평가했습니다 [임상 연구 (14.8) 참조].
예방 접종을 받은 1,237명의 남아 및 여아 중 1,220명이 주사 부위 이상 반응에 대한 안전성 추적 관찰을 받았습니다. 병용군과 비병용군 (GARDASIL 9 접종과 Menactra 및 Adacel 접종 사이에 1개월 간격을 둔 접종) 간 주사 부위 이상 반응 발생률은 유사했으며, 병용군에서 GARDASIL 9 주사 부위 붓기 발생률이 비병용군 (9.4%)에 비해 높게 나타났습니다 (14.4%). 주사 부위 붓기 이상 반응의 대부분은 경증에서 중등도로 보고되었습니다.
6.2 시판 후 경험
시판 후 이상 반응은 규모가 불확실한 모집단에서 자발적으로 보고되었으므로, 발생 빈도를 신뢰할 수 있게 추정하거나 백신 노출과의 인과 관계를 확립할 수 없습니다.
GARDASIL 9와 GARDASIL의 안전성 프로파일은 유사합니다. GARDASIL의 시판 후 안전성 경험은 백신이 유사하게 제조되고 동일한 4가지 HPV 유형의 동일한 L1 HPV 단백질을 함유하고 있으므로 GARDASIL 9와 관련이 있습니다.
GARDASIL 9
임상 연구에서 보고된 이상 반응 외에도, GARDASIL 9의 시판 후 사용 중 다음과 같은 이상 반응이 자발적으로 보고되었습니다.
위장관 장애: 구토
피부 및 피하 조직 장애: 두드러기
GARDASIL
또한, 다음과 같은 시판 후 이상 반응이 GARDASIL에 대해 자발적으로 보고되었습니다.
혈액 및 림프계 장애: 자가 면역 용혈성 빈혈, 특발성 혈소판 감소성 자반증, 림프절병증.
호흡기, 흉곽 및 종격 장애: 폐색전증.
위장관 장애: 췌장염.
일반적인 장애 및 투여 부위 상태: 무력증, 오한, 사망, 불쾌감.
면역 체계 장애: 자가 면역 질환, 과민 반응 (아나필락시스/아나필락시스양 반응, 기관지 경련 포함).
근골격계 및 결합 조직 장애: 관절통, 근육통.
신경계 장애: 급성 산재성 뇌척수염, 길랭-바레 증후군, 운동 뉴런 질환, 마비, 발작, 횡단성 척수염.
감염 및 기생충 감염: 봉와직염.
혈관 장애: 심부 정맥 혈전증.
7 약물 상호작용
7.1 전신 면역억제제와의 병용
면역억제 요법(방사선 조사, 항대사 물질, 알킬화제, 세포독성 약물 및 코르티코스테로이드(생리적 용량보다 높은 용량으로 사용) 포함)은 백신에 대한 면역 반응을 감소시킬 수 있습니다 [특정 인구 집단에서의 사용 (8.6) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
모든 임신에는 기형, 유산 또는 기타 부작용의 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다. 임산부에 대한 GARDASIL 9의 적절하고 잘 통제된 연구는 없습니다. GARDASIL과 GARDASIL 9는 모두 동일한 공정을 사용하여 제조되고 구성이 겹치기 때문에 GARDASIL의 데이터가 GARDASIL 9와 관련이 있습니다. GARDASIL과 GARDASIL 9에 의도치 않게 노출된 여성과 관련된 알려진 결과가 있는 임신 55건과 62건에 대한 사전 허가 연구 데이터가 평가되었습니다. 임신 노출 레지스트리 데이터는 각각 GARDASIL과 GARDASIL 9로 예방 접종을 받은 알려진 임신 결과가 있는 1640명과 69명의 예방 접종을 받은 여성으로부터 얻을 수 있습니다. 사용 가능한 데이터는 GARDASIL 또는 GARDASIL 9를 접종받은 여성에서 주요 기형 및 유산의 위험 증가를 시사하지 않습니다.
한 발달 독성 연구에서 9가지 HPV 항원 유형 각각의 1~1.5배를 함유한 백신 제제 0.5mL를 교미 전과 임신 중에 암컷 랫트에 투여했습니다. 두 번째 연구에서 동물은 교미 전, 임신 중 및 수유 중에 GARDASIL 9의 단일 인간 용량(0.5mL)을 투여받았습니다. 이러한 동물 연구는 GARDASIL 9로 인한 태아에 대한 해가 없음을 보여주었습니다. [데이터 참조].
데이터
인간 데이터
GARDASIL 9의 사전 허가 임상 연구에서 여성은 GARDASIL 9 또는 대조 백신(GARDASIL)의 각 용량 투여 직전에 임신 검사를 받았습니다. 임신으로 판명된 피험자는 임신이 끝날 때까지 예방 접종을 연기하라는 지시를 받았습니다. 이러한 임신 선별 요법에도 불구하고 일부 피험자는 인간 융모성 생식선 자극 호르몬(HCG)이 검출되기 전에 임신 초기에 예방 접종을 받았습니다. GARDASIL 9 또는 GARDASIL로 예방 접종 전후 30일 이내에 시작된 임신에 대한 임신 결과를 평가하기 위해 분석을 수행했습니다. 이러한 임신 중 GARDASIL 9와 GARDASIL에 대해 알려진 결과가 있는 임신은 각각 62건과 55건(자궁 외 임신 및 선택적 중절 제외)이었으며, 각각 44건과 48건의 생존 출산이 포함되었습니다. GARDASIL 9 또는 GARDASIL을 접종받은 피험자에서 유산으로 이어진 임신 비율은 각각 27.4%(17/62)와 12.7%(7/55)였습니다. GARDASIL 9 또는 GARDASIL을 접종받은 피험자에서 주요 기형이 있는 생존 출산 비율은 각각 0%(0/44)와 2.1%(1/48)였습니다.
GARDASIL 9에 대한 6년 임신 레지스트리는 마지막 생리 시작일(LMP) 전 1개월 이내 또는 임신 중 언제든지 GARDASIL 9에 노출된 여성 185명을 등록했으며, 그중 180명은 예방 접종을 받았습니다. 선택적 중절(n=1), 자궁 외 임신(n=0) 및 추적 관찰에서 제외된 경우(n=110)를 제외하고 알려진 결과가 있는 임신은 69건(쌍둥이 임신 1건 포함)이었습니다. 69건의 임신 중 5건은 임신 중 두 번 노출된 여성에게서 발생했습니다. 따라서 임신 중 GARDASIL 9에 대한 노출은 74건이었습니다. LMP 전 30일 동안 3건, 1분기 동안 34건, 2분기 동안 13건, 3분기 동안 19건, 알 수 없는 분기 동안 5건이었습니다. 임신 결과에는 유산 3건(모두 1분기 동안 임신 노출)과 주요 기형 3건(LMP 전 30일 동안 임신 노출, 1분기, 2분기 각각 1건)이 포함되었습니다. 임신 중 두 번 노출된 여성은 유산이 0건이었고 주요 기형이 0건이었습니다. 이러한 데이터는 GARDASIL 9를 접종받은 여성에서 주요 기형 및 유산의 위험 증가를 시사하지 않습니다.
5년 임신 레지스트리는 LMP 전 1개월 이내 또는 임신 중 언제든지 GARDASIL에 노출된 여성 2,942명을 등록했으며, 그중 2,566명은 예방 접종을 받았습니다. 선택적 중절(n=107), 자궁 외 임신(n=5) 및 추적 관찰에서 제외된 경우(n=814)를 제외하고 알려진 결과가 있는 임신은 1,640건이었습니다. 유산 및 주요 기형 비율은 각각 임신의 6.8%(111/1,640)와 생존 출산 영아의 2.4%(37/1,527)였습니다. 예방 접종을 받은 인구에서 평가된 결과 비율은 추정 배경 비율과 일치했습니다.
GARDASIL의 시판 후 연구 2건(한 건은 미국에서, 다른 한 건은 북유럽 국가에서 수행됨)에서 임신 중 GARDASIL을 접종받은 피험자의 임신 결과를 회고적으로 평가했습니다. 미국 연구 데이터베이스에 포함된 1,740건의 임신 중 결과는 주요 기형 및 유산 비율을 평가할 수 있었습니다. 북유럽 연구 데이터베이스에 포함된 499건의 임신 중 결과는 주요 기형 비율을 평가할 수 있었습니다. 두 연구 모두에서 평가된 결과 비율은 임신 중 GARDASIL 투여와 관련된 위험 증가를 시사하지 않았습니다.
11 설명
GARDASIL 9, Human Papillomavirus 9-valent Vaccine, Recombinant는 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52 및 58의 주요 캡시드(L1) 단백질의 정제된 바이러스 유사 입자(VLP)에서 제조된 비감염성 재조합 9가 백신입니다. L1 단백질은 재조합 Saccharomyces cerevisiae를 사용하여 별도의 발효를 통해 생산되고 VLP로 자가 조립됩니다. 발효 과정에는 비타민, 아미노산, 무기염 및 탄수화물을 포함하는 화학적으로 정의된 발효 배지에서 S. cerevisiae를 성장시키는 과정이 포함됩니다. VLP는 세포 파괴에 의해 효모 세포에서 방출되고 일련의 화학적 및 물리적 방법에 의해 정제됩니다. 정제된 VLP는 미리 형성된 알루미늄 함유 아주반트(무정형 알루미늄 하이드록시포스페이트 설페이트 또는 AAHS)에 흡착됩니다. 9가 HPV VLP 백신은 각 HPV 유형의 흡착된 VLP와 추가량의 알루미늄 함유 아주반트 및 최종 정제 완충액을 혼합하여 제조된 무균 액체 현탁액입니다.
GARDASIL 9는 근육 주사용 무균 현탁액입니다. 각 0.5mL 용량에는 HPV 유형 6 L1 단백질 약 30mcg, HPV 유형 11 L1 단백질 40mcg, HPV 유형 16 L1 단백질 60mcg, HPV 유형 18 L1 단백질 40mcg, HPV 유형 31 L1 단백질 20mcg, HPV 유형 33 L1 단백질 20mcg, HPV 유형 45 L1 단백질 20mcg, HPV 유형 52 L1 단백질 20mcg 및 HPV 유형 58 L1 단백질 20mcg이 들어 있습니다.
백신 0.5mL 용량에는 또한 약 500mcg의 알루미늄(AAHS로 제공), 9.56mg의 염화나트륨, 0.78mg의 L-히스티딘, 50mcg의 폴리소르베이트 80, 35mcg의 붕산나트륨, <7mcg의 효모 단백질 및 주사용수가 들어 있습니다. 이 제품에는 방부제나 항생제가 들어 있지 않습니다.
충분히 흔든 후 GARDASIL 9는 흰색의 탁한 액체입니다.
12 임상약리학
12.1 작용 기전
HPV는 인간에게만 감염됩니다. 유사한 동물 유두종 바이러스를 사용한 동물 연구에 따르면 L1 VLP 백신의 효능은 체액성 면역 반응의 발달과 관련이 있을 수 있습니다. GARDASIL 9의 항문 생식기 질환에 대한 효능은 백신에 의해 유도된 체액성 면역 반응에 의해 매개되는 것으로 생각되지만, 정확한 보호 기전은 알려져 있지 않습니다.
13 비임상 독성학
14 임상 연구
이 연구에서, 세로양성은 특정 HPV 유형에 대한 항-HPV 역가가 사전에 지정된 세로 상태 기준 이상인 것으로 정의됩니다. 세로음성은 특정 HPV 유형에 대한 항-HPV 역가가 사전에 지정된 세로 상태 기준 미만인 것으로 정의됩니다. 세로 상태 기준은 경쟁 Luminex 면역 분석법(cLIA)의 이전 버전에 의해 HPV 감염의 임상적 가능성과 양성 또는 음성 상태로 분류된 혈청 샘플을 신뢰할 수 있게 구별하는 분석법의 하한 검출 한계보다 높은 항체 역가 수준입니다. 9가 백신 HPV 유형 각각에 대한 하한 검출 한계와 세로 상태 기준은 아래 표 5에 나와 있습니다. PCR 양성은 특정 HPV 유형에 대한 DNA가 검출된 것으로 정의됩니다. PCR 음성은 특정 HPV 유형에 대한 DNA가 검출되지 않은 것으로 정의됩니다. 다중 HPV PCR 분석법의 검출 한계는 9가 백신 HPV 유형에 걸쳐 테스트당 5~34개의 복제본이었습니다.
| HPV 유형 | cLIA 검출 한계(mMU*/mL) | cLIA 세로 상태 기준 (mMU*/mL) |
|---|---|---|
|
||
| HPV 6 | 16 | 30 |
| HPV 11 | 6 | 16 |
| HPV 16 | 12 | 20 |
| HPV 18 | 8 | 24 |
| HPV 31 | 4 | 10 |
| HPV 33 | 4 | 8 |
| HPV 45 | 3 | 8 |
| HPV 52 | 3 | 8 |
| HPV 58 | 4 | 8 |
14.1 GARDASIL에 대한 효능 및 유효성 데이터
GARDASIL의 효능 및 유효성은 GARDASIL 9와 관련이 있습니다. 두 백신은 유사하게 제조되고 동일한 HPV L1 VLP를 4개 포함하기 때문입니다.
16세에서 26세까지의 개인
GARDASIL의 효능은 16세에서 26세까지의 개인(여성 20,541명, 남성 4,055명)을 대상으로 한 AAHS 대조군, 이중맹검, 무작위 배정 임상 시험 5건에서 평가되었습니다. 이러한 시험의 결과는 아래 표 6에 나와 있습니다.
| 질병 종말점 | GARDASIL | AAHS 대조군 | 효능 % (95% CI) | ||
|---|---|---|---|---|---|
| N | 사례 수 | N | 사례 수 | ||
| N=7개월 후 최소한 한 번의 추적 방문을 가진 개인 수 | |||||
| CI=신뢰 구간 | |||||
| 참고 1: 점 추정치 및 신뢰 구간은 추적 기간에 따라 조정됩니다. | |||||
| 참고 2: 표 6에는 백신으로 덮이지 않은 HPV 유형으로 인한 사례가 포함되어 있지 않습니다. | |||||
| AAHS = 무정형 알루미늄 수산화인산염 황산염, CIN = 자궁 경부 상피내 종양, VIN = 외음 상피내 종양, VaIN=질 상피내 종양, PIN=음경 상피내 종양, AIN=항문 상피내 종양, AIS=선암 In Situ | |||||
| 16세에서 26세까지의 여성† | |||||
| HPV 16 또는 18 관련 CIN 2/3 또는 AIS | 8493 | 2 | 8464 | 112 | 98.2 (93.5, 99.8) |
| HPV 16 또는 18 관련 VIN 2/3 | 7772 | 0 | 7744 | 10 | 100.0 (55.5, 100.0) |
| HPV 16 또는 18 관련 VaIN 2/3 | 7772 | 0 | 7744 | 9 | 100.0 (49.5, 100.0) |
| HPV 6, 11, 16 또는 18 관련 CIN (CIN 1, CIN 2/3) 또는 AIS | 7864 | 9 | 7865 | 225 | 96.0 (92.3, 98.2) |
| HPV 6, 11, 16 또는 18 관련 생식기 사마귀 | 7900 | 2 | 7902 | 193 | 99.0 (96.2, 99.9) |
| HPV 6 및 11 관련 생식기 사마귀 | 6932 | 2 | 6856 | 189 | 99.0 (96.2, 99.9) |
| 16세에서 26세까지의 남성 | |||||
| 외부 생식기 병변 HPV 6, 11, 16 또는 18 관련 | |||||
| 외부 생식기 병변 | 1394 | 3 | 1404 | 32 | 90.6 (70.1, 98.2) |
| 콘딜로마 | 1394 | 3 | 1404 | 28 | 89.3 (65.3, 97.9) |
| PIN 1/2/3 | 1394 | 0 | 1404 | 4 | 100.0 (-52.1, 100.0) |
| HPV 6-, 11-, 16-, or 18-related Endpoint | |||||
| AIN 1/2/3 | 194 | 5 | 208 | 24 | 77.5 (39.6, 93.3) |
| AIN 2/3 | 194 | 3 | 208 | 13 | 74.9 (8.8, 95.4) |
| AIN 1 Condyloma Acuminatum Non-acuminate |
194 194 194 |
4 0 4 |
208 208 208 |
16 6 11 |
73.0 (16.3, 93.4) 100.0 (8.2, 100.0) 60.4 (-33.5, 90.8) |
등록 당시 16세에서 26세 사이의 여성
등록 당시 16세에서 26세 사이의 여성을 대상으로 한 연장 연구에서, GARDASIL의 예방 효능은 60개월까지 HPV 6, 11, 16 및 18 관련 자궁경부 및 생식기 질환에 대해 AAHS 대조군과 비교하여 100%(95% CI: 12.3%, 100%)였습니다.
등록 당시 16세에서 23세 사이의 소녀 및 여성을 대상으로 한 연장 연구에서는 덴마크, 아이슬란드, 노르웨이 및 스웨덴의 국가 건강 관리 등록부를 사용하여 GARDASIL로 백신 접종을 받은 16세에서 23세 사이의 소녀 및 여성 2,650명을 대상으로 HPV 6, 11, 16 또는 18 관련 CIN(모든 등급), AIS, 자궁경부암, 외음암 또는 질암의 종말점 사례를 모니터링했습니다. 프로토콜 준수 효능 모집단의 중간 분석에는 GARDASIL 백신 접종 시리즈를 1년 이내에 완료하고, 3차 접종 후 1개월까지 관련 HPV 유형에 대한 경험이 없었으며, 프로토콜 위반이 없었고, 추적 데이터가 있는 1,902명의 피험자가 포함되었습니다. 백신 1차 접종 후 중간 추적 기간은 6.7년이었으며, 범위는 2.8년에서 8.4년이었습니다. 중간 분석 시점에서, 총 5,765명-년의 위험 기간 동안 HPV 6, 11, 16 또는 18 관련 CIN(모든 등급), AIS, 자궁경부암, 외음암 또는 질암 사례는 관찰되지 않았습니다.
9세에서 15세 사이의 소녀 및 소년
등록 당시 9세에서 15세 사이의 소녀 614명과 소년 565명을 대상으로 한 연장 연구에서, GARDASIL로 백신 접종을 받은 피험자는 성적 활동 시작 또는 16세 이후부터 HPV 6, 11, 16 또는 18 관련 지속적인 감염, CIN(모든 등급), AIS, VIN, VaIN, 자궁경부암, 외음암, 질암 및 외생식기 병변의 종말점 사례를 적극적으로 추적했습니다. 프로토콜 준수 효능 모집단의 중간 분석에는 GARDASIL 백신 접종 시리즈를 1년 이내에 완료하고, 백신 접종 시리즈 시작 시 관련 HPV 유형에 대한 음성 반응을 보였으며, GARDASIL 3차 접종을 받기 전에 성적 활동을 시작하지 않은 소녀 246명과 소년 168명이 포함되었습니다. 백신 1차 접종 후 중간 추적 기간은 7.2년이었으며, 범위는 0.5년에서 8.5년이었습니다. 중간 분석 시점에서, 총 1,105명-년의 위험 기간 동안 최소 12개월 지속 기간의 지속적인 감염 사례와 HPV 6, 11, 16 또는 18 관련 CIN(모든 등급), AIS, VIN, VaIN, 자궁경부암, 외음암, 질암 또는 외생식기 병변 사례는 관찰되지 않았습니다. HPV 6, 11, 16 또는 18 관련 지속적인 감염 사례는 최소 6개월 지속 기간의 사례가 4건 있었으며, 그중 3건은 HPV 16 관련 사례였고, 1건은 HPV 6 관련 사례였으며, 12개월 지속 기간까지 지속되지 않았습니다.
27세에서 45세 사이의 개인
임상 시험에서는 HPV 6, 11, 16 또는 18 관련 지속적인 감염, 생식기 사마귀, 모든 등급의 외음 및 질 이형성 병변, 모든 등급의 CIN, AIS 및 자궁경부암의 결합된 종말점을 기준으로 27세에서 45세 사이의 여성 3,253명을 대상으로 GARDASIL의 효능을 평가했습니다. 이 여성들은 GARDASIL 또는 AAHS 대조군을 받도록 1:1로 무작위 배정되었습니다. 임상 시험은 기본 연구와 장기 연구 연장의 두 단계로 진행되었습니다. 프로토콜 준수 효능(PPE) 모집단은 등록 후 1년 이내에 3회 백신 접종을 모두 받았고, 연구 프로토콜에서 주요 편차가 없었으며, 1차 접종 전에 관련 HPV 유형(6, 11, 16 및 18형)에 대한 경험이 없었고(PCR 음성 및 혈청 음성), 3차 접종 후 1개월(7개월)까지 관련 HPV 유형에 대한 PCR 음성을 유지했습니다.
기본 연구(3차 접종 후 중간 추적 기간 3.5년)에서, GARDASIL의 효능은 PPE 모집단에서 HPV 6, 11, 16 및 18 관련 지속적인 감염, 생식기 사마귀, VIN, VaIN, 외음암, 질암, 자궁경부 이형성증(모든 등급 CIN), AIS 및 자궁경부암의 결합된 발생률에 대해 87.7%(95% CI: 75.4%, 94.6%)였습니다. 결합된 종말점에 대한 효능 추정치는 주로 지속적인 감염 예방에 의해 좌우되었습니다. GARDASIL의 효능은 PPE 모집단에서 HPV 6, 11, 16 및 18 관련 생식기 사마귀 또는 자궁경부 이형성증의 결합된 발생률에 대해 95.0%(95% CI: 68.7%, 99.9%)였습니다. 기본 연구에서 GARDASIL은 HPV 16 및 18형 관련 2등급 및 3등급 자궁경부 상피내 종양(CIN 2/3), 상피내 선암(AIS) 또는 자궁경부암 예방에 대한 통계적으로 유의미한 효능을 보이지 않았지만, GARDASIL 그룹에서는 CIN 2/3 사례가 1건 관찰되었고, 위약 그룹에서는 5건이 관찰되었습니다. GARDASIL 그룹의 CIN 2 사례는 HPV 16 및 HPV 51에 대한 PCR 검사에서 양성 반응을 보였습니다.
이 연구의 장기 연장에서, 기본 연구에서 GARDASIL 그룹에 무작위 배정된 콜롬비아의 피험자(n=600)는 HPV 6, 11, 16 및 18 관련 생식기 사마귀 또는 자궁경부 이형성증을 모니터링했습니다. 3차 접종 후 중간 추적 기간은 8.9년이었으며, 범위는 0.1년에서 10.1년이었으며, 총 3,518명-년이었습니다. 장기 연장 단계에서, PPE 모집단에서 HPV 6, 11, 16 또는 18 관련 CIN(모든 등급) 또는 생식기 사마귀 사례는 관찰되지 않았습니다.
27세에서 45세 사이의 남성에서 GARDASIL의 효능은 위에서 설명한 27세에서 45세 사이의 여성에 대한 효능 데이터에서 추론되며, 27세에서 45세 사이의 남성 150명을 대상으로 한 임상 시험의 면역원성 데이터에 의해 뒷받침됩니다. 이들은 GARDASIL(0, 2, 6개월)의 3회 접종 요법을 받았습니다. 프로토콜 준수 면역원성 모집단의 교차 연구 분석은 이러한 27세에서 45세 사이의 남성(연구 A)의 7개월 후 HPV 6, 11, 16 및 18 GMT를 GARDASIL의 효능이 확립된 16세에서 26세 사이의 소년 및 남성(연구 B)의 GMT와 비교했습니다(표 6 참조). HPV 6, 11, 16 및 18에 대한 GMT 비율(연구 A/연구 B)은 각각 0.82(95%CI: 0.65, 1.03), 0.79(95%CI: 0.66, 0.93), 0.91(95%CI: 0.72, 1.13) 및 0.74(95%CI: 0.59, 0.92)였습니다.
14.2 GARDASIL 9에 대한 임상 시험
GARDASIL을 비교군으로 사용하여 HPV 관련 자궁경부, 외음 및 질 질환을 예방하는 GARDASIL 9의 3회 접종 요법의 효능 및/또는 면역원성을 7개의 임상 시험에서 평가했습니다. 연구 1에서는 GARDASIL을 비교군으로 사용하여 HPV 관련 자궁경부, 외음 및 질 질환을 예방하는 GARDASIL 9의 효능을 평가했습니다.
GARDASIL 9의 효능 분석은 등록 후 1년 이내에 3회 접종을 모두 받은 16세에서 26세 사이의 여성, 연구 프로토콜에서 주요한 편차가 없었고, 1차 접종 전에 자궁경부 질 분비물의 혈청학 및 PCR에 의해 관련 HPV 유형에 대한 감염이 없었으며, 3차 접종 후 1개월(7개월)까지 관련 HPV 유형에 대한 PCR 음성을 유지한 여성을 대상으로 한 프로토콜 효능(PPE) 집단에서 평가되었습니다. 전반적으로 약 52%의 피험자가 1일에 PCR과 혈청학 모두에서 모든 백신 HPV 유형에 대해 음성이었습니다.
HPV 유형 31, 33, 45, 52 및 58에 대한 효능의 주요 분석은 자궁경부 상피내 종양(CIN) 2, CIN 3, 상피내 선암(AIS), 침윤성 자궁경부암, 외음 상피내 종양(VIN) 2/3, 질 상피내 종양(VaIN) 2/3, 외음암 또는 질암의 결합된 종말점을 기반으로 합니다. 평가된 다른 종말점에는 모든 등급의 자궁경부, 외음 및 질 질환, 지속적인 감염, 세포학적 이상 및 침습적 절차가 포함됩니다. 모든 종말점의 경우 GARDASIL 9에서 HPV 유형 31, 33, 45, 52 및 58에 대한 효능은 GARDASIL과 비교하여 평가되었습니다. GARDASIL 9의 HPV 유형 31, 33, 45, 52 및 58에 의한 항문 병변에 대한 효능은 발생률이 낮아 평가되지 않았습니다. GARDASIL 9의 항문 병변에 대한 효능은 남성에서 HPV 유형 6, 11, 16 및 18에 의한 항문 병변에 대한 GARDASIL의 효능과 백신에 의해 GARDASIL 9에서 유발된 HPV 유형에 대한 항체 반응에서 추론되었습니다.
HPV 유형 6, 11, 16 및 18에 의한 질병에 대한 효능은 GARDASIL 9로 접종한 후 유형 특이적 항체의 기하 평균 역가(GMT)를 GARDASIL로 접종한 후 유형 특이적 항체의 기하 평균 역가(GMT)와 비교하여 평가했습니다(연구 1 및 연구 3). GARDASIL 9의 9세에서 15세 사이의 여아와 남아 및 16세에서 26세 사이의 남성과 여성에 대한 효능은 GARDASIL 9로 접종한 후 16세에서 26세 사이의 여성의 유형 특이적 항체 GMT와 비교하여 추론되었습니다. 면역원성 분석은 사전 정의된 날짜 범위 내에 3회 접종을 모두 받았고, 연구 프로토콜에서 주요한 편차가 없었으며, 항체 반응 평가를 위한 혈청 수집에 대한 사전 정의된 날짜 범위를 충족했으며, 1차 접종 전에 관련 HPV 유형에 대한 감염이 없었던(16세에서 26세 사이의 여성의 경우 PCR 음성; 연구 1 및 2) 및 혈청 음성(연구 1, 2, 3, 5, 7 및 8) 개인으로 구성된 프로토콜 면역원성(PPI) 집단에서 수행되었습니다. 16세에서 26세 사이의 여성(연구 1 및 2)의 경우 7개월까지 관련 HPV 유형에 대한 PCR 음성을 유지했습니다. 접종에 대한 사전 정의된 날짜 범위는 1일(1차 접종)을 기준으로 했습니다. 3회 접종 일정의 경우 2차 접종은 2개월(± 3주)에, 3차 접종은 6개월(± 4주)에 실시했습니다. 2회 접종 일정의 경우 2차 접종은 6개월 또는 12개월(± 4주)에 실시했습니다. 항체 반응 평가를 위한 혈청 수집에 대한 사전 정의된 날짜 범위는 마지막 접종 후 21일에서 49일이었습니다.
연구 1은 16세에서 26세 사이의 여성에서 GARDASIL 9의 면역원성과 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52 및 58에 의한 감염 및 질병을 예방하는 효능을 평가했습니다. 연구 2는 9세에서 15세 사이의 여아와 남아 및 16세에서 26세 사이의 여성에서 GARDASIL 9의 면역원성을 평가했습니다. 연구 3은 9세에서 15세 사이의 여아에서 GARDASIL 9의 면역원성을 GARDASIL과 비교하여 평가했습니다. 연구 4는 GARDASIL로 이전에 접종한 12세에서 26세 사이의 여성에게 GARDASIL 9를 투여하는 것을 평가했습니다. 연구 5는 11세에서 15세 사이의 여아와 남아에게 Menactra와 Adacel을 동시에 투여한 GARDASIL 9를 평가했습니다. 이러한 5가지 임상 시험을 통해 GARDASIL 9를 접종받은 12,233명의 개인(등록 당시 16세에서 26세 사이의 여성 8,048명, 평균 연령 21.8세; 등록 당시 9세에서 15세 사이의 여아 2,927명, 평균 연령 11.9세; 등록 당시 9세에서 15세 사이의 남아 1,258명, 평균 연령 11.9세)을 평가했습니다. 연구 7은 등록 당시 16세에서 26세 사이의 남성과 여성(평균 연령 각각 20.8세와 22.2세)에서 GARDASIL 9의 면역원성을 평가했습니다. 연구 9는 27세에서 45세 사이의 여성 640명과 16세에서 26세 사이의 여성 570명(평균 연령 각각 35.8세와 21.6세)에서 GARDASIL 9의 면역원성을 평가했습니다.
임상 시험에서 16세에서 26세 사이의 여성의 인종 분포는 다음과 같습니다. 백인 56.8%, 기타 25.2%, 아시아계 14.1%, 흑인 3.9%. 임상 시험에서 9세에서 15세 사이의 여아의 인종 분포는 다음과 같습니다. 백인 60.3%, 기타 19.3%, 아시아계 13.5%, 흑인 7.0%. 임상 시험에서 9세에서 15세 사이의 남아의 인종 분포는 다음과 같습니다. 백인 46.6%, 기타 34.3%, 아시아계 13.3%, 흑인 5.9%. 임상 시험에서 16세에서 26세 사이의 남성과 여성의 인종 분포는 다음과 같습니다. 백인 62.1%, 기타 22.6%, 아시아계 9.8%, 흑인 5.5%.
연구 9에서 27세에서 45세 사이의 여성의 인종 분포는 다음과 같습니다. 백인 97.7%, 아시아계 1.6%, 기타 또는 다인종 0.3%, 흑인 0.5%. 이 연구에서 16세에서 26세 사이의 여성의 인종 분포는 다음과 같습니다. 백인 94.6%, 아시아계 3.0%, 기타 또는 다인종 1.6%, 흑인 0.9%.
한 임상 시험(연구 8)은 GARDASIL 9의 2회 접종 요법을 평가했습니다. 연구 8은 9세에서 14세 사이의 여아와 남아에서 GARDASIL 9의 2회 접종과 9세에서 14세 사이의 여아와 16세에서 26세 사이의 여성에서 GARDASIL 9의 3회 접종의 면역원성을 평가했습니다(N=1,518; 여아 753명; 남아 451명, 여성 314명). 9세에서 14세 사이의 여아와 남아의 평균 연령은 11.5세였고, 16세에서 26세 사이의 여아와 여성의 평균 연령은 21.0세였습니다. 연구 8에서 인종 분포는 다음과 같습니다. 백인 61.1%, 아시아계 16.3%, 기타 13.3%, 흑인 8.9%.
14.3 16세에서 26세 사이의 여성에서 HPV 유형 31, 33, 45, 52 및 58에 대한 효능
HPV 유형 31, 33, 45, 52 및 58에 대한 GARDASIL 9의 효능을 뒷받침하는 연구
GARDASIL 9의 16세에서 26세 사이 여성에서의 효능은 HPV 감염 여부를 사전 선별하지 않고 등록 및 백신 접종을 받은 총 14,204명의 여성(GARDASIL 9 = 7,099명, GARDASIL = 7,105명)을 포함한 활성 비교 대조군, 이중 맹검, 무작위 배정 임상 시험(연구 1)에서 평가되었습니다. 피험자는 마지막 백신 접종 후 중앙값 40개월(범위 0~64개월) 동안 추적 관찰되었습니다.
주요 효능 평가는 HPV 31, 33, 45, 52 및 58 관련 자궁경부암, 외음암, 질암, CIN 2/3 또는 AIS, VIN 2/3 및 VaIN 2/3의 복합 임상 종말점을 기반으로 PPE 인구에서 수행되었습니다. 효능은 HPV 31, 33, 45, 52 및 58 관련 CIN 1, 모든 등급의 외음 및 질 질환 및 지속적인 감염의 임상 종말점을 사용하여 추가로 평가되었습니다. 또한 이 연구는 GARDASIL 9가 HPV 31, 33, 45, 52 및 58 관련 비정상적인 파파니콜라우(Pap) 검사, 자궁경부 및 외생식기 생검 및 확정적 치료[루프 전기 수술 절제술(LEEP) 및 원추 절제술 포함] 비율에 미치는 영향을 평가했습니다. 모든 종말점에 대한 효능은 7개월 방문 이후부터 측정되었습니다.
GARDASIL 9는 HPV 31, 33, 45, 52 및 58 관련 지속적인 감염 및 질병을 예방했으며 HPV 31, 33, 45, 52 및 58 관련 Pap 검사 이상, 자궁경부 및 외생식기 생검 및 확정적 치료(표 7)의 발생률을 감소시켰습니다.
| 질병 종말점 | GARDASIL 9 N†=7099 |
GARDASIL N†=7105 |
GARDASIL 9 효능 % (95% CI) |
||
|---|---|---|---|---|---|
| n‡ | 사례 수 | n‡ | 사례 수 | ||
| CI=신뢰 구간 | |||||
| CIN=자궁경부 상피내 종양, VIN=외음 상피내 종양, VaIN=질 상피내 종양, AIS=선암 In Situ, ASC-US=불명확한 의미의 비정상 편평 세포 | |||||
| HR=고위험 | |||||
|
|||||
| HPV 31, 33, 45, 52, 58 관련 CIN 2/3, AIS, 자궁경부암, VIN 2/3, VaIN 2/3, 외음암 및 질암 | 6016 | 1 | 6017 | 30 | 96.7 (80.9, 99.8) |
| HPV 31, 33, 45, 52, 58 관련 CIN 1 | 5948 | 1 | 5943 | 69 | 98.6 (92.4, 99.9) |
| HPV 31, 33, 45, 52, 58 관련 CIN 2/3 또는 AIS | 5948 | 1 | 5943 | 27 | 96.3 (79.5, 99.8) |
| HPV 31, 33, 45, 52, 58 관련 외음 또는 질 질환 | 6009 | 1 | 6012 | 16 | 93.8 (61.5, 99.7) |
| HPV 31, 33, 45, 52, 58 관련 지속적인 감염 ≥6개월§ | 5939 | 26 | 5953 | 642 | 96.2 (94.4, 97.5) |
| HPV 31-, 33-, 45-, 52-, 58-related Persistent Infection ≥12 Months¶ | 5939 | 15 | 5953 | 375 | 96.1 (93.7, 97.9) |
| HPV 31-, 33-, 45-, 52-, 58-related ASC-US HR-HPV Positive or Worse Pap# Abnormality | 5881 | 35 | 5882 | 462 | 92.6 (89.7, 94.8) |
| HPV 31-, 33-, 45-, 52-, 58-related Biopsy | 6016 | 7 | 6017 | 222 | 96.9 (93.6, 98.6) |
| HPV 31-, 33-, 45-, 52-, 58-related Definitive TherapyÞ | 6012 | 4 | 6014 | 32 | 87.5 (65.7, 96.0) |
14.4 GARDASIL 9 접종자에 대한 장기 추적 관찰
연구 2의 대상자를 대상으로 한 연장 연구에서, 등록 당시 9세에서 15세 사이의 소녀 971명과 소년 301명이 GARDASIL 9 3회 접종을 받았으며, 16세 이후부터 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 관련 지속 감염 및 질병의 종점 사례에 대해 적극적으로 추적 관찰되었습니다. 소녀의 경우, 평가된 질병 종점에는 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 관련 CIN(모든 등급), AIS, VIN, VaIN, 외음부 사마귀, 자궁경부암, 외음부암 및 질암이 포함되었습니다. 소년의 경우, 평가된 질병 종점에는 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 관련 PIN, 외음부 사마귀, 음경암, 회음부암 및 항문 주위암이 포함되었습니다.
프로토콜 준수 집단 분석에는 GARDASIL 9 백신 접종 시리즈를 1년 이내에 완료하고, 백신 접종 시리즈 시작 시 관련 HPV 유형에 대한 혈청 음성이었으며, GARDASIL 9 3차 접종을 받기 전에 성관계를 시작하지 않은 소녀 872명과 소년 262명이 포함되었습니다. 백신 마지막 접종 후 중앙 추적 관찰 기간은 9세에서 15세 사이의 소녀의 경우 3.0년에서 11.0년 범위에서 10.0년이었고, 9세에서 15세 사이의 소년의 경우 3.0년에서 10.6년 범위에서 9.9년이었습니다.
소녀의 경우, 총 4,576.1명-년의 위험 기간 동안 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 관련 CIN 2/3, AIS, VIN, VaIN, 외음부 사마귀, 자궁경부암, 외음부암 또는 질암 사례는 관찰되지 않았습니다. PCR에 의해 HPV 16, 39 및 59에 양성 반응을 보인 CIN1 사례가 1건 관찰되었습니다. 소년의 경우, 총 1,278.6명-년의 위험 기간 동안 HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 관련 PIN, 외음부 사마귀, 음경암, 회음부암 또는 항문 주위암 사례는 관찰되지 않았습니다.
연구 기간 동안 관찰된 소녀와 소년의 백신 HPV 유형 관련 지속 감염(최소 6개월 지속)의 발생률은 각각 10,000명-년당 52.4건(95% CI: 33.6, 78.0)과 54.6건(95% CI: 21.9, 112.4)이었으며, GARDASIL 9의 이전 효능 연구 결과를 기반으로 유사한 연령의 접종 집단에서 보고된 발생률 범위 내에 있었습니다(이는 연구 1의 여성에서 각각 HPV 6, 11, 16 및 18 관련 및 HPV 31, 33, 45, 52 및 58 관련 지속 감염에 대해 10,000명-년당 36.6건과 21.5건이었고, GARDASIL 연구의 여성과 남성에서 각각 HPV 6, 11, 16 및 18 관련 지속 감염에 대해 10,000명-년당 30건과 59건이었습니다).
14.5 HPV 관련 인두암 및 기타 두경부암 예방 효능
GARDASIL 9의 HPV 유형 16, 18, 31, 33, 45, 52 및 58에 의해 발생하는 인두암 및 기타 두경부암에 대한 효능은 백신에 포함된 HPV 유형에 의해 발생하는 항문 생식기 질환을 예방하는 GARDASIL 및 GARDASIL 9의 효능을 기반으로 합니다. [임상 연구(14.1, 14.2, 14.3) 참조].
14.6 3회 접종 요법의 면역원성
보호 효능을 부여하는 최소 항-HPV 역가는 밝혀지지 않았습니다.
유형 특이적 면역 분석법(예: cLIA)은 유형 특이적 표준을 사용하여 각 백신 HPV 유형에 대한 면역원성을 평가했습니다. 이러한 분석법은 각 HPV 유형에 대한 중화 항원에 대한 항체를 측정했습니다. 이러한 분석법의 척도는 각 HPV 유형에 고유하므로 유형 간 비교 및 다른 분석법과의 비교는 적절하지 않습니다. 면역원성은 (1) 관련 백신 HPV 유형에 대한 항체에 대해 혈청 양성인 개인의 비율과 (2) 기하 평균 역가(GMT)로 측정되었습니다.
GARDASIL 9의 HPV 유형 6, 11, 16 및 18에 대한 효능을 뒷받침하는 연구
HPV 유형 6, 11, 16 또는 18 관련 지속 감염 및 질병에 대한 GARDASIL 9의 효능은 연구 1(16세에서 26세 사이의 소녀 및 여성)과 연구 3(9세에서 15세 사이의 소녀)에서 GARDASIL 9 접종 후 GMT를 GARDASIL 접종 후 GMT와 비교한 비열등성 비교에서 추론되었습니다. 두 접종 그룹 모두에서 HPV 유형 6, 11, 16 및 18 관련 효능 종점 사례가 적어 이러한 HPV 유형과 관련된 질병 종점을 사용한 효능 평가가 의미 있게 이루어지지 않았습니다. 주요 분석은 프로토콜 준수 집단에서 수행되었으며, 여기에는 등록 후 1년 이내에 3회 접종을 모두 받고, 연구 프로토콜에서 주요 편차가 없었으며, HPV 감염이 없는 대상자가 포함되었습니다. HPV 감염이 없는 개인은 1차 접종 전에 관련 HPV 유형에 대한 혈청 음성으로 정의되었으며, 연구 1의 16세에서 26세 사이의 여성 대상자의 경우 1차 접종부터 7개월까지 자궁경부 질 분비물에서 관련 HPV 유형에 대한 PCR 음성으로 정의되었습니다.
9세에서 15세 사이의 소녀와 16세에서 26세 사이의 젊은 여성에서 GARDASIL 9에 대한 7개월째 항-HPV 6, 11, 16 및 18 GMT는 GARDASIL에 대한 해당 집단의 GMT와 비열등했습니다(표 8). 각 HPV 유형에 대한 분석에 포함된 개인의 최소 99.7%가 7개월째 혈청 양성이 되었습니다.
| 집단 | GARDASIL 9 | GARDASIL | GARDASIL 9/ GARDASIL |
|||
|---|---|---|---|---|---|---|
| N† (n‡) |
GMT mMU§/mL |
N† (n‡) |
GMT mMU§/mL |
GMT Ratio |
(95% CI)¶ | |
| CI=Confidence Interval | ||||||
| GMT=Geometric Mean Titer | ||||||
| cLIA=competitive Luminex Immunoassay | ||||||
|
||||||
| Anti-HPV 6 | ||||||
| 9- through 15-year-old girls | 300 (273) |
1679.4 | 300 (261) |
1565.9 | 1.07 | (0.93, 1.23) |
| 16- through 26-year-old girls and women | 6792 (3993) |
893.1 | 6795 (3975) |
875.2 | 1.02 | (0.99, 1.06) |
| Anti-HPV 11 | ||||||
| 9- through 15-year-old girls | 300 (273) |
1315.6 | 300 (261) |
1417.3 | 0.93 | (0.80, 1.08) |
| 16- through 26-year-old girls and women | 6792 (3995) |
666.3 | 6795 (3982) |
830.0 | 0.80 | (0.77, 0.83) |
| Anti-HPV 16 | ||||||
| 9- through 15-year-old girls | 300 (276) |
6739.5 | 300 (270) |
6887.4 | 0.97 | (0.85, 1.11) |
| 16- through 26-year-old girls and women | 6792 (4032) |
3131.1 | 6795 (4062) |
3156.6 | 0.99 | (0.96, 1.03) |
| Anti-HPV 18 | ||||||
| 9- through 15-year-old girls | 300 (276) |
1956.6 | 300 (269) |
1795.6 | 1.08 | (0.91, 1.29) |
| 16- through 26-year-old girls and women | 6792 (4539) |
804.6 | 6795 (4541) |
678.7 | 1.19 | (1.14, 1.23) |
GARDASIL 9의 9세에서 15세 사이의 여아 및 남아에 대한 백신 HPV 유형에 대한 효능을 뒷받침하는 연구
9세에서 15세 사이의 여아 및 남아에서 백신 HPV 유형과 관련된 지속적인 감염 및 질병에 대한 GARDASIL 9의 효능은 9세에서 15세 사이의 여아 및 남아에서 GARDASIL 9 접종 후 GMT의 PPI 모집단에서 수행된 비열등성 비교에서 16세에서 26세 사이의 여아 및 여성에서 추론되었습니다. 9세에서 15세 사이의 여아 및 남아에서 7개월째의 항-HPV GMT는 16세에서 26세 사이의 여아 및 여성에서 항-HPV GMT와 비열등했습니다(표 9).
| 모집단 | N† | n‡ | GMT mMU§/mL |
16세에서 26세 사이의 여아 및 여성에 대한 GMT 비율 (95% CI)¶ |
|---|---|---|---|---|
| cLIA=경쟁적 Luminex 면역 분석 | ||||
| CI=신뢰 구간 | ||||
| GMT=기하 평균 역가 | ||||
|
||||
| 항-HPV 6 | ||||
| 9세에서 15세 사이의 여아 | 630 | 503 | 1703.1 | 1.89 (1.68, 2.12) |
| 9세에서 15세 사이의 남아 | 641 | 537 | 2083.4 | 2.31 (2.06, 2.60) |
| 16세에서 26세 사이의 여아 및 여성 | 463 | 328 | 900.8 | 1 |
| 항-HPV 11 | ||||
| 9세에서 15세 사이의 여아 | 630 | 503 | 1291.5 | 1.83 (1.63, 2.05) |
| 9세에서 15세 사이의 남아 | 641 | 537 | 1486.3 | 2.10 (1.88, 2.36) |
| 16세에서 26세 사이의 여아 및 여성 | 463 | 332 | 706.6 | 1 |
| 항-HPV 16 | ||||
| 9세에서 15세 사이의 여아 | 630 | 513 | 6933.9 | 1.97 (1.75, 2.21) |
| 9세에서 15세 사이의 남아 | 641 | 546 | 8683.0 | 2.46 (2.20, 2.76) |
| 16세에서 26세 사이의 여아 및 여성 | 463 | 329 | 3522.6 | 1 |
| 항-HPV 18 | ||||
| 9세에서 15세 사이의 여아 | 630 | 516 | 2148.3 | 2.43 (2.12, 2.79) |
| 9- through 15-year-old boys | 641 | 544 | 2855.4 | 3.23 (2.83, 3.70) |
| 16- through 26-year-old girls and women | 463 | 345 | 882.7 | 1 |
| Anti-HPV 31 | ||||
| 9- through 15-year-old girls | 630 | 506 | 1894.7 | 2.51 (2.21, 2.86) |
| 9- through 15-year-old boys | 641 | 543 | 2255.3 | 2.99 (2.63, 3.40) |
| 16- through 26-year-old girls and women | 463 | 340 | 753.9 | 1 |
| Anti-HPV 33 | ||||
| 9- through 15-year-old girls | 630 | 518 | 985.8 | 2.11 (1.88, 2.37) |
| 9- through 15-year-old boys | 641 | 544 | 1207.4 | 2.59 (2.31, 2.90) |
| 16- through 26-year-old girls and women | 463 | 354 | 466.8 | 1 |
| Anti-HPV 45 | ||||
| 9- through 15-year-old girls | 630 | 518 | 707.7 | 2.60 (2.25, 3.00) |
| 9- through 15-year-old boys | 641 | 547 | 912.1 | 3.35 (2.90, 3.87) |
| 16- through 26-year-old girls and women | 463 | 368 | 272.2 | 1 |
| Anti-HPV 52 | ||||
| 9- through 15-year-old girls | 630 | 517 | 962.2 | 2.21 (1.96, 2.49) |
| 9- through 15-year-old boys | 641 | 545 | 1055.5 | 2.52 (2.22, 2.84) |
| 16- through 26-year-old girls and women | 463 | 337 | 419.6 | 1 |
| Anti-HPV 58 | ||||
| 9- through 15-year-old girls | 630 | 516 | 1288.0 | 2.18 (1.94, 2.46) |
| 9- through 15-year-old boys | 641 | 544 | 1593.3 | 2.70 (2.40, 3.03) |
| 16- through 26-year-old girls and women | 463 | 332 | 590.5 | 1 |
GARDASIL 9의 효능을 뒷받침하는 16세에서 26세 사이의 남성에 대한 백신 HPV 유형에 대한 연구
16세에서 26세 사이의 남성에서 백신 HPV 유형과 관련된 지속적인 감염 및 질병에 대한 GARDASIL 9의 효능은 16세에서 26세 사이의 남성에서 GARDASIL 9 접종 후 GMT의 PPI 인구에서 수행된 비열등성 비교에서 추론되었으며, 16세에서 26세 사이의 여성과 비교되었습니다. 16세에서 26세 사이의 남성에서 7개월째의 항-HPV GMT는 16세에서 26세 사이의 여성의 항-HPV GMT와 비열등했습니다(표 10). 연구 7은 또한 16세에서 26세 사이의 HIV 음성 MSM 313명을 모집했습니다. 7개월째, MSM에 대한 HM에 대한 항-HPV GMT 비율은 HPV 유형에 따라 0.6에서 0.8까지였습니다. MSM에 대한 HM에 대한 GMT 비율은 일반적으로 GARDASIL을 사용한 이전 임상 시험에서 관찰된 것과 유사했습니다.
| 인구 | N† | n‡ | GMT mMU§/mL |
16세에서 26세 사이의 여성에 대한 GMT 비율 (95% CI)¶ |
|---|---|---|---|---|
| cLIA=경쟁 Luminex 면역 분석 | ||||
| CI=신뢰 구간 | ||||
| GMT=기하 평균 역가 | ||||
|
||||
| 항-HPV 6 | ||||
| 16세에서 26세 사이의 HM | 1103 | 847 | 782.0 | 1.11 (1.02, 1.21) |
| 16세에서 26세 사이의 여성 | 1099 | 708 | 703.9 | 1 |
| 항-HPV 11 | ||||
| 16세에서 26세 사이의 HM | 1103 | 851 | 616.7 | 1.09 (1.00, 1.19) |
| 16세에서 26세 사이의 여성 | 1099 | 712 | 564.9 | 1 |
| 항-HPV 16 | ||||
| 16세에서 26세 사이의 HM | 1103 | 899 | 3346.0 | 1.20 (1.10, 1.30) |
| 16세에서 26세 사이의 여성 | 1099 | 781 | 2788.3 | 1 |
| 항-HPV 18 | ||||
| 16세에서 26세 사이의 HM | 1103 | 906 | 808.2 | 1.19 (1.08, 1.31) |
| 16세에서 26세 사이의 여성 | 1099 | 831 | 679.8 | 1 |
| 항-HPV 31 | ||||
| 16- through 26-year-old HM | 1103 | 908 | 708.5 | 1.24 (1.13, 1.37) |
| 16- through 26-year-old girls and women | 1099 | 826 | 570.1 | 1 |
| Anti-HPV 33 | ||||
| 16- through 26-year-old HM | 1103 | 901 | 384.8 | 1.19 (1.10, 1.30) |
| 16- through 26-year-old girls and women | 1099 | 853 | 322.0 | 1 |
| Anti-HPV 45 | ||||
| 16- through 26-year-old HM | 1103 | 909 | 235.6 | 1.27 (1.14, 1.41) |
| 16- through 26-year-old girls and women | 1099 | 871 | 185.7 | 1 |
| Anti-HPV 52 | ||||
| 16- through 26-year-old HM | 1103 | 907 | 386.8 | 1.15 (1.05, 1.26) |
| 16- through 26-year-old girls and women | 1099 | 849 | 335.2 | 1 |
| Anti-HPV 58 | ||||
| 16- through 26-year-old HM | 1103 | 897 | 509.8 | 1.25 (1.14, 1.36) |
| 16- through 26-year-old girls and women | 1099 | 839 | 409.3 | 1 |
GARDASIL 9의 27세에서 45세 여성에서 백신 HPV 유형에 대한 효과를 뒷받침하는 연구
27세에서 45세 여성에서 백신 HPV 유형과 관련된 지속적인 감염 및 질병에 대한 GARDASIL 9의 효과는 연구 9의 PPI 모집단에서 수행된 면역 교량 비교에 의해 뒷받침되었습니다. 연구 9에서 27세에서 45세 여성의 7개월째 항-HPV 반응의 GMT 비율은 16세에서 26세 소녀 및 여성의 항-HPV 반응에 비해 HPV 16, 18, 31, 33, 45, 52 및 58에 대한 GMT 비율의 95% CI 하한이 0.50보다 큰 성공 기준을 충족했습니다(표 11).
| 모집단 | N† | n‡ | GMT mMU§/mL |
16세에서 26세 소녀 및 여성에 대한 GMT 비율(95% CI)¶ |
|---|---|---|---|---|
| cLIA=경쟁 Luminex 면역 분석 | ||||
| CI=신뢰 구간 | ||||
| GMT=기하 평균 역가 | ||||
|
||||
| 항-HPV 6 | ||||
| 27세에서 45세 여성 | 640 | 448 | 638.4 | N.D# |
| 16세에서 26세 소녀 및 여성 | 570 | 421 | 787.8 | N.D# |
| 항-HPV 11 | ||||
| 27세에서 45세 여성 | 640 | 448 | 453.5 | N.D# |
| 16세에서 26세 소녀 및 여성 | 570 | 421 | 598.7 | N.D# |
| 항-HPV 16 | ||||
| 27세에서 45세 여성 | 640 | 448 | 2,147.5 | 0.70 (0.63, 0.77) |
| 16세에서 26세 소녀 및 여성 | 570 | 436 | 3,075.8 | 1 |
| 항-HPV 18 | ||||
| 27세에서 45세 여성 | 640 | 471 | 532.1 | 0.71 (0.64, 0.80) |
| 16세에서 26세 소녀 및 여성 | 570 | 421 | 744.5 | 1 |
| Anti-HPV 31 | ||||
| 27- through 45-year-old women | 640 | 488 | 395.7 | 0.66 (0.60, 0.74) |
| 16- through 26-year-old girls and women | 570 | 447 | 596.1 | 1 |
| Anti-HPV 33 | ||||
| 27- through 45-year-old women | 640 | 493 | 259.0 | 0.73 (0.67, 0.80) |
| 16- through 26-year-old girls and women | 570 | 457 | 354.5 | 1 |
| Anti-HPV 45 | ||||
| 27- through 45-year-old women | 640 | 515 | 145.6 | 0.68 (0.60, 0.76) |
| 16- through 26-year-old girls and women | 570 | 470 | 214.9 | 1 |
| Anti-HPV 52 | ||||
| 27- through 45-year-old women | 640 | 496 | 244.7 | 0.71 (0.64, 0.78) |
| 16- through 26-year-old girls and women | 570 | 456 | 346.5 | 1 |
| Anti-HPV 58 | ||||
| 27- through 45-year-old women | 640 | 478 | 296.4 | 0.69 (0.63, 0.76) |
| 16- through 26-year-old girls and women | 570 | 451 | 428.0 | 1 |
GARDASIL 9의 모든 임상 시험에서 면역 반응
모든 임상 시험에서 9가지 백신 HPV 유형 각각에 대한 분석에 포함된 개인의 최소 99.2%가 7개월까지 세로 양성이 되었습니다. 9~15세 소녀 및 소년과 16~26세 소년 및 남성의 7개월째 항-HPV GMT는 GARDASIL 9의 면역원성 연구에 대한 결합된 데이터베이스에서 16~26세 소녀 및 여성의 항-HPV 반응과 비슷했습니다.
GARDASIL 9에 대한 면역 반응의 지속성
연구 2의 개인을 대상으로 한 연장 연구에서 등록 당시 9~15세의 소녀 및 소년(HPV 유형별로 평가 가능한 데이터가 있는 피험자 494~525명)을 대상으로 3차 접종 후 10년 동안 추적 관찰한 결과, cLIA로 측정한 항-HPV 6, 11, 16, 18, 31, 33, 45, 52 및 58 GMT는 3차 접종 후 1개월째 해당 값과 비교하여 감소했습니다. 세로 양성 피험자의 비율은 HPV 유형에 따라 3차 접종 후 1개월째 99.6%에서 100%까지, 3차 접종 후 10년째 81.3%에서 97.7%까지였습니다.
GARDASIL로 이전에 백신을 접종받은 개인에 대한 GARDASIL 9의 투여
연구 4는 이전에 GARDASIL 3회 접종을 받은 921명의 소녀 및 여성(12~26세)에서 GARDASIL 9 3회 접종의 면역원성을 평가했습니다. 연구에 등록하기 전에 피험자의 99% 이상이 1년 이내에 GARDASIL 3회 주사를 받았습니다. GARDASIL의 마지막 주사와 GARDASIL 9의 첫 번째 주사 사이의 시간 간격은 약 12~36개월이었습니다.
GARDASIL 9를 접종받은 개인의 경우 7개월째 프로토콜에 따라 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52 및 58에 대한 세로 양성률은 98.3%에서 100%까지였습니다. 이전에 GARDASIL을 접종받은 집단의 항-HPV 31, 33, 45, 52 및 58 GMT는 이전에 GARDASIL을 접종받지 않은 연구 1, 2, 3 및 5의 결합된 집단에서 GMT의 25~63%였지만, 이러한 차이의 임상적 관련성은 알 수 없습니다. GARDASIL을 이전에 접종받은 개인에서 HPV 유형 31, 33, 45, 52 및 58과 관련된 감염 및 질병을 예방하는 GARDASIL 9의 효능은 평가되지 않았습니다.
14.7 9~14세 개인에서 2회 접종 요법을 사용한 GARDASIL 9에 대한 면역 반응
2회 접종 요법을 받은 9~14세 소녀 및 소년에서 백신 HPV 유형과 관련된 지속적인 감염 및 질병에 대한 GARDASIL 9의 효과는 2회 접종 요법(0, 6개월 또는 0, 12개월)을 받은 9~14세 소녀 및 소년에서 GARDASIL 9 접종 후 GMT와 3회 접종 요법(0, 2, 6개월)을 받은 16~26세 소녀 및 여성에서 GMT를 비교한 PPI 집단에서 실시된 비열등성 비교에서 추론되었습니다. 2회 접종 GARDASIL 9를 받은 9~14세 소녀 및 소년의 마지막 접종 후 1개월째 항-HPV GMT는 3회 접종 GARDASIL 9를 받은 16~26세 소녀 및 여성의 항-HPV GMT와 비열등했습니다(표 12).
지정된 요법의 마지막 접종 후 1개월째, 모든 그룹의 피험자 중 97.9%에서 100%까지가 9가지 백신 HPV 유형에 대한 항체에 대해 세로 양성이 되었습니다(표 12).
같은 연구에서 9~14세 소녀 및 소년의 경우 마지막 백신 접종 후 1개월째 GMT는 3회 접종 일정 후 9~14세 소녀에서보다 2회 접종 일정 후 일부 백신 유형에서 수치적으로 낮았습니다(0, 6개월 후 HPV 유형 18, 31, 45 및 52, 0, 12개월 후 HPV 유형 45; 표 12). 이러한 발견의 임상적 관련성은 알 수 없습니다.
GARDASIL 9의 2회 접종 일정의 면역 지속 기간은 확립되지 않았습니다.
| 집단(요법) | N | n | GMT mMU‡/mL |
16~26세 소녀 및 여성의 3회 접종 요법에 대한 GMT 비율 (95% CI) |
|---|---|---|---|---|
| N = 각 백신 접종 그룹에 무작위 배정되어 최소 1회 주사를 받은 개인 수 | ||||
| n = 분석에 기여한 개인 수 | ||||
| CI=신뢰 구간 | ||||
| cLIA=경쟁적 루미넥스 면역 분석 | ||||
| GMT=기하 평균 역가 | ||||
|
||||
| Anti-HPV 6 | ||||
| 9~14세 여아(0, 6)† | 301 | 258 | 1657.9 | 2.15 (1.83, 2.53)§ |
| 9~14세 남아(0, 6)† | 301 | 263 | 1557.4 | 2.02 (1.73, 2.36)§ |
| 9~14세 여아 및 남아(0, 12)† | 300 | 257 | 2678.8 | 3.47 (2.93, 4.11)§ |
| 9~14세 여아(0, 2, 6)† | 300 | 254 | 1496.1 | 1.94 (1.65, 2.29)¶ |
| 16~26세 여성(0, 2, 6)† | 314 | 238 | 770.9 | 1 |
| Anti-HPV 11 | ||||
| 9~14세 여아(0, 6)† | 301 | 258 | 1388.9 | 2.39 (2.03, 2.82)§ |
| 9~14세 남아(0, 6)† | 301 | 264 | 1423.9 | 2.45 (2.09, 2.88)§ |
| 9~14세 여아 및 남아(0, 12)† | 300 | 257 | 2941.8 | 5.07 (4.32, 5.94)§ |
| 9~14세 여아(0, 2, 6)† | 300 | 254 | 1306.3 | 2.25 (1.90, 2.66)¶ |
| 16~26세 여성(0, 2, 6)† | 314 | 238 | 580.5 | 1 |
| Anti-HPV 16 | ||||
| 9~14세 여아(0, 6)† | 301 | 272 | 8004.9 | 2.54 (2.14, 3.00)§ |
| 9~14세 남아(0, 6)† | 301 | 273 | 8474.8 | 2.69 (2.29, 3.15)§ |
| 9~14세 여아 및 남아(0, 12)† | 300 | 264 | 14329.3 | 4.54 (3.84, 5.37)§ |
| 9~14세 여아(0, 2, 6)† | 300 | 269 | 6996.0 | 2.22 (1.89, 2.61)¶ |
| 16- to 26-year-old women (0, 2, 6)† | 314 | 249 | 3154.0 | 1 |
| Anti-HPV 18 | ||||
| 9- to 14-year-old girls (0, 6)† | 301 | 272 | 1872.8 | 2.46 (2.05, 2.96)§ |
| 9- to 14-year-old boys (0, 6)† | 301 | 272 | 1860.9 | 2.44 (2.04, 2.92)§ |
| 9- to 14-year-old girls and boys (0, 12)† | 300 | 266 | 2810.4 | 3.69 (3.06, 4.45)§ |
| 9- to 14-year-old girls (0, 2, 6)† | 300 | 270 | 2049.3 | 2.69 (2.24, 3.24)¶ |
| 16- to 26-year-old women (0, 2, 6)† | 314 | 267 | 761.5 | 1 |
| Anti-HPV 31 | ||||
| 9- to 14-year-old girls (0, 6)† | 301 | 272 | 1436.3 | 2.51 (2.10, 3.00)§ |
| 9- to 14-year-old boys (0, 6)† | 301 | 271 | 1498.2 | 2.62 (2.20, 3.12)§ |
| 9- to 14-year-old girls and boys (0, 12)† | 300 | 268 | 2117.5 | 3.70 (3.08, 4.45)§ |
| 9- to 14-year-old girls (0, 2, 6)† | 300 | 271 | 1748.3 | 3.06 (2.54, 3.67)¶ |
| 16- to 26-year-old women (0, 2, 6)† | 314 | 264 | 572.1 | 1 |
| Anti-HPV 33 | ||||
| 9- to 14-year-old girls (0, 6)† | 301 | 273 | 1030.0 | 2.96 (2.50, 3.50)§ |
| 9- to 14-year-old boys (0, 6)† | 301 | 271 | 1040.0 | 2.99 (2.55, 3.50)§ |
| 9- to 14-year-old girls and boys (0, 12)† | 300 | 269 | 2197.5 | 6.31 (5.36, 7.43)§ |
| 9- to 14-year-old girls (0, 2, 6)† | 300 | 275 | 796.4 | 2.29 (1.95, 2.68) ¶ |
| 16- to 26-year-old women (0, 2, 6)† | 314 | 279 | 348.1 | 1 |
| Anti-HPV 45 | ||||
| 9- to 14-year-old girls (0, 6)† | 301 | 274 | 357.6 | 1.67 (1.38, 2.03)§ |
| 9- to 14-year-old boys (0, 6)† | 301 | 273 | 352.3 | 1.65 (1.37, 1.99)§ |
| 9세에서 14세 사이의 여아 및 남아 (0, 12)† | 300 | 268 | 417.7 | 1.96 (1.61, 2.37)§ |
| 9세에서 14세 사이의 여아 (0, 2, 6)† | 300 | 275 | 661.7 | 3.10 (2.54, 3.77)¶ |
| 16세에서 26세 사이의 여성 (0, 2, 6)† | 314 | 280 | 213.6 | 1 |
| Anti-HPV 52 | ||||
| 9세에서 14세 사이의 여아 (0, 6)† | 301 | 272 | 581.1 | 1.60 (1.36, 1.87)§ |
| 9세에서 14세 사이의 남아 (0, 6)† | 301 | 273 | 640.4 | 1.76 (1.51, 2.05)§ |
| 9세에서 14세 사이의 여아 및 남아 (0, 12)† | 300 | 268 | 1123.4 | 3.08 (2.64, 3.61)§ |
| 9세에서 14세 사이의 여아 (0, 2, 6)† | 300 | 275 | 909.9 | 2.50 (2.12, 2.95)¶ |
| 16세에서 26세 사이의 여성 (0, 2, 6)† | 314 | 271 | 364.2 | 1 |
| Anti-HPV 58 | ||||
| 9세에서 14세 사이의 여아 (0, 6)† | 301 | 270 | 1251.2 | 2.55 (2.15, 3.01)§ |
| 9세에서 14세 사이의 남아 (0, 6)† | 301 | 270 | 1325.7 | 2.70 (2.30, 3.16)§ |
| 9세에서 14세 사이의 여아 및 남아 (0, 12)† | 300 | 265 | 2444.6 | 4.98 (4.23, 5.86)§ |
| 9세에서 14세 사이의 여아 (0, 2, 6)† | 300 | 273 | 1229.3 | 2.50 (2.11, 2.97)¶ |
| 16세에서 26세 사이의 여성 (0, 2, 6)† | 314 | 261 | 491.1 | 1 |
14.8 Menactra 및 Adacel과의 연구
연구 5에서 GARDASIL 9와 Menactra [수막구균 (A, C, Y 및 W-135군) 다당류 디프테리아 독소 접합 백신] 및 Adacel [파상풍 독소, 감소된 디프테리아 독소 및 무세포 백일해 백신 흡착 (Tdap)]의 동시 투여 (같은 방문, 별도의 부위에 주사)의 안전성 및 면역원성을 등록 당시 11세에서 15세 사이의 남아 및 여아 1,237명에서 평가했습니다.
한 그룹은 1일째에 한쪽 사지에 GARDASIL 9를 투여 받고, 반대쪽 사지에 Menactra와 Adacel을 별도의 주사로 동시에 투여 받았습니다 (n = 619). 두 번째 그룹은 1일째에 한쪽 사지에 GARDASIL 9의 첫 번째 투여를 받고, 1개월 후에 반대쪽 사지에 Menactra와 Adacel을 별도의 주사로 투여 받았습니다 (n = 618). 두 백신 접종 그룹의 피험자는 2개월째에 GARDASIL 9의 두 번째 투여를 받고 6개월째에 세 번째 투여를 받았습니다. 면역원성은 백신 접종 후 1개월 (Menactra 및 Adacel의 경우 1회 투여, GARDASIL 9의 경우 3회 투여)에 모든 백신에 대해 평가했습니다.
백신 접종 후 면역 반응 평가에는 GARDASIL 9의 마지막 투여 후 4주에 각 백신 HPV 유형에 대한 유형 특이적 항체 GMT, Adacel 투여 후 4주에 항-필라멘트 헤마글루티닌, 항-퍼택틴 및 항-섬유 항체에 대한 GMT, Adacel 투여 후 4주에 항-파상풍 독소 및 항-디프테리아 독소 항체 농도 ≥0.1 IU/mL인 피험자의 비율, 그리고 Menactra 투여 후 4주에 백신 접종 전 기준선에서 N. meningitidis 혈청군 A, C, Y 및 W-135에 대한 항체 역가가 ≥4배 증가한 피험자의 비율이 포함되었습니다. 이러한 측정 결과를 기반으로, GARDASIL 9와 Menactra 및 Adacel의 동시 투여는 GARDASIL 9와 Menactra 및 Adacel의 비동시 투여와 비교했을 때 어떤 백신에 대한 항체 반응에도 영향을 미치지 않았습니다.
15 참고 문헌
- Study 1 NCT00543543
- Study 2 NCT00943722
- Study 3 NCT01304498
- Study 4 NCT01047345
- Study 5 NCT00988884
- Study 6 NCT01073293
- Study 7 NCT01651949
- Study 8 NCT01984697
- Study A NCT01432574
- Study B NCT00090285
- Study 9 NCT03158220
16 제공/보관 및 취급 방법
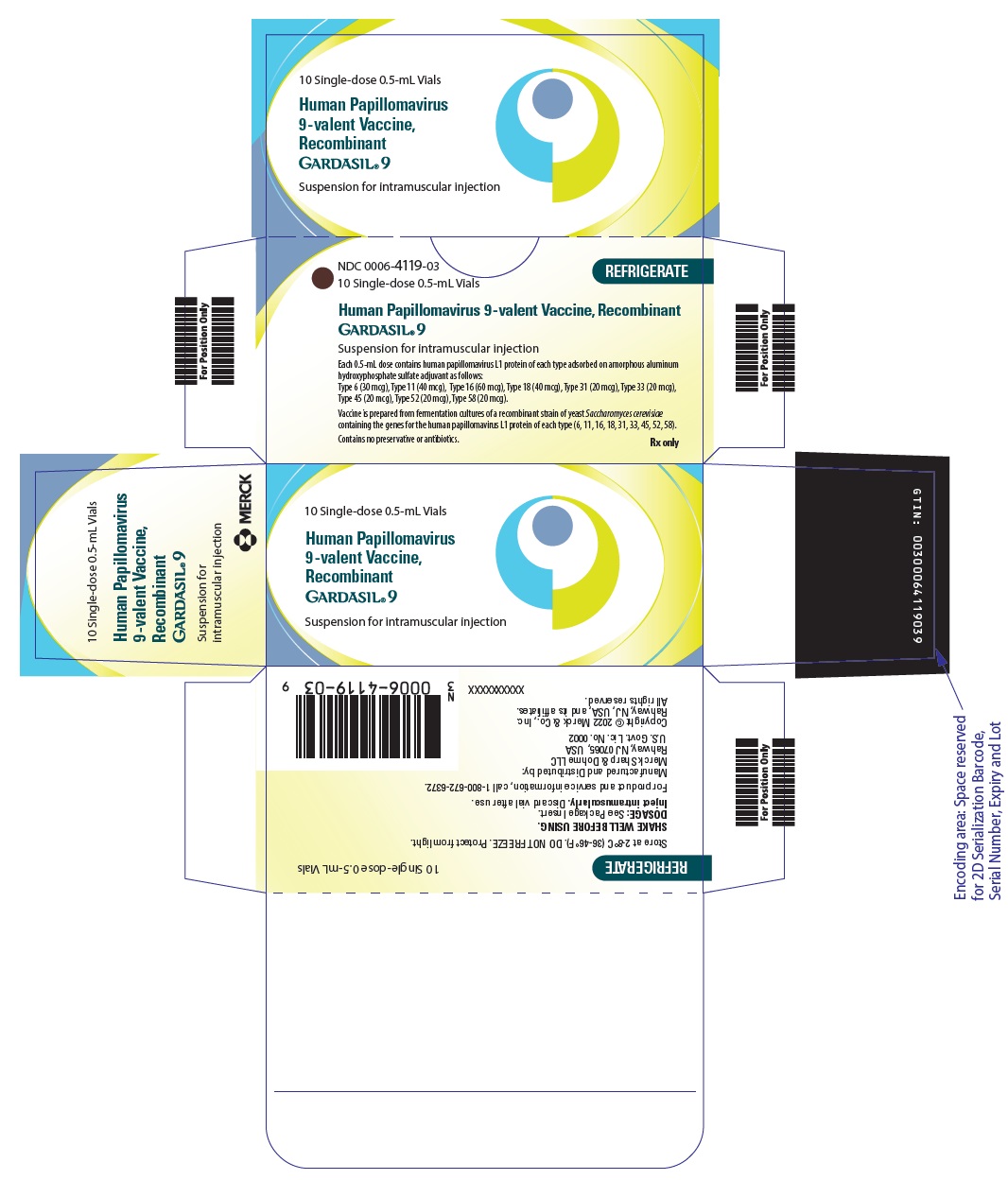
GARDASIL 9는 바이알과 주사기로 공급됩니다.
0.5mL 단회용 바이알 10개들이 상자. NDC 0006-4119-03
0.5mL 단회용 사전 충전 Luer Lock 주사기(팁 캡 포함) 10개들이 상자. NDC 0006-4121-02
2~8°C(36~46°F)에서 냉장 보관하십시오. 냉동하지 마십시오. 빛으로부터 보호하십시오.
GARDASIL 9는 냉장 보관에서 꺼낸 후 가능한 한 빨리 투여해야 합니다. GARDASIL 9는 냉장 보관에서 꺼낸 후 총(누적 다중 편차) 시간이 72시간을 초과하지 않는 한 투여할 수 있습니다(8°C~25°C). 0°C~2°C 사이의 누적 다중 편차도 0°C~2°C 사이의 총 시간이 72시간을 초과하지 않는 한 허용됩니다. 그러나 이는 보관 권장 사항이 아닙니다.
17 환자 상담 정보
환자에게 FDA 승인을 받은 환자 라벨링(환자 정보)을 읽어보도록 권고하십시오.
환자, 부모 또는 보호자에게 다음을 알립니다.
- 백신 접종을 받더라도 여성은 권장되는 자궁경부암 검진을 계속 받아야 합니다. GARDASIL 9를 접종받은 여성은 표준 치료법에 따라 자궁경부암 검진을 계속 받아야 합니다.
- GARDASIL 9 접종자는 의료 서비스 제공자가 권장하는 경우 항문암 검진을 중단해서는 안 됩니다.
- GARDASIL 9는 성적 접촉을 통해 이전에 노출된 적이 있는 백신 및 비백신 HPV 유형으로 인한 질병에 대한 예방 효과가 입증되지 않았습니다.
- HPV 백신 접종 후 실신이 보고되었으며, 때때로 넘어져 부상을 입는 경우가 있으므로 투여 후 15분 동안 관찰하는 것이 좋습니다.
- 백신 정보는 매회 접종 시 환자, 부모 또는 보호자에게 제공해야 합니다.
- 백신 접종과 관련된 이점과 위험에 대한 정보를 제공합니다.
- GARDASIL 9의 안전성과 유효성은 임산부를 대상으로 확립되지 않았습니다.
- 금기 사항이 없는 한 전체 백신 접종 시리즈를 완료하는 것이 중요합니다.
- 모든 부작용을 의료 서비스 제공자에게 보고하십시오.
SPL 미분류 섹션
제조 및 판매: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
특허 정보: www.msd.com/research/patent
본 문서에 표시된 상표는 각 회사의 소유입니다.
Copyright © 2006-2024 Merck & Co., Inc., Rahway, NJ, USA 및 계열사.
모든 권리 보유.
uspi-v503-i-2403r016
가다실®9 (가드아실 나인) (인유두종바이러스 9가 백신, 재조합)에 대한 환자 정보
GARDASIL®9를 맞기 전에 이 정보를 주의 깊게 읽어보십시오. 귀하 또는 귀하의 자녀(GARDASIL 9를 맞는 사람)는 나이에 따라 백신을 2회 또는 3회 맞아야 합니다. 각 회차를 맞기 전에 이 정보를 읽는 것이 중요합니다. 이 정보는 GARDASIL 9에 대해 의료 전문가와 상담하는 것을 대신할 수 없습니다.
GARDASIL 9는 무엇입니까?
GARDASIL 9는 9세에서 45세까지의 개인에게 인유두종 바이러스(HPV)의 일부 유형으로 인한 질병으로부터 보호하는 데 도움이 되는 백신(주사/주사)입니다.
GARDASIL 9는 어떤 질병으로부터 보호하는 데 도움이 될 수 있습니까?
9세에서 45세까지의 여성의 경우 GARDASIL 9는 다음 질병으로부터 보호하는 데 도움이 됩니다.
- 자궁경부암
- 외음 및 질암
- 항문암
- 인후 및 입 뒤 암과 같은 특정 머리 및 목암
- 자궁경부, 외음, 질 및 항문의 전암성 병변
- 생식기 사마귀
9세에서 45세까지의 남성의 경우 GARDASIL 9는 다음 질병으로부터 보호하는 데 도움이 됩니다.
- 항문암
- 인후 및 입 뒤 암과 같은 특정 머리 및 목암
- 전암성 항문 병변
- 생식기 사마귀
이러한 질병은 HPV 유형 6, 11, 16, 18, 31, 33, 45, 52 및 58을 포함한 여러 원인이 있을 수 있습니다. GARDASIL 9는 이러한 9가지 유형의 HPV로 인한 질병으로부터만 보호합니다.
사람들은 GARDASIL 9에서 HPV 또는 이러한 질병에 걸릴 수 없습니다.
GARDASIL 9에 대한 중요한 정보는 무엇입니까?
GARDASIL 9:
- 의료 전문가가 권장하는 대로 자궁경부, 외음, 질, 항문 및 인후 및 입 뒤 암과 같은 특정 머리 및 목암에 대한 검사가 필요하지 않습니다. 여성은 여전히 정기적인 자궁경부암 검사를 받아야 합니다.
- GARDASIL 9를 맞는 사람을 다른 유형의 HPV, 다른 바이러스 또는 박테리아로 인한 질병으로부터 보호하지 않습니다.
- HPV 감염을 치료하지 않습니다.
- GARDASIL 9를 맞는 사람이 이미 가지고 있을 수 있는 HPV 유형으로부터 보호하지 않습니다.
GARDASIL 9는 백신을 맞는 모든 사람을 완전히 보호하지 못할 수 있습니다.
누가 GARDASIL 9를 맞지 말아야 합니까?
다음에 알레르기 반응이 있는 사람:
- GARDASIL 9의 이전 복용량
- GARDASIL®의 이전 복용량
- 효모(심한 알레르기 반응)
- 무정형 알루미늄 하이드록시포스페이트 설페이트
- 폴리소르베이트 80
GARDASIL 9를 맞기 전에 의료 전문가에게 무엇을 알려야 합니까?
귀하 또는 귀하의 자녀(GARDASIL 9를 맞는 사람)가 다음과 같은 경우 의료 전문가에게 알리십시오.
- 임신 중이거나 임신을 계획 중입니다.
- HIV 또는 암과 같은 면역 문제가 있습니다.
- 면역 체계에 영향을 미치는 약을 복용합니다.
- 체온이 100°F(37.8°C) 이상입니다.
- GARDASIL 9 또는 GARDASIL의 이전 복용량에 알레르기 반응이 있었을 수 있습니다.
- 처방전 없이 구입할 수 있는 약을 포함하여 모든 약을 복용합니다.
의료 전문가가 귀하 또는 귀하의 자녀가 백신을 맞아야 하는지 결정하는 데 도움을 줄 것입니다.
GARDASIL 9는 어떻게 투여됩니까?
GARDASIL 9는 일반적으로 팔 근육에 주사하는 주사입니다. GARDASIL 9는 2회 또는 3회 주사로 투여될 수 있습니다.
| 다음과 같은 사람의 경우 | 필요한 복용량 | 투여 방식 |
|---|---|---|
| 9세에서 14세까지 | 2회 주사* | 1차: 첫 번째 주사 2차: 첫 번째 주사 후 6개월에서 12개월 사이에 두 번째 주사 |
| 또는 3회 주사† | 1차: 첫 번째 주사 2차: 첫 번째 주사 후 2개월에 두 번째 주사 3차: 첫 번째 주사 후 6개월에 세 번째 주사 |
|
| 15세에서 45세까지 | 3회 주사 | 1차: 첫 번째 주사 2차: 첫 번째 주사 후 2개월에 두 번째 주사 3차: 첫 번째 주사 후 6개월에 세 번째 주사 |
건강 관리 전문가가 권장하는 모든 용량을 귀하 또는 귀하의 자녀가 받도록 하여 귀하 또는 귀하의 자녀가 최상의 보호를 받도록 하십시오. GARDASIL 9를 맞은 사람이 용량을 놓친 경우 건강 관리 전문가에게 알리면 건강 관리 전문가가 놓친 용량을 언제 투여할지 결정합니다. 후속 용량을 위한 재진료와 관련하여 건강 관리 전문가의 지시를 따라야 합니다.
HPV 백신 접종 후 실신이 발생할 수 있습니다. 실신하는 사람들은 때때로 넘어져 다칠 수 있습니다. 이러한 이유로 건강 관리 전문가는 GARDASIL 9를 맞은 사람에게 백신 접종 후 15분 동안 앉거나 누워 있도록 요청할 수 있습니다. 실신하는 일부 사람들은 떨리거나 뻣뻣해질 수 있습니다. 건강 관리 전문가가 GARDASIL 9를 맞은 사람을 치료해야 할 수도 있습니다.
GARDASIL을 이미 맞았다면 GARDASIL 9를 맞을 수 있나요?
GARDASIL을 이미 맞았다면 건강 관리 전문가와 상담하여 GARDASIL 9가 귀하에게 적합한지 확인하십시오.
다른 백신과 함께 GARDASIL 9를 맞을 수 있나요?
GARDASIL 9는 다음과 함께 동시에 투여할 수 있습니다.
- Menactra [수막구균 (A, C, Y 및 W-135군) 다당류 디프테리아 독소 접합 백신]
- Adacel [파상풍 독소, 감소된 디프테리아 독소 및 무세포 백일해 백신 흡착 (Tdap)]
GARDASIL 9의 가능한 부작용은 무엇인가요?
GARDASIL 9에서 가장 흔히 나타나는 부작용은 다음과 같습니다.
- 주사를 맞은 부위의 통증, 부기, 발적, 가려움증, 멍, 출혈 및 덩어리
- 두통
- 발열
- 메스꺼움
- 현기증
- 피로
- 설사
- 복통
- 목 아픔
연구에 따르면 GARDASIL 9를 Menactra 및/또는 Adacel과 동시에 투여했을 때 주사를 맞은 부위의 부기가 더 많았습니다.
다음과 같은 문제가 발생하면 건강 관리 전문가에게 알리십시오. 이러한 문제는 알레르기 반응의 징후일 수 있습니다.
- 호흡 곤란
- 천명 (기관지 경련)
- 두드러기
- 발진
GARDASIL 9의 일반적인 사용 중에 보고된 추가 부작용은 아래에 나와 있습니다. GARDASIL의 일반적인 사용 중에 보고된 부작용도 아래에 나와 있습니다. 백신의 구성이 유사하기 때문에 GARDASIL 부작용은 GARDASIL 9와 관련이 있을 수 있습니다.
GARDASIL 9
- 구토
- 두드러기
또한, 다음 부작용은 GARDASIL의 일반적인 사용에서 관찰되었습니다.
GARDASIL
- 림프절 부종 (목, 겨드랑이 또는 사타구니)
- 관절통
- 비정상적인 피로, 쇠약 또는 혼란
- 오한
- 전반적으로 불편함
- 다리 통증
- 호흡 곤란
- 가슴 통증
- 근육통
- 근력 저하
- 발작
- 심한 복통
- 평소보다 쉽게 출혈 또는 멍이 들기
- 피부 감염
불편한 증상이 나타나면 즉시 건강 관리 전문가에게 연락해야 합니다.
부작용에 대한 자세한 목록은 건강 관리 전문가에게 문의하십시오.
부작용에 대한 의학적 조언은 건강 관리 전문가에게 문의하십시오. 또한 의사에게 또는 백신 부작용 보고 시스템 (VAERS)에 직접 부작용을 보고할 수 있습니다. VAERS 무료 전화번호는 1-800-822-7967 또는 온라인으로 보고할 수 있습니다. www.vaers.hhs.gov .
GARDASIL 9는 임신 사실을 알고 있는 여성에게는 연구되지 않았습니다. 귀하 또는 귀하의 자녀 (GARDASIL 9를 맞는 사람)가 임신 중이거나 임신을 계획하고 있다면 의사 또는 건강 관리 전문가에게 알리십시오.
GARDASIL 9에는 무엇이 들어 있나요?
GARDASIL 9에는 다음이 포함되어 있습니다.
- HPV 6형, 11형, 16형, 18형, 31형, 33형, 45형, 52형 및 58형 단백질
- 무정형 알루미늄 하이드록시포스페이트 설페이트
- 효모 단백질
- 염화나트륨
- L-히스티딘
- 폴리소르베이트 80
- 붕산나트륨
- 물
이 문서는 GARDASIL 9에 대한 정보 요약입니다.
GARDASIL 9에 대한 자세한 내용은 건강 관리 전문가에게 문의하거나 www.GARDASIL9.com 을 방문하십시오.
SPL 미분류 섹션
제조 및 판매: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
특허 정보: www.msd.com/research/patent
본 문서에 표시된 상표는 각 회사의 소유입니다.
Copyright © 2006-2024 Merck & Co., Inc., Rahway, NJ, USA 및 계열사.
모든 권리 보유.
개정: 2024년 3월
usppi-v503-i-2403r007
주요 표시면 – 0.5 mL 바이알 상자
NDC 0006-4119-03
10 단회용 0.5mL 바이알
냉장 보관
인간 유두종 바이러스 9가 백신, 재조합
GARDASIL® 9
근육 내 주사용 현탁액
각 0.5mL 용량은 다음과 같이 비정형 알루미늄 수산화인산염 황산염 보조제에 흡착된 각 유형의 인간 유두종 바이러스 L1 단백질을 함유합니다:
6형 (30 mcg), 11형 (40 mcg), 16형 (60 mcg), 18형 (40 mcg), 31형 (20 mcg), 33형 (20 mcg),
45형 (20 mcg), 52형 (20 mcg), 58형 (20 mcg).
백신은 각 유형(6, 11, 16, 18, 31, 33, 45, 52, 58)의 인간 유두종 바이러스 L1 단백질 유전자를 포함하는 재조합 효모 Saccharomyces cerevisiae
의 발효 배양에서 제조됩니다.
방부제 또는 항생제를 함유하지 않습니다.
처방전에 의해서만 구입 가능
주요 표시면 – 0.5 mL 주사기 상자
NDC 0006-4121-02
10 개별 용량 0.5-mL 주사기
냉장 보관
인유두종 바이러스
9가 백신, 재조합
GARDASIL® 9
근육 내 주사용 현탁액
각 0.5-mL 용량은 다음과 같이 무정형 알루미늄 수산화인산염 황산염 보조제에 흡착된 각 유형의 인유두종 바이러스 L1 단백질을 함유합니다.
유형 6 (30 mcg), 유형 11 (40 mcg), 유형 16 (60 mcg), 유형 18 (40 mcg),
유형 31 (20 mcg), 유형 33 (20 mcg), 유형 45 (20 mcg), 유형 52 (20 mcg),
유형 58 (20 mcg).
백신은 각 유형(6, 11, 16, 18, 31, 33, 45, 52, 58)의 인유두종 바이러스 L1 단백질 유전자를 포함하는 재조합 효모 균주
Saccharomyces cerevisiae의 발효 배양에서 제조됩니다.
방부제 또는 항생제를 함유하지 않습니다.
처방전에 의해서만 구입 가능


