의약품 제조업체: Takeda Pharmaceuticals America, Inc. (Updated: 2025-01-06)
처방 정보 하이라이트
FEIBA® (항억제제 응고 복합체)
정맥 주사용 용액용 동결건조 분말
미국 최초 승인: 1986
적응증 및 용법
FEIBA는 다음과 같은 억제제가 있는 A형 및 B형 혈우병 환자에게 사용되는 항억제제 응고 복합체입니다.
- 출혈 발생의 조절 및 예방.
- 수술 전후 관리.
- 출혈 발생 빈도를 예방하거나 줄이기 위한 일상적인 예방.
FEIBA는 VIII 인자 또는 IX 인자에 대한 억제제가 없는 경우 응고 인자 결핍으로 인한 출혈 발생의 치료에는 적응증이 없습니다. (1)
투여 및 투여 방법
제형 및 함량
FEIBA는 바이알당 500, 1000 또는 2500단위를 명목상 함유하는 1회용 바이알의 동결건조 분말로 제공됩니다. (3)
금기 사항
경고 및 주의 사항
- FEIBA는 1일 체중 kg당 200단위 이상의 용량 투여 후 및 혈전증 위험 요인이 있는 환자에서 혈전색전증을 유발할 수 있습니다. FEIBA를 투여받는 환자에 대해 혈전색전증의 징후 및 증상을 모니터링하십시오. (5.1)
- 아나필락시스 및 중증 과민 반응이 발생할 수 있습니다. 증상이 발생하면 FEIBA 치료를 중단하고 적절한 치료를 실시하십시오. (5.2)
- FEIBA는 사람 혈장으로 만들어졌으며 바이러스, 변형 크로이츠펠트-야코브병 (vCJD) 및 이론적으로 크로이츠펠트-야코브병 (CJD) 병원체와 같은 감염성 물질을 포함할 수 있습니다. (5.3)
유해 반응
- 피험자의 5% 이상에서 관찰된 가장 흔한 유해 반응은 빈혈, 설사, 혈관절, B형 간염 표면 항체 양성, 메스꺼움 및 구토였습니다. (6.1)
- 중대한 유해 약물 반응은 과민 반응 및 뇌졸중, 폐색전증 및 심부 정맥 혈전증을 포함한 혈전색전증입니다. (5.1, 5.2, 6)
의심되는 유해 반응을 보고하려면 Takeda Pharmaceuticals U.S.A., Inc.에 1-877-TAKEDA-7 (1-877-825-3327) 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호작용
트란 넥사믹산 및 아미노카프로산과 같은 전신성 항섬유소용해제를 사용할 때 혈전증 가능성을 고려하십시오. FEIBA 투여 후 약 6~12시간 이내에 항섬유소용해제를 사용하는 것은 권장하지 않습니다. (7)
환자 상담 정보는 17번을 참조하십시오.
개정: 12/2024
목차
전문 처방 정보: 목차*
경고: 색전 및 혈전성 사건
1 적응증 및 용법
2 용량 및 투여
2.1 용량
2.2 준비 및 재구성
2.3 투여
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 색전 및 혈전성 사건
5.2 과민 반응
5.3 감염성 병원체의 전파
5.4 동종응집소의 존재 및 실험실 검사 간섭
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 병용 약물
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아에서의 사용
8.5 노인에서의 사용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 장애
14 임상 연구
15 참고문헌
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전문 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: 색전증 및 혈전증 발생
- FEIBA 주입 후, 특히 고용량 투여 시 및/또는 혈전증 위험 인자가 있는 환자에서 시판 후 조사 중 혈전색전증 사례가 보고되었습니다.
- FEIBA를 투여받는 환자에게서 혈전색전증의 징후 및 증상을 모니터링하십시오.
1 적응증 및 사용법
FEIBA는 억제인자를 가진 A형 및 B형 혈우병 환자에서 다음과 같은 경우에 사용하는 항억제제 응고 복합체입니다.
- 출혈 발생의 조절 및 예방
- 수술 전후 관리
- 출혈 발생의 빈도를 예방하거나 감소시키기 위한 일상적인 예방요법.
FEIBA는 VIII인자 또는 IX인자에 대한 억제인자가 없는 경우 응고인자 결핍으로 인한 출혈 발생의 치료에는 적응증이 없습니다.
2 용법 및 투여
재구성 후 정맥 주사용입니다.
2.1 용량
FEIBA 투여 용량에 대한 지침은 표 1에 나와 있습니다.
| 용량 (단위/kg) | 투여 빈도 (시간) | 치료 기간 | |
|---|---|---|---|
| 출혈 조절 및 예방 | |||
| 관절 출혈 | 50 – 100 | 12 | 통증과 급성 장애가 호전될 때까지. |
| 점막 출혈 | 50 – 100 | 6 | 최소 1일 또는 출혈이 해결될 때까지. |
| 연조직 출혈 (예: 복막후 출혈) |
100 | 12 | 출혈이 해결될 때까지. |
| 기타 중증 출혈 (예: 중추신경계 출혈) |
100 | 6 – 12 | 출혈이 해결될 때까지. |
| 수술 전후 관리 | |||
| 수술 전 | 50 – 100 | 1회 용량 | 수술 직전. |
| 수술 후 | 50 – 100 | 6 – 12 | 출혈이 해결되고 치유될 때까지. |
| 일상적 예방 | |||
| 85 | 격일 | ||
- 투여량 및 치료 기간은 출혈의 위치와 정도, 환자의 임상 상태에 따라 달라집니다. 중대한 수술 또는 생명을 위협하는 출혈 발생 시에는 대체 요법을 신중하게 모니터링해야 합니다.
- FEIBA 바이알 하나에는 라벨에 표시된 양의 VIII 인자 억제제 우회 활성 단위가 포함되어 있습니다.
- FEIBA의 용량 및 빈도는 개별 환자의 임상 반응에 따라 결정합니다. FEIBA 치료에 대한 임상 반응은 환자마다 다를 수 있으며 환자의 억제제 역가와 상관관계가 없을 수 있습니다.
- 환자와 제품 배치 간의 연관성을 유지하기 위해 환자의 이름과 제품 배치 번호를 기록합니다.
- 체중 kg당 100단위를 초과하는 단일 용량 또는 체중 kg당 200단위를 초과하는 일일 용량을 투여하지 마십시오 [경고 및 주의사항 (5.1) 참조].
2.2 조제 및 용해
- 전체 용해 과정에서 무균 기법을 사용하십시오.
- 환자가 주사당 바이알을 하나 이상 사용하는 경우, 각 바이알을 다음 지침에 따라 용해하십시오.
- 냉장 보관한 경우 FEIBA 및 주사용 멸균수(희석제) 바이알을 실온에 도달하도록 합니다.
- 농축액 및 희석제 바이알에서 플라스틱 캡을 제거합니다.
- 두 바이알의 마개를 멸균 알코올 솜으로 닦고 사용 전에 말립니다.
- 내부를 만지지 않고 뚜껑을 완전히 벗겨 BAXJECT II Hi-Flow 장치 포장을 엽니다 (그림 A). 장치를 포장에서 제거하지 마십시오. 투명한 스파이크를 만지지 마십시오.
- 희석제 바이알을 평평하고 단단한 표면에 놓습니다. 포장을 뒤집어 투명 플라스틱 스파이크를 희석제 마개에 수직으로 눌러 삽입합니다 (그림 B).
- BAXJECT II Hi-Flow 장치 포장의 가장자리를 잡고 포장을 장치에서 벗겨냅니다 (그림 C). BAXJECT II Hi-Flow 장치에서 파란색 보호 캡을 제거하지 마십시오. 보라색 스파이크를 만지지 마십시오.
- 희석제 바이알이 위로 향하도록 시스템을 뒤집습니다. BAXJECT II Hi-Flow 장치의 보라색 스파이크를 FEIBA 바이알에 완전히 삽입합니다. 진공에 의해 희석제가 FEIBA 바이알로 흡입됩니다 (그림 D). 두 바이알의 연결은 스파이크를 희석제 바이알에 처음 삽입하여 생성된 개방된 유체 통로를 신속하게 닫기 위해 신속하게 수행해야 합니다.
- FEIBA가 완전히 용해될 때까지 바이알을 부드럽게 흔들어 줍니다(흔들지 마십시오). FEIBA가 완전히 용해되었는지 확인하십시오. 그렇지 않으면 활성 물질이 장치 필터를 통과하지 못합니다. 재구성된 용액은 투여 전에 이물질이 있는지 시각적으로 검사해야 합니다. 용액이 맑지 않거나 변색된 경우 폐기해야 합니다.
- FEIBA의 재구성이 완료되면 주사 또는 주입을 즉시 시작해야 하며 재구성 후 3시간 이내에 완료해야 합니다. 재구성 후 냉장 보관하지 마십시오. 사용하지 않은 부분은 버립니다.
그림 A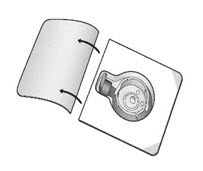 |
그림 B |
그림 C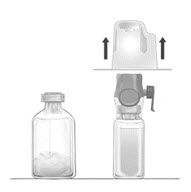 |
그림 D |
2.3 투여
재구성 후 정맥 주사 또는 정맥 주입에만 사용합니다.
- 투여 전에 재구성된 FEIBA 용액을 시각적으로 검사하여 이물질과 변색 여부를 확인합니다. 용액의 외관은 무색에서 약간 황색을 띠어야 합니다. 이물질이나 변색이 관찰되는 경우 사용하지 마십시오.
- FEIBA 주입 전후에 등장액 생리식염수로 정맥 접근 라인을 플러싱합니다. 다른 의약품과 같은 튜브 또는 용기에 투여하지 마십시오.
- FEIBA와 같은 단백질은 전유리 주사기에 달라붙는 경향이 있으므로 플라스틱 루어 락 주사기를 사용하십시오.
- BAXJECT II Hi-Flow 장치에서 파란색 보호 캡을 제거합니다. 주사기를 시계 방향으로 돌려 정지 위치까지 BAXJECT II Hi-Flow 장치에 단단히 연결합니다(주사기에 공기를 흡입하지 마십시오). 주사기와 BAXJECT II Hi-Flow 장치 간의 단단한 연결을 보장하기 위해 루어 락 주사기 사용을 적극 권장합니다 (그림 E).
- 용해된 FEIBA 제품이 위로 향하도록 시스템을 뒤집습니다. 거품이 생기지 않도록 플런저를 천천히 뒤로 당겨 용해된 제품을 주사기에 조심스럽게 흡입합니다 (그림 F).
- BAXJECT II Hi-Flow 장치와 주사기 사이의 단단한 연결이 유지되도록 합니다.
- 주사기를 분리합니다.
- 적절한 바늘을 부착하고 체중 kg당 분당 10단위를 초과하지 않는 속도로 정맥 주사 또는 주입합니다. 주사기 펌프를 사용하여 투여 속도를 조절할 수 있습니다. 체중 75kg인 환자의 경우 분당 최대 15mL의 주입 속도에 해당합니다.
그림 E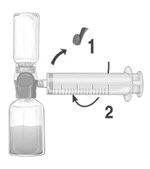 |
그림 F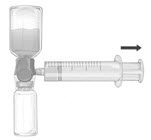 |
3 제형 및 함량
FEIBA는 공칭 500, 1000 또는 2500 유닛/바이알을 함유한 단일 용량 유리 바이알에 동결건조 분말로 제공됩니다.
4 금기 사항
- FEIBA 또는 그 구성성분 (키닌 생성 시스템의 인자 포함)에 대한 알려진 아나필락시스 또는 중증 과민반응.
- 파종성 혈관내 응고 (DIC).
- 급성 혈전증 또는 폐색전증 (심근경색증 포함).
5 경고 및 주의사항
5.1 색전 및 혈전증 발생
특히 고용량 (1일 체중 kg당 200단위 초과) 투여 후 및/또는 혈전증 위험 인자가 있는 환자에서 FEIBA와 관련하여 혈전색전증 (정맥 혈전증, 폐색전증, 심근 경색 및 뇌졸중 포함)이 발생할 수 있습니다 [유해 반응 (6) 참조].
DIC, 진행성 죽상동맥경화증, 압궤 손상, 패혈증 또는 재조합 VIIa 인자와의 병용 치료를 받는 환자는 순환 조직 인자 또는 소인이 되는 응고병증으로 인해 혈전증이 발생할 위험이 증가합니다. FEIBA 치료의 잠재적 이점은 이러한 혈전색전증의 잠재적 위험과 비교해야 합니다.
체중 kg당 100단위 이상의 FEIBA를 투여받는 환자는 DIC, 급성 관상 동맥 허혈 및 기타 혈전색전증의 징후 및 증상이 발생하는지 모니터링합니다. 흉통 또는 압박감, 호흡 곤란, 의식, 시력 또는 언어 변화, 사지 또는 복부 부종 및/또는 통증과 같은 임상 징후 또는 증상이 나타나면 수액 주입을 중단하고 적절한 진단 및 치료 조치를 시작합니다.
에미시주맙을 투여받는 환자의 돌발성 출혈에 대한 FEIBA의 안전성 및 유효성은 확립되지 않았습니다. 에미시주맙 치료 후 돌발성 출혈에 대한 치료 요법의 일환으로 피험자가 FEIBA를 투여받은 임상 시험에서 혈전성 미세 혈관 병증 (TMA) 사례가 보고되었습니다.6 에미시주맙 예방 요법을 받는 환자에게 FEIBA가 필요하다고 판단되는 경우 이점과 위험을 고려하십시오. 에미시주맙을 투여받는 환자에게 FEIBA 치료가 필요한 경우, 혈우병 치료 의사는 TMA의 징후와 증상을 면밀히 모니터링해야 합니다. FEIBA 임상 연구에서 혈전성 미세 혈관 병증 (TMA)은 보고되지 않았습니다.
5.2 과민 반응
FEIBA 주입 후 과민 반응 및 알레르기 반응 (심한 아나필락토이드 반응 포함)이 발생할 수 있습니다. 증상에는 두드러기, 안젤오에데마, 위장 증상, 기관지 경련 및 저혈압이 포함됩니다. 이러한 반응은 심각하고 전신적일 수 있습니다 (예: 두드러기 및 안젤오에데마, 기관지 경련 및 순환 쇼크를 동반한 아나필락시스). 오한, 발열 및 고혈압과 같은 기타 수액 반응도 보고되었습니다. 심각한 알레르기 반응의 징후와 증상이 나타나면 FEIBA 투여를 즉시 중단하고 적절한 지지 치료를 제공합니다.
5.3 감염성 인자 전파
FEIBA는 사람 혈장으로 만들어졌기 때문에 바이러스와 같은 감염성 인자 및 변이형 크로이츠펠트-야코브병 (vCJD) 인자, 이론적으로는 크로이츠펠트-야코브병 (CJD) 인자를 전파할 위험이 있을 수 있습니다. 특정 바이러스에 대한 이전 노출 여부에 대한 혈장 기증자 선별, 특정 현재 바이러스 감염의 존재 여부 검사 및 제조 과정에서 특정 바이러스의 불활성화 및 제거를 통해 위험이 최소화되었습니다 [설명 (11) 참조]. 이러한 조치에도 불구하고 제품은 여전히 인간 병원체를 전파할 수 있습니다. 알려지지 않은 감염성 인자가 여전히 존재할 가능성도 있습니다.
의사가 이 제품에 의해 전파되었을 가능성이 있다고 생각하는 모든 감염은 의사 또는 기타 의료 제공자가 Takeda Pharmaceuticals U.S.A., Inc. (미국 내 1-877-TAKEDA-7 (1-877-825-3327)) 및/또는 FDA Med Watch (1-800-FDA-1088 또는 www.fda.gov/medwatch)에 보고해야 합니다.
5.4 동종혈구응집소의 존재 및 검사 결과의 간섭
FEIBA에는 혈액형 동종혈구응집소 (항-A 및 항-B)가 포함되어 있습니다. 적혈구 항원 (예: A, B, D)에 대한 항체의 수동 전달은 항글로불린 검사 (Coombs 검사)와 같은 적혈구 항체에 대한 일부 혈청학적 검사를 방해할 수 있습니다.
6 부작용 반응
예방 시험에서 5% 이상의 피험자에게서 가장 흔하게 보고된 이상 반응은 빈혈, 설사, 혈관절 출혈, B형 간염 표면 항체 양성, 오심 및 구토였습니다.
FEIBA와 관련하여 나타나는 심각한 이상 반응은 과민반응 및 혈전색전증(뇌졸중, 폐색전증 및 심부 정맥 혈전증 포함)입니다.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실제에서 관찰된 발생률을 반영하지 않을 수도 있습니다.
FEIBA의 안전성 평가는 FEIBA를 급성 출혈 에피소드 치료에 사용한 두 건의 전향적 임상 시험 및 FEIBA의 예방적 사용과 필요에 따른 치료를 비교한 전향적 시험의 데이터 검토를 기반으로 합니다.
FEIBA를 급성 출혈 에피소드 치료에 사용한 두 건의 전향적 임상 시험에서 보고된 이상 반응은 오한, 흉통, 흉부 불편감, 현기증, 미각 이상, 호흡 곤란, 감각 저하, 억제제 역가 증가(기억 반응), 오심, 발열 및 졸음이었습니다. 특히, 첫 번째 시험은 VIII 인자에 대한 억제제가 있는 15명의 A형 혈우병 환자를 대상으로 한 다기관 무작위 이중맹검 시험이었습니다. 두 번째 시험은 억제제가 있는 44명의 A형 혈우병 환자, 억제제가 있는 3명의 B형 혈우병 환자 및 획득성 VIII 인자 억제제 환자 2명을 대상으로 실시한 다기관 FEIBA 연구였습니다. 두 번째 시험 중 급성 출혈 치료에 사용된 489회의 주입 중 18회(3.7%)가 오한, 발열, 오심, 현기증 및 미각 이상과 같은 경미한 일과성 반응을 유발했습니다. 49명의 피험자 중 10명(20%)은 FEIBA 치료 후 억제제 역가가 증가했습니다. 이러한 피험자 중 5명(50%)은 10배 이상 증가했으며, 이러한 피험자 중 3명(30%)은 FEIBA 치료 2주 전에 VIII 인자 또는 IX 인자 농축액을 투여받았습니다. 이러한 기억 반응은 FEIBA의 효능 감소와 관련이 없었습니다.
표 2는 억제제가 있는 36명의 A형 및 B형 혈우병 환자를 대상으로 FEIBA 예방 요법과 필요에 따른 치료를 비교한 무작위 전향적 예방 시험에서 5% 이상의 피험자에게 보고된 이상 반응을 나타냅니다3. 시험 대상자는 A형 혈우병 환자 33명(92%), B형 혈우병 환자 3명(8.3%)이었습니다. 4명(11%)의 피험자는 7세 이상 12세 미만이었고, 5명(14%)은 12세 이상 16세 미만이었고, 27명(75%)은 16세 이상이었습니다. 총 29명(80.6%)의 피험자는 백인이었고, 3명(8.3%)은 아시아인이었고, 2명(5.6%)은 흑인/아프리카계 미국인이었고, 2명(5.6%)은 기타였습니다. 피험자는 총 4,513회의 주입(예방 3,131회, 필요에 따른 치료 1,382회)을 받았습니다.
| MedDRA 장기계 분류 | 이상 반응 | 이상 반응 수 | 피험자 수 | 피험자 비율 (N=36) |
|---|---|---|---|---|
| 혈액 및 림프계 장애 | 빈혈 | 2 | 2 | 5.6 |
| 위장 장애 | 설사 | 2 | 2 | 5.6 |
| 오심 | 2 | 2 | 5.6 | |
| 구토 | 2 | 2 | 5.6 | |
| 검사 | B형 간염 표면 항체 양성 | 4 | 4 | 11.1 |
| 근골격계 및 결합조직 장애 | 혈관절 출혈 | 5 | 3 | 8.3 |
표 3은 세 그룹(50% 용량 감소, 속도 증가 4 U/kg/min; 50% 용량 감소, 속도 증가 10 U/kg/min; 전체 50% 용량 감소) 모두에서 5% 이상의 피험자에게 보고된 유해 반응 및 주입 관련 유해 사건을 보여줍니다. 이는 억제제가 있는 선천성 A형 혈우병 환자 33명을 대상으로 FEIBA의 표준 주입 속도 2 U/kg/min과 증가된 속도 4 및 10 U/kg/min에서 감소된 용량의 내약성 및 안전성을 평가하기 위한 무작위 전향적 교차 시험의 결과입니다.
| MedDRA 시스템 장기 분류 | 유해 반응 | 50% 용량 감소; 속도 증가 4 U/kg/min (N=30) n (%); m |
50% 용량 감소; 속도 증가 10 U/kg/min (N=28) n (%); m |
전체 50% 용량 감소* (N=30) n (%); m |
|
|---|---|---|---|---|---|
| n=피험자 수, m=사건 수 | |||||
|
|||||
| 유해 반응(ARs) | 신경계 장애 | 두통 | 0 | 0 | 2 (6.7%); 2 |
| 주입 관련 유해 사건 | 신경계 장애 | 두통 | 0 | 0 | 2 (6.7%); 2 |
6.2 시판 후 경험
다음 유해 반응은 FEIBA의 시판 후 사용 중에 확인되었습니다. 유해 반응에 대한 시판 후 보고는 자발적이며 불확실한 규모의 모집단에서 이루어지기 때문에, 이러한 반응의 빈도를 신뢰할 수 있게 추정하거나 제품 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
혈액 및 림프계 장애: 파종성 혈관내 응고
심장 장애: 빈맥, 홍조
호흡기, 흉부 및 종격동 장애: 기관지 경련, 천명
위장 장애: 복통
피부 및 피하 조직 장애: 가려움증
일반 장애 및 투여 부위 상태: 권태감, 열감, 주사 부위 통증
검사: 피브린 D-이합체 증가
7 약물 상호 작용
7.1 동시 투여 약물
FEIBA 치료 중 트랜넥사믹산 및 아미노카프로산과 같은 전신적 항섬유소용해제를 사용할 경우 혈전색전증 발생 가능성을 고려하십시오. FEIBA와 재조합 VIIa 인자 항섬유소용해제 또는 emicizumab의 병용 또는 순차적 사용에 대한 적절하고 잘 통제된 연구는 수행되지 않았습니다. FEIBA 투여 후 약 6~12시간 이내에 항섬유소용해제를 사용하는 것은 권장하지 않습니다.
emicizumab 임상 시험의 임상 경험에 따르면, 돌발성 출혈 치료 요법의 일부로 FEIBA를 사용했을 때 emicizumab과의 상호작용 가능성이 있는 것으로 나타났습니다6 [경고 및 주의 사항 (5.1) 참조].
8 특정 집단에서의 사용
8.4 소아 사용
FEIBA의 안전성 및 유효성은 4명의 7세 이상 12세 미만 소아 및 5명의 12세 이상 16세 미만 소아를 포함하여 일상적 예방 시험에서 치료받은 9명의 소아 피험자에서 평가되었습니다. 모든 소아 피험자에 대한 투여량은 체중에 따라 결정되었습니다. 총 223건의 출혈 에피소드(관절 출혈 에피소드 504회 주입, 근육 및 연조직 출혈 에피소드 72회 주입) 치료를 위해 총 576회의 주입이 이루어졌습니다. 223건(100%)의 에피소드에서 한 번 이상의 주입으로 지혈이 달성되었습니다. 지혈 효능은 두 가지 요법 모두에서 주입 후 24시간에 출혈 에피소드의 대부분(96.9%)에서 우수하거나 양호한 것으로 평가되었습니다. 7세 이상 12세 미만 어린이의 중앙값 연간 출혈 에피소드율(ABR)은 환자 1인당 연간 7.7회의 출혈이었으며, 이는 필요에 따라 치료받은 피험자의 39회와 비교됩니다 [임상 연구(14) 참조].
신생아에서 FEIBA의 안전성 및 유효성은 평가되지 않았습니다.
11 설명
FEIBA (항인히비터 응고 복합체)는 정맥 주사를 위해 재구성되는 제8인자 억제제 우회 활성을 가진 동결건조된 무균 인간 혈장 분획입니다. 제8인자 억제제 우회 활성은 임의 단위로 표현됩니다. 활성의 한 단위는 고역가 제8인자 억제제 표준 혈장의 aPTT를 공백값의 50%로 단축시키는 FEIBA의 양으로 정의됩니다.
FEIBA는 주로 비활성화된 II, IX, X 인자와 주로 활성화된 VII 인자를 포함합니다. 제8인자 억제제 우회 활성 및 프로트롬빈 복합체 인자의 단위는 거의 동일합니다. 또한, 이 제제는 mL당 1-6 단위의 제8인자 응고 항원 (FVIII C:Ag)을 포함합니다. 이 제품은 키닌 생성 시스템 인자의 미량을 포함합니다. 헤파린은 포함되어 있지 않습니다. 재구성된 FEIBA는 mL당 4mg의 구연산삼나트륨과 8mg의 염화나트륨을 포함합니다.
FEIBA는 대량의 인간 혈장으로 제조됩니다. 잠재적으로 감염성이 있는 물질에 대한 선별은 기증자 선정 과정에서 시작하여 혈장 수집 및 혈장 제조 전반에 걸쳐 계속됩니다. FEIBA 제조에 사용되는 각 개별 혈장 기증은 FDA 승인 혈액 기관에서 수집되며, FDA 허가 세균학적 검사를 통해 B형 간염 표면 항원 (HBsAg) 및 인간 면역결핍 바이러스 (HIV-1/HIV-2) 및 C형 간염 바이러스 (HCV)에 대한 항체에 대해 검사됩니다. 혈장의 미니풀은 검사를 거쳐 FDA 허가 핵산 검사 (NAT)에 의해 HIV-1 및 HCV의 존재에 대해 음성으로 판명됩니다.
바이러스 전파 위험을 줄이기 위해 FEIBA의 제조 공정에는 35nm 나노여과 및 증기 열처리 공정이라는 두 가지 전용 독립 바이러스 제거/불활화 단계가 포함됩니다. 또한, DEAE-Sephadex 흡착은 FEIBA의 바이러스 안전성 프로필에 기여합니다.
In vitro 스파이킹 연구는 제조 공정의 바이러스 제거 및 불활화 능력을 검증하는 데 사용되었습니다. 표 4는 FEIBA에 대한 바이러스 제거 연구 결과를 요약한 것입니다.
| 바이러스 유형 | 피막 RNA | 피막 DNA | 무피막 RNA | 무피막 DNA | |||
|---|---|---|---|---|---|---|---|
| 바이러스과 | 레트로바이러스과 | 플라비바이러스과 | 헤르페스바이러스과 | 피코르나바이러스과 | 파르보바이러스과 | ||
|
|||||||
| 바이러스* | HIV-1 | BVDV | WNV | PRV | HAV | B19V† | MMV |
| DEAE Sephadex 흡착 | 3.2 | 1.8 | ND | 2.5 | 1.5 | 1.7 | 1.2 |
| 35nm 나노여과 | >5.3 | 2.1 | 4.7 | >5.7 | 2.6 | 0.2‡ | 1.0 |
| 증기 열처리 | >5.9 | >5.6 | >8.1 | >6.7 | >5.2 | 3.5 | 0.9‡ |
| 전체 바이러스 감소 인자 (log10) | >14.4 | >9.5 | >12.8 | >14.9 | >9.3 | 5.2 | 2.2 |
12 약물동력학
12.1 작용 기전 (Mechanism of Action)
FEIBA의 작용 기전은 아직 과학적 논의의 주제입니다. FEIBA는 주로 비활성화 인자 II, IX, X 및 주로 활성화된 인자 VII를 포함한 여러 성분을 함유하고 있습니다. 이러한 인자는 혈장 응고 인자 및 혈소판과 상호 작용하여 억제제가 있는 혈우병 환자의 손상된 트롬빈 생성을 증가시켜 지혈을 유도합니다.
12.2 약력학 (Pharmacodynamics)
응고에 대한 실험실 평가가 반드시 FEIBA의 지혈 효과와 상관관계가 있거나 예측하는 것은 아닙니다. FEIBA의 VIII 인자 억제제 우회 활성은 in vitro뿐만 아니라 in vivo에서도 입증되었습니다. FEIBA는 활성화 부분 트롬보플라스틴 시간(aPTT)을 단축시키고 VIII 인자 억제제를 함유한 혈장에서 트롬빈 생성을 증가시킬 수 있습니다.4,5
12.3 약동학 (Pharmacokinetics)
FEIBA는 서로 다른 반감기를 가진 여러 응고 인자로 구성되어 있습니다. FEIBA의 약동학적 특성은 인체에서 공식적으로 연구되지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
FEIBA의 발암 가능성을 평가하기 위한 장기 동물 연구 또는 FEIBA의 유전독성 또는 생식능력에 대한 영향을 결정하기 위한 연구는 수행되지 않았습니다. FEIBA의 발암 가능성 평가는 제품 사용으로 인한 발암 위험이 최소임을 입증하기 위해 완료되었습니다.
14 CLINICAL STUDIES
출혈 에피소드의 조절 및 예방
두 건의 전향적 임상 시험을 통해 출혈 에피소드 치료에서 FEIBA의 효능이 입증되었습니다.1,2
첫 번째 시험은 VIII 인자에 대한 억제제가 있는 혈우병 A 환자 15명을 대상으로 FEIBA와 비활성화 프로트롬빈 복합 농축액의 효과를 비교한 다기관, 무작위, 이중맹검 시험이었습니다. 포함 기준은 고역가 억제제 병력, 고반응자 상태, 전년도에 월 1회 이상 출혈 에피소드 발생, 간부전 징후 없음이었습니다. 관절 출혈 117건, 근골격계 출혈 20건, 점막피부 출혈 4건을 포함하여 총 150건의 출혈 에피소드가 치료되었습니다. FEIBA 치료에는 체중 kg당 88단위의 단일 용량이 균일하게 사용되었습니다. 필요한 경우 근육 출혈은 12시간 후, 점막피부 출혈은 6시간 후에 두 번째 치료가 허용되었습니다.
피험자와 연구자는 효과, 부분적 효과, 효과 없음 또는 확실하지 않음의 척도를 기반으로 지혈 효능을 평가하도록 요청받았습니다. 효과 평가 기준은 통증의 심각도, 주관적 개선, 근육 또는 관절 둘레, 관절 운동 제한, 개방 출혈 중단, 재출혈 시작, 진통제의 양과 종류였습니다. FEIBA는 에피소드의 41%에서 효과적이었고 25%에서 부분적으로 효과적이었으며(즉, 복합 효과 66%), 프로트롬빈 복합 농축액은 에피소드의 25%에서 효과적이었고 21%에서 부분적으로 효과적이었습니다(즉, 복합 효과 46%).
FEIBA를 사용한 두 번째 시험은 다기관 무작위 전향적 시험이었습니다. 이 시험은 억제제가 있는 혈우병 A 환자 44명, 억제제가 있는 혈우병 B 환자 3명, 후천성 VIII 인자 억제제 환자 2명을 대상으로 실시되었습니다. 이 시험은 중추 신경계 출혈 및 수술 출혈과 같은 관절, 점막, 근육피부 및 응급 출혈 에피소드 치료에서 FEIBA의 효능을 평가하기 위해 설계되었습니다. 사용된 포함 기준은 4세 이상, 억제제 역가 ≥4 Bethesda Units (BU) 병력, 만성 간 질환 없음이었습니다. 혈전색전증 사건 또는 FEIBA에 대한 알레르기 반응 병력이 있는 피험자는 제외되었습니다.
9개 협력 혈우병 센터에서 5 BU 이상의 억제제 역가를 가진 49명의 피험자가 등록되었습니다. 피험자는 체중 kg당 50단위로 치료받았으며, 필요한 경우 12시간 간격(점막 출혈의 경우 6시간 간격)으로 반복 투여되었습니다. 총 489회의 주입이 165건의 출혈 에피소드(관절 102건, 근육 및 연조직 33건, 점막 20건, 중추 신경계 출혈 3건 및 수술 4건 포함 응급 출혈 10건) 치료를 위해 투여되었습니다. 출혈은 153건의 에피소드(93%)에서 조절되었습니다. 130건(78%)의 에피소드에서 36시간 이내에 한 번 이상의 주입으로 지혈이 달성되었습니다. 이 중 36%는 12시간 이내에 한 번의 주입으로 조절되었습니다. 추가 14%의 에피소드는 36시간 이상 후에 반응했습니다.
일상적 예방
예방을 위해 FEIBA를 투여받은 피험자와 주문형 치료를 위해 FEIBA를 투여받은 피험자를 비교한 다기관, 공개, 전향적, 무작위 임상 시험에서 VIII 또는 IX 인자에 대한 억제제가 있는 혈우병 A 및 B 환자 36명이 의도치료 분석에서 분석되었습니다. 연구 대상에는 백인 29명(80.6%), 아시아인 3명(8.3%), 흑인/아프리카계 미국인 2명(5.6%), 기타 2명(5.6%)이 포함되었습니다. 포함 기준은 고역가 억제제 또는 증가된 VIII 또는 IX 인자 투여량에 불응하는 저역가 억제제 병력이 있는 피험자, 4세에서 65세 사이의 피험자, 시험 참여 전 12개월 동안 우회제를 투여받고 출혈이 12회 이상 발생한 피험자였습니다. 혈전색전증 사건, 증상이 있는 간 질환 또는 혈소판 수 <100,000/mL의 병력이 있는 피험자, 면역 관용 유도 또는 일상적 예방을 받고 있는 피험자는 제외되었습니다.
피험자는 FEIBA를 사용한 12개월의 예방적 치료 또는 주문형 치료를 무작위로 받았습니다. 예방군에 무작위 배정된 17명의 피험자는 격일로 FEIBA 85단위/kg을 투여받았습니다. 주문형군에 무작위 배정된 19명의 피험자는 권장 용량 및 투여 요법에 따라 급성 출혈 에피소드 치료를 위해 FEIBA를 투여받았습니다. 표적 관절은 6개월 이내에 출혈 에피소드가 4회 이상 발생한 것으로 정의되었습니다. 이 시험에서 발목, 무릎, 팔꿈치, 엉덩이가 표적 관절 위치였습니다. 기존 표적 관절은 새로운 표적 관절로 간주되지 않았습니다.
급성 출혈 치료에 대한 지혈 효능은 사전 지정된 4점 척도(우수, 양호, 보통, 없음)에 따라 6시간 및 24시간에 평가되었습니다. “없음” 평가는 치료 실패로 간주되었습니다. 효과 평가 기준은 통증 완화, 출혈 중단, 출혈 치료에 필요한 주입 횟수였습니다.
예방 중에 발생한 196건과 주문형 치료 중에 발생한 629건을 포함하여 총 825건의 출혈 에피소드가 보고되었습니다. 효능이 평가된 794건의 출혈 에피소드 중 대다수(78%)는 1회 또는 2회 주입으로 치료되었습니다. 지혈 효능은 주입 후 6시간에 평가된 출혈 에피소드의 74%, 주입 후 24시간에 평가된 출혈 에피소드의 87%에서 우수 또는 양호로 평가되었습니다. 주입 후 6시간에 총 19건(2.4%)의 출혈이 “없음”으로 평가되었고, 24시간에 1건(0.1%)의 출혈이 “없음”으로 평가되었습니다.
일상적 예방에 대한 지혈 효능은 주문형 치료를 받은 피험자에 대해 평가되었습니다.
주문형군의 전체 연간 출혈률(ABR) 중앙값은 28.7이었고 예방군은 7.9였으며, 이는 예방으로 ABR 중앙값이 72% 감소했음을 나타냅니다. 출혈 부위(예: 관절, 비관절) 및 출혈 원인(예: 자발적, 외상적)별로 분석했을 때 FEIBA를 사용한 예방적 치료는 ABR을 50% 이상 감소시켰습니다. 예방군에서 새로운 표적 관절이 발생한 피험자 수가 더 적었습니다(예방 치료를 받은 피험자 5명에서 새로운 표적 관절 7개 발생, 주문형군 피험자 11명에서 새로운 표적 관절 23개 발생). 시험 등록 시 표적 관절이 보고되지 않은 주문형군 피험자 2명과 예방군 피험자 3명에서 표적 관절이 발생했습니다. 17명 중 3명(18%)의 피험자는 예방 중 출혈 에피소드가 없었습니다. 주문형군에서는 모든 피험자가 출혈 에피소드를 경험했습니다.
주문형 요법과 예방 요법 간의 연령 범주별 ABR은 표 5에 제공되어 있습니다. 예방을 받은 청소년 피험자 1명은 연구 등록 후 신체 활동 증가로 인해 출혈률이 더 높았을 가능성이 있습니다.
| 연령 카테고리 | 응급: 대상 수 |
응급: ABR 중앙값 |
예방: 대상 수 |
예방: ABR 중앙값 |
|---|---|---|---|---|
| 어린이 (≥7 ~ <12세) |
2 | 39.3 | 2 | 7.7 |
| 청소년 (≥12 ~ <16세) |
2 | 30.9 | 3 | 27.5 |
| 성인 (≥16세) |
15 | 23.9 | 12 | 6.9 |
15 참고 문헌
- Sjamsoedin LJ, Heijnen L, Mauser-Bunschoten EP, van Geijlswijk JL, van Houwelingen H, van Asten P, Sixma JJ. A형 혈우병 및 VIII 인자에 대한 항체를 가진 환자의 관절 및 근육 출혈에 대한 활성화 프로트롬빈 복합체 농축액 (FEIBA)의 효과. N Engl J Med. 1981;305(13): 717-721.
- Hilgartner MW, Knatterud GL. 억제제를 가진 혈우병 환자의 출혈 에피소드 치료를 위한 VIII 인자 억제제 우회 활성 (FEIBA IMMUNO) 제품의 사용. Blood. 1983;61(1): 36-40.
- Antunes SV, Tangada S, Stasyshyn O, Mamonov V, Phillips J, Guzman-Becerra N, Grigorian A, Ewenstein B, Wong WY. 억제제를 가진 A형 및 B형 혈우병 치료에서 FEIBA NF를 사용한 예방 및 필요시 요법의 무작위 비교. Haemophilia. 2013; DOI 10.1111/hae.12246.
- Turecek PL, Varadi K, Gritsch H, Auer W, Pichler L, Eder G, Schwarz HP. Factor Xa 및 프로트롬빈: FEIBA의 작용 기전. Vox Sanguinis 1999;77 Suppl 1:72-79.
- Turecek PL, Varadi K, Gritch H, Schwarz HP. FEIBA: 작용 방식 Haemophilia 2004;10: Suppl. 2:3-9
- Oldenburg et al. 억제제를 가진 A형 혈우병에서의 Emicizumab 예방. N Engl J Med 2017:377:809-818.
16 제공/보관 및 취급 방법
제품 정보
FEIBA는 다음과 같은 공칭 용량의 1회용 바이알로 제공됩니다.
| 공칭 용량 | 색상 코드 | VIII 인자 효능 범위 | Kit NDC | 멸균수 용량 |
|---|---|---|---|---|
| 500 units | 오렌지 | 바이알 당 350-650 units | 64193-426-02 | 10 mL |
| 1000 units | 녹색 | 바이알 당 700-1300 units | 64193-424-02 | 20 mL |
| 2500 units | 보라색 | 바이알 당 1750-3250 units | 64193-425-02 | 50 mL |
VIII 인자 억제제 우회 활성 단위 수는 각 바이알 라벨에 명시되어 있습니다.
FEIBA는 적절한 용량(10mL, 20mL 또는 50mL)의 USP 멸균 주사용수, BAXJECT II Hi-Flow 무침 옮김 장치 1개 및 설명서 1부와 함께 포장되어 있습니다.
천연 고무 라텍스를 사용하지 않고 제조되었습니다.
보관 및 취급
- 2°C ~ 25°C (36°F ~ 77°F)에서 보관하십시오.
- 빛으로부터 보호하기 위해 원래 포장 상태로 보관하십시오.
- 냉동하지 마십시오.
- 준비 및 용해 전에, 냉장 보관한 경우 FEIBA 및 멸균 주사용수(희석제) 바이알을 실온에 도달하도록 하십시오.
17 환자 상담 정보
환자에게 알려주십시오:
- 흉통 또는 압박감, 호흡 곤란, 의식, 시력 또는 언어 장애, 사지 또는 복부 부종 및/또는 통증과 같은 혈전증의 징후와 증상에 대해 알려주십시오. 이러한 증상이 나타나면 즉시 의사의 진료를 받도록 환자에게 조언하십시오.
- 두드러기, 안젤오에데마, 위장 증상, 기관지 경련 및 저혈압과 같은 과민 반응의 징후와 증상에 대해 알려주십시오. 이러한 증상이 나타나면 제품 사용을 중단하고 즉시 응급 치료를 받도록 환자에게 조언하십시오.
- FEIBA는 사람의 혈액으로 만들어졌기 때문에 바이러스, 변형 크로이츠펠트-야코브병(vCJD) 병원체 및 이론적으로 크로이츠펠트-야코브병(CJD) 병원체와 같은 감염성 병원체를 전파할 위험이 있을 수 있다는 점을 알려주십시오.
- 에미시주맙 예방 요법을 받고 있고 돌발 출혈 에피소드를 치료하기 위해 FEIBA가 필요한 경우, 환자는 반드시 혈우병 치료 의사, 바람직하게는 혈우병 치료 센터(HTC)에서 모니터링을 받아야 합니다.
- FEIBA 투여 후 발생하는 모든 이상 반응이나 문제점을 혈우병 치료 의사에게 보고하도록 하십시오.
기밀 산업 전반 환자 알림 시스템에 등록하려면 1-888-873-2838로 전화하십시오.
SPL 미분류 섹션
Takeda Pharmaceuticals U.S.A., Inc.
Cambridge, MA 02142
미국 허가 번호 1898
FEIBA는 Baxalta Incorporated의 등록상표입니다.
Takeda와  는 Takeda Pharmaceutical Company Limited의 등록상표입니다.
는 Takeda Pharmaceutical Company Limited의 등록상표입니다.
©2024 Takeda Pharmaceutical Company Limited. All rights reserved.
주요 표시면 – 키트 상자
20 mL, 동결건조
NDC 64193-424-02
항인히비터 응고 복합체
FEIBA
나노여과 및 증기 가열
재구성 후 정맥 주사용
방부제 무함유
용법 및 용량: 동봉된 설명서 참조.
보관: 2°C ~ 25°C (36°F ~ 77°F). 빛으로부터 보호하기 위해 원래 포장 상태로 보관하십시오.
재구성: 20 mL의 U.S.P. 주사용멸균정제수(SWFI) 사용; 재구성 후 냉장 보관하지 마십시오; 재구성 후 3시간 이내에 사용하십시오.
동결 금지
전문의약품
Takeda
포함
BAXJECT II Hi-Flow
무침 주사기

주요 표시 패널 – 20mL 바이알 라벨
20 mL, 동결건조
NDC 64193-324-01
항인히비터 응고인자 복합체
FEIBA
나노필터링 및 증기 가열 처리
재구성 후 정맥 주사용
방부제 무함유
용법 및 용량: 동봉된 설명서 참조.
보관: 2°C ~ 25°C (36°F ~ 77°F).
재구성: 20 mL의 U.S.P. 주사용멸균정제수 사용; 재구성 후 냉장 보관하지 마십시오.; 재구성 후 3시간 이내에 사용하십시오.
처방전 의약품
0754401

주요 표시면 – 키트 상자
1회용 바이알
NDC 64193-425-02
항인히비터 응고 복합체
FEIBA
나노필터링 및 증기 가열 처리
재구성 후 정맥 주사용
방부제 무함유
용법 및 용량: 동봉된 설명서 참조.
보관: 2°C ~ 25°C (36°F ~ 77°F).
빛으로부터 보호하기 위해 원래 포장 상태로 보관하십시오.
재구성: 50 mL의 USP 정제수 사용; 재구성 후 냉장 보관하지 마십시오; 재구성 후 3시간 이내에 사용하십시오.
동결 금지
전문의약품
Takeda
포함 품목:
BAXJECT II Hi-Flow
무침 주사기 이송 장치

주표시면 – 50mL 바이알 라벨
50 mL, 동결건조
NDC 64193-325-01
항인히비터 응고인자 복합제
FEIBA
나노여과 및 증기가열
재구성 후 정맥내 사용
방부제 무함유
용법 및 용량: 동봉된 설명서 참조.
보관: 2°C ~ 25°C (36°F ~ 77°F).
재구성: 50 mL의 U.S.P 멸균주사용수 사용; 재구성 후 냉장보관하지 마십시오.; 재구성 후 3시간 이내에 사용하십시오.
처방전 의약품
0754404

주요 표시면 – 키트 상자
1회용 바이알
NDC 64193-426-02
항인히비터
응고인자 복합제
FEIBA
나노필터링 및 증기 가열 처리
재구성 후 정맥 주사용
방부제 무첨가
용법 및 용량: 동봉된 설명서 참조.
보관: 2°C ~ 25°C (36°F ~ 77°F). 빛으로부터 보호하기 위해 원래 포장 상태로 보관하십시오.
재구성: USP 멸균 주사용수 10mL 사용; 재구성 후 냉장 보관하지 마십시오; 재구성 후 3시간 이내에 사용하십시오.
동결 금지
전문의약품
Takeda
포함 품목
BAXJECT II Hi-Flow
무침 바늘 이송 장치

주요 표시 패널 – 10mL 바이알 라벨
1회용 바이알
NDC 64193-326-01
항인히비터 응고인자 복합제
FEIBA
나노필터링 및 증기 가열 처리
재구성 후 정맥 주사용
방부제 없음
용법·용량: 동봉된 설명서 참조하십시오.
보관: 2°C ~ 25°C (36°F ~ 77°F).
재구성: 10 mL의 USP 정제수 사용; 재구성 후 냉장 보관하지 마십시오.; 재구성 후 3시간 이내에 사용하십시오.
처방전 의약품
Takeda
0754406


