의약품 제조업체: AstraZeneca Pharmaceuticals LP (Updated: 2024-10-24)
처방 정보의 주요 내용
FARXIGA® (다파글리플로진) 정제, 경구용
미국 최초 승인: 2014
적응증 및 사용
FARXIGA는 나트륨-포도당 공동 수송체 2(SGLT2) 억제제로 다음과 같은 경우에 사용됩니다.
- •
- 진행 위험이 있는 만성 신장 질환 성인에서 지속적인 eGFR 감소, 말기 신장 질환, 심혈관 사망 및 심부전 입원 위험 감소. (1)
- •
- 심부전 성인에서 심혈관 사망, 심부전 입원 및 긴급 심부전 방문 위험 감소. (1)
- •
- 확립된 심혈관 질환 또는 다중 심혈관 위험 요인이 있는 2형 당뇨병 성인에서 심부전 입원 위험 감소. (1)
- •
- 2형 당뇨병이 있는 10세 이상의 성인 및 소아 환자에서 식이 요법 및 운동과 함께 혈당 조절 개선. (1)
사용 제한:
- •
- 1형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. (1)
- •
- eGFR이 45 mL/min/1.73 m2 미만인 2형 당뇨병 환자의 혈당 조절 개선을 위해 사용하는 것은 권장되지 않습니다. FARXIGA는 작용 기전을 기반으로 이러한 환경에서 효과가 없을 가능성이 높습니다. (1)
- •
- 다낭성 신장 질환이 있는 환자 또는 신장 질환 치료를 위해 면역 억제 요법을 받고 있거나 최근에 받은 병력이 있는 환자의 만성 신장 질환 치료에는 권장되지 않습니다. FARXIGA는 이러한 환자에게 효과가 없을 것으로 예상됩니다. (1)
투여 및 관리
- •
- 투여 시작 전에 신장 기능을 평가하고 임상적으로 필요에 따라 평가합니다. 투여 시작 전에 체액 상태를 평가하고 체액 부족을 교정합니다. (2.1)
- •
- 혈당 조절을 개선하기 위해 권장 시작 용량은 1일 1회 경구로 5mg입니다. 추가 혈당 조절을 위해 1일 1회 경구로 10mg까지 용량을 증가시킬 수 있습니다. (2.2)
- •
- 다른 모든 적응증의 경우 권장 용량은 1일 1회 경구로 10mg입니다. (2.2)
- •
- 신장애 환자의 용량 권장 사항은 전체 처방 정보를 참조하십시오. (2.2, 2.3)
- •
- 가능한 경우, 주요 수술 또는 장기간 금식과 관련된 절차 전에 최소 3일 동안 FARXIGA를 중단합니다. (2.3)
투여 형태 및 강도
정제: 5mg 및 10mg (3)
금기사항
- •
- 다파글리플로진 또는 FARXIGA의 다른 성분에 대한 심각한 과민 반응의 병력. (4)
경고 및 주의 사항
- •
- 1형 당뇨병 환자 및 기타 케톤산증 위험 환자의 당뇨병성 케톤산증: 1형 당뇨병 환자의 경우 케톤 모니터링을 고려하고, 케톤산증 위험이 있는 다른 환자의 경우 필요에 따라 케톤 모니터링을 고려하십시오. 혈당 수치에 관계없이 케톤산증을 평가하고 케톤산증이 의심되는 경우 FARXIGA를 중단하십시오. 재투여하기 전에 케톤산증이 해결되었는지 모니터링하십시오. (5.1)
- •
- 혈액량 감소: FARXIGA를 시작하기 전에 노인, 신장애 환자, 저혈압 환자, 이뇨제를 복용하는 환자의 혈액량 상태와 신장 기능을 평가하십시오. 치료 중에 징후와 증상을 모니터링하십시오. (5.2)
- •
- 요로 감염 및 신우신염: 요로 감염의 징후와 증상을 평가하고 필요한 경우 즉시 치료하십시오. (5.3)
- •
- 저혈당: FARXIGA와 병용하여 사용할 경우 저혈당 위험을 줄이기 위해 인슐린 또는 인슐린 분비 촉진제의 용량을 낮추는 것을 고려하십시오. (5.4)
- •
- 회음부 괴사성 근막염(포르니에 괴사): 여성과 남성 모두 당뇨병 환자에서 심각하고 생명을 위협하는 사례가 발생했습니다. 생식기 또는 회음부의 통증 또는 압통, 발적 또는 부종과 함께 발열 또는 권태감이 있는 환자를 평가하십시오. 의심되는 경우 즉시 치료를 시작하십시오. (5.5)
- •
- 생식기 진균 감염: 모니터링하고 필요한 경우 치료하십시오. (5.6)
부작용
- •
- 가장 흔한 부작용(발생률 5% 이상)은 여성 생식기 진균 감염, 비인두염 및 요로 감염이었습니다. (6.1)
의심되는 부작용을 보고하려면 AstraZeneca에 1-800-236-9933으로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
- •
- FARXIGA의 약물 상호 작용 및 실험실 검사 간섭에 대한 정보는 전체 처방 정보를 참조하십시오. (7)
특정 인구 집단에서의 사용
환자 상담 정보 및 약물 안내서를 보려면 17을 참조하십시오.
개정: 2024년 10월
목차
전문 정보: 목차*
1 적응증 및 사용법
2 용법 및 용량
2.1 FARXIGA 투여 시작 전
2.2 2형 당뇨병 성인 및 10세 이상 소아 환자의 혈당 조절을 위한 권장 용량
2.3 성인의 다른 적응증에 대한 권장 용량
2.4 수술을 위한 일시적인 중단
3 제형 및 강도
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 1형 당뇨병 환자 및 기타 케톤산증 환자의 당뇨병성 케톤산증
5.2 혈액량 감소
5.3 요독증 및 신우신염
5.4 인슐린 및 인슐린 분비 촉진제와 병용 시 저혈당
5.5 회음부 괴사성 근막염 (포르니에 괴사)
5.6 생식기 진균 감염
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 2형 당뇨병 성인의 혈당 조절
14.2 2형 당뇨병 10세 이상 소아 환자의 혈당 조절
14.3 2형 당뇨병 성인의 심혈관계 결과
14.4 만성 신장 질환
14.5 심부전
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
FARXIGA (다파글리플로진)은 다음과 같은 경우에 사용됩니다.
- •
- 진행 위험이 있는 만성 신장 질환 성인에서 지속적인 eGFR 감소, 말기 신장 질환, 심혈관 사망 및 심부전 입원 위험을 줄이기 위해.
- •
- •
- 심부전 성인에서 심혈관 사망, 심부전 입원 및 긴급 심부전 방문 위험을 줄이기 위해.
- •
- 확립된 심혈관 질환 또는 다중 심혈관 위험 요인이 있는 2형 당뇨병 성인에서 심부전 입원 위험을 줄이기 위해.
- •
- 2형 당뇨병이 있는 10세 이상의 성인 및 소아 환자에서 혈당 조절을 개선하기 위해 식이 요법 및 운동과 병용하여.
사용 제한
- •
- FARXIGA는 1형 당뇨병 환자의 혈당 조절을 개선하기 위해 사용하는 것은 권장되지 않습니다 [경고 및 주의 사항 (5.1) 참조].
- •
- eGFR이 45 mL/min/1.73 m2 미만인 2형 당뇨병 환자의 혈당 조절을 개선하기 위해 FARXIGA를 사용하는 것은 권장되지 않습니다. FARXIGA는 작용 기전을 기반으로 이러한 환경에서 효과가 없을 가능성이 높습니다.
- •
- 다낭성 신장 질환이 있는 환자 또는 신장 질환에 대한 면역 억제 요법을 받고 있거나 최근에 받은 환자의 만성 신장 질환 치료에는 FARXIGA를 사용하는 것이 권장되지 않습니다. FARXIGA는 이러한 환자에게 효과가 없을 것으로 예상됩니다.
2 투여 및 관리
2.1 FARXIGA 투여 전
- •
- FARXIGA 치료를 시작하기 전, 그리고 임상적으로 필요한 경우 신장 기능을 평가하십시오. [see 경고 및 주의사항 (5.2)].
- •
- 체액량 상태를 평가하십시오. 체액량 감소가 있는 환자의 경우, FARXIGA를 시작하기 전에 이러한 상태를 교정하십시오. [see 경고 및 주의사항 (5.2) and 특정 집단에서의 사용 (8.5, 8.6)].
2.2 제2형 당뇨병을 가진 성인 및 10세 이상 소아 환자의 혈당 조절을 위한 권장 복용량
제2형 당뇨병을 가진 성인 및 10세 이상 소아 환자에서 혈당 조절 개선을 위한 FARXIGA의 권장 시작 용량은 1일 1회 경구 복용 5mg입니다. 추가적인 혈당 조절을 위해 용량을 1일 1회 경구 복용 10mg까지 늘릴 수 있습니다.
제2형 당뇨병 및 신장 기능 장애가 있는 성인 및 소아 환자:
- •
- eGFR이 45mL/min/1.73m2 이상인 환자에서 FARXIGA의 권장 용량은 정상 신기능을 가진 환자의 권장 용량과 동일합니다.
- •
- eGFR이 45mL/min/1.73m2 미만인 제2형 당뇨병 환자의 혈당 조절 개선을 위해 FARXIGA 사용은 권장되지 않습니다. FARXIGA는 작용 기전에 따라 이러한 환경에서 혈당 조절 개선에 효과적이지 않을 가능성이 높습니다.
2.3 성인의 다른 적응증에 대한 권장 복용량
다음 적응증에 대한 성인에서 FARXIGA의 권장 용량은 1일 1회 경구 복용 10mg입니다.
- •
- 만성 신장 질환 진행 위험이 있는 환자에서 지속적인 eGFR 감소, 말기 신장 질환(ESKD), 심혈관(CV) 사망 및 심부전으로 인한 입원(hHF) 위험 감소
- •
- 심부전 환자에서 CV 사망, hHF 및 긴급 심부전 발생 위험 감소
- •
- 확립된 CV 질환 또는 여러 CV 위험 요인을 가진 제2형 당뇨병 환자에서 hHF 위험 감소
혈당 조절 이외의 적응증으로 FARXIGA를 투여받는 신장 기능 장애가 있는 성인:
- •
- eGFR이 25mL/min/1.73m2 이상인 환자에서 FARXIGA의 권장 용량은 정상 신기능을 가진 환자의 권장 용량과 동일합니다.
- •
- eGFR이 25mL/min/1.73m2 미만인 환자에게는 FARXIGA 시작이 권장되지 않습니다.
- •
- FARXIGA 치료를 받는 동안 eGFR이 25mL/min/1.73m2 미만으로 떨어지면 환자는 eGFR 감소, ESKD, CV 사망 및 hHF 위험을 줄이기 위해 FARXIGA 10mg을 1일 1회 경구 복용할 수 있습니다.
2.4 수술을 위한 일시 중단
- 가능하면 대수술 또는 장시간 금식과 관련된 시술 전 최소 3일 동안 FARXIGA 투여를 중단하십시오. 환자의 상태가 임상적으로 안정되고 경구 섭취를 재개하면 FARXIGA 투여를 재개하십시오. [see 경고 및 주의사항 (5.1) and 임상 약리학 (12.2)].
3 제형 및 함량
3 DOSAGE FORMS AND STRENGTHS
정제:
- •
- 한쪽 면에 “5”가 새겨지고 반대쪽 면에 “1427”이 새겨진 노란색, 양쪽 볼록, 둥근 필름 코팅 정제.
- •
- 한쪽 면에 “10”이 새겨지고 반대쪽 면에 “1428”이 새겨진 노란색, 양쪽 볼록, 다이아몬드 모양의 필름 코팅 정제.
4 금기사항
다파글리플로진 또는 FARXIGA의 다른 성분에 대한 심각한 과민 반응의 병력이 있는 환자에게 FARXIGA는 금기입니다. FARXIGA와 관련하여 아나필락시스 및 안지오에데마를 포함한 심각한 과민 반응이 보고되었습니다 [부작용 (6.1) 참조].
5 경고 및 주의사항
5.1 1형 당뇨병 환자의 당뇨병성 케톤산증 및 기타 케톤산증
1형 당뇨병 환자에서 FARXIGA는 기저율을 넘어 생명을 위협하는 사건인 당뇨병성 케톤산증의 위험을 크게 증가시킵니다. 1형 당뇨병 환자를 대상으로 한 위약 대조 시험에서 케톤산증의 위험은 위약을 투여받은 환자에 비해 소듐-글루코스 공동 수송체 2(SGLT2) 억제제를 투여받은 환자에서 현저히 증가했습니다. FARXIGA는 1형 당뇨병 환자의 혈당 조절에 적응증이 없습니다.
2형 당뇨병 및 췌장 장애(예: 췌장염 병력 또는 췌장 수술)도 케톤산증의 위험 요소입니다. FARXIGA를 포함한 SGLT2 억제제를 사용하는 2형 당뇨병 환자에서 케톤산증으로 인한 사망 사례가 시판 후 보고되었습니다.
당뇨병성 케톤산증 또는 기타 케톤산증의 촉발 요인에는 인슐린 용량 감소 또는 인슐린 용량 누락으로 인한 인슐린 저하, 급성 발열성 질환, 칼로리 섭취 감소, 케토제닉 식단, 수술, 혈액량 감소 및 알코올 남용이 있습니다.
징후 및 증상은 탈수 및 심한 대사성 산증과 일치하며, 메스꺼움, 구토, 복통, 전신 권태감 및 호흡 곤란이 포함됩니다. 발현 시 혈당 수치는 일반적으로 당뇨병성 케톤산증에 예상되는 수치보다 낮을 수 있습니다(예: 250mg/dL 미만). 케톤산증 및 당뇨는 일반적으로 예상되는 것보다 더 오래 지속될 수 있습니다. FARXIGA 중단 후 3일 동안 요당 배설이 지속됩니다. [임상 약리학(12.2) 참조]; 그러나 SGLT2 억제제 중단 후 6일 이상 지속되고 일부는 최대 2주까지 지속되는 케톤산증 및/또는 당뇨가 시판 후 보고되었습니다.
1형 당뇨병 환자의 경우 케톤 모니터링을 고려하고 임상 상황에 따라 케톤산증 위험이 있는 다른 환자의 경우 케톤 모니터링을 고려하십시오. 심한 대사성 산증과 일치하는 징후 및 증상이 있는 환자의 경우 발현 시 혈당 수치에 관계없이 케톤산증을 평가하십시오. 케톤산증이 의심되는 경우 FARXIGA를 중단하고, 확인되면 즉시 평가하고 케톤산증을 치료하십시오. FARXIGA를 재개하기 전에 케톤산증이 해결되었는지 모니터링하십시오.
가능한 경우, 환자를 케톤산증에 취약하게 할 수 있는 일시적인 임상 상황에서는 FARXIGA를 중단하십시오. 환자가 임상적으로 안정되고 경구 섭취를 재개하면 FARXIGA를 재개하십시오. [투약 및 투여(2.3) 참조].
모든 환자에게 케톤산증의 징후 및 증상에 대해 교육하고 징후 및 증상이 나타나면 FARXIGA를 중단하고 즉시 의사의 진료를 받도록 지시하십시오.
5.2 혈액량 감소
FARXIGA는 때때로 증상성 저혈압 또는 크레아티닌의 급성 일시적 변화로 나타날 수 있는 혈관 내 혈액량 감소를 유발할 수 있습니다. FARXIGA를 포함한 SGLT2 억제제를 투여받은 2형 당뇨병 환자에서 입원 및 투석이 필요한 경우도 있는 급성 신장 손상이 시판 후 보고되었습니다. 신장 기능 저하(eGFR 60mL/min/1.73m2 미만), 노인 또는 루프 이뇨제를 복용하는 환자는 혈액량 감소 또는 저혈압의 위험이 높을 수 있습니다. 이러한 특징 중 하나 이상이 있는 환자에게 FARXIGA를 시작하기 전에 혈액량 상태와 신장 기능을 평가하십시오. 치료를 시작한 후 저혈압의 징후 및 증상과 신장 기능을 모니터링하십시오.
5.3 요독증 및 신우신염
FARXIGA를 포함한 SGLT2 억제제를 투여받은 환자에서 입원이 필요한 요독증 및 신우신염을 포함한 심각한 요로 감염이 보고되었습니다. SGLT2 억제제로 치료하면 요로 감염의 위험이 증가합니다. [부작용(6) 참조] 요로 감염의 징후 및 증상을 평가하고 필요한 경우 즉시 치료하십시오.
5.4 인슐린 및 인슐린 분비 촉진제와 병용 시 저혈당증
인슐린 및 인슐린 분비 촉진제(예: 설폰닐우레아)는 저혈당증을 유발하는 것으로 알려져 있습니다. FARXIGA는 인슐린 또는 인슐린 분비 촉진제와 병용하면 저혈당증의 위험을 증가시킬 수 있습니다. [부작용(6.1) 참조] 따라서 이러한 약물을 FARXIGA와 병용하는 경우 저혈당증의 위험을 최소화하기 위해 인슐린 또는 인슐린 분비 촉진제의 용량을 낮춰야 할 수 있습니다. [약물 상호 작용(7) 참조].
5.5 회음부 괴사성 근막염(푸르니에 괴저)
FARXIGA를 포함한 SGLT2 억제제를 투여받은 당뇨병 환자에서 시판 후 감시에서 긴급한 외과적 개입이 필요한 드물지만 심각하고 생명을 위협하는 괴사성 감염인 회음부 괴사성 근막염(푸르니에 괴저)이 보고되었습니다. 여성과 남성 모두에서 사례가 보고되었습니다. 심각한 결과에는 입원, 여러 번의 수술 및 사망이 포함되었습니다.
FARXIGA로 치료받는 환자에서 생식기 또는 회음부의 통증 또는 압통, 발적 또는 부종과 함께 발열 또는 권태감이 나타나면 괴사성 근막염을 평가해야 합니다. 의심되는 경우 광범위 항생제로 즉시 치료를 시작하고 필요한 경우 외과적 절개를 시행하십시오. FARXIGA를 중단하고 혈당 수치를 면밀히 모니터링하고 혈당 조절을 위한 적절한 대체 요법을 제공하십시오.
5.6 생식기 진균 감염
FARXIGA는 생식기 진균 감염의 위험을 증가시킵니다. 생식기 진균 감염 병력이 있는 환자는 생식기 진균 감염이 발생할 가능성이 더 높았습니다. [부작용(6.1) 참조] 적절히 모니터링하고 치료하십시오.
6 부작용
다음의 중요한 이상반응은 아래 및 라벨의 다른 곳에 설명되어 있습니다.
- •
- 제1형 당뇨병 환자의 당뇨병성 케톤산증 및 기타 케톤산증 [see Warnings and Precautions (5.1)]
- •
- 혈액량 감소 [see Warnings and Precautions (5.2)]
- •
- 요로 패혈증 및 신우신염 [see Warnings and Precautions (5.3)]
- •
- 인슐린 및 인슐린 분비촉진제와 병용 시 저혈당증 [see Warnings and Precautions (5.4)]
- •
- 회음부 괴사성 근막염(푸르니에 괴저) [see Warnings and Precautions (5.5)]
- •
- 생식기 진균 감염 [see Warnings and Precautions (5.6)]
6.1 임상시험 경험
임상시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험 발생률과 직접 비교할 수 없으며 임상 현장에서 관찰된 발생률을 반영하지 않을 수 있습니다.
FARXIGA는 제2형 당뇨병이 있는 성인 및 10세 이상 소아 환자, 심부전이 있는 성인 환자, 만성 신장 질환이 있는 성인 환자를 대상으로 한 임상시험에서 평가되었습니다. FARXIGA의 전반적인 안전성 프로파일은 연구된 적응증에서 일관되었습니다. DAPA-HF 및 DELIVER 심부전 시험 또는 만성 신장 질환 환자를 대상으로 한 DAPA-CKD 시험에서 새로운 이상반응은 확인되지 않았습니다. 중증 저혈당증 및 당뇨병성 케톤산증(DKA)은 당뇨병 환자에서만 관찰되었습니다.
제2형 당뇨병 성인 환자의 혈당 조절을 위한 임상시험
혈당 조절을 위한 FARXIGA 5mg 및 10mg의 성인 대상 12건의 위약 대조 시험 모음
표 1의 데이터는 제2형 당뇨병이 있는 성인 환자를 대상으로 12~24주 동안 진행된 12건의 혈당 조절 위약 대조 시험에서 파생되었습니다. 4건의 시험에서 FARXIGA는 단독 요법으로 사용되었고, 8건의 시험에서 FARXIGA는 배경 항당뇨병 요법에 추가 요법으로 또는 메트포르민과 병용 요법으로 사용되었습니다. [see Clinical Studies (14.1)].
이러한 데이터는 평균 21주 동안 FARXIGA에 노출된 2338명의 성인 환자를 반영합니다. 환자들은 위약(N=1393), FARXIGA 5mg(N=1145) 또는 FARXIGA 10mg(N=1193)을 1일 1회 투여받았습니다. 모집단의 평균 연령은 55세였고 2%는 75세 이상이었습니다. 모집단의 50%는 남성이었고, 81%는 백인, 14%는 아시아인, 3%는 흑인 또는 아프리카계 미국인이었습니다. 기준선에서 모집단은 평균 6년 동안 당뇨병을 앓았고 평균 당화혈색소(HbA1c)는 8.3%였으며 21%는 확립된 당뇨병의 미세혈관 합병증을 앓고 있었습니다. 기준 신장 기능은 환자의 92%에서 정상이거나 경도 장애였고 환자의 8%에서 중등도 장애였습니다(평균 eGFR 86mL/min/1.73m2).
표 1은 FARXIGA 사용과 관련된 성인의 흔한 이상반응을 보여줍니다. 이러한 이상반응은 기준선에는 없었고 위약보다 FARXIGA에서 더 흔하게 발생했으며 FARXIGA 5mg 또는 FARXIGA 10mg으로 치료받은 환자의 최소 2%에서 발생했습니다.
| 이상반응 | 환자 비율(%) | ||
|---|---|---|---|
| 12건의 위약 대조 시험 모음 | |||
| 위약 N=1393 |
FARXIGA 5mg N=1145 |
FARXIGA 10mg N=1193 |
|
|
|||
|
여성 생식기 진균 감염* |
1.5 |
8.4 |
6.9 |
|
비인두염 |
6.2 |
6.6 |
6.3 |
|
요로 감염† |
3.7 |
5.7 |
4.3 |
|
요통 |
3.2 |
3.1 |
4.2 |
|
빈뇨‡ |
1.7 |
2.9 |
3.8 |
|
남성 생식기 진균 감염§ |
0.3 |
2.8 |
2.7 |
|
구역 |
2.4 |
2.8 |
2.5 |
|
인플루엔자 |
2.3 |
2.7 |
2.3 |
|
이상지질혈증 |
1.5 |
2.1 |
2.5 |
|
변비 |
1.5 |
2.2 |
1.9 |
|
배뇨 불편 |
0.7 |
1.6 |
2.1 |
|
사지 통증 |
1.4 |
2.0 |
1.7 |
FARXIGA 10 mg의 혈당 조절에 대한 13건의 위약 대조 성인 임상시험 모음
FARXIGA 10 mg는 제2형 당뇨병 성인 환자를 대상으로 한 더 큰 규모의 혈당 조절 위약 대조 임상시험 모음에서도 평가되었습니다. 이 모음은 3건의 단독 요법 임상시험, 9건의 기존 항당뇨병 요법에 추가하는 임상시험, 그리고 메트포르민과의 초기 병용 요법 임상시험을 포함한 13건의 위약 대조 임상시험을 결합한 것입니다. 이 13건의 임상시험에서 2360명의 환자가 평균 22주 동안 FARXIGA 10 mg을 1일 1회 투여받았습니다. 모집단의 평균 연령은 59세였고 4%는 75세 이상이었습니다. 모집단의 58%는 남성이었고, 84%는 백인, 9%는 아시아인, 3%는 흑인 또는 아프리카계 미국인이었습니다. 기준 시점에서 모집단은 평균 9년 동안 당뇨병을 앓았고, 평균 HbA1c는 8.2%였으며, 30%는 확정된 미세혈관 질환을 가지고 있었습니다. 기준 시점에서 신기능은 88%의 환자에서 정상이거나 경도 손상이었고 11%의 환자에서 중등도 손상이었습니다(평균 eGFR 82 mL/min/1.73 m2).
제2형 당뇨병 성인 환자의 기타 이상반응
혈액량 감소
FARXIGA는 삼투성 이뇨를 유발하여 혈관 내 용적 감소로 이어질 수 있습니다. 12건 및 13건의 단기 위약 대조 임상시험 모음과 DECLARE 임상시험에서 제2형 당뇨병 성인 환자의 혈액량 감소 관련 이상반응(탈수, 저혈량증, 기립성 저혈압 또는 저혈압 보고 포함)은 표 2에 나와 있습니다. [경고 및 주의사항 (5.2) 참조].
|
|||||||
|
12건의 위약 대조 |
13건의 위약 대조 |
DECLARE 임상시험 |
|||||
|
위약 |
FARXIGA |
FARXIGA |
위약 |
FARXIGA |
위약 |
FARXIGA |
|
|
전체 모집단 N (%) |
N=1393 |
N=1145 |
N=1193 |
N=2295 |
N=2360 |
N=8569 |
N=8574 |
|
환자 하위그룹 n (%) |
|||||||
|
루프 이뇨제 복용 환자 |
n=55 |
n=40 |
n=31 |
n=267 |
n=236 |
n=934 |
n=866 |
|
eGFR ≥30 및 <60 mL/min/1.73 m2인 중등도 신장애 환자 |
n=107 |
n=107 |
n=89 |
n=268 |
n=265 |
n=658 |
n=604 |
|
65세 이상 환자 |
n=276 |
n=216 |
n=204 |
n=711 |
n=665 |
n=3950 |
n=3948 |
저혈당증
제2형 당뇨병 성인 환자를 대상으로 한 임상시험에서 저혈당증 발생 빈도는 [임상 연구 (14.1) 참조] 표 3에 나와 있습니다. FARXIGA를 설포닐우레아 또는 인슐린에 추가했을 때 저혈당증이 더 자주 발생했습니다. [경고 및 주의사항 (5.4) 참조].
| 위약/활성 대조군 | FARXIGA 5 mg |
FARXIGA 10 mg |
|
|---|---|---|---|
|
단독요법 (24주) |
N=75 |
N=64 |
N=70 |
|
중증 [n (%)] |
0 |
0 |
0 |
|
혈당 <54 mg/dL [n (%)] |
0 |
0 |
0 |
|
메트포르민 병용 (24주) |
N=137 |
N=137 |
N=135 |
|
중증 [n (%)] |
0 |
0 |
0 |
|
혈당 <54 mg/dL [n (%)] |
0 |
0 |
0 |
|
글리메피리드 병용 (24주) |
N=146 |
N=145 |
N=151 |
|
중증 [n (%)] |
0 |
0 |
0 |
|
혈당 <54 mg/dL [n (%)] |
1 (0.7) |
3 (2.1) |
5 (3.3) |
|
메트포르민 및 설포닐우레아 병용 (24주) |
N=109 |
– |
N=109 |
|
중증 [n (%)] |
0 |
– |
0 |
|
포도당 <54 mg/dL [n (%)] |
3 (2.8) |
– |
7 (6.4) |
|
피오글리타존 병용 (24주) |
N=139 |
N=141 |
N=140 |
|
중증 [n (%)] |
0 |
0 |
0 |
|
포도당 <54 mg/dL [n (%)] |
0 |
1 (0.7) |
0 |
|
DPP4 억제제 병용 (24주) |
N=226 |
– |
N=225 |
|
중증 [n (%)] |
0 |
– |
1 (0.4) |
|
포도당 <54 mg/dL [n (%)] |
1 (0.4) |
– |
1 (0.4) |
|
인슐린 병용 (기타 경구용 혈당강하제 병용 또는 단독)‡ (24주) |
N=197 |
N=212 |
N=196 |
|
중증 [n (%)] |
1 (0.5) |
2 (0.9) |
2 (1.0) |
|
포도당 <54 mg/dL [n (%)] |
43 (21.8) |
55 (25.9) |
45 (23.0) |
DECLARE 임상시험에서 [임상 연구 (14.3) 참조], FARXIGA로 치료받은 성인 환자 8574명 중 58명(0.7%)에서 중증 저혈당증이 보고되었고, 위약으로 치료받은 성인 환자 8569명 중 83명(1.0%)에서 중증 저혈당증이 보고되었습니다.
생식기 진균 감염
성인 대상 혈당 조절 임상시험에서 생식기 진균 감염은 FARXIGA 치료군에서 더 빈번하게 발생했습니다. 위약 대조군 12건의 임상시험에서 생식기 진균 감염은 위약군의 0.9%, FARXIGA 5mg 투여군의 5.7%, FARXIGA 10mg 투여군의 4.8%에서 보고되었습니다. 생식기 감염으로 인한 임상시험 중단은 위약 치료 환자의 0%와 FARXIGA 10mg 치료 환자의 0.2%에서 발생했습니다. 감염은 남성보다 여성에게서 더 자주 보고되었습니다(표 1 참조). 가장 흔하게 보고된 생식기 진균 감염은 여성의 외음 질 진균 감염과 남성의 귀두염이었습니다. 생식기 진균 감염 병력이 있는 환자는 병력이 없는 환자보다 임상시험 기간 동안 생식기 진균 감염이 발생할 가능성이 더 높았습니다(각각 위약, FARXIGA 5mg, FARXIGA 10mg에서 10.0%, 23.1%, 25.0% 대 0.8%, 5.9%, 5.0%). DECLARE 임상시험에서 [임상 연구 (14.3) 참조], 중증 생식기 진균 감염은 FARXIGA 치료 환자의 <0.1%와 위약 치료 환자의 <0.1%에서 보고되었습니다. 임상시험 약물 중단을 유발한 생식기 진균 감염은 FARXIGA 치료 환자의 0.9%와 위약 치료 환자의 <0.1%에서 보고되었습니다.
과민 반응
FARXIGA 치료에서 과민 반응(예: 혈관부종, 두드러기, 과민증)이 보고되었습니다. 성인 대상 혈당 조절 임상시험에서 중증 아나필락시스 반응 및 중증 피부 이상 반응과 혈관부종은 비교군 치료 환자의 0.2%와 FARXIGA 치료 환자의 0.3%에서 보고되었습니다. 과민 반응이 발생하면 FARXIGA 사용을 중단하고 표준 치료법에 따라 치료하고 징후와 증상이 해결될 때까지 모니터링합니다.
당뇨병 환자의 케톤산증
DECLARE 임상시험에서 [임상 연구 (14.3) 참조], 당뇨병성 케톤산증(DKA) 사례는 FARXIGA 치료군의 성인 환자 8574명 중 27명과 위약군의 성인 환자 8569명 중 12명에서 보고되었습니다. 이러한 사례는 임상시험 기간 동안 고르게 분포되었습니다.
제2형 당뇨병 성인 환자의 실험실 검사
혈청 크레아티닌 증가 및 eGFR 감소
FARXIGA를 포함한 SGLT2 억제제를 시작하면 혈청 크레아티닌이 약간 증가하고 eGFR이 감소합니다. 이러한 혈청 크레아티닌 및 eGFR 변화는 일반적으로 치료 시작 후 2주 이내에 발생하며 기준 신장 기능에 관계없이 안정화됩니다. 이러한 패턴에 맞지 않는 변화가 발생하면 급성 신손상 가능성을 배제하기 위해 추가 평가를 실시해야 합니다 [경고 및 주의사항 (5.2) 참조]. 중등도 신장애가 있는 제2형 당뇨병 성인 환자를 포함한 두 건의 임상시험에서 치료 중단 후 eGFR에 대한 급성 영향이 역전되었는데, 이는 급성 혈역학적 변화가 FARXIGA에서 관찰된 신기능 변화에 역할을 할 수 있음을 시사합니다.
헤마토크릿 증가
위약 대조군 13건의 혈당 조절 임상시험에서 FARXIGA 치료를 받은 성인 환자의 평균 헤마토크릿 값이 1주차부터 시작하여 기준치보다 증가했으며, 16주차까지 계속 증가하여 기준치와의 최대 평균 차이를 보였습니다. 24주차에 헤마토크릿의 기준치 대비 평균 변화는 위약군에서 -0.33%, FARXIGA 10mg군에서 2.30%였습니다. 24주차까지 헤마토크릿 값이 55%를 초과하는 경우는 위약 치료 환자의 0.4%와 FARXIGA 10mg 치료 환자의 1.3%에서 보고되었습니다.
저밀도 지단백 콜레스테롤 증가
위약 대조군 13건의 혈당 조절 임상시험에서 위약 치료 환자와 비교하여 FARXIGA 치료를 받은 성인 환자의 평균 지질 값 변화가 보고되었습니다. 24주차에 기준치 대비 평균 백분율 변화는 총 콜레스테롤의 경우 위약군에서 0.0% 대 FARXIGA 10mg군에서 2.5%, LDL 콜레스테롤의 경우 -1.0% 대 2.9%였습니다. DECLARE 임상시험에서 [임상 연구 (14.3) 참조], 4년 후 기준치 대비 평균 변화는 총 콜레스테롤의 경우 FARXIGA 치료군에서 0.4mg/dL 대 위약군에서 -4.1mg/dL, LDL 콜레스테롤의 경우 -2.5mg/dL 대 -4.4mg/dL였습니다.
혈청 중탄산염 감소
성인에서 FARXIGA 10mg과 서방형 엑세나타이드(메트포르민 배경) 병용 요법 임상시험에서 병용 요법을 받은 4명의 환자(1.7%)에서 혈청 중탄산염 값이 13mEq/L 이하였으며, FARXIGA 및 서방형 엑세나타이드 치료군에서는 각각 1명(0.4%)이었습니다 [경고 및 주의사항 (5.1) 참조].
제2형 당뇨병 소아 환자 대상 임상시험
제2형 당뇨병이 있는 10세 이상 소아 환자 157명을 대상으로 26주간 진행된 위약 대조 임상시험과 26주 연장 연구에서 관찰된 FARXIGA 안전성 프로파일은 성인에서 관찰된 것과 유사했습니다 [임상 연구 (14.2) 참조].
6.2 시판 후 경험
당뇨병 환자에서 FARXIGA 시판 후 사용 중 추가 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 일반적으로 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 불가능합니다.
감염: 회음부 괴사성 근막염(푸르니에 괴저), 요로 패혈증 및 신우신염
대사 및 영양 장애: 케톤산증
신장 및 요로 장애: 급성 신손상
피부 및 피하 조직 장애: 발진
7 약물 상호작용
|
인슐린 또는 인슐린 분비촉진제 |
|
|
임상적 영향 |
FARXIGA를 인슐린 또는 인슐린 분비촉진제(예: 설포닐우레아)와 병용 투여할 경우 저혈당 위험이 증가할 수 있습니다 [경고 및 주의사항 (5.4) 참조]. |
|
중재 |
저혈당 위험을 줄이기 위해 병용 투여 시 인슐린 또는 인슐린 분비촉진제의 용량을 줄여야 할 수 있습니다. |
|
Lithium |
|
|
임상적 영향 |
SGLT2 억제제와 리튬의 병용 투여는 혈청 리튬 농도를 감소시킬 수 있습니다. |
|
중재 |
FARXIGA 시작 및 용량 변경 중에는 혈청 리튬 농도를 더 자주 모니터링하십시오. |
|
요당 검사 양성 |
|
|
임상적 영향 |
SGLT2 억제제는 요당 배설을 증가시켜 요당 검사에서 양성 결과를 초래합니다. |
|
중재 |
SGLT2 억제제를 복용하는 환자의 경우 요당 검사로 혈당 조절을 모니터링하는 것은 권장되지 않습니다. 혈당 조절을 모니터링하기 위한 다른 방법을 사용하십시오. |
|
1,5-anhydroglucitol (1,5-AG) 분석 간섭 |
|
|
임상적 영향 |
SGLT2 억제제를 복용하는 환자에서 1,5-AG 측정은 혈당 조절 평가에 있어 신뢰할 수 없습니다. |
|
중재 |
1,5-AG 분석으로 혈당 조절을 모니터링하는 것은 권장되지 않습니다. 혈당 조절을 모니터링하기 위한 다른 방법을 사용하십시오. |
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 데이터에서 신장에 대한 유해한 영향을 보여주었기 때문에, FARXIGA는 임신 2분기 및 3분기 동안 권장되지 않습니다.
임산부에서 FARXIGA에 대한 제한된 데이터는 주요 선천적 기형 또는 유산에 대한 약물 관련 위험을 결정하기에 충분하지 않습니다. 임신 중에 당뇨병이 잘 조절되지 않고 심장 기능 저하가 치료되지 않으면 모체와 태아에 위험이 있습니다 (임상적 고려 사항 참조 임상적 고려 사항).
동물 연구에서, 모든 시험된 용량에서, 인간 임신의 2분기 후반 및 3분기에 해당하는 신장 발달 기간 동안 다파글리플로진을 투여했을 때, 완전히 회복되지 않은 신장 골반 및 세뇨관 확장이 쥐에서 관찰되었습니다. 가장 낮은 용량은 10mg 임상 용량의 15배의 노출을 제공했습니다 (데이터 참조 데이터).
주요 선천적 기형의 추정 배경 위험은 HbA1c가 7%를 초과하는 임신 전 당뇨병이 있는 여성의 경우 6~10%이며, HbA1c가 10%를 초과하는 여성의 경우 20~25%까지 보고되었습니다. 표시된 인구에 대한 유산의 추정 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 태아 위험
임신 중에 당뇨병이 잘 조절되지 않으면 모체의 당뇨병성 케톤산증, 자간전증, 자연 유산, 조산 및 분만 합병증 위험이 증가합니다. 당뇨병이 잘 조절되지 않으면 태아의 주요 선천적 기형, 사산 및 거대아 관련 질병 위험이 증가합니다.
데이터
동물 데이터
출생 후 21일(PND)부터 PND 90까지 1, 15 또는 75mg/kg/일의 용량으로 어린 쥐에 직접 투여한 다파글리플로진은 신장 무게를 증가시켰고 모든 용량 수준에서 신장 골반 및 세뇨관 확장의 발생률을 증가시켰습니다. 시험된 가장 낮은 용량에서의 노출은 10mg 임상 용량의 15배였습니다(AUC 기준). 어린 동물에서 관찰된 신장 골반 및 세뇨관 확장은 1개월 회복 기간 내에 완전히 회복되지 않았습니다.
임신 전 및 출생 후 발달 연구에서, 다파글리플로진을 임신 6일부터 수유 21일까지 1, 15 또는 75mg/kg/일의 용량으로 모체 쥐에 투여했고, 새끼는 자궁 내 및 수유 기간 동안 간접적으로 노출되었습니다. 75mg/kg/일에서 치료된 어미의 새끼에서 21일 된 새끼에서 신장 골반 확장의 발생률 또는 심각도가 증가했습니다(모체 및 새끼 다파글리플로진 노출은 각각 10mg 임상 용량에서 인간 값의 1415배 및 137배였습니다. AUC 기준). 10mg 임상 용량의 29배 이상(AUC 기준)에서 용량 의존적인 새끼 체중 감소가 관찰되었습니다. 1mg/kg/일(10mg 임상 용량의 19배, AUC 기준)에서 발달 종말점에 대한 부작용은 관찰되지 않았습니다. 이러한 결과는 쥐의 신장 발달 기간 동안 약물에 노출되어 인간 발달의 2분기 후반 및 3분기에 해당합니다.
쥐와 토끼에서의 배아 태아 발달 연구에서, 다파글리플로진을 인간 임신의 1분기에 해당하는 기관 형성 기간 동안 투여했습니다. 쥐에서 다파글리플로진은 75mg/kg/일(10mg 임상 용량의 1441배, AUC 기준)까지의 용량에서 배아 치사 또는 기형 유발 물질이 아니었습니다. 쥐 태아에 대한 용량 의존적인 영향(구조적 이상 및 체중 감소)은 150mg/kg 이상(10mg 임상 용량의 2344배 이상, AUC 기준)의 더 높은 용량에서만 발생했으며, 이는 모체 독성과 관련이 있었습니다. 180mg/kg/일(10mg 임상 용량의 1191배, AUC 기준)까지의 용량에서 토끼에서 발달 독성은 관찰되지 않았습니다.
8.2 수유
위험 요약
모유에서 다파글리플로진의 존재, 모유 수유하는 유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 정보는 없습니다. 다파글리플로진은 수유 쥐의 모유에 존재합니다 (데이터 참조 데이터). 그러나 수유 생리의 종 특이적 차이로 인해 이러한 데이터의 임상적 관련성은 명확하지 않습니다. 인간 신장 성숙은 자궁 내에서 발생하며 수유 노출이 발생할 수 있는 생후 2년 동안 발생하기 때문에 발달 중인 인간 신장에 위험이 있을 수 있습니다.
모유 수유하는 유아에게 심각한 부작용이 발생할 가능성이 있으므로, FARXIGA를 사용하는 여성에게 모유 수유 중에 FARXIGA 사용을 권장하지 않는다고 알려야 합니다.
데이터
다파글리플로진은 모유/혈장 비율이 0.49인 쥐의 모유에 존재했으며, 이는 다파글리플로진 및 그 대사산물이 모체 혈장 농도의 약 50%에 해당하는 농도로 모유로 전달됨을 나타냅니다. 다파글리플로진에 직접 노출된 어린 쥐는 성숙하는 동안 발달 중인 신장(신장 골반 및 세뇨관 확장)에 위험이 있음을 보여주었습니다.
8.4 소아 사용
2형 당뇨병 환자의 혈당 조절 개선을 위한 식이 요법 및 운동 보조제로서 FARXIGA의 안전성 및 유효성은 10세 이상의 소아 환자에서 확립되었습니다. 이 적응증에 대한 FARXIGA의 사용은 2형 당뇨병이 있는 10세에서 17세까지의 157명의 소아 환자를 대상으로 한 26주 위약 대조 시험과 26주 연장 시험, 소아 약동학 데이터 및 2형 당뇨병 성인 환자를 대상으로 한 시험에 의해 뒷받침됩니다. [임상 약리학 (12.3) 및 임상 연구 (14.1, 14.2) 참조]. 2형 당뇨병이 있는 소아 환자를 대상으로 한 위약 대조 시험에서 관찰된 안전성 프로파일은 성인에서 관찰된 안전성 프로파일과 유사했습니다. [유해 반응 (6.1) 참조].
2형 당뇨병 환자의 혈당 조절을 위한 FARXIGA의 안전성 및 유효성은 10세 미만의 소아 환자에서 확립되지 않았습니다.
FARXIGA의 안전성 및 유효성은 다음과 같은 위험을 줄이기 위한 소아 환자에서 확립되지 않았습니다. [적응증 및 사용 (1) 참조].
- •
- 진행 위험이 있는 만성 신장 질환 환자의 지속적인 eGFR 감소, 말기 신장 질환, 심혈관 사망 및 심부전 입원.
- •
- 심부전 환자의 심혈관 사망, 심부전 입원 및 긴급 심부전 방문.
- •
- 확립된 심혈관 질환 또는 다중 심혈관 위험 요인이 있는 2형 당뇨병 환자의 심부전 입원.
8.5 노인 사용
나이에 따라 FARXIGA 용량 조절은 권장되지 않습니다.
2형 당뇨병 환자의 혈당 조절 개선에 대한 FARXIGA의 유효성을 평가한 21건의 이중맹검, 대조, 임상 시험에서 FARXIGA로 치료받은 환자 5936명 중 1424명(24%)이 65세 이상이었고 207명(3.5%)이 75세 이상이었습니다. 신장 기능 수준(eGFR)을 조절한 후, 65세 미만 환자와 65세 이상 환자의 유효성은 유사했습니다. 혈당 조절을 위해 FARXIGA로 치료받은 65세 이상 환자의 경우, 저혈압의 유해 반응을 경험한 환자의 비율이 더 높았습니다. [경고 및 주의 사항 (5.2) 및 유해 반응 (6.1) 참조].
DAPA-CKD, DAPA-HF 및 DELIVER 시험에서 65세 이하 환자와 65세 이상 환자의 안전성 및 유효성은 유사했습니다. DAPA-HF 연구에서 HFrEF 환자 4744명 중 2714명(57%)이 65세 이상이었습니다. DELIVER 연구에서 심부전(LVEF >40%) 환자 6263명 중 4759명(76%)이 65세 이상이었습니다. DAPA-CKD 연구에서 CKD 환자 4304명 중 1818명(42%)이 65세 이상이었습니다.
8.6 신장 장애
DAPA-CKD 시험에서 만성 신장 질환(eGFR 25~75 mL/min/1.73 m2)이 있는 성인 환자 4304명을 대상으로 FARXIGA를 평가했습니다. DAPA-HF 시험에서 eGFR이 30~60 mL/min/1.73 m2인 성인 환자 1926명을 대상으로 FARXIGA를 평가했습니다. 이러한 연구에서 eGFR 하위 그룹 전반에 걸친 FARXIGA의 안전성 프로파일은 알려진 안전성 프로파일과 일치했습니다. [유해 반응 (6.1) 및 임상 연구 (14.4, 14.5) 참조].
FARXIGA는 중등도 신장 장애(eGFR 45~60 mL/min/1.73 m2 미만 [임상 연구 (14.1) 참조] 및 eGFR 30~60 mL/min/1.73 m2 미만)가 있는 2형 당뇨병 환자를 포함한 2건의 혈당 조절 성인 시험에서 평가되었습니다. FARXIGA를 사용하는 당뇨병 및 신장 장애 환자는 저혈압을 경험할 가능성이 더 높으며, 혈액량 감소로 인해 급성 신장 손상 위험이 더 높을 수 있습니다. eGFR이 30~60 mL/min/1.73 m2 미만인 성인 환자를 대상으로 한 시험에서 FARXIGA를 투여받은 환자 13명이 골절을 경험한 반면, 위약을 투여받은 환자는 없었습니다. 확립된 심혈관 질환 또는 심혈관 위험 요인이 없는 환자의 경우, eGFR이 45 mL/min/1.73 m2 미만일 때 혈당 조절을 위한 FARXIGA의 사용은 권장되지 않습니다. [용량 및 투여 (2.1) 참조].
FARXIGA를 사용한 유효성 및 안전성 시험에는 eGFR이 25 mL/min/1.73 m2 미만이거나 투석을 받는 환자는 포함되지 않았습니다. DAPA-CKD 및 DELIVER 시험에 등록된 후, 성인 환자는 eGFR이 25 mL/min/1.73 m2 미만으로 떨어지거나 투석이 시작된 경우 치료를 중단할 필요가 없었습니다. DAPA-HF 시험에 등록된 후, 성인 환자는 eGFR이 30 mL/min/1.73 m2 미만으로 떨어지거나 투석이 시작된 경우 치료를 중단할 필요가 없었습니다. [용량 및 투여 (2.3) 및 임상 연구 (14.4,14.5) 참조].
8.7 간 장애
경증, 중등도 또는 중증 간 장애가 있는 환자의 경우 용량 조절은 권장되지 않습니다. 그러나 dapagliflozin의 안전성 및 유효성이 이러한 환자군에서 특별히 연구되지 않았기 때문에 중증 간 장애가 있는 환자의 경우 dapagliflozin 사용의 유익성과 위험성을 개별적으로 평가해야 합니다. [임상 약리학 (12.3) 참조].
10 과다 복용
FARXIGA의 임상 개발 프로그램 동안 과다 복용 사례는 보고되지 않았습니다.
과다 복용 시, 추가적인 과다 복용 관리 권장 사항에 대해 Poison Help line (1-800-222-1222) 또는 의료 독물학자에게 문의하십시오. 환자의 임상 상태에 따라 필요한 경우 보조적인 조치를 취하는 것도 합리적입니다. 혈액 투석을 통한 dapagliflozin 제거는 연구되지 않았습니다.
11 설명
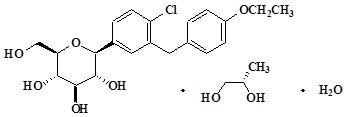
SGLT2 억제제인 다파글리플로진은 화학적으로 D-글루시톨, 1,5-안하이드로-1-C-[4-클로로-3-[(4-에톡시페닐)메틸]페닐]-, (1S)-, (2S)-1,2-프로판디올, 하이드레이트(1:1:1)와 결합된 것으로 설명됩니다. 경험적 공식은 C21H25ClO6•C3H8O2•H2O이고 분자량은 502.98입니다. 구조식은 다음과 같습니다.
FARXIGA는 경구 투여용 필름 코팅 정제로 제공되며, 다파글리플로진 프로판디올로서 다파글리플로진 5mg 또는 다파글리플로진 프로판디올로서 다파글리플로진 10mg에 해당하는 양을 함유하고 있으며, 다음과 같은 비활성 성분을 함유하고 있습니다: 무수 락토스, 크로스포비돈, 마그네슘 스테아레이트, 미결정 셀룰로스, 실리카. 또한, 필름 코팅에는 다음과 같은 비활성 성분이 포함되어 있습니다: 폴리에틸렌 글리콜, 폴리비닐 알코올, 활석, 이산화티탄, 황색 산화철.
12 임상약리학
12.1 작용 기전
근위 세뇨관에 발현되는 소듐-포도당 공동 수송체 2(SGLT2)는 사구체 여과된 포도당의 재흡수 대부분을 담당합니다. 다파글리플로진은 SGLT2 억제제입니다. 다파글리플로진은 SGLT2를 억제하여 사구체 여과된 포도당의 재흡수를 감소시키고, 그에 따라 요중 포도당 배설을 증가시킵니다.
다파글리플로진은 또한 소듐 재흡수를 감소시키고 원위 세뇨관으로의 소듐 전달을 증가시킵니다. 이는 심장의 전후 부하 감소 및 교감 신경 활성 저하, 사구체 내압 감소를 포함하되 이에 국한되지 않는 여러 생리적 기능에 영향을 미칠 수 있으며, 이는 세뇨관-사구체 피드백 증가에 의해 매개되는 것으로 여겨집니다.
12.2 약력학
일반
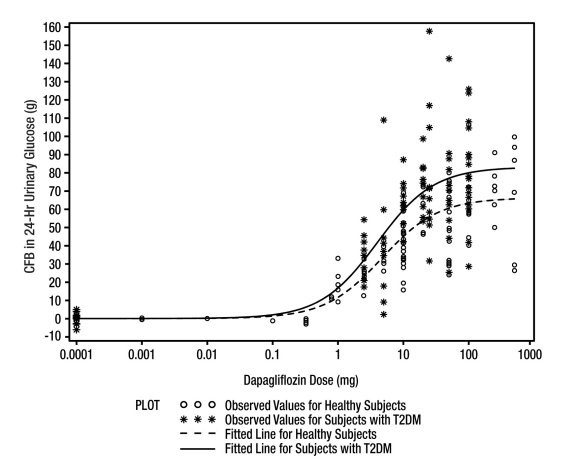
다파글리플로진 투여 후 건강한 피험자 및 2형 당뇨병 환자에서 요중 포도당 배설량 증가가 관찰되었습니다(그림 1 참조). 2형 당뇨병 환자에서 다파글리플로진 5mg 또는 10mg을 12주 동안 매일 투여한 결과, 12주차에 요중 포도당 배설량이 하루 약 70g으로 나타났습니다. 다파글리플로진 일일 용량 20mg에서 거의 최대 포도당 배설량이 관찰되었습니다. 다파글리플로진에 의한 이러한 요중 포도당 배설은 요량 증가로 이어집니다 [부작용(6.1) 참조]. 다파글리플로진 투여 중단 후, 평균적으로 요중 포도당 배설량 증가는 10mg 용량의 경우 약 3일 만에 기준선 수준으로 돌아갑니다.
그림 1: 건강한 피험자 및 2형 당뇨병(T2DM) 환자에서 기준선 대비 24시간 요중 포도당 배설량 변화와 다파글리플로진 용량 간 산점도 및 적합 선(반로그 플롯)
12.3 약동학
흡수
다파글리플로진을 경구 투여한 후, 공복 상태에서 최대 혈장 농도(Cmax)는 일반적으로 2시간 이내에 도달합니다. Cmax 및 AUC 값은 치료 용량 범위에서 다파글리플로진 용량 증가에 비례하여 증가합니다. 10mg 용량을 투여한 후 다파글리플로진의 절대 경구 생체 이용률은 78%입니다. 고지방 식사와 함께 다파글리플로진을 투여하면 Cmax가 최대 50% 감소하고 Tmax가 약 1시간 연장되지만, 공복 상태와 비교하여 AUC는 변하지 않습니다. 이러한 변화는 임상적으로 유의미하지 않은 것으로 간주되며, 다파글리플로진은 식사와 관계없이 투여할 수 있습니다.
대사
다파글리플로진의 대사는 주로 UGT1A9에 의해 매개됩니다. CYP 매개 대사는 인간에서 부차적인 청소 경로입니다. 다파글리플로진은 광범위하게 대사되며, 주로 비활성 대사체인 다파글리플로진 3-O-글루쿠로나이드를 생성합니다. 다파글리플로진 3-O-글루쿠로나이드는 50mg의 [14C]-다파글리플로진 용량의 61%를 차지하며, 인간 혈장에서 우세한 약물 관련 성분입니다.
배설
다파글리플로진 및 관련 대사체는 주로 신장 경로를 통해 배설됩니다. [14C]-다파글리플로진 50mg을 단일 용량 투여한 후, 총 방사능의 75%와 21%가 각각 요 및 대변으로 배설됩니다. 요에서 용량의 2% 미만이 모약물로 배설됩니다. 대변에서 용량의 약 15%가 모약물로 배설됩니다. FARXIGA 10mg을 단일 경구 용량 투여한 후 다파글리플로진의 평균 혈장 말기 반감기(t½)는 약 12.9시간입니다.
특정 인구 집단
소아 환자
2형 당뇨병이 있는 10세에서 17세 사이의 소아 환자에서 다파글리플로진의 약동학 및 약력학(당뇨뇨증)은 동일한 신장 기능을 가진 성인 환자에서 관찰된 것과 유사했습니다.
연령, 성별, 인종 및 체중의 약동학적 영향
모집단 약동학 분석 결과, 연령, 성별, 인종 및 체중은 다파글리플로진의 약동학에 임상적으로 유의미한 영향을 미치지 않으므로 용량 조절은 권장되지 않습니다.
신장애 환자
안정 상태(다파글리플로진 20mg 1일 1회 7일 투여)에서 eGFR에 의해 측정된 경증, 중등도 또는 중증 신장애가 있는 2형 당뇨병 성인 환자의 경우, 다파글리플로진의 기하 평균 전신 노출량은 정상 신장 기능을 가진 2형 당뇨병 환자에 비해 각각 45%, 100% 및 200% 높았습니다. 2형 당뇨병 유무에 관계없이 만성 신장 질환 환자 간 노출량에는 유의미한 차이가 없었습니다. 신장애가 있는 2형 당뇨병 환자의 다파글리플로진 전신 노출량 증가는 24시간 요중 포도당 배설량의 상응하는 증가로 이어지지 않았습니다. 2형 당뇨병 환자에서 경증, 중등도 및 중증 신장애가 있는 경우 안정 상태 24시간 요중 포도당 배설량은 정상 신장 기능을 가진 2형 당뇨병 환자에 비해 각각 42%, 80% 및 90% 낮았습니다.
다파글리플로진 노출에 대한 혈액 투석의 영향은 알려져 있지 않습니다. [경고 및 주의 사항 (5.2), 특정 환자군에서의 사용 (8.6) 및 임상 연구 (14) 참조]
간장애 환자
경증 및 중등도 간장애(Child-Pugh 등급 A 및 B)가 있는 성인 피험자의 경우, 다파글리플로진 10mg 단회 투여 후 다파글리플로진의 평균 Cmax 및 AUC는 건강한 대조군 피험자에 비해 각각 최대 12% 및 36% 높았습니다. 이러한 차이는 임상적으로 유의미하다고 여겨지지 않았습니다. 중증 간장애(Child-Pugh 등급 C)가 있는 성인 환자의 경우, 다파글리플로진의 평균 Cmax 및 AUC는 건강한 대조군에 비해 각각 최대 40% 및 67% 높았습니다. [특정 환자군에서의 사용 (8.7) 참조]
약물 상호 작용
시험관 내 약물 상호 작용 평가
시험관 내 연구에서 다파글리플로진 및 다파글리플로진 3-O-글루쿠로나이드는 CYP 1A2, 2C9, 2C19, 2D6 또는 3A4를 억제하지 않았으며 CYP 1A2, 2B6 또는 3A4를 유도하지도 않았습니다. 다파글리플로진은 P-당단백질(P-gp) 활성 수송체의 약한 기질이며, 다파글리플로진 3-O-글루쿠로나이드는 OAT3 활성 수송체의 기질입니다. 다파글리플로진 또는 다파글리플로진 3-O-글루쿠로나이드는 P-gp, OCT2, OAT1 또는 OAT3 활성 수송체를 유의미하게 억제하지 않았습니다. 전반적으로 다파글리플로진은 P-gp, OCT2, OAT1 또는 OAT3 기질인 동시 투여되는 약물의 약동학에 영향을 미칠 가능성이 낮습니다.
다른 약물의 다파글리플로진에 대한 영향
표 5는 성인에서 동시 투여되는 약물이 다파글리플로진의 약동학에 미치는 영향을 보여줍니다. 다파글리플로진에 대한 용량 조절은 권장되지 않습니다.
|
동시 투여되는 약물 |
다파글리플로진 |
다파글리플로진 노출량에 대한 영향 |
|
|
Cmax |
AUC† |
||
|
다음에 대한 용량 조절은 필요하지 않습니다. |
|||
|
경구 혈당 강하제 |
|||
|
메트포르민 (1000mg) |
20mg |
↔ |
↔ |
|
Pioglitazone (45 mg) |
50 mg |
↔ |
↔ |
|
Sitagliptin (100 mg) |
20 mg |
↔ |
↔ |
|
Glimepiride (4 mg) |
20 mg |
↔ |
↔ |
|
Voglibose (0.2 mg three times daily) |
10 mg |
↔ |
↔ |
|
Other Medications |
|||
|
Hydrochlorothiazide (25 mg) |
50 mg |
↔ |
↔ |
|
Bumetanide (1 mg) |
10 mg once daily |
↔ |
↔ |
|
Valsartan (320 mg) |
20 mg |
↓12% |
↔ |
|
Simvastatin (40 mg) |
20 mg |
↔ |
↔ |
|
Anti-infective Agent |
|||
|
Rifampin (600 mg once daily for 6 days) |
10 mg |
↓7% |
↓22% |
|
Nonsteroidal Anti-inflammatory Agent |
|||
|
Mefenamic Acid (loading dose of 500 mg followed by 14 doses of 250 mg every 6 hours) |
10 mg |
↑13% |
↑51% |
|
↔ = no change (geometric mean ratio of test: reference within 0.80 to 1.25); ↓ or ↑ = parameter was lower or higher, respectively, with coadministration compared to dapagliflozin administered alone (geometric mean ratio of test: reference was lower than 0.80 or higher than 1.25). |
|||
다파글리플로진의 다른 약물에 대한 영향
표 6은 성인에서 다파글리플로진이 다른 병용 투여 약물에 미치는 영향을 보여줍니다. 다파글리플로진은 병용 투여 약물의 약동학에 유의미한 영향을 미치지 않았습니다.
|
병용 투여 약물 |
다파글리플로진 |
병용 투여 약물 노출에 대한 영향 |
|
|
Cmax |
AUC† |
||
|
다음에 대해서는 용량 조절이 필요하지 않습니다. |
|||
|
경구 혈당 강하제 |
|||
|
메트포르민 (1000 mg) |
20 mg |
↔ |
↔ |
|
피오글리타존 (45 mg) |
50 mg |
↓7% |
↔ |
|
시타글립틴 (100 mg) |
20 mg |
↔ |
↔ |
|
글리메피리드 (4 mg) |
20 mg |
↔ |
↑13% |
|
기타 약물 |
|||
|
히드로클로로티아지드 (25 mg) |
50 mg |
↔ |
↔ |
|
부메타니드 (1 mg) |
10 mg 1일 1회 |
↑13% |
↑13% |
|
발사르탄 (320 mg) |
20 mg |
↓6% |
↑5% |
|
심바스타틴 (40 mg) |
20 mg |
↔ |
↑19% |
|
디곡신 (0.25 mg) |
20 mg 로딩 용량 |
↔ |
↔ |
|
와파린 (25 mg) |
20 mg 로딩 용량 |
↔ |
↔ |
|
↔ = 변화 없음 (시험: 참조 기하 평균 비율이 0.80~1.25 사이); ↓ 또는 ↑ = 다른 약물 단독 투여와 비교하여 동시 투여 시 매개변수가 각각 낮거나 높았음 (시험: 참조 기하 평균 비율이 0.80 미만 또는 1.25 초과). |
|||
13 비임상 독성학
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
2년간의 발암성 연구에서 평가된 어떤 용량에서도 Dapagliflozin은 마우스나 쥐에서 종양을 유발하지 않았습니다. 마우스에서 경구 용량은 수컷에서 5, 15, 40 mg/kg/day, 암컷에서 2, 10, 20 mg/kg/day였으며, 쥐에서 경구 용량은 수컷과 암컷 모두 0.5, 2, 10 mg/kg/day였습니다. 마우스에서 평가된 최고 용량은 AUC 노출을 기준으로 1일 10mg의 임상 용량의 약 72배(수컷) 및 105배(암컷)였습니다. 쥐에서 최고 용량은 AUC 노출을 기준으로 1일 10mg의 임상 용량의 약 131배(수컷) 및 186배(암컷)였습니다.
Dapagliflozin은 Ames 돌연변이 유발 분석에서 음성이었고, S9 활성화 하에서 그리고 100 µg/mL 이상의 농도에서 일련의 in vitro 염색체이상 유발 분석에서 양성이었습니다. Dapagliflozin은 임상 용량의 2100배 이상의 노출 배수에서 쥐의 미세핵 또는 DNA 복구를 평가하는 일련의 in vivo 연구에서 염색체이상 유발에 대해 음성이었습니다.
동물 연구에서 발암성 또는 돌연변이 유발 신호가 없었으며, 이는 dapagliflozin이 인간에게 유전독성 위험을 나타내지 않음을 시사합니다.
Dapagliflozin은 수컷과 암컷에서 각각 최대 권장 용량의 1708배 및 998배 이하의 노출 배수에서 치료된 수컷 또는 암컷 쥐의 교배, 생식력 또는 초기 배아 발달에 영향을 미치지 않았습니다.
14 임상 연구
14.1 2형 당뇨병 성인의 혈당 조절
2형 당뇨병 성인에서 FARXIGA의 임상 시험 개요
FARXIGA는 단독 요법, 메트포르민, 피오글리타존, 설폰요소제(글리메피리드), 시타글립틴(메트포르민과 함께 또는 없이), 메트포르민과 설폰요소제, 또는 인슐린(다른 경구 혈당 강하제와 함께 또는 없이)과의 병용 요법, 설폰요소제(글리피지드)와 비교하여, 그리고 메트포르민에 추가된 GLP-1 수용체 작용제(엑세나티드 지속 방출)와의 병용 요법으로 성인 환자에서 연구되었습니다. FARXIGA는 또한 중등도 신장 장애가 있는 2형 당뇨병 성인 환자에서 연구되었습니다.
단독 요법으로 FARXIGA를 투여하거나 메트포르민, 글리메피리드, 피오글리타존, 시타글립틴 또는 인슐린과 병용 투여한 경우, 대조군에 비해 24주째 기준선에서 평균 변화가 HbA1c에서 통계적으로 유의하게 개선되었습니다. HbA1c 감소는 성별, 연령, 인종, 질병 기간 및 기준선 체질량 지수(BMI)를 포함한 하위 그룹에서 관찰되었습니다.
단독 요법
총 840명의 치료 경험이 없는 성인 환자에서 적절히 조절되지 않은 2형 당뇨병이 FARXIGA 단독 요법의 안전성과 유효성을 평가하기 위해 위약 대조군 시험 2건에 참여했습니다.
단독 요법 시험 1건에서, 총 558명의 치료 경험이 없는 환자에서 적절히 조절되지 않은 당뇨병이 24주 시험(NCT00528372)에 참여했습니다. 2주간의 식이 요법 및 운동 위약 리드인 기간 후, HbA1c ≥7% 및 ≤10%인 485명의 환자가 FARXIGA 5mg 또는 FARXIGA 10mg을 아침(QAM, 주요 코호트) 또는 저녁(QPM)에 하루 한 번 또는 위약으로 무작위 배정되었습니다.
24주째, FARXIGA 10mg QAM 투여는 위약과 비교하여 HbA1c와 공복 혈당(FPG)에서 유의한 개선을 제공했습니다(표 7 참조).
| 유효성 지표 | FARXIGA 10mg N=70† |
FARXIGA 5mg N=64† |
위약 N=75† |
|---|---|---|---|
|
HbA1c (%) |
|||
|
기준선(평균) |
8.0 |
7.8 |
7.8 |
|
기준선에서 변화(조정된 평균‡) |
−0.9 |
−0.8 |
−0.2 |
|
위약과의 차이(조정된 평균‡) |
−0.7§ |
−0.5 |
|
|
HbA1c <7%를 달성한 환자 비율 |
50.8%¶ |
44.2%¶ |
31.6% |
|
FPG (mg/dL) |
|||
|
기준 (평균) |
166.6 |
157.2 |
159.9 |
|
기준 대비 변화 (조정된 평균‡) |
−28.8 |
−24.1 |
−4.1 |
|
위약 대비 차이 (조정된 평균‡) |
−24.7§ |
−19.9 |
|
메트포르민 XR과의 초기 병용 요법
24주 동안 진행된 2건의 활성 대조 시험에 부적절하게 조절된 2형 당뇨병(HbA1c ≥7.5% 및 ≤12%)을 가진 치료 경험이 없는 성인 환자 1236명이 참여하여 메트포르민 서방형(XR) 제제와 병용하여 FARXIGA 5mg 또는 10mg의 초기 요법을 평가했습니다.
한 시험(NCT00859898)에서 1주일의 리드인 기간 후 3개의 치료군 중 하나에 무작위 배정된 환자 638명은 FARXIGA 10mg + 메트포르민 XR(1일 최대 2,000mg), FARXIGA 10mg + 위약 또는 메트포르민 XR(1일 최대 2,000mg) + 위약을 투여받았습니다. 메트포르민 XR 용량은 내약성에 따라 매주 500mg씩 증량되었으며, 중간 용량은 2,000mg에 도달했습니다.
FARXIGA 10mg + 메트포르민 XR의 병용 요법은 단독 요법 중 어느 하나와 비교하여 HbA1c 및 FPG에서 통계적으로 유의한 개선을 보였으며, 메트포르민 XR 단독 요법과 비교하여 체중에서 통계적으로 유의한 감소를 보였습니다(표 8 및 그림 2 참조). 단독 요법으로 투여된 FARXIGA 10mg은 메트포르민 단독 요법과 비교하여 FPG에서 통계적으로 유의한 개선을 보였으며, 체중에서 통계적으로 유의한 감소를 보였고, HbA1c 감소 측면에서 메트포르민 XR 단독 요법에 비해 열등하지 않았습니다.
| 유효성 지표 | FARXIGA 10mg + 메트포르민 XR |
FARXIGA 10mg |
메트포르민 XR |
|---|---|---|---|
| N=211* | N=219* | N=208* | |
|
HbA1c (%) |
|||
|
기준(평균) |
9.1 |
9.0 |
9.0 |
|
기준 값에서의 변화(조정된 평균†) |
−2.0 |
−1.5 |
−1.4 |
|
FARXIGA와의 차이(조정된 평균†) |
−0.5‡ |
||
|
메트포르민 XR과의 차이(조정된 평균†) |
−0.5‡ |
0.0§ |
|
|
HbA1c <7%를 달성한 환자 비율 |
46.6%¶ |
31.7% |
35.2% |
|
FPG (mg/dL) |
|||
|
기준(평균) |
189.6 |
197.5 |
189.9 |
|
기준선에서의 변화 (조정된 평균†) |
−60.4 |
−46.4 |
−34.8 |
|
FARXIGA와의 차이 (조정된 평균†) |
−13.9‡ |
||
|
메트포르민 XR과의 차이 (조정된 평균†) |
−25.5‡ |
−11.6¶ |
|
|
체중 (kg) |
|||
|
기준선 (평균) |
88.6 |
88.5 |
87.2 |
|
기준선에서의 변화 (조정된 평균†) |
−3.3 |
−2.7 |
−1.4 |
|
메트포르민 XR과의 차이 (조정된 평균†) |
−2.0‡ |
−1.4‡ (−2.0, −0.7) |
|
그림 2: FARXIGA 메트포르민 XR 초기 병용 요법의 24주 활성 대조군 시험에서 기준선 대비 시간 경과에 따른 HbA1c 변화의 조정된 평균 (%).
두 번째 시험(NCT00643851)에서 603명의 환자를 1주일의 리드인 기간 후 3가지 치료군 중 하나에 무작위 배정했습니다. FARXIGA 5mg + 메트포르민 XR(1일 최대 2,000mg), FARXIGA 5mg + 위약, 또는 메트포르민 XR(1일 최대 2,000mg) + 위약. 메트포르민 XR 용량은 내약성에 따라 매주 500mg씩 증량되었으며, 중앙값 용량은 2,000mg에 도달했습니다.
FARXIGA 5mg + 메트포르민 XR 병용 요법은 단독 요법에 비해 HbA1c 및 FPG에서 통계적으로 유의미한 개선을 보였으며, 메트포르민 XR 단독 요법에 비해 체중 감소가 통계적으로 유의미하게 감소했습니다(표 9 참조).
|
효능 지표 |
FARXIGA |
FARXIGA |
메트포르민 XR |
|
N=194† |
N=203† |
N=201† |
|
|
HbA1c (%) |
|||
|
기준선(평균) |
9.2 |
9.1 |
9.1 |
|
기준선 대비 변화(조정된 평균‡) |
−2.1 |
−1.2 |
−1.4 |
|
FARXIGA 대비 차이(조정된 평균‡) |
−0.9§ |
||
|
메트포르민 XR 대비 차이(조정된 평균‡) |
−0.7§ |
||
|
HbA1c <7%를 달성한 환자 비율 |
52.4%¶ |
22.5% |
34.6% |
|
FPG (mg/dL) |
|||
|
기준선(평균) |
193.4 |
190.8 |
196.7 |
|
기준선 대비 변화(조정된 평균‡) |
-61.0 |
-42.0 |
-33.6 |
|
FARXIGA (조정된 평균‡)와의 차이 |
-19.1§ |
||
|
메트포르민 XR (조정된 평균‡)와의 차이 |
-27.5§ |
||
|
체중 (kg) |
|||
|
기준 (평균) |
84.2 |
86.2 |
85.8 |
|
기준 대비 변화 (조정된 평균‡) |
-2.7 |
-2.6 |
-1.3 |
|
메트포르민 XR (조정된 평균‡)와의 차이 |
-1.4§ |
||
메트포르민 병용 요법
2형 당뇨병 환자로서 적절한 혈당 조절이 이루어지지 않은 성인 환자(HbA1c ≥7% 및 ≤10%) 546명을 대상으로 메트포르민 병용 요법 시 FARXIGA의 효과를 평가하기 위한 위약 대조 24주 연구(NCT00528879)가 시행되었습니다. 메트포르민을 하루 1,500mg 이상 복용하는 환자는 2주간의 단일맹 위약 투여 기간을 거친 후 무작위 배정되었습니다. 투여 기간 종료 후, 적격 환자는 기존 메트포르민 복용량에 더하여 FARXIGA 5mg, FARXIGA 10mg 또는 위약을 무작위로 배정받았습니다.
메트포르민 병용 요법 시, FARXIGA 10mg은 24주차에 위약과 비교하여 HbA1c 및 FPG에서 통계적으로 유의미한 개선을 보였으며, 체중 감소에서도 통계적으로 유의미한 감소를 보였습니다(표 10 및 그림 3 참조). 메트포르민과 함께 FARXIGA 5mg 및 10mg을 투여한 경우, 위약과 메트포르민 병용 요법에 비해 수축기 혈압에서 통계적으로 유의미한(두 용량 모두 p <0.05) 평균 변화가 각각 -4.5mmHg 및 -5.3mmHg였습니다.
|
효능 지표 |
FARXIGA 10mg |
FARXIGA 5mg |
위약 |
|
HbA1c (%) |
|||
|
기준 값(평균) |
7.9 |
8.2 |
8.1 |
|
기준 값 대비 변화(조정된 평균‡) |
-0.8 |
-0.7 |
-0.3 |
|
위약 대비 차이(조정된 평균‡) |
-0.5§ (-0.7, -0.3) |
-0.4§ (-0.6, -0.2) |
|
|
HbA1c <7%를 달성한 환자 비율 |
40.6%¶ |
37.5%¶ |
25.9% |
|
FPG (mg/dL) |
|||
|
기준 값(평균) |
156.0 |
169.2 |
165.6 |
|
24주차 기준 값 대비 변화(조정된 평균‡) |
-23.5 |
-21.5 |
-6.0 |
|
위약 대비 차이 (조정된 평균‡) |
-17.5§ |
-15.5§ |
|
|
기준선 대비 변화 (1주차 조정된 평균‡) |
-16.5§ |
-12.0§ |
1.2 |
|
체중 (kg) |
|||
|
기준선 (평균) |
86.3 |
84.7 |
87.7 |
|
기준선 대비 변화 (조정된 평균‡) |
-2.9 |
-3.0 |
-0.9 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-2.0§ |
-2.2§ (-2.8, -1.5) |
|
그림 3: 메트포르민과 병용 투여한 FARXIGA의 위약 대조 24주 연구에서 기준선 대비 시간 경과에 따른 HbA1c 변화의 조정된 평균 (%).
활성 글리피지드 대조 연구: 메트포르민에 대한 추가 요법
2형 당뇨병 환자로서 불충분한 혈당 조절 (HbA1c >6.5% 및 ≤10%)을 보이는 성인 816명을 대상으로, 메트포르민에 대한 추가 요법으로서 FARXIGA를 평가하기 위한 52주, 글리피지드 대조, 비열등성 시험에 무작위 배정했습니다(NCT00660907). 하루 1,500mg 이상의 메트포르민을 복용하는 환자는 2주 위약 유도 기간 후 글리피지드 또는 다파글리플로진(각각 5mg 또는 2.5mg)에 무작위 배정되었으며, 18주 동안 최적의 혈당 효과(FPG <110mg/dL, <6.1mmol/L) 또는 환자가 내약성을 보이는 최고 용량 수준(최대 글리피지드 20mg 및 FARXIGA 10mg)까지 용량을 증량했습니다. 그 후, 저혈당을 예방하기 위한 용량 감소를 제외하고는 용량을 일정하게 유지했습니다.
적정 기간이 끝날 무렵, FARXIGA로 치료받은 환자의 87%가 최대 시험 용량(10mg)까지 적정된 반면, 글리피지드(20mg)로 치료받은 환자는 73%였습니다. FARXIGA는 52주(LOCF)에 기준선 대비 HbA1c의 평균 감소를 글리피지드와 비교하여 유사하게 유도하여 비열등성을 입증했습니다(표 11 참조). FARXIGA 치료는 52주(LOCF)에 기준선 대비 체중의 통계적으로 유의미한 평균 감소를 유도한 반면, 글리피지드 그룹에서는 체중의 평균 증가를 유도했습니다. 글리피지드와 메트포르민 병용 투여에 비해 FARXIGA와 메트포르민 병용 투여는 기준선 대비 수축기 혈압의 통계적으로 유의미한(p<0.0001) 평균 변화가 5.0mmHg였습니다.
| 효능 지표 | FARXIGA + 메트포르민 N=400† |
글리피지드 + 메트포르민 N=401† |
|---|---|---|
|
HbA1c (%) |
||
|
기준선 (평균) |
7.7 |
7.7 |
|
기준선 대비 변화 (조정된 평균‡) |
-0.5 |
-0.5 |
|
글리피지드 + 메트포르민과의 차이 (조정된 평균‡) |
0.0§ |
|
|
체중 (kg) |
||
|
기준선 (평균) |
88.4 |
87.6 |
|
기준선 대비 변화 (조정된 평균‡) |
-3.2 |
1.4 |
|
글리피지드 + 메트포르민과의 차이 (조정된 평균‡) |
-4.7¶ |
|
기타 당뇨병 치료제와의 병용 요법
설폰요소제와의 병용 요법
2형 당뇨병 환자로서 적절한 혈당 조절이 이루어지지 않은 성인 환자(HbA1c ≥7% 및 ≤10%) 597명을 대상으로 FARXIGA를 글리메피리드(설폰요소제)와 병용하여 평가하는 24주 위약 대조 시험(NCT00680745)을 실시했습니다.
최소 8주 동안 글리메피리드 단독 요법(4mg)의 최대 권장 용량의 절반 이상을 투여받은 환자를 대상으로 글리메피리드 4mg/일을 투여받는 환자군에 FARXIGA 5mg, FARXIGA 10mg 또는 위약을 무작위 배정했습니다. 치료 기간 동안 저혈당증이 발생할 경우 글리메피리드 용량을 2mg 또는 0mg으로 감량할 수 있었지만, 글리메피리드 용량을 증량할 수는 없었습니다.
글리메피리드와 병용 투여한 경우, FARXIGA 10mg은 24주차에 위약과 글리메피리드 병용 투여군에 비해 HbA1c, FPG 및 2시간 PPG가 통계적으로 유의하게 개선되었으며, 체중이 통계적으로 유의하게 감소했습니다(표 12 참조). 위약과 글리메피리드 병용 투여군에 비해 FARXIGA 5mg과 글리메피리드 병용 투여군 및 FARXIGA 10mg과 글리메피리드 병용 투여군의 수축기 혈압은 각각 -2.8mmHg 및 -3.8mmHg로 통계적으로 유의하게(두 용량 모두 p<0.05) 감소했습니다.
메트포르민과 설폰요소제와의 병용 요법
2형 당뇨병 환자로서 적절한 혈당 조절이 이루어지지 않은 성인 환자(HbA1c ≥7% 및 ≤10.5%) 218명을 대상으로 FARXIGA를 메트포르민과 설폰요소제와 병용하여 평가하는 24주 위약 대조 시험(NCT01392677)을 실시했습니다. 등록 전 최소 8주 동안 메트포르민(즉시 방출형 또는 서방형 제제) ≥1,500mg/일과 함께 설폰요소제의 최대 내약 용량(최대 용량의 절반 이상이어야 함)을 투여받은 환자를 대상으로 8주 위약 유도 기간 후 FARXIGA 10mg 또는 위약을 무작위 배정했습니다. 24주 치료 기간 동안 FARXIGA 또는 메트포르민 용량을 조절할 수 없었습니다. 저혈당증을 예방하기 위해 설폰요소제 용량을 감량할 수 있었지만, 용량을 증량할 수는 없었습니다. 메트포르민과 설폰요소제 병용 투여에 추가적인 치료로 FARXIGA 10mg을 투여한 경우, 24주차에 위약 투여군에 비해 HbA1c와 FPG가 통계적으로 유의하게 개선되었으며, 체중이 통계적으로 유의하게 감소했습니다(표 12 참조). 메트포르민과 설폰요소제 병용 투여군에서 FARXIGA 10mg을 메트포르민과 설폰요소제와 병용 투여한 경우, 8주차에 위약에 비해 수축기 혈압이 -3.8mmHg로 통계적으로 유의하게(p <0.05) 감소했습니다.
티아졸리딘디온과의 병용 요법
2형 당뇨병 환자로서 적절한 혈당 조절이 이루어지지 않은 성인 환자(HbA1c ≥7% 및 ≤10.5%) 420명을 대상으로 FARXIGA를 피오글리타존[티아졸리딘디온(TZD)] 단독 요법과 병용하여 평가하는 24주 위약 대조 시험(NCT00683878)을 실시했습니다. 12주 동안 피오글리타존 45mg/일(또는 45mg/일을 내약하지 못할 경우 30mg/일)을 투여받은 환자를 대상으로 2주 유도 기간 후 현재 투여받고 있는 피오글리타존 용량에 더하여 FARXIGA 5mg 또는 10mg 또는 위약을 무작위 배정했습니다. 시험 기간 동안 FARXIGA 또는 피오글리타존 용량을 조절할 수 없었습니다.
피오글리타존과 병용 투여한 경우, FARXIGA 10mg을 투여한 경우 24주차에 위약과 피오글리타존 병용 투여군에 비해 HbA1c, 2시간 PPG, FPG, HbA1c <7%를 달성한 환자 비율이 통계적으로 유의하게 개선되었으며, 체중이 통계적으로 유의하게 감소했습니다(표 12 참조). 피오글리타존과 병용 투여군에서 FARXIGA 10mg을 피오글리타존과 병용 투여한 경우, 위약에 비해 수축기 혈압이 -4.5mmHg로 통계적으로 유의하게(p <0.05) 감소했습니다.
DPP4 억제제와의 병용 요법
약물 치료를 받지 않은 환자 또는 등록 시 메트포르민 또는 DPP4 억제제 단독 요법 또는 병용 요법으로 치료받고 있으며 적절한 혈당 조절이 이루어지지 않은(무작위 배정 시 HbA1c ≥7.0% 및 ≤10.0%) 2형 당뇨병 환자 452명을 대상으로 FARXIGA를 시타글립틴(DPP4 억제제)과 병용하여 메트포르민과 함께 또는 메트포르민 없이 평가하는 24주 위약 대조 시험(NCT00984867)을 실시했습니다.
적격 환자를 배경 메트포르민(≥1,500mg/일) 유무에 따라 계층화했으며, 각 계층 내에서 FARXIGA 10mg과 시타글립틴 100mg을 1일 1회 투여하거나 위약과 시타글립틴 100mg을 1일 1회 투여하도록 무작위 배정했습니다. 종료점은 전체 시험군(메트포르민과 함께 또는 메트포르민 없이 시타글립틴 투여)과 각 계층(시타글립틴 단독 또는 시타글립틴과 메트포르민 병용 투여)에 대해 FARXIGA 10mg과 위약을 비교하여 평가했습니다. 환자의 37%(37%)는 약물 치료를 받지 않았으며, 32%는 메트포르민 단독 요법을, 13%는 DPP4 억제제 단독 요법을, 18%는 DPP4 억제제와 메트포르민 병용 요법을 받았습니다. 시험 기간 동안 FARXIGA, 시타글립틴 또는 메트포르민 용량을 조절할 수 없었습니다.
시타글립틴(메트포르민과 함께 또는 메트포르민 없이)과 병용 투여한 경우, FARXIGA 10mg은 24주차에 위약과 시타글립틴(메트포르민과 함께 또는 메트포르민 없이) 병용 투여군에 비해 HbA1c, FPG가 통계적으로 유의하게 개선되었으며, 체중이 통계적으로 유의하게 감소했습니다(표 12 참조). 이러한 개선은 FARXIGA 10mg과 시타글립틴 단독 요법을 투여받은 환자 계층(위약 조정 평균 HbA1c 변화 -0.56%; n=110)에서 위약과 시타글립틴 단독 요법을 투여받은 환자 계층(n=111)과 비교했을 때, 그리고 FARXIGA 10mg과 시타글립틴 및 메트포르민 병용 요법을 투여받은 환자 계층(위약 조정 평균 HbA1c 변화 -0.40; n=113)에서 위약과 시타글립틴 및 메트포르민 병용 요법을 투여받은 환자 계층(n=113)과 비교했을 때에도 나타났습니다.
인슐린과의 병용 요법
당뇨병성 혈당 조절이 불충분한 (HbA1c ≥7.5% 및 ≤10.5%) 성인 2형 당뇨병 환자 808명을 대상으로 24주 위약 대조 시험에서 FARXIGA를 인슐린 병용 요법으로 평가했습니다(NCT00673231). 등록 전 최소 8주 동안 1일 주입 인슐린 평균 용량이 최소 30 IU인 안정적인 인슐린 요법을 받고 있고, 메트포르민을 포함한 최대 2가지 경구 혈당 강하제(OAD)를 복용한 환자는 2주 등록 기간을 마친 후 현재 인슐린 용량과 기타 OAD(해당되는 경우)에 더하여 FARXIGA 5mg, FARXIGA 10mg 또는 위약을 무작위로 투여받았습니다. 환자는 배경 OAD 유무에 따라 계층화되었습니다. 인슐린의 증량 또는 감량은 치료 단계에서 특정 혈당 목표를 달성하지 못한 환자에게만 허용되었습니다. 인슐린 치료 중단 후 저혈당에 대한 우려가 있는 경우 OAD(s)를 감소시키는 것을 제외하고는 치료 단계에서 눈가림된 시험 약물 또는 OAD(s)의 용량 조정은 허용되지 않았습니다.
이 시험에서 환자의 50%는 기준선에서 인슐린 단독 요법을 받았고, 50%는 인슐린에 더하여 1개 또는 2개의 OAD를 복용했습니다. 24주차에 FARXIGA 10mg 용량은 인슐린과 병용하여 위약과 비교하여 HbA1c를 통계적으로 유의하게 개선하고 평균 인슐린 용량을 감소시켰으며, 최대 2개의 OAD를 병용하거나 병용하지 않고 인슐린과 병용하여 체중을 통계적으로 유의하게 감소시켰습니다(표 12 참조). FARXIGA의 HbA1c에 대한 효과는 인슐린 단독으로 치료받은 환자와 인슐린과 OAD를 병용하여 치료받은 환자에서 유사했습니다. 인슐린과 병용하여 위약과 비교하여 수축기 혈압의 기준선 대비 통계적으로 유의한(p<0.05) 평균 변화는 FARXIGA 10mg을 인슐린과 병용하여 -3.0 mmHg였습니다.
24주차에 FARXIGA 5mg(-5.7 IU, 위약과의 차이)과 10mg(-6.2 IU, 위약과의 차이)을 1일 1회 투여한 결과, 인슐린과 병용하여 위약과 비교하여 평균 일일 인슐린 용량이 통계적으로 유의하게 감소했으며(두 용량 모두 p<0.0001), FARXIGA 10mg을 투여받은 환자의 비율이 통계적으로 유의하게 높았습니다(19.6%). 위약(11.0%)과 비교하여 인슐린 용량을 최소 10% 감소시켰습니다.
|
|||
|
유효성 지표 |
FARXIGA 10mg |
FARXIGA 5mg |
위약 |
|
설폰요소제(글리메피리드)와 병용 |
|||
|
의도적 치료 집단 |
N=151† |
N=142† |
N=145† |
|
HbA1c (%) |
|||
|
기준선(평균) |
8.1 |
8.1 |
8.2 |
|
기준선 대비 변화(조정된 평균‡) |
-0.8 |
-0.6 |
-0.1 |
|
위약과의 차이 (조정된 평균‡) |
-0.7§ (-0.9, -0.5) |
-0.5§ (-0.7, -0.3) |
|
|
HbA1c <7% 달성 환자 비율 (기준선 조정) |
31.7%§ |
30.3%§ |
13.0% |
|
FPG (mg/dL) |
|||
|
기준선 (평균) |
172.4 |
174.5 |
172.7 |
|
기준선에서의 변화 (조정된 평균‡) |
-28.5 |
-21.2 |
-2.0 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-26.5§ (-33.5, -19.5) |
-19.3§ (-26.3, -12.2) |
|
|
2시간 PPG¶ (mg/dL) |
|||
|
기준선 (평균) |
329.6 |
322.8 |
324.1 |
|
기준선에서의 변화 (조정된 평균‡) |
-60.6 |
–54.5 |
-11.5 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-49.1§ (-64.1, -34.1) |
-43.0§ (–58.4, -27.5) |
|
|
체중 (kg) |
|||
|
기준선 (평균) |
80.6 |
81.0 |
80.9 |
|
기준선에서의 변화 (조정된 평균‡) |
-2.3 |
-1.6 |
-0.7 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-1.5§ (-2.2, -0.9) |
-0.8§ (-1.5, -0.2) |
|
|
메트포르민 및 설폰요소와 병용 |
|||
|
의도적 치료 집단 |
N=108† |
– |
N=108† |
|
HbA1c (%) |
|||
|
기준 (평균) |
8.08 |
– |
8.24 |
|
-0.86 |
– |
-0.17 |
|
|
(95% CI) |
-0.69§ (-0.89, -0.49) |
– |
|
|
HbA1c <7% 달성 환자 비율 |
31.8%§ |
– |
11.1% |
|
FPG (mg/dL) |
|||
|
기준 (평균) |
167.4 |
– |
180.3 |
|
기준 대비 변화 (조정된 평균‡) |
-34.2 |
– |
-0.8 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-33.5§ (-43.1, -23.8) |
– |
|
|
체중 (kg) |
|||
|
기준 (평균) |
88.57 |
– |
90.07 |
|
기준 대비 변화 (조정된 평균‡) |
-2.65 |
– |
-0.58 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-2.07§ (-2.79, -1.35) |
– |
|
|
티아졸리딘디온 (피오글리타존) 병용 |
|||
|
의도적 치료 집단 |
N=140Þ |
N=141Þ |
N=139Þ |
|
HbA1c (%) |
|||
|
기준 (평균) |
8.4 |
8.4 |
8.3 |
|
기준 대비 변화 (조정된 평균‡) |
-1.0 |
-0.8 |
-0.4 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-0.6§ (-0.8, -0.3) |
-0.4§ (-0.6, -0.2) |
|
|
HbA1c <7% 달성 환자 비율 |
38.8%ß |
32.5%ß |
22.4% |
|
FPG (mg/dL) |
|||
|
기준선 (평균) |
164.9 |
168.3 |
160.7 |
|
기준선 대비 변화 (조정된 평균‡) |
-29.6 |
-24.9 |
-5.5 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-24.1§ (-32.2, -16.1) |
-19.5§ (-27.5, -11.4) |
|
|
2시간 PPG¶ (mg/dL) |
|||
|
기준선 (평균) |
308.0 |
284.8 |
293.6 |
|
기준선 대비 변화 (조정된 평균‡) |
-67.5 |
-65.1 |
-14.1 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-53.3§ (-71.1, -35.6) |
-51.0§ (-68.7, -33.2) |
|
|
체중 (kg) |
|||
|
기준선 (평균) |
84.8 |
87.8 |
86.4 |
|
기준선 대비 변화 (조정된 평균‡) |
-0.1 |
0.1 |
1.6 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-1.8§ (-2.6, -1.0) |
-1.6§ (-2.3, -0.8) |
|
|
DPP4 억제제 (시타글립틴)와 메트포르민 병용 또는 단독 투여 |
|||
|
의도적 치료 집단 |
N=223† |
– |
N=224† |
|
HbA1c (%) |
|||
|
기준 (평균) |
7.90 |
– |
7.97 |
|
기준 대비 변화 (조정된 평균‡) |
-0.45 |
– |
0.04 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-0.48§ (-0.62, -0.34) |
– |
|
|
HbA1c 감소 ≥0.7%인 환자 (조정된 백분율) |
35.4% |
– |
16.6% |
|
FPG (mg/dL) |
|||
|
기준 (평균) |
161.7 |
– |
163.1 |
|
24주차 기준 대비 변화 (조정된 평균‡) |
-24.1 |
– |
3.8 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-27.9§ (-34.5, -21.4) |
– |
|
|
체중 (kg) |
|||
|
기준 (평균) |
91.02 |
– |
89.23 |
|
기준 대비 변화 (조정된 평균‡) |
-2.14 |
– |
-0.26 |
|
위약 대비 차이 (조정된 평균‡) (95% CI) |
-1.89§ (-2.37, -1.40) |
– |
|
|
인슐린과 함께 또는 최대 2가지 경구 혈당 강하제와 함께 사용 |
|||
|
의도적 치료 집단 |
N=194† |
N=211† |
N=193† |
|
HbA1c (%) |
|||
|
기준 (평균) |
8.6 |
8.6 |
8.5 |
|
기준 대비 변화 (조정된 평균‡) |
-0.9 |
-0.8 |
-0.3 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-0.6§ (-0.7, -0.5) |
-0.5§ (-0.7, -0.4) |
|
|
FPG (mg/dL) |
|||
|
기준 (평균) |
173.7 |
NTà |
170.0 |
|
기준 대비 변화 (조정된 평균‡) |
-21.7 |
NTà |
3.3 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-25.0§ (-34.3, -15.8) |
NTà |
|
|
체중 (kg) |
|||
|
기준 (평균) |
94.6 |
93.2 |
94.2 |
|
기준 대비 변화 (조정된 평균‡) |
-1.7 |
-1.0 |
0.0 |
|
위약과의 차이 (조정된 평균‡) (95% CI) |
-1.7§ (-2.2, -1.2) |
-1.0§ (-1.5, -0.5) |
|
엑세나타이드 지속 방출과의 병용 요법 (메트포르민 추가 요법)
메트포르민으로 치료받고 있지만 혈당 조절이 충분하지 않은 (HbA1c ≥8.0 및 ≤12.0%) 2형 당뇨병 성인 환자 694명을 대상으로, 메트포르민에 추가하여 FARXIGA를 엑세나타이드 지속 방출 (GLP-1 수용체 작용제)과 병용 투여한 경우, FARXIGA 단독 투여 및 엑세나타이드 지속 방출 단독 투여와 비교하는 28주 이중맹검, 활성 대조군 시험을 실시했습니다 (NCT02229396). 메트포르민을 하루 1,500mg 이상 투여받은 환자는 1주일의 위약 투여 기간 후, FARXIGA 10mg 1일 1회 (QD)를 엑세나타이드 지속 방출 2mg 1주 1회 (QW)와 병용 투여하거나, FARXIGA 10mg QD를 투여하거나, 엑세나타이드 지속 방출 2mg QW를 투여하도록 무작위 배정했습니다.
28주차에 FARXIGA를 엑세나타이드 지속 방출과 병용 투여한 경우, FARXIGA 단독 투여 (-1.32%, p=0.001) 및 엑세나타이드 지속 방출 단독 투여 (-1.42%, p=0.012)와 비교하여 HbA1c가 통계적으로 유의하게 더 크게 감소했습니다 (-1.77%). FARXIGA를 엑세나타이드 지속 방출과 병용 투여한 경우, FARXIGA 단독 투여 (-44.72 mg/dL, p=0.006) 및 엑세나타이드 지속 방출 단독 투여 (-40.53, p <0.001)와 비교하여 FPG가 통계적으로 유의하게 더 크게 감소했습니다 (-57.35 mg/dL).
중등도 신장애가 있는 성인 2형 당뇨병 환자에서의 사용
FARXIGA는 중등도 신장애가 있는 성인 2형 당뇨병 환자를 대상으로 한 두 건의 위약 대조군 시험에서 평가되었습니다.
현재 당뇨병 치료로 충분히 조절되지 않은 2형 당뇨병 환자 중 eGFR이 45mL/min/1.73 m2 이상 60mL/min/1.73 m2 미만인 환자를 대상으로 24주 이중맹검, 위약 대조군 임상 시험을 실시했습니다 (NCT02413398). 환자는 FARXIGA 10mg 또는 위약을 하루에 한 번 경구 투여하도록 무작위 배정했습니다. 24주차에 FARXIGA는 위약과 비교하여 HbA1c가 통계적으로 유의하게 감소했습니다 (표 13).
표 13: 중등도 신장애 (eGFR 45mL/min/1.73 m2 이상 60mL/min/1.73 m2 미만)가 있는 성인 2형 당뇨병 환자에서 FARXIGA에 대한 위약 대조군 시험의 24주차 결과
14.2 10세 이상 소아 및 청소년 2형 당뇨병 환자의 혈당 조절
소아 임상 시험(NCT03199053)에서, 2형 당뇨병(HbA1c ≥6.5% 및 ≤10.5%)이 적절히 조절되지 않은 10세에서 17세 사이의 환자들은 메트포르민, 인슐린 또는 메트포르민과 인슐린 병용 요법에 추가하여 FARXIGA(81명) 또는 위약(76명)을 무작위 배정받았습니다. 이 26주 위약 대조, 이중 맹검 무작위 배정 임상 시험은 26주 안전성 연장 기간을 포함했으며, 환자들은 리드인 기간 후 FARXIGA 5mg 또는 위약을 투여받았습니다. 14주차에 HbA1c 값이 <7%인 환자들은 5mg을 계속 투여받았고, HbA1c 값이 ≥7%인 환자들은 5mg을 계속 투여받거나 10mg으로 증량 투여받도록 무작위 배정되었습니다.
기준선에서 FARXIGA 투여군 환자의 88%와 위약 투여군 환자의 89%는 인슐린 유무와 관계없이 메트포르민을 배경 약물로 복용했습니다. 기준선에서 FARXIGA 투여군 환자의 평균 HbA1c는 8.2%였고, 위약 투여군 환자의 평균 HbA1c는 8.0%였으며, 2형 당뇨병의 평균 지속 기간은 FARXIGA 투여군 환자의 경우 2.3년, 위약 투여군 환자의 경우 2.5년이었습니다. FARXIGA 투여군 환자의 평균 연령은 14.4세였고, 위약 투여군 환자의 평균 연령은 14.7세였으며, FARXIGA 투여군 환자의 약 61%와 위약 투여군 환자의 약 58%가 여성이었습니다. FARXIGA 투여군 환자의 경우 약 52%가 백인, 22%가 아시아인, 9%가 흑인 또는 아프리카계 미국인, 56%가 히스패닉 또는 라틴 아메리카인이었습니다. 위약 투여군 환자의 경우 약 42%가 백인, 32%가 아시아인, 4%가 흑인 또는 아프리카계 미국인, 45%가 히스패닉 또는 라틴 아메리카인이었습니다. FARXIGA 투여군 환자의 평균 BMI는 29.7 kg/m2였고, 위약 투여군 환자의 평균 BMI는 28.5 kg/m2였으며, FARXIGA 투여군 환자의 평균 BMI Z 점수는 1.7이었고, 위약 투여군 환자의 평균 BMI Z 점수는 1.5였습니다. 기준선에서 FARXIGA 투여군 환자의 평균 eGFR은 115 mL/min/1.73 m2였고, 위약 투여군 환자의 평균 eGFR은 113 mL/min/1.73 m2였습니다.
26주차에 FARXIGA 치료는 위약과 비교하여 HbA1c에서 통계적으로 유의미한 개선을 보였습니다(표 14). 이 효과는 인종, 민족, 성별, 연령대(≥10세에서 <15세 및 ≥15세에서 <18세), 배경 당뇨병 치료 및 기준선 BMI를 포함한 하위 그룹에서 일관되었습니다.
| 효능 지표 | FARXIGA 5 mg 및 10 mg |
위약 |
|---|---|---|
| 의도적 치료 집단(N)* | 81 | 76 |
|
||
|
HbA1c (%) |
||
|
기준선(평균) |
8.2 |
8.0 |
|
기준선에서의 변화(조정된 평균†) |
-0.6 |
0.4 |
|
위약과의 차이(조정된 평균†) |
-1.0‡ (-1.6, -0.5) |
|
|
FPG (mg/dL) |
||
|
기준선(평균) |
162.2 |
152.1 |
|
기준선에서의 변화(조정된 평균†) |
-10.3 |
9.2 |
|
위약 대비 차이 (조정된 평균†)
|
-19.5§ (-36.4, -2.5) |
|
|
기준 HbA1c ≥7%인 대상자 중 HbA1c 수준 <7%를 달성한 비율 |
26.6%§ (N¶=64) |
10.0% (N¶=50) |
|
CI=신뢰 구간 |
||
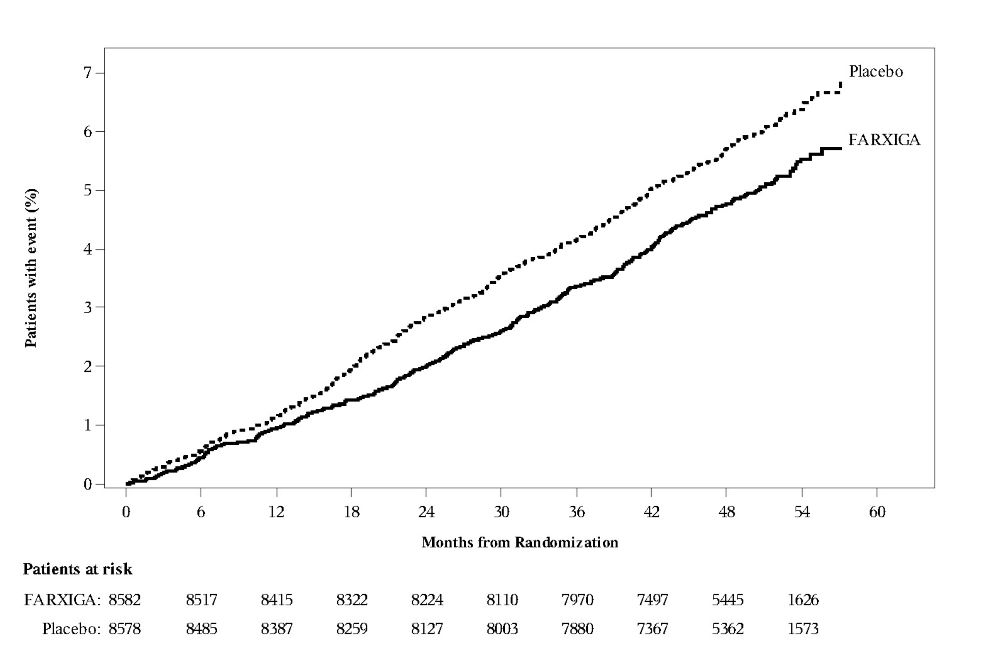
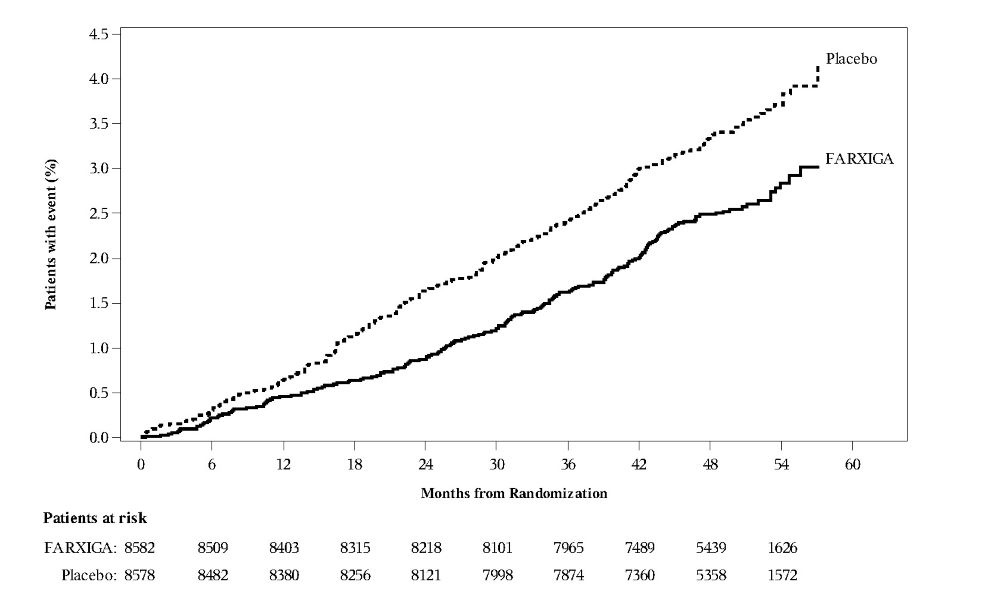
14.3 2형 당뇨병 성인의 심혈관계 결과
다파글리플로진의 심혈관계 사건에 대한 효과 (DECLARE, NCT01730534)는 FARXIGA가 기존 배경 치료에 추가되었을 때 심혈관계 (CV) 결과에 미치는 효과를 확인하기 위해 수행된 국제적, 다기관, 무작위 배정, 이중맹검, 위약 대조 임상 시험이었습니다. 모든 환자는 2형 당뇨병을 앓고 있었으며, 확립된 CV 질환 또는 2개 이상의 추가 CV 위험 요인(남성의 경우 ≥55세 또는 여성의 경우 ≥60세, 그리고 이상지질혈증, 고혈압 또는 현재 흡연 중 하나 이상)이 있었습니다. 연구자의 재량에 따라 동반되는 항당뇨병 및 죽상경화증 치료는 조정될 수 있었으며, 이는 참가자가 이러한 질환에 대한 표준 치료를 받도록 보장하기 위한 것이었습니다.
무작위 배정된 17160명의 환자 중 6974명(40.6%)은 확립된 CV 질환이 있었고 10186명(59.4%)은 확립된 CV 질환이 없었습니다. 총 8582명의 환자가 FARXIGA 10mg에 무작위 배정되었고, 8578명이 위약에 무작위 배정되었으며, 환자는 중앙값 4.2년 동안 추적 관찰되었습니다.
시험 대상 인구의 약 80%는 백인, 4%는 흑인 또는 아프리카계 미국인, 13%는 아시아인이었습니다. 평균 연령은 64세였으며, 약 63%가 남성이었습니다.
당뇨병의 평균 지속 기간은 11.9년이었으며, 환자의 22.4%는 5년 미만으로 당뇨병을 앓았습니다. 평균 eGFR은 85.2 mL/min/1.73 m2였습니다. 기준선에서 환자의 23.5%는 미세 알부민뇨(UACR ≥30 to ≤300 mg/g)를 보였고, 6.8%는 거대 알부민뇨(UACR >300 mg/g)를 보였습니다. 평균 HbA1c는 8.3%였고, 평균 BMI는 32.1 kg/m2였습니다. 기준선에서 환자의 10%는 심부전 병력이 있었습니다.
대부분의 환자(98.1%)는 기준선에서 하나 이상의 항당뇨병 약물을 사용했습니다. 환자의 82.0%는 메트포르민, 40.9%는 인슐린, 42.7%는 설폰요소제, 16.8%는 DPP4 억제제, 4.4%는 GLP-1 수용체 작용제로 치료받고 있었습니다.
환자의 약 81.3%는 안지오텐신 전환 효소 억제제 또는 안지오텐신 수용체 차단제, 75.0%는 스타틴, 61.1%는 항혈소판제, 55.5%는 아세틸살리실산, 52.6%는 베타 차단제, 34.9%는 칼슘 채널 차단제, 22.0%는 티아지드 이뇨제, 10.5%는 루프 이뇨제로 치료받고 있었습니다.
Cox 비례 위험 모델을 사용하여 위험 비율(HR)의 복합 CV 사망, 심근 경색(MI) 또는 허혈성 뇌졸중(MACE)에 대한 사전 지정된 위험 한계 1.3에 대한 비열등성을 검정했으며, 비열등성이 입증되면 두 가지 주요 종점에 대한 우월성을 검정했습니다. 1) 심부전 입원 또는 CV 사망의 복합, 2) MACE.
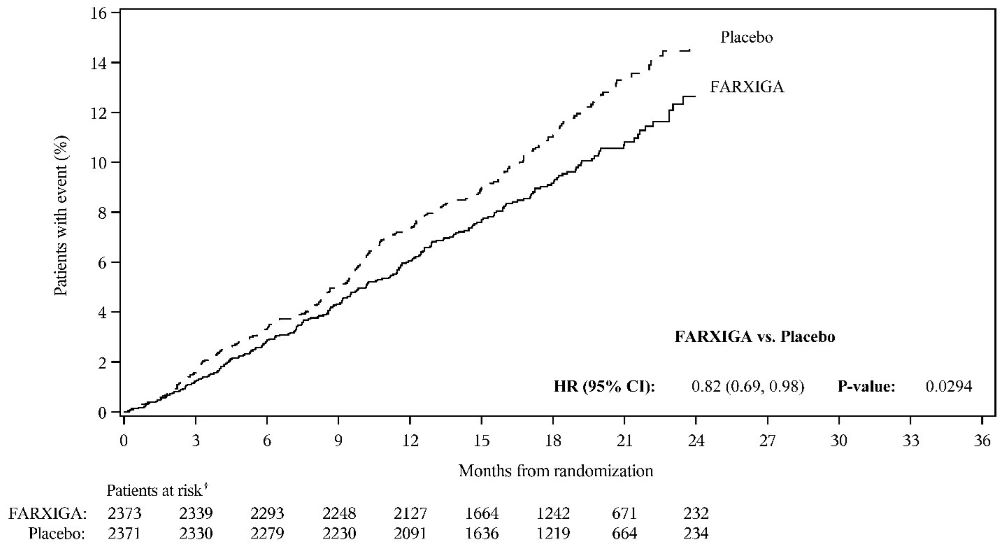
MACE의 발생률은 두 치료군 모두에서 유사했습니다. 다파글리플로진 투여군에서 100 환자-년당 2.30개의 MACE 사건, 위약 투여군에서 100 환자-년당 2.46개의 MACE 사건이 발생했습니다. 위약에 대한 다파글리플로진과 관련된 MACE의 추정 위험 비율은 0.93이었으며, 95% CI는 (0.84, 1.03)이었습니다. 이 신뢰 구간의 상한인 1.03은 사전 지정된 비열등성 한계인 1.3을 제외했습니다.
FARXIGA는 심부전 입원 또는 CV 사망의 주요 복합 종점 발생률을 줄이는 데 위약보다 우월했습니다 [HR 0.83 (95% CI 0.73, 0.95)].
치료 효과는 FARXIGA에 무작위 배정된 대상에서 심부전 입원 위험의 유의미한 감소로 인한 것이었으며 [HR 0.73 (95% CI 0.61, 0.88)], CV 사망 위험은 변하지 않았습니다(표 15 및 그림 4 및 5).
|
이벤트가 발생한 환자 n (%) |
|||
|
효능 변수 (최초 발생까지의 시간) |
FARXIGA 10 mg N=8582 |
위약 N=8578 |
위험 비율 (95% CI) |
|
주요 종점 |
|||
|
심부전 입원, CV 사망의 복합† |
417 (4.9) |
496 (5.8) |
0.83 (0.73, 0.95) |
|
CV 사망, MI, 허혈성 뇌졸중의 복합 종점 |
756 (8.8) |
803 (9.4) |
0.93 (0.84, 1.03) |
|
복합 종점의 구성 요소‡ |
|||
|
심부전으로 인한 입원 |
212 (2.5) |
286 (3.3) |
0.73 (0.61, 0.88) |
|
심혈관 사망 |
245 (2.9) |
249 (2.9) |
0.98 (0.82, 1.17) |
|
심근 경색 |
393 (4.6) |
441 (5.1) |
0.89 (0.77, 1.01) |
|
허혈성 뇌졸중 |
235 (2.7) |
231 (2.7) |
1.01 (0.84, 1.21) |
|
N=환자 수, CI=신뢰 구간, CV=심혈관, MI=심근 경색. |
|||
그림 4: DECLARE 연구에서 심부전 또는 심혈관 사망으로 인한 최초 입원까지의 시간
그림 5: DECLARE 연구에서 심부전으로 인한 최초 입원까지의 시간
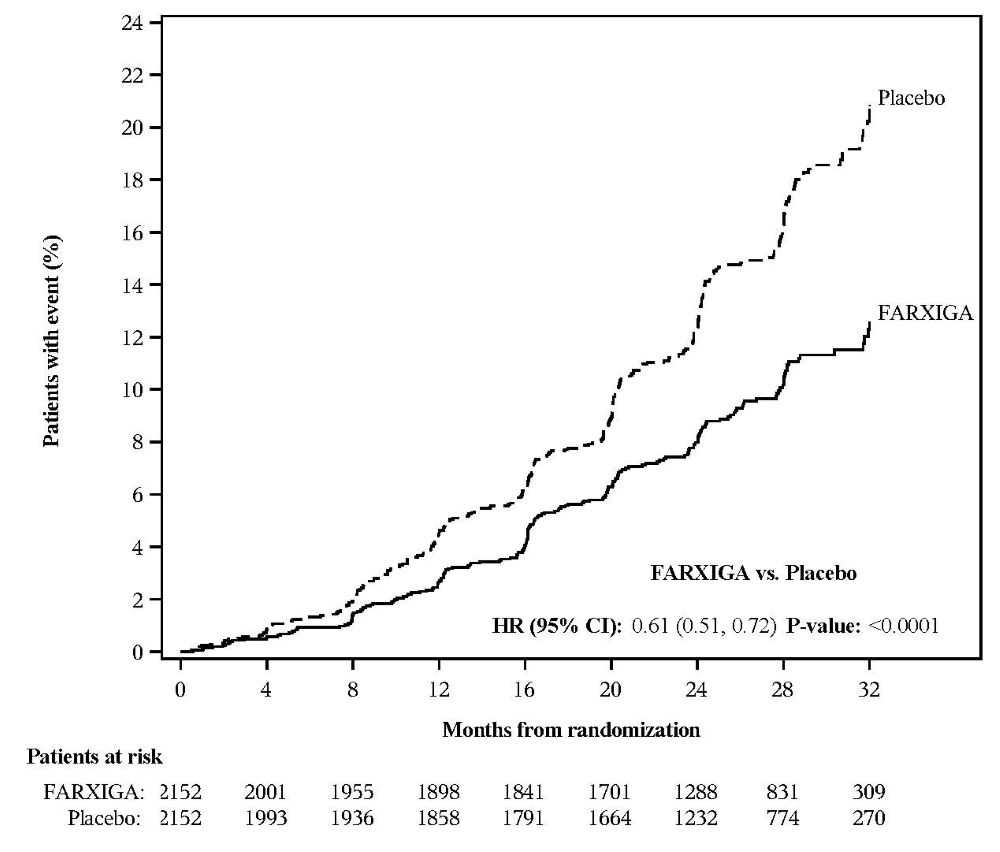
14.4 만성 신장 질환
만성 신장 질환 환자에서 다파글리플로진의 신장 결과 및 심혈관 사망에 대한 효과를 평가하기 위한 시험(DAPA-CKD, NCT03036150)은 만성 신장 질환(CKD)(eGFR 25~75 mL/min/1.73 m2) 및 알부민뇨[소변 알부민 크레아티닌 비율(UACR) 200~5000 mg/g]가 있는 성인 환자를 대상으로 한 국제적, 다기관, 무작위 배정, 이중맹검, 위약 대조 시험이었으며, 이들은 안지오텐신 전환 효소 억제제(ACEi) 또는 안지오텐신 수용체 차단제(ARB)의 최대 내약성, 표시된 일일 용량을 포함한 표준 치료 배경 요법을 받고 있었습니다. 이 시험은 상염색체 우성 또는 상염색체 열성 다낭성 신장 질환, 루푸스 신염 또는 ANCA 관련 혈관염이 있는 환자와 이전 6개월 동안 세포독성, 면역억제 또는 면역조절 요법이 필요한 환자를 제외했습니다.
주요 목표는 FARXIGA가 eGFR의 ≥50% 지속적인 감소, 말기 신장 질환(ESKD)으로의 진행(지속적인 eGFR <15 mL/min/1.73 m2, 만성 투석 치료 또는 신장 이식 시작으로 정의됨), 심혈관 또는 신장 사망의 복합적 종말점 발생률을 감소시키는지 여부를 확인하는 것이었습니다.
총 4304명의 환자가 FARXIGA 10mg 또는 위약에 무작위로 배정되었으며, 중앙값 28.5개월 동안 추적 관찰되었습니다.
시험 모집단의 평균 연령은 62세였으며, 67%가 남성이었습니다. 모집단은 백인 53%, 흑인 또는 아프리카계 미국인 4%, 아시아인 34%였으며, 25%는 히스패닉 또는 라틴계 민족이었습니다.
기준선에서 평균 eGFR은 43 mL/min/1.73 m2였으며, 환자의 44%는 eGFR이 30 mL/min/1.73 m2에서 45 mL/min/1.73 m2 미만이었고, 환자의 15%는 eGFR이 30 mL/min/1.73 m2 미만이었습니다. 중앙값 UACR은 950 mg/g였습니다. 환자의 총 68%는 무작위 배정 시 2형 당뇨병을 앓고 있었습니다. CKD의 가장 흔한 원인은 당뇨병성 신증(58%), 허혈성/고혈압성 신증(16%) 및 IgA 신증(6%)이었습니다.
기준선에서 환자의 97%는 ACEi 또는 ARB로 치료받았습니다. 약 44%는 항혈소판제를 복용했고, 65%는 스타틴을 복용했습니다.
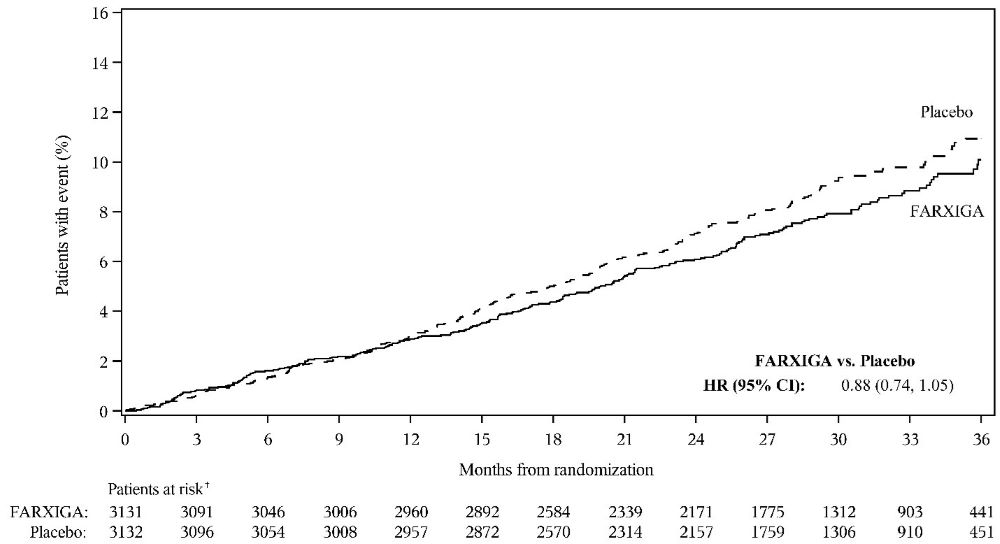
FARXIGA는 eGFR의 ≥50% 지속적인 감소, ESKD로의 진행, 심혈관 또는 신장 사망의 주요 복합적 종말점 발생률을 감소시켰습니다[HR 0.61(95% CI 0.51, 0.72); p<0.0001]. FARXIGA와 위약의 사건 곡선은 4개월째에 분리되기 시작하여 시험 기간 동안 계속 발산합니다. 치료 효과는 eGFR의 ≥50% 지속적인 감소, ESKD로의 진행 및 심혈관 사망 감소를 반영했습니다. 시험 중 신장 사망은 거의 없었습니다(표 16, 그림 6).
FARXIGA는 또한 심혈관 사망 또는 심부전으로 인한 입원의 복합적 종말점 발생률을 감소시켰습니다[HR 0.71(95% CI 0.55, 0.92), p=0.0089] 및 모든 원인 사망률을 감소시켰습니다[HR 0.69(95% CI 0.53, 0.88), p=0.0035].
|
||||
|
사건이 있는 환자(사건 발생률) |
||||
|
효능 변수 (최초 발생까지의 시간) |
FARXIGA 10 mg |
위약 |
위험 비율 |
p-값 |
|
eGFR의 ≥50% 지속적인 감소, ESKD, 심혈관 또는 신장 사망의 복합적 종말점 |
197 (4.6) |
312 (7.5) |
0.61 |
<0.0001 |
|
eGFR의 ≥50% 지속적인 감소 |
112 (2.6) |
201 (4.8) |
0.53 |
|
|
ESKD* |
109 (2.5) |
161 (3.8) |
0.64 |
|
|
CV Death |
65 (1.4) |
80 (1.7) |
0.81 |
|
|
Renal Death |
2 (<0.1) |
6 (0.1) |
||
|
≥50% sustained eGFR decline, ESKD or renal death |
142 (3.3) |
243 (5.8) |
0.56 |
<0.0001 |
|
CV death or Hospitalization for Heart Failure |
100 (2.2) |
138 (3.0) |
0.71 |
0.0089 |
|
Hospitalization for Heart Failure |
37 (0.8) |
71 (1.6) |
0.51 |
|
|
All-Cause Mortality |
101 (2.2) |
146 (3.1) |
0.69 |
0.0035 |
|
N=Number of patients, CI=Confidence interval, CV=Cardiovascular, ESKD=End stage kidney disease. |
||||
|
NOTE: Time to first event was analyzed in a Cox proportional hazards model. Event rates are presented as the number of subjects with event per 100 patient years of follow-up. There were too few events of renal death to compute a reliable hazard ratio. |
||||
그림 6: eGFR의 ≥50% 지속적 감소, ESKD, CV 또는 신장 사망의 첫 발생까지의 시간 (DAPA-CKD 연구)
위험군은 기간 시작 시 위험군에 속하는 대상자 수입니다. 1개월은 30일을 의미합니다. 양측 p-값이 표시됩니다. HR, CI 및 p-값은 Cox 비례 위험 모델에서 얻은 값입니다.
HR=위험 비율; CI=신뢰 구간; eGFR=추정 사구체 여과율; ESKD=말기 신장 질환; CV=심혈관; vs=대비.
주요 복합 결과 지표의 결과는 2형 당뇨병이 있는 CKD 환자와 없는 CKD 환자, CKD 원인, 연령, 생물학적 성별, 인종, UACR 및 eGFR을 포함한 검사된 하위 그룹에서 일관되었습니다.
DAPA-CKD는 진행 위험이 높은 상대적으로 진행된 CKD 환자를 모집했습니다. FARXIGA가 CV 결과에 미치는 영향을 확인하기 위해 수행된 무작위 배정, 이중 맹검, 위약 대조 시험(DECLARE 시험)의 탐색적 분석은 FARXIGA가 덜 진행된 CKD 환자에서도 효과적일 가능성이 높다는 결론을 뒷받침합니다.
14.5 심부전
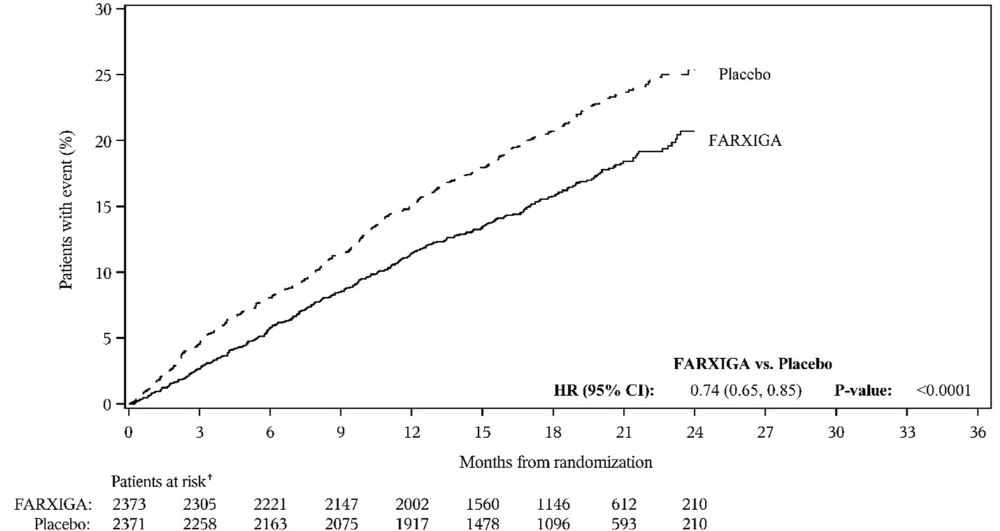
FARXIGA 10mg의 효능과 안전성은 성인 심부전 환자를 대상으로 한 2건의 3상 시험에서 독립적으로 평가되었습니다.
심부전에서의 다파글리플로진 및 부작용 예방(DAPA-HF, NCT03036124)은 심부전 환자[뉴욕 심장 협회(NYHA) 기능 등급 II-IV]에서 심장 사망 및 심부전으로 인한 입원 위험을 FARXIGA가 감소시키는지 여부를 확인하기 위해 수행된 국제적, 다기관, 무작위 배정, 이중 맹검, 위약 대조 시험입니다. 환자 4744명 중 2373명이 FARXIGA 10mg에 무작위 배정되었고 2371명이 위약에 무작위 배정되었으며 중앙값 18개월 동안 추적 관찰되었습니다.
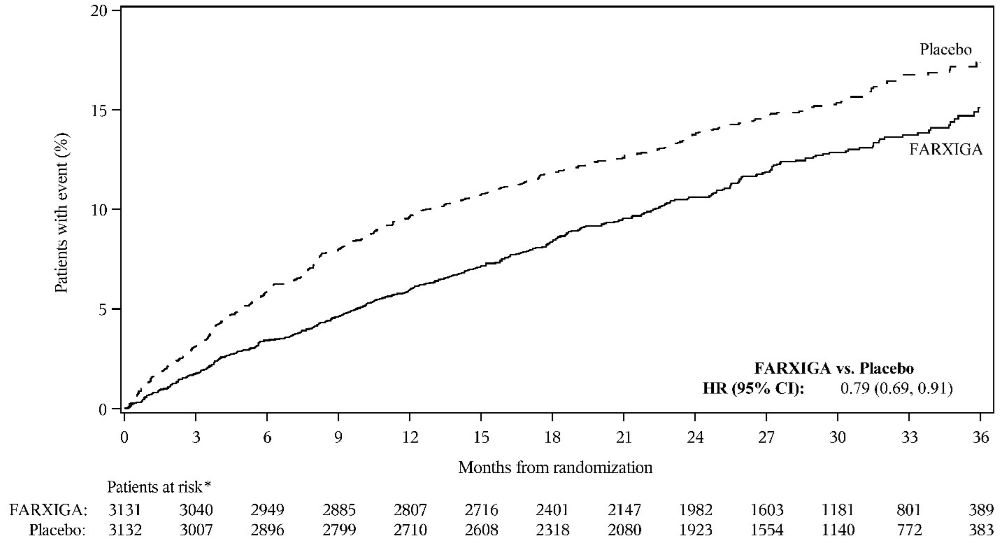
다파글리플로진 평가를 통한 보존된 박출 분율 심부전 환자의 삶 개선(DELIVER, NCT03619213)은 심장 사망, 심부전으로 인한 입원 또는 긴급 심부전 방문 위험을 FARXIGA가 감소시키는지 여부를 확인하기 위해 수행된 국제적, 다기관, 무작위 배정, 이중 맹검, 위약 대조 시험입니다. 환자 6263명 중 3131명이 FARXIGA 10mg에 무작위 배정되었고 3132명이 위약에 무작위 배정되었으며 중앙값 28개월 동안 추적 관찰되었습니다. 이 시험에는 심부전으로 인한 입원 중 또는 퇴원 후 30일 이내에 무작위 배정된 심부전 환자 654명(10%)이 포함되었습니다.
DAPA-HF에서 기준선 시점에 환자의 94%가 ACEi, ARB 또는 안지오텐신 수용체-네프릴리신 억제제(ARNI, 사쿠비트릴/발사르탄 11% 포함)로 치료받았고, 96%가 베타 차단제로, 71%가 미네랄 코르티코이드 수용체 길항제(MRA)로, 93%가 이뇨제로 치료받았으며, 26%가 이식형 기기(제세동기 기능 포함)를 사용했습니다.
DELIVER에서 기준선 시점에 환자의 77%가 ACEi, ARB 또는 ARNI로 치료받았고, 83%가 베타 차단제로, 43%가 MRA로, 98%가 이뇨제로 치료받았습니다.
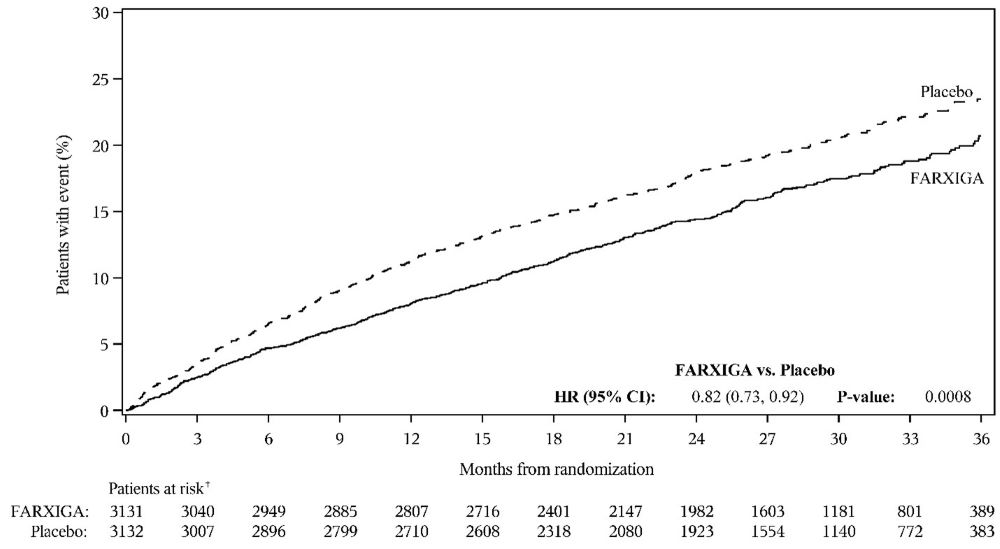
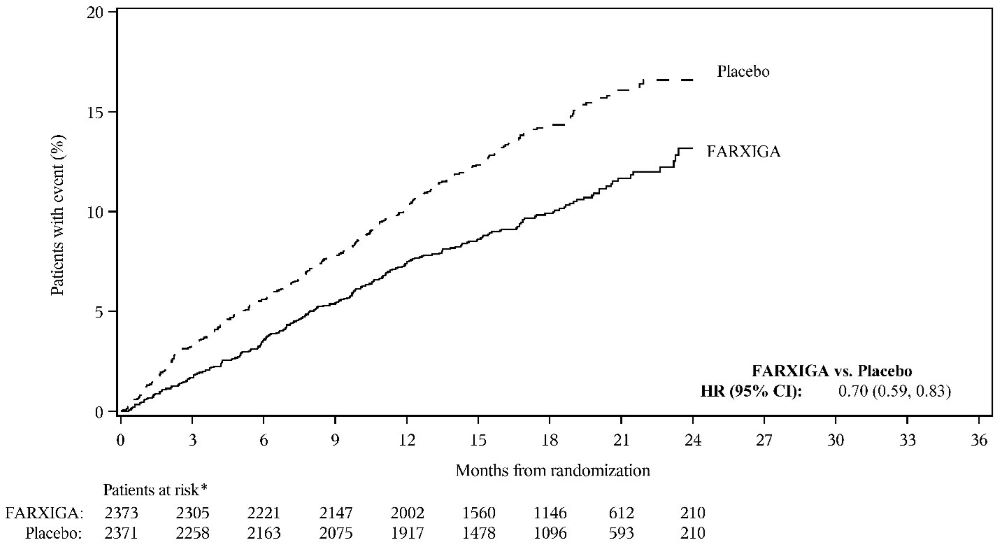
두 시험 모두에서 FARXIGA는 CV 사망, 심부전으로 인한 입원 또는 긴급 심부전 방문의 주요 복합 결과 지표 발생률을 감소시켰습니다(표 17 참조).
|
DAPA-HF 시험 |
DELIVER 시험 |
|||||||
|
사건 발생 환자 |
위험 비율 |
p-값† |
사건 발생 환자 |
위험 비율 |
p-값† |
|||
|
효능 변수 (첫 발생까지의 시간) |
FARXIGA 10 mg |
위약 |
FARXIGA 10 mg |
위약 |
||||
|
심부전 입원, 심혈관 사망‡ 또는 긴급 심부전 방문의 복합 |
386 |
502 |
0.74 |
<0.0001 |
512 |
610 |
0.82 |
0.0008 |
|
복합 종점의 구성 요소 |
||||||||
|
심혈관 사망‡ |
227 |
273 |
0.82 |
231 |
261 |
0.88 |
||
|
심부전 입원 또는 긴급 심부전 방문 |
237 |
326 |
0.70 |
368 |
455 |
0.79 |
||
|
심부전 입원 |
231 |
318 |
0.70 |
329 |
418 |
0.77 |
||
|
긴급 심부전 방문 |
10 |
23 |
0.43 |
60 |
78 |
0.76 |
||
|
N=환자 수, CI=신뢰 구간, CV=심혈관. |
||||||||
참고: 첫 번째 사건 발생까지의 시간은 Cox 비례 위험 모델에서 분석되었습니다. 단일 구성 요소에 대한 첫 번째 사건 수는 각 구성 요소에 대한 실제 첫 번째 사건 수이며 복합 종점의 사건 수와 합산되지 않습니다. 사건 발생률은 추적 관찰 기간 100 환자 연도당 사건이 발생한 대상자 수로 표시됩니다.
두 임상 시험 모두에서 일차 복합 종점의 세 가지 구성 요소가 모두 개별적으로 치료 효과에 기여했습니다. 두 임상 시험 모두에서 FARXIGA와 위약의 사건 곡선은 초기에 분리되었고 임상 시험 기간 동안 계속 발산되었습니다(그림 7 및 9 참조).
그림 7: 심혈관 사망*, 심부전 입원 또는 긴급 심부전 방문의 복합 종점이 처음 발생할 때까지의 시간
A) DAPA-HF 임상 시험
B) DELIVER 임상 시험
참고: 긴급 심부전 방문은 의사가 긴급하게 계획되지 않은 평가(예: 응급실)를 받고 악화된 심부전(경구 이뇨제 증가만 제외) 치료가 필요한 경우로 정의되었습니다.
* DAPA-HF에서 일차 종점의 심혈관 사망 구성 요소에는 원인 불명의 사망이 포함되었습니다. DELIVER에서 일차 종점의 심혈관 사망 구성 요소에는 원인 불명의 사망이 제외되었습니다.
† 위험 대상자는 기간 시작 시 위험 대상자 수입니다.
HR=위험 비율, CI=신뢰 구간, CV=심혈관.
그림 8: 심혈관 사망* 발생까지의 시간
A) DAPA-HF 임상 시험
B) DELIVER 임상 시험
* DAPA-HF에서 일차 종점의 심혈관 사망 구성 요소에는 원인 불명의 사망이 포함되었습니다. DELIVER에서 일차 종점의 심혈관 사망 구성 요소에는 원인 불명의 사망이 제외되었습니다.
† 위험 대상자는 기간 시작 시 위험 대상자 수입니다.
HR=위험 비율, CI=신뢰 구간, CV=심혈관.
그림 9: 심부전 입원 또는 긴급 심부전 방문이 처음 발생할 때까지의 시간
A) DAPA-HF 임상 시험
B) DELIVER 임상 시험
* 위험 대상자는 기간 시작 시 위험 대상자 수입니다.
HR=위험 비율, CI=신뢰 구간.
DAPA-HF에서 FARXIGA는 심부전 입원(첫 번째 및 재발) 사건과 심혈관 사망의 총 수를 줄였으며, FARXIGA 치료군과 위약군에서 각각 567건과 742건의 총 사건이 발생했습니다(발생 비율 0.75 [95% CI 0.65, 0.88]; p=0.0002).
DELIVER에서 FARXIGA는 심부전 사건(심부전 입원 또는 긴급 심부전 방문의 첫 번째 및 재발)과 심혈관 사망의 총 수를 줄였으며, FARXIGA 치료군과 위약군에서 각각 815건과 1057건의 총 사건이 발생했습니다(발생 비율 0.77 [95% CI 0.67, 0.89]; p=0.0003).
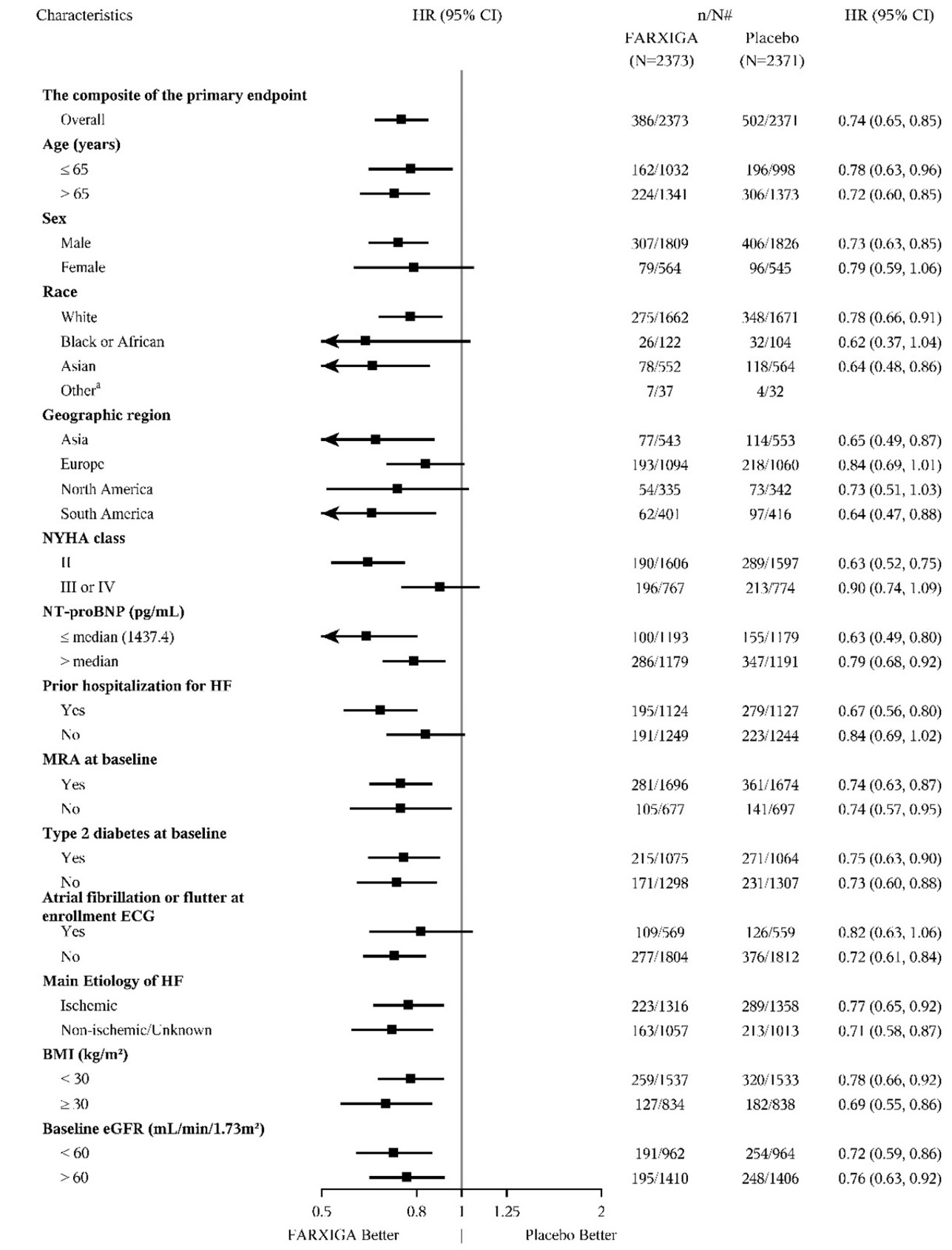
두 임상 시험 모두에서 일차 복합 종점의 결과는 조사된 하위 그룹 전반에 걸쳐 일관되었습니다(그림 10 참조).
그림 10: 일차 복합 종점(심혈관 사망 및 심부전 사건) 하위 그룹 분석에 대한 치료 효과
A) DAPA-HF 임상 시험
a 두 군을 합쳐 총 사건 수가 15건 미만인 하위 그룹에 대한 위험 비율 추정치는 제시되지 않습니다.
n/N# 하위 그룹에서 사건이 발생한 대상자 수/하위 그룹의 대상자 수.
NT-proBNP = N-말단 프로 b형 내분비 나트륨 이뇨 펩티드, HF = 심부전, MRA = 미네랄 코르티코이드 수용체 길항제,
ECG = 심전도, eGFR = 추정 사구체 여과율.
참고: 위 그림은 기준선 특성인 다양한 하위 그룹에서의 효과를 보여줍니다. 표시된 95% 신뢰 한계는 수행된 비교 수를 고려하지 않았으며 다른 모든 요인에 대한 조정 후 특정 요인의 효과를 반영하지 않을 수 있습니다. 그룹 간의 명백한 동질성 또는 이질성은 과도하게 해석해서는 안 됩니다.
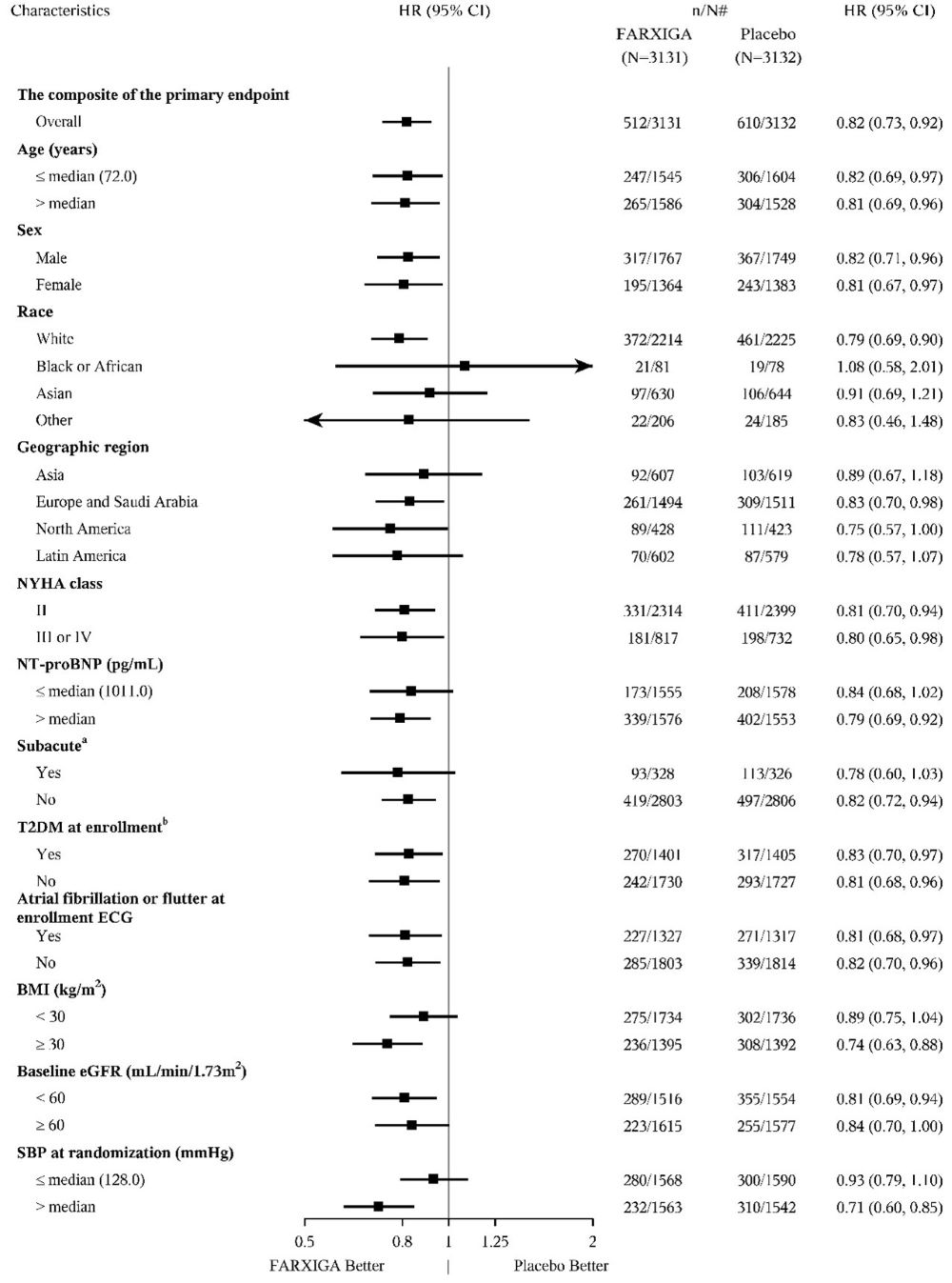
B) DELIVER 임상 시험
a 심부전 입원 중 또는 퇴원 후 30일 이내에 무작위 배정된 아급성 환자로 정의됩니다.
b 2형 당뇨병 병력으로 정의됩니다. 이 분석에는 2형 당뇨병이 계층화 요인으로 포함되지 않습니다.
n/N# 하위 그룹에서 사건이 발생한 대상자 수/하위 그룹의 대상자 수.
NT-proBNP = N-말단 프로 b형 내분비 나트륨 이뇨 펩티드, HF = 심부전, ECG = 심전도, eGFR = 추정 사구체 여과율, BMI = 체질량 지수, SBP = 수축기 혈압, T2DM = 2형 당뇨병.
참고: 위 그림은 기준선 특성인 다양한 하위 그룹에서의 효과를 보여줍니다. 표시된 95% 신뢰 한계는 수행된 비교 수를 고려하지 않았으며 다른 모든 요인에 대한 조정 후 특정 요인의 효과를 반영하지 않을 수 있습니다. 그룹 간의 명백한 동질성 또는 이질성은 과도하게 해석해서는 안 됩니다.
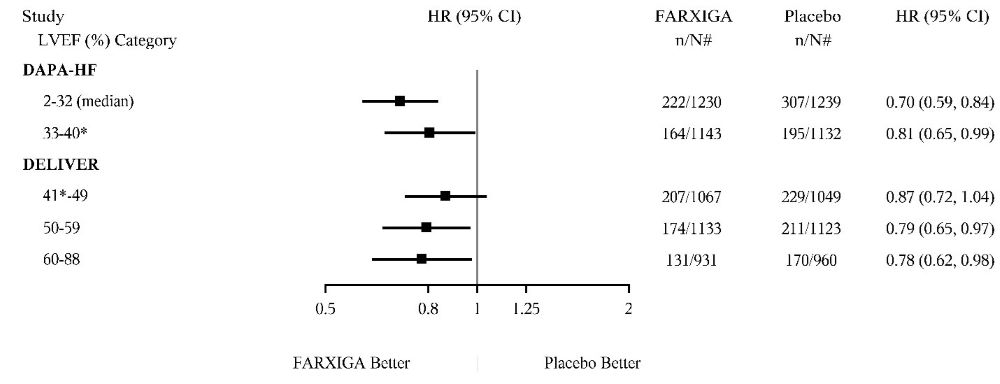
DAPA-HF 및 DELIVER 임상 시험에서 평가된 것처럼 FARXIGA의 심혈관 사망, 심부전 입원 또는 긴급 심부전의 복합 종점에 대한 치료 효과는 LVEF 범위 전반에 걸쳐 일관되었습니다(그림 11).
그림 11: LVEF별 일차 복합 종점(심혈관 사망 및 심부전 사건)에 대한 치료 효과(DAPA-HF 및 DELIVER 임상 시험)
* DAPA-HF 시험에서 1명의 환자는 LVEF가 >40이었습니다. DELIVER 시험에서 4명의 환자는 LVEF가 ≤40이었습니다.
DAPA-HF 시험에서 LVEF의 5% 및 95% 백분위수는 각각 20 및 40이었습니다. DELIVER 시험에서 LVEF의 5% 및 95% 백분위수는 각각 42 및 70이었습니다.
16 제공/보관 및 취급 방법
제품 정보
FARXIGA (다파글리플로진) 정제는 양면에 표시가 되어 있으며 표 19에 나열된 강도와 포장으로 제공됩니다.
| 정제 강도 | 필름 코팅 정제 색상/모양 |
정제 표시 |
포장 크기 | NDC 코드 |
|---|---|---|---|---|
|
5 mg |
노란색, |
한쪽 면에 “5” 각인, |
병 30개 |
0310-6205-30 |
|
병 90개 |
0310-6205-90 |
|||
|
10 mg |
노란색, |
한쪽 면에 “10” 각인, |
병 30개 |
0310-6210-30 |
|
병 90개 |
0310-6210-90 |
|||
|
병원 단위 용량 블리스터 포장: 30정(블리스터 카드 3장 x 카드당 10정)이 들어 있는 상자 |
0310-6210-39 |
보관 및 취급
20°C~25°C(68°F~77°F)에 보관하십시오. 15°C~30°C(59°F~86°F)의 온도 편차는 허용됩니다. [USP 제어 실온 참조].
17 환자 상담 정보
FDA 승인 환자 라벨(약물 안내)을 읽도록 환자에게 알려주십시오.
1형 당뇨병 환자 및 기타 케톤산증 환자의 당뇨병성 케톤산증
1형 당뇨병 환자의 경우 FARXIGA를 사용하면 생명을 위협하는 당뇨병성 케톤산증의 위험이 증가할 수 있음을 알려주십시오. 다른 모든 환자의 경우 FARXIGA는 잠재적으로 치명적인 케톤산증을 유발할 수 있으며, 2형 당뇨병 및 췌장 장애(예: 췌장염 병력 또는 췌장 수술)는 위험 요소임을 알려주십시오.
모든 환자에게 케톤산증의 촉발 요인(예: 인슐린 용량 감소 또는 인슐린 용량 누락, 감염, 칼로리 섭취 감소, 케토제닉 식단, 수술, 탈수, 알코올 남용) 및 케톤산증의 증상(예: 메스꺼움, 구토, 복통, 피로, 호흡 곤란)에 대해 교육하십시오. 케톤산증이 있는 경우에도 혈당 수치가 정상일 수 있음을 환자에게 알려주십시오.
환자에게 케톤을 모니터링하도록 요청받을 수 있음을 알려주십시오. 케톤산증 증상이 나타나면 환자에게 FARXIGA를 중단하고 즉시 의사의 진료를 받도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
용량 감소
환자에게 FARXIGA를 사용하면 증상성 저혈압이 발생할 수 있음을 알려주고, 이러한 증상이 나타나면 의료 서비스 제공자에게 연락하도록 조언하십시오 [경고 및 주의 사항 (5.2) 참조]. 환자에게 탈수는 저혈압 위험을 증가시킬 수 있으며, 충분한 수분을 섭취하도록 알려주십시오.
심각한 요로 감염
환자에게 심각할 수 있는 요로 감염이 발생할 수 있음을 알려주십시오. 요로 감염 증상에 대한 정보를 제공하십시오. 이러한 증상이 나타나면 즉시 의사의 진료를 받도록 조언하십시오 [경고 및 주의 사항 (5.3) 참조].
인슐린 및 인슐린 분비 촉진제와 병용 시 저혈당
환자에게 FARXIGA를 인슐린 분비 촉진제(예: 설폰요소) 및/또는 인슐린에 추가하면 저혈당 발생률이 증가할 수 있음을 알려주십시오. 환자에게 저혈당의 징후와 증상에 대해 교육하십시오 [경고 및 주의 사항 (5.4) 참조].
회음부 괴사성 근막염(포르니에 괴저)
환자에게 당뇨병 환자에서 FARXIGA를 사용하면 회음부 괴사성 감염(포르니에 괴저)이 발생할 수 있음을 알려주십시오. 환자에게 생식기 또는 생식기에서 항문까지의 부위에 통증 또는 압통, 발적 또는 부종과 함께 100.4°F 이상의 발열 또는 권태감이 나타나면 즉시 의사의 진료를 받도록 조언하십시오 [경고 및 주의 사항 (5.5) 참조].
여성의 생식기 진균 감염(예: 외음 질염)
여성 환자에게 질 효모 감염이 발생할 수 있음을 알려주고, 질 효모 감염의 징후와 증상에 대한 정보를 제공하십시오. 치료 옵션과 의사의 진료를 받아야 할 때를 알려주십시오 [경고 및 주의 사항 (5.6) 참조].
남성의 생식기 진균 감염(예: 포경염)
남성 환자에게 특히 과거 병력이 있는 환자의 경우 음경 효모 감염(예: 포경염 또는 포경 귀두염)이 발생할 수 있음을 알려주십시오. 포경염 및 포경 귀두염의 징후와 증상(음경 귀두 또는 포피의 발진 또는 발적)에 대한 정보를 제공하십시오. 치료 옵션과 의사의 진료를 받아야 할 때를 알려주십시오 [경고 및 주의 사항 (5.6) 참조].
과민 반응
환자에게 FARXIGA를 사용하면 심각한 과민 반응(예: 두드러기, 아나필락시스 반응, 혈관 부종)이 보고되었습니다. 환자에게 알레르기 반응 또는 혈관 부종을 시사하는 징후나 증상이 나타나면 즉시 보고하고, 의사의 진료를 받을 때까지 약물을 더 이상 복용하지 않도록 조언하십시오.
임신
임산부에게 FARXIGA 치료를 받으면 태아에게 위험이 발생할 수 있음을 알려주십시오. 임신 중이거나 임신을 계획하고 있다면 즉시 의료 서비스 제공자에게 알리도록 환자에게 지시하십시오 [특정 인구 집단에서의 사용 (8.1) 참조].
수유
환자에게 모유 수유 중에는 FARXIGA를 사용하지 않는 것이 좋습니다 [특정 인구 집단에서의 사용 (8.2) 참조].
실험실 검사
작용 기전으로 인해 FARXIGA를 복용하는 환자는 소변에서 포도당 검사 결과가 양성으로 나타납니다.
복용량 누락
복용량을 누락한 경우, 다음 복용 시간이 거의 다 된 것이 아니라면 즉시 복용하도록 환자에게 조언하십시오. 다음 복용 시간이 거의 다 된 경우에는 누락된 복용량을 건너뛰고 다음 정해진 시간에 약을 복용하십시오. 환자에게 FARXIGA를 동시에 두 번 복용하지 않도록 조언하십시오.
배포:
AstraZeneca Pharmaceuticals LP
Wilmington, DE 19850
FARXIGA®는 AstraZeneca 그룹 회사의 등록 상표입니다.
약물 안내문
|
MEDICATION GUIDE |
||||
|
FARXIGA에 대해 알아야 할 가장 중요한 정보는 무엇입니까? FARXIGA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
||||
|
|
|||
질이나 음경에 효모 감염 증상이 나타나면 의료 서비스 제공자와 상담하십시오. 의료 서비스 제공자는 일반의약품 항진균제를 사용하도록 제안할 수 있습니다. 일반의약품 항진균제를 사용해도 증상이 사라지지 않으면 즉시 의료 서비스 제공자에게 전화하십시오. |
||||
|
FARXIGA는 무엇입니까?
|
||||
|
FARXIGA를 복용해서는 안 되는 사람은 누구입니까? 다음과 같은 경우 FARXIGA를 복용하지 마십시오.
|
||||
|
FARXIGA를 복용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? FARXIGA를 복용하기 전에 다음과 같은 경우 의료 서비스 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. FARXIGA는 다른 약물의 작용 방식에 영향을 미칠 수 있으며 다른 약물은 FARXIGA의 작용 방식에 영향을 미칠 수 있습니다. 복용하는 약물을 알고 있어야 합니다. 새 약을 받을 때 의료 서비스 제공자와 약사에게 복용하는 약물 목록을 보여주십시오. |
||||
|
FARXIGA를 어떻게 복용해야 합니까?
|
||||
|
FARXIGA의 가능한 부작용은 무엇입니까? FARXIGA는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. “FARXIGA에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
FARXIGA의 가장 흔한 부작용은 다음과 같습니다.
이것들은 FARXIGA의 모든 가능한 부작용이 아닙니다. 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
||||
|
FARXIGA는 어떻게 보관해야 합니까? FARXIGA는 섭씨 20~25도(화씨 68~77도)의 실온에 보관하십시오. |
||||
|
FARXIGA의 안전하고 효과적인 사용에 대한 일반 정보 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. FARXIGA는 처방되지 않은 질환에 사용하지 마십시오. FARXIGA를 다른 사람에게 주지 마십시오. 같은 증상이 있어도 해로울 수 있습니다. 이 의약품 안내서는 FARXIGA에 대한 가장 중요한 정보를 요약한 것입니다. 자세한 내용은 의료 서비스 제공자에게 문의하십시오. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 FARXIGA에 대한 정보를 요청할 수 있습니다. FARXIGA에 대한 자세한 내용은 www.farxiga.com을 방문하거나 1-800-236-9933으로 전화하십시오. |
||||
|
FARXIGA의 성분은 무엇입니까? 활성 성분: dapagliflozin. 비활성 성분: 무수 락토스, 크로스포비돈, 마그네슘 스테아레이트, 미결정 셀룰로스 및 실리카. 필름 코팅에는 폴리에틸렌 글리콜, 폴리비닐 알코올, 활석, 이산화티탄 및 황색 산화철이 포함되어 있습니다.
FARXIGA는 AstraZeneca 그룹 회사의 등록 상표입니다. |
||||
이 의약품 안내서는 미국 식품의약국에서 승인했습니다. 2024년 6월 개정
주요 표시면 – 5mg 정
30 Tablets NDC 0310-6205-30
farxiga®
(dapagliflozin) tablets
5 mg
Medication Guide와 함께 제공
처방전으로만 구입 가능
AstraZeneca
주요 표시면 – 10mg 정
30 Tablets NDC 0310-6210-30
farxiga®
(dapagliflozin) tablets
10 mg
Medication Guide와 함께 제공
Dispense with
Medication Guide
처방전에 의해서만 구입 가능
Rx only
AstraZeneca