의약품 제조업체: Regeneron Pharmaceuticals, Inc. (Updated: 2024-10-10)
처방 정보의 주요 내용
EYLEA® (아플리버셉트) 주사제, 유리체 내 주사용
미국 최초 승인: 2011
최근 주요 변경 사항
| 경고 및 주의 사항 (5.1) | 2023년 12월 |
적응증 및 사용
투여량 및 투여 방법
-
신생혈관(습성) 연령 관련 황반 변성(AMD)
- EYLEA의 권장 용량은 첫 3개월 동안 4주(약 28일, 매월)마다 1회 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여하고, 그 후 8주(2개월)마다 1회 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. (2.5)
- EYLEA는 4주(약 25일, 매월)마다 2mg을 투여할 수 있지만, 대부분의 환자에서 4주마다 투여한 경우 8주마다 투여한 경우와 비교하여 추가적인 효능이 입증되지 않았습니다. 일부 환자는 첫 12주(3개월) 후에 4주(매월)마다 투여가 필요할 수 있습니다. (2.5)
- 권장되는 8주 투여 요법만큼 효과적이지는 않지만, 1년 동안 효과적인 치료를 받은 환자는 12주마다 1회 투여할 수도 있습니다. 환자는 정기적으로 평가해야 합니다. (2.5)
-
망막 정맥 폐쇄(RVO) 후 황반 부종
- EYLEA의 권장 용량은 4주(약 25일, 매월)마다 1회 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. (2.6)
-
당뇨병성 황반 부종(DME) 및 당뇨병성 망막병증(DR)
- EYLEA의 권장 용량은 첫 5회 주사 동안 4주(약 28일, 매월)마다 1회 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여하고, 그 후 8주(2개월)마다 1회 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. (2.7, 2.8)
- EYLEA는 4주(약 25일, 매월)마다 2mg을 투여할 수 있지만, 대부분의 환자에서 4주마다 투여한 경우 8주마다 투여한 경우와 비교하여 추가적인 효능이 입증되지 않았습니다. 일부 환자는 첫 20주(5개월) 후에 4주(매월)마다 투여가 필요할 수 있습니다. (2.7, 2.8)
-
미숙아 망막병증(ROP)
- EYLEA의 권장 용량은 유리체 내 주사로 0.4mg(40mg/mL 용액 0.01mL 또는 10마이크로리터)을 투여합니다. 치료는 같은 날 양쪽 눈에 투여할 수 있습니다. 주사는 각 눈에 반복적으로 투여할 수 있습니다. 같은 눈에 투여된 용량 사이의 치료 간격은 최소 10일이어야 합니다. (2.9)
투여 형태 및 강도
경고 및 주의 사항
부작용
EYLEA를 투여받은 환자에서 보고된 가장 흔한 부작용(≥5%)은 결막 출혈, 눈 통증, 백내장, 유리체 박리, 유리체 부유물 및 안압 상승이었습니다. (6.1)
의심되는 부작용을 보고하려면 Regeneron에 1-855-395-3248 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보는 17을 참조하십시오.
개정: 2024년 10월
목차
전문 정보: 목차*
1 적응증 및 사용법
1.1 신생혈관 (습성) 연령 관련 황반변성 (AMD)
1.2 망막 정맥 폐쇄 (RVO) 후 황반 부종
1.3 당뇨병성 황반 부종 (DME)
1.4 당뇨병성 망막병증 (DR)
1.5 미숙아 망막병증 (ROP)
2 용법 및 용량
2.1 중요한 주사 지침
2.2 투여 준비 – 사전 충전 주사기
2.3 투여 준비 – 바이알
2.4 성인에 대한 주사 절차
2.5 신생혈관 (습성) 연령 관련 황반변성 (AMD)
2.6 망막 정맥 폐쇄 (RVO) 후 황반 부종
2.7 당뇨병성 황반 부종 (DME)
2.8 당뇨병성 망막병증 (DR)
2.9 미숙아 망막병증 (ROP)
3 용법 및 용량
4 금기 사항
4.1 안구 또는 안구 주위 감염
4.2 활성 안내 염증
4.3 과민 반응
5 경고 및 주의 사항
5.1 내안염, 망막 박리 및 폐쇄 유무와 관계없이 망막 혈관염
5.2 안압 상승
5.3 ROP에서 장기 모니터링 및 추가 치료
5.4 혈전색전증
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 신생혈관 (습성) 연령 관련 황반변성 (AMD)
14.2 중심 망막 정맥 폐쇄 (CRVO) 후 황반 부종
14.3 분지 망막 정맥 폐쇄 (BRVO) 후 황반 부종
14.4 당뇨병성 황반 부종 (DME)
14.5 당뇨병성 망막병증 (DR)
14.6 미숙아 망막병증 (ROP)
16 포장 단위/보관 및 취급
16.1 포장 단위
16.2 보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
EYLEA는 다음 질환의 치료에 사용됩니다.
2 투여 및 관리
2.1 중요한 주사 지침
안구 내 유리체 내 주사용입니다. EYLEA는 자격을 갖춘 의사만 투여해야 합니다.
사전 충전 주사기: 30 게이지 × ½인치 멸균 주사 바늘이 필요하지만 제공되지 않습니다.
바이알: 5 마이크론 멸균 필터 바늘(18 게이지 × 1½인치), 1mL 루어 록 주사기 및 30 게이지 × ½인치 멸균 주사 바늘이 필요합니다.
EYLEA는 다음과 같이 포장되어 있습니다.
- 사전 충전 주사기
- 주사 구성품이 포함된 바이알 키트(필터 바늘, 주사기, 주사 바늘)
[제공 형태/보관 및 취급(16) 참조].
2.2 투여 준비 – 사전 충전 주사기
EYLEA 사전 충전 유리 주사기는 멸균되어 있으며 한 번만 사용하고 한쪽 눈에만 사용합니다. 사용하지 마십시오 EYLEA 사전 충전 주사기를 ROP 치료에 사용하지 마십시오.
사전 충전 주사기는 투여 전에 시각적으로 검사해야 합니다. 사용하지 마십시오 입자가 보이거나 흐리거나 변색되었거나 포장이 개봉되었거나 손상된 경우. 사전 충전 주사기의 주사기 캡 모양은 다를 수 있습니다(예: 색상 및 디자인). 사용하지 마십시오 사전 충전 주사기의 일부가 손상되었거나 주사기 캡이 루어 록에서 분리된 경우.
유리체 내 주사는 30 게이지 × ½인치 주사 바늘(제공되지 않음)로 수행해야 합니다.
사전 충전 주사기에는 권장 용량인 2mg 아플리버셉트(50마이크로리터에 해당)보다 많은 양이 들어 있습니다. 투여 전에 초과 용량은 버려야 합니다.
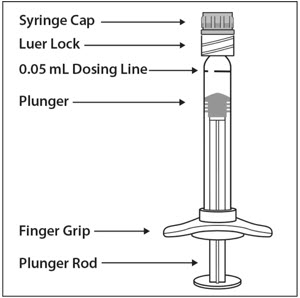
사전 충전 주사기 설명 – 그림 1:
무균 기법을 사용하여 다음 단계를 수행합니다.
1. 준비
EYLEA를 투여할 준비가 되면 상자를 열고 멸균된 블리스터 팩을 꺼냅니다. 멸균된 블리스터 팩을 조심스럽게 뜯어 내용물의 멸균 상태를 유지합니다. 조립할 준비가 될 때까지 주사기를 멸균 트레이에 보관합니다.
2. 주사기 제거
무균 기법을 사용하여 멸균된 블리스터 팩에서 주사기를 꺼냅니다.
3. 주사기 캡 풀기
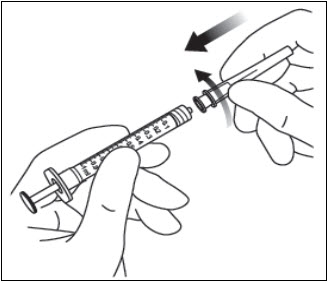
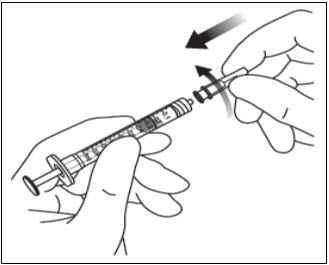
돌려서 풀기 (부러뜨리지 마십시오) 한 손으로 주사기를 잡고 다른 손의 엄지와 검지로 주사기 캡을 잡아 주사기 캡을 풀어냅니다(그림 2 참조).
참고: 제품의 멸균 상태를 유지하기 위해 플런저를 뒤로 당기지 마십시오.
4. 바늘 부착
무균 기법을 사용하여 30 게이지 × ½인치 주사 바늘을 루어 록 주사기 끝에 단단히 돌려서 부착합니다(그림 3 참조).
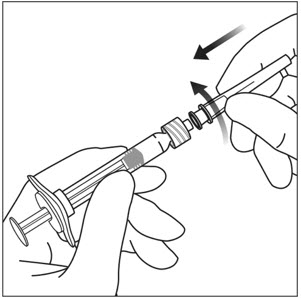
참고: EYLEA를 투여할 준비가 되면 바늘에서 플라스틱 바늘 보호대를 제거합니다.
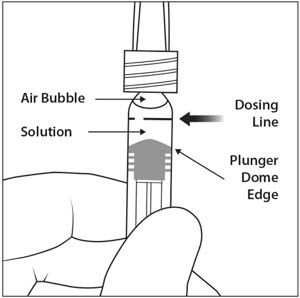
5. 공기 방울 제거
주사기를 바늘이 위로 향하게 잡고 주사기에 공기 방울이 있는지 확인합니다. 공기 방울이 있으면 손가락으로 주사기를 가볍게 두드려 공기 방울이 위로 올라오도록 합니다(그림 4 참조).
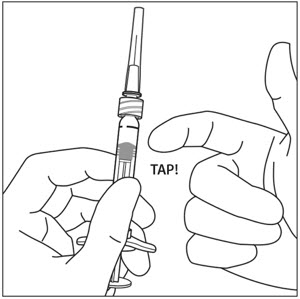
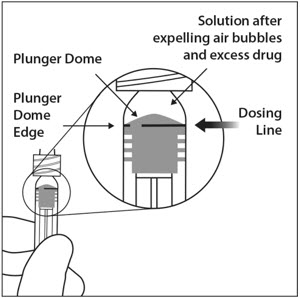
6. 공기 배출 및 용량 설정
모든 공기 방울을 제거하고 초과 약물을 배출하려면 플런저 돔 가장자리가(그림 5a 참조) 주사기의 검은색 용량 표시선(50마이크로리터에 해당)(그림 5b 참조)과 일치하도록 플런저 로드를 천천히 누릅니다.
7. 사전 충전 주사기는 한쪽 눈에만 한 번 사용합니다. 주사 후 사용하지 않은 제품은 폐기해야 합니다.
2.3 투여 준비 – 바이알
EYLEA는 투여 전에 시각적으로 검사해야 합니다. 입자가 보이거나 흐리거나 변색된 경우 바이알을 사용해서는 안 됩니다.
유리 바이알은 한쪽 눈에만 한 번 사용합니다.
다음 준비 단계를 수행할 때는 무균 기법을 사용하십시오.
다음과 같은 일회용 의료 기기를 사용하여 안구 내 주사를 준비하십시오.
- 5마이크론 무균 필터 바늘(18게이지 × 1½인치)
- 성인의 경우 0.05mL, ROP가 있는 미숙아의 경우 0.01mL를 측정할 수 있는 표시가 있는 1mL 무균 루어 록 주사기
- 무균 주사 바늘(30게이지 × ½인치)
- 바이알에서 보호 플라스틱 캡을 제거합니다( 그림 6 참조).
그림 6: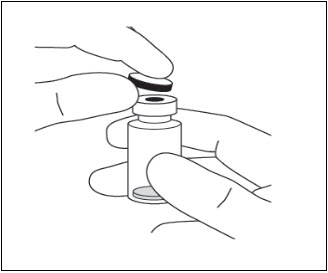
- 알코올 솜으로 바이알 윗부분을 닦습니다( 그림 7 참조).
그림 7: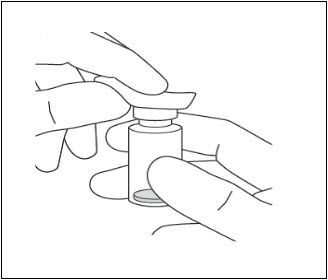
- 18게이지 × 1½인치, 5마이크론 필터 바늘과 1mL 주사기를 포장에서 꺼냅니다. 필터 바늘을 루어 록 주사기 끝에 끼워서 주사기에 연결합니다( 그림 8 참조).
- 필터 바늘을 바이알 마개 중앙에 밀어 넣어 바늘이 바이알에 완전히 삽입되고 바늘 끝이 바이알 바닥이나 바닥 가장자리에 닿도록 합니다.
- 무균 기법을 사용하여 바이알을 직립 상태로 유지하고 약간 기울여 EYLEA 바이알 내용물을 모두 주사기에 흡입합니다. 공기 유입을 방지하기 위해 필터 바늘의 경사면이 액체에 잠기도록 합니다. 흡입하는 동안 필터 바늘의 경사면이 액체에 잠기도록 바이알을 계속 기울입니다( 그림 9a 및 그림 9b 참조).
그림 9a: 그림 9b: 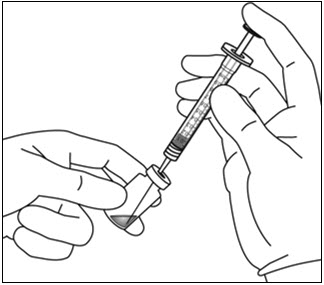
2.2 투여 전 준비
- 주사기에서 필터 니들을 제거하고 적절히 폐기합니다. 참고: 필터 니들은 사용하지 않습니다 유리체 내 주사에.
- 30 게이지 × ½ 인치 주사 바늘을 포장에서 꺼내 루어 락 주사기 끝에 주사 바늘을 단단히 돌려서 주사기에 부착합니다(참조 그림 10).
- EYLEA를 투여할 준비가 되면 바늘에서 플라스틱 바늘 보호대를 제거합니다.
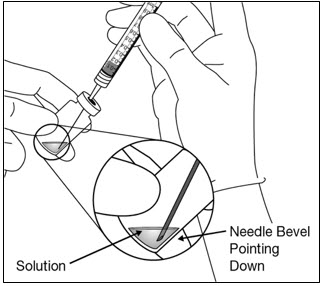
- 바늘을 위로 향하게 한 채 주사기를 잡고 주사기에 기포가 있는지 확인합니다. 기포가 있으면 손가락으로 주사기를 가볍게 두드려 기포가 위로 올라오도록 합니다(참조 그림 11).
그림 11: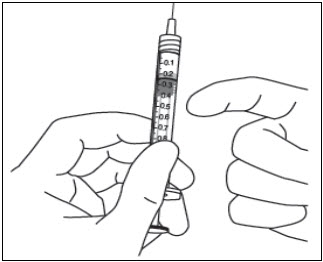
성인 투여:
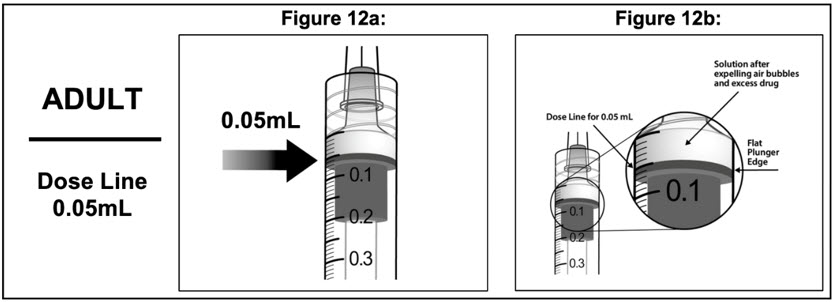
- 모든 기포를 제거하고 과량의 약물을 배출하기 위해 플런저 로드를 천천히 눌러 플런저 가장자리가 주사기의 0.05mL를 표시하는 선과 일치하도록 합니다(참조 그림 12a 및 그림 12b).
2.4 성인에 대한 주사 절차
유리체 내 주사 절차는 수술적 손 소독 및 멸균 장갑, 멸균 드레이프, 멸균 안검 스펙큘럼(또는 동등한 것) 사용을 포함한 통제된 무균 조건에서 수행해야 합니다. 주사 전에 적절한 마취와 국소 광범위 스펙트럼 미생물 제거제를 투여해야 합니다.
사전 충전 주사기: 플런저를 조심스럽고 일정한 압력으로 눌러 주사합니다. 플런저가 주사기 바닥에 도달하면 추가 압력을 가하지 마십시오. 전체 용량을 주사한 후 주사기에 소량의 잔여 용량이 남아 있을 수 있습니다. 이는 정상입니다. 주사기에 남아 있는 잔여 용액은 투여하지 마십시오.
유리체 내 주사 직후 환자는 안압 상승 여부를 모니터링해야 합니다. 적절한 모니터링은 시신경 유두 관류 확인 또는 압력계를 사용할 수 있습니다. 필요한 경우 멸균 천자 바늘을 준비해야 합니다.
유리체 내 주사 후 환자 및/또는 보호자는 안내염 또는 망막 박리(예: 눈 통증, 눈 충혈, 광공포증, 시력 흐림)를 시사하는 징후 및/또는 증상을 지체 없이 보고하도록 지시해야 합니다. [참조 환자 상담 정보 (17)].
멸균 사전 충전 주사기 또는 바이알은 한쪽 눈의 치료에만 사용해야 합니다. 반대쪽 눈에 치료가 필요한 경우 새 멸균 사전 충전 주사기 또는 바이알을 사용해야 하며, EYLEA를 다른 눈에 투여하기 전에 멸균 영역, 주사기, 장갑, 드레이프, 안검 스펙큘럼, 필터 및 주사 바늘을 교체해야 합니다.
주사 후 사용하지 않은 제품은 폐기해야 합니다.
2.5 신생혈관(습성) 연령 관련 황반 변성(AMD)
EYLEA의 권장 용량은 2mg(40mg/mL 용액 0.05mL)이며, 처음 12주(3개월) 동안 4주(약 28일, 매월)마다 유리체 내 주사로 투여하고, 그 후 8주(2개월)마다 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. EYLEA는 4주(약 25일, 매월)마다 2mg을 투여할 수 있지만, EYLEA를 4주마다 투여한 경우 8주마다 투여한 경우와 비교하여 대부분의 환자에서 추가적인 효능이 입증되지 않았습니다. [참조 임상 연구 (14.1)]. 일부 환자는 처음 12주(3개월) 후에 4주(매월)마다 투여가 필요할 수 있습니다. 권장되는 8주 투여 요법만큼 효과적이지는 않지만, 환자는 1년 동안 효과적인 치료를 받은 후 12주마다 한 번씩 투여를 받을 수도 있습니다. 환자는 정기적으로 평가해야 합니다.
2.6 망막 정맥 폐쇄(RVO) 후 황반 부종
EYLEA의 권장 용량은 2mg(40mg/mL 용액 0.05mL)이며, 4주(약 25일, 매월)마다 한 번씩 유리체 내 주사로 투여합니다. [참조 임상 연구 (14.2), (14.3)].
2.7 당뇨병성 황반 부종(DME)
EYLEA의 권장 용량은 2mg(40mg/mL 용액 0.05mL)이며, 처음 5회 주사는 4주(약 28일, 매월)마다 한 번씩 유리체 내 주사로 투여하고, 그 후 8주(2개월)마다 한 번씩 유리체 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. EYLEA는 4주(약 25일, 매월)마다 2mg을 투여할 수 있지만, EYLEA를 4주마다 투여한 경우 8주마다 투여한 경우와 비교하여 대부분의 환자에서 추가적인 효능이 입증되지 않았습니다. [참조 임상 연구 (14.4)]. 일부 환자는 처음 20주(5개월) 후에 4주(매월)마다 투여가 필요할 수 있습니다.
2.8 당뇨병성 망막병증 (DR)
EYLEA의 권장 용량은 4주(약 28일, 매월)마다 안구 내 주사로 투여되는 2mg(40mg/mL 용액 0.05mL)이며, 처음 5회 주사 후에는 8주(2개월)마다 안구 내 주사로 2mg(40mg/mL 용액 0.05mL)을 투여합니다. EYLEA는 4주(약 25일, 매월)마다 2mg씩 자주 투여할 수 있지만, EYLEA를 8주마다 투여한 경우와 비교하여 대부분의 환자에서 4주마다 투여했을 때 추가적인 효능이 입증되지 않았습니다. [임상 연구(14.5) 참조]. 일부 환자는 처음 20주(5개월) 후에 4주(매월)마다 투여가 필요할 수 있습니다.
2.9 미숙아 망막병증 (ROP)
권장 용량
EYLEA의 권장 용량은 안구 내 주사로 투여되는 0.4mg(40mg/mL 용액 0.01mL 또는 10마이크로리터)입니다. 치료는 적격 안구에 대한 단일 주사로 시작하며, 같은 날 양쪽 눈에 투여할 수 있습니다. 각 눈에 주사를 반복할 수 있습니다. 같은 눈에 주사된 용량 사이의 치료 간격은 최소 10일이어야 합니다. [임상 약리학(12.3) 및 임상 연구(14.6) 참조].
ROP를 가진 미숙아에 대한 투여 지침
안구 내 주사 절차는 수술용 손 소독 및 멸균 장갑, 멸균 드레이프, 멸균 안검 스펙큘럼(또는 동등한 것) 사용을 포함한 통제된 무균 조건에서 수행해야 합니다. 주사 전에 적절한 마취와 국소 광범위 스펙트럼 미생물 제거제를 투여해야 합니다.
안구 내 주사 직후, 환자는 안압 상승 여부를 모니터링해야 합니다. 적절한 모니터링은 시신경 유두 관류 확인 또는 안압 측정을 포함할 수 있습니다. 필요한 경우 멸균 천자 바늘을 준비해야 합니다.
안구 내 주사 후, 환자 및/또는 보호자는 안내염 또는 망막 박리(예: 눈 통증, 눈 충혈, 광선 공포증, 시력 흐림)를 시사하는 징후 및/또는 증상을 지체 없이 보고하도록 지시해야 합니다. [환자 상담 정보(17) 참조].
각 멸균 바이알은 한쪽 눈만 치료하는 데 사용해야 합니다. 사용하지 마십시오 ROP 치료를 위해 EYLEA 사전 충전 주사기를 사용합니다. 대측 눈에 치료가 필요한 경우 새 멸균 바이알을 사용해야 하며, EYLEA를 다른 눈에 투여하기 전에 멸균 영역, 주사기, 장갑, 드레이프, 안검 스펙큘럼, 필터 및 주사 바늘을 교체해야 합니다.
2.3 투여 준비 – 바이알에 나열된 1-10단계를 따르십시오.
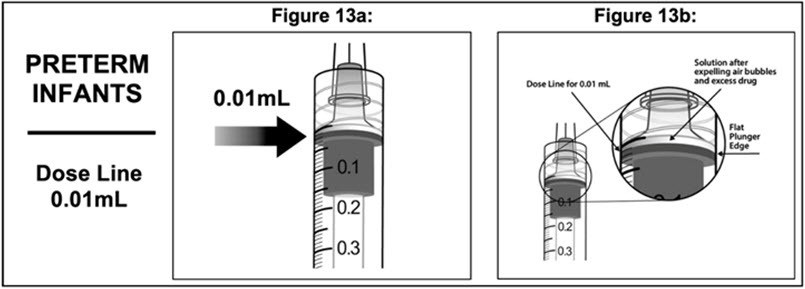
11 . 모든 기포를 제거하고 과도한 약물을 배출하려면 플런저 막대를 천천히 눌러 플런저 가장자리가 주사기에 표시된 0.01mL 선과 일치하도록 합니다(그림 13a 및 그림 13b 참조).
ROP 치료의 경우, 주사 바늘을 각막 가장자리에서 1mm 떨어진 눈에 삽입해야 하며, 바늘 각도는 렌즈와 망막을 피하도록 해야 합니다.
주사 후 사용하지 않은 제품은 폐기해야 합니다.
3 제형 및 함량
EYLEA는 투명하고 무색에서 연한 노란색 용액으로 다음과 같이 제공됩니다.
- 주사제: 2 mg (40 mg/mL 용액 0.05 mL) 단회용 미리 채워진 유리 주사기
- 주사제: 2 mg (40 mg/mL 용액 0.05 mL) 단회용 유리 바이알
4 금기사항
4.3 과민증
EYLEA는 아플리버셉트 또는 EYLEA의 첨가제에 대한 알려진 과민증이 있는 환자에게 금기입니다. 과민 반응은 발진, 가려움증, 두드러기, 심각한 아나필락시스/아나필락시스양 반응 또는 심각한 안구 내 염증으로 나타날 수 있습니다.
5 경고 및 주의사항
5.1 눈 속 염증, 망막 박리 및 망막 혈관염(혈관 폐쇄 동반 또는 미동반)
EYLEA를 포함한 유리체 내 주사는 눈 속 염증 및 망막 박리와 관련이 있으며 [ 이상반응(6.1) 참조], 드물게 혈관 폐쇄를 동반하거나 동반하지 않는 망막 혈관염과 관련이 있습니다 [이상반응(6.2) 참조]. EYLEA를 투여할 때는 항상 적절한 무균 주사 기법을 사용해야 합니다. 환자 및/또는 보호자에게 눈 속 염증, 망막 박리 또는 망막 혈관염을 시사하는 징후 및/또는 증상을 즉시 보고하도록 지시하고 적절하게 관리해야 합니다 [용량 및 투여(2.4) 및 환자 상담 정보(17) 참조].
5.2 안압 상승
EYLEA를 포함한 유리체 내 주사 후 60분 이내에 급성 안압 상승이 나타났습니다 [ 이상반응(6.1) 참조]. 혈관 내피 성장 인자(VEGF) 억제제를 유리체 내에 반복적으로 투여한 후에도 지속적인 안압 상승이 보고되었습니다. 안압과 시신경 유두 관류를 모니터링하고 적절하게 관리해야 합니다 [용량 및 투여(2.4) 참조].
5.3 ROP 환자의 연장 모니터링 및 추가 치료
EYLEA로 치료한 후 비정상적인 혈관 신생 및 사행이 다시 나타날 수 있습니다. 영아는 망막 혈관 생성이 완료될 때까지 또는 검사자가 ROP 재발이 발생하지 않을 것이라고 확신할 때까지 EYLEA 주사 후 면밀히 모니터링해야 합니다. ROP 영아의 경우 EYLEA 치료 시 장기간 ROP 모니터링이 필요하며 추가 EYLEA 주사 및/또는 레이저 치료가 필요할 수 있습니다.
5.4 혈전 색전성 사건
EYLEA를 포함한 VEGF 억제제를 유리체 내에 사용한 후 동맥 혈전 색전성 사건(ATE)이 발생할 위험이 있습니다. ATE는 비치명적 뇌졸중, 비치명적 심근경색 또는 혈관 사망(원인 불명 사망 포함)으로 정의됩니다. 첫해 습성 AMD 연구에서 보고된 혈전 색전성 사건의 발생률은 EYLEA로 치료받은 환자군에서 1.8%(1,824명 중 32명)였으며, 라니비주맙으로 치료받은 환자군에서는 1.5%(595명 중 9명)였습니다. 96주 동안 EYLEA군의 발생률은 3.3%(1,824명 중 60명), 라니비주맙군은 3.2%(595명 중 19명)였습니다. DME 연구에서 기준 시점부터 52주까지 EYLEA로 치료받은 환자군의 발생률은 3.3%(578명 중 19명)였으며, 대조군에서는 2.8%(287명 중 8명)였습니다. 기준 시점부터 100주까지 EYLEA로 치료받은 환자군의 발생률은 6.4%(578명 중 37명)였으며, 대조군에서는 4.2%(287명 중 12명)였습니다. RVO 연구의 첫 6개월 동안 EYLEA로 치료받은 환자에서는 혈전 색전성 사건이 보고되지 않았습니다.
6 부작용
다음과 같은 잠재적으로 심각한 유해 반응은 라벨링의 다른 부분에서 설명됩니다.
- 과민 반응 [금기 사항 (4.3) 참조]
- 내안염, 망막 박리 및 폐쇄 유무와 관계없이 망막 혈관염 [경고 및 주의 사항 (5.1) 참조]
- 안압 상승 [경고 및 주의 사항 (5.2) 참조]
- 혈전색전증 [경고 및 주의 사항 (5.4) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 유해 반응 발생률을 동일하거나 다른 약물의 다른 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
EYLEA로 치료받은 성인 환자 2980명이 8개의 3상 연구의 안전성 모집단을 구성했습니다. 그중 2379명의 환자가 권장 용량인 2mg으로 치료받았습니다. EYLEA로 유리체 내 주사와 관련된 심각한 유해 반응은 내안염 및 망막 박리를 포함하여 <0.1%에서 발생했습니다. EYLEA를 투여받은 환자에서 보고된 가장 흔한 유해 반응(≥5%)은 결막 출혈, 눈 통증, 백내장, 유리체 박리, 유리체 부유물 및 안압 상승이었습니다.
신생혈관 (습성) 연령 관련 황반 변성 (AMD)
아래에 설명된 데이터는 24개월 동안(1년 동안 활성 대조군 포함) 2건의 이중 맹검, 대조군 임상 연구(VIEW1 및 VIEW2)에서 습성 AMD 환자 1824명(2mg 용량으로 치료받은 환자 1223명 포함)에 대한 EYLEA 노출을 반영합니다. [임상 연구 (14.1) 참조]
52주 이중 맹검, 2상 연구에서 EYLEA 그룹에서 관찰된 안전성 데이터는 이러한 결과와 일치했습니다.
표 1: 습성 AMD 연구에서 가장 흔한 유해 반응(≥1%)
유해 반응 기준선에서 52주까지 기준선에서 96주까지 EYLEA
(N=1824)활성 대조군 (라니비주맙)
(N=595)EYLEA
(N=1824)대조군 (라니비주맙)
(N=595)결막 출혈 25% 28% 27% 30% 눈 통증 9% 9% 10% 10% 백내장 7% 7% 13% 10% 유리체 박리 6% 6% 8% 8% 유리체 부유물 6% 7% 8% 10% 안압 상승 5% 7% 7% 11% 안구 충혈 4% 8% 5% 10% 각막 상피 결손 4% 5% 5% 6% 망막 색소 상피 박리 3% 3% 5% 5% 주사 부위 통증 3% 3% 3% 4% 눈에 이물감 3% 4% 4% 4% 눈물 증가 3% 1% 4% 2% 시력 흐림 2% 2% 4% 3% 안구 염증 2% 3% 3% 4% 망막 색소 상피층 파열 2% 1% 2% 2% 주사 부위 출혈 1% 2% 2% 2% 눈꺼풀 부종 1% 2% 2% 3% 각막 부종 1% 1% 1% 1% 망막 박리 <1% <1% 1% 1% EYLEA로 치료받은 환자의 <1%에서 과민 반응, 망막 파열 및 내안염과 같은 덜 흔한 심각한 유해 반응이 보고되었습니다.
망막 정맥 폐쇄(RVO) 후 황반 부종
아래에 설명된 데이터는 2개의 임상 연구(COPERNICUS 및 GALILEO)에서 중심 망막 정맥 폐쇄(CRVO)를 앓고 있는 218명의 환자와 1개의 임상 연구(VIBRANT)에서 분지 망막 정맥 폐쇄(BRVO)를 앓고 있는 91명의 환자를 대상으로 매월 2mg 용량으로 EYLEA를 6개월 동안 투여한 결과를 반영합니다. [임상 연구(14.2), (14.3) 참조].
표 2: RVO 연구에서 가장 흔한 유해 반응(≥1%)
유해 반응 CRVO BRVO EYLEA
(N=218)대조군
(N=142)EYLEA
(N=91)대조군
(N=92)눈 통증 13% 5% 4% 5% 결막 출혈 12% 11% 20% 4% 안압 상승 8% 6% 2% 0% 각막 상피 결손 5% 4% 2% 0% 유리체 부유물 5% 1% 1% 0% 안구 충혈 5% 3% 2% 2% 눈에 이물감 3% 5% 3% 0% 유리체 박리 3% 4% 2% 0% 눈물 증가 3% 4% 3% 0% 주사 부위 통증 3% 1% 1% 0% 시력 흐림 1% <1% 1% 1% 안구 내 염증 1% 1% 0% 0% 백내장 <1% 1% 5% 0% 눈꺼풀 부종 <1% 1% 1% 0% 당뇨병성 황반 부종 (DME) 및 당뇨병성 망막병증 (DR)
아래에 설명된 데이터는 기준선부터 52주까지 및 기준선부터 100주까지 2개의 이중 맹검, 대조군 임상 연구(VIVID 및 VISTA)에서 2mg 용량으로 치료받은 DME 환자 578명에 대한 EYLEA 노출을 반영합니다. [임상 연구(14.4) 참조].
표 3: DME 연구에서 가장 흔한 유해 반응(≥1%)
유해 반응 기준선부터 52주까지 기준선부터 100주까지 EYLEA
(N=578)대조군
(N=287)EYLEA
(N=578)대조군
(N=287)결막 출혈 28% 17% 31% 21% 안구 통증 9% 6% 11% 9% 백내장 8% 9% 19% 17% 유리체 부유물 6% 3% 8% 6% 각막 상피 결손 5% 3% 7% 5% 안압 상승 5% 3% 9% 5% 안구 충혈 5% 6% 5% 6% 유리체 박리 3% 3% 8% 6% 안구 이물감 3% 3% 3% 3% 눈물 증가 3% 2% 4% 2% 시력 흐림 2% 2% 3% 4% 안내염 2% <1% 3% 1% 주사 부위 통증 2% <1% 2% <1% 눈꺼풀 부종 <1% 1% 2% 1% EYLEA로 치료받은 환자의 <1%에서 보고된 흔하지 않은 이상 반응은 과민 반응, 망막 박리, 망막 파열, 각막 부종 및 주사 부위 출혈이었습니다.
PANORAMA 시험에서 52주까지 비증식성 당뇨병성 망막증(NPDR) 환자 269명에서 관찰된 안전성 데이터는 3상 VIVID 및 VISTA 시험에서 관찰된 데이터와 일치했습니다(위의 표 3 참조).
미숙아 망막증(ROP)
아래에 설명된 데이터는 2건의 임상 연구(BUTTERFLEYE 및 FIREFLEYE/FIREFLEYE NEXT)에서 ROP로 진단받은 미숙아 168명에게 EYLEA를 투여하고 0.4mg 용량으로 치료한 결과를 반영하며, 첫 투여 시점부터 만 52주까지의 연령을 기준으로 합니다 [임상 연구(14.6) 참조]. 성인 적응증에 대해 확립된 이상 반응은 ROP를 가진 미숙아에게도 적용될 수 있지만, 모든 이상 반응이 임상 연구에서 관찰된 것은 아닙니다.
6.2 시판 후 경험
아래 이상 반응은 아플리버셉트의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
안과 질환:
- 아플리버셉트의 유리체 내 주사와 관련된 망막 혈관염 및 폐쇄성 망막 혈관염(2011년 11월부터 2023년 11월까지의 시판 후 경험을 기반으로 각각 100만 주사당 0.6회 및 0.2회의 비율로 보고됨).
- 공막염.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임산부에 대한 EYLEA의 적절하고 잘 통제된 연구는 수행되지 않았습니다. 아플리버셉트는 토끼에서 태아 발달에 악영향을 미쳤으며, 외부, 내장 및 골격 기형을 포함했습니다. 태아에 대한 무해한 최대 용량(NOAEL)은 확인되지 않았습니다. 태아 발달에 악영향을 미치는 것으로 나타난 가장 낮은 용량에서, 전신 노출(자유 아플리버셉트에 대한 AUC 기준)은 권장 임상 용량으로 단일 유리체 내 투여 후 사람에서 관찰된 AUC 값보다 약 6배 높았습니다. [동물 데이터 참조].
동물 생식 연구는 항상 사람의 반응을 예측하는 것은 아니며, EYLEA가 임산부에게 투여되었을 때 태아에게 해를 끼칠 수 있는지 여부는 알려져 있지 않습니다. 아플리버셉트의 항-VEGF 작용 기전을 기반으로 [임상 약리학 (12.1) 참조], EYLEA로 치료하면 인간 태아 발달에 위험을 초래할 수 있습니다. EYLEA는 임신 중에 태아에 대한 잠재적 이점이 잠재적 위험을 정당화하는 경우에만 사용해야 합니다.
모든 임신에는 기형, 유산 또는 기타 부작용의 배경 위험이 있습니다. 표시된 인구에 대한 주요 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
데이터
두 가지 태아 발달 연구에서, 아플리버셉트는 기관 형성 과정 동안 임신한 토끼에게 정맥 주사로 ≥3 mg/kg 또는 기관 형성 과정 동안 6일마다 피하 주사로 ≥0.1 mg/kg의 용량으로 투여했을 때 태아 발달에 악영향을 미쳤습니다.
태아 발달에 악영향을 미치는 것으로 나타난 것에는 착상 후 손실 및 태아 기형의 발생률 증가가 포함되었으며, 여기에는 전신 부종, 제대 탈출, 횡경막 탈출, 복벽 결손, 구개 파열, 손가락 결손, 장 폐쇄, 척추 갈림증, 뇌척수탈출증, 심장 및 주요 혈관 결손, 골격 기형(융합된 척추, 흉골 및 갈비뼈; 과잉 척추궁 및 갈비뼈; 불완전한 골화)이 포함됩니다. 이러한 연구에서 모체에 대한 무해한 최대 용량(NOAEL)은 3 mg/kg이었습니다. 아플리버셉트는 토끼에서 평가된 모든 용량에서 태아 기형을 유발했으며, 태아에 대한 NOAEL은 확인되지 않았습니다. 토끼에서 태아 발달에 악영향을 미치는 것으로 나타난 가장 낮은 용량(0.1 mg/kg)에서, 자유 아플리버셉트의 전신 노출(AUC)은 2 mg의 단일 유리체 내 투여 후 성인 환자에서 관찰된 전신 노출(AUC)보다 약 6배 높았습니다.
8.3 생식 능력이 있는 여성 및 남성
불임
EYLEA가 인간의 생식 능력에 미치는 영향에 대한 데이터는 없습니다. 아플리버셉트는 2 mg의 유리체 내 투여 후 성인 환자에서 관찰된 전신 수준보다 약 1500배 높은 용량으로 정맥 주사로 투여했을 때, 붉은털원숭이에서 여성 및 남성 생식 기관에 악영향을 미쳤습니다. 무해한 최대 용량(NOAEL)은 확인되지 않았습니다. 이러한 발견은 치료 중단 후 20주 이내에 회복되었습니다. [비임상 독성학 (13.1) 참조].
8.4 소아 사용
EYLEA의 안전성 및 유효성은 ROP를 가진 미숙아에 대한 두 가지 임상 연구에서 입증되었습니다.
이 두 가지 연구는 EYLEA 또는 레이저로 초기 치료를 받은 미숙아를 무작위 배정했습니다. 각 치료의 유효성은 치료 없이 예상되었을 것보다 더 나은 임상 경과를 보여주는 것으로 뒷받침됩니다. [투여량 및 투여 방법 (2.9), 부작용 (6.1), 임상 약리학 (12.3) 및 임상 연구 (14.6) 참조].
8.5 노인 사용
임상 연구에서, EYLEA로 치료를 받도록 무작위 배정된 환자의 약 76%(2049/2701)는 ≥65세였고, 약 46%(1250/2701)는 ≥75세였습니다. 이러한 연구에서 나이가 증가함에 따라 유효성 또는 안전성에 유의미한 차이가 관찰되지 않았습니다.
10 과다 복용
주입량 증가로 인한 과량 투여는 안압을 상승시킬 수 있습니다. 따라서 과량 투여의 경우, 안압을 모니터링해야 하며, 치료 의사가 필요하다고 판단하는 경우 적절한 치료를 시작해야 합니다.
11 설명
아플리버셉트는 인간 VEGF 수용체 1 및 2 세포외 도메인의 일부를 인간 IgG1의 Fc 부분에 융합시킨 재조합 융합 단백질로, 유리체 내 투여를 위한 등장액으로 제형화됩니다. 아플리버셉트는 이량체 당단백질로 단백질 분자량이 97킬로달톤(kDa)이며, 당화가 포함되어 총 분자량의 15%를 추가하여 총 분자량이 115kDa가 됩니다. 아플리버셉트는 재조합 중국 햄스터 난소(CHO) 세포에서 생산됩니다.
EYLEA(아플리버셉트) 주사제는 멸균된 무색 투명 또는 연한 황색의 용액입니다. EYLEA는 항균 보존제를 함유하지 않으며, 0.05mL(50마이크로리터)의 용액을 함유한 단회용 사전 충전 유리 주사기 또는 단회용 유리 바이알에 멸균된 수성 용액으로 제공되며, 이 용액은 폴리소르베이트 20(0.015mg), 염화나트륨(0.117mg), 인산일수소나트륨 일수화물(0.055mg), 인산이수소나트륨 7수화물(0.027mg), 수크로스(2.5mg) 및 주사용수를 함유하며, pH는 6.2입니다.
12 임상약리학
12.1 작용 기전
혈관 내피 성장 인자-A(VEGF-A) 및 태반 성장 인자(PlGF)는 내피 세포에 대해 유사분열, 화학 주성 및 혈관 투과 인자로 작용할 수 있는 VEGF 계열 혈관 신생 인자의 구성원입니다. VEGF는 내피 세포 표면에 존재하는 두 가지 수용체 티로신 키나아제인 VEGFR-1 및 VEGFR-2를 통해 작용합니다. PlGF는 백혈구 표면에도 존재하는 VEGFR-1에만 결합합니다. VEGF-A에 의한 이러한 수용체의 활성화는 신생혈관형성 및 혈관 투과성을 초래할 수 있습니다.
애플리버셉트는 VEGF-A 및 PlGF에 결합하는 가용성 미끼 수용체로 작용하여 이러한 동족 VEGF 수용체의 결합 및 활성화를 억제할 수 있습니다.
12.2 약력학
신생혈관(습성) 노인성 황반변성(AMD)
임상 연구에서 질병 활성의 해부학적 측정은 기준선에서 52주까지 모든 치료군에서 유사하게 개선되었습니다. 해부학적 데이터는 첫해 동안 치료 결정에 영향을 미치는 데 사용되지 않았습니다.
망막 정맥 폐쇄(RVO) 후 황반 부종
COPERNICUS, GALILEO 및 VIBRANT에서 24주차에 평균 망막 두께 감소가 기준선에 비해 관찰되었습니다. 해부학적 데이터는 치료 결정에 영향을 미치는 데 사용되지 않았습니다 [임상 연구(14.2), (14.3) 참조].
당뇨병성 황반 부종(DME)
VIVID 및 VISTA에서 52주 및 100주차에 평균 망막 두께 감소가 기준선에 비해 관찰되었습니다. 해부학적 데이터는 EYLEA 치료 결정에 영향을 미치는 데 사용되지 않았습니다 [임상 연구(14.4) 참조].
12.3 약동학
EYLEA는 눈에 국소적인 효과를 발휘하기 위해 유리체 내 투여됩니다. 습성 AMD, RVO 또는 DME 환자의 경우 EYLEA 유리체 내 투여 후 투여 용량의 일부가 눈의 내인성 VEGF와 결합하여 비활성 애플리버셉트:VEGF 복합체를 형성할 것으로 예상됩니다. 전신 순환으로 흡수되면 애플리버셉트는 혈장에서 유리 애플리버셉트(VEGF에 결합되지 않음) 및 순환하는 내인성 VEGF가 있는 보다 우세한 안정적인 비활성 형태(즉, 애플리버셉트:VEGF 복합체)로 나타납니다.
흡수/분포
습성 AMD, RVO 및 DME 환자에게 EYLEA를 눈당 2mg 유리체 내 투여한 후 혈장에서 유리 애플리버셉트의 평균 Cmax는 각각 0.02mcg/mL(범위: 0~0.054mcg/mL), 0.05mcg/mL(범위: 0~0.081mcg/mL) 및 0.03mcg/mL(범위: 0~0.076mcg/mL)였으며 1~3일 만에 도달했습니다. 유리 애플리버셉트 혈장 농도는 모든 환자에서 투여 후 2주 후에 검출되지 않았습니다. 애플리버셉트는 4주마다 유리체 내 반복 투여 시 혈장에 축적되지 않았습니다. 환자에게 2mg을 유리체 내 투여한 후 유리 애플리버셉트의 평균 최대 혈장 농도는 전신 VEGF를 반 최대로 결합하는 데 필요한 애플리버셉트 농도보다 100배 이상 낮은 것으로 추정됩니다.
애플리버셉트를 정맥 내(I.V.) 투여한 후 유리 애플리버셉트의 분포 용적은 약 6L로 확인되었습니다.
대사/배설
애플리버셉트는 치료용 단백질이며 약물 대사 연구가 수행되지 않았습니다. 애플리버셉트는 유리 내인성 VEGF에 결합을 통한 표적 매개 분포와 단백질 분해를 통한 대사를 통해 배설될 것으로 예상됩니다. 혈장에서 유리 애플리버셉트의 최종 배설 반감기(t1/2)는 2~4mg/kg 용량의 애플리버셉트를 I.V. 투여한 후 약 5~6일이었습니다.
특정 집단
소아 환자
애플리버셉트의 약동학은 애플리버셉트 0.4mg(눈당)을 단안 또는 양안으로 투여받은 ROP 조산아에서 평가되었습니다. BUTTERFLEYE 연구에서 혈장 내 유리 애플리버셉트의 평균 농도는 양안 치료 환자의 경우 1일째 0.583mcg/mL에서 28일째 0.0406mcg/mL로 감소했습니다.
FIREFLEYE 연구에서 모든 환자(양안 및 단안 투여 병합)의 혈장 내 유리 애플리버셉트의 평균 농도는 1일째 0.481mcg/mL에서 28일째 0.13mcg/mL로 감소했습니다. 혈장 내 유리 애플리버셉트의 농도는 이후 약 8주 이내에 정량 하한값 이하 또는 근접한 값으로 감소했습니다.
10일 또는 14일 간격으로 양안에 애플리버셉트 0.4mg/눈의 IVT 용량을 투여한 후 혈장 내 유리 애플리버셉트의 모집단 약동학적 추정 평균 최대 축적 비율은 약 2.0 및 1.4였습니다. 21일 이상의 투여 간격으로 양안에 0.4mg/눈의 IVT 용량을 투여할 경우 혈장 내 유리 애플리버셉트의 축적은 예상되지 않습니다.
12.6 면역원성
모든 치료용 단백질과 마찬가지로 EYLEA로 치료받은 환자에서 면역 반응이 나타날 가능성이 있습니다. 혈청 샘플에서 EYLEA의 면역원성을 평가했습니다. 면역원성 데이터는 면역 분석에서 EYLEA에 대한 항체 검사 결과가 양성으로 간주된 환자의 비율을 나타냅니다. 면역 반응의 검출은 사용된 분석법의 민감도 및 특이도, 샘플 취급, 샘플 수집 시기, 병용 약물 및 기저 질환에 따라 크게 달라집니다. 이러한 이유로 EYLEA에 대한 항체 발생률을 다른 제품에 대한 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
습성 AMD, RVO 및 DME 연구에서 치료 전 EYLEA에 대한 면역 반응성 발생률은 치료군 전체에서 약 1%~3%였습니다. 24-100주 동안 EYLEA로 투여한 후 유사한 비율의 환자에서 EYLEA에 대한 항체가 검출되었습니다. 마찬가지로 소아 ROP 연구에서 일측 또는 양측 투여 후 1% 미만의 환자에서 EYLEA에 대한 항체가 검출되었습니다.
면역 반응성이 있는 환자와 없는 환자 간에 효능이나 안전성의 차이는 없었습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
아플리버셉트의 돌연변이 유발 또는 발암 가능성에 대한 연구는 수행되지 않았습니다. 수컷 및 암컷 생식 능력에 대한 영향은 아플리버셉트를 주당 3~30mg/kg의 용량으로 정맥 주사한 원숭이를 대상으로 한 6개월 연구에서 평가되었습니다. 모든 용량 수준에서 암컷 생식 호르몬 수치 변화와 관련된 무월경 또는 불규칙적인 월경과 정자 형태 및 운동성 변화가 관찰되었습니다. 또한 암컷은 난소 및 자궁 무게 감소와 함께 황체 발달 저해 및 성숙 난포 감소를 보였습니다. 이러한 변화는 자궁 및 질 위축과 관련이 있었습니다. 무관찰 유해 효과 수준(NOAEL)은 확인되지 않았습니다. 원숭이에서 평가된 아플리버셉트의 가장 낮은 용량(3mg/kg)을 정맥 주사하면 자유 아플리버셉트에 대한 전신 노출(AUC)이 2mg의 안구 내 주사 후 성인 환자에서 관찰된 전신 노출보다 약 1500배 높았습니다. 모든 변화는 치료 중단 후 20주 이내에 회복되었습니다.
13.2 동물 독성 및/또는 약리학
아플리버셉트를 안구 내로 주사한 원숭이에서 안구 내 용량이 눈당 2 또는 4mg인 경우 비강 갑개의 호흡기 상피에 침식 및 궤양이 관찰되었습니다. 원숭이에서 NOAEL인 눈당 0.5mg에서 전신 노출(AUC)은 2mg의 안구 내 주사 후 성인 환자에서 관찰된 노출보다 56배 높았고, FIREFLEYE에서 관찰된 해당 값과 비교할 때 Cmax 기준으로 2배 높았습니다. [임상 연구 참조 임상 연구 (14)].
14 임상 연구
14.1 신생혈관(습성) 노인성 황반변성(AMD)
습성 AMD 환자를 대상으로 한 두 건의 무작위배정, 다기관, 이중맹검, 활성 대조군 연구에서 EYLEA의 안전성 및 유효성을 평가했습니다. 두 연구(VIEW1 및 VIEW2)에서 총 2412명의 환자가 치료를 받았으며 유효성 평가에 적합했습니다(EYLEA 투여군 1817명). 각 연구에서 최대 52주까지 환자들을 1:1:1:1 비율로 무작위 배정하여 다음 4가지 용량 요법 중 하나를 받도록 했습니다. 1) 처음 3개월 동안 매월 투여한 후 8주마다 EYLEA 2mg 투여(EYLEA 2Q8), 2) 4주마다 EYLEA 2mg 투여(EYLEA 2Q4), 3) 4주마다 EYLEA 0.5mg 투여(EYLEA 0.5Q4), 4) 4주마다 ranibizumab 0.5mg 투여(ranibizumab 0.5mg Q4). 프로토콜에 명시된 방문은 28±3일마다 이루어졌습니다. 환자의 연령은 49~99세였으며 평균 연령은 76세였습니다.
두 연구에서 1차 유효성 평가변수는 52주차에 기준치 대비 시력 손실이 15글자 미만으로 유지된 환자의 비율이었습니다. EYLEA 2Q8군과 EYLEA 2Q4군 모두 1년차에 ranibizumab 0.5mg Q4군과 임상적으로 동등한 유효성을 보였습니다.
VIEW1 및 VIEW2 연구 분석의 자세한 결과는 아래 표 5 및 그림 14에 나와 있습니다.
표 5: VIEW1 및 VIEW2 연구의 52주차 유효성 결과(LOCF를 이용한 전체 분석 집단)
VIEW1 VIEW2 EYLEA
2 mg Q8 weeks *EYLEA
2 mg Q4 weeksranibizu-mab
0.5 mg Q4 weeksEYLEA
2 mg Q8 weeks *EYLEA
2 mg Q4 weeksranibizu-mab
0.5 mg Q4 weeks전체 분석 집단 N=301 N=304 N=304 N=306 N=309 N=291 BCVA = 최대 교정 시력, CI = 신뢰 구간, ETDRS = 초기 당뇨병성 망막증 연구, LOCF = 최종 관찰 시점 이월(기준치는 이월하지 않음), 연구 중 실시된 안전성 평가를 위해 95.1% 신뢰 구간을 제시함 유효성 결과 시력을 유지한 환자의 비율(%)
(BCVA 손실 <15글자)94% 95% 94% 95% 95% 95% 차이† (%)
(95.1% CI)0.6
(-3.2, 4.4)1.3
(-2.4, 5.0)0.6
(-2.9, 4.0)-0.3
(-4.0, 3.3)ETDRS 글자 점수로 측정한 기준치 대비 BCVA의 평균 변화량 7.9 10.9 8.1 8.9 7.6 9.4 LS 평균의 차이†
(95.1% CI)0.3
(-2.0, 2.5)3.2
(0.9, 5.4)-0.9
(-3.1, 1.3)-2.0
(-4.1, 0.2)기준치 대비 시력이 15글자 이상 개선된 환자 수(%) 92
(31%)114
(38%)94
(31%)96
(31%)91
(29%)99
(34%)차이† (%)
(95.1% CI)-0.4
(-7.7, 7.0)6.6
(-1.0, 14.1)-2.6
(-10.2, 4.9)-4.6
(-12.1, 2.9)평가 가능한 하위 그룹(예: 연령, 성별, 인종, 기준 시력)의 각 연구에서 치료 효과는 일반적으로 전체 모집단의 결과와 일치했습니다.
그림 14: VIEW1 및 VIEW2 연구에서 기준선에서 96주까지의 시력 평균 변화*
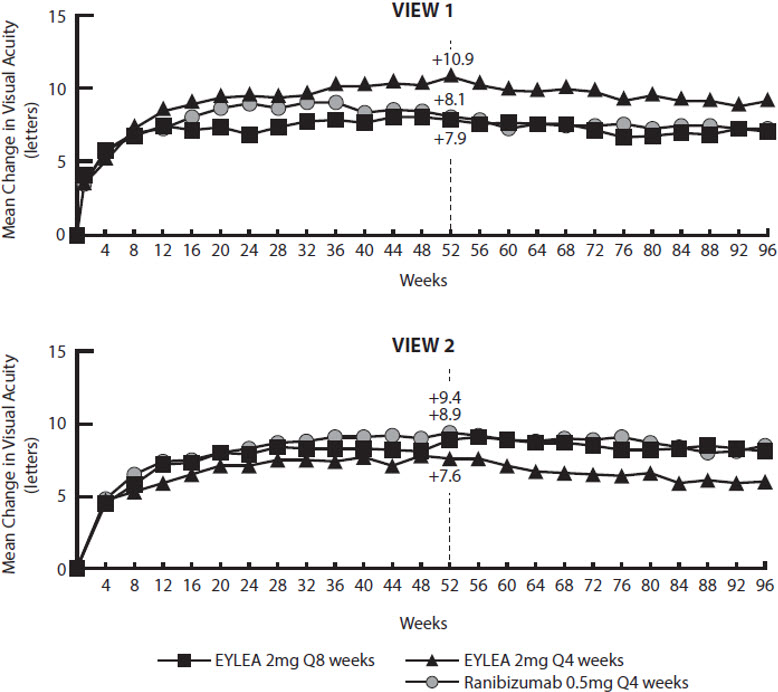
*환자 투여 일정은 수정된 12주 투여 요법을 사용하여 52주에서 96주까지 개별화되었습니다.
VIEW1 및 VIEW2 연구는 모두 96주 동안 진행되었습니다. 그러나 52주 후에 환자들은 더 이상 고정된 투여 일정을 따르지 않았습니다. 52주에서 96주 사이에 환자들은 수정된 12주 투여 일정(최소 12주마다 투여 및 필요에 따라 추가 투여)에 따라 처음에 무작위 배정된 약물 및 투여 강도를 계속 투여받았습니다. 따라서 이러한 연구의 2차 연도 동안에는 활성 대조군 비교군이 없었습니다.
14.2 중심 망막 정맥 폐쇄(CRVO) 후 황반 부종
황반 부종이 있는 환자를 대상으로 무작위 배정, 다기관, 이중 눈가림, 가짜 약물 대조군 연구 2건에서 EYLEA의 안전성과 유효성을 평가했습니다. 총 358명의 환자가 치료를 받았으며 두 연구(COPERNICUS 및 GALILEO)에서 유효성을 평가할 수 있었습니다(EYLEA 217명). 두 연구 모두에서 환자들은 4주마다 2mg EYLEA를 투여하는 군(2Q4) 또는 4주마다 가짜 주사를 투여하는 군(대조군)에 3:2 비율로 무작위 배정되어 총 6회 주사를 맞았습니다. 프로토콜에서 지정한 방문은 28±7일마다 이루어졌습니다. 환자의 연령은 22~89세였으며 평균 연령은 64세였습니다.
두 연구 모두에서 일차 유효성 평가 변수는 기준선에 비해 BCVA에서 최소 15글자를 얻은 환자의 비율이었습니다. 24주차에 EYLEA 2mg Q4군은 일차 평가 변수에 대해 대조군보다 우수했습니다.
COPERNICUS 및 GALILEO 연구 분석 결과는 아래 표 6 및 그림 15에 나와 있습니다.
표 6: COPERNICUS 및 GALILEO 연구의 24주차 유효성 결과(LOCF 포함 전체 분석 세트)
COPERNICUS GALILEO 대조군 EYLEA
2mg Q4주대조군 EYLEA
2mg Q4주N=73 N=114 N=68 N=103 유효성 결과 기준선 대비 BCVA에서 최소 15글자를 얻은 환자의 비율(%) 12% 56% 22% 60% 가중치 차이 *, † (%)
(95.1% CI)44.8%‡
(32.9, 56.6)38.3%‡
(24.4, 52.1)ETDRS 문자 점수로 측정한 기준선 대비 BCVA의 평균 변화(SD) -4.0
(18.0)17.3
(12.8)3.3
(14.1)18.0
(12.2)LS 평균의 차이 *, §
(95.1% CI)21.7‡
(17.3, 26.1)14.7‡
(10.7, 18.7)그림 15: COPERNICUS 및 GALILEO 연구에서 기준치 대비 24주차까지의 ETDRS 글자 점수로 측정한 BCVA의 평균 변화
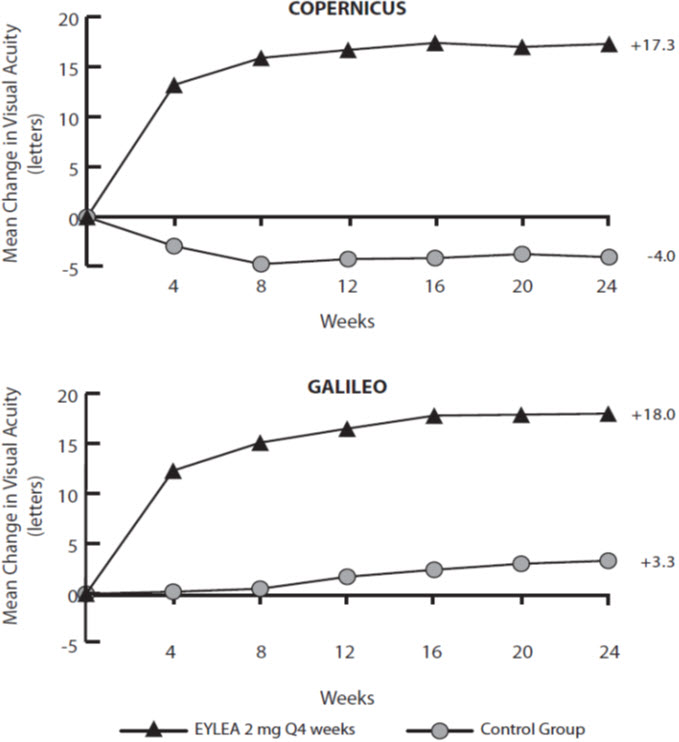
각 연구 및 통합 분석에서 평가 가능한 하위 그룹(예: 연령, 성별, 인종, 기준 시력, 망막 관류 상태 및 CRVO 기간)의 치료 효과는 일반적으로 전체 모집단의 결과와 일치했습니다.
14.3 망막 분지 정맥 폐쇄(BRVO) 후 황반부종
망막 분지 정맥 폐쇄(BRVO) 후 황반부종 환자를 대상으로 24주간 무작위 배정, 다기관, 이중 마스킹, 대조군 연구를 통해 EYLEA의 안전성과 유효성을 평가했습니다. VIBRANT 연구에서 총 181명의 환자가 치료를 받았으며 유효성을 평가할 수 있었습니다(EYLEA 투여군 91명). 이 연구에서 환자들은 4주마다 2mg의 EYLEA를 투여받는 군(2Q4) 또는 기준 시점에 레이저 광응고술을 시행하고 필요에 따라 추가 시행하는 군(대조군)으로 1:1 비율로 무작위 배정되었습니다. 프로토콜에서 지정한 방문은 28±7일마다 이루어졌습니다. 환자의 연령은 42~94세였으며 평균 연령은 65세였습니다.
VIBRANT 연구에서 1차 유효성 평가 변수는 24주차에 기준치 대비 BCVA 글자 수가 15개 이상 증가한 환자의 비율이었습니다. 24주차에 EYLEA 2mg Q4군은 1차 평가 변수에서 대조군보다 우수했습니다.
VIBRANT 연구 분석의 자세한 결과는 아래 표 7과 그림 16에 나와 있습니다.
표 7: VIBRANT 연구의 24주차 유효성 결과(LOCF를 사용한 전체 분석 세트)
VIBRANT 대조군 EYLEA
2mg Q4주N=90 N=91 유효성 결과 기준치 대비 BCVA 글자 수가 15개 이상 증가한 환자의 비율(%) 26.7% 52.7% 가중치 차이 *, † (%)
(95% CI)26.6%‡
(13.0, 40.1)ETDRS 글자 점수로 측정한 기준치 대비 BCVA의 평균 변화(SD) 6.9
(12.9)17.0
(11.9)LS 평균의 차이 *, §
(95% CI)10.5‡
(7.1, 14.0)그림 16: VIBRANT 연구에서 기준선에서 24주까지 ETDRS 문자 점수로 측정한 BCVA의 평균 변화
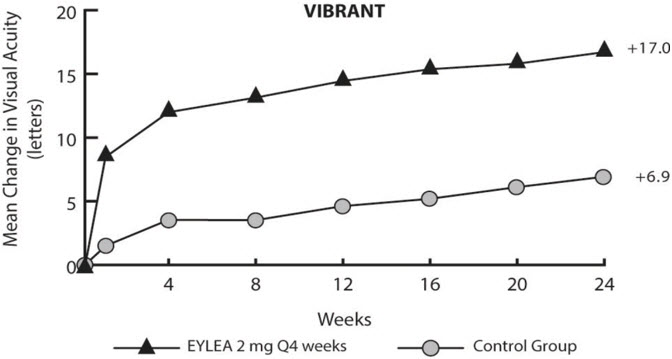
연구에서 평가 가능한 하위 그룹(예: 연령, 성별, 기준선 망막 관류 상태)의 치료 효과는 일반적으로 전체 모집단의 결과와 일치했습니다.
14.4 당뇨병성 황반 부종(DME)
EYLEA의 안전성과 효능은 DME 환자를 대상으로 한 두 건의 무작위, 다기관, 이중맹검, 대조군 연구에서 평가되었습니다. 총 862명의 무작위 배정 및 치료를 받은 환자가 효능 평가에 적합했습니다. 프로토콜에서 지정한 방문은 28±7일마다 이루어졌습니다. 환자의 연령은 23~87세였으며 평균 연령은 63세였습니다.
이 중 576명은 두 연구(VIVID 및 VISTA)에서 EYLEA 그룹에 무작위 배정되었습니다. 각 연구에서 환자는 1:1:1 비율로 3가지 용량 요법 중 하나에 무작위 배정되었습니다. 1) 5회의 초기 월별 주사 후 8주마다 EYLEA 2mg 투여(EYLEA 2Q8), 2) 4주마다 EYLEA 2mg 투여(EYLEA 2Q4), 3) 황반 레이저 광응고(기준선에서 시행하고 필요에 따라 시행).
두 연구 모두에서 1차 효능 평가 변수는 ETDRS 문자 점수로 측정했을 때 52주차에 기준선 대비 BCVA의 평균 변화였습니다. EYLEA 2Q8 그룹과 EYLEA 2Q4 그룹 모두 효능이 대조군보다 통계적으로 유의하게 우수했습니다. BCVA의 이러한 통계적으로 유의한 개선은 두 연구 모두에서 100주차까지 유지되었습니다.
VIVID 및 VISTA 연구 분석 결과는 아래 표 8과 그림 17에 나와 있습니다.
표 8: VIVID 및 VISTA 연구의 52주차 및 100주차의 효능 결과(LOCF 포함 전체 분석 세트)
VIVID VISTA EYLEA
2 mg Q8주 *EYLEA
2 mg Q4주대조군 EYLEA
2 mg Q8주 *EYLEA
2 mg Q4주대조군 전체 분석 세트 N=135 N=136 N=132 N=151 N=154 N=154 52주차의 효능 결과 기준선 대비 ETDRS 문자 점수로 측정한 BCVA의 평균 변화(SD) 10.7
(9.3)10.5
(9.6)1.2
(10.6)10.7
(8.2)12.5
(9.5)0.2
(12.5)LS 평균의 차이†, ‡
(97.5% CI)9.1§
(6.3, 11.8)9.3§
(6.5, 12.0)10.5§
(7.7, 13.2)12.2§
(9.4, 15.0)기준선 대비 BCVA에서 15글자 이상 개선된 환자의 비율(%) 33.3% 32.4% 9.1% 31.1% 41.6% 7.8% Adjusted Difference‡, ¶ (%)
(97.5% CI)24.2%§
(13.5, 34.9)23.3%§
(12.6, 33.9)23.3%§
(13.5, 33.1)34.2%§
(24.1, 44.4)100주차의 효능 결과 기준치 대비 ETDRS 문자 점수로 측정한 BCVA의 평균 변화량 (SD) 9.4
(10.5)11.4
(11.2)0.7
(11.8)11.1
(10.7)11.5
(13.8)0.9
(13.9)LS 평균의 차이†, ‡
(97.5% CI)8.2§
(5.2, 11.3)10.7§
(7.6, 13.8)10.1§
(7.0, 13.3)10.6§
(7.1, 14.2)기준치 대비 BCVA에서 15글자 이상을 얻은 환자의 비율 (%) 31.1% 38.2% 12.1% 33.1% 38.3% 13.0% Adjusted Difference‡, ¶ (%)
(97.5% CI)19.0%§
(8.0, 29.9)26.1%§
(14.8, 37.5)20.1%§
(9.6, 30.6)25.8%§
(15.1, 36.6)그림 17: VIVID 및 VISTA 연구에서 기준시점에서 100주까지 ETDRS 문자 점수로 측정한 BCVA의 평균 변화
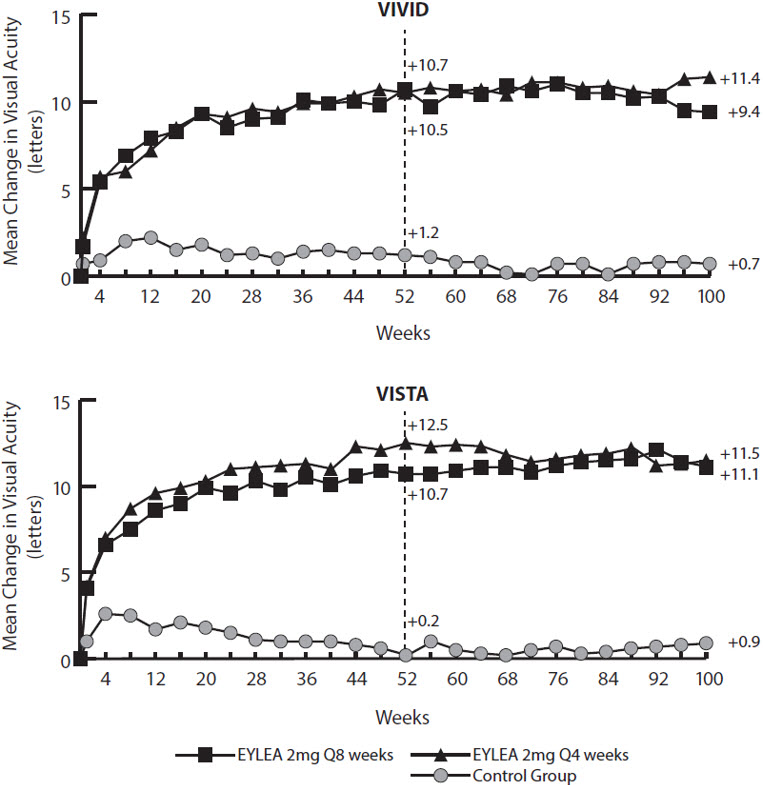
연구 참여 전에 VEGF 억제제로 치료받은 적이 있는 환자 하위 그룹의 치료 효과는 연구 참여 전에 VEGF 억제제를 투여받지 않은 환자에서 나타난 치료 효과와 유사했습니다.
각 연구의 평가 가능한 하위 그룹(예: 연령, 성별, 인종, 기준시점 HbA1c, 기준시점 시력, 이전의 항-VEGF 치료)의 치료 효과는 일반적으로 전체 모집단의 결과와 일치했습니다.
14.5 당뇨병성 망막증(DR)
당뇨병성 망막증(DR)에서 EYLEA의 효능 및 안전성 데이터는 VIVID, VISTA 및 PANORAMA 연구에서 비롯되었습니다.
VIVID 및 VISTA
VIVID 및 VISTA 연구에서 효능 결과는 조기 치료 당뇨병성 망막증 연구(ETDRS) 당뇨병성 망막증 중증도 척도(ETDRS-DRSS)의 변화였습니다. ETDRS-DRSS 점수는 기준시점과 그 후 연구 기간 동안 약 6개월마다 평가되었습니다. [임상 연구(14.4) 참조].
등록된 모든 환자는 기준시점에 DR 및 DME가 있었습니다. 이러한 연구에 등록된 대부분의 환자(77%)는 ETDRS-DRSS를 기준으로 중등도에서 중증의 비증식성 당뇨병성 망막증(NPDR)을 앓고 있었습니다. 100주차에 ETDRS-DRSS에서 최소 2단계 이상 개선된 환자의 비율은 대조군에 비해 두 EYLEA 치료군(2Q4 및 2Q8) 모두에서 유의하게 더 높았습니다.
VIVID 및 VISTA 연구에서 100주차에 ETDRS-DRSS 분석 결과는 아래 표 9에 나와 있습니다.
표 9: VIVID 및 VISTA 연구에서 100주차에 ETDRS-DRSS 점수에서 기준시점 대비 ≥2단계 개선을 달성한 환자의 비율
VIVID VISTA EYLEA
2 mg Q8주 *EYLEA
2 mg Q4주대조군 EYLEA
2 mg Q8주 *EYLEA
2 mg Q4주대조군 평가 가능한 환자† N=101 N=97 N=99 N=148 N=153 N=150 기준시점 이후 등급을 매길 수 없는 ETDRS-DRSS 값은 누락된 것으로 처리되었으며 마지막으로 등급을 매길 수 있었던 ETDRS-DRSS 값(기준시점 이후의 모든 값이 누락되었거나 등급을 매길 수 없는 경우 기준시점 값 포함)을 사용하여 대체되었습니다. ETDRS-DRSS에서 기준시점 대비 ≥2단계 개선된 환자 수 32 27 7 56 58 24 기준시점(%) (32%) (28%) (7%) (38%) (38%) (16%) 차이‡, § (%) 24%¶ 21%¶ 22%¶ 22%¶ (97.5% CI) (12, 36) (9, 33) (11, 33) (11, 33) 평가 가능한 하위 그룹(예: 연령, 성별, 인종, 기준 HbA1c, 기준 시력)에서 기준선부터 100주까지 ETDRS-DRSS에서 ≥2단계 개선을 달성한 환자의 비율은 일반적으로 전체 모집단의 환자 비율과 일치했습니다.
PANORAMA
PANORAMA 연구에서는 중증에서 중증의 비증식성 당뇨병성 망막증(NPDR)(ETDRS-DRSS 47 또는 53)이 있고 중심성 황반부종(CI-DME)이 없는 환자를 대상으로 무작위 배정, 다기관, 이중맹검, 대조군 연구를 통해 EYLEA의 안전성과 유효성을 평가했습니다. 총 402명의 무작위 배정 환자가 유효성 평가에 적합했습니다. 프로토콜에서 지정한 방문은 처음 5회 방문 동안 28±7일마다, 그 이후에는 8주(56±7일)마다 이루어졌습니다. 환자의 연령은 25~85세였으며 평균 연령은 55.7세였습니다.
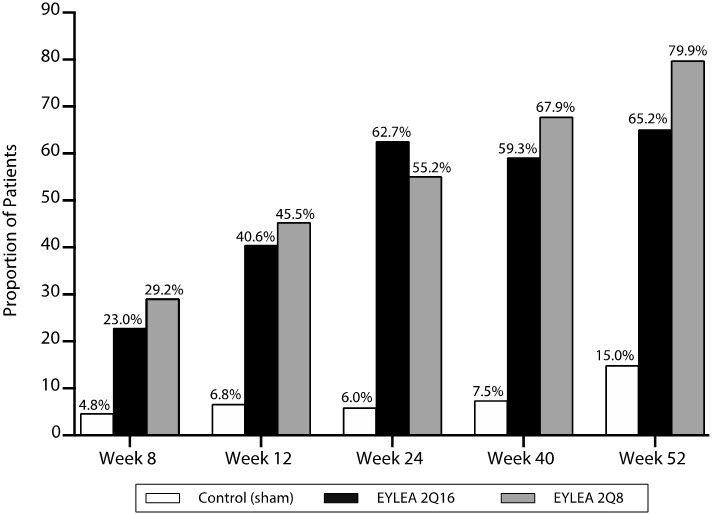
환자들은 1:1:1 비율로 3가지 용량 요법 중 하나에 무작위로 배정되었습니다. 1) EYLEA 2mg를 처음 3개월 동안 매월 투여한 후 8주 후에 1회 투여하고 그 후 16주마다 1회 투여(EYLEA 2Q16), 2) EYLEA 2mg를 5개월 동안 매월 투여한 후 8주마다 1회 투여(EYLEA 2Q8), 3) 가짜 치료.
주요 유효성 평가 기준은 병용 EYLEA 그룹의 경우 기준선부터 24주까지, 2Q16 및 2Q8 그룹의 경우 각각 52주까지 DRSS에서 ≥2단계 개선된 환자의 비율이었습니다. 주요 이차 평가 기준은 52주까지 증식성 당뇨병성 망막증 또는 전방 분절 신생혈관 형성이라는 복합 평가 기준이 발생한 환자의 비율이었습니다.
52주차에 2Q16 및 2Q8 그룹의 유효성은 가짜 치료 그룹보다 우수했습니다(표 10 및 표 11 참조). 시간 경과에 따른 ≥2단계 개선을 보인 환자의 비율은 그림 18에 나와 있습니다.
표 10: PANORAMA에서 24주차와 52주차에 ETDRS-DRSS 점수에서 기준선보다 ≥2단계 개선을 달성한 환자의 비율
PANORAMA 24주차 52주차 EYLEA
병용대조군
(가짜 치료)EYLEA
2Q16EYLEA
2Q8대조군
(가짜 치료)전체 분석 세트 N=269 N=133 N=135 N=134 N=133 등급을 매길 수 없는 기준 후 ETDRS-DRSS 값은 결측값으로 처리되었으며 마지막으로 등급을 매길 수 있었던 ETDRS-DRSS 값(기준 후 값을 모두 매길 수 없거나 등급을 매길 수 없는 경우 기준 값 포함)을 사용하여 대체되었습니다. 기준선보다 ETDRS-DRSS에서 ≥2단계 개선된 환자의 비율(%) 58% 6% 65% 80% 15% 조정된 차이* (%)
(95% CI)†52%‡
(45, 60)50%‡
(40, 60)65%‡
(56, 74)그림 18: PANORAMA에서 52주까지 ETDRS-DRSS 점수 기준 대비 2단계 이상 개선된 환자 비율
14.6 미숙아 망막증(ROP)
ROP에서 EYLEA의 효능 및 안전성 데이터는 두 가지 연구(BUTTERFLEYE 및 FIREFLEYE/FIREFLEYE NEXT)에서 비롯되었습니다. BUTTERFLEYE는 52주 연구였습니다. FIREFLEYE는 24주의 치료 및 추적 관찰을 포함했습니다. FIREFLEYE NEXT는 52주까지 FIREFLEYE에 대한 관찰적 추적 관찰이었습니다.
BUTTERFLEYE 및 FIREFLEYE 연구는 모두 무작위, 2-arm, 공개 라벨, 병렬 그룹 연구에서 EYLEA의 효능, 안전성 및 내약성을 평가했습니다. 이 연구는 EYLEA 치료와 레이저 광응고술(레이저)을 비교하여 ROP가 있는 미숙아를 대상으로 수행되었습니다. 적합한 각 눈은 기준 시점에 배정된 연구 치료를 받았습니다. 재치료 및/또는 응급 치료는 사전 지정된 기준에 따라 필요한 경우 시행되었습니다. 응급 치료에는 다른 치료법(EYLEA 또는 레이저)이 포함될 수 있습니다. 아플리베르셉트를 사용한 재치료는 필요한 경우 특정 눈에 최대 2회까지 시행되었으며, 연속 주사 간격은 최소 28일이었습니다.
적격한 환자는 출생 시 최대 재태 기간이 32주 이하이거나 최대 출생 체중이 1500g 이하였고, 치료 당일 체중이 800g을 초과해야 했으며, 다음 망막 소견 중 하나 이상을 가진 적어도 한쪽 눈에서 미숙아 망막증의 국제 분류(IC-ROP 2005)에 따라 분류된 치료 경험이 없는 ROP를 가지고 있어야 했습니다.
- ROP 1구역 1+, 2+, 3 또는 3+ 단계, 또는
- ROP 2구역 2+ 또는 3+ 단계, 또는
- AP-ROP(공격적 후방 ROP)
각 연구의 1차 효능 종료점은 생후 52주차에 활성 ROP가 없고 바람직하지 않은 구조적 결과(망막 박리, 황반 견인, 황반 주름, 수정체후부 혼탁)가 없는 환자의 비율이었습니다.
BUTTERFLEYE에서 환자들은 2가지 치료 요법 중 하나를 받기 위해 3:1 비율로 무작위 배정되었습니다. 1) 기준 시점에 EYLEA 0.4mg, 필요한 경우 최대 2회 추가 주사 및 2) 기준 시점에 각 눈에 레이저 광응고술, 필요한 경우 재치료. FIREFLEYE에서 환자들은 동일한 두 가지 치료에 대해 2:1 비율로 무작위 배정되었습니다. 응급 치료는 사전 지정된 기준에 따라 필요한 경우 시행되었습니다. 두 연구 모두에서 아플리베르셉트 그룹의 치료받은 모든 환자의 92% 이상이 연구 기간 동안 양안 주사를 받았습니다.
BUTTERFLEYE 및 FIREFLEYE/FIREFLEYE NEXT 연구의 생후 52주차 결과는 아래 표 12에 나와 있습니다.
임상적으로 유의미한 ROP 재활성화가 없고 바람직하지 않은 구조적 결과가 발생하지 않은 환자의 비율은 각 연구의 각 군에서 치료를 받지 않은 영아에게서 예상되는 것보다 높았습니다. 두 임상시험 모두 한 군이 다른 군에 비해 우월성을 입증하지 못했습니다. 두 임상시험 모두 한 군이 다른 군에 비해 열등성을 입증하지 못했습니다.
표 12: BUTTERFLEYE 및 FIREFLEYE/FIREFLEYE NEXT 연구의 생후 52주차 효능 결과
BUTTERFLEYE* FIREFLEYE/FIREFLEYE NEXT* EYLEA 0.4 mg 레이저 EYLEA 0.4 mg 레이저 전체 분석 세트† N=93 N=27 N=75 N=38 효능 결과 - *
- 양안 치료의 경우 양쪽 눈이 1차 평가변수를 충족한 경우에만 성공으로 간주했습니다. 동일한 눈에 주사된 2회 용량 간의 치료 간격은 최소 28일이었습니다.
- †
- BUTTERFLEYE 및 FIREFLEYE/FIREFLEYE NEXT 연구에서 무작위 배정되고 치료를 받은 환자가 포함되었습니다. 이는 통계 분석 계획에 정의된 바와 같이 1차 분석 모집단이었습니다.
- ‡
- 신뢰 구간(CI)이 있는 차이는 기준선 ROP 상태에 따라 조정된 Mantel-Haenszel 가중치 체계를 사용하여 계산되었습니다. 성공 기준: 95.1% CI의 하한이 -5% 이상입니다.
활성 ROP가 없고 바람직하지 않은 구조적 결과가 없는 환자의 비율(%) 79.6% 77.8% 78.7% 81.6% 조정된 차이‡ (%)
(95.1% CI)1.81% (-15.7, 19.3) -1.88% (-17.0, 13.2) 16 제공/보관 및 취급 방법
16.1 공급 형태
사전 충전된 주사기 또는 바이알은 투명하고 무색에서 옅은 노란색 용액이며 한쪽 눈에만 사용합니다. EYLEA는 다음과 같은 형태로 제공됩니다 [투약 및 투여 (2.1), (2.2), (2.3), (2.4) 및 (2.9) 참조]. 사용하지 않은 부분은 버립니다.
NDC 번호 카톤 유형 카톤 내용물 61755-005-01 사전 충전된 주사기 EYLEA 2mg (40mg/mL 용액 0.05mL) 멸균 단회용 사전 충전 유리 주사기가 들어 있는 블리스터 팩 1개
처방 정보 1개61755-005-02 주사 구성품이 포함된 바이알 키트 EYLEA 2mg (40mg/mL 용액 0.05mL) 단회용 유리 바이알 1개
바이알 내용물을 뽑아내기 위한 18게이지 × 1½인치, 5마이크론 필터 니들 1개
안구 내 주사를 위한 30게이지 × ½인치 주사 바늘 1개
투여를 위한 1mL 주사기 1개
처방 정보 1개16.2 보관 및 취급
EYLEA는 2°C~8°C(36°F~46°F)에서 냉장 보관하십시오. 냉동하지 마십시오. 카톤 및 용기 라벨에 표시된 날짜를 넘겨서는 사용하지 마십시오. 빛으로부터 보호하기 위해 사용할 때까지 원래 카톤에 보관하십시오. 사용할 때까지 밀봉된 블리스터 트레이를 열지 마십시오.
17 환자 상담 정보
EYLEA 투여 후 며칠 동안 환자는 폐쇄 여부와 관계없이 내안염, 망막 박리 또는 망막 혈관염이 발생할 위험이 있습니다. 눈이 빨갛게 되거나, 빛에 민감해지거나, 통증이 있거나, 시력이 변하면 환자 및/또는 보호자에게 안과 의사의 즉각적인 치료를 받도록 조언하십시오 [경고 및 주의 사항 (5.1) 참조].
환자는 EYLEA의 유리체 내 주사 및 관련 안과 검사 후 일시적인 시력 장애를 경험할 수 있습니다 [부작용 (6) 참조]. 시력 기능이 충분히 회복될 때까지 운전하거나 기계를 작동하지 않도록 환자에게 조언하십시오. ROP가 있는 영아의 경우 EYLEA로 치료하면 ROP 모니터링 기간이 연장됩니다.
SPL 미분류 섹션
제조사:
Regeneron Pharmaceuticals, Inc.
777 Old Saw Mill River Road
Tarrytown, NY 10591-6707
미국 허가 번호 1760
특허 정보: https://www.regeneron.com/downloads/us-patent-products.pdf
EYLEA는 Regeneron Pharmaceuticals, Inc.의 등록 상표입니다.
© 2024, Regeneron Pharmaceuticals, Inc.
모든 권리 보유.
개정일: 2024년 10월
주요 표시면 – 2mg/0.05mL 바이알 상자
NDC 61755-005-02
EYLEA®
(아플리버셉트) 주사제
유리체 내 주사용2 mg (40 mg/mL 용액 0.05 mL)
단회용 바이알카톤 내용물: 각 EYLEA 카톤에는 다음이 포함되어 있습니다.
- 단회용 3mL 유리 바이알 1개의 EYLEA
- 바이알 내용물을 뽑아내기 위한 18게이지 x 1½인치, 5마이크론 필터 니들 1개
(필터 니들은 유리체 내 주사에 사용하지 않아야 함) - 유리체 내 주사용 30게이지 x ½인치 니들 1개
- 투여용 1mL 플라스틱 주사기 1개
- 처방 정보 1개
처방전만

주요 표시면 – 2 mg/0.05 mL 주사기 상자
NDC 61755-005-01
Rx ONLYEYLEA®
(아플리버셉트) 주사제
유리체 내 주사용2 mg (40 mg/mL 용액 0.05 mL)
1회용 미리 채워진 주사기
카톤 내용물:
- 1개의 멸균 1회용 미리 채워진 유리 주사기를 포함하는 1개의 블리스터 팩
- 1개의 처방 정보
REGENERON
 Tags: PD-1
Tags: PD-1