의약품 제조업체: E.R. Squibb & Sons, L.L.C. (Updated: 2021-09-30)
처방 정보 주요 내용
ELIQUIS® (아픽사반) 정제, 경구용
미국 최초 승인: 2012
경고: (A) ELIQUIS의 조기 중단은 혈전색전증 위험을 증가시킵니다.
(B) 척추/경막 외혈종
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
(A) ELIQUIS의 조기 중단은 혈전색전증 위험을 증가시킵니다: ELIQUIS를 포함한 모든 경구 항응고제의 조기 중단은 혈전색전증 위험을 증가시킵니다. 이러한 위험을 줄이기 위해 ELIQUIS가 병리적 출혈 또는 치료 과정 완료 이외의 이유로 중단되는 경우 다른 항응고제로의 적용을 고려하십시오. (2.4, 5.1, 14.1)
(B) 척추/경막 외혈종: ELIQUIS로 치료받는 환자에서 척추 마취를 받거나 척추 천자를 시행하는 경우 경막 외 또는 척추 외혈종이 발생할 수 있습니다. 이러한 혈종은 장기간 또는 영구적인 마비를 초래할 수 있습니다. 환자를 척추 수술 일정을 잡을 때 이러한 위험을 고려하십시오. (5.3)
적응증 및 사용
투여량 및 투여 방법
투여 형태 및 강도
- •
- 정제: 2.5mg 및 5mg (3)
경고 및 주의 사항
부작용
가장 흔한 부작용(>1%)은 출혈과 관련이 있습니다. (6.1)
의심되는 부작용을 보고하려면 Bristol-Myers Squibb에 1-800-721-5072 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
특정 인구 집단에서의 사용
환자 상담 정보 및 약물 안내를 보려면 17을 참조하십시오.
개정: 2021년 4월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
WARNING: (A) PREMATURE DISCONTINUATION OF ELIQUIS INCREASES THE RISK OF THROMBOTIC EVENTS
(B) SPINAL/EPIDURAL HEMATOMA
1 적응증 및 용법
1.1 비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
1.2 고관절 또는 슬관절 치환술 후 심부 정맥 혈전증 예방
1.3 심부 정맥 혈전증 치료
1.4 폐색전증 치료
1.5 DVT 및 PE 재발 위험 감소
2 용량 및 투여
2.1 권장 용량
2.2 복용량 누락
2.3 수술 및 기타 중재를 위한 일시적 중단
2.4 ELIQUIS에서 전환 또는 ELIQUIS로 전환
2.5 복합 P-gp 및 강력한 CYP3A4 억제제
2.6 투여 방법
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 조기 중단 후 혈전성 사건 위험 증가
5.2 출혈
5.3 척추/경막외 마취 또는 천자
5.4 인공 심장 판막 환자
5.5 혈역학적으로 불안정하거나 혈전 용해 또는 폐 색전술이 필요한 급성 PE 환자
5.6 삼중 양성 항인지질 증후군 환자의 혈전증 위험 증가
6 이상 반응
6.1 임상 시험 경험
7 약물 상호 작용
7.1 복합 P-gp 및 강력한 CYP3A4 억제제
7.2 복합 P-gp 및 강력한 CYP3A4 유도제
7.3 항응고제 및 항혈소판제
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간 장애
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능 손상
14 임상 연구
14.1 비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
14.2 고관절 또는 슬관절 치환술 후 심부 정맥 혈전증 예방
14.3 DVT 및 PE 치료 및 DVT 및 PE 재발 위험 감소
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
경고
경고: (A) ELIQUIS의 조기 중단은 혈전성 사건의 위험을 증가시킵니다
(B) 척추/경막외 혈종
(A) ELIQUIS의 조기 중단은 혈전성 사건의 위험을 증가시킵니다
ELIQUIS를 포함한 모든 경구용 항응고제의 조기 중단은 혈전성 사건의 위험을 증가시킵니다. 병적 출혈 또는 치료 과정 완료 이외의 이유로 ELIQUIS를 사용한 항응고를 중단하는 경우 다른 항응고제로 치료하는 것을 고려하십시오 [복용량 및 투여 방법 (2.4), 경고 및 주의사항 (5.1), 및 임상 연구 (14.1) 참조].
(B) 척추/경막외 혈종
척추 마취를 받거나 척추 천자를 받는 ELIQUIS 치료를 받는 환자에게 경막외 또는 척추 혈종이 발생할 수 있습니다. 이러한 혈종은 장기간 또는 영구적인 마비를 초래할 수 있습니다. 환자의 척추 시술 일정을 잡을 때 이러한 위험을 고려하십시오. 이러한 환자에서 경막외 또는 척추 혈종 발생 위험을 증가시킬 수 있는 요인은 다음과 같습니다.
- •
- 삽입형 경막외 카테터 사용
- •
- 비스테로이드성 항염증제(NSAID), 혈소판 억제제, 기타 항응고제와 같은 지혈에 영향을 미치는 다른 약물의 병용
- •
- 외상성 또는 반복적인 경막외 또는 척추 천자의 병력
- •
- 척추 기형 또는 척추 수술의 병력
- •
- ELIQUIS 투여와 신경 축상 시술 사이의 최적 시간은 알려져 있지 않습니다
[경고 및 주의사항 (5.3) 참조]
신경학적 손상의 징후 및 증상에 대해 환자를 자주 모니터링하십시오. 신경학적 손상이 나타나면 긴급 치료가 필요합니다 [경고 및 주의사항 (5.3) 참조].
항응고 치료를 받았거나 받을 예정인 환자의 경우 신경 축상 중재 전에 이점과 위험을 고려하십시오 [경고 및 주의사항 (5.3) 참조].
1 적응증 및 용법
1.2 고관절 또는 슬관절 치환술 후 심부 정맥 혈전증 예방
ELIQUIS는 고관절 또는 슬관절 치환술을 받은 환자에서 폐색전증으로 이어질 수 있는 심부 정맥 혈전증(DVT) 예방에 사용됩니다.
2. 용법 및 용량
2.1 권장 용량
비판막성 심방세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
ELIQUIS의 권장 용량은 대부분의 환자에서 1일 2회 경구로 5mg입니다.
다음 특징 중 2가지 이상을 가진 환자의 경우 ELIQUIS의 권장 용량은 1일 2회 2.5mg입니다.
- •
- 연령 80세 이상
- •
- 체중 60kg 이하
- •
- 혈청 크레아티닌 1.5mg/dL 이상
고관절 또는 슬관절 치환술 후 심부 정맥 혈전증 예방
ELIQUIS의 권장 용량은 1일 2회 경구로 2.5mg입니다. 첫 번째 용량은 수술 후 12~24시간에 복용해야 합니다.
- •
- 고관절 치환술을 받은 환자의 경우 권장 치료 기간은 35일입니다.
- •
- 슬관절 치환술을 받은 환자의 경우 권장 치료 기간은 12일입니다.
심부 정맥 혈전증 및 폐색전증 재발 위험 감소
ELIQUIS의 권장 용량은 심부 정맥 혈전증 또는 폐색전증 치료를 최소 6개월 동안 받은 후 1일 2회 경구로 2.5mg입니다 [임상 연구 (14.3) 참조].
2.2 복용량 누락
ELIQUIS 복용량을 예정된 시간에 복용하지 못한 경우, 같은 날 가능한 한 빨리 복용해야 하며 1일 2회 복용을 재개해야 합니다. 누락된 복용량을 보충하기 위해 복용량을 두 배로 복용해서는 안 됩니다.
2.3 수술 및 기타 시술을 위한 일시적 중단
ELIQUIS는 수술 또는 중등도 또는 고위험의 수용할 수 없거나 임상적으로 유의미한 출혈 위험이 있는 침습적 시술 전 최소 48시간 전에 중단해야 합니다 [경고 및 주의 사항 (5.2) 참조]. ELIQUIS는 출혈 위험이 낮거나 출혈이 비판적인 위치가 아니고 쉽게 조절할 수 있는 수술 또는 침습적 시술 전 최소 24시간 전에 중단해야 합니다. ELIQUIS 중단 후 24~48시간 동안 및 시술 전에 교량 항응고제를 사용할 필요는 일반적으로 없습니다. ELIQUIS는 적절한 지혈이 확립되면 수술 또는 기타 시술 후 가능한 한 빨리 재개해야 합니다.
2.4 ELIQUIS로의 전환 또는 ELIQUIS에서의 전환
와파린에서 ELIQUIS로 전환: 와파린은 국제 표준화 비율 (INR)이 2.0 미만일 때 중단하고 ELIQUIS를 시작해야 합니다.
ELIQUIS에서 와파린으로 전환: ELIQUIS는 INR에 영향을 미치므로 와파린으로 전환하는 동안 초기 INR 측정은 와파린의 적절한 용량을 결정하는 데 유용하지 않을 수 있습니다. 한 가지 방법은 ELIQUIS를 중단하고 다음 ELIQUIS 복용 시간에 정맥 주사 항응고제와 와파린을 모두 시작하고 INR이 허용 범위에 도달하면 정맥 주사 항응고제를 중단하는 것입니다.
ELIQUIS에서 와파린이 아닌 다른 항응고제 (경구 또는 정맥 주사)로 전환: ELIQUIS를 중단하고 다음 ELIQUIS 복용 시간에 와파린이 아닌 새로운 항응고제를 복용하십시오.
와파린이 아닌 다른 항응고제 (경구 또는 정맥 주사)에서 ELIQUIS로 전환: 와파린이 아닌 항응고제를 중단하고 다음 와파린이 아닌 항응고제 복용 시간에 ELIQUIS를 복용하십시오.
2.5 P-gp 및 강력한 CYP3A4 억제제 병용
ELIQUIS를 1일 2회 5mg 또는 10mg 복용하는 환자의 경우, ELIQUIS를 P-glycoprotein (P-gp) 및 강력한 cytochrome P450 3A4 (CYP3A4) 억제제 (예: 케토코나졸, 이트라코나졸, 리토나비르)와 병용 투여할 때 용량을 50% 감소시켜야 합니다 [임상 약리학 (12.3) 참조].
이미 1일 2회 2.5mg을 복용하는 환자의 경우, ELIQUIS를 P-gp 및 강력한 CYP3A4 억제제와 병용 투여하지 않아야 합니다 [약물 상호 작용 (7.1) 참조].
2.6 투여 방법
정제를 통째로 삼키기 어려운 환자의 경우, 5mg 및 2.5mg ELIQUIS 정제를 분쇄하여 물, 5% 포도당 용액 (D5W) 또는 사과 주스에 현탁하거나 사과 소스와 섞어 즉시 경구로 투여할 수 있습니다 [임상 약리학 (12.3) 참조]. 또는 ELIQUIS 정제를 분쇄하여 60mL의 물 또는 D5W에 현탁하고 즉시 비강관을 통해 투여할 수 있습니다 [임상 약리학 (12.3) 참조].
분쇄된 ELIQUIS 정제는 물, D5W, 사과 주스 및 사과 소스에서 최대 4시간 동안 안정적입니다.
3. 투여 형태 및 용량
- •
- 2.5 mg, 노란색, 둥근 모양, 양쪽 볼록, 필름 코팅된 정제, 한쪽에는 “893”이 각인되어 있고 다른 쪽에는 “2½”이 각인되어 있습니다.
- •
- 5 mg, 분홍색, 타원형, 양쪽 볼록, 필름 코팅된 정제, 한쪽에는 “894”가 각인되어 있고 다른 쪽에는 “5”가 각인되어 있습니다.
4 금기 사항
ELIQUIS는 다음과 같은 환자에게 금기입니다.
- •
- 활성 병리적 출혈 [경고 및 주의 사항 (5.2) 및 유해 반응 (6.1) 참조]
- •
- ELIQUIS에 대한 중증 과민 반응 (예: 아나필락시스 반응) [유해 반응 (6.1) 참조]
5 경고 및 주의사항
5.1 조기 치료 중단 후 혈전성 사건 위험 증가
적절한 다른 항응고제를 사용하지 않고 ELIQUIS를 포함한 경구용 항응고제를 조기에 중단하면 혈전성 사건의 위험이 증가합니다. 심방세동 환자를 대상으로 한 임상 시험에서 ELIQUIS에서 와파린으로 전환하는 동안 뇌졸중 발생률이 증가한 것으로 나타났습니다. 병적인 출혈 또는 치료 과정의 완료 이외의 이유로 ELIQUIS를 중단하는 경우 다른 항응고제로 대체하는 것을 고려하십시오 [ 복용량 및 투여 방법 (2.4) 및 임상 연구 (14.1) 참조].
5.2 출혈
ELIQUIS는 출혈 위험을 증가시키며 심각하고 잠재적으로 치명적인 출혈을 유발할 수 있습니다 [ 복용량 및 투여 방법 (2.1) 및 이상반응 (6.1) 참조].
지혈에 영향을 미치는 약물을 병용하면 출혈 위험이 증가합니다. 여기에는 아스피린 및 기타 항혈소판제, 기타 항응고제, 헤파린, 혈전용해제, 선택적 세로토닌 재흡수 억제제, 세로토닌 노르에피네프린 재흡수 억제제 및 비스테로이드성 항염증제(NSAID)가 포함됩니다 [약물 상호 작용 (7.3) 참조].
환자에게 혈액 손실의 징후와 증상을 알리고 즉시 보고하거나 응급실에 가도록 조언하십시오. 활동성 병적 출혈이 있는 환자에게는 ELIQUIS를 중단하십시오.
항응고 효과의 반전
아픽사반의 항Xa 인자 활성을 되돌리는 약물을 사용할 수 있습니다. ELIQUIS의 약력학적 효과는 마지막 복용 후 최소 24시간, 즉 약 2회의 약물 반감기 동안 지속될 것으로 예상할 수 있습니다. 프로트롬빈 복합체 농축액(PCC), 활성화 프로트롬빈 복합체 농축액 또는 재조합 인자 VIIa를 고려할 수 있지만 임상 연구에서 평가되지 않았습니다 [임상 약리학 (12.2) 참조]. PCC를 사용할 때 응고 검사(PT, INR 또는 aPTT) 또는 항Xa 인자(FXa) 활성을 사용하여 아픽사반의 항응고 효과를 모니터링하는 것은 유용하지 않으며 권장되지 않습니다. 활성탄은 아픽사반의 흡수를 감소시켜 아픽사반 혈장 농도를 낮춥니다 [ 과다 복용 (10) 참조].
혈액 투석은 아픽사반 노출에 큰 영향을 미치지 않는 것으로 보입니다 [임상 약리학 (12.3) 참조]. 프로타민 설페이트와 비타민 K는 아픽사반의 항응고 활성에 영향을 미치지 않을 것으로 예상됩니다. 아픽사반을 투여받는 개인에서 항섬유소 용해제(트라넥삼산, 아미노카프로산)에 대한 경험은 없습니다. ELIQUIS를 투여받는 개인에서 전신 지혈제(데스모프레신)에 대한 경험은 없으며 반전제로서 효과적일 것으로 예상되지 않습니다.
5.3 척추/경막외 마취 또는 천자
척추/경막외 마취 또는 척추/경막외 천자를 시행할 때 혈전색전증 합병증 예방을 위해 항혈전제로 치료받는 환자는 장기 또는 영구적인 마비를 초래할 수 있는 경막외 또는 척추 혈종이 발생할 위험이 있습니다.
이러한 사건의 위험은 수술 후 경막외 카테터를 유치하거나 지혈에 영향을 미치는 의약품을 병용하면 증가할 수 있습니다. 유치된 경막외 또는 척추 내 카테터는 ELIQUIS를 마지막으로 투여한 후 24시간 이전에 제거해서는 안 됩니다. ELIQUIS의 다음 용량은 카테터 제거 후 5시간 이전에 투여해서는 안 됩니다. 외상성 또는 반복적인 경막외 또는 척추 천자로 인해 위험이 증가할 수도 있습니다. 외상성 천자가 발생하면 ELIQUIS 투여를 48시간 지연하십시오.
신경학적 손상의 징후와 증상(예: 다리의 무감각 또는 쇠약, 장 또는 방광 기능 장애)이 있는지 환자를 자주 모니터링하십시오. 신경학적 손상이 나타나면 긴급 진단 및 치료가 필요합니다. 척추 시술 전에 의사는 항응고제를 투여받는 환자 또는 혈전 예방을 위해 항응고제를 투여받을 환자의 잠재적 이점과 위험을 고려해야 합니다.
5.4 인공 심장 판막 환자
인공 심장 판막 환자에서 ELIQUIS의 안전성과 유효성은 연구되지 않았습니다. 따라서 이러한 환자에게는 ELIQUIS를 사용하지 않는 것이 좋습니다.
5.5 혈역학적으로 불안정한 급성 PE 환자 또는 혈전 용해 또는 폐 색전술이 필요한 환자
혈역학적으로 불안정하거나 혈전 용해 또는 폐 색전술을 받을 수 있는 PE 환자의 초기 치료를 위해 헤파린을 대체하여 ELIQUIS를 시작하는 것은 권장되지 않습니다.
5.6 삼중 양성 항인지질 증후군 환자의 혈전증 위험 증가
ELIQUIS를 포함한 직접 작용 경구 항응고제(DOAC)는 삼중 양성 항인지질 증후군(APS) 환자에게 사용하지 않는 것이 좋습니다. APS 환자(특히 삼중 양성[루푸스 항응고제, 항카르디올리핀 및 항베타 2-당단백질 I 항체 양성])의 경우 DOAC 치료는 비타민 K 길항제 치료에 비해 재발성 혈전성 사건 발생률이 증가하는 것과 관련이 있습니다.
6. 이상반응
다음 임상적으로 중요한 유해 반응은 처방 정보의 다른 섹션에서 자세히 설명됩니다.
- •
- 조기 중단 후 혈전 색전증 위험 증가 [경고 및 주의 사항 (5.1) 참조]
- •
- 출혈 [경고 및 주의 사항 (5.2) 참조]
- •
- 척추/경막 외 마취 또는 천자 [경고 및 주의 사항 (5.3) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
판막성이 아닌 심방 세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
ELIQUIS의 안전성은 ARISTOTLE 및 AVERROES 연구 [임상 연구 (14) 참조]에서 평가되었으며, 여기에는 ELIQUIS 5mg을 1일 2회 투여한 환자 11,284명과 ELIQUIS 2.5mg을 1일 2회 투여한 환자 602명이 포함되었습니다. ELIQUIS 노출 기간은 두 연구에서 9375명의 환자에서 ≥12개월, 3369명의 환자에서 ≥24개월이었습니다. ARISTOTLE에서 노출 기간의 평균은 89주(>15,000 환자-년)였습니다. AVERROES에서 노출 기간의 평균은 약 59주(>3000 환자-년)였습니다.
두 연구 모두에서 치료 중단의 가장 흔한 이유는 출혈 관련 유해 반응이었습니다. ARISTOTLE에서는 ELIQUIS와 와파린으로 치료받은 환자의 각각 1.7%와 2.5%에서 발생했고, AVERROES에서는 ELIQUIS와 아스피린으로 치료받은 환자의 각각 1.5%와 1.3%에서 발생했습니다.
ARISTOTLE 및 AVERROES에서 판막성이 아닌 심방 세동 환자의 출혈
표 1과 2는 ARISTOTLE 및 AVERROES에서 치료 기간 동안 주요 출혈을 경험한 환자 수와 출혈 발생률(100 환자-년당 최소한 한 번의 출혈 사건이 있는 피험자의 비율)을 보여줍니다.
| ELIQUIS N=9088 n (100 환자-년당) |
와파린 N=9052 n (100 환자-년당) |
위험 비율 (95% CI) |
P-값 | |
|---|---|---|---|---|
|
주요† |
327 (2.13) |
462 (3.09) |
0.69 (0.60, 0.80) |
<0.0001 |
|
두개 내 (ICH)‡ |
52 (0.33) |
125 (0.82) |
0.41 (0.30, 0.57) |
– |
|
뇌출혈§ |
38 (0.24) |
74 (0.49) |
0.51 (0.34, 0.75) |
– |
|
기타 ICH |
15 (0.10) |
51 (0.34) |
0.29 (0.16, 0.51) |
– |
|
위장관 (GI)¶ |
128 (0.83) |
141 (0.93) |
0.89 (0.70, 1.14) |
– |
|
치명적** |
10 (0.06) |
37 (0.24) |
0.27 (0.13, 0.53) |
– |
|
두개 내 |
4 (0.03) |
30 (0.20) |
0.13 (0.05, 0.37) |
– |
|
두개 내가 아닌 |
6 (0.04) |
7 (0.05) |
0.84 (0.28, 2.15) |
– |
- * 각 하위 범주 내의 출혈 사건은 대상자별로 한 번만 계산되었지만, 대상자는 여러 종료점에 사건을 기여했을 수 있습니다. 출혈 사건은 치료 기간 또는 연구 치료 중단 후 2일 이내(치료 기간)에 계산되었습니다.
† 임상적으로 명백한 출혈과 다음 중 하나 이상이 동반된 경우로 정의됩니다. 헤모글로빈 감소 ≥2 g/dL, 적혈구 농축액 2단위 이상 수혈, 중요 부위 출혈: 두개내, 척수내, 안구내, 심막, 관절내, 근육내(구획 증후군 동반), 복막 후 또는 사망 결과.
‡ 두개내 출혈에는 뇌내, 뇌실내, 경막하 및 지주막하 출혈이 포함됩니다. 모든 유형의 출혈성 뇌졸중은 심사를 받았으며 두개내 주요 출혈로 계산되었습니다.
§ 14절에 제시된 ITT 분석과 비교하여 안전성 모집단을 기반으로 한 치료 기간 분석.
¶ GI 출혈에는 상부 GI, 하부 GI 및 직장 출혈이 포함됩니다.
** 치명적인 출혈은 치료 기간 동안 두개내 출혈 또는 두개내가 아닌 출혈이 사망의 주요 원인인 것으로 심사된 사망입니다.
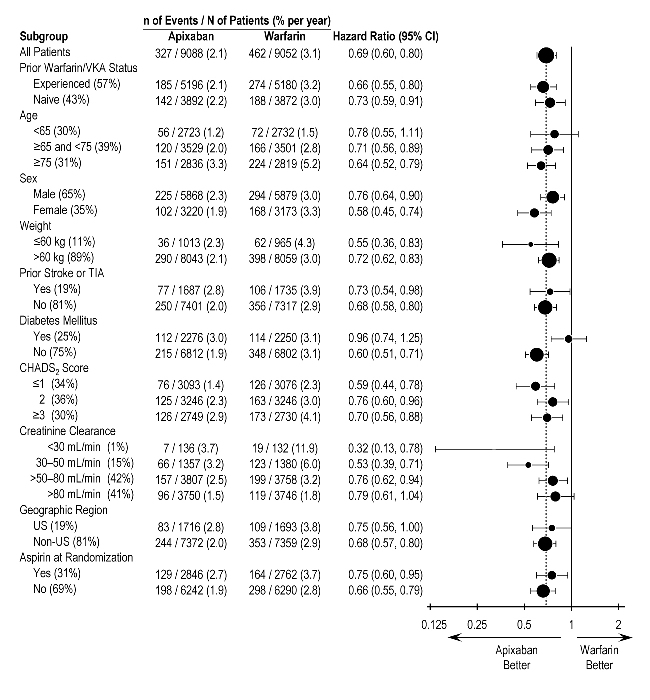
ARISTOTLE에서 주요 출혈 결과는 나이, 체중, CHADS2 점수(뇌졸중 위험을 추정하는 데 사용되는 0~6의 척도, 점수가 높을수록 위험이 더 크다는 것을 예측), 이전 와파린 사용, 지리적 지역 및 무작위 배정 시 아스피린 사용을 포함한 대부분의 주요 하위 그룹에서 일반적으로 일관되었습니다(그림 1). 당뇨병이 있는 ELIQUIS로 치료받은 대상자는 당뇨병이 없는 대상자(연간 1.9%)보다 더 많이 출혈했습니다(연간 3%).
그림 1: 기준 특성별 주요 출혈 위험 비율 – ARISTOTLE 연구
참고: 위 그림은 다양한 하위 그룹에서 효과를 보여주며, 이러한 하위 그룹은 모두 기준 특성이며, 그룹화가 아니더라도 모두 사전에 지정되었습니다. 표시된 95% 신뢰 구간은 몇 개의 비교가 이루어졌는지 고려하지 않으며, 다른 모든 요인에 대한 조정 후 특정 요인의 효과를 반영하지 않습니다. 그룹 간 명백한 동질성 또는 이질성은 과도하게 해석해서는 안 됩니다.
| ELIQUIS N=2798 n (%/year) |
아스피린 N=2780 n (%/year) |
위험 비율 (95% CI) |
P-값 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 각 종료점과 관련된 사건은 대상자별로 한 번만 계산되었지만, 대상자는 여러 종료점에 사건을 기여했을 수 있습니다. | |||||||||
|
주요 |
45 (1.41) |
29 (0.92) |
1.54 (0.96, 2.45) |
0.07 |
|||||
|
치명적 |
5 (0.16) |
5 (0.16) |
0.99 (0.23, 4.29) |
– |
|||||
|
두개내 |
11 (0.34) |
11 (0.35) |
0.99 (0.39, 2.51) |
– |
|||||
고관절 또는 무릎 교체 수술 후 심부 정맥 혈전증 예방
ELIQUIS의 안전성은 ELIQUIS 2.5mg을 1일 2회 투여받은 5924명의 환자를 대상으로 한 1상 II상 및 3상 III상 연구에서 평가되었으며, 이 환자들은 최대 38일 동안 하지의 주요 정형외과 수술 (선택적 고관절 교체 또는 선택적 무릎 교체)을 받았습니다.
총 ELIQUIS 2.5mg을 1일 2회 투여받은 환자의 11%에서 이상 반응이 발생했습니다.
3상 연구에서 치료 기간 동안의 출혈 결과는 표 3에 나와 있습니다. 출혈은 이중맹검 연구 약물의 첫 번째 투여량부터 각 연구에서 평가되었습니다.
| 출혈 종말점* | ADVANCE-3 고관절 교체 수술 |
ADVANCE-2 무릎 교체 수술 |
ADVANCE-1 무릎 교체 수술 |
|||
|---|---|---|---|---|---|---|
| * 모든 출혈 기준에는 수술 부위 출혈이 포함되었습니다. † ELIQUIS의 첫 번째 투여량 (수술 후 12~24시간 투여) 전에 발생한 주요 출혈 사건이 있는 13명의 피험자를 포함합니다. ‡ ELIQUIS의 첫 번째 투여량 (수술 후 12~24시간 투여) 전에 발생한 주요 출혈 사건이 있는 5명의 피험자를 포함합니다. § 두개 내, 척수 내, 안구 내, 심낭, 재수술 또는 개입이 필요한 수술된 관절, 구획 증후군이 있는 근육 내 또는 복막 후. 재수술 또는 개입이 필요한 수술된 관절로의 출혈은 이 범주의 출혈이 있는 모든 환자에게 나타났습니다. 사건 및 사건 발생률에는 ADVANCE-1에서 에녹사파린을 투여받은 환자 1명이 포함되며, 이 환자는 두개 내 출혈도 있었습니다. ¶ CRNM = 임상적으로 관련된 비주요. |
||||||
|
ELIQUIS |
에녹사파린 |
ELIQUIS |
에녹사파린 |
ELIQUIS |
에녹사파린 |
|
|
첫 번째 투여량 |
첫 번째 투여량 |
첫 번째 투여량 |
첫 번째 투여량 |
첫 번째 투여량 |
첫 번째 투여량 |
|
|
모두 치료 |
N=2673 |
N=2659 |
N=1501 |
N=1508 |
N=1596 |
N=1588 |
|
주요 (수술 부위 포함) |
22 (0.82%)† |
18 (0.68%) |
9 (0.60%)‡ |
14 (0.93%) |
11 (0.69%) |
22 (1.39%) |
|
치명적 |
0 |
0 |
0 |
0 |
0 |
1 (0.06%) |
Hgb 감소 ≥2 g/dL
13 (0.49%)
10 (0.38%)
8 (0.53%)
9 (0.60%)
10 (0.63%)
16 (1.01%)
RBC 2단위 이상 수혈
16 (0.60%)
14 (0.53%)
5 (0.33%)
9 (0.60%)
9 (0.56%)
18 (1.13%)
중요 부위 출혈§
1 (0.04%)
1 (0.04%)
1 (0.07%)
2 (0.13%)
1 (0.06%)
4 (0.25%)
중증
+ CRNM¶
129 (4.83%)
134 (5.04%)
53 (3.53%)
72 (4.77%)
46 (2.88%)
68 (4.28%)
전체
313 (11.71%)
334 (12.56%)
104 (6.93%)
126 (8.36%)
85 (5.33%)
108 (6.80%)
1단계 2상 연구와 3단계 3상 연구에서 고관절 또는 슬관절 치환 수술을 받은 환자의 ≥1%에서 발생한 부작용은 표 4에 나와 있습니다.
| ELIQUIS, n (%) 2.5 mg po bid N=5924 |
Enoxaparin, n (%) 40 mg sc qd or 30 mg sc q12h N=5904 |
|
|---|---|---|
|
메스꺼움 |
153 (2.6) |
159 (2.7) |
|
빈혈(수술 후 및 출혈성 빈혈, 및 관련 실험실 매개변수 포함) |
153 (2.6) |
178 (3.0) |
|
타박상 |
83 (1.4) |
115 (1.9) |
|
출혈(혈종, 질 및 요도 출혈 포함) |
67 (1.1) |
81 (1.4) |
|
시술 후 출혈(시술 후 혈종, 상처 출혈, 혈관 천자 부위 혈종, 카테터 부위 출혈 포함) |
54 (0.9) |
60 (1.0) |
|
트랜스아미나제 증가(알라닌 아미노트랜스퍼라제 증가 및 알라닌 아미노트랜스퍼라제 이상 포함) |
50 (0.8) |
71 (1.2) |
|
아스파르트산 아미노트랜스퍼라제 증가 |
47 (0.8) |
69 (1.2) |
|
감마-글루타밀트랜스퍼라제 증가 |
38 (0.6) |
65 (1.1) |
고관절 또는 슬관절 치환 수술을 받은 ELIQUIS 치료 환자에서 발생 빈도가 ≥0.1%에서 <1%인 덜 흔한 유해 반응:
혈액 및 림프계 장애: 혈소판 감소증(혈소판 수 감소 포함)
혈관 장애: 저혈압(시술 관련 저혈압 포함)
호흡기, 흉곽 및 종격 장애: 코피
위장 장애: 위장 출혈(토혈 및 흑변 포함), 혈변
간담도계 장애: 간 기능 검사 이상, 혈액 알칼리성 인산 가수분해효소 증가, 혈액 빌리루빈 증가
신장 및 요로 장애: 혈뇨(해당 실험실 매개변수 포함)
손상, 중독 및 시술 합병증: 상처 분비물, 절개 부위 출혈(절개 부위 혈종 포함), 수술 중 출혈
고관절 또는 슬관절 치환 수술을 받은 ELIQUIS 치료 환자에서 발생 빈도가 <0.1%인 덜 흔한 유해 반응:
치은 출혈, 객혈, 과민 반응, 근육 출혈, 안구 출혈(결막 출혈 포함), 직장 출혈
심부 정맥 혈전증 및 폐색전증 치료 및 심부 정맥 혈전증 또는 폐색전증 재발 위험 감소
ELIQUIS의 안전성은 AMPLIFY 및 AMPLIFY-EXT 연구에서 평가되었으며, 여기에는 ELIQUIS 10mg을 1일 2회 투여한 환자 2676명, ELIQUIS 5mg을 1일 2회 투여한 환자 3359명, ELIQUIS 2.5mg을 1일 2회 투여한 환자 840명이 포함되었습니다.
흔한 유해 반응(≥1%)은 치은 출혈, 코피, 타박상, 혈뇨, 직장 출혈, 혈종, 월경 과다, 객혈이었습니다.
AMPLIFY 연구
AMPLIFY 연구에서 ELIQUIS에 대한 평균 노출 기간은 154일이었고, 에녹사파린/와파린에 대한 평균 노출 기간은 152일이었습니다. 출혈과 관련된 유해 반응은 ELIQUIS 치료 환자 417명(15.6%)에서 발생한 반면, 에녹사파린/와파린 치료 환자에서는 661명(24.6%)에서 발생했습니다. AMPLIFY 연구에서 출혈 사건으로 인한 중단율은 ELIQUIS 치료 환자에서 0.7%였고, 에녹사파린/와파린 치료 환자에서는 1.7%였습니다.
AMPLIFY 연구에서 ELIQUIS는 주요 출혈의 1차 안전성 종말점에서 에녹사파린/와파린보다 통계적으로 우수했습니다(상대 위험 0.31, 95% CI [0.17, 0.55], P 값 <0.0001).
AMPLIFY 연구의 출혈 결과는 표 5에 요약되어 있습니다.
| ELIQUIS N=2676 n (%) |
에녹사파린/와파린 N=2689 n (%) |
상대 위험 (95% CI) | |
|---|---|---|---|
| * CRNM = 임상적으로 관련된 비주요 출혈. 각 종말점과 관련된 사건은 대상자별로 한 번만 계산되었지만, 대상자는 여러 종말점에 사건을 기여했을 수 있습니다. |
|||
|
주요 |
15 (0.6) |
49 (1.8) |
0.31 (0.17, 0.55) |
|
CRNM* |
103 (3.9) |
215 (8.0) |
|
|
주요 + CRNM |
115 (4.3) |
261 (9.7) |
|
|
경미 |
313 (11.7) |
505 (18.8) |
|
|
모두 |
402 (15.0) |
676 (25.1) |
|
AMPLIFY 연구에서 환자의 1% 이상에서 발생한 부작용은 표 6에 나열되어 있습니다.
| ELIQUIS N=2676 n (%) |
Enoxaparin/Warfarin N=2689 n (%) |
|
|---|---|---|
|
비강 출혈 |
77 (2.9) |
146 (5.4) |
|
타박상 |
49 (1.8) |
97 (3.6) |
|
혈뇨 |
46 (1.7) |
102 (3.8) |
|
월경과다 |
38 (1.4) |
30 (1.1) |
|
혈종 |
35 (1.3) |
76 (2.8) |
|
기흉 |
32 (1.2) |
31 (1.2) |
|
직장 출혈 |
26 (1.0) |
39 (1.5) |
|
잇몸 출혈 |
26 (1.0) |
50 (1.9) |
AMPLIFY-EXT 연구
AMPLIFY-EXT 연구에서 ELIQUIS에 노출된 기간은 약 330일이었으며, 플라시보에 노출된 기간은 312일이었습니다. 출혈과 관련된 부작용은 ELIQUIS를 투여받은 환자 중 219명(13.3%)에서 발생하였으며, 플라시보를 투여받은 환자 중 72명(8.7%)에서 발생하였습니다. 출혈 사건으로 인한 중단율은 AMPLIFY-EXT 연구에서 ELIQUIS를 투여받은 환자에서 약 1%이며, 플라시보 그룹의 환자에서는 0.4%였습니다.
AMPLIFY-EXT 연구에서의 출혈 결과는 표 7에 요약되어 있습니다.
| ELIQUIS 2.5 mg bid N=840 n (%) |
ELIQUIS 5 mg bid N=811 n (%) |
Placebo N=826 n (%) |
|
|---|---|---|---|
| * CRNM = clinically relevant nonmajor bleeding. Events associated with each endpoint were counted once per subject, but subjects may have contributed events to multiple endpoints. |
|||
|
중대한 출혈 |
2 (0.2) |
1 (0.1) |
4 (0.5) |
|
CRNM* |
25 (3.0) |
34 (4.2) |
19 (2.3) |
|
중대한 + CRNM |
27 (3.2) |
35 (4.3) |
22 (2.7) |
|
경미한 |
75 (8.9) |
98 (12.1) |
58 (7.0) |
|
전체 |
94 (11.2) |
121 (14.9) |
74 (9.0) |
AMPLIFY-EXT 연구에서 환자의 ≥1%에서 발생한 이상 반응은 표 8에 나와 있습니다.
| ELIQUIS 2.5 mg 1일 2회 N=840 n (%) |
ELIQUIS 5 mg 1일 2회 N=811 n (%) |
위약 N=826 n (%) |
|
|---|---|---|---|
|
코피 |
13 (1.5) |
29 (3.6) |
9 (1.1) |
|
혈뇨 |
12 (1.4) |
17 (2.1) |
9 (1.1) |
|
혈종 |
13 (1.5) |
16 (2.0) |
10 (1.2) |
|
타박상 |
18 (2.1) |
18 (2.2) |
18 (2.2) |
|
잇몸 출혈 |
12 (1.4) |
9 (1.1) |
3 (0.4) |
기타 이상 반응
AMPLIFY 또는 AMPLIFY-EXT 연구에서 ELIQUIS 치료를 받은 환자에서 0.1% 이상 ~ 1% 미만의 빈도로 발생한 덜 흔한 이상 반응:
혈액 및 림프계 장애: 출혈성 빈혈
위장 장애: 혈변, 치핵 출혈, 위장관 출혈, 토혈, 흑색변, 항문 출혈
손상, 중독 및 시술 합병증: 상처 출혈, 시술 후 출혈, 외상성 혈종, 안와 주위 혈종
근골격계 및 결합 조직 장애: 근육 출혈
생식 기관 및 유방 장애: 질 출혈, 자궁 출혈, 자궁 내막 출혈, 생식기 출혈
혈관 장애: 출혈
피부 및 피하 조직 장애: 멍, 피부 출혈, 자반
안과 질환: 결막 출혈, 망막 출혈, 눈 출혈
검사: 혈뇨 양성, 잠혈 양성, 잠혈, 요중 적혈구 양성
일반적인 장애 및 투여 부위 상태: 주사 부위 혈종, 혈관 천자 부위 혈종
7. 약물 상호 작용
아픽사반은 CYP3A4 및 P-gp의 기질입니다. CYP3A4 및 P-gp 억제제는 아픽사반에 대한 노출을 증가시키고 출혈 위험을 증가시킵니다. CYP3A4 및 P-gp 유도제는 아픽사반에 대한 노출을 감소시키고 뇌졸중 및 기타 혈전색전증 위험을 증가시킵니다.
7.1 P-gp 및 강력한 CYP3A4 억제제 병용
ELIQUIS 5mg 또는 10mg을 1일 2회 투여받는 환자의 경우, P-gp 및 강력한 CYP3A4 억제제(예: 케토코나졸, 이트라코나졸, 리토나비르)와 병용 투여할 때 ELIQUIS 용량을 50% 감소시켜야 합니다. [용법 및 용량 (2.5) 및 임상 약리 (12.3) 참조].
ELIQUIS를 1일 2회 2.5mg 용량으로 투여받는 환자의 경우, P-gp 및 강력한 CYP3A4 억제제와 병용 투여하지 마십시오. [용법 및 용량 (2.5) 및 임상 약리 (12.3) 참조].
클라리스로마이신
클라리스로마이신은 P-gp 및 강력한 CYP3A4 억제제이지만, 약동학적 데이터에 따르면 ELIQUIS와 병용 투여 시 용량 조절이 필요하지 않습니다. [임상 약리 (12.3) 참조].
7.2 P-gp 및 강력한 CYP3A4 유도제 병용
ELIQUIS를 P-gp 및 강력한 CYP3A4 유도제(예: 리팜핀, 카르바마제핀, 페니토인, 세인트 존스 워트)와 병용 투여하지 마십시오. 이러한 약물은 아픽사반에 대한 노출을 감소시키기 때문입니다. [임상 약리 (12.3) 참조].
7.3 항응고제 및 항혈소판제
항혈소판제, 섬유소 용해제, 헤파린, 아스피린 및 만성 NSAID 사용과의 병용 투여는 출혈 위험을 증가시킵니다.
아스피린 또는 아스피린과 클로피도그렐 병용 요법을 받는 고위험, 급성 관상 동맥 증후군 환자를 대상으로 한 ELIQUIS의 위약 대조 임상 시험인 APPRAISE-2는 ELIQUIS에서 위약에 비해 출혈 발생률이 높아 조기에 종료되었습니다. ISTH 주요 출혈 발생률은 단일 항혈소판 요법을 받는 환자의 경우 ELIQUIS에서 연간 2.8%, 위약에서 연간 0.6%였으며, 이중 항혈소판 요법을 받는 환자의 경우 ELIQUIS에서 연간 5.9%, 위약에서 연간 2.5%였습니다.
ARISTOTLE에서 아스피린 병용 투여는 ELIQUIS에서 출혈 위험을 연간 1.8%에서 3.4%로 증가시켰으며, 아스피린과 와파린 병용 투여는 출혈 위험을 연간 2.7%에서 4.6%로 증가시켰습니다. 이 임상 시험에서 ELIQUIS와의 이중 항혈소판 요법 사용은 제한적(2.3%)이었습니다.
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
ELIQUIS를 임산부에게 사용한 제한적인 데이터는 주요 선천적 기형, 유산 또는 발달상의 부작용과 관련된 약물 위험을 알리기에 충분하지 않습니다. 치료는 임신 및 분만 중 출혈 위험을 증가시킬 수 있습니다. 동물 생식 연구에서, 아픽사반을 기관 형성 기간 동안 랫드(경구), 토끼(정맥 주사) 및 마우스(경구)에 최대 권장 인간 용량(MRHD)의 5mg을 1일 2회 투여했을 때, 혈장 농도-시간 곡선 아래 면적(AUC)을 기준으로 한 인간 노출의 각각 4배, 1배 및 19배에 해당하는 결합되지 않은 아픽사반 노출 수준에서 발달상의 부작용이 관찰되지 않았습니다.
지정된 모집단에 대한 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
임상적 고려 사항
질병 관련 모체 및/또는 배아/태아 위험
임신은 혈전색전증 위험을 증가시키며, 이는 기저 혈전색전증 질환이 있는 여성과 특정 고위험 임신 상태에서 더 높습니다. 발표된 데이터에 따르면 정맥 혈전증의 과거력이 있는 여성은 임신 중 재발 위험이 높습니다.
태아/신생아 부작용
ELIQUIS를 포함한 항응고제의 사용은 태아 및 신생아에서 출혈 위험을 증가시킬 수 있습니다.
분만 또는 분만
임산부를 포함하여 항응고제를 투여받는 모든 환자는 출혈 위험이 있습니다. 신경 축 차단 마취를 받는 여성의 분만 또는 분만 중 ELIQUIS 사용은 경막 외 또는 척추 혈종을 초래할 수 있습니다. 분만이 다가오면 단기 작용 항응고제 사용을 고려하십시오. [경고 및 주의 사항(5.3) 참조].
데이터
동물 데이터
아픽사반을 기관 형성 기간 동안 랫드(경구), 토끼(정맥 주사) 및 마우스(경구)에 MRHD에서 인간 노출의 각각 4배, 1배 및 19배에 해당하는 결합되지 않은 아픽사반 노출 수준에서 투여했을 때 발달 독성이 관찰되지 않았습니다. 태아 출혈의 증거는 없었지만, 랫드와 토끼에서 배아 노출이 확인되었습니다. 임신 6일부터 수유 21일까지 랫드 어미에게 MRHD에서 인간 노출의 1.4배에서 5배에 해당하는 모체 결합되지 않은 아픽사반 노출 수준으로 경구 투여했을 때, 모체 사망률 감소 또는 배아/신생아 생존율 감소와 관련이 없었지만, 모든 용량에서 어미에서 질 주위 출혈 발생률이 증가했습니다. 신생아 출혈의 증거는 없었습니다.
8.2 수유
위험 요약
모유에서 아픽사반 또는 그 대사산물의 존재, 모유 수유 아동에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 아픽사반 및/또는 그 대사산물은 랫드의 모유에 존재했습니다(데이터 참조). 모유를 통한 인간 노출이 알려져 있지 않으므로 ELIQUIS 치료 중에는 모유 수유를 권장하지 않습니다.
데이터
동물 데이터
수유 랫드에 5mg을 단일 경구 투여한 후 30분 만에 최대 혈장 농도가 관찰되었습니다. 최대 모유 농도는 투여 후 6시간에 관찰되었습니다. 모유 대 혈장 AUC(0-24) 비율은 30:1로, 아픽사반이 모유에 축적될 수 있음을 나타냅니다. 동물 모유에서 아픽사반의 농도는 인간 모유에서 약물의 농도를 반드시 예측하지 않습니다.
8.3 생식 능력이 있는 여성 및 남성
항응고제가 필요한 생식 능력이 있는 여성은 의사와 임신 계획에 대해 논의해야 합니다.
ELIQUIS를 포함한 경구 항응고제로 확인된 임상적으로 유의미한 자궁 출혈 위험(부인과 수술적 개입이 필요할 수 있음)은 생식 능력이 있는 여성과 비정상적인 자궁 출혈이 있는 여성에서 평가해야 합니다.
8.5 노인 사용
ARISTOTLE 및 AVERROES 임상 연구에 참여한 총 대상자 중 69% 이상이 65세 이상이었고 31% 이상이 75세 이상이었습니다. ADVANCE-1, ADVANCE-2 및 ADVANCE-3 임상 연구에서 대상자의 50%가 65세 이상이었고 16%가 75세 이상이었습니다. AMPLIFY 및 AMPLIFY-EXT 임상 연구에서 대상자의 32% 이상이 65세 이상이었고 13% 이상이 75세 이상이었습니다. 다른 연령대의 대상자를 비교했을 때 안전성 또는 유효성에 임상적으로 유의미한 차이가 관찰되지 않았습니다.
8.6 신장애
비판막성 심방 세동 환자에서 뇌졸중 및 전신 색전증 위험 감소
다음 특징 중 두 가지 이상이 있는 환자의 경우 권장 용량은 1일 2회 2.5mg입니다. [용법 및 용량(2.1) 참조]:
- •
- 80세 이상
- •
- 체중 60kg 이하
- •
- 혈청 크레아티닌 1.5mg/dL 이상
말기 신장 질환 환자의 투석
ELIQUIS의 임상 효능 및 안전성 연구에는 투석을 받는 말기 신장 질환(ESRD) 환자는 포함되지 않았습니다. 간헐적 혈액 투석을 받는 ESRD 환자의 경우, 일반적으로 권장되는 용량으로 ELIQUIS를 투여하면 [용법 및 용량 (2.1) 참조] ARISTOTLE 연구에서 관찰된 것과 유사한 아픽사반 농도와 약력학적 활성이 나타납니다. [임상 약리학 (12.3) 참조] 투석을 받는 ESRD 환자에서 이러한 농도가 ARISTOTLE에서 관찰된 것과 유사한 뇌졸중 감소 및 출혈 위험으로 이어질지는 알 수 없습니다.
고관절 또는 무릎 관절 치환 수술 후 심부 정맥 혈전증 예방 및 DVT 및 PE 치료 및 DVT 및 PE 재발 위험 감소
투석을 받는 ESRD 환자를 포함하여 신장애 환자의 경우 용량 조절이 권장되지 않습니다. [용법 및 용량 (2.1) 참조] ELIQUIS의 임상 효능 및 안전성 연구에는 투석을 받는 ESRD 환자 또는 CrCl <15 mL/min 환자는 포함되지 않았습니다. 따라서 투약 권장 사항은 투석을 받는 ESRD 환자의 약동학 및 약력학(항-FXa 활성) 데이터를 기반으로 합니다. [임상 약리학 (12.3) 참조]
8.7 간 기능 장애
경증 간 기능 장애(Child-Pugh 등급 A) 환자의 경우 용량 조절이 필요하지 않습니다.
중등도 간 기능 장애(Child-Pugh 등급 B) 환자는 내재적인 응고 이상이 있을 수 있으며, 이러한 환자에 대한 ELIQUIS의 임상 경험이 제한적이므로 투약 권장 사항을 제공할 수 없습니다. [임상 약리학 (12.2) 참조]
ELIQUIS는 중증 간 기능 장애(Child-Pugh 등급 C) 환자에게 권장되지 않습니다. [임상 약리학 (12.2) 참조]
10 과량 복용
ELIQUIS 과량 복용은 출혈 위험을 증가시킵니다 [경고 및 주의 사항 (5.2) 참조].
대조군 임상 시험에서 건강한 피험자에게 3일에서 7일 동안 최대 50mg을 경구 투여(7일 동안 25mg 2회 또는 3일 동안 50mg 1회)한 결과 임상적으로 관련된 유해 반응은 나타나지 않았습니다.
건강한 피험자에서 아픽사반 20mg을 복용한 후 2시간과 6시간 후에 활성탄을 투여한 결과 아픽사반 AUC 평균이 각각 50%와 27% 감소했습니다. 따라서 활성탄 투여는 ELIQUIS 과량 복용 또는 우발적 섭취 관리에 유용할 수 있습니다. 아픽사반의 항-Xa 활성을 역전시키는 약제가 있습니다.
11. 성분
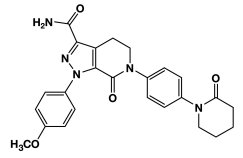
ELIQUIS (아픽사반), 인자 Xa (FXa) 억제제로, 화학적으로는 1-(4-메톡시페닐)-7-옥소-6-[4-(2-옥소피페리딘-1-일)페닐]-4,5,6,7-테트라하이드로-1H-피라졸로[3,4-c]피리딘-3-카르복사미드로 설명됩니다. 분자식은 C25H25N5O4이며, 분자량은 459.5에 해당합니다. 아픽사반의 구조식은 다음과 같습니다:
아픽사반은 흰색에서 연한 노란색의 분말입니다. 생리학적 pH(1.2-6.8)에서 아픽사반은 이온화되지 않으며, 생리학적 pH 범위에서의 수용성은 약 0.04 mg/mL입니다.
ELIQUIS 정제는 아픽사반 2.5 mg와 5 mg를 함유하고 있으며, 다음의 비활성 성분을 포함합니다: 무수 락토오스, 미세결정셀룰로오스, 크로스카르멜로오드륨, 소듐라우릴설페이트, 마그네슘 스테아레이트. 필름 코팅은 단수수화락토오스, 하이프로멜로오스, 이산화티타늄, 트리아세틴, 황색 산화철(2.5 mg 정제) 또는 적색 산화철(5 mg 정제)을 포함합니다.
12. 임상 약리학
12.1 작용 기전
아픽사반은 FXa의 선택적 억제제입니다. 아픽사반은 항혈전 활성에 항트롬빈 III를 필요로 하지 않습니다. 아픽사반은 유리 및 응고된 FXa와 프로트롬빈 활성을 억제합니다. 아픽사반은 혈소판 응집에 직접적인 영향을 미치지 않지만 트롬빈에 의해 유도된 혈소판 응집을 간접적으로 억제합니다. FXa를 억제함으로써 아픽사반은 트롬빈 생성과 혈전 형성을 감소시킵니다.
12.2 약력학
FXa 억제의 결과로 아픽사반은 프로트롬빈 시간(PT), INR 및 활성화 부분 트롬보플라스틴 시간(aPTT)과 같은 응고 검사를 연장시킵니다. 그러나 예상되는 치료 용량에서 이러한 응고 검사에서 관찰된 변화는 작고, 변동성이 크며, 아픽사반의 항응고 효과를 모니터링하는 데 유용하지 않습니다.
Rotachrom® 헤파린 크로모제닉 분석은 아픽사반 개발 프로그램 중에 인간에서 아픽사반의 FXa 활성에 대한 효과를 측정하는 데 사용되었습니다. 테스트된 용량 범위에서 항-FXa 활성의 농도 의존적 증가가 관찰되었으며, 건강한 피험자와 AF 환자에서 유사했습니다.
이 검사는 아픽사반의 항응고 효과를 평가하는 데 권장되지 않습니다.
ELIQUIS에 대한 PCC의 약력학적 효과
ELIQUIS를 투여받은 개인에서 4-요소 PCC 제품을 사용하여 출혈을 역전시키는 데 대한 임상 경험은 없습니다.
건강한 피험자에서 아픽사반의 약력학에 대한 4-요소 PCC의 효과를 연구했습니다. 아픽사반을 안정 상태로 투여한 후, 내인성 트롬빈 잠재력(ETP)은 30분 PCC 주입을 시작한 후 4시간 만에 아픽사반 투여 전 수준으로 돌아왔으며, 위약군에서는 45시간 만에 돌아왔습니다. 평균 ETP 수준은 계속 증가하여 아픽사반 투여 전 수준을 초과하여 PCC를 시작한 후 21시간에 최대(아픽사반 투여 전 수준보다 34%-51% 증가)에 도달했으며, 연구 종료 시(PCC를 시작한 후 69시간)까지 상승된 상태(21%-27% 증가)를 유지했습니다. 이러한 ETP 증가의 임상적 관련성은 알려져 있지 않습니다.
약력학적 약물 상호 작용 연구
아스피린, 클로피도그렐, 아스피린 및 클로피도그렐, 프라수그렐, 에녹사파린 및 나프록센과의 약력학적 약물 상호 작용 연구가 수행되었습니다. 아스피린, 클로피도그렐 또는 프라수그렐과의 약력학적 상호 작용은 관찰되지 않았습니다 [경고 및 주의 사항(5.2) 참조]. ELIQUIS를 에녹사파린 또는 나프록센과 함께 투여했을 때 항-FXa 활성이 50%에서 60% 증가했습니다.
12.3 약동학
아픽사반은 최대 10mg의 경구 용량에 대해 노출이 용량에 비례하여 증가하는 선형 약동학을 보입니다.
흡수
아픽사반의 절대 생체 이용률은 ELIQUIS 최대 10mg의 용량에 대해 약 50%입니다. 음식은 아픽사반의 생체 이용률에 영향을 미치지 않습니다. 아픽사반의 최대 농도(Cmax)는 ELIQUIS를 경구 투여한 후 3~4시간에 나타납니다. 용량이 25mg 이상인 경우 아픽사반은 생체 이용률이 감소된 용해 제한 흡수를 보입니다. 2개의 분쇄된 5mg 정제를 30mL의 물에 현탁시켜 10mg의 아픽사반을 경구 투여한 후, 노출은 2개의 온전한 5mg 정제를 경구 투여한 후와 유사했습니다. 2개의 분쇄된 5mg 정제를 30g의 애플소스와 혼합하여 10mg의 아픽사반을 경구 투여한 후, Cmax와 AUC는 2개의 온전한 5mg 정제를 투여했을 때와 비교하여 각각 20%와 16% 낮았습니다. 60mL D5W에 현탁시킨 분쇄된 5mg ELIQUIS 정제를 비강관을 통해 투여한 후, 노출은 건강한 자원봉사자에게 단일 경구 5mg 정제 용량을 투여한 다른 임상 시험에서 관찰된 노출과 유사했습니다.
대사
경구 투여된 아픽사반 용량의 약 25%가 소변과 대변에서 대사체로 회수됩니다. 아픽사반은 CYP3A4를 통해 주로 대사되며 CYP1A2, 2C8, 2C9, 2C19 및 2J2가 약간 기여합니다. 3-옥소피페리디닐 모이어티에서의 O-탈메틸화 및 하이드록실화는 생체 변환의 주요 부위입니다.
변경되지 않은 아픽사반은 인간 혈장에서 주요 약물 관련 성분이며, 활성 순환 대사체는 없습니다.
배설
아픽사반은 소변과 대변으로 배설됩니다. 신장 배설은 총 청소율의 약 27%를 차지합니다. 담즙 및 직접 장 배설은 대변으로의 아픽사반 배설에 기여합니다.
아픽사반은 총 청소율이 약 3.3L/시간이고 경구 투여 후 명백한 반감기가 약 12시간입니다.
아픽사반은 수송 단백질의 기질입니다: P-gp 및 유방암 내성 단백질.
약물 상호 작용 연구
in vitro 아픽사반 연구에서 치료적 노출량보다 훨씬 높은 농도에서 CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6, CYP3A4/5 또는 CYP2C19의 활성에 대한 억제 효과 또는 CYP1A2, CYP2B6 또는 CYP3A4/5의 활성에 대한 유도 효과가 관찰되지 않았습니다. 따라서 아픽사반은 이러한 효소에 의해 대사되는 동시 투여 약물의 대사 청소율을 변경하지 않을 것으로 예상됩니다. 아픽사반은 P-gp의 유의미한 억제제가 아닙니다.
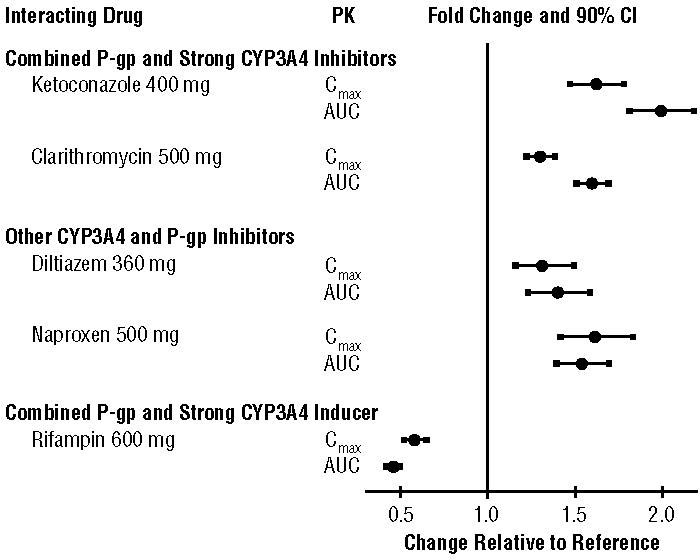
동시 투여 약물이 아픽사반의 약동학에 미치는 영향은 그림 2에 요약되어 있습니다 [경고 및 주의 사항 (5.2) 및 약물 상호 작용 (7) 참조].
그림 2: 동시 투여 약물이 아픽사반의 약동학에 미치는 영향
건강한 피험자를 대상으로 한 전용 연구에서 파모티딘, 아테놀롤, 프라수그렐 및 에녹사파린은 아픽사반의 약동학을 유의미하게 변경하지 않았습니다.
건강한 피험자를 대상으로 한 연구에서 아픽사반은 디곡신, 나프록센, 아테놀롤, 프라수그렐 또는 아세틸살리실산의 약동학을 유의미하게 변경하지 않았습니다.
특정 인구 집단
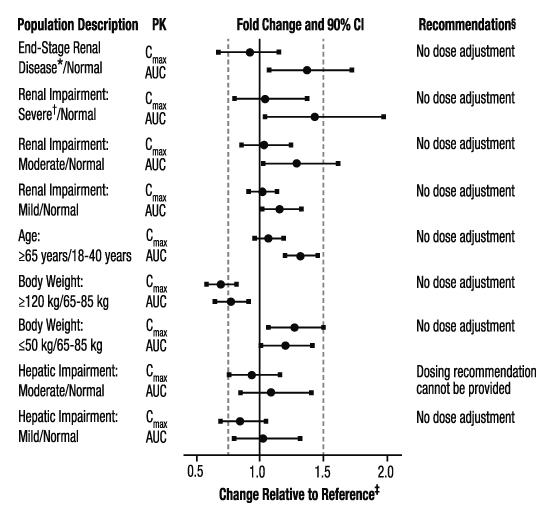
신장 기능 저하 수준, 연령, 체중 및 간 기능 저하 수준이 아픽사반의 약동학에 미치는 영향은 그림 3에 요약되어 있습니다.
그림 3: 특정 인구 집단이 아픽사반의 약동학에 미치는 영향
* 간헐적 혈액 투석으로 치료받는 ESRD 환자; 보고된 PK 결과는 혈액 투석 후 아픽사반 단일 용량 투여 후입니다.
† 결과는 회귀 분석을 기반으로 한 CrCl 15 mL/min을 반영합니다.
‡ 점선 수직선은 투약 권장 사항을 알리는 데 사용된 약동학적 변화를 보여줍니다.
§ 다음 환자 특징 중 2가지 이상이 있는 경우(연령 80세 이상, 체중 60kg 이하 또는 혈청 크레아티닌 1.5mg/dL 이상) 비판막 심방 세동 환자에게는 용량 조절을 권장하지 않습니다.
성별: 건강한 피험자를 대상으로 한 남성과 여성의 약동학을 비교한 연구 결과 유의미한 차이가 나타나지 않았습니다.
인종: 정상 피험자를 대상으로 한 약동학 연구 결과 백인/코카서스인, 아시아인 및 흑인/아프리카계 미국인 피험자 간에 아픽사반 약동학에 차이가 없는 것으로 나타났습니다. 인종/민족에 따라 용량 조절이 필요하지 않습니다.
ESRD 환자의 혈액 투석: 4시간 혈액 투석 세션 완료 직후(투석 후)에 단일 5mg 용량으로 투여된 아픽사반에 대한 전신 노출은 정상 신장 기능을 가진 피험자에 비해 36% 높습니다(그림 3). 4시간 혈액 투석 세션 2시간 전에 투여된 아픽사반에 대한 전신 노출은 투석액 유량이 500mL/min이고 혈액 유량이 350~500mL/min 범위인 경우 정상 신장 기능을 가진 사람에 비해 17% 높습니다. 아픽사반의 투석 청소율은 약 18mL/min입니다. 아픽사반의 전신 노출은 투석 중인 경우 투석하지 않은 경우에 비해 14% 낮습니다.
단백질 결합은 건강한 대조군과 ESRD 환자 간에 투석 중 및 투석하지 않은 기간 동안 유사했습니다(92%-94%).
13. 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성: 아픽사반은 최대 2년 동안 마우스와 랫드에 투여했을 때 발암성이 없었습니다. 최고 투여량(1500 및 3000 mg/kg/day)에서 무결합 아픽사반의 전신 노출(AUC)은 10 mg/day의 MRHD에서 무결합 약물의 인체 노출량의 각각 9배 및 20배였습니다. 최고 투여량(600 mg/kg/day)에서 무결합 아픽사반의 전신 노출은 수컷과 암컷 랫드에서 각각 인체 노출량의 2배와 4배였습니다.
돌연변이 유발성: 아픽사반은 박테리아 역돌연변이(Ames) 검사에서 돌연변이 유발성이 없었고, 중국 햄스터 난소 세포에서 in vitro로, 랫드 말초 혈액 림프구에서 1개월 in vivo/in vitro 세포 유전학 연구에서, 또는 랫드에서 in vivo로 마이크로 뉴클레우스 연구에서 염색체 이상을 유발하지 않았습니다.
생식능력 저해: 아픽사반은 최대 600 mg/kg/day의 투여량으로 수컷 또는 암컷 랫드의 생식능력에 영향을 미치지 않았으며, 이 투여량은 무결합 아픽사반 노출 수준이 인체 노출량의 각각 3배와 4배에 해당합니다.
임플란테이션부터 수유 종료까지 최대 1000 mg/kg/day의 투여량으로 암컷 랫드에 투여된 아픽사반은 최대 1000 mg/kg/day의 투여량에서 수컷 자손(F1 세대)에 부작용을 일으키지 않았으며, 이 투여량은 무결합 아픽사반에 대한 노출이 인체 노출량의 5배에 해당합니다. F1 세대 암컷 자손에서의 부작용은 ≥200 mg/kg/day(무결합 아픽사반에 대한 노출이 인체 노출량의 ≥5배에 해당하는 투여량)에서 교미 및 생식 지수 감소로 제한되었습니다.
14. 임상 연구
14.1 비판막성 심방세동에서 뇌졸중 및 전신 색전증 위험 감소
ARISTOTLE
ELIQUIS의 효능 및 안전성에 대한 증거는 비판막성 심방세동 환자를 대상으로 ELIQUIS와 와파린의 효과를 뇌졸중 및 비중추신경계(CNS) 전신 색전증 위험에 비교한 다국적, 이중맹검 연구인 ARISTOTLE에서 얻어졌습니다. ARISTOTLE에서 환자들은 ELIQUIS 5mg을 1일 2회 경구 투여(또는 80세 이상, 체중 60kg 이하 또는 혈청 크레아티닌 1.5mg/dL 이상인 환자의 경우 1일 2회 2.5mg) 또는 와파린(INR 범위 2.0-3.0으로 목표)으로 무작위 배정되었습니다. 환자들은 뇌졸중에 대한 다음과 같은 추가 위험 요인 중 하나 이상을 가져야 했습니다.
- •
- 이전 뇌졸중 또는 일과성 허혈 발작(TIA)
- •
- 이전 전신 색전증
- •
- 75세 이상
- •
- 치료가 필요한 고혈압
- •
- 당뇨병
- •
- 심장 기능 부전 ≥뉴욕 심장 협회 등급 2
- •
- 좌심실 박출 분율 ≤40%
ARISTOTLE의 주요 목표는 ELIQUIS 5mg을 1일 2회(또는 2.5mg을 1일 2회) 투여하는 것이 뇌졸중(허혈성 또는 출혈성) 및 전신 색전증 위험을 줄이는 데 효과적인지(와파린에 비해 비열등성)를 확인하는 것이었습니다. ELIQUIS의 와파린에 대한 우월성은 또한 주요 종말점(뇌졸중 및 전신 색전증 발생률), 주요 출혈 및 모든 원인으로 인한 사망에 대해 조사되었습니다.
총 18,201명의 환자가 무작위 배정되었고 연구 치료를 받으면서 중앙값 89주 동안 추적되었습니다. 환자의 43%는 비타민 K 길항제(VKA) “미경험자”였으며, 이는 연구에 참여하기 전에 와파린 또는 다른 VKA로 30일 연속 치료를 받은 적이 없는 것으로 정의되었습니다. 평균 연령은 69세였고 평균 CHADS2 점수(뇌졸중 위험을 추정하는 데 사용되는 0에서 6까지의 척도, 점수가 높을수록 위험이 더 크다는 것을 의미)는 2.1이었습니다. 인구는 남성 65%, 백인 83%, 아시아인 14%, 흑인 1%였습니다. 환자의 19%는 뇌졸중, TIA 또는 비-CNS 전신 색전증의 병력이 있었습니다. 이 연구에 참여한 환자의 동반 질환에는 고혈압 88%, 당뇨병 25%, 울혈성 심부전(또는 좌심실 박출 분율 ≤40%) 35%, 이전 심근 경색 14%가 포함되었습니다. ARISTOTLE에서 와파린으로 치료받은 환자의 치료 범위 내 시간(INR 2.0-3.0)의 평균 비율은 62%였습니다.
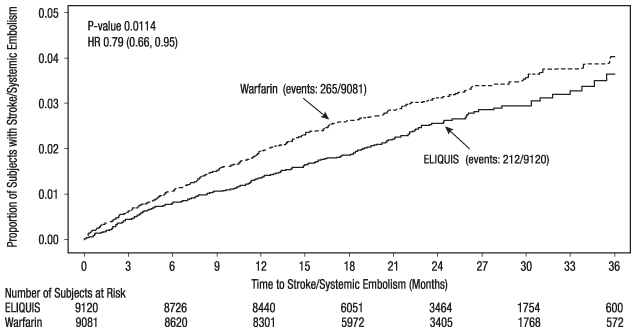
ELIQUIS는 뇌졸중 및 전신 색전증 위험을 줄이는 주요 종말점에서 와파린보다 우수했습니다(표 9 및 그림 4). 와파린에 대한 우월성은 주로 와파린에 비해 출혈성 뇌졸중 및 출혈 변환을 동반한 허혈성 뇌졸중 감소에 기인했습니다. 순수 허혈성 뇌졸중은 두 약물 모두에서 유사한 비율로 발생했습니다.
ELIQUIS는 와파린보다 주요 출혈이 현저히 적었습니다 [부작용(6.1) 참조].
| ELIQUIS N=9120 n (%/년) |
와파린 N=9081 n (%/년) |
위험 비율 (95% CI) |
P-값 | |
|---|---|---|---|---|
| 주요 종말점은 첫 번째 사건(대상자당 하나) 발생 시간을 기반으로 했습니다. 구성 요소 수는 모든 사건이 있는 대상자에 대한 것이며, 반드시 첫 번째 사건에 대한 것은 아닙니다. | ||||
|
뇌졸중 또는 전신 색전증 |
212 (1.27) |
265 (1.60) |
0.79 (0.66, 0.95) |
0.01 |
|
뇌졸중 |
199 (1.19) |
250 (1.51) |
0.79 (0.65, 0.95) |
|
|
출혈 없는 허혈성 |
140 (0.83) |
136 (0.82) |
1.02 (0.81, 1.29) |
|
|
출혈 변환을 동반한 허혈성 |
12 (0.07) |
20 (0.12) |
0.60 (0.29, 1.23) |
|
|
출혈성 |
40 (0.24) |
78 (0.47) |
0.51 (0.35, 0.75) |
|
|
알 수 없음 |
14 (0.08) |
21 (0.13) |
0.65 (0.33, 1.29) |
|
|
전신 색전증 |
15 (0.09) |
17 (0.10) |
0.87 (0.44, 1.75) |
|
그림 4: ARISTOTLE (의도적 치료 집단)에서 첫 번째 뇌졸중 또는 전신 색전증 발생까지의 시간에 대한 Kaplan-Meier 추정
모든 원인 사망은 이전 종점(뇌졸중 + 전신 색전증 및 주요 출혈)에 대한 효과가 입증된 경우 우월성을 검증할 수 있도록 순차적 검증 전략을 사용하여 평가했습니다. ELIQUIS 치료는 와파린 치료보다 모든 원인 사망률이 유의하게 낮았습니다(p = 0.046). 이는 주로 심혈관 사망, 특히 뇌졸중 사망 감소 때문입니다. 비혈관 사망률은 치료군에서 유사했습니다.
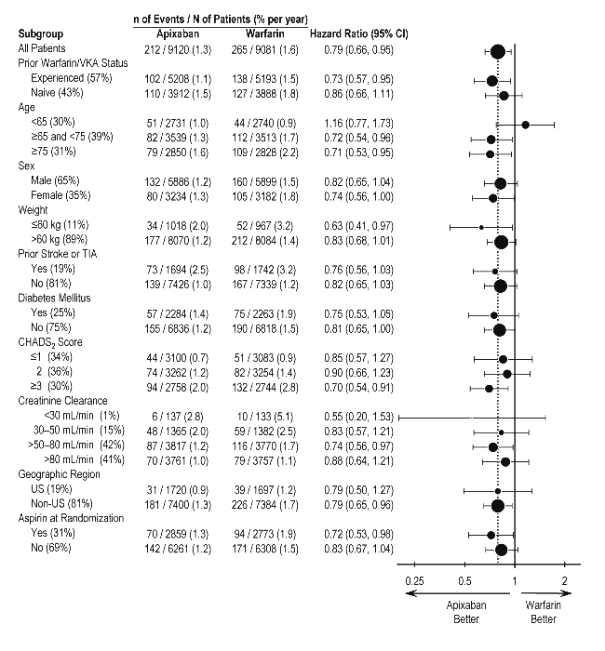
ARISTOTLE에서 일차 유효성 종점에 대한 결과는 체중, CHADS2 점수(AF 환자의 뇌졸중 위험을 예측하는 데 사용되는 0에서 6까지의 척도로, 점수가 높을수록 위험이 커짐), 이전 와파린 사용, 신장 기능 저하 수준, 지리적 지역 및 무작위 배정 시 아스피린 사용을 포함한 대부분의 주요 하위 집단에서 일반적으로 일관되었습니다(그림 5).
그림 5: 기준선 특성별 뇌졸중 및 전신 색전증 위험 비율 – ARISTOTLE 연구
참고: 위 그림은 다양한 하위 집단에서의 효과를 보여줍니다. 이러한 하위 집단은 모두 기준선 특성이며, 그룹화가 아닌 경우 사전에 지정되었습니다. 표시된 95% 신뢰 구간은 얼마나 많은 비교가 이루어졌는지 고려하지 않으며, 다른 모든 요인에 대한 조정 후 특정 요인의 효과를 반영하지 않습니다. 그룹 간 명백한 동질성 또는 이질성은 과도하게 해석해서는 안 됩니다.
ARISTOTLE 연구가 끝날 무렵, 연구를 완료한 와파린 환자는 일반적으로 항응고제 중단 없이 VKA를 유지했습니다. 연구를 완료한 ELIQUIS 환자는 일반적으로 ELIQUIS와 VKA를 2일 동안 병용 투여하여 VKA로 전환했으므로 일부 환자는 ELIQUIS 중단 후 안정적이고 치료적 INR에 도달할 때까지 적절한 항응고제를 받지 못했을 수 있습니다. 연구 종료 후 30일 동안 ELIQUIS 군의 6791명 환자(0.3%)에서 뇌졸중 또는 전신 색전증 사건이 21건 발생한 반면, 와파린 군의 6569명 환자(0.1%)에서 5건 발생했습니다. [투여량 및 투여 방법 (2.4)].
AVERROES
와파린 치료 대상이 아닌 것으로 여겨지는 비판막성 심방 세동 환자를 대상으로 ELIQUIS 5mg을 1일 2회 경구 투여(또는 선택된 환자의 경우 1일 2회 2.5mg) 또는 아스피린 81~324mg을 1일 1회 투여하도록 무작위 배정했습니다. 이 연구의 주요 목표는 ELIQUIS가 뇌졸중 또는 전신 색전증의 복합 결과를 예방하는 데 아스피린보다 우수한지 여부를 확인하는 것이었습니다. AVERROES는 사전에 지정된 중간 분석 결과 ELIQUIS가 아스피린에 비해 뇌졸중 및 전신 색전증을 유의하게 감소시키는 것으로 나타났고, 이는 주요 출혈이 약간 증가한 것과 관련이 있었습니다(표 10). [부작용 (6.1)].
| ELIQUIS N=2807 n (%/년) |
아스피린 N=2791 n (%/년) |
위험 비율 (95% CI) |
P-값 | |
|---|---|---|---|---|
|
뇌졸중 또는 전신 색전증 |
51 (1.62) |
113 (3.63) |
0.45 (0.32, 0.62) |
<0.0001 |
|
뇌졸중 |
||||
|
허혈성 또는 불명 |
43 (1.37) |
97 (3.11) |
0.44 (0.31, 0.63) |
– |
|
출혈성 |
6 (0.19) |
9 (0.28) |
0.67 (0.24, 1.88) |
– |
|
전신 색전증 |
2 (0.06) |
13 (0.41) |
0.15 (0.03, 0.68) |
– |
|
MI |
24 (0.76) |
28 (0.89) |
0.86 (0.50, 1.48) |
– |
|
모든 원인 사망 |
111 (3.51) |
140 (4.42) |
0.79 (0.62, 1.02) |
0.068 |
|
혈관 사망 |
84 (2.65) |
96 (3.03) |
0.87 (0.65, 1.17) |
– |
14.2 고관절 또는 무릎 치환 수술 후 심부 정맥 혈전증 예방
ELIQUIS의 효능에 대한 임상적 증거는 선택적 고관절(ADVANCE-3) 또는 무릎(ADVANCE-2 및 ADVANCE-1) 치환 수술을 받은 성인 환자를 대상으로 한 ADVANCE-1, ADVANCE-2 및 ADVANCE-3 임상 시험에서 얻어졌습니다. 총 11,659명의 환자가 3건의 이중맹검, 다국적 연구에 무작위 배정되었습니다. 이 총계에는 75세 이상 환자 1,866명, 저체중 환자(≤60kg) 1,161명, 체질량 지수 ≥33kg/m2인 환자 2,528명, 중증 또는 중등도 신장애 환자 625명이 포함되었습니다.
ADVANCE-3 연구에서 선택적 고관절 치환 수술을 받은 5,407명의 환자를 ELIQUIS 2.5mg을 1일 2회 경구 투여하거나 에녹사파린 40mg을 1일 1회 피하 투여하도록 무작위 배정했습니다. ELIQUIS의 첫 번째 투여는 수술 후 12~24시간에 실시했고, 에녹사파린은 수술 전 9~15시간에 시작했습니다. 치료 기간은 32~38일이었습니다.
선택적 무릎 치환 수술을 받은 환자의 경우 ELIQUIS 2.5mg을 1일 2회 경구 투여하는 것을 에녹사파린 40mg을 1일 1회 피하 투여(ADVANCE-2, N=3,057) 또는 에녹사파린 30mg을 12시간마다 피하 투여(ADVANCE-1, N=3,195)와 비교했습니다. ADVANCE-2 연구에서 ELIQUIS의 첫 번째 투여는 수술 후 12~24시간에 실시했고, 에녹사파린은 수술 전 9~15시간에 시작했습니다. ADVANCE-1 연구에서 ELIQUIS와 에녹사파린은 모두 수술 후 12~24시간에 시작했습니다. ADVANCE-2와 ADVANCE-1 모두에서 치료 기간은 10~14일이었습니다.
3건의 연구 모두에서 일차 종말점은 이중맹검 의도된 치료 기간 말에 심사된 무증상 및 증상성 DVT, 치명적이지 않은 PE 및 모든 원인 사망의 복합적 결과였습니다. ADVANCE-3 및 ADVANCE-2에서 일차 종말점은 ELIQUIS의 에녹사파린에 대한 비열등성, 그 다음 우월성을 검증했습니다. ADVANCE-1에서 일차 종말점은 ELIQUIS의 에녹사파린에 대한 비열등성을 검증했습니다.
효능 데이터는 표 11 및 12에 제공됩니다.
| * 각 종말점과 관련된 사건은 대상자별로 한 번 계산되었지만 대상자는 여러 종말점에 사건을 기여했을 수 있습니다. † 총 VTE에는 증상성 및 무증상 DVT와 PE가 포함됩니다. ‡ 증상성 및 무증상 DVT를 포함합니다. |
|||
|
ADVANCE-3 |
|||
|
35일 치료 기간 동안의 사건 |
ELIQUIS |
에녹사파린 |
상대 위험 |
|
환자 수 |
N=1,949 |
N=1,917 |
|
|
총 VTE†/모든 원인 사망 |
27 (1.39%) |
74 (3.86%) |
0.36 |
|
환자 수 |
N=2,708 |
N=2,699 |
|
|
모든 원인 사망 |
3 (0.11%) |
1 (0.04%) |
|
|
PE |
3 (0.11%) |
5 (0.19%) |
|
|
증상성 DVT |
1 (0.04%) |
5 (0.19%) |
|
|
환자 수 |
N=2,196 |
N=2,190 |
|
|
근위부 DVT‡ |
7 (0.32%) |
20 (0.91%) |
|
|
환자 수 |
N=1951 |
N=1908 |
|
|
원위 심부 정맥 혈전증‡ |
20 (1.03%) |
57 (2.99%) |
|
| ADVANCE-1 | ADVANCE-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| * 각 종료점과 관련된 사건은 대상자별로 한 번만 계산되었지만 대상자는 여러 종료점에 사건을 기여했을 수 있습니다. † 총 VTE에는 증상성 및 무증상 DVT 및 PE가 포함됩니다. ‡ 증상성 및 무증상 DVT를 포함합니다. |
||||||||||
|
12일 치료 기간 동안의 |
ELIQUIS |
에녹사파린 |
상대 위험 |
ELIQUIS |
에녹사파린 |
상대 위험 P값 |
||||
|
환자 수 |
N=1157 |
N=1130 |
N=976 |
N=997 |
||||||
|
총 VTE†/모든 원인 사망 |
104 (8.99%) |
100 (8.85%) |
1.02 |
147 (15.06%) |
243 (24.37%) |
0.62 |
||||
|
환자 수 |
N=1599 |
N=1596 |
N=1528 |
N=1529 |
||||||
|
모든 원인 사망 |
3 (0.19%) |
3 (0.19%) |
2 (0.13%) |
0 (0%) |
||||||
|
PE |
16 (1.0%) |
7 (0.44%) |
4 (0.26%) |
0 (0%) |
||||||
|
증상성 |
3 (0.19%) |
7 (0.44%) |
3 (0.20%) |
7 (0.46%) |
||||||
|
환자 수 |
N=1254 |
N=1207 |
N=1192 |
N=1199 |
||||||
근위 DVT‡
9 (0.72%)
(0.36, 1.39)
11 (0.91%)
(0.49, 1.65)
9 (0.76%)
(0.38, 1.46)
26 (2.17%)
(1.47, 3.18)
환자 수
N=1146
N=1133
N=978
N=1000
원위 DVT‡
83 (7.24%)
(5.88, 8.91)
91 (8.03%)
(6.58, 9.78)
142 (14.52%)
(12.45, 16.88)
239 (23.9%)
(21.36, 26.65)
ELIQUIS의 효능 프로파일은 이 적응증에 대한 관심 대상 하위 그룹(예: 연령, 성별, 인종, 체중, 신장애)에서 일반적으로 일관되었습니다.
14.3 DVT 및 PE 치료 및 DVT 및 PE 재발 위험 감소
ELIQUIS의 DVT 및 PE 치료 효능 및 안전성, 그리고 항응고제 치료 6~12개월 후 DVT 및 PE 재발 위험 감소는 AMPLIFY 및 AMPLIFY-EXT 연구에서 도출되었습니다. 두 연구 모두 증상성 근위 DVT 및/또는 증상성 PE 환자를 대상으로 한 무작위 배정, 병행군, 이중맹검 시험이었습니다. 모든 주요 안전성 및 효능 종료점은 독립 위원회에서 맹검 방식으로 평가되었습니다.
AMPLIFY
AMPLIFY의 주요 목표는 ELIQUIS가 재발성 VTE(정맥혈전색전증) 또는 VTE 관련 사망 발생률 측면에서 에녹사파린/와파린에 비열등한지 여부를 확인하는 것이었습니다. 객관적으로 확인된 증상성 DVT 및/또는 PE 환자를 ELIQUIS 10mg 1일 2회 경구 투여 7일 후 ELIQUIS 5mg 1일 2회 경구 투여 6개월 또는 에녹사파린 1mg/kg 1일 2회 피하 투여 최소 5일(INR ≥2까지) 후 와파린(목표 INR 범위 2.0~3.0) 경구 투여 6개월로 무작위 배정했습니다. 혈전 용해술, 하대정맥 필터 삽입 또는 섬유소 용해제 사용이 필요한 환자, 크레아티닌 청소율 <25mL/분, 심각한 간 질환, 기존 심장 판막 또는 심방세동, 활동성 출혈이 있는 환자는 AMPLIFY 연구에서 제외되었습니다. 환자는 이전 비경구 항응고제(최대 48시간)를 사용했는지 여부와 관계없이 연구에 참여할 수 있었습니다.
총 5244명의 환자가 효능 평가 대상이었으며 ELIQUIS 그룹에서는 평균 154일, 에녹사파린/와파린 그룹에서는 평균 152일 동안 추적 관찰했습니다. 평균 연령은 57세였습니다. AMPLIFY 연구 모집단은 남성 59%, 백인 83%, 아시아인 8%, 흑인 4%였습니다. 와파린에 무작위 배정된 환자의 경우 치료 범위(INR 2.0~3.0) 내 시간의 평균 비율은 60.9%였습니다.
AMPLIFY에 등록된 환자의 약 90%는 기저 상태에서 유발되지 않은 DVT 또는 PE를 보였습니다. 유발된 DVT 또는 PE가 있는 나머지 10%의 환자는 무작위 배정을 위해 추가적인 지속적인 위험 요인이 있어야 했으며, 여기에는 이전 DVT 또는 PE 발생, 고정, 암 병력, 활동성 암, 알려진 혈전증 유전형이 포함되었습니다.
ELIQUIS는 AMPLIFY 연구에서 6개월 치료 기간 동안 재발성 증상성 VTE(비치명적 DVT 또는 비치명적 PE) 또는 VTE 관련 사망의 주요 종료점 측면에서 에녹사파린/와파린에 비열등한 것으로 나타났습니다(표 13).
| ELIQUIS N=2609 n |
에녹사파린/와파린 N=2635 n |
상대 위험 (95% CI) |
|
|---|---|---|---|
| * 에녹사파린/와파린에 비해 비열등함(P-값 <0.0001). † 각 종료점과 관련된 사건은 대상자별로 한 번 계산되었지만, 대상자는 여러 종료점에 사건을 기여했을 수 있습니다. |
|||
|
VTE 또는 VTE 관련 사망* |
59 (2.3%) |
71 (2.7%) |
0.84 (0.60, 1.18) |
|
DVT† |
22 (0.8%) |
35 (1.3%) |
|
|
PE† |
27 (1.0%) |
25 (0.9%) |
|
|
VTE 관련 사망† |
12 (0.4%) |
16 (0.6%) |
|
|
VTE 또는 모든 원인 사망 |
84 (3.2%) |
104 (4.0%) |
0.82 (0.61, 1.08) |
|
VTE 또는 심혈관 관련 사망 |
61 (2.3%) |
77 (2.9%) |
0.80 (0.57, 1.11) |
AMPLIFY-EXT
DVT 및/또는 PE로 6개월에서 12개월 동안 항응고제 치료를 받았지만 재발 사건이 없는 환자는 12개월 동안 ELIQUIS 2.5mg 경구 투여 1일 2회, ELIQUIS 5mg 경구 투여 1일 2회 또는 위약을 무작위로 투여받았습니다. 환자의 약 1/3이 AMPLIFY-EXT 연구에 등록하기 전에 AMPLIFY 연구에 참여했습니다.
총 2482명의 환자가 연구 치료에 무작위 배정되었으며 ELIQUIS 그룹에서는 평균 약 330일, 위약 그룹에서는 평균 약 312일 동안 추적 관찰했습니다. AMPLIFY-EXT 연구의 평균 연령은 57세였습니다. 연구 대상자의 57%는 남성, 85%는 백인, 5%는 아시아인, 3%는 흑인이었습니다.
AMPLIFY-EXT 연구는 기준선에서 유발되지 않은 DVT 또는 PE가 있는 환자(약 92%) 또는 유발된 기준선 사건과 재발 위험 요인이 하나 더 있는 환자(약 8%)를 모집했습니다. 그러나 유발되지 않은 DVT 또는 PE가 여러 번 발생한 환자는 AMPLIFY-EXT 연구에서 제외되었습니다. AMPLIFY-EXT 연구에서 ELIQUIS의 두 용량 모두 증상이 있는 재발성 VTE(치명적이지 않은 DVT 또는 치명적이지 않은 PE) 또는 모든 원인으로 인한 사망(표 14)의 일차 종말점에서 위약보다 우수했습니다.
| 상대 위험(95% CI) | |||||
|---|---|---|---|---|---|
| ELIQUIS 2.5mg bid N=840 |
ELIQUIS 5mg bid N=813 |
위약
N=829 |
ELIQUIS 2.5mg bid vs 위약 |
ELIQUIS 5mg bid vs 위약 |
|
| * 사건이 둘 이상 발생한 환자는 여러 행에 계산됩니다. | |||||
|
n (%) |
|||||
|
재발성 VTE 또는 모든 원인으로 인한 사망 |
32 (3.8) |
34 (4.2) |
96 (11.6) |
0.33 (0.22, 0.48) |
0.36 (0.25, 0.53) |
|
DVT* |
19 (2.3) |
28 (3.4) |
72 (8.7) |
||
|
PE* |
23 (2.7) |
25 (3.1) |
37 (4.5) |
||
|
모든 원인으로 인한 사망 |
22 (2.6) |
25 (3.1) |
33 (4.0) |
||
16 공급/보관 및 취급 방법
공급 방법
ELIQUIS (아픽사반) 정제는 아래 표에 나열된 대로 제공됩니다.
| 정제 강도 |
정제 색상/모양 |
정제 마킹 | 포장 크기 | NDC 코드 |
|---|---|---|---|---|
|
2.5 mg |
노란색, 원형, |
한쪽 면에 “893” 양각, |
60정 병 |
0003-0893-21 |
|
양면 볼록 |
다른 쪽 면에 “2½” 양각 |
100정 병원용 단위 용량 블리스터 |
0003-0893-31 |
|
|
5 mg |
분홍색, 타원형, 양면 볼록 |
한쪽 면에 “894” 양각, |
60정 병 |
0003-0894-21 |
|
다른 쪽 면에 “5” 양각 |
74정 병 |
0003-0894-70 |
||
|
|
100정 병원용 단위 용량 블리스터 |
0003-0894-31 |
||
|
74정(42정 블리스터 팩 1개 및 32정 블리스터 팩 1개)이 들어 있는 DVT 및 PE 치료용 30일 스타터 팩 |
0003-3764-74 |
17. 환자 상담 정보
환자에게 FDA 승인 환자 라벨링(복약 안내)을 읽도록 권고하십시오.
환자에게 다음 사항을 알리십시오.
- •
- 의사와 먼저 상의하지 않고 ELIQUIS 복용을 중단하지 마십시오.
- •
- ELIQUIS로 치료받는 경우 출혈을 멈추는 데 평소보다 시간이 오래 걸릴 수 있으며, 더 쉽게 멍이 들거나 출혈이 발생할 수 있습니다. 출혈이나 저혈량증의 증상을 인지하는 방법과 특이한 출혈이 발생할 경우 즉시 의사에게 보고해야 할 필요성에 대해 환자에게 알리십시오.
- •
- 수술이나 의료 또는 치과 시술을 받기 전, 그리고 새로운 약을 복용하기 전에 의사와 치과 의사에게 ELIQUIS 및/또는 출혈에 영향을 미치는 것으로 알려진 다른 제품(아스피린 또는 NSAID와 같은 일반 의약품 포함)을 복용하고 있음을 알리십시오.
- •
- 환자가 신경축 마취 또는 척추 천자를 받는 경우 척추 또는 경막외 혈종의 징후와 증상을 관찰하도록 알리십시오 [경고 및 주의사항 (5.3) 참조]. 이러한 증상이 나타나면 응급 치료를 받도록 환자에게 알리십시오.
- •
- ELIQUIS 치료 중 임신 중이거나 임신을 계획 중이거나 모유 수유 중이거나 모유 수유를 계획 중인 경우 의사에게 알리십시오 [특정 환자군에서의 사용 (8.1, 8.2)] 참조.
- •
- 삼킬 수 없거나 비위관을 필요로 하는 경우 ELIQUIS를 복용하는 방법 [복용량 및 투여 방법 (2.6) 참조].
- •
- 복용량을 놓친 경우 어떻게 해야 하는지 [복용량 및 투여 방법 (2.2)] 참조.
SPL 미분류 섹션
판매원:
Bristol-Myers Squibb Company
Princeton, New Jersey 08543 USA
및
Pfizer Inc
New York, New York 10017 USA
Rotachrom®은 Diagnostica Stago의 등록 상표입니다.
[PRINT CODES]
복용 안내
ELIQUIS® (엘리퀴스)
(아픽사반)
정제
ELIQUIS에 대해 알아야 할 가장 중요한 정보는 무엇입니까?
- ●
-
심방세동 치료를 위해 ELIQUIS를 복용하는 사람의 경우:
심방세동(불규칙적인 심장 박동의 한 유형)이 있는 사람은 심장에 혈전이 생길 위험이 높아지며, 이 혈전은 뇌로 이동하여 뇌졸중을 일으키거나 신체의 다른 부위로 이동할 수 있습니다. ELIQUIS는 혈전 형성을 예방하여 뇌졸중 위험을 낮춥니다. ELIQUIS 복용을 중단하면 혈액에 혈전이 생길 위험이 높아질 수 있습니다.
ELIQUIS를 처방한 의사와 상의하지 않고 ELIQUIS 복용을 중단하지 마십시오. ELIQUIS 복용을 중단하면 뇌졸중 위험이 높아집니다.
ELIQUIS는 가능한 경우 수술이나 의료 또는 치과 시술 전에 중단해야 할 수 있습니다. ELIQUIS 복용을 중단해야 하는 시기를 ELIQUIS를 처방한 의사에게 문의하십시오. 의사는 수술이나 시술 후 ELIQUIS 복용을 다시 시작할 수 있는 시기를 알려줄 것입니다. ELIQUIS 복용을 중단해야 하는 경우 의사는 혈전 형성을 예방하는 데 도움이 되는 다른 약을 처방할 수 있습니다.
- ●
-
ELIQUIS는 출혈을 유발할 수 있습니다. 출혈은 심각할 수 있으며 드물게 사망에 이를 수 있습니다. 이는 ELIQUIS가 혈액 응고를 감소시키는 혈액 희석제이기 때문입니다.
ELIQUIS를 복용하고 출혈 위험을 높이는 다른 약을 복용하는 경우 출혈 위험이 높아질 수 있습니다. 여기에는 다음이 포함됩니다.
- ●
- 아스피린 또는 아스피린 함유 제품
- ●
- 장기간(만성) 비스테로이드성 항염증제(NSAIDs) 사용
- ●
- 와파린 나트륨(COUMADIN®, JANTOVEN®)
- ●
- 헤파린이 함유된 약물
- ●
- 선택적 세로토닌 재흡수 억제제(SSRIs) 또는 세로토닌 노르에피네프린 재흡수 억제제(SNRIs)
- ●
- 혈전 예방 또는 치료에 도움이 되는 다른 약물
이러한 약을 복용하는 경우 의사에게 알리십시오. 약이 위에 나열된 약물 중 하나인지 확실하지 않으면 의사 또는 약사에게 문의하십시오.ELIQUIS를 복용하는 동안:
-
- ●
- 멍이 더 쉽게 들 수 있습니다.
- ●
- 출혈이 멈추는 데 평소보다 시간이 더 걸릴 수 있습니다.
ELIQUIS를 복용하는 동안 다음과 같은 출혈 징후나 증상이 나타나면 즉시 의사에게 연락하거나 응급 처치를 받으십시오.
-
- ●
- 예상치 못한 출혈 또는 오랫동안 지속되는 출혈(예:
- ●
- 잇몸에서의 비정상적인 출혈
- ●
- 잦은 코피
- ●
- 평소보다 심한 월경 출혈 또는 질 출혈
- ●
- 심하거나 조절할 수 없는 출혈
- ●
- 붉은색, 분홍색 또는 갈색 소변
- ●
- 붉은색 또는 검은색 대변(타르처럼 보임)
- ●
- 피 또는 혈전을 토함
- ●
- 피를 토하거나 토사물이 커피 찌꺼기처럼 보임
- ●
- 예상치 못한 통증, 부기 또는 관절 통증
- ●
- 두통, 현기증 또는 쇠약감
- ●
- ELIQUIS는 인공 심장 판막이 있는 환자에게는 적합하지 않습니다.
- ●
-
척추 또는 경막 외 혈전(혈종). ELIQUIS와 같은 혈액 희석제(항응고제)를 복용하고 척추 및 경막 외 부위에 약물을 주입하거나 척추 천자를 받은 사람은 장기간 또는 영구적으로 움직일 수 없는 능력(마비)을 유발할 수 있는 혈전이 생길 위험이 있습니다. 다음과 같은 경우 척추 또는 경막 외 혈전이 생길 위험이 더 높습니다.
- ●
- 특정 약물을 투여하기 위해 등에 경막 외 카테터라는 가는 관을 삽입한 경우
- ●
- NSAIDs 또는 혈액 응고를 방지하는 약물을 복용하는 경우
- ●
- 경막 외 또는 척추 천자가 어렵거나 반복적으로 시행된 경험이 있는 경우
- ●
- 척추에 문제가 있거나 척추 수술을 받은 경험이 있는 경우
ELIQUIS를 복용하고 척추 마취를 받거나 척추 천자를 받는 경우 의사는 척추 또는 경막 외 혈전이나 출혈 증상을 주의 깊게 관찰해야 합니다. 특히 다리와 발에 따끔거림, 마비 또는 근력 약화가 나타나면 즉시 의사에게 알리십시오.
- ●
- ELIQUIS는 특히 삼중 항체 검사 결과가 양성이고 혈전 병력이 있는 항인지질 증후군(APS) 환자에게는 사용하지 않습니다.
ELIQUIS는 무엇입니까?
ELIQUIS는 다음과 같은 경우에 사용되는 처방약입니다.
- ●
- 심방세동이 있는 사람의 뇌졸중 및 혈전 위험 감소.
- ●
- 고관절 또는 무릎 수술을 받은 사람의 다리와 폐에 혈전이 생길 위험 감소.
- ●
- 다리 정맥의 혈전(심부 정맥 혈전증) 또는 폐의 혈전(폐색전증)을 치료하고 재발 위험 감소.
ELIQUIS가 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
누가 ELIQUIS를 복용해서는 안 됩니까?
다음과 같은 경우 ELIQUIS를 복용하지 마십시오.
- ●
- 현재 특정 유형의 비정상적인 출혈이 있는 경우.
- ●
- ELIQUIS에 대한 심각한 알레르기 반응이 있었던 경우. 확실하지 않으면 의사에게 문의하십시오.
ELIQUIS를 복용하기 전에 의사에게 무엇을 알려야 합니까?
ELIQUIS를 복용하기 전에 다음과 같은 경우 의사에게 알리십시오.
- ●
- 신장 또는 간 문제가 있는 경우
- ●
- 항인지질 증후군이 있는 경우
- ●
- 다른 의학적 상태가 있는 경우
- ●
- 출혈 문제가 있었던 경우
- ●
- 임신 중이거나 임신을 계획하고 있는 경우. ELIQUIS가 태아에게 해로운지 여부는 알려져 있지 않습니다.
임신 가능성이 있는 여성: ELIQUIS 치료 중 임신 계획에 대해 의료 서비스 제공자와 상담하십시오. ELIQUIS를 포함한 혈액 희석제로 치료받는 경우 심각한 자궁 출혈 위험에 대해 의료 서비스 제공자와 상담하십시오.
- ●
- 모유 수유 중이거나 모유 수유를 계획하고 있는 경우. ELIQUIS가 모유로 이행되는지 여부는 알려져 있지 않습니다. ELIQUIS를 복용할지 모유 수유를 할지 의사와 상의해야 합니다. 둘 다 할 수는 없습니다.
모든 의사와 치과 의사에게 ELIQUIS를 복용하고 있음을 알리십시오. 모든 수술, 의료 또는 치과 시술을 받기 전에 ELIQUIS를 처방한 의사와 상담해야 합니다.
복용하는 모든 약물(처방약 및 일반의약품, 비타민, 허브 보충제 포함)을 의사에게 알리십시오. 다른 약물 중 일부는 ELIQUIS의 효능에 영향을 미칠 수 있습니다. 특정 약물은 ELIQUIS와 함께 복용하면 출혈 또는 뇌졸중 위험을 증가시킬 수 있습니다. “ELIQUIS에 대해 알아야 할 가장 중요한 정보는 무엇입니까?“를 참조하십시오.
복용하는 약물을 알고 있어야 합니다. 새 약을 받을 때 의사와 약사에게 보여줄 수 있도록 약물 목록을 작성해 두십시오.
ELIQUIS는 어떻게 복용해야 합니까?
- ●
- ELIQUIS는 의사의 처방대로 정확히 복용하십시오.
- ●
- ELIQUIS는 음식과 함께 또는 음식 없이 하루에 두 번 복용하십시오.
- ●
- 의사의 지시가 없는 한 복용량을 변경하거나 ELIQUIS 복용을 중단하지 마십시오.
- ●
- ELIQUIS 복용량을 놓친 경우 기억하는 대로 복용하십시오. 놓친 복용량을 보충하기 위해 동시에 ELIQUIS를 두 번 복용하지 마십시오.
- ●
- 정제를 통째로 삼키기 어려운 경우 ELIQUIS 복용 방법에 대해 의사와 상담하십시오.
- ●
- 의사가 ELIQUIS 복용 기간을 결정합니다. 의사와 상담하지 않고 복용을 중단하지 마십시오. 심방세동으로 ELIQUIS를 복용하는 경우 ELIQUIS 복용을 중단하면 뇌졸중 위험이 증가할 수 있습니다.
- ●
- ELIQUIS가 부족하지 않도록 하십시오. ELIQUIS가 부족하기 전에 처방전을 다시 받으십시오. 고관절 또는 무릎 수술 후 병원에서 퇴원할 때는 복용량을 놓치지 않도록 ELIQUIS를 확보했는지 확인하십시오.
- ●
- ELIQUIS를 과량 복용한 경우 즉시 의사에게 연락하거나 가장 가까운 병원 응급실로 가십시오.
- ●
- 특히 머리를 부딪힌 경우 넘어지거나 부상을 입으면 즉시 의사 또는 의료 서비스 제공자에게 연락하십시오. 의사 또는 의료 서비스 제공자가 검사를 해야 할 수 있습니다.
ELIQUIS의 가능한 부작용은 무엇입니까?
- ●
- “ELIQUIS에 대해 알아야 할 가장 중요한 정보는 무엇입니까?“를 참조하십시오.
- ●
- ELIQUIS는 피부 발진 또는 심각한 알레르기 반응을 일으킬 수 있습니다. 다음 증상 중 하나가 나타나면 즉시 의사에게 연락하거나 의료 도움을 받으십시오.
- ●
- 가슴 통증 또는 압박감
- ●
- 얼굴 또는 혀 부종
- ●
- 호흡 곤란 또는 천명
- ●
- 현기증 또는 실신
귀찮거나 사라지지 않는 부작용이 있으면 의사에게 알리십시오.
이것들은 ELIQUIS의 모든 가능한 부작용이 아닙니다. 자세한 내용은 의사 또는 약사에게 문의하십시오.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 전화번호: 1-800-FDA-1088.
ELIQUIS는 어떻게 보관해야 합니까?
ELIQUIS는 섭씨 20도에서 25도(화씨 68도에서 77도)의 실온에 보관하십시오.
ELIQUIS 및 모든 약물을 어린이의 손이 닿지 않는 곳에 보관하십시오.
ELIQUIS에 대한 일반 정보
약물은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 ELIQUIS를 사용하지 마십시오. 동일한 증상이 있어도 다른 사람에게 ELIQUIS를 주지 마십시오. 해를 입힐 수 있습니다.
자세한 내용은 의사와 상담하십시오. 약사 또는 의사에게 의료 전문가를 위해 작성된 ELIQUIS에 대한 정보를 요청할 수 있습니다.
자세한 내용은 1-855-354-7847(1-855-ELIQUIS)로 전화하거나 www.ELIQUIS.com을 방문하십시오.
ELIQUIS의 성분은 무엇입니까?
활성 성분: 아픽사반.
비활성 성분: 무수 락토스, 미결정 셀룰로스, 크로스카멜로스 나트륨, 라우릴 황산나트륨, 스테아린산 마그네슘. 필름 코팅에는 락토스 일수화물, 히프로멜로스, 이산화티타늄, 트리아세틴, 황색 산화철(2.5mg 정제) 또는 적색 산화철(5mg 정제)이 포함되어 있습니다.
이 의약품 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다.
판매:
Bristol-Myers Squibb Company
Princeton, New Jersey 08543 USA
및
Pfizer Inc
New York, New York 10017 USA
COUMADIN®는 Bristol-Myers Squibb Pharma Company의 등록 상표입니다.
기타 모든 상표는 해당 회사의 자산입니다.
2021년 9월 개정
엘리퀴스 2.5 mg 정제 대표 포장
ELIQUIS의 사용 가능한 패키지의 완전한 목록은 제공 형태 섹션을 참조하십시오.
60정
NDC 0003-0893-21
ELIQUIS®
(apixaban) 정제
2.5 mg
약물 안내서와 함께 제공
처방전 필요
Bristol Myers Squibb
Pfizer
엘리퀴스 5 mg 정제 대표 포장
60정
NDC 0003-0894-21
ELIQUIS®
(apixaban) 정제
5 mg
복약 안내서와 함께 제공
처방전 의약품
Bristol Myers Squibb
Pfizer
엘리퀴스 스타터팩 5mg 정제, 대표 포장
처방전에 의해서만 사용 가능
30일 스타터팩
다음의 치료를 위해
심부 정맥 혈전증 (DVT)
및 폐색전증 (PE)
5 mg
정제 당
약물 안내서와 함께 제공
첨부된 전체 처방 정보를 참조하십시오.
여기에는 경고 및 약물 안내서가 포함되어 있습니다.
NDC 0003-3764-74
두 개의 지갑 포함
74 정제, 정제 당 5 mg
엘리퀴스®
(아픽사반) 정제
지갑 1: 1일~14일
지갑 1부터 시작
지갑 2: 15일~30일
15일에 지갑 2로 전환
어린이의 손이 닿지 않는 곳에 보관하십시오