의약품 제조업체: sanofi-aventis U.S. LLC (Updated: 2024-09-27)
처방 정보의 주요 내용
DUPIXENT® (dupilumab) 주사, 피하 주사용
미국 최초 승인: 2017
최근 주요 변경 사항
| 적응증 및 사용, 비강용종을 동반한 만성 비부비동염 (1.3) | 2024년 9월 |
| 적응증 및 사용, 호산구성 식도염 (1.4) | 2024년 1월 |
| 적응증 및 사용, 만성 폐쇄성 폐 질환 (1.6) | 2024년 9월 |
| 투여 및 관리, 천식이 있는 6세에서 11세까지의 소아 환자에서 100mg Q2W (2.4) | 2024년 4월 삭제 |
| 투여 및 관리, 비강용종을 동반한 만성 비부비동염 (2.5) | 2024년 9월 |
| 투여 및 관리, 호산구성 식도염 (2.6) | 2024년 1월 |
| 투여 및 관리, 만성 폐쇄성 폐 질환 (2.8) | 2024년 9월 |
| 경고 및 주의 사항 (5.2, 5.4) | 2024년 9월 |
적응증 및 사용
DUPIXENT는 인터루킨-4 수용체 알파 길항제로 다음과 같은 경우에 사용됩니다.
아토피 피부염
국소 처방 요법으로 적절히 조절되지 않거나 국소 처방 요법이 적합하지 않은 중등도에서 중증의 AD를 가진 6개월 이상의 성인 및 소아 환자의 치료. DUPIXENT는 국소 코르티코스테로이드와 함께 또는 없이 사용할 수 있습니다. (1.1)
천식
호산구 표현형 또는 경구 코르티코스테로이드 의존성 천식을 특징으로 하는 중등도에서 중증의 천식을 가진 6세 이상의 성인 및 소아 환자의 추가 유지 치료. (1.2)
사용 제한: 급성 기관지 경련 또는 천식 발작 완화를 위한 것이 아닙니다. (1.2)
비강용종을 동반한 만성 비부비동염
적절히 조절되지 않은 비강용종을 동반한 만성 비부비동염(CRSwNP)을 가진 12세 이상의 성인 및 소아 환자의 추가 유지 치료. (1.3)
호산구성 식도염
체중이 15kg 이상인 1세 이상의 성인 및 소아 환자의 호산구성 식도염(EoE) 치료. (1.4)
결절성 가려움증
결절성 가려움증(PN)을 가진 성인 환자의 치료. (1.5)
만성 폐쇄성 폐 질환
적절히 조절되지 않은 만성 폐쇄성 폐 질환(COPD)과 호산구 표현형을 가진 성인 환자의 추가 유지 치료. (1.6)
사용 제한: 급성 기관지 경련 완화를 위한 것이 아닙니다. (1.6)
투여 및 관리
아토피 피부염
성인 투여량 (2.3):
- 권장 투여량은 600mg(300mg 주사 2회)의 초기 투여량을 투여한 후 격주(Q2W)로 300mg을 투여하는 것입니다.
6개월에서 5세까지의 소아 환자 투여량 (2.3):
| 체중 | 초기 및 후속 투여량 |
|---|---|
| 5kg에서 15kg 미만 | 4주(Q4W)마다 200mg(200mg 주사 1회) |
| 15kg에서 30kg 미만 | 4주(Q4W)마다 300mg(300mg 주사 1회) |
6세에서 17세까지의 소아 환자 투여량 (2.3):
| 체중 | 초기 적재 투여량 | 후속 투여량* |
|---|---|---|
|
||
| 15kg에서 30kg 미만 | 600mg(300mg 주사 2회) | Q4W로 300mg |
| 30kg에서 60kg 미만 | 400mg(200mg 주사 2회) | Q2W로 200mg |
| 60kg 이상 | 600mg(300mg 주사 2회) | Q2W로 300mg |
천식
성인 및 12세 이상 소아 환자의 용량 (2.4):
| 초기 적재 용량 | 후속 용량 |
|---|---|
| 400 mg (200 mg 주사 2회) | 2주마다 (Q2W) 200 mg |
| 또는 | |
| 600 mg (300 mg 주사 2회) | 2주마다 (Q2W) 300 mg |
| 경구 코르티코스테로이드 의존성 천식 환자 또는 중등도에서 중증의 아토피 피부염이 동반된 환자 또는 중등도에서 중증의 비강용종을 동반한 만성 비부비강염이 동반된 성인의 용량 | |
| 600 mg (300 mg 주사 2회) | 2주마다 (Q2W) 300 mg |
6세에서 11세 소아 환자의 용량 (2.4):
| 체중 | 초기 용량 및 후속 용량 |
|---|---|
| 15kg 이상 30kg 미만 | 4주마다 (Q4W) 300 mg |
| ≥30 kg | 격주 (Q2W) 200 mg |
천식 및 중등도에서 중증의 아토피 피부염이 동반된 6세에서 11세 소아 환자의 경우, 초기 적재 용량을 포함한 표 2에 따라 권장 용량을 따르십시오. (2.3)
비강용종을 동반한 만성 비부비강염 (2.5):
- 성인 및 12세 이상 소아 환자의 권장 용량은 격주 (Q2W) 300 mg입니다.
호산구성 식도염 (2.6):
| 체중 | 성인 및 1세 이상, 체중 15kg 이상 소아 환자의 권장 용량 |
|---|---|
| 15kg 이상 30kg 미만 | 격주 (Q2W) 200 mg |
| 30kg 이상 40kg 미만 | 격주 (Q2W) 300 mg |
| 40kg 이상 | 매주 (QW) 300 mg |
결절성 가려움증 (2.7):
- 성인 환자에게 권장되는 용량은 600mg(300mg 주사 2회)의 초기 용량을 투여한 후 격주(Q2W)로 300mg을 투여하는 것입니다.
만성 폐쇄성 폐 질환 (2.8):
- 성인 환자에게 권장되는 용량은 격주(Q2W)로 300mg을 투여하는 것입니다.
투여 형태 및 강도
금기 사항
DUPIXENT의 두피루맙 또는 어떤 첨가제에 대한 알려진 과민증. (4)
경고 및 주의 사항
- 과민증: 아나필락시스, 혈청병, 안지오에데마, 두드러기, 발진, 결절 홍반, 다형 홍반을 포함한 과민증 반응이 발생했습니다. 과민증 반응이 발생하면 DUPIXENT를 중단하십시오. (5.1)
- 결막염 및 각막염: 환자에게 새로운 눈 증상이나 악화되는 눈 증상을 의료 서비스 제공자에게 보고하도록 조언하십시오. 적절한 경우 안과 검사를 고려하십시오. (5.2)
- 호산구성 질환: 특히 경구용 코르티코스테로이드 감량 시 혈관염 발진, 악화되는 폐 증상 및/또는 신경병증에 유의하십시오. (5.3)
- 코르티코스테로이드 용량 감소: DUPIXENT 투여를 시작할 때 전신, 국소 또는 흡입 코르티코스테로이드를 갑자기 중단하지 마십시오. 적절한 경우 스테로이드를 점차적으로 감소시키십시오. (5.5)
- 관절통: 환자에게 새로운 관절 증상이나 악화되는 관절 증상을 의료 서비스 제공자에게 보고하도록 조언하십시오. 증상이 지속되거나 악화되면 류마티스 검사 및/또는 DUPIXENT 중단을 고려하십시오. (5.7)
- 기생충(회충) 감염: DUPIXENT 투여를 시작하기 전에 기존의 회충 감염을 치료하십시오. DUPIXENT를 투여받는 동안 환자가 감염되고 항회충 치료에 반응하지 않으면 감염이 해결될 때까지 DUPIXENT를 중단하십시오. (5.8)
- 예방 접종: 생백신 사용을 피하십시오. (5.9)
부작용
가장 흔한 부작용은 다음과 같습니다.
- 아토피 피부염(발생률 ≥1%): 주사 부위 반응, 결막염, 눈꺼풀염, 구강 헤르페스, 각막염, 눈 가려움증, 기타 단순 헤르페스 바이러스 감염, 안구 건조증, 호산구 증가증. (6.1)
- 천식(발생률 ≥1%): 주사 부위 반응, 인두통, 호산구 증가증. (6.1)
- 비강 용종을 동반한 만성 비부비강염(발생률 ≥1%): 주사 부위 반응, 호산구 증가증, 불면증, 치통, 위염, 관절통, 결막염. (6.1)
- 호산구성 식도염(발생률 ≥2%): 주사 부위 반응, 상기도 감염, 관절통, 헤르페스 바이러스 감염. (6.1)
- 결절성 가려움증(발생률 ≥2%): 비인두염, 결막염, 헤르페스 감염, 현기증, 근육통, 설사. (6.1)
- 만성 폐쇄성 폐 질환(발생률 ≥2%): 바이러스 감염, 두통, 비인두염, 요통, 설사, 관절통, 요로 감염, 국소 투여 반응, 비염, 호산구 증가증, 치통, 위염. (6.1)
의심되는 부작용을 보고하려면 Regeneron에 1-844-387-4936 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2024년 9월
목차
전문 정보: 목차*
1 적응증 및 사용법
1.1 아토피 피부염
1.2 천식
1.3 비강용종을 동반한 만성 비부비동염
1.4 호산구성 식도염
1.5 결절성 가려움증
1.6 만성 폐쇄성 폐 질환
2 용법 및 용량
2.1 중요한 투여 지침
2.2 치료 전 예방 접종
2.3 아토피 피부염에 대한 권장 용량
2.4 천식에 대한 권장 용량
2.5 비강용종을 동반한 만성 비부비동염에 대한 권장 용량
2.6 호산구성 식도염에 대한 권장 용량
2.7 결절성 가려움증에 대한 권장 용량
2.8 만성 폐쇄성 폐 질환에 대한 권장 용량
2.9 누락된 용량
2.10 사용 준비
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 결막염 및 각막염
5.3 호산구성 질환
5.4 천식 또는 만성 폐쇄성 폐 질환의 급성 증상 또는 급성 악화 질환
5.5 코르티코스테로이드 용량 급격히 감소와 관련된 위험
5.6 동반 천식 환자
5.7 관절통
5.8 기생충 (회충) 감염
5.9 예방 접종
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과량 투여
11 설명
12 약리 작용
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 아토피 피부염
14.2 천식
14.3 비강용종을 동반한 만성 비부비동염
14.4 호산구성 식도염
14.5 결절성 가려움증
14.6 만성 폐쇄성 폐 질환
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1 아토피 피부염
DUPIXENT는 국소 처방 치료로 질환이 적절히 조절되지 않거나 이러한 치료법이 권장되지 않는 중등도에서 중증의 아토피 피부염(AD)을 앓고 있는 성인 및 6개월 이상의 소아 환자 치료에 적응증이 있습니다. DUPIXENT는 국소 코르티코스테로이드와 함께 또는 단독으로 사용할 수 있습니다.
1.2 천식
DUPIXENT는 호산구 표현형을 특징으로 하거나 경구 코르티코스테로이드 의존성 천식을 동반한 6세 이상의 성인 및 소아 환자에서 추가 유지 치료제로 적응증이 있습니다 [임상 연구 (14) 참조].
1.3 비용종을 동반한 만성 부비동염
DUPIXENT는 부적절하게 조절된 비용종을 동반한 만성 부비동염(CRSwNP)을 앓고 있는 성인 및 12세 이상의 소아 환자에서 추가 유지 치료제로 적응증이 있습니다.
2 투여 및 관리
2.1 중요한 투여 지침
DUPIXENT는 피하 주사로 투여합니다.
DUPIXENT는 의료 전문가의 지시에 따라 사용하도록 되어 있습니다. “사용 지침”에 따라 DUPIXENT의 준비 및 투여에 대한 적절한 교육을 환자 및/또는 보호자에게 제공하십시오.
사전 충전 펜 또는 사전 충전 주사기 사용
DUPIXENT 사전 충전 펜은 성인 및 2세 이상의 소아 환자에게 사용하도록 되어 있습니다.
DUPIXENT 사전 충전 주사기는 성인 및 6개월 이상의 소아 환자에게 사용하도록 되어 있습니다.
12세 이상의 보호자 또는 환자는 사전 충전 주사기 또는 사전 충전 펜을 사용하여 DUPIXENT를 주사할 수 있습니다. 12세에서 17세 사이의 소아 환자의 경우 성인의 감독 하에 DUPIXENT를 투여하십시오. 6개월에서 12세 미만의 소아 환자의 경우 보호자가 DUPIXENT를 투여하십시오.
투여 지침
초기 600mg 용량을 복용하는 AD, 천식 및 PN 환자의 경우, 두 개의 DUPIXENT 300mg 주사를 서로 다른 주사 부위에 투여하십시오.
초기 400mg 용량을 복용하는 AD 및 천식 환자의 경우, 두 개의 DUPIXENT 200mg 주사를 서로 다른 주사 부위에 투여하십시오.
배꼽 주위 2인치(5cm)를 제외하고 허벅지 또는 복부에 피하 주사를 투여하십시오. 보호자가 주사를 투여하는 경우 상완도 사용할 수 있습니다.
각 주사마다 주사 부위를 바꾸십시오. DUPIXENT를 붉거나, 손상되거나, 멍이 들거나, 흉터가 있는 피부에 주사하지 마십시오.
DUPIXENT “사용 지침”에는 DUPIXENT의 준비 및 투여에 대한 자세한 지침이 포함되어 있습니다 [사용 지침 참조].
2.2 치료 전 예방 접종
DUPIXENT 치료를 시작하기 전에 현재 예방 접종 지침에 따라 모든 연령에 적합한 예방 접종을 완료하는 것을 고려하십시오 [경고 및 주의 사항 (5.9) 참조].
2.3 아토피 피부염에 대한 권장 용량
2.4 천식에 대한 권장 용량
성인 및 12세 이상 소아 환자의 용량
성인 및 12세 이상 소아 환자의 DUPIXENT 권장 용량은 표 3에 명시되어 있습니다.
| 초기 적재 용량 | 후속 용량 |
|---|---|
| 400 mg (200 mg 주사 2회) | 2주마다 200 mg (Q2W) |
| 또는 | |
| 600 mg (300 mg 주사 2회) | 2주마다 300 mg (Q2W) |
| 경구 코르티코스테로이드 의존성 천식 또는 동반 중등도~중증 아토피 피부염이 있는 환자 또는 동반 만성 비부비동염과 비용종이 있는 성인의 용량 | |
| 600 mg (300 mg 주사 2회) | 2주마다 300 mg (Q2W) |
6세에서 11세 사이 소아 환자의 용량
6세에서 11세 사이 소아 환자의 DUPIXENT 권장 용량은 표 4에 명시되어 있습니다.
| 체중 | 초기* 및 후속 용량 |
|---|---|
|
|
| 15kg 이상 30kg 미만 | 4주마다 300 mg (Q4W) |
| 30kg 이상 | 격주로 200 mg (Q2W) |
천식과 동반 중등도~중증 AD가 있는 6세에서 11세 사이 소아 환자의 경우 초기 적재 용량을 포함한 표 2에 따른 권장 용량을 따르십시오 [용량 및 투여 (2.3) 참조].
2.6 호산구성 식도염에 대한 권장 용량
1세 이상 체중 15kg 이상 성인 및 소아 환자의 DUPIXENT 권장 용량은 표 5에 명시되어 있습니다.
| 체중 | 권장 용량 |
|---|---|
| 15kg 이상 30kg 미만 | 격주로 200 mg (Q2W) |
| 30kg 이상 40kg 미만 | 격주로 300 mg (Q2W) |
| 40kg 이상 | 매주 300 mg (QW) |
2.7 결절성 가려움증에 대한 권장 용량
성인 환자에 대한 DUPIXENT의 권장 용량은 600mg(300mg 주사 2회)의 초기 용량을 투여한 후 격주(Q2W)로 300mg을 투여하는 것입니다.
2.9 누락된 용량
주간 용량을 누락한 경우, 가능한 한 빨리 투여하고 마지막 투여한 날짜부터 새로운 주간 일정을 시작하십시오.
격주 용량을 누락한 경우, 누락된 용량부터 7일 이내에 주사를 투여하고 환자의 원래 일정을 재개하십시오. 누락된 용량을 7일 이내에 투여하지 않은 경우, 원래 일정의 다음 용량까지 기다리십시오.
4주마다 용량을 누락한 경우, 누락된 용량부터 7일 이내에 주사를 투여하고 환자의 원래 일정을 재개하십시오. 누락된 용량을 7일 이내에 투여하지 않은 경우, 이 날짜를 기준으로 새로운 일정을 시작하여 용량을 투여하십시오.
2.10 사용 준비
주사 전에 DUPIXENT를 냉장고에서 꺼내어 바늘 캡을 제거하지 않고 실온(300mg/2mL 사전 충전 주사기 또는 사전 충전 펜의 경우 45분, 200mg/1.14mL 사전 충전 주사기 또는 사전 충전 펜의 경우 30분)에 도달하도록 하십시오. 냉장고에서 꺼낸 후 DUPIXENT는 14일 이내에 사용하거나 폐기해야 합니다.
투여 전에 DUPIXENT를 시각적으로 검사하여 이물질과 변색이 있는지 확인하십시오. DUPIXENT는 투명하거나 약간 유백색이며 무색에서 연한 노란색 용액입니다. 액체에 눈에 띄는 이물질이 있거나 변색되거나 흐린 경우(투명하거나 약간 유백색이며 무색에서 연한 노란색이 아닌 경우) 사용하지 마십시오. DUPIXENT는 방부제를 함유하지 않으므로 사전 충전 주사기 또는 사전 충전 펜에 남아 있는 사용하지 않은 제품은 폐기하십시오.
3 제형 및 함량
DUPIXENT는 다음과 같은 형태의 투명하거나 약간 불투명한 무색에서 옅은 노란색 용액입니다.
주사기 바늘 보호대가 있는 1회용 미리 채워진 주사기:
- 주사: 300 mg/2 mL
- 주사: 200 mg/1.14 mL
1회용 미리 채워진 펜:
- 주사: 300 mg/2 mL
- 주사: 200 mg/1.14 mL
4 금기사항
DUPIXENT는 dupilumab 또는 DUPIXENT의 어떤 첨가제에 알려진 과민증이 있는 환자에게 금기입니다 [경고 및 주의 사항 (5.1) 참조].
5 경고 및 주의사항
5.1 Hypersensitivity
과민 반응은 아나필락시스, 혈청병 또는 혈청병 유사 반응, 혈관부종, 전신 두드러기, 발진, 결절홍반 및 다형홍반을 포함하여 보고되었습니다. 임상적으로 유의미한 과민 반응이 발생하면 적절한 치료를 시작하고 DUPIXENT를 중단하십시오 [이상 반응 (6.1, 6.2) 및 임상 약리학 (12.6) 참조].
5.2 결막염 및 각막염
임상 시험에서 결막염 및 각막염 이상 반응이 보고되었습니다.
결막염 및 각막염은 위약을 투여받은 환자보다 DUPIXENT를 투여받은 AD 환자에서 더 자주 발생했습니다. 결막염은 가장 자주 보고된 안구 질환이었습니다. 결막염 또는 각막염이 있는 대부분의 환자는 치료 기간 동안 회복되었거나 회복 중이었습니다 [이상 반응 (6.1) 참조].
천식 환자의 경우 DUPIXENT와 위약 간에 결막염 및 각막염의 빈도가 유사했습니다 [이상 반응 (6.1) 참조].
CRSwNP 성인 환자의 경우 24주 안전성 풀에서 결막염 빈도는 DUPIXENT 그룹에서 2%, 위약 그룹에서 1%였습니다. 이러한 환자들은 회복되었습니다. CRSwNP 개발 프로그램에서는 각막염 사례가 보고되지 않았습니다 [이상 반응 (6.1) 참조].
EoE 환자의 경우 위약 대조 시험에서 DUPIXENT 그룹에서 결막염 및 각막염 보고가 없었습니다 [이상 반응 (6.1) 참조].
PN 환자의 경우 결막염 빈도는 DUPIXENT 그룹에서 4%, 위약 그룹에서 1%였습니다. 이러한 환자들은 치료 기간 동안 회복되었거나 회복 중이었습니다. PN 개발 프로그램에서는 각막염 사례가 보고되지 않았습니다 [이상 반응 (6.1) 참조].
COPD 환자의 경우 결막염 및 각막염의 빈도는 DUPIXENT 그룹에서 각각 1.4% 및 0.1%였고 위약 그룹에서는 1% 및 0%였습니다 [이상 반응 (6.1) 참조].
시판 후 환경에서도 DUPIXENT와 함께 결막염 및 각막염 이상 사례가 보고되었으며, 주로 AD 환자에서 발생했습니다. 일부 환자들은 결막염 또는 각막염과 관련된 시각 장애(예: 시야 흐림)를 보고했습니다.
환자 또는 보호자에게 새로운 안구 증상이 나타나거나 악화되면 의료 서비스 제공자에게 보고하도록 조언하십시오. 적절하게 표준 치료 후에도 해결되지 않는 결막염 또는 각막염을 시사하는 징후 및 증상이 나타나는 환자에 대해서는 안과 검사를 고려하십시오 [이상 반응 (6.1) 참조].
5.3 호산구 증가증
천식 치료를 받는 환자는 때때로 전신 코르티코스테로이드 요법으로 치료되는 호산구성 육아종증을 동반한 다발혈관염과 일치하는 호산구성 폐렴 또는 혈관염의 임상적 특징을 보이는 심각한 전신 호산구 증가증을 나타낼 수 있습니다. 이러한 사건은 경구 코르티코스테로이드 요법의 감소와 관련될 수 있습니다. 의료 서비스 제공자는 호산구 증가증이 있는 환자에게서 나타나는 혈관염성 발진, 폐 증상 악화, 심장 합병증 및/또는 신경병증에 주의해야 합니다. 호산구성 폐렴 사례는 천식 개발 프로그램에 참여한 성인 환자에서 보고되었으며 호산구성 육아종증을 동반한 다발혈관염과 일치하는 혈관염 사례는 천식 개발 프로그램에 참여한 성인 환자뿐만 아니라 CRSwNP 개발 프로그램에서 동반 질환 천식이 있는 성인 환자에서 DUPIXENT와 함께 보고되었습니다. DUPIXENT와 이러한 상태 사이의 인과 관계는 확립되지 않았습니다.
5.4 천식 또는 만성 폐쇄성 폐 질환의 급성 증상 또는 급성 악화 질환
DUPIXENT는 천식 또는 COPD의 급성 증상 또는 급성 악화를 치료하는 데 사용해서는 안 됩니다. 급성 기관지 경련 또는 천식 지속증을 치료하기 위해 DUPIXENT를 사용하지 마십시오. DUPIXENT로 치료를 시작한 후 천식 또는 COPD가 조절되지 않거나 악화되면 환자는 의사의 진료를 받아야 합니다.
5.5 코르티코스테로이드 용량의 갑작스러운 감소와 관련된 위험
DUPIXENT로 치료를 시작할 때 전신, 국소 또는 흡입 코르티코스테로이드를 갑자기 중단하지 마십시오. 코르티코스테로이드 용량 감소는 적절한 경우 점진적으로 수행해야 하며 의료 서비스 제공자의 직접 감독 하에 수행해야 합니다. 코르티코스테로이드 용량 감소는 전신 금단 증상 및/또는 이전에 전신 코르티코스테로이드 요법으로 억제되었던 상태를 드러낼 수 있습니다.
5.7 관절통
DUPIXENT 사용과 관련하여 관절통이 보고되었으며 일부 환자는 관절 증상과 관련된 보행 장애 또는 이동성 감소를 보고했습니다. 일부 사례는 입원으로 이어졌습니다 [이상 반응 (6.1) 참조]. 시판 후 보고에서 관절통 발병은 DUPIXENT의 첫 번째 용량 후 며칠에서 몇 달까지 다양했습니다. 일부 환자의 증상은 DUPIXENT 치료를 계속하는 동안 해결되었고 다른 환자는 DUPIXENT를 중단한 후 회복되었거나 회복 중이었습니다.
새로운 관절 증상이 나타나거나 악화되면 의료 서비스 제공자에게 보고하도록 환자에게 알리십시오. 증상이 지속되거나 악화되면 류마티스 평가 및/또는 DUPIXENT 중단을 고려하십시오.
5.8 기생충(蠕虫) 감염
알려진 기생충 감염 환자는 임상 연구 참여에서 제외되었습니다. DUPIXENT가 기생충 감염에 대한 면역 반응에 영향을 미치는지는 알려져 있지 않습니다.
DUPIXENT 치료를 시작하기 전에 기존 기생충 감염이 있는 환자를 치료하십시오. DUPIXENT 치료를 받는 동안 환자가 감염되었고 구충 치료에 반응하지 않으면 감염이 해결될 때까지 DUPIXENT 치료를 중단하십시오. 소아 천식 개발 프로그램에 참여한 6~11세 소아 피험자에서 기생충 감염(요충 감염 5건, 회충증 1건)의 이상 반응이 보고되었습니다. [이상 반응(6.1) 참조].
5.9 예방 접종
DUPIXENT 치료를 시작하기 전에 현재 예방 접종 지침에 따라 권장되는 모든 연령에 맞는 예방 접종을 완료하는 것을 고려하십시오. DUPIXENT 치료 중에는 생백신 사용을 피하십시오. DUPIXENT 치료 중 생백신 투여가 이러한 백신의 안전성 또는 유효성에 영향을 미치는지는 알려져 있지 않습니다. DUPIXENT와 비활성화 백신의 병용 투여에 대한 데이터는 제한적입니다. [임상 약리학(12.2) 참조].
6 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 부분에서 설명되어 있습니다.
- 과민증 [경고 및 주의 사항 (5.1) 참조 ]
- 결막염 및 각막염 [경고 및 주의 사항 (5.2) 참조 ]
- 관절통 [경고 및 주의 사항 (5.7) 참조 ]
- 기생충 (회충) 감염 [경고 및 주의 사항 (5.8) 참조 ]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
아토피 피부염 성인
3개의 무작위 배정, 이중 맹검, 위약 대조, 다기관 임상 시험(SOLO 1, SOLO 2 및 CHRONOS)과 1개의 용량 범위 시험(AD-1021)에서 중등도에서 중증의 아토피 피부염 환자를 대상으로 DUPIXENT의 안전성을 평가했습니다. 안전성 모집단의 평균 연령은 38세였으며, 환자의 41%가 여성, 67%가 백인, 24%가 아시아인, 6%가 흑인이었습니다. 동반 질환 측면에서 환자의 48%가 천식, 49%가 알레르기성 비염, 37%가 음식 알레르기, 27%가 알레르기성 결막염을 앓고 있었습니다. 이 4개의 임상 시험에서 1472명의 환자가 DUPIXENT의 피하 주사를 받았으며, 국소 코르티코스테로이드(TCS)를 병용하거나 병용하지 않았습니다.
중등도에서 중증의 아토피 피부염에 대한 개발 프로그램에서 총 739명의 환자가 DUPIXENT를 1년 이상 투여 받았습니다.
SOLO 1, SOLO 2 및 AD-1021은 16주까지 DUPIXENT 단독 요법의 안전성을 위약과 비교했습니다. CHRONOS는 52주까지 DUPIXENT + TCS의 안전성을 위약 + TCS와 비교했습니다.
AD-1225는 다기관, 공개 라벨 연장(OLE) 시험으로, 이전에 DUPIXENT의 대조 시험에 참여했거나 SOLO 1 또는 SOLO 2에 대한 선별 검사를 받은 중등도에서 중증의 아토피 피부염 성인을 대상으로 260주까지 DUPIXENT의 반복 투여에 대한 장기 안전성을 평가했습니다. AD-1225의 안전성 데이터는 2677명의 환자에서 DUPIXENT 200mg QW, 300mg QW 및 300mg Q2W에 대한 노출을 반영하며, 여기에는 52주 이상 노출된 2254명, 100주 이상 노출된 1224명, 148주 이상 노출된 561명, 260주 이상 노출된 179명이 포함됩니다.
0주에서 16주(SOLO 1, SOLO 2, CHRONOS 및 AD-1021)
DUPIXENT 단독 요법 시험(SOLO 1, SOLO 2 및 AD-1021)에서 16주까지 유해 사건으로 인해 치료를 중단한 환자의 비율은 DUPIXENT 300mg Q2W군과 위약군 모두에서 1.9%였습니다. 표 6은 DUPIXENT 300mg Q2W 단독 요법군과 DUPIXENT + TCS군에서 각각의 비교군보다 높은 비율로 발생한 유해 반응을 요약한 것입니다. 이는 치료 첫 16주 동안의 결과입니다.
| 유해 반응 | DUPIXENT 단독 요법* | DUPIXENT + TCS† | ||
|---|---|---|---|---|
| DUPIXENT 300mg Q2W‡ |
위약 | DUPIXENT 300mg Q2W‡ + TCS |
위약 + TCS | |
| N=529 n (%) |
N=517 n (%) |
N=110 n (%) |
N=315 n (%) |
|
|
||||
| 주사 부위 반응 | 51 (10) | 28 (5) | 11 (10) | 18 (6) |
| 결막염§ | 51 (10) | 12 (2) | 10 (9) | 15 (5) |
| Blepharitis | 2 (<1) | 1 (<1) | 5 (5) | 2 (1) |
| Oral herpes | 20 (4) | 8 (2) | 3 (3) | 5 (2) |
| Keratitis¶ | 1 (<1) | 0 | 4 (4) | 0 |
| Eye pruritus | 3 (1) | 1 (<1) | 2 (2) | 2 (1) |
| Other herpes simplex virus infection# | 10 (2) | 6 (1) | 1 (1) | 1 (<1) |
| Dry eye | 1 (<1) | 0 | 2 (2) | 1 (<1) |
52주까지의 안전성 (CHRONOS)
52주까지 DUPIXENT와 동시 TCS 시험(CHRONOS)에서, 부작용으로 인해 치료를 중단한 대상자의 비율은 DUPIXENT 300mg Q2W + TCS 그룹에서 1.8%, 위약 + TCS 그룹에서 7.6%였습니다. 두 명의 대상자가 부작용으로 인해 DUPIXENT를 중단했습니다: 아토피 피부염(1명)과 박탈성 피부염(1명).
52주까지 DUPIXENT + TCS의 안전성 프로파일은 일반적으로 16주에 관찰된 안전성 프로파일과 일치했습니다.
아토피 피부염이 있는 12세에서 17세까지의 소아 대상자
DUPIXENT의 안전성은 중등도에서 중증 AD가 있는 12세에서 17세까지의 소아 대상자 250명을 대상으로 한 시험(AD-1526)에서 평가되었습니다. 이러한 대상자에서 16주까지 DUPIXENT의 안전성 프로파일은 AD가 있는 성인에서 관찰된 안전성 프로파일과 유사했습니다.
DUPIXENT의 장기 안전성은 중등도에서 중증 AD가 있는 12세에서 17세까지의 소아 대상자를 대상으로 한 오픈 라벨 연장 연구(AD-1434)에서 평가되었습니다. 52주까지 추적 관찰된 대상자에서 DUPIXENT의 안전성 프로파일은 AD-1526에서 16주에 관찰된 안전성 프로파일과 유사했습니다. 12세에서 17세까지의 소아 대상자에서 관찰된 DUPIXENT의 장기 안전성 프로파일은 AD가 있는 성인에서 관찰된 프로파일과 일치했습니다.
아토피 피부염이 있는 6세에서 11세까지의 소아 대상자
DUPIXENT와 동시 TCS의 안전성은 중증 AD가 있는 6세에서 11세까지의 소아 대상자 367명을 대상으로 한 시험(AD-1652)에서 평가되었습니다. 이러한 대상자에서 16주까지 DUPIXENT + TCS의 안전성 프로파일은 AD가 있는 성인 및 12세에서 17세까지의 소아 대상자를 대상으로 한 시험에서 얻은 안전성 프로파일과 유사했습니다.
DUPIXENT ± TCS의 장기 안전성은 AD가 있는 6세에서 11세까지의 소아 대상자 368명을 대상으로 한 오픈 라벨 연장 연구(AD-1434)에서 평가되었습니다. 이 연구에 참여한 대상자 중 110명(30%)은 AD-1434에 등록할 당시 중등도 AD를 보였고, 72명(20%)은 중증 AD를 보였습니다. 52주까지 추적 관찰된 대상자에서 DUPIXENT ± TCS의 안전성 프로파일은 AD-1652에서 16주까지 관찰된 안전성 프로파일과 유사했습니다. 6세에서 11세까지의 소아 대상자에서 관찰된 DUPIXENT ± TCS의 장기 안전성 프로파일은 AD가 있는 성인 및 12세에서 17세까지의 소아 대상자에서 관찰된 프로파일과 일치했습니다 [특정 인구 집단에서의 사용 (8.4) 참조].
아토피 피부염이 있는 6개월에서 5세까지의 소아 대상자
DUPIXENT와 동시 TCS의 안전성은 중등도에서 중증 AD가 있는 6개월에서 5세까지의 소아 대상자 161명을 대상으로 한 시험(AD-1539)에서 평가되었습니다. 이러한 대상자에서 16주까지 DUPIXENT + TCS의 안전성 프로파일은 AD가 있는 성인 및 6세에서 17세까지의 소아 대상자를 대상으로 한 시험에서 얻은 안전성 프로파일과 유사했습니다.
DUPIXENT ± TCS의 장기 안전성은 AD가 있는 6개월에서 5세까지의 소아 대상자 180명을 대상으로 한 오픈 라벨 연장 연구(AD-1434)에서 평가되었습니다. 대부분의 대상자는 4주마다 DUPIXENT 300mg으로 치료되었습니다. 52주까지 추적 관찰된 대상자에서 DUPIXENT ± TCS의 안전성 프로파일은 AD-1539에서 16주까지 관찰된 안전성 프로파일과 유사했습니다. 6개월에서 5세까지의 소아 대상자에서 관찰된 DUPIXENT ± TCS의 장기 안전성 프로파일은 AD가 있는 성인 및 6세에서 17세까지의 소아 대상자에서 관찰된 프로파일과 일치했습니다. 또한, DUPIXENT ± TCS로 치료받은 소아 대상자 9명(5%)에서 수족구병이 보고되었고, 4명(2%)에서 피부 유두종이 보고되었습니다. 이러한 경우는 연구 약물 중단으로 이어지지 않았습니다 [특정 인구 집단에서의 사용 (8.4) 참조].
손과/또는 발에 병변이 있는 아토피 피부염
DUPIXENT의 안전성은 손과/또는 발에 중등도에서 중증 병변이 있는 아토피 피부염이 있는 성인 및 12세에서 17세까지의 소아 대상자 133명을 대상으로 한 16주, 다기관, 무작위 배정, 이중 맹검, 병행군, 위약 대조 시험(Liberty-AD-HAFT)에서 평가되었습니다 [임상 연구 (14) 참조]. 이 시험에서 67명의 대상자가 DUPIXENT를 투여받았고, 66명의 대상자가 위약을 투여받았습니다. DUPIXENT로 치료받은 대상자는 연령과 체중에 따라 권장 용량을 투여받았습니다 [용량 및 투여 (2.3) 참조]. 이러한 대상자에서 16주까지 DUPIXENT의 안전성 프로파일은 6개월 이상의 성인 및 소아 대상자를 대상으로 한 중등도에서 중증 AD 연구에서 얻은 안전성 프로파일과 일치했습니다.
천식
천식이 있는 성인 및 12세 이상의 소아 대상자
24주에서 52주까지 지속되는 3개의 무작위 배정, 위약 대조, 다기관 시험(DRI12544, QUEST 및 VENTURE)에서 중등도에서 중증 천식(AS)이 있는 성인 및 12세에서 17세까지의 소아 대상자 총 2888명을 평가했습니다. 이 중 2678명은 중간에서 고용량 흡입용 코르티코스테로이드와 추가 조절제(들)를 정기적으로 사용했음에도 불구하고 등록 전 1년 동안 1회 이상의 중증 악화를 경험한 병력이 있었습니다(DRI12544 및 QUEST). 고용량 흡입용 코르티코스테로이드와 최대 2개의 추가 조절제를 투여받는 경구용 코르티코스테로이드 의존성 천식이 있는 대상자 총 210명이 등록되었습니다(VENTURE). 안전성 모집단(DRI12544 및 QUEST)은 12세에서 87세까지였으며, 그 중 63%가 여성이었고, 82%가 백인이었습니다. DUPIXENT 200mg 또는 300mg은 각각 400mg 또는 600mg의 초기 용량을 투여한 후 2주마다 피하 주사했습니다.
DRI12544 및 QUEST에서, 부작용으로 인해 치료를 중단한 대상의 비율은 위약군의 경우 4%, DUPIXENT 200 mg Q2W군의 경우 3%, DUPIXENT 300 mg Q2W군의 경우 6%였습니다.
표 7은 DRI12544 및 QUEST에서 DUPIXENT로 치료받은 대상에서 발생한 부작용 중, 발생률이 1% 이상이고 각 비교군보다 높은 부작용을 요약한 것입니다.
| 부작용 | DRI12544 및 QUEST | ||
|---|---|---|---|
| DUPIXENT 200 mg Q2W |
DUPIXENT 300 mg Q2W |
위약 | |
| N=779 n (%) |
N=788 n (%) |
N=792 n (%) |
|
|
|||
| 주사 부위 반응* | 111 (14%) | 144 (18%) | 50 (6%) |
| 인두 통증 | 13 (2%) | 19 (2%) | 7 (1%) |
| 호산구증가증† | 17 (2%) | 16 (2%) | 2 (<1%) |
6세에서 11세까지의 소아 천식 환자
DUPIXENT의 안전성은 중등도에서 중증 천식이 있는 6세에서 11세까지의 소아 405명에서 평가되었습니다(VOYAGE). 52주까지 이러한 대상에서 DUPIXENT의 안전성 프로파일은 12세 이상의 성인 및 소아 대상에서 중등도에서 중증 천식이 있는 대상에 대한 연구에서 관찰된 안전성 프로파일과 유사했으며, 기생충 감염이 추가되었습니다. 기생충 감염은 DUPIXENT군에서 2.2%(6명)에서 보고되었고, 위약군에서는 0.7%(1명)에서 보고되었습니다. 대부분의 경우는 장내 기생충 감염으로, DUPIXENT군에서 1.8%(5명)에서 보고되었고, 위약군에서는 보고되지 않았습니다. DUPIXENT군에서 회충 감염이 1건 있었습니다. 모든 기생충 감염 사례는 경증에서 중등도였으며, 대상은 DUPIXENT 치료 중단 없이 기생충 치료로 회복되었습니다.
비강 용종을 동반한 만성 비부비동염
비강 용종을 동반한 만성 비부비동염(CRSwNP)이 있는 성인 대상 722명이 24주에서 52주까지 지속되는 2건의 무작위 배정, 위약 대조, 다기관 시험(SINUS-24 및 SINUS-52)에서 평가되었습니다. 안전성 집단은 두 연구의 첫 24주 치료 데이터로 구성되었습니다.
안전성 집단에서, 유해 사건으로 인해 치료를 중단한 성인 대상의 비율은 위약군의 5%와 DUPIXENT 300mg Q2W군의 2%였습니다.
표 8은 SINUS-24 및 SINUS-52에서 DUPIXENT로 치료받은 성인 대상에서 1% 이상의 비율로 발생했고, 해당 비교군보다 높은 비율로 발생한 유해 반응을 요약합니다.
| 유해 반응 | SINUS-24 및 SINUS-52 | |
|---|---|---|
| DUPIXENT 300mg Q2W |
위약 | |
| N=440 n (%) |
N=282 n (%) |
|
| 투여 부위 반응* | 28 (6%) | 12 (4%) |
| 결막염† | 7 (2%) | 2 (1%) |
| 관절통 | 14 (3%) | 5 (2%) |
| 위염 | 7 (2%) | 2 (1%) |
| 불면증 | 6 (1%) | 0 (<1%) |
| 호산구 증가증 | 5 (1%) | 1 (<1%) |
| 치통 | 5 (1%) | 1 (<1%) |
DUPIXENT의 52주차까지의 안전성 프로파일은 일반적으로 24주차에 관찰된 안전성 프로파일과 일치했습니다.
호산구성 식도염
성인 및 12세 이상 소아 대상자의 EoE
총 239명의 성인 및 12세 이상 소아 대상자(체중 40kg 이상)로 EoE를 가진 대상자를 대상으로 무작위 배정, 이중맹검, 병행군, 다기관, 위약 대조 시험(2개의 24주 치료 기간 포함, 연구 EoE-1 A부 및 B부)에서 평가했으며, DUPIXENT 300mg QW 또는 위약을 투여받았습니다 [임상 연구(14.4) 참조].
유해 사건으로 인해 치료를 중단한 대상자의 비율은 위약군의 경우 2%, DUPIXENT 300mg QW군의 경우 2%였습니다.
표 9는 DUPIXENT로 치료받은 대상자에서 발생률이 2% 이상이고 각 비교군보다 높은 유해 반응을 요약한 것입니다.
| 연구 EoE-1 A부 및 B부 | ||
|---|---|---|
| 유해 반응 | DUPIXENT 300mg QW N=122 n (%) |
위약 N=117 n (%) |
| 주사 부위 반응* | 46 (38%) | 39 (33%) |
| 상기도 감염† | 22 (18%) | 12 (10%) |
| 관절통 | 3 (2%) | 1 (1%) |
| 헤르페스 바이러스 감염‡ | 3 (2%) | 1 (1%) |
DUPIXENT의 안전성 프로파일은 체중이 40kg 이상인 12세에서 17세 사이의 소아 72명과 성인을 대상으로 한 A부와 B부에서 유사했습니다.
체중이 15kg 이상인 1세에서 11세 사이의 EoE 소아
체중이 15kg 이상인 1세에서 11세 사이의 EoE 소아 61명을 대상으로 초기 16주 위약 대조 치료 기간(EoE-2 연구 A부)과 36주 연장 활성 치료 기간(EoE-2 연구 B부)을 포함하는 무작위 배정, 눈가림, 평행군, 다기관 연구를 실시했습니다. A부의 피험자는 DUPIXENT 또는 위약을 체중 기반 용량으로 투여받았습니다 [임상 연구(14.4) 참조]. B부의 모든 피험자는 A부를 완료했으며 B부에서 DUPIXENT를 체중 기반 용량으로 활성 치료를 받았습니다(N=47).
EoE-2 연구 A부 16주까지 DUPIXENT의 안전성 프로파일은 일반적으로 EoE를 가진 성인 및 12세 이상 소아의 안전성 프로파일과 유사했습니다. B부에서 DUPIXENT를 투여받은 피험자 1명에게서 기생충 감염이 보고되었습니다.
결절성 가려움증
결절성 가려움증(PN)을 가진 성인 309명을 대상으로 24주 무작위 배정, 이중 눈가림, 위약 대조, 다기관 연구 2건(PRIME 및 PRIME2)을 실시했습니다. 안전성 집단에는 두 연구 모두에서 24주 치료 기간과 12주 추적 기간의 데이터가 포함되었습니다.
부작용으로 인해 치료를 중단한 피험자의 비율은 위약군의 경우 3%, DUPIXENT 300mg Q2W군의 경우 0%였습니다.
안전성 집단의 평균 연령은 49세였으며, 피험자의 65%가 여성, 56%가 백인, 34%가 아시아인, 6%가 흑인 또는 아프리카계 미국인이었습니다. 동반 질환이 있는 피험자는 아토피 병력이 있는 피험자(아토피 피부염, 알레르기성 비염/결막염, 천식 또는 음식 알레르기의 병력이 있는 것으로 정의됨) 43%, 갑상선 기능 저하증 병력이 있는 피험자 8%, 제2형 당뇨병 병력이 있는 피험자 9%를 포함했습니다.
표 10은 PRIME 및 PRIME2에서 DUPIXENT로 치료받은 피험자에서 2% 이상 발생했고 해당 비교군보다 발생률이 높았던 부작용을 요약한 것입니다.
만성 폐쇄성 폐 질환
52주 치료 기간 동안 무작위 배정, 이중 맹검, 다기관, 병행군, 위약 대조 시험 2건(BOREAS 및 NOTUS)에서 부적절하게 조절된 만성 폐쇄성 폐 질환(COPD) 및 호산구 표현형을 가진 성인 피험자 1874명을 평가했습니다. [임상 연구(14.6) 참조] 무작위 배정된 피험자 중 1872명은 DUPIXENT 300mg 또는 위약을 2주마다(Q2W) 피하 주사로 최소 1회 투여받았습니다. DUPIXENT의 안전성은 BOREAS 및 NOTUS에서 DUPIXENT로 치료받은 성인 피험자 938명으로 구성된 풀링된 안전성 모집단에서 평가했습니다. DUPIXENT로 치료받은 피험자 중 98%는 기준선에서 흡입 삼중 요법(흡입 코르티코스테로이드, 장시간 작용 베타 작용제 및 장시간 작용 무스카린 길항제 포함)을 사용했으며 97%는 만성 기관지염을 앓고 있었습니다.
표 11은 BOREAS 및 NOTUS 시험에서 DUPIXENT로 치료받은 피험자 중 2% 이상에서 발생했고 위약보다 발생률이 높았던 이상 반응을 요약한 것입니다.
| 이상 반응 | BOREAS 및 NOTUS | |
|---|---|---|
| DUPIXENT 300 mg Q2W |
위약 | |
| N=938 n (%) |
N=934 n (%) |
|
| 바이러스 감염* | 133 (14.2) | 115 (12.3) |
| 두통 | 73 (7.8) | 62 (6.6) |
| 비인두염 | 73 (7.8) | 69 (7.4) |
| 요통 | 42 (4.5) | 29 (3.1) |
| 설사* | 35 (3.7) | 30 (3.2) |
| 관절통 | 29 (3.1) | 25 (2.7) |
| 요로 감염 | 28 (3.0) | 18 (1.9) |
| 국소 투여 반응* | 26 (2.8) | 6 (0.6) |
| 주사 부위 반응 | 11 (1.2) | 2 (0.2) |
| 비염 | 24 (2.6) | 17 (1.8) |
| 호산구증† | 22 (2.3) | 7 (0.7) |
| 치통 | 20 (2.1) | 11 (1.2) |
| 위염 | 19 (2) | 7 (0.7) |
AD, 천식, CRSwNP, EoE, PN 및 COPD에 대한 특정 유해 반응
결막염 및 각막염
AD 성인 환자에서 16주 단독 요법 시험(SOLO 1, SOLO 2 및 AD-1021) 동안 300mg 2주마다 투여군에서는 10%(100 환자-년당 34명)에서 결막염이 보고되었고, 위약 군에서는 2%(100 환자-년당 8명)에서 보고되었습니다. 병용 요법 AD 시험(CHRONOS)의 52주 치료 기간 동안 DUPIXENT 300mg 2주마다 + TCS 군에서는 16%(100 환자-년당 20명)에서 결막염이 보고되었고, 위약 + TCS 군에서는 9%(100 환자-년당 10명)에서 보고되었습니다. 260주까지 데이터가 있는 장기 OLE 시험(AD-1225) 동안 DUPIXENT 군에서는 21%(100 환자-년당 12명)에서 결막염이 보고되었습니다.
16주까지 DUPIXENT AD 단독 요법 시험(SOLO 1, SOLO 2 및 AD-1021)에서 DUPIXENT 군에서는 <1%(100 환자-년당 1명)에서 각막염이 보고되었고, 위약 군에서는 0%(100 환자-년당 0명)에서 보고되었습니다. 52주 DUPIXENT + 국소 코르티코스테로이드(TCS) AD 시험(CHRONOS)에서 DUPIXENT + TCS 군에서는 4%(100 환자-년당 4명)에서 각막염이 보고되었고, 위약 + TCS 군에서는 2%(100 환자-년당 2명)에서 보고되었습니다. 결막염 및 각막염은 DUPIXENT를 투여받은 AD 환자에서 더 자주 발생했습니다. 결막염은 가장 흔하게 보고된 안과 질환이었습니다. 260주까지 데이터가 있는 장기 OLE 시험(AD-1225) 동안 DUPIXENT 군에서는 3%(100 환자-년당 1명)에서 각막염이 보고되었습니다. 결막염 또는 각막염이 발생한 대부분의 환자는 치료 기간 동안 회복되었거나 회복 중이었습니다.
천식 환자에서 결막염 및 각막염의 빈도는 DUPIXENT와 위약 간에 유사했습니다.
CRSwNP 성인 환자에서 24주 안전성 집단에서 DUPIXENT 군에서는 결막염의 빈도가 2%였고, 위약 군에서는 1%였습니다. 이러한 환자는 회복되었습니다.
52주 CRSwNP 연구(SINUS-52)에서 DUPIXENT 성인 환자에서는 결막염의 빈도가 3%였고, 위약 환자에서는 1%였습니다. 이러한 환자는 모두 회복되었습니다. CRSwNP 개발 프로그램에서 각막염은 보고되지 않았습니다 [경고 및 주의 사항(5.2) 참조].
EoE 환자에서 위약 대조 시험에서 DUPIXENT 군에서 결막염 및 각막염은 보고되지 않았습니다 [경고 및 주의 사항(5.2) 참조]. 연구 EoE-2 Part B의 36주 활성 치료 연장 기간 동안 EoE가 있는 DUPIXENT 치료를 받은 소아 환자의 4%에서 결막염이 보고되었습니다.
PN 환자에서 DUPIXENT 군에서는 결막염의 빈도가 4%였고, 위약 군에서는 1%였습니다. 이러한 환자는 모두 회복되었거나 회복 중이었습니다. PN 개발 프로그램에서 각막염은 보고되지 않았습니다 [경고 및 주의 사항(5.2) 참조].
COPD 환자에서 DUPIXENT 군에서는 결막염 및 각막염의 빈도가 각각 1.4% 및 0.1%였고, 위약 군에서는 각각 1% 및 0%였습니다 [경고 및 주의 사항(5.2) 참조].
습진 헤르페스 및 대상포진
AD 시험에서 위약 군과 DUPIXENT 군에서 습진 헤르페스의 비율은 유사했습니다. 장기 OLE 시험(AD-1225)에서 260주까지 비율은 안정적으로 유지되었습니다.
16주 AD 단독 요법 시험에서 DUPIXENT 군에서는 <1%(100 환자-년당 1명)에서 대상포진이 보고되었고, 위약 군에서는 <1%(100 환자-년당 1명)에서 보고되었습니다. 52주 DUPIXENT + TCS AD 시험에서 DUPIXENT + TCS 군에서는 1%(100 환자-년당 1명)에서 대상포진이 보고되었고, 위약 + TCS 군에서는 2%(100 환자-년당 2명)에서 보고되었습니다. 260주까지 데이터가 있는 장기 OLE 시험(AD-1225) 동안 DUPIXENT 치료를 받은 환자의 2.0%(추적 관찰 100 환자-년당 0.94명)에서 대상포진이 보고되었습니다. 천식 환자에서 대상포진의 빈도는 DUPIXENT와 위약 간에 유사했습니다. CRSwNP 또는 EoE 환자에서 대상포진 또는 습진 헤르페스는 보고되지 않았습니다.
PN 환자에서 대상포진 및 안구 대상포진은 각각 DUPIXENT 군에서는 <1%(100 환자-년당 1명)에서 보고되었고, 위약 군에서는 0%에서 보고되었습니다.
COPD 환자에서 DUPIXENT 군에서는 대상포진이 0.9%에서 보고되었고, 위약 군에서는 0.2%에서 보고되었습니다. 안구 대상포진은 DUPIXENT 군에서는 0.1%에서 보고되었고, 위약 군에서는 0.2%에서 보고되었습니다.
과민 반응
DUPIXENT 치료를 받은 환자의 <1%에서 과민 반응이 보고되었습니다. 여기에는 아나필락시스, 혈청병 또는 혈청병 유사 반응, 전신 두드러기, 발진, 결절 홍반 및 다형 홍반이 포함됩니다 [금기 사항(4), 경고 및 주의 사항(5.1) 및 임상 약리(12.6) 참조].
호산구
AD, 천식, CRSwNP 및 COPD가 있는 DUPIXENT 치료를 받은 환자는 위약으로 치료받은 환자에 비해 기준선에서 혈액 호산구 수가 초기 증가했습니다. AD 성인 환자(SOLO 1, SOLO 2 및 AD-1021)에서 기준선에서 4주까지 혈액 호산구의 평균 및 중앙값 증가는 각각 100 및 0 세포/mcL이었습니다. AD가 있는 6세 미만 소아 환자에서 기준선에서 4주까지 평균 및 중앙값 증가는 각각 478 및 90 세포/mcL이었습니다.
성인 및 12세 이상 소아 청소년 천식 환자(DRI12544 및 QUEST)에서 기준선 대비 4주차 혈액 호산구 수의 평균 및 중앙값 증가는 각각 130세포/mcL 및 10세포/mcL이었습니다. 천식이 있는 6세에서 11세 소아(VOYAGE)에서 기준선 대비 12주차 혈액 호산구 수의 평균 및 중앙값 증가는 각각 124세포/mcL 및 0세포/mcL이었습니다.
성인 CRSwNP 환자(SINUS-24 및 SINUS-52)에서 기준선 대비 16주차 혈액 호산구 수의 평균 및 중앙값 증가는 각각 150세포/mcL 및 50세포/mcL이었습니다.
COPD 환자(BOREAS 및 NOTUS)에서 기준선 대비 8주차 혈액 호산구 수의 평균 및 중앙값 증가는 각각 60세포/mcL 및 0세포/mcL이었습니다.
DUPIXENT로 치료받은 성인 및 12세 이상 소아 청소년 EoE 환자에서 위약군과 비교하여 기준선 대비 혈액 호산구 수 증가는 관찰되지 않았습니다(EoE-1 연구). EoE가 있는 1세에서 11세 소아(EoE-2 연구 A 부분)에서 혈액 호산구 수는 일반적으로 EoE-1 연구에서 관찰된 수치와 일치했습니다.
PN 환자(PRIME 및 PRIME2)에서 기준선 대비 4주차 혈액 호산구 수의 평균 및 중앙값 감소는 각각 9세포/mcL 및 10세포/mcL이었습니다.
COPD 적응증에 대한 임상 시험에서 DUPIXENT(41.7%)에서 위약군(39.4%)보다 치료 관련 호산구 증가(≥500세포/mcL)가 더 높았습니다. 이러한 경우 중 어느 것도 임상 증상과 관련이 없었으며, DUPIXENT(13.6%)에서 위약군(8.1%)보다 치료 관련 호산구 증가(≥1000세포/mcL)가 더 높았습니다.
AD, 천식 및 CRSwNP 적응증에 대한 임상 시험에서 치료 관련 호산구 증가(≥500세포/mcL)의 발생률은 DUPIXENT군과 위약군에서 유사했습니다.
PN 적응증에 대한 임상 시험에서 치료 관련 호산구 증가(≥500세포/mcL)의 발생률은 DUPIXENT군에서 위약군보다 낮았습니다.
치료 관련 호산구 증가(≥5,000세포/mcL)는 DUPIXENT 치료 환자의 <3%와 위약군 치료 환자의 <0.5%에서 보고되었습니다(SOLO 1, SOLO 2 및 AD-1021; DRI12544, QUEST 및 VOYAGE; SINUS-24 및 SINUS-52; PRIME 및 PRIME2; BOREAS 및 NOTUS). 연구 치료 기간 동안 혈액 호산구 수는 기준선 수준으로 감소하거나 기준선 수준 이하로 유지되었습니다(PRIME 및 PRIME2; BOREAS 및 NOTUS). AD-1539 연구에서 치료 관련 호산구 증가(≥5,000세포/mcL)는 DUPIXENT 치료 환자의 8%와 위약군 치료 환자의 0%에서 보고되었습니다 [경고 및 주의 사항(5.3) 참조].
심혈관 색전증
성인 및 12세 이상 소아 청소년 천식 환자를 대상으로 한 1년 위약 대조 임상 시험(QUEST)에서 심혈관 색전증(심혈관 사망, 비치명적 심근 경색 및 비치명적 뇌졸중)은 DUPIXENT 200mg 2주마다 투여군 1명(0.2%), DUPIXENT 300mg 2주마다 투여군 4명(0.6%) 및 위약군 2명(0.3%)에서 보고되었습니다.
AD 환자를 대상으로 한 1년 위약 대조 임상 시험(CHRONOS)에서 심혈관 색전증(심혈관 사망, 비치명적 심근 경색 및 비치명적 뇌졸중)은 DUPIXENT + TCS 300mg 2주마다 투여군 1명(0.9%), DUPIXENT + TCS 300mg 매주 투여군 0명(0.0%) 및 위약 + TCS군 1명(0.3%)에서 보고되었습니다.
성인 CRSwNP 환자를 대상으로 한 24주 위약 대조 임상 시험(SINUS-24)에서 심혈관 색전증(심혈관 사망, 비치명적 심근 경색 및 비치명적 뇌졸중)은 DUPIXENT군 1명(0.7%) 및 위약군 0명(0.0%)에서 보고되었습니다.
성인 CRSwNP 환자를 대상으로 한 1년 위약 대조 임상 시험(SINUS-52)에서 어떤 치료군에서도 심혈관 색전증(심혈관 사망, 비치명적 심근 경색 및 비치명적 뇌졸중) 사례가 보고되지 않았습니다.
EoE 환자를 대상으로 한 24주 위약 대조 임상 시험(EoE-1 연구 A 부분 및 B 부분)에서 어떤 치료군에서도 심혈관 색전증(심혈관 사망, 비치명적 심근 경색 및 비치명적 뇌졸중) 사례가 보고되지 않았습니다.
6.2 시판 후 경험
DUPIXENT의 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애: 안지오에데마 [경고 및 주의 사항(5.1) 참조]
피부 및 피하 조직 장애: 홍반, 발진, 인설, 부종, 구진, 가려움증, 작열감 및 통증을 포함한 안면 피부 반응
8 특정 집단에서의 사용
8.1 임신
임신 노출 레지스트리
임신 중 DUPIXENT에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 레지스트리가 있습니다.
의료 서비스 제공자와 환자는 레지스트리에 등록하거나 레지스트리에 대한 정보를 얻으려면 1-877-311-8972로 전화하거나 https://mothertobaby.org/ongoing-study/dupixent/를 방문하십시오.
위험 요약
임산부에서 DUPIXENT 사용에 대한 사례 보고 및 사례 시리즈에서 얻은 데이터는 주요 선천적 기형, 유산 또는 모체 또는 태아 결과에 대한 약물 관련 위험을 밝혀내지 못했습니다. 인간 IgG 항체는 태반 장벽을 통과하는 것으로 알려져 있습니다. 따라서 DUPIXENT는 모체에서 태아로 전달될 수 있습니다. 임신 중 천식과 관련된 모체 및 태아 결과에 대한 부작용이 있습니다(임상적 고려 사항 참조 임상적 고려 사항). 강화된 출산 전 및 출산 후 발달 연구에서 기관 형성부터 분만까지 최대 10배의 최대 권장 인간 용량(MRHD)의 인터루킨-4 수용체 알파(IL-4Rα)에 대한 동종 항체를 피하 투여한 후 임신한 원숭이의 자손에서 발달에 대한 부작용이 관찰되지 않았습니다(데이터 참조 데이터).
지정된 인구에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
8.4 소아 사용
아토피 피부염
DUPIXENT의 안전성 및 유효성은 국소 처방 치료로 적절히 조절되지 않거나 해당 치료가 권장되지 않는 중등도에서 중증의 AD가 있는 6개월 이상의 소아 환자에서 확립되었습니다[임상 연구(14.1) 참조 임상 연구(14.1)].
이 연령대에서 DUPIXENT의 사용은 다음 임상 시험의 데이터에 의해 뒷받침됩니다.
- 중등도에서 중증의 AD를 가진 12세에서 17세까지의 소아 251명을 포함한 AD-1526. 251명의 피험자 중 82명은 DUPIXENT 200 mg Q2W (<60 kg) 또는 300 mg Q2W (≥60 kg)로 치료받았고 85명은 일치하는 위약으로 치료받았습니다.
- 중증의 AD를 가진 6세에서 11세까지의 소아 367명을 포함한 AD-1652. 367명의 피험자 중 120명은 DUPIXENT 300 mg Q4W + TCS (15 to <30 kg) 또는 200 mg Q2W + TCS (≥30 kg)로 치료받았고 123명은 일치하는 위약 + TCS로 치료받았습니다.
- 중등도에서 중증의 AD를 가진 6개월에서 5세까지의 소아 162명을 포함한 AD-1539. 162명의 피험자 중 83명은 DUPIXENT 200 mg Q4W + TCS (5 to <15 kg) 또는 300 mg Q4W + TCS (15 to <30 kg)로 치료받았고 79명의 피험자는 일치하는 위약 + TCS로 치료받도록 배정되었습니다.
- DUPIXENT ± TCS로 치료받은 12세에서 17세까지의 소아 275명, DUPIXENT ± TCS로 치료받은 6세에서 11세까지의 소아 368명, DUPIXENT ± TCS로 치료받은 6개월에서 5세까지의 소아 180명을 등록한 개방표지 연장 연구인 AD-1434
- 중등도에서 중증의 손 및/또는 발 관여를 동반한 아토피 피부염을 가진 12세에서 17세까지의 소아 27명을 포함한 Liberty-AD-HAFT. DUPIXENT (N=14) 또는 일치하는 위약 (N=13)으로 치료받았습니다.
안전성 및 유효성은 일반적으로 소아 환자와 성인 환자 간에 일치했습니다 [부작용 (6.1) 및 임상 연구 (14.1) 참조]. 또한, AD-1434에서 DUPIXENT ± TCS로 치료받은 6개월에서 5세까지의 소아 9명 (5%)에서 손-발-입병이 보고되었고 4명 (2%)에서 피부 유두종이 보고되었습니다. 이러한 경우는 연구 약물 중단으로 이어지지 않았습니다 [부작용 (6.1) 참조].
AD를 가진 6개월 미만의 소아 환자에서의 안전성 및 유효성은 확립되지 않았습니다.
천식
호산구 표현형을 특징으로 하는 중등도에서 중증의 천식 또는 경구용 코르티코스테로이드 의존성 천식 환자에서 추가 유지 치료제로서 DUPIXENT의 안전성 및 유효성은 6세 이상의 소아 환자에서 확립되었습니다. 이 적응증에 대한 DUPIXENT의 사용은 6세 이상의 성인 및 소아 환자에서 적절하고 잘 통제된 연구에서 얻은 증거에 의해 뒷받침됩니다 [임상 연구 (14.2)].
12세에서 17세까지의 소아 피험자:
중등도에서 중증의 천식을 가진 12세에서 17세까지의 소아 피험자 107명이 QUEST에 등록되었으며 200 mg (N=21) 또는 300 mg (N=18) DUPIXENT (또는 일치하는 위약 200 mg [N=34] 또는 300 mg [N=34]) Q2W를 받았습니다. 천식 악화 및 폐 기능은 12세에서 17세까지의 소아 피험자와 성인 모두에서 평가되었습니다. 200 mg 및 300 mg Q2W 용량 모두에서 FEV1의 개선 (12주차 기준선 대비 LS 평균 변화)이 관찰되었습니다 (각각 0.36 L 및 0.27 L). 200 mg Q2W 용량의 경우, 피험자는 성인과 일치하는 심각한 악화율 감소를 보였습니다. Dupilumab 노출은 각 용량 수준에서 성인보다 12세에서 17세까지의 소아 피험자에서 더 높았으며, 이는 주로 체중 차이로 인한 것입니다 [임상 약리학 (12.3) 참조].
12세에서 17세까지의 소아 피험자에서의 부작용 프로파일은 일반적으로 성인과 유사했습니다 [부작용 (6.1) 참조].
6세에서 11세까지의 소아 피험자:
중등도에서 중증의 천식을 가진 6세에서 11세까지의 소아 피험자 408명이 VOYAGE에 등록되었으며, 이 연구는 100 mg Q2W 또는 200 mg Q2W 용량을 평가했습니다. 천식 악화 및 폐 기능의 개선이 입증되었습니다 [임상 연구 (14.2) 참조]. 체중이 15 to <30 kg인 6세에서 11세까지의 피험자에서 DUPIXENT 300 mg Q4W의 유효성은 VOYAGE에서 100 mg Q2W의 유효성에서 외삽되었으며, 300 mg Q4W로 더 높은 약물 노출 수준을 보여주는 모집단 약동학 분석에 의해 뒷받침되었습니다 [임상 약리학 (12.3) 참조]. VOYAGE 연구의 치료 기간을 완료한 피험자는 개방표지 연장 연구 (LTS14424)에 참여할 수 있었습니다. 365명의 피험자 중 18명 (≥15 to <30 kg)이 이 연구에서 300 mg Q4W에 노출되었으며, 이 18명의 피험자에서의 안전성 프로파일은 VOYAGE에서 관찰된 것과 일치했습니다. DUPIXENT 300 mg Q4W에 대한 추가 안전성은 소아 AD 적응증에서 얻은 안전성 정보를 기반으로 합니다 [부작용 (6.1) 및 임상 약리학 (12.3) 참조].
천식을 가진 6세 미만의 소아 환자에서의 안전성 및 유효성은 확립되지 않았습니다.
CRSwNP
부적절하게 조절된 비강 용종을 동반한 만성 비부비동염 (CRSwNP) 환자에서 추가 유지 치료제로서 DUPIXENT의 안전성 및 유효성은 12세 이상의 소아 환자에서 확립되었습니다. 이 적응증에 대한 DUPIXENT의 사용은 부적절하게 조절된 CRSwNP를 가진 성인에서 DUPIXENT를 추가 유지 치료제로 사용한 적절하고 잘 통제된 연구 (SINUS-24 및 SINUS-52)에서 얻은 증거에 의해 뒷받침되며, 다음과 같은 추가 데이터가 있습니다.
- 중등도에서 중증의 천식을 가진 12세 이상의 성인 및 소아 환자와 부적절하게 조절된 CRSwNP를 가진 성인 환자에서 얻은 약동학 (PK) 데이터
- 중등도에서 중증의 천식을 가진 12세 이상의 소아 환자에서 얻은 안전성 데이터 [부작용 (6.1), 임상 약리학 (12.3), 및 임상 연구 (14.3) 참조]
CRSwNP를 가진 12세 미만의 소아 환자에서의 안전성 및 유효성은 확립되지 않았습니다.
EoE
DUPIXENT의 EoE 치료에 대한 안전성 및 유효성은 15kg 이상 체중의 1세 이상 소아에서 확립되었습니다. 이 인구집단에서 DUPIXENT의 사용은 성인과 12세에서 17세 사이의 72명의 소아를 대상으로 한 적절한 대조군 연구(EoE-1 연구), 1세에서 11세 사이의 61명의 소아를 대상으로 한 임상 연구(EoE-2 연구) 및 성인과 1세에서 17세 사이의 소아를 대상으로 한 약동학적 데이터에 의해 뒷받침됩니다. 1세에서 17세 사이의 소아에서 DUPIXENT의 안전성은 성인과 유사했습니다 [부작용(6.1), 임상 약리학(12.3) 및 임상 연구(14.4) 참조].
EoE가 있는 1세 미만 또는 15kg 미만의 소아 환자에서의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
DUPIXENT를 투여받은 1539명의 AD 환자 중 70명이 65세 이상이었습니다. AD에서 DUPIXENT의 임상 시험에는 65세 이상의 환자가 충분하지 않아 젊은 환자와 다르게 반응하는지 여부를 확인할 수 없었습니다 [임상 약리학(12.3) 참조].
DUPIXENT를 투여받은 1977명의 천식 환자 중 총 240명이 65세 이상이었습니다. 이 연령대의 효능과 안전성은 전체 연구 대상군과 유사했습니다.
DUPIXENT를 투여받은 440명의 CRSwNP 환자 중 총 79명이 65세 이상이었습니다. 이 연령대의 효능과 안전성은 전체 연구 대상군과 유사했습니다.
EoE에서 DUPIXENT의 임상 연구에는 65세 이상의 환자가 충분하지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없었습니다.
DUPIXENT를 투여받은 152명의 PN 환자 중 총 37명이 65세 이상이었으며, 그 중 8명이 75세 이상이었습니다. 임상 시험에는 65세 이상의 환자가 충분하지 않아 젊은 성인 환자와 다르게 반응하는지 여부를 확인할 수 없었습니다.
DUPIXENT의 임상 시험에서 무작위 배정된 1874명의 COPD 환자 중 총 1072명이 65세 이상이었고, 244명이 75세 이상이었습니다. 65세 이상의 환자와 젊은 성인 환자 사이에 DUPIXENT의 안전성 또는 유효성에 대한 전반적인 차이는 관찰되지 않았습니다.
10 과다 복용
DUPIXENT 과량 투여에 대한 특정 치료법은 없습니다. 과량 투여 시, 최신 권장 사항을 위해 독극물 관리 센터(1-800-222-1222)에 연락하고 환자의 부작용 징후 또는 증상을 모니터링하며 즉시 적절한 증상 치료를 실시하십시오.
11 설명
Dupilumab은 인터루킨-4 수용체 알파 길항제로, IL-4Rα 서브유닛에 결합하여 IL-4 및 IL-13 신호 전달을 억제하는 IgG4 서브클래스의 인간 단클론 항체입니다. Dupilumab의 분자량은 약 147 kDa입니다.
Dupilumab은 중국 햄스터 난소 세포 현탁 배양에서 재조합 DNA 기술로 생산됩니다.
DUPIXENT (dupilumab) Injection은 피하 주사용 무균, 방부제 무첨가, 투명 또는 약간 불투명한 무색에서 옅은 노란색 용액으로 제공됩니다. DUPIXENT는 바늘 보호대가 있는 단회용 미리 채워진 주사기 또는 실리콘 처리된 Type-1 투명 유리 주사기에 담긴 단회용 미리 채워진 펜으로 제공됩니다. 바늘 캡은 천연 고무 라텍스로 만들어지지 않았습니다.
각 300 mg 미리 채워진 주사기 또는 미리 채워진 펜은 2 mL에 300 mg dupilumab을 제공하며, 여기에는 L-아르기닌 염산염 (10.5 mg), L-히스티딘 (6.2 mg), 폴리소르베이트 80 (4 mg), 아세트산나트륨 (2 mg), 수크로스 (100 mg) 및 주사용수, pH 5.9가 포함되어 있습니다.
각 200 mg 미리 채워진 주사기 또는 미리 채워진 펜은 1.14 mL에 200 mg dupilumab을 제공하며, 여기에는 L-아르기닌 염산염 (12 mg), L-히스티딘 (3.5 mg), 폴리소르베이트 80 (2.3 mg), 아세트산나트륨 (1.2 mg), 수크로스 (57 mg) 및 주사용수, pH 5.9가 포함되어 있습니다.
12 임상약리학
12.1 작용 기전
듀피젠트는 IL-4 및 IL-13 수용체 복합체에 의해 공유되는 IL-4Rα 서브유닛에 특이적으로 결합하여 인터루킨-4(IL-4) 및 인터루킨-13(IL-13) 신호를 억제하는 인간 단클론 IgG4 항체입니다. 듀피젠트는 Type I 수용체를 통한 IL-4 신호 및 Type II 수용체를 통한 IL-4 및 IL-13 신호를 모두 억제합니다.
IL-4 및 IL-13에 의해 유도되는 염증은 천식, AD, CRSwNP, EoE, PN 및 COPD의 병태생리학에서 중요한 요소입니다. IL-4Rα를 발현하는 여러 세포 유형(예: 비만 세포, 호산구, 대식세포, 림프구, 상피 세포, 배상 세포) 및 염증 매개체(예: 히스타민, 에이코사노이드, 류코트리엔, 사이토카인, 케모카인)가 염증에 관여합니다. 듀피젠트로 IL-4Rα를 차단하면 IL-4 및 IL-13 사이토카인 유도 염증 반응, 즉 염증성 사이토카인, 케모카인, 일산화 질소 및 IgE의 방출이 억제됩니다. 듀피젠트의 작용 기전은 확실하게 밝혀지지 않았습니다.
12.2 약력학
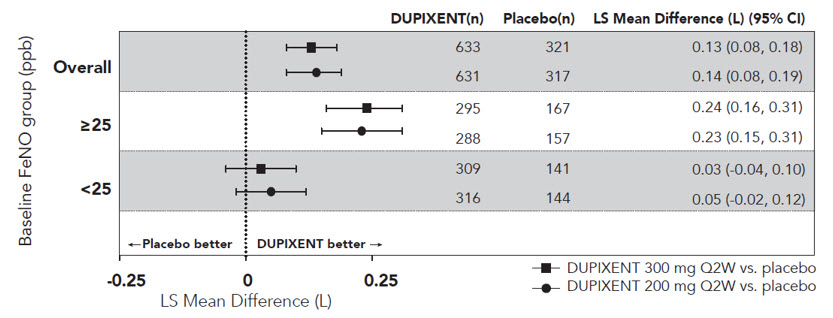
IL-4 및 IL-13 신호 억제와 일치하게, 듀피젠트 치료는 특정 염증 바이오마커를 감소시켰습니다. 천식 환자의 경우, 호기 일산화 질소 분율(FeNO)과 혈액 내 에오탁신-3, 총 IgE, 알레르겐 특이적 IgE, TARC 및 페리오스틴 농도가 위약에 비해 감소했습니다. 이러한 바이오마커의 감소는 300mg Q2W 및 200mg Q2W 요법에서 유사했습니다. 이러한 마커는 치료 2주 후에 최대 억제에 가까웠으며, IgE는 더 천천히 감소했습니다. 이러한 효과는 치료 전반에 걸쳐 지속되었습니다. 듀피젠트 치료로 인한 총 IgE 농도의 기준선 대비 중간 백분율 감소는 24주차에 52%(DRI12544)였고 52주차에 70%(QUEST)였습니다. FeNO의 경우, 기준선 대비 평균 백분율 감소는 DRI12544에서 2주차에 35%였고 QUEST에서 24%였으며, 전체 안전성 모집단에서 평균 FeNO 수준은 20ppb로 감소했습니다.
DUPIXENT 치료 중 비생백신에 대한 항체 반응
임상 연구에서 AD 성인 피험자는 16주 동안 300mg의 DUPIXENT를 1주일에 한 번(권장 투여 빈도의 두 배) 투여 받았습니다. 12주 투여 후, 피험자는 Tdap 백신과 수막구균 다당류 백신을 접종 받았습니다. 4주 후에 파상풍 독소 및 C군 수막구균 다당류에 대한 항체 반응을 평가했습니다. 파상풍 독소 및 C군 수막구균 다당류에 대한 항체 반응은 DUPIXENT 투여군과 위약 투여군에서 유사했습니다. 두 백신의 다른 활성 성분에 대한 항체 반응은 평가하지 않았습니다. 다른 비생백신에 대한 항체 반응도 평가하지 않았습니다.
12.3 약동학
듀피젠트의 약동학은 AD, 천식, CRSwNP, EoE, PN 및 COPD 환자에서 유사합니다.
흡수
600mg, 400mg 또는 300mg의 초기 피하(SC) 투여 후, 듀피젠트는 투여 후 약 1주일 만에 각각 70.1±24.1 mcg/mL, 41.8±12.4 mcg/mL 또는 30.5±9.39 mcg/mL의 최대 평균 ± SD 농도(Cmax)에 도달했습니다. 600mg 시작 용량 및 300mg 용량을 매주 또는 Q2W로 투여하거나, 400mg 시작 용량 및 200mg 용량을 Q2W로 투여하거나, 로딩 용량 없이 300mg Q2W로 투여한 후 16주차에 정상 상태 농도에 도달했습니다. 임상 시험 전반에 걸쳐, 300mg을 Q2W로 투여한 경우 평균 ± SD 정상 상태 골 농도는 55.3±34.3 mcg/mL에서 80.2±35.3 mcg/mL 범위였고, 300mg을 매주 투여한 경우 173±75.9 mcg/mL에서 195±71.7 mcg/mL 범위였으며, 200mg을 Q2W로 투여한 경우 29.2±18.7에서 36.5±22.2 mcg/mL 범위였습니다.
SC 투여 후 듀피젠트의 생체 이용률은 AD, 천식, CRSwNP, EoE, PN 및 COPD 환자 간에 유사하며 61%에서 64% 범위입니다.
배설
듀피젠트의 대사 경로는 규명되지 않았습니다. 인간 단클론 IgG4 항체인 듀피젠트는 내인성 IgG와 동일한 방식으로 대사 경로를 통해 작은 펩타이드와 아미노산으로 분해될 것으로 예상됩니다. 300mg QW, 300mg Q2W, 200mg Q2W, 300mg Q4W 또는 200mg Q4W 듀피젠트의 마지막 정상 상태 용량 투여 후, 성인 및 12세에서 17세 사이의 소아에서 검출 불가능한 농도(<78 ng/mL)에 도달하는 중간 시간은 9주에서 13주 범위였습니다. 모집단 약동학 분석에 따르면, 6세에서 11세 사이의 소아와 6개월에서 5세 사이의 소아에서 검출 불가능한 농도에 도달하는 중간 시간은 각각 약 1.5배(최대 19주) 및 2.5배(최대 32주) 더 길었습니다.
용량 선형성
듀피젠트는 75mg에서 600mg(즉, 권장 용량의 0.25배에서 2배)의 단일 용량 투여 후 노출이 용량에 비례하여 증가하는 비선형 표적 매개 약동학을 나타냈습니다. 용량을 8배 증가시키면 시스템 노출이 30배 증가했습니다.
특정 모집단
연령
인구 약동학 분석 결과, 연령은 성인 및 6세에서 17세까지의 소아에서 두피루맙 청소율에 영향을 미치지 않았습니다. 6개월에서 5세까지의 소아에서는 청소율이 연령과 함께 증가했습니다.
소아 환자
아토피 피부염
200mg(<60kg) 또는 300mg(≥60kg)의 두피루맙을 격주 투여(Q2W) 받은 12세에서 17세까지의 아토피 피부염 소아에서 두피루맙의 평균 ± 표준 편차 정상 상태 골 농도는 54.5±27.0 mcg/mL였습니다.
200mg(≥30kg)을 격주 투여(Q2W) 받은 6세에서 11세까지의 아토피 피부염 소아 또는 300mg(<30kg)을 4주마다 투여(Q4W) 받은 소아에서 평균 ± 표준 편차 정상 상태 골 농도는 각각 86.0±34.6 mcg/mL 및 98.7±33.2 mcg/mL였습니다.
300mg(≥15 to <30kg) 또는 200mg(≥5 to <15kg)을 4주마다 투여(Q4W) 받은 6개월에서 5세까지의 아토피 피부염 소아에서 평균 ± 표준 편차 정상 상태 골 농도는 각각 110±42.8 mcg/mL 및 109±50.8 mcg/mL였습니다.
천식
QUEST 연구에는 천식이 있는 12세에서 17세까지의 소아 107명이 등록되었습니다. 300mg 또는 200mg을 Q2W로 투여받은 경우 두피루맙의 평균 ± 표준 편차 정상 상태 골 농도는 각각 107±51.6 mcg/mL 및 46.7±26.9 mcg/mL였습니다.
VOYAGE 연구에서 두피루맙의 약동학적 특성은 중등도에서 중증 천식이 있는 270명의 피험자에서 피하 투여 후 조사되었습니다. 100mg Q2W(체중 <30kg인 소아 91명) 또는 200mg Q2W(체중 ≥30kg인 소아 179명)를 투여받았습니다. 평균 ± 표준 편차 정상 상태 골 농도는 각각 58.4±28.0 mcg/mL 및 85.1±44.9 mcg/mL였습니다. 체중이 ≥15 to <30kg인 6세에서 11세까지의 소아에게 300mg Q4W 피하 투여량을 시뮬레이션한 결과, 예측된 정상 상태 골 농도(98.7±41.0 mcg/mL)와 평균 농도는 100mg Q2W(<30kg)의 관찰된 골 농도와 평균 농도보다 높았습니다.
CRSwNP
12세 이상의 소아 CRSwNP 환자를 대상으로 임상 연구가 수행되지 않았습니다. 두피루맙 노출은 CRSwNP에 대한 권장 용량(2주마다 300mg)으로 성인과 12세 이상의 소아에서 비슷할 것으로 예상됩니다.
호산구성 식도염
EoE-1 연구에서 두피루맙의 약동학적 특성은 체중이 40kg 이상인 호산구성 식도염이 있는 12세에서 17세까지의 소아 35명에서 조사되었습니다. 이들은 300mg QW를 투여받았습니다. 두피루맙의 평균 ± 표준 편차 정상 상태 골 농도는 227±95.3 mcg/mL였습니다.
EoE-2 Part A 연구에서 두피루맙의 약동학적 특성은 호산구성 식도염이 있는 1세에서 11세까지의 소아 20명에서 조사되었습니다. 이들은 다음과 같은 체중 기반 투여 요법을 받았습니다. ≥15 to <30kg(200mg Q2W) 및 ≥30 to <40kg(300mg Q2W). 16주차에 두피루맙의 평균 ± 표준 편차 정상 상태 골 농도는 174±66.2 mcg/mL였습니다.
체중이 ≥40kg인 1세에서 11세까지의 소아에서 300mg QW를 투여받은 경우 체중이 ≥40kg인 성인 및 12세 이상의 소아에서의 전신 노출과 비슷할 것으로 예상됩니다. 체중이 <40kg인 12세에서 17세까지의 소아에서 300mg Q2W를 투여받은 경우 6세에서 11세까지의 소아에서의 전신 노출과 비슷할 것으로 예상됩니다.
약물 상호 작용 연구
두피루맙이 동시 투여되는 약물의 PK에 미치는 영향은 예상되지 않습니다. 인구 분석 결과, 일반적으로 동시 투여되는 약물은 중등도에서 중증 천식이 있는 피험자에서 DUPIXENT의 약동학적 특성에 영향을 미치지 않았습니다.
시토크롬 P450 기질
두피루맙이 미다졸람(CYP3A4에 의해 대사됨), 와파린(CYP2C9에 의해 대사됨), 오메프라졸(CYP2C19에 의해 대사됨), 메토프롤롤(CYP2D6에 의해 대사됨) 및 카페인(CYP1A2에 의해 대사됨)의 약동학적 특성에 미치는 영향은 아토피 피부염이 있는 평가 가능한 피험자 12-13명을 대상으로 한 연구에서 평가되었습니다(SC 로딩 용량 600mg을 투여한 후 6주 동안 매주 300mg SC를 투여했습니다). AUC에 임상적으로 유의미한 변화는 관찰되지 않았습니다. 메토프롤롤(CYP2D6)에서 AUC가 29% 증가하는 가장 큰 효과가 관찰되었습니다.
12.6 면역원성
관찰된 항체 발생률은 분석의 민감도와 특이도에 크게 의존합니다. 분석 방법의 차이로 인해 아래에 설명된 연구에서 관찰된 항체 발생률을 DUPIXENT 또는 다른 두피루맙 제품을 포함한 다른 연구에서 관찰된 항체 발생률과 의미 있게 비교할 수 없습니다.
아토피 피부염
52주 동안 DUPIXENT 300mg Q2W를 투여받은 아토피 피부염 환자의 약 6%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 2%에서 지속적인 ADA 반응이 나타났고, 약 1%에서 중화 항체가 나타났습니다. 200mg Q2W, 200mg Q4W 또는 300mg Q4W를 투여받은 6개월에서 11세까지의 아토피 피부염 소아에서도 유사한 결과가 관찰되었습니다.
16주 동안 DUPIXENT 300mg 또는 200mg Q2W를 투여받은 12세에서 17세까지의 아토피 피부염 소아의 약 16%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 3%에서 지속적인 ADA 반응이 나타났고, 약 5%에서 중화 항체가 나타났습니다.
천식
DUPIXENT 300 mg을 2주마다 52주 동안 투여받은 천식 환자의 약 5%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 2%에서 지속적인 ADA 반응이 나타났고, 약 2%에서 중화 항체가 나타났습니다. DUPIXENT 100 mg을 2주마다 또는 200 mg을 2주마다 최대 52주 동안 투여받은 6세에서 11세 사이의 소아 천식 환자에서도 유사한 결과가 관찰되었습니다.
DUPIXENT 200 mg을 2주마다 52주 동안 투여받은 천식 환자의 약 9%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 4%에서 지속적인 ADA 반응이 나타났고, 약 4%에서 중화 항체가 나타났습니다.
비강용종을 동반한 만성 비부비동염
DUPIXENT 300 mg을 2주마다 52주 동안 투여받은 CRSwNP 성인 환자의 약 5%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 2%에서 지속적인 ADA 반응이 나타났고, 약 3%에서 중화 항체가 나타났습니다.
호산구성 식도염
DUPIXENT 300 mg을 매주 52주 동안 투여받은 EoE 환자의 약 1%에서 DUPIXENT에 대한 항체가 발생했습니다. 지속적인 ADA 반응이 나타난 환자는 없었고, 중화 항체가 나타난 환자도 없었습니다. DUPIXENT 200 mg을 2주마다 또는 300 mg을 2주마다 52주 동안 투여받은 1세에서 11세 사이의 소아 EoE 환자에서도 유사한 결과가 관찰되었습니다.
결절성 가려움증
DUPIXENT 300 mg을 2주마다 24주 동안 투여받은 PN 환자의 약 8%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 1%에서 지속적인 ADA 반응이 나타났고, 약 3%에서 중화 항체가 나타났습니다.
만성 폐쇄성 폐 질환
DUPIXENT 300 mg을 2주마다 52주 동안 투여받은 COPD 환자의 약 8%에서 DUPIXENT에 대한 항체가 발생했습니다. 약 3%에서 지속적인 ADA 반응이 나타났고, 약 3%에서 중화 항체가 나타났습니다.
DUPIXENT를 투여받은 환자에서 검출된 항체 역가는 대부분 낮았습니다. DUPIXENT를 투여받은 환자에서 DUPIXENT에 대한 고역가 항체 발생은 혈청 dupilumab 농도가 낮아지는 것과 관련이 있었습니다. [임상 약리학 (12.3) 참조]
고역가 항체 반응을 보인 AD 성인 환자 2명에서 DUPIXENT 치료 중 혈청병 또는 혈청병 유사 반응이 발생했습니다. [경고 및 주의 사항 (5.1) 참조]
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
dupilumab의 발암성 또는 돌연변이 유발 가능성을 평가하기 위한 동물 연구는 수행되지 않았습니다.
성적으로 성숙한 쥐에 IL-4Rα에 대한 동종 항체를 최대 200 mg/kg/주까지 피하 투여한 결과, 생식 기관, 월경 주기 길이 또는 정자 분석과 같은 생식 능력 매개변수에 영향을 미치지 않았습니다.
14 임상 연구
14.1 아토피 피부염
아토피 피부염 성인 환자
무작위 배정, 이중맹검, 위약 대조 시험 3건(SOLO 1(NCT02277743), SOLO 2(NCT02277769), CHRONOS(NCT02260986))에서 국소 치료제(들)로 적절히 조절되지 않는 중등도~중증의 아토피 피부염 성인 환자 2,119명(18세 이상)을 대상으로 시험을 진행했습니다. 질병 중증도는 0~4점의 중증도 척도에서 아토피 피부염 병변에 대한 전체 평가에서 Investigator’s Global Assessment(IGA) 점수 ≥3점, 0~72점의 척도에서 Eczema Area and Severity Index(EASI) 점수 ≥16점, 최소 체표면적 ≥10%로 정의했습니다. 기준선에서 환자의 59%가 남성이었고, 67%가 백인이었으며, 52%가 기준선 IGA 점수 3점(중등도 아토피 피부염)이었고, 48%가 기준선 IGA 점수 4점(중증 아토피 피부염)이었습니다. 기준선 평균 EASI 점수는 33점이었고, 기준선 주간 평균 Peak Pruritus Numeric Rating Scale(NRS)은 0~10점의 척도에서 7점이었습니다.
3건의 시험 모두에서 DUPIXENT군 환자는 0주차에 DUPIXENT 600mg을 피하 주사한 후 격주(Q2W)로 300mg을 투여받았습니다. 단독 요법 시험(SOLO 1 및 SOLO 2)에서 환자는 16주 동안 DUPIXENT 또는 위약을 투여받았습니다.
병용 요법 시험(CHRONOS)에서 환자는 52주 동안 DUPIXENT 또는 위약을 국소 코르티코스테로이드(TCS) 및 필요에 따라 얼굴, 목, 간지럼 부위, 생식기 부위와 같은 문제 부위에만 국소 칼시뉴린 억제제를 병용 투여받았습니다.
3건의 시험 모두에서 1차 평가 변수인 기준선 대비 16주차에 IGA 0점(깨끗함) 또는 1점(거의 깨끗함) 및 최소 2점 개선을 달성한 환자 비율의 변화를 평가했습니다. 다른 평가 변수에는 EASI-75(기준선 대비 EASI 점수가 75% 이상 개선)를 달성한 환자 비율과 기준선 대비 16주차에 Peak Pruritus NRS에서 최소 4점 개선으로 정의된 가려움증 감소가 포함되었습니다.
16주차의 임상 반응(SOLO 1, SOLO 2, CHRONOS)
DUPIXENT 단독 요법 시험(SOLO 1 및 SOLO 2)과 DUPIXENT+TCS 병용 시험(CHRONOS)의 결과는 표 12에 제시되어 있습니다.
| SOLO 1 | SOLO 2 | CHRONOS | ||||
|---|---|---|---|---|---|---|
| DUPIXENT 300mg Q2W |
위약 | DUPIXENT 300mg Q2W |
위약 | DUPIXENT 300mg Q2W + TCS |
위약 + TCS | |
| 무작위 배정된 환자 수(FAS)* | 224 | 224 | 233 | 236 | 106 | 315 |
| IGA 0 또는 1†,‡ | 38% | 10% | 36% | 9% | 39% | 12% |
| EASI-75‡ | 51% | 15% | 44% | 12% | 69% | 23% |
| EASI-90‡ | 36% | 8% | 30% | 7% | 40% | 11% |
| 기준선 Peak Pruritus NRS 점수 ≥4점인 환자 수 | 213 | 212 | 225 | 221 | 102 | 299 |
| Peak Pruritus NRS(≥4점 개선)‡ | 41% | 12% | 36% | 10% | 59% | 20% |
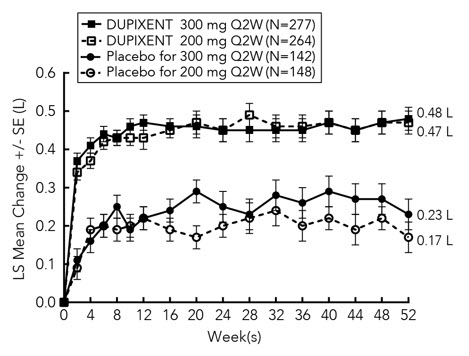
| Figure 1: Proportion of Adult Subjects 18 Years of Age and Older with Moderate-to-Severe AD with ≥4-point Improvement on the Peak Pruritus NRS in SOLO 1* and SOLO 2* Studies (FAS)† | |
|---|---|
| SOLO 1 | SOLO 2 |
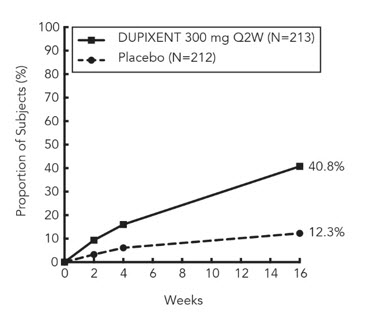 |
|
CHRONOS에서 421명의 대상 중 353명이 데이터 분석 시점에 52주 동안 연구에 참여했습니다. 이 353명의 대상 중 52주차에 반응을 보인 사람들은 16주차부터 효능을 유지한 대상(예: 16주차에 DUPIXENT IGA 0 또는 1에 반응을 보인 사람 중 53%가 52주차에 반응을 유지함)과 16주차에 반응을 보이지 않았지만 나중에 치료에 반응을 보인 대상(예: 16주차에 DUPIXENT IGA 0 또는 1에 반응을 보이지 않은 사람 중 24%가 52주차에 반응을 보임)이 혼합되어 있습니다. 병용 TCS 임상시험(CHRONOS)에 참여한 353명의 대상에 대한 지원 분석 결과는 표 13에 제시되어 있습니다.
| DUPIXENT 300 mg Q2W + TCS |
Placebo + TCS | |
|---|---|---|
| Number of Subjects* | 89 | 264 |
| Responder†,‡ at Week 16 and 52 | 22% | 7% |
| Responder at Week 16 but Non-responder at Week 52 | 20% | 7% |
| Non-responder at Week 16 and Responder at Week 52 | 13% | 6% |
| Non-responder at Week 16 and 52 | 44% | 80% |
| Overall Responder†,‡ Rate at Week 52 | 36% | 13% |
SOLO 1, SOLO 2, 및 CHRONOS에서 체중, 연령, 성별, 인종 및 이전 치료(면역억제제 포함)를 기준으로 한 하위 그룹의 치료 효과는 전반적으로 전체 연구 집단의 결과와 일치했습니다.
SOLO 1, SOLO 2, 및 CHRONOS에서 DUPIXENT 300 mg QW의 세 번째 무작위 배정 치료군은 DUPIXENT 300 mg Q2W보다 추가적인 치료 이점을 보이지 않았습니다.
IGA 0 또는 1이고 2점 이상 감소한 SOLO 1 및 SOLO 2의 대상은 SOLO CONTINUE(NCT02395133)에 다시 무작위 배정되었습니다. SOLO CONTINUE는 치료 반응을 유지하기 위한 여러 DUPIXENT 단독 요법 용량 요법을 평가했습니다. 이 연구에는 36주 동안 DUPIXENT 300 mg Q2W를 계속 투여받도록 무작위 배정된 대상(62명) 또는 위약으로 전환한 대상(31명)이 포함되었습니다. 36주차에 IGA 0 또는 1 반응은 Q2W 그룹에서 33명(53%), 위약 그룹에서 3명(10%)이었습니다.
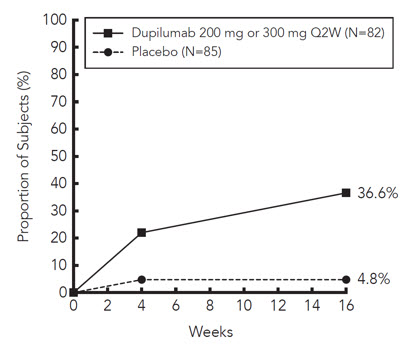
아토피 피부염이 있는 12~17세 소아 대상
중등도~중증 AD(IGA 점수 ≥3[0~4점 척도], EASI 점수 ≥16[0~72점 척도], 최소 BSA 침범 ≥10%)를 가진 12~17세 소아 대상 251명을 대상으로 한 다기관, 무작위 배정, 이중맹검, 위약 대조 시험(AD-1526, NCT03054428)에서 12~17세 소아 대상에서 DUPIXENT 단독 요법의 효능을 평가했습니다. 이 시험에 등록할 수 있는 대상은 국소 치료에 대한 반응이 이전에 불충분했던 대상입니다.
기준 체중이 60kg 미만인 DUPIXENT 그룹의 대상은 0주차에 400mg의 초기 용량을 투여받은 후 16주 동안 2주마다 200mg을 투여받았습니다. 기준 체중이 60kg 이상인 대상은 0주차에 600mg의 초기 용량을 투여받은 후 16주 동안 2주마다 300mg을 투여받았습니다. 연구자의 재량에 따라 대상에게 응급 치료를 할 수 있었습니다. 응급 치료를 받은 대상은 비반응자로 간주되었습니다.
AD-1526에서 평균 연령은 14.5세였고, 평균 체중은 59.4kg이었으며, 대상의 41%가 여성이었고, 63%가 백인, 15%가 아시아인, 12%가 흑인이었습니다. 기준선에서 대상의 46%는 IGA 점수가 3점(중등도 AD)이었고, 54%는 IGA 점수가 4점(중증 AD)이었으며, 평균 BSA 침범은 57%였고, 42%는 이전에 전신 면역억제제를 투여받은 적이 있었습니다. 또한 기준선에서 평균 EASI 점수는 36점이었고, 주간 평균 최고 가려움증 NRS는 0~10점 척도에서 8점이었습니다. 전반적으로 대상의 92%에게는 하나 이상의 동반 알레르기 질환이 있었습니다. 66%는 알레르기 비염, 54%는 천식, 61%는 식품 알레르기가 있었습니다.
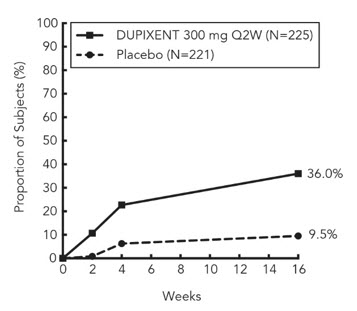
주요 평가 변수는 0주차에서 16주차까지 IGA 0(깨끗함) 또는 1(거의 깨끗함)이고 최소 2점 이상 개선된 대상의 비율이었습니다. 평가된 다른 결과에는 EASI-75 또는 EASI-90(기준선에서 EASI가 각각 75% 또는 90% 이상 개선됨)을 달성한 대상의 비율과 최고 가려움증 NRS(≥4점 개선)로 측정한 가려움증 감소가 포함되었습니다.
AD-1526에 대한 16주차의 효능 결과는 표 14에 나와 있습니다.
| DUPIXENT† 200mg(60kg 미만) 또는 300mg(60kg 이상) Q2W N=82* |
위약 N=85* |
|
|---|---|---|
| IGA 0 또는 1‡,§ | 24% | 2% |
| EASI-75§ | 42% | 8% |
| EASI-90§ | 23% | 2% |
| 최고 가려움증 NRS(≥4점 개선)§ | 37% | 5% |
DUPIXENT를 무작위 배정받은 피험자 중 위약군에 비해 최대 가려움증 NRS에서 개선을 보인 비율이 더 높았습니다(4주차에 ≥4점 개선으로 정의). 그림 2 참조.
6~11세 아토피 피부염 소아 환자
TCS와 병용한 DUPIXENT의 효능 및 안전성은 아토피 피부염이 IGA 점수 4점(0~4점), EASI 점수 ≥21점(0~72점), 최소 BSA 침범 ≥15%로 정의된 6~11세 소아 환자 367명을 대상으로 한 다기관, 무작위 배정, 이중맹검, 위약 대조 시험(AD-1652; NCT03345914)에서 평가되었습니다. 이 시험에 등록된 적격한 환자는 이전에 국소 치료에 적절한 반응을 보이지 않았습니다. 등록은 기준 체중(<30kg, ≥30kg)을 기준으로 계층화되었습니다.
DUPIXENT Q4W + TCS군의 환자는 체중에 관계없이 1일차에 600mg의 초기 용량을 투여받은 후 4주차부터 12주차까지 300mg을 Q4W로 투여받았습니다. 기준 체중이 <30kg인 DUPIXENT Q2W + TCS군의 환자는 1일차에 200mg의 초기 용량을 투여받은 후 2주차부터 14주차까지 100mg을 Q2W로 투여받았고, 기준 체중이 ≥30kg인 환자는 1일차에 400mg의 초기 용량을 투여받은 후 2주차부터 14주차까지 200mg을 Q2W로 투여받았습니다. 연구자의 재량에 따라 환자에게 응급 치료를 할 수 있었습니다. 응급 치료를 받은 환자는 반응이 없는 것으로 간주되었습니다.
AD-1652에서 평균 연령은 8.5세였고, 평균 체중은 29.8kg이었으며, 환자의 50%가 여성이었고, 69%가 백인, 17%가 흑인, 8%가 아시아인이었습니다. 기준 시점에서 평균 BSA 침범은 58%였고, 17%는 이전에 전신 비스테로이드성 면역억제제를 투여받은 적이 있었습니다. 또한 기준 시점에서 평균 EASI 점수는 37.9점이었고, 1일 최악 가려움증 점수의 주간 평균은 0~10점에서 7.8점이었습니다. 전반적으로 환자의 92%가 하나 이상의 동반 알레르기 질환을 가지고 있었습니다. 64%는 식품 알레르기, 63%는 기타 알레르기, 60%는 알레르기 비염, 47%는 천식이 있었습니다.
주요 평가 변수는 16주차에 IGA 0점(깨끗함) 또는 1점(거의 깨끗함)인 환자의 비율이었습니다. 평가된 다른 결과에는 EASI-75 또는 EASI-90(각각 기준치에서 EASI가 75% 또는 90% 이상 개선됨)인 환자의 비율과 최고 가려움증 NRS(≥4점 개선)로 측정한 가려움증 감소가 포함되었습니다.
표 15는 승인된 용량 요법에 대한 기준 체중 계층별 결과를 보여줍니다.
| DUPIXENT 300mg Q4W† + TCS |
위약 + TCS | DUPIXENT 200mg Q2W‡ + TCS |
위약 + TCS | |
|---|---|---|---|---|
| (N=61) | (N=61) | (N=59) | (N=62) | |
| <30kg | <30kg | ≥30kg | ≥30kg | |
| IGA 0점 또는 1점§,¶ | 30% | 13% | 39% | 10% |
| EASI-75¶ | 75% | 28% | 75% | 26% |
| EASI-90¶ | 46% | 7% | 36% | 8% |
| 최고 가려움증 NRS(≥4점 개선)¶ | 54% | 12% | 61% | 13% |
DUPIXENT + TCS 군에 무작위 배정된 대상자가 위약 + TCS 군에 비해 최고 가려움증 NRS에서 개선을 보인 비율이 더 높았습니다(16주차에 ≥4점 개선으로 정의). 그림 3을 참조하십시오.
아토피 피부염이 있는 6개월~5세 소아 환자
소아 환자에서 TCS와 병용한 DUPIXENT 사용의 유효성 및 안전성은 IGA 점수 ≥3(0~4점), EASI 점수 ≥16(0~72점), 최소 BSA 침범 ≥10%인 중등도~중증 AD를 가진 6개월~5세 대상자 162명을 대상으로 한 다기관, 무작위 배정, 이중맹검, 위약 대조 시험(AD-1539; NCT03346434)에서 평가되었습니다. 이 시험에 등록할 수 있는 대상자는 국소 약물에 대한 이전의 불충분한 반응을 보인 환자였습니다. 등록은 기준 체중(≥5~<15kg 및 ≥15~<30kg)으로 계층화되었습니다.
기준 체중이 ≥5~<15kg인 DUPIXENT Q4W + TCS 군의 대상자는 1일에 200mg의 초기 용량을 투여받았고, 이후 4주차부터 12주차까지 200mg Q4W를 투여받았으며, 기준 체중이 ≥15~<30kg인 대상자는 1일에 300mg의 초기 용량을 투여받았고, 이후 4주차부터 12주차까지 300mg Q4W를 투여받았습니다. 대상자는 연구자의 재량에 따라 구조 치료를 받을 수 있었습니다. 구조 치료를 받은 대상자는 반응하지 않은 것으로 간주되었습니다.
AD-1539에서 평균 연령은 3.8세였고, 평균 체중은 16.5kg이었으며, 대상자의 39%가 여성이었고, 69%가 백인, 19%가 흑인, 6%가 아시아인이었습니다. 기준선에서 평균 BSA 침범은 58%였고, 대상자의 29%가 이전에 전신 면역억제제를 투여받았습니다. 또한 기준선에서 평균 EASI 점수는 34.1이었고, 일일 최악의 긁힘/가려움 점수의 주간 평균은 0~10점에서 7.6점이었습니다. 전반적으로 대상자의 81.4%가 하나 이상의 동반 알레르기 질환을 가지고 있었고, 68.3%가 식품 알레르기, 52.8%가 다른 알레르기, 44.1%가 알레르기 비염, 25.5%가 천식을 가지고 있었습니다.
주요 평가 항목은 16주차에 IGA 0(깨끗함) 또는 1(거의 깨끗함)인 대상자의 비율이었습니다. 평가된 다른 결과에는 EASI-75 또는 EASI-90(기준선에서 EASI가 각각 75% 또는 90% 이상 개선)인 대상자의 비율과 최악의 긁힘/가려움 NRS(≥4점 개선)로 측정한 가려움증 감소가 포함되었습니다.
AD-1539에 대한 16주차의 유효성 결과는 표 16에 나와 있습니다.
| DUPIXENT + TCS 200mg(5~<15kg) 또는 300mg(15~<30kg) Q4W† |
위약 + TCS | 위약 대비 차이(95% CI) | |
|---|---|---|---|
| (N=83)* | (N=79)* | ||
| CI = 신뢰 구간 | |||
| IGA 0 또는 1‡,§ | 28% | 4% | 24%(13%, 34%) |
| EASI-75§ | 53% | 11% | 42%(29%, 55%) |
| EASI-90§ | 25% | 3% | 23%(12%, 33%) |
| 최악의 긁힘/가려움 NRS(≥4점 개선)§ | 48% | 9% | 39%(26%, 52%) |
손 및/또는 발에 나타나는 아토피 피부염
DUPIXENT의 효능 및 안전성은 중등도에서 중증의 손 및/또는 발 아토피 피부염이 있는 성인 및 12~17세 소아 피험자 133명을 대상으로 한 16주, 다기관, 무작위 배정, 이중맹검, 평행군, 위약 대조 시험(Liberty-AD-HAFT, NCT04417894)에서 평가되었습니다. 아토피 피부염의 확진 진단을 받았고, 병력 및 적절한 첩포 검사를 통해 자극성 및 알레르기성 접촉 피부염을 배제하기 위한 선별 검사를 받았으며, IGA(손 및 발) 점수 ≥3점(0~4점 척도)이고, 손 및 발 최대 가려움증에 대한 최고 가려움증 수치 등급 척도(NRS) 점수 ≥4점(0~10점 척도)인 경우 손 및/또는 발 아토피 피부염으로 정의되었습니다. 피험자 중 53%(N=70/133)는 손이나 발 이외의 부위에도 중등도에서 중증의 아토피 피부염(IGA 전체 점수 ≥3점)을 가지고 있었습니다. 적격한 피험자는 이전에 국소 아토피 피부염 치료제로 손 및/또는 발 피부염을 치료했으나 반응이 불충분했거나 불내성을 보인 환자였습니다. 이 시험에서 67명의 피험자는 DUPIXENT를 투여받았고, 66명의 피험자는 위약을 투여받았습니다. DUPIXENT 치료군 피험자는 연령 및 체중에 따라 권장 용량을 투여받았습니다. [용법 및 용량(2.3) 참조]. 피험자는 시험 기간 동안 손과 발에 대한 아토피 피부염 국소 치료제를 병용할 수 없었지만, 특정 제한 사항을 준수하는 경우 신체의 다른 부위에 대한 아토피 피부염 국소 치료제는 사용할 수 있었습니다.
Liberty-AD-HAFT에서 피험자의 38%는 남성이었고, 80%는 백인, 13%는 아시아인, 5%는 흑인 또는 아프리카계 미국인이었습니다. 민족의 경우 4%는 히스패닉 또는 라틴계로, 96%는 히스패닉 또는 라틴계가 아닌 것으로 확인되었습니다. 피험자의 72%(N=96/133)는 기준 IGA(손 및 발) 점수가 3점(중등도 손 및/또는 발 아토피 피부염)이었고, 28%(N=37/133)는 기준 IGA(손 및 발) 점수가 4점(중증 손 및/또는 발 아토피 피부염)이었습니다. 기준 주간 평균 손 및 발 최고 가려움증 NRS 점수는 7.1점이었습니다.
1차 유효성 평가변수는 16주차에 IGA 손 및 발 점수가 0점(깨끗함) 또는 1점(거의 깨끗함)인 피험자의 비율이었습니다. 주요 2차 유효성 평가변수는 손 및 발 최고 가려움증 NRS로 측정한 가려움증 감소(≥4점 개선)였습니다.
16주차에 Liberty-AD-HAFT의 효능 결과는 표 17에 제시되어 있습니다.
| DUPIXENT 200/300 mg Q2W† |
위약 | 위약 대비 차이(95% CI) | |
|---|---|---|---|
| (N=67)* | (N=66)* | ||
| CI = 신뢰 구간 | |||
|
|||
| IGA(손 및 발) 0점 또는 1점‡,§ | 40% | 17% | 24%(9%, 38%) |
| 주간 평균 손 및 발 최고 가려움증 NRS 개선(감소) ≥4점§ | 52% | 14% | 39%(24%, 53%) |
14.2 천식
12세 이상 환자를 대상으로 한 천식 개발 프로그램에는 총 2888명의 피험자가 등록된 24~52주 치료 기간의 무작위 배정, 이중맹검, 위약 대조, 병렬군, 다기관 시험 3건(DRI12544(NCT01854047), QUEST(NCT02414854) 및 VENTURE(NCT02528214))이 포함되었습니다. DRI12544 및 QUEST에 등록된 피험자는 시험 참여 1년 전에 전신 코르티코스테로이드 치료 또는 천식 치료를 위해 응급실 방문 또는 입원이 필요한 1회 이상의 천식 악화 병력이 있어야 했습니다. VENTURE에 등록된 피험자는 고용량 흡입 코르티코스테로이드와 추가 제어제를 정기적으로 사용하는 것 외에도 매일 경구 코르티코스테로이드에 의존해야 했습니다. 3건의 모든 시험에서 피험자는 최소 기준 혈액 호산구 수에 관계없이 등록되었습니다. QUEST 및 VENTURE에서 선별 혈액 호산구 수치가 >1500cells/mcL(<1.3%)인 피험자는 제외되었습니다. DUPIXENT는 배경 천식 치료에 추가로 투여되었습니다. 아래에 설명된 대로 VENTURE에서 OCS 용량이 감량된 경우를 제외하고 피험자는 연구 기간 동안 배경 천식 치료를 계속 받았습니다.
DRI12544
DRI12544는 776명의 성인 피험자(18세 이상)가 포함된 24주 용량 범위 연구였습니다. 위약과 비교한 DUPIXENT는 중용량 또는 고용량 흡입 코르티코스테로이드와 장기 작용 베타 작용제를 사용하는 중등도~중증 천식 성인 피험자에서 평가되었습니다. 피험자는 400mg, 600mg 또는 위약(N=158)의 초기 용량 후 각각 격주(Q2W)로 200mg(N=150) 또는 300mg(N=157)의 DUPIXENT를 투여받거나 4주마다 200mg(N=154) 또는 300mg(N=157)의 DUPIXENT를 투여받도록 무작위 배정되었습니다. 1차 평가변수는 기준 혈액 호산구 수치가 ≥300cells/mcL인 피험자에서 FEV1(L)의 기준치 대비 12주차까지의 평균 변화량이었습니다. 다른 평가변수는 24주간의 위약 대조 치료 기간 동안 FEV1의 기준치 대비 백분율 변화 및 중증 천식 악화 사건의 연간 발생률을 포함했습니다. 결과는 전체 모집단과 기준 혈액 호산구 수(≥300cells/mcL 및 <300cells/mcL)를 기준으로 한 하위 그룹에서 평가되었습니다. 추가 2차 평가변수는 환자 보고 천식 조절 설문지(ACQ-5) 및 천식 삶의 질 설문지 표준 버전(AQLQ(S)) 점수의 반응률을 포함했습니다.
QUEST
QUEST는 1902명의 성인 및 소아 피험자(12세 이상)가 포함된 52주 연구였습니다. 위약과 비교한 DUPIXENT는 중용량 또는 고용량 흡입 코르티코스테로이드(ICS)와 최소 1개에서 최대 2개의 추가 제어 약물을 사용하는 107명의 12~17세 소아 피험자 및 1795명의 성인 피험자에서 평가되었습니다. 피험자는 400mg, 600mg 또는 위약의 초기 용량 후 각각 격주(Q2W)로 200mg(N=631) 또는 300mg(N=633)의 DUPIXENT(또는 200mg[N=317] 또는 300mg[N=321] Q2W에 대한 일치 위약)를 투여받도록 무작위 배정되었습니다. 1차 평가변수는 52주간의 위약 대조 기간 동안의 중증 악화 사건의 연간 발생률과 전체 모집단(최소 기준 혈액 호산구 수에 제한 없음)에서 기관지확장제 투여 전 FEV1의 기준치 대비 12주차까지의 변화량이었습니다. 추가 2차 평가변수는 다양한 기준 혈액 호산구 수치를 가진 피험자의 연간 중증 악화율 및 FEV1과 ACQ-5 및 AQLQ(S) 점수의 반응률을 포함했습니다.
VENTURE
VENTURE는 고용량 흡입 코르티코스테로이드와 추가 제어제를 정기적으로 사용하는 것 외에도 매일 경구 코르티코스테로이드가 필요한 15세 이상의 천식 성인 및 소아 피험자 210명을 대상으로 한 24주 경구 코르티코스테로이드 감량 연구였습니다. 선별 기간 동안 OCS 용량을 최적화한 후, 피험자는 600mg 또는 위약의 초기 용량 후 24주 동안 격주로 1회 300mg DUPIXENT(N=103) 또는 위약(N=107)을 투여받았습니다. 피험자는 연구 중에 기존 천식 약물을 계속 투여받았습니다. 그러나 천식 조절이 유지되는 한 OCS 감량 단계(4~20주차) 동안 OCS 용량이 4주마다 감량되었습니다. 1차 평가변수는 전체 모집단(최소 기준 혈액 호산구 수에 제한 없음)에서 천식 조절을 유지하면서 기준 용량 대비 20~24주차의 경구 코르티코스테로이드 용량의 백분율 감소였습니다. 추가 2차 평가변수는 치료 기간 동안의 중증 악화 사건의 연간 발생률과 ACQ-5 및 AQLQ(S) 점수의 반응률을 포함했습니다.
이 3건의 시험에 대한 인구통계 및 기준 특성은 아래 표 18에 나와 있습니다.
| 매개변수 | DRI12544 (N=776) |
QUEST (N=1902) |
VENTURE (N=210) |
|---|---|---|---|
| ICS = 흡입 코르티코스테로이드, FEV1 = 1초간 노력 호기량, AD = 아토피 피부염, NP = 비용종, AR = 알레르기 비염, FeNO = 호기 산화질소 분율 | |||
| 평균 연령(세)(SD) | 49(13) | 48(15) | 51(13) |
| 여성 비율(%) | 63 | 63 | 61 |
| % 백인 | 78 | 83 | 94 |
| 천식 지속 기간(년), 평균(± SD) | 22 (15) | 21 (15) | 20 (14) |
| 비흡연자(%) | 77 | 81 | 81 |
| 전년도 평균 악화 횟수(± SD) | 2.2 (2.1) | 2.1 (2.2) | 2.1 (2.2) |
| 고용량 ICS 사용(%) | 50 | 52 | 89 |
| 기준치 투여 전 FEV1(L)(± SD) | 1.84 (0.54) | 1.78 (0.60) | 1.58 (0.57) |
| 기준치 예측 FEV1의 평균 백분율(%)(± SD) | 61 (11) | 58 (14) | 52 (15) |
| % 가역성(± SD) | 27 (15) | 26 (22) | 19 (23) |
| 아토피 병력 % 전체 (AD %, NP %, AR %) |
73 (8, 11, 62) |
78 (10, 13, 69) |
72 (8, 21, 56) |
| 평균 FeNO ppb(± SD) | 39 (35) | 35 (33) | 38 (31) |
| 평균 총 IgE IU/mL (± SD) | 435 (754) | 432 (747) | 431 (776) |
| 평균 기준치 혈액 호산구 수(± SD) cells/mcL | 350 (430) | 360 (370) | 350 (310) |
천식 환자의 악화
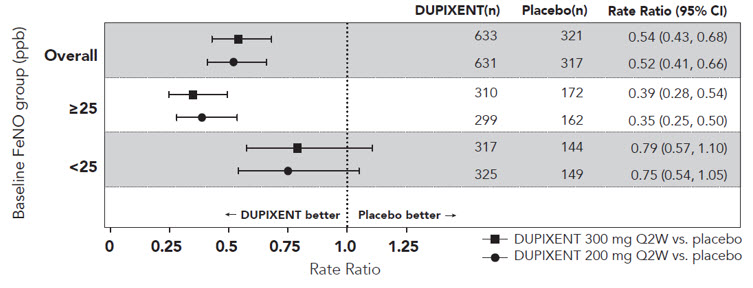
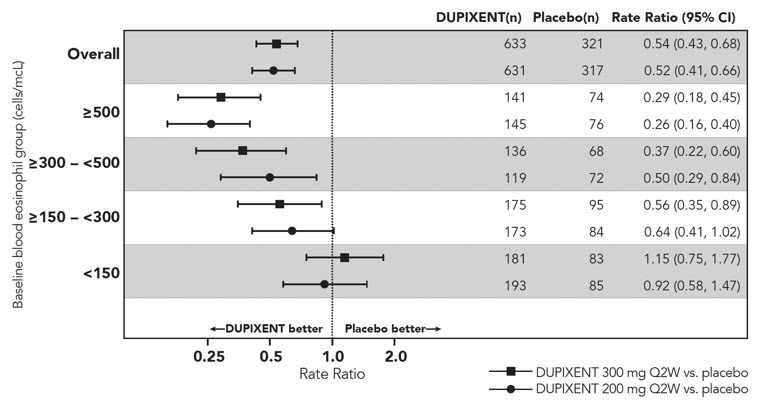
DRI12544 및 QUEST는 최소 3일 동안 전신 코르티코스테로이드 사용이 필요하거나 전신 코르티코스테로이드가 필요한 천식으로 인한 입원 또는 응급실 방문이 필요한 천식 악화로 정의되는 중증 천식 악화 빈도를 평가했습니다. 1차 분석 모집단(DRI12544에서 기준 혈액 호산구 수 ≥300cells/mcL인 대상 및 QUEST의 전체 모집단)에서 DUPIXENT 200mg 또는 300mg Q2W를 투여받은 대상은 위약에 비해 천식 악화 비율이 유의하게 감소했습니다. QUEST의 전체 모집단에서 중증 악화 비율은 DUPIXENT 200mg Q2W 및 300mg Q2W의 경우 각각 0.46 및 0.52였으며, 이에 비해 일치하는 위약 비율은 0.87 및 0.97였습니다. 위약에 비해 중증 악화의 비율 비는 DUPIXENT 200mg Q2W 및 300mg Q2W의 경우 각각 0.52(95% CI: 0.41, 0.66) 및 0.54(95% CI: 0.43, 0.68)였습니다. DRI12544 및 QUEST에서 기준 혈액 호산구 수 ≥300cells/mcL인 대상의 결과는 표 19에 나와 있습니다.
기준 혈액 호산구 및 QUEST에 대한 기준 FeNO별 반응률은 각각 그림 4와 그림 5에 전체 모집단에 대해 나와 있습니다. FeNO의 상승은 임상 데이터에 의해 뒷받침될 때 호산구성 천식 표현형의 지표가 될 수 있습니다. DRI12544 및 QUEST의 사전 지정된 하위군 분석 결과 기준 혈액 호산구 수치(≥150cells/mcL) 또는 FeNO(≥25ppb)가 높은 대상에서 중증 악화가 더 크게 감소한 것으로 나타났습니다. QUEST에서 악화 감소는 기준 혈액 호산구 ≥150cells/mcL인 대상의 하위군에서 유의했습니다. 기준 혈액 호산구 수 <150cells/mcL 및 FeNO <25ppb인 대상에서 DUPIXENT와 위약 간에 유사한 중증 악화 비율이 관찰되었습니다.
QUEST에서 입원 및/또는 응급실 방문으로 이어지는 악화의 추정 비율 비는 DUPIXENT 200mg 또는 300mg Q2W를 사용한 경우 위약에 비해 각각 0.53(95% CI: 0.28, 1.03) 및 0.74(95% CI: 0.32, 1.70)였습니다.
| 임상시험 | 치료 | 기준 혈액 EOS ≥300cells/mcL (1차 분석 모집단, DRI12544) |
||
|---|---|---|---|---|
| N | 비율 (95% CI) |
비율 비 (95% CI) |
||
| DRI12544 | DUPIXENT 200mg Q2W |
65 | 0.30 (0.13, 0.68) |
0.29 (0.11, 0.76) |
| DUPIXENT 300mg Q2W |
64 | 0.20 (0.08, 0.52) |
0.19 (0.07, 0.56) |
|
| 위약 | 68 | 1.04 (0.57, 1.90) |
||
| QUEST | DUPIXENT 200mg Q2W |
264 | 0.37 (0.29, 0.48) |
0.34 (0.24, 0.48) |
| 위약 | 148 | 1.08 (0.85, 1.38) |
||
| DUPIXENT 300mg Q2W |
277 | 0.40 (0.32, 0.51) |
0.33 (0.23, 0.45) |
|
| 위약 | 142 | 1.24 (0.97, 1.57) |
||
그림 4: 중등도~중증 천식 환자의 기준 혈액 호산구 수(cells/mcL)에 따른 중증 악화 연간 발생률의 상대적 위험(QUEST)
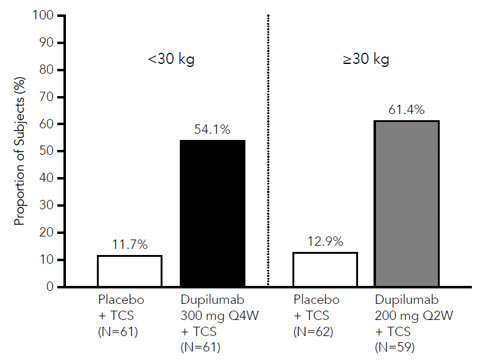
그림 5: 중등도~중증 천식 환자의 기준 FeNO 군(ppb)에 따른 중증 악화 연간 발생률의 상대적 위험(QUEST)
QUEST에서 첫 번째 악화까지의 시간은 위약에 비해 DUPIXENT를 투여받은 대상에서 더 길었습니다(그림 6).
천식 환자의 폐 기능
1차 분석 대상(DRI12544의 경우 기준 호산구 수치 ≥300 cells/mcL인 환자, QUEST의 경우 전체 환자군)에서 12주차에 기관지확장제 사용 전 FEV1이 유의하게 증가한 것으로 나타났습니다. QUEST의 전체 환자군에서 기준치 대비 FEV1 LS 평균 변화는 DUPIXENT 200mg Q2W의 경우 0.32L(21%), 300mg Q2W의 경우 0.34L(23%)였으며, 이에 대응하는 위약군의 평균은 각각 0.18L(12%)와 0.21L(14%)였습니다. 위약 대비 평균 치료 차이는 DUPIXENT 200mg Q2W의 경우 0.14L(95% CI: 0.08, 0.19), DUPIXENT 300mg Q2W의 경우 0.13L(95% CI: 0.08, 0.18)였습니다. DRI12544 및 QUEST에서 기준 호산구 수치가 ≥300 cells/mcL인 환자의 결과는 표 20에 나와 있습니다.
QUEST에서 기준 호산구 및 기준 FeNO별 FEV1 개선 사항은 각각 그림 7과 8에 나와 있습니다. DRI12544 및 QUEST의 하위그룹 분석 결과, 기준 호산구(≥150 cells/mcL) 또는 FeNO(≥25 ppb)가 더 높은 환자에서 개선 효과가 더 큰 것으로 나타났습니다. 기준 호산구 수치가 <150 cells/mcL이고 FeNO가 <25 ppb인 환자의 경우 DUPIXENT와 위약 간에 FEV1의 유사한 차이가 관찰되었습니다.
QUEST에서 시간 경과에 따른 FEV1의 평균 변화는 그림 9에 나와 있습니다.
| 시험 | 치료 | 기준 혈액 EOS ≥300 cells/mcL (1차 분석 대상, DRI12544) |
||
|---|---|---|---|---|
| N | 기준치 대비 LS 평균 변화 L (%) |
위약 대비 LS 평균 차이 (95% CI) |
||
| DRI12544 | DUPIXENT 200mg Q2W |
65 | 0.43 (25.9) | 0.26 (0.11, 0.40) |
| DUPIXENT 300mg Q2W |
64 | 0.39 (25.8) | 0.21 (0.06, 0.36) |
|
| 위약 | 68 | 0.18 (10.2) | ||
| QUEST | DUPIXENT 200mg Q2W |
264 | 0.43 (29.0) | 0.21 (0.13, 0.29) |
| 위약 | 148 | 0.21 (15.6) | ||
| DUPIXENT 300mg Q2W |
277 | 0.47 (32.5) | 0.24 (0.16, 0.32) |
|
| 위약 | 142 | 0.22 (14.4) | ||
Figure 7: LS Mean Difference in Change from Baseline vs Placebo to Week 12 in Pre-Bronchodilator FEV1 across Baseline Blood Eosinophil Counts (cells/mcL) in Subjects with Moderate-to-Severe Asthma (QUEST)
Figure 8: LS Mean Difference in Change from Baseline vs Placebo to Week 12 in Pre-bronchodilator FEV1 across Baseline FeNO (ppb) in Subjects with Moderate-to-Severe Asthma (QUEST)
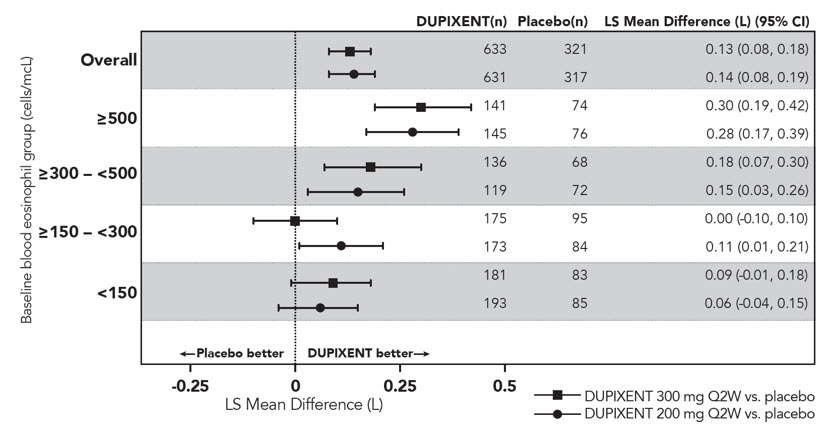
Figure 9: Mean Change from Baseline in Pre-Bronchodilator FEV1 (L) Over Time in Subjects with Moderate-to-Severe Asthma with Baseline Blood Eosinophils ≥300 cells/mcL (QUEST)
천식 임상시험의 추가적인 2차 평가변수 (QUEST)
QUEST에서 52주차에 ACQ-5 및 AQLQ(S)를 평가했습니다. 반응자 비율은 0.5점 이상의 점수 개선으로 정의되었습니다(척도 범위 ACQ-5의 경우 0-6점, AQLQ(S)의 경우 1-7점).
- 전체 모집단에서 DUPIXENT 200mg 및 300mg을 2주마다 투여했을 때 ACQ-5 반응자 비율은 각각 69% 대 위약 62%(오즈비 1.37, 95% CI: 1.01, 1.86) 및 69% 대 위약 63%(오즈비 1.28, 95% CI: 0.94, 1.73)였으며, AQLQ(S) 반응자 비율은 각각 62% 대 위약 54%(오즈비 1.61, 95% CI: 1.17, 2.21) 및 62% 대 위약 57%(오즈비 1.33, 95% CI: 0.98, 1.81)였습니다.
- 기준 혈액 호산구 수치가 300cells/mcL 이상인 피험자에서 DUPIXENT 200mg 및 300mg을 2주마다 투여했을 때 ACQ-5 반응자 비율은 각각 75% 대 위약 67%(오즈비: 1.46, 95% CI: 0.90, 2.35) 및 71% 대 위약 64%(오즈비: 1.39, 95% CI: 0.88, 2.19)였으며, AQLQ(S) 반응자 비율은 각각 71% 대 위약 55%(오즈비: 2.02, 95% CI: 1.24, 3.32) 및 65% 대 위약 55%(오즈비: 1.79, 95% CI: 1.13, 2.85)였습니다.
천식 임상시험에서 경구용 코르티코스테로이드 감량 (VENTURE)
VENTURE는 유지 경구용 코르티코스테로이드의 사용을 줄이는 데 DUPIXENT의 효과를 평가했습니다. 기준 평균 경구용 코르티코스테로이드 용량은 위약군에서 12mg, DUPIXENT 투여군에서 11mg이었습니다. 1차 평가변수는 천식 조절을 유지하면서 24주차에 최종 경구용 코르티코스테로이드 용량을 기준치 대비 백분율 감소한 것이었습니다.
위약과 비교했을 때, DUPIXENT를 투여받은 피험자는 천식 조절을 유지하면서 일일 유지 경구용 코르티코스테로이드 용량이 더 크게 감소했습니다. 일일 OCS 용량의 기준치 대비 평균 백분율 감소는 DUPIXENT 투여군에서 70%(중앙값 100%)(95% CI: 60%, 80%)였으며, 위약 투여군에서는 42%(중앙값 50%)(95% CI: 33%, 51%)였습니다. OCS 용량이 50% 이상 감소한 경우는 DUPIXENT 투여군에서 82명(80%), 위약 투여군에서 57명(53%)에서 관찰되었습니다. 24주차에 평균 최종 용량이 5mg 미만인 피험자의 비율은 DUPIXENT의 경우 72%, 위약의 경우 37%(오즈비 4.48, 95% CI: 2.39, 8.39)였습니다. DUPIXENT 투여군의 총 54명(52%)과 위약군의 31명(29%)의 피험자가 OCS 용량을 100% 감량했습니다.
이 24주 임상시험에서 천식 악화(최소 3일 동안 경구용 코르티코스테로이드 용량이 일시적으로 증가한 것으로 정의)는 위약군(DUPIXENT군의 경우 연간 발생률 0.65, 위약군의 경우 1.60, 발생률 비율 0.41 [95% CI 0.26, 0.63])에 비해 DUPIXENT를 투여받은 피험자에서 더 낮았으며, 기준치에서 24주차까지의 기관지확장제 사용 전 FEV1 개선은 위약군(DUPIXENT 대 위약의 LS 평균 차이 0.22L [95% CI: 0.09~0.34L])에 비해 DUPIXENT를 투여받은 피험자에서 더 컸습니다. 폐 기능, 경구 스테로이드 및 악화 감소에 대한 효과는 기준 혈액 호산구 수치와 관계없이 유사했습니다. VENTURE에서 ACQ-5 및 AQLQ(S)도 평가되었으며 QUEST에서 나타난 것과 유사한 개선을 보였습니다.
천식이 있는 6~11세 소아 피험자
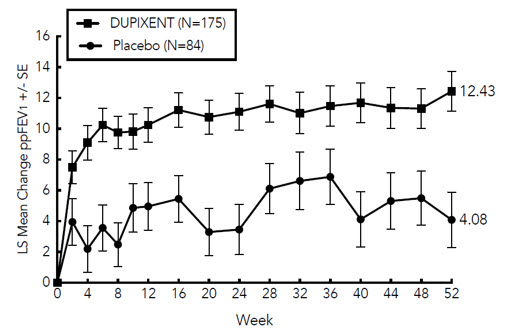
DUPIXENT의 효능 및 안전성은 중간 또는 고용량 ICS와 두 번째 조절제 약물 또는 고용량 ICS 단독으로 중등증에서 중증 천식을 앓고 있는 6~11세 피험자 408명을 대상으로 실시한 52주, 다기관, 무작위 배정, 이중맹검, 위약 대조 연구(VOYAGE, NCT02948959)에서 평가되었습니다. 피험자는 임상시험 참여 전 1년 동안 전신 코르티코스테로이드 치료 또는 천식 치료를 위한 응급실 방문 또는 입원이 필요한 천식 악화를 1회 이상 경험한 적이 있어야 했습니다. 피험자는 체중 <30kg(100mg 격주 투여) 또는 ≥30kg(200mg 격주 투여)을 기준으로 격주로 DUPIXENT(N=273) 또는 일치 위약(N=135)을 무작위로 투여받았습니다. DUPIXENT 300mg을 4주마다 투여했을 때의 유효성은 VOYAGE에서 100mg을 2주마다 투여했을 때의 효능에서 외삽되었으며, 300mg을 4주마다 투여했을 때 약물 노출 수준이 더 높다는 것을 보여주는 모집단 약동학 분석에서 뒷받침되었습니다. [소아에게의 사용(8.4) 및 약동학(12.3) 참조].
1차 평가변수는 52주 위약 대조 기간 동안의 중증 천식 악화 사건의 연간 발생률이었습니다. 중증 천식 악화는 최소 3일 동안 전신 코르티코스테로이드 사용이 필요하거나 전신 코르티코스테로이드가 필요한 천식으로 인한 입원 또는 응급실 방문이 필요한 천식 악화로 정의되었습니다. 주요 2차 평가변수는 12주차에 기관지확장제 사용 전 FEV1 예측 백분율의 기준치 대비 변화였습니다. 추가적인 2차 평가변수에는 ACQ-7-IA(Asthma Control Questionnaire-7-Interviewer Administered) 및 PAQLQ(S)-IA(Pediatric Asthma Quality of Life Questionnaire with Standardized Activities Interviewer Administered) 점수의 기준치 대비 평균 변화 및 반응자 비율이 포함되었습니다.
VOYAGE에 대한 인구 통계 및 기준 특성은 아래 표 21에 나와 있습니다.
| 매개변수 | VOYAGE (N=408) |
|---|---|
| ICS = 흡입 코르티코스테로이드, FEV1 = 1초간 노력 호기량, AD = 아토피 피부염, AR = 알레르기 비염, FeNO = 호기 산화 질소 분율 | |
| 평균 연령(세)(SD) | 9 (2) |
| 여성 비율(%) | 36 |
| 백인 비율(%) | 88 |
| 평균 체중(kg) | 36 |
| 전년도 평균 악화 횟수(± SD) | 2.4 (2.2) |
| 고용량 ICS 사용 비율(%) | 44 |
| 기준선에서 투여 전 FEV1(L)(± SD) | 1.48 (0.41) |
| 평균 예측 FEV1 비율(%)(±SD) | 78 (15) |
| 평균 가역성 비율(%)(± SD) | 20 (21) |
| 아토피 병력 비율 전체 (AD 비율(%), AR 비율(%)) |
92 (36, 82) |
| 평균 FeNO ppb(± SD) | 28 (24) |
| FeNO ppb ≥20인 피험자 비율(%) | 50 |
| 전체 IgE IU/mL 중앙값(±SD) | 792 (1093) |
| 평균 기준선 호산구 수(± SD) 세포/mcL | 502 (395) |
DUPIXENT는 호산구 수치 상승 및/또는 FeNO 수치 상승으로 나타나는 호산구성 표현형을 가진 소아 환자군에서 위약과 비교하여 52주 치료 기간 동안 연간 중증 천식 악화 발생률을 유의하게 감소시켰습니다. 기준 호산구 수치 또는 기준 FeNO 수치에 따른 DUPIXENT 치료 결과에 대한 하위군 분석은 소아(12~17세) 및 성인 임상 시험과 유사했으며 위에서 소아(12~17세) 및 성인 천식 환자군에 대해 설명했습니다. 기준 혈액 호산구 수 <150 cells/mcL 및 FeNO <20 ppb인 피험자에서 DUPIXENT와 위약 간에 유사한 중증 천식 악화 발생률이 관찰되었습니다.
12주차에 예측된 기관지확장제 사용 전 FEV1 백분율의 유의한 개선이 관찰되었습니다. VOYAGE에서 2주차에 예측된 FEV1 백분율의 유의한 개선이 관찰되었으며 52주차까지 유지되었습니다(그림 10).
VOYAGE의 효능 결과는 표 22에 제시되어 있습니다.
| 치료 | EOS ≥300 cells/mcL* | ||
|---|---|---|---|
| 52주 동안의 연간 중증 악화 발생률 | |||
| N | 발생률 (95% CI) |
발생률 비율 (95% CI) |
|
| DUPIXENT 100mg Q2W† (<30kg)/ 200mg Q2W (≥30kg) |
175 | 0.24 (0.16, 0.35) |
0.35 (0.22, 0.56) |
| 위약 | 84 | 0.67 (0.47, 0.95) |
|
| 12주차에 예측된 FEV1 백분율의 기준선 대비 평균 변화 | |||
| N | 기준선 대비 LS 평균 변화량 | 위약 대비 LS 평균 차이(95% CI) | |
| DUPIXENT 100mg Q2W† (<30kg)/ 200mg Q2W (≥30kg) |
168 | 10.15 | 5.32 (1.76, 8.88) |
| 위약 | 80 | 4.83 | |
Figure 10: 6~11세 소아 대상 VOYAGE 연구 (기준치 혈액 호산구 수 ≥300 cells/mcL)에서 시간 경과에 따른 예상 기관지확장제 투여 전 FEV1 (L) 백분율의 기준치 대비 평균 변화량
개선은 24주차에 ACQ-7-IA 및 PAQLQ(S)-IA에서도 관찰되었으며 52주차까지 유지되었습니다. 24주차에 위약과 비교하여 ACQ-7-IA 및 PAQLQ(S)-IA에서 더 큰 반응률이 관찰되었습니다. 반응률은 0.5점 이상의 점수 개선으로 정의되었습니다(ACQ-7-IA의 경우 0~6점, PAQLQ(S)-IA의 경우 1~7점 척도). 기준치 혈액 호산구 수가 ≥300 cells/mcL인 하위 그룹에서 DUPIXENT는 24주차에 ACQ-7-IA에서 반응을 보인 피험자 비율이 더 높았고(80.6% 대 위약 64.3%), OR은 2.79(95% CI: 1.43, 5.44)였으며, PAQLQ(S)-IA에서 반응을 보인 피험자 비율이 더 높았고(72.8% 대 위약 63.0%), OR은 1.84(95% CI: 0.92, 3.65)였습니다.
14.3 비용종을 동반한 만성 부비동염
부적절하게 조절된 비용종을 동반한 만성 부비동염(CRSwNP)을 앓고 있는 성인에서 추가 유지 치료제로서 DUPIXENT의 효능은 배경 비강 내 코르티코스테로이드(INCS)를 투여받은 18세 이상 성인 피험자 724명을 대상으로 한 두 건의 무작위 배정, 이중맹검, 평행군, 다기관, 위약 대조 연구(SINUS-24(NCT02912468) 및 SINUS-52(NCT02898454))에서 평가되었습니다. 이러한 연구에는 지난 2년 동안 부비동 수술 또는 전신 코르티코스테로이드 치료를 받았음에도 불구하고 CRSwNP가 있거나, 전신 코르티코스테로이드를 투여받을 자격이 없거나, 이에 내성이 있는 피험자가 포함되었습니다. 비용종이 없는 만성 부비동염 환자는 이러한 임상시험에 포함되지 않았습니다. 연구 중에 연구자의 재량에 따라 전신 코르티코스테로이드 또는 수술로 구제를 받을 수 있었습니다. SINUS-24에서 총 276명의 피험자가 24주 동안 격주로 300mg DUPIXENT(N=143) 또는 위약(N=133)을 투여받도록 무작위 배정되었습니다. SINUS-52에서 448명의 피험자가 52주 동안 격주로 300mg DUPIXENT(N=150), 24주차까지 격주로 300mg DUPIXENT(N=145)를 투여받은 후 52주차까지 4주마다 300mg DUPIXENT를 투여받거나, 위약(N=153)을 투여받도록 무작위 배정되었습니다. 모든 피험자는 Lund Mackay(LMK) 부비동 CT 스캔에서 부비동 불투명화 증거가 있었고, 73%~90%의 피험자는 모든 부비동의 불투명화가 있었습니다. 피험자는 이전 수술 이력 및 동반 질환인 천식/비스테로이드성 항염증제 악화 호흡기 질환(NSAID-ERD)을 기준으로 계층화되었습니다. 피험자의 총 63%가 이전에 부비동 수술을 받았다고 보고했으며, 평균 이전 수술 횟수는 2.0회였고, 74%는 지난 2년 동안 전신 코르티코스테로이드를 사용했으며 지난 2년 동안 평균 전신 코르티코스테로이드 치료 횟수는 1.6회였고, 59%는 동반 질환인 천식이 있었고, 28%는 NSAID-ERD가 있었습니다.
공동 일차 효능 종료점은 중앙 맹검 판독자가 등급을 매긴 기준치에서 24주차까지 양측 내시경 비용종 점수(NPS, 0~8점 척도)의 변화와 피험자가 일일 일기를 사용하여 결정한 기준치에서 24주차까지 28일 동안의 평균 비강 울혈/폐쇄 점수(NC, 0~3점 척도)의 변화였습니다. NPS의 경우 코 양쪽의 용종을 범주형 척도(0=용종 없음, 1=중비도에 작은 용종이 있고 중비갑개의 하연 아래로 뻗어 있지 않음, 2=중비갑개의 하연 아래로 뻗어 있는 용종, 3=하비갑개의 하연에 닿거나 중비갑개의 내측에 있는 큰 용종, 4=하비강을 완전히 막는 큰 용종)로 등급을 매겼습니다. 총점은 오른쪽과 왼쪽 점수의 합계였습니다. 비강 울혈은 피험자가 0~3점 범주형 중증도 척도(0=증상 없음, 1=경증, 2=중등도, 3=중증)를 사용하여 매일 평가했습니다.
두 연구 모두에서 24주차의 주요 이차 종료점에는 기준치에서 다음으로의 변화가 포함되었습니다. LMK 부비동 CT 스캔 점수, 일일 후각 상실, 22개 항목 부비동 결과 테스트(SNOT-22). LMK 부비동 CT 스캔 점수는 0~2점 척도(0=정상, 1=부분 불투명화, 2=전체 불투명화)를 사용하여 각 부비동의 불투명화를 평가하여 한쪽당 최대 12점, 총점 최대 24점을 산출했습니다(점수가 높을수록 불투명화가 더 심함을 나타냄). 후각 상실은 피험자가 매일 아침 0~3점 척도(0=증상 없음, 1=경증, 2=중등도, 3=중증)로 반영하여 점수를 매겼습니다. SNOT-22에는 CRSwNP와 관련된 증상 및 증상 영향을 평가하는 22개 항목이 포함되어 있으며, 각 항목은 0점(문제 없음)에서 5점(가능한 한 심각한 문제)까지 점수를 매기고 총점은 0~110점입니다. SNOT-22는 2주 회상 기간을 가졌습니다. 취합된 효능 결과에서 전신 코르티코스테로이드 및/또는 부비동 수술로 구제를 받은 피험자 비율의 감소(최대 52주차까지)를 평가했습니다.
이러한 2건의 임상시험의 인구 통계 및 기준치 특성은 아래 표 23에 나와 있습니다.
| 매개변수 | SINUS-24 (N=276) |
SINUS-52 (N=448) |
|---|---|---|
| SD = 표준 편차, AM = 오전, NPS = 비용종 점수, SNOT-22 = 22개 항목 부비동 결과 테스트, NSAID-ERD = 천식/비스테로이드성 항염증제 악화 호흡기 질환 | ||
|
||
| 평균 연령(세)(SD) | 50(13) | 52(12) |
| 남성 비율(%) | 57 | 62 |
| 평균 CRSwNP 기간(년)(SD) | 11(9) | 11(10) |
| 이전 수술 ≥1회를 받은 피험자 비율(%) | 72 | 58 |
| 지난 2년 동안 전신 코르티코스테로이드를 사용한 환자 비율 (%) | 65 | 80 |
| 평균 양측 내시경 NPS* (SD), 범위 0-8 | 5.8 (1.3) | 6.1 (1.2) |
| 평균 코막힘(NC) 점수* (SD), 범위 0-3 | 2.4 (0.6) | 2.4 (0.6) |
| 평균 LMK 부비동 CT 총점* (SD), 범위 0-24 | 19 (4.4) | 18 (3.8) |
| 평균 후각 상실 점수 *(AM), (SD) 범위 0-3 | 2.7 (0.5) | 2.8 (0.5) |
| 평균 SNOT-22 총점* (SD), 범위 0-110 | 49.4 (20.2) | 51.9 (20.9) |
| 평균 혈액 호산구 수(cells/mcL) (SD) | 440 (330) | 430 (350) |
| 평균 총 IgE IU/mL (SD) | 212 (276) | 240 (342) |
| 아토피 병력 % 전체 |
75 | 82 |
| 천식 (%) | 58 | 60 |
| NSAID-ERD (%) | 30 | 27 |
임상 반응(SINUS-24 및 SINUS-52)
CRSwNP 연구의 1차 평가변수 결과는 표 24에 제시되어 있습니다.
| SINUS-24 | SINUS-52 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 위약 (n=133) |
DUPIXENT 300mg 격주 투여 (n=143) |
위약 대비 LS 평균 차이 (95% CI) |
위약 (n=153) |
DUPIXENT 300mg 격주 투여 (n=295) |
위약 대비 LS 평균 차이 (95% CI) |
|||||
| 24주차의 1차 평가변수 | ||||||||||
| 점수 | 기준선 평균 | LS 평균 변화량 | 기준선 평균 | LS 평균 변화량 | 기준선 평균 | LS 평균 변화량 | 기준선 평균 | LS 평균 변화량 | ||
| 점수 감소는 개선을 나타냅니다. NPS = 비용종 점수, NC = 코막힘/폐쇄 |
||||||||||
| NPS | 5.86 | 0.17 | 5.64 | -1.89 | -2.06 (-2.43, -1.69) |
5.96 | 0.10 | 6.18 | -1.71 | -1.80 (-2.10, -1.51) |
| NC | 2.45 | -0.45 | 2.26 | -1.34 | -0.89 (-1.07, -0.71) |
2.38 | -0.38 | 2.46 | -1.25 | -0.87 (-1.03, -0.71) |
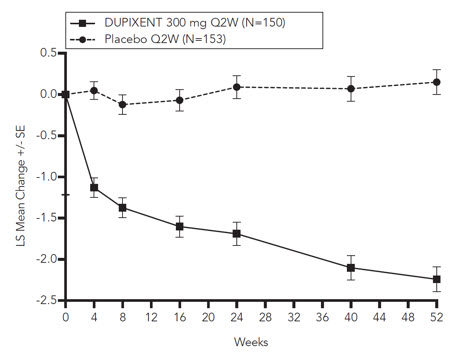
SINUS-52에서 24주 및 52주차에 양측 내시경 NPS 점수 개선과 관련하여 통계적으로 유의미한 효능이 관찰되었습니다( 그림 11 참조).
그림 11: CRSwNP가 있는 18세 이상 피험자의 양측 비폴립 점수(NPS) 기준선 대비 최대 52주까지의 LS 평균 변화(SINUS-52 – ITT 모집단)
24주차에 SINUS-24에서도 유사한 결과가 나타났습니다. 피험자들이 DUPIXENT를 중단한 치료 후 기간에는 치료 효과가 시간이 지남에 따라 감소했습니다( 그림 12 참조).
그림 12: CRSwNP가 있는 18세 이상 피험자의 양측 비폴립 점수(NPS) 기준선 대비 최대 48주까지의 LS 평균 변화(SINUS-24 – ITT 모집단)
52주차에 DUPIXENT군과 위약군 간의 코막힘에 대한 LS 평균 차이는 -0.98(95% CI -1.17, -0.79)였습니다. 두 연구 모두에서 4주차의 첫 번째 평가만큼 빠르게 코막힘이 유의미하게 개선된 것으로 나타났습니다. DUPIXENT군과 위약군 간의 4주차 코막힘에 대한 LS 평균 차이는 SINUS-24에서 -0.41(95% CI: -0.52, -0.30), SINUS-52에서 -0.37(95% CI: -0.46, -0.27)였습니다.
LMK 부비동 CT 스캔 점수가 유의미하게 감소한 것으로 나타났습니다. DUPIXENT군과 위약군 간의 24주차 LMK 부비동 CT 스캔 점수에 대한 LS 평균 차이는 SINUS-24에서 -7.44(95% CI: -8.35, -6.53), SINUS-52에서 -5.13(95% CI: -5.80, -4.46)였습니다. 52주차에 SINUS-52에서 DUPIXENT군과 위약군 간의 LMK 부비동 CT 스캔 점수에 대한 LS 평균 차이는 -6.94(95% CI: -7.87, -6.01)였습니다.
Dupilumab은 위약에 비해 후각 상실을 유의미하게 개선했습니다. DUPIXENT군과 위약군 간의 24주차 후각 상실에 대한 LS 평균 차이는 SINUS-24에서 -1.12(95% CI: -1.31, -0.93), SINUS-52에서 -0.98(95% CI: -1.15, -0.81)였습니다. 52주차에 DUPIXENT군과 위약군 간의 후각 상실에 대한 LS 평균 차이는 -1.10(95% CI -1.31, -0.89)였습니다. 두 연구 모두에서 4주차의 첫 번째 평가만큼 빠르게 일일 후각 상실 중증도가 유의미하게 개선된 것으로 나타났습니다.
Dupilumab은 위약에 비해 SNOT-22로 측정한 부비강 증상을 유의미하게 감소시켰습니다. DUPIXENT군과 위약군 간의 24주차 SNOT-22에 대한 LS 평균 차이는 SINUS-24에서 -21.12(95% CI: -25.17, -17.06), SINUS-52에서 -17.36(95% CI: -20.87, -13.85)였습니다. 52주차에 DUPIXENT군과 위약군 간의 LS 평균 차이는 -20.96(95% CI -25.03, -16.89)였습니다.
두 연구에 대한 사전 지정된 다중성 조정된 취합 분석에서 DUPIXENT로 치료한 결과 위약에 비해 전신 코르티코스테로이드 사용 및 부비강 수술 필요성이 유의미하게 감소했습니다(HR 0.24, 95% CI: 0.17, 0.35)( 그림 13 참조). 전신 코르티코스테로이드가 필요한 피험자의 비율은 74%(HR 0.26, 95% CI: 0.18, 0.38) 감소했습니다. 연간 전신 코르티코스테로이드 치료 과정의 총 수는 75%(RR 0.25, 95% CI: 0.17, 0.37) 감소했습니다. 수술이 필요한 피험자의 비율은 83%(HR 0.17, 95% CI: 0.07, 0.46) 감소했습니다.
그림 13: CRSwNP가 있는 18세 이상 피험자의 치료 기간 동안 첫 번째 전신 코르티코스테로이드 사용 및/또는 부비강 수술까지의 시간에 대한 카플란-마이어 곡선(SINUS-24 및 SINUS-52 취합 – ITT 모집단)
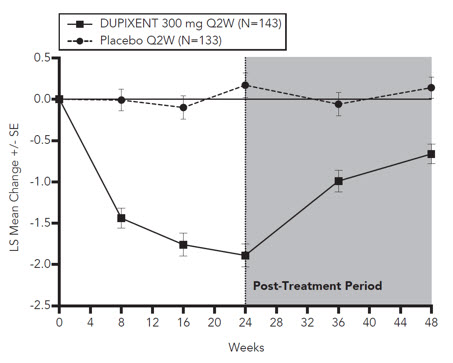
NPS 및 코막힘이라는 1차 평가변수와 LMK 부비동 CT 스캔 점수라는 주요 2차 평가변수에 대한 DUPIXENT의 효과는 이전에 수술을 받은 피험자와 수술을 받지 않은 피험자에서 일관되었습니다.
동반 질환인 천식이 있는 피험자의 경우 기관지확장제 사용 전 FEV1 개선은 천식 프로그램의 피험자와 유사했습니다.
14.4 호산구성 식도염
EoE가 있는 12세 이상의 성인 및 소아 피험자
EoE가 있는 12세 이상, 체중 40kg 이상의 성인 및 소아 피험자를 대상으로 24주 치료 기간 2회(EoE-1 연구 A부 및 B부)를 포함하는 단일 무작위배정, 이중맹검, 병렬군, 다기관, 위약 대조 시험을 실시했습니다(NCT03633617). 두 부분 모두에서 피험자는 무작위로 매주 DUPIXENT 300mg 또는 위약을 투여받았습니다. 적격한 피험자는 스크리닝 기간 이전 또는 스크리닝 기간 동안 양성자 펌프 억제제(PPI) 치료 과정을 거친 후 고배율 시야당 식도 상피내 호산구 수가 ≥15개(eos/hpf)였고 연하곤란 증상 설문지(DSQ)로 측정한 연하곤란 증상이 있었습니다. 기준선에서 A부 피험자의 43%와 B부 피험자의 37%가 이전에 식도 확장술을 받은 적이 있었습니다.
A부와 B부의 인구 통계 및 기준선 특성은 유사했습니다. 총 81명의 피험자(성인 61명, 소아 피험자 20명)가 A부에 등록했고 159명의 피험자(성인 107명, 소아 피험자 52명)가 B부에 등록했습니다. 평균 연령은 A부에서 32세(범위 13~62세), B부에서 28세(범위 12~66세)였습니다. 대부분의 피험자는 남성(A부 60%, B부 68%)이고 백인(A부 96%, B부 90%)이었습니다. 평균 기준선 DSQ 점수(SD)는 A부에서 33.6(12.4), B부에서 37.2(10.7)였습니다.
A부와 B부의 공동 1차 효능 평가변수는 (1) 24주차에 최대 식도 상피내 호산구 수 ≤6 eos/hpf로 정의된 조직학적 관해를 달성한 피험자의 비율, (2) 기준선에서 24주차까지 피험자가 보고한 DSQ 점수의 절대적 변화였습니다.
A부와 B부의 효능 결과는 표 25에 나와 있습니다.
| EoE-1 연구 파트 A | EoE-1 연구 파트 B | |||||
|---|---|---|---|---|---|---|
| DUPIXENT 300 mg QW* | 위약* | 위약 대비 차이 (95% CI)* |
DUPIXENT 300 mg QW* | 위약* | 위약 대비 차이 (95% CI)* |
|
| N = 42 | N = 39 | N = 80 | N = 79 | |||
| 공동 1차 평가변수 | ||||||
| 조직학적 관해를 달성한 피험자 비율(최고 식도 상피내 호산구 수 ≤6 eos/hpf), n (%) | 25 (59.5) |
2 (5.1) |
57.0 (40.9, 73.1) |
47 (58.8) |
5 (6.3) |
53.5 (41.2, 65.8) |
| 기준치 대비 DSQ 점수(0-84†)의 절대적 변화, LS 평균(SE) | -21.9 (2.5) |
-9.6 (2.8) |
-12.3 (-19.1, -5.5) |
-23.8 (1.9) |
-13.9 (1.9) |
-9.9 (-14.8, -5.0) |
A파트 및 B파트에서 위약군에 비해 DUPIXENT 무작위 배정을 받은 대상자 중 더 많은 비율이 조직학적 관해(최고 식도 상피내 호산구 수 ≤6 eos/hpf)에 도달했습니다. 또한 DUPIXENT로 치료한 결과 24주차에 위약군에 비해 LS 평균 DSQ 점수 변화가 유의미하게 개선되었습니다. 대상자의 관점을 통합한 앵커 기반 분석 결과 A파트 및 B파트에서 관찰된 연하곤란 개선이 임상적으로 의미 있는 대상 내 개선을 나타내는 것으로 나타났습니다.
1~11세, 체중 15kg 이상의 EoE 소아 대상자
무작위 배정, 눈가림, 평행군, 다기관 시험(EoE-2 연구 A파트 및 B파트, NCT04394351)에서 1~11세, 체중 15kg 이상의 EoE 소아 대상자에서 DUPIXENT의 유효성 및 안전성을 평가했습니다. 적격 대상자는 스크리닝 기간 이전 또는 스크리닝 기간 동안 양성자 펌프 억제제(PPI) 치료 과정에도 불구하고 고배율 시야당 ≥15개의 상피내 호산구(eos/hpf)를 보였고 EoE 징후 및 증상의 병력이 있었습니다. A파트에서는 16주 치료 기간 동안 61명의 대상자를 대상으로 체중 기반 DUPIXENT 용량 요법인 200mg Q2W(≥15~<30kg) 및 300mg Q2W(≥30~<60kg) 또는 위약을 평가했습니다.
1~11세, 체중 40kg 이상의 소아 대상자에 대한 권장 용량인 300mg QW는 EoE가 있는 성인 및 12세 이상, 체중 40kg 이상의 소아 대상자에서 300mg QW 용량에 비해 유사한 노출을 제공하기 위해 모델링된 약동학 데이터를 기반으로 합니다. [용량 및 투여(2.6) 및 약동학(12.3) 참조].
A파트를 완료한 47명의 대상자를 대상으로 36주 연장된 활성 치료 기간(EoE-2 연구 B파트) 동안 평가했습니다. B파트의 모든 대상자는 A파트에 대해 설명된 체중 기반 DUPIXENT 용량 요법으로 치료받았습니다.
A파트에서 평가된 전체 대상자의 평균 연령은 8세였고, 평균 체중은 28kg이었으며, 75%가 남성이었습니다. 7%가 히스패닉 또는 라틴계로 확인되었으며, 85%가 백인, 12%가 흑인, 2%가 아시아인으로 확인되었으며, 2%는 다른 인종 하위 그룹으로 확인되었습니다.
A파트의 1차 유효성 평가 변수는 16주차에 최고 식도 상피내 호산구 수 ≤6 eos/hpf로 정의된 조직학적 관해에 도달한 대상자의 비율이었습니다.
A파트에 대한 유효성 결과는 표 26에 제시되어 있습니다.
| DUPIXENT* N=32 |
위약 N=29 |
위약 대비 차이 (95% CI) |
|
|---|---|---|---|
|
|||
| 조직학적 관해에 도달한 대상자의 비율(최고 식도 상피내 호산구 수 ≤6 eos/hpf), n (%)† | 21 (65.6) |
1 (3.4) |
62.0 (44.00, 79.95) |
B파트에서 히스토리적 관해는 A파트와 B파트에서 DUPIXENT로 치료받은 32명의 대상자 중 17명과 A파트에서 위약을, B파트에서 DUPIXENT로 치료받은 15명의 대상자 중 8명에서 52주차에 달성되었습니다.
EoE-2 연구 A파트에서 관찰자 보고 결과인 소아 EoE 징후/증상 설문지-보호자(PESQ-C)를 사용하여 EoE의 징후를 측정했습니다. 16주 치료 후 위약군에 비해 DUPIXENT로 치료받은 대상자에서 EoE의 1가지 이상의 징후가 나타난 날짜 비율(PESQ-C 기준)이 더 크게 감소한 것으로 관찰되었습니다.
14.5 결절성 양진
결절성 양진(PN) 개발 프로그램에는 가려움증(0~10점 척도에서 WI-NRS ≥ 7)과 20개 이상의 결절성 병변이 있는 18세 이상 성인 대상자 311명을 대상으로 한 2건의 24주 무작위 배정, 이중맹검, 위약 대조, 다기관, 병렬군 임상시험(PRIME(NCT04183335) 및 PRIME 2(NCT04202679))이 포함되었습니다. PRIME 및 PRIME 2에서는 가려움증 개선에 대한 DUPIXENT의 효과와 PN 병변에 대한 효과를 평가했습니다.
이 두 임상시험에서 대상자들은 1일째에 피하 DUPIXENT 600mg(300mg 주사 2회)을 투여받은 후 24주 동안 격주로 300mg을 1회(Q2W) 투여받거나, 일치하는 위약을 투여받았습니다.
이러한 임상시험에서 평균 연령은 49.5세였고, 평균 체중은 71kg이었으며, 대상자의 65%가 여성이었고, 57%가 백인, 6%가 흑인, 34%가 아시아인이었습니다. 기준선에서 평균 최악의 가려움증-숫자 등급 척도(WI-NRS)는 8.5였고, 66%는 20~100개의 결절(중등도)을 가지고 있었고, 34%는 100개가 넘는 결절(중증)을 가지고 있었습니다. 대상자의 11%는 기준선에서 안정적인 용량의 항우울제를 복용하고 있었고 임상시험 기간 동안 이러한 약물을 계속 복용하도록 지시받았습니다. 43%는 아토피 병력(AD, 알레르기 비염/알레르기 결막염, 천식 또는 식품 알레르기 병력이 있는 것으로 정의)이 있었습니다.
WI-NRS는 “가려움증 없음”에서 10 “상상할 수 있는 최악의 가려움증”까지의 척도로 평가되는 단일 항목으로 구성됩니다. 대상자들은 지난 24시간 동안 가장 심한 가려움증의 강도를 이 척도를 사용하여 평가하도록 요청받았습니다. 연구자의 결절성 양진-단계에 대한 전체 평가(IGA PN-S)는 0(깨끗함)에서 4(심각)까지의 5점 척도를 사용하여 대략적인 결절 수를 측정하는 척도입니다.
유효성은 WI-NRS가 ≥4점 개선(감소)된 대상자의 비율, IGA PN-S 0 또는 1(0~5개 결절에 해당)인 대상자의 비율, 위에서 설명한 기준에 따라 WI-NRS와 IGA PN-S 모두에서 반응을 달성한 대상자의 비율로 평가했습니다.
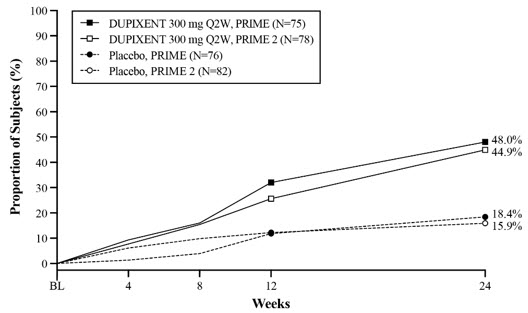
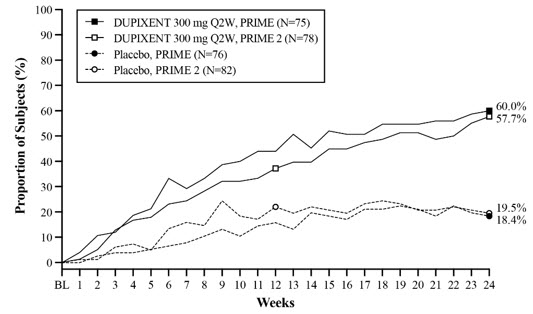
PRIME 및 PRIME2에 대한 유효성 결과는 표 27과 그림 14, 15, 16에 나와 있습니다.
| PRIME | PRIME2 | |||||
|---|---|---|---|---|---|---|
| 위약 (N=76) |
DUPIXENT 300mg Q2W (N=75) |
위약 대비 DUPIXENT의 차이(95% CI) | 위약 (N=82) |
DUPIXENT 300mg Q2W (N=78) |
위약 대비 DUPIXENT의 차이(95% CI) | |
| 기준선에서 24주차까지 WI-NRS가 ≥4점 개선(감소)되고 24주차에 IGA PN-S 0 또는 1인 대상자의 비율* | 9.2% | 38.7% | 29.6% (16.4, 42.8) |
8.5% | 32.1% | 25.5% (13.1, 37.9) |
| 24주차에 기준선에서 WI-NRS가 ≥4점 개선(감소)된 대상자의 비율* | 18.4% | 60.0% | 42.7% (27.8, 57.7) |
19.5% | 57.7% | 42.6% (29.1, 56.1) |
| 24주차에 IGA PN-S 0 또는 1인 대상자의 비율* | 18.4% | 48.0% | 28.3% (13.4, 43.2) |
15.9% | 44.9% | 30.8% (16.4, 45.2) |
| 12주차에 기준선에서 WI-NRS가 ≥4점 개선(감소)된 대상자의 비율* | 15.8%† | 44.0%† | 29.2% (14.5, 43.8)† |
22.0% | 37.2% | 16.8% (2.3, 31.2) |
그림 14: PRIME 및 PRIME2에서 시간 경과에 따른 WI-NRS ≥4점 개선 및 IGA PN-S 0 또는 1을 모두 나타낸 성인 PN 환자 비율
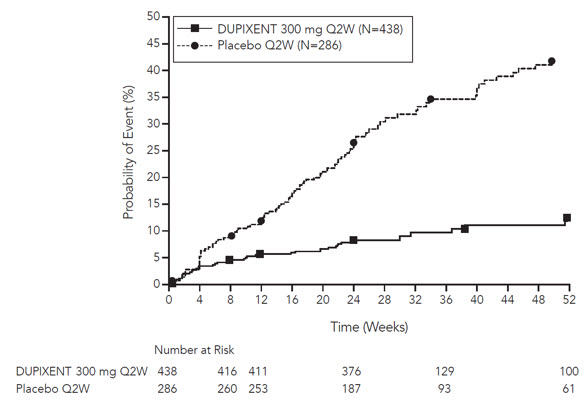
그림 15: PRIME 및 PRIME2에서 시간 경과에 따른 WI-NRS ≥4점 개선을 나타낸 성인 PN 환자 비율
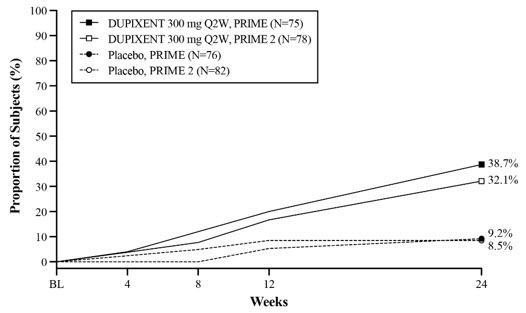
그림 16: PRIME 및 PRIME 2에서 시간 경과에 따른 IGA PN-S 0 또는 1을 나타낸 성인 환자 비율
유효성 데이터는 인구통계학적 하위 그룹에서 차별적인 치료 효과를 보이지 않았습니다.
14.6 만성 폐쇄성 폐 질환
부적절하게 조절된 COPD 및 호산구성 표현형을 가진 성인 환자의 추가 유지 관리 치료로서 DUPIXENT의 유효성은 52주 동안 무작위, 이중맹검, 다기관, 병렬 그룹, 위약 대조 시험 2건(BOREAS [NCT03930732] 및 NOTUS [NCT04456673])에서 평가되었습니다. 두 임상시험에는 COPD 성인 피험자 1874명이 등록되었습니다.
두 임상시험 모두 중등도에서 중증 기류 제한(기관지확장제 투여 후 FEV1/FVC 비율 <0.7 및 기관지확장제 투여 후 예측 FEV1 30%~70%)이 있는 COPD 진단을 받았고, 스크리닝 시 최소 혈액 호산구 수가 300cells/mcL인 피험자를 등록했습니다. 임상시험 등록에는 장기 작용 무스카린 길항제(LAMA), 장기 작용 베타 작용제(LABA) 및 흡입 코르티코스테로이드(ICS)로 구성된 유지 관리 3중 요법을 받았음에도 불구하고 전년도에 최소 2회의 중등도 악화 또는 1회의 중증 악화 이력이 있고, 지난 1년 동안 최소 3개월 동안 만성 생산적 기침 증상이 있어야 했습니다. 각 임상시험에서 95% 이상의 피험자에게서 만성 기관지염이 나타났습니다. 또한 피험자는 Medical Research Council(MRC) 호흡곤란 점수 ≥2점(범위 0-4점)을 받았습니다. COPD 악화는 호흡곤란, 천명, 기침, 가래량 증가 및/또는 가래 화농 증가를 포함한 COPD 증상의 임상적으로 유의미한 악화로 정의되었습니다. 악화 중증도는 전신 코르티코스테로이드 및/또는 항생제 치료가 필요한 경우 중등도로, 입원을 하거나 응급실 또는 긴급 진료 시설에서 24시간 이상 관찰이 필요한 경우 중증으로 추가 정의되었습니다.
두 임상시험 모두에서 피험자는 52주 동안 배경 유지 관리 요법 외에 2주마다(Q2W) DUPIXENT 300mg을 피하 투여받거나 위약을 투여받도록 무작위 배정되었습니다.
BOREAS 및 NOTUS 임상시험 모집단의 인구통계 및 기준 특성은 아래 표 28에 나와 있습니다.
| 매개변수 | BOREAS (N = 939) |
NOTUS (N = 935) |
|---|---|---|
| ICS = 흡입 코르티코스테로이드, LAMA = 장기 작용 무스카린 길항제, LABA = 장기 작용 베타 작용제, FEV1 = 1초간 노력성 호기량, FVC = 노력성 폐활량 |
||
| 평균 연령(세) (± SD) | 65.1 (8.1) | 65.0 (8.3) |
| 남성 (%) | 66.0 | 67.6 |
| 백인, N (%) | 790 (84.1) | 838 (89.6) |
| 아시아인, N (%) | 134 (14.3) | 10 (1.1) |
| 흑인, N (%) | 5 (0.5) | 12 (1.3) |
| 아메리카 인디언 또는 알래스카 원주민, N (%) | 7 (0.7) | 48 (5.1) |
| 기타/복수, N (%) | 3 (0.3) | 27 (2.9) |
| 히스패닉/라틴계 민족, N (%) | 261 (27.8) | 300 (32.1) |
| 평균 흡연 이력(갑년) (± SD) | 40.5 (23.4) | 40.3 (27.2) |
| 현재 흡연자 (%) | 30.0 | 29.5 |
| 만성 기관지염 (%) | 95.0 | 99.9 |
| 폐기종 (%) | 32.6 | 30.4 |
| 지난 해 중등도* 또는 중증† 악화 평균 횟수(± SD) | 2.3 (1.0) | 2.1 (0.9) |
| 무작위 배정 시 배경 COPD 약물: ICS/LAMA/LABA (%) |
97.6 | 98.8 |
| 기관지확장제 투여 후 평균 FEV1/FVC 비율(± SD) | 0.49 (0.12) | 0.50 (0.12) |
| 기관지확장제 투여 후 평균 FEV1 (L)(± SD) | 1.40 (0.47) | 1.45 (0.49) |
| 기관지확장제 투여 후 예측된 평균 FEV1 백분율(%)(± SD) | 50.6 (13.1) | 50.1 (12.6) |
| 평균 SGRQ 총점(± SD) | 48.4 (17.4) | 51.5 (17.0) |
| 스크리닝 혈액 호산구 수‡ 평균(cells/mcL)(± SD) | 521 (307) | 538 (333) |
| 기준선 혈액 호산구 수§ 평균(cells/mcL)(± SD) | 401 (298) | 407 (336) |
COPD 성인 환자의 악화
BOREAS 및 NOTUS 임상시험의 1차 평가변수는 52주 치료 기간 동안 연간 중등도 또는 중증 COPD 악화 발생률이었습니다. 두 임상시험 모두에서 DUPIXENT는 배경 유지 요법에 추가 시 위약에 비해 연간 중등도 또는 중증 COPD 악화 발생률을 유의하게 감소시켰습니다(표 29 참조).
| 임상시험 | 치료 (N) |
발생률(악화 횟수/년) | 위약 대비 발생률 비 (95% CI) |
|---|---|---|---|
| BOREAS | DUPIXENT 300mg Q2W (N=468) |
0.78 | 0.71 (0.58, 0.86) |
| 위약 (N=471) |
1.10 | ||
| NOTUS | DUPIXENT 300mg Q2W (N=470) |
0.86 | 0.66 (0.54, 0.82) |
| 위약 (N=465) |
1.30 | ||
DUPIXENT로 치료하면 BOREAS(HR: 0.80; 95% CI: 0.66, 0.98) 및 NOTUS(HR: 0.71; 95% CI: 0.57, 0.89)에서 위약과 비교했을 때 첫 번째 악화까지의 시간으로 측정한 중등도에서 중증 COPD 악화 위험이 감소했습니다.
COPD 성인 환자의 폐 기능
두 임상시험(BOREAS 및 NOTUS) 모두에서 DUPIXENT는 기존 유지 요법에 추가했을 때 위약과 비교하여 12주 및 52주차에 기관지확장제 사용 후 FEV1이 수치상으로 개선된 것으로 나타났습니다( 표 30 및 그림 17 참조). 두 임상시험 모두에서 위약군에 비해 DUPIXENT 치료군에서 12주 및 52주차에 기관지확장제 사용 전 FEV1의 기준치 대비 변화에서 유사한 개선이 관찰되었습니다.
| 임상시험 | 치료 (N) |
기준치 대비 최소 제곱 평균 변화 mL | 위약 대비 최소 제곱 평균 차이 mL (95% CI) |
|---|---|---|---|
|
|||
| 12주차의 기관지확장제 사용 후 FEV1 | |||
| BOREAS | DUPIXENT 300mg 2주마다 (N=468) |
158 | 74 (31, 117) |
| 위약 (N=471) |
84 | ||
| NOTUS | DUPIXENT 300mg 2주마다 (N=470) |
134 | 68 (26, 110) |
| 위약 (N=465) |
67 | ||
| 52주차의 기관지확장제 사용 후 FEV1 | |||
| BOREAS | DUPIXENT 300mg 2주마다 (N=468) |
138 | 79 (34, 124) |
| 위약 (N=471) |
58 | ||
| NOTUS* | DUPIXENT 300mg 2주마다 (N=362) |
127 | 67 (16, 119) |
| 위약 (N=359) |
59 | ||
건강 관련 삶의 질
두 임상시험(BOREAS 및 NOTUS) 모두에서 52주차에 St. George’s Respiratory Questionnaire(SGRQ) 총점 반응률(기준치에서 SGRQ가 최소 4점 개선된 환자의 비율로 정의됨)을 평가했습니다. BOREAS에서 반응률은 DUPIXENT 치료군이 51%, 위약군이 43%였습니다(N=939, 오즈비: 1.44, 95% CI: 1.10, 1.89). NOTUS에서 반응률은 DUPIXENT 치료군이 51%, 위약군이 47%였습니다(N=721, 오즈비: 1.16, 95% CI: 0.86, 1.58).
16 제공/보관 및 취급 방법
제품 형태
DUPIXENT (dupilumab) Injection은 투명하거나 약간 불투명하며 무색 또는 연한 노란색 용액으로, 바늘 보호대가 있는 1회용 미리 채워진 주사기 또는 미리 채워진 펜으로 제공됩니다.
바늘 보호대가 있는 미리 채워진 주사기는 다음을 제공하도록 설계되었습니다.
- DUPIXENT 300mg, 2mL 용액 (NDC 0024-5914-00)
- DUPIXENT 200mg, 1.14mL 용액 (NDC 0024-5918-00)
미리 채워진 펜은 다음을 제공하도록 설계되었습니다.
- DUPIXENT 300mg, 2mL 용액 (NDC 0024-5915-00)
- DUPIXENT 200mg, 1.14mL 용액 (NDC 0024-5919-00)
DUPIXENT는 바늘 보호대가 있는 미리 채워진 주사기 2개 또는 미리 채워진 펜 2개가 들어 있는 상자에 포장되어 있습니다.
| 포장 단위 | 바늘 보호대가 있는 300mg/2mL 미리 채워진 주사기 | 바늘 보호대가 있는 200mg/1.14mL 미리 채워진 주사기 |
|---|---|---|
| 주사기 2개 포장 | NDC 0024-5914-01 | NDC 0024-5918-01 |
| 포장 단위 | 300mg/2mL 미리 채워진 펜 | 200mg/1.14mL 미리 채워진 펜 |
|---|---|---|
| 펜 2개 포장 | NDC 0024-5915-02 | NDC 0024-5919-02 |
보관 및 취급
DUPIXENT는 멸균 제품이며 방부제가 들어 있지 않습니다. 사용하지 않은 부분은 버리십시오.
원래 포장 상태로 냉장 보관 (2°C~8°C(36°F~46°F))하여 빛으로부터 보호하십시오.
필요한 경우 DUPIXENT는 최대 14일 동안 실온 (최대 25°C(77°F))에 보관할 수 있습니다. 25°C(77°F) 이상 보관하지 마십시오. 냉장 보관에서 꺼낸 DUPIXENT는 14일 이내에 사용하거나 버리십시오.
DUPIXENT를 열이나 직사광선에 노출시키지 마십시오.
냉동하지 마십시오. 흔들지 마십시오.
17 환자 상담 정보
FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 환자에게 알려주십시오.
임신 레지스트리
임신 중 DUPIXENT에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 레지스트리가 있습니다. 참여를 장려하고 환자에게 레지스트리 등록 방법을 알려주십시오 [특정 인구 집단에서의 사용 (8.1) 참조].
투여 지침
사용 전에 무균 기술을 포함한 적절한 피하 주사 기술과 DUPIXENT의 준비 및 투여에 대해 환자 및/또는 보호자에게 적절한 교육을 제공하십시오. 환자에게 날카로운 물건 폐기 권장 사항을 따르도록 알려주십시오 [용량 및 투여 (2.1) 및 사용 지침 참조].
호산구성 질환
환자에게 호산구성 폐렴 또는 혈관염의 임상적 특징이 나타나면 의료 서비스 제공자에게 알려주십시오. 이는 다발성 혈관염을 동반한 호산구성 과립육종과 일치합니다 [경고 및 주의 사항 (5.3) 참조].
천식 또는 만성 폐쇄성 폐 질환의 급성 증상 또는 급성 악화에 대한 치료제가 아님
환자에게 DUPIXENT는 천식 또는 COPD의 급성 증상 또는 급성 악화를 치료하지 않는다는 것을 알려주십시오. 환자에게 DUPIXENT 치료를 시작한 후 천식 또는 COPD가 조절되지 않거나 악화되면 의료 서비스를 받도록 알려주십시오 [경고 및 주의 사항 (5.4) 참조].
코르티코스테로이드 용량 감소
환자에게 의료 서비스 제공자의 직접적인 감독 없이는 전신 또는 흡입 코르티코스테로이드를 중단하지 말라고 알려주십시오. 환자에게 코르티코스테로이드 용량 감소는 전신 금단 증상 및/또는 전신 코르티코스테로이드 요법으로 이전에 억제되었던 질환을 드러낼 수 있다는 것을 알려주십시오 [경고 및 주의 사항 (5.5) 참조].
예방 접종
환자에게 생백신으로 예방 접종하는 것은 DUPIXENT를 투여하기 직전과 투여하는 동안 권장되지 않습니다. 환자에게 잠재적인 예방 접종 전에 DUPIXENT를 복용하고 있다는 것을 의료 서비스 제공자에게 알리도록 지시하십시오 [경고 및 주의 사항 (5.9) 참조].
SPL 미분류 섹션
제조사:
Regeneron Pharmaceuticals, Inc.
Tarrytown, NY 10591
미국 허가 번호 1760
판매사:
sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및
Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591)
특허 정보: www.dupixent-patents.com
DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다.
© 2024 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유.
환자 안내문
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 9월 | |||
| 환자 정보 DUPIXENT® (DU-pix-ent) (dupilumab) 주사제, 피하 주사용 |
||||
| DUPIXENT는 무엇입니까? DUPIXENT는 다음과 같은 경우에 사용되는 처방약입니다. |
||||
|
||||
|
||||
| DUPIXENT를 사용하지 마십시오 dupilumab 또는 DUPIXENT의 성분에 알레르기가 있는 경우. DUPIXENT의 성분 목록은 본 환자 정보 팸플릿의 끝부분을 참조하십시오. | ||||
DUPIXENT를 사용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오.
하지 마십시오 의료 서비스 제공자와 상담하지 않고 다른 약물, 코르티코스테로이드 약물 또는 다른 천식 약물을 변경하거나 중단하십시오. 이렇게 하면 해당 약물로 조절되었던 다른 증상이 다시 나타날 수 있습니다. |
||||
DUPIXENT는 어떻게 사용해야 합니까?
|
||||
| DUPIXENT의 가능한 부작용은 무엇입니까? DUPIXENT는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
||||
|
|
|
||
|
||||
|
|
|||
DUPIXENT의 가장 흔한 부작용은 다음과 같습니다. |
||||
|
|
|||
DUPIXENT와 관련하여 다음과 같은 추가 부작용이 보고되었습니다.
불편하거나 사라지지 않는 부작용이 있는 경우 의료 서비스 제공자에게 알리십시오. |
||||
DUPIXENT는 어떻게 보관해야 합니까?
DUPIXENT 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||||
| DUPIXENT의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 팜플렛에 나열된 목적 이외의 목적으로 처방됩니다. DUPIXENT는 처방되지 않은 질환에 사용하지 마십시오. DUPIXENT를 다른 사람에게 주지 마십시오. 다른 사람에게 해를 끼칠 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 DUPIXENT에 대한 정보를 문의하십시오. |
||||
| DUPIXENT의 성분은 무엇입니까? 활성 성분: dupilumab 비활성 성분: L-아르기닌염산염, L-히스티딘, 폴리소르베이트 80, 아세트산나트륨, 수크로스 및 주사용수. 제조사: Regeneron Pharmaceuticals, Inc., Tarrytown, NY 10591 U.S. License No. 1760 판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591) DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다. / © 2024 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유. DUPIXENT에 대한 자세한 내용은 www.DUPIXENT.com을 방문하거나 1-844-DUPIXENT (1-844-387-4936)로 전화하십시오. |
||||
듀픽센트®(두픽센트) (두필루맙) 피하주사용 일회용 사전충전형 주사기에 부착된 바늘 실드 사용 설명서
DUPIXENT 사전 충전 주사기를 사용하기 전에 이 사용 설명서를 읽으십시오. DUPIXENT 주사 방법을 보여주기 전에는 자신이나 다른 사람에게 주사하지 마십시오. 의료 서비스 제공자는 처음으로 직접 주사하기 전에 DUPIXENT의 투여 방법을 보여줄 수 있습니다. 나중에 참조할 수 있도록 이 설명서를 보관하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
이 기기는 단회 사용 사전 충전 주사기(이 설명서에서는 “DUPIXENT 주사기”라고 함)입니다. 피부 아래(피하 주사) 주사를 위한 DUPIXENT 300mg이 들어 있습니다.
DUPIXENT 주사기의 부품은 아래와 같습니다.
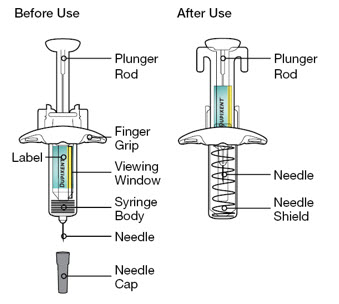
| 중요 정보 | |
|---|---|
|
|
DUPIXENT를 어떻게 보관해야 합니까?
|
|
1단계: 제거
주사기 본체 중간을 잡고 DUPIXENT 주사기를 상자에서 꺼냅니다.
 주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
 DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
2단계: 준비
다음이 있는지 확인하십시오.
- DUPIXENT 사전 충전 주사기
- 알코올 솜 1개*
- 솜뭉치 또는 거즈 1개*
- 날카로운 물건 처리 용기* (13단계 참조)
*상자에 포함되지 않은 품목

3단계: 확인
DUPIXENT 주사기를 받으면 항상 다음을 확인하십시오.
- 올바른 약과 용량을 받았는지 확인하십시오.
- 단회용 사전 충전 주사기의 유효 기간이 지나지 않았는지 확인하십시오.
 유효 기간이 지난 DUPIXENT 주사기는 사용하지 마십시오.
유효 기간이 지난 DUPIXENT 주사기는 사용하지 마십시오.
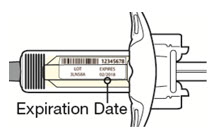
4단계: 검사
DUPIXENT 주사기의 시야 창을 통해 약을 살펴보십시오.
액체가 맑고 무색에서 연한 노란색인지 확인하십시오.
참고: 기포가 보일 수 있습니다. 이는 정상입니다.
 액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 포함되어 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 포함되어 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
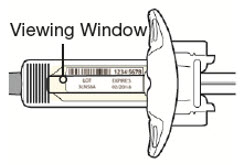
5단계: 45분 대기
DUPIXENT 주사기를 평평한 표면에 놓고 적어도 45분 동안 실온에서 자연스럽게 데워지도록 합니다.
 DUPIXENT 주사기를 가열하지 마십시오.
DUPIXENT 주사기를 가열하지 마십시오.
 DUPIXENT 주사기를 직사광선에 두지 마십시오.
DUPIXENT 주사기를 직사광선에 두지 마십시오.
 DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관된 DUPIXENT 주사기는 버리십시오(폐기하십시오).
DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관된 DUPIXENT 주사기는 버리십시오(폐기하십시오).
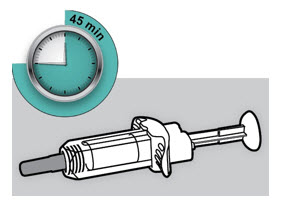
6단계: 주사 부위 선택
- 배꼽 주변 2인치(5cm)를 제외하고 허벅지 또는 복부에 주사할 수 있습니다.
- 보호자가 용량을 주사하는 경우 팔뚝 바깥쪽을 사용할 수도 있습니다.
- DUPIXENT를 주사할 때마다 다른 부위를 선택하십시오.
 부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에 주사하지 마십시오.
부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에 주사하지 마십시오.
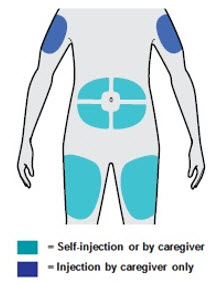
7단계: 청소
손을 씻으십시오.
알코올 솜으로 주사 부위를 닦으십시오.
주사하기 전에 피부가 마르도록 하십시오.
 주사 전에 주사 부위를 다시 만지거나 불지 마십시오.
주사 전에 주사 부위를 다시 만지거나 불지 마십시오.
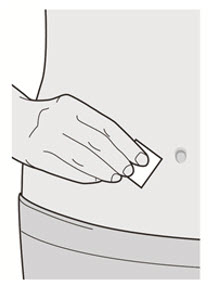
8단계: 바늘 캡 제거
바늘이 자신에게 향하지 않도록 주사기 본체 중간을 잡고 DUPIXENT 주사기를 잡고 바늘 캡을 벗깁니다.
 바늘 캡을 다시 씌우지 마십시오.
바늘 캡을 다시 씌우지 마십시오.
 바늘을 만지지 마십시오.
바늘을 만지지 마십시오.
바늘 캡을 벗긴 후 즉시 약을 주사하십시오.
9단계: 집게
주사 부위(배꼽 주변 2인치를 제외한 허벅지 또는 복부, 또는 보호자가 주사하는 경우 팔뚝 바깥쪽)의 피부를 집어서 접습니다. 아래 그림은 복부 피부를 접는 예시입니다.
10단계: 삽입
바늘을 약 45° 각도로 피부 접힌 부분에 완전히 삽입합니다.
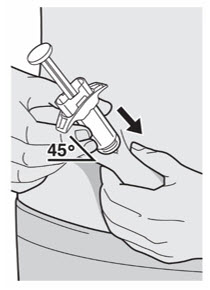
11단계: 밀어넣기
집게를 풀어줍니다.
DUPIXENT 주사기가 비워질 때까지 플런저 로드를 천천히 그리고 꾸준히 끝까지 밀어넣습니다.
참고: 약간의 저항을 느낄 것입니다. 이는 정상입니다.
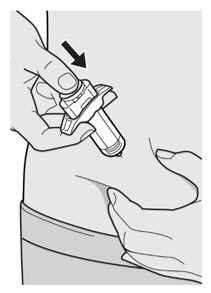
12단계: 풀고 제거
바늘이 바늘 보호대로 덮일 때까지 엄지를 들어 올려 플런저 로드를 풀고 주사 부위에서 주사기를 제거합니다.
피가 보이면 솜뭉치 또는 거즈로 주사 부위를 가볍게 누릅니다.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.
 주사 후 피부를 문지르지 마십시오.
주사 후 피부를 문지르지 마십시오.
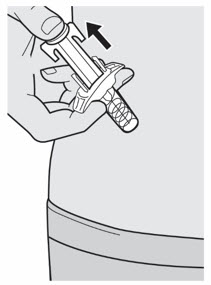
사용한 바늘, DUPIXENT 주사기 및 바늘캡은 사용 직후 FDA 승인 폐기 용기에 넣으십시오.
 바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
FDA 승인 폐기 용기가 없다면 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진
- 바늘이 빠져나올 수 없도록 꽉 끼는, 펑크 방지 뚜껑으로 닫을 수 있는
- 사용 중에 똑바로 서고 안정적인
- 누출 방지
- 용기 내부의 위험 폐기물을 경고하는 적절한 라벨이 붙은
폐기 용기가 거의 가득 차면 지역 사회의 폐기물 처리 지침에 따라 폐기 용기를 올바르게 폐기해야 합니다. 사용한 바늘과 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 폐기 방법에 대한 자세한 내용과 거주하는 주의 폐기 방법에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
사용한 폐기 용기를 가정 쓰레기통에 버리지 마십시오. 지역 사회의 지침에서 허용하는 경우를 제외합니다. 사용한 폐기 용기를 재활용하지 마십시오.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.
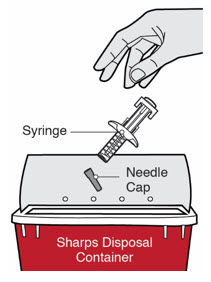

제조사: Regeneron Pharmaceuticals, Inc. Tarrytown, NY 10591
미국 허가 번호 1760
판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591)
DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다.
© 2023 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유.
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2023년 7월
듀픽센트®(두픽센트) (두필루맙) 피하주사용 일회용 사전충전형 주사기에 부착된 바늘 실드 사용 설명서
DUPIXENT 사전 충전 주사기를 사용하기 전에 이 사용 설명서를 읽으십시오. DUPIXENT 주사 방법을 배우기 전에는 자신이나 다른 사람에게 주사하지 마십시오. 의료 서비스 제공자는 처음으로 직접 주사하기 전에 DUPIXENT를 준비하고 주사하는 방법을 보여줄 수 있습니다. 나중에 참조할 수 있도록 이 설명서를 보관하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
이 장치는 단회 사용 사전 충전 주사기(이 설명서에서는 “DUPIXENT 주사기”라고 함)입니다. 피부 아래(피하 주사) 주사를 위한 200mg의 DUPIXENT가 들어 있습니다.
DUPIXENT 주사기의 부품은 아래와 같습니다.
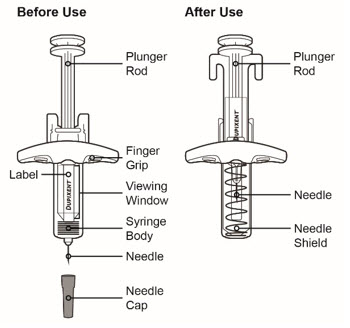
| 중요 정보 | |
|---|---|
|
|
DUPIXENT를 어떻게 보관해야 합니까?
|
|
1단계: 제거
주사기 본체 중간을 잡고 DUPIXENT 주사기를 상자에서 꺼냅니다.
 주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
 DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
2단계: 준비
다음이 있는지 확인하십시오.
- DUPIXENT 사전 충전 주사기
- 알코올 솜 1개*
- 면봉 또는 거즈 1개*
- 날카로운 물건 처리 용기* (13단계 참조)
*상자에 포함되지 않은 품목

3단계: 확인
DUPIXENT 주사기를 받으면 항상 다음을 확인하십시오.
- 올바른 약과 용량을 받았는지 확인하십시오.
- 단회용 사전 충전 주사기의 유효 기간이 지나지 않았는지 확인하십시오.
 유효 기간이 지난 DUPIXENT 주사기를 사용하지 마십시오.
유효 기간이 지난 DUPIXENT 주사기를 사용하지 마십시오.
4단계: 검사
DUPIXENT 주사기의 시야 창을 통해 약을 살펴보십시오.
액체가 맑고 무색에서 연한 노란색인지 확인하십시오.
참고: 기포가 보일 수 있습니다. 이는 정상입니다.
 액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 포함되어 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 포함되어 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
5단계: 30분 기다리기
DUPIXENT 주사기를 평평한 표면에 놓고 적어도 30분 동안 실온에서 자연스럽게 따뜻하게 합니다.
 DUPIXENT 주사기를 가열하지 마십시오.
DUPIXENT 주사기를 가열하지 마십시오.
 DUPIXENT 주사기를 직사광선에 두지 마십시오.
DUPIXENT 주사기를 직사광선에 두지 마십시오.
 DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관한 DUPIXENT 주사기는 버리십시오(폐기하십시오).
DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관한 DUPIXENT 주사기는 버리십시오(폐기하십시오).
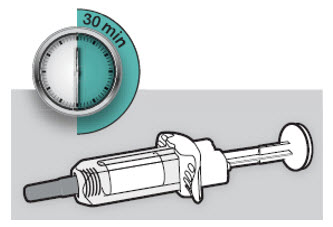
6단계: 주사 부위 선택
- 배꼽 주변 2인치(5cm)를 제외하고 허벅지 또는 복부에 주사할 수 있습니다.
- 보호자가 용량을 주사하는 경우 팔뚝의 바깥쪽 부분도 사용할 수 있습니다.
- DUPIXENT를 주사할 때마다 다른 부위를 선택하십시오.
 부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에 주사하지 마십시오.
부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에 주사하지 마십시오.
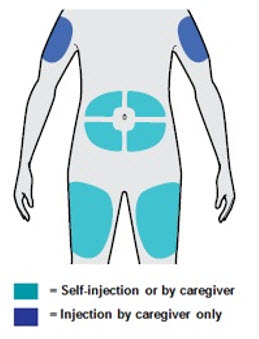
7단계: 청소
손을 씻으십시오.
알코올 솜으로 주사 부위를 닦으십시오.
주사하기 전에 피부를 말리십시오.
 주사 전에 주사 부위를 다시 만지거나 불지 마십시오.
주사 전에 주사 부위를 다시 만지거나 불지 마십시오.
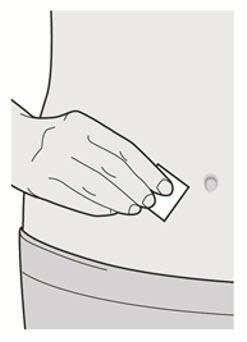
8단계: 바늘 캡 제거
바늘이 자신에게 향하지 않도록 주사기 본체 중간을 잡고 DUPIXENT 주사기를 잡고 바늘 캡을 벗깁니다.
 바늘 캡을 다시 씌우지 마십시오.
바늘 캡을 다시 씌우지 마십시오.
 바늘을 만지지 마십시오.
바늘을 만지지 마십시오.
바늘 캡을 벗긴 후 즉시 약을 주사하십시오.
9단계: 집게
주사 부위(배꼽 주변 2인치를 제외한 허벅지 또는 복부, 또는 보호자가 주사하는 경우 팔뚝의 바깥쪽 부분)의 피부를 집어서 접습니다. 아래 그림은 복부의 피부를 집어서 접는 예를 보여줍니다.
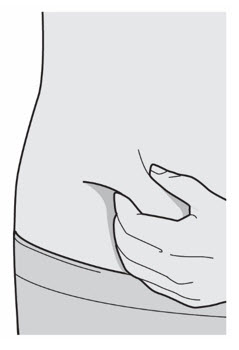
10단계: 삽입
바늘을 약 45° 각도로 피부 접힌 부분에 완전히 삽입하십시오.
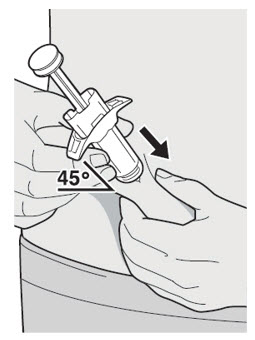
11단계: 밀기
집은 것을 풀어주십시오.
DUPIXENT 주사기가 비워질 때까지 플런저 로드를 천천히 그리고 꾸준히 끝까지 밀어내립니다.
참고: 저항을 느낄 것입니다. 이는 정상입니다.
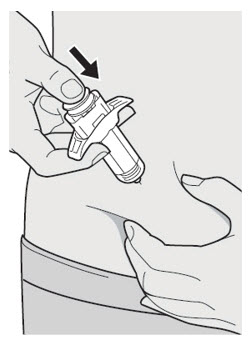
12단계: 풀고 제거
엄지를 들어 올려 바늘이 바늘 보호대로 덮일 때까지 플런저 로드를 풀고 주사기를 주사 부위에서 제거하십시오.
피가 보이면 면봉 또는 거즈로 주사 부위를 가볍게 누르십시오.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.
 주사 후 피부를 문지르지 마십시오.
주사 후 피부를 문지르지 마십시오.
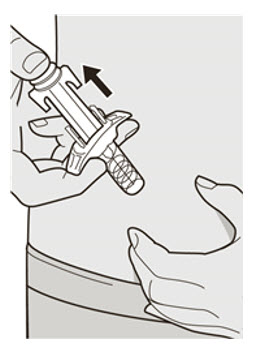
사용한 바늘, DUPIXENT 주사기 및 바늘캡은 사용 직후 FDA 승인 폐기 용기에 넣으십시오.
 바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
FDA 승인 폐기 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진,
- 바늘이 빠져나올 수 없도록 꽉 끼는, 펑크 방지 뚜껑으로 닫을 수 있는,
- 사용 중에 똑바로 서고 안정적인,
- 누출 방지, 그리고
- 용기 내부의 위험한 폐기물을 경고하는 적절한 라벨이 붙은
폐기 용기가 거의 가득 차면 지역 사회의 폐기물 처리 지침에 따라 폐기 용기를 올바르게 폐기해야 합니다. 사용한 바늘과 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 폐기 방법에 대한 자세한 내용과 거주하는 주의 폐기 방법에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
하지 마십시오 지역 사회 지침에서 허용하지 않는 한 사용한 폐기 용기를 가정 쓰레기통에 버리십시오. 하지 마십시오 사용한 폐기 용기를 재활용하십시오.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.
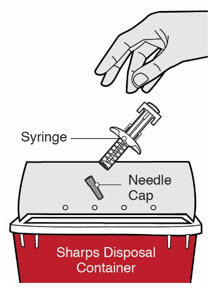

제조사: Regeneron Pharmaceuticals, Inc. Tarrytown, NY 10591
미국 허가 번호 1760
판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591)
DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다.
© 2023 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유.
이 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2023년 7월
사용 지침
사용 지침
DUPIXENT® (듀픽센트)
(두필루맙)
주사제, 피하 주사용
1회용 미리 채워진 펜 (300 mg/2 mL)
이 사용 지침에는 DUPIXENT를 주사하는 방법에 대한 정보가 포함되어 있습니다.
DUPIXENT 미리 채워진 펜을 사용하기 전에 이 사용 지침을 읽으십시오. DUPIXENT를 주사하는 방법을 보여주기 전에는 자신이나 다른 사람에게 주사하지 마십시오. 의료 서비스 제공자는 처음으로 직접 주사하기 전에 DUPIXENT의 투여량을 준비하고 주사하는 방법을 보여줄 수 있습니다. 이 사용 지침을 보관하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
이 DUPIXENT 미리 채워진 펜은 성인과 2세 이상의 어린이에게만 사용됩니다.
이 DUPIXENT 미리 채워진 펜은 1회용 기기입니다. 피부 아래 (피하 주사) 주사를 위해 300 mg의 DUPIXENT가 들어 있습니다.
DUPIXENT 미리 채워진 펜의 부품은 아래에 표시되어 있습니다.
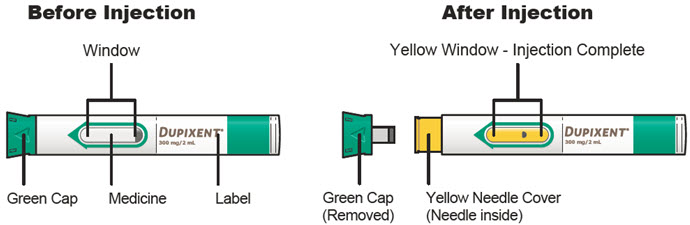
중요 정보
|
DUPIXENT 보관
|
| A. 주사 준비 | |
|---|---|
| A1. 준비물 모으기 | |
| 깨끗하고 평평한 작업대를 찾으십시오. 다음 준비물이 있는지 확인하십시오. |

|
| A2. 펜 확인 | |
|
 |
| A3. 라벨 확인 | |
|
 |
|
 |
| A4. 약물 확인 | |
|---|---|
|
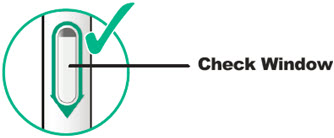 |
| A5. 45분 기다리기 | |
|---|---|
|
 |
| B. 주사 부위 선택 및 준비 | |
|---|---|
| B1. 비누와 물로 손을 깨끗이 씻으십시오 | |
 |
|
| B2. 주사 부위 선택 | |
|
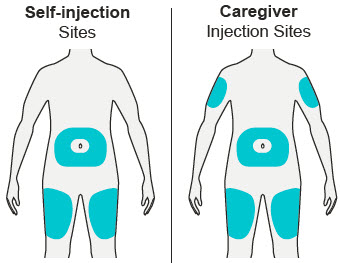
|
| B3. 주사 부위 준비 | |
|---|---|
|
 |
| C. 주사하기 | |
| C1. 녹색 캡 제거 | |
|
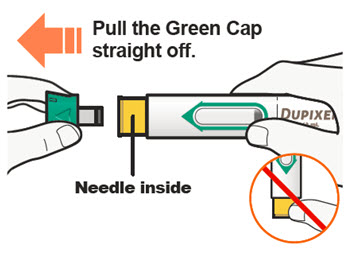 |
| C2. 피부를 꼬집고 놓습니다 | ||
|---|---|---|
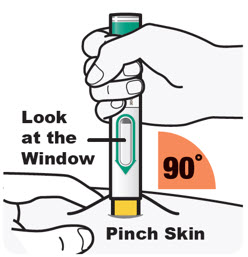 |
||
주사 전후 및 주사 중에 피부를 꼬집습니다.
|
||
| C3. 누릅니다 ➜ 창이 완전히 노랗게 변할 때까지 지켜봅니다 ➜ 그런 다음 5까지 셉니다 | ||
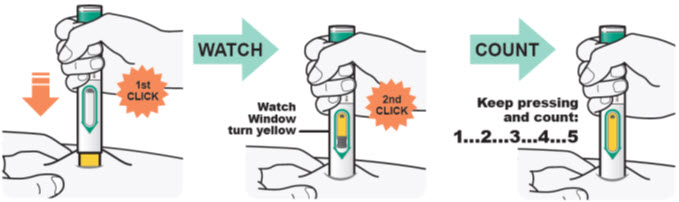 |
||
DUPIXENT 사전 충전 펜을 피부에 단단히 누르고 노란색 바늘 덮개가 보이지 않을 때까지 계속 누릅니다.
|
DUPIXENT 사전 충전 펜을 피부에 계속 누르고 창을 지켜봅니다.
|
DUPIXENT 사전 충전 펜을 피부에 계속 누르고 전체 용량을 투여했는지 확인하기 위해 5까지 셉니다. |
| 성인 및 12세 이상의 어린이의 경우 피부를 꼬집을 필요가 없습니다. | |
|---|---|
| C4. 제거 | |
|
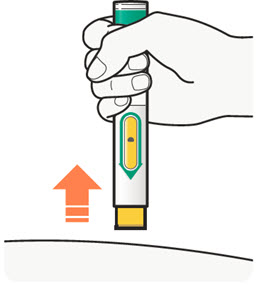 |
| D. 사용한 DUPIXENT 프리필드 펜 폐기 | |
|---|---|
| 본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2023년 7월 |
| DUPIXENT 프리필드 펜 폐기 방법:
사용한 DUPIXENT 프리필드 펜과 녹색 캡은 사용 직후 FDA 승인을 받은 날카로운 물체 폐기 용기에 넣으십시오.
FDA 승인을 받은 날카로운 물체 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
날카로운 물체 폐기 용기가 거의 가득 차면, 날카로운 물체 폐기 용기를 폐기하는 올바른 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 DUPIXENT 프리필드 펜을 폐기하는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
|
|
|
|
|
|
제조사: Regeneron Pharmaceuticals, Inc. Tarrytown, NY 10591 미국 라이선스 번호 1760 판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591) DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다. © 2023 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유. |
|
사용 지침
DUPIXENT® (DU-pix-ent)
(dupilumab)
injection, for subcutaneous use
Single-Dose Pre-filled Pen (200 mg/1.14 mL)
본 사용 설명서는 DUPIXENT 주사 방법에 대한 정보를 제공합니다.
DUPIXENT 프리필드 펜을 사용하기 전에 본 사용 설명서를 읽어보십시오. DUPIXENT 주사 방법을 배우기 전에는 자신이나 다른 사람에게 주사하지 마십시오. 의료진이 처음으로 직접 주사하기 전에 DUPIXENT 투여 준비 및 주사 방법을 보여줄 수 있습니다. 본 사용 설명서를 보관하십시오. 궁금한 사항은 의료진에게 문의하십시오.
본 DUPIXENT 프리필드 펜은 성인 및 2세 이상의 소아에게만 사용할 수 있습니다.
본 DUPIXENT 프리필드 펜은 1회용 기기입니다. 피부 아래(피하 주사) 주사를 위한 200mg의 DUPIXENT가 들어 있습니다.
DUPIXENT 프리필드 펜의 부품은 아래와 같습니다.
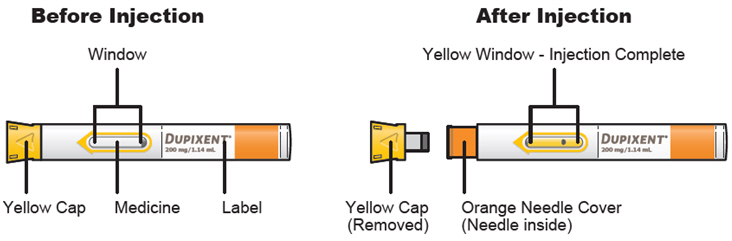
중요 정보
|
DUPIXENT 보관
|
| A. 주사 준비 | |
|---|---|
| A1. 준비물 모으기 | |
| 깨끗하고 평평한 작업대를 찾으십시오. 다음 준비물이 있는지 확인하십시오. |
|
| A2. 펜 확인 | |
|
  |
| A3. 라벨 확인 | |
|
 |
|
 |
| A4. 약물 확인 | |
|---|---|
|
 |
| A5. 30분 기다리기 | |
|---|---|
|
 |
| B. 주사 부위 선택 및 준비 | |
|---|---|
| B1. 비누와 물로 손을 깨끗이 씻으십시오 | |
 |
|
| B2. 주사 부위 선택 | |
|
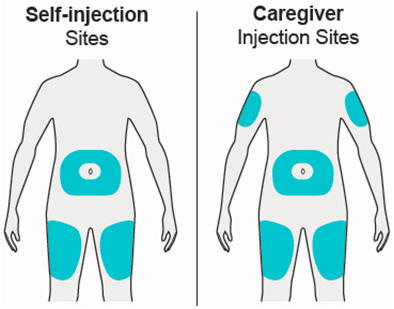
|
| B3. 주사 부위 준비 | |
|---|---|
|
 |
| C. 주사하기 | |
| C1. 노란색 캡 제거 | |
|
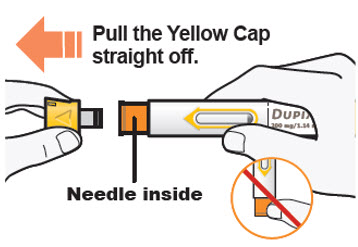 |
| C2. 피부를 꼬집고 놓기 | ||
|---|---|---|
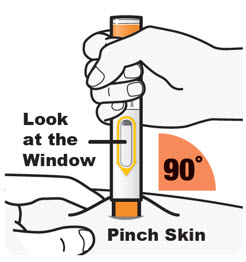 |
||
주사 전후 및 주사 중에 피부를 꼬집어 주세요.
|
||
| C3. 누르기 ➜ 창이 완전히 노란색으로 변할 때까지 보기 ➜ 5까지 세기 | ||
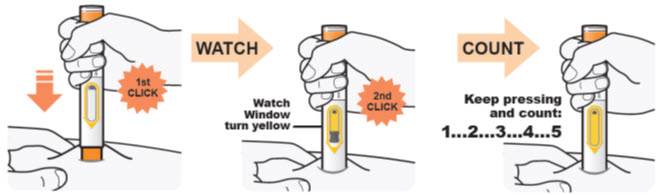 |
||
DUPIXENT 사전 충전 펜을 피부에 단단히 누르고 주황색 바늘 덮개가 보이지 않을 때까지 누르고 있습니다.
|
DUPIXENT 사전 충전 펜을 피부에 계속 누르고 창을 봅니다.
|
DUPIXENT 사전 충전 펜을 피부에 계속 누르고 전체 용량을 투여받았는지 확인하기 위해 5까지 셉니다. |
| 성인 및 12세 이상의 어린이의 경우 피부를 꼬집을 필요가 없습니다. | |
|---|---|
| C4. 제거 | |
|
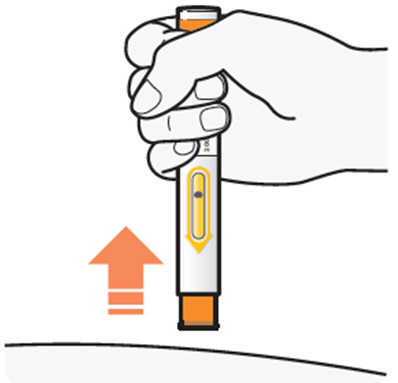 |
| D. 사용한 DUPIXENT 프리필드 펜 폐기 | |
|---|---|
| 이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2023년 7월 |
| DUPIXENT 프리필드 펜 폐기 방법:
사용한 DUPIXENT 프리필드 펜과 노란색 캡은 사용 직후 FDA 승인을 받은 날카로운 물체 폐기 용기에 넣으십시오.
FDA 승인을 받은 날카로운 물체 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
날카로운 물체 폐기 용기가 거의 가득 차면 지역 사회의 날카로운 물체 폐기 용기 폐기 지침을 따라야 합니다. 사용한 DUPIXENT 프리필드 펜을 폐기하는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다. 날카로운 물체 안전 폐기에 대한 자세한 내용과 거주하는 주의 날카로운 물체 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
|
|
|
|
|
|
제조사: Regeneron Pharmaceuticals, Inc. Tarrytown, NY 10591 미국 라이선스 번호 1760 판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals, Inc. (Tarrytown, NY 10591) DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다. © 2023 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유. |
|
듀피젠트® (듀-픽-센트) (두필루맙) 주사제, 피하 주사용 1회용 미리 채워진 주사기 (바늘 보호캡 포함) 사용 설명서
DUPIXENT 사전 충전 주사기를 사용하기 전에 이 사용 설명서를 읽으십시오. DUPIXENT 주사 방법을 보여줄 때까지 아이에게 주사하지 마십시오. 의료 서비스 제공자는 처음으로 직접 주사하기 전에 DUPIXENT를 준비하고 주사하는 방법을 보여줄 수 있습니다. 나중에 참조할 수 있도록 이 설명서를 보관하십시오. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
이 기기는 단회 사용 사전 충전 주사기(이 설명서에서는 “DUPIXENT 주사기”라고 함)입니다. 피부 아래(피하 주사)로 주사할 DUPIXENT 100mg이 들어 있습니다.
DUPIXENT 주사기의 부품은 아래와 같습니다.
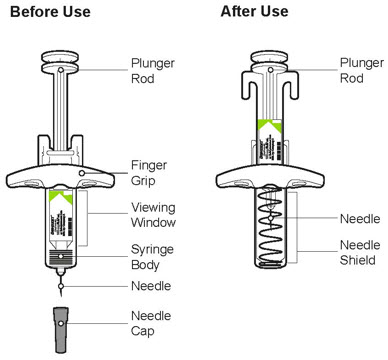
| 중요 정보 | |
|
|
DUPIXENT를 어떻게 보관해야 합니까?
|
|
1단계: 제거
주사기 본체 중간을 잡고 DUPIXENT 주사기를 상자에서 꺼냅니다.
 주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
주사할 준비가 될 때까지 바늘 캡을 벗기지 마십시오.
 DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
DUPIXENT 주사기가 딱딱한 표면에 떨어지거나 손상된 경우 사용하지 마십시오.
2단계: 준비
다음이 있는지 확인하십시오.
- DUPIXENT 사전 충전 주사기
- 알코올 솜 1개*
- 면봉 또는 거즈 1개*
- 날카로운 물건 처리 용기* (13단계 참조)
*상자에 포함되지 않은 품목

3단계: 확인
DUPIXENT 주사기를 받으면 항상 다음을 확인하십시오.
- 올바른 약과 용량을 받았는지 확인하십시오.
- 단회용 사전 충전 주사기의 유효 기간이 지나지 않았는지 확인하십시오.
 유효 기간이 지난 DUPIXENT 주사기는 사용하지 마십시오.
유효 기간이 지난 DUPIXENT 주사기는 사용하지 마십시오.
4단계: 검사
DUPIXENT 주사기의 시야 창을 통해 약을 살펴보십시오.
액체가 맑고 무색에서 연한 노란색인지 확인하십시오.
참고: 기포가 보일 수 있습니다. 이는 정상입니다.
 액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
액체가 변색되거나 흐리거나 눈에 띄는 조각이나 입자가 있는 경우 DUPIXENT 주사기를 사용하지 마십시오.
5단계: 30분 기다리기
DUPIXENT 주사기를 평평한 표면에 놓고 적어도 30분 동안 실온에서 자연스럽게 따뜻하게 합니다.
 DUPIXENT 주사기를 가열하지 마십시오.
DUPIXENT 주사기를 가열하지 마십시오.
 DUPIXENT 주사기를 직사광선에 두지 마십시오.
DUPIXENT 주사기를 직사광선에 두지 마십시오.
 DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관한 DUPIXENT 주사기는 버리십시오(폐기하십시오).
DUPIXENT 주사기를 실온에 14일 이상 보관하지 마십시오. 실온에 14일 이상 보관한 DUPIXENT 주사기는 버리십시오(폐기하십시오).
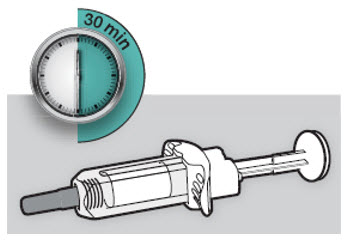
6단계: 주사 부위 선택
- 허벅지, 팔뚝 바깥쪽 또는 복부에 주사할 수 있지만 배꼽 주변 2인치(5cm)는 제외합니다.
- DUPIXENT를 주사할 때마다 다른 부위를 선택하십시오.
 부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에는 주사하지 마십시오.
부드럽거나 손상되거나 멍이 들거나 흉터가 있는 피부에는 주사하지 마십시오.
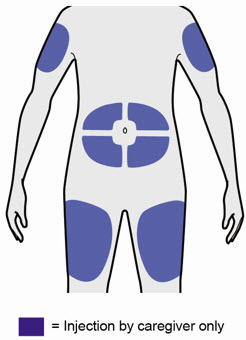
7단계: 청소
손을 씻으십시오.
알코올 솜으로 주사 부위를 닦으십시오.
주사하기 전에 피부를 말리십시오.
 주사 전에 주사 부위를 다시 만지거나 바람을 불지 마십시오.
주사 전에 주사 부위를 다시 만지거나 바람을 불지 마십시오.
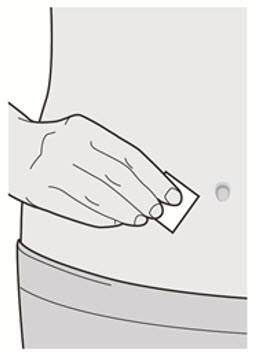
8단계: 바늘 캡 제거
바늘이 자신에게서 멀어지도록 주사기 본체 중간을 잡고 DUPIXENT 주사기를 잡고 바늘 캡을 벗깁니다.
 바늘 캡을 다시 씌우지 마십시오.
바늘 캡을 다시 씌우지 마십시오.
 바늘을 만지지 마십시오.
바늘을 만지지 마십시오.
바늘 캡을 벗긴 후 즉시 약을 주사하십시오.
9단계: 집게
주사 부위(허벅지 또는 복부, 배꼽 주변 2인치 제외 또는 팔뚝 바깥쪽)의 피부를 집어서 접습니다. 아래 그림은 복부 피부를 집어서 접는 예시입니다.
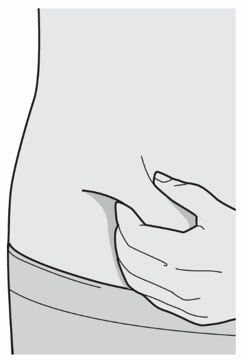
10단계: 삽입
바늘을 약 45° 각도로 피부 접힌 부분에 완전히 삽입합니다.
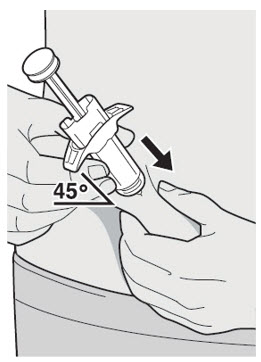
11단계: 밀기
집은 것을 풀어줍니다.
DUPIXENT 주사기가 비워질 때까지 플런저 로드를 천천히 그리고 꾸준히 끝까지 밀어줍니다.
참고: 약간의 저항을 느낄 것입니다. 이는 정상입니다.
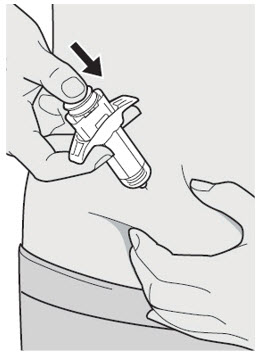
12단계: 풀고 제거
바늘이 바늘 보호대로 덮일 때까지 엄지를 들어 올려 플런저 로드를 풀고 주사 부위에서 주사기를 제거합니다.
피가 보이면 면봉 또는 거즈로 주사 부위를 가볍게 누릅니다.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.
 주사 후 피부를 문지르지 마십시오.
주사 후 피부를 문지르지 마십시오.
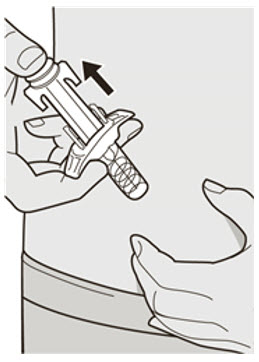
사용한 바늘, DUPIXENT 주사기 및 바늘캡은 사용 직후 FDA 승인 폐기 용기에 넣으십시오.
 바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
바늘, DUPIXENT 주사기 및 바늘캡을 가정 쓰레기통에 버리지 마십시오.
FDA 승인 폐기 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진,
- 바늘이 밖으로 나오지 않도록 꽉 끼는, 펑크 방지 뚜껑으로 닫을 수 있는,
- 사용 중에 똑바로 서고 안정적인,
- 누출 방지, 그리고
- 용기 내부의 위험한 폐기물을 경고하는 적절한 라벨이 붙은
폐기 용기가 거의 가득 차면, 지역 사회의 폐기물 처리 지침에 따라 폐기 용기를 올바르게 폐기해야 합니다. 사용한 바늘과 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 바늘 폐기에 대한 자세한 내용과 거주하는 주의 바늘 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오.
사용한 폐기 용기를 가정 쓰레기통에 버리지 마십시오. 지역 사회 지침에서 허용하는 경우를 제외합니다. 사용한 폐기 용기를 재활용하지 마십시오.
 바늘캡을 다시 씌우지 마십시오.
바늘캡을 다시 씌우지 마십시오.

제조사: Regeneron Pharmaceuticals, Inc. Tarrytown, NY 10591
미국 라이선스 번호 1760
판매사: sanofi-aventis U.S. LLC (Bridgewater, NJ 08807) 및 Regeneron Pharmaceuticals,
Inc. (Tarrytown, NY 10591)
DUPIXENT®는 Sanofi Biotechnology의 등록 상표입니다.
© 2023 Regeneron Pharmaceuticals, Inc. / sanofi-aventis U.S. LLC. 모든 권리 보유.
이 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2023년 7월
주요 표시면 – 300mg/2mL 주사기 상자 – 5914
NDC 0024-5914-01
처방전 의약품
DUPIXENT®
(dupilumab)
주사제
300 mg/2 mL (150 mg/mL)
피하 주사 전용.
300 mg/2 mL
2
단회용
사전 충전 주사기
바늘 보호 장치 포함
어린이의 손이 닿지 않는 곳에 보관하십시오. 유효 기간이 지난 후에는 사용하지 마십시오.
밀봉이 훼손되었거나 손상된 경우 사용하지 마십시오.
원래 포장 상태로 냉장 보관 (2° to 8°C).
복용량 및 투여: 복용량 정보 및 사용 방법은 포장 삽입 첨부 문서를 참조하십시오.
sanofi | REGENERON

주요 표시 패널 – 200 mg/1.14 mL 주사기 상자
NDC 0024-5918-01
처방전 의약품
DUPIXENT®
(dupilumab)
주사제
200 mg/1.14 mL (175 mg/mL)
피하 주사 전용.
200 mg/1.14 mL
2
단회용
사전 충전 주사기
바늘 보호대 포함
어린이의 손이 닿지 않는 곳에 보관하십시오. 유효 기간이 지난 후에는 사용하지 마십시오.
밀봉이 훼손되었거나 손상된 경우 사용하지 마십시오.
원래 포장 상태로 냉장 보관 (2° to 8°C).
복용량 및 투여: 복용량 정보 및 사용 방법은 포장 삽입 첨부 문서를 참조하십시오.
sanofi | REGENERON

주요 표시면 – 300mg/2mL 사전 충전 펜 상자
NDC 0024-5915-02
처방전 의약품
DUPIXENT®
(dupilumab)
주사제
1회용 미리 채워진 펜
300 mg/2 mL (150 mg/mL)
피하 주사 전용.
2
1회용
미리 채워진 펜
어린이의 손이 닿지 않는 곳에 보관하십시오. 유효 기간이 지난 후에는 사용하지 마십시오.
밀봉이 훼손되었거나 손상된 경우 사용하지 마십시오.
원래 포장 상태로 냉장 보관 (2° to 8°C).
냉동하지 마십시오. 가열하지 마십시오.
투여량 및 투여 방법: 투여량 정보 및 사용 방법은 포장 삽입 첨부 문서를 참조하십시오.
300 mg/2 mL
sanofi | REGENERON

주요 표시 기재 사항 – 200mg/1.14mL 사전 충전 펜 카톤
NDC 0024-5919-02
처방전 의약품
DUPIXENT®
(dupilumab)
주사제
1회용 미리 채워진 펜
200 mg/1.14 mL (175 mg/mL)
피하 주사 전용.
2
1회용
미리 채워진 펜
어린이의 손이 닿지 않는 곳에 보관하십시오. 유효 기간이 지난 후에는 사용하지 마십시오.
밀봉이 훼손되었거나 손상된 경우 사용하지 마십시오.
원래 포장 상태로 냉장 보관 (2° to 8°C). 냉동하지 마십시오. 가열하지 마십시오.
복용량 및 투여: 복용량 정보 및 사용 방법은 포장 삽입 팜플렛을 참조하십시오.
200 mg/1.14 mL
sanofi | REGENERON

주요 표시면 – 100mg/0.67mL 주사기 상자
NDC 0024-5911-02
처방전 의약품
DUPIXENT®
(dupilumab)
주사제
100 mg/0.67 mL (150 mg/mL)
피하 주사 전용.
2
단회용
사전 충전 주사기
바늘 보호대 포함
어린이의 손이 닿지 않는 곳에 보관하십시오. 유효 기간이 지난 후에는 사용하지 마십시오.
밀봉이 훼손되었거나 손상된 경우 사용하지 마십시오.
원래 포장 상태로 냉장 보관 (2° to 8°C).
복용량 및 투여: 복용량 정보 및 사용 방법은 포장 삽입 첨부 문서를 참조하십시오.
100 mg/0.67 mL
sanofi | REGENERON