의약품 제조업체: Novartis Pharmaceuticals Corporation (Updated: 2024-10-04)
처방 정보의 주요 내용
COSENTYX® (secukinumab) injection, for subcutaneous or intravenous use
Initial U.S. Approval: 2015
처방 정보 요약
COSENTYX는 다음 질환의 치료에 사용되는 인간 인터루킨-17A 길항제입니다:
투여량 및 투여 방법
- COSENTYX 투여 시작 전에 모든 연령에 적합한 예방 접종을 완료하고 환자의 결핵 (TB)을 평가하십시오. (2.1). COSENTYX의 준비 및 투여에 대한 지침은 전체 처방 정보를 참조하십시오. (2.2, 2.10, 2.11)
- 정맥 주사 제형 투여: 정맥 주사용 COSENTYX는 투여 전에 희석해야 합니다. 희석 후 30분 동안 정맥 주입으로 투여하십시오. (2.11)
- 판상 건선:
-
건선성 관절염:
성인 환자
피하 투여량:- 동반된 중등도에서 중증의 PsO가 있는 PsA 환자의 경우 PsO에 대한 투여량 및 투여 방법을 사용하십시오. (2.3)
- 다른 PsA 환자의 경우 로딩 투여량을 사용하거나 사용하지 않고 투여하십시오.
- 로딩 투여량을 사용하는 경우: 0주, 1주, 2주, 3주 및 4주에 150mg을 투여하고 그 후 4주마다 투여합니다.
- 로딩 투여량을 사용하지 않는 경우: 4주마다 150mg을 투여합니다.
- 환자가 활동성 PsA를 지속적으로 보이는 경우 4주마다 300mg의 투여량을 고려하십시오. (2.4)
정맥 주사 투여량:
권장 정맥 주사 투여량은 다음과 같습니다.
- 로딩 투여량을 사용하는 경우: 0주에 로딩 투여량으로 6mg/kg을 투여한 후 그 후 4주마다 1.75mg/kg을 투여합니다 (최대 유지 용량은 주입당 300mg).
- 로딩 투여량을 사용하지 않는 경우: 4주마다 1.75mg/kg을 투여합니다 (최대 유지 용량은 주입당 300mg). (2.4)
2세 이상 소아 환자
피하 투여량: 0주, 1주, 2주, 3주 및 4주에 피하 주사로 투여하고 그 후 4주마다 투여합니다:- 15kg 이상 50kg 미만의 환자의 경우 투여량은 75mg입니다.
- 50kg 이상의 환자의 경우 투여량은 150mg입니다. (2.5)
-
강직성 척추염:
피하 투여량:
로딩 투여량을 사용하거나 사용하지 않고 투여하십시오.
권장 투여량은 다음과 같습니다.- 로딩 투여량을 사용하는 경우: 0주, 1주, 2주, 3주 및 4주에 150mg을 투여하고 그 후 4주마다 투여합니다.
- 로딩 투여량을 사용하지 않는 경우: 4주마다 150mg을 투여합니다.
- 환자가 활동성 강직성 척추염을 지속적으로 보이는 경우 4주마다 300mg의 투여량을 고려하십시오. (2.6)
정맥 주사 투여량:
권장 정맥 주사 투여량은 다음과 같습니다.
- 로딩 투여량을 사용하는 경우: 0주에 로딩 투여량으로 6mg/kg을 투여한 후 그 후 4주마다 1.75mg/kg을 투여합니다 (최대 유지 용량은 주입당 300mg).
- 로딩 투여량을 사용하지 않는 경우: 4주마다 1.75mg/kg을 투여합니다 (최대 유지 용량은 주입당 300mg). (2.6)
-
비방사선성 축성 척추 관절염:
피하 투여량:
로딩 투여량을 사용하거나 사용하지 않고 투여하십시오. 권장 투여량은 다음과 같습니다.- 로딩 투여량을 사용하는 경우: 0주, 1주, 2주, 3주 및 4주에 150mg을 투여하고 그 후 4주마다 투여합니다.
- 로딩 투여량을 사용하지 않는 경우: 4주마다 150mg을 투여합니다. (2.7)
정맥 주사 투여량:
권장 정맥 주사 투여량은 다음과 같습니다.
- 적재 용량 사용 시: 0주차에 6 mg/kg을 적재 용량으로 투여하고, 그 후 4주마다 1.75 mg/kg을 투여합니다(최대 유지 용량은 주입 당 300 mg).
- 적재 용량을 사용하지 않을 경우: 4주마다 1.75 mg/kg을 투여합니다(최대 유지 용량은 주입 당 300 mg). (2.7)
-
건선성 관절염: 권장 체중 기반 용량은 0주차, 1주차, 2주차, 3주차, 4주차에 피하 주사로 투여하고, 그 후 4주마다 투여합니다.
- 15 kg 이상 50 kg 미만의 환자의 경우 용량은 75 mg입니다.
- 50 kg 이상의 환자의 경우 용량은 150 mg입니다. (2.8)
- 농포성 땀샘염: 권장 용량은 0주차, 1주차, 2주차, 3주차, 4주차에 피하 주사로 300 mg을 투여하고, 그 후 4주마다 투여합니다. 환자가 적절히 반응하지 않으면 용량을 2주마다 300 mg으로 증량하는 것을 고려하십시오. (2.9)
투여 형태 및 강도
금기 사항
COSENTYX의 세쿠키뉴맙 또는 어떤 첨가제에 대한 심각한 과민 반응. (4)
경고 및 주의 사항
- 감염: 심각한 감염이 발생했습니다. 만성 감염 또는 재발성 감염 병력이 있는 환자에서 COSENTYX 사용을 고려할 때 주의하십시오. 심각한 감염이 발생하면 감염이 해결될 때까지 COSENTYX를 중단하십시오. (5.1)
- 과민 반응: 아나필락시스 반응 또는 기타 심각한 알레르기 반응이 발생하면 즉시 COSENTYX를 중단하고 적절한 치료를 시작하십시오. (5.2)
- 결핵(TB): COSENTYX 치료를 시작하기 전에 결핵을 평가하십시오. (5.3)
- 염증성 장 질환(IBD): 임상 시험에서 IBD 사례가 관찰되었습니다. IBD가 있는 환자에게 COSENTYX를 처방할 때 주의하십시오. (5.4)
- 습진성 발진: COSENTYX를 투여받은 환자에서 심각한 습진성 발진 사례가 발생했습니다. (5.5)
- 예방 접종: COSENTYX로 치료받는 환자에게 생백신을 사용하지 마십시오. (5.7)
부작용
가장 흔한 부작용(> 1%)은 비인두염, 설사 및 상기도 감염입니다. (6.1)
의심되는 부작용을 보고하려면 Novartis Pharmaceuticals Corporation에 1-888-669-6682 또는 FDA에 1-800-FDA-1088로 전화하거나 www.fda.gov/medwatch를 방문하십시오.
환자 상담 정보 및 약물 안내서를 보려면 17을 참조하십시오.
개정: 2024년 10월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법
1.1 판상 건선
1.2 건선성 관절염
1.3 강직성 척추염
1.4 방사선 비증명 축성 척추관절염
1.5 Enthesitis-Related Arthritis
1.6 Hidradenitis Suppurativa
2 용량 및 투여
2.1 치료 시작 전 검사 및 절차
2.2 중요 투여 지침
2.3 판상 건선에서 권장 용량
2.4 건선성 관절염 성인 환자에서 권장 용량
2.5 유년기 건선성 관절염이 있는 만 2세 이상 소아 환자에서 권장 용량
2.6 강직성 척추염 성인 환자에서 권장 용량
2.7 방사선 비증명 축성 척추관절염 성인 환자에서 권장 용량
2.8 Enthesitis-Related Arthritis에서 권장 용량
2.9 Hidradenitis Suppurativa에서 권장 용량
2.10 COSENTYX UnoReady 펜, Sensoready 펜 및 사전 충전형 주사기 사용 준비
2.11 정맥 주사용 COSENTYX 준비 및 투여
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 감염
5.2 과민 반응
5.3 치료 전 결핵 평가
5.4 염증성 장 질환
5.5 Eczematous Eruptions
5.6 라텍스에 민감한 개인의 과민 반응 위험
5.7 예방 접종
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 손상
14 임상 연구
14.1 성인 판상 건선
14.2 소아 판상 건선
14.3 성인 건선성 관절염
14.4 강직성 척추염
14.5 방사선 비증명 축성 척추관절염
14.6 유년기 건선성 관절염 및 Enthesitis-Related Arthritis
14.7 Hidradenitis Suppurativa
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.4 Non-Radiographic Axial Spondyloarthritis
COSENTYX는 객관적인 염증 징후가 있는 활동성 방사선 비투과성 축성 척추관절염(nr-axSpA) 성인 환자 치료에 사용됩니다.
2 투여 및 관리
2.1 치료 시작 전 검사 및 절차
COSENTYX 투여 시작 전에 다음 평가를 수행하십시오.
- 활동성 또는 잠복성 결핵(TB)을 평가하십시오. 활동성 TB 감염이 있는 환자의 경우 COSENTYX 투여를 권장하지 않습니다. COSENTYX 투여 시작 전에 잠복성 TB를 치료하십시오 [경고 및 주의 사항(5.3) 참조].
- COSENTYX 치료 시작 전에 현재 면역 접종 지침에 따라 모든 연령에 적합한 예방 접종을 완료하십시오 [경고 및 주의 사항(5.7) 참조].
2.2 중요한 투여 지침
- COSENTYX는 의료 전문가의 지시 및 감독 하에 사용해야 합니다.
- UnoReady 펜, Sensoready 펜 및 미리 채워진 주사기는 피하 투여용으로만 사용하십시오.
- 바이알에 들어 있는 용액은 성인 환자에게만 정맥 주사용입니다.
중요한 피하 투여 지침
성인 환자는 적절한 피하 주사 기술 교육을 받은 후 스스로 COSENTYX를 투여하거나 보호자가 투여할 수 있습니다.
소아 환자는 스스로 COSENTYX를 투여해서는 안 됩니다. 성인 보호자는 적절한 피하 주사 기술 교육을 받은 후 COSENTYX를 준비하고 투여해야 합니다.
각 피하 주사는 이전 주사와 다른 해부학적 위치(예: 윗팔, 허벅지 또는 복부의 모든 사분면)에 투여하고, 피부가 압통, 멍, 홍반, 경화 또는 건선으로 인해 영향을 받는 부위에는 투여하지 마십시오. 윗팔 바깥쪽에 피하 COSENTYX를 투여하는 것은 보호자 또는 의료 전문가가 수행할 수 있습니다.
각 제형 및 강도에 대한 COSENTYX “사용 지침”에는 환자와 보호자를 위한 COSENTYX 준비 및 투여에 대한 자세한 지침이 포함되어 있습니다 [사용 지침 참조].
중요한 정맥 주입 지침
정맥 주입은 의료 환경에서 의료 전문가만 수행해야 합니다. COSENTYX 정맥 주입은 바이알에 들어 있는 COSENTYX 주사액을 희석하여 환자 체중에 따라 투여합니다 [투여 및 용량(2.11) 참조]. 정맥 주입은 PsA, AS 및 nr-axSPA가 있는 성인에게만 투여할 수 있습니다.
2.3 판상 건선 성인 환자의 권장 용량
판상 건선 성인 환자의 권장 피하 용량
판상 건선 성인 환자의 권장 용량은 0주, 1주, 2주, 3주 및 4주에 피하 주사로 300mg을 투여하고 그 후 4주마다 투여합니다. 각 300mg 용량은 300mg 피하 주사 1회 또는 150mg 피하 주사 2회로 투여합니다.
일부 환자의 경우 0주, 1주, 2주, 3주 및 4주에 피하 주사로 150mg을 투여하고 그 후 4주마다 투여하는 용량이 적절할 수 있습니다.
판상 건선 6세 이상 소아 환자의 권장 피하 용량
판상 건선 6세 이상 소아 환자의 권장 체중 기반 용량은 0주, 1주, 2주, 3주 및 4주에 피하 주사로 투여하고 그 후 4주마다 투여합니다.
- 투여 시점에 < 50kg인 환자의 경우 권장 용량은 75mg입니다.
- 투여 시점에 ≥ 50kg인 환자의 경우 권장 용량은 150mg입니다.
2.4 건선성 관절염 성인 환자의 권장 용량
COSENTYX는 메토트렉세이트와 함께 또는 메토트렉세이트 없이 투여할 수 있습니다.
권장 피하 용량
건선성 관절염이 있고 동시에 중등도에서 중증의 판상 건선이 있는 성인 환자의 경우 판상 건선 성인 환자에 대한 용량 및 투여 권장 사항을 따르십시오 [투여 및 용량(2.3) 참조].
건선성 관절염이 있는 다른 성인 환자의 경우 COSENTYX를 로딩 용량과 함께 또는 로딩 용량 없이 피하 주사로 투여하십시오.
건선성 관절염 성인 환자의 권장 용량:
- 로딩 용량과 함께 투여하는 경우 0주, 1주, 2주, 3주 및 4주에 150mg을 투여하고 그 후 4주마다 투여합니다.
- 로딩 용량 없이 투여하는 경우 4주마다 150mg을 투여합니다.
- 환자가 건선성 관절염이 활동성으로 지속되는 경우 4주마다 피하 주사로 300mg으로 용량을 늘리는 것을 고려하십시오. 각 300mg 용량은 300mg 피하 주사 1회 또는 150mg 피하 주사 2회로 투여합니다.
권장 정맥 용량
정맥 주사용 COSENTYX 주사액(바이알에 들어 있는 용액)은 정맥 투여 전에 희석해야 합니다. 건선성 관절염 성인 환자의 권장 정맥 용량 요법:
- 로딩 용량과 함께 투여하는 경우 0주에 6mg/kg 로딩 용량을 투여하고 그 후 4주마다 1.75mg/kg을 투여합니다(유지 용량).
- 로딩 용량 없이 투여하는 경우 4주마다 1.75mg/kg을 투여합니다.
30분 동안 정맥 주입으로 투여하십시오 [투여 및 용량(2.11) 참조].
건선성 관절염 성인 환자의 경우 1.75mg/kg 유지 용량에 대해 주입당 300mg을 초과하는 총 용량은 권장하지 않습니다 [투여 및 용량(2.11) 참조].
2.5 소아 및 청소년 류마티스 관절염 환자(2세 이상)에 대한 권장 용량
COSENTYX는 메토트렉세이트와 함께 또는 메토트렉세이트 없이 투여할 수 있습니다.
소아 및 청소년 류마티스 관절염 환자(2세 이상)에 대한 권장 피하 투여 용량은 체중 기반으로 하며, 0주, 1주, 2주, 3주, 4주에 투여하고 그 이후로는 4주마다 투여합니다.
- 체중 ≥ 15kg 및 < 50kg인 환자의 경우 권장 용량은 75mg입니다.
- 체중 ≥ 50kg인 환자의 경우 권장 용량은 150mg입니다.
2.6 강직성 척추염 성인 환자에 대한 권장 용량
권장 피하 투여 용량
활성 AS 성인 환자에게 COSENTYX를 피하 주사로 투여할 때, 로딩 용량을 사용하거나 사용하지 않고 투여할 수 있습니다. 권장 용량은 다음과 같습니다.
- 로딩 용량을 사용하는 경우, 0주, 1주, 2주, 3주, 4주에 150mg을 투여하고 그 이후로는 4주마다 투여합니다.
- 로딩 용량을 사용하지 않는 경우, 4주마다 150mg을 투여합니다.
- 환자가 활성 AS를 지속적으로 나타내는 경우, 피하 주사로 4주마다 300mg으로 용량을 증가시키는 것을 고려하십시오. 300mg 용량은 300mg을 한 번 피하 주사하거나 150mg을 두 번 피하 주사하여 투여합니다.
권장 정맥 투여 용량
정맥 주사용 COSENTYX 주사액(바이알에 들어 있는 용액)은 정맥 주사 전에 희석해야 합니다. 활성 AS 성인 환자에 대한 권장 정맥 투여 용량 요법은 다음과 같습니다.
- 로딩 용량을 사용하는 경우, 0주에 6mg/kg 로딩 용량을 투여하고 그 이후로는 4주마다 1.75mg/kg(유지 용량)을 투여합니다.
- 로딩 용량을 사용하지 않는 경우, 4주마다 1.75mg/kg을 투여합니다.
30분 동안 정맥 주입으로 투여하십시오 [용법 및 용량(2.11) 참조].
AS 환자의 경우 1.75mg/kg 유지 용량에 대해 주입 당 300mg을 초과하는 총 용량은 권장하지 않습니다 [용법 및 용량(2.11) 참조].
2.7 비방사선학적 축성 척추 관절염 성인 환자에 대한 권장 용량
권장 피하 투여 용량
활성 nr-axSpA 성인 환자에게 COSENTYX를 피하 주사로 투여할 때, 로딩 용량을 사용하거나 사용하지 않고 투여할 수 있습니다.
권장 용량은 다음과 같습니다.
- 로딩 용량을 사용하는 경우, 0주, 1주, 2주, 3주, 4주에 150mg을 투여하고 그 이후로는 4주마다 투여합니다.
- 로딩 용량을 사용하지 않는 경우, 4주마다 150mg을 투여합니다.
권장 정맥 투여 용량
정맥 주사용 COSENTYX 주사액(바이알에 들어 있는 용액)은 정맥 주사 전에 희석해야 합니다. 활성 nr-axSpA 성인 환자에 대한 권장 정맥 투여 용량 요법은 다음과 같습니다.
- 로딩 용량을 사용하는 경우, 0주에 6mg/kg 로딩 용량을 투여하고 그 이후로는 4주마다 1.75mg/kg(유지 용량)을 투여합니다.
- 로딩 용량을 사용하지 않는 경우, 4주마다 1.75mg/kg을 투여합니다.
30분 동안 정맥 주입으로 투여하십시오 [용법 및 용량(2.11) 참조].
nr-axSpA 환자의 경우 1.75mg/kg 유지 용량에 대해 주입 당 300mg을 초과하는 총 용량은 권장하지 않습니다 [용법 및 용량(2.11) 참조].
2.8 건염 관련 관절염에 대한 권장 용량
COSENTYX는 활성 ERA를 앓고 있는 4세 이상의 소아 환자에게 피하 주사로만 투여할 수 있습니다.
활성 ERA를 앓고 있는 4세 이상의 소아 환자에 대한 권장 체중 기반 용량은 0주, 1주, 2주, 3주, 4주에 피하 주사로 투여하고 그 이후로는 4주마다 투여합니다.
- 체중 ≥ 15kg 및 < 50kg인 환자의 경우 권장 용량은 75mg입니다.
- 체중 ≥ 50kg인 환자의 경우 권장 용량은 150mg입니다.
2.9 농포성 한선염에 대한 권장 용량
중등도에서 중증의 HS 성인 환자에 대한 권장 용량은 0주, 1주, 2주, 3주, 4주에 피하 주사로 300mg을 투여하고 그 이후로는 4주마다 투여합니다.
환자가 적절히 반응하지 않는 경우, 용량을 2주마다 300mg으로 증가시키는 것을 고려하십시오. 300mg 용량은 300mg을 한 번 피하 주사하거나 150mg을 두 번 피하 주사하여 투여합니다.
2.10 COSENTYX UnoReady Pen, Sensoready Pen 및 미리 채워진 주사기 사용 준비
COSENTYX UnoReady Pen, Sensoready Pen 및 미리 채워진 주사기는 피하 주사 전용입니다.
피하 주사 전에 COSENTYX를 냉장고에서 꺼내어 실온(Sensoready Pen, 150mg/mL 및 75mg/0.5mL 미리 채워진 주사기의 경우 15~30분, UnoReady Pen 및 300mg/2mL 미리 채워진 주사기의 경우 30~45분)에 도달하도록 하십시오. 이때 바늘 캡은 제거하지 마십시오.
COSENTYX 150mg/mL Sensoready Pen 및 COSENTYX 미리 채워진 주사기(150mg/mL, 75mg/0.5mL)의 탈착식 캡에는 천연 고무 라텍스가 포함되어 있으므로 라텍스 알레르기가 있는 사람은 만지지 않아야 합니다 [경고 및 주의 사항(5.6) 참조].
투여 전에 COSENTYX를 시각적으로 검사하여 이물질과 변색이 있는지 확인하십시오. COSENTYX 주사액은 투명하거나 약간 불투명하며 무색 또는 약간 노란색 용액입니다. 액체에 눈에 띄는 입자가 있거나 변색되거나 흐리면 사용하지 마십시오. 사용하지 않은 제품은 폐기하십시오.
2.11 정맥 주사용 COSENTYX의 준비 및 투여
COSENTYX (정맥 주사용)는 주입 전에 희석해야 합니다. 무균 기술을 사용하여 다음과 같이 COSENTYX (정맥 주사용)를 준비하십시오.
1단계. 용량 계산
-
환자의 실제 체중을 기준으로 정맥 주사용 COSENTYX 용액에 필요한 총 용량(mL)을 다음과 같이 계산합니다.
- 적재 용량(6 mg/kg)은 0.24 mL/kg입니다.
- 유지 용량(1.75 mg/kg)은 0.07 mL/kg입니다.
- 필요한 총 용량에 따라 바이알 수를 사용하십시오(바이알 1개에는 COSENTYX 용액 5mL가 들어 있습니다).
2단계. 희석
- 용액 및 용기가 허용하는 경우, 투여 전에 비경구 약물 제제를 시각적으로 검사하여 이물질과 변색이 있는지 확인하십시오. 입자 또는 변색이 발견되면 사용하지 마십시오.
- 환자의 체중에 따라 권장되는 주입 백 크기를 표 1에서 확인하십시오.
| *50mL 주입 백을 사용할 수 없는 경우, 100mL 주입 백을 사용하고 무균 기술을 사용하여 0.9% 염화나트륨 주사액, USP 50mL를 빼내어 버리고 준비 및 투여 단계를 계속 진행하십시오. | ||
| 투여 시 체중 | 적재 용량(6 mg/kg)에 대한 권장 주입 백 |
유지 용량(1.75 mg/kg)에 대한 권장 주입 백 |
| 52kg 초과 | 100mL | 100mL |
| 52kg 이하 | 100mL | 50mL* |
- 주입 백에서 환자의 용량에 필요한 COSENTYX 용액의 계산된 용량과 같은 양의 0.9% 염화나트륨 주사액, USP를 빼내어 버립니다. [용량 및 투여(2.4, 2.6, 2.7) 참조].
- 바이알에서 계산된 용량(mL)의 COSENTYX 용액을 빼내어 0.9% 염화나트륨 주사액, USP 주입 백에 천천히 넣습니다. 용액을 혼합하려면 거품이 생기지 않도록 백을 부드럽게 뒤집으십시오. 흔들지 마십시오.
- 보존제가 들어 있지 않으므로 바이알에 남은 COSENTYX 제품은 폐기하십시오.
정맥 주입을 시작하기 전에 희석된 COSENTYX 주입 용액을 실온으로 데우십시오. 희석된 COSENTYX 주입 용액을 가능한 한 빨리 투여하십시오. 즉시 투여하지 않을 경우, 희석된 용액을 다음과 같이 보관하십시오.
- 준비 시작(첫 번째 바이알 천공)부터 주입 완료까지 4.5시간을 초과하지 않도록 실온 20ºC~25ºC(68ºF~77ºF)에서 보관하십시오.
- 준비 시작(첫 번째 바이알 천공)부터 주입 완료까지 24시간을 초과하지 않도록 2°C~8°C(36°F~46°F)의 냉장 보관하십시오. 이 시간에는 희석된 용액의 냉장 보관 시간과 희석된 용액을 실온으로 데우는 데 걸리는 시간이 포함됩니다. 냉장 보관하는 동안 희석된 용액을 빛으로부터 보호하십시오.
3단계. 투여
- 내장형, 무균, 비발열성, 저단백 결합 필터(기공 크기 0.2마이크로미터)가 있는 주입 세트만 사용하십시오.
- 100mL 백의 경우 약 3.3mL/분, 50mL 백의 경우 1.7mL/분의 유속으로 주입하십시오(총 투여 시간: 30분).
- 투여가 완료되면 0.9% 염화나트륨 주사액, USP로 라인을 세척하여 라인에 있는 COSENTYX 주입 용액이 모두 투여되었는지 확인하십시오.
- COSENTYX를 다른 약물과 동일한 정맥 라인에 동시에 주입하지 마십시오. COSENTYX를 다른 약물과 함께 정맥 내로 동시 투여하는 것에 대한 물리적 또는 생화학적 적합성 연구는 수행되지 않았습니다.
3 제형 및 함량
피하 주사용:
- 300 mg/2 mL, 1회용 UnoReady 펜에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공
- 300 mg/2 mL, 1회용 미리 채워진 주사기에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공
- 150 mg/mL, 1회용 Sensoready 펜에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공
- 150 mg/mL, 1회용 미리 채워진 주사기에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공
- 75 mg/0.5 mL, 1회용 미리 채워진 주사기에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공 (체중 50 kg 미만의 소아 환자용)
정맥 주사용:
- 125 mg/5 mL, 정맥 주입 전 희석을 위한 1회용 바이알에 투명하거나 유백색, 무색 또는 약간 황색 용액으로 제공 (의료 전문가 전용).
4 금기사항
COSENTYX는 secukinumab 또는 COSENTYX의 부형제에 대해 이전에 심각한 과민 반응을 보인 환자에게는 금기입니다. COSENTYX 치료 중 아나필락시스 및 혈관부종 사례가 보고되었습니다. [경고 및 주의사항 (5.2) 참조].
5 경고 및 주의사항
5.1 감염
COSENTYX는 감염 위험을 증가시킬 수 있습니다. 임상 시험에서, COSENTYX 치료를 받은 환자들은 위약 치료를 받은 환자들에 비해 더 높은 비율로 감염이 나타났습니다. 중등도에서 중증의 PsO 환자를 대상으로 한 위약 대조 임상 시험에서, COSENTYX 치료를 받은 환자들은 위약 치료를 받은 환자들에 비해 비인두염(11.4% 대 8.6%), 상기도 감염(2.5% 대 0.7%), 칸디다증을 동반한 점막 피부 감염(1.2% 대 0.3%)과 같은 일반적인 감염 발생률이 더 높았습니다. PsA, AS, nr-axSpA 환자를 대상으로 한 위약 대조 임상 시험에서도 COSENTYX 치료를 받은 환자들에게서 유사한 감염 위험 증가가 나타났습니다. 임상 시험에서 진균 감염을 포함한 특정 유형의 감염 발생률은 용량 의존적인 것으로 나타났습니다 [부작용 (6.1) 참조].
시판 후 조사에서 COSENTYX를 포함한 IL-17 억제제를 투여받은 환자에서 심각한 세균성, 바이러스성, 진균성 기회 감염 및 일부 치명적인 감염이 보고되었습니다. B형 간염 바이러스 재활성화 사례가 보고되었습니다 [부작용 (6.2) 참조].
만성 감염이 있거나 재발성 감염의 병력이 있는 환자에게 COSENTYX 사용을 고려할 때는 주의해야 합니다. 감염을 시사하는 징후나 증상이 나타나면 의사의 진료를 받도록 환자에게 알려주십시오. 환자에게 심각한 감염이 발생하면 환자를 면밀히 모니터링하고 감염이 해결될 때까지 COSENTYX 투여를 중단하십시오.
B형 간염 바이러스 재활성화 징후가 나타나면 간 전문의와 상담하십시오. 활동성 바이러스성 간염 환자에게는 COSENTYX를 사용하지 않는 것이 좋습니다.
5.2 과민 반응
임상 시험 및 시판 후 조사에서 COSENTYX 치료를 받은 환자에서 아나필락시스, 혈관부종, 두드러기를 포함한 심각한 과민 반응이 보고되었습니다 [부작용 (6.1, 6.2) 참조]. 아나필락시스 또는 기타 심각한 알레르기 반응이 발생하면 즉시 COSENTYX 투여를 중단하고 적절한 치료를 시작하십시오 [금기 (4) 참조].
5.3 결핵에 대한 치료 전 평가
COSENTYX 치료를 시작하기 전에 활동성 또는 잠복 결핵 감염 여부를 평가하십시오. 활동성 결핵 감염 환자에게는 COSENTYX 투여를 피하십시오. COSENTYX를 투여하기 전에 잠복 결핵 치료를 시작하십시오. 과거에 잠복 결핵 또는 활동성 결핵이 있었지만 적절한 치료 과정을 확인할 수 없는 환자의 경우 COSENTYX를 시작하기 전에 항결핵 치료를 고려하십시오. 치료 중 및 치료 후 활동성 결핵의 징후 및 증상이 있는지 환자를 면밀히 모니터링하십시오.
시판 후 조사에서 잠복 결핵 병력이 있는 환자가 COSENTYX 치료를 받은 후 활동성 결핵이 발생한 사례가 보고되었습니다.
5.4 염증성 장 질환
PsO, PsA, AS, nr-axSpA, HS 환자를 대상으로 한 임상 시험에서 COSENTYX 치료를 받은 환자에서 경우에 따라 심각하거나 COSENTYX 중단으로 이어지는 IBD(염증성 장 질환) 악화가 발생했습니다. 성인 HS 환자의 경우 IBD 발생률은 2주마다 COSENTYX 300mg을 투여받은 환자(궤양성 대장염[UC] 1건, EAIR 0.2/100인년, 크론병[CD] 1건, EAIR 0.2/100인년)가 4주마다 COSENTYX 300mg을 투여받은 환자(IBD 1건, EAIR 0.2/100인년)보다 높았습니다. 또한 임상 시험에서 COSENTYX 치료를 받은 환자에서 새롭게 IBD가 발생한 사례가 나타났습니다. 활동성 크론병 환자 59명을 대상으로 한 예비 시험[COSENTYX는 크론병 치료제로 승인되지 않았음]에서 COSENTYX 치료를 받은 환자는 위약 치료를 받은 환자에 비해 질병 활성도가 더 높아지고 부작용이 증가하는 경향이 나타났습니다.
IBD 환자에게 COSENTYX를 처방할 때는 주의해야 합니다. COSENTYX 치료를 받는 환자는 IBD의 징후 및 증상이 있는지 모니터링해야 합니다 [부작용 (6.1) 참조].
5.5 습진성 발진
시판 후 보고에서 COSENTYX를 투여받은 환자에서 아토피 피부염 유사 발진, 수포성 습진, 홍피증을 포함한 심각한 습진성 발진 사례가 보고되었으며, 일부 사례에서는 입원이 필요했습니다. 습진성 발진의 발병 시기는 COSENTYX 첫 번째 용량 투여 후 며칠에서 몇 개월까지 다양했습니다.
습진성 발진을 해결하기 위해 치료를 중단해야 할 수도 있습니다. 일부 환자는 COSENTYX를 계속 투여하면서 습진성 발진을 성공적으로 치료했습니다.
5.6 라텍스에 민감한 개인의 과민 반응 위험
COSENTYX 150mg/mL 센소레디 펜과 COSENTYX 1mL 및 0.5mL 사전 충전형 주사기의 제거 가능한 캡에는 천연 고무 라텍스가 포함되어 있어 라텍스에 민감한 개인에게 과민 반응을 일으킬 수 있습니다. 라텍스에 민감한 개인에게 COSENTYX 150mg/mL 센소레디 펜 또는 1mL 및 0.5mL 사전 충전형 주사기를 안전하게 사용할 수 있는지 여부는 연구되지 않았습니다.
5.7 예방 접종
COSENTYX 치료를 시작하기 전에 현재 예방 접종 지침에 따라 연령에 맞는 모든 예방 접종을 완료하는 것을 고려하십시오. COSENTYX는 생백신에 대한 환자의 면역 반응을 변화시킬 수 있습니다. COSENTYX 치료를 받는 환자에게는 생백신을 사용하지 마십시오 [임상 약리학 (12.2) 참조].
6 부작용
다음의 이상반응은 라벨의 다른 곳에서 더 자세히 논의됩니다.
- 감염 [see Warnings and Precautions (5.1)]
- 과민성 반응 [see Warnings and Precautions (5.2)]
- 염증성 장 질환 [see Warnings and Precautions (5.4)]
- 습진성 발진 [see Warnings and Precautions (5.5)]
6.1 임상시험 경험
임상시험은 매우 다양한 조건에서 수행되기 때문에, 특정 약물의 임상시험에서 관찰된 이상반응 발생률을 다른 약물의 임상시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 관찰된 발생률을 반영하지 않을 수 있습니다.
피하 COSENTYX 임상시험의 이상반응
건선 환자를 대상으로 한 성인 임상시험의 이상반응
총 3,430명의 성인 건선 환자가 대조 및 비대조 임상시험에서 COSENTYX로 치료를 받았습니다. 이 중 1,641명의 환자가 1년 이상 COSENTYX로 치료를 받았습니다.
건선 환자를 대상으로 한 4건의 위약 대조 3상 시험(PsO1, PsO2, PsO3, PsO4 시험)을 모아 치료 시작 후 최대 12주 동안 위약과 비교하여 COSENTYX의 안전성을 평가했습니다. 총 2,077명의 환자가 평가되었습니다(COSENTYX 300 mg 그룹 691명, COSENTYX 150 mg 그룹 692명, 위약 그룹 694명). COSENTYX로 무작위 배정된 환자는 0, 1, 2, 3, 4주차에 300 mg 또는 150 mg 용량을 피하 주사한 후 4주마다 동일한 용량을 투여받았습니다. [see Clinical Studies (14)].
표 2는 이러한 시험의 12주 위약 대조 기간 동안 COSENTYX 그룹에서 위약 그룹보다 1% 이상의 비율로 발생한 이상반응을 요약한 것입니다.
| COSENTYX | |||
| 이상반응 | 300 mg (N = 691) n (%) |
150 mg (N = 692) n (%) |
위약 (N = 694) n (%) |
| 비인두염 | 79 (11.4) | 85 (12.3) | 60 (8.6) |
| 설사 | 28 (4.1) | 18 (2.6) | 10 (1.4) |
| 상기도 감염 | 17 (2.5) | 22 (3.2) | 5 (0.7) |
| 비염 | 10 (1.4) | 10 (1.4) | 5 (0.7) |
| 구강 헤르페스 | 9 (1.3) | 1 (0.1) | 2 (0.3) |
| 인두염 | 8 (1.2) | 7 (1.0) | 0 (0) |
| 두드러기 | 4 (0.6) | 8 (1.2) | 1 (0.1) |
| 콧물 | 8 (1.2) | 2 (0.3) | 1 (0.1) |
12주까지의 임상시험 PsO1, PsO2, PsO3 및 PsO4의 위약 대조 기간 동안 COSENTYX로 치료받은 환자에서 1% 미만의 비율로 발생한 이상 반응은 다음과 같습니다. 부비동염, 발 무좀, 결막염, 편도선염, 구강 칸디다증, 농가진, 중이염, 외이도염, IBD, 간 트랜스아미나제 증가 및 호중구 감소증.
감염
PsO 임상시험(총 1,382명의 환자가 최대 12주 동안 COSENTYX로 치료받았고 694명의 환자가 위약으로 치료받음)의 위약 대조 기간 동안 감염은 COSENTYX로 치료받은 환자의 28.7%에서 보고되었으며 위약으로 치료받은 환자의 18.9%에서 보고되었습니다.
전체 치료 기간(대부분의 환자에서 최대 52주 동안 COSENTYX로 치료받은 총 3,430명의 PsO 환자) 동안 감염은 COSENTYX로 치료받은 환자의 47.5%(추적 조사 1년 환자당 0.9건)에서 보고되었으며 심각한 감염은 COSENTYX로 치료받은 환자의 1.2%(추적 조사 1년 환자당 0.015건)에서 보고되었습니다.
3상 데이터에 따르면 혈청 세쿠키누맙 농도가 증가함에 따라 일부 유형의 감염이 증가하는 추세를 보였습니다. 칸디다 감염, 헤르페스 바이러스 감염, 포도상구균 피부 감염 및 치료가 필요한 감염은 혈청 세쿠키누맙 농도가 증가함에 따라 증가했습니다.
PsO1 및 PsO2 임상시험의 PsO 공개 연장 연구(중앙값 추적 조사 기간 3.9년)에서 3,582명의 환자-년 노출을 나타내는 COSENTYX 치료 환자의 74%가 감염을 보고했으며(100명의 환자-년당 55건), COSENTYX 치료 환자의 4.5%에서 심각한 감염이 보고되었습니다(100명의 환자-년당 1.4건). 패혈증은 5명의 COSENTYX 치료 환자에서 보고되었습니다(100명의 환자-년당 0.2건).
호중구 감소증은 임상시험의 대조군에서 관찰되었습니다. COSENTYX 관련 호중구 감소증의 대부분은 일시적이고 가역적이었습니다. 호중구 감소증 사례와 관련된 심각한 감염은 없었습니다.
PsO1 및 PsO2 임상시험의 공개 연장 연구에서 호중구 감소증(ANC < 1 x 109/L)은 COSENTYX 치료 환자의 1%(100명의 환자-년당 0.3건)에서 보고되었습니다. 일부 심각한 감염 사례는 호중구 감소증과 관련이 있었지만 인과 관계는 확립되지 않았습니다.
염증성 장 질환
임상시험에서 COSENTYX로 치료받은 환자에서 경우에 따라 심각한 IBD 사례가 관찰되었습니다. PsO 프로그램에서 최대 52주 동안 전체 치료 기간 동안 COSENTYX에 노출된 3,430명의 환자(2,725명의 환자-년)에서 CD 악화 사례 3건(100명의 환자-년당 0.11건), UC 악화 사례 2건(100명의 환자-년당 0.08건), 새로운 UC 발병 사례 2건(100명의 환자-년당 0.08건)이 있었습니다. 12주간의 위약 대조 기간 동안 위약 치료 환자(N = 793, 176명의 환자-년)에서는 IBD 사례가 없었습니다.
PsO 임상시험의 공개 라벨 부분에서 COSENTYX 치료 환자에서 크론병 악화 사례 1건이 보고되었습니다.
PsO 소아 환자를 대상으로 한 임상시험의 이상 반응
COSENTYX의 안전성은 PsO 소아 환자를 대상으로 한 두 건의 3상 임상시험에서 평가되었습니다.
- 첫 번째 임상시험은 전신 요법의 대상이 되는 중증 PsO(PASI 점수 ≥ 20, IGA 수정 2011 점수 4점, 체표면적[BSA]의 ≥ 10% 포함)가 있는 6세 이상 소아 환자 162명을 등록한 무작위 배정, 이중맹검, 위약 및 활성 대조군, 236주 임상시험(PsO8 임상시험)이었습니다. 162명의 환자는 무작위로 위약, 생물학적 활성 대조군 또는 COSENTYX를 투여받았습니다. COSENTYX 그룹에서 체중(BW)이 25kg 미만인 환자는 75mg을 투여받았고, BW가 25kg 이상 50kg 미만인 환자는 75mg 또는 150mg(권장 용량의 2배)을 투여받았으며, BW가 50kg 이상인 환자는 150mg 또는 300mg(권장 용량의 2배)을 투여받았습니다. 환자들은 0, 1, 2, 3, 4주차에 투여받았고 이후 4주마다 투여받았습니다.
- 두 번째 임상시험은 무작위 배정, 공개 라벨, 208주 임상시험(PsO9 임상시험, NCT03668613)으로, 중등도에서 중증의 PsO(무작위 배정 시 PASI 점수 ≥ 12, IGA mod 2011 점수 ≥ 3, BSA 관련 ≥ 10%로 정의)가 있는 6세 이상 소아 환자 84명을 두 개의 COSENTYX 군(1군: BW < 50kg의 경우 75mg 또는 ≥ 50kg의 경우 150mg, 2군: BW < 25kg의 경우 75mg, BW ≥ 25kg 및 < 50kg의 경우 150mg 또는 BW ≥ 50kg의 경우 300mg)에 무작위로 배정했습니다. 환자들은 0, 1, 2, 3, 4주차에 투여받았고 이후 4주마다 투여받았습니다.
이러한 임상시험에서 보고된 COSENTYX의 안전성 프로필은 성인 PsO 임상시험에서 보고된 안전성 프로필과 일치했습니다.
감염
위약 대조 기간 동안 COSENTYX 치료를 받은 소아 환자 1명에서 메티실린 내성 황색포도상구균(MRSA) 독성 쇼크 증후군(TSS) 사례 1건이 보고되었습니다.
치료 기간 동안 최소 1회 이상 COSENTYX를 투여받은 모든 환자를 포함하는 소아 안전성 풀[198명의 환자(287명의 환자-년)]에서 22명(11%)의 환자가 ≥ 일반적인 이상 반응 용어 기준(CTCAE) 2등급 호중구 감소증(≥ 1,000 ~ < 1,500 cells/mm3)을 보고했으며, 이 중 57%의 환자가 1년 이상 추적 관찰되었고 30%의 환자가 2년 이상 추적 관찰되었습니다. 최대 12주 동안 COSENTYX로 치료받은 소아 환자 80명과 위약으로 치료받은 환자 41명을 포함한 위약 대조 기간 동안 ≥ CTCAE 2등급 호중구 감소증은 COSENTYX로 치료받은 환자 3명(4%)에서 보고되었으며 위약으로 치료받은 환자에서는 보고되지 않았습니다. 호중구 감소증 사례와 관련된 심각한 감염은 없었습니다.
PsA 성인을 대상으로 한 임상시험의 이상 반응
COSENTYX는 1,003명의 성인 환자(COSENTYX 703명, 위약 300명)를 대상으로 한 두 건의 위약 대조 PsA 임상시험에서 연구되었습니다. COSENTYX를 투여받은 703명의 환자 중 299명은 COSENTYX 피하 주사 용량(PsA1)을 투여받았고 404명은 secukinumab 정맥 주사 용량(PsA2)을 투여받은 후 4주마다 COSENTYX 피하 주사를 투여받았습니다. PsA 환자를 대상으로 한 16주간의 위약 대조 기간 동안 이상반응이 발생한 환자의 전체 비율은 secukinumab 치료군과 위약 치료군이 유사했습니다(각각 59% 및 58%). 16주간의 위약 대조 기간 동안 COSENTYX군에서 위약군보다 최소 2% 이상 높은 비율로 발생한 이상반응은 비인두염, 상기도 감염, 두통, 메스꺼움, 고콜레스테롤혈증이었습니다. COSENTYX로 치료받은 성인 PsA 환자에서 관찰된 안전성 프로파일은 성인 PsO 임상시험의 안전성 프로파일과 일치합니다.
PsO 환자를 대상으로 한 임상시험과 유사하게 COSENTYX군(29%)에서 위약군(26%)에 비해 감염 환자 비율이 증가했습니다.
악화되거나 새로운 질환이 발생한 환자를 포함하여 secukinumab군에서 CD 및 UC 사례가 있었습니다. IBD 사례는 3건이었으며, 이 중 2명은 secukinumab을, 1명은 위약을 투여받았습니다.
AS 성인 환자의 임상시험에서 나타난 이상반응
COSENTYX는 590명의 성인 환자(COSENTYX 394명, 위약 196명)를 대상으로 한 두 건의 위약 대조 AS 임상시험에서 연구되었습니다. COSENTYX를 투여받은 394명의 환자 중 145명은 COSENTYX 피하 주사 용량(AS1 연구)을 투여받았고 249명은 secukinumab 정맥 주사 용량(AS2 연구)을 투여받은 후 4주마다 COSENTYX 피하 주사를 투여받았습니다. AS 환자를 대상으로 한 16주간의 위약 대조 기간 동안 이상반응이 발생한 환자의 전체 비율은 secukinumab군이 위약 치료군보다 높았습니다(각각 66% 및 59%). 16주간의 위약 대조 기간 동안 COSENTYX군에서 위약군보다 최소 2% 이상 높은 비율로 발생한 이상반응은 비인두염, 메스꺼움, 상기도 감염이었습니다. COSENTYX로 치료받은 AS 환자에서 관찰된 안전성 프로파일은 PsO 임상시험의 안전성 프로파일과 일치합니다. 세 번째 AS 대조 임상시험(AS3 연구)에서 COSENTYX 300mg 용량의 안전성 프로파일은 COSENTYX 150mg 용량의 안전성 프로파일과 일치했습니다.
PsO 환자를 대상으로 한 임상시험과 유사하게 COSENTYX군(31%)에서 위약군(18%)에 비해 감염 환자 비율이 증가했습니다.
571명의 환자가 COSENTYX에 노출된 최초 AS 프로그램에서 전체 치료 기간 동안 8건의 IBD 사례가 있었습니다[크론병 5건(환자 100년당 0.7건) 및 UC 3건(환자 100년당 0.4건)]. 16주간의 위약 대조 기간 동안 COSENTYX로 치료받은 환자에서는 크론병 악화 2건과 중대한 이상반응인 UC 새 발병 사례 1건이 발생한 반면, 위약으로 치료받은 환자에서는 이러한 사례가 발생하지 않았습니다. 모든 환자가 COSENTYX를 투여받은 나머지 임상시험 기간 동안 1명의 환자에서 크론병이 발생했고, 2명의 환자에서 크론병 악화가 발생했으며, 1명의 환자에서 UC가 발생했고, 1명의 환자에서 UC 악화가 발생했습니다.
nr-axSpA 성인 환자의 임상시험에서 나타난 이상반응
COSENTYX는 555명의 성인 환자(COSENTYX 부하 용량 투여 환자 185명, COSENTYX 부하 용량 비투여 환자 184명, 위약 투여 환자 186명)를 대상으로 한 무작위배정, 이중맹검, 위약 대조 nr-axSpA 임상시험 한 건에서 연구되었습니다. COSENTYX로 치료받은 nr-axSpA 환자의 안전성 프로파일은 전반적으로 AS 환자에서 나타난 안전성 프로파일 및 이전의 다른 COSENTYX 경험과 유사했습니다. nr-axSpA1 임상시험에서 부하 용량 요법을 투여받은 환자는 부하 용량 요법을 투여받지 않은 환자에 비해 비인두염, 상기도 감염, 요로 감염을 포함한 감염 및 감염증 발생률(환자 100년당 92건 대비 72건)과 위염, 하복부 통증, 대장염, 설사, 혈변을 포함한 위장관 질환 발생률(환자 100년당 27건 대비 22건)이 더 높았습니다.
소아 특발성 관절염(JPsA) 및 ERA 소아 환자의 임상시험에서 나타난 이상반응
COSENTYX는 JPsA 및 ERA를 앓고 있는 2~18세 미만의 소아 환자 86명을 대상으로 한 이중맹검, 위약 대조, 사건 발생 중심, 무작위배정 임상시험 한 건에서 연구되었습니다. 이 임상시험에서 보고된 안전성 프로파일은 secukinumab의 안전성 프로파일과 일치했습니다.
HS 성인 환자의 임상시험에서 나타난 이상반응
COSENTYX는 총 901명의 피험자-연수에 해당하는 COSENTYX 노출(COSENTYX로 치료받은 피험자의 평균 노출 기간은 360일)을 사용하여 1,084명의 성인 피험자(COSENTYX 300mg을 2주마다 투여받은 피험자 361명, COSENTYX 300mg을 4주마다 투여받은 피험자 360명, 위약을 투여받은 피험자 363명)를 대상으로 한 두 건의 52주, 무작위배정, 이중맹검, 위약 대조 HS 임상시험에서 연구되었습니다. 이러한 HS 임상시험에서 관찰된 COSENTYX의 안전성 프로파일은 PsO 임상시험에서 관찰된 COSENTYX의 알려진 안전성 프로파일과 일치했습니다.
감염
16주간의 위약 대조 기간 동안 COSENTYX 300mg을 2주마다 투여받은 피험자는 진균 감염 발생률이 가장 높았으며(5.3%), COSENTYX 300mg을 4주마다 투여받은 피험자(4.2%)와 위약을 투여받은 피험자(2.8%)가 그 뒤를 이었습니다. 노출 기간이 길어짐에 따라 COSENTYX 300mg을 2주마다 투여받은 피험자(피험자 100년당 14.7건)는 COSENTYX 300mg을 4주마다 투여받은 피험자(피험자 100년당 10.1건)에 비해 진균 감염 발생률이 계속 높게 나타났습니다. 대부분의 사례는 중증도가 낮은 비중대한 사례로 보고되었으며 항진균 치료로 해결되었습니다.
염증성 장 질환
HS 임상시험의 공개 라벨 기간 동안 5건(0.7%)의 IBD 이상반응이 보고되었으며, 이는 모두 중대한 사례였고 임상시험 약물 중단으로 이어졌으며, COSENTYX 300mg을 2주마다 투여받은 피험자에게서만 발생했습니다. COSENTYX 300mg을 4주마다 투여받은 피험자에게서는 IBD 사례가 발생하지 않았습니다.
정맥 주사용 COSENTYX의 이상반응
정맥 주사 COSENTYX의 안전성은 PsA, AS 및 nr-axSpA 환자에서 피하 COSENTYX의 약동학적 노출 및 확립된 안전성의 외삽을 기반으로 합니다. [임상 약리학 (12.3) 참조].
6.2 시판 후 경험
COSENTYX의 시판 후 사용 중 다음과 같은 이상 반응이 보고되었습니다. 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애: 아나필락시스, 혈관 부종
피부 및 피하 조직 장애: 습진성 발진(아토피 피부염 유사 발진, 한포진, 홍피증), 괴저성 농피증
감염: 식도 칸디다증, 기관지 칸디다증, 피부 아스페르길루스증, 사이토메갈로바이러스 위장염/대장염, 단순 헤르페스 뇌염, 단순 헤르페스 각막염, Pneumocystis jiroveci 폐렴, B형 간염 바이러스 재활성화, 히스토플라스마증, 톡소플라스마증을 포함한 세균성, 바이러스성 및 진균성 기회 감염
7 약물 상호작용
특정 CYP450 기질
PsO, PsA, AS, nr-axSpA, ERA 및 HS를 포함한 특정 질환과 관련된 만성 염증 동안 사이토카인(예: IL-17)의 농도가 증가하면 CYP 효소 형성이 억제될 수 있습니다.
CYP450 기질을 동시에 투여받는 환자에서 COSENTYX를 시작하거나 중단할 때, 특히 농도가 최소한 감소하면 CYP 기질의 효과가 감소하거나 농도가 최소한 증가하면 CYP 기질의 부작용이 증가할 수 있는 경우, CYP 기질의 치료 효과 또는 농도를 모니터링하고 필요에 따라 CYP 기질의 용량을 조정하는 것을 고려하십시오 [임상 약리학 (12.3) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
COSENTYX를 임산부에게 사용한 제한적인 인체 데이터는 약물 관련 태아 발달 결과의 위험을 알리기에 충분하지 않습니다. 배아-태아 발달 연구에서, 기관 형성 기간 동안 최대 권장 인체 용량(MRHD)의 30배까지의 용량으로 피하 투여 후 임신 원숭이의 신생아에서 태아 발달에 대한 부작용이 관찰되지 않았습니다 (데이터 참조).
지정된 모집단에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 그러나 미국 일반 인구에서 주요 선천적 기형의 배경 위험은 임상적으로 인식된 임신의 2%에서 4%이고 유산의 배경 위험은 15%에서 20%입니다.
데이터
동물 데이터
시클루마브를 사용한 시노몰구스 원숭이에서 배아-태아 발달 연구가 수행되었습니다. 기관 형성 기간 동안 피하 경로로 매주 시클루마브를 투여한 임신 원숭이의 태아에서 기형이나 배아-태아 독성이 관찰되지 않았으며, MRHD의 최대 30배(모체 용량 150mg/kg 기준 mg/kg 기준)까지의 용량에서 관찰되지 않았습니다.
시클루마브의 마우스 유사체를 사용한 마우스에서 출산 전후 발달 독성 연구가 수행되었습니다. 임신 기간 6일, 11일, 17일 및 출산 후 4일, 10일, 16일에 최대 150mg/kg/용량으로 시클루마브의 마우스 유사체를 투여한 임신 마우스의 태아에서 기능적, 형태학적 또는 면역학적 발달에 대한 치료 관련 효과가 관찰되지 않았습니다.
8.2 수유
위험 요약
시클루마브가 모유로 배설되는지 또는 섭취 후 전신적으로 흡수되는지 여부는 알려져 있지 않습니다. COSENTYX가 모유 수유 중인 아기에게 미치는 영향이나 모유 생산에 미치는 영향에 대한 데이터는 없습니다. 모유 수유의 발달적 및 건강상의 이점은 COSENTYX에 대한 어머니의 임상적 필요와 COSENTYX 또는 기저 모체 질환으로 인한 모유 수유 중인 아기에게 미칠 수 있는 잠재적인 부작용과 함께 고려해야 합니다.
8.4 소아 사용
피하 투여
소아 판상 건선
COSENTYX의 안전성 및 유효성은 전신 요법 또는 광선 요법의 대상이 되는 6세 이상의 소아 환자에서 중등도에서 중증의 PsO 치료에 대해 확립되었습니다 [부작용(6.1) 참조] 및 임상 연구(14.2)].
6세 미만의 소아 환자에서 PsO에 대한 COSENTYX의 안전성 및 유효성은 확립되지 않았습니다.
소아 건선성 관절염
COSENTYX의 안전성 및 유효성은 체중이 15kg 이상인 2세 이상의 소아 환자에서 활동성 JPsA 치료에 대해 확립되었습니다 [부작용(6.1) 참조] 및 임상 연구(14.6)].
2세 미만의 소아 환자 또는 체중이 15kg 미만인 소아 환자에서 JPsA에 대한 COSENTYX의 안전성 및 유효성은 확립되지 않았습니다.
건염 관련 관절염
COSENTYX의 안전성 및 유효성은 체중이 15kg 이상인 4세 이상의 소아 환자에서 활동성 ERA 치료에 대해 확립되었습니다 [부작용(6.1) 참조] 및 임상 연구(14.6)].
4세 미만의 소아 환자 또는 체중이 15kg 미만인 소아 환자에서 COSENTYX의 안전성 및 유효성은 확립되지 않았습니다.
농포성 한선염
소아 환자에서 HS에 대한 COSENTYX의 안전성 및 유효성은 확립되지 않았습니다.
정맥 내 투여
소아 환자에서 정맥 내 COSENTYX의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
임상 시험에서 피하 COSENTYX에 노출된 3,430명의 PsO 피험자 중 총 230명(7%)이 65세 이상이었고, 32명(1%)의 피험자가 75세 이상이었습니다. 65세 이상의 피험자와 젊은 성인 피험자 간에 안전성 또는 유효성의 차이가 관찰되지 않았지만, 65세 이상의 피험자 수가 젊은 성인 피험자와 다르게 반응하는지 여부를 결정하기에 충분하지 않았습니다.
임상 시험에서 COSENTYX에 노출된 1,060명의 HS 피험자 중 총 14명(1.3%)이 65세 이상이었습니다. HS에 대한 임상 시험에는 65세 이상의 피험자가 충분하지 않아 젊은 성인 피험자와 다르게 반응하는지 여부를 결정할 수 없었습니다.
10 과다 복용
과량 투여 시, 환자에게서 나타나는 부작용의 징후나 증상을 모니터링하고 적절한 대증 치료를 해야 합니다. 추가적인 과량 투여 관리 권장 사항은 Poison Help line(1-800-222-1222) 또는 의료 독물학자에게 문의하십시오.
11 설명
세쿠키뉴맙은 재조합 인간 단클론 IgG1/κ 항체로 인터루킨-17A 길항제입니다. 재조합 중국 햄스터 난소(CHO) 세포주에서 발현됩니다. 세쿠키뉴맙의 분자량은 약 151kDa이며, 세쿠키뉴맙의 두 개의 중쇄 모두 올리고당 사슬을 포함합니다.
피하 주사용 COSENTYX 주사제
COSENTYX 주사제는 피하 주사용 무방부제, 멸균, 투명 또는 약간 불투명한 무색 또는 약간 노란색 용액으로 단회용 300mg/2mL UnoReady 펜(27 게이지 고정 ½인치 바늘), 단회용 150mg/mL Sensoready 펜(27 게이지 고정 ½인치 바늘) 또는 단회용 미리 채워진 주사기(300mg/2mL, 150mg/mL, 75mg/0.5mL) (27 게이지 고정 ½인치 바늘)로 제공됩니다. COSENTYX 150mg/mL Sensoready 펜 또는 1mL 및 0.5mL 미리 채워진 주사기의 탈착식 캡에는 천연 고무 라텍스가 포함되어 있습니다.
각 COSENTYX 300mg/2mL UnoReady 펜 또는 300mg/2mL 미리 채워진 주사기에는 다음과 같이 제형화된 세쿠키뉴맙 300mg이 포함되어 있습니다. L-히스티딘/히스티딘 염산염 일수화물(6.206mg), L-메티오닌(1.492mg), 폴리소르베이트 80(0.4mg), 트레할로스 이수화물(151.34mg) 및 주사용 멸균수 USP, pH 5.8.
각 COSENTYX 150mg/mL Sensoready 펜 또는 150mg/mL 미리 채워진 주사기에는 다음과 같이 제형화된 세쿠키뉴맙 150mg이 포함되어 있습니다. L-히스티딘/히스티딘 염산염 일수화물(3.103mg), L-메티오닌(0.746mg), 폴리소르베이트 80(0.2mg), 트레할로스 이수화물(75.67mg) 및 주사용 멸균수 USP, pH 5.8.
각 COSENTYX 75mg/0.5mL 미리 채워진 주사기에는 다음과 같이 제형화된 세쿠키뉴맙 75mg이 포함되어 있습니다. L-히스티딘/히스티딘 염산염 일수화물(1.552mg), L-메티오닌(0.373mg), 폴리소르베이트 80(0.1mg), 트레할로스 이수화물(37.83mg) 및 주사용 멸균수 USP, pH 5.8.
정맥 주사용 COSENTYX 주사제
COSENTYX 용액은 희석 후 정맥 주입용 단회용 바이알로 제공되는 무방부제, 멸균, 투명 또는 약간 불투명한 무색 또는 약간 노란색 용액입니다.
각 COSENTYX 바이알에는 다음과 같이 제형화된 세쿠키뉴맙 125mg이 포함되어 있습니다. L-히스티딘(5.67mg), L-히스티딘 염산염 일수화물(13.3mg), L-메티오닌(3.73mg), 폴리소르베이트 80(1mg), 트레할로스 이수화물(426mg) 및 주사용 멸균수 USP, pH 5.8.
12 임상약리학
12.1 작용 기전
세쿠키뉴맙은 인터루킨-17A(IL-17A) 사이토카인에 선택적으로 결합하여 IL-17 수용체와의 상호 작용을 억제하는 인간 IgG1 단클론 항체입니다. IL-17A는 정상적인 염증 및 면역 반응에 관여하는 자연 발생 사이토카인입니다. 세쿠키뉴맙은 염증성 사이토카인 및 케모카인의 방출을 억제합니다.
12.2 약력학
IL-17A 수치는 건선 병변과 HS 병변에서 상승합니다. COSENTYX로 치료하면 건선 병변에서 표피 호중구와 IL-17A 수치가 감소할 수 있습니다. 세쿠키뉴맙 치료 후 4주차와 12주차에 측정한 총 IL-17A(유리 및 세쿠키뉴맙 결합 IL-17A) 혈청 수치는 증가했습니다. 이러한 약력학적 활성은 소규모 탐색 시험을 기반으로 합니다. 이러한 약력학적 활성과 세쿠키뉴맙이 임상적 효과를 발휘하는 기전과의 관계는 알려져 있지 않습니다.
PsA 및 AS 환자의 혈액에서 IL-17A 생성 림프구 및 선천 면역 세포의 수가 증가하고 IL-17A 수치가 증가했습니다. nr-axSpA 환자에서도 IL-17A 생성 림프구의 수가 증가했습니다.
치료 중 비생백신에 대한 면역 반응
미국에서 승인되지 않은 C군 수막구균 다당류 결합 백신과 미국에서 승인되지 않은 불활성 계절 인플루엔자 백신으로 백신 접종을 하기 2주 전에 COSENTYX를 1회 150mg 투여한 건강한 개인은 백신 접종 전에 COSENTYX를 투여받지 않은 개인과 비교하여 유사한 항체 반응을 보였습니다. 수막구균 및 인플루엔자 백신의 임상적 효과는 COSENTYX 치료를 받는 환자에서 평가되지 않았습니다 [경고 및 주의 사항(5.7) 참조].
12.3 약동학
피하 투여 후 약동학
PsO, PsA, AS 및 nr-axSpA 환자에게 피하 투여한 세쿠키뉴맙의 관찰된 약동학(PK)은 유사했습니다. 세쿠키뉴맙 PK는 동일한 체중 계층별 투약 요법에 따라 ERA 및 PsO를 가진 소아 환자에서도 유사합니다.
세쿠키뉴맙의 평균 정상 상태 골 농도는 HS 피험자에서 PsO 피험자보다 약 26% 낮았습니다.
흡수
PsO 피험자에게 COSENTYX를 1회 150mg 또는 300mg(150mg을 2회 주사) 피하 투여한 후, 세쿠키뉴맙은 투여 후 약 6일에 평균(± SD) 혈청 농도(Cmax)가 각각 13.7 ± 4.8 mcg/mL 및 27.3 ± 9.5 mcg/mL에 도달했습니다.
COSENTYX를 여러 번 피하 투여(150mg을 1회 또는 2회 주사)한 후, 세쿠키뉴맙의 평균(± SD) 혈청 골 농도는 12주차에 150mg(22.8 ± 10.2 mcg/mL)에서 300mg(45.4 ± 21.2 mcg/mL)까지 다양했습니다. 4주차와 12주차에 300mg 투여 시, Sensoready 펜에서 나온 평균 골 농도는 사전 충전 주사기에서 나온 농도보다 약 30% 높았습니다. 300mg/2mL UnoReady 펜을 통해 300mg을 여러 번 피하 투여한 후, 세쿠키뉴맙의 평균 혈청 골 농도는 일반적으로 300mg을 전달하는 데 사용된 이전 Sensoready 펜 연구에서 나온 농도와 일치했습니다.
세쿠키뉴맙의 정상 상태 농도는 4주마다 COSENTYX 투약 요법을 시행한 후 24주차에 도달했습니다. 평균(± SD) 정상 상태 골 농도는 150mg(16.7 ± 8.2 mcg/mL)에서 300mg(150mg을 2회 주사)(34.4 ± 16.6 mcg/mL)까지 다양했습니다.
건강한 피험자와 PsO 피험자에서 세쿠키뉴맙의 생체 이용률은 COSENTYX를 150mg 또는 300mg(150mg을 2회 주사) 피하 투여한 후 55%에서 77%까지 다양했습니다.
0주차, 1주차, 2주차, 3주차, 4주차에 COSENTYX를 300mg 피하 투여하고 그 후 2주마다 투여한 후, 세쿠키뉴맙의 정상 상태 농도는 두 HS 시험 모두에서 24주차에 도달했습니다. 평균(± SD) 정상 상태 골 농도는 HS 시험 1에서 55.7 ± 28.9 mcg/mL, HS 시험 2에서 50.5 ± 28.2 mcg/mL였습니다.
분포
단일 정맥 주사 후 종말기 단계에서 평균 분포 용적(Vz)은 PsO 피험자에서 7.10L에서 8.60L까지 다양했습니다.
PsO 피험자의 병변 및 비병변 피부의 간질액에서 세쿠키뉴맙 농도는 COSENTYX를 300mg(150mg을 2회 주사) 단일 피하 투여 후 1주일과 2주일에 혈청 농도의 27%에서 40%까지 다양했습니다.
배설
대사
세쿠키뉴맙의 대사 경로는 규명되지 않았습니다. 인간 IgG1κ 단클론 항체인 세쿠키뉴맙은 내인성 IgG와 같은 방식으로 대사 경로를 통해 작은 펩타이드와 아미노산으로 분해될 것으로 예상됩니다.
배설
평균 전신 청소율(CL)은 PsO 시험에서 정맥 주사 및 피하 투여 후 0.14 L/day에서 0.22 L/day까지 다양했고, 평균 반감기는 22일에서 31일까지 다양했습니다.
모집단 PK 분석에서 HS 피험자의 평균 전신 CL은 0.26 L/day였습니다. 모집단 PK 분석에서 추정한 평균 배설 반감기는 HS 피험자에서 23일이었습니다.
용량 선형성
세쿠키뉴맙은 PsO 피험자에서 피하 투여 후 25mg(권장 용량의 약 0.083배)에서 300mg까지의 용량 범위에서 용량 비례적 PK를 나타냈습니다.
체중
세쿠키뉴맙의 청소율과 분포 용적은 체중이 증가함에 따라 증가합니다.
특정 모집단
간 또는 신장 기능 장애 환자
간 또는 신장 기능 장애가 세쿠키뉴맙의 PK에 미치는 영향에 대한 공식적인 시험은 수행되지 않았습니다.
노인 환자
모집단 PK 분석 결과, 세쿠키뉴맙의 청소율은 PsO, PsA 및 AS를 가진 성인 피험자에서 나이에 의해 유의미하게 영향을 받지 않았습니다. 65세 이상의 피험자는 65세 미만의 피험자와 유사한 세쿠키뉴맙의 명백한 청소율을 보였습니다.
소아 환자
두 소아 임상 시험의 집단에서 중등도에서 중증의 건선(6세 이상) 환자에게 권장 소아 용량 요법으로 피하 COSENTYX를 투여했습니다. 24주차에, 25kg 미만의 체중을 가진 환자에게 피하 COSENTYX 75mg을 투여한 경우, 25kg 이상 50kg 미만의 체중을 가진 환자에게 피하 COSENTYX 75mg을 투여한 경우, 그리고 50kg 이상의 체중을 가진 환자에게 피하 COSENTYX 150mg을 투여한 경우, secukinumab의 안정 상태 평균 ± SD 혈청 최저 농도는 각각 32.6 ± 10.8 mcg/mL (n = 8), 19.8 ± 6.96 mcg/mL (n = 24), 27.3 ± 10.1 mcg/mL (n = 36)이었습니다.
소아 임상 시험에서, JPsA 및 ERA 환자(2세 이상 18세 미만)에게 권장 소아 용량 요법으로 피하 COSENTYX를 투여했습니다. 24주차에, 15kg 이상 50kg 미만의 체중을 가진 환자와 50kg 이상의 체중을 가진 환자의 안정 상태 평균 ± SD 최저 농도는 각각 25.2 ± 5.45 mcg/mL (n = 10) 및 27.9 ± 9.57 mcg/mL (n = 19)이었습니다.
약물 상호 작용
시토크롬 P450 기질
건선 환자 성인 대상에서, 미다졸람(CYP3A4 기질)의 약동학은 단독 투여 시 또는 COSENTYX 300mg을 단일 또는 5주 연속 피하 투여한 후 투여 시 유사했습니다 [약물 상호 작용(7) 참조].
정맥 투여 후 약동학
4주마다 1.75 mg/kg 유지 용량을 정맥 투여한 후, 0일에 6 mg/kg의 로딩 용량을 투여하거나 투여하지 않은 경우, secukinumab 농도 [안정 상태 최저 secukinumab 농도(Cmin,ss), 평균 secukinumab 농도(Cavg,ss), 및 최대 secukinumab 농도(Cmax,ss)]는 4주마다 COSENTYX 150mg 및 300mg 용량을 피하 투여한 후 안정 상태 농도 범위 내에 있는 것으로 추정됩니다.
12.6 면역원성
관찰된 항체 형성 발생률은 분석의 민감도 및 특이도에 크게 의존합니다. 분석 방법의 차이로 인해 아래에 설명된 임상 시험에서 관찰된 항체 형성 발생률을 COSENTYX(secukinumab)를 포함한 다른 임상 시험에서 관찰된 항체 형성 발생률과 의미 있게 비교할 수 없습니다.
COSENTYX의 면역원성은 전기화학 발광 기반 브리징 면역 분석법을 사용하여 평가했습니다. COSENTYX로 치료받은 환자의 1% 미만에서 최대 52주까지 secukinumab에 대한 항체가 형성되었습니다. 그러나 이 분석법은 secukinumab이 존재하는 경우 항-secukinumab 항체를 검출하는 데 제한이 있으므로 항체 형성 발생률을 신뢰할 수 있게 결정하지 못했을 수 있습니다.
건선, 건선성 관절염, 강직성 척추염, 비방사선성 축상 척추관절염, 족저 옹, 소아 건선, JPsA 및 ERA 환자를 대상으로 한 대조군 임상 시험에서 최대 52주까지의 치료 기간 동안 [임상 연구(14) 참조], 항-secukinumab 항체(ADA로 지칭) 형성 발생률은 1% 미만(COSENTYX로 치료받은 총 6268명의 환자 중 25명)이었습니다. COSENTYX로 치료받은 환자 중 ADA가 형성된 환자의 약 8%에서 중화 항체가 형성되었습니다. ADA 발생률이 낮기 때문에 이러한 항체가 COSENTYX의 약동학, 약력학, 안전성 또는 효능에 미치는 영향은 알 수 없습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
COSENTYX의 발암성 또는 돌연변이 유발 가능성을 평가하기 위한 동물 연구는 수행되지 않았습니다. 일부 출판된 문헌에 따르면 IL-17A는 in vitro에서 암세포 침윤을 직접 촉진하는 반면, 다른 보고서는 IL-17A가 T 세포 매개 종양 거부를 촉진한다고 나타냅니다. 중화 항체를 사용하여 IL-17A를 고갈시키면 마우스에서 종양 발달이 억제되었습니다. 마우스 모델에서 얻은 실험 결과가 인간의 악성 종양 위험에 대한 관련성은 알려져 있지 않습니다.
교미 기간 전과 동안 주 1회 최대 150 mg/kg의 피하 투여량으로 세쿠키뉴맙의 마우스 유사체를 투여한 수컷 및 암컷 마우스에서 생식능력에 대한 영향은 관찰되지 않았습니다.
14 임상 연구
14.1 성인 판상 건선
피하 COSENTYX 투여에 대한 다기관, 무작위 배정, 이중맹검, 위약 대조 시험 4건(시험 PsO1, PsO2, PsO3 및 PsO4)에서 18세 이상의 건선 환자 2,403명(COSENTYX 300mg 투여군 691명, COSENTYX 150mg 투여군 692명, 위약 투여군 694명, 생물학적 활성 대조군 323명)을 모집했습니다. 이러한 시험에서 300mg 용량은 150mg씩 2회 주사했습니다.
- 시험 PsO1(NCT01365455)에서는 738명의 환자(COSENTYX 300mg 투여군 245명, COSENTYX 150mg 투여군 245명, 위약 투여군 248명)를 모집했습니다. 환자는 0주, 1주, 2주, 3주 및 4주에 피하 투여를 받았고, 그 후 4주마다 투여를 받았습니다. 12주차에 반응하지 않은 위약 투여군 환자는 12주, 13주, 14주, 15주 및 16주에 COSENTYX(300mg 또는 150mg)를 투여받았고, 그 후 4주마다 동일한 용량을 투여받았습니다. 모든 환자는 시험 치료를 처음 투여한 후 최대 52주까지 추적 관찰했습니다.
- 시험 PsO2(NCT01358578)에서는 1,306명의 환자(COSENTYX 300mg 투여군 327명, COSENTYX 150mg 투여군 327명, 위약 투여군 326명, 생물학적 활성 대조군 323명)를 모집했습니다. 환자는 0주, 1주, 2주, 3주 및 4주에 피하 투여를 받았고, 그 후 4주마다 투여를 받았습니다. 12주차에 반응하지 않은 위약 투여군 환자는 12주, 13주, 14주, 15주 및 16주에 COSENTYX(300mg 또는 150mg)를 투여받았고, 그 후 4주마다 동일한 용량을 투여받았습니다. 모든 환자는 시험 치료를 처음 투여한 후 최대 52주까지 추적 관찰했습니다.
- 시험 PsO3(NCT01555125)에서는 177명의 환자(COSENTYX 300mg 투여군 59명, COSENTYX 150mg 투여군 59명, 위약 투여군 59명)를 모집했으며, 12주 동안 COSENTYX 자가 투여(사전 충전 주사기)의 안전성, 내약성 및 사용 편의성을 평가했습니다. 환자는 0주, 1주, 2주, 3주 및 4주에 피하 투여를 받았고, 그 후 최대 12주까지 4주마다 동일한 용량을 투여받았습니다.
- 시험 PsO4(NCT01636687)에서는 182명의 환자(COSENTYX 300mg 투여군 60명, COSENTYX 150mg 투여군 61명, 위약 투여군 61명)를 모집했으며, 12주 동안 COSENTYX 자가 투여(Sensoready 펜)의 안전성, 내약성 및 사용 편의성을 평가했습니다. 환자는 0주, 1주, 2주, 3주 및 4주에 피하 투여를 받았고, 그 후 최대 12주까지 4주마다 동일한 용량을 투여받았습니다.
종점
모든 시험에서 종점은 12주차에 기준선 대비 PASI 점수가 최소 75% 감소한 환자 비율(PASI 75)과 조사자 전반적 평가 수정 2011(IGA)에서 치료 성공(완전 또는 거의 완전)이었습니다. 평가된 다른 결과에는 12주차에 기준선 대비 PASI 점수가 최소 90% 감소한 환자 비율(PASI 90), 52주차까지 효능 유지, 건선 증상 일기©에 따른 12주차 가려움증, 통증 및 각질 개선이 포함되었습니다.
PASI는 BSA 영향을 받는 비율과 영향을 받은 부위 내 건선 변화의 성격 및 심각도(경화, 홍반 및 각질)를 모두 고려하는 복합 점수입니다. IGA는 “0 = 완전” “1 = 거의 완전” “2 = 경증” “3 = 중등도” 또는 “4 = 중증”을 포함하는 5단계 척도로, 경화, 홍반 및 각질에 중점을 두어 건선 심각도에 대한 의사의 전반적인 평가를 나타냅니다. “완전” 또는 “거의 완전” 치료 성공은 건선 징후가 없거나 병변의 정상 또는 분홍색 색상, 판의 두꺼워짐 없음, 국소적 각질이 없거나 최소 수준을 의미했습니다.
기준선 질병 특징
모든 치료군에서 기준선 PASI 점수는 11에서 72까지였으며 중앙값은 20이었고, 기준선 IGA 점수는 “중등도”(62%)에서 “중증”(38%)까지였습니다. 위약 대조 시험에 포함된 2,077명의 건선 환자 중 79%는 생물학적 치료를 처음 받은 환자(생물학적 치료를 이전에 받은 적이 없음)였고, 45%는 비생물학적 치료 실패 환자(비생물학적 치료를 이전에 받았지만 반응하지 않음)였습니다. 생물학적 치료를 이전에 받은 환자 중 3분의 1 이상이 생물학적 치료 실패 환자였습니다. 시험 대상자의 약 15%에서 25%는 건선 관절염 병력이 있었습니다.
임상 반응
시험 PsO1 및 PsO2의 결과는 표 3에 제시되어 있습니다.
| 시험 PsO1 | 시험 PsO2 | |||||
| COSENTYX 300mg (N = 245) n (%) |
COSENTYX 150mg (N = 245) n (%) |
위약 (N = 248) n (%) |
COSENTYX 300mg (N = 327) n (%) |
COSENTYX 150mg (N = 327) n (%) |
위약 (N = 326) n (%) |
|
| PASI 75 반응 | 200 (82) | 174 (71) | 11 (4) | 249 (76) | 219 (67) | 16 (5) |
| IGA of clear or almost clear | 160 (65) | 125 (51) | 6 (2) | 202 (62) | 167 (51) | 9 (3) |
PsO3 및 PsO4 시험 결과는 표 4에 제시되어 있습니다.
| PsO3 시험 | PsO4 시험 | |||||
| COSENTYX 300 mg (N = 59) n (%) |
COSENTYX 150 mg (N = 59) n (%) |
위약 (N = 59) n (%) |
COSENTYX 300 mg (N = 60) n (%) |
COSENTYX 150 mg (N = 61) n (%) |
위약 (N = 61) n (%) |
|
| PASI 75 반응 | 44 (75) | 41 (69) | 0 (0) | 52 (87) | 43 (70) | 2 (3) |
| IGA of clear or almost clear | 40 (68) | 31 (53) | 0 (0) | 44 (73) | 32 (52) | 0 (0) |
연령, 성별 및 인종 하위 집단에 대한 검사 결과 이러한 하위 집단에서 COSENTYX에 대한 반응에 차이가 발견되지 않았습니다. 중등도에서 중증의 건선 환자를 대상으로 한 사후 분석에 따르면 체중이 낮고 질병 중증도가 낮은 환자는 COSENTYX 150mg으로 적절한 반응을 얻을 수 있습니다.
12주차에 COSENTYX 300mg 및 150mg으로 위약군에 비해 PASI 90 반응이 각각 59%(145/245) 및 39%(95/245) 대 1%(3/248)로 나타났습니다(시험 PsO1). 또한 각각 54%(175/327) 및 42%(137/327) 대 2%(5/326)로 나타났습니다(시험 PsO2). 시험 PsO3 및 PsO4에서도 유사한 결과가 나타났습니다.
- 52주 동안 지속적인 치료를 받은 시험 PsO1의 환자 중 12주차에 PASI 75 반응을 보인 환자는 COSENTYX 300mg으로 치료받은 환자의 81%(161/200)와 COSENTYX 150mg으로 치료받은 환자의 72%(126/174)가 반응을 유지했습니다. 12주차에 IGA에서 명확하거나 거의 명확한 상태였던 시험 PsO1의 환자는 COSENTYX 300mg으로 치료받은 환자의 74%(119/160)와 COSENTYX 150mg으로 치료받은 환자의 59%(74/125)가 반응을 유지했습니다.
- 마찬가지로 시험 PsO2에서 PASI 75 반응을 보인 환자는 COSENTYX 300mg으로 치료받은 환자의 84%(210/249)와 COSENTYX 150mg으로 치료받은 환자의 82%(180/219)가 반응을 유지했습니다. 12주차에 IGA에서 명확하거나 거의 명확한 상태였던 시험 PsO2의 환자는 COSENTYX 300mg으로 치료받은 환자의 80%(161/202)와 COSENTYX 150mg으로 치료받은 환자의 68%(113/167)가 반응을 유지했습니다.
환자 보고 결과 평가에 참여하기로 선택한 환자(39%) 중에서 건선 증상 일기©를 사용하여 위약군에 비해 12주차에 가려움증, 통증 및 각질과 관련된 징후 및 증상이 개선된 것으로 나타났습니다(시험 PsO1 및 PsO2).
두피 건선 병변
무작위 배정, 위약 대조 시험(시험 PsO5; NCT02267135)에는 건선 두피 중증도 지수(PSSI) 점수가 12 이상, IGA 두피 전용 점수가 3 이상, 두피의 적어도 30%가 영향을 받은 중등도에서 중증의 두피 건선 병변이 있는 환자 102명이 등록되었습니다. 이 시험에서 환자의 62%가 두피 표면적의 적어도 50%가 영향을 받았습니다. 이 연구에서 각 300mg 용량은 150mg의 두 번의 주사로 투여되었습니다. IGA 두피 전용 점수가 0 또는 1(명확하거나 거의 명확함)인 환자의 비율은 COSENTYX 300mg군에서 각각 56.9%와 5.9%였고 위약군에서는 각각 5.9%였습니다.
300mg/2mL 사전 충전 주사기 및 300mg/2mL UnoReady 펜
두 개의 무작위 배정, 이중 맹검, 위약 대조, 52주 시험(PsO6 및 PsO7)에는 전신 요법 또는 광선 요법의 대상인 중등도에서 중증의 건선이 있는 18세 이상의 환자 336명이 등록되어 COSENTYX 300mg을 단일 300mg/2mL 사전 충전 주사기(시험 PsO6, NCT02748863, 환자 214명) 또는 단일 300mg/2mL UnoReady 펜(시험 PsO7, NCT03589885, 환자 122명)으로 피하 투여하여 150mg/1mL 사전 충전 주사기를 사용한 두 번의 피하 주사와 비교하여 안전성 및 유효성을 평가했습니다. 두 시험 모두 공동 1차 종료점은 12주차에 기준선에서 적어도 2단계 감소한 PASI 75 반응과 IGA mod 2011 ‘명확함’ 또는 ‘거의 명확함’ 반응을 달성한 환자의 비율이었습니다.
| 약어: PFS, 사전 충전 주사기. 누락된 데이터는 다중 대치를 사용하여 대치되었습니다. |
||||||
| 시험 PsO6 | 시험 PsO7 | |||||
| COSENTYX 300mg | COSENTYX 300mg | |||||
| 2mL PFS (N = 72) % |
두 개의 1mL PFS (N = 71) % |
위약 (N = 71) % |
2mL 펜 (N = 41) % |
두 개의 1mL PFS (N = 41) % |
위약 (N = 40) % |
|
| 명확하거나 거의 명확한 IGA | 76 | 69 | 1 | 76 | 68 | 8 |
| PASI 75 반응 | 89 | 82 | 2 | 95 | 83 | 10 |
| PASI 90 반응 | 67 | 70 | 2 | 76 | 62 | 5 |
14.2 소아 판상 건선
52주, 다기관 무작위 배정, 이중맹검, 위약 및 활성 대조군 시험(시험 PsO8; NCT02471144)은 전신 치료의 후보자였던 중증 판상 건선(PASI 점수 ≥ 20, IGA 수정 2011 점수 4, BSA의 ≥ 10%를 포함하는 것으로 정의됨)이 있는 6세 이상의 소아 피험자 162명을 등록했습니다.
피험자들은 피하 위약, COSENTYX 또는 생물학적 활성 대조군을 무작위로 투여받았습니다. COSENTYX 그룹에서 BW가 25kg 미만인 피험자는 75mg을 투여받았고, BW가 25kg 이상 50kg 미만인 피험자는 75mg 또는 150mg(권장 용량의 2배)을 투여받았으며, BW가 50kg 이상인 피험자는 150mg 또는 300mg(권장 용량의 2배)을 투여받았습니다. 이 연구에서 각 300mg 용량은 150mg의 피하 주사 2회로 투여되었습니다. COSENTYX 및 위약 그룹의 피험자는 0주, 1주, 2주, 3주 및 4주에 피하 치료를 받았고 그 후 4주마다 투약을 받았습니다. 12주차에 위약을 무작위로 투여받은 비반응자는 COSENTYX(체중에 따른 용량)로 전환되었고 12주, 13주, 14주 및 15주에 COSENTYX를 투여받았으며, 16주차부터 4주마다 동일한 용량을 투여받았습니다.
기준 특성
전반적으로 피험자의 60%가 여성이었고, 83%가 백인이었으며, 중간 BW는 50.6kg이었고, 평균 연령은 13.5세였으며, 피험자의 23%가 12세 미만이었습니다. 기준선에서 중간 PASI 점수는 26(17에서 60까지)이었고, 피험자의 99%가 IGA 수정 2011 점수가 4(‘중증’)였습니다. 피험자의 약 43%가 광선 요법을 사전에 경험했고, 53%가 기존 전신 치료를 경험했고, 3%가 생물학적 제제를 경험했고, 9%가 동반 건선 관절염을 앓고 있었습니다.
종점
공동 1차 종점은 기준선에서 12주차까지 PASI 점수가 최소 75% 감소한 피험자의 비율(PASI 75)과 기준선에서 12주차까지 IGA 수정 2011 점수가 ‘맑음’ 또는 ‘거의 맑음'(0 또는 1)으로 최소 2점 개선된 피험자의 비율이었습니다. 주요 2차 종점은 기준선에서 12주차까지 PASI 점수가 최소 90% 감소한 피험자의 비율(PASI 90)이었습니다.
임상 반응
표 6은 시험 PsO8에서 승인된 용량에 대한 기준 체중 계층별 12주차 유효성 결과를 보여줍니다.
| 누락된 값을 처리하기 위해 비반응자 대입이 사용되었습니다. aCOSENTYX 치료를 받은 피험자는 50kg 미만의 피험자에게는 75mg을, 50kg 이상의 피험자에게는 150mg을 투여받았습니다. |
||||||
| 체중 < 50kg | 체중 ≥ 50kg | 총계 | ||||
| COSENTYX 75mg (N = 22) n (%) |
위약
(N = 20) |
COSENTYX 150mg (N = 21) n (%) |
위약
(N = 21) |
COSENTYXa
(N = 43) |
위약
(N = 41) |
|
| IGA가 맑음 또는 거의 맑음 | 7 (32) | 1 (5) | 17 (81) | 1 (5) | 24 (56) | 2 (5) |
| PASI 75 반응 | 12 (55) | 2 (10) | 18 (86) | 4 (19) | 30 (70) | 6 (15) |
| PASI 90 반응 | 9 (41) | 1 (5) | 17 (81) | 0 (0) | 26 (60) | 1 (2) |
14.3 성인 건선성 관절염
COSENTYX의 안전성 및 유효성은 3개의 무작위 배정, 이중 맹검, 위약 대조 시험(PsA1, PsA2 및 PsA3)에서 비스테로이드성 항염증제(NSAID), 코르티코스테로이드 또는 질병 수정 항류마티스제(DMARD) 치료에도 불구하고 활동성 PsA(3개 이상의 부은 관절 및 3개 이상의 압통 관절)를 가진 18세 이상 성인 환자 1,999명을 대상으로 평가되었습니다. 이러한 시험의 환자들은 모든 시험에서 최소 5년 동안 PsA 진단을 받았습니다.
- PsA1 연구(NCT 01752634)는 397명의 환자를 평가했으며, 이들은 0주, 1주, 2주, 3주 및 4주에 75mg, 150mg 또는 300mg의 COSENTYX(150mg의 피하 주사 2회 투여)로 치료받았으며, 그 후 4주마다 동일한 피하 용량으로 치료받았습니다. 위약을 투여받은 환자는 16주 또는 24주에 반응자 상태에 따라 피하 COSENTYX(4주마다 150mg 또는 300mg)를 투여받도록 재무작위 배정되었습니다. 일차 종료점은 24주에 ACR20 반응을 달성한 환자의 비율이었습니다.
- PsA2 연구(NCT 01392326)는 606명의 환자를 평가했으며, 이들은 0주, 2주 및 4주에 정맥 주사 secukinumab 10mg/kg 또는 위약을 투여받았으며, 그 후 4주마다 피하 COSENTYX 치료(또는 위약) 75mg 또는 150mg을 투여받았습니다. 위약을 투여받은 환자는 16주 또는 24주에 반응자 상태에 따라 피하 COSENTYX(4주마다 75mg 또는 150mg)를 투여받도록 재무작위 배정되었습니다.
- PsA3 연구(NCT 02404350)는 996명의 환자를 평가했으며, 이들은 0주, 1주, 2주, 3주 및 4주에 150mg 또는 300mg의 COSENTYX(150mg의 피하 주사 2회 투여)를 투여받았으며, 그 후 4주마다 동일한 피하 용량으로 치료받았거나, 4주마다 COSENTYX 150mg을 1회 투여받았습니다. 위약으로 치료받은 환자는 기준선 무작위 배정에 따라 16주 또는 24주에 피하 COSENTYX(150mg 또는 300mg)를 투여받았습니다. 일차 종료점은 16주에 ACR20 반응이었으며, 주요 이차 종료점은 24주에 수정된 총 Sharp 점수(mTSS)의 기준선 대비 변화였습니다.
기준선 질병 특징
기준선에서 환자의 61% 이상과 42%는 각각 힘줄염과 지염을 보였습니다. 전반적으로 환자의 31%는 효능 부족 또는 내약성으로 인해 이전에 항-TNFα제 치료를 중단했습니다. 또한, 두 연구 모두에서 약 53%의 환자가 메토트렉세이트(MTX)를 병용했습니다. 다양한 유형의 PsA를 가진 환자가 등록되었으며, 여기에는 류마티스 결절이 없는 다관절염(80%), 비대칭 말초 관절염(63%), 원위 지골 관절염(58%), 말초 관절염을 동반한 척추염(20%) 및 관절 변형(7%)이 포함되었습니다.
임상 반응
PsA1에서 COSENTYX 150mg 또는 300mg으로 치료받은 환자는 24주에 위약으로 치료받은 환자에 비해 ACR20, ACR50 및 ACR70을 포함한 임상 반응이 더 크게 나타났습니다(표 7). 반응은 병용 MTX 치료 여부에 관계없이 환자에서 유사했습니다. 반응은 이전 항-TNFα 노출 여부에 관계없이 나타났습니다.
COSENTYX를 투여받은 동반 PsO를 가진 환자(n = 99)의 경우, 피부 병변의 건선은 위약에 비해 치료로 개선되었으며, 이는 건선 면적 중증도 지수(PASI)로 측정되었습니다.
| a16주에 탈출 기준(압통 또는 부은 관절 수의 20% 미만 개선)을 충족한 환자는 비반응자로 간주되었습니다. | |||||
| COSENTYX | COSENTYX | 위약 | 위약 대비 차이(95% CI) | ||
| 150mg (N = 100) |
300mg (N = 100) |
(N = 98) |
COSENTYX 150mg |
COSENTYX 300mg |
|
| ACR20 반응 | |||||
| 16주 (%) | 60 | 57 | 18 | 42 (30, 54) |
38 (26, 51) |
| 24주 (%) | 51 | 54 | 15 | 36 (24, 48) |
39 (27, 51) |
| ACR50 반응 | |||||
| 16주 (%) | 37 | 35 | 6 | 31 (21, 42) |
28 (18, 39) |
| 24주 (%) | 35 | 35 | 7 | 28 (18, 38) |
28 (17, 38) |
| ACR70 반응 | |||||
| 16주차 (%) | 17 | 15 | 2 | 15 (7, 23) |
13 (5, 20) |
| 24주차 (%) | 21 | 20 | 1 | 20 (12, 28) |
19 (11, 27) |
방문 시 ACR20 반응을 달성한 환자의 비율은 그림 1에 나와 있습니다. 로딩 요법 없이 COSENTYX를 투여받은 위약군 환자는 시간이 지남에 따라 유사한 ACR20 반응을 보였습니다(데이터 미제공).
그림 1: PsA1 연구에서 24주까지 ACR 20 반응a을 달성한 성인 환자의 비율(피하 투여)
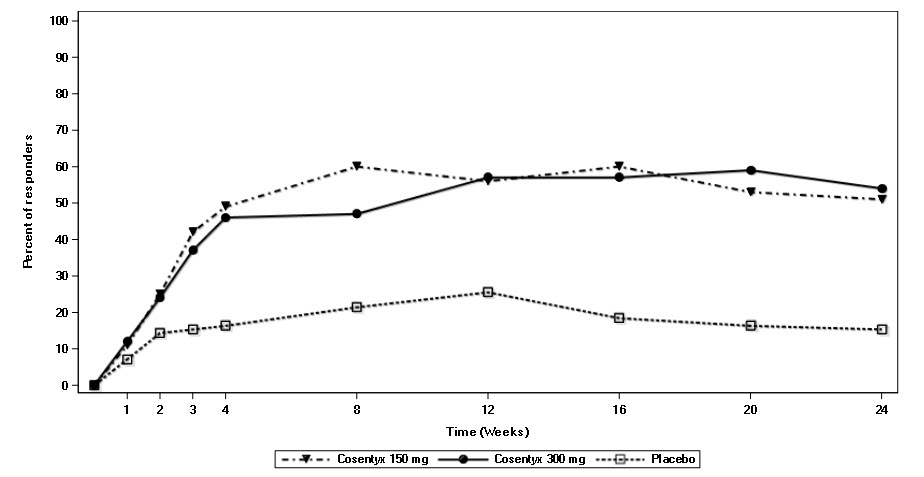
a16주에 탈출 기준(압통 또는 팽윤 관절 수의 20% 미만 개선)을 충족한 환자는 비반응자로 간주되었습니다.
PsA1 연구에서 ACR 반응 기준 구성 요소의 개선 사항은 표 8에 나와 있습니다.
| a위약 탈출 후 COSENTYX와의 비교를 위해 24주 데이터가 아닌 16주 데이터가 표시됩니다. b관찰된 데이터를 기반으로 한 평균 변화. |
|||
| COSENTYX 150 mg (N = 100) |
COSENTYX 300 mg (N = 100) |
위약 (N = 98) |
|
| 팽윤 관절 수 | |||
| 기준선 | 12.0 | 11.2 | 12.1 |
| 16주 시 평균 변화 | -4.86 | -5.83 | -3.22 |
| 압통 관절 수 | |||
| 기준선 | 24.1 | 20.2 | 23.5 |
| 16주 시 평균 변화 | -10.70 | -10.01 | -1.77 |
| 환자의 통증 평가 | |||
| 기준선 | 58.9 | 57.7 | 55.4 |
| 16주 시 평균 변화 | -22.91 | -23.97 | -7.98 |
| 환자 전반적 평가 | |||
| 기준선 | 62.0 | 60.7 | 57.6 |
| 16주 시 평균 변화 | -25.47 | -25.40 | -8.25 |
| 의사 전반적 평가 | |||
| 기준선 | 56.7 | 55.0 | 55.0 |
| 16주 시 평균 변화 | -29.24 | -34.71 | -14.95 |
| 장애 지수 (HAQ) | |||
| 기준선 | 1.2200 | 1.2828 | 1.1684 |
| 16주 시 평균 변화 | -0.45 | -0.55 | -0.23 |
| CRP (mg/L) | |||
| 기준선 | 14.15 | 10.88 | 7.87 |
| 16주 시 평균 변화b | -8.41 | -7.21 | 0.79 |
24주차에 위약군과 비교하여 각 COSENTYX 군에서 힘줄염 및 지염 점수의 개선이 관찰되었습니다.
방사선학적 반응
PsA3 연구에서 구조적 손상 진행 억제는 방사선학적으로 평가되었으며, 24주차에 기준선과 비교하여 수정된 mTSS 및 그 구성 요소인 침식 점수(ES) 및 관절 간격 협착 점수(JSN)로 표현되었습니다. 손, 손목 및 발의 방사선 사진은 기준선, 16주차 및/또는 24주차에 촬영되었으며, 치료군 및 방문 번호를 모르는 최소 2명의 독자가 독립적으로 점수를 매겼습니다. 로딩 용량 없이 피하 COSENTYX 150mg, 로딩 용량이 있는 150mg 및 로딩 용량이 있는 300mg으로 치료하면 24주차에 mTSS 기준선 변화로 측정한 바와 같이 위약 치료와 비교하여 말초 관절 손상 진행이 유의하게 억제되었습니다. 무작위 배정부터 24주차까지 질병 진행이 없는 환자의 비율(mTSS의 기준선 변화가 0.0 이하로 정의됨)은 COSENTYX 150mg(로딩 용량 없음), 150mg, 300mg에 대해 각각 75.7%, 70.9%, 76.5%였으며, 위약의 경우 68.2%였습니다.
| 16주차에 탈출 치료를 받은 위약 대상자의 경우 탈출 후 데이터를 제외한 선형 혼합 효과 모델의 결과입니다. 이 모델은 시간에 따라 대략 선형 진행을 가정하고 24주 동안 진행 속도(기울기)의 차이를 추정하여 치료군을 비교합니다. | |||
| 치료 | N | 24주당 변화율 | 위약과의 차이 (95% CI) |
| COSENTYX 150mg(로딩 용량 없음) | 210 | -0.10 | -0.61 (-0.95, -0.26) |
| COSENTYX 150mg(로딩 용량 있음) | 213 | 0.14 | -0.37 (-0.71, -0.03) |
| COSENTYX 300mg(로딩 용량 있음) | 217 | 0.03 | -0.48 (-0.82, -0.14) |
| 위약 | 296 | 0.51 | — |
신체 기능
건강 평가 설문지-장애 지수(HAQ-DI)로 평가한 신체 기능의 개선은 기준선에서 HAQ-DI 점수가 최소 -0.3 개선된 환자의 비율이 16주차와 24주차에 피하 COSENTYX 150mg 및 300mg 그룹에서 위약 그룹보다 높았음을 보여주었습니다. PsA1 연구에서 16주차에 기준선에서 추정 평균 변화는 위약 그룹에서 -0.23인 반면 COSENTYX 150mg 그룹에서는 -0.45, COSENTYX 300mg 그룹에서는 -0.55였습니다.
정맥 주사 COSENTYX를 사용한 활성 건선 관절염 성인 환자 치료
활성 PsA를 가진 성인 환자에서 정맥 주사 COSENTYX의 효능은 활성 PsA를 가진 성인 환자에서 피하 COSENTYX의 확립된 효능에서 약동학적 노출을 기반으로 추론되었습니다. [임상 약리학(12.3) 참조]
14.4 강직성 척추염
피하 COSENTYX의 안전성과 유효성은 3개의 무작위 배정, 이중 맹검, 위약 대조 시험(AS1, AS2 및 AS3)에서 활성 AS를 가진 816명의 성인 환자(18세 이상)에서 평가되었습니다. 환자는 비스테로이드성 항염증제(NSAID), 코르티코스테로이드 또는 질병 수정 항류마티스제(DMARD) 치료에도 불구하고 Bath 강직성 척추염 질병 활성 지수(BASDAI)가 4 이상인 활성 질환을 가졌습니다.
- AS1 연구(NCT01649375)는 219명의 환자를 대상으로 0주차, 1주차, 2주차, 3주차 및 4주차에 피하 COSENTYX 75mg 또는 150mg 치료를 받은 후 4주마다 동일한 용량을 투여했습니다. 16주차에 위약을 투여받은 환자는 4주마다 피하 COSENTYX 75mg 또는 150mg 중 하나로 재무작위 배정되었습니다. 일차 평가 변수는 16주차에 ASAS20 반응을 달성한 환자의 비율이었습니다.
- AS2 연구(NCT01358175)는 371명의 환자를 대상으로 0주차, 2주차 및 4주차에 정맥 주사 세쿠키누맙 10mg/kg(두 치료군 모두) 또는 위약을 투여한 후 4주마다 피하 COSENTYX 75mg 또는 150mg 치료 또는 위약을 투여했습니다. 위약을 투여받은 환자는 16주차 또는 24주차에 반응자 상태에 따라 피하 COSENTYX(4주마다 75mg 또는 150mg)를 투여받도록 재무작위 배정되었습니다.
- AS3 연구(NCT02008916)는 226명의 환자를 대상으로 0주차, 2주차 및 4주차에 정맥 주사 세쿠키누맙 10mg/kg(두 치료군 모두) 또는 위약을 투여한 후 4주마다 피하 COSENTYX 150mg 또는 300mg 치료 또는 위약을 투여했습니다. 위약을 투여받은 환자는 16주차에 피하 COSENTYX(4주마다 150mg 또는 300mg)를 투여받도록 재무작위 배정되었습니다. 일차 평가 변수는 16주차에 ASAS20 반응을 달성한 환자의 비율이었습니다. 환자는 52주차까지 치료 요법을 맹검했으며 시험은 156주차까지 계속되었습니다. 이 연구에서 300mg 용량은 150mg을 2회 주사하여 투여했습니다.
기준선 질병 특징
기준선에서 약 13%와 25%가 각각 동반 MTX 또는 설파살라진을 사용했습니다. 전반적으로 환자의 29%가 효능 부족 또는 내약성으로 인해 이전 항-TNFα제 치료를 중단했습니다.
임상 반응
AS1에서 COSENTYX 150mg으로 치료받은 환자는 16주차에 위약으로 치료받은 환자보다 ASAS20 및 ASAS40 반응에서 더 큰 개선을 보였습니다(표 10). 동반 치료 여부에 관계없이 환자의 반응은 유사했습니다.
| COSENTYX 150 mg (n = 72) |
위약
(n = 74) |
위약과의 차이 (95% CI) |
|
| ASAS20 반응, % | 61 | 28 | 33 (18, 48) |
| ASAS40 반응, % | 36 | 11 | 25 (12, 38) |
ASAS20 반응 기준의 주요 구성 요소 및 질병 활동의 다른 측정 지표의 개선 사항은 표 11에 나와 있습니다.
|
||||
| COSENTYX 150 mg (N = 72) |
위약
(N = 74) |
|||
| 기준선 | 16주차 기준선 대비 변화 |
기준선 | 16주차 기준선 대비 변화 |
|
| ASAS20 반응 기준 | ||||
| -질병 활동에 대한 환자 전반적 평가(0-100 mm)1 | 67.5 | -27.7 | 70.5 | -12.9 |
| -척추 전체 통증(0-100 mm) | 66.2 | -28.5 | 69.2 | -10.9 |
| -BASFI(0-10)2 | 6.2 | -2.2 | 6.1 | -0.7 |
| -염증(0-10)3 | 6.5 | -2.5 | 6.5 | -0.8 |
| BASDAI 점수4 | 6.6 | -2.2 | 6.8 | -0.9 |
| BASMI5 | 3.6 | -0.51 | 3.9 | -0.22 |
| hsCRP6 (mg/L) 16주차 평균 변화 |
27.0 | -17.2 | 15.9 | 0.8 |
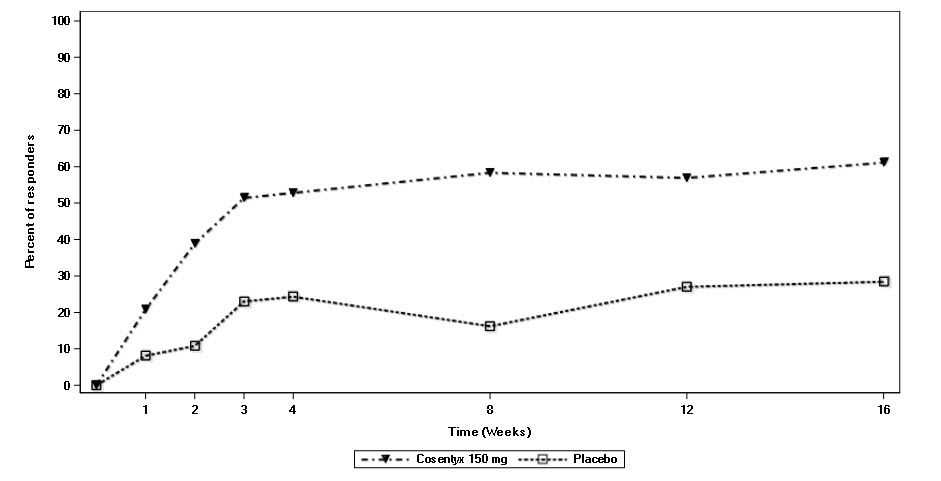
방문별로 ASAS20 반응을 달성한 환자의 비율은 그림 2에 나와 있습니다. 로딩 요법 없이 COSENTYX를 투여받은 위약군 환자는 시간이 지남에 따라 유사한 ASAS20 반응을 보였습니다(데이터 미제공).
그림 2: 최대 16주까지 모든 AS1 연구 환자의 시간 경과에 따른 ASAS20 반응(피하 투여)
AS3 연구에서 피하 COSENTYX(150mg 및 300mg)로 치료받은 환자는 증상과 징후가 개선되었으며, 용량에 관계없이 유사한 효능 반응을 보였으며, 16주차에 위약군보다 주요 및 대부분의 이차 종료점에서 우수했습니다. 16주차에 ASAS20 및 ASAS40 반응은 150mg의 경우 각각 58.1% 및 40.5%, 300mg의 경우 각각 60.5% 및 42.1%였습니다. 방문별로 ASAS20 반응을 달성한 환자의 비율은 그림 3에 나와 있습니다.
COSENTYX로 치료받은 환자는 16주차에 ASQoL로 평가한 건강 관련 삶의 질 측면에서 위약군 환자보다 개선된 결과를 보였습니다.
그림 3: 최대 16주까지 모든 AS3 연구 환자의 시간 경과에 따른 ASAS20 반응(피하 투여)
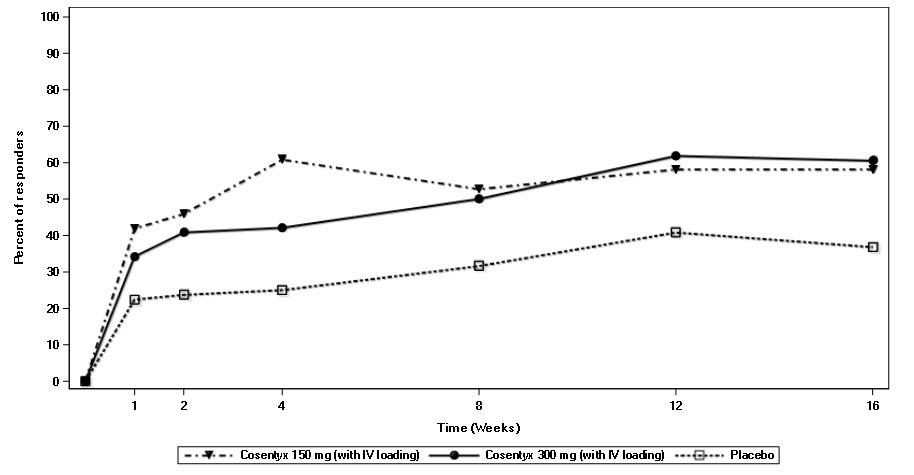
정맥 주사 COSENTYX를 사용한 활동성 척추관절염 성인 환자의 치료
활동성 AS 성인 환자에서 정맥 주사 COSENTYX의 효능은 활동성 AS 성인 환자에서 피하 COSENTYX의 확립된 효능에서 약동학적 노출을 기반으로 추론되었습니다 [임상 약리학(12.3) 참조].
14.5 비방사선학적 축성 척추관절염
COSENTYX의 안전성 및 효능은 활동성 nr-axSpA가 있는 555명의 성인 환자(18세 이상)를 대상으로 한 무작위 배정, 이중 맹검, 위약 대조 3상 연구(nr-axSpA1, NCT02696031)에서 평가되었습니다. 환자는 염증의 객관적인 징후가 있는 axSpA에 대한 ASAS 기준을 충족했으며, NSAID 치료에도 불구하고 BASDAI가 4 이상, 총 요통에 대한 시각적 아날로그 척도(VAS)가 40 이상(0-100mm 척도)인 활동성 질환이 있었고, AS에 대한 수정된 뉴욕 기준을 충족하는 천장관절의 방사선학적 변화 증거는 없었습니다. 환자는 또한 상한선 이상의 C-반응성 단백질(CRP) 수치 또는 자기 공명 영상(MRI)에서 천장관절염 증거와 같은 염증의 객관적인 징후가 있어야 했습니다.
환자는 로딩 용량(0주, 1주, 2주, 3주, 4주) 또는 로딩 용량 없이(0주 및 4주) 피하 COSENTYX 150mg으로 치료받았으며, 그 후 4주마다 동일한 용량 또는 위약을 투여받았습니다. 이중 맹검 기간 동안 환자(n = 555)는 52주 동안 위약 또는 COSENTYX를 투여받았습니다. 16주부터 용량 조절 또는 동반 NSAID 및 DMARD의 추가가 허용되었습니다. 20주부터 환자는 연구자와 환자의 재량에 따라 매월 피하 COSENTYX 150mg 또는 다른 생물학적 제제로 개방 표지 치료로 전환할 수 있었습니다. 주요 종료점은 52주차에 척추관절염 국제 학회(ASAS40) 평가에서 최소 40% 개선이었습니다.
기준 질환 특징
환자의 약 10%와 15%는 각각 동반 MTX 또는 설파살라진을 사용했습니다. 전반적으로 환자의 10%는 이전에 항-TNFα 제제로 치료를 받았지만 효능 부족 또는 내약성으로 인해 중단했습니다.
임상 반응
nr-axSpA1 연구에서 COSENTYX 150mg으로 치료한 경우 16주차와 52주차에 위약으로 치료한 경우보다 질병 활성도 측정에서 유의미한 개선이 나타났습니다(표 12).
| 정규 근사를 기반으로 한 95% CI를 가진 비율의 차이. | |||||
| ASAS40 반응이 있는 피험자 수(%) | COSENTYX 150mg 로딩 없음 (n = 184) |
COSENTYX 150mg 로딩 있음 (n = 185) |
위약과의 차이(95% CI) | ||
| 위약 (n = 186) |
COSENTYX 150mg 로딩 없음 |
COSENTYX 150mg 로딩 있음 |
|||
| 16주차 | 75 (41) | 74 (40) | 52 (28) | 13 (3, 22) | 12 (2, 22) |
| 52주차 | 70 (38) | 62 (34) | 36 (19) | 19 (10, 28) | 14 (5, 23) |
nr-axSpA1 연구에서 ASAS40 반응 기준의 주요 구성 요소 결과는 표 13에 나와 있습니다.
| COSENTYX 150 mg, 로딩 용량 없음 (N = 184) |
COSENTYX 150 mg, 로딩 용량 포함 (N = 185) |
위약
(N = 186) |
||||
| 기준선 | 16주차 기준선 대비 변화 |
기준선 | 16주차 기준선 대비 변화 |
기준선 | 16주차 기준선 대비 변화 |
|
| ASAS40 반응 기준 | ||||||
| – 환자 전반적 질병 활성도 평가 (0-100 mm) | 71.0 | -26.2 | 72.6 | -24.1 | 68.8 | -13.8 |
| – 총 요통 (0-100 mm) | 72.0 | -25.5 | 73.3 | -25.0 | 70.9 | -15.6 |
| – BASFI (0-10) | 5.9 | -1.6 | 6.2 | -1.8 | 5.9 | -1.0 |
| – 염증 (0-10) | 6.8 | -2.8 | 7.2 | -2.8 | 6.6 | -1.7 |
| hsCRP (mg/L) 16주차 평균 변화 | 9.8 | -4.7 | 13.4 | -7.9 | 9.2 | -2.4 |
| BASDAI (0-10) | 6.9 | -2.4 | 7.1 | -2.4 | 6.8 | -1.5 |
| – 척추 통증 | 7.6 | -3.0 | 7.8 | -3.0 | 7.5 | -2.0 |
| – 말초 통증 및 부종 (0-10) | 6.6 | -2.4 | 6.3 | -2.3 | 6.1 | -1.6 |
| BASMI | 2.8 | -0.3 | 2.9 | -0.3 | 2.8 | -0.1 |
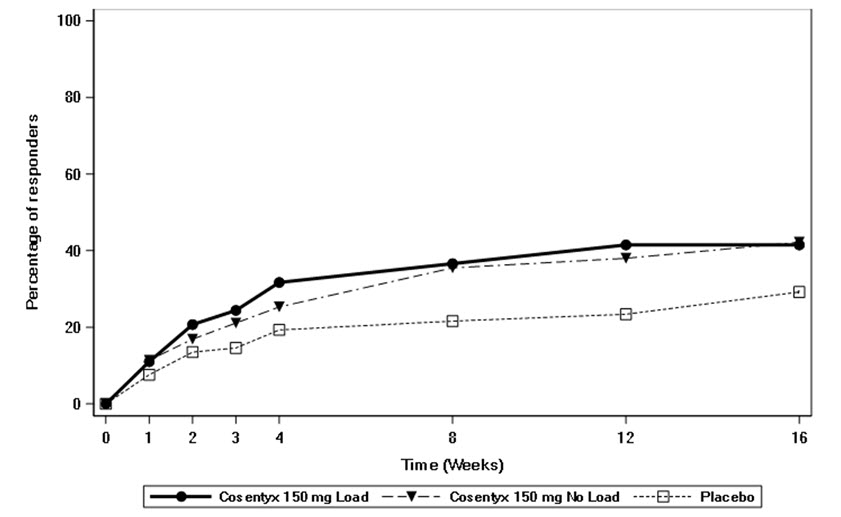
방문별로 ASAS40 반응을 달성한 환자의 비율은 그림 4에 나와 있습니다.
그림 4: 16주까지 nr-axSpA1 연구에서 시간 경과에 따른 ASAS40 반응 (피하 투여)
건강 관련 삶의 질
COSENTYX로 치료받은 환자는 ASQoL로 측정한 건강 관련 삶의 질에서 위약군에 비해 16주에 로딩 용량 및 로딩 용량 없이 모두 개선되었습니다(LS 평균 변화: 16주: -3.5 및 -3.6 대 -1.8).
정맥 주사 COSENTYX를 사용한 활성 비방사선학적 척추관절염 성인 환자 치료
활성 nr-axSpA 성인 환자에서 정맥 주사 COSENTYX의 효능은 활성 nr-axSpA 성인 환자에서 피하 주사 COSENTYX의 확립된 효능에서 약동학적 노출을 기반으로 추론되었습니다 [임상 약리학(12.3) 참조].
14.6 소아 건선성 관절염 및 힘줄염 관련 관절염
피하 주사 세쿠키누맙의 효능과 안전성은 수정된 국제 류마티스학회(ILAR) 소아 특발성 관절염(JIA) 분류 기준에 따라 진단된 활성 ERA 또는 JPsA를 가진 소아 환자(2세에서 18세 미만) 86명을 대상으로 한 2년, 3단계, 이중맹검, 위약 대조, 사건 기반, 무작위 배정, 3상 연구(NCT03031782)에서 평가되었습니다. 이 시험은 개방 표지 부분(1단계)에 이어 무작위 배정 철회(2단계)에 이어 개방 표지 치료(3단계)로 구성되었습니다. 환자는 체중이 50kg 미만인 경우 75mg의 피하 주사 용량을, 체중이 50kg 이상인 경우 150mg의 피하 주사 용량을 0주, 1주, 2주, 3주, 4주에 피하 주사로 투여하고 그 이후로는 4주마다 투여했습니다.
주요 종료점은 2단계에서 발병까지의 시간이었습니다. 질병 발병은 6가지 JIA ACR 반응 기준 중 3가지 이상에서 30% 이상 악화되고 6가지 JIA ACR 반응 기준 중 1가지 이하에서 30% 이상 개선되며 활성 관절이 2개 이상인 경우로 정의되었습니다.
개방 표지 1단계에서 모든 환자는 12주까지 피하 주사 세쿠키누맙을 투여받았습니다. 12주에 반응자(JIA ACR30 반응 달성)로 분류된 환자는 2단계 이중맹검 단계에 진입하여 세쿠키누맙 치료를 계속하거나 위약 치료를 시작하도록 1:1로 무작위 배정되었습니다.
기준 질병 특징
연구 시작 시 JIA 환자 아형은 ERA가 60.5%, JPsA가 39.5%였습니다. 이 연구에서 JPsA 환자의 67.6%와 ERA 환자의 63.5%가 MTX와 병용 치료를 받았습니다.
임상 반응
각 JIA 아형(JPsA 및 ERA)에서 유사한 반응이 관찰되었습니다. 12주에 JPsA 및 ERA 환자의 JIA ACR 30, 50, 70 및 90 반응은 아래 표 14에 제시되어 있습니다.
| 반응을 보인 대상자 수(%) | JIA ACR 30 | JIA ACR 50 | JIA ACR 70 | JIA ACR 90 |
| JPsA (N = 34) | 31 (91) | 31 (91) | 24 (71) | 16 (47) |
| ERA (N = 52) | 44 (85) | 41 (79) | 34 (65) | 17 (33) |
소아 건선성 관절염 결과
2부 동안 위약군의 JPsA 환자 11명이 플레어 이벤트를 경험한 반면, 세쿠키누맙군의 JPsA 환자는 4명이었습니다. 세쿠키누맙을 투여받은 환자의 플레어 위험은 위약을 투여받은 환자에 비해 85% 감소했습니다(위험 비율 = 0.15, 95% CI: 0.04~0.56)(그림 5).
그림 5: JPsA 환자의 2부 플레어 발생 시간에 대한 Kaplan-Meier 추정치(피하 투여)
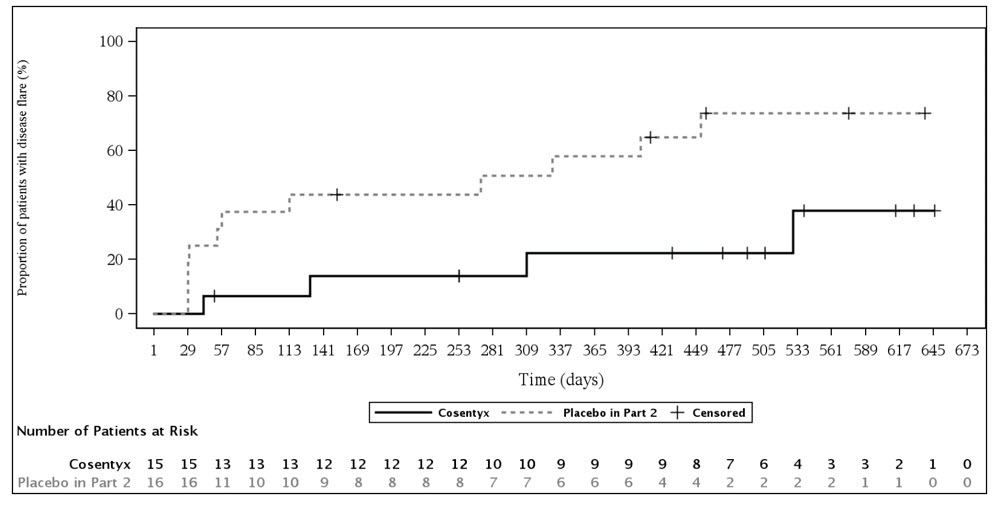
힘줄염 관련 관절염 결과
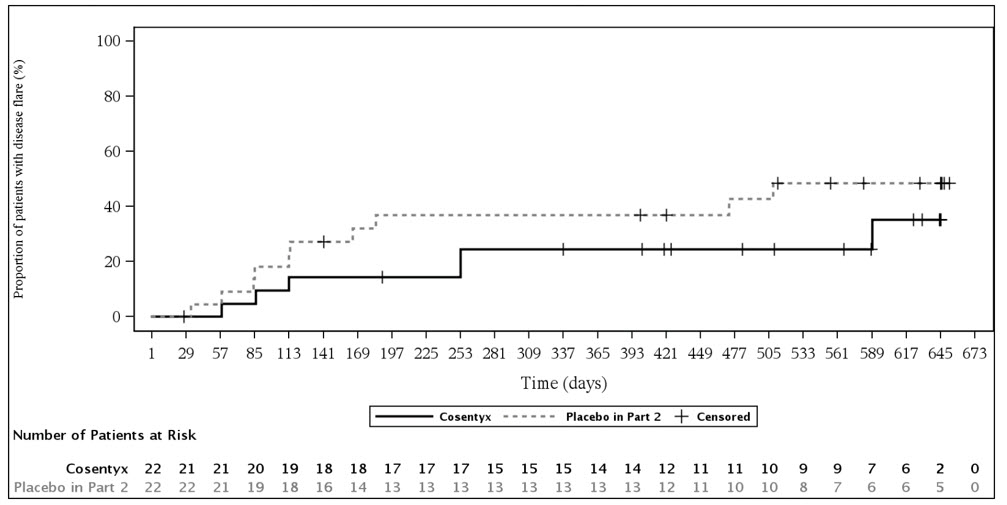
2부 동안 위약군의 ERA 환자 10명이 플레어 이벤트를 경험한 반면, 세쿠키누맙군의 ERA 환자는 6명이었습니다. 세쿠키누맙을 투여받은 환자의 플레어 위험은 위약을 투여받은 환자에 비해 53% 감소했습니다(위험 비율 = 0.47, 95% CI: 0.17~1.32)(그림 6). 보충 분석은 ERA에서 치료 효과에 대한 확인 증거를 제공했습니다.
그림 6: ERA 환자의 2부 플레어 발생 시간에 대한 Kaplan-Meier 추정치(피하 투여)
14.7 농포성 한선염
2건의 무작위 배정, 이중 맹검, 위약 대조 52주 3상 시험(즉, HS 시험 1[NCT03713619] 및 HS 시험 2[NCT03713632])은 중등도에서 중증 농포성 한선염(HS) 성인 환자의 치료에 대한 COSENTYX의 효능과 안전성을 평가했습니다. 두 시험 모두에서 피험자는 위약 또는 COSENTYX 300mg을 0주, 1주, 2주, 3주 및 4주에 피하 주사로 무작위 배정받았으며, 그 후 2주마다 또는 4주마다 300mg을 투여받았습니다. 16주차에 위약을 무작위 배정받은 피험자는 16주, 17주, 18주, 19주 및 20주에 COSENTYX 300mg을 투여받도록 재배정되었으며, 그 후 COSENTYX 300mg을 2주마다(Q2W) 또는 4주마다(Q4W) 투여받았습니다.
기준 인구 통계 및 질병 특징
HS 시험 1과 HS 시험 2에는 중등도에서 중증 HS를 가진 성인 피험자 1,084명이 포함되었습니다. HS 시험 1은 541명의 피험자를 평가했고 HS 시험 2는 543명의 피험자를 평가했으며, 그 중 각각 13%와 11%가 안정적인 용량의 전신 항생제를 병용했습니다. HS 시험 1과 HS 시험 2에서 각각 24%와 23%의 환자가 이전에 생물학적 제제로 치료받았고(생물학적 제제 노출 환자) 효능 부족 또는 내약성으로 인해 생물학적 제제를 중단했습니다.
종점
두 시험 모두에서 주요 종점은 16주차에 기준선 대비 농양 및 염증성 결절(AN) 수가 50% 이상 감소하고 농양 수 및/또는 배농 누공 수가 증가하지 않은 농포성 한선염 임상 반응(HiSCR50)을 달성한 피험자의 비율이었습니다.
임상 반응
HS 시험 1과 HS 시험 2에서 COSENTYX 300mg을 2주마다(처음 4주 후) 투여받은 피험자는 위약을 투여받은 환자에 비해 16주차에 HiSCR50 반응을 달성한 비율이 통계적으로 유의하게 높았습니다(표 15 참조). 두 HS 시험 모두에서 COSENTYX 300mg을 4주마다(처음 4주 후) 투여받은 피험자는 위약을 투여받은 피험자에 비해 16주차에 HiSCR50을 달성한 비율이 높았습니다(표 15 참조). 여기서 통계적 유의성은 HS 시험 2에서 달성되었습니다. 두 시험 모두에서 COSENTYX의 작용 시작은 2주차에 나타났으며 효능은 16주차까지 점진적으로 증가했습니다.
주요 종점인 HiSCR50의 경우 구제 약물 또는 병변 개입을 받은 피험자는 치료 실패로 간주되었으며 비반응자로 처리되었습니다(HS 시험 1에서 위약군 20명, Q4W군 11명, Q2W군 8명; HS 시험 2에서 위약군 23명, Q4W군 17명, Q2W군 13명).
이전 또는 병용 항생제 치료 또는 이전 생물학적 제제 노출 여부에 관계없이 HS 피험자의 주요 종점에서 개선이 관찰되었습니다.
| 1누락된 데이터에 대해 다중 대치가 구현되었습니다. 2피험자는 0주, 1주, 2주, 3주 및 4주에 피하 주사로 COSENTYX 300mg을 투여받았으며, 그 후 4주마다(Q4W) 또는 2주마다(Q2W) 300mg을 투여받았습니다. *전체 알파 = 0.05(양측)를 사용한 사전 정의된 계층 구조에 따라 위약 대비 통계적으로 유의함. |
||||||
| HS 시험 1 | HS 시험 2 | |||||
| 위약 (n = 180) |
COSENTYX 300mg 4주마다2 (n = 180) |
COSENTYX 300mg 2주마다2 (n = 181) |
위약 (n = 183) |
COSENTYX 300mg 4주마다2 (n = 180) |
COSENTYX 300mg 2주마다2 (n = 180) |
|
| HiSCR50 | 29.4% | 41.3% | 44.5%* | 26.1% | 42.5%* | 38.3%* |
16 제공/보관 및 취급 방법
제품 정보
COSENTYX (secukinumab) 주사제는 투명하거나 유백색을 띠는 무색에서 약간 노란색의 용액으로 다음과 같이 제공됩니다.
피하 주사용 COSENTYX 주사제
COSENTYX 300 mg/2 mL UnoReady 펜
- NDC 0078-1070-68: 300 mg/2 mL (300 mg 용량) 단회용 UnoReady 펜 (주사제) 1개가 들어 있는 상자
COSENTYX 300 mg/2 mL (150 mg/mL) 미리 채워진 주사기
- NDC 0078-1070-97: 300 mg/2 mL (150 mg/mL) 단회용 미리 채워진 주사기 (주사제) 1개가 들어 있는 상자
COSENTYX 150 mg/mL Sensoready 펜
- NDC 0078-0639-41: 150 mg/mL (300 mg 용량) 단회용 Sensoready 펜 (주사제) 2개가 들어 있는 상자
- NDC 0078-0639-68: 150 mg/mL 단회용 Sensoready 펜 (주사제) 1개가 들어 있는 상자
COSENTYX 150 mg/mL 미리 채워진 주사기
- NDC 0078-0639-98: 150 mg/mL (300 mg 용량) 단회용 미리 채워진 주사기 (주사제) 2개가 들어 있는 상자
- NDC 0078-0639-97: 150 mg/mL 단회용 미리 채워진 주사기 (주사제) 1개가 들어 있는 상자
COSENTYX 75 mg/0.5 mL 미리 채워진 주사기 (50 kg 미만의 소아 환자용)
- NDC 0078-1056-97: 75 mg/0.5 mL 단회용 미리 채워진 주사기 (주사제) 1개가 들어 있는 상자
COSENTYX 150 mg/mL Sensoready 펜 및 미리 채워진 주사기, 75 mg/0.5 mL 미리 채워진 주사기의 탈착식 캡에는 천연 고무 라텍스가 포함되어 있습니다. 300 mg/2 mL UnoReady 펜, 150 mg/mL Sensoready 펜, 300 mg/2 mL, 150 mg/mL 및 75 mg/0.5 mL 미리 채워진 주사기에는 바늘 안전 가드가 장착되어 있습니다.
정맥 주사용 COSENTYX 주사제
- NDC 0078-1168-61: 정맥 주입 전 희석을 위한 단회용 바이알에 125 mg/5 mL (25 mg/mL) 용액이 들어 있는 상자 1개.
보관 및 취급
피하 주사용 COSENTYX 주사제 (300 mg/2 mL UnoReady 펜, 150 mg/mL Sensoready 펜, 150 mg/mL 및 75 mg/0.5 mL 미리 채워진 주사기) 및 정맥 주사용 COSENTYX 주사제는 2ºC~8ºC (36ºF~46ºF)에서 냉장 보관하십시오. 사용할 때까지 제품을 원래 상자에 보관하여 빛으로부터 보호하십시오. 냉동하지 마십시오. 거품이 생기는 것을 방지하기 위해 흔들지 마십시오. COSENTYX에는 보존제가 포함되어 있지 않으므로 사용하지 않은 부분은 버리십시오.
냉장 보관에서 꺼낸 경우, COSENTYX 150 mg/mL Sensoready 펜, 150 mg/mL 및 75 mg/0.5 mL 미리 채워진 주사기:
- 30°C (86°F)를 초과하지 않는 실온에서 최대 4일 동안 보관할 수 있습니다.
- COSENTYX를 냉장 보관에서 꺼내고 다시 냉장 보관한 날짜를 상자에 제공된 공간에 적으십시오.
- 냉장고 밖에서 4일 이상 보관한 경우 버리십시오.
- 냉장고에 한 번만 다시 넣을 수 있으며 사용하거나 만료될 때까지 2ºC~8ºC (36ºF~46ºF)에서 보관해야 합니다.
17 환자 상담 정보
FDA 승인 환자 라벨(약물 안내 및 사용 지침)을 읽도록 환자에게 알려주십시오.
감염
COSENTYX는 면역 체계의 감염과 싸우는 능력을 떨어뜨릴 수 있으며, COSENTYX를 사용하면 기회 감염을 포함한 심각한 감염이 발생할 수 있다는 사실을 환자에게 알려주십시오. 환자에게 감염 병력을 의사에게 알리는 것이 중요하며, 감염 증상이 나타나면 의사에게 연락하도록 지시하십시오 [경고 및 주의 사항(5.1) 참조].
과민 반응
심각한 과민 반응 증상이 나타나면 즉시 의료 처치를 받도록 환자에게 알려주십시오 [경고 및 주의 사항(5.2) 참조].
습진성 발진
COSENTYX를 사용하면 습진과 유사한 피부 반응이 나타날 수 있다는 사실을 환자에게 알려주십시오. 습진의 징후나 증상이 나타나면 의사의 진료를 받도록 환자에게 지시하십시오 [경고 및 주의 사항(5.5) 참조].
라텍스 알레르기 환자의 과민 반응 위험
라텍스 알레르기가 있는 환자에게 COSENTYX 150 mg/mL Sensoready 펜과 COSENTYX 1 mL 및 0.5 mL 사전 충전 주사기의 제거 캡에는 천연 고무 라텍스가 포함되어 있으며, 라텍스 알레르기가 있는 사람에게 알레르기 반응을 일으킬 수 있다는 사실을 알려주십시오 [경고 및 주의 사항(5.6) 참조].
예방 접종
COSENTYX 치료 중에는 생백신으로 예방 접종을 하는 것이 권장되지 않는다는 사실을 환자에게 알려주십시오. 환자에게 예방 접종을 받기 전에 의료 전문가에게 COSENTYX를 복용하고 있다는 사실을 알리도록 지시하십시오 [경고 및 주의 사항(5.7) 참조].
피하 주사 기술에 대한 지침
환자 또는 보호자가 UnoReady 펜, Sensoready 펜 또는 사전 충전 주사기를 사용하여 COSENTYX를 피하 주사하는 경우, 주사 기술을 지시하고 피하 주사 능력을 평가하여 COSENTYX가 적절히 투여되도록 하십시오 [투여 및 관리(2.2, 2.9), 약물 안내 및 사용 지침 참조].
소아 환자의 경우, 소아 환자는 COSENTYX를 스스로 투여해서는 안 된다는 사실을 환자와 보호자에게 알려주십시오.
환자 또는 보호자에게 주사기와 바늘을 적절히 폐기하는 방법을 지시하고 이러한 품목을 재사용하지 않도록 조언하십시오. 약물 안내 및 사용 지침에 제공된 지침에 따라 COSENTYX를 전량 주사하도록 환자에게 지시하십시오.
보관
환자에게 COSENTYX를 2°C~8°C(36ºF~46ºF)의 냉장고에 보관하고 만료되었거나 사용하지 않은 COSENTYX는 폐기하도록 지시하십시오.
환자에게 냉장 보관에서 꺼낸 경우 COSENTYX 150 mg/mL Sensoready 펜, 150 mg/mL 및 75 mg/0.5 mL 사전 충전 주사기는 최대 4일 동안 86°F(30°C)를 초과하지 않는 실온에 보관할 수 있다는 사실을 알려주십시오. 환자에게 냉장고 밖에 4일 이상 보관한 경우 폐기하도록 지시하십시오 [포장 단위/보관 및 취급(16) 참조].
제조사:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
미국 허가 번호 1244
© Novartis
T2024-74
약물 안내문
| 이 약물 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2024년 8월 | ||
| 약물 안내서 COSENTYX® (코센틱스) (세쿠키누맙) 주사제, 피하 또는 정맥 주사용 |
|||
| COSENTYX에 대해 알아야 할 가장 중요한 정보는 무엇입니까? COSENTYX는 면역 체계에 영향을 미치는 약물입니다. COSENTYX는 다음과 같은 심각한 부작용의 위험을 증가시킬 수 있습니다. 감염. COSENTYX는 면역 체계가 감염과 싸우는 능력을 떨어뜨리고 감염 위험을 증가시킬 수 있습니다. 일부 사람들은 COSENTYX를 복용하는 동안 결핵(TB)을 포함한 심각한 감염과 박테리아, 곰팡이 또는 바이러스로 인한 감염을 경험했습니다. 일부 사람들은 이러한 감염으로 사망했습니다.
|
|||
COSENTYX를 시작하기 전에 다음 사항에 대해 의료 서비스 제공자에게 알리십시오.
|
|||
| ◦ 발열, 땀 또는 오한 ◦ 근육통 ◦ 기침 ◦ 호흡 곤란 ◦ 객혈 |
◦ 체중 감소 ◦ 따뜻하고 붉거나 통증이 있는 피부 또는 신체의 궤양 ◦ 설사 또는 복통 ◦ 배뇨 시 화끈거림 또는 평소보다 자주 배뇨 |
||
| COSENTYX를 시작한 후 위에 나열된 감염 징후가 나타나면 즉시 의료 서비스 제공자에게 연락하십시오. 의료 서비스 제공자의 지시가 없는 한 감염 징후가 있는 경우 COSENTYX를 사용하지 마십시오. “COSENTYX의 가능한 부작용은 무엇입니까?”를 참조하여 부작용에 대한 자세한 내용을 확인하십시오. |
|||
| COSENTYX는 무엇입니까? COSENTYX는 다음을 치료하는 데 사용되는 처방약입니다.
COSENTYX가 다음과 같은 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다.
|
|||
다음과 같은 경우 COSENTYX를 사용하지 마십시오.
|
|||
COSENTYX를 사용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. |
|||
| COSENTYX는 어떻게 투여받나요? 피하 주사(피부 아래) COSENTYX를 준비하고 주사하는 방법과 사용한 COSENTYX를 올바르게 버리는 방법에 대한 자세한 “사용 지침”을 읽어보세요.
정맥 주사(정맥)
|
|||
| COSENTYX의 가능한 부작용은 무엇인가요? COSENTYX는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
|||
| ◦ 어지러움 ◦ 얼굴, 눈꺼풀, 입술, 입, 혀 또는 목의 부기 |
◦ 호흡 곤란 또는 목이 조이는 느낌 ◦ 가슴 답답함 |
◦ 피부 발진 ◦ 두드러기(붉고 가려운 융기) |
|
| 심각한 알레르기 반응이 나타나면 COSENTYX를 다시 주사하지 마세요. | |||
|
|||
| ◦ 붉어짐 또는 발진 ◦ 가려움증 ◦ 작은 융기 또는 반점 |
◦ 피부가 건조하거나 가죽처럼 느껴짐 ◦ 손이나 발에 물집이 생기고 진물이 나거나 딱딱하게 굳어짐 ◦ 피부 벗겨짐 |
||
| COSENTYX의 가장 흔한 부작용은 다음과 같습니다. | |||
| • 감기 증상 | • 설사 | • 상기도 감염 | |
|
COSENTYX의 가능한 부작용은 모두 나열되지 않았습니다. 부작용에 대한 의학적 조언은 의사에게 문의하세요. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
|||
COSENTYX는 어떻게 보관해야 하나요?
COSENTYX와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하세요. |
|||
| COSENTYX의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 COSENTYX를 사용하지 마십시오. 자신과 동일한 증상이 있는 다른 사람에게 COSENTYX를 투여하지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 COSENTYX에 대한 정보를 문의할 수 있습니다. |
|||
| COSENTYX의 성분은 무엇입니까? 활성 성분: secukinumab. 비활성 성분: L-히스티딘/히스티딘 염산염 일수화물, L-메티오닌, 폴리소르베이트 80, 트레할로스 이수화물 및 주사용 멸균수. 제조사: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936, U.S. License Number 1244 자세한 내용은 1-888-669-6682로 전화하거나 www.COSENTYX.com을 방문하십시오. |
|||
T2024-65
사용 지침
사용 지침
COSENTYX® [koe-sen-tix]
(secukinumab)
주사제, 피하 주사용
300 mg/2 mL 1회용 미리 채워진 주사기
COSENTYX를 주사하기 전에 이 사용 지침을 읽고 이해하고 따르십시오. 의료 서비스 제공자는 처음 사용하기 전에 미리 채워진 주사기를 사용하여 COSENTYX를 준비하고 주사하는 방법을 보여줄 것입니다. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
COSENTYX를 주사하기 전에 알아야 할 중요한 정보:
- 사용하지 마십시오 외부 상자의 밀봉 또는 블리스터의 밀봉이 깨진 COSENTYX 미리 채워진 주사기를 사용하지 마십시오. 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 밀봉된 상자에 보관하십시오.
- 사용하지 마십시오 주사기를 딱딱한 표면에 떨어뜨렸거나 바늘 캡을 제거한 후 떨어뜨린 경우 COSENTYX 미리 채워진 주사기를 사용하지 마십시오.
- 흔들지 마십시오 COSENTYX 미리 채워진 주사기를 흔들지 마십시오.
- 미리 채워진 주사기에는 주사가 끝난 후 바늘을 덮는 바늘 보호대가 있습니다. 바늘 보호대는 미리 채워진 주사기를 취급하는 사람의 바늘 찔림 부상을 예방하는 데 도움이 됩니다.
- 하지 마십시오 주사를 하기 직전까지 바늘 캡을 제거하지 마십시오.
- 사용 전에 주사기 보호대 날개를 만지지 마십시오. 만지면 바늘 보호대가 너무 일찍 작동될 수 있습니다.
- 사용 후 즉시 사용한 COSENTYX 미리 채워진 주사기를 버리십시오. COSENTYX 미리 채워진 주사기를 다시 사용하지 마십시오. 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오.
COSENTYX를 어떻게 보관해야 합니까?
- COSENTYX 미리 채워진 주사기 상자를 냉장고에 36°F에서 46°F(2°C에서 8°C) 사이에 보관하십시오.
- 빛으로부터 보호하기 위해 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 원래 상자에 보관하십시오.
- 하지 마십시오 COSENTYX 미리 채워진 주사기를 냉동하지 마십시오.
- 만료되었거나 사용하지 않은 COSENTYX 미리 채워진 주사기는 모두 버리십시오.
COSENTYX와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
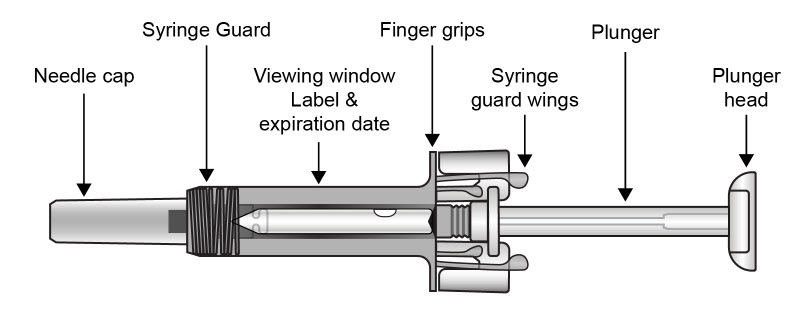
COSENTYX 미리 채워진 주사기 부품(그림 A 참조):
| 이 사용 지침은 미국 식품의약국에서 승인했습니다. | 발행: 2023년 7월 |
| 그림 A | |
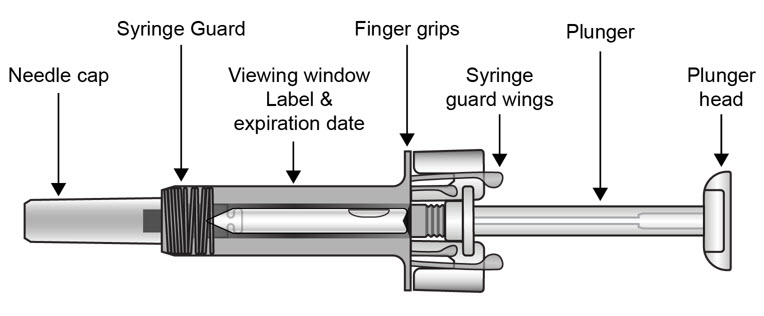 |
|
| 주사에 필요한 것: | |
| 상자에 포함됨: | |
| 새 COSENTYX 미리 채워진 주사기. | |
| 각 COSENTYX 미리 채워진 주사기에는 300 mg의 COSENTYX가 들어 있습니다. 올바른 의약품과 용량을 가지고 있는지 확인하십시오. | |
| 상자에 포함되지 않음 (그림 B 참조): • 알코올 솜 1개 • 면봉 또는 거즈 1개 • 날카로운 물건 처리 용기 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오. |
그림 B |
| COSENTYX 300 mg 미리 채워진 주사기 준비 | |
| 1단계. 깨끗하고 밝은 평평한 작업대를 찾으십시오. | |
| 2단계. COSENTYX 미리 채워진 주사기가 들어 있는 상자를 냉장고에서 꺼내 작업대에 열지 않고 약 30~45분 동안 두어 실온에 도달하도록 하십시오. | |
| 3단계. 비누와 물로 손을 잘 씻으십시오. | |
| 4단계. 외부 상자에서 COSENTYX 미리 채워진 주사기를 꺼내 블리스터에서 꺼내십시오. | |
| 5단계. COSENTYX 미리 채워진 주사기의 시야 창을 통해 살펴보십시오. 내부의 액체는 투명해야 합니다. 색상은 무색에서 약간 노란색일 수 있습니다. 액체에 작은 기포가 보일 수 있습니다. 이는 정상입니다. 사용하지 마십시오 액체에 눈에 보이는 입자가 포함되어 있거나 액체가 흐리거나 변색된 경우 미리 채워진 주사기를 사용하지 마십시오. | |
| 6단계. 사용하지 마십시오 COSENTYX 미리 채워진 주사기가 깨진 경우 미리 채워진 주사기와 포장을 약국에 반환하십시오. | |
| 7단계. 사용하지 마십시오 만료일이 지난 COSENTYX 미리 채워진 주사기를 사용하지 마십시오. | |
| 주사 부위를 선택하고 깨끗이 닦으십시오 | |
|
그림 C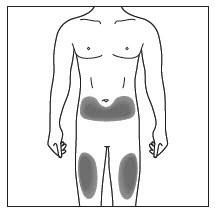 |
| 8단계. 알코올 솜으로 주사 부위를 원을 그리며 닦아냅니다. 주사하기 전에 마를 때까지 기다립니다. 주사하기 전에 닦은 부위를 다시 만지지 마십시오. | 그림 D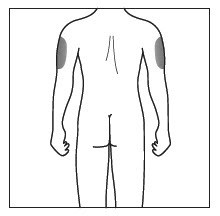 |
주사하기 |
|
| 9단계. COSENTYX 미리 채워진 주사기에서 바늘 캡을 조심스럽게 제거합니다. (그림 E 참조). 바늘 캡을 버립니다. 바늘 끝에 액체 방울이 보일 수 있습니다. 이는 정상입니다. | 그림 E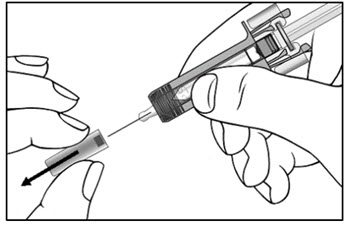 |
| 10단계. 한 손으로 주사 부위의 피부를 살짝 잡습니다. 다른 손으로 그림과 같이 바늘을 45도 각도로 피부에 삽입합니다. (그림 F 참조). 전체 용량을 주사할 수 있도록 바늘을 끝까지 삽입합니다. | 그림 F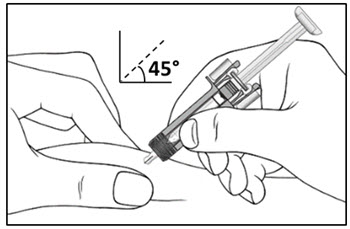 |
| 11단계. 그림과 같이 COSENTYX 미리 채워진 주사기의 손잡이를 잡습니다. (그림 G 참조). 플런저를 최대한 천천히 눌러 플런저 헤드가 주사기 가드 날개 사이에 완전히 들어가도록 합니다. 이렇게 하면 주사기 가드가 활성화됩니다.
12단계. 플런저를 5초 동안 계속 완전히 누릅니다. 주사기를 5초 동안 그대로 유지합니다. |
그림 G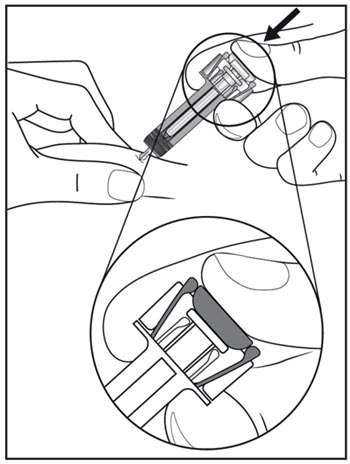 |
| 13단계. 플런저를 완전히 누른 상태로 바늘을 주사 부위에서 조심스럽게 똑바로 빼냅니다. (그림 H 참조). | 그림 H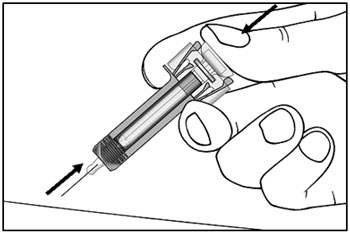 |
| 14단계. 플런저를 천천히 놓으면 주사기 가드가 자동으로 노출된 바늘을 덮습니다. (그림 I 참조).
15단계. 주사 부위에 약간의 피가 날 수 있습니다. 면봉이나 거즈를 주사 부위에 대고 10초 동안 누릅니다. 주사 부위를 문지르지 마십시오. 필요한 경우 주사 부위를 작은 접착 붕대로 덮을 수 있습니다. |
그림 I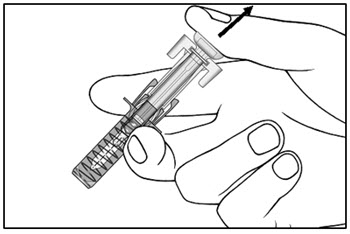 |
| 사용한 COSENTYX 미리 채워진 주사기를 어떻게 폐기해야 합니까? | |
|
16단계. 사용한 미리 채워진 주사기를 사용 후 즉시 FDA 승인 폐기 용기에 넣습니다. (그림 J 참조). 가정 쓰레기통에 미리 채워진 주사기를 버리지 마십시오. FDA 승인 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
날카로운 물체 폐기 용기가 거의 가득 차면, 날카로운 물체 폐기 용기를 폐기하는 올바른 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 바늘, 주사기 및 미리 채워진 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다. 안전한 날카로운 물체 폐기에 대한 자세한 내용과 거주하는 주에서 날카로운 물체 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오. |
그림 J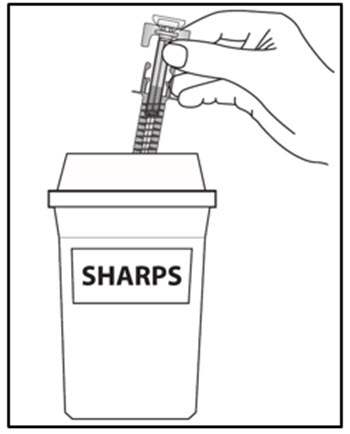 |
|
제조사: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 미국 라이선스 번호 1244 |
|
|
© Novartis |
|
T2023-42
사용 지침
사용 지침
COSENTYX® [koe-sen-tix]
(secukinumab)
주사제, 피하 주사용
150 mg/mL 단회용 미리 채워진 주사기
COSENTYX를 주사하기 전에 이 사용 지침을 읽고 이해하고 따르십시오. 의료 서비스 제공자는 처음 사용하기 전에 미리 채워진 주사기를 사용하여 COSENTYX를 준비하고 주사하는 방법을 보여줄 것입니다. 어린이는 미리 채워진 주사기를 사용하여 스스로 COSENTYX를 주사해서는 안 됩니다. 성인 보호자는 피하 주사 기술에 대한 적절한 교육을 받은 후 COSENTYX를 준비하고 주사해야 합니다. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
COSENTYX를 주사하기 전에 알아야 할 중요한 정보:
- 사용하지 마십시오 외부 상자의 밀봉 또는 블리스터의 밀봉이 깨진 COSENTYX 미리 채워진 주사기를 사용하지 마십시오. 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 밀봉된 상자에 보관하십시오.
- 사용하지 마십시오 주사기를 딱딱한 표면에 떨어뜨렸거나 바늘 캡을 제거한 후 떨어뜨린 COSENTYX 미리 채워진 주사기를 사용하지 마십시오.
- 흔들지 마십시오 COSENTYX 미리 채워진 주사기를 흔들지 마십시오.
- 미리 채워진 주사기의 바늘 캡에는 라텍스가 포함되어 있습니다. 라텍스에 민감한 경우 미리 채워진 주사기를 만지지 마십시오.
- 미리 채워진 주사기에는 주사가 끝난 후 바늘을 덮는 바늘 가드가 있습니다. 바늘 가드는 미리 채워진 주사기를 다루는 사람의 바늘 찔림 부상을 예방하는 데 도움이 됩니다.
- 주사 직전까지 바늘 캡을 제거하지 마십시오.
- 사용 전에 주사기 가드 날개를 만지지 마십시오. 만지면 주사기 가드가 너무 일찍 작동될 수 있습니다.
- 사용한 COSENTYX 미리 채워진 주사기를 사용 후 즉시 버리십시오. COSENTYX 미리 채워진 주사기를 재사용하지 마십시오. 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오.
COSENTYX를 어떻게 보관해야 합니까?
- COSENTYX 미리 채워진 주사기 상자를 냉장고에 36°F~46°F(2°C~8°C) 사이에 보관하십시오.
- 빛으로부터 보호하기 위해 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 원래 상자에 보관하십시오.
- COSENTYX 미리 채워진 주사기는 최대 4일 동안 최대 86°F(30°C)의 실온에 보관할 수 있습니다.
- COSENTYX 미리 채워진 주사기를 냉장고에서 꺼내고 다시 넣은 날짜를 상자에 제공된 공간에 적으십시오.
- 냉장고 밖에 4일 이상 보관한 COSENTYX 미리 채워진 주사기를 버리십시오.
- COSENTYX 미리 채워진 주사기를 한 번만 냉장고에 다시 넣을 수 있으며, 사용하거나 만료될 때까지 36°F~46°F(2°C~8°C) 사이에 보관해야 합니다.
- 냉동하지 마십시오 COSENTYX 미리 채워진 주사기를 냉동하지 마십시오.
- 만료되었거나 사용하지 않은 COSENTYX 미리 채워진 주사기를 버리십시오.
COSENTYX와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
| 이 사용 지침은 미국 식품의약국에서 승인했습니다. | 개정: 2023년 7월 |
| COSENTYX 미리 채워진 주사기 부품(그림 A 참조): | |
| 그림 A | |
 |
|
| 주사에 필요한 것: | |
| 상자에 포함됨: | |
| 새 COSENTYX 미리 채워진 주사기. | |
각 COSENTYX 미리 채워진 주사기에는 150 mg의 COSENTYX가 들어 있습니다. 올바른 약과 용량을 가지고 있는지 확인하십시오.
|
|
| 상자에 포함되지 않음 (그림 B 참조): • 알코올 솜 1개 • 면봉 또는 거즈 1개 • 날카로운 물건 처리 용기 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오. |
그림 B |
| COSENTYX 150 mg 미리 채워진 주사기 준비 | |
| 1단계. 깨끗하고 밝은 평평한 작업대를 찾으십시오. | |
| 2단계. COSENTYX 미리 채워진 주사기가 들어 있는 상자를 냉장고에서 꺼내고 작업대에 열지 않고 약 15~30분 동안 두어 실온에 도달하도록 합니다. | |
| 3단계. 비누와 물로 손을 잘 씻으십시오. | |
| 4단계. 외부 상자에서 COSENTYX 미리 채워진 주사기를 꺼내고 블리스터에서 꺼내십시오. | |
| 5단계. COSENTYX 미리 채워진 주사기의 시야 창을 통해 살펴보십시오. 내부의 액체는 투명해야 합니다. 색상은 무색에서 약간 노란색일 수 있습니다. 액체에 작은 기포가 보일 수 있습니다. 이는 정상입니다. 사용하지 마십시오 액체에 눈에 보이는 입자가 포함되어 있거나 액체가 흐리거나 변색된 경우 미리 채워진 주사기를 사용하지 마십시오. | |
| 6단계. COSENTYX 사전 충전 주사기가 부러진 경우 사용하지 마십시오. 사전 충전 주사기와 포장을 약국으로 반환하십시오. | |
| 7단계. COSENTYX 사전 충전 주사기의 유효 기간이 지난 경우 사용하지 마십시오. | |
| 주사 부위를 선택하고 청소하십시오 | |
|
그림 C |
| 8단계. 알코올 솜으로 주사 부위를 원을 그리며 닦으십시오. 주사하기 전에 마를 때까지 기다리십시오. 주사하기 전에 닦은 부위를 다시 만지지 마십시오. | 그림 D |
주사하기 |
|
| 9단계. COSENTYX 사전 충전 주사기에서 바늘 캡을 조심스럽게 제거하십시오. (그림 E 참조). 바늘 캡을 버리십시오. 바늘 끝에 액체 방울이 보일 수 있습니다. 이는 정상입니다. | 그림 E |
| 10단계. 한 손으로 주사 부위의 피부를 부드럽게 잡습니다. 다른 손으로 그림과 같이 45도 각도로 바늘을 피부에 삽입하십시오. (그림 F 참조). 전체 용량을 주사하도록 바늘을 끝까지 밀어넣으십시오. | 그림 F |
| 11단계. 그림과 같이 COSENTYX 사전 충전 주사기의 손가락 잡는 부분을 잡습니다. (그림 G 참조). 플런저 헤드가 주사기 가드 날개 사이에 완전히 들어갈 때까지 플런저를 천천히 아래로 누릅니다. 이렇게 하면 주사기 가드가 활성화됩니다.
12단계. 플런저를 5초 동안 더 완전히 누릅니다. 5초 동안 주사기를 그대로 유지하십시오. |
그림 G |
| 13단계. 플런저를 완전히 누른 상태로 바늘을 주사 부위에서 조심스럽게 똑바로 빼냅니다. (그림 H 참조). | 그림 H |
| 14단계. 플런저를 천천히 놓으면 주사기 가드가 노출된 바늘을 자동으로 덮습니다. (그림 I 참조).
15단계. 주사 부위에 약간의 피가 날 수 있습니다. 면봉이나 거즈를 주사 부위에 대고 10초 동안 누릅니다. 주사 부위를 문지르지 마십시오. 필요한 경우 주사 부위에 작은 접착 붕대를 붙일 수 있습니다. |
그림 I |
처방된 COSENTYX 용량이 300mg인 경우 새로운 COSENTYX 사전 충전 주사기를 사용하여 4단계부터 15단계까지 반복하십시오. 사용한 COSENTYX 사전 충전 주사기를 어떻게 폐기해야 합니까? |
|
|
16단계. 사용한 사전 충전 주사기를 사용 후 즉시 FDA 승인 샤프스 폐기 용기에 넣으십시오. (그림 J 참조). 가정 쓰레기통에 사전 충전 주사기를 버리지 마십시오. FDA 승인 샤프스 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
샤프스 폐기 용기가 거의 가득 차면 지역 사회의 샤프스 폐기 용기 폐기 지침을 따라야 합니다. 사용한 바늘, 주사기 및 사전 충전 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다. 안전한 샤프스 폐기에 대한 자세한 내용과 거주하는 주의 샤프스 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 방문하십시오. |
그림 J |
|
제조사: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 미국 라이선스 번호 1244 |
|
|
© Novartis |
|
T2023-43
사용 지침
사용 지침
COSENTYX® [koe-sen-tix]
(secukinumab)
피하 주사용 주사액, 농축액
75 mg/0.5 mL 1회용 미리 채워진 주사기
COSENTYX를 주사하기 전에 이 사용 지침을 읽고 이해하고 따르십시오. 의료 서비스 제공자는 처음 사용하기 전에 미리 채워진 주사기를 사용하여 COSENTYX를 준비하고 주사하는 방법을 보여줄 것입니다. 어린이는 미리 채워진 주사기를 사용하여 스스로 COSENTYX를 주사해서는 안 됩니다. 성인 보호자는 피하 주사 기술에 대한 적절한 교육을 받은 후 COSENTYX를 준비하고 주사해야 합니다. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오.
COSENTYX를 주사하기 전에 알아야 할 중요한 정보:
- 사용하지 마십시오 외부 상자의 밀봉 또는 블리스터의 밀봉이 깨진 COSENTYX 미리 채워진 주사기를 사용하지 마십시오. 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 밀봉된 상자에 보관하십시오.
- 사용하지 마십시오 주사기가 딱딱한 표면에 떨어졌거나 바늘 캡을 제거한 후 떨어진 COSENTYX 미리 채워진 주사기를 사용하지 마십시오.
- 흔들지 마십시오 COSENTYX 미리 채워진 주사기를 흔들지 마십시오.
- 미리 채워진 주사기의 바늘 캡에는 라텍스가 포함되어 있습니다. 라텍스에 민감한 경우 미리 채워진 주사기를 만지지 마십시오.
- 미리 채워진 주사기에는 주사가 끝난 후 바늘을 덮는 바늘 가드가 있습니다. 바늘 가드는 미리 채워진 주사기를 다루는 사람의 바늘 찔림 부상을 예방하는 데 도움이 됩니다.
- 주사 직전까지 바늘 캡을 제거하지 마십시오.
- 사용 전에 주사기 가드 날개를 만지지 마십시오. 만지면 주사기 가드가 너무 일찍 작동될 수 있습니다.
- 사용 후 즉시 사용한 COSENTYX 미리 채워진 주사기를 버리십시오. COSENTYX 미리 채워진 주사기를 재사용하지 마십시오. 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오.
COSENTYX를 어떻게 보관해야 합니까?
- COSENTYX 미리 채워진 주사기 상자를 냉장고에 36°F~46°F(2°C~8°C)에 보관하십시오.
- 빛으로부터 보호하기 위해 사용할 준비가 될 때까지 COSENTYX 미리 채워진 주사기를 원래 상자에 보관하십시오.
- COSENTYX 미리 채워진 주사기는 최대 4일 동안 최대 86°F(30°C)의 실온에 보관할 수 있습니다.
- COSENTYX 미리 채워진 주사기를 냉장고에서 꺼내고 다시 넣은 날짜를 상자에 제공된 공간에 적으십시오.
- 냉장고 밖에 4일 이상 보관한 COSENTYX 미리 채워진 주사기를 버리십시오.
- COSENTYX 미리 채워진 주사기를 냉장고에 1회만 다시 넣을 수 있으며, 사용할 때까지 또는 유효 기간이 지날 때까지 36°F~46°F(2°C~8°C)에 보관해야 합니다.
- 냉동하지 마십시오 COSENTYX 미리 채워진 주사기를 냉동하지 마십시오.
- 유효 기간이 지났거나 사용하지 않은 COSENTYX 미리 채워진 주사기를 버리십시오.
COSENTYX와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
| 이 사용 지침은 미국 식품의약국에서 승인했습니다. | 개정: 2023년 7월 |
| COSENTYX 미리 채워진 주사기 부품(그림 A 참조): | |
| 그림 A | |
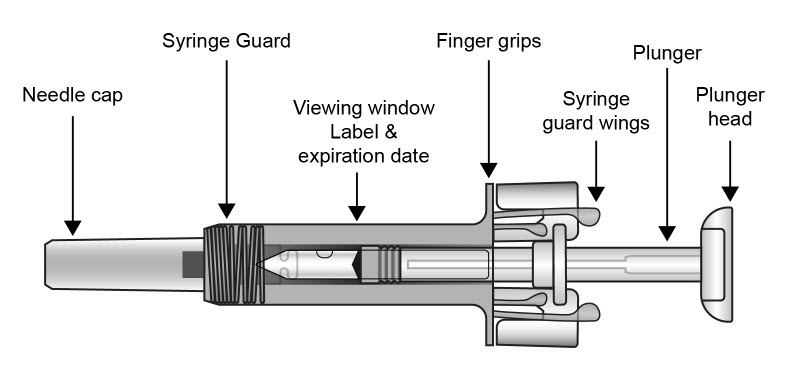 |
|
| 주사에 필요한 것: | |
| 상자에 포함됨: | |
| 새 COSENTYX 미리 채워진 주사기. | |
| 각 COSENTYX 미리 채워진 주사기에는 75 mg의 COSENTYX가 들어 있습니다. 올바른 의약품과 용량을 확인하십시오. | |
| 상자에 포함되지 않음 (그림 B 참조): • 알코올 솜 1개 • 면봉 또는 거즈 1개 • 날카로운 물건 처리 용기 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX 미리 채워진 주사기를 어떻게 버려야 합니까?”를 참조하십시오. |
그림 B |
| COSENTYX 75 mg 미리 채워진 주사기 준비 | |
| 1단계. 깨끗하고 밝은 평평한 작업대를 찾으십시오. | |
| 2단계. COSENTYX 미리 채워진 주사기가 들어 있는 상자를 냉장고에서 꺼내어 작업대에 열지 않고 약 15~30분 동안 두어 실온에 도달하도록 하십시오. | |
| 3단계. 비누와 물로 손을 잘 씻으십시오. | |
| 4단계. 외부 상자에서 COSENTYX 미리 채워진 주사기를 꺼내어 블리스터에서 꺼내십시오. | |
| 5단계. COSENTYX 미리 채워진 주사기의 시야 창을 통해 살펴보십시오. 내부의 액체는 투명해야 합니다. 색상은 무색에서 약간 노란색일 수 있습니다. 액체에 작은 기포가 보일 수 있습니다. 이는 정상입니다. 사용하지 마십시오 액체에 눈에 띄는 입자가 포함되어 있거나 액체가 흐리거나 변색된 경우 미리 채워진 주사기를 사용하지 마십시오. | |
| 6단계. 사용하지 마십시오 COSENTYX 미리 채워진 주사기가 깨진 경우 미리 채워진 주사기와 포장을 약국에 반환하십시오. | |
| 7단계. 사용하지 마십시오 유효 기간이 지난 COSENTYX 미리 채워진 주사기를 사용하지 마십시오. | |
| 주사 부위를 선택하고 소독하십시오 | |
|
그림 C |
| 8단계. 알코올 솜으로 주사 부위를 원을 그리며 닦으십시오. 주사하기 전에 완전히 마르도록 하십시오. 하지 마십시오 주사하기 전에 닦은 부위를 다시 만지십시오. | 그림 D |
주사하기 |
|
| 9단계. COSENTYX 미리 채워진 주사기에서 바늘 캡을 조심스럽게 제거하십시오. (그림 E 참조). 바늘 캡을 버리십시오. 바늘 끝에 액체 방울이 보일 수 있습니다. 이는 정상입니다. | 그림 E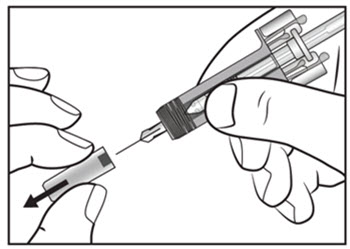 |
| 10단계. 한 손으로 주사 부위의 피부를 부드럽게 잡습니다. 다른 손으로 바늘을 그림과 같이 45도 각도로 피부에 삽입하십시오. (그림 F 참조). 전체 용량을 주사할 수 있도록 바늘을 끝까지 삽입하십시오. | 그림 F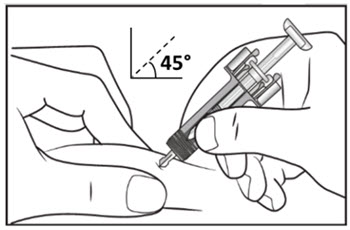 |
| 11단계. 그림과 같이 COSENTYX 미리 채워진 주사기 손잡이를 잡습니다. (그림 G 참조). 플런저를 완전히 눌러 플런저 헤드가 주사기 가드 날개 사이에 완전히 들어가도록 천천히 누릅니다. 이렇게 하면 주사기 가드가 활성화됩니다.
12단계. 플런저를 5초 동안 더 완전히 누릅니다. 5초 동안 주사기를 그대로 유지하십시오. |
그림 G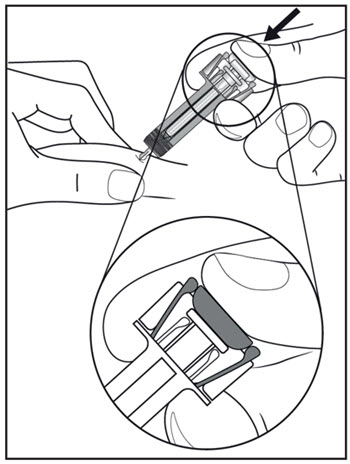 |
| 13단계. 플런저를 완전히 누른 상태로 바늘을 주사 부위에서 조심스럽게 똑바로 빼냅니다. (그림 H 참조). | 그림 H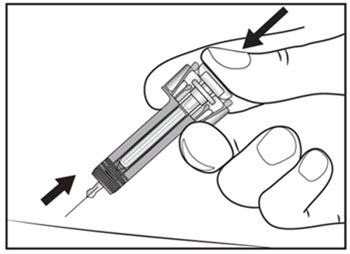 |
| 14단계. 플런저를 천천히 놓으면 주사기 가드가 노출된 바늘을 자동으로 덮습니다. (그림 I 참조).
15단계. 주사 부위에 약간의 피가 날 수 있습니다. 면봉이나 거즈를 주사 부위에 대고 10초 동안 누릅니다. 하지 마십시오 주사 부위를 문지릅니다. 필요한 경우 주사 부위에 작은 접착 붕대를 붙일 수 있습니다. |
그림 I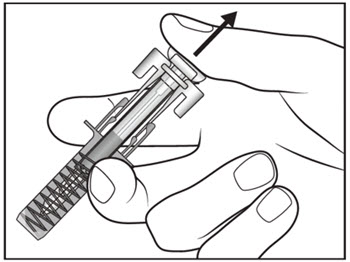 |
| 사용한 COSENTYX 미리 채워진 주사기를 어떻게 폐기해야 합니까? 16단계. 사용한 미리 채워진 주사기를 FDA 승인 폐기 용기에 즉시 넣으십시오. (그림 J 참조). 버리지 마십시오 (폐기하지 마십시오) 가정 쓰레기통에 미리 채워진 주사기를 버리십시오. FDA 승인 폐기 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다.
날카로운 물건 폐기 용기가 거의 가득 차면 날카로운 물건 폐기 용기를 폐기하는 올바른 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 바늘, 주사기 및 미리 채워진 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다. 안전한 날카로운 물건 폐기에 대한 자세한 내용과 거주하는 주에서 날카로운 물건 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 방문하십시오. |
그림 J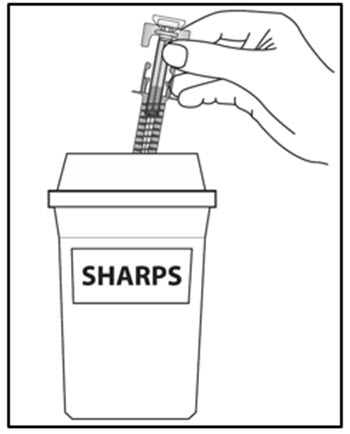 |
|
제조사: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 미국 라이선스 번호 1244 |
|
|
© Novartis |
|
T2023-44
사용 지침
| 본 사용 지침서는 미국 식품의약국(FDA)의 승인을 받았습니다. | 발행: 2023년 7월 |
| 사용 지침 COSENTYX® [koe-sen-tix] (secukinumab) 피하 주사, 피하 주사용 300 mg/2 mL 단회용 UnoReady® 펜 |
|
| COSENTYX를 주사하기 전에 본 사용 지침서를 읽고 이해하고 따르십시오. 처음 사용하기 전에 의료 서비스 제공자가 COSENTYX UnoReady 펜을 준비하고 올바르게 주사하는 방법을 보여줄 것입니다. 궁금한 사항은 의료 서비스 제공자에게 문의하십시오. | |
| Cosentyx UnoReady 펜 부품 | |
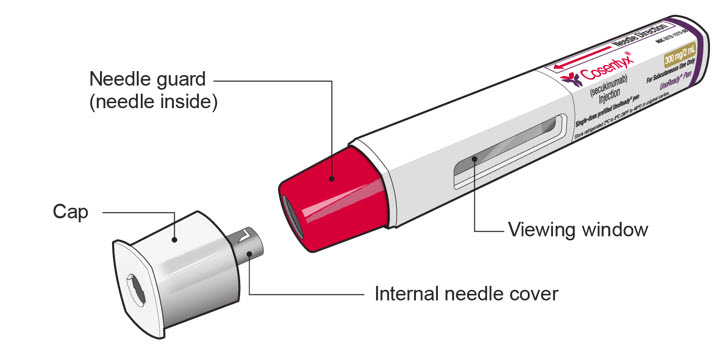 |
|
| 그림 A | |
| COSENTYX UnoReady 펜은 캡을 제거한 상태로 그림 A에 표시되어 있습니다. 주사할 준비가 될 때까지 캡을 제거하지 마십시오. |
|
| COSENTYX를 주사하기 전에 알아야 할 중요한 정보: | |
|
|
| COSENTYX UnoReady 펜 보관 | |
COSENTYX UnoReady 펜과 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
| 주사에 필요한 것 | |
 그림 B 그림 B |
상자에 포함된 것(그림 B 참조)
|
 그림 C 그림 C |
상자에 포함되지 않은 것(그림 C 참조)
|
| 주사 준비 | |
 그림 D 그림 D |
1단계. 실온으로 가져오기 COSENTYX UnoReady 펜이 들어 있는 상자를 냉장고에서 꺼내 (그림 D 참조) 주사하기 30분에서 45분 전에 개봉하지 않고 그대로 두어 실온에 도달하도록 하십시오. |
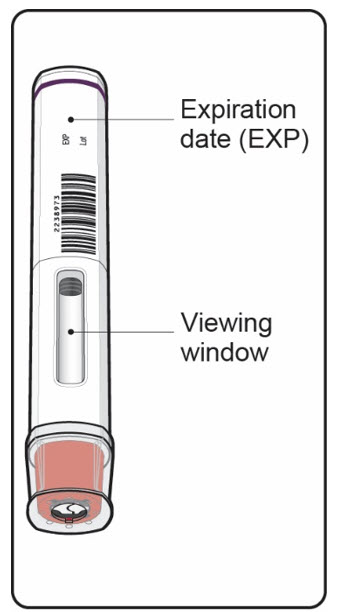 그림 E 그림 E |
2단계. 주사하기 전에 중요한 안전 점검(그림 E 참조)
COSENTYX UnoReady 펜이 이러한 점검 중 하나라도 통과하지 못하면 의료 서비스 제공자 또는 약사에게 문의하십시오. |
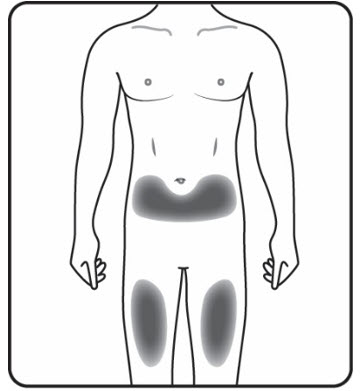 그림 F 그림 F |
3단계. 주사 부위 선택
|
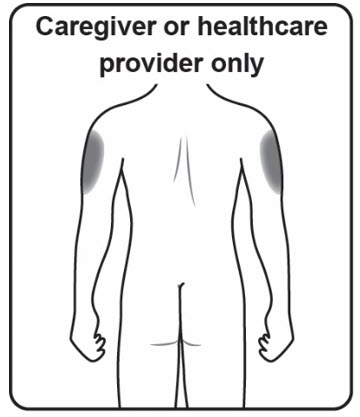 Figure G Figure G |
|
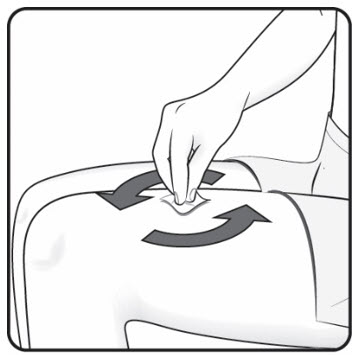 Figure H Figure H |
4단계. 주사 부위를 소독합니다
|
| COSENTYX UnoReady 펜으로 주사하기 | |
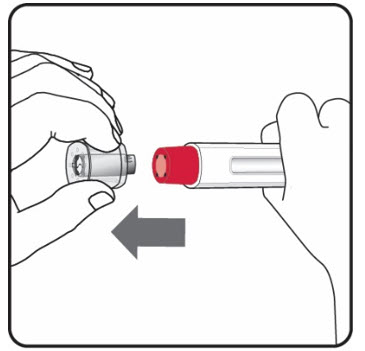 Figure I Figure I |
5단계. 캡을 제거합니다
|
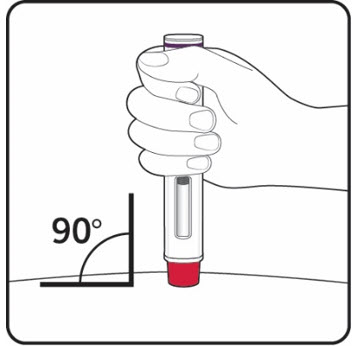 Figure J Figure J |
6단계. COSENTYX UnoReady 펜을 위치시킵니다 COSENTYX UnoReady 펜을 소독한 주사 부위에 90도 각도로 대고, 관찰 창이 당신을 향하도록 합니다 (그림 J 참조). 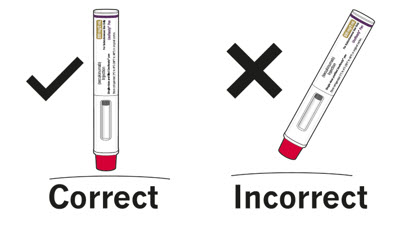 |
| 7단계. COSENTYX UnoReady 펜으로 주사하기 아래 설명과 같이 (그림 K 참조) | |
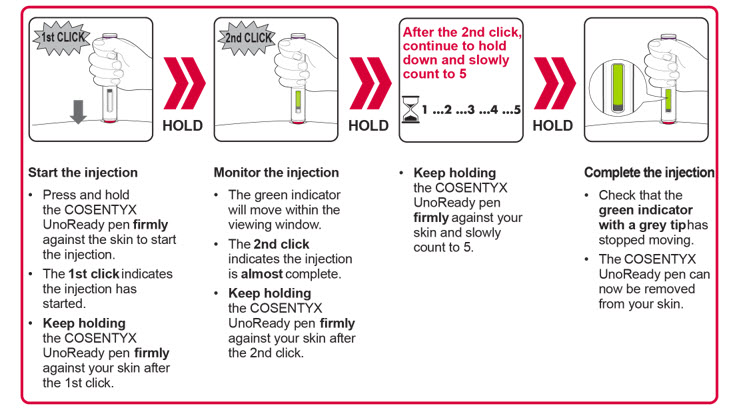 Figure K Figure K |
|
| 주사 후 |
|
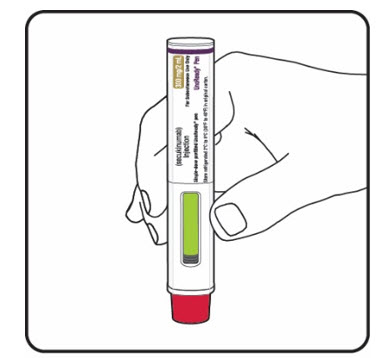 Figure L Figure L |
8단계. 녹색 표시등이 창을 가득 채웠는지 확인합니다 (그림 L 참조)
|
 Figure M Figure M |
9단계. 사용한 COSENTYX UnoReady 펜을 폐기합니다
날카로운 물건을 안전하게 폐기하는 방법에 대한 자세한 내용과 거주하는 주에서 날카로운 물건을 폐기하는 방법에 대한 구체적인 정보는 FDA 웹사이트를 방문하세요: http://www.fda.gov/safesharpsdisposal. |
| 제조사: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 미국 허가 번호 1244 |
|
|
© Novartis |
|
T2023-45
사용 지침
사용 지침
COSENTYX® [koe-sen-tix]
(secukinumab)
피하 주사용 주사액, 농축액
150 mg/mL 단회용 Sensoready® 펜
COSENTYX를 주사하기 전에 이 사용 지침을 읽고 이해하고 따르십시오. 의료진이 처음 사용하기 전에 Sensoready 펜을 사용하여 COSENTYX를 준비하고 주사하는 방법을 보여줄 것입니다. 어린이는 Sensoready 펜을 사용하여 스스로 COSENTYX를 주사해서는 안 됩니다. 성인 보호자는 피하 주사 기술에 대한 적절한 교육을 받은 후 COSENTYX를 준비하고 주사해야 합니다. 궁금한 사항은 의료진에게 문의하십시오.
COSENTYX를 주사하기 전에 알아야 할 중요한 정보:
- 사용하지 마십시오 외부 포장의 밀봉 또는 펜의 밀봉이 손상된 COSENTYX Sensoready 펜을 사용하지 마십시오. 사용할 준비가 될 때까지 COSENTYX Sensoready 펜을 밀봉된 외부 포장에 보관하십시오.
- 흔들지 마십시오 COSENTYX Sensoready 펜을 흔들지 마십시오.
- Sensoready 펜의 캡에는 라텍스가 포함되어 있습니다. 라텍스에 민감한 경우 Sensoready 펜을 만지지 마십시오.
- COSENTYX Sensoready 펜을 떨어뜨린 경우, 사용하지 마십시오 Sensoready 펜이 손상된 것처럼 보이거나 캡을 제거한 상태로 떨어뜨린 경우.
- 사용한 COSENTYX Sensoready 펜은 사용 후 즉시 버리십시오. COSENTYX Sensoready 펜을 재사용하지 마십시오. 이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX Sensoready 펜은 어떻게 버려야 합니까?”를 참조하십시오.
COSENTYX는 어떻게 보관해야 합니까?
- COSENTYX Sensoready 펜이 들어 있는 포장을 냉장 보관하십시오. 36°F에서 46°F(2°C에서 8°C) 사이.
- 빛으로부터 보호하기 위해 사용할 준비가 될 때까지 COSENTYX Sensoready 펜을 원래 포장에 보관하십시오.
- COSENTYX Sensoready 펜은 최대 4일 동안 최대 86°F(30°C)의 실온에 보관할 수 있습니다.
- COSENTYX Sensoready 펜을 냉장고에서 꺼내고 다시 넣은 날짜를 포장에 제공된 공간에 적으십시오.
- 냉장고 밖에 4일 이상 보관한 COSENTYX Sensoready 펜은 버리십시오.
- COSENTYX Sensoready 펜은 한 번만 냉장고에 다시 넣을 수 있으며, 사용하거나 만료될 때까지 36°F에서 46°F(2°C에서 8°C) 사이에 보관해야 합니다.
- 하지 마십시오 COSENTYX Sensoready 펜을 냉동하지 마십시오.
- 만료되었거나 사용하지 않은 COSENTYX Sensoready 펜은 버리십시오.
COSENTYX와 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
| 이 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2023년 7월 |
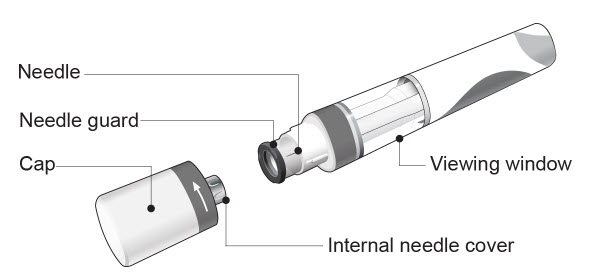
| COSENTYX Sensoready 펜 부품(그림 A 참조): | |
| 그림 A | |
 |
|
| 위에 표시된 COSENTYX Sensoready 펜은 캡을 제거한 상태입니다. 하지 마십시오 주사할 준비가 될 때까지 캡을 제거하지 마십시오. | |
| 주사에 필요한 것: | |
| 포장에 포함됨: 새 COSENTYX Sensoready 펜 (그림 B 참조). 각 COSENTYX Sensoready 펜에는 150 mg의 COSENTYX가 들어 있습니다. 올바른 약과 용량을 확인하십시오.
|
그림 B |
포장에 포함되지 않음 (그림 C 참조):
이 사용 지침의 끝 부분에 있는 “사용한 COSENTYX Sensoready 펜은 어떻게 버려야 합니까?”를 참조하십시오. |
그림 C |
|
주사 전: COSENTYX Sensoready 펜이 들어 있는 포장을 냉장고에서 꺼내어 주사하기 전에 약 15분에서 30분 동안 개봉하지 않고 그대로 두어 실온에 도달하도록 하십시오. |
|
1단계. 주사하기 전에 중요한 안전 점검 (그림 D 참조):
COSENTYX Sensoready 펜이 이러한 점검 중 하나라도 통과하지 못하면 약사에게 문의하십시오. |
그림 D |
2단계. 주사 부위 선택:
|
그림 E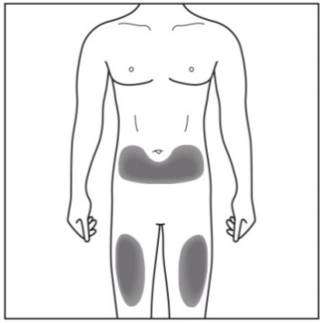 |
|
그림 F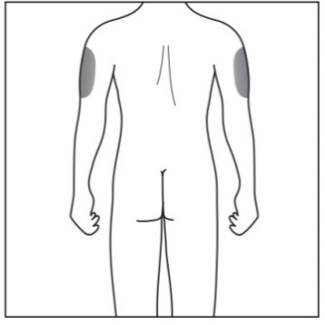 |
3단계. 주사 부위 소독:
|
그림 G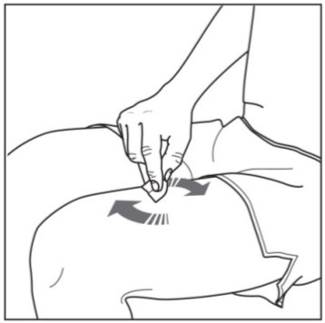 |
|
주사: |
|
4단계. 캡 제거:
|
그림 H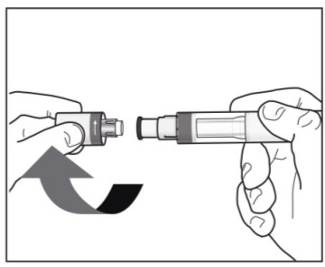 |
5단계. COSENTYX Sensoready 펜 잡기:
|
그림 I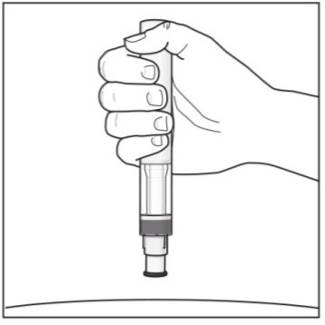 |
중요: 주사 중 큰 소리로 두 번 클릭하는 소리가 들립니다.
녹색 표시등이 창을 채우고 움직임을 멈출 때까지 COSENTYX Sensoready 펜을 피부에 단단히 고정해야 합니다. |
|
6단계. 주사 시작:
|
그림 J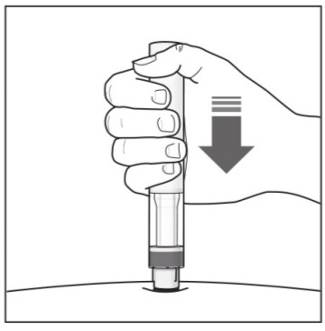 |
7단계. 주사 완료:
|
그림 K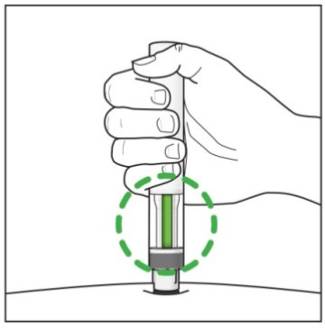 |
|
주사 후: |
|
8단계. 녹색 표시등이 창을 채웠는지 확인하십시오 (그림 L 참조):
처방된 COSENTYX 용량이 300mg인 경우, 새로운 COSENTYX Sensoready 펜으로 1단계부터 8단계까지 반복하십시오. |
그림 L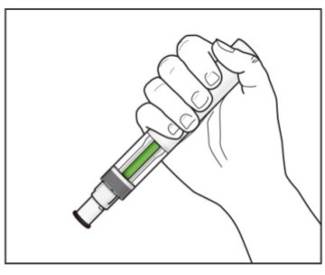 |
|
사용한 COSENTYX Sensoready 펜은 어떻게 폐기해야 합니까? |
|
| 9단계. 사용한 Sensoready 펜은 사용 직후 FDA 승인 폐기 용기에 넣으십시오 (그림 M 참조). Sensoready 펜을 가정 쓰레기통에 버리지 마십시오.
FDA 승인 폐기 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다.
폐기 용기가 거의 가득 차면, 지역 사회의 폐기물 처리 지침에 따라 폐기 용기를 올바르게 폐기해야 합니다. 사용한 바늘, 주사기 및 Sensoready 펜을 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다. 안전한 날카로운 물체 폐기에 대한 자세한 내용과 거주하는 주에서 날카로운 물체 폐기에 대한 구체적인 정보는 FDA 웹사이트(http://www.fda.gov/safesharpsdisposal)를 참조하십시오. |
그림 M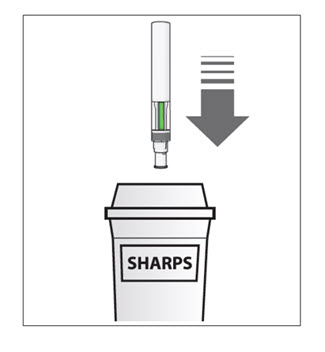 |
|
제조사: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936 미국 허가 번호 1244 |
|
|
© Novartis |
|
T2023-46
주요 디스플레이 패널
NDC 0078-0639-97
처방전 의약품
Cosentyx®
(secukinumab)
주사제
1회용 미리 채워진 주사기
150 mg/mL
1개의 미리 채워진 주사기
주의: 동봉된 약물 안내서와 함께 제공하십시오.
피하 주사 전용
멸균 용액 – 보존제를 함유하지 않음
주의: 알레르기 반응을 일으킬 수 있는 천연 고무 라텍스를 함유하고 있습니다.
NOVARTIS
주요 디스플레이 패널
NDC 0078-1056-97
처방전 의약품
Cosentyx®
(secukinumab)
주사제
75 mg/0.5 mL
1회용 미리 채워진 주사기 1개
피하 주사 전용
주의: 천연 고무 라텍스 함유
알레르기 반응을 일으킬 수 있습니다.
주의:
동봉된 약물 안내서와 함께 제공하십시오.
NOVARTIS

주요 디스플레이 패널
NDC 0078-1070-68
처방전에 의해서만 구입 가능
Cosentyx®
(secukinumab)
주사제
1회용 미리 채워진 UnoReady® 펜
300 mg/2 mL
피하 주사 전용
1 UnoReady® 펜
주의: 동봉된 약물 안내서와 함께 제공하십시오.
포장 내용: • 1회용 미리 채워진 UnoReady® 펜 • 처방 정보 • 약물 안내서 • 사용 지침
NOVARTIS

주요 디스플레이 패널
NDC 0078-1168-61
처방전에 의해서만 구입 가능
Cosentyx®
(secukinumab)
주사제
125 mg/5 mL
(25 mg/mL)
희석 후 정맥 주입용.
주의: 동봉된 약물 안내서와 함께 제공하십시오.
1회용 바이알.
사용하지 않은 부분은 폐기하십시오.
NOVARTIS



