의약품 제조업체: Pfizer Laboratories Div Pfizer Inc (Updated: 2025-01-08)
처방 정보 하이라이트
CHANTIX® (바레니클린) 정제, 경구용
미국 최초 승인: 2006
최근 주요 변경 사항
|
경고 및 주의 사항, 심혈관계 사건 (5.5) |
2018년 6월 |
용법 및 용량
- •
- 환자가 금연하기로 결정한 날짜 1주일 전에 CHANTIX 복용을 시작합니다. 또는 환자는 CHANTIX 복용을 시작한 후 치료 8일에서 35일 사이에 금연할 수 있습니다. (2.1)
- •
- 시작 주: 1일차~3일차는 0.5mg 1일 1회, 4일차~7일차는 0.5mg 1일 2회 복용합니다. (2.1)
- •
- 계속 주: 1mg 1일 2회 총 12주간 복용합니다. (2.1)
- •
- 금연에 성공한 경우 장기간 금연 가능성을 높이기 위해 추가로 12주간의 치료를 권장합니다. (2.1)
- •
- 갑작스러운 금연이 어렵거나 원하지 않는 환자의 경우 CHANTIX를 사용하여 금연을 점진적으로 시도하는 것을 고려하십시오. 환자는 CHANTIX 복용을 시작하고 첫 4주 이내에 기준선 대비 흡연량을 50% 줄이고, 그 다음 4주 이내에 추가로 50% 줄이며, 12주까지 완전 금연을 목표로 계속 줄여나가야 합니다. 총 24주 동안 치료를 계속합니다. (2.1)
- •
- 중증 신장애(추정 크레아티닌 청소율 30 mL/min 미만): 0.5mg 1일 1회 복용으로 시작하여 0.5mg 1일 2회까지 증량합니다. 말기 신부전으로 투석 치료를 받는 환자의 경우, 내약성이 있는 경우 최대 0.5mg을 1일 1회 투여할 수 있습니다. (2.2)
- •
- 유해 반응을 견딜 수 없는 환자의 경우 용량 감량을 고려하십시오. (2.1)
- •
- 금연에 실패하거나 재발한 경우, 실패 원인이 해결된 후 추가 치료를 권장합니다. (2.1)
- •
- 금연 시도를 지원하기 위해 환자에게 적절한 교육 자료와 상담을 제공하십시오. (2.1)
제형 및 강도
정제: 0.5mg 및 1mg (3)
금기
CHANTIX에 대한 중증 과민반응 또는 피부 반응의 병력. (4)
경고 및 주의사항
- •
- 신경정신과적 유해 사건: 시판 후 보고된 중증 또는 임상적으로 유의미한 신경정신과적 유해 사건에는 기분 변화(우울증 및 조증 포함), 정신병, 환각, 편집증, 망상, 살인 충동, 공격성, 적대감, 불안, 공황, 그리고 자살 충동, 자살 시도 및 자살 완료가 포함됩니다. CHANTIX로 금연을 시도하는 환자에게 이러한 증상이 나타나는지 관찰하고, 이러한 유해 사건이 발생하는 경우 CHANTIX 복용을 중단하고 의료 제공자에게 연락하도록 지시하십시오. (5.1)
- •
- 발작: CHANTIX를 복용하는 환자에서 새로운 발작 또는 악화된 발작이 관찰되었습니다. CHANTIX는 발작 병력이 있거나 발작 역치를 낮출 수 있는 다른 요인이 있는 환자에게는 신중하게 사용해야 합니다. (5.2)
- •
- 알코올과의 상호작용: 알코올 효과 증가가 보고되었습니다. CHANTIX가 자신에게 어떤 영향을 미치는지 알 때까지 알코올 섭취량을 줄이도록 환자에게 지시하십시오. (5.3)
- •
- 우발적 부상: 우발적 부상(예: 교통사고)이 보고되었습니다. CHANTIX가 자신에게 어떤 영향을 미치는지 알 때까지 운전이나 기계 조작에 주의하도록 환자에게 지시하십시오. (5.4)
- •
- 심혈관계 사건: 기저 심혈관(CV) 질환이 있는 환자는 심혈관계 사건의 위험이 증가할 수 있지만, 이러한 우려 사항은 금연의 건강상 이점과 균형을 이루어야 합니다. 새로운 또는 악화되는 심혈관계 증상에 대해 의료 제공자에게 알리고, 심근 경색(MI) 또는 뇌졸중의 징후와 증상이 나타나는 경우 즉시 의료 처치를 받도록 환자에게 지시하십시오. (5.5 및 6.1)
- •
- 몽유병: CHANTIX를 복용하는 환자에서 몽유병 사례가 보고되었습니다. 일부 사례에서는 자신, 타인 또는 재산에 대한 유해 행동이 설명되었습니다. 몽유병이 발생하는 경우 CHANTIX 복용을 중단하고 의료 제공자에게 알리도록 환자에게 지시하십시오. (5.6 및 6.2)
- •
- 안지오에데마 및 과민반응: 안지오에데마를 포함한 이러한 반응은 드물지만 생명을 위협할 수 있습니다. 증상이 나타나는 경우 CHANTIX 복용을 중단하고 즉시 의료 처치를 받도록 환자에게 지시하십시오. (5.7 및 6.2)
- •
- 중증 피부 반응: 드물지만 생명을 위협할 수 있는 피부 반응이 보고되었습니다. 점막 병변이 있는 피부 발진이 처음 나타나는 경우 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 환자에게 지시하십시오. (5.8 및 6.2)
- •
- 메스꺼움: 메스꺼움은 가장 흔한 유해 반응입니다(최대 30% 발생률). 용량 감량이 도움이 될 수 있습니다. (5.9)
유해 반응
가장 흔한 유해 반응(>5% 및 위약 치료 환자에서 관찰된 비율의 2배)은 메스꺼움, 이상(예: 생생한, 특이한 또는 이상한) 꿈, 변비, 팽만감 및 구토였습니다. (6)
의심되는 유해 반응을 보고하려면 Pfizer Inc.에 1-800-438-1985 또는 FDA에 1-800-FDA-1088로 연락하거나 www.fda.gov/medwatch를 방문하십시오.
약물 상호작용
환자 상담 정보 및 약물 안내서에 대해서는 17항을 참조하십시오.
개정: 2019년 2월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법 (INDICATIONS AND USAGE)
2 용량 및 투여 (DOSAGE AND ADMINISTRATION)
2.1 성인의 일반적인 용량 (Usual Dosage for Adults)
2.2 특수 집단에서의 용량 (Dosage in Special Populations)
3 제형 및 함량 (DOSAGE FORMS AND STRENGTHS)
4 금기 (CONTRAINDICATIONS)
5 경고 및 주의사항 (WARNINGS AND PRECAUTIONS)
5.1 자살 성향을 포함한 신경정신과적 이상반응 (Neuropsychiatric Adverse Events including Suicidality)
5.2 발작 (Seizures)
5.3 알코올과의 상호작용 (Interaction with Alcohol)
5.4 사고 부상 (Accidental Injury)
5.5 심혈관계 사건 (Cardiovascular Events)
5.6 몽유병 (Somnambulism)
5.7 혈관부종 및 과민 반응 (Angioedema and Hypersensitivity Reactions)
5.8 중증 피부 반응 (Serious Skin Reactions)
5.9 메스꺼움 (Nausea)
6 이상반응 (ADVERSE REACTIONS)
6.1 임상시험 경험 (Clinical Trials Experience)
6.2 시판 후 경험 (Postmarketing Experience)
7 약물 상호작용 (DRUG INTERACTIONS)
7.1 금연을 위한 다른 약물과의 병용 (Use with Other Drugs for Smoking Cessation)
7.2 금연이 다른 약물에 미치는 영향 (Effect of Smoking Cessation on Other Drugs)
8 특정 집단에서의 사용 (USE IN SPECIFIC POPULATIONS)
8.1 임신 (Pregnancy)
8.2 수유 (Lactation)
8.4 소아에서의 사용 (Pediatric Use)
8.5 노인에서의 사용 (Geriatric Use)
8.6 신장애 (Renal Impairment)
9 약물 남용 및 의존성 (DRUG ABUSE AND DEPENDENCE)
9.1 규제 약물 (Controlled Substance)
9.3 의존성 (Dependence)
10 과다 복용 (OVERDOSAGE)
11 설명 (DESCRIPTION)
12 임상 약리학 (CLINICAL PHARMACOLOGY)
12.1 작용 기전 (Mechanism of Action)
12.3 약동학 (Pharmacokinetics)
13 비임상 독성학 (NONCLINICAL TOXICOLOGY)
13.1 발암성, 돌연변이 유발성, 생식능력 손상 (Carcinogenesis, Mutagenesis, Impairment of Fertility)
14 임상 연구 (CLINICAL STUDIES)
14.1 금연 시작 (Initiation of Abstinence)
14.2 흡연 욕구 (Urge to Smoke)
14.3 장기 금연 (Long-Term Abstinence)
14.4 금연 날짜 설정을 위한 다른 지침 (Alternative Instructions for Setting a Quit Date)
14.5 점진적인 금연 접근법 (Gradual Approach to Quitting Smoking)
14.6 재치료 연구 (Re-Treatment Study)
14.7 만성 폐쇄성 폐질환 환자 (Subjects with Chronic Obstructive Pulmonary Disease)
14.8 심혈관 질환 환자 및 기타 심혈관 분석 (Subjects with Cardiovascular Disease and Other Cardiovascular Analyses)
14.9 주요 우울 장애 환자 (Subjects with Major Depressive Disorder)
14.10 시판 후 신경정신과적 안전성 결과 시험 (Postmarketing Neuropsychiatric Safety Outcome Trial)
16 공급/보관 및 취급 방법 (HOW SUPPLIED/STORAGE AND HANDLING)
17 환자 상담 정보 (PATIENT COUNSELING INFORMATION)
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용법
CHANTIX는 금연 치료 보조제로 사용됩니다.
2 용법 및 투여
2.1 성인에 대한 일반적인 용법
금연 치료는 금연 의지를 가진 환자이고 추가적인 조언과 지원을 받는 환자에게 더 성공적일 가능성이 높습니다. 환자에게 적절한 교육 자료와 상담을 제공하여 금연 시도를 지원하십시오.
환자는 금연 날짜를 정해야 합니다. 이 날짜 1주일 전에 CHANTIX 복용을 시작하십시오. 또는 환자는 CHANTIX 복용을 시작한 후 치료 8일에서 35일 사이에 금연할 수 있습니다.
CHANTIX는 식후에 물 한 컵과 함께 경구 복용해야 합니다.
CHANTIX의 권장 용량은 다음과 같이 1주일간의 적정 기간 후 1일 2회 1mg입니다.
|
1일차 – 3일차: |
0.5mg 1일 1회 |
|
4일차 – 7일차: |
0.5mg 1일 2회 |
|
8일차 – 치료 종료: |
1mg 1일 2회 |
환자는 12주 동안 CHANTIX로 치료해야 합니다. 12주 후에 성공적으로 금연한 환자의 경우, 장기 금연 가능성을 더 높이기 위해 추가로 12주간의 CHANTIX 치료를 권장합니다.
갑작스럽게 금연할 수 없거나 하려고 하지 않는 환자의 경우, CHANTIX를 사용하여 금연을 점진적으로 접근하는 것을 고려하십시오. 환자는 CHANTIX 복용을 시작하고 첫 4주 이내에 기준치에서 흡연량을 50% 줄이고, 다음 4주 이내에 추가로 50% 줄이며, 12주까지 완전 금연을 목표로 계속 줄여야 합니다. 준비가 되었다고 느끼면 더 빨리 금연을 시도하도록 격려하십시오 [임상 연구 (14.5) 참조].
금연 의지를 가진 환자이지만, 유해 사건으로 인한 불내성 이외의 이유로 이전 CHANTIX 치료 중 금연에 성공하지 못했거나 치료 후 재발한 환자는 실패 원인이 확인되고 해결된 후 CHANTIX로 다시 시도하도록 격려해야 합니다.
CHANTIX의 유해 반응을 견딜 수 없는 환자의 경우 일시적 또는 영구적인 용량 감소를 고려하십시오.
2.2 특수 환자군에서의 용법
신장 기능 저하 환자
경증에서 중등도의 신장 장애 환자의 경우 용량 조절이 필요하지 않습니다. 중증 신장 장애 환자(추정 크레아티닌 청소율 30mL/분 미만)의 경우 CHANTIX의 권장 시작 용량은 0.5mg 1일 1회입니다. 그런 다음 필요에 따라 최대 0.5mg 1일 2회까지 적정할 수 있습니다. 말기 신부전으로 투석 치료를 받는 환자의 경우, 내약성이 있는 경우 최대 0.5mg 1일 1회를 투여할 수 있습니다 [특정 환자군에서의 사용 (8.6), 임상 약리학 (12.3) 참조].
고령자 및 간 기능 저하 환자
간 장애 환자의 경우 용량 조절이 필요하지 않습니다. 고령자는 신장 기능 저하 가능성이 더 높으므로 용량 선택에 주의해야 하며, 신장 기능을 모니터링하는 것이 유용할 수 있습니다 [특정 환자군에서의 사용 (8.5) 참조].
3 제형 및 함량
캡슐형, 양쪽 볼록 정제: 0.5 mg (흰색 또는 백색에 가까운 색상, 한쪽 면에는 “Pfizer” 각인, 다른 면에는 “CHX 0.5” 각인) 및 1 mg (연한 파란색, 한쪽 면에는 “Pfizer” 각인, 다른 면에는 “CHX 1.0” 각인).
4 금기 사항
CHANTIX는 CHANTIX에 대한 심각한 과민 반응 또는 피부 반응의 병력이 있는 환자에게 금기입니다.
5 경고 및 주의사항
5.1 자살 충동을 포함한 신경정신과적 이상 반응
CHANTIX으로 치료받는 환자에게서 심각한 신경정신과적 이상 반응이 보고되었습니다 [이상 반응 (6.2) 참조]. 이러한 시판 후 보고에는 기분 변화(우울증 및 조증 포함), 정신병, 환각, 편집증, 망상, 살인 충동, 공격성, 적대감, 불안, 공황뿐만 아니라 자살 충동, 자살 시도 및 자살 완료가 포함되었습니다. 금연을 중단한 일부 환자는 우울한 기분을 포함한 니코틴 금단 증상을 경험했을 수 있습니다. 우울증(드물게 자살 충동 포함)은 약물 없이 금연 시도를 하는 흡연자에게서 보고되었습니다. 그러나 이러한 이상 반응 중 일부는 계속 흡연하는 CHANTIX 복용 환자에게서 발생했습니다.
신경정신과적 이상 반응은 기존 정신 질환이 있는 환자와 없는 환자 모두에게서 발생했습니다. 일부 환자는 정신 질환이 악화되었습니다. 자신이나 타인에게 향하는 특이하고 때로는 공격적인 행동을 포함한 일부 신경정신과적 이상 반응은 알코올 병용 사용으로 악화되었을 수 있습니다 [경고 및 주의 사항 (5.3), 이상 반응 (6.2) 참조]. 신경정신과적 이상 반응 발생 여부를 관찰하십시오. 환자에게서 불안, 우울한 기분 또는 환자에게 일반적이지 않은 행동이나 사고의 변화가 관찰되거나 자살 충동이나 자살 행동이 발생하는 경우 환자와 보호자에게 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 조언하십시오. 의료 제공자는 증상의 심각성과 환자가 치료로부터 얻는 이점의 정도를 평가하고 용량 감소, 보다 면밀한 모니터링 하의 지속적인 치료 또는 치료 중단을 포함한 옵션을 고려해야 합니다. 많은 시판 후 사례에서 CHANTIX 중단 후 증상 해소가 보고되었습니다. 그러나 일부 사례에서는 증상이 지속되었습니다. 따라서 증상이 해소될 때까지 지속적인 모니터링과 지지 치료를 제공해야 합니다.
CHANTIX의 신경정신과적 안전성은 정신 질환 병력이 없는 환자(비정신과 코호트, N=3912)와 정신 질환 병력이 있는 환자(정신과 코호트, N=4003)를 포함한 무작위, 이중 맹검, 활성 및 위약 대조 연구에서 평가되었습니다. 비정신과 코호트에서 CHANTIX는 불안, 우울증, 이상 감각, 적대감, 불안, 공격성, 망상, 환각, 살인 충동, 조증, 공황 및 과민성을 포함하는 복합 종점에서 임상적으로 유의미한 신경정신과적 이상 반응의 발생률 증가와 관련이 없었습니다. 정신과 코호트에서는 비정신과 코호트에 비해 각 치료군에서 더 많은 사례가 보고되었으며, 복합 종점의 사례 발생률은 위약에 비해 각 활성 치료에서 더 높았습니다. 위약 대비 위험 차이(RD)(95%CI)는 CHANTIX의 경우 2.7%(-0.05, 5.4), 부프로피온의 경우 2.2%(-0.5, 4.9), 경피 니코틴의 경우 0.4%(-2.2, 3.0)였습니다. 비정신과 코호트에서 심각한 신경정신과적 이상 반응은 CHANTIX 치료 환자의 0.1%와 위약 치료 환자의 0.4%에서 보고되었습니다. 정신과 코호트에서 심각한 신경정신과적 이상 반응은 CHANTIX 치료 환자의 0.6%에서 보고되었으며, 0.5%는 정신과 입원을 포함했습니다. 위약 치료 환자의 경우 심각한 신경정신과적 이상 반응은 0.6%에서 발생했으며, 0.2%는 정신과 입원이 필요했습니다 [임상 연구 (14.10) 참조].
5.2 발작
임상 시험 및 시판 후 경험에서 CHANTIX로 치료받는 환자에게서 발작이 보고되었습니다. 일부 환자는 발작 병력이 없었던 반면, 다른 환자는 원격 또는 잘 조절된 발작 장애 병력이 있었습니다. 대부분의 경우 발작은 치료 첫 달 이내에 발생했습니다. 발작 병력이 있거나 발작 역치를 낮출 수 있는 기타 요인이 있는 환자에게 CHANTIX를 처방하기 전에 이러한 잠재적 위험을 잠재적 이점과 비교하십시오. 환자에게 치료 중 발작이 발생하면 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 조언하십시오 [이상 반응 (6.2) 참조].
5.3 알코올과의 상호작용
CHANTIX 복용 중 알코올의 취기 효과가 증가한 환자에 대한 시판 후 보고가 있습니다. 일부 사례에서는 특이하고 때로는 공격적인 행동이 설명되었으며, 종종 사건에 대한 기억 상실을 동반했습니다. CHANTIX가 알코올에 대한 내성에 영향을 미치는지 여부를 알 때까지 CHANTIX 복용 중 알코올 섭취량을 줄이도록 환자에게 조언하십시오 [이상 반응 (6.2) 참조].
5.4 우발적 부상
CHANTIX 복용 환자에게서 교통 사고, 교통 사고 직전 사건 또는 기타 우발적 부상에 대한 시판 후 보고가 있습니다. 일부 사례에서 환자는 졸음, 어지러움, 의식 상실 또는 집중력 저하를 보고했으며, 이로 인해 운전 또는 기계 조작에 장애가 발생하거나 잠재적 장애에 대한 우려가 발생했습니다. CHANTIX가 자신에게 어떤 영향을 미칠지 알 때까지 운전 또는 기계 조작 또는 기타 잠재적으로 위험한 활동을 할 때 주의하도록 환자에게 조언하십시오.
5.5 심혈관계 이상반응
CHANTIX에 대한 심혈관계(CV) 위험의 포괄적인 평가에 따르면 기저 심혈관 질환이 있는 환자는 위험이 증가할 수 있지만, 이러한 우려는 금연의 건강상 이점과 비교하여 평가해야 합니다. 무작위 대조 시험(RCT) 및 RCT 메타 분석에서 CHANTIX에 대한 심혈관계 위험이 평가되었습니다. 안정적인 심혈관 질환이 있는 환자를 대상으로 한 금연 시험에서 전반적으로 심혈관계 이상반응은 드물었지만, 비치명적 심근경색(MI)과 비치명적 뇌졸중은 위약과 비교하여 CHANTIX로 치료받은 환자에서 더 자주 발생했습니다. 모든 원인 및 심혈관계 사망률은 CHANTIX로 치료받은 환자에서 더 낮았습니다 [임상 연구(14.8) 참조]. 이 연구는 다양한 임상 환자군에서 15건의 CHANTIX 효능 시험에 대한 메타 분석에 포함되었으며, 주요 심혈관계 이상반응(MACE)에 대한 위험비 증가(1.95)를 보였지만, 이러한 결과는 통계적으로 유의하지 않았습니다(95% CI: 0.79, 4.82). 대규모 시판 후 신경정신 안전성 결과 시험에서 시험 기간 중 및 28주 비치료 연장 기간 동안 심사된 MACE 사건에 대한 분석이 수행되었습니다. 시험 중에 발생한 MACE 사건은 거의 없었으므로, 이러한 결과는 CHANTIX에 대한 심혈관계 위험에 대한 이해에 실질적으로 기여하지 않았습니다. 새로운 또는 악화되는 심혈관계 증상에 대해 의료 제공자에게 알리고 심근경색 또는 뇌졸중의 징후와 증상이 나타나면 즉시 의료 처치를 받도록 환자에게 지시하십시오 [임상 연구(14.10) 참조].
5.6 몽유병
CHANTIX를 복용하는 환자에서 몽유병 사례가 보고되었습니다. 일부 사례에서는 자신, 타인 또는 재산에 대한 유해한 행동이 설명되었습니다. 몽유병이 발생하면 CHANTIX 복용을 중단하고 의료 제공자에게 알리도록 환자에게 지시하십시오 [이상 반응(6.2) 참조].
5.7 안젤오에데마 및 과민반응
CHANTIX로 치료받은 환자에서 안젤오에데마를 포함한 과민반응에 대한 시판 후 보고가 있었습니다 [이상 반응(6.2), 환자 상담 정보(17) 참조]. 임상 징후에는 얼굴, 입(혀, 입술 및 잇몸), 사지 및 목(목구멍 및 후두)의 부종이 포함되었습니다. 호흡 곤란으로 인해 응급 의료 처치가 필요한 생명을 위협하는 안젤오에데마에 대한 보고는 드물었습니다. 이러한 증상이 나타나면 CHANTIX 복용을 중단하고 즉시 의료 처치를 받도록 환자에게 지시하십시오.
5.8 심각한 피부 반응
CHANTIX를 사용하는 환자에서 스티븐스-존슨 증후군 및 다형 홍반을 포함한 드물지만 심각한 피부 반응에 대한 시판 후 보고가 있었습니다 [이상 반응(6.2) 참조]. 이러한 피부 반응은 생명을 위협할 수 있으므로, 점막 병변이 있는 피부 발진 또는 기타 과민반응 징후가 처음 나타나면 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 환자에게 지시하십시오.
5.9 메스꺼움
메스꺼움은 CHANTIX 치료와 관련하여 가장 흔하게 보고된 이상 반응이었습니다. 메스꺼움은 일반적으로 경증 또는 중등도로 설명되었으며 종종 일시적이었지만, 일부 환자의 경우 수개월 동안 지속되었습니다. 메스꺼움의 발생률은 용량 의존적이었습니다. 초기 용량 적정은 메스꺼움 발생을 줄이는 데 도움이 되었습니다. 초기 용량 적정 후 1일 2회 최대 권장 용량인 1mg으로 치료받은 환자의 경우 메스꺼움 발생률은 30%였으며, 이는 비슷한 위약 요법을 복용하는 환자의 10%와 비교되었습니다. 초기 적정 후 1일 2회 0.5mg의 CHANTIX를 복용하는 환자의 경우 발생률은 16%였으며, 이는 위약의 11%와 비교되었습니다. 12주 치료를 포함하는 연구에서 1일 2회 1mg의 CHANTIX로 치료받은 환자 중 약 3%가 메스꺼움으로 인해 조기에 치료를 중단했습니다. 참을 수 없는 메스꺼움이 있는 환자의 경우 용량 감소를 고려해야 합니다.
6 부작용 반응
시판 후 경험에서 다음과 같은 심각한 이상 반응이 보고되었으며, 이는 라벨의 다른 부분에서 더 자세히 설명되어 있습니다.
- •
- 자살 충동을 포함한 신경정신과적 이상 사례 [경고 및 주의 사항 (5.1) 참조]
- •
- 발작 [경고 및 주의 사항 (5.2) 참조]
- •
- 알코올과의 상호작용 [경고 및 주의 사항 (5.3) 참조]
- •
- 우발적 부상 [경고 및 주의 사항 (5.4) 참조]
- •
- 심혈관계 이상 사례 [경고 및 주의 사항 (5.5) 참조]
- •
- 몽유병 [경고 및 주의 사항 (5.6) 참조]
- •
- 혈관부종 및 과민반응 [경고 및 주의 사항 (5.7) 참조]
- •
- 심각한 피부 반응 [경고 및 주의 사항 (5.8) 참조]
위약 대조 시판 전 연구에서 CHANTIX와 관련된 가장 흔한 이상 사례(>5% 및 위약 치료 환자에서 관찰된 비율의 두 배)는 메스꺼움, 이상(생생한, 특이하거나 이상한) 꿈, 변비, 팽만감 및 구토였습니다.
1일 2회 1mg 용량으로 투여받은 환자의 이상 사례로 인한 치료 중단율은 3개월 치료 연구에서 CHANTIX의 경우 12%, 위약의 경우 10%였습니다. 이 그룹에서 CHANTIX 치료 환자의 가장 흔한 이상 사례에 대해 위약보다 높은 중단율은 다음과 같습니다. 메스꺼움(3% 대 위약 0.5%), 불면증(1.2% 대 위약 1.1%), 이상 꿈(0.3% 대 위약 0.2%).
치료 여부와 관계없이 금연은 니코틴 금단 증상과 관련이 있으며, 기저 정신 질환의 악화와도 관련이 있습니다.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되기 때문에, 약물의 임상 연구에서 관찰된 이상 반응률을 다른 약물의 임상 시험에서 관찰된 비율과 직접 비교할 수 없으며, 임상 실제에서 관찰된 비율을 반영하지 않을 수도 있습니다.
CHANTIX의 시판 전 개발 과정에서 4500명 이상의 피험자가 CHANTIX에 노출되었으며, 450명 이상이 24주 이상, 약 100명이 1년 동안 치료를 받았습니다. 대부분의 연구 참가자는 12주 이하로 치료를 받았습니다.
CHANTIX 치료와 관련된 가장 흔한 이상 사례는 메스꺼움이며, 권장 용량으로 치료받은 환자의 30%에서 발생한 반면, 비슷한 위약 요법을 받은 환자의 경우 10%였습니다 [경고 및 주의 사항 (5.9) 참조].
표 1은 첫째 주 적정을 포함한 12주 고정 용량 시판 전 연구[연구 2(적정군만 해당), 4 및 5]에서 CHANTIX와 위약에 대한 이상 사례를 보여줍니다. 이상 사례는 의약품 규제 활동을 위한 의학 용어 사전(MedDRA, 버전 7.1)을 사용하여 분류되었습니다.
CHANTIX 1일 2회 1mg 용량군 환자의 ≥5%에서 보고되었고 위약군보다 더 흔하게 보고된 MedDRA 상위 수준 그룹 용어(HLGT)는 CHANTIX 환자의 ≥1%(그리고 위약보다 최소 0.5% 더 빈번)에서 보고된 하위 우선 용어(PT)와 함께 나열되어 있습니다. ‘불면증’, ‘초기 불면증’, ‘중간 불면증’, ‘조기 각성’과 같이 밀접하게 관련된 우선 용어는 그룹화되었지만, 두 개 이상의 그룹화된 사례를 보고한 개별 환자는 한 번만 계산됩니다.
| 시스템 기관 분류 상위 수준 그룹 용어 |
CHANTIX 1일 2회 0.5mg |
CHANTIX 1일 2회 1mg |
위약 |
|---|---|---|---|
| 우선 용어 | N=129 | N=821 | N=805 |
|
위장관(GI) |
|||
|
GI 징후 및 증상 |
|||
|
메스꺼움 |
16 |
30 |
10 |
|
복통 * |
5 |
7 |
5 |
|
팽만감 |
9 |
6 |
3 |
|
소화불량 |
5 |
5 |
3 |
|
구토 |
1 |
5 |
2 |
|
위장관 운동성/배변 장애 |
|||
|
변비 |
5 |
8 |
3 |
|
역류성 식도염 |
1 |
1 |
0 |
|
침샘 장애 |
|||
|
구강건조 |
4 |
6 |
4 |
|
정신과적 장애 |
|||
|
수면 장애 |
|||
|
불면증 † |
19 |
18 |
13 |
|
이상 꿈 |
9 |
13 |
5 |
|
수면 장애 |
2 |
5 |
3 |
|
악몽 |
2 |
1 |
0 |
|
신경계 |
|||
|
두통 |
|||
|
두통 |
19 |
15 |
13 |
|
기타 신경계 장애 |
|||
|
미각이상 |
8 |
5 |
4 |
|
졸음 |
3 |
3 |
2 |
|
무력증 |
2 |
1 |
0 |
|
전반적인 장애 |
|||
|
기타 전반적인 장애 |
|||
|
피로/권태/무기력증 |
4 |
7 |
6 |
|
호흡기/흉부/종격동 |
|||
|
기타 호흡기 장애 |
|||
|
콧물 |
0 |
1 |
0 |
|
호흡곤란 |
2 |
1 |
1 |
|
상기도 질환 |
7 |
5 |
4 |
|
피부/피하조직 |
|||
|
표피 및 진피 질환 |
|||
|
발진 |
1 |
3 |
2 |
|
가려움증 |
0 |
1 |
1 |
|
대사 및 영양 |
|||
|
식욕/일반 영양 장애 |
|||
|
식욕 증가 |
4 |
3 |
2 |
|
식욕 감소/식욕 부진 |
1 |
2 |
1 |
장기간 시판 전 임상시험에서 유해사건의 전반적인 양상 및 빈도는 표 1에 기술된 것과 유사했지만, 장기간 사용 환자의 더 높은 비율에서 가장 흔한 몇몇 사건이 보고되었습니다(예: 1년 연구에서 CHANTIX 1mg 1일 2회 투여군 환자의 40%에서 오심이 보고된 반면, 위약 투여군 환자에서는 8%에서 보고됨).
다음은 시판 전 모든 임상시험 중 CHANTIX로 치료받은 환자에게서 보고된 치료로 인한 유해사건 목록이며, 약 5,000명의 바레니클린 치료 환자를 포함한 18건의 위약 대조 시판 전 및 시판 후 연구의 통합 데이터를 기반으로 업데이트되었습니다. 유해사건은 MedDRA 버전 16.0을 사용하여 분류되었습니다. 이 목록에는 이전 표 또는 라벨의 다른 곳에 이미 나열된 사건, 약물이 원인일 가능성이 낮은 사건, 너무 일반적이어서 정보가 없는 사건, 그리고 급성 생명 위협 가능성이 크지 않은 단 한 번만 보고된 사건은 포함되어 있지 않습니다.
혈액 및 림프계 장애. 흔하지 않음: 빈혈, 림프절병증. 드물게: 백혈구증가증, 비장종대, 혈소판감소증.
심장 장애. 흔하지 않음: 협심증, 심근경색, 심계항진, 빈맥. 드물게: 급성관상동맥증후군, 부정맥, 심방세동, 서맥, 심방세동, 폐심, 관상동맥질환, 심실성기외수축.
귀 및 미로 장애. 흔하지 않음: 이명, 현기증. 드물게: 난청, 메니에르병.
내분비 장애. 흔하지 않음: 갑상선 장애.
안과적 장애. 흔하지 않음: 결막염, 눈 자극, 안통, 시력흐림, 시각장애. 드물게: 일과성 실명, 피막하 백내장, 안구건조증, 야맹증, 안구 혈관 장애, 광선공포증, 유리체 부유물.
위장 장애. 흔함: 설사, 치통. 흔하지 않음: 연하곤란, 트림, 위염, 위장관 출혈, 구내염. 드물게: 장염, 식도염, 위궤양, 장폐색, 급성 췌장염.
일반 장애 및 투여 부위 이상. 흔함: 흉통. 흔하지 않음:흉부 불편감, 오한, 부종, 인플루엔자 유사 질환, 발열.
담도계 장애. 드물게: 담낭 장애.
검사. 흔함: 이상 간 기능 검사, 체중 증가. 흔하지 않음: 이상 심전도. 드물게: 근육 효소 증가, 이상 소변 검사.
대사 및 영양 장애. 흔하지 않음: 당뇨병, 저혈당증. 드물게: 고지혈증, 저칼륨혈증.
근골격계 및 결합조직 장애. 흔함: 관절통, 요통, 근육통. 흔하지 않음: 관절염, 근육 경련, 근골격계 통증. 드물게: 근염, 골다공증.
신경계 장애. 흔함: 주의력 장애, 어지러움. 흔하지 않음: 기억상실, 경련, 편두통, 이취증, 실신, 진전. 드물게: 균형 장애, 뇌혈관 사고, 구어 장애, 정신 장애, 다발성 경화증, VIIth 신경 마비, 안진, 정신 운동 과잉 활동, 정신 운동 기술 장애, 불안한 다리 증후군, 감각 장애, 일과성 허혈 발작, 시야 결손.
정신 장애. 흔하지 않음: 해리, 성욕 감퇴, 기분 변화, 이상 사고. 드물게: 완서증, 방향 감각 상실, 행복감.
신장 및 비뇨기 장애. 흔하지 않음: 야뇨증, 빈뇨, 소변 이상. 드물게: 신결석, 다뇨증, 급성 신부전, 요도 증후군, 요정체.
생식기계 및 유방 장애. 흔함: 월경 장애. 흔하지 않음: 발기 부전. 드물게: 성 기능 장애.
호흡기, 흉부 및 종격동 장애. 흔함: 호흡기 장애. 흔하지 않음: 천식, 코피, 알레르기성 비염, 상기도 염증. 드물게: 흉막염, 폐색전증.
피부 및 피하 조직 장애. 흔하지 않음: 여드름, 건조한 피부, 습진, 홍반, 다한증, 두드러기. 드물게: 광과민 반응, 건선.
혈관 장애. 흔하지 않음: 홍조. 드물게: 혈전증.
CHANTIX는 또한 다음을 포함한 시판 후 시험에서 연구되었습니다. (1) 만성 폐쇄성 폐 질환(COPD) 환자를 대상으로 한 시험, (2) 치료 8일에서 35일 사이에 금연 날짜를 선택할 수 있도록 허용된 일반적으로 건강한 환자(시판 전 연구의 환자와 유사)를 대상으로 한 시험(“대체 금연일 지시 시험”), (3) 이전 CHANTIX 치료 중 금연에 성공하지 못했거나 치료 후 재발한 환자를 대상으로 한 시험(“재치료 시험”), (4) 안정적인 심혈관 질환 환자를 대상으로 한 시험, (5) 안정적인 조현병 또는 조울병 환자를 대상으로 한 시험, (6) 주요 우울 장애 환자를 대상으로 한 시험, (7) 정신 질환 병력 유무에 관계없이 환자를 대상으로 한 시판 후 신경 정신 안전성 결과 시험, (8) 심혈관 안전성을 평가한 시판 후 신경 정신 안전성 결과 시험의 비치료 연장, (9) 갑작스럽게 금연할 수 없거나 원하지 않는 환자에게 점진적인 금연을 지시한 시험(“점진적 금연 접근 시험”).
COPD 환자 시험(1), 대체 금연일 지시 시험(2) 및 점진적 금연 접근 시험(9)의 이상 사례는 시판 전 연구에서 관찰된 이상 사례와 유사했습니다. 재치료 시험(3)에서 흔한 이상 사례의 특징은 이전에 보고된 내용과 유사했지만, 추가적으로 varenicline 치료 환자는 설사(6% 대 위약 치료 환자 4%), 우울증 및 장애(6% 대 1%) 및 기타 기분 장애(5% 대 2%)를 흔하게 보고했습니다.
안정적인 심혈관 질환 환자 시험(4)에서는 아래 표 1과 표 2에 나와 있는 바와 같이 시판 전 연구와 비교하여 더 많은 유형과 수의 심혈관계 사건이 보고되었습니다.
| CHANTIX 1mg BID |
위약 | |
|---|---|---|
| N=353 | N=350 | |
|
||
|
어느 치료군에서든 ≥1%의 이상 사례 |
||
|
치료 후 최대 30일 |
||
|
협심증 |
3.7 |
2.0 |
|
흉통 |
2.5 |
2.3 |
|
말초 부종 |
2.0 |
1.1 |
|
고혈압 |
1.4 |
2.6 |
|
심계항진 |
0.6 |
1.1 |
|
판정된 심혈관 사망률 (최대 52주) |
0.3 |
0.6 |
|
어느 치료군에서든 ≥1%인 판정된 비치명적 심각한 심혈관 사건 |
||
|
치료 후 최대 30일 |
||
|
비치명적 심근경색 |
1.1 |
0.3 |
|
협심증 입원 |
0.6 |
1.1 |
|
치료 후 30일 이상 및 최대 52주 |
||
|
관상동맥 재관류술 필요성* |
2.0 |
0.6 |
|
협심증으로 인한 입원 |
1.7 |
1.1 |
|
말초혈관질환(PVD)의 신규 진단 또는 PVD 시술을 위한 입원 |
1.4 |
0.6 |
안정적인 정신분열증 또는 정신분열정동장애 환자(5)를 대상으로 한 시험에서 항정신병 약물을 복용하는 흡연자 128명을 12주 동안 바레니클린(1mg, 1일 2회) 또는 위약에 2:1로 무작위 배정하고 12주간의 약물 복용 중단 후 추적 관찰을 실시했습니다. 이 시험에서 보고된 가장 흔한 치료 관련 이상 사례는 아래 표 3에 나와 있습니다.
| CHANTIX 1 mg BID |
위약 | |
|---|---|---|
| N=84 | N=43 | |
|
바레니클린군에서 ≥10%인 이상 사례 |
||
|
메스꺼움 |
24 |
14 |
|
두통 |
11 |
19 |
|
구토 |
11 |
9 |
|
위약군보다 발생률이 높은 ≥5%의 정신과적 이상 사례 |
||
|
불면증 |
10 |
5 |
주요 우울 장애 환자 시험(6)에서 보고된 가장 흔한 치료 관련 이상 사례는 아래 표 4에 나와 있습니다. 또한, 이 시험에서 바레니클린으로 치료받은 환자는 위약으로 치료받은 환자보다 적대감 및 공격성과 관련된 사건 중 하나를 보고할 가능성이 더 높았습니다(3% 대 1%).
| CHANTIX 1mg BID |
위약 | |
|---|---|---|
| N=256 | N=269 | |
|
어느 치료군에서든 ≥10%인 이상 사례 |
||
|
메스꺼움 |
27 |
10 |
|
두통 |
17 |
11 |
|
이상 꿈 |
11 |
8 |
|
불면증 |
11 |
5 |
|
과민성 |
11 |
8 |
|
어떤 치료군에서든 ≥2%인 정신과적 이상 사례(위에 포함되지 않음) |
||
|
우울한 기분 장애 및 이상 |
11 |
9 |
|
불안 |
7 |
9 |
|
초조 |
7 |
4 |
|
긴장 |
4 |
3 |
|
적대감 |
2 |
0.4 |
|
불안정 |
2 |
2 |
정신 질환 병력이 없는 환자 또는 정신 질환 병력이 있는 환자를 대상으로 한 시험(7)에서, 바레니클린으로 치료받은 피험자에게서 가장 흔하게 나타난 유해 사례는 시판 전 연구에서 관찰된 것과 유사했습니다. 이 시험에서 보고된 가장 흔한 치료 발생 유해 사례는 아래 표 5에 나와 있습니다.
| CHANTIX 1 mg 1일 2회 |
플라세보 | |
|---|---|---|
|
바레니클린 그룹에서 ≥10%인 유해 사례 |
||
|
전체 연구 대상자, N |
1982 |
1979 |
|
메스꺼움 |
25 |
7 |
|
두통 |
12 |
10 |
|
어떤 치료군에서든 ≥2%인 정신과적 유해 사례 |
||
|
비정신과 코호트, N |
975 |
982 |
|
이상 꿈 |
8 |
4 |
|
불안 |
3 |
3 |
|
불안감 |
5 |
6 |
|
우울한 기분 |
3 |
3 |
|
불면증 |
10 |
7 |
|
과민성 |
3 |
4 |
|
수면 장애 |
3 |
2 |
|
정신과 코호트, N |
1007 |
997 |
|
이상 꿈 |
12 |
5 |
|
불안 |
5 |
4 |
|
불안감 |
8 |
6 |
|
우울한 기분 |
5 |
5 |
|
우울증 |
5 |
5 |
|
불면증 |
9 |
7 |
|
과민성 |
5 |
7 |
|
신경과민 |
2 |
3 |
수면장애
3
2
심혈관 안전성을 평가한 시판 후 신경정신 안전성 결과 시험의 비치료 연장 연구(8)에서, 바레니클린으로 치료받은 대상자에게서 마지막 투여 후 최대 30일까지 발생한 가장 흔한 이상 반응은 시판 전 연구에서 관찰된 것과 유사했습니다.
6.2 시판 후 경험
다음 이상 반응은 CHANTIX 시판 후 사용 중에 보고되었습니다. 이러한 사례는 불확실한 규모의 모집단으로부터 자발적으로 보고되었기 때문에, 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것은 불가능합니다.
CHANTIX 복용 중 금연을 시도하는 환자에게서 우울증, 조증, 정신병, 환각, 편집증, 망상, 살인 충동, 공격성, 적대감, 불안 및 공황, 그리고 자살 충동, 자살 시도 및 자살 완료에 대한 보고가 있었습니다 [경고 및 주의 사항 (5.1) 참조].
CHANTIX로 치료받은 환자에게서 새로운 발작 또는 악화된 발작에 대한 시판 후 보고가 있었습니다 [경고 및 주의 사항 (5.2) 참조].
CHANTIX 복용 중 알코올의 중독 효과가 증가한 환자에 대한 시판 후 보고가 있습니다. 일부는 비정상적이고 때로는 공격적인 행동을 포함한 신경정신 사건을 보고했습니다 [경고 및 주의 사항 (5.1) 및 (5.3) 참조].
혈관부종을 포함한 과민증 반응에 대한 보고가 있습니다 [경고 및 주의 사항 (5.7) 참조].
CHANTIX를 복용하는 환자에게서 스티븐스-존슨 증후군 및 다형 홍반을 포함한 심각한 피부 반응에 대한 보고도 있습니다 [경고 및 주의 사항 (5.8) 참조].
CHANTIX를 복용하는 환자에게서 심근경색(MI) 및 뇌혈관 질환(CVA)(허혈성 및 출혈성 사건 포함)에 대한 보고가 있습니다. 보고된 사례의 대부분에서 환자는 기존의 심혈관 질환 및/또는 기타 위험 요소를 가지고 있었습니다. 흡연은 MI 및 CVA의 위험 요소이지만, 약물 사용과 사건 사이의 시간적 관계를 바탕으로 바레니클린의 기여 역할을 배제할 수 없습니다 [경고 및 주의 사항 (5.5) 참조].
CHANTIX 복용 시작 후 고혈당에 대한 보고가 있습니다.
CHANTIX로 치료받은 환자에게서 자다가 몽유병을 경험하고, 일부는 자신, 타인 또는 재산에 해로운 행동을 한 경우에 대한 보고가 있습니다 [경고 및 주의 사항 (5.6) 참조].
7 약물 상호 작용
지금까지 varenicline의 특징과 임상 경험에 따르면, CHANTIX는 임상적으로 유의미한 약물동태학적 약물 상호작용이 없습니다. [임상 약리학 (12.3) 참조].
7.1 금연을 위한 다른 약물과의 병용
CHANTIX와 다른 금연 치료법의 병용에 대한 안전성과 유효성은 연구되지 않았습니다.
Bupropion
Varenicline (1 mg 1일 2회)은 46명의 흡연자에서 bupropion (150 mg 1일 2회)의 항정 상태 약물동태에 영향을 미치지 않았습니다. Bupropion과 varenicline 병용의 안전성은 확립되지 않았습니다.
Nicotine replacement therapy (NRT)
최대 12일 동안 varenicline (1 mg 1일 2회)과 경피 니코틴 (21 mg/일)을 병용 투여해도 니코틴 약물동태에 영향을 미치지 않았지만, 메스꺼움, 두통, 구토, 현기증, 소화불량 및 피로감 발생률은 NRT 단독 투여보다 병용 투여에서 더 높았습니다. 이 연구에서 varenicline과 NRT 병용으로 치료받은 22명의 환자 중 8명(36%)은 이상반응으로 인해 치료를 조기에 중단했으며, NRT와 위약으로 치료받은 환자 17명 중 1명(6%)과 비교됩니다.
7.2 금연이 다른 약물에 미치는 영향
CHANTIX 치료 유무와 관계없이 금연으로 인한 생리적 변화는 특정 약물(예: theophylline, warfarin, insulin)의 약물동태 또는 약력학을 변화시켜 용량 조정이 필요할 수 있습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
임신 중 바레니클린에 노출된 여성의 주요 선천적 결손 위험이 흡연 여성에 비해 증가했다는 것을 시사하는 데이터는 없습니다. [데이터 참조]. 임신 중 흡연은 산모, 태아 및 신생아에게 위험을 초래합니다. (임상적 고려사항 참조). 동물 연구에서 바레니클린은 주요 기형을 유발하지 않았지만, 최대 권장 인체 용량(MRHD)에서의 노출량의 50배에 해당하는 용량을 기관 형성기에 투여했을 때 토끼의 태아 체중 감소를 유발했습니다. 또한, 기관 형성기부터 수유기까지 임신한 쥐에게 바레니클린을 투여한 결과, MRHD에서의 인체 노출량의 36배에 해당하는 모체 노출량에서 자손의 발달 독성이 나타났습니다. [데이터 참조].
구순열의 추정 배경 위험은 임신 중 흡연하는 여성의 영아에서 흡연하지 않는 임신 여성에 비해 약 30% 증가합니다. 적응증 대상 집단의 다른 주요 선천적 결손 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 확인된 임신의 주요 선천적 결손 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
인체 데이터
덴마크와 스웨덴의 국가 등록부를 사용한 인구 기반 관찰 코호트 연구에서 바레니클린에 노출된 여성(N=335, 임신 초기 3개월 노출 317명 포함)과 임신 중 흡연한 여성(N=78,412) 및 비흡연 임신 여성(N=806,438)의 임신 및 출산 결과를 비교했습니다. 주요 결과인 주요 기형의 유병률은 흡연 그룹과 비흡연 그룹을 포함한 모든 그룹에서 유사했습니다. 바레니클린 노출 코호트의 주산기 이상 발생률은 흡연 여성 코호트보다 높지 않았으며 세 코호트 간에 약간의 차이가 있었습니다. 표 6에 1차 및 2차 결과의 유병률을 나타냈습니다.
| 결과 | 바레니클린 코호트 (n=335) |
흡연 코호트 (n=78,412) |
비흡연 코호트 (n=806,438) |
|---|---|---|---|
|
주요 선천성 기형* |
12 / 334 (3.6%) |
3,382 / 78,028 (4.3%) |
33,950 /804,020 (4.2%) |
|
사산 |
1 (0.3%) |
384 (0.5%) |
2,418 (0.3%) |
|
재태 연령별 저체중 |
42 (12.5%) |
13,433 (17.1%) |
73,135 (9.1%) |
|
조산 |
25 (7.5%) |
6,173 (7.9%) |
46,732 (5.8%) |
|
조기 파막(Premature rupture of membranes) |
12 (3.6%) |
4,246 (5.4%) |
30,641 (3.8%) |
|
영아돌연사증후군(Sudden infant death syndrome)† |
0/307 (0.0%) |
51/71,720 (0.1%) |
58/755,939 (<0.1%) |
이 연구의 한계에는 생존 출산으로 이어지지 않은 임신에서의 기형 발생을 파악할 수 없다는 점과 바레니클린 또는 흡연에 대한 결과 및 노출의 오분류 가능성이 포함됩니다.
바레니클린에 노출된 임산부를 대상으로 한 다른 소규모 역학 연구에서는 덴마크 및 스웨덴 관찰 코호트 연구와 일치하여 주요 기형과의 연관성을 확인하지 못했습니다. 이러한 연구의 방법론적 한계에는 소규모 표본과 적절한 대조군의 부족이 포함됩니다.
전반적으로, 이용 가능한 연구는 임신 중 바레니클린 관련 위험을 확실하게 확립하거나 배제할 수 없습니다.
Animal Data
임신한 쥐와 토끼에게 각각 최대 15mg/kg/일 및 30mg/kg/일의 경구 용량으로 기관 형성 기간 동안 바레니클린 숙시네이트를 투여했습니다. 두 종 모두에서 태아 구조적 이상이 발생하지 않았지만, 최고 용량의 토끼에서 체중 증가 감소 및 태아 체중 감소를 특징으로 하는 모체 독성이 발생했습니다(AUC 기준 1mg 1일 2회 MRHD에서 인체 노출량의 50배). AUC 기준 MRHD에서 인체 노출량의 23배인 토끼에서는 태아 체중 감소가 발생하지 않았습니다.
출생 전후 발달 연구에서 임신한 쥐에게 기관 형성부터 수유까지 최대 15mg/kg/일의 경구 바레니클린 숙시네이트를 투여했습니다. 15mg/kg/일(AUC 기준 MRHD에서 인체 노출량의 36배)에서 체중 증가 감소를 특징으로 하는 모체 독성이 관찰되었습니다. 그러나 최고 모체 용량인 15mg/kg/일에서 자손의 생식력 감소 및 청각 경악 반응 증가가 발생했습니다.
8.2 수유
위험 요약
모유 중 바레니클린의 존재, 모유 수유 유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 동물 연구에서 바레니클린은 수유 중인 쥐의 모유에서 검출되었습니다 [see Data]. 그러나 수유 생리학의 종 특이적 차이로 인해 동물 데이터가 인체 모유의 약물 수치를 확실하게 예측하지 못할 수 있습니다. 수유 중 임상 데이터가 부족하기 때문에 수유 중 유아에 대한 CHANTIX의 위험을 명확하게 판단할 수 없습니다. 그러나 모유 수유의 발달 및 건강상의 이점은 CHANTIX에 대한 산모의 임상적 필요성 및 CHANTIX 또는 기저 산모 질환으로 인한 모유 수유 유아에 대한 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
CHANTIX는 16세 이하의 소아 환자에게 사용하는 것은 권장되지 않습니다. 이 집단에서 효능이 입증되지 않았기 때문입니다.
바레니클린의 단회 및 다회 투여 약동학은 12~17세 소아 환자를 대상으로 조사되었으며 연구된 0.5mg~2mg 1일 용량 범위에서 거의 용량 비례적이었습니다. AUC(0-24)로 평가한 체중 >55kg인 청소년 환자의 정상 상태 전신 노출은 성인 집단에서 동일한 용량에 대해 나타난 것과 비슷했습니다. 0.5mg BID를 투여했을 때 바레니클린의 정상 상태 1일 노출은 체중 ≤55kg인 청소년 환자에서 성인 집단에 비해 평균적으로 더 높았습니다(약 40%).
바레니클린의 효능 및 안전성은 모집 전 30일 동안 평균 5개비 이상의 담배를 피웠고, Fagerstrom 니코틴 의존도 척도에서 4점 이상의 점수를 받았으며, 이전에 금연 시도에 한 번 이상 실패한 12~19세 환자 312명을 대상으로 한 무작위, 이중 맹검, 위약 대조 연구에서 평가되었습니다. 환자는 연령(12~16세, n=216 및 17~19세, n=96) 및 체중(≤55kg 및 >55kg)으로 계층화되었습니다. 환자는 체중에 따라 조정된 두 가지 용량의 바레니클린 중 하나와 위약에 무작위 배정되어(성인 연구를 기반으로) 효과적인 범위의 혈장 수치를 제공했습니다. 환자는 12주 동안 치료를 받았고 그 후 40주 동안 비치료 기간을 거쳤으며, 연구 기간 내내 연령에 적합한 상담을 받았습니다. 이 연구의 결과는 연구된 두 용량의 바레니클린 모두 12~19세 대상에서 치료 9~12주차에 위약에 비해 지속적인 금연율을 개선하지 못했음을 보여주었습니다. 이 연구에서 바레니클린의 안전성 프로파일은 성인 연구에서 관찰된 것과 일치했습니다.
8.5 노인 사용
단회 및 다회 투여 약동학 연구를 통해 16명의 건강한 노인 남녀 흡연자(65~75세)에게 7일 연속 1일 1회 또는 2회 1mg 바레니클린을 투여했을 때 약동학이 젊은 피험자와 유사함이 입증되었습니다. 이러한 피험자와 젊은 피험자 사이에 안전성 또는 유효성의 전반적인 차이는 관찰되지 않았으며, 보고된 다른 임상 경험에서도 노인과 젊은 환자 사이의 반응 차이가 확인되지 않았지만 일부 노인의 민감도가 더 높을 가능성을 배제할 수는 없습니다.
Varenicline은 신장을 통해 상당량 배설되는 것으로 알려져 있으며, 신기능이 저하된 환자에서 이 약물에 대한 독성 반응의 위험이 더 클 수 있습니다. 노인 환자는 신기능이 저하될 가능성이 더 높기 때문에 용량 선택에 주의해야 하며 신기능을 모니터링하는 것이 유용할 수 있습니다 [see Dosage and Administration (2.2)].
노인 환자의 경우 용량 조절이 권장되지 않습니다.
8.6 신장애
Varenicline은 활발한 세뇨관 분비와 함께 신사구체 여과를 통해 상당량 제거됩니다. 경증에서 중등도의 신장애 환자의 경우 용량 감량이 필요하지 않습니다. 중증 신장애 환자(추정 크레아티닌 청소율 <30mL/min) 및 혈액투석을 받는 말기 신질환 환자의 경우 용량 조절이 필요합니다 [see Dosage and Administration (2.2), Clinical Pharmacology (12.3)].
9. 약물 남용 및 의존성
9.3 Dependence
Humans
CHANTIX 임상 시험에서 1,000명 중 1명 미만의 환자가 euphoria를 보고했습니다. 고용량(2mg 초과)에서 CHANTIX는 메스꺼움 및 구토와 같은 위장 장애 보고 빈도가 더 높았습니다. 임상 연구에서 치료 효과를 유지하기 위한 용량 증량의 증거는 없으며, 이는 내성이 발생하지 않음을 시사합니다. CHANTIX의 갑작스러운 중단은 최대 3%의 환자에서 과민성 및 수면 장애 증가와 관련이 있었습니다. 이는 일부 환자에서 바레니클린이 중독과 관련이 없는 경미한 신체적 의존성을 유발할 수 있음을 시사합니다.
인간 실험실 약물 남용 책임 연구에서 흡연자에게 1mg의 바레니클린 단회 경구 투여는 유의미한 긍정적 또는 부정적 주관적 반응을 나타내지 않았습니다. 비흡연자의 경우 1mg의 바레니클린은 일부 긍정적인 주관적 효과의 증가를 나타냈지만, 이는 특히 메스꺼움과 같은 부정적인 부작용의 증가를 동반했습니다. 흡연자와 비흡연자 모두에게 3mg의 바레니클린 단회 경구 투여는 일관되게 불쾌한 주관적 반응을 나타냈습니다.
Animals
설치류 연구에서 바레니클린은 니코틴에 의해 생성되는 것과 유사한 행동 반응을 생성하는 것으로 나타났습니다. 니코틴과 식염수를 구별하도록 훈련된 쥐에서 바레니클린은 니코틴 단서에 대한 완전한 일반화를 생성했습니다. 자가 투여 연구에서 바레니클린이 니코틴을 대체하는 정도는 작업의 요구 사항에 따라 달라집니다. 쉬운 조건에서 니코틴을 자가 투여하도록 훈련된 쥐는 니코틴과 비슷한 정도로 바레니클린을 계속 자가 투여했습니다. 그러나 더 까다로운 작업에서는 쥐가 니코틴보다 적은 양의 바레니클린을 자가 투여했습니다. 바레니클린 전처치는 또한 니코틴 자가 투여를 감소시켰습니다.
10 과다 복용
과다 복용 시 필요에 따라 표준 치료적 조치를 취해야 합니다.
바레니클린은 말기 신부전 환자에서 투석이 가능한 것으로 나타났습니다 [임상 약리 (12.3) 참조], 그러나 과다 복용 후 투석에 대한 경험은 없습니다.
11 설명
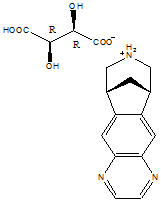
CHANTIX 정제는 타르트레이트 염으로서 α4β2 니코틴성 아세틸콜린 수용체 아형에 대해 선택적인 부분 니코틴성 작용제인 바레니클린을 함유하고 있습니다.
타르트레이트 염으로서의 바레니클린은 백색에서 백색에 가까운 색 또는 약간 황색을 띠는 고체 분말이며, 화학명은 다음과 같습니다: 7,8,9,10-tetrahydro-6,10-methano-6H-pyrazino[2,3- h][3]benzazepine, (2R,3R)-2,3-dihydroxybutanedioate (1:1). 물에 매우 잘 녹습니다. 바레니클린 타르트레이트의 분자량은 361.35 달톤이며, 분자식은 C13H13N3 ∙ C4H6O6입니다. 화학 구조는 다음과 같습니다.
CHANTIX는 경구 투여를 위해 두 가지 강도로 제공됩니다: 한쪽 면에는 “Pfizer“가, 다른 면에는 “CHX 0.5″가 각인된 0.5mg의 캡슐형 양볼록, 백색에서 백색에 가까운 색의 필름 코팅 정제와 한쪽 면에는 “Pfizer“가, 다른 면에는 “CHX 1.0″가 각인된 1mg의 캡슐형 양볼록, 연청색 필름 코팅 정제입니다. 각 0.5mg CHANTIX 정제는 0.5mg의 바레니클린 유리염기에 해당하는 0.85mg의 바레니클린 타르트레이트를 함유하고 있으며, 각 1mg CHANTIX 정제는 1mg의 바레니클린 유리염기에 해당하는 1.71mg의 바레니클린 타르트레이트를 함유하고 있습니다. 정제에는 미결정 셀룰로오스, 무수 이염기성 인산칼슘, 크로스카멜로오스나트륨, 콜로이드성 이산화규소, 스테아린산마그네슘, Opadry® White (0.5mg용), Opadry® Blue (1mg용), 및 Opadry® Clear가 포함되어 있습니다.
12 약물동력학
12.1 작용 기전
바레니클린은 α4β2 뉴런성 니코틴성 아세틸콜린 수용체에 높은 친화력과 선택성으로 결합합니다. CHANTIX의 금연 효능은 α4β2 니코틴성 수용체 아형에서 바레니클린의 활성에 기인하는 것으로 여겨지는데, 이는 바레니클린이 이러한 수용체에 결합하여 작용제 활성을 생성하는 동시에 니코틴이 이러한 수용체에 결합하는 것을 방지하기 때문입니다.
in vitro 전기생리학 연구와 in vivo 신경화학 연구는 바레니클린이 α4β2 뉴런성 니코틴성 아세틸콜린 수용체에 결합하여 수용체 매개 활성을 자극하지만, 니코틴보다 훨씬 낮은 수준임을 보여주었습니다. 바레니클린은 니코틴이 α4β2 수용체를 활성화하고 따라서 중추 신경계 중뇌변연계 도파민 시스템을 자극하는 능력을 차단하는데, 이는 흡연 시 경험하는 강화 및 보상의 신경 기전으로 여겨집니다. 바레니클린은 매우 선택적이며 다른 일반적인 니코틴성 수용체(>500배 α3β4, >3,500배 α7, >20,000배 α1βγδ) 또는 비니코틴성 수용체 및 수송체(>2,000배)보다 α4β2 수용체에 더 강력하게 결합합니다. 바레니클린은 5-HT3 수용체에도 중간 정도의 친화력(Ki = 350 nM)으로 결합합니다.
12.3 약동학
흡수
바레니클린의 최대 혈장 농도는 일반적으로 경구 투여 후 3~4시간 이내에 나타납니다. 바레니클린의 여러 경구 용량을 투여한 후 4일 이내에 정상 상태에 도달했습니다. 권장 용량 범위에서 바레니클린은 단회 또는 반복 투여 후 선형 약동학을 나타냅니다.
질량 균형 연구에서 바레니클린의 흡수는 경구 투여 후 사실상 완전했으며 전신 이용률은 약 90%였습니다.
특정 집단
특정 약동학 연구 및 모집단 약동학 분석에서 나타난 바와 같이, 연령, 인종, 성별, 흡연 상태 또는 동시 투여 약물 사용으로 인한 바레니클린 약동학의 임상적으로 의미 있는 차이는 없습니다.
연령: 노인 환자
단회 및 다회 투여 약동학 연구를 종합한 결과, 7일 연속으로 1일 1회 또는 1일 2회 1mg 바레니클린을 투여받은 16명의 건강한 고령 남녀 흡연자(65~75세)의 약동학적 특성은 젊은 피험자와 유사했습니다.
신장 장애
경도 신장 장애 환자(추정 크레아티닌 청소율 >50 mL/min 및 ≤80 mL/min)의 바레니클린 약동학은 변화가 없었습니다. 중등도 신장 장애 환자(추정 크레아티닌 청소율 ≥30 mL/min 및 ≤50 mL/min)의 경우 정상 신장 기능 환자(추정 크레아티닌 청소율 >80 mL/min)에 비해 바레니클린 노출이 1.5배 증가했습니다. 중증 신장 장애 환자(추정 크레아티닌 청소율 <30 mL/min)의 경우 바레니클린 노출이 2.1배 증가했습니다. 1주일에 3일 동안 3시간의 혈액 투석을 받는 말기 신부전(ESRD) 환자의 경우, 12일 동안 1일 0.5mg를 투여한 후 바레니클린 노출이 2.7배 증가했습니다. 이 환경에서 관찰된 바레니클린의 혈장 Cmax 및 AUC는 1일 2회 1mg을 투여받은 건강한 피험자의 수치와 유사했습니다 [용법 및 용량 (2.2), 특정 집단에서의 사용 (8.6) 참조]. 또한, ESRD 환자의 경우 바레니클린은 혈액 투석으로 효율적으로 제거되었습니다 [과량 투여 (10) 참조].
약물 상호작용
In vitro 연구 결과, 바레니클린은 다음의 cytochrome P450 효소를 억제하지 않는 것으로 나타났습니다 (IC50 >6400 ng/mL): 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 및 3A4/5. 또한, 사람의 간세포를 이용한 in vitro 연구에서 바레니클린은 cytochrome P450 효소 1A2 및 3A4를 유도하지 않았습니다.
In vitro 연구 결과, 바레니클린은 치료 농도에서 사람의 신장 수송 단백질을 억제하지 않는 것으로 나타났습니다. 따라서, 신장 분비를 통해 배설되는 약물 (예: 메트포르민 [아래 참조])은 바레니클린의 영향을 받을 가능성이 적습니다.
In vitro 연구 결과, 바레니클린의 능동적 신장 분비는 사람의 유기 양이온 수송체 OCT2에 의해 매개되는 것으로 나타났습니다. OCT2 억제제 (예: 시메티딘 [아래 참조])와 병용 투여하는 경우, CHANTIX에 대한 전신 노출 증가가 임상적으로 의미 있는 수준이 아닐 것으로 예상되므로 CHANTIX의 용량 조절이 필요하지 않을 수 있습니다. 또한, 바레니클린 대사는 전체 청소율의 10% 미만을 차지하므로, cytochrome P450 시스템에 영향을 미치는 것으로 알려진 약물은 CHANTIX의 약동학적 특성을 변경할 가능성이 적습니다 [임상 약리 (12.3) 참조]; 따라서 CHANTIX의 용량 조절은 필요하지 않습니다.
바레니클린과 디곡신, 와파린, 경피 니코틴, 부프로피온, 시메티딘 및 메트포르민을 이용한 약물 상호작용 연구가 수행되었습니다. 임상적으로 의미 있는 약물 상호작용은 확인되지 않았습니다.
흡연자 30명에게 병용 투여한 결과, 바레니클린 (1mg, 1일 2회)은 OCT2 기질인 메트포르민 (500mg, 1일 2회)의 정상 상태 약동학적 특성을 변화시키지 않았습니다. 메트포르민은 바레니클린의 정상 상태 약동학적 특성에 영향을 미치지 않았습니다.
흡연자 12명에게 OCT2 억제제인 시메티딘 (300mg, 1일 4회)을 바레니클린 (2mg, 단회 용량)과 병용 투여한 결과, 바레니클린의 신장 청소율 감소로 인해 바레니클린의 전신 노출이 29% 증가했습니다 (90% CI: 21.5%, 36.9%).
와파린
흡연자 24명에게 바레니클린 (1mg, 1일 2회)을 (R, S)-와파린 (25mg, 단회 용량)과 병용 투여한 결과, 와파린의 약동학적 특성은 변화하지 않았습니다. 프로트롬빈 시간 (INR)은 바레니클린의 영향을 받지 않았습니다. 금연 자체가 와파린 약동학적 특성의 변화를 초래할 수 있습니다 [약물 상호작용 (7.2) 참조].
다른 금연 치료제와의 병용
부프로피온: 흡연자 46명에게 바레니클린 (1mg, 1일 2회)을 부프로피온 (150mg, 1일 2회)과 병용 투여한 결과, 부프로피온의 정상 상태 약동학적 특성은 변화하지 않았습니다 [약물 상호작용 (7.1) 참조].
NRT: 바레니클린 (1mg, 1일 2회)과 경피 니코틴 (21mg/일)을 최대 12일 동안 병용 투여한 결과, 니코틴의 약동학적 특성에는 영향을 미치지 않았지만, 부작용 발생률은 NRT 단독 투여군보다 병용 투여군에서 더 높았습니다 [약물 상호작용 (7.1) 참조].
13 비임상 독성학
13.1 비임상 독성학
발암성
CD-1 마우스와 Sprague-Dawley 랫드에서 평생 발암성 연구가 수행되었습니다. 최대 20mg/kg/day(AUC 기준 최대 권장 인간 1일(MRHD) 노출량의 47배) 용량으로 2년 동안 경구 위관 영양법으로 바레니클린을 투여한 마우스에서 발암 효과의 증거는 없었습니다. 랫드에게 2년 동안 경구 위관 영양법으로 바레니클린(1, 5, 15mg/kg/day)을 투여했습니다. 수컷 랫드(n = 용량 그룹당 성별당 65마리)에서 갈색 지방종(갈색 지방의 종양) 발생률이 중간 용량(1개 종양, 5mg/kg/day, AUC 기준 MRHD 노출량의 23배) 및 최대 용량(2개 종양, 15mg/kg/day, AUC 기준 MRHD 노출량의 67배)에서 증가했습니다. 이 발견의 인간에 대한 임상적 관련성은 확립되지 않았습니다. 암컷 랫드에서는 발암성의 증거가 없었습니다.
돌연변이 유발
바레니클린은 대사 활성화 유무에 관계없이 다음 분석에서 유전독성이 없었습니다. 에임즈 박테리아 돌연변이 분석; 포유류 CHO/HGPRT 분석; 랫드 골수에서 생체 내 및 인간 림프구에서 시험관 내 염색체 이상 검사.
생식력 손상
최대 15mg/kg/day(1mg 1일 2회에서 AUC 기준 MRHD 노출량의 각각 67배 및 36배)까지 바레니클린 숙시네이트를 투여한 수컷 또는 암컷 Sprague-Dawley 랫드에서 생식력 손상의 증거는 없었습니다. 체중 증가 감소를 특징으로 하는 모체 독성이 15mg/kg/day에서 관찰되었습니다. 그러나 15mg/kg/day의 경구 용량으로 바레니클린 숙시네이트를 투여받은 임신 랫드의 새끼에서 생식력 감소가 나타났습니다. 치료받은 암컷 랫드 새끼의 이러한 생식력 감소는 3mg/kg/day(1mg 1일 2회에서 AUC 기준 MRHD 노출량의 9배)의 경구 용량에서는 명확하지 않았습니다.
14 CLINICAL STUDIES
CHANTIX의 금연 효과는 총 3659명의 만성 흡연자(하루 10개비 이상 흡연)를 대상으로 한 6건의 임상 시험에서 입증되었습니다. 모든 임상 연구에서 금연 여부는 환자의 자가 보고에 의해 결정되었으며, 매주 방문 시 일산화탄소 배출량 측정(CO≤10 ppm)을 통해 검증되었습니다. 이러한 연구에 참여한 CHANTIX 치료 환자 중 완료율은 65%였습니다. 용량 범위 연구(연구 1) 및 금연 유지 연구(연구 6)를 제외하고 환자는 12주 동안 치료를 받았으며 치료 후 40주 동안 추적 관찰되었습니다. 이러한 시험에 참여한 환자 대부분은 백인이었습니다(79~96%). 모든 연구에는 거의 동일한 수의 남성과 여성이 참여했습니다. 이러한 연구에 참여한 환자의 평균 연령은 43세였습니다. 환자들은 평균적으로 하루 약 21개비의 담배를 약 25년 동안 피웠습니다. 환자들은 금연 날짜(목표 금연일)를 정했으며, 투약은 이 날짜 1주일 전에 시작되었습니다.
7건의 추가 연구에서는 심혈관 질환 환자, 만성 폐쇄성 폐 질환 환자 [임상 연구 (14.7) 참조], 치료 8일과 35일 사이에 금연일을 선택하도록 지시받은 환자 [임상 연구 (14.4) 참조], 주요 우울 장애 환자 [임상 연구 (14.9) 참조], 이전에 CHANTIX를 사용하여 금연을 시도했지만 성공하지 못했거나 치료 후 재발한 환자 [임상 연구 (14.6) 참조], 시판 후 신경 정신과적 안전성 결과 시험에 참여한 정신 질환 병력이 없는 또는 있는 환자 [경고 및 주의 사항 (5.1), 임상 연구 (14.10) 참조], 그리고 갑자기 금연할 수 없거나 원하지 않고 점진적으로 금연하도록 지시받은 환자 [임상 연구 (14.5) 참조]에서 CHANTIX의 효과를 평가했습니다.
모든 연구에서 환자에게는 금연에 대한 교육 소책자가 제공되었으며, Agency for Healthcare Research and Quality 지침에 따라 매주 치료 방문 시 최대 10분 동안 금연 상담을 받았습니다.
14.1 금연 시작
연구 1
이것은 CHANTIX와 위약을 비교한 6주간의 용량 범위 연구였습니다. 이 연구는 하루 1mg 또는 2mg의 총 용량으로 CHANTIX가 금연 보조제로 효과적이라는 초기 증거를 제공했습니다.
연구 2
627명의 환자를 대상으로 한 이 연구에서는 하루 1mg과 2mg의 CHANTIX를 위약과 비교했습니다. 환자는 12주 동안 치료를 받았고(1주일 적정 기간 포함) 치료 후 40주 동안 추적 관찰되었습니다. CHANTIX는 1일 2회 분할 투여되었습니다. CHANTIX의 각 용량은 초기 용량 적정 유무에 따라 두 가지 다른 요법으로 투여되어 서로 다른 투여 요법이 내약성에 미치는 영향을 조사했습니다. 적정군의 경우, 1주일 동안 용량이 적정되었으며, 2주차부터는 최대 용량으로 투여되었습니다. 적정군과 비적정군은 효능 분석을 위해 통합되었습니다.
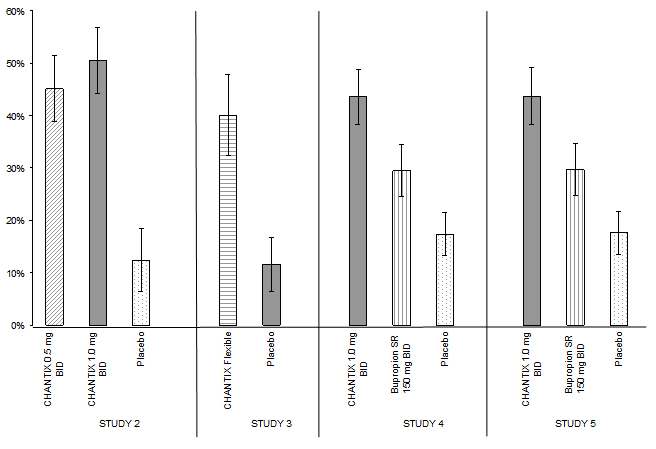
CHANTIX 1mg/일(0.5mg 2회/일)을 투여받은 환자의 45%와 2mg/일(1mg 2회/일)을 투여받은 환자의 51%는 9~12주 동안 CO로 확인된 지속적인 금연을 보였으며, 위약군은 12%였습니다(그림 1). 또한, 1mg/일 투여군의 31%와 2mg/일 투여군의 31%는 TQD 후 1주일부터 치료 종료까지 지속적으로 금연을 유지한 반면, 위약군은 8%였습니다.
연구 3
312명의 환자를 대상으로 한 이 유연 용량 연구에서는 환자 주도적 CHANTIX 또는 위약 투여 전략의 효과를 조사했습니다. 1일 0.5mg 2회 투여 용량으로 1주일간 초기 적정을 실시한 후, 환자는 1일 0.5mg 1회부터 1일 1mg 2회까지 원하는 대로 용량을 조절할 수 있었습니다. 연구 기간 중 언제든지 최대 허용 용량으로 적정한 환자는 69%였습니다. 환자의 44%는 가장 많이 선택한 용량이 1일 1mg 2회였으며, 연구 참가자의 절반 이상은 가장 많이 선택한 용량이 1mg/일 이하였습니다.
CHANTIX로 치료받은 환자 중 40%는 9~12주 동안 CO로 확인된 지속적인 금연을 보였으며, 위약군은 12%였습니다. 또한, CHANTIX군의 29%는 TQD 후 1주일부터 치료 종료까지 지속적으로 금연을 유지한 반면, 위약군은 9%였습니다.
연구 4 및 연구 5
이러한 동일한 이중맹검 연구에서는 하루 2mg의 CHANTIX, 부프로피온 서방형(SR) 1일 150mg 2회 및 위약을 비교했습니다. 환자는 12주 동안 치료를 받았고 치료 후 40주 동안 추적 관찰되었습니다. 1일 1mg 2회의 CHANTIX 용량은 처음 3일 동안 1일 0.5mg 1회, 그 다음 4일 동안 1일 0.5mg 2회 적정하여 달성했습니다. 1일 150mg 2회의 부프로피온 SR 용량은 3일 동안 1일 150mg 1회 적정하여 달성했습니다. 연구 4에는 1022명의 환자가, 연구 5에는 1023명의 환자가 참여했습니다. 부프로피온 치료에 부적절하거나 이전에 부프로피온을 사용한 환자는 제외되었습니다.
연구 4에서 CHANTIX로 치료받은 환자는 9~12주 동안 CO로 확인된 금연율(44%)이 부프로피온 SR(30%) 또는 위약(17%)으로 치료받은 환자보다 우수했습니다. 부프로피온 SR 금연율 또한 위약보다 우수했습니다. 또한, CHANTIX군의 29%는 TQD 후 1주일부터 치료 종료까지 지속적으로 금연을 유지한 반면, 위약군은 12%, 부프로피온 SR군은 23%였습니다.
연구 5에서도 CHANTIX로 치료받은 환자는 부프로피온 SR(30%) 또는 위약(18%)으로 치료받은 환자에 비해 9주에서 12주 사이에 CO로 확인된 금연율이 더 높았습니다(44%). 부프로피온 SR의 금연율 또한 위약보다 높았습니다. 또한, CHANTIX 그룹의 29%는 TQD 후 1주일부터 치료 종료 시까지 지속적으로 금연한 반면, 위약 그룹은 11%, 부프로피온 SR 그룹은 21%였습니다.
| CHANTIX 0.5mg 1일 2회 |
CHANTIX 1mg 1일 2회 |
CHANTIX 유연 용법 |
Bupropion SR | 위약 | |
|---|---|---|---|---|---|
| 1일 2회 = 1일 2회 복용 | |||||
|
연구 2 |
45% |
51% |
12% |
||
|
연구 3 |
40% |
12% |
|||
|
연구 4 |
44% |
30% |
17% |
||
|
연구 5 |
44% |
30% |
18% |
||
14.3 장기 금연
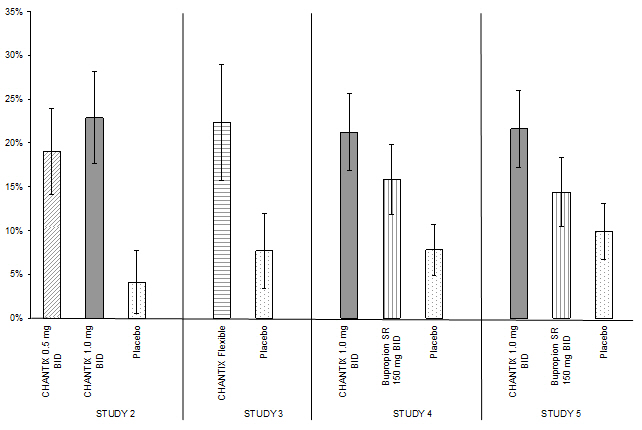
연구 1~5에는 40주간의 치료 후 추적 관찰이 포함되었습니다. 각 연구에서 CHANTIX로 치료받은 환자는 위약으로 치료받은 환자보다 추적 관찰 기간 동안 금연을 유지할 가능성이 더 높았습니다(그림 2, 표 8).
| CHANTIX 0.5mg 1일 2회 |
CHANTIX 1mg 1일 2회 |
CHANTIX 유연 용법 |
Bupropion SR | Placebo | |
|---|---|---|---|---|---|
| BID = 1일 2회 | |||||
|
연구 2 |
19% |
23% |
4% |
||
|
연구 3 |
22% |
8% |
|||
|
연구 4 |
21% |
16% |
8% |
||
|
연구 5 |
22% |
14% |
10% |
||
연구 6
본 연구는 추가 12주간의 CHANTIX 치료가 장기간 금연 가능성에 미치는 영향을 평가했습니다. 본 연구(N=1927)의 환자들은 12주 동안 공개적으로 CHANTIX 1mg을 1일 2회 복용했습니다. 12주차까지 최소 1주일 동안 금연한 환자(N=1210)는 이후 CHANTIX(1mg 1일 2회) 또는 위약으로 추가 12주 동안 이중맹검 치료를 받았으며, 그 후 28주 동안 치료 후 추적 관찰을 받았습니다.
13주차부터 24주차까지의 지속적 금연율은 CHANTIX 치료를 계속한 환자(70%)가 위약으로 바꾼 환자(50%)보다 높았습니다. 위약에 대한 우월성은 치료 후 28주 추적 관찰 기간에도 유지되었습니다(CHANTIX 54% 대 위약 39%).
아래 그림 3에서 x축은 각 관찰에 대한 연구 주차를 나타내며, CHANTIX 중단 후 유사한 시점의 그룹을 비교할 수 있도록 합니다. CHANTIX 후 추적 관찰은 위약 그룹의 경우 13주차에, CHANTIX 그룹의 경우 25주차에 시작됩니다. y축은 CHANTIX 치료의 마지막 주 동안 금연했고 주어진 시점에서 금연 상태를 유지한 환자의 비율을 나타냅니다.
14.4 금연 날짜 설정을 위한 대체 지침
CHANTIX는 환자들에게 치료 8일차부터 35일차 사이에 목표 금연 날짜를 선택하도록 지시한 이중맹검, 위약 대조 시험에서 평가되었습니다. 피험자들은 12주간의 치료를 위해 3:1의 비율로 CHANTIX 1mg 1일 2회 복용군 (N=486) 또는 위약군 (N=165)에 무작위 배정되었으며, 치료 후 12주 동안 추가적으로 추적 관찰되었습니다. CHANTIX로 치료받은 환자들은 9주차부터 12주차까지 (54%) 위약으로 치료받은 환자들 (19%)에 비해, 그리고 9주차부터 24주차까지 (35%) 위약으로 치료받은 피험자들 (13%)에 비해 CO 확인 금연율이 더 높았습니다.
14.5 금연을 위한 점진적 접근법
CHANTIX는 4주 이내에 금연할 수 없거나 하려고 하지 않지만, 금연 전 12주 동안 흡연량을 점진적으로 줄이려는 1,510명의 피험자를 대상으로 한 52주 이중맹검 위약 대조 연구에서 평가되었습니다. 피험자들은 24주 동안 CHANTIX 1mg 1일 2회 복용군 (N=760) 또는 위약군 (N=750)에 무작위 배정되었으며, 치료 후 52주차까지 추적 관찰되었습니다. 피험자들은 치료 첫 4주차 말까지 흡연량을 최소 50% 줄이도록 지시받았으며, 4주차부터 8주차까지 추가로 50% 감소시켜 12주차까지 완전 금연을 목표로 했습니다. 초기 12주 감소 단계 후, 피험자들은 추가로 12주 동안 치료를 계속했습니다. CHANTIX로 치료받은 피험자들은 15주차부터 24주차 (32% 대 7%) 및 15주차부터 52주차 (24% 대 6%)까지 위약에 비해 유의하게 높은 지속적 금연율을 보였습니다.
14.6 재치료 연구
CHANTIX는 이전에 CHANTIX를 사용하여 금연을 시도했지만 금연에 성공하지 못하거나 치료 후 재발한 환자들을 대상으로 한 이중맹검, 위약 대조 시험에서 평가되었습니다. 피험자들은 12주간의 치료를 위해 1:1의 비율로 CHANTIX 1mg 1일 2회 복용군 (N=249) 또는 위약군 (N=245)에 무작위 배정되었으며, 치료 후 40주 동안 추적 관찰되었습니다. 이 연구에 포함된 환자들은 연구 참여 3개월 전에 최소 2주간의 총 치료 기간 동안 과거에 금연 시도를 위해 CHANTIX를 복용했으며, 최소 4주 동안 흡연을 해왔습니다.
CHANTIX로 치료받은 환자들은 9주차부터 12주차까지 (45%) 위약으로 치료받은 환자들 (12%)에 비해, 그리고 9주차부터 52주차까지 (20%) 위약으로 치료받은 피험자들 (3%)에 비해 CO 확인 금연율이 더 높았습니다.
| 9주차부터 12주차 | 9주차부터 52주차 | |||
|---|---|---|---|---|
| CHANTIX 1mg 1일 2회 |
위약 | CHANTIX 1mg 1일 2회 |
위약 | |
| 1일 2회 = 1일 2회 복용 | ||||
|
재치료 연구 |
45% |
12% |
20% |
3% |
14.7 만성 폐쇄성 폐질환 환자
CHANTIX는 35세 이상의 경증~중등도 COPD 환자(기관지확장제 사용 후 FEV1/FVC <70% 및 예측 정상치의 FEV1 ≥ 50%)를 대상으로 한 무작위, 이중맹검, 위약 대조 연구에서 평가되었습니다. 피험자들은 12주 동안 CHANTIX 1mg 1일 2회 복용군(N=223) 또는 위약군(N=237)에 무작위 배정되었으며, 이후 40주 동안 치료 후 추적 관찰되었습니다. CHANTIX 치료군은 위약 치료군에 비해 9주차부터 12주차까지(41% 대 9%) 그리고 9주차부터 52주차까지(19% 대 6%) CO 확인 금연율이 더 높았습니다.
| 9주차~12주차 | 9주차~52주차 | |||
|---|---|---|---|---|
| CHANTIX 1mg 1일 2회 |
위약 | CHANTIX 1mg 1일 2회 |
위약 | |
| 1일 2회 = BID | ||||
|
COPD 연구 |
41% |
9% |
19% |
6% |
14.8 심혈관 질환 환자 및 기타 심혈관 분석
CHANTIX는 2개월 이상 안정적으로 진단된 심혈관 질환(고혈압 이외 또는 고혈압 추가 진단)이 있는 35~75세 피험자를 대상으로 한 무작위, 이중맹검, 위약 대조 연구에서 평가되었습니다. 피험자들은 12주 동안 CHANTIX 1mg 1일 2회 복용군(N=353) 또는 위약군(N=350)에 무작위 배정되었으며, 이후 40주 동안 치료 후 추적 관찰되었습니다. CHANTIX 치료군은 위약 치료군에 비해 9주차부터 12주차까지(47% 대 14%) 그리고 9주차부터 52주차까지(20% 대 7%) CO 확인 금연율이 더 높았습니다.
| 9주차~12주차 | 9주차~52주차 | |||
|---|---|---|---|---|
| CHANTIX 1mg 1일 2회 |
위약 | CHANTIX 1mg 1일 2회 |
위약 | |
| 1일 2회 = BID | ||||
|
CVD 연구 |
47% |
14% |
20% |
7% |
본 연구에서, 모든 원인 및 심혈관 사망률은 CHANTIX로 치료받은 환자에서 더 낮았지만, 특정 비치명적 심혈관계 사건은 위약 치료 환자보다 CHANTIX로 치료받은 환자에서 더 빈번하게 발생했습니다 [경고 및 주의사항 (5.5), 유해 반응 (6.1) 참조]. 아래 표 12는 CHANTIX군과 위약군을 비교하여 CHANTIX군에서 더 빈번하게 발생한 사망률 및 선택된 비치명적 심각한 심혈관계 사건의 발생률을 보여줍니다. 이러한 사건들은 독립적인 맹검 위원회에 의해 판정되었습니다. 나열되지 않은 비치명적 심각한 심혈관계 사건은 위약군에서 동일한 발생률 또는 더 높은 발생률로 발생했습니다. 동일한 유형의 심혈관계 사건이 두 개 이상 발생한 환자는 행당 한 번만 계산됩니다. 관상동맥 재관류술이 필요했던 환자 중 일부는 비치명적 심근경색 및 협심증 입원 치료의 일환으로 시술을 받았습니다.
| 사망률 및 심혈관계 사건 | CHANTIX (N=353) n (%) |
위약 (N=350) n (%) |
|---|---|---|
|
사망률 (52주까지 심혈관 및 모든 원인) |
||
|
심혈관계 |
1 (0.3) |
2 (0.6) |
|
모든 원인 |
2 (0.6) |
5 (1.4) |
|
|
||
|
비치명적 심혈관계 사건 (CHANTIX 발생률 > 위약) |
||
|
치료 후 30일까지 |
||
|
비치명적 심근경색 |
4 (1.1) |
1 (0.3) |
|
비치명적 뇌졸중 |
2 (0.6) |
0 (0) |
|
치료 후 30일 초과 및 52주까지 |
||
|
비치명적 심근경색 |
3 (0.8) |
2 (0.6) |
|
관상동맥 재관류술 필요 |
7 (2.0) |
2 (0.6) |
|
협심증 입원 |
6 (1.7) |
4 (1.1) |
|
일과성 허혈 발작 |
1 (0.3) |
0 (0) |
|
말초혈관질환(PVD) 신규 진단 또는 PVD 시술 입원 |
5 (1.4) |
2 (0.6) |
심혈관질환 연구 이후, 7002명의 환자(CHANTIX 4190명, 위약 2812명)를 포함한 ≥12주 치료 기간의 15건의 임상 시험에 대한 메타 분석을 실시하여 CHANTIX의 심혈관 안전성을 체계적으로 평가했습니다. 위에 설명된 안정적인 심혈관 질환 환자를 대상으로 한 연구는 메타 분석에 포함되었습니다. 메타 분석에서 CHANTIX군은 위약군에 비해 모든 원인 사망률(CHANTIX 6명 [0.14%]; 위약 7명 [0.25%]) 및 심혈관 사망률(CHANTIX 2명 [0.05%]; 위약 2명 [0.07%])이 더 낮았습니다.
주요 심혈관 안전성 분석에는 심혈관 사망, 비치명적 심근경색 및 비치명적 뇌졸중으로 정의된 주요 심혈관계 사건(MACE)의 복합 종점의 발생 및 시기가 포함되었습니다. 이 종점에 포함된 사건은 맹검된 독립 위원회에 의해 판정되었습니다. 전반적으로 표 13에 설명된 바와 같이 메타 분석에 포함된 시험에서 소수의 MACE가 발생했습니다. 이러한 사건은 주로 알려진 심혈관 질환이 있는 환자에게서 발생했습니다.
| CHANTIX N=4190 |
위약 N=2812 |
|
|---|---|---|
|
||
|
MACE 사례, n (%) |
13 (0.31%) |
6 (0.21%) |
|
환자-연 노출 |
1316 |
839 |
|
위험 비 (95% CI) |
||
|
1.95 (0.79, 4.82) |
||
|
1,000 환자-연당 발생률 차이 (95% CI) |
||
|
6.30 (-2.40, 15.10) |
||
메타 분석 결과 CHANTIX에 노출된 환자의 MACE 위험비는 치료 후 최대 30일까지 1.95 (95% 신뢰구간 0.79~4.82)였으며, 이는 노출 환자 1,000명-연당 약 6.3건의 MACE 증가에 해당합니다. 메타 분석 결과, 다양한 기간 및 사전에 지정된 민감도 분석(다양한 연구 그룹 및 심혈관계 질환 결과 포함)에서 위약 대비 CHANTIX 복용 환자의 심혈관계 질환 종점 발생률이 더 높은 것으로 나타났습니다. 이러한 결과는 통계적으로 유의미하지 않았지만 일관성이 있었습니다. 전반적으로 사건 수가 적었기 때문에 이 정도 규모의 신호에서 통계적으로 유의미한 차이를 발견할 수 있는 검정력이 낮습니다.
또한, 시판 후 신경정신과 안전성 결과 연구에 심혈관계 질환 종점 분석이 추가되었으며, 비치료 연장도 포함되었습니다. [경고 및 주의사항 (5.5), 유해 반응 (6.1), 임상 연구 (14.10) 참조]
14.9 주요 우울 장애 환자
CHANTIX는 정신병적 특징이 없는 주요 우울 장애(DSM-IV TR) 환자 18~75세를 대상으로 한 무작위, 이중맹검, 위약 대조 연구에서 평가되었습니다. 약물을 복용 중인 경우, 피험자는 최소 2개월 동안 안정적인 항우울제 요법을 받아야 했습니다. 약물을 복용하지 않은 경우, 피험자는 지난 2년 동안 주요 우울 에피소드를 경험했고 성공적으로 치료를 받았어야 했습니다. 피험자는 12주간 CHANTIX 1mg 1일 2회(N=256) 또는 위약(N=269) 투여군에 무작위 배정되었으며, 그 후 치료 후 40주 동안 추적 관찰되었습니다. CHANTIX로 치료받은 피험자는 9주차부터 12주차까지 CO 확인 금단율이 위약 치료 피험자(16%)에 비해 우수했으며(36%), 9주차부터 52주차까지도 위약 치료 피험자(10%)에 비해 우수했습니다(20%).
| 9주차~12주차 | 9주차~52주차 | |||
|---|---|---|---|---|
| CHANTIX 1mg 1일 2회 |
위약 | CHANTIX 1mg 1일 2회 |
위약 | |
| 1일 2회 = 1일 2회 | ||||
|
MDD 연구 |
36% |
16% |
20% |
10% |
14.10 시판 후 신경정신과적 안전성 결과 시험
CHANTIX는 정신과적 장애의 병력이 없는 피험자(비정신과 코호트, N=3912)와 정신과적 장애의 병력이 있는 피험자(정신과 코호트, N=4003)를 포함하는 무작위 배정, 이중맹검, 활성 대조 및 위약 대조 시험에서 평가되었습니다. 하루 10개 이상의 담배를 피우는 18~75세 피험자는 CHANTIX 1mg BID, 부프로피온 SR 150mg BID, NRT 패치 21mg/day(감량 포함) 또는 위약에 1:1:1:1로 무작위 배정되어 12주간 치료를 받았습니다. 그 후 치료 후 12주 동안 추적 관찰되었습니다. [경고 및 주의사항 (5.1) 참조]
임상적으로 유의미한 신경정신과적(NPS) 이상 반응을 포착하기 위한 복합 안전성 평가 종점에는 다음과 같은 NPS 이상 반응이 포함되었습니다: 불안, 우울증, 이상 감각, 적대감, 불안정, 공격성, 망상, 환각, 살인 충동, 조증, 공황, 편집증, 정신병, 과민성, 자살 충동, 자살 행동 또는 자살 완료.
표 15에 나타난 바와 같이, 비정신과 코호트에서 CHANTIX, 부프로피온 및 NRT의 사용은 위약과 비교하여 임상적으로 유의미한 NPS 이상 반응의 위험 증가와 관련이 없었습니다. 마찬가지로, 비정신과 코호트에서 CHANTIX의 사용은 부프로피온 또는 NRT와 비교하여 복합 안전성 평가 종점에서 임상적으로 유의미한 NPS 이상 반응의 위험 증가와 관련이 없었습니다.
| CHANTIX (N=975) n (%) |
부프로피온 (N=968) n (%) |
NRT (N=987) n (%) |
위약 (N=982) n (%) |
|
|---|---|---|---|---|
|
임상적으로 유의미한 NPS |
30 (3.1) |
34 (3.5) |
33 (3.3) |
40 (4.1) |
|
중대한 NPS |
1 (0.1) |
5 (0.5) |
1 (0.1) |
4 (0.4) |
|
정신과적 입원 |
1 (0.1) |
2 (0.2) |
0 (0.0) |
1 (0.1) |
표 16에 나타난 바와 같이, 정신과 병력이 있는 환자군에서는 비정신과 환자군과 비교하여 각 치료군에서 임상적으로 유의미한 NPS 이상 사례가 더 많이 보고되었습니다. 합성 평가변수의 사건 발생률은 위약에 비해 각 활성 치료제에서 더 높았습니다: 위약 대비 위험 차이 (RD) (95%CI)는 CHANTIX의 경우 2.7% (-0.05, 5.4), 부프로피온의 경우 2.2% (-0.5, 4.9), NRT 경피 니코틴의 경우 0.4% (-2.2, 3.0)였습니다.
| CHANTIX (N=1007) n (%) |
부프로피온 (N=1004) n (%) |
NRT (N=995) n (%) |
위약 (N=997) n (%) |
|
|---|---|---|---|---|
|
임상적으로 유의미한 NPS |
123 (12.2) |
118 (11.8) |
98 (9.8) |
95 (9.5) |
|
심각한 NPS |
6 (0.6) |
8 (0.8) |
4 (0.4) |
6 (0.6) |
|
정신과 입원 |
5 (0.5) |
8 (0.8) |
4 (0.4) |
2 (0.2) |
비정신과 환자군에서 위약 치료 환자 1명에게서 치료 중 자살 사례가 1건 있었습니다. 정신과 환자군에서는 자살 사례가 보고되지 않았습니다.
두 환자군 모두에서 CHANTIX로 치료받은 대상자는 부프로피온, 니코틴 패치 및 위약으로 치료받은 대상자에 비해 9주에서 12주 및 9주에서 24주 동안 CO 확인 금단율이 더 높았습니다.
| CHANTIX 1mg 1일 2회 |
부프로피온 SR 150mg 1일 2회 |
NRT 21mg/일, 감량 |
위약 | |
|---|---|---|---|---|
| 1일 2회 = 1일 2회 복용 | ||||
|
9주~12주 |
||||
|
비정신과 환자군 |
38% |
26% |
26% |
14% |
|
정신과 환자군 |
29% |
19% |
20% |
11% |
|
9주~24주 |
||||
|
비정신과 환자군 |
25% |
19% |
18% |
11% |
|
정신과 환자군 |
18% |
14% |
13% |
8% |
심혈관계 결과 분석
CHANTIX의 심혈관계 위험에 대한 또 다른 데이터 출처를 얻기 위해, 시판 후 신경정신과 안전성 결과 연구에 심혈관계 종점 분석이 추가되었고, 비치료 연장 연구도 함께 진행되었습니다. 모집단 연구(N=8027)에서, 하루 10개 이상의 담배를 피우는 18~75세 피험자들을 CHANTIX 1mg BID, 부프로피온 SR 150mg BID, 니코틴 대체 요법(NRT) 패치 21mg/day 또는 위약에 1:1:1:1로 무작위 배정하여 12주간 치료하였습니다. 그 후 치료 후 12주 동안 추적 관찰하였습니다. 연장 연구에는 모집단 연구에서 무작위 배정되어 치료받은 8027명의 피험자 중 4590명(57.2%)이 등록하여 추가로 28주 동안 추적 관찰하였습니다. 모든 치료받은 피험자 중 1743명(21.7%)은 중간 심혈관계 위험군에 속했고, 640명(8.0%)은 Framingham 점수에 따라 고위험군에 속했습니다. 모집단 연구의 한 연구 기관은 심혈관계 안전성 평가에서 제외되었고, 두 연구 기관은 신경정신과 안전성 평가에서 제외되었다는 점에 유의하십시오.
1차 심혈관계 종점은 주요 심혈관계 유해 사건(MACE) 발생 시점이었으며, 이는 치료 중 심혈관계 사망, 비치명적 심근 경색 또는 비치명적 뇌졸중으로 정의되었습니다. 사망 및 심혈관계 사건은 눈가림된 독립 위원회에 의해 판정되었습니다. 아래 표 18은 모집단 연구에서 연구 치료의 적어도 1회 부분 용량에 노출된 모든 무작위 배정된 피험자에 대한 MACE 발생률과 위약 대비 위험비를 보여줍니다.
| CHANTIX N=2006 |
부프로피온 N=1997 |
NRT N=2017 |
위약 N=2007 |
|
|---|---|---|---|---|
| [IR]은 1000인년당 발생률을 나타냅니다 | ||||
|
치료 중* |
||||
|
MACE, n [IR] |
1 [2.4] |
2 [4.9] |
1 [2.4] |
4 [9.8] |
|
위약 대비 위험비 (95% CI) |
0.24 |
0.49 |
0.24 |
|
|
연구 종료 시까지† |
||||
|
MACE, n [IR] |
3 [2.1] |
9 [6.3] |
6 [4.3] |
8 [5.7] |
|
위약 대비 위험비 (95% CI) |
0.36 |
1.09 |
0.74 |
|
본 연구에서 MACE+는 모든 MACE 또는 새로운 발병 또는 악화된 말초혈관질환(PVD)로서 중재가 필요하거나, 관상동맥 재관류술이 필요하거나, 불안정형 협심증으로 입원한 경우로 정의되었습니다. 모 연구에서 연구 치료의 적어도 1회 부분 용량에 노출된 모든 무작위 대상자에 대한 모든 치료군의 치료 기간 및 연구 종료 시점까지의 MACE+ 및 모든 원인 사망의 발생률은 아래 표 19에 나와 있습니다.
| CHANTIX N=2006 |
Bupropion N=1997 |
NRT N=2017 |
Placebo N=2007 |
|
|---|---|---|---|---|
| [IR]은 1,000인년당 발생률을 나타냅니다 | ||||
|
치료 기간 중* |
||||
|
MACE+, n [IR] |
5 [12.1] |
4 [9.9] |
2 [4.8] |
5 [12.2] |
|
모든 원인 사망, n [IR] |
0 |
2 [4.9] |
0 |
2 [4.9] |
|
연구 종료 시점까지† |
||||
|
MACE+, n [IR] |
10 [6.9] |
15 [10.5] |
10 [7.1] |
12 [8.6] |
|
모든 원인 사망, n [IR] |
2 [1.4] |
4 [2.8] |
3 [2.1] |
4 [2.9] |
CHANTIX로 치료받은 환자보다 위약으로 치료받은 환자에서 MACE, MACE+ 및 모든 원인 사망을 경험한 대상자 수가 비슷하거나 적었습니다. 전반적으로 관찰된 사건 수가 너무 적어 치료군 간의 의미 있는 차이를 구별하기 어려웠습니다.
16 제공/보관 및 취급 방법
CHANTIX는 0.5mg 및 1mg 두 가지 용량의 경구 투여용으로 제공됩니다. 0.5mg는 캡슐형 양면 볼록, 흰색~회백색 필름 코팅 정제이며, 한쪽 면에는 “Pfizer“가, 다른 면에는 “CHX 0.5″가 새겨져 있습니다. 1mg는 캡슐형 양면 볼록, 연한 파란색 필름 코팅 정제이며, 한쪽 면에는 “Pfizer“가, 다른 면에는 “CHX 1.0″가 새겨져 있습니다. CHANTIX는 다음과 같은 포장 구성으로 제공됩니다.
| 설명 | NDC | |
|---|---|---|
|
팩 |
시작 4주 카드: 0.5 mg × 11정 및 1 mg × 42정 |
NDC 0069-0471-03 |
|
지속 4주 카드: 1 mg × 56정 |
NDC 0069-0469-03 |
|
|
시작 월 박스: 0.5 mg × 11정 및 1 mg × 42정 |
NDC 0069-0471-03 |
|
|
지속 월 박스: 1 mg × 56정 |
NDC 0069-0469-03 |
|
|
병 |
0.5 mg – 56정 병 |
NDC 0069-0468-56 |
|
1 mg – 56정 병 |
NDC 0069-0469-56 |
17 환자 상담 정보
치료 시작 및 금단 시도 지속
금연 날짜를 정하고 금연 날짜 1주일 전에 CHANTIX 치료를 시작하도록 환자에게 지시합니다. 또는 환자는 CHANTIX 복용을 시작한 후 치료 8일에서 35일 사이에 금연 날짜를 정할 수 있습니다. 금연일 이후 조기에 금단 증상이 나타나더라도 금연 시도를 계속하도록 환자를 격려합니다 [용법 및 용량 (2.1) 참조].
갑작스럽게 금연할 수 없거나 하려고 하지 않는 환자의 경우, CHANTIX를 사용하여 금연을 점진적으로 접근하는 방법을 고려할 수 있습니다. 환자는 CHANTIX 복용을 시작하고 처음 12주 동안 흡연량을 줄인 다음 그 기간이 끝날 때까지 금연하고 추가로 12주 동안 치료를 계속하여 총 24주 동안 치료를 받아야 합니다 [용법 및 용량 (2.1) 참조].
금연 의지가 있고 이전 CHANTIX 치료 중에 부작용으로 인한 불내성 이외의 이유로 금연에 성공하지 못했거나 치료 후 재발한 환자에게는 실패 원인이 확인되고 해결된 후 CHANTIX로 다시 시도하도록 격려합니다 [용법 및 용량 (2.1), 임상 연구 (14.6) 참조].
시작 주차 용량
하루 0.5mg으로 시작하는 CHANTIX의 적정 방법에 대해 환자에게 설명합니다. 처음 3일 동안은 0.5mg 정제 1정을 매일 복용하고, 그 다음 4일 동안은 아침에 0.5mg 정제 1정, 저녁에 0.5mg 정제 1정을 복용해야 한다고 설명합니다 [용법 및 용량 (2.1) 참조].
CHANTIX 또는 다른 약물의 용량 조절
메스꺼움과 불면증은 CHANTIX의 부작용이며 일반적으로 일시적이지만, 이러한 증상으로 지속적으로 고통받는 경우 용량 감소를 고려할 수 있도록 처방 의사에게 알리도록 환자에게 알립니다.
금연 후 일부 약물의 용량 조절이 필요할 수 있다고 환자에게 알립니다 [용법 및 용량 (2.1) 참조].
신경정신과적 이상 반응
일부 환자의 경우 CHANTIX 복용 중 금연 시 기분 변화(우울증 및 조증 포함), 정신병, 환각, 편집증, 망상, 살인 충동, 공격성, 적대감, 불안, 불안감 및 공황 발작뿐만 아니라 자살 충동 및 자살을 경험한 경우가 있다고 환자에게 알립니다. 이러한 증상이 나타나면 CHANTIX 복용을 중단하고 의료 전문가에게 연락하도록 환자에게 지시합니다 [경고 및 주의 사항 (5.1), 이상 반응 (6.2) 참조].
발작
발작 병력이나 발작 역치를 낮출 수 있는 기타 요인을 보고하도록 환자를 격려합니다. 치료 중 발작이 발생하면 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 환자에게 지시합니다 [경고 및 주의 사항 (5.2) 참조].
알코올과의 상호작용
CHANTIX가 알코올 내성에 영향을 미치는지 여부를 알 때까지 CHANTIX 복용 중 알코올 섭취량을 줄이도록 환자에게 알립니다 [경고 및 주의 사항 (5.3), 이상 반응 (6.2) 참조].
운전 또는 기계 조작
금연 및/또는 바레니클린이 환자에게 미치는 영향을 알 때까지 운전 또는 기계 조작 시 주의를 기울이도록 환자에게 알려주십시오 [경고 및 주의사항 (5.4) 참조].
심혈관계 이상반응
환자는 새로운 심혈관계 이상반응 또는 악화되는 증상에 대해 의료 제공자에게 알리고, 심근경색 또는 뇌졸중의 징후 및 증상이 나타나면 즉시 의료 처치를 받도록 지시해야 합니다 [경고 및 주의사항 (5.5), 이상반응 (6.1) 참조].
안면부종
얼굴, 입(입술, 잇몸, 혀) 및 목(후두 및 인두)의 부종을 동반하는 안면부종이 보고되었으며, 이는 생명을 위협하는 호흡곤란으로 이어질 수 있다는 점을 환자에게 알려주십시오. 이러한 증상이 나타나면 CHANTIX 복용을 중단하고 즉시 의료 처치를 받도록 환자에게 지시하십시오 [경고 및 주의사항 (5.7), 이상반응 (6.2) 참조].
중증 피부 반응
스티븐스-존슨 증후군 및 다형 홍반과 같은 중증 피부 반응이 CHANTIX를 복용한 일부 환자에게서 보고되었다는 점을 환자에게 알려주십시오. 점막 병변 또는 피부 반응을 동반한 발진의 첫 징후가 나타나면 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하도록 환자에게 알려주십시오 [경고 및 주의사항 (5.8), 이상반응 (6.2) 참조].
임신 및 수유
임신 중이거나 수유 중이거나 임신을 계획 중인 환자에게는 임산부와 태아에게 미치는 흡연의 위험, 임신 및 수유 중 CHANTIX 사용의 잠재적 위험, 그리고 CHANTIX를 사용하거나 사용하지 않고 금연하는 것의 이점에 대해 알려주어야 합니다. 수유부는 유아에게 경련과 구토가 나타나는지 모니터링하도록 조언하십시오 [특정 집단에서의 사용 (8.1) 및 8.2) 참조].
미분류 섹션
이 제품의 라벨이 업데이트되었을 수 있습니다. 전체 처방 정보는 www.pfizer.com을 방문하십시오.
LAB- 0327-24.0
약물 안내문
| 본 의약품 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다. 2019년 2월 개정 | |||
|
의약품 안내서 |
|||
|
CHANTIX를 복용하든 복용하지 않든 금연을 시도할 때 니코틴 금단 증상이 나타날 수 있으며, 여기에는 다음이 포함됩니다. |
|||
|
|
|
|
|
약물 복용 없이 금연을 시도할 때 자살 충동을 경험한 사람들도 있습니다. 때때로 금연은 이미 앓고 있는 정신 건강 문제(예: 우울증)를 악화시킬 수 있습니다. 금연을 돕기 위해 CHANTIX를 복용하는 동안 다음과 같은 심각한 부작용을 경험한 사람들도 있습니다. 행동이나 사고의 변화, 공격성, 적대감, 불안, 우울한 기분 또는 자살 생각이나 행동과 같은 새로운 또는 악화된 정신 건강 문제. 어떤 사람들은 CHANTIX 복용을 시작할 때 이러한 증상을 경험했고, 다른 사람들은 몇 주간의 치료 후 또는 CHANTIX 복용 중단 후에 이러한 증상이 나타났습니다. 이러한 증상은 CHANTIX 복용 전에 정신 건강 문제의 병력이 있는 사람들에게 정신 건강 문제의 병력이 없는 사람들보다 더 자주 발생했습니다. 본인, 가족 또는 보호자가 이러한 증상 중 하나라도 발견하면 CHANTIX 복용을 중단하고 즉시 의료 제공자에게 연락하십시오. 의료 제공자와 협력하여 CHANTIX 복용을 계속할지 여부를 결정하십시오. 많은 사람들에게서 이러한 증상은 CHANTIX 복용 중단 후 사라졌지만, 어떤 사람들에게는 CHANTIX 복용 중단 후에도 증상이 지속되었습니다. 증상이 사라질 때까지 의료 제공자의 추적 관찰을 받는 것이 중요합니다. CHANTIX 복용 전에 우울증이나 기타 정신 건강 문제가 있었는지 의료 제공자에게 알리십시오. CHANTIX를 복용하든 복용하지 않든 다른 때 금연을 시도하는 동안 경험했던 증상에 대해서도 의료 제공자에게 알려야 합니다. |
|||
|
CHANTIX란 무엇입니까? CHANTIX는 사람들이 금연하도록 돕는 처방약입니다. 금연은 폐 질환, 심장 질환 또는 흡연과 관련된 특정 유형의 암에 걸릴 가능성을 낮출 수 있습니다. CHANTIX는 16세 이하 어린이에게 효과가 있는 것으로 나타나지 않았습니다. CHANTIX는 16세 이하 어린이에게 사용해서는 안 됩니다. 다른 금연 약물과 함께 CHANTIX를 사용하는 것이 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|||
|
누가 CHANTIX를 복용해서는 안 됩니까? CHANTIX에 대한 심각한 알레르기 또는 피부 반응이 있었던 경우 CHANTIX를 복용하지 마십시오. 증상에는 다음이 포함될 수 있습니다.
|
|||
|
|
|
|
|
CHANTIX 복용 전에 의료 제공자에게 무엇을 알려야 합니까? “CHANTIX에 대해 가장 중요한 정보는 무엇입니까?“를 참조하십시오. CHANTIX를 복용하기 전에 다음 사항을 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. 금연 시 일부 약물의 복용량을 변경해야 할 수도 있습니다. 다른 금연 약물을 사용하는 동안 CHANTIX를 사용해서는 안 됩니다. 다른 금연 치료법을 사용하는 경우 의료 제공자에게 알리십시오. 복용하는 약을 알고 있어야 합니다. 새로운 약을 받을 때 의료 제공자와 약사에게 보여줄 수 있도록 약물 목록을 가지고 다니십시오. |
|||
CHANTIX는 어떻게 복용해야 합니까?
- •
- 금연을 돕기 위해 CHANTIX를 사용하는 방법에는 세 가지가 있습니다. 다음 세 가지 CHANTIX 사용 방법에 대해 의료 제공자와 상담하십시오.
- o
- 금연을 시작하는 날짜를 정하십시오. 금연 시작 날짜 1주일(7일) 전에 CHANTIX 복용을 시작하십시오. 12주 동안 CHANTIX를 복용하십시오.
또는 - o
- 금연 시작 날짜를 정하기 전에 CHANTIX 복용을 시작하십시오. 치료 8일에서 35일 사이에 금연할 날짜를 정하십시오. 12주 동안 CHANTIX를 복용하십시오.
또는 - o
- 금연을 바로 할 수 없거나 하려고 하지 않는 경우, CHANTIX 복용을 시작하고 처음 12주 동안 다음과 같이 흡연량을 줄이십시오.
1주차부터 4주차까지
하루 흡연량을 절반으로 줄이십시오.
예: 평소 하루에 20개비를 피우는 경우, 1주차부터 4주차까지는 하루에 10개비로 줄이십시오.
5주차부터 8주차까지
하루 흡연량을 4분의 1로 줄이십시오.
예: 평소 하루에 20개비를 피우는 경우, 5주차부터 8주차까지는 하루에 5개비로 줄이십시오.
9주차부터 12주차까지
더 이상 담배를 피우지 않을 때까지(하루에 0개비가 될 때까지) 계속 흡연량을 줄이십시오.
12주차가 끝날 때까지, 또는 준비가 되었다고 느끼면 그보다 빨리 금연하는 것을 목표로 하십시오. 총 24주간의 치료를 위해 추가로 12주 동안 CHANTIX를 계속 복용하십시오.
금연 시작 날짜 전에 CHANTIX 복용을 시작하면 CHANTIX가 체내에 축적될 시간을 줍니다. 이 기간 동안 계속 흡연할 수 있습니다. 의료 제공자가 처방한 대로 CHANTIX를 정확하게 복용하십시오.
- •
- CHANTIX는 흰색 정제(0.5mg)와 파란색 정제(1mg)로 제공됩니다. 흰색 정제부터 시작하여 일반적으로 파란색 정제로 넘어갑니다. 성인의 복용 지침은 아래 표를 참조하십시오.
1일차부터 3일차까지
- o
- 흰색 정제(0.5mg)
- o
- 하루에 1정 복용
4일차부터 7일차까지
- o
- 흰색 정제(0.5mg)
- o
- 아침에 1정, 저녁에 1정 복용
8일차부터 치료 종료까지
- o
- 파란색 정제(1mg)
- o
- 아침에 1정, 저녁에 1정 복용
- •
- 금연 시작 날짜에 금연하려고 노력하십시오. 실수로 담배를 피우더라도 다시 시도하십시오. 어떤 사람들은 CHANTIX가 최대한 효과를 발휘하려면 몇 주 동안 복용해야 합니다.
- •
- 대부분의 사람들은 최대 12주 동안 CHANTIX를 복용합니다. 12주 안에 완전히 금연했다면, 의료 제공자는 담배를 피우지 않도록 돕기 위해 추가로 12주 동안 CHANTIX를 처방할 수 있습니다.
- •
- 식후에 물 한 컵(8온스)과 함께 CHANTIX를 복용하십시오.
- •
- 이 복용량 일정이 모든 사람에게 적합한 것은 아닙니다. 메스꺼움, 이상한 꿈 또는 수면 문제와 같은 부작용이 있는 경우 의료 제공자와 상담하십시오. 의료 제공자는 복용량을 줄이려고 할 수 있습니다.
- •
- CHANTIX 복용량을 놓친 경우 기억나는 대로 복용하십시오. 다음 복용 시간이 거의 다 된 경우 놓친 복용량은 건너뛰십시오. 정해진 시간에 다음 복용량을 복용하십시오.
CHANTIX 복용 중에 무엇을 피해야 합니까?
- •
- CHANTIX가 자신에게 어떤 영향을 미치는지 알 때까지 운전이나 기계 조작 시 주의하십시오. CHANTIX는 졸음, 어지러움 또는 집중력 저하를 유발하여 안전하게 운전하거나 다른 활동을 수행하기 어렵게 만들 수 있습니다.
- •
- CHANTIX가 알코올 내성에 영향을 미치는지 알 때까지 CHANTIX 치료 중 알코올 섭취량을 줄이십시오. CHANTIX 치료 중 알코올을 섭취한 일부 사람들에게서 다음과 같은 증상이 나타났습니다.
- o
- 알코올 중독 증가
- o
- 이상하거나 때로는 공격적인 행동
- o
- 일어난 일에 대한 기억 상실
|
CHANTIX의 가능한 부작용은 무엇입니까? CHANTIX의 심각한 부작용에는 다음이 포함될 수 있습니다.
다음 증상이 나타나면 CHANTIX 복용을 중단하고 즉시 의료 지원을 받으십시오.
CHANTIX의 가장 흔한 부작용은 다음과 같습니다.
귀찮거나 사라지지 않는 부작용에 대해 의료 제공자에게 알리십시오. 이것들은 CHANTIX의 모든 부작용이 아닙니다. 자세한 내용은 의료 제공자 또는 약사에게 문의하십시오. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
|||
|
CHANTIX는 어떻게 보관해야 합니까?
|
|||
|
CHANTIX의 안전하고 효과적인 사용에 대한 일반 정보 의약품은 때때로 의약품 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 CHANTIX를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 CHANTIX를 제공하지 마십시오. 해를 끼칠 수 있습니다. 자세한 내용은 의료 제공자와 상담하십시오. 의료 전문가를 위해 작성된 CHANTIX에 대한 정보는 의료 제공자 또는 약사에게 문의할 수 있습니다. CHANTIX에 대한 자세한 정보와 금연 팁은 www.CHANTIX.com을 방문하거나 1-877-242-6849로 전화하십시오. 금연 의지를 가지고 있지만 부작용 이외의 이유로 이전 CHANTIX 치료 중 성공하지 못했거나 치료 후 흡연을 재개한 경우, 다른 CHANTIX 치료 과정이 적합한지 의료 제공자와 상담하십시오. |
|||
|
CHANTIX의 성분은 무엇입니까? 활성 성분: varenicline tartrate 비활성 성분: 미정질 셀룰로오스, 무수 이염기성 인산칼슘, 크로스카멜로오스나트륨, 콜로이드성 이산화규소, 스테아린산마그네슘, Opadry® White (0.5mg용), Opadry® Blue (1mg용), Opadry® Clear. LAB-0328-17.0 |
주요 표시 패널 – 0.5/1mg 정 시작 패키지 포장
포함 성분:
1주차(시작): 0.5 mg* x 11정
3주차(계속): 1 mg† x 42정
NDC 0069-0471-03
처방전 의약품
CHANTIX®
(varenicline) 정제
시작 월 상자
(처음 4주)
Chantix 복용을 시작할 때는 시작 주(녹색) 블리스터 카드를
먼저 사용하십시오.
동봉된 약물 사용 설명서와 함께 반드시 제공하십시오.
주요 표시 패널 – 0.5mg/1mg 정제 시작 팩
NDC 0069-0471-03
처방전 의약품
CHANTIX®
(varenicline) 정제
시작 패키지
Chantix 복용을 시작할 때는 먼저 시작 주(녹색) 블리스터 카드를 사용하십시오.
내용물:
시작 주 (0.5 mg* x 11정)
계속 주 (1 mg† x 42정)
반드시 동봉된 약물 사용 설명서와 함께 조제하십시오.
주요 표시 패널 – 0.5mg 정제 병 라벨
반드시 약물 사용 설명서와 함께 조제하십시오
NDC 0069-0468-56
Pfizer
Chantix®
(varenicline) tablets
0.5 mg*
56 Tablets
처방전 의약품
진열대 라벨 – 1mg 정제 병 라벨
항상 복약 안내서와 함께 제공하십시오
Pfizer
NDC 0069-0469-56
Chantix®
(varenicline) 정제
1 mg*
56정
처방전 의약품
주요 표시면 – 1mg x 56정 연용 포장
NDC 0069-0469-03
처방전 의약품
CHANTIX®
(varenicline) TABLETS
지속 복용팩
내용:
4주 지속 복용 (1 mg† x 56정)
반드시 동봉된 약물 사용 설명서와 함께 조제하십시오
주요 표시면 – 1mg x 56정 월간 복용 박스
포함 성분:
4주분 (1 mg† x 56정)
NDC 0069-0469-03
처방전 의약품
CHANTIX®
(바레니클린) 정제
4주분
(다음 4주분)
반드시 동봉된 약물 사용 설명서와 함께 제공하십시오.