의약품 제조업체: AstraZeneca Pharmaceuticals LP (Updated: 2025-01-16)
처방 정보 하이라이트
CALQUENCE® (acalabrutinib) capsules, for oral use
Initial U.S. Approval: 2017
최근 주요 변경 사항
Indications and Usage, Mantle Cell Lymphoma (1.1) 1/2025
Dosage and Administration, Recommended Dosage (2.1) 1/2025
Dosage and Administration, Dosage Modifications for Adverse Reactions (2.4) 1/2025
Warnings and Precautions, Second Primary Malignancies (5.4) 1/2025
Warnings and Precautions, Cardiac Arrhythmias (5.5) 6/2024
Warnings and Precautions, Hepatotoxicity, Including Drug-Induced Liver Injury (5.6) 6/2024
적응증 및 용법
용법 및 용량
제형 및 함량
캡슐: 100 mg. (3)
금기
없음. (4)
경고 및 주의사항
- •
- 심각한 감염 및 기회 감염: 감염 징후 및 증상을 모니터링하고 즉시 치료하십시오. (5.1)
- •
- 출혈: 출혈을 모니터링하고 적절하게 관리하십시오. (5.2)
- •
- 혈구감소증: 정기적으로 전체 혈구 수를 모니터링하십시오. (5.3)
- •
- 두 번째 원발성 악성 종양: 피부암 및 기타 고형 종양을 포함한 다른 악성 종양이 발생했습니다. 환자에게 자외선 차단제 사용을 권장하십시오. (5.4)
- •
- 심장 부정맥: 부정맥 증상을 모니터링하고 관리하십시오. (5.5)
- •
- 약물 유발 간 손상을 포함한 간독성: 치료 기간 동안 간 기능을 모니터링하십시오. (5.6)
이상반응
가장 흔한 이상반응(발생률 ≥ 30%)은 빈혈, 호중구 감소증, 상기도 감염, 혈소판 감소증, 두통, 설사 및 근골격계 통증이었습니다. (6.1)
의심되는 이상반응을 보고하려면 AstraZeneca(1-800-236-9933) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch.)에 문의하십시오.
약물 상호작용
환자 복약 지도 정보는 17을 참조하십시오.
개정: 1/2025
목차
전문 정보: 목차*
1 적응증 및 용법
1.1 이전 치료를 받지 않은 맨틀세포 림프종
1.2 이전 치료를 받은 맨틀세포 림프종
1.3 만성 림프구성 백혈병 또는 소림프구성 림프종
2 용법 및 용량
2.1 권장 용량
2.2 간 손상 환자에 대한 권장 용량
2.3 약물 상호작용에 대한 권장 용량
2.4 유해 반응에 대한 용량 조절
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 중증 및 기회 감염
5.2 출혈
5.3 혈구감소증
5.4 제2의 원발성 악성종양
5.5 심장 부정맥
5.6 약물 유발 간 손상을 포함한 간 독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 간 손상
11 성상
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 약리
13.1 발암성, 돌연변이 유발성, 생식능력 저하
14 임상 연구
14.1 이전 치료를 받지 않은 맨틀세포 림프종
14.2 이전 치료를 받은 맨틀세포 림프종
14.3 만성 림프구성 백혈병
16 포장단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분 또는 소항목은 나열되지 않았습니다.
1 적응증 및 사용법
1.1 이전 치료를 받지 않은 망토세포 림프종
자가 조혈모세포 이식(HSCT)을 받을 수 없는 이전 치료를 받지 않은 망토세포 림프종(MCL) 성인 환자의 치료에 벤다무스틴 및 리툭시맙과 병용한 CALQUENCE가 적응증으로 되어 있습니다.
1.3 만성 림프구성 백혈병 또는 소림프구성 림프종
만성 림프구성 백혈병(CLL) 또는 소림프구성 림프종(SLL) 성인 환자의 치료에 CALQUENCE가 적응증으로 되어 있습니다.
2 용법 및 투여
2.1 권장 복용량
CALQUENCE 투여 지침
환자에게 캡슐을 물과 함께 통째로 삼키도록 지시하십시오. 캡슐을 열거나 부수거나 씹지 않도록 환자에게 알려주십시오. CALQUENCE는 음식과 함께 또는 음식 없이 복용할 수 있습니다. CALQUENCE 복용량을 3시간 이상 놓친 경우, 건너뛰고 다음 복용량을 정기적으로 예정된 시간에 복용해야 합니다. 놓친 복용량을 보충하기 위해 CALQUENCE 캡슐을 추가로 복용해서는 안 됩니다.
CALQUENCE 단독 요법
MCL, CLL 또는 SLL 환자의 경우 권장 CALQUENCE 복용량은 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 100mg을 경구 복용하는 것입니다.
벤다무스틴 및 리툭시맙과 병용 투여하는 CALQUENCE
이전에 치료받지 않은 MCL 환자의 경우 권장 CALQUENCE 복용량은 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 100mg을 경구 복용하는 것입니다.
1주기(각 주기는 28일) 1일에 CALQUENCE 투여를 시작하고 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 투여합니다. 1주기 1일과 2일에 벤다무스틴 90mg/m2를 투여하고 1주기 1일에 리툭시맙 375mg/m2를 투여하고 총 6주기 동안 계속합니다. 처음 6주기 후에 반응(PR 또는 CR)을 보이는 환자는 8주기부터 30주기까지 최대 12회 추가 용량에 대해 격주기 1일에 유지 리툭시맙을 투여받을 수 있습니다 [임상 연구(14.1) 참조].
오비누투주맙과 병용 투여하는 CALQUENCE
이전에 치료받지 않은 CLL 또는 SLL 환자의 경우 권장 CALQUENCE 복용량은 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 100mg을 경구 복용하는 것입니다. 1주기(각 주기는 28일)에 CALQUENCE 투여를 시작합니다. 총 6주기 동안 2주기에 오비누투주맙 투여를 시작하고 권장 복용량에 대해서는 오비누투주맙 처방 정보를 참조하십시오. 같은 날 투여할 경우 오비누투주맙 전에 CALQUENCE를 투여하십시오.
2.2 간 장애에 대한 권장 복용량
중증 간 장애 환자에게 CALQUENCE 투여를 피하십시오.
경증 또는 중등도 간 장애 환자의 경우 용량 조정이 필요하지 않습니다 [특정 집단에서의 사용(8.6) 및 임상 약리학(12.3) 참조].
2.3 약물 상호작용에 대한 권장 복용량
CYP3A 저해제 또는 유도제와 함께 사용하기 위한 용량 조정
이는 표 1에 설명되어 있습니다 [약물 상호작용(7) 참조].
|
CYP3A |
병용 약물 |
권장 CALQUENCE 사용 |
|
저해 |
강력한 CYP3A 저해제 |
병용 사용을 피하십시오. 이러한 저해제를 단기간(예: 최대 7일 동안 항감염제) 사용할 경우 CALQUENCE 투여를 중단하십시오. |
|
중등도 CYP3A 저해제 |
1일 1회 100mg. |
|
|
유도 |
강력한 CYP3A 유도제 |
병용 사용을 피하십시오. 이러한 유도제를 피할 수 없는 경우 CALQUENCE 용량을 약 12시간마다 200mg으로 늘리십시오. |
위산 감소제와의 병용
양성자 펌프 억제제: 병용 투여하지 마십시오 [약물 상호작용 (7) 참조].
H2-수용체 길항제: H2-수용체 길항제를 복용하기 2시간 전에 CALQUENCE를 복용하십시오 [약물 상호작용 (7) 참조].
제산제: 최소 2시간 간격을 두고 복용하십시오 [약물 상호작용 (7) 참조].
2.4 이상반응에 대한 용량 조정
권장 용량 조정은 표 2와 3에 제공됩니다.
|
이상반응 |
이상반응 발생 |
용량 조정 (시작 용량 = 약 12시간마다 100mg) |
|
3등급 이상의 비혈액학적 독성, 출혈이 있는 3등급 혈소판 감소증 |
첫 번째 및 두 번째 |
CALQUENCE 투여를 중단하십시오. 독성이 1등급 또는 기준치 수준으로 해결되면 CALQUENCE를 약 12시간마다 100mg으로 재개할 수 있습니다. |
|
4등급 혈소판 감소증 또는 7일 이상 지속되는 4등급 호중구 감소증 |
세 번째 |
CALQUENCE 투여를 중단하십시오. 독성이 1등급 또는 기준치 수준으로 해결되면 CALQUENCE를 하루 한 번 100mg의 감량된 빈도로 재개할 수 있습니다. |
|
네 번째 |
CALQUENCE 투여를 중단하십시오. |
|
|
미국 국립암연구소 이상반응 공통 용어 기준(NCI CTCAE)에 따라 등급이 매겨진 이상반응. |
||
| 이상반응 | 중증도a | 용량 수정 (CALQUENCE 시작 용량 = 약 12시간마다 100mg) |
|---|---|---|
|
Neutropeniab[see Warnings and Precautions (5.4)] |
절대 호중구 수가 7일 이상 0.5 x 109/L 미만 |
CALQUENCE 투여를 중단합니다. 독성이 2등급 이하로 해소되면 CALQUENCE를 시작 용량으로 재개합니다. 2번째 또는 3번째 발생 시 CALQUENCE 용량을 1일 1회 100mg으로 줄입니다.c 4번째 발생 시 CALQUENCE 투여를 중단합니다. 벤다무스틴의 경우: 벤다무스틴 투여를 중단합니다. 독성이 2등급 이하로 해소되면 벤다무스틴을 재개하고 용량을 70mg/m2로 줄이는 것을 고려합니다.d,e |
|
Thrombocytopeniaf[see Warnings and Precautions (5.4)] |
혈소판 수 25~50 x 109/L 및 임상적으로 유의미한 출혈 또는 혈소판 수 25 x 109/L 미만 |
CALQUENCE 투여를 중단합니다. 독성이 2등급 이하 또는 기준치로 해소되면 CALQUENCE를 시작 용량으로 재개합니다. 재발 시 CALQUENCE 용량을 1일 1회 100mg으로 줄입니다.c 3번째 발생 시 CALQUENCE 투여 중단을 고려합니다. 벤다무스틴f의 경우: 벤다무스틴 투여를 중단합니다. 독성이 2등급 이하 또는 기준치로 해소되면 벤다무스틴을 재개하고 용량을 70mg/m2로 줄이는 것을 고려합니다.e |
|
비혈액학적 이상반응 [see Warnings and Precautions (5)] |
3등급 이상 |
CALQUENCE 투여를 중단합니다. 독성이 2등급 이하 또는 기준치로 해소되면 CALQUENCE를 시작 용량으로 재개합니다. 재발 시 CALQUENCE 용량을 1일 1회 100mg으로 줄입니다.c 4등급 독성이 3번째 발생 시 CALQUENCE 투여를 중단합니다. 3등급 독성의 경우 CALQUENCE 투여를 계속할지에 대한 위험과 이점을 고려합니다. 벤다무스틴의 경우: 벤다무스틴 투여를 중단합니다. 독성이 2등급 이하 또는 기준치로 해소되면 벤다무스틴을 재개하고 용량을 70mg/m2로 줄이는 것을 고려합니다.e |
|
a 미국 국립암연구소 이상반응 공통 용어 기준(NCI CTCAE) 버전 4.03에 따라 등급이 매겨집니다. b ANC가 1 x 109/L 미만인 호중구 감소증의 경우 특정 상황에서 벤다무스틴 투여 중단 및 용량을 70mg/m2로 줄이는 것을 고려할 수 있습니다. c 환자가 감량된 용량을 4주 이상 tolerated하는 경우 의사의 재량에 따라 용량을 다시 늘릴 수 있습니다. d 벤다무스틴 용량 감량 전에 골수 성장 인자 사용을 고려합니다. e 추가 용량 감량이 필요한 경우 벤다무스틴 투여 중단을 고려합니다. f 혈소판 감소증의 경우 임상적으로 유의미한 출혈이 없더라도 혈소판 수가 50 x 109/L 미만이면 벤다무스틴 투여를 중단해야 합니다. |
||
독성 관리에 대한 추가 정보는 CALQUENCE와 병용되는 각 제품의 처방 정보를 참조하십시오.
3 제형 및 함량
캡슐: 100mg 아칼라브루티닙, 크기 1호 경질 젤라틴 캡슐, 노란색 몸체와 파란색 뚜껑, 검정색 잉크로 ‘ACA 100 mg’ 표시.
4 금기 사항
없음.
5 경고 및 주의사항
5.1 중증 및 기회 감염
혈액 악성 종양 환자에서 CALQUENCE 치료 중 치명적이고 중증 감염(기회 감염 포함)이 발생했습니다.
임상 시험에서 CALQUENCE에 노출된 1,764명의 환자 중 32%에서 중증 또는 3등급 이상의 감염(세균성, 바이러스성 또는 진균성)이 발생했으며, 대부분 호흡기 감염(모든 환자의 19%, 폐렴 포함 9%) 때문이었습니다 [유해 반응 (6.1) 참조]. 이러한 감염은 대부분 3등급 또는 4등급 호중구 감소증이 없는 상태에서 발생했으며, 호중구 감소증 관련 감염은 모든 환자의 2.7%에서 보고되었습니다. CALQUENCE 투여 환자에서 발생한 기회 감염에는 B형 간염 바이러스 재활성화, 진균성 폐렴, Pneumocystis jiroveci 폐렴, 에프스타인-바 바이러스 재활성화, 거대세포바이러스 및 진행성 다초점 백질뇌병증(PML) 등이 포함되지만 이에 국한되지 않습니다. 기회 감염 위험이 높은 환자에게는 예방 요법을 고려하십시오. 감염의 징후 및 증상을 모니터링하고 신속하게 치료하십시오.
5.2 출혈
CALQUENCE 치료를 받은 환자에서 치명적이고 중증의 출혈 사건이 발생했습니다. 주요 출혈(중증 또는 3등급 이상의 출혈 또는 중추 신경계 출혈)은 환자의 4.4%에서 발생했으며, 임상 시험에서 CALQUENCE에 노출된 1,764명의 환자 중 0.2%에서 치명적인 출혈이 발생했습니다. 멍과 점상 출혈을 제외한 모든 등급의 출혈 사건은 환자의 40%에서 발생했습니다 [유해 반응 (6.1) 참조].
CALQUENCE와 함께 항혈전제를 병용하면 출혈 위험이 더욱 증가할 수 있습니다. 임상 시험에서 항혈전제를 사용하지 않고 CALQUENCE를 복용한 환자의 7%, 항혈전제와 함께 CALQUENCE를 복용한 환자의 4%에서 주요 출혈이 발생했습니다. CALQUENCE와 병용 투여 시 항혈전제의 위험과 이점을 고려하십시오. 출혈 징후를 모니터링하십시오.
수술 유형과 출혈 위험에 따라 수술 전후 3~7일 동안 CALQUENCE 투여를 중단하는 것의 이점과 위험을 고려하십시오.
5.3 혈구감소증
CALQUENCE는 3등급 또는 4등급 혈구감소증을 유발할 수 있습니다. CALQUENCE 단독 또는 obinutuzumab과 병용하여 치료받은 환자에서 3등급 또는 4등급 혈구감소증에는 절대 호중구 수 감소(26%), 혈소판 감소(10%), 헤모글로빈 감소(10%) 및 절대 림프구 수 감소(10%)가 포함되었으며, 4등급 호중구 감소증은 14%에서 발생했습니다 [유해 반응 (6.1) 참조].
치료 중에 정기적으로 완전 혈구 수를 모니터링하십시오. 필요에 따라 치료를 중단하거나, 용량을 줄이거나, 치료를 중단하십시오 [용법 및 용량 (2.4) 참조].
5.4 제2의 원발성 악성 종양
임상 시험에서 CALQUENCE에 노출된 1,764명의 환자 중 18%에서 피부암 및 기타 고형 종양을 포함한 제2의 원발성 악성 종양이 발생했습니다 [유해 반응 (6.1) 참조]. 가장 흔한 제2의 원발성 악성 종양은 비흑색종 피부암으로 환자의 10%에서 보고되었으며, 그 뒤를 이어 다른 고형 종양이 9%(흑색종, 폐암, 위장관암 및 비뇨생식기암 포함) 및 혈액 악성 종양(1%)이었습니다. 제2의 암 발생 여부를 모니터링하고 자외선 노출로부터 보호하도록 조언하십시오.
5.5 심장 부정맥
CALQUENCE 치료를 받은 환자에서 치명적이고 중증의 심장 부정맥이 발생했습니다. CALQUENCE로 치료받은 1,764명의 환자 중 2.6%에서 3등급 또는 4등급 심방세동 또는 심방 flutter가 보고되었으며, 모든 등급의 심방세동 또는 심방 flutter는 모든 환자의 7%에서 보고되었습니다 [유해 반응 (6.1) 참조]. 3등급 이상의 심실 부정맥 사건은 환자의 0.6%에서 보고되었으며, 모든 환자의 0.3%에서 치명적인 경우가 포함되었습니다. 심장 위험 요인, 고혈압, 이전 부정맥 및 급성 감염이 있는 환자의 경우 부정맥 위험이 증가할 수 있습니다. 부정맥 증상(예: 두근거림, 현기증, 실신, 호흡 곤란)을 모니터링하고 적절하게 관리하십시오.
5.6 약물 유발 간 손상을 포함한 간 독성
CALQUENCE를 포함한 Bruton 티로신 키나아제 억제제로 치료받은 환자에서 중증, 생명을 위협하는 잠재적으로 치명적인 약물 유발 간 손상(DILI)을 포함한 간 독성이 발생했습니다.
CALQUENCE 치료 전반에 걸쳐 기준선에서 빌리루빈과 트랜스아미나제를 평가하십시오. CALQUENCE 후 비정상적인 간 기능 검사가 나타나는 환자의 경우 간 기능 검사 이상 및 간 독성의 임상 징후와 증상을 더 자주 모니터링하십시오. DILI가 의심되는 경우 CALQUENCE 투여를 중단하십시오. DILI가 확인되면 CALQUENCE 투여를 중단하십시오.
6 부작용 반응
다음의 임상적으로 유의미한 이상반응은 라벨의 다른 섹션에서 자세히 논의됩니다.
- •
- 심각한 감염 및 기회 감염 [see 경고 및 주의사항 (5.1)]
- •
- 출혈 [see 경고 및 주의사항 (5.2)]
- •
- 세포감소증 [see 경고 및 주의사항 (5.3)]
- •
- 두 번째 원발성 악성종양 [see 경고 및 주의사항 (5.4)]
- •
- 심장 부정맥 [see 경고 및 주의사항 (5.5)]
- •
- DILI를 포함한 간독성 [see 경고 및 주의사항 (5.6)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상 시험에서 관찰된 이상반응률을 다른 약물의 임상 시험에서 관찰된 이상반응률과 직접 비교할 수 없으며 실제로 관찰된 이상반응률을 반영하지 않을 수 있습니다.
경고 및 주의사항의 데이터는 혈액 악성종양 환자 1,764명에서 약 12시간마다 CALQUENCE 100mg을 투여한 결과를 반영합니다. 치료에는 9건의 시험에서 1,256명의 환자에게 CALQUENCE 단독 요법, 3건의 시험에서 508명의 환자에게 CALQUENCE 병용 요법이 포함됩니다. CALQUENCE 투여 환자 중 88%는 최소 6개월 동안, 80%는 최소 1년 동안 투여받았습니다. 이 통합 안전성 모집단에서 실험실 이상을 제외하고 1,764명의 환자 중 ≥ 30%에서 발생한 이상반응은 설사(37%), 상기도 감염(36%), 두통(35%), 근골격계 통증(33%), 하기도 감염(32%), 피로(32%)였습니다. 가장 흔한 3등급 또는 4등급 실험실 이상(≥10%)은 절대 호중구 수 감소(31%), 절대 림프구 수 감소(23%), 혈소판 감소(11%), 헤모글로빈 감소(10%)였습니다.
이전에 치료받지 않은 외투 세포 림프종
아래에 설명된 안전성 데이터는 MCL 환자에서 CALQUENCE(약 12시간마다 100mg, BR 병용 또는 단독) 투여 결과를 반영합니다[임상 연구 (14.1) 참조].
ECHO
벤다무스틴 및 리툭시맙 병용 CALQUENCE(CALQUENCE + BR)의 안전성은 ECHO에서 이전에 치료받지 않은 MCL 환자 297명을 대상으로 평가되었습니다[임상 연구 (14.1) 참조]. 이 시험에는 이전에 치료받지 않은 MCL 환자, ≥ 65세, 이식 의도 없음, 총 빌리루빈 ≤ 1.5 × ULN, AST 또는 ALT ≤ 2.5 × ULN, 추정 크레아티닌 청소율 > 50mL/min인 환자가 등록되었습니다. 환자들은 벤다무스틴 및 리툭시맙과 병용하여 6주기(28일 주기) 동안 CALQUENCE 100mg을 1일 2회 경구 투여(n = 297) 또는 위약 투여(n = 297)받았습니다. 그런 다음 환자들은 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 CALQUENCE 100mg을 1일 2회 경구 투여 또는 위약을 계속 투여받았으며, 30주기까지 격주기마다 리툭시맙 12회 추가 투여받았습니다.
CALQUENCE 치료의 중앙값 기간은 28.6개월이었습니다. 총 171명(57.6%)의 환자가 24개월 넘게 CALQUENCE로 치료받았고 122명(41.1%)의 환자가 36개월 넘게 치료받았습니다.
CALQUENCE + BR을 투여받은 환자의 69%에서 심각한 이상반응이 발생했습니다. ≥ 2%의 환자에서 보고된 심각한 이상반응은 폐렴(23%; COVID-19 폐렴 포함), COVID-19(20%; COVID-19 폐렴 포함), 발열(6%), 두 번째 원발성 악성종양(7%), 발진(3.4%), 발열성 호중구 감소증(3.4%), 심방세동(3%), 패혈증(2.7%), 빈혈(2.4%)이었습니다. 마지막 연구 치료 후 30일 이내에 발생한 치명적인 이상반응은 CALQUENCE + BR을 투여받은 환자의 12%에서 보고되었으며, COVID-19(6%; COVID-19 폐렴 포함), 폐렴(1%), 패혈증(0.3%), 두 번째 원발성 악성종양(0.7%), 폐렴(0.3%)이 포함됩니다.
이상반응으로 인해 환자의 43%에서 CALQUENCE 투여가 영구적으로 중단되었고, 74%에서 투여량이 중단되었으며, 10%에서 투여량이 감소되었습니다. 10% 이상에서 투여량 수정을 초래한 이상반응에는 감염, 세포감소증, 발진, 위장관 독성이 포함되었습니다. 환자의 ≥ 4%에서 CALQUENCE 투여의 영구적인 중단을 초래한 이상반응에는 COVID-19(COVID-19 폐렴 포함) 및 호중구 감소증이 포함되었습니다.
표 4와 표 5는 ECHO에서 치료받은 환자에서 관찰된 이상반응 및 실험실 이상을 요약한 것입니다.
|
신체 기관계 이상반응* |
CALQUENCE + BR N = 297 |
위약 + BR N = 297 |
||
|
모든 등급 (%) |
등급 3 또는 4 (%) |
모든 등급 (%) |
등급 3 또는 4 (%) |
|
|
피부 및 피하 조직 장애 |
||||
|
Rasha |
47 |
12 |
31 |
3 |
|
감염 |
||||
|
Covid-19b |
38 |
13 |
27 |
11 |
|
상기도 감염c |
30 |
0.7 |
29 |
1 |
|
….Pneumoniad |
31 |
17 |
25 |
14 |
|
위장 장애 |
||||
|
설사 |
37 |
3 |
28 |
2.4 |
|
구토 |
26 |
0.7 |
14 |
1 |
|
변비 |
25 |
1 |
25 |
0.3 |
|
전신 장애 |
||||
|
피로 |
37 |
3.7 |
32 |
4.4 |
|
발열 |
29 |
2.4 |
24 |
1.3 |
|
부종 |
20 |
1.3 |
19 |
0 |
|
신경계 장애 |
||||
|
두통 |
31 |
1.7 |
14 |
0.7 |
|
현기증 |
18 |
1 |
17 |
0.3 |
|
Respiratory, thoracic and mediastinal disorders |
||||
|
기침 |
27 |
0 |
20 |
0.3 |
|
호흡곤란 |
17 |
1 |
11 |
2.7 |
|
Neoplasms |
||||
|
이차 원발암 malignancye |
19 |
7 |
15 |
7 |
|
Musculoskeletal and connective tissue disorders |
||||
|
관절통 |
18 |
0.7 |
16 |
1 |
|
Vascular disorders |
||||
|
출혈f |
||||
|
*Excludes laboratory terms. a Includes rash, dermatitis, and other related terms. b Includes the following fatal adverse reactions: n=24 for COVID-19. c Includes upper respiratory tract infection, sinusitis, pharyngitis, and related terms. d Includes pneumonia, terms containing pneumonia, and related infections. COVID-19 pneumonia is represented under both Pneumonia and COVID-19. e Includes terms related to malignant neoplasms including cutaneous neoplasms. f Includes all terms containing hematoma or hemorrhage and related terms indicative of bleeding. |
||||
CALQUENCE와 BR 병용 투여 환자의 15% 미만에서 임상적으로 관련 있는 이상반응은 멍, 복통, 심방세동 또는 심방조동, 그리고 종양 용해 증후군이었습니다.
|
Laboratory Abnormality |
CALQUENCE plus BRa |
Placebo plus BRa |
||
|
모든 등급 (%) |
등급 3 또는 4 (%) |
모든 등급 (%) |
등급 3 또는 4 (%) |
|
|
Hematologic Abnormalities |
||||
|
Lymphocytes decreased |
98 |
87 |
97 |
89 |
|
Hemoglobin decreased |
80 |
11 |
65 |
11 |
|
Neutrophils decreased |
76 |
56 |
77 |
51 |
|
Platelets decreased |
69 |
18 |
60 |
16 |
|
Chemistry Abnormalities |
||||
|
AST increased |
53 |
5 |
50 |
3.4 |
|
Uric acid increased |
45 |
45 |
40 |
40 |
|
ALT increased |
44 |
7 |
41 |
2.4 |
|
Potassium increased |
40 |
2 |
38 |
2.7 |
|
Creatinine increased |
37 |
3 |
28 |
2.4 |
|
인산염 감소 (Phosphate decreased) |
36 |
4.4 |
30 |
4.7 |
|
칼륨 감소 (Potassium decreased) |
29 |
7 |
23 |
6 |
|
빌리루빈 증가 (Bilirubin increased) |
19 |
2 |
12 |
2 |
|
a 비율 계산에 사용된 분모는 기준값과 최소 하나 이상의 치료 후 값을 가진 환자 수에 따라 296에서 297 사이에서 변동되었습니다. (The denominator used to calculate the rate varied between 296 and 297 based on the number of patients with a baseline value and at least one post-treatment value.) |
||||
15% 이상의 CALQUENCE와 BR 병용 투여 환자에서 4등급 이상의 실험실적 이상은 절대 림프구 수 감소(26%), 절대 호중구 수 감소(36%), 요산 증가(17%)를 포함합니다.
이전에 치료받은 외투세포림프종
ACE-LY-004
이 섹션에 설명된 안전성 데이터는 LY-004 임상시험에서 이전에 치료받은 MCL 환자 124명에게 CALQUENCE(약 12시간마다 100mg)를 투여한 결과를 반영합니다 [see Clinical Studies (14.2)]. CALQUENCE의 중앙값 치료 기간은 16.6개월(범위: 0.1~26.6개월)이었습니다. 총 91명(73.4%)의 환자가 6개월 이상 CALQUENCE로 치료받았고 74명(59.7%)의 환자가 1년 이상 치료받았습니다.
모든 등급에서 가장 흔한 이상반응(≥ 20%)은 빈혈, 혈소판 감소증, 두통, 호중구 감소증, 설사, 피로, 근육통, 멍이었습니다. 비혈액학적 가장 흔한 이상반응의 1등급 중증도는 다음과 같습니다. 두통(25%), 설사(16%), 피로(20%), 근육통(15%), 멍(19%). 가장 흔한 3등급 이상의 비혈액학적 이상반응(환자의 최소 2%에서 보고됨)은 설사였습니다.
이상반응으로 인한 용량 감소 및 치료 중단은 각각 환자의 1.6% 및 6.5%에서 보고되었습니다.
표 6과 7은 CALQUENCE로 치료받은 MCL 환자에서 관찰된 이상반응의 빈도 범주를 보여줍니다.
|
신체 기관계 이상반응* |
CALQUENCE 단독요법 N=124 |
|
|
모든 등급 (%) |
3등급 이상 (%) |
|
|
신경계 장애 |
||
|
두통 |
39 |
1.6 |
|
위장관계 장애 |
||
|
설사 |
31 |
3.2 |
|
메스꺼움 |
19 |
0.8 |
|
복통 |
15 |
1.6 |
|
변비 |
15 |
– |
|
구토 |
13 |
1.6 |
|
전신 장애 |
||
|
피로 |
28 |
0.8 |
|
근골격계 및 결합조직 장애 |
||
|
근육통 |
21 |
0.8 |
|
피부 및 피하조직 장애 |
||
|
멍† |
21 |
– |
|
발진‡ |
18 |
0.8 |
|
혈관 장애 |
||
|
Hemorrhage§ |
8 |
0.8 |
|
호흡기계, 흉부 및 종격 질환 (Respiratory, thoracic and mediastinal disorders) |
||
|
코피 (Epistaxis) |
6 |
– |
|
||
|
혈액학적 (Hematologic) 이상반응 (Adverse Reactions)* |
CALQUENCE 단독요법 (CALQUENCE Monotherapy) N=124 |
|
|
모든 등급 (%) (All Grades (%)) |
3등급 이상 (%) (Grade ≥ 3 (%)) |
|
|
헤모글로빈 감소 (Hemoglobin decreased) |
46 |
10 |
|
혈소판 감소 (Platelets decreased) |
44 |
12 |
|
호중구 감소 (Neutrophils decreased) |
36 |
15 |
정상 상한치의 1.5~3배 크레아티닌 증가는 환자의 4.8%에서 발생했습니다.
만성 림프구성 백혈병
아래에 설명된 안전성 데이터는 두 건의 무작위 대조 임상 시험에서 CLL 환자 511명에게 CALQUENCE(약 12시간마다 100mg, 오비누투주맙 병용 또는 단독)를 투여한 결과를 반영합니다. [see Clinical Studies (14.3)].
CLL 환자에서 가장 흔한 모든 등급의 이상반응(≥ 30%)은 빈혈, 호중구 감소증, 혈소판 감소증, 두통, 상기도 감염 및 설사였습니다.
ELEVATE-TN
CALQUENCE + 오비누투주맙(CALQUENCE+G), CALQUENCE 단독 요법, 오비누투주맙 + 클로람부실(GClb)의 안전성은 이전에 치료받지 않은 CLL 환자 526명을 대상으로 한 무작위, 다기관, 공개, 활성 대조 시험에서 평가되었습니다. [see Clinical Studies (14.2)].
CLL 환자에서 가장 흔한 모든 등급의 이상반응(≥ 30%)은 빈혈, 호중구 감소증, 혈소판 감소증, 두통, 상기도 감염 및 설사였습니다.
ELEVATE-TN
CALQUENCE + 오비누투주맙(CALQUENCE+G), CALQUENCE 단독 요법, 오비누투주맙 + 클로람부실(GClb)의 안전성은 이전에 치료받지 않은 CLL 환자 526명을 대상으로 한 무작위, 다기관, 공개, 활성 대조 시험에서 평가되었습니다. [see Clinical Studies (14.3)].
CALQUENCE+G군에 무작위 배정된 환자는 6주기 동안 CALQUENCE와 오비누투주맙 병용 요법으로 치료받은 후 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 CALQUENCE 단독 요법으로 치료받았습니다. 환자는 2주기 1일째에 오비누투주맙 투여를 시작하여 총 6주기 동안 계속 투여했습니다. CALQUENCE 단독 요법에 무작위 배정된 환자는 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 CALQUENCE를 투여받았습니다. 이 시험에서는 연령 ≥ 65세 또는 18~< 65세이면서 총 누적 질병 등급 척도(CIRS) > 6 또는 크레아티닌 청소율 30~69mL/min, 간 트랜스아미나제 ≤ ULN의 3배, 총 빌리루빈 ≤ ULN의 1.5배인 환자가 필요했으며, 환자는 와파린 또는 동등한 비타민 K 길항제 이외의 항혈전제를 투여받을 수 있었습니다.
무작위 치료 기간 동안 CALQUENCE+G군과 CALQUENCE 단독 요법군에서 CALQUENCE에 대한 중앙값 노출 기간은 27.7개월(범위 0.3~40개월)이었으며, 각각 95%와 92%, 89%와 86%의 환자가 최소 6개월과 12개월 동안 노출되었습니다. 오비누투주맙 + 클로람부실군에서 중앙값 주기 수는 6이었으며, 84%의 환자가 최소 6주기의 오비누투주맙을 투여받았고, 70%의 환자가 최소 6주기의 클로람부실을 투여받았습니다. CALQUENCE+G군 환자의 85%가 최소 6주기의 오비누투주맙을 투여받았습니다.
CALQUENCE+G군과 CALQUENCE 단독 요법군에서 질병 진행 없이 마지막 연구 치료 후 30일 이내에 발생한 치명적인 이상반응은 각 치료군에서 2%로 보고되었으며, 대부분 감염으로 인한 것이었습니다. 중대한 이상반응은 CALQUENCE+G군 환자의 39%와 CALQUENCE 단독 요법군 환자의 32%에서 보고되었으며, 대부분 폐렴(2.8%~7%)으로 인한 것이었습니다.
CALQUENCE+G군에서 이상반응으로 인해 11%의 환자에서 치료가 중단되었고 7%의 환자에서 CALQUENCE 용량이 감량되었습니다. CALQUENCE 단독 요법군에서 이상반응으로 인해 10%의 환자에서 치료가 중단되었고 4%의 환자에서 용량이 감량되었습니다.
표 8과 9는 ELEVATE-TN 시험에서 확인된 이상반응과 실험실 이상을 나타냅니다.
|
||||||
|
신체 기관 이상반응*
|
CALQUENCE + Obinutuzumab |
CALQUENCE 단독요법 N=179 |
Obinutuzumab + Chlorambucil |
|||
|
모든 등급 (%) |
3등급 이상 (%) |
모든 등급 (%) |
3등급 이상 (%) |
모든 등급 (%) |
3등급 이상 (%) |
|
|
||||||
|
69 |
22‡ |
65 |
14‡ |
46 |
13‡ |
|
39 |
2.8 |
35 |
0 |
17 |
1.2 |
|
24 |
8 |
18 |
4.5 |
7 |
1.8 |
|
15 |
1.7 |
15 |
2.8 |
5 |
0.6 |
|
||||||
|
53 |
37 |
23 |
13 |
78 |
50 |
|
52 |
12 |
53 |
10 |
54 |
14 |
|
51 |
12 |
32 |
3.4 |
61 |
16 |
|
12 |
11 |
16 |
15 |
0.6 |
0.6 |
|
||||||
|
40 |
1.1 |
39 |
1.1 |
12 |
0 |
|
20 |
0 |
12 |
0 |
7 |
0 |
|
||||||
|
39 |
4.5 |
35 |
0.6 |
21 |
1.8 |
|
20 |
0 |
22 |
0 |
31 |
0 |
|
||||||
|
37 |
2.2 |
32 |
1.1 |
16 |
2.4 |
|
22 |
1.1 |
16 |
0.6 |
4.7 |
1.2 |
|
||||||
|
34 |
2.2 |
23 |
1.1 |
24 |
1.2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
20 |
1.7 |
20 |
1.7 |
6 |
0 |
다른 임상적으로 관련 있는 이상반응(CALQUENCE 투여 환자[obinutuzumab 병용 및 단독요법]에서 모든 등급 발생률 < 15%):
- •
- 신생물: 이차 원발성 악성종양 (10%), 비흑색종 피부암 (5%)
- •
- 심장 질환: 심방세동 또는 심방조동 (3.6%), 고혈압 (5%)
- •
- 감염: 헤르페스바이러스 감염 (6%)
| 검사 이상*† | CALQUENCE + Obinutuzumab N=178 |
CALQUENCE 단독요법 N=179 |
Obinutuzumab + Chlorambucil N=169 |
|||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | |
|
요산 증가 |
29 |
29 |
22 |
22 |
37 |
37 |
|
ALT 증가 |
30 |
7 |
20 |
1.1 |
36 |
6 |
|
AST 증가 |
38 |
5 |
17 |
0.6 |
60 |
8 |
|
빌리루빈 증가 |
13 |
0.6 |
15 |
0.6 |
11 |
0.6 |
CALQUENCE 병용군과 단독요법군 환자의 3.9%와 2.8%에서 각각 크레아티닌 수치가 ULN의 1.5~3배까지 증가했습니다.
ASCEND
재발성 또는 불응성 CLL 환자에서 CALQUENCE의 안전성은 무작위, 공개 라벨 연구(ASCEND)에서 평가되었습니다[임상 연구(14.3) 참조]. 이 시험에는 이전에 최소 한 번의 치료를 받은 재발성 또는 불응성 CLL 환자를 등록했으며 간 트랜스아미나제 ≤ ULN의 2배, 총 빌리루빈 ≤ ULN의 1.5배, 추정 크레아티닌 청소율 ≥ 30mL/min이 요구되었습니다. 이 시험에서는 절대 호중구 수 < 500/µL, 혈소판 수 < 30,000/µL, 프로트롬빈 시간 또는 활성 부분 트롬보플라스틴 시간 > ULN의 2배, 심각한 심혈관 질환 또는 강력한 CYP3A 억제제 또는 유도제가 필요한 환자는 제외되었습니다. 환자는 와파린 또는 동등한 비타민 K 길항제 이외의 항혈전제를 투여받을 수 있었습니다.
ASCEND에서 154명의 환자는 CALQUENCE(질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 100mg)를 투여받았고, 118명은 리툭시맙 제품을 최대 8회 주입하면서 이델라리십(질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 약 12시간마다 150mg)을 투여받았으며, 35명은 최대 6주기의 벤다무스틴과 리툭시맙 제품을 투여받았습니다. 전체 평균 연령은 68세(범위: 32-90세)였고, 67%는 남성이었으며, 92%는 백인이었고, 88%는 ECOG 수행 상태가 0 또는 1이었습니다.
CALQUENCE군에서 심각한 이상반응은 환자의 29%에서 발생했습니다. CALQUENCE를 투여받은 환자의 5% 이상에서 발생한 심각한 이상반응에는 하기도 감염(6%)이 포함되었습니다. CALQUENCE의 마지막 용량 투여 후 30일 이내에 발생한 치명적인 이상반응은 환자의 2.6%에서 발생했으며, 여기에는 이차 원발성 악성종양 및 감염이 포함됩니다.
CALQUENCE 투여 환자에서 이상반응으로 인한 영구적인 투약 중단은 환자의 10%에서 발생했으며, 가장 흔한 원인은 이차 원발성 악성종양 다음으로 감염이었습니다. 이상반응으로 인해 CALQUENCE의 용량 중단은 환자의 34%에서 발생했으며, 가장 흔한 원인은 호흡기 감염 다음으로 호중구 감소증이었고, 용량 감소는 환자의 3.9%에서 발생했습니다.
선택된 이상반응은 표 10에 설명되어 있으며 비혈액학적 검사 이상은 표 11에 설명되어 있습니다. 이 표는 환자의 94%가 6개월 이상 치료를 받았고 86%가 12개월 이상 치료를 받은 CALQUENCE에 대한 평균 노출 기간 15.7개월을 반영합니다. 이델라리십에 대한 평균 노출 기간은 11.5개월이었고 환자의 72%가 6개월 이상 치료를 받았고 48%가 12개월 이상 치료를 받았습니다. 환자의 83%가 6주기의 벤다무스틴과 리툭시맙 제품 투여를 완료했습니다.
|
||||||
|
신체 기관계 이상반응*
|
CALQUENCE N=154 |
이델라리십 + 리툭시맙 제품 N=118 |
벤다무스틴 + 리툭시맙 제품 N=35 |
|||
|
전체 |
3등급 이상 (%) |
전체 |
3등급 이상 (%) |
전체 |
3등급 이상 (%) |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
CALQUENCE 복용 환자에서 임상적으로 관련 있는 기타 이상반응(모든 등급 발생률 < 15%)은 다음과 같습니다.
- •
- 피부 및 피하 조직 장애: 멍(10%), 발진(9%)
- •
- 신생물: 두 번째 원발성 악성 종양(12%), 비흑색종 피부암(6%)
- •
- 근골격계 및 결합 조직 장애: 관절통(8%)
- •
- 심장 질환: 심방세동 또는 조동(5%), 고혈압(3.2%)
- •
- 감염: 헤르페스 바이러스 감염(4.5%)
| Laboratory Abnormality* | CALQUENCE N=154 |
Idelalisib plus Rituximab Product N=118 |
Bendamustine plus Rituximab Product N=35 |
|||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | 모든 등급 (%) |
3등급 이상 (%) | |
|
||||||
|
Uric acid increase |
15 |
15 |
11 |
11 |
23 |
23 |
|
ALT increase |
15 |
1.9 |
59 |
23 |
26 |
2.9 |
|
AST increase |
13 |
0.6 |
48 |
13 |
31 |
2.9 |
|
Bilirubin increase |
13 |
1.3 |
16 |
1.7 |
26 |
11 |
|
Per NCI CTCAE version 5 |
||||||
6.2 시판 후 경험
CALQUENCE 시판 후 사용 중 다음과 같은 이상반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되므로 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
- •
- 심장 질환: 심실 부정맥
- •
- 간담도 질환: 약물 유발 간 손상
7 약물 상호 작용
|
강력한 CYP3A 저해제 |
||
|
임상적 영향 |
|
|
|
예방 또는 관리 |
|
|
|
중등도 CYP3A 저해제 |
||
|
임상적 영향 |
|
|
|
예방 또는 관리 |
|
|
|
강력한 CYP3A 유도제 |
||
|
임상적 영향 |
|
|
|
예방 또는 관리 |
|
|
|
위산 감소제 |
||
|
임상적 영향 |
|
|
|
예방 또는 관리 |
제산제 |
최소 2시간 간격으로 투여하십시오 [약물 상호작용 권장 용량 (2.3) 참조]. |
|
H2 수용체 길항제 |
H2 수용체 길항제 복용 2시간 전에 CALQUENCE를 복용하십시오 [약물 상호작용 권장 용량 (2.3) 참조]. |
|
|
프로톤 펌프 저해제 |
병용 투여를 피하십시오. 프로톤 펌프 저해제의 지속적인 효과로 인해 용량 간격을 두더라도 CALQUENCE와의 상호작용을 제거하지 못할 수 있습니다. |
|
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과에 따르면, CALQUENCE는 임산부에게 투여될 경우 태아에게 해를 끼치고 분만 장애를 유발할 수 있습니다. 약물 관련 위험을 알려주는 임산부에 대한 데이터는 없습니다. 동물 생식 연구에서, 기관 형성기에 동물에게 acalabrutinib를 투여한 결과, 랫드에서는 분만 장애가 발생했고, 토끼에서는 어미의 노출량(AUC)이 100mg을 약 12시간마다 투여하는 권장 용량의 환자 노출량의 약 2배일 때 태아의 성장이 감소했습니다(자료 참조). 임산부에게 태아에 대한 잠재적 위험을 알려주십시오.
해당 인구집단에서 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 유산 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 선천적 기형 및 유산의 배경 위험은 각각 2-4% 및 15-20%로 추정됩니다.
자료
동물 자료
암컷 랫드에서의 생식능력 및 배아-태아 발생에 대한 병합 연구에서, acalabrutinib는 교미 14일 전부터 임신 17일까지 최대 200 mg/kg/일의 용량으로 경구 투여되었습니다. 배아-태아 발생 및 생존에 대한 영향은 관찰되지 않았습니다. 임신 랫드에서 200 mg/kg/일의 AUC는 100mg을 약 12시간마다 투여하는 권장 용량의 환자 AUC의 약 9배였습니다. 태아 랫드 혈장에서 acalabrutinib 및 그 활성 대사체의 존재가 확인되었습니다.
토끼에서의 배아-태아 발생 연구에서, 임신 동물에게 기관 형성 기간(GD 6-18) 동안 최대 200 mg/kg/일의 용량으로 acalabrutinib를 경구 투여했습니다. 100 mg/kg/일 이상의 용량으로 acalabrutinib를 투여하면 어미의 독성이 발생했고, 100 mg/kg/일의 용량에서는 태아 체중 감소 및 골화 지연이 발생했습니다. 임신 토끼에서 100 mg/kg/일의 AUC는 100mg을 약 12시간마다 투여하는 환자의 AUC의 약 2배였습니다.
랫드에서의 출산 전후 발생 연구에서, acalabrutinib는 기관 형성, 분만 및 수유 기간 동안 임신 동물에게 50, 100 및 150 mg/kg/일의 용량으로 경구 투여되었습니다. 100 mg/kg/일 이상의 용량에서는 분만 장애(분만 지연 또는 어려움) 및 자손 사망이 관찰되었습니다. 임신 랫드에서 100 mg/kg/일의 AUC는 100mg을 약 12시간마다 투여하는 환자의 AUC의 약 2배였습니다. 또한 150 mg/kg/일(환자의 100mg을 약 12시간마다 투여하는 AUC의 약 5배)의 AUC에서 F1 세대 자손에게서 신장 유두 저발달이 관찰되었습니다.
8.3 생식 능력이 있는 여성 및 남성
CALQUENCE는 임산부에게 투여될 경우 태아에게 해를 끼치고 분만 장애를 유발할 수 있습니다 [특정 인구집단에서의 사용 (8.1) 참조].
임신 검사
CALQUENCE 치료를 시작하기 전에 생식 능력이 있는 여성에게 임신 검사를 권장합니다.
피임
여성
생식 능력이 있는 여성 환자에게 CALQUENCE 치료 중 및 마지막 CALQUENCE 복용 후 최소 1주일 동안 효과적인 피임법을 사용하도록 조언하십시오. 이 약물을 임신 중에 사용하거나 이 약물을 복용하는 동안 임신이 된 경우, 환자에게 태아에 대한 잠재적 위험을 알려야 합니다.
8.5 노인 사용
CLL 및 이전에 치료받은 MCL
임상 시험에서 CLL 또는 재발성 또는 불응성 MCL이 있는 CALQUENCE 치료 환자 1,467명 중 977명(67%)이 65세 이상이었고, 328명(22%)이 75세 이상이었습니다. 65세 이상 환자 중 74%가 3등급 이상의 부작용을 경험했고, 58%가 심각한 부작용을 경험했습니다. 65세 미만 환자 중 61%가 3등급 이상의 부작용을 경험했고, 39%가 심각한 부작용을 경험했습니다. 65세 이상 환자와 그 미만 환자 간에 유효성에 임상적으로 관련된 차이는 관찰되지 않았습니다.
이전에 치료받지 않은 MCL
이전에 치료받지 않은 MCL이 있는 CALQUENCE 치료 환자 297명 중 214명(72%)이 65~74세였고, 83명(28%)이 75세 이상이었습니다. 65~74세 환자와 75세 이상 환자 간에 안전성 또는 유효성에 임상적으로 관련된 차이는 관찰되지 않았습니다.
8.6 간 손상
중증 간 손상 환자에게는 CALQUENCE 투여를 피하십시오. 중등도 또는 중증 간 손상 환자에 대한 CALQUENCE의 안전성은 평가되지 않았습니다 [간 손상에 대한 권장 용량 (2.2) 및 임상 약리학 (12.3) 참조].
11 설명
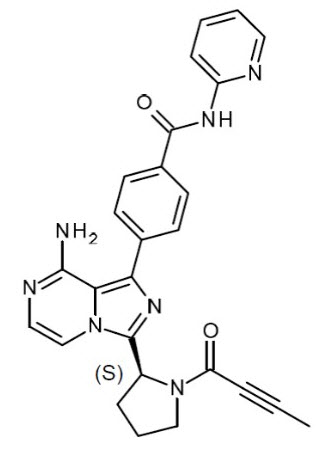
CALQUENCE (acalabrutinib)는 Bruton tyrosine kinase (BTK) 억제제입니다. acalabrutinib의 분자식은 C26H23N7O2이며, 분자량은 465.51입니다. 화학명은 4-{8-amino-3-[(2S)-1-(but-2-ynoyl)pyrrolidin-2-yl]imidazo[1,5-a]pyrazin-1-yl)}-N-(pyridine-2-yl)benzamide입니다.
acalabrutinib의 화학 구조는 아래와 같습니다:
Acalabrutinib는 pH 의존성 용해도를 가진 백색에서 황색 분말입니다. pH 3 미만에서는 물에 자유롭게 용해되고, pH 6 이상에서는 실질적으로 불용성입니다.
경구 투여용 CALQUENCE 캡슐은 100mg의 acalabrutinib와 다음과 같은 불활성 성분을 함유하고 있습니다: silicified microcrystalline cellulose, partially pregelatinized starch, magnesium stearate, sodium starch glycolate. 캡슐 껍질은 gelatin, titanium dioxide, yellow iron oxide, FD&C Blue 2를 함유하고 있으며, 식용 검정색 잉크로 각인되어 있습니다.
12 약물동력학
12.1 작용 기전
아칼라브루티닙은 BTK의 소분자 억제제입니다. 아칼라브루티닙과 그 활성 대사체인 ACP-5862는 BTK 활성 부위의 시스테인 잔기와 공유 결합을 형성하여 BTK 효소 활성을 억제합니다. BTK는 B 세포 항원 수용체(BCR) 및 사이토카인 수용체 경로의 신호 전달 분자입니다. B 세포에서 BTK 신호 전달은 B 세포 증식, 이동, 화학 주성 및 부착에 필요한 경로의 활성화를 초래합니다. 비임상 연구에서 아칼라브루티닙은 BTK 매개 하류 신호 전달 단백질 CD86 및 CD69의 활성화를 억제하고 마우스 이종 이식 모델에서 악성 B 세포 증식 및 종양 성장을 억제했습니다.
12.2 약력학
B 세포 악성 종양 환자에게 약 12시간마다 100mg을 투여한 경우, 말초혈액에서 12시간 이상 ≥ 95%의 BTK 점유율 중앙값이 유지되어 권장 투여 간격 동안 BTK가 불활성화되었습니다.
심장 전기 생리학
48명의 건강한 성인 피험자를 대상으로 한 무작위, 이중 맹검, 이중 가짜 약물, 위약 및 양성 대조군, 4방향 교차 완전 QTc 연구에서 QTc 간격에 대한 아칼라브루티닙의 효과를 평가했습니다. 최대 권장 단회 투여량의 4배에 해당하는 아칼라브루티닙 단회 투여는 임상적으로 관련 있는 정도(즉, ≥ 10ms)까지 QTc 간격을 연장하지 않았습니다.
12.3 약동학
아칼라브루티닙은 용량 비례성을 나타내며, 아칼라브루티닙과 그 활성 대사체인 ACP-5862의 노출량은 B 세포 악성 종양 환자에서 75~250mg(승인된 권장 단회 투여량의 0.75~2.5배)의 용량 범위에서 용량에 따라 증가합니다. 1일 2회 100mg의 권장 용량에서 아칼라브루티닙의 기하 평균(% 변동 계수[CV]) 일일 혈장 약물 농도 시간 경과 곡선하 면적(AUC24h) 및 최대 혈장 농도(Cmax)는 각각 1843(38%) ng•h/mL 및 563(29%) ng/mL이었고, ACP-5862의 경우 각각 3947(43%) ng•h/mL 및 451(52%) ng/mL이었습니다.
흡수
아칼라브루티닙의 기하 평균 절대 생체 이용률은 25%였습니다. 아칼라브루티닙 혈장 농도의 최고점에 도달하는 시간(Tmax)의 중앙값[최소값, 최대값]은 0.9[0.5, 1.9]시간이었고, ACP-5862의 경우 1.6[0.9, 2.7]시간이었습니다.
음식의 영향
건강한 피험자에서 고지방, 고칼로리 식사(약 918칼로리, 탄수화물 59g, 지방 59g, 단백질 39g)와 함께 아칼라브루티닙 75mg 단회 투여(승인된 권장 단회 투여량의 0.75배)를 한 경우, 공복 상태에서 투여한 경우와 비교하여 평균 AUC에는 영향을 미치지 않았습니다. 결과적으로 Cmax는 73% 감소했고 Tmax는 1~2시간 지연되었습니다.
분포
인간 혈장 단백질에 대한 가역적 결합은 아칼라브루티닙의 경우 97.5%, ACP-5862의 경우 98.6%였습니다. 시험관 내 평균 혈액-혈장 비율은 아칼라브루티닙의 경우 0.8, ACP-5862의 경우 0.7이었습니다. 기하 평균(% CV) 정상 상태 분포 용적(Vss)은 아칼라브루티닙의 경우 약 101(52%) L, ACP-5862의 경우 67(32%) L이었습니다.
배설
아칼라브루티닙의 기하 평균(% CV) 최종 배설 반감기(t1/2)는 아칼라브루티닙의 경우 1(59%)시간, ACP-5862의 경우 3.5(24%)시간이었습니다. 아칼라브루티닙의 기하 평균(%CV) 겉보기 경구 청소율(CL/F)은 71(35%) L/hr이었고, ACP-5862의 경우 13(42%) L/hr이었습니다.
대사
시험관 내 연구에 따르면 아칼라브루티닙은 주로 CYP3A 효소에 의해 대사되고, 부차적으로 글루타티온 접합 및 아미드 가수분해에 의해 대사됩니다. ACP-5862는 혈장에서 주요 활성 대사체로 확인되었으며, 그 노출량(AUC)의 기하 평균은 아칼라브루티닙 노출량보다 약 2~3배 높았습니다. ACP-5862는 BTK 억제와 관련하여 아칼라브루티닙보다 약 50% 덜 강력합니다.
배출
건강한 피험자에게 방사성 동위원소로 표지된 아칼라브루티닙 100mg 단회 투여 후, 투여량의 84%는 대변에서 회수되었고, 투여량의 12%는 소변에서 회수되었으며, 투여량의 2% 미만이 변화되지 않은 아칼라브루티닙으로 소변과 대변에서 배설되었습니다.
특정 집단
연령, 인종 및 체중
연령(32~90세), 성별, 인종(백인, 흑인), 체중(40~149kg)은 아칼라브루티닙과 그 활성 대사체인 ACP-5862의 약동학에 임상적으로 의미 있는 영향을 미치지 않았습니다.
신장 장애
경도 또는 중등도 신장 장애(MDRD(신장 질환 식이 수정 방정식)에 의해 추정된 eGFR ≥ 30 mL/min/1.73m2) 환자에서 임상적으로 관련 있는 약동학적 차이는 관찰되지 않았습니다. 아칼라브루티닙 약동학은 중증 신장 장애(eGFR < 29 mL/min/1.73m2, MDRD) 환자 또는 투석이 필요한 신장 장애 환자에서 평가되지 않았습니다.
간 장애
정상 간 기능을 가진 피험자와 비교하여 경도 간 장애(Child-Pugh 등급 A) 피험자의 아칼라브루티닙 AUC는 1.9배, 중등도 간 장애(Child-Pugh 등급 B) 피험자의 경우 1.5배, 중증 간 장애(Child-Pugh 등급 C) 피험자의 경우 5.3배 증가했습니다. 정상 간 기능을 가진 피험자와 비교하여 중증 간 장애(Child-Pugh 등급 C) 피험자에서 ACP-5862의 임상적으로 관련 있는 약동학적 차이는 관찰되지 않았습니다. 정상 간 기능(총 빌리루빈 및 AST가 ULN 범위 내)을 가진 환자에 비해 경도 또는 중등도 간 장애(총 빌리루빈이 정상 상한치[ULN] 이하이고 AST가 ULN보다 크거나, 총 빌리루빈이 ULN보다 크고 AST가 어떤 값이든) 환자에서 아칼라브루티닙과 ACP-5862의 임상적으로 관련 있는 약동학적 차이는 관찰되지 않았습니다.
약물 상호작용 연구
CYP3A 억제제가 아칼라브루티닙에 미치는 영향
강력한 CYP3A 저해제(1일 1회 200mg 이트라코나졸 5일간 투여)와 병용 투여 시 건강한 피험자에서 아칼라브루티닙 Cmax는 3.9배, AUC는 5.1배 증가했습니다.
아칼라브루티닙과 중등도 CYP3A 저해제(에리스로마이신, 플루코나졸, 딜티아젬)에 대한 생리 기반 약물동력학(PBPK) 시뮬레이션 결과, 병용 투여 시 아칼라브루티닙 Cmax와 AUC가 약 2~3배 증가하는 것으로 나타났습니다.
CYP3A 유도제의 아칼라브루티닙에 대한 영향
강력한 CYP3A 유도제(1일 1회 600mg 리팜핀 9일간 투여)와 병용 투여 시 건강한 피험자에서 아칼라브루티닙 Cmax는 68% 감소하고 AUC는 77% 감소했습니다.
위산 감소제
아칼라브루티닙의 용해도는 pH가 증가함에 따라 감소합니다. 건강한 피험자에서 제산제(1g 탄산칼슘)와 병용 투여 시 아칼라브루티닙 AUC는 53% 감소했습니다. 프로톤 펌프 억제제(40mg 오메프라졸 5일간 투여)와 병용 투여 시 아칼라브루티닙 AUC는 43% 감소했습니다.
In Vitro 연구
대사 경로
아칼라브루티닙은 CYP3A4/5, CYP2C8 및 CYP2C9의 약한 저해제이지만 CYP1A2, CYP2B6, CYP2C19, CYP2D6, UGT1A1 및 UGT2B7는 저해하지 않습니다. ACP-5862는 CYP2C8, CYP2C9 및 CYP2C19의 약한 저해제이지만 CYP1A2, CYP2B6, CYP2D6, CYP3A4/5, UGT1A1 및 UGT2B7는 저해하지 않습니다.
아칼라브루티닙은 CYP1A2, CYP2B6 및 CYP3A4의 약한 유도제이며, ACP-5862는 CYP3A4를 약하게 유도합니다.
In vitro 데이터 및 PBPK 모델링을 바탕으로 임상적으로 관련성 있는 농도에서는 CYP 기질과의 상호작용은 예상되지 않습니다.
약물 수송체 시스템
아칼라브루티닙과 그 활성 대사체인 ACP-5862는 P-당단백질(P-gp)과 유방암 저항성 단백질(BCRP)의 기질입니다. 아칼라브루티닙은 신장 흡수 수송체 OAT1, OAT3 및 OCT2 또는 간 수송체 OATP1B1 및 OATP1B3의 기질이 아닙니다. ACP-5862는 OATP1B1 또는 OATP1B3의 기질이 아닙니다.
아칼라브루티닙과 ACP-5862는 임상적으로 관련성 있는 농도에서 P-gp, OAT1, OAT3, OCT2, OATP1B1, OATP1B3 및 MATE2-K를 저해하지 않습니다.
아칼라브루티닙은 장 BCRP의 저해를 통해 병용 투여된 BCRP 기질(예: 메토트렉세이트)의 노출을 증가시킬 수 있습니다. ACP-5862는 임상적으로 관련성 있는 농도에서 BCRP를 저해하지 않습니다. 아칼라브루티닙은 MATE1을 저해하지 않지만, ACP-5862는 MATE1의 저해를 통해 병용 투여된 MATE1 기질(예: 메트포르민)의 노출을 증가시킬 수 있습니다.
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저해
아칼라브루티닙을 사용한 발암성 연구는 수행되지 않았습니다.
아칼라브루티닙은 시험관내 세균 역돌연변이(AMES) 분석에서 돌연변이원성이 없었으며, 시험관내 인간 림프구 염색체 이상 분석 또는 생체내 랫드 골수 미세핵 분석에서 염색체 이상을 유발하지 않았습니다.
랫드를 대상으로 한 생식능력 연구에서, 1일 2회 100mg의 권장 용량으로 투여받은 환자에게서 관찰된 AUC의 11배(수컷 랫드) 또는 9배(암컷 랫드)에 해당하는 노출량에서도 아칼라브루티닙은 수컷 또는 암컷 랫드의 생식능력에 영향을 미치지 않았습니다.
14 CLINICAL STUDIES
14.1 이전 치료를 받지 않은 맨틀세포 림프종
ECHO
이전 치료를 받지 않은 MCL 환자에서 CALQUENCE의 효능은 무작위 배정, 이중맹검, 위약 대조, 다기관 연구(ECHO; NCT02972840)에서 평가되었습니다. 이 연구에는 65세 이상이고 이식을 할 의향이 없는 598명의 환자가 등록되었습니다. 이 연구는 총 빌리루빈 > 정상 상한치(ULN)의 1.5배, AST 또는 ALT > ULN의 2.5배, 또는 추정 크레아티닌 청소율 ≤ 50 mL/min인 환자를 제외했습니다. 환자는 1:1 비율로 CALQUENCE + 벤다무스틴 + 리툭시맙(CALQUENCE + BR) 또는 위약 + BR을 투여받도록 무작위 배정되었습니다. 두 군 모두에 대한 투여는 다음과 같이 28일 주기로 시행되었습니다.
- •
- CALQUENCE + BR은 최대 6회의 치료 주기 동안 투여되었습니다. CALQUENCE 100mg 경구제는 1주기 1일에 1일 2회 투여를 시작했습니다. 벤다무스틴은 6주기 각각의 1일과 2일에 30분 동안 정맥 주사로 90mg/m2 투여되었습니다. 리툭시맙은 6주기 동안 각 주기의 1일에 375mg/m2 정맥 주사로 투여되었습니다.
- •
- 반응(PR 또는 CR)을 달성한 환자의 경우, CALQUENCE 100mg 경구제는 1일 2회 지속적으로 투여되었으며, 리툭시맙은 30주기까지 최대 12회 추가 투여량으로 격주 1일에 375mg/m2 투여되었습니다. 리툭시맙 중단 후, 환자는 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 CALQUENCE 단독 요법을 1일 2회 100mg 경구로 계속 투여받았습니다.
대조군 환자는 CALQUENCE 대신 위약을 제외하고 동일한 요법을 받았습니다. 위약 + BR 군 환자는 질병 진행 시 CALQUENCE 단독 요법으로 전환이 허용되었습니다.
무작위 배정된 모든 환자 중 중앙값 연령은 71세(범위: 65-86세)였으며, 71%가 남성이었고, 78%가 백인, 16%가 아시아인, 0.5%가 흑인 또는 아프리카계 미국인이었습니다. 총 80%가 MCL의 고전적 조직학적 특징을 보였고, 7.7%가 폭발성 MCL, 5.5%가 다형성 MCL을 보였습니다. 단순화된 MIPI(맨틀세포 림프종 국제 예후 지수) 점수는 환자의 33%에서 낮았고, 43%에서 중간이었고, 24%에서 높았습니다. 총 38%의 환자가 종양 크기 ≥ 5cm였고, 86%가 Ann Arbor 4기 질환을 보였습니다.
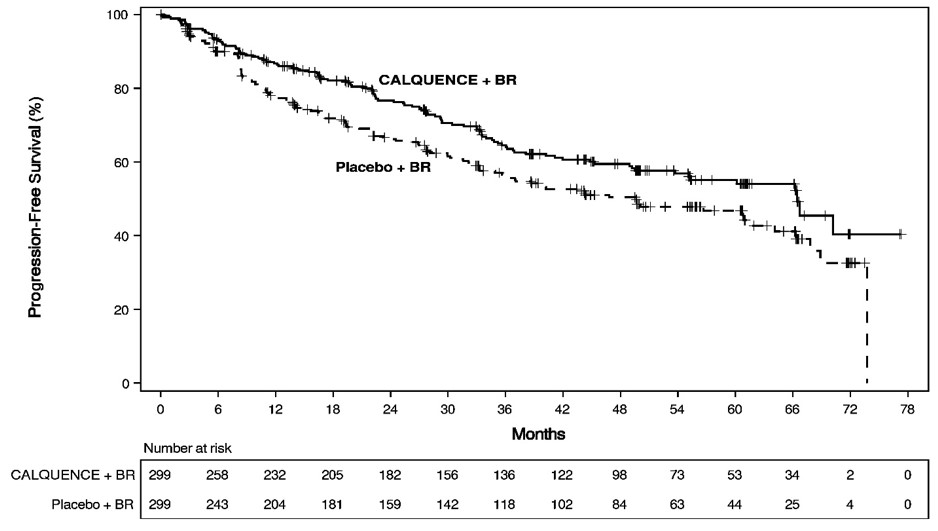
주요 효능 결과는 Lugano 분류를 사용하는 독립적 검토 위원회(IRC)에 의해 평가된 무진행 생존율(PFS)이었습니다. 효능 결과는 표 12에 제시되어 있습니다. PFS에 대한 Kaplan-Meier 곡선은 그림 1에 나와 있습니다. 이 사전에 지정된 중간 분석에서 PFS에 대한 중앙값 추적 관찰 기간은 두 군 모두 49.8개월이었습니다.
|
IRC 기준 결과 |
CALQUENCE + BR N= 299 |
위약 + BR N= 299 |
|
무진행 생존율* |
||
|
66.4 (55.1, NE) |
49.6 (36.0, 64.1) |
|
0.73 (0.57, 0.94) |
|
|
0.016 |
|
|
전체 반응률(ORR)(CR + PR) |
||
|
272 (91) |
263 (88) |
|
87, 94 |
84, 91 |
|
199 (67) |
160 (54) |
|
73 (24) |
103 (34) |
|
0.220 |
|
|
HR = hazard ratio, CR = complete response, PR = partial response, NE – not evaluable |
||
Figure 1. ECHO 연구에서 이전 치료를 받지 않은 MCL 환자의 IRC 평가 PFS에 대한 Kaplan-Meier 곡선
PFS 분석 시점에서, 두 군 모두에서 중앙 전체 생존 기간은 도달하지 않았으며, 총 203명이 사망했습니다: CALQUENCE + BR 군에서는 97명(32%), placebo + BR 군에서는 106명(35%)의 환자가 사망했습니다.
14.2 이전에 치료받은 맨틀세포 림프종
ACE-LY-004
CALQUENCE의 효능은 “맨틀세포 림프종 환자에서 ACP-196의 개방표지, 2상 연구”라는 제목의 LY-004 시험(NCT02213926)을 기반으로 했습니다. LY-004 시험에는 이전에 최소 한 가지 치료를 받은 MCL 환자 124명이 등록되었습니다.
중앙 연령은 68세(범위 42~90세)였으며, 80%가 남성이었고, 74%가 백인이었습니다. 기준 시점에서 환자의 93%가 ECOG 기능 상태 0 또는 1이었습니다. 진단 이후 중앙 시간은 46.3개월이었고, 이전 치료의 중앙 수는 2회(범위 1~5회)였으며, 이전 줄기세포 이식을 받은 환자는 18%였습니다. BTK 억제제로 이전 치료를 받은 환자는 제외되었습니다. 가장 흔한 이전 요법은 CHOP 기반(52%) 및 ARA-C(34%)였습니다. 기준 시점에서 환자의 37%가 최장 직경이 5cm 이상인 종양을 하나 이상 가지고 있었고, 73%가 림프절 외 병변을 보였으며, 그중 51%는 골수 병변이 있었습니다. 단순화된 맨틀세포 림프종 국제 예후 지수(MIPI) 점수(연령, ECOG 점수, 기준 젖산 탈수소 효소 및 백혈구 수 포함)는 환자의 44%에서 중간이었고 17%에서 높았습니다.
CALQUENCE는 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 경구로 12시간마다 약 100mg을 투여했습니다. 중앙 용량 강도는 98.5%였습니다. LY-004 시험의 주요 효능 결과는 전체 반응률이었으며, 중앙 추적 관찰 기간은 15.2개월이었습니다.
|
||
|
연구자 평가 N=124 |
독립적 검토 위원회(IRC) 평가 N=124 |
|
|
전체 반응률(ORR)* |
||
|
ORR (%) [95% CI] |
81 [73, 87] |
80 [72, 87] |
|
완전 관해 (%) [95% CI] |
40 [31, 49] |
40 [31, 49] |
|
부분 관해 (%) [95% CI] |
41 [32, 50] |
40 [32, 50] |
|
반응 지속 기간(DoR) |
||
|
중앙 DoR (개월) [범위] |
NE [1+ to 20+] |
NE [0+ to 20+] |
|
CI= 신뢰 구간; NE=추정 불가; +는 검열된 관찰값을 나타냅니다 |
||
최적 반응까지의 중앙값 기간은 1.9개월이었습니다.
림프구증가증
CALQUENCE 투여 시작 시, 시험 LY-004에서 환자의 31.5%에서 림프구 수의 일시적인 증가(절대 림프구 수(ALC)가 기준치보다 ≥ 50% 증가하고 기준치 이후 평가 ≥ 5 x 109로 정의)가 나타났습니다. 림프구증가증 발병까지의 중앙값 기간은 1.1주였고, 림프구증가증의 중앙값 기간은 6.7주였습니다.
14.3 만성 림프구성 백혈병
CLL 환자에서 CALQUENCE의 효능은 두 건의 무작위 대조 시험에서 입증되었습니다. CALQUENCE의 적응증에는 동일한 질병인 SLL 환자도 포함됩니다.
ELEVATE-TN
CALQUENCE의 효능은 ELEVATE-TN 시험에서 평가되었습니다. 이 시험은 이전에 치료받지 않은 만성 림프구성 백혈병 환자 535명을 대상으로 한 무작위, 다기관, 공개, 적극적 대조, 3군 시험으로, obinutuzumab 병용 CALQUENCE, CALQUENCE 단독 요법, chlorambucil 병용 obinutuzumab을 비교했습니다 (NCT02475681). 65세 이상 또는 누적 질병 평가 척도(CIRS)가 > 6 또는 크레아티닌 청소율이 30~69 mL/min인 18~65세 환자를 등록했습니다. 이 시험에는 또한 간 트랜스아미나제가 정상 상한치(ULN)의 ≤ 3배이고 총 빌리루빈이 ULN의 ≤ 1.5배인 환자를 포함했으며, Richter 변환이 있는 환자는 제외했습니다.
환자는 3군으로 1:1:1 비율로 무작위 배정되어 다음을 투여받았습니다.
- •
- CALQUENCE + obinutuzumab (CALQUENCE+G): CALQUENCE 100mg을 1주기 1일차부터 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 약 12시간마다 투여했습니다. Obinutuzumab는 2주기 1일차부터 최대 6회 치료 주기 동안 투여했습니다. Obinutuzumab 1000mg을 2주기 1일차 및 2일차(1일차 100mg, 2일차 900mg), 8일차 및 15일차에 투여한 후 3주기부터 7주기까지 1일차에 1000mg을 투여했습니다. 각 주기는 28일이었습니다.
- •
- CALQUENCE 단독 요법: CALQUENCE 100mg을 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 약 12시간마다 투여했습니다.
- •
- Obinutuzumab + chlorambucil (GClb): Obinutuzumab 및 chlorambucil을 최대 6회 치료 주기 동안 투여했습니다. Obinutuzumab 1000mg을 1주기 1일차 및 2일차(1일차 100mg, 2일차 900mg), 8일차 및 15일차에 정맥 주사로 투여한 후 2주기부터 6주기까지 1일차에 1000mg을 투여했습니다. Chlorambucil 0.5mg/kg을 1주기부터 6주기까지 1일차 및 15일차에 경구 투여했습니다. 각 주기는 28일이었습니다.
무작위 배정은 17p 결실 돌연변이 상태, ECOG 수행 상태(0 또는 1 대 2), 지리적 지역에 따라 계층화되었습니다. 총 535명의 환자가 무작위 배정되었으며, CALQUENCE+G군 179명, CALQUENCE 단독 요법군 179명, GClb군 177명이었습니다. 전체 중앙값 연령은 70세(범위: 41~91세)였으며, 47%가 Rai 3기 또는 4기 질병을 앓고 있었고, 14%가 17p 결실 또는 TP53 돌연변이를 가지고 있었고, 63%의 환자가 돌연변이가 없는 IGVH를 가지고 있었고, 18%가 11q 결실을 가지고 있었습니다. 기준치 인구통계학적 특징 및 질병 특징은 치료군 간에 유사했습니다.
효능은 독립적 검토 위원회(IRC)가 평가한 무진행 생존율(PFS)을 기준으로 했습니다. 추적 관찰의 중앙값 기간은 28.3개월(범위: 0.0~40.8개월)이었습니다. 효능 결과는 표 10에 제시되어 있습니다. PFS에 대한 Kaplan-Meier 곡선은 그림 1에 나와 있습니다.
|
CALQUENCE + Obinutuzumab N=179 |
CALQUENCE 단독 요법 N=179 |
Obinutuzumab + Chlorambucil N=177 |
|
|
무진행 생존율* |
|||
|
사건 수 (%) |
14 (8) |
26 (15) |
93 (53) |
|
PD, n (%) |
9 (5) |
20 (11) |
82 (46) |
|
사망 사건, n (%) |
5 (3) |
6 (3) |
11 (6) |
|
중앙값 (95% CI), 개월† |
NE |
NE (34, NE) |
22.6 (20, 28) |
|
HR‡(95% CI) |
0.10 (0.06, 0.17) |
0.20 (0.13, 0.30) |
– |
|
p-값§ |
< 0.0001 |
< 0.0001 |
– |
|
전체 반응률* (CR + CRi + nPR + PR) |
|||
|
ORR, n (%) |
168 (94) |
153 (86) |
139 (79) |
|
(95% CI) |
(89, 97) |
(80, 90) |
(72, 84) |
|
p-값¶ |
< 0.0001 |
0.0763 |
– |
|
CR, n (%) |
23 (13) |
1 (1) |
8 (5) |
|
CRi, n (%) |
1 (1) |
0 |
0 |
|
nPR, n (%) |
1 (1) |
2 (1) |
3 (2) |
|
PR, n (%) |
143 (80) |
150 (84) |
128 (72) |
|
ITT=intent-to-treat; CI=신뢰구간; HR=위험비; NE=추정 불가; CR=완전 관해; CRi=불완전한 혈구 수 회복을 동반한 완전 관해; nPR=결절성 부분 관해; PR=부분 관해. |
|||
그림 2: ELEVATE-TN에서 CLL 환자의 IRC 평가 PFS에 대한 Kaplan-Meier 곡선
28.3개월의 중앙 추적 관찰 기간에서, 어떤 군에서도 중앙 전체 생존 기간에 도달하지 못했으며, 10% 미만의 환자에서 사건이 발생했습니다.
ASCEND
재발성 또는 불응성 CLL 환자에서 CALQUENCE의 효능은 다기관, 무작위, 공개 표지 시험(ASCEND; NCT02970318)을 기반으로 했습니다. 이 시험에는 적어도 1가지 이전 전신 치료 후 재발성 또는 불응성 CLL 환자 310명이 등록되었습니다. 이 시험에서는 형질전환 질환, 전림프구성 백혈병 또는 이전에 venetoclax, Bruton 티로신 키나제 억제제 또는 phosphoinositide-3 키나제 억제제로 치료받은 환자는 제외되었습니다.
환자는 1:1 비율로 무작위 배정되어 다음 중 하나를 받았습니다.
- •
- 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 약 12시간마다 CALQUENCE 100mg을 투여하거나,
- •
- 연구자의 선택:
- o
- Idelalisib + rituximab 제제(IR): 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 약 12시간마다 경구로 Idelalisib 150mg을 투여하고, rituximab 제제 8회 주입(1주기 1일에 정맥내로 375 mg/m2, 그 후 4회 용량에 대해 2주마다 500 mg/m2, 그리고 3회 용량에 대해 4주마다)과 병용하며, 28일 주기 길이를 사용합니다.
- o
- Bendamustine + rituximab 제제(BR): 28일 주기의 1일과 2일에 정맥내로 Bendamustine 70 mg/m2을 투여하고, rituximab 제제(1주기 1일에 정맥내로 375 mg/m2, 그 후 이후 주기 1일에 500 mg/m2)와 병용하여 최대 6주기까지 투여합니다.
무작위 배정은 17p 결실 돌연변이 상태, ECOG 기능 상태(0 또는 1 대 2), 그리고 이전 치료 횟수(1~3 대 ≥4)에 따라 계층화되었습니다. 총 310명의 환자 중 155명이 CALQUENCE 단독 요법에, 119명이 IR에, 36명이 BR에 배정되었습니다. 전체 중앙 연령은 67세(범위: 32~90세)였으며, 42%가 Rai 3기 또는 4기 질환을 가졌고, 28%가 17p 결실 또는 TP53 돌연변이를 가졌고, 78%의 환자가 돌연변이가 없는 IGVH를 가졌고, 27%가 11q 결실을 가졌습니다. CALQUENCE 군의 중앙 이전 치료 횟수는 1회(범위 1~8회)였으며, 47%가 적어도 2회 이상의 이전 치료를 받았습니다. 연구자 선택 군의 중앙 이전 치료 횟수는 2회(범위 1~10회)였으며, 57%가 적어도 2회 이상의 이전 치료를 받았습니다.
CALQUENCE 군에서 중앙 치료 기간은 15.7개월이었으며, 94%의 환자가 적어도 6개월 이상 치료받았고, 86%의 환자가 적어도 1년 이상 치료받았습니다. 연구자 선택 군에서 중앙 치료 기간은 8.4개월이었으며, 59%의 환자가 적어도 6개월 이상 치료받았고, 37%의 환자가 적어도 1년 이상 치료받았습니다.
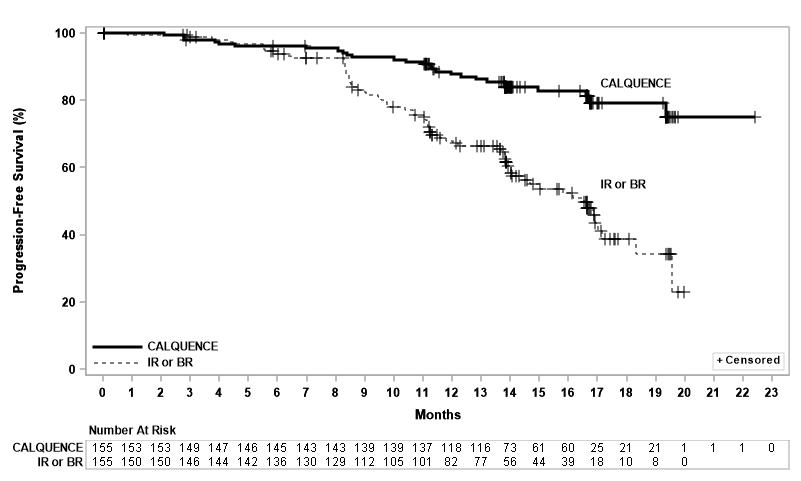
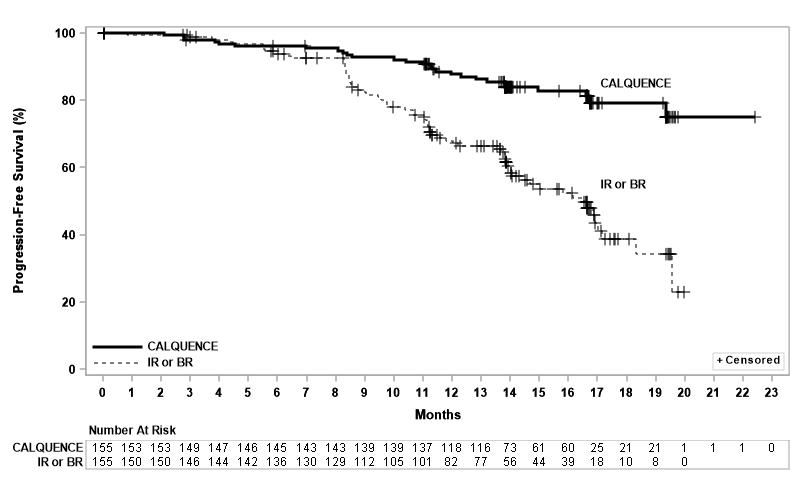
효능은 IRC에 의해 평가된 PFS를 기반으로 하였으며, 중앙 추적 관찰 기간은 16.1개월(범위 0.03~22.4개월)이었습니다. 효능 결과는 표 11에 제시되어 있습니다. PFS에 대한 Kaplan-Meier 곡선은 그림 2에 나와 있습니다. 두 치료 군 간에 전체 반응률에 통계적으로 유의미한 차이는 없었습니다.
| CALQUENCE 단독 요법 N=155 |
Idelalisib + Rituximab 제제 또는 Bendamustine + Rituximab 제제 연구자 선택 N=155 |
|
|---|---|---|
|
무진행 생존 기간* |
||
|
사건 수, n (%) |
27 (17) |
68 (44) |
|
질병 진행, n |
19 |
59 |
|
사망, n |
8 |
9 |
|
중앙값 (95% CI), 개월† |
NE (NE, NE) |
16.5 (14.0, 17.1) |
|
HR (95% CI)‡ |
0.31 (0.20, 0.49) |
|
|
P-값§ |
< 0.0001 |
|
|
ORR, n (%)¶ |
126 (81) |
117 (75) |
|
(95% CI) |
(74, 87) |
(68, 82) |
|
CR, n (%) |
0 |
2 (1) |
|
CRi, n (%) |
0 |
0 |
|
nPR, n (%) |
0 |
0 |
|
PR, n (%) |
126 (81) |
115 (74) |
|
ITT=intent-to-treat; CI=confidence interval; HR=hazard ratio; NE=not estimable; CR=complete response; CRi=complete response with incomplete blood count recovery; nPR=nodular partial response; PR=partial response |
||
그림 3: ASCEND에서 CLL 환자의 IRC 평가 PFS에 대한 Kaplan-Meier 곡선
16.1개월의 중앙 추적 관찰 기간 동안, 어느 군에서도 중앙 전체 생존 기간에 도달하지 못했으며, 11% 미만의 환자에서 사건이 발생했습니다.
16 제공/보관 및 취급 방법
포장 단위
|
포장 규격 |
내용물 |
NDC 번호 |
|
60정들이 병 |
캡슐 60정이 들어있는 병 100mg, 노란색 몸체와 파란색 뚜껑의 경질 젤라틴 캡슐, 검정색 잉크로 ‘ACA 100 mg’ 표시 |
0310-0512-60 |
보관
20°C-25°C (68°F-77°F)에 보관하십시오. 15°C-30°C (59°F-86°F)의 온도 편차는 허용됩니다 [USP 제어 실온 참조].
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨링(환자 정보)을 읽도록 권장하십시오.
심각한 감염 및 기회 감염
환자에게 심각한 감염의 가능성을 알리고 감염을 시사하는 징후나 증상을 보고하도록 하십시오 [경고 및 주의사항 (5.1) 참조].
출혈
환자에게 출혈의 징후나 증상을 보고하도록 알리십시오. 주요 수술의 경우 CALQUENCE 복용을 중단해야 할 수 있음을 환자에게 알리십시오 [경고 및 주의사항 (5.2) 참조].
혈구감소증
CALQUENCE 치료 중 혈구 수치를 확인하기 위해 정기적인 혈액 검사가 필요함을 환자에게 알리십시오 [경고 및 주의사항 (5.3) 참조].
두 번째 원발성 악성 종양
피부암 및 기타 고형 종양을 포함하여 CALQUENCE로 치료받은 환자에서 다른 악성 종양이 보고되었음을 환자에게 알리십시오. 환자에게 자외선 차단제를 사용하도록 권장하십시오 [경고 및 주의사항 (5.4) 참조].
심장 부정맥
환자에게 심계항진, 현기증, 실신, 흉부 불편감 및 호흡 곤란의 징후를 보고하도록 지시하십시오 [경고 및 주의사항 (5.5) 참조].
약물 유발 간 손상을 포함한 간독성:
CALQUENCE 치료 중 약물 유발 간 손상 및 간 검사 이상을 포함한 간 문제가 발생할 수 있음을 환자에게 알리십시오. 복부 불편감, 짙은 소변 또는 황달이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 환자에게 조언하십시오 [경고 및 주의사항 (5.6) 참조].
임신 합병증
CALQUENCE는 태아에게 해를 끼치고 난산을 유발할 수 있습니다. 여성에게 치료 중 및 CALQUENCE 마지막 복용 후 최소 1주일 동안 임신을 피하도록 조언하십시오 [특정 집단에서의 사용 (8.3) 참조].
수유
여성에게 CALQUENCE 치료 중 및 마지막 복용 후 최소 2주 동안 모유 수유를 하지 않도록 조언하십시오 [특정 집단에서의 사용 (8.2) 참조].
복용 지침
환자에게 CALQUENCE를 약 12시간 간격으로 하루 두 번 경구 복용하도록 지시하십시오. CALQUENCE는 음식과 함께 또는 음식 없이 복용할 수 있습니다. CALQUENCE 캡슐은 열거나 부수거나 씹지 않고 물 한 컵과 함께 통째로 삼켜야 함을 환자에게 알리십시오 [복용량 및 투여 (2.1) 참조].
복용량 누락
환자에게 CALQUENCE 복용량을 놓친 경우 일반적으로 복용하는 시간에서 최대 3시간 후까지 복용할 수 있음을 알리십시오. 3시간 이상 경과한 경우 해당 복용량을 건너뛰고 다음 CALQUENCE 복용량을 평소 시간에 복용하도록 지시해야 합니다. 놓친 복용량을 보충하기 위해 추가 캡슐을 복용해서는 안 된다는 점을 환자에게 경고하십시오 [복용량 및 투여 (2.1) 참조].
약물 상호작용
환자에게 일반 의약품, 비타민 및 허브 제품을 포함한 모든 병용 약물을 의료 서비스 제공자에게 알리도록 조언하십시오 [약물 상호작용 (7) 참조].
유통:
AstraZeneca Pharmaceuticals LP
Wilmington, DE 19850
CALQUENCE는 AstraZeneca 그룹의 등록 상표입니다.
©AstraZeneca 2025
환자 정보
|
환자 정보 CALQUENCE® (칼퀀스) (acalabrutinib) 캡슐제 |
|
CALQUENCE란 무엇입니까? CALQUENCE는 다음 질환을 가진 성인을 치료하는 처방약입니다.
소아에 대한 CALQUENCE의 안전성 및 유효성은 알려져 있지 않습니다. |
|
CALQUENCE 복용 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 제공자에게 알리십시오.
처방약과 일반의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 제공자에게 알리십시오. 특정 다른 약물과 CALQUENCE를 함께 복용하면 CALQUENCE의 작용 방식에 영향을 미치고 부작용을 일으킬 수 있습니다. 특히 혈액 희석제를 복용하는 경우 의료 제공자에게 알리십시오. |
|
CALQUENCE는 어떻게 복용해야 합니까?
|
|
칼퀀스의 가능한 부작용은 무엇입니까? 칼퀀스는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
칼퀀스의 가장 흔한 부작용은 다음과 같습니다.
이것들은 칼퀀스의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다(1‑800‑FDA‑1088). |
|
칼퀀스는 어떻게 보관해야 합니까?
칼퀀스와 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
칼퀀스의 안전하고 효과적인 사용에 대한 일반 정보. 약물은 때때로 환자 정보 설명서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 칼퀀스를 사용하지 마십시오. 동일한 증상이 있는 다른 사람에게 칼퀀스를 제공하지 마십시오. 해를 끼칠 수 있습니다. 의료 전문가를 위해 작성된 칼퀀스에 대한 자세한 내용은 의료 제공자 또는 약사에게 문의할 수 있습니다. |
|
칼퀀스의 성분은 무엇입니까? 활성 성분: acalabrutinib 비활성 성분: silicified microcrystalline cellulose, pregelatinized starch, magnesium stearate, and sodium starch glycolate. 캡슐 껍질 포함: gelatin, titanium dioxide, yellow iron oxide, FD&C Blue 2, and black ink. 판매원: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 칼퀀스는 AstraZeneca 그룹 회사의 등록 상표입니다. ©AstraZeneca 2025 자세한 내용은 www.CALQUENCE.com을 방문하거나 1-800-236-9933으로 전화하십시오. |
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. 개정: 2025년 1월
패키지/라벨 주요 디스플레이 패널
NDC 0310-0512-60 캡슐 60정
CALQUENCE®
(acalabrutinib) capsules
100 mg
처방전 의약품
제조사:
AstraZeneca Pharmaceuticals LP
Wilmington, DE 19850
위탁 제조사: AstraZeneca AB
SE-151 85 Södertàlje, Sweden
스위스산
AstraZeneca