의약품 제조업체: Alvogen, Inc. (Updated: 2024-05-07)
처방 정보 주요 내용
이러한 중요 사항에 LENALIDOMIDE CAPSULES를 안전하고 효과적으로 사용하는 데 필요한 모든 정보가 포함되어 있는 것은 아닙니다. LENALIDOMIDE CAPSULES에 대한 전체 처방 정보를 참조하십시오.
LENALIDOMIDE capsules, 경구용
최초 미국 승인: 2005년
경고: 배아-태아 독성, 혈액학적 독성, 정맥 및 동맥 혈전색전증
전체 박스형 경고는 전체 처방 정보를 참조하십시오.
배아-태아 독성
- 탈리도마이드 유사체인 레날리도마이드는 사람에서 탈리도마이드로 인한 선천적 결손과 유사한 발달 원숭이 연구에서 사지 기형을 유발했습니다. 임신 중 레날리도마이드를 사용하면 선천적 결손이나 배아-태아 사망을 유발할 수 있습니다.
- 치료 시작 전에 임신을 배제해야 합니다. 치료 중에는 두 가지 신뢰할 수 있는 피임법을 사용하여 임신을 예방하십시오(5.1).
레날리도마이드 캡슐은 레날리도마이드 REMS 프로그램이라는 제한된 유통 프로그램을 통해서만 구할 수 있습니다(5.2, 17).
혈액학적 독성. 레날리도마이드 캡슐은 심각한 호중구 감소증 및 혈소판 감소증을 유발할 수 있습니다(5.3).
정맥 및 동맥 혈전색전증
- 덱사메타손과 함께 레날리도마이드 캡슐을 투여받은 다발성 골수종 환자에서 심근경색 및 뇌졸중 위험뿐만 아니라 심부정맥 혈전증(DVT) 및 폐색전증(PE) 위험이 크게 증가했습니다. 항혈전제 예방이 권장됩니다(5.4).
적응증 및 용법
용량 및 투여
제형 및 함량
캡슐: 2.5mg, 5mg, 10mg, 15mg, 20mg, 25mg(3).
경고 및 주의사항
- 사망률 증가: 레날리도마이드 캡슐로 치료받은 CLL 환자에서 심각하고 치명적인 심장 이상 반응이 발생했습니다 (5.5).
- 두 번째 원발성 악성 종양(SPM): 레날리도마이드 캡슐을 투여받은 MM 환자를 대상으로 한 대조 임상시험에서 SPM 발생률이 더 높게 나타났습니다 (5.6).
- 사망률 증가: 덱사메타손 및 탈리도마이드 유사체에 펨브롤리주맙을 추가했을 때 MM 환자에서 관찰되었습니다 (5.7).
- 간독성: 사망을 포함한 간부전 간 기능을 모니터링합니다. 간독성이 의심되는 경우 레날리도마이드 캡슐 복용을 중단하고 평가합니다 (5.8).
- 중증 피부 반응: 중증 반응에 대해서는 레날리도마이드 캡슐 복용을 중단합니다 (5.9).
- 사망을 포함한 종양 용해 증후군(TLS): TLS 위험이 있는 환자(즉, 종양 부담이 높은 환자)를 모니터링하고 적절한 예방 조치를 취합니다 (5.10).
- 종양 플레어 반응: 만성 림프구성 백혈병 및 림프종에 대한 레날리도마이드 캡슐의 시험적 사용 중에 치명적인 반응을 포함한 심각한 종양 플레어 반응이 발생했습니다 (5.11).
- 줄기세포 동원 장애: 레날리도마이드 캡슐로 치료(> 4주기) 후 채취한 CD34+ 세포 수가 감소했다는 보고가 있습니다. 이식 센터에 조기 의뢰하는 것을 고려하십시오 (5.12).
- 과민증: 잠재적인 과민증에 대해 환자를 모니터링합니다. 혈관부종 및 아나필락시스가 발생하면 레날리도마이드 캡슐 복용을 중단합니다 (5.15).
이상 반응
- MM: 가장 흔한 이상 반응(≥20%)에는 설사, 피로, 빈혈, 변비, 호중구 감소증, 백혈구 감소증, 말초 부종, 불면증, 근육 경련/경련, 복통, 요통, 메스꺼움, 무력증, 발열, 상기도 감염, 기관지염, 비인두염, 위장염, 기침, 발진, 호흡곤란, 현기증, 식욕 감소, 혈소판 감소증, 떨림이 있습니다 (6.1).
- MDS: 가장 흔한 이상 반응(>15%)에는 혈소판 감소증, 호중구 감소증, 설사, 가려움증, 발진, 피로, 변비, 메스꺼움, 비인두염, 관절통, 발열, 요통, 말초 부종, 기침, 현기증, 두통, 근육 경련, 호흡곤란, 인두염, 코피가 있습니다 (6.1).
의심되는 이상 반응을 보고하려면 Alvogen, Inc.(1-866-770-3024) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch)에 문의하십시오.
약물 상호 작용
특정 집단에서의 사용
- 수유: 모유 수유를 하지 말 것을 권고합니다 (8.2).
환자 상담 정보 및 복약 안내는 17을 참조하십시오.
개정일: 2023년 11월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
WARNING: 배아-태아 독성, 혈액학적 독성 및 정맥 및 동맥 혈전색전증
1 적응증 및 용법
1.1 다발성 골수종
1.2 골수이형성증후군
1.6 사용 제한
2 용량 및 투여
2.1 다발성 골수종에 권장되는 용량
2.2 골수이형성증후군에 권장되는 용량
2.5 비혈액학적 이상반응에 대한 용량 수정
2.6 신장애 환자에 권장되는 용량
2.7 투여
3 투여형태 및 함량
4 금기
4.1 임신
4.2 중증 과민반응
5 경고 및 주의사항
5.1 배아-태아 독성
5.2 레날리도마이드 REMS 프로그램
5.3 혈액학적 독성
5.4 정맥 및 동맥 혈전색전증
5.5 CLL 환자의 사망률 증가
5.6 제2 원발암
5.7 탈리도마이드 유사체 및 덱사메타손에 펨브롤리주맙을 추가했을 때 MM 환자의 사망률 증가
5.8 간독성
5.9 중증 피부 반응
5.10 종양 용해 증후군
5.11 종양 플레어 반응
5.12 줄기세포 동원 장애
5.13 갑상선 질환
5.15 과민증
5.16 타르트라진으로 인한 알레르기 반응 위험
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 디곡신
7.2 혈전증 위험을 증가시킬 수 있는 병용 요법
7.3 와파린
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
10 과다복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 다발성 골수종
14.2 5번 염색체 장완 결손 세포유전학적 이상이 있는 골수이형성증후군(MDS)
15 참고문헌
16 공급 방법/보관 및 취급
16.1 공급 방법
16.2 보관
16.3 취급 및 폐기
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
boxed 경고
경고: 태아 독성, 혈액학적 독성, 정맥 및 동맥 혈전색전증
태아 독성
임신 중에는 레날리도마이드 캡슐을 사용하지 마십시오. 탈리도마이드 유사체인 레날리도마이드는 발생 중인 원숭이 연구에서 사지 기형을 유발했습니다. 탈리도마이드는 생명을 위협하는 심각한 인간 선천적 기형을 유발하는 것으로 알려진 인간 기형 유발 물질입니다. 임신 중에 레날리도마이드를 사용하면 선천적 기형이나 태아 사망을 유발할 수 있습니다. 가임 여성의 경우 레날리도마이드 캡슐 치료를 시작하기 전에 임신 검사를 두 번 받아 음성임을 확인해야 합니다. 가임 여성은 레날리도마이드 캡슐 치료 중 및 치료 후 4주 동안 2가지 형태의 피임법을 사용하거나 이성애 성교를 지속적으로 삼가야 합니다[경고 및 주의사항 (5.1), 복약 안내서 (17)]. 레날리도마이드에 태아가 노출되는 것을 방지하기 위해 레날리도마이드 캡슐은 제한 유통 프로그램인 레날리도마이드 REMS 프로그램 (5.2)을 통해서만 제공됩니다.
레날리도마이드 REMS 프로그램에 대한 정보는 www.lenalidomiderems.com에서 확인하거나 수신료 무료 전화번호 1-888-423-5436으로 문의하십시오.
혈액학적 독성(호중구 감소증 및 혈소판 감소증)
레날리도마이드 캡슐은 심각한 호중구 감소증 및 혈소판 감소증을 유발할 수 있습니다. 주요 연구에서 del 5q 골수이형성증후군 환자의 80%가 용량 지연/감량을 받아야 했습니다. 환자의 34%는 두 번째 용량 지연/감량을 받아야 했습니다. 3등급 또는 4등급 혈액학적 독성은 연구에 등록된 환자의 80%에서 나타났습니다. del 5q 골수이형성증후군에 대한 치료를 받는 환자는 치료 첫 8주 동안 매주, 그 이후에는 최소 매월 전체 혈구 수를 모니터링해야 합니다. 환자는 용량 중단 및/또는 감량이 필요할 수 있습니다. 환자는 혈액 제제 지원 및/또는 성장 인자를 사용해야 할 수 있습니다[용량 및 투여 (2.2)].
정맥 및 동맥 혈전색전증
레날리도마이드 캡슐은 레날리도마이드 캡슐과 덱사메타손 치료를 받은 다발성 골수종 환자에서 심근 경색 및 뇌졸중 위험뿐만 아니라 심부 정맥 혈전증(DVT) 및 폐색전증(PE)의 위험이 크게 증가한 것으로 나타났습니다. 혈전색전증의 징후와 증상을 모니터링하고 환자에게 조언하십시오. 숨가쁨, 흉통 또는 팔이나 다리 부기와 같은 증상이 나타나면 즉시 치료를 받도록 환자에게 조언하십시오. 혈전 예방이 권장되며 요법의 선택은 환자의 기저 위험 평가를 기반으로 해야 합니다[경고 및 주의사항 (5.4)].
1 적응증 및 용법
1.2 골수이형성증후군
레날리도마이드 캡슐은 추가적인 세포유전학적 이상 유무와 관계없이 5q 결손 세포유전학적 이상과 관련된 저위험 또는 중등도-1-위험 골수이형성증후군(MDS)으로 인한 수혈 의존성 빈혈이 있는 성인 환자 치료에 사용됩니다.
2 용법 및 용량
2.1 다발성 골수종에 대한 권장 복용량
레날리도마이드 캡슐 병용 요법
레날리도마이드 캡슐의 권장 시작 용량은 28일 주기로 반복되는 1~21일에 덱사메타손과 병용하여 1일 1회 25mg을 경구 복용하는 것입니다. 특정 덱사메타손 복용량은 14.1절을 참조하십시오. 75세 이상의 환자의 경우 덱사메타손의 시작 용량을 줄일 수 있습니다 [임상 연구 참조 (14.1)]. 질병이 진행되거나 허용할 수 없는 독성이 나타날 때까지 치료를 계속해야 합니다.
자가-HSCT를 받을 수 없는 환자의 경우 질병이 진행되거나 허용할 수 없는 독성이 나타날 때까지 치료를 계속해야 합니다. 자가-HSCT 적격 환자의 경우 레날리도마이드 함유 요법의 4주기 이내에 조혈모세포 동원이 이루어져야 합니다 [경고 및 주의사항 참조 (5.12)].
MM 치료 중 혈액학적 독성에 대한 용량 조정
아래 표 1에 요약된 대로 용량 수정 지침은 3등급 또는 4등급 호중구 감소증 또는 혈소판 감소증 또는 레날리도마이드 캡슐과 관련된 것으로 판단되는 기타 3등급 또는 4등급 독성을 관리하는 데 권장됩니다.
표 1: MM에 대한 혈액학적 독성에 대한 용량 조정
혈소판 수
MM의 혈소판 감소증
| 혈소판이 | 권장 과정
28일 주기로 반복되는 1~21일 |
| 30,000/mcL 미만으로 떨어지는 경우 | 레날리도마이드 캡슐 치료 중단, 매주 CBC 추적 관찰 |
| 최소 30,000/mcL로 돌아오는 경우 | 다음으로 낮은 용량의 레날리도마이드 캡슐을 다시 시작합니다. 1일 2.5mg 미만으로 복용하지 마십시오. |
| 이후 30,000/mcL 미만으로 떨어질 때마다 | 레날리도마이드 캡슐 치료 중단 |
| 최소 30,000/mcL로 돌아오는 경우 | 다음으로 낮은 용량의 레날리도마이드 캡슐을 다시 시작합니다. 1일 2.5mg 미만으로 복용하지 마십시오. |
절대 호중구 수(ANC)
MM의 호중구 감소증
| 호중구가 | 권장 과정
28일 주기로 반복되는 1~21일 |
| 1,000/mcL 미만으로 떨어지는 경우 | 레날리도마이드 캡슐 치료 중단, 매주 CBC 추적 관찰 |
| 최소 1,000/mcL로 돌아오고 호중구 감소증이 유일한 독성인 경우 | 1일 25mg 또는 초기 시작 용량의 레날리도마이드 캡슐을 다시 시작합니다. |
| 최소 1,000/mcL로 돌아오고 다른 독성이 있는 경우 | 다음으로 낮은 용량의 레날리도마이드 캡슐을 다시 시작합니다. 1일 2.5mg 미만으로 복용하지 마십시오. |
| 이후 1,000/mcL 미만으로 떨어질 때마다 | 레날리도마이드 캡슐 치료 중단 |
| 최소 1,000/mcL로 돌아오는 경우 | 다음으로 낮은 용량의 레날리도마이드 캡슐을 다시 시작합니다. 1일 2.5mg 미만으로 복용하지 마십시오. |
2.2 골수이형성증후군에 대한 권장 복용량
레날리도마이드 캡슐의 권장 시작 용량은 1일 10mg입니다. 치료는 임상 및 실험실 소견에 따라 계속되거나 수정됩니다. 질병이 진행되거나 허용할 수 없는 독성이 나타날 때까지 치료를 계속합니다.
MDS 치료 중 혈액학적 독성에 대한 용량 조정
초기에 10mg을 투여받았고 혈소판 감소증이 나타나는 환자는 다음과 같이 용량을 조정해야 합니다.
혈소판 수
MDS에서 1일 10mg으로 치료를 시작한 후 4주 이내에 혈소판 감소증이 발생하는 경우
| 기준치가 최소 100,000/mcL인 경우 | |
| 혈소판이 | 권장 과정 |
| 50,000/mcL 미만으로 떨어지는 경우 | 레날리도마이드 캡슐 치료 중단 |
| 최소 50,000/mcL로 돌아오는 경우 | 1일 5mg의 레날리도마이드 캡슐을 다시 시작합니다. |
| 기준치가 100,000/mcL 미만인 경우 | |
| 혈소판이 | 권장 과정 |
| 기준치의 50%로 떨어지는 경우 | 레날리도마이드 캡슐 치료 중단 |
| 기준치가 최소 60,000/mcL이고 최소 50,000/mcL로 돌아오는 경우 | 1일 5mg의 레날리도마이드 캡슐을 다시 시작합니다. |
| 기준치가 60,000/mcL 미만이고 최소 30,000/mcL로 돌아오는 경우 | 1일 5mg의 레날리도마이드 캡슐을 다시 시작합니다. |
MDS에서 1일 10mg으로 치료를 시작한 후 4주 후에 혈소판 감소증이 발생하는 경우
| 혈소판이 | 권장 과정 |
| 30,000/mcL 미만으로 떨어지거나 혈소판 수혈을 받고 50,000/mcL 미만으로 떨어지는 경우 | 레날리도마이드 캡슐 치료 중단 |
| (지혈 실패 없이) 최소 30,000/mcL로 돌아오는 경우 | 1일 5mg의 레날리도마이드 캡슐을 다시 시작합니다. |
1일 5mg 투여 시 혈소판 감소증이 나타나는 환자는 다음과 같이 용량을 조절해야 합니다.
MDS에서 1일 5mg으로 치료하는 동안 혈소판 감소증이 발생하는 경우
| 혈소판 수치 | 권장 조치 |
| 30,000/mcL 미만이거나 혈소판 수혈을 받고 50,000/mcL 미만인 경우 | 레날리도마이드 캡슐 치료 중단 |
| (지혈 이상 없이) 최소 30,000/mcL로 회복된 경우 | 레날리도마이드 캡슐 1일 2.5mg으로 재개 |
초기 용량이 10mg이고 호중구 감소증이 나타나는 환자는 다음과 같이 용량을 조절해야 합니다.
절대 호중구 수(ANC)
MDS에서 1일 10mg으로 치료를 시작한 후 4주 이내에 호중구 감소증이 발생하는 경우
| 기준 ANC가 최소 1,000/mcL인 경우 | |
| 호중구 수치 | 권장 조치 |
| 750/mcL 미만으로 감소한 경우 | 레날리도마이드 캡슐 치료 중단 |
| 최소 1,000/mcL로 회복된 경우 | 레날리도마이드 캡슐 1일 5mg으로 재개 |
| 기준 ANC가 1,000/mcL 미만인 경우 | |
| 호중구 수치 | 권장 조치 |
| 500/mcL 미만으로 감소한 경우 | 레날리도마이드 캡슐 치료 중단 |
| 최소 500/mcL로 회복된 경우 | 레날리도마이드 캡슐 1일 5mg으로 재개 |
MDS에서 1일 10mg으로 치료를 시작한 후 4주 후에 호중구 감소증이 발생하는 경우
| 호중구 수치 | 권장 조치 |
| 500/mcL 미만이 7일 이상 지속되거나 500/mcL 미만이면서 열(최소 38.5°C)이 나타나는 경우 | 레날리도마이드 캡슐 치료 중단 |
| 최소 500/mcL로 회복된 경우 | 레날리도마이드 캡슐 1일 5mg으로 재개 |
1일 5mg 투여 시 호중구 감소증이 나타나는 환자는 다음과 같이 용량을 조절해야 합니다.
MDS에서 1일 5mg으로 치료하는 동안 호중구 감소증이 발생하는 경우
| 호중구 수치 | 권장 조치 |
| 500/mcL 미만이 7일 이상 지속되거나 500/mcL 미만이면서 열(최소 38.5°C)이 나타나는 경우 | 레날리도마이드 캡슐 치료 중단 |
| 최소 500/mcL로 회복된 경우 | 레날리도마이드 캡슐 1일 2.5mg으로 재개 |
2.5 비혈액학적 이상반응에 대한 용량 조절
레날리도마이드 캡슐과 관련된 것으로 판단되는 3/4등급 비혈액학적 독성의 경우, 독성이 2등급 이하로 해소되면 의사의 판단에 따라 다음으로 낮은 용량 수준에서 치료를 보류하고 다시 시작합니다.
혈관부종, 아나필락시스, 4등급 발진, 피부 박리, 수포 또는 기타 중증 피부 반응의 경우 레날리도마이드 캡슐을 영구적으로 중단합니다. [경고 및 주의사항 (5.9, 5.15) 참조].
2.6 신장애 환자에 대한 권장 용량
신장애 환자에 대한 용량 권장 사항은 다음 표에 나와 있습니다. [임상 약리학 (12.3) 참조].
| 신기능(Cockcroft-Gault) | MM에 대한 레날리도마이드 캡슐 병용 요법의 용량 | MDS에 대한 레날리도마이드 캡슐의 용량 |
| CLcr 30~60mL/min | 1일 1회 10mg | 1일 1회 5mg |
| CLcr 30mL/min 미만(투석이 필요하지 않음) | 격일로 15mg | 1일 1회 2.5mg |
| CLcr 30mL/min 미만(투석이 필요함) | 1일 1회 5mg. 투석을 받는 날에는 투석 후에 용량을 투여합니다. | 1일 1회 2.5mg. 투석을 받는 날에는 투석 후에 용량을 투여합니다. |
MM에 대한 레날리도마이드 캡슐 병용 요법: CLcr이 30~60mL/min인 경우, 용량 제한 독성 없이 10mg 용량의 레날리도마이드를 환자가 견딜 수 있다면 2주기 후에 용량을 15mg으로 증량하는 것을 고려합니다.
MDS에 대한 레날리도마이드 캡슐: 이후 레날리도마이드 캡슐 용량 증량 또는 감량은 개별 환자의 치료 내성을 기준으로 합니다. [복용량 및 투여 방법 (2.2) 참조].
2.7 투여
환자에게 레날리도마이드 캡슐을 매일 거의 같은 시간에 음식과 함께 또는 음식 없이 경구 복용하도록 조언합니다. 환자에게 레날리도마이드 캡슐을 물과 함께 통째로 삼키고 열거나 쪼개거나 씹지 않도록 조언합니다.
3 투여 형태 및 함량
캡슐:
- 2.5 mg: 진한 파란색 불투명 캡/ 밝은 주황색 불투명 바디, 캡슐 껍질 크기 4호, 캡에 “LP” 및 바디에 “637”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
- 5 mg: 녹색 불투명 캡/ 밝은 카라멜색 불투명 바디, 캡슐 껍질 크기 2호, 캡에 “LP” 및 바디에 “638”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
- 10 mg: 금색 불투명 캡/ 회색 불투명 바디, 캡슐 껍질 크기 0호, 캡에 “LP” 및 바디에 “639”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
- 15 mg: 카라멜색 불투명 캡/ 회색 불투명 바디, 캡슐 껍질 크기 2호, 캡에 “LP” 및 바디에 “640”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
- 20 mg: 따뜻한 벽돌색 불투명 캡/ 밝은 회색 불투명 바디, 캡슐 껍질 크기 1호, 캡에 “LP” 및 바디에 “641”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
- 25 mg: 흰색 불투명 캡/ 흰색 불투명 바디, 캡슐 껍질 크기 0호, 캡에 “LP” 및 바디에 “642”이 검정색 잉크로 인쇄되어 있으며 흰색 분말이 채워져 있습니다.
4 금기
4.1 임신
Lenalidomide는 임산부에게 투여 시 태아에게 위해를 가할 수 있습니다. 기관형성 과정 중에 lenalidomide를 투여받은 원숭이의 새끼에서 사지 기형이 나타났습니다. 이러한 영향은 시험한 모든 용량에서 나타났습니다. 이러한 발생 원숭이 연구 결과와 알려진 인간 기형 유발 물질인 thalidomide에 대한 lenalidomide의 구조적 유사성으로 인해, 임산부에게는 lenalidomide가 금기됩니다 [경고문 참조]. 임신 중이거나 이 약물을 복용하는 동안 임신하게 된 경우, 태아에 대한 잠재적 위험에 대해 환자에게 알려야 합니다 [경고 및 주의사항 (5.1, 5.2), 특정 환자군에서의 사용 (8.1, 8.3) 참조].
4.2 중증 과민 반응
Lenalidomide 캡슐은 lenalidomide에 대해 중증 과민증(예: 혈관부종, Stevens-Johnson 증후군, 독성 표피 괴사)을 보인 환자에게는 금기됩니다 [경고 및 주의사항 (5.9, 5.15) 참조].
5. 경고 및 주의사항
5.1 태아-태아 독성
레날리도마이드 캡슐은 탈리도마이드 유사체이며 임신 중 사용 금기입니다. 탈리도마이드는 생명을 위협하는 선천적 기형이나 태아 사망을 유발하는 것으로 알려진 인간 기형 유발 물질입니다. [특정 집단에서의 사용 (8.1) 참조]. 원숭이를 대상으로 한 태아-태아 발달 연구에 따르면 레날리도마이드는 임신 중 약물을 투여받은 암컷 원숭이의 새끼에서 기형을 유발했으며, 이는 임신 중 탈리도마이드에 노출된 후 인간에게서 관찰된 선천적 기형과 유사합니다.
레날리도마이드 캡슐은 레날리도마이드 REMS 프로그램을 통해서만 구할 수 있습니다. [경고 및 주의사항 (5.2) 참조].
가임 여성
가임 여성은 레날리도마이드 캡슐 치료를 시작하기 전 최소 4주 동안, 치료 중, 용량 중단 중, 치료 종료 후 최소 4주 동안 임신을 피해야 합니다.
여성은 레날리도마이드 캡슐 치료를 시작하기 4주 전부터, 치료 중, 용량 중단 중, 레날리도마이드 캡슐 치료 중단 후 4주 동안 지속적으로 이성애 성교를 삼가하거나 두 가지의 신뢰할 수 있는 피임법을 사용하기로 약속해야 합니다.
치료를 시작하기 전에 두 번의 임신 음성 검사를 받아야 합니다. 첫 번째 검사는 10~14일 이내에, 두 번째 검사는 레날리도마이드 캡슐 치료를 처방하기 24시간 이내에 실시해야 하며, 그 후 생리 주기가 규칙적인 여성의 경우 매월, 생리 주기가 불규칙적인 여성의 경우 2주마다 실시해야 합니다. [특정 집단에서의 사용 (8.3) 참조].
남성
레날리도마이드는 약물을 투여받는 환자의 정액에서 검출됩니다. 따라서 남성은 레날리도마이드 캡슐을 복용하는 동안 및 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 가임 여성과 성적 접촉을 할 때는 항상 라텍스 또는 합성 콘돔을 사용해야 하며, 정관 수술을 성공적으로 받은 경우에도 마찬가지입니다. 레날리도마이드 캡슐을 복용하는 남성 환자는 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 정자를 기증해서는 안 됩니다. [특정 집단에서의 사용 (8.3) 참조].
헌혈
환자는 레날리도마이드 캡슐 치료 중 및 약물 중단 후 4주 동안 헌혈을 해서는 안 됩니다. 혈액이 레날리도마이드 캡슐에 노출되어서는 안 되는 임산부 환자에게 전달될 수 있기 때문입니다.
5.2 레날리도마이드 REMS 프로그램
태아-태아 위험 때문에 [경고 및 주의사항 (5.1) 참조], 레날리도마이드 캡슐은 위험 평가 및 완화 전략(REMS)에 따라 레날리도마이드 REMS 프로그램이라는 제한된 프로그램을 통해서만 제공됩니다.
레날리도마이드 REMS 프로그램의 필수 구성 요소는 다음과 같습니다.
- 처방자는 REMS 요구 사항에 등록하고 준수함으로써 레날리도마이드 REMS 프로그램에 대해 인증을 받아야 합니다.
- 환자는 환자-의사 동의서에 서명하고 REMS 요구 사항을 준수해야 합니다. 특히 임신하지 않은 가임 여성 환자는 임신 검사 및 피임 요구 사항을 준수해야 하며 [특정 집단에서의 사용 (8.3) 참조] 남성은 피임 요구 사항을 준수해야 합니다. [특정 집단에서의 사용 (8.3) 참조].
- 약국은 레날리도마이드 REMS 프로그램에 대해 인증을 받아야 하며, 레날리도마이드 캡슐을 받을 수 있는 권한이 있는 환자에게만 조제하고 REMS 요구 사항을 준수해야 합니다.
레날리도마이드 REMS 프로그램에 대한 자세한 내용은 www.lenalidomiderems.com 또는 1-888-423-5436번으로 문의하십시오.
5.3 혈액학적 독성
레날리도마이드 캡슐은 심각한 호중구 감소증 및 혈소판 감소증을 유발할 수 있습니다. 호중구 감소증 환자에게 감염 징후가 있는지 모니터링하십시오. 환자에게 출혈이나 멍이 있는지 관찰하도록 조언하고, 특히 출혈 위험을 증가시킬 수 있는 병용 약물을 사용하는 경우 더욱 주의하십시오. 레날리도마이드 캡슐을 복용하는 환자는 아래에 설명된 대로 정기적으로 전체 혈구 수를 평가해야 합니다. [용량 및 투여 방법 (2.1, 2.2) 참조].
MM에 대해 레날리도마이드 캡슐과 덱사메타손을 병용 투여하는 환자의 경우 처음 2주기 동안 매주 7일마다, 3주기의 1일차와 15일차에, 그 이후에는 28일(4주)마다 전체 혈구 수(CBC)를 모니터링합니다. 용량 중단 및/또는 용량 감량이 필요할 수 있습니다. [용량 및 투여 방법 (2.1) 참조]. 다른 적응증에 대한 임상시험에서 3등급 또는 4등급 호중구 감소증은 레날리도마이드 치료를 받은 환자의 최대 59%에서, 3등급 또는 4등급 혈소판 감소증은 레날리도마이드 치료를 받은 환자의 최대 38%에서 보고되었습니다.
MDS에 대해 레날리도마이드 캡슐을 복용하는 환자의 경우 처음 8주 동안은 매주, 그 이후에는 최소 매월 전체 혈구 수(CBC)를 모니터링합니다. MDS 연구에 등록한 환자의 80%에서 3등급 또는 4등급 혈액학적 독성이 나타났습니다. 3등급 또는 4등급 호중구 감소증이 발생한 환자의 48%에서 발병까지의 중간 시간은 42일(범위: 14~411일)이었고, 문서화된 회복까지의 중간 시간은 17일(범위: 2~170일)이었습니다. 3등급 또는 4등급 혈소판 감소증이 발생한 환자의 54%에서 발병까지의 중간 시간은 28일(범위: 8~290일)이었고, 문서화된 회복까지의 중간 시간은 22일(범위: 5~224일)이었습니다. [경고 및 용량 및 투여 방법 (2.2) 참조].
5.4 정맥 및 동맥 혈전색전증
레날리도마이드 캡슐로 치료받은 환자에서 정맥 혈전색전증(VTE [DVT 및 PE])과 동맥 혈전색전증(ATE, 심근경색 및 뇌졸중)이 증가합니다.
항응고제 치료를 다양하게 사용한 임상시험에서 위약 및 덱사메타손 그룹(3.1% 및 0.9%)으로 치료받은 환자에 비해 레날리도마이드 캡슐 및 덱사메타손 치료로 치료받은 이전에 하나 이상의 치료를 받은 MM 환자에서 DVT(7.4%) 및 PE(3.7%) 위험이 유의하게 증가했습니다. 거의 모든 환자가 항혈전 예방을 받은 새로 진단된 다발성 골수종(NDMM) 연구에서 DVT는 각각 Rd Continuous, Rd18 및 MPT군에서 심각한 이상반응(3.6%, 2.0% 및 1.7%)으로 보고되었습니다. PE의 심각한 이상반응 빈도는 Rd Continuous, Rd18 및 MPT군(각각 3.8%, 2.8% 및 3.7%) 간에 유사했습니다. [see Boxed Warning and Adverse Reactions (6.1)].
임상시험에서 위약 및 덱사메타손(0.6% 및 0.9%)으로 치료받은 환자에 비해 레날리도마이드 캡슐 및 덱사메타손 치료로 치료받은 이전에 하나 이상의 치료를 받은 MM 환자에서 심근경색(1.7%) 및 뇌졸중(CVA)(2.3%)이 증가합니다. NDMM 연구에서 심근경색(급성 포함)은 각각 Rd Continuous, Rd18 및 MPT군에서 심각한 이상반응(2.3%, 0.6% 및 1.1%)으로 보고되었습니다. CVA의 심각한 이상반응 빈도는 Rd Continuous, Rd18 및 MPT군(각각 0.8%, 0.6% 및 0.6%) 간에 유사했습니다. [see Adverse Reactions (6.1)].
이전의 혈전증을 포함하여 알려진 위험 인자가 있는 환자는 위험이 더 높을 수 있으며, 모든 수정 가능한 인자(예: 고지혈증, 고혈압, 흡연)를 최소화하기 위한 조치를 취해야 합니다.
병용 혈전 예방을 사용하지 않은 대조 임상시험에서 레날리도마이드 캡슐 및 덱사메타손으로 치료받은 불응성 및 재발성 MM 환자의 21.5%에서 전체 혈전성 사건(표준 MedDRA 질의 색전성 및 혈전성 사건)이 발생한 반면, 위약 및 덱사메타손으로 치료받은 환자에서는 8.3%의 혈전증이 발생했습니다. 첫 번째 혈전증 사건까지의 중간 시간은 2.8개월이었습니다. 거의 모든 환자가 항혈전 예방을 받은 NDMM 연구에서 혈전성 사건의 전체 빈도는 병합된 Rd Continuous 및 Rd18군에서 17.4%였으며 MPT군에서는 11.6%였습니다. 첫 번째 혈전증 사건까지의 중간 시간은 병합된 Rd Continuous 및 Rd18군에서 4.3개월이었습니다.
혈전 예방이 권장됩니다. 혈전 예방 요법은 환자의 기저 위험 평가를 기반으로 해야 합니다. 혈전성 사건을 시사하는 징후와 증상을 즉시 보고하도록 환자에게 지시하십시오. ESA와 에스트로겐은 혈전증의 위험을 더욱 증가시킬 수 있으며, 레날리도마이드 캡슐을 투여받는 환자에게 이를 사용할 때는 유익-위험 결정을 기반으로 해야 합니다. [see Drug Interactions (7.2)].
5.5 만성 림프구성 백혈병 환자의 사망률 증가
만성 림프구성 백혈병 환자의 1차 치료에 대한 전향적 무작위(1:1) 임상시험에서 단일 제제 레날리도마이드 캡슐 치료는 단일 제제 클로람부실에 비해 사망 위험을 증가시켰습니다. 중간 분석에서 레날리도마이드 캡슐 치료군 210명 중 34명이 사망한 반면, 클로람부실 치료군 211명 중 18명이 사망했으며, 전체 생존에 대한 위험 비는 1.92[95% CI: 1.08-3.41]로 사망 위험이 92% 증가한 것과 일치했습니다. 이 시험은 2013년 7월 안전상의 이유로 중단되었습니다.
심방세동, 심근경색 및 심부전을 포함한 심각한 심혈관계 이상반응은 레날리도마이드 캡슐 치료군에서 더 자주 발생했습니다. 레날리도마이드 캡슐은 대조 임상시험 이외의 CLL에서 사용하도록 승인 또는 권장되지 않습니다.
5.6 제2 원발암
레날리도마이드 캡슐을 투여받은 MM 환자를 대상으로 한 임상시험에서 특히 AML 및 MDS와 같은 혈액학적 종양과 고형 종양을 포함한 제2 원발암(SPM)의 증가가 관찰되었습니다. 레날리도마이드를 경구 멜팔란과 병용 투여받은 NDMM 환자의 5.3%에서 AML 및 MDS를 포함한 혈액학적 SPM의 증가가 나타났으며, 레날리도마이드 없이 멜팔란을 투여받은 환자의 경우 1.3%였습니다. 멜팔란 없이 덱사메타손과 병용하여 레날리도마이드로 치료받은 NDMM 환자에서 AML 및 MDS 사례의 빈도는 0.4%였습니다.
다른 적응증에 대한 연구에서 혈액학적 SPM은 환자의 7.5%에서 발생했으며, 위약을 투여받은 환자의 경우 3.3%였습니다. 혈액학적 종양과 고형 종양(편평 세포 암종 및 기저 세포 암종 제외)을 포함한 SPM의 발생률은 14.9%였으며, 위약을 투여받은 환자의 경우 91.5개월의 중간 추적 관찰 기간 동안 8.8%였습니다. 편평 세포 암종 및 기저 세포 암종을 포함한 비흑색종 피부암 SPM은 레날리도마이드 유지 요법을 받은 환자의 3.9%에서 발생했으며, 위약군에서는 2.6%였습니다.
레날리도마이드/덱사메타손으로 치료받은 재발성 또는 불응성 MM 환자에서 혈액학적 종양과 고형 종양(편평 세포 암종 및 기저 세포 암종 제외)을 포함한 SPM의 발생률은 2.3%였으며, 덱사메타손 단독 투여군에서는 0.6%였습니다. 편평 세포 암종 및 기저 세포 암종을 포함한 비흑색종 피부암 SPM은 레날리도마이드/덱사메타손을 투여받은 환자의 3.1%에서 발생했으며, 덱사메타손 단독 투여군에서는 0.6%였습니다.
질병 진행될 때까지 레날리도마이드 함유 요법을 받은 환자는 고정 기간 레날리도마이드 함유 요법을 받은 환자보다 침습성 SPM의 발생률이 더 높지 않았습니다. 제2 원발암 발생에 대해 환자를 모니터링하십시오. 레날리도마이드 캡슐 치료를 고려할 때 레날리도마이드 캡슐의 잠재적 이점과 제2 원발암의 위험을 모두 고려하십시오.
5.7 탈리도마이드 유사체 및 덱사메타손에 펨브롤리주맙을 추가했을 때 MM 환자의 사망률 증가
MM 환자를 대상으로 한 두 건의 무작위 임상 시험에서, PD-1 또는 PD-L1 차단 항체가 적응증이 없는 용도인 탈리도마이드 유사체와 덱사메타손에 펨브롤리주맙을 추가했을 때 사망률이 증가했습니다. 대조 임상 시험 이외에서 탈리도마이드 유사체 및 덱사메타손과 함께 PD-1 또는 PD-L1 차단 항체로 MM 환자를 치료하는 것은 권장되지 않습니다.
5.8 간독성
레날리도마이드와 덱사메타손 병용 요법으로 치료받은 환자에서 사망을 포함한 간부전이 발생했습니다. 임상 시험에서 환자의 15%가 간독성(간세포성, 담즙정체성 및 혼합 특성 포함)을 경험했습니다. MM 환자의 2%와 골수이형성증후군 환자의 1%에서 심각한 간독성 사례가 발생했습니다. 약물 유발 간독성의 메커니즘은 알려져 있지 않습니다. 기존의 바이러스성 간 질환, 기준치 상승된 간 효소 및 병용 약물이 위험 요소가 될 수 있습니다. 간 효소를 주기적으로 모니터링하십시오. 간 효소가 상승하면 레날리도마이드 캡슐 복용을 중단하십시오. 기준치로 돌아온 후에는 더 낮은 용량으로 치료를 고려할 수 있습니다.
5.9 중증 피부 반응
Stevens-Johnson 증후군(SJS), 독성 표피 괴사 용해(TEN), 호산구 증가와 전신 증상을 동반한 약물 반응(DRESS)을 포함한 중증 피부 반응이 보고되었습니다. DRESS는 피부 반응(예: 발진 또는 박탈성 피부염), 호산구 증가증, 발열 및/또는 림프절병증과 함께 간염, 신장염, 폐렴, 심근염 및/또는 심낭염과 같은 전신 합병증을 나타낼 수 있습니다. 이러한 사례는 치명적일 수 있습니다. 탈리도마이드 치료와 관련하여 4등급 발진 병력이 있는 환자는 레날리도마이드 캡슐을 복용해서는 안 됩니다. 2~3등급 피부 발진이 나타나면 레날리도마이드 캡슐 투여를 중단하거나 중단하는 것을 고려하십시오. 4등급 발진, 박탈성 또는 수포성 발진 또는 SJS, TEN 또는 DRESS와 같은 기타 중증 피부 반응이 나타나면 레날리도마이드 캡슐을 영구적으로 중단하십시오. [용량 및 투여 방법 (2.5) 참조].
5.10 종양 용해 증후군
레날리도마이드 치료 중에 치명적인 종양 용해 증후군(TLS) 사례가 보고되었습니다. TLS 위험이 있는 환자는 치료 전에 종양 부담이 큰 환자입니다. 위험이 있는 환자를 면밀히 모니터링하고 적절한 예방 조치를 취하십시오.
5.11 종양 발열 반응
CLL 및 림프종에 대한 레날리도마이드의 시험적 사용 중에 치명적인 반응을 포함한 종양 발열 반응(TFR)이 발생했으며, 림프절 압통, 미열, 통증 및 발진이 특징입니다. 레날리도마이드 캡슐은 CLL에 적응증이 없으며 대조 임상 시험 이외에서 사용하는 것은 권장되지 않습니다.
종양 발열 반응은 질병 진행(PD)과 유사할 수 있습니다.
1등급 및 2등급 TFR 환자의 경우 의사의 재량에 따라 레날리도마이드 캡슐을 중단하거나 변경하지 않고 계속 투여할 수 있습니다. 1등급 및 2등급 TFR 환자는 TFR 증상 관리를 위해 코르티코스테로이드, 비스테로이드성 항염증제(NSAID) 및/또는 마약성 진통제로 치료할 수도 있습니다. 3등급 또는 4등급 TFR 환자의 경우 TFR이 1등급 이하로 해결될 때까지 레날리도마이드 캡슐 치료를 보류하는 것이 좋습니다. 3등급 또는 4등급 TFR 환자는 1등급 및 2등급 TFR 치료 지침에 따라 증상 관리를 위해 치료할 수 있습니다.
5.12 조혈모세포 동원 장애
레날리도마이드 캡슐 치료(4주기 초과) 후 채취한 CD34+ 세포 수가 감소했다는 보고가 있습니다. 자가-HSCT 후보 환자인 경우, 조혈모세포 채취 시기를 최적화하기 위해 치료 초기에 이식 센터에 의뢰해야 합니다. 레날리도마이드 함유 치료를 4주기 이상 받았거나 G-CSF 단독으로 적절한 수의 CD34+ 세포를 채취하지 못한 환자의 경우 G-CSF와 시클로포스파미드 병용 요법 또는 G-CSF와 CXCR4 억제제 병용 요법을 고려할 수 있습니다.
5.13 갑상선 질환
갑상선 기능 저하증과 갑상선 기능 항진증이 모두 보고되었습니다 [부작용 (6.2) 참조]. 레날리도마이드 캡슐 치료를 시작하기 전과 치료 중에 갑상선 기능을 측정하십시오.
5.15 과민성
혈관 부종, 아나필락시스, 레날리도마이드 캡슐에 대한 아나필락시스 반응을 포함한 과민성이 보고되었습니다. 혈관 부종 및 아나필락시스가 나타나면 레날리도마이드 캡슐을 영구적으로 중단하십시오. [용량 및 투여 방법 (2.2) 참조].
5.16 타르트라진으로 인한 알레르기 반응 위험
이 제품에는 특정 민감한 사람에게 알레르기 유형 반응(기관지 천식 포함)을 일으킬 수 있는 FD&C Yellow No. 5(타르트라진)가 포함되어 있습니다. 일반 인구에서 FD&C Yellow No. 5(타르트라진) 민감도의 전반적인 발생률은 낮지만 아스피린 과민증이 있는 환자에게서 자주 나타납니다.
6 이상반응
다음의 임상적으로 유의미한 이상반응은 처방 정보의 다른 섹션에 자세히 설명되어 있습니다.
- 태아 독성 [박스형 경고, 경고 및 주의사항 (5.1, 5.2) 참조]
- 혈액학적 독성[박스형 경고, 경고 및 주의사항 (5.3) 참조]
- 정맥 및 동맥 혈전색전증 [박스형 경고, 경고 및 주의사항 (5.4) 참조]
- CLL 환자의 사망률 증가 [경고 및 주의사항 (5.5) 참조]
- 제2 원발성 악성종양 [경고 및 주의사항 (5.6) 참조]
- 탈리도마이드 유사체 및 덱사메타손에 펨브롤리주맙을 추가했을 때 MM 환자의 사망률 증가 [경고 및 주의사항 (5.7) 참조]
- 간독성 [경고 및 주의사항 (5.8) 참조]
- 중증 피부 반응 [경고 및 주의사항 (5.9) 참조]
- 종양 용해 증후군 [경고 및 주의사항 (5.10) 참조]
- 종양 플레어 반응 [경고 및 주의사항 (5.11) 참조]
- 줄기세포 동원 장애 [경고 및 주의사항 (5.12) 참조]
- 갑상선 질환 [경고 및 주의사항 (5.13) 참조]
- 과민증 [경고 및 주의사항 (5.15) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되기 때문에 임상 시험에서 관찰된 약물의 이상반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
새롭게 진단된 MM – 레날리도마이드 캡슐 병용 요법:
대규모 3상 연구에서 저용량 덱사메타손(Rd)과 함께 레날리도마이드 캡슐을 2가지 다른 기간(즉, 질병 진행 시까지 [Rd 지속군, N=532] 또는 최대 18회의 28일 주기 [72주, Rd18군, N=540]) 동안 투여받거나 멜팔란, 프레드니손 및 탈리도마이드(MPT군, N=541)를 최대 12회의 42일 주기(72주) 동안 투여받은 1613명의 환자로부터 얻은 데이터를 평가했습니다. Rd 지속군의 치료 기간 중앙값은 80.2주(범위 0.7~246.7) 또는 18.4개월(범위 0.16~56.7)이었습니다.
일반적으로 가장 자주 보고된 이상반응은 Rd 지속군과 Rd18군에서 유사했으며 설사, 빈혈, 변비, 말초 부종, 호중구 감소증, 피로, 요통, 메스꺼움, 무력증 및 불면증이 포함되었습니다. 가장 자주 보고된 3등급 또는 4등급 반응에는 호중구 감소증, 빈혈, 혈소판 감소증, 폐렴, 무력증, 피로, 요통, 저칼륨혈증, 발진, 백내장, 림프구 감소증, 호흡곤란, DVT, 고혈당증 및 백혈구 감소증이 포함되었습니다. 감염 발생 빈도는 MPT군(56%)에 비해 Rd 지속군(75%)에서 가장 높았습니다. Rd 지속군에서 MPT군 또는 Rd18군보다 3등급 및 4등급의 심각한 감염 이상반응이 더 많았습니다.
Rd 지속군에서 레날리도마이드 캡슐의 용량 중단으로 이어지는 가장 흔한 이상반응은 감염 사건(28.8%)이었습니다. 전반적으로 레날리도마이드 캡슐의 첫 번째 용량 중단까지의 중앙값은 7주였습니다. Rd 지속군에서 레날리도마이드 캡슐의 용량 감소로 이어지는 가장 흔한 이상반응은 혈액학적 사건(10.7%)이었습니다. 전반적으로 레날리도마이드 캡슐의 첫 번째 용량 감소까지의 중앙값은 16주였습니다. Rd 지속군에서 레날리도마이드 캡슐의 중단으로 이어지는 가장 흔한 이상반응은 감염 사건(3.4%)이었습니다.
두 Rd군 모두 이상반응 발생 빈도는 일반적으로 치료 첫 6개월 동안 가장 높았다가 시간이 지남에 따라 감소하거나 백내장을 제외하고 치료 전반에 걸쳐 안정적으로 유지되었습니다. 백내장 발생 빈도는 시간이 지남에 따라 증가하여 처음 6개월 동안 0.7%였던 것이 Rd 지속군에서 치료 2년차까지 9.6%로 증가했습니다.
표 4는 Rd 지속군, Rd18군 및 MPT 치료군에 대해 보고된 이상반응을 요약한 것입니다.
| 참고: 이상반응이 여러 번 발생한 환자는 해당 신체 기관계/이상반응에서 한 번만 계산되었습니다. a Rd 연속 또는 Rd18군의 환자 중 최소 5% 이상에서 나타났으며, Rd 연속 또는 Rd18군에서 MPT군에 비해 빈도(%)가 최소 2% 더 높은 모든 치료 후 발생한 이상반응. b Rd 연속 또는 Rd18군의 환자 중 최소 1% 이상에서 나타났으며, Rd 연속 또는 Rd18군에서 MPT군에 비해 빈도(%)가 최소 1% 더 높은 모든 3등급 또는 4등급 치료 후 발생한 이상반응. c Rd 연속 또는 Rd18군의 환자 중 최소 1% 이상에서 나타났으며, Rd 연속 또는 Rd18군에서 MPT군에 비해 빈도(%)가 최소 1% 더 높은 중대한 치료 후 발생한 이상반응. d 혈액 및 림프계 장애 신체 기관계에 대한 우선 용어는 Rd 연속/Rd18에 대한 알려진 이상반응으로 의학적 판단에 따라 포함되었으며, 중대한 것으로 보고되었습니다. e 각주 “a”는 적용되지 않습니다. f 각주 “b”는 적용되지 않습니다. @ – 최소 한 건 이상 사망에 이른 이상반응. % – 최소 한 건 이상 생명을 위협하는 것으로 간주된 이상반응(반응 결과 사망한 경우 사망 사례에 포함됨). *복합 이상반응 용어에 포함된 이상반응: 복통: 복통, 상복부 통증, 하복부 통증, 위장관 통증 폐렴: 폐렴, 엽성 폐렴, 폐렴구균 폐렴, 기관지폐렴, Pneumocystis jiroveci 폐렴, Legionella 폐렴, 포도구균 폐렴, Klebsiella 폐렴, 비정형 폐렴, 세균성 폐렴, Escherichia 폐렴, 연쇄구균 폐렴, 바이러스성 폐렴 패혈증: 패혈증, 패혈성 쇼크, 요로 패혈증, Escherichia 패혈증, 호중구 감소증 패혈증, 폐렴구균 패혈증, 포도구균 패혈증, 세균성 패혈증, 수막구균 패혈증, 장구균 패혈증, Klebsiella 패혈증, Pseudomonas 패혈증 발진: 발진, 소양성 발진, 홍반성 발진, 반점구진성 발진, 전신 발진, 구진성 발진, 박탈성 발진, 모낭성 발진, 반점성 발진, 호산구 증가증 및 전신 증상을 동반한 약물 발진, 다형 홍반, 농포성 발진 심부정맥 혈전증: 심부정맥 혈전증, 사지 정맥 혈전증, 정맥 혈전증 |
||||||
|
신체 기관계 |
모든 이상반응a |
3/4등급 이상반응b |
||||
|
Rd 연속 |
Rd18 |
MPT |
Rd 연속 |
Rd18 |
MPT |
|
|
전신 장애 및 투여 부위 이상 |
||||||
|
피로% |
173 (33) |
177 (33) |
154 (28) |
39 (7) |
46 (9) |
31 (6) |
|
무력증 |
150 (28) |
123 (23) |
124 (23) |
41 (8) |
33 (6) |
32 (6) |
|
열c |
114 (21) |
102 (19) |
76 (14) |
13 (2) |
7 (1) |
7 (1) |
|
Non-cardiac chest pain f |
29 (5) |
31 (6) |
18 (3) |
<1% |
< 1% |
< 1% |
|
위장관 장애 |
||||||
|
설사 |
242 (45) |
208 (39) |
89 (16) |
21 (4) |
18 (3) |
8 (1) |
|
복통% f |
109 (20) |
78 (14) |
60 (11) |
7 (1) |
9 (2) |
< 1% |
|
Dyspepsia f |
57 (11) |
28 (5) |
36 (7) |
<1% |
< 1% |
0 (0) |
|
근골격계 및 결합 조직 장애 |
||||||
|
요통c |
170 (32) |
145 (27) |
116 (21) |
37 (7) |
34 (6) |
28 (5) |
|
Muscle spasms f |
109 (20) |
102 (19) |
61 (11) |
< 1% |
< 1% |
< 1% |
|
Arthralgia f |
101 (19) |
71 (13) |
66 (12) |
9 (2) |
8 (1) |
8 (1) |
|
Bone pain f |
87 (16) |
77 (14) |
62 (11) |
16 (3) |
15 (3) |
14 (3) |
|
Pain in extremity f |
79 (15) |
66 (12) |
61 (11) |
8 (2) |
8 (1) |
7 (1) |
|
Musculoskeletal pain f |
67 (13) |
59 (11) |
36 (7) |
< 1% |
< 1% |
< 1% |
|
근골격계 흉통 f |
60 (11) |
51 (9) |
39 (7) |
6 (1) |
< 1% |
< 1% |
|
근육 약화 f |
43 (8) |
35 (6) |
29 (5) |
< 1% |
8 (1) |
< 1% |
|
목 통증 f |
40 (8) |
19 (4) |
10 (2) |
< 1% |
< 1% |
< 1% |
|
감염 및 감염증 |
||||||
|
기관지염c |
90 (17) |
59 (11) |
43 (8) |
9 (2) |
6 (1) |
< 1% |
|
비인두염 f |
80 (15) |
54 (10) |
33 (6) |
0 (0) |
0 (0) |
0 (0) |
|
요로 감염 f |
76 (14) |
63 (12) |
41 (8) |
8 (2) |
8 (1) |
< 1% |
|
상기도 감염c% f |
69 (13) |
53 (10) |
31 (6) |
< 1% |
8 (1) |
< 1% |
|
폐렴c@ |
93 (17) |
87 (16) |
56 (10) |
60 (11) |
57 (11) |
41 (8) |
|
호흡기 감염% |
35 (7) |
25 (5) |
21 (4) |
7 (1) |
< 1% |
< 1% |
|
인플루엔자 f |
33 (6) |
23 (4) |
15 (3) |
< 1% |
< 1% |
0 (0) |
|
위장염 f |
32 (6) |
17 (3) |
13 (2) |
0 (0) |
< 1% |
0 (0) |
|
하기도 감염 |
29 (5) |
14 (3) |
16 (3) |
10 (2) |
< 1% |
< 1% |
|
비염 f |
29 (5) |
24 (4) |
14 (3) |
0 (0) |
0 (0) |
0 (0) |
|
봉와직염c |
< 5% |
< 5% |
< 5% |
8 (2) |
< 1% |
< 1% |
|
패혈증c@ |
33 (6) |
26 (5) |
18 (3) |
26 (5) |
20 (4) |
13 (2) |
|
신경계 장애 |
||||||
|
두통 f |
75 (14) |
52 (10) |
56 (10) |
< 1% |
< 1% |
< 1% |
|
미각이상증 f |
39 (7) |
45 (8) |
22 (4) |
< 1% |
0 (0.0) |
< 1% |
|
혈액 및 림프계 장애d |
||||||
|
빈혈 |
233 (44) |
193 (36) |
229 (42) |
97 (18) |
85 (16) |
102 (19) |
|
호중구 감소증 |
186 (35) |
178 (33) |
328 (61) |
148 (28) |
143 (26) |
243 (45) |
|
혈소판 감소증 |
104 (20) |
100 (19) |
135 (25) |
44 (8) |
43 (8) |
60 (11) |
|
열성 호중구 감소증 |
7 (1) |
17 (3) |
15 (3) |
6 (1) |
16 (3) |
14 (3) |
|
범혈구 감소증 |
< 1% |
6 (1) |
7 (1) |
< 1% |
< 1% |
< 1% |
|
호흡기계, 흉부 및 종격동 장애 |
||||||
|
기침 f |
121 (23) |
94 (17) |
68 (13) |
< 1% |
< 1% |
< 1% |
|
호흡곤란c,e |
117 (22) |
89 (16) |
113 (21) |
30 (6) |
22 (4) |
18 (3) |
|
코피 f |
32 (6) |
31 (6) |
17 (3) |
< 1% |
< 1% |
0 (0) |
|
구인두 통증 f |
30 (6) |
22 (4) |
14 (3) |
0 (0) |
0 (0) |
0 (0) |
|
운동 시 호흡곤란 e |
27 (5) |
29 (5) |
< 5% |
6 (1) |
< 1% |
0 (0) |
|
대사 및 영양 장애 |
||||||
|
식욕 감소 |
123 (23) |
115 (21) |
72 (13) |
14 (3) |
7 (1) |
< 1% |
|
저칼륨혈증% |
91 (17) |
62 (11) |
38 (7) |
35 (7) |
20 (4) |
11 (2) |
|
고혈당증 |
62 (12) |
52 (10) |
19 (4) |
28 (5) |
23 (4) |
9 (2) |
|
저칼슘혈증 |
57 (11) |
56 (10) |
31 (6) |
23 (4) |
19 (4) |
8 (1) |
|
탈수증% |
25 (5) |
29 (5) |
17 (3) |
8 (2) |
13 (2) |
9 (2) |
|
통풍 e |
< 5% |
< 5% |
< 5% |
8 (2) |
0 (0) |
0 (0) |
|
당뇨병% e |
5% 미만 |
5% 미만 |
5% 미만 |
8 (2) |
1% 미만 |
1% 미만 |
|
저인산혈증 e |
5% 미만 |
5% 미만 |
5% 미만 |
7 (1) |
1% 미만 |
1% 미만 |
|
저나트륨혈증% e |
5% 미만 |
5% 미만 |
5% 미만 |
7 (1) |
13 (2) |
6 (1) |
|
피부 및 피하 조직 질환 |
||||||
|
발진 |
139 (26) |
151 (28) |
105 (19) |
39 (7) |
38 (7) |
33 (6) |
|
가려움증 f |
47 (9) |
49 (9) |
24 (4) |
1% 미만 |
1% 미만 |
1% 미만 |
|
정신 질환 |
||||||
|
불면증 |
147 (28) |
127 (24) |
53 (10) |
1% 미만 |
6 (1) |
0 (0) |
|
우울증 |
58 (11) |
46 (9) |
30 (6) |
10 (2) |
1% 미만 |
1% 미만 |
|
혈관 질환 |
||||||
|
심부정맥 혈전증c% |
55 (10) |
39 (7) |
22 (4) |
30 (6) |
20 (4) |
15 (3) |
|
저혈압c% |
51 (10) |
35 (6) |
36 (7) |
11 (2) |
8 (1) |
6 (1) |
|
손상, 중독 및 시술 합병증 |
||||||
|
낙상 f |
43 (8) |
25 (5) |
25 (5) |
1% 미만 |
6 (1) |
6 (1) |
|
좌상 f |
33 (6) |
24 (4) |
15 (3) |
< 1% |
< 1% |
0 (0) |
|
눈 장애 |
||||||
|
백내장 |
73 (14) |
31 ( 6) |
< 1% |
31 ( 6) |
14 ( 3) |
< 1% |
|
낭하 백내장 e |
< 5% |
< 5% |
< 5% |
7 ( 1) |
0 ( 0) |
0 ( 0) |
|
검사 |
||||||
|
체중 감소 |
72 (14) |
78 (14) |
48 (9) |
11 (2) |
< 1% |
< 1% |
|
심장 질환 |
||||||
|
심방세동c |
37 (7) |
25 (5) |
25 (5) |
13 (2) |
9 (2) |
6 (1) |
|
심근경색(급성 포함)c ,e |
< 5% |
< 5% |
< 5% |
10 (2) |
< 1% |
< 1% |
|
신장 및 비뇨기 질환 |
||||||
|
신부전(급성 포함)c@,f |
49 (9) |
54 (10) |
37 (7) |
28 (5) |
33 (6) |
29 (5) |
|
양성, 악성 및 상세불명 신생물(낭종 및 용종 포함) |
||||||
|
편평 세포 암종c e |
< 5% |
< 5% |
< 5% |
8 (2) |
< 1% |
0 (0) |
|
기저 세포 암종c e,f |
< 5% |
< 5% |
< 5% |
< 1% |
< 1% |
0 (0) |
다발성 골수종에 대한 하나 이상의 이전 치료 후:
레날리도마이드/덱사메타손(353명) 또는 위약/덱사메타손(350명)을 최소 1회 투여받은 두 연구의 703명 환자로부터 얻은 데이터를 평가했습니다.
레날리도마이드/덱사메타손 치료군에서 269명(76%)의 환자가 위약/덱사메타손 치료군의 199명(57%)과 비교하여 레날리도마이드의 용량 감량을 동반하거나 동반하지 않고 최소 1회 용량 중단을 경험했습니다. 용량 감량을 동반하거나 동반하지 않고 1회 용량 중단을 경험한 이러한 환자 중 레날리도마이드/덱사메타손 치료군의 50%가 위약/덱사메타손 치료군의 21%와 비교하여 용량 감량을 동반하거나 동반하지 않고 최소 1회 추가 용량 중단을 경험했습니다. 대부분의 이상 반응 및 3/4등급 이상 반응은 위약/덱사메타손과 비교하여 레날리도마이드/덱사메타손 병용 요법을 투여받은 환자에서 더 자주 발생했습니다.
표 6, 7, 8은 레날리도마이드/덱사메타손 및 위약/덱사메타손 그룹에 대해 보고된 이상 반응을 요약한 것입니다.
| 신체 기관계 이상 반응 |
레날리도마이드/덱사메타손 (N=353) n (%) |
위약/덱사메타손 (N=350) n (%) |
|---|---|---|
| 혈액 및 림프계 장애 | ||
| 호중구 감소증 * | 149 (42) | 22 (6) |
| 빈혈 † | 111 (31) | 83 (24) |
| 혈소판 감소증 † | 76 (22) | 37 (11) |
| 백혈구 감소증 | 28 (8) | 4 (1) |
| 림프구 감소증 | 19 (5) | 5 (1) |
| 전신 장애 및 투여 부위 상태 | ||
| 피로 | 155 (44) | 146 (42) |
| 발열 | 97 (27) | 82 (23) |
| 말초 부종 | 93 (26) | 74 (21) |
| 흉통 | 29 (8) | 20 (6) |
| 무기력증 | 24 (7) | 8 (2) |
| 위장관 장애 | ||
| 변비 | 143 (41) | 74 (21) |
| 설사 † | 136 (39) | 96 (27) |
| 메스꺼움 † | 92 (26) | 75 (21) |
| 구토 † | 43 (12) | 33 (9) |
| 복통 † | 35 (10) | 22 (6) |
| 구강 건조 | 25 (7) | 13 (4) |
| 근골격계 및 결합 조직 장애 | ||
| 근육 경련 | 118 (33) | 74 (21) |
| 요통 | 91 (26) | 65 (19) |
| 뼈 통증 | 48 (14) | 39 (11) |
| 사지 통증 | 42 (12) | 32 (9) |
| 신경계 장애 | ||
| 어지러움 | 82 (23) | 59 (17) |
| 떨림 | 75 (21) | 26 (7) |
| 미각장애 | 54 (15) | 34 (10) |
| 감각 저하 | 36 (10) | 25 (7) |
| Neuropathya | 23 (7) | 13 (4) |
| 호흡기계, 흉부 및 종격동 장애 | ||
| 호흡곤란 | 83 (24) | 60 (17) |
| 비인두염 | 62 (18) | 31 (9) |
| 인두염 | 48 (14) | 33 (9) |
| 기관지염 | 40 (11) | 30 (9) |
| 감염b 및 기생충 감염 | ||
| 상기도 감염 | 87 (25) | 55 (16) |
| 폐렴 † | 48 (14) | 29 (8) |
| 요로 감염 | 30 (8) | 19 (5) |
| 부비동염 | 26 (7) | 16 (5) |
| 피부 및 피하 조직 질환 | ||
| 발진c | 75 (21) | 33 (9) |
| 발한 증가 | 35 (10) | 25 (7) |
| 피부 건조 | 33 (9) | 14 (4) |
| 가려움증 | 27 (8) | 18 (5) |
| 대사 및 영양 장애 | ||
| 식욕 부진 | 55 (16) | 34 (10) |
| 저칼륨혈증 | 48 (14) | 21 (6) |
| 저칼슘혈증 | 31 (9) | 10 (3) |
| 식욕 감소 | 24 (7) | 14 (4) |
| 탈수증 | 23 (7) | 15 (4) |
| 저마그네슘혈증 | 24 (7) | 10 (3) |
| 검사 | ||
| 체중 감소 | 69 (20) | 52 (15) |
| 눈 장애 | ||
| 시야 흐림 | 61 (17) | 40 (11) |
| 혈관 장애 | ||
| 심부정맥 혈전증 * | 33 (9) | 15 (4) |
| 고혈압 | 28 (8) | 20 (6) |
| 저혈압 | 25 (7) | 15 (4) |
| 신체 기관계 이상반응 |
레날리도마이드/덱사메타손 (N=353) n (%) |
위약/덱사메타손 (N=350) n (%) |
|---|---|---|
| 혈액 및 림프계 장애 | ||
| Neutropenia * | 118 (33) | 12 (3) |
| 혈소판 감소증 † | 43 (12) | 22 (6) |
| 빈혈 † | 35 (10) | 20 (6) |
| Leukopenia | 14 (4) | < 1% |
| Lymphopenia | 10 (3) | 4 (1) |
| Febrile neutropenia * | 8 (2) | 0 (0) |
| 전신 장애 및 투여 부위 이상 | ||
| 피로 | 23 (7) | 17 (5) |
| 혈관 장애 | ||
| 심부 정맥 혈전증 * | 29 (8) | 12 (3) |
| 감염 및 감염성 질환 | ||
| 폐렴 † | 30 (8) | 19 (5) |
| 요로 감염 | 5 (1) | < 1% |
| 대사 및 영양 장애 | ||
| 저칼륨혈증 | 17 (5) | 5 (1) |
| Hypocalcemia | 13 (4) | 6 (2) |
| Hypophosphatemia | 9 (3) | 0 (0) |
| 호흡기, 흉부 및 종격동 장애 | ||
| 폐색전증 † | 14 (4) | < 1% |
| Respiratory distress † | 4 (1) | 0 (0) |
| 근골격계 및 결합 조직 장애 | ||
| 근력 약화 | 20 (6) | 10 (3) |
| 위장관 장애 | ||
| 설사 † | 11 (3) | 4 (1) |
| 변비 | 7 (2) | < 1% |
| 메스꺼움 † | 6 (2) | < 1% |
| 심장 장애 | ||
| 심방세동 † | 13 (4) | 4 (1) |
| Tachycardia | 6 (2) | < 1% |
| 울혈성 심부전 † | 5 (1) | < 1% |
| 신경계 장애 | ||
| Syncope | 10 (3) | < 1% |
| 현기증 | 7 (2) | < 1% |
| 눈 장애 | ||
| 백내장 | 6 (2) | < 1% |
| 편측 백내장 | 5 (1) | 0 (0) |
| 정신 장애 | ||
| Depression | 10 (3) | 6 (2) |
| 신체 기관계 이상 반응 |
레날리도마이드/덱사메타손 (N=353) n (%) |
위약/덱사메타손 (N=350) n (%) |
|---|---|---|
| 위 표 6, 7, 8: | ||
| 혈액 및 림프계 장애 | ||
| Febrile neutropenia* | 6 (2) | 0 (0) |
| 혈관 장애 | ||
| Deep vein thrombosis * | 26 (7) | 11 (3) |
| 감염 및 감염성 질환 | ||
| Pneumonia† | 33 (9) | 21 (6) |
| 호흡기, 흉부 및 종격동 장애 | ||
| Pulmonary embolism † | 13 (4) | < 1% |
| 심장 장애 | ||
| Atrial fibrillation † | 11 (3) | < 1% |
| Cardiac failure congestive † | 5 (1) | 0 (0) |
| 신경계 장애 | ||
| Cerebrovascular accident † | 7 (2) | < 1% |
| 위장관 장애 | ||
| Diarrhea † | 6 (2) | < 1% |
| 근골격계 및 결합 조직 장애 | ||
| Bone pain | 4 (1) | 0 (0) |
레날리도마이드/덱사메타손으로 치료받은 환자의 평균 노출 기간은 44주였고 위약/덱사메타손으로 치료받은 환자의 평균 노출 기간은 23주였습니다. 레날리도마이드/덱사메타손군과 위약/덱사메타손군의 두 치료군 간 이상 반응 빈도를 비교할 때 이 점을 고려해야 합니다.
정맥 및 동맥 혈전색전증 [경고, 경고 및 주의사항 (5.4) 참조]
레날리도마이드 캡슐로 치료받은 환자에서 VTE 및 ATE가 증가합니다.
심부정맥 혈전증(DVT)은 최소 1회 이상의 이전 치료를 받은 환자를 대상으로 한 2건의 연구에서 레날리도마이드/덱사메타손군에서 각각 3.1% 및 3.4%였던 위약/덱사메타손군에 비해 더 높은 비율로 중대한(7.4%) 또는 중증(8.2%) 이상 약물 반응으로 보고되었으며, DVT 이상 반응으로 인한 중단은 두 군 간에 비슷한 비율로 보고되었습니다. NDMM 연구에서 DVT는 Rd 연속, Rd18 및 MPT군에서 각각 이상 반응(모든 등급: 10.3%, 7.2%, 4.1%), 중대한 이상 반응(3.6%, 2.0%, 1.7%) 및 3/4등급 이상 반응(5.6%, 3.7%, 2.8%)으로 보고되었습니다. DVT 이상 반응으로 인한 중단 및 용량 감소는 Rd 연속군과 Rd18군 간에 비슷한 비율로 보고되었습니다(모두 <1%). DVT 이상 반응으로 인한 레날리도마이드 캡슐 치료 중단은 Rd 연속군(2.3%)과 Rd18군(1.5%) 간에 비슷한 비율로 보고되었습니다. 폐색전증(PE)은 최소 1회 이상의 이전 치료를 받은 환자를 대상으로 한 2건의 연구에서 위약/덱사메타손군에서 0.9%(중대 또는 3/4등급)였던 것에 비해 레날리도마이드/덱사메타손군에서 더 높은 비율로 중대한 이상 약물 반응(3.7%) 또는 3/4등급(4.0%)으로 보고되었으며, PE 이상 반응으로 인한 중단은 두 군 간에 비슷한 비율로 보고되었습니다. NDMM 연구에서 PE 이상 반응의 빈도는 이상 반응(모든 등급: 각각 3.9%, 3.3% 및 4.3%), 중대한 이상 반응(각각 3.8%, 2.8% 및 3.7%) 및 3/4등급 이상 반응(각각 3.8%, 3.0% 및 3.7%)에서 Rd 연속군, Rd18군 및 MPT군 간에 유사했습니다.
심근경색증은 위약/덱사메타손군에서 각각 0.6% 및 0.6%였던 것에 비해 레날리도마이드/덱사메타손군에서 더 높은 비율로 중대한(1.7%) 또는 중증(1.7%) 이상 약물 반응으로 보고되었습니다. MI(급성 포함) 이상 반응으로 인한 중단은 레날리도마이드/덱사메타손군에서 0.8%였고 위약/덱사메타손군에서는 없었습니다. NDMM 연구에서 심근경색증(급성 포함)은 Rd 연속, Rd18 및 MPT군에서 각각 이상 반응(모든 등급: 2.4%, 0.6% 및 1.1%), 중대한 이상 반응(2.3%, 0.6% 및 1.1%) 또는 중증 이상 반응(1.9%, 0.6% 및 0.9%)으로 보고되었습니다.
뇌졸중(CVA)은 위약/덱사메타손군에서 각각 0.9% 및 0.9%였던 것에 비해 레날리도마이드/덱사메타손군에서 중대한(2.3%) 또는 중증(2.0%) 이상 약물 반응으로 보고되었습니다. 뇌졸중(CVA)으로 인한 중단은 레날리도마이드/덱사메타손군에서 1.4%였고 위약/덱사메타손군에서는 0.3%였습니다. NDMM 연구에서 CVA는 Rd 연속, Rd18 및 MPT군에서 각각 이상 반응(모든 등급: 0.8%, 0.6% 및 0.6%), 중대한 이상 반응(0.8%, 0.6% 및 0.6%) 또는 중증 이상 반응(0.6%, 0.6%, 0.2%)으로 보고되었습니다.
기타 이상 반응: MM에 대한 최소 1회 이상의 이전 치료 후
이 2건의 연구에서 발생률이 ≥1%이고 위약 비율의 두 배 이상인 위에서 설명하지 않은 다음과 같은 이상 약물 반응(ADR)이 보고되었습니다.
혈액 및 림프계 장애: 범혈구감소증, 자가면역 용혈성 빈혈
심장 장애: 서맥, 심근경색증, 협심증
내분비 장애: 다모증
눈 장애: 시력 상실, 안구 고혈압
위장관 장애: 위장관 출혈, 설통
전신 장애 및 투여 부위 이상: 권태감
검사: 간 기능 검사 비정상, 알라닌 아미노전이효소 증가
신경계 장애: 뇌 허혈
정신 장애: 기분 변화, 환각, 성욕 감퇴
생식계 및 유방 장애: 발기 기능 장애
호흡기계, 흉부 및 종격동 장애: 기침, 목쉼
피부 및 피하 조직 장애: 발진, 피부 과색소침착
골수이형성증후군:
총 148명의 환자가 del 5q MDS 임상 연구에서 10mg 레날리도마이드 캡슐을 1회 이상 투여받았습니다. 10mg 용량의 레날리도마이드 캡슐로 치료받은 148명의 환자 모두에게서 최소 1건의 이상 반응이 보고되었습니다. 가장 자주 보고된 이상 반응은 혈액 및 림프계 장애, 피부 및 피하 조직 장애, 위장관 장애, 전신 장애 및 투여 부위 이상과 관련이 있었습니다.
혈소판 감소증(61.5%; 91/148) 및 호중구 감소증(58.8%; 87/148)이 가장 자주 보고된 이상 반응이었습니다. 그 다음으로 흔하게 나타난 이상 반응은 설사(48.6%; 72/148), 가려움증(41.9%; 62/148), 발진(35.8%; 53/148) 및 피로(31.1%; 46/148)였습니다. 표 9는 del 5q MDS 임상 연구에서 레날리도마이드 캡슐로 치료받은 환자의 ≥ 5%에서 보고된 이상 반응을 요약한 것입니다. 표 10은 레날리도마이드 캡슐 치료와의 관련성에 관계없이 가장 자주 관찰된 3등급 및 4등급 이상 반응을 요약한 것입니다. 단일군 연구에서는 약물 관련 이상 반응과 환자의 기저 질환을 반영하는 이상 반응을 구별하는 것이 종종 불가능합니다.
| 신체 기관계 이상 반응 * |
10mg 전체 (N=148) |
|---|---|
|
|
| 하나 이상의 이상반응이 있는 환자 | 148 (100) |
| 혈액 및 림프계 장애 | |
| 혈소판 감소증 | 91 (61) |
| 호중구 감소증 | 87 (59) |
| 빈혈 | 17 (11) |
| 백혈구 감소증 | 12 (8) |
| 발열성 호중구 감소증 | 8 (5) |
| 피부 및 피하 조직 장애 | |
| 가려움증 | 62 (42) |
| 발진 | 53 (36) |
| 피부 건조 | 21 (14) |
| 멍 | 12 (8) |
| 식은땀 | 12 (8) |
| 땀 증가 | 10 (7) |
| 반상 출혈 | 8 (5) |
| 홍반 | 8 (5) |
| 위장관 장애 | |
| 설사 | 72 (49) |
| 변비 | 35 (24) |
| 메스꺼움 | 35 (24) |
| 복통 | 18 (12) |
| 구토 | 15 (10) |
| 상복부 통증 | 12 (8) |
| 구강 건조 | 10 (7) |
| 묽은 변 | 9 (6) |
| 호흡기, 흉부 및 종격동 장애 | |
| 비인두염 | 34 (23) |
| 기침 | 29 (20) |
| 호흡 곤란 | 25 (17) |
| 인두염 | 23 (16) |
| 코피 | 22 (15) |
| 운동성 호흡 곤란 | 10 (7) |
| 비염 | 10 (7) |
| 기관지염 | 9 (6) |
| 전신 장애 및 투여 부위 상태 | |
| 피로 | 46 (31) |
| 열 | 31 (21) |
| 말초 부종 | 30 (20) |
| 무력증 | 22 (15) |
| 부종 | 15 (10) |
| 통증 | 10 (7) |
| 오한 | 9 (6) |
| 흉통 | 8 (5) |
| 근골격계 및 결합 조직 장애 | |
| 관절통 | 32 (22) |
| 요통 | 31 (21) |
| 근육 경련 | 27 (18) |
| 사지 통증 | 16 (11) |
| 근육통 | 13 (9) |
| 말초 부종 | 12 (8) |
| 신경계 장애 | |
| 현기증 | 29 (20) |
| 두통 | 29 (20) |
| 감각 저하증 | 10 (7) |
| 미각 장애 | 9 (6) |
| 말초 신경병증 | 8 (5) |
| 감염 및 감염성 질환 | |
| 상기도 감염 | 22 (15) |
| 폐렴 | 17 (11) |
| 요로 감염 | 16 (11) |
| 부비동염 | 12 (8) |
| 봉와직염 | 8 (5) |
| 대사 및 영양 장애 | |
| Hypokalemia | 16 (11) |
| 식욕 부진 | 15 (10) |
| Hypomagnesemia | 9 (6) |
| 조사 | |
| Alanine Aminotransferase Increased | 12 (8) |
| 정신 장애 | |
| 불면증 | 15 (10) |
| 우울증 | 8 (5) |
| 신장 및 비뇨기 장애 | |
| 배뇨곤란 | 10 (7) |
| 혈관 장애 | |
| 고혈압 | 9 (6) |
| 내분비 장애 | |
| 후천성 갑상선 기능 저하증 | 10 (7) |
| 심장 질환 | |
| 심계항진 | 8 (5) |
| 이상반응 † | 10 mg (N=148) |
|---|---|
| 3/4등급 이상반응이 하나 이상 있는 환자 | 131 (89) |
| Neutropenia | 79 (53) |
| Thrombocytopenia | 74 (50) |
| Pneumonia | 11 (7) |
| Rash | 10 (7) |
| Anemia | 9 (6) |
| Leukopenia | 8 (5) |
| Fatigue | 7 (5) |
| Dyspnea | 7 (5) |
| 요통 | 7 (5) |
| Febrile Neutropenia | 6 (4) |
| Nausea | 6 (4) |
| Diarrhea | 5 (3) |
| Pyrexia | 5 (3) |
| Sepsis | 4 (3) |
| Dizziness | 4 (3) |
| Granulocytopenia | 3 (2) |
| Chest Pain | 3 (2) |
| Pulmonary Embolism | 3 (2) |
| Respiratory Distress | 3 (2) |
| Pruritus | 3 (2) |
| Pancytopenia | 3 (2) |
| Muscle Cramp | 3 (2) |
| Respiratory Tract Infection | 2 (1) |
| Upper Respiratory Tract Infection | 2 (1) |
| Asthenia | 2 (1) |
| Multi-organ Failure | 2 (1) |
| Epistaxis | 2 (1) |
| Hypoxia | 2 (1) |
| Pleural Effusion | 2 (1) |
| Pneumonitis | 2 (1) |
| Pulmonary Hypertension | 2 (1) |
| Vomiting | 2 (1) |
| Sweating Increased | 2 (1) |
| Arthralgia | 2 (1) |
| 사지 통증 | 2 (1) |
| Headache | 2 (1) |
| Syncope | 2 (1) |
MDS 환자를 대상으로 레날리도마이드 캡슐을 사용한 다른 임상 연구에서 표 9 또는 10에 설명되지 않은 다음과 같은 중대한 이상 반응(연구 약물 치료와의 관련성과 무관)이 보고되었습니다.
혈액 및 림프계 장애: 온난형 용혈성 빈혈, 비장 경색, 골수억제, 응고병증, 용혈, 용혈성 빈혈, 불응성 빈혈
심장 질환: 심부전 울혈성, 심방세동, 협심증, 심정지, 심부전, 심폐 정지, 심근병증, 심근경색, 심근 허혈, 심방세동 악화, 서맥, 심인성 쇼크, 폐부종, 상심실성 부정맥, 빈맥, 심실 기능 장애
귀 및 미로 장애: 현기증
내분비 장애: 바세도우병
위장관 장애: 위장관 출혈, 허혈성 대장염, 장 천공, 직장 출혈, 결장 용종, 게실염, 연하 곤란, 위염, 위장염, 위식도 역류 질환, 폐쇄성 서혜부 탈장, 과민성 대장 증후군, 흑색변, 담도 폐쇄로 인한 췌장염, 췌장염, 직장 주위 농양, 소장 폐쇄, 상부 위장관 출혈
일반적 장애 및 투여 부위 상태: 질병 진행, 낙상, 비정상적인 걸음걸이, 간헐적 발열, 결절, 오한, 급사
간담도 질환: 고빌리루빈혈증, 담낭염, 급성 담낭염, 간부전
면역 체계 장애: 과민증
감염 및 감염성 질환: 감염성 균혈증, 중심 정맥 카테터 감염, 클로스트리듐 감염, 귀 감염, Enterobacter 패혈증, 진균 감염, 단순포진 바이러스 감염 NOS, 인플루엔자, 신장 감염, Klebsiella 패혈증, 엽성 폐렴, 국소 감염, 구강 감염, Pseudomonas 감염, 패혈성 쇼크, 급성 부비동염, 부비동염, Staphylococcal 감염, 요로 감염
손상, 중독 및 시술 합병증: 대퇴골 골절, 수혈 반응, 경추 골절, 대퇴 경부 골절, 골반 골절, 고관절 골절, 과다 복용, 시술 후 출혈, 늑골 골절, 교통사고, 척추 압박 골절
검사: 혈액 크레아티닌 증가, 헤모글로빈 감소, 간 기능 검사 비정상, 트로포닌 I 증가
대사 및 영양 장애: 탈수증, 통풍, 고나트륨혈증, 저혈당증
근골격계 및 결합 조직 장애: 관절염, 관절염 악화, 통풍성 관절염, 목 통증, 피로인산칼슘 침착증
양성, 악성 및 상세 불명의 신생물: 급성 백혈병, 급성 골수성 백혈병, 기관지폐포암, 폐암 전이, 림프종, 전립선암 전이
신경계 장애: 뇌혈관 사고, 실어증, 소뇌 경색, 뇌경색, 의식 저하, 구음 장애, 편두통, 척수 압박, 지주막하 출혈, 일과성 허혈 발작
정신 질환: 혼돈 상태
신장 및 요로 장애: 신부전, 혈뇨, 급성 신부전, 질소혈증, 요관 결석, 신장 종괴
생식 기관 및 유방 장애: 골반 통증
호흡기계, 흉부 및 종격동 장애: 기관지염, 만성 폐쇄성 폐 질환 악화, 호흡 부전, 호흡 곤란 악화, 간질성 폐 질환, 폐 침윤, 천명
피부 및 피하 조직 장애: 급성 열성 호중구 피부병
혈관 장애: 심부 정맥 혈전증, 저혈압, 대동맥 질환, 허혈, 표재성 혈전정맥염, 혈전증
6.2 시판 후 경험
다음과 같은 이상 약물 반응은 레날리도마이드 캡슐의 전 세계 시판 후 경험에서 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다[경고 및 주의 사항 섹션 (5.8 ~ 5.11, 및 5.13) 참조].
내분비 장애: 갑상선 기능 저하증, 갑상선 기능 항진증
간담도 질환: 간부전(사망 포함), 독성 간염, 세포 용해성 간염, 담즙 정체성 간염, 혼합 세포 용해성/담즙 정체성 간염, 일시적인 간 기능 검사 수치 비정상
면역 체계 장애: 혈관 부종, 아나필락시스, 급성 이식편대숙주병(동종 조혈모세포 이식 후), 고형 장기 이식 거부 반응
감염 및 감염성 질환: 바이러스 재활성화(B형 간염 바이러스 및 수두 대상포진 바이러스 등), 진행성 다초점 백질뇌병증(PML)
양성, 악성 및 상세 불명의 신생물(낭종 및 용종 포함): 종양 용해 증후군, 종양 발열 반응
호흡기계, 흉부 및 종격동 장애: 폐렴
피부 및 피하 조직 장애: 스티븐스-존슨 증후군, 독성 표피 괴사 용해, 호산구 증가 및 전신 증상을 동반한 약물 반응(DRESS)
7 약물 상호 작용
7.1 Digoxin
레날리도마이드 캡슐 (10mg/일)을 여러 번 투여하면서 digoxin을 병용 투여했을 때 digoxin의 Cmax 및 AUCinf가 14% 증가했습니다. 레날리도마이드 캡슐 투여 중 이 약을 투여받는 환자의 임상적 판단에 따라 표준 임상 진료를 기반으로 digoxin 혈장 수치를 주기적으로 모니터링하십시오.
7.2 혈전증 위험을 증가시킬 수 있는 병용 요법
적혈구 생성제 또는 에스트로겐 함유 요법과 같이 혈전증 위험을 증가시킬 수 있는 다른 약제는 레날리도마이드 캡슐을 투여받는 환자에서 유익성-위험성 평가를 수행한 후 주의해서 사용해야 합니다 [경고 및 주의사항 (5.4) 참조].
7.3 Warfarin
레날리도마이드 캡슐 (10mg/일)을 여러 번 투여하면서 warfarin (25mg)을 단일 투여했을 때 레날리도마이드 또는 R- 및 S-warfarin의 약동학에 영향을 미치지 않았습니다. warfarin 투여 후 PT 및 INR의 검사실 평가에서 예상되는 변화가 관찰되었지만 이러한 변화는 레날리도마이드 캡슐 병용 투여의 영향을 받지 않았습니다. dexamethasone과 warfarin 사이에 상호 작용이 있는지는 알려져 있지 않습니다. warfarin을 병용 투여하는 MM 환자의 경우 PT 및 INR을 면밀히 모니터링하는 것이 좋습니다.
8. 특정 집단에서의 사용
8.1 임신
임신 노출 등록
임신 중 레날리도마이드 캡슐에 노출된 여성과 레날리도마이드 캡슐에 노출된 남성 환자의 여성 파트너의 임신 결과를 모니터링하는 임신 노출 등록이 있습니다. 이 등록은 또한 임신의 근본 원인을 이해하는 데 사용됩니다. 태아가 레날리도마이드 캡슐에 노출되었다고 의심되는 경우 1-800-FDA-1088번으로 MedWatch 프로그램을 통해 FDA에 보고하고 1-888-423-5436번으로 REMS 콜센터에도 보고하십시오.
위험 요약
작용 기전 [12.1 임상 약리학 참조] 및 동물 연구 결과 [데이터 참조]에 따라 레날리도마이드 캡슐은 임산부에게 투여 시 태아에게 해를 끼칠 수 있으며 임신 중에는 금기입니다 [경고, 4.1 금기, 5.1 특정 집단에서의 사용 참조].
레날리도마이드 캡슐은 탈리도마이드 유사체입니다. 탈리도마이드는 사람에게 기형을 유발하는 물질로, 무지증(사지 결손), 단지증(짧은 사지), 뼈 발육 부전, 뼈 결손, 외이 기형(무이증, 소이증, 외이도가 작거나 없는 경우 포함), 안면 마비, 눈 기형(무안구증, 소안구증), 선천성 심장 결손과 같은 심각하고 생명을 위협하는 선천적 결손을 높은 빈도로 유발합니다. 또한 소화관, 요로 및 생식기 기형이 보고되었으며 출생 시 또는 출생 직후 사망이 보고된 영아는 약 40%였습니다.
레날리도마이드는 원숭이 새끼에게 탈리도마이드 유형의 사지 기형을 유발했습니다. 레날리도마이드는 임신한 토끼와 쥐에게 투여한 후 태반을 통과했습니다[데이터 참조]. 임신 중에 이 약을 사용하는 경우 또는 이 약을 복용하는 동안 환자가 임신하게 된 경우 태아에 대한 잠재적 위험을 환자에게 알려야 합니다.
치료 중 임신이 된 경우 즉시 약물 투여를 중단하십시오. 이러한 조건에서는 환자를 생식 독성 경험이 있는 산부인과 의사에게 의뢰하여 추가 평가 및 상담을 받도록 하십시오. 태아가 레날리도마이드 캡슐에 노출되었다고 의심되는 경우 1-800-FDA-1088번으로 MedWatch 프로그램을 통해 FDA에 보고하고 1-888-423-5436번으로 REMS 콜센터에도 보고하십시오.
해당 집단에서 주요 선천적 결손 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 결손, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 주요 선천적 결손의 추정 배경 위험은 2~4%이며 유산은 임상적으로 확인된 임신의 15~20%입니다.
데이터
동물 데이터
원숭이를 대상으로 한 배아-태아 발달 독성 연구에서 임신한 원숭이에게 기관 형성 중에 레날리도마이드를 경구 투여했을 때 탈리도마이드 유사 사지 기형을 포함한 기형 발생이 새끼에게서 발생했습니다. 최저 용량에서 원숭이의 노출(AUC)은 최대 권장 용량(MRHD) 25mg에서 사람 노출량의 0.17배였습니다. 임신한 토끼와 쥐에게 각각 MRHD의 20배와 200배 용량으로 유사한 연구를 수행한 결과 토끼에서는 배아 치사율이 나타났고 쥐에서는 생식에 대한 부작용이 나타나지 않았습니다.
쥐를 대상으로 한 출생 전 및 출생 후 발달 연구에서 동물에게 기관 형성부터 수유기까지 레날리도마이드를 투여했습니다. 이 연구에서는 최대 500mg/kg(체표면적 기준 사람 용량 25mg의 약 200배) 용량의 레날리도마이드로 치료받은 암컷 쥐의 새끼에게서 몇 가지 부작용이 나타났습니다. 수컷 새끼는 성 성숙이 약간 지연되었고 암컷 새끼는 수컷 새끼와 교배했을 때 임신 중 체중 증가가 약간 적었습니다. 탈리도마이드와 마찬가지로 쥐 모델은 레날리도마이드에 대한 사람 배아-태아 발달 효과의 전체 범위를 적절하게 다루지 못할 수 있습니다.
임신한 토끼에게 임신 7일부터 20일까지 레날리도마이드를 매일 경구 투여한 후 태아 혈장 레날리도마이드 농도는 산모 Cmax의 약 20~40%였습니다. 임신한 쥐에게 단일 용량을 경구 투여한 후 태아 혈장 및 조직에서 레날리도마이드가 검출되었습니다. 태아 조직의 방사능 농도는 일반적으로 산모 조직의 방사능 농도보다 낮았습니다. 이러한 데이터는 레날리도마이드가 태반을 통과한다는 것을 나타냅니다.
8.2 수유
위험 요약
모유에서 레날리도마이드의 존재 여부, 레날리도마이드 캡슐이 모유 수유 중인 영아에게 미치는 영향 또는 레날리도마이드 캡슐이 모유 생산에 미치는 영향에 대한 정보는 없습니다. 많은 약물이 모유로 배설되고 레날리도마이드 캡슐로 인해 모유 수유 중인 영아에게서 부작용이 발생할 가능성이 있으므로 레날리도마이드 캡슐로 치료하는 동안 여성에게 모유 수유를 하지 않도록 권고하십시오.
8.3 가임기 여성 및 남성
임신 검사
레날리도마이드 캡슐은 임신 중에 투여하면 태아에게 해를 끼칠 수 있습니다 [8.1 특정 집단에서의 사용 참조]. 레날리도마이드 캡슐 치료를 시작하기 전과 치료 중에 가임기 여성의 임신 여부를 확인하십시오. 가임기 여성에게 치료 4주 전, 레날리도마이드 캡슐 복용 중, 용량 중단 중 및 치료 종료 후 최소 4주 동안 임신을 피해야 한다고 조언하십시오.
가임기 여성은 레날리도마이드 캡슐 치료를 시작하기 전에 임신 검사를 2회 받아 음성이 확인되어야 합니다. 첫 번째 검사는 10~14일 이내에 수행해야 하고 두 번째 검사는 레날리도마이드 캡슐을 처방하기 24시간 이내에 수행해야 합니다. 치료를 시작한 후 및 용량 중단 중에 가임기 여성은 처음 4주 동안 매주 임신 검사를 받아야 하며, 그 후 생리 주기가 규칙적인 여성은 4주마다 임신 검사를 반복해야 합니다. 생리 주기가 불규칙한 경우 2주마다 임신 검사를 받아야 합니다. 생리를 건너뛰거나 생리 출혈에 이상이 있는 경우 임신 검사 및 상담을 받아야 합니다. 이 평가 중에는 레날리도마이드 캡슐 치료를 중단해야 합니다.
피임
여성
가임 여성은 이성애 성교를 지속적으로 삼가하거나 매우 효과적인 피임법 1가지(난관 결찰, 자궁 내 장치, 호르몬 피임[피임약, 주사, 호르몬 패치, 질 링 또는 임플란트] 또는 파트너의 정관 수술)와 효과적인 피임법 1가지(남성용 라텍스 또는 합성 콘돔, 다이어프램 또는 자궁 경부 캡) 등 2가지의 확실한 피임법을 동시에 사용해야 합니다. 레날리도마이드 캡슐로 치료를 시작하기 4주 전부터 치료 중, 용량 중단 중, 그리고 레날리도마이드 캡슐 치료 중단 후 4주 동안 피임을 계속해야 합니다. 자궁 적출술로 인한 경우를 제외하고 불임 병력이 있는 경우에도 확실한 피임이 필요합니다. 가임 여성은 필요한 경우 자격을 갖춘 피임법 제공자에게 의뢰해야 합니다.
남성
레날리도마이드는 레날리도마이드 캡슐을 복용하는 남성의 정액에 존재합니다. 따라서 남성은 레날리도마이드 캡슐을 복용하는 동안과 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 가임 여성과 성적 접촉을 할 때는 항상 라텍스 또는 합성 콘돔을 사용해야 합니다(정관 수술을 성공적으로 받은 경우에도 마찬가지). 레날리도마이드 캡슐을 복용하는 남성 환자는 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 정자를 기증해서는 안 됩니다.
8.5 노인에 대한 사용
다발성 골수종 병용 요법: 전반적으로 연구 치료를 받은 NDMM 연구의 환자 1613명 중 94%(1521/1613명)가 65세 이상이었고 35%(561/1613명)는 75세를 초과했습니다. 75세를 초과한 환자의 비율은 연구군 간에 유사했습니다(Rd 연속: 33%, Rd18: 34%, MPT: 33%). 전반적으로 모든 치료군에서 대부분의 이상 반응 범주(예: 모든 이상 반응, 3/4등급 이상 반응, 중대한 이상 반응)의 빈도는 젊은 피험자(≤75세)보다 나이든 피험자(> 75세)에서 더 높았습니다. 전반적으로 모든 치료군에서 일반 장애 및 투여 부위 이상 체계의 3등급 또는 4등급 이상 반응은 젊은 피험자보다 나이든 피험자에서 일관되게 더 높은 빈도(최소 5% 차이)로 보고되었습니다. 감염 및 감염증, 심장 질환(심부전 및 울혈성 심부전 포함), 피부 및 피하 조직 질환, 신장 및 요로 질환(신부전 포함) 체계의 3등급 또는 4등급 이상 반응도 전반적으로 모든 치료군에서 젊은 피험자보다 나이든 피험자에서 약간 더 자주(<5% 차이) 보고되었습니다. 다른 신체 체계(예: 혈액 및 림프계 질환, 감염 및 감염증, 심장 질환, 혈관 질환)의 경우 전반적으로 모든 치료군에서 젊은 피험자보다 나이든 피험자에서 3/4등급 이상 반응 빈도가 증가하는 경향이 덜 일관되었습니다. 중대한 이상 반응은 전반적으로 모든 치료군에서 젊은 피험자보다 나이든 피험자에서 더 높은 빈도로 보고되었습니다.
최소 1회 이상의 이전 치료 후 다발성 골수종: 연구 1과 2에서 연구 치료를 받은 다발성 골수종 환자 703명 중 45%가 65세 이상이었고 12%는 75세 이상이었습니다. 65세 이상 환자의 비율은 레날리도마이드/덱사메타손군과 위약/덱사메타손군 간에 유의미한 차이가 없었습니다. 레날리도마이드/덱사메타손을 투여받은 353명의 환자 중 46%가 65세 이상이었습니다. 두 연구 모두에서 65세를 초과한 환자는 레날리도마이드 캡슐 사용 후 65세 이하의 환자보다 DVT, 폐색전증, 심방세동 및 신부전을 경험할 가능성이 더 높았습니다. 65세를 초과한 환자와 젊은 환자 간에 효능의 차이는 관찰되지 않았습니다.
주요 연구에 등록된 del 5q MDS 환자 148명 중 38%가 65세 이상이었고 33%는 75세 이상이었습니다. 이상 반응의 전체 빈도(100%)는 65세를 초과한 환자와 젊은 환자에서 동일했지만 중대한 이상 반응의 빈도는 젊은 환자(33%)보다 65세를 초과한 환자(54%)에서 더 높았습니다. 젊은 환자(16%)보다 65세를 초과한 환자(27%)에서 이상 반응으로 인해 임상 연구를 중단한 비율이 더 높았습니다. 65세를 초과한 환자와 젊은 환자 간에 효능의 차이는 관찰되지 않았습니다.
노인 환자는 신장 기능이 저하될 가능성이 더 높으므로 용량 선택에 주의해야 합니다. 신장 기능을 모니터링하십시오.
10 과량투여
MM 또는 MDS 환자에서 레날리도마이드 과량투여 치료에 대한 구체적인 경험은 없습니다. 건강한 피험자를 대상으로 한 용량 범위 연구에서 일부 피험자는 최대 200mg(100mg을 1일 2회 투여)까지 투여받았으며, 단회 투여 연구에서는 일부 피험자가 최대 400mg까지 투여받았습니다. 가려움증, 두드러기, 발진 및 간 트랜스아미나제 상승이 주요 보고된 AE였습니다. 임상시험에서 용량 제한 독성은 호중구 감소증 및 혈소판 감소증이었습니다.
12 임상 약리학
12.1 작용 기전
Lenalidomide는 탈리도마이드의 유사체로서 면역조절, 항혈관신생 및 항종양 특성을 가지고 있습니다. Lenalidomide의 세포 활성은 cullin ring E3 ubiquitin ligase 효소 복합체의 구성 요소인 표적 cereblon을 통해 매개됩니다. in vitro에서 약물의 존재 하에 기질 단백질(Aiolos, Ikaros 및 CK1α 포함)은 유비퀴틴화 및 후 subsequent degradation의 표적이 되어 직접적인 세포독성 및 면역조절 효과를 나타냅니다. Lenalidomide는 in vitro에서 MM 및 del(5q) 골수이형성증후군을 포함한 특정 조혈 종양 세포의 증식을 억제하고 세포사멸을 유도합니다. Lenalidomide는 MM을 포함한 일부 in vivo 비임상 조혈 종양 모델에서 종양 성장 지연을 유발합니다. Lenalidomide의 면역조절 특성에는 인터루킨-2 및 인터페론-감마의 분비 증가, NKT 세포 수 증가, 단핵구에 의한 전염증성 사이토카인(예: TNF-α 및 IL-6)의 억제를 통한 항체 의존성 세포 매개 세포독성(ADCC)의 직접적 및 향상된 활성화로 이어지는 T 세포 및 자연 살해(NK) 세포의 수 증가 및 활성화가 포함됩니다. MM 세포에서 lenalidomide와 dexamethasone의 조합은 세포 증식 억제 및 세포사멸 유도를 상승적으로 작용합니다.
12.2 약력학
심장 전기생리학
QT 연장 연구에서 60명의 건강한 남성 피험자를 대상으로 lenalidomide가 QTc 간격에 미치는 영향을 평가했습니다. 최대 권장 용량의 두 배 용량에서 lenalidomide는 QTc 간격을 연장하지 않았습니다. lenalidomide와 위약 간의 평균 차이에 대한 양측 90% CI의 가장 큰 상한은 10ms 미様でした.
12.3 약동학
흡수
MM 또는 MDS 환자에게 lenalidomide 캡슐을 단회 및 다회 투여한 후 최대 혈장 농도는 투여 후 0.5~6시간 사이에 나타났습니다. lenalidomide의 단회 및 다회 투여 약동학적 disposición은 선형이며 AUC 및 Cmax 값은 용량에 비례하여 증가합니다. 권장 용량으로 lenalidomide 캡슐을 다회 투여해도 약물 축적이 발생하지 않습니다.
건강한 피험자에게 고지방 식사와 함께 lenalidomide 캡슐 25mg을 단회 투여하면 흡수 정도가 감소하여 AUC는 약 20%, Cmax는 50% 감소합니다. lenalidomide 캡슐의 효능 및 안전성이 확립된 임상 시험에서 약물은 음식 섭취와 관계없이 투여되었습니다. Lenalidomide 캡슐은 음식과 함께 또는 음식 없이 투여할 수 있습니다.
분포
In vitro에서 [14C]-lenalidomide의 혈장 단백질 결합은 약 30%입니다.
Lenalidomide는 lenalidomide 캡슐 25mg을 매일 투여한 후 2시간(1379ng/ejaculate) 및 24시간(35ng/ejaculate)에 정액에 존재합니다.
제거
Lenalidomide의 평균 반감기는 건강한 피험자에서 3시간, MM 또는 MDS 환자에서 3~5시간입니다.
대 metabolims
Lenalidomide는 제한적으로 대사됩니다. 변하지 않은 lenalidomide는 인간에서 주요 순환 성분입니다. 확인된 두 가지 대사 산물은 5-hydroxy-lenalidomide 및 N-acetyl-lenalidomide이며, 각각 순환계에서 모 약물 수준의 5% 미만을 차지합니다.
배설
제거는 주로 신장을 통해 이루어집니다. 건강한 피험자에게 [14C]-lenalidomide 25mg을 1회 경구 투여한 후 방사성 용량의 약 90% 및 4%가 각각 10일 이내에 소변과 대변으로 배설되었습니다. 방사성 용량의 약 82%가 24시간 이내에 소변으로 lenalidomide로 배설되었습니다. Hydroxy-lenalidomide 및 N-acetyl-lenalidomide는 각각 배설된 용량의 4.6% 및 1.8%를 차지했습니다. Lenalidomide의 신장 청소율은 사구체 여과율을 초과합니다.
특정 집단
신장애: 경도 신장애(Cockcroft-Gault를 사용하여 계산한 크레아티닌 청소율(CLcr) 50~79mL/min) 피험자 8명, 중등도 신장애(CLcr 30~49mL/min) 피험자 9명, 중증 신장애(CLcr < 30mL/min) 피험자 4명, 투석이 필요한 말기 신질환(ESRD) 환자 6명에게 lenalidomide 캡슐 25mg을 단회 투여했습니다. 신기능이 정상인(CLcr > 80mL/min) 비슷한 연령대의 건강한 피험자 3명에게도 lenalidomide 캡슐 25mg을 단회 투여했습니다. CLcr이 감소함에 따라 반감기는 증가하고 약물 청소율은 선형적으로 감소했습니다. 중등도 및 중증 장애 환자는 건강한 피험자에 비해 반감기가 3배 증가했으며 약물 청소율은 66~75% 감소했습니다. 혈액투석을 받는 환자(n=6)는 건강한 피험자에 비해 반감기가 약 4.5배 증가했으며 약물 청소율은 80% 감소했습니다. 4시간 동안의 혈액투석 세션 동안 체내 약물의 약 30%가 제거되었습니다.
CLcr 값을 기준으로 신장애 환자의 lenalidomide 캡슐 시작 용량을 조절하십시오 [용량 및 투여 (2.6)]를 참조하십시오.
간장애: 경도 간장애(총 빌리루빈 > 정상 상한치(ULN)의 1~1.5배 또는 아스파르테이트 트랜스아미나제가 ULN보다 큰 경우로 정의)는 lenalidomide의 disposición에 영향을 미치지 않았습니다. 중등도에서 중증 간장애 환자에 대한 약동학적 데이터는 없습니다.
기타 내인성 요인: 연령(39~85세), 체중(33~135kg), 성별, 인종 및 혈액 악성 종양 유형(MM 또는 MDS)은 성인 환자의 lenalidomide 청소율에 임상적으로 관련된 영향을 미치지 않았습니다.
약물 상호 작용
dexamethasone(40mg)을 단회 또는 다회 투여해도 lenalidomide 캡슐(25mg)의 다회 투여 약동학에 임상적으로 관련된 영향을 미치지 않았습니다.
퀴니딘(1일 2회 600mg)과 같은 P-gp 억제제를 다회 투여한 후 lenalidomide 캡슐(25mg)을 병용 투여해도 lenalidomide의 Cmax 또는 AUC가 유의하게 증가하지 않았습니다.
P-gp 억제제 및 기질인 temsirolimus(25mg)를 lenalidomide 캡슐(25mg)과 병용 투여해도 lenalidomide, temsirolimus 또는 sirolimus(temsirolimus의 대사 산물)의 약동학이 유의하게 변경되지 않았습니다.
In vitro 연구 결과 lenalidomide 캡슐은 P-glycoprotein(P-gp)의 기질임이 입증되었습니다. Lenalidomide 캡슐은 인간 유방암 저항성 단백질(BCRP), 다약제 내성 단백질(MRP) 운반체 MRP1, MRP2 또는 MRP3, 유기 음이온 운반체(OAT) OAT1 및 OAT3, 유기 음이온 운반 폴리펩타이드 1B1(OATP1B1), 유기 양이온 운반체(OCT) OCT1 및 OCT2, 다약제 및 독소 배출 단백질(MATE) MATE1, 유기 양이온 운반체 신규(OCTN) OCTN1 및 OCTN2의 기질이 아닙니다. Lenalidomide는 P-gp, 담즙산 배출 펌프(BSEP), BCRP, MRP2, OAT1, OAT3, OATP1B1, OATP1B3 또는 OCT2의 억제제가 아닙니다. Lenalidomide는 CYP450 동위효소를 억제하거나 유도하지 않습니다. 또한 lenalidomide는 UGT1A1 유전자형이 UGT1A1*1/*1, UGT1A1*1/*28 및 UGT1A1*28/*28인 인간 간 마이크로솜에서 빌리루빈 글루쿠론산화 형성을 억제하지 않습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
레날리도마이드를 이용한 발암성 연구는 수행된 바 없습니다.
레날리도마이드는 박테리아 역돌연변이 분석(에임스 시험)에서 돌연변이 유발성을 나타내지 않았으며, 배양된 인간 말초 혈액 림프구에서 염색체 이상을 유발하지 않았고, 마우스 림프종 L5178Y 세포의 티미딘 키나제(tk) 유전자좌에서 돌연변이를 유발하지 않았습니다. 레날리도마이드는 시리아 햄스터 배아 분석에서 형태학적 변형을 증가시키지 않았으며, 수컷 쥐의 골수에서 다염색성 적혈구의 미소핵을 유도하지 않았습니다.
최대 500mg/kg(체표면적 기준, 25mg 용량을 투여받은 사람 용량의 약 200배)의 레날리도마이드를 투여한 쥐를 대상으로 한 생식능력 및 초기 배아 발달 연구에서 부모에게 독성이 나타나지 않았으며 생식능력에 대한 부작용도 나타나지 않았습니다.
14. 임상 연구
14.1 다발성 골수종
새롭게 다발성 골수종(MM) 진단을 받은 환자를 대상으로 한 무작위 배정, 공개형 임상시험:
새롭게 다발성 골수종(MM) 진단을 받았지만 줄기세포 이식이 적합하지 않은 환자 1,623명을 대상으로 레날리도마이드 캡슐 및 저용량 덱사메타손(Rd)을 서로 다른 기간 동안 투여했을 때의 효능 및 안전성을 멜팔란, 프레드니손 및 탈리도마이드(MPT) 병용 요법과 비교하기 위해 무작위 배정, 다기관, 공개형 3군 임상시험을 실시했습니다. 연구의 첫 번째 군에서는 질병이 진행될 때까지 Rd를 지속적으로 투여했습니다[Rd 지속 투여군]. 두 번째 군에서는 최대 18회의 28일 주기[72주, Rd18군] 동안 Rd를 투여했습니다. 세 번째 군에서는 최대 12회의 42일 주기(72주) 동안 멜팔란, 프레드니손 및 탈리도마이드(MPT)를 투여했습니다. 본 연구의 목적상, 65세 미만 환자의 경우 SCT 요법을 거부하거나 비용 또는 기타 이유로 SCT를 받을 수 없는 경우 SCT가 적합하지 않은 것으로 간주했습니다. 환자는 무작위 배정 시 연령(≤75세 대 >75세), 병기(ISS 병기 I 및 II 대 병기 III) 및 국가별로 계층화되었습니다.
Rd 지속 투여군과 Rd18군의 환자는 28일 주기의 1~21일에 레날리도마이드 캡슐 25mg을 1일 1회 투여받았습니다. 덱사메타손은 각 28일 주기의 1, 8, 15, 22일에 40mg을 1일 1회 경구 투여했습니다. 75세를 초과하는 환자의 경우 덱사메타손의 시작 용량은 28일 주기의 1, 8, 15, 22일에 20mg을 1일 1회 경구 투여했습니다. Rd 지속 투여군과 Rd18군의 초기 용량 및 요법은 연령과 신기능에 따라 조정했습니다. 모든 환자는 예방적 항응고제를 투여받았으며, 가장 일반적으로 사용된 것은 아스피린이었습니다.
환자의 인구 통계 및 질병 관련 기준선 특성은 3개 군 간에 균형을 이루었습니다. 일반적으로 연구 대상은 진행된 병기를 가지고 있었습니다. 전체 연구 집단에서 평균 연령은 3개 군 모두 73세였으며, 전체 환자의 35%가 75세를 초과했습니다. 59%는 ISS 병기 I/II였고, 41%는 ISS 병기 III였습니다. 9%는 중증 신장애(크레아티닌 청소율[CLcr] < 30mL/min)를, 23%는 중등도 신장애(CLcr > 30~50mL/min)를, 44%는 경도 신장애(CLcr >50~80mL/min)를 가지고 있었습니다. ECOG 수행 상태의 경우 29%는 0등급, 49%는 1등급, 21%는 2등급, 0.4%는 3등급 이상이었습니다.
1차 효능 평가 변수인 무진행 생존 기간(PFS)은 무작위 배정부터 PFS 추적 관찰 단계가 끝날 때까지 연구 기간 동안 먼저 발생한 국제 골수종 작업 그룹[IMWG] 기준에 따라 독립 반응 평가 위원회(IRAC)에서 결정한 질병 진행의 첫 번째 기록 또는 모든 원인으로 인한 사망까지의 기간으로 정의했습니다. 모든 평가 변수에 대한 효능 분석에서 1차 비교는 Rd 지속 투여군과 MPT군 간에 이루어졌습니다. 효능 결과는 아래 표에 요약되어 있습니다. PFS는 MPT군보다 Rd 지속 투여군에서 유의하게 더 길었습니다. HR 0.72(95% CI: 0.61-0.85, p <0.0001). PFS 사건이 발생한 환자의 비율은 MPT군에 비해 Rd 지속 투여군에서 더 낮았습니다(각각 52% 대 61%). MPT군에 비해 Rd 지속 투여군에서 개선된 PFS 중앙값은 4.3개월이었습니다. 골수종 반응률은 MPT군(62.3%)에 비해 Rd 지속 투여군(75.1%)에서 더 높았으며, 완전 반응을 보인 환자는 Rd 지속 투여군에서 15.1%, MPT군에서 9.3%였습니다. 첫 번째 반응까지의 중앙값은 Rd 지속 투여군에서 1.8개월, MPT군에서 2.8개월이었습니다.
2014년 3월 3일 데이터 마감 시점의 중간 OS 분석에서 모든 생존 환자의 중간 추적 관찰 기간은 45.5개월이었고 사망 사건은 697건으로, 계획된 최종 OS 분석에 필요한 사전 지정된 사건의 78%를 나타냅니다(최종 OS 사건 896건 중 697건). 관찰된 OS HR은 Rd 지속 투여군 대 MPT군에서 0.75였습니다(95% CI = 0.62, 0.90).
표 13: 효능 결과 개요 – MM-020 연구(치료 의향 집단)
|
|
Rd 지속 투여 (N = 535) |
Rd18 (N = 541) |
MPT (N = 547) |
|
PFS – IRAC(개월)g |
|
|
|
|
PFS 사건 수 |
278(52) |
348(64.3) |
334(61.1) |
|
PFS 중앙값a(개월)(95% CI)b |
25.5(20.7, 29.4) |
20.7(19.4, 22) |
21.2(19.3, 23.2) |
|
HR[95% CI]c; p-값d |
|
|
|
|
Rd 지속 투여 대 MPT |
0.72(0.61, 0.85); <0.0001 |
|
|
|
Rd 지속 투여 대 Rd18 |
0.70(0.60, 0.82) |
|
|
|
Rd18 대 MPT |
1.03(0.89, 1.20) |
|
|
|
전체 생존 기간(개월)h |
|
|
|
|
사망 사건 수 |
208(38.9) |
228(42.1) |
261(47.7) |
|
OS 중앙값a(개월)(95% CI)b |
58.9(56, NE)f |
56.7(50.1, NE) |
48.5(44.2, 52) |
|
HR [95% CI]c |
|
|
|
|
Rd Continuous vs MPT |
0.75 (0.62, 0.90) |
|
|
|
Rd Continuous vs Rd18 |
0.91 (0.75, 1.09) |
|
|
|
Rd18 vs MPT |
0.83 (0.69, 0.99) |
|
|
|
반응률e – IRAC, n (%)g |
|
|
|
|
CR |
81 (15.1) |
77 (14.2) |
51 (9.3) |
|
VGPR |
152 (28.4) |
154 (28.5) |
103 (18.8) |
|
PR |
169 (31.6) |
166 (30.7) |
187 (34.2) |
|
전체 반응: CR, VGPR 또는 PR |
402 (75.1) |
397 (73.4) |
341 (62.3) |
|
CR = 완전 반응; d = 저용량 덱사메타손; HR = 위험 비율; IRAC = 독립 반응 평가 위원회; M = 멜팔란; NE = 추정 불가; OS = 전체 생존 기간; P = 프레드니손; PFS = 무진행 생존 기간; PR = 부분 반응; R = 레날리도마이드 캡슐; Rd Continuous = 질병 진행이 문서화될 때까지 투여된 Rd; Rd18 = ≤ 18주기 동안 투여된 Rd; T = 탈리도마이드; VGPR = 매우 우수한 부분 반응; vs = 대비. a 중앙값은 카플란-마이어 추정치를 기반으로 합니다. b 중앙값에 대한 95% 신뢰 구간(CI). c 표시된 치료군과 관련된 위험 함수를 비교하는 Cox 비례 위험 모델을 기반으로 합니다. d p-값은 표시된 치료군 간의 카플란-마이어 곡선 차이에 대한 계층화되지 않은 로그 순위 검정을 기반으로 합니다. e 연구의 치료 단계 동안 최상의 반응 평가. f 반응 평가 데이터가 없거나 유일한 평가가 “반응을 평가할 수 없음”인 환자를 포함합니다. g 데이터 차단 날짜 = 2013년 5월 24일. h 데이터 차단 날짜 = 2014년 3월 3일. |
|||
IRAC 평가 기준 질병 진행 소요 기간의 카플란-마이어 곡선(ITT MM 모집단)
Rd 지속, Rd18 및 MPT군 간 비교
절단 날짜: 2013년 5월 24일
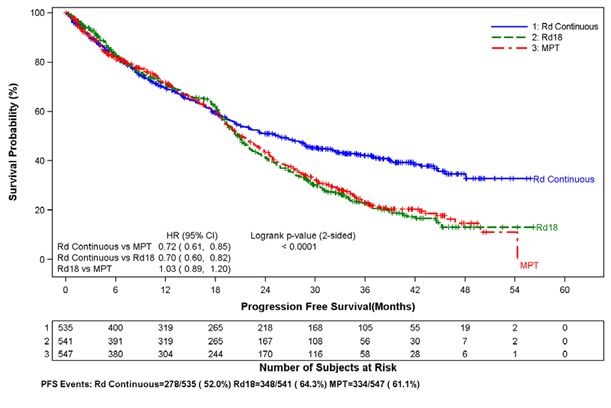
CI = 신뢰 구간, d = 저용량 덱사메타손, HR = 위험 비, IRAC = 독립 반응 평가 위원회, M = 멜팔란, P = 프레드니손, R = 레날리도마이드 캡슐,
Rd 지속 = 질병 진행 기록이 있을 때까지 Rd 투여, Rd18 = 최대 18주기 동안 Rd 투여, T = 탈리도마이드.
전체 생존율의 카플란-마이어 곡선(ITT MM 모집단)
Rd 지속, Rd18 및 MPT군 간 비교
절단 날짜: 2014년 3월 3일
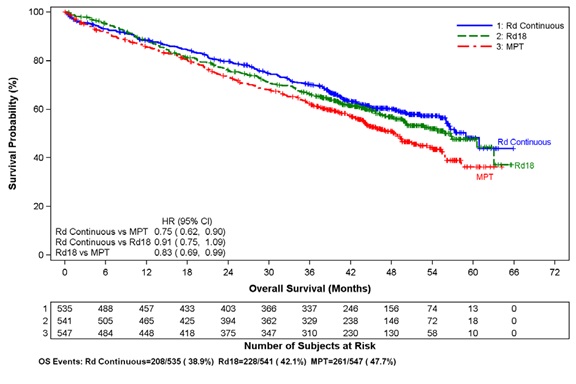
CI = 신뢰 구간, d = 저용량 덱사메타손, HR = 위험 비, M = 멜팔란, P = 프레드니손, R = 레날리도마이드 캡슐,
Rd 지속 = 질병 진행 기록이 있을 때까지 Rd 투여, Rd18 = 최대 18주기 동안 Rd 투여, T = 탈리도마이드.
최소 1회 이상의 이전 치료를 받은 MM 환자를 대상으로 한 무작위 배정, 공개 라벨 임상 연구
레날리도마이드 캡슐의 효능 및 안전성을 평가하기 위해 두 건의 무작위 배정 연구(연구 1 및 2)가 수행되었습니다. 이러한 다기관, 다국적, 이중맹검, 위약 대조 연구에서는 최소 1회 이상의 이전 치료를 받은 MM 환자를 대상으로 레날리도마이드 캡슐 + 경구 펄스 고용량 덱사메타손 요법을 덱사메타손 단독 요법과 비교했습니다. 이러한 연구에는 절대 호중구 수(ANC) ≥ 1000/mm3, 혈소판 수 ≥ 75,000/mm3, 혈청 크레아티닌 ≤ 2.5mg/dL, 혈청 SGOT/AST 또는 SGPT/ALT ≤ 정상 상한치(ULN)의 3배, 혈청 직접 빌리루빈 ≤ 2mg/dL인 환자가 등록되었습니다.
두 연구 모두에서 레날리도마이드/덱사메타손군의 환자는 28일 주기의 1~21일에 1일 1회 레날리도마이드 캡슐 25mg을 경구 복용했으며, 22~28일에 1일 1회 일치하는 위약 캡슐을 복용했습니다. 위약/덱사메타손군의 환자는 28일 주기의 1~28일에 1일 1회 위약 캡슐 1개를 복용했습니다. 두 치료군의 환자는 치료 첫 4주기 동안 28일 주기의 1~4일, 9~12일, 17~20일에 1일 1회 덱사메타손 40mg을 경구 복용했습니다.
덱사메타손 용량은 치료 첫 4주기 후 28일 주기의 1~4일에 1일 1회 덱사메타손 40mg을 경구 복용하는 것으로 줄였습니다. 두 연구 모두에서 치료는 질병이 진행될 때까지 계속되었습니다.
두 연구 모두에서 임상 및 검사 결과에 따라 용량 조절이 허용되었습니다. 독성에 대해 1일 15mg, 1일 10mg, 1일 5mg으로 순차적 용량 감량이 허용되었습니다. [용량 및 투여 방법 (2.1) 참조].
표 16은 두 연구의 기준 환자 및 질병 특성을 요약한 것입니다. 두 연구 모두에서 기준 인구 통계 및 질병 관련 특성은 레날리도마이드/덱사메타손군과 위약/덱사메타손군 간에 유사했습니다.
표 16: 기준 인구 통계 및 질병 관련 특성 – MM 연구 1 및 2
| 연구 1 | 연구 2 | |||
| 레날리도마이드/덱사메타손
N=177 |
위약/덱사메타손
N=176 |
레날리도마이드/덱사메타손
N=176 |
위약/덱사메타손
N=175 |
|
| 환자 특성 | ||||
| 나이(세) | ||||
| 중앙값 | 64 | 62 | 63 | 64 |
| 최소값, 최대값 | 36, 86 | 37, 85 | 33, 84 | 40, 82 |
| 성별 | ||||
| 남성 | 106 (60%) | 104 (59%) | 104 (59%) | 103 (59%) |
| 여성 | 71 (40%) | 72 (41%) | 72 (41%) | 72 (41%) |
| 인종/민족 | ||||
| 백인 | 141(80%) | 148 (84%) | 172 (98%) | 175 (100%) |
| 기타 | 36 (20%) | 28 (16%) | 4 (2%) | 0 (0%) |
| ECOG 수행 상태 | ||||
| 0-1등급 | 157 (89%) | 168 (95%) | 150 (85%) | 144 (82%) |
| 질병 특성 | ||||
| 다발성 골수종 병기(Durie-Salmon) | ||||
| I | 3% | 3% | 6% | 5% |
| II | 32% | 31% | 28% | 33% |
| III | 64% | 66% | 65% | 63% |
| β2-마이크로글로불린(mg/L) | ||||
| ≤ 2.5 mg/L | 52 (29%) | 51 (29%) | 51 (29%) | 48 (27%) |
| > 2.5 mg/L | 125 (71%) | 125 (71%) | 125 (71%) | 127 (73%) |
| 이전 치료 횟수 | ||||
| 1회 | 38% | 38% | 32% | 33% |
| ≥ 2회 | 62% | 62% | 68% | 67% |
| 이전 치료 유형 | ||||
| 줄기 세포 이식 | 62% | 61% | 55% | 54% |
| 탈리도마이드 | 42% | 46% | 30% | 38% |
| 덱사메타손 | 81% | 71% | 66% | 69% |
| 보르테조밉 | 11% | 11% | 5% | 4% |
| 멜팔란 | 33% | 31% | 56% | 52% |
| 독소루비신 | 55% | 51% | 56% | 57% |
두 연구 모두에서 일차 유효성 평가 지표는 질병 진행 시간(TTP)이었습니다. TTP는 무작위 배정부터 질병 진행이 처음 발생할 때까지의 시간으로 정의되었습니다.
두 연구에 대한 사전 계획된 중간 분석 결과 레날리도마이드/덱사메타손 병용 요법이 덱사메타손 단독 요법보다 TTP 측면에서 유의하게 우수한 것으로 나타났습니다. 위약/덱사메타손 그룹의 환자들이 레날리도마이드/덱사메타손 병용 요법으로 치료받을 수 있도록 연구에 대한 블라인딩을 해제했습니다. 두 연구 모두 교차가 있는 연장 추적 관찰 생존 데이터를 분석했습니다. 연구 1에서 레날리도마이드/덱사메타손 그룹의 평균 생존 기간은 39.4개월(95% CI: 32.9, 47.4)이었고 위약/덱사메타손 그룹은 31.6개월(95% CI: 24.1, 40.9)이었으며 위험 비는 0.79(95% CI: 0.61-1.03)였습니다. 연구 2에서 레날리도마이드/덱사메타손 그룹의 평균 생존 기간은 37.5개월(95% CI: 29.9, 46.6)이었고 위약/덱사메타손 그룹은 30.8개월(95% CI: 23.5, 40.3)이었으며 위험 비는 0.86(95% CI: 0.65-1.14)였습니다.
표 17: MM 연구 1 및 연구 2의 TTP 결과
| 연구 1 | 연구 2 | |||
| 레날리도마이드/덱사메타손
N=177 |
위약/덱사메타손
N=176 |
레날리도마이드/덱사메타손
N=176 |
위약/덱사메타손
N=175 |
|
| TTP | ||||
| 이벤트 수 n (%) | 73 (41) | 120 (68) | 68 (39) | 130 (74) |
| 평균 TTP(개월) [95% CI] | 13.9 [9.5, 18.5] | 4.7 [3.7, 4.9] | 12.1 [9.5, NE] | 4.7 [3.8, 4.8] |
| 위험 비 [95% CI] | 0.285 [0.210, 0.386] | 0.324 [0.240, 0.438] | ||
| 로그 순위 검정 p-값 3 | <0.001 | <0.001 | ||
| 반응 | ||||
| 완전 반응(CR) n (%) | 23 (13) | 1 (1) | 27 (15) | 7 (4) |
| 부분 반응(RR/PR) n (%) | 84 (48) | 33 (19) | 77 (44) | 34 (19) |
| 전반적 반응 n (%) | 107 (61) | 34 (19) | 104 (59) | 41 (23) |
| p-값 | <0.001 | <0.001 | ||
| 오즈비 [95% CI] | 6.38 [3.95, 10.32] | 4.72 [2.98, 7.49] | ||
Kaplan-Meier Estimate of Time to Progression – MM Study 1

Kaplan-Meier Estimate of Time to Progression – MM Study 2
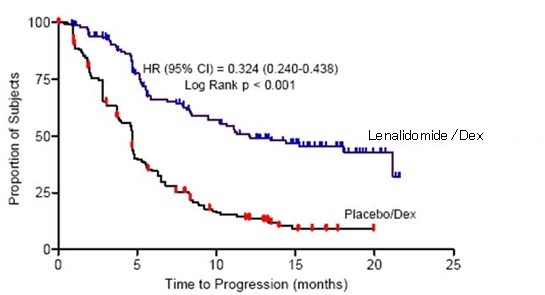
14.2 5q 세포유전학적 이상이 있는 골수이형성증후군(MDS)
레날리도마이드 캡슐의 효능 및 안전성은 단독 또는 추가 세포유전학적 이상이 있는 저위험 또는 중등도-1- 위험 MDS 환자 중 수혈 의존성 빈혈 환자를 대상으로 1일 1회 10mg 또는 28일마다 21일 동안 1일 1회 10mg을 투여하는 공개 라벨, 단일군, 다기관 연구에서 평가되었습니다. 주요 연구는 2가지 투여 요법의 효능을 전향적으로 비교하도록 설계되거나 그렇게 할 만한 검정력을 갖추지 못했습니다. 독성에 대해서는 1일 5mg 및 격일 5mg으로의 순차적 용량 감량과 용량 지연이 허용되었습니다. [2.2 용량 및 투여 참조].
이 주요 연구에는 RBC 수혈 의존성 빈혈 환자 148명이 등록되었습니다. RBC 수혈 의존성은 연구 치료 전 8주 이내에 2단위 이상의 RBC를 투여받은 것으로 정의되었습니다. 이 연구에는 절대 호중구 수(ANC) ≥ 500/mm3, 혈소판 수 ≥ 50,000/mm3, 혈청 크레아티닌 ≤ 2.5mg/dL, 혈청 SGOT/AST 또는 SGPT/ALT ≤ 정상 상한치(ULN)의 3배, 혈청 직접 빌리루빈 ≤ 2mg/dL인 환자가 등록되었습니다. 호중구 감소증 또는 호중구 감소증과 관련된 열이 발생한 환자에게는 과립구 콜로니 자극 인자가 허용되었습니다. 기준 환자 및 질병 관련 특성은 표 18에 요약되어 있습니다.
표 18: MDS 연구의 기준 인구 통계 및 질병 관련 특성
| 전체(N=148) | ||
| 연령(세) | ||
| 중앙값 | 71 | |
| 최소값, 최대값 | 37, 95 | |
| 성별 | n | (%) |
| 남성 | 51 | (34.5) |
| 여성 | 97 | (65.5) |
| 인종 | n | (%) |
| 백인 | 143 | (96.6) |
| 기타 | 5 | (3.4) |
| MDS 기간(년) | ||
| 중앙값 | 2.5 | |
| 최소값, 최대값 | 0.1, 20.7 | |
| Del 5 (q31-33) 세포유전학적 이상 | n | (%) |
| 예 | 148 | (100) |
| 기타 세포유전학적 이상 | 37 | (25.2) |
| IPSS 점수 a | n | (%) |
| 저위험(0) | 55 | (37.2) |
| 중등도-1 (0.5~1.0) | 65 | (43.9) |
| 중등도-2 (1.5~2.0) | 6 | (4.1) |
| 고위험(≥2.5) | 2 | (1.4) |
| 누락 | 20 | (13.5) |
| 중앙 검토에서 FAB 분류b | n | (%) |
| RA | 77 | (52) |
| RARS | 16 | (10.8) |
| RAEB | 30 | (20.3) |
| CMML | 3 | (2) |
a IPSS 위험 범주: 저위험(합산 점수 = 0), 중등도-1(합산 점수 = 0.5~1), 중등도-2(합산 점수 = 1.5~2.0), 고위험(합산 점수 ≥ 2.5); 합산 점수 = (골수 아세포 점수 + 핵형 점수 + 세포감소증 점수)
b MDS의 프랑스-미국-영국(FAB) 분류.
RBC 수혈 비의존성의 빈도는 MDS에 대한 국제 실무 그룹(IWG) 반응 기준에서 수정된 기준을 사용하여 평가되었습니다. RBC 수혈 비의존성은 치료 기간 동안 연속 “롤링” 56일(8주) 동안 RBC 수혈이 없는 것으로 정의되었습니다.
99/148명(67%)의 환자에서 수혈 비의존성이 나타났습니다(95% CI [59, 74]). 99명의 반응자 중 RBC 수혈 비의존성이 처음 선언된 날짜(즉, 56일 RBC 수혈 무료 기간의 마지막 날)부터 56일 수혈 무료 기간 이후 추가 수혈을 받은 날짜까지의 중앙값 기간은 44주였습니다(범위: 0~>67주). 수혈 효과를 달성한 환자의 90%는 연구 3개월 이내에 효과를 보였습니다.
RBC 수혈 비의존성 비율은 연령이나 성별의 영향을 받지 않았습니다.
148명의 환자 중 118명(79.7%)에서 이상 반응으로 인해 레날리도마이드 캡슐의 용량이 감량되거나 중단되었습니다. 첫 번째 용량 감량 또는 중단까지의 중앙값 시간은 21일(평균 35.1일, 범위 2~253일)이었고, 첫 번째 용량 중단 기간의 중앙값은 22일(평균 28.5일, 범위 2~265일)이었습니다. 148명의 환자 중 50명(33.8%)에서 이상 반응으로 인해 두 번째 용량 감량 또는 중단이 필요했습니다. 첫 번째와 두 번째 용량 감량 또는 중단 사이의 중앙값 간격은 51일(평균 59.7일, 범위 15~205일)이었고 두 번째 용량 중단 기간의 중앙값은 21일(평균 26일, 범위 2~148일)이었습니다.
15 참고 문헌
1. OSHA 위험 약물. OSHA [2013년 1월 29일 http://www.osha.gov/SLTC/hazardousdrugs/index.html에서 확인]
17. 환자 상담 정보
환자에게 FDA 승인을 받은 환자 라벨링( 복용 안내)을 읽도록 권고하십시오.
태아 독성
환자에게 레날리도마이드 캡슐은 임신 중에 금기임을 알리십시오. [경고, 금기 (4.1) 참조] 레날리도마이드 캡슐은 탈리도마이드 유사체이며 태아에게 심각한 선천적 기형이나 사망을 유발할 수 있습니다. [경고 및 주의사항 (5.1), 특정 환자군에서의 사용 (8.1) 참조].
- 가임 여성에게 레날리도마이드 캡슐을 복용하는 동안 및 치료 종료 후 최소 4주 동안 임신을 피해야 한다고 알리십시오.
- 임신 검사에서 음성 판정을 받은 후에만 가임 여성에게 레날리도마이드 캡슐 치료를 시작하십시오.
- 가임 여성에게 매달 임신 검사의 중요성과 레날리도마이드 캡슐 치료 중, 복용 중단 중 및 레날리도마이드 캡슐 복용을 완전히 중단한 후 4주 동안 최소 1가지 이상의 매우 효과적인 방법을 포함하여 2가지 피임법을 동시에 사용해야 할 필요성을 알리십시오. 난관 결찰술 이외의 매우 효과적인 피임법에는 자궁 내 장치와 호르몬제(피임약, 주사, 패치 또는 임플란트) 및 파트너의 정관 수술이 있습니다. 효과적인 피임법에는 라텍스 또는 합성 콘돔, 질 가로막 및 자궁경부 캡이 있습니다.
- 환자에게 이 약을 복용하는 동안 임신을 하거나, 생리가 없거나, 비정상적인 질 출혈이 있거나, 피임을 중단했거나, 어떤 이유로든 임신했을 수 있다고 생각되는 경우 즉시 레날리도마이드 캡슐 복용을 중단하고 의료 서비스 제공자에게 연락하도록 지시하십시오.
- 환자에게 의료 서비스 제공자와 연락할 수 없는 경우 REMS 콜센터 1-888-423-5436으로 전화하도록 알리십시오. [경고 및 주의사항 (5.1), 특정 환자군에서의 사용 (8.3) 참조].
- 남성에게 레날리도마이드 캡슐을 복용하는 동안 및 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 가임 여성과 성관계를 할 때는 정관 수술을 받았더라도 항상 라텍스 또는 합성 콘돔을 사용하도록 알리십시오.
- 레날리도마이드 캡슐을 복용하는 남성 환자에게 레날리도마이드 캡슐을 중단한 후 최대 4주 동안 정자를 기증해서는 안 된다고 알리십시오. [경고 및 주의사항 (5.1), 특정 환자군에서의 사용 (8.3) 참조].
- 모든 환자에게 레날리도마이드 캡슐을 복용하는 동안, 복용을 중단하는 동안 및 레날리도마이드 캡슐을 중단한 후 4주 동안 헌혈을 해서는 안 된다고 지시해야 합니다. [경고 및 주의사항 (5.1) 참조].
레날리도마이드 REMS 프로그램
레날리도마이드 캡슐은 태아 독성 위험 때문에 레날리도마이드 REMS 프로그램이라는 제한된 프로그램을 통해서만 구할 수 있습니다. [경고 및 주의사항 (5.2) 참조].
- 환자는 환자-의사 동의서에 서명하고 레날리도마이드 캡슐을 받기 위한 요구 사항을 준수해야 합니다. 특히 가임 여성은 임신 검사, 피임 요구 사항을 준수하고 매월 전화 설문 조사에 참여해야 합니다. 남성은 피임 요구 사항을 준수해야 합니다. [특정 환자군에서의 사용 (8.3) 참조].
- 레날리도마이드 캡슐은 레날리도마이드 REMS 프로그램에서 인증한 약국에서만 구할 수 있습니다. 환자에게 제품을 구하는 방법에 대한 정보를 얻을 수 있는 전화번호와 웹사이트를 제공하십시오.
임신 노출 등록
여성에게 임신 중 레날리도마이드 캡슐에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록이 있으며 1-888-423-5436으로 전화하여 임신 노출 등록에 연락할 수 있음을 알리십시오. [특정 환자군에서의 사용 (8.1) 참조].
혈액학적 독성
환자에게 레날리도마이드 캡슐이 심각한 호중구 감소증 및 혈소판 감소증과 관련이 있음을 알리십시오. [경고, 경고 및 주의사항 (5.3) 참조].
정맥 및 동맥 혈전색전증
환자에게 DVT, PE, MI 및 뇌졸중을 포함한 혈전증의 위험을 알리고 이러한 사건을 암시하는 징후와 증상이 나타나면 즉시 보고하여 평가를 받도록 하십시오. [경고, 경고 및 주의사항 (5.4) 참조].
CLL 환자의 사망률 증가
환자에게 레날리도마이드 캡슐이 CLL 환자의 사망률을 증가시켰으며 심방 세동, 심근 경색 및 심부전을 포함한 심각한 심혈관계 이상 반응을 일으켰음을 알리십시오. [경고 및 주의사항 (5.5) 참조].
두 번째 원발성 악성 종양
환자에게 레날리도마이드 캡슐 치료 중 두 번째 원발성 악성 종양이 발생할 가능성이 있음을 알리십시오. [경고 및 주의사항 (5.6) 참조].
간독성
환자에게 간부전 및 사망을 포함한 간독성의 위험을 알리고 이러한 사건과 관련된 징후와 증상이 나타나면 의료 서비스 제공자에게 보고하여 평가를 받도록 하십시오. [경고 및 주의사항 (5.8) 참조].
심각한 피부 반응
환자에게 SJS, TEN, DRESS와 같은 심각한 피부 반응의 위험을 알리고 이러한 반응과 관련된 징후와 증상이 나타나면 의료 서비스 제공자에게 보고하여 평가를 받도록 하십시오. 탈리도마이드 치료와 관련하여 4등급 발진 병력이 있는 환자는 레날리도마이드 캡슐을 투여해서는 안 됩니다. [경고 및 주의사항 (5.9) 참조].
종양 용해 증후군
환자에게 종양 용해 증후군의 잠재적 위험에 대해 알리고 이러한 사례와 관련된 징후 및 증상이 나타나면 평가를 위해 의료 서비스 제공자에게 보고하도록 하십시오. [경고 및 주의사항 (5.10) 참조].
종양 플레어 반응
환자에게 종양 플레어 반응의 잠재적 위험에 대해 알리고 이러한 사례와 관련된 징후 및 증상이 나타나면 평가를 위해 의료 서비스 제공자에게 보고하도록 하십시오. [경고 및 주의사항 (5.11) 참조].
과민증
환자에게 레날리도마이드 캡슐에 대한 혈관 부종 및 아나필락시스와 같은 심각한 과민 반응의 가능성에 대해 알리십시오. 이러한 반응의 징후와 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 환자에게 지시하십시오. 심각한 과민 반응의 징후 또는 증상이 나타나면 응급 치료를 받도록 환자에게 조언하십시오. [경고 및 주의사항 (5.15) 참조].
복용 지침
환자에게 레날리도마이드 캡슐 복용 방법을 알리십시오. [용량 및 투여 (2) 참조]
- 레날리도마이드 캡슐은 매일 거의 같은 시간에 한 번 복용해야 합니다.
- 레날리도마이드 캡슐은 음식과 함께 또는 음식 없이 복용할 수 있습니다.
- 캡슐을 열거나 쪼개거나 씹어서는 안 됩니다. 레날리도마이드 캡슐은 물과 함께 통째로 삼켜야 합니다.
- 환자가 레날리도마이드 캡슐 복용을 잊은 경우 일반적으로 복용하는 시간으로부터 최대 12시간 이내에는 여전히 복용할 수 있음을 알리십시오. 12시간 이상 경과한 경우 해당 날짜의 복용량은 건너뛰도록 지시해야 합니다. 다음 날에는 평소 시간에 레날리도마이드 캡슐을 복용해야 합니다. 놓친 복용량을 보충하기 위해 2회 복용하지 않도록 환자에게 경고하십시오.
SPL 미분류 섹션
제조원:
Lotus Pharmaceutical Co., Ltd.
Nantou City, Nantou County
54066 Taiwan
OR
제조원:
Haupt Pharma Amareg GmbH
Regensburg, Bavaria D-93055,
Germany
유통:
Alvogen, Inc.
Morristown, NJ 07960 USA
인도에서 제조
PI483-00
Rev. 11/2023
복용 안내
| This Medication Guide has been approved by the U.S. Food and Drug Administration. Revised: November 2023 PL483-00 |
|||
| 복용 안내 레날리도마이드 (len” a lid’ oh mide) 캡슐 |
|||
| 레날리도마이드 캡슐에 대해 알아야 할 가장 중요한 정보는 무엇입니까? 레날리도마이드 캡슐 복용을 시작하기 전에 레날리도마이드 REMS 프로그램의 모든 지침을 읽고 동의해야 합니다. 의료 서비스 제공자는 레날리도마이드 캡슐을 처방하기 전에 레날리도마이드 REMS 프로그램에 대해 설명하고 환자-의사 동의서에 서명하도록 할 것입니다. 레날리도마이드 캡슐은 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
레날리도마이드 캡슐은 다음과 같은 성인 환자를 치료하는 데 사용되는 처방약입니다.
- 다발성 골수종(MM)
- 덱사메타손 약물과 병용
- 골수이형성증후군(MDS)이라는 질환. 레날리도마이드 캡슐은 5번 염색체의 일부가 없는 염색체 문제가 있는 유형의 MDS에 사용됩니다. 이러한 유형의 MDS를 결손 5q MDS라고 합니다. 이러한 유형의 MDS 환자는 적혈구 수치가 낮아 수혈 치료가 필요할 수 있습니다.
레날리도마이드 캡슐은 통제된 임상 시험에 참여하는 경우를 제외하고 만성 림프구성 백혈병(CLL) 환자를 치료하는 데 사용해서는 안 됩니다.
레날리도마이드 캡슐이 소아 환자에게 안전하고 효과적인지는 알려져 있지 않습니다.
다음과 같은 경우 레날리도마이드 캡슐을 복용하지 마십시오.
- 임신 중이거나, 임신을 계획 중이거나, 레날리도마이드 캡슐 치료 중 임신하게 된 경우. “레날리도마이드 캡슐에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
- 레날리도마이드 또는 레날리도마이드 캡슐의 성분에 알레르기가 있는 경우. 레날리도마이드 캡슐의 전체 성분 목록은 이 약물 가이드의 끝부분을 참조하십시오.
레날리도마이드 캡슐을 복용하기 전에 다음을 포함한 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
- 간 문제가 있는 경우
- 신장 문제가 있거나 신장 투석 치료를 받는 경우
- 갑상선 문제가 있는 경우
- 탈리도마이드 치료로 심각한 피부 발진이 발생한 적이 있는 경우. 레날리도마이드 캡슐을 복용해서는 안 됩니다.
- 유당 불내증이 있는 경우. 레날리도마이드 캡슐에는 유당이 포함되어 있습니다.
- 모유 수유 중인 경우. 레날리도마이드 캡슐 치료 중에는 모유 수유를 하지 마십시오. 레날리도마이드가 모유로 분비되어 아기에게 해를 끼칠 수 있는지는 알려져 있지 않습니다.
처방약과 일반 의약품, 비타민, 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. 레날리도마이드 캡슐과 다른 약물이 서로 영향을 미쳐 심각한 부작용을 일으킬 수 있습니다. 새로운 약을 복용하기 전에 의료 서비스 제공자와 상담하십시오.
복용하는 약의 이름을 알아두십시오. 의료 서비스 제공자와 약사에게 보여주기 위해 복용하는 약 목록을 보관하십시오.
- 레날리도마이드 캡슐은 처방된 대로 정확하게 복용하고 Lenalidomide REMS 프로그램의 모든 지침을 따르십시오.
- 레날리도마이드 캡슐은 하루에 한 번 물과 함께 통째로 삼키십시오. 캡슐을 열거나, 쪼개거나, 씹지 마십시오.
- 레날리도마이드 캡슐은 음식과 함께 복용하거나 음식 없이 복용할 수 있습니다.
- 레날리도마이드 캡슐은 매일 거의 같은 시간에 복용하십시오.
- 레날리도마이드 캡슐을 열거나 쪼개거나 필요 이상으로 만지지 마십시오.
- 레날리도마이드 캡슐의 가루가 피부에 닿으면 즉시 비누와 물로 피부를 씻으십시오.
- 레날리도마이드 캡슐의 가루가 눈, 코 또는 입 안쪽에 닿으면 물로 잘 헹구십시오.
- 레날리도마이드 캡슐을 잊었고 정기적으로 복용하는 시간으로부터 12시간이 지나지 않았다면 기억나는 대로 즉시 복용하십시오. 12시간 이상 지났다면 잊어버린 용량은 건너뛰십시오. 같은 시간에 2회 복용하지 마십시오.
- 레날리도마이드 캡슐을 너무 많이 복용했다면 즉시 의료 서비스 제공자에게 연락하십시오.
- “레날리도마이드 캡슐에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
- 여성: 레날리도마이드 캡슐을 복용하는 동안 임신해서는 안 되며 모유 수유를 해서는 안 됩니다.
- 남성: 레날리도마이드 캡슐을 복용하는 동안, 치료를 중단(중단)하는 동안, 그리고 레날리도마이드 캡슐 복용을 중단한 후 최대 4주 동안은 정자를 기증하지 마십시오.
- 레날리도마이드 캡슐을 다른 사람과 공유하지 마십시오. 선천적 결손증 및 기타 심각한 문제를 일으킬 수 있습니다.
- 레날리도마이드 캡슐을 복용하는 동안, 치료를 중단(중단)하는 동안, 그리고 레날리도마이드 캡슐 복용을 중단한 후 4주 동안은 헌혈하지 마십시오. 임신한 사람이 귀하의 헌혈된 혈액을 수혈받는 경우, 태아가 레날리도마이드 캡슐에 노출되어 선천적 결손증을 가지고 태어날 수 있습니다.
레날리도마이드 캡슐은 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
- “레날리도마이드 캡슐에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
- 만성 림프구성 백혈병(CLL) 환자의 사망 위험 증가. 레날리도마이드 캡슐을 복용하는 CLL 환자는 chlorambucil 약물을 복용하는 환자에 비해 사망 위험이 증가합니다. 레날리도마이드 캡슐은 심방세동, 심장마비 또는 심부전을 포함하여 사망에 이를 수 있는 심각한 심장 문제를 일으킬 수 있습니다. 통제된 임상 시험에 참여하는 경우를 제외하고 CLL이 있는 경우 레날리도마이드 캡슐을 복용해서는 안 됩니다.
- 새로운 암(악성 종양)의 위험. 레날리도마이드 캡슐과 melphalan을 투여받았거나 조혈모세포 이식을 받은 환자에서 급성 골수성 백혈병(AML) 및 골수이형성증후군(MDS)과 같은 특정 혈액암과 피부 및 기타 기관의 특정 유형의 암을 포함한 새로운 (두 번째) 암의 발생이 증가했습니다. 레날리도마이드 캡슐을 복용하는 경우 새로운 암 발생 위험에 대해 의료 서비스 제공자와 상담하십시오. 의료 서비스 제공자는 레날리도마이드 캡슐 치료 중 새로운 암이 있는지 확인할 것입니다.
- 간부전 및 사망을 포함한 심각한 간 문제. 의료 서비스 제공자는 레날리도마이드 캡슐 치료 중 혈액 검사를 통해 간 기능을 확인해야 합니다. 다음과 같은 간 문제 증상이 나타나면 즉시 의료 서비스 제공자에게 알리십시오.
- 피부나 눈의 흰자위가 노랗게 변하는 경우(황달)
- 진하거나 갈색(홍차색) 소변
- 오른쪽 상복부 통증
- 평소보다 쉽게 출혈하거나 멍이 드는 경우
- 심한 피로감
- 심각한 피부 반응 및 심각한 알레르기 반응은 레날리도마이드 캡슐과 함께 발생할 수 있으며 사망에 이를 수 있습니다.
- 레날리도마이드 캡슐 치료 중 다음과 같은 징후나 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하십시오.
- 붉고 가려운 피부 발진
- 피부가 벗겨지거나 물집이 생기는 경우
- 심한 가려움증
- 열
- 레날리도마이드 캡슐 치료 중 다음과 같은 징후나 증상이 나타나면 즉시 응급 치료를 받으십시오.
- 입술, 입, 혀 또는 목이 붓는 경우
- 호흡 곤란 또는 삼키기 어려움
- 피부에 붉게 튀어나온 부분(두드러기)
- 매우 빠른 심장 박동
- 어지럽거나 실신할 것 같은 느낌
- 종양 용해 증후군(TLS). TLS는 암세포가 빠르게 분해되어 발생합니다. TLS는 신부전 및 투석 치료, 비정상적인 심장 박동, 발작, 때로는 사망을 유발할 수 있습니다. 의료 서비스 제공자는 TLS 검사를 위해 혈액 검사를 수행할 수 있습니다.
- 종양 악화(종양 플레어 반응)는 레날리도마이드 캡슐과 함께 발생할 수 있으며 사망에 이를 수 있습니다. 레날리도마이드 캡슐 치료 중 만지면 아픈 림프절 부종, 미열, 통증 또는 발진과 같은 종양 플레어 반응 증상이 나타나면 의료 서비스 제공자에게 알리십시오.
레날리도마이드 캡슐 치료 중 특정 심각한 부작용이 발생하면 의료 서비스 제공자가 복용량을 줄이거나, 일시적으로 중단하거나, 레날리도마이드 캡슐 복용을 영구적으로 중단하라고 지시할 수 있습니다.
- 갑상선 문제. 의료 서비스 제공자는 레날리도마이드 캡슐 복용을 시작하기 전과 레날리도마이드 캡슐 치료 중에 갑상선 기능을 검사할 수 있습니다.
레날리도마이드 캡슐의 가장 흔한 부작용은 다음과 같습니다.
- 설사
- 발진
- 메스꺼움
- 변비
- 피로 또는 쇠약
- 열
- 가려움증
- 팔, 손, 다리, 발, 피부 부종
- 수면 장애(불면증)
- 두통
- 근육 경련 또는 연축
- 호흡 곤란
- 기침, 인후통 및 기타 감기 증상
- 상기도 감염 또는 기관지염
- 위장염(“장염”)
- 코피
- 흔들림 또는 떨림(떨림)
- 관절통
- 등 또는 복부 통증
부작용에 대한 의학적 조언은 의사에게 문의하십시오. 1-800-FDA-1088로 FDA에 부작용을 보고할 수 있습니다.
- 레날리도마이드 캡슐은 실온(섭씨 20~25도/화씨 68~77도)에서 보관하십시오.
- 사용하지 않은 레날리도마이드 캡슐은 Alvogen, Inc. 또는 의료 서비스 제공자에게 반환하십시오.
레날리도마이드 캡슐과 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
의약품은 때때로 의약품 가이드에 나열된 것 이외의 목적으로 처방되기도 합니다. 처방되지 않은 질환에 레날리도마이드 캡슐을 복용하지 마십시오. 다른 사람에게 레날리도마이드 캡슐을 주지 마십시오. 같은 증상이 있더라도 해로울 수 있으며 선천적 기형을 유발할 수 있습니다.
자세한 내용은 의료 서비스 제공자에게 문의하십시오. 의료 전문가를 위해 작성된 레날리도마이드 캡슐에 대한 정보는 의료 서비스 제공자 또는 약사에게 문의할 수 있습니다.
활성 성분: 레날리도마이드
비활성 성분: 크로스카멜로스 나트륨, 무수 락토스, 스테아르산 마그네슘 및 미결정 셀룰로스.
2.5mg 캡슐 껍질에는 젤라틴, 적색 산화철, 황색 산화철, 이산화티타늄, FD&C 블루 #1, FD&C 레드 #3, FD&C 레드 #40 및 검은색 잉크가 포함되어 있습니다.
5mg 캡슐 껍질에는 젤라틴, 이산화티타늄, 흑색 산화철, 적색 산화철, 황색 산화철, FD&C 블루 #1, FD&C 옐로우 #6 및 검은색 잉크가 포함되어 있습니다.
10mg 캡슐 껍질에는 젤라틴, 이산화티타늄, FD&C 블루 #1, FD&C 레드 #40, FD&C 옐로우 #6, FD&C 옐로우 #5 및 검은색 잉크가 포함되어 있습니다.
15mg 캡슐 껍질에는 젤라틴, 이산화티타늄, FD&C 블루 #1, FD&C 레드 #40, FD&C 옐로우 #5, 흑색 산화철, 적색 산화철, 황색 산화철 및 검은색 잉크가 포함되어 있습니다.
20mg 캡슐 껍질에는 젤라틴, 이산화티타늄, FD&C 블루 #1, FD&C 레드 #40, 적색 산화철, 황색 산화철 및 검은색 잉크가 포함되어 있습니다.
25mg 캡슐 껍질에는 젤라틴, 이산화티타늄 및 검은색 잉크가 포함되어 있습니다.
검은색 인쇄 잉크에는 셸락, 강암모니아 용액, 흑색 산화철이 포함되어 있습니다.
제조원: Lotus Pharmaceutical Co., Ltd., Nantou City, Nantou County 54066 Taiwan
또는
제조원: Haupt Pharma Amareg GmbH, Regensburg, Bavaria D-93055, Germany
유통: Alvogen, Inc., Morristown, NJ 07960 USA
인도 제품
자세한 내용은 Alvogen, Inc.(1-866-770-3024)에 문의하거나 www.lenalidomiderems.com을 방문하십시오.
포장 라벨 주 표시면
NDC 47781-483-28
Lenalidomide Capsules
2.5 mg
주의 약사: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형 유발 가능성
Rx only 28 Capsules

포장 라벨 주 표시면
NDC 47781-484-28
Lenalidomide Capsules
5 mg
주의 약사: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형을 유발할 수 있음
Rx only 28 Capsules

포장 라벨 주 표시면
NDC 47781-485-28
Lenalidomide Capsules
10 mg
주의 약사: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형 유발 가능성
Rx only 28 Capsules

포장 라벨 주 표시면
NDC 47781-486-77
Lenalidomide Capsules
15 mg
주의 약사: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형 유발 가능성
Rx only 21 Capsules

포장 라벨 주 표시면
NDC 47781-487-77
Lenalidomide Capsules
20 mg
주의 약사: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형 유발 가능성
Rx only 21 Capsules

포장 라벨 주 표시면
NDC 47781-488-77
레날리도마이드 캡슐
25 mg
약사 주의: 각 환자에게 동봉된 복약 안내서를 제공하십시오.
경고: 선천적 기형 유발 가능성
Rx only 21 캡슐


