의약품 제조업체: Mylan Pharmaceuticals Inc. (Updated: 2024-07-26)
처방 정보의 주요 내용
SORAFENIB tablets, for oral use
Initial U.S. Approval: 2005
적응증 및 용법 (INDICATIONS AND USAGE)
용량 및 투여 (DOSAGE AND ADMINISTRATION)
- •
- 권장 용량은 음식 없이 1일 2회 400mg 경구 투여입니다. (2.1)
제형 및 함량 (DOSAGE FORMS AND STRENGTHS)
정제: 200 mg (3)
금기 (CONTRAINDICATIONS)
경고 및 주의사항 (WARNINGS AND PRECAUTIONS)
- •
- 심혈관계 이상반응: Sorafenib tablets의 일시적 또는 영구적 중단을 고려하십시오. (2.2, 5.1)
- •
- 출혈: 필요한 경우 sorafenib tablets를 중단하십시오. (5.2)
- •
- 고혈압: 처음 6주 동안 매주 혈압을 모니터링하고 그 이후에는 주기적으로 모니터링하십시오. 항고혈압제 치료에도 불구하고 중증 또는 지속적인 고혈압의 경우 일시적 또는 영구적 중단을 고려하십시오. (5.3)
- •
- 피부 독성: 투여를 중단 및/또는 감량하십시오. 중증 또는 지속적인 반응이 나타나거나 Stevens-Johnson 증후군 및 독성 표피 괴사융해가 의심되는 경우 중단하십시오. (5.4)
- •
- 위장관 천공: Sorafenib tablets를 중단하십시오. (5.5)
- •
- 상처 치유 장애 위험: 선택적 수술 최소 10일 전에 sorafenib tablets 투여를 중단하십시오. 대수술 후 최소 2주 동안 그리고 상처가 적절히 치유될 때까지 투여하지 마십시오. 상처 치유 합병증 해결 후 sorafenib tablets 재투여의 안전성은 확립되지 않았습니다. (5.7)
- •
- QT 연장: 심실 부정맥 위험이 증가한 환자에서 심전도 및 전해질을 모니터링하십시오. 전해질을 교정하십시오. QTc 간격이 500msec를 초과하거나 기준치에서 60msec 이상 증가하는 경우 투여를 중단하십시오. (2.2, 5.9, 12.2)
- •
- 약물 유발 간 손상: 간 기능 검사를 정기적으로 모니터링하십시오. 설명할 수 없는 트랜스아미나제 상승의 경우 투여를 중단하십시오. (5.10)
- •
- 배아-태아 독성: Sorafenib는 태아에게 해를 끼칠 수 있습니다. 환자에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임법을 사용하도록 조언하십시오. (5.11, 8.1, 8.3)
- •
- DTC에서 갑상선 자극 호르몬 억제(TSH) 장애: 갑상선암 환자에서 TSH를 매달 모니터링하고 갑상선 대체 요법을 조정하십시오. (5.12)
이상반응 (ADVERSE REACTIONS)
가장 흔한 이상반응(≥ 20%)은 설사, 피로, 감염, 탈모, 손발 피부 반응, 발진, 체중 감소, 식욕 감퇴, 메스꺼움, 위장 및 복통, 고혈압 및 출혈입니다. (6)
의심되는 이상반응을 보고하려면 Mylan(1-877-446-3679 (1-877-4-INFO-RX)) 또는 FDA(1-800-FDA-1088 또는 www.fda.gov/medwatch)에 문의하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정: 7/2024
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법(INDICATIONS AND USAGE)
1.1 간세포암종(Hepatocellular Carcinoma)
1.2 신세포암종(Renal Cell Carcinoma)
1.3 분화 갑상선암(Differentiated Thyroid Carcinoma)
2 용량 및 투여(DOSAGE AND ADMINISTRATION)
2.1 권장 용량(Recommended Dosage)
2.2 이상반응에 대한 용량 조정(Dosage Modifications for Adverse Reactions)
3 제형 및 함량(DOSAGE FORMS AND STRENGTHS)
4 금기(CONTRAINDICATIONS)
5 경고 및 주의사항(WARNINGS AND PRECAUTIONS)
5.1 심혈관계 사건(Cardiovascular Events)
5.2 출혈(Hemorrhage)
5.3 고혈압(Hypertension)
5.4 피부 독성(Dermatologic Toxicities)
5.5 위장관 천공(Gastrointestinal Perforation)
5.6 와파린 병용 투여 시 출혈 위험 증가(Increased Risk of Bleeding with Concomitant Use of Warfarin)
5.7 상처 치유 장애 위험(Risk of Impaired Wound Healing)
5.8 편평상피세포 폐암에서 카보플라틴/파클리탁셀 및 젬시타빈/시스플라틴과 병용 투여된 소라페닙에서 관찰된 사망률 증가(Increased Mortality Observed with Sorafenib Administered in Combination with Carboplatin/Paclitaxel and Gemcitabine/Cisplatin in Squamous Cell Lung Cancer)
5.9 QT 간격 연장(QT Interval Prolongation)
5.10 약물 유발 간 손상(Drug-Induced Liver Injury)
5.11 배아-태아 독성(Embryo-Fetal Toxicity)
5.12 분화 갑상선암에서 갑상선 자극 호르몬 억제 장애(Impairment of Thyroid Stimulating Hormone Suppression in Differentiated Thyroid Carcinoma)
6 이상반응(ADVERSE REACTIONS)
6.1 임상시험 경험(Clinical Trials Experience)
6.2 시판 후 경험(Postmarketing Experience)
7 약물 상호작용(DRUG INTERACTIONS)
7.1 다른 약물이 소라페닙에 미치는 영향(Effect of Other Drugs on Sorafenib)
7.2 와파린 병용 투여(Concomitant Use of Warfarin)
7.3 QT 간격을 연장하는 약물(Drugs That Prolong the QT Interval)
8 특정 집단에서의 사용(USE IN SPECIFIC POPULATIONS)
8.1 임신(Pregnancy)
8.2 수유(Lactation)
8.3 가임기 여성 및 남성(Females and Males of Reproductive Potential)
8.4 소아에서의 사용(Pediatric Use)
8.5 노인에서의 사용(Geriatric Use)
8.6 신장애(Renal Impairment)
8.7 간장애(Hepatic Impairment)
10 과다 복용(OVERDOSAGE)
11 설명(DESCRIPTION)
12 임상 약리학(CLINICAL PHARMACOLOGY)
12.1 작용 기전(Mechanism of Action)
12.2 약력학(Pharmacodynamics)
12.3 약동학(Pharmacokinetics)
13 비임상 독성학(NONCLINICAL TOXICOLOGY)
13.1 발암성, 돌연변이 유발성, 생식능력 장애(Carcinogenesis, Mutagenesis, Impairment of Fertility)
14 임상 연구(CLINICAL STUDIES)
14.1 간세포암종(Hepatocellular Carcinoma)
14.2 신세포암종(Renal Cell Carcinoma)
14.3 분화 갑상선암(Differentiated Thyroid Carcinoma)
16 공급/보관 및 취급 방법(HOW SUPPLIED/STORAGE AND HANDLING)
17 환자 상담 정보(PATIENT COUNSELING INFORMATION)
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.(Sections or subsections omitted from the full prescribing information are not listed.)
1 적응증 및 용법
2 투여 및 관리
2.1 권장 용량
소라페닙 정제의 권장 용량은 환자가 치료로부터 임상적으로 더 이상 이익을 얻지 못하거나 용납할 수 없는 독성이 나타날 때까지 식사와 관계없이 (식사 1시간 전 또는 2시간 후) 하루 2회 경구로 400mg입니다.
2.2 유해 반응에 대한 용량 조절
권장 용량 조절
유해 반응에 대한 권장 용량 조절은 표 1, 2 및 3에 나와 있습니다.
|
용량 감소 |
간세포암 및 신세포암 |
분화된 갑상선암 |
|
첫 번째 용량 감소 |
하루 1회 경구로 400mg |
약 12시간 간격으로 아침에 경구로 400mg, 저녁에 경구로 200mg 또는 약 12시간 간격으로 아침에 경구로 200mg, 저녁에 경구로 400mg |
|
두 번째 용량 감소 |
하루 1회 경구로 200mg 또는 격일로 400mg |
하루 2회 경구로 200mg |
|
세 번째 용량 감소 |
없음 |
하루 1회 경구로 200mg |
|
||||||
|
부작용 |
심각도* |
소라페닙 정제 용량 조절 |
||||
|
심혈관계 사건 [경고 및 주의 사항 (5.1) 참조] |
||||||
|
심근 허혈 및/또는 심근 경색 |
2등급 이상 |
영구적으로 중단합니다. |
||||
|
울혈성 심부전 |
3등급 |
|||||
|
4등급 |
영구적으로 중단합니다. |
|||||
|
출혈 [경고 및 주의 사항 (5.2) 참조] |
의학적 개입이 필요한 2등급 이상 |
영구적으로 중단합니다. |
||||
|
고혈압 [경고 및 주의 사항 (5.3) 참조] |
2등급(증상/지속적) 또는 이전에 정상 범위 내에 있었던 경우 20mmHg(이완기) 이상 또는 140/90mmHg 이상 증가하는 증상성 2등급 증가 또는 3등급 |
증상이 해소되고 이완기 혈압이 90mmHg 미만이 될 때까지 중단하고, 1단계 감소된 용량으로 재개합니다.‡
필요한 경우, 용량을 1단계 더 감소시킵니다.‡ |
||||
|
4등급 |
영구적으로 중단합니다. |
|||||
|
위장관 천공 [경고 및 주의 사항 (5.5) 참조] |
모든 등급 |
영구적으로 중단합니다. |
||||
|
QT 간격 연장 [경고 및 주의 사항 (5.9) 참조] |
500밀리초 초과 또는 기준선에서 60밀리초 이상 증가 |
중단하고 전해질 이상(마그네슘, 칼륨, 칼슘)을 교정합니다. 재개하기 전에 의학적 판단을 사용합니다. |
||||
|
약물 유발 간 손상 [경고 및 주의 사항 (5.10) 참조] |
다른 원인이 없는 경우 3등급 ALT 이상§ 또는 다른 원인이 없는 경우 AST/ALT가 상한선 정상치(ULN)의 3배 이상이고 빌리루빈이 ULN의 2배 이상 |
영구적으로 중단합니다. |
||||
|
비혈액학적 독성 [부작용 (6.1) 참조] |
2등급 |
1단계 감소된 용량으로 치료를 계속합니다. |
||||
|
피부 독성 등급 |
발생 횟수 |
소라페닙 정제 용량 조절 |
|
|
간세포암 및 신세포암 |
분화된 갑상선암 |
||
|
등급 2: 손이나 발의 통증성 홍반 및 부종, 또는 환자의 일상 활동에 영향을 미치는 불편함 |
1st 발생 |
소라페닙 정제를 계속 투여하고 증상 완화를 위해 국소 치료를 고려하십시오. 7일 이내에 호전되지 않으면 아래를 참조하십시오. |
소라페닙 정제를 하루 600mg으로 감량하십시오. 7일 이내에 호전되지 않으면 아래를 참조하십시오. |
|
감량 후 7일 이내에 호전되지 않음 또는 2nd 및 3rd 발생 |
등급 0~1로 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
등급 1로 완전히 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
|
|
치료를 재개할 때, 용량을 1단계 감량하십시오. |
치료를 재개할 때, 2nd 발생의 경우 용량을 1단계 감량하고 3rd 발생의 경우 용량을 2단계 감량하십시오. |
||
|
4th 발생 |
소라페닙 정제 치료를 중단하십시오. |
||
|
등급 3: 손이나 발의 습윤성 박탈, 궤양, 수포 또는 심한 통증으로 인해 작업이나 일상 생활 수행이 불가능한 경우 |
1st 발생 |
등급 0~1로 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
등급 1로 완전히 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
|
치료를 재개할 때, 용량을 1단계 감량하십시오. |
치료를 재개할 때, 용량을 1단계 감량하십시오. |
||
|
2nd 발생 |
등급 0~1로 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
등급 1로 완전히 호전되거나 해결될 때까지 소라페닙 정제 투여를 중단하십시오. |
|
|
치료를 재개할 때, 용량을 1단계 감량하십시오. |
치료를 재개할 때, 용량을 2단계 감량하십시오. |
||
|
3rd 발생 |
소라페닙 정제 치료를 중단하십시오. |
||
감량된 소라페닙 정제 용량으로 최소 28일 동안 등급 2 또는 3 피부 독성이 등급 0 또는 1로 호전된 후에는 소라페닙 정제 용량을 감량된 용량에서 1단계 증량할 수 있습니다. 피부 독성으로 인해 용량 감량이 필요한 환자의 약 50%는 이러한 기준을 충족하여 더 높은 용량을 재개할 것으로 예상되며, 이전 용량을 재개한 환자의 약 50%는 더 높은 용량을 견딜 것으로 예상됩니다(즉, 재발성 등급 2 이상의 피부 독성 없이 더 높은 용량 수준을 유지할 것으로 예상됩니다).
3 제형 및 함량
Sorafenib Tablets, USP는 200mg 소라페닙 (소라페닙 토실레이트, USP 274mg에 해당)을 함유하고 있습니다.
- •
- 200mg 정제는 복숭아색 필름 코팅, 원형, 무절개 정제로 한쪽 면에는 200이, 반대쪽 면에는 NAT가 각인되어 있습니다.
4 금기사항
- •
- 소라페닙 정제는 소라페닙 또는 소라페닙 정제의 다른 성분에 대한 중증 과민반응이 있는 환자에게 금기입니다.
- •
- 카보플라틴 및 팍리탁셀과 병용한 소라페닙 정제는 편평상피세포 폐암 환자에게 금기입니다 [경고 및 주의 사항 (5.8) 참조].
5 경고 및 주의사항
5.1 심혈관계 사건
SHARP (HCC) 연구에서 소라페닙 치료 환자의 심근 허혈/심근 경색 발생률은 위약군 1.3%에 비해 2.7%였습니다. TARGET (RCC) 연구에서 심근 허혈/심근 경색 발생률은 위약군 0.4%에 비해 소라페닙 치료군에서 더 높았습니다(2.9%). DECISION (DTC) 연구에서 심근 허혈/심근 경색 발생률은 위약군 0%에 비해 소라페닙 치료군에서 1.9%였습니다. 불안정 협심증 또는 최근 심근 경색 환자는 이 연구에서 제외되었습니다. 여러 임상 시험에서 소라페닙 치료 환자(N = 2276)의 1.9%에서 울혈성 심부전이 보고되었습니다. [유해 반응 (6.2) 참조]
심혈관계 사건이 발생한 환자의 경우 소라페닙을 일시적으로 또는 영구적으로 중단하는 것을 고려하십시오. [투여 및 관리 (2.2) 참조]
5.2 출혈
소라페닙 투여 후 출혈 위험이 증가할 수 있습니다. SHARP (HCC) 연구에서 소라페닙 치료 환자와 위약군에서 식도 정맥류 출혈(2.4% 및 4%) 및 모든 부위에서 치명적인 결과를 초래하는 출혈(2.4% 및 4%) 비율은 유사했습니다. TARGET (RCC) 연구에서 소라페닙 치료군 환자의 15.3%와 위약군 환자의 8.2%에서 출혈이 보고되었습니다. 소라페닙 치료 환자의 3등급 및 4등급 출혈 발생률은 각각 2% 및 0%였으며, 위약군 환자의 경우 각각 1.3% 및 0.2%였습니다. TARGET (RCC) 연구에서 각 치료군에서 치명적인 출혈이 1건 발생했습니다. DECISION (DTC) 연구에서 소라페닙 치료 환자의 17.4%와 위약군 환자의 9.6%에서 출혈이 보고되었지만, 소라페닙 치료 환자와 위약군 환자의 3등급 출혈 발생률은 유사했습니다(1% 및 1.4%).
출혈로 인해 의학적 개입이 필요한 경우 소라페닙을 영구적으로 중단하는 것을 고려하십시오. [투여 및 관리 (2.2) 참조] 출혈 위험이 있으므로 DTC 환자의 경우 소라페닙 정제를 투여하기 전에 국소 치료로 기관, 기관지 및 식도 침윤을 치료하십시오.
5.3 고혈압
SHARP (HCC) 연구에서 소라페닙 치료 환자의 9.4%와 위약군 환자의 4.3%에서 고혈압이 보고되었습니다. TARGET (RCC) 연구에서 소라페닙 치료 환자의 16.9%와 위약군 환자의 1.8%에서 고혈압이 보고되었습니다. DECISION (DTC) 연구에서 소라페닙 치료 환자의 40.6%와 위약군 환자의 12.4%에서 고혈압이 보고되었습니다. 고혈압은 일반적으로 경증에서 중등도였으며, 치료 초기에 발생했으며, 표준 고혈압 치료로 관리되었습니다. SHARP (HCC) 연구에서 소라페닙 치료 환자 297명 중 1명, TARGET (RCC) 연구에서 소라페닙 치료 환자 451명 중 1명, DECISION (DTC) 연구에서 소라페닙 치료 환자 207명 중 1명에서 고혈압으로 인해 영구적으로 중단되었습니다.
소라페닙 치료 첫 6주 동안 매주 혈압을 모니터링하십시오. 그 후 표준 의료 관행에 따라 혈압을 모니터링하고 필요한 경우 고혈압을 치료하십시오. 고혈압 치료를 시작했음에도 불구하고 심각하거나 지속적인 고혈압이 발생하는 경우 소라페닙 정제를 일시적으로 또는 영구적으로 중단하는 것을 고려하십시오. [투여 및 관리 (2.2) 참조]
5.4 피부 독성
손발 피부 반응과 발진은 소라페닙으로 인한 가장 흔한 유해 반응입니다. 발진과 손발 피부 반응은 일반적으로 1등급과 2등급이며, 일반적으로 소라페닙 치료 첫 6주 동안 나타납니다. 손발 피부 반응으로 인해 HCC 환자의 소라페닙 치료 환자 297명 중 4명(1.3%), RCC 환자의 소라페닙 치료 환자 451명 중 3명(0.7%), DTC 환자의 소라페닙 치료 환자 207명 중 11명(5.3%)에서 치료를 영구적으로 중단했습니다.
피부 독성의 관리에는 증상 완화를 위한 국소 치료, 소라페닙의 일시적인 치료 중단 및/또는 용량 감소 또는 심각하거나 지속적인 경우 소라페닙의 영구적인 중단이 포함될 수 있습니다. [투여 및 관리 (2.2) 참조]
스티븐스-존슨 증후군(SJS)과 독성 표피 괴사(TEN)를 포함한 심각한 피부 독성이 보고되었습니다. 이러한 경우는 생명을 위협할 수 있습니다. SJS 또는 TEN이 의심되는 경우 소라페닙을 중단하십시오.
5.5 위장관 천공
소라페닙을 복용한 환자의 1% 미만에서 위장관 천공이 보고되었습니다. 일부 경우에는 명백한 복강 내 종양과 관련이 없었습니다. 위장관 천공이 발생하는 경우 소라페닙을 영구적으로 중단하십시오.
5.6 와파린과 병용 사용 시 출혈 위험 증가
소라페닙을 복용하는 동안 와파린을 복용하는 일부 환자에서 드물게 출혈 또는 국제 표준화 비율(INR) 상승이 보고되었습니다. 와파린을 병용 투여하는 환자의 경우 프로트롬빈 시간(PT), INR 또는 임상적 출혈 에피소드의 변화를 정기적으로 모니터링하십시오.
5.7 상처 치유 장애 위험
VEGF 신호 전달 경로를 억제하는 약물을 투여받은 환자에서 상처 치유 장애가 발생할 수 있습니다. 따라서 소라페닙은 상처 치유에 부정적인 영향을 미칠 가능성이 있습니다.
선택적 수술 전 최소 10일 동안 소라페닙을 중단하십시오. 주요 수술 후 최소 2주 동안, 그리고 상처 치유가 적절히 될 때까지 투여하지 마십시오. 상처 치유 합병증이 해결된 후 소라페닙 재투여의 안전성은 확립되지 않았습니다.
5.8 편평세포 폐암에서 카보플라틴/파클리탁셀 및 젬시타빈/시스플라틴과 병용 투여된 소라페닙으로 관찰된 사망률 증가
화학 요법을 받지 않은 IIIb-IV기 비소세포 폐암 환자를 대상으로 한 두 건의 무작위 대조 시험의 하위 집단 분석에서, 편평세포 암 환자는 카보플라틴/파클리탁셀 단독 치료군에 비해 소라페닙을 추가 투여한 경우 사망률이 더 높았습니다(HR 1.81; 95% CI 1.19, 2.74). 젬시타빈/시스플라틴 단독 치료군에 비해 사망률이 더 높았습니다(HR 1.22; 95% CI 0.82, 1.80). 카보플라틴/파클리탁셀과 병용하여 소라페닙을 사용하는 것은 편평세포 폐암 환자에게 금기입니다. 젬시타빈/시스플라틴과 병용하여 소라페닙을 사용하는 것은 편평세포 폐암 환자에게 권장되지 않습니다. 소라페닙의 안전성 및 유효성은 비소세포 폐암 환자에서 확립되지 않았습니다.
5.9 QT 간격 연장
소라페닙은 QT/QTc 간격을 연장할 수 있습니다. QT/QTc 간격 연장은 심실 부정맥 위험을 증가시킵니다.
선천성 장 QT 증후군 환자에게는 소라페닙을 피하십시오. 울혈성 심부전, 서맥성 부정맥, QT 간격을 연장하는 것으로 알려진 약물(Ia 및 III군 항부정맥제 포함)이 있는 환자의 전해질 및 심전도를 모니터링하십시오. 전해질 이상(마그네슘, 칼륨, 칼슘)을 교정하십시오. QTc 간격이 500밀리초를 초과하거나 기준선에서 60밀리초 이상 증가하는 경우 소라페닙을 중단하십시오 [임상 약리학 (12.2) 참조].
5.10 약물 유발 간 손상
소라페닙 유발 간염은 간세포 손상 패턴을 특징으로 하며, 아미노트랜스퍼라제가 현저히 증가하여 간부전 및 사망으로 이어질 수 있습니다. 빌리루빈 및 INR 증가도 발생할 수 있습니다. 전 세계 단일 요법 데이터베이스에서 심각한 약물 유발 간 손상(정상 상한치의 20배를 초과하는 아미노트랜스퍼라제 수치 상승 또는 임상적으로 중요한 후유증(예: INR 상승, 복수, 사망 또는 이식)이 있는 아미노트랜스퍼라제 상승)의 발생률은 3,357명 중 2명(0.06%)이었습니다.
간 기능 검사를 정기적으로 모니터링하십시오. 바이러스성 간염 또는 진행성 기저 악성 종양과 같은 다른 설명 없이 아미노트랜스퍼라제가 현저히 증가하는 경우 소라페닙을 중단하십시오 [투여량 및 투여 방법 (2.2) 참조].
5.11 태아 독성
작용 기전 및 동물 실험 결과를 바탕으로 소라페닙은 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. 소라페닙은 하루 2회 400mg의 권장 용량으로 투여했을 때 사람의 노출량보다 훨씬 낮은 모체 노출량에서 동물에게 태아 독성을 유발했습니다. 임산부 및 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알려주십시오. 임신 가능성이 있는 여성에게는 소라페닙 치료 기간 동안과 마지막 투여 후 6개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 임신 가능성이 있는 여성 파트너가 있거나 임신한 파트너가 있는 남성 환자에게는 소라페닙 치료 기간 동안과 마지막 투여 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 인구 집단에서의 사용 (8.1, 8.3) 참조].
5.12 분화된 갑상선암에서 갑상선 자극 호르몬 억제 저해
소라페닙은 외인성 갑상선 억제를 저해합니다. DECISION(DTC) 연구에서 환자의 99%가 기준 갑상선 자극 호르몬(TSH) 수치가 0.5mU/L 미만이었습니다. 소라페닙 치료를 받은 환자의 41%에서 위약을 받은 환자의 16%에 비해 TSH 수치가 0.5mU/L를 초과하는 것으로 나타났습니다. 소라페닙을 투여받는 동안 TSH 억제가 저해된 환자의 경우 중간 최대 TSH는 1.6mU/L이었고 25%는 TSH 수치가 4.4mU/L를 초과했습니다.
DTC 환자의 경우 TSH 수치를 매월 모니터링하고 필요에 따라 갑상선 대체 약물을 조정하십시오 .
6 부작용
다음 임상적으로 중요한 유해 반응은 라벨링의 다른 부분에서 논의됩니다.
- •
- 심혈관계 사건 [경고 및 주의 사항 (5.1) 참조]
- •
- 출혈 [경고 및 주의 사항 (5.2) 참조]
- •
- 고혈압 [경고 및 주의 사항 (5.3) 참조]
- •
- 피부 독성 [경고 및 주의 사항 (5.4) 참조]
- •
- 위장관 천공 [경고 및 주의 사항 (5.5) 참조]
- •
- QT 간격 연장 [경고 및 주의 사항 (5.9) 및 임상 약리학 (12.2) 참조]
- •
- 약물 유발 간 손상 [경고 및 주의 사항 (5.10) 참조]
- •
- DTC에서 TSH 억제 저해 [경고 및 주의 사항 (5.12) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
설명된 데이터는 간세포암종(N = 297), 진행성 신세포암종(N = 451) 또는 분화된 갑상선암종(N = 207)에서 위약 대조 연구에 참여한 955명의 환자에게 소라페닙 노출을 반영합니다. HCC, RCC 또는 DTC 환자에서 소라페닙과 관련된 것으로 간주되는 가장 흔한 유해 반응(≥ 20%)은 설사, 피로, 감염, 탈모, 손발 피부 반응, 발진, 체중 감소, 식욕 감소, 메스꺼움, 위장 및 복통, 고혈압 및 출혈입니다.
간세포암종
표 4는 SHARP(HCC) 연구에서 위약을 투여받은 환자보다 소라페닙을 투여받은 그룹에서 더 높은 비율로 보고된 유해 반응을 경험한 환자의 비율을 보여줍니다.
|
||||||
|
소라페닙 정제 N = 297 |
위약 N = 302 |
|||||
|
유해 반응* |
모든 등급 % |
등급 3 % |
등급 4 % |
모든 등급 % |
등급 3 % |
등급 4 % |
|
모든 유해 반응 |
98 |
39 |
6 |
96 |
24 |
8 |
|
위장관 |
||||||
|
설사 |
55 |
10 |
< 1 |
25 |
2 |
0 |
|
식욕부진 |
29 |
3 |
0 |
18 |
3 |
< 1 |
|
메스꺼움 |
24 |
1 |
0 |
20 |
3 |
0 |
|
구토 |
15 |
2 |
0 |
11 |
2 |
0 |
|
변비 |
14 |
0 |
0 |
10 |
0 |
0 |
|
전신 증상 |
||||||
|
피로 |
46 |
9 |
1 |
45 |
12 |
2 |
|
체중 감소 |
30 |
2 |
0 |
10 |
1 |
0 |
|
통증 |
||||||
|
복통 |
31 |
9 |
0 |
26 |
5 |
1 |
|
피부과/피부 |
||||||
|
Hand-foot skin reaction |
21 |
8 |
0 |
3 |
< 1 |
0 |
|
Rash/desquamation |
19 |
1 |
0 |
14 |
0 |
0 |
|
Alopecia |
14 |
0 |
0 |
2 |
0 |
0 |
|
Pruritus |
14 |
< 1 |
0 |
11 |
< 1 |
0 |
|
Dry skin |
10 |
0 |
0 |
6 |
0 |
0 |
|
Hepatobiliary/pancreas |
||||||
|
Liver dysfunction |
11 |
2 |
1 |
8 |
2 |
1 |
고혈압은 소라페닙으로 치료받은 환자의 9%와 위약제를 투여받은 환자의 4%에서 보고되었습니다. 3등급 고혈압은 소라페닙으로 치료받은 환자의 4%와 위약제를 투여받은 환자의 1%에서 보고되었습니다.
출혈은 소라페닙을 투여받은 환자의 18%와 위약제를 투여받은 환자의 20%에서 보고되었습니다. 3등급 및 4등급 출혈 비율은 위약제를 투여받은 환자에서 더 높았습니다(3등급 – 소라페닙 3% 및 위약제 5%, 4등급 – 소라페닙 2% 및 위약제 4%).
식도 정맥류 출혈은 소라페닙으로 치료받은 환자의 2.4%와 위약제를 투여받은 환자의 4%에서 보고되었습니다.
신부전은 소라페닙으로 치료받은 환자의 < 1%와 위약제를 투여받은 환자의 3%에서 보고되었습니다. 임상적 췌장염은 소라페닙으로 치료받은 297명의 환자 중 1명(2등급)에서 보고되었습니다.
진행성 질환과 관련된 부작용을 포함하여 영구적으로 투약 중단으로 이어진 부작용 발생률은 소라페닙으로 치료받은 환자와 위약제를 투여받은 환자 모두에서 유사했습니다(소라페닙으로 치료받은 환자의 32%와 위약제를 투여받은 환자의 35%).
SHARP에서 보고된 실험실 검사 이상은 표 5에 제시되어 있습니다.
| NR = 보고되지 않음 | ||||
|
||||
|
실험실 매개변수* |
소라페닙 정제 N = 297 |
위약제 N = 302 |
||
|
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
|
저알부민혈증 |
59 |
0 |
47 |
0 |
|
리파아제 상승 |
40 |
9 |
37 |
9 |
|
림프구 감소증 |
47 |
NR |
42 |
NR |
|
혈소판 감소증 |
46 |
4 |
41 |
< 1 |
|
INR 상승 |
42 |
4 |
34 |
2 |
|
저인산혈증 |
35 |
11 |
11 |
2 |
|
아밀라아제 상승 |
34 |
2 |
29 |
2 |
|
저칼슘혈증 |
27 |
2.4 |
15 |
1 |
저칼륨혈증
10
< 1
6
< 1
신세포암
표 6은 TARGET (RCC) 연구에서 소라페닙 치료군에서 위약군보다 더 높은 비율로 보고된, 적어도 10%의 환자에게서 발생한 이상 반응의 비율을 보여줍니다.
영구적인 중단으로 이어진 이상 반응(진행성 질환과 관련된 이상 반응 포함)의 비율은 소라페닙 치료군과 위약군 모두에서 유사했습니다(각각 10%와 8%).
임상적 췌장염은 소라페닙 치료군 451명 중 3명(2등급 1명, 4등급 2명)에서 보고되었습니다.
|
||||||
|
소라페닙 정제 N = 451 |
위약 N = 451 |
|||||
|
이상 반응* |
모든 등급 % |
3등급 % |
4등급 % |
모든 등급 % |
3등급 % |
4등급 % |
|
모든 이상 반응 |
95 |
31 |
7 |
86 |
22 |
6 |
|
위장 증상 |
||||||
|
설사 |
43 |
2 |
0 |
13 |
< 1 |
0 |
|
메스꺼움 |
23 |
< 1 |
0 |
19 |
< 1 |
0 |
|
식욕 부진 |
16 |
< 1 |
0 |
13 |
1 |
0 |
|
구토 |
16 |
< 1 |
0 |
12 |
1 |
0 |
|
변비 |
15 |
< 1 |
0 |
11 |
< 1 |
0 |
|
피부과/피부 |
||||||
|
발진/박탈 |
40 |
< 1 |
0 |
16 |
< 1 |
0 |
|
손-발 피부 반응 |
30 |
6 |
0 |
7 |
0 |
0 |
|
탈모 |
27 |
< 1 |
0 |
3 |
0 |
0 |
|
가려움증 |
19 |
< 1 |
0 |
6 |
0 |
0 |
|
건조한 피부 |
11 |
0 |
0 |
4 |
0 |
0 |
|
전신 증상 |
||||||
|
피로 |
37 |
5 |
< 1 |
28 |
3 |
< 1 |
|
체중 감소 |
10 |
< 1 |
0 |
6 |
0 |
0 |
|
심혈관, 일반 |
||||||
|
고혈압 |
17 |
3 |
< 1 |
2 |
< 1 |
0 |
|
출혈 |
||||||
|
모든 부위 출혈 |
15 |
2 |
0 |
8 |
1 |
< 1 |
|
폐 |
||||||
|
호흡곤란 |
14 |
3 |
< 1 |
12 |
2 |
< 1 |
|
신경 |
||||||
|
감각 신경병증 |
13 |
< 1 |
0 |
6 |
< 1 |
0 |
|
통증 |
||||||
|
복통 |
11 |
2 |
0 |
9 |
2 |
0 |
|
두통 |
10 |
< 1 |
0 |
6 |
< 1 |
0 |
|
관절통 |
10 |
2 |
0 |
6 |
< 1 |
0 |
TARGET에서 보고된 실험실 검사 이상은 표 7에 제시되어 있습니다.
|
||||
|
실험실 매개변수* |
소라페닙 정제 N = 451 |
위약 N = 451 |
||
|
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
|
저인산혈증 |
45 |
13 |
11 |
3 |
|
빈혈 |
44 |
2 |
49 |
4 |
|
리파아제 상승 |
41 |
12 |
30 |
7 |
|
아밀라아제 상승 |
30 |
1 |
23 |
3 |
|
림프구 감소증 |
23 |
13 |
13 |
7 |
|
호중구 감소증 |
18 |
5 |
10 |
2 |
|
혈소판 감소증 |
12 |
1 |
5 |
0 |
|
저칼슘혈증 |
12 |
2 |
8 |
<1 |
|
저칼륨혈증 |
5 |
1 |
<1 |
<1 |
분화된 갑상선암
소라페닙의 안전성은 방사성 요오드(RAI) 치료에 내성이 있는 국소 재발 또는 전이성, 진행성 분화된 갑상선암(DTC) 환자 416명을 대상으로 한 DECISION 연구에서 평가되었으며, 이 연구에서 환자들은 이중맹검 시험에서 질병 진행 또는 참을 수 없는 독성이 나타날 때까지 400mg의 소라페닙을 하루 두 번(n=207) 또는 위약(n=209)을 투여받도록 무작위 배정되었습니다. [임상 연구(14.3) 참조]. 아래에 설명된 데이터는 소라페닙에 대한 중간 노출 기간이 46주(범위 0.3~135)를 반영합니다. 소라페닙에 노출된 인구는 남성이 50%였으며 중간 연령은 63세였습니다.
소라페닙을 투여받은 환자의 66%에서 부작용으로 인해 투약 중단이 필요했고, 64%의 환자에서 투약량 감소가 필요했습니다. 소라페닙을 투여받은 환자의 14%에서 치료 중단을 초래한 부작용이 보고된 반면, 위약을 투여받은 환자의 경우 1.4%였습니다.
표 8은 DECISION 연구의 이중맹검 단계에서 소라페닙을 투여받은 환자보다 위약을 투여받은 환자에서 부작용 발생률이 더 높았던 DTC 환자의 비율을 보여줍니다. 소라페닙을 투여받은 환자의 53%에서 3등급 부작용이 발생한 반면, 위약을 투여받은 환자의 경우 23%였습니다. 소라페닙을 투여받은 환자의 12%에서 4등급 부작용이 발생한 반면, 위약을 투여받은 환자의 경우 7%였습니다.
|
부작용 |
소라페닙 정제 N = 207 |
위약 N = 209 |
||
|
모든 등급 (%) |
3등급 및 4등급 (%) |
모든 등급 (%) |
3등급 및 4등급 (%) |
|
|
피부 및 피하 조직 장애 |
||||
|
PPES† |
69 |
19 |
8 |
0 |
|
탈모 |
67 |
0 |
8 |
0 |
|
발진 |
35 |
5 |
7 |
0 |
|
가려움증 |
20 |
0.5 |
11 |
0 |
|
건조한 피부 |
13 |
0.5 |
5 |
0 |
|
홍반 |
10 |
0 |
0.5 |
0 |
|
과각화증 |
7 |
0 |
0 |
0 |
|
위장관 장애 |
||||
|
설사 |
68 |
6 |
15 |
1 |
|
구내염‡ |
24 |
2 |
3 |
0 |
|
메스꺼움 |
21 |
0 |
12 |
0 |
|
복통§ |
20 |
1 |
7 |
1 |
|
변비 |
16 |
0 |
8 |
0.5 |
|
구강 통증¶ |
14 |
0.5 |
6 |
0 |
|
구토 |
11 |
0 |
3 |
0 |
|
검사 |
||||
|
체중 감소 |
49 |
6 |
14 |
1 |
|
일반적인 장애 및 투여 부위 상태 |
||||
|
피로 |
41 |
5 |
20 |
1 |
|
무력증 |
12 |
0 |
7 |
0 |
|
발열 |
11 |
1 |
5 |
0 |
|
혈관 장애 |
||||
|
고혈압# |
41 |
10 |
12 |
2 |
|
대사 및 영양 장애 |
||||
|
식욕 감퇴 |
30 |
2 |
5 |
0 |
|
신경계 장애 |
||||
|
두통 |
17 |
0 |
6 |
0 |
|
미각 이상 |
6 |
0 |
0 |
0 |
|
근골격계 및 결합 조직 장애 |
||||
|
사지 통증 |
15 |
1 |
7 |
0 |
|
근육 경련 |
10 |
0 |
3 |
0 |
|
호흡기, 흉곽 및 종격 장애 |
||||
|
쉰 목소리 |
13 |
0.5 |
3 |
0 |
|
코피 |
7 |
0 |
1 |
0 |
|
양성, 악성 및 불명확한 신생물 |
||||
|
피부 편평 세포 암종 |
3 |
3 |
0 |
0 |
DECISION 연구에서 위약군과 비교하여 소라페닙 투여 환자에서 관찰된 다음 실험실 이상의 상대적 증가는 RCC 및 HCC 연구에서 관찰된 것과 유사합니다. 리파아제, 아밀라아제, 저칼륨혈증, 저인산혈증, 호중구 감소증, 림프구 감소증, 빈혈 및 혈소판 감소증. 저칼슘혈증은 RCC 또는 HCC 환자에 비해 특히 저갑상선 기능 저하증의 병력이 있는 DTC 환자에서 더 빈번하고 더 심했습니다. DECISION에서 보고된 다른 실험실 검사 이상은 표 9에 제시되어 있습니다.
|
||||
|
실험실 매개변수* |
소라페닙 정제 N = 207 |
위약 N = 209 |
||
|
모든 등급(%) |
3등급 또는 4등급(%) |
모든 등급(%) |
3등급 또는 4등급(%) |
|
|
ALT 상승 |
59 |
4 |
24 |
0 |
|
AST 상승 |
54 |
2 |
15 |
0 |
|
저칼슘혈증 |
36 |
10 |
11 |
3 |
Additional Data from Multiple Clinical Trials
다음 추가 약물 관련 이상 반응 및 실험실 이상은 소라페닙 임상 시험에서 보고되었습니다 (매우 흔함 10% 이상, 흔함 1% 이상 10% 미만, 드물게 0.1% 이상 1% 미만, 희귀 0.1% 미만):
심혈관: 흔함: 울혈성 심부전*†, 심근 허혈 및/또는 심근 경색 드물게: 고혈압 위기* 희귀: QT 연장*
피부: 매우 흔함: 홍반 흔함: 박탈성 피부염, 여드름, 홍조, 모낭염, 각화증 드물게: 습진, 다형 홍반
소화기: 매우 흔함: 리파아제 증가, 아밀라아제 증가 흔함: 점막염, 구내염(구강 건조 및 설통 포함), 소화 불량, 연하 곤란, 위식도 역류 드물게: 췌장염, 위염, 위장 천공*, 담낭염, 담관염
리파아제 상승은 매우 흔합니다(41%, 아래 참조). 췌장염 진단은 비정상적인 실험실 값만으로는 내려서는 안 됩니다.
일반적인 장애: 매우 흔함: 감염, 출혈(위장관* 및 호흡기* 포함, 드물게 뇌출혈* 포함), 무력증, 통증(입, 뼈 및 종양 통증 포함), 발열, 식욕 감소 흔함: 독감 유사 증상
혈액학적: 매우 흔함: 백혈구 감소증, 림프구 감소증 흔함: 빈혈, 호중구 감소증, 혈소판 감소증 드물게: INR 이상
간담도계 장애: 희귀: 약물 유발성 간 손상(간부전 및 사망 포함)
과민 반응: 드물게: 과민 반응(피부 반응 및 두드러기 포함), 아나필락시스 반응
대사 및 영양: 매우 흔함: 저인산혈증 흔함: 일시적인 트랜스아미나아제 증가, 저칼슘혈증, 저칼륨혈증, 저나트륨혈증, 저갑상선증 드물게: 탈수, 일시적인 알칼리성 포스파타아제 증가, 빌리루빈 증가(황달 포함), 갑상선 기능 항진증
근골격계: 매우 흔함: 관절통 흔함: 근육통, 근육 경련
신경계 및 정신과적: 흔함: 우울증, 미각 이상 드물게: 이명, 가역적 후방 백질뇌병증*
신장 및 비뇨생식기: 흔함: 신부전, 단백뇨 희귀: 신증후군
생식: 흔함: 발기 부전 드물게: 여성형 유방
호흡기: 흔함: 콧물 드물게: 간질성 폐 질환 유사 사건(폐렴, 방사선 폐렴, 급성 호흡곤란 증후군, 간질성 폐렴, 폐렴 및 폐 염증 보고 포함)
또한, 소라페닙 임상 시험에서 다음과 같은 의학적으로 중요한 이상 반응이 드물게 발생했습니다. 일과성 허혈 발작, 부정맥 및 혈전색전증. 이러한 이상 반응의 경우 소라페닙과의 인과 관계가 확립되지 않았습니다.
* 이상 반응은 생명을 위협하거나 치명적일 수 있습니다.
† 소라페닙으로 치료받은 환자(N = 2276)의 1.9%에서 보고되었습니다.
6.2 시판 후 경험
소라페닙의 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
혈액 및 림프계 장애: 혈전성 미세혈관병증(TMA)
피부: 스티븐스-존슨 증후군 및 독성 표피 괴사증(TEN)
과민 반응: 혈관 부종
근골격계: 횡문근 융해증, 턱뼈 괴사
호흡기: 간질성 폐 질환 유사 사건(생명을 위협하거나 치명적일 수 있음)
혈관: 동맥(대동맥 포함) 동맥류, 박리 및 파열
7 약물 상호작용
7.1 소라페닙에 대한 다른 약물의 영향
강력한 CYP3A4 유도제
강력한 CYP3A4 유도제인 리팜핀과 소라페닙을 병용하면 소라페닙의 평균 AUC가 감소하여 항암 활성이 감소할 수 있습니다 [임상 약리학 (12.3) 참조]. 이러한 약물은 소라페닙의 전신 노출을 감소시킬 수 있으므로 가능하면 강력한 CYP3A4 유도제와 소라페닙의 병용을 피하십시오.
네오마이신
네오마이신과 소라페닙을 병용하면 소라페닙의 평균 AUC가 감소하여 항암 활성이 감소할 수 있습니다. 네오마이신과 소라페닙의 병용을 피하십시오. 다른 항생제가 소라페닙의 약동학에 미치는 영향은 연구되지 않았습니다 [임상 약리학 (12.3) 참조].
7.2 와파린과의 병용
소라페닙과 와파린을 병용하면 출혈 위험이 증가하거나 INR이 증가할 수 있습니다. 소라페닙을 투여받는 동안 와파린을 복용하는 환자의 경우 INR과 임상적 출혈 에피소드를 모니터링하십시오 [경고 및 주의 사항 (5.6) 참조].
7.3 QT 간격을 연장하는 약물
소라페닙은 QTc 간격 연장과 관련이 있습니다. QT/QTc 간격을 연장할 가능성이 있는 것으로 알려진 의약품과 소라페닙을 병용하지 마십시오 [경고 및 주의 사항 (5.9), 임상 약리학 (12.2) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
동물 연구 결과 및 작용 기전 [임상 약리학 (12.1) 참조]을 기반으로, 소라페닙은 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 약물 관련 위험을 알려주는 임산부에 대한 데이터는 없습니다. 동물 생식 연구에서, 소라페닙을 임신 랫드와 토끼에게 기관 형성 기간 동안 경구 투여한 결과, 하루 2회 400mg의 권장 용량으로 인간에게 노출되는 것보다 훨씬 낮은 모체 노출 수준에서 배아-태아 독성이 나타났습니다. (데이터 참조). 임산부와 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알려야 합니다.
해당 모집단의 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신의 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
데이터
동물 데이터
동물 생식 연구에서, 소라페닙은 기관 형성 기간 동안 임신 랫드와 토끼에게 경구 투여했을 때 기형 유발성이 있었고 배아-태아 독성(착상 후 손실, 흡수, 골격 지연 및 태아 체중 감소 증가 포함)을 유발했습니다. 이러한 효과는 하루 2회 400mg의 권장 인간 용량(체표면적 기준 약 500mg/m2/일)보다 훨씬 낮은 용량에서 발생했습니다. 랫드의 경우 0.2mg/kg/일(1.2mg/m2/일) 이상, 토끼의 경우 0.3mg/kg/일(3.6mg/m2/일) 이상의 용량에서 자궁 내 발달에 대한 부작용이 관찰되었습니다. 이러한 용량은 권장 용량으로 환자에게 노출되는 AUC의 약 0.008배에 해당하는 노출(AUC)을 초래합니다.
8.2 수유
위험 요약
모유에서 소라페닙 또는 그 대사산물의 존재 여부, 모유 수유 중인 아기 또는 모유 생산에 미치는 영향에 대한 데이터는 없습니다. 소라페닙은 수유 랫드의 모유에서 검출되었습니다. (데이터 참조). 소라페닙으로 인해 모유 수유 중인 아기에게 심각한 부작용이 발생할 가능성이 있으므로, 여성에게 소라페닙 치료 기간 동안과 마지막 투여 후 2주 동안 모유 수유를 하지 않도록 조언해야 합니다.
8.3 임신 가능성이 있는 여성 및 남성
소라페닙은 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. [특정 모집단에서의 사용 (8.1) 참조].
피임
남성
유전 독성 및 동물 생식 연구 결과를 기반으로, 임신 가능성이 있는 여성 파트너가 있거나 임신한 파트너가 있는 남성에게 소라페닙 치료 기간 동안과 마지막 투여 후 3개월 동안 효과적인 피임 방법을 사용하도록 조언해야 합니다. [특정 모집단에서의 사용 (8.1), 비임상 독성 (13.1) 참조].
불임
남성
동물 연구 결과를 기반으로, 소라페닙은 임신 가능성이 있는 남성의 생식 능력을 손상시킬 수 있습니다. [비임상 독성 (13.1) 참조].
8.5 노인 사용
소라페닙으로 치료받은 HCC 환자의 총 59%가 65세 이상이었고 19%가 75세 이상이었습니다. 소라페닙으로 치료받은 RCC 환자의 총 32%가 65세 이상이었고 4%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성 또는 유효성의 차이가 관찰되지 않았으며, 보고된 다른 임상 경험에서 노인 환자와 젊은 환자 간에 반응의 차이가 확인되지 않았지만, 일부 노인 환자의 민감성이 더 높을 가능성은 배제할 수 없습니다.
8.6 신장애
투석을 받지 않는 경증, 중등도 또는 중증 신장애 환자의 경우 용량 조절이 필요하지 않습니다. 소라페닙의 약동학은 투석을 받는 환자에서 연구되지 않았습니다 [임상 약리학 (12.3) 참조].
8.7 간장애
경증 또는 중등도 간장애 환자의 경우 용량 조절이 필요하지 않습니다. 소라페닙의 약동학은 중증 (Child-Pugh C) 간장애 환자에서 연구되지 않았습니다 [임상 약리학 (12.3) 참조].
10 과다 복용
권장 용량의 2배인 800mg 1일 2회 용량에서 관찰된 이상반응은 주로 설사와 피부과적 이상반응이었다. 동물에서 실시한 경구 급성 독성 연구에서 흡수 포화로 인해 동물에서 급성 과다 복용 증상에 대한 정보는 없다.
과다 복용이 의심되는 경우, sorafenib 투여를 중단하고 지지 요법을 시작하십시오.
11 설명
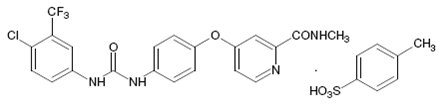
소라페닙은 키나아제 억제제로, 소라페닙의 토실레이트 염입니다. 소라페닙 토실레이트, USP는 4-[4-({[4-클로로-3-(트리플루오로메틸)페닐]카르바모일}아미노)페녹시]-N-메틸피리딘-2-카르복사미드, 토실레이트라는 화학명을 가지고 있습니다. 소라페닙 토실레이트, USP의 분자식은 C21H16ClF3N4O3•C7H8O3S이며, 소라페닙 토실레이트, USP의 분자량은 637.03 g/mole입니다. 구조식은 다음과 같습니다.
소라페닙 토실레이트, USP는 크림색에서 노란색의 결정성 분말입니다. 소라페닙 토실레이트, USP는 수성 매질에 실질적으로 불용성이며, 에탄올에 약간 용해되고 PEG 400에 용해됩니다.
경구용 소라페닙 정제, USP는 200mg 소라페닙(소라페닙 토실레이트, USP 274mg에 해당)을 함유하는 필름 코팅 정제로 제공되며, 다음과 같은 비활성 성분이 포함되어 있습니다: 카르복시메틸셀룰로오스 칼슘, 크로스카르멜로오스 나트륨, 하이프로멜로오스, 마그네슘 스테아레이트, 미결정 셀룰로오스, 폴리에틸렌 글리콜, 적색 산화철, 라우릴 황산나트륨 및 이산화티타늄.
12 임상약리학
12.1 작용 기전
소라페닙은 키나아제 억제제로서 시험관 내에서 종양 세포 증식을 감소시킵니다. 소라페닙은 여러 세포 내(c-CRAF, BRAF 및 돌연변이 BRAF) 및 세포 표면 키나아제(KIT, FLT-3, RET, RET/PTC, VEGFR-1, VEGFR-2, VEGFR-3 및 PDGFR-ß)를 억제하는 것으로 나타났습니다. 이러한 키나아제 중 여러 개는 종양 세포 신호 전달, 혈관 신생 및 세포 사멸에 관여하는 것으로 생각됩니다. 소라페닙은 면역 결핍 마우스에서 HCC, RCC 및 DTC 인간 종양 이종 이식편의 종양 성장을 억제했습니다. 소라페닙 치료 시 HCC 및 RCC 모델에서 종양 혈관 신생 감소가 관찰되었고, HCC, RCC 및 DTC 모델에서 종양 세포 사멸 증가가 관찰되었습니다.
12.2 약력학
심장 전기 생리
진행성 암 환자 53명을 대상으로 다기관, 공개, 비무작위 임상 시험에서 소라페닙 400mg을 1일 2회 투여한 경우 QTc 간격에 미치는 영향을 평가했습니다. 이 임상 시험에서 기준선에서 평균 QTc 간격의 큰 변화(즉, > 20ms)는 발견되지 않았습니다. 28일 치료 주기 1회 후, 2주기 1일 투여 후 6시간에 8.5ms(양측 90% 신뢰 구간의 상한, 13.3ms)의 가장 큰 평균 QTc 간격 변화가 관찰되었습니다. [경고 및 주의 사항 (5.9), 약물 상호 작용 (7.3) 참조].
12.3 약동학
소라페닙을 7일 동안 여러 번 투여하면 단일 투여량에 비해 2.5~7배 축적되었습니다. 평균 농도의 최고점 대 최저점 비율이 2 미만인 7일 이내에 혈장 소라페닙 농도가 안정 상태에 도달했습니다.
소라페닙 400mg을 1일 2회 투여한 후 소라페닙의 안정 상태 농도를 DTC, RCC 및 HCC 환자에서 평가했습니다. DTC 환자는 HCC 환자보다 평균 안정 상태 농도가 1.8배 높고 RCC 환자보다 2.3배 높습니다. DTC 환자에서 소라페닙 농도가 증가하는 이유는 알려져 있지 않습니다.
경구 투여량이 1일 2회 400mg을 초과하면 평균 Cmax 및 AUC가 투여량에 비례하여 증가하지 않았습니다.
배설
소라페닙의 평균 배설 반감기는 약 25~48시간이었습니다.
배설
소라페닙은 안정 상태에서 혈장 순환 분석 물질의 약 70~85%를 차지했습니다. 소라페닙의 대사체 8개가 확인되었으며, 그 중 5개가 혈장에서 검출되었습니다. 안정 상태에서 순환 분석 물질의 약 9~16%를 차지하는 소라페닙의 주요 순환 대사체인 피리딘 N-옥사이드는 시험관 내에서 소라페닙과 유사한 효능을 보였습니다.
소라페닙 용액 제형 100mg을 경구 투여한 후, 투여량의 96%가 14일 이내에 회수되었으며, 투여량의 77%가 대변으로, 19%가 글루쿠론산화된 대사체로 소변으로 배설되었습니다. 투여량의 51%를 차지하는 변화되지 않은 소라페닙은 대변에서 발견되었지만 소변에서는 발견되지 않았습니다.
특정 인구 집단
소라페닙의 약동학 연구에 따르면 아시아인(N = 78)의 소라페닙 평균 AUC는 백인(N = 40)보다 30% 낮았습니다. 성별과 연령은 소라페닙의 약동학에 임상적으로 의미 있는 영향을 미치지 않습니다.
신장애 환자
경증(CLcr 50-80 mL/min), 중등도(CLcr 30 – < 50 mL/min) 및 중증(CLcr < 30 mL/min) 신장애는 소라페닙의 약동학에 영향을 미치지 않습니다. [특정 인구 집단에서의 사용 (8.6) 참조].
간 기능 장애 환자
경증 (Child-Pugh A) 및 중등도 (Child-Pugh B) 간 기능 장애는 소라페닙의 약동학에 영향을 미치지 않습니다 [특정 집단에서의 사용 (8.7) 참조].
약물 상호 작용 연구
강력한 CYP3A4 억제제의 소라페닙에 대한 영향
CYP3A4 및 P-glycoprotein의 강력한 억제제인 케토코나졸을 7일 동안 하루 1회 400mg으로 투여한 결과, 건강한 피험자에서 소라페닙 50mg을 단회 경구 투여한 후 평균 AUC에 변화가 없었습니다.
강력한 CYP3A4 유도제의 소라페닙에 대한 영향
건강한 자원 봉사자에게 소라페닙 400mg을 단회 경구 투여한 후 5일 동안 하루 1회 600mg으로 리팜핀을 투여하여 소라페닙과 병용 투여한 결과, 소라페닙의 평균 AUC가 37% 감소했습니다.
네오마이신의 소라페닙에 대한 영향
건강한 피험자에게 소라페닙 400mg을 단회 경구 투여한 후 5일 동안 하루 3회 1g으로 네오마이신을 경구 투여한 결과, 소라페닙의 평균 AUC가 54% 감소했습니다.
소라페닙의 다른 약물에 대한 영향
28일 동안 하루 2회 400mg의 소라페닙을 투여한 결과, 동시에 투여한 미다졸람 (CYP3A4 기질), 덱스트로메토르판 (CYP2D6 기질) 및 오메프라졸 (CYP2C19 기질)의 전신 노출이 증가하지 않았습니다 [임상 약리학 (12.3) 참조].
위산도를 증가시키는 약물
소라페닙의 수용성은 pH 의존적이며, pH가 높을수록 용해도가 낮아집니다. 그러나 5일 동안 하루 1회 40mg으로 프로톤 펌프 억제제인 오메프라졸을 투여한 결과, 소라페닙 단회 투여 노출에 임상적으로 유의미한 변화가 나타나지 않았습니다.
시험관 내 연구
소라페닙은 시험관 내에서 CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 및 CYP3A4를 경쟁적으로 억제했습니다. 그러나 28일 동안 하루 2회 400mg의 소라페닙을 CYP3A4, CYP2D6 및 CYP2C19 기질과 함께 투여한 결과, 이러한 기질의 전신 노출이 증가하지 않았습니다 [약물 상호 작용 (7.3) 참조].
소라페닙은 CYP1A2 및 CYP3A4 활성을 증가시키지 않았으며, 이는 소라페닙이 인간에서 CYP1A2 또는 CYP3A4를 유도할 가능성이 낮음을 시사합니다.
소라페닙은 시험관 내에서 UGT1A1 및 UGT1A9에 의한 글루쿠론산화를 억제합니다. 소라페닙은 UGT1A1 또는 UGT1A9 기질인 동시에 투여된 약물의 전신 노출을 증가시킬 수 있습니다.
소라페닙은 시험관 내에서 P-glycoprotein을 억제합니다. 소라페닙은 P-glycoprotein 기질인 동시에 투여된 약물의 농도를 증가시킬 수 있습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
소라페닙으로 발암성 연구는 수행되지 않았습니다. 소라페닙은 대사 활성화가 있는 상태에서 시험관 내 포유류 세포 분석(중국 햄스터 난소)에서 염색체 이상을 유발했습니다. 소라페닙은 시험관 내 아메스 박테리아 세포 분석에서 돌연변이 유발성이 없었고, 생체 내 마우스 미세핵 분석에서 염색체 이상을 유발하지 않았습니다. 제조 공정 중 하나의 중간체는 최종 의약품 물질에도 존재하며(< 0.15%), 독립적으로 시험했을 때 시험관 내 박테리아 세포 분석(아메스 검사)에서 돌연변이 유발성이 양성이었습니다.
소라페닙으로 동물에서 생식능력에 미치는 영향을 평가하기 위한 특정 연구는 수행되지 않았습니다. 그러나 반복 투여 독성 연구 결과는 소라페닙이 생식 기능과 생식능력을 저해할 가능성이 있음을 시사합니다. 수컷과 암컷 생식 기관에서 여러 가지 부작용이 관찰되었으며, 랫드가 마우스나 개보다 더 민감했습니다. 랫드에서 나타나는 전형적인 변화는 고환 위축 또는 퇴행, 부고환, 전립선 및 정낭 퇴행, 황체 중심 괴사 및 난포 발달 정지였습니다. 랫드의 생식 기관에 대한 소라페닙 관련 영향은 매일 경구 투여량 ≥ 5 mg/kg(30 mg/m2)에서 나타났습니다. 이 투여량은 권장 인간 투여량에서 환자의 AUC의 약 0.5배에 해당하는 노출(AUC)을 초래합니다. 개는 30 mg/kg/일(600 mg/m2/일)에서 고환의 세관 퇴행을 보였습니다. 이 투여량은 권장 인간 투여량에서 AUC의 약 0.3배에 해당하는 노출을 초래합니다. 소라페닙 60 mg/kg/일(1200 mg/m2/일)에서 개에서 무정자증이 관찰되었습니다.
14 임상 연구
14.1 간세포암
SHARP (HCC) 연구(NCT00105443)는 불수술성 간세포암 환자를 대상으로 한 국제적 다기관 무작위 이중맹검 위약 대조 시험이었습니다. 전체 생존율이 일차 종말점이었습니다. 총 602명의 환자가 무작위 배정되었으며, 299명은 소라페닙 400mg을 1일 2회 투여받았고, 303명은 일치하는 위약을 투여받았습니다. 무작위 배정된 602명의 모든 대상자는 효능 분석을 위한 ITT 모집단에 포함되었습니다.
인구통계학적 특징과 기저 질환 특징은 나이, 성별, 인종, 수행 상태, 원인(B형 간염, C형 간염 및 알코올성 간 질환 포함), TNM 병기(병기 I: < 1% 대 < 1%; 병기 II: 10.4% 대 8.3%; 병기 III: 37.8% 대 43.6%; 병기 IV: 50.8% 대 46.9%), 거시적 혈관 침윤 및 간외 종양 전이가 없는 경우(30.1% 대 30.0%), 바르셀로나 간암 클리닉 병기(병기 B: 18.1% 대 16.8%; 병기 C: 81.6% 대 83.2%; 병기 D: < 1% 대 0%) 측면에서 소라페닙군과 위약군 간에 유사했습니다. Child-Pugh 점수에 따른 간 기능 장애는 소라페닙군과 위약군 간에 비슷했습니다(A등급: 95% 대 98%; B등급: 5% 대 2%). Child-Pugh C등급 환자는 1명만 등록되었습니다. 이전 치료에는 수술적 절제술(19.1% 대 20.5%), 국소 치료(고주파 절제술, 경피적 에탄올 주입 및 경동맥 화학색전술 포함; 38.8% 대 40.6%), 방사선 치료(4.3% 대 5.0%) 및 전신 치료(3.0% 대 5.0%)가 포함되었습니다.
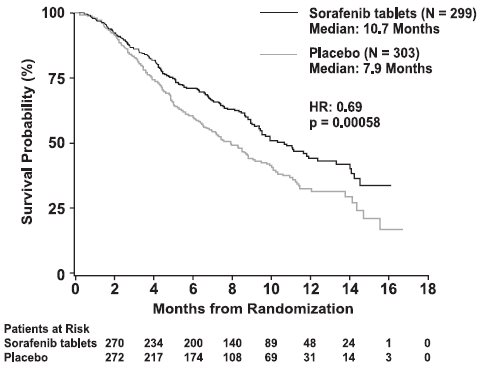
생존율에 대한 사전 지정된 두 번째 중간 분석에서 소라페닙이 위약에 비해 전체 생존율에서 통계적으로 유의미한 이점을 보여주는 결과(HR: 0.69, p = 0.00058)(표 10 및 그림 1 참조)가 나온 후 효능을 이유로 시험이 중단되었습니다. 이러한 이점은 분석된 모든 하위 집합에서 일관되었습니다.
이전 시점(독립적인 방사선학적 검토에 의해)의 데이터를 기반으로 한 종양 진행까지의 시간(TTP)에 대한 최종 분석에서도 소라페닙군에서 유의미하게 더 길었습니다(HR: 0.58, p = 0.000007)(표 10 참조).
| CI = 신뢰 구간 | ||
|
효능 매개변수 |
소라페닙 정제 (N = 299) |
위약 (N = 303) |
|
전체 생존율 |
||
|
사건 수 |
143 |
178 |
|
중앙값, 개월 |
10.7 |
7.9 |
|
(95% CI) |
(9.4, 13.3) |
(6.8, 9.1) |
|
위험 비율* (95% CI) |
0.69 (0.55, 0.87) |
|
|
P-값(로그 순위 검정†) |
0.00058 |
|
|
진행까지의 시간‡ |
||
|
사건 수 |
107 |
156 |
|
중앙값, 개월 |
5.5 |
2.8 |
|
(95% CI) |
(4.1, 6.9) |
(2.7, 3.9) |
|
위험 비율* (95% CI) |
0.58 (0.45, 0.74) |
|
|
P-값(로그 순위 검정†) |
0.000007 |
|
14.2 신장 세포 암종
진행성 신장 세포 암종(RCC) 치료에서 소라페닙의 안전성 및 유효성은 다음 두 가지 무작위 배정 대조 임상 시험에서 연구되었습니다.
TARGET:TARGET(NCT00073307)은 진행성 신장 세포 암종 환자를 대상으로 한 국제적 다기관 무작위 배정 이중 맹검 위약 대조 시험으로, 이 환자들은 이전에 전신 치료를 한 번 받았습니다. 주요 연구 종료점에는 전체 생존율과 무진행 생존율(PFS)이 포함되었습니다. 종양 반응률은 이차 종료점이었습니다. PFS 분석에는 MSKCC(Memorial Sloan Kettering Cancer Center) 예후 위험 범주(낮음 또는 중간) 및 국가별로 계층화된 프로토콜에 따라 769명의 환자가 포함되었으며, 소라페닙 400mg을 1일 2회(N = 384) 또는 위약(N = 385)으로 무작위 배정되었습니다.
표 11은 분석된 연구 모집단의 인구 통계적 특징과 질병 특징을 요약한 것입니다. 기준선 인구 통계적 특징과 질병 특징은 두 치료 그룹 모두에서 잘 균형을 이루었습니다. RCC의 초기 진단부터 무작위 배정까지의 중간 시간은 소라페닙 군과 위약 군에서 각각 1.6년과 1.9년이었습니다.
|
||||
|
특징 |
소라페닙 정제 N = 384 |
위약 N = 385 |
||
|
N |
(%) |
N |
(%) |
|
|
성별 |
||||
|
남성 |
267 |
(70) |
287 |
(75) |
|
여성 |
116 |
(30) |
98 |
(25) |
|
인종 |
||||
|
백인 |
276 |
(72) |
278 |
(73) |
|
흑인/아시아인/히스패닉/기타 |
11 |
(3) |
10 |
(2) |
|
보고되지 않음* |
97 |
(25) |
97 |
(25) |
|
연령대 |
||||
|
< 65세 |
255 |
(67) |
280 |
(73) |
|
≥ 65세 |
127 |
(33) |
103 |
(27) |
|
ECOG 수행 기준선 상태 |
||||
|
0 |
184 |
(48) |
180 |
(47) |
|
1 |
191 |
(50) |
201 |
(52) |
|
2 |
6 |
(2) |
1 |
(< 1) |
|
보고되지 않음 |
3 |
(< 1) |
3 |
(< 1) |
|
MSKCC 예후 위험 범주 |
||||
|
낮음 |
200 |
(52) |
194 |
(50) |
|
중간 |
184 |
(48) |
191 |
(50) |
|
이전 IL-2 및/또는 인터페론 |
||||
|
예 |
319 |
(83) |
313 |
(81) |
|
아니오 |
65 |
(17) |
72 |
(19) |
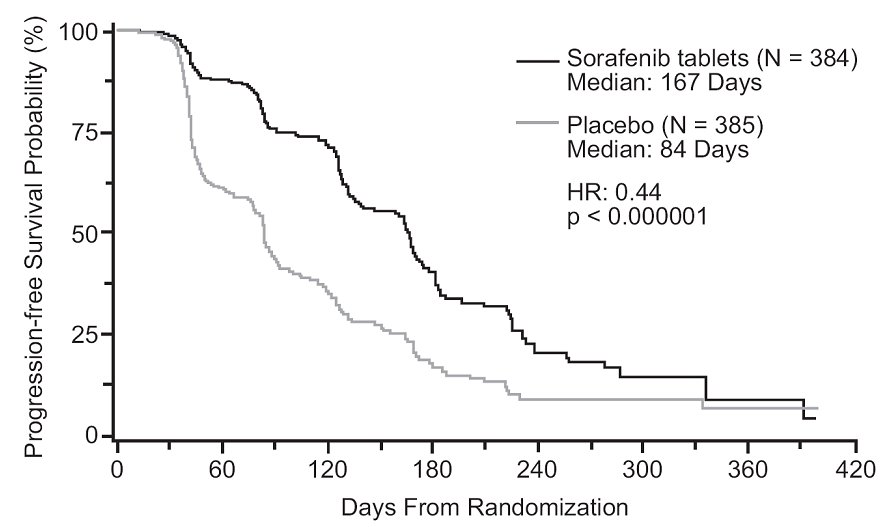
무진행 생존 기간은 무작위 배정부터 질병 진행 또는 사망(어느 것이 먼저 발생하든)까지의 시간으로 정의되었으며, RECIST 기준을 사용하여 눈가림 독립적 방사선학적 검토를 통해 평가되었습니다. 그림 2는 PFS에 대한 Kaplan-Meier 곡선을 보여줍니다. PFS 분석은 MSKCC 예후 위험 범주 및 국가별로 계층화된 양측 Log-Rank 검정을 기반으로 했습니다.
참고: HR은 다음 공변량을 사용한 Cox 회귀 모델에서 나온 것입니다. MSKCC 예후 위험 범주 및 국가. P 값은 MSKCC 예후 위험 범주 및 국가별로 계층화된 양측 Log-Rank 검정에서 나온 것입니다.
소라페닙에 무작위 배정된 환자의 중간 PFS는 167일이었고, 위약에 무작위 배정된 환자의 경우 84일이었습니다. 추정 위험 비율(소라페닙과 위약 비교 시 진행 또는 사망의 즉각적인 위험)은 0.44(95% CI: 0.35, 0.55)였습니다.
PFS의 탐색적 일변량 분석에서 일련의 환자 하위 집단을 검토했습니다. 하위 집단에는 65세 이상 또는 미만의 연령, ECOG PS 0 또는 1, MSKCC 예후 위험 범주, 이전 치료가 진행성 전이 질환에 대한 것이었는지 또는 초기 질환 설정에 대한 것이었는지, 진단 후 시간이 1.5년 미만 또는 이상인지 여부가 포함되었습니다. PFS에 대한 소라페닙의 효과는 이러한 하위 집단 전반에 걸쳐 일관되었으며, 이전 IL-2 또는 인터페론 치료를 받지 않은 환자(N = 137; 소라페닙을 받은 환자 65명, 위약을 받은 환자 72명)를 포함하여 소라페닙 군의 중간 PFS는 172일이었고 위약 군의 경우 85일이었습니다.
종양 반응은 RECIST 기준에 따라 독립적인 방사선학적 검토를 통해 결정되었습니다. 전반적으로 반응 평가 가능한 672명의 환자 중 소라페닙 군에서는 7명(2%)의 환자가 확인된 부분 반응을 보였고, 위약 군에서는 0명(0%)의 환자가 확인된 부분 반응을 보였습니다. 따라서 PFS의 증가는 주로 안정적인 질환 집단을 반영합니다.
예정된 중간 생존 분석 시점에서 사망자 220명을 기준으로, 소라페닙에 무작위 배정된 환자의 전체 생존 기간은 위약에 비해 더 길었으며 위험 비율은 0.72였습니다. 이 분석은 통계적 유의성에 대한 사전 지정된 기준을 충족하지 못했습니다. 생존 데이터가 성숙함에 따라 추가 분석이 계획되어 있습니다.
BAY43-9006: BAY43-9006(NCT00101413)은 RCC를 포함한 전이성 악성 종양 환자를 대상으로 한 무작위 중단 시험이었습니다. 주요 평가 변수는 24주에 무진행 상태로 유지된 무작위 배정 환자의 비율이었습니다. 모든 환자는 처음 12주 동안 소라페닙을 받았습니다. 방사선학적 평가는 12주에 반복되었습니다. 기준선에서 이차원 종양 측정값이 25% 미만으로 변한 환자는 추가 12주 동안 소라페닙 또는 위약에 무작위 배정되었습니다. 위약에 무작위 배정된 환자는 진행 시 개방 표지 소라페닙으로 교차할 수 있었습니다. 종양이 25% 이상 축소된 환자는 소라페닙을 계속했고, 종양이 25% 이상 성장한 환자는 치료를 중단했습니다.
사전 치료를 받지 않은 환자와 명확한 세포 암종 이외의 종양 조직학을 가진 환자를 포함하여 202명의 진행성 RCC 환자가 BAY43-9006에 등록되었습니다. 소라페닙을 처음 12주 동안 투여한 후, RCC 환자 79명이 개방 표지 소라페닙을 계속했고, 65명의 환자가 소라페닙 또는 위약에 무작위 배정되었습니다. 추가 12주 후, 24주에 무작위 배정된 65명의 환자에서 소라페닙에 무작위 배정된 환자(16/32, 50%)의 무진행 비율이 위약에 무작위 배정된 환자(6/33, 18%)보다 유의하게 높았습니다(p = 0.0077). 무진행 생존 기간은 소라페닙 군(163일)이 위약에 무작위 배정된 환자(41일)보다 유의하게 길었습니다(p = 0.0001, HR = 0.29).
14.3 분화된 갑상선암
소라페닙의 안전성과 유효성은 방사성 요오드(RAI) 치료에 내성이 있는 국소 재발성 또는 전이성, 진행성 분화된 갑상선암(DTC) 환자 417명을 대상으로 실시된 다기관, 무작위(1:1), 이중 눈가림, 위약 대조 시험(DECISION; NCT00984282)에서 평가되었습니다. 무작위 배정은 연령(< 60세 대 ≥ 60세) 및 지리적 지역(북미, 유럽 및 아시아)별로 계층화되었습니다. 효능 분석을 위해 ITT 집단에 417명의 모든 피험자가 포함되었습니다.
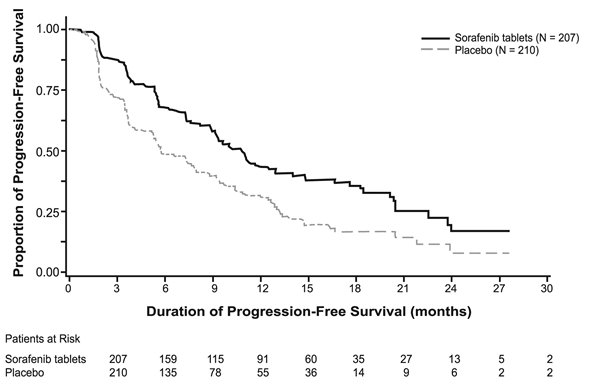
모든 환자는 등록 후 14개월 이내에 진행이 확인된 활성 진행성 질환을 가져야 했습니다. RAI 내성 질환은 상호 배타적이지 않은 4가지 기준을 기반으로 정의되었습니다. 모든 RAI 치료 및 진단 스캔은 저요오드 식단 및 적절한 TSH 자극 조건에서 수행되어야 했습니다. 다음은 RAI 내성 기준과 연구에 참여한 환자 중 각 기준을 충족한 비율입니다. RAI 스캔에서 요오드 흡수가 없는 표적 병변(68%); 요오드 흡수가 있고 등록 후 16개월 이내에 RAI 치료 후 진행된 종양(12%); 요오드 흡수가 있고 여러 번의 RAI 치료를 받았으며 마지막 치료가 등록 전 16개월 이상 전에 이루어졌고, 서로 16개월 이내에 실시된 두 번의 RAI 치료 후 각 치료 후 질병이 진행된 종양(7%); 누적 RAI 용량 ≥ 600 mCi 투여(34%). 주요 효능 결과 측정값은 수정된 고형 종양에 대한 반응 평가 기준 v. 1.0(RECIST)을 사용한 눈가림 독립적 방사선학적 검토를 통해 결정된 무진행 생존 기간(PFS)이었습니다. RECIST는 외부 빔 방사선 치료가 필요한 뼈 병변의 임상적 진행을 포함하여 수정되었습니다(진행 사건의 4.4%). 추가 효능 결과 측정값에는 전체 생존 기간(OS), 종양 반응률 및 반응 지속 기간이 포함되었습니다.
환자는 소라페닙 400mg을 하루 두 번(n = 207) 또는 위약(n = 210)을 받도록 무작위 배정되었습니다. 무작위 배정된 417명의 환자 중 48%가 남성이었고, 중간 연령은 63세였으며, 61%가 60세 이상이었고, 60%가 백인이었고, 62%가 ECOG 수행 상태가 0이었고, 99%가 갑상선 절제술을 받았습니다. 조직학적 진단은 연구 집단의 57%에서 유두암, 25%에서 여포암(Hürthle 세포 포함), 10%에서 미분화암, 8%에서 기타였습니다. 전이가 환자의 96%에서 발견되었습니다. 폐에서 86%, 림프절에서 51%, 뼈에서 27%. 연구 참여 전에 투여된 중간 누적 RAI 활동은 400 mCi였습니다.
소라페닙 치료군에서 위약군에 비해 PFS가 통계적으로 유의하게 연장된 것으로 나타났습니다(그림 3). 최종 전체 생존율(OS) 분석에서는 통계적으로 유의한 차이가 관찰되지 않았습니다(표 12). 연구자에 의해 질병 진행이 결정된 후 위약군에 무작위 배정된 환자 161명(77%)에서 오픈 라벨 소라페닙으로 교차 투여되었습니다.
| NR = 도달하지 않음, CI = 신뢰 구간, NE = 추정 불가 | ||
|
소라페닙 정제 N = 207 |
위약 N = 210 |
|
|
무진행 생존율* |
||
|
사망 또는 진행 수 |
113 (55%) |
136 (65%) |
|
월 단위 중간 PFS(95% CI) |
10.8 (9.1, 12.9) |
5.8 (5.3, 7.8) |
|
위험 비율(95% CI) |
0.59 (0.46, 0.76) |
|
|
P-값† |
< 0.001 |
|
|
전체 생존율‡ |
||
|
사망 수 |
103 (49.8%) |
109 (51.9%) |
|
월 단위 중간 OS(95% CI) |
42.8 (34.6, 52.6) |
39.4 (32.7, 51.4) |
|
위험 비율(95% CI) |
0.92 (0.71, 1.21) |
|
|
P-값† |
0.570 |
|
|
객관적 반응 |
||
|
객관적 반응자 수§ |
24 (12%) |
1 (0.5%) |
|
(95% CI) |
(7.6%, 16.8%) |
(0.01%, 2.7%) |
|
월 단위 중간 반응 지속 기간(95% CI) |
10.2 (7.4, 16.6) |
NE |
16 제공/보관 및 취급 방법
Sorafenib Tablets, USP는 200mg sorafenib (sorafenib tosylate, USP 274mg에 해당)을 함유하고 있습니다.
200mg 정제는 복숭아색 필름 코팅, 둥근 모양, 무절개 정제이며 한쪽 면에는 200, 반대쪽 면에는 NAT가 각인되어 있습니다. 다음과 같이 제공됩니다.
NDC 0378-1201-78
120정 병
20°~25°C(68°~77°F)에 보관하십시오. [USP 제어 실온 참조]. 건조한 곳에 보관하십시오.
어린이 보호 마개를 사용하여 USP에 정의된 바와 같이 밀폐된 광선 차단 용기에 보관하십시오.
17 환자 상담 정보
FDA가 승인한 환자 라벨링(Patient Information)을 읽도록 환자에게 권고하십시오.
심혈관계 사건: sorafenib 치료 중 심장 허혈 및/또는 심근경색 및 울혈성 심부전이 보고되었으며, 흉통 또는 기타 심장 허혈이나 울혈성 심부전 증상이 나타나면 즉시 보고해야 한다는 점을 환자와 상의하십시오 [see Warnings and Precautions (5.1)].
출혈: sorafenib은 출혈 위험을 증가시킬 수 있으며 출혈 발생 시 즉시 보고해야 한다는 점을 환자에게 알리십시오 [see Warnings and Precautions (5.2)].
sorafenib을 복용하는 동안 warfarin을 복용하는 일부 환자에서 출혈 또는 INR(International Normalized Ratio) 상승이 보고되었으며 INR을 정기적으로 모니터링해야 한다는 점을 환자에게 알리십시오 [see Warnings and Precautions (5.6)].
고혈압: 특히 치료 첫 6주 동안 sorafenib 치료 중 고혈압이 발생할 수 있으며 치료 중 혈압을 정기적으로 모니터링해야 한다는 점을 환자에게 알리십시오 [see Warnings and Precautions (5.3)].
피부 반응: sorafenib 치료 중 수족 피부 반응 및 발진 발생 가능성과 적절한 대응책에 대해 환자에게 조언하십시오 [see Warnings and Precautions (5.4)].
위장관 천공: sorafenib을 복용하는 환자에서 위장관 천공 사례가 보고되었다는 점을 환자에게 알리십시오 [see Warnings and Precautions (5.5)].
상처 치유 장애 위험: sorafenib은 상처 치유를 저해할 수 있다는 점을 환자에게 알리십시오. 계획된 수술 절차가 있는 경우 의료 서비스 제공자에게 알리도록 환자에게 조언하십시오 [see Warnings and Precautions (5.7)].
QT 간격 연장: QT 간격 연장 병력이 있는 환자에게 sorafenib이 상태를 악화시킬 수 있다는 점을 알리십시오 [see Warnings and Precautions (5.9) and Clinical Pharmacology (12.2)].
약물 유발 간 손상: sorafenib은 간부전 및 사망으로 이어질 수 있는 간염을 유발할 수 있다는 점을 환자에게 알리십시오. 치료 중 간 기능 검사를 정기적으로 모니터링하고 간염의 징후와 증상을 보고하도록 환자에게 조언하십시오 [see Warnings and Precautions (5.10)].
배아-태아 독성: 임신 중이거나 임신하게 된 경우 의료 서비스 제공자에게 알리도록 여성에게 조언하십시오. 태아에 대한 위험과 임신 손실 가능성에 대해 여성 환자에게 알리십시오 [see Use in Specific Populations (8.1)]. 가임기 여성에게 sorafenib 치료 중 및 마지막 복용 후 6개월 동안 효과적인 피임법을 사용하도록 조언하십시오. 가임기 여성 파트너가 있거나 임신 중인 남성 환자에게 sorafenib 치료 중 및 마지막 sorafenib 복용 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오 [see Warnings and Precautions (5.11), Use in Specific Populations (8.1, 8.3)].
수유: sorafenib을 복용하는 동안 그리고 마지막 sorafenib 복용 후 2주 동안 모유 수유를 하지 않도록 환자에게 조언하십시오 [see Use in Specific Populations (8.2)].
복용량 누락: sorafenib 복용량을 놓친 경우 다음 복용량은 정기적으로 예정된 시간에 복용해야 하며 복용량을 두 배로 늘리지 않도록 환자에게 지시하십시오. sorafenib을 너무 많이 복용한 경우 즉시 의료 서비스 제공자에게 연락하도록 환자에게 지시하십시오.
환자 정보
|
Sorafenib Tablets, USP (soe raf’ e nib) |
|
|
소라페닙 정제는 무엇입니까? 소라페닙 정제는 다음을 치료하는 처방약입니다.
소라페닙 정제가 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
|
다음과 같은 경우 소라페닙 정제를 복용하지 마십시오.
|
|
|
소라페닙 정제를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. 특히 와파린을 복용하는 경우 의료 서비스 제공자에게 알리십시오. |
|
|
소라페닙 정제는 어떻게 복용해야 합니까?
|
|
|
소라페닙 정제의 가능한 부작용은 무엇입니까? 소라페닙 정제는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
|
|
|
|
|
|
|
소라페닙 정의 가장 흔한 부작용은 다음과 같습니다. |
|
|
|
|
소라페닙 정은 남성의 생식력 문제를 유발할 수 있습니다. 이는 자녀를 낳는 능력에 영향을 미칠 수 있습니다. 이것이 걱정된다면 의료 서비스 제공자와 상담하십시오.
이것이 소라페닙 정의 가능한 모든 부작용은 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. 부작용은 FDA에 1-800-FDA-1088로 보고할 수 있습니다. |
|
|
소라페닙 정은 어떻게 보관해야 합니까?
소라페닙 정과 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|
|
소라페닙 정의 안전하고 효과적인 사용에 대한 일반 정보 의약품은 때때로 환자 정보 전단지에 나열된 것 이외의 목적으로 처방되는 경우가 있습니다. 소라페닙 정을 처방되지 않은 질환에 사용하지 마십시오. 다른 사람이 같은 증상을 보이더라도 소라페닙 정을 주지 마십시오. 그들에게 해로울 수 있습니다. 의료 서비스 제공자 또는 약사에게 의료 전문가를 위해 작성된 소라페닙 정에 대한 정보를 요청할 수 있습니다. |
|
|
소라페닙 정의 성분은 무엇입니까? 활성 성분: 소라페닙 토실레이트 비활성 성분: 카르복시메틸셀룰로오스 칼슘, 크로스카르멜로스 나트륨, 히프로멜로스, 마그네슘 스테아레이트, 미결정 셀룰로오스, 폴리에틸렌 글리콜, 적색 산화철, 나트륨 라우릴 설페이트 및 이산화티타늄.
제조업체: Mylan Pharmaceuticals Inc., Morgantown, WV 26505 U.S.A. 자세한 정보는 Mylan에 1-877-446-3679 (1-877-4-INFO-RX)로 문의하십시오. |
|
이 환자 정보는 미국 식품의약국(U.S. Food and Drug Administration)의 승인을 받았습니다.
제조:
Mylan Pharmaceuticals Inc.
Morgantown, WV 26505 U.S.A.
생산:
Natco Pharma Limited
Plot No.: 89 & 90, JNPC SEZ
Ramky Pharma City
Parawada, Visakhapatnam
Andhra Pradesh, India – 531019
40500541
개정일: 7/2024
NPLV:SORA:R3
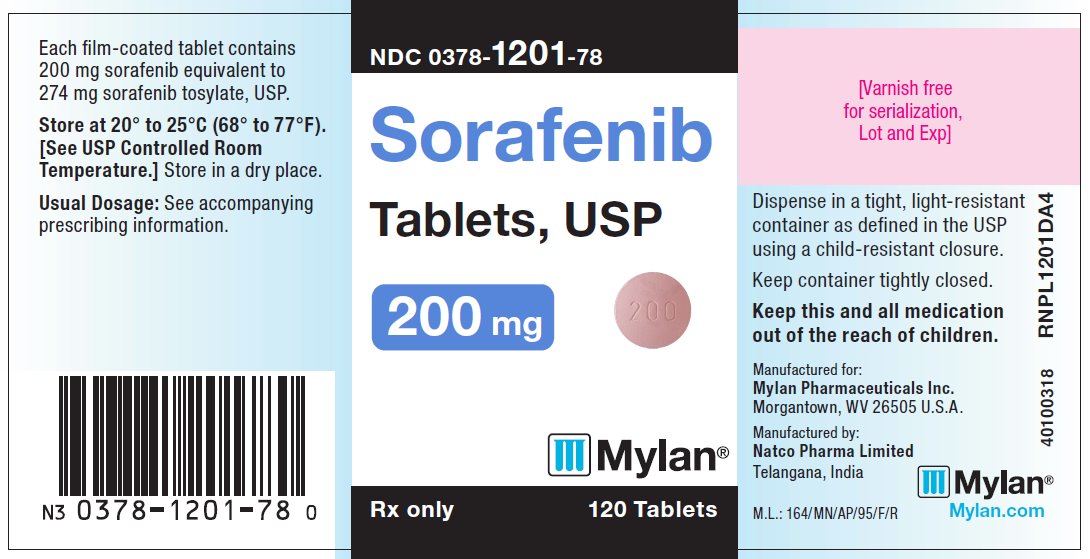
주 표시면 – 200 mg
NDC 0378-1201-78
Sorafenib
Tablets, USP
200 mg
Rx only 120 Tablets
Each film-coated tablet contains
200 mg sorafenib equivalent to
274 mg sorafenib tosylate, USP.
Store at 20° to 25°C (68° to 77°F).
[See USP Controlled Room
Temperature.] Store in a dry place.
Usual Dosage: See accompanying
prescribing information.
Dispense in a tight, light-resistant
container as defined in the USP
using a child-resistant closure.
Keep container tightly closed.
Keep this and all medication
out of the reach of children.
Manufactured for:
Mylan Pharmaceuticals Inc.
Morgantown, WV 26505 U.S.A.
Manufactured by:
Natco Pharma Limited
Visakhapatnam – 531019
AP, India
Mylan.com
M.L.: 18/VSP/AP/2018/F/G
40100226
RNPLV1201DA