의약품 제조업체: E.R. Squibb & Sons, L.L.C. (Updated: 2024-07-31)
처방 정보의 주요 내용
SPRYCEL (다사티닙) 정제, 경구 투여
미국 최초 승인: 2006
적응증 및 사용법
SPRYCEL은 다음 치료에 사용되는 키나아제 억제제입니다.
- •
- 만성기 필라델피아 염색체 양성(Ph+) 만성 골수성 백혈병(CML) 진단을 새로 받은 성인. (1, 14)
- •
- 이마티닙을 포함한 이전 치료에 내성이 있거나 내약성이 없는 만성, 가속 또는 골수 또는 림프아구성 폭발기 Ph+ CML 성인. (1, 14)
- •
- 이전 치료에 내성이 있거나 내약성이 없는 필라델피아 염색체 양성 급성 림프구성 백혈병(Ph+ ALL) 성인. (1, 14)
- •
- 만성기 Ph+ CML 소아 환자(1세 이상). (1, 14)
- •
- 화학 요법과 병용하여 새로 진단된 Ph+ ALL 소아 환자(1세 이상). (1, 14)
투여량 및 투여 방법
투여 형태 및 강도
정제: 20mg, 50mg, 70mg, 80mg, 100mg 및 140mg. (3)
금기 사항
없음. (4)
경고 및 주의 사항
- •
- 골수억제 및 출혈 사건: 심각한 혈소판 감소증, 호중구 감소증 및 빈혈이 발생할 수 있습니다. 혈소판 기능을 억제하는 약물 또는 항응고제와 병용하는 경우 주의하십시오. 혈액 검사를 정기적으로 모니터링하십시오. 필요에 따라 수혈을 하고 SPRYCEL 투여를 중단하십시오. (2.5, 5.1, 5.2)
- •
- 체액 저류: 때때로 심각한 흉막 삼출액을 포함한 체액 저류. 지지 요법 및/또는 용량 조절로 관리하십시오. (2.5, 5.3)
- •
- 심혈관 독성: 환자의 징후 또는 증상을 모니터링하고 적절히 치료하십시오. (5.4)
- •
- 폐동맥 고혈압(PAH): SPRYCEL은 PAH 발생 위험을 증가시킬 수 있으며, 이는 투여 중단 시 가역적일 수 있습니다. 기저 위험을 고려하고 치료 중에 PAH의 징후와 증상에 대해 환자를 평가하십시오. PAH가 확인되면 SPRYCEL 투여를 중단하십시오. (5.5)
- •
- QT 연장: QT 간격 연장이 있는 환자 또는 QT 간격 연장이 발생할 수 있는 환자에게 SPRYCEL을 주의하여 사용하십시오. (5.6)
- •
- 심각한 피부 반응: 심각한 점막 피부 반응이 보고되었습니다. (5.7)
- •
- 종양 용해 증후군: 종양 용해 증후군이 보고되었습니다. SPRYCEL 치료를 시작하기 전에 적절한 수분을 유지하고 요산 수치를 교정하십시오. (5.8)
- •
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 임신 가능성이 있는 환자에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임을 사용하도록 조언하십시오. (5.9, 8.1, 8.3)
- •
- 소아 환자의 성장 및 발달에 미치는 영향: 골단판 융합 지연, 골다공증, 성장 지연 및 유방 비대가 보고되었습니다. 소아 환자의 골 성장 및 발달을 모니터링하십시오. (5.10)
- •
- 간 독성: 치료 시작 전에 간 기능을 평가하고 그 후 매월 또는 임상적으로 필요에 따라 평가하십시오. 간 기능 장애와 관련된 화학 요법과 병용하는 경우 간 기능을 모니터링하십시오. (5.11)
부작용
단독 요법으로 SPRYCEL을 투여받은 환자에서 가장 흔한 부작용(≥15%)은 골수억제, 체액 저류 사건, 설사, 두통, 피부 발진, 출혈, 호흡 곤란, 피로, 메스꺼움 및 근골격통이었습니다. (6)
화학 요법과 병용하여 SPRYCEL을 투여받은 소아 환자에서 가장 흔한 부작용(≥30%)은 구내염, 발열성 호중구 감소증, 발열, 설사, 메스꺼움, 구토, 근골격통, 복통, 기침, 두통, 발진, 피로, 변비, 부정맥, 고혈압, 부종, 감염(세균성, 바이러스성 및 진균성), 저혈압, 식욕 감소, 과민 반응, 호흡 곤란, 코피, 말초 신경병증 및 의식 변화였습니다. (6)
의심되는 부작용을 보고하려면 Bristol-Myers Squibb에 1-800-721-5072 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2024년 7월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법
2 용량 및 투여
2.1 성인 환자에서 SPRYCEL의 용량
2.2 CML 또는 Ph+ ALL 소아 환자에서 SPRYCEL의 용량
2.3 용량 수정
2.4 CML 및 Ph+ ALL 성인 환자와 CML 소아 환자에서 용량 증량
2.5 이상반응에 대한 용량 조절
2.6 치료 기간
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 골수억제
5.2 출혈 관련 사건
5.3 체액 저류
5.4 심혈관 독성
5.5 폐동맥 고혈압
5.6 QT 연장
5.7 중증 피부 반응
5.8 종양 용해 증후군
5.9 태아 독성
5.10 소아 환자의 성장 및 발달에 미치는 영향
5.11 간독성
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 다른 약물이 다사티닙에 미치는 영향
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 가임기 여성 및 남성
8.4 소아 사용
8.5 노인 사용
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 새롭게 진단된 성인의 만성기 CML
14.2 이매티닙 내성 또는 불내성 CML 또는 성인의 Ph+ ALL
14.3 소아 환자의 CML
14.4 소아 환자의 Ph+ ALL
15 참고 문헌
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
SPRYCEL (다사티닙)은 다음과 같은 성인 환자의 치료에 사용됩니다.
- •
- 만성기 새로 진단된 필라델피아 염색체 양성 (Ph+) 만성 골수성 백혈병 (CML).
- •
- 이마티닙을 포함한 이전 치료에 내성 또는 불내성이 있는 만성, 가속 또는 골수 또는 림프아구성 폭발기 Ph+ CML.
- •
- 이전 치료에 내성 또는 불내성이 있는 필라델피아 염색체 양성 급성 림프구성 백혈병 (Ph+ ALL).
SPRYCEL (다사티닙)은 다음과 같은 1세 이상의 소아 환자의 치료에 사용됩니다.
- •
- 만성기 Ph+ CML.
- •
- 화학 요법과 병용하여 새로 진단된 Ph+ ALL.
2 투여 및 관리
2.1 성인 환자에서 SPRYCEL 복용량
성인의 만성기 CML에 대한 SPRYCEL의 권장 시작 용량은 1일 1회 100mg을 경구 투여하는 것입니다. 가속기 CML, 골수성 또는 림프성 모구성 CML 또는 성인의 Ph+ ALL에 대한 SPRYCEL의 권장 시작 용량은 1일 1회 140mg을 경구 투여하는 것입니다. 정제는 부수거나, 자르거나, 씹어서는 안 됩니다. 정제는 통째로 삼켜야 합니다. SPRYCEL은 아침이나 저녁에 식사와 함께 또는 식사 없이 복용할 수 있습니다.
2.2 CML 또는 Ph+ ALL 소아 환자에서 SPRYCEL 복용량
소아에 대한 권장 시작 용량은 표 1과 같이 체중을 기준으로 합니다. 권장 용량은 음식과 함께 또는 음식 없이 1일 1회 경구 투여해야 합니다. 3개월마다 또는 필요한 경우 체중 변화에 따라 용량을 다시 계산하십시오.
정제를 부수거나, 자르거나, 씹지 마십시오. 정제는 통째로 삼키십시오. 정제를 통째로 삼키는 데 어려움을 겪는 소아 환자의 경우 추가 투여 고려 사항이 있습니다. [특정 집단에서의 사용(8.4) 및 임상 약리학(12.3) 참조].
| 체중(kg)b | 1일 복용량(mg) |
|---|---|
| a Ph+ ALL 소아 환자의 경우 진단이 확인되면 유도 화학 요법 15일째 또는 그 이전에 SPRYCEL 치료를 시작하고 2년 동안 계속합니다. b 체중이 10kg 미만인 환자에게는 정제 복용을 권장하지 않습니다. |
|
|
10 ~ 20 미만 |
40mg |
|
20 ~ 30 미만 |
60mg |
|
30 ~ 45 미만 |
70mg |
|
45 이상 |
100mg |
2.4절에서 성인 CML 및 Ph+ ALL 환자와 소아 CML 환자의 용량 증량 권장 사항을 참조하십시오.
2.3 용량 수정
강력한 CYP3A4 유도제
강력한 CYP3A4 유도제 및 세인트존스워트와의 병용을 피하십시오. 환자에게 강력한 CYP3A4 유도제를 병용 투여해야 하는 경우 SPRYCEL 용량 증량을 고려하십시오. SPRYCEL의 용량을 증량하는 경우 독성에 대해 환자를 주의 깊게 모니터링하십시오. [ 약물 상호 작용 (7.1)]를 참조하십시오.
강력한 CYP3A4 억제제
강력한 CYP3A4 억제제 및 자몽 주스와의 병용을 피하십시오. 가능하면 효소 억제 가능성이 없거나 최소화된 다른 병용 약물을 선택하는 것이 좋습니다. SPRYCEL을 강력한 CYP3A4 억제제와 함께 투여해야 하는 경우 다음과 같이 용량 감소를 고려하십시오.
• SPRYCEL 140mg을 매일 복용하는 환자의 경우 매일 40mg.
• SPRYCEL 100mg을 매일 복용하는 환자의 경우 매일 20mg.
• SPRYCEL 70mg을 매일 복용하는 환자의 경우 매일 20mg.
SPRYCEL 60mg 또는 40mg을 매일 복용하는 환자의 경우 억제제를 중단할 때까지 SPRYCEL을 중단하는 것을 고려하십시오. 억제제를 중단한 후 약 1주일의 휴약 기간을 두었다가 SPRYCEL을 다시 시작하십시오.
이러한 SPRYCEL 감량은 CYP3A4 억제제 없이 관찰된 범위로 곡선 아래 면적(AUC)을 조정할 것으로 예상되지만, 강력한 CYP3A4 억제제를 투여받는 환자에서 이러한 용량 조정에 대한 임상 데이터는 없습니다. 용량 감소 후 SPRYCEL을 견딜 수 없는 경우 강력한 CYP3A4 억제제를 중단하거나 억제제를 중단할 때까지 SPRYCEL을 중단하십시오. 억제제를 중단한 후 약 1주일의 휴약 기간을 두었다가 SPRYCEL 용량을 증량하십시오. [약물 상호 작용 (7.1)]를 참조하십시오.
2.4 CML 및 Ph+ ALL 성인 환자와 CML 소아 환자의 용량 증량
CML 및 Ph+ ALL 성인 환자의 경우 권장 시작 용량에서 혈액학적 또는 세포유전학적 반응을 달성하지 못한 환자는 하루에 한 번 140mg(만성기 CML) 또는 하루에 한 번 180mg(진행성 CML 및 Ph+ ALL)으로 용량 증량을 고려하십시오. CML 소아 환자의 경우 하루에 한 번 120mg으로 용량 증량을 고려하십시오(아래 표 2 참조). SPRYCEL을 화학 요법과 병용 투여하는 Ph+ ALL 소아 환자에게는 용량 증량이 권장되지 않습니다.
권장 시작 용량에서 혈액학적 또는 세포유전학적 반응을 달성하지 못한 만성기 CML 소아 환자의 경우 표 2에 표시된 대로 SPRYCEL 용량을 증량하십시오.
|
제형 |
용량(1일 최대 용량) |
|
|
시작 용량 |
증량 |
|
|
정제 |
40mg |
50mg |
|
60mg |
70mg |
|
|
70mg |
90mg |
|
|
100mg |
120mg |
|
2.5 이상반응에 대한 용량 조절
골수억제
임상 연구에서 골수억제는 용량 중단, 용량 감소 또는 연구 치료 중단으로 관리했습니다. 조혈 성장 인자는 내성 골수억제가 있는 환자에게 사용되었습니다. 성인 및 소아 환자에 대한 용량 수정 지침은 각각 표 3과 표 4에 요약되어 있습니다.
| * ANC: 절대 호중구 수 | ||
|
만성기 CML (시작 용량 1일 1회 100mg) |
ANC* <0.5 × 109/L |
|
|
가속기 CML, 급성기 CML 및 Ph+ ALL (시작 용량 1일 1회 140mg) |
ANC* <0.5 × 109/L |
|
| *ANC: 절대 호중구 수 ** 더 낮은 용량의 정제는 사용할 수 없음 |
||||
|
||||
|
1. 혈구감소증이 3주 이상 지속되면 혈구감소증이 백혈병과 관련이 있는지 확인합니다(골수 천자 또는 생검). 2. 혈구감소증이 백혈병과 관련이 없는 경우 ANC* ≥1.0 × 109/L 및 혈소판 ≥75 × 109/L에 도달할 때까지 SPRYCEL 투여를 중단하고 원래 시작 용량 또는 감량된 용량으로 재개합니다. 3. 혈구감소증이 재발하면 골수 천자/생검을 반복하고 감량된 용량으로 SPRYCEL을 재개합니다. |
|
|
|
|
|
정제 |
|
|
|
|
|
|
|
||
|
|
|
||
|
|
|
||
만성기 CML 소아 환자의 경우, 완전 혈액학적 반응(CHR) 중에 3등급 이상의 호중구 감소증이나 혈소판 감소증이 재발하면 SPRYCEL 투여를 중단하고 감량하여 재개합니다. 필요에 따라 중간 정도의 혈구 감소증 및 질병 반응에 대해 일시적으로 용량을 감량합니다.
Ph+ ALL 소아 환자의 경우, 호중구 감소증 및/또는 혈소판 감소증으로 인해 다음 치료 단계가 14일 이상 지연되면 SPRYCEL 투여를 중단하고 다음 치료 단계가 시작되면 동일한 용량 수준으로 재개합니다. 호중구 감소증 및/또는 혈소판 감소증이 지속되고 다음 치료 단계가 7일 더 지연되면 골수 평가를 수행하여 세포충실도와 모세포 비율을 평가합니다. 골수 세포충실도가 <10%이면 ANC가 >500/μL(0.5 x 109/L)가 될 때까지 SPRYCEL 치료를 중단하고, 이때 전체 용량으로 치료를 재개할 수 있습니다. 골수 세포충실도가 >10%이면 SPRYCEL 치료 재개를 고려할 수 있습니다.
비혈액학적 이상반응
Ph+ CML 및 ALL 성인 환자와 Ph+ CML 소아 환자의 경우, SPRYCEL 사용으로 심각한 비혈액학적 이상반응이 발생하면 이상반응이 해결되거나 개선될 때까지 치료를 보류해야 합니다. 그 후, 중증도 및 재발에 따라 감량된 용량으로 적절하게 치료를 재개할 수 있습니다 [경고 및 주의사항(5) 참조].
Ph+ ALL 소아 환자의 경우, 간 기능 검사 이상을 제외하고 3등급 이상의 비혈액학적 이상반응이 발생하면 치료를 중단하고 1등급 이하로 해결되면 감량하여 재개합니다. 직접 빌리루빈 수치가 기관의 정상 상한치(ULN)의 5배를 초과하는 경우, 기준치 또는 1등급 이하로 개선될 때까지 치료를 중단합니다. AST/ALT 수치가 기관 ULN의 15배를 초과하는 경우, 기준치 또는 1등급 미만으로 개선될 때까지 치료를 중단합니다. 위와 같이 간 기능 검사 이상이 재발하는 경우, SPRYCEL을 다시 시작한 후 이러한 이상반응이 재발하면 용량을 줄입니다. 용량 감량 권장 사항은 표 5에 설명되어 있습니다.
| ** 더 낮은 용량의 정제는 사용할 수 없음 | ||||
|
용량(1일 최대 용량) |
||||
|
1. 2등급의 비혈액학적 독성이 발생하는 경우, 증상 치료에도 회복되지 않으면 SPRYCEL 투여 중단을 고려합니다. 1등급 이하로 회복되면 원래 시작 용량으로 재개합니다. 재발 시에는 SPRYCEL을 감량하여 재개합니다. 2. 3등급의 비혈액학적 독성이 발생하는 경우, 1등급 이하로 회복될 때까지 SPRYCEL을 중단한 다음 감량하여 재개합니다. 3. 직접 빌리루빈이 >5 ULN이거나 AST/ALT가 >15 ULN인 경우, 1등급 이하로 회복될 때까지 SPRYCEL을 중단한 다음 원래 시작 용량으로 SPRYCEL을 재개합니다. 간독성이 재발하는 경우 SPRYCEL을 감량하여 재개합니다. |
원래 시작 용량 |
1단계 용량 감량 |
2단계 용량 감량 |
|
|
정제 |
40mg |
20mg |
** |
|
|
60mg |
40mg |
20mg |
||
|
70mg |
60mg |
50mg |
||
|
100mg |
80mg |
70mg |
||
2.6 치료 기간
임상 연구에서 만성기 CML 성인 및 소아 환자에 대한 SPRYCEL 치료는 질병이 진행되거나 환자가 더 이상 견딜 수 없을 때까지 계속되었습니다. 세포유전학적 반응(완전 세포유전학적 반응[CCyR] 포함) 또는 주요 분자 유전학적 반응(MMR 및 MR4.5)을 달성한 후 치료 중단이 장기적인 질병 결과에 미치는 영향은 확립되지 않았습니다.
임상 연구에서 Ph+ ALL 소아 환자에 대한 SPRYCEL 치료는 최대 2년 동안 투여되었습니다 [용량 및 투여(2.2) 및 임상 연구(14.4) 참조].
SPRYCEL은 유해 제품입니다. 해당되는 특수 취급 및 폐기 절차를 따르십시오.1
3 제형 및 함량
SPRYCEL (다사티닙) 정제는 20mg, 50mg, 70mg, 80mg, 100mg 및 140mg의 백색에서 거의 백색의 양쪽 볼록, 필름 코팅 정제로 제공됩니다.
4 금기사항
없음.
5 경고 및 주의사항
5.1 골수억제
SPRYCEL 치료는 심각한 (NCI CTCAE 등급 3 또는 4) 혈소판 감소증, 호중구 감소증 및 빈혈과 관련이 있으며, 만성기 CML 환자보다 진행된 CML 또는 Ph+ ALL 환자에서 더 일찍 그리고 더 자주 발생합니다 [유해 반응 (6.1) 참조].
만성기 CML 환자의 경우, 처음 12주 동안 2주마다 완전 혈구 수 (CBC)를 실시하고, 그 이후에는 3개월마다 또는 임상적으로 필요한 경우 실시합니다. 진행된 CML 또는 Ph+ ALL 환자의 경우, 처음 2개월 동안 매주 CBC를 실시하고, 그 이후에는 매월 또는 임상적으로 필요한 경우 실시합니다.
화학 요법과 함께 SPRYCEL로 치료받는 Ph+ ALL 소아 환자의 경우, 각 화학 요법 블록 시작 전과 임상적으로 필요한 경우 CBC를 실시합니다. 화학 요법 통합 블록 동안에는 회복될 때까지 2일마다 CBC를 실시합니다.
골수억제는 일반적으로 가역적이며, 일반적으로 SPRYCEL을 일시적으로 중단하거나 용량을 감소시켜 관리합니다 [용량 및 투여 (2.5) 참조].
5.2 출혈 관련 사건
SPRYCEL은 심각하고 치명적인 출혈을 유발할 수 있습니다. 모든 CML 또는 Ph+ ALL 임상 연구에서, SPRYCEL을 투여받은 환자의 <1%에서 사망을 포함한 등급 ≥3 중추 신경계 (CNS) 출혈이 발생했습니다. 등급 3/4 출혈의 발생률은 성인 환자의 5.8%에서 발생했으며, 일반적으로 치료 중단 및 수혈이 필요했습니다. 등급 5 출혈의 발생률은 성인 환자의 0.4%에서 발생했습니다. 출혈의 가장 흔한 부위는 위장관이었습니다 [유해 반응 (6.1) 참조]. 임상 연구에서 발생한 대부분의 출혈 사건은 심각한 혈소판 감소증과 관련이 있었습니다. 다사티닙은 인간 피험자에서 혈소판 감소증을 유발하는 것 외에도 시험관 내에서 혈소판 기능 장애를 유발했습니다.
혈소판 기능을 억제하는 동반 약물 또는 항응고제는 출혈 위험을 증가시킬 수 있습니다.
5.3 체액 저류
SPRYCEL은 체액 저류를 유발할 수 있습니다 [유해 반응 (6.1) 참조]. 성인 무작위 새로 진단된 만성기 CML 연구(n=258)에서 5년 추적 관찰 후, 등급 3 또는 4 체액 저류가 환자의 5%에서 보고되었으며, 이 중 3%는 등급 3 또는 4 흉막 삼출이 있었습니다. 새로 진단된 또는 이마티닙 내성 또는 불내성 만성기 CML이 있는 성인 환자의 경우, 권장 용량으로 SPRYCEL을 투여받은 환자(n=548)의 6%에서 등급 3 또는 4 체액 저류가 발생했습니다. 진행된 CML 또는 Ph+ ALL이 있는 성인 환자의 경우, 권장 용량으로 SPRYCEL을 투여받은 환자(n=304)의 8%에서 등급 3 또는 4 체액 저류가 보고되었으며, 이 중 7%는 등급 3 또는 4 흉막 삼출이 보고되었습니다. 만성기 CML 소아 환자의 경우, 등급 1 또는 2 체액 저류가 환자의 10.3%에서 보고되었습니다.
흉막 삼출 또는 기타 체액 저류의 증상(예: 운동 시 또는 안정 시 새롭게 발생하거나 악화된 호흡 곤란, 흉막통 또는 마른 기침)이 나타나는 환자는 흉부 X선 또는 적절한 추가 진단 영상 검사를 통해 신속하게 평가해야 합니다. 체액 저류 사건은 일반적으로 이뇨제 또는 단기간 스테로이드를 포함한 지지 요법으로 관리되었습니다. 심각한 흉막 삼출은 흉막 천자 및 산소 요법이 필요할 수 있습니다. 용량 감소 또는 치료 중단을 고려해야 합니다 [용량 및 투여 (2.5) 참조].
5.4 심혈관 독성
SPRYCEL은 심장 기능 장애를 유발할 수 있습니다 [유해 반응 (6.1) 참조]. 성인에서 무작위 새로 진단된 만성기 CML 임상 시험(n=258)에서 5년 추적 관찰 후, 다음과 같은 심장 유해 반응이 발생했습니다. 심장 허혈성 사건(다사티닙 3.9% 대 이마티닙 1.6%), 심장 관련 체액 저류(다사티닙 8.5% 대 이마티닙 3.9%), 전도계 이상(가장 흔하게 부정맥 및 두근거림)(다사티닙 7.0% 대 이마티닙 5.0%). 이마티닙으로 인해 말초 동맥 폐색 질환이 2건(0.8%) 발생했고, 다사티닙으로 인해 일과성 허혈 발작이 2건(0.8%) 발생했습니다. 심장 기능 장애와 일치하는 징후나 증상이 있는 환자를 모니터링하고 적절하게 치료해야 합니다.
5.5 폐동맥 고혈압
SPRYCEL은 성인 및 소아 환자에서 폐동맥 고혈압(PAH) 발생 위험을 증가시킬 수 있으며, 치료 시작 후 언제든지 발생할 수 있으며, 치료 시작 후 1년 이상 경과한 후에도 발생할 수 있습니다. 증상으로는 호흡 곤란, 피로, 저산소증 및 체액 저류가 있습니다 [유해 반응 (6.1) 참조]. PAH는 SPRYCEL을 중단하면 가역적일 수 있습니다. SPRYCEL을 시작하기 전과 치료 중에 환자를 기저 심폐 질환의 징후와 증상에 대해 평가해야 합니다. PAH가 확인되면 SPRYCEL을 영구적으로 중단해야 합니다.
5.6 QT 연장
SPRYCEL은 저칼륨혈증 또는 저마그네슘혈증이 있는 환자, 선천적 장 QT 증후군이 있는 환자, 항부정맥제 또는 QT 연장을 유발하는 다른 의약품을 복용하는 환자, 그리고 누적 고용량 안트라사이클린 요법을 받은 환자를 포함한 환자에서 QTc 연장 위험을 증가시킬 수 있습니다 [유해 반응 (6.1) 참조]. SPRYCEL 투여 전후로 저칼륨혈증 또는 저마그네슘혈증을 교정해야 합니다.
5.7 심각한 피부 반응
스프라이셀로 치료받은 환자에서 스티븐스-존슨 증후군 [부작용 (6.2) 참조] 및 다형 홍반을 포함한 심각한 점막 피부 반응이 보고되었습니다. 치료 중 심각한 점막 피부 반응이 발생한 환자에서 다른 원인을 찾을 수 없으면 스프라이셀을 영구적으로 중단하십시오.
5.8 종양 용해 증후군
종양 용해 증후군은 이전 이마티닙 치료에 내성이 있는 환자, 특히 진행된 질환 단계에서 보고되었습니다. 종양 용해 증후군의 가능성 때문에, 스프라이셀 치료를 시작하기 전에 적절한 수분 공급을 유지하고, 요산 수치를 교정하고, 전해질 수치를 모니터링하십시오. 진행된 질환 단계 및/또는 종양 부담이 높은 환자는 위험이 증가할 수 있으며 더 자주 모니터링해야 합니다 [부작용 (6.1) 참조].
5.9 배아-태아 독성
제한적인 인체 데이터를 기반으로, 스프라이셀은 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 스프라이셀의 부작용은 태아 수종, 태아 백혈구 감소증 및 태아 혈소판 감소증을 포함하며, 스프라이셀에 대한 모체 노출과 관련하여 보고되었습니다. 임신 가능성이 있는 여성과 임신 가능성이 있는 여성 파트너가 있는 남성에게는 스프라이셀 치료 중 및 마지막 투여 후 30일 동안 효과적인 피임법을 사용하도록 조언하십시오 [특정 환자군에서의 사용 (8.1, 8.3) 참조].
5.10 소아 환자의 성장 및 발달에 대한 영향
최소 2년 이상 스프라이셀로 치료받은 만성기 CML 소아 환자를 대상으로 한 임상 시험에서 5명(5.2%)의 환자에게 뼈 성장 및 발달과 관련된 부작용이 보고되었으며, 그 중 1건은 중증도(성장 지연 3등급)였습니다. 이 5건의 사례에는 골단 연골 유합 지연, 골감소증, 성장 지연 및 유방 비대가 포함되었습니다 [부작용 (6.1) 및 특정 환자군에서의 사용 (8.4) 참조]. 이 5건의 사례 중 골감소증 1건과 유방 비대 1건은 치료 중에 해결되었습니다.
소아 환자의 뼈 성장 및 발달을 모니터링하십시오.
5.11 간 독성
스프라이셀은 빌리루빈, 아스파르테이트 아미노트랜스퍼라제(AST), 알라닌 아미노트랜스퍼라제(ALT) 및 알칼리성 포스파타제 수치 상승으로 측정된 간 독성을 유발할 수 있습니다 [부작용 (6.1) 참조]. 치료 중에 기준선 및 매월 또는 임상적으로 필요에 따라 트랜스아미나제를 모니터링하십시오. 중증도에 따라 스프라이셀 용량을 줄이거나, 투여를 중단하거나, 영구적으로 중단하십시오 [용법 및 용량 (2.5) 참조]. 스프라이셀을 화학 요법과 병용하여 투여할 경우, 트랜스아미나제 상승 및 고빌리루빈혈증 형태의 간 독성이 관찰되었습니다. 스프라이셀을 화학 요법과 병용하여 사용할 경우 간 기능을 모니터링하십시오.
6 부작용
다음 임상적으로 유의미한 유해 반응은 라벨의 다른 섹션에서 자세히 설명됩니다.
- •
- 골수억제 [투여 및 관리 (2.5) 및 경고 및 주의 사항 (5.1) 참조].
- •
- 출혈 관련 사건 [경고 및 주의 사항 (5.2) 참조].
- •
- 체액 저류 [경고 및 주의 사항 (5.3) 참조].
- •
- 심혈관 독성 [경고 및 주의 사항 (5.4) 참조].
- •
- 폐동맥 고혈압 [경고 및 주의 사항 (5.5) 참조].
- •
- QT 연장 [경고 및 주의 사항 (5.6) 참조].
- •
- 심각한 피부 반응 [경고 및 주의 사항 (5.7) 참조].
- •
- 종양 용해 증후군 [경고 및 주의 사항 (5.8) 참조].
- •
- 소아 환자의 성장 및 발달에 대한 영향 [경고 및 주의 사항 (5.10) 참조].
- •
- 간 독성 [경고 및 주의 사항 (5.11) 참조].
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
아래에 설명된 데이터는 임상 연구에서 테스트된 모든 용량으로 단독 요법으로 투여된 SPRYCEL에 대한 노출을 반영하며, 여기에는 새로 진단된 만성기 CML이 있는 성인 환자 324명, 이마티닙에 내성이 있거나 이마티닙을 견디지 못하는 만성기 또는 진행기 CML 또는 Ph+ ALL이 있는 성인 환자 2388명, 그리고 만성기 CML이 있는 소아 환자 97명이 포함됩니다. 총 2712명의 성인 환자에서 치료 기간의 중앙값은 19.2개월(범위 0~93.2개월)이었습니다. 새로 진단된 만성기 CML 환자를 대상으로 한 무작위 배정 시험에서 치료 기간의 중앙값은 약 60개월이었습니다. 만성기 CML이 있는 1618명의 성인 환자에서 치료 기간의 중앙값은 29개월(범위 0~92.9개월)이었습니다.
진행기 CML 또는 Ph+ ALL이 있는 1094명의 성인 환자에서 치료 기간의 중앙값은 6.2개월(범위 0~93.2개월)이었습니다.
만성기 CML이 있는 97명의 소아 환자(새로 진단된 환자 51명, 이마티닙으로 이전 치료에 내성이 있거나 견디지 못하는 환자 46명)를 대상으로 한 두 건의 비무작위 배정 시험에서 치료 기간의 중앙값은 51.1개월(범위 1.9~99.6개월)이었습니다.
총 2712명의 성인 환자 모집단에서 88%의 환자가 언젠가 유해 반응을 경험했고 19%의 환자가 치료 중단으로 이어지는 유해 반응을 경험했습니다.
새로 진단된 만성기 CML이 있는 성인 환자를 대상으로 한 무작위 배정 시험에서 최소 60개월의 추적 관찰 후 유해 반응으로 인해 약물이 중단된 환자는 16%였습니다. 최소 60개월의 추적 관찰 후 누적 중단율은 39%였습니다. 만성기 CML이 있는 1618명의 환자 중 치료 중단으로 이어지는 약물 관련 유해 반응은 329명(20.3%)의 환자에게서 보고되었고, 진행기 CML 또는 Ph+ ALL이 있는 1094명의 환자 중 치료 중단으로 이어지는 약물 관련 유해 반응은 191명(17.5%)의 환자에게서 보고되었습니다.
97명의 소아 대상자 중 치료 중단으로 이어지는 약물 관련 유해 반응은 1명(1%)에게서 보고되었습니다.
약 60개월의 추적 관찰 중앙값에서 새로 진단된 만성기 CML이 있는 성인 환자의 10% 이상에서 보고된 유해 반응과 다른 관심 있는 유해 반응은 표 6에 제시되어 있습니다.
이전 이마티닙 치료에 내성이 있거나 견디지 못하는 만성기 CML 환자를 대상으로 한 무작위 배정 용량 최적화 시험에서 약 84개월의 추적 관찰 중앙값에서 하루 1회 100mg의 권장 용량으로 치료받은 성인 환자의 10% 이상에서 보고된 유해 반응과 다른 관심 있는 유해 반응은 표 8에 제시되어 있습니다.
약 51.1개월의 추적 관찰 중앙값에서 소아 환자의 10% 이상에서 보고된 유해 반응은 표 11에 제시되어 있습니다.
새로 진단된 만성기 CML이 있는 환자를 대상으로 한 무작위 배정 시험에서 성인 환자의 16.7%에게 약물 관련 심각한 유해 반응(SAR)이 보고되었습니다. 환자의 5% 이상에서 보고된 심각한 유해 반응에는 흉막 삼출(5%)이 포함되었습니다.
이전 이마티닙 치료에 내성이 있거나 견디지 못하는 성인 환자를 대상으로 한 무작위 배정 용량 최적화 시험에서 하루 1회 100mg의 권장 용량으로 치료받은 환자의 26.1%에게 약물 관련 SAR이 보고되었습니다. 환자의 5% 이상에서 보고된 심각한 유해 반응에는 흉막 삼출(10%)이 포함되었습니다.
소아 환자의 14.4%에게 약물 관련 SAR이 보고되었습니다.
만성 골수성 백혈병(CML)
새로 진단된 만성기 CML 환자의 경우 표 6에, 이전 이마티닙 치료에 내성이 있거나 견디지 못하는 CML 환자의 경우 표 8과 10에 성인 환자의 10% 이상에서 보고된 유해 반응(실험실 이상 제외)이 표시되어 있습니다.
| 모든 등급 | 3/4등급 | |||
|---|---|---|---|---|
| SPRYCEL (n=258) |
Imatinib (n=258) |
SPRYCEL (n=258) |
Imatinib (n=258) |
|
| Adverse Reaction | Percent (%) of Patients | |||
| a Includes cardiac failure acute, cardiac failure congestive, cardiomyopathy, diastolic dysfunction, ejection fraction decreased, and left ventricular dysfunction. b Includes erythema, erythema multiforme, rash, rash generalized, rash macular, rash papular, rash pustular, skin exfoliation, and rash vesicular. c Adverse reaction of special interest with <10% frequency. d Includes conjunctival hemorrhage, ear hemorrhage, ecchymosis, epistaxis, eye hemorrhage, gingival bleeding, hematoma, hematuria, hemoptysis, intra-abdominal hematoma, petechiae, scleral hemorrhage, uterine hemorrhage, and vaginal hemorrhage. |
||||
|
체액 저류 |
38 |
45 |
5 |
1 |
|
흉막 삼출 |
28 |
1 |
3 |
0 |
|
국소 표재성 부종 |
14 |
38 |
0 |
<1 |
|
폐 고혈압 |
5 |
<1 |
1 |
0 |
|
전신 부종 |
4 |
7 |
0 |
0 |
|
심낭 삼출 |
4 |
1 |
1 |
0 |
|
울혈성 심부전/심장 기능 장애a |
2 |
1 |
<1 |
<1 |
|
폐 부종 |
1 |
0 |
0 |
0 |
|
설사 |
22 |
23 |
1 |
1 |
|
근골격계 통증 |
14 |
17 |
0 |
<1 |
|
발진b |
14 |
18 |
0 |
2 |
|
두통 |
14 |
11 |
0 |
0 |
|
복통 |
11 |
8 |
0 |
1 |
|
피로 |
11 |
12 |
<1 |
0 |
|
메스꺼움 |
10 |
25 |
0 |
0 |
|
근육통 |
7 |
12 |
0 |
0 |
|
관절통 |
7 |
10 |
0 |
<1 |
|
출혈c |
8 |
8 |
1 |
1 |
|
위장관 출혈 |
2 |
2 |
1 |
0 |
|
기타 출혈d |
6 |
6 |
0 |
<1 |
|
CNS 출혈 |
<1 |
<1 |
0 |
<1 |
|
구토 |
5 |
12 |
0 |
0 |
|
근육 경련 |
5 |
21 |
0 |
<1 |
SPRYCEL로 치료받은 새로 진단받은 만성기 CML 환자의 무작위 임상 시험에서 최소 1년 및 5년 추적 관찰 기간 동안 10% 이상의 환자에게 보고된 유해 반응의 누적 비율 비교는 표 7에 나와 있습니다.
| 최소 1년 추적 관찰 | 최소 5년 추적 관찰 | |||
|---|---|---|---|---|
| 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 | |
| 유해 반응 | 환자 비율(%) | |||
| a 심장 부전 급성, 심장 부전 울혈성, 심근병증, 이완기 기능 장애, 박출 분율 감소 및 좌심실 기능 장애를 포함합니다. b 홍반, 다형성 홍반, 발진, 발진 전반, 발진 구진성, 발진 구진성, 발진 농포성, 피부 박리 및 발진 수포성을 포함합니다. |
||||
|
체액 저류 |
19 |
1 |
38 |
5 |
|
흉막 삼출 |
10 |
0 |
28 |
3 |
|
국소 표재성 부종 |
9 |
0 |
14 |
0 |
|
폐 고혈압 |
1 |
0 |
5 |
1 |
|
전신 부종 |
2 |
0 |
4 |
0 |
|
심낭 삼출 |
1 |
<1 |
4 |
1 |
|
울혈성 심부전/심장 |
2 |
<1 |
2 |
<1 |
|
폐 부종 |
<1 |
0 |
1 |
0 |
|
설사 |
17 |
<1 |
22 |
1 |
|
근골격계 통증 |
11 |
0 |
14 |
0 |
|
발진b |
11 |
0 |
14 |
0 |
|
두통 |
12 |
0 |
14 |
0 |
|
복통 |
7 |
0 |
11 |
0 |
|
피로 |
8 |
<1 |
11 |
<1 |
|
메스꺼움 |
8 |
0 |
10 |
0 |
60개월 시점에서, 다사티닙 치료 환자 26명(10.1%)과 이마티닙 치료 환자 26명(10.1%)에서 사망이 발생했습니다. 각 그룹에서 1명의 사망은 연구 치료와 관련이 있다고 연구자에 의해 평가되었습니다.
| a 약물 발진, 홍반, 다형성 홍반, 홍반증, 박탈성 발진, 전신 홍반, 생식기 발진, 열 발진, 밀리아, 발진, 홍반성 발진, 모낭성 발진, 전신 발진, 반점 발진, 반점 구진성 발진, 구진성 발진, 가려움증을 동반한 발진, 농포성 발진, 피부 박탈, 피부 자극, 수포성 두드러기, 수포성 발진 포함. | ||
|
|
1일 1회 100mg |
|
|
|
만성 |
|
|
이상 반응 |
모든 등급 |
3/4등급 |
|
환자 비율 (%) |
||
|
체액 저류 |
48 |
7 |
|
국소 표재성 부종 |
22 |
0 |
|
흉막 삼출 |
28 |
5 |
|
전신 부종 |
4 |
0 |
|
심낭 삼출 |
3 |
1 |
|
폐 고혈압 |
2 |
1 |
|
두통 |
33 |
1 |
|
설사 |
28 |
2 |
|
피로 |
26 |
4 |
|
호흡 곤란 |
24 |
2 |
|
근골격계 통증 |
22 |
2 |
|
메스꺼움 |
18 |
1 |
|
피부 발진a |
18 |
2 |
|
근육통 |
13 |
0 |
|
관절통 |
13 |
1 |
|
감염 (세균성, 바이러스성, 진균성, |
13 |
1 |
|
복통 |
12 |
1 |
|
출혈 |
12 |
1 |
|
위장관 출혈 |
2 |
1 |
|
가려움증 |
12 |
1 |
|
통증 |
11 |
1 |
|
변비 |
10 |
1 |
이마티닙에 내성이 있거나 이마티닙을 견디지 못하는 만성기 CML 환자를 대상으로 한 무작위 용량 최적화 시험에서 100mg 1일 1회 권장 시작 용량으로 치료받은 환자에서 시간 경과에 따라 보고된 선택된 유해 반응의 누적 비율은 표 9에 나와 있습니다.
| 최소 2년 추적 관찰 | 최소 5년 추적 관찰 | 최소 7년 추적 관찰 | ||||
|---|---|---|---|---|---|---|
| 유해 반응 | 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 | 모든 등급 | 3/4등급 |
| 환자 비율 (%) | ||||||
| a 100mg 1일 1회 권장 시작 용량 (n=165) 모집단에서 보고된 무작위 용량 최적화 시험 결과. | ||||||
|
설사 |
27 |
2 |
28 |
2 |
28 |
2 |
|
체액 저류 |
34 |
4 |
42 |
6 |
48 |
7 |
|
표재성 부종 |
18 |
0 |
21 |
0 |
22 |
0 |
|
흉막 삼출 |
18 |
2 |
24 |
4 |
28 |
5 |
|
전신 부종 |
3 |
0 |
4 |
0 |
4 |
0 |
|
심낭 삼출 |
2 |
1 |
2 |
1 |
3 |
1 |
|
폐 고혈압 |
0 |
0 |
0 |
0 |
2 |
1 |
|
출혈 |
11 |
1 |
11 |
1 |
12 |
1 |
|
위장관 출혈 |
2 |
1 |
2 |
1 |
2 |
1 |
| a 심실 기능 장애, 심장 부전, 심장 부전 울혈, 심근병증, 울혈성 심근병증, 이완기 기능 장애, 박출 분율 감소 및 심실 부전 포함. b 약물 발진, 홍반, 다형성 홍반, 홍조, 박탈성 발진, 전신 홍반, 생식기 발진, 열 발진, 밀리아, 발진, 홍반성 발진, 모낭성 발진, 전신 발진, 반점 발진, 반점 구진성 발진, 구진성 발진, 가려움증 발진, 농포성 발진, 피부 박탈, 피부 자극, 수포성 두드러기 및 수포성 발진 포함. |
||||||
|
1일 1회 140mg |
||||||
|
급성 |
골수성 폭발 |
림프구성 폭발 |
||||
|
이상 반응 |
모든 |
3/4등급 |
모든 |
3/4등급 |
모든 |
3/4등급 |
|
환자 비율 (%) |
||||||
|
체액 저류 |
35 |
8 |
34 |
7 |
21 |
6 |
|
국소 표재성 부종 |
18 |
1 |
14 |
0 |
3 |
0 |
|
흉막 삼출 |
21 |
7 |
20 |
7 |
21 |
6 |
|
전신 부종 |
1 |
0 |
3 |
0 |
0 |
0 |
|
심낭 삼출 |
3 |
1 |
0 |
0 |
0 |
0 |
|
울혈성 심부전/심장 |
0 |
0 |
4 |
0 |
0 |
0 |
|
폐 부종 |
1 |
0 |
4 |
3 |
0 |
0 |
|
두통 |
27 |
1 |
18 |
1 |
15 |
3 |
|
설사 |
31 |
3 |
20 |
5 |
18 |
0 |
|
피로 |
19 |
2 |
20 |
1 |
9 |
3 |
|
호흡곤란 |
20 |
3 |
15 |
3 |
3 |
3 |
|
근골격계 통증 |
11 |
0 |
8 |
1 |
0 |
0 |
|
메스꺼움 |
19 |
1 |
23 |
1 |
21 |
3 |
|
피부 발진b |
15 |
0 |
16 |
1 |
21 |
0 |
|
관절통 |
10 |
0 |
5 |
1 |
0 |
0 |
|
감염 (세균, 바이러스, 곰팡이, |
10 |
6 |
14 |
7 |
9 |
0 |
|
출혈 |
26 |
8 |
19 |
9 |
24 |
9 |
|
위장관 출혈 |
8 |
6 |
9 |
7 |
9 |
3 |
|
CNS 출혈 |
1 |
1 |
0 |
0 |
3 |
3 |
|
구토 |
11 |
1 |
12 |
0 |
15 |
0 |
|
발열 |
11 |
2 |
18 |
3 |
6 |
0 |
|
발열성 호중구 감소증 |
4 |
4 |
12 |
12 |
12 |
12 |
| 모든 등급 | 3/4등급 | |
|---|---|---|
| 이상 반응 | 환자 비율 (%) | |
|
두통 |
28 |
3 |
|
메스꺼움 |
20 |
0 |
|
설사 |
21 |
0 |
|
피부 발진 |
19 |
0 |
|
구토 |
13 |
0 |
|
사지 통증 |
19 |
1 |
|
복통 |
16 |
0 |
|
피로 |
10 |
0 |
|
관절통 |
10 |
1 |
만성기 CML 소아 환자 5명(5.2%)에서 골 성장 및 발달과 관련된 이상 반응이 보고되었습니다 [경고 및 주의 사항 (5.10) 참조].
검사 결과 이상
모든 환자군에서 골수억제가 흔하게 보고되었습니다. 3등급 또는 4등급 호중구 감소증, 혈소판 감소증 및 빈혈의 빈도는 만성기 CML 환자보다 진행기 CML 환자에서 더 높았습니다(표 12 및 13). 골수억제는 기준 검사 결과가 정상인 환자뿐만 아니라 기존 검사 결과 이상이 있는 환자에서도 보고되었습니다.
심각한 골수억제를 경험한 환자의 경우 일반적으로 투여 중단 또는 감량 후 회복되었으며, 새로 진단된 만성기 CML 성인 환자의 2%와 이전 이마티닙 치료에 대한 내성 또는 불내성이 있는 성인 환자의 5%에서 치료를 영구적으로 중단했습니다 [경고 및 주의 사항 (5.1) 참조].
3등급 또는 4등급 아미노트랜스퍼라제 또는 빌리루빈 상승 및 3등급 또는 4등급 저칼슘혈증, 저칼륨혈증 및 저인산혈증은 모든 CML 단계의 환자에서 보고되었지만 골수성 또는 림프구성 폭발기 CML 환자에서 더 자주 보고되었습니다. 아미노트랜스퍼라제 또는 빌리루빈 상승은 일반적으로 투여 감량 또는 중단으로 관리되었습니다. SPRYCEL 치료 중 3등급 또는 4등급 저칼슘혈증이 발생한 환자의 경우 경구 칼슘 보충제로 회복되는 경우가 많았습니다.
새로 진단된 만성기 CML 성인 환자에서 보고된 검사 결과 이상은 표 12에 나와 있습니다. 생화학적 검사 결과로 인해 이 환자군에서 SPRYCEL 치료를 중단한 경우는 없었습니다.
| SPRYCEL (n=258) |
이마티닙 (n=258) |
|
|---|---|---|
| 환자 비율 (%) | ||
| CTC 등급: 호중구 감소증(3등급 ≥0.5–<1.0 × 109/L, 4등급 <0.5 × 109/L); 혈소판 감소증(3등급 ≥25–<50 × 109/L, 4등급 <25 × 109/L); 빈혈(헤모글로빈 3등급 ≥65–<80 g/L, 4등급 <65 g/L); 크레아티닌 상승(3등급 >3–6 × 정상 상한치(ULN), 4등급 >6 × ULN); 빌리루빈 상승(3등급 >3–10 × ULN, 4등급 >10 × ULN); SGOT 또는 SGPT 상승(3등급 >5–20 × ULN, 4등급 >20 × ULN); 저칼슘혈증(3등급 <7.0–6.0 mg/dL, 4등급 <6.0 mg/dL); 저인산혈증(3등급 <2.0–1.0 mg/dL, 4등급 <1.0 mg/dL); 저칼륨혈증(3등급 <3.0–2.5 mmol/L, 4등급 <2.5 mmol/L). | ||
|
혈액학적 매개변수 |
|
|
|
호중구 감소증 |
29 |
24 |
|
혈소판 감소증 |
22 |
14 |
|
빈혈 |
13 |
9 |
|
생화학적 매개변수 |
|
|
|
저인산혈증 |
7 |
31 |
|
저칼륨혈증 |
0 |
3 |
|
저칼슘혈증 |
4 |
3 |
|
SGPT(ALT) 상승 |
<1 |
2 |
|
SGOT(AST) 상승 |
<1 |
1 |
|
빌리루빈 상승 |
1 |
0 |
|
크레아티닌 상승 |
1 |
1 |
이마티닙에 내성이 있거나 이마티닙을 견딜 수 없는 CML 환자에서 SPRYCEL 권장 시작 용량을 투여받은 환자에서 보고된 실험실 이상은 표 13에 질병 단계별로 나타나 있습니다.
| CTC 등급: 호중구 감소증(등급 3 ≥0.5–<1.0 × 109/L, 등급 4 <0.5 × 109/L); 혈소판 감소증(등급 3 ≥25–<50 × 109/L, 등급 4 <25 × 109/L); 빈혈(헤모글로빈 등급 3 ≥65–<80 g/L, 등급 4 <65 g/L); 크레아티닌 상승(등급 3 >3–6 × 정상 상한치(ULN), 등급 4 >6 × ULN); 빌리루빈 상승(등급 3 >3–10 × ULN, 등급 4 >10 × ULN); SGOT 또는 SGPT 상승(등급 3 >5–20 × ULN, 등급 4 >20 × ULN); 저칼슘혈증(등급 3 <7.0–6.0 mg/dL, 등급 4 <6.0 mg/dL); 저인산혈증(등급 3 <2.0–1.0 mg/dL, 등급 4 <1.0 mg/dL); 저칼륨혈증(등급 3 <3.0–2.5 mmol/L, 등급 4 <2.5 mmol/L). * 만성기 CML에서 1일 1회 100mg 투여에 대한 혈액학적 매개변수는 최소 60개월 추적 관찰을 반영합니다. |
||||
|
만성기 CML |
진행기 CML |
|||
|
가속기 |
골수성 폭발 |
림프구성 폭발 |
||
|
(n=165) |
(n=157) |
(n=74) |
(n=33) |
|
|
|
환자 비율 (%) |
|||
|
혈액학적 매개변수* |
|
|
|
|
|
호중구 감소증 |
36 |
58 |
77 |
79 |
|
혈소판 감소증 |
24 |
63 |
78 |
85 |
|
빈혈 |
13 |
47 |
74 |
52 |
|
생화학적 매개변수 |
|
|
|
|
|
저인산혈증 |
10 |
13 |
12 |
18 |
|
저칼륨혈증 |
2 |
7 |
11 |
15 |
|
저칼슘혈증 |
<1 |
4 |
9 |
12 |
|
SGPT(ALT) 상승 |
0 |
2 |
5 |
3 |
|
SGOT(AST) 상승 |
<1 |
0 |
4 |
3 |
|
빌리루빈 상승 |
<1 |
1 |
3 |
6 |
|
Elevated Creatinine |
0 |
2 |
8 |
0 |
이전 이마티닙 치료에 내성 또는 불내성이 있는 만성기 CML 성인 환자에서 2년 및 5년 시점에 누적 등급 3 또는 4 혈구감소증은 유사했으며, 여기에는 호중구감소증(36% 대 36%), 혈소판감소증(23% 대 24%) 및 빈혈(13% 대 13%)이 포함됩니다.
CML에 대한 소아 연구에서 실험실 이상의 비율은 성인의 실험실 매개변수에 대한 알려진 프로필과 일치했습니다.
성인의 필라델피아 염색체 양성 급성 림프구성 백혈병(Ph+ ALL)
임상 연구에서 Ph+ ALL 성인 환자 135명에게 SPRYCEL을 투여했습니다. 치료 기간 중앙값은 3개월(범위 0.03~31개월)이었습니다. Ph+ ALL 환자의 안전성 프로필은 림프구 폭발기 CML 환자와 유사했습니다. 가장 흔하게 보고된 유해 반응에는 흉막 삼출(24%) 및 표재성 부종(19%)과 같은 체액 저류 사건과 설사(31%), 메스꺼움(24%) 및 구토(16%)와 같은 위장 장애가 포함되었습니다. 출혈(19%), 발열(17%), 발진(16%) 및 호흡 곤란(16%)도 흔하게 보고되었습니다. 환자의 5% 이상에서 보고된 중대한 유해 반응에는 흉막 삼출(11%), 위장관 출혈(7%), 발열성 호중구감소증(6%) 및 감염(5%)이 포함되었습니다.
소아 환자의 필라델피아 염색체 양성 급성 림프구성 백혈병(Ph+ ALL)
새로 진단된 Ph+ ALL 소아 환자 81명을 대상으로 한 다중 코호트 연구에서 다제 화학 요법과 함께 연속적으로 투여한 SPRYCEL의 안전성을 확인했습니다. [ 임상 연구(14.4) 참조]. 치료 기간 중앙값은 24개월(범위 2~27개월)이었습니다.
치명적인 유해 반응은 3명의 환자(4%)에서 발생했으며, 모두 감염으로 인한 것이었습니다. 8명(10%)의 환자가 진균성 패혈증, 이식편 대 숙주 질환 환경에서의 간 독성, 혈소판감소증, CMV 감염, 폐렴, 메스꺼움, 장염 및 약물 과민증을 포함한 치료 중단으로 이어지는 유해 반응을 경험했습니다.
가장 흔한 중대한 유해 반응(발생률 ≥10%)은 발열, 발열성 호중구감소증, 점막염, 설사, 패혈증, 저혈압, 감염(세균성, 바이러스성 및 진균성), 과민증, 구토, 신부전, 복통 및 근골격계 통증이었습니다.
연구에서 흔한 유해 반응(발생률 ≥20%)의 발생률은 표 14에 나와 있습니다.
|
환자 비율(%) |
||
|
유해 반응 |
모든 등급 |
등급 3/4 |
|
점막염 |
93 |
60 |
|
발열성 호중구감소증 |
86 |
86 |
|
발열 |
85 |
17 |
|
설사 |
84 |
31 |
|
메스꺼움 |
84 |
11 |
|
구토 |
83 |
17 |
|
근골격계 통증 |
83 |
25 |
|
복통 |
78 |
17 |
|
기침 |
78 |
1 |
|
두통 |
77 |
15 |
|
Rash |
68 |
7 |
|
Fatigue |
59 |
3 |
|
Constipation |
57 |
1 |
|
Arrhythmia |
47 |
12 |
|
Hypertension |
47 |
10 |
|
Edema |
47 |
6 |
|
Viral infection |
40 |
12 |
|
Hypotension |
40 |
26 |
|
Decreased appetite |
38 |
22 |
|
Hypersensitivity |
36 |
20 |
|
Upper respiratory tract infection |
36 |
10 |
|
Dyspnea |
35 |
10 |
|
Epistaxis |
31 |
6 |
|
Peripheral neuropathy |
31 |
7 |
|
Sepsis (excluding fungal) |
n/a |
31 |
|
Altered state of consciousness |
30 |
4 |
|
Fungal infection |
30 |
11 |
|
Pneumonia (excluding fungal) |
28 |
25 |
|
Pruritus |
28 |
– |
|
Clostridial infection (excluding sepsis) |
25 |
14 |
|
Urinary Tract Infection |
24 |
14 |
|
Bacteremia (excluding fungal) |
22 |
20 |
|
홍반 |
22 |
6 |
|
오한 |
21 |
– |
|
흉막 삼출 |
21 |
9 |
|
부비동염 |
21 |
10 |
|
탈수 |
20 |
9 |
|
신부전 |
20 |
9 |
|
시각 장애 |
20 |
– |
SPRYCEL에 의해 발생한 일반적인 부작용의 발생률(연구에서 보고된 빈도 ≥10%, 모든 등급 및 3/4 등급 포함)은 다음과 같습니다(N=81): 발열성 호중구감소증(23%, 23%), 메스꺼움(21%, 4%), 구토(19%, 4%), 점막염(17%, 6%), 근골격계 통증(17%, 2%), 복통(16%, 5%), 설사(16%, 7%), 발진(15%, 0%), 피로(12%, 0%), 발열(12%, 6%), 두통(12%, 5%).
SPRYCEL과 화학요법을 병용하여 치료받은 Ph+ ALL 소아 환자의 CTCAE 3/4 등급 실험실 이상은 표 15에 나와 있습니다.
| 환자 비율 (%) | |
|---|---|
|
혈액학적 매개변수 |
|
|
호중구감소증 |
96 |
|
혈소판감소증 |
88 |
|
빈혈 |
82 |
|
생화학적 매개변수 |
|
|
SGPT (ALT) 상승 |
47 |
|
저칼륨혈증 |
40 |
|
SGOT (AST) 상승 |
26 |
|
저칼슘혈증 |
19 |
|
저나트륨혈증 |
19 |
|
빌리루빈 상승 |
11 |
|
저인혈증 |
11 |
|
독성 등급은 CTCAE 버전 4에 따릅니다. |
|
임상 시험에서 추가적으로 모아진 데이터
다음의 추가적인 이상 반응은 SPRYCEL CML 임상 연구에서 성인 및 소아 환자(n=2809)와 Ph+ ALL 임상 연구에서 성인 환자에게 10% 이상, 1%~<10%, 0.1%~<1% 또는 <0.1%의 빈도로 보고되었습니다. 이러한 이상 반응은 임상적 관련성을 기반으로 포함되었습니다.
위장관 장애: 1%~<10% – 점막 염증(점막염/구내염 포함), 소화 불량, 복부 팽만감, 변비, 위염, 대장염(호중구 감소증성 대장염 포함), 구강 연조직 장애; 0.1%~<1% – 복수, 연하 곤란, 항문 열상, 상부 위장관 궤양, 식도염, 췌장염, 위식도 역류 질환; <0.1% – 단백질 소실성 위장병, 일레우스, 급성 췌장염, 항문 누공.
일반적인 장애 및 투여 부위 상태: ≥10% – 말초 부종, 안면 부종; 1%~<10% – 무력증, 흉통, 오한; 0.1%~<1% – 불쾌감, 기타 표재성 부종, 말초 부종; <0.1% – 보행 장애.
피부 및 피하 조직 장애: 1%~<10% – 탈모, 여드름, 건조한 피부, 다한증, 두드러기, 피부염(습진 포함); 0.1%~<1% – 색소 침착 장애, 피부 궤양, 수포성 질환, 광과민성, 손톱 장애, 호중구성 피부염, 지방층염, 손바닥-발바닥 홍반 각화증, 모발 장애; <0.1% – 혈관염, 피부 섬유증.
호흡기, 흉곽 및 종격 장애: 1%~<10% – 폐 침윤, 폐렴, 기침; 0.1%~ <1% – 천식, 기관지 경련, 발성 장애, 폐동맥 고혈압; <0.1% – 급성 호흡곤란 증후군, 폐색전증.
신경계 장애: 1%~<10% – 신경병증(말초 신경병증 포함), 현기증, 미각 이상, 졸음; 0.1%~<1% – 기억 상실, 떨림, 실신, 평형 장애; <0.1% – 경련, 뇌혈관 사고, 일과성 허혈 발작, 시신경염, VII 뇌신경 마비, 치매, 운동 실조.
혈액 및 림프계 장애: 0.1%~<1% – 림프절병증, 림프구 감소증; <0.1% – 순수 적혈구 무형성증.
근골격계 및 결합 조직 장애: 1%~<10% – 근력 저하, 근골격계 경직; 0.1%–<1% – 횡문근 융해증, 건염, 근육 염증, 골괴사, 관절염; <0.1% – 골단 유합 지연(소아 연구에서 1%~<10%로 보고됨), 성장 지연(소아 연구에서 1%~<10%로 보고됨).
검사: 1%~<10% – 체중 증가, 체중 감소; 0.1%~<1% – 혈액 크레아틴 인산화효소 증가, 감마-글루타밀 전이효소 증가.
감염 및 기생충 감염: 1%~<10% – 폐렴(세균성, 바이러스성 및 진균성 포함), 상기도 감염/염증, 헤르페스 바이러스 감염, 장염 감염, 패혈증(치명적인 결과 포함 [0.2%]).
대사 및 영양 장애: 1%~<10% – 식욕 장애, 고요산혈증; 0.1%~<1% – 저알부민혈증, 종양 용해 증후군, 탈수, 고콜레스테롤혈증; <0.1% – 당뇨병.
심장 장애: 1%~<10% – 부정맥(빈맥 포함), 두근거림; 0.1%~<1% – 협심증, 심장 비대, 심낭염, 심실 부정맥(심실 빈맥 포함), 심전도 T파 이상, 트로포닌 증가; <0.1% – 폐심, 심근염, 급성 관상 동맥 증후군, 심장 마비, 심전도 PR 연장, 관상 동맥 질환, 흉막심낭염.
안과 질환: 1%~<10% – 시력 장애(시력 장애, 시력 흐림 및 시력 감소 포함), 안구 건조증; 0.1%~<1% – 결막염, 시력 저하, 눈물 분비 증가, <0.1% – 눈부심.
혈관 장애: 1%~<10% – 홍조, 고혈압; 0.1%~<1% – 저혈압, 정맥염, 혈전증; <0.1% – 망상 홍반, 심부 정맥 혈전증, 색전증.
정신 장애: 1%~<10% – 불면증, 우울증; 0.1%~<1% – 불안, 감정 변화, 혼돈 상태, 성욕 감소.
임신, 산욕 및 출산 관련 상태: <0.1% – 유산.
생식 기관 및 유방 장애: 0.1%~<1% – 여성형 유방, 월경 장애.
손상, 중독 및 수술적 합병증: 1%~<10% – 타박상.
귀 및 미로 장애: 1%~<10% – 이명; 0.1%~<1% – 현기증, 청력 상실.
간담도계 장애: 0.1%~<1% – 담즙 정체, 담낭염, 간염.
신장 및 요로 장애: 0.1%~<1% – 빈뇨, 신부전, 단백뇨; <0.1% – 신장 기능 저하.
면역 체계 장애: 0.1%~<1% – 과민 반응(결절 홍반 포함).
내분비 장애: 0.1%–<1% – 갑상선 기능 저하증; <0.1% – 갑상선 기능 항진증, 갑상선염.
6.2 시판 후 경험
다음과 같은 추가적인 이상 반응이 SPRYCEL의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
감염: B형 간염 바이러스 재활성화
심장 장애: 심방 세동/심방 flutter
호흡기, 흉곽 및 종격동 장애: 간질성 폐 질환, 흉관
피부 및 피하 조직 장애: 스티븐스-존슨 증후군
신장 및 요로 장애: 신증후군
혈액 및 림프계 장애: 혈전성 미세 혈관 병증
간담도계 장애: 간 독성
7 약물 상호작용
7.1 다른 약물의 다사티닙에 대한 영향
강력한 CYP3A4 억제제
강력한 CYP3A4 억제제와의 병용 투여는 다사티닙 농도를 증가시킬 수 있습니다 [임상 약리학 (12.3) 참조]. 다사티닙 농도 증가는 독성 위험을 증가시킬 수 있습니다. 강력한 CYP3A4 억제제와의 병용 투여를 피하십시오. 강력한 CYP3A4 억제제와의 병용 투여를 피할 수 없는 경우, SPRYCEL 용량 감소를 고려하십시오 [용량 및 투여 (2.5) 참조].
강력한 CYP3A4 유도제
SPRYCEL과 강력한 CYP3A 유도제의 병용 투여는 다사티닙 농도를 감소시킬 수 있습니다 [임상 약리학 (12.3) 참조]. 다사티닙 농도 감소는 효능을 감소시킬 수 있습니다. 효소 유도 가능성이 낮은 대체 약물을 고려하십시오. 강력한 CYP3A4 유도제와의 병용 투여를 피할 수 없는 경우, SPRYCEL 용량 증가를 고려하십시오.
위산 감소제
SPRYCEL과 위산 감소제의 병용 투여는 다사티닙 농도를 감소시킬 수 있습니다. 다사티닙 농도 감소는 효능을 감소시킬 수 있습니다.
SPRYCEL과 함께 H2 길항제 또는 프로톤 펌프 억제제를 투여하지 마십시오. H2 길항제 또는 프로톤 펌프 억제제 대신 제산제 사용을 고려하십시오. 제산제는 SPRYCEL 투여 2시간 전 또는 2시간 후에 투여하십시오. SPRYCEL과 제산제를 동시에 투여하지 마십시오.
8 특정 집단에서의 사용
8.1 임신
위험 요약
제한적인 인체 데이터를 기반으로, SPRYCEL은 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. SPRYCEL에 대한 모체 노출과 관련하여 태아 수종, 태아 백혈구 감소증 및 태아 혈소판 감소증을 포함한 부작용이 보고되었습니다. 랫드에서의 동물 생식 연구에서 기관 형성, 태아기 및 신생아에서 광범위한 사망률이 나타났습니다. 제한된 수의 생존한 랫드 및 토끼 배아에서 골격 기형이 관찰되었습니다. 이러한 발견은 다사티닙의 치료적 용량을 투여받은 사람보다 낮은 다사티닙 혈장 농도에서 발생했습니다 [자료 참조]. 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
미국 일반 인구에서 주요 선천적 기형의 추정 배경 위험은 임상적으로 인식된 임신의 2%에서 4%이고 유산은 15%에서 20%입니다.
자료
동물 데이터
다사티닙의 치료적 용량을 투여받은 사람에서 관찰된 혈장 농도보다 낮은 혈장 농도에서 비임상 연구에서 랫드와 토끼에서 배아-태아 독성이 관찰되었습니다. 랫드에서 태아 사망이 관찰되었습니다. 랫드와 토끼 모두에서 시험된 다사티닙의 가장 낮은 용량(랫드: 2.5 mg/kg/일 [15 mg/m2/일] 및 토끼: 0.5 mg/kg/일 [6 mg/m2/일])은 배아-태아 독성을 초래했습니다. 이러한 용량은 랫드와 토끼에서 각각 105 ng•h/mL 및 44 ng•h/mL(인체 AUC의 0.1배)의 모체 AUC를 생성했습니다. 배아-태아 독성에는 여러 부위(견갑골, 상완골, 대퇴골, 요골, 갈비뼈 및 쇄골)의 골격 기형, 골화 감소(흉골; 흉추, 요추 및 천추; 앞발 지골; 골반; 및 설골체), 부종 및 미소 간증이 포함되었습니다. 랫드에서의 출산 전 및 출산 후 발달 연구에서 임신 16일(GD)부터 수유 20일(LD)까지, GD 21부터 LD 20까지 또는 LD 4부터 LD 20까지 다사티닙을 투여하면 다사티닙으로 치료받은 환자의 권장 표시 용량에서 노출보다 낮은 모체 노출에서 광범위한 새끼 사망률이 발생했습니다.
8.4 소아 사용
만성기 Ph+ CML
SPRYCEL 단독 요법의 안전성 및 유효성은 새로 진단된 만성기 CML이 있는 소아 환자에서 입증되었습니다 [임상 연구 (14.3) 참조]. 1세 미만의 어린이에 대한 데이터는 없습니다. 골 성장 및 발달과 관련된 부작용은 환자 5명(5.2%)에서 보고되었습니다 [경고 및 주의 사항 (5.10) 참조].
Ph+ ALL
SPRAYCEL의 안전성 및 유효성은 새로 진단된 Ph+ ALL이 있는 1세 이상의 소아 환자에서 화학 요법과 병용하여 입증되었습니다. 소아 환자에서 SPRAYCEL의 사용은 하나의 소아 연구에서 얻은 증거에 의해 뒷받침됩니다. 1세 미만의 어린이에 대한 데이터는 없습니다. 1등급 골감소증이 1건 보고되었습니다.
소아 피험자에서 SPRAYCEL의 안전성 프로파일은 성인 피험자에서 수행된 연구에서 보고된 것과 유사했습니다 [부작용 (6.1) 및 임상 연구 (14.3, 14.4) 참조].
소아 환자의 뼈 성장 및 발달을 모니터링하십시오 [경고 및 주의 사항 (5.10) 참조].
알약을 삼키는 데 어려움이 있는 소아 환자
Ph+ ALL이 있는 2~10세의 환자 5명이 연구 CA180372에서 SPRAYCEL 정제를 주스에 분산시켜 적어도 1회 복용했습니다. 분산된 정제의 노출은 소아 환자에서 온전한 정제에 비해 36% 낮았습니다 [임상 약리학 (12.3) 참조]. 제한된 임상 데이터로 인해 SPRAYCEL 정제를 분산시키는 것이 SPRAYCEL의 안전성 및/또는 유효성을 크게 변경하는지 여부는 불분명합니다.
8.5 노인 사용
SPRAYCEL의 임상 연구에 참여한 2712명의 환자 중 617명(23%)이 65세 이상이었고 123명(5%)이 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 확인된 완전 세포 유전학적 반응(cCCyR) 및 MMR에 차이가 관찰되지 않았습니다. 노인 인구에서 SPRAYCEL의 안전성 프로파일은 젊은 인구에서와 유사했지만 65세 이상의 환자는 피로, 흉막 삼출, 설사, 호흡 곤란, 기침, 하부 위장관 출혈 및 식욕 장애와 같은 흔히 보고되는 부작용을 경험할 가능성이 더 높고, 복부 팽만, 현기증, 심낭 삼출, 울혈성 심부전, 고혈압, 폐 부종 및 체중 감소와 같은 덜 흔하게 보고되는 부작용을 경험할 가능성이 더 높으므로 주의 깊게 모니터링해야 합니다.
10 과다 복용
임상 연구에서 SPRYCEL 과량 복용 경험은 제한적이며, 단일 사례에 국한됩니다. 2명의 환자에서 1주일 동안 하루 280mg의 최대 과량 복용이 보고되었으며, 두 환자 모두 심각한 골수억제 및 출혈을 경험했습니다. SPRYCEL은 심각한 골수억제와 관련이 있으므로 [경고 및 주의 사항 (5.1) 및 이상 반응 (6.1) 참조], 권장 용량보다 많은 양을 섭취한 환자는 골수억제를 면밀히 모니터링하고 적절한 지지 요법을 제공해야 합니다.
동물에서 급성 과량 복용은 심장 독성과 관련이 있었습니다. 설치류에서 단일 용량 ≥100 mg/kg (600 mg/m2)에서 심장 독성 증거로 심실 괴사 및 판막/심실/심방 출혈이 나타났습니다. 원숭이에서 단일 용량 ≥10 mg/kg (120 mg/m2)에서 수축기 및 이완기 혈압이 증가하는 경향이 있었습니다.
11 설명
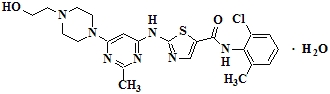
SPRYCEL (다사티닙)은 키나아제 억제제입니다. 다사티닙의 화학명은 N-(2-클로로-6-메틸페닐)-2-[[6-[4-(2-히드록시에틸)-1-피페라지닐]-2-메틸-4-피리미디닐]아미노]-5-티아졸카르복사미드, 일수화물입니다. 분자식은 C22H26ClN7O2S • H2O이며, 이는 506.02(일수화물)의 분자량에 해당합니다. 무수 유리 염기는 분자량이 488.01입니다. 다사티닙은 다음과 같은 화학 구조를 가지고 있습니다.
다사티닙은 백색에서 거의 백색의 분말입니다. 약물 성분은 물에 불용성이며 에탄올 및 메탄올에 약간 용해됩니다.
SPRYCEL 정제는 다사티닙을 함유한 백색에서 거의 백색의 양쪽 볼록, 필름 코팅 정제이며, 다음과 같은 비활성 성분을 함유하고 있습니다: 유당 일수화물, 미결정 셀룰로오스, 크로스카멜로오스 나트륨, 히드록시프로필 셀룰로오스 및 마그네슘 스테아레이트. 정제 코팅은 히프로멜로오스, 이산화티탄 및 폴리에틸렌 글리콜로 구성됩니다.
12 임상약리학
12.1 작용 기전
다사티닙은 나노몰 농도에서 BCR-ABL, SRC 계열(SRC, LCK, YES, FYN), c-KIT, EPHA2 및 PDGFRβ를 포함한 다음 키나아제를 억제합니다. 모델링 연구에 따르면 다사티닙은 ABL 키나아제의 여러 형태에 결합하는 것으로 예측됩니다.
시험관 내에서 다사티닙은 이마티닙 메실레이트에 민감하고 내성이 있는 질환의 변이를 나타내는 백혈병 세포주에서 활성을 보였습니다. 다사티닙은 BCR-ABL을 과발현하는 만성 골수성 백혈병(CML) 및 급성 림프구성 백혈병(ALL) 세포주의 성장을 억제했습니다. 분석 조건에서 다사티닙은 BCR-ABL 키나아제 도메인 돌연변이, SRC 계열 키나아제(LYN, HCK)를 포함하는 대체 신호 경로의 활성화 및 다중 약물 내성 유전자 과발현으로 인한 이마티닙 내성을 극복할 수 있었습니다.
12.2 약력학
심장 전기 생리학
임상 시험에서 모든 용량으로 SPRYCEL을 투여받은 2440명의 환자 중 16명(<1%)에서 QTc 연장이 부작용으로 보고되었습니다. 22명의 환자(1%)에서 QTcF > 500ms가 발생했습니다. 5개의 2상 연구에서 SPRYCEL 70mg 1일 2회로 백혈병 치료를 받은 865명의 환자에서 기준선 대비 QTcF의 최대 평균 변화(90% 상한 CI)는 7ms에서 13.4ms까지였습니다.
5개의 2상 연구(70mg 1일 2회)에서 환자를 대상으로 한 데이터와 건강한 피험자(100mg 단일 용량)를 대상으로 한 1상 연구의 데이터 분석 결과, 다사티닙 치료 용량을 투여받은 피험자의 경우 기준선 대비 Fridericia 보정 QTc 간격이 최대 3~6밀리초 증가하는 것으로 나타났으며, 관련된 상한 95% 신뢰 구간은 <10msec였습니다.
12.3 약동학
다사티닙의 약동학은 15mg/일(승인된 최저 권장 용량의 0.15배)에서 240mg/일(승인된 최고 권장 용량의 1.7배)까지의 용량 범위에서 AUC가 용량에 비례하여 증가하고 선형 제거 특성을 보입니다.
100mg 1일 1회 투여 시, 정상 상태에서 최대 농도(Cmax)는 82.2ng/mL(CV% 69%), 혈장 약물 농도 시간 곡선 아래 면적(AUC)은 397ng/mL*hr(CV% 55%)입니다. 다사티닙의 청소율은 시간 불변인 것으로 밝혀졌습니다. 성인 건강한 피험자에게 주스에 분산된 정제 형태로 투여했을 때, 조정된 기하 평균 비율은 Cmax의 경우 0.97(90% CI: 0.85, 1.10), AUC의 경우 0.84(90% CI: 0.78, 0.91)로, 온전한 정제와 비교했을 때 유사했습니다.
흡수
다사티닙의 최대 혈장 농도(Cmax)는 경구 투여 후 0.5시간에서 6시간(Tmax) 사이에 관찰됩니다.
식품 효과
고지방 식사는 100mg 단일 용량 투여 후 다사티닙의 평균 AUC를 14% 증가시켰습니다. 고지방 식사의 총 칼로리 함량은 985kcal였습니다. 고지방 식사에서 지방, 탄수화물 및 단백질에서 유래한 칼로리는 각각 52%, 34%, 14%였습니다.
분포
겉보기 분포 용적은 2505L(CV% 93%)입니다.
다사티닙의 인간 혈장 단백질 결합은 시험관 내에서 약 96%였으며, 활성 대사체의 경우 93%였으며, 100ng/mL에서 500ng/mL까지의 농도 범위에서 농도 의존성이 없었습니다.
다사티닙은 시험관 내에서 P-gp 기질입니다.
제거
다사티닙의 평균 말단 반감기는 3시간에서 5시간입니다. 평균 겉보기 경구 청소율은 363.8L/hr(CV% 81.3%)입니다.
대사
다사티닙은 인간에서 주로 CYP3A4에 의해 대사됩니다. CYP3A4는 활성 대사체 형성에 주요 역할을 하는 효소입니다. 플라빈 함유 모노옥시게나아제 3(FMO-3) 및 유리딘 이인산 글루쿠로노실 전이효소(UGT) 효소도 다사티닙 대사체 형성에 관여합니다.
다사티닙과 동등한 효능을 가진 활성 대사체의 노출은 다사티닙 AUC의 약 5%를 차지합니다. 다사티닙의 활성 대사체는 관찰된 약물 약리학에 주요 역할을 하지 않는 것으로 보입니다. 다사티닙은 또한 여러 가지 다른 비활성 산화 대사체를 가지고 있습니다.
배설
제거는 주로 대변을 통해 이루어집니다. 경구 다사티닙에 방사성 동위원소 표지된 단일 용량을 투여한 후, 투여된 방사성 동위원소의 4%는 소변에서, 85%는 대변에서 10일 이내에 회수되었습니다. 변하지 않은 다사티닙은 투여 용량의 0.1%가 소변에서, 19%가 대변에서 회수되었으며, 나머지 용량은 대사체였습니다.
특정 인구 집단
연령(15세에서 86세), 성별 및 신장 장애(Cockcroft Gault에 의해 추정된 크레아티닌 청소율 21.6mL/min에서 342.3mL/min)는 다사티닙의 약동학에 임상적으로 관련된 영향을 미치지 않습니다.
소아 환자
다사티닙의 약동학은 60 mg/m2에서 120 mg/m2까지의 경구 용량으로 식사와 함께 또는 식사 없이 투여한 백혈병 또는 고형 종양이 있는 43명의 소아 환자에서 평가되었습니다. 약동학은 용량에 비례하여 용량 관련 노출 증가를 보였습니다. 평균 Tmax는 0.5시간에서 6시간 사이에 관찰되었고 평균 반감기는 2시간에서 5시간이었습니다. 이 43명의 소아 환자에서 체중 정규화된 청소율의 기하 평균(CV%)은 5.98(41.5%) L/h/kg입니다. 60 mg/m2의 투약 요법을 가진 소아 환자에서 모델 시뮬레이션된 다사티닙의 기하 평균(CV%) 정상 상태 플라즈마 평균 농도는 14.7(64.6%) ng/mL(2세에서 <6세), 16.3(97.5%) ng/mL(6세에서 <12세), 18.2(67.7%) ng/mL(12세 이상)였습니다 [투약 및 투여(2.2) 참조]. 다사티닙의 청소율과 분포 용적은 소아 환자의 체중에 따라 달라집니다. 다사티닙은 1세 미만의 환자에서 연구되지 않았습니다.
소아 환자에서 분산 정제의 생체 이용률은 온전한 정제보다 36% 낮은 것으로 추정되었습니다.
간 기능 장애 환자
정상 간 기능을 가진 피험자와 비교하여 중등도 간 기능 장애(Child Pugh B) 환자는 평균 Cmax가 47% 감소하고 평균 AUC가 8% 감소했습니다. 중증 간 기능 장애(Child Pugh C) 환자는 정상 간 기능을 가진 피험자와 비교하여 평균 Cmax가 43% 감소하고 평균 AUC가 28% 감소했습니다.
약물 상호 작용 연구
시토크롬 P450 효소
케토코나졸(강력한 CYP3A4 억제제)을 1일 2회 병용 투여하면 20mg의 단일 경구 용량 투여 후 다사티닙의 평균 Cmax가 4배 증가하고 다사티닙의 평균 AUC가 5배 증가했습니다.
리팜핀(강력한 CYP3A4 유도제)을 1일 1회 병용 투여하면 다사티닙의 평균 Cmax가 81% 감소하고 다사티닙의 평균 AUC가 82% 감소했습니다.
다사티닙은 CYP3A4의 시간 의존적 억제제입니다. 다사티닙은 CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 또는 2E1을 억제하지 않습니다. 다사티닙은 CYP 효소를 유도하지 않습니다.
위산 감소제
SPRYCEL 단일 용량 투여 2시간 전에 수산화알루미늄/수산화마그네슘 30mL를 투여하면 다사티닙의 평균 AUC에는 관련 변화가 없었지만 다사티닙의 평균 Cmax는 26% 증가했습니다.
SPRYCEL 단일 용량과 동시에 수산화알루미늄/수산화마그네슘 30mL를 투여하면 다사티닙의 평균 AUC가 55% 감소하고 다사티닙의 평균 Cmax가 58% 감소했습니다.
파모티딘(H2 길항제) 투여 후 10시간 후에 SPRYCEL 단일 용량을 투여하면 다사티닙의 평균 AUC가 61% 감소하고 다사티닙의 평균 Cmax가 63% 감소했습니다.
오메프라졸(양성자 펌프 억제제) 40mg 용량을 정상 상태에서 투여한 후 22시간 후에 SPRYCEL 100mg 단일 용량을 투여하면 다사티닙의 평균 AUC가 43% 감소하고 다사티닙의 평균 Cmax가 42% 감소했습니다.
수송체
다사티닙은 P-gp의 in vitro 억제제가 아닙니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
2년 발암성 연구에서 랫드에 다사티닙을 경구 투여량 0.3, 1 및 3 mg/kg/일로 투여했습니다. 최고 용량은 1일 1회 100mg에서 인체 노출의 약 60%에 해당하는 혈장 약물 노출(AUC) 수준을 초래했습니다. 다사티닙은 고용량 암컷의 자궁 및 자궁 경부에서 편평 상피 세포 암종 및 유두종의 발생률을 통계적으로 유의하게 증가시켰고, 저용량 수컷에서 전립선 선종을 유발했습니다.
다사티닙은 대사 활성화 유무에 관계없이 중국 햄스터 난소 세포에서 in vitro로 시험했을 때 염색체 이상을 유발했습니다. 다사티닙은 in vitro 박테리아 세포 분석(Ames test)에서 돌연변이 유발성이 없었고, in vivo 랫드 미세핵 연구에서 유전 독성이 없었습니다.
다사티닙은 1일 100mg에서 인체 노출과 유사한 혈장 약물 노출(AUC)에서 수컷 및 암컷 랫드의 교미 또는 생식 능력에 영향을 미치지 않았습니다. 반복 투여 연구에서 다사티닙 투여는 정낭의 크기 및 분비 감소, 미성숙 전립선, 정낭 및 고환을 초래했습니다. 다사티닙 투여는 원숭이에서 자궁 염증 및 광물화, 설치류에서 낭포성 난소 및 난소 비대를 초래했습니다.
14 임상 연구
14.1 성인 신규 진단 만성기 CML
DASISION (Dasatinib 대 Imatinib, 치료 경험 없는 만성 골수성 백혈병 환자 대상 연구) (NCT00481247)은 신규 진단 만성기 CML 성인 환자를 대상으로 실시된 개방형, 다기관, 국제적, 무작위 배정 시험이었습니다. 총 519명의 환자가 SPRYCEL 100mg 1일 1회 또는 imatinib 400mg 1일 1회 투여군에 무작위 배정되었습니다. 심장 질환 병력이 있는 환자는 6개월 이내에 심근 경색, 3개월 이내에 울혈성 심부전, 심각한 부정맥 또는 QTc 연장이 없는 경우 이 시험에 포함되었습니다. 일차 평가 변수는 12개월 이내에 확인된 완전 세포 유전학적 반응(CCyR) 비율이었습니다. 확인된 CCyR은 최소 28일 간격으로 2회 연속 관찰된 CCyR으로 정의되었습니다.
SPRYCEL 군의 중간 연령은 46세였고 imatinib 군의 중간 연령은 49세였으며 각각 10%와 11%의 환자가 65세 이상이었습니다. 두 군 모두 남성 환자가 여성 환자보다 약간 더 많았습니다(59% 대 41%). 모든 환자의 53%가 백인이었고 39%가 아시아인이었습니다. 기준선에서 Hasford 점수 분포는 SPRYCEL 치료군과 imatinib 치료군에서 유사했습니다(저위험: 33%와 34%; 중간 위험: 48%와 47%; 고위험: 19%와 19%). 최소 12개월 추적 관찰에서 SPRYCEL에 무작위 배정된 환자의 85%와 imatinib에 무작위 배정된 환자의 81%가 여전히 연구에 참여했습니다.
최소 24개월 추적 관찰에서 SPRYCEL에 무작위 배정된 환자의 77%와 imatinib에 무작위 배정된 환자의 75%가 여전히 연구에 참여했으며 최소 60개월 추적 관찰에서 각각 61%와 62%의 환자가 연구 종료 시점에 여전히 치료를 받고 있었습니다.
효능 결과는 표 16에 요약되어 있습니다.
| SPRYCEL (n=259) |
Imatinib (n=260) |
|
|---|---|---|
| a 확인된 CCyR은 최소 28일 간격으로 2회 연속 관찰된 CCyR으로 정의됩니다. b 주요 분자 반응(어느 시점에서든)은 국제 규모로 표준화된 말초 혈액 샘플에서 RQ-PCR에 의해 BCR-ABL 비율이 ≤0.1%인 것으로 정의되었습니다. 이는 지정된 기간 동안 최소 추적 관찰을 나타내는 누적 비율입니다. * Hasford 점수로 조정되었으며 사전 정의된 명목상 유의 수준에서 통계적 유의성을 나타냅니다. CI = 신뢰 구간. |
||
|
확인된 CCyRa |
||
|
12개월 이내 (95% CI) |
76.8% (71.2–81.8) |
66.2% (60.1–71.9) |
|
P-값 |
0.007* |
|
|
주요 분자 반응b |
||
|
12개월 (95% CI) |
52.1% (45.9–58.3) |
33.8% (28.1–39.9) |
|
P-값 |
<0.0001 |
|
|
60개월 (95% CI) |
76.4% (70.8–81.5) |
64.2% (58.1–70.1) |
SPRYCEL 투여군과 이마티닙 투여군에서 24개월, 36개월 및 60개월 시점의 확인된 CCyR은 각각 80% 대 74%, 83% 대 77%, 83% 대 79%였습니다. SPRYCEL 투여군과 이마티닙 투여군에서 24개월 및 36개월 시점의 MMR은 각각 65% 대 50% 및 69% 대 56%였습니다.
60개월 추적 관찰 후 확인된 CCyR까지의 중간 시간은 SPRYCEL 반응자 215명에서 3.1개월, 이마티닙 반응자 204명에서 5.8개월이었습니다. 60개월 추적 관찰 후 MMR까지의 중간 시간은 SPRYCEL 반응자 198명에서 9.3개월, 이마티닙 반응자 167명에서 15.0개월이었습니다.
60개월 시점에 다사티닙 투여군에서는 8명(3%)의 환자가 가속기 또는 폭발기로 진행되었고, 이마티닙 투여군에서는 15명(6%)의 환자가 가속기 또는 폭발기로 진행되었습니다.
SPRYCEL 투여 환자와 이마티닙 투여 환자의 추정 60개월 생존율은 각각 90.9%(CI: 86.6%–93.8%) 및 89.6%(CI: 85.2%–92.8%)였습니다. 시험에 마지막으로 등록된 환자 이후 5년 동안의 데이터를 기반으로, 다사티닙 치료군에서는 83%의 환자가 생존한 것으로 확인되었고, 이마티닙 치료군에서는 77%의 환자가 생존한 것으로 확인되었습니다. 두 치료군 모두 10%의 환자가 사망한 것으로 확인되었고, 다사티닙 치료군에서는 7%, 이마티닙 치료군에서는 13%의 환자가 생존 여부가 불분명했습니다.
SPRYCEL 투여군의 60개월 추적 관찰에서 Hasford 점수로 결정된 각 위험군에서 MMR 발생률은 90%(저위험), 71%(중간 위험) 및 67%(고위험)였습니다. 이마티닙 투여군에서 Hasford 점수로 결정된 각 위험군에서 MMR 발생률은 69%(저위험), 65%(중간 위험) 및 54%(고위험)였습니다.
새로 진단된 시험에 참여한 환자 중 다사티닙 또는 이마티닙 치료를 중단한 환자의 혈액 샘플에서 BCR-ABL 염기서열 분석을 수행했습니다. 다사티닙 투여 환자에서 발견된 돌연변이는 T315I, F317I/L 및 V299L이었습니다.
in vitro 데이터에 따르면 다사티닙은 T315I 돌연변이에 대해 활성이 없는 것으로 나타났습니다.
14.2 성인의 이마티닙 내성 또는 불내성 CML 또는 Ph+ ALL
SPRYCEL의 효능과 안전성은 이마티닙에 내성이 있거나 이마티닙을 불내성하는 CML 또는 Ph+ ALL 성인 환자에서 조사되었습니다. 1158명의 환자가 만성기 CML, 858명의 환자가 가속기, 골수 폭발기 또는 림프구 폭발기 CML, 130명의 환자가 Ph+ ALL을 앓고 있었습니다. 만성기 CML의 임상 시험에서 이마티닙 내성은 완전 혈액학적 반응(CHR; 3개월 후) 달성 실패, 주요 세포 유전학적 반응(MCyR; 6개월 후) 달성 실패 또는 완전 세포 유전학적 반응(CCyR; 12개월 후) 달성 실패 또는 이전 분자 반응 소실(동시에 Ph+ 중기가 ≥10% 증가), 세포 유전학적 반응 또는 혈액학적 반응으로 정의되었습니다. 이마티닙 불내성은 하루 400mg 이상의 이마티닙을 내성할 수 없거나 독성으로 인해 이마티닙을 중단해야 하는 경우로 정의되었습니다.
아래에 설명된 결과는 SPRYCEL 치료 시작 후 최소 2년의 추적 관찰을 기반으로 하며, 환자의 초기 진단부터 중간 시간은 약 5년입니다. 모든 연구에서 환자의 48%가 여성, 81%가 백인, 15%가 흑인 또는 아시아인, 25%가 65세 이상, 5%가 75세 이상이었습니다. 대부분의 환자는 이마티닙, 세포 독성 화학 요법, 인터페론 및 줄기 세포 이식을 포함한 광범위한 사전 치료를 받은 장기 질환 병력을 가지고 있었습니다. 전반적으로 환자의 80%가 이마티닙 내성 질환을 앓고 있었고, 20%의 환자가 이마티닙을 불내성했습니다. 환자의 약 60%에서 최대 이마티닙 용량은 400–600mg/일이었고, 40%의 환자에서 최대 이마티닙 용량은 >600mg/일이었습니다.
만성기 CML의 주요 효능 평가 지표는 MCyR이었으며, 이는 Ph+ 조혈 세포의 제거(CCyR) 또는 상당한 감소(최소 65%, 부분 세포 유전학적 반응)로 정의되었습니다. 가속기, 골수 폭발기, 림프구 폭발기 CML 및 Ph+ ALL의 주요 효능 평가 지표는 주요 혈액학적 반응(MaHR)이었으며, 이는 CHR 또는 백혈병 증거 없음(NEL)으로 정의되었습니다.
만성기 CML
용량 최적화 시험: 성인 만성기 CML 환자에서 SPRYCEL을 1일 1회 투여한 경우와 1일 2회 투여한 경우의 효능과 안전성을 평가하기 위해 무작위 배정, 공개 표지 시험(NCT00123474)이 수행되었습니다. 6개월 이내에 심근 경색, 3개월 이내에 울혈성 심부전, 심각한 부정맥 또는 QTc 연장을 포함한 심각한 심장 질환이 있는 환자는 시험에서 제외되었습니다. 주요 효능 평가 지표는 이마티닙 내성 CML 환자의 MCyR이었습니다. 이마티닙 내성 질환을 앓고 있는 497명을 포함하여 총 670명의 환자가 SPRYCEL 100mg 1일 1회 투여군, 140mg 1일 1회 투여군, 50mg 1일 2회 투여군 또는 70mg 1일 2회 투여군에 무작위 배정되었습니다. 치료의 중간 기간은 22개월이었습니다.
모든 SPRYCEL 치료군에서 효능이 달성되었으며, 1일 1회 투여 일정은 주요 효능 평가 지표(MCyR 차이 1.9%; 95% CI [−6.8%–10.6%])에서 1일 2회 투여 일정과 비교하여 유사한 효능(비열등성)을 보였습니다. 그러나 100mg 1일 1회 투여 요법은 안전성과 내약성이 향상되었습니다.
효능 결과는 권장 시작 용량인 100mg 1일 1회를 투여받은 만성기 CML 성인 환자에 대해 표 17과 18에 제시되어 있습니다.
| 모든 환자 | 100mg 1일 1회 (n=167) |
|---|---|
| a CHR(4주 후 반응 확인): WBC ≤ 기관 ULN, 혈소판 <450,000/mm3, 말초 혈액에 아무런 폭발 세포나 전골수구가 없음, 말초 혈액에 골수구와 후골수구가 5% 미만, 말초 혈액에 호염기구가 20% 미만, 골수 외 침윤 없음. b MCyR은 완전(0% Ph+ 중기) 및 부분(>0%–35%) 반응을 모두 포함합니다. |
|
|
혈액학적 반응률 %(95% CI) |
|
|
CHRa |
92% (86–95) |
|
Cytogenetic Response Rate % (95% CI) |
|
|
MCyRb |
63% (56–71) |
|
CCyR |
50% (42–58) |
| 최소 추적 기간 | |||
|---|---|---|---|
| 2년 | 5년 | 7년 | |
| a 1일 1회 100mg의 권장 시작 용량으로 보고된 결과. b 주요 분자 반응 기준: 말초 혈액 샘플에서 RQ-PCR에 의해 BCR-ABL/대조군 전사체 ≤0.1%로 정의됨. |
|||
|
주요 분자 반응b % (n/N) |
|||
|
무작위 배정된 모든 환자 |
34% (57/167) |
43% (71/167) |
44% (73/167) |
|
이마티닙 내성 환자 |
33% (41/124) |
40% (50/124) |
41% (51/124) |
|
이마티닙 불내성 환자 |
37% (16/43) |
49% (21/43) |
51% (22/43) |
시험에 마지막으로 참여한 환자 이후 7년 동안의 데이터를 기반으로 44%는 생존한 것으로 알려졌고, 31%는 사망한 것으로 알려졌으며, 25%는 생존 상태를 알 수 없었습니다.
7년까지, 1일 1회 100mg 치료군에서 치료 중인 9명의 환자에게 가속기 또는 폭발기로의 전환이 발생했습니다.
진행된 CML 및 Ph+ ALL
용량 최적화 시험: 진행된 CML(가속기 CML, 골수 폭발기 CML 또는 림프구 폭발기 CML) 환자를 대상으로 SPRYCEL을 1일 2회 투여한 경우와 비교하여 1일 1회 투여한 SPRYCEL의 효능과 안전성을 평가하기 위해 무작위 배정 오픈 라벨 시험(NCT00123487)이 수행되었습니다. 1차 효능 평가 지표는 MaHR이었습니다. 총 611명의 환자가 SPRYCEL 1일 1회 140mg 투여군 또는 1일 2회 70mg 투여군에 무작위 배정되었습니다. 두 치료군 모두 치료 기간 중앙값은 약 6개월이었습니다. 1일 1회 투여 일정은 1차 효능 평가 지표에서 1일 2회 투여 일정과 비교하여 비슷한 효능(비열등성)을 보였지만, 140mg 1일 1회 요법은 안전성과 내약성이 향상되었습니다.
140mg 1일 1회 투여군 환자의 반응률은 표 19에 제시되어 있습니다.
| 1일 1회 140mg | ||||
|---|---|---|---|---|
| 가속기 (n=158) |
골수 폭발기 (n=75) |
림프구 폭발기 (n=33) |
Ph+ ALL (n=40) |
|
| a 혈액학적 반응 기준(모든 반응은 4주 후 확인됨): 주요 혈액학적 반응: (MaHR) = 완전 혈액학적 반응(CHR) + 백혈병 증거 없음(NEL). CHR: WBC ≤ 기관 ULN, ANC ≥1000/mm3, 혈소판 ≥100,000/mm3, 말초혈액에 폭발 세포 또는 전골수구 없음, 골수 폭발 세포 ≤5%, 말초혈액에서 5% 미만의 골수구 및 후골수구, 말초혈액에서 호염기구 <20%, 그리고 골수 외 침윤 없음. NEL: CHR과 동일한 기준이지만 ANC ≥500/mm3 및 ≤1000/mm3, 또는 혈소판 ≥20,000/mm3 및 ≤100,000/mm3. b MCyR은 완전(0% Ph+ 중기) 및 부분(>0%–35%) 반응을 모두 결합합니다. CI = 신뢰 구간 ULN = 정상 범위 상한. |
||||
|
MaHRa |
66% |
28% |
42% |
38% |
|
(95% CI) |
(59–74) |
(18–40) |
(26–61) |
(23–54) |
|
CHRa |
47% |
17% |
21% |
33% |
|
(95% CI) |
(40–56) |
(10–28) |
(9–39) |
(19–49) |
|
NELa |
19% |
11% |
21% |
5% |
|
(95% CI) |
(13–26) |
(5–20) |
(9–39) |
(1–17) |
|
MCyRb |
39% |
28% |
52% |
70% |
|
(95% CI) |
(31–47) |
(18–40) |
(34–69) |
(54–83) |
|
CCyR |
32% |
17% |
39% |
50% |
|
(95% CI) |
(25–40) |
(10–28) |
(23–58) |
(34–66) |
SPRYCEL 140mg 1일 1회 투여군에서, 가속기 CML 환자의 MaHR까지의 중앙값은 1.9개월(최소-최대: 0.7-14.5)이었고, 골수성 폭발기 CML 환자의 경우 1.9개월(최소-최대: 0.9-6.2)이었으며, 림프구성 폭발기 CML 환자의 경우 1.8개월(최소-최대: 0.9-2.8)이었습니다.
골수성 폭발기 CML 환자에서 MaHR의 중앙값 지속 기간은 140mg 1일 1회 투여군에서 8.1개월(최소-최대: 2.7-21.1)이었고, 70mg 1일 2회 투여군에서 9.0개월(최소-최대: 1.8-23.1)이었습니다. 림프구성 폭발기 CML 환자에서 MaHR의 중앙값 지속 기간은 140mg 1일 1회 투여군에서 4.7개월(최소-최대: 3.0-9.0)이었고, 70mg 1일 2회 투여군에서 7.9개월(최소-최대: 1.6-22.1)이었습니다. SPRYCEL 140mg 1일 1회 투여를 받은 Ph+ ALL 환자에서 MaHR의 중앙값 지속 기간은 4.6개월(최소-최대: 1.4-10.2)이었습니다. SPRYCEL 140mg 1일 1회 투여 및 70mg 1일 2회 투여를 받은 Ph+ ALL 환자의 무진행 생존 기간의 중앙값은 각각 4.0개월(최소-최대: 0.4-11.1)과 3.1개월(최소-최대: 0.3-20.8)이었습니다.
14.3 소아 환자의 CML
소아 환자에서 SPRYCEL의 효능은 만성기 CML 소아 환자 97명을 대상으로 한 두 건의 소아 연구에서 평가되었습니다. 두 건의 소아 연구에서 만성기 CML로 치료받은 97명의 환자 중, 오픈 라벨, 비무작위 배정 용량 범위 연구(NCT00306202)와 오픈 라벨, 비무작위 배정, 단일군 연구(NCT00777036)에서 51명의 환자(단일군 연구에서만)는 새로 진단된 만성기 CML을 가졌고, 46명의 환자(용량 범위 연구에서 17명, 단일군 연구에서 29명)는 이매티닙으로 이전 치료에 저항하거나 내약성이 없었습니다. 97명의 소아 환자 중 91명은 SPRYCEL 정제 60mg/m2 1일 1회(BSA가 높은 환자의 경우 최대 용량 100mg 1일 1회)로 치료받았습니다. 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 받았습니다.
이매티닙에 저항하거나 내약성이 없는 46명의 환자의 기준 인구 통계적 특징은 다음과 같습니다. 중앙값 연령 13.5세(범위 2~20세), 백인 78.3%, 아시아인 15.2%, 흑인 4.4%, 기타 2.2%, 여성 52%. 새로 진단된 51명의 환자의 기준 특징은 다음과 같습니다. 중앙값 연령 12.8세(범위 1.9~17.8세), 백인 60.8%, 아시아인 31.4%, 흑인 5.9%, 기타 2%, 여성 49%.
이매티닙에 저항하거나 내약성이 없는 환자의 경우 추적 관찰 기간의 중앙값은 5.2년(범위 0.5~9.3년)이었고, 새로 진단된 환자의 경우 4.5년(범위 1.3~6.4년)이었습니다. 두 건의 소아 연구의 효능 결과는 표 20에 요약되어 있습니다.
표 20은 시간(3개월~24개월)에 따라 CCyR, MCyR 및 MMR의 반응이 증가하는 추세를 보여줍니다. 세 가지 종말점 모두에서 반응의 증가 추세는 새로 진단된 환자와 이매티닙에 저항하거나 내약성이 없는 환자 모두에서 나타납니다.
표 20: CP-CML 소아 환자에서 SPRYCEL의 효능 최소 추적 관찰 기간별 시간 경과에 따른 누적 반응
| 3개월 | 6개월 | 12개월 | 24개월 | |
|---|---|---|---|---|
| a 경구 정제 제형을 투여받은 새로 진단된 CP-CML 소아 연구 환자 b 경구 정제 제형을 투여받은 이매티닙에 저항하거나 내약성이 없는 CP-CML 소아 연구 환자 |
||||
|
CCyR |
||||
|
새로 진단 |
43.1% |
66.7% |
96.1% |
96.1% |
|
이전 이매티닙 |
45.7% |
71.7% |
78.3% |
82.6% |
|
MCyR |
||||
|
새로 진단 |
60.8% |
90.2% |
98.0% |
98.0% |
|
이전 이매티닙 |
60.9% |
82.6% |
89.1% |
89.1% |
|
MMR |
||||
|
새로 진단된 |
7.8% |
31.4% |
56.9% |
74.5% |
|
이마티닙 이전 |
15.2% |
26.1% |
39.1% |
52.2% |
새로 진단된 환자의 경우 중간 추적 관찰 기간이 4.5년인 반면, 응답 환자의 절반 이상이 데이터 마감 시점까지 진행되지 않았기 때문에 CCyR, MCyR, MMR의 중간 지속 기간을 추정할 수 없었습니다. 응답 지속 기간의 범위는 (CCyR의 경우 2.5+에서 66.5+개월), (MCyR의 경우 1.4에서 66.5+개월), (24개월까지 MMR을 달성한 대상의 경우 5.4+에서 72.5+개월, 그리고 언제든지 MMR을 달성한 대상의 경우 0.03+에서 72.5+개월)이었으며, 여기서 ‘+’는 검열된 관찰을 나타냅니다.
이마티닙 내성 또는 불내성 환자의 경우 중간 추적 관찰 기간이 5.2년인 반면, 응답 환자의 절반 이상이 데이터 마감 시점까지 진행되지 않았기 때문에 CCyR, MCyR, MMR의 중간 지속 기간을 추정할 수 없었습니다. 응답 지속 기간의 범위는 (CCyR의 경우 2.4에서 86.9+개월), (MCyR의 경우 2.4에서 86.9+개월), (MMR의 경우 2.6+에서 73.6+개월)이었으며, 여기서 ‘+’는 검열된 관찰을 나타냅니다.
MCyR에 대한 중간 응답 시간은 풀링된 이마티닙 내성/불내성 CP-CML 환자에서 2.9개월(95% CI: 2.8개월, 3.5개월)이었습니다. CCyR에 대한 중간 응답 시간은 풀링된 이마티닙 내성/불내성 CP-CML 환자에서 3.3개월(95% CI: 2.8개월, 4.7개월)이었습니다. MMR에 대한 중간 응답 시간은 풀링된 이마티닙 내성/불내성 CP-CML 환자에서 8.3개월(95% CI: 5.0개월, 11.8개월)이었습니다.
MCyR에 대한 중간 응답 시간은 새로 진단된 치료 경험이 없는 CP-CML 환자에서 3.0개월(95% CI: 2.8개월, 4.3개월)이었습니다. CCyR에 대한 중간 응답 시간은 새로 진단된 치료 경험이 없는 CP-CML 환자에서 5.5개월(95% CI: 3.0개월, 5.7개월)이었습니다. MMR에 대한 중간 응답 시간은 새로 진단된 치료 경험이 없는 CP-CML 환자에서 8.9개월(95% CI: 6.2개월, 11.7개월)이었습니다.
2상 소아 연구에서 새로 진단된 환자 1명과 이마티닙 내성 또는 불내성 환자 2명이 폭발성 백혈병 CML로 진행되었습니다.
14.4 소아 환자의 Ph+ ALL
SPRYCEL의 효능은 새로 진단된 B 세포 전구체 Ph+ ALL 소아 환자의 다기관, 다코호트 연구인 연구 CA180372(NCT01460160)의 단일 코호트(코호트 1)에서 화학 요법과 병용하여 평가되었습니다. 코호트 1의 78명의 환자는 화학 요법과 병용하여 최대 24개월 동안 SPRYCEL을 60mg/m2의 일일 용량으로 투여받았습니다. 기본 화학 요법 요법은 AIEOP-BFM ALL 2000 다제 화학 요법 프로토콜이었습니다.
환자의 중간 연령은 10.4세(범위 2.6~17.9세)였으며, 2~6세 환자 20명(25%), 7~12세 환자 37명(46%), 13~17세 환자 24명(30%)이 포함되었습니다. 환자의 82%는 백인이었고, 55%는 남성이었습니다. 32명의 환자(41%)는 진단 시 백혈구 수(WBC)가 ≥50,000 mcl이었고, 17명의 환자(22%)는 골수 외 질환이 있었습니다.
효능은 3년 무사건 생존율(EFS)을 기준으로 평가되었으며, 이는 SPRYCEL 투여 시작부터 3번째 고위험 블록 종료 시 완전 관해가 없는 경우, 재발, 이차 악성 종양 또는 모든 원인에 의한 사망까지의 시간으로 정의됩니다. 연구 CA180372에 참여한 환자의 3년 EFS 이진율은 64.1%(95% CI: 52.4, 74.7)였습니다. 유도 종료 시 75명의 환자(96%)가 골수에서 림프모세포가 5% 미만이었고, 76명의 환자(97%)가 강화 종료 시 이 수준에 도달했습니다.
15 참고 문헌
1. http://www.osha.gov/SLTC/hazardousdrugs/index.html
16 제공/보관 및 취급 방법
제품 정보
SPRYCEL® (다사티닙) 정제는 표 21에 설명된 바와 같이 제공됩니다.
|
NDC 번호 |
강도 |
설명 |
병당 정제 수 |
|
0003-0527-11 |
20 mg |
흰색에서 거의 흰색, 양쪽 볼록, 둥근, 필름 코팅 정제, 한쪽에는 “BMS”가, 다른 쪽에는 “527”이 각인되어 있습니다. |
60 |
|
0003-0528-11 |
50 mg |
흰색에서 거의 흰색, 양쪽 볼록, 타원형, 필름 코팅 정제, 한쪽에는 “BMS”가, 다른 쪽에는 “528”이 각인되어 있습니다. |
60 |
|
0003-0524-11 |
70 mg |
흰색에서 거의 흰색, 양쪽 볼록, 둥근, 필름 코팅 정제, 한쪽에는 “BMS”가, 다른 쪽에는 “524”가 각인되어 있습니다. |
60 |
|
0003-0855-22 |
80 mg |
흰색에서 거의 흰색, 양쪽 볼록, 삼각형, 필름 코팅 정제, 한쪽에는 “BMS”와 “80” (BMS 위에 80)이 각인되어 있고, 다른 쪽에는 “855”가 각인되어 있습니다. |
30 |
|
0003-0852-22 |
100 mg |
흰색에서 거의 흰색, 양쪽 볼록, 타원형, 필름 코팅 정제, 한쪽에는 “BMS 100”이 각인되어 있고, 다른 쪽에는 “852”가 각인되어 있습니다. |
30 |
|
0003-0857-22 |
140 mg |
흰색에서 거의 흰색, 양쪽 볼록, 둥근, 필름 코팅 정제, 한쪽에는 “BMS”와 “140” (BMS 위에 140)이 각인되어 있고, 다른 쪽에는 “857”가 각인되어 있습니다. |
30 |
보관
SPRYCEL 정제는 20°C에서 25°C(68°F에서 77°F)에 보관해야 합니다. 15°C에서 30°C(59°F에서 86°F) 사이의 온도 변화는 허용됩니다. [USP 제어 실온 참조].
취급 및 폐기
SPRYCEL은 항암제입니다. 특수 취급 및 폐기 절차를 따르십시오.1
임신한 직원은 분쇄되거나 부서진 정제에 노출되지 않도록 해야 합니다.
SPRYCEL 정제는 핵심 정제를 필름 코팅으로 둘러싸서 의료 전문가가 활성 성분에 노출되는 것을 방지합니다. 실수로 정제가 분쇄되거나 부서진 경우 적절한 폐기를 위해 라텍스 또는 니트릴 장갑을 착용하는 것이 좋습니다. 이는 피부 노출 위험을 최소화하기 위한 것입니다.
17 환자 상담 정보
FDA 승인 환자 라벨(환자 정보)을 읽도록 환자에게 알려주십시오.
골수억압
환자에게 낮은 혈구 수치가 발생할 가능성을 알려주십시오. 환자에게 특히 감염 징후와 관련하여 발열이 발생하면 즉시 보고하도록 알려주십시오 [경고 및 주의 사항 (5.1) 참조].
출혈
환자에게 심각한 출혈이 발생할 가능성을 알려주고 출혈의 징후나 증상(비정상적인 출혈 또는 멍이 쉽게 드는 것)이 나타나면 즉시 보고하도록 알려주십시오 [경고 및 주의 사항 (5.2) 참조].
체액 저류
환자에게 체액 저류(부종, 체중 증가, 마른 기침, 호흡 시 가슴 통증 또는 호흡 곤란)가 발생할 가능성을 알려주고 이러한 증상이 나타나면 즉시 의사의 진료를 받도록 알려주십시오 [경고 및 주의 사항 (5.3) 참조].
심혈관 독성
환자에게 심장 허혈성 사건, 심장 관련 체액 저류, 전도 이상 및 일과성 뇌허혈 발작을 포함한 심혈관 독성이 발생할 가능성을 알려주십시오. 환자에게 가슴 통증, 호흡 곤란, 두근거림, 일과성 시력 문제 또는 발음이 부정확한 등 심혈관 독성을 시사하는 증상이 나타나면 즉시 의사의 진료를 받도록 알려주십시오 [경고 및 주의 사항 (5.4) 참조].
폐동맥 고혈압
환자에게 폐동맥 고혈압(호흡 곤란, 피로, 저산소증 및 체액 저류)이 발생할 가능성을 알려주고 이러한 증상이 나타나면 즉시 의사의 진료를 받도록 알려주십시오 [경고 및 주의 사항 (5.5) 참조].
종양 용해 증후군
환자에게 메스꺼움, 구토, 쇠약, 부종, 호흡 곤란, 근육 경련 및 발작과 같은 증상이 나타나면 즉시 보고하고 의사의 진료를 받도록 알려주십시오. 이러한 증상은 종양 용해 증후군을 나타낼 수 있습니다 [경고 및 주의 사항 (5.8) 참조].
소아 환자의 성장 및 발달
소아 환자와 보호자에게 뼈 성장 이상, 뼈 통증 또는 유방 비대가 발생할 가능성을 알려주고 이러한 증상이 나타나면 즉시 의사의 진료를 받도록 알려주십시오 [경고 및 주의 사항 (5.10) 참조].
태아-태아 독성
- •
- 임산부에게 태아에 대한 잠재적 위험을 알려주십시오 [경고 및 주의 사항 (5.9) 및 특정 인구 집단에서의 사용 (8.1) 참조].
- •
- 생식 능력이 있는 여성과 생식 능력이 있는 여성 파트너가 있는 남성에게 SPRYCEL 치료 중 및 마지막 투여 후 30일 동안 효과적인 피임 방법을 사용하도록 알려주십시오. SPRYCEL을 복용하는 동안 임신이 발생하거나 임신이 의심되는 경우 여성은 의료 서비스 제공자에게 연락하도록 알려주십시오 [경고 및 주의 사항 (5.9) 및 특정 인구 집단에서의 사용 (8.1, 8.3) 참조].
위장관 불편
환자에게 SPRYCEL을 복용하면 메스꺼움, 구토 또는 설사가 발생할 수 있다는 것을 알려주십시오. 환자에게 이러한 증상이 심하거나 지속되면 의사의 진료를 받도록 알려주십시오.
제산제를 사용하는 환자에게 SPRYCEL과 제산제를 2시간 이내에 함께 복용하지 않도록 알려주십시오 [약물 상호 작용 (7.1) 참조].
통증
환자에게 SPRYCEL을 복용하면 두통 또는 근골격계 통증이 발생할 수 있다는 것을 알려주십시오. 환자에게 이러한 증상이 심하거나 지속되면 의사의 진료를 받도록 알려주십시오.
발진
환자에게 SPRYCEL을 복용하면 피부 발진이 발생할 수 있다는 것을 알려주십시오. 환자에게 이러한 증상이 심하거나 지속되면 의사의 진료를 받도록 알려주십시오.
스프라이셀® (스프라이셀)(다사티닙) 정제 환자 정보
|
SPRYCEL은 무엇입니까? SPRYCEL은 다음을 치료하는 데 사용되는 처방약입니다.
SPRYCEL이 1세 미만의 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
||
|
SPRYCEL을 복용하기 전에, 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약 및 일반 의약품, 비타민, 제산제, 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. 제산제를 복용하는 경우 SPRYCEL 복용 2시간 전 또는 2시간 후에 복용하십시오. |
||
|
SPRYCEL은 어떻게 복용해야 합니까?
|
||
|
SPRYCEL의 가능한 부작용은 무엇입니까? SPRYCEL은 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
|
||
|
|
|
|
||
|
|
|
|
SPRYCEL을 단독으로 투여받는 성인 및 어린이의 SPRYCEL의 가장 흔한 부작용은 다음과 같습니다. |
||
|
|
|
|
화학 요법과 함께 SPRYCEL을 투여받는 어린이의 SPRYCEL의 가장 흔한 부작용은 다음과 같습니다. |
||
|
|
|
|
SPRYCEL은 남성과 여성의 생식 능력에 문제를 일으킬 수 있습니다. 이것이 걱정되는 경우 의료 서비스 제공자와 상담하십시오. 귀하를 괴롭히거나 사라지지 않는 부작용이 있는 경우 의료 서비스 제공자에게 알리십시오. 이것들은 SPRYCEL의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
||
|
SPRYCEL은 어떻게 보관해야 합니까?
SPRYCEL과 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
||
|
SPRYCEL의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 팜플렛에 나열된 것과 다른 목적으로 처방됩니다. 처방되지 않은 질환에 SPRYCEL을 사용하지 마십시오. 귀하와 같은 증상이 있어도 다른 사람에게 SPRYCEL을 주지 마십시오. 해를 입힐 수 있습니다. 의료 서비스 제공자 또는 약사에게 의료 전문가를 위해 작성된 SPRYCEL에 대한 정보를 요청할 수 있습니다. |
||
|
SPRYCEL의 성분은 무엇입니까? 활성 성분: dasatinib 비활성 성분: 유당 일수화물, 미결정 셀룰로오스, 크로스카멜로오스 나트륨, 히드록시프로필 셀룰로오스 및 마그네슘 스테아레이트. 정제 코팅은 히프로멜로오스, 이산화티타늄 및 폴리에틸렌 글리콜로 구성됩니다. 배포: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA |
||
이 환자 정보는 미국 식품의약국에서 승인했습니다.
개정: 2023년 2월
스프라이셀 20mg 정 대표 포장
SPRYCEL의 모든 포장 단위 목록은 포장 단위 섹션을 참조하십시오.
60 정 NDC 0003-0527-11
SPRYCEL®
(다사티닙)
정제
20 mg
처방전 의약품
정제를 부수거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
Bristol Myers Squibb
스프라이셀 50mg 정 대표 포장
60 정 NDC 0003-0528-11
SPRYCEL®
(다사티닙)
정제
50 mg
처방전 의약품
정제를 부수거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
브리스톨 마이어스 스퀴브
스프라이셀 70mg 정 대표 포장
60 정 NDC 0003-0524-11
SPRYCEL®
(다사티닙)
정제
70 mg
처방전 의약품
정제를 부수거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
Bristol Myers Squibb
스프라이셀 80mg 정 대표 포장
30정 NDC 0003-0855-22
SPRYCEL®
(다사티닙)
정제
80 mg
처방전 필요
정제를 으깨거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
Bristol Myers Squibb
스프라이셀 100mg 정 대표 포장
30 정 NDC 0003-0852-22
SPRYCEL®
(다사티닙)
정제
100 mg
처방전 의약품
정제를 부수거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
Bristol Myers Squibb
스프라이셀 140mg 정 대표 포장
30 정 NDC 0003-0857-22
SPRYCEL®
(다사티닙)
정제
140 mg
처방전 의약품
정제를 부수거나, 자르거나, 씹지 마십시오.
정제를 통째로 삼키십시오.
브리스톨 마이어스 스퀴브