의약품 제조업체: Waylis Therapeutics LLC (Updated: 2023-05-15)
사용상의 주의사항
경고
LEUKERAN (chlorambucil)은 골수 기능을 심각하게 억제할 수 있습니다. Chlorambucil은 인체에 발암성이 있습니다. Chlorambucil은 인체에 돌연변이 유발 및 기형 유발 가능성이 있습니다. Chlorambucil은 인체 불임을 유발합니다 (WARNINGS 및 PRECAUTIONS 참조).
제품 설명
LEUKERAN (chlorambucil)은 Everett 등에 의해 처음 합성되었습니다. 이것은 선택된 인간 종양 질환에 대해 활성이 있는 것으로 밝혀진 nitrogen mustard 계열의 이중 기능성 알킬화제입니다.
Chlorambucil은 화학적으로 4-[bis(2-chlorethyl)amino]benzenebutanoic acid로 알려져 있으며 다음과 같은 구조식을 가지고 있습니다:
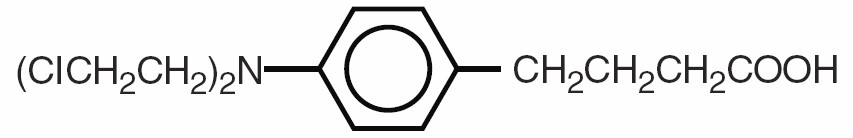
Chlorambucil은 물에서 가수분해되며 pKa는 5.8입니다.
LEUKERAN (chlorambucil)은 경구 투여를 위한 정제 형태로 제공됩니다. 각 필름코팅정에는 chlorambucil 2mg과 비활성 성분인 colloidal silicon dioxide, hypromellose, lactose (anhydrous), macrogol/PEG 400, microcrystalline cellulose, red iron oxide, stearic acid, titanium dioxide, yellow iron oxide가 함유되어 있습니다.
약력학
작용 기전
방향족 nitrogen mustard 유도체인 Chlorambucil은 알킬화제입니다. Chlorambucil은 세포질 p53의 축적과 apoptosis 촉진제인 Bax의 후속 활성화를 통해 DNA 복제를 방해하고 세포 apoptosis를 유도합니다.
약동학
LEUKERAN 0.2 mg/kg 단회 경구 투여를 받은 12명의 환자를 대상으로 한 연구에서, 평균 용량 보정(±SD) 혈장 chlorambucil Cmax는 492 ± 160 ng/mL, AUC는 883 ± 329 ng.h/mL, 평균 소실 반감기(t½)는 1.3 ± 0.5시간, Tmax는 0.83 ± 0.53시간이었습니다. 주요 대사체인 phenylacetic acid mustard (PAAM)의 경우, 평균 용량 보정(± SD) 혈장 Cmax는 306 ± 73 ng/mL, AUC는 1204 ± 285 ng.h/mL, 평균 t½는 1.8 ± 0.4시간, Tmax는 1.9 ± 0.7시간이었습니다.
0.6에서 1.2 mg/kg의 단회 경구 투여 후, 혈장 chlorambucil 최고 농도(Cmax)는 1시간 이내에 도달하며 모약물의 최종 소실 반감기(t½)는 1.5시간으로 추정됩니다.
흡수: Chlorambucil은 위장관에서 빠르고 완전하게(>70%) 흡수됩니다. Chlorambucil의 빠르고 예측 가능한 흡수와 일치하게, 15에서 70 mg 사이의 경구 투여 후 chlorambucil의 혈장 약동학의 개인 간 변동성은 상대적으로 작은 것으로 나타났습니다(2배의 환자 내 변동성 및 AUC에서 2~4배의 환자 간 변동성). Chlorambucil의 흡수는 식사 후에 감소합니다. 10명의 환자를 대상으로 한 연구에서 음식 섭취는 중앙값 Tmax를 2배 증가시키고 용량 보정된 Cmax 및 AUC 값을 각각 55% 및 20% 감소시켰습니다.
분포: 만성 림프구성 백혈병이 있는 11명의 암 환자에서 0.2 mg/kg 단회 경구 투여 후 분포 용적은 평균 0.31 L/kg이었습니다. Chlorambucil과 그 대사체는 혈장 및 조직 단백질과 광범위하게 결합합니다. In vitro에서 chlorambucil은 혈장 단백질, 특히 albumin과 99% 결합합니다. Chlorambucil의 뇌척수액 농도는 확인되지 않았습니다.
대사: Chlorambucil은 주로 간에서 광범위하게 대사되어 항종양 활성이 있는 phenylacetic acid mustard를 생성합니다. Chlorambucil과 그 주요 대사체는 monohydroxy 및 dihydroxy 유도체로 산화 분해됩니다.
배설: 방사성 표지된 chlorambucil(14C) 단회 투여 후, 약 20%에서 60%의 방사능이 24시간 후 소변에서 검출됩니다. 역시 요중 방사능의 1% 미만이 chlorambucil 또는 phenylacetic acid mustard 형태로 존재합니다.
적응증 및 사용법
LEUKERAN (chlorambucil)은 만성 림프구성 백혈병, 림프육종, 거대 여포성 림프종, 호지킨 병을 포함한 악성 림프종의 치료에 사용 적응증이 있습니다. 이들 질환에서 완치를 기대할 수는 없지만 임상적으로 유용한 완화 효과를 나타낼 수 있습니다.
금기 사항
이전에 chlorambucil에 대한 내성을 보인 환자에게는 사용해서는 안 된다. Chlorambucil에 과민반응을 나타낸 환자에게는 투여하지 않아야 한다.
Chlorambucil과 다른 alkylating agents 사이에는 교차 과민반응(피부 발진)이 있을 수 있다.
경고
Chlorambucil은 발암 특성으로 인해 만성 림프구성 백혈병 또는 악성 림프종 이외의 상태에 있는 환자에게 투여해서는 안 됩니다. Chlorambucil이 악성 및 비악성 질환의 치료에 사용되었을 때 경련, 불임, 백혈병 및 이차 악성종양이 관찰되었습니다.
Chlorambucil 치료 후 악성 및 비악성 질환을 모두 가진 환자에서 급성 백혈병이 발생했다는 많은 보고가 있습니다. 많은 경우에 이러한 환자들은 또한 다른 화학요법제 또는 일부 형태의 방사선 요법을 받았습니다. 사람에서 백혈병 또는 암을 유발하는 chlorambucil의 위험 정량화는 불가능합니다. Chlorambucil(및 기타 alkylating agents)을 받은 환자에서 발생한 백혈병에 대한 발표된 보고서를 평가하면 백혈병 발생 위험은 치료 기간과 누적 용량이 모두 증가함에 따라 증가하는 것으로 보입니다. 그러나 이차 악성종양 유발의 위험이 없는 누적 용량을 정의하는 것은 불가능한 것으로 밝혀졌습니다. Chlorambucil 요법의 잠재적 이점은 이차 악성종양 유발의 가능한 위험에 대해 개별적으로 평가되어야 합니다.
Chlorambucil은 사람에서 chromatid 또는 염색체 손상을 일으키는 것으로 나타났습니다. Chlorambucil을 투여받은 양성 모두에서 가역적 및 영구적 불임이 관찰되었습니다.
Chlorambucil이 사춘기 전 및 사춘기 남성에게 투여될 때 높은 발생률의 불임이 기록되었습니다. 성인 남성에서도 장기간 또는 영구적인 무정자증이 관찰되었습니다. Chlorambucil에 이차적인 성선 기능장애에 대한 대부분의 보고는 남성과 관련이 있지만, alkylating agents로 여성에서 무월경을 유발하는 것은 잘 기록되어 있으며 chlorambucil은 무월경을 유발할 수 있습니다. Chlorambucil을 포함한 병용 화학요법으로 치료받은 악성 림프종 여성의 난소에 대한 부검 연구에서 다양한 정도의 섬유증, 혈관염 및 원시 난포 고갈이 나타났습니다.
드물게 피부 발진이 진행되어 다형 홍반, 독성 표피 괴사용해 또는 Stevens-Johnson 증후군으로 진행되는 경우가 보고되었습니다. 피부 반응이 나타나는 환자에서는 즉시 chlorambucil 투여를 중단해야 합니다.
임신
Chlorambucil은 임신한 여성에게 투여할 때 태아에게 해를 줄 수 있습니다. 임신 제1삼분기에 chlorambucil을 투여받은 산모의 2명의 자손에서 일측성 신장 무형성증이 관찰되었습니다. 신장 결손을 포함한 비뇨생식기 기형이 chlorambucil을 투여받은 랫드 태아에서 발견되었습니다. 임신한 여성을 대상으로 한 적절하고 잘 통제된 연구는 없습니다. 임신 중 이 약을 사용하거나 이 약을 복용하는 동안 임신하게 되면 태아에 대한 잠재적 위험을 환자에게 알려야 합니다. 가임기 여성은 임신하지 않도록 주의해야 합니다.
주의사항
일반적 주의사항
많은 환자들이 치료 중 서서히 진행되는 림프구 감소증을 겪습니다. 림프구 수치는 보통 약물 치료가 완료되면 빠르게 정상 수준으로 돌아옵니다. 대부분의 환자는 3주차 치료 후 호중구 감소증이 나타나며, 이는 마지막 투여 후 10일까지 지속될 수 있습니다. 그 후, 호중구 수치는 보통 빠르게 정상으로 돌아옵니다. 중증 호중구 감소증은 용량과 관련이 있는 것으로 보이며, 보통 continuous dosing으로 한 치료 과정에서 총 용량 6.5mg/kg 이상을 투여 받은 환자에게만 발생합니다. continuous-dose 스케줄을 받은 모든 환자의 약 1/4, 그리고 8주 이하로 이 용량을 투여받은 환자의 1/3은 중증 호중구 감소증이 발생할 것으로 예상됩니다.
호중구 수치 감소의 첫 증거가 나타났다고 해서 chlorambucil을 중단할 필요는 없지만, 마지막 투여 후 10일까지 감소가 지속될 수 있으며, 총 용량이 6.5mg/kg에 근접할수록 불가역적인 골수 손상을 일으킬 위험이 있다는 것을 기억해야 합니다. 백혈구 또는 혈소판 수치가 정상 이하로 떨어지면 chlorambucil의 용량을 감량해야 하며, 더 심각한 감소 시에는 중단해야 합니다.
방사선 요법이나 화학요법 전체 치료 과정이 끝난 후 4주 이내에는 이러한 조건에서 골수가 손상되기 쉬우므로 chlorambucil을 완전한 용량으로 투여해서는 안 됩니다. 치료 시작 전 골수 질환 과정으로 인해 백혈구 또는 혈소판 수치가 감소한 경우, 감량하여 치료를 시작해야 합니다.
지속적으로 낮은 호중구 및 혈소판 수치 또는 말초 림프구증가증은 골수 침윤을 암시합니다. 골수 검사로 확인된 경우, chlorambucil의 일일 용량은 0.1mg/kg을 초과해서는 안 됩니다. Chlorambucil은 골수 억제 작용 외에는 위장 부작용이나 다른 독성 증거와 비교적 무관한 것으로 보입니다. 사람의 경우 20mg 이상의 단일 경구 투여 시 구역질 및 구토가 발생할 수 있습니다.
신증후군이 있는 소아 및 고용량 pulse chlorambucil 투여 환자는 발작 위험이 증가할 수 있습니다. 발작 장애 또는 두부 외상 병력이 있거나 다른 잠재적 유발 약물을 복용 중인 환자에게 chlorambucil을 투여할 때는 주의를 기울여야 합니다.
면역 저하 환자에게 생백신을 투여하는 것은 피해야 합니다.
환자를 위한 정보
환자에게 chlorambucil의 주요 독성은 과민증, 약열, 골수 억제, 간독성, 불임, 발작, 위장 독성 및 이차성 악성종양과 관련이 있음을 알려야 합니다. 환자는 의사의 감독 없이 약을 복용해서는 안 되며, 피부 발진, 출혈, 발열, 황달, 지속적인 기침, 발작, 구역, 구토, 무월경 또는 비정상적인 덩어리/종괴가 발생하면 의사와 상담해야 합니다. 가임기 여성은 임신을 피하도록 조언받아야 합니다.
검사실 검사
치료 중 생명을 위협하는 골수 손상을 피하기 위해 환자를 주의 깊게 추적 관찰해야 합니다. 매주 혈액 검사를 실시하여 헤모글로빈 수치, 총 백혈구 및 감별 백혈구 수, 정량적 혈소판 수를 확인해야 합니다. 또한 치료 첫 3~6주 동안에는 매주 전체 혈구 계산 후 3~4일마다 백혈구 수 검사를 하는 것이 좋습니다. Galton 등은 환자를 추적 관찰할 때 체중, 체온, 비장 크기 등을 기록할 때 혈구 수를 차트에 표시하는 것이 도움이 된다고 제안했습니다. 치료 중 혈액학적 및 임상적 검사 없이 환자를 2주 이상 방치하는 것은 위험한 것으로 간주됩니다.
수유
이 약물이 모유로 배설되는지는 알려져 있지 않습니다. 많은 약물이 모유로 배설되고 chlorambucil로 인해 수유 중인 유아에게 심각한 이상반응이 발생할 가능성이 있으므로, 수유를 중단할지 또는 약물을 중단할지는 산모에 대한 약물의 중요성을 고려하여 결정해야 합니다.
노인 사용
Chlorambucil의 임상 연구에는 65세 이상의 피험자가 충분히 포함되지 않아 젊은 피험자와 다르게 반응하는지 여부를 확인할 수 없었습니다. 그 밖의 보고된 임상 경험에서 고령 환자와 젊은 환자 간의 반응 차이는 확인되지 않았습니다. 일반적으로 고령 환자의 용량 선택은 간, 신장 또는 심장 기능 저하, 동반 질환 또는 기타 약물 요법의 빈도가 더 높아 용량 범위의 하한에서 시작하는 등 주의해야 합니다.
신장애 환자에서의 사용: 신장애가 chlorambucil 배설에 미치는 영향은 공식적으로 연구되지 않았습니다. 변화되지 않은 chlorambucil 및 그 주요 활성 대사물인 phenylacetic acid mustard의 신장 배설은 투여 용량의 1% 미만을 차지합니다. 또한, chlorambucil을 투여 받은 2명의 투석 환자에서 용량 조절이 필요하지 않았습니다. 따라서 신장애는 chlorambucil의 배설에 큰 영향을 미치지 않을 것으로 예상됩니다.
간장애 환자에서의 사용: 간장애 환자를 대상으로 한 공식적인 연구는 수행되지 않았습니다. Chlorambucil은 주로 간에서 대사되므로, LEUKERAN으로 치료받는 간장애 환자는 독성에 대해 면밀히 모니터링해야 하며, 간장애 환자에서는 용량 감량을 고려할 수 있습니다(용법·용량 참조).
이상반응
의심되는 이상반응을 보고하려면 Waylis Therapeutics LLC에 수신자 부담 전화 1-888-514-4727로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
혈액학적
가장 흔한 부작용은 골수 억제, 빈혈, 백혈구 감소증, 호중구 감소증, 혈소판 감소증 또는 범혈구 감소증입니다. 골수 억제는 자주 발생하지만 chlorambucil을 충분히 일찍 중단하면 대개 가역적입니다. 그러나 비가역적인 골수 부전이 보고되었습니다.
중추신경계
떨림, 근육 경련, 근간대경련, 혼란, 초조, 운동실조, 이완성 마비 및 환각은 chlorambucil에 대한 드문 이상반응으로 보고되었으며 약물 중단 시 해결됩니다. 드물게 국소 및/또는 전신 발작이 치료 1일 용량과 pulse-dosing 요법 모두에서 성인과 소아 모두에서 발생하는 것으로 보고되었으며, 급성 과량투여 시에도 발생합니다(사용상의 주의사항: 일반 참조).
피부과적
두드러기 및 혈관부종과 같은 알레르기 반응이 초기 또는 후속 투여 후에 보고되었습니다. 피부 과민 반응(다형 홍반, 독성 표피 괴사융해증 및 스티븐스-존슨 증후군으로 진행되는 드문 피부 발진 보고 포함)이 보고되었습니다(경고 참조).
과량 투여
가역적 범혈구감소증은 chlorambucil 우발적 과량 투여의 주요 소견이었습니다.
흥분된 행동 및 ataxia부터 다발성 대발작에 이르는 신경학적 독성도 발생했습니다. 알려진 해독제가 없으므로 혈액상을 면밀히 모니터링하고 필요한 경우 적절한 수혈과 함께 일반적인 지지요법을 시행해야 합니다. Chlorambucil은 투석이 불가능합니다.
마우스에서 경구 LD50 단일 용량은 123 mg/kg입니다. 랫드에서 chlorambucil 12.5 mg/kg의 단일 복강 내 투여는 장 점막 및 림프 조직의 위축, 4일 후 최대가 되는 중증 림프구감소증, 빈혈 및 혈소판감소증을 포함하는 전형적인 nitrogen-mustard 효과를 나타냅니다. 이 용량 투여 후 동물은 3일 이내에 회복되기 시작하고 약 1주일 후에는 정상으로 보이지만 골수는 약 3주 동안 완전히 정상으로 회복되지 않을 수 있습니다. 18.5 mg/kg의 복강 내 투여량은 경련 발생과 함께 약 50%의 랫드를 사망에 이르게 합니다. 50 mg/kg까지 단일 용량으로 랫드에 경구 투여하여 회복되었습니다. 이러한 용량은 서맥, 과도한 침분비, 혈뇨, 경련 및 호흡기능 장애를 유발합니다.
용법 및 투여
일반적인 경구 용량은 필요에 따라 3~6주 동안 체중 kg당 0.1~0.2mg을 매일 투여하는 것입니다. 이는 보통 평균 환자의 경우 하루에 4~10mg에 해당합니다. 전체 일일 용량을 한 번에 투여할 수 있습니다. 이러한 용량은 치료 시작 시 또는 단기 치료 시 사용됩니다. 용량은 환자의 반응에 따라 주의 깊게 조정되어야 하며, 백혈구 수치가 급격히 떨어지는 즉시 감량해야 합니다. Hodgkin’s disease 환자는 보통 하루에 체중 kg당 0.2mg이 필요한 반면, 다른 lymphoma 또는 만성 lymphocytic leukemia 환자는 보통 하루에 체중 kg당 0.1mg만 필요합니다. 골수에 lymphocytic infiltration이 있거나 골수가 hypoplastic한 경우, 일일 용량은 체중 kg당 0.1mg(평균 환자의 경우 약 6mg)을 초과해서는 안 됩니다. 만성 lymphocytic leukemia 치료를 위해 간헐적, 격주 또는 월 1회 pulse 용량의 chlorambucil을 사용하는 대체 일정이 보고되었습니다. Chlorambucil의 간헐적 일정은 0.4mg/kg의 초기 단일 용량으로 시작합니다. 용량은 일반적으로 lymphocytosis 또는 독성이 관찰될 때까지 체중 kg당 0.1mg씩 증량됩니다. 이후 용량은 경미한 혈액학적 독성을 유발하도록 조정됩니다. 격주 또는 월 1회 일정으로 chlorambucil을 투여할 경우 만성 lymphocytic leukemia의 반응률이 이전에 일일 투여로 보고된 것과 유사하거나 더 우수하며, 혈액학적 독성은 일일 chlorambucil을 사용한 연구에서 발생한 것보다 적거나 같은 것으로 여겨집니다.
방사선 및 cytotoxic 약물은 골수를 손상에 더 취약하게 만들므로, 방사선 요법 또는 화학요법의 전체 과정이 끝난 후 4주 이내에는 chlorambucil을 특별히 주의하여 사용해야 합니다. 그러나 골수에서 멀리 떨어진 고립된 병소에 대한 소량의 완화 방사선은 보통 호중구 및 혈소판 수를 감소시키지 않습니다. 이러한 경우 chlorambucil을 통상적인 용량으로 투여할 수 있습니다.
현재로서는 단기 치료가 지속적인 유지 요법보다 더 안전하다고 생각되지만, 두 방법 모두 효과적이었습니다. 지속적인 치료는 실제로 관해 상태에 있고 추가 약물이 즉시 필요하지 않은 환자에게 “유지”의 모습을 줄 수 있다는 점을 인식해야 합니다. 유지 용량을 사용하는 경우, 하루에 체중 kg당 0.1mg을 초과해서는 안 되며 하루에 체중 kg당 0.03mg 정도로 낮출 수 있습니다. 전형적인 유지 용량은 혈액 검사 상태에 따라 하루에 2mg에서 4mg 이하입니다. 따라서 최대 조절이 이루어진 후에는 약물을 중단하는 것이 바람직할 수 있습니다. 재발 시 다시 시작한 간헐적 치료는 지속적인 치료만큼 효과적일 수 있기 때문입니다.
항암제의 적절한 취급 및 폐기 절차를 사용해야 합니다. 이 주제에 대한 여러 가이드라인이 발표되었습니다.1-4 가이드라인에서 권장하는 모든 절차가 필요하거나 적절하다는 일반적인 합의는 없습니다.
특수 집단
간 장애: 간 장애가 있는 환자는 독성에 대해 면밀히 모니터링해야 합니다. Chlorambucil은 주로 간에서 대사되므로, LEUKERAN으로 치료 시 간 장애 환자에서 용량 감소를 고려할 수 있습니다. 그러나 간 장애 환자에서 특정 용량 권장 사항을 제공할 수 있는 데이터는 충분하지 않습니다.
공급 형태
LEUKERAN은 갈색 유리병에 담긴 2 mg chlorambucil을 함유한 갈색의 필름 코팅된 원형 양면이 볼록한 정제로 공급됩니다. 어린이 안전 뚜껑이 있습니다. 한 면에는 “GX EG3″가 새겨져 있고 다른 면에는 “L”이 새겨져 있습니다.
25정들이 병 (NDC 80725-610-25)
2°~8°C (36°~46°F)의 냉장고에 보관하십시오.
참고문헌
1. NIOSH Alert: 의료기관 내 항암제 및 기타 유해 약물에 대한 직업적 노출 예방. 2004. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Section VI: Chapter 2. 유해 약물에 대한 직업적 노출 관리. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP 유해 약물 취급 지침. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, J. M., & Kelleher, L.O. (eds.) 2005. 항암요법 및 생물학적 요법 지침 및 실무 권고사항 (2nd. ed.) Pittsburgh, PA: Oncology Nursing Society.
SPL 미분류 섹션

유통: Waylis Therapeutics LLC
Wixom, MI 48393
Made in Germany
Rev. 02/2023
패키지 라벨 주요 디스플레이 패널
주요 디스플레이 패널
NDC 80725-610-25
LEUKERAN®
(chlorambucil) 정제
2 mg
25 정
각 정제는 chlorambucil 2 mg을 함유합니다.
Rx Only.

Leukeran 2mg 25 ct. 상자

Leukeran 2mg 25 ct. 라벨

