의약품 제조업체: Merck Sharp & Dohme LLC (Updated: 2024-07-05)
처방 정보의 주요 내용
ZEPATIER® (엘바스비어 및 그라조프레비어) 정제, 경구용
미국 최초 승인: 2016
경고: HCV 및 HBV에 동시 감염된 환자에서 B형 간염 바이러스 재활성화 위험
전체 경고 상자에 대한 전체 처방 정보를 참조하십시오.
B형 간염 바이러스(HBV) 재활성화가 보고되었으며, 일부 경우에는 급성 간염, 간 기능 부전 및 사망으로 이어졌습니다. (5.1)
최근 주요 변경 사항
적응증 및 사용법
ZEPATIER는 C형 간염 바이러스(HCV) NS5A 억제제인 엘바스비어와 HCV NS3/4A 프로테아제 억제제인 그라조프레비어를 함유한 고정 용량 복합 제제이며, 성인 및 12세 이상 또는 체중이 30kg 이상인 소아 환자의 만성 HCV 1형 또는 4형 감염 치료에 사용됩니다. ZEPATIER는 특정 환자군에서 리바비린과 함께 사용됩니다. (1)
투여량 및 투여 방법
- 치료 시작 전 검사:
- 성인 및 12세 이상 또는 체중이 30kg 이상인 소아 환자의 권장 투여량: 음식과 관계없이 하루에 한 번 경구로 1정을 복용합니다. (2.2)
| 환자군 | 치료 | 기간 |
|---|---|---|
| 1a형: 치료 경험이 없는 또는 PegIFN/RBV 경험이 있는* 없이 기준 NS5A 다형성† |
ZEPATIER | 12주 |
| 1a형: 치료 경험이 없는 또는 PegIFN/RBV 경험이 있는* 있는 기준 NS5A 다형성† |
ZEPATIER + 리바비린 | 16주 |
| 1b형: 치료 경험이 없는 또는 PegIFN/RBV 경험이 있는* |
ZEPATIER | 12주 |
| 1a형 또는 1b형: PegIFN/RBV/PI 경험‡ | ZEPATIER + 리바비린 | 12주 |
| 4형: 치료 경험이 없는 |
ZEPATIER | 12주 |
| 4형: PegIFN/RBV 경험* |
ZEPATIER + 리바비린 | 16주 |
투약 형태 및 강도
- 정제: 엘바스비어 50mg 및 그라조프레비어 100mg (3)
금기 사항
경고 및 주의 사항
- B형 간염 바이러스 재활성화 위험: HCV 치료 시작 전에 모든 환자에 대해 현재 또는 과거 HBV 감염 증거를 검사하십시오. HCV/HBV 공동 감염 환자는 HCV 치료 및 치료 후 추적 관찰 중에 HBV 재활성화 및 간염 악화를 모니터링하십시오. 임상적으로 나타나는 경우 HBV 감염에 대한 적절한 환자 관리를 시작하십시오. (5.1)
- ALT 상승: 치료 전, 치료 8주차에, 그리고 임상적으로 필요한 경우 간 기능 검사를 실시하십시오. 16주 치료를 받는 환자의 경우 치료 12주차에 추가 간 기능 검사를 실시하십시오. ZEPATIER에 대한 ALT 상승의 경우 전체 처방 정보의 권장 사항을 따르십시오. (5.2)
- 진행된 간 질환 증거가 있는 환자의 간 기능 저하/부전 위험: 간 기능 저하/부전(치명적인 결과 포함)은 주로 간경변증이 있고 기저 간 기능 장애가 중등도 또는 중증(Child-Pugh B 또는 C)인 환자에서 HCV NS3/4A 프로테아제 억제제 함유 요법으로 치료받은 경우 보고되었습니다. 간 기능 저하의 임상적 및 실험실적 증거를 모니터링하십시오. 간 기능 저하/부전 증거가 나타나는 환자는 ZEPATIER를 중단하십시오. (5.3)
- 리바비린 병용 치료와 관련된 위험: ZEPATIER를 리바비린과 함께 투여하는 경우 리바비린에 대한 경고 및 주의 사항도 적용됩니다. (5.4)
부작용
12주 동안 ZEPATIER를 투여받은 피험자에서 가장 흔하게 보고된 모든 강도의 부작용(위약 대조 시험에서 5% 이상)은 피로, 두통 및 메스꺼움이었습니다. 16주 동안 리바비린과 함께 ZEPATIER를 투여받은 피험자에서 가장 흔하게 보고된 중등도 또는 중증 강도의 부작용(5% 이상)은 빈혈 및 두통이었습니다. (6.1)
의심되는 부작용을 보고하려면 Merck Sharp & Dohme LLC에 1-877-888-4231 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch 로 연락하십시오.
약물 상호 작용
- ZEPATIER를 중등도 CYP3A 유도제와 함께 투여하는 것은 ZEPATIER의 혈장 농도를 감소시킬 수 있으므로 권장되지 않습니다. (7)
- ZEPATIER를 특정 강력한 CYP3A 억제제와 함께 투여하는 것은 ZEPATIER의 혈장 농도를 증가시킬 수 있으므로 권장되지 않습니다. (7)
- 직접 작용 항바이러스제로 HCV 감염을 제거하면 간 기능이 변할 수 있으며, 이는 동반 약물의 안전하고 효과적인 사용에 영향을 미칠 수 있습니다. 관련 실험실 매개변수(INR 또는 혈당)를 자주 모니터링하고 특정 동반 약물의 용량 조절이 필요할 수 있습니다. (7.2)
- 잠재적인 약물 상호 작용에 대해 치료 전 및 치료 중에 전체 처방 정보를 참조하십시오. (4, 5.5, 7, 12.3)
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 2022년 5월
목차
전문 정보: 목차*
경고: HCV 및 HBV 동시 감염 환자에서 B형 간염 바이러스 재활성화 위험
1 적응증 및 사용법
2 용법 및 용량
2.1 치료 시작 전 검사
2.2 성인 및 12세 이상 또는 체중 30kg 이상의 소아 환자에 대한 권장 용량
2.3 신장애
2.4 간장애
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 HCV 및 HBV 동시 감염 환자에서 B형 간염 바이러스 재활성화 위험
5.2 ALT 상승 위험 증가
5.3 진행된 간 질환 증거가 있는 환자에서 간 기능 저하/부전 위험
5.4 리바비린 병용 치료와 관련된 위험
5.5 약물 상호 작용으로 인한 유해 반응 또는 치료 효과 감소 위험
6 유해 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 약물 상호 작용 가능성
7.2 확립된 및 기타 잠재적으로 중요한 약물 상호 작용
7.3 ZEPATIER와 임상적으로 유의미한 상호 작용이 없는 약물
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 성별
8.7 인종
8.8 신장애
8.9 간장애
10 과량 복용
11 설명
12 약리 작용
12.1 작용 기전
12.2 약력학
12.3 약동학
12.4 미생물학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 임상 시험 개요
14.2 유전자형 1 HCV를 가진 치료 경험이 없는 피험자에 대한 임상 시험 (C-EDGE TN 및 C-EDGE COINFECTION)
14.3 유전자형 1 HCV를 가진 치료 경험이 있는 피험자에 대한 임상 시험
14.4 혈액 투석을 포함한 중증 신장애를 가진 유전자형 1 HCV 피험자에 대한 임상 시험 (C-SURFER)
14.5 유전자형 4 HCV를 가진 임상 시험
14.6 유전자형 1 또는 4 만성 C형 간염 감염 소아 피험자에 대한 임상 시험
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: HCV 및 HBV 동시 감염 환자에서의 B형 간염 바이러스 재활성화 위험
ZEPATIER 치료를 시작하기 전에 모든 환자에게 현재 또는 과거 B형 간염 바이러스 (HBV) 감염 증거를 검사하십시오. HBV 재활성화는 HCV 직접 작용 항바이러스제로 치료를 받고 있거나 완료했으며 HBV 항바이러스 요법을 받지 않은 HCV/HBV 동시 감염 환자에서 보고되었습니다. 일부 사례는 급성 간염, 간 기능 부전 및 사망으로 이어졌습니다. HCV 치료 및 치료 후 추적 관찰 동안 HCV/HBV 동시 감염 환자의 간염 악화 또는 HBV 재활성화를 모니터링하십시오. 임상적으로 적응증이 있는 경우 HBV 감염에 대한 적절한 환자 관리를 시작하십시오 [경고 및 주의 사항 (5.1) 참조].
1 적응증 및 용법
ZEPATIER®는 12세 이상 또는 체중이 30kg 이상인 성인 및 소아 환자의 만성 C형 간염 바이러스(HCV) 1형 또는 4형 감염 치료에 사용됩니다.
ZEPATIER는 특정 환자군에서 리바비린과 함께 사용됩니다 [용법 및 용량(2.2) 참조].
2 투여 및 관리
2.1 치료 시작 전 검사
HBV 감염 검사
ZEPATIER로 HCV 치료를 시작하기 전에 모든 환자에게 B형 간염 표면 항원(HBsAg)과 B형 간염 코어 항체(anti-HBc)를 측정하여 현재 또는 과거 HBV 감염 여부를 검사하십시오 [경고 및 주의 사항(5.1) 참조].
HCV 유전형 1a 감염 환자의 NS5A 내성 검사
ZEPATIER로 치료를 시작하기 전에 HCV 유전형 1a 감염 환자에게 NS5A 내성 관련 다형성을 가진 바이러스가 있는지 검사하여 투약 요법 및 기간을 결정하는 것이 좋습니다 [투약 및 투여(2.2), 표 1 참조]. ZEPATIER를 12주 동안 투여받은 대상자의 경우, 유전형 1a 감염 환자 중 아미노산 위치 28, 30, 31 또는 93에 하나 이상의 기준 NS5A 내성 관련 다형성이 있는 환자의 지속적인 바이러스학적 반응(SVR12) 비율이 더 낮았습니다 [미생물학(12.4), 표 12 참조].
2.2 성인 및 12세 이상 또는 체중 30kg 이상의 소아 환자에 대한 권장 용량
ZEPATIER는 단일 정제에 엘바스비어 50mg과 그라조프레비어 100mg이 함유된 2가 고정 용량 복합 제제입니다. ZEPATIER의 권장 용량은 음식과 관계없이 1일 1회 경구 투여하는 1정입니다 [임상 약리학(12.3) 참조]. ZEPATIER는 특정 환자군에서 리바비린과 병용하여 사용됩니다(표 1 참조). ZEPATIER와 함께 투여하는 경우, 신장 장애가 없는 환자의 경우 리바비린의 권장 용량은 체중 기반으로 음식과 함께 2회 분할하여 투여합니다. 리바비린 투약 및 용량 조절에 대한 자세한 내용은 리바비린 처방 정보를 참조하십시오.
치료 요법 및 치료 기간
재발률은 기준 환자 및 바이러스 요인의 영향을 받으며 특정 하위 그룹의 경우 치료 요법 및 기간에 따라 다릅니다 [임상 연구(14) 참조].
아래 표 1은 간경변 유무, 신장 장애 유무(혈액 투석을 받는 환자 포함)를 포함하여 HCV 단독 감염 및 HCV/HIV-1 동시 감염 환자의 환자군 및 유전형에 따른 ZEPATIER 권장 치료 요법 및 기간을 보여줍니다.
| 환자군 | 치료 | 기간 |
|---|---|---|
|
||
| 유전형 1a: 치료 경험이 없는 또는 PegIFN/RBV 경험이 있는* 기준 NS5A 다형성이 없는† | ZEPATIER | 12주 |
| 1a형: 치료 경험이 없는 환자 또는 PegIFN/RBV 치료 경험이 있는 환자* with 기저 NS5A 다형성† | ZEPATIER + RBV‡ | 16주 |
| 1b형: 치료 경험이 없는 환자 또는 PegIFN/RBV 치료 경험이 있는 환자* | ZEPATIER | 12주 |
| 1a형§ 또는 1b형: PegIFN/RBV/PI 치료 경험이 있는 환자¶ | ZEPATIER + RBV‡ | 12주 |
| 4형: 치료 경험이 없는 환자 | ZEPATIER | 12주 |
| 4형: PegIFN/RBV 치료 경험이 있는 환자* | ZEPATIER + RBV‡ | 16주 |
2.3 신장애
투석을 받는 환자를 포함하여 신장애가 있는 환자의 경우 ZEPATIER 용량 조절은 권장되지 않습니다. 표 1 [특정 인구집단에서의 사용 (8.8) 및 임상 연구 (14.4) 참조]의 권장 사항에 따라 리바비린과 함께 또는 리바비린 없이 ZEPATIER를 투여하십시오. CrCl이 50mL/분 이하인 환자의 경우 리바비린 정제 처방 정보에서 올바른 리바비린 용량을 참조하십시오.
2.4 간장애
경증 간장애(Child-Pugh A)가 있는 환자의 경우 ZEPATIER 용량 조절은 권장되지 않습니다. ZEPATIER는 중증 또는 중증 간장애(Child-Pugh B 또는 C)가 있는 환자 또는 이전 간 기능 저하 병력이 있는 환자에게는 금기입니다. [금기 사항 (4), 경고 및 주의 사항 (5.3), 특정 인구집단에서의 사용 (8.9) 및 임상 약리학 (12.3) 참조].
3 제형 및 함량
ZEPATIER는 한쪽 면에 “770”이 각인되고 다른 쪽은 평평한 베이지색 타원형 필름 코팅 정제로 제공됩니다. 각 정제는 엘바스비어 50mg과 그라조프레비어 100mg을 함유하고 있습니다.
4 금기사항
- ZEPATIER는 중등도 또는 중증의 간 기능 장애(Child-Pugh B 또는 C) 환자에게는 금기입니다. 그라조프레비어 혈장 농도가 유의하게 증가하고 알라닌 아미노트랜스퍼라제(ALT) 상승 위험이 증가하기 때문입니다. [경고 및 주의 사항(5.2), 특정 집단에서의 사용(8.9), 임상 약리학(12.3) 참조].
- ZEPATIER는 중등도 또는 중증의 간 기능 장애(Child-Pugh B 또는 C) 환자 또는 간 기능 저하의 병력이 있는 환자에게는 금기입니다. 간 기능 저하 위험이 있기 때문입니다. [경고 및 주의 사항(5.3), 특정 집단에서의 사용(8.9) 참조].
- ZEPATIER는 유기 음이온 수송 폴리펩타이드 1B1/3(OATP1B1/3) 억제제(그라조프레비어 혈장 농도를 유의하게 증가시키는 것으로 알려져 있거나 예상되는)와, 시토크롬 P450 3A(CYP3A)의 강력한 유도제, 그리고 에파비렌즈와 함께 투여해서는 안 됩니다. [경고 및 주의 사항(5.5), 약물 상호 작용(7), 임상 약리학(12.3) 참조].
- ZEPATIER를 리바비린과 함께 투여하는 경우 리바비린에 대한 금기 사항도 이 병용 요법에 적용됩니다. 리바비린에 대한 금기 사항 목록은 리바비린 처방 정보를 참조하십시오.
표 2는 ZEPATIER와 함께 투여해서는 안 되는 약물 목록입니다.
| 약물 종류 | 금기 약물 | 임상적 주석* |
|---|---|---|
| 항경련제 | 페니토인 카르바마제핀 |
CYP3A 유도를 통한 엘바스비어 및 그라조프레비어 혈장 농도의 유의한 감소로 인해 ZEPATIER에 대한 바이러스학적 반응이 상실될 수 있습니다. |
| 항결핵제 | 리팜핀 | CYP3A 유도를 통한 엘바스비어 및 그라조프레비어 혈장 농도의 유의한 감소로 인해 ZEPATIER에 대한 바이러스학적 반응이 상실될 수 있습니다. |
| 허브 제품 | 세인트 존스 워트(Hypericum perforatum) | CYP3A 유도를 통한 엘바스비어 및 그라조프레비어 혈장 농도의 유의한 감소로 인해 ZEPATIER에 대한 바이러스학적 반응이 상실될 수 있습니다. |
| HIV 치료제 | 에파비렌즈† | CYP3A 유도를 통한 엘바스비어 및 그라조프레비어 혈장 농도의 유의한 감소로 인해 ZEPATIER에 대한 바이러스학적 반응이 상실될 수 있습니다. |
| HIV 치료제 | 아타자나비어 다루나비어 로피나비어 사퀴나비어 티프라나비어 |
OATP1B1/3 억제를 통한 그라조프레비어 혈장 농도의 유의한 증가로 인해 ALT 상승 위험이 증가할 수 있습니다. |
| 면역 억제제 | 시클로스포린 | OATP1B1/3 억제를 통한 그라조프레비어 혈장 농도의 유의한 증가로 인해 ALT 상승 위험이 증가할 수 있습니다. |
5 경고 및 주의사항
5.1 HCV 및 HBV 동시 감염 환자에서의 B형 간염 바이러스 재활성화 위험
HCV/HBV 동시 감염 환자에서 HCV 직접 작용 항바이러스제 치료를 받는 중이거나 치료를 완료한 환자에서 HBV 항바이러스 치료를 받지 않은 경우 B형 간염 바이러스 (HBV) 재활성화가 보고되었습니다. 일부 사례는 급성 간염, 간 기능 부전 및 사망으로 이어졌습니다. HBsAg 양성 환자와 HBV 감염이 해결된 것으로 혈청학적 증거가 있는 환자 (즉, HBsAg 음성 및 항-HBc 양성)에서 사례가 보고되었습니다. HBV 재활성화는 특정 면역 억제제 또는 화학 요법제를 투여받는 환자에서도 보고되었습니다. HCV 직접 작용 항바이러스제 치료와 관련된 HBV 재활성화 위험은 이러한 환자에서 증가할 수 있습니다.
HBV 재활성화는 혈청 HBV DNA 수치의 급격한 증가로 나타나는 HBV 복제의 급격한 증가로 특징지어집니다. HBV 감염이 해결된 환자에서 HBsAg가 다시 나타날 수 있습니다. HBV 복제의 재활성화는 간염을 동반할 수 있으며, 즉 아미노트랜스퍼라제 수치가 증가하고 심한 경우 빌리루빈 수치가 증가하고 간 기능 부전 및 사망이 발생할 수 있습니다.
ZEPATIER로 HCV 치료를 시작하기 전에 HBsAg와 항-HBc를 측정하여 모든 환자에서 현재 또는 이전 HBV 감염의 증거를 검사하십시오. HBV 감염의 혈청학적 증거가 있는 환자의 경우 ZEPATIER로 HCV 치료 중 및 치료 후 추적 관찰 중에 간염 악화 또는 HBV 재활성화의 임상적 및 실험실적 징후를 모니터링하십시오. 임상적으로 나타나는 대로 HBV 감염에 대한 적절한 환자 관리를 시작하십시오.
5.2 ALT 상승 위험 증가
리바비린 유무와 관계없이 ZEPATIER로 실시한 임상 시험에서 피험자의 1%가 일반적으로 치료 8주차에 또는 그 이후에 ALT가 정상 수치에서 정상 상한치의 5배를 초과하는 수준으로 상승했습니다. ALT 상승은 일반적으로 무증상이었으며 대부분 치료를 계속하거나 완료하면서 해결되었습니다. 다음과 같은 하위 집단에서 늦은 ALT 상승 비율이 더 높았습니다. 여성 (2% [10/608]), 아시아계 (2% [4/164]), 65세 이상 (2% [3/177]) [부작용 (6.1) 참조].
치료 전, 치료 8주차에, 그리고 임상적으로 나타나는 대로 간 기능 검사를 실시해야 합니다. 16주 치료를 받는 환자의 경우 치료 12주차에 추가 간 기능 검사를 실시해야 합니다.
- 환자는 피로, 쇠약, 식욕 부진, 메스꺼움 및 구토, 황달 또는 대변 변색이 발생하면 지체 없이 의료 전문가에게 진찰을 받도록 지시해야 합니다.
- ALT 수치가 정상 상한치의 10배를 초과하여 지속적으로 유지되는 경우 ZEPATIER 투여를 중단하는 것을 고려하십시오.
- ALT 상승이 간염의 징후 또는 증상 또는 결합형 빌리루빈, 알칼리성 포스파타제 또는 국제 표준화 비율 (INR)의 증가를 동반하는 경우 ZEPATIER 투여를 중단하십시오.
5.3 진행된 간 질환의 증거가 있는 환자에서의 간 기능 저하/부전 위험
ZEPATIER를 포함한 HCV NS3/4A 프로테아제 억제제 함유 요법으로 치료받은 환자에서 치명적인 결과를 포함한 간 기능 저하/부전 사례가 보고되었습니다.
보고된 사례는 기저 간경변증이 있고 중등도 또는 중증 간 기능 장애 (Child-Pugh B 또는 C)가 있는 환자와 간경변증이 없는 일부 환자를 포함하여 HCV NS3/4A 프로테아제 억제제 함유 요법으로 치료받은 환자에서 발생했습니다. 이러한 사건은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
모든 환자에서 간 기능 검사를 실시해야 합니다 [경고 및 주의 사항 (5.2) 참조]. 보상된 간경변증 (Child-Pugh A)이 있거나 문맥 고혈압과 같은 진행된 간 질환의 증거가 있는 환자의 경우 더 빈번한 간 기능 검사가 필요할 수 있으며, 황달, 복수, 간성 뇌병증 및 정맥류 출혈과 같은 간 기능 저하의 징후와 증상을 모니터링해야 합니다. 간 기능 저하/부전의 증거가 나타나는 환자의 경우 ZEPATIER 투여를 중단하십시오.
ZEPATIER는 중등도에서 중증 간 기능 장애 (Child-Pugh B 또는 C)가 있는 환자 또는 이전에 간 기능 저하의 병력이 있는 환자에게는 금기입니다 [금기 사항 (4), 부작용 (6.1), 특정 모집단에서의 사용 (8.9) 및 임상 약리학 (12.3) 참조].
5.4 리바비린 병용 치료와 관련된 위험
ZEPATIER를 리바비린과 함께 투여하는 경우 임신 회피 경고를 포함한 리바비린에 대한 경고 및 주의 사항이 이 병용 요법에도 적용됩니다. 리바비린에 대한 경고 및 주의 사항 전체 목록은 리바비린 처방 정보를 참조하십시오 [투여 및 관리 (2.2) 참조].
5.5 약물 상호 작용으로 인한 부작용 또는 치료 효과 감소 위험
ZEPATIER와 특정 약물을 동시에 사용하면 알려진 또는 잠재적으로 중요한 약물 상호 작용이 발생할 수 있으며, 일부는 다음과 같은 결과를 초래할 수 있습니다.
- 동시에 사용하는 약물 또는 ZEPATIER의 성분에 대한 노출 증가로 인해 임상적으로 중요한 부작용이 발생할 수 있습니다.
- 엘바스비어 및 그라조프레비어 혈장 농도가 현저히 감소하여 ZEPATIER의 치료 효과가 감소하고 내성이 발생할 수 있습니다.
이러한 알려진 또는 잠재적으로 중요한 약물 상호 작용을 예방하거나 관리하는 단계(투여 권장 사항 포함)는 표 2 및 6을 참조하십시오 [금기 사항 (4) 및 약물 상호 작용 (7.2) 참조].
6 부작용
다음의 이상반응은 아래 및 라벨의 다른 곳에 설명되어 있습니다.
- ALT 상승 위험 증가 [경고 및 주의사항 (5.2) 참조].
6.1 임상시험 경험
임상시험은 매우 다양한 조건에서 수행되므로 임상시험에서 관찰된 약물의 이상반응 발생률을 다른 약물의 임상시험에서의 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
ZEPATIER를 리바비린과 함께 투여하는 경우 리바비린 관련 이상반응에 대한 설명은 리바비린의 처방 정보를 참조하십시오.
성인 대상 임상시험
성인 대상에서 ZEPATIER의 안전성은 보상성 간 질환(간경변증 유무와 관계없이)이 있는 만성 C형 간염 바이러스 감염 환자 약 1700명을 대상으로 한 2건의 위약 대조 시험과 7건의 비대조 2상 및 3상 임상시험을 기반으로 평가되었습니다. [임상 연구 (14) 참조].
치료 경험이 없는 대상에서 ZEPATIER의 이상반응
C-EDGE TN은 ZEPATIER 또는 위약 1정을 1일 1회 12주 동안 투여받은 HCV 감염 치료 경험이 없는(TN) 대상 421명을 대상으로 한 3상 무작위 배정, 이중맹검, 위약 대조 시험이었습니다. ZEPATIER로 12주 동안 치료받은 대상의 최소 5%에서 발생한 이상반응(모든 강도)은 표 3에 나와 있습니다. ZEPATIER로 치료받은 대상 중 이상반응을 보고한 대상의 73%에서 경증의 이상반응이 나타났습니다. 보상성 간경변증이 있는 대상의 이상반응 유형 및 중증도는 간경변증이 없는 대상에서 나타난 것과 유사했습니다. ZEPATIER 또는 위약으로 치료받은 대상 중 심각한 이상반응을 경험한 대상은 없었습니다. 이상반응으로 인해 영구적으로 치료를 중단한 ZEPATIER 또는 위약 치료 대상의 비율은 각 그룹에서 1%였습니다.
| C-EDGE TN | ||
|---|---|---|
| ZEPATIER N=316 % 12 weeks |
Placebo N=105 % 12 weeks |
|
| 피로 | 11% | 10% |
| 두통 | 10% | 9% |
C-EDGE COINFECTION은 ZEPATIER를 12주 동안 하루에 한 번 복용한 치료 경험이 없는 HCV/HIV 동시 감염 환자 218명을 대상으로 한 3상 오픈 라벨 시험이었습니다. ZEPATIER를 12주 동안 복용한 환자의 5% 이상에서 보고된 부작용(모든 강도)은 피로(7%), 두통(7%), 메스꺼움(5%), 불면증(5%), 설사(5%)였습니다. 부작용으로 인해 심각한 부작용을 보고하거나 치료를 중단한 환자는 없었습니다. 혈장 HIV-1 RNA 억제 손실로 인해 항레트로바이러스 치료 요법을 변경한 환자는 없었습니다. 12주 치료 종료 시 CD4+ T 세포 수는 중앙값으로 mm3당 31개 세포 증가했습니다.
치료 경험이 있는 환자에서 리바비린 유무에 관계없이 ZEPATIER와 관련된 부작용
C-EDGE TE는 치료 경험이 있는(TE) 환자를 대상으로 한 3상 무작위 배정 오픈 라벨 시험이었습니다. ZEPATIER를 12주 동안 하루에 한 번 복용하거나 ZEPATIER를 16주 동안 하루에 한 번 리바비린과 함께 복용한 C-EDGE TE에서 보고된 중등도 또는 중증 강도의 부작용은 표 4에 제시되어 있습니다. ZEPATIER를 12주 동안 리바비린 없이 복용한 환자 중 심각한 부작용을 보고하거나 부작용으로 인해 치료를 중단한 환자는 없었습니다. ZEPATIER를 16주 동안 리바비린과 함께 복용한 환자 중 심각한 부작용을 경험한 환자의 비율은 1%였습니다. ZEPATIER를 16주 동안 리바비린과 함께 복용한 환자 중 부작용으로 인해 치료를 영구적으로 중단한 환자의 비율은 3%였습니다. 간경변증이 있는 환자의 부작용 유형 및 중증도는 간경변증이 없는 환자에서 관찰된 것과 유사했습니다.
| C-EDGE TE | ||
|---|---|---|
| ZEPATIER N=105 % 12주 |
ZEPATIER + 리바비린 N=106 % 16주 |
|
| 빈혈 | 0% | 8% |
| 두통 | 0% | 6% |
| 피로 | 5% | 4% |
| 호흡곤란 | 0% | 4% |
| 발진 또는 가려움증 | 0% | 4% |
| 짜증 | 1% | 3% |
| 복통 | 2% | 2% |
| 우울증 | 1% | 2% |
| 관절통 | 0% | 2% |
| 설사 | 2% | 0% |
리바비린 병용 또는 비병용 ZEPATIER에 대한 이상반응의 유형 및 중증도는 HCV/HIV 동시 감염된 치료 경험이 있는 환자 10명에서 HIV 감염이 없는 환자에서 보고된 것과 유사했습니다. ZEPATIER 단독요법으로 12주 치료 종료 시 CD4+ T 세포 수의 중앙값이 32cells/mm3 증가했습니다. 16주 동안 ZEPATIER와 리바비린을 병용하여 치료받은 환자의 경우, 치료 종료 시 CD4+ T 세포 수가 135cells/mm3만큼 감소했습니다. 혈장 HIV-1 RNA 억제 손실로 인해 항레트로바이러스 요법을 변경한 환자는 없었습니다. AIDS 관련 기회 감염을 경험한 환자는 없었습니다.
C-SALVAGE는 79명의 PegIFN/RBV/PI 경험이 있는 환자를 대상으로 한 2상 공개 라벨 시험이었습니다. 리바비린과 함께 12주 동안 1일 1회 ZEPATIER로 치료받은 환자 중 최소 2%에서 보고된 중등도 또는 중증의 이상반응은 피로(3%) 및 불면증(3%)이었습니다. 이상반응으로 인해 중대한 이상반응을 보고하거나 치료를 중단한 환자는 없었습니다.
중증 신장애(혈액투석 환자 포함)가 있는 환자에서 ZEPATIER의 이상반응
보상성 간질환(간경변증 동반 또는 비동반)을 동반한 만성 C형 간염 바이러스 감염 환자 235명(C-SURFER)을 대상으로 중증 신장애(4기 또는 5기 만성 신질환, 혈액투석 환자 포함) 환자에서 위약과 비교하여 엘바스비르 및 그라조프레비르의 안전성을 평가했습니다. [임상 연구(14.4) 참조]. 12주 동안 ZEPATIER로 치료받은 환자의 5% 이상에서 발생한 이상반응(모든 강도)은 표 5에 나와 있습니다. ZEPATIER로 치료받은 환자 중 이상반응을 보고한 환자의 76%가 경증의 이상반응을 경험했습니다. 중대한 이상반응이 나타난 ZEPATIER 또는 위약 치료군의 비율은 각 치료군에서 1% 미만이었고, 이상반응으로 인해 치료를 영구적으로 중단한 환자의 비율은 각 치료군에서 각각 1% 미만과 3% 미만이었습니다.
| ZEPATIER N=122 % 12주 |
위약 N=113 % 12주 |
|
|---|---|---|
| 메스꺼움 | 11% | 8% |
| 두통 | 11% | 5% |
| 피로 | 5% | 8% |
리바비린 병용 또는 비병용 ZEPATIER 투여 환자에서 나타나는 검사 이상
혈청 ALT 상승
치료 기간과 관계없이 리바비린 병용 또는 비병용 ZEPATIER 임상시험에서 피험자의 1%(12/1599)에서 정상 수치에서 ULN의 5배를 초과하는 ALT 상승이 일반적으로 치료 8주째 또는 그 이후(평균 발현 시간 10주, 범위 6-12주)에 나타났습니다. 이러한 ALT 후기 상승은 일반적으로 무증상이었습니다. 대부분의 ALT 후기 상승은 ZEPATIER를 이용한 치료를 지속하면서 또는 치료 완료 후 해소되었습니다 [경고 및 주의사항 (5.2) 참조]. ALT 후기 상승 빈도는 grazoprevir 혈장 농도가 높은 피험자에서 더 높았습니다 [약물 상호작용 (7.1) 및 임상 약리학 (12.3) 참조]. ALT 후기 상승 발생률은 치료 기간의 영향을 받지 않았습니다. 간경변은 ALT 후기 상승의 위험 인자가 아니었습니다.
혈청 빌리루빈 상승
치료 기간과 관계없이 리바비린 병용 또는 비병용 ZEPATIER 임상시험에서 ZEPATIER 단독요법을 받은 환자의 1% 미만과 비교하여 리바비린과 함께 ZEPATIER를 투여받은 환자의 6%에서 2.5 ULN을 초과하는 빌리루빈 상승이 관찰되었습니다. 이러한 빌리루빈 증가는 주로 간접적이었으며 일반적으로 리바비린 병용 투여와 관련하여 관찰되었습니다. 빌리루빈 상승은 일반적으로 혈청 ALT 상승과 관련이 없었습니다.
헤모글로빈 감소
리바비린 병용 또는 비병용 ZEPATIER 임상시험에서 12주 동안 ZEPATIER로 치료받은 피험자의 헤모글로빈 수치의 기준치 대비 평균 변화는 –0.3g/dL였으며 16주 동안 리바비린과 함께 ZEPATIER로 치료받은 피험자의 경우 약 –2.2g/dL였습니다. 헤모글로빈은 치료 첫 8주 동안 감소했고 나머지 치료 기간 동안 낮게 유지되었으며 추적 관찰 기간 동안 기준치 수준으로 정상화되었습니다. 리바비린과 함께 ZEPATIER로 치료받은 피험자의 1% 미만에서 치료 중 헤모글로빈 수치가 8.5g/dL 미만으로 감소했습니다. ZEPATIER 단독요법을 받은 피험자 중 헤모글로빈 수치가 8.5g/dL 미만인 경우는 없었습니다.
소아 대상 임상시험
12세 이상 소아 피험자에서 나타난 이상반응
2b상 공개 라벨 임상시험(MK-5172-079)에서 12주 동안 ZEPATIER로 치료받은 간경변이 없는 22명의 소아 피험자 데이터를 기반으로 12세 이상 소아 피험자에서 ZEPATIER의 안전성을 평가했습니다. 관찰된 이상반응은 성인 대상 ZEPATIER 임상시험에서 관찰된 것과 일치했습니다 [임상 연구 (14.6) 참조]. ZEPATIER를 투여받은 피험자의 5% 이상에서 관찰된 이상약물반응은 두통(14%)과 메스꺼움(9%)이었습니다.
6.2 시판 후 경험
ZEPATIER의 시판 후 사용 중 다음과 같은 이상반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 빈도를 확실하게 추정하거나 약물 노출과의 인과관계를 확립할 수 있는 것은 아닙니다.
7 약물 상호작용
7.1 약물 상호 작용 가능성
그라조프레비르는 OATP1B1/3 수송체의 기질입니다. 그라조프레비르 혈장 농도를 유의미하게 증가시키는 것으로 알려져 있거나 예상되는 OATP1B1/3 억제제와 ZEPATIER를 병용 투여하는 것은 금기입니다 [금기 사항 (4), 임상 약리학 (12.3) 및 표 2 참조].
엘바스비르와 그라조프레비르는 CYP3A 및 P-gp의 기질이지만, 장 P-gp가 엘바스비르와 그라조프레비르 흡수에 미치는 역할은 최소한으로 보입니다. ZEPATIER와 CYP3A의 중등도 또는 강력한 유도제를 병용 투여하면 엘바스비르와 그라조프레비르 혈장 농도가 감소하여 ZEPATIER의 치료 효과가 감소할 수 있습니다. ZEPATIER와 강력한 CYP3A 유도제 또는 에파비렌즈를 병용 투여하는 것은 금기입니다 [금기 사항 (4), 임상 약리학 (12.3) 및 표 2 참조]. ZEPATIER와 CYP3A의 중등도 유도제를 병용 투여하는 것은 권장되지 않습니다 [경고 및 주의 사항 (5.5), 임상 약리학 (12.3) 및 표 6 참조]. ZEPATIER와 강력한 CYP3A 억제제를 병용 투여하면 엘바스비르와 그라조프레비르 농도가 증가할 수 있습니다. ZEPATIER와 특정 강력한 CYP3A 억제제를 병용 투여하는 것은 권장되지 않습니다 [경고 및 주의 사항 (5.5), 임상 약리학 (12.3) 및 표 6 참조].
7.2 확립된 및 기타 잠재적으로 유의미한 약물 상호 작용
ZEPATIER 치료로 인해 동반 약물의 용량 조절이 이루어진 경우, ZEPATIER 투여가 완료된 후 용량을 재조정해야 합니다.
직접 작용 항바이러스제로 HCV 감염을 제거하면 간 기능 변화가 발생할 수 있으며, 이는 동반 약물의 안전하고 효과적인 사용에 영향을 미칠 수 있습니다. 예를 들어, 시판 후 사례 보고 및 발표된 역학 연구에서 당뇨병 환자에게 심각한 증상성 저혈당증을 유발하는 혈당 조절 변화가 보고되었습니다. 이러한 경우 저혈당증 관리에는 당뇨병 치료에 사용되는 동반 약물의 중단 또는 용량 조절이 필요했습니다.
안전하고 효과적인 사용을 보장하기 위해 관련 실험실 매개변수(예: 와파린을 복용하는 환자의 INR, 당뇨병 환자의 혈당 수치) 또는 좁은 치료 범위를 가진 CYP450 기질과 같은 동반 약물의 약물 농도(예: 특정 면역 억제제)를 자주 모니터링하는 것이 좋습니다. 동반 약물의 용량 조절이 필요할 수 있습니다.
표 6은 확립된 또는 잠재적으로 임상적으로 유의미한 약물 상호 작용 목록을 제공합니다. 설명된 약물 상호 작용은 ZEPATIER, ZEPATIER의 성분(엘바스비르 [EBR] 및 그라조프레비르 [GZR])을 개별 약물로 사용한 연구 또는 ZEPATIER와 발생할 수 있는 예상되는 약물 상호 작용을 기반으로 합니다 [금기 사항 (4), 경고 및 주의 사항 (5.5) 및 임상 약리학 (12.3) 참조].
| 동반 약물 종류: 약물 이름 | 농도에 미치는 영향† | 임상적 주석 |
|---|---|---|
|
||
| 항생제: 나프실린 |
↓ EBR ↓ GZR |
ZEPATIER와 나프실린을 병용 투여하면 ZEPATIER의 치료 효과가 감소할 수 있습니다. 병용 투여는 권장되지 않습니다. |
| 항진균제: 경구 케토코나졸‡ |
↑ EBR ↑ GZR |
경구 케토코나졸을 병용 투여하는 것은 권장되지 않습니다. |
| 엔도텔린 길항제: 보센탄 |
↓ EBR ↓ GZR |
ZEPATIER와 보센탄을 병용 투여하면 ZEPATIER의 치료 효과가 감소할 수 있습니다. 병용 투여는 권장되지 않습니다. |
| 면역 억제제: 타크로리무스‡ |
↑ 타크로리무스 | 병용 투여를 시작할 때 타크로리무스 전혈 농도, 신장 기능 변화 및 타크로리무스 관련 이상 반응을 자주 모니터링하는 것이 좋습니다. |
| HIV 약물: | ||
| Etravirine | ↓ EBR ↓ GZR |
ZEPATIER와 etravirine을 함께 투여하면 ZEPATIER의 치료 효과가 감소할 수 있습니다. 함께 투여하는 것은 권장되지 않습니다. |
| Elvitegravir/ cobicistat/ emtricitabine/ tenofovir (disoproxil fumarate‡ or alafenamide) | ↑ EBR ↑ GZR |
cobicistat 함유 요법과의 병용 투여는 권장되지 않습니다. |
| HMG-CoA Reductase Inhibitors§: | ||
| Atorvastatin‡ | ↑ atorvastatin | ZEPATIER와 병용 투여하는 경우 atorvastatin의 용량은 1일 20mg을 초과해서는 안 됩니다.§ |
| Rosuvastatin‡ | ↑ rosuvastatin | ZEPATIER와 병용 투여하는 경우 rosuvastatin의 용량은 1일 10mg을 초과해서는 안 됩니다.§ |
| Fluvastatin Lovastatin Simvastatin |
↑ fluvastatin ↑ lovastatin ↑ simvastatin |
근병증과 같은 스타틴 관련 이상 반응을 면밀히 모니터링해야 합니다. ZEPATIER와 병용 투여하는 경우 최소 필요 용량을 사용해야 합니다.§ |
| Wakefulness-Promoting Agents: Modafinil |
↓ EBR ↓ GZR |
ZEPATIER와 modafinil을 함께 투여하면 ZEPATIER의 치료 효과가 감소할 수 있습니다. 함께 투여하는 것은 권장되지 않습니다. |
7.3 ZEPATIER와 임상적으로 유의미한 상호 작용이 없는 약물
ZEPATIER의 성분(elbasvir 또는 grazoprevir) 또는 ZEPATIER와 다음 약물 간의 상호 작용은 임상 연구에서 평가되었으며, ZEPATIER를 다음 약물과 개별적으로 사용하는 경우 용량 조절이 필요하지 않습니다. 산 감소제(proton pump inhibitors, H2 blockers, antacids), buprenorphine/naloxone, digoxin, dolutegravir, methadone, mycophenolate mofetil, 경구 피임약, 인산염 결합제, pitavastatin, pravastatin, prednisone, raltegravir, ribavirin, rilpivirine, tenofovir disoproxil fumarate, 및 sofosbuvir [임상 약리학 (12.3) 참조].
ZEPATIER를 abacavir, emtricitabine, entecavir, 및 lamivudine과 병용 투여하는 경우 임상적으로 유의미한 약물 상호 작용은 예상되지 않습니다.
8 특정 집단에서의 사용
8.1 임신
위험 요약
ZEPATIER가 임신 결과에 위험을 초래하는지 여부를 확인할 수 있는 적절한 인체 데이터가 없습니다. 동물 생식 연구에서 ZEPATIER의 성분(엘바스비어 또는 그라조프레비어)은 권장 인체 용량(RHD)에서 인체보다 높은 노출량에서도 유해한 발달 결과의 증거가 관찰되지 않았습니다. (자세한 내용은 데이터 참조). 랫드와 토끼의 기관 형성 과정에서 전신 노출(AUC)은 RHD에서 인체 노출량의 각각 약 10배 및 18배(엘바스비어의 경우)와 117배 및 41배(그라조프레비어의 경우)였습니다. 랫드의 출산 전/후 발달 연구에서 엘바스비어와 그라조프레비어에 대한 모체 전신 노출(AUC)은 RHD에서 인체 노출량의 각각 약 10배 및 78배였습니다.
표시된 인구 집단의 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2-4% 및 15-20%입니다.
ZEPATIER를 리바비린과 함께 투여하는 경우, 이 조합 요법은 임산부와 여성 파트너가 임신한 남성에게 금기입니다. 임신 중 사용에 대한 자세한 내용은 리바비린 처방 정보를 참조하십시오.
데이터
동물 데이터
엘바스비어: 엘바스비어는 임신한 랫드와 토끼에게 각각 임신 6일부터 20일까지와 7일부터 20일까지 경구로 최대 1000 mg/kg/일을 투여했으며, 랫드에게는 임신 6일부터 수유/출산 후 20일까지 투여했습니다. 최대 시험 용량까지도 배아-태아(랫드와 토끼) 또는 출산 전/후(랫드) 발달에 영향을 미치지 않았습니다. 엘바스비어에 대한 전신 노출(AUC)은 RHD에서 인체 노출량의 약 10배(랫드)와 18배(토끼)였습니다. 두 종 모두에서 엘바스비어는 태반을 통과하는 것으로 나타났으며, 태아 혈장 농도는 임신 20일에 관찰된 모체 농도의 최대 0.8%(토끼)와 2.2%(랫드)였습니다.
그라조프레비어: 그라조프레비어는 임신한 랫드(경구 용량 최대 400 mg/kg/일)와 토끼(정맥 용량 최대 100 mg/kg/일)에게 각각 임신 6일부터 20일까지와 7일부터 20일까지 투여했으며, 랫드(경구 용량 최대 400 mg/kg/일)에게는 임신 6일부터 수유/출산 후 20일까지 투여했습니다. 최대 시험 용량까지도 배아-태아(랫드와 토끼) 또는 출산 전/후(랫드) 발달에 영향을 미치지 않았습니다. 그라조프레비어에 대한 전신 노출(AUC)은 RHD에서 인체 노출량의 ≥78배(랫드)와 41배(토끼)였습니다. 두 종 모두에서 그라조프레비어는 태반을 통과하는 것으로 나타났으며, 태아 혈장 농도는 임신 20일에 관찰된 모체 농도의 최대 7%(토끼)와 89%(랫드)였습니다.
8.2 수유
위험 요약
ZEPATIER가 모유에 존재하는지, 모유 생산에 영향을 미치는지, 또는 모유 수유 아기에게 영향을 미치는지 여부는 알려져 있지 않습니다. 수유 랫드에게 투여했을 때, ZEPATIER의 성분(엘바스비어와 그라조프레비어)은 모유에 존재했지만, 수유 새끼의 성장과 발달에 영향을 미치지 않았습니다. (자세한 내용은 데이터 참조).
모유 수유의 발달적 및 건강상 이점은 모체의 ZEPATIER에 대한 임상적 필요성과 ZEPATIER 또는 기저 모체 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 유해한 영향과 함께 고려해야 합니다.
ZEPATIER를 리바비린과 함께 투여하는 경우, 수유 모체에 대한 리바비린 정보는 이 조합 요법에도 적용됩니다. 수유 중 사용에 대한 자세한 내용은 리바비린 처방 정보를 참조하십시오.
8.3 생식 능력이 있는 여성과 남성
ZEPATIER를 리바비린과 함께 투여하는 경우, 임신 검사, 피임 및 불임에 대한 리바비린 정보는 이 조합 요법에도 적용됩니다. 자세한 내용은 리바비린 처방 정보를 참조하십시오.
8.4 소아 사용
ZEPATIER의 안전성, 유효성 및 약동학은 12주 동안 ZEPATIER를 투여받은 12세 이상의 피험자 22명(n=21, 유전자형 1; n=1, 유전자형 4)을 포함한 공개 표지 임상 시험(MK-5172-079)에서 평가되었습니다. 이 시험에서 관찰된 안전성, 약동학 및 유효성은 성인에서 관찰된 것과 유사했습니다 [투여량 및 투여 방법 (2.2), 부작용 (6.1), 임상 약리학 (12.3) 및 임상 연구 (14.6) 참조].
30kg 미만의 12세 미만 소아 환자에서 ZEPATIER의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
리바비린 유무와 관계없이 ZEPATIER의 임상 시험에는 65세 이상의 피험자 187명이 포함되었습니다. 65세 이상의 피험자에서 더 높은 엘바스비어 및 그라조프레비어 혈장 농도가 관찰되었습니다. 임상 시험에서 65세 이상의 피험자에서 ALT 상승이 더 많이 관찰되었습니다 [경고 및 주의 사항 (5.2) 참조]. 그러나 노인 환자에서 ZEPATIER의 용량 조절은 권장되지 않습니다 [임상 약리학 (12.3) 참조].
8.6 성별
남성에 비해 여성에서 더 높은 엘바스비어 및 그라조프레비어 혈장 농도가 관찰되었습니다. 임상 시험에서 여성에서 ALT 상승이 더 많이 관찰되었습니다 [경고 및 주의 사항 (5.2) 참조]. 그러나 성별에 따라 ZEPATIER의 용량 조절은 권장되지 않습니다 [임상 약리학 (12.3) 참조].
8.7 인종
코카시안에 비해 아시아인에서 더 높은 엘바스비어 및 그라조프레비어 혈장 농도가 관찰되었습니다. 임상 시험에서 아시아인에서 ALT 상승이 더 많이 관찰되었습니다 [경고 및 주의 사항 (5.2) 참조]. 그러나 인종/민족에 따라 ZEPATIER의 용량 조절은 권장되지 않습니다 [임상 약리학 (12.3) 참조].
8.8 신장애
혈액 투석을 받는 환자를 포함하여 신장애가 있는 환자의 경우 ZEPATIER의 용량 조절은 권장되지 않습니다 [임상 약리학 (12.3) 참조]. 표 1의 권장 사항에 따라 리바비린 유무와 관계없이 ZEPATIER를 투여하십시오 [투여량 및 투여 방법 (2.2), 2.3) 참조]. CrCl이 50mL/분 이하인 환자의 경우 리바비린 정제 처방 정보를 참조하여 리바비린의 신장 용량 조절을 확인하십시오.
8.9 간장애
경증 간장애(Child-Pugh A) 환자의 경우 ZEPATIER의 용량 조절은 권장되지 않습니다. HCV 감염된 Child-Pugh B 환자에서 임상적 안전성 및 유효성 경험이 부족하기 때문에 중등도 간장애(Child-Pugh B) 환자의 경우 ZEPATIER는 금기이며, HCV 감염되지 않은 Child-Pugh C 피험자에서 그라조프레비어 노출이 12배 증가하기 때문에 중증 간장애(Child-Pugh C) 환자의 경우 ZEPATIER는 금기입니다. 또한, 진행된 간 질환 환자에서 간 기능 저하/부전 사례가 보고되었습니다 [투여량 및 투여 방법 (2.4), 금기 사항 (4), 경고 및 주의 사항 (5.3) 및 임상 약리학 (12.3) 참조].
간 이식을 기다리는 환자 또는 간 이식을 받은 환자에서 ZEPATIER의 안전성 및 유효성은 확립되지 않았습니다.
10 과다 복용
ZEPATIER 과다 복용에 대한 인체 경험은 제한적입니다. ZEPATIER 과다 복용에 대한 특정 해독제는 없습니다. 과다 복용의 경우, 환자를 모니터링하여 부작용의 징후 또는 증상을 확인하고 적절한 증상 치료를 실시하는 것이 좋습니다.
엘바스비어와 그라조프레비어는 혈장 단백질에 고도로 결합되어 있으므로 혈액 투석으로는 제거되지 않습니다 [임상 약리학 (12.3) 참조].
11 설명
ZEPATIER는 경구 투여를 위한 엘바스비어와 그라조프레비어를 함유한 고정 용량 복합제입니다.
엘바스비어는 HCV NS5A 억제제이고, 그라조프레비어는 HCV NS3/4A 프로테아제 억제제입니다.
각 정제는 엘바스비어 50mg과 그라조프레비어 100mg을 함유하고 있습니다. 정제는 다음과 같은 비활성 성분을 포함합니다: 콜로이드성 실리카, 코포비돈, 크로스카멜로스나트륨, 히프로멜로스, 유당 일수화물, 마그네슘 스테아레이트, 만니톨, 미결정 셀룰로스, 염화나트륨, 라우릴황산나트륨, 비타민 E 폴리에틸렌 글리콜 숙시네이트. 정제는 다음과 같은 비활성 성분을 함유한 코팅 재료로 필름 코팅되어 있습니다: 카르나우바 왁스, 페로소페릭 산화물, 히프로멜로스, 산화철 적색, 산화철 황색, 유당 일수화물, 이산화티탄, 트리아세틴.
Elbasvir:
엘바스비어의 IUPAC 명칭은 Dimethyl N,N’-([(6S)-6-phenylindolo[1,2-c][1,3]benzoxazine-3,10-diyl]bis{1H-imidazole-5,2-diyl-(2S)-pyrrolidine-2,1-diyl[(2S)-3-methyl-1-oxobutane-1,2-diyl]})dicarbamate입니다.
분자식은 C49H55N9O7이고 분자량은 882.02입니다. 다음과 같은 구조식을 가지고 있습니다.
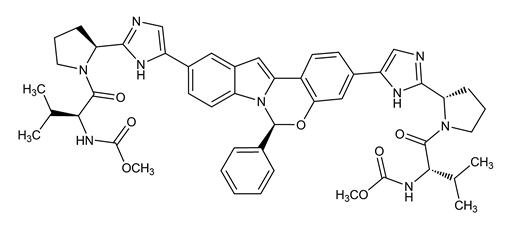
엘바스비어는 물에 실질적으로 불용성(mL당 0.1mg 미만)이고 에탄올에 매우 약간 용해(mL당 0.2mg)되지만 에틸 아세테이트와 아세톤에 매우 잘 용해됩니다.
Grazoprevir:
그라조프레비어의 IUPAC 명칭은 (1aR,5S,8S,10R,22aR)-N-[(1R,2S)-1-[(Cyclopropylsulfonamido)carbonyl]-2-ethenylcyclopropyl]-14-methoxy-5-(2-methylpropan-2-yl)-3,6-dioxo-1,1a,3,4,5,6,9,10,18,19,20,21,22,22a-tetradecahydro-8H-7,10-methanocyclopropa[18,19][1,10,3,6]dioxadiazacyclononadecino[11,12-b]quinoxaline-8-carboxamide입니다.
분자식은 C38H50N6O9S이고 분자량은 766.90입니다. 다음과 같은 구조식을 가지고 있습니다.
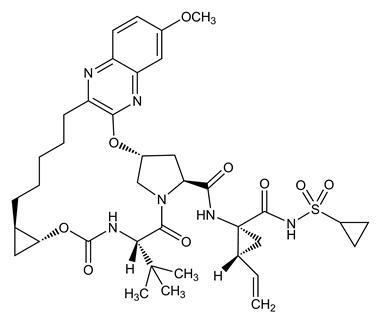
그라조프레비어는 물에 실질적으로 불용성(mL당 0.1mg 미만)이지만 에탄올과 일부 유기 용매(예: 아세톤, 테트라히드로푸란 및 N,N-디메틸포름아미드)에 자유롭게 용해됩니다.
12 임상약리학
12.2 약력학
심장 전기 생리학
엘바스비어와 그라조프레비어에 대한 철저한 QT 연구가 수행되었습니다.
42명의 건강한 피험자를 대상으로 한 무작위 배정, 단일 용량, 위약 및 활성 대조군(모시플록사신 400mg) 3주기 교차 설계의 철저한 QT 시험에서 엘바스비어 700mg의 QTc 간격에 대한 효과를 평가했습니다. 치료 농도의 3~4배 농도에서 엘바스비어는 임상적으로 유의미한 수준으로 QTc를 연장하지 않습니다.
41명의 건강한 피험자를 대상으로 한 무작위 배정, 단일 용량, 위약 및 활성 대조군(모시플록사신 400mg) 3주기 교차 설계의 철저한 QT 시험에서 그라조프레비어 1600mg(승인된 용량의 16배)의 QTc 간격에 대한 효과를 평가했습니다. 치료 농도의 40배 농도에서 그라조프레비어는 임상적으로 유의미한 수준으로 QTc를 연장하지 않습니다.
12.3 약동학
엘바스비어와 그라조프레비어의 약동학적 특성은 HCV 감염되지 않은 성인 피험자와 HCV 감염된 성인 피험자에서 평가되었습니다. 엘바스비어의 약동학은 건강한 피험자와 HCV 감염된 피험자에서 유사했으며 1일 1회 5~100mg 범위에서 용량에 비례했습니다. 그라조프레비어의 경구 노출은 HCV 감염된 피험자에서 건강한 피험자에 비해 약 2배 더 높습니다. HCV 감염된 피험자에서 그라조프레비어의 약동학은 1일 1회 10~800mg 범위에서 용량에 비례하는 것보다 더 높게 증가했습니다. ZEPATIER와 함께 리바비린을 병용 투여하면 ZEPATIER 단독 투여와 비교하여 엘바스비어와 그라조프레비어의 혈장 AUC와 Cmax에 임상적으로 유의미한 영향을 미치지 않았습니다. 비경변증 HCV 감염된 피험자에서 엘바스비어와 그라조프레비어의 기하 평균 정상 상태 약동학적 매개변수 값은 표 7에 나와 있습니다. HCV 감염된 피험자에게 ZEPATIER를 1일 1회 투여한 후 엘바스비어와 그라조프레비어는 약 6일 이내에 정상 상태에 도달했습니다.
| 기하 평균(90% 신뢰 구간) | |||
|---|---|---|---|
| AUC0-24 (ng•hr/mL) | Cmax (ng/mL) | C24 (ng/mL) | |
| 엘바스비어 | 1920 (1880, 1960) | 121 (118, 123) | 48.4 (47.3, 49.6) |
| 그라조프레비어 | 1420 (1400, 1530) | 165 (161, 176) | 18.0 (17.8, 19.9) |
흡수
HCV 감염 환자에게 ZEPATIER를 투여한 후, 엘바스비어의 최고 농도는 중앙값 Tmax 3시간(범위 3~6시간)에 나타났습니다. 그라조프레비어의 최고 농도는 중앙값 Tmax 2시간(범위 30분~3시간)에 나타났습니다. 엘바스비어의 절대 생체 이용률은 약 32%로 추정되며, 그라조프레비어의 절대 생체 이용률은 약 27%로 추정됩니다.
음식의 영향
건강한 피험자에게 단일 용량의 ZEPATIER를 고지방(900kcal, 지방 500kcal) 식사와 함께 투여한 경우, 공복 상태에 비해 엘바스비어 AUC0-inf와 Cmax는 각각 약 11%와 15% 감소했고, 그라조프레비어 AUC0-inf와 Cmax는 각각 약 1.5배와 2.8배 증가했습니다. 이러한 엘바스비어와 그라조프레비어 노출의 차이는 임상적으로 중요하지 않습니다. 따라서 ZEPATIER는 음식과 관계없이 복용할 수 있습니다 [용법 및 용량 (2.2) 참조].
분포
엘바스비어와 그라조프레비어는 인간 혈장 단백질에 광범위하게 결합(각각 99.9% 및 98.8% 초과)됩니다. 엘바스비어와 그라조프레비어는 모두 인간 혈청 알부민과 α1-산성 글리코단백질에 결합합니다. 모집단 약동학 모델링을 기반으로 엘바스비어와 그라조프레비어의 추정 표관 분포 용적은 각각 약 680L와 1250L입니다.
전임상 분포 연구에서 엘바스비어는 간을 포함한 대부분의 조직에 분포하는 반면, 그라조프레비어는 OATP1B1/3 간 흡수 수송체를 통한 능동 수송에 의해 촉진되어 간에 주로 분포합니다.
배설
HCV 감염 환자에서 엘바스비어(50mg)와 그라조프레비어(100mg)의 기하 평균 표관 말기 반감기는 각각 약 24시간과 31시간입니다.
특정 집단
소아 집단
엘바스비어와 그라조프레비어의 약동학은 HCV 유전형 1 또는 4를 가진 12세 이상의 소아 피험자 22명에서 ZEPATIER(엘바스비어 50mg/그라조프레비어 100mg)를 매일 투여하여 평가했습니다. 12세 이상의 소아 피험자에서 엘바스비어와 그라조프레비어의 약동학적 특성은 표 8에 제시되어 있습니다. 소아 피험자의 노출은 성인에서 관찰된 노출과 유사했습니다.
| PK 매개변수* | 기하 평균(90% 신뢰 구간) | ||
|---|---|---|---|
| AUC0-24 (ng•hr/mL) | Cmax (ng/mL) | C24 (ng/mL) | |
|
|||
| 엘바스비어 | 2120 (1800, 2510) | 167 (140, 199) | 50.3 (41.7, 60.6) |
| 그라조프레비어 | 1110 (871, 1410) | 188 (140, 253) | 11.7 (9.43, 14.5) |
체중/BMI
인구 약동학 분석에서 엘바스비어 약동학에 대한 체중의 영향은 없었습니다. 그라조프레비어 AUC는 77kg 피험자에 비해 53kg 피험자에서 15% 더 높은 것으로 추정됩니다. 이러한 변화는 그라조프레비어에 대해 임상적으로 중요하지 않습니다.
인종/민족
인구 약동학 분석에서 엘바스비어와 그라조프레비어 AUC는 백인에 비해 아시아인에서 각각 15%와 50% 더 높은 것으로 추정됩니다. 엘바스비어와 그라조프레비어 노출에 대한 인구 약동학 추정치는 백인과 흑인/아프리카계 미국인 사이에서 비슷했습니다.
신장애
인구 약동학 분석에서 엘바스비어 AUC는 심각한 신장애가 없는 피험자에 비해 혈액 투석 의존성 피험자에서 25% 더 높고, 혈액 투석 비의존성 심각한 신장애 피험자에서 46% 더 높았습니다. HCV 감염 피험자에 대한 인구 약동학 분석에서 그라조프레비어 AUC는 심각한 신장애가 없는 피험자에 비해 혈액 투석 의존성 피험자에서 10% 더 높고, 혈액 투석 비의존성 심각한 신장애 피험자에서 40% 더 높았습니다. 엘바스비어와 그라조프레비어는 혈액 투석으로 제거되지 않습니다. 엘바스비어와 그라조프레비어는 두 약물 모두 고도로 단백질 결합되어 있으므로 복막 투석으로 제거될 가능성이 낮습니다.
전반적으로 혈액 투석 유무와 관계없이 HCV 감염 신장애 피험자에서 엘바스비어와 그라조프레비어 노출의 변화는 임상적으로 중요하지 않습니다. [특정 인구 집단에서의 사용 (8.8) 참조].
간 기능 장애
엘바스비어와 그라조프레비어의 약동학은 경증 간 기능 장애(Child-Pugh Category A [CP-A], 점수 5-6), 중등도 간 기능 장애(Child-Pugh Category B [CP-B], 점수 7-9) 및 중증 간 기능 장애(Child-Pugh Category C [CP-C], 점수 10-15)가 있는 HCV 비감염 피험자에서 평가되었습니다. 또한 엘바스비어와 그라조프레비어의 약동학은 보상된 간경변이 있는 CP-A 피험자를 포함한 HCV 감염 피험자에서도 평가되었습니다.
정상 간 기능이 있는 HCV 비감염 피험자에 비해 경증, 중등도 또는 중증 간 기능 장애가 있는 HCV 비감염 피험자에서 엘바스비어 AUC 값의 임상적으로 중요한 차이는 관찰되지 않았습니다. 인구 약동학 분석에서 엘바스비어 정상 상태 AUC는 HCV 비감염, 비경변증 피험자에 비해 보상된 간경변이 있는 HCV 감염 피험자에서 유사했습니다.
정상 간 기능이 있는 HCV 비감염 피험자에 비해 그라조프레비어 AUC 값은 경증, 중등도 및 중증 간 기능 장애가 있는 HCV 비감염 피험자에서 각각 1.7배, 5배 및 12배 더 높았습니다. 인구 약동학 분석에서 그라조프레비어 정상 상태 AUC 값은 HCV 비감염, 비경변증 피험자에 비해 보상된 간경변이 있는 HCV 감염 피험자에서 1.65배 더 높았습니다.
약물 상호 작용 연구
약물 상호 작용 연구는 건강한 성인을 대상으로 엘바스비어, 그라조프레비어 또는 엘바스비어와 그라조프레비어를 병용 투여하고, 함께 투여될 가능성이 있는 약물 또는 약동학적 상호 작용에 대한 프로브로 일반적으로 사용되는 약물을 사용하여 수행되었습니다. 표 9는 ZEPATIER(엘바스비어와 그라조프레비어)의 개별 성분 노출에 대한 병용 투여 약물의 영향을 요약합니다. 표 10은 ZEPATIER의 개별 성분이 병용 투여 약물의 노출에 미치는 영향을 요약합니다. 임상 권장 사항에 대한 정보는 [금기 사항 (4), 경고 및 주의 사항 (5) 및 약물 상호 작용 (7) 참조].
엘바스비어와 그라조프레비어는 CYP3A 및 P-gp의 기질이지만, 장 P-gp가 엘바스비어와 그라조프레비어 흡수에 미치는 역할은 최소한인 것으로 보입니다. ZEPATIER와 함께 중등도 및 강력한 CYP3A 유도제를 병용 투여하면 엘바스비어와 그라조프레비어 혈장 농도가 감소하여 ZEPATIER의 치료 효과가 감소할 수 있습니다. ZEPATIER와 함께 강력한 CYP3A4 억제제를 병용 투여하면 엘바스비어와 그라조프레비어 혈장 농도가 증가할 수 있습니다.
그라조프레비어는 OATP1B1/3의 기질입니다. ZEPATIER와 OATP1B1/3 수송체를 억제하는 약물을 병용 투여하면 그라조프레비어 혈장 농도가 임상적으로 중요하게 증가할 수 있습니다.
엘바스비어는 시험관 내에서 CYP3A 억제제가 아니며, 그라조프레비어는 인간에서 약한 CYP3A 억제제입니다. 그라조프레비어와 함께 투여하면 미다졸람 혈장 노출이 34% 증가하고 타크로리무스 혈장 노출이 43% 증가했습니다( 표 6 및 10 참조). 엘바스비어는 시험관 내에서 P-gp를 억제했지만, 엘바스비어를 병용 투여하여 디곡신(P-gp 기질; 표 10 참조) 농도가 임상적으로 중요하게 증가하는 것은 관찰되지 않았습니다. 그라조프레비어는 시험관 내에서 P-gp 억제제가 아닙니다. 엘바스비어와 그라조프레비어는 인간에서 장 수준에서 약물 수송체 유방암 저항 단백질(BCRP)의 억제제이며, 병용 투여된 BCRP 기질의 혈장 농도를 증가시킬 수 있습니다.
ZEPATIER가 다른 CYP 효소(CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 및 CYP2D6), UGT1A1, 에스터라아제(CES1, CES2 및 CatA), 유기 음이온 수송체(OAT)1 및 OAT3, 유기 양이온 수송체(OCT)2의 억제제로서 임상적으로 유의미한 약물 상호 작용은 예상되지 않으며, in vitro 데이터에 따르면 엘바스비어 또는 그라조프레비어의 다회 투여는 CYP1A2, CYP2B6 또는 CYP3A에 의해 대사되는 약물의 대사를 유도할 가능성이 낮습니다.
| 동시 투여된 약물 | 동시 투여된 약물의 요법 | EBR 또는/및 GZR의 요법 | N | 동시 투여된 약물이 없는 EBR 및 GZR PK의 기하 평균 비율 [90% CI](효과 없음=1.00) | |||
|---|---|---|---|---|---|---|---|
| AUC* | Cmax | C24 | |||||
| 약어: EBR, 엘바스비어; GZR, 그라조프레비어; IV, 정맥 주사; PO, 경구; EBR + GZR, 별도의 알약으로 EBR 및 GZR 투여; EBR/GZR, 단일 고정 용량 복합 정제로 EBR 및 GZR 투여. | |||||||
| 항진균제 | |||||||
| 케토코나졸 | 1일 1회 400mg | EBR 50mg 단일 투여 | 7 | EBR | 1.80 (1.41, 2.29) | 1.29 (1.00, 1.66) | 1.89 (1.37, 2.60) |
| 1일 1회 400mg | GZR 100mg 단일 투여 | 8 | GZR | 3.02 (2.42, 3.76) | 1.13 (0.77, 1.67) | 2.01 (1.49, 2.71) | |
| 항결핵제 | |||||||
| 리팜핀 | 단일 투여 IV 600mg | EBR 50mg 단일 투여 | 14 | EBR | 1.22 (1.06, 1.40) | 1.41 (1.18, 1.68) | 1.31 (1.12, 1.53) |
| 단일 투여 PO 600mg | EBR 50mg 단일 투여 | 14 | EBR | 1.17 (0.98, 1.39) | 1.29 (1.06, 1.58) | 1.21 (1.03, 1.43) | |
| 1일 1회 PO 600mg | 1일 1회 GZR 200mg | 12 | GZR | 0.93 (0.75, 1.17) | 1.16 (0.82, 1.65) | 0.10 (0.07, 0.13) | |
| 단일 투여 IV 600mg | GZR 200mg 단일 투여 | 12 | GZR | 10.21 (8.68, 12.00) | 10.94 (8.92, 13.43) | 1.77 (1.40, 2.24) | |
| 단일 투여 PO 600mg | 1일 1회 GZR 200mg | 12 | GZR | 8.35 (7.38, 9.45)† | 6.52 (5.16, 8.24) | 1.62 (1.32, 1.98) | |
| HCV 항바이러스제 | |||||||
| EBR | 1일 1회 20mg | 1일 1회 GZR 200mg | 10 | GZR | 0.90 (0.63, 1.28) | 0.87 (0.50, 1.52) | 0.94 (0.77, 1.15) |
| GZR | 1일 1회 200 mg | EBR 1일 1회 20 mg | 10 | EBR | 1.01 (0.83, 1.24) | 0.93 (0.76, 1.13) | 1.02 (0.83, 1.24) |
| HIV 프로테아제 억제제 | |||||||
| Atazanavir/ ritonavir | 1일 1회 300 mg/100 mg | EBR 1일 1회 50 mg | 10 | EBR | 4.76 (4.07, 5.56) | 4.15 (3.46, 4.97) | 6.45 (5.51, 7.54) |
| 1일 1회 300 mg/100 mg | GZR 1일 1회 200 mg | 12 | GZR | 10.58 (7.78, 14.39) | 6.24 (4.42, 8.81) | 11.64 (7.96, 17.02) | |
| Darunavir/ ritonavir | 1일 2회 600 mg/100 mg | EBR 1일 1회 50 mg | 10 | EBR | 1.66 (1.35, 2.05) | 1.67 (1.36, 2.05) | 1.82 (1.39, 2.39) |
| 1일 2회 600 mg/100 mg | GZR 1일 1회 200 mg | 13 | GZR | 7.50 (5.92, 9.51) | 5.27 (4.04, 6.86) | 8.05 (6.33, 10.24) | |
| Lopinavir/ ritonavir | 1일 2회 400 mg/100 mg | EBR 1일 1회 50 mg | 10 | EBR | 3.71 (3.05, 4.53) | 2.87 (2.29, 3.58) | 4.58 (3.72, 5.64) |
| 1일 2회 400 mg/100 mg | GZR 1일 1회 200 mg | 13 | GZR | 12.86 (10.25, 16.13) | 7.31 (5.65, 9.45) | 21.70 (12.99, 36.25) | |
| Ritonavir‡ | 1일 2회 100 mg | GZR 단회 투여 200 mg | 10 | GZR | 2.03 (1.60, 2.56) | 1.15 (0.60, 2.18) | 1.88 (1.65, 2.14) |
| HIV 인테그라제 가닥 전이 억제제 | |||||||
| Dolutegravir | 단회 투여 50 mg | EBR 50 mg + GZR 200 mg 1일 1회 | 12 | EBR | 0.98 (0.93, 1.04) | 0.97 (0.89, 1.05) | 0.98 (0.93, 1.03) |
| 단회 투여 50 mg | EBR 50 mg + GZR 200 mg 1일 1회 | 12 | GZR | 0.81 (0.67, 0.97) | 0.64 (0.44, 0.93) | 0.86 (0.79, 0.93) | |
| Raltegravir | 단회 투여 400 mg | EBR 단회 투여 50 mg | 10 | EBR | 0.81 (0.57, 1.17) | 0.89 (0.61, 1.29) | 0.80 (0.55, 1.16) |
| 1일 2회 400 mg | GZR 1일 1회 200 mg | 11 | GZR | 0.89 (0.72, 1.09) | 0.85 (0.62, 1.16) | 0.90 (0.82, 0.99) | |
| HIV 비뉴클레오시드 역전사효소 억제제 | |||||||
| Efavirenz | 1일 1회 600 mg | EBR 1일 1회 50 mg | 10 | EBR | 0.46 (0.36, 0.59) | 0.55 (0.41, 0.73) | 0.41 (0.28, 0.59) |
| 1일 1회 600 mg | GZR 1일 1회 200 mg | 12 | GZR | 0.17 (0.13, 0.24) | 0.13 (0.09, 0.19) | 0.31 (0.25, 0.38) | |
| Rilpivirine | 1일 1회 25 mg | EBR 50 mg + GZR 200 mg 1일 1회 | 19 | EBR | 1.07 (1.00, 1.15) | 1.07 (0.99, 1.16) | 1.04 (0.98, 1.11) |
| 1일 1회 25mg | 1일 1회 EBR 50mg + GZR 200mg | 19 | GZR | 0.98 (0.89, 1.07) | 0.97 (0.83, 1.14) | 1.00 (0.93, 1.07) | |
| HIV 뉴클레오티드 역전사효소 억제제 | |||||||
| 테노포비르 디소프록실 푸마레이트 | 1일 1회 300mg | 1일 1회 EBR 50mg | 10 | EBR | 0.93 (0.82, 1.05) | 0.88 (0.77, 1.00) | 0.92 (0.81, 1.05) |
| 1일 1회 300mg | 1일 1회 GZR 200mg | 12 | GZR | 0.86 (0.65, 1.12) | 0.78 (0.51, 1.18) | 0.89 (0.78, 1.01) | |
| HIV 고정 용량 복합 요법 | |||||||
| 엘비테그라비르/코비시스타트/엠트리시타빈/테노포비르 디소프록실 푸마레이트 | 1일 1회 150mg/ 150mg/ 200mg/ 300mg | 1일 1회 EBR 50mg/ GZR 100mg | 21 | EBR | 2.18 (2.02, 2.35) | 1.91 (1.77, 2.05) | 2.38 (2.19, 2.60) |
| 1일 1회 EBR 50mg/ GZR 100mg | 21 | GZR | 5.36 (4.48, 6.43) | 4.59 (3.70, 5.69) | 2.78 (2.48, 3.11) | ||
| 면역억제제 | |||||||
| 시클로스포린 | 단회 투여 400mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | EBR | 1.98 (1.84, 2.13) | 1.95 (1.84, 2.07) | 2.21 (1.98, 2.47) |
| 단회 투여 400mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | GZR | 15.21 (12.83, 18.04) | 17.00 (12.94, 22.34) | 3.39 (2.82, 4.09) | |
| 미코페놀레이트 모페틸 | 단회 투여 1000mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | EBR | 1.07 (1.00, 1.14) | 1.07 (0.98, 1.16) | 1.05 (0.97, 1.14) |
| 단회 투여 1000mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | GZR | 0.74 (0.60, 0.92) | 0.58 (0.42, 0.82) | 0.97 (0.89, 1.06) | |
| 프레드니손 | 단회 투여 40mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | EBR | 1.17 (1.11, 1.24) | 1.25 (1.16, 1.35) | 1.04 (0.97, 1.12) |
| 단회 투여 40mg | 1일 1회 EBR 50mg + GZR 200mg | 14 | GZR | 1.09 (0.95, 1.25) | 1.34 (1.10, 1.62) | 0.93 (0.87, 1.00) | |
| 타크로리무스 | 단회 투여 2mg | 1일 1회 EBR 50mg + GZR 200mg | 16 | EBR | 0.97 (0.90, 1.06) | 0.99 (0.88, 1.10) | 0.92 (0.83, 1.02) |
| 단회 투여 2mg | 1일 1회 EBR 50mg + GZR 200mg | 16 | GZR | 1.12 (0.97, 1.30) | 1.07 (0.83, 1.37) | 0.94 (0.87, 1.02) | |
| 아편 유사제 대체 요법 | |||||||
| 부프레노르핀/날록손 | 단회 투여 8mg/2mg | 단회 투여 EBR 50mg | 15 | EBR | 1.22 (0.98, 1.52) | 1.13 (0.87, 1.46) | 1.22 (0.99, 1.51) |
| 8-24 mg/ 2-6 mg 1일 1회 | GZR 200 mg 1일 1회 | 12§ | GZR | 0.86 (0.63, 1.18) | 0.80 (0.54, 1.20) | 0.97 (0.77, 1.22) | |
| Methadone | 20-120 mg 1일 1회 | EBR 50 mg 1일 1회 | 10§ | EBR | 1.20 (0.94, 1.53) | 1.23 (0.94, 1.62) | 1.32 (1.03, 1.68) |
| 20-150 mg 1일 1회 | GZR 200 mg 1일 1회 | 12§ | GZR | 1.03 (0.76, 1.41) | 0.89 (0.60, 1.32) | 0.98 (0.79, 1.23) | |
| 산 감소제 | |||||||
| Famotidine | 20 mg 단회 투여 | EBR 50 mg/ GZR 100 mg 단회 투여 | 16 | EBR | 1.05 (0.92, 1.18) | 1.11 (0.98, 1.26) | 1.03 (0.91, 1.17) |
| 20 mg 단회 투여 | EBR 50 mg/ GZR 100 mg 단회 투여 | 16 | GZR | 1.10 (0.95, 1.28) | 0.89 (0.71, 1.11) | 1.12 (0.97, 1.30) | |
| Pantoprazole | 40 mg 1일 1회 | EBR 50 mg/ GZR 100 mg 단회 투여 | 16 | EBR | 1.05 (0.93, 1.18) | 1.02 (0.92, 1.14) | 1.03 (0.92, 1.17) |
| 40 mg 1일 1회 | EBR 50 mg/ GZR 100 mg 단회 투여 | 16 | GZR | 1.12 (0.96, 1.30) | 1.10 (0.89, 1.37) | 1.17 (1.02, 1.34) | |
| 인산염 결합제 | |||||||
| Calcium acetate | 2668 mg 단회 투여 | EBR 50 mg + GZR 100 mg 단회 투여 | 12 | EBR | 0.92 (0.75, 1.14) | 0.86 (0.71, 1.04) | 0.87 (0.70, 1.09) |
| 2668 mg 단회 투여 | EBR 50 mg + GZR 100 mg 단회 투여 | 12 | GZR | 0.79 (0.68, 0.91) | 0.57 (0.40, 0.83) | 0.77 (0.61, 0.99) | |
| Sevelamer carbonate | 2400 mg 단회 투여 | EBR 50 mg + GZR 100 mg 단회 투여 | 12 | EBR | 1.13 (0.94, 1.37) | 1.07 (0.88, 1.29) | 1.22 (1.02, 1.45) |
| 2400 mg 단회 투여 | EBR 50 mg + GZR 100 mg 단회 투여 | 12 | GZR | 0.82 (0.68, 0.99) | 0.53 (0.37, 0.76) | 0.84 (0.71, 0.99) | |
| 스타틴 | |||||||
| Atorvastatin | 20 mg 단회 투여 | GZR 200 mg 1일 1회 | 9 | GZR | 1.26 (0.97, 1.64) | 1.26 (0.83, 1.90) | 1.11 (1.00, 1.23) |
| Pitavastatin | 1 mg 단회 투여 | GZR 200 mg 1일 1회 | 9 | GZR | 0.81 (0.70, 0.95) | 0.72 (0.57, 0.92) | 0.91 (0.82, 1.01) |
| Pravastatin | 40 mg 단회 투여 | EBR 50 mg + GZR 200 mg 1일 1회 | 12 | EBR | 0.98 (0.93, 1.02) | 0.97 (0.89, 1.05) | 0.97 (0.92, 1.02) |
| 40 mg 단회 투여 | EBR 50 mg + GZR 200 mg 1일 1회 | 12 | GZR | 1.24 (1.00, 1.53) | 1.42 (1.00, 2.03) | 1.07 (0.99, 1.16) | |
| Rosuvastatin | 10 mg single-dose | EBR 50 mg + GZR 200 mg single-dose | 11 | EBR | 1.09 (0.98, 1.21) | 1.11 (0.99, 1.26) | 0.96 (0.86, 1.08) |
| 10 mg single-dose | GZR 200 mg once daily | 11 | GZR | 1.16 (0.94, 1.44) | 1.13 (0.77, 1.65) | 0.93 (0.84, 1.03) | |
| 10 mg single-dose | EBR 50 mg + GZR 200 mg once daily | 11 | GZR | 1.01 (0.79, 1.28) | 0.97 (0.63, 1.50) | 0.95 (0.87, 1.04) | |
| 병용 투여 약물 | 병용 투여 약물 요법 | EBR 또는/및 GZR 투여 | EBR 또는/및 GZR 요법 | N | EBR 또는/및 GZR 유무에 따른 병용 투여 약물 PK의 기하 평균 비율 [90% CI] (효과 없음=1.00) | ||
|---|---|---|---|---|---|---|---|
| AUC* | Cmax | Ctrough† | |||||
| 약어: EBR, 엘바스비어; GZR, 그라조프레비어; EBR + GZR, 별도의 정제로 EBR 및 GZR 투여; EBR/GZR, 단일 고정 용량 복합 정제로 EBR 및 GZR 투여 | |||||||
| P-gp 기질 | |||||||
| 디곡신 | 디곡신 0.25 mg 단회 투여 | EBR | 1일 1회 50 mg | 18 | 1.11 (1.02, 1.22) | 1.47 (1.25, 1.73) | — |
| CYP3A 기질 | |||||||
| 미다졸람 | 미다졸람 2 mg 단회 투여 | GZR | 1일 1회 200 mg | 11 | 1.34 (1.29, 1.39) | 1.15 (1.01, 1.31) | — |
| CYP2C8 기질 | |||||||
| 몬테루카스트 | 몬테루카스트 10 mg 단회 투여 | GZR | 1일 1회 200 mg | 23 | 1.11 (1.01, 1.20) | 0.92 (0.81, 1.06) | 1.39 (1.25, 1.56) |
| HCV 항바이러스제 | |||||||
| GS-331007 | 소포스부비어 400 mg 단회 투여 | EBR + GZR | 1일 1회 50 mg + 200 mg | 16 | 1.13 (1.05, 1.21) | 0.87 (0.78, 0.96) | 1.53 (1.43, 1.63) |
| 소포스부비어 | 소포스부비어 400 mg 단회 투여 | EBR + GZR | 1일 1회 50 mg + 200 mg | 16 | 2.43 (2.12, 2.79)‡ | 2.27 (1.72, 2.99) | — |
| HIV 프로테아제 억제제 | |||||||
| 아타자나비어/ 리토나비어 | 1일 1회 아타자나비어 300 mg/ 리토나비어 100 mg | EBR | 1일 1회 50 mg | 8 | 1.07 (0.98, 1.17) | 1.02 (0.96, 1.08) | 1.15 (1.02, 1.29) |
| 1일 1회 아타자나비어 300 mg/ 리토나비어 100 mg | GZR | 1일 1회 200 mg | 11 | 1.43 (1.30, 1.57) | 1.12 (1.01, 1.24) | 1.23 (1.13, 1.34) | |
| 다루나비어/ 리토나비어 | 1일 2회 다루나비어 600 mg/ 리토나비어 100 mg | EBR | 1일 1회 50 mg | 8 | 0.95 (0.86, 1.06) | 0.95 (0.85, 1.05) | 0.94 (0.85, 1.05) |
| Darunavir 600 mg/ ritonavir 100 mg twice daily | GZR | 200 mg once daily | 13 | 1.11 (0.99, 1.24) | 1.10 (0.96, 1.25) | 1.00 (0.85, 1.18) | |
| Lopinavir/ ritonavir | Lopinavir 400 mg/ ritonavir 100 mg twice daily | EBR | 50 mg once daily | 9 | 1.02 (0.93, 1.13) | 1.02 (0.92, 1.13) | 1.07 (0.97, 1.18) |
| Lopinavir 400 mg/ ritonavir 100 mg twice daily | GZR | 200 mg once daily | 13 | 1.03 (0.96, 1.16) | 0.97 (0.88, 1.08) | 0.97 (0.81, 1.15) | |
| HIV Integrase Strand Transfer Inhibitor | |||||||
| Dolutegravir | Dolutegravir 50 mg single-dose | EBR + GZR | 50 mg + 200 mg once daily | 12 | 1.16 (1.00, 1.34) | 1.22 (1.05, 1.40) | 1.14 (0.95, 1.36) |
| Raltegravir | Raltegravir 400 mg single-dose | EBR | 50 mg single-dose | 10 | 1.02 (0.81, 1.27) | 1.09 (0.83, 1.44) | 0.99 (0.80, 1.22)§ |
| Raltegravir 400 mg twice daily | GZR | 200 mg once daily | 11 | 1.43 (0.89, 2.30) | 1.46 (0.78, 2.73) | 1.47 (1.09, 2.00) | |
| HIV Non-Nucleoside Reverse Transcriptase Inhibitor | |||||||
| Efavirenz | Efavirenz 600 mg once daily | EBR | 50 mg once daily | 7 | 0.82 (0.78, 0.86) | 0.74 (0.67, 0.82) | 0.91 (0.87, 0.96) |
| Efavirenz 600 mg once daily | GZR | 200 mg once daily | 11 | 1.00 (0.96, 1.05) | 1.03 (0.99, 1.08) | 0.93 (0.88, 0.98) | |
| Rilpivirine | Rilpivirine 25 mg once daily | EBR + GZR | 50 mg + 200 mg once daily | 19 | 1.13 (1.07, 1.20) | 1.07 (0.97, 1.17) | 1.16 (1.09, 1.23) |
| HIV Nucleotide Reverse Transcriptase Inhibitor | |||||||
| Tenofovir disoproxil fumarate | Tenofovir disoproxil fumarate 300 mg once daily | EBR | 50 mg once daily | 10 | 1.34 (1.23, 1.47) | 1.47 (1.32, 1.63) | 1.29 (1.18, 1.41) |
| Tenofovir disoproxil fumarate 300 mg once daily | GZR | 200 mg once daily | 12 | 1.18 (1.09, 1.28) | 1.14 (1.04, 1.25) | 1.24 (1.10, 1.39) | |
| Tenofovir disoproxil fumarate 300 mg once daily | EBR/GZR | 50 mg + 100 mg once daily | 13 | 1.27 (1.20, 1.35) | 1.14 (0.95, 1.36) | 1.23 (1.09, 1.40) | |
| HIV Fixed-Dose Combination Regimen | |||||||
| Elvitegravir/ cobicistat/ emtricitabine/ tenofovir disoproxil fumarate | Elvitegravir 150 mg once daily | EBR/GZR | 50 mg / 100 mg once daily | 22 | 1.10 (1.00, 1.21) | 1.02 (0.93, 1.11) | 1.31 (1.11, 1.55) |
| Cobicistat 150 mg once daily | EBR/GZR | 50 mg / 100 mg once daily | 22 | 1.49 (1.42, 1.57) | 1.39 (1.29, 1.50) | — | |
| Emtricitabine 200 mg 1일 1회 | EBR/GZR | 50 mg / 100 mg 1일 1회 | 22 | 1.07 (1.03, 1.10) | 0.96 (0.90, 1.02) | 1.19 (1.13, 1.25) | |
| Tenofovir disoproxil fumarate 300 mg 1일 1회 | EBR/GZR | 50 mg / 100 mg 1일 1회 | 22 | 1.18 (1.13, 1.24) | 1.25 (1.14, 1.37) | 1.20 (1.15, 1.26) | |
| 면역억제제 | |||||||
| Cyclosporine | Cyclosporine 400 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 14 | 0.96 (0.90, 1.02) | 0.90 (0.85, 0.97) | 1.00 (0.92, 1.08)§ |
| Mycophenolic acid | Mycophenolate mofetil 1000 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 14 | 0.95 (0.87, 1.03) | 0.85 (0.67, 1.07) | — |
| Prednisolone | Prednisone 40 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 14 | 1.08 (1.01, 1.16) | 1.04 (0.99, 1.09) | — |
| Prednisone | Prednisone 40 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 14 | 1.08 (1.00, 1.17) | 1.05 (1.00, 1.10) | — |
| Tacrolimus | Tacrolimus 2 mg 단회 투여 |
EBR + GZR | 50 mg + 200 mg 1일 1회 | 16 | 1.43 (1.24, 1.64) | 0.60 (0.52, 0.69) | 1.70 (1.49, 1.94)§ |
| 경구 피임약 | |||||||
| Ethinyl estradiol (EE) | 0.03 mg EE/ 0.15 mg LNG 단회 투여 | EBR | 50 mg 1일 1회 | 20 | 1.01 (0.97, 1.05) | 1.10 (1.05, 1.16) | — |
| GZR | 200 mg 1일 1회 | 20 | 1.10 (1.05, 1.14) | 1.05 (0.98, 1.12) | — | ||
| Levonorgestrel (LNG) | EBR | 50 mg 1일 1회 | 20 | 1.14 (1.04, 1.24) | 1.02 (0.95, 1.08) | — | |
| GZR | 200 mg 1일 1회 | 20 | 1.23 (1.15, 1.32) | 0.93 (0.84, 1.03) | — | ||
| 아편 유사제 대체 치료 | |||||||
| Buprenorphine | Buprenorphine 8 mg/Naloxone 2 mg 단회 투여 | EBR | 50 mg 1일 1회 | 15 | 0.98 (0.89, 1.08) | 0.94 (0.82, 1.08) | 0.98 (0.88, 1.09) |
| Buprenorphine 8-24 mg/ Naloxone 2-6 mg 1일 1회 | GZR | 200 mg 1일 1회 | 12 | 0.98 (0.81, 1.19) | 0.90 (0.76, 1.07) | — | |
| R-Methadone | Methadone 20-120 mg 1일 1회 | EBR | 50 mg 1일 1회 | 10 | 1.03 (0.92, 1.15) | 1.07 (0.95, 1.20) | 1.10 (0.96, 1.26) |
| Methadone 20-150 mg 1일 1회 | GZR | 200 mg 1일 1회 | 12 | 1.09 (1.02, 1.17) | 1.03 (0.96, 1.11) | — | |
| S-Methadone | Methadone 20-120 mg 1일 1회 | EBR | 50 mg 1일 1회 | 10 | 1.09 (0.94, 1.26) | 1.09 (0.95, 1.25) | 1.20 (0.98, 1.47) |
| Methadone 20-150 mg 1일 1회 | GZR | 200 mg 1일 1회 | 12 | 1.23 (1.12, 1.35) | 1.15 (1.07, 1.25) | — | |
| Statin | |||||||
| Atorvastatin | Atorvastatin 10 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 16 | 1.94 (1.63, 2.33) | 4.34 (3.10, 6.07) | 0.21 (0.17, 0.26) |
| Pitavastatin | Pitavastatin 1 mg 단회 투여 | GZR | 200 mg 1일 1회 | 9 | 1.11 (0.91, 1.34) | 1.27 (1.07, 1.52) | — |
| Pravastatin | Pravastatin 40 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 12 | 1.33 (1.09, 1.64)¶ | 1.28 (1.05, 1.55) | — |
| Rosuvastatin | Rosuvastatin 10 mg 단회 투여 | EBR + GZR | 50 mg + 200 mg 1일 1회 | 12 | 2.26 (1.89, 2.69)# | 5.49 (4.29, 7.04) | 0.98 (0.84, 1.13) |
12.4 미생물학
작용 기전
ZEPATIER는 바이러스 생활 주기의 여러 단계에서 HCV를 표적으로 하기 위해 서로 다른 작용 기전과 중복되지 않는 내성 프로파일을 가진 두 가지 직접 작용 항바이러스제를 결합합니다.
엘바스비르는 HCV NS5A의 억제제로, 바이러스 RNA 복제 및 바이러스 입자 조립에 필수적입니다. 엘바스비르의 작용 기전은 세포 배양 항바이러스 활성 및 약물 내성 매핑 연구를 기반으로 규명되었습니다.
그라조프레비르는 HCV NS3/4A 프로테아제의 억제제로, HCV가 암호화한 폴리펩티드(NS3, NS4A, NS4B, NS5A 및 NS5B 단백질의 성숙한 형태로)의 단백질 분해 절단에 필요하며 바이러스 복제에 필수적입니다. 생화학적 분석에서 그라조프레비르는 재조합 HCV 유형 1a, 1b 및 4a NS3/4A 프로테아제 효소의 단백질 분해 활성을 각각 7pM, 4pM 및 62pM의 IC50 값으로 억제했습니다.
항바이러스 활성
HCV 복제체 분석에서 유형 1a, 1b 및 4의 전체 길이 복제체에 대한 엘바스비르의 EC50 값은 각각 4pM, 3pM 및 0.3pM이었습니다. 임상 격리주에서 NS5A 서열을 암호화하는 키메라 복제체에 대한 엘바스비르의 중간 EC50 값은 유형 1a의 경우 5pM(범위 3-9pM; N=5), 유형 1b의 경우 9pM(범위 5-10pM; N=4), 유형 4a의 경우 0.2pM(범위 0.2-0.2pM; N=2), 유형 4b의 경우 3,600pM(범위 17pM-34,000pM; N=3), 유형 4d의 경우 0.45pM(범위 0.4-0.5pM; N=2), 유형 4f의 경우 1.9pM(N=1), 유형 4g의 경우 36.3pM(범위 0.6-72pM; N=2), 유형 4m의 경우 0.6pM(범위 0.4-0.7pM; N=2), 유형 4o의 경우 2.2pM(N=1) 및 유형 4q의 경우 0.5pM(N=1)이었습니다.
HCV 복제체 분석에서 유형 1a, 1b 및 4의 전체 길이 복제체에 대한 그라조프레비르의 EC50 값은 각각 0.4nM, 0.5nM 및 0.3nM이었습니다. 임상 격리주에서 NS3/4A 서열을 암호화하는 키메라 복제체에 대한 그라조프레비르의 중간 EC50 값은 유형 1a의 경우 0.8nM(범위 0.4-5.1nM; N=10), 유형 1b의 경우 0.3nM(범위 0.2-5.9nM; N=9), 유형 4a의 경우 0.3nM(N=1), 유형 4b의 경우 0.16nM(범위 0.11-0.2nM; N=2) 및 유형 4g의 경우 0.24nM(범위 0.15-0.33nM; N=2)이었습니다.
복합 항바이러스 활성
그라조프레비르 또는 리바비린과 함께 엘바스비르를 평가한 결과 복제체 세포에서 HCV RNA 수준을 감소시키는 데 길항 작용이 나타나지 않았습니다. 리바비린과 함께 그라조프레비르를 평가한 결과 복제체 세포에서 HCV RNA 수준을 감소시키는 데 길항 작용이 나타나지 않았습니다.
내성
세포 배양에서
엘바스비르 및 그라조프레비르에 대한 감수성이 감소된 HCV 복제체는 유형 1a, 1b 및 4에 대해 세포 배양에서 선택되었으며, 이는 각각 NS5A 또는 NS3에서 내성 관련 아미노산 치환의 출현으로 이어졌습니다. 세포 배양에서 선택되었거나 2b상 및 3상 임상 시험에서 확인된 NS5A 또는 NS3의 대부분의 아미노산 치환은 유형 1a, 1b 또는 4 복제체에서 표현형적으로 특성화되었습니다.
엘바스비르의 경우 HCV 유형 1a 복제체에서 단일 NS5A 치환 M28A/G/T, Q30D/E/H/K/R, L31M/V, H58D 및 Y93C/H/N은 엘바스비르 항바이러스 활성을 1.5배에서 2,000배까지 감소시켰습니다. 유형 1b 복제체에서 단일 NS5A 치환 L28M, L31F 및 Y93H는 엘바스비르 항바이러스 활성을 2배에서 17배까지 감소시켰습니다. 유형 4 복제체에서 단일 NS5A 치환 L30S, M31V 및 Y93H는 엘바스비르 항바이러스 활성을 3배에서 23배까지 감소시켰습니다. 일반적으로 HCV 유형 1a, 1b 또는 4 복제체에서 엘바스비르 내성 관련 치환의 조합은 엘바스비르 항바이러스 활성을 더욱 감소시켰습니다.
그라조프레비르의 경우 HCV 유형 1a 복제체에서 단일 NS3 치환 Y56H, R155K, A156G/T/V 및 D168A/E/G/N/S/V/Y는 그라조프레비르 항바이러스 활성을 2배에서 81배까지 감소시켰습니다. V36L/M, Q80K/R 또는 V107I 단일 치환은 세포 배양에서 그라조프레비르 항바이러스 활성에 영향을 미치지 않았습니다. 유형 1b 복제체에서 단일 NS3 치환 F43S, Y56F, V107I, A156S/T/V 및 D168A/G/V는 그라조프레비르 항바이러스 활성을 1.5배에서 375배까지 감소시켰습니다. 유형 4 복제체에서 단일 NS3 치환 D168A/V는 그라조프레비르 항바이러스 활성을 110배에서 320배까지 감소시켰습니다. 일반적으로 HCV 유형 1a, 1b 또는 4 복제체에서 그라조프레비르 내성 관련 치환의 조합은 그라조프레비르 항바이러스 활성을 더욱 감소시켰습니다.
임상 연구에서
2상 및 3상 임상 시험에서 ZEPATIER 또는 엘바스비르 + 그라조프레비르(리바비린 유무)를 포함하는 요법으로 치료받은 대상자의 풀링된 분석에서 바이러스학적 실패를 경험하고 서열 데이터를 사용할 수 있는 50명의 대상자(치료 중 바이러스학적 실패 6명, 치료 후 재발 44명)에 대해 두 가지 약물 표적에 대한 내성 분석을 수행했습니다. HCV 유형 및 아형에 따른 이러한 대상자의 바이러스 집단에서 관찰된 치료 발생 치환은 표 11에 나와 있습니다. 치료 발생 NS5A 치환은 37명 중 30명(81%)의 유형 1a 감염 대상자, 8명 중 7명(88%)의 유형 1b 감염 대상자 및 5명 중 5명(100%)의 유형 4 감염 대상자에서 검출되었습니다. 유형 1a에서 가장 흔한 치료 발생 NS5A 치환은 위치 Q30(n=22)에서 발생했습니다. 치료 발생 NS3 치환은 37명 중 29명(78%)의 유형 1a 감염 대상자, 8명 중 2명(25%)의 유형 1b 감염 대상자 및 5명 중 2명(40%)의 유형 4 감염 대상자에서 검출되었습니다. 유형 1a에서 가장 흔한 치료 발생 NS3 치환은 위치 D168(n=18)에서 발생했습니다. 치료 발생 치환은 37명 중 23명(62%)의 유형 1a 감염 대상자, 8명 중 1명(13%)의 유형 1b 감염 대상자 및 5명 중 2명(40%)의 유형 4 감염 대상자에서 두 가지 HCV 약물 표적 모두에서 검출되었습니다.
| Target | Genotype 1a N = 37 |
Genotype 1b N = 8 |
Genotype 4 N = 5 |
|---|---|---|---|
| NS5A | M28A/G/T, Q30H/K/R/Y, L31F/M/V, H58D, Y93H/N/S | L28M, L31F/V, Y93H | L28S/T, M31I/V, P58D, Y93H |
| NS3 | V36L/M, Y56H, V107I, R155I/K, A156G/T/V, V158A, D168A/G/N/V/Y | Y56F, V107I, A156T | A156M/T/V, D168A/G, V170I |
내성 관련 치환의 지속성
NS5A 및 NS3에서 각각 엘바스비어 및 그라조프레비어 치료로 인해 발생하는 아미노산 치환의 지속성은 약물 표적에서 치료로 인해 발생하는 내성 관련 치환이 있는 HCV 1형 감염 환자를 대상으로 한 2상 및 3상 시험에서 평가되었으며, 인구 집단 핵산 서열 분석을 사용하여 치료 후 최소 24주까지 이용 가능한 데이터를 통해 평가되었습니다.
치료로 인해 발생하는 NS5A 내성 관련 치환이 있는 바이러스 집단은 일반적으로 NS3 내성 관련 치환이 있는 바이러스 집단보다 더 지속되었습니다. 1a형 감염 환자 중 NS5A 내성 관련 치환은 추적 관찰 12주차에 95%(35/37)의 환자에서 검출 가능한 수준으로 지속되었으며, 추적 관찰 24주차 데이터가 있는 환자의 경우 100%(9/9)에서 지속되었습니다. 1b형 감염 환자 중 NS5A 내성 관련 치환은 추적 관찰 12주차에 100%(7/7)의 환자에서 검출 가능한 수준으로 지속되었으며, 추적 관찰 24주차 데이터가 있는 환자의 경우 100%(3/3)에서 지속되었습니다.
1a형 감염 환자 중 NS3 내성 관련 치환은 추적 관찰 24주차에 31%(4/13)의 환자에서 검출 가능한 수준으로 지속되었습니다. 1b형 감염 환자 중 NS3 내성 관련 치환은 추적 관찰 24주차에 50%(1/2)의 환자에서 검출 가능한 수준으로 지속되었습니다.
치료로 인해 발생하는 NS5A 및 NS3 내성 관련 치환이 있는 1형 감염 환자 수가 제한적이기 때문에 이 유형에서 치료로 인해 발생하는 치환의 지속성 추세를 확립할 수 없었습니다.
내성 관련 치환을 포함하는 바이러스가 검출되지 않았다고 해서 해당 치환을 가진 바이러스 집단이 치료 전에 존재했을 수 있는 배경 수준으로 감소했음을 의미하는 것은 아닙니다. ZEPATIER 내성 관련 치환을 포함하는 바이러스의 발생 또는 지속성의 장기적인 임상적 영향은 알려져 있지 않습니다.
1형 감염 환자에서 기준 HCV 아미노산 다형성의 치료 반응에 대한 영향
인구 집단 핵산 서열 분석을 사용한 분석을 통해 NS5A 또는 NS3 아미노산 다형성과 치료 경험이 없는 및 치료 경험이 있는 1형 감염 환자의 치료 반응 간의 연관성을 조사했습니다. 내성 관련 위치에서 기준 NS5A 다형성(NS5A 아미노산 위치 28, 30, 31 또는 93에서 서브타입 참조와의 변화에 중점)을 평가했습니다. 위치 36, 54, 55, 56, 80, 107, 122, 132, 155, 156, 158, 168, 170 또는 175에서 기준 NS3 다형성을 평가했습니다. SVR12 비율 분석은 직접 작용 항바이러스제에 대한 경험이 없는 환자와 3상 임상 시험에서 리바비린 유무와 함께 ZEPATIER를 투여받은 환자의 데이터를 풀링했으며, 바이러스학적 실패와 관련이 없는 이유로 SVR12를 달성하지 못한 환자는 제외했습니다.
1a형
임상 연구에서
1a형 감염 환자에서 M28, Q30, L31 또는 Y93 위치에서 하나 이상의 HCV NS5A 아미노산 다형성이 있는 경우 이전 치료력 또는 간경변증 상태에 관계없이 12주 동안 ZEPATIER의 효능이 감소하는 것과 관련이 있었습니다(표 12). 1a형 감염 환자에서 이러한 위치 중 어느 하나에서 다형성이 있는 비율은 전체적으로 11%(62/561)였으며, 특히 ZEPATIER를 12주 동안 또는 ZEPATIER와 리바비린을 16주 동안 평가한 2상 및 3상 임상 시험에서 미국 환자의 경우 12%(37/309)였습니다. 1a형 감염 환자에서 이러한 위치에서 다형성이 있는 비율은 M28 위치에서 6%(35/561), Q30 위치에서 2%(11/561), L31 위치에서 3%(15/561), Y93 위치에서 2%(10/561)였습니다. NS5A 위치 H58에서 다형성은 흔했습니다(10%) 그리고 바이러스가 기준 M28V 및 H58D 다형성을 가진 단일 바이러스학적 실패 환자를 제외하고는 ZEPATIER 효능과 관련이 없었습니다.
12주 동안 ZEPATIER로 치료받은 환자의 SVR12 비율은 M28V/T/L 다형성이 있는 환자의 경우 88%(29/33)(각각 n=29, 3, 1), Q30H/R/L 다형성이 있는 환자의 경우 40%(4/10)(각각 n=5, 3, 2), L31M 다형성이 있는 환자의 경우 38%(5/13), Y93C/H/N/S 다형성이 있는 환자의 경우 63%(5/8)(각각 n=3, 3, 1, 1)였습니다. 임상 시험 데이터는 제한적이지만, 이러한 NS5A 다형성이 있는 1a형 감염 환자 중 16주 동안 ZEPATIER와 리바비린을 투여받은 환자 6명 중 6명이 SVR12를 달성했습니다. 16주 동안 ZEPATIER와 리바비린을 투여받은 환자에서 관찰된 특정 NS5A 다형성에는 M28V(n=2), Q30H(n=1), L31M(n=2) 또는 Y93C/H(각각 n=1)가 포함되었습니다.
| NS5A 다형성 상태 | ZEPATIER 12주 SVR12 % (n/N) |
ZEPATIER + RBV 16주 SVR12 % (n/N) |
|---|---|---|
|
||
| 기준 NS5A 다형성 없음 (M28, Q30, L31 또는 Y93) |
98% (441/450) | 100% (49/49) |
| 기준 NS5A 다형성 있음 (M28*, Q30*, L31* 또는 Y93*) |
70% (39/56) | 100% (6/6) |
이전 치료 경험이 있는 대상자에서 HCV NS5A 아미노산 다형성의 영향
이전 PegIFN + RBV + HCV 프로테아제 억제제 치료에 실패하고 리바비린과 함께 ZEPATIER를 투여받은 이전 치료 경험이 있는 대상자에서 HCV NS5A 아미노산 다형성의 영향을 결정하기 위한 임상 시험 데이터가 충분하지 않습니다.
유전자형 1a 감염 대상자에서 NS3 Q80K 다형성은 치료 반응에 영향을 미치지 않았습니다. 다른 NS3 내성 관련 위치의 다형성은 드물었으며 치료 효능 감소와 관련이 없었습니다.
프로토콜 095
전향적 관찰 비교 연구의 하위 연구인 프로토콜 095에서 아미노산 위치 M28, Q30, L31 및/또는 Y93에서 1개 이상의 기준 NS5A 다형성을 가진 HCV 유전자형 1a 감염 환자 29명을 대상으로 리바비린과 함께 ZEPATIER로 16주간 치료한 효능을 평가했습니다. 4개 아미노산 위치 중 어느 하나에서 1개 이상의 기준 NS5A 다형성을 가진 환자의 전체 SVR12 비율은 93%(27/29)였습니다. 23명의 환자가 기준선에서 단일 아미노산 위치에 NS5A 다형성을 보였습니다. 아미노산 위치 M28, Q30, L31 또는 Y93에서 단일 다형성을 가진 환자의 SVR12 비율은 각각 100%(14/14), 100%(1/1), 33%(1/3) 및 100%(5/5)였습니다. 6명의 환자가 기준선에서 1개 이상의 아미노산 위치(M28, Q30, L31 및/또는 Y93)에 NS5A 다형성을 보였습니다. 이러한 환자의 SVR12 비율은 100%(6/6)였습니다.
VA NS5A 코호트 연구
회귀적 재향군인 관리(VA) NS5A 코호트 연구에서 아미노산 위치 M28, Q30, L31 및/또는 Y93에서 1개 이상의 기준 NS5A 다형성을 가진 HCV 유전자형 1a 감염 환자 93명을 대상으로 리바비린과 함께 ZEPATIER로 16주간 치료한 효능을 평가했습니다. 4개 아미노산 위치 중 어느 하나에서 1개 이상의 기준 NS5A 다형성을 가진 환자의 전체 SVR12 비율은 81%(75/93)였습니다. 65명의 환자가 기준선에서 단일 아미노산 위치에 NS5A 다형성을 보였습니다. 아미노산 위치 M28, Q30, L31 또는 Y93에서 단일 다형성을 가진 환자의 SVR12 비율은 각각 94%(16/17), 100%(8/8), 84%(16/19) 및 81%(17/21)였습니다. 28명의 환자가 기준선에서 1개 이상의 아미노산 위치(M28, Q30, L31 및/또는 Y93)에 NS5A 다형성을 보였습니다. 이러한 환자의 SVR12 비율은 64%(18/28)였습니다.
유전자형 4 감염 대상자에서 기준 HCV 다형성의 치료 반응에 대한 영향
ZEPATIER 또는 엘바스비어 + 그라조프레비어를 리바비린과 함께 또는 리바비린 없이 포함하는 요법으로 치료받은 대상자(비바이러스적 실패 제외)의 풀링된 분석에서 유전자형 4 감염 대상자(n=71)의 HCV 서열에 대한 계통 발생 분석은 4개의 HCV 유전자형 4 아형(4a, 4d, 4k, 4o)을 확인했습니다. 대부분의 대상자는 아형 4a(42%) 또는 4d(51%)에 감염되었으며, 다른 유전자형 4 아형 각각에 1~2명의 대상자가 감염되었습니다. 미국 연구 사이트에 등록된 대상자 중 11/13(85%)이 HCV 아형 4a에 감염되었습니다. 그라조프레비어와 엘바스비어를 포함하는 요법으로 바이러스적 실패를 경험한 HCV 아형 4d에 감염된 대상자가 2명 있었습니다.
유전자형 4 감염 대상자에서 기준 NS5A 다형성(모집단 염기 서열 분석에 의해 NS5A 아미노산 위치 28, 30, 31, 58 및 93에서 기준과의 변화)을 가진 대상자의 SVR12 비율은 100%(28/28)였고, 기준 NS5A 다형성이 없는 대상자의 경우 95%(41/43)였습니다.
유전자형 4 감염 대상자에서 기준 NS3 다형성(모집단 염기 서열 분석에 의해 NS3 아미노산 위치 36, 54, 55, 56, 80, 107, 122, 132, 155, 156, 158, 168, 170 및 175에서 기준과의 변화)을 가진 대상자의 SVR12 비율은 100%(18/18)였고, 기준 NS3 다형성이 없는 대상자의 경우 96%(51/53)였습니다.
교차 내성
클래스별로 NS5A 억제제와 NS3/4A 프로테아제 억제제 간에 교차 내성이 가능합니다. 엘바스비어와 그라조프레비어는 NS5B 억제제에 대한 내성을 부여하는 치환이 있는 바이러스 집단에 대해 완전히 활성이 있습니다.
C-SALVAGE 시험에서 이전에 보세프레비어(n=28), 시메프레비어(n=8) 또는 텔라프레비어(n=43)를 PegIFN + RBV와 함께 병용하여 치료받았지만 실패한 유전자형 1 감염 대상자는 EBR 50mg을 1일 1회 + GZR 100mg을 1일 1회 + RBV를 12주간 투여받았습니다. 이전 PegIFN + RBV + HCV 프로테아제 억제제 치료에 실패하고 리바비린과 함께 ZEPATIER를 투여받은 이전 치료 경험이 있는 대상자에서 기준선에서 검출된 HCV NS3 내성 관련 치환의 영향을 결정하기 위한 데이터가 제한적입니다. 기준선에서 검출된 NS3 내성 관련 치환이 있는 유전자형 1a 및 유전자형 1b 감염 대상자의 88%(21/24)에서 SVR이 달성되었습니다. 기준선에서 관찰된 특정 NS3 치환은 다음 중 하나 이상을 포함했습니다. V36L/M(n=8), T54S(n=4), S122G/T(n=9), R155K/T(n=9), A156S/T(n=1) 및 D168E/N(n=3). 기준 NS3 내성 치환이 없는 대상자의 SVR은 100%(55/55)였습니다. 바이러스적 실패를 보인 3명의 대상자는 기준선에서 다음 NS3 또는 NS5A 치환/다형성을 보였습니다. NS3 R155T/D168N, NS3 R155K + NS5A H58D 및 NS3 T54S + NS5A L31M.
ZEPATIER의 효능은 이전에 NS5A 억제제를 포함하는 다른 요법으로 치료받았지만 실패한 환자에서 확립되지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
발암성 및 돌연변이 유발성
Elbasvir와 grazoprevir는 미생물 돌연변이 유발, 중국 햄스터 난소 세포의 염색체 이상, in vivo 랫트 소핵 분석을 포함한 일련의 in vitro 또는 in vivo 분석에서 유전독성을 나타내지 않았습니다.
Elbasvir 또는 grazoprevir를 사용한 발암성 연구는 수행되지 않았습니다.
ZEPATIER를 리바비린을 포함하는 요법으로 투여하는 경우 리바비린의 발암성 및 돌연변이 유발성에 대한 정보는 이 병용 요법에도 적용됩니다. 발암성 및 돌연변이 유발성에 대한 정보는 리바비린 처방 정보를 참조하십시오.
14 임상 연구
14.1 임상 시험 개요
ZEPATIER의 효능은 유전자형(GT) 1, 4 또는 6형의 보상성 간 질환(간경변증 동반 또는 비동반)을 동반한 만성 C형 간염 바이러스 감염 환자 1401명을 대상으로 실시한 2건의 위약 대조 시험과 4건의 비대조군 제2상 및 제3상 임상 시험, 그리고 유전자형 1 또는 4형의 보상성 간 질환(간경변증 동반 또는 비동반)을 동반한 만성 C형 간염 바이러스 감염 소아 환자 22명을 대상으로 실시한 1건의 임상 시험에서 평가되었습니다. 유전자형 1 또는 4형에서 효능 평가에 기여한 6건의 시험(n=1373)에 대한 개요는 표 13에 나와 있습니다. C-EDGE TN, C-EDGE COINFECTION, C-SCAPE 및 C-EDGE TE에는 유전자형 6형 HCV 감염 환자(n=28)도 포함되었습니다. ZEPATIER는 유전자형 6형 감염에 대해 승인되지 않았으므로 유전자형 6형 감염 환자에 대한 결과는 임상 연구(14)에 포함되지 않았습니다.
| 시험 | 대상 환자군 | 연구군 및 기간 (치료받은 환자 수) |
|---|---|---|
| GT = 유전자형 | ||
| TN = 치료받은 적 없음 | ||
| TE = 치료 경험 있음(이전에 인터페론[IFN] 또는 페그인터페론 알파[PegIFN](리바비린[RBV] 병용 또는 비병용)으로 치료 실패했거나 이전 치료에 대해 내약성이 없는 경우). | ||
| C-EDGE TN (이중맹검) |
GT 1, 4 간경변증 동반 또는 비동반 TN |
|
| C-EDGE COINFECTION (공개 라벨) |
GT 1, 4 간경변증 동반 또는 비동반 TN HCV/HIV-1 동시 감염 |
|
| C-SURFER (이중맹검) |
GT 1 간경변증 동반 또는 비동반 TN 또는 TE 혈액투석을 포함한 중증 신장애 |
|
| C-SCAPE (공개 라벨) |
GT 4 간경변증 비동반 TN |
|
| C-EDGE TE (공개 라벨) |
GT 1, 4 간경변증 동반 또는 비동반 TE HCV/HIV-1 동시 감염 동반 또는 비동반 |
|
| C-SALVAGE (공개 라벨) |
GT 1 HCV 프로테아제 억제제 요법†을 받은 적이 있는 간경변증 동반 또는 비동반 TE |
|
| MK-5172-079 (공개 라벨) |
GT 1, 4 TN 또는 TE 소아 환자 |
|
본 임상 시험에서 ZEPATIER는 1일 1회 경구 투여되었습니다. 리바비린(RBV)을 투여받은 대상자의 경우 RBV 용량은 체중 기반으로 투여되었습니다(66kg 미만 = 1일 800mg, 66~80kg = 1일 1000mg, 81~105kg = 1일 1200mg, 105kg 초과 = 1일 1400mg). RBV는 음식과 함께 하루 2회 경구 투여되었습니다.
모든 임상 시험에서 지속적인 바이러스학적 반응(SVR)이 주요 평가 변수였으며, 치료 종료 후 12주 시점의 HCV RNA가 정량화 하한(LLOQ) 미만으로 정의되었습니다(SVR12). 본 임상 시험에서 혈청 HCV RNA 값은 COBAS AmpliPrep/COBAS Taqman HCV 검사(버전 2.0)를 사용하여 측정되었으며, LLOQ는 15 HCV RNA IU/mL였습니다. 단, C-SCAPE의 경우 검사의 LLOQ는 25 HCV RNA IU/mL였습니다.
14.2 1형 HCV 감염 치료 경험이 없는 대상자를 대상으로 한 임상 시험(C-EDGE TN 및 C-EDGE COINFECTION)
C-EDGE TN 및 C-EDGE COINFECTION 임상 시험에서 간경변 유무와 관계없이 1형 만성 C형 간염 바이러스 감염 치료 경험이 없는 대상자에 대한 ZEPATIER의 효능이 입증되었습니다.
C-EDGE TN은 간경변 유무와 관계없이 1형 또는 4형 감염 치료 경험이 없는 대상자를 대상으로 한 무작위 배정, 이중 맹검, 위약 대조 임상 시험이었습니다. 대상자는 3:1 비율로 무작위 배정되었습니다. ZEPATIER 12주 투여(즉각 치료군) 또는 위약 12주 투여 후 ZEPATIER로 12주간 공개적으로 치료(지연 치료군). 1형 감염으로 즉각 치료군에 무작위 배정된 대상자 중 중간 연령은 55세(범위: 20~78세)였습니다. 대상자의 56%가 남성이었고, 61%가 백인, 20%가 흑인 또는 아프리카계 미국인, 8%가 히스패닉 또는 라틴계였습니다. 평균 체질량 지수는 26kg/m2였습니다. 기준선 HCV RNA 수치가 800,000 IU/mL를 초과한 대상자는 72%였습니다. 간경변이 있는 대상자는 24%였습니다. 비-C/C IL28B 대립 유전자(CT 또는 TT)를 가진 대상자는 67%였습니다. 1a형 만성 HCV 감염은 55%, 1b형 만성 HCV 감염은 45%였습니다.
C-EDGE COINFECTION은 간경변 유무와 관계없이 1형 또는 4형 감염 치료 경험이 없는 HCV/HIV-1 동시 감염 대상자를 대상으로 한 공개, 단일군 임상 시험이었습니다. 대상자는 ZEPATIER를 12주간 투여받았습니다. 1형 감염 대상자 중 중간 연령은 50세(범위: 21~71세)였습니다. 대상자의 85%가 남성이었고, 75%가 백인, 19%가 흑인 또는 아프리카계 미국인, 6%가 히스패닉 또는 라틴계였습니다. 평균 체질량 지수는 25kg/m2였습니다. 기준선 HCV RNA 수치가 800,000 IU/mL를 초과한 대상자는 59%였습니다. 간경변이 있는 대상자는 16%였습니다. 비-C/C IL28B 대립 유전자(CT 또는 TT)를 가진 대상자는 65%였습니다. 1a형 만성 HCV 감염은 76%, 1b형 만성 HCV 감염은 23%, 1형 기타 만성 HCV 감염은 1%였습니다.
표 14는 C-EDGE TN(즉각 치료군) 및 C-EDGE COINFECTION에서 ZEPATIER를 12주간 투여받은 1형 감염 치료 경험이 없는 대상자에 대한 치료 결과를 보여줍니다. ZEPATIER를 4형 감염에 대한 치료 결과는 [임상 시험(14.5) 참조].
| 임상 시험 | C-EDGE TN (즉각 치료군) |
C-EDGE COINFECTION (HCV/HIV-1 동시 감염) |
|---|---|---|
| 요법 | ZEPATIER 12주 N=288 |
ZEPATIER 12주 N=189 |
| 1형에서의 SVR | 95% (273/288) | 95% (179/189) |
| SVR이 없는 대상자의 결과 | ||
| 치료 중 바이러스학적 실패* | <1% (1/288) | 0% (0/189) |
| 재발 | 3% (10/288) | 3% (6/189) |
| 기타† | 1% (4/288) | 2% (4/189) |
| 아형별 SVR | ||
| GT 1a‡ | 92% (144/157) | 94% (136/144) |
| GT 1b§ | 98% (129/131) | 96% (43/45) |
| 간경변 상태별 SVR | ||
| 간경변 없음 | 94% (207/220) | 94% (148/158) |
| 간경변 있음 | 97% (66/68) | 100% (31/31) |
14.3 1형 HCV 감염 치료 경험자 대상 임상 시험
PegIFN과 RBV 치료 실패 경험자 (C-EDGE TE)
C-EDGE TE는 1형 또는 4형 감염, 간경변 유무, HCV/HIV-1 동시 감염 유무와 관계없이 PegIFN + RBV 치료에 실패한 환자를 대상으로 한 무작위 배정, 공개 표지 비교 시험이었습니다. 환자는 ZEPATIER 12주, ZEPATIER + RBV 12주, ZEPATIER 16주 또는 ZEPATIER + RBV 16주 중 하나의 치료 그룹에 1:1:1:1 비율로 무작위 배정되었습니다. 1형 감염 환자의 경우 중간 연령은 57세(범위: 19~77세)였으며, 환자의 64%가 남성이었고, 67%가 백인이었고, 18%가 흑인 또는 아프리카계 미국인이었고, 9%가 히스패닉 또는 라틴계였으며, 평균 체질량 지수는 28 kg/m2였으며, 78%가 기준선 HCV RNA 수치가 800,000 IU/mL 이상이었고, 34%가 간경변이 있었고, 79%가 비-C/C IL28B 대립 유전자(CT 또는 TT)를 가지고 있었고, 60%가 1a형, 39%가 1b형, 1%가 1-기타 만성 HCV 감염이었습니다.
ZEPATIER 12주 또는 ZEPATIER + RBV 16주로 치료받은 1형 환자의 치료 결과는 표 15에 제시되어 있습니다. ZEPATIER + RBV 12주 또는 RBV 없이 16주 치료 결과는 PegIFN/RBV 경험자 1형 환자에게 이러한 요법이 권장되지 않기 때문에 표시되지 않습니다. ZEPATIER의 4형 감염 치료 결과는 [임상 시험 (14.5) 참조].
| 요법 | ZEPATIER 12주 N=96 |
ZEPATIER + RBV 16주 N=96 |
|---|---|---|
| 1형에서 SVR | 94% (90/96) | 97% (93/96) |
| SVR이 없는 환자의 결과 | ||
| 치료 중 바이러스 실패* | 0% (0/96) | 0% (0/96) |
| 재발 | 5% (5/96) | 0% (0/96) |
| 기타† | 1% (1/96) | 3% (3/96) |
| 1형 아형별 SVR | ||
| GT 1a‡ | 90% (55/61) | 95% (55/58) |
| GT 1b§ | 100% (35/35) | 100% (38/38) |
| 간경변 상태별 SVR | ||
| 비간경변 | 94% (61/65) | 95% (61/64) |
| 간경변 | 94% (29/31) | 100% (32/32) |
| 이전 HCV 치료에 대한 반응별 SVR | ||
| 치료 중 바이러스 실패¶ | 90% (57/63) | 95% (58/61) |
| 재발자 | 100% (33/33) | 100% (35/35) |
이전 PegIFN + RBV + HCV 프로테아제 억제제 치료 실패 경험이 있는 대상자 (C-SALVAGE)
C-SALVAGE는 보세프레비어, 시메프레비어 또는 텔라프레비어와 PegIFN + RBV 병용 요법으로 이전 치료에 실패한, 간경변 유무와 관계없이 1형 감염 대상자를 대상으로 한 개방형 단일군 시험이었습니다. 대상자는 EBR 50mg 1일 1회 + GZR 100mg 1일 1회 + RBV를 12주 동안 투여받았습니다. 대상자의 중간 연령은 55세(범위: 23~75세)였으며, 남성이 58%, 백인이 97%, 흑인 또는 아프리카계 미국인이 3%, 히스패닉 또는 라틴 아메리카인이 15%, 평균 체질량 지수는 28kg/m2, 기준선 HCV RNA 수치가 800,000 IU/mL를 초과한 비율이 63%, 간경변이 있는 비율이 43%, 비-C/C IL28B 대립 유전자(CT 또는 TT)가 있는 비율이 97%, 기준선 NS3 내성 관련 치환이 있는 비율이 46%였습니다.
EBR + GZR + RBV를 12주 동안 투여받은 대상자의 전체 SVR은 96%(76/79)였습니다. 4%(3/79)의 대상자는 재발로 인해 SVR을 달성하지 못했습니다. 치료 결과는 1a형과 1b형 대상자, 이전 HCV 치료에 대한 반응이 다른 대상자, 간경변 유무와 관계없이 일관되었습니다. 치료 결과는 기준선에서 NS3 내성 관련 치환 유무와 관계없이 일반적으로 일관되었지만, 특정 NS3 내성 관련 치환이 있는 대상자에 대한 데이터는 제한적입니다 [미생물학(12.4) 참조].
14.4 1형 HCV 및 중증 신장애(혈액 투석 중인 대상자 포함)가 있는 대상자를 대상으로 한 임상 시험(C-SURFER)
C-SURFER는 간경변 유무와 관계없이 1형 감염, 만성 신장 질환(CKD) 4기(eGFR 15-29 mL/min/1.73 m2) 또는 CKD 5기(eGFR <15 mL/min/1.73 m2)(혈액 투석 중인 대상자 포함), 치료 경험이 없는 또는 이전 IFN 또는 PegIFN ± RBV 치료에 실패한 대상자를 대상으로 한 무작위 배정, 이중 맹검, 위약 대조 시험이었습니다. 대상자는 다음 치료 그룹 중 하나에 1:1 비율로 무작위 배정되었습니다. EBR 50mg 1일 1회 + GZR 100mg 1일 1회를 12주 동안 투여(즉각 치료 그룹) 또는 위약을 12주 동안 투여한 후 EBR + GZR로 12주 동안 개방형 치료(지연 치료 그룹). 또한 11명의 대상자가 EBR + GZR를 12주 동안 개방형으로 투여받았습니다(집중 약동학[PK] 그룹). 즉각 치료 그룹과 집중 PK 그룹에 무작위 배정된 대상자의 중간 연령은 58세(범위: 31~76세)였으며, 남성이 75%, 백인이 50%, 흑인 또는 아프리카계 미국인이 45%, 히스패닉 또는 라틴 아메리카인이 11%, 기준선 HCV RNA 수치가 800,000 IU/mL를 초과한 비율이 57%, 간경변이 있는 비율이 6%, 비-C/C IL28B 대립 유전자(CT 또는 TT)가 있는 비율이 72%였습니다.
ZEPATIER를 12주 동안 투여받은 대상자의 치료 결과는 즉각 치료 그룹과 집중 PK 그룹을 합친 그룹에 대해 표 16에 제시되어 있습니다.
| 요법 | EBR + GZR 12주 (즉각 치료 그룹) N=122* |
|---|---|
| 전체 SVR | 94% (115/122)† |
| SVR 없는 대상자의 결과 | |
| 치료 중 바이러스학적 실패 | 0% (0/122) |
| 재발 | <1% (1/122) |
| 기타‡ | 5% (6/122) |
| 유전형별 SVR | |
| GT 1a | 97% (61/63) |
| GT 1b§ | 92% (54/59) |
| 간경변 상태별 SVR | |
| 없음 | 95% (109/115) |
| 있음 | 86% (6/7) |
| 이전 HCV 치료 상태별 SVR | |
| 치료 경험 없음 | 95% (96/101) |
| 치료 경험 있음 | 90% (19/21) |
| 투석 상태별 SVR | |
| 환자 정보 ZEPATIER® (제파티어) (엘바스비르 및 그라조프레비르) 정제 |
ZEPATIER에 대해 알아야 할 사항
|
ZEPATIER는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
B형 간염 바이러스 재활성화: ZEPATIER로 치료를 시작하기 전에 의료 서비스 제공자는 혈액 검사를 통해 B형 간염 바이러스 감염 여부를 확인합니다. 과거에 B형 간염 바이러스에 감염된 적이 있는 경우 ZEPATIER로 C형 간염 바이러스 감염을 치료하는 동안 또는 치료 후에 B형 간염 바이러스가 다시 활성화될 수 있습니다. B형 간염 바이러스가 다시 활성화되면(재활성화라고 함) 간부전 및 사망을 포함한 심각한 간 문제가 발생할 수 있습니다. 의료 서비스 제공자는 치료 중 및 ZEPATIER 복용을 중단한 후 B형 간염 바이러스 재활성화 위험이 있는지 여부를 모니터링합니다.
부작용에 대한 자세한 내용은 “ZEPATIER의 가능한 부작용은 무엇입니까?” 섹션을 참조하십시오.
| ZEPATIER®는 무엇입니까? |
ZEPATIER는 리바비린과 함께 또는 단독으로 사용하여 성인 및 12세 이상이거나 체중이 최소 66파운드(30kg)인 소아의 만성(장기간 지속) C형 간염 바이러스(HCV) 유전자형 1 또는 4 감염을 치료하는 처방약입니다.
ZEPATIER는 체중이 66파운드(30kg) 미만인 12세 미만의 소아에게 사용해서는 안 됩니다.
ZEPATIER가 간 이식을 기다리는 사람이나 간 이식을 받은 사람에게 안전하고 효과적인지는 알려져 있지 않습니다.
특정 간 문제가 있는 경우 ZEPATIER를 복용하지 마십시오.
| ZEPATIER를 복용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? |
ZEPATIER를 복용하기 전에 다음을 포함하여 귀하의 모든 건강 상태에 대해 의료 서비스 제공자에게 알리십시오.
- B형 간염 바이러스에 감염된 적이 있는 경우
- C형 간염 이외의 간 문제가 있는 경우
- C형 간염 치료제를 복용한 적이 있는 경우
- HIV 감염자인 경우
- 간 이식을 받았거나 기다리고 있는 경우
- 임신 중이거나 임신을 계획 중인 경우. ZEPATIER는 임산부를 대상으로 연구된 적이 없습니다. 임신 중에 ZEPATIER가 태아에게 해를 끼칠지는 알 수 없습니다.
- ZEPATIER 및 리바비린을 복용하는 남성과 여성은 임신, 피임 및 불임에 대한 중요한 정보를 얻으려면 리바비린 의약품 설명서도 읽어야 합니다.
- 모유 수유 중이거나 모유 수유를 계획 중인 경우. ZEPATIER가 모유로 이행되어 아기에게 전달되는지는 알 수 없습니다.
- ZEPATIER로 치료하는 동안 아기에게 가장 좋은 수유 방법에 대해 의료 서비스 제공자와 상담하십시오.
| 다른 약을 복용하고 있습니까? |
처방약과 일반 의약품, 비타민, 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 서비스 제공자에게 알리십시오. ZEPATIER는 다른 약물의 작용 방식에 영향을 미칠 수 있으며 다른 약물은 ZEPATIER의 작용 방식에 영향을 미칠 수 있습니다. 일부 약물은 ZEPATIER와 함께 복용할 수 없습니다. 의료 서비스 제공자는 다른 약물과 함께 ZEPATIER를 복용해도 안전한지 여부를 알려줄 수 있습니다.
- 복용하는 약을 알고 있어야 합니다. 복용하는 약 목록을 보관하고 새 약을 처방받을 때 의료 서비스 제공자와 약사에게 보여주십시오.
- 의료 서비스 제공자 또는 약사에게 이 약과 상호 작용하는 약물 목록을 요청할 수 있습니다.
- 의료 서비스 제공자에게 알리지 않고 새로운 약을 복용하기 시작하지 마십시오.
| ZEPATIER는 어떻게 복용합니까? |
- 매일 같은 시간에 ZEPATIER 정제 1정을 복용하십시오.
- ZEPATIER는 개별 포장된 정제가 들어 있는 블리스터 포장으로 제공됩니다. 복용할 준비가 될 때까지 정제를 이 포장에 보관하십시오.
- 의료 서비스 제공자의 지시에 따라 ZEPATIER를 정확히 복용하십시오.
- ZEPATIER는 음식과 함께 또는 음식 없이 복용할 수 있습니다.
- 의료 서비스 제공자와 상담하지 않고 ZEPATIER 복용을 중단하지 마십시오.
- 처방된 용량보다 더 많은 양을 복용한 경우 즉시 의료 서비스 제공자에게 연락하십시오.
| ZEPATIER 복용을 잊었을 경우 어떻게 해야 합니까? |
- 놓친 복용량을 보충하기 위해 ZEPATIER를 한 번에 두 번 복용하지 마십시오.
- 어떻게 해야 할지 확실하지 않으면 의료 서비스 제공자 또는 약사에게 연락하십시오. 치료 중에 ZEPATIER 복용량을 놓치거나 건너뛰지 않는 것이 중요합니다.
ZEPATIER는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.
B형 간염 바이러스 재활성화. “ZEPATIER에 대해 알아야 할 가장 중요한 정보는 무엇입니까?“를 참조하십시오.
간 문제의 징후. ZEPATIER는 간 관련 혈액 검사 결과를 증가시킬 수 있습니다. 이는 심각한 간 문제의 징후일 수 있습니다. 의료 서비스 제공자는 ZEPATIER 치료 전후로 혈액 검사를 실시하여 간 기능을 확인합니다. ZEPATIER 치료 중에 다음 증상이 나타나거나 악화되면 즉시 의료 서비스 제공자에게 알리십시오.
|
|
리바비린 없이 사용할 때 ZEPATIER의 흔한 부작용은 다음과 같습니다.
|
|
리바비린과 함께 사용할 때 ZEPATIER의 흔한 부작용은 다음과 같습니다.
|
|
불편하거나 사라지지 않는 부작용이 발생하면 의료 서비스 제공자에게 알리십시오.
ZEPATIER의 다른 부작용이 있을 수 있습니다.
부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. 자세한 정보 또는 의학적 조언은 의사에게 문의하십시오.
| ZEPATIER는 어디에 보관해야 합니까? |
- 복용할 준비가 될 때까지 ZEPATIER를 원래 포장(블리스터 포장)에 보관하십시오. 정제를 원래 블리스터 포장에서 꺼내 알약통과 같은 다른 용기에 보관하지 마십시오. 정제는 습기에 민감하기 때문에 이는 중요합니다. 포장은 정제를 보호하도록 설계되었습니다.
- ZEPATIER를 실온에 보관하십시오.
- ZEPATIER 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
| ZEPATIER에 대한 일반 정보 |
- 의약품은 때때로 환자 정보에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 ZEPATIER를 사용하지 마십시오. 같은 질환이 있어도 다른 사람에게 ZEPATIER를 주지 마십시오. 해를 입힐 수 있습니다.
- 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. 의료 전문가를 위해 작성된 ZEPATIER에 대한 정보를 요청할 수 있습니다.
- 자세한 내용은 ZEPATIER를 제조하는 회사에 1-877-888-4231로 전화하거나 www.ZEPATIER.com을 방문하십시오.
| ZEPATIER의 성분은 무엇입니까? |
활성 성분은 다음과 같습니다. 엘바스비어 및 그라조프레비어.
비활성 성분은 다음과 같습니다. 무수규산, 코포비돈, 크로스카멜로스나트륨, 히프로멜로스, 유당일수화물, 마그네슘스테아레이트, 만니톨, 미결정셀룰로스, 염화나트륨, 라우릴황산나트륨, 비타민 E 폴리에틸렌글리콜 숙시네이트.
정제는 다음과 같은 비활성 성분이 포함된 코팅 재료로 필름 코팅되어 있습니다. 카르나우바 왁스, 페로소페릭 산화물, 히프로멜로스, 적색 산화철, 황색 산화철, 유당일수화물, 이산화티타늄, 트리아세틴.
이 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다.
SPL 미분류 섹션
제조사: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
특허 정보: www.msd.com/research/patent
본 문서에 표시된 상표는 각 회사의 소유입니다.
Copyright © 2016-2022 Merck & Co., Inc., Rahway, NJ, USA 및 계열사.
모든 권리 보유.
개정: 05/2022
usppi-mk5172a-t-2205r005
주요 표시 패널 – 50mg/100mg 정제 복용량 포장 상자
NDC 0006-3074-02
Zepatier®
(elbasvir and grazoprevir) tablets
50 mg/100 mg
Rx only
28 Tablets
이 상자는 총 28개의 정제를 포함하고 있습니다.
2개의 복용량 포장 내에 포장되어 있습니다.
각 복용량 포장은 1개의 정제가 들어 있는 14개의 블리스터 유닛을 포함하고 있습니다.


