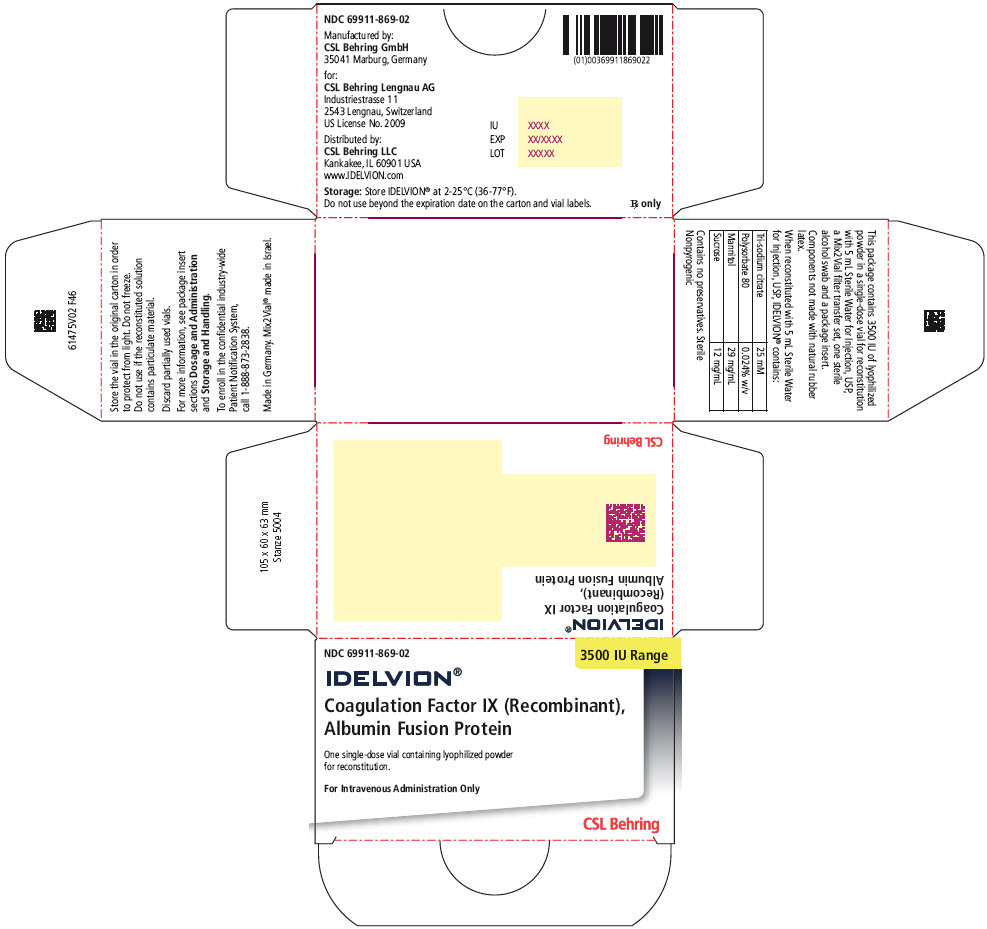
의약품 제조업체: CSL Behring Lengnau AG (Updated: 2023-06-30)
처방 정보 하이라이트
IDELVION [응고 인자 IX(재조합), 알부민 융합 단백질]
정맥 주사용 용액을 위한 동결 건조 분말
미국 최초 승인: 2016
적응증 및 용법
IDELVION, 응고 인자 IX(재조합), 알부민 융합 단백질(rIX-FP)은 재조합 DNA 유래 응고 인자 IX 농축액으로, 소아 및 성인 혈우병 B(선천성 인자 IX 결핍증) 환자에게 다음과 같은 경우에 사용됩니다.
- 출혈 에피소드의 주문형 치료 및 관리
- 수술 전후 출혈 관리
- 출혈 에피소드의 빈도를 줄이기 위한 일상적인 예방
사용 제한:
IDELVION은 혈우병 B 환자의 면역 관용 유도에는 적응되지 않습니다. (1)
용량 및 투여
재구성 후 정맥 주사용으로만 사용하십시오.
- IDELVION의 각 단회 투여 바이알에는 실제 인자 IX 역가가 국제 단위(IU)로 표시되어 있습니다. (2.1)
- 체중 1kg당 IDELVION 1IU는 순환하는 인자 IX의 활성도를 다음과 같이 증가시킬 것으로 예상됩니다.
- 정맥 주사하십시오. 주입 속도는 분당 10mL를 초과하지 마십시오. (2.3)
출혈 에피소드의 주문형 치료 및 관리 및 수술 전후 관리:
- IDELVION의 치료 용량 및 기간은 인자 IX 결핍의 중증도, 출혈 부위 및 정도, 환자의 임상 상태, 연령 및 인자 IX 회복에 따라 다릅니다. (2.1)
- 다음 공식을 사용하여 초기 용량을 결정합니다.
필요한 용량(IU) = 체중(kg) × 원하는 인자 IX 상승(정상 비율 또는 IU/dL) × (회복률의 역수(IU/dL당 IU/kg)) (2.1) - 환자의 임상 상태 및 반응에 따라 용량을 조정합니다. (2.1)
일상적인 예방:
투여 형태 및 함량
IDELVION은 명목상 250, 500, 1000, 2000 또는 3500IU를 함유한 단회 투여 바이알에 동결 건조 분말 형태로 제공됩니다. (3)
금기
햄스터 단백질을 포함하여 IDELVION 또는 그 성분에 대해 생명을 위협하는 과민 반응을 경험한 적이 있는 환자에게는 사용하지 마십시오. (4)
경고 및 주의사항
- 과민증이 보고되었습니다. 아나필락시스를 포함한 과민 반응의 증상이 나타나면 IDELVION 투여를 중단하고 적절한 치료를 하십시오. (5.1)
- IDELVION을 사용하면서 인자 IX에 대한 중화 항체(억제제) 형성이 보고되었습니다. 환자 혈장에서 예상되는 인자 IX 혈장 회복률에 도달하지 못하거나 적절한 용량으로 출혈이 조절되지 않으면 인자 IX 억제제 농도를 측정하는 분석을 수행하십시오. (5.2, 5.5)
- 인자 IX 함유 제품을 사용할 때 혈전 색전증(예: 폐색전증, 정맥 혈전증, 동맥 혈전증)이 발생할 수 있습니다. (5.3)
- 인자 IX 억제제가 있고 인자 IX에 대한 알레르기 반응의 병력이 있는 혈우병 B 환자에서 인자 IX 함유 제품을 사용한 면역 관용 유도 후 신증후군이 보고되었습니다. (5.4)
- 인자 IX 활성도 분석 결과는 사용된 활성 부분 트롬보플라스틴 시간 시약의 유형에 따라 다를 수 있습니다. (5.5)
이상 반응
임상 시험에서 보고된 가장 흔한 이상 반응(발생률 ≥1%)은 두통, 어지러움, 과민증 및 발진이었습니다. (6)
의심되는 이상 반응을 보고하려면 1-866-915-6958번으로 CSL Behring Pharmacovigilance Department에 문의하거나 1-800-FDA-1088번 또는 www.fda.gov/medwatch.으로 FDA에 문의하십시오.
환자 상담 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정: 2023년 6월
목차
전문 정보: 내용*
1 적응증 및 사용법
2 용법 및 용량
2.1 용량
2.2 제조 및 재구성
2.3 투여
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 중화 항체
5.3 혈전색전증 합병증
5.4 신증후군
5.5 실험실 검사 모니터링
6 이상 반응
6.1 임상 시험 경험
6.2 면역원성
6.3 시판 후 경험
8 특정 인구 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 손상
14 임상 연구
15 참고 문헌
16 공급/보관 및 취급 방법
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
IDELVION®, 재조합 인간 혈액응고 9인자, 알부민 융합 단백질 (rIX-FP)은 재조합 DNA 유래 혈액응고 9인자 농축액으로, 소아 및 성인의 혈우병 B (선천성 9인자 결핍증) 환자에게 다음과 같은 경우에 사용됩니다.
- 출혈 에피소드 발생 시 치료 및 조절
- 수술 전후 출혈 관리
- 출혈 에피소드 빈도 감소를 위한 일상적 예방
2 투여 및 관리
재구성 후 정맥 주사로만 사용하십시오.
2.1 투여량
- IDELVION 단회용 바이알은 카톤 및 바이알 라벨에 명시된 국제 단위(IU)의 재조합 Factor IX 역가를 함유하고 있습니다.
- IDELVION으로 치료하는 투여량 및 기간은 Factor IX 결핍의 중증도, 출혈의 위치 및 범위, 환자의 임상 상태, 연령 및 Factor IX 회복에 따라 다릅니다.
- IDELVION의 필요 투여량 계산은 12세 이상 환자의 경우 체중 1kg당 IDELVION 1IU가 순환 Factor IX 수치를 1.3 IU/dL 증가시키고, 12세 미만 환자의 경우 1 IU/dL 증가시킨다는 경험적 결과를 기반으로 합니다. 출혈 에피소드 치료에 필요한 IDELVION 투여량은 다음 공식을 사용하여 결정합니다.
필요 단위(IU) = 체중(kg) × 목표 Factor IX 상승(% 정상 또는 IU/dL) × (회복의 역수(IU/kg당 IU/dL)) 또는 Factor IX IU/dL(또는 % 정상) 증가 = 투여량(IU) × 회복(IU/dL당 IU/kg)/체중(kg) - 개별 환자의 임상 상태 및 반응에 따라 투여량을 조절하십시오.
요청 시 치료 및 출혈 에피소드 조절
요청 시 치료 및 출혈 에피소드 조절을 위한 IDELVION 투여량에 대한 지침은 표 1에 나와 있습니다. 투여량은 표 1에 명시된 혈장 수치(% 정상 또는 IU/dL) 이상으로 혈장 Factor IX 활성 수치를 유지하는 것을 목표로 해야 합니다.
| 출혈 에피소드 유형 | 필요한 순환 Factor IX 활성 [% 또는 (IU/dL)] |
투여 빈도(시간) | 치료 기간(일)* |
|---|---|---|---|
|
|||
| 경미하거나 중등도 합병증 없는 혈관절 출혈, 근육 출혈(장골근 제외) 또는 구강 출혈 |
30-60 | 48-72 | 출혈이 멎고 치유될 때까지 최소 1일. 대부분의 출혈에는 단일 투여로 충분합니다. |
| 중증 생명 또는 사지 위협적인 출혈, 장골근을 포함한 심부 근육 출혈, 두개내, 인두 뒤 |
60-100 | 48-72 | 출혈이 멎고 치유될 때까지 7-14일. 주 1회 유지 용량. |
수술 전 출혈 관리
수술 전 출혈 관리를 위한 IDELVION 투여량에 대한 지침은 표 2에 나와 있습니다.
| 수술 유형 | 필요한 순환 Factor IX 활성 [% 또는 (IU/dL)] |
투여 빈도(시간) | 치료 기간(일)* |
|---|---|---|---|
|
|||
| 경미한 (합병증 없는 치아 발치 포함) |
50-80 | 48-72 | 최소 1일 또는 치유될 때까지. 대부분의 경미한 수술에는 단일 투여로 충분합니다. |
| 중증 (두개내, 인두, 인두 뒤, 복막 뒤 포함) |
60-100 (초기 수치) |
48-72 | 출혈이 멎고 치유될 때까지 7-14일. 첫 주 동안 또는 치유될 때까지 48-72시간마다 투여를 반복합니다. 주 1-2회 유지 용량. |
일상적인 예방
12세 이상 환자의 경우, 권장 용량은 체중 kg당 25-40 IU IDELVION을 매 7일마다 투여하는 것입니다. 7일 요법으로 잘 조절되는 환자는 체중 kg당 50-75 IU IDELVION을 매 14일마다 투여하는 요법으로 전환할 수 있습니다 [임상 연구(14) 참조].
12세 미만 환자의 경우, 권장 용량은 체중 kg당 40-55 IU IDELVION을 매 7일마다 투여하는 것입니다.
- 성인의 경우, 요법은 개별적으로 조정하여 투여 빈도를 줄이거나 늘릴 수 있습니다.
2.2 준비 및 재구성
다음 절차는 IDELVION 준비 및 재구성에 대한 일반적인 지침입니다.
- 다음 절차를 수행하기 전에 항상 깨끗한 표면에서 작업하고 손을 씻으십시오.
- 재구성 절차 중에는 무균 기법을 사용하십시오.
- 키트에 제공된 희석액(주사용 멸균수)과 전달 장치(Mix2Vial)를 사용하여 IDELVION을 재구성하십시오.
- 투여하려면 주사기와 적합한 바늘(제공되지 않음)도 필요합니다.
- 혼합하기 전에 IDELVION 바이알과 주사용 멸균수 바이알을 실온에 두십시오.
- 재구성은 아래에 설명된 대로 수행됩니다.
IDELVION 재구성 지침
- IDELVION 바이알, 희석액 바이알 및 Mix2Vial® 전달 세트를 평평한 표면에 놓습니다.
- IDELVION 및 주사용 멸균수(희석액) 바이알에서 플립 캡을 제거합니다.
- 제공된 멸균 알코올 솜으로 마개를 닦고 Mix2Vial 전달 세트 포장을 열기 전에 말립니다.
- 뚜껑을 벗겨(그림 1) Mix2Vial 전달 세트 포장을 엽니다. 장치를 포장에서 제거하지 마십시오.
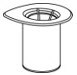
그림 1 - 희석액 바이알을 평평한 표면에 놓고 바이알을 단단히 잡습니다. Mix2Vial 전달 세트를 투명 포장과 함께 잡고 Mix2Vial 전달 세트의 파란색 끝에 있는 플라스틱 스파이크를 희석액 바이알 마개 중앙을 통해 단단히 밀어 넣습니다(그림 2).
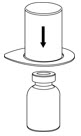
그림 2 - Mix2Vial 전달 세트에서 투명 포장을 조심스럽게 제거합니다. Mix2Vial 전달 세트를 제거하거나 장치의 노출된 끝을 만지지 마십시오(그림 3).
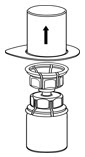
그림 3 - IDELVION 바이알을 평평한 표면에 단단히 놓고 Mix2Vial 전달 세트가 부착된 희석액 바이알을 뒤집어 투명 어댑터의 플라스틱 스파이크를 IDELVION 바이알 마개 중앙을 통해 단단히 밀어 넣습니다(그림 4). 희석액이 IDELVION 바이알로 자동으로 전달됩니다.
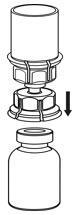
그림 4 - 희석액과 IDELVION 바이알이 Mix2Vial 전달 세트에 부착된 상태에서 IDELVION 바이알을 부드럽게 흔들어 분말이 완전히 용해되도록 합니다(그림 5). 바이알을 흔들지 마십시오.
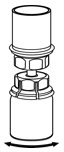
그림 5 - 한 손으로 Mix2Vial 전달 세트의 IDELVION 쪽을 잡고 다른 손으로 Mix2Vial 전달 세트의 파란색 희석액 쪽을 잡고 세트를 두 부분으로 분리합니다(그림 6).
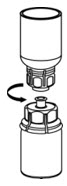
그림 6 - 빈 멸균 주사기에 공기를 채웁니다. IDELVION 바이알을 세워 놓고 주사기를 Mix2Vial 전달 세트에 연결합니다. IDELVION 바이알에 공기를 주입합니다.
- 주사기 플런저를 누른 상태를 유지하고 시스템을 뒤집어 플런저를 천천히 뒤로 당겨 주사기에 농축액을 채웁니다(그림 7).
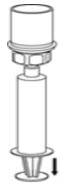
그림 7 - 채워진 주사기를 Mix2Vial 전달 세트에서 분리합니다(그림 8). 재구성된 용액은 투명하거나 노란색에서 무색의 용액이어야 합니다. 입자가 보이거나 변색된 경우 사용하지 마십시오.
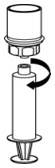
그림 8 - 재구성 후 즉시 또는 4시간 이내에 사용하세요. 재구성된 용액은 실온에 보관하세요. 냉장하지 마세요.
- 투여량에 한 병 이상이 필요한 경우 각 제품 병에 대해 별도의 미사용한 Mix2Vial 전달 세트 및 멸균 주사용수(희석제) 병을 사용하세요. 10-12단계를 반복하여 각 병의 내용물을 한 주사기에 담습니다.
2.3 투여
정맥주사용만 가능합니다.
- IDELVION을 다른 의약품과 같은 튜빙이나 용기에 섞거나 투여하지 마세요.
- 투여 전 및 용액과 용기가 허용하는 경우 최종 용액을 입자물질 및 변색 유무에 대해 육안으로 검사하세요. 입자물질 또는 변색이 발견되면 사용하지 마세요.
- 재구성된 IDELVION 용액이 든 주사기를 멸균 주입세트에 연결하고 정맥주사를 통해 투여하세요. 각 환자의 편안함 정도에 맞게 주입 속도를 조정하되 1분당 10mL를 초과하지 마세요.
- IDELVION을 실온에서 재구성 후 4시간 이내에 투여하고 사용하지 않은 제품은 폐기하세요.
3 제형 및 함량
IDELVION은 연노랑색에서 흰색의 동결건조 분말로 단회 투여용 바이알에 250, 500, 1000, 2000 또는 3500 IU의 IX 인자의 명목상 효능이 함유되어 있습니다. 각 바이알과 상자에는 실제 IX 인자의 효능이 표시되어 있습니다.
4 금기 사항
IDELVION은 IDELVION 또는 그 구성 요소(햄스터 단백질 포함)에 대한 생명을 위협하는 과민 반응을 보인 환자에게 금기입니다 [경고 및 주의 사항 (5.1) 참조].
5 경고 및 주의 사항
5.1 과민 반응
과민 반응이 발생했습니다. 아나필락시스로 진행될 수 있는 과민 반응의 초기 징후에는 안지오에데마, 흉부 압박감, 저혈압, 전신 두드러기, 천명음 및 호흡 곤란이 포함됩니다. 과민 반응 또는 아나필락시스 증상이 나타나면 즉시 투여를 중단하고 적절한 치료를 시작하십시오.
IDELVION은 미량의 중국 햄스터 난소(CHO) 단백질을 함유하고 있습니다. 이 제품으로 치료받은 환자는 이러한 비인간 포유류 단백질에 대한 과민 반응을 일으킬 수 있습니다.
5.2 중화 항체
IDELVION으로 치료받은 환자에서 IX 인자에 대한 중화 항체(억제제) 형성이 보고되었습니다. [부작용(6.3) 참조]. 적절한 임상 관찰 또는 실험실 검사를 통해 IDELVION으로 치료받은 모든 환자에서 중화 항체(억제제) 발생 여부를 모니터링하십시오. 예상 혈장 IX 인자 활성 수준에 도달하지 않거나 적절한 용량으로 출혈이 조절되지 않으면 IX 인자 억제제 농도를 측정하는 검사를 수행하십시오.
IX 인자 억제제가 있는 환자는 IX 인자에 재 노출될 경우 심각한 과민 반응 또는 아나필락시스 위험이 증가합니다. 알레르기 반응을 경험하는 환자에서 억제제 유무를 평가하고, 특히 제품에 대한 노출 초기 단계에서 억제제가 있는 환자는 급성 과민 반응의 징후와 증상을 면밀히 모니터링하십시오. [경고 및 주의 사항(5.1) 참조].
5.3 혈전색전증 합병증
IX 인자 함유 제품을 사용할 때 혈전색전증(예: 폐색전증, 정맥 혈전증 및 동맥 혈전증)이 발생할 수 있습니다. IX 인자 제품 사용과 관련된 혈전색전증의 잠재적 위험으로 인해 간 질환, 섬유소 용해, 수술 전후 상태 또는 혈전색전증 또는 파종성 혈관 내 응고증 위험 요소가 있는 환자에게 IDELVION을 투여할 때 혈전색전증 및 소모성 응고병증의 초기 징후를 모니터링하십시오.
5.4 신증후군
IX 인자 억제제가 있고 알레르기 반응 병력이 있는 혈우병 B 환자에서 면역 관용 유도를 시도한 후 신증후군이 보고되었습니다. IDELVION을 사용하여 면역 관용 유도를 시행하는 안전성과 유효성은 확립되지 않았습니다.
5.5 실험실 검사 모니터링
- 단일 단계 응고 검사를 통해 IX 인자 혈장 수준을 모니터링하여 적절한 IX 인자 수준이 달성되고 유지되었는지 확인하십시오. [투여량 및 투여 방법(2.1) 참조]. IX 인자 활성 검사 결과는 검사 시스템에 사용된 활성화 부분 트롬보플라스틴 시간(aPTT) 시약 유형에 따라 다를 수 있습니다.1 예를 들어, 카올린 기반 aPTT 시약과 루푸스 항응고제에 대한 반응성이 낮도록 설계된 다른 시약2은 표시된 역가를 기반으로 예상되는 회복률보다 약 50% 낮은 것으로 나타났습니다.
- 다른 재조합 IX 인자 제품에 대한 유사한 결과와 일치하게, IDELVION의 스파이크 샘플에서 IX 인자 활성의 과대 평가(평균 과대 평가 32%)가 일반적으로 사용되는 aPTT 시약을 사용하여 낮은 IX 인자 수준에서 발생했습니다.3
- 예상 IX 인자 활성 혈장 수준에 도달하지 않거나 권장 용량의 IDELVION으로 출혈이 조절되지 않으면 환자에서 억제제 발생 여부를 모니터링하십시오. IX 인자 억제제가 있는지 여부를 확인하는 데 사용되는 검사는 베데스다 단위(BUs)로 적정해야 합니다.
6 이상 반응
임상 시험에서 보고된 가장 흔한 이상 반응(발생률 ≥1%)은 두통, 현기증, 과민 반응 및 발진이었습니다.
6.1 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 이상 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 임상 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
IDELVION을 사용한 5건의 다기관, 전향적, 공개 표지 임상 시험에서, 이전에 치료받은 환자(PTPs; Factor IX 함유 제품에 노출된 기간이 ≥100 노출 일(EDs)) 114명이 출혈 에피소드의 필요에 따른 치료, 주요 및 경미한 수술, 치과 또는 기타 침습적 절차의 수술 전 관리, 일상적인 예방 또는 약동학 평가의 일환으로 IDELVION을 최소한 한 번 이상 주입받았습니다. 27명의 어린이는 12세 미만이었고, 9명의 청소년은 12세 이상 18세 미만이었으며, 78명의 성인은 18세 이상 65세 이하였습니다. 총 16,326회의 주입이 중앙값 1,543.5일(범위: 25일~2,565일) 동안 실시되었습니다.
피험자의 0.5% 이상에서 발생한 이상 반응은 표 3에 나와 있습니다.
| MedDRA 표준 기관계 분류 |
이상 반응 | 피험자 수 n (%), (N=114) |
|---|---|---|
| 신경계 장애 | 두통 | 2 (1.8) |
| 현기증 | 2 (1.8) | |
| 면역 체계 장애 | 과민 반응 | 1 (0.9) |
| 피부 및 피하 조직 장애 | 발진 | 1 (0.9) |
| 습진 | 1 (0.9) |
IDELVION의 안전성은 이전에 치료받지 않은 환자(PUPs) 12명을 대상으로 한 완료된 연구에서도 평가되었습니다. EDs의 중앙값은 피험자당 50회(범위: 22회~146회)였으며, 총 8명의 피험자가 최소한 50회의 EDs를 달성했으며, 그중 3명의 피험자가 ≥100회의 EDs를 달성했습니다.
IDELVION으로 치료받은 12명의 피험자 중 2명에서 이상 약물 반응이 보고되었습니다. PUP 연구에서 한 명의 피험자(8.3%)가 높은 역가의 Factor IX 억제제(최고 역가 188 BU/mL)를 개발했으며, 동일한 피험자(8.3%)가 과민 반응을 개발했습니다. PUP 연구에서 한 명의 추가 피험자(8.3%)가 발진을 개발했습니다.
6.2 면역원성
모든 피험자는 다음 시점에 rIX-FP(특히 rFIX, pdFIX 및 알부민)에 대한 억제 및 결합 항체와 CHO 숙주 세포 단백질에 대한 결합 항체를 모니터링했습니다. 스크리닝 시, IDELVION 첫 주입 후 2~4주, 12주, 그 이후 3개월마다(어린이의 경우 결합 항체는 6개월마다). IDELVION 주입 후 어떤 시점에서도 Factor IX에 대한 비중화 항체 또는 알부민 및 CHO 단백질에 대한 항체가 발생한 피험자는 없었습니다. 이전에 치료받지 않은 환자를 평가한 임상 연구에서 Factor IX에 대한 억제제 발생이 한 건 보고되었습니다. 이전에 치료받은 환자를 등록한 IDELVION 임상 시험에서 Factor IX에 대한 항체는 관찰되지 않았습니다.
항체 형성의 검출은 검사의 민감도와 특이성에 크게 의존합니다. 또한, 검사에서 관찰된 항체(중화 항체 포함) 양성 발생률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로, 위에서 설명한 연구에서 IDELVION에 대한 항체 발생률을 다른 연구 또는 다른 제품의 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
6.3 시판 후 경험
IDELVION의 시판 후 사용 중 다음 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 발생 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
혈액 및 림프계 장애: Factor IX 억제제 발생
8 특정 인구 집단에서의 사용
8.4 소아 사용
18세 미만의 이전에 치료받은 환자(PTPs) 34명을 포함한 임상 연구에서 IDELVION을 7일마다 예방적으로 투여한 결과 치료가 필요한 자발적 출혈 에피소드 예방에 성공했습니다 [임상 연구(14) 참조]. 이 중 7명의 피험자는 12세 이상 18세 미만이었으며, 이 중 5명의 피험자는 IDELVION을 10일 또는 14일마다 예방적으로 투여하는 것으로 전환했습니다. 18세 미만의 피험자에서 성인과 비교하여 안전성 프로필에 명백한 차이가 없었습니다 [부작용(6.1) 참조].
성인과 비교하여 증가된 rIX-FP 회복은 약간 낮은 것으로 나타났고 체중 조정된 청소율은 더 높은 것으로 나타났습니다. 어린이는 체중 조정된 Factor IX 청소율이 더 높고 반감기가 더 짧으며 회복률이 더 낮을 수 있습니다. 이러한 환자에게는 체중 kg당 더 높은 용량 또는 더 빈번한 투여가 필요할 수 있습니다 [투여량 및 투여(2.1) 및 임상 약리학(12.3) 참조].
11 설명
IDELVION, 응고 인자 IX (재조합), 알부민 융합 단백질 (rIX-FP)은 정맥 주사를 위한 무균 주사용수 (sWFI)로 재구성되는 무균, 비발열성 동결 건조 분말입니다. IDELVION은 시트르산나트륨, 폴리소르베이트 80, 만니톨 및 수크로스로 제형화된 약 250, 500, 1000, 2000 또는 3500 IU의 Factor IX를 함유한 단일 용량 바이알로 제공됩니다. 각 바이알에 표시된 IU의 실제 Factor IX 활성량. 동결 건조 분말을 재구성한 후 모든 용량 강도는 투명한 노란색에서 무색의 용액을 생성합니다. IDELVION은 방부제를 함유하지 않습니다.
IDELVION의 활성 성분인 재조합 인간 응고 인자 IX 알부민 융합 단백질은 재조합 DNA 기술로 생산된 정제된 단백질입니다. 재조합 알부민을 재조합 응고 인자 IX에 유전적으로 융합하여 생성됩니다. 인간 알부민의 cDNA를 인간 응고 인자 IX의 cDNA에 유전적으로 융합하면 유전자 산물이 rIX-FP로 지정된 단일 재조합 단백질로 발현될 수 있습니다. IDELVION의 Factor IX 부분은 인간 혈장 유래 Factor IX의 Thr148 대립 유전자 형태와 동일합니다. Factor IX와 알부민 모이어티 사이의 절단 가능한 링커는 천연 Factor IX의 내인성 활성화 펩타이드에서 유래합니다. rIX-FP는 Factor IX가 활성화될 때까지 순환에서 무결하게 유지되며, 그러면 알부민이 Factor IX에서 절단되어 응고에 필요할 때 활성화된 Factor IX (FIXa)를 방출합니다.
IDELVION은 인간 또는 동물 공급원 물질에서 유래한 단백질을 첨가하지 않고 제조됩니다. IDELVION은 유전자 조작된 중국 햄스터 난소 (CHO) 세포주에 의해 분비되는 1018개의 아미노산으로 구성된 당단백질입니다. CHO 세포주는 정의된 세포 배양 배지에 rIX-FP를 분비하고 rIX-FP 단백질은 단일클론 항체 시약을 사용할 필요가 없는 공정으로 정제됩니다. 제조 공정에는 용매/계면 활성제 처리에 의한 바이러스 불활성화 및 여과에 의한 바이러스 제거를 포함한 세 가지 검증된 바이러스 제거 단계가 통합되어 있습니다.
국제 단위로 표현된 역가는 CSL Behring의 제조 참조 표준에 대한 시험관 내 aPTT 기반 단일 단계 응고 분석을 사용하여 결정됩니다. 이 내부 역가 표준은 합성 실리카 및 합성 인지질 기반 시약을 사용하는 단일 단계 응고 분석을 통해 세계보건기구 (WHO) Factor IX 농축물에 대한 국제 표준에 대해 교정되었습니다.
12 임상약리학
12.1 작용 기전
IDELVION은 효과적인 지혈에 필요한 결손된 응고 인자 IX를 일시적으로 대체하는 재조합 단백질입니다. IDELVION은 유전적으로 융합된 재조합 응고 인자 IX와 재조합 알부민으로 구성됩니다. 재조합 알부민과의 융합은 인자 IX의 반감기를 연장시킵니다 [설명 (11) 및 임상 약리학 (12.3) 참조].
12.3 약동학
성인 ≥18세
IDELVION의 약동학적(PK) 프로파일은 25, 50 또는 75 IU/kg의 단일 용량을 정맥 주사한 후 평가되었습니다. PK 매개변수는 단일 단계 응고 분석법으로 측정한 혈장 인자 IX 활성을 기반으로 했습니다. PK 분석을 위한 혈액 샘플은 투여 전과 투여 후 최대 336시간(14일)까지 수집했습니다.
표 4는 IDELVION의 단일 25 IU/kg, 50 IU/kg 또는 75 IU/kg 용량 투여 후 약동학적 매개변수를 보여줍니다.
| PK 매개변수 | rIX-FP 25 (IU/kg) (N=7) |
rIX-FP 50 (IU/kg) (N=47) |
rIX-FP 75 (IU/kg) (N=8) |
|---|---|---|---|
| IR = 주사 후 30분에 기록된 증가량 회복; AUC = 인자 IX 활성 시간 곡선 아래 면적; t1/2 = 반감기; MRT = 평균 체류 시간; CL = 체중 조정된 청소율; Vss = 정상 상태에서 체중 조정된 분포 용적. | |||
|
|||
| IR (IU/dL)/(IU/kg) | 1.65 (11) | 1.30 (24) | 1.08 (20) |
| Cmax (IU/dL) | 41.1 (13) | 66.6 (27) | 82.0 (20) |
| AUC0-inf (h*IU/dL) | 4658 (36) | 7482 (28) | 9345 (20) |
| t1/2 (시간) | 118 (38) | 104 (25) | 104 (18) |
| MRT (시간) | 153 (24) | 143 (23) | 145 (14) |
| CL (mL/h/kg) | 0.57 (31) | 0.73 (27) | 0.84 (20) |
| Vss (dL/kg) | 0.86 (32) | 1.02 (28) | 1.20 (23) |
| 인자 IX 활성 1%까지의 시간(일)* | 22 (25) | 23 (19) | 25 (13) |
| 인자 IX 활성 3%까지의 시간(일)* | 14 (19) | 17 (19) | 18 (13) |
| 인자 IX 활성 5%까지의 시간(일)* | 10 (25) | 13 (20) | 15 (13) |
IDELVION은 최대 30주까지 단회 또는 반복 투여 후 유사한 PK 매개변수를 보였다.
18세 미만의 대상자
IDELVION의 약동학적 매개변수는 50 IU/kg의 IDELVION 정맥 주사 후 개방표지, 다기관 연구에서 5명의 청소년(12세 이상 18세 미만)과 27명의 어린이(0세 이상 12세 미만)에서 평가되었다. PK 샘플은 투여 전과 투여 후 최대 336시간(14일)까지 여러 시간 지점에서 수집되었다.
표 5는 0세 이상 18세 미만의 32명의 대상자에 대한 소아 데이터에서 계산된 PK 매개변수를 요약한다. 추정된 매개변수는 시간에 따른 혈장 Factor IX 활성 프로필을 기반으로 했다. 성인과 비교하여 어린이의 증가된 회복률은 낮고(15%~27%), 체중 조정된 청소율은 높다(45%~62%).
| PK 매개변수 | 0세 이상 6세 미만 (N=12) |
6세 이상 12세 미만 (N=15) |
12세 이상 18세 미만 (N=5) |
|---|---|---|---|
| IR = 주사 후 30분에 기록된 증가된 회복률; AUC = Factor IX 활성 시간 곡선 아래 면적; t1/2 = 반감기; MRT = 평균 체류 시간; CL = 체중 조정된 청소율; Vss = 정상 상태에서 체중 조정된 분포 용적. | |||
|
|||
| IR (IU/dL)/(IU/kg) | 0.95 (22) | 1.06 (23) | 1.11 (28) |
| Cmax (IU/dL) | 48.3 (19) | 52.9 (23) | 55.3 (28) |
| AUC0-inf (h*IU/dL) | 4583 (33) | 5123 (31) | 5347 (48) |
| t1/2 (시간) | 90 (13) | 93 (21) | 87 (36) |
| MRT (시간) | 123 (14) | 129 (19) | 119 (31) |
| CL (mL/h/kg) | 1.18 (28) | 1.06 (29) | 1.08 (39) |
| Vss (dL/kg) | 1.42 (24) | 1.32 (20) | 1.16 (14) |
| Factor IX 활성 1%까지의 시간(일) * | 17 (29) | 20 (22) | 19 (37) |
| Factor IX 활성 3%까지의 시간(일) * | 12 (32) | 14 (22) | 13 (38) |
| Factor IX 활성 5%까지의 시간(일) * | 9 (32) | 11 (26) | 11 (38) |
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
IDELVION의 발암 가능성을 평가하는 비임상 연구는 수행되지 않았습니다.
75 IU/kg IDELVION의 최대 권장 예방 임상 용량의 6.7배를 매일 28일 동안 투여한 동물에서 생식 기관의 거시적 또는 미시적 병리학적 변화는 관찰되지 않았습니다. IDELVION 투여 후 생식능력 저해에 대한 동물 연구는 수행되지 않았습니다.
14 임상 연구
IDELVION의 안전성 및 유효성은 이전에 치료받은 환자(PTPs) 63명의 남성 혈우병 B 환자(내인성 IX 인자 활성도 ≤2%)를 대상으로 한 전향적, 개방표지, 다기관 임상 연구에서 평가되었으며, 이 환자들은 요구 시 치료 및 출혈 에피소드 조절, 주요 및 경미한 수술, 치과 또는 기타 침습적 절차의 수술 전 관리, 7일, 10일 또는 14일 간격으로 한 번씩의 정기적 예방, 또는 약동학 평가의 일환으로 IDELVION을 최소한 한 번 이상 주입받았습니다. 피험자의 연령은 12세에서 61세까지였으며, 12세에서 17세까지의 청소년 피험자 7명을 포함했습니다. 피험자들은 최대 27개월 동안 치료를 받았습니다.
요구 시 치료 및 출혈 에피소드 조절
총 358건의 출혈 사건이 IDELVION으로 치료되었습니다. 그 중 204건(57%)의 출혈 사건은 자발적이었고, 140건(39%)의 사건은 외상성이었으며, 14건(4%)의 사건은 원인 불명이었습니다. 또한, 총 267건(75%)의 에피소드가 관절 출혈 사건이었습니다.
전반적인 치료 효능은 각 출혈 에피소드에 대해 연구자에 의해 우수, 양호, 중등도 또는 불량/무반응의 4점 척도를 기반으로 평가되었습니다. 요구 시 치료 및 출혈 에피소드 조절을 위한 IDELVION의 효능은 표 6에 요약되어 있습니다.
| 치료가 필요한 출혈 에피소드 수 (n = 358) | |
|---|---|
|
|
| 출혈 에피소드 치료를 위한 주입 횟수 | |
| 1회 주입, n (%) | 335 (94) |
| 2회 주입, n (%) | 18 (5) |
| >2회 주입, n (%) | 5 (1.4) |
| 효능 평가* | |
| 우수 또는 양호, n (%) | 337 (94) |
| 중등도, n (%) | 9 (2.5) |
| 불량/무반응, n (%) | 1 (0.3) |
수술 전후 출혈 관리
두 효능 연구 및 연장 연구에서 총 20명의 피험자(5~59세)가 29건의 수술 절차의 수술 전후 출혈 관리를 위해 IDELVION을 투여받았습니다. 용량은 피험자의 PK 및 치료에 대한 임상 반응에 따라 개별화되었습니다. 여기에는 정형외과 수술(n=14), 지방 흡입을 동반한 유방 절제술(n=1), 치질 절제술(n=2), 코 성형술, 점막 하 절제술 및 하비갑개 절제술(n=1), 포경 수술(n=3), 발치(n=5), 음낭 정계 정맥류 색전술(n=1), 색소성 모반 절제술(n=1) 및 내시경 점막 절제술(n=1)이 포함되었습니다.
수술 전 단일 볼루스를 97%(n=28)의 수술에 사용했습니다. 지혈 효능은 지혈 반응이 보고된 모든 시점에서 모든 수술에 대해 우수하거나 양호한 것으로 평가되었으며, 48시간 평가에서 중간으로 평가된 한 번의 평가를 제외했습니다. 14일 수술 후 기간 동안 환자는 0~11회의 주입을 받았고 FIX 소비량은 0~444.1 IU/kg이었습니다. 수술을 받은 6명의 환자가 당일에 수술 치료 장소에서 퇴원했습니다.
일상적인 예방
IDELVION으로 치료받은 63명의 피험자 중 23명의 PTP는 연구 첫 6개월 동안 출혈 에피소드 치료를 위해 IDELVION만을 투여받았습니다. 이러한 PTP 중 19명은 추가적으로 평균 10개월 동안 일주일에 한 번 예방 요법으로 전환했습니다.
요청 시 치료 및 주간 예방을 위해 IDELVION으로 치료받은 19명의 피험자를 분석한 결과, 예방 치료 중 평균 연간 자발적 출혈률(AsBR)은 0.7(범위: 0~4.2)이었으며, 요청 시 치료 중에는 15.4(범위: 2~39.5)였습니다. Poisson 모델에 따르면 IDELVION으로 예방 치료를 하면 연간 자발적 출혈률이 93% 감소했습니다.
예방 치료 중 평균 연간 출혈률(총 ABR – 자발적 및 외상성)은 1.6(범위: 0~21.1)이었으며, 요청 시 치료 중에는 19.2(범위: 2~46.1)였습니다. Poisson 모델에 따르면 IDELVION으로 예방 치료를 하면 연간 출혈률이 88% 감소했습니다.
| 출혈 에피소드 원인 | 요청 시(n=19)* | 주간 예방 (n=19)* |
예방으로 인한 감소율 (n=19)* |
|---|---|---|---|
| IQR=사분위수 범위, 25th 백분위수와 75th 백분위수로 정의됨; SD=표준 편차; 효능 평가 가능한 피험자는 요청 시 치료를 최소한 한 번 이상 받고 예방 치료를 최소한 한 번 이상 받은 피험자입니다. | |||
| 자발적 | |||
| 평균(SD) | 14.6 (8.42) | 0.9 (1.17) | 93.5 (8.03) |
| 중간값 | 15.4 | 0.7 | 95.9 |
| IQR | 8.0, 18.0 | 0, 1.6 | 89.0, 100 |
| 범위 | 2.0, 39.5 | 0, 4.2 | 75.2, 100 |
| 총계† | |||
| 평균(SD) | 20.8 (9.19) | 2.9 (4.79) | 88.0 (14.06) |
| 중간값 | 19.2 | 1.6 | 90.9 |
| IQR | 16.7, 25.8 | 0, 4.3 | 81.2, 100 |
| 범위 | 2.0, 46.1 | 0, 21.1 | 54.3, 100 |
40명의 피험자가 매주 정기적인 예방 요법을 받았습니다. 37명의 피험자가 6개월 동안 일주일에 한 번 예방 요법을 완료했습니다. 이 중 21명의 피험자는 IDELVION 50-75 IU/kg으로 14일 간격으로 전환했으며, 중간 기간은 12.7개월이었습니다. 전환 전, 이 21명의 피험자는 IDELVION으로 잘 조절되었습니다(전환 1개월 전에 용량 조정이 필요하지 않았거나 자발적 출혈이 발생하지 않았으며 매 7일마다 ≤40 IU/kg의 예방 용량으로 유지됨).
매주 및 14일 예방 요법을 받은 21명의 피험자에 대한 중간 AsBR은 각각 0(범위: 0~4.5)과 0(범위: 0~7.3)이었습니다(표 8에 요약됨). 또한, 매주 및 10일 예방 요법을 받은 7명의 피험자에 대한 중간 AsBR은 각각 0(범위: 0~0)과 0(범위: 0~0.9)이었습니다.
| 출혈 에피소드 원인 | 매주 예방 요법 (n=21)* |
14일 예방 요법 (n=21)* |
|---|---|---|
| IQR = 사분위간 범위; SD = 표준 편차 | ||
|
||
| 자발적 | ||
| 평균(SD) | 0.28 (1.01) | 1.07 (2.1) |
| 중간값 | 0 | 0 |
| IQR | 0, 0 | 0, 1 |
| 범위 | 0, 4.5 | 0, 7.3 |
12세 미만 PTP의 정기적 예방 및 출혈 조절
IDELVION의 안전성, 유효성 및 약동학은 1세에서 12세 미만의 이전에 치료받은 소아 환자(PTP)에서 평가되었습니다. 총 27명의 남성, 12명의 환자(6세 미만) 및 15명의 환자(6세에서 12세 미만)가 예방 및 출혈 에피소드 조절을 위해 IDELVION을 받았습니다. 27명의 피험자 모두 IDELVION으로 매주 예방 치료를 받았으며, 연구 참여 기간은 평균 13.1개월(범위: 9, 18개월)이었습니다.
rIX-FP를 사용한 정기적인 매주 요법은 출혈 에피소드 예방에 효과적이었습니다. 유효성 모집단에서 예방 치료 중 ABR(치료받지 않은 출혈 에피소드 포함, 총 출혈 에피소드) 및 연간 자발적 출혈률(AsBR)의 중간값(Q1, Q3)은 각각 3.41[1.18, 7.44] 및 0[0, 1.34] 출혈 에피소드/피험자/년이었습니다. 치료받은 출혈 에피소드와 치료받지 않은 출혈 에피소드를 모두 합산한 결과, 평균 ABR은 4.55 출혈 에피소드/년/피험자였으며, 평균 AsBR은 0.79였습니다. 연구 참여 전에 3명의 피험자에게 보고된 표적 관절(연속적인 6개월 동안 단일 관절에 3회 이상의 자발적 출혈)은 연구 기간 동안 해결되었습니다. 모든 피험자는 연구 기간 동안 매주 정기적인 예방 요법을 유지했습니다.
106건의 출혈 에피소드 중 대부분(94건; 89%)은 단일 주사로 치료되었으며, 103건(97%)은 1~2회 주사로 치료되었습니다. 출혈 해소 시 지혈 효능은 치료받은 모든 출혈 에피소드의 96%에서 우수하거나 양호한 것으로 평가되었습니다.
15 참고문헌
- Wilmot HV, Hogwood J, Gray E. 재조합 인자 IX: 단일 단계 응고 및 크로모젠 분석 간의 차이. Haemophilia 2014, 1-7.
- Fritsma GA, Dembitzer FR, Randhawa A, et al. 적절한 활성화 부분 트롬보플라스틴 시간 시약 선택 및 활용에 대한 권장 사항. Am J Clin Pathol 2012;137:904-908.
- Sommer JM, Buyue Y, Bardan S, Peters RT, Jiang H, Kamphaus G, Gray E, Pierce GF. 비교 현장 연구: 재조합 인자 IX Fc 융합 단백질 (rFIXFc) 활성 평가에 대한 실험실 분석 변동성의 영향. Thrombosis and Haemostasis 2014, 112(5):932-40.
16 공급/보관 및 취급 방법
IDELVION은 표시된 Factor IX 활성량(국제 단위(IU)로 표시)을 함유한 단회용 바이알에 동결 건조된 분말 형태로 공급됩니다.
IDELVION은 2.5mL(250, 500 또는 1000 IU 바이알 재구성용) 또는 5mL(2000 또는 3500 IU 바이알 재구성용)의 주사용 무균수 USP, Mix2Vial 필터 전달 세트 1개 및 무균 알코올 솜 1개와 함께 포장됩니다. 구성 요소는 천연 고무 라텍스로 만들어지지 않습니다.
| 공칭 강도 (국제 단위) |
충전 크기 색상 표시기 |
키트 NDC |
|---|---|---|
| 250 | 주황색 | 69911-864-02 |
| 500 | 파란색 | 69911-865-02 |
| 1000 | 녹색 | 69911-866-02 |
| 2000 | 보라색 | 69911-867-02 |
| 3500 | 노란색 | 69911-869-02 |
보관 및 취급
- IDELVION은 빛으로부터 보호하기 위해 포장 상태로 보관하십시오.
- IDELVION 포장은 냉장 보관하거나 실온 2-25°C(36~77°F)에서 보관하십시오. 냉동하지 마십시오.
- IDELVION 또는 주사용 무균수 희석제는 카톤 및 바이알 라벨에 인쇄된 유효 기한이 지나면 사용하지 마십시오.
17 환자 상담 정보
- 환자에게 FDA 승인 환자 라벨(환자 정보 및 사용 지침)을 읽도록 지시하십시오.
- 환자에게 IDELVION 투여 후 발생하는 모든 이상 반응이나 문제를 의료 서비스 제공자에게 보고하도록 지시하십시오.
- 환자에게 과민증 또는 알레르기 반응(두드러기, 전신 두드러기, 가슴 답답함, 천명, 저혈압 포함)의 초기 징후와 증상을 알려주십시오. 이러한 증상이 나타나면 환자에게 IDELVION 사용을 중단하고 의료 서비스 제공자에게 연락하거나 즉시 응급 치료를 받도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- 환자에게 IX 인자 대체 요법에 대한 임상적 반응이 부족한 경우, 일부 경우 이는 억제제의 발현일 수 있으므로 의료 서비스 제공자 또는 혈우병 치료 센터에 연락하여 추가 치료 및/또는 평가를 받도록 지시하십시오 [경고 및 주의 사항 (5.2) 참조].
SPL 미분류 섹션
제조:
CSL Behring GmbH
35041 Marburg, Germany
다음을 위해:
CSL Behring Lengnau AG
Biotech Innovation Park
2543 Lengnau, Switzerland
US License No. 2009
유통:
CSL Behring LLC
Kankakee, IL 60901 USA
IDELVION®는 Novozymes Biopharma A/S, Bagsvaerd, Denmark의 라이선스 하에 제조됩니다.
Mix2Vial®은 West Pharmaceutical Services, Inc.의 자회사인 West Pharma. Services IL, Ltd.의 등록 상표입니다.
FDA 승인 환자 라벨
IDELVION® (아이델비온),
Coagulation Factor IX (Recombinant), Albumin Fusion Protein
이 첨부문서는 IDELVION에 대한 중요한 정보를 요약한 것입니다. IDELVION을 사용하기 전에 주의 깊게 읽어보십시오. 이 정보는 의료 서비스 제공자와의 대화를 대신할 수 없으며 IDELVION에 대한 모든 중요한 정보를 포함하지 않습니다. 이 내용을 읽은 후 질문이 있으면 의료 서비스 제공자에게 문의하십시오.
IDELVION은 무엇입니까?
IDELVION, Coagulation Factor IX (Recombinant), Albumin Fusion Protein은 혈우병 B(선천적 Factor IX 결핍증 또는 크리스마스병이라고도 함) 환자에서 부족한 응고 인자(Factor IX)를 대체하는 주사제입니다. 혈우병 B는 유전성 출혈 장애로 혈액이 정상적으로 응고되지 못하게 합니다. IDELVION은 혈우병 B를 가진 어린이와 성인에서 출혈 에피소드를 조절하고 예방하는 데 사용됩니다. 의료 서비스 제공자는 수술을 받을 때 IDELVION을 투여할 수 있습니다. IDELVION은 정기적으로 사용(예방)하면 출혈 에피소드 수를 줄일 수 있습니다.
누가 IDELVION을 사용해서는 안 됩니까?
다음과 같은 경우 IDELVION을 사용해서는 안 됩니다.
- IDELVION에 대한 생명을 위협하는 과민 반응이 있었던 경우
- 햄스터 단백질에 알레르기가 있는 경우
- IDELVION의 성분에 알레르기가 있는 경우
IDELVION을 사용하기 전에 Factor IX 제품에 대한 알레르기 반응이 있었는지 의료 서비스 제공자에게 알리십시오.
임신 중이거나 모유 수유 중인 경우 의료 서비스 제공자에게 알리십시오. IDELVION이 적합하지 않을 수 있습니다.
IDELVION을 사용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까?
다음과 같은 경우 의료 서비스 제공자에게 알려야 합니다.
- 의학적 문제가 있거나 있었던 경우
- 처방전이 필요한 약과 처방전이 필요 없는 약, 예를 들어 일반 의약품, 보충제 또는 허브 치료제를 포함하여 약을 복용하는 경우
- 햄스터 단백질에 대한 알레르기를 포함하여 알레르기가 있는 경우
- 모유 수유 중인 경우. IDELVION이 모유로 전달되는지, 아기에게 해를 끼칠 수 있는지 여부는 알려져 있지 않습니다.
- 임신 중이거나 임신을 계획하고 있는 경우. IDELVION이 태아에게 해를 끼칠 수 있는지 여부는 알려져 있지 않습니다.
- Factor IX에 대한 억제제가 있다고 들었던 경우(IDELVION이 효과가 없을 수 있음).
IDELVION은 어떻게 투여해야 합니까?
- IDELVION은 혈류로 직접 투여됩니다.
- IDELVION은 의료 서비스 제공자가 지시한 대로 투여해야 합니다.
- 의료 서비스 제공자 또는 혈우병 치료 센터에서 주사 방법을 교육받아야 합니다. 혈우병 B를 가진 많은 사람들은 스스로 또는 가족 구성원의 도움을 받아 IDELVION을 주사하는 방법을 배웁니다. IDELVION을 혼합하고 주입하는 방법에 대한 지침은 이 첨부문서 끝부분에 있는 단계별 안내(사용 지침)를 참조하십시오.
- 의료 서비스 제공자는 체중, 혈우병 B의 심각도 및 출혈 부위에 따라 사용할 IDELVION 양을 알려줄 것입니다.
- IDELVION을 투여한 후 혈액 응고에 충분한 Factor IX 혈중 수치가 있는지 확인하기 위해 혈액 검사를 받아야 할 수 있습니다.
- IDELVION을 투여한 후에도 출혈이 멈추지 않으면 즉시 의료 서비스 제공자에게 연락하십시오.
IDELVION의 가능한 부작용은 무엇입니까?
IDELVION과 관련하여 알레르기 및 과민 반응이 보고되었습니다. 발진이나 두드러기, 가려움증, 가슴이나 목이 조이는 느낌, 호흡 곤란, 어지러움, 현기증, 메스꺼움 또는 혈압 저하가 발생하면 즉시 의료 서비스 제공자에게 연락하고 치료를 중단하십시오.
신체는 Factor IX에 대한 항체(억제제라고 함)를 생성할 수 있으며, 이는 IDELVION이 제대로 작동하지 못하게 할 수 있습니다. 의료 서비스 제공자는 때때로 억제제에 대한 혈액 검사를 해야 할 수 있습니다.
IDELVION은 특히 혈전 형성 위험 요소가 있는 경우 신체에서 비정상적인 혈전이 형성될 위험을 증가시킬 수 있습니다. 가슴 통증, 호흡 곤란, 다리 통증 또는 부종이 있는 경우 의료 서비스 제공자에게 연락하십시오.
IDELVION의 가장 흔한 부작용은 두통과 현기증입니다.
이것은 IDELVION으로 인해 발생할 수 있는 유일한 부작용이 아닙니다. 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. 불편하거나 사라지지 않는 부작용에 대해 의료 서비스 제공자에게 알리십시오.
IDELVION의 복용량 강도는 무엇입니까?
IDELVION은 250, 500, 1000, 2000 또는 3500 IU의 다섯 가지 복용량 강도로 제공됩니다. IDELVION의 실제 강도는 상자와 바이알 라벨에 인쇄되어 있습니다. 다섯 가지 복용량 강도의 라벨은 아래 표 1에 제공된 대로 색상으로 구분됩니다.
| 충전 크기 색상 표시기 | 공칭 강도 |
|---|---|
| 주황색 | 250 IU |
| 파란색 | 500 IU |
| 녹색 | 1000 IU |
| 보라색 | 2000 IU |
| 노란색 | 3500 IU |
항상 라벨에 인쇄된 실제 복용량 강도를 확인하여 의료 서비스 제공자가 처방한 강도를 사용하고 있는지 확인하십시오.
IDELVION은 어떻게 보관해야 합니까?
- 빛으로부터 보호하기 위해 원래 상자에 바이알을 보관하십시오.
- 2-25°C(36-77°F)에서 보관하십시오. 냉동하지 마십시오.
- 라벨에 인쇄된 유효 기한이 지난 IDELVION은 사용하지 마십시오.
- 재구성된 제품(건조 제품을 희석제와 혼합한 후)은 4시간 이내에 사용해야 하며 보관하거나 냉장할 수 없습니다. 주입이 끝나면 바이알에 남아 있는 IDELVION은 버리십시오.
IDELVION에 대해 알아야 할 다른 사항은 무엇입니까?
- 처방되지 않은 질환에 IDELVION을 사용하지 마십시오.
- IDELVION을 다른 사람과 공유하지 마십시오. 같은 증상이 있다고 해도 마찬가지입니다.
사용 지침
재구성 후 정맥 주사만 가능합니다.
의료 서비스 제공자 또는 혈우병 센터에서 사용 방법을 교육받지 않은 경우 정맥 주사를 시도하지 마십시오.
항상 의료 서비스 제공자가 제공한 특정 지침을 따르십시오. 아래 나열된 단계는 IDELVION 사용에 대한 일반적인 지침입니다. 지침이 불확실한 경우 IDELVION 사용 전에 의료 서비스 제공자에게 문의하십시오. IDELVION 사용 후 출혈이 조절되지 않으면 즉시 의료 서비스 제공자에게 연락하십시오. 의료 서비스 제공자가 복용해야 하는 용량을 처방합니다. 때때로 혈액 검사를 받아야 할 수도 있습니다. 여행 전에 의료 서비스 제공자와 상담하십시오. 사용하지 않은 용액, 빈 바이알(들) 및 기타 사용된 의료 용품은 적절한 의료 폐기물 용기에 버리십시오.
- 항상 깨끗하고 평평한 표면에서 작업하고 혼합(재구성) 절차를 수행하기 전에 손을 씻으십시오.
- 키트에 제공된 희석제(주사용 멸균수) 및 전달 장치(Mix2Vial)를 사용하여 IDELVION을 혼합(재구성)하십시오.
- 주사를 하려면 주사기와 적합한 바늘(제공되지 않음)도 필요합니다.
- 포장이 개봉되었거나 손상된 경우 사용하지 말고 의료 서비스 제공자에게 연락하십시오.
- 바이알 라벨과 상자에 표시된 유효 기한이 지난 IDELVION은 사용하지 마십시오.
- 혼합(재구성)된 용액을 확인하십시오. 재구성된 용액이 흐리거나 입자가 포함되어 있거나 변색된 경우 IDELVION을 사용하지 마십시오.
- IDELVION 바이알은 단일 용량으로만 사용됩니다. 방부제가 포함되어 있지 않습니다. 부분적으로 사용한 바이알은 버리십시오.
- 혼합하기 전에 IDELVION 바이알과 주사용 멸균수 바이알을 실온에 두십시오.
- 아래에 설명된 재구성 지침을 따르십시오.
IDELVION 재구성 지침
- IDELVION 바이알, 희석제 바이알 및 Mix2Vial® 전달 세트를 평평한 표면에 놓습니다.
- IDELVION 및 주사용 멸균수(희석제) 바이알에서 플립 캡을 제거합니다.
- 제공된 멸균 알코올 솜으로 마개를 닦고 Mix2Vial 전달 세트 포장을 열기 전에 말립니다.
- 뚜껑을 벗겨(그림 1) Mix2Vial 전달 세트 포장을 엽니다. 장치를 포장에서 제거하지 마십시오.
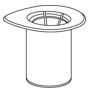
그림 1 - 희석제 바이알을 평평한 표면에 놓고 바이알을 단단히 잡습니다. Mix2Vial 전달 세트를 투명 포장과 함께 잡고 Mix2Vial 전달 세트의 파란색 끝에 있는 플라스틱 스파이크를 희석제 바이알 마개 중앙을 통해 단단히 밀어 넣습니다(그림 2).
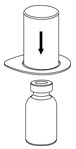
그림 2 - Mix2Vial 전달 세트에서 투명 포장을 조심스럽게 제거합니다. Mix2Vial 전달 세트를 제거하거나 장치의 노출된 끝을 만지지 마십시오(그림 3).
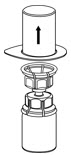
그림 3 - IDELVION 바이알을 평평한 표면에 단단히 놓고 Mix2Vial 전달 세트가 부착된 희석제 바이알을 뒤집어 투명 어댑터의 플라스틱 스파이크를 IDELVION 바이알 마개 중앙을 통해 단단히 밀어 넣습니다(그림 4). 희석제가 IDELVION 바이알로 자동으로 전달됩니다.
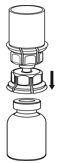
그림 4 - 희석제와 IDELVION 바이알이 Mix2Vial 전달 세트에 여전히 부착된 상태에서 IDELVION 바이알을 부드럽게 흔들어 분말이 완전히 용해되었는지 확인합니다(그림 5). 바이알을 흔들지 마십시오.
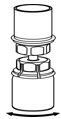
그림 5 - 한 손으로 Mix2Vial 전달 세트의 IDELVION 쪽을 잡고 다른 손으로 Mix2Vial 전달 세트의 파란색 희석제 쪽을 잡고 세트를 두 조각으로 분리합니다(그림 6).
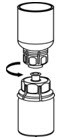
그림 6 - 빈 멸균 주사기에 공기를 채웁니다. IDELVION 바이알이 직립된 상태에서 주사기를 Mix2Vial 전달 세트에 끼웁니다. IDELVION 바이알에 공기를 주입합니다.
- 주사기 플런저를 누른 상태를 유지하고 시스템을 거꾸로 뒤집어 플런저를 천천히 뒤로 당겨 주사기에 농축액을 채웁니다(그림 7).
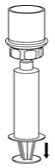
그림 7 - 채워진 주사기를 Mix2Vial 전달 세트에서 분리합니다(그림 8). 재구성된 용액은 투명하거나 노란색에서 무색의 용액이어야 합니다. 입자 물질이나 변색이 관찰되는 경우 사용하지 마십시오.
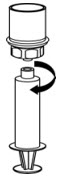
그림 8 - 재구성 후 즉시 또는 4시간 이내에 사용하십시오. 용액을 실온에 보관하십시오. 재구성 후 냉장 보관하지 마십시오.
- 용량이 여러 바이알을 필요로 하는 경우, 각 제품 바이알에 대해 별도의 미사용 Mix2Vial 이송 세트와 주사용 멸균수(희석제) 바이알을 사용하십시오. 10-12단계를 반복하여 바이알의 내용물을 하나의 주사기에 모으십시오.
- 치료 기록 – 사용한 각 바이알의 라벨에서 벗겨낼 수 있는 부분을 제거하여 환자의 치료 일지/기록부에 붙이십시오.
투여 (정맥 주사)
- IDELVION을 다른 의약품과 같은 튜브 또는 용기에 혼합하지 마십시오.
- 재구성된 IDELVION 용액이 들어 있는 주사기를 멸균 주입 세트에 연결하고 의료 서비스 제공자 또는 혈우병 치료 센터의 지시에 따라 주사하십시오.
- 정맥 주사하십시오. 주입 속도는 분당 10mL를 초과하지 마십시오.
CSL Behring에서 환자에게 제공되는 리소스:
부작용 보고는 다음으로 연락하십시오.
CSL Behring 약물 감시 부서 1-866-915-6958
제품 정보를 더 얻으려면 CSL Behring에 연락하십시오:
환자 지원 핫라인 1-800-676-4266
자세한 내용은 www.IDELVION.com을 방문하십시오.
제조사:
CSL Behring GmbH
35041 Marburg, Germany
for:
CSL Behring Lengnau AG
Biotech Innovation Park
2543 Lengnau, Switzerland
US License No. 2009
판매원:
CSL Behring LLC
Kankakee, IL 60901 USA
IDELVION®은 덴마크 Bagsvaerd에 있는 Novozymes Biopharma A/S의 라이선스 하에 제조됩니다.
Mix2Vial®은 West Pharmaceutical Services, Inc.의 자회사인 West Pharma. Services IL, Ltd.의 등록 상표입니다.
개정: 6/2023
주요 표시 패널 – 250 IU 범위 키트 상자
NDC 69911-864-02
250 IU Range
IDELVION®
Coagulation Factor IX (Recombinant),
Albumin Fusion Protein
재구성 용 동결건조 분말이 들어 있는 일회용 바이알 1개
정맥 투여 전용
CSL Behring

주요 표시면 – 500 IU 범위 키트 상자
NDC 69911-865-02
500 IU 범위
IDELVION®
Coagulation Factor IX (Recombinant),
Albumin Fusion Protein
재구성 용 동결 건조 분말이 들어 있는 일회용 바이알 1개
정맥 투여 전용
CSL Behring

주요 표시 패널 – 1000 IU 범위 키트 상자
NDC 69911-866-02
1000 IU Range
IDELVION®
Coagulation Factor IX (Recombinant),
Albumin Fusion Protein
재구성 용 동결 건조 분말이 들어 있는 일회용 바이알 1개
정맥 투여 전용
CSL Behring

주요 표시면 – 2000 IU 범위 키트 상자
NDC 69911-867-02
2000 IU 범위
IDELVION®
Coagulation Factor IX (Recombinant),
Albumin Fusion Protein
재구성 용 동결 건조 분말이 들어있는 1회용 바이알
정맥 투여 전용
CSL Behring

주요 표시 패널 – 3500 IU 범위 키트 상자
NDC 69911-869-02
3500 IU 범위
IDELVION®
응고 인자 IX (재조합),
알부민 융합 단백질
재구성을 위한 동결 건조 분말이 들어 있는 일회용 바이알 1개
정맥 주사 전용
CSL Behring