의약품 제조업체: Kyowa Kirin, Inc. (Updated: 2023-11-20)
처방 정보 요약
CRYSVITA® (burosumab-twza) 주사제, 피하 주사용
미국 최초 승인: 2018
적응증 및 사용
투여량 및 투여 방법
피하 주사 전용 (2)
-
소아 XLH(6개월 이상):
- 체중이 10kg 미만인 환자의 경우, 시작 용량 요법은 체중 1kg당 1mg을 가장 가까운 1mg으로 반올림하여 2주마다 투여합니다. (2.2)
- 체중이 10kg 이상인 환자의 경우, 시작 용량 요법은 체중 1kg당 0.8mg을 가장 가까운 10mg으로 반올림하여 2주마다 투여합니다. 최소 시작 용량은 10mg이며 최대 용량은 90mg입니다. (2.2)
혈청 인 수치를 정상화하기 위해 용량을 2주마다 약 2mg/kg(최대 90mg)까지 증가시킬 수 있습니다. (2.2)
- 성인 XLH: 용량 요법은 체중 1kg당 1mg을 가장 가까운 10mg으로 반올림하여 최대 90mg까지 4주마다 투여합니다. (2.3)
- 소아 TIO(2세 이상): 시작 용량은 체중 1kg당 0.4mg을 가장 가까운 10mg으로 반올림하여 2주마다 투여합니다. 용량은 2주마다 180mg을 초과하지 않는 범위에서 체중 1kg당 2mg까지 증가시킬 수 있습니다. (2.4)
- 성인 TIO: 시작 용량은 4주마다 체중 1kg당 0.5mg입니다. 용량은 2주마다 180mg을 초과하지 않는 범위에서 체중 1kg당 2mg까지 증가시킬 수 있습니다. (2.5)
투여 형태 및 강도
주사제: 1회용 바이알에 10mg/mL, 20mg/mL 또는 30mg/mL (3)
금기 사항
경고 및 주의 사항
부작용
- 소아 XLH 환자에서 CRYSVITA군에서 가장 흔한 부작용(≥25% 및 활성 대조군 >)은 발열, 주사 부위 반응, 기침, 구토, 사지 통증, 두통, 치아 농양, 치아 우식증입니다. (6.1)
- 성인 XLH 환자에서 가장 흔한 부작용(>5% 및 위약군보다 적어도 2명 이상의 환자에서)은 요통, 두통, 치아 감염, 불안한 다리 증후군, 비타민 D 감소, 현기증, 변비, 근육 경련, 혈액 인 증가입니다. (6.1)
- TIO 환자에서 가장 흔한 부작용(>10%)은 치아 농양, 근육 경련, 현기증, 변비, 주사 부위 반응, 발진, 두통입니다. (6.1)
의심되는 부작용을 보고하려면 Kyowa Kirin, Inc.에 1-844-768-3544 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보는 17을 참조하십시오.
개정: 2023년 3월
목차
전문 정보: 내용*
1 적응증 및 사용법
1.1 X-연관 저인산혈증
1.2 종양 유발성 골연화증
2 용법 및 용량
2.1 중요한 용법 및 용량 정보
2.2 X-연관 저인산혈증 소아 환자(6개월에서 18세 미만)
2.3 X-연관 저인산혈증 성인 환자(18세 이상)
2.4 종양 유발성 골연화증 소아 환자(2세에서 18세 미만)
2.5 종양 유발성 골연화증 성인 환자(18세 이상)
2.6 누락된 용량
2.7 25-하이드록시 비타민 D 보충
2.8 피하 투여에 대한 일반적인 고려 사항
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 고인산혈증 및 신장 석회화 위험
5.3 주사 부위 반응
6 이상 반응
6.1 임상 시험 경험
6.2 면역원성
6.3 시판 후 경험
7 약물 상호 작용
7.1 경구 인산염 및 활성 비타민 D 유사체
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
10 과량 투여
11 설명
12 약리 작용
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 소아 X-연관 저인산혈증
14.2 성인 X-연관 저인산혈증
14.3 종양 유발성 골연화증
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용법
1.2 종양 유발성 골연화증
CRYSVITA는 2세 이상의 성인 및 소아 환자에서 치료적으로 절제하거나 국소화할 수 없는 인산뇨성 간엽 종양과 관련된 종양 유발성 골연화증(TIO)에서 FGF23 관련 저인산혈증 치료에 사용됩니다.
2 투여 및 관리
2.1 중요 복용량 및 투여 정보
치료 시작 1주일 전에 경구 인산염 및/또는 활성 비타민 D 유사체(예: 칼시트리올, 파리칼시톨, 독세르칼시페롤, 칼시페디올)를 중단하십시오. [금기(4) 참조].
치료 시작 전 공복 혈청 인 농도는 연령별 기준 범위보다 낮아야 합니다. [금기(4) 참조].
CRYSVITA는 피하 주사로 투여하며 의료 전문가가 투여해야 합니다.
주사당 CRYSVITA의 최대 용량은 1.5mL입니다. 여러 번 주사해야 하는 경우 다른 주사 부위에 투여하십시오.
2.2 X-연관 저인산혈증 소아 환자(6개월 이상 18세 미만)
체중이 10kg 미만인 환자의 경우 권장 시작 용량은 체중 kg당 1mg이며, 가장 가까운 1mg 단위로 반올림하여 2주마다 투여합니다.
체중이 10kg 이상인 환자의 경우 권장 시작 용량은 체중 kg당 0.8mg이며, 가장 가까운 10mg 단위로 반올림하여 2주마다 투여합니다. 최소 시작 용량은 10mg이며 최대 용량은 90mg입니다.
CRYSVITA로 치료를 시작한 후 처음 3개월 동안 4주마다 공복 혈청 인을 측정하고 이후에는 적절하게 측정합니다. 혈청 인이 연령별 기준 범위의 하한보다 높고 5mg/dL 미만이면 동일한 용량으로 치료를 계속합니다. 연령별 기준 범위 내에서 혈청 인을 유지하려면 아래 용량 조정 일정을 따르십시오.
용량 조정
용량 조정 후 4주 후에 공복 혈청 인 수치를 재평가하십시오.
CRYSVITA는 4주에 한 번 이상 조정하지 마십시오.
용량 증량:
체중이 10kg 미만인 환자의 경우 혈청 인이 연령별 기준 범위보다 낮으면 용량을 1.5mg/kg까지 늘릴 수 있으며, 가장 가까운 1mg 단위로 반올림하여 2주마다 투여합니다. 용량을 추가로 늘려야 하는 경우 용량을 최대 용량인 2mg/kg까지 늘릴 수 있으며, 가장 가까운 1mg 단위로 반올림하여 2주마다 투여합니다.
체중이 10kg 이상인 환자의 경우 혈청 인이 연령별 기준 범위보다 낮으면 표 1에 표시된 용량 일정에 따라 2주마다 투여하는 용량을 약 2mg/kg까지 단계적으로 늘릴 수 있습니다(최대 용량 90mg).
| 체중(kg) | 시작 용량(mg) | 첫 번째 용량 증량(mg) | 두 번째 용량 증량(mg) |
|---|---|---|---|
| 10 – 14 | 10 | 15 | 20 |
| 15 – 18 | 10 | 20 | 30 |
| 19 – 31 | 20 | 30 | 40 |
| 32 – 43 | 30 | 40 | 60 |
| 44 – 56 | 40 | 60 | 80 |
| 57 – 68 | 50 | 70 | 90 |
| 69 – 80 | 60 | 90 | 90 |
| 81 – 93 | 70 | 90 | 90 |
| 94 – 105 | 80 | 90 | 90 |
| 106 이상 | 90 | 90 | 90 |
용량 감량:
혈청 인 수치가 5mg/dL을 초과하는 경우 다음 복용량을 보류하고 4주 후에 혈청 인 수치를 재평가하십시오. 환자는 CRYSVITA를 다시 시작하려면 연령별 기준 범위 미만의 혈청 인 수치를 유지해야 합니다. 혈청 인 수치가 연령별 기준 범위 미만이 되면 치료를 다시 시작할 수 있습니다.
체중이 10kg 미만인 환자의 경우 2주마다 체중 kg당 0.5mg을 가장 가까운 1mg 단위로 반올림하여 CRYSVITA를 다시 시작하십시오. 체중이 10kg 이상인 환자의 경우 표 2에 표시된 복용량 일정에 따라 CRYSVITA를 다시 시작하십시오.
| 이전 복용량(mg) | 재시작 복용량(mg) |
|---|---|
| 10 | 5 |
| 15 | 10 |
| 20 | 10 |
| 30 | 10 |
| 40 | 20 |
| 50 | 20 |
| 60 | 30 |
| 70 | 30 |
| 80 | 40 |
| 90 | 40 |
용량을 줄인 후 용량 조절 4주 후에 혈청 인 수치를 재평가하십시오. 재시작 용량 후에도 수치가 연령별 기준 범위 미만으로 유지되면 용량 증량에 설명된 대로 용량을 조절할 수 있습니다.
2.3 X-연관 저인산혈증 성인 환자(18세 이상)
성인에게 권장되는 용량 요법은 체중 kg당 1mg이며, 가장 가까운 10mg 단위로 반올림하여 최대 용량 90mg을 4주마다 투여합니다.
CRYSVITA로 치료를 시작한 후 치료 첫 3개월 동안 매달 복용 후 2주째에 공복 혈청 인 수치를 평가하고, 그 이후에는 적절하게 평가하십시오. 혈청 인 수치가 정상 범위 내에 있으면 동일한 용량으로 계속하십시오.
용량 감량
용량 조절 후 2주째에 공복 혈청 인 수치를 재평가하십시오.
CRYSVITA는 4주에 한 번 이상 조절하지 마십시오.
혈청 인 수치가 정상 범위를 초과하는 경우 다음 복용량을 보류하고 4주 후에 혈청 인 수치를 재평가하십시오. 환자는 CRYSVITA를 다시 시작하려면 혈청 인 수치가 정상 범위 미만이어야 합니다. 혈청 인 수치가 정상 범위 미만이 되면 표 3에 표시된 복용량 일정에 따라 초기 시작 용량의 약 절반(최대 용량 40mg, 4주마다 투여)으로 치료를 다시 시작할 수 있습니다. 용량을 변경한 후 2주째에 혈청 인 수치를 재평가하십시오.
| 이전 복용량(mg) | 재시작 복용량(mg) |
|---|---|
| 40 | 20 |
| 50 | 20 |
| 60 | 30 |
| 70 | 30 |
| 80 이상 | 40 |
2.4 종양 유발 골연화증 소아 환자(2세 이상 18세 미만)
소아에게 권장되는 시작 용량은 2주마다 투여하는 체중 kg당 0.4mg이며, 가장 가까운 10mg 단위로 반올림하고, 최대 용량은 2주마다 투여하는 180mg을 초과하지 않는 kg당 2mg입니다.
CRYSVITA 치료를 시작한 후, 치료 첫 3개월 동안 매달 공복 시 혈청 인 수치를 평가하고(투여 2주 후 측정), 이후 적절하게 평가합니다. 혈청 인 수치가 연령별 기준 범위 내에 있으면 동일한 용량으로 계속합니다. 연령별 기준 범위 내에서 혈청 인 수치를 유지하려면 아래 용량 조정 일정을 따르십시오.
용량 조정
용량 조정 4주 후에 공복 시 혈청 인 수치를 재평가합니다.
CRYSVITA 용량을 4주에 한 번 이상 조정하지 마십시오.
용량 증량
혈청 인 수치가 연령별 기준 범위 미만인 경우, 2주마다 최대 용량 kg당 2mg까지 표 4에 따라 용량을 조정해야 합니다. 최대 용량은 180mg을 초과해서는 안 됩니다.
| 체중 (kg) |
시작 용량 (mg) |
첫 번째 용량 증량 (mg) |
두 번째 용량 증량 (mg) |
세 번째 용량* 증량 (mg) |
|---|---|---|---|---|
|
||||
| 10 – 14 | 5 | 10 | 15 | 20 |
| 15 – 18 | 5 | 10 | 20 | 25 |
| 19 – 31 | 10 | 20 | 25 | 30 |
| 32 – 43 | 10 | 30 | 40 | 50 |
| 44 – 56 | 20 | 40 | 50 | 70 |
| 57 – 68 | 20 | 50 | 70 | 90 |
| 69 – 80 | 30 | 60 | 80 | 100 |
| 81 – 93 | 30 | 70 | 100 | 120 |
| 94 – 105 | 40 | 80 | 110 | 140 |
| 106 이상 | 40 | 90 | 130 | 160 |
용량 감량
혈청 인 수치가 연령별 기준 범위를 초과하는 경우 다음 용량을 보류하고 4주 후에 혈청 인 수치를 재평가하십시오. CRYSVITA를 다시 시작하려면 환자의 혈청 인 수치가 연령별 기준 범위 미만이어야 합니다. 혈청 인 수치가 연령별 기준 범위 미만이 되면 소아의 경우 2주마다 투여하는 최대 180mg 용량까지 초기 시작 용량의 약 절반 용량으로 치료를 다시 시작할 수 있습니다. 용량을 줄인 후 용량 조절 4주 후에 혈청 인 수치를 재평가하십시오. 재개시 용량 투여 후 수치가 연령별 기준 범위 미만으로 유지되는 경우 표 4에 설명된 대로 용량을 조절할 수 있습니다.
투여 중단
환자가 기저 종양에 대한 치료(즉, 수술적 절제 또는 방사선 치료)를 받는 경우 CRYSVITA 치료를 중단하고 치료 완료 후 혈청 인을 재평가해야 합니다. 혈청 인이 정상 하한 미만으로 유지되는 경우 환자의 시작 용량으로 CRYSVITA 용량을 다시 시작해야 합니다. 혈청 인을 연령별 기준 범위 내로 유지하기 위해 표 4에 따른 용량 조절을 따르십시오.
2.5 종양 유발 골연화증 성인 환자(18세 이상)
성인의 권장 시작 용량은 4주마다 체중 kg당 0.5mg이며, 가장 가까운 10mg 단위로 반올림하고, 최대 용량은 2주마다 투여하는 180mg을 초과하지 않는 범위 내에서 체중 kg당 2mg입니다.
CRYSVITA로 치료를 시작한 후 치료 첫 3개월 동안 매달 공복 혈청 인을 평가하고(투여 후 2주 측정), 그 이후에는 적절하게 평가합니다. 혈청 인이 정상 범위 내에 있으면 동일한 용량을 계속 사용하십시오. 혈청 인을 기준 범위 내로 유지하려면 아래 용량 조절 일정을 따르십시오.
용량 조절
용량 조절 후 2주 후에 공복 혈청 인 수치를 재평가하십시오.
CRYSVITA를 4주마다보다 자주 조절하지 마십시오.
용량 증량
혈청 인이 정상 범위 미만이면 2주마다 투여하는 180mg을 초과하지 않는 범위 내에서 최대 용량인 체중 kg당 2mg까지 표 5에 따라 용량을 적정해야 합니다. 혈청 인이 정상 하한보다 높아지지 않는 개인의 경우 의사는 4주마다 투여하는 총 용량을 나누어 2주마다 투여하는 것을 고려할 수 있습니다.
| 시작 용량 | 첫 번째 용량 증량‡ | 두 번째 용량 증량‡ | 세 번째 용량 증량‡ | 네 번째 용량 증량 | 다섯 번째 용량 증량 (최대 용량) |
|
|---|---|---|---|---|---|---|
| 용량 조절 후 2주 후 혈청 인이 정상 하한 미만인 경우 | 4주마다 체중 kg당 0.5mg | 다음으로 증량: 4주마다 체중 kg당 1mg 또는 2주마다 체중 kg당 0.5mg |
다음으로 증량: 4주마다 체중 kg당 1.5mg§ 또는 2주마다 체중 kg당 0.75mg |
다음으로 증량: 4주마다 체중 kg당 2mg§ 또는 2주마다 체중 kg당 1mg |
다음으로 증량: 2주마다 180mg을 초과하지 않는 범위 내에서 체중 kg당 1.5mg |
다음으로 증량: 2주마다 180mg을 초과하지 않는 범위 내에서 체중 kg당 2mg |
용량 감량
혈청 인 수치가 정상 범위를 초과하는 경우 다음 용량을 보류하고 4주 후에 혈청 인 수치를 재평가합니다. CRYSVITA를 다시 시작하려면 환자의 혈청 인 수치가 기준 범위 미만이어야 합니다. 혈청 인 수치가 기준 범위 미만이 되면 성인의 경우 2주마다 투여되는 최대 180mg의 초기 시작 용량의 약 절반 용량으로 치료를 다시 시작할 수 있습니다. 용량을 줄인 후 용량 조정 후 2주 후에 혈청 인 수치를 재평가합니다. 재개시 용량 투여 후 수치가 기준 범위 미만으로 유지되면 표 5에 설명된 대로 용량을 조정할 수 있습니다.
투여 중단
환자가 기저 종양(즉, 수술적 절제 또는 방사선 요법)에 대한 치료를 받는 경우 CRYSVITA 치료를 중단하고 치료가 완료된 후 혈청 인을 재평가해야 합니다. 혈청 인이 정상 하한 미만으로 유지되는 경우 CRYSVITA 용량을 환자의 시작 용량으로 다시 시작해야 합니다. 표 5에 따른 용량 조정을 따라 혈청 인을 기준 범위 내로 유지하십시오.
2.6 복용량 누락
환자가 복용량을 누락한 경우 가능한 한 빨리 처방된 용량의 CRYSVITA를 다시 투여하십시오. 복용량 누락을 방지하기 위해 예정된 치료 날짜를 기준으로 전후 3일 이내에 치료를 투여할 수 있습니다.
2.7 25-하이드록시 비타민 D 보충
25-하이드록시 비타민 D 수치를 모니터링하십시오. 콜레칼시페롤 또는 에르고칼시페롤을 보충하여 연령에 맞는 정상 범위의 25-하이드록시 비타민 D 수치를 유지하십시오. CRYSVITA 치료 중에는 활성 비타민 D 유사체를 투여하지 마십시오. [금기(4) 참조].
2.8 피하 투여에 대한 일반적인 고려 사항
주사 부위는 이전 주사와 다른 해부학적 위치(상완, 허벅지, 엉덩이 또는 복부의 사분면)에 각 주사를 투여하면서 번갈아 가며 주사해야 합니다. 점, 흉터 또는 피부가 아프거나, 멍이 들었거나, 붉거나, 딱딱하거나, 온전하지 않은 부위에는 주사하지 마십시오. 투여일에 특정 용량에 여러 바이알의 CRYSVITA가 필요한 경우 두 바이알의 내용물을 혼합하여 주사할 수 있습니다. 주사당 CRYSVITA의 최대 용량은 1.5mL입니다. 투여일에 여러 번 주사해야 하는 경우 다른 주사 부위에 투여하십시오. 반응 징후를 모니터링하십시오. [경고 및 주의 사항(5.3) 참조].
투여하기 전에 CRYSVITA에 미립자가 있는지 그리고 변색되었는지 육안으로 검사하십시오. CRYSVITA는 무균의 보존제가 없는 투명하고 약간 유백색을 띠며 무색에서 옅은 갈색을 띠는 노란색 용액으로 피하 주사용입니다. 용액의 색이 변했거나 흐리거나 용액에 입자 또는 이물질이 있는 경우 사용하지 마십시오.
3 제형 및 함량
주사제: 단회용 바이알에 10mg/mL, 20mg/mL 또는 30mg/mL의 투명에서 약간 유백색 및 무색에서 옅은 갈색-노랑색의 용액.
4 금기 사항
CRYSVITA는 다음과 같은 경우 금기입니다.
- 고인산혈증의 위험으로 인해 경구 인산염 및/또는 활성 비타민 D 유사체(예: 칼시트리올, 파리칼시트롤, 닥서칼시페롤, 칼시페디올)와 병용 투여하는 경우 [경고 및 주의 사항 (5.2) 및 약물 상호 작용 (7.1) 참조].
- 혈청 인 수치가 연령에 따른 정상 범위 내 또는 그 이상인 경우 [경고 및 주의 사항 (5.2) 참조].
- 이러한 상태는 비정상적인 무기질 대사와 관련이 있으므로 중증 신장 장애 또는 말기 신장 질환 환자의 경우 [특정 인구 집단에서의 사용 (8.6) 참조].
5 경고 및 주의 사항
5.1 과민반응
CRYSVITA를 투여받은 환자에서 과민반응(예: 발진, 두드러기)이 보고되었습니다. 심각한 과민반응이 발생하면 CRYSVITA 투여를 중단하고 적절한 의학적 치료를 시작하십시오 [부작용 (6.1) 참조].
5.2 고인산혈증 및 신장석회화 위험
혈청 인 수치가 정상 상한치를 초과하여 증가하면 신장석회화 위험이 증가할 수 있습니다. 이미 CRYSVITA를 복용하고 있는 환자의 경우, 혈청 인 수치에 따라 투여 중단 및/또는 용량 감소가 필요할 수 있습니다. 종양 유발성 골연화증 환자의 경우, 기저 종양 치료를 받으면 고인산혈증을 예방하기 위해 투여를 중단하고 조정해야 합니다 [투여 및 관리 (2) 및 부작용 (6.1) 참조].
5.3 주사 부위 반응
CRYSVITA 투여는 국소 주사 부위 반응을 유발할 수 있습니다. 심각한 주사 부위 반응이 발생하면 CRYSVITA 투여를 중단하고 적절한 의학적 치료를 시행하십시오 [부작용 (6.1) 참조].
6 부작용
다음 부작용은 아래 및 라벨의 다른 부분에서 설명됩니다.
- 과민증 [경고 및 주의 사항 (5.1) 참조]
- 고인산혈증 및 신장석회화 위험 [경고 및 주의 사항 (5.2) 참조]
- 주사 부위 반응 [경고 및 주의 사항 (5.3) 참조]
6.1 임상 시험 경험
임상 시험은 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 부작용 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
XLH 소아 환자에서의 부작용
CRYSVITA는 3개의 소아 XLH 연구에서 연구되었습니다. 연구 1은 1세에서 12세 사이의 XLH 환자를 대상으로 한 무작위 배정, 공개 라벨 3상 연구로, CRYSVITA 치료 또는 경구 인산염 및 활성 비타민 D의 활성 대조군 치료(CRYSVITA N = 29, 활성 대조군 N = 32)로 무작위 배정되었습니다. 연구 2는 5세에서 12세 사이의 XLH 환자를 대상으로 한 공개 라벨 2상 연구입니다(N = 52). 연구 3은 1세에서 5세 미만의 XLH 환자를 대상으로 한 공개 라벨 2상 연구입니다(N = 13). 전반적으로 환자 인구는 1-12세(평균 연령 7.0세), 남성 49%, 백인 88%였습니다.
연구 1에서 CRYSVITA로 무작위 배정된 환자는 2주마다 약 0.90 mg/kg(범위 0.8-1.2 mg/kg)의 평균 용량을 투여받았습니다. 이 그룹과 활성 대조군 그룹의 모든 환자는 64주 동안 치료를 완료했습니다.
연구 1에서 64주 치료 기간 동안 CRYSVITA 그룹의 피험자 중 ≥ 10%에서 발생하고 활성 대조군 그룹의 피험자보다 빈도가 높은 부작용은 표 6에 나와 있습니다.
| 부작용 | CRYSVITA (N=29) n (%) |
활성 대조군 (N=32) n (%) |
|---|---|---|
| n = 이벤트가 발생한 환자 수; N = CRYSVITA 또는 활성 대조군을 최소한 1회 이상 투여받은 환자의 총 수 | ||
|
||
| 발열 | 16 (55) | 6 (19) |
| 주사 부위 반응* | 15 (52) | 0 (0) |
| 기침† | 15 (52) | 6 (19) |
| 구토 | 12 (41) | 8 (25) |
| 사지 통증 | 11 (38) | 10 (31) |
| 두통 | 10 (34) | 6 (19) |
| 치아 농양‡ | 10 (34) | 4 (13) |
| 충치 | 9 (31) | 2 (6) |
| 설사 | 7 (24) | 2 (6) |
| 비타민 D 감소§ | 7 (24) | 1 (3) |
| 변비 | 5 (17) | 0 (0) |
| 발진¶ | 4 (14) | 2 (6) |
| 메스꺼움 | 3 (10) | 1 (3) |
연구 2에서, 26명의 환자는 64주차에 평균 1.05 mg/kg(범위 0.4 – 2.0 mg/kg)의 CRYSVITA를 2주마다 투여받았고, 나머지 26명의 환자는 4주마다 CRYSVITA를 투여받았습니다. 연구 2에서 평균 노출 기간은 124주였습니다. 연구 3에서, 환자는 40주차에 평균 0.90 mg/kg(범위 0.8-1.2 mg/kg)의 CRYSVITA를 2주마다 투여받았습니다. 연구 3에서 평균 노출 기간은 45주였습니다.
연구 2와 3에서 CRYSVITA를 투여받은 환자의 10% 이상에서 발생한 부작용은 표 7에 나와 있습니다.
| 부작용 | 연구 2 (N=52) n (%) |
연구 3 (N=13) n (%) |
전체 (N=65) n (%) |
|---|---|---|---|
| n = 이벤트가 발생한 환자 수; N = CRYSVITA를 최소 한 번 이상 투여받은 환자의 총 수 | |||
| 두통 | 38 (73) | 1 (8) | 39 (60) |
| 주사 부위 반응* | 35 (67) | 3 (23) | 38 (59) |
| 구토 | 25 (48) | 6 (46) | 31 (48) |
| 발열 | 23 (44) | 8 (62) | 31 (48) |
| 사지 통증 | 24 (46) | 3 (23) | 27 (42) |
| 비타민 D 감소† | 19 (37) | 2 (15) | 21 (32) |
| 발진‡ | 14 (27) | 1 (8) | 15 (23) |
| 치통 | 12 (23) | 2 (15) | 14 (22) |
| 근육통 | 9 (17) | 1 (8) | 10 (15) |
| 치아 농양 | 8 (15) | 3 (23) | 11 (17) |
| 현기증§ | 8 (15) | 0 (0) | 8 (12) |
과민 반응
연구 1(CRYSVITA군 N=29)에서 가장 흔한 과민 반응은 발진(10%), 주사 부위 발진(10%) 및 주사 부위 두드러기(7%)였습니다. 연구 2 및 3(N=65)에서 가장 흔한 과민 반응은 발진(22%), 주사 부위 발진(6%) 및 두드러기(5%)였습니다.
고인산혈증
소아 연구에서 고인산혈증 사례는 보고되지 않았습니다.
주사 부위 반응(ISR)
연구 1(CRYSVITA군 N=29)에서 환자의 52%가 CRYSVITA 주사 부위에 국소 주사 부위 반응(예: 주사 부위 두드러기, 홍반, 발진, 부종, 멍, 통증, 가려움증 및 혈종)을 보였습니다. 연구 2 및 3(N=65)에서 환자의 약 58%가 CRYSVITA 주사 부위에 국소 주사 부위 반응을 보였습니다. 주사 부위 반응은 일반적으로 중증도가 경미했고, 주사 후 1일 이내에 발생했으며, 약 1~3일 지속되었고, 치료가 필요하지 않았으며, 거의 모든 경우에 해소되었습니다.
XLH 성인 환자의 부작용
XLH 성인 환자에서 CRYSVITA의 안전성은 20~63세(평균 연령 41세)의 134명 환자를 대상으로 한 무작위, 이중맹검, 위약 대조 연구(연구 4)에서 입증되었습니다. 이 중 대부분은 백인/코카서스인(81%)이었고 여성(65%)이었습니다. 총 68명과 66명의 환자가 각각 CRYSVITA 또는 위약을 최소한 1회 투여 받았습니다. CRYSVITA의 평균 투여량은 4주마다 피하 주사로 0.95mg/kg(범위 0.3~1.2mg/kg)이었습니다. 연구 4의 24주 위약 대조 기간 동안 CRYSVITA 치료 환자의 5% 이상 및 위약보다 2명 이상의 환자에게서 보고된 부작용은 표 8에 나와 있습니다.
| 부작용 | CRYSVITA (N=68) n (%) |
위약 (N=66) n (%) |
|---|---|---|
| n = 사건이 발생한 환자 수; N = CRYSVITA 또는 위약을 최소한 1회 투여 받은 환자의 총 수 | ||
| 요통 | 10 (15) | 6 (9) |
| 두통* | 9 (13) | 6 (9) |
| 치아 감염† | 9 (13) | 6 (9) |
| 불안한 다리 증후군 | 8 (12) | 5 (8) |
| 비타민 D 감소‡ | 8 (12) | 3 (5) |
| 현기증 | 7 (10) | 4 (6) |
| 근육 경련 | 5 (7) | 2 (3) |
| 변비 | 6 (9) | 0 (0) |
| 혈액 인산염 증가§ | 4 (6) | 0 (0) |
24주 위약 대조 연구는 모든 환자가 4주마다 CRYSVITA를 피하 주사로 투여받은 24주 오픈 라벨 치료 기간으로 이어졌습니다. 오픈 라벨 연장 기간 동안 새로운 부작용은 확인되지 않았습니다.
과민 반응
연구 4의 이중 맹검 기간 동안 CRYSVITA 및 위약 치료 그룹 모두에서 약 6%의 환자가 과민 반응을 경험했습니다. 이러한 사건은 경미하거나 중등도였으며 중단을 요구하지 않았습니다.
고인산혈증
연구 4의 이중 맹검 기간 동안 CRYSVITA 치료 그룹의 7% 환자가 투여량 감소에 대한 프로토콜 지정 기준을 충족하는 고인산혈증을 경험했습니다(단일 혈청 인 수치가 5.0mg/dL을 초과하거나 혈청 인 수치가 4.5mg/dL[정상 상한]을 두 번 초과). 고인산혈증은 투여량 감소로 관리되었습니다. 프로토콜 지정 기준을 충족하는 모든 환자의 투여량은 50% 감소했습니다. 한 명의 환자는 지속적인 고인산혈증으로 인해 두 번째 투여량 감소가 필요했습니다.
주사 부위 반응(ISR)
연구 4의 이중 맹검 기간 동안 CRYSVITA 및 위약 치료 그룹 모두에서 약 12%의 환자가 주사 부위에 국소 반응(예: 주사 부위 반응, 홍반, 발진, 멍, 통증, 가려움증 및 혈종)을 보였습니다. 주사 부위 반응은 일반적으로 중증도가 경미했으며 주사 후 1일 이내에 발생하여 약 1~3일 지속되었으며 치료가 필요하지 않았으며 거의 모든 경우에 해결되었습니다.
불안한 다리 증후군(RLS)
연구 4의 이중 맹검 기간 동안 CRYSVITA 치료 그룹의 약 12%가 기저 불안한 다리 증후군(RLS)이 악화되었거나 경미하거나 중등도의 새로운 RLS가 발생했습니다. 이러한 사건은 투여량 중단으로 이어지지 않았습니다. 비중증 RLS는 다른 반복 투여 성인 XLH 연구에서도 보고되었습니다. 한 경우 기저 RLS가 악화되어 약물 중단으로 이어졌고 이후 사건이 해결되었습니다.
척추 협착증
척추 협착증은 XLH 성인에게 흔하며 척수 압박이 보고되었습니다. XLH 성인에 대한 CRYSVITA 2상 및 3상 연구(총 N=176)에서 총 7명의 환자가 척추 수술을 받았습니다. 이러한 경우 대부분은 기존 척추 협착증의 진행과 관련된 것으로 보입니다. CRYSVITA 치료가 척추 협착증이나 척수 압박을 악화시키는지 여부는 알 수 없습니다.
TIO 환자의 부작용
TIO 환자에서 CRYSVITA의 안전성은 총 27명의 환자를 등록한 두 개의 단일군 임상 연구(연구 6 및 연구 7)에서 입증되었습니다. 14명의 환자가 남성이었으며 환자의 연령은 33세에서 73세까지였습니다. CRYSVITA의 평균 투여량은 4주마다 0.77mg/kg이었고 평균 노출 기간은 121주였습니다.
연구 6 및 연구 7의 풀링된 데이터에서 성인 TIO 환자에게 보고된 부작용은 표 9에 나와 있습니다.
| 부작용 | 전반적 (N=27) n (%) |
|---|---|
| 치아 농양* | 5 (19) |
| 근육 경련 | 5 (19) |
| 현기증 | 4 (15) |
| 변비 | 4 (15) |
| 주사 부위 반응† | 4 (15) |
| 발진‡ | 4 (15) |
| 두통 | 3 (11) |
| 비타민 D 결핍 | 2 (7) |
| 고인산혈증 | 2 (7) |
| 불안한 다리 증후군 | 2 (7) |
과민 반응
연구 6 및 7의 통합 데이터에서 환자의 22%가 과민 반응을 경험했습니다. 가장 흔한 과민 반응은 습진(11%)과 발진(11%)이었습니다. 이러한 사건은 중증도가 경미하거나 중간 정도였습니다.
고인산혈증
연구 6 및 7의 통합 데이터에서 2명의 환자(7%)가 고인산혈증을 경험했으며, 이는 용량 감소로 관리되었습니다.
주사 부위 반응
주사 부위 반응의 빈도는 15%(주사 부위 반응, 주사 부위 통증 및 주사 부위 부종)였습니다. 주사 부위 반응은 일반적으로 중증도가 경미했으며, 치료가 필요하지 않았고 모든 경우에 해결되었습니다.
불안한 다리 증후군
연구 6 및 7의 통합 데이터에서 2명의 환자(7%)가 불안한 다리 증후군의 증상을 경험했으며, 이는 경미했고 치료 중단이 필요하지 않았습니다.
6.2 면역원성
모든 치료용 단백질과 마찬가지로 면역원성이 발생할 가능성이 있습니다. 항체 형성의 검출은 분석의 민감도와 특이성에 크게 의존합니다. 또한, 분석에서 관찰된 항체(중화 항체 포함) 양성의 발생률은 분석 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로 아래에 설명된 연구에서 burosumab-twza에 대한 항체 발생률을 다른 연구의 항체 발생률 또는 다른 제품과 비교하는 것은 오해의 소지가 있을 수 있습니다.
XLH 임상 연구에서 1~4세 환자의 경우 0명(0/13), 5~12세 환자의 경우 19%(10/52), 성인 환자의 경우 15%(20/131)가 CRYSVITA를 투여받은 후 항약물 항체(ADA) 양성 판정을 받았습니다. 이 중 5~12세 환자 3명이 중화 항체 양성 판정을 받았습니다. ADA의 존재는 XLH 환자에서 burosumab의 약동학, 약력학, 효능 및 안전성에 임상적으로 관련된 변화와 관련이 없었습니다.
TIO 임상 연구 한 건에서 성인 환자의 14%(2/14)가 CRYSVITA를 투여받은 후 ADA 양성 판정을 받았습니다. ADA 양성 환자 중 중화 항체 양성 판정을 받은 환자는 없었습니다. 또 다른 TIO 임상 연구에서 성인 환자 13명 중 ADA 양성 판정을 받은 환자는 없었습니다.
6.3 시판 후 경험
CRYSVITA의 시판 후 사용 중 다음과 같은 부작용이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
조사: CRYSVITA를 투여받은 소아 XLH 환자에서 혈액 인산염 증가가 보고되었습니다.
7 약물 상호작용
7.1 구강 인산염 및 활성 비타민 D 유사체
CRYSVITA와 구강 인산염 및/또는 활성 비타민 D 유사체를 함께 사용하면 CRYSVITA 단독 사용 시 예상보다 인산염 농도가 더 증가합니다. 이 증가는 신장 석회화증을 유발할 수 있는 고인산혈증을 초래할 수 있습니다.
CRYSVITA와 구강 인산염 및/또는 활성 비타민 D 유사체의 동시 사용은 금기입니다.
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
임산부에서 CRYSVITA 사용에 대한 데이터가 없어 약물 관련 태아 발달 이상 위험을 알 수 없습니다. 시험관 내에서, 붉은털원숭이에서 burosumab-twza 노출은 기형 유발 효과를 유발하지 않았습니다. 그러나, 태아 사망 및 조산과 같은 부작용이 임신한 붉은털원숭이에서 관찰되었지만, 이러한 효과는 최대 권장 인간 용량(MRHD) 2mg/kg 2주마다 투여 시 인간 노출량의 15배 높은 AUC에서 발생했고, 모체 고인산혈증 및 태반 광물화를 동반했기 때문에 임상적 위험을 나타내는 것은 아닙니다(자세한 내용은 데이터 참조). 임신 기간 동안 혈청 인산염 수치를 모니터링해야 합니다([투여 및 관리(2.2) 참조]). Kyowa Kirin, Inc.의 부작용 보고 전화 1-844-768-3544로 임신 사실을 보고하십시오.
지정된 인구 집단에서 주요 선천적 기형 및 유산의 배경 위험은 알 수 없습니다. 그러나 미국 일반 인구에서 주요 선천적 기형의 추정 배경 위험은 임상적으로 인식된 임신의 2%에서 4%이고, 유산의 경우 15%에서 20%입니다.
데이터
동물 데이터
임신한 붉은털원숭이에서의 생식 독성 연구에서, burosumab-twza를 임신 20일부터 분만 또는 제왕절개(133일)까지 2주마다 1회 정맥 주사했습니다. 이 기간에는 기관 형성 기간이 포함됩니다. 투여 용량은 성인 MRHD 2mg/kg 2주마다 투여 시 인간 노출량의 0.2배, 2배 및 15배였습니다. 치료는 태아 또는 자손에서 기형 유발 효과를 유발하지 않았습니다. 성인 MRHD 2mg/kg 2주마다 투여 시 인간 노출량의 15배에서 태아 사망 증가, 임신 기간 단축 및 조산 발생률 증가가 관찰되었으며, 이는 모체 고인산혈증 및 태반 광물화와 동반되었습니다. burosumab-twza는 태아 혈청에서 검출되어 태반을 통한 이동을 나타냅니다. 성인 MRHD 2mg/kg 2주마다 투여 시 인간 노출량의 15배에 노출된 어미의 태아 및 자손에서 고인산혈증이 나타났지만, 이소성 광물화는 나타나지 않았습니다. burosumab-twza는 자손의 생존율을 포함한 출생 전 및 출생 후 성장에 영향을 미치지 않았습니다.
8.2 수유
위험 요약
모유에서 burosumab-twza의 존재 여부 또는 burosumab-twza가 모유 생산 또는 모유 수유 아기에게 미치는 영향에 대한 정보는 없습니다. 모체 IgG는 모유에 존재합니다. 그러나 모유 수유 아기에서 국소 위장관 노출 및 제한적인 전신 노출의 영향은 알 수 없습니다. 수유 중 임상 데이터가 부족하여 수유 중 아기에게 CRYSVITA의 위험을 명확하게 판단할 수 없습니다. 따라서 모유 수유의 발달적 및 건강상 이점을 CRYSVITA에 대한 모체의 임상적 필요성과 CRYSVITA 또는 기저 모체 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다.
8.4 소아 사용
CRYSVITA의 안전성 및 유효성은 6개월 이상 소아 환자에서 확립되었습니다. XLH가 있는 1세 이상 소아 환자에서의 안전성 및 유효성은 1~12세(연구 1)의 61명의 환자를 대상으로 한 3상, 개방형, 활성 대조군 연구와 혈청 인산염 및 방사선학적 소견을 평가한 2개의 개방형 연구(5~12세의 52명의 환자(연구 2) 및 1~4세의 13명의 환자(연구 3))를 기반으로 합니다. 6개월에서 1세 사이의 환자와 청소년에서의 안전성 및 유효성은 1세에서 13세 미만의 XLH가 있는 소아 환자를 대상으로 한 연구에서 얻은 증거와 성인 및 소아 약동학(PK) 및 약력학(PD) 데이터의 추가 모델링 및 시뮬레이션을 통해 투여량을 결정한 결과를 바탕으로 합니다([부작용(6.1) 및 임상 연구(14) 참조]).
6개월 미만의 XLH가 있는 소아 환자에서 CRYSVITA의 안전성 및 유효성은 확립되지 않았습니다.
TIO가 있는 2세 이상 소아 환자에서 CRYSVITA의 안전성 및 유효성은 TIO가 있는 성인 환자를 대상으로 한 연구에서 얻은 증거와 성인 및 소아 XLH 환자와 성인 TIO 환자의 PK 데이터의 추가 모델링 및 시뮬레이션을 통해 투여량을 결정한 결과를 바탕으로 합니다.
2세 미만의 TIO가 있는 소아 환자에서 CRYSVITA의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
CRYSVITA의 임상 연구에는 65세 이상 환자가 충분히 포함되지 않아 젊은 환자와 반응이 다른지 여부를 확인할 수 없습니다. 다른 보고된 임상 경험에서 노인과 젊은 환자 간에 반응의 차이가 확인되지 않았습니다. 일반적으로 노인 환자의 경우 투여량 선택은 신중해야 하며, 일반적으로 투여량 범위의 하한에서 시작해야 합니다. 이는 간, 신장 또는 심장 기능 저하, 동반 질환 또는 다른 약물 치료의 빈도가 높기 때문입니다.
8.6 신장애
신장애가 burosumab-twza의 약동학에 미치는 영향은 알 수 없습니다. 그러나 신장애는 비정상적인 무기질 대사를 유발할 수 있으며, 이는 CRYSVITA 단독으로 예상되는 것보다 인산염 농도를 더 높일 수 있습니다. 이러한 증가는 고인산혈증을 유발할 수 있으며, 이는 신장 석회화를 유발할 수 있습니다.
CRYSVITA는 다음과 같이 정의된 중증 신장애 환자에게는 금기입니다.
- 추정 사구체 여과율(eGFR)이 15mL/min/1.73m2에서 29mL/min/1.73m2 또는 말기 신장 질환(eGFR < 15mL/min/1.73m2)인 소아 환자
- 크레아티닌 청소율(CLcr)이 15mL/min에서 29mL/min 또는 말기 신장 질환(CLcr < 15mL/min)인 성인 환자.
10 과량 투여
CRYSVITA 과량 투여에 대한 보고는 없습니다. CRYSVITA는 소아 임상 시험에서 체중 kg당 최대 2mg의 용량으로, 최대 90mg의 용량을 2주마다 투여하여 용량 제한 독성 없이 투여되었습니다. XLH 성인 임상 시험에서 체중 kg당 최대 1mg 또는 최대 총 용량 128mg을 4주마다 투여하여 용량 제한 독성이 관찰되지 않았습니다. 비-XLH 토끼와 붉은털원숭이에서, 생리적 혈청 인산염 수준을 초과하는 burosumab-twza 용량에서 여러 조직과 기관의 이소성 광화가 관찰되었습니다. 뼈에 대한 부작용으로 뼈 무기질 밀도, 뼈 광화 및 뼈 강도 감소도 인간 노출보다 높은 노출에서 관찰되었습니다 [see Nonclinical Toxicology (13.2)].
과량 투여의 경우, 혈청 인산염 수치, 혈청 칼슘 수치 및 신장 기능을 즉시 측정하고 정상/기준 수치로 회복될 때까지 주기적으로 모니터링하는 것이 좋습니다. 고인산혈증의 경우, CRYSVITA 투여를 중단하고 적절한 의학적 치료를 시작하십시오.
11 설명
부로수맙-트자는 중국 햄스터 난소 세포를 사용한 재조합 DNA 기술로 생산된 인간 면역글로불린 G 서브클래스 1(IgG1), 항인간 섬유아세포 성장 인자 23(FGF23) 항체입니다. 부로수맙-트자는 두 개의 중쇄(γ1-쇄) 분자와 두 개의 경쇄(κ-쇄) 분자로 구성됩니다. 각 중쇄는 아스파라긴 297(Asn297)에 N-결합 탄수화물 부분을 가지고 있습니다. 질량 분석법으로 결정된 부로수맙-트자의 분자량은 약 147,000입니다.
CRYSVITA(부로수맙-트자) 피하 주사용 주사제는 단회용 바이알에 무균, 방부제가 없는, 투명하거나 약간 불투명하고 무색에서 옅은 갈색-황색 용액으로 제공됩니다.
용액 1mL에는 부로수맙-트자 10mg, 20mg 또는 30mg, L-히스티딘(1.55mg), L-메티오닌(1.49mg), 폴리소르베이트 80(0.5mg), D-소르비톨(45.91mg)이 주사용수 USP에 함유되어 있습니다. pH를 6.25로 조절하기 위해 염산을 사용할 수 있습니다.
12 임상 약리
12.1 작용 기전
X-연관 저인산혈증은 신장 세뇨관 인산 재흡수 및 1,25-디하이드록시 비타민 D의 신장 생산을 억제하는 과도한 섬유아세포 성장 인자 23(FGF23)에 의해 발생합니다. 부로수맙-twza는 FGF23의 생물학적 활성에 결합하여 억제하여 신장 인산 재흡수를 회복시키고 혈청 1,25-디하이드록시 비타민 D 농도를 증가시킵니다.
12.2 약력학
XLH 및 TIO 환자에게 SC 투여 후, 더 높은 부로수맙-twza 농도는 혈청 인 수치의 더 큰 증가와 관련이 있었습니다. 혈청 인의 증가는 가역적이었으며 전신 부로수맙-twza의 제거와 함께 기준선으로 돌아왔습니다.
신장 세뇨관 최대 인산 재흡수율과 사구체 여과율의 비율(TmP/GFR)은 기준선에서 용량 의존적으로 증가했습니다 [임상 연구 (14) 참조].
부로수맙-twza 치료 시작 후 혈청 총 FGF23의 상승이 관찰되었지만, 임상적 의미는 알려져 있지 않습니다.
12.3 약동학
다음 약동학적 매개변수는 별도로 명시되지 않는 한 70kg 환자를 기준으로 승인된 권장 시작 용량을 투여받은 XLH 환자에서 관찰되었습니다. 모집단 PK 분석에 따르면 부로수맙-twza의 PK 특징은 XLH 환자와 TIO 환자 간에 유사했습니다.
부로수맙-twza는 0.1~1mg/kg(70kg XLH 환자를 기준으로 최대 승인된 권장 용량의 0.08~0.8배)의 용량 범위 내에서 SC 주사 후 선형 약동학을 나타냈습니다.
부로수맙-twza의 안정 상태 골 농도는 성인 XLH 환자에서 평균 (± SD) 5.8 (± 3.4) mcg/mL였습니다.
흡수
부로수맙-twza의 평균 Tmax 값은 8~11일 범위였습니다.
분포
부로수맙-twza의 명백한 분포 용적은 8L입니다.
제거
명백한 청소율은 0.290 L/day입니다. 부로수맙-twza의 반감기는 약 19일입니다.
대사
부로수맙-twza 대사의 정확한 경로는 규명되지 않았습니다. 부로수맙-twza는 대사 경로를 통해 작은 펩타이드와 아미노산으로 분해될 것으로 예상됩니다.
특정 인구집단
연령에 따라 부로수맙-twza 약동학의 임상적으로 유의미한 차이는 관찰되지 않았습니다.
신장 또는 간 기능 장애가 부로수맙-twza의 약동학에 미치는 영향은 알려져 있지 않습니다.
소아 환자
안정 상태 골 농도는 5~12세 XLH 환자에서 15.8 (± 9.4) mcg/mL였고, 1~4세 XLH 환자에서 11.2 (± 4.6) mcg/mL였습니다.
체중
부로수맙-twza의 청소율과 분포 용적은 체중이 증가함에 따라 증가합니다.
약물 상호 작용 연구
CRYSVITA와 함께 약물 상호 작용 연구는 수행되지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
Burosumab-twza의 발암 가능성은 장기 동물 연구에서 평가되지 않았습니다.
Burosumab-twza의 돌연변이 유발 가능성을 평가하기 위한 연구는 수행되지 않았습니다.
Burosumab-twza의 영향을 평가하기 위해 동물을 대상으로 특정 생식력 연구가 수행되지 않았습니다.
Cynomolgus 원숭이에서 최대 40주 동안 지속된 burosumab-twza를 사용한 독성학 연구에서 2주마다 2mg/kg의 최대 권장 용량(MRHD)에서 최대 16배의 사람에게 노출된 용량에서 암컷 생식 기관에 대한 유의미한 부작용은 나타나지 않았습니다. 수컷 원숭이의 경우 2주마다 2mg/kg의 MRHD에서 3~9배의 사람에게 노출된 경우 고인산혈증과 관련된 정세관 또는 세뇨관의 최소 광물화가 관찰되었지만 정액 분석에서는 부작용이 나타나지 않았습니다.
13.2 동물 독성학 및/또는 약리학
토끼와 cynomolgus 원숭이의 경우 burosumab-twza에 의한 FGF23 신호 전달 억제는 혈청 인산염과 1,25 다이하이드록시 비타민 D를 증가시켰습니다. 여러 조직과 기관에서 생리적 혈청 인산염 수치를 초과하는 burosumab-twza 용량에서 이소성 광물화가 관찰되었습니다. XLH의 마우스 모델인 야생형(WT) 및 저인산혈증 Hyp 마우스를 대상으로 한 연구에서 Hyp 마우스에서 이소성 광물화가 현저히 적었습니다.
성인 cynomolgus 원숭이의 경우 burosumab-twza는 2주마다 2mg/kg의 MRHD에서 9~16배의 사람에게 노출된 경우 골 전환율, 무기질 함량 및/또는 무기질 밀도 및 피질 두께를 증가시켰습니다. 2주마다 2mg/kg의 MRHD에서 9~11배의 사람에게 노출된 성인 수컷 원숭이의 경우 골밀도 감소, 골 무기질화 및 골 강도 감소를 포함한 뼈에 대한 부작용이 관찰되었습니다.
어린 cynomolgus 원숭이의 경우 burosumab-twza는 0.2~2배의 임상 소아 노출에서 골 전환율, 무기질 함량 및/또는 무기질 밀도 및/또는 피질 두께를 증가시켰습니다. 2배의 소아 노출에서 수컷 원숭이의 경우 골 무기질화가 감소했지만 골 강도에는 영향이 없었습니다. Burosumab-twza는 최대 2배의 소아 노출 용량에서 어린 원숭이의 뼈 발달에 영향을 미치지 않았습니다.
14건의 임상 연구
14.1 소아 X-연관 저인산혈증
CRYSVITA는 총 126명의 소아 XLH 환자를 등록한 3건의 연구에서 평가되었습니다.
연구 1(NCT 02915705)은 1~12세의 소아 XLH 환자 61명을 대상으로 CRYSVITA 치료를 활성 대조군(경구 인산염 및 활성 비타민 D)과 비교한 64주 무작위배정, 공개 라벨 연구입니다. 첫 번째 용량을 투여할 당시 환자의 평균 연령은 6.3세였고 44%가 남성이었습니다. 모든 환자는 기준선에서 RSS 점수 ≥ 2.0인 구루병의 방사선학적 증거를 보였으며 평균(SD) 4(3.1)년 동안 경구 인산염과 활성 비타민 D 유사체를 투여받았습니다. 경구 인산염과 활성 비타민 D 유사체는 연구 등록 전 7일간의 휴약 기간 동안 중단되었고 활성 대조군의 환자에게 다시 시작되었습니다. 환자들은 2주마다 0.8mg/kg의 시작 용량으로 CRYSVITA를 투여받거나 경구 인산염(권장 용량 20-60mg/kg/일)과 활성 비타민 D(권장 용량 칼시트리올 20-30ng/kg/일 또는 알파칼시돌 40-60ng/kg/일)를 무작위로 투여받았습니다. 활성 대조군에 무작위 배정된 환자는 40주차에 평균 약 41mg/kg/일(범위 18~110mg/kg/일)의 경구 인산염 용량을 투여받았고 64주차에는 약 46mg/kg/일(범위 18mg/kg/일~166mg/kg/일)의 용량을 투여받았습니다. 또한 이들은 40주차에 평균 26ng/kg/일, 64주차에 27ng/kg/일의 경구 칼시트리올 용량 또는 치료적 동등량의 알파칼시돌을 투여받았습니다. CRYSVITA군의 8명의 환자는 혈청 인 수치에 따라 1.2mg/kg까지 증량했습니다. 모든 환자가 연구에서 최소 64주를 완료했습니다.
혈청 인
연구 1에서 CRYSVITA는 평균(SD) 혈청 인 수치를 기준선에서 2.4(0.24)mg/dL에서 40주차에 3.3(0.43)mg/dL, 64주차에 3.3(0.42)mg/dL로 증가시켰습니다. 활성 대조군에서 평균(SD) 혈청 인 농도는 기준선에서 2.3(0.26)mg/dL에서 40주차에 2.5(0.34)mg/dL, 64주차에 2.5(0.39)mg/dL로 증가했습니다. TmP/GFR로 평가한 신장 인 재흡수 용량은 CRYSVITA 치료를 받은 환자에서 기준선에서 평균(SD) 2.2(0.37)mg/dL에서 40주차와 64주차에 각각 3.4(0.67)mg/dL 및 3.3(0.65)mg/dL로 증가했습니다. 활성 대조군에서 평균(SD) TmP/GFR은 기준선에서 2.0(0.33)mg/dL에서 40주차에 1.8(0.35)mg/dL로 감소했으며 64주차에 1.9(0.49)mg/dL로 기준선 이하를 유지했습니다.
그림 1: 연구 1의 1~12세 소아에서 치료군별 혈청 인 농도 및 기준선 대비 변화량(mg/dL)(평균 ± SD)
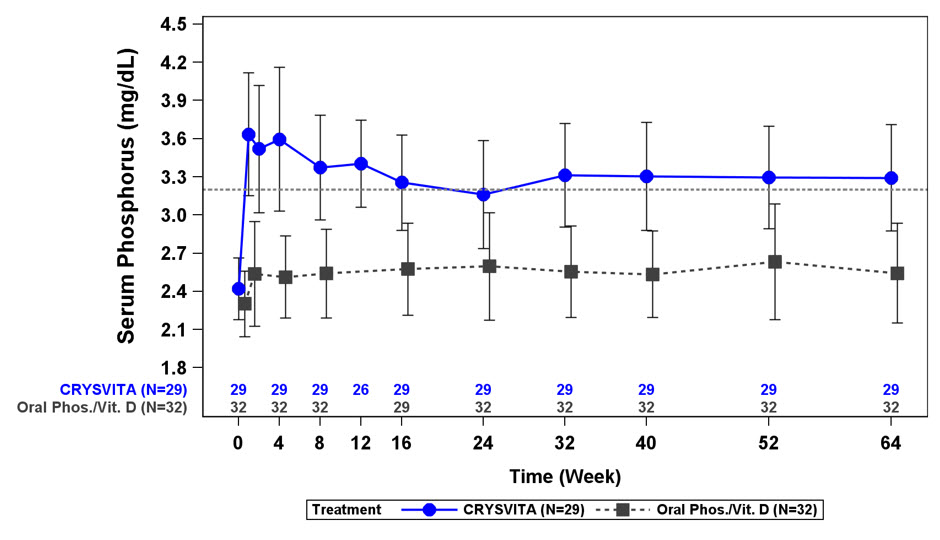
점선은 연구 1의 환자에 대한 정상 하한(3.2mg/dL)을 나타냅니다.
구루병의 방사선학적 평가
10점 Thacher 구루병 중증도 점수(RSS)와 7점 방사선학적 전반적 변화 평가(RGI-C)를 사용하여 방사선 사진을 검사하여 XLH 관련 구루병을 평가했습니다. RSS 점수는 단일 시점의 손목과 무릎 영상을 기반으로 부여되며 점수가 높을수록 구루병의 중증도가 높음을 나타냅니다. RGI-C 점수는 두 시점의 손목과 무릎 방사선 사진을 나란히 비교하여 부여되며 점수가 높을수록 구루병의 방사선학적 증거가 더 많이 개선되었음을 나타냅니다. +2.0의 RGI-C 점수는 상당한 치유의 방사선학적 증거로 정의되었습니다.
연구 1에서 기준선 평균(SD) 총 RSS는 CRYSVITA군에서 3.2(0.98), 활성 대조군에서 3.2(1.14)였습니다. 40주 동안 CRYSVITA로 치료한 후 평균 총 RSS는 3.2에서 1.1(0.72)로 감소했으며 활성 대조군에서는 3.2에서 2.5(1.09)로 감소했습니다. LS 평균(SE) RGI-C 전체 점수는 40주차에 CRYSVITA군에서 +1.9(0.11), 활성 대조군에서 +0.8(0.11)였습니다(표 10 참조). 40주차에 CRYSVITA군의 29명 중 21명과 활성 대조군의 32명 중 2명이 ≥ +2.0의 RGI-C 전체 점수를 달성했습니다. 이러한 결과는 표 10과 같이 64주차에도 유지되었습니다.
| 평가 항목 시점 |
2주마다 CRYSVITA (N=29) |
활성 대조군 (N=32) |
|---|---|---|
| RSS 총점 | ||
| 기준선 평균(SD) | 3.2 (0.98) | 3.2 (1.14) |
| 총점의 기준선 대비 LS 평균 변화량*(감소는 개선을 나타냄), 95% CI 포함 | ||
| 40주차 | -2.0 (-2.33, -1.75) | -0.7 (-0.98, -0.43) |
| 64주차 | -2.2 (-2.46, -2.00) | -1.0 (-1.31, -0.72) |
| RGI-C 전체 점수† | ||
| LS 평균 점수*(양수는 치유를 나타냄), 95% CI 포함 | ||
| 40주차 | +1.9 (+1.70, +2.14) | +0.8 (+0.56, +0.99) |
| 64주차 | +2.06 (+1.91, +2.20) | +1.03 (+0.77, +1.30) |
하지 골격 기형
연구 1에서, 하지 골격 기형은 서 있는 상태에서 촬영한 다리 전체 방사선 사진에서 RGI-C로 평가했습니다. 64주차에 CRYSVITA 군은 활성 대조군에 비해 더 큰 개선을 유지했습니다(LS 평균 [SE]: +1.25 [0.17] 대 +0.29 [0.12], +0.97의 차이(95% CI: +0.57, +1.37, GEE 모델)).
혈청 알칼리성 인산분해효소 활성
연구 1의 경우, 평균(SD) 혈청 총 알칼리성 인산분해효소 활성은 CRYSVITA 군에서 기준 시 511(125) U/L에서 64주차에 337(86) U/L로 감소했으며(평균 변화: -33%), 활성 대조군에서는 기준 시 523(154) U/L에서 64주차에 495(182) U/L로 감소했습니다(평균 변화: -5%).
성장
연구 1에서, 64주 동안 CRYSVITA 치료는 기준 시 -2.32(1.17)였던 평균(SD) 신장 Z 점수를 64주차에 -2.11(1.11)로 증가시켰습니다(LS 평균 변화(SE): +0.17(0.07)). 활성 대조군에서 평균(SD) 신장 Z 점수는 기준 시 -2.05(0.87)에서 64주차에 -2.03(0.83)으로 증가했습니다(LS 평균(SE) 변화: +0.02(0.04)). 64주차에 치료군 간의 차이는 +0.14였습니다(95% CI: 0.00, +0.29).
연구 2(NCT 02163577)는 5~12세의 사춘기 이전 XLH 환자 52명을 대상으로 2주마다 CRYSVITA를 투여하는 치료와 4주마다 투여하는 치료를 비교한 무작위배정, 공개 라벨 연구입니다. 초기 16주 용량 적정 단계 후, 환자들은 48주 동안 2주마다 CRYSVITA로 치료를 완료했습니다. 52명의 환자 모두 연구를 최소 64주 동안 완료했으며, 중단한 환자는 없었습니다. Burosumab-twza 용량은 투여 당일 공복 혈청 인 농도에 따라 3.5~5.0mg/dL의 공복 혈청 인 농도를 목표로 조정했습니다. 52명의 환자 중 26명은 최대 2mg/kg의 용량으로 2주마다 CRYSVITA를 투여받았습니다. 평균 용량은 16주차에 0.73mg/kg(범위: 0.3, 1.5), 40주차에 0.98mg/kg(범위: 0.4, 2.0), 60주차에 1.04mg/kg(범위: 0.4, 2.0)였습니다. 나머지 26명의 환자는 4주마다 CRYSVITA를 투여받았습니다. 연구 참여 시 환자의 평균 연령은 8.5세였으며 46%가 남성이었습니다. 96%가 평균(SD) 7(2.4)년 동안 경구 인산염과 활성 비타민 D 유사체를 투여받았습니다. 경구 인산염과 활성 비타민 D 유사체는 연구 등록 전에 중단되었습니다. 환자의 94%가 기준 시 구루병의 방사선학적 증거를 보였습니다.
연구 3(NCT 02750618)은 1~4세의 소아 XLH 환자 13명을 대상으로 한 64주 공개 라벨 연구입니다. 환자들은 2주마다 0.8mg/kg의 용량으로 CRYSVITA를 투여받았으며, 3명의 환자는 혈청 인 측정값에 따라 1.2mg/kg까지 적정했습니다. 모든 환자는 연구를 최소 40주 동안 완료했으며, 중단한 환자는 없었습니다. 연구 참여 시 환자의 평균 연령은 2.9세였으며 69%가 남성이었습니다. 모든 환자는 기준 시 구루병의 방사선학적 증거를 보였으며, 12명의 환자는 평균(SD) 16.7(14.4)개월 동안 경구 인산염과 활성 비타민 D 유사체를 투여받았습니다. 경구 인산염과 활성 비타민 D 유사체는 연구 등록 전에 중단되었습니다.
혈청 인
연구 2에서, CRYSVITA는 2주마다 CRYSVITA를 투여받은 환자의 평균(SD) 혈청 인 수치를 기준 시 2.4(0.40)mg/dL에서 40주차와 64주차에 각각 3.3(0.40)mg/dL과 3.4(0.45)mg/dL로 증가시켰습니다. 사구체 여과율에 대한 인의 최대 세뇨관 재흡수율 비율(TmP/GFR)은 이러한 환자에서 기준 시 평균(SD) 2.2(0.49)mg/dL에서 40주차와 64주차에 각각 3.3(0.60)mg/dL과 3.4(0.53)mg/dL로 증가했습니다.
연구 3에서, CRYSVITA는 평균(SD) 혈청 인 수치를 기준 시 2.5(0.28)mg/dL에서 40주차에 3.5(0.49)mg/dL로 증가시켰습니다.
구루병의 방사선학적 평가
연구 2에서, 2주마다 CRYSVITA를 투여받은 환자의 기준 시 평균(SD) RSS 총점은 1.9(1.17)였습니다. 40주 동안 CRYSVITA로 치료한 후 평균 총 RSS는 1.9에서 0.8로 감소했습니다(표 11 참조). 40주 동안 CRYSVITA로 치료한 후 2주마다 CRYSVITA를 투여받은 환자의 평균 RGI-C Global 점수는 +1.7이었습니다. 26명의 환자 중 18명이 +2.0 이상의 RGI-C 점수를 달성했습니다. 이러한 결과는 표 11과 같이 64주차까지 유지되었습니다.
연구 3에서, 13명의 환자의 기준 시 평균(SD) 총 RSS는 2.9(1.37)였습니다. 40주 동안 CRYSVITA로 치료한 후 평균 총 RSS는 2.9에서 1.2로 감소했으며, 평균(SE) RGI-C Global 점수는 +2.3(0.08)이었습니다(표 11 참조). 13명의 환자 모두 +2.0 이상의 RGI-C Global 점수를 달성했습니다.
| 평가변수 시점 |
2주마다 CRYSVITA 투여 | |
|---|---|---|
| 연구 2* (N=26) |
연구 3† (N=13) |
|
| RSS 총점 | ||
| 기준 시 평균(SD) | 1.9 (1.17) | 2.9 (1.37) |
| 총점의 기준 시 대비 LS 평균 변화(감소는 개선을 나타냄), 95% CI 포함 | ||
| 40주차 | -1.1 (-1.28, -0.85) | -1.7 (-2.03, -1.44) |
| 64주차 | -1.0 (-1.2, -0.79) | |
| RGI-C Global 점수 | ||
| LS 평균 점수(양수는 치유를 나타냄), 95% CI 포함 | ||
| 40주차 | +1.7 (+1.48, +1.84) | +2.3 (+2.16, +2.51) |
| Week 64 | +1.6 (+1.34, +1.78) | |
하지 골격 기형
연구 3에서, 서 있는 자세로 촬영한 다리 전체 방사선 사진을 사용하여 RGI-C로 평가한 하지 기형의 평균(SE) 변화는 40주차에 +1.3(0.14)였습니다.
혈청 알칼리성 인산분해효소 활성도
연구 2의 경우, 2주마다 CRYSVITA를 투여받은 환자에서 평균(SD) 혈청 총 알칼리성 인산분해효소 활성도는 기준치 462(110)U/L에서 64주차에 354(73)U/L로 감소했습니다(-23%).
연구 3의 경우, 평균(SD) 혈청 총 알칼리성 인산분해효소 활성도는 기준치 549(194)U/L에서 40주차에 335(88)U/L로 감소했습니다(평균 변화: -36%).
성장
연구 2에서, 64주 동안 CRYSVITA 치료를 받은 결과, 2주마다 CRYSVITA를 투여받은 환자에서 평균(SD) 신장 Z 점수가 기준치 -1.72(1.03)에서 -1.54(1.13)로 증가했습니다(LS 평균 변화 +0.19(95% CI: 0.09~0.29)).
14.2 성인 X-연관 저인산혈증
연구 4(NCT 02526160)는 성인 XLH 환자 134명을 대상으로 한 무작위배정, 이중맹검, 위약 대조 연구입니다. 이 연구는 24주간의 위약 대조 치료 단계와 그 후 모든 환자가 CRYSVITA를 투여받는 24주간의 공개 라벨 치료 기간으로 구성됩니다. CRYSVITA는 4주마다 1mg/kg 용량으로 투여되었습니다. 연구 등록 시 환자의 평균 연령은 40세(범위 19~66세)였으며 35%가 남성이었습니다. 모든 환자는 기준치에서 XLH/골연화증과 관련된 골격 통증이 있었습니다. 기준 평균(SD) 혈청 인 농도는 1.98(0.31)mg/dL로 정상 하한치 미만이었습니다. 연구 기간 동안 경구 인산염 및 활성 비타민 D 유사체는 허용되지 않았습니다. 연구에 등록한 134명의 환자 중 CRYSVITA군의 환자 1명이 24주간의 위약 대조 치료 기간 동안 치료를 중단했으며, 7명의 환자가 공개 라벨 치료 기간 동안 CRYSVITA 치료를 중단했습니다.
연구 5(NCT 02537431)는 장골능 골 생검의 조직학적 및 조직형태계측적 평가에 의해 결정된 바와 같이 골연화증의 개선에 대한 CRYSVITA의 효과를 평가하기 위한 성인 XLH 환자 14명을 대상으로 한 48주간의 공개 라벨, 단일군 연구입니다. 환자들은 4주마다 1mg/kg의 CRYSVITA를 투여받았습니다. 연구 등록 시 환자의 평균 연령은 40세(범위 25~52세)였으며 43%가 남성이었습니다. 연구 기간 동안 경구 인산염 및 활성 비타민 D 유사체는 허용되지 않았습니다.
혈청 인
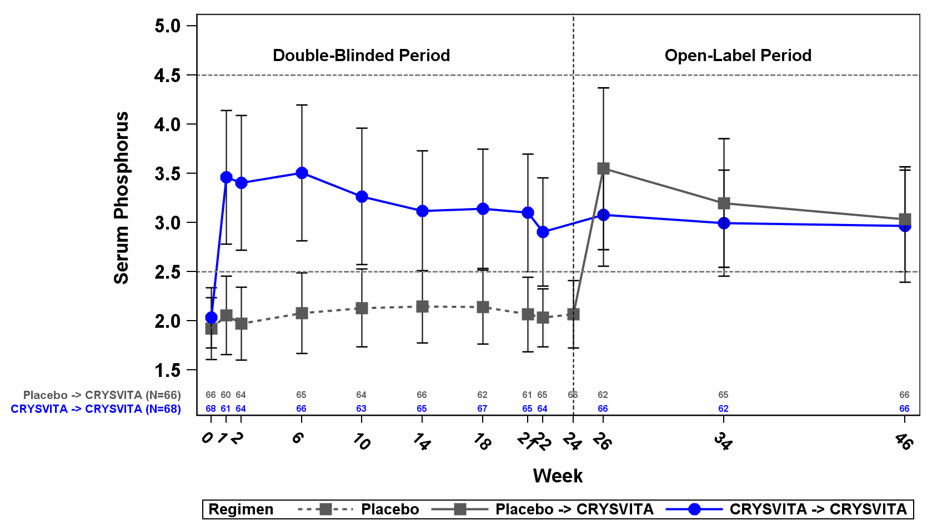
연구 4에서 기준치 혈청 인은 위약군에서 평균(SD) 1.9(0.32), CRYSVITA군에서 2.0(0.30)mg/dL였습니다. 초기 24주간의 이중맹검, 위약 대조 기간 동안 투여 간격 중간 지점(투여 후 2주)에서 평균(SD) 혈청 인은 위약군에서 2.1(0.30)mg/dL, CRYSVITA군에서 3.2(0.53)mg/dL였으며, 투여 간격 종료 시점에서 평균(SD) 혈청 인은 위약군에서 2.0(0.30)mg/dL, CRYSVITA군에서 2.7(0.45)mg/dL였습니다.
CRYSVITA로 치료받은 환자의 총 94%가 24주차까지 위약군의 8%에 비해 정상 하한치(LLN)를 초과하는 혈청 인 수치에 도달했습니다(표 12 참조).
| 위약 (N = 66) |
CRYSVITA (N = 68) |
|
|---|---|---|
| 95% CI는 Wilson 점수법을 사용하여 계산되었습니다. | ||
|
||
| 24주차까지 투여 간격 중간 지점에서 평균 혈청 인 > LLN 달성 – n (%) | 5 (8%) | 64 (94%) |
| 95% CI | (3.3, 16.5) | (85.8, 97.7) |
| p-값* | < 0.0001 | |
공개 라벨 치료 기간 동안 혈청 인은 지속적인 CRYSVITA 치료 중 유지되었으며 48주차까지 효과 손실의 증거는 없었습니다.
기준치에서 사구체 여과율에 대한 인의 최대 세뇨관 재흡수율(TmP/GFR)의 평균(SD) 비율은 위약군에서 1.60(0.37)mg/dL, CRYSVITA군에서 1.68(0.40)mg/dL이었습니다. 22주차(투여 간격의 중간 지점)에서 평균(SD) TmP/GFR은 위약군에서 1.69(0.37)mg/dL, CRYSVITA군에서 2.73(0.75)mg/dL이었습니다. 24주차(투여 간격의 종료 시점)에서 평균(SD) TmP/GFR은 위약군에서 1.73(0.42)mg/dL, CRYSVITA군에서 2.21(0.48)mg/dL이었습니다. 공개 라벨 치료 기간 동안 48주차까지 CRYSVITA 치료를 계속하는 동안 TmP/GFR은 안정적으로 유지되었습니다.
골연화증의 방사선학적 평가
연구 4에서 골연화증 관련 골절 및 가성 골절을 식별하기 위해 기준치에서 골격 조사를 실시했습니다. 골연화증 관련 골절은 두 피질골을 가로지르는 외상을 동반하지 않은 투과 영역으로 정의되고 가성 골절은 하나의 피질골을 가로지르는 외상을 동반하지 않은 투과 영역으로 정의됩니다. 기준치에서 활성(미치유) 골절(12%) 또는 활성 가성 골절(47%) 중 하나를 보인 환자는 52%였습니다. 활성 골절 및 가성 골절은 주로 대퇴골, 경골/비골 및 발의 중족골에 위치했습니다. 24주차에 이러한 활성 골절/가성 골절 부위를 평가한 결과 표 13과 같이 위약군에 비해 CRYSVITA군에서 완전 치유율이 더 높았습니다. 24주차까지 이중맹검, 위약 대조 치료 기간 동안 위약을 투여받은 66명의 환자에서 8건의 새로운 이상이 나타난 것에 비해 CRYSVITA를 투여받은 68명의 환자에서 총 6건의 새로운 골절 또는 가성 골절이 나타났습니다( 표 13 참조).
| 활성 골절 | 활성 가성 골절 | 총 골절 | ||||
|---|---|---|---|---|---|---|
| 위약 n (%) |
CRYSVITA n (%) |
위약 n (%) |
CRYSVITA n (%) |
위약 n (%) |
CRYSVITA n (%) |
|
| 기준치에서의 골절 수 | 13 | 14 | 78 | 51 | 91 | 65 |
| 24주차에 치유됨 | 0 (0%) | 7 (50%) | 7 (9%) | 21 (41%) | 7 (8%) | 28 (43%) |
공개 라벨 치료 기간 동안 CRYSVITA를 계속 투여받은 환자는 48주차에 골절이 지속적으로 치유되는 것을 보였습니다[활성 골절(n = 8, 57%), 활성 가성 골절(n = 33, 65%)]. ‘위약 투여군에서 CRYSVITA 투여군’으로 전환된 경우, 48주차에 활성 골절(n = 6, 46%) 및 활성 가성 골절(n = 26, 33%)에서 골절 치유가 관찰되었습니다.
환자 보고 결과
연구 4에서는 환자가 보고한 XLH 관련 증상(통증, 관절 경직 및 신체 기능)을 평가했습니다.
24주차에 CRYSVITA 투여군은 경직 중증도 점수(범위 0~100, 낮은 점수는 증상 개선을 반영함)에서 위약 투여군(+0.3)에 비해 기준치(-7.9)에서 평균 개선을 보였습니다.
24주차에 CRYSVITA와 위약 간에 환자가 보고한 통증 강도 또는 신체 기능 점수에서 유의미한 차이가 나타나지 않았습니다.
뼈 조직형태계측
연구 5에서 48주 치료 후, 골기질 부피/뼈 부피(OV/BV)가 기준치에서 평균(SD) 점수 26%(12.4)에서 11%(6.5)로 감소하여 -57% 변화하면서 10명의 환자에서 골연화증 치유가 관찰되었습니다. 골기질 두께(O.Th)는 11명의 환자에서 평균(SD) 17(4.1)마이크로미터에서 12(3.1)마이크로미터로 감소하여 -33% 변화했습니다. 무기화 지연 시간(MLt)은 6명의 환자에서 평균(SD) 594(675)일에서 156(77)일로 감소하여 평균 -74% 변화했습니다.
14.3 종양 유발 골연화증
CRYSVITA는 총 27명의 TIO 환자를 등록한 두 건의 연구에서 평가되었습니다.
연구 6(NCT 02304367)은 수술적 절제가 불가능하거나 위치를 찾을 수 없는 기저 종양으로 인한 FGF23 관련 저인산혈증 진단이 확진된 성인 환자 14명을 등록한 단일군 공개 라벨 연구입니다. 연구 6에 등록된 14명의 TIO 환자 중 8명은 남성이었고, 환자의 연령은 33세에서 68세였습니다(중앙값 59.5세). 경구 인산염 및 활성 비타민 D 유사체는 연구 등록 2주 전에 중단되었습니다. 환자들은 4주마다 체중 기반 시작 용량 0.3mg/kg으로 CRYSVITA를 투여받았으며, 공복 시 혈청 인 수치가 2.5~4.0mg/dL에 도달하도록 용량을 조정했습니다. 평균 용량은 20주차에 0.83mg/kg, 48주차에 0.87mg/kg, 96주차에 0.77mg/kg, 144주차에 0.71mg/kg이었습니다.
연구 7(NCT 02722798)은 단일군 공개 라벨 연구입니다. 연구 7에서 TIO 진단이 확진된 성인 환자 13명이 CRYSVITA를 투여받았습니다. 연구 7에서 치료를 받은 13명의 TIO 환자 중 6명은 남성이었고, 환자의 연령은 41세에서 73세였습니다(중앙값 58.0세). 경구 인산염 및 활성 비타민 D 유사체는 연구 등록 2주 전에 중단되었습니다. 환자들은 4주마다 체중 기반 시작 용량 0.3mg/kg으로 CRYSVITA를 투여받았으며, 공복 시 혈청 인 수치가 2.5~4.0mg/dL에 도달하도록 용량을 조정했습니다. 48주차의 평균(SD) 용량은 0.91(0.59)mg/kg이었고, 88주차의 평균(SD) 용량은 0.96(0.70)mg/kg이었습니다.
혈청 인
연구 6에서 CRYSVITA는 평균(SD) 혈청 인 수치를 기준치 1.60(0.47)mg/dL에서 24주차까지 용량 간격 중간 지점에서 평균 2.64(0.76)mg/dL로 증가시켰으며, 환자의 50%(7/14)가 24주차까지 용량 간격 중간 지점에서 평균 혈청 인 수치가 LLN 이상에 도달했습니다. 평균 혈청 인 농도의 증가는 144주차까지 LLN 근처 또는 그 이상으로 유지되었습니다(그림 3). 이러한 환자에서 사구체 여과율에 대한 인의 최대 세뇨관 재흡수율 비율(TmP/GFR)은 기준치에서 평균(SD) 1.12(0.54)mg/dL에서 48주차에 2.12(0.64)mg/dL로 증가했으며 144주차까지 안정적으로 유지되었습니다.
그림 3: 연구 6의 혈청 인 농도 및 기준치 대비 변화(mg/dL)
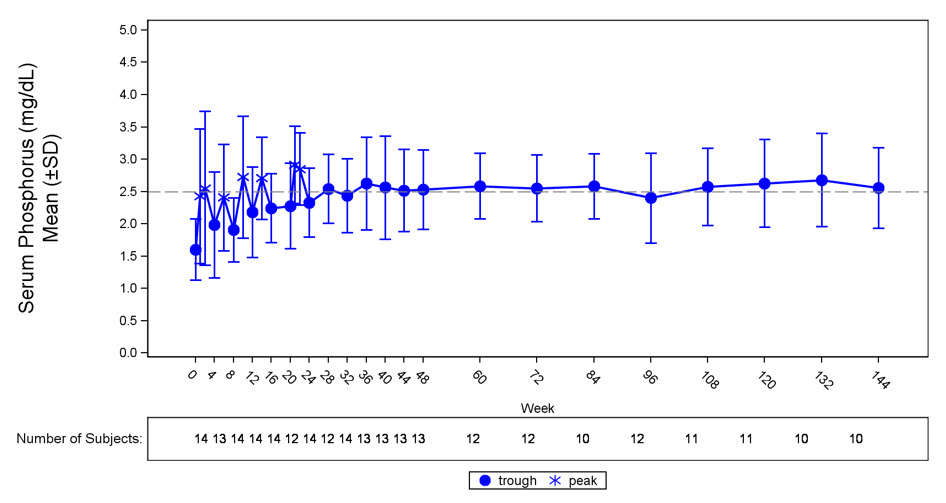
점선은 연구 6의 환자에 대한 정상 하한(2.5mg/dL)을 나타냅니다.
연구 7에서 CRYSVITA는 평균(SD) 혈청 인 수치를 기준치 1.62(0.49)mg/dL에서 24주차까지 용량 간격 중간 지점에서 평균 2.63(0.87)mg/dL로 증가시켰으며, 환자의 69%(9/13)가 24주차까지 용량 간격 중간 지점에서 평균 혈청 인 수치가 LLN 이상에 도달했습니다. 평균 혈청 인 농도는 88주차까지 LLN 이상으로 유지되었습니다. TmP/GFR로 평가한 신장 인 재흡수 용량은 기준치에서 평균(SD) 1.15(0.43)mg/dL에서 48주차에 2.30mg/dL(0.48)mg/dL로 증가했습니다.
뼈 조직형태계측
연구 6에서 뼈 생검을 받은 11명의 환자 중 9명에게서 기준치에 골연화증이 나타났으며, 48주 치료 후 치유를 평가했습니다. 기준치에 골연화증이 있었던 이 9명의 환자에서 OV/BV는 기준치에서 평균(SD) 점수 21.2%(19.9)에서 13.9%(16.7)로 감소하여 -34% 변화했습니다. O.Th는 평균(SD) 18.9(11.9)마이크로미터에서 12.1(10.1)마이크로미터로 감소하여 -36% 변화했습니다. MLt는 3명의 환자에서 평균(SD) 667(414)일에서 331(396)일로 감소하여 -50% 변화했습니다.
연구 7에서 뼈 생검을 받은 3명의 환자 모두에게서 기준치에 골연화증이 나타났으며, 48주 치료 후 치유를 평가했습니다. 이 3명의 환자에서 OV/BV는 기준치에서 평균(SD) 점수 14.0%(15.2)에서 9.2%(5.5)로 감소하여 -34% 변화했습니다. O.Th는 평균(SD) 16.0(13.7)마이크로미터에서 13.5(7.1)마이크로미터로 감소하여 -16% 변화했습니다.
골연화증의 방사선학적 평가
연구 6에서 14명의 모든 환자를 대상으로 기준치 및 연구 중 후속 시점에 99m테크네튬 표지 전신 골 스캔을 수행했습니다. 골 스캔을 통해 골연화증을 포함한 광범위한 뼈 질환에서 추적자 섭취 증가 부위를 평가할 수 있습니다. TIO 환자의 경우, 골 스캔에서 추적자 섭취 증가는 비외상성 골절 및 가성 골절로 추정됩니다. 기준치에서 모든 환자에게 추적자 섭취 부위가 있었으며, 14명의 환자에서 총 249개의 뼈 이상이 나타났습니다. 추적자 섭취 부위의 수는 48주차부터 144주차까지 감소했으며, 이는 뼈 이상의 치유를 시사합니다.
16 공급/보관 및 취급 방법
피하 주사용 CRYSVITA (burosumab-twza)는 멸균된 방부제가 없는 투명하거나 약간 유백색이며 무색에서 옅은 갈색-황색 용액으로 제공됩니다. 이 제품은 다음 농도로 상자당 단일 용량 바이알 1개로 제공됩니다.
10 mg/mL (NDC# 42747-102-01)
20 mg/mL (NDC# 42747-203-01)
30 mg/mL (NDC# 42747-304-01)
CRYSVITA 바이알은 사용 시까지 냉장 보관(36°F~46°F[2°C~8°C]) 상태로 원래 상자에 보관해야 합니다. 사용 시까지 CRYSVITA 바이알을 원래 상자에 보관하여 빛으로부터 보호하십시오.
CRYSVITA를 냉동하거나 흔들지 마십시오.
상자에 표시된 유효 기한이 지난 CRYSVITA는 사용하지 마십시오.
CRYSVITA 바이알은 단일 용량으로만 사용됩니다. 사용하지 않은 제품은 폐기하십시오.
17 환자 상담 정보
약물 상호 작용
환자에게 경구 인산염 및/또는 활성 비타민 D 유사체 제품을 사용하지 않도록 조언하십시오 [금기 사항 (4) 참조].
과민 반응
환자에게 CRYSVITA는 발진, 주사 부위 발진 및 두드러기와 같은 과민 반응을 일으킬 수 있음을 알려주십시오. 이러한 반응이 발생하면 의사에게 연락하도록 지시하십시오 [ 부작용 (6.1) 참조].
주사 부위 반응
환자에게 CRYSVITA 주사 부위에 주사 부위 반응(예: 홍반, 발진, 부종, 멍, 통증, 가려움증, 두드러기 및 혈종)이 발생했음을 알려주십시오. 이러한 반응이 발생하면 의사에게 연락하도록 지시하십시오 [ 부작용 (6.1) 참조].
불안한 다리 증후군
환자에게 CRYSVITA는 RLS를 유발하거나 기존 RLS 증상을 악화시킬 수 있음을 알려주십시오. 이러한 반응이 발생하면 의사에게 연락하도록 지시하십시오 [ 부작용 (6.1) 참조].
임신
임신 사실을 Kyowa Kirin, Inc. 부작용 보고 전화 1-844-768-3544로 보고하십시오 [특정 집단에서의 사용 (8.1) 참조].
제조사:
Kyowa Kirin, Inc.
Princeton, NJ 08540
미국 라이선스 번호 2077
주요 표시 부분 – 10 mg/mL 바이알
NDC 42747-102-01
CRYSViTA®
(burosumab-twza)
주사
10 mg/mL
1 mL 1회 투여 바이알
Kyowa Kirin, Inc.
미국 허가 번호 2077

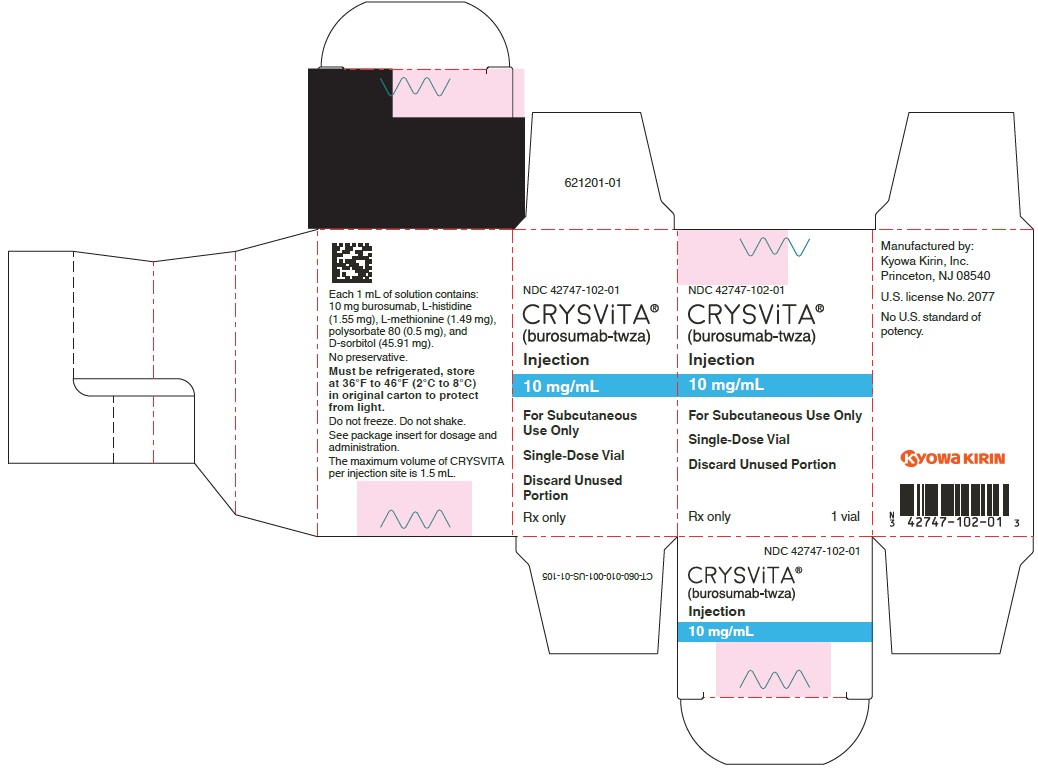
주요 표시 패널 – 10mg/mL 바이알 상자
NDC 42747-102-01
크리스비타®
(부로수맙-twza)
주사제
10mg/mL
피하용으로만 사용
단회용 바이알
사용하지 않은 부분은 폐기
의사 처방전만 필요
1 바이알
주요 표시 패널 – 20 mg/mL 바이알
NDC 42747-203-01
CRYSViTA®
(burosumab-twza)
주사제
20 mg/mL
1 mL 단회용 바이알
쿄와 키린, Inc.
미국 라이선스 번호 2077

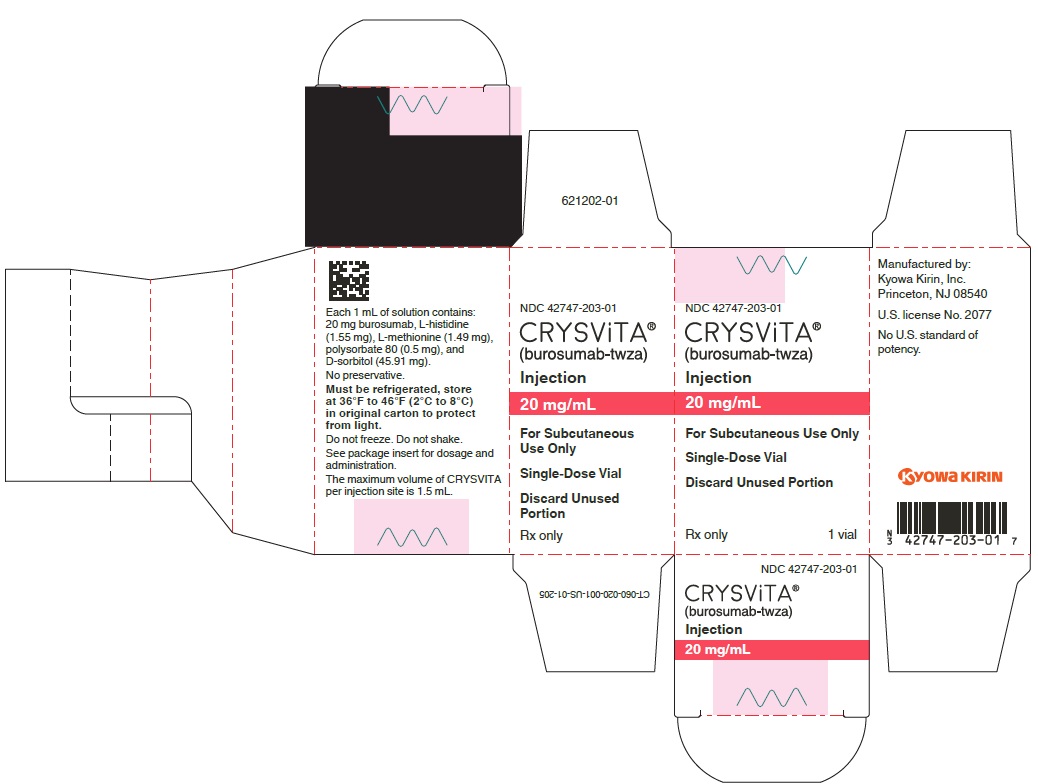
주요 표시 패널 – 20mg/mL 바이알 상자
NDC 42747-203-01
크리스비타®
(부로수맙-twza)
주사제
20mg/mL
피하주사용만
단회용 바이알
미사용 부분 폐기
의사 처방전용
1 개의 바이알
주요 표시 패널 – 30 mg/mL 바이알
NDC 42747-304-01
CRYSViTA®
(burosumab-twza)
주사제
30 mg/mL
1 mL 단회용 바이알
쿄와 키린, Inc.
미국 라이선스 번호 2077

주요 디스플레이 패널 – 30mg/mL 바이알 상자
NDC 42747-304-01
크리스비타®
(브로수맙-twza)
주사제
30mg/mL
피하주사용 전용
단회용 바이알
미사용 부분 폐기
의사 처방전에 의해서만
1 바이알