의약품 제조업체: Radius Health, Inc. (Updated: 2024-02-08)
처방 정보 요약
TYMLOS® (abaloparatide) 주사, 피하 주사용
미국 최초 승인: 2017
적응증 및 사용
투여량 및 투여 방법
투여 형태 및 강도
주사: 1회용 프리필드 펜에 투명하고 무색의 용액으로 abaloparatide 3120 mcg/1.56 ml (2000 mcg/ml). 프리필드 펜은 40 mcl에 abaloparatide 80 mcg의 30일 분량을 제공합니다. (3)
금기 사항
TYMLOS에 대한 알려진 과민증. (4)
경고 및 주의 사항
- 골육종: 골육종 위험이 증가된 환자, 즉 개방된 골단, 파제트병을 포함한 대사성 골 질환, 골 전이 또는 골 악성 종양 병력, 골격에 대한 이전 외부 빔 또는 이식 방사선 치료, 골육종을 유발하는 유전 질환이 있는 환자의 경우 사용을 피하십시오. (5.1)
- 기립성 저혈압: 투여 후 증상이 나타나면 환자가 앉거나 누울 수 있도록 지시하십시오. (5.2)
- 고칼슘혈증: 기존 고칼슘혈증이 있는 환자 및 원발성 부갑상선 기능 항진증과 같은 기저 고칼슘혈증 장애가 있는 것으로 알려진 환자의 경우 사용을 피하십시오. (5.3)
- 고칼슘뇨증 및 요로결석: 기존 고칼슘뇨증 또는 활동성 요로결석이 의심되는 경우 소변 칼슘을 모니터링하십시오. (5.4)
부작용
- 폐경 후 여성의 골다공증: 가장 흔한 부작용(발생률 ≥2%)은 고칼슘뇨증, 현기증, 메스꺼움, 두통, 두근거림, 피로, 상복부 통증 및 현훈입니다. (6.1)
- 남성의 골다공증: 가장 흔한 부작용(발생률 ≥2%)은 주사 부위 홍반, 현기증, 관절통, 주사 부위 부종, 주사 부위 통증, 타박상, 메스꺼움, 설사, 복부 팽만감, 복통 및 골통입니다. (6.1)
의심되는 부작용을 보고하려면 Radius Health, Inc.에 1-855-672-3487 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
17을 참조하십시오. 환자 상담 정보 및 약물 안내.
개정: 2023년 12월
목차
전문 정보: 내용*
1 적응증 및 사용법
1.1 골절 위험이 높은 폐경 후 여성의 골다공증 치료
1.2 골절 위험이 높은 남성의 골다공증 치료를 위한 골밀도 증가
2 용법 및 용량
2.1 권장 용량
2.2 투여 지침
2.3 치료 기간
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 골육종 위험
5.2 기립성 저혈압
5.3 고칼슘혈증
5.4 고칼슘뇨증 및 요로결석
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 신장애
10 과량 투여
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 손상
13.2 동물 독성 및 약리학
14 임상 연구
14.1 폐경 후 골다공증 여성에 대한 효능 연구
14.2 골다공증 남성
16 포장 단위/보관 및 취급
16.1 포장 단위
16.2 보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
1.1 골절 위험이 높은 폐경 후 여성의 골다공증 치료
TYMLOS는 골절 위험이 높은 폐경 후 여성(골다공증 골절 이력 또는 여러 골절 위험 요인이 있는 경우) 또는 다른 골다공증 치료에 실패했거나 내약성이 없는 환자의 골다공증 치료에 적응됩니다. TYMLOS는 폐경 후 여성의 골다공증에서 척추 골절 및 비척추 골절의 위험을 감소시킵니다.
1.2 골절 위험이 높은 남성의 골밀도 증가를 위한 치료
TYMLOS는 골절 위험이 높은 남성(골다공증 골절 이력 또는 여러 골절 위험 요인이 있는 경우) 또는 다른 골다공증 치료에 실패했거나 내약성이 없는 환자의 골밀도를 증가시키는 데 적응됩니다.
2 용법 및 투여
2.2 투여 지침
- TYMLOS는 복부 배꼽 주위에 피하 주사로 투여합니다. 매일 주사 부위를 바꿔 주고 매일 거의 같은 시간에 투여합니다. 정맥 주사 또는 근육 주사로 투여하지 마십시오.
- 기립성 저혈압 증상이 나타날 경우, 환자가 앉거나 누울 수 있는 곳에서 처음 몇 회 투여하십시오. [경고 및 주의 사항 (5.2) 및 이상 반응 (6.1) 참조].
- 투여 전에 TYMLOS를 시각적으로 검사하여 이물질이나 변색이 있는지 확인하십시오. TYMLOS는 투명하고 무색의 용액입니다. 고체 입자가 보이거나 용액이 흐리거나 색이 변한 경우 사용하지 마십시오.
- 환자와 보호자에게 TYMLOS 펜의 올바른 사용 방법에 대한 적절한 교육과 지침을 제공하십시오.
3 제형 및 함량
주사제: 3120 mcg/1.56 mL(2000 mcg/mL)의 아발로파라티드가 투명하고 무색의 용액으로 단일 환자 사용용 사전 충전 펜에 들어 있습니다. 사전 충전 펜은 TYMLOS 30 회분을 제공하며 각각 40 mcL에서 아발로파라티드 80 mcg가 들어 있습니다.
4 금기 사항
TYMLOS는 아발파라타이드 또는 제품 제형의 구성 요소에 대한 전신 과민 반응 병력이 있는 환자에게 금기입니다. 반응에는 아나필락시스, 호흡 곤란 및 두드러기가 포함되었습니다 [부작용 참조 (6.2)].
5 경고 및 주의 사항
5.1 골육종 위험
아발로파라타이드는 피하 투여 후 수컷 및 암컷 랫드에서 80 mcg의 임상 용량에서 인간 노출의 4배에서 28배에 해당하는 노출량으로 용량 의존적으로 골육종 발생률을 증가시켰습니다 [비임상 독성학 (13.1) 참조]. TYMLOS가 인간에게 골육종을 유발하는지 여부는 알려져 있지 않습니다.
골육종은 시판 후 설정에서 PTH 유사체로 치료받은 환자에서 보고되었지만, 인간의 관찰 연구에서는 골육종 위험 증가가 관찰되지 않았습니다. TYMLOS 및/또는 PTH 유사체 사용 2년 이상의 골육종 위험을 평가하는 데이터는 제한적입니다 [투여 및 투약 (2.3) 및 비임상 독성학 (13.1) 참조].
다음 환자(이러한 환자는 골육종의 기저 위험이 증가되어 있습니다)에게는 TYMLOS 사용을 피하십시오.
- 개방된 골단(소아 및 젊은 성인 환자)(TYMLOS는 소아 환자에게 승인되지 않았습니다) [특정 인구 집단에서의 사용 (8.4) 참조].
- 골다공증을 제외한 대사성 골 질환, 골의 파제트병 포함.
- 뼈 전이 또는 골격 악성 종양의 병력.
- 골격에 대한 이전 외부 빔 또는 이식 방사선 치료.
- 골육종에 대한 유전적 장애.
5.2 기립성 저혈압
TYMLOS는 일반적으로 주사 후 4시간 이내에 기립성 저혈압을 유발할 수 있습니다. 관련 증상으로는 현기증, 두근거림, 빈맥 또는 메스꺼움이 포함될 수 있으며, 환자가 누워 있으면 해소될 수 있습니다. 처음 몇 번의 투여량의 경우, 환자가 필요할 경우 앉거나 누울 수 있는 곳에서 TYMLOS를 투여해야 합니다 [유해 반응 (6.1) 참조].
5.3 고칼슘혈증
TYMLOS는 고칼슘혈증을 유발할 수 있습니다. TYMLOS는 기존의 고칼슘혈증이 있는 환자 또는 원발성 부갑상선 기능 항진증과 같은 기저 고칼슘혈증 장애가 있는 환자에게는 고칼슘혈증 악화 가능성 때문에 권장되지 않습니다 [유해 반응 (6.1) 참조].
5.4 고칼슘뇨증 및 요로결석
TYMLOS는 고칼슘뇨증을 유발할 수 있습니다. TYMLOS가 활성 요로결석 또는 요로결석 병력이 있는 환자에서 요로결석을 악화시킬 수 있는지 여부는 알려져 있지 않습니다. 활성 요로결석 또는 기존의 고칼슘뇨증이 의심되는 경우, 요중 칼슘 배설량 측정을 고려해야 합니다 [유해 반응 (6.1) 참조].
6. 부작용
다음 부작용은 다른 섹션에서 자세히 설명되어 있습니다.
6.1 임상 시험 경험
임상 연구는 매우 다양한 조건에서 수행되므로 약물의 임상 연구에서 관찰된 부작용 발생률을 다른 약물의 임상 연구에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
골다공증이 있는 폐경 후 여성의 임상 시험에서 발생한 부작용
TYMLOS의 안전성은 49세에서 86세(평균 연령 69세)의 골다공증이 있는 폐경 후 여성을 대상으로 한 무작위 배정, 다기관, 이중맹검, 위약 대조 임상 시험에서 평가되었으며, 이들은 18개월 동안 매일 1회 피하 주사로 TYMLOS 80mcg(N=824) 또는 위약(N=821)을 투여받았습니다. [임상 연구 (14.1) 참조].
이 연구에서 모든 원인 사망률은 TYMLOS 그룹에서 0.4%, 위약 그룹에서 0.6%였습니다. 중대한 부작용 발생률은 TYMLOS 그룹에서 10%, 위약 그룹에서 11%였습니다. 부작용으로 인해 연구 약물 투여를 중단한 환자의 비율은 TYMLOS 그룹에서 10%, 위약 그룹에서 6%였습니다. TYMLOS 그룹에서 연구 약물 투여 중단으로 이어진 가장 흔한 부작용은 메스꺼움(2%), 현기증(1%), 두통(1%), 두근거림(1%)이었습니다.
표 1은 시험에서 가장 흔한 부작용을 보여줍니다. 이러한 부작용은 일반적으로 기준선에서 나타나지 않았으며, TYMLOS를 투여받은 환자보다 위약을 투여받은 환자에게 더 흔하게 나타났으며, TYMLOS로 치료받은 환자의 최소 2%에서 발생했습니다.
|
* TYMLOS로 치료받은 환자의 ≥2%에서 보고된 부작용. |
||
| 선호 용어 | TYMLOS (N=822) (%) |
위약 (N=820) (%) |
| 고칼슘뇨증 | 11 | 9 |
| 현기증 | 10 | 6 |
| 메스꺼움 | 8 | 3 |
| 두통 | 8 | 6 |
| 두근거림 | 5 | 0.4 |
| 피로 | 3 | 2 |
| 상복부 통증 | 3 | 2 |
| 현훈 | 2 | 2 |
기립성 저혈압
폐경 후 골다공증 여성을 대상으로 한 임상 시험에서, 첫 번째 주사 후 1시간에 기립성 혈압 저하 ≥20 mmHg 수축기 또는 ≥10 mmHg 이완기가 발생한 빈도는 TYMLOS 그룹에서 4%, 위약 그룹에서 3%였습니다. 이후 시간대에서는 치료 그룹 간에 발생 빈도가 일반적으로 유사했습니다. 기립성 저혈압의 부작용은 TYMLOS를 투여받은 환자의 1%와 위약을 투여받은 환자의 0.5%에서 보고되었습니다. 현기증은 TYMLOS를 투여받은 환자(10%)에서 위약(6%)보다 더 많이 보고되었습니다 [경고 및 주의 사항 (5.2) 참조].
빈맥
폐경 후 골다공증 여성에서, 심방 세동을 포함한 빈맥의 부작용은 TYMLOS를 투여받은 환자의 2%와 위약 그룹의 1%에서 보고되었습니다. 빈맥을 경험한 TYMLOS 투여 환자 13명 중 5명에서 증상이 투여 후 1시간 이내에 발생했습니다. TYMLOS는 주사 후 15분 이내에 발생하고 약 6시간 후에 해소되는 심박수의 용량 의존적 증가와 관련이 있습니다 [임상 약리학 (12.2) 참조].
주사 부위 반응
시험 첫 달 동안 주사 부위 반응은 주사 후 1시간마다 매일 평가되었습니다. TYMLOS는 위약보다 주사 부위 발적(58% 대 28%), 부종(11% 대 3%) 및 통증(10% 대 7%)의 발생률이 더 높았습니다. 심한 발적, 심한 부종 및 심한 통증은 TYMLOS를 투여받은 환자의 2.9%, 0.4% 및 0.4%에서 보고되었습니다.
실험실 이상
고칼슘혈증
폐경 후 골다공증 여성을 대상으로 한 임상 시험에서 TYMLOS는 혈청 칼슘 농도를 증가시켰습니다 [경고 및 주의 사항 (5.3) 참조]. 고칼슘혈증의 발생률은, 모든 방문에서 주사 후 4시간에 알부민 보정 혈청 칼슘 ≥10.7 mg/dL로 정의되며, TYMLOS를 투여받은 환자의 3%와 위약 투여 환자의 0.1%였습니다. 두 그룹 모두 투여 전 혈청 칼슘은 기준선과 유사했습니다. 고칼슘혈증으로 인해 연구에서 중단된 TYMLOS를 투여받은 환자는 2명(0.2%)이었고, 위약을 투여받은 환자는 없었습니다. TYMLOS로 인한 고칼슘혈증의 발생률은 정상 신장 기능을 가진 환자(1%)보다 경증 또는 중등도 신장 장애가 있는 환자(4%)에서 더 높았습니다.
폐경 후 골다공증 여성을 대상으로 한 연장 연구의 부작용
TYMLOS 또는 위약으로 18개월 동안 치료한 후, 1139명의 여성이 일주일에 한 번 경구로 투여되는 알렌드로네이트 70mg 치료로 전환되었습니다. 알렌드로네이트 치료 중에 발생한 부작용의 발생률은 이전에 위약 또는 TYMLOS 치료를 받은 환자에서 유사했습니다 [임상 연구 (14.1) 참조].
골다공증 남성을 대상으로 한 임상 시험의 부작용
TYMLOS의 안전성은 42세에서 85세(평균 연령 68세)의 골다공증 남성을 대상으로 한 무작위 배정, 다기관, 이중 맹검, 위약 대조 임상 시험에서 평가되었으며, 이들은 12개월 동안 매일 피하로 TYMLOS 80mcg(N = 149) 또는 위약(N = 79)을 투여받도록 무작위 배정되었습니다 [임상 연구 (14.2) 참조].
이 연구에서, 두 치료 그룹 모두에서 시험 기간 동안 사망에 이르는 부작용을 경험한 환자는 없었습니다. 심각한 부작용은 TYMLOS를 투여받은 피험자의 5.4%와 위약 그룹의 5.1%에서 보고되었습니다. 연구 약물 중단으로 이어진 부작용은 TYMLOS를 투여받은 환자의 6.7%와 위약을 투여받은 환자의 5.1%에서 보고되었습니다. TYMLOS 그룹에서 연구 약물 중단으로 이어진 가장 흔한 부작용은 현기증(2%)이었습니다.
표 2는 시험에서 가장 흔한 부작용을 보여줍니다. 이러한 부작용은 일반적으로 기준선에 존재하지 않았으며, TYMLOS를 투여받은 경우 위약보다 더 흔하게 발생했으며, TYMLOS를 투여받은 환자의 2% 이상에서 발생했습니다.
기립성 저혈압
골다공증 남성을 대상으로 한 임상 시험에서, 첫 번째 주사 후 1시간에 수축기 혈압이 ≥20 mmHg 또는 이완기 혈압이 ≥10 mmHg 감소하는 기립성 저혈압의 발생률은 TYMLOS 그룹에서 6%, 위약 그룹에서 3%였습니다. 기립성 저혈압의 부작용은 TYMLOS를 투여받은 환자의 1%에서 보고되었고, 위약을 투여받은 환자에서는 0명이었습니다. 현기증은 TYMLOS를 투여받은 환자(9%)에서 위약(1%)보다 더 많이 보고되었습니다. [경고 및 주의 사항 (5.2) 참조].
실험실 이상
고칼슘혈증
골다공증 남성을 대상으로 한 임상 시험에서, TYMLOS는 혈청 칼슘 농도를 증가시켰습니다. [경고 및 주의 사항 (5.3) 참조]. 고칼슘혈증의 발생률은, 임상 방문 시 주사 후 4시간에 알부민 보정 혈청 칼슘이 ≥10.8 mg/dL인 경우로 정의했을 때, TYMLOS를 투여받은 환자의 3%, 위약을 투여받은 환자의 0%였습니다. 두 그룹 모두 투여 전 혈청 칼슘은 기준선과 유사했습니다. 고칼슘혈증의 발생률은, 임상 방문 시 주사 후 4시간에 알부민 보정 혈청 칼슘이 ≥10.8 mg/dL인 경우로 정의했을 때, 경증 또는 중등도 신장애 환자(4%)에서 정상 신장 기능 환자(0%)보다 TYMLOS를 투여받은 환자에서 더 높았습니다.
6.2 시판 후 경험
TYMLOS의 시판 후 사용 중 다음 부작용이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
- 복부 팽만감, 복통
- 변비, 설사, 구토
- 무력증, 졸음, 권태감
- 불면증
- 과민 반응 및 아나필락시스 반응, 호흡 곤란(알레르기 반응과 관련하여)
- 가려움증, 발진
- 전반적인 통증 및 뼈, 관절, 등 및 사지 통증
- 다리 및 등의 근육 경련
- 주사 부위 반응(멍, 출혈, 가려움증 및 발진 포함)
7 약물 상호 작용
특정 약물-약물 상호 작용 연구는 수행되지 않았습니다 [임상 약리학 참조 (12.3)].
8 특정 인구 집단에서의 사용
8.4 소아 사용
TYMLOS의 소아 환자에 대한 안전성 및 유효성은 확립되지 않았습니다. TYMLOS는 골육종의 기저 위험이 증가하기 때문에 골단이 열려 있는 소아 환자 또는 골육종에 걸릴 위험이 있는 유전 질환이 있는 소아 환자에게 사용하지 않는 것이 좋습니다. [경고 및 주의 사항 (5.1) 참조].
8.5 노인 사용
TYMLOS의 폐경 후 골다공증 임상 연구에 참여한 환자 중 82%가 65세 이상이었고 19%가 75세 이상이었습니다. 남성 골다공증 연구에서 74%가 65세 이상이었고 23%가 75세 이상이었습니다. 이러한 대상과 젊은 대상 간에 안전성 또는 유효성에 대한 전반적인 차이가 관찰되지 않았지만 일부 노인의 민감성이 더 높을 가능성을 배제할 수 없습니다.
8.6 신장애
경증, 중등증 또는 중증 신장애 환자의 경우 용량 조절이 필요하지 않습니다. 정상 신장 기능 또는 경증, 중등증 또는 중증 신장애가 있는 대상을 대상으로 TYMLOS 80 mcg를 피하 주사로 단일 투여한 연구를 수행했습니다. 아발파라타이드의 최대 농도(Cmax)와 농도-시간 곡선 아래 면적(AUC)은 정상 신장 기능이 있는 대상에 비해 중증 신장애가 있는 대상에서 각각 1.4배 및 2.1배 증가했습니다. 중증 신장애 환자는 아발파라타이드 노출이 증가하여 부작용 위험이 증가할 수 있으므로 부작용을 모니터링해야 합니다. [임상 약리학 (12.3) 참조].
10 과량 투여
임상 연구에서 1일 400mcg(권장 임상 용량의 5배)을 투여받은 환자에서 우발적인 과량 투여가 보고되었으며, 투여는 일시적으로 중단되었습니다. 환자는 무력증, 두통, 메스꺼움, 현기증을 경험했습니다. 과량 투여 당일에는 혈청 칼슘을 평가하지 않았지만, 다음 날 환자의 혈청 칼슘은 정상 범위였습니다. 과량 투여의 영향에는 고칼슘혈증, 메스꺼움, 구토, 현기증, 빈맥, 기립성 저혈압, 두통이 포함될 수 있습니다.
과량 투여 관리
TYMLOS의 특이적인 해독제는 없습니다. 의심되는 과량 투여의 치료에는 TYMLOS의 중단, 혈청 칼슘 및 인 수치 모니터링, 수분 공급과 같은 적절한 지지 요법의 시행이 포함되어야 합니다. 분자량, 혈장 단백질 결합 및 분포 용적을 기준으로 할 때, 아발로파라티드는 투석 가능할 것으로 예상되지 않습니다.
11 설명
피하 주사용 TYMLOS 주사제는 합성 34개 아미노산 펩타이드인 아발로파라타이드를 함유하고 있습니다. 아발로파라타이드는 인간 부갑상선 호르몬 관련 펩타이드인 PTHrP(1-34)의 유사체입니다. hPTH(1-34)(인간 부갑상선 호르몬 1-34)와 41%의 상동성을 가지고 있으며 hPTHrP(1-34)(인간 부갑상선 호르몬 관련 펩타이드 1-34)와 76%의 상동성을 가지고 있습니다.
아발로파라타이드의 분자식은 C174H300N56O49이며 분자량은 3961 달톤이며 아래에 표시된 아미노산 서열을 가지고 있습니다.
- Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-Arg-Arg-Arg-Glu-Leu-Leu-Glu-Lys-Leu-Leu-Aib-Lys-Leu-His-Thr-Ala-NH2
TYMLOS 주사제는 일회용 단일 환자용 펜에 미리 조립된 유리 카트리지에 무균, 무색, 투명 용액으로 제공됩니다. 펜은 40 mcL의 80 mcg의 일일 아발로파라타이드 용량 30회를 제공하도록 설계되었습니다. 각 카트리지에는 3.12 mg의 아발로파라타이드를 함유한 1.56 mL의 TYMLOS 용액이 들어 있으며, 다음과 같은 비활성 성분이 포함되어 있습니다. 9.95 mg 아세트산 99%, 7.8 mg 페놀, 7.92 mg 아세트산나트륨 삼수화물 및 주사용수(목표 pH 범위 5.1~5.2).
12. 임상 약리
12.1 작용 기전
Abaloparatide는 PTH1 수용체(PTH1R)에서 작용제로 작용하는 PTHrP(1-34) 유사체입니다. 그 결과 표적 세포에서 cAMP 신호 전달 경로가 활성화됩니다. Abaloparatide를 1일 1회 투여하면 조골 세포 활성 자극을 통해 해면골 및 피질골 표면에서 새로운 뼈 형성이 촉진됩니다. 쥐와 원숭이에서 abaloparatide는 척추 및/또는 비척추 부위의 골 강도 증가와 관련된 BMD 및 골밀도(BMC)의 증가로 입증된 바와 같이 뼈에 대한 동화 작용을 나타냈습니다. [13.2 비임상 독성학 참조].
12.2 약력학
골 교체 표지자에 대한 영향
폐경 후 골다공증 여성을 대상으로 24주 동안 abaloparatide를 1일 1회 투여한 용량 발견 연구에서 BMD 및 골 형성 표지자에 대한 용량 반응 관계가 나타났습니다.
폐경 후 골다공증 여성에게 TYMLOS를 18개월 동안 매일 투여한 결과 골 형성 표지자인 혈청 프로콜라겐 유형 I N-프로펩티드(sPINP)와 골 흡수 표지자인 혈청 콜라겐 유형 I 교차 결합 C-텔로펩티드(sCTX)가 증가했습니다. 폐경 후 여성의 경우 평균 sPINP 수치 증가는 1개월째에 기준치보다 93% 높았다가 18개월째에는 기준치보다 45% 높은 수준으로 시간이 지남에 따라 천천히 감소했습니다. 폐경 후 여성의 경우 평균 sCTX 수치 증가는 3개월째에 기준치보다 26% 높았다가 18개월째에는 기준치 수준으로 감소했습니다.
골다공증 남성에게 TYMLOS를 12개월 동안 매일 투여한 결과 골 형성 표지자인 sPINP와 골 흡수 표지자인 sCTX가 증가했습니다. 남성의 경우 평균 sPINP 수치 증가는 1개월째에 기준치보다 133% 높았다가 12개월째에는 기준치보다 84% 높은 수준으로 시간이 지남에 따라 천천히 감소했습니다. 남성의 경우 평균 sCTX 수치 증가는 6개월째에 기준치보다 46% 높았고 12개월째에는 기준치보다 35% 높았습니다.
심장 전기 생리학
플라시보, 80mcg 및 240mcg(권장 용량의 3배)의 피하 주사 abaloparatide, 경구 moxifloxacin 400mg을 단회 투여받은 건강한 피험자 55명을 대상으로 4방향 교차 완전 QT/QTc 연구를 수행했습니다. Abaloparatide는 심박수를 증가시켰으며, 80mcg 및 240mcg 투여 후 첫 번째 시점(15분)에서 평균 최대 증가는 각각 분당 15회(bpm) 및 20bpm이었습니다. Abaloparatide는 QTcI(개별적으로 보정된 QT 간격) 또는 심장 전기 생리학에 임상적으로 유의미한 영향을 미치지 않았습니다.
12.3 약동학
Abaloparatide 80mcg를 7일 동안 피하 투여한 후 폐경 후 골다공증 여성의 경우 평균(SD) abaloparatide 노출은 Cmax의 경우 812(118)pg/mL, AUC0–24의 경우 1622(641)pg∙hr/mL였습니다.
흡수
피하 투여 후 abaloparatide 80mcg의 최고 농도에 도달하는 데 걸리는 중앙값(범위) 시간은 0.51시간(0.25~0.52시간)이었습니다. 80mcg 용량을 피하 투여한 후 건강한 여성에서 abaloparatide의 절대 생체 이용률은 36%였습니다.
특정 집단
남성 및 여성 피험자
평균(±SD) 연령이 53.1(±6.9)세인 건강한 남성을 대상으로 수행한 연구에서 관찰된 평균 혈청 abaloparatide 농도-시간 프로파일은 동일한 투여 요법을 사용하여 평균(±SD) 연령이 53.7(±7.1)세인 건강한 여성에서 관찰된 것과 유사했습니다.
신장애 환자
경도 신장애 환자 8명(CLCr 60~89mL/min), 중등도 신장애 환자 7명(CLCr 30~59mL/min), 중증 신장애 환자 8명(CLCr 15~29mL/min), 성별, 연령 및 체질량 지수(BMI)가 일치하는 정상 신기능을 가진 건강한 대상자 8명(CLCr 90mL/min 이상)에게 단회 용량 80mcg의 아발로파라티드를 피하 투여했습니다. 정상 신기능을 가진 건강한 대상자에 비해 경도, 중등도 및 중증 신장애 환자에서 아발로파라티드 Cmax는 각각 1.0배, 1.3배 및 1.4배 증가했습니다. 정상 신기능을 가진 건강한 대상자에 비해 경도, 중등도 및 중증 신장애 환자에서 아발로파라티드 AUC는 각각 1.2배, 1.7배 및 2.1배 증가했습니다. 투석을 받는 환자는 연구에 포함되지 않았습니다.
12.6 면역원성
관찰된 항약물 항체 발생률은 분석의 민감도 및 특이도에 따라 크게 달라집니다. 분석 방법의 차이로 인해 아래에 설명된 연구에서의 항약물 항체 발생률과 아발로파라티드 또는 다른 아발로파라티드 제품에 대한 다른 연구에서의 항약물 항체 발생률을 의미 있게 비교할 수 없습니다.
폐경 후 골다공증 여성
18개월 동안 TYMLOS를 투여받은 환자 중 41%(318/773)에서 항아발로파라티드 항체가 발생했으며 26%(204/773)에서 아발로파라티드에 대한 중화 항체가 발생했습니다. 교차 반응성 검사를 받은 항아발로파라티드 항체를 가진 환자 중 2.4%(7/297)에서 PTHrP에 대한 교차 반응성이 발생했으며, 이 중 7명 중 3명에서 PTHrP에 대한 중화 항체가 발생했습니다. 0.3%(1/297)만이 PTH에 대한 교차 반응 항체를 발생시켰으며, 이는 PTH를 중화하지 않았습니다. 항체 형성은 골밀도(BMD) 반응, 골절 감소 또는 이상 반응을 포함한 안전성 또는 유효성 평가 변수에 임상적으로 유의미한 영향을 미치지 않는 것으로 나타났습니다.
TYMLOS 치료 중 항아발로파라티드 항체가 있는 환자의 대부분(86%[275/318])은 TYMLOS 치료 완료 후 6개월마다 항체 음성으로 혈청 전환되거나 추적 관찰이 손실될 때까지 추적 항체 측정을 받았습니다. 이러한 환자 중 127명은 치료 중단 후 1년째에도 항체 양성을 유지했고, 55명은 2년째에도 항체 양성을 유지했으며, 6명은 3년째에도 항체 양성을 유지했습니다.
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
2년 발암성 연구에서 아발파라타이드를 수컷 및 암컷 피셔 랫트에 10, 25 및 50 mcg/kg의 용량으로 하루에 한 번 피하 주사했습니다. 이러한 용량은 80 mcg의 권장 피하 용량을 투여한 후 사람에서 관찰된 전신 노출의 각각 4, 16 및 28배에 해당하는 아발파라타이드에 대한 전신 노출을 초래했습니다(AUC 비교 기준). 아발파라타이드로 치료한 것과 관련된 신생물 변화는 모든 수컷 및 암컷 용량 그룹에서 골육종 및 골아세포종 발생률의 현저한 용량 의존적 증가로 구성되었습니다. 골육종의 발생률은 치료하지 않은 대조군에서 0-2%였으며 수컷 및 암컷 고용량 그룹에서 각각 87% 및 62%에 도달했습니다. 뼈 신생물은 뼈 질량의 현저한 증가를 동반했습니다.
랫트에서 얻은 결과가 사람에게 미치는 영향은 불확실합니다. TYMLOS는 골육종 위험이 증가한 환자에게 사용하지 않는 것이 좋습니다 [경고 및 주의 사항 (5.1) 참조].
돌연변이 유발성
아발파라타이드는 박테리아 돌연변이 유발에 대한 Ames 검사, 인간 말초 림프구를 사용한 염색체 이상 검사 및 마우스 소핵 검사를 포함한 표준 검사 배터리에서 유전 독성 또는 돌연변이 유발성이 없었습니다.
생식능력 저해
아발파라타이드가 암컷 생식 능력에 미치는 영향은 비임상적으로 평가되지 않았습니다. 수컷 랫트에서 아발파라타이드가 수컷 생식 능력에 미치는 부작용은 관찰되지 않았습니다. 수컷 랫트 생식 능력 연구에서 아발파라타이드를 교미 전 2주, 교미 기간 동안 및 교미 기간 후 약 2주 동안(총 6주) 10, 25 및 70 µg/kg/일의 용량으로 피하 주사했습니다. 아발파라타이드는 70 µg/kg/일(80 mcg의 권장 피하 용량을 투여한 후 사람에서 관찰된 전신 노출의 28배(AUC 비교 기준))까지 교미, 생식 지수, 수태율, 생식 기관 무게 또는 정자 매개변수에 부작용을 일으키지 않았습니다.
13.2 동물 독성 및 약리학
랫트 및 원숭이에서 각각 최대 26주 및 39주 동안 진행된 독성 연구에서 발견된 결과는 혈관 확장, 혈청 칼슘 증가, 혈청 인 감소 및 10 mcg/kg/일 이상의 용량에서 연조직 광물화를 포함했습니다. 10 mcg/kg/일 용량은 랫트 및 원숭이에서 아발파라타이드에 대한 전신 노출을 초래했으며, 이는 각각 80 mcg의 일일 피하 용량으로 사람에게 노출된 것의 2배 및 3배였습니다.
아발파라타이드가 골격에 미치는 약리학적 효과는 난소 절제술(OVX) 랫트 및 원숭이에서 각각 12개월 및 16개월 연구에서 각각 80 mcg의 권장 피하 용량으로 사람에게 노출된 것의 11배 및 1배에 해당하는 용량까지 평가했습니다(AUC 비교 기준). 폐경 후 골다공증의 이러한 동물 모델에서 아발파라타이드로 치료하면 척추 및/또는 비척추 부위에서 뼈 질량이 용량 의존적으로 증가했으며, 이는 뼈 강도 증가와 상관관계가 있습니다. 아발파라타이드의 동화 작용은 골아세포 골 형성의 주요 증가로 인한 것이었으며, 내막 골 형성으로 인한 뼈대 판 두께 및/또는 피질 두께 증가로 입증되었습니다. 아발파라타이드는 평가된 모든 골격 부위에서 뼈 품질을 유지하거나 개선했으며 광물화 결손을 일으키지 않았습니다.
남성 골다공증 모델인 안드로겐 결핍 고환 절제술(ORX) 수컷 랫트에서 8주 연구에서 5 및 25 mcg/kg/일 아발파라타이드(AUC 기준 임상 노출의 47배 이상)의 효과를 골 형성, 뼈 질량 및 뼈 강도에 대해 조사했습니다. 아발파라타이드는 골 형성을 유도하고 뼈 재흡수 매개변수를 증가시키지 않고 피질 및 뼈대 BMD, 기하학 및 구조를 개선했습니다.
14 임상 연구
14.1 폐경 후 골다공증 여성 대상 효능 연구
폐경 후 골다공증 치료를 위한 TYMLOS의 효능은 49~86세(평균 연령 69세)의 폐경 후 여성을 대상으로 한 18개월, 무작위 배정, 다기관, 이중맹검, 위약 대조 임상시험인 연구 003(NCT 01343004)에서 평가되었습니다. 환자들은 TYMLOS 80mcg(N = 824) 또는 위약(N = 821)을 1일 1회 피하 투여받도록 무작위 배정되었습니다. 환자의 약 80%는 백인, 16%는 아시아인, 3%는 흑인이었으며, 24%는 히스패닉이었습니다. 기준 요추의 평균 T-점수는 -2.9점, 대퇴골 경부는 -2.1점, 전체 고관절은 -1.9점이었습니다. 기준 시점에서 환자의 24%는 하나 이상의 유병률 척추 골절이 있었고 48%는 하나 이상의 이전 비척추 골절이 있었습니다. 환자들은 매일 칼슘(500~1,000mg)과 비타민 D(400~800IU)를 보충적으로 섭취했습니다.
효능 연구는 연구 003을 완료한 환자의 92%인 1,139명의 환자가 등록된 공개 라벨 연구인 연구 005(NCT 01657162)로 확장되었습니다. 여기에는 이전에 TYMLOS를 투여받았던 환자 558명과 이전에 위약을 투여받았던 환자 581명이 포함되었습니다. 누적 25개월 효능 데이터 세트에는 연구 003에서 TYMLOS 또는 위약에 18개월 동안 노출된 후 1개월 동안 치료를 받지 않고 연구 005에서 6개월 동안 알렌드로네이트 요법을 받은 것이 포함되었습니다. 그런 다음 연구 005는 환자가 더 이상 원래 연구 003 치료군에 대해 맹검되지 않은 상태에서 18개월 동안 알렌드로네이트를 추가로 투여받는 것으로 계속되었습니다.
새로운 척추 골절에 대한 효과
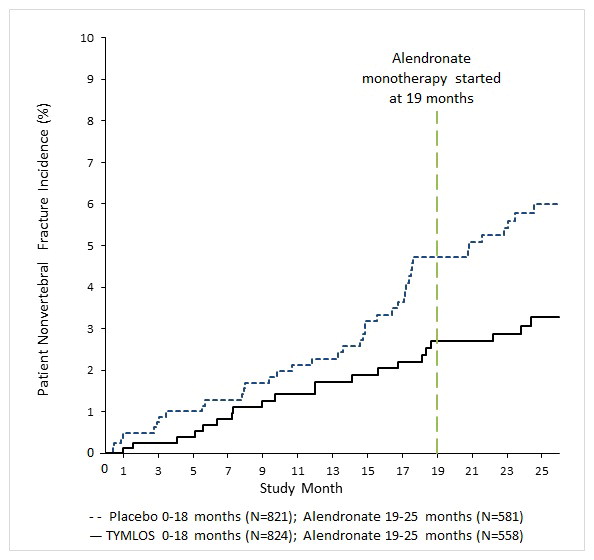
1차 평가변수는 위약군과 비교하여 TYMLOS로 치료받은 환자에서 새로운 척추 골절 발생률이었습니다. TYMLOS는 18개월 시점에 위약에 비해 새로운 척추 골절 발생률을 유의하게 감소시켰습니다(TYMLOS 0.6% 대 위약 4.2%, p <0.0001). 18개월 시점에 새로운 척추 골절의 절대적 위험 감소는 3.6%였고, 위약에 비해 TYMLOS의 상대적 위험 감소는 86%였습니다(표 3). 25개월 시점에 새로운 척추 골절 발생률은 TYMLOS를 투여받은 후 알렌드로네이트를 투여받은 환자군에서 0.6%였던 반면, 위약을 투여받은 후 알렌드로네이트를 투여받은 환자군에서는 4.4%였습니다(p <0.0001). 25개월 시점에 새로운 척추 골절의 상대적 위험 감소는 위약을 투여받은 후 알렌드로네이트를 투여받은 환자군에 비해 TYMLOS를 투여받은 후 알렌드로네이트를 투여받은 환자군에서 87%였고, 절대적 위험 감소는 3.9%였습니다(표 3). 24개월 간의 공개 라벨 알렌드로네이트 요법 후 TYMLOS 요법으로 달성한 척추 골절 위험 감소가 유지되었습니다.
척추 외 골절에 대한 효과
TYMLOS는 18개월 치료 및 이후 약물을 투여하지 않은 1개월의 추적 관찰 기간 말에 척추 외 골절 발생률을 유의하게 감소시켰습니다(TYMLOS 치료 환자 2.7% 대 위약 치료 환자 4.7%). 위약과 비교하여 TYMLOS의 척추 외 골절 상대 위험 감소율은 43%(로그 순위 검정 p = 0.049)였으며 절대 위험 감소율은 2.0%였습니다.
연구 005에서 6개월간의 알렌드로네이트 치료 후 25개월 시점에서 척추 외 골절의 누적 발생률은 이전 TYMLOS 그룹 여성의 경우 2.7%였고 이전 위약 그룹 여성의 경우 5.6%였습니다(그림 1). 25개월 시점에서 척추 외 골절의 상대 위험 감소율은 52%(로그 순위 검정 p = 0.017)였으며 절대 위험 감소율은 2.9%였습니다.
그림 1: 25개월 동안의 척추 외 골절 누적 발생률1(치료 의향 집단)2
TYMLOS는 연령, 폐경 후 기간, 이전 골절(척추, 척추 외)의 유무 및 기준 시점에서의 BMD와 관계없이 척추 및 척추 외 골절 위험을 지속적으로 감소시켰습니다.
골밀도(BMD)에 대한 효과
연구 003에서 18개월 동안 TYMLOS로 치료한 결과 요추, 전체 고관절 및 대퇴골 경부에서 위약에 비해 BMD가 유의하게 증가했으며, 각각 p<0.0001였습니다(표 4). 연구 005에서 6개월간의 알렌드로네이트 치료 후에도 유사한 결과가 나타났습니다(표 4).
|
* 연구 003에 무작위 배정된 환자 포함 |
|||
|
† 연구 005에 등록된 환자 포함 |
|||
|
‡ 최종 관찰 이월 |
|||
|
§ 신뢰 구간 |
|||
| TYMLOS (N=824*) (%) |
위약 (N=821*) (%) |
치료 차이 (%) (95% CI§) |
|
| 18개월 | |||
| 요추 | 9.2 | 0.5 | 8.8 (8.2, 9.3) |
| 전체 고관절 | 3.4 | -0.1 | 3.5 (3.3, 3.8) |
| 대퇴골 경부 | 2.9 | -0.4 | 3.3 (3.0, 3.7) |
| TYMLOS/ 알렌드로네이트 (N=558†) (%) |
위약/ 알렌드로네이트 (N=581†) (%) |
||
| 25개월 | |||
| 요추 | 12.8 | 3.5 | 9.3 (8.6, 10.1) |
| 전체 고관절 | 5.5 | 1.4 | 4.1 (3.7, 4.5) |
| 대퇴골 경부 | 4.5 | 0.5 | 4.1 (3.6, 4.6) |
나이, 폐경 후 기간, 인종, 민족, 지역, 과거 골절(척추, 비척추) 유무 및 기준치 BMD로 정의된 하위 그룹에서 TYMLOS의 BMD에 대한 효과 차이의 증거는 없었습니다.
14.2 골다공증이 있는 남성
골다공증이 있는 남성의 치료를 위한 TYMLOS의 효능은 42~85세(평균 연령 68세)의 남성을 대상으로 12개월 동안 무작위 배정, 다기관, 이중맹검, 위약 대조 임상시험으로 실시된 연구 019(NCT 03512262)에서 평가되었습니다. 이들은 TYMLOS 80mcg(N = 149) 또는 위약(N = 79)을 1일 1회 피하 투여받도록 무작위 배정되었습니다. 환자의 약 95%는 백인이었고, 4%는 아시아인이었으며, 1% 미만(0.4%)은 흑인이었습니다. 16%는 히스패닉이었습니다. 기준치에서 평균 T 점수는 요추에서 -2.1, 대퇴골 경부에서 -2.1, 전체 고관절에서 -1.7이었습니다. 환자들은 매일 칼슘(500~1,000mg)과 비타민 D(400~800IU)를 보충적으로 섭취했습니다.
골밀도(BMD)에 대한 효과
1차 평가변수는 위약과 비교하여 TYMLOS로 치료받은 환자에서 12개월째 요추 BMD의 기준치 대비 백분율 변화였습니다. 연구 019에서 12개월 동안 TYMLOS로 치료한 결과 표 5에서 볼 수 있듯이 요추, 전체 고관절 및 대퇴골 경부에서 위약에 비해 BMD가 유의하게 증가했으며, 각각 p<0.0001이었습니다.
| TYMLOS (N=149*) (%) |
위약 (N=79*) (%) |
치료 차이 (%) (99% CI†) |
|
|---|---|---|---|
| 12개월 | |||
| 요추 | 8.5 | 1.2 | 7.3 (5.1, 9.6) |
| 전체 고관절 | 2.1 | <0.1 | 2.1 (1.0, 3.2) |
| 대퇴골 경부 | 3.0 | 0.2 | 2.8 (1.4, 4.2) |
12개월째 나이, 인종, 민족, 지역, 과거 골절 유무 및 기준치 BMD로 정의된 하위 그룹에서 TYMLOS의 BMD에 대한 효과 차이의 증거는 없었습니다.
16. 공급/보관 및 취급
16.1 공급 형태
TYMLOS (abaloparatide) 주사제는 투명하고 무색의 용액으로, 사용 설명서 및 약물 안내서가 포함된 판지 상자 (NDC 70539-001-02)에 포장된 일회용 사전 조립된 단일 환자용 펜 (NDC 70539-001-01)으로 제공됩니다. 각 일회용 펜은 1.56mL (2000mcg/mL)에 abaloparatide 3120mcg를 함유한 유리 카트리지를 포함합니다. 각 펜은 40mcL에 abaloparatide 80mcg를 하루 한 번 주사하는 30일 분량을 제공합니다.
멸균 바늘은 포함되어 있지 않습니다.
16.2 보관 및 취급
- 최초 사용 전에는 TYMLOS를 2°C에서 8°C (36°F에서 46°F) 사이의 냉장 보관하십시오.
- 최초 사용 후에는 20°C에서 25°C (68°F에서 77°F) 사이에서 최대 30일 동안 보관하십시오.
- 동결하거나 열에 노출시키지 마십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(약물 안내 및 사용 지침)을 읽도록 알려주십시오.
골육종 위험
TYMLOS의 활성 성분인 아발로파라타이드는 수컷 및 암컷 랫드에서 골육종 발생률을 용량 의존적으로 증가시켰으며, TYMLOS가 사람에게 골육종을 유발하는지 여부는 알려져 있지 않습니다 [경고 및 주의 사항 (5.1) 참조].
환자에게 지속적인 국소 통증 또는 촉진 시 통증이 있는 새로운 연조직 종양과 같은 골육종의 가능한 징후와 증상을 즉시 보고하도록 지시하십시오.
고칼슘혈증
환자에게 TYMLOS가 고칼슘혈증을 유발할 수 있으며 고칼슘혈증의 증상(예: 메스꺼움, 구토, 변비, 졸음, 근력 저하)에 대해 논의하십시오 [경고 및 주의 사항 (5.3) 참조].
환자에게 고칼슘혈증의 징후와 증상을 즉시 보고하도록 지시하십시오.
기립성 저혈압
환자에게 주사 후 현기증이나 두근거림이 느껴지면 증상이 사라질 때까지 앉거나 누워 있도록 알려주십시오. 이러한 증상이 지속되거나 악화되면 환자에게 치료를 계속하기 전에 의료 서비스 제공자에게 문의하도록 알려주십시오 [용법 및 투여량 (2.2) 참조].
과민 반응
환자에게 아나필락시스, 호흡 곤란 또는 두드러기 등 과민 반응의 징후나 증상이 나타나면 즉시 의료 서비스를 받도록 알려주십시오 [금기 사항 (4) 및 이상 반응 (6.2) 참조].
TYMLOS 펜 사용
TYMLOS를 투여하는 환자와 보호자에게 TYMLOS 펜을 올바르게 사용하는 방법과 날카로운 물건 폐기 권장 사항을 따르도록 지시하십시오 [용법 및 투여량 (2.2) 참조]. 환자에게 TYMLOS 펜이나 바늘을 다른 환자와 공유하지 말고 펜의 내용물을 주사기에 옮기지 말라고 알려주십시오.
환자에게 각 TYMLOS 펜은 최대 30일 동안 사용할 수 있으며, 30일 사용 기간이 지나면 사용하지 않은 용액이 남아 있어도 TYMLOS 펜을 폐기하도록 알려주십시오 [포장 단위/보관 및 취급 (16.2) 참조].
제조사:
Radius Health, Inc.
22 Boston Wharf Road, 7th Floor
Boston, MA 02210
TYMLOS는 Radius Health, Inc.의 등록 상표입니다.
Copyright © 2023, Radius Health, Inc. All rights reserved.
개정: 2023년 12월
US-PI-000001-v10.0
약물 안내문
| MEDICATION GUIDE TYMLOS® (tim lows’) (abaloparatide) injection, for subcutaneous use |
||
|
TYMLOS에 대해 알아야 할 가장 중요한 정보는 무엇입니까? TYMLOS는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
|
||
| TYMLOS는 무엇입니까?
TYMLOS는 다음과 같은 경우에 사용되는 처방약입니다.
TYMLOS가 18세 이하 어린이에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. TYMLOS는 뼈가 아직 성장하고 있는 어린이와 청소년에게 사용해서는 안 됩니다. |
||
TYMLOS를 복용하지 마십시오.
|
||
TYMLOS를 복용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. |
||
TYMLOS는 어떻게 사용해야 합니까?
|
TYMLOS는 다음과 같은 심각한 부작용을 유발할 수 있습니다.
- “TYMLOS에 대해 알아야 할 가장 중요한 정보는 무엇입니까?”를 참조하십시오.
- 체위 변화 시 혈압 저하. 일부 사람들은 TYMLOS 주사를 맞은 직후 현기증, 심박수 증가 또는 어지러움을 느낄 수 있습니다. 이러한 증상은 일반적으로 몇 시간 안에 사라집니다. 이러한 증상이 나타나면 즉시 앉거나 누울 수 있는 곳에서 TYMLOS 주사를 맞으십시오. 증상이 악화되거나 사라지지 않으면 TYMLOS 복용을 중단하고 의료 서비스 제공자에게 연락하십시오.
- 혈중 칼슘 증가(고칼슘혈증). TYMLOS는 일부 사람들에게 정상보다 높은 혈중 칼슘 수치를 유발할 수 있습니다. 의료 서비스 제공자는 TYMLOS 치료를 시작하기 전과 치료 중에 혈중 칼슘 수치를 확인할 수 있습니다. 메스꺼움, 구토, 변비, 무기력 또는 근육 약화가 나타나면 의료 서비스 제공자에게 알리십시오. 이는 혈중 칼슘 수치가 너무 높다는 신호일 수 있습니다.
- 요중 칼슘 증가(고칼슘뇨증). TYMLOS는 일부 사람들에게 정상보다 높은 요중 칼슘 수치를 유발할 수 있습니다. 칼슘 수치가 증가하면 신장, 방광 또는 요로에 결석(요로결석)이 생길 수도 있습니다. 허리 아래 또는 배 아래 통증, 배뇨 시 통증 또는 혈뇨와 같은 신장 결석 증상이 나타나면 즉시 의료 서비스 제공자에게 알리십시오.
폐경 후 골다공증 여성에서 TYMLOS의 가장 흔한 부작용은 다음과 같습니다.
- 현기증
- 심박수 증가
- 상복부 통증
- 메스꺼움
- 피로감(피로)
- 현기증(현훈)
- 두통
골다공증 남성에서 TYMLOS의 가장 흔한 부작용은 다음과 같습니다.
- 주사 부위 발적
- 주사 부위 통증
- 메스꺼움
- 현기증
- 멍
- 복통
- 관절 통증
- 복부 팽만감
- 뼈 통증
- 주사 부위 부종
- 설사
이것들은 TYMLOS의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088.
- 최초 사용 전, TYMLOS 펜을 냉장고에 36°F~46°F(2°C~8°C)에서 보관하십시오.
- 최초 사용 후, TYMLOS 펜을 실온 68°F~77°F(20°C~25°C)에서 최대 30일 동안 보관하십시오.
- 냉동하지 마십시오 TYMLOS 펜 또는 열에 노출시키지 마십시오.
- 펜과 포장에 인쇄된 유효 기한이 지난 TYMLOS는 사용하지 마십시오.
- 약이 남아 있어도 30일 후에는 TYMLOS 펜을 버리십시오( “사용 지침” 참조).
TYMLOS와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
의약품은 때때로 약물 안내에 나열된 목적 이외의 목적으로 처방됩니다. TYMLOS는 처방받지 않은 질환에 사용하지 마십시오. TYMLOS를 다른 사람에게 주지 마십시오. 같은 질환이 있어도 해로울 수 있습니다.
약사 또는 의료 서비스 제공자에게 의료 전문가를 위한 TYMLOS 정보를 요청할 수 있습니다.
활성 성분: abaloparatide
비활성 성분: 아세트산, 페놀, 아세트산나트륨 3수화물 및 주사용수.
Radius Health, Inc., 22 Boston Wharf Road, 7th Floor, Boston, MA 02210
TYMLOS는 Radius Health, Inc.의 등록 상표입니다. US-MG-000001 v8.0
Copyright © 2023, Radius Health, Inc. All rights reserved.
TYMLOS에 대한 자세한 내용은 웹사이트 www.TYMLOS.com을 방문하거나 Radius Health, Inc.에 1-855-672-3487로 전화하십시오.
사용 설명서
사용 지침
TYMLOS® (타임 로스)
(아발로파라타이드)
주사제, 피하 주사용
사용 지침
TYMLOS 펜을 올바르게 주사하기 위해 이 사용 지침을 읽고 따르십시오. TYMLOS 펜을 올바르게 사용하는 방법에 대한 질문이 있으면 의료 서비스 제공자에게 문의하십시오.
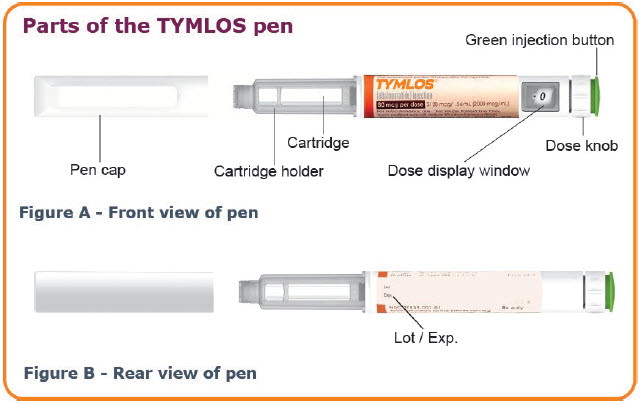
TYMLOS 펜에 대한 중요 정보
- 의료 서비스 제공자로부터 TYMLOS 펜을 올바르게 사용하는 방법에 대한 교육을 받을 때까지 스스로 TYMLOS를 주사하려고 하지 마십시오.
- 바늘을 교체했더라도 다른 사람과 TYMLOS 펜이나 펜 바늘을 공유하지 마십시오. 다른 사람에게 심각한 감염을 일으키거나 다른 사람으로부터 심각한 감염을 얻을 수 있습니다.
- 각 TYMLOS 펜은 30회 분량의 TYMLOS가 미리 채워진 펜입니다. 각 용량에는 80 mcg의 TYMLOS가 포함됩니다. 용량을 측정할 필요가 없습니다. 펜이 각 용량의 TYMLOS를 측정합니다.
- 각 주사에 새 펜 바늘을 사용하십시오. 펜을 사용하지 않을 때는 TYMLOS 펜에 캡을 씌워 두십시오.
- 펜을 사용하기 전에 항상 라벨을 확인하여 TYMLOS 펜인지 확인하십시오.
- TYMLOS 펜이 손상된 것처럼 보이면 사용하지 마십시오. TYMLOS 펜을 떨어뜨리거나 손상된 경우 의료 서비스 제공자 또는 약사에게 연락하거나 1-855-672-3487로 전화하십시오.
- TYMLOS 펜을 청소하려면 필요한 경우 깨끗하고 축축한 천으로 펜의 외부를 닦으십시오.
- TYMLOS 펜은 펜을 올바르게 사용하는 방법에 대한 교육을 받은 사람의 도움 없이는 시각 장애인이나 시력이 좋지 않은 사람이 사용하는 것이 좋지 않습니다.
TYMLOS 펜과 함께 사용할 펜 바늘
- 펜 바늘은 포함되어 있지 않습니다 TYMLOS 펜과 함께. 약국에서 펜 바늘을 구입하려면 의료 서비스 제공자로부터 처방전이 필요합니다.
- TYMLOS 펜과 함께 사용할 수 있는 올바른 바늘은 5~8mm, 31게이지 바늘입니다. 호환 가능한 바늘에는 Clickfine®, BD Ultra-Fine™, MedtFine®, Easy Comfort, Clever Choice™ Comfort EZ™ 및 SureComfort™가 포함됩니다. 사용할 바늘 유형이 확실하지 않으면 의료 서비스 제공자 또는 약사에게 문의하십시오.
TYMLOS 펜을 사용하여 각 주사에 필요한 물품
- 1개의 TYMLOS 펜
- 1개의 펜 바늘
- 1개의 알코올 솜
- 1개의 면봉 또는 거즈 패드
- 펜 바늘과 TYMLOS 펜을 위한 1개의 날카로운 물체 처리 용기. 오른쪽 열의 “펜 바늘과 TYMLOS 펜을 어떻게 버려야 합니까?“를 참조하십시오.
TYMLOS 펜을 어떻게 보관해야 합니까?
- 첫 사용 전, TYMLOS 펜을 냉장고에 36°F~46°F(2°C~8°C)에서 보관하십시오.
- 바늘이 부착된 상태로 펜을 보관하지 마십시오.
- TYMLOS 펜을 냉동하거나 열에 노출시키지 마십시오.
30일 사용 기간 동안:
- 첫 사용 후, TYMLOS 펜을 실온(68°F~77°F, 20°C~25°C)에서 최대 30일 동안 보관하십시오.
- 보관할 때는 TYMLOS 펜에 캡을 씌워 두십시오. 바늘이 부착된 상태로 TYMLOS 펜을 보관하지 마십시오.
- TYMLOS 펜을 30일 동안만 사용하십시오.
- TYMLOS를 처음 사용한 날짜를 여기에 적으십시오: _____/_____/_____. TYMLOS 펜을 처음 개봉한 후 30일이 지나면 사용하지 않은 약이 남아 있어도 버리십시오.
TYMLOS 펜, 펜 바늘 및 모든 약은 어린이의 손이 닿지 않는 곳에 보관하십시오.

- TYMLOS 펜을 FDA 승인 날카로운 물체 처리 용기 또는 천자 방지 용기에 버리십시오. 처음 개봉한 후 30일이 지나면 사용하지 않은 약이 남아 있어도 버리십시오.
- 사용한 펜 바늘을 FDA 승인 날카로운 물체 처리 용기에 즉시 버리십시오. 사용한 날카로운 물체 처리 용기를 가정 쓰레기통에 버리지 마십시오.
- FDA 승인 날카로운 물체 처리 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진
- 날카로운 물체가 밖으로 나오지 않도록 꽉 끼는 천자 방지 뚜껑으로 닫을 수 있는
- 사용 중에 똑바로 서고 안정적인
- 누출 방지 기능이 있으며 용기 내부의 위험한 폐기물을 경고하는 라벨이 적절히 붙어 있는
- 날카로운 물체 처리 용기가 거의 가득 차면 날카로운 물체 처리 용기를 올바르게 버리는 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 바늘, 주사기 및 미리 채워진 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
- 날카로운 물체를 안전하게 버리는 방법에 대한 자세한 내용과 거주하는 주에서 날카로운 물체를 버리는 방법에 대한 구체적인 정보는 FDA 웹사이트(https://www.fda.gov/safesharpsdisposal)를 참조하십시오.
- 지역 사회 지침에서 허용하지 않는 한 사용한 날카로운 물체 처리 용기를 가정 쓰레기통에 버리지 마십시오. 사용한 날카로운 물체 처리 용기를 재활용하지 마십시오.
TYMLOS 펜에 대한 자세한 내용
자세한 내용은 www.TYMLOS.com을 방문하거나 1-855-672-3487로 전화하십시오.
제조사:
Radius
Radius Health, Inc.
22 Boston Wharf Road, 7th Floor
Boston, MA 02210
TYMLOS는 Radius Health, Inc.의 등록 상표입니다.
US-IFU-000001-v8.0
주사 시작.
TYMLOS® 펜 확인
1단계. 손을 씻고 말리십시오.
2단계. TYMLOS 펜의 유효 기간(Exp.)을 확인하십시오.
- 유효 기간이 지난 경우 펜을 사용하지 마십시오.
- 유효 기간이 지난 경우 의료 서비스 제공자 또는 약사에게 연락하십시오.
TYMLOS 펜에 펜 바늘 부착
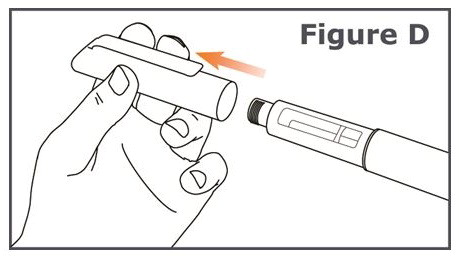
3단계. TYMLOS 펜에서 펜 캡을 벗기십시오. (그림 D 참조).
- TYMLOS 카트리지를 확인하십시오. 액체는 맑고 무색이며 입자가 없어야 합니다. 그렇지 않으면 사용하지 마십시오.
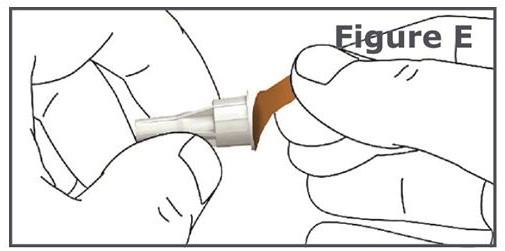
4단계. 펜 바늘의 바깥쪽 바늘 캡에서 보호용 종이를 벗깁니다. (그림 E 참조).
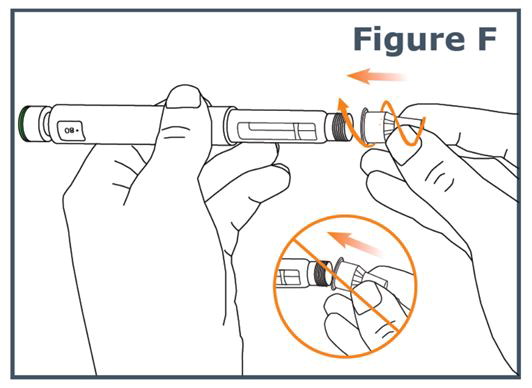
5단계. 바늘을 똑바로 유지하고 펜에 고정될 때까지 돌립니다. 눈에 띄는 정지 지점이 없더라도 단단히 고정됩니다. 너무 세게 조이지 마십시오. (그림 F 참조).
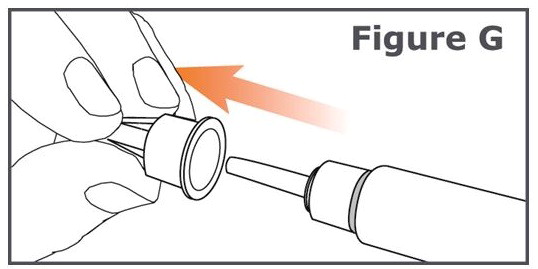
6단계. 펜 바늘에서 바깥쪽 펜 바늘 캡을 벗기고 주사 후 사용할 수 있도록 보관합니다. (그림 G 참조).
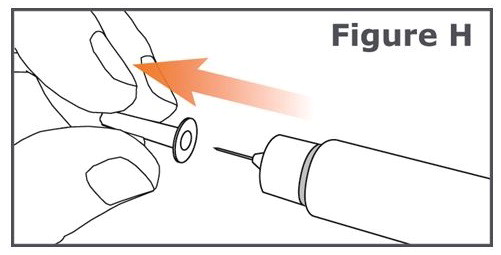
7단계. 안쪽 펜 바늘 캡을 조심스럽게 벗겨 버립니다. (그림 H 참조).
8단계. 이 펜을 처음 사용하는 경우 “새 펜 설정 – 1일차에만 해당” 섹션으로 이동하여 펜을 프라이밍합니다.
- 이 펜을 이미 사용한 적이 있는 경우 2일부터 30일까지 13단계로 이동합니다.
새 펜 설정 – 1일차에만 해당(TYMLOS 펜 프라이밍)

2일부터 30일까지 새 펜 설정을 반복하지 마십시오.
9단계. “새 펜 설정” 은 기포를 제거합니다(펜을 프라이밍합니다). 새 펜마다 1일차에만 펜을 프라이밍해야 합니다. 그렇지 않으면 약물이 낭비됩니다.
- 2일부터 30일까지 10단계부터 12단계까지 건너뜁니다.
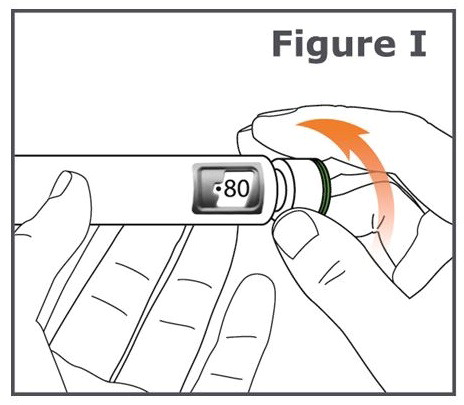
10단계. TYMLOS 펜의 용량 조절 노브를 사용자 쪽에서 멀리(시계 방향) 돌려서 멈출 때까지 돌립니다. (그림 I 참조).
참고: 용량 표시 창에 ” • 80 “이 정렬되어 있는 것을 볼 수 있습니다.
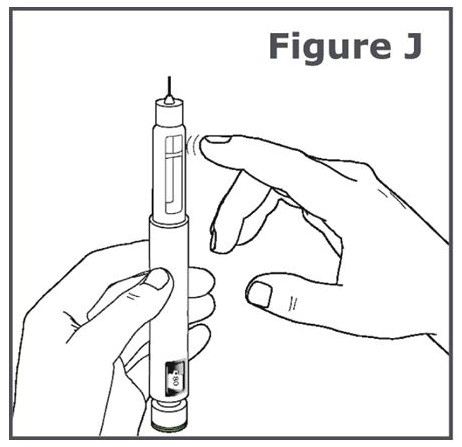
11단계. 펜 바늘이 위로 향하도록 TYMLOS 펜을 잡습니다. 카트리지 홀더를 손가락으로 가볍게 두드려 카트리지에 있는 기포를 카트리지 상단으로 이동시킵니다. (그림 J 참조).
참고: 기포가 보이지 않더라도 11단계를 수행합니다.
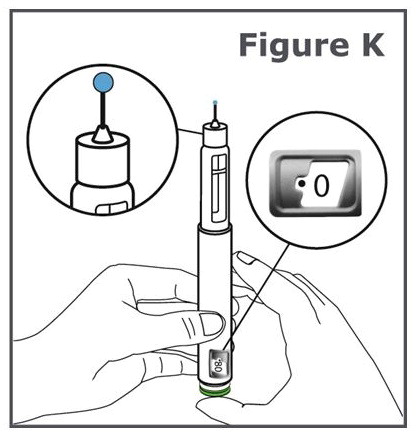
12단계. 녹색 주사 버튼을 더 이상 눌리지 않을 때까지 누릅니다. (그림 K 참조).
참고: 바늘 끝에서 액체가 나오는 것을 볼 수 있습니다.
참고: 용량 표시 창에 “•0″이 정렬되어 있는 것을 볼 수 있습니다.
바늘 끝에서 액체가 나오지 않으면 어떻게 해야 합니까?
- TYMLOS가 한 방울도 보이지 않으면 10단계부터 12단계까지 반복합니다. 액체가 한 방울 나와야 합니다.
- 액체가 한 방울도 보이지 않으면 의료 서비스 제공자나 약사에게 전화하고 새 TYMLOS 펜을 사용합니다.
- 새 TYMLOS 펜을 처음 사용할 준비가 되면 새 TYMLOS 펜을 프라이밍하기 위해 9단계부터 12단계까지 모두 반복해야 합니다.
TYMLOS 펜의 용량 설정
용량을 설정하는 동안 녹색 주사 버튼을 누르지 마십시오.
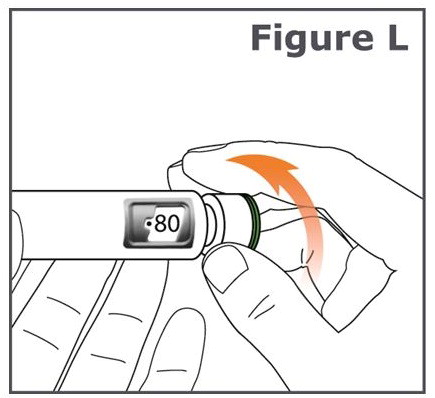
13단계. 펜의 용량 조절 노브를 사용자 쪽에서 멀리(시계 방향) 돌려서 용량 조절 노브가 멈추고 용량 표시 창에 “•80″이 정렬될 때까지 돌립니다. (그림 L 참조).
주사를 준비하기 전에 용량을 설정한 경우 용량 표시 창에 “•0″이 나타날 때까지 용량 조절 노브를 사용자 쪽으로(반시계 방향) 돌립니다.
TYMLOS 펜을 “•80″으로 설정할 수 없는 경우, 펜을 버리고 1단계부터 13단계까지 반복하여 새 TYMLOS 펜을 사용하여 주사합니다.
- 펜을 “•80″으로 설정할 수 없는 경우 TYMLOS 펜에 전체 용량을 주입할 만큼 충분한 약물이 없습니다. 반대쪽에 있는 “펜 바늘과 TYMLOS 펜을 어떻게 버려야 합니까?“를 참조하십시오.
주사 부위를 선택하고 청소합니다
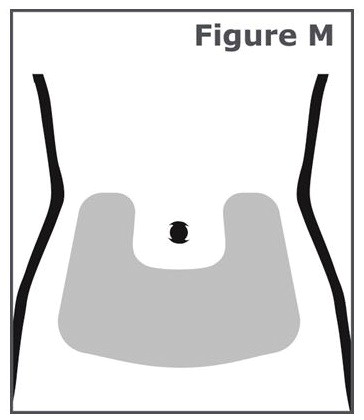
14단계. 주사는 아랫배(복부)에 맞춰야 합니다. (그림 M 참조). 배꼽(배꼽) 주변 2인치 영역은 피하십시오.
각 주사마다 복부 주변의 주사 부위를 바꿔야 합니다. 각 주사에 대한 주사 부위를 바꾸는 방법에 대해 의료 서비스 제공자와 상담하십시오. 각 주사마다 같은 주사 부위를 사용하지 마십시오. 피부가 부드럽거나 멍이 들거나 붉거나 비늘 모양이거나 단단한 부위에는 주사하지 마십시오. 흉터나 튼살이 있는 부위는 피하십시오.
15단계. 알코올 솜으로 주사 부위를 닦고 말립니다. 주사 부위를 청소한 후에는 만지거나 부채질하거나 불지 마십시오.
TYMLOS 펜 주사하기
주사를 하기 전에 16단계와 17단계를 읽으십시오.
의료 서비스 제공자가 보여준 대로 TYMLOS 펜을 주사합니다.
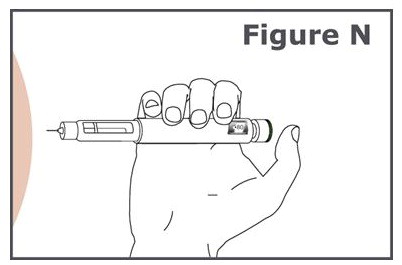
16단계. (그림 N 참조).
- 주사하는 동안 용량 표시 창이 보이도록 펜을 잡습니다.
- 펜 바늘을 피부에 똑바로 삽입합니다.
17단계. (그림 O 참조).
- 녹색 주사 버튼을 더 이상 눌리지 않고 용량 표시 창에 “•0″이 나타날 때까지 누릅니다. 바늘을 삽입한 후에는 TYMLOS 펜을 움직이지 마십시오.
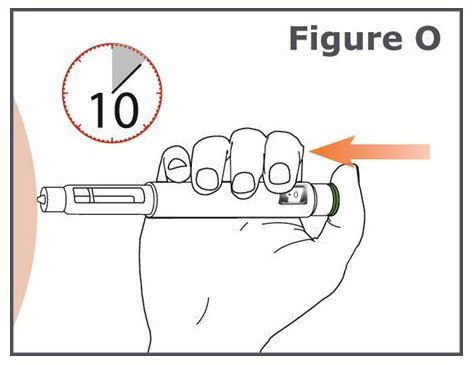
- 10까지 세는 동안 녹색 주사 버튼을 계속 누릅니다. 10까지 세면 TYMLOS의 전체 용량이 주입됩니다.
18단계. 10까지 센 후, 녹색 주사 버튼에서 손가락을 떼고 TYMLOS 펜을 주사 부위에서 펜 바늘을 똑바로 빼내어 천천히 제거합니다.
펜 바늘 제거
19단계. 펜 바늘에 바깥쪽 바늘 캡을 조심스럽게 다시 씌웁니다. 바깥쪽 바늘 캡을 눌러 제자리에 고정될 때까지 누릅니다. (그림 P 참조).
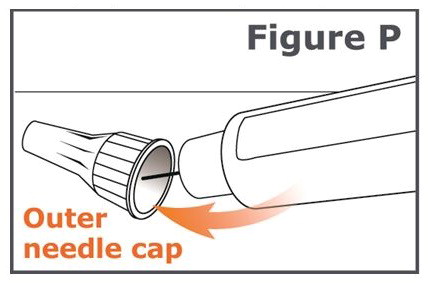
주의: 바늘 찔림 사고를 방지하려면 20단계를 주의 깊게 따르십시오.
20단계. 캡이 씌워진 바늘을 풀어냅니다(병뚜껑을 푸는 것과 같습니다). 캡이 씌워진 바늘을 풀려면 8회 이상 돌려야 할 수도 있으며, 그런 다음 캡이 씌워진 바늘이 떨어질 때까지 부드럽게 당깁니다. (그림 Q 참조).
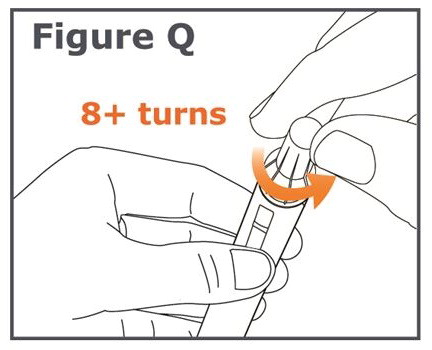
참고: 바늘을 풀 때 바깥쪽 바늘 캡을 누르지 마십시오. 바늘을 풀면 바깥쪽 바늘 캡과 펜 사이의 간격이 넓어지는 것을 볼 수 있습니다. (그림 R 참조).
펜 캡 교체
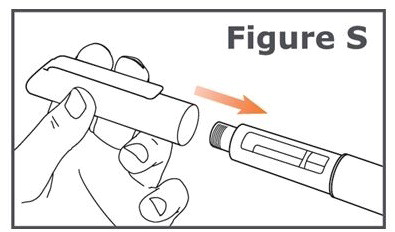
21단계. TYMLOS 펜에 펜 캡을 단단히 다시 씌웁니다. (그림 S 참조).
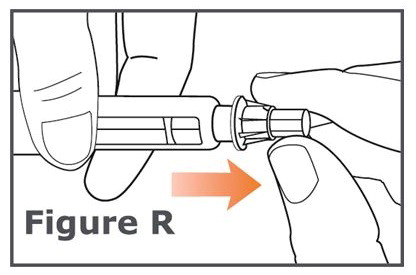
주사 사이에는 TYMLOS 펜에 펜 캡을 씌워 두십시오.
주사 후
22단계. 주사 부위에 솜뭉치나 거즈를 대고 10초 동안 누릅니다. 주사 부위를 문지르지 마십시오. 약간의 출혈이 있을 수 있습니다. 이는 정상입니다.
필요한 경우 주사 부위에 작은 방수 밴드를 붙일 수 있습니다.
- 펜 바늘을 버립니다. “펜 바늘과 TYMLOS 펜은 어떻게 버려야 합니까?“ 를 참조하십시오.
이 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다.
발행: 2021년 4월
주요 표시면 – 80 mcg 사전 충전 펜 라벨
NDC 70539-001-01
Rx only
주사하기 전에 사용 설명서를 읽으십시오.
최초 사용 날짜 ________/________/________.
처음 개봉 후 30일 이내에 사용하지 않은 부분은 폐기하십시오.
TYMLOS®
(abaloparatide) 주사제
1회 투여량당 80 mcg
3120 mcg/1.56 mL (2000 mcg/mL)
피하 사용
환자 1명만 사용
사전 충전된 각 펜은 30회의 피하 주사를 제공합니다.
처음 사용하기 전에 냉장 보관하십시오(2°C – 8°C (36°F – 46°F)).
처음 사용 후에는 20°C – 25°C
(68°F – 77°F)에서 최대 30일 동안 보관하십시오. 얼리거나 열에 노출시키지 마십시오.
제조: Radius Health, Inc.
Boston, MA 02210 USA
10006074-04
제조번호:
사용기한:
주요 표시 패널 – 80 mcg 카톤 라벨
NDC 70539-001-02
TYMLOS®
(아발로파라타이드) 주사제
1회 투여량당 80 mcg
3120 mcg/1.56 mL (2000 mcg/mL)
피하 주사용
단일 환자용
처방전에 의해서만 사용 가능
멸균
1개의 미리 채워진 펜
바늘은 포함되어 있지 않습니다.
각 미리 채워진 펜은
30회의 피하 주사를 제공합니다.
동봉된
약물 안내서
및 사용 지침을
각 환자에게 제공하십시오.
주요 표시 패널 – 샘플 80mcg 사전 충전 펜 라벨
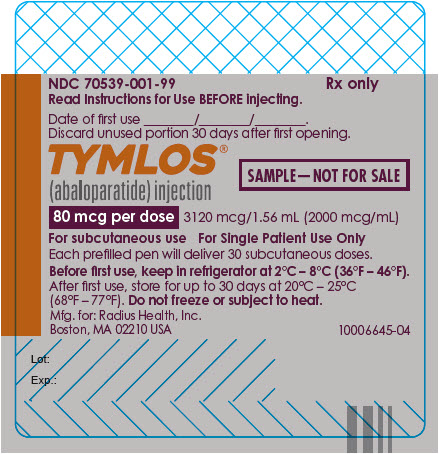
NDC 70539-001-99
처방전 전용
주사하기 전에 사용 설명서를 읽으십시오.
첫 사용 날짜 ________/________/________.
처음 개봉한 후 30일 후에 사용하지 않은 부분은 폐기하십시오.
TYMLOS®
(abaloparatide) 주사액
샘플 – 판매용이 아닙니다.
1회 복용량당 80mcg
3120mcg/1.56mL (2000mcg/mL)
피하 주사용
단일 환자 전용
각 사전 충전 펜은 30회의 피하 주사를 제공합니다.
처음 사용하기 전에 2°C – 8°C (36°F – 46°F)의 냉장고에 보관하십시오.
처음 사용한 후에는 최대 30일 동안 20°C – 25°C
(68°F – 77°F)에서 보관하십시오. 냉동하거나 열에 노출시키지 마십시오.
제조업체: Radius Health, Inc.
Boston, MA 02210 USA
10006645-04
로트:
유효기간:
주요 표시 패널 – 샘플 80 mcg 카톤 라벨
NDC 70539-001-98
TYMLOS®
(abaloparatide) injection
80 mcg per dose
3120 mcg/1.56 mL (2000 mcg/mL)
피하 주사용
단일 환자용
멸균
처방전에 의해서만
샘플 – 판매용 아님
1개의 사전 충전 펜
바늘은 포함되어 있지 않음
각 사전 충전 펜은
30회의 피하 주사를 제공합니다.
동봉된
약물 안내서
및 사용 지침을
각 환자에게 제공하십시오.