의약품 제조업체: AstraZeneca Pharmaceuticals LP (Updated: 2024-11-04)
처방 정보의 주요 내용
BRILINTA® (티카그렐로르) 정제, 경구용
미국 최초 승인: 2011
경고: 출혈 위험
전체 경고 상자에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
적응증 및 용법
BRILINTA는 P2Y12 혈소판 억제제로, 다음과 같은 경우에 사용됩니다.
- •
- 급성 관상동맥 증후군(ACS) 환자 또는 MI 병력이 있는 환자에서 심혈관(CV) 사망, 심근경색(MI) 및 뇌졸중 위험 감소. ACS 이후 최소 12개월 동안 클로피도그렐보다 우수합니다.
BRILINTA는 또한 ACS 치료를 위해 스텐트 시술을 받은 환자의 스텐트 혈전증 위험을 감소시킵니다. (1.1) - •
- 관상동맥 질환(CAD)이 있고 이러한 사건의 위험이 높은 환자에서 첫 번째 MI 또는 뇌졸중 위험 감소. 사용이 이 환경으로 제한되지는 않지만, BRILINTA의 효능은 2형 당뇨병(T2DM) 환자에서 입증되었습니다. (1.2)
- •
- 급성 허혈성 뇌졸중(NIH 뇌졸중 척도 점수 ≤5) 또는 고위험 일과성 허혈 발작(TIA) 환자의 뇌졸중 위험 감소. (1.3)
용법 및 용량
- •
- ACS 또는 MI 병력
- •
- BRILINTA 180mg 경구 초기 용량으로 치료를 시작합니다. 그런 다음 첫 해 동안 90mg을 1일 2회 투여합니다. 1년 후에는 60mg을 1일 2회 투여합니다. (2.2)
- •
- CAD 환자 및 이전 뇌졸중 또는 MI 없음
- •
- BRILINTA 60mg을 1일 2회 투여합니다. (2.3)
- •
- 급성 허혈성 뇌졸중
- •
- BRILINTA 180mg 초기 용량으로 치료를 시작한 다음 최대 30일 동안 90mg을 1일 2회 계속 투여합니다. (2.4)
BRILINTA를 75-100mg의 아스피린 일일 유지 용량과 함께 사용하십시오. (2) 그러나 PCI를 받은 환자의 경우 혈전증 대 출혈 사건에 대한 진화하는 위험을 기반으로 BRILINTA를 사용한 단일 항혈소판 요법을 고려하십시오. (2.2)
제형 및 강도
- •
- 60mg 및 90mg 정제 (3)
경고 및 주의 사항
유해 반응
가장 흔한 유해 반응(>5%)은 출혈과 호흡곤란입니다. (5.1, 5.3, 6.1)
의심되는 이상 반응을 보고하려면 AstraZeneca에 1-800-236-9933 또는 FDA에 1-800-FDA-1088로 연락하거나 www.fda.gov/medwatch를 방문하십시오.
약물 상호작용
특정 환자군에서의 사용
- •
- 수유: 모유 수유 권장하지 않음. (8.2)
환자 상담 정보 및 약물 안내서에 대해서는 17항을 참조하십시오.
개정: 2024년 11월
목차
전문 정보: 목차*
경고: 출혈 위험
1 적응증 및 용법
1.1 급성 관상동맥 증후군 또는 과거 심근경색 병력
1.2 관상동맥 질환, 하지만 이전 뇌졸중 또는 심근경색 병력 없음
1.3 급성 허혈성 뇌졸중 또는 일과성 허혈 발작 (TIA)
2 용법 및 용량
2.1 일반 지침
2.2 급성 관상동맥 증후군 또는 과거 심근경색 병력
2.3 관상동맥 질환, 하지만 이전 뇌졸중 또는 심근경색 병력 없음
2.4 급성 허혈성 뇌졸중 또는 일과성 허혈 발작 (TIA)
3 제형 및 강도
4 금기사항
4.1 두개내 출혈 병력
4.2 활동성 출혈
4.3 과민증
5 경고 및 주의사항
5.1 출혈 위험
5.2 관상동맥 질환 치료 환자에서 BRILINTA 중단
5.3 호흡곤란
5.4 서맥성 부정맥
5.5 중증 간 손상
5.6 중추성 수면 무호흡
5.7 검사 결과 간섭
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
7 약물 상호작용
7.1 강력한 CYP3A 저해제
7.2 강력한 CYP3A 유도제
7.3 오피오이드
7.4 심바스타틴, 로바스타틴, 로수바스타틴
7.5 디곡신
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
8.6 간 손상
8.7 신장 손상
10 과량 복용
11 일반적 특성
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.5 약물유전체학
13 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 급성 관상동맥 증후군 및 심근경색 후 2차 예방
14.2 관상동맥 질환, 하지만 이전 뇌졸중 또는 심근경색 병력 없음
14.3 급성 허혈성 뇌졸중 또는 일과성 허혈 발작 (TIA)
16 포장단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 부분 또는 소항목은 나열되지 않았습니다.
제품에 대한 경고(BOXED WARNING)
경고: 출혈 위험
- •
- 다른 항혈소판제와 마찬가지로 BRILINTA는 심각하고 때로는 치명적인 출혈을 유발할 수 있습니다 (5.1, 6.1).
- •
- 활동성 병적 출혈 또는 두개내 출혈 병력이 있는 환자에게 BRILINTA를 사용하지 마십시오.
- •
- (4.1, 4.2).
- •
- 긴급 관상동맥 우회술(CABG)을 받는 환자에게 BRILINTA를 시작하지 마십시오 (5.1,
- •
- 6.1).
- •
- 가능하면 BRILINTA를 중단하지 않고 출혈을 관리하십시오. BRILINTA를 중단하면
- •
- 이후 심혈관계 사건의 위험이 증가합니다 (5.2).
1 적응증 및 용법
1.1 급성관상동맥증후군 또는 과거 심근경색 병력
BRILINTA는 급성관상동맥증후군(ACS) 또는 과거 심근경색(MI) 병력이 있는 환자에서 심혈관(CV) 사망, 심근경색(MI) 및 뇌졸중 위험 감소에 사용됩니다. ACS 이후 최소 12개월 동안은 클로피도그렐보다 우수합니다.
BRILINTA는 또한 ACS 치료를 위해 스텐트 시술을 받은 환자에서 스텐트 혈전증 위험을 감소시킵니다 [임상 연구 (14.1) 참조].
1.2 관상동맥질환, 그러나 이전 뇌졸중 또는 심근경색 병력 없음
BRILINTA는 이러한 사건의 위험이 높은 관상동맥질환(CAD) 환자에서 첫 번째 MI 또는 뇌졸중 위험 감소에 사용됩니다 [임상 연구 (14.2) 참조]. 사용이 이 환경으로 제한되지는 않지만, BRILINTA의 효능은 2형 당뇨병(T2DM) 환자에서 입증되었습니다.
1.3 급성 허혈성 뇌졸중 또는 일과성 허혈 발작(TIA)
BRILINTA는 급성 허혈성 뇌졸중(NIH 뇌졸중 척도 점수 ≤5) 또는 고위험 일과성 허혈 발작(TIA) 환자에서 뇌졸중 위험 감소에 사용됩니다 [임상 연구 (14.3) 참조].
2 투여 및 관리
2.1 일반 지침
BRILINTA 복용을 놓친 환자에게는 다음 복용 시간에 예정된 용량을 복용하도록 조언하십시오.
정제를 통째로 삼킬 수 없는 환자의 경우, BRILINTA 정제를 부수어 물에 섞어 마실 수 있습니다.
이 혼합물은 비강관(CH8 이상)을 통해 투여할 수도 있습니다 [임상 약리학 (12.3) 참조].
다른 경구용 P2Y12 혈소판 억제제와 BRILINTA를 함께 투여하지 마십시오.
권장 용량보다 많은 양의 아스피린을 복용하지 마십시오 [임상 연구 (14.1) 참조].
2.2 급성 관상동맥 증후군 또는 과거 심근 경색 병력
BRILINTA 180mg 로딩 용량으로 치료를 시작합니다. BRILINTA의 첫 번째 90mg 유지 용량은
로딩 용량 투여 후 6~12시간 후에 투여합니다. ACS 사건 발생 후 첫 1년 동안은 BRILINTA 90mg을 1일 2회 투여합니다.
1년 후에는 BRILINTA 60mg을 1일 2회 투여합니다.
아스피린 75mg~100mg의 일일 유지 용량으로 BRILINTA 치료를 시작합니다. 그러나
경피적 관상동맥 중재술(PCI)을 받은 환자의 경우, 혈전증 대 출혈 위험의 변화에 따라 BRILINTA를 사용한 단일 항혈소판 요법을 고려하십시오 [경고 및 주의 사항 (5.1) 및 임상 연구 (14) 참조].
2.3 관상동맥 질환이 있지만 이전 뇌졸중 또는 심근 경색 병력이 없는 경우
BRILINTA 60mg을 1일 2회 투여합니다.
일반적으로 아스피린 75mg~100mg의 일일 유지 용량과 함께 BRILINTA를 사용합니다 [임상 연구 (14) 참조].
2.4 급성 허혈성 뇌졸중 또는 일과성 허혈 발작(TIA)
BRILINTA 180mg 로딩 용량으로 치료를 시작한 후 최대 30일 동안 90mg을 1일 2회 투여합니다.
로딩 용량 투여 후 6~12시간 후에 첫 번째 유지 용량을 투여합니다.
아스피린 로딩 용량(300mg~325mg)과 아스피린 75mg~100mg의 일일 유지 용량과 함께 BRILINTA를 사용합니다 [임상 연구 (14) 참조].
3 제형 및 함량
BRILINTA (ticagrelor) 90 mg은 한쪽 면에 “90” 위에 “T”가 표시된 원형의 양면볼록 노란색 필름 코팅 정제로 공급됩니다.
BRILINTA (ticagrelor) 60 mg은 한쪽 면에 “60” 위에 “T”가 표시된 원형의 양면볼록 분홍색 필름 코팅 정제로 공급됩니다.
4 금기사항
4.1 두개내 출혈의 병력
BRILINTA는 이러한 환자군에서 ICH 재발 위험이 높기 때문에 두개내 출혈 (ICH) 병력이 있는 환자에게는 금기입니다. [see 임상 연구 (14.1), (14.2)].
4.2 활동성 출혈
BRILINTA는 소화성 궤양 또는 두개내 출혈과 같은 활동성 병적 출혈이 있는 환자에게는 금기입니다. [see 경고 및 주의사항 (5.1) and 이상반응 (6.1)].
5 경고 및 주의사항
5.1 출혈 위험
BRILINTA를 포함한 혈소판 기능을 억제하는 약물은 출혈 위험을 증가시킵니다 [경고 및 주의사항 참조
(5.2) 및 유해 반응 (6.1)].
급성 허혈성 뇌졸중 또는 일과성 허혈 발작으로 치료받는 환자
NIHSS >5인 환자 및 혈전용해제를 투여받는 환자는 THALES에서 제외되었으며, 이러한 환자에게 BRILINTA를 사용하는 것은 권장되지 않습니다.
5.2 관상동맥 질환 치료 환자에서 BRILINTA 중단
관상동맥 질환 치료를 받는 환자에서 BRILINTA를 중단하면 심근경색, 뇌졸중 및 사망 위험이 증가합니다.
BRILINTA를 일시적으로 중단해야 하는 경우(예: 출혈 치료 또는 중대한
수술의 경우) 가능한 한 빨리 재개하십시오. 가능한 경우, 출혈 위험이 큰 수술 5일 전에 BRILINTA 치료를 중단하십시오.
지혈이 되는 즉시 BRILINTA를 재개하십시오.
5.3 호흡곤란
임상 시험에서 BRILINTA로 치료받은 환자의 약 14%(PLATO 및 PEGASUS)에서 21%(THEMIS)까지가 호흡곤란을 경험했습니다. 호흡곤란은 일반적으로 중등도였으며, 종종 지속적인 치료 중에 해결되었지만, 환자의 0.9%(PLATO), 1.0%(THALES), 4.3%(PEGASUS) 및 6.9%(THEMIS)에서 연구 약물 중단으로 이어졌습니다.
PLATO의 하위 연구에서, 호흡곤란을 보고했는지 여부에 관계없이 199명의 피험자가 폐 기능 검사를 받았습니다. 1개월 후 또는 만성 치료 6개월 후에 평가된 폐 기능에 대한 부작용의 징후는 없었습니다.
BRILINTA와 관련이 있다고 판단되는 새로운, 장기간 지속되거나 악화된 호흡곤란이 발생하는 경우, 특별한 치료는 필요하지 않습니다. 가능한 경우 BRILINTA를 중단하지 않고 계속 복용하십시오. BRILINTA 중단을 요구하는 참을 수 없는 호흡곤란의 경우, 다른 항혈소판제를 처방하는 것을 고려하십시오.
5.4 서맥성 부정맥
BRILINTA는 심실 정지의 원인이 될 수 있습니다 [유해 반응 (6.1) 참조]. AV 블록을 포함한 서맥성 부정맥이
시판 후 조사에서 보고되었습니다. 병적인 동방 결절 증후군, 2nd 또는 3rd도 AV 블록 또는
심박동기로 보호받지 않는 서맥 관련 실신의 병력이 있는 환자는 임상 연구에서 제외되었으며 티카그렐로르로 인해 서맥성 부정맥이 발생할 위험이 증가할 수 있습니다.
5.5 중증 간 손상
중증 간 손상 환자에게는 BRILINTA 사용을 피하십시오. 중증 간 손상은
티카그렐로르의 혈청 농도를 증가시킬 가능성이 높습니다. 중증 간 손상 환자에 대한 BRILINTA 연구는 없습니다 [
임상 약리학 (12.3)] 참조.
5.6 중추성 수면 무호흡
티카그렐로르를 복용하는 환자에서 시판 후 조사에서 체인-스토크스 호흡(CSR)을 포함한 중추성 수면 무호흡(CSA)이 보고되었으며, 재도전 후 CSA/CSR의 재발 또는 악화가 포함됩니다. 중추성 수면 무호흡이
의심되는 경우 추가적인 임상 평가를 고려하십시오.
5.7 검사 결과 간섭
헤파린 유도 혈소판 감소증(HIT)에 대한 위음성 기능 검사
BRILINTA는 헤파린 유도 혈소판 감소증(HIT) 환자의 혈소판 기능 검사(헤파린 유도 혈소판 응집(HIPA) 분석 포함)에서 위음성 결과를 유발하는 것으로 보고되었습니다. 이는
영향을 받은 환자의 혈청/혈장에 있는 티카그렐로르에 의해 검사에서 건강한 공여자 혈소판의 P2Y12 수용체가 억제되는 것과 관련이 있습니다.
HIT 기능 검사의 해석에는 BRILINTA와의 병용 치료에 대한 정보가 필요합니다. BRILINTA 간섭 메커니즘을 기반으로, BRILINTA는 HIT에 대한 PF4 항체 검사에 영향을 미칠 것으로 예상되지 않습니다.
6 부작용
다음의 유해 반응은 이 약물 설명서의 다른 부분에서도 설명하고 있습니다:
- •
- 출혈 [경고 및 주의사항 (5.1) 참조]
- •
- 호흡곤란 [경고 및 주의사항 (5.3) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건 하에서 수행되므로, 특정 약물의 임상 시험에서 관찰된 유해 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제 발생률을 반영하지 않을 수도 있습니다.
BRILINTA는 58,000명 이상의 환자를 대상으로 안전성이 평가되었습니다.
PLATO (급성 관상 동맥 증후군에서 혈전 색전성 사건 위험 감소)에서의 출혈
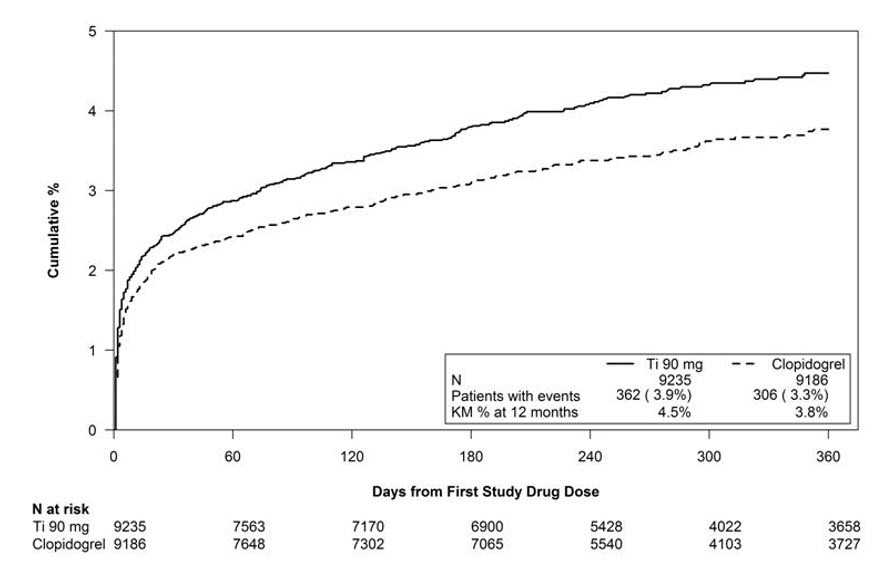
그림 1은 첫 번째 비-CABG 주요 출혈 사건 발생 시점을 나타낸 그래프입니다.
그림 1 – 첫 번째 비-CABG PLATO 기준 주요 출혈 사건 발생 시점에 대한 Kaplan-Meier 추정치 (PLATO)
PLATO에서 출혈 발생 빈도는 표 1과 표 2에 요약되어 있습니다. 비-CABG 주요 출혈 사건의 약 절반은 처음 30일 이내에 발생했습니다.
|
||
|
BRILINTA* |
클로피도그렐 |
|
|
사건 발생 환자 수 (%) |
사건 발생 환자 수 (%) |
|
|
PLATO 주요 + 경미 출혈 |
713 (7.7) |
567 (6.2) |
|
주요 출혈 |
362 (3.9) |
306 (3.3) |
|
치명적/생명 위협적 |
171 (1.9) |
151 (1.6) |
|
치명적 |
15 (0.2) |
16 (0.2) |
|
두개내 출혈 (치명적/생명 위협적) |
26 (0.3) |
15 (0.2) |
|
PLATO 경미 출혈: 출혈을 멈추거나 치료하기 위해 의학적 개입이 필요한 경우. PLATO 주요 출혈: 다음 중 하나에 해당하는 경우: 치명적; 두개내; 심낭 압전을 동반한 심막내; 개입이 필요한 저혈량성 쇼크 또는 심한 저혈압; 상당히 장애를 유발하는 (예: 영구적인 시력 상실을 동반한 안구내); Hb 감소가 3 g/dL 이상(또는 헤마토크릿(Hct) 감소가 9% 이상); 2단위 이상의 수혈. PLATO 주요 출혈, 치명적/생명 위협적: 위에 설명된 주요 출혈 중 Hb 감소가 5 g/dL 이상(또는 헤마토크릿(Hct) 감소가 15% 이상)인 경우; 4단위 이상의 수혈. 치명적: 출혈 사건이 7일 이내에 직접적으로 사망으로 이어진 경우. |
||
기준 인구통계학적 요인은 BRILINTA와 클로피도그렐 비교 시 출혈의 상대적 위험을 변화시키지 않았습니다.
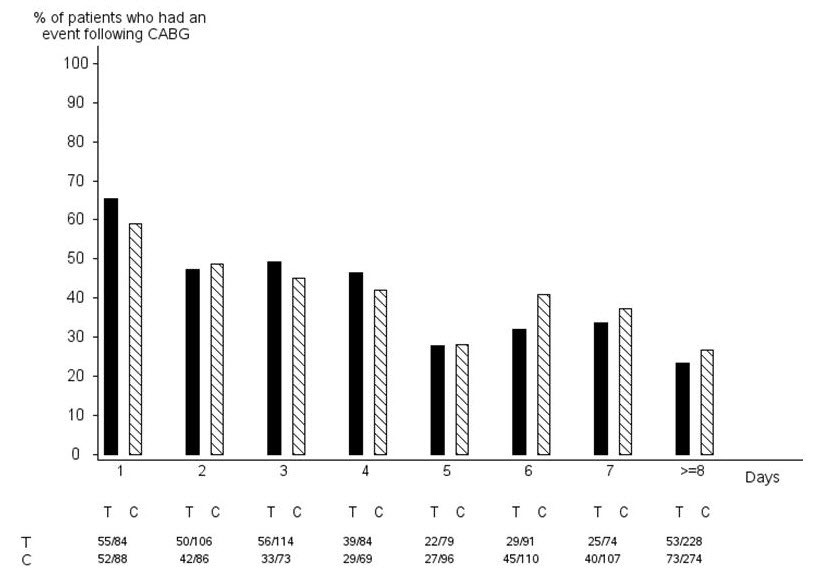
PLATO 연구에서 1584명의 환자가 CABG 수술을 받았습니다. 출혈이 발생한 환자의 비율은 그림 2와 표 2에 나와 있습니다.
그림 2 – 연구 약물 최종 투여 시점부터 CABG 시술까지의 일수별 ‘주요 치명적/생명 위협적’ CABG 관련 출혈 (PLATO)
X축은 CABG 전 연구 약물 최종 투여 시점부터의 일수입니다.
PLATO 프로토콜은 맹검 해제 없이 CABG 또는 기타 주요 수술 전 연구 약물 투여 중단 절차를 권장했습니다. 수술이 선택적이거나 긴급하지 않은 경우, 연구 약물은 다음과 같이 일시적으로 중단되었습니다. 수술 전 항혈소판 효과가 소실되도록 하는 것이 지역 관행인 경우, 캡슐(맹검 클로피도그렐)은 수술 5일 전에 중단되었고, 정제(맹검 티카그렐로르)는 수술 최소 24시간 전부터 최대 72시간 전까지 중단되었습니다. 항혈소판 효과 소실을 기다리지 않고 수술을 시행하는 것이 지역 관행인 경우, 캡슐과 정제는 수술 24시간 전에 중단되었고 아프로티닌 또는 기타 지혈제 사용이 허용되었습니다. IPA 모니터링을 사용하여 수술 시행 시점을 결정하는 것이 지역 관행인 경우, 캡슐과 정제는 동시에 중단되었고 일반적인 모니터링 절차가 따랐습니다.
T 티카그렐로르; C 클로피도그렐.
|
||
|
BRILINTA* N=770 |
클로피도그렐 N=814 |
|
|
사건 발생 환자 수 (%) |
사건 발생 환자 수 (%) |
|
|
PLATO 총 주요 출혈 |
626 (81.3) |
666 (81.8) |
|
치명적/생명 위협적 |
337 (43.8) |
350 (43.0) |
|
치명적 |
6 (0.8) |
7 (0.9) |
|
PLATO 주요 출혈: 다음 중 하나 이상: 치명적; 두개내; 심낭 압전을 동반한 심막내; 혈액량 감소성 쇼크 또는 중재가 필요한 심한 저혈압; 상당히 장애를 유발하는 (예: 영구적 시력 상실을 동반한 안구내); Hb 감소가 최소 3 g/dL 이상(또는 헤마토크릿(Hct) 감소가 최소 9% 이상); 2단위 이상의 수혈. PLATO 주요 출혈, 치명적/생명 위협적: 위에 설명된 주요 출혈 중 Hb 감소가 5 g/dL 이상(또는 헤마토크릿(Hct) 감소가 최소 15% 이상)인 경우; 4단위 이상의 수혈. |
||
CABG 전 5일 동안 항혈소판 요법을 중단했을 때, BRILINTA 치료 환자의 75%와 클로피도그렐 치료 환자의 79%에서 주요 출혈이 발생했습니다.
PLATO 연구의 다른 이상 반응
PLATO 연구에서 4% 이상의 발생률로 나타난 이상 반응은 표 3에 나와 있습니다.
|
||
|
BRILINTA* |
클로피도그렐 |
|
|
호흡곤란 |
13.8 |
7.8 |
|
현기증 |
4.5 |
3.9 |
|
메스꺼움 |
4.3 |
3.8 |
PEGASUS 연구(이전 심근경색 병력이 있는 환자의 2차 예방)에서의 출혈
PEGASUS 연구에서 출혈 사건의 전반적인 결과는 표 4에 나와 있습니다.
|
||
|
BRILINTA* N=6958 |
플라시보 N=6996 |
|
|
사건/1000 환자년 |
사건/1000 환자년 |
|
|
TIMI 주요 |
8 |
3 |
|
사망 |
1 |
1 |
|
두개내 출혈 |
2 |
1 |
|
TIMI 주요 또는 경미 |
11 |
5 |
|
TIMI 주요: 사망 출혈 또는 두개내 출혈 또는 헤모글로빈(Hgb) ≥5 g/dL 감소 또는 헤마토크릿(Hct) ≥15% 감소와 관련된 임상적으로 명백한 출혈 징후. 사망: 7일 이내에 직접적으로 사망으로 이어진 출혈 사건. TIMI 경미: 헤모글로빈 3-5 g/dL 감소를 동반한 임상적으로 명백한 출혈. |
||
BRILINTA 60mg의 출혈 프로파일은 아스피린 단독 요법과 비교하여 TIMI 주요 및 TIMI 주요 또는 경미 출혈 사건에 대해 여러 사전 정의된 하위 그룹(예: 연령, 성별, 체중, 인종, 지역, 동반 질환, 동반 치료, 스텐트 및 병력)에서 일관되었습니다.
PEGASUS 연구의 다른 이상 반응
PEGASUS 연구에서 3% 이상의 비율로 발생한 이상 반응은 표 5에 나와 있습니다.
|
||
|
BRILINTA* |
플라시보 |
|
|
호흡곤란 |
14.2% |
5.5% |
|
현기증 |
4.5% |
4.1% |
|
설사 |
3.3% |
2.5% |
THEMIS 연구 (관상동맥질환 및 2형 당뇨병 환자에서 주요 심혈관계 사건 예방)에서의 출혈
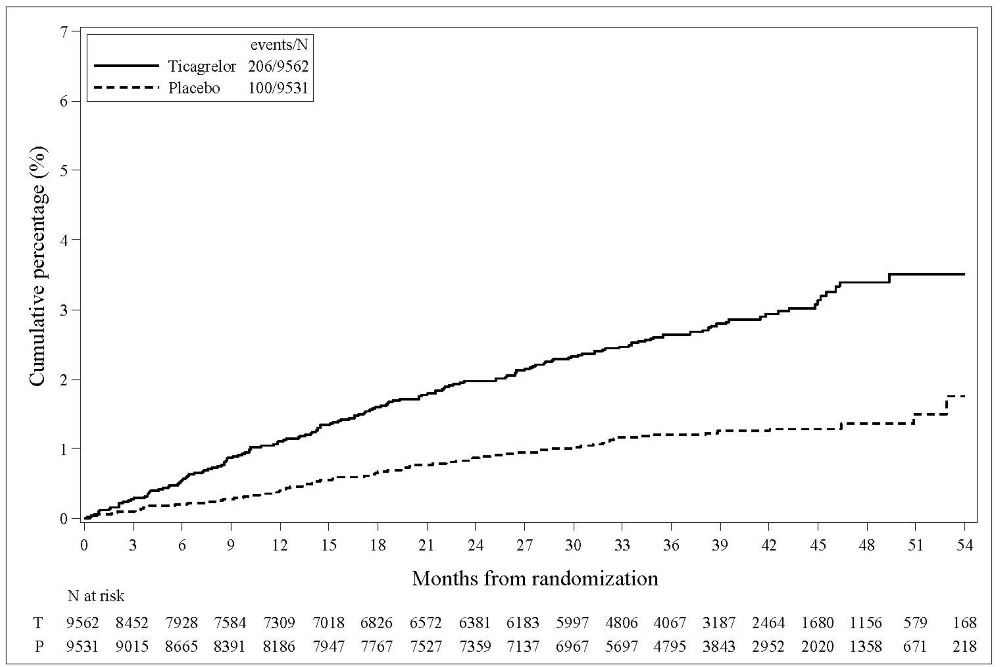
최초 TIMI 주요 출혈 사건 발생까지의 시간에 대한 Kaplan-Meier 곡선은 그림 3에 제시되어 있습니다.
그림 3 – 최초 TIMI 주요 출혈 사건 발생까지의 시간 (THEMIS)
T = 티카그렐로르; P = 위약; N = 환자 수
THEMIS에서의 출혈 사건은 아래 표 6에 나와 있습니다.
|
BRILINTA N=9562 |
위약 N=9531 |
|
|
사건 / 1000 환자년 |
사건 / 1000 환자년 |
|
|
TIMI 주요 |
9 |
4 |
|
TIMI 주요 또는 경미 |
12 |
5 |
|
TIMI 주요 또는 경미 또는 의료적 처치 필요 |
46 |
18 |
|
치명적 출혈 |
1 |
0 |
|
두개내 출혈 |
3 |
2 |
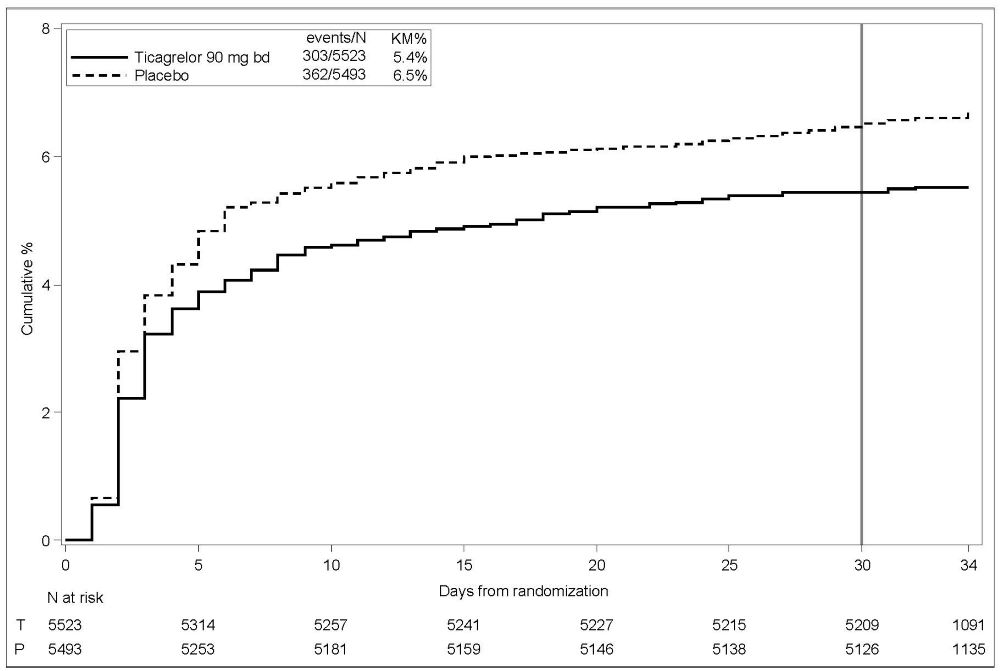
THALES (급성 허혈성 뇌졸중 또는 일과성 허혈 발작 환자의 뇌졸중 위험 감소)에서의 출혈
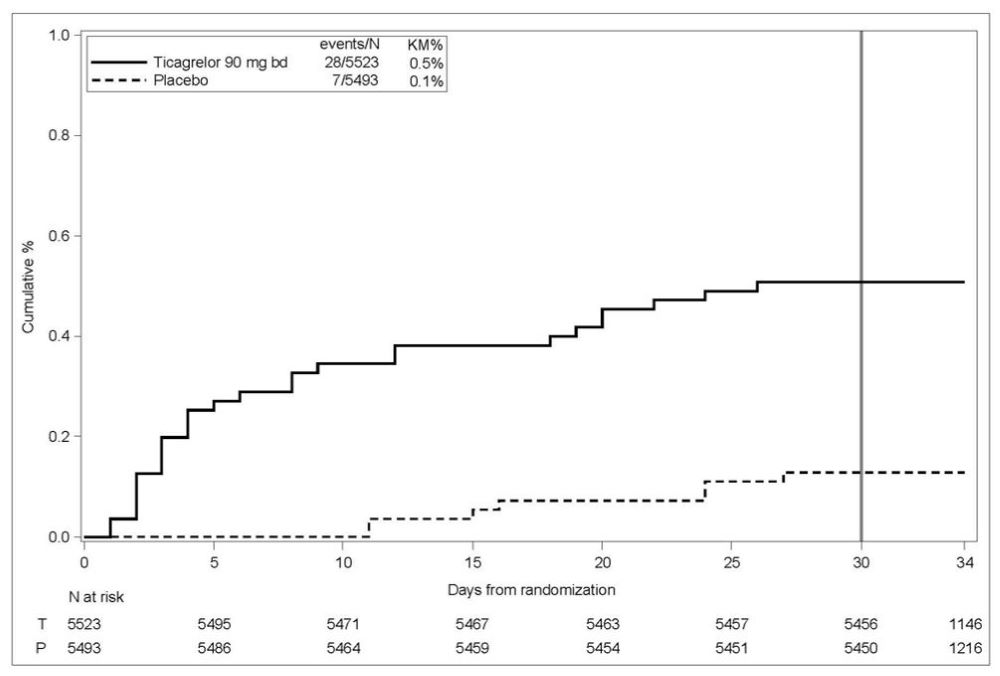
GUSTO 중증 출혈 사건의 경과 시간에 대한 Kaplan-Meier 곡선은 그림 4에 제시되어 있습니다.
그림 4 – GUSTO 중증 출혈 사건의 경과 시간
KM%: 30일째 평가된 Kaplan-Meier 백분율; T = 티카그렐로르; P = 플라시보; N = 환자 수
GUSTO 중증: 다음 중 하나에 해당하는 경우: 치명적 출혈, 두개내 출혈(무증상 허혈성 뇌경색의 무증상 출혈성 변화 및 기울기 에코 자기 공명 영상에서만 나타나는 < 10mm 미세 출혈 제외), 혈역학적 손상을 일으켜 개입이 필요한 출혈(예: 수혈 또는 수액 보충, 또는 혈관 수축제/강심제 지지 또는 외과적 개입이 필요한 수축기 혈압 <90 mmHg).
THALES에서의 두개내 출혈 및 치명적 출혈: 총 BRILINTA 투여군에서 21건의 두개내 출혈(ICH)이 발생했고, 플라시보 투여군에서는 6건의 ICH가 발생했습니다. 거의 모든 ICH인 치명적 출혈은 BRILINTA 투여군에서 11건, 플라시보 투여군에서 2건 발생했습니다.
서맥
PLATO 연구의 약 3000명의 환자를 대상으로 한 Holter 하위 연구에서, 급성기에는 BRILINTA 투여군(6.0%)에서 클로피도그렐 투여군(3.5%)보다 심실 정지가 더 많이 발생했습니다. 1개월 후에는 각각 2.2%와 1.6%였습니다. PLATO, PEGASUS, THEMIS 및 THALES 연구에서는 서맥 사건의 위험이 증가된 환자(예: 병적인 동방 결절 증후군, 2nd 또는 3rd도 AV 차단 또는 서맥 관련 실신 환자로서, 페이스메이커로 보호되지 않은 환자)를 제외했습니다.
검사치 이상
혈청 요산:
PLATO 연구에서, BRILINTA 90mg 투여군의 혈청 요산 수치는 기준치보다 약 0.6mg/dL 증가했고, 클로피도그렐 투여군은 약 0.2mg/dL 증가했습니다. 이러한 차이는 치료 중단 후 30일 이내에 사라졌습니다. PLATO 연구에서 통풍 보고는 치료군 간에 차이가 없었습니다(각 군 0.6%).
PEGASUS 연구에서, BRILINTA 60mg 투여군의 혈청 요산 수치는 기준치보다 약 0.2mg/dL 증가했고, 아스피린 단독 투여군에서는 상승이 관찰되지 않았습니다. 통풍은 BRILINTA 투여군에서 아스피린 단독 투여군보다 더 흔하게 발생했습니다(1.5%, 1.1%). 치료 중단 후 평균 혈청 요산 농도는 감소했습니다.
혈청 크레아티닌:
PLATO 연구에서, BRILINTA 90mg 투여군 환자의 7.4%에서 혈청 크레아티닌 수치가 50% 이상 증가한 반면, 클로피도그렐 투여군에서는 5.9%였습니다. 이러한 증가는 일반적으로 지속적인 치료에도 진행되지 않았고, 종종 지속적인 치료로 감소했습니다. 치료 중 가장 큰 증가를 보인 환자에서도 치료 중단 시 가역성이 관찰되었습니다. PLATO 연구에서 치료군 간에 급성 신부전, 만성 신부전, 독성 신병증 또는 핍뇨와 같은 신장 관련 중대한 이상 반응에 차이가 없었습니다.
PEGASUS 연구에서, BRILINTA 60mg 투여군 환자의 약 4%에서 혈청 크레아티닌 농도가 50% 이상 증가했는데, 이는 아스피린 단독 투여군과 유사했습니다. 연령 및 기저 신장 기능에 관계없이 티카그렐로르와 아스피린 단독 투여군의 신장 관련 이상 반응 빈도는 유사했습니다.
6.2 시판 후 경험
다음과 같은 이상 반응이 BRILINTA의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 알 수 없는 규모의 모집단으로부터 자발적으로 보고되었기 때문에, 항상 그 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
혈액 및 림프계 장애: 드물게 BRILINTA 사용과 관련하여 특발성 혈소판 감소성 자반병(TTP)이 보고되었습니다. TTP는 단기간 노출(<2주) 후에도 발생할 수 있는 심각한 질환이며 즉각적인 치료가 필요합니다.
면역계 장애: 안지오에데마를 포함한 과민반응 [금기 사항 (4.3) 참조].
호흡기 장애: 중추성 수면 무호흡, 치인-스톡스 호흡
피부 및 피하 조직 장애: 발진
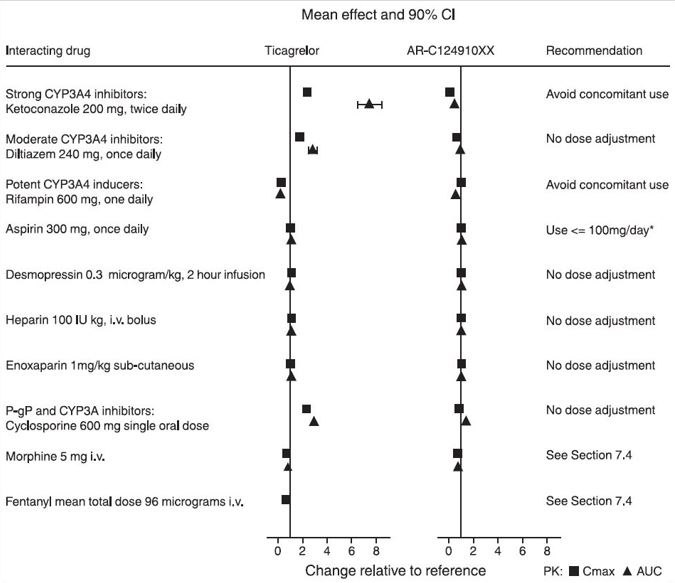
7 약물 상호작용
7.1 강력한 CYP3A 저해제
강력한 CYP3A 저해제는 티카그렐로르 노출을 상당히 증가시켜 호흡곤란, 출혈 및 기타 유해 사건의 위험을 증가시킵니다. CYP3A의 강력한 저해제(예: 케토코나졸, 이트라코나졸, 보리코나졸, 클라리스로마이신, 네파조돈, 리토나비르, 사퀴나비르, 넬피나비르, 인디나비르, 아타자나비르 및 텔리트로마이신)의 사용을 피하십시오 [임상 약리학 (12.3) 참조].
7.2 강력한 CYP3A 유도제
강력한 CYP3A 유도제는 티카그렐로르 노출을 상당히 감소시켜 티카그렐로르의 효능을 감소시킵니다. CYP3A의 강력한 유도제(예: 리팜핀, 페니토인, 카르바마제핀 및 페노바르비탈)와 함께 사용하지 마십시오 [임상 약리학 (12.3) 참조].
7.3 오피오이드
다른 경구 P2Y12 억제제와 마찬가지로, 오피오이드 작용제의 병용 투여는 위 배출 지연으로 인해 티카그렐로르 및 그 활성 대사체의 흡수를 지연시키고 감소시킵니다 [임상 약리학 (12.3) 참조]. 모르핀 또는 기타 오피오이드 작용제의 병용 투여가 필요한 급성 관상 동맥 증후군 환자에게는 비경구 항혈소판제 사용을 고려하십시오.
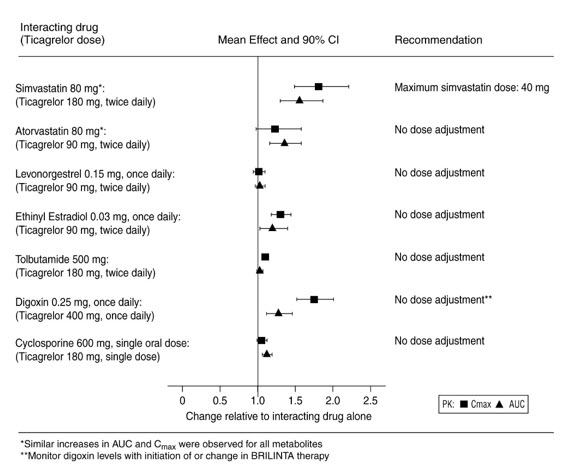
7.4 심바스타틴, 로바스타틴, 로수바스타틴
BRILINTA는 이 약물들이 CYP3A4에 의해 대사되기 때문에 심바스타틴과 로바스타틴의 혈청 농도를 증가시킵니다. 40mg을 초과하는 심바스타틴과 로바스타틴 용량은 피하십시오 [임상 약리학 (12.3) 참조].
Brilinta는 로수바스타틴이 BCRP 기질이기 때문에 로수바스타틴의 혈청 농도를 증가시킵니다 [임상 약리학 (12.3) 참조].
8 특정 집단에서의 사용
8.1 임신
위험 요약
임산부에서 BRILINTA 사용에 대한 증례 보고에서 얻을 수 있는 데이터는 주요 선천적 결손, 유산 또는 산모 또는 태아에 대한 부작용 위험을 확인하지 못했습니다. 기관 형성 과정에서 임신한 쥐와 토끼에게 투여된 Ticagrelor는 체표면적을 기준으로 최대 권장 용량(MRHD)의 약 5~7배에 해당하는 산모 용량에서 자손의 구조적 이상을 유발했습니다. 임신 후기 및 수유기에 쥐에게 ticagrelor를 투여했을 때, 새끼의 사망 및 새끼 성장에 대한 영향이 MRHD의 약 10배에서 나타났습니다( 데이터 참조).
표시된 집단에 대한 주요 선천적 결손 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 결손, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 확인된 임신에서 주요 선천적 결손 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
데이터
동물 데이터
생식 독성 연구에서 임신한 쥐는 기관 형성 과정에서 20~300mg/kg/일의 용량으로 ticagrelor를 투여받았습니다. 20mg/kg/일은 mg/m2 기준으로 60kg인 사람의 MRHD 90mg 2회/일에 해당합니다. 자손의 부작용은 300mg/kg/일(mg/m2 기준으로 MRHD의 16.5배) 용량에서 발생했으며, 간엽 및 늑골의 과잉, 흉골의 불완전 골화, 골반 관절의 변위, 흉골의 기형/정렬 불량이 포함되었습니다. 100mg/kg/일(mg/m2 기준으로 MRHD의 5.5배)의 중간 용량에서 간 및 골격 발달 지연이 관찰되었습니다. 임신한 토끼가 기관 형성 과정에서 21~63mg/kg/일의 용량으로 ticagrelor를 투여받았을 때, 63mg/kg/일(mg/m2 기준으로 MRHD의 6.8배)의 최고 산모 용량에 노출된 태아는 담낭 발달 지연 및 설골, 치골 및 흉골의 불완전 골화가 발생했습니다.
출생 전/후 연구에서 임신한 쥐는 임신 후기 및 수유기에 10~180mg/kg/일의 용량으로 ticagrelor를 투여받았습니다. 새끼의 사망 및 새끼 성장에 대한 영향은 180mg/kg/일(mg/m2 기준으로 MRHD의 약 10배)에서 관찰되었습니다. 귓바퀴 펼침 및 눈 뜨임 지연과 같은 비교적 경미한 영향은 10 및 60mg/kg(mg/m2 기준으로 MRHD의 약 1/2 및 3.2배) 용량에서 발생했습니다.
8.2 수유
위험 요약
모유에서 ticagrelor 또는 대사체의 존재, 모유 수유 유아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. Ticagrelor와 대사체는 산모 혈장보다 더 높은 농도로 쥐의 모유에 존재했습니다. 약물이 동물의 모유에 존재하는 경우, 해당 약물은 사람의 모유에도 존재할 가능성이 높습니다. BRILINTA 치료 중에는 모유 수유가 권장되지 않습니다.
8.4 소아 사용
BRILINTA의 안전성과 유효성은 소아 환자에서 확립되지 않았습니다. 2세~18세 미만의 BRILINTA 치료 소아 환자 101명을 대상으로 실시한 적절하고 잘 통제된 연구에서 겸상 적혈구 질환의 혈관 폐쇄 위기 발생률 감소에 대한 유효성이 입증되지 않았습니다.
8.5 노인 사용
PLATO, PEGASUS, THEMIS 및 THALES 연구의 환자 중 약 절반이 65세 이상이었고 최소 15%는 75세 이상이었습니다. 노인 환자와 젊은 환자 사이에 안전성 또는 유효성의 전반적인 차이는 관찰되지 않았습니다.
8.6 간 장애
Ticagrelor는 간에서 대사되며 간 기능 장애는 출혈 및 기타 부작용의 위험을 증가시킬 수 있습니다. 중증 간 장애 환자에게는 BRILINTA 사용을 피하십시오. 중등도 간 장애 환자에서 BRILINTA 사용 경험은 제한적입니다. ticagrelor 노출 증가 가능성에 유의하여 치료의 위험과 이점을 고려하십시오. 경증 간 장애 환자에서는 용량 조절이 필요하지 않습니다[경고 및 주의사항(5.5) 및 임상 약리학(12.3) 참조].
8.7 신장 장애
신장 장애 환자에서는 용량 조절이 필요하지 않습니다[임상 약리학(12.3) 참조].
투석 중인 말기 신질환 환자
BRILINTA의 임상 효능 및 안전성 연구에는 투석 중인 말기 신질환(ESRD) 환자가 등록되지 않았습니다. 간헐적 혈액 투석을 받고 있는 ESRD 환자에서 ticagrelor 및 대사체의 농도와 혈소판 억제는 정상 신기능 환자에서 관찰된 것과 비교하여 임상적으로 유의미한 차이가 없을 것으로 예상됩니다[임상 약리학(12.3) 참조]. 이러한 농도가 PLATO, PEGASUS, THEMIS 및 THALES에서 관찰된 것과 유사한 효능 및 안전성을 투석 중인 ESRD 환자에게서 나타낼지는 알려져 있지 않습니다.
10 과다 복용
현재 BRILINTA의 효과를 되돌릴 수 있는 알려진 치료법은 없으며, ticagrelor는 투석되지 않습니다. 과다 복용의 치료는 지역 표준 의료 관행을 따라야 합니다. 출혈은 과다 복용의 예상되는 약리학적 효과입니다. 출혈이 발생하면 적절한 지지 조치를 취해야 합니다.
건강한 지원자에서 혈소판 수혈은 BRILINTA의 항혈소판 효과를 되돌리지 못했으며 출혈이 있는 환자에게 임상적 이점을 제공할 가능성이 낮습니다.
과다 복용의 다른 영향으로는 위장 효과(메스꺼움, 구토, 설사) 또는 심실 휴지가 포함될 수 있습니다. ECG를 모니터링하십시오.
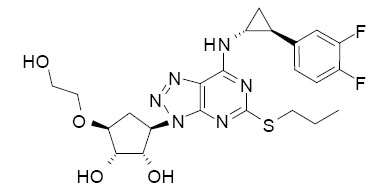
11 설명
BRILINTA는 사이클로펜틸트리아졸로피리미딘인 티카그렐러를 함유하고 있으며, P2Y12 ADP-수용체에 의해 매개되는 혈소판 활성화 및 응집의 억제제입니다. 화학적으로는 (1S,2S,3R,5S)-3-[7-{[(1R,2S)-2-(3,4-다이플루오로페닐)사이클로프로필]아미노}-5-(프로필티오)-3H-[1,2,3]-트리아졸로[4,5-d]피리미딘-3-일]-5-(2-하이드록시에톡시)사이클로펜탄-1,2-다이올입니다. 티카그렐러의 실험식은 C23H28F2N6O4S이며, 분자량은 522.57입니다. 티카그렐러의 화학 구조는 다음과 같습니다.
티카그렐러는 실온에서 약 10 μg/mL의 수용해도를 갖는 결정성 분말입니다.
경구 투여용 BRILINTA 90mg 정제는 90mg의 티카그렐러와 만니톨, 인산이칼슘, 글리콜산 나트륨 전분, 하이드록시프로필 셀룰로오스, 스테아르산마그네슘, 하이드록시프로필 메틸셀룰로오스, 이산화티타늄, 탈크, 폴리에틸렌 글리콜 400, 황색 산화철을 함유하고 있습니다.
경구 투여용 BRILINTA 60mg 정제는 60mg의 티카그렐러와 만니톨, 인산이칼슘, 글리콜산 나트륨 전분, 하이드록시프로필 셀룰로오스, 스테아르산마그네슘, 하이드록시프로필 메틸셀룰로오스, 이산화티타늄, 폴리에틸렌 글리콜 400, 흑색 산화철, 적색 산화철을 함유하고 있습니다.
12 임상약리학
12.1 작용 기전
티카그렐러 및 주요 대사체는 혈소판 P2Y12 ADP 수용체와 가역적으로 상호 작용하여 신호 전달 및 혈소판 활성화를 방지합니다. 티카그렐러와 그 활성 대사체는 거의 동등한 효능을 나타냅니다.
12.2 약물역학
6주 연구에서 혈소판 응집 억제제(IPA)에 대한 티카그렐러와 클로피도그렐의 억제 효과를 비교하였으며, 혈소판 응집 유도제로 20 μM ADP를 사용하여 급성 및 만성 혈소판 억제 효과를 모두 조사했습니다.
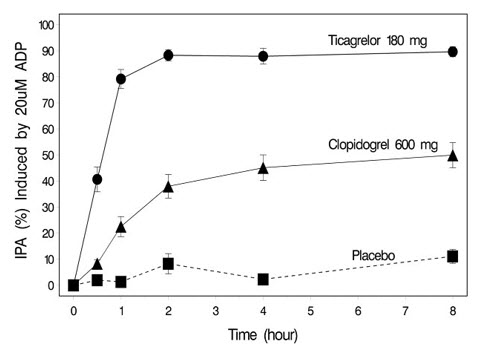
180mg 티카그렐러 또는 600mg 클로피도그렐 로딩 용량 투여 후 연구 1일에 IPA 발현을 평가했습니다. 그림 5에 표시된 바와 같이, 모든 시점에서 티카그렐러 그룹의 IPA가 더 높았습니다. 티카그렐러의 최대 IPA 효과는 약 2시간에 도달했으며, 최소 8시간 동안 유지되었습니다.
티카그렐러 90mg 1일 2회 또는 클로피도그렐 75mg 1일 1회 6주 후 IPA 소실을 다시 20 μM ADP에 대한 반응으로 조사했습니다.
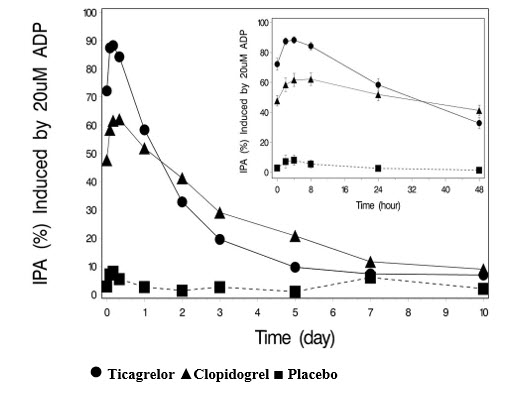
그림 6에 표시된 바와 같이, 마지막 티카그렐러 용량 투여 후 평균 최대 IPA는 티카그렐러의 경우 88%, 클로피도그렐의 경우 62%였습니다. 그림 6의 삽입 그림은 티카그렐러 그룹(58%)의 IPA가 24시간 후 클로피도그렐 그룹(52%)의 IPA와 유사함을 보여주며, 이는 티카그렐러 복용을 놓친 환자도 클로피도그렐로 치료받은 환자의 골짜기 IPA와 유사한 IPA를 유지할 것임을 나타냅니다. 5일 후 티카그렐러 그룹의 IPA는 위약 그룹의 IPA와 유사했습니다. 티카그렐러 또는 클로피도그렐에 대한 출혈 위험 또는 혈전증 위험이 IPA와 어떻게 관련되는지는 알려져 있지 않습니다.
그림 5 – 위약, 180mg 티카그렐러 또는 600mg 클로피도그렐의 단회 경구 용량 투여 후 평균 혈소판 응집 억제율(±SE)
그림 6 – 위약, 티카그렐러 90mg 1일 2회 또는 클로피도그렐 75mg 1일 1회 6주 후 평균 혈소판 응집 억제율(IPA)
클로피도그렐에서 BRILINTA로 전환하면 절대 IPA가 26.4% 증가하고, BRILINTA에서 클로피도그렐로 전환하면 절대 IPA가 24.5% 감소했습니다. 항혈소판 효과 중단 없이 클로피도그렐에서 BRILINTA로 전환할 수 있습니다 [용법 및 용량 (2) 참조].
12.3 약동학
티카그렐러는 용량 비례 약동학을 나타내며, 환자와 건강한 지원자 간에 유사합니다.
흡수
BRILINTA는 음식과 함께 또는 음식 없이 복용할 수 있습니다. 티카그렐러의 흡수는 중앙값 tmax 1.5시간(범위 1.0~4.0)으로 발생합니다. 티카그렐러로부터 주요 순환 대사체 AR-C124910XX(활성)의 형성은 중앙값 tmax 2.5시간(범위 1.5~5.0)으로 발생합니다.
티카그렐러의 평균 절대 생체 이용률은 약 36%(범위 30~42%)입니다. 고지방 식사 섭취는 티카그렐러 Cmax에 영향을 미치지 않았지만 AUC를 21% 증가시켰습니다. 주요 대사체의 Cmax는 AUC 변화 없이 22% 감소했습니다.
물에 섞어 분쇄한 BRILINTA 정제는 경구 또는 위관영양 튜브를 통해 위에 투여할 때 전체 정제와 생체 동등합니다(티카그렐러 및 AR-C124910XX에 대해 AUC 및 Cmax가 80~125% 이내). 티카그렐러의 중앙값 tmax는 1.0시간(범위 1.0~4.0), AR-C124910XX의 중앙값 tmax는 2.0시간(범위 1.0~8.0)입니다.
분포
티카그렐러의 정상 상태 분포 용적은 88L입니다. 티카그렐러와 활성 대사체는 인체 혈장 단백질에 광범위하게 결합되어 있습니다(>99%).
대사
CYP3A4는 티카그렐러 대사 및 주요 활성 대사체 형성에 관여하는 주요 효소입니다. 티카그렐러와 그 주요 활성 대사체는 약한 P-당단백질 기질 및 억제제입니다. 활성 대사체에 대한 전신 노출은 티카그렐러 노출의 약 30~40%입니다. 티카그렐러는 BCRP 억제제입니다.
배설
티카그렐러의 주요 배설 경로는 간 대사입니다. 방사성 동위원소로 표지된 티카그렐러를 투여하면 방사능의 평균 회수율은 약 84%(대변 58%, 소변 26%)입니다. 소변에서 티카그렐러와 활성 대사체의 회수율은 모두 투여량의 1% 미만이었습니다. 티카그렐러 주요 대사체의 주요 배설 경로는 담즙 분비일 가능성이 가장 높습니다. 티카그렐러의 평균 t1/2는 약 7시간이고, 활성 대사체의 경우 약 9시간입니다.
특정 집단
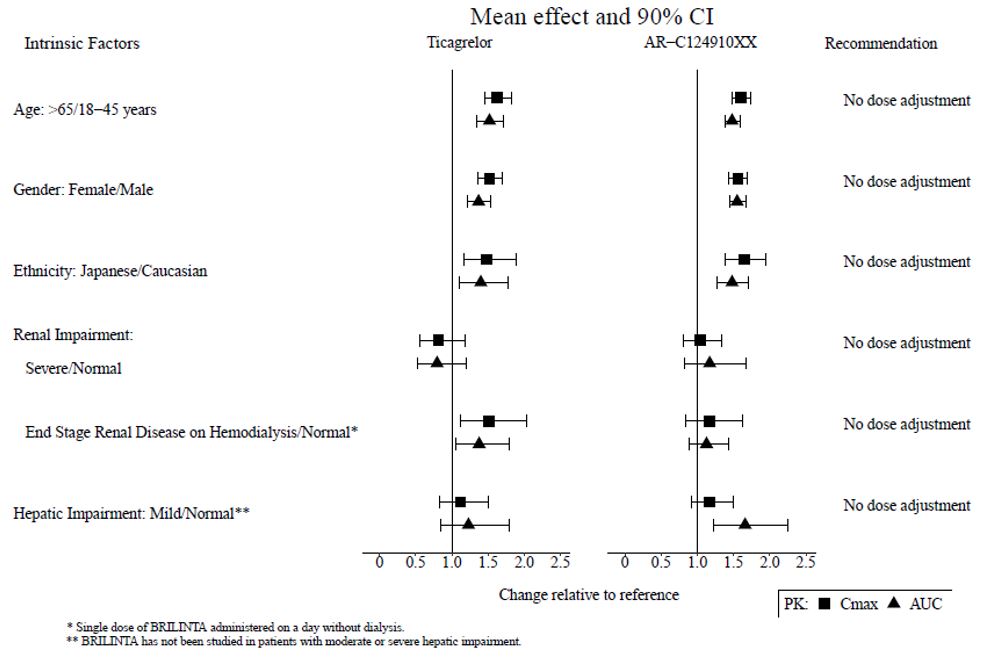
연령, 성별, 인종, 신장 장애 및 경도 간 장애가 티카그렐러 약동학에 미치는 영향은 그림 7에 제시되어 있습니다. 영향은 미미하며 용량 조절이 필요하지 않습니다.
말기 신부전 환자 (혈액 투석)
혈액 투석을 받는 말기 신부전 환자의 경우, 투석이 없는 날 투여된 BRILINTA 90mg의 AUC와 Cmax는 정상 신기능을 가진 피험자에 비해 각각 38%와 51% 더 높았습니다. BRILINTA를 투석 직전에 투여했을 때도 유사한 노출 증가가 관찰되어 BRILINTA는 투석되지 않음을 보여줍니다. 활성 대사체의 노출은 더 적은 정도로 증가했습니다. 말기 신부전 환자에서 BRILINTA의 IPA 효과는 투석과 무관하며 정상 신기능을 가진 건강한 성인과 유사했습니다.
그림 7 – 고유 요인이 티카그렐러 약동학에 미치는 영향
다른 약물이 BRILINTA에 미치는 영향
CYP3A4는 티카그렐로르 대사 및 주요 활성 대사체 형성에 관여하는 주요 효소입니다. 다른 약물이 티카그렐로르 약동학에 미치는 영향은 그림 8에 티카그렐로르 단독 투여(대조군/시험군)에 대한 변화로 제시되어 있습니다. 강력한 CYP3A 억제제(예: 케토코나졸, 이트라코나졸, 클라리스로마이신)는 티카그렐로르 노출을 상당히 증가시킵니다. 중등도 CYP3A 억제제는 효과가 적습니다(예: 딜티아젬). CYP3A 유도제(예: 리팜핀)는 티카그렐로르 혈중 농도를 상당히 감소시킵니다. P-gp 억제제(예: 시클로스포린)는 티카그렐로르 노출을 증가시킵니다.
정맥내 모르핀 5mg과 티카그렐로르 180mg 로딩 용량을 병용 투여한 결과, 건강한 성인의 경우 관찰된 평균 티카그렐로르 노출량이 최대 25%, PCI를 시행받은 ACS 환자의 경우 최대 36% 감소했습니다. Tmax는 1~2시간 지연되었습니다. 활성 대사체의 노출량도 유사한 정도로 감소했습니다. 모르핀 병용 투여는 건강한 성인의 혈소판 억제를 지연시키거나 감소시키지 않았습니다. ACS 환자에서 모르핀을 병용 투여한 경우 로딩 용량 투여 후 최대 3시간까지 평균 혈소판 응집이 더 높았습니다.
PCI를 시행받은 ACS 환자에게 정맥내 펜타닐과 티카그렐로르 180mg 로딩 용량을 병용 투여한 결과, 티카그렐로르 노출 및 혈소판 억제에 대한 유사한 효과가 나타났습니다.
그림 8 – 병용 투여 약물이 티카그렐로르 약동학에 미치는 영향
*용법 및 용량(2) 참조
BRILINTA가 다른 약물에 미치는 영향
In vitro 대사 연구 결과, 티카그렐로르 및 주요 활성 대사체는 CYP3A4의 약한 억제제이며, CYP3A5의 잠재적 활성제이고 P-gp 수송체의 억제제임을 보여줍니다. In vitro 대사 연구 결과, 티카그렐로르는 BCRP 억제제임을 보여줍니다. 티카그렐로르와 AR-C124910XX는 인간 CYP1A2, CYP2C19 및 CYP2E1 활성에 대한 억제 효과가 없는 것으로 나타났습니다. 심바스타틴, 아토르바스타틴, 에티닐 에스트라디올, 레보노르게스트렐, 톨부타마이드, 디곡신 및 시클로스포린의 약동학에 대한 특정 in vivo 효과는 그림 9를 참조하십시오.
그림 9 – BRILINTA가 병용 투여 약물의 약동학에 미치는 영향
13 비임상 독성학
13.1 발암성, 돌연변이원성, 생식능력 저하
발암성
Ticagrelor는 최대 250 mg/kg/day의 용량으로 마우스에서 또는 최대 120 mg/kg/day의 용량으로 수컷 랫드에서 발암성이 나타나지 않았습니다 (각각 AUC 기준으로 1일 2회 90mg의 MRHD의 19배 및 15배). 180 mg/kg/day의 용량(AUC 기준으로 1일 2회 90mg의 최대 권장 용량의 29배)으로 암컷 랫드에서 자궁암종, 자궁 선암종 및 간세포 선종이 관찰되었으나, 60 mg/kg/day(AUC 기준으로 MRHD의 8배)의 용량에서는 암컷 랫드에서 발암성이 나타나지 않았습니다.
돌연변이원성
Ames 박테리아 돌연변이원성 시험, 마우스 림프종 분석 및 랫드 소핵 시험에서 Ticagrelor는 유전독성을 나타내지 않았습니다. 활성 O-탈메틸화 대사체는 Ames 시험 및 마우스 림프종 분석에서 유전독성을 나타내지 않았습니다.
생식능력 저하
Ticagrelor는 최대 180 mg/kg/day의 용량으로 수컷의 생식능력에 영향을 미치지 않았으며, 최대 200 mg/kg/day의 용량으로 암컷의 생식능력에도 영향을 미치지 않았습니다 (AUC 기준으로 MRHD의 15배 초과). 암컷 랫드에 10 mg/kg/day 이상의 용량을 투여했을 때 발정 주기의 불규칙적인 지속 기간의 발생률이 증가했습니다 (AUC 기준으로 MRHD의 1.5배).
14 임상 연구
14.1 급성 관상동맥 증후군 및 심근경색 후 2차 예방
PLATO
PLATO (NCT00391872)는 급성 관상동맥 증후군(ACS) 환자에서 아스피린 및 기타 표준 치료와 병용하여 BRILINTA (N=9333)와 클로피도그렐 (N=9291)을 비교한 무작위 이중맹검 연구였습니다. 가장 최근의 흉통 또는 증상 발병 후 24시간 이내에 내원한 환자들이 대상이었습니다. 이 연구의 1차 종점은 심혈관 사망, 비치명적 심근경색(무증상 심근경색 제외), 또는 비치명적 뇌졸중의 첫 발생의 복합적인 결과였습니다.
이미 클로피도그렐로 치료받은 환자도 등록하여 연구 치료군에 무작위 배정될 수 있었습니다. 6개월 이내에 두개내 출혈, 위장관 출혈 병력이 있거나, 알려진 출혈 경향 또는 응고 장애가 있는 환자는 제외되었습니다. 항응고제를 복용하는 환자는 연구 참여에서 제외되었으며, 시험 중 항응고제 적응증이 발생한 환자는 연구 약물 투여가 중단되었습니다. ACS를 약물 치료 또는 관혈적 치료할 의향이 있었는지 여부에 관계없이 환자를 포함할 수 있었지만, 환자 무작위 배정은 이러한 의향에 따라 계층화되지 않았습니다.
BRILINTA 투여군의 모든 환자는 180mg의 로딩 용량에 이어 90mg을 1일 2회 유지 용량으로 투여받았습니다. 클로피도그렐 투여군 환자는 클로피도그렐 치료를 이미 받지 않은 경우 300mg의 초기 로딩 용량으로 치료받았습니다. PCI를 받는 환자는 연구자의 재량에 따라 추가로 300mg의 클로피도그렐을 투여받을 수 있었습니다. 아스피린 75-100mg의 일일 유지 용량이 권장되었지만, 지역적 판단에 따라 더 높은 아스피린 유지 용량이 허용되었습니다. 환자들은 최소 6개월에서 최대 12개월 동안 치료받았습니다.
PLATO 연구 대상 환자는 주로 남성(72%)과 백인(92%)이었습니다. 약 43%의 환자가 65세 이상이었고, 15%는 75세 이상이었습니다. 연구 약물에 대한 중앙값 노출 기간은 276일이었습니다. 약 절반의 환자가 연구 전에 클로피도그렐을 투여받았고, 약 99%의 환자가 PLATO 기간 중 어느 시점에 아스피린을 투여받았습니다. 약 35%의 환자가 기준 시점에 스타틴을 복용하고 있었고, 93%는 PLATO 기간 중 어느 시점에 스타틴을 투여받았습니다.
표 7은 1차 복합 종점에 대한 연구 결과와 각 구성 요소가 1차 종점에 기여한 부분을 보여줍니다. 전체 CV 사망, 심근경색 및 뇌졸중 발생률과 전체 사망률에 대한 별도의 2차 종점 분석 결과가 제시되어 있습니다.
|
심혈관 사망 |
45 |
57 |
0.79 (0.69, 0.91) |
0.0013 |
|
심근경색‡ |
65 |
76 |
0.84 (0.75, 0.95) |
0.0045 |
|
뇌졸중‡ |
16 |
14 |
1.17 (0.91, 1.52) |
0.22 |
|
모든 원인에 의한 사망 |
51 |
65 |
0.78 (0.69, 0.89) |
0.0003 |
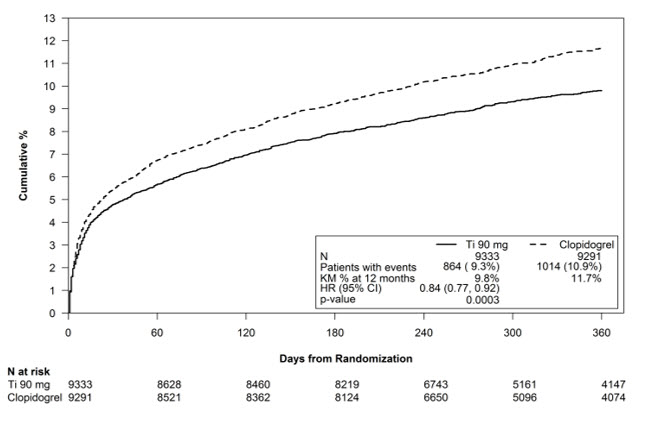
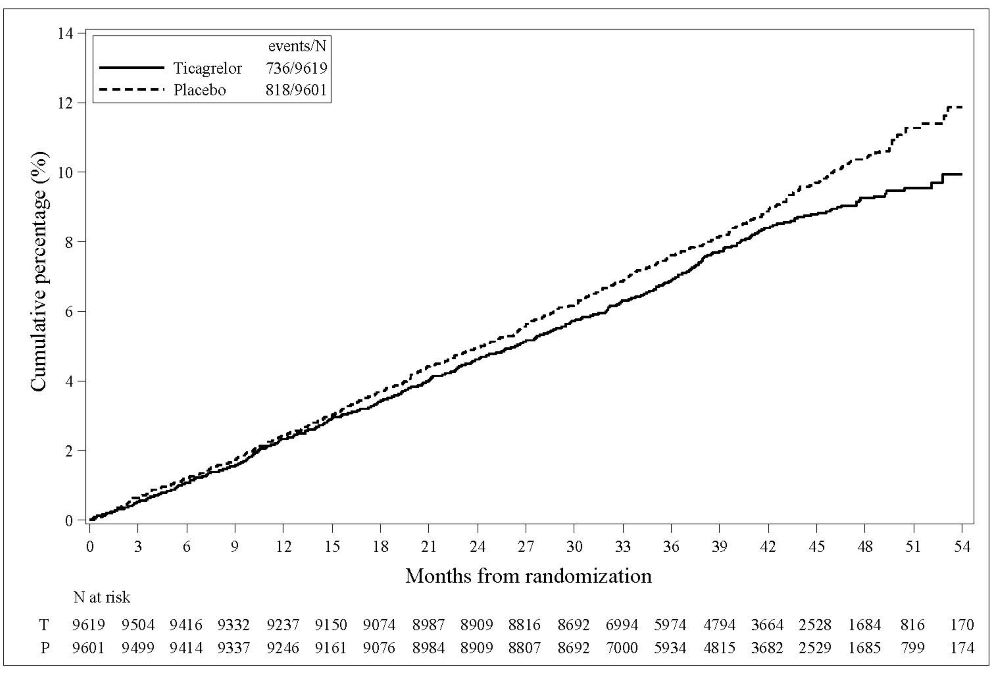
Kaplan-Meier 곡선(그림 10)은 전체 연구에서 심혈관 사망, 비치명적 심근경색 또는 비치명적 뇌졸중이라는 주요 복합 평가변수의 첫 발생까지의 시간을 보여줍니다.
그림 10 – 심혈관 사망, 심근경색 또는 뇌졸중의 첫 발생까지의 시간 (PLATO)
곡선은 30일째 분리되고[상대 위험 감소(RRR) 12%] 12개월 치료 기간 동안 계속해서 차이가 납니다(RRR 16%).
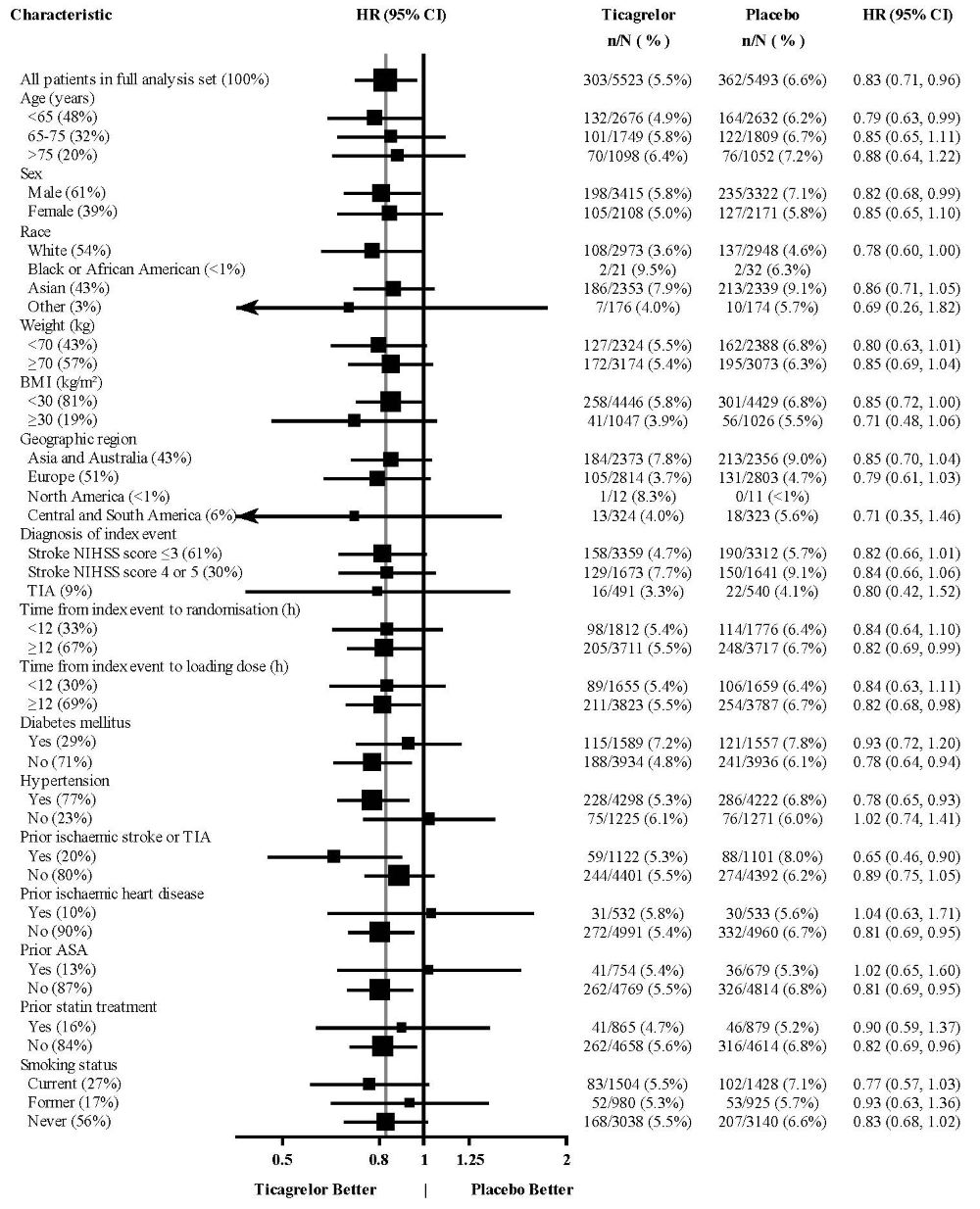
PLATO 연구 동안 스텐트 시술을 받은 11,289명의 환자 중 스텐트 혈전증 위험(심사 확정 “확실”의 경우 1.3%)이 클로피도그렐(1.9%)보다 낮았습니다(HR 0.67, 95% CI 0.50-0.91; p=0.009). 약물 용출 스텐트와 금속 스텐트의 결과는 유사했습니다.
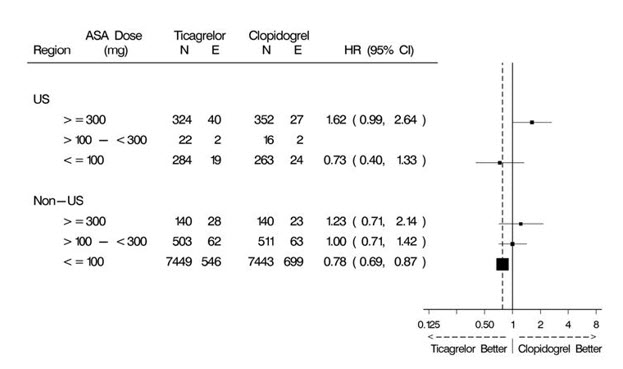
다양한 인구 통계, 병용 기준 약물 및 기타 치료 차이가 결과에 미치는 영향을 조사했습니다. 이 중 일부는 그림 11에 나와 있습니다. 많은 수의 분석에서 차이가 우연의 결과를 반영할 수 있으므로 이러한 분석은 신중하게 해석해야 합니다. 대부분의 분석은 전체 결과와 일치하는 효과를 보여주지만 두 가지 예외가 있습니다. 지역별 이질성 발견과 아스피린 유지 용량의 강력한 영향입니다. 이는 아래에서 자세히 설명합니다.
표시된 특성의 대부분은 기준 특성이지만 일부는 무작위 배정 후 결정 사항을 반영합니다(예: 아스피린 유지 용량, PCI 사용).
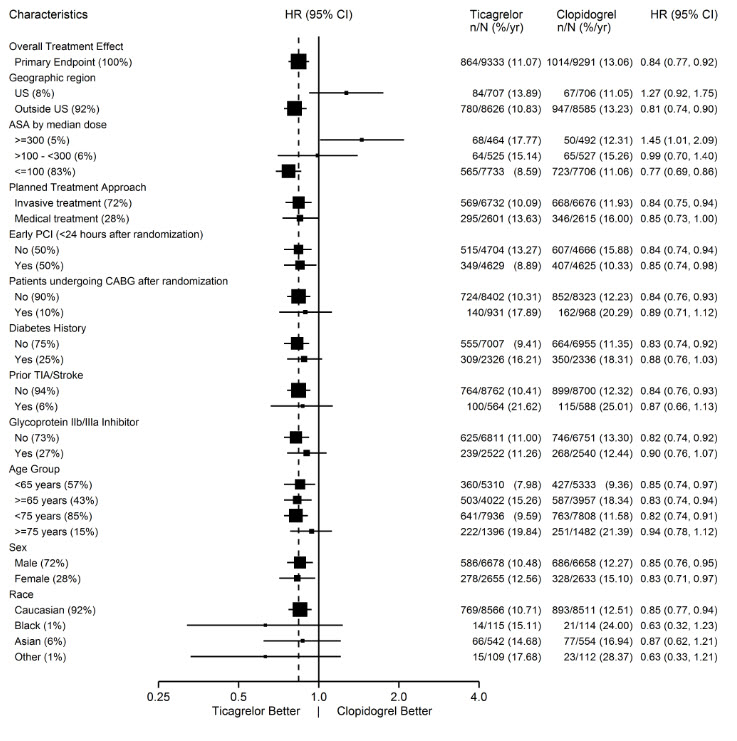
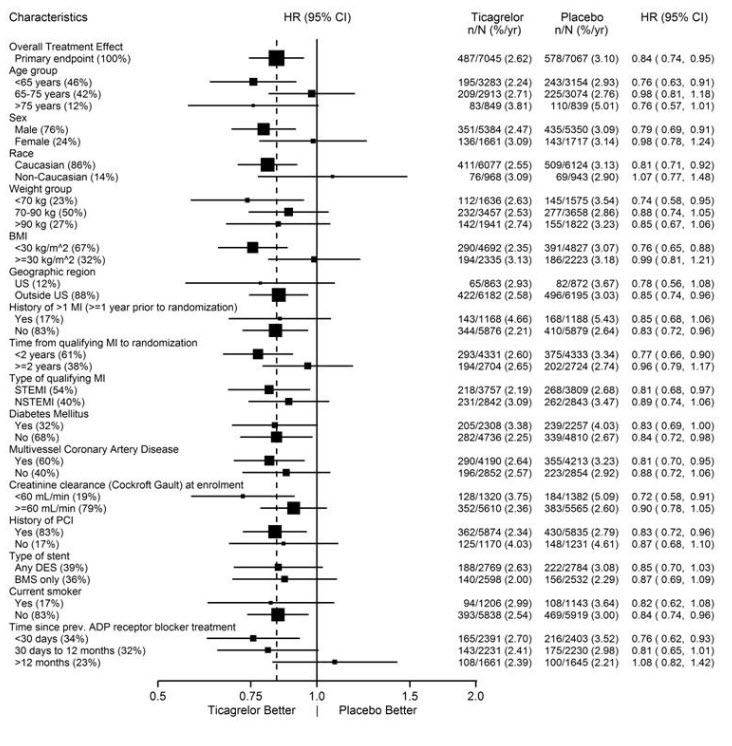
그림 11 – (PLATO)의 하위 그룹 분석
참고: 위 그림은 대부분 기준 특성이고 대부분 사전 지정된 다양한 하위 그룹의 효과를 나타냅니다. 표시된 95% 신뢰 한계는 비교 횟수를 고려하지 않으며 다른 모든 요인을 조정한 후 특정 요인의 효과를 반영하지 않습니다. 그룹 간의 명백한 동질성 또는 이질성을 과도하게 해석해서는 안 됩니다.
지역적 차이
북미(미국 및 캐나다)의 효과와 비교한 다른 지역의 결과는 북미에서 더 작은 효과를 보여주며, 수치적으로 대조군보다 열등하고 미국 하위 집합에 의해 주도됩니다. 미국/비미국 비교에 대한 통계적 검정은 통계적으로 유의미하며(p=0.009), 심혈관 사망 및 비치명적 심근경색 모두에서 동일한 경향이 나타납니다. 모든 하위 집합 분석과 마찬가지로 개별 결과 및 명목 p-값은 신중하게 해석해야 하며 우연한 결과를 나타낼 수 있습니다. 그러나 심혈관 사망률 및 비치명적 심근경색 구성 요소 모두에서 차이가 일관되게 나타난다는 것은 이 결과가 신뢰할 수 있음을 뒷받침합니다.
미국과 비미국 간의 다양한 기준 및 시술 차이(침습적 vs. 계획된 의학적 관리, GPIIb/IIIa 억제제 사용, 약물 용출 스텐트 vs. 금속 스텐트 사용 포함)를 조사하여 지역적 차이를 설명할 수 있는지 확인했지만 아스피린 유지 용량이라는 한 가지 예외를 제외하고 이러한 차이가 결과의 차이로 이어지지는 않았습니다.
아스피린 용량
PLATO 프로토콜에서는 연구자가 아스피린 유지 용량을 선택하도록 했으며 사용 패턴은 미국 이외 지역의 현장과 미국 현장에서 달랐습니다. 비미국 연구자의 약 8%는 100mg 이상의 아스피린 용량을 투여했고 약 2%는 300mg 이상의 용량을 투여했습니다. 미국에서는 환자의 57%가 100mg 이상의 용량을, 54%가 300mg 이상의 용량을 투여받았습니다. 전체 결과는 저용량(≤100mg)의 아스피린과 함께 사용했을 때 BRILINTA에 유리했으며 아스피린 용량별로 분석한 결과는 미국과 다른 지역에서 유사했습니다. 그림 10은 중앙값 아스피린 용량별 전체 결과를 보여줍니다. 그림 12는 지역 및 용량별 결과를 보여줍니다.
그림 12 – 미국 및 미국 이외 지역의 유지 아스피린 용량별 심혈관 사망, 심근경색, 뇌졸중 (PLATO)
계획되지 않은 모든 하위 집합 분석, 특히 특성이 진정한 기준 특성이 아니고 일반적인 연구자 관행에 따라 결정될 수 있는 경우 위의 분석은 신중하게 처리해야 합니다. 그러나 아스피린 용량이 두 지역 모두에서 유슷한 패턴으로 결과를 예측하고 패턴이 주요 평가변수의 두 가지 주요 구성 요소인 심혈관 사망 및 비치명적 심근경색과 유사하다는 점은 주목할 만합니다.
이러한 결과를 신중하게 처리해야 하지만 티카그렐러와 함께 사용하는 아스피린 유지 용량을 100mg으로 제한하는 것이 좋습니다. 고용량은 ACS 환경에서 확립된 이점이 없으며 이러한 용량을 사용하면 BRILINTA의 효과가 감소한다는 강력한 암시가 있습니다.
PEGASUS
PEGASUS TIMI-54 연구(NCT01225562)는 21,162명의 환자를 대상으로 한 무작위, 이중맹검, 위약 대조, 병렬 그룹 연구였습니다. 75-150mg의 아스피린과 함께 병용 투여되는 90mg 1일 2회 또는 60mg 1일 2회의 두 가지 티카그렐러 용량을 아스피린 단독 요법과 비교하여 심근경색 병력이 있는 환자를 대상으로 비교했습니다. 주요 평가변수는 심혈관 사망, 비치명적 심근경색 및 비치명적 뇌졸중의 첫 발생 복합 평가변수였습니다. 심혈관 사망 및 모든 원인으로 인한 사망률을 2차 평가변수로 평가했습니다.
환자는 ≥50세이고 무작위 배정 1~3년 전에 심근경색 병력이 있고 혈전성 심혈관 질환에 대한 다음 위험 요소 중 하나 이상을 가진 경우 참여 자격이 있었습니다. ≥65세, 약물 치료가 필요한 당뇨병, 하나 이상의 다른 이전 심근경색, 다중 혈관 관상 동맥 질환의 증거 또는 크레아티닌 청소율 <60mL/min. 환자는 이전 ADP 수용체 차단제 요법 또는 요법 중단 여부에 관계없이 무작위 배정될 수 있었습니다. 연구 기간 동안 신장 투석이 필요하거나 필요할 것으로 예상되는 환자는 제외되었습니다. 과거 6개월 이내에 두개내 출혈, 위장관 출혈이 있었거나 출혈 소인 또는 응고 장애가 알려진 환자는 제외되었습니다. 항응고제를 복용하는 환자는 참여에서 제외되었고 시험 중 항응고제 적응증이 발생한 환자는 연구 약물에서 중단되었습니다. 뇌졸중 병력이 있는 소수의 환자가 포함되었습니다. PEGASUS 외부 정보에 따르면 뇌졸중 병력이 있는 102명의 환자(그 중 90명이 연구 약물을 투여받음)가 조기에 종료되었고 더 이상 그러한 환자는 등록되지 않았습니다.
환자들은 최소 12개월에서 최대 48개월 동안 치료를 받았으며, 중앙 추적 관찰 기간은 33개월이었습니다.
환자들은 주로 남성(76%), 백인(87%)이었으며 평균 연령은 65세였고, 99.8%의 환자들이 이전에 아스피린 치료를 받았습니다.
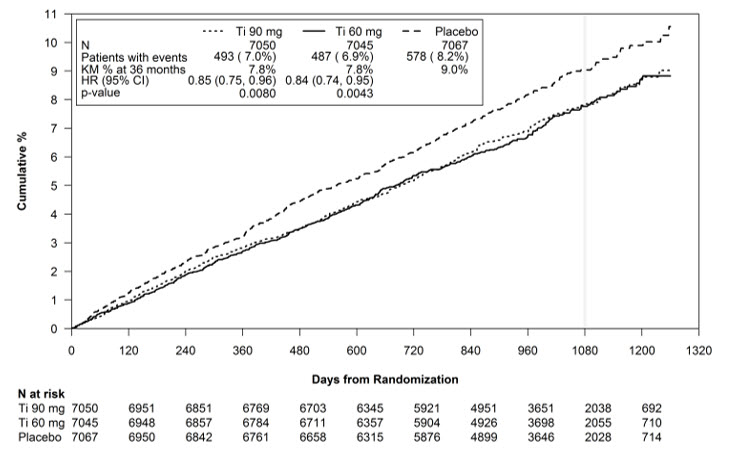
Kaplan-Meier 곡선(그림 13)은 심혈관 사망, 비치명적 심근경색 또는 비치명적 뇌졸중의 일차 복합 종점의 첫 발생까지의 시간을 보여줍니다.
그림 13 – 심혈관 사망, 심근경색 또는 뇌졸중의 첫 발생까지의 시간 (PEGASUS)
Ti = 티카그렐로르 1일 2회, CI = 신뢰 구간; HR = 위험 비; KM = Kaplan-Meier; N = 환자 수.
아스피린과 병용한 BRILINTA 60mg 및 90mg 요법 모두 아스피린 단독 요법에 비해 심혈관 사망, 심근경색 또는 뇌졸중 발생률을 감소시키는 데 우수했습니다. BRILINTA + 아스피린 대 아스피린 단독 요법의 절대적 위험 감소는 60mg 및 90mg 요법에서 각각 1.27% 및 1.19%였습니다. 두 요법의 효능 프로파일은 유사했지만, 저용량은 출혈 및 호흡곤란의 위험이 더 낮았습니다.
표 8은 60mg + 아스피린 요법 vs. 아스피린 단독 요법의 결과를 보여줍니다.
|
BRILINTA* |
플라시보 |
HR (95% CI) |
p-값 |
|
|
사건 수 / 1000 환자년 |
사건 수 / 1000 환자년 |
|||
|
심혈관 사망, 심근경색 또는 뇌졸중의 첫 발생까지의 시간† |
26 |
31 |
0.84 (0.74, 0.95) |
0.0043 |
|
9 |
11 |
0.83 (0.68, 1.01) |
||
|
심근경색§ |
15 |
18 |
0.84 (0.72, 0.98) |
|
|
뇌졸중§ |
5 |
7 |
0.75 (0.57, 0.98) |
|
|
모든 원인 사망‡ |
16 |
18 |
0.89 (0.76, 1.04) |
|
|
CI = 신뢰 구간; CV = 심혈관; HR = 위험 비; MI = 심근경색; N = 환자 수. |
||||