의약품 제조업체: GlaxoSmithKline Biologicals SA (Updated: 2023-05-22)
처방 정보 하이라이트
SHINGRIX (Zoster Vaccine Recombinant, Adjuvanted), suspension for intramuscular injection
Initial U.S. Approval: 2017
적응증 및 용법
SHINGRIX는 대상포진(HZ) 예방을 위한 백신으로 다음과 같은 경우에 사용됩니다.
- •
- 만 50세 이상 성인
- •
- 알려진 질병이나 치료로 인한 면역 결핍 또는 면역 억제로 인해 HZ 위험이 높거나 높아질 것으로 예상되는 만 18세 이상 성인
사용 제한 (1):
- •
- SHINGRIX는 수두(chickenpox)의 일차 감염 예방을 위해 사용되지 않습니다.
용량 및 투여 방법
투여 형태 및 함량
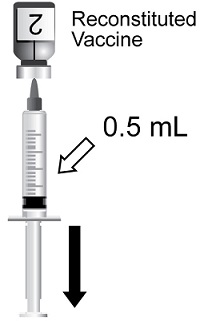
동봉된 AS01B 보조제 현탁액 성분 바이알로 재구성하기 위한 동결 건조 수두 대상포진 바이러스 당단백질 E(gE) 항원 성분의 단회 투여 바이알로 제공되는 주사용 현탁액. 재구성 후 SHINGRIX 1회 용량은 0.5mL입니다. (3)
금기 사항
백신 성분에 대한 중증 알레르기 반응(예: 아나필락시스) 또는 이전 SHINGRIX 투여 후 중증 알레르기 반응을 경험한 적이 있는 경우. (4)
경고 및 주의 사항
이상 반응
- •
- 만 50세 이상의 사람들에게서 보고된 국소적 이상 반응은 통증(78%), 발적(38%), 부기(26%)였습니다. (6.1)
- •
- 만 50세 이상의 사람들에게서 보고된 일반적 이상 반응은 근육통(45%), 피로(45%), 두통(38%), 오한(27%), 발열(21%), 위장관 증상(17%)였습니다. (6.1)
- •
- 자가 조혈모세포 이식을 받은 환자(18~49세 및 50세 이상)에게서 보고된 국소적 이상 반응은 통증(88% 및 83%), 발적(30% 및 35%), 부기(21% 및 18%)였습니다. (6.1)
- •
- 자가 조혈모세포 이식을 받은 환자(18~49세 및 50세 이상)에게서 보고된 일반적 이상 반응은 피로(64% 및 54%), 근육통(58% 및 52%), 두통(44% 및 30%), 위장관 증상(21% 및 28%), 오한(31% 및 25%), 발열(28% 및 18%)였습니다. (6.1)
의심되는 이상 반응을 보고하려면 GlaxoSmithKline(1-888-825-5249) 또는 VAERS(1-800-822-7967 또는 www.vaers.hhs.gov.)에 문의하십시오.
환자 상담 정보는 17을 참조하십시오.
개정일: 2023년 5월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법
2 용량 및 투여
2.1 재구성
2.2 투여 지침
2.3 용량 및 일정
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 알레르기 백신 반응 예방 및 관리
5.2 길랭-바레 증후군(GBS)
5.3 실신
6 이상반응
6.1 임상시험 경험
6.2 시판 후 경험
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
11 설명
12 임상 약리학
12.1 작용 기전
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
14 임상 연구
14.1 50세 이상 대상자의 효능
14.2 70세 이상 대상자의 효능
14.3 연구 1 및 2에 대한 통합 효능 분석
14.4 투여 일정을 뒷받침하는 면역학적 평가
14.5 면역 저하 성인(18세 이상)의 효능
14.6 ZOSTAVAX(생대상포진 백신) 접종 후 재접종
14.7 다른 백신과의 병용 투여
16 공급 방법/보관 및 취급
16.1 재구성 전 보관
16.2 재구성 후 보관
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
SHINGRIX는 대상포진(HZ) 예방을 위한 백신으로 다음과 같은 경우에 사용됩니다.
• 만 50세 이상 성인
• 알려진 질병이나 치료로 인한 면역결핍 또는 면역억제로 인해 HZ 위험이 높거나 높아질 것으로 예상되는 만 18세 이상 성인
사용 제한:
- •
- SHINGRIX는 수두(chickenpox)의 일차 감염 예방을 위해 사용되지 않습니다.
2 복용량 및 투여
근육 주사로만 투여하십시오.
2.1 재구성
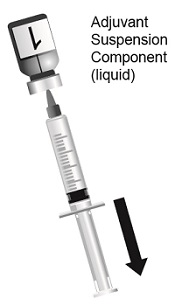
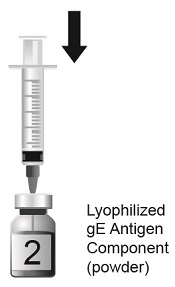
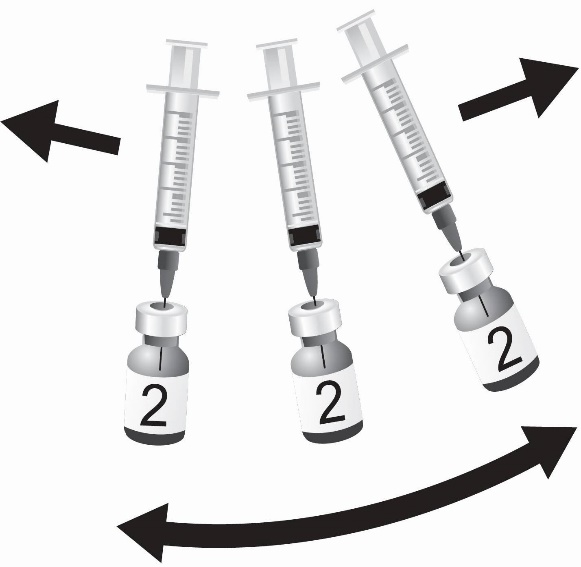
SHINGRIX는 투여 전에 혼합해야 하는 2개의 바이알에 들어 있습니다. 동봉된 AS01B 보조제 현탁액 성분(액체)으로 동결 건조된 수두 대상포진 바이러스 당단백질 E(gE) 항원 성분(분말)을 재구성하여 SHINGRIX를 준비합니다. 재구성에는 제공된 보조제 현탁액 성분(액체)만 사용하십시오. 재구성된 백신은 유백색의 무색에서 옅은 갈색의 액체여야 합니다. 비경구 약물은 용액과 용기가 허용되는 경우 투여 전에 미립자 및 변색 여부를 육안으로 검사해야 합니다. 이러한 조건 중 하나라도 존재하는 경우 백신을 투여해서는 안 됩니다.
2.2 투여 지침
근육 주사로만 투여하십시오.
재구성 후 즉시 SHINGRIX를 투여하거나 2~8°C(36~46°F)에서 냉장 보관하고 6시간 이내에 사용하십시오. 6시간 이내에 사용하지 않은 재구성된 백신은 폐기하십시오.
개인마다 별도의 살균된 바늘과 주사기를 사용하십시오. 근육 주사에 선호되는 부위는 팔 위쪽의 삼각근 부위입니다.
2.3 복용량 및 일정
다음 일정에 따라 근육 내로 2회 복용(각 0.5mL)을 투여합니다.
• 0개월에 1차 접종을 하고 2~6개월 후에 2차 접종을 합니다.
• 면역결핍 또는 면역억제 상태이거나 면역결핍 또는 면역억제 상태가 될 예정이며 더 짧은 예방 접종 일정의 이점을 얻을 수 있는 개인: 0개월에 1차 접종을 하고 1~2개월 후에 2차 접종을 합니다.
3. 투여 형태 및 용량
SHINGRIX는 동결건조된 gE 항원 성분으로 구성된 단일 용량 바이알로 제공되는 주사용 현탁액이며, 함께 제공되는 AS01B adjuvant suspension 성분 바이알로 재구성합니다. 재구성 후 단일 용량은 0.5mL입니다.
4 금기 사항
SHINGRIX를 백신의 성분에 대한 심각한 알레르기 반응(예: 아나필락시스) 병력이 있는 사람이나 SHINGRIX의 이전 투여 후에 투여하지 마십시오. [설명 참조(11)].
5 경고 및 주의사항
5.1 알레르기 백신 반응 예방 및 관리
투여 전에 의료 서비스 제공자는 백신 과민성 및 이전의 백신 관련 이상 반응에 대한 예방 접종 이력을 검토해야 합니다. SHINGRIX 투여 후 발생할 수 있는 아나필락시스 반응을 관리하기 위해 적절한 치료 및 감독을 받을 수 있어야 합니다.
5.3 실신
실신(기절)은 SHINGRIX를 포함한 주사 백신 투여와 관련될 수 있습니다. 실신은 시각 장애, 감각 이상, 강직-간대성 사지 운동과 같은 일시적인 신경학적 징후를 동반할 수 있습니다. 낙상으로 인한 부상을 방지하고 실신 후 뇌 혈류를 회복하기 위한 절차가 마련되어야 합니다.
6. 부작용
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 백신의 임상 시험에서 관찰된 유해 반응 발생률은 다른 백신의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제로 관찰된 발생률을 반영하지 않을 수 있습니다. SHINGRIX의 광범위한 사용은 임상 시험에서 관찰되지 않은 유해 반응을 밝혀낼 가능성이 있습니다.
50세 이상 성인
전반적으로 17건의 임상 연구에서 17,041명의 50세 이상 성인이 SHINGRIX를 최소 1회 투여 받았습니다.
SHINGRIX의 안전성은 0개월과 2개월 일정에 따라 SHINGRIX(n = 14,645) 또는 생리식염수 위약(n = 14,660)을 최소 1회 투여 받은 50세 이상의 피험자 29,305명을 대상으로 한 2건의 위약 대조 임상 연구(연구 1 및 2)의 데이터를 풀링하여 평가했습니다. 예방 접종 당시 인구의 평균 연령은 69세였으며, 7,286명(25%)의 피험자가 50~59세, 4,488명(15%)의 피험자가 60~69세, 17,531명(60%)의 피험자가 70세 이상이었습니다. 두 연구 모두 북미, 라틴 아메리카, 유럽, 아시아 및 호주에서 수행되었습니다. 전체 인구에서 대부분의 피험자는 백인(74%)이었고, 그 다음으로 아시아인(18%), 흑인(1.4%), 기타 인종/민족 그룹(6%)이었으며, 여성이 58%였습니다.
요청된 유해 반응: 연구 1 및 2에서, 요청된 국소 및 전신 유해 반응에 대한 데이터는 각 백신 투여량 또는 위약(즉, 예방 접종 당일 및 그 후 6일) 후 7일 동안 표준화된 일기 카드를 사용하여 피험자의 하위 집단(SHINGRIX를 투여 받은 피험자 n = 4,886, 위약을 투여 받은 피험자 n = 4,881, 최소 1회 투여량이 기록됨)에서 수집했습니다. 두 연구 모두에서, SHINGRIX(두 투여량 모두 합쳐서) 투여 후 요청된 국소 및 전신 유해 반응을 보고한 50세 이상 피험자의 비율은 통증(78%), 발적(38%), 부기(26%); 및 근육통(45%), 피로(45%), 두통(38%), 오한(27%), 발열(21%), 위장 증상(17%)이었습니다.
2건의 연구에서 연령 그룹별로 특정 요청된 국소 유해 반응 및 전신 유해 반응(피험자당 전체)의 보고된 빈도는 표 1에 제시되어 있습니다.
| 안전성을 위한 전체 예방 접종 코호트에는 최소 1회 투여량이 기록된 모든 피험자(n)가 포함되었습니다. a 7일은 예방 접종 당일과 그 후 6일을 포함합니다. b 50~59세 및 60~69세 피험자에 대한 데이터는 연구 1을 기반으로 합니다. 70세 이상 피험자에 대한 데이터는 연구 1: NCT01165177 및 연구 2: NCT01165229의 풀링된 데이터를 기반으로 합니다. c 위약은 생리식염수 용액이었습니다. d 3등급 통증: 휴식 시 심한 통증으로 정의되며, 일상적인 활동을 방해합니다. e 3등급 근육통, 피로, 두통, 오한 및 GI: 정상적인 활동을 방해하는 것으로 정의됩니다. f 발열은 경구, 액와 또는 고막 경로의 경우 ≥37.5°C/99.5°F, 직장 경로의 경우 ≥38°C/100.4°F로 정의됩니다. 3등급 발열은 >39.0°C/102.2°F로 정의됩니다. g GI = 메스꺼움, 구토, 설사 및/또는 복통을 포함한 위장 증상. |
||||||
|
유해 반응 |
50~59세 |
60~69세 |
≥70세 |
|||
|
SHINGRIX |
위약c |
SHINGRIX |
위약c |
SHINGRIX |
위약c |
|
|
국소 유해 반응 |
n = 1,315 % |
n = 1,312 % |
n = 1,311 % |
n = 1,305 % |
n = 2,258 % |
n = 2,263 % |
|
통증 |
88 |
14 |
83 |
11 |
69 |
9 |
|
통증, 3등급d |
10 |
1 |
7 |
1 |
4 |
0.2 |
|
발적 |
39 |
1 |
38 |
2 |
38 |
1 |
|
발적, >100 mm |
3 |
0 |
3 |
0 |
3 |
0 |
|
부종 |
31 |
1 |
27 |
1 |
23 |
1 |
|
부종, >100 mm |
1 |
0 |
1 |
0 |
1 |
0 |
|
일반적인 부작용 |
n = 1,315 % |
n = 1,312 % |
n = 1,309 % |
n = 1,305 % |
n = 2,252 % |
n = 2,264 % |
|
근육통 |
57 |
15 |
49 |
11 |
35 |
10 |
|
근육통, 3등급e |
9 |
1 |
5 |
1 |
3 |
0.4 |
|
피로 |
57 |
20 |
46 |
17 |
37 |
14 |
|
피로, 3등급e |
9 |
2 |
5 |
1 |
4 |
1 |
|
두통 |
51 |
22 |
40 |
16 |
29 |
12 |
|
두통, 3등급e |
6 |
2 |
4 |
0.2 |
2 |
0.4 |
|
떨림 |
36 |
7 |
30 |
6 |
20 |
5 |
|
떨림, 3등급e |
7 |
0.2 |
5 |
0.3 |
2 |
0.3 |
|
발열 |
28 |
3 |
24 |
3 |
14 |
3 |
|
발열, 3등급f |
0.4 |
0.2 |
1 |
0.2 |
0.1 |
0.1 |
|
GIg |
24 |
11 |
17 |
9 |
14 |
8 |
|
GI, 3등급e |
2 |
1 |
1 |
1 |
1 |
0.4 |
70세 이상의 대상자에서 50세에서 69세 사이의 대상자에 비해 요구되는 국소 및 전신 반응의 발생률이 낮았습니다.
SHINGRIX와 함께 관찰된 국소 및 전신 이상 반응의 중간 지속 시간은 2~3일이었습니다.
1차 접종과 2차 접종 사이에 요구되는 국소 반응을 보고한 대상자의 비율에 차이가 없었습니다. 두통과 오한은 1차 접종(각각 24% 및 14%)에 비해 2차 접종 후 대상자에서 더 자주 보고되었습니다(각각 28% 및 21%). 3등급 요구되는 전신 이상 반응(두통, 오한, 근육통 및 피로)은 1차 접종(각각 1.4%, 1.4%, 2.3% 및 2.4%)에 비해 2차 접종 후 대상자에서 더 자주 보고되었습니다(각각 2.3%, 3%, 4% 및 4%).
요구되지 않은 이상 사례: 각 접종 후 30일 이내(0일~29일)에 발생한 요구되지 않은 이상 사례는 모든 대상자에 의해 일기 카드에 기록되었습니다. 2개의 연구에서, 접종 후 30일 이내에 발생한 요구되지 않은 이상 사례는 SHINGRIX(n=14,645) 또는 위약(n=14,660)을 투여받은 대상자의 각각 51% 및 32%에서 보고되었습니다(총 접종 코호트). SHINGRIX 투여받은 사람의 1% 이상에서 발생하고 위약보다 적어도 1.5배 높은 비율로 발생한 요구되지 않은 이상 사례에는 오한(4% 대 0.2%), 주사 부위 가려움증(2.2% 대 0.2%), 불쾌감(1.7% 대 0.3%), 관절통(1.7% 대 1.2%), 메스꺼움(1.4% 대 0.5%) 및 현기증(1.2% 대 0.8%)이 포함되었습니다.
통풍(통풍성 관절염 포함)은 접종 후 30일 이내에 SHINGRIX 또는 위약을 각각 투여받은 대상자의 0.18%(n=27) 대 0.05%(n=8)에서 보고되었습니다. 이용 가능한 정보는 SHINGRIX와의 인과 관계를 밝히기에 충분하지 않습니다.
중대한 이상 사례(SAEs): 2개의 연구에서, SAEs는 첫 번째 투여된 용량부터 마지막 접종 후 30일까지 SHINGRIX(2.3%) 또는 위약(2.2%)을 투여받은 대상자에서 유사한 비율로 보고되었습니다. SAEs는 첫 번째 투여된 용량부터 마지막 접종 후 1년까지 SHINGRIX를 투여받은 대상자의 10.1% 및 위약을 투여받은 대상자의 10.4%에서 보고되었습니다. 1명의 대상자(<0.01%)가 림프절염을 보고했고 1명의 대상자(<0.01%)가 39°C를 초과하는 발열을 보고했습니다. SHINGRIX와의 인과 관계를 뒷받침할 근거가 있었습니다.
시신경 허혈성 신경병증은 SHINGRIX를 투여받은 3명의 대상자(0.02%)(모두 접종 후 50일 이내)에서 보고되었고 위약을 투여받은 대상자는 0명이었습니다. 이용 가능한 정보는 SHINGRIX와의 인과 관계를 밝히기에 충분하지 않습니다.
사망: 2개의 연구에서, 첫 번째 투여된 용량부터 마지막 접종 후 30일까지 사망은 SHINGRIX를 투여받은 대상자의 0.04% 및 위약을 투여받은 대상자의 0.05%에서 보고되었습니다. 첫 번째 투여된 용량부터 마지막 접종 후 1년까지 사망은 SHINGRIX를 투여받은 대상자의 0.8% 및 위약을 투여받은 대상자의 0.9%에서 보고되었습니다. 대상자의 사망 원인은 일반적으로 성인 및 노인 인구에서 보고되는 사망 원인과 일치했습니다.
잠재적인 면역 매개 질환: 2개의 연구에서, 새로운 잠재적인 면역 매개 질환(pIMDs)의 발생 또는 기존 pIMDs의 악화는 첫 번째 투여된 용량부터 마지막 접종 후 1년까지 SHINGRIX를 투여받은 대상자의 0.6% 및 위약을 투여받은 대상자의 0.7%에서 보고되었습니다. 가장 자주 보고된 pIMDs는 SHINGRIX를 투여받은 그룹과 위약 그룹에서 비슷한 빈도로 발생했습니다.
투약 일정: 공개 표지 임상 연구에서, 50세 이상의 238명의 대상자에게 SHINGRIX를 0개월과 2개월 또는 0개월과 6개월 일정으로 투여했습니다. SHINGRIX의 안전성 프로파일은 0개월과 2개월 또는 0개월과 6개월 일정에 따라 투여했을 때 유사했으며 연구 1과 2에서 관찰된 안전성 프로파일과 일치했습니다.
면역 저하 성인(18세 이상)
SHINGRIX의 안전성은 5가지 다른 면역 결핍 또는 면역 억제(면역 저하라고 함) 인구에서 18세 이상의 3,116명의 대상자를 등록한 6개의 위약 대조 임상 연구에서 평가되었으며, 이 중 총 1,587명이 SHINGRIX를 투여받았습니다. 모든 연구에서, 대상자는 SHINGRIX 1차 및 2차 접종을 1~2개월 간격으로 투여받았습니다. 이러한 연구에 대한 안전성 모니터링은 연구 1과 2와 유사했습니다. 또한, 대상자는 특정 질병 또는 상태와 관련된 사건에 대해 모니터링되었습니다.
SHINGRIX 또는 위약을 투여받을 당시, 인구의 평균 연령은 55세였습니다. 28%의 대상자가 18~49세였고 72%의 대상자가 50세 이상이었습니다. 각 연구는 북미, 라틴 아메리카, 유럽, 아시아, 아프리카 및 호주/뉴질랜드 중 하나 이상의 지역에서 수행되었습니다. 대부분의 대상자는 백인(77%)이었고, 그 다음으로 아시아인(17%), 흑인(2%) 및 기타 인종 그룹(3%)이었습니다. 4%는 미국 히스패닉 또는 라틴 아메리카계였고 37%는 여성이었습니다.
| a 첫 번째 용량은 자가 조혈 줄기 세포 이식 후 50~70일 이내에 투여되었습니다. b 안전성 추적 관찰은 HZ 사례 누적에 따라 이루어졌으며, 마지막 접종 후 최소 12개월에서 대상자 수준에서 4년까지였습니다. c 암 치료 과정 중에 접종을 받은 대상자의 경우, 각 용량은 접종과 암 치료 주기 사이에 최소 10일 간격을 두고 투여되었습니다. d 암 치료 과정을 완료한 후 접종을 받은 대상자의 경우, 첫 번째 용량은 암 치료가 끝난 후 10일에서 6개월 사이에 투여되었습니다. e 첫 번째 용량은 신장 이식 후 4~18개월 사이에 투여되었습니다. f PreChemo 그룹(TVC: SHINGRIX [n=90], 위약 [n=91])의 경우, 첫 번째 용량은 화학 요법 주기 시작 전 최대 1개월에서 최소 10일 전에 투여되었고, 두 번째 용량은 화학 요법 주기 첫날에 투여되었습니다. g OnChemo 그룹(TVC: SHINGRIX [n=27], 위약 [n=24])의 경우, 각 용량은 화학 요법 주기 첫날에 투여되었습니다. |
|||||||||||
|
임상 연구 |
백신 접종 대상자 수 |
연구 대상군 |
안전성 추적 기간 |
||||||||
|
SHINGRIX |
위약 |
||||||||||
|
auHSCT (NCT01610414) |
922 |
924 |
자가 조혈 줄기 세포 이식 수혜자a |
안전성 추적 기간 중앙값 29개월b |
|||||||
|
혈액 악성 종양 (NCT01767467) |
283 |
279 |
혈액 악성 종양c,d |
마지막 백신 접종 후 12개월 |
|||||||
|
신장 이식 (NCT02058589) |
132 |
132 |
신장 이식 수혜자e |
마지막 백신 접종 후 12개월 |
|||||||
|
고형 악성 종양 (NCT01798056) |
117 |
115 |
화학 요법을 받는 고형 종양 환자f,g |
마지막 백신 접종 후 12개월 |
|||||||
|
HIV (NCT01165203) |
74 |
49 |
HIV 감염자 |
마지막 백신 접종 후 12개월 |
|||||||
|
auHSCT (NCT00920218) |
59 |
30 |
자가 조혈 줄기 세포 이식 수혜자a |
마지막 백신 접종 후 12개월 |
|||||||
auHSCT 연구(NCT01610414)에서 SHINGRIX 또는 위약을 투여받은 시점에 모집단의 평균 연령은 55세였으며, 25%의 피험자가 18~49세였고 75%의 피험자가 50세 이상이었습니다. 피험자의 대부분은 백인(78%)이었으며, 그 다음으로 아시아인(16%), 흑인(2%), 기타 인종 그룹(3%)이었고, 3%는 미국 히스패닉 또는 라틴계 민족이었으며, 37%는 여성이었습니다.
요청된 유해 반응: auHSCT 수혜자(18~49세 및 ≥50세)에게 SHINGRIX(두 번의 투여량 모두 포함)를 투여한 후 7일 이내에 보고된 요청된 국소 유해 반응은 통증(88% 및 83%), 발적(30% 및 35%), 부기(21% 및 18%)였습니다. auHSCT 수혜자(18~49세 및 ≥50세)에게 SHINGRIX(두 번의 투여량 모두 포함)를 투여한 후 7일 이내에 보고된 요청된 전반적인 유해 반응은 피로(64% 및 54%), 근육통(58% 및 52%), 두통(44% 및 30%), 위장 증상(21% 및 28%), 오한(31% 및 25%), 발열(28% 및 18%)이었습니다. auHSCT 연구(NCT01610414)에서 SHINGRIX 또는 위약의 각 투여량을 투여한 후 각 요청된 국소 및 전반적인 유해 반응을 보고한 18세 이상 피험자의 비율은 표 3에 제시되어 있습니다.
| 안전성을 위한 총 백신 접종 코호트(TVC)에는 최소 1회의 투여량이 기록된 모든 피험자가 포함되었습니다(n). % = 증상을 최소 1회 보고한 피험자의 비율. a 7일은 백신 접종일과 그 이후 6일을 포함합니다. b 위약은 염화나트륨 용액으로 재구성된 자당이었습니다. c 3등급 통증: 휴식 시에도 심한 통증으로 인해 일상적인 활동을 할 수 없는 경우로 정의됩니다. d 3등급 근육통, 피로, 두통, 오한 및 GI: 정상적인 활동을 할 수 없는 경우로 정의됩니다. e GI = 메스꺼움, 구토, 설사 및/또는 복통을 포함한 위장 증상. |
||||||||||||||||||||
|
유해 반응 |
18~49세 |
≥50세 |
||||||||||||||||||
|
SHINGRIX |
위약b |
SHINGRIX |
위약b |
|||||||||||||||||
|
1차 투여량 |
2차 투여량 |
1차 투여량 |
2차 투여량 |
1차 투여량 |
2차 투여량 |
1차 투여량 |
2차 투여량 |
|||||||||||||
|
국소 유해 반응 |
n = 223 |
n = 205 |
n = 217 |
n = 207 |
n = 673 |
n = 635 |
n = 673 |
n = 627 |
||||||||||||
|
통증 |
81 |
82 |
8 |
6 |
75 |
74 |
6 |
5 |
||||||||||||
|
통증, 3등급c |
11 |
11 |
1 |
0 |
5 |
7 |
0.3 |
0 |
||||||||||||
|
발적 |
20 |
25 |
0 |
0 |
21 |
28 |
1 |
1 |
||||||||||||
|
발적, >100 mm |
1 |
2 |
0 |
0 |
1 |
3 |
0 |
0 |
||||||||||||
|
부종 |
14 |
17 |
0 |
0 |
10 |
15 |
1 |
1 |
||||||||||||
|
부종, >100 mm |
0 |
2 |
0 |
0 |
0.1 |
1 |
0 |
0 |
||||||||||||
|
일반적인 부작용 |
n = 222 |
n = 203 % |
n = 218 |
n = 207 |
n = 674 |
n = 633 |
n = 674 |
n = 628 |
||||||||||||
|
근육통 |
41 |
51 |
22 |
21 |
37 |
43 |
18 |
17 |
||||||||||||
|
근육통, 3등급d |
4 |
8 |
2 |
2 |
2 |
4 |
1 |
1 |
||||||||||||
|
피로 |
49 |
51 |
34 |
25 |
37 |
46 |
31 |
26 |
||||||||||||
|
피로, 3등급d |
6 |
10 |
1 |
2 |
3 |
4 |
2 |
3 |
||||||||||||
|
두통 |
23 |
38 |
17 |
17 |
15 |
25 |
13 |
8 |
||||||||||||
|
두통, 3등급d |
1 |
5 |
0 |
2 |
0.1 |
2 |
0.4 |
1 |
||||||||||||
|
떨림 |
20 |
26 |
12 |
6 |
11 |
21 |
7 |
7 |
||||||||||||
|
떨림, 3등급d |
1 |
6 |
0 |
0 |
0.4 |
3 |
1 |
0.2 |
||||||||||||
|
발열, ≥37.5°C/99.5°F |
9 |
28 |
4 |
2 |
6 |
15 |
3 |
4 |
||||||||||||
|
발열, 3등급 >39.5°C/103.1°F |
0 |
1 |
0 |
0 |
0.1 |
0.2 |
0 |
0.2 |
||||||||||||
|
GIe |
14 |
13 |
13 |
12 |
18 |
18 |
16 |
12 |
||||||||||||
|
GI, Grade 3d |
1 |
1 |
0 |
1 |
1 |
2 |
1 |
2 |
||||||||||||
일반적으로 면역 저하 환자를 대상으로 한 다른 연구에서 보고된 요구되는 국소 및 전신 이상 반응의 빈도는 auHSCT 연구(NCT01610414)와 유사했습니다. SHINGRIX와 관련된 국소 및 전신 이상 반응은 면역 저하 대상자를 모집한 모든 연구에서 중간 지속 시간이 1~3일이었습니다.
요청되지 않은 이상 사례: 면역 저하 대상자를 모집한 모든 6개 연구에서 각 예방 접종 후 30일 이내에 발생한 요청되지 않은 이상 사례(중증 및 경증 사례 포함)는 SHINGRIX 또는 위약을 투여받은 대상자의 46%와 44%에서 보고되었습니다. 관절통, 감염성 폐렴 및 독감 유사 질환의 이상 사례는 SHINGRIX 투여받은 사람의 1% 이상에서 발생했으며 위약보다 최소 1.5배 높은 비율로 발생했습니다(각각 1.5% 대 1.0%, 1.5% 대 0.9%, 1.3% 대 0.6%).
중증 이상 사례: 면역 저하 대상자를 모집한 모든 6개 연구에서 첫 번째 투여량부터 마지막 예방 접종 후 30일까지 SHINGRIX(7%) 또는 위약(8%)을 투여받은 대상자에서 유사한 비율로 SAE가 보고되었습니다. 첫 번째 투여량부터 마지막 예방 접종 후 1년까지 SHINGRIX를 투여받은 대상자의 26%와 위약을 투여받은 대상자의 27%에서 SAE가 보고되었습니다. 감염성 폐렴의 SAE는 마지막 예방 접종 후 30일까지 SHINGRIX를 투여받은 21명(1.3%)과 위약을 투여받은 11명(0.7%)에서 보고되었습니다. 사용 가능한 정보는 예방 접종과의 인과 관계를 결정하기에 충분하지 않습니다.
사망: 면역 저하 대상자를 모집한 모든 6개 연구에서 첫 번째 투여량부터 마지막 예방 접종 후 30일까지 SHINGRIX를 투여받은 2명(0.1%)과 위약을 투여받은 7명(0.5%)에서 사망이 보고되었습니다. 첫 번째 투여량부터 마지막 예방 접종 후 1년까지 SHINGRIX를 투여받은 대상자의 6%와 위약을 투여받은 대상자의 6%에서 사망이 보고되었습니다. 대상자의 사망 원인은 평가된 인구에서 예상되는 원인과 일치했습니다.
잠재적인 면역 매개 질환: 면역 저하 대상자를 모집한 모든 6개 연구에서 첫 번째 투여량부터 마지막 예방 접종 후 1년까지 SHINGRIX를 투여받은 대상자의 1.3%와 위약을 투여받은 대상자의 1.0%에서 새로운 pIMD 발병 또는 기존 pIMD 악화가 보고되었습니다. 치료 그룹 간에 특정 pIMD에서 눈에 띄는 불균형은 없었습니다.
기타 의학적으로 관련된 사건: auHSCT 연구(NCT01610414)에서 첫 번째 예방 접종부터 연구 종료까지 SHINGRIX를 최소 1회 투여받은 922명 중 315명(34%)과 위약을 투여받은 924명 중 331명(36%)에서 재발 또는 진행이 보고되었습니다.
auHSCT 연구(NCT00920218)에서 첫 번째 예방 접종부터 연구 종료까지 SHINGRIX를 최소 1회 투여받은 59명 중 17명(29%)과 위약을 투여받은 30명 중 8명(27%)에서 재발 또는 진행이 보고되었습니다.
혈액 악성 종양 연구에서 첫 번째 예방 접종부터 연구 종료까지 SHINGRIX를 최소 1회 투여받은 283명 중 45명(16%)과 위약을 투여받은 279명 중 58명(21%)에서 재발 또는 진행이 보고되었습니다.
신장 이식 연구에서 첫 번째 예방 접종부터 연구 종료(약 13개월 후)까지 SHINGRIX를 투여받은 132명 중 4명(3%)과 위약을 투여받은 132명 중 7명(5%)에서 생검으로 확인된 이식편 거부 반응이 보고되었습니다. 이식 기능 측정 지표인 크레아티닌과 예방 접종 후 동종 면역 변화는 체계적으로 평가되지 않았습니다.
HIV 연구에서 첫 번째 예방 접종부터 연구 종료까지 SHINGRIX를 투여받은 74명 중 9명(12%)과 위약을 투여받은 49명 중 5명(10%)에서 HIV 상태 악화 사례가 최소 1건 보고되었습니다.
23가 폐렴구균 다당류 백신과의 동시 투여
50세 이상 대상자를 대상으로 한 공개 표지 임상 연구(NCT02045836)에서 요구되는 국소 및 전신 이상 반응에 대한 정보는 7일(즉, 예방 접종 당일 및 그 후 6일) 동안 일기 카드를 사용하여 수집되었습니다. SHINGRIX의 첫 번째 투여량과 함께 PNEUMOVAX 23을 동시 투여한 경우 SHINGRIX의 첫 번째 투여량을 단독으로 투여한 경우와 비교하여 더 많은 비율의 대상자가 ≥37.5°C/99.5°F(각각 16% 대 7%)로 정의된 발열과 떨림(각각 21% 대 7%)을 보고했습니다. [임상 연구(14.7)].
6.2 시판 후 경험
SHINGRIX의 시판 후 사용 중 다음과 같은 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 인구에서 자발적으로 보고되기 때문에 빈도를 신뢰할 수 있게 추정하거나 백신과의 인과 관계를 확립하는 것이 항상 가능한 것은 아닙니다.
일반 장애 및 투여 부위 상태
주사를 맞은 팔의 운동 제한이 1주일 이상 지속될 수 있습니다.
면역 체계 장애
과민 반응(혈관 부종, 발진, 두드러기 포함).
신경계 장애
길랭-바레 증후군.
SHINGRIX 접종 후 길랭-바레 증후군 위험에 대한 시판 후 관찰 연구
SHINGRIX 접종과 GBS 간의 연관성은 65세 이상의 메디케어 수혜자를 대상으로 평가되었습니다. 메디케어 청구 데이터를 사용하여 2017년 10월부터 2020년 2월까지 수혜자의 SHINGRIX 접종은 국가 약물 코드를 통해 식별되었으며 SHINGRIX 투여받은 사람의 입원한 GBS의 잠재적 사례는 국제 질병 분류 코드를 통해 식별되었습니다.
SHINGRIX 접종 후 GBS 위험은 예방 접종 후 1~42일의 위험 기간과 예방 접종 후 43~183일의 대조 기간을 사용하는 자체 대조군 사례 시리즈 분석에서 평가되었습니다. 주요 분석(청구 기반, 모든 투여량)은 SHINGRIX 접종 후 42일 동안 GBS 위험이 증가했으며 65세 이상 성인에게 투여된 백만 회분당 GBS 사례가 3건 증가한 것으로 추정되었습니다. 보조 분석에서 SHINGRIX의 첫 번째 투여량 후 42일 동안 GBS 위험이 증가했으며 65세 이상 성인에게 투여된 백만 회분당 GBS 사례가 6건 증가한 것으로 추정되었으며 SHINGRIX의 두 번째 투여량 후에는 GBS 위험이 증가하지 않았습니다. 청구 데이터에서 GBS 진단에 대한 이러한 분석은 의료 기록 검토로 확인된 GBS 사례 분석으로 뒷받침되었습니다. 이 관찰 연구 결과는 GBS와 SHINGRIX의 인과 관계를 시사하지만 사용 가능한 증거는 인과 관계를 확립하기에 충분하지 않습니다.
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
모든 임신에는 기형, 유산 또는 기타 부작용의 위험이 있습니다. 미국 일반 인구에서 임상적으로 인지된 임신에서 주요 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다. 임산부에서 SHINGRIX와 관련된 위험이 있는지 여부를 확립하기 위한 데이터가 충분하지 않습니다.
임신 전, 임신 중 및 수유 중에 SHINGRIX 또는 AS01B 아주반트만을 투여한 암컷 랫트에서 발달 독성 연구가 수행되었습니다. 총 투여량은 각 경우에 0.2mL였습니다(SHINGRIX의 단일 인간 투여량은 0.5mL임). 이 연구는 SHINGRIX로 인한 태아 또는 이유 전 발달에 대한 부작용을 밝혀내지 못했습니다. (데이터 참조).
데이터
동물 데이터: 발달 독성 연구에서 암컷 랫트에 SHINGRIX 또는 AS01B 아주반트만을 근육 내 주사로 교미 전 28일과 14일, 임신 3일, 8일, 11일 및 15일, 수유 7일에 투여했습니다. 총 투여량은 각 경우에 0.2mL였습니다(SHINGRIX의 단일 인간 투여량은 0.5mL임). 출생 후 25일까지 이유 전 발달에 대한 부작용은 관찰되지 않았습니다. 백신과 관련된 태아 기형이나 변이는 없었습니다.
8.2 수유
위험 요약
SHINGRIX가 모유로 배설되는지 여부는 알려져 있지 않습니다. SHINGRIX가 모유 수유 아기에게 미치는 영향이나 모유 생산/배설에 미치는 영향을 평가할 수 있는 데이터가 없습니다.
모유 수유의 발달적 및 건강상 이점은 어머니의 SHINGRIX에 대한 임상적 필요와 SHINGRIX 또는 기저 모성 질환으로 인한 모유 수유 아기에게 미칠 수 있는 잠재적 부작용과 함께 고려해야 합니다. 예방 백신의 경우 기저 모성 질환은 백신으로 예방되는 질병에 대한 감수성입니다.
8.5 노인 사용
60세 이상 성인
연구 1 및 2에서 SHINGRIX를 최소 1회 투여받은 총 대상자 수(n=14,645명) 중 2,243명(15%)은 60세에서 69세, 6,837명(47%)은 70세에서 79세, 1,921명(13%)은 80세 이상이었습니다. 연령대별로 유효성에 임상적으로 의미 있는 차이는 없었습니다. [임상 연구(14.1, 14.2, 14.3) 참조].
70세 이상 대상자에서 요구되는 국소 및 전신 부작용의 빈도는 젊은 성인(50세에서 69세)보다 낮았습니다. [부작용(6.1) 참조].
65세 이상 면역 저하 성인
auHSCT 연구에서 SHINGRIX를 최소 1회 투여받은 총 대상자 수(n=922명) 중 172명(18.7%)은 65세 이상이었습니다. [임상 연구(14.5) 참조]. 이러한 대상자와 젊은 성인(18세에서 64세) 사이에 유효성에 임상적으로 의미 있는 차이는 없었습니다.
면역 저하 대상자에 대한 6개 연구에서 SHINGRIX를 최소 1회 투여받은 총 대상자 수(n=1,587명) 중 337명(21.2%)은 65세 이상이었습니다. 65세 이상 대상자에서 요구되는 국소 및 전신 부작용의 빈도는 일반적으로 젊은 성인(18세에서 64세)에서 보고된 빈도와 유사하거나 낮았습니다.
11 성분
SHINGRIX(재조합 대상포진 생바이러스 백신, 아주반트 키트)는 근육 주사용 멸균 현탁액입니다. 이 백신은 동결 건조된 재조합 수두 대상포진 바이러스 표면 당단백질 E(gE) 항원 성분 바이알로 제공되며, 사용 시 함께 제공된 AS01B 아주반트 현탁액 성분 바이알로 재구성해야 합니다. 동결 건조된 gE 항원 성분은 멸균된 백색 분말 형태로 제공됩니다. AS01B 아주반트 현탁액 성분은 바이알에 담겨 제공되는 유백색의 무색에서 옅은 갈색을 띠는 액체입니다.
gE 항원은 절단된 gE 유전자를 지닌 유전자 조작된 중국 햄스터 난소 세포를 아미노산이 함유된 배지에서 배양하여 얻으며, 알부민, 항생제 또는 동물 유래 단백질은 함유하지 않습니다. gE 단백질은 여러 크로마토그래피 단계를 거쳐 정제하고, 부형제와 함께 제제화하여 바이알에 채운 후 동결 건조합니다.
아주반트 현탁액 성분은 AS01B로, 이는 Salmonella minnesota에서 유래한 3-O-데사실-4’-모노포스포릴 지질 A(MPL)와 식물 추출물인 Quillaja saponaria Molina에서 정제한 사포닌인 QS-21을 리포좀 제제에 결합한 것입니다. 리포좀은 인산염 완충 생리식염수 용액에 함유된 디올레오일포스파티딜콜린(DOPC)과 콜레스테롤로 구성되며, 이 용액에는 무수 인산수소이나트륨, 인산이수소칼륨, 염화나트륨 및 주사용수가 포함되어 있습니다.
재구성 후, 각 0.5mL 용량에는 재조합 gE 항원 50 mcg, MPL 50 mcg 및 QS-21 50 mcg이 함유되어 있습니다. 또한 각 용량에는 수크로스(안정제로서) 20 mg, 염화나트륨 4.385 mg, DOPC 1 mg, 인산이수소칼륨 0.54 mg, 콜레스테롤 0.25 mg, 인산수소이나트륨 이수화물 0.160 mg, 무수 인산이나트륨 0.15 mg, 인산이칼륨 0.116 mg 및 폴리소르베이트 80 0.08 mg이 함유되어 있습니다. 재구성 후 SHINGRIX는 멸균된 유백색의 무색에서 옅은 갈색을 띠는 액체입니다.
SHINGRIX에는 방부제가 함유되어 있지 않습니다. 각 용량에는 제조 공정에서 비롯된 잔류량의 숙주 세포 단백질(≤3.0%) 및 DNA(≤2.1피코그램)가 함유될 수도 있습니다.
바이알 마개는 천연 고무 라텍스로 만들어지지 않았습니다.
12. 임상 약리
12.1 작용 기전
나이가 들거나 질병 및/또는 치료로 인한 면역 억제로 인해 증가하는 HZ 발생 위험은 수두-대상포진 바이러스(VZV) 특이적 면역력 감소와 관련이 있는 것으로 보입니다. SHINGRIX는 VZV 특이적 면역 반응을 증강시키는 것으로 나타났으며, 이는 대상포진 질환으로부터 보호하는 기전으로 생각됩니다 [임상 연구 참조 (14)].
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
SHINGRIX는 발암성 또는 돌연변이 유발성 가능성에 대해 평가되지 않았습니다. 암컷 쥐에게 SHINGRIX를 접종한 결과 생식능력에 미치는 영향은 없었습니다 [특정 집단에서의 사용 참조 (8.1)]. 수컷 생식능력 연구에서 쥐에게 교배 42일, 28일, 14일 전에 SHINGRIX 0.1mL를 접종했습니다(1회 인체 용량은 0.5mL임). 수컷 생식능력에 미치는 영향은 없었습니다.
14건의 임상 연구
14.1 50세 이상 피험자에서의 효능
연구 1은 18개국에서 실시된 무작위 배정, 위약 대조, 관찰자 눈가림 임상 연구였습니다. 무작위 배정은 연령별로 계층화(8:5:3:1)되었습니다: 50~59세, 60~69세, 70~79세 및 ≥80세. 이 연구는 면역 저하, 이전 HZ 병력, 수두 또는 HZ 백신 접종, 생존 기간이 4년 미만으로 예상되는 환자 또는 연구 평가를 방해할 수 있는 상태를 가진 환자를 포함하여 다른 피험자를 제외했습니다. 피험자는 HZ 및 대상포진 후 신경통(PHN) 발생에 대해 중앙값 3.1년(범위: 0~3.7년) 동안 추적되었습니다. 의심되는 HZ 사례는 PHN 발생에 대해 전향적으로 추적되었으며, PHN은 HZ 관련 합병증으로 정의되며, 확인된 HZ 사례에서 발진 발병 후 최소 90일 동안 발생하거나 지속되는 HZ 관련 통증(연구 피험자가 0~10점 척도에서 3점 이상으로 평가)입니다.
주요 효능 분석 모집단(수정된 총 백신 접종 코호트[mTVC]라고 함)에는 SHINGRIX(n=7,344) 또는 위약(n=7,415)을 2회(0개월 및 2개월) 접종받고 두 번째 접종 후 1개월 이내에 확인된 HZ 사례가 발생하지 않은 50세 이상 피험자 14,759명이 포함되었습니다. mTVC 모집단에서 여성이 61%, 백인이 72%, 아시아인이 19%, 흑인이 1.7%, 기타 인종/민족 그룹이 7%였습니다. 피험자의 평균 연령은 62.3세였습니다.
확인된 HZ 사례는 중합효소 연쇄 반응(PCR)(89.4%) 또는 임상 평가 위원회(10.6%)에 의해 결정되었습니다.
대상포진에 대한 효능
위약과 비교하여 SHINGRIX는 50세 이상 피험자에서 HZ 발생 위험을 97.2%(95% CI: 93.7, 99.0)로 유의하게 감소시켰습니다(표 4).
| N=각 그룹에 포함된 피험자 수; n=최소 1회의 확인된 HZ 에피소드를 가진 피험자 수; HZ=대상포진; CI=신뢰 구간. a 연구 1: NCT01165177. b mTVC=SHINGRIX 또는 위약을 2회(0개월 및 2개월) 접종받고 두 번째 접종 후 1개월 이내에 확인된 HZ 사례가 발생하지 않은 피험자로 정의된 수정된 총 백신 접종 코호트. c 주요 연구 종료점은 50세 이상 피험자에서 확인된 HZ 사례를 기반으로 했습니다. |
|||||||
|
연령 그룹 (년) |
SHINGRIX |
위약 |
% 효능 (95% CI) |
||||
|
N |
n |
1,000인년당 HZ 발생률 |
N |
n |
1,000인년당 HZ 발생률 |
||
|
전체 (≥50)c |
7,344 |
6 |
0.3 |
7,415 |
210 |
9.1 |
97.2 (93.7, 99.0) |
|
50-59 |
3,492 |
3 |
0.3 |
3,525 |
87 |
7.8 |
96.6 (89.6, 99.3) |
|
60-69 |
2,141 |
2 |
0.3 |
2,166 |
75 |
10.8 |
97.4 (90.1, 99.7) |
|
≥70 |
1,711 |
1 |
0.2 |
1,724 |
48 |
9.4 |
97.9 (87.9, 100.0) |
기술적 분석에서 50세 이상의 피험자에서 HZ에 대한 백신 효능은 백신 접종 후 4년째에 93.1%(95% CI: 81.3, 98.2)였습니다.
대상포진 후 신경통 발생
mTVC의 50세 이상의 모든 피험자 중 백신 그룹에서는 PHN 사례가 보고되지 않은 반면, 위약 그룹에서는 18건이 보고되었습니다.
14.2 70세 이상 피험자에서의 효능
연구 2는 18개국에서 실시된 무작위, 위약 대조, 관찰자 눈가림 임상 연구였습니다. 무작위 추출은 연령별로 3:1로 계층화되었습니다(70~79세 및 ≥80세). 연령을 제외하고 연구 제외 기준은 연구 1과 동일했습니다. 피험자들은 평균 3.9년(범위: 0~4.5년) 동안 HZ 및 PHN 발생 여부를 추적 관찰했습니다. 의심되는 HZ 사례는 연구 1과 마찬가지로 PHN 발생 여부를 전향적으로 추적 관찰했습니다.
주요 효능 분석 모집단(mTVC)에는 2회 용량(0개월 및 2개월)의 SHINGRIX(n = 6,541) 또는 위약(n = 6,622)을 투여받았고 두 번째 용량 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 70세 이상의 피험자 13,163명이 포함되었습니다. mTVC 모집단에서 여성은 55%였고, 백인은 78%, 아시아인은 17%, 흑인은 1%, 기타 인종/민족은 4%였습니다. 피험자의 평균 연령은 75.5세였습니다.
확진된 HZ 사례는 PCR(92.3%) 또는 임상 평가 위원회(7.7%)에 의해 결정되었습니다.
대상포진에 대한 효능
70세 이상의 피험자에서 HZ에 대한 백신 효능 결과는 표 5에 나와 있습니다.
| N = 각 그룹에 포함된 피험자 수, n = 확진된 HZ 에피소드가 1회 이상 발생한 피험자 수, HZ = 대상포진, CI = 신뢰 구간 a 연구 2: NCT01165229. b mTVC = 수정된 백신 접종 완료 코호트. 2회 용량(0개월 및 2개월)의 SHINGRIX 또는 위약을 투여받았고 두 번째 용량 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 피험자로 정의됩니다. c 주요 연구 종료점은 70세 이상의 피험자에서 확진된 HZ 사례를 기반으로 했습니다. |
|||||||
|
연령대(세) |
SHINGRIX |
위약 |
효능 %(95% CI) |
||||
|
N |
n |
1,000인년당 HZ 발생률 |
N |
n |
1,000인년당 HZ 발생률 |
||
|
전체(≥70)c |
6,541 |
23 |
0.9 |
6,622 |
223 |
9.2 |
89.8 (84.3, 93.7) |
|
70-79 |
5,114 |
17 |
0.9 |
5,189 |
169 |
8.8 |
90.0 (83.5, 94.3) |
|
≥80 |
1,427 |
6 |
1.2 |
1,433 |
54 |
11.0 |
89.1 (74.7, 96.2) |
기술적 분석에서 70세 이상 피험자의 HZ에 대한 백신 효능은 백신 접종 후 4년째에 85.1%(95% CI: 64.5, 94.8)였습니다.
대상포진후 신경통에 대한 효능
mTVC의 70세 이상 모든 피험자 중 백신 그룹에서는 4건의 PHN이 보고된 반면, 위약 그룹에서는 28건이 보고되었습니다. PHN에 대한 백신 효능은 85.5%(95% CI: [58.5; 96.3])였습니다. 대상포진후 신경통 예방에 대한 SHINGRIX의 효과는 HZ 예방에 대한 백신의 효과로 인한 것일 수 있습니다.
진통제 사용 감소
확진된 HZ 환자 중 HZ 관련 진통제 사용은 SHINGRIX를 투여받은 23명 중 10명(43.5%)에서, 위약을 투여받은 223명 중 160명(71.7%)에서 보고되었습니다.
14.3 연구 1과 2에 대한 취합 효능 분석
70세 이상 피험자에서 HZ 및 PHN을 예방하는 SHINGRIX의 효능은 mTVC에서 사전 지정된 취합 분석을 통해 연구 1과 2의 결과를 결합하여 평가했습니다. SHINGRIX와 위약을 투여받은 총 8,250명과 8,346명의 피험자가 각각 취합 mTVC 분석에 포함되었습니다.
Herpes Zoster에 대한 효능
위약과 비교했을 때, SHINGRIX는 70세 이상 피험자에서 HZ 발생 위험을 91.3%(95% CI: 86.9, 94.5) 감소시켰습니다(표 6).
| N = 각 그룹에 포함된 피험자 수, n = 확진된 HZ 에피소드가 1회 이상 있는 피험자 수, HZ = Herpes zoster, CI = 신뢰 구간 a 연구 1: NCT01165177(50세 이상 피험자) 및 연구 2: NCT01165229(70세 이상 피험자)의 취합 데이터. b mTVC = SHINGRIX 또는 위약을 2회(0개월 및 2개월) 투여받고 두 번째 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 피험자로 정의된 수정된 총 백신 접종 코호트. c 취합 분석의 1차 평가변수는 70세 이상 피험자의 확진된 HZ 사례를 기반으로 했습니다. |
|||||||
|
연령대(세) |
SHINGRIX |
위약 |
효능 %(95% CI) |
||||
|
N |
n |
1,000인년당 HZ 발생률 |
N |
n |
1,000인년당 HZ 발생률 |
||
|
전체(≥70)c |
8,250 |
25 |
0.8 |
8,346 |
284 |
9.3 |
91.3 (86.9, 94.5) |
|
70-79 |
6,468 |
19 |
0.8 |
6,554 |
216 |
8.9 |
91.3 (86.0, 94.9) |
|
≥80 |
1,782 |
6 |
1.0 |
1,792 |
68 |
11.1 |
91.4 (80.2, 96.9) |
대상포진후 신경통에 대한 유효성
표 7은 두 연구에 걸쳐 백신 그룹과 위약 그룹의 PHN 전체 비율을 비교한 것입니다.
| N = 각 그룹에 포함된 피험자 수, n = PHN이 1회 이상 발생한 피험자 수, CI = 신뢰 구간 a 연구 1: NCT01165177(50세 이상 피험자) 및 연구 2: NCT01165229(70세 이상 피험자)의 통합 데이터. b mTVC = SHINGRIX 또는 위약을 2회(0개월 및 2개월 시점) 투여받고 2차 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 피험자로 정의되는 수정된 백신 접종 코호트. c PHN = Zoster Brief Pain Inventory 설문지를 사용하여 발진 발생 후 최소 90일 동안 발생하거나 지속되는 것으로 평가된 3등급 이상(0~10점 척도)의 HZ 관련 통증으로 정의되는 대상포진후 신경통. |
|||||||||||||||
|
연령군(세) |
SHINGRIX |
위약 |
유효성 %(95% CI) |
||||||||||||
|
N |
n |
PHN 발생률c 1,000인년당 |
N |
n |
PHN 발생률 1,000인년당 |
||||||||||
|
전체 (≥70) |
8,250 |
4 |
0.1 |
8,346 |
36 |
1.2 |
88.8 (68.7, 97.1) |
||||||||
|
70-79 |
6,468 |
2 |
0.1 |
6,554 |
29 |
1.2 |
93.0 (72.5, 99.2) |
||||||||
|
≥80 |
1,782 |
2 |
0.3 |
1,792 |
7 |
1.1 |
71.2 (-51.5, 97.1) |
||||||||
대상포진 예방에 있어서 SHINGRIX의 유익성은 HZ 예방에 대한 백신의 효과에 기인할 수 있습니다. 확진된 HZ 환자에서 PHN 예방에 대한 SHINGRIX의 효능은 입증될 수 없었습니다.
14.4 투여 일정을 뒷받침하는 면역학적 평가
HZ에 대한 защи를 제공하는 면역 반응의 척도는 알려져 있지 않습니다. Anti-gE 항체 수치는 anti-gE enzyme-linked immunosorbent assay (gE ELISA)로 측정했으며 투여 일정을 뒷받침하는 데 사용되었습니다.
공개형 임상 연구에서 50세 이상의 피험자 238명에게 0개월 및 2개월 또는 0개월 및 6개월 일정으로 SHINGRIX를 투여했습니다. 두 번째 용량 투여 1개월 후 anti-gE ELISA GMC를 기준으로 0개월 및 2개월 일정과 비교하여 0개월 및 6개월 일정의 비열등성이 입증되었습니다.
14.5 18세 이상의 면역저하 성인에서의 효능
SHINGRIX의 효능은 1상 3상 무작위 배정, 위약 대조, 관찰자 눈가림 임상 연구에서 1회 용량 투여 50~70일 전에 auHSCT를 받았고 이식 후 ≤6개월 동안 예방적 항바이러스제 치료를 받을 것으로 예상되는 18세 이상의 면역저하 성인을 대상으로 평가되었습니다. SHINGRIX의 효능은 면역억제 화학 요법을 완료하는 동안 또는 완료 후 6개월 이내에 SHINGRIX 또는 위약의 1회 용량을 투여받은 혈액 악성 종양 환자를 대상으로 한 또 다른 무작위 배정, 위약 대조, 관찰자 눈가림 연구에서 사후 분석으로 계산되었습니다. 이러한 각 연구는 북미, 라틴 아메리카, 유럽, 아시아, 아프리카(auHSCT 연구만 해당) 및 호주/뉴질랜드 지역에서 수행되었습니다.
18세 이상 피험자에서의 효능: auHSCT 수혜자
auHSCT 연구에서 피험자들은 평균 21개월(범위: 0~49.4개월) 동안 HZ 및 PHN 발생 여부를 추적 관찰했습니다. 의심되는 HZ 사례는 연구 1 및 2에서와 같이 PHN 발생 여부를 전향적으로 추적 관찰했습니다.
auHSCT 연구의 1차 효능 분석 모집단(mTVC)에는 SHINGRIX 또는 위약 2회 용량을 투여받았고 2회 용량 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 피험자 1,721명이 포함되었습니다. 확진된 HZ 사례는 PCR(83.7%) 또는 임상 평가 위원회(16.3%)에 의해 결정되었습니다.
대상포진에 대한 효능: 위약과 비교했을 때 SHINGRIX는 18세 이상의 auHSCT 수혜자에서 HZ 발생 위험을 유의하게 감소시켰습니다(표 8).
| auHSCT = 자가 조혈모세포 이식. N = 각 군에 포함된 피험자 수, n = 확진된 HZ 에피소드가 1회 이상 발생한 피험자 수, HZ = 대상포진, CI = 신뢰 구간. a mTVC = 수정된 백신 접종 완료 코호트, SHINGRIX 또는 위약 2회 용량(0개월 및 1~2개월)을 투여받았고 2회 용량 투여 후 1개월 이내에 확진된 HZ 사례가 발생하지 않은 피험자로 정의. 재발에 대한 치료 시점에 추적 관찰이 중단되었습니다. b NCT01610414. c 1차 연구 종점은 18세 이상 피험자에서 확진된 HZ 사례를 기반으로 했습니다. |
||||||||
|
임상 연구 |
연령군(세) |
SHINGRIX |
위약 |
효능 %(95% CI) |
||||
|
N |
n |
1,000인년당 HZ 발생률 |
N |
n |
1,000인년당 HZ 발생률 |
|||
|
auHSCTb |
전체(≥18)c |
870 |
49 |
30.0 |
851 |
135 |
94.3 |
68.2 (55.5, 77.6) |
|
18-49 |
213 |
9 |
21.5 |
212 |
29 |
76.0 |
71.8 (38.7, 88.3) |
|
|
≥50 |
657 |
40 |
33.0 |
639 |
106 |
100.9 |
67.3 (52.6, 77.9) |
|
혈액 악성종양이 있는 18세 이상 피험자의 효능
혈액 악성종양 연구에서 평균 연령은 57세였습니다. 대부분의 피험자는 백인(71%)이었고, 그 다음으로 아시아인(25%), 흑인(0.4%) 및 기타 인종 그룹(4%)이었으며, 5%는 미국 히스패닉 또는 라틴 아메리카계였으며, 41%는 여성이었습니다. 피험자들은 중앙값 11.1개월(범위: 0~15.6개월) 동안 대상포진 발생 여부를 추적 관찰했습니다. PHN은 연구 종료점으로 평가되지 않았습니다.
혈액 악성종양 연구에서 사후 효능 분석 대상은 SHINGRIX 또는 위약 2회 용량을 투여받았고 2차 접종 후 1개월 이내에 확진된 대상포진 사례가 발생하지 않은 515명의 피험자였습니다. 확진된 대상포진 사례는 PCR(81.3%) 또는 임상 평가 위원회(18.7%)에 의해 결정되었습니다. 사후 분석 결과 SHINGRIX는 대상포진 발생을 87.2%(95% CI [44.2; 98.6]) 예방하는 효과가 있는 것으로 나타났습니다. 1,000인년당 대상포진 발생률은 SHINGRIX군이 8.5명인 데 비해 위약군은 66.2명이었습니다.
자가 조혈모세포 이식(auHSCT) 연구에서 평가된 추가 효능 종료점
대상포진후 신경통 예방 효과: mTVC에 참여한 18세 이상의 모든 피험자를 포함한 기술적 분석에서 백신군에서 PHN 사례가 1건 보고된 반면, 위약군에서는 9건이 보고되었습니다. PHN에 대한 백신 효능은 89.3%(95% CI: [22.5; 99.8])였습니다. PHN 예방에 대한 SHINGRIX의 이점은 대상포진 예방에 대한 백신의 효과 때문일 수 있습니다.
대상포진 관련 통증: 대상포진이 의심되는 피험자는 10점 척도에서 “가장 심한” 대상포진 관련 통증을 평가했습니다. 확진된 대상포진 환자 중 SHINGRIX를 투여받은 49명 중 37명(75.5%)과 위약을 투여받은 135명 중 120명(88.9%)이 “가장 심한” 대상포진 관련 통증을 3점 이상으로 평가했습니다. 이러한 피험자 하위 집단에서 “가장 심한” 대상포진 관련 통증의 중앙값 지속 기간은 SHINGRIX 투여군에서 14일, 위약 투여군에서 24일이었습니다.
14.6 ZOSTAVAX(생대상포진 백신) 접종 후 재접종
공개형 임상 연구(NCT02581410)에서 연구 등록 5년 이상 전에 ZOSTAVAX를 접종받은 적이 있는 65세 이상의 피험자(n = 215) 또는 ZOSTAVAX를 접종받은 적이 없는 피험자(n = 215)는 0개월 및 2개월에 SHINGRIX 1회 용량을 투여받았습니다. ZOSTAVAX를 접종받은 적이 없는 피험자는 연령(65~69세, 70~79세, ≥80세), 성별, 인종/민족, 질병(면역 매개 질환, 당뇨병, 우울증, 폐 질환 또는 심장 질환)의 사전 정의된 변수에 따라 ZOSTAVAX를 이전에 접종받은 피험자와 매칭되었습니다. 평균 연령은 71세였고 51%가 여성이었습니다. 모든 피험자는 백인이었고 히스패닉 또는 라틴 아메리카계가 아니었습니다.
ZOSTAVAX를 이전에 접종받은 피험자에서 SHINGRIX 2회 용량 투여 1개월 후 ELISA로 측정한 항-gE 항체(Ab) 농도는 ZOSTAVAX를 접종받은 적이 없는 피험자의 항체 농도보다 비열등했습니다. ZOSTAVAX를 접종받은 적이 없는 피험자와 ZOSTAVAX를 이전에 접종받은 피험자 간의 항-gE Ab 보정 기하 평균 농도(GMC) 비율에 대한 95% 신뢰 구간(CI)의 상한(UL)은 1.17(성공 기준 <1.5)이었습니다. ZOSTAVAX를 이전에 접종받은 피험자에서 SHINGRIX에 대한 면역 반응의 간섭에 대한 증거는 없었습니다.
14.7 다른 백신과의 동시 투여
인플루엔자 백신과의 동시 투여
공개형 임상 연구(NCT01954251)에서 50세 이상의 피험자는 0개월에 SHINGRIX 및 4가 인플루엔자 백신(FLUARIX QUADRIVALENT)을 각 1회 용량씩 투여받고 2개월에 SHINGRIX 1회 용량을 투여받았거나(n = 413), 0개월에 FLUARIX QUADRIVALENT 1회 용량을 투여받고 2개월 및 4개월에 SHINGRIX 1회 용량을 투여받았습니다(n = 415). 연구 대상 집단의 평균 연령은 63세였고 52%가 여성이었습니다. 대부분의 피험자는 백인(92%)이었고, 그 다음으로 아시아인(6%), 흑인(2%)이었으며, 0.4%는 미국 히스패닉 또는 라틴 아메리카계였습니다. SHINGRIX 또는 동시 투여된 백신에 포함된 항원에 대한 면역 반응의 간섭에 대한 증거는 없었습니다.
PNEUMOVAX 23(폐렴구균 다가 백신)과의 동시 투여
공개형 임상 연구(NCT02045836)에서 50세 이상의 피험자는 0개월에 SHINGRIX 및 PNEUMOVAX 23을 각 1회 용량씩 투여받고 2개월에 SHINGRIX 1회 용량을 투여받았거나(n = 432), 0개월에 PNEUMOVAX 23 1회 용량을 투여받고 2개월 및 4개월에 SHINGRIX 1회 용량을 투여받았습니다(n = 433). 연구 대상 집단의 평균 연령은 63세였고 60%가 여성이었습니다. 대부분의 피험자는 백인(94%)이었고, 그 다음으로 흑인(2%), 아시아인(2%) 및 기타 인종 그룹(2%)이었으며, 1%는 미국 히스패닉 또는 라틴 아메리카계였습니다.
항-gE Ab를 기반으로 한 SHINGRIX에 대한 면역 반응은 SHINGRIX 2차 접종 1개월 후 ELISA로 측정했습니다. PNEUMOVAX 23에 포함된 23가지 폐렴구균 혈청형 중 12가지에 대한 면역 반응은 PNEUMOVAX 23 1회 용량 투여 1개월 후 다중 오소닌화 작용 분석(MOPA)으로 측정했습니다. 두 백신을 동시에 투여했을 때 SHINGRIX에 포함된 항원 또는 PNEUMOVAX 23에 포함된 12가지 평가 항원에 대한 면역 반응의 간섭에 대한 증거는 없었습니다.
PREVNAR 13(폐렴구균 13가 접합 백신 [디프테리아 CRM197 단백질])과의 동시 투여
공개형 임상 연구(NCT03439657)에서 50세 이상의 피험자는 0개월에 SHINGRIX 및 PREVNAR 13을 각 1회 용량씩 투여받고 2개월에 SHINGRIX 1회 용량을 투여받았거나(n = 449), 0개월에 PREVNAR 13 1회 용량을 투여받고 2개월 및 4개월에 SHINGRIX 1회 용량을 투여받았습니다(n = 463). 연구 대상 집단의 평균 연령은 63세였고 60%가 여성이었습니다. 대부분의 피험자는 백인(98%)이었고, 그 다음으로 흑인(2%)이었으며, 0.4%는 미국 히스패닉 또는 라틴 아메리카계였습니다.
항-gE Ab를 기반으로 한 SHINGRIX에 대한 면역 반응은 SHINGRIX 2차 접종 1개월 후 ELISA로 측정했습니다. PREVNAR 13에 포함된 폐렴구균 혈청형에 대한 면역 반응은 PREVNAR 13 1회 용량 투여 1개월 후 MOPA로 측정했습니다. 두 백신을 동시에 투여했을 때 SHINGRIX 또는 PREVNAR 13에 포함된 항원에 대한 면역 반응의 간섭에 대한 증거는 없었습니다.
BOOSTRIX(파상풍 톡소이드, 감량 디프테리아 톡소이드 및 무세포 백일해 백신, 흡착)와의 동시 투여
공개형 임상 연구(NCT02052596)에서 50세 이상의 피험자는 0개월에 SHINGRIX와 BOOSTRIX를 각각 1회 투여받고 2개월에 SHINGRIX를 1회 투여받았습니다(n = 412, 동시 투여군). 또는 0개월에 BOOSTRIX를 1회 투여받고 2개월과 4개월에 SHINGRIX를 1회 투여받았습니다(n = 418, 순차 투여군). 피험자의 평균 연령은 63세였으며 54%가 여성이었습니다. 대부분의 피험자는 백인(87%)이었고 흑인(11%)과 기타 인종이 그 뒤를 이었습니다. 2%는 미국 히스패닉 또는 라틴 아메리카계였습니다.
항-gE Ab를 기반으로 한 SHINGRIX에 대한 면역 반응은 SHINGRIX 두 번째 투여 1개월 후 ELISA로 측정했습니다. BOOSTRIX에 대한 면역 반응(항-D, 항-T 및 백일해 항원에 대한 항체)은 BOOSTRIX 단일 투여 1개월 후 측정했습니다. 동시 투여는 SHINGRIX에 포함된 항원 또는 BOOSTRIX에 포함된 항원에 대한 면역 반응에 대한 간섭 증거를 보이지 않았습니다. 단, 백일해 항원 중 하나인 퍼탁틴은 비열등성 기준을 충족하지 못했습니다. 항퍼탁틴 항체에 대한 보정된 GMC 비율(순차 투여군/동시 투여군)에 대한 95% CI의 UL은 1.58이었습니다(비열등성 기준 <1.5). 퍼탁틴에 대한 면역 반응 감소의 임상적 significan는 알려져 있지 않습니다.
16 공급/보관 및 취급 방법
SHINGRIX는 2가지 성분으로 제공됩니다. 단회용 바이알의 동결 건조된 gE 항원 성분(분말)과 단회용 바이알의 아쥬반트 현탁액 성분(액체)(주사기 또는 바늘 없이 포장됨).
|
제품 형태 |
카톤 NDC 번호 |
성분 |
|
|
아쥬반트 현탁액 성분(액체) |
동결 건조된 gE 항원 성분(분말) |
||
|
1회용 외곽 상자 |
58160-819-12 |
바이알 1/2 NDC 58160-829-01 |
바이알 2/2 NDC 58160-828-01 |
|
10회용 외곽 상자 |
58160-823-11 |
바이알 10개 NDC 58160-829-03 |
바이알 10개 NDC 58160-828-03 |
16.1 재구성 전 보관
아쥬반트 현탁액 성분 바이알: 2°~8°C(36°~46°F)에서 냉장 보관하십시오. 바이알을 빛으로부터 보호하십시오. 냉동하지 마십시오. 아쥬반트 현탁액이 냉동된 경우 폐기하십시오.
동결 건조된 gE 항원 성분 바이알: 2°~8°C(36°~46°F)에서 냉장 보관하십시오. 바이알을 빛으로부터 보호하십시오. 냉동하지 마십시오. 항원 성분이 냉동된 경우 폐기하십시오.
16.2 재구성 후 보관
- •
- 즉시 투여하거나 사용 전 최대 6시간 동안 2°~8°C(36°~46°F)에서 냉장 보관하십시오.
- •
- 6시간 이내에 사용하지 않은 재구성된 백신은 폐기하십시오.
- •
- 냉동하지 마십시오. 백신이 냉동된 경우 폐기하십시오.
17. 환자 상담 정보
- •
- 환자에게 SHINGRIX 접종의 잠재적 이점과 위험성 및 일정에 따라 2회 접종 일정을 완료하는 것의 중요성을 알립니다.
- •
- SHINGRIX 투여와 시간적으로 관련된 것으로 보고된 이상 반응 가능성에 대해 환자에게 알립니다.
- •
- 질병통제예방센터(CDC) 웹사이트(www.cdc.gov/vaccines)에서 무료로 제공되는 백신 정보 설명서를 제공합니다.
SPL 미분류 섹션
BOOSTRIX 및 FLUARIX QUADRIVALENT는 GSK 그룹의 상표이거나 GSK 그룹이 라이선스를 보유하고 있습니다. 나열된 다른 브랜드는 해당 소유자의 상표이거나 해당 소유자가 라이선스를 보유하고 있으며 GSK 그룹의 소유가 아니거나 GSK 그룹에 라이선스가 부여되지 않았습니다. 이러한 브랜드의 제조업체는 GSK 그룹 또는 그 제품과 제휴하거나 보증하지 않습니다.
GlaxoSmithKline Biologicals에서 제조
벨기에 리크센사르트, 미국 라이선스 1617 및
GlaxoSmithKline에서 배포
더럼, 노스캐롤라이나주 27701
©2023 GSK 그룹 또는 라이선스 제공자.
SHX:7PI
주요 표시 패널
주요 표시 패널
NDC 58160-819-12
SHINGRIX
Zoster Vaccine Recombinant, Adjuvanted
처방전에 의해서만 구입 가능
주의: 사용 전에 동결 건조 분말 바이알 1개와 액상 현탁액 바이알 1개를 반드시 혼합해야 합니다.
50세 이상 및 면역 저하로 인해 대상포진 위험이 높은 18세 이상의 경우
내용물 (SHINGRIX 1회 투여량):
동결 건조된 gE 항원 성분이 들어 있는 바이알 1개
보조제 현탁액 성분이 들어 있는 바이알 1개
재구성 후 SHINGRIX 1회 투여량은 0.5mL입니다.
GSK
SHINGRIX
항원 및 보조제는 벨기에에서 제조되었습니다.
©2021 GSK 그룹 계열사 또는 라이선스 제공자.
- Rev. 7/23
- 515720
주요 표시 패널
보조제 바이알 라벨 한 개
NDC 58160-829-01
- 496837 Rev. 2/19
주요 표시 부분
항원 바이알 라벨 1개입
NDC 58160-828-01
- 496835 Rev. 2/19
주 표시면
주요 표시 부분
NDC 58160-823-11
SHINGRIX
재조합 대상포진 생백신, 면역증강제 포함
처방전 필요
주의: 동결 건조 분말 1병과 액상 현탁액 1병을 사용 전에 혼합해야 합니다
50세 이상 및 면역 저하로 대상포진 위험이 증가한 18세 이상
내용물(SHINGRIX 10회분):
동결 건조 gE 항원 성분이 들어 있는 바이알 10개
면역증강제 현탁액 성분이 들어 있는 바이알 10개
재구성 후 SHINGRIX 1회 용량은 0.5mL입니다.
GSK
SHINGRIX
항원 및 면역증강제는 벨기에에서 제조
©2023 GSK group of companies or its licensor.
- Rev. 8/23
- 515300
주 표시면
10 개 수량 조력제 병 라벨
NDC 58160-829-03
- 490658 Rev. 10/17
주요 표시 패널
10개 항원 바이알 라벨
NDC 58160-828-03
- 490735 Rev. 10/17