의약품 제조업체: AbbVie Inc. (Updated: 2024-06-18)
처방 정보의 주요 내용
SKYRIZI® (risankizumab-rzaa) 주사제, 피하 또는 정맥 투여용
미국 최초 승인: 2019
처방 정보 요약
투여량 및 투여 방법
- 크론병 및 궤양성 대장염 치료: SKYRIZI 치료를 시작하기 전에 간 효소 및 빌리루빈 수치를 확인하십시오. (2.1, 5.4)
- 현재의 예방 접종 지침에 따라 모든 연령에 적합한 예방 접종을 완료하십시오. (2.1, 5.5)
권장 투여량
판상 건선 및 건선성 관절염:
- 0주, 4주에 피하 주사로 150mg을 투여하고 그 후 12주마다 투여합니다. (2.3, 2.4)
- 건선성 관절염 환자의 경우 SKYRIZI는 단독으로 또는 비생물학적 질병 수정 항류마티스제 (DMARD)와 병용하여 투여할 수 있습니다. (2.4)
크론병:
- 권장 유도 투여량은 0주, 4주, 8주에 최소 1시간 동안 정맥 주입으로 600mg을 투여하는 것입니다. 권장 유지 투여량은 12주에 피하 주사로 180mg 또는 360mg을 투여하고 그 후 8주마다 투여하는 것입니다. 치료 반응을 유지하기 위해 최소 유효 용량을 사용하십시오. (2.6)
궤양성 대장염:
- 권장 유도 투여량은 0주, 4주, 8주에 최소 2시간 동안 정맥 주입으로 1,200mg을 투여하는 것입니다. 권장 유지 투여량은 12주에 피하 주사로 180mg 또는 360mg을 투여하고 그 후 8주마다 투여하는 것입니다. 치료 반응을 유지하기 위해 최소 유효 용량을 사용하십시오. (2.7)
투여 형태 및 강도
금기 사항
- 리스안키주맙-rzaa 또는 첨가제에 대한 중증의 과민 반응 병력이 있는 환자에게는 SKYRIZI를 투여해서는 안 됩니다. (4)
경고 및 주의 사항
- 과민 반응: 아나필락시스를 포함한 중증의 과민 반응이 발생할 수 있습니다. (5.1)
- 감염: SKYRIZI는 감염 위험을 증가시킬 수 있습니다. 임상적으로 중요한 감염의 징후 또는 증상이 나타나면 의사의 진료를 받도록 환자에게 지시하십시오. 이러한 감염이 발생하면 감염이 해결될 때까지 SKYRIZI를 투여하지 마십시오. (5.2)
- 결핵(TB): SKYRIZI 치료를 시작하기 전에 결핵을 평가하십시오. (5.3)
- 염증성 장 질환 치료 중 간 독성: 유도 기간 동안 약물 유발성 간 손상이 보고되었습니다. 기준선 및 유도 기간 동안 최소 12주까지 치료 기간 동안 간 효소 및 빌리루빈 수치를 모니터링하십시오. 그 후에는 일반적인 환자 관리에 따라 모니터링하십시오. (5.4)
- 백신 투여: 생백신 사용을 피하십시오. (5.5)
부작용
가장 흔한 부작용은 다음과 같습니다:
- 판상 건선 및 건선성 관절염 (≥ 1%): 상기도 감염, 두통, 피로, 주사 부위 반응 및 백선 감염. (6.1)
-
크론병 (>3%):
◦ 유도: 상기도 감염, 두통 및 관절통. (6.1)
◦ 유지: 관절통, 복통, 주사 부위 반응, 빈혈, 발열, 요통, 관절병증 및 요로 감염. (6.1) -
궤양성 대장염 (≥3%):
◦ 유도: 관절통. (6.1)
◦ 유지: 관절통, 발열, 주사 부위 반응 및 발진. (6.1)
의심되는 부작용을 보고하려면 AbbVie Inc.에 1-800-633-9110으로 연락하거나 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 약물 안내는 17을 참조하십시오.
개정: 2024년 6월
목차
전문 정보: 목차*
1 적응증 및 사용법
1.1 판상 건선
1.2 건선성 관절염
1.3 크론병
1.4 궤양성 대장염
2 투여량 및 투여 방법
2.1 치료 시작 전 절차
2.2 투여에 대한 일반적인 고려 사항
2.3 판상 건선에 대한 권장 용량
2.4 건선성 관절염에 대한 권장 용량
2.5 준비 및 투여 지침s (판상 건선 및 건선성 관절염)
2.6 크론병에 대한 권장 용량
2.7 궤양성 대장염에 대한 권장 용량
2.8 준비 및 투여 지침 (크론병 및 궤양성 대장염)
3 투여 형태 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 과민 반응
5.2 감염
5.3 결핵
5.4 염증성 장 질환 치료 시 간독성
5.5 백신 투여
6 이상 반응
6.1 임상 시험 경험
6.2 면역원성
6.3 시판 후 경험
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소아 사용
8.5 노인 사용
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 손상
14 임상 연구
14.1 판상 건선
14.2 건선성 관절염
14.3 크론병
14.4 궤양성 대장염
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
2 투여 및 관리
2.2 투여에 대한 일반적인 고려 사항
-
투여 전에 SKYRIZI를 시각적으로 검사하여 이물질 및 변색 여부를 확인하십시오. 용액에는 몇 개의 반투명 또는 흰색 입자가 포함될 수 있습니다.
◦ SKYRIZI 150 mg/mL, 180 mg/1.2 mL 및 360 mg/2.4 mL: 무색에서 황색, 투명에서 약간 불투명한 용액.
◦ SKYRIZI 90 mg/mL 및 600 mg/10 mL: 무색에서 약간 황색, 투명에서 약간 불투명한 용액.
◦ 용액에 큰 입자가 포함되어 있거나 흐리거나 변색된 경우 사용하지 마십시오.
- 사용 후 폐기하십시오. 재사용하지 마십시오.
2.4 건선성 관절염에 대한 권장 용량
권장 용량은 0주, 4주 및 그 이후 12주마다 피하 주사로 150mg을 투여하는 것입니다.
SKYRIZI는 단독으로 또는 비생물학적 질병 수정 항류마티스제(DMARD)와 병용하여 투여할 수 있습니다.
2.5 준비 및 투여 지침s (판상 건선 및 건선성 관절염)
• SKYRIZI 150 mg/mL 미리 채워진 펜 또는 미리 채워진 주사기를 피하 주사로 투여하십시오.
• 환자는 피하 주사 기술에 대한 교육을 받은 후 스스로 SKYRIZI를 주사할 수 있습니다. SKYRIZI의 피하 주사 기술에 대한 적절한 교육을 환자 및/또는 보호자에게 제공하십시오.
• 주사하기 전에 SKYRIZI가 들어 있는 상자를 냉장고에서 꺼내고 미리 채워진 펜 또는 미리 채워진 주사기를 상자에서 꺼내지 않고 직사광선을 피하여 실온에 도달하도록 하십시오(미리 채워진 펜의 경우 30~90분, 미리 채워진 주사기의 경우 15~30분).
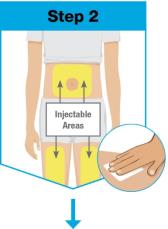
• 피부가 압통, 멍, 홍반, 경화 또는 건선으로 인해 영향을 받는 부위에는 주사하지 마십시오. 상완 외측 상부에 SKYRIZI를 투여하는 것은 의료 전문가 또는 보호자만 수행할 수 있습니다.
• 복용량을 놓친 경우 가능한 한 빨리 복용하십시오. 그 후 정기적으로 예정된 시간에 복용을 재개하십시오.
SKYRIZI “사용 지침”에는 SKYRIZI의 준비 및 투여에 대한 자세한 지침이 포함되어 있습니다 [사용 지침 참조]. 환자가 투여 전에 사용 지침을 읽도록 지시하십시오.
2.6 크론병에 대한 권장 용량
성인 환자: 유도
SKYRIZI의 권장 유도 용량은 0주, 4주 및 8주에 최소 1시간 동안 정맥 주입으로 600mg을 투여하는 것입니다.
성인 환자: 유지
SKYRIZI의 권장 유지 용량은 12주에 피하 주사로 180mg 또는 360mg을 투여하고 그 이후 8주마다 투여하는 것입니다. 치료 반응을 유지하는 데 필요한 최소 유효 용량을 사용하십시오.
2.7 궤양성 대장염에 대한 권장 용량
성인 환자: 유도
SKYRIZI의 권장 유도 용량은 0주, 4주 및 8주에 최소 2시간 동안 정맥 주입으로 1,200mg을 투여하는 것입니다.
성인 환자: 유지
SKYRIZI의 권장 유지 용량은 12주에 피하 주사로 180mg 또는 360mg을 투여하고 그 이후 8주마다 투여하는 것입니다. 치료 반응을 유지하는 데 필요한 최소 유효 용량을 사용하십시오.
2.8 투여 준비 및 방법 (크론병 및 궤양성 대장염)
정맥내 유도 투여 요법:
1. 정맥내 투여용 SKYRIZI 바이알은 무균적 기법을 사용하는 의료 전문가가 투여하도록 되어 있습니다.
2. 정맥내 투여 전에 환자의 적응증에 따라 투여량과 필요한 SKYRIZI 바이알 수를 결정합니다(아래 표 참조). 바이알(600 mg/10 mL)에서 SKYRIZI 용액 10 mL를 뽑아 5% 덱스트로스 주사액 또는 0.9% 염화나트륨 주사액이 들어 있는 정맥내 주입 백 또는 유리병에 주입하여(아래 표 1 참조) 최종 농도가 약 1.2 mg/mL에서 6 mg/mL가 되도록 합니다. 바이알에 남아 있는 용액은 모두 버립니다.
|
적응증 |
정맥내 유도 투여량 | SKYRIZI 600 mg/10 mL 바이알 수 | 5% 덱스트로스 또는 0.9% 염화나트륨 주사액 총량 |
| 크론병 | 600 mg | 1 | 100 mL, 또는 250 mL, 또는 500 mL |
| 궤양성 대장염 | 1,200 mg | 2 | 250 mL, 또는 500 mL |
3. SKYRIZI 600 mg 용량의 경우 최소 1시간 동안, SKYRIZI 1,200 mg 용량의 경우 최소 2시간 동안 희석된 용액을 정맥 주사합니다. 냉장 보관한 경우, 정맥 주사 시작 전에 주입 백 또는 유리병에 든 희석된 SKYRIZI 용액을 실온으로 데웁니다.
4. 다른 의약품과 동일한 정맥 주사 라인에 희석된 SKYRIZI 용액을 동시에 투여하지 마십시오.
바이알 및 희석된 용액의 취급 및 보관:
• 바이알 또는 주입 백 또는 유리병에 든 희석된 용액을 흔들지 마십시오.
• 준비된 주입액은 즉시 사용하십시오. 즉시 사용하지 않을 경우, 희석된 SKYRIZI 용액을 냉장 보관하고 빛으로부터 보호하여 36°F~46°F(2°C~8°C)에서 최대 20시간 동안 보관하십시오.
• 준비 직후 또는 냉장 보관에서 꺼낸 후, 희석된 SKYRIZI 용액은 실온에서 최대 77°F(25°C)(직사광선을 피하여)에서 4시간(희석 시작부터 주입 시작까지의 누적 시간) 동안 보관할 수 있습니다.
• 실온 보관 및 투여 중 실내 조명에 노출되는 것은 허용됩니다.
• 동결하지 마십시오.
피하 유지 요법 용량:
단일 용량 180 mg 또는 360 mg 사전 충전 카트리지를 On-Body 주입기와 함께 사용하는 경우:
• SKYRIZI는 의료 전문가의 지시 및 감독 하에 사용하도록 되어 있습니다.
• 환자는 피하 주사 기술에 대한 교육을 받은 후 사전 충전 카트리지가 장착된 On-Body 주입기를 사용하여 SKYRIZI를 자가 주사할 수 있습니다. 환자 및/또는 보호자에게 SKYRIZI의 피하 주사 기술에 대한 적절한 교육을 제공하십시오.
• 사전 충전 카트리지가 장착된 On-Body 주입기를 사용하기 전에, 냉장고에서 카톤을 꺼내 직사광선을 피하여 실온(45~90분)으로 데우되, 사전 충전 카트리지 또는 On-Body 주입기를 카톤에서 꺼내지 마십시오.
• On-Body 주입기를 사용하여 SKYRIZI 180 mg/1.2 mL 또는 SKYRIZI 360 mg/2.4 mL 사전 충전 카트리지를 허벅지 또는 복부에 피하 주사합니다.
• 사전 충전 카트리지를 On-Body 주입기에 삽입한 후 5분 이내에 주사를 시작하십시오.
• 피부가 압통, 멍, 홍반, 경화 또는 병변으로 인해 영향을 받는 부위에는 주사하지 마십시오.
• 용량을 놓친 경우, 가능한 한 빨리 투여하십시오. 그 후, 정기적으로 예정된 시간에 투여를 재개하십시오.
SKYRIZI “사용 지침”에는 SKYRIZI의 준비 및 투여에 대한 자세한 지침이 포함되어 있습니다. [사용 지침 참조사용 지침]. 환자에게 투여 전에 사용 지침을 읽도록 지시하십시오.
90 mg/mL 사전 충전 주사기를 사용하는 경우:
• 각 SKYRIZI 90 mg/mL 사전 충전 주사기를 피하 주사합니다.
• 환자는 피하 주사 기술에 대한 교육을 받은 후 SKYRIZI를 자가 주사할 수 있습니다. 환자 및/또는 보호자에게 SKYRIZI의 피하 주사 기술에 대한 적절한 교육을 제공하십시오.
• 주사하기 전에, 냉장고에서 카톤을 꺼내 사전 충전 주사기를 카톤에서 꺼내지 않고 직사광선을 피하여 SKYRIZI를 실온(15~30분)으로 데우십시오.
• SKYRIZI 90 mg/mL 사전 충전 주사기를 사용하여 다음과 같이 SKYRIZI 180 mg 또는 SKYRIZI 360 mg을 피하 주사합니다.
◦ SKYRIZI 90 mg/mL 사전 충전 주사기를 사용하는 경우, 180 mg 유지 용량에는 90 mg 사전 충전 주사기 2개가 필요합니다. 서로 다른 해부학적 위치(예: 허벅지 또는 복부)에 사전 충전 주사기를 하나씩 주사합니다.
◦ SKYRIZI 90 mg/mL 사전 충전 주사기를 사용하는 경우, 360 mg 유지 용량에는 90 mg 사전 충전 주사기 4개가 필요합니다. 서로 다른 해부학적 위치(예: 허벅지 또는 복부)에 사전 충전 주사기를 하나씩 주사합니다.
• 피부가 압통, 멍, 홍반, 경화 또는 병변으로 인해 영향을 받는 부위에는 주사하지 마십시오. 상완 외측에 SKYRIZI를 투여하는 것은 의료 전문가 또는 보호자만 수행할 수 있습니다.
• 용량을 놓친 경우, 가능한 한 빨리 투여하십시오. 그 후, 정기적으로 예정된 시간에 투여를 재개하십시오.
SKYRIZI “사용 지침”에는 SKYRIZI의 준비 및 투여에 대한 자세한 지침이 포함되어 있습니다. [사용 지침 참조사용 지침]. 환자에게 투여 전에 사용 지침을 읽도록 지시하십시오.
3 제형 및 함량
피하 주사
SKYRIZI 펜
- 주사: 1회용 미리 채워진 펜 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 150 mg/mL.
SKYRIZI 미리 채워진 주사기
- 주사: 1회용 미리 채워진 주사기 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 90 mg/mL.
- 주사: 1회용 미리 채워진 주사기 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 150 mg/mL.
SKYRIZI 미리 채워진 카트리지 및 제공된 체외 주입기
- 주사: 체외 주입기에 사용하기 위한 1회용 미리 채워진 카트리지 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 180 mg/1.2 mL (150 mg/mL).
- 주사: 체외 주입기에 사용하기 위한 1회용 미리 채워진 카트리지 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 360 mg/2.4 mL (150 mg/mL).
정맥 주입
SKYRIZI 바이알
- 주사: 1회용 바이알 각각에 무색에서 약간 노란색, 투명에서 약간 불투명한 용액으로 600 mg/10 mL (60 mg/mL).
4 금기사항
SKYRIZI는 risankizumab-rzaa 또는 첨가제에 대한 심각한 과민 반응의 병력이 있는 환자에게 금기입니다 [경고 및 주의 사항 (5.1) 참조].
5 경고 및 주의사항
5.1 과민 반응
SKYRIZI 사용과 관련하여 아나필락시스를 포함한 심각한 과민 반응이 보고되었습니다. 심각한 과민 반응이 발생하면 SKYRIZI를 중단하고 즉시 적절한 치료를 시작하십시오 [유해 반응 (6.1) 참조].
5.2 감염
SKYRIZI는 감염 위험을 증가시킬 수 있습니다 [유해 반응 (6.1) 참조].
임상적으로 중요한 활성 감염이 있는 환자의 경우 감염이 해결되거나 적절히 치료될 때까지 SKYRIZI 치료를 시작해서는 안 됩니다.
만성 감염 또는 재발성 감염 병력이 있는 환자의 경우 SKYRIZI 처방 전에 위험과 이점을 고려하십시오. 환자에게 임상적으로 중요한 감염의 징후 또는 증상이 나타나면 의료 상담을 받도록 지시하십시오. 환자가 이러한 감염이 발생하거나 표준 치료에 반응하지 않는 경우 환자를 면밀히 모니터링하고 감염이 해결될 때까지 SKYRIZI를 투여하지 마십시오.
5.3 결핵
SKYRIZI 치료를 시작하기 전에 결핵(TB) 감염 여부를 평가하십시오. 3상 건선 임상 연구에서 SKYRIZI와 적절한 TB 예방 요법을 동시에 투여받은 잠복성 TB가 있는 72명의 피험자 중 SKYRIZI를 평균 61주 동안 투여받은 동안 활동성 TB가 발생한 경우는 없었습니다. 잠복성 TB 치료를 위해 이소니아지드를 복용한 2명의 피험자는 간 손상으로 인해 치료를 중단했습니다. PsO-3 연구에서 예방 요법을 받지 않은 잠복성 TB가 있는 31명의 피험자 중 SKYRIZI를 평균 55주 동안 투여받은 동안 활동성 TB가 발생한 경우는 없었습니다. 적절한 치료 과정을 확인할 수 없는 과거 잠복성 또는 활동성 TB 병력이 있는 환자의 경우 SKYRIZI를 시작하기 전에 항-TB 요법을 고려하십시오. SKYRIZI 치료 중 및 후에 활동성 TB의 징후와 증상을 모니터링하십시오. 활동성 TB가 있는 환자에게는 SKYRIZI를 투여하지 마십시오.
5.4 염증성 장 질환 치료 시 간 독성
크론병 환자에서 SKYRIZI 600mg 정맥 주사 2회 투여 후 입원이 필요한 발진과 함께 약물 유발성 간 손상이라는 심각한 유해 반응이 보고되었습니다(ALT 54x ULN, AST 30x ULN, 총 빌리루빈 2.2x ULN). 스테로이드 투여 후 간 기능 검사 이상이 해결되었습니다. 그 후 SKYRIZI를 중단했습니다.
크론병 및 궤양성 대장염 치료의 경우 기준선 및 유도 기간 동안 최소 12주까지 치료를 받는 동안 간 효소와 빌리루빈을 평가하십시오. 그 후에는 일상적인 환자 관리에 따라 모니터링하십시오.
간 경변 증거가 있는 환자의 경우 다른 치료 옵션을 고려하십시오. 약물 유발성 간 손상의 잠재적인 사례를 식별하기 위해 간 효소 상승의 원인을 신속하게 조사하는 것이 좋습니다. 약물 유발성 간 손상이 의심되는 경우 이 진단이 배제될 때까지 치료를 중단하십시오. 환자에게 간 기능 장애를 시사하는 증상이 나타나면 즉시 의료 상담을 받도록 지시하십시오.
5.5 백신 투여
SKYRIZI로 치료받는 환자에게는 생백신 사용을 피하십시오. 면역 체계와 상호 작용하는 약물은 생백신 투여 후 감염 위험을 증가시킬 수 있습니다. SKYRIZI 치료를 시작하기 전에 현재 예방 접종 지침에 따라 모든 연령에 적합한 예방 접종을 완료하십시오. 생백신 또는 불활성 백신에 대한 반응에 대한 데이터는 없습니다.
6 부작용
다음의 이상 반응은 라벨의 다른 섹션에서 논의됩니다.
- 과민 반응 [경고 및 주의 사항 (5.1)]
- 감염 [경고 및 주의 사항 (5.2)]
- 결핵 [경고 및 주의 사항 (5.3)]
- 염증성 장 질환 치료에서의 간 독성 [경고 및 주의 사항 (5.4)]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 이상 약물 반응 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제로 관찰된 발생률을 반영하지 않을 수 있습니다.
판상 건선
총 2234명의 피험자가 임상 개발 시험에서 SKYRIZI로 치료를 받았습니다. 이 중 건선이 있는 1208명의 피험자가 SKYRIZI에 1년 이상 노출되었습니다.
위약 대조군 및 활성 대조군 시험의 데이터를 풀링하여 최대 16주 동안 SKYRIZI의 안전성을 평가했습니다. 총 1306명의 피험자가 SKYRIZI 150mg 그룹에서 평가되었습니다.
표 2는 풀링된 임상 시험의 16주 통제 기간 동안 SKYRIZI 그룹에서 위약 그룹보다 발생률이 1% 이상이고 더 높은 이상 약물 반응을 요약합니다.
| 이상 약물 반응 | SKYRIZI N = 1306 n (%) |
위약 N = 300 n (%) |
| 상기도 감염a | 170 (13.0) | 29 (9.7) |
| 두통b | 46 (3.5) | 6 (2.0) |
| 피로c | 33 (2.5) | 3 (1.0) |
| 주사 부위 반응d | 19 (1.5) | 3 (1.0) |
| 백선 감염e | 15 (1.1) | 1 (0.3) |
| a 포함: 호흡기 감염 (바이러스성, 박테리아성 또는 불명), 부비강염 (급성 포함), 비염, 인두염, 인두염 (바이러스성 포함), 편도염 b 포함: 두통, 긴장성 두통, 부비강 두통, 경추성 두통 c 포함: 피로, 무력증 d 포함: 주사 부위 멍, 발적, 혈관 외 유출, 혈종, 출혈, 감염, 염증, 자극, 통증, 가려움증, 반응, 부종, 열감 e 포함: 무좀, 사타구니 백선, 백선, 비듬 백선, 손 백선, 백선 감염, 조갑진균증 |
||
SKYRIZI군에서 위약군보다 높은 비율로 16주까지 1% 미만, 0.1% 초과의 대상자에게 발생한 약물 이상 반응은 모낭염과 두드러기였습니다.
특정 약물 이상 반응
감염
처음 16주 동안 감염은 SKYRIZI군의 22.1%(100 대상자-년당 90.8건)에서 발생한 반면 위약군에서는 14.7%(100 대상자-년당 56.5건)에서 발생했으며 SKYRIZI 중단으로 이어지지 않았습니다. SKYRIZI군과 위약군의 중증 감염 발생률은 ≤0.4%였습니다. SKYRIZI군의 중증 감염에는 봉와직염, 골수염, 패혈증 및 대상포진이 포함되었습니다. 연구 PsO-1 및 PsO-2에서 52주까지 감염 발생률(100 대상자-년당 73.9건)은 치료 첫 16주 동안 관찰된 발생률과 유사했습니다.
안전성 52주까지
52주까지 새로운 이상 반응은 확인되지 않았으며 이상 반응 발생률은 치료 첫 16주 동안 관찰된 발생률과 유사했습니다. 이 기간 동안 연구 중단으로 이어진 중증 감염에는 폐렴이 포함되었습니다.
건선성 관절염
SKYRIZI로 치료받은 건선성 관절염 환자에서 관찰된 전반적인 안전성 프로파일은 일반적으로 판상 건선 환자의 안전성 프로파일과 일치합니다. 또한, 위약 대조 3상 시험에서 간 이벤트 발생률은 위약군(3.9%, 100 환자-년당 12.6건)에 비해 SKYRIZI군(5.4%, 100 환자-년당 16.7건)에서 더 높았습니다. 이 중 위약군과 SKYRIZI군 모두에서 더 자주 보고된 가장 흔한 이벤트는 ALT 증가(위약: n=12(1.7%); SKYRIZI: n=16(2.3%)), AST 증가(위약: n=9(1.3%); SKYRIZI: n=13(1.8%)) 및 GGT 증가(위약: n=5(0.7%); SKYRIZI: n=8(1.1%))였습니다. 중증 간 이벤트는 보고되지 않았습니다. 과민 반응 발생률은 위약군(n=9, 1.3%)에 비해 SKYRIZI군(n=16, 2.3%)에서 더 높았습니다. 위약 대조 3상 시험에서 SKYRIZI군에서 더 높은 비율로 보고된 과민 반응에는 발진(위약: n=4(0.6%); SKYRIZI: n=5(0.7%), 알레르기성 비염(위약: n=1(0.1%); SKYRIZI: n=2(0.3%) 및 안면 부종(위약: n=0(0.0%); SKYRIZI n=1(0.1%)이 포함되었습니다. 2상 임상 시험에서 SKYRIZI를 투여받은 대상자 1명에게서 아나필락시스 1건이 보고되었습니다.
크론병
SKYRIZI는 2개의 무작위 배정, 이중 맹검, 위약 대조 유도 연구(CD-1, CD-2)와 무작위 배정, 이중 맹검, 위약 대조, 용량 찾기 연구(CD-4; NCT02031276)에서 중등도에서 중증의 활동성 크론병 환자를 대상으로 최대 12주 동안 연구되었습니다. 유도 요법에 반응한 대상자를 대상으로 무작위 배정, 이중 맹검, 위약 대조 유지 연구(CD-3)에서 최대 52주까지 장기 안전성을 평가했습니다. [임상 연구(14.3)]를 참조하십시오.
2개의 유도 연구(CD-1, CD-2)와 용량 찾기 연구(CD-4)에서 620명의 대상자가 0주, 4주 및 8주에 SKYRIZI 정맥 유도 요법을 받았습니다. 유지 연구(CD-3)에서 연구 CD-1 및 CD-2에서 정맥 SKYRIZI로 12주간 유도 치료 후 기준선에서 CDAI가 최소 100점 감소한 것으로 정의된 임상 반응을 달성한 297명의 대상자가 12주에 피하 SKYRIZI 180mg 또는 360mg을 투여받고 그 후 최대 52주까지 8주마다 투여받는 유지 요법을 받았습니다.
유도 연구에서 대상자의 3% 초과에서 보고된 이상 반응으로 위약보다 높은 비율로 보고된 이상 반응은 표 3에 나와 있습니다.
| 약물 이상 반응 | SKYRIZI 600mg 정맥 주입a N = 620 n (%) |
위약 N = 432 n (%) |
| 상기도 감염b | 66 (10.6) | 40 (9.3) |
| 두통c | 41 (6.6) | 24 (5.6) |
| 관절통 | 31 (5.0) | 19 (4.4) |
| a 0주, 4주 및 8주에 정맥 주입으로 SKYRIZI 600mg. b 다음을 포함합니다. 인플루엔자 유사 질환, 비인두염, 인플루엔자, 인후염, 상기도 감염, 바이러스성 상기도 감염, COVID-19, 비충혈, 바이러스성 호흡기 감염, 바이러스성 인후염, 편도염, 상기도 염증 c 두통, 긴장성 두통 포함 |
||
유지 연구에서 피험자의 >3%에서 보고되었고 위약보다 높은 비율로 보고된 이상 반응은 표 4에 나와 있습니다.
| 이상 약물 반응 | SKYRIZI 피하 주사 180mg N = 155 n (%) |
SKYRIZI 피하 주사 360mg N = 142 n (%) |
위약 N = 143 n (%) |
| 관절통 | 13 (8.4) | 13 (9.2) | 12 (8.4) |
| 복통b | 9 (5.8) | 12 (8.5) | 6 (4.2) |
| 주사 부위 반응c,d | 7 (4.5) | 8 (5.6) | 4 (2.8) |
| 빈혈 | 7 (4.5) | 7 (4.9) | 6 (4.2) |
| 발열 | 4 (2.6) | 7 (4.9) | 4 (2.8) |
| 요통 | 3 (1.9) | 6 (4.2) | 3 (2.1) |
| 관절병증 | 1 (0.6) | 5 (3.5) | 2 (1.4) |
| 요로 감염 | 1 (0.6) | 5 (3.5) | 4 (2.8) |
| a 12주차에 SKYRIZI 180mg 또는 360mg을 투여하고 그 이후 최대 52주 동안 8주마다 투여 b 다음을 포함합니다. 복통, 상복부 통증, 하복부 통증 c 다음을 포함합니다. 주사 부위 발진, 주사 부위 홍반, 주사 부위 부종, 주사 부위 두드러기, 주사 부위 열감, 주사 부위 통증, 주사 부위 과민 반응, 주사 부위 반응 d 일부 피험자는 주사 부위 반응이 여러 번 발생했습니다. 이 표에서 주사 부위 반응은 비율 계산을 위해 피험자당 한 번만 계산됩니다. |
|||
특정 약물 부작용
감염
52주까지 유지 연구(CD-3)에서 SKYRIZI 180mg을 투여받은 대상자의 감염 발생률은 32.3%(100 대상자-년당 50.2건)였고, SKYRIZI 360mg을 투여받은 대상자의 감염 발생률은 36.6%(100 대상자-년당 60.8건)였으며, SKYRIZI 유도 요법 후 위약을 투여받은 대상자의 감염 발생률은 36.4%(100 대상자-년당 60.3건)였습니다. SKYRIZI 180mg을 투여받은 대상자의 중증 감염 발생률은 2.6%(100 대상자-년당 2.7건)였고, SKYRIZI 360mg을 투여받은 대상자의 중증 감염 발생률은 5.6%(100 대상자-년당 7.4건)였으며, SKYRIZI 유도 요법 후 위약을 투여받은 대상자의 중증 감염 발생률은 2.1%(100 대상자-년당 2.4건)였습니다.
지질 수치 상승
지질 매개변수(총 콜레스테롤 및 저밀도 지단백 콜레스테롤[LDL-C])의 상승은 유도 시험(CD-1, CD-2)에서 SKYRIZI 투여 시작 후 4주에 처음 평가되었습니다. 기준선 대비 증가 및 위약 대비 증가는 4주에 관찰되었으며, 12주까지 안정적으로 유지되었습니다. SKYRIZI 유도 요법 후 총 콜레스테롤 평균은 기준선 대비 9.4mg/dL 증가하여 12주에 평균 절대값 175.1mg/dL을 나타냈습니다. 마찬가지로 LDL-C 평균은 기준선 대비 6.6mg/dL 증가하여 12주에 평균 절대값 92.6mg/dL을 나타냈습니다. SKYRIZI 180mg 유지 요법을 시행한 경우 LDL-C 평균은 기준선 대비 3.1mg/dL 증가하여 52주에 평균 절대값 99.0mg/dL을 나타냈으며, SKYRIZI 360mg 유지 요법을 시행한 경우 LDL-C 평균은 기준선 대비 2.3mg/dL 증가하여 52주에 평균 절대값 102.2mg/dL을 나타냈습니다(CD-3).
궤양성 대장염
SKYRIZI는 무작위 배정, 이중 맹검, 위약 대조 유도 연구(UC-1) 및 무작위 배정, 이중 맹검, 위약 대조, 용량 찾기 연구(UC-3)에서 중등도에서 중증의 활동성 궤양성 대장염 환자를 대상으로 최대 12주까지 연구되었습니다. 유도 요법에 반응한 대상자를 대상으로 무작위 배정, 이중 맹검, 위약 대조 유지 연구(UC-2)에서 최대 52주까지 장기 안전성을 평가했습니다. [임상 연구(14.4) 참조].
유도 연구(UC-1 및 UC-3)에서 712명의 대상자가 0주, 4주 및 8주에 SKYRIZI 1,200mg 정맥내 유도 요법을 받았습니다. 유지 연구(UC-2)에서 mMS가 기준선 대비 ≥2점 및 ≥30% 감소하고 RBS가 기준선 대비 ≥1 감소하거나 절대 RBS가 ≤1인 임상 반응을 보인 347명의 대상자가 12주에 SKYRIZI 180mg 또는 360mg 피하 주사를 받고, 그 후 최대 52주까지 8주마다 유지 요법을 받았습니다.
궤양성 대장염 유도 연구(UC-1 및 UC-3)에서 SKYRIZI로 치료받은 대상자의 ≥3%에서 보고된 부작용 중 위약보다 발생률이 높았던 것은 관절통(SKYRIZI 3% 대 위약 1%)이었습니다.
유지 연구(UC-2)에서 SKYRIZI로 치료받은 대상자의 ≥3%에서 보고된 부작용 중 위약보다 발생률이 높았던 것은 표 5에 나와 있습니다.
| 약물 부작용 | SKYRIZI 180mg 피하 주사 N = 170 n (%) |
SKYRIZI 360mg 피하 주사 N = 177 n (%) |
위약 N = 173 n (%) |
| 관절통 | 9 (5.3) | 17 (9.6) | 8 (4.6) |
| 발열 | 8 (4.7) | 7 (4.0) | 6 (3.5) |
| 주사 부위 반응b,c | 5 (2.9) | 5 (2.8) | 2 (1.2) |
| 발진d | 7 (4.1) | 1 (0.6) | 3 (1.7) |
| a 12주에 SKYRIZI 180mg 또는 360mg을 투여하고, 그 후 최대 52주까지 8주마다 투여 b 다음을 포함합니다. 투여 부위 통증, 주사 부위 홍반, 주사 부위 통증, 주사 부위 가려움증, 주사 부위 반응 c 일부 대상자는 주사 부위 반응이 여러 번 발생했습니다. 이 표에서는 발생률 계산을 위해 대상자당 주사 부위 반응을 한 번만 계산했습니다. d 다음을 포함합니다. 발진 및 반점상 발진 |
|||
6.1 특정 약물 유해 반응
유도 연구(UC-1 및 UC-3) 및 유지 연구(UC-2)에서 위약을 투여받은 대상자와 비교하여 SKYRIZI를 투여받은 궤양성 대장염 환자에서 감염, 심각한 감염 및 지질 상승의 발생률은 유도 연구(CD-1, CD-2 및 CD-4) 및 유지 연구(CD-3)에서 위약을 투여받은 대상자와 비교하여 SKYRIZI를 투여받은 크론병 환자에서의 발생률과 유사했습니다.
6.2 면역원성
모든 치료용 단백질과 마찬가지로 면역원성이 발생할 가능성이 있습니다. 항체 형성의 검출은 검사의 민감도와 특이도에 크게 의존합니다. 또한, 검사에서 관찰된 항체(중화 항체 포함) 양성률은 검사 방법, 샘플 취급, 샘플 수집 시기, 동반 약물 및 기저 질환을 포함한 여러 요인의 영향을 받을 수 있습니다. 이러한 이유로, 아래에 설명된 연구에서 항체 발생률을 다른 연구 또는 다른 제품(다른 리산키주맙 제품 포함)의 항체 발생률과 비교하는 것은 오해의 소지가 있을 수 있습니다.
판상 건선
52주차까지, 권장 용량으로 SKYRIZI를 투여받은 대상자의 약 24%(1079명 중 263명)에서 리산키주맙-rzaa에 대한 항체가 발생했습니다. 리산키주맙-rzaa에 대한 항체가 발생한 대상자 중 약 57%(SKYRIZI를 투여받은 모든 대상자의 14%)는 중화 항체로 분류된 항체를 가지고 있었습니다. SKYRIZI를 투여받은 대상자의 약 1%에서 더 높은 항체 역가는 리산키주맙-rzaa 농도가 낮아지고 임상 반응이 감소하는 것과 관련이 있었습니다.
건선성 관절염
28주차까지, 권장 용량으로 SKYRIZI를 투여받은 대상자의 약 12.1%(652명 중 79명)에서 리산키주맙-rzaa에 대한 항체가 발생했습니다. 리산키주맙-rzaa에 대한 항체가 발생한 대상자 중 중화 항체로 분류된 항체를 가진 대상자는 없었습니다. 리산키주맙-rzaa에 대한 항체는 건선성 관절염의 임상 반응 변화와 관련이 없었습니다. 약물 항체가 있는 대상자에서 약물 항체가 없는 대상자(과민 반응 3.8%(574명 중 22명), 주사 부위 반응 0.7%(574명 중 4명))와 비교하여 과민 반응(6.3%(79명 중 5명)) 및 주사 부위 반응(2.5%(79명 중 2명))을 경험한 비율이 더 높았습니다. 이러한 과민 반응 및 주사 부위 반응 중 리산키주맙-rzaa 중단으로 이어진 것은 없었습니다.
크론병
64주차까지, SKYRIZI 유도 요법 후 360mg 유지 요법을 받은 대상자의 약 3.4%(58명 중 2명)에서 리산키주맙-rzaa에 대한 항체가 발생했습니다. SKYRIZI 유도 요법 후 180mg 유지 요법을 받은 대상자(57명 중 0명)는 리산키주맙-rzaa에 대한 항체가 발생하지 않았습니다. 리산키주맙-rzaa에 대한 항체가 발생한 대상자 중 중화 항체로 분류된 항체를 가진 대상자는 없었습니다.
궤양성 대장염
64주차까지, SKYRIZI 유도 요법 후 180mg 또는 360mg 유지 요법을 받은 대상자의 약 8.9%(90명 중 8명) 또는 4.4%(91명 중 4명)에서 리산키주맙-rzaa에 대한 항체가 발생했습니다. 리산키주맙-rzaa에 대한 항체가 발생한 대상자 중 75%(SKYRIZI 유도 요법 후 180mg 유지 요법을 받은 모든 대상자의 6.7%) 또는 50%(SKYRIZI 유도 요법 후 360mg 유지 요법을 받은 모든 대상자의 2.2%)는 각각 중화 항체로 분류된 항체를 가지고 있었습니다.
6.3 시판 후 경험
SKYRIZI의 시판 후 다음과 같은 유해 반응이 보고되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되었기 때문에 항상 발생 빈도를 신뢰할 수 있게 추정하거나 SKYRIZI 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
- 피부 및 피하 조직 장애: 습진 및 발진
8 특정 집단에서의 사용
8.1 임신
임신 노출 레지스트리
SKYRIZI로 치료받는 동안 임신한 여성의 결과를 모니터링하는 임신 노출 레지스트리가 있습니다. 환자는 1-877-302-2161로 전화하거나 http://glowpregnancyregistry.com을 방문하여 등록하도록 권장해야 합니다.
위험 요약
임산부에서 리산키주맙 사용에 대한 유효한 약물 감시 및 임상 시험 데이터는 주요 선천적 기형, 유산 또는 기타 모체 또는 태아 결과에 대한 약물 관련 위험을 확립하기에 충분하지 않습니다. 리산키주맙-rzaa에 대한 데이터는 없지만, 모노클로날 항체는 태반을 통해 적극적으로 수송될 수 있으며, SKYRIZI는 자궁 내 노출된 영아에서 면역 억제를 유발할 수 있습니다. 염증성 장 질환이 있는 여성에서 임신 결과가 좋지 않습니다 (임상적 고려 사항 참조).
강화된 출산 전후 발달 독성 연구에서, 임신한 붉은털원숭이에게 기관 형성 기간부터 분만까지 일주일에 한 번 5 또는 50 mg/kg의 리산키주맙-rzaa를 피하 주사했습니다. 50 mg/kg 용량에서 임신한 원숭이에서 태아/영아 사망률이 증가했습니다 (데이터 참조). 임신한 원숭이에서 50 mg/kg 용량은 최대 권장 유도 용량(1,200 mg)을 투여받은 사람의 노출(AUC)의 약 5배, 최대 권장 유지 용량(360 mg)을 투여받은 사람의 노출(AUC)의 32배에 해당했습니다. 출생부터 6개월까지 영아 원숭이에서 기능적 또는 면역학적 발달에 대한 리산키주맙-rzaa 관련 효과는 관찰되지 않았습니다. 이러한 발견이 인간에게 미치는 임상적 의미는 알려져 있지 않습니다.
모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 표시된 인구에 대한 주요 선천적 기형 및 유산의 배경 위험은 알려져 있지 않습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
임상적 고려 사항
질병 관련 모체 및 배아/태아 위험
발표된 데이터에 따르면 염증성 장 질환이 있는 여성에서 임신 결과가 좋지 않을 위험은 질병 활동 증가와 관련이 있습니다. 임신 결과가 좋지 않은 경우에는 조산(임신 37주 전), 저체중아(2,500g 미만) 출산 및 출생 시 태아의 성장 지연이 포함됩니다.
태아/신생아 부작용
임신이 진행됨에 따라 태반을 통한 내인성 IgG 항체의 수송이 증가하고 3분기에 최고조에 달합니다. 리산키주맙은 감염에 대한 면역 반응을 방해할 수 있으므로, 자궁 내에서 SKYRIZI에 노출된 영아에게 생백신을 투여하기 전에 위험과 이점을 고려해야 합니다. 출생 시 영아 혈청 리산키주맙 수치와 출생 후 영아 혈청에서 리산키주맙의 지속 기간에 대한 데이터가 충분하지 않습니다. 자궁 내 노출된 영아에서 생바이러스 면역 접종을 지연시키는 특정 기간은 알려져 있지 않지만, 제품의 반감기를 고려하여 출생 후 최소 5개월을 고려해야 합니다.
데이터
동물 데이터
붉은털원숭이에서 강화된 출산 전후 발달 독성 연구를 수행했습니다. 임신한 붉은털원숭이에게 임신 20일부터 분만까지 일주일에 한 번 5 또는 50 mg/kg의 리산키주맙-rzaa를 피하 주사했으며, 붉은털원숭이(어미와 영아)는 분만 후 6개월 동안 모니터링했습니다. 이 연구에서 모체 독성은 관찰되지 않았습니다. 성장 및 발달, 기형, 발달 면역 독성 또는 신경 행동 발달에 대한 치료 관련 효과는 없었습니다. 그러나 리산키주맙-rzaa 치료군(5 mg/kg군에서 32%, 50 mg/kg군에서 43%)에서 대조군(19%)에 비해 태아/영아 사망률이 용량 의존적으로 증가했습니다. 50 mg/kg군에서 태아/영아 사망률이 증가한 것은 리산키주맙-rzaa 치료와 관련이 있는 것으로 간주되었습니다. 모체 독성에 대한 무관찰 유해 효과 수준(NOAEL)은 50 mg/kg으로 확인되었으며, 발달 독성에 대한 NOAEL은 5 mg/kg으로 확인되었습니다. 임신한 원숭이에서 5 mg/kg 용량은 최대 권장 유도 용량(1,200 mg)을 투여받은 사람의 노출(AUC)의 약 0.6배, 최대 권장 유지 용량(360 mg)을 투여받은 사람의 노출(AUC)의 5배에 해당했습니다. 영아에서 평균 혈청 농도는 용량 의존적으로 증가했으며, 각각의 모체 농도의 약 17%-86%였습니다. 분만 후, 리산키주맙-rzaa 치료군의 대부분의 성인 암컷 붉은털원숭이와 모든 영아는 분만 후 최대 91일까지 측정 가능한 리산키주맙-rzaa 혈청 농도를 보였습니다. 혈청 농도는 분만 후 180일에 검출 가능한 수준 이하였습니다.
8.2 수유
위험 요약
모유에서 리산키주맙-rzaa의 존재 여부, 모유 수유 영아에 대한 영향 또는 모유 생산에 대한 영향에 대한 데이터는 없습니다. 내인성 모체 IgG와 모노클로날 항체는 모유로 전달됩니다. 모유 수유 영아에서 리산키주맙-rzaa에 대한 국소 위장관 노출 및 제한적인 전신 노출의 영향은 알려져 있지 않습니다. 모유 수유의 발달적 및 건강상 이점을 SKYRIZI에 대한 모체의 임상적 필요와 SKYRIZI 또는 기저 모체 질환으로 인한 모유 수유 영아에 대한 잠재적인 부작용과 함께 고려해야 합니다.
8.5 노인 사용
SKYRIZI에 노출된 6,862명의 피험자 중 총 664명이 65세 이상(판상 건선 환자 243명, 건선성 관절염 환자 246명, 크론병 환자 72명, 궤양성 대장염 환자 103명)이었고, 71명이 75세 이상이었습니다.
각 적응증 내에서 SKYRIZI의 임상 연구에는 65세 이상의 피험자가 충분하지 않아 젊은 성인 피험자와 반응이 다른지 여부를 확인할 수 없었습니다.
나이에 따라 리산키주맙-rzaa의 약동학에서 임상적으로 의미 있는 차이는 관찰되지 않았습니다[임상 약리학 (12.3)].
11 설명
리산키주맙-rzaa는 인터루킨-23(IL-23) 길항제로, 인간화된 면역글로불린 G1(IgG1) 단일클론항체입니다. 리산키주맙-rzaa는 중국의 햄스터 난소 세포에서 재조합 DNA 기술로 생산되며 약 149 kDa의 분자량을 가집니다.
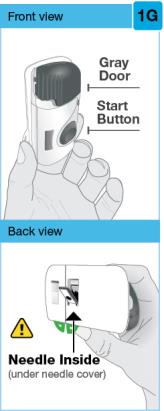
SKYRIZI(리산키주맙-rzaa) 주사제 90mg/mL 피펫 주사기, 피하 주사용
각각의 SKYRIZI 피펫 주사기는 살균된, 방부제가 없고, 무색에서 약간 노란색이며, 투명에서 약간 유백색인 용액을 포함합니다. 각 주사기는 리산키주맙-rzaa 90mg을 함유하며 비활성 성분으로 폴리소르베이트 20(0.2mg), 숙신산나트륨(0.63mg), 솔비톨(41mg), 숙신산(0.059mg), 및 USP 주사용수가 있습니다. pH는 6.2입니다.
SKYRIZI(리산키주맙-rzaa) 주사제 150mg/mL 피펫 주사기 또는 피펫 펜, 피하 주사용
각각의 SKYRIZI 피펫 펜 혹은 피펫 주사기는 살균된, 방부제가 없고, 무색에서 노란색이며, 투명에서 약간 유백색인 용액을 포함합니다. 각 주사기와 펜은 리산키주맙-rzaa 150mg과 비활성 성분으로 빙초산(0.054mg), 폴리소르베이트 20(0.2mg), 아세트산나트륨(0.75mg), 트레할로스(63.33mg), 및 USP 주사용수가 있습니다. pH는 5.7입니다.
SKYRIZI (리산키주맙-rzaa) 주사제 180 mg/1.2mL (150mg/mL) 사전 충전 카트리지, 제공된 신체 부착용 주사기와 함께 사용, 피하 주사용
각각의 SKYRIZI 사전 충전 카트리지는 살균된, 방부제가 없고, 무색에서 노란색이며, 투명에서 약간 유백색인 용액을 포함합니다. 각 카트리지는 리산키주맙-rzaa 180mg을 함유하며 비활성 성분으로 빙초산(0.065mg), 폴리소르베이트 20(0.24mg), 아세트산나트륨(0.9mg), 트레할로스(76mg), 및 USP 주사용수가 있습니다. pH는 5.7입니다.
SKYRIZI (리산키주맙-rzaa) 주사제 360mg/2.4mL (150mg/mL) 사전 충전 카트리지 제공된 on-body injector과 함께 사용, 피하 주사용
각각의 SKYRIZI 사전 충전 카트리지는 살균된, 방부제가 없고, 무색에서 노란색이며, 투명에서 약간 유백색인 용액을 포함합니다. 각 카트리지는 리산키주맙-rzaa 360mg을 함유하며 비활성 성분으로 빙초산(0.13mg), 폴리소르베이트 20(0.48mg), 아세트산나트륨(1.8mg), 트레할로스(152mg), 및 USP 주사용수가 있습니다. pH는 5.7입니다.
SKYRIZI 600mg/10mL (60mg/mL) 용액병 내 정맥 주입용
SKYRIZI(리산키주맙-rzaa) 주사제 600mg/10mL (60mg/mL)은 10mL 싱글-도스 용액병 내의 살균된, 방부제가 없고, 무색에서 약간 노란색이며, 투명에서 약간 유백색인 용액입니다.
각각의 10mL 싱글-도스 용액병에는 리산키주맙-rzaa 600mg을 함유하며 비활성 성분으로 빙초산(0.54mg), 폴리소르베이트 20(2mg), 아세트산나트륨(7.5mg), 트레할로스(633.3mg), 및 USP 주사용수가 있습니다. pH는 5.7입니다.
12 임상약리학
12.1 작용 기전
Risankizumab-rzaa는 인간 IL-23 사이토카인의 p19 서브유닛에 선택적으로 결합하여 IL-23 수용체와의 상호 작용을 억제하는 인간화 IgG1 단클론 항체입니다. IL-23은 염증 및 면역 반응에 관여하는 자연 발생 사이토카인입니다.
Risankizumab-rzaa는 염증성 사이토카인 및 케모카인의 방출을 억제합니다.
12.3 약동학
단일 용량 투여 후 Risankizumab-rzaa 혈장 농도는 피하 투여 시 18mg에서 360mg까지 용량에 비례하여 증가했습니다(최저 권장 용량의 0.12배에서 2.4배, 최고 권장 용량의 0.05배에서 1배). 건강한 피험자에서 최대 3시간의 정맥 주입으로 투여한 경우 200mg에서 1,800mg까지 용량에 비례하여 증가했습니다(권장 용량의 0.2배에서 3배).
플라크 건선 환자에서 0주, 4주, 그 이후 12주마다 150mg을 피하 투여한 경우, 정상 상태 최고 농도(Cmax)와 최저 농도(Ctrough)는 각각 12 mcg/mL와 2 mcg/mL로 추정됩니다.
동일한 피하 투여 요법으로, 건선성 관절염 환자에서 Risankizumab-rzaa의 약동학은 플라크 건선 환자에서와 유사했습니다.
크론병 환자에서 0주, 4주, 8주에 600mg 정맥 주입 유도 용량을 투여한 후, 12주 및 그 이후 8주마다 180mg 또는 360mg 피하 유지 용량을 투여한 경우, 8-12주 동안 중앙값 Cmax와 Ctrough는 각각 156 mcg/mL와 38.8 mcg/mL로 추정됩니다. 40-48주 동안 정상 상태 중앙값 Cmax와 Ctrough는 180mg의 경우 각각 14.0 mcg/mL와 4.1 mcg/mL, 360mg의 경우 각각 28.0 mcg/mL와 8.1 mcg/mL로 추정됩니다.
궤양성 대장염 환자에서 0주, 4주, 8주에 1,200mg 정맥 주입 유도 용량을 투여한 후, 12주 및 그 이후 8주마다 180mg 또는 360mg 피하 유지 용량을 투여한 경우, 유도 기간(8-12주) 동안 중앙값 Cmax와 Ctrough는 각각 350 mcg/mL와 87.7 mcg/mL로 추정됩니다. 유지 기간(40-48주) 동안 정상 상태 중앙값 Cmax와 Ctrough는 180mg의 경우 각각 19.6 mcg/mL와 4.64 mcg/mL, 360mg의 경우 각각 39.2 mcg/mL와 9.29 mcg/mL로 추정됩니다.
모집단 약동학 분석에 따르면, 궤양성 대장염 환자에서 Risankizumab-rzaa의 약동학은 일반적으로 크론병 환자에서와 유사했습니다.
흡수
Risankizumab-rzaa의 절대 생체 이용률은 피하 주사 후 74%에서 89%로 추정되었습니다. 건강한 피험자에서 단일 피하 투여 후, Cmax는 3일에서 14일 사이에 도달했습니다.
분포
플라크 건선 환자에서 추정된 정상 상태 분포 용적(피험자 간 CV%)은 11.2 L(34%)였고, 크론병 환자에서 7.68 L(64%)였습니다.
배설
추정된 전신 청소율(피험자 간 CV%)은 플라크 건선 환자에서 각각 0.31 L/day(24%)와 0.30 L/day(34%)였고, 말단 배설 반감기는 각각 약 28일과 21일이었습니다.
대사
Risankizumab-rzaa의 대사 경로는 규명되지 않았습니다. 인간화 IgG1 단클론 항체인 Risankizumab-rzaa는 내인성 IgG와 유사한 방식으로 이화 작용 경로를 통해 작은 펩타이드와 아미노산으로 분해될 것으로 예상됩니다.
특정 인구 집단
노인 환자(≥65세)에서 Risankizumab-rzaa 노출량(Ctrough)은 각 적응증 내에서 젊은 성인 환자와 유사했습니다. 신장애 또는 간장애가 Risankizumab-rzaa의 약동학에 미치는 영향을 조사한 연구는 수행되지 않았습니다.
체중
Risankizumab-rzaa 청소율과 분포 용적은 체중이 증가함에 따라 증가하고 혈장 농도는 감소하지만, 체중에 따라 용량 조절은 권장되지 않습니다.
약물 상호 작용 연구
시토크롬 P450 기질
플라크 건선 환자(Risankizumab-rzaa 150mg을 0주, 4주, 8주, 12주에 피하 투여)와 크론병 또는 궤양성 대장염 환자(Risankizumab-rzaa 1,800mg을 0주, 4주, 8주에 정맥 주입, 즉 크론병과 궤양성 대장염에 대한 권장 용량의 각각 3배와 1.5배)에서 Risankizumab-rzaa와 병용 투여했을 때 카페인(CYP1A2 기질), 와파린(CYP2C9 기질), 오메프라졸(CYP2C19 기질), 메토프롤롤(CYP2D6 기질), 또는 미다졸람(CYP3A 기질)의 노출량에 임상적으로 유의미한 변화가 관찰되지 않았습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
SKYRIZI에 대한 발암성 및 돌연변이 유발성 연구는 수행되지 않았습니다.
성적으로 성숙한 수컷 붉은털원숭이에게 26주 동안 주 1회 50 mg/kg의 risankizumab-rzaa를 투여한 결과, 최대 권장 유도 용량(1,200 mg)을 투여받은 사람의 노출량(AUC)의 4배, 최대 권장 유지 용량(360 mg)을 투여받은 사람의 노출량의 39배에 해당하는 수준에서 수컷 생식 능력 지표에 대한 영향은 관찰되지 않았습니다.
14 임상 연구
14.1 판상 건선
4개의 다기관, 무작위 배정, 이중맹검 연구 [PsO-1 (NCT02684370), PsO-2 (NCT02684357), PsO-3 (NCT02672852) 및 PsO-4 (NCT02694523)]에 중등도에서 중증의 판상 건선이 있는 18세 이상의 피험자 2,109명이 등록되었습니다. 이들은 체표면적(BSA)이 ≥10%, 정적 피부과 전문의 전반적 평가(sPGA) 점수가 ≥3(“중등도”) (건선의 심각도 척도 0~4에서 판의 두께/경화, 홍반 및 인설)이고, 건선 면적 및 심각도 지수(PASI) 점수가 ≥12였습니다.
전반적으로 피험자의 중간 기준 PASI 점수는 17.8이었고, 중간 BSA는 20%였습니다. 기준 sPGA 점수는 피험자의 19%에서 4(“중증”)였습니다. 연구 피험자의 10%는 진단된 건선성 관절염의 병력이 있었습니다.
모든 연구에서 피험자의 38%는 이전에 광선 요법을 받았고, 48%는 이전에 생물학적 제제가 아닌 전신 요법을 받았으며, 42%는 이전에 건선 치료를 위해 생물학적 제제를 받았습니다.
PsO-1 및 PsO-2 연구
PsO-1 및 PsO-2 연구에는 997명의 피험자가 등록되었습니다(SKYRIZI 150mg 그룹에 무작위 배정된 598명의 피험자, 위약 그룹에 무작위 배정된 200명의 피험자, 생물학적 활성 대조군 그룹에 무작위 배정된 199명의 피험자 포함). 피험자는 0주, 4주 및 그 이후 12주마다 치료를 받았습니다.
두 연구 모두 2개의 공동 1차 종료점에 대한 위약과 비교하여 16주차의 반응을 평가했습니다.
- sPGA 점수가 0(“완전 소실”) 또는 1(“거의 완전 소실”)인 피험자의 비율
- 기준 PASI에서 최소 90% 감소를 달성한 피험자의 비율(PASI 90)
2차 종료점에는 16주차에 PASI 100, sPGA 0 및 건선 증상 척도(PSS) 0을 달성한 피험자의 비율이 포함되었습니다.
결과는 표 6에 제시되어 있습니다.
| PsO-1 | PsO-2 | |||
| SKYRIZI (N=304) n (%) |
위약 (N=102) n (%) |
SKYRIZI (N=294) n (%) |
위약 (N=98) n (%) |
|
| sPGA 0 또는 1 (“완전 소실 또는 거의 완전 소실”)a | 267 (88) | 8 (8) | 246 (84) | 5 (5) |
| PASI 90a | 229 (75) | 5 (5) | 220 (75) | 2 (2) |
| sPGA 0 (“완전 소실”) | 112 (37) | 2 (2) | 150 (51) | 3 (3) |
| PASI 100 | 109 (36) | 0 (0) | 149 (51) | 2 (2) |
| a 공동 1차 종료점 | ||||
나이, 성별, 인종, 체중, 기준 PASI 점수 및 전신 또는 생물학적 요법제로의 이전 치료를 조사한 결과, 16주차에 이러한 하위 그룹 간에 SKYRIZI에 대한 반응에 차이가 발견되지 않았습니다.
PsO-1 및 PsO-2에서 52주차에 SKYRIZI를 투여받은 대상자는 sPGA 0(각각 58% 및 60%), PASI 90(각각 82% 및 81%) 및 PASI 100(각각 56% 및 60%)을 달성했습니다.
환자 보고 결과
PSS로 평가한 결과, 두 연구 모두에서 위약과 비교하여 16주차에 통증, 발적, 가려움증 및 화끈거림과 관련된 징후 및 증상이 개선되었습니다. PsO-1 및 PsO-2에서 SKYRIZI를 투여받은 대상자의 약 30%가 16주차에 PSS 0(“없음”)을 달성한 반면, 위약을 투여받은 대상자의 경우 1%였습니다.
연구 PsO-3
연구 PsO-3에는 507명의 대상자(407명은 SKYRIZI 150mg에 무작위 배정, 100명은 위약에 무작위 배정)가 등록되었습니다. 대상자는 0주차, 4주차 및 그 이후 12주마다 치료를 받았습니다.
16주차에 SKYRIZI는 sPGA 0 또는 1(SKYRIZI 84%, 위약 7%) 및 PASI 90(SKYRIZI 73%, 위약 2%)의 공동 1차 종료점에서 위약보다 우수했습니다. 16주차에 SKYRIZI와 위약의 각 반응률은 다음과 같습니다. sPGA 0(SKYRIZI 46%, 위약 1%); PASI 100(SKYRIZI 47%, 위약 1%); PASI 75(SKYRIZI 89%, 위약 8%).
반응의 유지 및 지속성
PsO-1 및 PsO-2에서 16주차에 SKYRIZI를 투여받고 PASI 100을 달성한 대상자 중 SKYRIZI를 계속 투여받은 대상자의 80%(258명 중 206명)가 52주차에 PASI 100을 달성했습니다. 16주차에 PASI 90에 반응한 대상자의 경우 88%(450명 중 398명)가 52주차에 PASI 90을 달성했습니다.
PsO-3에서 원래 SKYRIZI를 투여받고 28주차에 sPGA 0 또는 1을 달성한 대상자는 12주마다 SKYRIZI를 계속 투여받거나 치료를 중단하도록 재무작위 배정되었습니다. 52주차에 SKYRIZI를 계속 투여받도록 재무작위 배정된 대상자의 87%(111명 중 97명)가 sPGA 0 또는 1을 달성한 반면, SKYRIZI 투여를 중단하도록 재무작위 배정된 대상자의 경우 61%(225명 중 138명)였습니다.
14.2 건선성 관절염
SKYRIZI의 안전성 및 유효성은 건선성 관절염(PsA)이 있는 18세 이상의 대상자를 대상으로 한 2건의 무작위 배정, 이중 맹검, 위약 대조 연구(PsA-1[NCT03675308]에서 964명, PsA-2[NCT03671148]에서 443명)에서 1407명의 대상자를 대상으로 평가되었습니다.
이러한 연구의 대상자는 건선성 관절염 분류 기준(CASPAR)에 따라 건선성 관절염 진단을 받은 지 최소 6개월이 되었으며, 기준선에서 건선성 관절염의 중간 기간은 4.9년, ≥ 5개의 압통 관절 및 ≥ 5개의 부종 관절, 그리고 기준선에서 활성 판상 건선 또는 건선성 손톱 질환이 있었습니다. 기준선 임상 양상과 관련하여, 대상자의 55.9%가 활성 판상 건선이 있는 ≥3% BSA를 가졌습니다. 대상자의 63.4%와 27.9%는 각각 힘줄염과 지염을 가졌습니다. 건선성 손톱 질환이 추가로 평가된 PsA-1에서 67.3%가 건선성 손톱 질환을 가졌습니다.
PsA-1에서 모든 대상자는 비생물학적 DMARD 치료에 대한 이전 부적절한 반응 또는 내약성이 있었고 생물학적 요법을 처음 받았습니다. PsA-2에서 대상자의 53.5%는 비생물학적 DMARD 치료에 대한 이전 부적절한 반응 또는 내약성이 있었고, 대상자의 46.5%는 생물학적 요법에 대한 이전 부적절한 반응 또는 내약성이 있었습니다.
두 연구 모두에서 대상자는 0주차, 4주차 및 16주차에 SKYRIZI 150mg 또는 위약을 무작위 배정받았습니다. 28주차부터 모든 대상자는 12주마다 SKYRIZI를 투여받았습니다. 두 연구 모두 최대 204주까지 추가로 장기 연장이 포함되었습니다. 동반 약물 사용과 관련하여, 대상자의 59.6%는 동반 메토트렉세이트(MTX)를 투여받고 있었고, 11.6%는 MTX 이외의 동반 비생물학적 DMARD를 투여받고 있었고, 28.9%는 SKYRIZI 단독 요법을 투여받고 있었습니다.
두 연구 모두에서 1차 종료점은 24주차에 미국 류마티스학회(ACR) 20 반응을 달성한 대상자의 비율이었습니다.
임상 반응
두 연구 모두에서 SKYRIZI로 치료한 결과, 24주차에 위약과 비교하여 질병 활성도 측정치가 유의하게 개선되었습니다. 주요 유효성 결과는 표 7 및 8을 참조하십시오.
두 연구 모두에서 동반 비생물학적 DMARD 사용, 이전 비생물학적 DMARD 수, 나이, 성별, 인종 및 BMI에 관계없이 유사한 반응이 나타났습니다. PsA-2에서 이전 생물학적 요법에 관계없이 반응이 나타났습니다.
| 종료점 | 위약 N=481 반응률 |
SKYRIZI N=483 반응률 |
위약과의 차이 (95% CI) |
| ACR20 반응* | |||
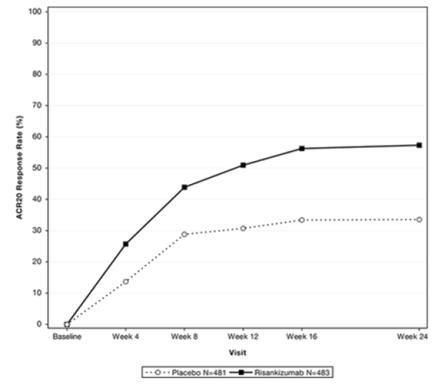
| 16주차 | 33.4% | 56.3%a | 23.1% (16.8, 29.4) |
| 24주차 | 33.5% | 57.3%a | 24.0% (18.0, 30.0) |
| ACR50 반응* | |||
| 16주차 | 11.1% | 26.4% | 15.4% (10.6, 20.2) |
| 24주차 | 11.3% | 33.4 % | 22.2% (17.3, 27.2) |
| ACR70 반응* | |||
| 16주 | 2.7% | 11.8% | 9.2% (6.1, 12.4) |
| 24주 | 4.7% | 15.3% | 10.5% (6.9, 14.2) |
| a. 다중성 제어 p≤0.001, SKYRIZI 대 위약 비교. *구제 약물 또는 효능 평가에 유의미한 영향을 미칠 수 있는 PsA에 대한 병용 약물 투여를 시작한 후에는 대상자를 비반응자로 간주했습니다. |
|||
| 종점 | 위약 N=219 반응률 |
SKYRIZI N=224 반응률 |
위약과의 차이 (95% CI) |
| ACR20 반응* | |||
| 16주 | 25.3% | 48.3% a | 22.6% (13.9, 31.2) |
| 24주 | 26.5% | 51.3% a | 24.5% (15.9, 33.0) |
| ACR50 반응* | |||
| 16주 | 6.8% | 20.3% | 13.5% (7.3, 19.7) |
| 24주 | 9.3% | 26.3% | 16.6% (9.7, 23.6) |
| ACR70 반응* | |||
| 16주 | 3.4% | 11.2% | 7.8% (3.0, 12.6) |
| 24주 | 5.9% | 12.0% | 6.0% (0.8, 11.3) |
| a. 다중성 제어 p≤0.001, SKYRIZI 대 위약 비교. *구제 약물 또는 효능 평가에 유의미한 영향을 미칠 수 있는 PsA에 대한 병용 약물 투여를 시작한 후에는 대상자를 비반응자로 간주했습니다. |
|||
주 24까지 PsA-1 연구에서 ACR20 반응을 달성한 대상의 비율은 그림 1에 나와 있습니다.
그림 1. 주 24까지 PsA-1 연구에서 ACR20 반응을 달성한 대상의 비율
두 연구 모두 ACR 반응 기준의 구성 요소 결과는 표 9에 나와 있습니다.
| PsA-1 | PsA-2 | |||
| 위약 (N=481) 평균 (SD) |
SKYRIZI (N=483) 평균 (SD) |
위약 (N=219) 평균 (SD) |
SKYRIZI (N=224) 평균 (SD) |
|
| 부은 관절 수 (0-66) | ||||
| 기준선 | 12.2 (8.0) | 12.1 (7.8) | 13.6 (9.0) | 13.0 (8.7) |
| 주 16 평균 변화 | -5.5 (7.0) | -7.7 (7.2) | -5.4 (8.5) | -8.0 (7.4) |
| 주 24 평균 변화 | -6.7 (7.2) | -8.7 (7.2) | -6.5 (7.8) | -9.1 (7.6) |
| 압통 관절 수 (0-68) | ||||
| 기준선 | 20.5 (12.8) | 20.8 (14.0) | 22.3 (13.8) | 22.8 (14.9) |
| 주 16 평균 변화 | -6.3 (11.1) | -10.7 (11.4) | -6.0 (13.1) | -11.3 (13.0) |
| 주 24 평균 변화 | -7.9 (10.7) | -12.0 (12.3) | -8.3 (11.3) | -13.0 (12.5) |
| 환자의 통증 평가 a | ||||
| 기준선 | 57.1 (22.6) | 57.1 (22.6) | 57.0 (23.1) | 55.0 (23.5) |
| 주 16 평균 변화 | -8.6 (23.7) | -18.4 (26.3) | -5.7 (22.7) | -14.4 (26.4) |
| 주 24 평균 변화 | -10.9 (25.4) | -21.4 (26.5) | -8.7 (25.3) | -15.3 (26.5) |
| 환자의 전반적인 평가 a | ||||
| 기준선 | 57.4 (22.1) | 57.9 (21.7) | 56.2 (23.0) | 56.2 (21.8) |
| 주 16 평균 변화 | -10.2 (23.9) | -19.4 (25.7) | -4.9 (23.6) | -17.0 (27.1) |
| 24주차 평균 변화 | -11.1 (25.1) | -22.6 (26.9) | -8.7 (25.4) | -17.7 (27.7) |
| 의사 전반적 평가 a | ||||
| 기준 | 62.4 (17.0) | 61.3 (17.6) | 60.7 (16.4) | 63.0 (17.0) |
| 16주차 평균 변화 | -18.3 (22.5) | -31.1 (23.4) | -19.0 (23.3) | -32.7 (24.7) |
| 24주차 평균 변화 | -22.2 (22.8) | -34.8 (23.2) | -21.3 (25.2) | -35.5 (25.6) |
| 건강 평가 설문지 – 장애 지수 (HAQ-DI) b | ||||
| 기준 | 1.2 (0.7) | 1.2 (0.7) | 1.1 (0.6) | 1.1 (0.6) |
| 16주차 평균 변화 | -0.1 (0.5) | -0.3 (0.5) | -0.1 (0.5) | -0.2 (0.5) |
| 24주차 평균 변화 | -0.1 (0.5) | -0.3 (0.5) | -0.1 (0.4) | -0.2 (0.5) |
| 고감도 C-반응성 단백질 (hs-CRP) mg/L | ||||
| 기준 | 11.3 (14.1) | 11.9 (15.9) | 8.2 (17.1) | 7.4 (10.9) |
| 16주차 평균 변화 | -0.3 (14.7) | -4.8 (14.2) | -0.1 (6.8) | -2.1 (7.5) |
| 24주차 평균 변화 | -0.2 (11.7) | -4.3 (12.8) | -0.5 (14.5) | -1.8 (13.4) |
| SD= 표준 편차. a. 시각적 아날로그 척도 (100mm) 기반 평가, 왼쪽 끝은 “통증 없음” (환자의 통증 평가), “매우 좋음” (환자 전반적 평가), 또는 “관절염 활동 없음” (의사 전반적 평가)을 나타내고, 오른쪽 끝은 “가능한 최악의 통증” (환자의 통증 평가), “나쁨” (환자 전반적 평가), 또는 “매우 활동적인 관절염” (의사 전반적 평가)을 나타냅니다. b. 건강 평가 설문지의 장애 지수; 0 = 어려움 없음에서 3 = 수행 불가능까지, 환자의 다음 수행 능력을 측정합니다. 옷 입기, 일어나기, 식사, 걷기, 위생, 닿기, 잡기, 일상 생활 활동. |
||||
SKYRIZI 치료는 기존 지관절염 또는 힘줄염이 있는 피험자에서 지관절염 및 힘줄염의 개선으로 이어졌습니다.
SKYRIZI를 투여받은 동반되는 판상 건선 환자의 경우, 판상 건선의 피부 병변은 24주차에 판상 건선 면적 중증도 지수(PASI 90)로 측정한 결과, 위약에 비해 치료로 개선되었습니다.
신체 기능
두 연구 모두에서 SKYRIZI로 치료받은 환자는 24주차에 HAQ-DI로 평가한 결과, 위약에 비해 기준선에서 신체 기능이 통계적으로 유의하게 개선되었습니다(표 7). 24주차에 기준선에서 HAQ-DI 변화에 대한 위약과의 평균 차이(95% CI)는 PsA-1 연구에서 -0.20(-0.26, -0.14)이고 PsA-2 연구에서 -0.16(-0.26, -0.07)이었습니다.
두 연구 모두에서 24주차에 SKYRIZI 그룹에서 위약 그룹에 비해 더 많은 비율의 피험자가 기준선에서 HAQ-DI 점수가 최소 0.35 감소했습니다.
기타 건강 관련 결과
두 연구 모두에서 일반 건강 상태는 36개 항목 단축형 건강 설문 조사(SF-36 V2)로 평가했습니다. 피로는 만성 질환 치료 피로 척도(FACIT-피로)로 평가했습니다.
두 연구 모두에서 24주차에 SKYRIZI로 치료받은 피험자는 위약을 투여받은 피험자에 비해 SF-36 신체 구성 요소 요약 점수가 개선되었습니다. 또한 두 연구 모두에서 24주차에 SKYRIZI로 치료받은 피험자는 위약에 비해 신체 기능, 역할 신체, 신체 통증, 일반 건강, 활력, 사회적 기능, 정신 건강, 역할 감정 영역 점수 및 정신 구성 요소 요약 점수가 수치적으로 개선되었습니다. 두 연구 모두에서 24주차에 SKYRIZI로 치료받은 피험자는 위약을 투여받은 피험자에 비해 FACIT-피로 점수가 개선되었습니다.
14.3 크론병
유도 시험(연구 CD-1 및 CD-2)
12주 유도 연구 2건(CD-1; NCT03105128 및 CD-2; NCT03104413)에서 중등도에서 중증의 활동성 크론병 환자는 0주차, 4주차 및 8주차에 SKYRIZI 600mg, SKYRIZI 1,200mg 또는 위약을 정맥 주입으로 무작위 배정받았습니다. 중등도에서 중증의 활동성 CD는 크론병 활동 지수(CDAI)가 220~450이고 크론병에 대한 단순 내시경 점수(SES-CD)가 ≥6(또는 고립된 회장 질환의 경우 ≥4)로 정의되었습니다. 경구 아미노살리실레이트, 코르티코스테로이드, 면역 억제제 및/또는 생물학적 치료에 대한 반응이 불충분하거나 반응 상실 또는 내약성이 없는 환자를 등록했습니다.
기준선에서 CD-1의 중간 CDAI는 307(범위: 76~634)이고 CD-2의 중간 CDAI는 307(범위: 72~651)이었으며, CD-1의 중간 SES-CD는 12(범위: 4~45)이고 CD-2의 중간 SES-CD는 13(범위 4~40)이었습니다. CD-1에서 피험자의 58%(491/850)는 하나 이상의 생물학적 치료에 대한 치료 실패 또는 내약성이 있었습니다(이전 생물학적 치료 실패). CD-2의 모든 피험자는 이전 생물학적 치료 실패를 경험했습니다. 기준선에서 환자의 30%와 34%는 코르티코스테로이드를 투여받고 있었고, 환자의 24%와 23%는 면역 조절제(아자티오프린, 6-머캅토푸린, 메토트렉세이트)를 투여받고 있었으며, 환자의 31%와 19%는 CD-1과 CD-2에서 각각 아미노살리실레이트를 투여받고 있었습니다. CD-1과 CD-2를 합쳐서 중간 연령은 36세(16~80세)였고, 피험자의 81%(1145/1419)는 백인이었으며, 53%(753/1419)는 남성이었습니다.
CD-1과 CD-2에서 공동 일차 종료점은 12주차의 임상적 완화 및 내시경적 반응이었습니다. 이차 종료점에는 임상적 반응 및 내시경적 완화가 포함되었습니다(표 10 및 표 11 참조). SKYRIZI 1,200mg 용량은 600mg 용량에 비해 추가적인 치료 효능을 보이지 않았으며, 권장 요법이 아닙니다 [용량 및 투여(2.6)].
| 종료점 | 위약 |
SKYRIZI 600mg 정맥 주입a |
치료 차이 b (95% CI) |
| 임상적 완화c,d | |||
| 전체 모집단 | N=175 25% |
N=336 45% |
21% e (12%, 29%) |
| 이전 생물학적 치료 실패f | N=97 26% |
N=195 42% |
|
| 이전 생물학적 치료 실패 없음 | N=78 23% |
N=141 49% |
|
| 내시경적 반응c,g | |||
| 전체 모집단 | N=175 12% |
N=336 40% |
28% e (21%, 35%) |
| Prior biologic failuref | N=97 11% |
N=195 33% |
|
| Without prior biologic failure | N=78 13% |
N=141 50% |
|
| Clinical Responseh | |||
| Total Population | N=175 37% |
N=336 60% |
23% e (14%, 32%) |
| Prior biologic failuref | N=97 34% |
N=195 58% |
|
| Without prior biologic failure | N=78 40% |
N=141 62% |
|
| Endoscopic Remissioni | |||
| Total Population | N=175 9% |
N=336 24% |
15% e (9%, 21%) |
| Prior biologic failuref | N=97 5% |
N=195 18% |
|
| Without prior biologic failure | N=78 14% |
N=141 32% |
|
| a. SKYRIZI 600 mg as an intravenous infusion at Week 0, Week 4, and Week 8 b. Adjusted treatment difference (95% CI) based on Cochran-Mantel-Haenszel method adjusted for randomization stratification factors c. Co-primary endpoints d. CDAI <150 e. p <0.001 f. Prior biologic failure includes inadequate response, loss of response, or intolerance to one or more biologic treatments for CD g. A decrease in SES-CD > 50% from baseline, or a decrease of at least 2 points for subjects with a baseline score of 4 and isolated ileal disease, based on central reading h. A reduction of CDAI ≥ 100 points from baseline i. SES-CD ≤ 4 and at least a 2-point reduction from baseline, with no individual subscore greater than 1, based on central reading |
|||
| Endpoint | Placebo N=187 |
SKYRIZI 600 mg Intravenous Infusionb N=191 |
Treatment Differencec (95% CI) |
| Clinical Remissiond,e | 20% | 42% | 22% f (13%, 31%) |
| Endoscopic Response d,g | 11% | 29% | 18% f (10%, 25%) |
| Clinical Responseh | 30% | 60% | 29% f (20%, 39%) |
| Endoscopic Remissioni | 4% | 19% | 15% f (9%, 21%) |
| a. All subjects enrolled in CD-2 had prior biologic failure. Prior biologic failure includes inadequate response, loss of response, or intolerance to one or more biologic treatments for CD b. SKYRIZI 600 mg as an intravenous infusion at Week 0, Week 4, and Week 8 c. Adjusted treatment difference (95% CI) based on Cochran-Mantel-Haenszel method adjusted for randomization stratification factors d. Co-primary endpoints e. CDAI score <150 f. p < 0.001 g. A decrease in SES-CD > 50% from baseline, or a decrease of at least 2 points for subjects with a baseline score of 4 and isolated ileal disease, based on central reading h. A reduction of CDAI ≥ 100 points from baseline i. SES-CD ≤ 4 and at least a 2-point reduction versus from baseline, with and no individual subscore greater than 1, based on central reading |
|||
CDAI 기준 임상 반응 및 임상 완화는 SKYRIZI 600mg 유도 요법으로 치료받은 대상자에서 위약군에 비해 4주 만에 더 많은 비율로 나타났습니다.
대변 빈도 및 복통 감소는 SKYRIZI 600mg 유도 요법으로 치료받은 대상자에서 위약군에 비해 12주에 더 많은 비율로 관찰되었습니다.
연구 CD-3
유지 연구 CD-3는 연구 CD-1 및 CD-2에서 정맥 주사 SKYRIZI로 12주간 유도 치료 후 기준선에서 CDAI가 최소 100점 감소한 임상 반응을 달성한 382명의 대상자를 평가했습니다. 대상자는 12주에 SKYRIZI 180mg 또는 SKYRIZI 360mg 또는 위약을 무작위로 배정받아 최대 52주 동안 8주마다 유지 요법을 받았습니다.
CD-3의 공동 1차 평가변수는 52주차의 임상 완화 및 내시경 반응이었습니다(표 12 참조).
| 평가변수 | 위약a |
SKYRIZI 180mg 피하 주사b |
SKYRIZI 360mg 피하 주사c |
치료 차이 vs 위약d (95% CI) |
||
| SKYRIZI 180mg |
SKYRIZI 360mg |
|||||
| 임상 완화e,f | ||||||
| 전체 모집단 | N=130 46% |
N=135 61% |
N=117 57% |
17%g (6%, 28%) |
14%g (3%, 26%) |
|
| 생물학적 치료 실패 이력h | N=99 40% |
N=95 56% |
N=83 51% |
|||
| 생물학적 치료 실패 이력 없음 | N=31 65% |
N=40 75% |
N=34 71% |
|||
| 내시경 반응e,i | ||||||
| 전체 모집단 | N=130 22% |
N=135 50% |
N=117 48% |
30%g (20%, 39%) |
31%g (21%, 41%) |
|
| 생물학적 치료 실패 이력h | N=99 21% |
N=95 44% |
N=83 44% |
|||
| 생물학적 치료 실패 이력 없음 | N=31 23% |
N=40 65% |
N=34 59% |
|||
| a. 위약군은 SKYRIZI에 반응한 환자로 유지 치료 시작 시 위약을 무작위로 배정받았습니다. b. 12주차에 SKYRIZI 180mg을 투여하고 그 후 최대 52주 동안 8주마다 투여 c. 12주차에 SKYRIZI 360mg을 투여하고 그 후 최대 52주 동안 8주마다 투여 d. 무작위 배정 계층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 사용하여 계산된 조정된 치료 차이 및 95% CI e. 공동 1차 평가변수 f. CDAI <150 g. p <0.05 h. 생물학적 치료 실패 이력에는 CD에 대한 하나 이상의 생물학적 치료에 대한 부적절한 반응, 반응 상실 또는 내약성이 포함됩니다. i. 기준선에서 SES-CD가 50% 이상 감소하거나, 기준선 점수가 4점이고 고립된 회장 질환이 있는 대상자의 경우 최소 2점 감소(중앙 판독 기준) |
||||||
주 52주에 SKYRIZI 180mg 유지 요법으로 치료받은 대상자의 33%(44/135)와 SKYRIZI 360mg 유지 요법으로 치료받은 대상자의 41%(48/117)에서 내시경적 관해가 관찰된 반면, 위약으로 치료받은 대상자의 경우 13%(17/130)에서 관찰되었습니다. 이러한 종말점은 사전에 지정된 다중 검정 절차에 따라 통계적으로 유의하지 않았습니다.
14.4 궤양성 대장염
유도 시험(UC-1 연구)
12주 유도 연구(UC-1; NCT03398148)에서 중등도에서 중증의 활동성 궤양성 대장염이 있는 966명의 대상자를 무작위 배정하여 주 0, 주 4 및 주 8에 SKYRIZI 1,200mg 또는 위약을 정맥 주입으로 투여했습니다. 질병 활성도는 수정된 Mayo 점수(mMS)로 평가했으며, 이는 3가지 구성 요소로 이루어진 Mayo 점수(0-9)로 다음과 같은 하위 점수(각 하위 점수에 대해 0에서 3까지)로 구성됩니다. 대변 빈도(SFS), 직장 출혈(RBS) 및 중앙 판독 내시경 점수(ES)에 대한 소견. ES 2는 현저한 발적, 혈관 패턴 부재, 모든 취약성 및/또는 침식으로 정의되었으며, ES 3은 자발적 출혈 및 궤양으로 정의되었습니다. 등록된 대상자는 mMS가 5에서 9 사이였으며 ES가 2 또는 3이었습니다. 경구 아미노살리실레이트, 코르티코스테로이드, 면역 조절제, 생물학적 제제, Janus 키나아제 억제제(JAKi) 및/또는 스핑고신-1-인산 수용체 조절제(S1PRM)에 대한 반응이 불충분하거나 내약성이 없는 대상자를 등록했습니다.
UC-1에서 기준선에서 mMS 중앙값은 7이었으며, 37%는 중증의 활동성 질환(mMS >7)이었고, 69%는 ES가 3이었습니다. UC-1에서 대상자의 52%(499/966)는 하나 이상의 생물학적 제제, JAKi 또는 S1PRM으로 치료에 실패(반응이 불충분하거나 내약성이 없음)했습니다. 이러한 499명의 대상자 중 484명(97%)은 생물학적 제제에 실패했고 90명(18%)은 JAK 억제제에 실패했습니다. 등록된 대상자는 안정적인 용량의 경구 코르티코스테로이드(프레드니손 20mg/일 또는 동등한 용량까지), 면역 조절제 및 아미노살리실레이트를 사용할 수 있었습니다. 기준선에서 대상자의 36%는 코르티코스테로이드를 투여받고 있었고, 대상자의 16%는 면역 조절제(아자티오프린, 6-머캅토푸린, 메토트렉세이트 포함)를 투여받고 있었고, 대상자의 73%는 UC-1에서 아미노살리실레이트를 투여받고 있었습니다.
UC-1에서 주요 종말점은 주 12에 mMS를 사용하여 정의된 임상적 관해였습니다(표 13 참조). 주요 이차 종말점에는 임상적 반응, 내시경적 개선 및 조직학적 내시경적 점막 개선(HEMI)이 포함되었습니다(표 13 참조).
| 종말점 | 위약 | SKYRIZI 1,200mg 정맥 주입a | 치료 차이(95% CI)b |
| 임상적 관해c | |||
| 전체 모집단 | N=320 8% |
N=646 24% |
16%h (12%, 20%) |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패d | N=168 6% |
N=331 14% |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=152 9% |
N=315 33% |
|
| 임상적 반응e | |||
| 전체 모집단 | N=320 36% |
N=646 65% |
29%h (23%, 35%) |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패d | N=168 32% |
N=331 56% |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=152 41% |
N=315 75% |
|
| 내시경적 개선f | |||
| 전체 모집단 | N=320 12% |
N=646 36% |
25%h (20%, 30%) |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패d | N=168 10% |
N=331 26% |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=152 14% |
N=315 47% |
|
| 조직학적 내시경적 점막 개선(HEMI)g | |||
| 전체 모집단 | N=320 7% |
N=646 24% |
17%h (13%, 21%) |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패d | N=168 7% |
N=331 16% |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=152 8% |
N=315 33% |
|
| a SKYRIZI 1,200 mg을 0주, 4주 및 8주에 정맥 주입 b 층화 요인에 대해 조정된 Cochran-Mantel-Haenszel 방법을 기반으로 한 조정된 치료 차이 (95% CI) c mMS 기준: SFS ≤ 1 및 기준선보다 크지 않음, RBS = 0 및 ES ≤ 1 (취약성 없음) d 이전 실패는 다음 중 하나 이상에 대한 치료에 대한 부적절한 반응 또는 내약성을 포함합니다. 생물학적 치료제, Janus Kinase 억제제 (JAKi) 및/또는 스핑고신-1-인산 수용체 조절제 (S1PRM) e mMS 기준: 기준선에서 ≥ 2점 및 ≥ 30% 감소, 기준선에서 RBS ≥ 1 감소 또는 절대 RBS ≤ 1 f ES ≤ 1 (취약성 없음) g ES ≤ 1 (취약성 없음) 및 Geboes 점수 ≤ 3.1 (암호의 <5%에서 호중구 침윤, 암호 파괴 없음 및 침식, 궤양 또는 과립 조직 없음을 나타냄) h p < 0.001 |
|||
UC-1은 12주째의 조직학적 내시경 점막 개선과 질병 진행 및 장기 결과의 관계를 평가하도록 설계되지 않았습니다.
직장 출혈 및 변비 빈도 하위 점수
위약과 비교하여 SKYRIZI로 치료받은 피험자에서 직장 출혈 및 변비 빈도 하위 점수의 감소는 4주 만에 관찰되었습니다.
내시경 평가
내시경 완화는 ES 0으로 정의되었습니다. 12주째에 위약과 비교하여 SKYRIZI로 치료받은 피험자에서 내시경 완화를 달성한 비율이 더 높았습니다(11% 대 3%).
장 긴급성
위약과 비교하여 SKYRIZI 1,200mg 유도 요법으로 치료받은 피험자에서 12주째에 장 긴급성이 없는 비율이 더 높았습니다(44% 대 27%).
피로
UC-1에서 SKYRIZI로 치료받은 피험자는 위약으로 치료받은 피험자와 비교하여 12주째에 FACIT-F 점수의 기준선 변화로 평가한 피로에서 임상적으로 의미 있는 개선을 경험했습니다. 12주 유도 후 피로를 개선하는 SKYRIZI의 효과는 확립되지 않았습니다.
기타 UC 증상
12주째에 야간 배변이 없는 피험자의 비율은 위약과 비교하여 SKYRIZI로 치료받은 피험자에서 더 높았습니다(67% 대 43%).
유지연구UC-2
유지 연구(UC-2; NCT03398135)는 연구 UC-1 또는 UC-3에서 12주 동안 1,200mg 요법을 포함한 3가지 SKYRIZI 유도 요법 중 하나를 받은 547명의 피험자를 평가했으며 12주 후 mMS에 따른 임상적 반응을 보였습니다. 피험자는 12주째에 피하(SC) SKYRIZI 180mg 또는 SKYRIZI 360mg 또는 위약을 무작위로 받았고 그 후 최대 52주 동안 8주마다 받았습니다.
UC-2에서 피험자의 75%(411/547)는 하나 이상의 생물학적 제제, JAKi 또는 S1PRM 치료에 실패(반응 불충분 또는 내약성)했습니다. 이 411명의 피험자 중 407명(99%)은 생물학적 제제에 실패했고 78명(19%)은 JAK 억제제에 실패했습니다.
UC-2의 주요 종료점은 52주째에 mMS를 사용한 임상적 완화였습니다( 표 14 참조). 주요 이차 종료점에는 코르티코스테로이드 없는 임상적 완화, 내시경 개선 및 조직학적 내시경 점막 개선이 포함되었습니다( 표 14 참조).
| 종료점 | 위약a | SKYRIZI 180mg SC 주사b |
SKYRIZI 360mg SC 주사c |
| 임상적 완화d | |||
| 전체 모집단 | N=182 26% |
N=179 45% |
N=186 41% |
| 위약 대비 치료 차이e (95% CI) | 20% j [11%, 29%] |
16% j [7%, 25%] |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패f | N=138 24% |
N=134 41% |
N=139 32% |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=44 32% |
N=45 58% |
N=47 67% |
| 코르티코스테로이드 없는 임상적 완화g | |||
| 전체 모집단 | N=182 26% |
N=179 45% |
N=186 40% |
| 위약 대비 치료 차이e (95% CI) | 20% j [11%, 29%] |
16%j [7%, 25%] |
|
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패f | N=138 24% |
N=134 40% |
N=139 32% |
| 이전 생물학적 제제, JAKi 또는 S1PRM 실패 없음 | N=44 32% |
N=45 58% |
N=47 64% |
| 내시경 개선h | |||
| 전체 모집단 | N=182 31% |
N=179 51% |
N=186 48% |
| 위약 대비 치료 차이e (95% CI) | 20% j [11%, 30%] |
18% j [8%, 27%] |
|
| Prior biologic, JAKi, or S1PRM failuref | N=138 30% |
N=134 48% |
N=139 39% |
| Without prior biologic, JAKi, or S1PRM failure | N=44 34% |
N=45 60% |
N=47 76% |
| Histologic Endoscopic Mucosal Improvementi | |||
| Total Population | N=182 24% |
N=179 43% |
N=186 42% |
| Treatment Difference vs Placeboe (95% CI) | 20% j [11%, 29%] |
20% j [11%, 29%] |
|
| Prior biologic, JAKi, or S1PRM failuref | N=138 22% |
N=134 39% |
N=139 33% |
| Without prior biologic, JAKi, or S1PRM failure | N=44 30% |
N=45 55% |
N=47 69% |
| a The placebo group consisted of subjects who were in response to 12 weeks of SKYRIZI induction and were randomized to receive placebo at the start of maintenance therapy. b SKYRIZI 180 mg at Week 12 and every 8 weeks thereafter for up to an additional 52 weeks c SKYRIZI 360 mg at Week 12 and every 8 weeks thereafter for up to an additional 52 weeks d Per mMS: SFS ≤ 1 and not greater than baseline, RBS = 0, and ES ≤ 1 without friability e Adjusted treatment difference (95% CI) based on Cochran-Mantel-Haenszel method adjusted for stratification factors f Prior failure includes inadequate response or intolerance to treatment with one or more of the following: biologic therapies, Janus Kinase inhibitors (JAKi), and/or sphingosine-1-phosphate receptor modulators (S1PRM) g Clinical remission per mMS at Week 52 and corticosteroid-free for ≥90 days h ES ≤ 1 without the evidence of friability i ES ≤ 1without the evidence of friability and Geboes score ≤ 3.1 (indicating neutrophil infiltration in <5% of crypts, no crypt destruction and no erosions, ulcerations or granulation tissue) j p < 0.001 |
|||
Endoscopic Assessment
Endoscopic remission was defined as ES of 0. In UC-2, a greater proportion of subjects treated with SKYRIZI 180 mg and SKYRIZI 360 mg compared to placebo achieved endoscopic remission at Week 52 (23% and 24% vs 15%).
16 제공/보관 및 취급 방법
제품 정보
SKYRIZI (risankizumab-rzaa) 주사제는 다음과 같은 농도로 제공됩니다.
| 농도 | 포장 단위 | NDC |
| 피하 주사 | ||
| 150 mg/mL 단회용 펜 | 1개들이 상자 | 0074-2100-01 |
| 90 mg/mL 단회용 미리 채워진 주사기 | 2개들이 상자 | 0074-7040-02 |
| 4개들이 상자 | 0074-7042-04 | |
| 150 mg/mL 단회용 미리 채워진 주사기 | 1개들이 상자 | 0074-1050-01 |
| 180 mg/1.2 mL (150 mg/mL) 단회용 미리 채워진 카트리지 (자가 주사기 포함) | 키트 | 0074-1065-01 |
| 360 mg/2.4 mL (150 mg/mL) 단회용 미리 채워진 카트리지 (자가 주사기 포함) | 키트 | 0074-1070-01 |
| 정맥 주입 | ||
| 600 mg/10 mL (60 mg/mL) 단회용 바이알 | 1개들이 상자 | 0074-5015-01 |
피하 주사
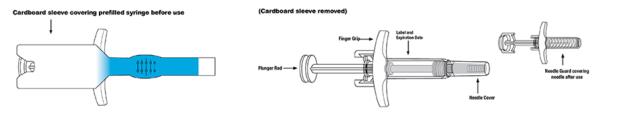
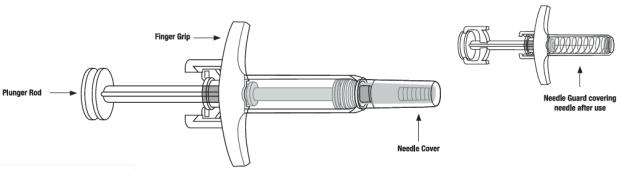
SKYRIZI 150 mg/mL 미리 채워진 주사기 또는 미리 채워진 펜은 멸균된 방부제가 없는 무색에서 황색, 투명에서 약간 불투명한 용액을 함유하고 있습니다. 각 미리 채워진 주사기 또는 미리 채워진 펜은 고정된 27 게이지 ½ 인치 바늘과 바늘 보호 장치가 있는 1 mL 유리 주사기로 구성됩니다.
SKYRIZI 90 mg/mL 미리 채워진 주사기는 멸균된 방부제가 없는 무색에서 약간 황색, 투명에서 약간 불투명한 용액입니다. 각 미리 채워진 주사기는 고정된 29 게이지 ½ 인치 바늘과 바늘 보호 장치가 있는 1 mL 유리 주사기로 구성됩니다.
SKYRIZI 180 mg/1.2 mL (150 mg/mL) 사이클릭 올레핀 폴리머 미리 채워진 카트리지는 격막과 캡이 있으며, 멸균된 방부제가 없는 무색에서 황색, 투명에서 약간 불투명한 용액을 함유하고 있으며, 제공된 자가 주사기 투여 장치와 함께 사용됩니다.
SKYRIZI 360 mg/2.4 mL (150 mg/mL) 사이클릭 올레핀 폴리머 미리 채워진 카트리지는 격막과 캡이 있으며, 멸균된 방부제가 없는 무색에서 황색, 투명에서 약간 불투명한 용액을 함유하고 있으며, 제공된 자가 주사기 투여 장치와 함께 사용됩니다.
정맥 주입
SKYRIZI 600 mg/10 mL (60 mg/mL) 바이알은 멸균된 방부제가 없는 무색에서 약간 황색, 투명에서 약간 불투명한 용액을 함유하고 있습니다. 각 유리 바이알은 마개와 파란색 플립 캡으로 닫혀 있습니다.
보관 및 취급
- 냉장 보관 (2°C to 8°C).
- 냉동하지 마십시오.
- 흔들지 마십시오.
- 빛으로부터 보호하기 위해 원래 상자에 보관하십시오.
- 천연 고무 라텍스로 만들어지지 않았습니다.
17 환자 상담 정보
환자 및/또는 간병인에게 FDA 승인을 받은 환자 라벨링( 복약 안내 및 사용 지침)을 읽도록 권고하십시오.
과민 반응
심각한 과민 반응의 증상이 나타나면 SKYRIZI 사용을 중단하고 즉시 치료를 받도록 환자에게 알리십시오. [경고 및 주의사항(5.1) 참조].
감염
SKYRIZI는 감염에 대항하는 면역 체계의 능력을 저하시킬 수 있음을 환자에게 알리십시오. 환자에게 이전 감염 이력을 의료 서비스 제공자에게 알리고 감염 증상이 나타나면 의료 서비스 제공자에게 연락하는 것의 중요성을 알리십시오. [경고 및 주의사항(5.2) 참조].
염증성 장 질환 치료 시 간독성
SKYRIZI는 특히 치료 첫 12주 동안 간 손상을 유발할 수 있음을 환자에게 알리십시오. 간 기능 장애를 시사하는 증상(예: 원인 불명의 발진, 메스꺼움, 구토, 복통, 피로, 식욕 부진 또는 황달 및/또는 짙은 소변)이 나타나면 즉시 치료를 받도록 환자에게 알리십시오. [경고 및 주의사항(5.4) 참조].
백신 접종
SKYRIZI 치료 중 및 SKYRIZI 치료 직전 또는 직후에는 생백신 접종이 권장되지 않음을 환자에게 알리십시오. 면역 체계와 상호 작용하는 약물은 생백신 접종 후 감염 위험을 증가시킬 수 있습니다. 잠재적인 백신 접종 전에 SKYRIZI를 복용하고 있음을 의료 서비스 종사자에게 알리도록 환자에게 알리십시오. [경고 및 주의사항 (5.5)] 참조.
투여 지침
환자 또는 간병인에게 투여 부위 선택 및 적절한 피하 주사 기술을 포함하여 SKYRIZI의 준비 및 투여에 대한 교육을 위해 자격을 갖춘 의료 서비스 전문가의 감독과 지도 하에 첫 번째 자가 주사 용량을 투여하도록 알리십시오. [사용 지침] 참조.
SKYRIZI 90mg/mL를 사용하는 경우, 환자 또는 간병인에게 크론병에 대한 전체 180mg 유지 용량을 위해 90mg 용량의 일회용 주사기를 두 개 투여하거나 전체 360mg 유지 용량을 위해 90mg 용량의 일회용 주사기를 네 개 투여하도록 알리십시오. [사용 지침] 참조.
환자 또는 간병인에게 펜 또는 주사기 폐기 기술을 알리십시오. [사용 지침] 참조.
임신
임신 중 SKYRIZI에 노출된 여성의 임신 결과를 모니터링하는 임신 등록소가 있음을 환자에게 알리십시오. [특정 환자군에서의 사용 (8.1)] 참조.
제조:
AbbVie Inc.
North Chicago, IL 60064, USA
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
© 2019-2024 AbbVie Inc.
20086179 R2 6/2024
약물 안내문
| 약물 안내 SKYRIZI® (스카이리지) (리스안키주맙-르자아) 주사제, 피하 또는 정맥 주사용 |
|||||||
| SKYRIZI에 대해 알아야 할 가장 중요한 정보는 무엇입니까? SKYRIZI는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다. 심각한 알레르기 반응. 심각한 알레르기 반응의 증상이 나타나면 SKYRIZI 사용을 중단하고 즉시 응급 의료 도움을 받으십시오. |
|||||||
| ● 실신, 현기증, 어지러움(저혈압) | ● 가슴 답답함 | ||||||
| ● 얼굴, 눈꺼풀, 입술, 입, 혀 또는 목의 부기 | ● 피부 발진, 두드러기 | ||||||
| ● 호흡 곤란 또는 목이 조이는 느낌 | ● 가려움증 | ||||||
| 감염. SKYRIZI는 면역 체계의 감염과 싸우는 능력을 떨어뜨리고 감염 위험을 높일 수 있습니다. 의료 서비스 제공자는 SKYRIZI 치료를 시작하기 전에 감염과 결핵(TB)을 검사해야 하며, TB 병력이 있거나 활동성 TB가 있는 경우 SKYRIZI 치료를 시작하기 전에 TB를 치료할 수 있습니다. 의료 서비스 제공자는 SKYRIZI 치료 중 및 치료 후에 TB의 징후와 증상을 주의 깊게 관찰해야 합니다. 감염이 있거나 감염 증상이 나타나면 즉시 의료 서비스 제공자에게 알리십시오. 여기에는 다음이 포함됩니다. | |||||||
| ● 발열, 땀, 오한 | ● 근육통 | ● 체중 감소 | |||||
| ● 기침 | ● 따뜻하고 붉거나 통증이 있는 피부 또는 몸의 궤양(건선과 다름) | ● 설사 또는 복통 | |||||
| ● 호흡 곤란 | ● 소변을 볼 때 따끔거림 또는 평소보다 자주 소변을 보는 경우 | ||||||
| ● 가래(담)에 피가 섞여 나오는 경우 | |||||||
| 부작용에 대한 자세한 내용은 “SKYRIZI의 가능한 부작용은 무엇입니까?” 를 참조하십시오. | |||||||
| SKYRIZI는 무엇입니까? SKYRIZI는 다음을 치료하는 처방약입니다.
|
|||||||
| 누가 SKYRIZI를 사용해서는 안 됩니까? 리스안키주맙-르자아 또는 SKYRIZI의 성분에 알레르기가 있는 경우 SKYRIZI를 사용하지 마십시오. SKYRIZI의 성분 목록은 이 약물 안내의 끝부분을 참조하십시오. |
|||||||
SKYRIZI를 사용하기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민 및 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. |
|||||||
| SKYRIZI는 어떻게 사용해야 합니까? SKYRIZI를 준비하고 주입하는 방법과 사용한 SKYRIZI 사전 충전 펜, 사전 충전 주사기 또는 신체 부착형 주입기가 있는 사전 충전 카트리지를 올바르게 버리는 방법에 대한 자세한 내용은 SKYRIZI와 함께 제공되는 “사용 지침”을 참조하십시오.
플라크 건선 또는 건선성 관절염이 있는 성인은 사전 충전 펜 또는 사전 충전 주사기를 사용하여 피부 아래(피하 주사)로 SKYRIZI를 주입받습니다. |
|||||||
| SKYRIZI의 가능한 부작용은 무엇입니까? SKYRIZI는 다음을 포함한 심각한 부작용을 유발할 수 있습니다.:
|
|||||||
|
|
|
|
||||
| 크론병 및 궤양성 대장염 치료를 받은 사람들에게서 가장 흔한 부작용은 다음과 같습니다.: | |||||||
|
|
|
|||||
| 플라크 건선 및 건선성 관절염 치료를 받은 사람들에게서 가장 흔한 SKYRIZI 부작용은 다음과 같습니다. | |||||||
|
|
|
|||||
| 이것들은 SKYRIZI의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
|||||||
SKYRIZI는 어떻게 보관해야 합니까?
SKYRIZI 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. |
|||||||
| SKYRIZI의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 약물 안내서에 나열된 목적 이외의 목적으로 처방됩니다. 처방되지 않은 질환에 SKYRIZI를 사용하지 마십시오. 귀하와 동일한 증상이 있는 다른 사람에게 SKYRIZI를 주지 마십시오. 해를 입힐 수 있습니다. 약사 또는 의료 서비스 제공자에게 의료 전문가를 위해 작성된 SKYRIZI에 대한 정보를 문의할 수 있습니다. |
|||||||
| SKYRIZI의 성분은 무엇인가? 유효성분: 리사니주맙-rzaa. SKYRIZI 90mg/mL 불활성 성분들: 폴리소르베이트 20, 소듐 숙시네이트, 솔비톨, 숙신산 및 주사용 USP 물. SKYRIZI 150mg/mL, 180mg/1.2mL, 360mg/2.4mL 및 600mg/ 10 mL 불활성 성분들: 빙초산, 폴리소르베이트 20, 소듐 아세테이트, 트레할로스 및 주사용 USP 물. 제조사: AbbVie Inc., North Chicago, IL 60064, U.S.A. |
|||||||
| 이 약물 안내서는 미국 식품의약국으로부터 승인되었습니다 20086179 R2 |
개정: 6/2024 | ||||||
사용 지침
사용 지침
SKYRIZI® (스카이리지) 펜
(리스안키주맙-르자아)
피하 주사용
첫 사용 전에 읽어보십시오
제품 정보는 약물 안내서를 참조하십시오.
SKYRIZI 펜 (리스안키주맙-르자아) 주사를 사용하기 전에 이 사용 지침을 읽어보십시오.
SKYRIZI를 사용하기 전에 의료 서비스 제공자로부터 SKYRIZI 주사 방법에 대한 교육을 받아야 합니다.
SKYRIZI 단회용 펜
중요 정보
- SKYRIZI는 냉장 보관하십시오(36°F~46°F [2°C~8°C]).
- 사용할 준비가 될 때까지 SKYRIZI를 원래 상자에 넣어 빛으로부터 보호하십시오.
-
주사하기 전에 SKYRIZI 상자를 냉장고에서 꺼내십시오. 상자를 실온에 두고 직사광선을 피하여 30분에서 90분 동안 그대로 두십시오.
- 검사 창의 액체는 투명에서 노란색으로 보이며 작은 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 액체가 변색되거나 흐리거나 조각이나 큰 입자가 포함되어 있는 경우 SKYRIZI를 사용하지 마십시오.
- 유효 기간(EXP)이 지난 경우 SKYRIZI를 사용하지 마십시오.
- 액체가 얼었더라도 해동된 경우에도 SKYRIZI를 사용하지 마십시오.
- SKYRIZI를 흔들지 마십시오.
- SKYRIZI 펜이 떨어지거나 손상된 경우 사용하지 마십시오.
-
SKYRIZI 상자의 천공이 찢어진 경우 사용하지 마십시오. 제품을 약국으로 반환하십시오.
- 주사 직전까지 짙은 회색 캡을 제거하지 마십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
SKYRIZI 주사 준비 
|
SKYRIZI 상자를 냉장고에서 꺼내십시오. 상자를 실온에 두고 직사광선을 피하여 30분에서 90분 동안 그대로 두십시오.
|

|
유효 기간(EXP)을 확인하십시오. 유효 기간이 지난 경우 펜을 사용하지 마십시오. 다음을 깨끗하고 평평한 표면에 놓으십시오.
손을 씻고 말리십시오. |
|
주사 부위를 선택하십시오.
알코올 솜으로 주사 부위를 원을 그리며 닦고 말리십시오.
|
|
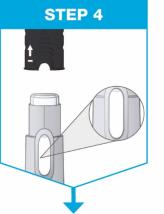
짙은 회색 캡이 위로 향하도록 펜을 잡으십시오.
검사 창을 통해 액체를 확인하십시오.
|
SKYRIZI 주사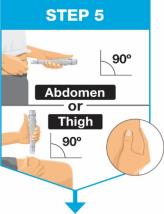
|
회색 손잡이를 손가락으로 잡고 펜을 잡으십시오. 펜을 흰색 바늘 덮개가 주사 부위를 향하고 녹색 활성화 버튼이 보이도록 돌리십시오. 주사 부위의 피부를 꼬집어 볼록하게 만들고 단단히 잡으십시오. 흰색 바늘 덮개를 볼록한 주사 부위에 직각(90도 각도)으로 놓으십시오. |
|
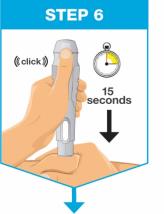
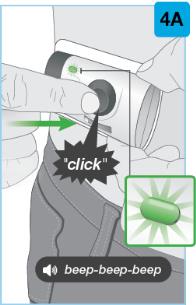
잡으세요 녹색 활성화 버튼과 검사 창이 보이도록 펜을 잡으세요. 누르고 계속 누르세요 펜을 아래로 돌출된 주사 부위에 대고 누르세요.
누르세요 녹색 활성화 버튼을 누르고 15초 동안 펜을 잡으세요.
|
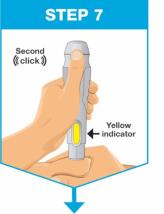
|
계속 누르세요 펜을 아래로 주사 부위에 대고 누르세요. 주사가 완료되면:
이것은 최대 15초가 걸립니다. |
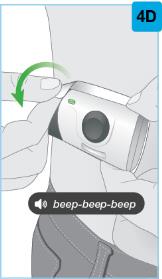
SKYRIZI 주사 후
|
주사가 완료되면 펜을 피부에서 천천히 똑바로 빼내세요. 흰색 바늘 슬리브가 바늘 끝을 덮고 다시 “클릭” 소리가 납니다. 주사를 완료한 후 주사 부위의 피부에 솜이나 거즈를 놓으세요.
|

|
버리세요 (폐기하세요) 사용한 펜을 FDA 승인 날카로운 물체 처리 용기에 사용 직후 바로 버리세요. ● 하지 마세요 사용한 펜을 가정 쓰레기통에 버리지 마세요. 지역 사회 지침에서 허용하는 경우를 제외합니다. ● 하지 마세요 날카로운 물체 처리 용기를 재활용하지 마세요. 진한 회색 캡, 알코올 솜, 솜이나 거즈, 포장은 가정 쓰레기통에 버릴 수 있습니다. 자세한 내용은 “사용한 SKYRIZI 사전 충전 펜 폐기”를 참조하세요. |
중요 정보
- SKYRIZI는 냉장고에 36°F~46°F(2°C~8°C)에서 보관하십시오.
- 사용할 준비가 될 때까지 SKYRIZI를 원래 포장 상자에 넣어 빛으로부터 보호하십시오.
- 주사하기 전에 SKYRIZI 포장 상자를 냉장고에서 꺼내십시오. 포장 상자를 실온에 두고 직사광선을 피하여 30분에서 90분 동안 그대로 두십시오.
- 검사 창의 액체는 투명에서 노란색으로 보이며 미세한 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 액체가 변색되었거나, 흐릿하거나, 조각 또는 큰 입자가 포함되어 있는 경우 SKYRIZI를 사용하지 마십시오.
- 유효 기간(EXP)이 지난 경우 SKYRIZI를 사용하지 마십시오.
- 냉동된 경우, 해동되었더라도 SKYRIZI를 사용하지 마십시오.
- SKYRIZI를 흔들지 마십시오.
- SKYRIZI 펜이 떨어지거나 손상된 경우 사용하지 마십시오.
- 포장 상자의 천공이 찢어진 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국으로 반환하십시오.
- 주사 직전까지 짙은 회색 캡을 제거하지 마십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
SKYRIZI 펜과 날카로운 물체 처리 용기를 어린이의 손이 닿지 않는 곳에 보관하십시오.
도움이 필요하거나 진행 방법을 모르는 경우 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
SKYRIZI 펜 사용에 대한 질문
Q.
SKYRIZI 주사 방법에 대한 도움이 필요하면 어떻게 해야 합니까?
A.
도움이 필요하면 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q.
짙은 회색 캡을 제거하고 녹색 활성화 버튼을 눌렀는데 주사가 시작되지 않습니다. 왜 그럴까요?
A.
흰색 바늘 슬리브가 주사 부위에 단단히 눌려 있지 않으면 녹색 활성화 버튼이 주사를 시작하지 않습니다.
Q.
주사가 완료되었는지 어떻게 알 수 있나요?
A.
펜이 두 번째 “클릭” 소리를 내거나 노란색 표시기가 검사 창을 채우면 주사가 완료됩니다. 이는 최대 15초가 걸립니다.
Q.
주사 부위에 액체가 몇 방울 이상 떨어지면 어떻게 해야 합니까?
A.
도움을 받으려면 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q.
주사 후 사용한 펜을 어떻게 처리해야 합니까?
A.
사용한 펜은 사용 직후 날카로운 물체 처리 용기에 버리십시오. 사용한 펜을 가정 쓰레기통에 버리지 마십시오.
www.SKYRIZI.com을 방문하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하여 추가 비용 없이 SKYRIZI 펜 처리를 위한 날카로운 물체 처리 용기를 신청할 수 있습니다.
(866) SKYRIZI 또는 (866) 759-7494로 전화하거나 www.SKYRIZI.com을 방문하여 주사에 대한 도움을 받으십시오.
 |
SKYRIZI 주사를 맞은 날짜를 달력에 표시하여 주사 시기를 기억하는 데 도움을 받으십시오. |
SKYRIZI 펜과 날카로운 물체 처리 용기를 어린이의 손이 닿지 않는 곳에 보관하십시오.
도움이 필요하거나 SKYRIZI 사용에 대한 질문이 있는 경우 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
사용한 SKYRIZI 사전 충전 펜 처리
FDA 승인 날카로운 물체 처리 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 강한 플라스틱으로 만들어진 경우,
- 날카로운 물체가 밖으로 나오지 않도록 꽉 끼는 구멍이 없는 뚜껑으로 닫을 수 있는 경우,
- 사용 중에 똑바로 서고 안정적인 경우,
- 누출 방지 기능이 있는 경우, 그리고
- 용기 내부에 위험한 폐기물이 있음을 경고하는 적절한 라벨이 붙어 있는 경우.
날카로운 물체 처리 용기가 거의 가득 차면 지역 사회의 날카로운 물체 처리 용기 폐기 지침을 따라야 합니다. 사용한 펜을 폐기하는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
날카로운 물체 안전 처리에 대한 자세한 내용과 거주하는 주의 날카로운 물체 처리에 대한 구체적인 정보는 FDA 웹사이트(www.fda.gov/safesharpsdisposal)를 참조하십시오.
사용한 날카로운 물체 처리 용기를 재활용하지 마십시오.
제조사: AbbVie Inc., North Chicago, IL 60064, U.S.A.
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
© 2019-2024 AbbVie Inc.
20086179
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2024년 6월
사용 지침
사용 지침
SKYRIZI® (스카이리지)
(리스안키주맙-르자아)
피하 주사, 피하 주사용
150 mg/mL 미리 채워진 주사기
첫 사용 전에 읽어보십시오
제품 정보는 약물 안내서를 참조하십시오.
SKYRIZI 단회용 미리 채워진 주사기
중요 정보
- 사용할 때까지 SKYRIZI를 원래 상자에 보관하여 빛으로부터 보호하십시오.
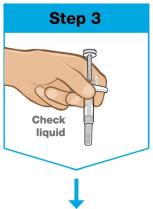
- 액체는 투명에서 노란색으로 보이며 미세한 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 사용하지 마십시오 SKYRIZI 액체가 변색되었거나, 흐리거나 조각 또는 큰 입자가 포함되어 있는 경우.
- 사용하지 마십시오 상자와 미리 채워진 주사기에 표시된 유효 기한 (EXP:)이 지난 경우.
- 사용하지 마십시오 액체가 냉동된 경우 (해동된 경우에도).
- 흔들지 마십시오 SKYRIZI.
- 사용하지 마십시오 미리 채워진 주사기가 떨어지거나 손상된 경우.
- 사용하지 마십시오 상자의 천공이 찢어진 경우. 제품을 약국으로 반환하십시오.
- 사용하지 마십시오 주사 바늘 덮개를 주사 직전까지 제거하지 마십시오.
SKYRIZI 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
SKYRIZI 미리 채워진 주사기를 사용하기 전에 전체 사용 지침을 읽어보십시오.
주사하기 전에
- 받으십시오 주사를 하기 전에 SKYRIZI 주사 방법에 대한 교육을 받으십시오. 도움이 필요하면 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
- 표시하십시오 미리 SKYRIZI를 복용해야 하는 날짜를 기억하기 위해 달력에 표시하십시오.
-
두십시오 상자를 실온에 두고 직사광선을 피하여 15분에서 30분 동안 따뜻하게 하십시오.
- 하지 마십시오 SKYRIZI를 실온에 도달하도록 할 때 주사기를 상자에서 꺼내십시오.
- 하지 마십시오 SKYRIZI를 다른 방법으로 따뜻하게 하십시오 (예: 하지 마십시오 전자레인지 또는 뜨거운 물에 데우십시오).
중요 정보
- 액체는 투명에서 노란색으로 보이며 미세한 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 사용하지 마십시오 SKYRIZI 액체가 변색되었거나, 흐리거나 조각 또는 큰 입자가 포함되어 있는 경우.
- 사용하지 마십시오 상자와 미리 채워진 주사기에 표시된 유효 기한 (EXP:)이 지난 경우.
- 사용하지 마십시오 주사기가 떨어지거나 손상된 경우.
- 사용하지 마십시오 상자의 천공이 찢어진 경우. 제품을 약국으로 반환하십시오.
보관 정보
- SKYRIZI를 냉장 보관하십시오. 36°F에서 46°F (2°C에서 8°C) 사이.
- 흔들지 마십시오 SKYRIZI.
- 사용할 때까지 SKYRIZI를 원래 상자에 보관하여 빛으로부터 보호하십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
- 사용하지 마십시오 액체가 냉동된 경우 (해동된 경우에도).
SKYRIZI 및 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
도움이 필요하거나 어떻게 진행해야 할지 모르는 경우 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
 |
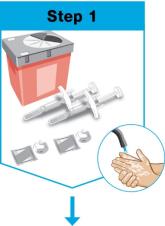
모으십시오 주사에 필요한 물품.
놓으십시오 다음을 깨끗하고 평평한 표면에 놓으십시오.
씻으십시오 손을 씻고 말리십시오. |
|
 |
제거하십시오 손잡이를 잡고 미리 채워진 주사기를 판지 슬리브에서 꺼내십시오. | |
|
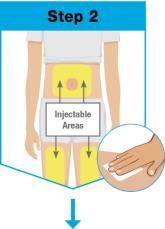
선택 주사 가능한 3곳 중 한 곳을 선택하세요:
닦아내세요 주사 전에 알코올 솜으로 주사 부위를 원을 그리며 닦아내세요.
|
|
 |
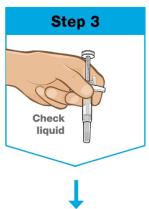
잡으세요 덮개가 덮인 바늘이 아래를 향하도록 미리 채워진 주사기를 잡으세요. 확인하세요 미리 채워진 주사기의 액체를 확인하세요.
|
|
|
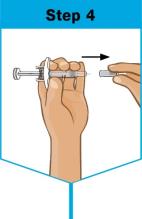
제거하세요 바늘 덮개를 제거하세요.
|
|
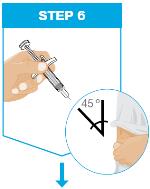 |
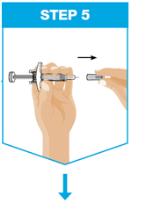
잡으세요 한 손으로 엄지와 검지로 미리 채워진 주사기 본체를 잡으세요. 집게 다른 손으로 깨끗이 닦은 피부 부위를 잡고 단단히 잡으세요. 삽입하세요 바늘을 약 45도 각도로 피부에 삽입하세요. 빠르고 짧은 동작으로 삽입하세요. 각도를 유지하세요. |
|
|
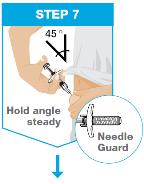
천천히 밀어넣으세요 액체가 모두 주입될 때까지 플런저 로드를 끝까지 천천히 밀어넣어 미리 채워진 주사기가 비도록 하세요. 당기세요 미리 채워진 주사기를 같은 각도로 유지하면서 바늘을 피부에서 빼내세요. 풀어주세요 플런저 로드를 풀고 바늘 전체가 바늘 보호대에 덮일 때까지 미리 채워진 주사기가 위로 올라가도록 하세요. 액체가 모두 주입되지 않으면 미리 채워진 주사기 바늘 보호대가 작동하지 않습니다.
|
|

|
넣으세요 사용한 미리 채워진 주사기를 FDA 승인 폐기 용기에 바로 버리세요.
자세한 내용은 “사용한 SKYRIZI 미리 채워진 주사기 폐기” 섹션을 참조하세요. |
SKYRIZI 사용에 대한 질문
| Q. SKYRIZI 주사 방법에 대한 도움이 필요하면 어떻게 해야 하나요? |
| A. 도움이 필요하면 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하세요. |
| Q.주사 후 사용한 미리 채워진 주사기를 어떻게 처리해야 하나요? |
| A. 사용한 미리 채워진 주사기를 가정 쓰레기통이 아닌 폐기 용기에 버리세요. www.SKYRIZI.com 으로 이동하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하여 SKYRIZI 주사기 폐기를 위한 폐기 용기를 추가 비용 없이 신청할 수 있습니다. |
|
|
| A. 미리 채워진 주사기가 비고, 플런저 로드가 끝까지 밀려 들어가고, 주사기 바늘 보호대가 작동하면 주사가 완료된 것입니다. |
사용한 SKYRIZI 프리필드 시린지 폐기
FDA 승인 sharps 폐기 용기가 없다면, 다음과 같은 가정용 용기를 사용할 수 있습니다:
- 내구성이 강한 플라스틱으로 만들어진,
- 날카로운 물체가 밖으로 나오지 않도록 꽉 끼는, 펑크 방지 뚜껑으로 닫을 수 있는,
- 사용 중에 똑바로 서고 안정적인,
- 누출 방지, 그리고
- 용기 내부의 위험한 폐기물을 경고하는 적절한 라벨이 붙어 있는.
sharps 폐기 용기가 거의 가득 차면, sharps 폐기 용기를 폐기하는 올바른 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 바늘과 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 sharps 폐기에 대한 자세한 내용과 거주하는 주의 sharps 폐기에 대한 구체적인 정보는 FDA 웹사이트(www.fda.gov/safesharpsdisposal)를 방문하십시오.
하지 마십시오 사용한 sharps 폐기 용기를 재활용하십시오.
제조사: AbbVie Inc., North Chicago, IL 60064, U.S.A.
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
© 2019-2024 AbbVie Inc.
20086082
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2024년 6월
사용 지침
사용 지침
SKYRIZI® (스카이-리지)
(risankizumab-rzaa)
피하 주사용
총 180mg/2mL 용량의 2 x 90mg/mL 용량의 일회용 프리필드 주사기
처음 사용하기 전에 읽어보십시오
제품 정보는 복약 안내서를 참조하십시오.
SKYRIZI 일회용 프리필드 주사기
SKYRIZI 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
중요 정보:
- 사용할 때까지 SKYRIZI를 원래 상자에 보관하여 빛으로부터 보호하십시오.
- 액체는 투명하거나 약간 노란색을 띠며 작은 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 액체의 색이 변했거나, 흐리거나 플레이크 또는 큰 입자가 포함된 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 및 프리필드 주사기에 표시된 유효 기간(EXP:)이 지난 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 액체가 얼었던 경우(해동된 경우에도) SKYRIZI를 사용하지 마십시오.
- 주사기를 흔들지 마십시오.
- 프리필드 주사기를 떨어뜨리거나 손상시킨 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 천공이 찢어진 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 주사를 맞기 직전까지 바늘 덮개를 제거하지 마십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
SKYRIZI 프리필드 주사기를 사용하기 전에 전체 사용 지침을 읽어보십시오
주사하기 전에:
- 주사를 맞기 전에 SKYRIZI를 주사하는 방법에 대한 교육을 받으십시오. 도움이 필요하면 의료 서비스 제공자에게 문의하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
- SKYRIZI를 언제 복용해야 하는지 기억하기 위해 미리 달력에 표시하십시오.
-
상자를 실온에서 직사광선을 피해 15~30분 동안 두어 데우십시오.
- SKYRIZI가 실온에 도달하도록 하는 동안 프리필드 주사기를 상자에서 꺼내지 마십시오.
- 다른 방법으로 SKYRIZI를 데우지 마십시오(예: 전자레인지나 뜨거운 물에 데우지 마십시오).
중요 정보:
- 액체는 투명하거나 약간 노란색을 띠며 작은 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 액체의 색이 변했거나, 흐리거나 플레이크 또는 큰 입자가 포함된 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 및 프리필드 주사기에 표시된 유효 기간 (EXP:)이 지난 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 프리필드 주사기를 떨어뜨리거나 손상시킨 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 천공이 찢어진 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
보관 정보:
- SKYRIZI는 냉장고에 36°F~46°F(2°C~8°C) 사이에 보관하십시오.
- SKYRIZI를 흔들지 마십시오.
- 사용할 때까지 SKYRIZI를 원래 상자에 보관하여 빛으로부터 보호하십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
- 액체가 얼었던 경우(해동된 경우에도) 사용하지 마십시오.
SKYRIZI 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
도움이 필요하거나 진행 방법을 모르는 경우 의료 서비스 제공자에게 문의하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
|
 주사에 필요한 물품을 모아 다음을 깨끗하고 평평한 곳에 놓으십시오.
손을 씻고 말리십시오. |
|
선택 3개의 주사 가능 부위에서:
|
|
포장된 바늘이 아래를 향하도록 사전 충전된 주사기를 쥐세요. 사전 충전된 주사기의 액체를 확인
|
|
바늘 커버를 제거
|
|
사전 충전된 주사기의 몸통을 엄지와 집게손가락 사이로 한 손에 잡으세요. 다른 손으로 닦은 피부 영역을 부드럽게 집어 단단히 잡아주세요. 바늘을 빠르고 짧은 동작으로 약 45도 각도로 피부에 삽입하세요. 각도를 일정하게 유지하세요. |
|
플런저 로드를 천천히 끝까지 밀어 액체가 모두 주사되고 주사기가 비워질 때까지. 바늘을 같은 각도로 유지한 채 피부에서 뽑아냅니다. 플런저 로드를 풀어주세요.
액체가 모두 주사되기 전에는 바늘 보호대가 자동으로 작동하지 않습니다.
|

|
2단계에서 6단계를 반복 두 번째 사전 충전된 주사기로 완전한 용량을 맞추세요.
|
|
사용한 사전 충전된 주사기를 사용 후 곧바로 FDA 승인된 날카로운 물체 폐기용기 안에 넣으세요.
더 자세한 정보나 FDA 승인된 날카로운 물체 폐기용기가 없으면 이 지시사항의 다른 면에 위치한 ” 사용된 SKYRIZI 사전 충전식 주사기 폐기 ” 섹션을 참조하세요. |
SKYRIZI 주사기 사용에 대한 질문
Q. 의료 전문가로부터 직접 교육을 받지 못했다면 어떻게 해야 합니까?
A. 도움이 필요하면 의료 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오. 받으십시오 주사를 투여하기 전에 SKYRIZI 주사 방법에 대한 교육을 받으십시오.
Q. 주사 후 사용한 두 개의 미리 채워진 주사기를 어떻게 처리해야 합니까?
A. 사용한 두 개의 미리 채워진 주사기를 모두 날카로운 물체 처리 용기에 버리십시오. 하지 마십시오 가정 쓰레기에 버리십시오. 자세한 내용은 “사용한 SKYRIZI 미리 채워진 주사기 폐기” 섹션을 참조하십시오.
www.SKYRIZI.com으로 이동하거나 (866) 759-7494로 전화하여 추가 비용 없이 SKYRIZI 미리 채워진 주사기 폐기를 위한 날카로운 물체 처리 용기를 신청할 수 있습니다.
Q. 주사가 완료되었는지 어떻게 알 수 있습니까?
A. 미리 채워진 주사기가 비어 있고, 플런저 로드가 완전히 밀려 들어가고, 주사기 바늘 보호대가 작동되면 주사가 완료된 것입니다.
사용한 SKYRIZI 미리 채워진 주사기 폐기
사용한 두 개의 미리 채워진 주사기를 모두 날카로운 물체 처리 용기에 버리십시오. 하지 마십시오 가정 쓰레기에 버리십시오.
FDA 승인을 받은 날카로운 물체 처리 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 내구성이 뛰어난 플라스틱으로 만들어졌으며,
- 날카로운 물체가 빠져나올 수 없도록 꽉 끼는, 천공 방지 뚜껑으로 닫을 수 있으며,
- 사용 중에 똑바로 서고 안정적이며,
- 누출 방지 기능이 있으며,
- 용기 내부에 위험한 폐기물이 있음을 경고하는 적절한 라벨이 붙어 있습니다.
날카로운 물체 처리 용기가 거의 가득 차면 지역 사회의 지침에 따라 날카로운 물체 처리 용기를 폐기하는 올바른 방법을 따라야 합니다. 사용한 바늘과 주사기를 폐기하는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 날카로운 물체 폐기에 대한 자세한 내용과 거주하는 주에서 날카로운 물체 폐기에 대한 구체적인 정보는 FDA 웹사이트 www.fda.gov/safesharpsdisposal를 방문하십시오.
하지 마십시오 사용한 날카로운 물체 처리 용기를 재활용하십시오.
제조사: AbbVie Inc., North Chicago, IL 60064, U.S.A.
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 상표입니다.
© 2019-2024 AbbVie Inc.
20078139
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 3/2024
사용 지침
사용 지침
SKYRIZI® (스카이-리-지)
(risankizumab-rzaa)
피하 주사용 주사제
총 360mg/4mL 용량의 90mg/mL 용량의 일회용 프리필드 시린지 4개
처음 사용하기 전에 읽어보십시오
제품 정보는 복약 안내서를 참조하십시오.
SKYRIZI 일회용 프리필드 시린지

SKYRIZI 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
중요 정보:
- 사용할 때까지 SKYRIZI를 원래 포장 상태로 보관하여 빛으로부터 보호하십시오.
- 용액은 투명하거나 약간 노란색을 띠어야 하며 작은 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 용액의 색이 변했거나, 흐리거나 플레이크 또는 큰 입자가 포함된 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 및 프리필드 시린지에 표시된 유효 기간(EXP:)이 지난 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 용액이 얼었던 경우(해동된 경우에도) SKYRIZI를 사용하지 마십시오.
- 시린지를 흔들지 마십시오.
- 프리필드 시린지를 떨어뜨리거나 손상시킨 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 천공이 찢어진 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 주사를 맞기 직전까지 바늘 덮개를 제거하지 마십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
SKYRIZI 프리필드 시린지를 사용하기 전에 전체 사용 지침을 읽어보십시오
주사하기 전에:
- 주사를 맞기 전에 SKYRIZI 주사 방법에 대한 교육을 받으십시오. 도움이 필요하면 담당 의료 전문가에게 문의하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
- SKYRIZI를 언제 투여해야 하는지 기억하기 위해 미리 달력에 표시해 두십시오.
-
상자를 실온에서 직사광선을 피해 15~30분 동안 두어 데우십시오.
- SKYRIZI가 실온에 도달하도록 하는 동안 프리필드 시린지를 상자에서 꺼내지 마십시오.
- 다른 방법으로 SKYRIZI를 데우지 마십시오(예: 전자레인지나 뜨거운 물에 데우지 마십시오).
중요 정보:
- 용액은 투명하거나 약간 노란색을 띠어야 하며 작은 흰색 또는 투명한 입자가 포함될 수 있습니다.
- 용액의 색이 변했거나, 흐리거나 플레이크 또는 큰 입자가 포함된 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 및 프리필드 시린지에 표시된 유효 기간 (EXP:)이 지난 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 프리필드 시린지를 떨어뜨리거나 손상시킨 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
- 상자 천공이 찢어진 경우 SKYRIZI를 사용하지 마십시오. 제품을 약국에 반품하십시오.
보관 정보:
- SKYRIZI는 냉장고에 2°C~8°C(36°F~46°F)에서 보관하십시오.
- SKYRIZI를 흔들지 마십시오.
- 사용할 때까지 SKYRIZI를 원래 포장 상태로 보관하여 빛으로부터 보호하십시오.
- SKYRIZI는 천연 고무 라텍스로 만들어지지 않았습니다.
- 용액이 얼었던 경우(해동된 경우에도) 사용하지 마십시오.
SKYRIZI 및 모든 의약품은 어린이의 손이 닿지 않는 곳에 보관하십시오.
도움이 필요하거나 진행 방법을 모르는 경우 담당 의료 전문가에게 문의하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
|
 주사에 필요한 물품을 모아 다음을 깨끗하고 평평한 표면에 놓으십시오.
손을 씻고 말리십시오. |
|
선택 3개의 주사 가능한 부위 중에서:
|
|
손으로 바늘이 덮인 채로 있는 주사기를 아래로 향하게 잡으세요, 그림과 같이. 프리필드 주사기 안의 액체를 확인하세요.
|
|
바늘커버를 제거하세요.
|
|
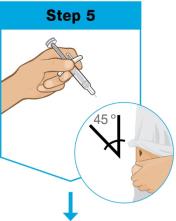
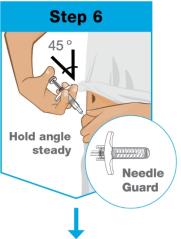
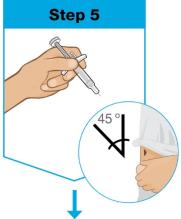
손으로 프리필드 주사기 몸통을 엄지와 검지 사이로 쥐세요. 부드럽게 붙잡고 다른 손으로 세척한 피부의 부위를 잡으세요. 빠르고 짧은 동작으로 바늘을 45도 각도로 피부에 꽂으세요. 각도를 유지하세요. |
|
천천히 밀어서 플런저 막대기를 끝까지 넣으세요. 액체가 모두 주입되고 주사기가 비어질 때까지. 동일한 각도로 바늘을 피부에서 빼세요. 플런저 막대기를 놓으세요.
모든 액체가 주사되었을 때에만 바늘 가드가 자동으로 작동됩니다.
|

|
2에서 6단계를 반복 각각 2번째, 3번째, 4번째 프리필드 주사기로 완전한 용량을 맞추세요.
|

|
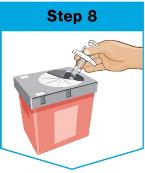
사용한 오용된 프리필드 주사기를 FDA 승인된 날카로운 물건 처리용 컨테이너에 사용 후 바로 넣으세요.
더 많은 정보 또는 FDA 승인된 날카로운 물건 처리용 컨테이너가 없을 경우에는 이 설명의 반대쪽 면에 있는 “사용된 SKYRIZI 프리필드 주사기 처리” 섹션을 참조해 주세요. |
SKYRIZI 주사기에 대한 질문
질문 의료 전문가로부터 직접 교육을 받지 못한 경우 어떻게 해야 합니까?
답변: 도움이 필요하면 의료 서비스 제공자에게 문의하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오. SKYRIZI를 주사하기 전에 주사 방법에 대한 교육을 받으십시오.
질문: 주사 후 사용한 4개의 사전 충전형 주사기는 모두 어떻게 해야 합니까?
답변: 사용한 4개의 사전 충전형 주사기는 모두 sharps 폐기 용기에 버리십시오(폐기). 일반 가정용 쓰레기와 함께 버리지 마십시오. 자세한 내용은 “사용한 SKYRIZI 사전 충전형 주사기 폐기” 섹션을 참조하십시오.
www.SKYRIZI.com을 방문하거나 (866) 759-7494로 전화하여 추가 비용 없이 SKYRIZI 사전 충전형 주사기 폐기를 위한 샤프스 용기를 받을 수 있습니다
질문: 주사가 완료되었는지 어떻게 알 수 있습니까?
답변: 사전 충전형 주사기가 비어 있고 플런저 로드가 끝까지 밀어 넣어졌으며 주사기 바늘 가드가 활성화되면 주사가 완료된 것입니다.
사용한 SKYRIZI 사전 충전형 주사기 폐기
사용한 4개의 사전 충전형 주사기는 모두 sharps 폐기 용기에 버리십시오(폐기). 일반 가정용 쓰레기와 함께 버리지 마십시오.
FDA 승인을 받은 샤프스 폐기 용기가 없는 경우 다음과 같은 가정용 용기를 사용할 수 있습니다.
- 고강도 플라스틱으로 만들어지고,
- 날카로운 물건이 빠져나올 수 없도록 꼭 맞는 천공 방지 뚜껑으로 닫을 수 있으며,
- 사용 중에 똑바로 세워져 있고 안정적이며,
- 누출 방지 기능이 있으며,
- 용기 내부에 유해 폐기물이 있음을 경고하는 라벨이 올바르게 부착되어 있어야 합니다.
샤프스 폐기 용기가 거의 가득 차면 해당 지역의 지침에 따라 샤프스 폐기 용기를 올바르게 폐기해야 합니다. 사용한 바늘과 주사기 폐기에 대한 주 또는 지역 법률이 있을 수 있습니다.
안전한 샤프스 폐기에 대한 자세한 내용과 거주하는 주의 샤프스 폐기에 대한 구체적인 정보는 FDA 웹사이트(www.fda.gov/safesharpsdisposal)를 참조하십시오.
사용한 샤프스 폐기 용기를 재활용하지 마십시오.
제조: AbbVie Inc., North Chicago, IL 60064, U.S.A.
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 상표입니다.
© 2019-2024 AbbVie Inc.
이 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정일: 2024년 3월
사용 지침
사용 지침
SKYRIZI® (스카이리지) 온바디 주사기
risankizumab-rzaa
피하 주사용, 피하 주사 전용
온바디 주사기 및 180 mg/1.2 mL 사전 충전 카트리지,
온바디 주사기 및 360 mg/2.4 mL 사전 충전 카트리지
SKYRIZI를 처음 사용하기 전과 재충전을 받을 때마다 이 사용 지침을 읽어보십시오. 새로운 정보가 있을 수 있습니다. 이 정보는 의료 상태 또는 치료에 대해 의료 서비스 제공자와 상담하는 것을 대신할 수 없습니다.
SKYRIZI 제품 정보에 대한 약물 안내서를 참조하십시오. 도움이 필요하면 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하거나 SKYRIZI.com 을 방문하십시오.
SKYRIZI를 주사하기 전에 알아야 할 중요한 정보
- 주사를 하기 전에 SKYRIZI 주사 방법에 대한 교육을 받으십시오.
- 흔들지 마십시오 SKYRIZI 상자, 온바디 주사기 또는 사전 충전 카트리지.
- 제거하지 마십시오 주사 준비가 될 때까지 상자에서 온바디 주사기 또는 사전 충전 카트리지를 꺼내지 마십시오.
- 기다리지 마십시오 청소한 사전 충전 카트리지를 온바디 주사기에 장착한 후 주사를 시작하기까지 5분 이상 기다리지 마십시오. 기다리면 약이 마르고 온바디 주사기가 작동하지 않습니다.
-
누르지 마십시오 온바디 주사기를 사전 충전 카트리지에 장착하고 피부에 놓고 주사할 준비가 될 때까지 시작 버튼을 누르지 마십시오.
◦ 시작 버튼은 1회만 누를 수 있습니다. - 사용하지 마십시오 온바디 주사기 또는 사전 충전 카트리지가 떨어지거나 손상된 경우.
- 재사용하지 마십시오 온바디 주사기 또는 사전 충전 카트리지. 온바디 주사기와 사전 충전 카트리지는 1회(단회 용량)만 사용할 수 있습니다.
- 닿게 하지 마십시오 온바디 주사기가 물이나 다른 액체에 닿지 않도록 하십시오.
- 이 단회 용량 온바디 주사기는 SKYRIZI 사전 충전 카트리지 전용으로 설계되었습니다.
- 주사 과정 동안 신체 활동은 제한해야 합니다. 걷기, 팔 뻗기, 구부리기와 같은 중간 강도의 신체 활동을 할 수 있습니다.
- 사용하지 마십시오 유효 기간(EXP:)이 지난 SKYRIZI.
- 사용하지 마십시오 액체가 변색되었거나, 흐리거나 조각 또는 큰 입자가 포함된 경우 사전 충전 카트리지. 액체는 투명에서 노란색으로 보여야 하며 작은 흰색 또는 투명 입자가 포함될 수 있습니다.
- 온바디 주사기와 사전 충전 카트리지는 천연 고무 라텍스로 만들어지지 않았습니다.
- SKYRIZI와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오.
보관 및 사용 준비
- 사용할 때까지 SKYRIZI를 빛과 물리적 손상으로부터 보호하기 위해 원래 상자에 보관하십시오.
- SKYRIZI를 냉장고에 36°F에서 46°F(2°C에서 8°C) 사이에 보관하십시오.
- 사용할 준비가 되면 상자를 냉장고에서 꺼내어 SKYRIZI가 따뜻해지도록 최소 45분에서 최대 90분 동안 실온에 두십시오.
- 온바디 주사기는 실온에 45분 미만으로 두면 작동하지 않습니다.
- 두지 마십시오 직사광선에 두지 마십시오.
- 제거하지 마십시오 SKYRIZI가 실온에 도달하는 동안 상자에서 온바디 주사기 또는 사전 충전 카트리지를 꺼내지 마십시오.
- 따뜻하게 하지 마십시오 SKYRIZI를 다른 방법으로 따뜻하게 하지 마십시오. 예를 들어, 따뜻하게 하지 마십시오 전자레인지 또는 뜨거운 물에 따뜻하게 하지 마십시오.
- 사용하지 마십시오 액체가 얼었을 경우(해동된 경우에도).
-
사용하지 마십시오 상자의 천공이 찢어진 경우 SKYRIZI. 제품을 약국으로 반환하십시오.
- 사용하지 마십시오 흰색 종이 트레이 씰이 없거나 손상된 경우 온바디 주사기와 사전 충전 카트리지를 사용하고 상자를 약국으로 반환하십시오.
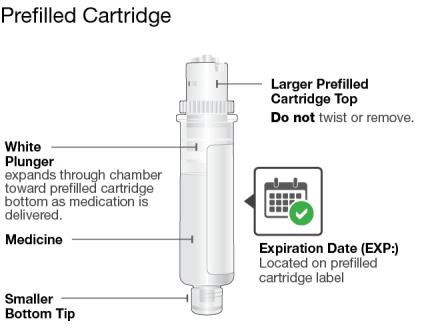
SKYRIZI 온바디 주사기와 사전 충전 카트리지 알아보기
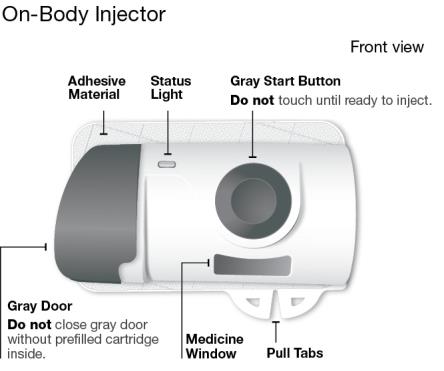
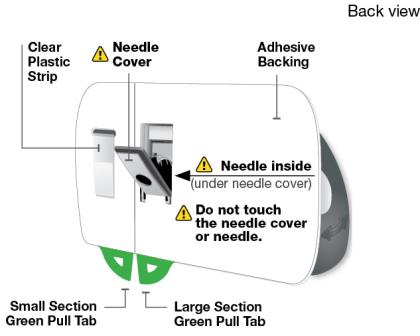
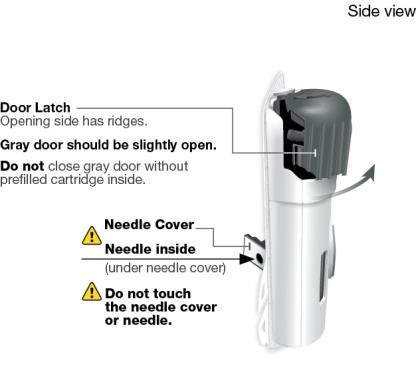
SKYRIZI를 사용하기 전에 전체 사용 지침을 읽어보십시오. 도움이 필요하거나 진행 방법을 모르는 경우 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하거나 www.SKYRIZI.com을 방문하십시오.
| 1단계 준비 | ||
| SKYRIZI를 사용하기 전에 SKYRIZI 주사 방법에 대한 교육을 받아야 합니다. | ||
|
유효 기간 확인
|
|
 |
최소 45분 대기
|
|
 |
상자를 열고 플라스틱 트레이를 제거하세요
|
|
 |
모든 공급품을 모으고 손을 씻습니다
|
|
|
흰 종이 트레이 실링을 제거합니다
|
|
|
플라스틱 뚜껑을 들어 올립니다
|
|
 |
온바디 주사기를 확인합니다
|
|
| 단계 2 온바디 주사기 설치 | ||
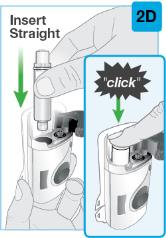
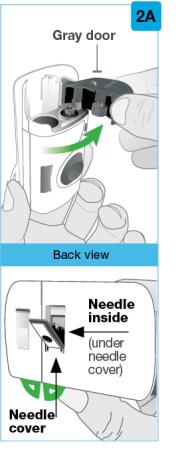 |
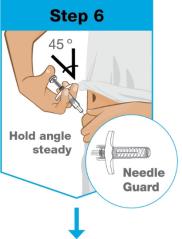
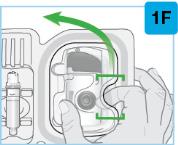
회색 문을 완전히 열어요 온바디 주사기의 뒤쪽에 있는 바늘 덮개나 바늘 을 만지지 마세요. 바늘은 바늘 덮개 뒤입니다. 온바디 주사기의 뒤쪽에 있는 바늘 덮개나 바늘 을 만지지 마세요. 바늘은 바늘 덮개 뒤입니다.
|
|
 |
사전 충전 카트리지를 검사하십시오
|
|
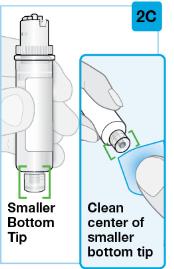 |
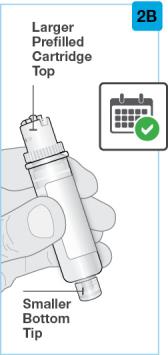
사전 충전 카트리지의 작은 아래쪽 끝을 닦으십시오
|
|
|
닦은 사전 충전 카트리지를 On-Body Injector에 장착하십시오
|
|
 |
사전 충전 카트리지를 On-Body Injector에 삽입한 후 5분 이내에 주사를 시작해야 합니다. 기다리면 약액이 마르고 On-Body Injector가 작동하지 않습니다. | |
 |
회색 문을 닫으십시오
|
|
| 3단계 주사 준비 | ||
| 주사가 완료될 때까지 휴대폰을 포함한 전자 기기를 On-Body Injector에서 최소 12인치(30cm) 떨어뜨려 두십시오. | ||
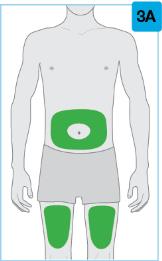 |
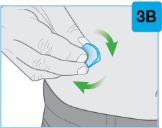
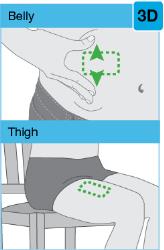
주사 부위를 선택하십시오 맨살에 단단하고 평평한 부위를 찾으십시오. 해당 부위가 옷으로 가려져 있지 않아야 합니다.
|
|
 |
주사 부위를 닦으십시오
|
|
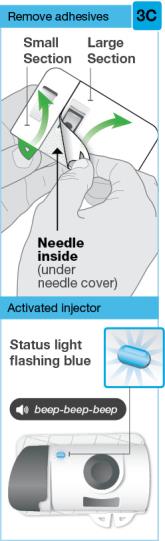 |
두 개의 탭을 모두 벗겨 접착제를 노출시킵니다.
|
|
 |
||
|
On-Body Injector를 배치할 준비를 합니다.
|
|
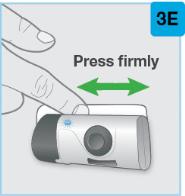 |
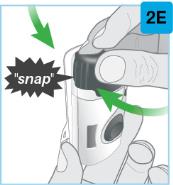
On-Body Injector를 피부에 붙입니다.
|
|
| 4단계 약물 주입 | ||
 |
주입 시작
|
|
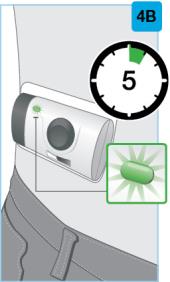 |
주입이 끝날 때까지 기다립니다.
주입 중:
|
|
 |
주입 완료
|
|
 |
On-Body Injector 제거
|
|
| 5단계 확인 및 폐기 | ||

|
On-Body Injector 확인
|
|
|
사용한 On-Body Injector를 사용 후 즉시 FDA 승인 샤프 폐기 용기에 넣습니다.
|
|

SKYRIZI를 사용하기 전에 사용 설명서를 모두 읽어보십시오. 도움이 필요하거나 진행 방법을 모르는 경우 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하거나 www.SKYRIZI.com을 방문하십시오.
자주 묻는 질문
Q. 주사기 몸체에 부착된 주사기 문을 열어 사전 충전된 카트리지를 삽입할 수 없으면 어떻게 해야 합니까?
A. 주사기 몸체에 부착된 주사기 문을 열려면 문의 왼쪽을 눌러 문 걸쇠를 풀어주십시오. 문을 열 수 없으면 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사기 몸체에 부착된 주사기를 피부에 붙이기 전에 회색 시작 버튼을 누르면 어떻게 해야 합니까?
A. 회색 시작 버튼은 한 번만 누를 수 있습니다. 회색 시작 버튼을 몸에 붙이기 전에 누르면 더 이상 사용할 수 없습니다. (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사기 몸체에 부착된 주사기를 몸에 붙인 후 녹색 풀 탭을 떼어내면 주사기 몸체에 부착된 주사기가 울리지 않고 파란색 상태 표시등이 깜박이지 않으면 어떻게 해야 합니까?
A. 작은 녹색 풀 탭을 떼어내면 투명 플라스틱 스트립이 제거되어 주사기 몸체에 부착된 주사기가 활성화됩니다. 접착제가 붙은 종이를 모두 제거했는데도 주사기 몸체에 부착된 주사기가 켜지지 않으면 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사기 몸체에 부착된 주사기를 피부에 붙인 후 지시에 따라 시작 버튼을 누르면 표시등이 파란색으로 유지되면 어떻게 해야 합니까?
A. 회색 시작 버튼을 다시 눌러주십시오. 상태 표시등이 파란색으로 유지되거나 빨간색으로 깜박이면 주사기 몸체에 부착된 주사기를 피부에서 조심스럽게 떼어내십시오. 주사기 몸체에 부착된 주사기를 다시 붙이지 마십시오. (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사기 몸체에 부착된 주사기를 착용하는 동안 상태 표시등이 빨간색으로 깜박이고 울리면 어떻게 해야 합니까?
A. 상태 표시등이 계속 빨간색으로 깜박이고 울리면 주사기 몸체에 부착된 주사기를 사용하지 마십시오. 주사기 몸체에 부착된 주사기가 몸에 붙어 있으면 조심스럽게 떼어내십시오. (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사 중에 주사기 몸체에 부착된 주사기가 몸에서 떨어지면 어떻게 해야 합니까?
A. 약물이 채워진 주사기 몸체에 부착된 주사기는 더 이상 사용할 수 없습니다. 몸에 다시 붙이지 마십시오. (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
Q. 주사가 완료되었는지 어떻게 알 수 있습니까?
A. 주사기 몸체에 부착된 주사기가 울리고 흰색 플런저가 약물 창을 완전히 채우고 상태 표시등이 녹색 깜박임에서 녹색 고정으로 바뀌면 주사가 완료됩니다.
Q. 주사 부위에 액체가 몇 방울 이상 떨어지면 어떻게 해야 합니까?
A. 도움이 필요하면 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오 .
Q. 주사 후 사용한 주사기 몸체에 부착된 주사기를 어떻게 처리해야 합니까?
A. 사용한 주사기 몸체에 부착된 주사기를 FDA 승인 폐기 용기에 버리고 가정 쓰레기에는 버리지 마십시오. www.SKYRIZI.com을 방문하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하여 SKYRIZI 폐기용 폐기 용기를 추가 비용 없이 받을 수 있습니다.
Q. 의료 서비스 제공자로부터 직접 교육을 받지 못했으면 어떻게 해야 합니까?
A. 도움이 필요하면 의료 서비스 제공자에게 전화하거나 (866) SKYRIZI 또는 (866) 759-7494로 전화하십시오.
SKYRIZI 주사를 하기 전에 주사 방법에 대한 교육을 받으십시오.

SKYRIZI 폐기
- SKYRIZI를 사용한 후 즉시 FDA 승인 폐기 용기에 넣으십시오. SKYRIZI를 가정 쓰레기에 버리지 마십시오.
- FDA 승인 폐기 용기가 없으면 다음과 같은 가정용 용기를 사용할 수 있습니다.
◦ 내구성이 강한 플라스틱으로 만들어진,
◦ 날카로운 물건이 밖으로 나오지 않도록 꽉 끼는 구멍이 나지 않는 뚜껑으로 닫을 수 있는,
◦ 사용 중에 똑바로 서고 안정적인,
◦ 누출 방지,
◦ 용기 내부의 위험한 폐기물을 경고하는 적절한 라벨이 붙은.
폐기 용기가 거의 가득 차면 날카로운 폐기물 용기를 폐기하는 올바른 방법에 대한 지역 사회 지침을 따라야 합니다. 사용한 바늘과 주사기를 버리는 방법에 대한 주 또는 지역 법률이 있을 수 있습니다.
거주하는 주에서 안전한 날카로운 폐기물 폐기에 대한 자세한 내용은 FDA 웹사이트(www.fda.gov/safesharpsdisposal)를 방문하십시오.
하지 마십시오 사용한 날카로운 폐기물 용기를 재활용하십시오.
추가 정보
● BF 유형 적용 부품.
●  주사기 몸체에 부착된 주사기는 에틸렌 옥사이드를 사용하여 멸균되었습니다.
주사기 몸체에 부착된 주사기는 에틸렌 옥사이드를 사용하여 멸균되었습니다.
● 고도 범위는 -1,312피트에서 10,499피트(-400미터에서 3,200미터)입니다.
주사기 몸체에 부착된 주사기의 전자기 적합성(EMC)
주사기 몸체에 부착된 주사기는 가정용 또는 전문 의료 환경에서 사용하도록 설계되었으며 ISO 11608-1:2014 및 IEC 60601-1-2:2014를 준수합니다.
성능(누락되거나 불완전한 SKYRIZI 투여량)에 부정적인 영향을 미치지 않도록 다음과 같은 특정 제한 및 환경 내에서 주사기 몸체에 부착된 주사기를 사용하십시오.
- 주사가 완료될 때까지 휴대폰을 포함한 전자 기기를 On-Body Injector에서 최소 12인치(30cm) 떨어뜨려 두십시오. On-Body Injector를 12인치(30cm) 이내에서 작동할 때 전자 간섭의 잠재적 영향은 알려져 있지 않습니다.
- On-Body Injector를 자기 공명(MR) 환경(예: MRI)에 노출시키지 마십시오.
- 다른 전기 장비 근처에서 사용하는 경우 On-Body Injector와 다른 장비를 관찰하여 정상적으로 작동하는지 확인하십시오.
방출
| 방출 테스트 이름 | 테스트 수준 |
| 방사된 무선 주파수 전자기장 | CISPR 11, class B 기준 |
전자기 내성
| 테스트 이름 | 테스트 수준 |
| 정전기 방전(ESD) | ± 8 kV 접촉 ± 2 kV, ± 4 kV, ± 8 kV, ± 15 kV 공기 |
| 무선 주파수 전자기장 | 10 V/m 80 MHz – 2.7 GHz |
| 전력 주파수 50 Hz 자기장 | 30 A/m |
RF 무선 통신 장비에 대한 인클로저 포트 내성은 IEC 60601-1-2:2014를 준수합니다.
기호 용어
| 기호 | 기호 설명 |
 |
건조 보관 |
 |
에틸렌 옥사이드로 멸균 |
 |
재사용 금지 |
 |
포장이 손상된 경우 사용하지 마시고 사용 설명서를 참조하십시오. |
 |
제조일 |
 |
배치 코드 |
 |
카탈로그 번호 |
 |
일련 번호 |
 |
사용 설명서/소책자 참조 |
 |
BF 유형 적용 부품 |
 |
MR 안전하지 않음 |
제조사:
AbbVie Inc., North Chicago, IL 60064, U.S.A.
미국 라이선스 번호 1889
SKYRIZI®는 AbbVie Biotechnology Ltd.의 등록 상표입니다.
©2024 AbbVie Inc.
본 사용 설명서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 6/2024
20086115
주요 디스플레이 패널
NDC 0074-2100-01
1mL 단회용 프리필드 펜 1개
Skyrizi® PEN 150 mg/mL
리스안키주맙-르자아 주사제
피하 주사 전용
상자의 천공이 찢어진 경우 약국으로 반품하십시오.
약사 주의:
각 환자는
동봉된 약물 안내서를 받아야 합니다.
이 상자 전체는 하나의 단위로 제공됩니다.
약국 라벨 부착 공간
www.SKYRIZI.com
처방전에 의해서만
abbvie
주요 디스플레이 패널
NDC 0074-1050-01
1 mL 단회용 사전충전 주사기 하나
스카이리지i® 150 mg/mL
risankizumab-rzaa
주사용액
피하 주사용만
카톤의 천공 부분이 손상되었을 경우 약국으로 반환하세요.
이 전체 카톤은 하나의 단위로 제공됩니다.
약국용 라벨 변경 구역
www.SKYRIZI.com
전문의 처방전 없이는 구매 불가
Abbvie
주요 디스플레이 패널
NDC 0074-1070-01
1 x 2.4 mL Prefilled Cartridge
스카이리지i®
리산키주맙-rzaa 주사액
(360 mg/2.4 mL)
150 mg/mL
피하 주사용 만으로 사용
일회용량
SKYRIZI.com
의사의 처방전만 필요
abbvie
주요 디스플레이 패널
NDC 0074-5015-01
스카이리지i®
리산키주맙-rzaa 주사제
600 mg/10 mL
(60mg/mL)
정맥주입용만 가능
사용 전 희석 필요
10mL 단일용량 바이알 하나 –
미사용 부분 폐기
주의: 동봉된 약물 안내서를 각 환자에게 제공하시오.
전문의처방전만
abbvie
주요 디스플레이 패널
NDC 0074-1069-01
Skyrizi®
Risankizumab-rzaa
주사제
360 mg/2.4 mL
(150 mg/mL)
피하 주사용
1회 용량
전문의약품

주요 디스플레이 패널
NDC 0074-1069-02
판매용 아님
Skyrizi®
Risankizumab-rzaa
주사제
360 mg/2.4 mL
(150 mg/mL)
피하 주사 전용
1회용
처방전 의약품

주요 디스플레이 패널
NDC 0074-1065-01
1 x 1.2 mL 사전 충전 카트리지
1 체내 주사기
Skyrizi®
risankizumab-rzaa 주사제
(180 mg/1.2 mL)
150 mg/mL
피하 주사 전용
단회 용량
SKYRIZI.com
처방전에 의해서만 구입 가능
abbvie

주요 디스플레이 패널
NDC 0074-1066-01
Skyrizi®
Risankizumab-rzaa
Injection
180 mg/1.2 mL
(150 mg/mL)
피하 주사 전용
1회용
처방전 의약품

주요 디스플레이 패널
NDC 0074-1066-02
판매용 아님
Skyrizi®
Risankizumab-rzaa
주사제
180 mg/1.2 mL
(150 mg/mL)
피하 주사 전용
단회용
처방전 의약품

주요 디스플레이 패널
NDC 0074-7034-02
2 x 1 mL 사전 충전 주사기
Skyrizi®
risankizumab-rzaa 주사제
주사기당 90 mg/mL
2 x 90 mg/mL. 단회용 사전 충전
총 180 mg/2 mL 용량의 주사기
피하 주사 전용
의료 전문가 투여 전용
www. SKYRIZI.com
처방전에 의해서만 구입 가능
abbvie

주요 디스플레이 패널
NDC 0074-7032-90
1 mL 단회용 미리 채워진 주사기 1개
Skyrizi®
risankizumab-rzaa 주사제
90 mg/mL
피하 주사 전용
의료 전문가 투여 전용
www. SKYRIZI.com
처방전 의약품
abbvie
주요 디스플레이 패널
NDC 0074-7036-04
4 x 1 mL 사전 충전 주사기
Skyrizi®
risankizumab-rzaa 주사제
주사기당 90 mg/mL
4 x 90 mg/mL 단회용 사전 충전
총 360 mg/4 mL 용량의 주사기
피하 주사 전용
의료 전문가 투여 전용
약사 주의:
각 환자는 동봉된 약물 안내서를 받아야 합니다.
전체 카톤은 단위로 제공되어야 합니다.
카톤 밀봉이 깨지거나 누락된 경우 약국으로 반품하십시오.
www. SKYRIZI.com
전문의약품
Abbvie

주요 디스플레이 패널
NDC 0074-7032-01
Skyrizi® 90 mg/mL
risankizumab-rzaa
Injection
피하 주사용
의료 전문가만 투여 가능
350 MG 투여 시,
90 MG 주사기 4개가 필요합니다.
전체 용량을 위해 4개의 주사기를 모두 주사하십시오.
www.SKYRIZI.com
전문의약품
abbvie

NDC 0074-7040-02
90 mg/mL 단회용 미리 채워진 주사기 2개
Skyrizi®
주사기당 90 mg/mL
90 mg/mL 단회용 미리 채워진
총 180 mg/2 mL 용량의 주사기 2개
risankizumab-rzaa
Injection
피하 주사용
상자의 천공이 찢어진 경우 약국으로 반환하십시오.
약사 주의:
각 환자는
동봉된 약물 안내서를 받아야 합니다.
이 전체 상자는 하나의 단위로 제공됩니다.
180 MG 투여 시,
90 MG 주사기 2개가 필요합니다.
전체 용량을 위해 2개의 주사기를 주사하십시오.
www.SKYRIZI.com
전문의약품
abbvie





