의약품 제조업체: Janssen Pharmaceuticals, Inc. (Updated: 2024-09-18)
처방 정보의 주요 내용
INVEGA SUSTENNA
®(팔리페리돈 팔미테이트) 서방형 주사제, 근육 내 사용
미국 최초 승인: 2006년
경고: 치매 관련 정신병을 앓고 있는 노인 환자의 사망률 증가
전문의약품의 처방을 위한 전체 주의사항은 전체 처방 정보를 참조하십시오.
항정신병 약물로 치료받은 치매 관련 정신병을 앓고 있는 노인 환자는 사망 위험이 증가합니다. INVEGA SUSTENNA는 치매 관련 정신병 환자에게 사용하도록 승인되지 않았습니다. (
5.1)
최근 주요 변경 사항
| 복용량 및 투여 방법 (
2.7) |
9/2024 |
적응증 및 용법
복용량 및 투여 방법
- 근육 내 주사 전용. (
2.1)
- 각 주사는 의료 전문가만 투여해야 합니다. (
2.1)
- 삼각근 주사의 경우 체중이 90kg 미만인 환자에게는 1인치 23G 바늘을 사용하고 체중이 90kg 이상인 환자에게는 1½인치 22G 바늘을 사용합니다. 둔근 주사의 경우 환자의 체중에 관계없이 1½인치 22G 바늘을 사용합니다. (
2.1)
| 적응증 | 초기 투여량 (삼각근) |
월간 유지 관리 용량
* |
최대 월간 용량 | |
|---|---|---|---|---|
| 1일차 | 8일차 | |||
| 조현병 (
2.2) |
234mg | 156mg | 39–234mg | 234mg |
| 분열정동장애 (
2.2) |
234mg | 156mg | 78–234mg | 234mg |
- For patients naïve to oral paliperidone or oral or injectable risperidone, establish tolerability with oral paliperidone or oral risperidone prior to initiating treatment with INVEGA SUSTENNA. (
2.2)
- Missed Doses: To manage either a missed second initiation dose or a missed monthly maintenance dose, refer to the Full Prescribing Information. (
2.3)
-
Moderate to severe renal impairment (creatinine clearance < 50 mL/min):INVEGA SUSTENNA는 권장되지 않습니다. (
2.5)
-
Mild renal impairment (creatinine clearance ≥ 50 mL/min to < 80 mL/min):1일차에는 삼각근에 156mg을, 8일차에는 117mg을 투여합니다. 그 후 삼각근 또는 둔근에 투여하는 권장 월간 유지 용량인 78mg을 투여합니다. 39mg, 78mg, 117mg 또는 156mg의 용량 내에서 내약성 및/또는 효능에 따라 월간 유지 용량을 조정합니다. 경도 신장애 환자의 최대 월간 용량은 156mg입니다. (
2.5)
제형 및 함량
서방형 주사 현탁액: 39 mg/0.25 mL, 78 mg/0.5 mL, 117 mg/0.75 mL, 156 mg/mL 또는 234 mg/1.5 mL (
3)
금기
팔리페리돈, 리스페리돈 또는 INVEGA SUSTENNA의 부형제에 대해 알려진 과민증이 있는 경우. (
4)
경고 및 주의사항
-
치매 관련 정신병이 있는 노인 환자의 뇌혈관 이상 반응(뇌졸중 포함):뇌혈관 이상 반응(예: 뇌졸중, 일과성 허혈 발작) 발생률 증가. (
5.2)
-
악성 신경이완제 증후군:약물을 즉시 중단하고 면밀히 모니터링하여 관리합니다. (
5.3)
-
QT 연장:QT 간격을 증가시키는 약물과 함께 사용하거나 QT 간격 연장 위험 요인이 있는 환자에게 사용하지 마십시오. (
5.4)
-
지연성 운동이상증:임상적으로 적절한 경우 약물을 중단합니다. (
5.5)
-
대사 변화:고혈당증/당뇨병, 이상지질혈증 및 체중 증가를 모니터링합니다. (
5.6)
-
기립성 저혈압 및 실신:심박수와 혈압을 모니터링하고 심혈관 또는 뇌혈관 질환이 있거나 탈수 또는 실신 위험이 있는 환자에게 주의를 줍니다. (
5.7)
-
백혈구 감소증, 호중구 감소증 및 무과립구증:백혈구 수(WBC)가 이전부터 낮거나 백혈구 감소증 또는 호중구 감소증의 병력이 있는 환자에게는 전혈구 수(CBC)를 검사합니다. 다른 원인이 없는 상태에서 WBC가 임상적으로 유의미하게 감소하는 경우 INVEGA SUSTENNA의 중단을 고려합니다. (
5.9)
-
고프로락틴혈증:프롤락틴 수치 상승이 발생하며 만성 투여 중에 지속됩니다. (
5.10)
-
인지 및 운동 장애 가능성:기계를 작동할 때 주의하십시오. (
5.11)
-
발작:발작 병력이 있거나 발작 역치를 낮추는 질환이 있는 환자에게는 주의해서 사용하십시오. (
5.12)
이상 반응
가장 흔한 이상 반응(발생률 ≥ 5% 및 위약보다 최소 2배 이상 발생)은 주사 부위 반응, 졸음/진정, 어지러움, 정좌불능증 및 추체외로 장애였습니다. (
6)
의심되는 이상 반응을 보고하려면 Janssen Pharmaceuticals, Inc.(1-800-JANSSEN(1-800-526-7736)) 또는 FDA(1-800-FDA-1088 또는www.fda.gov/medwatch
에 문의하십시오.
약물 상호 작용
환자 복약 지도 정보 및 FDA 승인 환자 라벨링은 17을 참조하십시오.
개정일: 2024년 9월
목차
전문 정보: 목차*
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가
1 적응증 및 사용법
2 용법 및 용량
2.1 투여 지침
2.2 조현병 및 조현병적 장애
2.3 누락된 용량
2.4 리스페리돈 또는 경구용 팔리페리돈과의 병용
2.5 용량 조절
2.6 다른 항정신병제에서 전환
2.7 준비 및 투여 지침
3 제형 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 치매 관련 정신병이 있는 노인 환자의 사망률 증가
5.2 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 부작용, 뇌졸중 포함
5.3 악성 신경 이완 증후군
5.4 QT 연장
5.5 지연성 운동 장애
5.6 대사 변화
5.7 기립성 저혈압 및 실신
5.8 낙상
5.9 백혈구 감소증, 호중구 감소증 및 무과립구증
5.10 고프롤락틴혈증
5.11 인지 및 운동 장애 가능성
5.12 발작
5.13 연하 곤란
5.14 발기 부전
5.15 체온 조절 장애
6 부작용
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 INVEGA SUSTENNA와 임상적으로 중요한 상호 작용을 하는 약물
7.2 INVEGA SUSTENNA와 임상적으로 중요한 상호 작용을 하지 않는 약물
8 특정 환자군에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
8.6 신장애
8.7 간장애
8.8 파킨슨병 또는 루이 소체 치매 환자
9 약물 남용 및 의존성
9.1 마약류
9.2 남용
9.3 의존성
10 과량 복용
10.1 인체 경험
10.2 과량 복용 관리
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
14 임상 연구
14.1 조현병
14.2 조현병적 장애
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
제품에 대한 경고(BOXED WARNING)
경고: 치매 관련 정신병이 있는 노인 환자의 사망률 증가
항정신병 약물로 치료받는 치매 관련 정신병이 있는 노인 환자는 사망 위험이 증가합니다. INVEGA SUSTENNA는 치매 관련 정신병 환자에게 사용하도록 승인되지 않았습니다.
[참조
.
1 적응증 및 용법
INVEGA SUSTENNA (팔리페리돈 팔미테이트)는 다음 질환의 치료에 사용됩니다.
- 성인의 정신분열증
[참조
- 성인의 정신분열정동장애, 단독 요법 및 기분 안정제 또는 항우울제와 병용 요법
[참조
2 투여 및 관리
2.1 투여 지침
모든 주사는 의료 전문가만 투여해야 합니다.
제품 및 용기가 허용하는 경우, 비경구 제제는 투여 전에 이물질 및 변색 여부를 시각적으로 검사해야 합니다.
INVEGA SUSTENNA는 근육 내 투여 전용입니다. 다른 경로로 투여하지 마십시오. 혈관 내 주사를 우연히 맞지 않도록 주의하십시오. 용량을 단일 주사로 투여하십시오. 용량을 나누어 투여하지 마십시오. 델토이드근 또는 둔근에 천천히 깊이 주사하십시오.
INVEGA SUSTENNA는 INVEGA SUSTENNA 키트에 제공된 바늘만 사용하여 투여해야 합니다.
INVEGA SUSTENNA를 델토이드근에 투여할 때 권장되는 바늘 크기는 환자 체중에 따라 결정됩니다.
- 체중이 90kg 미만인 환자의 경우 1인치, 23게이지 바늘을 권장합니다.
- 체중이 90kg 이상인 환자의 경우 1½인치, 22게이지 바늘을 권장합니다.
델토이드근 주사는 두 델토이드근을 번갈아 가며 투여해야 합니다.
INVEGA SUSTENNA를 둔근에 투여할 때 권장되는 바늘 크기는 환자 체중에 관계없이 1½인치, 22게이지 바늘입니다.
둔근의 상외측 사분면에 투여하십시오. 둔근 주사는 두 둔근을 번갈아 가며 투여해야 합니다.
2.2 조현병 및 조현병적 장애
경구 팔리페리돈 또는 경구 또는 주사용 리스페리돈을 복용한 적이 없는 환자의 경우, INVEGA SUSTENNA 치료를 시작하기 전에 경구 팔리페리돈 또는 경구 리스페리돈으로 내약성을 확립하는 것이 좋습니다.
승인된 각 적응증에 대한 INVEGA SUSTENNA의 권장 용량은 표 1에 나와 있습니다. INVEGA SUSTENNA의 권장 시작 용량은 치료 1일에 234mg, 1주일 후 156mg이며, 모두 델토이드근에 투여합니다. 두 번째 시작 용량 투여 후, 월별 유지 용량은 델토이드근 또는 둔근에 투여할 수 있습니다.
| 적응증 | 시작 용량 (델토이드근) |
월별 유지 용량
* |
최대 월별 용량 | |
|---|---|---|---|---|
| 1일 | 8일 | |||
| 조현병 | 234mg | 156mg | 39–234mg | 234mg |
| 조현병적 장애 | 234mg | 156mg | 78–234mg | 234mg |
유지 용량 조절은 매월 이루어질 수 있습니다. 용량 조절을 할 때는 INVEGA SUSTENNA의 지속 방출 특성을 고려해야 합니다.
[
, 용량 조절의 완전한 효과는 몇 달 후에 나타날 수 있습니다.
2.3 누락된 용량
누락된 용량 방지
INVEGA SUSTENNA의 두 번째 시작 용량은 첫 번째 용량 투여 후 1주일 후에 투여하는 것이 좋습니다. 누락된 용량을 방지하기 위해 환자에게 두 번째 용량을 1주일 시점에서 4일 전 또는 후에 투여할 수 있습니다. 마찬가지로, 시작 요법 후 세 번째 및 그 이후의 주사는 매월 투여하는 것이 좋습니다. 매월 누락된 용량을 방지하기 위해 환자에게 매월 시점에서 7일 전 또는 후에 주사를 투여할 수 있습니다.
누락된 두 번째 시작 용량 관리
두 번째 INVEGA SUSTENNA 주사(1주일 ± 4일)의 목표 날짜를 놓친 경우, 환자의 첫 번째 주사 후 경과된 시간에 따라 권장 재시작이 달라집니다. 누락된 두 번째 시작 용량의 경우 표 2에 제공된 투약 지침을 따르십시오.
| 누락된 두 번째 시작 용량의 시기 | 투약 |
|---|---|
| 첫 번째 주사 후 4주 미만 | 가능한 한 빨리 델토이드 근육에 156mg의 두 번째 시작 용량을 투여하십시오.
|
| 첫 번째 주사 후 4주에서 7주 | 다음과 같은 방식으로 156mg의 두 번의 주사로 투약을 재개하십시오.
|
| 첫 번째 주사 후 7주 이상 | 권장 시작으로 투약을 재개하십시오.(
:
|
누락된 유지 용량 관리
누락된 유지 용량의 경우 표 3에 제공된 투약 지침을 따르십시오.
| 누락된 유지 용량의 시기 | 투약 |
|---|---|
| 마지막 주사 후 4주에서 6주 | 가능한 한 빨리 환자의 이전 안정화된 용량으로 정기적인 월별 투약을 재개하고, 그 후 매월 간격으로 주사를 투여하십시오. |
| 마지막 주사 후 6주에서 6개월 | 환자가 이전에 안정화된 용량(환자가 234mg 용량으로 안정화된 경우, 처음 2회 주사는 각각 156mg이어야 함)을 다음과 같은 방식으로 재개하십시오.
|
| 마지막 주사 후 6개월 이상 | 권장 시작으로 투약을 재개하십시오.(
:
|
2.4 리스페리돈 또는 경구용 팔리페리돈과의 병용
팔리페리돈은 리스페리돈의 주요 활성 대사체이므로, INVEGA SUSTENNA를 리스페리돈 또는 경구용 팔리페리돈과 장기간 병용 투여하는 경우 주의해야 합니다. INVEGA SUSTENNA를 다른 항정신병제와 병용 투여한 안전성 데이터는 제한적입니다.
2.5 용량 조절
신장애 환자
INVEGA SUSTENNA는 신장애 환자에서 체계적으로 연구되지 않았습니다.
[
.
경증 신장애 환자(크레아티닌 청소율 ≥ 50 mL/min ~ < 80 mL/min [Cockcroft-Gault 공식])의 경우, 치료 1일째 156mg, 8일째 117mg을 델토이드 근육에 투여하여 INVEGA SUSTENNA를 시작합니다. 델토이드 또는 둔근에 78mg의 권장 월별 유지 용량을 투여하여 계속합니다. 39mg, 78mg, 117mg 또는 156mg의 강도 내에서 내약성 및/또는 효능에 따라 월별 유지 용량을 조절합니다. 경증 신장애 환자의 경우 최대 월별 용량은 156mg입니다.
[
.
INVEGA SUSTENNA는 중등도 또는 중증 신장애 환자(크레아티닌 청소율 < 50 mL/min)에게 권장되지 않습니다.
[
.
2.6 다른 항정신병제에서 전환
조현병 또는 조현병적 장애 환자를 다른 항정신병제에서 INVEGA SUSTENNA로 전환하거나 다른 항정신병제와의 병용 투여에 대한 체계적으로 수집된 데이터는 없습니다.
경구용 항정신병제에서 전환
경구용 팔리페리돈 또는 경구용 또는 주사용 리스페리돈을 복용한 적이 없는 환자의 경우, INVEGA SUSTENNA 치료를 시작하기 전에 경구용 팔리페리돈 또는 경구용 리스페리돈으로 내약성을 확립해야 합니다.
INVEGA SUSTENNA 치료를 시작할 때 이전 경구용 항정신병제를 점차적으로 중단할 수 있습니다. INVEGA SUSTENNA의 권장 시작 용량은 치료 1일째 234mg, 1주일 후 156mg이며, 둘 다 델토이드 근육에 투여합니다.
[
. 이전에 INVEGA 서방형 정제의 다른 용량으로 안정화된 환자는 표 4에 표시된 것처럼 INVEGA SUSTENNA 월별 용량으로 유지 치료 중에 유사한 팔리페리돈 정상 상태 노출을 얻을 수 있습니다.
| 제형 | INVEGA 서방형 정제 | INVEGA SUSTENNA 주사제 |
|---|---|---|
| 투여 빈도 | 1일 1회 | 4주마다 1회 |
| 용량 (mg) | 12 | 234 |
| 9 | 156 | |
| 6 | 117 | |
| 3 | 39–78 |
장기 작용 주사제 항정신성 약물에서 전환
경구용 팔리페리돈 또는 경구용 또는 주사제 리스페리돈을 복용한 적이 없는 환자의 경우, INVEGA SUSTENNA 치료를 시작하기 전에 경구용 팔리페리돈 또는 경구용 리스페리돈으로 내약성을 확립해야 합니다.
장기 작용 주사제 항정신성 약물을 안정적으로 복용하고 있는 환자를 전환할 때는 다음 예정된 주사 대신 INVEGA SUSTENNA 치료를 시작합니다. 그런 다음 INVEGA SUSTENNA를 매월 간격으로 계속 투여해야 합니다. 2.2절에 설명된 1주일 시작 투여 요법은 필요하지 않습니다. 권장되는 매월 유지 용량은 위의
표 1을 참조하십시오. 이전 임상 내약성 및/또는 효능에 대한 병력에 따라 일부 환자는 사용 가능한 강도(39mg, 78mg, 117mg, 156mg 및 234mg) 내에서 더 낮거나 더 높은 유지 용량을 사용하면 도움이 될 수 있습니다. 39mg 강도는 장기간 정신병적 장애 연구에서 연구되지 않았습니다. 매월 유지 용량은 삼각근 또는 둔근에 투여할 수 있습니다.
[
참조]
.
INVEGA SUSTENNA를 중단하는 경우 지속 방출 특성을 고려해야 합니다. 다른 항정신성 약물에서 권장하는 것처럼 기존의 추체 외 증상(EPS) 약물의 지속 필요성을 주기적으로 재평가해야 합니다.
2.7 준비 및 투여 지침
각 주사는 의료 전문가만 투여해야 합니다.
키트에는 근육 내 주사를 위한 사전 충전 주사기와 2개의 안전 바늘(1 ½인치 22게이지 바늘과 1인치 23게이지 바늘)이 들어 있습니다.
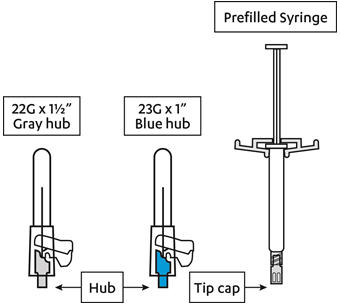
INVEGA SUSTENNA는 일회용입니다.
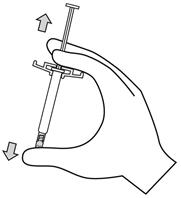
- 균일한 현탁액을 얻기 위해 주사기를 최소 10초 동안 강하게 흔듭니다.
- 적절한 바늘을 선택합니다.
삼각근 주사의 경우:- 환자의 체중이 90kg 미만인 경우 1인치
23게이지 바늘(
파란색허브가 있는 바늘)을 사용합니다.
- 환자의 체중이 90kg 이상인 경우 1 ½인치
22게이지 바늘(
회색허브가 있는 바늘)을 사용합니다.
둔근 주사의 경우:
환자의 체중에 관계없이 1 ½인치
22게이지 바늘(
회색허브가 있는 바늘)을 사용합니다.
- 환자의 체중이 90kg 미만인 경우 1인치
-
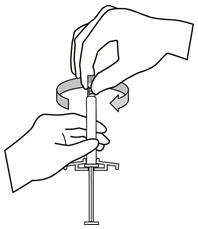
주사기의 팁 캡이 위로 향하도록 주사기를 잡습니다. 부드러운 비틀림 동작으로 고무 팁 캡을 제거합니다.
-
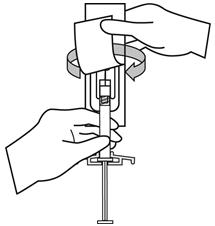
안전 바늘 주머니를 반쯤 벗겨냅니다. 플라스틱 벗겨내기 주머니를 사용하여 바늘 덮개를 잡습니다. 주사기를 위로 향하게 잡습니다. 바늘 허브에 균열이나 손상이 발생하지 않도록 부드러운 비틀림 동작으로 안전 바늘을 주사기에 부착합니다. 투여 전에 항상 손상이나 누출 징후를 확인하십시오.
- 바늘에서 덮개를 똑바로 잡아당겨 빼냅니다. 바늘이 주사기에서 느슨해질 수 있으므로 덮개를 비틀지 마십시오.
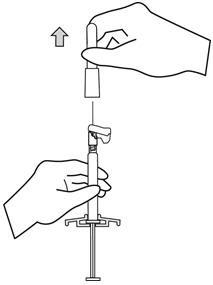
- 부착된 바늘이 있는 주사기를 수직으로 세워 공기를 제거합니다. 플런저 로드를 조심스럽게 앞으로 밀어 주사기를 공기 제거합니다.
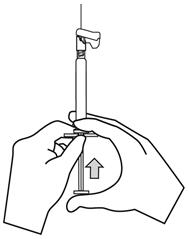
- 환자의 선택된 삼각근 또는 둔근에 천천히 전체 내용물을 근육 내로 깊숙이 주사합니다. 다른 경로로 투여하지 마십시오.
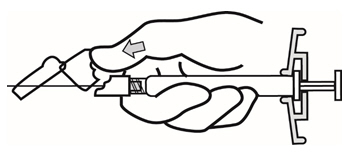
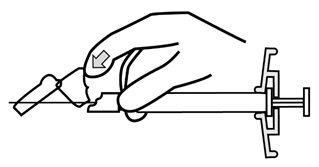
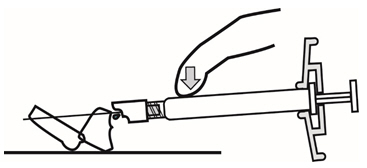
- 주사가 완료되면 한 손의 엄지 또는 손가락(h1, h2) 또는 평평한 표면(h3)을 사용하여 바늘 보호 시스템을 활성화합니다. ‘딸깍’ 소리가 들리면 바늘 보호 시스템이 완전히 활성화됩니다. 주사기를 바늘과 함께 적절히 폐기하십시오.
| h1 | |
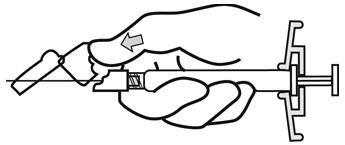 |
|
| h2 | |
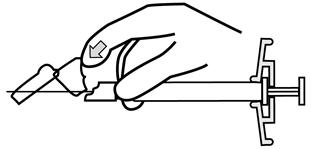 |
|
| h3 | |
 |
|
3 제형 및 함량
INVEGA SUSTENNA는 39 mg/0.25 mL, 78 mg/0.5 mL, 117 mg/0.75 mL, 156 mg/mL 및 234 mg/1.5 mL paliperidone palmitate를 함유하는 단회용 미리 채워진 주사기에 담긴 백색에서 거의 백색의 수성 장기 방출 주사용 현탁액으로 근육 주사용으로 제공됩니다.
4 금기사항
INVEGA SUSTENNA는 팔리페리돈 또는 리스페리돈 또는 INVEGA SUSTENNA 제제의 어떤 첨가제에 대해 알려진 과민증이 있는 환자에게 금기입니다. 리스페리돈으로 치료받은 환자와 팔리페리돈으로 치료받은 환자에서 아나필락시스 반응과 안지오에데마를 포함한 과민증 반응이 보고되었습니다. 팔리페리돈 팔미테이트는 팔리페리돈으로 전환되며, 이는 리스페리돈의 대사체입니다.
5 경고 및 주의사항
5.1 치매 관련 정신병을 앓고 있는 노인 환자의 사망률 증가
항정신병 약물로 치료받은 치매 관련 정신병을 앓고 있는 노인 환자는 사망 위험이 증가합니다. 17건의 위약 대조 임상시험(평균 지속 기간 10주)에 대한 분석 결과(대부분 비정형 항정신병 약물을 복용하는 환자 대상) 약물 치료를 받은 환자의 사망 위험이 위약 치료를 받은 환자보다 1.6~1.7배 높은 것으로 나타났습니다. 일반적인 10주간의 대조 임상시험 기간 동안 약물 치료를 받은 환자의 사망률은 약 4.5%였던 반면, 위약군의 사망률은 약 2.6%였습니다. 사망 원인은 다양했지만 대부분 심혈관계(예: 심부전, 급사) 또는 감염(예: 폐렴)과 관련된 것으로 나타났습니다. 관찰 연구에 따르면 비정형 항정신병 약물과 마찬가지로 기존의 항정신병 약물 치료 시 사망률이 증가할 수 있습니다. 관찰 연구에서 나타난 사망률 증가가 환자의 특성이 아닌 항정신병 약물로 인한 것인지는 명확하지 않습니다. INVEGA SUSTENNA는 치매 관련 정신병 환자의 치료제로 승인되지 않았습니다.
[see
Warnings and Precautions (5.2)]
.
5.2 치매 관련 정신병을 앓고 있는 노인 환자의 뇌혈관계 이상반응(뇌졸중 포함)
치매를 앓고 있는 노인 환자를 대상으로 한 리스페리돈, 아리피프라졸, 올란자핀 위약 대조 임상시험에서 위약 치료를 받은 환자에 비해 뇌혈관계 이상반응(뇌혈관계 사고 및 일과성 허혈 발작 포함) 발생률(사망 포함)이 더 높았습니다. 치매를 앓고 있는 노인 환자를 대상으로 경구용 팔리페리돈, INVEGA SUSTENNA 또는 3개월 지속형 팔리페리돈 팔미테이트 서방형 주사제 현탁액에 대한 연구는 수행된 바 없습니다. 이러한 약물은 치매 관련 정신병 환자의 치료제로 승인되지 않았습니다.
[see
Warnings and Precautions (5.1)]
.
5.3 신경이완제 악성 증후군
잠재적으로 치명적인 증상 복합체인 신경이완제 악성 증후군(NMS)이 팔리페리돈을 포함한 항정신병 약물과 관련하여 보고되었습니다.
NMS의 임상 증상은 고열, 근육 강직, 섬망을 포함한 정신 상태 변화, 자율신경 불안정(불규칙적인 맥박 또는 혈압, 빈맥, 발한, 심장 부정맥)입니다. 추가적인 징후로는 크레아틴 키나아제 상승, 근육소변증(횡문근융해증), 급성 신부전 등이 있습니다.
NMS가 의심되는 경우 즉시 INVEGA SUSTENNA 투여를 중단하고 증상 치료 및 모니터링을 제공하십시오.
5.4 QT 연장
팔리페리돈은 교정 QT(QTc) 간격을 어느 정도 증가시킵니다. 1A 등급(예: 퀴니딘, 프로카인아미드) 또는 3등급(예: 아미오다론, 소탈롤) 항부정맥제, 항정신병 약물(예: 클로르프로마진, 티오리다진), 항생제(예: 가티플록사신, 목시플록사신) 또는 QTc 간격을 연장하는 것으로 알려진 기타 모든 종류의 약물을 포함하여 QTc를 연장하는 것으로 알려진 다른 약물과 함께 팔리페리돈을 사용하는 것은 피해야 합니다. 또한 선천성 QT 연장 증후군 환자와 심장 부정맥 병력이 있는 환자에게도 팔리페리돈을 사용해서는 안 됩니다.
특정 상황에서는 (1) 서맥, (2) 저칼륨혈증 또는 저마그네슘혈증, (3) QTc 간격을 연장하는 다른 약물의 병용, (4) 선천성 QT 간격 연장 등 QTc 간격을 연장하는 약물 사용과 관련하여 torsades de pointes 및/또는 급사 위험이 증가할 수 있습니다.
QTc 간격에 대한 경구용 팔리페리돈의 영향은 조현병 및 분열정동 장애 성인을 대상으로 한 이중맹검, 활성 대조(목시플록사신 400mg 단회 투여), 다기관 QT 연구와 조현병 성인을 대상으로 한 3건의 위약 및 활성 대조 6주, 고정 용량 효능 임상시험에서 평가되었습니다.
QT 연구(n=141)에서 8mg 용량의 속방성 경구용 팔리페리돈(n=50)은 8일째 투여 후 1.5시간에 QTcLD의 평균 위약 보정 기준선 대비 증가가 12.3msec(90% CI: 8.9; 15.6)였습니다. 이 8mg 용량의 팔리페리돈 속방정의 평균 정상 상태 최고 혈장 농도(C
max ss= 113ng/mL)는 삼각근에 투여한 INVEGA SUSTENNA의 최대 권장 용량 234mg에서 관찰된 노출량(예측 중앙값 C
max ss= 50ng/mL)의 2배가 넘었습니다. 이 연구에서 C
max ss= 35ng/mL인 4mg 용량의 팔리페리돈 속방 경구 제형은 2일째 투여 후 1.5시간에 QTcLD의 위약 보정 증가가 6.8msec(90% CI: 3.6; 10.1)였습니다.
조현병 환자를 대상으로 한 3건의 경구용 팔리페리돈 서방정 고정 용량 효능 연구에서 다양한 시점에 측정한 심전도(ECG) 결과 경구용 팔리페리돈 12mg군의 한 환자에서만 6일째 한 시점에서 60msec를 초과하는 변화(62msec 증가)가 나타났습니다.
조현병 환자를 대상으로 한 4건의 INVEGA SUSTENNA 고정 용량 효능 연구와 분열정동 장애 환자를 대상으로 한 장기 연구에서 어떤 시점에서도 QTcLD 변화가 60msec를 초과한 환자는 없었으며 QTcLD 값이 500msec를 초과한 환자도 없었습니다. 조현병 환자를 대상으로 한 유지 연구에서 QTcLD 변화가 60msec를 초과한 환자는 없었으며, 한 환자에서 QTcLD 값이 507msec(Bazett 공식으로 보정한 QT 간격[QTcB] 값 483msec)였습니다. 이 환자는 분당 심박수가 45회였습니다.
5.5 지연성 운동이상증
정신병 치료제로 치료받은 환자에서 비가역적이고, 불수의적이며, 이상운동성 운동으로 구성된 증후군인 지연성 운동이상증이 나타날 수 있습니다. 이 증후군의 유병률은 노인, 특히 노년 여성에서 가장 높은 것으로 보이지만 어떤 환자가 이 증후군을 보일지 예측하는 것은 불가능합니다. 정신병 치료제 제품마다 지연성 운동이상증을 유발할 가능성이 다른지는 알려져 있지 않습니다.
지연성 운동이상증이 발생할 위험과 비가역적일 가능성은 치료 기간 및 누적 용량에 따라 증가하는 것으로 보입니다. 이 증후군은 저용량으로 비교적 짧은 치료 기간 후에도 발생할 수 있습니다. 치료 중단 후에도 발생할 수 있습니다.
정신병 치료를 중단하면 지연성 운동이상증이 부분적으로 또는 완전히 완화될 수 있습니다. 그러나 정신병 치료 자체가 증후군의 징후와 증상을 억제(또는 부분적으로 억제)하여 기저 과정을 가릴 수 있습니다. 증상 억제가 증후군의 장기적인 경과에 미치는 영향은 알려져 있지 않습니다.
이러한 고려 사항을 감안할 때 INVEGA SUSTENNA는 지연성 운동이상증의 발생을 최소화할 가능성이 가장 높은 방식으로 처방되어야 합니다. 만성 정신병 치료는 일반적으로 다음 환자에게만 사용해야 합니다. (1) 정신병 치료제에 반응하는 것으로 알려진 만성 질환을 앓고 있는 환자, (2) 똑같이 효과적이지만 잠재적으로 덜 해로운 다른 치료법을 사용할 수 없거나 적절하지 않은 환자. 만성 치료가 필요한 환자의 경우 만족스러운 임상 반응을 나타내는 최저 용량과 최단 치료 기간을 사용하십시오. 지속적인 치료의 필요성을 주기적으로 재평가하십시오.
INVEGA SUSTENNA를 투여받은 환자에게 지연성 운동이상증의 징후와 증상이 나타나면 약물 중단을 고려해야 합니다. 그러나 일부 환자는 증후군이 나타나더라도 INVEGA SUSTENNA로 치료해야 할 수 있습니다.
5.6 대사 변화
비정형 정신병 치료제는 심혈관/뇌혈관 위험을 증가시킬 수 있는 대사 변화와 관련이 있습니다. 이러한 대사 변화에는 고혈당증, 이상지질혈증 및 체중 증가가 포함됩니다. 이 분류의 모든 약물이 일부 대사 변화를 일으키는 것으로 나타났지만 각 약물에는 고유한 특정 위험 프로필이 있습니다.
고혈당증 및 당뇨병
경우에 따라 케톤산증 또는 고삼투압성 혼수 또는 사망과 관련된 극심한 고혈당증 및 당뇨병이 모든 비정형 정신병 치료제로 치료받은 환자에서 보고되었습니다. 이러한 사례는 대부분 임상 시험이 아닌 시판 후 임상 사용 및 역학 연구에서 나타났습니다. INVEGA SUSTENNA로 치료받은 시험 대상자에서 고혈당증 및 당뇨병이 보고되었습니다. 비정형 정신병 치료제 사용과 포도당 이상 사이의 관계를 평가하는 것은 조현병 환자에서 당뇨병의 배경 위험 증가 가능성과 일반 인구에서 당뇨병의 발생률 증가로 인해 복잡합니다. 이러한 교란 요인을 감안할 때 비정형 정신병 치료제 사용과 고혈당증 관련 이상 반응 사이의 관계는 완전히 이해되지 않았습니다. 그러나 역학 연구에 따르면 비정형 정신병 치료제로 치료받은 환자에서 고혈당증 관련 이상 반응의 위험이 증가하는 것으로 나타났습니다.
비정형 정신병 치료제를 시작한 당뇨병 진단을 받은 환자는 혈당 조절 악화에 대해 정기적으로 모니터링해야 합니다. 비정형 정신병 치료제로 치료를 시작하는 당뇨병 위험 요인(예: 비만, 당뇨병 가족력)이 있는 환자는 치료 시작 시와 치료 중에 주기적으로 공복 혈당 검사를 받아야 합니다. 비정형 정신병 치료제로 치료받는 모든 환자는 다음을 포함한 고혈당증 증상을 모니터링해야 합니다. 다음, 다음, 다음 및 약점. 비정형 정신병 치료제로 치료하는 동안 고혈당증 증상이 나타나는 환자는 공복 혈당 검사를 받아야 합니다. 어떤 경우에는 비정형 정신병 치료제를 중단했을 때 고혈당증이 해결되었습니다. 그러나 일부 환자는 의심되는 약물을 중단했음에도 불구하고 항당뇨병 치료를 계속해야 했습니다.
조현병 환자를 대상으로 한 4건의 위약 대조(9주 1건, 13주 3건), 고정 용량 연구에서 얻은 취합 데이터가 표 5에 제시되어 있습니다.
| INVEGA SUSTENNA | |||||||
|---|---|---|---|---|---|---|---|
| 위약 | 39mg | 78mg | 156mg | 234/39mg | 234/156mg | 234/234mg | |
|
|||||||
| 기준치 대비 평균 변화(mg/dL) | |||||||
| n=367 | n=86 | n=244 | n=238 | n=110 | n=126 | n=115 | |
| Serum Glucose 기준치 대비 변화 |
-1.3 | 1.3 | 3.5 | 0.1 | 3.4 | 1.8 | -0.2 |
| 변화를 보인 환자 비율 | |||||||
| Serum Glucose 정상에서 높음 |
4.6% | 6.3% | 6.4% | 3.9% | 2.5% | 7.0% | 6.6% |
| (<100 mg/dL to ≥126 mg/dL) | (11/241) | (4/64) | (11/173) | (6/154) | (2/79) | (6/86) | (5/76) |
조현병 환자를 대상으로 실시한 장기 공개 라벨 약동학 및 안전성 연구에서 최고 용량(234mg)까지 평가했을 때, INVEGA SUSTENNA는 29주차(n=109)에 평균 포도당 변화 -0.4mg/dL, 53주차(n=100)에 +6.8mg/dL과 관련이 있었습니다.
조현정동장애 환자를 대상으로 실시한 장기 연구의 최초 25주 공개 라벨 기간 동안 INVEGA SUSTENNA는 평균 포도당 변화 +5.3mg/dL(n=518)과 관련이 있었습니다. 이후 15개월 이중맹검 기간 연구의 종료 시점에서 INVEGA SUSTENNA는 위약군의 평균 변화 +4.0mg/dL(n=120)에 비해 평균 포도당 변화 +0.3mg/dL(n=131)을 나타냈습니다.
이상지질혈증
비정형 항정신병 약물로 치료받은 환자에서 바람직하지 않은 지질 변화가 관찰되었습니다.
조현병 환자를 대상으로 실시한 4건의 위약 대조(9주 연구 1건, 13주 연구 3건), 고정 용량 연구에서 얻은 통합 데이터가 표 6에 제시되어 있습니다.
| INVEGA SUSTENNA | |||||||
|---|---|---|---|---|---|---|---|
| 위약 | 39mg | 78mg | 156mg | 234/39mg | 234/156mg | 234/234mg | |
|
|||||||
| 기준치 대비 평균 변화(mg/dL) | |||||||
| 콜레스테롤 | n=366 | n=89 | n=244 | n=232 | n=105 | n=119 | n=120 |
| 기준치 대비 변화 | -6.6 | -6.4 | -5.8 | -7.1 | -0.9 | -4.2 | 9.4 |
| LDL | n=275 | n=80 | n=164 | n=141 | n=104 | n=117 | n=108 |
| 기준치 대비 변화 | -6.0 | -4.8 | -5.6 | -4.8 | 0.9 | -2.4 | 5.2 |
| HDL | n=286 | n=89 | n=165 | n=150 | n=105 | n=118 | n=115 |
| 기준치 대비 변화 | 0.7 | 2.1 | 0.6 | 0.3 | 1.5 | 1.1 | 0.0 |
| 트리글리세리드 | n=366 | n=89 | n=244 | n=232 | n=105 | n=119 | n=120 |
| 기준치 대비 변화 | -16.7 | 7.6 | -9.0 | -11.5 | -14.1 | -20.0 | 11.9 |
| 변화를 보인 환자 비율 | |||||||
| 콜레스테롤 | |||||||
| 정상에서 높음 | 3.2% | 2.0% | 2.0% | 2.1% | 0% | 3.1% | 7.1% |
| (<200mg/dL에서 ≥240mg/dL) | (7/222) | (1/51) | (3/147) | (3/141) | (0/69) | (2/65) | (6/84) |
| LDL | |||||||
| 정상 ~ 높음 | 1.1% | 0% | 0% | 0% | 0% | 0% | 0% |
| (<100 mg/dL to ≥160 mg/dL) | (1/95) | (0/29) | (0/67) | (0/46) | (0/41) | (0/37) | (0/44) |
| HDL | |||||||
| 정상 ~ 낮음 | 13.8% | 14.8% | 9.6% | 14.2% | 12.7% | 10.5% | 16.0% |
| (≥40 mg/dL to <40 mg/dL) | (28/203) | (9/61) | (11/115) | (15/106) | (9/71) | (8/76) | (13/81) |
| Triglycerides | |||||||
| 정상 ~ 높음 | 3.6% | 6.1% | 9.2% | 7.2% | 1.3% | 3.7% | 10.7% |
| (<150 mg/dL to ≥200 mg/dL) | (8/221) | (3/49) | (14/153) | (10/139) | (1/79) | (3/82) | (9/84) |
사용 가능한 최고 용량(234mg)을 평가한 조현병 환자 대상 장기 공개 라벨 약동학 및 안전성 연구에서 지질 수치의 기준치 대비 평균 변화는 표 7에 나와 있습니다.
| INVEGA SUSTENNA 234 mg | ||
|---|---|---|
| 29주차 | 53주차 | |
| 기준치 대비 평균 변화(mg/dL) | ||
| Cholesterol | n=112 | n=100 |
| 기준치 대비 변화 | -1.2 | 0.1 |
| LDL | n=107 | n=89 |
| 기준치 대비 변화 | -2.7 | -2.3 |
| HDL | n=112 | n=98 |
| 기준치 대비 변화 | -0.8 | -2.6 |
| Triglycerides | n=112 | n=100 |
| 기준치 대비 변화 | 16.2 | 37.4 |
정신분열증을 동반한 환자들을 대상으로 실시한 장기간 연구에서 초기 25주 공개 라벨 기간 동안 및 이후 15개월 이중맹검 기간 종료 시점에서 지질 수치의 기준치 대비 평균 변화를 표 8에 나타냈습니다.
| 공개 라벨 기간 | 이중맹검 기간 | ||
|---|---|---|---|
| INVEGA SUSTENNA | 위약 | INVEGA SUSTENNA | |
| 기준치 대비 평균 변화(mg/dL) | |||
| 콜레스테롤 | n=198 | n=119 | n=132 |
| 기준치 대비 변화 | -3.9 | -4.2 | 2.3 |
| LDL | n=198 | n=117 | n=130 |
| 기준치 대비 변화 | -2.7 | -2.8 | 5.9 |
| HDL | n=198 | n=119 | n=131 |
| 기준치 대비 변화 | -2.7 | -0.9 | -0.7 |
| 트리글리세리드 | n=198 | n=119 | n=132 |
| 기준치 대비 변화 | 7.0 | 2.5 | -12.3 |
체중 증가
비정형 항정신병제제 사용으로 체중 증가가 관찰되었습니다. 체중에 대한 임상적 모니터링이 권장됩니다.
조현병 환자를 대상으로 실시한 위약 대조(9주 1회 및 13주 3회), 고정 용량 연구 4건에서 체중의 평균 변화 및 체중 증가 기준(체중의 ≥ 7% 증가)을 충족하는 환자의 비율에 대한 데이터를 표 9에 나타냈습니다.
| INVEGA SUSTENNA | |||||||
|---|---|---|---|---|---|---|---|
| 위약 | 39mg | 78mg | 156mg | 234/39mg | 234/156mg | 234/234mg | |
|
|||||||
| n=451 | n=116 | n=280 | n=267 | n=137 | n=144 | n=145 | |
| 기준치 대비 체중(kg) 변화 | -0.4 | 0.4 | 0.8 | 1.4 | 0.4 | 0.7 | 1.4 |
| 기준치 대비 체중 증가 ≥ 7% | 3.3% | 6.0% | 8.9% | 9.0% | 5.8% | 8.3% | 13.1% |
234mg으로 평가 가능한 최고 용량을 사용한 장기간 공개 라벨 약동학 및 안전성 연구에서 INVEGA SUSTENNA는 29주차(n=134)에 평균 +2.4kg, 53주차(n=113)에 +4.3kg의 체중 변화와 관련이 있었습니다.
정동정서 장애 환자를 대상으로 한 장기간 연구의 초기 25주 공개 라벨 기간 동안 INVEGA SUSTENNA는 평균 +2.2kg의 체중 변화와 관련이 있었고, 피험자의 18.4%에서 체중이 ≥ 7%(n=653) 증가했습니다. 후속 연구의 15개월 이중맹검 기간 종료 시점에서 INVEGA SUSTENNA는 평균 -0.2kg의 체중 변화와 관련이 있었고, 피험자의 13.0%에서 체중이 ≥ 7%(n=161) 증가했습니다. 위약군은 평균 -0.8kg의 체중 변화를 보였고, 피험자의 6.0%에서 체중이 ≥ 7%(n=168) 증가했습니다.
5.7 기립성 저혈압 및 실신
Paliperidone은 알파-아드레날린 차단 활성으로 인해 일부 환자에서 기립성 저혈압 및 실신을 유발할 수 있습니다. 위약으로 치료받은 환자의 0%(0/510)와 비교하여 4건의 고정 용량, 이중맹검, 위약 대조 임상시험에서 권장 용량 범위 39mg~234mg의 INVEGA SUSTENNA로 치료받은 환자의 < 1%(4/1293)에서 실신이 보고되었습니다. 조현병 환자를 대상으로 한 4건의 고정 용량 효능 연구에서 기립성 저혈압은 위약군의 0%(0/510)와 비교하여 INVEGA SUSTENNA 치료군의 < 1%(2/1293)에서 이상반응으로 보고되었습니다. 조현병 및 정동정서 장애 환자를 대상으로 한 장기간 연구에서 기립성 저혈압 및 실신 발생률은 단기간 연구에서 관찰된 것과 유사했습니다.
INVEGA SUSTENNA는 심혈관 질환(예: 심부전, 심근경색 또는 허혈 병력, 전도 이상), 뇌혈관 질환 또는 저혈압을 유발할 수 있는 질환(예: 탈수증, 저혈량증 및 항고혈압제 치료)이 있는 환자에게 주의해서 사용해야 합니다. 저혈압에 취약한 환자의 경우 기립성 활력징후 모니터링을 고려해야 합니다.
5.8 낙상
INVEGA SUSTENNA를 포함한 항정신병 약물의 사용으로 인해 졸음, 기립성 저혈압, 운동 및 감각 불안정이 보고되었으며, 이는 낙상으로 이어져 골절 또는 기타 낙상 관련 부상을 초래할 수 있습니다. 특히 노인의 경우 이러한 영향을 악화시킬 수 있는 질병, 질환 또는 약물을 복용하는 환자의 경우 항정신병 치료를 시작할 때 낙상 위험을 평가하고 장기간 항정신병 치료를 받는 환자의 경우 정기적으로 평가해야 합니다.
5.9 백혈구 감소증, 호중구 감소증 및 무과립구증
임상시험 및/또는 시판 후 경험에서 INVEGA SUSTENNA를 포함한 항정신병 약물과 시간적으로 관련된 백혈구 감소증 및 호중구 감소증 사례가 보고되었습니다. 무과립구증도 보고되었습니다.
백혈구 감소증/호중구 감소증의 가능한 위험 인자에는 기존 백혈구 수(WBC)/절대 호중구 수(ANC) 저하 및 약물 유발 백혈구 감소증/호중구 감소증 병력이 포함됩니다. 임상적으로 유의미한 WBC/ANC 저하 또는 약물 유발 백혈구 감소증/호중구 감소증 병력이 있는 환자의 경우 치료 첫 몇 개월 동안 전체 혈구 수(CBC)를 자주 검사해야 합니다. 이러한 환자의 경우 다른 원인이 없는 상태에서 임상적으로 유의미한 WBC 감소 징후가 처음 나타날 때 INVEGA SUSTENNA 중단을 고려해야 합니다.
임상적으로 유의미한 호중구 감소증이 있는 환자의 경우 열 또는 기타 감염 증상이나 징후가 있는지 모니터링하고 그러한 증상이나 징후가 나타나면 즉시 치료해야 합니다. 중증 호중구 감소증(절대 호중구 수 < 1000/mm
3)이 있는 환자의 경우 INVEGA SUSTENNA를 중단하고 회복될 때까지 WBC를 추적 관찰해야 합니다.
5.10 고프로락틴혈증
도파민 D
2수용체를 길항하는 다른 약물과 마찬가지로 paliperidone은 프로락틴 수치를 상승시키고 이러한 상승은 만성 투여 중에 지속됩니다. Paliperidone은 다른 항정신병 약물보다 프로락틴 수치가 더 높은 것으로 알려진 risperidone에서 나타나는 것과 유사한 프로락틴 상승 효과를 나타냅니다.
원인에 관계없이 고프로락틴혈증은 시상하부 GnRH를 억제하여 뇌하수체 성선자극호르몬 분비를 감소시킬 수 있습니다. 이는 여성과 남성 환자 모두에서 생식선 스테로이드 생성을 손상시켜 생식 기능을 저해할 수 있습니다. 프로락틴 상승 화합물을 투여받은 환자에서 유즙 분비, 무월경, 여성형 유방 및 발기 부전이 보고되었습니다. 저성선 기능증과 관련된 장기간의 고프로락틴혈증은 여성과 남성 모두에서 골밀도 감소로 이어질 수 있습니다.
조직 배양 실험에 따르면 인간 유방암의 약 3분의 1이
체외에서 프로락틴 의존성을 나타내며, 이는 이전에 유방암이 발견된 환자에게 이러한 약물의 처방을 고려할 때 잠재적으로 중요한 요소입니다. 생쥐와 쥐를 대상으로 한 risperidone 발암성 연구에서 뇌하수체, 유선 및 췌장 섬세포 종양(유선 선암종, 뇌하수체 및 췌장 선종)의 발생률 증가가 관찰되었습니다.
[
비임상 독성학(13.1) 참조]
. 현재까지 수행된 임상 연구나 역학 연구에서 이러한 종류의 약물의 만성 투여와 인간의 종양 발생 사이의 연관성이 밝혀지지 않았지만, 결정적인 결론을 내리기에는 이용 가능한 증거가 너무 제한적입니다.
INVEGA SUSTENNA를 사용한 두 건의 장기간 이중맹검, 위약 대조 연구의 프로락틴 데이터는 다음과 같습니다. 한 연구는 조현병 환자 집단을 대상으로 했고, 두 번째 연구는 정동정서 장애 환자를 대상으로 했습니다.
조현병
조현병 환자를 대상으로 INVEGA SUSTENNA를 장기간 유지 요법으로 투여한 임상시험(PSY-3001 연구) [
임상 연구(14.1) 참조]에서 이중맹검 기간 동안 언제든지 기준치(남성 > 18ng/mL, 여성 > 30ng/mL)를 초과하는 프로락틴 수치 상승이 위약군에 비해 INVEGA SUSTENNA 군에서 나타난 비율이 남성(51.9% 대 29.0%)과 여성(50.5% 대 42.9%) 모두에서 더 높았습니다. 이중맹검 기간 동안 INVEGA SUSTENNA 군의 여성 4명(4.2%)에서 프로락틴 관련 이상반응(무월경 N=2, 유즙분비과다 N=1, 월경불순 N=1)이 나타났으며, 위약군의 여성 2명(2.2%)에서 프로락틴 관련 이상반응(무월경 N=1, 유방통 N=1)이 나타났습니다. INVEGA SUSTENNA 군의 남성 1명(0.9%)에서 발기부전이 나타났으며, 위약군의 남성 1명(0.9%)에서 여성형 유방이 나타났습니다.
이중맹검 기간 전(장기 유지 요법 임상시험의 33주 공개 라벨 기간 동안) 혈청 프로락틴 평균(SD) 값은 남성(N=490)의 경우 기준치에서 14.9(22.3)ng/mL였으며, 여성(N=358)의 경우 35.2(39.6)ng/mL였습니다. 공개 라벨 기간이 끝날 때 프로락틴 평균(SD) 값은 남성(N=470)의 경우 24.7(22.5)ng/mL였으며, 여성(N=333)의 경우 59.5(38.1)ng/mL였습니다. 공개 라벨 기간 동안 여성의 49.2%와 남성의 47.7%에서 기준치에 비해 프로락틴 수치가 상승했으며, 남성에 비해 여성에서 프로락틴 관련 이상반응이 나타난 비율이 더 높았습니다(5.3% 대 1.8%). 여성의 경우 무월경(2.5%)이 2%를 초과하는 비율로 나타났으며, 남성의 경우 2%를 초과하는 비율로 나타난 프로락틴 관련 이상반응은 없었습니다.
정신분열형 장애
정신분열형 장애 환자를 대상으로 INVEGA SUSTENNA를 장기간 유지 요법으로 투여한 임상시험(SCA-3004 연구) [
임상 연구(14.2) 참조]에서 15개월 이중맹검 기간 동안 언제든지 기준치(남성 > 13.13ng/mL, 여성 > 26.72ng/mL)를 초과하는 프로락틴 수치 상승이 위약군에 비해 INVEGA SUSTENNA 군에서 나타난 비율이 남성(55.6% 대 23.2%)과 여성(44.3% 대 25.0%) 모두에서 더 높았습니다. 15개월 이중맹검 기간 동안 INVEGA SUSTENNA 군의 여성 11명(13.9%)에서 14건의 프로락틴 관련 이상반응(고프로락틴혈증 N=3, 혈중 프로락틴 증가 N=4, 성욕 감소 N=1, 무월경 N=3, 유즙분비과다 N=3)이 나타났으며, 위약군의 여성 5명(5.8%)에서 6건의 프로락틴 관련 이상반응(고프로락틴혈증 N=2, 혈중 프로락틴 증가 N=1, 무월경 N=2, 유즙분비과다 N=1)이 나타났습니다. INVEGA SUSTENNA 군의 남성 6명(7.1%)에서 6건의 프로락틴 관련 이상반응(고프로락틴혈증 N=4, 성욕 감소 N=1, 발기부전 N=1)이 나타났으며, 위약군의 남성 1명(1.2%)에서 혈중 프로락틴 증가 이상반응이 나타났습니다.
15개월 이중맹검 기간 전(장기 유지 요법 임상시험의 25주 공개 라벨 기간 동안) 혈청 프로락틴 평균(SD) 값은 남성(N=352)의 경우 기준치에서 14.6(14.0)ng/mL였으며, 여성(N=302)의 경우 39.1(44.6)ng/mL였습니다. 공개 라벨 기간이 끝날 때 프로락틴 평균(SD) 값은 남성(N=275)의 경우 32.8(17.2)ng/mL였으며, 여성(N=239)의 경우 72.4(46.5)ng/mL였습니다. 공개 라벨 기간 동안 여성의 48.9%와 남성의 53.3%에서 기준치에 비해 프로락틴 수치가 상승했으며, 남성에 비해 여성에서 프로락틴 관련 이상반응이 나타난 비율이 더 높았습니다(10.0% 대 9.0%). 여성의 경우 무월경(5.8%)과 유즙분비과다(2.9%), 남성의 경우 성욕 감소(2.8%)와 발기부전(2.5%)이 2%를 초과하는 비율로 나타났습니다.
5.11 인지 및 운동 장애 가능성
INVEGA SUSTENNA로 치료받은 환자에서 졸음, 진정 및 어지러움이 이상반응으로 보고되었습니다.
[
이상반응(6.1) 참조]
. INVEGA SUSTENNA를 포함한 항정신병제는 판단력, 사고력 또는 운동 능력을 저하시킬 가능성이 있습니다. 환자는 팔리페리돈 요법이 자신에게 악영향을 미치지 않는다는 확신이 들 때까지 위험한 기계 작동이나 자동차 운전과 같이 정신적 주의력이 필요한 활동을 수행할 때 주의해야 합니다.
5.12 발작
조현병 환자를 대상으로 실시한 4건의 고정 용량 이중맹검 위약 대조 연구에서 권장 용량 범위인 39mg~234mg의 INVEGA SUSTENNA로 치료받은 환자 중 <1%(1/1293)에서 경련 이상반응이 나타났으며, 이에 비해 위약으로 치료받은 환자 중 <1%(1/510)에서 대발작 경련 이상반응이 나타났습니다.
다른 항정신병제와 마찬가지로 INVEGA SUSTENNA는 발작 병력이 있거나 발작 역치를 낮출 가능성이 있는 다른 질환이 있는 환자에게는 신중하게 사용해야 합니다. 발작 역치를 낮추는 질환은 65세 이상의 환자에게 더 흔할 수 있습니다.
5.13 연하곤란
식도 운동이상증 및 흡인은 항정신병제 사용과 관련이 있습니다. INVEGA SUSTENNA 및 기타 항정신병제는 흡인성 폐렴의 위험이 있는 환자에게는 신중하게 사용해야 합니다.
5.14 지속발기증
알파-아드레날린 차단 효과가 있는 약물이 지속발기증을 유발하는 것으로 보고되었습니다. INVEGA SUSTENNA의 임상시험에서는 지속발기증 사례가 보고되지 않았지만, 시판 후 조사에서 경구용 팔리페리돈 사용 시 지속발기증이 보고되었습니다. 심각한 지속발기증은 수술적 중재가 필요할 수 있습니다.
5.15 체온 조절 장애
심부 체온을 낮추는 신체 기능 장애는 항정신병 약물로 인한 것으로 여겨집니다. INVEGA SUSTENNA를 격렬한 운동, 극심한 열에 대한 노출, 항콜린 활성이 있는 약물의 병용 투여 또는 탈수 상태와 같이 심부 체온 상승에 기여할 수 있는 조건을 경험하게 될 환자에게 처방할 때는 적절한 주의가 필요합니다.
6 부작용
다음은 라벨의 다른 섹션에서 자세히 설명됩니다.
- 치매 관련 정신병이 있는 노인 환자의 사망률 증가
[참조
경고및
- 치매 관련 정신병이 있는 노인 환자의 뇌혈관계 부작용(뇌졸중 포함)
[참조
- 악성 신경 이완 증후군
[참조
- QT 연장
[참조
- 지연성 운동 장애
[참조
- 대사 변화
[참조
- 기립성 저혈압 및 실신
[참조
- 낙상
[참조
- 백혈구 감소증, 호중구 감소증 및 무과립구증
[참조
- 고프롤락틴혈증
[참조
- 인지 및 운동 장애 가능성
[참조
- 발작
[참조
- 연하 곤란
[참조
- 프라이아피즘
[참조
- 체온 조절 장애
[참조
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로 약물의 임상 시험에서 관찰된 부작용 발생률을 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 임상 실무에서 관찰된 발생률을 반영하지 않을 수 있습니다.
환자 노출
이 섹션에 설명된 데이터는 39mg에서 234mg의 권장 용량 범위에서 INVEGA SUSTENNA를 최소한 1회 투여받은 조현병 환자 3817명(약 1705명-년 노출)과 위약을 투여받은 조현병 환자 510명으로 구성된 임상 시험 데이터베이스에서 파생되었습니다. INVEGA SUSTENNA를 투여받은 3817명의 환자 중 1293명은 4개의 고정 용량, 이중 맹검, 위약 대조 임상 시험(9주 1개, 13주 3개 연구)에서 INVEGA SUSTENNA를 투여받았고, 849명은 유지 요법 임상 시험(이 연구의 초기 33주 개방 표지 단계 동안 중간 노출 229일, 그 중 205명은 이 연구의 이중 맹검 위약 대조 단계 동안 INVEGA SUSTENNA를 계속 투여받음[중간 노출 171일])에서 INVEGA SUSTENNA를 투여받았으며, 1675명은 5개의 비위약 대조 임상 시험(3개의 비열등성 활성 비교 임상 시험, 1개의 장기 개방 표지 약동학 및 안전성 연구, 주사 부위[삼각근-둔부] 교차 연구)에서 INVEGA SUSTENNA를 투여받았습니다. 13주 연구 중 하나는 234mg의 INVEGA SUSTENNA 초기 용량을 투여한 후 4주마다 39mg, 156mg 또는 234mg으로 치료했습니다.
INVEGA SUSTENNA의 안전성은 조현병 성인 환자에서 INVEGA SUSTENNA를 선택적 경구 항정신병 약물과 비교한 15개월 장기 연구에서도 평가되었습니다. 총 226명의 환자가 이 연구의 15개월 개방 표지 기간 동안 INVEGA SUSTENNA를 투여받았고, 218명의 환자가 선택적 경구 항정신병 약물을 투여받았습니다. INVEGA SUSTENNA의 안전성은 조현병 성인 환자에서 이전에 수행된 이중 맹검, 위약 대조 임상 시험에서 관찰된 안전성과 유사했습니다.
INVEGA SUSTENNA의 안전성은 조현병적 정동 장애 성인 환자에서 장기 연구에서도 평가되었습니다. 총 667명의 환자가 이 연구의 초기 25주 개방 표지 기간 동안 INVEGA SUSTENNA를 투여받았습니다(중간 노출 147일). 164명의 환자가 이 연구의 15개월 이중 맹검 위약 대조 기간 동안 INVEGA SUSTENNA를 계속 투여받았습니다(중간 노출 446일). INVEGA SUSTENNA 그룹에서 위약 그룹보다 더 자주 발생한 부작용(두 그룹 간에 2% 이상 차이)은 체중 증가, 비인두염, 두통, 고프롤락틴혈증 및 발열이었습니다.
이중 맹검, 위약 대조 임상 시험에서의 부작용
흔히 관찰되는 부작용:조현병 환자를 대상으로 한 이중 맹검, 위약 대조 임상 시험에서 가장 흔하게(모든 INVEGA SUSTENNA 그룹에서 5% 이상) 그리고 약물과 관련이 있을 가능성이 높은(약물 발생률이 위약 발생률의 2배 이상인 부작용) 부작용은 주사 부위 반응, 졸음/진정, 현기증, 불안정, 추체 외로 장애
.조현병적 정동 장애 환자를 대상으로 한 장기 이중 맹검, 위약 대조 연구에서 이 임계값에 도달한 부작용은 없었습니다.
부작용으로 인한 치료 중단:4개의 고정 용량, 이중 맹검, 위약 대조 조현병 임상 시험에서 부작용으로 인해 치료를 중단한 환자의 비율은 INVEGA SUSTENNA를 투여받은 환자와 위약을 투여받은 환자에서 유사했습니다.
장기 연구의 개방 표지 기간 동안 조현병 스펙트럼 장애 환자를 대상으로 한 연구에서, 이상 사례로 인해 연구를 중단한 환자의 비율은 7.5%였습니다. 해당 연구의 이중 맹검, 위약 대조 기간 동안, 이상 사례로 인해 연구를 중단한 환자의 비율은 INVEGA SUSTENNA 투여군에서 5.5%, 위약 투여군에서 1.8%였습니다.
용량 관련 이상 반응:조현병 환자를 대상으로 한 4건의 고정 용량, 이중 맹검, 위약 대조 시험에서 얻은 통합 데이터를 기반으로, INVEGA SUSTENNA 투여군에서 발생한 이상 반응 중 발생률이 2% 이상인 이상 반응은 아카시시아만 용량에 따라 증가했습니다. 고프로락틴혈증 또한 용량과의 관계를 보였지만, 4건의 고정 용량 연구에서 INVEGA SUSTENNA 투여군에서 발생률이 2% 이상이 되지는 않았습니다.
INVEGA SUSTENNA 투여 환자에서 발생률이 2% 이상인 이상 반응:표 10은 4건의 고정 용량, 이중 맹검, 위약 대조 시험에서 조현병 환자 중 INVEGA SUSTENNA 투여군에서 2% 이상 보고되었고 위약군보다 발생 비율이 높았던 이상 반응을 보여줍니다.
| INVEGA SUSTENNA | |||||||
|---|---|---|---|---|---|---|---|
| 기관계 | 위약 | 39 mg | 78 mg | 156 mg | 234/39 mg | 234/156 mg | 234/234 mg |
| 이상 반응 | (N=510) | (N=130) | (N=302) | (N=312) | (N=160) | (N=165) | (N=163) |
| 백분율은 반올림하여 정수로 표시했습니다. 표에는 INVEGA SUSTENNA 투여군 중 어느 한 군에서 2% 이상 보고되었고 위약군보다 발생률이 높았던 이상 반응이 포함되어 있습니다. | |||||||
| 이상 반응이 있는 환자의 총 비율 | 70 | 75 | 68 | 69 | 63 | 60 | 63 |
| 위장관 장애 | |||||||
| 복통/상복부 통증 | 2 | 2 | 4 | 4 | 1 | 2 | 4 |
| 설사 | 2 | 0 | 3 | 2 | 1 | 2 | 2 |
| 구강 건조 | 1 | 3 | 1 | 0 | 1 | 1 | 1 |
| 메스꺼움 | 3 | 4 | 4 | 3 | 2 | 2 | 2 |
| 치통 | 1 | 1 | 1 | 3 | 1 | 2 | 3 |
| 구토 | 4 | 5 | 4 | 2 | 3 | 2 | 2 |
| 일반적인 장애 및 투여 부위 상태 | |||||||
| 쇠약 | 0 | 2 | 1 | <1 | 0 | 1 | 1 |
| 피로 | 1 | 1 | 2 | 2 | 1 | 2 | 1 |
| 주사 부위 반응 | 2 | 0 | 4 | 6 | 9 | 7 | 10 |
| 감염 및 기생충 감염 | |||||||
| 비인두염 | 2 | 0 | 2 | 2 | 4 | 2 | 2 |
| 상기도 감염 | 2 | 2 | 2 | 2 | 1 | 2 | 4 |
| 요로 감염 | 1 | 0 | 1 | <1 | 1 | 1 | 2 |
| 검사 | |||||||
| 체중 증가 | 1 | 4 | 4 | 1 | 1 | 1 | 2 |
| 근골격계 및 결합 조직 장애 | |||||||
| 요통 | 2 | 2 | 1 | 3 | 1 | 1 | 1 |
| 근골격계 경직 | 1 | 1 | <1 | <1 | 1 | 1 | 2 |
| 근육통 | 1 | 2 | 1 | <1 | 1 | 0 | 2 |
| 사지 통증 | 1 | 0 | 2 | 2 | 2 | 3 | 0 |
| 신경계 장애 | |||||||
| 불안정증 | 3 | 2 | 2 | 3 | 1 | 5 | 6 |
| 현기증 | 1 | 6 | 2 | 4 | 1 | 4 | 2 |
| 추체 외로 장애 | 1 | 5 | 2 | 3 | 1 | 0 | 0 |
| 두통 | 12 | 11 | 11 | 15 | 11 | 7 | 6 |
| 졸음/진정 | 3 | 5 | 7 | 4 | 1 | 5 | 5 |
| 정신 장애 | |||||||
| 흥분 | 7 | 10 | 5 | 9 | 8 | 5 | 4 |
| 불안 | 7 | 8 | 5 | 3 | 5 | 6 | 6 |
| 악몽 | <1 | 2 | 0 | 0 | 0 | 0 | 0 |
| 호흡기, 흉곽 및 종격 장애 | |||||||
| 기침 | 1 | 2 | 3 | 1 | 0 | 1 | 1 |
| 혈관 장애 | |||||||
| 고혈압 | 1 | 2 | 1 | 1 | 1 | 1 | 0 |
INVEGA SUSTENNA의 발생률이 위약군과 같거나 낮았던 이상 반응은 표에 나열되어 있지 않지만 다음과 같습니다. 소화불량, 정신병, 정신분열증 및 떨림. 다음 용어는 결합되었습니다. 졸음/진정, 유방 압통/유방 통증, 복통/상복부 통증/위 불편함 및 빈맥/동성 빈맥/심박수 증가. 모든 주사 부위 반응 관련 이상 반응은 축소되었으며 “주사 부위 반응”으로 그룹화됩니다.
INVEGA SUSTENNA의 임상 시험 평가 중 관찰된 기타 이상 반응
다음 목록에는 다음이 포함되어 있지 않습니다. 1) 이전 표 또는 라벨의 다른 곳에 이미 나열된 반응, 2) 약물 원인이 원격인 반응, 3) 정보가 너무 일반적인 반응, 또는 4) 임상적으로 중요하지 않다고 간주되는 반응.
심장 질환:1도 방실 블록, 서맥, 방실 블록, 두근거림, 기립성 기립성 빈맥 증후군, 빈맥
귀 및 미로 질환:현기증
안과 질환:안구 운동 장애, 안구 회전, 안구 운동 발작, 시력 흐림
위장관 질환:변비, 소화불량, 팽만감, 타액 과다 분비
면역 체계 장애:과민 반응
검사:알라닌 아미노 전이효소 증가, 아스파르트산 아미노 전이효소 증가, 심전도 이상
대사 및 영양 장애:식욕 감소, 고인슐린혈증, 식욕 증가
근골격계 및 결합 조직 장애:관절통, 관절 강직, 근육 강직, 근육 경련, 근육 긴장, 근육 경련, 경부 강직
신경계 장애:느린 운동, 뇌혈관 사고, 기어가는 강직, 경련, 기립성 현기증, 침 흘림, 발음 장애, 운동 장애, 근긴장 이상, 고긴장, 졸림, 구강 및 하악 근긴장 이상, 파킨슨증, 정신 운동 과다, 실신
정신 질환:불면증, 성욕 감소, 불안
생식기 및 유방 장애:무월경, 유즙 분비, 유방 확대/유방 부종, 유방 압통/유방 통증, 사정 장애, 발기 부전, 유즙 분비, 여성형 유방, 월경 장애, 월경 지연, 월경 불규칙, 성 기능 장애
호흡기, 흉곽 및 종격동 장애:코 막힘
피부 및 피하 조직 장애:약물 발진, 가려움증, 전신 가려움증, 발진, 두드러기
인구 통계적 차이
이중 맹검 위약 대조 시험에서 인구 하위 집단을 조사한 결과 나이, 성별 또는 인종만으로는 안전성에 차이가 있는 증거가 나타나지 않았습니다. 그러나 65세 이상의 피험자는 거의 없었습니다.
추체 외로 증상(EPS)
정신분열증 성인 피험자를 대상으로 한 이중 맹검, 위약 대조, 13주 고정 용량 시험 2건의 통합 데이터는 EPS에 대한 정보를 제공했습니다. EPS를 측정하는 데 여러 가지 방법이 사용되었습니다. (1) 파킨슨증을 광범위하게 평가하는 Simpson-Angus 전반적인 점수, (2) 불안을 평가하는 Barnes Akathisia 등급 척도 전반적인 임상 등급 점수, (3) 운동 장애를 평가하는 비정상적인 자발적 운동 척도 점수, (4) EPS 치료를 위한 항콜린성 약물 사용(표 11), 및 (5) EPS에 대한 자발적 보고 발생률(표 12).
| 피험자 비율 | ||||
|---|---|---|---|---|
| INVEGA SUSTENNA | ||||
| 척도 | 위약 (N=262) |
39mg (N=130) |
78mg (N=223) |
156mg (N=228) |
| 파킨슨증 | 9 | 12 | 10 | 6 |
| 불안 | 5 | 5 | 6 | 5 |
| 운동 장애 | 3 | 4 | 6 | 4 |
| 항콜린성 약물 사용 | 12 | 10 | 12 | 11 |
| 피험자 비율 | ||||
|---|---|---|---|---|
| INVEGA SUSTENNA | ||||
| EPS 그룹 | 위약 (N=262) |
39 mg (N=130) |
78 mg (N=223) |
156 mg (N=228) |
| 파킨슨증 그룹에는 다음이 포함됩니다: 추체외로 장애, 고긴장, 근골격계 경직, 파킨슨증, 타액 분비 과다, 가면 얼굴, 근육 긴장, 운동 저하 과운동증 그룹에는 다음이 포함됩니다: 불안정, 불안한 다리 증후군, 불안 이상 운동증 그룹에는 다음이 포함됩니다: 이상 운동증, 무도 운동, 근육 경련, 근육 경련, 지연성 이상 운동증 근긴장 이상 그룹에는 다음이 포함됩니다: 근긴장 이상, 근육 경련 |
||||
| EPS 관련 유해 사건이 있는 피험자의 전체 비율 | 10 | 12 | 11 | 11 |
| 파킨슨증 | 5 | 6 | 6 | 4 |
| 과운동증 | 2 | 2 | 2 | 4 |
| 떨림 | 3 | 2 | 2 | 3 |
| 이상 운동증 | 1 | 2 | 3 | 1 |
| 근긴장 이상 | 0 | 1 | 1 | 2 |
모든 스키조프레니아 환자를 대상으로 한 유지 치료 시험의 모든 단계에서 유사한 결과가 나타났습니다. 9주 고정 용량 이중 맹검 위약 대조 시험에서 등급 척도 발생률로 평가한 파킨슨 증후군 및 아카시시아 비율은 INVEGA SUSTENNA 156mg 그룹(각각 18% 및 11%)에서 INVEGA SUSTENNA 78mg 그룹(각각 9% 및 5%) 및 위약 그룹(각각 7% 및 4%)보다 높았습니다.
스키조프레니아 환자를 대상으로 한 13주 연구에서 234mg 초기 투여량을 사용한 경우, 모든 EPS의 발생률은 위약 그룹(8%)과 유사했지만, INVEGA SUSTENNA 234/39mg, 234/156mg 및 234/234mg 그룹에서 각각 6%, 10% 및 11%로 용량 의존적 패턴을 보였습니다. 이 연구에서 과운동증은 EPS 관련 이상 반응의 가장 빈번한 범주였으며, 위약(4.9%)과 INVEGA SUSTENNA 234/156mg(4.8%) 및 234/234mg(5.5%) 그룹 사이에서 유사한 비율로 보고되었지만, 234/39mg 그룹(1.3%)에서는 더 낮은 비율로 보고되었습니다.
스키조정동 장애 환자를 대상으로 한 장기 연구에서 25주 개방 표지 INVEGA SUSTENNA 치료 중 보고된 EPS에는 과운동증(12.3%), 파킨슨 증후군(8.7%), 떨림(3.4%), 운동 장애(2.5%) 및 경직(2.1%)이 포함되었습니다. 15개월 이중 맹검 치료 중 모든 EPS의 발생률은 위약 그룹(각각 8.5% 및 7.1%)과 유사했습니다. 이중 맹검 단계 연구(INVEGA SUSTENNA 대 위약)에서 모든 치료 그룹에서 가장 흔하게 보고된 치료 발생 EPS 관련 이상 반응(> 2%)은 과운동증(3.7% 대 2.9%), 파킨슨 증후군(3.0% 대 1.8%) 및 떨림(1.2% 대 2.4%)이었습니다.
경직
근육 그룹의 지속적인 비정상적인 수축인 경직 증상은 치료 첫 며칠 동안 민감한 개인에게 발생할 수 있습니다. 경직 증상에는 목 근육 경련, 때로는 목이 조이는 것으로 진행되어 목이 조이고, 삼키기 어려움, 호흡 곤란 및/또는 혀가 튀어나오는 것이 포함됩니다. 이러한 증상은 낮은 용량에서 발생할 수 있지만, 고강도 및 고용량의 1세대 항정신병 약물을 사용할 경우 더 자주 발생하고 심각도가 더 높습니다. 급성 경직의 위험 증가는 남성과 젊은 연령대에서 관찰됩니다.
통증 평가 및 국소 주사 부위 반응
스키조프레니아 환자를 대상으로 한 두 건의 13주 고정 용량 이중 맹검 위약 대조 시험에서 얻은 통합 데이터에서 시각적 아날로그 척도(0 = 통증 없음에서 100 = 견딜 수 없을 정도로 고통스러움)를 사용하여 피험자가 보고한 주사 통증의 평균 강도는 모든 치료 그룹에서 첫 번째 주사에서 마지막 주사까지 감소했습니다(위약: 10.9에서 9.8; 39mg: 10.3에서 7.7; 78mg: 10.0에서 9.2; 156mg: 11.1에서 8.8). 9주 고정 용량 이중 맹검 위약 대조 시험과 유지 시험의 이중 맹검 단계에서 얻은 결과는 유사한 결과를 보였습니다.
스키조프레니아 환자를 대상으로 한 234mg 초기 투여량을 사용한 13주 연구에서 맹검 연구 인력이 평가한 경화, 발적 또는 부종의 발생은 드물었고, 일반적으로 경미했으며, 시간이 지남에 따라 감소했으며, INVEGA SUSTENNA 그룹과 위약 그룹 사이에서 발생률이 유사했습니다. 주사 통증에 대한 연구자 평가는 위약 그룹과 INVEGA SUSTENNA 그룹에서 유사했습니다. 첫 번째 주사 후 발적, 부종, 경화 및 통증에 대한 주사 부위에 대한 연구자 평가는 INVEGA SUSTENNA 그룹과 위약 그룹 모두에서 피험자의 69~100%에서 없음으로 평가되었습니다. 92일째에 연구자는 INVEGA SUSTENNA 그룹과 위약 그룹 모두에서 피험자의 95~100%에서 발적, 부종, 경화 및 통증이 없음으로 평가했습니다.
경구 팔리페리돈을 사용한 임상 시험에서 보고된 추가 이상 반응
다음은 경구 팔리페리돈을 사용한 임상 시험에서 보고된 추가 이상 반응 목록입니다.
심장 질환: 좌측 방실 블록, 동성 부정맥
위장관 질환: 복통, 소장 폐쇄
일반적인 장애 및 투여 부위 상태: 부종, 말초 부종
면역 체계 장애: 아나필락시스 반응
감염 및 기생충 감염:비염
근골격계 및 결합 조직 장애: 근골격계 통증, 사경, 개구 장애
신경계 장애: 대발작, 파킨슨 보행, 일과성 허혈 발작
정신 질환:수면 장애
생식 기관 및 유방 장애: 유방 팽만
호흡기, 흉곽 및 종격동 장애:인두 후두 통증, 흡인성 폐렴
피부 및 피하 조직 장애: 구진성 발진
혈관 장애: 저혈압, 허혈
6.2 시판 후 경험
팔리페리돈의 시판 후 사용 중 다음 이상 반응이 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되었기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다. 혈관 부종, 긴장증, 마비, 몽유병, 혀 부종, 혈소판 감소성 혈전성 혈소판 감소성 자반증, 요실금 및 요폐.
경구 리스페리돈 또는 경구 팔리페리돈을 이전에 내성이 있었던 환자에서 INVEGA SUSTENNA 주사 후 아나필락시스 반응 사례가 시판 후 경험 중 보고되었습니다.
팔리페리돈은 리스페리돈의 주요 활성 대사체입니다. 경구 리스페리돈 및 리스페리돈 장기 작용 주사와 관련하여 보고된 이상 반응은 해당 제품의 포장 삽입지의
이상 반응(6)섹션에서 찾을 수 있습니다.
7 약물 상호작용
7.1 INVEGA SUSTENNA와 임상적으로 중요한 상호 작용을 하는 약물
팔리페리돈 팔미테이트는 팔리페리돈으로 가수분해되므로
[
임상 약리학 (12.3) 참조]
, 약물-약물 상호 작용 가능성을 평가할 때 경구용 팔리페리돈에 대한 연구 결과를 고려해야 합니다.
| 병용 약물명 또는 약물 등급 | 임상적 근거 | 임상 권장 사항 |
|---|---|---|
| 중추 신경 작용 약물 및 알코올 | 팔리페리돈의 주요 CNS 효과를 감안할 때 중추 신경 작용 약물 및 알코올을 병용하면 INVEGA SUSTENNA의 CNS 효과가 조절될 수 있습니다. | INVEGA SUSTENNA는 다른 중추 신경 작용 약물 및 알코올과 함께 사용할 때 주의해야 합니다.
[ 6.2) 참조] . |
| 기립성 저혈압을 유발할 가능성이 있는 약물 | INVEGA SUSTENNA는 기립성 저혈압을 유발할 가능성이 있으므로 INVEGA SUSTENNA를 이러한 가능성이 있는 다른 치료제와 함께 투여할 경우 추가 효과가 발생할 수 있습니다.
[ 경고 및 주의 사항 (5.7) 참조] . |
저혈압에 취약한 환자의 기립성 활력 징후를 모니터링합니다.
[ 경고 및 주의 사항 (5.7) 참조] . |
| CYP3A4 및 P-gp의 강력한 유도제(예: 카르바마제핀, 리팜핀 또는 세인트존스워트) | 팔리페리돈과 CYP3A4 및 P-gp의 강력한 유도제를 병용하면 팔리페리돈의 노출이 감소할 수 있습니다.
[ 임상 약리학 (12.3) 참조] . |
가능하면 1개월 투여 간격 동안 INVEGA SUSTENNA와 함께 CYP3A4 및/또는 P-gp 유도제를 사용하지 마십시오. 강력한 유도제를 투여해야 하는 경우 팔리페리돈 서방정을 사용하여 환자를 관리하는 것을 고려하십시오.
[ 용량 및 투여 (2.5) 참조] . |
| 레보도파 및 기타 도파민 작용제 | 팔리페리돈은 레보도파 및 기타 도파민 작용제의 효과를 길항할 수 있습니다. | 임상적으로 적절하게 환자를 모니터링하고 관리합니다. |
7.2 INVEGA SUSTENNA와 임상적으로 중요한 상호 작용이 없는 약물
INVEGA SUSTENNA와 발프로에이트(발프로산 및 디발프로엑스 나트륨 포함) 간에 임상적으로 의미 있는 약동학적 상호 작용은 예상되지 않습니다. 경구용 팔리페리돈에 대한 약동학 연구에 따르면 발프로에이트와 함께 투여할 때 INVEGA SUSTENNA의 용량 조절은 필요하지 않습니다.
[
임상 약리학 (12.3) 참조].
또한 INVEGA SUSTENNA와 함께 투여할 때 발프로에이트의 용량 조절은 필요하지 않습니다.
[
임상 약리학 (12.3) 참조].
리튬과 INVEGA SUSTENNA 간의 약동학적 상호 작용도 가능성이 낮습니다.
팔리페리돈은 사이토크롬 P450 동종효소에 의해 대사되는 약물과 임상적으로 중요한 약동학적 상호 작용을 일으키지 않을 것으로 예상됩니다.
시험관 내 연구에 따르면 CYP2D6 및 CYP3A4가 팔리페리돈 대사에 관여할 수 있습니다. 그러나
생체 내에서 이러한 효소의 억제제가 팔리페리돈의 대사에 상당한 영향을 미친다는 증거는 없습니다. 팔리페리돈은 CYP1A2, CYP2A6, CYP2C9 및 CYP2C19의 기질이 아닙니다. 이러한 동종효소의 억제제 또는 유도제와의 상호 작용은 가능성이 낮습니다.
[
임상 약리학 (12.3) 참조]
8 특정 집단에서의 사용
8.1 임신
임신 노출 등록
임신 중 INVEGA SUSTENNA를 포함한 비정형 항정신병 약물에 노출된 여성의 임신 결과를 모니터링하는 임신 노출 등록이 있습니다. 의료 서비스 제공자는 1-866-961-2388로 전화하거나
http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/에서 온라인으로 국가 비정형 항정신병 약물 임신 등록에 문의하여 환자를 등록하는 것이 좋습니다.
위험 요약
임신 3기에 항정신병 약물에 노출된 신생아는 분만 후 추체외로 증상 및/또는 금단 증상의 위험이 있습니다.
(
임상적 고려 사항 참조)
. 전반적으로, 임신 중 팔리페리돈에 노출된 임산부에 대한 공개된 역학 연구에서 얻은 데이터는 주요 선천적 기형, 유산 또는 부작용에 대한 약물 관련 위험을 확립하지 못했습니다.
(
데이터 참조)
. 임신 중 치료받지 않은 정신분열증 및 INVEGA SUSTENNA를 포함한 항정신병 약물에 대한 노출과 관련된 산모에 대한 위험이 있습니다.
(
임상적 고려 사항 참조).
INVEGA SUSTENNA를 단회 투여한 후 최대 126일 동안 성인 피험자의 혈장에서 팔리페리돈이 검출되었습니다.
[
임상 약리학(12.3) 참조]
, 임신 전이나 임신 중 언제든지 투여된 INVEGA SUSTENNA의 임상적 유의성은 알려져 있지 않습니다.
표시된 집단에서 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구에서 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2~4% 및 15~20%입니다.
동물 생식 연구에서 임신한 쥐에게 기관 형성 기간 동안 mg/m
2 체표면적을 기준으로 최대 권장 용량(MRHD)인 234mg의 10배 용량의 팔리페리돈 팔미테이트를 근육 내 주사했을 때 자손에 대한 치료 관련 영향은 없었습니다. 임신한 쥐와 토끼에게 기관 형성 기간 동안 mg/m
2 체표면적을 기준으로 최대 12mg의 MRHD의 8배 용량의 팔리페리돈을 경구 투여했을 때 태아 기형이 증가하지 않았습니다. 팔리페리돈으로 광범위하게 전환되는 리스페리돈을 경구 투여한 추가 생식 독성 연구가 수행되었습니다(
동물 데이터 참조).
임상적 고려 사항
데이터
인간 데이터
임신 중 비정형 항정신병 약물 사용에 대한 관찰 연구, 출생 등록 및 증례 보고서에서 발표된 데이터는 항정신병 약물과 주요 선천적 기형 간의 명확한 연관성을 보고하지 않습니다. 팔리페리돈의 모화합물인 리스페리돈으로 치료받은 여성 6명을 포함한 전향적 관찰 연구에서 리스페리돈과 팔리페리돈의 태반 통과가 입증되었습니다. 임신 중 항정신병 약물에 노출된 9258명의 여성에 대한 Medicaid 데이터베이스의 후향적 코호트 연구에서는 주요 선천적 기형의 전반적인 위험 증가가 나타나지 않았습니다. 임신 첫 번째 3개월 동안 팔리페리돈의 모화합물인 리스페리돈에 노출된 여성 1566명의 하위 그룹에서 주요 선천적 기형 위험(RR= 1.26, 95% CI 1.02–1.56) 및 심장 기형 위험(RR=1.26, 95% CI 0.88–1.81)이 약간 증가했습니다. 그러나 기형 발생률의 차이를 설명할 수 있는 작용 메커니즘은 없습니다.
동물 데이터
기관 형성 기간 동안 임신한 쥐에게 mg/m
2 체표면적을 기준으로 234mg의 팔리페리돈 MRHD의 10배인 최대 250mg/kg 용량의 팔리페리돈 팔미테이트 장시간 방출 주사 현탁액을 근육 내 주사했을 때 자손에 대한 치료 관련 영향은 없었습니다.
동물 생식 연구에서 임신한 쥐와 토끼에게 기관 형성 기간 동안 mg/m
2 체표면적을 기준으로 최대 12mg의 MRHD의 8배 용량의 팔리페리돈을 경구 투여했을 때 태아 기형이 증가하지 않았습니다.
Additional reproduction toxicity studies were conducted with orally administered risperidone, which is extensively converted to paliperidone. Cleft palate was observed in the offspring of pregnant mice treated with risperidone at 3 to 4 times the MRHD of 16 mg based on mg/m
2body surface area; maternal toxicity occurred at 4 times the MHRD. There was no evidence of teratogenicity in embryo-fetal developmental toxicity studies with risperidone in rats and rabbits at doses up to 6 times the MRHD of 16 mg/day risperidone based on mg/m
2body surface area. When the offspring of pregnant rats, treated with risperidone at 0.6 times the MRHD based on mg/m
2body surface area, reached adulthood, learning was impaired. Increased neuronal cell death occurred in the fetal brains of the offspring of pregnant rats treated at 0.5 to 1.2 times the MRHD; the postnatal development and growth of the offspring was delayed.
In rat reproduction studies with risperidone, pup deaths occurred at oral doses which are less than the MRHD of risperidone based on mg/m
2body surface area; it is not known whether these deaths were due to a direct effect on the fetuses or pups or, to effects on the dams (see RISPERDAL package insert).
8.2 수유
위험 요약
출판된 문헌의 제한된 데이터는 인간 모유에서 팔리페리돈의 존재를 보고합니다. 모유 수유 유아에 대한 영향이나 모유 생산에 대한 영향에 대한 정보는 없습니다. 그러나 팔리페리돈의 모화합물인 리스페리돈에 노출된 모유 수유 유아에서 진정, 발육 부진, 초조, 추체외로 증상(떨림 및 비정상적인 근육 움직임)이 보고되었습니다.
(
임상 고려 사항 참조)
. 팔리페리돈은 INVEGA SUSTENNA 단회 투여 후 최대 126일 동안 성인 피험자의 혈장에서 검출되었습니다.
[
임상 약리학(12.3) 참조]
, 모유 수유 유아에 대한 임상적 유의성은 알려져 있지 않습니다. 모유 수유의 발달적 및 건강상의 이점은 INVEGA SUSTENNA에 대한 산모의 임상적 필요성 및 INVEGA SUSTENNA 또는 산모의 기저 질환으로 인한 모유 수유 유아에 대한 잠재적인 부작용과 함께 고려해야 합니다.
8.3 가임기 여성 및 남성
불임
여성
팔리페리돈의 약리학적 작용(D2 수용체 길항제)에 따라 INVEGA SUSTENNA로 치료하면 혈청 프로락틴 수치가 증가하여 가임기 여성의 가역적인 생식력 감소로 이어질 수 있습니다.
[
경고 및 주의 사항(5.10) 참조].
8.4 소아 사용
18세 미만 환자에서 INVEGA SUSTENNA의 안전성과 유효성은 확립되지 않았습니다.
청소년 동물 연구
생후 24일에서 73일 사이의 어린 쥐에게 경구용 팔리페리돈을 투여한 연구에서 학습 및 기억력 테스트에서 가역적인 수행 장애가 나타났으며, 암컷에서만 0.63mg/kg/일의 무효과 용량으로 나타났으며, 이는 12mg/일 용량의 청소년에서 나타나는 팔리페리돈의 혈장 수치(AUC)와 유사합니다. 청소년에서 팔리페리돈의 혈장 수치를 2~3배 증가시킨 최고 용량(2.5mg/kg/일)까지 테스트한 결과, 신경 행동 또는 생식 발달에 대한 다른 일관된 영향은 나타나지 않았습니다.
어린 개에게 동물과 인간에서 팔리페리돈으로 광범위하게 대사되는 경구용 리스페리돈을 0.31, 1.25 또는 5mg/kg/일 용량으로 40주 동안 투여했습니다. 뼈 길이와 밀도 감소는 0.31mg/kg/일의 무효과 용량에서 나타났으며, 이는 MRHD의 리스페리돈을 투여받은 어린이 및 청소년에서 나타나는 리스페리돈과 팔리페리돈의 혈장 수치(AUC)와 유사합니다. 또한 수컷과 암컷 모두 모든 용량에서 성 성숙 지연이 나타났습니다. 위의 효과는 12주간의 약물 없는 회복 기간 후 암컷에서 거의 또는 전혀 가역성을 보이지 않았습니다.
성장 및 성 성숙에 대한 INVEGA SUSTENNA의 장기적인 영향은 어린이와 청소년에서 완전히 평가되지 않았습니다.
8.5 노인 사용
INVEGA SUSTENNA의 임상 연구에는 65세 이상의 피험자가 충분히 포함되지 않아 고령자의 반응이 젊은 피험자와 다른지 여부를 판단할 수 없습니다. 보고된 다른 임상 경험에서도 노인 환자와 젊은 환자 간의 반응 차이가 확인되지 않았습니다.
이 약물은 신장을 통해 상당히 배설되는 것으로 알려져 있으며 신장애 환자의 경우 청소율이 감소합니다.
[
임상 약리학(12.3) 참조]
, 복용량을 줄여야 합니다. 노인 환자는 신장 기능이 저하될 가능성이 더 높기 때문에 신장 기능에 따라 용량을 조절하십시오.
[
용량 및 투여(2.5) 참조].
8.6 신장애
INVEGA SUSTENNA는 중등도 또는 중증의 신장애 환자(크레아티닌 청소율 < 50mL/min)에게 사용하지 않는 것이 좋습니다. 경도의 신장애 환자(크레아티닌 청소율 ≥ 50mL/min ~ < 80mL/min)에게는 감량이 권장됩니다.
[see
Dosage and Administration (2.5)and
.
8.7 간장애
INVEGA SUSTENNA는 간장애 환자를 대상으로 연구된 바 없습니다. 경구용 팔리페리돈을 사용한 연구에 따르면, 경도 또는 중등도의 간장애 환자의 경우 용량 조절이 필요하지 않습니다. 팔리페리돈은 중증의 간장애 환자를 대상으로 연구된 바 없습니다.
[see
.
8.8 파킨슨병 또는 루이소체 치매 환자
파킨슨병 또는 루이소체 치매 환자는 INVEGA SUSTENNA에 대한 민감도가 증가할 수 있습니다. 혼란, 의식 저하, 잦은 낙상을 동반한 자세 불안정, 추체외로 증상, 신경이완제 악성 증후군과 일치하는 임상적 특징이 나타날 수 있습니다.
9 약물 남용 및 의존성
10 과다 복용
10.1 인체 경험
INVEGA SUSTENNA의 시판 전 연구에서 과량 투여 사례는 보고되지 않았습니다. INVEGA SUSTENNA는 의료 전문가가 투여하므로 환자의 과량 투여 가능성은 낮습니다.
팔리페리돈 과량 투여에 대한 경험은 제한적이지만, 경구 팔리페리돈으로 시판 전 임상 시험에서 보고된 소수의 과량 투여 사례 중 가장 높은 추정 섭취량은 405mg이었습니다. 관찰된 징후 및 증상에는 추체 외 증상 및 보행 불안정이 포함되었습니다. 기타 잠재적인 징후 및 증상에는 팔리페리돈의 알려진 약리학적 효과의 과장으로 인한 증상, 즉 졸음 및 진정, 빈맥 및 저혈압, QT 연장이 포함됩니다. 경구 팔리페리돈 과량 투여 환자에서 토르사드 드 포인트 및 심실 세동이 보고되었습니다.
팔리페리돈은 리스페리돈의 주요 활성 대사체입니다. 리스페리돈으로 보고된 과량 투여 경험은 리스페리돈 포장 삽입지의
과량 투여 섹션에서 확인할 수 있습니다.
10.2 과량 투여 관리
INVEGA SUSTENNA 과량 투여 관리에 대한 최신 정보는 인증된 독극물 관리 센터에 문의하십시오(1-800-222-1222 또는 www.poison.org). 밀접한 의학적 감독 및 모니터링을 포함한 지지 요법을 제공하십시오. 치료는 모든 약물의 과량 투여 관리에 사용되는 일반적인 조치로 구성되어야 합니다. 다중 약물 과량 투여 가능성을 고려하십시오. 적절한 기도, 산소 공급 및 환기를 확보하십시오. 심장 리듬 및 활력징후를 모니터링하십시오. 지지적 및 증상 완화적 조치를 취하십시오. 팔리페리돈에 대한 특정 해독제는 없습니다.
치료 요구 사항 및 회복을 평가할 때 INVEGA SUSTENNA의 지속 방출 특성과 팔리페리돈의 긴 명백한 반감기를 고려하십시오.
11 설명
INVEGA SUSTENNA
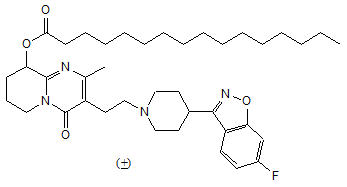
®는 팔리페리돈 팔미테이트를 함유하고 있습니다. 활성 성분인 팔리페리돈은 벤지소옥사졸 유도체의 화학적 계열에 속하는 비정형 항정신병 약물입니다. INVEGA SUSTENNA는 (+)- 및 (-)- 팔리페리돈 팔미테이트의 라세미 혼합물을 함유하고 있습니다. 화학적 명칭은 (9
RS)-3-[2-[4-(6-플루오로-1,2-벤지소옥사졸-3-일)피페리딘-1-일]에틸]-2-메틸-4-옥소-6,7,8,9-테트라히드로-4
H-피리도[1,2-
a]피리미딘-9-일 헥사데카노에이트입니다. 분자식은 C
39H
57FN
4O
4이고 분자량은 664.89입니다. 구조식은 다음과 같습니다.
팔리페리돈 팔미테이트는 에탄올 및 메탄올에 매우 약간 용해되고 폴리에틸렌 글리콜 400 및 프로필렌 글리콜에는 실질적으로 용해되지 않으며 에틸 아세테이트에는 약간 용해됩니다.
INVEGA SUSTENNA는 다음과 같은 팔리페리돈 팔미테이트 용량 강도(및 전달 가능한 부피)의 단일 용량 사전 충전 주사기(근육 주사용 무균 수성 서방형 현탁액)로 제공됩니다. 39 mg(0.25 mL), 78 mg(0.5 mL), 117 mg(0.75 mL), 156 mg(1.0 mL) 및 234 mg(1.5 mL). 약물 제품은 활성 성분인 팔리페리돈으로 가수 분해되어 각각 25 mg, 50 mg, 75 mg, 100 mg 및 150 mg의 팔리페리돈 용량 강도를 나타냅니다. 비활성 성분은 폴리소르베이트 20(12 mg/mL), 폴리에틸렌 글리콜 4000(30 mg/mL), 구연산 일수화물(5 mg/mL), 무수 인산이수소나트륨(5 mg/mL), 일수화물 인산수소이수소나트륨(2.5 mg/mL), 수산화나트륨(2.84 mg/mL, pH를 7로 조절하기 위한 알칼리화제로 사용), 주사용수입니다.
INVEGA SUSTENNA는 플런저 마개 및 팁 캡(브롬부틸 고무)이 있는 단일 용량 사전 충전 주사기(사이클릭 올레핀 코폴리머)로 제공됩니다. 키트에는 2개의 안전 바늘(1 ½인치 22 게이지 안전 바늘 및 1인치 23 게이지 안전 바늘)도 포함되어 있습니다.
12 임상약리학
12.1 작용 기전
팔리페리돈 팔미테이트는 팔리페리돈으로 가수분해됩니다.
[
참조]
. 팔리페리돈은 리스페리돈의 주요 활성 대사체입니다. 팔리페리돈의 작용 기전은 명확하지 않습니다. 그러나 조현병에서 약물의 치료 효과는 중추 도파민 2형(D
2) 및 세로토닌 2형(5HT
2A) 수용체 길항 작용의 조합을 통해 매개될 수 있습니다.
12.2 약력학
시험관 내에서 팔리페리돈은 중추 도파민 2형(D
2) 및 세로토닌 2형(5HT
2A) 수용체에서 D
2에 대한 1.6–2.8 nM 및 5HT
2A 수용체에 대한 0.8–1.2 nM의 결합 친화도(Ki 값)를 가진 길항제로 작용합니다. 팔리페리돈은 또한 히스타민 H
1 및 α
1 및 α
2 아드레날린 수용체에서 각각 32 nM, 4 nM, 17 nM의 결합 친화도를 가진 길항제로 작용합니다. 팔리페리돈은 콜린성 무스카린성 또는 β
1– 및 β
2– 아드레날린 수용체에 대한 친화도가 없습니다. (+)- 및 (-)- 팔리페리돈 거울상 이성질체의 약리학적 활성은 질적으로나 양적으로 유사합니다.
.
12.3 약동학
흡수 및 분포
극도로 낮은 수용성으로 인해 팔리페리돈 팔미테이트의 1개월 제형은 근육 내 주사 후 팔리페리돈으로 가수분해되고 전신 순환으로 흡수되기 전에 천천히 용해됩니다. 단일 근육 내 투여 후 팔리페리돈의 혈장 농도는 중간 T
max가 13일인 최대 혈장 농도에 도달할 때까지 점차 증가합니다. 약물 방출은 1일째에 시작하여 최대 126일까지 지속됩니다.
델토이드 근육에 단일 용량(39mg – 234mg)을 근육 내 주사한 후, 평균적으로 둔부 근육 주사와 비교하여 28% 더 높은 C
max가 관찰되었습니다. 1일째 234mg, 8일째 156mg의 델토이드 근육 내 초기 주사 2회는 치료 농도를 신속하게 달성하는 데 도움이 됩니다. INVEGA SUSTENNA의 방출 프로필 및 투약 요법은 지속적인 치료 농도를 제공합니다. INVEGA SUSTENNA 투여 후 팔리페리돈의 AUC는 39mg-234mg 용량 범위에서 용량에 비례했으며, 78mg을 초과하는 용량의 경우 C
max에 대해 용량에 비례하지 않았습니다. 156mg의 INVEGA SUSTENNA 용량에 대한 평균 정상 상태 최고점:골짜기 비율은 둔부 투여 후 1.8, 델토이드 투여 후 2.2였습니다.
팔리페리돈 팔미테이트 투여 후 팔리페리돈의 (+) 및 (-) 거울상 이성질체는 상호 변환되어 약 1.6–1.8의 AUC (+) 대 (-) 비율에 도달합니다.
모집단 분석에 따르면 팔리페리돈의 명백한 분포 용적은 391L입니다. 라세미 팔리페리돈의 혈장 단백질 결합은 74%입니다.
대사 및 배설
경구 속방
14C-팔리페리돈을 사용한 연구에서 1mg 속방
14C-팔리페리돈의 단일 경구 용량 투여 후 1주일 후, 투여 용량의 59%가 변하지 않은 형태로 소변으로 배설되어 팔리페리돈이 간에서 광범위하게 대사되지 않음을 나타냅니다. 투여된 방사능의 약 80%가 소변에서 회수되었고 11%가 대변에서 회수되었습니다. 4가지 대사 경로가
생체 내에서 확인되었으며, 그 중 어느 것도 투여 용량의 10%를 초과하지 않았습니다. 탈알킬화, 수산화, 탈수소화 및 벤지소옥사졸 분열. 비록
시험관 내 연구에서 CYP2D6 및 CYP3A4가 팔리페리돈 대사에 역할을 하는 것으로 나타났지만, 이러한 동종 효소가
생체 내에서 팔리페리돈 대사에 중요한 역할을 한다는 증거는 없습니다. 모집단 약동학 분석은 CYP2D6 기질의 광범위 대사자와 약한 대사자 간에 경구 팔리페리돈 투여 후 팔리페리돈의 명백한 청소율에 현저한 차이가 없음을 나타냅니다.
INVEGA SUSTENNA 단일 용량 투여 후 39mg – 234mg 용량 범위에서 팔리페리돈의 중간 명백한 반감기는 25일 – 49일이었습니다.
장기 작용 팔리페리돈 팔미테이트 주사 vs 경구 서방형 팔리페리돈
INVEGA SUSTENNA는 매월 팔리페리돈을 전달하도록 설계된 반면, 서방형 경구 팔리페리돈은 매일 투여됩니다. INVEGA SUSTENNA의 시작 요법(1일째/8일째 델토이드 근육에 234mg/156mg)은 경구 보충제를 사용하지 않고 치료를 시작할 때 정상 상태 팔리페리돈 농도를 신속하게 달성하도록 설계되었습니다.
일반적으로 INVEGA SUSTENNA를 사용한 전체 시작 혈장 수준은 6–12mg 서방형 경구 팔리페리돈에서 관찰된 노출 범위 내에 있었습니다. INVEGA SUSTENNA 시작 요법을 사용하면 환자는 골짜기 전 투여일에(8일째 및 36일째)도 6–12mg 서방형 경구 팔리페리돈의 노출 창에 머물 수 있었습니다. INVEGA SUSTENNA에서 전달된 팔리페리돈 약동학에 대한 개체 간 변동성은 서방형 경구 팔리페리돈 정제에서 결정된 변동성에 비해 낮았습니다. 두 제품의 중간 약동학 프로필이 다르기 때문에 약동학적 특성을 직접 비교할 때는 주의해야 합니다.
약물 상호 작용 연구
INVEGA SUSTENNA를 사용한 특정 약물 상호 작용 연구는 수행되지 않았습니다. 아래 정보는 경구 팔리페리돈을 사용한 연구에서 얻은 것입니다.
팔리페리돈의 노출에 대한 다른 약물의 영향은 그림 1에 요약되어 있습니다. 파록세틴(강력한 CYP2D6 억제제)을 경구 투여한 후, 평형 상태에서 평균 C
max및 AUC 값이 증가하는 것으로 관찰되었습니다(
그림 1 참조). 파록세틴의 더 높은 용량은 연구되지 않았습니다. 임상적 관련성은 알려져 있지 않습니다. 경구 투여 후, CYP3A4 및 P-gp 모두의 강력한 유도제인 카르바마제핀으로 치료받는 환자의 경우 평형 상태에서 평균 C
max및 AUC 값이 감소할 것으로 예상됩니다
[
. 이 감소는 팔리페리돈의 신장 청소율이 35% 증가하기 때문에 상당 부분 발생합니다.
그림 1: 다른 약물이 팔리페리돈 약동학에 미치는 영향.
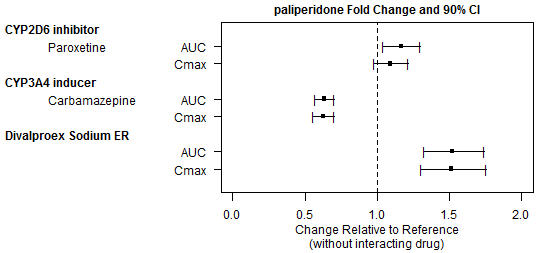
INVEGA SUSTENNA와 발프로에이트(발프로산 및 디발프로엑스 나트륨 포함) 간의 임상적으로 의미 있는 약동학적 상호 작용은 예상되지 않습니다. 디발프로엑스 나트륨 서방형 정제(하루에 500mg 정제 2개를 평형 상태에서 1회 투여)를 경구 팔리페리돈 서방형 정제와 함께 경구 투여한 결과 팔리페리돈의 C
max및 AUC가 약 50% 증가했습니다.
팔리페리돈을 경구 투여한 후, 디발프로엑스 나트륨 서방형 정제의 평형 상태 C
max및 AUC는 디발프로엑스 나트륨 서방형 정제로 안정화된 13명의 환자에게 영향을 미치지 않았습니다. 임상 연구에서, 디발프로엑스 나트륨 서방형 정제의 안정적인 용량을 복용하는 피험자는 경구 팔리페리돈 서방형 정제 3~15mg/일을 기존 디발프로엑스 나트륨 서방형 정제 치료에 추가했을 때 비교 가능한 발프로에이트 평균 혈장 농도를 보였습니다
[
.
시험관 내 연구에 따르면 CYP2D6 및 CYP3A4가 팔리페리돈 대사에 관여할 수 있지만, 이러한 효소의 억제제가 팔리페리돈의 대사에 유의미하게 영향을 미친다는 증거는 없습니다.
생체 내 이들은 총 체내 청소율의 일부만 차지합니다.
시험관 내 연구에 따르면 팔리페리돈은 P-당단백질(P-gp)의 기질임을 보여주었습니다
[
.
시험관 내 인간 간 미세소체에서 수행한 연구에 따르면 팔리페리돈은 CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 및 CYP3A5를 포함한 시토크롬 P450 동종효소에 의해 대사되는 약물의 대사를 실질적으로 억제하지 않습니다. 따라서 팔리페리돈은 이러한 대사 경로에 의해 대사되는 약물의 청소율을 임상적으로 관련성 있는 방식으로 억제하지 않을 것으로 예상됩니다. 팔리페리돈은 효소 유도 특성을 가질 것으로 예상되지 않습니다.
팔리페리돈은 고농도에서 P-gp의 약한 억제제입니다.
생체 내 데이터는 없으며 임상적 관련성은 알려져 있지 않습니다.
특정 모집단에서의 연구
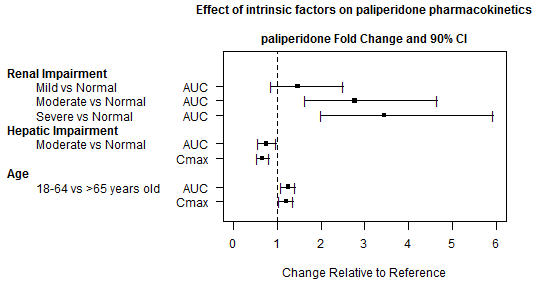
특정 모집단에서 INVEGA SUSTENNA에 대한 특정 약동학 연구는 수행되지 않았습니다. 모든 정보는 경구 팔리페리돈 연구에서 얻거나 경구 팔리페리돈 및 INVEGA SUSTENNA의 모집단 약동학 모델링을 기반으로 합니다. 특정 모집단(신장 장애, 간 장애 및 노인)에서 팔리페리돈의 노출은 그림 2에 요약되어 있습니다
[
.
중등도 간 장애가 있는 환자에게 팔리페리돈을 경구 투여한 후, 단백질 결합 감소로 인해 총 팔리페리돈 노출이 감소했지만, 유리 팔리페리돈의 혈장 농도는 건강한 피험자와 유사했습니다. 팔리페리돈은 중증 간 장애가 있는 환자에게 연구되지 않았습니다
[
.
노인 피험자에게 팔리페리돈을 경구 투여한 후, C
max및 AUC는 젊은 피험자에 비해 1.2배 증가했습니다. 그러나 크레아티닌 청소율이 나이와 관련하여 감소할 수 있습니다
[
.
그림 2: 팔리페리돈 약동학에 대한 내재적 요인의 영향.
인간 간 효소를 사용한
시험관 내 연구에 따르면 팔리페리돈은 CYP1A2의 기질이 아니므로 흡연은 팔리페리돈의 약동학에 영향을 미치지 않아야 합니다.
모집단 약동학 분석에서 여성에게서 흡수가 느린 것으로 나타났습니다. INVEGA SUSTENNA로 명백한 평형 상태에서, 골 농도는 남성과 여성 사이에서 유사했습니다.
과체중 및 비만 피험자에서 C
max가 낮은 것으로 나타났습니다. INVEGA SUSTENNA로 명백한 평형 상태에서, 골 농도는 정상 체중, 과체중 및 비만 피험자 사이에서 유사했습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
발암성
근육 내 주사된 팔리페리돈 팔미테이트의 발암 가능성은 랫드에서 평가되었습니다. 암컷 랫드에서 16, 47 및 94 mg/kg/월에서 유방샘 선암이 증가했으며, 이는 각각 mg/m
2체표면적 기준으로 INVEGA SUSTENNA의 MRHD인 234 mg의 0.6배, 2배 및 4배입니다. 무효용량은 확립되지 않았습니다. 수컷 랫드는 mg/m
2체표면적 기준으로 MRHD의 2배 및 4배에서 유방샘 선종, 섬유선종 및 선암이 증가했습니다. 팔리페리돈 팔미테이트를 사용한 마우스에서 발암성 연구는 수행되지 않았습니다.
랫드, 마우스 및 사람에서 팔리페리돈으로 광범위하게 전환되는 리스페리돈을 사용한 발암성 연구는 스위스 알비노 마우스와 위스타 랫드에서 수행되었습니다. 리스페리돈은 마우스의 경우 18개월 동안, 랫드의 경우 25개월 동안 매일 0.63, 2.5 및 10 mg/kg의 식이량으로 투여되었습니다. 수컷 마우스에서 최대 내성 용량은 달성되지 않았습니다. 뇌하수체 선종, 내분비 췌장 선종 및 유방샘 선암이 통계적으로 유의하게 증가했습니다. 이러한 종양에 대한 무효용량은 mg/m
2체표면적 기준으로 리스페리돈의 최대 권장 인간 용량보다 작거나 같았습니다(리스페리돈 포장 삽입물 참조). 다른 항정신병 약물을 장기간 투여한 후 설치류에서 유방, 뇌하수체 및 내분비 췌장 신생물이 증가한 것으로 나타났으며, 이는 장기간 도파민 D
2길항 작용 및 고프롤락틴혈증에 의해 매개되는 것으로 간주됩니다. 설치류에서 이러한 종양 발견의 인간 위험성은 불분명합니다
[
참조]
.
돌연변이 유발성
팔리페리돈 팔미테이트는
in vitroAmes 박테리아 역돌연변이 시험 또는 마우스 림프종 분석에서 유전 독성을 나타내지 않았습니다. 팔리페리돈은
in vitroAmes 박테리아 역돌연변이 시험, 마우스 림프종 분석 또는
in vivo랫드 골수 미세핵 시험에서 유전 독성을 나타내지 않았습니다.
생식능력 저해
팔리페리돈 팔미테이트를 사용한 생식 연구는 수행되지 않았습니다.
경구 팔리페리돈 생식 연구에서, mg/m
2체표면적 기준으로 MRHD의 2배인 최대 2.5 mg/kg/일의 경구 팔리페리돈 용량에서 임신한 암컷 랫드의 비율은 영향을 받지 않았습니다. 그러나, 2.5 mg/kg에서 이식 전 및 후 손실이 증가했고, 살아있는 배아 수가 약간 감소했으며, 이 용량은 경미한 모체 독성을 유발했습니다. 이러한 매개변수는 mg/m
2체표면적 기준으로 MRHD의 절반인 0.63 mg/kg 용량에서는 영향을 받지 않았습니다.
mg/m
2체표면적 기준으로 MRHD인 12 mg/일의 2배인 최대 경구 팔리페리돈 용량에서 수컷 랫드의 생식 능력은 영향을 받지 않았지만, 팔리페리돈을 사용한 정자 수 및 정자 생존율 연구는 수행되지 않았습니다. 개에서 리스페리돈을 사용한 만성 연구에서, 개와 사람에서 팔리페리돈으로 광범위하게 전환되는 리스페리돈은 시험된 모든 용량(0.31 mg/kg – 5.0 mg/kg)에서 혈청 테스토스테론과 정자 운동성 및 농도를 감소시켰습니다(리스페리돈의 MRHD인 16 mg/일의 0.6배에서 10배, mg/m
2체표면적 기준). 혈청 테스토스테론과 정자 매개변수는 부분적으로 회복되었지만, 마지막 관찰(치료 중단 후 2개월) 후에도 감소된 상태를 유지했습니다.
14 임상 연구
14.1 조현병
단기 단독 요법 (연구 1, 2, 3, 4)
INVEGA SUSTENNA의 조현병 급성 치료 효능은 DSM-IV 조현병 기준을 충족하는 급성 재발 성인 입원 환자를 대상으로 한 4건의 단기 (9주 1건, 13주 3건) 이중맹검, 무작위 배정, 위약 대조, 고정 용량 연구에서 평가되었습니다. 이 연구에서 INVEGA SUSTENNA의 고정 용량은 9주 연구에서는 1일, 8일, 36일에, 13주 연구에서는 64일에 추가로 투여되었으며, 즉 초기 2회 용량은 매주 간격으로, 그 후 유지 용량은 4주마다 투여되었습니다.
효능은 양성 및 음성 증후군 척도 (PANSS)의 총점을 사용하여 평가했습니다. PANSS는 조현병의 양성 증상 (7개 항목), 음성 증상 (7개 항목) 및 일반 정신병리 (16개 항목)을 측정하는 30개 항목 척도이며, 각 항목은 1 (없음)에서 7 (극심함)까지의 척도로 평가됩니다. PANSS 총점은 30에서 210까지입니다.
연구 1 (PSY-3007)은 13주 연구 (n=636)로, INVEGA SUSTENNA의 3가지 고정 용량 (234mg의 초기 삼각근 주사 후 39mg/4주, 156mg/4주 또는 234mg/4주 중 하나의 3가지 둔부 또는 삼각근 용량)을 위약과 비교했으며, INVEGA SUSTENNA의 3가지 용량 모두 위약보다 PANSS 총점 개선에 우수했습니다.
연구 2 (PSY-3003)은 또 다른 13주 연구 (n=349)로, INVEGA SUSTENNA의 3가지 고정 용량 (78mg/4주, 156mg/4주 및 234mg/4주)을 위약과 비교했으며, INVEGA SUSTENNA의 156mg/4주만 위약보다 PANSS 총점 개선에 우수했습니다.
연구 3 (PSY-3004)은 세 번째 13주 연구 (n=513)로, INVEGA SUSTENNA의 3가지 고정 용량 (39mg/4주, 78mg/4주 및 156mg/4주)을 위약과 비교했으며, INVEGA SUSTENNA의 3가지 용량 모두 위약보다 PANSS 총점 개선에 우수했습니다.
연구 4 (SCH-201)은 9주 연구 (n=197)로, INVEGA SUSTENNA의 2가지 고정 용량 (78mg/4주 및 156mg/4주)을 위약과 비교했으며, INVEGA SUSTENNA의 두 용량 모두 위약보다 PANSS 총점 개선에 우수했습니다.
4건의 단기 급성 조현병 연구에서 평균 기준선 PANSS 점수와 기준선에서의 평균 변화 요약은 표 14에 나와 있습니다.
| 연구 번호 | 치료 그룹 | 주요 효능 측정: PANSS 총점 | ||
|---|---|---|---|---|
| 평균 기준선 점수 (SD) | 기준선에서의 LS 평균 변화 (SE) | 위약에서 뺀 차이
* |
||
| SD: 표준 편차; SE: 표준 오차; LS 평균: 최소 제곱 평균; CI: 조정되지 않은 신뢰 구간. | ||||
| 연구 1 | INVEGA SUSTENNA (39mg/4주) | 86.9 (11.99) | -11.2 (1.69) | -5.1 (-9.01, -1.10) |
| INVEGA SUSTENNA (156mg/4주) | 86.2 (10.77) | -14.8 (1.68) | -8.7 (-12.62, -4.78) | |
| INVEGA SUSTENNA (234mg/4주) | 88.4 (11.70) | -15.9 (1.70) | -9.8 (-13.71, -5.85) | |
| 위약 | 86.8 (10.31) | -6.1 (1.69) | — | |
| 연구 2‡ | INVEGA SUSTENNA (78mg/4주) | 89.9 (10.78) | -6.9 (2.50) | -3.5 (-8.73, 1.77) |
| INVEGA SUSTENNA (156mg/4주) | 90.1 (11.66) | -10.4 (2.47) | -6.9 (-12.12, -1.68) | |
| 위약 | 92.4 (12.55) | -3.5 (2.15) | — | |
| 연구 3 | INVEGA SUSTENNA (39mg/4주) | 90.7 (12.25) | -19.8 (2.19) | -6.6 (-11.40, -1.73) |
| INVEGA SUSTENNA (78mg/4주) | 91.2 (12.02) | -19.2 (2.19) | -5.9 (-10.76, -1.07) | |
| INVEGA SUSTENNA (156mg/4주) | 90.8 (11.70) | -22.5 (2.18) | -9.2 (-14.07, -4.43) | |
| 위약 | 90.7 (12.22) | -13.3 (2.21) | — | |
| 연구 4 | INVEGA SUSTENNA (78 mg/4주) | 88.0 (12.39) | -4.6 (2.43) | -11.2 (-16.85, -5.57) |
| INVEGA SUSTENNA (156 mg/4주) | 85.2 (11.09) | -7.4 (2.45) | -14.0 (-19.51, -8.58) | |
| 위약 | 87.8 (13.90) | 6.6 (2.45) | — | |
유지 단독 요법 치료 (연구 5: PSY-3001)
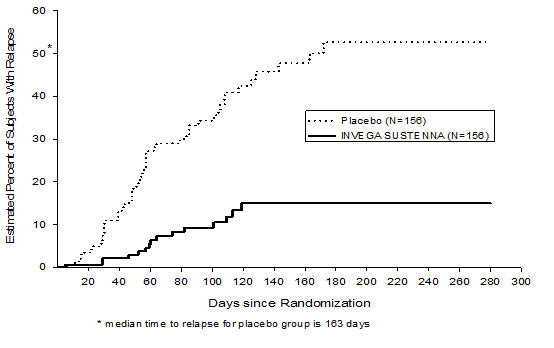
INVEGA SUSTENNA의 조현병 증상 조절 유지 효능은 DSM-IV 조현병 기준을 충족하는 성인 피험자를 대상으로 한 장기 이중맹검, 위약 대조, 유연 용량 연구에서 입증되었습니다. 이 연구에는 최소 12주 고정 용량 안정화 단계와 재발을 관찰하기 위한 무작위 배정, 위약 대조 단계가 포함되었습니다. 이중맹검 단계 동안 환자는 안정화 단계에서 받은 INVEGA SUSTENNA의 동일한 용량, 즉 4주마다 39mg, 78mg 또는 156mg을 투여받거나 위약을 투여받도록 무작위 배정되었습니다. 안정화된 총 410명의 환자를 조현병 증상 재발이 발생할 때까지 INVEGA SUSTENNA 또는 위약에 무작위 배정했습니다. 재발은 다음 중 하나 이상이 처음으로 나타나는 시점으로 사전 정의되었습니다. 정신과 입원, 총 PANSS 점수가 기준선 점수보다 ≥ 25% 증가(기준선 점수가 > 40인 경우) 또는 10점 증가(기준선 점수가 ≤ 40인 경우)가 2회 연속 평가에서 나타나는 경우, 고의적 자해, 폭력적 행동, 자살/타살 생각 또는 특정 PANSS 항목에 대한 2회 연속 평가에서 점수가 ≥ 5(최대 기준선 점수가 ≤ 3인 경우) 또는 ≥ 6(최대 기준선 점수가 4인 경우)인 경우. 주요 효능 변수는 재발까지의 시간이었습니다. 사전 계획된 중간 분석 결과 INVEGA SUSTENNA로 치료받은 환자에서 위약군에 비해 재발까지의 시간이 통계적으로 유의하게 길었으며, 효능 유지가 입증되었기 때문에 연구가 조기에 중단되었습니다. 위약군의 34% (34%) 피험자와 INVEGA SUSTENNA군의 10% 피험자에서 재발 사건이 발생했습니다. INVEGA SUSTENNA에 유리하게 치료군 간에 통계적으로 유의미한 차이가 있었습니다. 치료군별 재발까지의 시간에 대한 Kaplan-Meier 플롯은 그림 3에 나와 있습니다. 위약군 피험자의 재발까지의 시간은 INVEGA SUSTENNA군보다 통계적으로 유의하게 짧았습니다. 인구 하위 집단 검사 결과 성별, 연령 또는 인종에 따른 반응성에 임상적으로 유의미한 차이가 발견되지 않았습니다.
그림 3: 시간에 따른 재발이 있는 피험자의 누적 비율에 대한 Kaplan-Meier 플롯 (조현병 연구 5)
장기 비교 단독 요법 치료 대 경구 항정신병 약물 치료 (연구 6: SCH-3006)
INVEGA SUSTENNA의 치료 실패까지의 시간 지연 효능은 조현병을 앓고 있으며 과거에 수감된 경험이 있는 피험자를 대상으로 한 장기, 무작위 배정, 유연 용량 연구에서 입증되었습니다. 피험자는 최대 14일 동안 선별 검사를 받았으며, 그 후 15개월 치료 단계 동안 치료 실패를 관찰했습니다.
주요 종료점은 첫 번째 치료 실패까지의 시간이었습니다. 치료 실패는 다음 중 하나로 정의되었습니다. 체포 및/또는 수감, 정신과 입원, 안전성 또는 내약성으로 인한 항정신병 치료 중단, 효능이 불충분하여 다른 항정신병 치료로 보충, 임박한 정신과 입원을 예방하기 위해 정신과 서비스 수준을 높여야 할 필요성, 효능이 불충분하여 항정신병 치료 중단 또는 자살. 치료 실패는 치료 배정을 모르는 사건 모니터링 위원회(EMB)에서 결정했습니다. 총 444명의 피험자를 INVEGA SUSTENNA(N = 226; 중간 용량 156mg) 또는 최대 7가지 사전 지정된 유연 용량, 흔히 처방되는 경구 항정신병 약물(N = 218; 아리피프라졸, 할로페리돌, 올란자핀, 팔리페리돈, 퍼페나진, 퀴에티아핀 또는 리스페리돈) 중 하나에 무작위 배정했습니다. 경구 항정신병 약물의 선택은 연구자에 의해 환자에게 적절하다고 판단되었습니다. INVEGA SUSTENNA는 경구 항정신병 약물에 비해 첫 번째 치료 실패까지의 시간이 통계적으로 유의하게 길었습니다. INVEGA SUSTENNA와 항정신병 약물의 중간 치료 실패까지의 시간은 각각 416일과 226일이었습니다. 첫 번째 치료 실패까지의 시간에 대한 Kaplan-Meier 플롯은 그림 4에 나와 있습니다. 유형별 첫 번째 치료 실패 사건의 빈도는 표 15에 나와 있습니다. 첫 번째 체포 및/또는 수감 또는 정신과 입원까지의 시간도 INVEGA SUSTENNA군이 경구 항정신병군보다 통계적으로 유의하게 길었습니다.
그림 4: 조현병을 앓고 있으며 과거에 수감된 경험이 있는 피험자를 대상으로 한 장기, 무작위 배정, 유연 용량 연구에서 첫 번째 치료 실패까지의 시간에 대한 Kaplan-Meier 플롯 (조현병 연구 6)
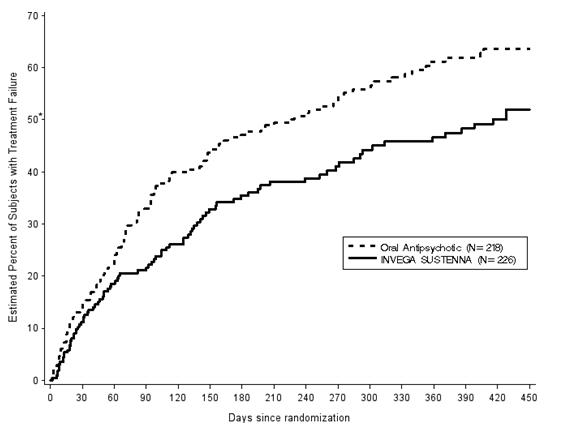
*첫 번째 치료 실패까지의 중간 시간: INVEGA SUSTENNA의 경우 416일; 경구 항정신병의 경우 226일
| 사건 유형 | INVEGA SUSTENNA N=226 빈도 (%) |
경구 항정신병 N=218 빈도 (%) |
위험 비율
* |
|---|---|---|---|
| First Treatment Failures | 90 (39.8%) | 117 (53.7%) | 0.70 [0.53, 0.92] |
| First Treatment Failure Component Events | |||
|
48 (21.2%) | 64 (29.4%) | |
|
18 (8.0%) | 26 (11.9%) | |
|
15 (6.6%) | 8 (3.7%) | |
|
5 (2.2%) | 6 (2.8%) | |
|
3 (1.3%) | 4 (1.8%) | |
|
1 (0.4%) | 9 (4.1%) | |
|
0 | 0 | |
| Arrest and/or Incarceration or Psychiatric Hospitalization Events, regardless of whether they were first events† | 76 (33.6%) | 98 (45.0%) | 0.70 [0.52, 0.94] |
14.2 조울증
유지 치료 – 단독 요법 및 기분 안정제 또는 항우울제 병용 요법 (SAff 연구 1: SCA-3004)
INVEGA SUSTENNA의 조울증 증상 조절 유지 효능은 DSM-IV 기준에 따른 조울증 진단을 받은 성인 대상으로 재발을 지연시키기 위해 설계된 장기 이중맹검, 위약 대조, 유연 용량 무작위 배정 철회 연구에서 입증되었습니다. 이 연구에는 조울증 양극성 및 우울 유형을 가진 대상이 포함되었습니다. 대상은 INVEGA SUSTENNA를 단독 요법으로 또는 항우울제 또는 기분 안정제의 안정적인 용량과 병용하여 투여받았습니다.
이 연구에는 1) 급성 정신병 증상 악화; 2) 망상, 개념적 혼란, 환각 행동, 흥분, 의심/박해, 적대감, 비협조, 긴장, 충동 조절 불량 등 PANSS 항목 3개 이상에서 점수가 ≥4; 3) Young Mania Rating Scale (YMRS) 및/ 또는 Hamilton Rating Scale for Depression, 21-item version (HAM-D-21)에서 현저한 기분 증상 ≥16을 보인 총 667명의 대상을 모집한 13주 오픈 라벨 유연 용량 (INVEGA SUSTENNA 78mg, 117mg, 156mg 또는 234mg) 리드인 기간이 포함되었습니다. 대상의 연령은 19세에서 66세(평균 39.5세)였으며, 53.5%가 남성이었습니다. 오픈 라벨 등록 시 PANSS 총점의 평균 점수는 85.8(범위 42~128), HAM-D-21은 20.4(범위 3~43), YMRS는 18.6(범위 0~50), CGI-S-SCA는 4.4(범위 2~6)였습니다.
13주 오픈 라벨 유연 용량 INVEGA SUSTENNA 치료 후, 432명의 대상이 안정화 기준(PANSS 총점 ≤70, YMRS ≤12, HAM-D-21 ≤12)을 충족했으며, 12주 오픈 라벨 고정 용량 안정화 기간으로 진행되었습니다.
12주 연속으로 안정화 기준을 충족한 총 334명의 대상은 15개월 이중맹검 유지 기간 동안 동일한 용량의 INVEGA SUSTENNA를 계속 투여받거나 위약을 투여받도록 (1:1) 무작위 배정되었습니다. INVEGA SUSTENNA를 무작위 배정받은 164명의 대상에서 용량 분포는 78mg(4.9%), 117mg(9.8%), 156mg(47.0%), 234mg(38.4%)였습니다. 주요 효능 변수는 재발까지의 시간이었습니다. 재발은 다음 중 하나 이상이 처음 발생한 경우로 정의되었습니다. 1) 정신과적 입원; 2) 입원을 피하기 위해 사용된 개입; 3) 임상적으로 유의미한 자해, 자살 또는 타살 생각 또는 폭력적 행동; 4) 다음 개별 PANSS 항목 중 하나 이상에서 ≥6 점수(무작위 배정 시 점수가 ≤4인 경우): 망상, 개념적 혼란, 환각 행동, 흥분, 의심/박해, 적대감, 비협조 또는 충동 조절 불량; 5) 7일 이내에 연속적으로 2회 평가에서: PANSS 총점이 ≥25% 증가(무작위 배정 시 점수가 >45인 경우) 또는 ≥10점 증가(무작위 배정 시 점수가 ≤45인 경우); 다음 개별 PANSS 항목 중 하나 이상에서 ≥5 점수(무작위 배정 시 점수가 ≤3인 경우): 망상, 개념적 혼란, 환각 행동, 흥분, 의심/박해, 적대감, 비협조 또는 충동 조절 불량; CGI-S-SCA 전반적인 점수가 ≥2점 증가(무작위 배정 시 점수가 1[병이 아님]에서 3[경미한 병]인 경우) 또는 ≥1점 증가(무작위 배정 시 점수가 ≥4[중등도 이상의 병]인 경우).
INVEGA SUSTENNA를 투여받은 그룹에서 재발까지의 시간이 통계적으로 유의미하게 차이가 있었습니다. 치료 그룹별 재발까지의 시간에 대한 Kaplan-Meier 플롯은 그림 5에 나와 있습니다.
그림 5: 시간 경과에 따른 재발 대상의 누적 비율에 대한 Kaplan-Meier 플롯 (SAff 연구 1)
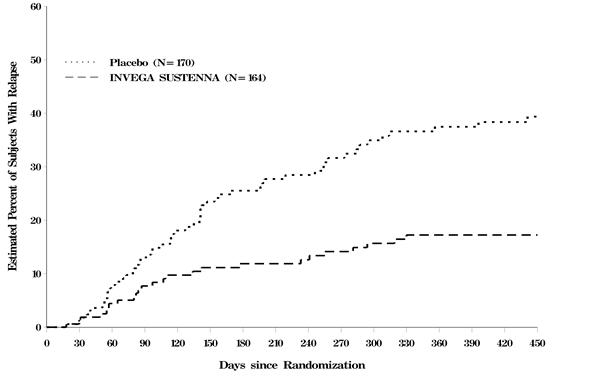
표 16은 전체 모집단, 하위 그룹(단독 요법 대 병용 요법) 및 재발 첫 발생 시 증상 유형별로 재발 대상 수를 요약합니다.
| 재발한 대상 수 (%) | ||
|---|---|---|
| 위약 N=170 |
INVEGA SUSTENNA N=164 |
|
| 모든 대상 | 57 (33.5%) | 25 (15.2%) |
| 단독 요법 하위 그룹 | N=73 24 (32.9%) |
N=78 9 (11.5%) |
| 항우울제 또는 기분 안정제 병용 요법 하위 그룹 | N=97 33 (34.0%) |
N=86 16 (18.6%) |
| 정신병 증상* | 53 (31.2%) | 21 (12.8%) |
| 기분 증상† | ||
| 모든 기분 증상 | 48 (28.2%) | 18 (11.0%) |
| 조증 | 16 (9.4%) | 5 (3.0%) |
| 우울증 | 23 (13.5%) | 8 (4.9%) |
| 혼합 | 9 (5.3%) | 5 (3.0%) |
16 제공/보관 및 취급 방법
INVEGA SUSTENNA
®는 39 mg/0.25 mL, 78 mg/0.5 mL, 117 mg/0.75 mL, 156 mg/mL 및 234 mg/1.5 mL paliperidone palmitate의 단일 용량 사전 충전 주사기에 근육 주사를 위한 백색에서 거의 백색의 무균 수성 장기 방출 현탁액으로 제공됩니다. 단일 사용 키트에는 사전 충전 주사기와 2개의 안전 바늘(1 ½ 인치 22 게이지 안전 바늘과 1 인치 23 게이지 안전 바늘)이 포함되어 있습니다.
| 39 mg paliperidone palmitate kit | (NDC 50458-560-01) |
| 78 mg paliperidone palmitate kit | (NDC 50458-561-01) |
| 117 mg paliperidone palmitate kit | (NDC 50458-562-01) |
| 156 mg paliperidone palmitate kit | (NDC 50458-563-01) |
| 234 mg paliperidone palmitate kit | (NDC 50458-564-01) |
Storage and Handling
실온(25°C, 77°F)에 보관하십시오. 15°C와 30°C(59°F와 86°F) 사이의 변동은 허용됩니다. 다른 제품이나 희석제와 혼합하지 마십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(환자 정보)을 읽도록 지시하십시오.
악성 신경 이완 증후군(NMS)
환자에게 항정신병 약물 투여와 관련하여 보고된 잠재적으로 치명적인 부작용인 악성 신경 이완 증후군(NMS)에 대해 알려주십시오. 환자, 가족 구성원 또는 보호자에게 고열, 근육 강직, 섬망을 포함한 의식 변화, 자율 신경 불안정(불규칙적인 맥박 또는 혈압, 빈맥, 발한 및 심장 부정맥)의 징후와 증상이 나타나면 의료 서비스 제공자에게 연락하거나 응급실로 가도록 지시하십시오.
[
경고 및 주의 사항(5.3) 참조].
지연성 운동 장애
환자에게 지연성 운동 장애의 징후와 증상에 대해 알려주고 이러한 비정상적인 움직임이 발생하면 의료 서비스 제공자에게 연락하도록 지시하십시오.
[
경고 및 주의 사항(5.5) 참조].
대사 변화
환자에게 대사 변화의 위험, 고혈당증 및 당뇨병의 증상을 인식하는 방법, 혈당, 지질 및 체중을 포함한 특정 모니터링의 필요성에 대해 교육하십시오.
[
경고 및 주의 사항(5.6) 참조].
백혈구 감소증/호중구 감소증
기존의 낮은 백혈구 수 또는 약물 유발 백혈구 감소증/호중구 감소증의 병력이 있는 환자에게 INVEGA SUSTENNA를 복용하는 동안 CBC를 모니터링해야 한다고 알려주십시오.
[
경고 및 주의 사항(5.9) 참조]
.
고프롤락틴혈증
환자에게 INVEGA SUSTENNA의 만성 사용과 관련될 수 있는 고프롤락틴혈증의 징후와 증상에 대해 알려주십시오. 다음과 같은 증상이 나타나면 의료 서비스를 받도록 지시하십시오. 여성의 경우 무월경 또는 유즙 분비, 남성의 경우 발기 부전 또는 유방 비대.
[
경고 및 주의 사항(5.10) 참조]
.
인지 및 운동 기능 저하
환자에게 INVEGA SUSTENNA 치료가 자신에게 부정적인 영향을 미치지 않는다고 확신할 때까지 위험한 기계 작동 또는 자동차 운전과 같이 정신적 각성이 필요한 활동을 수행하는 것에 대해 주의를 기울이도록 지시하십시오.
[
경고 및 주의 사항(5.11) 참조]
.
프라이아피즘
환자에게 고통스럽거나 지속적인 발기(프라이아피즘)의 가능성에 대해 알려주십시오. 프라이아피즘이 발생하면 즉시 의료 서비스를 받도록 지시하십시오.
[
경고 및 주의 사항(5.14) 참조]
.
동반 약물
환자에게 임상적으로 중요한 상호 작용이 발생할 수 있으므로 처방전 또는 일반 의약품을 복용하고 있거나 복용할 계획이 있다면 의료 서비스 제공자에게 알리도록 지시하십시오.
[
약물 상호 작용(7) 참조]
.
임신
환자에게 INVEGA SUSTENNA 치료 중 임신하거나 임신할 계획이 있다면 의료 서비스 제공자에게 알리도록 지시하십시오. 환자에게 INVEGA SUSTENNA가 신생아에게 추체외로 증상 및/또는 금단 증상을 유발할 수 있다고 알려주십시오. 환자에게 임신 중 INVEGA SUSTENNA에 노출된 여성의 임신 결과를 모니터링하는 임신 레지스트리가 있다고 알려주십시오.
[
.
수유
INVEGA SUSTENNA를 사용하는 모유 수유 여성에게 유아를 졸음, 발육 부진, 떨림 및 추체외로 증상(떨림 및 비정상적인 근육 움직임)에 대해 모니터링하고 이러한 징후가 나타나면 의료 서비스를 받도록 지시하십시오.
[
.
불임
생식 가능 여성에게 INVEGA SUSTENNA가 혈청 프로락틴 수치 증가로 인해 생식 능력을 저해할 수 있다고 알려주십시오. 생식 능력에 대한 영향은 가역적입니다.
[
특정 인구 집단에서의 사용(8.3) 참조].
SPL 미분류 섹션
INVEGA SUSTENNA (팔리페리돈 팔미테이트) 서방형 주사 현탁액
아일랜드 제품
제조사:
Janssen Pharmaceutica NV
벨기에 Beerse
제조 판매:
Janssen Pharmaceuticals, Inc.
미국 뉴저지주 Titusville 08560
특허 정보: www.janssenpatents.com
©2009 Janssen Pharmaceutical Companies
환자 안내문
| This Patient Information has been approved by the U.S. Food and Drug Administration. Revised: September 2024 | |
|
환자 정보 ®(인-베이-가 서스-텐-어)
|
|
|
INVEGA SUSTENNA에 대해 제가 알아야 할 가장 중요한 정보는 무엇입니까? INVEGA SUSTENNA는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
|
|
INVEGA SUSTENNA는 무엇입니까? INVEGA SUSTENNA는 의료 전문가가 주사로 투여하는 처방약으로 다음을 치료하는 데 사용됩니다. |
|
|
|
|
INVEGA SUSTENNA가 18세 미만의 어린이에게 안전하고 효과적인지는 알려져 있지 않습니다. |
|
|
누가 INVEGA SUSTENNA를 투여받으면 안 됩니까? 다음과 같은 경우 INVEGA SUSTENNA를 투여받지 마십시오.
|
|
|
INVEGA SUSTENNA를 투여받기 전에 의료 전문가에게 무엇을 알려야 합니까? INVEGA SUSTENNA를 투여받기 전에 다음을 포함하여 모든 의학적 상태에 대해 의료 전문가에게 알리십시오.
처방약과 일반 의약품, 비타민, 허브 보충제를 포함하여 복용하는 모든 약에 대해 의료 전문가에게 알리십시오. 복용하는 약을 알고 있어야 합니다. 새 약을 받으면 의료 전문가나 약사에게 보여줄 수 있도록 목록을 보관하십시오. |
|
|
INVEGA SUSTENNA는 어떻게 투여받습니까?
|
|
|
INVEGA SUSTENNA를 투여받는 동안 무엇을 피해야 합니까?
|
|
|
인베가 서스테나의 가능한 부작용은 무엇입니까? 인베가 서스테나는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
|
|
인베가 서스테나의 가장 흔한 부작용은 다음과 같습니다.주사 부위 반응, 졸음 또는 졸음, 현기증, 불안감 또는 끊임없이 움직여야 할 필요성, 떨림(흔들림), 셔플링, 제어되지 않는 비자발적 움직임 및 비정상적인 눈 움직임을 포함한 비정상적인 근육 움직임. 귀찮거나 사라지지 않는 부작용이 있으면 의료 서비스 제공자에게 알리십시오. 이것이 인베가 서스테나의 가능한 모든 부작용은 아닙니다. 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의하십시오. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. 1-800-FDA-1088로 FDA에 부작용을 보고할 수 있습니다. |
|
|
인베가 서스테나의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 전단지에 나열된 것 이외의 목적으로 처방되기도 합니다. 처방되지 않은 질환에 인베가 서스테나를 사용하지 마십시오. 다른 사람에게 인베가 서스테나를 투여하지 마십시오. 증상이 같더라도 해를 입을 수 있습니다. 의료 서비스 제공자를 위해 작성된 인베가 서스테나에 대한 정보는 약사 또는 의료 서비스 제공자에게 문의할 수 있습니다. 이 환자 정보 전단지는 인베가 서스테나에 대한 가장 중요한 정보를 요약한 것입니다. 자세한 내용은 의료 서비스 제공자에게 문의하십시오. 의료 서비스 제공자를 위해 작성된 자세한 내용은 의료 서비스 제공자 또는 약사에게 문의할 수 있습니다. 자세한 내용은 www.invegasustenna.com을 방문하거나 1-800-526-7736으로 전화하십시오. |
|
|
인베가 서스테나의 성분은 무엇입니까? 활성 성분: 팔리페리돈 팔미테이트 비활성 성분:폴리소르베이트 20, 폴리에틸렌 글리콜 4000, 시트르산 모노하이드레이트, 인산이수소나트륨 모노하이드레이트, 수산화나트륨 및 주사용수 제조원: Janssen Pharmaceutica NV, Beerse, Belgium www.janssenpatents.com |
|
사용 지침
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
지속 방출 주사용 현탁액
전문의약품
1회 사용만 가능
사용 전에 전체 사용 지침을 주의 깊게 읽어보십시오.
델토이드 및 둔부 근육 내 주사만 가능
동봉된 전체 포장 삽입 첨부 문서를 참조하십시오.
중요한 리소스
추가 정보는
www.invegasustenna.com을 방문하거나 얀센 제약(Janssen Pharmaceuticals, Inc.)에 1-800-526-7736으로 전화하십시오.
키트 내용물
각 주사는 의료 전문가만 투여해야 합니다. 키트에는 근육 내 주사를 위한 사전 충전 주사기와 2개의 안전 바늘(1.5인치 22게이지 바늘과 1인치 23게이지 바늘)이 들어 있습니다. INVEGA SUSTENNA는 1회 사용만 가능합니다.
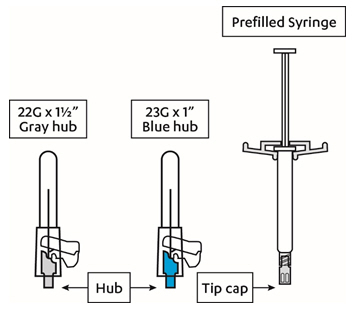
INVEGA SUSTENNA는 근육 내 주사만을 위해 사용됩니다. 천천히 근육 깊숙이 주사하십시오. 실수로 혈관에 주사하지 않도록 주의하십시오. 각 주사는 의료 전문가가 투여해야 합니다. 1회 주사로 투여해야 합니다. 나눠서 투여하지 마십시오. 혈관 내 또는 피하 주사하지 마십시오.
사용 지침
- 균일한 현탁액을 얻기 위해 주사기를 최소 10초 동안 강하게 흔들어 주십시오.
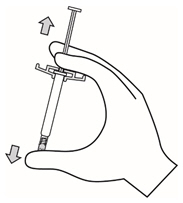
- 적절한 바늘을 선택하십시오.
델토이드 주사의 경우:- 환자의 체중이 90kg 미만인 경우 1인치
23게이지 바늘(
파란색허브가 있는 바늘)을 사용하십시오.
- 환자의 체중이 90kg 이상인 경우 1.5인치
22게이지 바늘(
회색허브가 있는 바늘)을 사용하십시오.
둔부 주사의 경우:
환자의 체중에 관계없이 1.5인치22게이지 바늘(
회색허브가 있는 바늘)을 사용하십시오.
- 환자의 체중이 90kg 미만인 경우 1인치
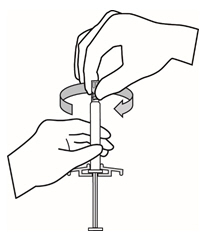
- 주사기의 팁 캡이 위로 향하도록 잡습니다. 부드럽게 비틀어서 고무 팁 캡을 제거하십시오.
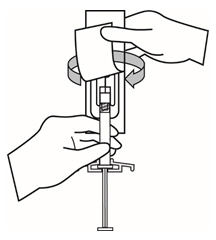
- 안전 바늘 포장을 반쯤 벗겨냅니다. 플라스틱 벗겨내기 포장을 사용하여 바늘 덮개를 잡습니다. 주사기를 위로 향하게 잡습니다. 바늘 허브에 균열이나 손상이 발생하지 않도록 부드럽게 비틀어서 안전 바늘을 주사기에 연결합니다. 투여 전에 항상 손상이나 누출 여부를 확인하십시오.
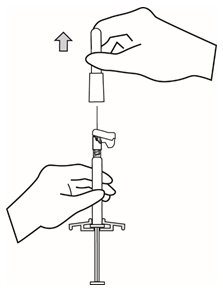
- 바늘이 주사기에서 느슨해질 수 있으므로 덮개를 비틀지 말고 직선으로 잡아당겨 바늘에서 덮개를 분리하십시오.
- 주사기를 바늘이 부착된 상태로 직립 상태로 놓아 공기를 제거합니다. 플런저 로드를 조심스럽게 앞으로 밀어 주사기를 공기 제거합니다.
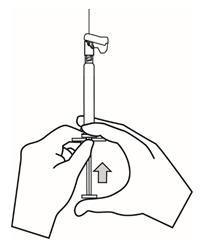
- 전체 내용물을 천천히 환자의 선택된 델토이드 또는 둔부 근육에 근육 내로 깊숙이 주사하십시오. 다른 경로로 투여하지 마십시오.
- 주사가 완료되면 한 손의 엄지 또는 손가락(h1, h2) 또는 평평한 표면(h3)을 사용하여 바늘 보호 시스템을 활성화하십시오. ‘딸깍’ 소리가 들리면 바늘 보호 시스템이 완전히 활성화됩니다. 주사기를 바늘과 함께 적절히 폐기하십시오.
어린이의 손이 닿지 않는 곳에 보관하십시오.
| h1 | |
 |
|
| h2 | |
 |
|
| h3 | |
 |
|
제조:
얀센 제약(Janssen Pharmaceuticals, Inc.)
미국 뉴저지주 타이틀스빌 08560
특허 정보는 www.janssenpatents.com에서 확인하십시오.
©2009 얀센 제약 회사(Janssen Pharmaceutical Companies)
본 사용 지침은 미국 식품의약국(FDA)의 승인을 받았습니다.
개정: 2024년 9월
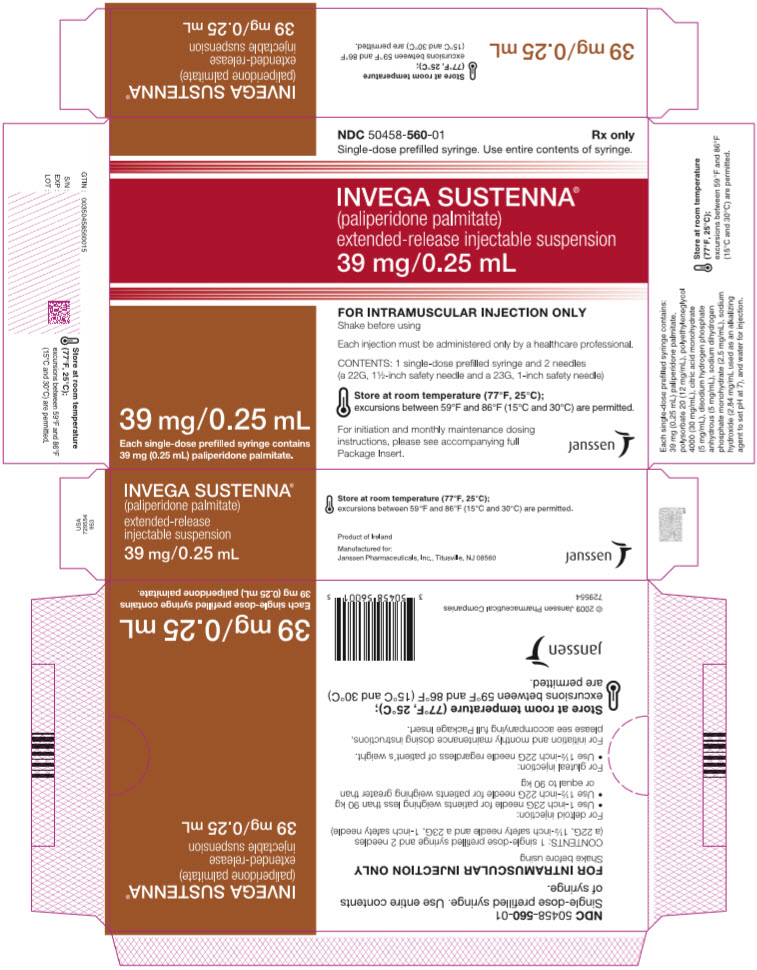
주요 표시면 – 39mg 주사기 키트
NDC 50458-560-01
Rx only
단회용 미리 채워진 주사기. 주사기의 내용물을 모두 사용하십시오.
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
서방형 주사용 현탁액
39 mg/0.25 mL
39 mg/0.25 mL
단회용 미리 채워진 주사기 1개에는
팔리페리돈 팔미테이트 39 mg(0.25 mL)이 들어 있습니다.
근육 주사 전용
사용 전에 흔들어 주십시오
각 주사는 의료 전문가만 투여해야 합니다.
내용물: 단회용 미리 채워진 주사기 1개 및 바늘 2개
(22G, 1½인치 안전 바늘 및 23G, 1인치 안전 바늘)
실온(77°F, 25°C)에 보관하십시오.
59°F와 86°F(15°C와 30°C) 사이의 온도 변화는 허용됩니다.
시작 및 매월 유지 용량
지침은 동봉된 전체
포장 삽입 팜플렛을 참조하십시오.
janssen
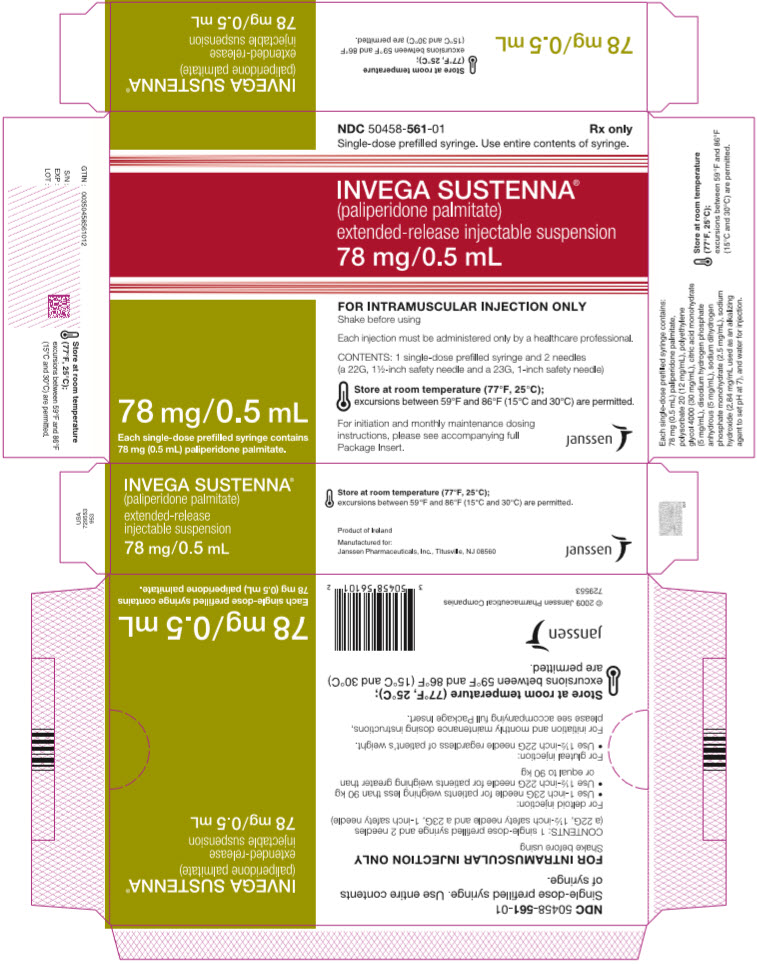
주요 표시 부분 – 78mg 주사기 키트
NDC 50458-561-01
Rx only
단회용 미리 채워진 주사기. 주사기의 내용물을 모두 사용하십시오.
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
서방형 주사용 현탁액
78 mg/0.5 mL
78 mg/0.5 mL
단회용 미리 채워진 주사기 1개에는
팔리페리돈 팔미테이트 78 mg(0.5 mL)이 들어 있습니다.
근육 주사 전용
사용 전 흔들어 주십시오
각 주사는 의료 전문가만이 투여해야 합니다.
내용물: 단회용 미리 채워진 주사기 1개 및 바늘 2개
(22G, 1½인치 안전 바늘 및 23G, 1인치 안전 바늘)
실온(77°F, 25°C)에 보관하십시오.
59°F와 86°F(15°C와 30°C) 사이의 온도 변화는 허용됩니다.
시작 및 매월 유지 용량
지침은 동봉된 전체
포장 삽입 팸플릿을 참조하십시오.
janssen
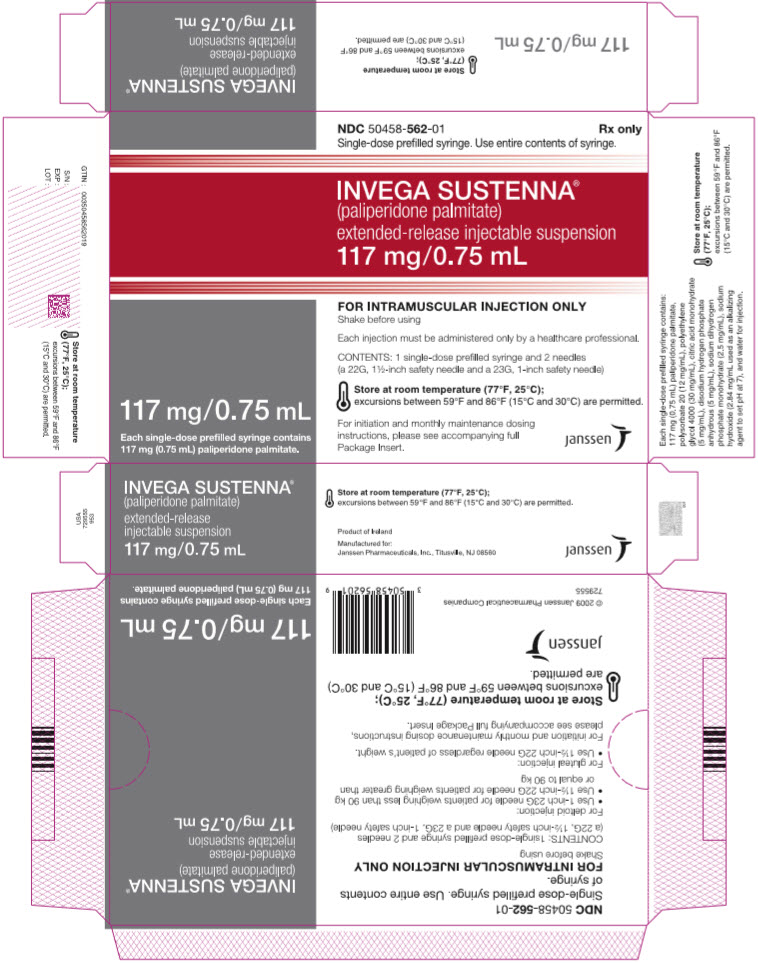
주요 표시면 – 117mg 주사기 키트
NDC 50458-562-01
Rx only
단회용 미리 채워진 주사기. 주사기의 내용물을 모두 사용하십시오.
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
서방형 주사용 현탁액
117 mg/0.75 mL
117 mg/0.75 mL
단회용 미리 채워진 주사기 1개에는
팔리페리돈 팔미테이트 117 mg (0.75 mL)이 들어 있습니다.
근육 주사 전용
사용 전 흔들어 주십시오
각 주사는 의료 전문가만이 투여해야 합니다.
내용물: 단회용 미리 채워진 주사기 1개 및 바늘 2개
(22G, 1½인치 안전 바늘 및 23G, 1인치 안전 바늘)
실온 (77°F, 25°C)에 보관하십시오.
59°F와 86°F (15°C와 30°C) 사이의 온도 변화는 허용됩니다.
시작 및 매월 유지 용량
지침은 동봉된 전체
포장 삽입 팸플릿을 참조하십시오.
janssen
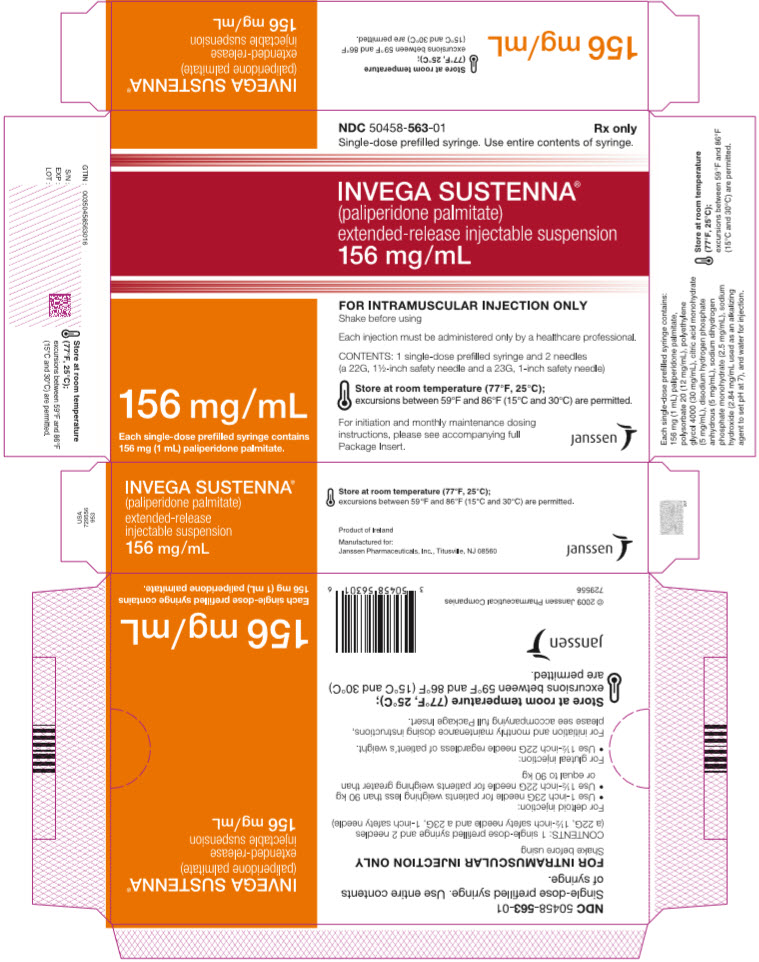
주요 표시면 – 156mg 주사기 키트
NDC 50458-563-01
Rx only
단회용 미리 채워진 주사기. 주사기의 내용물을 모두 사용하십시오.
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
지속 방출 주사용 현탁액
156 mg/mL
156 mg/mL
단회용 미리 채워진 주사기 1개에는
팔리페리돈 팔미테이트 156 mg (1 mL)이 들어 있습니다.
근육 주사 전용
사용 전에 흔들어 주십시오
각 주사는 의료 전문가만이 투여해야 합니다.
내용물: 단회용 미리 채워진 주사기 1개 및 바늘 2개
(22G, 1½인치 안전 바늘 및 23G, 1인치 안전 바늘)
실온 (77°F, 25°C)에 보관하십시오.
59°F와 86°F (15°C와 30°C) 사이의 온도 변화는 허용됩니다.
시작 및 매월 유지 용량
지침은 동봉된 전체
포장 삽입 팜플렛을 참조하십시오.
janssen
주요 표시면 – 234mg 주사기 키트
NDC 50458-564-01
Rx only
단회용 미리 채워진 주사기. 주사기의 내용물을 모두 사용하십시오.
INVEGA SUSTENNA
®
(팔리페리돈 팔미테이트)
서방형 주사용 현탁액
234 mg/1.5 mL
234 mg/1.5 mL
단회용 미리 채워진 주사기 1개에는
팔리페리돈 팔미테이트 234 mg (1.5 mL)이 들어 있습니다.
근육 주사 전용
사용 전에 흔들어 주십시오.
각 주사는 의료 전문가만이 투여해야 합니다.
내용물: 단회용 미리 채워진 주사기 1개 및 바늘 2개
(22G, 1½인치 안전 바늘 및 23G, 1인치 안전 바늘)
실온 (77°F, 25°C)에 보관하십시오.
59°F와 86°F (15°C와 30°C) 사이의 온도 변화는 허용됩니다.
시작 및 매월 유지 용량
지침은 동봉된 전체
포장 삽입 팜플렛을 참조하십시오.
janssen


