의약품 제조업체: Janssen Biotech, Inc. (Updated: 2024-10-31)
처방 정보의 주요 내용
DARZALEX
®(다라투무맙) 주사, 정맥 주사용
미국 최초 승인: 2015
적응증 및 사용법
DARZALEX는 다발성 골수종 성인 환자의 치료에 사용되는 CD38 표적 세포 용해 항체입니다.
- 자가 조혈모세포 이식이 불가능한 새로 진단된 환자와 적어도 1회 이상의 치료를 받은 재발 또는 불응성 다발성 골수종 환자에서 레날리도마이드 및 덱사메타손과 병용
- 자가 조혈모세포 이식이 불가능한 새로 진단된 환자에서 보르테조밉, 멜팔란 및 프레드니손과 병용
- 자가 조혈모세포 이식이 가능한 새로 진단된 환자에서 보르테조밉, 탈리도마이드 및 덱사메타손과 병용
- 적어도 1회 이상의 치료를 받은 환자에서 보르테조밉 및 덱사메타손과 병용
- 1~3회의 치료를 받은 재발 또는 불응성 다발성 골수종 환자에서 카필조밉 및 덱사메타손과 병용
- 레날리도마이드 및 프로테아좀 억제제를 포함한 적어도 2회 이상의 치료를 받은 환자에서 포말리도마이드 및 덱사메타손과 병용
- 프로테아좀 억제제(PI) 및 면역조절제를 포함한 적어도 3회 이상의 치료를 받았거나 PI 및 면역조절제에 이중 불응성인 환자에서 단독 요법. (
1)
투여량 및 투여 방법
금기 사항
다라투무맙 또는 제제의 구성 성분에 대한 중증 과민 반응의 병력이 있는 환자. (
4)
경고 및 주의 사항
-
주입 관련 반응: 모든 중증도의 주입 관련 반응에 대해 DARZALEX 주입을 중단하십시오. 아나필락시스 반응 또는 생명을 위협하는 주입 관련 반응의 경우 주입을 영구히 중단하고 적절한 응급 처치를 실시하십시오. (
2.4,
5.1)
-
교차 적합 및 적혈구 항체 선별 방해: 치료 시작 전에 환자의 혈액형 및 선별 검사를 실시하십시오. 환자가 DARZALEX를 투여받았음을 혈액 은행에 알리십시오. (
5.2,
7.1)
-
호중구 감소증: 치료 중에 정기적으로 완전 혈구 수를 모니터링하십시오. 호중구 감소증이 있는 환자의 경우 감염 징후를 모니터링하십시오. 호중구가 회복될 때까지 용량 지연이 필요할 수 있습니다. (
5.3)
-
혈소판 감소증: 치료 중에 정기적으로 완전 혈구 수를 모니터링하십시오. 혈소판이 회복될 때까지 용량 지연이 필요할 수 있습니다. (
5.4)
-
태아 독성: 태아에게 해를 끼칠 수 있습니다. 임산부에게 태아에 대한 잠재적 위험을 알리고 임신 가능성이 있는 여성에게는 효과적인 피임법을 사용하도록 조언하십시오. (
5.6,
8.1,
8.3)
부작용
가장 흔하게 보고된 부작용(발생률 ≥20%)은 상기도 감염, 호중구 감소증, 주입 관련 반응, 혈소판 감소증, 설사, 변비, 빈혈, 말초 감각 신경병증, 피로, 말초 부종, 메스꺼움, 기침, 발열, 호흡 곤란 및 무력증입니다. (
6.1)
의심되는 부작용을 보고하려면 Janssen Biotech, Inc.에 1-800-526-7736(1-800-JANSSEN) 또는 FDA에 1-800-FDA-1088 또는
www.fda.gov/medwatch로 연락하십시오.
17을 참조하십시오. 환자 상담 정보 및 FDA 승인 환자 라벨.
개정: 2024년 7월
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
1 적응증 및 용법 (INDICATIONS AND USAGE)
2 용량 및 투여 (DOSAGE AND ADMINISTRATION)
2.1 중요 투여 정보 (Important Dosing Information)
2.2 권장 용량 (Recommended Dosage)
2.3 권장 병용 약물 (Recommended Concomitant Medications)
2.4 이상반응에 대한 용량 조정 (Dosage Modifications for Adverse Reactions)
2.5 준비 및 투여 (Preparation and Administration)
3 제형 및 함량 (DOSAGE FORMS AND STRENGTHS)
4 금기 (CONTRAINDICATIONS)
5 경고 및 주의사항 (WARNINGS AND PRECAUTIONS)
5.1 주입 관련 반응 (Infusion-Related Reactions)
5.2 혈청학적 검사 간섭 (Interference with Serological Testing)
5.3 호중구 감소증 (Neutropenia)
5.4 혈소판 감소증 (Thrombocytopenia)
5.5 완전 반응 측정 간섭 (Interference with Determination of Complete Response)
5.6 배아-태아 독성 (Embryo-Fetal Toxicity)
6 이상반응 (ADVERSE REACTIONS)
6.1 임상시험 경험 (Clinical Trials Experience)
6.2 시판 후 경험 (Postmarketing Experience)
7 약물 상호작용 (DRUG INTERACTIONS)
7.1 Daratumumab의 실험실 검사에 대한 영향 (Effects of Daratumumab on Laboratory Tests)
8 특정 집단에서의 사용 (USE IN SPECIFIC POPULATIONS)
8.1 임신 (Pregnancy)
8.2 수유 (Lactation)
8.3 가임기 여성 및 남성 (Females and Males of Reproductive Potential)
8.4 소아에서의 사용 (Pediatric Use)
8.5 노인에서의 사용 (Geriatric Use)
11 설명 (DESCRIPTION)
12 임상 약리학 (CLINICAL PHARMACOLOGY)
12.1 작용 기전 (Mechanism of Action)
12.2 약력학 (Pharmacodynamics)
12.3 약동학 (Pharmacokinetics)
12.6 면역원성 (Immunogenicity)
13 비임상 독성학 (NONCLINICAL TOXICOLOGY)
13.1 발암성, 돌연변이 유발성, 생식능력 장애 (Carcinogenesis, Mutagenesis, Impairment of Fertility)
14 임상 연구 (CLINICAL STUDIES)
14.1 새롭게 진단된 다발성 골수종 (Newly Diagnosed Multiple Myeloma)
14.2 재발/불응성 다발성 골수종 (Relapsed/Refractory Multiple Myeloma)
15 참고문헌 (REFERENCES)
16 공급/보관 및 취급 방법 (HOW SUPPLIED/STORAGE AND HANDLING)
17 환자 상담 정보 (PATIENT COUNSELING INFORMATION)
- *
- 전체 처방 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 용법
DARZALEX는 다음과 같은 다발성 골수종 성인 환자의 치료에 사용됩니다.
- 자가 조혈모세포 이식이 불가능한 새로 진단된 환자 및 적어도 1회 이상의 치료를 받은 재발성 또는 불응성 다발성 골수종 환자에서 레날리도마이드 및 덱사메타손과 병용.
- 자가 조혈모세포 이식이 불가능한 새로 진단된 환자에서 보르테조밉, 멜팔란 및 프레드니손과 병용.
- 자가 조혈모세포 이식이 가능한 새로 진단된 환자에서 보르테조밉, 탈리도마이드 및 덱사메타손과 병용.
- 적어도 1회 이상의 치료를 받은 환자에서 보르테조밉 및 덱사메타손과 병용.
- 1~3회의 치료를 받은 재발성 또는 불응성 다발성 골수종 환자에서 카필조밉 및 덱사메타손과 병용.
- 레날리도마이드 및 프로테아좀 억제제를 포함한 적어도 2회 이상의 치료를 받은 환자에서 포말리도마이드 및 덱사메타손과 병용.
- 프로테아좀 억제제(PI) 및 면역조절제를 포함한 적어도 3회 이상의 치료를 받았거나 PI 및 면역조절제에 이중 불응성인 환자에서 단독 요법.
2 투여 및 관리
2.1 중요한 투약 정보
- 투약 전 및 투약 후 약물을 투여하십시오.
[
참조]
.
- 0.9% 염화나트륨 주사액에 희석한 후 정맥 주입으로만 투여하십시오.
[
참조]
- DARZALEX는 의료 전문가가 투여해야 하며, 투여 관련 반응이 발생할 경우 응급 장비와 적절한 의료 지원에 즉시 접근할 수 있어야 합니다.
[
참조]
- DARZALEX 투여를 시작하기 전에 환자의 혈액형을 검사하십시오.
[
참조]
.
2.2 권장 용량
단독 요법 및 레날리도마이드 (D-Rd) 또는 포말리도마이드 (D-Pd) 및 덱사메타손과 병용 요법
표 1에 나와 있는 DARZALEX 투약 일정은 병용 요법 (4주기) 및 단독 요법에 적용됩니다.
- 자가 조혈모세포 이식 (ASCT)을 받을 수 없는 새로 진단된 다발성 골수종 환자의 경우 레날리도마이드 및 저용량 덱사메타손과 병용 요법
- 재발/불응성 다발성 골수종 환자의 경우 포말리도마이드 및 저용량 덱사메타손과 병용 요법
- 재발/불응성 다발성 골수종 환자의 경우 단독 요법.
DARZALEX의 권장 용량은 실제 체중 kg당 16mg이며, 다음 투약 일정에 따라 정맥 주입으로 투여합니다.
| 주차 | 일정 |
|---|---|
| 1주차부터 8주차까지 | 매주 (총 8회 투약) |
| 9주차부터 24주차까지 | 2주마다 (총 8회 투약) |
| 25주차부터 질병 진행까지 | 4주마다 |
DARZALEX와 함께 투여되는 병용 약물의 투약 지침은
및 제조업체의 처방 정보를 참조하십시오.
보르테조밉, 멜팔란 및 프레드니손 (D-VMP)과 병용 요법
표 2에 나와 있는 DARZALEX 투약 일정은 ASCT를 받을 수 없는 새로 진단된 다발성 골수종 환자의 경우 보르테조밉, 멜팔란 및 프레드니손 (6주기)과 병용 요법에 적용됩니다.
DARZALEX의 권장 용량은 실제 체중 kg당 16mg이며, 다음 투약 일정에 따라 정맥 주입으로 투여합니다.
| 주차 | 일정 |
|---|---|
| 1주차부터 6주차까지 | 매주 (총 6회 투약) |
| 7주차부터 54주차까지 | 3주마다 (총 16회 투약) |
| 55주차부터 질병 진행까지 | 4주마다 |
보르테조밉, 탈리도마이드 및 덱사메타손 (D-VTd)과 병용
표 3의 DARZALEX 투여 일정은 ASCT를 받을 수 있는 새로 진단된 다발성 골수종 환자의 보르테조밉, 탈리도마이드 및 덱사메타손 (4주기 요법)과의 병용 요법에 대한 것입니다.
DARZALEX의 권장 용량은 실제 체중 kg당 16mg으로, 다음 투여 일정에 따라 정맥 주입으로 투여합니다.
| 치료 단계 | 주 | 일정 |
|---|---|---|
| 유도 | 1주부터 8주까지 | 매주 (총 8회 투여) |
| 9주부터 16주까지 | 2주마다 (총 4회 투여) | |
| 고용량 화학 요법 및 ASCT 중단 | ||
| 강화 | 1주부터 8주까지 | 2주마다 (총 4회 투여) |
DARZALEX와 함께 투여되는 병용제의 투여 지침은
임상 연구 (14.1) 및 제조업체의 처방 정보를 참조하십시오.
보르테조밉 및 덱사메타손 (D-Vd)과 병용
표 4의 DARZALEX 투여 일정은 재발/불응성 다발성 골수종 환자의 보르테조밉 및 덱사메타손 (3주기)과의 병용 요법에 대한 것입니다.
DARZALEX의 권장 용량은 실제 체중 kg당 16mg으로, 다음 투여 일정에 따라 정맥 주입으로 투여합니다.
| 주 | 일정 |
|---|---|
| 1주부터 9주까지 | 매주 (총 9회 투여) |
| 10주부터 24주까지 | 3주마다 (총 5회 투여) |
| 25주부터 질병 진행까지 | 4주마다 |
DARZALEX와 함께 투여되는 병용제의 투여 지침은
참조임상 연구 (14.2)및 제조업체의 처방 정보
.
카필조밉 및 덱사메타손 (DKd)과 병용
재발/불응성 다발성 골수종 환자에서 카필조밉 및 덱사메타손 (4주 주기)과 병용하여 투여하는 경우 DARZALEX의 권장 용량은 표 5에 나와 있습니다.
| 주차 | DARZALEX 용량 | 일정 |
|---|---|---|
| 1주차 | 8 mg/kg | 1일차 및 2일차 (총 2회 투여) |
| 2주차~8주차 | 16 mg/kg | 매주 (총 7회 투여) |
| 9주차~24주차 | 16 mg/kg | 2주마다 (총 8회 투여) |
| 25주차부터 질병 진행까지 | 16 mg/kg | 4주마다 |
DARZALEX와 함께 투여되는 병용 요법제의 투여 지침은
임상 연구 (14.1)및 제조업체의 처방 정보를 참조하십시오.
.
주입 속도
아래 표 6에 설명된 주입 속도로 DARZALEX를 정맥 주입하십시오. 주입 관련 반응이 없는 경우에만 주입 속도를 점진적으로 높이십시오.
DARZALEX를 단독 요법 또는 병용 요법으로 투여할 때 1일차에 투여되는 16 mg/kg의 권장 용량은 1일차에 8 mg/kg 용량을 투여하고 2일차에 각각 8 mg/kg 용량을 투여하여 2일 연속으로 나눌 수 있습니다.
| 희석 용량 | 초기 속도 (첫 번째 시간) | 속도 증가 | 최대 속도 | |
|---|---|---|---|---|
| 1주차 주입 | ||||
| 옵션 1 (단일 용량 주입) | ||||
| 1주차 1일차 (16 mg/kg) | 1,000 mL | 50 mL/시간 | 매 시간 50 mL/시간 | 200 mL/시간 |
| 옵션 2 (분할 용량 주입) | ||||
| 1주차 1일차 (8 mg/kg) | 500 mL | 50 mL/시간 | 매 시간 50 mL/시간 | 200 mL/시간 |
| 1주차 2일차 (8 mg/kg) | 500 mL | 50 mL/시간 | 매 시간 50 mL/시간 | 200 mL/시간 |
| 2주차 (16 mg/kg)† | 500 mL | 50 mL/시간 | 매 시간 50 mL/시간 | 200 mL/시간 |
| 3주차 이후 (16 mg/kg)‡ | 500 mL | 100 mL/시간 | 매 시간 50 mL/시간 | 200 mL/시간 |
2.3 Recommended Concomitant Medications
Pre-infusion Medication
모든 DARZALEX 주입 전 1시간에서 3시간 전에 다음과 같은 주입 전 약물을 투여하십시오.
- 코르티코스테로이드 (장기 또는 중간 작용)
-
단독 요법:
메틸프레드니솔론 100mg (또는 동등량)을 정맥 주사하십시오. 두 번째 주입 후, 경구 또는 정맥 주사로 60mg (또는 동등량)으로 감량하는 것을 고려하십시오.
병용 요법:
덱사메타손 20mg (또는 동등량)을 경구 또는 정맥 주사하십시오.
덱사메타손이 배경 요법 특정 코르티코스테로이드인 경우, 배경 요법에 포함된 덱사메타손 용량은 DARZALEX 주입일에 사전 약물로 사용됩니다.[
환자가 덱사메타손 (또는 동등량)을 사전 약물로 투여받은 경우, DARZALEX 주입일에 배경 요법 특정 코르티코스테로이드 (예: 프레드니손)를 투여하지 마십시오.
-
단독 요법:
- 아세트아미노펜 650mg에서 1,000mg 경구
- 디펜히드라민 25mg에서 50mg (또는 동등량) 경구 또는 정맥 주사.
Post-infusion Medication
다음과 같은 주입 후 약물을 투여하십시오.
-
단독 요법:
DARZALEX 투여 후 다음 날부터 2일 동안 메틸프레드니솔론 20mg (또는 중간 또는 장기 작용 코르티코스테로이드의 동등 용량)을 경구로 투여하십시오.
병용 요법:
DARZALEX 주입 후 다음 날부터 메틸프레드니솔론 경구 투여를 20mg 이하 (또는 중간 또는 장기 작용 코르티코스테로이드의 동등 용량)로 고려하십시오.
DARZALEX 주입 후 다음 날에 배경 요법 특정 코르티코스테로이드 (예: 덱사메타손, 프레드니손)를 투여하는 경우, 추가 코르티코스테로이드가 필요하지 않을 수 있습니다.[
만성 폐쇄성 폐 질환 병력이 있는 환자의 경우, 단기 및 장기 작용 기관지 확장제와 흡입용 코르티코스테로이드 처방을 고려하십시오. 첫 4회의 DARZALEX 주입 후, 환자가 주요 주입 관련 반응을 경험하지 않는 경우, 이러한 추가 주입 후 약물의 중단을 고려하십시오.
2.4 Dosage Modifications for Adverse Reactions
DARZALEX의 용량 감소는 권장되지 않습니다. 골수억제가 발생하는 경우, 혈구 수치 회복을 허용하기 위해 DARZALEX 투여를 중단하는 것을 고려하십시오.
[
Warnings and Precautions (5.3,
5.4)]
.
DARZALEX와 병용 투여되는 약물에 대한 정보는 제조업체의 처방 정보를 참조하십시오.
Infusion-Related Reactions
모든 등급/심각도의 주입 관련 반응의 경우, DARZALEX 주입을 즉시 중단하고 증상을 관리하십시오. 주입 관련 반응의 관리에는 아래에 설명된 대로 주입 속도 감소 또는 DARZALEX 투여 중단이 추가로 필요할 수 있습니다.
[
Warnings and Precautions (5.1)]
.
- 1~2등급 (경증에서 중등도): 반응 증상이 해소되면, 반응이 발생한 속도의 절반 이하로 주입을 재개하십시오. 환자가 추가 반응 증상을 경험하지 않는 경우, 임상적으로 적절한 증가량과 간격으로 최대 속도 200mL/시간까지 주입 속도를 다시 높일 수 있습니다 (표 6).
- 3등급 (중증): 반응 증상이 해소되면, 반응이 발생한 속도의 절반 이하로 주입을 다시 시작하는 것을 고려하십시오. 환자가 추가 증상을 경험하지 않는 경우, 표 6에 설명된 대로 증가량과 간격으로 주입 속도를 다시 높이십시오. 3등급 이상의 주입 관련 반응이 재발하는 경우 위의 절차를 반복하십시오. 3등급 이상의 주입 관련 반응이 세 번째로 발생하면 DARZALEX를 영구적으로 중단하십시오.
- 4등급 (생명을 위협하는): DARZALEX를 영구적으로 중단하십시오.
2.5 Preparation and Administration
Preparation
DARZALEX는 단회 투여용입니다.
무균적 기법을 사용하여 다음과 같이 주입용 용액을 준비하십시오.
- 환자의 실제 체중을 기반으로 DARZALEX 용액에 필요한 용량(mg), 총 부피(mL) 및 필요한 DARZALEX 바이알 수를 계산합니다.
- 다른 NDC를 가진 동일한 강도의 DARZALEX 바이알은 사용 가능하며 동일한 주입 백에 혼합할 수 있습니다.
[참조
.
- DARZALEX 용액이 무색에서 옅은 노란색인지 확인하십시오. 불투명한 입자, 변색 또는 기타 이물질이 있는 경우 사용하지 마십시오.
- 주입 백/용기에서 필요한 DARZALEX 용액 부피와 동일한 부피의 0.9% 염화나트륨 주사액을 제거합니다.
- 필요한 양의 DARZALEX 용액을 뽑아내고 표 6에 명시된 대로 0.9% 염화나트륨 주사액이 들어 있는 주입 백/용기에 첨가하여 적절한 부피로 희석합니다.
[참조
. 주입 백/용기는 폴리염화비닐(PVC), 폴리프로필렌(PP), 폴리에틸렌(PE) 또는 폴리올레핀 블렌드(PP+PE)로 만들어져야 합니다. 적절한 무균 조건에서 희석하십시오. 바이알에 남아 있는 사용하지 않은 부분은 버립니다.
- 용액을 섞기 위해 백/용기를 부드럽게 뒤집습니다. 흔들지 마십시오.
- 주입 전에 용액과 용기가 허용하는 경우, 주입용 의약품은 시각적으로 입자와 변색을 검사해야 합니다. 다라투무맙은 단백질이므로 희석된 용액에 매우 작고 반투명한 흰색 단백질 입자가 생길 수 있습니다. 눈에 띄게 불투명한 입자, 변색 또는 이물질이 관찰되는 경우 사용하지 마십시오.
- 즉시 사용하지 않을 경우, 희석된 용액을 2°C~8°C(36°F~46°F)에서 최대 24시간 동안 냉장 보관하거나 15°C~25°C(59°F~77°F)에서 최대 15시간 동안 실온 보관하십시오. 실온 보관에는 주입 시간이 포함됩니다. 보관 중에는 빛을 차단하십시오. 냉동하지 마십시오.
투여
- 냉장 보관한 경우, 용액을 실온으로 올립니다. 유량 조절기가 장착된 주입 세트와 인라인, 멸균, 비발열성, 저단백질 결합 폴리에테르설폰(PES) 필터(기공 크기 0.22 마이크로미터 또는 0.2 마이크로미터)를 사용하여 정맥 주입으로 희석된 용액을 투여합니다. 주입 세트는 폴리우레탄(PU), 폴리부타디엔(PBD), PVC, PP 또는 PE로 만들어져야 합니다.
- 주입 용액의 사용하지 않은 부분은 재사용하지 마십시오. 사용하지 않은 제품이나 폐기물은 현지 규정에 따라 폐기해야 합니다.
- DARZALEX를 다른 약물과 동일한 정맥 라인에 동시에 주입하지 마십시오.
3 제형 및 함량
DARZALEX는 무색에서 옅은 노란색의 방부제가 없는 용액으로 다음과 같이 제공됩니다.
주사제:
- 단회용 바이알에 100 mg/5 mL (20 mg/mL).
- 단회용 바이알에 400 mg/20 mL (20 mg/mL).
4 금기사항
DARZALEX는 daratumumab 또는 제형의 구성 성분에 심각한 과민증(예: 아나필락시스 반응) 병력이 있는 환자에게 금기입니다.
[
경고 및 주의사항 (5.1) 참조]
.
5 경고 및 주의사항
5.1 주입 관련 반응
DARZALEX는 아나필락시스 반응을 포함한 심각하거나 심각한 주입 관련 반응을 유발할 수 있습니다. 이러한 반응은 생명을 위협할 수 있으며 사망 사례가 보고되었습니다.
[
부작용 (6.2) 참조
.
임상 시험(단독 요법 및 병용 요법: N=2,066)에서 주입 관련 반응은 1주차(16 mg/kg) 주입에서 환자의 37%, 2주차 주입에서 2%, 이후 주입에서 누적적으로 6%에서 발생했습니다. 환자의 1% 미만이 2주차 또는 이후 주입에서 3/4등급 주입 관련 반응을 보였습니다. 반응 발생까지의 중앙값은 1.5시간(범위: 0~73시간)이었습니다. 반응으로 인한 주입 수정의 발생률은 36%였습니다. 1주차, 2주차 및 이후 주입에 대한 16 mg/kg 주입의 중앙값 기간은 각각 약 7시간, 4시간 및 3시간이었습니다. 거의 모든 반응은 주입 중 또는 DARZALEX 완료 후 4시간 이내에 발생했습니다. 임상 시험에서 주입 후 약물이 도입되기 전에는 주입 관련 반응이 주입 후 최대 48시간까지 발생했습니다.
기관지 경련, 저산소증, 호흡 곤란, 고혈압, 빈맥, 두통, 후두 부종, 폐 부종 및 맥락막 삼출, 급성 근시 및 급성 폐쇄각 녹내장을 포함한 안구 부작용을 포함한 심각한 반응이 발생했습니다. 징후 및 증상에는 코 막힘, 기침, 인후통과 같은 호흡기 증상뿐만 아니라 오한, 구토 및 메스꺼움이 포함될 수 있습니다. 덜 흔한 징후 및 증상은 천명, 알레르기성 비염, 발열, 가슴 통증, 가려움증, 저혈압 및 시력 흐림이었습니다.
[
부작용 (6.1) 참조
.
ASCT(CASSIOPEIA) 설정에서 DARZALEX 투여가 중단된 경우(중앙값 3.75개월, 범위: 2.4~6.9개월), DARZALEX 재개 시 ASCT 후 첫 번째 주입에서 주입 관련 반응의 발생률은 11%였습니다. ASCT 중단 전 마지막 DARZALEX 주입에 사용된 주입 속도/희석량이 ASCT 후 재개 시 사용되었습니다. ASCT 후 DARZALEX 재개 시 발생하는 주입 관련 반응은 이전 연구에서 2주차 또는 이후 주입에서 보고된 증상 및 중증도(3등급 또는 4등급: <1%)와 일치했습니다.
EQUULEUS에서 병용 요법을 받은 환자(n=97)는 1주차에 첫 번째 16 mg/kg 용량을 이틀에 걸쳐 투여받았습니다. 즉, 1일차에 8 mg/kg, 2일차에 8 mg/kg을 각각 투여받았습니다. 모든 등급의 주입 관련 반응의 발생률은 42%였으며, 환자의 36%가 1주차 1일차에 주입 관련 반응을 경험했고, 4%가 1주차 2일차에 주입 관련 반응을 경험했으며, 8%가 이후 주입에서 주입 관련 반응을 경험했습니다. 반응 발생까지의 중앙값은 1.8시간(범위: 0.1~5.4시간)이었습니다. 반응으로 인한 주입 중단의 발생률은 30%였습니다. 주입의 중앙값 기간은 1주차 1일차의 경우 4.2시간, 1주차 2일차의 경우 4.2시간, 이후 주입의 경우 3.4시간이었습니다.
항히스타민제, 해열제 및 코르티코스테로이드로 환자를 사전 투약하십시오. 전체 주입 동안 환자를 자주 모니터링하십시오.
[
. 모든 중증도의 반응에 대해 DARZALEX 주입을 중단하고 필요에 따라 의학적 관리를 시작하십시오. 아나필락시스 반응 또는 생명을 위협하는(4등급) 반응이 발생하면 DARZALEX 치료를 영구적으로 중단하고 적절한 응급 처치를 시작하십시오. 1등급, 2등급 또는 3등급 반응이 있는 환자의 경우 주입을 재개할 때 주입 속도를 줄이십시오.
[
.
지연된 주입 관련 반응의 위험을 줄이기 위해 모든 환자에게 DARZALEX 주입 후 경구 코르티코스테로이드를 투여하십시오.
[
. 만성 폐쇄성 폐 질환 병력이 있는 환자는 호흡기 합병증을 관리하기 위해 주입 후 추가 약물이 필요할 수 있습니다. 만성 폐쇄성 폐 질환이 있는 환자에게 단기 및 장기 작용 기관지 확장제 및 흡입 코르티코스테로이드 처방을 고려하십시오.
[
.
DARZALEX 주입과 함께 급성 근시 및 잠재적으로 안압 상승 또는 녹내장을 유발할 수 있는 섬모체 맥락막 삼출로 인한 전방 각 협착을 포함한 안구 부작용이 발생했습니다. 안구 증상이 발생하면 DARZALEX 주입을 중단하고 DARZALEX를 재개하기 전에 즉시 안과 진료를 받으십시오.
5.2 혈청학적 검사 방해
다라투무맙은 적혈구(RBC)의 CD38에 결합하여 간접 항글로불린 검사(간접 쿰스 검사) 양성을 유발합니다. 다라투무맙 매개 간접 항글로불린 검사 양성은 마지막 다라투무맙 주입 후 최대 6개월까지 지속될 수 있습니다. 적혈구에 결합된 다라투무맙은 환자 혈청에서 미량 항원에 대한 항체 검출을 가립니다.
[
참고 문헌 (15) 참조
. 환자의 ABO 및 Rh 혈액형 결정에는 영향을 미치지 않습니다.
[
.
혈액 수혈 센터에 이러한 혈청학적 검사 방해를 알리고 환자가 DARZALEX를 투여받았음을 혈액 은행에 알리십시오. DARZALEX를 시작하기 전에 환자의 혈액형 및 스크리닝을 실시하십시오.
[
.
5.3 호중구 감소증
DARZALEX는 배경 치료로 인한 호중구 감소증을 증가시킬 수 있습니다.
[
부작용 (6.1) 참조].
배경 치료에 대한 제조업체의 처방 정보에 따라 치료 중에 정기적으로 완전 혈구 수를 모니터링하십시오. 호중구 감소증이 있는 환자의 감염 징후를 모니터링하십시오. 호중구가 회복될 때까지 DARZALEX 투여를 중단하는 것을 고려하십시오.
5.4 혈소판 감소증
DARZALEX는 배경 치료로 인한 혈소판 감소증을 증가시킬 수 있습니다.
[
부작용 (6.1) 참조].
제조업체의 처방 정보에 따라 배경 치료에 대한 완전 혈구 수를 정기적으로 모니터링하십시오. 혈소판이 회복될 때까지 DARZALEX 투여를 중단하는 것을 고려하십시오.
5.5 완전 반응 결정의 방해
Daratumumab은 내인성 M-단백질의 임상 모니터링에 사용되는 혈청 단백질 전기영동(SPE) 및 면역 고정(IFE) 분석 모두에서 검출될 수 있는 인간 IgG 카파 단클론 항체입니다.
[
참조]
. 이러한 간섭은 IgG 카파 골수종 단백질이 있는 일부 환자에서 완전 반응 및 질병 진행 결정에 영향을 미칠 수 있습니다.
5.6 배아-태아 독성
작용 기전을 기반으로 DARZALEX는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. DARZALEX는 태아 면역 세포 고갈 및 골밀도 감소를 유발할 수 있습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 생식 능력이 있는 여성에게는 DARZALEX 치료 중 및 마지막 투여 후 3개월 동안 효과적인 피임법을 사용하도록 조언하십시오.
[
참조]
.
DARZALEX와 레날리도마이드, 포말리도마이드 또는 탈리도마이드의 병용은 임산부에게 금기입니다. 레날리도마이드, 포말리도마이드 및 탈리도마이드는 기형 및 태아 사망을 유발할 수 있기 때문입니다. 임신 중 사용에 대한 레날리도마이드, 포말리도마이드 또는 탈리도마이드 처방 정보를 참조하십시오.
6 부작용
다음의 임상적으로 유의미한 이상반응은 라벨의 다른 곳에서 설명되어 있습니다.
- 주입 관련 반응
[see
Warnings and Precautions (5.1)]
.
- 호중구 감소증
[see
Warnings and Precautions (5.3)]
.
- 혈소판 감소증
[see
Warnings and Precautions (5.4)]
.
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 한 약물의 임상 시험에서 관찰된 이상반응률을 다른 약물의 임상 시험에서 관찰된 이상반응률과 직접 비교할 수 없으며 실제로 관찰된 이상반응률을 반영하지 않을 수 있습니다.
아래에 설명된 안전성 데이터는 다발성 골수종 환자 2,459명에서 DARZALEX (16 mg/kg)에 대한 노출을 반영하며, 여기에는 배경 요법과 함께 DARZALEX를 투여받은 환자 2,303명과 단일 요법으로 DARZALEX를 투여받은 환자 156명이 포함됩니다. 이 통합 안전성 모집단에서 가장 흔한 이상반응(≥20%)은 상기도 감염, 호중구 감소증, 주입 관련 반응, 혈소판 감소증, 설사, 변비, 빈혈, 말초 감각 신경병증, 피로, 말초 부종, 메스꺼움, 기침, 발열, 호흡 곤란 및 무력증이었습니다.
자가 조혈모세포 이식에 적합하지 않은 새롭게 진단된 다발성 골수종
레날리도마이드 및 덱사메타손 병용 요법 (DRd)
레날리도마이드 및 덱사메타손과 병용한 DARZALEX의 안전성은 MAIA에서 평가되었습니다.
[see
표 7에 설명된 이상반응은 다라투무맙-레날리도마이드-덱사메타손(DRd)의 경우 중앙값 치료 기간 25.3개월(범위: 0.1~40.44개월), 레날리도마이드-덱사메타손(Rd)의 경우 21.3개월(범위: 0.03~40.64개월) 동안 DARZALEX에 대한 노출을 반영합니다.
Rd군에 비해 DRd군에서 발생률이 2% 더 높은 심각한 이상반응은 폐렴(DRd 15% vs Rd 8%), 기관지염(DRd 4% vs Rd 2%), 탈수(DRd 2% vs Rd <1%)였습니다.
| 신체 기관계 이상반응 |
DRd (N=364) | Rd (N=365) | ||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) | 3등급 (%) | 4등급 (%) | 모든 등급 (%) | 3등급 (%) | 4등급 (%) | |
| 키: D=다라투무맙, Rd=레날리도마이드-덱사메타손. | ||||||
|
||||||
| 위장 장애 | ||||||
| 설사 | 57 | 7 | 0 | 46 | 4 | 0 |
| 변비 | 41 | 1 | <1 | 36 | <1 | 0 |
| 메스꺼움 | 32 | 1 | 0 | 23 | 1 | 0 |
| 구토 | 17 | 1 | 0 | 12 | <1 | 0 |
| 감염 | ||||||
| 상기도 감염 | 52 | 2 | <1 | 36 | 2 | <1 |
| 기관지염 | 29 | 3 | 0 | 21 | 1 | 0 |
| 폐렴 | 26 | 14 | 1 | 14 | 7 | 1 |
| 요로 감염 | 18 | 2 | 0 | 10 | 2 | 0 |
| 전신 장애 및 투여 부위 상태 | ||||||
| 주입 관련 반응 | 41 | 2 | <1 | 0 | 0 | 0 |
| 말초 부종 | 41 | 2 | 0 | 33 | 1 | 0 |
| 피로 | 40 | 8 | 0 | 28 | 4 | 0 |
| 무력증 | 32 | 4 | 0 | 25 | 3 | <1 |
| 발열 | 23 | 2 | 0 | 18 | 2 | 0 |
| 오한 | 13 | 0 | 0 | 2 | 0 | 0 |
| 근골격계 및 결합 조직 장애 | ||||||
| 요통 | 34 | 3 | <1 | 26 | 3 | <1 |
| 근육 경련 | 29 | 1 | 0 | 22 | 1 | 0 |
| 호흡기, 흉부 및 종격 장애 | ||||||
| 호흡곤란 | 32 | 3 | <1 | 20 | 1 | 0 |
| 기침 | 30 | <1 | 0 | 18 | 0 | 0 |
| 신경계 장애 | ||||||
| 말초 감각 신경병증 | 24 | 1 | 0 | 15 | 0 | 0 |
| 두통 | 19 | 1 | 0 | 11 | 0 | 0 |
| 감각이상 | 16 | 0 | 0 | 8 | 0 | 0 |
| 대사 및 영양 장애 | ||||||
| 식욕 감퇴 | 22 | 1 | 0 | 15 | <1 | <1 |
| 고혈당증 | 14 | 6 | 1 | 8 | 3 | 1 |
| 저칼슘혈증 | 14 | 1 | <1 | 9 | 1 | 1 |
| 혈관 장애 | ||||||
| 고혈압 | 13 | 6 | <1 | 7 | 4 | 0 |
표 8에 나열된 기준치에서 치료 중 악화된 실험실 이상.
| DRd (N=364) | Rd (N=365) | |||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, Rd=lenalidomide-dexamethasone. | ||||||
| 백혈구 감소증 | 90 | 30 | 5 | 82 | 20 | 4 |
| 호중구 감소증 | 91 | 39 | 17 | 77 | 28 | 11 |
| 림프구 감소증 | 84 | 41 | 11 | 75 | 36 | 6 |
| 혈소판 감소증 | 67 | 6 | 3 | 58 | 7 | 4 |
| 빈혈 | 47 | 13 | 0 | 57 | 24 | 0 |
Bortezomib, Melphalan 및 Prednisone 병용 요법
DARZALEX와 bortezomib, melphalan 및 prednisone 병용 투여의 안전성은 ALCYONE에서 평가되었습니다.
[
임상 연구 (14.1) 참조].
표 9에 설명된 이상반응은 daratumumab, bortezomib, melphalan 및 prednisone (D-VMP)에 대해서는 14.7개월(범위: 0~25.8개월), VMP에 대해서는 12개월(범위: 0.1~14.9개월)의 중앙값 치료 기간 동안 DARZALEX에 대한 노출을 반영합니다.
D-VMP군에서 VMP군에 비해 발생률이 최소 2% 이상 높은 중대한 이상반응은 폐렴(D-VMP 11% vs VMP 4%), 상기도 감염(D-VMP 5% vs VMP 1%), 폐부종(D-VMP 2% vs VMP 0%)이었습니다.
| 신체 기관계 이상반응 |
D-VMP (N=346) | VMP (N=354) | ||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) | 3등급 (%) | 4등급 (%) | 모든 등급 (%) | 3등급 (%) | 4등급 (%) | |
| 키: D=daratumumab, VMP=bortezomib-melphalan-prednisone. | ||||||
|
||||||
| 감염 | ||||||
| 상기도 감염 | 48 | 5 | 0 | 28 | 3 | 0 |
| 폐렴 | 16 | 12 | < 1 | 6 | 5 | < 1 |
| 전신 질환 및 투여 부위 이상 | ||||||
| 주입 관련 반응 | 28 | 4 | 1 | 0 | 0 | 0 |
| 말초 부종 | 21 | 1 | < 1 | 14 | 1 | 0 |
| 호흡기, 흉부 및 종격 질환 | ||||||
| 기침 | 16 | < 1 | 0 | 8 | < 1 | 0 |
| 호흡곤란 | 13 | 2 | 1 | 5 | 1 | 0 |
| 혈관 질환 | ||||||
| 고혈압 | 10 | 4 | < 1 | 3 | 2 | 0 |
표 10에 나열된 기준치에서 치료 중 악화된 실험실 이상.
| D-VMP (N=346) | VMP (N=354) | |||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, VMP=bortezomib-melphalan-prednisone. | ||||||
| 혈소판 감소증 | 88 | 27 | 11 | 88 | 26 | 16 |
| 호중구 감소증 | 86 | 34 | 10 | 87 | 32 | 11 |
| 림프구 감소증 | 85 | 46 | 12 | 83 | 44 | 9 |
| 빈혈 | 47 | 18 | 0 | 50 | 21 | 0 |
자가 조혈모세포 이식에 적합한 새롭게 진단된 다발성 골수종
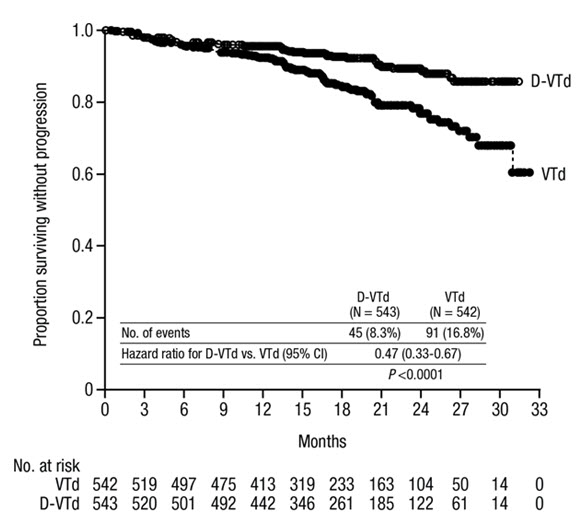
Bortezomib, Thalidomide 및 Dexamethasone (DVTd) 병용 요법
Bortezomib, thalidomide 및 dexamethasone와 병용한 DARZALEX의 안전성은 CASSIOPEIA에서 평가되었습니다
[
임상 연구 (14.1) 참조].
표 11에 설명된 이상반응은 이식 후 최대 100일까지 DARZALEX에 대한 노출을 반영합니다. 유도/ASCT/강화 요법의 중앙값 기간은 DVTd의 경우 8.9개월(범위: 7.0~12.0개월), VTd의 경우 8.7개월(범위: 6.4~11.5개월)이었습니다.
VTd군에 비해 DVTd군에서 발생률이 2% 더 높은 심각한 이상반응은 기관지염(DVTd 2% vs VTd <1%) 및 폐렴(DVTd 6% vs VTd 4%)이었습니다.
| 신체 기관계 이상반응 |
DVTd (N=536) | VTd (N=538) | ||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) | 3등급 (%) | 4등급 (%) | 모든 등급 (%) | 3등급 (%) | 4등급 (%) | |
| 키: D=daratumumab, VTd=bortezomib-thalidomide-dexamethasone. 참고: 혈액학 실험실 관련 독성은 제외되었으며 아래 표에 별도로 보고되었습니다. |
||||||
| 전신 장애 및 투여 부위 이상 | ||||||
| 주입 관련 반응 | 35 | 3 | <1 | 0 | 0 | 0 |
| 발열 | 26 | 2 | <1 | 21 | 2 | 0 |
| 위장 장애 | ||||||
| 메스꺼움 | 30 | 4 | 0 | 24 | 2 | <1 |
| 구토 | 16 | 2 | 0 | 10 | 2 | 0 |
| 감염 | ||||||
| 상기도 감염 | 27 | 1 | 0 | 17 | 1 | 0 |
| 기관지염 | 20 | 1 | 0 | 13 | 1 | 0 |
| 호흡기, 흉부 및 종격 장애 | ||||||
| 기침 | 17 | 0 | 0 | 9 | 0 | 0 |
| 혈관 장애 | ||||||
| 고혈압 | 10 | 4 | 0 | 5 | 2 | 0 |
| DVTd (N=536) | VTd (N=538) | |||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, VTd=bortezomib-thalidomide -dexamethasone. | ||||||
| 림프구감소증 | 95 | 44 | 15 | 91 | 37 | 10 |
| 백혈구감소증 | 82 | 14 | 10 | 57 | 6 | 9 |
| 혈소판감소증 | 81 | 9 | 5 | 58 | 8 | 3 |
| 호중구감소증 | 63 | 19 | 14 | 41 | 10 | 9 |
| 빈혈 | 36 | 4 | 0 | 35 | 5 | 0 |
재발성/불응성 다발성 골수종
레날리도마이드 및 덱사메타손 병용 요법
레날리도마이드 및 덱사메타손과 병용한 DARZALEX의 안전성은 POLLUX에서 평가되었습니다.
[
임상 연구 (14.2) 참조].
표 13에 설명된 이상반응은 다라투무맙-레날리도마이드-덱사메타손(DRd)의 경우 13.1개월(범위: 0~20.7개월), 레날리도마이드-덱사메타손(Rd)의 경우 12.3개월(범위: 0.2~20.1개월)의 중앙값 치료 기간 동안 DARZALEX에 대한 노출을 반영합니다.
중대한 이상반응은 Rd군의 42%에 비해 DRd군의 환자 49%에서 발생했습니다. Rd군에 비해 DRd군에서 발생률이 2% 이상 높은 중대한 이상반응은 폐렴(DRd 12% vs Rd 10%), 상기도 감염(DRd 7% vs Rd 4%), 인플루엔자 및 발열(각각 DRd 3% vs Rd 1%)이었습니다.
이상반응으로 인해 Rd군의 8%(n=22)에 비해 DRd군의 환자 7%(n=19)에서 치료가 중단되었습니다.
| 이상반응 | DRd (N=283) | Rd (N=281) | ||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=다라투무맙, Rd=레날리도마이드-덱사메타손. | ||||||
|
||||||
| 감염 | ||||||
| 상기도 감염 | 65 | 6 | < 1 | 51 | 4 | 0 |
| 전신 장애 및 투여 부위 이상 | ||||||
| 주입 관련 반응 | 48 | 5 | 0 | 0 | 0 | 0 |
| 피로 | 35 | 6 | < 1 | 28 | 2 | 0 |
| 발열 | 20 | 2 | 0 | 11 | 1 | 0 |
| 위장 장애 | ||||||
| 설사 | 43 | 5 | 0 | 25 | 3 | 0 |
| 메스꺼움 | 24 | 1 | 0 | 14 | 0 | 0 |
| 구토 | 17 | 1 | 0 | 5 | 1 | 0 |
| 호흡기, 흉부 및 종격 장애 | ||||||
| 기침 | 30 | 0 | 0 | 15 | 0 | 0 |
| 호흡곤란 | 21 | 3 | < 1 | 12 | 1 | 0 |
| 근골격계 및 결합 조직 장애 | ||||||
| 근육 경련 | 26 | 1 | 0 | 19 | 2 | 0 |
| 신경계 장애 | ||||||
| 두통 | 13 | 0 | 0 | 7 | 0 | 0 |
표 14에 나열된 기준치에서 치료 중 악화된 실험실 이상.
| DRd (N=283) | Rd (N=281) | |||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, Rd=lenalidomide-dexamethasone. | ||||||
| 림프구감소증 | 95 | 42 | 10 | 87 | 32 | 6 |
| 호중구감소증 | 92 | 36 | 17 | 87 | 32 | 8 |
| 혈소판감소증 | 73 | 7 | 6 | 67 | 10 | 5 |
| 빈혈 | 52 | 13 | 0 | 57 | 19 | 0 |
보르테조밉 및 덱사메타손 병용 요법
보르테조밉 및 덱사메타손과 병용한 DARZALEX의 안전성은 CASTOR에서 평가되었습니다.
[
임상 연구 (14.2) 참조].
표 15에 설명된 이상 반응은 다라투무맙-보르테조밉-덱사메타손(DVd)의 경우 중앙값 치료 기간 6.5개월(범위: 0~14.8개월), 보르테조밉-덱사메타손(Vd)군의 경우 5.2개월(범위: 0.2~8.0개월) 동안 DARZALEX에 노출된 것을 반영합니다.
중대한 이상 반응은 Vd군의 34%에 비해 DVd군의 환자 42%에서 발생했습니다. Vd군에 비해 DVd군에서 발생률이 최소 2% 더 높은 중대한 이상 반응은 상기도 감염(DVd 5% vs Vd 2%), 설사 및 심방세동(각각 DVd 2% vs Vd 0%)이었습니다.
이상 반응으로 인해 Vd군의 9%(n=22)에 비해 DVd군의 환자 7%(n=18)에서 치료가 중단되었습니다.
| 이상 반응 | DVd (N=243) | Vd (N=237) | ||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=다라투무맙, Vd=보르테조밉-덱사메타손. | ||||||
|
||||||
| 신경계 장애 | ||||||
| 말초 감각 신경병증 | 47 | 5 | 0 | 38 | 6 | < 1 |
| 전신 장애 및 투여 부위 이상 | ||||||
| 주입 관련 반응 | 45 | 9 | 0 | 0 | 0 | 0 |
| 말초 부종 | 22 | 1 | 0 | 13 | 0 | 0 |
| 발열 | 16 | 1 | 0 | 11 | 1 | 0 |
| 감염 | ||||||
| 상기도 감염 | 44 | 6 | 0 | 30 | 3 | < 1 |
| 위장 장애 | ||||||
| 설사 | 32 | 3 | < 1 | 22 | 1 | 0 |
| 구토 | 11 | 0 | 0 | 4 | 0 | 0 |
| 호흡기계, 흉부 및 종격 질환 | ||||||
| 기침 | 27 | 0 | 0 | 14 | 0 | 0 |
| 호흡곤란 | 21 | 4 | 0 | 11 | 1 | 0 |
치료 중 악화된 실험실 이상은 표 16에 나열되어 있습니다.
| DVd (N=243) | Vd (N=237) | |||||
|---|---|---|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, Vd=bortezomib-dexamethasone. | ||||||
| 혈소판감소증 | 90 | 28 | 19 | 85 | 22 | 13 |
| 림프구감소증 | 89 | 41 | 7 | 81 | 24 | 3 |
| 호중구감소증 | 58 | 12 | 3 | 40 | 5 | < 1 |
| 빈혈 | 48 | 13 | 0 | 56 | 14 | 0 |
주 2회 (20/56 mg/m
2) Carfilzomib 및 Dexamethasone 병용 치료
DARZALEX와 주 2회 carfilzomib 및 dexamethasone 병용 요법의 안전성은 CANDOR에서 평가되었습니다.
[
임상 연구 (14.2) 참조]
. 표 17에 설명된 이상반응은 daratumumab-carfilzomib-dexamethasone (DKd) 그룹의 경우 중앙값 치료 기간 16.1개월(범위: 0.1~23.7개월), carfilzomib-dexamethasone 그룹(Kd)의 경우 중앙값 치료 기간 9.3개월(범위: 0.1~22.4개월) 동안 DARZALEX에 노출된 것을 반영합니다.
중대한 이상반응은 DARZALEX와 Kd를 병용 투여받은 환자의 56%, Kd를 투여받은 환자의 46%에서 발생했습니다. Kd군과 비교하여 DKd군에서 보고된 가장 흔한 중대한 이상반응은 폐렴(DKd 14% vs Kd 9%), 발열(DKd 4.2% vs Kd 2.0%), 인플루엔자(DKd 3.9% vs Kd 1.3%), 패혈증(DKd 3.9% vs Kd 1.3%), 빈혈(DKd 2.3% vs Kd 0.7%), 기관지염(DKd 1.9% vs Kd 0%), 설사(DKd 1.6% vs Kd 0%)였습니다. 모든 연구 치료의 마지막 투여 후 30일 이내에 발생한 치명적인 이상반응은 DARZALEX와 Kd를 병용 투여받은 308명의 환자 중 10%, Kd를 투여받은 153명의 환자 중 5%에서 발생했습니다. 가장 흔한 치명적인 이상반응은 감염(4.5% vs 2.6%)이었습니다.
이상반응으로 인해 DARZALEX 투여를 영구적으로 중단한 환자는 9%였습니다. DARZALEX 투여의 영구적인 중단을 초래한 이상반응(>1%)에는 폐렴이 포함되었습니다.
DARZALEX 투여 당일 또는 다음 날 발생한 주입 관련 반응은 환자의 18%에서 발생했으며, 첫 번째 DARZALEX 투여 당일 또는 다음 날 발생한 주입 관련 반응은 12%에서 발생했습니다.
| 이상반응 | DKd (N=308) | Kd (N=153) | ||
|---|---|---|---|---|
| 모든 등급 | 3등급 또는 4등급 | 모든 등급 | 3등급 또는 4등급 | |
| (%) | (%) | (%) | (%) | |
| 키: D=daratumumab; Kd=carfilzomib-dexamethasone. | ||||
|
||||
| 전신 장애 및 투여 부위 이상 | ||||
| 주입 관련 반응 | 41 | 12 | 28 | 5 |
| 피로 | 32 | 11 | 28 | 8 |
| 발열 | 20 | 1.9 | 15 | 0.7 |
| 감염 | ||||
| 호흡기 감염 | 40 | 7 | 29 | 3.3 |
| 폐렴 | 18 | 13 | 12 | 9 |
| 기관지염 | 17 | 2.6 | 12 | 1.3 |
| 혈액 및 림프계 장애 (Blood and lymphatic system disorders) | ||||
| Thrombocytopenia (혈소판 감소증) | 37 | 25 | 30 | 16 |
| Anemia (빈혈) | 33 | 17 | 31 | 14 |
| 위장관 장애 (Gastrointestinal disorders) | ||||
| Diarrhea (설사) | 32 | 3.9 | 14 | 0.7 |
| Nausea (메스꺼움) | 18 | 0 | 13 | 0.7 |
| 혈관 장애 (Vascular Disorders) | ||||
| Hypertension (고혈압) | 31 | 18 | 28 | 13 |
| 호흡기, 흉부 및 종격동 장애 (Respiratory, Thoracic and Mediastinal Disorders) | ||||
| Cough (기침) | 21 | 0 | 21 | 0 |
| Dyspnea (호흡곤란) | 20 | 3.9 | 22 | 2.6 |
| 정신 장애 (Psychiatric disorders) | ||||
| Insomnia (불면증) | 18 | 3.9 | 11 | 2 |
| 근골격계 및 결합 조직 장애 (Musculoskeletal and connective tissue disorders) | ||||
| Back pain (요통) | 16 | 1.9 | 10 | 1.3 |
발생 빈도가 15% 미만인 이상반응
- 혈액 및 림프계 장애:neutropenia, lymphopenia, leukopenia, febrile neutropenia
- 심장 질환:atrial fibrillation
- 위장관 장애:구토, 변비
- 전신 장애 및 투여 부위 이상:말초 부종, 무력증, 오한
- 감염:인플루엔자, 요로 감염, 패혈증, 패혈성 쇼크
- 대사 및 영양 장애:식욕 감소, 고혈당증, 저칼슘혈증, 탈수
- 근골격계 및 결합 조직 장애:근육 경련, 관절통, 근골격계 흉통
- 신경계 장애:두통, 어지러움, 말초 감각 신경병증, 감각 이상, 가역적 후측 뇌병증 증후군
- 호흡기계, 흉부 및 종격 장애:폐부종
- 피부 및 피하 조직 장애:발진, 가려움증
주 1회 (20/70 mg/m
2) 카필조밉 및 덱사메타손 병용 요법
DARZALEX와 주 1회 카필조밉 및 덱사메타손 병용 요법의 안전성은 EQUULEUS에서 평가되었습니다.
[
임상 연구(14.2) 참조]
. 표 18에 설명된 이상반응은 DARZALEX에 대한 중앙값 치료 기간 19.8개월(범위: 0.3~34.5개월) 동안의 노출을 반영합니다.
중대한 이상반응은 환자의 48%에서 보고되었습니다. 보고된 가장 흔한 중대한 이상반응은 폐렴(4.7%), 상기도 감염(4.7%), 기저 세포 암종(4.7%), 인플루엔자(3.5%), 전반적인 신체 건강 악화(3.5%) 및 고칼슘혈증(3.5%)이었습니다. 모든 연구 치료의 마지막 용량 투여 후 30일 이내에 발생한 치명적인 이상반응은 전반적인 신체 건강 악화, 폐 아스페르길루스증으로 인한 다발성 장기 부전 및 질병 진행으로 사망한 환자의 3.5%에서 발생했습니다.
이상반응으로 인한 DARZALEX의 영구적인 중단은 환자의 8%에서 발생했습니다. DARZALEX의 영구적인 중단을 초래한 이상반응은 두 명 이상의 환자에서 발생하지 않았습니다.
DARZALEX 용량 투여 당일 또는 다음 날에 발생한 주입 관련 반응은 환자의 44%에서 발생했습니다. 분할된 첫 번째 DARZALEX 용량을 투여받은 환자의 경우, DARZALEX 투여 첫날과 둘째 날에 각각 36%와 4%에서 주입 관련 반응이 발생했습니다.
| 이상반응 | DKd (N=85) | |
|---|---|---|
| 모든 등급 (%) | 3등급 또는 4등급 (%) | |
| 키: D=다라투무맙; Kd=카필조밉-덱사메타손. | ||
|
||
| 혈액 및 림프계 장애 | ||
| 혈소판감소증 | 68 | 32 |
| 빈혈 | 52 | 21 |
| 호중구감소증 | 31 | 21 |
| 림프구감소증 | 29 | 25 |
| 전신 장애 및 투여 부위 이상 | ||
| 피로 | 54 | 18 |
| Infusion-related reactions | 53 | 12 |
| 발열 | 37 | 1.2 |
| 감염 | ||
| Respiratory tract infection | 53 | 3.5 |
| 기관지염 | 19 | 0 |
| 비인두염 | 18 | 0 |
| 인플루엔자 | 17 | 3.5 |
| 위장 장애 | ||
| 메스꺼움 | 42 | 1.2 |
| 구토 | 40 | 1.2 |
| 설사 | 38 | 2.4 |
| 변비 | 17 | 0 |
| 호흡기, 흉부 및 종격 장애 | ||
| 호흡곤란 | 35 | 3.5 |
| 기침 | 33 | 0 |
| 혈관 장애 | ||
| 고혈압 | 33 | 20 |
| 정신 장애 | ||
| 불면증 | 33 | 4.7 |
| 신경계 장애 | ||
| 두통 | 27 | 1.2 |
| 근골격계 및 결합 조직 장애 | ||
| 요통 | 25 | 0 |
| 사지 통증 | 15 | 0 |
15% 미만 빈도로 발생하는 이상반응
- 혈액 및 림프계 장애:leukopenia, febrile neutropenia
- 심장 질환:atrial fibrillation
- 위장관 장애:pancreatitis
- 전신 장애 및 투여 부위:말초 부종, 오한
- 감염:pneumonia, urinary tract infection, sepsis, septic shock
- 대사 및 영양 장애:식욕 감소, 고혈당증, 탈수, 저칼슘혈증
- 근골격계 및 결합 조직 장애:근육 경련, 흉부 근골격계 통증, 관절통
- 신경계 장애:현기증, 감각 이상, 말초 감각 신경병증
- 피부 및 피하 조직 장애:가려움증, 발진
포말리도마이드 및 덱사메타손 병용 요법
포말리도마이드 및 덱사메타손과 병용한 DARZALEX의 안전성은 EQUULEUS에서 평가되었습니다.
[
임상 연구 (14.2) 참조]
. 표 19에 설명된 이상반응은 DARZALEX, 포말리도마이드 및 덱사메타손(DPd)에 대한 중앙값 치료 기간 6개월(범위: 0.03~16.9개월) 노출을 반영합니다.
중대한 이상반응의 전체 발생률은 49%였습니다. ≥5%의 환자에서 보고된 중대한 이상반응에는 폐렴(7%)이 포함되었습니다. 이상반응으로 인해 13%의 환자가 치료를 중단했습니다.
| 이상반응 | DPd (N=103) | ||
|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=daratumumab, Pd=pomalidomide-dexamethasone. | |||
| 전신 장애 및 투여 부위 | |||
| 피로 | 50 | 10 | 0 |
| 주입 관련 반응 | 50 | 4 | 0 |
| 발열 | 25 | 1 | 0 |
| 오한 | 20 | 0 | 0 |
| 말초 부종 | 17 | 4 | 0 |
| 무력증 | 15 | 0 | 0 |
| 비심장성 흉통 | 15 | 0 | 0 |
| 통증 | 11 | 0 | 0 |
| 감염 | |||
| 상기도 감염 | 50 | 4 | 1 |
| 폐렴 | 15 | 8 | 2 |
| 호흡기, 흉부 및 종격동 장애 | |||
| 기침 | 43 | 1 | 0 |
| 호흡곤란 | 33 | 6 | 1 |
| 코막힘 | 16 | 0 | 0 |
| 위장 장애 | |||
| 설사 | 38 | 3 | 0 |
| 변비 | 33 | 0 | 0 |
| 메스꺼움 | 30 | 0 | 0 |
| 구토 | 21 | 2 | 0 |
| 근골격계 및 결합 조직 장애 | |||
| 근육 경련 | 26 | 1 | 0 |
| 요통 | 25 | 6 | 0 |
| 관절통 | 22 | 2 | 0 |
| 사지 통증 | 15 | 0 | 0 |
| 골통 | 13 | 4 | 0 |
| 근골격계 흉통 | 13 | 2 | 0 |
| 정신 장애 | |||
| 불면증 | 23 | 2 | 0 |
| 불안 | 13 | 0 | 0 |
| 신경계 장애 | |||
| 현기증 | 21 | 2 | 0 |
| 떨림 | 19 | 3 | 0 |
| 두통 | 17 | 0 | 0 |
| 대사 및 영양 장애 | |||
| 저칼륨혈증 | 16 | 3 | 0 |
| 고혈당증 | 13 | 5 | 1 |
| 식욕 감소 | 11 | 0 | 0 |
치료 중 악화된 실험실 이상은 표 20에 나열되어 있습니다.
| DPd (N=103) |
|||
|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 키: D=다라투무맙, Pd=포말리도마이드-덱사메타손. | |||
| 호중구 감소증 | 95 | 36 | 46 |
| 림프구 감소증 | 94 | 45 | 26 |
| 혈소판 감소증 | 75 | 10 | 10 |
| 빈혈 | 57 | 30 | 0 |
단독 요법
DARZALEX의 안전성은 재발성 및 불응성 다발성 골수종 성인 환자 156명을 대상으로 세 건의 공개형 임상 시험에서 평가되었습니다. 환자들은 DARZALEX 16mg/kg을 투여받았습니다. 평균 노출 기간은 3.3개월(범위: 0.03~20.04개월)이었습니다.
중대한 이상반응은 51명(33%)의 환자에서 보고되었습니다. 가장 흔한 중대한 이상반응은 폐렴(6%), 전반적인 신체 건강 악화(3%), 발열(3%)이었습니다.
이상반응으로 인해 24명(15%)의 환자에서 치료가 지연되었으며, 가장 흔한 원인은 감염이었습니다. 이상반응으로 인해 6명(4%)의 환자에서 치료가 중단되었습니다.
환자의 최소 10% 이상에서 발생한 이상반응은 표 21에 제시되어 있습니다. 표 22는 ≥10%의 비율로 보고된 3~4등급의 검사 이상을 설명합니다.
| 이상반응 | DARZALEX (N=156) |
||
|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| 전신 장애 및 투여 부위 이상 | |||
| 주입 관련 반응 | 48 | 3 | 0 |
| 피로 | 39 | 2 | 0 |
| 발열 | 21 | 1 | 0 |
| 오한 | 10 | 0 | 0 |
| 위장 장애 | |||
| 메스꺼움 | 27 | 0 | 0 |
| 설사 | 16 | 1 | 0 |
| 변비 | 15 | 0 | 0 |
| 구토 | 14 | 0 | 0 |
| 근골격계 및 결합 조직 장애 | |||
| 요통 | 23 | 2 | 0 |
| 관절통 | 17 | 0 | 0 |
| 사지 통증 | 15 | 1 | 0 |
| 근골격계 흉통 | 12 | 1 | 0 |
| 호흡기계, 흉부 및 종격 장애 | |||
| 기침 | 21 | 0 | 0 |
| 코막힘 | 17 | 0 | 0 |
| 호흡곤란 | 15 | 1 | 0 |
| 감염 | |||
| 상기도 감염 | 20 | 1 | 0 |
| 비인두염 | 15 | 0 | 0 |
| Pneumonia | 11 | 6 | 0 |
| 대사 및 영양 장애 | |||
| 식욕 감퇴 | 15 | 1 | 0 |
| 신경계 장애 | |||
| 두통 | 12 | 1 | 0 |
| 혈관 장애 | |||
| 고혈압 | 10 | 5 | 0 |
| Daratumumab 16 mg/kg (N=156) | |||
|---|---|---|---|
| 모든 등급 (%) |
3등급 (%) |
4등급 (%) |
|
| Lymphopenia | 72 | 30 | 10 |
| Neutropenia | 60 | 17 | 3 |
| Thrombocytopenia | 48 | 10 | 8 |
| Anemia | 45 | 19 | 0 |
대상포진 바이러스 재활성화
일부 DARZALEX 임상 시험에서 환자에게 대상포진 바이러스 재활성화 예방이 권장되었습니다. 단독 요법 연구에서 대상포진은 환자의 3%에서 보고되었습니다. 병용 요법 연구에서 대상포진은 DARZALEX를 투여받은 환자의 2-5%에서 보고되었습니다.
감염
3등급 또는 4등급 감염은 다음과 같이 보고되었습니다.
- 재발/불응성 환자 연구: DVd: 21% vs. Vd: 19%; DRd: 28% vs. Rd: 23%; DPd: 28%; DKd
1: 37%, Kd
1: 29%; DKd
2: 21%
- 새롭게 진단된 환자 연구: D-VMP: 23%, VMP: 15%; DRd: 32%, Rd: 23%; DVTd: 22%; VTd: 20%.
폐렴은 연구 전반에 걸쳐 가장 흔하게 보고된 중증(3등급 또는 4등급) 감염이었습니다. 활성 대조군 연구에서 감염으로 인한 치료 중단은 환자의 1-4%에서 발생했습니다.
치명적인 감염(5등급)은 다음과 같이 보고되었습니다.
- 재발/불응성 환자 연구: DVd: 1%, Vd: 2%; DRd: 2%, Rd: 1%; DPd: 2%; DKd
1: 5%, Kd
1: 3%; DKd
2: 0%
- 새롭게 진단된 환자 연구: D-VMP: 1%, VMP: 1%; DRd: 2%, Rd: 2%; DVTd: 0%, VTd: 0%.
치명적인 감염은 일반적으로 드물었으며 DARZALEX 함유 요법과 활성 대조군 사이에서 균형을 이루었습니다. 치명적인 감염은 주로 폐렴과 패혈증으로 인한 것이었습니다.
6.2 시판 후 경험
다음과 같은 이상 반응은 다라투무맙의 시판 후 사용 중 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에 항상 발생 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
면역 체계 장애:아나필락시스 반응, IRR(사망 포함)
위장 장애:췌장염
감염:사이토메갈로바이러스, 리스테리아증
7 약물 상호작용
7.1 Daratumumab의 실험실 검사에 대한 영향
간접 항글로불린 검사 (간접 쿰스 검사)의 간섭
Daratumumab은 RBC의 CD38에 결합하여 항체 선별 및 교차 시험을 포함한 적합성 검사를 방해합니다. Daratumumab 간섭 완화 방법에는 dithiothreitol (DTT)로 시약 RBC를 처리하여 daratumumab 결합을 방해하는 방법
[참조
또는 유전자형 분석이 포함됩니다. Kell 혈액형 시스템도 DTT 처리에 민감하기 때문에 DTT 처리된 RBC를 사용하여 동종 항체를 배제하거나 식별한 후 K-음성 단위를 제공하십시오.
응급 수혈이 필요한 경우, 지역 혈액 은행 관행에 따라 교차 시험을 거치지 않은 ABO/RhD 적합 RBC를 투여하십시오.
혈청 단백질 전기영동 및 면역고정 검사의 간섭
Daratumumab은 질병 단일클론 면역글로불린(M 단백질) 모니터링에 사용되는 혈청 단백질 전기영동(SPE) 및 면역고정(IFE) 분석에서 검출될 수 있습니다. IgG 카파 골수종 단백질을 가진 환자의 경우 위양성 SPE 및 IFE 분석 결과가 발생하여 국제 골수종 작업 그룹(IMWG) 기준에 의한 완전 반응의 초기 평가에 영향을 미칠 수 있습니다. daratumumab 간섭이 의심되는 지속적인 매우 좋은 부분 반응을 보이는 환자의 경우, FDA 승인 daratumumab 특이 IFE 분석을 사용하여 환자 혈청의 나머지 내인성 M 단백질에서 daratumumab을 구별하여 완전 반응 결정을 촉진하는 것을 고려하십시오.
8 특정 집단에서의 사용
8.1 임신
위험 요약
DARZALEX는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. 다라투무맙 제품과 관련된 위험 평가는 작용 기전과 표적 항원 CD38 녹아웃 동물 모델의 데이터를 기반으로 합니다.
(
. DARZALEX를 임산부에게 사용한 데이터가 없어 주요 선천적 기형, 유산 또는 모체 또는 태아의 부작용과 관련된 약물 위험을 평가할 수 없습니다. 동물 생식 연구는 수행되지 않았습니다.
지정된 인구 집단의 주요 선천적 기형 및 유산의 추정 배경 위험은 알려져 있지 않습니다. 모든 임신에는 선천적 기형, 손실 또는 기타 부작용의 배경 위험이 있습니다. 미국 일반 인구의 경우 임상적으로 인식된 임신에서 주요 선천적 기형 및 유산의 추정 배경 위험은 각각 2%에서 4% 및 15%에서 20%입니다.
DARZALEX와 레날리도마이드, 포말리도마이드 또는 탈리도마이드의 병용은 임산부에게 금기입니다. 레날리도마이드, 포말리도마이드 및 탈리도마이드는 태아의 기형 및 사망을 유발할 수 있습니다. 레날리도마이드, 포말리도마이드 및 탈리도마이드는 REMS 프로그램을 통해서만 제공됩니다. 임신 중 사용에 대한 레날리도마이드, 포말리도마이드 또는 탈리도마이드 처방 정보를 참조하십시오.
8.2 수유
위험 요약
모유에서 다라투무맙의 존재, 모유 수유 아기에게 미치는 영향 또는 모유 생산에 미치는 영향에 대한 데이터는 없습니다. 모체 면역글로불린 G는 모유에 존재하는 것으로 알려져 있습니다. 발표된 데이터에 따르면 모유의 항체는 신생아 및 유아 순환계로 상당한 양이 들어가지 않습니다. DARZALEX를 레날리도마이드, 포말리도마이드 또는 탈리도마이드와 함께 투여할 경우 모유 수유 아기에게 심각한 부작용이 발생할 가능성이 있으므로 여성에게 DARZALEX 치료 중에는 모유 수유를 하지 않도록 조언하십시오. 추가 정보는 레날리도마이드, 포말리도마이드 또는 탈리도마이드 처방 정보를 참조하십시오.
8.3 생식 능력이 있는 여성 및 남성
DARZALEX는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다.
[
.
8.5 노인 사용
권장 용량으로 DARZALEX를 투여받은 2,459명의 환자 중 38%가 65세에서 74세였고 15%가 75세 이상이었습니다. 이러한 환자와 젊은 환자 사이에 유효성에 대한 전반적인 차이는 관찰되지 않았습니다. 심각한 부작용의 발생률은 젊은 환자보다 노인 환자에서 더 높았습니다.
[
부작용(6.1) 참조]
. 재발 및 불응성 다발성 골수종 환자(n=1,213) 중 65세 이상 환자에서 더 자주 발생한 심각한 부작용은 폐렴과 패혈증이었습니다. CANDOR에서 DKd 그룹 내에서 치명적인 부작용은 65세 이상 환자의 14%에서 발생한 반면 65세 미만 환자의 경우 6%에서 발생했습니다. 자가 조혈 줄기 세포 이식이 불가능한 새로 진단된 다발성 골수종 환자(n=710) 중 75세 이상 환자에서 더 자주 발생한 심각한 부작용은 폐렴이었습니다.
11 설명
다라투무맙은 CD38 항원에 결합하는 면역글로불린 G1 캡파(IgG1κ) 인간 단클론 항체입니다. 재조합 DNA 기술을 사용하여 중국 햄스터 난소(CHO) 세포에서 생산됩니다. 다라투무맙의 분자량은 약 148 kDa입니다.
DARZALEX
®(다라투무맙) 주사제는 단회용 바이알에 무색에서 옅은 노란색의 방부제가 없는 용액으로 제공되며 정맥 주사용입니다. pH는 5.5입니다.
DARZALEX 20mL 단회용 바이알 각각에는 (NDC 57894-502-20) 다라투무맙 400mg, 빙초산(3.7mg), 만니톨(510mg), 폴리소르베이트 20(8mg), 아세트산나트륨 3수화물(59.3mg), 염화나트륨(70.1mg) 및 주사용수 USP가 함유되어 있습니다.
DARZALEX 5mL 단회용 바이알 각각에는 (NDC 57894-502-05) 다라투무맙 100mg, 빙초산(0.9mg), 만니톨(127.5mg), 폴리소르베이트 20(2mg), 아세트산나트륨 3수화물(14.8mg), 염화나트륨(17.5mg) 및 주사용수 USP가 함유되어 있습니다.
DARZALEX 20mL 단회용 바이알 각각에는 (NDC 57894-505-20) 다라투무맙 400mg, L-히스티딘(7mg), L-히스티딘 염산염 일수화물(32.6mg), L-메티오닌(20mg), 폴리소르베이트 20(8mg), 소르비톨(1093mg) 및 주사용수 USP가 함유되어 있습니다.
DARZALEX 5mL 단회용 바이알 각각에는 (NDC 57894-505-05) 다라투무맙 100mg, L-히스티딘(1.8mg), L-히스티딘 염산염 일수화물(8.2mg), L-메티오닌(5mg), 폴리소르베이트 20(2mg), 소르비톨(273.3mg) 및 주사용수 USP가 함유되어 있습니다.
12 임상약리학
12.1 작용 기전
CD38은 다발성 골수종 및 기타 세포 유형 및 조직을 포함한 조혈 세포의 표면에 발현되는 막관통 당단백질(48 kDa)이며, 수용체 매개 부착, 신호 전달 및 사이클레이스 및 하이드롤레이스 활성 조절과 같은 여러 기능을 가지고 있습니다. 다라투무맙은 CD38에 결합하는 IgG1κ 인간 단클론 항체(mAb)이며, Fc 매개 교차 결합을 통한 직접적인 세포 사멸 유도뿐만 아니라 보체 의존성 세포 독성(CDC), 항체 의존성 세포 매개 세포 독성(ADCC) 및 항체 의존성 세포 식작용(ADCP)을 통한 면역 매개 종양 세포 용해를 통해 CD38 발현 종양 세포의 성장을 억제합니다. 다라투무맙에 의해 골수 유래 억제 세포(CD38+MDSCs), 조절 T 세포(CD38+T
regs) 및 B 세포(CD38+B
regs)의 하위 집합이 감소합니다.
12.2 약력학
NK 세포는 CD38을 발현하며 다라투무맙 매개 세포 용해에 취약합니다. DARZALEX 치료로 말초 전혈 및 골수에서 총 NK 세포(CD16+CD56+) 및 활성화된(CD16+CD56
dim) NK 세포의 절대 수와 백분율이 감소하는 것으로 관찰되었습니다.
12.3 약동학
다라투무맙 농도-시간 곡선 아래 면적(AUC)은 단독 요법으로 1~24mg/kg(승인된 권장 용량의 0.06~1.5배) 또는 병용 요법으로 1~16mg/kg(승인된 권장 용량의 0.06~1배)의 용량 범위에서 용량에 비례하여 증가합니다.
DARZALEX를 단독 요법 또는 병용 요법으로 승인된 권장 용량으로 투여한 후, 평균 혈청 최대 농도(C
max)는 주간 투여 마지막에 첫 번째 투여량에 비해 약 2.7~3배 높았습니다. DARZALEX를 단독 요법으로 투여했을 때 주간 투여 마지막의 평균 ± 표준 편차(SD) 골 혈청 농도(C
min)는 573 ± 332 µg/mL이었고, DARZALEX를 병용 요법으로 투여했을 때 502 ± 196~607 ± 231 µg/mL이었습니다. 첫 번째 투여량을 분할 투여하면 단일 투여에 비해 첫 번째 날의 약동학적 프로파일이 달랐지만, 1주차 2일에 두 번째 분할 투여량을 투여한 후에는 C
max및 C
min농도가 예측 및 관찰 모두에서 유사했습니다.
DARZALEX를 단독 요법으로 투여했을 때, 다라투무맙 정상 상태는 4주마다 투여 기간(21
st주입)이 시작된 후 약 5개월 만에 달성되었습니다. 정상 상태에서 다라투무맙의 평균 ± SD 축적 비율은 C
max에 대해 1.6 ± 0.5였습니다.
제거
다라투무맙 청소율은 용량 증가 및 다중 투여와 함께 감소했습니다. 승인된 권장 용량의 DARZALEX를 단독 요법으로 투여한 후, 평균 ± SD 선형 청소율은 171.4 ± 95.3 mL/day로 추정되었고, 평균 ± SD 추정 말단 반감기는 선형 청소율과 관련하여 18 ± 9일이었습니다. DARZALEX를 병용 요법으로 투여했을 때 말단 반감기는 유사했습니다.
12.6 면역원성
관찰된 항체 생성 항체(ADA, 중화 항체 포함) 발생률은 분석의 민감도 및 특이도에 크게 의존합니다. 분석 방법의 차이로 인해 아래에 설명된 연구에서 ADA 발생률을 다른 연구(다라투무맙 또는 기타 다라투무맙 제품 포함)의 ADA 발생률과 의미 있게 비교할 수 없습니다.
DARZALEX 단독 요법 또는 병용 요법으로 치료받은 다발성 골수종 환자를 대상으로 한 10건의 임상 시험에서 DARZALEX 치료 중앙값이 3.3~48개월인 경우, 항-다라투무맙 항체 발생률은 0.6%(2,179명 중 14명)였으며, 12명의 환자가 중화 항체에 대해 양성 반응을 보였습니다. 항체 생성 항체 발생률이 낮기 때문에 이러한 항체가 다라투무맙 제품의 약동학, 약력학, 안전성 및/또는 효능에 미치는 영향은 알려져 있지 않습니다.
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 저해
다라투무맙을 이용한 발암성 또는 유전독성 연구는 수행되지 않았습니다. 다라투무맙의 생식 또는 발달에 대한 잠재적 영향을 평가하거나 수컷 또는 암컷의 생식 능력에 대한 잠재적 영향을 결정하기 위한 동물 연구는 수행되지 않았습니다.
14 임상 연구
14.1 새롭게 진단된 다발성 골수종
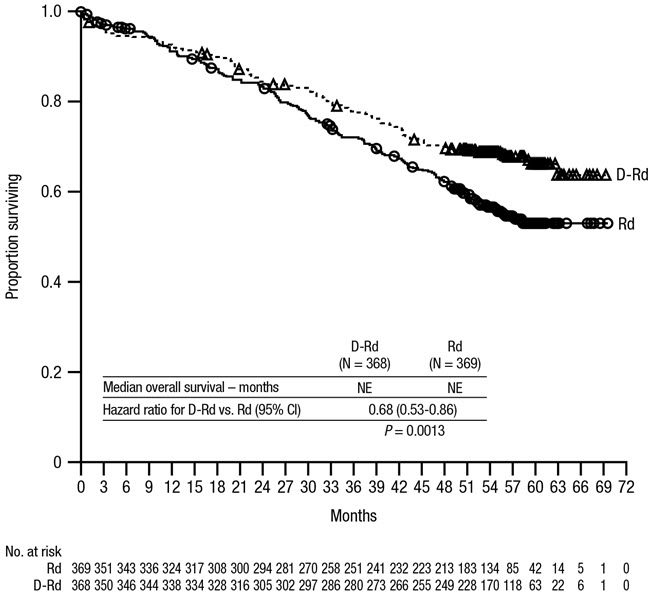
자가 조혈모세포 이식이 적합하지 않은 환자에서 레날리도마이드 및 덱사메타손 병용 요법
공개형 무작위 활성 대조군 시험인 MAIA (NCT02252172)에서는 자가 조혈모세포 이식이 적합하지 않은 새롭게 진단된 다발성 골수종 환자에서 DARZALEX 16 mg/kg을 레날리도마이드 및 저용량 덱사메타손(DRd)과 병용하는 치료법과 레날리도마이드 및 저용량 덱사메타손(Rd)을 사용하는 치료법을 비교했습니다. 레날리도마이드(28일[4주] 주기로 1~21일에 1일 1회 25mg 경구 투여)를 저용량 경구 또는 정맥 주사 덱사메타손 40mg/주(또는 75세 초과 환자 또는 체질량 지수[BMI] 18.5 미만 환자의 경우 감량된 용량 20mg/주)와 함께 투여했습니다. DARZALEX 주입일에 덱사메타손 용량을 주입 전 약물로 투여했습니다. 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 두 군 모두에서 치료를 계속했습니다.
총 737명의 환자가 무작위 배정되었습니다. 368명은 DRd군에, 369명은 Rd군에 배정되었습니다. 두 치료군 간의 기준선 인구 통계 및 질병 특성은 유사했습니다. 중앙 연령은 73세(범위: 45~90세)였으며, 환자의 44%가 75세 이상이었습니다. 환자의 52%는 남성이었고, 92%는 백인, 4%는 흑인 또는 아프리카계 미국인, 1%는 아시아인이었습니다. 환자의 3%는 히스패닉 또는 라틴계 민족이라고 보고했습니다. 34%는 ECOG(Eastern Cooperative Oncology Group) 수행 상태 점수가 0이었고, 50%는 ECOG 수행 상태 점수가 1이었으며, 17%는 ECOG 수행 상태 점수가 2 이상이었습니다. 27%는 ISS(International Staging System) 병기 I, 43%는 ISS 병기 II, 29%는 ISS 병기 III였습니다. IMWG(International Myeloma Working Group) 기준에 따라 무진행 생존(PFS)을 통해 효능을 평가했습니다.
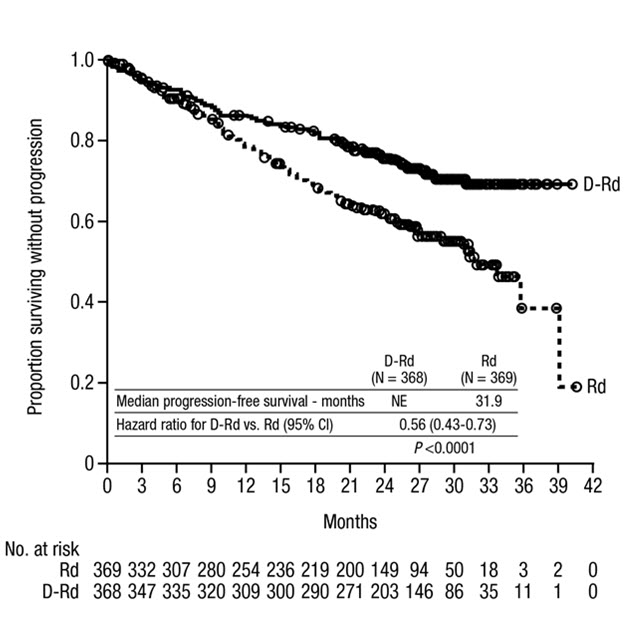
MAIA는 Rd군에 비해 DRd군에서 무진행 생존(PFS)의 개선을 보여주었습니다. DRd군의 PFS 중앙값에 도달하지 않았으며 Rd군에서는 31.9개월이었습니다(위험 비[HR]=0.56, 95% CI: 0.43, 0.73, p<0.0001). 이는 DRd로 치료받은 환자에서 질병 진행 또는 사망 위험이 44% 감소했음을 나타냅니다. 64개월의 중앙값 추적 관찰 후, DRd군의 PFS 중앙값은 61.9개월(95% CI: 54.8, NE)이었고 Rd군에서는 34.4개월(95% CI: 29.6, 39.2)이었습니다.
중앙값 56개월의 추적 관찰 후, MAIA는 Rd군과 비교하여 DRd군에서 전체 생존율(OS)의 개선을 보여주었습니다(HR=0.68; 95% CI: 0.53, 0.86; p=0.0013). 이는 DRd군에서 치료받은 환자의 사망 위험이 32% 감소했음을 나타냅니다. 두 군 모두에서 중앙값 OS에 도달하지 못했습니다.
그림 2: MAIA의 OS 카플란-마이어 곡선
MAIA의 추가 효능 결과는 표 23에 제시되어 있습니다.
| DRd (N=368) | Rd (N=369) | |
|---|---|---|
| DRd=daratumumab-lenalidomide-dexamethasone; Rd=lenalidomide-dexamethasone; MRD=minimal residual disease; CI=confidence interval | ||
| 전체 반응 (sCR+CR+VGPR+PR) n(%) | 342 (92.9%) | 300 (81.3%) |
| p-값 | <0.0001 | |
| 엄격한 완전 반응 (sCR) | 112 (30.4%) | 46 (12.5%) |
| 완전 반응 (CR) | 63 (17.1%) | 46 (12.5%) |
| 매우 좋은 부분 반응 (VGPR) | 117 (31.8%) | 104 (28.2%) |
| 부분 반응 (PR) | 50 (13.6%) | 104 (28.2%) |
| CR 이상 (sCR + CR) | 175 (47.6%) | 92 (24.9%) |
| p-값 | <0.0001 | |
| VGPR 이상 (sCR + CR + VGPR) | 292 (79.3%) | 196 (53.1%) |
| p-값 | <0.0001 | |
| MRD 음성률 | 89 (24.2%) | 27 (7.3%) |
| 95% CI (%) | (19.9%, 28.9%) | (4.9%, 10.5%) |
| p-값 | <0.0001 | |
| CR 이상 환자의 MRD 음성률 | ||
| CR 이상 환자 수 | N=175 | N=92 |
| MRD 음성률 n(%) | 89 (50.9%) | 27 (29.3%) |
| 95% CI (%) | (43.2%, 58.5%) | (20.3%, 39.8%) |
반응을 보인 환자에서 반응까지의 중앙값 시간은 DRd 그룹에서 1.05개월(범위: 0.2~12.1개월), Rd 그룹에서 1.05개월(범위: 0.3~15.3개월)이었습니다. DRd 그룹에서는 반응 지속 기간의 중앙값에 도달하지 않았으며 Rd 그룹에서는 34.7개월(95% CI: 30.8, 추정 불가)이었습니다.
자가 조혈모세포 이식 부적격 환자에서 보르테조밉, 멜팔란 및 프레드니손(VMP) 병용 요법
공개형 무작위 활성 대조군 시험인 ALCYONE(NCT02195479)에서는 자가 조혈모세포 이식 부적격인 새롭게 진단된 다발성 골수종 환자에서 DARZALEX 16mg/kg을 보르테조밉, 멜팔란 및 프레드니손(D-VMP)과 병용하는 치료를 VMP 치료와 비교했습니다. 보르테조밉은 첫 6주 주기(주기 1; 8회 투여)의 1, 2, 4, 5주차에 1.3mg/m
2 체표면적 용량으로 주 2회 피하(SC) 주사로 투여한 후, 8회의 6주 주기(주기 2~9; 주기당 4회 투여) 동안 1, 2, 4, 5주차에 주 1회 투여했습니다. 멜팔란 9mg/m
2 및 프레드니손 60mg/m
2은 9회의 6주 주기(주기 1~9)의 1~4일에 경구 투여했습니다. DARZALEX는 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 계속 투여했습니다.
총 706명의 환자가 무작위 배정되었습니다. 350명은 D-VMP군에, 356명은 VMP군에 배정되었습니다. 두 치료군 간의 기준선 인구 통계 및 질병 특성은 유사했습니다. 중앙값 연령은 71세(범위: 40~93세)였으며, 환자의 30%는 75세 이상이었습니다. 대다수는 백인(85%), 여성(54%)이었고, 25%는 ECOG 수행 상태 점수가 0, 50%는 ECOG 수행 상태 점수가 1, 25%는 ECOG 수행 상태 점수가 2였습니다. 환자의 19%는 ISS 병기 I, 42%는 ISS 병기 II, 38%는 ISS 병기 III였습니다. 효능은 IMWG 기준에 따른 PFS 및 전체 생존(OS)으로 평가했습니다.
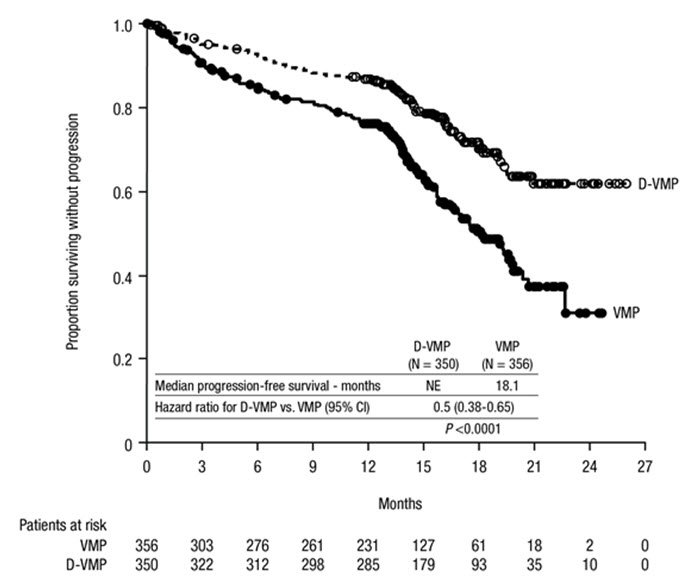
ALCYONE은 VMP군에 비해 D-VMP군에서 PFS의 개선을 보여주었습니다(HR=0.50; 95% CI: 0.38, 0.65; p<0.0001). 이는 D-VMP로 치료받은 환자에서 질병 진행 또는 사망 위험이 50% 감소했음을 나타냅니다. 40개월의 중앙값 추적 관찰 후, D-VMP군의 PFS 중앙값은 36.4개월(95% CI: 32.1, 45.9)이었고 VMP군의 PFS 중앙값은 19.3개월(95% CI: 18.0, 20.4)이었습니다.
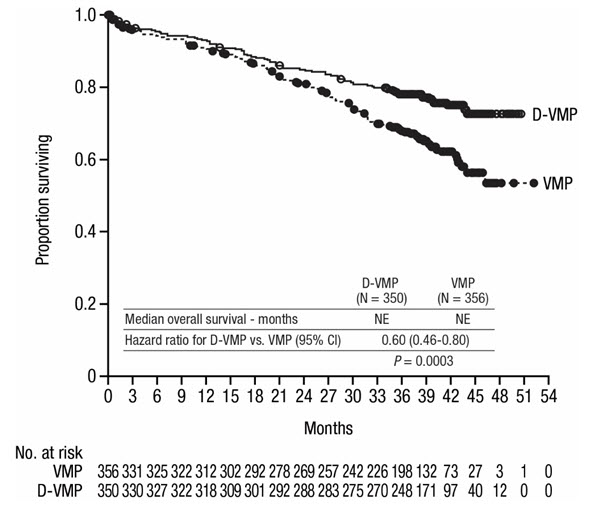
40개월의 중앙값 추적 관찰 후, ALCYONE은 VMP군에 비해 D-VMP군에서 전체 생존(OS)의 개선을 보여주었습니다(HR=0.60; 95% CI: 0.46, 0.80; p=0.0003). 이는 D-VMP군에서 치료받은 환자의 사망 위험이 40% 감소했음을 나타냅니다. 두 군 모두 OS 중앙값에 도달하지 않았습니다.
87개월의 중앙값 추적 관찰 후, D-VMP군의 OS 중앙값은 83개월(95% CI: 72.5, NE)이었고 VMP군의 OS 중앙값은 53.6개월(95% CI: 46.3, 60.9)이었습니다.
ALCYONE의 추가 효능 결과는 표 24에 제시되어 있습니다.
| D-VMP (N=350) | VMP (N=356) | |
|---|---|---|
| D-VMP = daratumumab-bortezomib-melphalan-prednisone; VMP = bortezomib-melphalan-prednisone; MRD = minimal residual disease; CI = confidence interval | ||
| 전반적인 반응 (sCR+CR+VGPR+PR) n(%) | 318 (90.9%) | 263 (73.9%) |
| p-값 | <0.0001 | |
| 엄격한 완전 반응 (sCR) | 63 (18.0%) | 25 (7.0%) |
| 완전 반응 (CR) | 86 (24.6%) | 62 (17.4%) |
| 매우 좋은 부분 반응 (VGPR) | 100 (28.6%) | 90 (25.3%) |
| 부분 반응 (PR) | 69 (19.7%) | 86 (24.2%) |
| MRD 음성률 | 78 (22.3%) | 22 (6.2%) |
| 95% CI (%) | (18.0, 27.0) | (3.9, 9.2) |
| p-값 | <0.0001 | |
| CR 이상 환자의 MRD 음성률 | ||
| CR 이상 환자 수 | N=149 | N=87 |
| MRD 음성률 n(%) | 74 (49.7%) | 22 (25.3%) |
| 95% CI (%) | (41.4, 58.0) | (16.6, 35.7) |
반응을 보인 환자에서 반응까지의 중앙값 시간은 D-VMP 그룹에서 0.79개월(범위: 0.4~15.5개월), VMP 그룹에서 0.82개월(범위: 0.7~12.6개월)이었습니다. 반응 지속 기간 중앙값은 D-VMP 그룹에서 도달하지 않았고 VMP 그룹에서는 21.3개월(범위: 0.5+, 23.7+)이었습니다.
자가 조혈모세포 이식(ASCT)에 적합한 환자에서 보르테조밉, 탈리도마이드 및 덱사메타손 병용 요법
공개형 무작위 활성 대조군 시험인 CASSIOPEIA(NCT02541383)는 새롭게 다발성 골수종 진단을 받고 ASCT에 적합한 환자에서 DARZALEX 16mg/kg을 보르테조밉, 탈리도마이드 및 덱사메타손(DVTd)과 병용한 유도 및 공고 요법을 보르테조밉, 탈리도마이드 및 덱사메타손(VTd) 요법과 비교했습니다. 공고 요법 단계는 환자가 충분히 회복되고 생착이 완료된 시점인 ASCT 후 최소 30일째에 시작되었습니다. 이 시험은 65세 이하의 환자로 제한되었습니다. 보르테조밉은 반복되는 28일(4주) 유도 요법 주기(1~4주기)의 2주 동안(1, 4, 8, 11일째) 1.3mg/m
2 체표면적 용량으로 주 2회 피하(SC) 주사 또는 정맥(IV) 주사로 투여되었으며, 4주기 후 ASCT 후 2회의 공고 주기(5주기 및 6주기) 동안 투여되었습니다. 탈리도마이드는 6회의 보르테조밉 주기 동안 100mg을 매일 경구 투여했습니다. 덱사메타손(경구 또는 정맥)은 1주기 및 2주기의 1, 2, 8, 9, 15, 16, 22, 23일째에 40mg을 투여했으며, 3~4주기의 1~2일째에는 40mg을, 이후 투여일(8, 9, 15, 16일째)에는 20mg을 투여했습니다. 덱사메타손 20mg은 5주기 및 6주기의 1, 2, 8, 9, 15, 16일째에 투여했습니다. DARZALEX 주입일에 덱사메타손 용량은 주입 전 약물로 정맥 투여했습니다.
총 1,085명의 환자가 무작위 배정되었습니다. 543명은 DVTd군에, 542명은 VTd군에 배정되었습니다. 두 치료군 간의 기준선 인구 통계 및 질병 특성은 유사했습니다. 중앙값 연령은 58세(범위: 22~65세)였습니다. 대다수는 남성(59%)이었고, 48%는 ECOG 수행 상태 점수가 0, 42%는 ECOG 수행 상태 점수가 1, 10%는 ECOG 수행 상태 점수가 2였습니다. 40%는 ISS 병기 I, 45%는 ISS 병기 II, 15%는 ISS 병기 III였습니다.
효능은 이식 후 100일째의 엄격한 완전 반응(sCR)률, 이식 후 100일째의 완전 반응률(CR), 무진행 생존(PFS)으로 평가했습니다.
| DVTd (N=543) | VTd (N=542) | |
|---|---|---|
| D-VTd = 다라투무맙-보르테조밉-탈리도마이드-덱사메타손; VTd = 보르테조밉-탈리도마이드-덱사메타손 | ||
| 전반적인 반응(sCR+CR+VGPR+PR) n(%) | 503 (92.6%) | 487 (89.9%) |
| 엄격한 완전 반응(sCR) | 157 (28.9%) | 110 (20.3%) |
| p값 | 0.0010 | |
| 완전 반응(CR) | 54 (9.9%) | 31 (5.7%) |
| 매우 좋은 부분 반응(VGPR) | 242 (44.6%) | 282 (52.0%) |
| 부분 반응(PR) | 50 (9.2%) | 64 (11.8%) |
CASSIOPEIA는 VTd군에 비해 DVTd군에서 PFS 개선을 보여주었습니다. 18.8개월의 중앙값 추적 관찰 기간 동안 두 군 모두에서 PFS 중앙값에 도달하지 못했습니다. DVTd 치료는 VTd 단독 치료에 비해 질병 진행 또는 사망 위험을 53% 감소시켰습니다(HR=0.47; 95% CI: 0.33, 0.67; p<0.0001).
14.2 재발성/불응성 다발성 골수종
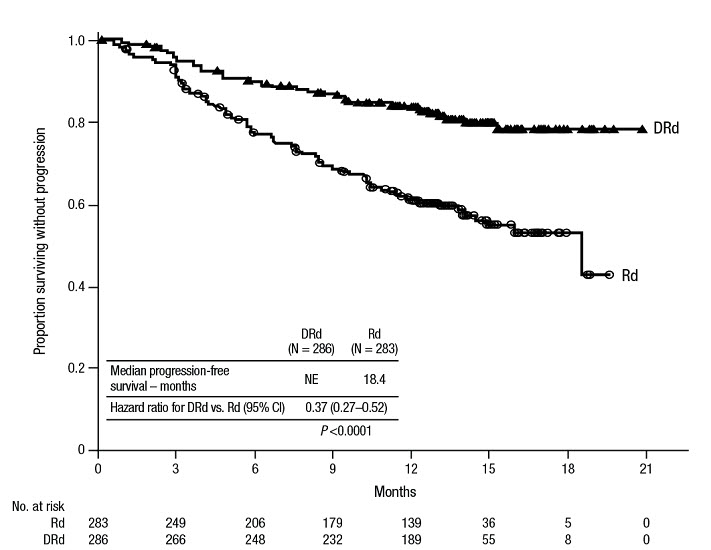
레날리도마이드 및 덱사메타손 병용 요법
공개형 무작위 활성 대조군 시험인 POLLUX (NCT02076009)는 이전에 최소 한 번의 치료를 받은 다발성 골수종 환자에서 레날리도마이드 및 저용량 덱사메타손(Rd) 치료와 비교하여 DARZALEX 16mg/kg을 레날리도마이드 및 저용량 덱사메타손(DRd)과 병용하는 치료를 비교했습니다. 레날리도마이드(반복되는 28일[4주] 주기의 1~21일에 1일 1회 25mg 경구 투여)는 저용량 경구 또는 정맥 내 덱사메타손 40mg/주(또는 75세 초과 또는 BMI <18.5인 환자의 경우 감량된 용량 20mg/주)와 함께 투여되었습니다. DARZALEX 주입일에 덱사메타손 용량 20mg을 주입 전 약물로 투여하고 나머지는 주입 다음 날 투여했습니다. 덱사메타손 감량 용량을 투여받는 환자의 경우 전체 20mg 용량을 DARZALEX 주입 전 약물로 투여했습니다. 레날리도마이드 및 덱사메타손의 용량 조정은 제조업체의 처방 정보에 따라 적용되었습니다. 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 두 군 모두에서 치료를 계속했습니다.
총 569명의 환자가 무작위 배정되었습니다. 286명은 DRd군에, 283명은 Rd군에 배정되었습니다. 기준선 인구 통계 및 질병 특성은 DARZALEX군과 대조군 사이에서 유사했습니다. 환자의 평균 연령은 65세(범위 34~89세)였고, 11%는 75세 이상, 59%는 남성이었으며, 69%는 백인, 18%는 아시아인, 3%는 아프리카계 미국인이었습니다. 환자들은 평균 1회의 이전 치료를 받았습니다. 환자의 63%는 이전에 자가 조혈모세포 이식(ASCT)을 받았습니다. 대다수의 환자(86%)는 이전에 PI를 받았고, 55%의 환자는 이전에 면역 조절제를 받았으며, 여기에는 이전에 레날리도마이드를 받은 환자의 18%가 포함됩니다. 그리고 44%의 환자는 이전에 PI와 면역 조절제를 모두 받았습니다. 기준선에서 환자의 27%는 마지막 치료 라인에 불응했습니다. 환자의 18%는 PI에만 불응했고 21%는 보르테조밉에 불응했습니다. 효능은 IMWG 기준에 따라 PFS로 평가했습니다.
POLLUX는 Rd군에 비해 DRd군에서 PFS의 개선을 보여주었습니다(HR=0.37; 95% CI: 0.27, 0.52; p<0.0001). 이는 DRd로 치료받은 환자에서 질병 진행 또는 사망 위험이 63% 감소했음을 나타냅니다. 55개월의 중앙값 추적 관찰 후 DRd군의 중앙값 PFS는 45.0개월(95% CI: 34.1, 53.9)이었고 Rd군의 중앙값 PFS는 17.5개월(95% CI: 13.9, 20.8)이었습니다.
80개월의 중앙값 추적 관찰 후 POLLUX는 Rd군에 비해 DRd군에서 전체 생존율(OS)의 개선을 보여주었습니다(HR=0.73; 95% CI: 0.58, 0.91; p=0.0044). 이는 DRd군에서 치료받은 환자의 사망 위험이 27% 감소했음을 나타냅니다. DRd군의 중앙값 OS는 67.6개월이었고 Rd군의 중앙값 OS는 51.8개월이었습니다.
그림 7: POLLUX의 OS 카플란-마이어 곡선
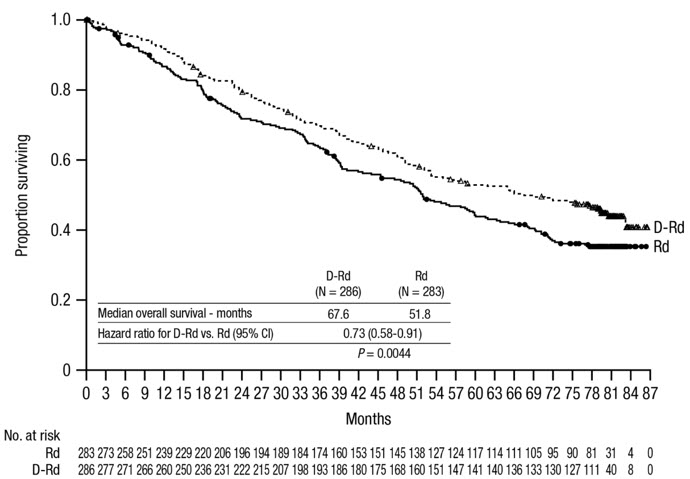
POLLUX의 추가 효능 결과는 표 26에 제시되어 있습니다.
| DRd (N=286) | Rd (N=283) | |
|---|---|---|
| DRd = 다라투무맙-레날리도마이드-덱사메타손; Rd = 레날리도마이드-덱사메타손 | ||
| 전반적인 반응(sCR+CR+VGPR+PR) | 261 (91.3%) | 211 (74.6%) |
| p-값 | <0.0001 | |
| 엄격한 완전 반응(sCR) | 51 (17.8%) | 20 (7.1%) |
| 완전 반응(CR) | 70 (24.5%) | 33 (11.7%) |
| 매우 좋은 부분 반응(VGPR) | 92 (32.2%) | 69 (24.4%) |
| 부분 반응(PR) | 48 (16.8%) | 89 (31.4%) |
반응을 보인 환자에서 반응까지의 중앙값 시간은 DRd 그룹에서 1개월(범위: 0.9~13개월), Rd 그룹에서 1.1개월(범위: 0.9~10개월)이었습니다. 반응 지속 기간 중앙값은 DRd 그룹에서 도달하지 않았으며(범위: 1+~19.8+개월), Rd 그룹에서는 17.4개월(범위: 1.4~18.5+개월)이었습니다.
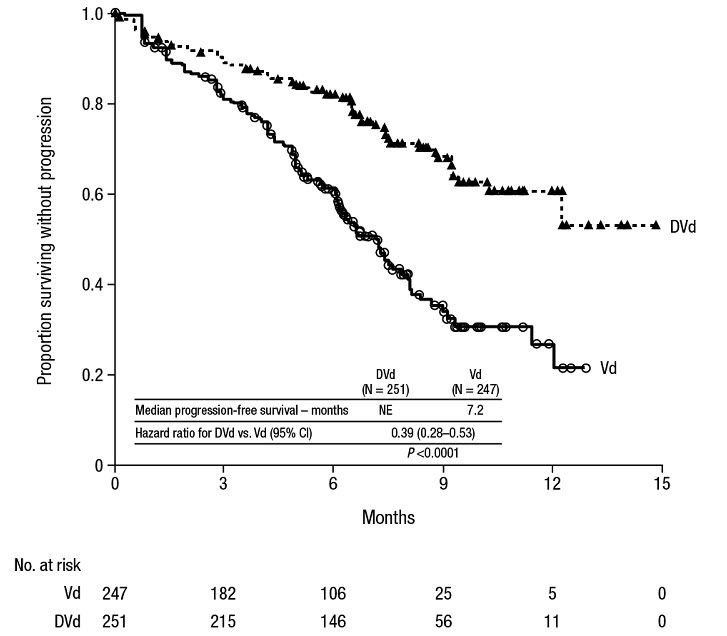
보르테조밉 및 덱사메타손 병용 요법
공개형 무작위 활성 대조군 3상 임상시험인 CASTOR(NCT02136134)에서는 이전에 최소 한 가지 치료를 받은 다발성 골수종 환자에서 DARZALEX 16mg/kg을 보르테조밉 및 덱사메타손(DVd)과 병용하는 치료를 보르테조밉 및 덱사메타손(Vd) 치료와 비교했습니다. 보르테조밉은 반복 21일(3주) 치료 주기의 2주 동안(1, 4, 8, 11일) 1.3mg/m
2 체표면적 용량으로 주 2회 피하 주사 또는 정맥 주사로 투여되었으며, 총 8주기 동안 투여되었습니다. 덱사메타손은 각 8회 보르테조밉 주기의 1, 2, 4, 5, 8, 9, 11, 12일에 20mg 용량으로 경구 투여되었으며(보르테조밉 주기 3주 중 2주 동안 80mg/주), 75세 이상, BMI <18.5, 조절되지 않는 당뇨병 또는 이전 스테로이드 요법 불내성 환자의 경우 20mg/주 감량 용량으로 투여되었습니다. DARZALEX 주입일에 덱사메타손 용량 20mg을 주입 전 약물로 투여했습니다. 덱사메타손 감량 용량을 투여받는 환자의 경우 전체 20mg 용량을 DARZALEX 주입 전 약물로 투여했습니다. 보르테조밉과 덱사메타손은 두 치료군 모두 8회 3주 주기 동안 투여되었으며, DARZALEX는 질병 진행까지 투여되었습니다. 그러나 DVd군에서는 덱사메타손 20mg을 DARZALEX 주입 전 약물로 계속 투여했습니다. 보르테조밉과 덱사메타손의 용량 조 adjustment정은 제조업체의 처방 정보에 따라 적용했습니다.
총 498명의 환자가 무작위 배정되었으며, DVd군에 251명, Vd군에 247명이 배정되었습니다. 기준 인구 통계 및 질병 특성은 DARZALEX군과 대조군에서 유사했습니다. 환자의 평균 연령은 64세(범위 30~88세)였으며, 12%는 75세 이상, 57%는 남성, 87%는 백인, 5%는 아시아인, 4%는 아프리카계 미국인이었습니다. 환자들은 평균 2회 이전 치료를 받았으며, 61%의 환자는 이전에 자가 조혈모세포 이식(ASCT)을 받았습니다. 69%의 환자는 이전에 PI(66%는 보르테조밉 투여)를 받았으며, 76%의 환자는 면역 조절제(42%는 레날리도마이드 투여)를 받았습니다. 기준 시점에서 32%의 환자는 마지막 치료에 불응했으며, 특정 이전 치료에 불응한 환자의 비율은 일반적으로 치료군 간에 균형이 잘 잡혀 있었습니다. 33%의 환자는 면역 조절제에만 불응했으며, DVd군의 24% 환자와 Vd군의 33% 환자는 각각 레날리도마이드에 불응했습니다. 효능은 IMWG 기준에 따라 PFS로 평가했습니다.
CASTOR는 Vd군에 비해 DVd군에서 PFS 개선을 보였으며(HR=0.39; 95% CI: 0.28, 0.53; p<0.0001), DVd로 치료받은 환자의 질병 진행 또는 사망 위험이 Vd에 비해 61% 감소했음을 나타냅니다. 50개월의 중앙값 추적 관찰 후 DVd군의 PFS 중앙값은 16.7개월(95% CI: 13.1, 19.4)이었고 Vd군의 PFS 중앙값은 7.1개월(95% CI: 6.2, 7.7)이었습니다.
중앙값 73개월의 추적 관찰 후, CASTOR는 Vd군과 비교하여 DVd군에서 전체 생존율(OS)의 개선을 보여주었습니다(HR=0.74; 95% CI: 0.59, 0.92; p=0.0075). 이는 DVd군에서 치료받은 환자의 사망 위험이 26% 감소했음을 나타냅니다. DVd군의 OS 중앙값은 49.6개월이었고 Vd군은 38.5개월이었습니다.
그림 9: CASTOR의 OS 카플란-마이어 곡선
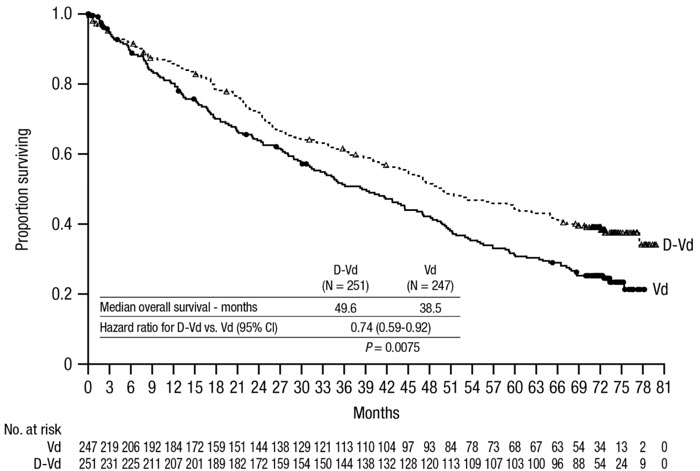
CASTOR의 추가 효능 결과는 표 27에 제시되어 있습니다.
| DVd (N=251) | Vd (N=247) | |
|---|---|---|
| DVd = daratumumab- bortezomib-dexamethasone; Vd = bortezomib-dexamethasone | ||
| 전체 반응 (sCR+CR+VGPR+PR) | 199 (79.3%) | 148 (59.9%) |
| P-값 | <0.0001 | |
| 엄격한 완전 반응 (sCR) | 11 (4.4%) | 5 (2.0%) |
| 완전 반응 (CR) | 35 (13.9%) | 16 (6.5%) |
| 매우 좋은 부분 반응 (VGPR) | 96 (38.2%) | 47 (19.0%) |
| 부분 반응 (PR) | 57 (22.7%) | 80 (32.4%) |
반응을 보인 환자에서 반응까지의 중앙값 시간은 DVd 그룹에서 0.8개월(범위: 0.7~4개월), Vd 그룹에서 1.5개월(범위: 0.7~5개월)이었습니다. 반응 지속 기간의 중앙값은 DVd 그룹에서 도달하지 않았으며(범위: 1.4+~14.1+개월), Vd 그룹에서는 7.9개월(1.4+~12+개월)이었습니다.
주 2회 카필조밉(20/56 mg/m
2) 및 덱사메타손 병용 요법
CANDOR(NCT03158688)는 최소 1~3회 이전 치료를 받은 재발성 또는 불응성 다발성 골수종 환자에서 주 2회 카필조밉 및 덱사메타손(Kd) 대비 DARZALEX와 주 2회 카필조밉 및 덱사메타손(DKd) 병용을 평가한 무작위, 공개, 다기관 시험이었습니다. 다음과 같은 환자는 시험에서 제외되었습니다. 지난 2년 이내에 중등도 또는 중증의 지속성 천식이 알려진 환자, 예상 정상 FEV1의 50% 미만인 만성 폐쇄성 폐질환(COPD)이 알려진 환자, 활동성 울혈성 심부전 환자. 무작위 배정은 스크리닝 시 ISS(1기 또는 2기 대 3기), 이전 프로테아좀 억제제 노출(예 대 아니오), 이전 치료 라인 수(1 대 ≥2) 또는 이전 분화 클러스터 항원 38(CD38) 항체 치료(예 대 아니오)에 따라 계층화되었습니다.
DARZALEX는 1주기 1일과 2일에 8mg/kg의 용량으로 정맥 주사되었습니다. 그 후, DARZALEX는 1주기 8일, 15일 및 22일에 16mg/kg의 용량으로 정맥 주사되었습니다. 2주기 1일, 8일, 15일 및 22일; 3~6주기 1일 및 15일; 질병 진행까지 매 28일 주기의 1일에 투여되었습니다. 카필조밉은 1주기 1일과 2일에 20mg/m
2의 용량으로 정맥 주사되었습니다. 1주기 8일, 9일, 15일 및 16일에 56mg/m
2의 용량으로 투여되었습니다. 그 이후 매 28일 주기의 1일, 2일, 8일, 9일, 15일 및 16일에 56mg/m
2의 용량으로 투여되었습니다. 덱사메타손 20mg은 1일, 2일, 8일, 9일, 15일 및 16일에 경구 또는 정맥으로 투여되었고, 그 후 매 28일 주기의 22일에 40mg을 경구 또는 정맥으로 투여되었습니다. 덱사메타손 용량을 20mg으로 줄인 75세 이상의 환자의 경우, DARZALEX 투여일에 DARZALEX 주입 전 약물로 전체 20mg 용량을 투여했습니다. 그 외에는 두 연구군 모두에서 카필조밉 투여일에 덱사메타손 용량을 분할하여 투여했습니다. 치료는 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 두 군 모두에서 계속되었습니다.
총 466명의 환자가 무작위 배정되었습니다. DKd군 312명, Kd군 154명. 기준선 인구 통계 및 질병 특성은 두 군 간에 유사했습니다. 중앙값 연령은 64세(범위 29~84세)였고, 9%는 75세 이상, 58%는 남성이었습니다. 백인 79%, 아시아인 14%, 흑인 2%. 환자들은 이전에 중앙값 2회의 치료를 받았으며 58%의 환자는 이전에 자가 조혈모세포 이식(ASCT)을 받았습니다. 대다수의 환자(92%)는 이전에 PI를 받았으며, 이 중 34%는 PI를 포함한 요법에 불응했습니다. 42%의 환자는 이전에 레날리도마이드를 받았으며, 이 중 33%는 레날리도마이드 함유 요법에 불응했습니다.
유효성은 IMWG 반응 기준에 따른 IRC 평가 PFS로 평가했습니다. 유효성 결과는 그림 10에 나와 있습니다. CANDOR는 Kd군에 비해 DKd군에서 PFS의 개선을 보여주었습니다. DKd군의 PFS 중앙값에 도달하지 않았고 Kd군에서는 15.8개월이었으며(위험 비율[HR]=0.63; 95% CI: 0.46, 0.85; p=0.0014), DKd로 치료받은 환자의 질병 진행 또는 사망 위험이 Kd에 비해 37% 감소한 것을 나타냅니다.
그림 10: CANDOR의 PFS 카플란-마이어 곡선
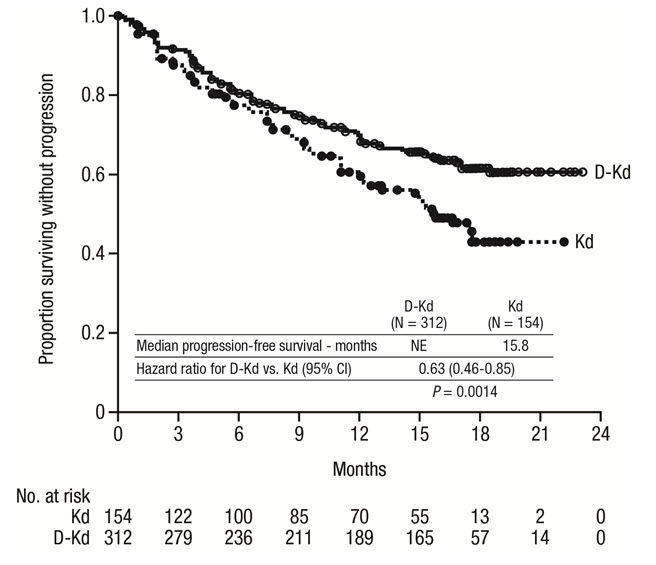
CANDOR의 추가 유효성 결과는 표 28에 제시되어 있습니다.
| DKd (N=312) | Kd (N=154) | |
|---|---|---|
| DKd = 다라투무맙-카필조밉-덱사메타손; Kd = 카필조밉-덱사메타손; MRD [-] CR=미세잔존질환; CI=신뢰 구간 | ||
| 전반적인 반응 (sCR+CR+VGPR+PR) n(%) | 263 (84%) | 115 (75%) |
| 95% CI (%) | (80, 88) | (67, 81) |
| p값
*(단측) |
0.0040 | |
| 완전 반응 (CR) | 89 (28%) | 16 (10%) |
| 매우 좋은 부분 반응 (VGPR) | 127 (41%) | 59 (38%) |
| 부분 반응 (PR) | 47 (15%) | 40 (26%) |
| 12개월 시점의 MRD [-] CR 비율 n(%) | 39 (12%) | 2 (1.3%) |
| 95% CI (%) | (9, 17) | (0.2, 4.6) |
| p-값
*(단측) |
<0.0001 | |
| MRD [-] CR | 43 (14%) | 5 (3.2%) |
DKd 그룹의 반응까지의 중앙값 시간은 1개월(범위: 1~14개월)이었고 Kd 그룹은 1개월(범위: 1~10개월)이었습니다. 반응 지속 기간의 중앙값은 DKd 그룹에서 도달하지 않았고 Kd 그룹에서는 16.6개월(95% CI: 13.9, 추정 불가)이었습니다.
주 1회 (20/70 mg/m
2) 카필조밉 및 덱사메타손 병용 치료
EQUULEUS(NCT01998971)는 최소 1~3회의 이전 치료를 받은 재발성 또는 불응성 다발성 골수종 환자에서 주 1회 카필조밉 및 덱사메타손과 DARZALEX 병용을 평가한 공개형 다중 코호트 시험이었습니다. 다음과 같은 환자는 시험에서 제외되었습니다. 지난 2년 이내에 알려진 중등도 또는 중증의 지속성 천식, 예상 정상 FEV1의 50% 미만인 만성 폐쇄성 폐질환(COPD) 또는 활동성 울혈성 심부전(뉴욕 심장 협회 등급 III–IV로 정의).
10명의 환자에게 1주기 1일에 16mg/kg의 DARZALEX를 정맥 주사했고 나머지 환자에게는 1주기 1일과 2일에 8mg/kg의 DARZALEX를 정맥 주사했습니다. 그 후, DARZALEX는 1주기 8일, 15일 및 22일에 16mg/kg의 용량으로 정맥 주사되었습니다. 2주기 1일, 8일, 15일 및 22일; 3~6주기의 1일 및 15일; 그리고 나서 각 28일 주기의 나머지 주기 동안 1일에 투여했습니다. 카필조밉은 1주기 1일에 20mg/m
2의 용량으로 주 1회 정맥 주사했고 1주기 8일과 15일, 그리고 후속 각 28일 주기의 1일, 8일, 15일에 70mg/m
2의 용량으로 증량했습니다. 1주기와 2주기에는 덱사메타손 20mg을 1일, 2일, 8일, 9일, 15일, 16일, 22일 및 23일에 경구 또는 정맥으로 투여했습니다. 3~6주기에는 덱사메타손 20mg을 1일, 2일, 15일 및 16일에 경구 또는 정맥으로 투여했고 8일과 22일에는 40mg의 용량으로 투여했습니다. 7주기 이후에는 덱사메타손 20mg을 1일과 2일에 경구 또는 정맥으로 투여했고 8일, 15일, 22일에는 40mg의 용량으로 투여했습니다. 75세 이상의 환자의 경우 첫 주 이후에 덱사메타손 20mg을 매주 경구 또는 정맥으로 투여했습니다. 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 치료를 계속했습니다.
EQUULEUS 시험에는 85명의 환자가 등록했습니다. 환자의 평균 연령은 66세(범위: 38~85세)였고 75세 이상의 환자는 9%였습니다. 54%는 남성이었고 80%는 백인, 3.5%는 흑인, 3.5%는 아시아인이었습니다. 연구에 참여한 환자는 평균 2회의 이전 치료를 받았습니다. 73%의 환자가 이전에 ASCT를 받았습니다. 모든 환자가 이전에 보르테조밉을 받았고 95%의 환자가 이전에 레날리도마이드를 받았습니다. 59%의 환자가 레날리도마이드에 불응했고 29%의 환자가 PI와 IMiD 모두에 불응했습니다.
유효성 결과는 IMWG 기준을 사용한 전체 반응률을 기반으로 했습니다. 유효성 결과는 표 29에 나와 있습니다. 반응까지의 중앙값 시간은 0.95개월(범위: 0.9, 14.3)이었습니다. 반응 지속 기간의 중앙값은 28개월(95% CI: 20.5, 추정 불가)이었습니다.
| N=85 | |
|---|---|
| ORR = sCR+CR+VGPR+PR CI = 신뢰 구간 |
|
| 전체 반응률(ORR) | 69 (81%) |
| 95% CI (%) | (71, 89) |
| 엄격한 완전 반응(sCR) | 18 (21%) |
| 완전 반응(CR) | 12 (14%) |
| 매우 좋은 부분 반응(VGPR) | 28 (33%) |
| 부분 반응(PR) | 11 (13%) |
포말리도마이드 및 덱사메타손 병용 요법
EQUULEUS (NCT01998971)는 이전에 PI와 면역조절제를 투여받은 다발성 골수종 환자 103명에게 질병 진행까지 포말리도마이드 및 저용량 덱사메타손과 병용하여 16mg/kg DARZALEX를 투여한 공개형 시험이었습니다. 포말리도마이드(반복 28일[4주] 주기의 1~21일에 1일 1회 4mg 경구 투여)는 저용량 경구 또는 정맥 주사 덱사메타손 40mg/주(75세 이상 또는 BMI <18.5인 환자의 경우 20mg/주로 감량)와 함께 투여되었습니다. DARZALEX 주입일에 덱사메타손 용량 20mg을 주입 전 약물로 투여하고 나머지는 주입 다음 날 투여했습니다. 덱사메타손 감량 용량을 투여받는 환자의 경우 전체 20mg 용량을 DARZALEX 주입 전 약물로 투여했습니다.
환자의 평균 연령은 64세(범위: 35~86세)였으며 환자의 8%가 75세 이상이었습니다. 연구에 참여한 환자는 이전에 평균 4회의 치료를 받았습니다. 환자의 74%가 이전에 ASCT를 받았습니다. 환자의 98%가 이전에 보르테조밉 치료를 받았고, 33%가 이전에 카필조밉을 받았습니다. 모든 환자가 이전에 레날리도마이드 치료를 받았으며, 환자의 98%가 이전에 보르테조밉과 레날리도마이드 병용 요법을 받았습니다. 환자의 89%는 레날리도마이드 불응성이었고 71%는 보르테조밉 불응성이었습니다. 환자의 64%는 보르테조밉 및 레날리도마이드 불응성이었습니다.
유효성 결과는 IMWG 기준을 사용하여 독립 검토 위원회에서 결정한 전체 반응률을 기반으로 했습니다(
표 30 참조).
| N=103 | |
|---|---|
| ORR = sCR+CR+VGPR+PR CI = 신뢰 구간 |
|
| 전체 반응률 (ORR) | 61 (59.2%) |
| 95% CI (%) | (49.1, 68.8) |
| 엄격한 완전 반응 (sCR) | 8 (7.8%) |
| 완전 반응 (CR) | 6 (5.8%) |
| 매우 우수한 부분 반응 (VGPR) | 29 (28.2%) |
| 부분 반응 (PR) | 18 (17.5%) |
반응까지의 중앙값 시간은 1개월(범위: 0.9~2.8개월)이었습니다. 반응 지속 기간의 중앙값은 13.6개월(범위: 0.9+~14.6+개월)이었습니다.
단독 요법
SIRIUS (NCT01985126)는 프로테아좀 억제제와 면역조절제를 포함하여 최소 3회의 이전 치료를 받았거나 프로테아좀 억제제와 면역조절제에 이중 불응성인 재발성 또는 불응성 다발성 골수종 환자에서 DARZALEX 단독 요법을 평가하는 공개형 시험이었습니다. 106명의 환자에게 주입 전후 약물과 함께 DARZALEX 16mg/kg을 투여했습니다. 치료는 허용할 수 없는 독성 또는 질병 진행까지 계속되었습니다.
환자의 평균 연령은 63.5세(범위: 31~84세)였으며 49%는 남성이었고 79%는 백인이었습니다. 환자는 이전에 평균 5회의 치료를 받았습니다. 환자의 80%가 이전에 자가 조혈모세포 이식(ASCT)을 받았습니다. 이전 치료에는 보르테조밉(99%), 레날리도마이드(99%), 포말리도마이드(63%) 및 카필조밉(50%)이 포함되었습니다. 기준 시점에서 환자의 97%는 마지막 치료에 불응성이었고, 95%는 프로테아좀 억제제(PI)와 면역조절제 모두에 불응성이었으며, 77%는 알킬화제에 불응성이었습니다.
유효성 결과는 IMWG 기준을 사용하여 독립 검토 위원회 평가에서 결정한 전체 반응률을 기반으로 했습니다(
표 31 참조).
| N=106 | |
|---|---|
| ORR = sCR+CR+VGPR+PR CI = 신뢰 구간 |
|
| 전체 반응률 (ORR) | 31 (29.2%) |
| 95% CI (%) | (20.8, 38.9) |
| 엄격한 완전 반응 (sCR) | 3 (2.8%) |
| 완전 반응 (CR) | 0 |
| 매우 우수한 부분 반응 (VGPR) | 10 (9.4%) |
| 부분 반응 (PR) | 18 (17.0%) |
중앙값 반응 시간은 1개월(범위: 0.9~5.6개월)이었습니다. 중앙값 반응 지속 기간은 7.4개월(범위: 1.2~13.1+개월)이었습니다.
GEN501 연구(NCT00574288)는 최소 2가지의 세포감소 요법을 받은 재발성 또는 불응성 다발성 골수종 환자에서 DARZALEX 단독 요법을 평가하는 공개형 용량 증량 시험이었습니다. 42명의 환자에게 주입 전후 약물과 함께 DARZALEX 16mg/kg을 투여했습니다. 치료는 허용할 수 없는 독성 또는 질병 진행이 나타날 때까지 계속되었습니다.
환자의 중앙값 연령은 64세(범위: 44~76세)였으며, 64%는 남성이었고 76%는 백인이었습니다. 연구에 참여한 환자들은 이전에 중앙값 4회의 치료를 받았습니다. 환자의 74%는 이전에 ASCT를 받았습니다. 이전 치료에는 bortezomib(100%), lenalidomide(95%), pomalidomide(36%), carfilzomib(19%)가 포함되었습니다. 기준 시점에서 환자의 76%는 마지막 치료에 불응했고, 64%는 PI와 면역조절제 모두에 불응했으며, 60%는 알킬화제에 불응했습니다.
전반적인 반응률은 36%(95% CI: 21.6, 52.0%)였으며, 1건의 CR과 3건의 VGPR이 나타났습니다. 중앙값 반응 시간은 1개월(범위: 0.5~3.2개월)이었습니다. 중앙값 반응 지속 기간은 추정할 수 없었습니다(범위: 2.2~13.1+개월).
15 참고 문헌
- Chapuy, CI, RT Nicholson, MD Aguad, et al., 2015, 혈액 적합성 검사에서 daratumumab 간섭 해결 (Resolving the daratumumab interference with blood compatibility testing), Transfusion, 55:1545–1554 (http://onlinelibrary.wiley.com/doi/10.1111/trf.13069/epdf에서 확인 가능).
16 제공/보관 및 취급 방법
제품 형태
DARZALEX
®(다라투무맙) 주사제는 무색에서 옅은 노란색의 방부제가 없는 정맥 주입용 액상입니다.
NDC 57894-502-05 및 NDC 57894-505-05는 각각 100 mg/5 mL (20 mg/mL) 단회용 바이알 1개를 포함합니다.
NDC 57894-502-20 및 NDC 57894-505-20는 각각 400 mg/20 mL (20 mg/mL) 단회용 바이알 1개를 포함합니다.
17 환자 상담 정보
FDA 승인 환자 라벨(환자 정보)을 읽도록 환자에게 알려주십시오.
주입 관련 반응
다음과 같은 주입 관련 반응의 징후나 증상이 나타나면 즉시 의료 서비스를 받도록 환자에게 알려주십시오. 가려움증, 콧물 또는 코막힘, 발열, 오한, 메스꺼움, 구토, 인후통, 기침, 두통, 현기증 또는 어지러움, 빈맥, 가슴 통증, 천명, 호흡 곤란 또는 호흡 곤란, 가려움증, 시력 흐림
[
참조]
.
실험실 검사 간섭
예정된 수혈의 경우, 혈액 수혈 센터 직원을 포함하여 의료 서비스 제공자에게 DARZALEX를 복용하고 있음을 알리도록 환자에게 알려주십시오.
[
참조]
.
DARZALEX는 일부 환자에서 완전 반응을 결정하는 데 사용되는 일부 검사 결과에 영향을 미칠 수 있으며, 반응을 평가하기 위해 추가 검사가 필요할 수 있음을 환자에게 알려주십시오.
[
참조]
.
B형 간염 바이러스(HBV) 재활성화
B형 간염 감염이 있었거나 있을 수 있음을 의료 서비스 제공자에게 알리도록 환자에게 알려주십시오. DARZALEX는 B형 간염 바이러스가 다시 활성화될 수 있습니다.
[
참조]
.
태아 독성
임산부에게 태아에 대한 잠재적 위험을 알려주십시오. 임신 가능성이 있는 여성은 알려진 또는 의심되는 임신을 의료 서비스 제공자에게 알리도록 알려주십시오.
[
참조]
.
임신 가능성이 있는 여성은 DARZALEX 치료 중 및 마지막 투여 후 3개월 동안 임신을 피하도록 알려주십시오.
[
참조]
.
레날리도마이드, 포말리도마이드 또는 탈리도마이드는 태아에게 해를 끼칠 수 있으며 피임, 임신 검사, 혈액 및 정자 기증, 정자를 통한 전염에 대한 특정 요구 사항이 있음을 환자에게 알려주십시오. 레날리도마이드, 포말리도마이드 및 탈리도마이드는 REMS 프로그램을 통해서만 제공됩니다.
[
참조]
.
SPL 미분류 섹션
제조:
Janssen Biotech, Inc.
Horsham, PA 19044, USA
U.S. License Number 1864
특허 정보: www.janssenpatents.com
© 2015–2021 Janssen Pharmaceutical Companies
환자 안내문
| 본 환자 정보는 미국 식품의약국(FDA)의 승인을 받았습니다. | 개정: 2022년 11월 | ||
| 환자 정보 DARZALEX ®(Dar’-zah-lex)
|
|||
| DARZALEX는 레날리도마이드, 탈리도마이드 또는 포말리도마이드와 같은 다른 약물과 함께 사용될 수 있습니다. DARZALEX를 이러한 약물과 함께 사용하는 경우 레날리도마이드, 탈리도마이드 또는 포말리도마이드와 함께 제공되는
약물 안내서를 읽어보십시오. |
|||
| DARZALEX는 무엇입니까? DARZALEX는 다발성 골수종이 있는 성인을 치료하는 데 사용되는 처방약입니다.
DARZALEX가 소아에게 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|||
다음과 같은 경우 DARZALEX를 투여받지 마십시오.
|
|||
DARZALEX를 투여받기 전에 다음과 같은 경우를 포함하여 모든 의학적 상태를 의료 서비스 제공자에게 알리십시오.
복용하는 모든 약물을 의료 서비스 제공자에게 알리십시오.처방약과 일반의약품, 비타민 및 허브 보충제를 포함합니다. |
|||
DARZALEX는 어떻게 투여받습니까?
|
|||
| DARZALEX의 가능한 부작용은 무엇입니까? DARZALEX는 다음을 포함한 심각한 반응을 일으킬 수 있습니다.
|
|||
|
|
|
|
DARZALEX의 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
|
|
| 이것들은 DARZALEX의 모든 가능한 부작용이 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. |
|||
| DARZALEX의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 환자 정보 팜플렛에 나열된 목적 이외의 목적으로 처방됩니다. 의료 전문가를 위해 작성된 DARZALEX에 대한 정보는 약사 또는 의료 서비스 제공자에게 문의할 수 있습니다. |
|||
| DARZALEX의 성분은 무엇입니까? 활성 성분:다라투무맙 비활성 성분:빙초산, L-히스티딘, L-히스티딘 염산염 일수화물, L-메티오닌, 만니톨, 폴리소르베이트 20, 초산나트륨 삼수화물, 염화나트륨, 소르비톨 및 주사용수를 포함할 수 있습니다. 제조사: Janssen Biotech, Inc., Horsham, PA 19044, USA; 미국 라이선스 번호 1864 특허 정보는 다음 웹사이트를 참조하십시오. www.janssenpatents.com © 2015–2021 Janssen Pharmaceutical Companies 자세한 내용은 1-800-526-7736으로 전화하거나 www.DARZALEX.com을 방문하십시오. |
|||
주요 표시면 – 100mg/5mL 바이알 상자
NDC 57894-502-05
DARZALEX
®
(daratumumab)
Injection
100 mg/5 mL
(20 mg/mL)
정맥 주입 전용
사용 전 희석
처방전 의약품
1회용 바이알.
사용하지 않은 부분은 폐기하십시오.
janssen

주요 표시 패널 – 100mg/5mL 바이알 카톤 – 57894-505
NDC 57894-505-05
DARZALEX
®
(다라투무맙)
주사제
100 mg/5 mL
(20 mg/mL)
정맥 주입 전용
사용 전 희석
처방전 의약품
5 mL 바이알 1개
1회용 바이알.
사용하지 않은 부분은 폐기하십시오.
janssen