의약품 제조업체: Gilead Sciences, Inc. (Updated: 2024-04-30)
처방 정보 요약
BIKTARVY® (bictegravir, emtricitabine, and tenofovir alafenamide) tablets, for oral use
미국 최초 승인: 2018
경고: B형 간염의 치료 후 급성 악화
전체 박스 경고에 대한 자세한 내용은 전체 처방 정보를 참조하십시오.
HIV-1과 HBV에 동시 감염된 환자에서 emtricitabine(FTC) 및/또는 tenofovir disoproxil fumarate(TDF)를 함유한 제품을 중단한 후 B형 간염의 심각한 급성 악화가 보고되었으며, BIKTARVY 중단 시 발생할 수 있습니다. 이러한 환자의 간 기능을 면밀히 모니터링하십시오. 적절한 경우 B형 간염 치료가 필요할 수 있습니다. (5.1)
적응증 및 사용법
BIKTARVY는 인간 면역 결핍 바이러스 1형(HIV-1) 인테그라제 가닥 전달 억제제(INSTI)인 bictegravir(BIC)와 HIV-1 뉴클레오시드 유사체 역전사효소 억제제(NRTI)인 emtricitabine(FTC) 및 tenofovir alafenamide(TAF)의 3가지 약물 조합으로, 체중이 14kg 이상인 성인 및 소아 환자의 HIV-1 감염 치료를 위한 완전한 요법으로 사용됩니다.
- 항레트로바이러스 치료 경험이 없는 환자 또는
- bictegravir 또는 tenofovir에 대한 내성과 관련된 알려진 또는 의심되는 치환이 없는 안정적인 항레트로바이러스 요법을 받고 바이러스 억제(HIV-1 RNA 50 copies/mL 미만)된 환자의 경우 현재 항레트로바이러스 요법을 대체하기 위해 사용됩니다. (1)
투여 및 관리
- 검사: BIKTARVY를 시작하기 전 또는 시작 시 B형 간염 바이러스 감염 검사를 실시하십시오. BIKTARVY를 시작하기 전 또는 시작 시, 그리고 치료 중에 임상적으로 적절한 경우 모든 환자의 혈청 크레아티닌, 추정 크레아티닌 청소율, 요당 및 요단백을 평가하십시오. 만성 신장 질환 환자의 경우 혈청 인산염도 평가하십시오. (2.1)
- 체중이 25kg 이상인 성인 및 소아 환자 또는 추정 크레아티닌 청소율이 15mL/min 미만이고 만성 혈액 투석을 받는 바이러스 억제된 성인에게 권장되는 투여량: BIC 50mg, FTC 200mg, TAF 25mg이 함유된 정제 1정을 하루에 한 번 식사와 관계없이 복용합니다. (2.2)
- 체중이 14kg 이상 25kg 미만인 소아 환자에게 권장되는 투여량: BIC 30mg, FTC 120mg, TAF 15mg이 함유된 정제 1정을 하루에 한 번 식사와 관계없이 복용합니다. (2.3)
- 안정적인 항레트로바이러스 요법을 받고 바이러스 억제(HIV-1 RNA 50 copies/mL 미만)된 임산부에게 권장되는 투여량: BIKTARVY의 개별 성분에 대한 내성과 관련된 알려진 치환이 없는 경우: BIC 50mg, FTC 200mg, TAF 25mg이 함유된 정제 1정을 하루에 한 번 식사와 관계없이 경구로 복용합니다. (2.4)
- 신장애: 추정 크레아티닌 청소율이 15~30mL/min 미만인 환자 또는 만성 혈액 투석을 받지 않는 환자 또는 항레트로바이러스 치료 경험이 없는 환자의 경우 BIKTARVY를 사용하지 않는 것이 좋습니다. (2.5)
- 간장애: 중증 간장애 환자의 경우 BIKTARVY를 사용하지 않는 것이 좋습니다. (2.6)
경고 및 주의 사항
부작용
가장 흔한 부작용(발생률이 5% 이상, 모든 등급)은 설사, 메스꺼움 및 두통입니다. (6.1)
의심되는 부작용을 보고하려면 Gilead Sciences, Inc.에 1-800-GILEAD-5 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
약물 상호 작용
환자 상담 정보 및 FDA 승인 환자 라벨은 17을 참조하십시오.
개정: 4/2024
목차
FULL PRESCRIBING INFORMATION: CONTENTS*
WARNING: POST TREATMENT ACUTE EXACERBATION OF HEPATITIS B
1 적응증 및 용법
2 복용량 및 투여
2.1 BIKTARVY 치료 시작 시 및 치료 중 검사
2.2 체중이 25kg 이상인 성인 및 소아 환자에 권장되는 복용량
2.3 체중이 14kg 이상 25kg 미만인 소아 환자에 권장되는 복용량
2.4 임산부에 권장되는 복용량
2.5 중증 신장애 환자에게는 권장되지 않음
2.6 중증 간 장애 환자에게는 권장되지 않음
3 제형 및 함량
4 금기
5 경고 및 주의사항
5.1 HIV-1 및 HBV 동시 감염 환자에서의 중증 급성 B형 간염 악화
5.2 약물 상호 작용으로 인한 이상 반응 또는 바이러스 반응 손실 위험
5.3 면역 재구성 증후군
5.4 신규 발병 또는 악화된 신장애
5.5 젖산 산증/지방간을 동반한 중증 간비대
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
7 약물 상호 작용
7.1 기타 항레트로바이러스제
7.2 BIKTARVY가 다른 약물에 미칠 수 있는 영향
7.3 다른 약물이 BIKTARVY의 하나 이상 성분에 미칠 수 있는 영향
7.4 신기능에 영향을 미치는 약물
7.5 확립되었거나 임상적으로 유의미한 약물 상호 작용
7.6 BIKTARVY와 임상적으로 유의미한 상호 작용이 없는 약물
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.4 소ediatric 사용
8.5 노인 사용
8.6 신장애
8.7 간 장애
10 과다 복용
11 설명
12 임상 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.4 미생물학
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
13.2 동물 독성학 및/또는 약리학
14 임상 연구
14.1 임상 시험 설명
14.2 HIV-1에 감염되었지만 항레트로바이러스 치료 경험이 없는 성인의 임상 시험 결과
14.3 BIKTARVY로 전환한 바이러스학적으로 억제된 HIV-1 성인의 임상 시험 결과
14.4 HIV-1에 감염된 소아 대상의 임상 시험 결과
16 공급 방법/보관 및 취급
17 환자 상담 정보
- *
- 전체 처방 정보에서 생략된 섹션이나 하위 섹션은 나열되지 않습니다.
경고 사항
경고: B형 간염의 치료 후 급성 악화
HIV-1과 HBV에 동시 감염된 환자에서 에mt리시타빈(FTC) 및/또는 테노포비르 디소프록실 푸마레이트(TDF)를 함유한 제품을 중단한 후 B형 간염의 심각한 급성 악화가 보고되었으며, BIKTARVY 중단 시에도 발생할 수 있습니다.
HIV-1과 HBV에 동시 감염된 환자에서 BIKTARVY를 중단하는 경우 최소 몇 달 동안 임상적 및 실험실적 추적 관찰을 통해 간 기능을 면밀히 모니터링하십시오. 적절한 경우 B형 간염 치료가 필요할 수 있습니다 [경고 및 주의 사항 (5.1) 참조].
1 적응증 및 사용
BIKTARVY는 다음과 같은 경우 인간 면역결핍 바이러스 1형(HIV-1) 감염 치료를 위한 완전한 요법으로 사용됩니다.
- 체중이 14kg 이상인 성인 및 소아 환자:
- 항레트로바이러스 치료 경험이 없는 경우 또는
- 바이러스 억제 상태(HIV-1 RNA 50 copies/mL 미만)인 안정적인 항레트로바이러스 요법을 받고 있는 환자에서 현재 항레트로바이러스 요법을 대체하기 위해, 바이시그라비어 또는 테노포비어에 대한 내성과 관련된 알려진 또는 의심되는 치환이 없는 경우 [용법 및 용량(2.4) 및 특정 집단에서의 사용(8.1) 참조].
2. 용량 및 투여
2.1 BIKTARVY 투여 시작 및 치료 중 검사
BIKTARVY 투여 시작 전 또는 투여 시, 환자의 B형 간염 바이러스 감염 여부를 검사하십시오 [경고 및 주의 사항 (5.1) 참조].
BIKTARVY 투여 시작 전 또는 투여 시, 그리고 BIKTARVY 치료 중, 임상적으로 적절한 경우 모든 환자의 혈청 크레아티닌, 추정 크레아티닌 청소율, 요당 및 요단백을 평가하십시오. 만성 신장 질환 환자의 경우 혈청 인도 평가하십시오 [경고 및 주의 사항 (5.4) 참조].
2.2 성인 및 체중 25kg 이상 소아 환자에 대한 권장 용량
BIKTARVY는 비크테그라비어 (BIC), 엠트리시타빈 (FTC) 및 테노포비어 알라페나미드 (TAF)를 함유한 3가 약물 고정 용량 복합 제제입니다. BIKTARVY의 권장 용량은 BIC 50mg, FTC 200mg 및 TAF 25mg을 함유한 정제 1정을 [용량 및 투여 (2.4) 참조]에서 언급한 바와 같이 음식과 관계없이 1일 1회 경구 투여하는 것입니다:
- 추정 크레아티닌 청소율이 30mL/분 이상인 성인 및 체중 25kg 이상 소아 환자; 또는
- 추정 크레아티닌 청소율이 15mL/분 미만인 바이러스학적으로 억제된 성인으로 만성 혈액 투석을 받는 경우. 혈액 투석을 하는 날에는 혈액 투석 치료가 끝난 후 BIKTARVY의 일일 용량을 투여하십시오 [특정 집단에서의 사용 (8.4), (8.6) 및 임상 약리 (12.3) 참조].
2.3 체중 14kg 이상 25kg 미만 소아 환자에 대한 권장 용량
BIKTARVY의 권장 용량은 BIC 30mg, FTC 120mg 및 TAF 15mg을 함유한 정제 1정을 다음과 같이 음식과 관계없이 1일 1회 경구 투여하는 것입니다:
- 추정 크레아티닌 청소율이 30mL/분 이상인 체중 14kg 이상 25kg 미만 소아 환자 [특정 집단에서의 사용 (8.4), (8.6) 및 임상 약리 (12.3) 참조].
정제를 통째로 삼키기 어려운 어린이의 경우, 정제를 반으로 나누어 각 부분을 따로 복용할 수 있습니다. 단, 모든 부분을 약 10분 이내에 복용해야 합니다.
2.4 임산부에 대한 권장 용량
임산부에 대한 BIKTARVY의 권장 용량은 BIC 50mg, FTC 200mg 및 TAF 25mg을 함유한 정제 1정을 바이러스학적으로 억제된 (HIV-1 RNA가 50copies/mL 미만) 임산부에게 BIKTARVY의 개별 성분에 대한 내성과 관련된 알려진 치환이 없는 안정적인 항레트로바이러스 요법을 받고 있는 경우 음식과 관계없이 1일 1회 경구 투여하는 것입니다. 임신 중 BIKTARVY의 노출량이 감소한 것으로 관찰되었으므로 바이러스 부하를 면밀히 모니터링해야 합니다 [약물 상호 작용 (7.5), 특정 집단에서의 사용 (8.1) 및 임상 약리 (12.3) 참조].
2.5 중증 신장애 환자에게 권장하지 않음
BIKTARVY는 [용량 및 투여 (2.2), (2.3) 및 특정 집단에서의 사용 (8.6) 참조]에서 언급한 바와 같이 다음 환자에게 권장하지 않습니다:
- 중증 신장애 (추정 크레아티닌 청소율 15~30mL/분 미만); 또는
- 말기 신장 질환 (ESRD; 추정 크레아티닌 청소율 15mL/분 미만으로 만성 혈액 투석을 받지 않는 경우; 또는
- 항레트로바이러스 치료 이력이 없고 만성 혈액 투석을 받는 ESRD 환자.
2.6 중증 간장애 환자에게 권장하지 않음
BIKTARVY는 중증 간장애 (Child-Pugh Class C) 환자에게 권장하지 않습니다 [특정 집단에서의 사용 (8.7) 및 임상 약리 (12.3) 참조].
3 복용 형태 및 강도
BIKTARVY 정제는 두 가지 복용량으로 제공됩니다.
- 50 mg/200 mg/25 mg 정제: 50 mg의 비크테그라비르(BIC) (52.5 mg의 비크테그라비르 나트륨과 동일), 200 mg의 엠트리시타빈(FTC), 25 mg의 테노포비르 알라페나마이드(TAF) (28 mg의 테노포비르 알라페나마이드 푸마레이트와 동일). 이러한 정제는 자주빛 갈색, 캡슐 모양, 필름 코팅이며 한쪽에는 “GSI”가, 다른 쪽에는 “9883”이 새겨져 있습니다.
- 30 mg/120 mg/15 mg 정제: 30 mg의 BIC (31.5 mg의 비크테그라비르 나트륨과 동일), 120 mg의 FTC, 15 mg의 TAF (16.8 mg의 테노포비르 알라페나마이드 푸마레이트와 동일). 이러한 정제는 분홍색, 캡슐 모양, 필름 코팅이며 한쪽에는 “GSI”가, 다른 쪽에는 “B”가 새겨져 있습니다.
4 금기 사항
BIKTARVY는 다음과 함께 투여해서는 안 됩니다.
- 도페틸라이드는 도페틸라이드 혈장 농도 증가 및 관련 심각하거나 생명을 위협하는 사건의 가능성이 있기 때문입니다 [약물 상호 작용 (7.5) 참조].
- 리팜핀은 BIC 혈장 농도 감소로 인해 치료 효과가 상실되고 BIKTARVY에 대한 내성이 생길 수 있기 때문입니다 [약물 상호 작용 (7.5) 참조].
5 경고 및 주의 사항
5.1 HIV-1 및 HBV 동시 감염 환자에서의 중증 급성 B형 간염 악화
HIV-1 감염 환자는 항레트로바이러스 치료를 시작하기 전 또는 시작 시 만성 B형 간염 바이러스(HBV) 감염 여부를 검사해야 합니다 [투여 및 관리(2.1) 참조].
HIV-1 및 HBV 동시 감염 환자에서 FTC 및/또는 테노포비르 디소프록실 푸마레이트(TDF)를 함유하는 제품을 중단한 경우 중증 급성 B형 간염 악화(예: 간 기능 저하 및 간부전)가 보고되었으며, BIKTARVY 중단 시에도 발생할 수 있습니다. BIKTARVY를 중단하는 HIV-1 및 HBV 동시 감염 환자는 치료 중단 후 최소 몇 달 동안 임상적 및 실험실적 추적 관찰을 통해 면밀히 모니터링해야 합니다. 적절한 경우, 특히 진행된 간 질환 또는 간경변증이 있는 환자는 치료 후 간염 악화로 인해 간 기능 저하 및 간부전이 발생할 수 있으므로 항 B형 간염 치료가 필요할 수 있습니다.
5.2 약물 상호 작용으로 인한 이상 반응 또는 바이러스학적 반응 상실 위험
BIKTARVY를 특정 다른 약물과 병용하면 알려진 또는 잠재적으로 중요한 약물 상호 작용이 발생할 수 있으며, 이 중 일부는 다음과 같은 결과를 초래할 수 있습니다 [금기 사항(4) 및 약물 상호 작용(7.5) 참조]:
- BIKTARVY의 치료 효과 상실 및 내성 발생 가능성.
- 병용 약물의 노출 증가로 인한 임상적으로 중요한 이상 반응 발생 가능성.
이러한 가능한 및 알려진 중요한 약물 상호 작용을 예방하거나 관리하기 위한 단계(투여 권장 사항 포함)는 표 3을 참조하십시오. BIKTARVY 치료 전 및 치료 중 약물 상호 작용 가능성을 고려하고, BIKTARVY 치료 중 병용 약물을 검토하고, 병용 약물과 관련된 이상 반응을 모니터링하십시오.
5.3 면역 재구성 증후군
면역 재구성 증후군은 복합 항레트로바이러스 치료를 받는 환자에서 보고되었습니다. 복합 항레트로바이러스 치료의 초기 단계에서 면역 체계가 반응하는 환자는 마이코박테리움 아비움 감염, 거대세포바이러스, 폐포자충 폐렴(PCP) 또는 결핵과 같은 잠복성 또는 잔류 기회 감염에 대한 염증 반응을 보일 수 있으며, 이는 추가 평가 및 치료가 필요할 수 있습니다.
면역 재구성 환경에서 그레이브스병, 다발성 근육염, 길랭-바레 증후군 및 자가 면역성 간염과 같은 자가 면역 질환도 보고되었지만, 발병 시간은 더 다양하며 치료 시작 후 여러 달 후에 발생할 수 있습니다.
5.4 새로운 발병 또는 악화된 신장 기능 저하
TAF 함유 제품과 관련하여 급성 신부전, 근위부 신세뇨관 병증(PRT) 및 판코니 증후군을 포함한 신장 기능 저하가 시판 후 보고되었습니다. 이러한 사례의 대부분은 보고된 신장 사건에 기여했을 수 있는 잠재적인 교란 요인이 특징이었지만, 이러한 요인이 환자를 테노포비르 관련 이상 반응에 취약하게 만들었을 가능성도 있습니다 [이상 반응(6.1, 6.2) 참조]. BIKTARVY는 중증 신장 기능 저하(추정 크레아티닌 청소율 15~30mL/분 미만) 환자, 만성 혈액 투석을 받지 않는 ESRD(추정 크레아티닌 청소율 15mL/분 미만) 환자 또는 항레트로바이러스 치료 이력이 없는 ESRD 환자로서 만성 혈액 투석을 받는 환자에게는 권장되지 않습니다 [투여 및 관리(2.4) 및 특정 인구 집단에서의 사용(8.6) 참조].
신장 기능이 저하된 테노포비르 전구 약물을 복용하는 환자와 비스테로이드성 항염증제를 포함한 신독성 약물을 복용하는 환자는 신장 관련 이상 반응이 발생할 위험이 높습니다.
BIKTARVY를 시작하기 전 또는 시작 시, 그리고 BIKTARVY 치료 중에 임상적으로 적절한 모든 환자에서 혈청 크레아티닌, 추정 크레아티닌 청소율, 요당 및 요단백을 평가하십시오. 만성 신장 질환 환자의 경우 혈청 인산염도 평가하십시오. 임상적으로 유의미한 신장 기능 저하 또는 판코니 증후군 증거가 나타나는 환자는 BIKTARVY를 중단하십시오.
5.5 젖산 산증/지방간을 동반한 중증 간 비대
BIKTARVY의 성분인 엠트리시타빈과 테노포비르의 또 다른 전구 약물인 테노포비르 DF를 단독으로 또는 다른 항레트로바이러스와 병용하여 사용하면 젖산 산증 및 지방간을 동반한 중증 간 비대(치명적인 경우 포함)가 보고되었습니다. 임상적 또는 실험실적 소견에서 젖산 산증 또는 현저한 간 독성(간 비대 및 지방간을 포함하며, 현저한 트랜스아미나제 상승이 없는 경우에도 포함)이 나타나는 환자는 BIKTARVY 치료를 중단해야 합니다.
6. 부작용
다음 부작용은 라벨의 다른 섹션에서 논의됩니다.
- B형 간염의 심각한 급성 악화 [경고 및 주의 사항 (5.1) 참조 ].
- 면역 재구성 증후군 [경고 및 주의 사항 (5.3) 참조 ].
- 새로운 발병 또는 악화된 신장 손상 [경고 및 주의 사항 (5.4) 참조 ].
- 젖산 산증/지방증을 동반한 심각한 간 비대 [경고 및 주의 사항 (5.5) 참조 ].
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 부작용 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며, 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
항레트로바이러스 치료 경험이 없는 성인 대상 임상 시험
BIKTARVY의 주요 안전성 평가는 144주까지 항레트로바이러스 치료 경험이 없는 HIV-1 감염 성인 피험자 1274명을 등록한 두 건의 무작위 배정, 이중 맹검, 활성 대조군 시험인 시험 1489 및 시험 1490의 데이터를 기반으로 했습니다. 144주 이후, 피험자들은 추가 96주(연구 종료) 동안 선택적 연장 단계에서 공개적으로 BIKTARVY를 투여받았습니다. 총 634명과 1025명의 피험자가 이중 맹검(144주) 및 연장 단계에서 각각 BIKTARVY 1정을 1일 1회 투여받았습니다 [임상 연구 (14.2) 참조 ].
시험 1489 또는 시험 1490에서 BIKTARVY 그룹의 피험자 중 5% 이상에서 보고된 가장 흔한 부작용(모든 등급)은 설사, 메스꺼움 및 두통이었습니다. 중증도에 관계없이 부작용으로 인해 144주까지 BIKTARVY, 아바카비르 [ABC]/돌루테그라비르 [DTG]/라미부딘 [3TC] 또는 DTG + FTC/TAF 치료를 중단한 피험자의 비율은 각각 1%, 2% 및 2%였습니다. 표 1은 BIKTARVY 그룹에서 2% 이상의 부작용(모든 등급)의 빈도를 보여줍니다.
| 시험 1489 | 시험 1490 | |||
|---|---|---|---|---|
| 부작용 | BIKTARVY N=314 |
ABC/DTG/3TC N=315 |
BIKTARVY N=320 |
DTG + FTC/TAF N=325 |
|
||||
| 설사 | 6% | 4% | 3% | 3% |
| 메스꺼움 | 6% | 18% | 3% | 5% |
| 두통 | 5% | 5% | 4% | 3% |
| 피로 | 3% | 4% | 2% | 2% |
| 이상한 꿈 | 3% | 3% | <1% | 1% |
| 현기증 | 2% | 3% | 2% | 1% |
| 불면증 | 2% | 3% | 2% | <1% |
| 복부 팽만감 | 2% | 2% | 1% | 2% |
BIKTARVY를 투여받은 피험자의 2% 미만에서 발생한 추가적인 이상 반응(모든 등급)에는 구토, 팽만감, 소화불량, 복통, 발진 및 우울증이 포함되었습니다.
자살 충동, 자살 시도 및 우울증 자살은 BIKTARVY를 투여받은 피험자의 2%에서 발생했습니다. 이러한 사건은 주로 기존의 우울증 병력, 이전 자살 시도 또는 정신 질환이 있는 피험자에서 발생했습니다.
BIKTARVY와 관련된 이상 사건의 대부분(84%)은 1등급이었습니다.
시험 1489 및 1490의 공개 라벨 연장 단계에서의 이상 반응은 144주 분석에서 BIKTARVY를 투여받은 피험자에서 관찰된 것과 유사했습니다.
바이러스학적으로 억제된 성인의 임상 시험
바이러스학적으로 억제된 성인에서 BIKTARVY의 안전성은 바이러스학적으로 억제된 피험자를 DTG + ABC/3TC 또는 ABC/DTG/3TC에서 BIKTARVY로 전환한 무작위 배정, 이중 맹검, 활성 대조군 시험(시험 1844)에서 282명의 피험자에 대한 48주 데이터; 바이러스학적으로 억제된 피험자를 아타자나비르(ATV)(코비시스타트 또는 리토나비르와 함께 투여) 또는 다루나비르(DRV)(코비시스타트 또는 리토나비르와 함께 투여)와 FTC/TDF 또는 ABC/3TC를 포함한 요법에서 BIKTARVY로 전환한 공개 라벨, 활성 대조군 시험에서 290명의 피험자에 대한 48주 데이터(시험 1878); 및 284명의 바이러스학적으로 억제된 피험자를 DTG와 FTC/TAF 또는 FTC/TDF를 포함한 요법에서 BIKTARVY로 전환한 무작위 배정, 이중 맹검, 활성 대조군 시험에서 48주 데이터(시험 4030)를 기반으로 했습니다. 전반적으로 시험 1844, 1878 및 4030에서 바이러스학적으로 억제된 성인 피험자의 안전성 프로파일은 항레트로바이러스 치료 병력이 없는 피험자의 안전성 프로파일과 유사했습니다 [임상 연구(14.3) 참조].
말기 신장 질환(ESRD)이 있는 성인의 임상 시험(만성 혈액 투석을 받음)
FTC와 TAF(BIKTARVY의 성분)의 안전성은 단일 군, 공개 라벨 시험(시험 1825)에서 바이러스학적으로 억제된 ESRD(추정 크레아티닌 청소율이 15mL/분 미만)가 있는 성인을 대상으로 96주 동안 고정 용량 복합제 정제로 엘비테그라비르와 코비시스타트와 함께 FTC+TAF를 투여하여 평가했습니다(N=55). 가장 흔하게 보고된 이상 반응(조사자가 인과 관계가 있다고 평가한 이상 사건 및 모든 등급)은 메스꺼움(7%)이었습니다. 중대한 이상 사건은 피험자의 65%에서 보고되었으며, 가장 흔한 중대한 이상 사건은 폐렴(15%), 체액 과부하(7%), 고칼륨혈증(11%) 및 골수염(7%)이었습니다. 전반적으로 피험자의 7%가 이상 사건으로 인해 치료를 영구히 중단했습니다. 10명의 피험자가 48주 동안 BIKTARVY로 전환한 시험 1825의 연장 단계에서 안전성 결과는 공개 라벨 시험의 초기 단계에서의 결과와 유사했습니다 [특정 인구 집단에서의 사용(8.6) 및 임상 연구(14.3) 참조].
실험실 이상
시험 1489 및 1490에서 BIKTARVY를 투여받은 피험자의 2% 이상에서 발생한 실험실 이상(3~4등급)의 빈도는 표 2에 제시되어 있습니다.
| 시험 1489 | 시험 1490 | |||
|---|---|---|---|---|
| 실험실 매개변수 이상* | BIKTARVY N=314 |
ABC/DTG/3TC N=315 |
BIKTARVY N=320 |
DTG + FTC/TAF N=325 |
| ULN = 정상 상한 | ||||
| 아밀라아제(>2.0 × ULN) | 3% | 4% | 3% | 4% |
| ALT(>5.0 × ULN) | 2% | 2% | 3% | 1% |
| AST(>5.0 × ULN) | 5% | 3% | 2% | 3% |
| 크레아틴 키나아제(≥10.0 × ULN) | 8% | 8% | 6% | 4% |
| 호중구(<750 mm3) | 3% | 4% | 3% | 2% |
| LDL-콜레스테롤(공복)(>190 mg/dL) | 5% | 5% | 4% | 6% |
| 리파아제(> 3.0 × ULN)† | 2% | 2% | <1% | 2% |
| GGT(>5.0 × ULN) | 2% | 2% | 1% | 1% |
혈청 크레아티닌 변화: BIC는 신장 사구체 기능에 영향을 미치지 않고 크레아티닌의 세뇨관 분비를 억제하여 혈청 크레아티닌을 증가시키는 것으로 나타났습니다 [임상 약리학 (12.2) 참조]. 혈청 크레아티닌의 증가는 치료 4주째에 발생하여 144주까지 안정적으로 유지되었습니다. 시험 1489 및 1490에서 BIKTARVY군의 혈청 크레아티닌 중앙값 (Q1, Q3)은 기준선에서 144주까지 0.11 (0.03, 0.19) mg/dL 증가했으며, ABC/DTG/3TC 또는 DTG + FTC/TAF를 투여받은 비교군과 유사했습니다. 임상 시험에서 144주까지 BIKTARVY로 치료받은 참가자의 1% 미만에서 신장 관련 심각한 이상 반응이 발생했으며, 신장 관련 이상 반응으로 인한 치료 중단은 없었습니다.
빌리루빈 변화: 시험 1489 및 1490에서 144주까지 BIKTARVY를 투여받은 피험자의 17%에서 총 빌리루빈 증가가 관찰되었습니다. 증가는 주로 등급 1 (1.0~1.5 × ULN) (12%) 및 등급 2 (1.5~2.5 × ULN) (4%)였습니다. ABC/DTG/3TC 및 DTG + FTC/TAF군의 등급별 빌리루빈 증가는 각각 7% 및 8%였습니다. 증가는 주로 등급 1 (ABC/DTG/3TC 5% 및 DTG + FTC/TAF 7%) 또는 등급 2 (ABC/DTG/3TC 2% 및 DTG + FTC/TAF 2%)였습니다. BIKTARVY 임상 연구에서 144주까지 간 관련 이상 반응으로 인한 치료 중단은 없었습니다.
소아 대상 임상 시험
BIKTARVY의 안전성은 12세 이상 18세 미만의 바이러스 억제된 HIV-1 감염 환자(N=50)에서 48주까지(코호트 1), 6세 이상 12세 미만의 바이러스 억제된 환자(N=50)에서 24주까지(코호트 2), 그리고 2세 이상 14kg 이상 25kg 미만의 바이러스 억제된 환자(N=22)에서 24주까지(코호트 3) 오픈 라벨 임상 시험(시험 1474)에서 평가되었습니다 [임상 연구 (14.4) 참조]. 성인에서 관찰된 것과 비교하여 새로운 이상 반응이나 실험실 검사 이상은 확인되지 않았습니다. 소아 환자의 11%에서 이상 반응이 보고되었습니다. 대부분(76%)의 이상 반응은 등급 1이었습니다. 등급 3 또는 4 이상 반응은 보고되지 않았습니다. 2명 이상의 환자에서 보고된 이상 반응(중증도와 관계없이)은 복통(n=2)이었습니다. 1명의 환자(1%)에서 불면증과 불안의 등급 2 이상 반응이 발생하여 BIKTARVY 투여를 중단했습니다. 단일 환자에서 발생한 다른 이상 반응은 성인에서 관찰된 것과 유사했습니다.
6.2 시판 후 경험
다음 사건은 BIKTARVY 또는 TAF 함유 제품의 시판 후 사용 중에 확인되었습니다. 이러한 사건은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
7 약물 상호작용
7.1 다른 항레트로바이러스 약물
BIKTARVY는 완전한 요법이므로 HIV-1 감염 치료를 위한 다른 항레트로바이러스 약물과의 병용 투여는 권장되지 않습니다 [적응증 및 사용법 (1) 참조]. 다른 항레트로바이러스 약물과의 잠재적인 약물 상호 작용에 대한 포괄적인 정보는 제공되지 않습니다. 동시 HIV-1 항레트로바이러스 요법의 안전성 및 유효성이 알려져 있지 않기 때문입니다.
7.2 BIKTARVY가 다른 약물에 미치는 잠재적 영향
BIC는 시험관 내에서 유기 양이온 운반체 2(OCT2) 및 다중 약물 및 독소 배출 운반체 1(MATE1)을 억제합니다. OCT2 및 MATE1의 기질인 약물(예: 도페틸라이드)과 BIKTARVY를 병용 투여하면 이러한 약물의 혈장 농도가 증가할 수 있습니다(표 3 참조).
7.3 다른 약물이 BIKTARVY의 한 가지 이상의 성분에 미치는 잠재적 영향
BIC는 CYP3A 및 UGT1A1의 기질입니다. CYP3A의 강력한 유도제이자 UGT1A1의 유도제인 약물은 BIC의 혈장 농도를 상당히 감소시킬 수 있으며, 이는 BIKTARVY의 치료 효과 상실 및 내성 발생으로 이어질 수 있습니다 [임상 약리학 (12.3) 참조].
CYP3A의 강력한 억제제이자 UGT1A1의 억제제인 약물과 BIKTARVY를 병용 투여하면 BIC의 혈장 농도가 현저히 증가할 수 있습니다.
TAF는 P-당단백질(P-gp) 및 유방암 저항 단백질(BCRP)의 기질입니다. P-gp 및 BCRP를 억제하는 약물과의 병용 투여는 TAF의 흡수 및 혈장 농도를 증가시킬 수 있습니다 [임상 약리학 (12.3) 참조]. P-gp 활성을 유도하는 약물과의 병용 투여는 TAF의 흡수를 감소시켜 TAF의 혈장 농도를 감소시키고, 이는 BIKTARVY의 치료 효과 상실 및 내성 발생으로 이어질 수 있습니다(표 3 참조).
7.4 신장 기능에 영향을 미치는 약물
FTC 및 테노포비르는 주로 사구체 여과 및 활성 세뇨관 분비의 조합을 통해 신장으로 배설되므로, BIKTARVY를 신장 기능을 감소시키거나 활성 세뇨관 분비를 경쟁하는 약물과 병용 투여하면 FTC, 테노포비르 및 기타 신장으로 배설되는 약물의 농도가 증가할 수 있으며, 이는 부작용 위험을 증가시킬 수 있습니다. 활성 세뇨관 분비를 통해 배설되는 약물의 예로는 아시클로비르, 시도포비르, 간시클로비르, 발아시클로비르, 발간시클로비르, 아미노글리코사이드(예: 젠타마이신) 및 고용량 또는 다중 NSAID가 있지만 이에 국한되지 않습니다 [경고 및 주의 사항 (5.4) 참조].
7.5 확립된 및 잠재적으로 중요한 약물 상호 작용
표 3은 권장되는 예방 또는 관리 전략과 함께 확립된 또는 잠재적으로 임상적으로 중요한 약물 상호 작용 목록을 제공합니다. 설명된 약물 상호 작용은 BIKTARVY, BIKTARVY의 성분(BIC, FTC 및 TAF)을 개별 약물로 수행한 연구를 기반으로 하거나 BIKTARVY와 발생할 수 있는 약물 상호 작용입니다 [금기 사항 (4), 경고 및 주의 사항 (5.2) 및 임상 약리학 (12.3) 참조].
| 병용 약물 종류: 약물 이름 | 농도에 미치는 영향† | 임상적 주석 |
|---|---|---|
| 항부정맥제: 도페틸라이드 |
↑ 도페틸라이드 | 도페틸라이드 치료와 관련된 심각하거나 생명을 위협하는 사건의 가능성으로 인해 병용 투여는 금기입니다 [금기 사항 (4) 참조]. |
| 항경련제: 카르바마제핀‡ 옥스카르바제핀 페노바르비탈 페니토인 |
↓ BIC ↓ TAF |
대체 항경련제와의 병용 투여를 고려해야 합니다. |
| 항결핵제: 리파부틴‡ 리팜핀‡,§ 리파펜틴 |
↓ BIC ↓ TAF |
리팜핀은 BIKTARVY의 BIC 성분에 미치는 영향으로 인해 리팜핀과의 병용 투여는 금기입니다 [금기 사항 (4) 참조]. 리파부틴 또는 리파펜틴과의 병용 투여는 권장되지 않습니다. |
| 허브 제품: 세인트 존스 워트¶ |
↓ BIC ↓ TAF |
세인트 존스 워트와의 병용 투여는 권장되지 않습니다. |
| 다가 양이온 (예: Mg, Al, Ca, Fe)을 함유한 경구 약물 또는 보충제: 칼슘 또는 철분 보충제‡ 양이온 함유 제산제 또는 완하제‡ 수크랄페이트 완충제 |
↓ BIC | Al/Mg 함유 제산제: BIKTARVY는 Al/Mg 함유 제산제 복용 최소 2시간 전 또는 6시간 후에 복용할 수 있습니다. Al/Mg 함유 제산제와 함께 또는 2시간 후에 BIKTARVY를 정기적으로 투여하는 것은 권장하지 않습니다. 칼슘 또는 철분 함유 보충제 또는 제산제: BIKTARVY와 칼슘 또는 철분 함유 보충제 또는 제산제는 음식과 함께 복용할 수 있습니다. 공복 상태에서 칼슘 또는 철분 함유 보충제 또는 제산제와 함께 또는 2시간 후에 BIKTARVY를 정기적으로 투여하는 것은 권장하지 않습니다. 임산부의 경우: Al/Mg 함유 제산제: BIKTARVY는 음식 섭취 여부와 관계없이 Al/Mg 함유 제산제 복용 최소 2시간 전 또는 6시간 후에 복용할 수 있습니다. 칼슘 또는 철분 함유 보충제 또는 제산제: BIKTARVY와 칼슘 또는 철분 함유 보충제 또는 제산제는 음식과 함께 복용할 수 있습니다. 그러나 공복 상태에서 복용하는 경우 BIKTARVY는 칼슘 또는 철분 함유 보충제 또는 제산제 복용 최소 2시간 전 또는 6시간 후에 복용해야 합니다. |
| 메트포르민 | ↑ 메트포르민 | BIKTARVY와 메트포르민의 병용 사용의 이점과 위험을 평가하려면 메트포르민 처방 정보를 참조하십시오. |
7.6 BIKTARVY와 임상적으로 유의미한 상호 작용이 없는 약물
BIKTARVY 또는 BIKTARVY 성분을 사용하여 수행된 약물 상호 작용 연구에 따르면 BIKTARVY를 다음 약물과 병용했을 때 임상적으로 유의미한 약물 상호 작용이 관찰되지 않았습니다: 에티닐 에스트라디올, 레디파스비어/소포스부비어, 미다졸람, 노르게스티메이트, 세르탈린, 소포스부비어, 소포스부비어/벨파타스비어, 소포스부비어/벨파타스비어/복실라프레비어.
8 특정 인구 집단에서의 사용
8.1 임신
임신 노출 등록
임신 중 BIKTARVY에 노출된 개인의 임신 결과를 모니터링하는 임신 노출 등록이 있습니다. 의료 서비스 제공자는 1-800-258-4263으로 항레트로바이러스 임신 등록(APR)에 전화하여 환자를 등록하는 것이 좋습니다.
위험 요약
임신 중 BIC, FTC 및 TAF 사용에 대한 관찰 연구 및 APR에서 얻은 가용 데이터는 주요 선천적 결손, 유산 또는 기타 유해한 산모 또는 태아 결과의 약물 관련 위험을 확립하지 못했습니다. BIC, FTC 또는 TAF 함유 제품으로 치료받은 임산부에 대한 보고는 이러한 성분에 대한 APR의 전반적인 위험 평가에 기여합니다. APR에서 얻은 가용 데이터는 미국 대도시 애틀랜타 선천적 결손 프로그램(MACDP)의 주요 선천적 결손에 대한 배경 비율인 2.7%와 비교하여 BIC, FTC 또는 TAF에 대한 주요 선천적 결손의 전반적인 위험에서 통계적으로 유의미한 차이를 보이지 않습니다. ( 데이터 참조). 유산율은 APR에 보고되지 않았습니다. 미국 일반 인구에서 임상적으로 인지된 임신의 추정 배경 유산율은 15~20%입니다.
BIKTARVY 안전성은 또한 성인의 다른 임상시험과 일치하는 안전성 결과를 입증한 공개 라벨 임상시험에서 평가되었습니다. ( 데이터 참조).
동물 생식 연구에서 권장 사람 용량(RHD)에서 사람의 용량보다 독성이 없거나(토끼) 더 큰 노출 수준에서 BIKTARVY 성분으로 인한 유해한 발달 결과에 대한 증거는 관찰되지 않았습니다( 데이터 참조). 기관 형성 중 BIC에 대한 전신 노출(AUC)은 BIKTARVY의 RHD에서 노출의 약 36배(쥐) 및 0.6배(토끼)였으며, FTC는 약 60배(쥐) 및 108배(토끼)였으며, TAF는 약 2배(쥐) 및 78배(토끼)였습니다. 쥐의 출생 전/후 발달 연구에서 산모의 전신 노출(AUC)은 RHD에서 사람의 각 성분 노출의 30배(BIC), 60배(FTC) 및 19배(TDF)였습니다.
데이터
인간 데이터
BIKTARVY는 HIV-1에 걸렸지만 BIC, FTC 또는 TAF에 대한 내성과 관련된 알려진 치환이 없는 바이러스학적으로 억제된(HIV-1 RNA < 50 copies/mL) 성인 33명을 대상으로 한 공개 라벨 임상시험에서 평가되었습니다. 임산부에게는 임신 2기 또는 3기부터 산후까지 BIKTARVY(BIC 50mg, FTC 200mg 및 TAF 25mg 함유)를 1일 1회 투여했습니다. BIC, FTC 및 TAF의 노출은 산후에 비해 임신 중에 더 낮았습니다. [ 임상 약리학(12.3) 참조]. 연구를 완료한 성인 참가자 32명 모두 임신 중, 분만 시 및 산후 18주까지 바이러스 억제를 유지했습니다. 기준 CD4+ 세포 수의 중앙값은 558 cells/µL였으며, 기준에서 산후 12주까지 CD4+ 세포 수의 변화량 중앙값은 159 cells/μL였습니다. 신생아 참가자 29명 모두 출생 시 및/또는 출생 후 4~8주에 HIV-1 PCR 결과가 음성/검출 불가능했습니다. 이 임상시험의 안전성 결과는 성인의 다른 임상시험과 일치했습니다.
BIKTARVY는 바이러스학적으로 억제된 임산부에서만 연구되었으며, 임신 중에는 산후에 비해 BIKTARVY의 혈장 노출이 더 낮게 관찰되었습니다. 따라서 BIKTARVY는 BIKTARVY의 개별 성분에 대한 내성과 관련된 알려진 치환 없이 안정적인 항레트로바이러스 요법으로 바이러스학적으로 억제된 임산부에게 권장됩니다.
Bictegravir (BIC):
생존 출산으로 이어진 임신 중 BIC 함유 요법에 대한 500건 이상의 노출에 대한 APR의 전향적 보고(1분기에 423건, 2/3분기에 113건 노출 포함)에 따르면, 생존 출산 시 선천적 결손의 유병률은 BIC 함유 요법에 대한 1분기 및 2/3분기 노출 후 각각 4.3%(95% CI: 2.5%~6.6%) 및 1.8%(0.2%, 6.2%)였습니다.
Emtricitabine (FTC):
생존 출산으로 이어진 임신 중 FTC 함유 요법에 대한 6,500건 이상의 노출에 대한 APR의 전향적 보고(1분기에 4,800건 이상, 2/3분기에 1,700건 이상 노출 포함)에 따르면, 생존 출산 시 선천적 결손의 유병률은 FTC 함유 요법에 대한 1분기 및 2/3분기 노출 후 각각 2.9%(95% CI: 2.5%~3.4%) 및 2.8%(95% CI: 2.1%~3.7%)였습니다.
Tenofovir Alafenamide (TAF):
생존 출산으로 이어진 임신 중 TAF 함유 요법에 대한 1,200건 이상의 노출에 대한 APR의 전향적 보고(1분기에 1,000건 이상, 2/3분기에 200건 이상 노출 포함)에 따르면, 생존 출산 시 선천적 결손의 유병률은 TAF 함유 요법에 대한 1분기 및 2/3분기 노출 후 각각 3.9%(95% CI: 2.8%~5.2%) 및 4.8%(95% CI: 2.5%~8.3%)였습니다.
APR의 방법론적 제한 사항에는 외부 비교군으로 MACDP를 사용하는 것이 포함됩니다. MACDP 모집단은 질병 특이적이지 않으며, 제한된 지리적 영역의 개인과 유아를 평가하며, 임신 20주 미만에 발생한 출산에 대한 결과는 포함하지 않습니다.
동물 데이터
비크테그라비르: 임신한 랫트(5, 30 또는 300mg/kg/일) 및 토끼(100, 300 또는 1000mg/kg/일)에게 각각 임신 7~17일 및 7~19일에 BIC를 경구 투여했습니다. BIKTARVY의 RHD에서 인체 노출량의 약 36배(랫트) 및 0.6배(토끼)까지의 BIC 노출(AUC)에서 랫트 및 토끼에서 태아에게 미치는 유해한 영향은 관찰되지 않았습니다. 토끼에서 모체 독성 용량(1000mg/kg/일, RHD에서 인체 노출량보다 약 1.4배 높음)에서 자연 유산, 임상 징후 증가[대변 변화, 체중 감소 및 차가운 체온] 및 체중 감소가 관찰되었습니다.
출산 전/후 발달 연구에서 임신한 랫트(최대 300mg/kg/일)에게 임신 6일부터 수유/산후 24일까지 BIC를 경구 투여했습니다. RHD에서 인체 노출량보다 각각 약 30배 및 11배 높은 모체 및 새끼 노출(AUC)에서 출생 전(자궁 내)부터 수유 기간 동안 매일 노출된 새끼에서 유의미한 유해 효과는 관찰되지 않았습니다.
엠트리시타빈: FTC를 임신한 생쥐(250, 500 또는 1000mg/kg/일) 및 토끼(100, 300 또는 1000mg/kg/일)에게 기관 형성 기간(각각 임신 6~15일 및 7~19일) 동안 경구 투여했습니다. RHD에서 인체 노출량보다 약 60배 높은 노출량의 생쥐와 약 108배 높은 노출량의 토끼에서 수행된 엠트리시타빈을 이용한 배아-태아 독성 연구에서 유의미한 독성 효과는 관찰되지 않았습니다.
FTC를 이용한 출산 전/후 발달 연구에서 생쥐에게 최대 1000mg/kg/일의 용량을 투여했습니다. RHD에서 인체 노출량보다 약 60배 높은 일일 노출(AUC)에서 출생 전(자궁 내)부터 성적으로 성숙할 때까지 매일 노출된 새끼에서 약물과 직접적인 관련이 있는 유의미한 유해 효과는 관찰되지 않았습니다.
테노포비르 알라페나미드: TAF를 임신한 랫트(25, 100 또는 250mg/kg/일) 및 토끼(10, 30 또는 100mg/kg/일)에게 기관 형성 기간(각각 임신 6~17일 및 7~20일) 동안 경구 투여했습니다. BIKTARVY의 1일 권장 용량에서 인체 노출량보다 약 2배(랫트) 및 78배(토끼) 높은 TAF 노출에서 랫트 및 토끼에서 태아에게 미치는 유해한 영향은 관찰되지 않았습니다. TAF는 테노포비르로 빠르게 전환됩니다. 랫트 및 토끼에서 관찰된 테노포비르 노출은 RHD에서 인체 테노포비르 노출량보다 55배(랫트) 및 86배(토끼) 높았습니다. TAF는 테노포비르로 빠르게 전환되고 TDF 투여 후 비해 TAF 투여 후 랫트 및 생쥐에서 더 낮은 테노포비르 노출이 관찰되었으므로 랫트에서 출산 전/후 발달 연구는 TDF만으로 수행되었습니다. 수유 기간 동안 최대 600mg/kg/일의 용량을 투여했습니다. BIKTARVY의 RHD에서 인체 노출량보다 약 12배[19배] 높은 테노포비르 노출에서 임신 7일[및 수유 20일]에 새끼에서 유해 효과는 관찰되지 않았습니다.
8.2 수유
위험 요약
공개된 문헌의 데이터에 따르면 모유에서 BIC, FTC, TAF 및 테노포비르가 검출되었다고 보고되었습니다. 모유 수유 중인 영아에 대한 BIC의 영향에 대한 데이터는 없습니다. 공개된 문헌의 데이터에 따르면 모유 수유 중인 영아에 대한 FTC 또는 TAF의 유해 효과는 보고되지 않았습니다. 모유 생성에 대한 BIC, FTC 또는 TAF의 영향에 대한 데이터는 없습니다.
모유 수유의 잠재적 위험은 다음과 같습니다. (1) HIV-1 음성 영아에게 HIV-1 전파, (2) HIV-1 양성 영아에서 바이러스 내성 발생, (3) 모유 수유 중인 영아에게 성인에서 나타나는 것과 유사한 이상 반응.
8.4 소아에 대한 사용
BIKTARVY의 안전성과 유효성은 체중이 14kg 이상인 소아 환자에서 인체 면역결핍 바이러스 1형(HIV-1) 감염 치료를 위한 완전 요법으로 확립되었습니다.
- 항레트로바이러스 치료 경험이 없는 환자 또는
- 비크테그라비르 또는 테노포비르에 대한 알려졌거나 의심되는 내성이 없는 안정적인 항레트로바이러스 요법으로 바이러스학적으로 억제된(HIV-1 RNA 50copies/mL 미만) 환자에서 현재의 항레트로바이러스 요법을 대체하기 위한 경우 [적응증 및 용법(1) 및 용량 및 투여 방법(2.2, 2.3)] 참조.
체중이 14kg 이상인 소아 환자에서 BIKTARVY 사용은 다음에 의해 뒷받침됩니다.
- 성인 대상 임상시험 [임상 연구(14.1)] 참조
- 바이러스학적으로 억제된 소아 피험자의 세 가지 연령 기반 코호트를 대상으로 한 공개 표지 임상시험 [임상 연구(14.4)] 참조
- 코호트 1: 12세 이상 18세 미만, 체중 35kg 이상으로 48주 동안 BIKTARVY를 투여받은 피험자(N=50)
- 코호트 2: 6세 이상 12세 미만, 체중 25kg 이상으로 24주 동안 BIKTARVY를 투여받은 피험자(N=50)
- 코호트 3: 2세 이상, 체중 14kg 이상 25kg 미만으로 24주 동안 BIKTARVY를 투여받은 피험자(N=22). 2세 소아 피험자는 등록되지 않았습니다. 등록 당시 3세였던 6명의 소아 피험자 중 3명의 체중은 14kg 이상 15kg 미만이었습니다.
이러한 소아 피험자에서 BIKTARVY의 안전성과 유효성은 성인에서와 유사했으며 BIKTARVY 성분에 대한 노출의 임상적으로 유의미한 변화는 없었습니다. [이상 반응(6.1), 임상 약리학(12.3) 및 임상 연구(14.4)] 참조.
체중이 14kg 미만인 소아 환자에서 BIKTARVY의 안전성과 유효성은 확립되지 않았습니다.
8.5 노인 환자에 대한 사용
바이러스학적으로 억제된 환자를 대상으로 한 임상 시험(시험 4449, 1844 및 1878)에는 BIKTARVY를 투여받은 65세 이상의 환자 111명이 포함되었으며, 여기에는 이전의 항레트로바이러스 요법에서 BIKTARVY로 전환한 65세 이상의 환자를 대상으로 한 공개 라벨 단일군 시험에 참여한 환자 86명이 포함되었습니다 [임상 연구(14.3) 참조]. 이러한 시험에서 BIKTARVY로 치료받은 환자의 총 수 중 100명(90%)은 65~74세였고 11명(10%)은 75~84세였습니다. 노인 환자와 18세 이상 65세 미만의 성인 환자 간에 안전성 또는 유효성 측면에서 전반적인 차이가 관찰되지 않았으며, 보고된 다른 임상 경험에서도 노인 환자와 젊은 환자 간에 반응 차이가 나타나지 않았지만 일부 노인 환자의 민감도가 더 높을 가능성은 배제할 수 없습니다.
8.6 신장애
만성 혈액투석을 받고 있는 바이러스학적으로 억제된 ESRD(추정 크레아티닌 청소율 15mL/min 미만) 성인을 대상으로 한 단일군 공개 라벨 시험(시험 1825)에서 FTC 및 TAF(BIKTARVY의 성분)의 약동학, 안전성, 바이러스학적 반응 및 면역학적 반응을 96주 동안 엘비테그라비르 및 코비시스타트와 함께 고정 용량 복합제 정제로 FTC+TAF를 투여하여 평가했습니다(N=55). 시험 1825의 연장 단계에서 바이러스학적으로 억제된 환자 10명이 BIKTARVY로 전환했으며 모두 48주 동안 바이러스학적으로 억제된 상태를 유지했습니다 [이상반응(6.1), 임상 약리학(12.3) 및 임상 연구(14.3) 참조].
추정 크레아티닌 청소율이 30mL/min 이상이거나 만성 혈액투석을 받고 있는 바이러스학적으로 억제된 성인(추정 크레아티닌 청소율 15mL/min 미만)의 경우 BIKTARVY의 용량 조절이 권장되지 않습니다. 혈액투석을 받는 날에는 혈액투석 치료를 마친 후 BIKTARVY 1일 용량을 투여하십시오 [용량 및 투여 방법(2.2) 참조
Cockcroft-Gault 방법으로 추정한 크레아티닌 청소율이 30mL/min 미만인 환자, 만성 투석을 받지 않는 ESRD(추정 크레아티닌 청소율 15mL/min 미만) 환자 또는 항레트로바이러스 치료 경험이 없고 만성 투석을 받고 있는 ESRD 환자의 경우 이러한 환자군에서 BIKTARVY의 안전성 및/또는 유효성이 확립되지 않았으므로 투여가 권장되지 않습니다 [용량 및 투여 방법(2.4), 경고 및 주의사항(5.4) 및 임상 약리학(12.3) 참조].
8.7 간장애
경도(Child-Pugh 등급 A) 또는 중등도(Child-Pugh 등급 B) 간장애 환자의 경우 BIKTARVY의 용량 조절이 권장되지 않습니다. 중증 간장애(Child-Pugh 등급 C) 환자에서는 BIKTARVY가 연구된 바 없습니다. 따라서 중증 간장애 환자에게는 BIKTARVY를 사용하지 않는 것이 좋습니다 [용량 및 투여 방법(2.4) 및 임상 약리학(12.3) 참조].
10 과량 복용
BIKTARVY 과량 복용에 대한 환자 데이터는 없습니다. 과량 복용이 발생하면 환자의 독성 증상을 모니터링하십시오. BIKTARVY 과량 복용 치료는 활력징후 모니터링 및 환자의 임상 상태 관찰을 포함한 일반적인 지지 요법으로 구성됩니다.
혈액 투석 치료는 FTC 투여 후 1.5시간 이내에 시작하는 3시간 투석 기간 동안 FTC 용량의 약 30%를 제거합니다(혈류 속도 400mL/분, 투석액 흐름 속도 600mL/분). FTC가 복막 투석으로 제거될 수 있는지 여부는 알려져 있지 않습니다.
테노포비르는 추출 계수가 약 54%인 혈액 투석으로 효율적으로 제거됩니다.
11. 성분
BIKTARVY (bictegravir, emtricitabine, and tenofovir alafenamide)은 bictegravir (BIC), emtricitabine (FTC) 및 tenofovir alafenamide (TAF)를 함유한 고정용량 조합 정제로 경구 투여용입니다.
- BIC는 인테그라제 가단전이 억제제(INSTI)입니다.
- FTC는 시티딘의 합성 핵산 아날로그로서 HIV 핵산 아날로그 역전사 효소 억제제(HIV NRTI)입니다.
- TAF는 HIV NRTI로서, 아데노신 5′-인산의 아싸이클릭 핵산 인산포네이트(뉴클레오티드) 아날로그인 테노포비르로 in vivo에서 전환됩니다.
BIKTARVY 정제는 두 가지 용량 강도로 제공됩니다:
- 50 mg/200 mg/25 mg 정제는 BIC 50 mg(비테그라비르 나트륨 52.5 mg에 해당), FTC 200 mg 및 TAF 25 mg(테노포비르 알라페나미드 푸마르산 28 mg에 해당)를 함유합니다.
- 30 mg/120 mg/15 mg 정제는 BIC 30 mg(비테그라비르 나트륨 31.5 mg에 해당), FTC 120 mg 및 TAF 15 mg(테노포비르 알라페나미드 푸마르산 16.8 mg에 해당)를 함유합니다.
BIKTARVY 정제의 두 가지 용량 강도 모두 다음 비활성 성분을 포함합니다: 크로스카르멜로스 나트륨, 스테아릭산 마그네슘 및 미세결정셀룰로오스. 두 가지 용량 강도의 정제는 철 산화물 검정색, 철 산화물 적색, 폴리에틸렌 글리콜, 폴리비닐 알코올, 탈크 및 이산화티타늄을 포함한 코팅 물질로 필름 코팅되어 있습니다.
Bictegravir: 비테그라비르 나트륨의 화학명은 2,5-Methanopyrido[1′,2′:4,5]pyrazino[2,1-b][1,3]oxazepine-10-carboxamide, 2,3,4,5,7,9,13,13a-octahydro-8-hydroxy-7,9-dioxo-N-[(2,4,6-trifluorophenyl)methyl]-, sodium salt (1:1), (2R,5S,13aR)-입니다.
비테그라비르 나트륨은 C21H17F3N3NaO5의 분자식과 471.4의 분자량을 가지며 다음 구조식을 가지고 있습니다:
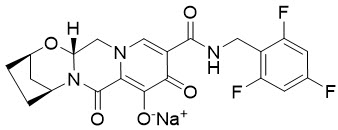
비테그라비르 나트륨은 20 °C에서 물 1 mL당 0.1 mg의 용해도를 가지는 오프화이트에서 노란색 고체입니다.
Emtricitabine: FTC의 화학명은 4-amino-5-fluoro-1-(2R-hydroxymethyl-1,3-oxathiolan-5S-yl)-(1H)-pyrimidin-2-one입니다. FTC는 시티딘의 티오 아날로그인 (-)에난티오머로, 다른 시티딘 아날로그와 다른 점은 5번 위치에 플루오린이 있는 것입니다.
FTC는 C8H10FN3O3S의 분자식과 247.2의 분자량을 가지며 다음 구조식을 가지고 있습니다:
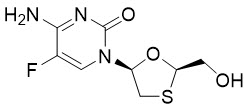
FTC는 25 °C에서 물 1 mL당 약 112 mg의 용해도를 가지는 흰색에서 오프화이트의 분말입니다.
Tenofovir alafenamide: 테노포비르 알라페나미드 푸마르산 약물물질의 화학명은 L-alanine, N-[(S)-[[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl]phenoxyphosphinyl]-, 1-methylethyl ester, (2E)-2-butenedioate (2:1)입니다.
테노포비르 알라페나미드 푸마르산은 C21H29O5N6P∙½(C4H4O4)의 분자식과 534.5의 분자량을 가지며 다음 구조식을 가지고 있습니다:
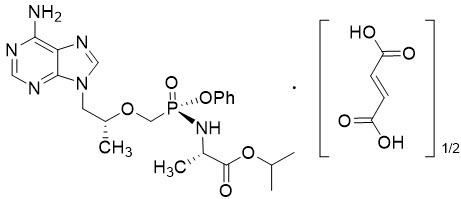
테노포비르 알라페나미드 푸마르산은 20 °C에서 물 1 mL당 4.7 mg의 용해도를 가지는 흰색에서 오프화이트 또는 연한 분말입니다.
12. 임상 약리
12.1 작용 기전
BIKTARVY는 항레트로바이러스 약물인 비크테그라비어(BIC), 엠트리시타빈(FTC) 및 테노포비어 알라페나미드(TAF)의 고정 용량 복합제입니다 [미생물학(12.4) 참조].
12.2 약력학
12.3 약동학
BIKTARVY 성분의 약동학적(PK) 특성은 표 4에 나와 있습니다. BIKTARVY 성분의 다중 용량 PK 매개변수(모집단 약동학 분석 기반)는 표 5에 나와 있습니다.
| 비크테그라비어(BIC) | 엠트리시타빈(FTC) | 테노포비어 알라페나미드(TAF) | ||
|---|---|---|---|---|
| PBMC=말초혈액 단핵구; CES1=카르복실 에스테라아제 1 | ||||
|
||||
| 흡수 | ||||
| Tmax (h)* | 2.0–4.0 | 1.5–2.0 | 0.5–2.0 | |
| 고지방 식사의 영향 (공복에 비해)† |
AUC 비율 | 1.24 (1.16, 1.33) | 0.96 (0.93, 0.99) | 1.63 (1.43, 1.85) |
| Cmax 비율 | 1.13 (1.06, 1.20) | 0.86 (0.78, 0.93) | 0.92 (0.73, 1.14) | |
| 분포 | ||||
| 인간 혈장 단백질에 대한 결합 % | >99 | <4 | ~80 | |
| 혈액-혈장 비율 | 0.64 | 0.6 | 1.0 | |
| 배설 | ||||
| t1/2 (h)‡ | 17.3 (14.8, 20.7) | 10.4 (9.0, 12.0) | 0.51 (0.45, 0.62)‡ | |
| 대사 | ||||
| 대사 경로 | CYP3A UGT1A1 |
유의미한 대사 없음 | 카텝신 A§ (PBMC) CES1 (간세포) |
|
| 배설 | ||||
| 주요 배설 경로 | 대사 | 사구체 여과 및 활성 세뇨관 분비 | 대사 | |
| 소변으로 배설되는 용량의 %¶ | 35 | 70 | <1 | |
| 대변으로 배설되는 용량의 %¶ | 60.3 | 13.7 | 31.7 | |
| 매개변수 평균 (CV%) | Bictegravir | Emtricitabine | Tenofovir Alafenamide |
|---|---|---|---|
| CV=변동 계수; NA=해당 없음 | |||
| Cmax (마이크로그램/mL) |
6.15 (22.9) | 2.13 (34.7) | 0.121 (15.4) |
| AUCtau (마이크로그램∙h/mL) |
102 (26.9) | 12.3 (29.2) | 0.142 (17.3) |
| Ctrough (마이크로그램/mL) |
2.61 (35.2) | 0.096 (37.4) | NA |
특정 인구집단
신장애 환자
1상 연구에서 심각한 신장애(Cockcroft-Gault 방법으로 추정된 크레아티닌 청소율 15~30mL/분 미만)가 있는 피험자와 건강한 피험자 간에 BIC, TAF 또는 대사체인 테노포비어의 약동학적 차이가 임상적으로 유의하지 않았습니다. FTC 단독으로 진행된 별도의 1상 연구에서 심각한 신장애가 있는 피험자의 FTC 노출량이 증가했습니다.
BIC, FTC 및 TAF의 약동학은 시험 1825에서 만성 혈액 투석을 받는 ESRD(Cockcroft-Gault 방법으로 추정된 크레아티닌 청소율 15mL/분 미만)가 있는 바이러스학적으로 억제된 HIV-1 감염 환자의 하위 집단에서 평가되었습니다. TAF의 약동학은 건강한 피험자와 만성 혈액 투석을 받는 ESRD 환자 간에 유사했으며, ESRD 환자의 FTC 및 테노포비어 노출량 증가는 임상적으로 유의하지 않다고 판단되었습니다. BIKTARVY를 투여받은 ESRD 환자(n=7)의 중앙값(최소값, 최대값) BIC Ctrough 값은 846ng/mL(288, 1810)였으며, 정상 신장 기능이 있는 환자(N=584)의 경우 2540ng/mL(757, 6499)였습니다. 바이러스학적으로 억제된 ESRD 집단에서 BIC Ctrough 값이 유의하게 낮았음에도 불구하고 바이러스 억제가 유지되었습니다 [특정 인구집단에서의 사용(8.6) 및 임상 연구(14.3) 참조].
간 기능 장애 환자
Emtricitabine: 간 기능 장애가 있는 피험자에서 FTC의 약동학은 연구되지 않았습니다. 그러나 FTC는 간 효소에 의해 유의하게 대사되지 않으므로 간 기능 장애의 영향은 제한적일 것으로 예상됩니다.
Tenofovir Alafenamide: 경증 또는 중등도(Child-Pugh Class A 및 B) 간 기능 장애가 있는 피험자에서 TAF 또는 대사체인 테노포비어의 약동학적 변화가 임상적으로 유의하지 않았습니다 [특정 인구집단에서의 사용(8.7) 참조].
노인 환자
BIC, FTC 및 TAF의 약동학은 노인(65세 이상)에서 완전히 평가되지 않았습니다. BIKTARVY의 3상 시험에서 HIV 감염 환자의 모집단 약동학 분석 결과, 74세까지 나이가 BIC 및 TAF의 노출량에 임상적으로 유의한 영향을 미치지 않는 것으로 나타났습니다 [특정 인구집단에서의 사용(8.5) 참조].
소아 환자
시험 1474에서 BIKTARVY를 투여받은 12세 이상 18세 미만의 체중이 35kg 이상인 소아 환자 50명에서 평균 BIC Ctrough 값은 성인보다 낮았지만, 노출-반응 관계를 기반으로 임상적으로 유의하지 않다고 판단되었습니다. 이러한 소아 환자의 FTC 및 TAF 노출량은 성인과 유사했습니다(표 6).
| 매개변수 평균(CV%) | Bictegravir* | Emtricitabine† | Tenofovir Alafenamide* |
|---|---|---|---|
| CV=변이 계수; NA=해당 없음 | |||
| Cmax (마이크로그램/mL) |
6.24 (27.1) | 2.69 (34.0) | 0.133 (70.2) |
| AUCtau (마이크로그램∙h/mL) |
89.1 (31.0) | 13.6 (21.7) | 0.196 (50.3) |
| Ctrough (마이크로그램/mL) |
1.78 (44.4) | 0.064 (25.0) | NA |
BIC의 평균 Cmax 및 FTC와 TAF의 노출량(AUCtau 및 Cmax)은 6세 이상 12세 미만이고 체중이 25kg 이상인 소아 환자 50명과 2세 이상이고 체중이 14kg 이상 25kg 미만인 소아 환자 22명에서 시험 1474에서 BIKTARVY를 투여받은 후 성인보다 높았습니다. 그러나 안전성 프로파일이 성인과 소아 환자에서 유사했기 때문에 증가는 임상적으로 유의미하지 않은 것으로 간주되었습니다(표 7 및 8). [특정 인구 집단에서의 사용(8.4) 참조].
| 매개변수 평균(CV%) | Bictegravir* | Emtricitabine† | Tenofovir Alafenamide* |
|---|---|---|---|
| CV=변동 계수; NA=해당 없음 | |||
| Cmax (마이크로그램/mL) |
9.46 (24.3) | 3.89 (31.0) | 0.205 (44.6) |
| AUCtau (마이크로그램∙h/mL) |
128 (27.8) | 17.6 (36.9) | 0.278 (40.3) |
| Ctrough (마이크로그램/mL) |
2.36 (39.0) | 0.227 (323) | NA |
| 매개변수 평균(CV%) | Bictegravir† | Emtricitabine‡ | Tenofovir Alafenamide‡ |
|---|---|---|---|
| CV=변동 계수; NA=해당 없음 | |||
| Cmax (마이크로그램/mL) |
9.15 (44.8) | 3.85 (34.7) | 0.414 (31.0) |
| AUCtau (마이크로그램∙h/mL) |
126 (42.4) | 15.0 (21.9) | 0.305 (42.6) |
| Ctrough (마이크로그램/mL) |
2.43 (40.1) | 0.210 (243) | NA |
임신
BIKTARVY 50mg/200mg/25mg 복용 후 임신 중 BIC, FTC 및 TAF의 혈장 노출량(Ctrough 및 AUCtau)은 분만 후에 비해 낮았습니다(표 9). 임신 중 노출량 변화는 바이러스학적으로 억제된 임산부에게 임상적으로 유의미하지 않습니다 [약물 상호 작용(7.5) 참조].
| 매개변수 평균(%CV) | 2기 (N=21) |
3기 (N=30) |
분만 후 12주 (N=32) |
|---|---|---|---|
| CV = 변이 계수; NA = 해당 없음 | |||
|
|||
| Bictegravir | |||
| Cmax (microgram per mL) |
5.82 (30.1) | 5.37 (25.9) | 11.03 (24.9) |
| AUCtau (microgram∙h per mL) |
62.8 (32.2) | 60.2 (29.1) | 148.3 (28.5) |
| 결합되지 않은 AUCtau* (microgram∙h per mL) |
0.224 (42.0) | 0.219 (33.9) | 0.374 (32.2) |
| Ctrough (microgram per mL) |
1.05 (45.2) | 1.07 (41.7) | 3.64 (34.1) |
| Emtricitabine | |||
| Cmax (microgram per mL) |
2.64 (36.6) | 2.59 (26.5) | 3.36 (26.9) |
| AUCtau (microgram∙h per mL) |
10.3 (20.0) | 10.4 (20.3) | 15.3 (21.9) |
| Ctrough (microgram per mL) |
0.06 (103.9) | 0.05 (27.2) | 0.08 (33.7) |
| Tenofovir Alafenamide | |||
| Cmax (microgram per mL) |
0.33 (52.1) | 0.27 (42.1) | 0.49 (52.5) |
| AUCtau (microgram∙h per mL) |
0.24 (45.6) | 0.21 (45.0) | 0.30 (31.8) |
| 결합되지 않은 AUCtau* (microgram∙h per mL) |
0.015 (28.2) | 0.016 (28.4) | 0.017 (23.4) |
약물 상호 작용 연구
BIKTARVY는 HIV-1 감염 치료를 위한 완전한 요법이므로 다른 항레트로바이러스제와의 잠재적인 약물 상호 작용에 대한 포괄적인 정보는 제공되지 않습니다.
BIC는 CYP3A 및 UGT1A1의 기질입니다.
BIC는 OCT2 및 MATE1의 억제제입니다. 임상적으로 관련된 농도에서 BIC는 간 수송체 OATP1B1, OATP1B3, OCT1, BSEP, 신장 수송체 OAT1 및 OAT3 또는 CYP(CYP3A 포함) 또는 UGT1A1 효소의 억제제가 아닙니다.
TAF는 P-gp 및 BCRP의 기질입니다.
임상적으로 관련된 농도에서 TAF는 약물 수송체 P-gp, BCRP, 간 수송체 OATP1B1, OATP1B3, OCT1, BSEP, 신장 수송체 OAT1, OAT3, OCT2, MATE1 또는 CYP(CYP3A 포함) 또는 UGT1A1 효소의 억제제가 아닙니다.
약물 상호 작용 연구는 BIKTARVY 또는 그 구성 요소로 수행되었습니다. 표 10 및 11은 각각 다른 약물의 BIC 및 TAF에 대한 약동학적 영향을 요약합니다. 표 12는 BIKTARVY 또는 그 구성 요소의 다른 약물에 대한 약동학적 영향을 요약합니다.
다른 약물의 BIKTARVY 성분에 대한 영향
| 동시 투여 약물 | 동시 투여 약물 용량 (mg) | BIC (mg) | BIC 약동학적 매개변수의 평균 비율 (90% CI); 효과 없음 = 1.00 | ||
|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||
| NA= 해당 없음 | |||||
| Ledipasvir/Sofosbuvir (식사 후) | 90/400 1일 1회 | 75 1일 1회 | 0.98 (0.94, 1.03) |
1.00 (0.97, 1.03) |
1.04 (0.99, 1.09) |
| 리파부틴 (공복) |
300 1일 1회 | 75 1일 1회 | 0.80 (0.67, 0.97) |
0.62 (0.53, 0.72) |
0.44 (0.37, 0.52) |
| 리팜핀 (식사 후) |
600 1일 1회 | 75 단일 용량 | 0.72 (0.67, 0.78) |
0.25 (0.22, 0.27) |
NA |
| Sofosbuvir/ velpatasvir/ voxilaprevir (식사 후) |
400/100/100+100 voxilaprevir† 1일 1회 | 50 1일 1회 | 0.98 (0.94, 1.01) |
1.07 (1.03, 1.10) |
1.10 (1.05, 1.17) |
| 보리코나졸 (공복) |
300 1일 2회 | 75 단일 용량 | 1.09 (0.96, 1.23) |
1.61 (1.41, 1.84) |
NA |
| 최대 강도 제산제 (동시 투여, 공복) |
20 mL‡ 단일 용량 (경구) | 50 단일 용량 | 0.20 (0.16, 0.24) |
0.21 (0.18, 0.26) |
NA |
| 최대 강도 제산제 (BIKTARVY 공복 후 2시간) |
20 mL‡ 단일 용량 (경구) | 50 단일 용량 | 0.93 (0.88, 1.00) |
0.87 (0.81, 0.93) |
NA |
| 최대 강도 제산제 (BIKTARVY 공복 전 2시간) |
20 mL‡ 단일 용량 (경구) | 50 단일 용량 | 0.42 (0.33, 0.52) |
0.48 (0.38, 0.59) |
NA |
| 최대 강도 제산제 (동시 투여, 식사 후§) |
20 mL‡ 단일 용량 (경구) | 50 단일 용량 | 0.51 (0.43, 0.62) |
0.53 (0.44, 0.64) |
NA |
| 탄산칼슘 (동시 투여, 공복) |
1200 단일 용량 | 50 단일 용량 | 0.58 (0.51, 0.67) |
0.67 (0.57, 0.78) |
NA |
| 탄산칼슘 (동시 투여, 식후§) |
1200 단일 용량 | 50 단일 용량 | 0.90 (0.78, 1.03) |
1.03 (0.89, 1.20) |
NA |
| 푸마르산 제일철 (동시 투여, 공복) |
324 단일 용량 | 50 단일 용량 | 0.29 (0.26, 0.33) |
0.37 (0.33, 0.42) |
NA |
| 푸마르산 제일철 (동시 투여, 식후§) |
324 단일 용량 | 50 단일 용량 | 0.75 (0.65, 0.87) |
0.84 (0.74, 0.95) |
NA |
| 동시 투여 약물 | 동시 투여 약물 용량 (mg) | 테노포비르 알라페나미드 (mg) | 테노포비르 알라페나미드 약동학적 매개변수의 평균 비율 (90% CI); 효과 없음 = 1.00 | ||
|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||
| NA= 해당 없음 | |||||
| 카르바마제핀 | 300 1일 2회 | 25 단일 용량† | 0.43 (0.36, 0.51) |
0.46 (0.40, 0.54) |
NA |
| 레디파스비어/소포스부비어 | 90/400 1일 1회 | 25 1일 1회 | 1.17 (1.00, 1.38) |
1.27 (1.19, 1.34) |
NA |
| 소포스부비어/벨파타스비어/복실라프레비어 | 400/100/100 +100 복실라프레비어‡ 1일 1회 | 25 1일 1회 | 1.28 (1.09, 1.51) |
1.57 (1.44, 1.71) |
NA |
BIKTARVY 성분의 다른 약물에 대한 영향
| 동시 투여 약물 | 동시 투여 약물 용량 (mg) | BIC (mg) | TAF (mg) | 동시 투여 약물 약동학적 매개변수의 평균 비율 (90% CI); 영향 없음 = 1.00 | ||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| NA= 해당 없음 | ||||||
| 레디파스비르 | 90/400 1일 1회 | 75 1일 1회 | 25 1일 1회 | 0.85 (0.81, 0.90) |
0.87 (0.83, 0.92) |
0.90 (0.84, 0.96) |
| 소포스부비르 | 1.11 (1.00, 1.24) |
1.07 (1.01, 1.13) |
NA | |||
| GS-331007† | 1.10 (1.07, 1.13) |
1.11 (1.08, 1.14) |
1.02 (0.99, 1.06) |
|||
| 메트포르민 | 500 1일 2회 | 50 1일 1회 | 25 1일 1회 | 1.28 (1.21, 1.36) |
1.39 (1.31, 1.48) |
1.36 (1.21, 1.53) |
| 미다졸람 | 2 단일 용량 | 50 1일 1회 | 25 1일 1회 | 1.03 (0.87, 1.23) |
1.15 (1.00, 1.31) |
NA |
| 노렐게스트로민 | 노르게스티메이트 0.180/0.215/0.250 1일 1회 / 에티닐 에스트라디올 0.025 1일 1회 | 75 1일 1회 | – | 1.23 (1.14, 1.32) |
1.08 (1.05, 1.10) |
1.10 (1.05, 1.15) |
| 노르게스트렐 | 1.15 (1.10, 1.21) |
1.13 (1.07, 1.19) |
1.14 (1.06, 1.22) |
|||
| 에티닐 에스트라디올 | 1.15 (1.03, 1.27) |
1.04 (0.99, 1.10) |
1.05 (0.95, 1.14) |
|||
| 노렐게스트로민 | 노르게스티메이트 0.180/0.215/0.250 1일 1회 / 에티닐 에스트라디올 0.025 1일 1회 | – | 25 1일 1회‡ | 1.17 (1.07,1.26) |
1.12 (1.07,1.17) |
1.16 (1.08, 1.24) |
| 노르게스트렐 | 1.10 (1.02, 1.18) |
1.09 (1.01, 1.18) |
1.11 (1.03, 1.20) |
|||
| 에티닐 에스트라디올 | 1.22 (1.15, 1.29) |
1.11 (1.07, 1.16) |
1.02 (0.92, 1.12) |
|||
| 세르탈린 | 50 단일 용량 | – | 10 1일 1회§ | 1.14 (0.94, 1.38) |
0.93 (0.77, 1.13) |
NA |
| 소포스부비르 | 400/100/100+100¶ 1일 1회 | 50 1일 1회 | 25 1일 1회 | 1.14 (1.04,1.25) |
1.09 (1.02, 1.15) |
NA |
| GS-331007† | 1.03 (0.99,1.06) |
1.03 (1.00,1.06) |
1.01 (0.98, 1.05) |
|||
| Velpatasvir | 0.96 (0.91,1.01) |
0.96 (0.90, 1.02) |
0.94 (0.88, 1.01) |
|||
| Voxilaprevir | 0.90 (0.76, 1.06) |
0.91 (0.80, 1.03) |
0.97 (0.88, 1.06) |
|||
12.4 미생물학
작용 기전
Bictegravir: BIC는 바이러스 복제에 필요한 HIV-1 암호화 효소인 HIV-1 인테그라제(인테그라제 가닥 전이 억제제; INSTI)의 가닥 전이 활성을 억제합니다. 인테그라제 억제는 선형 HIV-1 DNA가 숙주 게놈 DNA에 통합되는 것을 방지하여 HIV-1 프로바이러스 형성과 바이러스 전파를 차단합니다.
Emtricitabine: FTC는 시티딘의 합성 뉴클레오시드 유사체로, 세포 효소에 의해 인산화되어 emtricitabine 5′-triphosphate를 형성합니다. Emtricitabine 5′-triphosphate는 자연 기질인 deoxycytidine 5′-triphosphate와 경쟁하여 HIV-1 RT의 활성을 억제하고, 새로 생성된 바이러스 DNA에 통합되어 사슬 종결을 유발합니다. Emtricitabine 5′-triphosphate는 포유류 DNA 중합효소 α, β, Ɛ 및 미토콘드리아 DNA 중합효소 γ의 약한 억제제입니다.
Tenofovir Alafenamide: TAF는 테노포비르(2′-deoxyadenosine monophosphate 유사체)의 포스폰아미데이트 프로드럭입니다. TAF에 대한 혈장 노출은 세포 내 침투를 허용하고, 그 후 TAF는 카텝신 A에 의한 가수분해를 통해 세포 내에서 테노포비르로 전환됩니다. 테노포비르는 그 후 세포 키나아제에 의해 활성 대사체인 테노포비르 이인산염으로 인산화됩니다. 테노포비르 이인산염은 HIV RT에 의해 바이러스 DNA에 통합되어 DNA 사슬 종결을 유발하여 HIV-1 복제를 억제합니다. 테노포비르 이인산염은 미토콘드리아 DNA 중합효소 γ를 포함한 포유류 DNA 중합효소의 약한 억제제이며, 세포 배양에서 미토콘드리아에 대한 독성 증거는 없습니다.
세포 배양에서의 항바이러스 활성
BIC, FTC 및 TAF의 삼중 조합은 세포 배양에서 항바이러스 활성에 대해 길항적이지 않았습니다.
Bictegravir: BIC의 항바이러스 활성은 HIV-1의 실험실 및 임상 균주에 대해 림프모세포주, PBMC, 일차 단핵구/대식세포 및 CD4+ T 림프구에서 평가되었습니다. HIV-1 IIIB로 급성 감염된 MT-4 세포(인간 림프모세포 T 세포주)에서 평균 50% 효과 농도(EC50)는 2.4±0.4 nM이었고, 단백질 조정 EC95 값은 361 nM(0.162 마이크로그램/mL)이었습니다. BIC는 활성화된 PBMC에서 하위 유형 A, B, C, D, E, F 및 G를 포함한 그룹 M, N 및 O를 대표하는 HIV-1의 임상 균주에 대해 항바이러스 활성을 나타냈으며, 중간 EC50 값은 0.55 nM(범위 <0.05~1.71 nM)이었습니다. 단일 HIV-2 균주에 대한 EC50 값은 1.1 nM이었습니다.
Emtricitabine: FTC의 항바이러스 활성은 T 림프모세포주, MAGI-CCR5 세포주 및 PBMC에서 HIV-1의 실험실 및 임상 균주에 대해 평가되었습니다. HIV-1 하위 유형 A, B, C, D, E, F 및 G로 급성 감염된 PBMC에서 FTC의 중간 EC50 값은 9.5 nM(범위 1~30 nM)이었고, HIV-2에 대한 값은 7 nM이었습니다.
Tenofovir Alafenamide: TAF의 항바이러스 활성은 림프모세포주, PBMC, 일차 단핵구/대식세포 및 CD4-T 림프구에서 HIV-1 하위 유형 B의 실험실 및 임상 균주에 대해 평가되었습니다. TAF의 EC50 값은 2.0~14.7 nM 범위였습니다. TAF는 하위 유형 A, B, C, D, E, F 및 G를 포함한 모든 HIV-1 그룹(M, N, O)에 대해 세포 배양에서 항바이러스 활성을 나타냈으며(EC50 값은 0.1~12 nM 범위), HIV-2에 대해 균주 특이적 활성을 나타냈습니다(EC50 값은 0.9~2.6 nM 범위).
내성
세포 배양에서
Bictegravir: BIC에 대한 감수성이 감소된 HIV-1 균주는 세포 배양에서 선별되었습니다. BIC를 사용한 한 가지 선별에서 HIV-1 인테그라제에 아미노산 치환 M50I 및 R263K를 발현하는 바이러스 풀이 나타났습니다. M50I, R263K 및 M50I+R263K 치환은 부위 지정 돌연변이 유발을 통해 야생형 바이러스에 도입되었을 때 BIC에 대한 감수성이 각각 1.3배, 2.2배 및 2.9배 감소했습니다. 두 번째 선별에서 아미노산 치환 T66I 및 S153F의 출현이 감지되었으며, T66I, S153F 및 T66I+S153F에 대해 BIC 감수성이 각각 0.4배, 1.9배 및 0.5배 감소했습니다. 또한 선별 과정에서 S24G 및 E157K 치환이 나타났습니다.
임상 시험에서
항레트로바이러스 치료 경험이 없는 피험자: BIKTARVY를 투여받은 피험자(N=634)의 이중맹검 단계 144주차 또는 연장 단계 96주차(n=1025)까지 시험 1489 및 1490에서 기준선 및 치료 중 HIV-1 격리주에 대한 유전형 내성 분석의 풀링된 결과 [임상 연구(14.2) 참조]는 확인된 바이러스학적 실패 또는 조기 연구 약물 중단 시점에 HIV-1 RNA가 200 copies/mL 이상인 피험자에서 수행되었습니다. 최종 내성 분석 모집단에서 평가 가능한 유전형 내성 데이터가 있고 BIC에 대한 유전형 내성과의 연관성을 확립하지 못한 11명의 치료 실패 피험자에서 특정 아미노산 치환이 일관되게 나타나지 않았습니다. 평가된 11개의 치료 실패 격리주에서 치료로 인한 NRTI 내성 관련 치환이 발견되지 않았습니다. 실패 격리주의 표현형 내성 분석 결과, 야생형 참조 HIV-1과 비교하여 BIC, FTC 및 TFV에 대한 약물 감수성의 배수 변화가 생물학적 또는 임상적 기준치 미만으로 나타났습니다.
바이러스학적으로 억제된 성인 피험자: 바이러스학적으로 억제된 HIV-1 감염 피험자(n=572)에 대한 2개의 전환 시험인 시험 1844 및 1878에서 내성 분석 모집단에서 바이러스학적 재발이 발생한 피험자 중 IN 유전형 및 표현형 데이터가 있는 피험자는 1명뿐이었고, 2명의 재발 피험자는 RT 유전형 및 표현형 데이터가 있었습니다. BIC, FTC 또는 TAF에 대한 치료로 인한 유전형 또는 표현형 내성이 있는 HIV-1이 있는 피험자는 없었습니다. 시험 4030에서 BIKTARVY를 투여받은 피험자 중 BIC, FTC 또는 TAF에 대한 치료로 인한 표현형 내성이 있는 피험자는 없었습니다.
바이러스학적으로 억제된 소아 피험자: 시험 1474 [임상 연구(14.4) 참조]에서 코호트 1의 50명 피험자 중 2명은 48주차까지 내성 발생에 대해 평가되었으며, BIC, FTC 또는 TFV에 대한 내성과 관련된 것으로 알려진 아미노산 치환은 발견되지 않았습니다. 코호트 2 또는 3의 피험자는 24주차까지 내성 분석 기준을 충족하지 않았습니다.
교차 내성
Bictegravir: INSTI 간에 교차 내성이 관찰되었습니다. BIC의 감수성은 IAS-USA에서 나열된 알려진 INSTI 내성 관련 치환(단일 치환 20개, 2개 이상의 치환 44개)을 발현하는 64개의 임상 격리주에 대해 시험되었습니다. E92Q, T97A, Y143C/R, Q148R 및 N155H를 포함한 단일 INSTI 내성 치환이 있는 격리주는 BIC에 대한 감수성이 2배 미만으로 감소했습니다. BIC에 대한 감수성이 2.5배 이상 감소한(BIC에 대한 생물학적 기준치 이상) 모든 격리주(n=14)는 G140A/C/S 및 Q148H/R/K 치환을 포함했습니다. 대부분(64.3%, 9/14)은 추가 INSTI 내성 치환 L74M, T97A 또는 E138A/K가 있는 복잡한 INSTI 내성 패턴을 보였습니다. 추가 INSTI 내성 치환 없이 G140A/C/S 및 Q148H/R/K 치환을 포함하는 평가된 격리주 중 38.5%(5/13)는 2.5배 이상 감소를 보였습니다. 또한 G118R(돌루테그라비르 및 랄테그라비르 치료로 인한 치환) 및 G118R+T97A가 있는 부위 지정 돌연변이 바이러스는 BIC에 대한 감수성이 각각 3.4배 및 2.8배 감소했습니다.
BIC는 야생형 바이러스와 비교하여 NNRTI, NRTI 및 PI에 대한 내성과 관련된 치환을 발현하는 HIV-1 변이체에 대해 감수성이 2배 미만으로 감소하면서 동등한 항바이러스 활성을 보였습니다.
13. 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식능 저하
Bictegravir
BIC는 수컷의 경우 최대 100mg/kg/일, 암컷의 경우 최대 300mg/kg/일 용량으로 6개월 동안 rasH2 형질전환 마우스를 대상으로 실시한 연구에서 발암성을 나타내지 않았습니다. BIC는 최대 300mg/kg/일 용량으로 2년 동안 랫트를 대상으로 실시한 연구에서 발암성을 나타내지 않았으며, 이는 권장 용량의 BIKTARVY를 투여한 사람에서의 노출량의 약 31배에 해당하는 노출입니다.
BIC는 세균 역돌연변이 시험(에임즈 시험), 마우스 림프종 또는 랫트 소핵 시험에서 유전독성을 나타내지 않았습니다.
BIC는 권장 용량의 BIKTARVY를 투여한 사람에서의 노출량(AUC)보다 29배 높은 노출량에서 수컷과 암컷 랫트의 생식능, 생식 수행력 또는 배아 생존력에 영향을 미치지 않았습니다.
Emtricitabine
FTC의 장기 발암성 연구에서 마우스의 경우 최대 750mg/kg/일(권장 용량의 BIKTARVY를 투여한 사람에서의 전신 노출량의 25배) 또는 랫트의 경우 최대 600mg/kg/일(권장 용량의 BIKTARVY를 투여한 사람에서의 전신 노출량의 30배) 용량에서 약물 관련 종양 발생률 증가가 나타나지 않았습니다.
FTC는 세균 역돌연변이 시험(에임즈 시험), 마우스 림프종 또는 마우스 소핵 시험에서 유전독성을 나타내지 않았습니다.
FTC는 권장 용량의 BIKTARVY를 투여한 사람에서의 노출량(AUC)보다 수컷 랫트의 경우 약 140배, 수컷과 암컷 마우스의 경우 약 60배 높은 노출량에서 생식능에 영향을 미치지 않았습니다. 권장 용량의 BIKTARVY를 투여한 사람에서의 노출량(AUC)보다 약 60배 높은 일일 노출량에서 출생 전(자궁 내)부터 성적으로 성숙할 때까지 매일 노출된 마우스 새끼의 생식능은 정상이었습니다.
Tenofovir Alafenamide
TAF는 tenofovir로 빠르게 전환되고 TDF 투여 후 비해 TAF 투여 후 랫트와 마우스에서 더 낮은 tenofovir 노출이 관찰되었기 때문에 발암성 연구는 TDF로만 수행되었습니다. 마우스와 랫트에서 TDF의 장기 경구 발암성 연구는 300mg 용량의 TDF를 투여한 후 사람에서 관찰된 것보다 약 10배(마우스) 및 4배(랫트) 높은 노출량에서 수행되었습니다. 이러한 연구에서 tenofovir 노출은 권장 용량의 BIKTARVY를 투여한 후 사람에서 관찰된 것보다 약 151배(마우스) 및 51배(랫트) 높았습니다. 암컷 마우스의 경우 고용량에서 권장 용량의 BIKTARVY를 투여한 사람에서 관찰된 노출량의 약 151배에 해당하는 tenofovir 노출량에서 간 선종이 증가했습니다. 랫트의 경우 이 연구에서 발암성 소견은 나타나지 않았습니다.
TAF는 세균 역돌연변이 시험(에임즈 시험), 마우스 림프종 또는 랫트 소핵 시험에서 유전독성을 나타내지 않았습니다.
교배 전 28일 동안 체표면적 비교를 기준으로 BIKTARVY 사람 용량의 155배에 해당하는 용량을 수컷 랫트에 투여하고 교배 전 14일부터 임신 7일까지 암컷 랫트에 투여했을 때 생식능, 교배 수행력 또는 초기 배아 발달에 미치는 영향은 없었습니다.
13.2 동물 독성학 및/또는 약리학
TAF를 3개월 및 9개월 동안 투여한 후 유사한 중증도로 개에서 후포도막에 단핵 세포의 미세한 침윤에서 경미한 침윤이 관찰되었습니다. 3개월 회복 기간 후 회복 가능성이 나타났습니다. 권장 용량의 BIKTARVY를 투여한 사람에서 나타나는 노출량의 7배(TAF) 및 14배(tenofovir)에 해당하는 전신 노출량에서 개에서 안 독성은 관찰되지 않았습니다.
14건의 임상 연구
14.1 임상 시험 설명
BIKTARVY의 효능 및 안전성은 표 13에 요약된 시험에서 평가되었습니다.
| 시험 | 모집단 | 시험군 (N) | 시점 (주) |
|---|---|---|---|
| OLE = 공개 표지 연장 | |||
|
|||
| 시험 1489* (NCT 02607930) |
항레트로바이러스 치료 경험이 없는 성인 | BIKTARVY (314) ABC/DTG/3TC (315) |
144 + 96 (OLE)† |
| 시험 1490* (NCT 02607956) |
BIKTARVY (320) DTG + FTC/TAF(325) |
144 + 96 (OLE)† | |
| 시험 1844* (NCT 02603120) |
바이러스학적으로 억제된‡ 성인 | BIKTARVY (282) ABC/DTG/3TC (281) |
48 |
| 시험 1878§ (NCT 02603107) |
BIKTARVY (290) ATV 또는 DRV (코비시스타트 또는 리토나비어와 함께) 플러스 FTC/TDF 또는 ABC/3TC (287) |
48 | |
| 시험 4030* (NCT 03110380) |
BIKTARVY (284 [M184V/I가 있는 47명]) DTG 플러스 FTC/TAF (281 [M184V/I가 있는 34명]) |
48 | |
| 시험 1825¶ (NCT 02600819) |
바이러스학적으로 억제된‡ 만성 혈액 투석을 받는 ESRD# 성인 | 고정 용량 조합으로 엘비테그라비어 및 코비시스타트와 함께 FTC+TAF (55). 시험 1825의 연장 단계에서 바이러스학적으로 억제된 10명의 피험자가 BIKTARVY로 전환되었습니다. | 48Þ |
| 시험 4449¶ (NCT 03405935) |
바이러스학적으로 억제된‡ 65세 이상 성인 | BIKTARVY (86) | 48 |
| 시험 1474¶ (코호트 1) (NCT 02881320) |
바이러스학적으로 억제된‡ 12세 이상 18세 미만 청소년 (체중 35kg 이상) | BIKTARVY (50) | 48 |
| 시험 1474¶ (코호트 2) (NCT 02881320) |
바이러스학적으로 억제된‡ 6세 이상 12세 미만 어린이 (체중 25kg 이상) | BIKTARVY (50) | 24 |
| 시험 1474¶ (코호트 3) (NCT 02881320) |
바이러스학적으로 억제된‡ 2세 이상 어린이 (체중 14kg 이상 25kg 미만) | BIKTARVY (22) | 24 |
14.2 HIV-1 감염 성인 대상 항레트로바이러스 치료 경험이 없는 환자에서의 임상 시험 결과
1489번 시험에서 성인 환자들은 BIKTARVY(BIC 50mg, FTC 200mg, TAF 25mg 함유)(N=314) 또는 ABC/DTG/3TC(600mg/50mg/300mg)(N=315)를 1일 1회 투여받도록 1:1 비율로 무작위 배정되었습니다. 1490번 시험에서 피험자들은 BIKTARVY(N=320) 또는 DTG + FTC/TAF(50mg + 200mg/25mg)(N=325)를 1일 1회 투여받도록 1:1 비율로 무작위 배정되었습니다.
1489번 시험에서 평균 연령은 34세(범위 18–71세)였으며, 남성이 90%, 백인이 57%, 흑인이 36%, 아시아인이 3%였습니다. 환자의 22%는 히스패닉/라틴계로 확인되었습니다. 기준선 플라즈마 HIV-1 RNA 평균은 4.4 log10 copies/mL(범위 1.3–6.5)였습니다. 기준선 CD4+ 세포 수 평균은 464 cells per mm3(범위 0–1424)였으며, 11%는 CD4+ 세포 수가 200 cells per mm3 미만이었습니다. 피험자의 16%는 기준선 바이러스 부하가 100,000 copies per mL 초과였습니다.
1490번 시험에서 평균 연령은 37세(범위 18–77세)였으며, 남성이 88%, 백인이 59%, 흑인이 31%, 아시아인이 3%였습니다. 환자의 25%는 히스패닉/라틴계로 확인되었습니다. 기준선 플라즈마 HIV-1 RNA 평균은 4.4 log10 copies/mL(범위 2.3–6.6)였습니다. 기준선 CD4+ 세포 수 평균은 456 cells per mm3(범위 2–1636)였으며, 12%는 CD4+ 세포 수가 200 cells per mm3 미만이었습니다. 피험자의 19%는 기준선 바이러스 부하가 100,000 copies per mL 초과였습니다.
두 시험 모두에서 피험자들은 기준선 HIV-1 RNA(100,000 copies per mL 이하, 100,000 copies per mL 초과 ~ 400,000 copies per mL 이하 또는 400,000 copies per mL 초과), CD4 수(50 cells per mm3 미만, 50–199 cells per mm3 또는 200 cells per mm3 이상), 지역(미국 또는 미국 외)에 따라 계층화되었습니다.
1489번 및 1490번 시험의 144주차까지 치료 결과는 표 14에 제시되어 있습니다.
| 1489번 시험 | 1490번 시험 | |||
|---|---|---|---|---|
| BIKTARVY (N=314) |
ABC/DTG/3TC (N=315) |
BIKTARVY (N=320) |
DTG + FTC/TAF (N=325) |
|
|
||||
| HIV-1 RNA < 50 copies/mL | 82% | 84% | 82% | 84% |
| 치료 차이(95% CI) BIKTARVY 대비 비교약 | -2.6% (-8.5% to 3.4%) | -1.9% (-7.8% to 3.9%) | ||
| HIV-1 RNA ≥ 50 copies/mL† | 1% | 3% | 5% | 3% |
| 144주차 기간 동안 바이러스학적 데이터 없음 | 18% | 13% | 13% | 13% |
| AE 또는 사망으로 인해 연구 약물 중단‡ | 1% | 2% | 3% | 3% |
| 다른 이유로 연구 약물 중단 및 마지막으로 이용 가능한 HIV-1 RNA <50 copies/mL§ | 16% | 11% | 11% | 9% |
| 기간 동안 데이터 누락되었지만 연구 약물 복용 중 | 1% | <1% | 0% | 1% |
나이, 성별, 인종, 기준 바이러스 부하 및 기준 CD4+ 세포 수에 따른 하위 그룹에서 치료 결과는 유사했습니다.
시험 1489 및 1490에서, 144주차에 기준 대비 CD4+ 수의 평균 증가는 각각 BIKTARVY 및 ABC/DTG/3TC 그룹에서 299 및 317 세포/mm3이었고, 각각 BIKTARVY 및 DTG + FTC/TAF 그룹에서 278 및 289 세포/mm3이었습니다.
14.3 바이러스학적으로 억제된 HIV-1 성인에서 BIKTARVY로 전환한 임상 시험 결과
시험 1844에서, 바이러스학적으로 억제된(HIV-1 RNA 50 사본/mL 미만) HIV-1 감염 성인(N=563, 무작위 배정 및 투약)에서 DTG + ABC/3TC 또는 ABC/DTG/3TC 요법에서 BIKTARVY로 전환한 경우의 효능 및 안전성을 무작위 배정 이중맹검 시험에서 평가했습니다. 피험자는 시험 참여 전 최소 3개월 동안 기준 요법에서 안정적으로 억제(HIV-1 RNA 50 사본/mL 미만)되어야 했으며, 치료 실패의 병력이 없어야 했습니다. 피험자는 기준선에서 BIKTARVY(BIC 50mg, FTC 200mg 및 TAF 25mg 함유)(N=282)로 전환하거나 기준 항레트로바이러스 요법을 유지(N=281)하도록 1:1 비율로 무작위 배정되었습니다. 피험자의 평균 연령은 45세(범위 20~71세)였으며, 89%가 남성, 73%가 백인, 22%가 흑인이었습니다. 17%의 피험자가 히스패닉/라틴계로 확인되었습니다. 기준 CD4+ 세포 수의 평균은 723 세포/mm3(범위 124~2444)이었습니다.
시험 1878에서, 바이러스학적으로 억제된 HIV-1 감염 성인(N=577, 무작위 배정 및 투약)에서 ABC/3TC 또는 FTC/TDF(200/300mg) 플러스 ATV 또는 DRV(코비시스타트 또는 리토나비르와 함께 투여)에서 BIKTARVY(BIC 50mg, FTC 200mg 및 TAF 25mg 함유)로 전환한 경우의 효능 및 안전성을 무작위 배정 공개 표지 연구에서 평가했습니다. 피험자는 최소 6개월 동안 기준 요법에서 안정적으로 억제되어야 했으며, 이전에 어떤 INSTI로도 치료받은 적이 없어야 했으며, 치료 실패의 병력이 없어야 했습니다. 피험자는 BIKTARVY(N=290)로 전환하거나 기준 항레트로바이러스 요법을 유지(N=287)하도록 1:1 비율로 무작위 배정되었습니다. 피험자의 평균 연령은 46세(범위 20~79세)였으며, 83%가 남성, 66%가 백인, 26%가 흑인이었습니다. 19%의 피험자가 히스패닉/라틴계로 확인되었습니다. 기준 CD4+ 세포 수의 평균은 663 세포/mm3(범위 62~2582)이었습니다. 피험자는 이전 치료 요법에 따라 계층화되었습니다. 선별 시, 15%의 피험자가 ABC/3TC 플러스 ATV 또는 DRV(코비시스타트 또는 리토나비르와 함께 투여)를 받았고, 85%의 피험자가 FTC/TDF 플러스 ATV 또는 DRV(코비시스타트 또는 리토나비르와 함께 투여)를 받았습니다.
48주차까지 시험 1844 및 1878의 치료 결과는 표 15에 제시되어 있습니다.
| 시험 1844 | 시험 1878 | |||
|---|---|---|---|---|
| BIKTARVY (N=282) |
ABC/DTG/3TC (N=281) |
BIKTARVY (N=290) |
ATV- 또는 DRV-기반 요법† (N=287) |
|
|
||||
| HIV-1 RNA ≥ 50 사본/mL‡ | 1% | <1% | 2% | 2% |
| 치료 차이(95% CI) | 0.7%(-1.0%~2.8%) | 0.0%(-2.5%~2.5%) | ||
| HIV-1 RNA < 50 사본/mL | 94% | 95% | 92% | 89% |
| 48주차 기간에 바이러스학적 데이터 없음 | 5% | 5% | 6% | 9% |
| AE 또는 사망으로 인해 연구 약물 중단 및 마지막으로 이용 가능한 HIV-1 RNA < 50 사본/mL | 2% | 1% | 1% | 1% |
| 다른 이유로 연구 약물 중단 및 마지막으로 이용 가능한 HIV-1 RNA < 50 사본/mL§ | 2% | 3% | 3% | 7% |
| 기간 동안 데이터 누락되었지만 연구 약물 복용 중 | 2% | 1% | 2% | 2% |
시험 1844에서, 치료군 간의 치료 결과는 연령, 성별, 인종 및 지역별 하위 그룹에서 유사했습니다. 48주차에 기준선에서 CD4+ 세포 수의 평균 변화는 BIKTARVY로 전환한 피험자에서 -31세포/mm3이고 ABC/DTG/3TC를 유지한 피험자에서 4세포/mm3이었습니다.
시험 1878에서, 치료군 간의 치료 결과는 연령, 성별, 인종 및 지역별 하위 그룹에서 유사했습니다. 48주차에 기준선에서 CD4+ 세포 수의 평균 변화는 BIKTARVY로 전환한 환자에서 25세포/mm3이고 기준선 요법을 유지한 환자에서 0세포/mm3이었습니다.
시험 4030에서, 바이러스 억제된 HIV-1 감염 성인에서 DTG와 FTC/TAF 또는 FTC/TDF 중 하나를 BIKTARVY(BIC 50mg, FTC 200mg, TAF 25mg 함유)로 전환하는 효능과 안전성을 무작위 배정, 이중 맹검 연구에서 평가했습니다. 피험자는 기준선 요법에서 최소 6개월(문서화 또는 의심되는 NRTI 내성이 있는 경우) 또는 최소 3개월(문서화 또는 의심되는 NRTI 내성이 없는 경우) 동안 안정적으로 억제(HIV-1 RNA 50사본/mL 미만)되어야 시험에 참여할 수 있었습니다. 피험자는 BIKTARVY로 전환(N=284)하거나 기존 치료 요법인 DTG+F/TAF(N=281)를 계속하도록 무작위 배정되었습니다. 주요 종료점은 48주차에 HIV-1 RNA ≥ 50사본/mL인 피험자의 비율이었습니다. 48주차에 HIV-1 RNA ≥ 50사본/mL인 피험자의 비율은 BIKTARVY군에서 0.4%(1/284)이고 DTG+F/TAF군에서 1.1%(3/281)이었습니다(차이 -0.7%[95%CI: -2.8%, 1.0%]).
BIKTARVY를 투여받은 피험자 중 47명은 HIV-1 RT에서 기존의 M184V 또는 I 내성 치환(M184M/V, M184M/I, M184V/I, M184V)이 있는 HIV-1을 가지고 있었습니다. M184V 또는 I가 있는 피험자의 89%(42/47)는 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했고 11%(5/47명)는 연구 약물 중단으로 인해 48주차에 바이러스학적 데이터가 없었습니다.
시험 1825는 개방 표지 단일 군 시험으로, FTC와 TAF(BIKTARVY의 구성 요소)의 효능, 안전성 및 약동학을 만성 혈액 투석을 받는 ESRD(추정 크레아티닌 청소율 15mL/min 미만)가 있는 바이러스 억제된 성인에서 96주 동안 FTC+TAF를 엘비테그라비르와 코비시스타트와 함께 고정 용량 복합제 정제로 투여하여 평가했습니다(N=55). 시험 1825의 연장 단계에서, 바이러스 억제된 10명의 피험자가 BIKTARVY로 전환했고 모든 피험자는 48주 동안 바이러스 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했습니다.
시험 4449에서, 안정적인 항레트로바이러스 요법에서 BIKTARVY(BIC 50mg, FTC 200mg, TAF 25mg 함유)로 전환하는 효능과 안전성을 바이러스 억제된(HIV-1 RNA 50사본/mL 미만) HIV-1 감염 성인(65세 이상)(N=86)을 대상으로 한 개방 표지 단일 군 시험에서 평가했습니다. BIKTARVY로 치료받은 피험자의 평균 연령은 70세(범위: 65~80)였습니다. 주요 종료점은 48주차에 HIV RNA > 50사본/mL인 피험자의 비율이었습니다. HIV RNA > 50사본/mL인 피험자는 없었습니다. 48주차에 피험자의 91%(78/86)는 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했습니다. 8명의 피험자는 중단 또는 데이터 누락으로 인해 48주차에 바이러스학적 데이터가 없었습니다.
14.4 HIV-1 감염 소아 피험자에서의 임상 시험 결과
시험 1474는 개방 표지 단일 군 시험으로, HIV-1 감염 소아 피험자에서 BIKTARVY의 효능, 안전성 및 약동학을 바이러스 억제된 청소년(12세 이상 18세 미만, 체중 35kg 이상)(N=50), 바이러스 억제된 어린이(6세 이상 12세 미만, 체중 25kg 이상)(N=50) 및 바이러스 억제된 어린이(2세 이상, 체중 14kg 이상 25kg 미만)(N=22)에서 평가했습니다.
코호트 1: 바이러스 억제된 청소년(12세 이상 18세 미만; 체중 35kg 이상)
코호트 1에서 BIKTARVY(BIC 50mg, FTC 200mg, TAF 25mg 함유)를 1일 1회 투여받은 피험자의 평균 연령은 14세(범위: 12~17)이고 기준선 체중의 평균은 51.7kg(범위: 35~123)이었으며, 여성이 64%, 아시아인이 27%, 흑인이 65%였습니다. 기준선에서 CD4+ 세포 수의 중앙값은 750세포/mm3(범위: 337~1207)이고 CD4+%의 중앙값은 33%(범위: 19%~45%)였습니다.
BIKTARVY로 전환한 후, 코호트 1의 피험자 98%(49/50)는 48주차에 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했습니다. 48주차에 기준선에서 CD4+ 세포 수의 평균 변화는 -22세포/mm3이었습니다.
코호트 2: 바이러스 억제된 어린이(6세 이상 12세 미만; 체중 25kg 이상)
코호트 2에서 BIKTARVY를 1일 1회 투여받은 피험자의 평균 연령은 10세(범위: 6~11)이고 기준선 체중의 평균은 31.9kg(범위: 25~69)이었으며, 여성이 54%, 아시아인이 22%, 흑인이 72%였습니다. 기준선에서 CD4+ 세포 수의 중앙값은 898세포/mm3(범위: 390~1991)이고 CD4+%의 중앙값은 37%(범위: 19%~53%)였습니다.
BIKTARVY(BIC 50mg, FTC 200mg, TAF 25mg 함유)로 전환한 후, 코호트 2의 피험자 100%(50/50)는 24주차에 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했습니다. 24주차에 기준선에서 CD4+ 세포 수의 평균 변화는 -24세포/mm3이었습니다.
코호트 3: 바이러스 억제된 어린이(2세 이상; 체중 14kg 이상 25kg 미만)
코호트 3에서 BIKTARVY(BIC 30mg, FTC 120mg, TAF 15mg 함유)를 1일 1회 투여받은 피험자의 평균 연령은 5세(범위: 3~9)이고 기준선 체중의 평균은 18.8kg(범위: 14~24)이었으며, 여성이 50%, 아시아인이 23%, 흑인이 73%였습니다. 기준선에서 CD4+ 세포 수(SD)의 평균은 1104(440)이고 CD4%(SD)의 평균은 33.4%(6.0%)였습니다.
BIKTARVY로 전환한 후, 코호트 3의 피험자 91%(20/22)는 24주차에 억제된 상태(HIV-1 RNA < 50사본/mL)를 유지했습니다. COVID-19 팬데믹 관련 연구 중단으로 인해 2명의 피험자는 24주차에 HIV-1 RNA를 수집하지 못했습니다. 기준선에서 24주차까지 CD4+ 세포 수(SD)의 평균 변화는 -126(264.2)세포/mm3이고 기준선에서 24주차까지 CD4%(SD)의 평균 변화는 0.2%(4.4%)였습니다.
16 공급 형태/보관 및 취급
BIKTARVY 정제는 병 및 블리스터 팩으로 제공됩니다.
병
- 50mg/200mg/25mg 정제는 각각 bictegravir(BIC) 50mg, emtricitabine(FTC) 200mg, tenofovir alafenamide(TAF) 25mg을 함유하고 있습니다. 이 정제는 자줏빛을 띤 갈색의 캡슐 모양이며, 필름 코팅되어 있고 한쪽 면에는 “GSI”, 다른 면에는 “9883”이 새겨져 있습니다(NDC 61958-2501-1).
- 30mg/120mg/15mg 정제는 각각 BIC 30mg, FTC 120mg, TAF 15mg을 함유하고 있습니다. 이 정제는 분홍색의 캡슐 모양이며, 필름 코팅되어 있고 한쪽 면에는 “GSI”, 다른 면에는 “B”가 새겨져 있습니다(NDC 61958-2505-1).
각 병에는 30정과 실리카겔 건조제, 폴리에스터 코일이 들어 있으며 어린이 보호용 뚜껑으로 닫혀 있습니다. 건조제 패킷은 제거하지 마십시오.
블리스터 팩
- 50mg/200mg/25mg 정제는 각각 BIC 50mg, FTC 200mg, TAF 25mg을 함유하고 있습니다. 이 정제는 자줏빛을 띤 갈색의 캡슐 모양이며, 필름 코팅되어 있고 한쪽 면에는 “GSI”, 다른 면에는 “9883”이 새겨져 있습니다(NDC 61958-2501-3).
각 블리스터 팩에는 30정(7정이 들어 있는 스트립 4개와 2정이 들어 있는 스트립 1개)이 들어 있습니다. 블리스터 팩은 어린이 보호용 라미네이트 호일 리딩 재질(벗겨서 미는 방식)로 밀봉되어 있으며, 각 블리스터 공간에는 호일 리딩 재질에 열 접착된 다이컷 건조 필름이 들어 있습니다.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨(환자 정보)을 읽도록 지시하십시오.
HBV 동시 감염 환자의 치료 후 급성 B형 간염 악화
HBV와 HIV-1에 동시 감염된 환자에서 FTC 및/또는 TDF를 함유한 제품을 중단한 후 B형 간염의 심각한 급성 악화가 보고되었으며, BIKTARVY 중단 시에도 마찬가지로 발생할 수 있습니다 [경고 및 주의 사항 (5.1) 참조]. 환자에게 의료 서비스 제공자에게 알리지 않고 BIKTARVY를 중단하지 않도록 지시하십시오.
약물 상호 작용
BIKTARVY는 특정 약물과 상호 작용할 수 있으므로 환자에게 다른 처방약 또는 일반 의약품 또는 약초 제품(예: 세인트 존스 워트)의 사용을 의료 서비스 제공자에게 보고하도록 지시하십시오 [금기 사항 (4) 및 약물 상호 작용 (7) 참조].
면역 재구성 증후군
환자에게 감염 증상이 나타나면 즉시 의료 서비스 제공자에게 알리도록 지시하십시오. 왜냐하면 진행된 HIV 감염(AIDS)이 있는 일부 환자의 경우 항 HIV 치료를 시작한 직후 이전 감염으로 인한 염증의 징후와 증상이 나타날 수 있기 때문입니다 [경고 및 주의 사항 (5.3) 참조].
신장 장애
환자에게 신독성 약물을 동시에 또는 최근에 사용한 경우 BIKTARVY를 복용하지 않도록 지시하십시오. 시판 후 신장 장애(급성 신부전 포함)가 보고되었습니다 [경고 및 주의 사항 (5.4) 참조].
젖산 산증 및 심각한 간 비대
BIKTARVY와 유사한 약물을 사용한 경우 젖산 산증 및 지방증을 동반한 심각한 간 비대(치명적인 경우 포함)가 보고되었습니다. 환자에게 젖산 산증 또는 뚜렷한 간 독성을 시사하는 임상 증상이 나타나면 BIKTARVY를 중단해야 한다고 알리십시오 [경고 및 주의 사항 (5.5) 참조].
복용량 누락
환자에게 음식과 함께 또는 음식 없이 정기적인 복용 일정으로 BIKTARVY를 복용하고 복용량을 누락하지 않는 것이 중요하다고 알리십시오. 복용량을 누락하면 내성이 생길 수 있습니다 [복용량 및 투여 (2.2) 참조].
정제 분할
보호자에게 전체 정제를 삼킬 수 없는 어린이의 경우 정제를 분할하여 각 부분을 별도로 복용할 수 있지만 모든 부분을 약 10분 이내에 섭취해야 한다고 알리십시오 [복용량 및 투여 (2.3) 참조].
수유
HIV-1 감염자에게 모유 수유의 잠재적 위험은 다음과 같다고 알리십시오. (1) HIV-1 음성 영아에게 HIV-1 전염, (2) HIV-1 양성 영아에서 바이러스 내성 발생, (3) 성인에게서 나타나는 것과 유사한 모유 수유 영아의 부작용 [특정 집단에서의 사용 (8.2) 참조].
SPL 분류되지 않은 섹션
BIKTARVY는 Gilead Sciences, Inc. 또는 그 관련 회사의 상표입니다. 여기에 언급된 다른 모든 상표는 해당 소유자의 자산입니다.
© 2024 Gilead Sciences, Inc. 판권 소유.
환자용 요약 정보
| 환자 정보 BIKTARVY® (빅타비) (비크테그라비어, 엠트리시타빈, 및 테노포비어 알라페나미드) 정제 |
|
|---|---|
| 본 환자 정보는 미국 식품의약국에서 승인되었습니다. | 개정: 2024년 4월 |
| 중요: 의료 서비스 제공자 또는 약사에게 BIKTARVY와 함께 복용해서는 안 되는 약물에 대해 문의하십시오. 자세한 내용은 “BIKTARVY를 복용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까?“를 참조하십시오. | |
| BIKTARVY는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. | |
|
|
| 부작용에 대한 자세한 내용은 “BIKTARVY의 가능한 부작용은 무엇입니까?“를 참조하십시오. | |
| BIKTARVY는 무엇입니까? BIKTARVY는 다른 인간 면역 결핍 바이러스-1(HIV-1) 약물 없이 성인 및 체중이 31파운드(14kg) 이상인 어린이의 HIV-1 감염 치료에 사용되는 처방약입니다. |
|
|
|
| HIV-1은 후천성 면역 결핍 증후군(AIDS)을 유발하는 바이러스입니다. BIKTARVY는 비크테그라비어, 엠트리시타빈 및 테노포비어 알라페나미드 약물을 함유하고 있습니다. 체중이 31파운드(14kg) 미만인 어린이에게 BIKTARVY가 안전하고 효과적인지 여부는 알려져 있지 않습니다. |
|
| 다음을 포함하는 약물을 복용하는 경우 BIKTARVY를 복용하지 마십시오. | |
|
|
|
BIKTARVY를 복용하기 전에 의료 서비스 제공자에게 무엇을 알려야 합니까? |
|
복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. 여기에는 처방약과 일반 의약품, 제산제, 완하제, 비타민 및 허브 보충제가 포함됩니다.
|
|
BIKTARVY는 어떻게 복용해야 합니까?
|
|
| BIKTARVY는 다음을 포함한 심각한 부작용을 유발할 수 있습니다. | |
|
|
| BIKTARVY의 가장 흔한 부작용은 설사, 메스꺼움 및 두통입니다. | |
| 이것들은 BIKTARVY의 가능한 모든 부작용이 아닙니다. | |
| 부작용에 대한 의학적 조언은 의사에게 문의하십시오. FDA에 부작용을 보고할 수 있습니다. 1-800-FDA-1088. | |
BIKTARVY는 어떻게 보관해야 합니까?
|
|
| BIKTARVY와 모든 의약품을 어린이의 손이 닿지 않는 곳에 보관하십시오. | |
| BIKTARVY의 안전하고 효과적인 사용에 대한 일반 정보. | |
| 의약품은 때때로 환자 정보 책자에 나열된 목적 이외의 목적으로 처방됩니다. BIKTARVY는 처방되지 않은 질환에 사용하지 마십시오. BIKTARVY를 다른 사람에게 주지 마십시오. 증상이 같더라도 다른 사람에게 해를 끼칠 수 있습니다. 자세한 내용은 의료 서비스 제공자와 상담하십시오. 의료 서비스 제공자 또는 약사에게 의료 전문가를 위해 작성된 BIKTARVY에 대한 정보를 요청할 수 있습니다. | |
| BIKTARVY의 성분은 무엇입니까? | |
| 활성 성분: bictegravir, emtricitabine, and tenofovir alafenamide. | |
| 비활성 성분: croscarmellose sodium, magnesium stearate, and microcrystalline cellulose. | |
| 정제는 검은색 산화철, 붉은색 산화철, 폴리에틸렌 글리콜, 폴리비닐 알코올, 활석 및 이산화티탄을 함유한 코팅 재료로 필름 코팅되어 있습니다. | |
| 제조 및 유통: Gilead Sciences, Inc. Foster City, CA 94404 | |
| BIKTARVY는 Gilead Sciences, Inc. 또는 관련 회사의 상표입니다. 여기에 언급된 다른 모든 상표는 해당 소유자의 재산입니다. | |
| © 2024 Gilead Sciences, Inc. 판권 소유. 210251-GS-013 | |
| 자세한 내용은 1-800-445-3235로 전화하거나 www.BIKTARVY.com을 방문하십시오. | |
주요 디스플레이 패널 – 50 mg/200 mg/25 mg 정제 병 라벨
NDC 61958-2501-1
30 정제
바이크타르비 ®
(비크테그라비르 나트륨, 엠티리시타빈, 그리고
테노포비르 알라페나마이드) 정제
50 mg /200 mg /25 mg
약사에게 주의:
알림 상자를 약국 라벨로 덮지 마십시오.
주의: 바이크타르비와 함께 복용해서는 안 되는 약물에 대해 알아보세요.

주요 디스플레이 패널 – 30 mg/120 mg/15 mg 정제 병 라벨
NDC 61958-2505-1
30 정
바이크타르비®
(비크테그라비르 나트륨, 엠티리시타빈, 테노포비르 알라페나미드 후마레이트) 정
30 mg / 120 mg / 15 mg
약사에게 유의사항:
알림 상자를 약국 라벨로 가리지 마십시오.
경고: 바이크타르비와 함께 복용해서는 안 되는 약물에 대해 알아보세요.


