의약품 제조업체: E.R. Squibb & Sons, L.L.C. (Updated: 2024-03-06)
처방 정보 주요 내용
OPDIVO® (니볼루맙) 주사, 정맥 주사용
미국 최초 승인: 2014
처방 정보 주요 사항
OPDIVO는 프로그램 세포 사멸 수용체-1(PD-1) 차단 항체로 다음 질환의 치료에 사용됩니다.
흑색종
- •
- 불수술 가능 또는 전이성 흑색종 성인 및 소아(12세 이상) 환자에게 단독 요법 또는 이필리무맙과 병용 요법으로 사용됩니다. (1.1)
- •
- 완전히 절제된 IIB기, IIC기, III기 또는 IV기 흑색종 성인 및 소아(12세 이상) 환자의 보조 요법으로 사용됩니다. (1.2)
비소세포폐암(NSCLC)
- •
- 수술 가능(종양 ≥4cm 또는 림프절 양성) 비소세포폐암 성인 환자에게 백금 이중 요법과 병용하여 신보조 요법으로 사용됩니다. (1.3)
- •
- FDA 승인 검사에서 PD-L1(≥1%) 발현이 확인된 전이성 비소세포폐암 성인 환자에게 EGFR 또는 ALK 유전체 종양 변이가 없는 경우 이필리무맙과 병용하여 1차 치료제로 사용됩니다. (1.4)
- •
- EGFR 또는 ALK 유전체 종양 변이가 없는 전이성 또는 재발성 비소세포폐암 성인 환자에게 이필리무맙과 백금 이중 요법 2주기와 병용하여 1차 치료제로 사용됩니다. (1.4)
- •
- 백금 기반 화학 요법 후 진행된 전이성 비소세포폐암 성인 환자에게 사용됩니다. EGFR 또는 ALK 유전체 종양 변이가 있는 환자는 OPDIVO를 투여하기 전에 해당 변이에 대한 FDA 승인 치료제로 질병이 진행되어야 합니다. (1.4)
악성 흉막 중피종
- •
- 불수술 가능 악성 흉막 중피종 성인 환자에게 이필리무맙과 병용하여 1차 치료제로 사용됩니다. (1.5)
신세포암(RCC)
- •
- 중간 위험 또는 고위험 진행성 신세포암 성인 환자에게 이필리무맙과 병용하여 1차 치료제로 사용됩니다. (1.6)
- •
- 진행성 신세포암 성인 환자에게 카보잔티닙과 병용하여 1차 치료제로 사용됩니다. (1.6)
- •
- 이전에 항혈관 생성 요법을 받은 진행성 신세포암 성인 환자에게 사용됩니다. (1.6)
고전적 호지킨 림프종(cHL)
- •
- 다음 치료 후 재발 또는 진행된 고전적 호지킨 림프종 성인 환자에게 사용됩니다. a: (1.7)
- •
- 자가 조혈 줄기 세포 이식(HSCT) 및 브렌툭시맙 베도틴, 또는
- •
- 자가 HSCT를 포함한 3회 이상의 전신 요법.
두경부 편평 세포암(SCCHN)
- •
- 백금 기반 요법 후 질병이 진행된 재발성 또는 전이성 두경부 편평 세포암 성인 환자에게 사용됩니다. (1.8)
요로 상피암
- •
- 요로 상피암(UC)의 근치적 절제술 후 재발 위험이 높은 성인 환자의 보조 요법으로 사용됩니다. (1.9)
- •
- 불수술 가능 또는 전이성 요로 상피암 성인 환자에게 시스플라틴 및 젬시타빈과 병용하여 1차 치료제로 사용됩니다. (1.9)
- •
- 다음과 같은 국소 진행성 또는 전이성 요로 상피암 성인 환자에게 사용됩니다.
- •
- 백금 함유 화학 요법 중 또는 후에 질병이 진행된 경우.
- •
- 백금 함유 화학 요법으로 신보조 또는 보조 치료를 받은 후 12개월 이내에 질병이 진행된 경우. (1.9)
대장암
- •
- 마이크로 위성 불안정성이 높은(MSI-H) 또는 불일치 복구 결손(dMMR) 전이성 대장암 성인 및 소아(12세 이상) 환자에게 플루오로피리미딘, 옥살리플라틴 및 이리노테칸으로 치료 후 질병이 진행된 경우 단독 요법 또는 이필리무맙과 병용 요법으로 사용됩니다. a (1.10)
간세포암(HCC)
- •
- 이전에 소라페닙으로 치료받은 간세포암 성인 환자에게 이필리무맙과 병용 요법으로 사용됩니다. a (1.11)
식도암
- •
- 신보조 화학 방사선 요법(CRT)을 받은 식도암 또는 위식도 접합부암이 완전히 절제된 성인 환자에게 잔여 병리학적 질환이 있는 경우 사용됩니다. (1.12)
- •
- 불수술 가능 진행성 또는 전이성 식도 편평 세포암 성인 환자에게 플루오로피리미딘 및 백금 함유 화학 요법과 병용하여 1차 치료제로 사용됩니다. (1.12)
- •
- 불수술 가능 진행성 또는 전이성 식도 편평 세포암 성인 환자에게 이필리무맙과 병용하여 1차 치료제로 사용됩니다. (1.12)
- •
- 이전에 플루오로피리미딘 및 백금 기반 화학 요법을 받은 불수술 가능 진행성, 재발성 또는 전이성 식도 편평 세포암(ESCC) 성인 환자에게 사용됩니다. (1.12)
위암, 위식도 접합부암 및 식도 선암
- •
- 플루오로피리미딘 및 백금 함유 화학 요법과 병용하여 진행성 또는 전이성 위암, 위식도 접합부암 및 식도 선암 환자. (1.13)
a 본 적응증은 전체 반응률 및 반응 지속 기간을 기반으로 한 가속 승인에 따라 승인되었습니다. 본 적응증에 대한 지속적인 승인은 확인적 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다.
투여 및 관리
- •
- 각 적응증에 권장된 주입 속도에 따라 희석 후 정맥 주입으로 투여합니다. (2)
- •
- 절제 불가능 또는 전이성 흑색종
- •
- 체중 40kg 이상 성인 및 소아 환자: 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 체중 40kg 미만 소아 환자: 2주마다 3mg/kg 또는 4주마다 6mg/kg. (2.2)
- •
- 체중 40kg 이상 성인 및 소아 환자: 1mg/kg에 이어 같은 날 3mg/kg의 ipilimumab을 3주마다 4회 투여한 후 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 체중 40kg 미만 소아 환자: 1mg/kg에 이어 같은 날 3mg/kg의 ipilimumab을 3주마다 4회 투여한 후 2주마다 3mg/kg 또는 4주마다 6mg/kg. (2.2)
- •
- 흑색종의 보조 요법
- •
- 절제 가능한 (종양 ≥4cm 또는 림프절 양성) 비소세포폐암의 신보조 요법
- •
- 3주마다 3사이클 동안 같은 날 백금 이중 약물 화학 요법과 함께 360mg. (2.2)
- •
- 전이성 비소세포폐암
- •
- 악성 흉막 중피종
- •
- 3주마다 360mg과 함께 6주마다 1mg/kg의 ipilimumab. (2.2)
- •
- 진행성 신세포암
- •
- 고전적 호지킨 림프종
- •
- 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 재발성 또는 전이성 두경부 편평 세포암
- •
- 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 요로 상피암의 보조 요법
- •
- 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 1차 절제 불가능 또는 전이성 요로 상피암
- •
- 최대 6사이클 동안 같은 날 cisplatin 및 gemcitabine과 함께 3주마다 360mg을 투여한 후 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 이전에 치료받은 국소 진행성 또는 전이성 요로 상피암
- •
- 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 미세 위성 불안정성 고(MSI-H) 또는 불일치 복구 결손(dMMR) 전이성 대장암
- •
- 간세포암
- •
- 1mg/kg에 이어 같은 날 3mg/kg의 ipilimumab을 3주마다 4회 투여한 후 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 절제된 식도암 또는 식도 위암의 보조 요법
- •
- 총 치료 기간 1년 동안 2주마다 240mg 또는 4주마다 480mg. (2.2)
- •
- 식도 편평 세포암
- •
- 위암, 식도 위 접합부암 및 식도 선암(GC, GEJC 또는 EAC)
- •
- 준비 및 투여 지침과 부작용에 대한 용량 조정에 대한 자세한 처방 정보를 참조하십시오.
처방 정보 주요 사항
- •
- 주사제: 40 mg/4 mL (10 mg/mL), 100 mg/10 mL (10 mg/mL), 120 mg/12 mL (10 mg/mL) 및 240 mg/24 mL (10 mg/mL) 용액, 1회용 바이알. (3)
금기 사항
- •
- 없음. (4)
경고 및 주의 사항
- •
-
면역 매개 이상 반응: (5.1)
- •
- 심각하거나 치명적일 수 있는 면역 매개 이상 반응은 폐렴, 대장염, 간염 및 간 독성, 내분비 질환, 피부 이상 반응, 신염 및 신장 기능 장애를 포함한 모든 기관계 또는 조직에서 발생할 수 있습니다.
- •
- 조기에 발견하고 관리하기 위해 모니터링합니다. 기준선 및 치료 중 주기적으로 간 효소, 크레아티닌 및 갑상선 기능을 평가합니다.
- •
- 반응의 심각도와 유형에 따라 투여를 중단하거나 영구적으로 중단합니다. (2.3)
- •
- 주입 관련 반응: 반응의 심각도에 따라 OPDIVO 주입을 중단하거나 속도를 늦추거나 영구적으로 중단합니다. (5.2)
- •
- 동종 이식 HSCT의 합병증: PD-1/PD-L1 차단 항체로 치료하기 전이나 후에 동종 이식 HSCT를 받은 환자에서 치명적이거나 심각한 합병증이 발생할 수 있습니다. (5.3)
- •
- 태아 독성: 태아에게 해를 끼칠 수 있습니다. 임신 가능성이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 효과적인 피임을 사용하도록 조언합니다. (5.4, 8.1, 8.3)
- •
- 탈리도마이드 유사체와 덱사메타손을 병용하여 PD-1 또는 PD-L1 차단 항체로 다발성 골수종 환자를 치료하는 것은 통제된 임상 시험 외부에서는 권장하지 않습니다. (5.5)
이상 반응
환자에서 가장 흔한 이상 반응(발생률 ≥20%)은 다음과 같습니다.
- •
- 단독 요법: 피로, 발진, 근골격계 통증, 가려움증, 설사, 메스꺼움, 무력증, 기침, 호흡 곤란, 변비, 식욕 감소, 요통, 관절통, 상기도 감염, 발열, 두통, 복통, 구토 및 요로 감염. (6.1)
- •
- 이필리무맙과 병용: 피로, 설사, 발진, 가려움증, 메스꺼움, 근골격계 통증, 발열, 기침, 식욕 감소, 구토, 복통, 호흡 곤란, 상기도 감염, 관절통, 두통, 저갑상선증, 변비, 체중 감소 및 현기증. (6.1)
- •
- 백금 이중 약물 화학 요법과 병용: 메스꺼움, 피로, 근골격계 통증, 변비, 식욕 감소, 발진, 구토 및 말초 신경병증. (6.1)
- •
- 이필리무맙과 백금 이중 약물 화학 요법과 병용: 피로, 근골격계 통증, 메스꺼움, 설사, 발진, 식욕 감소, 변비 및 가려움증. (6.1)
- •
- 카보잔티닙과 병용: 설사, 피로, 간 독성, 손바닥-발바닥 홍반증, 구내염, 발진, 고혈압, 저갑상선증, 근골격계 통증, 식욕 감소, 메스꺼움, 미각 이상, 복통, 기침 및 상기도 감염. (6.1)
- •
- 플루오로피리미딘 및 백금 함유 화학 요법과 병용: 메스꺼움, 말초 신경병증, 식욕 감소, 피로, 변비, 구내염, 설사, 구토, 복통 및 근골격계 통증. (6.1)
의심되는 이상 반응을 보고하려면 Bristol-Myers Squibb에 1-800-721-5072 또는 FDA에 1-800-FDA-1088 또는 www.fda.gov/medwatch로 연락하십시오.
환자 상담 정보 및 약물 안내를 보려면 17을 참조하십시오.
개정: 2024년 3월
목차
전문 정보: 내용*
1 적응증 및 사용법
1.1 절제 불가능하거나 전이성 흑색종
1.2 흑색종의 보조 치료
1.3 절제 가능한 비소세포폐암의 신보조 치료
1.4 전이성 비소세포폐암
1.5 악성 흉막 중피종
1.6 진행성 신세포암
1.7 고전적 호지킨 림프종
1.8 두경부 편평세포암종
1.9 요로 상피암
1.10 미세 위성 불안정성-고 또는 불일치 복구 결손 전이성 대장암
1.11 간세포암
1.12 식도암
1.13 위암, 위식도 접합부암 및 식도 선암
2 용법 및 용량
2.1 환자 선택
2.2 권장 용량
2.3 용량 조절
2.4 준비 및 투여
3 용법 및 강도
4 금기 사항
5 경고 및 주의 사항
5.1 심각하고 치명적인 면역 매개 이상 반응
5.2 주입 관련 반응
5.3 동종 조혈모세포 이식의 합병증
5.4 태아 독성
5.5 OPDIVO를 탈리도마이드 유사체 및 덱사메타손에 추가했을 때 다발성 골수종 환자의 사망률 증가
6 이상 반응
6.1 임상 시험 경험
6.2 시판 후 경험
8 특정 집단에서의 사용
8.1 임신
8.2 수유
8.3 생식 능력이 있는 여성 및 남성
8.4 소아 사용
8.5 노인 사용
11 설명
12 약리학
12.1 작용 기전
12.2 약력학
12.3 약동학
12.6 면역원성
13 비임상 독성학
13.1 발암성, 돌연변이 유발성, 생식 능력 저해
13.2 동물 독성 및/또는 약리학
14 임상 연구
14.1 절제 불가능하거나 전이성 흑색종
14.2 흑색종의 보조 치료
14.3 절제 가능한 (종양 ≥4cm 또는 림프절 양성) 비소세포폐암의 신보조 치료
14.4 전이성 비소세포폐암
14.5 악성 흉막 중피종
14.6 진행성 신세포암
14.7 고전적 호지킨 림프종
14.8 재발성 또는 전이성 두경부 편평세포암종
14.9 요로 상피암
14.10 미세 위성 불안정성-고 또는 불일치 복구 결손 전이성 대장암
14.11 간세포암
14.12 식도암
14.13 위암, 위식도 접합부암 및 식도 선암
16 포장 단위/보관 및 취급
17 환자 상담 정보
- *
- 전문 정보에서 생략된 섹션 또는 하위 섹션은 나열되지 않습니다.
1 적응증 및 사용
1.1 절제 불가능 또는 전이성 흑색종
OPDIVO는 단독 요법 또는 ipilimumab과 병용 요법으로 절제 불가능 또는 전이성 흑색종이 있는 성인 및 12세 이상 소아 환자의 치료에 사용됩니다.
1.3 절제 가능한 비소세포폐암의 신보조 요법
OPDIVO는 백금 이중 약물 화학 요법과 병용하여 절제 가능한 (종양 ≥4 cm 또는 림프절 양성) 비소세포폐암 (NSCLC) 성인 환자의 신보조 요법에 사용됩니다.
1.4 전이성 비소세포폐암
- •
- OPDIVO는 FDA 승인 시험으로 결정된 PD-L1 (≥1%)을 발현하는 종양이 있는 전이성 NSCLC 성인 환자의 1차 치료에 ipilimumab과 병용하여 사용되며, EGFR 또는 ALK 유전체 종양 변이가 없습니다. [투약 및 투여 (2.1) 참조]
- •
- OPDIVO는 EGFR 또는 ALK 유전체 종양 변이가 없는 전이성 또는 재발성 NSCLC 성인 환자의 1차 치료에 ipilimumab 및 2 사이클의 백금 이중 약물 화학 요법과 병용하여 사용됩니다.
- •
- OPDIVO는 백금 기반 화학 요법 후 진행된 전이성 NSCLC 성인 환자의 치료에 사용됩니다. EGFR 또는 ALK 유전체 종양 변이가 있는 환자는 OPDIVO를 투여하기 전에 이러한 변이에 대한 FDA 승인 요법으로 질병이 진행되어야 합니다.
1.6 진행성 신세포암
- •
- OPDIVO는 중간 위험 또는 저위험 진행성 RCC 성인 환자의 1차 치료에 ipilimumab과 병용하여 사용됩니다.
- •
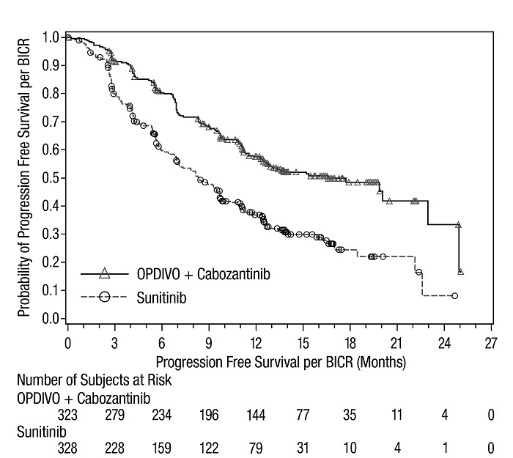
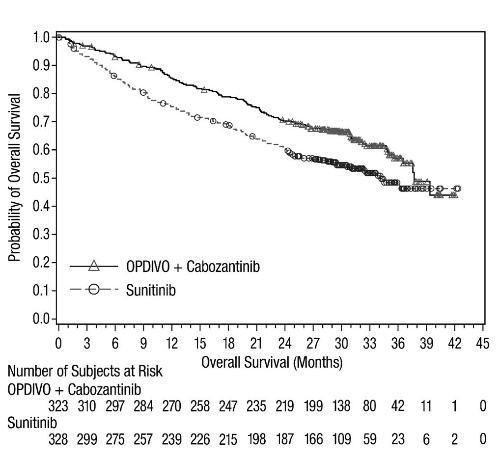
- OPDIVO는 진행성 RCC 성인 환자의 1차 치료에 cabozantinib과 병용하여 사용됩니다.
- •
- OPDIVO는 이전 항혈관 생성 요법을 받은 진행성 신세포암 (RCC) 성인 환자의 치료에 단독 요법으로 사용됩니다.
1.7 고전적 호지킨 림프종
OPDIVO는 다음과 같은 치료 후 재발 또는 진행된 고전적 호지킨 림프종 (cHL) 성인 환자의 치료에 사용됩니다.
- •
- 자가 조혈 줄기 세포 이식 (HSCT) 및 brentuximab vedotin, 또는
- •
- 자가 HSCT를 포함한 3회 이상의 전신 요법.
이 적응증은 전체 반응률을 기반으로 한 가속 승인에 따라 승인되었습니다. [임상 연구 (14.7) 참조] 이 적응증에 대한 지속적인 승인은 확증 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다.
1.9 요로 상피암
OPDIVO는 요로 상피암 (UC)의 근치적 절제술을 받은 후 재발 위험이 높은 성인 환자의 보조 요법에 사용됩니다. [임상 연구 (14.9) 참조]
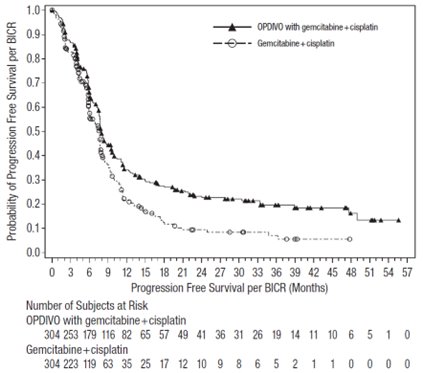
OPDIVO는 절제 불가능 또는 전이성 요로 상피암 성인 환자의 1차 치료에 시스플라틴 및 젬시타빈과 병용하여 사용됩니다.
OPDIVO는 다음과 같은 국소 진행성 또는 전이성 요로 상피암 성인 환자의 치료에 사용됩니다.
- •
- 백금 함유 화학 요법 중 또는 후에 질병이 진행된 경우.
- •
- 백금 함유 화학 요법으로 신보조 또는 보조 치료를 받은 후 12개월 이내에 질병이 진행된 경우.
1.10 마이크로 위성 불안정성-고 또는 불일치 복구 결핍 전이성 대장암
OPDIVO는 플루오로피리미딘, 옥살리플라틴 및 이리노테칸으로 치료 후 진행된 마이크로 위성 불안정성-고 (MSI-H) 또는 불일치 복구 결핍 (dMMR) 전이성 대장암 (CRC)이 있는 성인 및 12세 이상 소아 환자의 치료에 단독 요법 또는 ipilimumab과 병용하여 사용됩니다.
이 적응증은 전체 반응률 및 반응 지속 기간을 기반으로 한 가속 승인에 따라 승인되었습니다. [임상 연구 (14.10) 참조] 이 적응증에 대한 지속적인 승인은 확증 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다.
1.11 간세포암
OPDIVO는 소라페닙으로 사전 치료를 받은 성인 간세포암(HCC) 환자의 치료에 이필리무맙과 병용하여 사용됩니다. 이 적응증은 전체 반응률 및 반응 지속 기간을 기반으로 한 가속 승인에 따라 승인되었습니다 [임상 연구(14.11) 참조]. 이 적응증에 대한 지속적인 승인은 확증적 시험에서 임상적 이점의 검증 및 설명에 따라 달라질 수 있습니다.
1.12 식도암
- •
- OPDIVO는 신보조 화학 방사선 요법(CRT)을 받은 성인 환자에서 잔여 병리학적 질환이 있는 완전히 절제된 식도암 또는 위식도 접합부암의 보조 치료에 사용됩니다.
- •
- OPDIVO는 불수술 가능한 진행성 또는 전이성 식도 편평 상피암(ESCC) 성인 환자의 1차 치료에 플루오로피리미딘 및 백금 함유 화학 요법과 병용하여 사용됩니다.
- •
- OPDIVO는 불수술 가능한 진행성 또는 전이성 식도 편평 상피암(ESCC) 성인 환자의 1차 치료에 이필리무맙과 병용하여 사용됩니다.
- •
- OPDIVO는 이전 플루오로피리미딘 및 백금 기반 화학 요법 후 불수술 가능한 진행성, 재발성 또는 전이성 식도 편평 상피암(ESCC) 성인 환자의 치료에 사용됩니다.
1.13 위암, 위식도 접합부암 및 식도 선암
OPDIVO는 진행성 또는 전이성 위암, 위식도 접합부암 및 식도 선암 성인 환자의 치료에 플루오로피리미딘 및 백금 함유 화학 요법과 병용하여 사용됩니다.
2. 용법 및 용량
2.1 환자 선택
PD-L1 발현에 따라 이필리무맙과 병용하여 OPDIVO로 치료할 전이성 NSCLC 환자를 선택하십시오 [임상 연구 (14.4) 참조].
NSCLC에서 PD-L1 발현을 결정하기 위한 FDA 승인 시험에 대한 정보는 다음 웹사이트에서 확인할 수 있습니다. http://www.fda.gov/CompanionDiagnostics.
2.2 권장 용량
단독 요법으로 사용되는 OPDIVO의 권장 용량은 표 1에 나와 있습니다.
| * 30분 정맥 주입. | ||
|
적응증 |
권장 OPDIVO 용량 |
치료 기간 |
|
전이성 비소세포폐암 |
2주마다 240mg* 또는 4주마다 480mg* |
질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 |
|
진행성 신세포암 |
||
|
고전적 호지킨 림프종 |
||
|
두경부 편평세포암종 |
||
|
국소 진행성 또는 전이성 요로상피암 |
||
|
식도 편평세포암종 |
||
|
절제 불가능 또는 전이성 흑색종 |
성인 환자 및 12세 이상 40kg 이상의 소아 환자: |
질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 |
|
12세 이상 40kg 미만의 소아 환자: 또는 4주마다 6mg/kg* |
||
|
흑색종의 보조 치료 |
성인 환자 및 12세 이상 40kg 이상의 소아 환자: 또는 4주마다 480mg* |
질병 재발 또는 용납할 수 없는 독성이 나타날 때까지 최대 1년까지 |
|
12세 이상 40kg 미만의 소아 환자: 또는 4주마다 6mg/kg* |
||
|
요로상피암(UC)의 보조 치료 |
2주마다 240mg* 또는 4주마다 480mg* |
질병 재발 또는 용납할 수 없는 독성이 나타날 때까지 최대 1년까지 |
|
미세위성불안정성-고(MSI-H) 또는 불일치 복구 결손(dMMR) 전이성 대장암 |
성인 환자 및 12세 이상 40kg 이상의 소아 환자: 또는 4주마다 480mg* |
질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 |
|
12세 이상 40kg 미만의 소아 환자: |
||
|
절제된 식도암 또는 위식도 접합부암의 보조 치료 |
2주마다 240mg* 또는 4주마다 480mg* |
질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 총 치료 기간 1년 |
OPDIVO를 다른 치료제와 병용하여 사용할 때 권장 용량은 표 2에 나와 있습니다. OPDIVO와 병용하여 투여되는 각 치료제의 처방 정보를 참조하여 적절한 권장 용량 정보를 확인하십시오.
| * 동일한 날에 30분 동안 정맥 주입합니다. | ||
|
적응증 |
OPDIVO 권장 용량 |
치료 기간 |
|
절제 불가능 또는 전이성 흑색종 |
1 mg/kg, 3주마다* |
이필리무맙과 병용하여 최대 4회 투여하거나, 용납할 수 없는 독성이 나타날 때까지, 둘 중 빠른 시기에 투여 중단 |
|
성인 환자 및 12세 이상, 체중 40kg 이상의 소아 환자: 240 mg, 2주마다* |
병용 요법으로 4회 투여를 완료한 후, 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 단독 요법으로 투여 |
|
|
12세 이상, 체중 40kg 미만의 소아 환자:
3 mg/kg, 2주마다* |
||
|
절제 가능한 비소세포폐암의 신보조 요법 |
360 mg, 3주마다* |
백금 이중 약물 화학 요법과 병용하여 3주기 투여 |
|
PD-L1 발현 전이성 비소세포폐암 |
360 mg, 3주마다* |
이필리무맙과 병용하여 질병 진행, 용납할 수 없는 독성이 나타날 때까지, 또는 질병 진행 없이 최대 2년까지 투여 |
|
전이성 또는 재발성 비소세포폐암 |
360 mg, 3주마다* |
이필리무맙과 병용하여 질병 진행, 용납할 수 없는 독성이 나타날 때까지, 또는 질병 진행 없이 최대 2년까지 투여 |
|
조직학 기반 백금 이중 약물 화학 요법 2주기 |
||
|
악성 흉막 중피종 |
360 mg, 3주마다* |
이필리무맙과 병용하여 질병 진행, 용납할 수 없는 독성이 나타날 때까지, 또는 질병 진행 없이 최대 2년까지 투여 |
|
진행성 신세포암 |
3 mg/kg, 3주마다* |
이필리무맙과 병용하여 4회 투여 |
|
240 mg, 2주마다*
또는 OPDIVO는 카보잔티닙 40 mg을 식사와 관계없이 하루에 한 번 경구 투여와 병용하여 투여 |
OPDIVO: 질병 진행, 용납할 수 없는 독성이 나타날 때까지, 또는 최대 2년까지 |
|
|
카보잔티닙: 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 |
||
|
240 mg, 2주마다* 480 mg, 4주마다* |
이필리무맙과 병용하여 4회 투여를 완료한 후, 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 단독 요법으로 투여 |
|
|
1차 절제 불가능 또는 전이성 요로상피암 |
360 mg, 3주마다* |
시스플라틴과 젬시타빈과 병용하여 최대 6주기 투여 |
2주마다 240mg*
또는
4주마다 480mg*
최대 6주기의 병용 요법을 완료한 후, 질병 진행, 용납할 수 없는 독성 또는 첫 번째 투여 후 최대 2년까지 단독 요법으로 투여
미세 위성 불안정성 고도(MSI-H) 또는 불일치 복구 결손(dMMR) 전이성 대장암
3주마다 3mg/kg*
이필리무맙 1mg/kg 정맥 주사와 함께*
이필리무맙과 병용
4회 투여
성인 환자 및 12세 이상의 소아 환자로 체중이 40kg 이상인 경우:
2주마다 240mg*
또는
4주마다 480mg*
4회의 병용 요법을 완료한 후, 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 단독 요법으로 투여
12세 이상의 소아 환자로 체중이 40kg 미만인 경우:
2주마다 3mg/kg*
간세포암
3주마다 1mg/kg*
이필리무맙 3mg/kg 정맥 주사와 함께*
이필리무맙과 병용
4회 투여
2주마다 240mg*
또는
4주마다 480mg*
4회의 병용 요법을 완료한 후, 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 단독 요법으로 투여
식도 편평 상피암
2주마다 240mg*
또는
4주마다 480mg*
플루오로피리미딘 및 백금 함유 화학 요법과 함께 OPDIVO를 투여
OPDIVO: 질병 진행, 용납할 수 없는 독성 또는 최대 2년까지
화학 요법: 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지
2주마다 3mg/kg*
또는
3주마다 360mg*
이필리무맙 1mg/kg을 6주마다 함께 투여
이필리무맙과 병용하여 질병 진행, 용납할 수 없는 독성 또는 최대 2년까지
위암, 위식도 접합부암 및 식도 선암
2주마다 240mg*
플루오로피리미딘 및 백금 함유 화학 요법을 2주마다 함께 투여
또는
3주마다 360mg*
플루오로피리미딘 및 백금 함유 화학 요법을 3주마다 함께 투여
질병 진행, 용납할 수 없는 독성 또는 최대 2년까지
2.3 용량 조절
OPDIVO에 대한 용량 감소는 권장되지 않습니다. 일반적으로 OPDIVO는 중증(3등급) 면역 매개 이상 반응에 대해 투여를 중단합니다. 생명을 위협하는(4등급) 면역 매개 이상 반응, 전신 면역 억제 치료가 필요한 재발성 중증(3등급) 면역 매개 반응 또는 스테로이드 투여 시작 후 12주 이내에 프레드니손 또는 동등한 약물의 용량을 하루 10mg 이하로 줄일 수 없는 경우 OPDIVO를 영구적으로 중단합니다.
이러한 일반적인 지침과 다른 관리가 필요한 이상 반응에 대한 OPDIVO 또는 OPDIVO와의 병용 요법의 용량 조절은 표 3과 표 4에 요약되어 있습니다.
OPDIVO를 이필리무맙과 병용하여 투여하는 경우, 이러한 용량 조절 지침을 충족하는 이상 반응에 대해 이필리무맙과 OPDIVO 모두 투여를 중단하거나 영구적으로 중단합니다.
| a 코르티코스테로이드 감량 후 완전 또는 부분적 해소(0등급에서 1등급)가 나타난 환자에게 재개합니다. 마지막 투여 후 12주 이내에 완전 또는 부분적 해소가 나타나지 않거나 스테로이드 투여 시작 후 12주 이내에 프레드니손을 하루 10mg(또는 동등한 약물) 이하로 줄일 수 없는 경우 영구적으로 중단합니다. b 기준선에서 AST와 ALT가 ULN 이하인 경우, 간에 영향을 미치지 않는 간염에 대한 권장 사항에 따라 OPDIVO 투여를 중단하거나 영구적으로 중단합니다. c 임상 중증도에 따라, 호르몬 대체 요법으로 증상이 호전될 때까지 2등급 내분비 장애에 대해 투여를 중단하는 것을 고려합니다. 급성 증상이 해소되면 재개합니다. ALT = 알라닌 아미노트랜스퍼라제, AST = 아스파르테이트 아미노트랜스퍼라제, DRESS = 약물 발진과 호산구 증가 및 전신 증상, SJS = 스티븐스-존슨 증후군, TEN = 독성 표피 괴사, ULN = 정상 상한치 |
||
|
이상 반응 |
중증도 |
용량 조절 |
|
면역 매개 이상 반응 [경고 및 주의 사항 (5.1) 참조] |
||
|
폐렴 |
2등급 |
투여 중단a |
|
3등급 또는 4등급 |
영구적으로 중단 |
|
|
대장염
이필리무맙과의 병용 요법으로 치료받는 환자의 경우 대장염에 대한 내용은 표 4를 참조하십시오. |
2등급 또는 3등급 |
투여 중단a |
|
4등급 |
영구적으로 중단 |
|
|
종양이 간에 영향을 미치지 않는 간염
이필리무맙과의 병용 요법으로 치료받는 환자의 경우 간 효소 수치 상승에 대한 내용은 표 4를 참조하십시오. |
AST/ALT가 ULN의 3배 초과 및 8배 이하로 증가 또는 총 빌리루빈이 ULN의 1.5배 초과 및 3배 이하로 증가. |
투여 중단a |
|
AST 또는 ALT가 ULN의 8배 초과로 증가 또는 총 빌리루빈이 ULN의 3배 초과로 증가. |
영구적으로 중단 |
|
|
종양이 간에 영향을 미치는 간염b
이필리무맙과의 병용 요법으로 치료받는 환자의 경우 간 효소 수치 상승에 대한 내용은 표 4를 참조하십시오. |
기준선 AST/ALT가 ULN의 1배 초과 및 3배 이하이고 ULN의 5배 초과 및 10배 이하로 증가 또는 기준선 AST/ALT가 ULN의 3배 초과 및 5배 이하이고 ULN의 8배 초과 및 10배 이하로 증가. |
투여 중단a |
|
AST/ALT가 ULN의 10배 초과로 증가 또는 총 빌리루빈이 ULN의 3배 초과로 증가. |
영구적으로 중단 |
|
|
내분비 장애c |
3등급 또는 4등급 |
임상적으로 안정될 때까지 투여를 중단하거나 중증도에 따라 영구적으로 중단 |
|
신장 기능 장애를 동반한 신염 |
혈중 크레아티닌이 증가한 2등급 또는 3등급 |
투여 중단a |
|
혈중 크레아티닌이 증가한 4등급 |
영구적으로 중단 |
|
|
박리성 피부 질환 |
SJS, TEN 또는 DRESS 의심 |
투여 중단 |
|
확인된 SJS, TEN 또는 DRESS |
영구적으로 중단 |
|
|
심근염 |
2, 3 또는 4등급 |
영구적으로 중단 |
|
신경 독성 |
2등급 |
보류a |
|
3 또는 4등급 |
영구적으로 중단 |
|
|
기타 이상 반응 |
||
|
주입 관련 반응 |
1 또는 2등급 |
주입을 중단하거나 속도를 늦춤 |
|
3 또는 4등급 |
영구적으로 중단 |
|
| a 코르티코스테로이드 감량 후 완전 또는 부분적 회복(등급 0~1)이 있는 환자에게 재투여합니다. 마지막 투여 후 12주 이내에 완전 또는 부분적 회복이 없거나 스테로이드 투여 시작 후 12주 이내에 프레드니손을 하루 10mg(또는 그에 상응하는 용량) 이하로 줄일 수 없는 경우 영구적으로 중단합니다. b 기준선에서 AST 및 ALT가 ULN 이하인 경우, 간에 대한 종양 침범이 없는 간염에 대한 권장 사항에 따라 이필리무맙과 병용 투여되는 OPDIVO를 보류하거나 영구적으로 중단합니다. c 카보잔티닙과 병용 투여 시 OPDIVO를 보류하거나 중단하는 경우 간 부작용에 대한 코르티코스테로이드 요법을 고려합니다. d 회복 후 OPDIVO 및 카보잔티닙 중 하나 또는 둘 다를 재투여하는 것을 고려할 수 있습니다. 카보잔티닙을 OPDIVO와 함께 또는 OPDIVO 없이 재투여하는 경우 카보잔티닙 처방 정보를 참조하십시오. |
|||
|
치료 |
부작용 |
중증도 |
용량 조정 |
|
이필리무맙과 병용 투여되는 OPDIVO |
대장염 |
등급 2 |
보류a |
|
등급 3 또는 4 |
영구적으로 중단 |
||
|
간에 대한 종양 침범이 없는 간염 |
AST/ALT가 ULN의 3배 초과 및 5배 이하로 증가 |
보류a |
|
|
AST 또는 ALT가 ULN의 5배 초과 |
영구적으로 중단 |
||
|
간에 대한 종양 침범이 있는 간염b/HCC |
기준선 AST/ALT가 ULN의 1배 초과 및 3배 이하이고 ULN의 5배 초과 및 10배 이하로 증가 |
보류a |
|
|
AST/ALT가 ULN의 10배 초과 |
영구적으로 중단 |
||
|
카보잔티닙과 병용 투여되는 OPDIVO |
간 효소 상승 |
ALT 또는 AST가 ULN의 3배 초과이지만 10배 이하이고 동시에 총 빌리루빈이 ULN의 2배 미만 |
OPDIVO와 카보잔티닙 모두 부작용이 등급 0-1로 회복될 때까지 보류cd |
|
ALT 또는 AST가 ULN의 10배 초과 또는 ULN의 3배 초과이고 동시에 총 빌리루빈이 ULN의 2배 이상 |
OPDIVO와 카보잔티닙 모두 영구적으로 중단c |
||
2.4 투여 준비 및 방법
입자 및 변색 여부를 시각적으로 확인하십시오. OPDIVO는 투명에서 유백색, 무색에서 옅은 노란색 용액입니다. 흐리거나 변색되었거나 투명에서 흰색의 단백질 입자를 제외한 이물질이 포함되어 있는 경우 폐기하십시오. 흔들지 마십시오.
준비
- •
- 필요한 양의 OPDIVO를 추출하여 정맥 주입 용기에 옮깁니다.
- •
- OPDIVO를 0.9% 염화나트륨 주사액 USP 또는 5% 포도당 주사액 USP로 희석하여 최종 농도가 1 mg/mL에서 10 mg/mL 범위가 되도록 주입액을 준비합니다. 주입액의 총 용량은 160 mL를 초과해서는 안 됩니다.
• 체중이 40 kg 이상인 성인 및 소아 환자의 경우 주입액의 총 용량은 160 mL를 초과해서는 안 됩니다.
• 체중이 40 kg 미만인 성인 및 소아 환자의 경우 주입액의 총 용량은 체중 1 kg당 4 mL를 초과해서는 안 됩니다. - •
- 희석된 용액을 부드럽게 뒤집어 섞습니다. 흔들지 마십시오.
- •
- 부분적으로 사용한 바이알 또는 비어 있는 OPDIVO 바이알은 폐기하십시오.
- •
- 본 제품은 보존제를 함유하고 있지 않습니다.
- •
- 준비 후 희석된 용액을 다음과 같이 보관하십시오.
• 실온 및 실내 조명에서 준비 시간부터 주입 종료까지 최대 8시간 동안 보관합니다. 준비 후 8시간 이내에 사용하지 않으면 희석된 용액을 폐기하십시오. 또는
• 2°C에서 8°C(36°F에서 46°F)의 냉장 보관하고 빛으로부터 보호하여 준비 시간부터 주입 종료까지 최대 7일 동안 보관합니다. 준비 후 7일 이내에 사용하지 않으면 희석된 용액을 폐기하십시오. - •
- 냉동하지 마십시오.
투여
- •
- 희석 후 무균, 비발열성, 저단백 결합 인라인 필터(공극 크기 0.2 마이크로미터에서 1.2 마이크로미터)가 장착된 정맥 주입 라인을 통해 30분 동안 주입합니다.
- •
- 다음과 같이 다른 치료제와 함께 OPDIVO를 투여합니다.
- •
- 이필리무맙과 함께: OPDIVO를 먼저 투여한 다음 같은 날에 이필리무맙을 투여합니다.
- •
- 백금 이중 약물 화학 요법과 함께: OPDIVO를 먼저 투여한 다음 같은 날에 백금 이중 약물 화학 요법을 투여합니다.
- •
- 이필리무맙 및 백금 이중 약물 화학 요법과 함께: OPDIVO를 먼저 투여한 다음 이필리무맙을 투여하고 같은 날에 백금 이중 약물 화학 요법을 투여합니다.
- •
- 플루오로피리미딘 및 백금 함유 화학 요법과 함께: OPDIVO를 먼저 투여한 다음 같은 날에 플루오로피리미딘 및 백금 함유 화학 요법을 투여합니다.
- •
- 각 주입에 대해 별도의 주입 백과 필터를 사용하십시오.
- •
- 주입이 끝나면 정맥 주입 라인을 세척하십시오.
- •
- 같은 정맥 주입 라인을 통해 다른 약물을 함께 투여하지 마십시오.
3가지 용량 형태 및 함량
주사: 40 mg/4 mL (10 mg/mL), 100 mg/10 mL (10 mg/mL), 120 mg/12 mL (10 mg/mL), 그리고 240 mg/24 mL (10 mg/mL)의 단회용 약병에 투명한 유리색에서 흐릿한 연한 노란색 용액이 들어 있습니다.
4 금기 사항
없음.
5. 경고 및 주의 사항
5.1 심각하고 치명적인 면역 매개 이상 반응
OPDIVO는 프로그램 세포 사멸 수용체 1(PD-1) 또는 PD-리간드 1(PD-L1)에 결합하는 약물 계열에 속하는 단일클론 항체로, PD-1/PD-L1 경로를 차단하여 면역 반응의 억제를 제거하고, 말초 내성을 깨뜨리고 면역 매개 이상 반응을 유발할 수 있습니다. 경고 및 주의 사항에 나열된 중요한 면역 매개 이상 반응에는 모든 가능한 심각하고 치명적인 면역 매개 반응이 포함되지 않을 수 있습니다.
심각하거나 치명적일 수 있는 면역 매개 이상 반응은 모든 기관계 또는 조직에서 발생할 수 있습니다. 면역 매개 이상 반응은 PD-1/PD-L1 차단 항체 치료를 시작한 후 언제든지 발생할 수 있습니다. 면역 매개 이상 반응은 일반적으로 PD-1/PD-L1 차단 항체 치료 중에 나타나지만, PD-1/PD-L1 차단 항체 치료 중단 후에도 나타날 수 있습니다.
PD-1/PD-L1 차단 항체의 안전한 사용을 보장하기 위해 면역 매개 이상 반응을 조기에 발견하고 관리하는 것이 중요합니다. 기저 상태 및 치료 중에 정기적으로 간 효소, 크레아티닌 및 갑상선 기능을 모니터링하여 근본적인 면역 매개 이상 반응의 임상적 징후가 될 수 있는 증상과 징후를 환자에게 주의 깊게 모니터링합니다. 면역 매개 이상 반응이 의심되는 경우 감염을 포함한 다른 원인을 배제하기 위해 적절한 검사를 시작합니다. 적절한 경우 전문의 진료를 포함하여 적절한 의학적 관리를 즉시 시작합니다.
중증도에 따라 OPDIVO를 중단하거나 영구적으로 중단합니다. [투여 및 관리 (2.3) 참조]. 일반적으로 OPDIVO를 중단하거나 중단해야 하는 경우, 1등급 이하로 호전될 때까지 전신 코르티코스테로이드 요법(프레드니손 1~2mg/kg/일 또는 동등한 용량)을 투여합니다. 1등급 이하로 호전되면 코르티코스테로이드 감량을 시작하고 최소 1개월 동안 감량을 계속합니다. 코르티코스테로이드 요법으로 면역 매개 이상 반응이 조절되지 않는 환자의 경우 다른 전신 면역 억제제 투여를 고려합니다.
전신 스테로이드가 필요하지 않은 이상 반응(예: 내분비 장애 및 피부 반응)에 대한 독성 관리 지침은 아래에서 논의합니다.
면역 매개 폐렴
OPDIVO는 스테로이드 사용이 필요하고 명확한 다른 원인이 없는 면역 매개 폐렴을 유발할 수 있습니다. 다른 PD-1/PD-L1 차단 항체로 치료받은 환자의 경우, 이전에 흉부 방사선을 받은 환자에서 폐렴 발생률이 더 높습니다.
단독 요법으로 사용되는 OPDIVO
단독 요법으로 OPDIVO를 투여받은 환자의 3.1%(1994명 중 61명)에서 면역 매개 폐렴이 발생했으며, 여기에는 4등급(<0.1%), 3등급(0.9%) 및 2등급(2.1%) 이상 반응이 포함됩니다. 폐렴으로 인해 OPDIVO를 영구적으로 중단한 환자는 1.1%, OPDIVO를 중단한 환자는 0.8%였습니다.
폐렴이 발생한 환자의 100%(61명 중 61명)에서 전신 코르티코스테로이드가 필요했습니다. 61명의 환자 중 84%에서 폐렴이 해결되었습니다. 폐렴으로 인해 OPDIVO를 중단한 15명의 환자 중 14명은 증상이 호전된 후 OPDIVO를 재개했으며, 이 중 4명(29%)에서 폐렴이 재발했습니다.
이필리무맙과 함께 사용되는 OPDIVO
OPDIVO 3mg/kg과 이필리무맙 1mg/kg: NSCLC에서 2주마다 OPDIVO 3mg/kg을 이필리무맙 1mg/kg과 함께 6주마다 투여받은 환자의 9%(576명 중 50명)에서 면역 매개 폐렴이 발생했으며, 여기에는 4등급(0.5%), 3등급(3.5%) 및 2등급(4.0%) 면역 매개 폐렴이 포함됩니다. 4명의 환자(0.7%)가 폐렴으로 사망했습니다. 면역 매개 폐렴으로 인해 OPDIVO와 이필리무맙을 영구적으로 중단한 환자는 5%, OPDIVO와 이필리무맙을 중단한 환자는 3.6%였습니다.
폐렴이 발생한 환자의 100%에서 전신 코르티코스테로이드가 필요했습니다. 환자의 72%에서 폐렴이 해결되었습니다. OPDIVO와 이필리무맙을 재개한 후 약 13%(16명 중 2명)의 환자에서 폐렴이 재발했습니다.
면역 매개 대장염
OPDIVO는 스테로이드 사용이 필요하고 명확한 다른 원인이 없는 면역 매개 대장염을 유발할 수 있습니다. 대장염 정의에 포함된 일반적인 증상은 설사였습니다. 코르티코스테로이드에 반응하지 않는 면역 매개 대장염 환자에서 거대세포바이러스(CMV) 감염/재활성화가 보고되었습니다. 코르티코스테로이드에 반응하지 않는 대장염의 경우, 다른 원인을 배제하기 위해 감염 검사를 반복하는 것을 고려합니다.
단독 요법으로 사용되는 OPDIVO
단독 요법으로 OPDIVO를 투여받은 환자의 2.9%(1994명 중 58명)에서 면역 매개 대장염이 발생했으며, 여기에는 3등급(1.7%) 및 2등급(1%) 이상 반응이 포함됩니다. 대장염으로 인해 OPDIVO를 영구적으로 중단한 환자는 0.7%, OPDIVO를 중단한 환자는 0.9%였습니다.
대장염이 발생한 환자의 100%(58명 중 58명)에서 전신 코르티코스테로이드가 필요했습니다. 4명의 환자는 고용량 코르티코스테로이드에 인플릭시맙을 추가해야 했습니다. 58명의 환자 중 86%에서 대장염이 해결되었습니다. 대장염으로 인해 OPDIVO를 중단한 18명의 환자 중 16명은 증상이 호전된 후 OPDIVO를 재개했으며, 이 중 12명(75%)에서 대장염이 재발했습니다.
이필리무맙과 함께 사용되는 OPDIVO
OPDIVO 1mg/kg과 이필리무맙 3mg/kg: 흑색종 또는 HCC 환자에서 3주마다 OPDIVO 1mg/kg을 이필리무맙 3mg/kg과 함께 투여받은 환자의 25%(456명 중 115명)에서 면역 매개 대장염이 발생했으며, 여기에는 4등급(0.4%), 3등급(14%) 및 2등급(8%) 이상 반응이 포함됩니다. 대장염으로 인해 OPDIVO와 이필리무맙을 영구적으로 중단한 환자는 14%, OPDIVO와 이필리무맙을 중단한 환자는 4.4%였습니다.
대장염이 발생한 환자의 100%(115명 중 115명)에서 전신 코르티코스테로이드가 필요했습니다. 약 23%의 환자는 고용량 코르티코스테로이드에 인플릭시맙을 추가해야 했습니다. 115명의 환자 중 93%에서 대장염이 해결되었습니다. 대장염으로 인해 OPDIVO와 이필리무맙을 중단한 20명의 환자 중 16명은 증상이 호전된 후 치료를 재개했으며, 이 중 9명(56%)에서 대장염이 재발했습니다.
OPDIVO 3mg/kg과 이필리무맙 1mg/kg: RCC 또는 CRC 환자에서 3주마다 OPDIVO 3mg/kg을 이필리무맙 1mg/kg과 함께 투여받은 환자의 9%(666명 중 60명)에서 면역 매개 대장염이 발생했으며, 여기에는 3등급(4.4%) 및 2등급(3.7%) 이상 반응이 포함됩니다. 대장염으로 인해 OPDIVO와 이필리무맙을 영구적으로 중단한 환자는 3.2%, OPDIVO와 이필리무맙을 중단한 환자는 2.7%였습니다.
전신 코르티코스테로이드는 대장염이 있는 환자의 100%(60/60)에서 필요했습니다. 면역 매개성 대장염 환자의 약 23%는 고용량 코르티코스테로이드에 인플릭시맙을 추가해야 했습니다. 대장염은 60명의 환자 중 95%에서 해결되었습니다. 대장염으로 인해 OPDIVO와 이필리무맙 투여를 중단한 18명의 환자 중 16명은 증상이 호전된 후 치료를 재개했으며, 이 중 10명(63%)은 대장염이 재발했습니다.
면역 매개성 간염 및 간 독성
OPDIVO는 코르티코스테로이드 사용을 요구하고 명확한 다른 원인이 없는 면역 매개성 간염을 유발할 수 있습니다.
단독 요법으로서의 OPDIVO
면역 매개성 간염은 단독 요법으로 OPDIVO를 투여받은 환자의 1.8%(1994명 중 35명)에서 발생했으며, 여기에는 4등급(0.2%), 3등급(1.3%) 및 2등급(0.4%)의 이상 반응이 포함됩니다. 간염으로 인해 OPDIVO를 영구적으로 중단한 환자는 0.7%, OPDIVO 투여를 중단한 환자는 0.6%였습니다.
전신 코르티코스테로이드는 간염이 있는 환자의 100%(35/35)에서 필요했습니다. 2명의 환자는 고용량 코르티코스테로이드에 미코페놀산을 추가해야 했습니다. 간염은 35명의 환자 중 91%에서 해결되었습니다. 간염으로 인해 OPDIVO 투여를 중단한 12명의 환자 중 11명은 증상이 호전된 후 OPDIVO를 재개했으며, 이 중 9명(82%)은 간염이 재발했습니다.
OPDIVO와 이필리무맙 병용
OPDIVO 1mg/kg와 이필리무맙 3mg/kg 병용: 흑색종 또는 HCC 환자에서 OPDIVO 1mg/kg과 이필리무맙 3mg/kg을 3주마다 병용 투여받은 환자의 15%(456명 중 70명)에서 면역 매개성 간염이 발생했으며, 여기에는 4등급(2.4%), 3등급(11%) 및 2등급(1.8%)의 이상 반응이 포함됩니다. 면역 매개성 간염으로 인해 OPDIVO와 이필리무맙 병용 투여를 영구적으로 중단한 환자는 8%, OPDIVO와 이필리무맙 병용 투여를 중단한 환자는 3.5%였습니다.
전신 코르티코스테로이드는 간염이 있는 환자의 100%(70/70)에서 필요했습니다. 면역 매개성 간염 환자의 약 9%는 고용량 코르티코스테로이드에 미코페놀산을 추가해야 했습니다. 간염은 70명의 환자 중 91%에서 해결되었습니다. 간염으로 인해 OPDIVO와 이필리무맙 병용 투여를 중단한 16명의 환자 중 14명은 증상이 호전된 후 치료를 재개했으며, 이 중 8명(57%)은 간염이 재발했습니다.
OPDIVO 3mg/kg와 이필리무맙 1mg/kg 병용: RCC 또는 CRC 환자에서 OPDIVO 3mg/kg과 이필리무맙 1mg/kg을 3주마다 병용 투여받은 환자의 7%(666명 중 48명)에서 면역 매개성 간염이 발생했으며, 여기에는 4등급(1.2%), 3등급(4.9%) 및 2등급(0.4%)의 이상 반응이 포함됩니다. 면역 매개성 간염으로 인해 OPDIVO와 이필리무맙 병용 투여를 영구적으로 중단한 환자는 3.6%, OPDIVO와 이필리무맙 병용 투여를 중단한 환자는 2.6%였습니다.
전신 코르티코스테로이드는 간염이 있는 환자의 100%(48/48)에서 필요했습니다. 면역 매개성 간염 환자의 약 19%는 고용량 코르티코스테로이드에 미코페놀산을 추가해야 했습니다. 간염은 48명의 환자 중 88%에서 해결되었습니다. 간염으로 인해 OPDIVO와 이필리무맙 병용 투여를 중단한 17명의 환자 중 14명은 증상이 호전된 후 치료를 재개했으며, 이 중 10명(71%)은 간염이 재발했습니다.
OPDIVO와 카보잔티닙 병용
카보잔티닙과 병용한 OPDIVO는 단독 요법으로 OPDIVO를 투여한 경우보다 3등급 및 4등급 ALT 및 AST 상승 빈도가 높은 간 독성을 유발할 수 있습니다. 치료 시작 전과 치료 중 정기적으로 간 효소를 모니터링하십시오. 약물을 단독 요법으로 투여할 때보다 간 효소를 더 자주 모니터링하는 것을 고려하십시오. 간 효소가 상승하면 OPDIVO와 카보잔티닙 투여를 중단하고 코르티코스테로이드 투여를 고려하십시오 [용법 및 투여 (2.3) 참조].
OPDIVO와 카보잔티닙 병용 투여 시 3등급 및 4등급 ALT 또는 AST 상승은 환자의 11%에서 관찰되었습니다 [이상 반응 (6.1) 참조]. ALT 또는 AST가 ULN의 3배 이상(2등급 이상)인 경우 83명의 환자에게 보고되었으며, 이 중 23명(28%)은 전신 코르티코스테로이드를 투여받았습니다. ALT 또는 AST는 74명(89%)에서 0-1등급으로 해결되었습니다. 3등급 이상의 ALT 또는 AST 상승을 보인 44명의 환자 중 단독 요법으로 OPDIVO(n=11) 또는 카보잔티닙(n=9)을 재투여하거나 둘 다(n=24)를 재투여한 환자에서 2등급 이상의 ALT 또는 AST 상승이 재발한 경우는 OPDIVO를 투여받은 환자 2명, 카보잔티닙을 투여받은 환자 2명, OPDIVO와 카보잔티닙을 모두 투여받은 환자 7명에서 관찰되었습니다.
면역 매개성 내분비 질환
부신 기능 저하증
OPDIVO는 일차성 또는 이차성 부신 기능 저하증을 유발할 수 있습니다. 2등급 이상의 부신 기능 저하증의 경우, 임상적으로 필요한 경우 호르몬 대체 요법을 포함한 증상 치료를 시작하십시오. 중증도에 따라 OPDIVO 투여를 중단하십시오 [용법 및 투여 (2.3) 참조].
단독 요법으로서의 OPDIVO
부신 기능 저하증은 단독 요법으로 OPDIVO를 투여받은 환자의 1%(1994명 중 20명)에서 발생했으며, 여기에는 3등급(0.4%) 및 2등급(0.6%)의 이상 반응이 포함됩니다. 부신 기능 저하증으로 인해 OPDIVO를 영구적으로 중단한 환자는 0.1%, OPDIVO 투여를 중단한 환자는 0.4%였습니다.
부신 기능 저하증이 있는 환자의 약 85%는 호르몬 대체 요법을 받았습니다. 전신 코르티코스테로이드는 부신 기능 저하증이 있는 환자의 90%(20명 중 18명)에서 필요했습니다. 부신 기능 저하증은 20명의 환자 중 35%에서 해결되었습니다. 부신 기능 저하증으로 인해 OPDIVO 투여를 중단한 8명의 환자 중 4명은 증상이 호전된 후 OPDIVO를 재개했으며, 모두 지속적인 부신 기능 저하증에 대한 호르몬 대체 요법을 받았습니다.
OPDIVO와 이필리무맙 병용
OPDIVO 1mg/kg와 이필리무맙 3mg/kg 병용: 흑색종 또는 HCC 환자에서 OPDIVO 1mg/kg과 이필리무맙 3mg/kg을 3주마다 병용 투여받은 환자의 8%(456명 중 35명)에서 부신 기능 저하증이 발생했으며, 여기에는 4등급(0.2%), 3등급(2.4%) 및 2등급(4.2%)의 이상 반응이 포함됩니다. 부신 기능 저하증으로 인해 OPDIVO와 이필리무맙 병용 투여를 영구적으로 중단한 환자는 0.4%, OPDIVO와 이필리무맙 병용 투여를 중단한 환자는 2.0%였습니다.
부신 기능 저하증이 있는 환자의 약 71%(35명 중 25명)는 전신 코르티코스테로이드를 포함한 호르몬 대체 요법을 받았습니다. 부신 기능 저하증은 35명의 환자 중 37%에서 해결되었습니다. 부신 기능 저하증으로 인해 OPDIVO와 이필리무맙 병용 투여를 중단한 9명의 환자 중 7명은 증상이 호전된 후 치료를 재개했으며, 모두 지속적인 부신 기능 저하증에 대한 호르몬 대체 요법을 받았습니다.
OPDIVO 3 mg/kg with Ipilimumab 1 mg/kg: 3주마다 OPDIVO 3 mg/kg와 ipilimumab 1 mg/kg를 투여받은 RCC 또는 CRC 환자의 7%(48/666)에서 부신 기능 저하증이 발생했으며, 여기에는 4등급(0.3%), 3등급(2.5%) 및 2등급(4.1%)의 이상 반응이 포함됩니다. 부신 기능 저하증으로 인해 RCC 또는 CRC 환자의 1.2%에서 OPDIVO와 ipilimumab의 영구적인 투약 중단이 발생했고, 2.1%에서 OPDIVO와 ipilimumab의 투약 중단이 발생했습니다.
부신 기능 저하증이 발생한 환자의 약 94%(45/48)는 전신 코르티코스테로이드를 포함한 호르몬 대체 요법을 받았습니다. 부신 기능 저하증은 48명의 환자 중 29%에서 해결되었습니다. 부신 기능 저하증으로 인해 OPDIVO와 ipilimumab의 투약이 중단된 14명의 환자 중 11명은 증상이 호전된 후 치료를 재개했으며, 이 중 모든 환자는 호르몬 대체 요법을 받았고 2명(18%)은 부신 기능 저하증이 재발했습니다.
OPDIVO with Cabozantinib
OPDIVO와 cabozantinib를 투여받은 RCC 환자의 4.7%(15/320)에서 부신 기능 저하증이 발생했으며, 여기에는 3등급(2.2%) 및 2등급(1.9%)의 이상 반응이 포함됩니다. 부신 기능 저하증으로 인해 RCC 환자의 0.9%에서 OPDIVO와 cabozantinib의 영구적인 투약 중단이 발생했고, 2.8%에서 OPDIVO와 cabozantinib의 투약 중단이 발생했습니다.
부신 기능 저하증이 발생한 환자의 약 80%(12/15)는 전신 코르티코스테로이드를 포함한 호르몬 대체 요법을 받았습니다. 부신 기능 저하증은 15명의 환자 중 27%(n=4)에서 해결되었습니다. 부신 기능 저하증으로 인해 OPDIVO와 cabozantinib의 투약이 중단된 9명의 환자 중 6명은 증상이 호전된 후 치료를 재개했으며, 이 중 모든 환자(n=6)는 호르몬 대체 요법을 받았고 2명은 부신 기능 저하증이 재발했습니다.
Hypophysitis
OPDIVO는 면역 매개성 뇌하수체염을 유발할 수 있습니다. 뇌하수체염은 두통, 광선 공포증 또는 시야 결손과 같은 종괴 효과와 관련된 급성 증상으로 나타날 수 있습니다. 뇌하수체염은 뇌하수체 기능 저하증을 유발할 수 있습니다. 임상적으로 필요한 경우 호르몬 대체 요법을 시작하십시오. 심각도에 따라 OPDIVO를 투약 중단하거나 영구적으로 중단하십시오. [투약 및 투여(2.3) 참조].
OPDIVO as a Single Agent
단독 요법으로 OPDIVO를 투여받은 환자의 0.6%(12/1994)에서 뇌하수체염이 발생했으며, 여기에는 3등급(0.2%) 및 2등급(0.3%)의 이상 반응이 포함됩니다. 뇌하수체염으로 인해 OPDIVO의 영구적인 투약 중단은 <0.1%에서 발생했고, OPDIVO의 투약 중단은 0.2%에서 발생했습니다.
뇌하수체염이 발생한 환자의 약 67%(8/12)는 전신 코르티코스테로이드를 포함한 호르몬 대체 요법을 받았습니다. 뇌하수체염은 12명의 환자 중 42%에서 해결되었습니다. 뇌하수체염으로 인해 OPDIVO의 투약이 중단된 3명의 환자 중 2명은 증상이 호전된 후 OPDIVO를 재개했으며, 이 중 뇌하수체염이 재발한 환자는 없었습니다.
OPDIVO with Ipilimumab
OPDIVO 1 mg/kg with Ipilimumab 3 mg/kg: 3주마다 OPDIVO 1 mg/kg와 ipilimumab 3 mg/kg를 투여받은 흑색종 또는 HCC 환자의 9%(42/456)에서 뇌하수체염이 발생했으며, 여기에는 3등급(2.4%) 및 2등급(6%)의 이상 반응이 포함됩니다. 뇌하수체염으로 인해 OPDIVO와 ipilimumab의 영구적인 투약 중단은 0.9%에서 발생했고, OPDIVO와 ipilimumab의 투약 중단은 4.2%에서 발생했습니다.
뇌하수체염이 발생한 환자의 약 86%는 호르몬 대체 요법을 받았습니다. 뇌하수체염이 발생한 환자의 88%(37/42)에서 전신 코르티코스테로이드가 필요했습니다. 뇌하수체염은 42명의 환자 중 38%에서 해결되었습니다. 뇌하수체염으로 인해 OPDIVO와 ipilimumab의 투약이 중단된 19명의 환자 중 9명은 증상이 호전된 후 치료를 재개했으며, 이 중 1명(11%)은 뇌하수체염이 재발했습니다.
OPDIVO 3 mg/kg with Ipilimumab 1 mg/kg: 3주마다 OPDIVO 3 mg/kg와 ipilimumab 1 mg/kg를 투여받은 RCC 또는 CRC 환자의 4.4%(29/666)에서 뇌하수체염이 발생했으며, 여기에는 4등급(0.3%), 3등급(2.4%) 및 2등급(0.9%)의 이상 반응이 포함됩니다. 뇌하수체염으로 인해 RCC 또는 CRC 환자의 1.2%에서 OPDIVO와 ipilimumab의 영구적인 투약 중단이 발생했고, 2.1%에서 OPDIVO와 ipilimumab의 투약 중단이 발생했습니다.
뇌하수체염이 발생한 환자의 약 72%(21/29)는 전신 코르티코스테로이드를 포함한 호르몬 대체 요법을 받았습니다. 뇌하수체염은 29명의 환자 중 59%에서 해결되었습니다. 뇌하수체염으로 인해 OPDIVO와 ipilimumab의 투약이 중단된 14명의 환자 중 11명은 증상이 호전된 후 치료를 재개했으며, 이 중 2명(18%)은 뇌하수체염이 재발했습니다.
Thyroid Disorders
OPDIVO는 면역 매개성 갑상선 질환을 유발할 수 있습니다. 갑상선염은 내분비 질환이 있거나 없이 나타날 수 있습니다. 갑상선 기능 저하증은 갑상선 기능 항진증에 이어 발생할 수 있습니다. 임상적으로 필요한 경우 호르몬 대체 요법 또는 의학적 관리를 시작하십시오. 심각도에 따라 OPDIVO를 투약 중단하거나 영구적으로 중단하십시오. [투약 및 투여(2.3) 참조].
Thyroiditis
OPDIVO as a Single Agent
단독 요법으로 OPDIVO를 투여받은 환자의 0.6%(12/1994)에서 갑상선염이 발생했으며, 여기에는 2등급(0.2%)의 이상 반응이 포함됩니다. 갑상선염으로 인해 OPDIVO의 영구적인 투약 중단은 발생하지 않았고, OPDIVO의 투약 중단은 0.2%에서 발생했습니다.
갑상선염이 발생한 환자의 17%(2/12)에서 전신 코르티코스테로이드가 필요했습니다. 갑상선염은 12명의 환자 중 58%에서 해결되었습니다. 갑상선염으로 인해 OPDIVO의 투약이 중단된 3명의 환자 중 1명은 증상이 호전된 후 OPDIVO를 재개했으며, 갑상선염이 재발하지 않았습니다.
Hyperthyroidism
OPDIVO as a Single Agent
단독 요법으로 OPDIVO를 투여받은 환자의 2.7%(54/1994)에서 갑상선 기능 항진증이 발생했으며, 여기에는 3등급(<0.1%) 및 2등급(1.2%)의 이상 반응이 포함됩니다. 갑상선 기능 항진증으로 인해 OPDIVO의 영구적인 투약 중단은 발생하지 않았고, OPDIVO의 투약 중단은 0.4%에서 발생했습니다.
갑상선 기능 항진증이 발생한 환자의 약 19%는 메티마졸을, 7%는 카르비마졸을, 4%는 프로필티오우라실을 투여받았습니다. 갑상선 기능 항진증이 발생한 환자의 9%(5/54)에서 전신 코르티코스테로이드가 필요했습니다. 갑상선 기능 항진증은 54명의 환자 중 76%에서 해결되었습니다. 갑상선 기능 항진증으로 인해 OPDIVO의 투약이 중단된 7명의 환자 중 4명은 증상이 호전된 후 OPDIVO를 재개했으며, 이 중 갑상선 기능 항진증이 재발한 환자는 없었습니다.
OPDIVO with Ipilimumab
OPDIVO 1 mg/kg with Ipilimumab 3 mg/kg: 3주마다 OPDIVO 1 mg/kg와 ipilimumab 3 mg/kg를 투여받은 흑색종 또는 HCC 환자의 9%(42/456)에서 갑상선 기능 항진증이 발생했으며, 여기에는 3등급(0.9%) 및 2등급(4.2%)의 이상 반응이 포함됩니다. 갑상선 기능 항진증으로 인해 OPDIVO와 ipilimumab의 영구적인 투약 중단은 발생하지 않았고, OPDIVO와 ipilimumab의 투약 중단은 2.4%에서 발생했습니다.
약 26%의 갑상선 기능 항진증 환자는 메티마졸을 투여받았고 21%는 카르비마졸을 투여받았습니다. 전신 코르티코스테로이드는 17%(7/42)의 환자에게 필요했습니다. 갑상선 기능 항진증은 42명의 환자 중 91%에서 해결되었습니다. 갑상선 기능 항진증으로 인해 OPDIVO와 이필리무맙 투여가 중단된 11명의 환자 중 8명은 증상이 호전된 후 치료를 재개했으며, 이 중 1명(13%)은 갑상선 기능 항진증이 재발했습니다.
OPDIVO 3 mg/kg와 이필리무맙 1 mg/kg: 갑상선 기능 항진증은 3주마다 OPDIVO 3 mg/kg와 이필리무맙 1 mg/kg을 투여받은 RCC 또는 CRC 환자의 12%(80/666)에서 발생했으며, 이 중 3등급(0.6%)과 2등급(4.5%)의 이상 반응이 포함되었습니다. 갑상선 기능 항진증으로 인해 OPDIVO와 이필리무맙 투여가 영구적으로 중단된 환자는 없었으며, RCC 또는 CRC 환자의 2.3%에서 OPDIVO와 이필리무맙 투여가 중단되었습니다.
갑상선 기능 항진증이 발생한 RCC 또는 CRC 환자 80명 중 약 16%는 메티마졸을 투여받았고 3%는 카르비마졸을 투여받았습니다. 전신 코르티코스테로이드는 갑상선 기능 항진증 환자의 20%(16/80)에게 필요했습니다. 갑상선 기능 항진증은 80명의 환자 중 85%에서 해결되었습니다. 갑상선 기능 항진증으로 인해 OPDIVO와 이필리무맙 투여가 중단된 15명의 환자 중 11명은 증상이 호전된 후 치료를 재개했으며, 이 중 3명(27%)은 갑상선 기능 항진증이 재발했습니다.
저하증
단독 요법으로 사용되는 OPDIVO
저하증은 단독 요법으로 OPDIVO를 투여받은 환자의 8%(163/1994)에서 발생했으며, 이 중 3등급(0.2%)과 2등급(4.8%)의 이상 반응이 포함되었습니다. 저하증으로 인해 OPDIVO 투여가 영구적으로 중단된 환자는 없었으며, 환자의 0.5%에서 OPDIVO 투여가 중단되었습니다.
저하증이 발생한 환자의 약 79%는 르보티록신을 투여받았습니다. 전신 코르티코스테로이드는 저하증 환자의 3.1%(5/163)에게 필요했습니다. 저하증은 163명의 환자 중 35%에서 해결되었습니다. 저하증으로 인해 OPDIVO 투여가 중단된 9명의 환자 중 3명은 증상이 호전된 후 OPDIVO 투여를 재개했으며, 이 중 1명(33%)은 저하증이 재발했습니다.
OPDIVO와 이필리무맙
OPDIVO 1 mg/kg와 이필리무맙 3 mg/kg: 저하증은 3주마다 OPDIVO 1 mg/kg와 이필리무맙 3 mg/kg을 투여받은 흑색종 또는 HCC 환자의 20%(91/456)에서 발생했으며, 이 중 3등급(0.4%)과 2등급(11%)의 이상 반응이 포함되었습니다. 저하증으로 인해 OPDIVO와 이필리무맙 투여가 영구적으로 중단된 환자는 0.9%였으며, OPDIVO와 이필리무맙 투여가 중단된 환자는 0.9%였습니다.
저하증이 발생한 환자의 약 89%는 르보티록신을 투여받았습니다. 전신 코르티코스테로이드는 저하증 환자의 2.2%(2/91)에게 필요했습니다. 저하증은 91명의 환자 중 41%에서 해결되었습니다. 저하증으로 인해 OPDIVO와 이필리무맙 투여가 중단된 4명의 환자 중 2명은 증상이 호전된 후 치료를 재개했으며, 이 중 저하증이 재발한 환자는 없었습니다.
OPDIVO 3 mg/kg와 이필리무맙 1 mg/kg: 저하증은 3주마다 OPDIVO 3 mg/kg과 이필리무맙 1 mg/kg을 투여받은 RCC 또는 CRC 환자의 18%(122/666)에서 발생했으며, 이 중 3등급(0.6%)과 2등급(11%)의 이상 반응이 포함되었습니다. 저하증으로 인해 OPDIVO와 이필리무맙 투여가 영구적으로 중단된 환자는 0.2%였으며, RCC 또는 CRC 환자의 1.4%에서 OPDIVO와 이필리무맙 투여가 중단되었습니다.
저하증이 발생한 RCC 또는 CRC 환자 122명 중 약 82%는 르보티록신을 투여받았습니다. 전신 코르티코스테로이드는 저하증 환자의 7%(9/122)에게 필요했습니다. 저하증은 122명의 환자 중 27%에서 해결되었습니다. 저하증으로 인해 OPDIVO와 이필리무맙 투여가 중단된 9명의 환자 중 5명은 증상이 호전된 후 치료를 재개했으며, 이 중 1명(20%)은 저하증이 재발했습니다.
당뇨병성 케톤산증으로 나타날 수 있는 1형 당뇨병
고혈당증 또는 당뇨병의 다른 징후 및 증상에 대해 환자를 모니터링하십시오. 임상적으로 적응증에 따라 인슐린 치료를 시작하십시오. 중증도에 따라 OPDIVO 투여를 중단하십시오. [투여 및 관리(2.3) 참조].
단독 요법으로 사용되는 OPDIVO
당뇨병은 단독 요법으로 OPDIVO를 투여받은 환자의 0.9%(17/1994)에서 발생했으며, 이 중 3등급(0.4%)과 2등급(0.3%)의 이상 반응이 포함되었으며, 당뇨병성 케톤산증이 2건 발생했습니다. 당뇨병으로 인해 OPDIVO 투여가 영구적으로 중단된 환자는 없었으며, 환자의 0.1%에서 OPDIVO 투여가 중단되었습니다.
당뇨병이 발생한 환자(0/17)는 전신 코르티코스테로이드를 투여받지 않았습니다. 당뇨병은 17명의 환자 중 29%에서 해결되었습니다. 당뇨병으로 인해 OPDIVO 투여가 중단된 2명의 환자는 모두 증상이 호전된 후 OPDIVO 투여를 재개했으며, 이 중 당뇨병이 재발한 환자는 없었습니다.
신장 기능 장애를 동반한 면역 매개성 신염
OPDIVO는 스테로이드 사용이 필요하고 명확한 다른 원인이 없는 면역 매개성 신염을 유발할 수 있습니다.
단독 요법으로 사용되는 OPDIVO
면역 매개성 신염 및 신장 기능 장애는 단독 요법으로 OPDIVO를 투여받은 환자의 1.2%(23/1994)에서 발생했으며, 이 중 4등급(<0.1%), 3등급(0.5%) 및 2등급(0.6%)의 이상 반응이 포함되었습니다. 면역 매개성 신염 및 신장 기능 장애로 인해 OPDIVO 투여가 영구적으로 중단된 환자는 0.3%였으며, OPDIVO 투여가 중단된 환자는 0.4%였습니다.
전신 코르티코스테로이드는 신염 및 신장 기능 장애가 발생한 환자의 100%(23/23)에게 필요했습니다. 신염 및 신장 기능 장애는 23명의 환자 중 78%에서 해결되었습니다. 신염 또는 신장 기능 장애로 인해 OPDIVO 투여가 중단된 7명의 환자 중 7명은 증상이 호전된 후 OPDIVO 투여를 재개했으며, 이 중 1명(14%)은 신염 또는 신장 기능 장애가 재발했습니다.
면역 매개성 피부과적 이상 반응
OPDIVO는 스테로이드 사용이 필요하고 명확한 다른 원인이 없는 면역 매개성 발진 또는 피부염을 유발할 수 있습니다. 박탈성 피부염, 스티븐스-존슨 증후군, 독성 표피 괴사증(TEN) 및 DRESS(약물 발진, 호산구 증가증 및 전신 증상)는 PD-1/PD-L1 차단 항체로 인해 발생했습니다. 경미한 비박탈성 발진은 국소 연화제 및/또는 국소 코르티코스테로이드로 치료할 수 있습니다. 중증도에 따라 OPDIVO 투여를 중단하거나 영구적으로 중단하십시오. [투여 및 관리(2.3) 참조].
단독 요법으로 사용되는 OPDIVO
면역 매개성 발진은 환자의 9%(171/1994)에서 발생했으며, 이 중 3등급(1.1%)과 2등급(2.2%)의 이상 반응이 포함되었습니다. 면역 매개성 발진으로 인해 OPDIVO 투여가 영구적으로 중단된 환자는 0.3%였으며, OPDIVO 투여가 중단된 환자는 0.5%였습니다.
면역 매개 발진이 있는 환자의 100%(171/171)에서 전신 코르티코스테로이드가 필요했습니다. 발진은 171명의 환자 중 72%에서 해결되었습니다. 면역 매개 발진으로 인해 OPDIVO가 중단된 10명의 환자 중 9명은 증상이 호전된 후 OPDIVO를 재개했습니다. 이 중 3명(33%)은 면역 매개 발진이 재발했습니다.
OPDIVO와 이필리무맙
OPDIVO 1mg/kg와 이필리무맙 3mg/kg: 3주마다 OPDIVO 1mg/kg와 이필리무맙 3mg/kg을 투여받은 흑색종 또는 HCC 환자의 28%(127/456)에서 면역 매개 발진이 발생했으며, 여기에는 3등급(4.8%) 및 2등급(10%) 이상 반응이 포함됩니다. 면역 매개 발진은 환자의 0.4%에서 OPDIVO와 이필리무맙의 영구적인 중단으로 이어졌고, 환자의 3.9%에서 OPDIVO와 이필리무맙의 중단으로 이어졌습니다.
면역 매개 발진이 있는 환자의 100%(127/127)에서 전신 코르티코스테로이드가 필요했습니다. 발진은 127명의 환자 중 84%에서 해결되었습니다. 면역 매개 발진으로 인해 OPDIVO와 이필리무맙이 중단된 18명의 환자 중 15명은 증상이 호전된 후 치료를 재개했습니다. 이 중 8명(53%)은 면역 매개 발진이 재발했습니다.
OPDIVO 3mg/kg와 이필리무맙 1mg/kg: 3주마다 OPDIVO 3mg/kg와 이필리무맙 1mg/kg을 투여받은 RCC 또는 CRC 환자의 16%(108/666)에서 면역 매개 발진이 발생했으며, 여기에는 3등급(3.5%) 및 2등급(4.2%) 이상 반응이 포함됩니다. 면역 매개 발진은 환자의 0.5%에서 OPDIVO와 이필리무맙의 영구적인 중단으로 이어졌고, RCC 또는 CRC 환자의 2.0%에서 OPDIVO와 이필리무맙의 중단으로 이어졌습니다.
면역 매개 발진이 있는 환자의 100%(108/108)에서 전신 코르티코스테로이드가 필요했습니다. 발진은 108명의 환자 중 75%에서 해결되었습니다. 면역 매개 발진으로 인해 OPDIVO와 이필리무맙이 중단된 13명의 환자 중 11명은 증상이 호전된 후 치료를 재개했습니다. 이 중 5명(46%)은 면역 매개 발진이 재발했습니다.
기타 면역 매개 이상 반응
OPDIVO 또는 OPDIVO와 이필리무맙 병용 투여를 받은 환자에서 발생 빈도가 1% 미만(달리 명시되지 않는 한)인 다음과 같은 임상적으로 중요한 면역 매개 이상 반응이 발생했거나 다른 PD-1/PD-L1 차단 항체 사용과 관련하여 보고되었습니다. 이러한 이상 반응 중 일부는 심각하거나 치명적인 경우가 보고되었습니다.
심혈관계: 심근염, 심낭염, 혈관염
신경계: 수막염, 뇌염, 척수염 및 탈수초, 근무력증 증후군/중증 근무력증(악화 포함), 길랭-바레 증후군, 신경 마비, 자가 면역 신경병증
안과적: 포도막염, 홍채염 및 기타 안구 염증 독성이 발생할 수 있습니다. 일부 경우 망막 박리가 동반될 수 있습니다. 실명을 포함한 다양한 등급의 시력 장애가 발생할 수 있습니다. 포도막염이 다른 면역 매개 이상 반응과 함께 발생하는 경우, 영구적인 시력 상실 위험을 줄이기 위해 전신 스테로이드로 치료가 필요할 수 있는 포그트-코야나기-하라다 증후군과 같은 증후군을 고려하십시오.
위장관: 췌장염(혈청 아밀라아제 및 리파아제 수치 증가 포함), 위염, 십이지장염
근골격계 및 결합 조직: 근염/다발성 근염, 횡문근 융해증 및 신부전, 관절염, 다발성 근육통을 포함한 관련 후유증
내분비: 저칼슘혈증
기타(혈액학적/면역학적): 용혈성 빈혈, 재생 불량성 빈혈, 식세포성 림프조직구증, 전신 염증 반응 증후군, 조직구 괴사성 림프절염(키쿠치 림프절염), 사르코이드증, 면역 혈소판 감소성 자반증, 고형 장기 이식 거부 반응, 기타 이식(각막 이식 포함) 거부 반응
5.2 주입 관련 반응
OPDIVO는 심각한 주입 관련 반응을 유발할 수 있으며, 임상 시험에서 환자의 1.0% 미만에서 보고되었습니다. 심각하거나 생명을 위협하는 주입 관련 반응이 있는 환자에게는 OPDIVO를 중단하십시오. 경증 또는 중등도 주입 관련 반응이 있는 환자에게는 주입 속도를 중단하거나 늦추십시오. [투여 및 관리(2.3) 참조].
단독 요법으로서의 OPDIVO
60분 정맥 주입으로 OPDIVO를 투여받은 환자의 6.4%(127/1994)에서 주입 관련 반응이 발생했습니다.
더 빠른 주입의 약동학 및 안전성을 평가한 시험에서 환자는 60분 정맥 주입 또는 30분 정맥 주입으로 OPDIVO를 투여받았으며, 각각 환자의 2.2%(8/368) 및 2.7%(10/369)에서 주입 관련 반응이 발생했습니다. 또한 각각 환자의 0.5%(2/368) 및 1.4%(5/369)에서 주입 후 48시간 이내에 OPDIVO의 투여 지연, 영구적인 중단 또는 중단으로 이어지는 이상 반응이 발생했습니다.
OPDIVO와 이필리무맙
OPDIVO 1mg/kg와 이필리무맙 3mg/kg
3주마다 OPDIVO 1mg/kg와 이필리무맙 3mg/kg을 투여받은 흑색종 환자의 2.5%(10/407)와 HCC 환자의 8%(4/49)에서 주입 관련 반응이 발생했습니다.
OPDIVO 3mg/kg와 이필리무맙 1mg/kg
3주마다 OPDIVO 3mg/kg와 이필리무맙 1mg/kg을 투여받은 RCC 환자의 5.1%(28/547)와 CRC 환자의 4.2%(5/119)에서 각각 주입 관련 반응이 발생했습니다. 2주마다 OPDIVO 3mg/kg과 6주마다 이필리무맙 1mg/kg을 투여받은 악성 흉막 중피종 환자의 12%(37/300)에서 주입 관련 반응이 발생했습니다.
5.3 동종 조혈모세포 이식의 합병증
PD-1 수용체 차단 항체로 치료하기 전 또는 후에 동종 조혈모세포 이식(HSCT)을 받은 환자에서 치명적인 합병증을 포함한 심각한 합병증이 발생할 수 있습니다. 이식 관련 합병증에는 급성 거부반응(GVHD), 만성 GVHD, 감소 강도 조절 후 간 정맥 폐쇄 질환(VOD) 및 스테로이드 요법이 필요한 발열 증후군(확인된 감염 원인 없음)이 포함됩니다. [부작용(6.1) 참조]. 이러한 합병증은 PD-1 차단과 동종 HSCT 사이에 중재 치료가 있더라도 발생할 수 있습니다.
이식 관련 합병증의 증거를 주의 깊게 관찰하고 즉시 개입하십시오. 동종 HSCT 전 또는 후에 PD-1 수용체 차단 항체로 치료할 때 이점과 위험을 고려하십시오.
5.4 태아 독성
작용 기전 및 동물 연구 데이터를 기반으로 OPDIVO는 임산부에게 투여하면 태아에게 해를 끼칠 수 있습니다. 동물 생식 연구에서, 기관 형성 시작부터 분만까지 시노몰구스 원숭이에게 니볼루맙을 투여한 결과 유산 및 조산아 사망률이 증가했습니다. 임산부에게 태아에 대한 잠재적 위험을 알리십시오. 임신 가능성이 있는 여성에게는 OPDIVO 치료 중 및 마지막 투여 후 5개월 동안 효과적인 피임 방법을 사용하도록 조언하십시오. [특정 집단에서의 사용(8.1), 8.3) 참조].
5.5 다발성 골수종 환자에서 OPDIVO를 탈리도마이드 유사체 및 덱사메타손에 추가했을 때 사망률 증가
다발성 골수종 환자를 대상으로 한 무작위 대조 임상 시험에서, PD-1 또는 PD-L1 차단 항체가 적응증이 없는 탈리도마이드 유사체와 덱사메타손에 PD-1 차단 항체(OPDIVO 포함)를 추가했을 때 사망률이 증가했습니다. 탈리도마이드 유사체와 덱사메타손과 함께 PD-1 또는 PD-L1 차단 항체로 다발성 골수종 환자를 치료하는 것은 통제된 임상 시험 외부에서는 권장하지 않습니다.
6. 부작용
다음 임상적으로 유의미한 유해 반응은 라벨링의 다른 부분에서 설명됩니다.
- •
- 중증 및 치명적인 면역 매개 유해 반응 [경고 및 주의 사항 (5.1) 참조]
- •
- 주입 관련 반응 [경고 및 주의 사항 (5.2) 참조]
- •
- 동종 이식 HSCT의 합병증 [경고 및 주의 사항 (5.3) 참조]
6.1 임상 시험 경험
임상 시험은 매우 다양한 조건에서 수행되므로, 약물의 임상 시험에서 관찰된 유해 반응 발생률은 다른 약물의 임상 시험에서 관찰된 발생률과 직접 비교할 수 없으며 실제에서 관찰된 발생률을 반영하지 않을 수 있습니다.
경고 및 주의 사항의 데이터는 CHECKMATE-037, CHECKMATE-017, CHECKMATE-057, CHECKMATE-066, CHECKMATE-025, CHECKMATE-067, CHECKMATE-205, CHECKMATE-039에 등록된 1994명의 환자에서 단일 요법으로 OPDIVO에 대한 노출을 반영하며, NSCLC(n=117)의 단일군 시험; CHECKMATE-067(n=313), CHECKMATE-040(n=49), 또는 다른 무작위 시험(n=94)에 등록된 환자에서 ipilimumab 3 mg/kg과 함께 OPDIVO 1 mg/kg; CHECKMATE-214 또는 CHECKMATE-142에 등록된 환자에서 ipilimumab 1 mg/kg과 함께 OPDIVO 3 mg/kg(n=666); CHECKMATE-227(n=576) 또는 CHECKMATE-743(n=300)에 등록된 환자에서 2주마다 OPDIVO 3 mg/kg과 6주마다 ipilimumab 1 mg/kg; CHECKMATE-9LA(n=361)에서 ipilimumab 1 mg/kg과 백금 이중 약물 화학 요법 2 사이클과 함께 OPDIVO 360 mg; 그리고 CHECKMATE-9ER(n=320)에 등록된 환자에서 cabozantinib 40 mg과 함께 OPDIVO 240 mg.
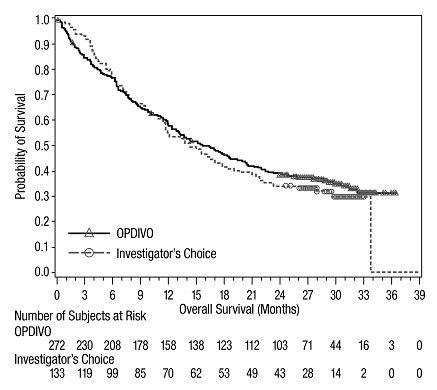
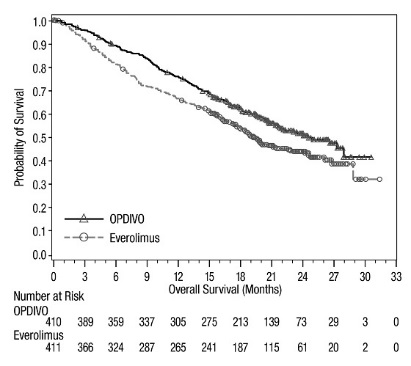
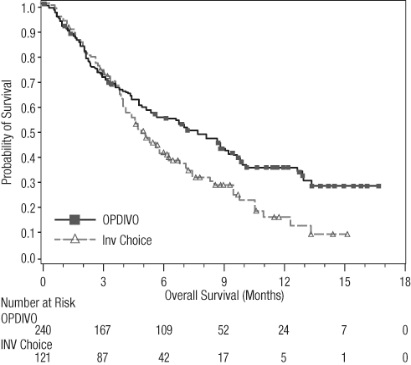
절제 불가능하거나 전이성 흑색종
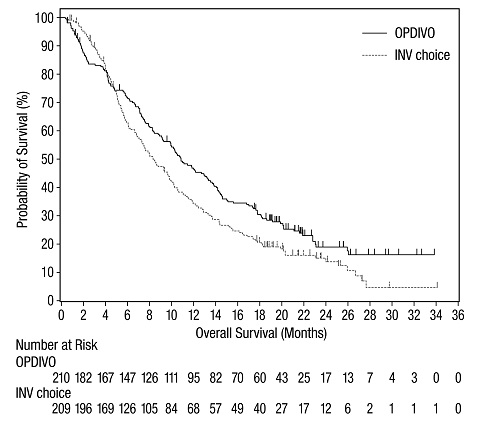
이전에 치료받은 전이성 흑색종
OPDIVO의 안전성은 370명의 절제 불가능하거나 전이성 흑색종 환자를 대상으로 한 무작위, 공개 라벨 시험인 CHECKMATE-037에서 평가되었습니다. [임상 연구 (14.1) 참조] 환자는 ipilimumab 치료 후 질병 진행이 확인되었으며, BRAF V600 돌연변이 양성인 경우 BRAF 억제제를 투여받았습니다. 이 시험은 자가 면역 질환, 이전 ipilimumab 관련 4등급 유해 반응(내분비 질환 제외) 또는 12주 이내에 해결되지 않았거나 적절히 조절되지 않은 3등급 ipilimumab 관련 유해 반응이 있는 환자, 만성적인 전신 코르티코스테로이드 치료(1일 10mg 이상의 프레드니손 등가물) 또는 다른 면역 억제제를 필요로 하는 환자, B형 또는 C형 간염 검사 양성 환자, HIV 병력이 있는 환자를 제외했습니다. 환자는 2주마다 60분 동안 정맥 주입으로 OPDIVO 3 mg/kg(n=268) 또는 연구자의 선택에 따라 화학 요법(n=102)을 투여받았습니다: 3주마다 정맥 주입으로 다카바진 1000 mg/m2 또는 3주마다 정맥 주입으로 카보플라틴 AUC 6 mg/mL/min 및 팍리탁셀 175 mg/m2. OPDIVO 치료 환자의 중간 노출 기간은 5.3개월(범위: 1일~13.8개월 이상)이었고, 화학 요법 치료 환자의 중간 노출 기간은 2개월(범위: 1일~9.6개월 이상)이었습니다. 이 진행 중인 시험에서 24%의 환자가 6개월 이상 OPDIVO를 투여받았고, 3%의 환자가 1년 이상 OPDIVO를 투여받았습니다.
OPDIVO 그룹과 화학 요법 그룹의 인구 통계적 특징은 유사했습니다: 남성 66%, 중간 연령 59.5세, 백인 98%, 기준선 동부 협력 종양학 그룹(ECOG) 수행 상태 0(59%) 또는 1(41%), M1c 병기 질환 74%, 피부 흑색종 73%, 점막 흑색종 11%, 73%가 진행성 또는 전이성 질환에 대한 2회 이상의 이전 치료를 받았으며, 18%가 뇌 전이를 가졌습니다. 기준선에서 젖산 탈수소 효소(LDH)가 상승한 환자는 OPDIVO 그룹에 더 많았습니다(51% 대 38%).
OPDIVO를 투여받은 환자의 41%에서 심각한 유해 반응이 발생했습니다. OPDIVO는 9%의 환자에서 유해 반응으로 인해 중단되었습니다. OPDIVO를 투여받은 환자의 26%에서 유해 반응으로 인해 투여량이 중단되었습니다. OPDIVO를 투여받은 환자의 42%에서 3등급 및 4등급 유해 반응이 발생했습니다. OPDIVO를 투여받은 환자의 2%~5% 미만에서 보고된 가장 흔한 3등급 및 4등급 유해 반응은 복통, 저나트륨혈증, 아스파르테이트 아미노트랜스퍼라제 증가, 리파아제 증가였습니다. 가장 흔한 유해 반응(환자의 20% 이상에서 보고됨)은 발진이었습니다.
표 5와 6은 각각 CHECKMATE-037에서 유해 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 구진성 발진, 홍반성 발진, 가려움증 발진, 모낭성 발진, 반점성 발진, 구진성 발진, 농포성 발진, 수포성 발진, 여드름형 피부염을 포함합니다. b 비염, 인두염, 비인두염을 포함합니다. |
||||
|
유해 반응 |
OPDIVO |
화학 요법 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
피부 및 피하 조직 |
||||
|
발진a |
21 |
0.4 |
7 |
0 |
|
가려움증 |
19 |
0 |
3.9 |
0 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침 |
17 |
0 |
6 |
0 |
|
감염 |
||||
|
상기도 감염b |
11 |
0 |
2 |
0 |
|
일반 |
||||
|
말초 부종 |
10 |
0 |
5 |
0 |
OPDIVO를 투여받은 환자의 10% 미만에서 임상적으로 중요한 유해 반응이 나타났습니다.
심장 질환: 심실 부정맥
안과 질환: 홍채 모양체염
일반적인 장애 및 투여 부위 상태: 주입 관련 반응
검사: 아밀라아제 증가, 리파아제 증가
신경계 장애: 현기증, 말초 및 감각 신경병증
피부 및 피하 조직 장애: 박탈성 피부염, 다형 홍반, 백반증, 건선
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 그룹 (범위: 252~256명) 및 화학 요법 그룹 (범위: 94~96명). | ||||
|
실험실 이상 |
OPDIVO |
화학 요법 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
AST 증가 |
28 |
2.4 |
12 |
1 |
|
저나트륨혈증 |
25 |
5 |
18 |
1.1 |
|
알칼리성 포스파타아제 증가 |
22 |
2.4 |
13 |
1.1 |
|
ALT 증가 |
16 |
1.6 |
5 |
0 |
|
고칼륨혈증 |
15 |
2 |
6 |
0 |
이전에 치료받지 않은 전이성 흑색종
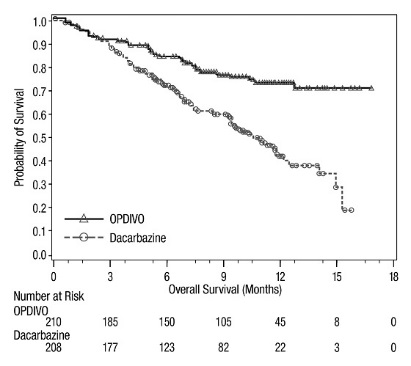
CHECKMATE-066
OPDIVO의 안전성은 또한 BRAF V600 야생형 절제 불가능 또는 전이성 흑색종이 있는 이전에 치료받지 않은 환자 411명을 대상으로 한 무작위 배정, 이중 맹검, 활성 대조군 시험인 CHECKMATE-066에서 평가되었습니다. [임상 연구(14.1) 참조]. 이 시험은 자가 면역 질환이 있는 환자와 코르티코스테로이드(프레드니손 등가물 1일 10mg 초과) 또는 기타 면역 억제제로 만성적인 전신 치료가 필요한 환자를 제외했습니다. 환자는 OPDIVO 3mg/kg을 2주마다 60분 동안 정맥 주입으로 투여받았습니다(n=206) 또는 3주마다 정맥 주입으로 다카바진 1000mg/m2를 투여받았습니다(n=205). OPDIVO 치료 환자의 중간 노출 기간은 6.5개월(범위: 1일~16.6개월)이었습니다. 이 시험에서 환자의 47%가 OPDIVO를 6개월 이상 투여받았고 환자의 12%가 OPDIVO를 1년 이상 투여받았습니다.
OPDIVO 그룹과 다카바진 그룹의 시험 인구 특성: 남성 59%, 중간 연령 65세, 백인 99.5%, M1c 병기 질환 61%, 피부 흑색종 74%, 점막 흑색종 11%, 뇌 전이 4%, 기준선에서 LDH 상승 37%. ECOG 수행 상태 0인 환자가 OPDIVO 그룹에 더 많았습니다(71% 대 59%).
OPDIVO를 투여받은 환자의 36%에서 심각한 이상 반응이 발생했습니다. 이상 반응으로 인해 환자의 7%에서 OPDIVO 투여가 영구적으로 중단되었고 환자의 26%에서 투여량이 중단되었습니다. 단일 유형의 이상 반응이 OPDIVO 투여 중단의 대부분을 차지하지 않았습니다. OPDIVO를 투여받은 환자의 41%에서 3등급 및 4등급 이상 반응이 발생했습니다.
OPDIVO를 투여받은 환자의 2% 이상에서 보고된 가장 빈번한 3등급 및 4등급 이상 반응은 감마-글루타밀 전이효소 증가(3.9%)와 설사(3.4%)였습니다. 가장 흔한 이상 반응(환자의 20% 이상에서 보고되었으며 다카바진 군보다 발생률이 높았음)은 피로, 근골격계 통증, 발진 및 가려움증이었습니다.
표 7과 8은 각각 CHECKMATE-066에서 선택된 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 안와 주위 부종, 얼굴 부종, 전신 부종, 중력 부종, 국소 부종, 말초 부종, 폐 부종 및 림프 부종을 포함합니다. b 등 통증, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증, 턱 통증 및 척추 통증을 포함합니다. c 구진 구진성 발진, 홍반성 발진, 가려운 발진, 모낭성 발진, 반점성 발진, 구진성 발진, 농포성 발진, 수포성 발진, 피부염, 알레르기성 피부염, 박탈성 피부염, 여드름형 피부염, 약물 발진 및 피부 반응을 포함합니다. d 비염, 바이러스성 비염, 인두염 및 비인두염을 포함합니다. |
||||
|
이상 반응 |
OPDIVO |
다카바진 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||
|
피로 |
49 |
1.9 |
39 |
3.4 |
|
부종a |
12 |
1.5 |
4.9 |
0 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증b |
32 |
2.9 |
25 |
2.4 |
|
피부 및 피하 조직 |
||||
|
발진c |
28 |
1.5 |
12 |
0 |
|
가려움증 |
23 |
0.5 |
12 |
0 |
|
백반증 |
11 |
0 |
0.5 |
0 |
|
홍반 |
10 |
0 |
2.9 |
0 |
|
감염 |
||||
|
상기도 감염d |
17 |
0 |
6 |
0 |
OPDIVO를 투여받은 환자의 10% 미만에서 임상적으로 중요한 부작용이 나타났습니다.
신경계 장애: 말초 신경병증
| a 각 검사 발생률은 기준선과 연구 중 적어도 한 번의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 군(범위: 194~197명) 및 다카바진 군(범위: 186~193명). | ||||
|
실험실 이상 |
OPDIVO |
다카바진 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
ALT 증가 |
25 |
3 |
19 |
0.5 |
|
AST 증가 |
24 |
3.6 |
19 |
0.5 |
|
알칼리성 포스파타제 증가 |
21 |
2.6 |
14 |
1.6 |
|
빌리루빈 증가 |
13 |
3.1 |
6 |
0 |
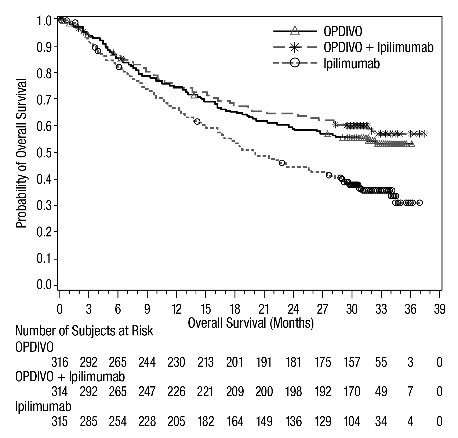
CHECKMATE-067
OPDIVO는 이피리무맙과 병용 투여하거나 단독 요법으로 투여했을 때, 이전에 치료를 받지 않은 절제 불가능하거나 전이성 흑색종 환자 937명을 대상으로 한 무작위 배정(1:1:1), 이중 맹검 시험인 CHECKMATE-067에서 안전성을 평가했습니다. [임상 연구(14.1) 참조] 이 시험은 자가 면역 질환, 연구 치료 시작 14일 이내에 코르티코스테로이드(프레드니손 등가물 1일 10mg 초과) 또는 기타 면역 억제제로 전신 치료가 필요한 의학적 상태, B형 또는 C형 간염에 대한 양성 검사 결과 또는 HIV 병력이 있는 환자를 제외했습니다.
환자는 다음과 같이 무작위 배정되었습니다.
- •
- OPDIVO 1mg/kg을 60분 동안 정맥 주입으로 투여하고 이피리무맙 3mg/kg을 3주마다 정맥 주입으로 4회 투여한 후 OPDIVO를 단독 요법으로 2주마다 3mg/kg을 60분 동안 정맥 주입으로 투여(OPDIVO 및 이피리무맙 군; n=313), 또는
- •
- OPDIVO 3mg/kg을 2주마다 60분 동안 정맥 주입으로 투여(OPDIVO 군; n=313), 또는
- •
- 이피리무맙 3mg/kg을 3주마다 최대 4회 정맥 주입으로 투여(이피리무맙 군; n=311).
OPDIVO에 대한 노출 기간 중앙값은 OPDIVO 및 이피리무맙 군에서 2.8개월(범위: 1일~36.4개월), OPDIVO 군에서 6.6개월(범위: 1일~36.0개월)이었습니다. OPDIVO 및 이피리무맙 군에서 39%가 ≥6개월 동안 OPDIVO에 노출되었고 30%가 1년 이상 노출되었습니다. OPDIVO 군에서 53%가 ≥6개월 동안 노출되었고 40%가 1년 이상 노출되었습니다.
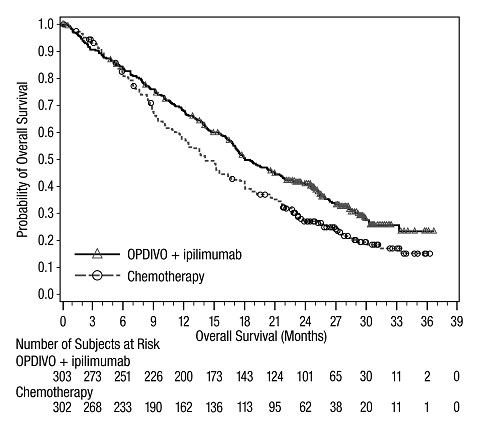
인구 통계적 특징은 다음과 같습니다. 남성 65%, 중앙값 연령 61세, 백인 97%, 기준 ECOG 수행 상태 0(73%) 또는 1(27%), 93%가 미국 암 공동위원회(AJCC) 4기 질환, 58%가 M1c기 질환; 기준 LDH 상승 36%, 뇌 전이 병력 4%, 22%가 보조 요법을 받았습니다.
중증 이상 반응(74% 및 44%), 영구적으로 중단(47% 및 18%) 또는 투약 지연(58% 및 36%)으로 이어진 이상 반응, 3등급 또는 4등급 이상 반응(72% 및 51%)은 모두 OPDIVO 및 이피리무맙 군에서 OPDIVO 군에 비해 더 자주 발생했습니다.
OPDIVO 및 이피리무맙 군과 OPDIVO 군에서 가장 흔한(≥10%) 중증 이상 반응은 각각 설사(13% 및 2.2%), 대장염(10% 및 1.9%), 발열(10% 및 1.0%)이었습니다. OPDIVO 및 이피리무맙 군에서 두 약물 모두 중단으로 이어진 가장 흔한 이상 반응과 OPDIVO 군에서 OPDIVO 중단으로 이어진 가장 흔한 이상 반응은 각각 대장염(10% 및 0.6%), 설사(8% 및 2.2%), ALT 상승(4.8% 및 1.0%), AST 상승(4.5% 및 0.6%), 폐렴(1.9% 및 0.3%)이었습니다.
OPDIVO 및 이피리무맙 군에서 가장 흔한(≥20%) 이상 반응은 피로, 설사, 발진, 메스꺼움, 발열, 가려움증, 근골격계 통증, 구토, 식욕 감소, 기침, 두통, 호흡 곤란, 상기도 감염, 관절통, 트랜스아미나제 상승이었습니다. OPDIVO 군에서 가장 흔한(≥20%) 이상 반응은 피로, 발진, 근골격계 통증, 설사, 메스꺼움, 기침, 가려움증, 상기도 감염, 식욕 감소, 두통, 변비, 관절통, 구토였습니다.
표 9와 10은 CHECKMATE-067에서 이상 반응과 실험실 이상의 발생률을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 무력증 및 피로 포함. b 농포성 발진, 피부염, 여드름 모양 피부염, 알레르기성 피부염, 아토피성 피부염, 수포성 피부염, 박탈성 피부염, 건선 모양 피부염, 약물 발진, 박탈성 발진, 홍반성 발진, 전신 발진, 반점 발진, 반점 구진성 발진, 홍역 모양 발진, 구진성 발진, 구진 인설성 발진, 가려운 발진 포함. c 등 통증, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증, 척추 통증 포함. d 상기도 감염, 비인두염, 인두염, 비염 포함. e 고혈압 및 혈압 상승 포함. |
||||||
|
이상 반응 |
OPDIVO 및 이피리무맙 |
OPDIVO |
이피리무맙 |
|||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||||
|
피로a |
62 |
7 |
59 |
1.6 |
51 |
4.2 |
|
발열 |
40 |
1.6 |
16 |
0 |
18 |
0.6 |
|
위장 |
||||||
|
설사 |
54 |
11 |
36 |
5 |
47 |
7 |
|
메스꺼움 |
44 |
3.8 |
30 |
0.6 |
31 |
1.9 |
|
구토 |
31 |
3.8 |
20 |
1 |
17 |
1.6 |
|
피부 및 피하 조직 |
||||||
|
발진b |
53 |
6 |
40 |
1.9 |
42 |
3.5 |
|
백반증 |
9 |
0 |
10 |
0.3 |
5 |
0 |
|
근골격계 및 결합 조직 |
||||||
|
근골격계 통증c |
32 |
2.6 |
42 |
3.8 |
36 |
1.9 |
|
관절통 |
21 |
0.3 |
21 |
1 |
16 |
0.3 |
|
신진대사 및 영양 |
||||||
|
식욕 감퇴 |
29 |
1.9 |
22 |
0 |
24 |
1.3 |
|
호흡기, 흉곽 및 종격동 |
||||||
|
기침/객담 동반 기침 |
27 |
0.3 |
28 |
0.6 |
22 |
0 |
|
호흡곤란/운동성 호흡곤란 |
24 |
2.9 |
18 |
1.3 |
17 |
0.6 |
|
감염 |
||||||
|
상기도 감염d |
23 |
0 |
22 |
0.3 |
17 |
0 |
|
내분비 |
||||||
|
저하갑상선증 |
19 |
0.6 |
11 |
0 |
5 |
0 |
|
갑상선 기능 항진증 |
11 |
1.3 |
6 |
0 |
1 |
0 |
|
검사 |
||||||
|
체중 감소 |
12 |
0 |
7 |
0 |
7 |
0.3 |
|
혈관 |
||||||
|
고혈압e |
7 |
2.2 |
11 |
5 |
9 |
2.3 |
OPDIVO와 이필리무맙 병용 투여 또는 단독 OPDIVO 투여를 받은 환자의 10% 미만에서 임상적으로 중요한 유해 반응이 나타났습니다.
위장관 장애: 구내염, 장 천공
피부 및 피하 조직 장애: 백반증
근골격계 및 결합 조직 장애: 근병증, 쇼그렌 증후군, 척추 관절병증, 근염(다발성 근염 포함)
신경계 장애: 신경염, 비골 신경 마비
| a 각 검사 발생률은 기준선과 연구 중 적어도 한 번의 실험실 검사 측정값이 모두 있는 환자 수를 기반으로 합니다. OPDIVO와 이필리무맙(범위: 75~297); OPDIVO(범위: 81~306); 이필리무맙(범위: 61~301). | ||||||
|
실험실 검사 이상 |
OPDIVO와 이필리무맙 |
OPDIVO |
이필리무맙 |
|||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||||
|
ALT 증가 |
55 |
16 |
25 |
3 |
29 |
2.7 |
|
고혈당 |
53 |
5.3 |
46 |
7 |
26 |
0 |
|
AST 증가 |
52 |
13 |
29 |
3.7 |
29 |
1.7 |
|
저나트륨혈증 |
45 |
10 |
22 |
3.3 |
26 |
7 |
|
리파아제 증가 |
43 |
22 |
32 |
12 |
24 |
7 |
|
알칼리성 |
41 |
6 |
27 |
2 |
23 |
2 |
저칼슘혈증
31
1.1
15
0.7
20
0.7
아밀라아제 증가
27
10
19
2.7
15
1.6
크레아티닌 증가
26
2.7
19
0.7
17
1.3
Hematology
빈혈
52
2.7
41
2.6
41
6
림프구 감소증
39
5
41
4.9
29
4
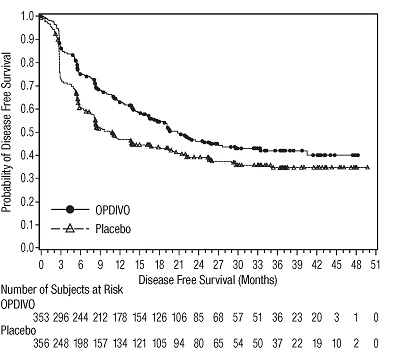
멜라노마의 보조 치료
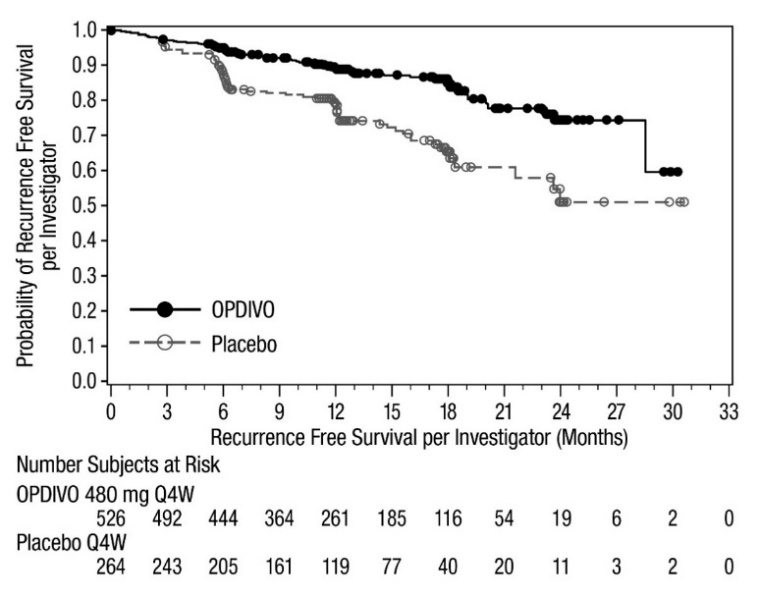
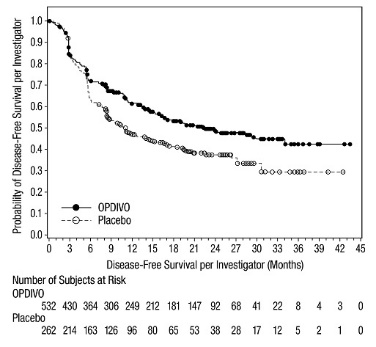
CHECKMATE-76K
OPDIVO의 단독 요법으로서의 안전성은 완전히 절제된 IIB/C기 멜라노마 환자 788명을 대상으로 한 무작위(2:1), 이중맹검 시험인 CHECKMATE-76K에서 평가되었으며, 이 환자들은 4주마다 30분 동안 정맥 주입으로 OPDIVO 480mg을 투여받았습니다(n=524) 또는 4주마다 30분 동안 정맥 주입으로 위약을 투여받았습니다(n=264). 최대 1년 동안 [임상 연구(14.2) 참조]. OPDIVO로 치료받은 환자의 중간 노출 기간은 11개월이었고 위약으로 치료받은 환자의 중간 노출 기간은 11개월이었습니다.
OPDIVO로 치료받은 환자의 18%에서 심각한 이상 반응이 발생했습니다. 치명적인 이상 반응은 1명(0.2%) 환자(심부전 및 급성 신장 손상)에서 발생했습니다. 이상 반응으로 인해 OPDIVO를 영구적으로 중단한 환자는 17%였습니다. OPDIVO를 영구적으로 중단한 환자의 1% 이상에서 발생한 이상 반응에는 설사(1.1%), 관절통(1.7%) 및 발진(1.7%)이 포함되었습니다.
이상 반응으로 인해 OPDIVO 투여를 중단한 환자는 25%였습니다. 1% 이상의 환자에서 투여량 중단을 요구한 이상 반응에는 COVID-19 감염, 주입 관련 반응, 설사, 관절통 및 ALT 증가가 포함되었습니다.
가장 흔한 이상 반응(환자의 20% 이상에서 보고됨)은 피로, 근골격계 통증, 발진, 설사 및 가려움증이었습니다.
표 11과 12는 각각 CHECKMATE-76K에서 발생한 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v5에 따라 등급이 매겨졌습니다. a 무력증 포함. b 관절통, 관절염, 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근골격계 경직, 근육통, 목 통증, 비심장성 흉통, 척추 통증, 사지 통증 포함. c 피부염, 여드름 모양 피부염, 습진성 습진, 습진, 건조 습진, 눈꺼풀 발진, 생식기 발진, 천포창, 음경 발진, 홍반성 발진, 모낭성 발진, 반점 발진, 반점-구진성 발진, 구진성 발진, 가려운 발진, 농포성 발진, 수포성 발진, 피부 박리, 독성 피부 발진 포함. d 자가 면역성 대장염, 대장염, 설사, 장염, 장염 포함. e 자가 면역성 갑상선 저하증, 혈액 갑상선 자극 호르몬 증가 포함. f 군발 두통, 편두통 포함. |
||||
|
이상 반응 |
OPDIVO |
위약 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||
|
피로a |
36 |
0.4 |
34 |
0.4 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증b |
30 |
0.4 |
26 |
0.4 |
|
피부 및 피하 조직 |
||||
|
발진c |
28 |
1.1 |
15 |
0.4 |
|
가려움증 |
20 |
0.2 |
11 |
0 |
|
위장관 |
||||
|
설사d |
23 |
1.3 |
16 |
0 |
|
메스꺼움 |
14 |
0 |
11 |
0 |
|
내분비 |
||||
|
저갑상선증e |
14 |
0 |
2.3 |
0 |
|
신경계 |
||||
|
두통f |
12 |
0.2 |
14 |
0.8 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 그룹(범위: 262~513명) 및 위약 그룹(범위: 138~261명). | ||||
|
실험실 이상 |
OPDIVO |
위약 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
빈혈 |
19 |
0 |
14 |
0 |
|
림프구 감소증 |
17 |
1.1 |
17 |
1.7 |
|
호중구 감소증 |
10 |
0 |
10 |
0.4 |
|
화학 |
||||
|
AST 증가 |
25 |
2.2 |
16 |
0.4 |
|
리파아제 증가 |
22 |
2.9 |
21 |
2.3 |
|
ALT 증가 |
20 |
2.1 |
15 |
0.4 |
|
아밀라아제 증가 |
17 |
0.4 |
9 |
0 |
|
크레아티닌 증가 |
15 |
0.4 |
13 |
0 |
|
나트륨 감소 |
13 |
0.6 |
11 |
0.4 |
|
칼륨 증가 |
13 |
1 |
15 |
1.1 |
CHECKMATE-238
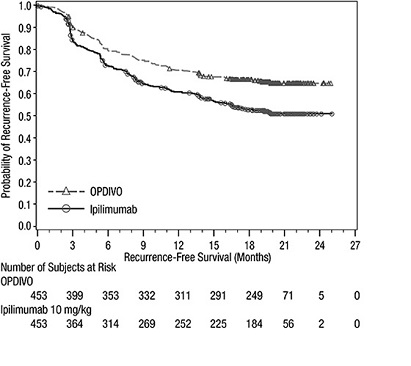
OPDIVO의 단독 요법의 안전성은 완전 절제된 IIIB/C기 또는 IV기 흑색종 환자 905명을 대상으로 한 무작위(1:1), 이중맹검 시험인 CHECKMATE-238에서 평가되었으며, 이 환자들은 2주마다 60분 동안 정맥 주입으로 OPDIVO 3 mg/kg(n=452) 또는 4회 투여 후 24주부터 1년까지 12주마다 정맥 주입으로 ipilimumab 10 mg/kg(n=453)을 투여받았습니다. [임상 연구(14.2) 참조]. OPDIVO 투여군의 중간 노출 기간은 11.5개월이었고, ipilimumab 투여군의 중간 노출 기간은 2.7개월이었습니다. 이 진행 중인 시험에서 환자의 74%가 6개월 이상 OPDIVO를 투여받았습니다.
중증 이상 반응은 OPDIVO 투여군 환자의 18%에서 발생했습니다. 이상 반응으로 인해 연구 치료를 중단한 환자는 OPDIVO 투여군의 9%와 ipilimumab 투여군의 42%였습니다. OPDIVO 투여군 환자의 28%는 이상 반응으로 인해 최소한 한 번의 투여량을 누락했습니다. 3등급 또는 4등급 이상 반응은 OPDIVO 투여군 환자의 25%에서 발생했습니다.
OPDIVO 투여군 환자의 2% 이상에서 보고된 가장 흔한 3등급 및 4등급 이상 반응은 설사와 리파아제 및 아밀라아제 증가였습니다. 가장 흔한 이상 반응(최소 20%)은 피로, 설사, 발진, 근골격통, 가려움증, 두통, 메스꺼움, 상기도 감염 및 복통이었습니다. 가장 흔한 면역 매개 이상 반응은 발진(16%), 설사/대장염(6%) 및 간염(3%)이었습니다.
표 13과 14는 각각 CHECKMATE-238에서 발생한 이상 반응과 실험실 이상을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 무력증 포함. b 복통, 하복부 통증, 상복부 통증 및 복부 압통 포함. c 여드름형, 알레르기성, 수포성 또는 박탈성 피부염과 같은 피부염과 일반화된, 홍반성, 반점, 구진, 반점구진, 가려움증, 농포성, 수포성 또는 나비형 발진 및 약물 발진 포함. d 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 척추 통증 및 사지 통증 포함. e 자세성 현기증 및 현훈 포함. f 바이러스성 호흡기 감염을 포함한 상기도 감염, 하기도 감염, 비염, 인두염 및 비인두염 포함. g 이차성 갑상선 기능 저하증 및 자가 면역성 갑상선 기능 저하증 포함. |
||||
|
이상 반응 |
OPDIVO |
Ipilimumab 10 mg/kg |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||
|
피로a |
57 |
0.9 |
55 |
2.4 |
|
위장 |
||||
|
설사 |
37 |
2.4 |
55 |
11 |
|
메스꺼움 |
23 |
0.2 |
28 |
0 |
|
복통b |
21 |
0.2 |
23 |
0.9 |
|
변비 |
10 |
0 |
9 |
0 |
|
피부 및 피하 조직 |
||||
|
발진c |
35 |
1.1 |
47 |
5.3 |
|
가려움증 |
28 |
0 |
37 |
1.1 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 |
32 |
0.4 |
27 |
0.4 |
|
관절통 |
19 |
0.4 |
13 |
0.4 |
|
신경계 |
||||
|
두통 |
23 |
0.4 |
31 |
2.0 |
|
현기증e |
11 |
0 |
8 |
0 |
|
감염 |
||||
|
상기도 |
22 |
0 |
15 |
0.2 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침/생산적 |
19 |
0 |
19 |
0 |
|
호흡곤란/운동성 |
10 |
0.4 |
10 |
0.2 |
|
내분비 |
||||
|
저갑상선증g |
12 |
0.2 |
7.5 |
0.4 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다: OPDIVO 그룹(범위: 400~447명) 및 이필리무맙 10mg/kg 그룹(범위: 392~443명). | ||||
|
실험실 이상 |
OPDIVO |
이필리무맙 10mg/kg |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
림프구 감소증 |
27 |
0.4 |
12 |
0.9 |
|
빈혈 |
26 |
0 |
34 |
0.5 |
|
백혈구 감소증 |
14 |
0 |
2.7 |
0.2 |
|
호중구 감소증 |
13 |
0 |
6 |
0.5 |
|
화학 |
||||
|
리파아제 증가 |
25 |
7 |
23 |
9 |
|
ALT 증가 |
25 |
1.8 |
40 |
12 |
|
AST 증가 |
24 |
1.3 |
33 |
9 |
|
아밀라아제 증가 |
17 |
3.3 |
13 |
3.1 |
|
저나트륨혈증 |
16 |
1.1 |
22 |
3.2 |
|
고칼륨혈증 |
12 |
0.2 |
9 |
0.5 |
크레아티닌 증가
12
0
13
0
저칼슘혈증
10
0.7
16
0.5
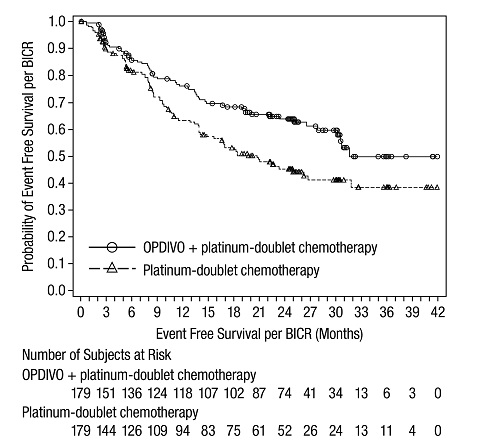
절제 가능한 비소세포폐암(종양 크기 ≥4cm 또는 림프절 양성)의 신보조 치료
OPDIVO와 백금 이중 약물 화학 요법 병용 투여의 안전성은 절제 가능한 NSCLC 환자를 대상으로 한 무작위 배정, 공개, 다기관 임상 시험인 CHECKMATE-816에서 평가되었습니다. [임상 연구(14.3) 참조] 환자는 3주마다 3사이클 동안 백금 이중 약물 화학 요법과 병용 투여된 OPDIVO 360mg을 투여받거나 3주마다 3사이클 동안 백금 이중 약물 화학 요법을 투여받았습니다.
OPDIVO와 백금 이중 약물 화학 요법 또는 백금 이중 약물 화학 요법을 투여받은 환자의 중간 연령은 65세(범위: 34~84)였으며, 남성이 72%, 백인이 47%, 아시아인이 50%, 흑인/아프리카계 미국인이 2%였습니다.
OPDIVO와 백금 이중 약물 화학 요법 병용 투여를 받은 환자의 30%에서 심각한 이상 반응이 발생했습니다. 2% 이상의 심각한 이상 반응에는 폐렴과 구토가 포함되었습니다. OPDIVO와 백금 이중 약물 화학 요법 병용 투여를 받은 환자에서 치명적인 이상 반응은 발생하지 않았습니다.
OPDIVO와 백금 이중 약물 화학 요법 병용 투여로 인한 이상 반응으로 인해 10%의 환자에서 연구 치료를 영구적으로 중단했으며, 30%의 환자에서 이상 반응으로 인해 최소한 한 번의 치료를 보류했습니다. OPDIVO와 백금 이중 약물 화학 요법 병용 투여를 영구적으로 중단하게 된 가장 흔한 이상 반응(≥1%)은 아나필락시스 반응(1.7%), 급성 신장 손상(1.1%), 발진(1.1%), 피로(1.1%)였습니다.
가장 흔한 이상 반응(>20%)은 메스꺼움, 변비, 피로, 식욕 감소, 발진이었습니다. 가장 흔한 3등급 또는 4등급 실험실 이상(≥2%)은 호중구 감소증, 고혈당증, 백혈구 감소증, 림프구 감소증, 아밀라아제 증가, 빈혈, 혈소판 감소증, 저나트륨혈증이었습니다.
표 15와 16은 CHECKMATE-816에서 선택된 이상 반응과 실험실 이상을 각각 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 피로와 무력증 포함 b 발진, 피부염, 여드름 모양 피부염, 아토피 피부염, 수포성 피부염, 약물 발진, 구진성 발진, 가려움증을 동반한 발진 포함 c 말초 신경병증, 이상 감각, 감각 저하, 말초 운동 신경병증, 말초 감각 신경병증 포함. |
||||
|
이상 반응 |
OPDIVO와 백금 이중 약물 화학 요법 |
백금 이중 약물 화학 요법 |
||
|
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
|
위장관 |
||||
|
메스꺼움 |
38 |
0.6 |
45 |
1.1 |
|
변비 |
34 |
0 |
32 |
1.1 |
|
구토 |
11 |
1.1 |
13 |
0.6 |
|
일반 |
||||
|
피로a |
26 |
2.3 |
23 |
1.1 |
|
불쾌감 |
15 |
0.6 |
14 |
0.6 |
|
대사 및 영양 |
||||
|
식욕 감퇴 |
20 |
1.1 |
23 |
2.3 |
|
피부 및 피하 조직 |
||||
|
발진b |
20 |
2.3 |
7 |
0 |
|
탈모 |
11 |
0 |
15 |
0 |
|
신경계 |
||||
|
말초 신경병증c |
13 |
0 |
6 |
0 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 백금 이중 약물 화학 요법 그룹(범위: 73~171명) 및 백금 이중 약물 화학 요법 그룹(범위: 68~171명). | ||||
|
실험실 이상 |
OPDIVO 및 백금 이중 약물 화학 요법a |
백금 이중 약물 화학 요법a |
||
|
모든 등급 (%) |
3등급 또는 4등급 (%) |
모든 등급 (%) |
3등급 또는 4등급 (%) |
|
|
혈액학 |
||||
|
빈혈 |
63 |
3.5 |
70 |
6 |
|
호중구 감소증 |
58 |
22 |
58 |
27 |
|
백혈구 감소증 |
53 |
5 |
51 |
11 |
|
림프구 감소증 |
38 |
4.7 |
31 |
1.8 |
|
혈소판 감소증 |
24 |
2.9 |
22 |
3 |
|
화학 |
||||
|
고혈당 |
37 |
6 |
35 |
2.9 |
|
저마그네슘혈증 |
25 |
1.2 |
29 |
1.2 |
|
저나트륨혈증 |
25 |
2.4 |
28 |
1.8 |
|
아밀라아제 증가 |
23 |
3.6 |
13 |
1.8 |
|
ALT 증가 |
23 |
0 |
20 |
1.2 |
전이성 비소세포폐암
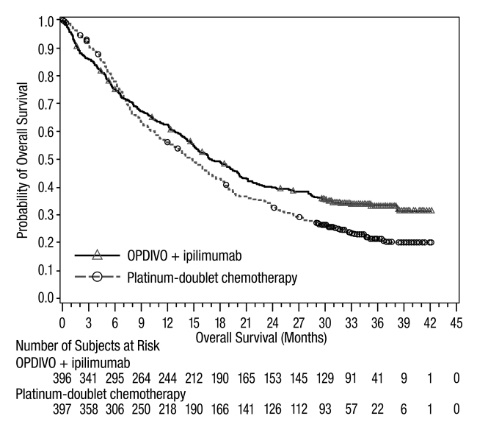
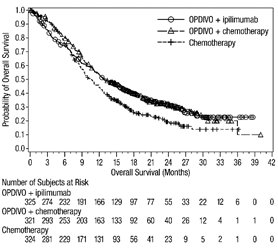
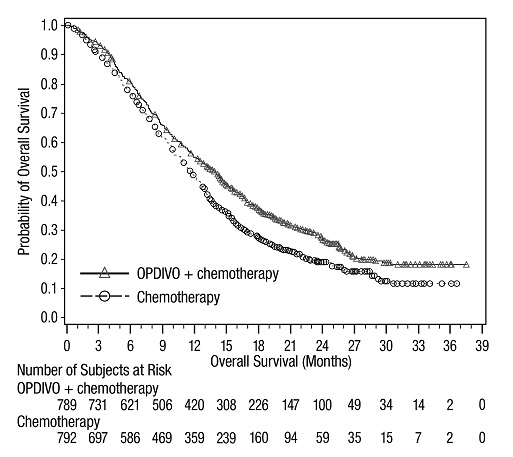
전이성 NSCLC의 1차 치료: 이필리무맙과 병용
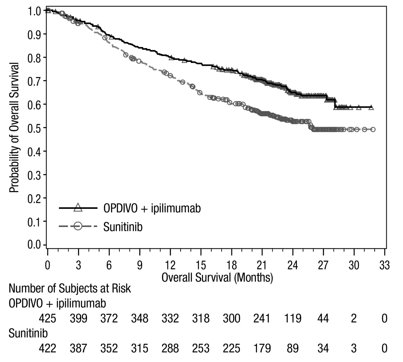
OPDIVO와 이필리무맙 병용 투여의 안전성은 EGFR 또는 ALK 유전체 종양 변이가 없는 이전에 치료받지 않은 전이성 또는 재발성 NSCLC 환자를 대상으로 한 무작위 배정, 다기관, 다군, 공개 표지 시험인 CHECKMATE-227에서 평가되었습니다. [임상 연구(14.4) 참조]. 이 시험은 치료받지 않은 뇌 전이, 암성 수막염, 활성 자가 면역 질환 또는 전신 면역 억제가 필요한 의학적 상태가 있는 환자를 제외했습니다. 환자는 2주마다 30분 동안 정맥 주입으로 OPDIVO 3mg/kg을 투여받았고, 6주마다 30분 동안 정맥 주입으로 이필리무맙 1mg/kg을 투여받았거나 4주기 동안 3주마다 백금 이중 약물 화학 요법을 투여받았습니다. OPDIVO 및 이필리무맙 치료 환자의 중간 치료 기간은 4.2개월(범위: 1일~25.5개월)이었습니다. 환자의 39%가 6개월 이상 OPDIVO 및 이필리무맙을 투여받았고, 환자의 23%가 1년 이상 OPDIVO 및 이필리무맙을 투여받았습니다. 인구 통계적 특징은 다음과 같습니다. 중간 연령 64세(범위: 26~87세); 48%가 65세 이상, 76%가 백인, 67%가 남성. 기준 ECOG 기능 상태는 0(35%) 또는 1(65%)이었고, 85%가 과거/현재 흡연자였으며, 11%가 뇌 전이가 있었고, 28%가 편평 상피 조직학적 특징을 보였고, 72%가 비편평 상피 조직학적 특징을 보였습니다.
중증 이상 반응은 환자의 58%에서 발생했습니다. OPDIVO 및 이필리무맙은 환자의 24%에서 이상 반응으로 인해 중단되었고, 53%는 이상 반응으로 인해 적어도 한 번의 투여를 보류했습니다.
가장 흔한(≥2%) 중증 이상 반응은 폐렴, 설사/대장염, 폐렴, 간염, 폐색전증, 부신 기능 저하증 및 뇌하수체염이었습니다. 치명적인 이상 반응은 환자의 1.7%에서 발생했습니다. 여기에는 폐렴(4명), 심근염, 급성 신장 손상, 쇼크, 고혈당, 다기관 장기 부전 및 신부전 사례가 포함되었습니다. 가장 흔한(≥20%) 이상 반응은 피로, 발진, 식욕 감소, 근골격계 통증, 설사/대장염, 호흡 곤란, 기침, 간염, 메스꺼움 및 가려움증이었습니다.
표 17과 18은 CHECKMATE-227에서 선택된 이상 반응과 실험실 이상을 각각 요약합니다.
| a 피로 및 무력증 포함. b 눈꺼풀 부종, 얼굴 부종, 전신 부종, 국소 부종, 부종, 말초 부종 및 안와 주위 부종 포함. c 자가 면역 피부염, 피부염, 여드름 모양 피부염, 알레르기성 피부염, 아토피 피부염, 수포성 피부염, 접촉성 피부염, 박탈성 피부염, 건선 모양 피부염, 육아종성 피부염, 전신 발진, 약물 발진, 습진, 습진, 박탈성 발진, 결절성 발진, 발진, 홍반성 발진, 반점 발진, 반점-구진성 발진, 구진성 발진, 가려운 발진, 농포성 발진, 독성 피부 발진 포함. d 가려움증 및 전신 가려움증 포함. e 등 통증, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근골격계 통증, 근육통 및 사지 통증 포함. f 대장염, 미세 대장염, 궤양성 대장염, 설사, 감염성 장염, 장염, 감염성 장염 및 바이러스성 장염 포함. g 복통, 복통, 하복통, 상복통 및 복부 압통 포함. h 호흡 곤란 및 운동 시 호흡 곤란 포함. i 기침 및 객담 포함. j 알라닌 아미노 전이효소 증가, 아스파르테이트 아미노 전이효소 증가, 자가 면역 간염, 혈액 빌리루빈 증가, 간 효소 증가, 간 기능 부전, 간 기능 이상, 간염, E형 간염, 간세포 손상, 간 독성, 고빌리루빈혈증, 면역 매개 간염, 간 기능 검사 이상, 간 기능 검사 증가, 아미노 전이효소 증가 포함. k 자가 면역 갑상선염, 혈액 갑상선 자극 호르몬 증가, 저갑상선증, 원발성 저갑상선증, 갑상선염 및 유리 트리요오드티로닌 감소 포함. l 혈액 갑상선 자극 호르몬 감소, 갑상선 기능 항진증 및 유리 트리요오드티로닌 증가 포함. m 하기도 감염, 세균성 하기도 감염, 폐 감염, 폐렴, 아데노바이러스성 폐렴, 흡인성 폐렴, 세균성 폐렴, 클렙시엘라 폐렴, 인플루엔자 폐렴, 바이러스성 폐렴, 비정형 폐렴, 조직화 폐렴 포함. |
||||
|
이상 반응 |
OPDIVO 및 이필리무맙 |
백금 이중 약물 화학 요법 |
||
|
모든 등급 |
3-4등급 |
모든 등급 |
3-4등급 |
|
|
일반 |
||||
|
피로a |
44 |
6 |
42 |
4.4 |
|
발열 |
18 |
0.5 |
11 |
0.4 |
|
부종b |
14 |
0.2 |
12 |
0.5 |
|
피부 및 피하 조직 |
||||
|
발진c |
34 |
4.7 |
10 |
0.4 |
|
가려움증d |
21 |
0.5 |
3.3 |
0 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
31 |
2.3 |
26 |
1.4 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증e |
27 |
1.9 |
16 |
0.7 |
|
관절통 |
13 |
0.9 |
2.5 |
0.2 |
|
위장관 |
||||
|
설사/대장염f |
26 |
3.6 |
16 |
0.9 |
|
메스꺼움 |
21 |
1 |
42 |
2.5 |
|
변비 |
18 |
0.3 |
27 |
0.5 |
|
구토 |
13 |
1 |
18 |
2.3 |
|
복통g |
10 |
0.2 |
9 |
0.7 |
|
호흡기, 흉곽 및 종격동 |
||||
|
호흡곤란h |
26 |
4.3 |
16 |
2.1 |
|
기침i |
23 |
0.2 |
13 |
0 |
|
간담도계 |
||||
|
간염j |
21 |
9 |
10 |
1.2 |
|
내분비계 |
||||
|
저갑상선증k |
16 |
0.5 |
1.2 |
0 |
|
갑상선 기능 항진증l |
10 |
0 |
0.5 |
0 |
|
감염 및 기생충 감염 |
||||
|
폐렴m |
13 |
7 |
8 |
4 |
|
신경계 |
||||
|
두통 |
11 |
0.5 |
6 |
0 |
CHECKMATE-227에서 임상적으로 중요한 다른 이상 반응은 다음과 같았습니다.
피부 및 피하 조직: 두드러기, 탈모, 다형 홍반, 백반증
위장: 구내염, 췌장염, 위염
근골격계 및 결합 조직: 관절염, 다발성 근육통, 횡문근 융해증
신경계: 말초 신경병증, 자가 면역성 뇌염
혈액 및 림프계: 호산구 증가증
안과 질환: 시력 흐림, 포도막염
심장: 심방 세동, 심근염
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 ipilimumab 그룹(범위: 494~556명) 및 화학 요법 그룹(범위: 469~542명). | ||||
|
실험실 이상 |
OPDIVO 및 Ipilimumab |
백금 이중 화학 요법 |
||
|
1-4등급 |
3-4등급 |
1-4등급 |
3-4등급 |
|
|
혈액학 |
||||
|
빈혈 |
46 |
3.6 |
78 |
14 |
|
림프구 감소증 |
46 |
5 |
60 |
15 |
|
화학 |
||||
|
저나트륨혈증 |
41 |
12 |
26 |
4.9 |
|
AST 증가 |
39 |
5 |
26 |
0.4 |
|
ALT 증가 |
36 |
7 |
27 |
0.7 |
|
리파아제 증가 |
35 |
14 |
14 |
3.4 |
|
알칼리성 |
34 |
3.8 |
20 |
0.2 |
|
아밀라아제 증가 |
28 |
9 |
18 |
1.9 |
|
저칼슘혈증 |
28 |
1.7 |
17 |
1.3 |
고칼륨혈증
27
3.4
22
0.4
크레아티닌 증가
22
0.9
17
0.2
전이성 또는 재발성 비소세포폐암의 1차 치료: 이필리무맙 및 백금 이중 약물 화학 요법과 병용
이필리무맙 및 백금 이중 약물 화학 요법과 병용한 OPDIVO의 안전성은 CHECKMATE-9LA에서 평가되었습니다 [임상 연구 (14.4) 참조]. 환자는 3주마다 투여되는 OPDIVO 360mg을 이필리무맙 1mg/kg(6주마다 투여) 및 백금 이중 약물 화학 요법(3주마다 2 사이클 투여)과 병용하거나, 3주마다 4 사이클 투여되는 백금 이중 약물 화학 요법을 투여받았습니다. 이필리무맙 및 백금 이중 약물 화학 요법과 병용한 OPDIVO 치료의 중간 기간은 6개월(범위: 1일~19개월)이었습니다. 환자의 50%는 6개월 이상 OPDIVO와 이필리무맙을 투여받았고, 13%는 1년 이상 OPDIVO와 이필리무맙을 투여받았습니다.
이필리무맙 및 백금 이중 약물 화학 요법과 병용한 OPDIVO로 치료받은 환자의 57%에서 심각한 이상 반응이 발생했습니다. 가장 흔한(>2%) 심각한 이상 반응은 폐렴, 설사, 발열성 호중구 감소증, 빈혈, 급성 신장 손상, 근골격계 통증, 호흡 곤란, 폐렴 및 호흡 부전이었습니다. 치명적인 이상 반응은 7명(2%)의 환자에서 발생했으며, 간 독성, 급성 신부전, 패혈증, 폐렴, 저칼륨혈증을 동반한 설사, 혈소판 감소증 환경에서 발생한 대량 객혈이 포함되었습니다.
이필리무맙 및 백금 이중 약물 화학 요법과 병용한 OPDIVO로 치료받은 환자의 24%에서 이상 반응으로 인해 치료가 영구적으로 중단되었고, 56%는 이상 반응으로 인해 적어도 한 번의 치료가 보류되었습니다. 가장 흔한(>20%) 이상 반응은 피로, 근골격계 통증, 메스꺼움, 설사, 발진, 식욕 감소, 변비 및 가려움증이었습니다.
표 19와 20은 각각 CHECKMATE-9LA에서 선택된 이상 반응과 실험실 이상을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 피로와 무력증 포함 b 근육통, 요통, 사지 통증, 근골격계 통증, 뼈 통증, 옆구리 통증, 근육 경련, 근골격계 흉통, 근골격계 장애, 골염, 근골격계 경직, 비심장성 흉통, 관절통, 관절염, 관절병증, 관절 삼출, 건선성 관절염, 활막염 포함 c 대장염, 궤양성 대장염, 설사 및 장염 포함 d 복통, 복부 통증, 하복부 통증, 상복부 통증 및 위장 통증 포함 e 여드름, 피부염, 여드름 모양 피부염, 알레르기성 피부염, 아토피 피부염, 수포성 피부염, 전신 박탈성 피부염, 습진, 각화증, 손바닥-발바닥 적색증, 발진, 홍반성 발진, 전신 발진, 반점 발진, 반점-구진성 발진, 홍역 모양 발진, 구진성 발진, 가려운 발진, 피부 박리, 피부 반응, 피부 독성, 스티븐스-존슨 증후군, 두드러기 포함 f 가려움증 및 전신 가려움증 포함 g 기침, 객담 기침 및 상기도 기침 증후군 포함 h 호흡 곤란, 안정 시 호흡 곤란 및 운동 시 호흡 곤란 포함 i 자가 면역성 갑상선염, 혈액 갑상선 자극 호르몬 증가, 저갑상선증, 갑상선염 및 유리 트리요오드티로닌 감소 포함 j 현기증, 어지러움 및 자세성 어지러움 포함 |
||||
|
이상 반응 |
OPDIVO와 이필리무맙 및 백금 이중 약물 화학 요법 |
백금 이중 약물 화학 요법 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||
|
피로a |
49 |
5 |
40 |
4.9 |
|
발열 |
14 |
0.6 |
10 |
0.6 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증b |
39 |
4.5 |
27 |
2 |
|
위장 |
||||
|
메스꺼움 |
32 |
1.7 |
41 |
0.9 |
|
설사c |
31 |
6 |
18 |
1.7 |
|
변비 |
21 |
0.6 |
23 |
0.6 |
|
구토 |
18 |
2 |
17 |
1.4 |
|
복통d |
12 |
0.6 |
11 |
0.9 |
|
피부 및 피하 조직 |
||||
|
발진e |
30 |
4.7 |
10 |
0.3 |
|
가려움증f |
21 |
0.8 |
2.9 |
0 |
|
탈모 |
11 |
0.8 |
10 |
0.6 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
28 |
2 |
22 |
1.7 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침g |
19 |
0.6 |
15 |
0.9 |
|
호흡 곤란h |
18 |
4.7 |
14 |
3.2 |
|
내분비 |
||||
|
저갑상선증i |
19 |
0.3 |
3.4 |
0 |
|
신경계 |
||||
|
두통 |
11 |
0.6 |
7 |
0 |
|
현기증j |
11 |
0.6 |
6 |
0 |
| a 각 검사 발생률은 기준치와 연구 중 적어도 하나의 실험실 측정치를 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 이필리무맙과 백금 이중 약물 화학 요법 그룹(범위: 197~347명) 및 백금 이중 약물 화학 요법 그룹(범위: 191~335명). | ||||
|
실험실 이상 |
OPDIVO 및 이필리무맙과 백금 이중 약물 화학 요법 |
백금 이중 약물 화학 요법 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
빈혈 |
70 |
9 |
74 |
16 |
|
림프구 감소증 |
41 |
6 |
40 |
11 |
|
호중구 감소증 |
40 |
15 |
42 |
15 |
|
백혈구 감소증 |
36 |
10 |
40 |
9 |
|
혈소판 감소증 |
23 |
4.3 |
24 |
5 |
|
화학 |
||||
|
고혈당증 |
45 |
7 |
42 |
2.6 |
|
저나트륨혈증 |
37 |
10 |
27 |
7 |
|
ALT 증가 |
34 |
4.3 |
24 |
1.2 |
|
리파아제 증가 |
31 |
12 |
10 |
2.2 |
|
알칼리성 포스파타아제 증가 |
31 |
1.2 |
26 |
0.3 |
아밀라아제 증가
30
7
19
1.3
AST 증가
30
3.5
22
0.3
저마그네슘혈증
29
1.2
33
0.6
저칼슘혈증
26
1.4
22
1.8
크레아티닌 증가
26
1.2
23
0.6
고칼륨혈증
22
1.7
21
2.1
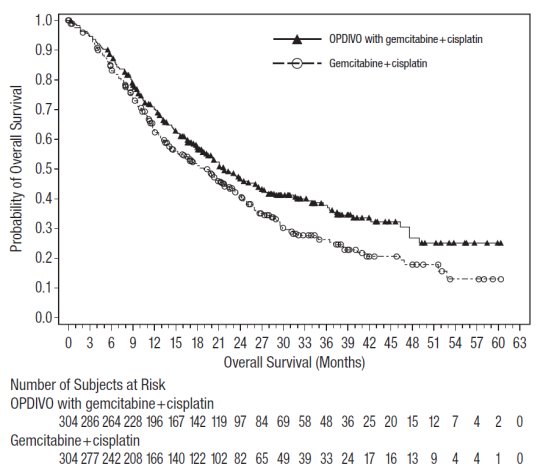
전이성 비소세포폐암의 2차 치료
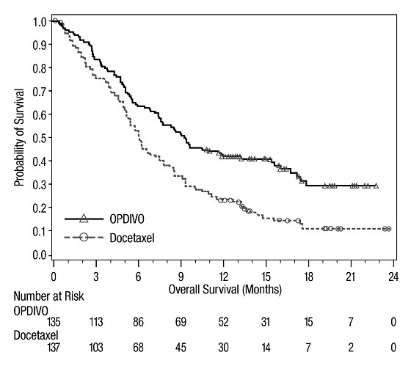
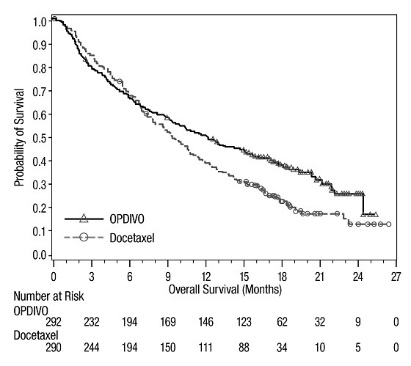
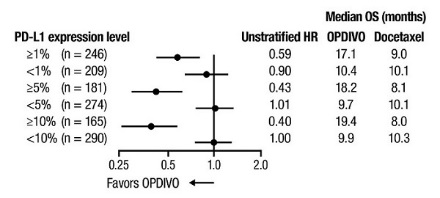
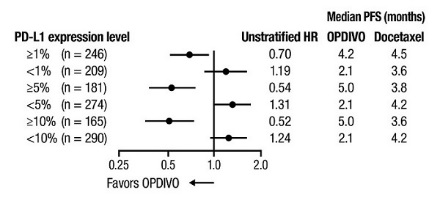
OPDIVO의 안전성은 전이성 편평상피세포 NSCLC 환자를 대상으로 한 무작위 배정, 공개, 다기관 시험인 CHECKMATE-017과 전이성 비편평상피세포 NSCLC 환자를 대상으로 한 무작위 배정, 공개, 다기관 시험인 CHECKMATE-057에서 평가되었습니다. 이러한 시험은 활성 자가면역 질환, 전신 면역 억제를 요하는 의학적 상태 또는 증상성 간질성 폐 질환이 있는 환자를 제외했습니다. 환자는 2주마다 정맥 주입으로 60분 동안 OPDIVO 3 mg/kg 또는 3주마다 정맥 주입으로 도세탁셀 75 mg/m2를 투여받았습니다. CHECKMATE-017에서 OPDIVO 치료 환자의 치료 중앙값 기간은 3.3개월(범위: 1일~21.7+개월)이었고, CHECKMATE-057에서는 2.6개월(범위: 0~24.0+개월)이었습니다. CHECKMATE-017에서 환자의 36%가 OPDIVO를 6개월 이상 투여받았고, 환자의 18%가 OPDIVO를 1년 이상 투여받았으며, CHECKMATE-057에서는 환자의 30%가 OPDIVO를 6개월 이상 투여받았고, 환자의 20%가 OPDIVO를 1년 이상 투여받았습니다.
두 시험 모두에서 OPDIVO 치료 환자의 중앙값 연령은 61세(범위: 37~85세)였으며, 38%가 65세 이상이었고, 61%가 남성이었으며, 91%가 백인이었습니다. 환자의 10%가 뇌 전이를 보였고, ECOG 수행 상태는 0(26%) 또는 1(74%)이었습니다.
CHECKMATE-057에서 OPDIVO 군에서 사망 7건은 감염으로 인한 것이었으며, 그 중 1건은 폐포자충 폐렴이었고, 4건은 폐색전증으로 인한 것이었으며, 1건은 변연계 뇌염으로 인한 것이었습니다. OPDIVO를 투여받은 환자의 46%에서 심각한 부작용이 발생했습니다. OPDIVO는 환자의 11%에서 중단되었고, 부작용으로 인해 환자의 28%에서 투여가 지연되었습니다.
OPDIVO를 투여받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 부작용은 폐렴, 폐색전증, 호흡곤란, 발열, 흉막 삼출, 폐렴, 호흡 부전이었습니다. 두 시험 모두에서 가장 흔한 부작용(≥20%)은 피로, 근골격계 통증, 기침, 호흡곤란, 식욕 감소였습니다.
표 21과 22는 각각 CHECKMATE-057에서 선택된 부작용과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. | ||||
|
부작용 |
OPDIVO |
도세탁셀 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
호흡기, 흉곽 및 종격동 |
||||
|
기침 |
31 |
0.7 |
24 |
0 |
|
대사 및 영양 |
||||
|
식욕 감소 |
28 |
1.4 |
23 |
1.5 |
|
피부 및 피하 조직 |
||||
|
가려움증 |
10 |
0.2 |
2 |
0 |
OPDIVO 투여 환자에서 관찰된 다른 임상적으로 중요한 유해 반응으로, 도세탁셀 투여 환자에서 유사한 발생률로 나타났으며 6항에 나열되지 않은 반응은 다음과 같습니다. 피로/무력증(모든 등급 48%, 3-4등급 5%), 근골격계 통증(모든 등급 33%), 흉막 삼출(모든 등급 4.5%), 폐색전증(모든 등급 3.3%).
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값이 있는 환자 수를 기반으로 함: OPDIVO 그룹(범위: 405~417명) 및 도세탁셀 그룹(범위: 372~390명), TSH 제외: OPDIVO 그룹 n=314, 도세탁셀 그룹 n=297. b NCI CTCAE v4에 따라 등급이 매겨지지 않음. |
||||
|
실험실 이상 |
OPDIVO |
도세탁셀 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
저나트륨혈증 |
35 |
7 |
34 |
4.9 |
|
AST 증가 |
27 |
1.9 |
13 |
0.8 |
|
알칼리성 인산분해효소 증가 |
26 |
0.7 |
18 |
0.8 |
|
ALT 증가 |
22 |
1.7 |
17 |
0.5 |
|
크레아티닌 증가 |
18 |
0 |
12 |
0.5 |
|
TSH 증가b |
14 |
N/A |
6 |
N/A |
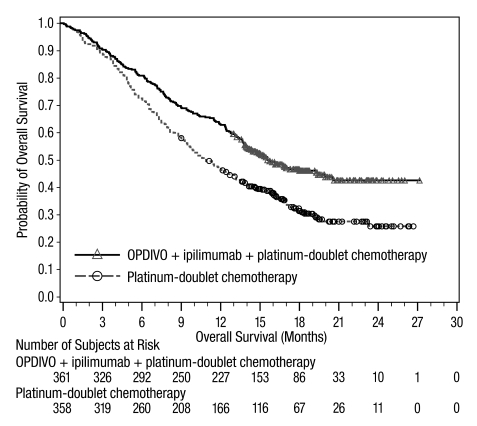
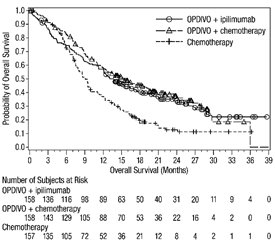
악성 흉막 중피종
OPDIVO와 이필리무맙 병용 투여의 안전성은 이전에 치료를 받지 않은 절제 불가능한 악성 흉막 중피종 환자를 대상으로 한 무작위 배정, 공개 표지 시험인 CHECKMATE-743에서 평가되었습니다. [임상 연구(14.5) 참조]. 환자는 OPDIVO 3 mg/kg을 30분 동안 정맥 주입으로 2주마다 1회 투여하고 이필리무맙 1 mg/kg을 30분 동안 정맥 주입으로 6주마다 1회 투여하여 최대 2년 동안 치료를 받았습니다. 또는 최대 6 사이클 동안 백금 이중 약물 화학 요법을 받았습니다. OPDIVO와 이필리무맙으로 치료받은 환자의 치료 중앙값 기간은 5.6개월(범위: 0~26.2개월)이었습니다. 환자의 48%가 OPDIVO와 이필리무맙을 6개월 이상 투여받았고, 환자의 24%가 OPDIVO와 이필리무맙을 1년 이상 투여받았습니다.
OPDIVO와 이필리무맙 병용 투여를 받은 환자의 54%에서 심각한 이상 반응이 발생했습니다. 가장 흔한(≥2%) 심각한 이상 반응은 폐렴, 발열, 설사, 폐렴, 흉막 삼출, 호흡 곤란, 급성 신장 손상, 주입 관련 반응, 근골격계 통증 및 폐색전증이었습니다. 치명적인 이상 반응은 4명(1.3%)의 환자에게서 발생했으며, 폐렴, 급성 심부전, 패혈증 및 뇌염이 포함되었습니다.
OPDIVO와 이필리무맙은 이상 반응으로 인해 환자의 23%에서 영구적으로 중단되었고, 52%는 이상 반응으로 인해 적어도 1회 이상 투여가 보류되었습니다.
가장 흔한(≥20%) 이상 반응은 피로, 근골격계 통증, 발진, 설사, 호흡 곤란, 메스꺼움, 식욕 감소, 기침 및 가려움증이었습니다.
표 23과 24는 각각 CHECKMATE-743에서 이상 반응과 실험실 이상을 요약한 것입니다.
| a 피로와 무력증 포함. b 발열과 종양 관련 발열 포함. c 부종, 전신 부종, 말초 부종 및 말초 팽윤 포함. d 근골격계 통증, 요통, 뼈 통증, 옆구리 통증, 불수의적 근육 수축, 근육 경련, 근육 떨림, 근골격계 흉통, 근골격계 경직, 근육통, 목 통증, 비심장성 흉통, 사지 통증, 다발성 근육통, 척추 통증 포함. e 발진, 여드름, 여드름 모양 피부염, 알레르기성 피부염, 아토피 피부염, 자가 면역성 피부염, 수포성 피부염, 접촉성 피부염, 피부염, 약물 발진, 습진, 습진, 홍반성 발진, 박탈성 발진, 전신 박탈성 피부염, 전신 발진, 육아종성 피부염, 각화증, 구진성 발진, 구진성 발진, 건선 모양 피부염, 가려운 발진, 농포성 발진, 피부 박리, 피부 반응, 피부 독성, 스티븐스-존슨 증후군, 독성 피부 발진, 두드러기 포함. f 가려움증, 알레르기성 가려움증 및 전신 가려움증 포함. g 설사, 대장염, 장염, 감염성 장염, 장염, 감염성 장염, 미세 대장염, 궤양성 대장염, 바이러스성 장염 포함. h 복통, 복부 불편감, 복부 압통, 위장 통증, 하복부 통증, 상복부 통증 포함. i 호흡 곤란, 안정 시 호흡 곤란, 운동 시 호흡 곤란 포함. j 기침, 객담을 동반한 기침, 상기도 기침 증후군 포함. k 갑상선 기능 저하증, 자가 면역성 갑상선염, 유리 트리요오드티로닌 감소, 혈액 갑상선 자극 호르몬 증가, 원발성 갑상선 기능 저하증, 갑상선염, 자가 면역성 갑상선 기능 저하증 포함. l 상기도 감염, 비인두염, 인두염, 비염 포함. m 폐렴, 하기도 감염, 폐 감염, 흡인성 폐렴, 폐렴구균 폐렴 포함. |
||||
|
이상 반응 |
OPDIVO와 이필리무맙 |
화학 요법 |
||
|
모든 등급 |
3-4등급 |
모든 등급 |
3-4등급 |
|
|
일반 |
||||
|
피로a |
43 |
4.3 |
45 |
6 |
|
발열b |
18 |
1.3 |
4.6 |
0.7 |
|
부종c |
17 |
0 |
8 |
0 |
|
근골격 및 결합 조직 |
||||
|
근골격계 통증d |
38 |
3.3 |
17 |
1.1 |
|
관절통 |
13 |
1 |
1.1 |
0 |
|
피부 및 피하 조직 |
||||
|
발진e |
34 |
2.7 |
11 |
0.4 |
|
가려움증f |
21 |
1 |
1.4 |
0 |
|
위장 |
||||
|
설사g |
32 |
6 |
12 |
1.1 |
|
메스꺼움 |
24 |
0.7 |
43 |
2.5 |
|
변비 |
19 |
0.3 |
30 |
0.7 |
|
복통h |
15 |
1 |
10 |
0.7 |
|
구토 |
14 |
0 |
18 |
2.1 |
|
호흡기, 흉곽 및 종격동 |
||||
|
호흡곤란i |
27 |
2.3 |
16 |
3.2 |
|
기침j |
23 |
0.7 |
9 |
0 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
24 |
1 |
25 |
1.4 |
|
내분비 |
||||
|
저갑상선증k |
15 |
0 |
1.4 |
0 |
|
감염 및 기생충 감염 |
||||
|
상기도 감염l |
12 |
0.3 |
7 |
0 |
|
폐렴m |
10 |
4 |
4.2 |
2.1 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다: OPDIVO 및 이필리무맙 그룹(범위: 109~297명) 및 화학 요법 그룹(범위: 90~276명). | ||||
|
실험실 이상 |
OPDIVO 및 이필리무맙 |
화학 요법 |
||
|
1-4등급 |
3-4등급 |
1-4등급 |
3-4등급 |
|
|
화학 |
||||
|
고혈당 |
53 |
3.7 |
34 |
1.1 |
|
AST 증가 |
38 |
7 |
17 |
0 |
|
ALT 증가 |
37 |
7 |
15 |
0.4 |
|
리파아제 증가 |
34 |
13 |
9 |
0.8 |
|
저나트륨혈증 |
32 |
8 |
21 |
2.9 |
|
알칼리성 포스파타아제 증가 |
31 |
3.1 |
12 |
0 |
|
고칼륨혈증 |
30 |
4.1 |
16 |
0.7 |
|
저칼슘혈증 |
28 |
0 |
16 |
0 |
|
아밀라아제 증가 |
26 |
5 |
13 |
0.9 |
|
크레아티닌 증가 |
20 |
0.3 |
20 |
0.4 |
|
혈액학 |
||||
|
림프구 감소증 |
43 |
8 |
57 |
14 |
|
빈혈 |
43 |
2.4 |
75 |
15 |
진행성 신세포암
1차 진행성 신세포암
CHECKMATE-214
OPDIVO와 ipilimumab의 안전성은 이전에 치료를 받지 않은 진행성 RCC 환자 1082명을 대상으로 한 무작위 배정 오픈 라벨 시험인 CHECKMATE-214에서 평가되었으며, 이 환자들은 60분 동안 3 mg/kg의 OPDIVO를 ipilimumab 1 mg/kg와 함께 정맥 주사로 3주마다 4회 투여한 다음 2주마다 3 mg/kg의 OPDIVO를 단독 요법으로 정맥 주사로 투여받았습니다(n=547) 또는 6주 주기의 첫 4주 동안 매일 경구로 50 mg의 sunitinib를 투여받았습니다(n=535) [임상 연구(14.6) 참조]. OPDIVO와 ipilimumab을 투여받은 환자의 중간 치료 기간은 7.9개월(범위: 1일~21.4개월 이상)이었고, sunitinib를 투여받은 환자의 중간 치료 기간은 7.8개월(범위: 1일~20.2개월 이상)이었습니다. 이 시험에서 OPDIVO와 ipilimumab 군의 57% 환자가 6개월 이상 치료를 받았고, 38% 환자가 1년 이상 치료를 받았습니다.
OPDIVO와 ipilimumab을 투여받은 환자의 59%에서 심각한 이상 반응이 발생했습니다. OPDIVO와 ipilimumab을 투여받은 환자의 31%에서 이상 반응으로 인해 연구 치료를 중단했습니다. OPDIVO와 ipilimumab을 투여받은 환자의 54%(54%)에서 이상 반응으로 인해 투여량이 중단되었습니다.
OPDIVO와 ipilimumab으로 치료받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 설사, 발열, 폐렴, 폐렴, 뇌하수체염, 급성 신장 손상, 호흡 곤란, 부신 기능 저하 및 대장염이었고, sunitinib으로 치료받은 환자의 경우 폐렴, 흉막 삼출 및 호흡 곤란이었습니다. 가장 흔한 이상 반응(환자의 20% 이상에서 보고됨)은 피로, 발진, 설사, 근골격계 통증, 가려움증, 메스꺼움, 기침, 발열, 관절통 및 식욕 감소였습니다. 기준선에 비해 악화된 가장 흔한 실험실 이상(OPDIVO와 ipilimumab을 투여받은 환자의 30% 이상에서 발생)은 리파아제 증가, 빈혈, 크레아티닌 증가, ALT 증가, AST 증가, 저나트륨혈증, 아밀라아제 증가 및 림프구 감소증입니다.
표 25와 26은 각각 CHECKMATE-214에서 OPDIVO와 ipilimumab을 투여받은 환자의 15% 이상에서 발생한 이상 반응과 실험실 이상을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 무력증 포함. b 말초 부종, 말초 붓기 포함. c 여드름형, 수포성 및 박탈성 피부염, 약물 발진, 박탈성, 홍반성, 모낭성, 전신성, 반점성, 반점구진성, 구진성, 가려움증 및 농포성 발진, 고정 약물 발진으로 설명되는 피부염 포함. d 등 통증, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증, 척추 통증 포함. |
||||
|
이상 반응 |
OPDIVO와 Ipilimumab |
Sunitinib |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
이상 반응 |
99 |
65 |
99 |
76 |
|
일반 |
||||
|
피로a |
58 |
8 |
69 |
13 |
|
발열 |
25 |
0.7 |
17 |
0.6 |
|
부종b |
16 |
0.5 |
17 |
0.6 |
|
피부 및 피하 조직 |
||||
|
발진c |
39 |
3.7 |
25 |
1.1 |
|
가려움증/전신 가려움증 |
33 |
0.5 |
11 |
0 |
|
위장관 |
||||
|
설사 |
38 |
4.6 |
58 |
6 |
|
메스꺼움 |
30 |
2 |
43 |
1.5 |
|
구토 |
20 |
0.9 |
28 |
2.1 |
|
복통 |
19 |
1.6 |
24 |
1.9 |
|
변비 |
17 |
0.4 |
18 |
0 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증d |
37 |
4 |
40 |
2.6 |
|
관절통 |
23 |
1.3 |
16 |
0 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침/객담 동반 기침 |
28 |
0.2 |
25 |
0.4 |
|
호흡곤란/운동 시 호흡곤란 |
20 |
2.4 |
21 |
2.1 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
21 |
1.8 |
29 |
0.9 |
|
신경계 |
||||
|
두통 |
19 |
0.9 |
23 |
0.9 |
|
내분비 |
||||
|
저갑상선증 |
18 |
0.4 |
27 |
0.2 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 이필리무맙 그룹(범위: 490~538명) 및 수니티닙 그룹(범위: 485~523명). | ||||
|
실험실 이상 |
OPDIVO 및 이필리무맙 |
수니티닙 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
리파아제 증가 |
48 |
20 |
51 |
20 |
|
크레아티닌 증가 |
42 |
2.1 |
46 |
1.7 |
|
ALT 증가 |
41 |
7 |
44 |
2.7 |
|
AST 증가 |
40 |
4.8 |
60 |
2.1 |
|
아밀라아제 증가 |
39 |
12 |
33 |
7 |
|
저나트륨혈증 |
39 |
10 |
36 |
7 |
|
알칼리성 포스파타아제 증가 |
29 |
2 |
32 |
1 |
|
고칼륨혈증 |
29 |
2.4 |
28 |
2.9 |
|
저칼슘혈증 |
21 |
0.4 |
35 |
0.6 |
|
저마그네슘혈증 |
16 |
0.4 |
26 |
1.6 |
|
혈액학 |
||||
|
빈혈 |
43 |
3 |
64 |
9 |
|
림프구 감소증 |
36 |
5 |
63 |
14 |
또한, 기준선에서 TSH ≤ULN인 환자 중 OPDIVO 및 ipilimumab 그룹에서 sunitinib 그룹에 비해 TSH > ULN의 치료 발생 상승을 경험한 환자의 비율이 낮았습니다(각각 31% 및 61%).
CHECKMATE-9ER
OPDIVO와 cabozantinib의 안전성은 이전에 치료받지 않은 진행성 RCC 환자를 대상으로 한 무작위 배정, 공개 표지 연구인 CHECKMATE-9ER에서 평가되었습니다. 환자는 cabozantinib 40mg을 1일 1회 경구 투여하여 30분 동안 OPDIVO 240mg을 2주마다 투여받았습니다(n=320) 또는 sunitinib 50mg을 1일 1회 경구 투여하여 치료 4주 동안 투여한 다음 2주 동안 휴약했습니다(n=320) [임상 연구(14.6) 참조]. Cabozantinib는 1일 20mg 또는 격일 20mg으로 중단 또는 감량할 수 있습니다. OPDIVO 및 cabozantinib 치료 환자의 중간 치료 기간은 14개월(범위: 0.2~27개월)이었습니다. 이 시험에서 OPDIVO 및 cabozantinib 군 환자의 82%가 6개월 이상 치료에 노출되었고 60%의 환자가 1년 이상 치료에 노출되었습니다.
OPDIVO 및 cabozantinib를 투여받은 환자의 48%에서 심각한 이상 반응이 발생했습니다. 가장 흔한(≥2%) 심각한 이상 반응은 설사, 폐렴, 폐렴, 폐색전증, 요로 감염 및 저나트륨혈증이었습니다. 치명적인 장 천공은 3명(0.9%)의 환자에서 발생했습니다.
OPDIVO 또는 cabozantinib의 중단으로 이어진 이상 반응은 환자의 20%에서 발생했습니다. 7%는 OPDIVO만, 8%는 cabozantinib만, 6%는 동일한 이상 반응으로 인해 동시에 두 약물 모두에서 발생했습니다. OPDIVO 또는 cabozantinib의 투여 중단 또는 감량으로 이어진 이상 반응은 환자의 83%에서 발생했습니다. 3%는 OPDIVO만, 46%는 cabozantinib만, 21%는 동일한 이상 반응으로 인해 동시에 두 약물 모두에서 발생했고, 6%는 두 약물 모두 순차적으로 발생했습니다.
OPDIVO 및 cabozantinib로 치료받은 환자의 ≥20%에서 보고된 가장 흔한 이상 반응은 설사, 피로, 간 독성, 손바닥-발바닥 홍반 각화증, 구내염, 발진, 고혈압, 저갑상선증, 근골격계 통증, 식욕 감소, 메스꺼움, 미각 이상, 복통, 기침 및 상기도 감염이었습니다.
표 27과 28은 각각 CHECKMATE-9ER에서 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 복통, 하복부 통증, 상복부 통증 포함. b 위식도 역류 질환 포함. c 무력증 포함. d 간 독성, ALT 상승, AST 상승, 혈액 알칼리성 포스파타제 상승, 감마-글루타밀 전이효소 상승, 자가 면역 간염, 혈액 빌리루빈 상승, 약물 유발 간 손상, 간 효소 상승, 간염, 고빌리루빈혈증, 간 기능 검사 상승, 간 기능 검사 이상, 트랜스아미나제 상승, 간 기능 부전 포함. e 점막 염증, 아프타성 궤양, 구강 궤양 포함. f 피부염, 여드름성 피부염, 수포성 피부염, 박탈성 발진, 홍반성 발진, 모낭성 발진, 반점성 발진, 반점-구진성 발진, 구진성 발진, 가려운 발진 포함. g 혈압 상승, 수축기 혈압 상승 포함. h 원발성 저갑상선증 포함. i 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증, 척추 통증 포함. j 기침 포함. k 비인두염, 인두염, 비염 포함. |
||||
|
이상 반응 |
OPDIVO 및 Cabozantinib |
Sunitinib |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
위장관 |
||||
|
설사 |
64 |
7 |
47 |
4.4 |
|
메스꺼움 |
27 |
0.6 |
31 |
0.3 |
|
복통a |
22 |
1.9 |
15 |
0.3 |
|
구토 |
17 |
1.9 |
21 |
0.3 |
|
소화불량b |
15 |
0 |
22 |
0.3 |
|
일반 |
||||
|
피로c |
51 |
8 |
50 |
8 |
|
간담도계 |
||||
|
간독성d |
44 |
11 |
26 |
5 |
|
피부 및 피하조직 |
||||
|
손바닥-발바닥 |
40 |
8 |
41 |
8 |
|
구내염e |
37 |
3.4 |
46 |
4.4 |
|
발진f |
36 |
3.1 |
14 |
0 |
|
가려움증 |
19 |
0.3 |
4.4 |
0 |
|
혈관 |
||||
|
고혈압g |
36 |
13 |
39 |
14 |
|
내분비 |
||||
|
저갑상선증h |
34 |
0.3 |
30 |
0.3 |
|
근골격계 및 결합조직 |
||||
|
근골격계 통증i |
33 |
3.8 |
29 |
3.1 |
|
관절통 |
18 |
0.3 |
9 |
0.3 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
28 |
1.9 |
20 |
1.3 |
|
신경계 |
||||
|
미각 이상 |
24 |
0 |
22 |
0 |
|
두통 |
16 |
0 |
12 |
0.6 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침j |
20 |
0.3 |
17 |
0 |
|
쉰 목소리 |
17 |
0.3 |
3.4 |
0 |
|
감염 및 기생충 감염 |
||||
|
상기도 감염k |
20 |
0.3 |
8 |
0.3 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 카보잔티닙 그룹(범위: 170~317명) 및 수니티닙 그룹(범위: 173~311명). | ||||
|
실험실 이상 |
OPDIVO 및 카보잔티닙 |
수니티닙 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
ALT 증가 |
79 |
9.8 |
39 |
3.5 |
|
AST 증가 |
77 |
7.9 |
57 |
2.6 |
|
저인산혈증 |
69 |
28 |
48 |
10 |
|
저칼슘혈증 |
54 |
1.9 |
24 |
0.6 |
|
저마그네슘혈증 |
47 |
1.3 |
25 |
0.3 |
|
고혈당증 |
44 |
3.5 |
44 |
1.7 |
|
저나트륨혈증 |
43 |
11 |
36 |
12 |
|
리파아제 증가 |
41 |
14 |
38 |
13 |
|
아밀라아제 증가 |
41 |
10 |
28 |
6 |
|
알칼리성 포스파타아제 증가 |
41 |
2.8 |
37 |
1.6 |
크레아티닌 증가
39
1.3
42
0.6
고칼륨혈증
35
4.7
27
1
저혈당증
26
0.8
14
0.4
Hematology
림프구 감소증
42
6.6
45
10
혈소판 감소증
41
0.3
70
9.7
빈혈
37
2.5
61
4.8
백혈구 감소증
37
0.3
66
5.1
호중구 감소증
35
3.2
67
12
이전에 치료받은 신세포암
CHECKMATE-025
OPDIVO의 안전성은 CHECKMATE-025에서 평가되었으며, 이는 적어도 하나의 항혈관 생성 치료 요법을 받은 후 또는 그 동안 질병 진행을 경험한 진행성 RCC 환자 803명을 대상으로 한 무작위 배정 오픈 라벨 시험으로, OPDIVO 3 mg/kg을 2주마다 정맥 주입으로 60분 동안 투여(n=406) 또는 에베롤리무스 10 mg을 매일 투여(n=397)했습니다. [임상 연구(14.6) 참조]. OPDIVO 치료 환자의 중간 치료 기간은 5.5개월(범위: 1일~29.6개월 이상)이었고, 에베롤리무스 치료 환자의 중간 치료 기간은 3.7개월(범위: 6일~25.7개월 이상)이었습니다.
치료 중 또는 마지막 투여 후 30일 이내 사망률은 OPDIVO 군에서 4.7%였습니다. OPDIVO를 투여받은 환자의 47%에서 심각한 이상 반응이 발생했습니다. OPDIVO 환자의 16%에서 이상 반응으로 인해 연구 치료가 중단되었습니다. OPDIVO를 투여받은 환자의 44%(44%)에서 이상 반응으로 인해 투여가 중단되었습니다.
환자의 2% 이상에서 가장 흔한 심각한 이상 반응은 급성 신장 손상, 흉막 삼출, 폐렴, 설사 및 고칼슘혈증이었습니다. 가장 흔한 이상 반응(≥20%)은 피로, 기침, 메스꺼움, 발진, 호흡 곤란, 설사, 변비, 식욕 감소, 요통 및 관절통이었습니다. 기준선에 비해 악화된 가장 흔한 실험실 이상(≥30%)은 크레아티닌 증가, 림프구 감소증, 빈혈, AST 증가, 알칼리성 포스파타제 증가, 저나트륨혈증, 트리글리세리드 증가 및 고칼륨혈증을 포함합니다. 또한 기준선에서 TSH < ULN인 환자 중에서 OPDIVO 군에서 에베롤리무스 군에 비해 TSH >ULN의 치료 발생 상승을 경험한 환자의 비율이 더 높았습니다(각각 26%와 14%).
표 29와 30은 각각 CHECKMATE-025에서의 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 무력증, 활동 감소, 피로 및 권태감을 포함합니다. b 비인두염, 인두염, 비염 및 바이러스성 상기도 감염(URI)을 포함합니다. c 대장염, 장염 및 위장염을 포함합니다. d 피부염, 여드름 모양 피부염, 홍반성 발진, 전신 발진, 반점 발진, 반점 구진 발진, 구진 발진, 가려운 발진, 다형 홍반 및 홍반을 포함합니다. |
||||
|
이상 반응 |
OPDIVO |
에베롤리무스 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
이상 반응 |
98 |
56 |
96 |
62 |
|
일반 |
||||
|
피로a |
56 |
6 |
57 |
7 |
|
발열 |
17 |
0.7 |
20 |
0.8 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침/객담 |
34 |
0 |
38 |
0.5 |
|
호흡 곤란/운동 시 호흡 곤란 |
27 |
3 |
31 |
2 |
|
상기도 감염b |
18 |
0 |
11 |
0 |
|
위장 |
||||
|
메스꺼움 |
28 |
0.5 |
29 |
1 |
|
설사c |
25 |
2.2 |
32 |
1.8 |
|
변비 |
23 |
0.5 |
18 |
0.5 |
|
구토 |
16 |
0.5 |
16 |
0.5 |
|
피부 및 피하 조직 |
||||
|
발진d |
28 |
1.5 |
36 |
1 |
|
가려움증/전신 가려움증 |
19 |
0 |
14 |
0 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
23 |
1.2 |
30 |
1.5 |
|
근골격계 및 결합 조직 |
||||
|
관절통 |
20 |
1 |
14 |
0.5 |
|
요통 |
21 |
3.4 |
16 |
2.8 |
CHECKMATE-025에서 임상적으로 중요한 다른 이상 반응은 다음과 같았습니다.
일반 장애 및 투여 부위 상태: 말초 부종/부종
위장 장애: 복통/불편함
근골격계 및 결합 조직 장애: 사지 통증, 근골격계 통증
신경계 장애: 두통/편두통, 말초 신경병증
검사: 체중 감소
피부 장애: 손바닥-발바닥 홍반각화증
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 그룹(범위: 259~401명의 환자) 및 에베롤리무스 그룹(범위: 257~376명의 환자). | ||||
|
실험실 이상 |
OPDIVO |
에베롤리무스 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
림프구 감소증 |
42 |
6 |
53 |
11 |
|
빈혈 |
39 |
8 |
69 |
16 |
|
화학 |
||||
|
크레아티닌 증가 |
42 |
2 |
45 |
1.6 |
|
AST 증가 |
33 |
2.8 |
39 |
1.6 |
|
알칼리성 포스파타제 증가 |
32 |
2.3 |
32 |
0.8 |
|
저나트륨혈증 |
32 |
7 |
26 |
6 |
|
고칼륨혈증 |
30 |
4 |
20 |
2.1 |
|
저칼슘혈증 |
23 |
0.9 |
26 |
1.3 |
|
ALT 증가 |
22 |
3.2 |
31 |
0.8 |
고칼슘혈증
19
3.2
6
0.3
지질
트리글리세라이드 증가
32
1.5
67
11
콜레스테롤 증가
21
0.3
55
1.4
고전적 호지킨 림프종
OPDIVO의 안전성은 cHL을 가진 성인 환자 266명(CHECKMATE-205 시험에서 243명, CHECKMATE-039 시험에서 23명)에서 평가되었습니다. [임상 연구(14.7) 참조]. 환자는 질병 진행, 최대 임상적 이점 또는 용납할 수 없는 독성이 나타날 때까지 2주마다 60분 동안 정맥 주입으로 OPDIVO 3 mg/kg을 투여받았습니다.
중간 연령은 34세(범위: 18~72세)였으며, 환자의 98%는 자가 조혈모세포 이식(HSCT)을 받았고, 아무도 동종 조혈모세포 이식(HSCT)을 받지 않았으며, 74%는 브렌툭시맙 베도틴을 받았습니다. 이전 전신 요법의 중간 횟수는 4회(범위: 2~15회)였습니다. 환자는 OPDIVO를 중간 23회(주기)(범위: 1~48회) 투여받았으며, 중간 치료 기간은 11개월(범위: 0~23개월)이었습니다.
11명의 환자가 질병 진행 이외의 원인으로 사망했습니다. 3명은 마지막 니볼루맙 투여 후 30일 이내에 유해 반응으로, 2명은 니볼루맙 완료 후 8~9개월 후 감염으로, 6명은 동종 조혈모세포 이식(HSCT) 합병증으로 사망했습니다. 환자의 26%에서 중대한 유해 반응이 발생했습니다. 유해 반응으로 인해 투여 지연이 발생한 환자는 34%였습니다. 유해 반응으로 인해 OPDIVO 투여를 중단한 환자는 7%였습니다.
환자의 1% 이상에서 보고된 가장 흔한 중대한 유해 반응은 폐렴, 주입 관련 반응, 발열, 결장염 또는 설사, 흉막 삼출, 폐렴, 발진이었습니다. 모든 환자에서 가장 흔한 유해 반응(≥20%)은 상기도 감염, 피로, 기침, 설사, 발열, 근골격계 통증, 발진, 메스꺼움, 가려움증이었습니다.
표 31과 32는 CHECKMATE-205와 CHECKMATE-039에서 각각 유해 반응과 실험실 이상을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 원인과 관계없이 마지막 니볼루맙 투여 후 30일까지 발생한 사건을 포함합니다. 면역 매개 유해 반응 후, 초기 니볼루맙 치료 과정을 완료한 후 30일까지 발생한 니볼루맙 재투여 후 반응을 포함했습니다. b 비인두염, 인두염, 비염, 부비동염을 포함합니다. c 세균성 폐렴, 마이코플라스마 폐렴, 폐포자충 폐렴을 포함합니다. d 무력증을 포함합니다. e 결장염을 포함합니다. f 복통과 상복부 통증을 포함합니다. g 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증을 포함합니다. h 피부염, 여드름성 피부염, 박탈성 피부염, 반점, 구진, 반점구진, 가려움증, 박탈성, 여드름성으로 설명되는 발진을 포함합니다. i 과민증, 저감각, 감각 이상, 이상 감각, 말초 운동 신경병증, 말초 감각 신경병증, 다발성 신경병증을 포함합니다. 이러한 숫자는 치료 발생 사건에만 해당됩니다. |
||
|
유해 반응a |
OPDIVO (n=266) |
|
|
모든 등급 (%) |
3-4등급 (%) |
|
|
감염 |
||
|
상기도 감염b |
44 |
0.8 |
|
폐렴/기관지 폐렴c |
13 |
3.8 |
|
코막힘 |
11 |
0 |
|
일반 |
||
|
피로d |
39 |
1.9 |
|
발열 |
29 |
<1 |
|
호흡기, 흉곽 및 종격동 |
||
|
기침/객담 동반 기침 |
36 |
0 |
|
호흡 곤란/운동성 호흡 곤란 |
15 |
1.5 |
|
위장관 |
||
|
설사e |
33 |
1.5 |
|
메스꺼움 |
20 |
0 |
|
구토 |
19 |
<1 |
|
복통f |
16 |
<1 |
|
변비 |
14 |
0.4 |
|
근골격계 및 결합 조직 |
||
|
근골격계 통증g |
26 |
1.1 |
|
관절통 |
16 |
<1 |
|
피부 및 피하 조직 |
||
|
발진h |
24 |
1.5 |
|
가려움증 |
20 |
0 |
|
신경계 |
||
|
두통 |
17 |
<1 |
|
말초 신경병증i |
12 |
<1 |
|
손상, 중독 및 수술적 합병증 |
||
|
주입 관련 반응 |
14 |
<1 |
|
내분비 |
||
|
저갑상선증/갑상선염 |
12 |
0 |
임상적으로 중요한 유해 반응에 대한 추가 정보:
면역 매개성 폐렴: CHECKMATE-205 및 CHECKMATE-039에서 OPDIVO를 투여받은 환자의 6.0%(16/266)에서 간질성 폐 질환을 포함한 폐렴이 발생했습니다. OPDIVO를 투여받은 환자의 4.9%(13/266)에서 면역 매개성 폐렴이 발생했습니다(3등급 1건, 2등급 12건). 발병까지의 중앙값은 4.5개월(범위: 5일~12개월)이었습니다. 13명의 환자 모두 전신 코르티코스테로이드를 투여받았으며 12명에서 호전되었습니다. 폐렴으로 인해 OPDIVO를 영구적으로 중단한 환자는 4명이었습니다. 8명의 환자가 OPDIVO를 계속 투여받았습니다(3명은 투여 지연 후). 이 중 2명은 폐렴이 재발했습니다.
말초 신경병증: OPDIVO를 투여받은 모든 환자의 12%(31/266)에서 치료로 인한 말초 신경병증이 보고되었습니다. 28명의 환자(11%)에서 새롭게 말초 신경병증이 발생했고 3명의 환자에서 기준선 대비 신경병증이 악화되었습니다. 발병까지의 중앙값은 50일(범위: 1~309일)이었습니다.
OPDIVO 투여 후 동종 이식 HSCT의 합병증: CHECKMATE-205 및 CHECKMATE-039 시험에서 OPDIVO로 치료받은 후 동종 이식 HSCT를 받은 cHL 환자 17명 중 6명(35%)이 이식 관련 합병증으로 사망했습니다. 5건의 사망이 심각한(3~4등급) 또는 난치성 GVHD 환경에서 발생했습니다. 급성 GVHD는 2명의 환자(12%)에서 발생했고 3등급 이상 GVHD는 5명의 환자(29%)에서 보고되었습니다. 간 VOD는 감소 강도 조절 동종 이식 HSCT를 받고 GVHD와 다발성 장기 부전으로 사망한 1명의 환자에서 발생했습니다.
표 32는 cHL 환자의 실험실 이상을 요약합니다. 가장 흔한(≥20%) 치료로 인한 실험실 이상에는 혈구 감소증, 간 기능 이상 및 리파아제 증가가 포함되었습니다. 기타 흔한 소견(≥10%)에는 크레아티닌 증가, 전해질 이상 및 아밀라아제 증가가 포함되었습니다.
| a 각 검사 발생률은 기준선과 연구 중 적어도 한 번의 실험실 측정을 모두 가진 환자 수를 기반으로 합니다: 범위: 203~266명의 환자. b 마지막 니볼루맙 투여 후 30일까지 발생하는 사건을 포함합니다. 면역 매개성 유해 반응 후, 초기 니볼루맙 치료 과정을 완료한 후 30일 이내에 발생한 니볼루맙 재투여 후 반응이 포함되었습니다. c 또한 안전성 모집단에서 공복 고혈당(모든 1~2등급)은 평가 가능한 환자 69명 중 27명(39%)에서 보고되었고 공복 저혈당(모든 1~2등급)은 69명 중 11명(16%)에서 보고되었습니다. |
||
|
실험실 이상 |
OPDIVOa |
|
|
모든 등급 (%)b |
3~4등급 (%)b |
|
|
혈액학 |
||
|
백혈구 감소증 |
38 |
4.5 |
|
호중구 감소증 |
37 |
5 |
|
혈소판 감소증 |
37 |
3 |
|
림프구 감소증 |
32 |
11 |
|
빈혈 |
26 |
2.6 |
|
화학c |
||
|
AST 증가 |
33 |
2.6 |
|
ALT 증가 |
31 |
3.4 |
|
리파아제 증가 |
22 |
9 |
|
알칼리성 포스파타아제 증가 |
20 |
1.5 |
|
저나트륨혈증 |
20 |
1.1 |
|
저칼륨혈증 |
16 |
1.9 |
|
크레아티닌 증가 |
16 |
<1 |
|
저칼슘혈증 |
15 |
<1 |
|
고칼륨혈증 |
15 |
1.5 |
|
저마그네슘혈증 |
14 |
<1 |
|
아밀라아제 증가 |
13 |
1.5 |
|
빌리루빈 증가 |
11 |
1.5 |
두경부 편평세포암종
OPDIVO의 안전성은 이전 백금 기반 치료를 받은 후 6개월 이내에 진행되거나 진행 중인 재발성 또는 전이성 SCCHN 환자를 대상으로 한 무작위 배정, 활성 대조, 공개 라벨, 다기관 시험인 CHECKMATE-141에서 평가되었습니다. [임상 연구(14.8) 참조]. 이 시험은 활성 자가 면역 질환, 전신 면역 억제가 필요한 의학적 상태 또는 비인두의 재발성 또는 전이성 암, 원발 부위가 알려지지 않은 편평세포암종, 침샘 또는 비편평 조직학(예: 점막 흑색종)을 가진 환자를 제외했습니다. 환자는 2주마다 60분 동안 정맥 주입으로 OPDIVO 3mg/kg(n=236) 또는 연구자의 선택에 따라 세툭시맙(400mg/m2 초기 용량을 정맥 주입한 후 250mg/m2를 매주), 또는 메토트렉세이트(40~60mg/m2를 매주 정맥 주입), 또는 도세탁셀(30~40mg/m2를 매주 정맥 주입)을 투여받았습니다. OPDIVO 치료 환자에서 니볼루맙에 대한 노출 기간 중앙값은 1.9개월(범위: 1일~16.1개월 이상)이었습니다. 이 시험에서 환자의 18%가 6개월 이상 OPDIVO를 투여받았고 환자의 2.5%가 1년 이상 OPDIVO를 투여받았습니다.
모든 무작위 배정 환자의 중앙값 연령은 60세(범위: 28~83세)였습니다. OPDIVO 그룹의 환자 28%가 65세 이상이었고 비교 그룹의 환자 37%가 65세 이상이었으며, 83%가 남성이었고 83%가 백인이었으며, 12%가 아시아인이었고 4%가 흑인이었습니다. 기준 ECOG 수행 상태는 0(20%) 또는 1(78%)이었으며, 환자의 45%가 이전에 전신 치료를 한 번만 받았고, 나머지 55%의 환자는 이전에 두 번 이상의 치료를 받았으며, 90%가 이전에 방사선 치료를 받았습니다.
OPDIVO를 투여받은 환자의 49%에서 심각한 이상 반응이 발생했습니다. OPDIVO는 환자의 14%에서 중단되었고 환자의 24%에서 이상 반응으로 인해 지연되었습니다. SCCHN 환자에서 발생한 이상 반응과 실험실 이상은 일반적으로 흑색종 및 비소세포폐암 환자에서 발생한 이상과 유사했습니다.
OPDIVO를 투여받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 폐렴, 호흡 곤란, 호흡 부전, 호흡기 감염 및 패혈증이었습니다. OPDIVO 치료 환자의 10% 이상에서 발생하고 연구자의 선택보다 발생률이 높았던 가장 흔한 이상 반응은 기침과 호흡 곤란이었습니다. OPDIVO 치료 환자의 10% 이상에서 발생하고 연구자의 선택보다 발생률이 높았던 가장 흔한 실험실 이상은 알칼리성 포스파타제 증가, 아밀라아제 증가, 고칼슘혈증, 고칼륨혈증 및 TSH 증가였습니다.
방광암(UC)의 보조 치료
OPDIVO의 안전성은 방광 또는 상부 요로(신우 또는 요관)에서 발생한 UC의 근치적 절제술을 받았고 재발 위험이 높은 성인 환자를 대상으로 한 무작위 배정, 이중 맹검, 다기관 시험인 CHECKMATE-274에서 위약과 비교하여 평가되었습니다. [임상 연구(14.9) 참조]. 환자는 재발 또는 용납할 수 없는 독성이 발생할 때까지 최대 1년 동안 2주마다 30분 동안 정맥 주입으로 OPDIVO 240mg(n=351) 또는 위약(n=348)을 투여받았습니다. OPDIVO 치료 기간 중앙값은 8.8개월(범위: 0~12.5개월)이었습니다.
OPDIVO 환자의 30%에서 심각한 이상 반응이 발생했습니다. 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 요로 감염이었습니다. 치명적인 이상 반응은 환자의 1%에서 발생했습니다. 여기에는 폐렴(0.6%) 사례가 포함되었습니다. OPDIVO는 환자의 18%에서 이상 반응으로 인해 중단되었습니다. OPDIVO는 환자의 33%에서 이상 반응으로 인해 지연되었습니다.
가장 흔한 이상 반응(환자의 20% 이상에서 보고됨)은 발진, 피로, 설사, 가려움증, 근골격계 통증 및 요로 감염이었습니다.
표 33과 34는 각각 CHECKMATE-274에서 발생한 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 여기에는 여드름, 물집, 피부염, 여드름성 피부염, 알레르기성 피부염, 접촉성 피부염, 습진, 건성 습진, 동전상 습진, 홍반, 다형성 홍반, 백색 수포증, 지루각화증, 천포창, 광과민 반응, 색소 침착 장애, 건선, 발진, 홍반성 발진, 반점 발진, 반점 구진성 발진, 구진성 발진, 가려운 발진, 주사, 피부 박리, 피부 병변, 피부 반응, 독성 피부 발진 및 두드러기가 포함됩니다. b 여기에는 대장염, 미세 대장염, 설사, 십이지장염, 장염, 면역 매개성 장염이 포함됩니다. c 여기에는 복통, 복부 불편감, 복부 압통, 하복부 및 상복부 통증이 포함됩니다. d 여기에는 근골격계 통증, 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편감, 근육통, 목 통증, 사지 통증 및 척추 통증이 포함됩니다. e 여기에는 방광염, 대장균 요로 감염, 신우 신염, 급성 신우 신염, 만성 신우 신염, 요도염, 요로 감염, 세균성 요로 감염, 포도상 구균 요로 감염 및 요독증이 포함됩니다. f 여기에는 상기도 감염, 비인두염, 인두염 및 비염이 포함됩니다. g 여기에는 급성 신장 손상, 자가 면역 신염, 혈액 크레아티닌 증가, 사구체 여과율 감소, 면역 매개성 신염, 신염, 신부전 및 신장 기능 장애가 포함됩니다. h 여기에는 기침, 객담을 동반한 기침 및 상기도 기침 증후군이 포함됩니다. i 여기에는 호흡 곤란 및 운동성 호흡 곤란이 포함됩니다. j 여기에는 현기증, 자세성 현기증 및 어지럼증이 포함됩니다. k 여기에는 아스파르테이트 아미노 전이효소 증가, 알라닌 아미노 전이효소 증가, 혈액 빌리루빈 증가, 담관염, 약물 유발성 간 손상, 간부전, 간 기능 이상, 간염, 간세포 손상, 고빌리루빈혈증, 감마-글루타밀 전이효소 증가, 간 손상 및 아미노 전이효소 증가가 포함됩니다. |
||||
|
이상 반응 |
OPDIVO (n=351) |
위약 (n=348) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
피부 및 피하 조직 |
||||
|
발진a |
36 |
1.7 |
19 |
0.3 |
|
가려움증 |
30 |
0 |
16 |
0 |
|
일반 |
||||
|
피로/무력증 |
36 |
1.1 |
32 |
0.3 |
|
발열 |
10 |
0.3 |
10 |
0.3 |
|
위장관 |
||||
|
설사b |
30 |
2.8 |
27 |
1.7 |
|
메스꺼움 |
16 |
0.6 |
13 |
0 |
|
복통c |
15 |
0.9 |
15 |
0.6 |
|
변비 |
13 |
0.3 |
15 |
0.3 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증d |
28 |
0.6 |
24 |
0.9 |
|
관절통 |
11 |
0.3 |
13 |
0 |
|
감염 |
||||
|
요로 감염e |
22 |
6 |
23 |
9 |
|
상기도 감염f |
16 |
0.3 |
16 |
0.6 |
|
내분비 |
||||
|
갑상선 기능 항진증 |
11 |
0 |
1.1 |
0 |
|
갑상선 기능 저하증 |
11 |
0 |
2.3 |
0 |
|
신장 및 비뇨기 질환 |
||||
|
신장 기능 장애g |
17 |
1.7 |
16 |
0.9 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침h |
14 |
0 |
11 |
0 |
|
호흡 곤란i |
11 |
0.3 |
6 |
0.3 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
13 |
0.9 |
7 |
0.3 |
|
신경계 질환 |
||||
|
현기증j |
11 |
0.3 |
9 |
0 |
|
간담도계 |
||||
|
간염k |
11 |
4 |
8 |
0.6 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 그룹(범위: 322~348명) 및 위약 그룹(범위: 312~341명). | ||||
|
실험실 이상 |
OPDIVO (n=351) |
위약 (n=348) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
크레아티닌 증가 |
36 |
1.7 |
36 |
2.6 |
|
아밀라아제 증가 |
34 |
8 |
23 |
3.2 |
|
리파아제 증가 |
33 |
12 |
31 |
10 |
|
고칼륨혈증 |
32 |
5 |
30 |
6 |
|
알칼리성 포스파타아제 증가 |
24 |
2.3 |
15 |
0.6 |
|
AST 증가 |
24 |
3.5 |
16 |
0.9 |
|
ALT 증가 |
23 |
2.9 |
15 |
0.6 |
|
저나트륨혈증 |
22 |
4.1 |
17 |
1.8 |
|
저칼슘혈증 |
17 |
1.2 |
11 |
0.9 |
|
저마그네슘혈증 |
16 |
0 |
9 |
0 |
고칼슘혈증
12
0.3
8
0.3
혈액학
림프구 감소증
33
2.9
27
1.5
빈혈
30
1.4
28
0.9
호중구 감소증
11
0.6
10
0.3
First-line Treatment of Unresectable or Metastatic UC
OPDIVO의 안전성은 절제 불가능하거나 전이성 UC를 가진 시스플라틴 적합 환자를 대상으로 한 무작위 배정, 공개 표지 시험인 CHECKMATE-901에서 평가되었습니다. [임상 연구(14.9) 참조]. 환자는 최대 2년 동안 4주마다 단일 요법 OPDIVO 480mg을 투여받기 전에 최대 6주기 동안 3주마다 시스플라틴과 젬시타빈을 병용한 OPDIVO 360mg을 투여받았습니다(n=304) 또는 최대 6주기 동안 3주마다 시스플라틴과 젬시타빈 화학 요법을 투여받았습니다(n=288). 시스플라틴만 중단한 환자는 카보플라틴으로 전환할 수 있었습니다.
화학 요법과 함께 OPDIVO를 투여받은 환자 중 OPDIVO 노출의 중간 기간은 7.4개월(범위: 0.03~47.9개월)이었습니다. 화학 요법과 병용하여 OPDIVO를 투여받은 환자의 48%에서 심각한 이상 반응이 발생했습니다. 화학 요법과 함께 OPDIVO를 투여받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 요로 감염(4.9%), 급성 신장 손상(4.3%), 빈혈(3%), 폐색전증(2.6%), 패혈증(2.3%) 및 혈소판 수 감소(2.3%)였습니다. 가장 흔한 이상 반응(환자의 20% 이상에서 보고됨)은 메스꺼움, 피로, 근골격계 통증, 변비, 식욕 감소, 발진, 구토 및 말초 신경병증이었습니다.
화학 요법과 병용하여 OPDIVO를 투여받은 환자의 3.6%에서 치명적인 이상 반응이 발생했습니다. 여기에는 패혈증(1%)이 포함됩니다.
OPDIVO 및/또는 화학 요법은 환자의 30%에서 중단되었고 이상 반응으로 인해 환자의 67%에서 지연되었습니다.
표 35와 36은 CHECKMATE-901에서 각각 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 대장염, 면역 매개성 장염을 포함합니다. b 상복부 통증, 하복부 통증, 복통, 상복부 불편감, 위장 통증 및 간 통증을 포함합니다. c 무력증을 포함합니다. d 말초 부종, 부종, 말초 부종, 국소 부종, 부종, 안면 부종, 고환 부종, 중력 부종 및 생식기 부종을 포함합니다. e 고열, 체온 상승 및 고열을 포함합니다. f 요통, 관절통, 뼈 통증, 관절염, 근골격계 흉통, 비심장성 흉통, 근육통, 목 통증, 사지 통증 및 척추 통증을 포함합니다. g 구진 구진 발진, 홍반성 발진, 반점 발진, 구진 발진, 농포성 발진, 여드름 모양 피부염, 피부염, 알레르기성 피부염, 아토피 피부염, 박탈성 발진, 건조증 습진, 다형 홍반, 손바닥-발바닥 홍반 각화증, 습진, 박탈성 피부염 전신 및 피부 박탈을 포함합니다. h 지각 이상, 말초 감각 신경병증, 감각 저하, 이상 감각, 신경통, 과민증, 말초 운동 신경병증, 다발성 신경병증을 포함합니다. i 후두 신경통을 포함합니다. j 요로 패혈증, 방광염, 신우신염, 급성 신우신염, 장구균 요로 감염, 대장균 요로 감염을 포함합니다. k 혈액 자극 호르몬 증가를 포함합니다. l 급성 신장 손상, 신부전, 신장 기능 저하, 사구체 여과율 감소, 무뇨증, 질소혈증을 포함합니다. |
||||
|
이상 반응 |
OPDIVO 및 백금 이중 화학 요법 |
백금 이중 화학 요법 (n=288) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
위장관 장애 |
||||
|
메스꺼움 |
52 |
0.3 |
53 |
1 |
|
변비 |
30 |
0 |
28 |
0.7 |
|
구토 |
23 |
1.3 |
19 |
2.1 |
|
설사a |
19 |
2 |
14 |
0 |
|
복통b |
14 |
0.3 |
9 |
0.3 |
|
일반 |
||||
|
피로c |
48 |
3.9 |
43 |
4.2 |
|
부종d |
18 |
0 |
9 |
0.3 |
|
발열e |
14 |
1 |
14 |
0 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증f |
33 |
3 |
21 |
0.3 |
|
신진대사 및 영양 |
||||
|
식욕 감퇴 |
30 |
1.6 |
19 |
1 |
|
피부 및 피하 조직 |
||||
|
발진g |
25 |
2.3 |
7 |
0.3 |
|
가려움증 |
17 |
0.7 |
3.5 |
0 |
|
신경계 장애 |
||||
|
말초 신경병증h |
20 |
0.7 |
14 |
0 |
|
두통i |
11 |
0 |
5 |
0 |
|
감염 |
||||
|
요로 감염j |
19 |
8 |
18 |
8 |
|
내분비 장애 |
||||
|
저갑상선증k |
17 |
0 |
0.3 |
0 |
|
신장 및 요로 장애 |
||||
|
신장 기능 장애l |
14 |
6 |
11 |
1.7 |
|
혈뇨 |
11 |
1 |
7 |
1.4 |
|
검사 |
||||
|
체중 감소 |
11 |
0.3 |
6 |
0 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 함: OPDIVO 그룹(범위: 289-301명) 및 화학 요법 그룹(범위: 265-281명). | ||||
|
실험실 이상 |
OPDIVO 및 백금 이중 약물 화학 요법 |
백금 이중 약물 화학 요법 |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
빈혈 |
88 |
21 |
80 |
21 |
|
호중구 감소증 |
82 |
35 |
76 |
28 |
|
림프구 감소증 |
71 |
17 |
56 |
13 |
|
혈소판 감소증 |
60 |
13 |
51 |
8 |
|
화학 |
||||
|
크레아티닌 증가 |
53 |
2.4 |
42 |
1.1 |
|
저마그네슘혈증 |
48 |
3.8 |
39 |
1.5 |
|
저나트륨혈증 |
43 |
13 |
39 |
8 |
|
고혈당증 |
41 |
3.9 |
37 |
3.2 |
|
저칼슘혈증 |
36 |
2.1 |
24 |
1.1 |
|
고칼륨혈증 |
33 |
3.0 |
32 |
1.1 |
아밀라아제 증가
32
4.2
23
3.6
AST 증가
31
2.4
17
0.7
ALT 증가
29
2.4
19
0.7
이전에 치료받은 진행성 또는 전이성 UC
OPDIVO의 안전성은 CHECKMATE-275에서 평가되었으며, 이는 백금 함유 화학 요법 중 또는 그 후에 질병 진행이 발생한 국소 진행성 또는 전이성 UC 환자 270명 또는 백금 함유 화학 요법으로 신보조 또는 보조 치료를 받은 후 12개월 이내에 질병 진행이 발생한 환자를 대상으로 한 단일군 시험입니다 [임상 연구(14.9) 참조]. 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 2주마다 60분 동안 정맥 주입으로 OPDIVO 3 mg/kg을 투여받았습니다. 치료 기간 중앙값은 3.3개월(범위: 0~13.4+개월)이었습니다. 환자의 46%는 유해 반응으로 인해 투여량이 중단되었습니다.
질병 진행 이외의 원인으로 사망한 환자는 14명(5.2%)이었습니다. 여기에는 OPDIVO 치료와 관련된 폐렴 또는 심혈관 부전으로 사망한 환자 4명(1.5%)이 포함됩니다. 중증 유해 반응은 환자의 54%에서 발생했습니다. 환자의 17%에서 유해 반응으로 인해 OPDIVO 투여가 중단되었습니다.
환자의 2% 이상에서 보고된 가장 흔한 중증 유해 반응은 요로 감염, 패혈증, 설사, 소장 폐쇄 및 전반적인 신체 건강 악화였습니다. 가장 흔한 유해 반응(환자의 20% 이상에서 보고됨)은 피로, 근골격계 통증, 메스꺼움 및 식욕 감소였습니다.
표 37과 38은 각각 CHECKMATE-275에서 발생한 유해 반응과 실험실 이상을 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 등 통증, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 목 통증, 사지 통증 및 척추 통증을 포함합니다. b 복통, 하복부 통증 및 상복부 통증을 포함합니다. c 피부염, 여드름성 피부염, 수포성 피부염 및 발진(일반화, 반점, 반점구진, 가려움증)을 포함합니다. d 자가 면역 갑상선염, 혈액 TSH 감소, 혈액 TSH 증가, 갑상선 기능 항진증, 갑상선 기능 저하증, 갑상선염, 티록신 감소, 유리 티록신 증가, 티록신 증가, 유리 트리요오드티로닌 증가, 트리요오드티로닌 증가를 포함합니다. |
||
|
유해 반응 |
OPDIVO |
|
|
모든 등급(%) |
3-4등급(%) |
|
|
유해 반응 |
99 |
51 |
|
일반 |
||
|
쇠약/피로/권태감 |
46 |
7 |
|
발열/종양 관련 발열 |
17 |
0.4 |
|
부종/말초 부종/말초 팽윤 |
13 |
0.4 |
|
근골격계 및 결합 조직 |
||
|
근골격계 통증a |
30 |
2.6 |
|
관절통 |
10 |
0.7 |
|
신진대사 및 영양 |
||
|
식욕 감소 |
22 |
2.2 |
|
위장관 |
||
|
메스꺼움 |
22 |
0.7 |
|
설사 |
17 |
2.6 |
|
변비 |
16 |
0.4 |
|
복통b |
13 |
1.5 |
|
구토 |
12 |
1.9 |
|
호흡기, 흉곽 및 종격동 |
||
|
기침/객담 동반 기침 |
18 |
0 |
|
호흡곤란/운동성 호흡곤란 |
14 |
3.3 |
|
감염 |
||
|
요로 감염/대장균/진균성 요로 감염 |
17 |
7 |
|
피부 및 피하 조직 |
||
|
발진c |
16 |
1.5 |
|
가려움증 |
12 |
0 |
|
내분비 |
||
|
갑상선 장애d |
15 |
0 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다: 범위: 84~256명의 환자. | ||
|
실험실 이상 |
OPDIVOa |
|
|
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||
|
고혈당 |
42 |
2.4 |
|
저나트륨혈증 |
41 |
11 |
|
크레아티닌 증가 |
39 |
2 |
|
알칼리성 포스파타제 증가 |
33 |
5.5 |
|
저칼슘혈증 |
26 |
0.8 |
|
AST 증가 |
24 |
3.5 |
|
리파아제 증가 |
20 |
7 |
|
고칼륨혈증 |
19 |
1.2 |
|
ALT 증가 |
18 |
1.2 |
|
아밀라아제 증가 |
18 |
4.4 |
|
저마그네슘혈증 |
16 |
0 |
|
혈액학 |
||
|
림프구 감소증 |
42 |
9 |
|
빈혈 |
40 |
7 |
|
혈소판 감소증 |
15 |
2.4 |
|
백혈구 감소증 |
11 |
0 |
MSI-H 또는 dMMR 전이성 대장암
단독 요법 또는 이필리무맙과 병용 투여된 OPDIVO의 안전성은 다기관, 비무작위 배정, 다중 병행 코호트, 공개 표지 시험인 CHECKMATE-142에서 평가되었습니다. [임상 연구(14.10) 참조]. CHECKMATE-142에서 mCRC 환자 74명은 질병 진행 또는 참을 수 없는 독성이 나타날 때까지 2주마다 60분 동안 정맥 주입으로 OPDIVO 3 mg/kg을 투여받았고, mCRC 환자 119명은 4회 투여 동안 3주마다 OPDIVO 3 mg/kg과 이필리무맙 1 mg/kg을 투여받은 후 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 2주마다 OPDIVO 3 mg/kg을 투여받았습니다.
이필리무맙과 병용 투여된 OPDIVO 코호트에서 환자의 47%에서 심각한 이상 반응이 발생했습니다. 환자의 13%에서 치료를 중단했고, 환자의 45%에서 이상 반응으로 인해 치료를 지연했습니다. 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 대장염/설사, 간 이벤트, 복통, 급성 신장 손상, 발열 및 탈수증이었습니다. 가장 흔한 이상 반응(환자의 20% 이상에서 보고됨)은 피로, 설사, 발열, 근골격계 통증, 복통, 가려움증, 메스꺼움, 발진, 식욕 감소 및 구토였습니다.
표 39와 40은 각각 CHECKMATE-142에서 이상 반응과 실험실 이상을 요약한 것입니다. CHECKMATE-142의 설계를 기반으로 아래 데이터는 아래 요약된 두 코호트 간의 모든 이상 반응에 대한 통계적으로 유의미한 차이를 식별하는 데 사용할 수 없습니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 무력증 포함. b 말초 부종 및 말초 팽창 포함. c 상복부 통증, 하복부 통증 및 복부 불편함 포함. d 요통, 사지 통증, 근육통, 목 통증 및 뼈 통증 포함. e 피부염, 여드름성 피부염 및 구진-반점, 홍반 및 전신으로 설명되는 발진 포함. f 비인두염 및 비염 포함. |
||||
|
이상 반응 |
OPDIVO |
OPDIVO 및 이필리무맙 |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
일반 |
||||
|
피로a |
54 |
5 |
49 |
6 |
|
발열 |
24 |
0 |
36 |
0 |
|
부종b |
12 |
0 |
7 |
0 |
|
위장 |
||||
|
설사 |
43 |
2.7 |
45 |
3.4 |
|
복통c |
34 |
2.7 |
30 |
5 |
|
메스꺼움 |
34 |
1.4 |
26 |
0.8 |
|
구토 |
28 |
4.1 |
20 |
1.7 |
|
변비 |
20 |
0 |
15 |
0 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증d |
28 |
1.4 |
36 |
3.4 |
|
관절통 |
19 |
0 |
14 |
0.8 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침 |
26 |
0 |
19 |
0.8 |
|
호흡곤란 |
8 |
1 |
13 |
1.7 |
|
피부 및 피하 조직 |
||||
|
발진e |
23 |
1.4 |
25 |
4.2 |
|
가려움증 |
19 |
0 |
28 |
1.7 |
|
건조한 피부 |
7 |
0 |
11 |
0 |
|
감염 |
||||
|
상기도 감염f |
20 |
0 |
9 |
0 |
|
내분비 |
||||
|
고혈당 |
19 |
2.7 |
6 |
1 |
|
저하갑상선증 |
5 |
0 |
14 |
0.8 |
|
갑상선 기능 항진증 |
4 |
0 |
12 |
0 |
|
신경계 |
||||
|
두통 |
16 |
0 |
17 |
1.7 |
|
현기증 |
14 |
0 |
11 |
0 |
|
대사 및 영양 |
||||
|
식욕 감소 |
14 |
1.4 |
20 |
1.7 |
|
정신과적 |
||||
|
불면증 |
9 |
0 |
13 |
0.8 |
|
검사 |
||||
|
체중 감소 |
8 |
0 |
10 |
0 |
OPDIVO와 ipilimumab을 함께 투여받은 환자의 10% 미만에서 보고된 임상적으로 중요한 유해 반응은 뇌염(0.8%), 괴사성 근육염(0.8%) 및 포도막염(0.8%)이었습니다.
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. 평가 가능한 환자 수는 OPDIVO 코호트의 경우 62명에서 71명까지, OPDIVO 및 ipilimumab 코호트의 경우 87명에서 114명까지입니다. | ||||
|
실험실 이상 |
OPDIVO |
OPDIVO 및 Ipilimumab |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
빈혈 |
50 |
7 |
42 |
9 |
|
림프구 감소증 |
36 |
7 |
25 |
6 |
|
호중구 감소증 |
20 |
4.3 |
18 |
0 |
|
혈소판 감소증 |
16 |
1.4 |
26 |
0.9 |
|
화학 |
||||
|
알칼리성 포스파타제 증가 |
37 |
2.8 |
28 |
5 |
|
리파아제 증가 |
33 |
19 |
39 |
12 |
|
ALT 증가 |
32 |
2.8 |
33 |
12 |
|
AST 증가 |
31 |
1.4 |
40 |
12 |
|
저나트륨혈증 |
27 |
4.3 |
26 |
5 |
|
저칼슘혈증 |
19 |
0 |
16 |
0 |
저마그네슘혈증
17
0
18
0
아밀라아제 증가
16
4.8
36
3.4
빌리루빈 증가
14
4.2
21
5
저칼륨혈증
14
0
15
1.8
크레아티닌 증가
12
0
25
3.6
고칼륨혈증
11
0
23
0.9
간세포암
OPDIVO 1 mg/kg와 ipilimumab 3 mg/kg 병용 투여의 안전성은 sorafenib에 진행 또는 내약성이 없는 HCC 환자 및 Child-Pugh Class A 간경변증 환자 49명을 포함하는 CHECKMATE-040의 4군에서 평가되었으며, 이는 다기관, 다군, 공개 표지 시험입니다 [임상 연구(14.11) 참조]. OPDIVO와 ipilimumab은 4회 투여 후 3주마다 투여되었으며, 이후 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 2주마다 단독 OPDIVO 240 mg을 투여했습니다. OPDIVO와 ipilimumab 병용 투여 기간 동안 49명 중 33명(67%)의 환자가 계획된 OPDIVO와 ipilimumab 4회 투여를 모두 받았습니다. 전체 치료 기간 동안 OPDIVO에 대한 중간 노출 기간은 5.1개월(범위: 0~35개월 이상)이었고, ipilimumab에 대한 중간 노출 기간은 2.1개월(범위: 0~4.5개월)이었습니다. 환자의 47%가 6개월 이상 치료에 노출되었고, 환자의 35%가 1년 이상 치료에 노출되었습니다. 중대한 이상 반응은 환자의 59%에서 발생했습니다. 이상 반응으로 인해 환자의 29%에서 치료가 중단되었고, 환자의 65%에서 치료가 지연되었습니다.
환자의 4% 이상에서 보고된 가장 흔한 중대한 이상 반응은 발열, 설사, 빈혈, AST 증가, 부신 기능 저하증, 복수, 식도 정맥류 출혈, 저나트륨혈증, 혈액 빌리루빈 증가 및 폐렴이었습니다.
표 41과 42는 각각 CHECKMATE-040에서 발생한 이상 반응과 실험실 검사 이상을 요약한 것입니다.
|
이상 반응 |
OPDIVO와 ipilimumab (n=49) |
|
|
모든 등급(%) |
3-4등급(%) |
|
|
피부 및 피하 조직 |
||
|
발진 |
53 |
8 |
|
가려움증 |
53 |
4 |
|
근골격계 및 결합 조직 |
||
|
근골격계 통증 |
41 |
2 |
|
관절통 |
10 |
0 |
|
위장관 |
||
|
설사 |
39 |
4 |
|
복통 |
22 |
6 |
|
메스꺼움 |
20 |
0 |
|
복수 |
14 |
6 |
|
변비 |
14 |
0 |
|
구강 건조 |
12 |
0 |
|
소화 불량 |
12 |
2 |
|
구토 |
12 |
2 |
|
구내염 |
10 |
0 |
|
호흡기, 흉곽 및 종격동 |
||
|
기침 |
37 |
0 |
|
호흡곤란 |
14 |
0 |
|
폐렴 |
10 |
2 |
|
신진대사 및 영양 |
||
|
식욕 감소 |
35 |
2 |
|
일반 |
||
|
피로 |
27 |
2 |
|
발열 |
27 |
0 |
|
불쾌감 |
18 |
2 |
|
부종 |
16 |
2 |
|
독감 유사 증상 |
14 |
0 |
|
오한 |
10 |
0 |
|
신경계 |
||
|
두통 |
22 |
0 |
|
현기증 |
20 |
0 |
|
내분비 |
||
|
저갑상선증 |
20 |
0 |
|
부신 기능 저하증 |
18 |
4 |
|
검사 |
||
|
체중 감소 |
20 |
0 |
|
정신 |
||
|
불면증 |
18 |
0 |
|
혈액 및 림프계 |
||
|
빈혈 |
10 |
4 |
|
감염 |
||
|
독감 |
10 |
2 |
|
혈관 |
||
|
저혈압 |
10 |
0 |
OPDIVO와 이필리무맙을 함께 투여받은 환자의 10% 미만에서 보고된 임상적으로 중요한 유해 반응은 고혈당증(8%), 대장염(4%) 및 혈청 크레아틴 키나아제 증가(2%)였습니다.
|
실험실 이상 |
OPDIVO 및 이필리무맙 (n=47) |
|
|
모든 등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||
|
림프구 감소증 |
53 |
13 |
|
빈혈 |
43 |
4.3 |
|
호중구 감소증 |
43 |
9 |
|
백혈구 감소증 |
40 |
2.1 |
|
혈소판 감소증 |
34 |
4.3 |
|
화학 |
||
|
AST 증가 |
66 |
40 |
|
ALT 증가 |
66 |
21 |
|
빌리루빈 증가 |
55 |
11 |
|
리파아제 증가 |
51 |
26 |
|
저나트륨혈증 |
49 |
32 |
|
저칼슘혈증 |
47 |
0 |
|
알칼리성 포스파타아제 증가 |
40 |
4.3 |
|
아밀라아제 증가 |
38 |
15 |
|
저칼륨혈증 |
26 |
2.1 |
|
고칼륨혈증 |
23 |
4.3 |
|
크레아티닌 증가 |
21 |
0 |
|
저마그네슘혈증 |
11 |
0 |
이피리무맙과 함께 OPDIVO를 투여받은 환자의 경우, 기저 상태에서 활성 HBV 또는 HCV가 있는 환자에서 각각 28명 중 4명(14%)과 4명 중 2명(50%)에서 바이러스학적 돌파가 발생했습니다. HBV 바이러스학적 돌파는 기저 상태에서 검출 가능한 HBV DNA가 있는 환자의 경우 HBV DNA가 1 log 이상 증가한 것으로 정의되었습니다. HCV 바이러스학적 돌파는 기저 상태에서 HCV RNA가 1 log 증가한 것으로 정의되었습니다.
식도암
절제된 식도암 또는 위식도 접합부 암의 보조 치료
OPDIVO의 안전성은 CHECKMATE-577에서 평가되었으며, 이는 화학 방사선 요법(CRT) 후 잔여 병리학적 질환이 있는 완전히 절제된(음성 마진) 식도암 또는 위식도 접합부 암 환자 792명을 대상으로 한 무작위 배정, 위약 대조, 이중 맹검, 다기관 시험입니다. [임상 연구(14.12) 참조]. 이 시험은 수술 전 동시 CRT를 받지 않은 환자, IV기 절제 가능 질환이 있는 환자, 자가 면역 질환이 있는 환자, 또는 코르티코스테로이드(매일 10mg 이상의 프레드니손 또는 동등한 약물) 또는 기타 면역 억제제로 전신 치료가 필요한 환자를 제외했습니다. 환자는 16주 동안 2주마다 30분 동안 정맥 주입으로 OPDIVO 240mg 또는 위약을 투여받았고, 그 후 17주부터 4주마다 30분 동안 정맥 주입으로 480mg 또는 위약을 투여받았습니다. 환자는 질병 재발, 용납할 수 없는 독성 또는 최대 1년 동안 치료를 받았습니다. OPDIVO 치료 환자의 중간 노출 기간은 10.1개월(범위: <0.1~14개월)이었고, 위약 치료 환자의 중간 노출 기간은 9개월(범위: <0.1~15개월)이었습니다. OPDIVO를 투여받은 환자 중 61%는 6개월 이상, 54%는 9개월 이상 노출되었습니다.
중증의 유해 반응은 OPDIVO를 투여받은 환자의 33%에서 발생했습니다. OPDIVO를 투여받은 환자의 2% 이상에서 보고된 중증의 유해 반응은 폐렴이었습니다. OPDIVO를 투여받은 환자 1명에서 심근 경색의 치명적인 유해 반응이 발생했습니다.
OPDIVO는 환자의 12%에서 중단되었고, 환자의 28%에서 유해 반응으로 인해 지연되었습니다.
표 43과 44는 CHECKMATE-577에서 발생한 유해 반응과 실험실 이상을 각각 요약한 것입니다.
| a 상복부 통증, 하복부 통증 및 복통을 포함합니다. b 위식도 역류를 포함합니다. c 무력증을 포함합니다. d 기침을 포함합니다. e 운동 시 호흡 곤란을 포함합니다. f 농포성 발진, 피부염, 여드름형 피부염, 알레르기성 피부염, 수포성 피부염, 박탈성 발진, 홍반성 발진, 반점 발진, 반점 구진성 발진, 구진성 발진, 가려움증을 포함합니다. g 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편함, 근육통, 늑간 근육통, 목 통증, 사지 통증, 척추 통증을 포함합니다. |
||||
|
유해 반응 |
OPDIVO (n=532) |
위약 (n=260) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
유해 반응 |
96 |
34 |
93 |
32 |
|
위장관 |
||||
|
설사 |
29 |
0.9 |
29 |
0.8 |
|
메스꺼움 |
23 |
0.8 |
21 |
0 |
|
복통a |
17 |
0.8 |
20 |
1.5 |
|
구토 |
15 |
0.6 |
16 |
1.2 |
|
연하곤란 |
13 |
0.8 |
17 |
3.5 |
|
소화불량b |
12 |
0.2 |
16 |
0.4 |
|
변비 |
11 |
0 |
12 |
0 |
|
일반 |
||||
|
피로c |
34 |
1.3 |
29 |
1.5 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침d |
20 |
0.2 |
21 |
0.4 |
|
호흡곤란e |
12 |
0.8 |
12 |
0.4 |
|
피부 및 피하 조직 |
||||
|
발진f |
21 |
0.9 |
10 |
0.4 |
|
가려움증 |
13 |
0.4 |
6 |
0 |
|
검사 |
||||
|
체중 감소 |
13 |
0.4 |
9 |
0 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 통증g |
21 |
0.6 |
20 |
0.8 |
|
관절통 |
10 |
0.2 |
8 |
0 |
|
신진대사 및 영양 |
||||
|
식욕 감소 |
15 |
0.9 |
10 |
0.8 |
|
내분비 |
||||
|
저하선 기능 저하증 |
11 |
0 |
1.5 |
0 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 함: OPDIVO 그룹(범위: 163~526명) 및 위약 그룹(범위: 86~256명). b 알라닌 아미노트랜스퍼라제 증가, 아스파르테이트 아미노트랜스퍼라제 증가 포함. |
||||
|
실험실 이상 |
OPDIVO (n=532) |
위약 (n=260) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
AST 증가 |
27 |
2.1 |
22 |
0.8 |
|
알칼리성 포스파타제 증가 |
25 |
0.8 |
18 |
0.8 |
|
알부민 증가 |
21 |
0.2 |
18 |
0 |
|
ALT 증가 |
20 |
1.9 |
16 |
1.2 |
|
아밀라아제 증가 |
20 |
3.9 |
13 |
1.3 |
|
저나트륨혈증 |
19 |
1.7 |
12 |
1.2 |
|
고칼륨혈증 |
17 |
0.8 |
15 |
1.6 |
|
저칼륨혈증 |
12 |
1 |
11 |
1.2 |
|
아미노트랜스퍼라제 증가b |
11 |
1.5 |
6 |
1.2 |
|
혈액학 |
||||
|
림프구 감소증 |
44 |
17 |
35 |
12 |
빈혈
27
0.8
21
0.4
호중구 감소증
24
1.5
23
0.4
불수술 가능한 진행성 또는 전이성 ESCC의 1차 치료
화학 요법과 병용하거나 이필리무맙과 병용한 OPDIVO의 안전성은 이전에 치료를 받지 않은 불수술 가능한 진행성, 재발성 또는 전이성 ESCC 환자를 대상으로 한 무작위 배정, 활성 대조, 다기관, 공개 표지 시험인 CHECKMATE-648에서 평가되었습니다. [임상 연구(14.12) 참조]. 환자는 다음 치료 중 하나를 받았습니다.
- •
- OPDIVO 240mg을 1일차와 15일차에 투여하고, 5-FU(플루오로우라실) 800mg/m2/일을 1일부터 5일까지(5일 동안) 정맥 주사하고, 시스플라틴 80mg/m2를 1일차에 정맥 주사(4주기).
- •
- OPDIVO 3mg/kg을 2주마다 투여하고, 이필리무맙 1mg/kg을 6주마다 투여.
- •
- 5-FU(플루오로우라실) 800mg/m2/일을 1일부터 5일까지(5일 동안) 정맥 주사하고, 시스플라틴 80mg/m2를 1일차에 정맥 주사(4주기).
화학 요법과 병용하여 OPDIVO를 투여받은 환자의 경우 중간 노출 기간은 5.7개월(범위: 0.1~30.6개월)이었습니다. OPDIVO와 이필리무맙을 투여받은 환자의 경우 중간 노출 기간은 2.8개월(범위: 0~24개월)이었습니다.
화학 요법과 병용하여 OPDIVO를 투여받은 환자의 62%에서 심각한 이상 반응이 발생했고, OPDIVO와 이필리무맙을 투여받은 환자의 69%에서 심각한 이상 반응이 발생했습니다. 화학 요법과 병용하여 OPDIVO를 투여받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 폐렴(11%), 연하 곤란(7%), 식도 협착(2.9%), 급성 신장 손상(2.9%), 발열(2.3%)이었습니다. OPDIVO와 이필리무맙을 투여받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 폐렴(10%), 발열(4.3%), 폐렴(4%), 흡인성 폐렴(3.7%), 연하 곤란(3.7%), 간 기능 이상(2.8%), 식욕 감퇴(2.8%), 부신 기능 저하(2.5%), 탈수(2.5%)였습니다.
화학 요법과 병용하여 OPDIVO를 투여받은 환자 5명(1.6%)에서 치명적인 이상 반응이 발생했으며, 여기에는 폐렴, 장간막 기종, 폐렴, 급성 신장 손상이 포함되었습니다. OPDIVO와 이필리무맙을 투여받은 환자 5명(1.6%)에서 치명적인 이상 반응이 발생했으며, 여기에는 폐렴, 간질성 폐 질환, 폐색전증, 급성 호흡곤란 증후군이 포함되었습니다.
이상 반응으로 인해 환자의 39%에서 OPDIVO 및/또는 화학 요법이 중단되었고, 환자의 71%에서 OPDIVO 및/또는 화학 요법이 지연되었습니다. 이상 반응으로 인해 환자의 23%에서 OPDIVO 및/또는 이필리무맙이 중단되었고, 환자의 46%에서 OPDIVO 및/또는 이필리무맙이 지연되었습니다.
화학 요법과 병용하여 OPDIVO를 투여받은 환자의 20% 이상에서 보고된 가장 흔한 이상 반응은 메스꺼움, 식욕 감퇴, 피로, 변비, 구내염, 설사, 구토였습니다. OPDIVO와 이필리무맙을 투여받은 환자의 20% 이상에서 보고된 가장 흔한 이상 반응은 발진, 피로, 발열, 메스꺼움, 설사, 변비였습니다.
표 45와 46은 CHECKMATE-648에서 발생한 이상 반응과 실험실 검사 이상을 각각 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 구내염, 구강 궤양, 점막 염증을 포함합니다. b 복통, 하복부 통증, 상복부 통증을 포함합니다. c 무력증과 권태감을 포함합니다. d 종양 관련 발열을 포함합니다. e 부종, 전신 부종, 말초 부종, 말초 부종을 포함합니다. f 지각 과민, 지각 저하, 말초 운동 신경병증, 말초 감각 운동 신경병증, 말초 감각 신경병증을 포함합니다. g 피부염, 여드름성 피부염, 알레르기성 피부염, 수포성 피부염, 약물 발진, 박탈성 발진, 홍반성 발진, 모낭성 발진, 반점성 발진, 반점 구진성 발진, 구진성 발진, 가려움증을 포함합니다. h 기침을 포함합니다. i 조직화 폐렴, 세균성 폐렴, 슈도모나스 폐렴을 포함합니다. j 요통, 뼈 통증, 근골격계 흉통, 근육통, 목 통증, 사지 통증, 척추 통증을 포함합니다. |
||||||
|
이상 반응 |
시스플라틴과 5-FU와 병용한 OPDIVO (n=310) |
OPDIVO와 이필리무맙 (n=322) |
시스플라틴과 5-FU |
|||
|
모든 등급(%) |
3-4등급(%) |
모든 등급(%) |
3-4등급(%) |
모든 등급(%) |
3-4등급(%) |
|
|
위장관 |
||||||
|
메스꺼움 |
65 |
4.2 |
22 |
0.6 |
56 |
2.6 |
|
변비 |
44 |
1.0 |
20 |
0.3 |
43 |
1 |
|
구내염a |
44 |
9 |
11 |
0.6 |
35 |
3 |
|
설사 |
29 |
2.9 |
22 |
1.9 |
20 |
2 |
|
구토 |
23 |
2.3 |
15 |
1.6 |
19 |
3 |
|
연하곤란 |
14 |
7 |
12 |
5 |
12 |
4.9 |
|
복통b |
13 |
1.9 |
10 |
0.9 |
11 |
0.7 |
|
신진대사 및 영양 |
||||||
|
식욕 감소 |
51 |
7 |
17 |
4 |
50 |
6 |
|
일반 |
||||||
|
피로c |
47 |
3.5 |
28 |
2.5 |
41 |
4.9 |
|
발열d |
19 |
0.3 |
23 |
0.9 |
12 |
0.3 |
|
부종e |
16 |
0 |
7 |
0 |
13 |
0 |
|
신경계 |
||||||
|
말초 |
18 |
1.3 |
2.8 |
0 |
13 |
1 |
|
정신과적 |
||||||
|
불면증 |
16 |
0 |
8 |
0 |
10 |
0.3 |
|
피부 및 피하 조직 |
||||||
|
발진g |
16 |
0.6 |
31 |
3.1 |
7 |
0 |
|
가려움증 |
11 |
0 |
17 |
0.9 |
3.6 |
0 |
|
탈모 |
10 |
0 |
11 |
0 |
||
|
호흡기, 흉곽 및 종격동 |
||||||
|
기침h |
16 |
0.3 |
13 |
0.3 |
13 |
0.3 |
|
감염 및 기생충 감염 |
||||||
|
폐렴i |
13 |
5 |
14 |
8 |
10 |
2.6 |
|
내분비 |
||||||
|
저갑상선증 |
7 |
0 |
14 |
0 |
0.3 |
0 |
|
검사 |
||||||
|
체중 감소 |
12 |
0.6 |
12 |
1.9 |
11 |
1 |
|
근골격계 및 결합 조직 |
||||||
|
근골격계 |
11 |
0.3 |
14 |
0.6 |
8 |
0.3 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO + 시스플라틴 + 5-FU 군(범위: 60~305명), OPDIVO + 이필리무맙 군(범위: 59~307명) 또는 시스플라틴 + 5-FU 군(범위: 56~283명). | ||||||
|
실험실 이상 |
OPDIVO + 시스플라틴 + 5-FU |
OPDIVO + 이필리무맙 |
시스플라틴 + 5-FU |
|||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||||
|
빈혈 |
81 |
21 |
52 |
7 |
66 |
14 |
|
림프구 감소증 |
67 |
23 |
50 |
13 |
44 |
8 |
|
호중구 감소증 |
61 |
18 |
13 |
1.3 |
48 |
13 |
|
백혈구 감소증 |
53 |
11 |
39 |
5 |
||
|
혈소판 감소증 |
43 |
3.3 |
12 |
1 |
29 |
2.8 |
|
화학 |
||||||
|
저나트륨혈증 |
52 |
15 |
45 |
11 |
40 |
8 |
|
저칼슘혈증 |
43 |
3 |
32 |
0 |
23 |
0.7 |
|
크레아티닌 증가 |
41 |
2.3 |
15 |
0.7 |
31 |
0.7 |
|
저마그네슘혈증 |
35 |
1.7 |
15 |
0 |
25 |
1.8 |
|
고혈당증 |
34 |
0 |
43 |
4.3 |
36 |
0.8 |
|
고칼륨혈증 |
33 |
2.3 |
23 |
1.6 |
24 |
0.7 |
|
저칼륨혈증 |
29 |
9 |
19 |
5 |
17 |
6 |
|
알칼리성 인산염 증가 |
26 |
1.3 |
31 |
3.3 |
15 |
0 |
|
AST 증가 |
23 |
3.3 |
39 |
6 |
11 |
1.4 |
|
ALT 증가 |
23 |
2.3 |
33 |
6 |
8 |
0.7 |
|
저혈당증 |
18 |
0.4 |
15 |
1.2 |
7 |
0 |
|
고칼슘혈증 |
11 |
2.6 |
15 |
2 |
8 |
0 |
이전에 치료받은 절제 불가능한 진행성, 재발성 또는 전이성 식도 편평 상피암 (ESCC)
OPDIVO의 안전성은 절제 불가능한 진행성, 재발성 또는 전이성 ESCC 환자 209명을 대상으로 한 무작위 배정, 활성 대조, 공개, 다기관 시험인 ATTRACTION-3에서 평가되었으며, 이 환자들은 적어도 1회의 플루오로피리미딘 및 백금 기반 화학 요법에 내성이 있거나 내약성이 없었습니다. [임상 연구 (14.12) 참조]. 이 시험은 탁산 요법에 내성이 있거나 내약성이 없는 환자, 증상이 있는 뇌 전이 또는 치료가 필요한 환자, 자가 면역 질환이 있는 환자, 전신 코르티코스테로이드 또는 면역 억제제를 사용하는 환자, 식도 종양에 인접한 기관으로의 명백한 종양 침윤이 있는 환자 또는 식도 또는 호흡기관에 스텐트가 있는 환자를 제외했습니다. 환자는 2주마다 30분 동안 정맥 주입으로 OPDIVO 240mg을 투여받았습니다(n=209) 또는 연구자의 선택: 3주마다 정맥 주입으로 도세탁셀 75mg/m2(n=65) 또는 6주 동안 일주일에 한 번 정맥 주입으로 파클리탁셀 100mg/m2, 그 후 1주일 휴식(n=143). 환자는 질병 진행 또는 용납할 수 없는 독성이 나타날 때까지 치료를 받았습니다. OPDIVO 치료 환자의 중간 노출 기간은 2.6개월(범위: 0~29.2개월)이었고, 도세탁셀 또는 파클리탁셀 치료 환자의 중간 노출 기간은 2.6개월(범위: 0~21.4개월)이었습니다. OPDIVO를 투여받은 환자 중 26%는 6개월 이상, 10%는 1년 이상 노출되었습니다.
OPDIVO를 투여받은 환자의 38%에서 심각한 이상 반응이 발생했습니다. OPDIVO를 투여받은 환자의 2% 이상에서 보고된 심각한 이상 반응은 폐렴, 식도 누공, 간질성 폐 질환 및 발열이었습니다. OPDIVO를 투여받은 환자에서 다음과 같은 치명적인 이상 반응이 발생했습니다. 간질성 폐 질환 또는 폐렴(1.4%), 폐렴(1.0%), 패혈성 쇼크(0.5%), 식도 누공(0.5%), 위장관 출혈(0.5%), 폐색전증(0.5%), 급사(0.5%).
OPDIVO는 환자의 13%에서 중단되었고, 이상 반응으로 인해 환자의 27%에서 투여가 지연되었습니다.
표 47과 48은 ATTRACTION-3에서 발생한 이상 반응과 실험실 이상을 각각 요약한 것입니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 두드러기, 약물 발진, 습진, 건성 습진, 동전 모양 습진, 손바닥-발바닥 홍반 각화증, 홍반, 다형 홍반, 물집, 피부 박리, 스티븐스-존슨 증후군, 피부염, 여드름 모양, 수포성 또는 접촉성으로 묘사된 피부염, 구진-반점, 전신 또는 농포성으로 묘사된 발진을 포함합니다. b 식욕 부진 및 음식 기피를 포함합니다. c 대장염을 포함합니다. d 척추 전방 전위증, 관절 주위염, 근골격계 흉통, 목 통증, 관절통, 요통, 근육통, 사지 통증, 관절염, 뼈 통증 및 석회화 관절 주위염을 포함합니다. e 독감, 독감 유사 질환, 인후염, 비인두염, 기관염 및 기관지염을 동반한 상기도 감염을 포함합니다. f 흡인성 폐렴, 세균성 폐렴 및 폐 감염을 포함합니다. OPDIVO 치료군에서 2명의 환자(1.0%)가 폐렴으로 사망했습니다. 화학 요법 치료군에서 2명의 환자(1.0%)가 폐렴으로 사망했습니다. 이 사망은 파클리탁셀에서만 발생했습니다. g 기침을 포함합니다. h 종양 관련 발열을 포함합니다. i 무력증을 포함합니다. j 헤모글로빈 감소 및 철 결핍성 빈혈을 포함합니다. k 혈액 갑상선 자극 호르몬 증가를 포함합니다. |
||||
|
이상 반응 |
OPDIVO (n=209) |
도세탁셀 또는 파클리탁셀 (n=208) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
피부 및 피하 조직 |
||||
|
발진a |
22 |
1.9 |
28 |
1 |
|
가려움증 |
12 |
0 |
7 |
0 |
|
신진대사 및 영양 |
||||
|
식욕 감소b |
21 |
1.9 |
35 |
5 |
|
위장관 |
||||
|
설사c |
18 |
1.9 |
17 |
1.4 |
|
변비 |
17 |
0 |
19 |
0 |
|
메스꺼움 |
11 |
0 |
20 |
0.5 |
|
근골격계 및 결합 조직 |
||||
|
근골격계 |
17 |
0 |
26 |
1.4 |
|
감염 |
||||
|
상기도 감염e |
17 |
1 |
14 |
0 |
|
폐렴f |
13 |
5 |
19 |
9 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침g |
16 |
0 |
14 |
0.5 |
|
일반 |
||||
|
발열h |
16 |
0.5 |
19 |
0.5 |
|
피로i |
12 |
1.4 |
27 |
4.8 |
|
혈액 및 림프계 |
||||
|
빈혈j |
13 |
8 |
30 |
13 |
|
내분비 |
||||
|
저갑상선증k |
11 |
0 |
1.4 |
0 |
| a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다: OPDIVO 그룹(209명) 및 도세탁셀 또는 파클리탁셀 그룹(범위: 207~208명). | ||||
|
실험실 이상 |
OPDIVO (n=209) |
도세탁셀 또는 파클리탁셀 (n=208) |
||
|
모든 등급 (%) |
3-4등급 (%) |
모든 등급 (%) |
3-4등급 (%) |
|
|
화학 |
||||
|
크레아티닌 증가 |
78 |
0.5 |
68 |
0.5 |
|
고혈당 |
52 |
5 |
62 |
5 |
|
저나트륨혈증 |
42 |
11 |
50 |
12 |
|
AST 증가 |
40 |
6 |
30 |
1 |
|
알칼리성 포스파타제 증가 |
33 |
4.8 |
24 |
1.0 |
|
ALT 증가 |
31 |
5 |
22 |
1.9 |
|
고칼슘혈증 |
22 |
6 |
14 |
2.9 |
|
고칼륨혈증 |
22 |
0.5 |
31 |
1 |
|
저혈당 |
14 |
1.4 |
14 |
0.5 |
|
저칼륨혈증 |
11 |
2.9 |
13 |
3.4 |
|
혈액학 |
||||
|
림프구 감소증 |
46 |
19 |
72 |
43 |
|
빈혈 |
42 |
9 |
71 |
17 |
|
백혈구 감소증 |
11 |
0.5 |
79 |
45 |
위암, 위식도 접합부암 및 식도 선암
OPDIVO의 안전성은 이전에 치료받지 않은 진행성 또는 전이성 위암, 위식도 접합부암 및 식도 선암 환자를 대상으로 한 무작위 배정, 다기관, 공개 표지 시험인 CHECKMATE-649에서 화학 요법과 병용하여 평가되었습니다. [임상 연구(14.13) 참조] 이 시험은 알려진 인간 표피 성장 인자 수용체 2(HER2) 양성 또는 치료되지 않은 중추 신경계(CNS) 전이가 있는 환자를 제외했습니다. 환자는 OPDIVO와 화학 요법 또는 화학 요법을 병용하여 무작위 배정되었습니다. 환자는 다음 치료 중 하나를 받았습니다.
- •
- OPDIVO 240mg을 mFOLFOX6(플루오로우라실, 류코보린 및 옥살리플라틴)와 병용하여 2주마다 또는 mFOLFOX6을 2주마다 투여합니다.
- •
- OPDIVO 360mg을 CapeOX(카페시타빈 및 옥살리플라틴)와 병용하여 3주마다 또는 CapeOX를 3주마다 투여합니다.
환자는 질병 진행, 용납할 수 없는 독성 또는 최대 2년까지 OPDIVO와 화학 요법 또는 화학 요법을 병용하여 치료받았습니다. OPDIVO와 화학 요법을 병용하여 치료받은 환자의 중간 노출 기간은 6.8개월(범위: 0~33.5개월)이었습니다. OPDIVO와 화학 요법을 병용하여 치료받은 환자 중 54%는 6개월 이상, 28%는 1년 이상 노출되었습니다.
OPDIVO와 화학 요법을 병용하여 치료받은 환자 16명(2.0%)에서 치명적인 이상 반응이 발생했습니다. 여기에는 폐렴(4명), 발열성 호중구 감소증(2명), 뇌졸중(2명), 위장 독성, 장 점막염, 패혈성 쇼크, 폐렴, 감염, 위장 출혈, 장간막 혈관 혈전증 및 파종성 혈관 내 응고가 포함되었습니다. OPDIVO와 화학 요법을 병용하여 치료받은 환자의 52%에서 심각한 이상 반응이 발생했습니다. OPDIVO 및/또는 화학 요법은 환자의 44%에서 중단되었으며 이상 반응으로 인해 환자의 76%에서 최소한 한 번의 투여가 보류되었습니다.
OPDIVO와 화학 요법을 병용하여 치료받은 환자의 2% 이상에서 보고된 가장 흔한 심각한 이상 반응은 구토(3.7%), 폐렴(3.6%), 빈혈(3.6%), 발열(2.8%), 설사(2.7%), 발열성 호중구 감소증(2.6%) 및 폐렴(2.4%)이었습니다. OPDIVO와 화학 요법을 병용하여 치료받은 환자의 20% 이상에서 보고된 가장 흔한 이상 반응은 말초 신경병증, 메스꺼움, 피로, 설사, 구토, 식욕 감소, 복통, 변비 및 근골격계 통증이었습니다.
표 49와 50은 CHECKMATE-649에서 각각 이상 반응과 실험실 이상을 요약합니다.
| 독성은 NCI CTCAE v4에 따라 등급이 매겨졌습니다. a 이상 감각, 저감각, 말초 운동 신경병증, 말초 감각 운동 신경병증 및 말초 감각 신경병증 포함. b 복부 불편감, 하복부 통증 및 상복부 통증 포함. c 아프타성 궤양, 구강 궤양 및 점막 염증 포함. d 무력증 포함. e 종양 관련 발열 포함. f 부종, 전신 부종, 말초 부종 및 말초 부종 포함. g 혈청 알부민 감소 포함. h 요통, 뼈 통증, 근골격계 흉통, 근골격계 불편감, 근육통, 목 통증, 사지 통증 및 척추 통증 포함. i 피부염, 여드름성 피부염, 알레르기성 피부염, 수포성 피부염, 약물 발진, 박탈성 발진, 결절성 발진, 홍반성 발진, 반점성 발진, 반점 구진성 발진, 구진성 발진, 가려운 발진 및 수포성 발진 포함. j 기침 포함. k 비인두염, 인두염 및 비염 포함. |
||||
|
이상 반응 |
OPDIVO와 mFOLFOX6 또는 CapeOX (n=782) |
mFOLFOX6 또는 CapeOX |
||
|
모든 등급(%) |
3-4등급(%) |
모든 등급(%) |
3-4등급(%) |
|
|
이상 반응 |
99 |
69 |
98 |
59 |
|
신경계 |
||||
|
말초 신경병증a |
53 |
7 |
46 |
4.8 |
|
두통 |
11 |
0.8 |
6 |
0.3 |
|
위장 |
||||
|
메스꺼움 |
48 |
3.2 |
44 |
3.7 |
|
설사 |
39 |
5 |
34 |
3.7 |
|
구토 |
31 |
4.2 |
29 |
4.2 |
|
복통b |
27 |
2.8 |
24 |
2.6 |
|
변비 |
25 |
0.6 |
21 |
0.4 |
|
구내염c |
17 |
1.8 |
13 |
0.8 |
|
일반 |
||||
|
피로d |
44 |
7 |
40 |
5 |
|
발열e |
19 |
1 |
11 |
0.4 |
|
부종f |
12 |
0.5 |
8 |
0.1 |
|
신진대사 및 영양 |
||||
|
식욕 감소 |
29 |
3.6 |
26 |
2.5 |
|
저알부민혈증g |
14 |
0.3 |
9 |
0.3 |
|
검사 |
||||
|
체중 감소 |
17 |
1.3 |
15 |
0.7 |
|
리파아제 증가 |
14 |
7 |
8 |
3.7 |
|
아밀라아제 증가 |
12 |
3.1 |
5 |
0.4 |
|
근골격 및 결합 조직 |
||||
|
근골격계 통증h |
20 |
1.3 |
14 |
2 |
|
피부 및 피하 조직 |
||||
|
발진i |
18 |
1.7 |
4.4 |
0.1 |
|
손바닥-발바닥 홍반각화증 |
13 |
1.5 |
12 |
0.8 |
|
호흡기, 흉곽 및 종격동 |
||||
|
기침j |
13 |
0.1 |
9 |
0 |
|
감염 및 기생충 감염 |
||||
|
상기도 감염k |
10 |
0.1 |
7 |
0.1 |
|
실험실 이상 |
OPDIVO 및 mFOLFOX6 또는 CapeOX |
mFOLFOX6 또는 CapeOX |
||
|
1-4등급 (%) |
3-4등급 (%) |
1-4등급 (%) |
3-4등급 (%) |
|
|
혈액학 |
||||
|
호중구 감소증 |
73 |
29 |
62 |
23 |
|
백혈구 감소증 |
69 |
12 |
59 |
9 |
|
혈소판 감소증 |
68 |
7 |
63 |
4.4 |
|
빈혈 |
59 |
14 |
60 |
10 |
|
림프구 감소증 |
59 |
12 |
49 |
9 |
|
화학 |
||||
|
AST 증가 |
52 |
4.6 |
47 |
1.9 |
|
저칼슘혈증 |
42 |
1.6 |
37 |
1 |
|
고혈당증 |
41 |
3.9 |
38 |
2.7 |
|
ALT 증가 |
37 |
3.4 |
30 |
1.9 |
|
저나트륨혈증 |
34 |
6 |
24 |
5 |
|
저칼륨혈증 |
27 |
7 |
24 |
4.8 |
Hyperbilirubinemia
24
2.8
21
2
Increased creatinine
15
1
9
0.5
Hyperkalemia
14
1.4
11
0.7
Hypoglycemia
12
0.7
9
0.2
Hypernatremia
11
0.5
7.1
0
a 각 검사 발생률은 기준선과 연구 중 적어도 하나의 연구 실험실 측정값을 모두 가진 환자 수를 기반으로 합니다. OPDIVO 및 mFOLFOX6 또는 CapeOX 그룹(407~767명) 또는 mFOLFOX6 또는 CapeOX 그룹(범위: 405~735명).
6.2 시판 후 경험
다음 부작용은 OPDIVO의 시판 후 사용 중에 확인되었습니다. 이러한 반응은 불확실한 규모의 모집단에서 자발적으로 보고되기 때문에, 항상 빈도를 신뢰할 수 있게 추정하거나 약물 노출과의 인과 관계를 확립할 수 있는 것은 아닙니다.
눈: Vogt-Koyanagi-Harada(VKH) 증후군
동종 이식 후 OPDIVO 치료의 합병증: 치료에 반응하지 않는 심각한 급성 및 만성 GVHD
혈액 및 림프계 장애: 혈구 탐식성 림프조직구증(HLH)(치명적인 경우 포함), 자가 면역 용혈성 빈혈(치명적인 경우 포함)
8 특정 인구 집단에서의 사용
8.1 임신
위험 요약
동물 연구 데이터 및 작용 기전 [임상 약리학 (12.1) 참조]을 기반으로, OPDIVO는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다. 동물 생식 연구에서, 기관 형성 시작부터 분만까지 시노몰구스 원숭이에게 니볼루맙을 투여한 결과 유산 및 조산아 사망 증가가 나타났습니다 (데이터 참조). 인간 IgG4는 태반 장벽을 통과하는 것으로 알려져 있으며, 니볼루맙은 면역글로불린 G4(IgG4)입니다. 따라서 니볼루맙은 모체에서 태아로 전달될 가능성이 있습니다. OPDIVO의 효과는 임신 2분기 및 3분기에 더 클 가능성이 높습니다. 약물 관련 위험을 평가하기 위한 임산부에서 OPDIVO 사용에 대한 데이터는 없습니다. 임산부에게 태아에 대한 잠재적 위험을 알려야 합니다.
미국 일반 인구에서 주요 선천적 기형의 배경 위험은 임상적으로 인식된 임신의 2%에서 4%이며, 유산의 배경 위험은 15%에서 20%입니다.
데이터
동물 데이터
PD-1/PD-L1 경로의 중심 기능은 태아에 대한 모체 면역 관용을 유지하여 임신을 보존하는 것입니다. 임신의 마우스 모델에서 PD-L1 신호 차단은 태아에 대한 관용을 방해하고 태아 손실을 증가시키는 것으로 나타났습니다. 기관 형성 시작부터 분만까지 2주에 한 번 니볼루맙을 투여받은 원숭이에서 니볼루맙의 태아 및 출생 후 발달에 대한 영향을 평가했습니다. 이때 노출 수준은 임상 용량 3mg/kg(AUC 기준)에서 관찰된 수준보다 9배에서 42배 높았습니다. 니볼루맙 투여는 용량과 무관하게 자연 유산 증가 및 신생아 사망 증가를 초래했습니다. 작용 기전을 기반으로, 니볼루맙에 대한 태아 노출은 면역 매개 질환 발병 위험을 증가시키거나 정상적인 면역 반응을 변경할 수 있으며, 면역 매개 질환은 PD-1 녹아웃 마우스에서 보고되었습니다. 니볼루맙으로 치료받은 시노몰구스 원숭이의 생존한 새끼(32마리 중 18마리 대비 대조군에 노출된 새끼 16마리 중 11마리)에서, 6개월 출생 후 기간 동안 명백한 기형이나 신경 행동, 면역학적 또는 임상 병리학적 매개변수에 대한 영향은 없었습니다.
8.3 생식 능력이 있는 여성 및 남성
피임
OPDIVO는 임산부에게 투여될 경우 태아에게 해를 끼칠 수 있습니다 [특정 인구에서의 사용 (8.1) 참조]. 생식 능력이 있는 여성에게 OPDIVO 치료 기간 동안 및 마지막 투여 후 5개월 동안 효과적인 피임법을 사용하도록 조언해야 합니다.
8.4 소아 사용
OPDIVO의 안전성 및 유효성은 다음 적응증에 대해 12세 이상의 소아 환자에서 확립되었습니다. 단일 요법 및 이필리무맙과 병용하여 불수술 가능하거나 전이성 흑색종 치료, 단일 요법으로 완전히 절제된 IIB기, IIC기, III기 또는 IV기 흑색종의 보조 치료, 단일 요법 또는 이필리무맙과 병용하여 플루오로피리미딘, 옥살리플라틴 및 이리노테칸 치료 후 진행된 MSI-H 또는 dMMR mCRC 치료. 이러한 적응증에 대한 OPDIVO 사용은 흑색종 또는 MSI-H 또는 dMMR mCRC가 있는 성인에 대한 적절하고 잘 통제된 연구에서 얻은 증거와 소아 환자에서 얻은 추가 약동학 데이터에 의해 뒷받침됩니다. 12세 이상의 소아 환자에서 니볼루맙 노출은 성인과 유사하며, 12세 이상의 소아 환자에서 흑색종 및 MSI-H 또는 dMMR mCRC의 경과는 성인과 유사하여 안전성 및 유효성을 외삽할 수 있습니다 [부작용 (6.1), 임상 약리학 (12.3), 임상 연구 (14.1, 14.10)].
흑색종 또는 MSI-H 또는 dMMR mCRC가 있는 12세 미만의 소아 환자에서 OPDIVO의 안전성 및 유효성은 확립되지 않았습니다.
비소세포폐암, 악성 흉막 중피종, 진행성 신세포암, 고전적 호지킨 림프종, 두경부 편평 세포암, 요로 상피암, 간세포암, 식도암, 위암, 위식도암 및 식도 선암이 있는 소아 환자에서 OPDIVO의 안전성 및 유효성은 확립되지 않았습니다.
8.5 노인 사용
단일 요법
멜라노마, NSCLC, 신세포암, 요로상피암, ESCC, 식도암 또는 위식도 접합부암 환자 3,569명을 대상으로 임상 연구에서 단독 요법으로 OPDIVO를 무작위 배정한 결과, 41%가 65세 이상이었고 10%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성 또는 효능에 대한 전반적인 차이가 관찰되지 않았습니다. [임상 연구(14.1, 14.2, 14.4, 14.6, 14.9, 14.12) 참조].
임상 연구에서 단독 요법으로 OPDIVO를 투여받은 cHL, 재발성 두경부 SCC 또는 dMMR 또는 MSI-H 전이성 CRC(mCRC) 환자의 경우 65세 이상 환자 수가 충분하지 않아 젊은 환자와 다르게 반응하는지 여부를 판단할 수 없었습니다. [임상 연구(14.7, 14.8, 14.10) 참조].
이필리무맙과 병용
멜라노마 환자 314명을 대상으로 이필리무맙과 병용하여 OPDIVO를 무작위 배정한 결과, 41%가 65세 이상이었고 11%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성 또는 효능에 대한 전반적인 차이가 보고되지 않았습니다. [임상 연구(14.1) 참조].
NSCLC 환자 576명을 대상으로 이필리무맙과 병용하여 OPDIVO를 무작위 배정한 결과, 48%가 65세 이상이었고 10%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이가 보고되지 않았지만, 75세 이상 환자(29%)에서 OPDIVO와 이필리무맙을 병용 투여받은 모든 환자(18%)에 비해 유해 반응으로 인한 중단율이 더 높았습니다. 이필리무맙과 병용하여 OPDIVO를 무작위 배정받은 1차 효능 모집단(PD-L1 ≥1%) 396명 중 전체 생존율에 대한 위험 비율은 65세 미만 환자 199명에서 0.70(95% CI: 0.55, 0.89)이었고, 65세 이상 환자 197명에서 0.91(95% CI: 0.72, 1.15)이었습니다. [임상 연구(14.3) 참조].
악성 흉막 중피종 환자 303명을 대상으로 이필리무맙과 병용하여 OPDIVO를 무작위 배정한 결과, 77%가 65세 이상이었고 26%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이가 보고되지 않았지만, 75세 이상 환자(68% 및 35%)에서 OPDIVO와 이필리무맙을 병용 투여받은 모든 환자(54% 및 28%)에 비해 심각한 유해 반응 및 유해 반응으로 인한 중단율이 더 높았습니다. 화학 요법을 받은 75세 이상 환자의 경우 심각한 유해 반응 발생률은 34%였고 유해 반응으로 인한 중단율은 26%였으며, 모든 환자의 경우 각각 28% 및 19%였습니다. 이필리무맙과 병용하여 OPDIVO를 무작위 배정받은 65세 미만 환자 71명에서 전체 생존율에 대한 위험 비율은 0.76(95% CI: 0.52, 1.11)이었고, 65세 이상 환자 232명에서 0.74(95% CI: 0.59, 0.93)이었습니다. [임상 연구(14.5) 참조].
신세포암 환자 550명을 대상으로 이필리무맙과 병용하여 OPDIVO를 무작위 배정한 결과, 38%가 65세 이상이었고 8%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이가 보고되지 않았습니다. 중간 위험 또는 불량 위험을 가진 노인 환자의 경우 효능에 대한 전반적인 차이가 보고되지 않았습니다. [임상 연구(14.6) 참조].
이필리무맙과 병용하여 OPDIVO를 투여받은 간세포암 환자 49명 중 29%가 65세에서 74세 사이였고 8%가 75세 이상이었습니다. 이필리무맙과 병용하여 OPDIVO를 투여한 임상 연구에는 65세 이상 간세포암 환자가 충분하지 않아 젊은 환자와 다르게 반응하는지 여부를 판단할 수 없었습니다. [임상 연구(14.11) 참조].
ESCC 환자 325명을 대상으로 이필리무맙과 병용하여 OPDIVO를 무작위 배정한 결과, 43%가 65세 이상이었고 7%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이가 보고되지 않았지만, 75세 이상 환자(38%)에서 OPDIVO와 이필리무맙을 병용 투여받은 모든 환자(23%)에 비해 유해 반응으로 인한 중단율이 더 높았습니다. 화학 요법을 받은 75세 이상 환자의 경우 유해 반응으로 인한 중단율은 33%였으며, 모든 환자의 경우 23%였습니다. [임상 연구(14.12) 참조].
백금 함유 화학 요법과 병용
NSCLC 환자 179명을 대상으로 백금 이중 화학 요법과 병용하여 OPDIVO를 무작위 배정한 결과, 48%가 65세 이상이었고 6%가 75세 이상이었습니다. 65세 이상 환자와 65세 미만 환자 간에 안전성 또는 효능에 대한 전반적인 차이가 보고되지 않았습니다. [임상 연구(14.3) 참조].
ESCC, GC, GEJC 또는 EAC 환자 1,110명을 대상으로 플루오로피리미딘 및 백금 함유 화학 요법과 병용하여 OPDIVO를 무작위 배정한 결과, 42%가 65세 이상이었고 10%가 75세 이상이었습니다. 노인 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이가 보고되지 않았습니다. [임상 연구(14.12, 14.13) 참조].
젬시타빈 및 백금 이중 화학 요법과 병용하여 OPDIVO를 투여받은 UC 환자 304명 중 40%가 65세 이상이었고 11%가 75세 이상이었습니다. 65세 이상 환자와 젊은 환자 간에 안전성 또는 효능에 대한 전반적인 차이가 관찰되지 않았습니다. 백금 이중 화학 요법과 병용하여 OPDIVO를 투여한 임상 연구에는 75세 이상 환자가 충분하지 않아 젊은 환자와 비교하여 안전성 및 효능이 다른지 여부를 판단할 수 없었습니다. [임상 연구(14.9) 참조].
이필리무맙 및 백금 이중 화학 요법과 병용
비소세포폐암 환자 361명을 대상으로 이필리무맙과 백금 이중 약물 화학 요법과 함께 OPDIVO를 투여 받은 환자 중 51%가 65세 이상이었고 10%가 75세 이상이었습니다. 고령 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이는 보고되지 않았지만, 75세 이상 환자의 경우 OPDIVO와 이필리무맙 및 화학 요법을 투여 받은 모든 환자(24%)에 비해 유해 반응으로 인한 중단율이 더 높았습니다(43%). 화학 요법만 투여 받은 75세 이상 환자의 경우 유해 반응으로 인한 중단율은 모든 환자의 중단율이 13%인 것에 비해 16%였습니다. 전체 생존율에 대한 업데이트된 분석에 따르면, 이필리무맙과 백금 이중 약물 화학 요법과 함께 OPDIVO를 투여 받은 361명의 환자 중 65세 미만 환자 176명의 전체 생존율에 대한 위험 비율은 0.61(95% CI: 0.47, 0.80)이었고, 65세 이상 환자 185명의 경우 0.73(95% CI: 0.56, 0.95)이었습니다 [임상 연구(14.4) 참조].
카보잔티닙과 병용
카보잔티닙과 함께 OPDIVO를 투여 받은 신장 세포 암 환자 320명 중 41%가 65세 이상이었고 9%가 75세 이상이었습니다. 고령 환자와 젊은 환자 간에 안전성에 대한 전반적인 차이는 보고되지 않았습니다 [임상 연구(14.6) 참조].
11 설명
니볼루맙은 프로그래밍된 세포 사멸 수용체-1(PD-1) 차단 항체입니다. 니볼루맙은 계산된 분자량이 146 kDa인 IgG4 카파 면역글로불린입니다. 재조합 중국 햄스터 난소(CHO) 세포주에서 발현됩니다.
OPDIVO는 무균, 방부제 무첨가, 비발열성, 투명에서 반투명, 무색에서 옅은 노란색 액체로, 가벼운(몇 개) 입자가 포함될 수 있습니다.
정맥 주사용 OPDIVO(니볼루맙) 주사액은 단일 용량 바이알로 제공됩니다. OPDIVO 용액 1mL에는 니볼루맙 10mg, 만니톨(30mg), 펜테트산(0.008mg), 폴리소르베이트 80(0.2mg), 염화나트륨(2.92mg), 구연산나트륨 이수화물(5.88mg), 주사용 정제수(USP)가 포함되어 있습니다. pH를 6으로 조절하기 위해 염산 및/또는 수산화나트륨이 포함될 수 있습니다.
12. 임상 약리학
12.1 작용 기전
PD-1 리간드인 PD-L1 및 PD-L2가 T 세포에서 발견되는 PD-1 수용체에 결합하면 T 세포 증식 및 사이토카인 생성이 억제됩니다. PD-1 리간드의 상향 조절은 일부 종양에서 발생하며 이 경로를 통한 신호 전달은 종양에 대한 활성 T 세포 면역 감시의 억제에 기여할 수 있습니다. 니볼루맙은 PD-1 수용체에 결합하고 PD-L1 및 PD-L2와의 상호 작용을 차단하여 종양 면역 반응을 포함한 면역 반응의 PD-1 경로 매개 억제를 해제하는 인간 면역 글로불린 G4(IgG4) 단클론 항체입니다. 동종 이식 마우스 종양 모델에서 PD-1 활성을 차단하면 종양 성장이 감소했습니다.
니볼루맙(항-PD-1)과 이필리무맙(항-CTLA-4)의 결합된 억제는 단독 항체의 효과보다 큰 T 세포 기능 향상을 초래하며 전이성 흑색종 및 진행성 RCC에서 향상된 항종양 반응을 초래합니다. 마우스 동종 이식 종양 모델에서 PD-1과 CTLA-4의 이중 차단은 항종양 활성을 증가시켰습니다.
12.3 약동학
니볼루맙 약동학(PK)은 단독 요법 OPDIVO와 OPDIVO와 이필리무맙의 경우 모두 모집단 PK 접근 방식을 사용하여 평가되었습니다. 니볼루맙의 PK는 0.1 mg/kg에서 20 mg/kg의 용량 범위에서 단일 용량으로 또는 2주 또는 3주마다 60분 정맥 주입으로 OPDIVO를 여러 용량으로 투여한 환자에서 연구되었습니다. 2주마다 투여되는 0.1~10 mg/kg의 용량 범위에서 니볼루맙에 대한 노출은 용량에 비례하여 증가합니다. 30분 주입 후 예측된 니볼루맙 노출은 60분 주입에서 관찰된 노출과 유사합니다. 2주마다 3 mg/kg으로 투여했을 때 니볼루맙의 정상 상태 농도는 12주까지 도달했으며 전신 축적은 3.7배였습니다.
분포
정상 상태에서 기하 평균 분포 용적(Vss) 및 변동 계수(CV%)는 6.8 L(27.3%)입니다.
제거
니볼루맙 청소율(CL)은 시간이 지남에 따라 감소하며 기하 평균 정상 상태 청소율(CLss)(CV%)은 전이성 종양이 있는 환자에서 8.2 mL/h(53.9%)로 기준선 값(CV%)에서 평균 최대 감소는 24.5%(47.6%)입니다. CLss의 감소는 임상적으로 유의미하지 않습니다. 니볼루맙 청소율은 완전히 절제된 흑색종 환자에서는 시간이 지남에 따라 감소하지 않으며, 이는 기하 평균 모집단 청소율이 정상 상태에서 전이성 흑색종 환자에 비해 이 환자 집단에서 24% 낮기 때문입니다.
기하 평균 제거 반감기(t1/2)는 25일(77.5%)입니다.
특정 모집단
다음 요인은 니볼루맙 청소율에 임상적으로 중요한 영향을 미치지 않았습니다. 연령(29~87세), 체중(35~160kg), 성별, 인종, 기준선 LDH, PD-L1 발현, 고형 종양 유형, 종양 크기, 신장 기능 장애(eGFR ≥ 15 mL/min/1.73 m2), 경증(총 빌리루빈[TB]이 ULN 이하이고 AST가 ULN보다 크거나 TB가 ULN의 1~1.5배이고 AST가 임의로 크거나) 또는 중등도 간 기능 장애(TB가 ULN의 1.5~3배이고 AST가 임의로 크거나). 니볼루맙은 중증 간 기능 장애(TB가 ULN의 3배 이상이고 AST가 임의로 크거나) 환자에서 연구되지 않았습니다.
소아 환자
12세 이상 소아 환자에서 니볼루맙의 노출은 권장 용량에서 성인의 노출과 유사합니다. [용법 및 용량(2.2) 참조].
약물 상호 작용 연구
OPDIVO 3 mg/kg을 3주마다 이필리무맙 1 mg/kg을 3주마다 투여했을 때 니볼루맙과 이필리무맙의 CL은 단독으로 투여했을 때와 비교하여 변하지 않았습니다.
OPDIVO 1 mg/kg을 3주마다 이필리무맙 3 mg/kg을 3주마다 투여했을 때 니볼루맙의 CL은 단독으로 투여했을 때와 비교하여 29% 증가했고 이필리무맙의 CL은 단독으로 투여했을 때와 비교하여 변하지 않았습니다.
OPDIVO 3 mg/kg을 2주마다 이필리무맙 1 mg/kg을 6주마다 투여했을 때 니볼루맙의 CL은 단독으로 투여했을 때와 비교하여 변하지 않았고 이필리무맙의 CL은 단독으로 투여했을 때와 비교하여 30% 증가했습니다.
OPDIVO 360 mg을 3주마다 이필리무맙 1 mg/kg을 6주마다 화학 요법과 함께 투여했을 때 니볼루맙의 CL은 단독으로 투여했을 때와 비교하여 변하지 않았고 이필리무맙의 CL은 단독으로 투여했을 때와 비교하여 22% 증가했습니다.
12.6 면역원성
관찰된 항체 형성 발생률은 분석의 민감도와 특이성에 크게 의존합니다. 분석 방법의 차이로 인해 아래에 설명된 연구에서 항체 형성 발생률을 OPDIVO 또는 다른 니볼루맙 제품을 포함한 다른 연구의 항체 형성 발생률과 의미 있게 비교할 수 없습니다.
항체 형성 및 중화 항체 반응은 위험 대비 이점 비율이 평가된 치료 기간 동안 모니터링되었습니다. 항체 형성 및 중화 항체 발생률은 표 51에 제시되어 있습니다.
| a 각 치료 요법의 세부 사항은 섹션 14에 설명되어 있습니다. [임상 연구(14) 참조]. b NAb 발생률은 ADA 양성 환자 하위 집단에서 보고됩니다. c 절제 불가능하거나 전이성 흑색종, 전이성 비소세포폐암, 진행성 RCC, cHL, 재발성 또는 전이성 두경부 편평 세포암 및 UC 적응증을 포함합니다. ADA = 치료로 인한 항-니볼루맙 항체, NAb = 중화 항체, HCC = 간세포암, RCC = 신세포암, CRC = 대장암, NSCLC = 비소세포폐암. |
||||||
|
치료 요법a |
적응증(들) |
ADA |
NAbb |
|
단독 요법으로 OPDIVO |
다발성c |
11% |
7% |
|
4회 투여의 ipilimumab과 함께 OPDIVO를 투여한 후 단독 요법으로 OPDIVO 투여 |
흑색종 |
38% |
12% |
|
HCC |
56% |
41% |
|
|
RCC 및 CRC |
26% |
3% |
|
|
ipilimumab과 함께 OPDIVO |
악성 흉막 중피종 |
26% |
2.9% |
|
NSCLC |
37% |
3.9% |
|
|
ipilimumab 및 2 사이클의 백금 이중 약물 화학 요법과 함께 OPDIVO |
NSCLC |
34% |
8% |
항체 의약품 항체의 효과
니볼루맙 단독 요법 또는 ipilimumab과 병용 요법으로 니볼루맙을 투여한 후 치료 발생 항 니볼루맙 항체의 존재는 니볼루맙 클리어런스를 최대 20%까지 증가시켰습니다. 이러한 항체 의약품 항체 관련 약동학적 변화는 임상적으로 유의미하지 않은 것으로 간주되었습니다. 항체 의약품 항체는 주입 관련 반응 발생률에 임상적으로 유의미한 영향을 미치지 않았습니다. 항체 의약품 항체의 효능에 대한 영향은 완전히 규명되지 않았습니다.
13. 비임상 약리학
13.1 발암성, 돌연변이 유발성, 생식능력 손상
니볼루맙의 발암성 또는 유전독성 가능성을 평가하기 위한 연구는 수행되지 않았습니다. 니볼루맙을 사용한 생식능력 연구는 수행되지 않았습니다. 원숭이를 대상으로 한 1개월 및 3개월 반복 투여 독성 연구에서 수컷 및 암컷 생식 기관에 현저한 영향은 없었지만, 이러한 연구의 대부분의 동물은 성적으로 성숙하지 않았습니다.
13.2 동물 독성 및/또는 약리학
동물 모델에서 PD-1 신호 전달 억제는 일부 감염의 심각성을 증가시키고 염증 반응을 강화했습니다. 결핵균에 감염된 PD-1 녹아웃 마우스는 야생형 대조군에 비해 생존율이 현저히 감소했으며, 이는 이러한 동물에서 박테리아 증식 및 염증 반응 증가와 관련이 있었습니다. PD-1 녹아웃 마우스는 또한 림프구성 뇌척수막염 바이러스 감염 후 생존율이 감소한 것으로 나타났습니다.
14. 임상 연구
14.1 절제 불가능 또는 전이성 흑색종
이전에 치료받은 전이성 흑색종
CHECKMATE-037(NCT01721746)은 절제 불가능 또는 전이성 흑색종 환자를 대상으로 OPDIVO 3mg/kg을 2주마다 정맥 주사하거나 연구자 선택 화학 요법(단일 약제 다카르바진 1000mg/m2 3주마다 또는 카보플라틴 AUC 6 3주마다 정맥 주사와 파클리탁셀 175mg/m2 3주마다 정맥 주사 병용)을 받도록 (2:1) 무작위 배정한 다기관 공개 라벨 시험이었습니다. 환자는 이필리무맙 치료 중 또는 치료 후 질병 진행이 있어야 했으며, BRAF V600 돌연변이 양성인 경우 BRAF 억제제를 투여받아야 했습니다. 이 시험은 자가 면역 질환, 전신 면역 억제가 필요한 의학적 상태, 눈 흑색종, 활동성 뇌 전이 또는 Grade 4 이필리무맙 관련 이상 반응(내분비 장애 제외) 또는 시작 후 12주 이내에 해결되지 않았거나 적절하게 조절되지 않은 Grade 3 이필리무맙 관련 이상 반응의 병력이 있는 환자를 제외했습니다. 종양 평가는 무작위 배정 후 9주째에 실시한 다음 첫해에는 6주마다, 그 이후에는 12주마다 실시했습니다.
유료성은 CHECKMATE-037에서 OPDIVO를 투여받았고 최소 추적 기간이 6개월인 최초 120명의 환자에 대한 단일군, 비교군 없음, 계획된 중간 분석에서 평가했습니다. 이 모집단의 주요 유효성 평가 변수는 Response Evaluation Criteria in Solid Tumors(RECIST 1.1)를 사용한 맹검 독립 중앙 검토로 측정한 확진된 전체 반응률(ORR) 및 반응 기간이었습니다.
OPDIVO로 치료받은 120명의 환자 중 중간 연령은 58세(범위: 25~88세)였고, 65%가 남성이었으며, 98%가 백인이었고, ECOG 수행 상태 점수는 0(58%) 또는 1(42%)이었습니다. 질병 특징은 M1c 질환(76%), BRAF V600 돌연변이 양성(22%), LDH 상승(56%), 뇌 전이 병력(18%) 및 전이성 질환에 대한 2회 이상의 이전 전신 치료(68%)였습니다.
ORR은 32%(95% 신뢰 구간[CI]: 23, 41)였으며, 여기에는 OPDIVO 치료 환자의 완전 반응 4건과 부분 반응 34건이 포함됩니다. 반응을 보인 38명의 환자 중 87%가 2.6개월 이상~10개월 이상 범위의 지속적인 반응을 보였으며, 여기에는 6개월 이상 지속적인 반응을 보인 환자 13명이 포함됩니다.
BRAF V600 돌연변이 양성 흑색종 환자와 음성 흑색종 환자 모두에서 반응이 나타났습니다. 총 405명의 환자가 무작위 배정되었으며 OS의 중간 기간은 OPDIVO 치료 환자에서 15.7개월(95% CI: 12.9, 19.9)이었던 반면 연구자 선택 치료군에서는 14.4개월(95% CI: 11.7, 18.2)(HR 0.95, 95.54% CI: 0.73, 1.24)였습니다. 그림 1은 OS 결과를 요약한 것입니다.
그림 1: 전체 생존 기간 – CHECKMATE-037*
* 1차 OS 분석은 후속 치료를 고려하여 조정되지 않았으며, 화학 요법군의 54명(40.6%)은 이후에 anti-PD1 치료를 받았습니다. OS는 탈락, 후속 치료의 불균형 및 기준 요인의 차이로 인해 교란될 수 있습니다.
이전에 치료받지 않은 전이성 흑색종
CHECKMATE-066
CHECKMATE-066(NCT01721772)은 BRAF V600 야생형 절제 불가능 또는 전이성 흑색종 환자 418명을 대상으로 한 다기관 이중맹검 무작위 배정(1:1) 시험이었습니다. 환자는 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 OPDIVO 3mg/kg을 2주마다 정맥 주입하거나 다카르바진 1000mg/m2을 3주마다 정맥 주사받도록 무작위 배정되었습니다. 무작위 배정은 PD-L1 상태(면역 조직 화학 검사에 의한 종양 세포막 염색 ≥5% 대 <5% 또는 불확정 결과) 및 M 단계(M0/M1a/M1b 대 M1c)에 따라 층화되었습니다. 주요 적격 기준에는 조직학적으로 확인된 절제 불가능 또는 전이성 피부, 점막 또는 말단 흑색종, 전이성 질환에 대한 이전 치료 없음, 무작위 배정 최소 6주 전 보조 요법 또는 선행 보조 요법 완료, ECOG 수행 상태 0 또는 1, 자가 면역 질환 없음, 활동성 뇌 또는 뇌척수막 전이 없음이 포함되었습니다. 이 시험은 눈 흑색종 환자를 제외했습니다. 종양 평가는 무작위 배정 후 9주째에 실시한 다음 첫해에는 6주마다, 그 이후에는 12주마다 실시했습니다. 주요 유효성 평가 변수는 전체 생존 기간(OS)이었습니다. 추가적인 결과 측정에는 연구자가 평가한 무진행 생존 기간(PFS) 및 RECIST v1.1에 따른 ORR이 포함되었습니다.
시험 모집단의 특징은 다음과 같습니다. 중간 연령은 65세(범위: 18~87세)였고, 59%가 남성이었으며, 99.5%가 백인이었습니다. 질병 특징은 M1c 병기 질환(61%), 피부 흑색종(74%), 점막 흑색종(11%), LDH 수치 상승(37%), PD-L1 ≥5% 종양 세포막 발현(35%) 및 뇌 전이 병력(4%)이었습니다. OPDIVO군에서 ECOG 수행 상태가 0인 환자의 비율이 더 높았습니다(71% 대 58%).
CHECKMATE-066은 OS에 대해 계획된 총 사건 수의 47%를 기준으로 한 중간 분석에서 다카르바진군에 비해 OPDIVO군의 OS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 분석 당시 OPDIVO 치료 환자의 88%(63/72)가 지속적인 반응을 보였으며, 여기에는 6개월 이상 지속적인 반응을 보인 환자 43명이 포함됩니다. 유효성 결과는 표 52 및 그림 2에 나와 있습니다.
| a 도달하지 않음 b 층화 비례 위험 모델을 기반으로 함. c 층화 로그 순위 검정을 기반으로 함. d p-값은 이 중간 분석에 대해 할당된 알파 0.0021과 비교함. |
||
|
OPDIVO |
다카르바진 |
|
|
전체 생존 기간 |
||
|
사망 (%) |
50 (24) |
96 (46) |
|
중앙값(개월)(95% CI) |
NRa |
10.8 (9.3, 12.1) |
|
위험 비율(95% CI)b |
0.42 (0.30, 0.60) |
|
|
p-값c,d |
<0.0001 |
|
|
무진행 생존 기간 |
||
|
질병 진행 또는 사망 (%) |
108 (51) |
163 (78) |
|
중앙값(개월)(95% CI) |
5.1 (3.5, 10.8) |
2.2 (2.1, 2.4) |
|
위험 비율(95% CI)b |
0.43 (0.34, 0.56) |
|
|
p-값c,d |
<0.0001 |
|
|
전체 반응률 |
34% |
9% |
|
(95% CI) |
(28, 41) |
(5, 13) |
|
완전 반응률 |
4% |
1% |
|
부분 반응률 |
30% |
8% |
그림 2: 전체 생존율 – CHECKMATE-066
CHECKMATE-067
CHECKMATE-067(NCT01844505)은 이전에 치료받지 않은 절제 불가능 또는 전이성 흑색종 환자 945명을 대상으로 OPDIVO 및 ipilimumab, OPDIVO 또는 ipilimumab 등 세 가지 군 중 하나에 무작위 배정(1:1:1)하여 이중맹검 방식으로 진행한 다기관 임상시험입니다. 환자는 무작위 배정 최소 6주 전에 보조요법 또는 선행요법을 완료했고, 이전에 항-CTLA-4 항체 치료를 받은 적이 없으며, 활동성 뇌 전이, 눈 흑색종, 자가면역 질환 또는 전신 면역억제가 필요한 의학적 상태가 없어야 했습니다.
환자는 다음을 투여받도록 무작위 배정되었습니다.
- •
- 3주마다 4회 용량의 OPDIVO 1mg/kg 및 ipilimumab 3mg/kg을 정맥 투여한 후, 2주마다 단일 제제로 OPDIVO 3mg/kg을 정맥 주입(OPDIVO 및 ipilimumab 군),
- •
- 2주마다 OPDIVO 3mg/kg을 정맥 주입(OPDIVO 군), 또는
- •
- 3주마다 4회 용량의 ipilimumab 3mg/kg을 정맥 투여한 후, 2주마다 위약 투여(ipilimumab 군).
무작위 배정은 임상시험 분석에서 결정된 PD-L1 발현(≥5% 대 <5% 종양 세포막 발현), BRAF V600 돌 мутация 상태, AJCC 병기 분류 체계(M0, M1a, M1b 대 M1c)에 따라 층화되었습니다. 종양 평가는 무작위 배정 후 12주 후에 실시한 다음 첫해에는 6주마다, 그 이후에는 12주마다 실시했습니다. 주요 유효성 결과 측정값은 RECIST v1.1 및 OS에 따른 연구자 평가 PFS였습니다. 추가 유효성 결과 측정값은 확증된 ORR 및 반응 지속 기간이었습니다.
임상시험 모집단 특징은 다음과 같습니다. 중앙값 연령 61세(범위: 18~90세), 남성 65%, 백인 97%, ECOG 수행 상태 점수 0(73%) 또는 1(27%). 질병 특징은 다음과 같습니다. AJCC 병기 IV 질환(93%), M1c 질환(58%), LDH 상승(36%), 뇌 전이 이력(4%), BRAF V600 돌연변이 양성 흑색종(32%), 임상시험 분석에서 결정된 PD-L1 ≥5% 종양 세포막 발현(46%) 및 이전 보조요법(22%).
CHECKMATE-067은 ipilimumab 군과 비교하여 OPDIVO 함유 군에 무작위 배정된 환자의 OS 및 PFS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 이 임상시험은 OPDIVO에 ipilimumab을 추가하면 단일 제제로서의 OPDIVO에 비해 PFS 또는 OS가 개선되는지 여부를 평가하도록 설계되지 않았습니다. 유효성 결과는 표 53 및 그림 3에 나와 있습니다.
| a OS 결과는 최소 28개월의 추적 관찰 기간이 포함된 최종 OS 분석을 기반으로 합니다. PFS(공동 1차 평가변수) 및 ORR(2차 평가변수) 결과는 최소 9개월의 추적 관찰 기간이 포함된 1차 분석을 기반으로 합니다. b 층화 비례 위험 모델을 기반으로 합니다. c 층화 로그 순위 검정을 기반으로 합니다. d 두 OS p-값 중 최대값이 0.04(Hochberg 절차에 의해 할당된 유의 수준) 미만인 경우 두 p-값 모두 유의미한 것으로 간주됩니다. e p-값은 최종 PFS 치료 비교를 위해 할당된 알파의 0.005와 비교됩니다. f 층화 Cochran-Mantel-Haenszel 검정을 기반으로 합니다. + 중도절단 관찰값 |
|||
|
OPDIVO 및 Ipilimumab |
OPDIVO |
Ipilimumab |
|
|
전체 생존율a |
|||
|
사망 (%) |
128 (41) |
142 (45) |
197 (63) |
|
위험 비b (대 ipilimumab) |
0.55 |
0.63 |
|
|
p-값c, d |
<0.0001 |
<0.0001 |
|
|
무진행 생존율a |
|||
|
질병 진행 또는 사망 |
151 (48%) |
174 (55%) |
234 (74%) |
|
중앙값(개월) |
11.5 |
6.9 |
2.9 |
|
위험 비b (vs. ipilimumab) |
0.42 |
0.57 |
|
|
p-값c, e |
<0.0001 |
<0.0001 |
|
|
확인된 전체 반응률a |
50% |
40% |
14% |
|
(95% CI) |
(44, 55) |
(34, 46) |
(10, 18) |
|
p-값f |
<0.0001 |
<0.0001 |
|
|
완전 반응 |
8.9% |
8.5% |
1.9% |
|
부분 반응 |
41% |
31% |
12% |
|
반응 지속 기간 |
|||
|
지속 기간 ≥6개월 비율 |
76% |
74% |
63% |
|
범위(개월) |
1.2+ to 15.8+ |
1.3+ to 14.6+ |
1.0+ to 13.8+ |
그림 3: 전체 생존율 – CHECKMATE-067
최소 48개월의 추적 관찰 결과, OPDIVO 및 ipilimumab 군에서 전체 생존 기간(OS) 중앙값에 도달하지 못했습니다(95% CI: 38.2, NR). OPDIVO 군의 OS 중앙값은 36.9개월(95% CI: 28.3, NR)이었고 ipilimumab 군의 OS 중앙값은 19.9개월(95% CI: 16.9, 24.6)이었습니다.
최소 28개월의 추적 관찰 결과, 무진행 생존 기간(PFS) 중앙값은 OPDIVO 및 ipilimumab 군에서 11.7개월(95% CI: 8.9, 21.9), OPDIVO 군에서 6.9개월(95% CI: 4.3, 9.5), ipilimumab 군에서 2.9개월(95% CI: 2.8, 3.2)이었습니다. 최소 28개월의 추적 관찰 결과, 24개월 이상 지속된 반응 비율은 OPDIVO 및 ipilimumab 군에서 55%, OPDIVO 군에서 56%, ipilimumab 군에서 39%였습니다.
14.2 흑색종의 보조 요법
CHECKMATE-76K
CHECKMATE-76K(NCT04099251)는 완전히 절제된 IIB/C기 흑색종 환자 790명을 대상으로 한 무작위배정, 이중맹검 임상시험이었습니다. 환자들은 4주마다 최대 1년 동안 또는 질병 재발이나 허용할 수 없는 독성이 나타날 때까지 OPDIVO 480mg 또는 위약을 정맥 주입받도록 무작위로 배정되었습니다(2:1). 등록을 위해서는 무작위배정 12주 이내에 절제술 이외의 흑색종 치료를 받은 적이 없고, 음성 변연 및 음성 감시 림프절을 가진 원발성 흑색종을 완전히 절제하고, ECOG 수행 상태가 0 또는 1이어야 했습니다. 이 임상시험에서는 안구/포도막 또는 점막 흑색종, 자가면역 질환, 코르티코스테로이드(프레드니손 10mg 이상 또는 이에 상응하는 용량) 또는 기타 면역억제제를 사용한 전신 치료가 필요한 질환이 있는 환자는 제외되었습니다. 무작위배정은 AJCC 8th 병기 결정 시스템 에디션(T3b 대 T4a 대 T4b)으로 계층화되었습니다. 주요 효능 결과 측정값은 연구자가 평가한 바와 같이 무작위배정 날짜와 첫 번째 재발(국소, 국부 또는 원격 전이), 새로운 원발성 흑색종 또는 사망(원인 불문) 중 빠른 날짜까지의 기간으로 정의된 무재발 생존 기간(RFS)이었습니다. 종양 평가는 1~3년 동안 26주마다, 그 이후 5년까지 52주마다 실시되었습니다.
임상시험 모집단의 특징은 다음과 같습니다. 연령 중앙값 62세(범위: 19~92세), 남성 61%, 백인 98%, 흑인 또는 아프리카계 미국인 0.4%, 아시아인 0.1%, 인종 불명 1.1%, 히스패닉 또는 라틴 아메리카계 2.2%, 히스패닉 또는 라틴 아메리카계 아님 58%, 민족 불명 40%, ECOG 수행 상태 0인 경우 94%. 61%는 IIB기, 39%는 IIC기 흑색종이었습니다.
CHECKMATE-76K는 위약군에 비해 OPDIVO 군에 무작위로 배정된 환자의 RFS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 효능 결과는 표 54 및 그림 4에 나와 있습니다.
| a 도달하지 않음. b Kaplan-Meier 추정치 기준. c 위험 비율은 계층화된 Cox 비례 위험 모델을 기반으로 한 OPDIVO 대비 위약입니다. d 양측 계층화 로그 순위 검정 기준. 통계적 유의성 경계: p값 <0.033. |
||
|
OPDIVO |
위약 |
|
|
무재발 생존 기간 |
||
|
이벤트 수, n (%) |
66 (13%) |
69 (26%) |
|
중앙값(개월) b |
NRa |
NRa |
|
위험 비율c |
0.42 |
|
그림 4: 무재발 생존 기간 – CHECKMATE-76K
CHECKMATE-238
CHECKMATE-238(NCT02388906)은 완전히 절제된 IIIB/C기 또는 IV기 흑색종 환자 906명을 대상으로 한 무작위 배정, 이중맹검 임상시험이었습니다. 환자들은 OPDIVO 3 mg/kg을 2주마다 정맥 주입으로 투여받거나 ipilimumab 10 mg/kg을 3주마다 정맥 주입으로 4회 투여받은 후 24주차부터 시작하여 최대 1년 동안 12주마다 투여받도록 (1:1) 무작위 배정되었습니다. 등록을 위해서는 무작위 배정 전 12주 이내에 병변에 대해 음성인 경계를 가진 흑색종의 완전 절제가 요구되었습니다. 이 임상시험은 안구/포도막 흑색종, 자가면역 질환, 코르티코스테로이드(프레드니손 10 mg 이상/일 또는 동등한 용량) 또는 기타 면역억제제를 사용한 전신 치료가 필요한 질환의 병력이 있는 환자, 그리고 수술, 중추 신경계 병변에 대한 신경외과적 절제 후 보조 방사선 요법, 무작위 배정 전 6개월 이상 완료된 이전의 보조 인터페론을 제외하고 흑색종에 대한 이전 치료를 받은 환자를 제외했습니다. 무작위 배정은 PD-L1 상태(양성[5% 수준 기준] 대 음성/판단 불가) 및 AJCC 병기(IIIB/C기 대 IV기 M1a-M1b 대 IV기 M1c)에 따라 층화되었습니다. 주요 유효성 평가 변수는 연구자의 평가에 따라 무작위 배정 날짜와 최초 재발(국소, 국부, 또는 원격 전이), 새로운 원발성 흑색종 또는 사망 중 빠른 날짜 사이의 기간으로 정의된 무재발 생존 기간(RFS)이었습니다. 환자들은 처음 2년 동안 12주마다, 그 이후에는 6개월마다 종양 재발에 대한 영상 검사를 받았습니다.
임상시험 모집단의 특징은 다음과 같습니다. 중앙값 연령은 55세(범위: 18~86세)였고, 58%는 남성이었고, 95%는 백인이었고, 90%는 ECOG 수행 상태가 0이었습니다. 질병 특징은 AJCC IIIB기(34%), IIIC기(47%), IV기(19%), M1a-b(14%), BRAF V600 돌연변이 양성(42%), BRAF 야생형(45%), LDH 상승(8%), 임상시험 분석에 의해 결정된 PD-L1 ≥5% 종양 세포막 발현(34%), 육안적 림프절(48%) 및 종양 궤양(32%)이었습니다.
CHECKMATE-238은 ipilimumab 10 mg/kg군에 비해 OPDIVO군에 무작위 배정된 환자의 RFS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 유효성 결과는 표 55 및 그림 5에 나와 있습니다.
| a 도달하지 않음. b 층화 비례 위험 모델을 기반으로 함. c 층화 로그 순위 검정을 기반으로 함. d p-값은 이 분석에 대해 할당된 알파의 0.0244와 비교함. e 최종 OS 분석 시점에 원래 예상했던 것보다 더 적은 전체 생존 사건이 관찰됨(약 302건). |
||
|
OPDIVO |
Ipilimumab 10 mg/kg |
|
|
무재발 생존 기간 |
||
|
사건 수, n (%) |
154 (34%) |
206 (45%) |
|
중앙값(개월) |
NRa |
NRa |
|
위험 비b |
0.65 |
|
|
전체 생존 기간 |
||
|
사건 수, n (%)e |
100 (22%) |
111 (25%) |
|
중앙값(개월) |
NRa |
NRa |
|
위험 비b |
0.87 |
|
그림 5: 무재발 생존 기간 – CHECKMATE-238
14.3 절제 가능한 비소세포폐암(종양 ≥4cm 또는 림프절 양성)의 수술 전 보조 요법
CHECKMATE-816(NCT02998528)은 절제 가능한 NSCLC 환자를 대상으로 한 무작위 배정, 공개 라벨 시험이었습니다. 이 시험에는 ECOG 수행 상태가 0 또는 1이고, 측정 가능한 질환(RECIST 버전 1.1 기준)을 가진 절제 가능하고 조직학적으로 확인된 병기 IB(≥4cm), II 또는 IIIA NSCLC 환자(제7판 미국암공동위원회/국제암퇴치연합(AJCC/UICC) 병기 기준 기준)가 포함되었습니다. 절제 불가능하거나 전이성 NSCLC, 알려진 EGFR 돌연변이 또는 ALK 전좌, 2등급 이상의 말초 신경병증, 활동성 자가면역 질환 또는 전신 면역억제가 필요한 의학적 상태를 가진 환자는 연구에서 제외되었습니다.
환자는 다음 중 하나를 받도록 무작위 배정되었습니다.
- •
- OPDIVO 360mg을 30분 이상 정맥 투여하고 백금 기반 이중 항암화학요법을 3주마다 최대 3주기 동안 정맥 투여하거나,
- •
- 백금 기반 이중 항암화학요법을 3주마다 최대 3주기 동안 투여했습니다.
백금 기반 이중 항암화학요법은 파클리탁셀 175mg/m2 또는 200mg/m2 및 카보플라틴 AUC 5 또는 AUC 6(모든 조직 유형), 페메트렉시드 500mg/m2 및 시스플라틴 75mg/m2(비편평상피 조직 유형), 또는 젬시타빈 1000mg/m2 또는 1250mg/m2 및 시스플라틴 75mg/m2(편평상피 조직 유형)으로 구성되었습니다. 백금 기반 이중 항암화학요법군에서 두 가지 추가 치료 요법 옵션에는 비노렐빈 25mg/m2 또는 30mg/m2 및 시스플라틴 75mg/m2, 또는 도세탁셀 60mg/m2 또는 75mg/m2 및 시스플라틴 75mg/m2(모든 조직 유형)이 포함되었습니다.
무작위 배정을 위한 층화 요인은 종양 PD-L1 발현 수준(≥1% 대 <1% 또는 정량화 불가능), 질병 병기(IB/II 대 IIIA) 및 성별(남성 대 여성)이었습니다. 종양 평가는 기준 시점, 수술 후 14일 이내, 수술 후 2년 동안 12주마다, 그 후 3년 동안 6개월마다, 그리고 질병 재발 또는 진행될 때까지 5년 동안 매년 수행되었습니다. 주요 효능 결과 측정값은 맹검 독립 중앙 검토(BICR) 평가를 기반으로 한 무사건 생존 기간(EFS)과 맹검 독립 병리학적 검토(BIPR)로 평가한 병리학적 완전 반응(pCR)이었습니다. 추가 효능 결과 측정값에는 OS가 포함되었습니다.
총 358명의 환자가 OPDIVO와 백금 기반 이중 항암화학요법 병용(n=179) 또는 백금 기반 이중 항암화학요법(n=179)을 받도록 무작위 배정되었습니다. 평균 연령은 65세(범위: 34~84세)였으며, 환자의 51%가 65세 이상, 7%가 75세 이상이었고, 50%는 아시아인, 47%는 백인, 2%는 흑인이었으며, 71%는 남성이었습니다. 기준 시점 ECOG 수행 상태는 0(67%) 또는 1(33%)이었습니다. 50%는 PD-L1 발현이 ≥1%인 종양을 가지고 있었고, 35%는 IB/II기, 64%는 IIIA기 질환을 가지고 있었으며, 51%는 편평상피 조직 유형의 종양을, 49%는 비편평상피 조직 유형의 종양을 가지고 있었고, 89%는 과거/현재 흡연자였습니다.
OPDIVO와 백금 기반 이중 항암화학요법 병용군의 83%가 백금 기반 이중 항암화학요법군의 75%에 비해 확정적 수술을 받았습니다.
이 연구는 EFS 및 pCR의 통계적으로 유의미한 개선을 보여주었습니다. 효능 결과는 표 56과 그림 6에 나와 있습니다.
| EFS에 대한 최소 추적 관찰 기간은 21개월이었습니다. a Kaplan-Meier 추정값. b 층화 Cox 비례 위험 모델을 기반으로 함. c 층화 로그 순위 검정을 기반으로 함. 통계적 유의성 경계: p-값 <0.0262. d Clopper 및 Pearson 방법을 기반으로 함. e Cochran-Mantel-Haenszel 가중 방법을 기반으로 한 층화 조정 차이. f 층화 CMH 검정에서 비롯됨. |
||
|
OPDIVO 및 백금 기반 이중 항암화학요법 |
백금 기반 이중 항암화학요법 |
|
|
BICR 기준 무사건 생존 기간(EFS) |
||
|
사건 수(%) |
64(35.8) |
87(48.6) |
|
중앙값(개월)a (95% CI) |
31.6 (30.2, NR) |
20.8 (14.0, 26.7) |
|
위험 비b (95% CI) |
0.63 (0.45, 0.87) |
|
|
층화 로그 순위 p-값c |
0.0052 |
|
|
BIPR 기준 병리학적 완전 반응(pCR) |
||
|
pCR을 보인 환자 수 |
43 |
4 |
|
pCR 비율 (%), (95% CI)d |
24.0 (18.0, 31.0) |
2.2 (0.6, 5.6) |
|
예상 치료 차이 (95% CI)e |
21.6 (15.1, 28.2) |
|
|
p-값f |
<0.0001 |
|
그림 6: 무사건 생존율 – CHECKMATE-816
EFS 분석 당시 환자의 26%가 사망했습니다. OS에 대한 사전 지정된 중간 분석 결과 HR은 0.57(95% CI: 0.38, 0.87)였으며 통계적 유의성에 대한 경계를 넘지 않았습니다.
14.4 전이성 비소세포폐암
PD-L1을 발현하는 전이성 비소세포폐암(NSCLC)에 대한 1차 치료(≥1%): 이필리무맙과 병용
CHECKMATE-227(NCT02477826)은 전이성 또는 재발성 NSCLC 환자를 대상으로 한 무작위 배정, 공개 라벨, 다기관 시험이었습니다. 이 연구에는 조직학적으로 확인된 4기 또는 재발성 NSCLC(7차 국제폐암연구협회[IASLC] 분류 기준), ECOG 수행 상태 0 또는 1, 이전의 항암 치료를 받지 않은 환자(18세 이상)가 포함되었습니다. 환자는 종양 PD-L1 상태와 관계없이 등록되었습니다. 알려진 EGFR 돌연변이 또는 사용 가능한 표적 억제제 치료에 민감한 ALK 전좌, 치료하지 않은 뇌 전이, 암성 수막염, 활동성 자가면역 질환 또는 전신 면역억제가 필요한 의학적 상태를 가진 환자는 연구에서 제외되었습니다. 치료받은 뇌 전이가 있는 환자는 등록 전 최소 2주 동안 신경학적으로 기준치로 돌아왔고 코르티코스테로이드를 중단했거나 10mg 미만의 프레드니손 등가물을 안정적이거나 감소하는 용량으로 복용한 경우 참여할 수 있었습니다.
1차 유효성 결과는 PD-L1 종양 발현이 ≥1%인 환자로 제한된 연구의 파트 1a를 기반으로 했습니다. 종양 검체는 중앙 실험실에서 PD-L1 IHC 28-8 pharmDx 분석을 사용하여 전향적으로 평가했습니다. 무작위 배정은 종양 조직학(비편평세포 대 편평세포)에 따라 계층화되었습니다. 유효성 평가는 다음 간의 비교에 의존했습니다.
- •
- 30분에 걸쳐 2주마다 정맥 주사로 투여되는 OPDIVO 3mg/kg과 30분에 걸쳐 6주마다 정맥 주사로 투여되는 이필리무맙 1mg/kg을 병용; 또는
- •
- 백금 기반 이중 항암화학요법
항암화학요법 요법은 비편평세포 NSCLC의 경우 페메트렉세드(500mg/m2) 및 시스플라틴(75mg/m2) 또는 페메트렉세드(500mg/m2) 및 카보플라틴(AUC 5 또는 6), 편평세포 NSCLC의 경우 겜시타빈(1000 또는 1250mg/m2) 및 시스플라틴(75mg/m2) 또는 겜시타빈(1000mg/m2) 및 카보플라틴(AUC 5)(겜시타빈은 각 주기의 1일차와 8일차에 투여)으로 구성되었습니다.
연구 치료는 질병 진행, 허용할 수 없는 독성 또는 최대 24개월까지 계속되었습니다. 환자가 임상적으로 안정적이고 연구자가 임상적 이점을 얻는 것으로 간주되는 경우 질병 진행 후에도 치료가 계속되었습니다. 이필리무맙으로 인한 이상 반응으로 인해 병용 요법을 중단한 환자는 OPDIVO를 단일 요법으로 계속 투여할 수 있었습니다. 종양 평가는 첫 번째 연구 치료 용량을 투여한 후 처음 12개월 동안 6주마다, 그 후 질병이 진행되거나 연구 치료가 중단될 때까지 12주마다 수행되었습니다. 1차 유효성 결과 측정값은 OS였습니다. 추가 유효성 결과 측정값에는 BICR에서 평가한 PFS, ORR 및 반응 기간이 포함되었습니다.
파트 1a에서 총 793명의 환자가 OPDIVO와 이필리무맙 병용(n=396) 또는 백금 기반 이중 항암화학요법(n=397)을 투여받도록 무작위 배정되었습니다. 평균 연령은 64세(범위: 26~87세)였으며 환자의 49%가 65세 이상, 10%가 75세 이상이었고, 76%가 백인이었으며, 65%가 남성이었습니다. 기준 ECOG 수행 상태는 0(34%) 또는 1(65%)이었고, 50%는 PD-L1 ≥50%였으며, 29%는 편평세포 조직학, 71%는 비편평세포 조직학이었고, 10%는 뇌 전이가 있었으며, 85%는 과거/현재 흡연자였습니다.
이 연구는 백금 기반 이중 항암화학요법군에 비해 OPDIVO 및 이필리무맙군에 무작위 배정된 PD-L1 ≥1% 환자에서 OS가 통계적으로 유의미하게 개선되었음을 입증했습니다. OS 결과는 표 57과 그림 7에 나와 있습니다.
| a Kaplan-Meier 추정값. b 계층화된 Cox 비례 위험 모델을 기반으로 함. |
||
|
OPDIVO 및 이필리무맙 |
백금 기반 이중 항암화학요법 |
|
|
전체 생존 기간 |
||
|
사건 발생(%) |
258(65%) |
298(75%) |
|
중앙값(개월)a (95% CI) |
17.1 (15, 20.1) |
14.9 (12.7, 16.7) |
|
위험 비율(95% CI)b |
0.79(0.67, 0.94) |
|
|
계층화된 로그 순위 p-값 |
0.0066 |
|
그림 7: 전체 생존 기간(PD-L1 ≥1%) – CHECKMATE-227
BICR로 평가한 PFS는 HR 0.82(95% CI: 0.69, 0.97)였으며, OPDIVO 및 ipilimumab 투여군의 PFS 중앙값은 5.1개월(95% CI: 4.1, 6.3), 백금 기반 이중 약물 화학요법 투여군은 5.6개월(95% CI: 4.6, 5.8)이었습니다. BICR로 평가한 확증된 ORR은 OPDIVO 및 ipilimumab 투여군에서 36%(95% CI: 31, 41), 백금 기반 이중 약물 화학요법 투여군에서 30%(95% CI: 26, 35)였습니다. OPDIVO 및 ipilimumab 투여군에서 관찰된 반응 지속 기간 중앙값은 23.2개월이었고, 백금 기반 이중 약물 화학요법 투여군에서는 6.2개월이었습니다.
전이성 또는 재발성 NSCLC에 대한 1차 치료: Ipilimumab 및 백금 기반 이중 약물 화학요법과의 병용
CHECKMATE-9LA(NCT03215706)는 전이성 또는 재발성 NSCLC 환자를 대상으로 한 무작위 배정, 공개형 시험이었습니다. 이 시험에는 조직학적으로 확인된 IV기 또는 재발성 NSCLC(제7차 국제폐암연구협회[IASLC] 분류 기준), ECOG 수행 상태 0 또는 1이며 전이성 질환에 대해 이전의 항암 치료(EGFR 및 ALK 억제제 포함)를 받은 적이 없는 환자(18세 이상)가 포함되었습니다. 환자는 종양 PD-L1 상태와 관계없이 등록되었습니다. 사용 가능한 표적 억제제 치료에 민감한 EGFR 돌연변이 또는 ALK 전좌가 알려져 있거나, 치료받지 않은 뇌 전이, 암성 수막염, 활동성 자가면역 질환이 있거나, 전신 면역억제가 필요한 의학적 상태가 있는 환자는 이 연구에서 제외되었습니다. 안정적인 뇌 전이가 있는 환자는 등록 자격이 있었습니다.
환자는 다음 중 하나를 받도록 1:1로 무작위 배정되었습니다.
- •
- 3주마다 30분에 걸쳐 OPDIVO 360mg을 정맥 투여하고, 6주마다 30분에 걸쳐 ipilimumab 1mg/kg을 정맥 투여하고, 3주마다 백금 기반 이중 약물 화학요법을 2주기 동안 정맥 투여하거나,
- •
- 3주마다 백금 기반 이중 약물 화학요법을 4주기 동안 투여합니다.
백금 기반 이중 약물 화학요법은 비편평 NSCLC의 경우 carboplatin(AUC 5 또는 6) 및 pemetrexed 500mg/m2 또는 cisplatin 75mg/m2 및 pemetrexed 500mg/m2로 구성되었고, 편평 NSCLC의 경우 carboplatin(AUC 6) 및 paclitaxel 200mg/m2으로 구성되었습니다. 대조군의 비편평 NSCLC 환자는 선택적으로 pemetrexed 유지 요법을 받을 수 있었습니다. 무작위 배정을 위한 층화 요인은 종양 PD-L1 발현 수준(≥1% 대 <1% 또는 정량 불가), 조직학(편평 대 비편평) 및 성별(남성 대 여성)이었습니다. 연구 치료는 질병 진행, 허용 불가능한 독성 또는 최대 2년까지 계속되었습니다. 환자가 임상적으로 안정적이고 연구자가 임상적 이점을 얻는다고 판단한 경우 질병 진행 후에도 치료를 계속할 수 있었습니다. ipilimumab으로 인한 이상 반응으로 인해 병용 요법을 중단한 환자는 연구의 일환으로 단일 제제로 OPDIVO를 계속 투여할 수 있었습니다. 종양 평가는 첫 번째 연구 치료 투여 후 처음 12개월 동안 6주마다, 그 후 질병 진행 또는 연구 치료 중단 시까지 12주마다 수행되었습니다. 1차 유효성 평가 변수는 OS였습니다. 추가 유효성 평가 변수에는 BICR로 평가한 PFS, ORR 및 반응 지속 기간이 포함되었습니다.
총 719명의 환자가 OPDIVO와 ipilimumab 및 백금 기반 이중 약물 화학요법 병용 투여군(n=361) 또는 백금 기반 이중 약물 화학요법 투여군(n=358)으로 무작위 배정되었습니다. 평균 연령은 65세(범위: 26~86세)였으며, 환자의 51%가 65세 이상, 10%가 75세 이상이었습니다. 대다수의 환자는 백인(89%)이었고 남성(70%)이었습니다. 기준 ECOG 수행 상태는 0(31%) 또는 1(68%)이었고, 57%는 PD-L1 발현이 ≥1%인 종양을 가지고 있었고, 37%는 PD-L1 발현이 <1%인 종양을 가지고 있었으며, 32%는 편평 조직학적 유형의 종양을 가지고 있었고, 68%는 비편평 조직학적 유형의 종양을 가지고 있었으며, 17%는 CNS 전이가 있었고, 86%는 과거 또는 현재 흡연자였습니다.
이 연구는 OS, PFS 및 ORR에서 통계적으로 유의미한 이점을 입증했습니다. 351개의 사건이 관찰되었을 때(최종 분석을 위해 계획된 사건 수의 87%) 사전 지정된 중간 분석의 유효성 결과는 표 58에 나와 있습니다.
| a 층화 Cox 비례 위험 모델을 기반으로 합니다. b p-값은 이 중간 분석에 대해 할당된 알파 0.033과 비교합니다. c p-값은 이 중간 분석에 대해 할당된 알파 0.0252와 비교합니다. d Kaplan-Meier 추정값. e Clopper 및 Pearson 방법을 기반으로 한 신뢰 구간. f p-값은 이 중간 분석에 대해 할당된 알파 0.025와 비교합니다. |
||
|
OPDIVO 및 Ipilimumab 및 백금 기반 이중 약물 화학요법 |
백금 기반 이중 약물 화학요법 |
|
|
전체 생존 기간 |
||
|
사건 수(%) |
156(43.2) |
195(54.5) |
|
중앙값(개월) (95% CI) |
14.1 |
10.7 |
|
위험 비(96.71% CI)a |
0.69(0.55, 0.87) |
|
|
층화 로그 순위 p-값b |
0.0006 |
|
|
BICR에 따른 무진행 생존 기간 |
||
|
이벤트 (%) |
232 (64.3) |
249 (69.6) |
|
위험 비율 (97.48% CI)a |
0.70 (0.57, 0.86) |
|
|
층화 로그 순위 p-값c |
0.0001 |
|
|
중앙값(개월)d (95% CI) |
6.8 |
5.0 |
|
BICR에 따른 전체 반응률 (%) |
38 |
25 |
|
(95% CI)e |
(33, 43) |
(21, 30) |
|
층화 CMH 검정 p-값f |
0.0003 |
|
|
BICR에 따른 반응 지속 기간 |
||
|
중앙값(개월) (95% CI)d |
10.0 |
5.1 |
추가 4.6개월의 추적 관찰 결과, 전체 생존에 대한 위험 비율은 0.66(95% CI: 0.55, 0.80)이었고, OPDIVO 및 ipilimumab과 백금 기반 이중 화학 요법 또는 백금 기반 이중 화학 요법을 투여받은 환자의 중앙값 생존 기간은 각각 15.6개월(95% CI: 13.9, 20.0) 및 10.9개월(95% CI: 9.5, 12.5)이었습니다(그림 8).
그림 8: 전체 생존 – CHECKMATE-9LA
전이성 편평 비소세포폐암의 2차 치료
CHECKMATE-017(NCT01642004)은 이전 백금 기반 이중 화학 요법 치료 중 또는 후에 질병이 진행된 전이성 편평 비소세포폐암 환자 272명을 대상으로 한 무작위 배정(1:1), 공개 라벨 시험이었습니다. 환자들은 2주마다 OPDIVO 3mg/kg을 정맥 주입(n=135)받거나 3주마다 docetaxel 75mg/m2을 정맥 주입(n=137)받았습니다. 무작위 배정은 이전 paclitaxel 대 다른 이전 치료 및 지역(미국/캐나다 대 유럽 대 기타 지역)으로 계층화되었습니다. 이 시험에는 PD-L1 상태와 관계없이 환자가 포함되었습니다. 자가면역 질환, 전신 면역억제가 필요한 의학적 상태, 증상이 있는 간질성 폐 질환 또는 치료받지 않은 뇌 전이가 있는 환자는 이 시험에서 제외되었습니다. 치료받은 뇌 전이가 있는 환자는 등록 전 최소 2주 동안 신경학적으로 기준치로 돌아왔고 코르티코스테로이드를 중단했거나 10mg 미만의 prednisone 등가물을 매일 안정적이거나 감소하는 용량으로 복용한 경우 참여할 수 있었습니다. 첫 번째 종양 평가는 무작위 배정 후 9주 후에 실시되었으며 이후 6주마다 계속되었습니다. 주요 효능 결과 측정값은 OS였습니다. 추가 효능 결과 측정값은 연구자 평가 ORR 및 PFS였습니다.
시험 모집단 특성은 다음과 같습니다. 중앙값 연령은 63세(범위: 39~85세)였고 44%는 65세 이상, 11%는 75세 이상이었습니다. 대부분의 환자는 백인(93%)이고 남성(76%)이었습니다. 대부분의 환자는 유럽(57%)에서 등록했으며 나머지는 미국/캐나다(32%)와 기타 지역(11%)에서 등록했습니다. 기준 ECOG 수행 상태는 0(24%) 또는 1(76%)이었고 92%는 과거/현재 흡연자였습니다. 연구자가 보고한 모집단의 기준 질병 특성은 3기B(19%), 4기(80%) 및 뇌 전이(6%)였습니다. 모든 환자는 이전에 백금 기반 이중 요법을 받았고 99%의 환자는 편평 세포 조직학적 종양을 가지고 있었습니다.
이 시험에서는 199건의 사건이 관찰되었을 때(최종 분석을 위해 계획된 사건 수의 86%) 사전 지정된 중간 분석에서 docetaxel에 비해 OPDIVO에 무작위 배정된 환자의 OS가 통계적으로 유의미하게 개선된 것으로 나타났습니다. 효능 결과는 표 59 및 그림 9에 나와 있습니다.
| a 계층화된 비례 위험 모델을 기반으로 합니다. b 계층화된 로그 순위 검정을 기반으로 합니다. c p-값은 이 중간 분석에 대해 할당된 알파의 .0315와 비교됩니다. d 계층화된 Cochran-Mantel-Haenszel 검정을 기반으로 합니다. e 도달하지 않음 |
||
|
OPDIVO |
Docetaxel |
|
|
전체 생존 기간 |
||
|
사망 (%) |
86 (64%) |
113 (82%) |
|
중앙값(개월) |
9.2 |
6.0 |
|
위험 비율(95% CI)a |
0.59 (0.44, 0.79) |
|
|
p-값b,c |
0.0002 |
|
|
전체 반응률 |
27 (20%) |
12 (9%) |
|
(95% CI) |
(14, 28) |
(5, 15) |
|
p-값d |
0.0083 |
|
|
완전 반응 |
1 (0.7%) |
0 |
|
반응 지속 기간 중앙값(개월) |
NRe |
8.4 |
|
무진행 생존 |
||
|
질병 진행 또는 사망 (%) |
105 (78%) |
122 (89%) |
|
중앙값(개월) |
3.5 |
2.8 |
|
위험 비율 (95% CI)a |
0.62 (0.47, 0.81) |
|
|
p-값b |
0.0004 |
|
그림 9: 전체 생존 기간 – CHECKMATE-017
보관된 종양 검체를 후향적으로 평가하여 PD-L1 발현을 조사했습니다. 전체 임상시험 모집단에서 272명의 환자 중 17%가 정량화할 수 없는 결과를 보였습니다. 정량화할 수 있는 결과를 보인 225명의 환자 중 47%는 PD-L1 음성 편평 비소세포폐암(PD-L1을 발현하는 종양 세포가 1% 미만으로 정의됨)이었고, 53%는 PD-L1 양성 편평 비소세포폐암(PD-L1을 발현하는 종양 세포가 1% 이상으로 정의됨)이었습니다. 사전 지정된 하위 그룹 탐색 분석에서 생존에 대한 위험 비율은 PD-L1 음성 하위 그룹에서 0.58(95% CI: 0.37, 0.92), PD-L1 양성 하위 그룹에서 0.69(95% CI: 0.45, 1.05)였습니다.
전이성 비편평 비소세포폐암의 2차 치료
CHECKMATE-057(NCT01673867)은 백금 기반 이중 화학요법 1회 치료 중 또는 치료 후 질병이 진행된 전이성 비편평 비소세포폐암 환자 582명을 대상으로 한 무작위 배정(1:1), 공개 표지 임상시험이었습니다. EGFR 민감성 돌연변이 또는 ALK 전좌가 알려진 환자의 경우 적절한 사전 표적 치료가 허용되었습니다. 환자들은 2주마다 OPDIVO 3mg/kg을 정맥 주입(n=292)받거나 3주마다 도세탁셀 75mg/m2을 정맥 주입(n=290)받았습니다. 무작위 배정은 사전 유지 치료(예 또는 아니오) 및 사전 치료 횟수(1회 또는 2회)에 따라 층화되었습니다. 자가면역 질환, 전신 면역억제가 필요한 질환, 증상성 간질성 폐질환 또는 치료받지 않은 뇌 전이가 있는 환자는 이 임상시험에서 제외되었습니다. 치료받은 뇌 전이가 있는 환자는 신경학적으로 안정적인 경우 참여할 수 있었습니다. 첫 번째 종양 평가는 무작위 배정 후 9주차에 실시되었으며 이후 6주마다 계속되었습니다. 주요 유효성 평가 변수는 OS였습니다. 추가 유효성 평가 변수는 연구자 평가 ORR 및 PFS였습니다. 또한 PD-L1 발현으로 정의된 하위 그룹에서 사전 지정된 분석이 수행되었습니다.
임상시험 모집단 특성: 평균 연령은 62세(범위: 21~85세)였으며, 환자의 42%가 65세 이상이었고 7%가 75세 이상이었습니다. 대부분의 환자는 백인(92%) 및 남성(55%)이었으며, 대부분의 환자가 유럽(46%)에서 등록되었고, 그 다음으로 미국/캐나다(37%) 및 기타 지역(17%) 순이었습니다. 기준 ECOG 수행 상태는 0(31%) 또는 1(69%)이었고, 79%는 과거/현재 흡연자였으며, 3.6%는 ALK 재배열이 있는 비소세포폐암, 14%는 EGFR 돌연변이가 있는 비소세포폐암, 12%는 이전에 치료받은 뇌 전이가 있었습니다. 사전 치료에는 백금 이중 요법(100%)이 포함되었으며 40%는 1차 요법의 일환으로 유지 치료를 받았습니다. 조직학적 아형에는 선암종(93%), 대세포암(2.4%) 및 세기관지폐포암(0.9%)이 포함되었습니다.
CHECKMATE-057은 최종 분석을 위해 계획된 사건 수의 93%인 413건의 사건이 관찰되었을 때 사전 지정된 중간 분석에서 도세탁셀에 비해 OPDIVO에 무작위 배정된 환자의 OS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 유효성 결과는 표 60 및 그림 10에 나와 있습니다.
| a 층화 비례 위험 모델을 기반으로 함. b 층화 로그 순위 검정을 기반으로 함. c p-값은 이 중간 분석에 대해 할당된 알파의 .0408과 비교됨. d 층화 코크란-맨텔-헨젤 검정을 기반으로 함. e 도달하지 않음. |
||
|
OPDIVO |
도세탁셀 |
|
|
전체 생존 기간 |
||
|
사망 (%) |
190 (65%) |
223 (77%) |
|
중앙값(개월) |
12.2 |
9.4 |
|
위험 비율(95% CI)a |
0.73 (0.60, 0.89) |
|
|
p-값b,c |
0.0015 |
|
|
전체 반응률 |
56 (19%) |
36 (12%) |
|
(95% CI) |
(15, 24) |
(9, 17) |
|
p-값d |
0.02 |
|
|
완전 반응 |
4 (1.4%) |
1 (0.3%) |
|
반응 지속 기간 중앙값(개월) |
17 |
6 |
|
무진행 생존 기간 |
||
|
질병 진행 또는 사망 (%) |
234 (80%) |
245 (84%) |
|
중앙값(개월) |
2.3 |
4.2 |
|
위험 비율 (95% CI)a |
0.92 (0.77, 1.11) |
|
|
p-값b |
0.39 |
|
그림 10: 전체 생존율 – CHECKMATE-057
시험 완료 후 보관된 종양 검체를 대상으로 PD-L1 발현을 평가했습니다. 전체 시험 집단에서 582명의 환자 중 22%가 정량화할 수 없는 결과를 보였습니다. 나머지 455명의 환자 중 PD-L1 IHC 28-8 pharmDx 분석을 사용한 PD-L1 검사를 기반으로 후향적으로 결정된 하위 그룹의 환자 비율은 다음과 같습니다. PD-L1 음성 46%(PD-L1을 발현하는 종양 세포 <1%로 정의) 및 PD-L1 발현 54%(PD-L1을 발현하는 종양 세포 ≥1%로 정의). PD-L1을 발현하는 종양이 있는 246명의 환자 중 26%는 양성 염색이 있는 종양 세포가 ≥1%이지만 <5%였고, 7%는 양성 염색이 있는 종양 세포가 ≥5%이지만 <10%였고, 67%는 양성 염색이 있는 종양 세포가 ≥10%였습니다. 그림 11과 12는 PD-L1을 발현하는 종양 세포의 백분율에 따라 결정된 하위 그룹에서 OS 및 PFS에 대한 사전 지정된 분석 결과를 요약한 것입니다.
그림 11: 포레스트 플롯: PD-L1 발현 기반 OS – CHECKMATE-057
그림 12: 포레스트 플롯: PD-L1 발현 기반 PFS – CHECKMATE-057
14.5 악성 흉막 중피종
CHECKMATE-743(NCT02899299)은 절제 불가능한 악성 흉막 중피종 환자를 대상으로 한 무작위 배정, 공개 표지 시험이었습니다. 이 시험에는 조직학적으로 확진되었으며 이전에 치료를 받지 않았고 치료 시작 후 14일 이내에 완화 방사선 치료를 받지 않은 악성 흉막 중피종 환자가 포함되었습니다. 간질성 폐 질환, 활동성 자가 면역 질환, 전신 면역 억제가 필요한 의학적 상태 또는 활동성 뇌 전이가 있는 환자는 시험에서 제외되었습니다.
환자들은 다음 중 하나를 받도록 1:1로 무작위 배정되었습니다.
- •
- OPDIVO 3mg/kg을 30분 동안 2주마다 정맥 주입하고 ipilimumab 1mg/kg을 30분 동안 6주마다 정맥 주입하여 최대 2년 동안 투여하거나
- •
- 시스플라틴 75mg/m2 및 페메트렉세드 500mg/m2 또는 카보플라틴 5AUC 및 페메트렉세드 500mg/m2을 3주마다 6회 투여합니다.
무작위 배정을 위한 층화 요인은 종양 조직학(상피양 대 육종양 또는 혼합 조직학 아형) 및 성별(남성 대 여성)이었습니다. 연구 치료는 질병 진행 또는 허용할 수 없는 독성이 발생할 때까지 최대 2년 동안 계속되었습니다. ipilimumab으로 인한 이상 반응으로 인해 병용 요법을 중단한 환자는 OPDIVO를 단일 제제로 계속 투여할 수 있었습니다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이점을 얻는 것으로 간주되는 경우 질병 진행 후에도 치료를 계속할 수 있습니다. 종양 평가는 첫 번째 연구 치료 투여 후 처음 12개월 동안 6주마다, 그 후 질병 진행 또는 연구 치료가 중단될 때까지 12주마다 수행되었습니다. 1차 효능 결과 측정값은 OS였습니다. 추가 효능 결과 측정값에는 수정된 RECIST 기준을 사용하여 BICR에서 평가한 PFS, ORR 및 반응 기간이 포함되었습니다.
총 605명의 환자가 OPDIVO와 ipilimumab 병용(n=303) 또는 화학 요법(n=302)을 받도록 무작위 배정되었습니다. 평균 연령은 69세(범위: 25~89세)였으며, 환자의 72%가 65세 이상, 26%가 75세 이상이었습니다. 85%는 백인, 11%는 아시아인, 77%는 남성이었습니다. 기준 ECOG 수행 상태는 0(40%) 또는 1(60%)이었고, 35%는 3기, 51%는 4기 질환이었으며, 75%는 상피양, 25%는 비상피양 조직학이었으며, 75%는 PD-L1 발현이 ≥1%인 종양을 가지고 있었고, 22%는 PD-L1 발현이 <1%인 종양을 가지고 있었습니다.
이 시험은 화학 요법에 비해 OPDIVO와 ipilimumab 병용으로 무작위 배정된 환자의 OS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 사전 지정된 중간 분석의 효능 결과는 표 61과 그림 13에 나와 있습니다.
| a 중간 분석 당시 419명의 사망(최종 분석에 필요한 사망자 수의 89%)이 발생했습니다. b 카플란-마이어 추정값. c 층화 콕스 비례 위험 모델. d p-값은 이 중간 분석에 대해 할당된 알파 0.0345와 비교됩니다. e BICR에 의해 확인된 반응을 기반으로 합니다. |
||
|
OPDIVO 및 Ipilimumab |
화학 요법 |
|
|
전체 생존율a |
||
|
이벤트 수(%) |
200(66) |
219(73) |
|
중앙값(개월)b (95% CI) |
18.1 |
14.1 |
|
위험 비율(95% CI)c |
0.74(0.61, 0.89) |
|
|
층화 로그 순위 p-값d |
0.002 |
|
|
무진행 생존율 |
||
|
이벤트 (%) |
218 (72) |
209 (69) |
|
Hazard ratio (95% CI)c |
1.0 (0.82, 1.21) |
|
|
중앙값(개월)b (95% CI) |
6.8 |
7.2 |
|
전체 반응률e |
40% |
43% |
|
(95% CI) |
(34, 45) |
(37, 49) |
|
반응 지속 기간 |
||
|
중앙값(개월)b |
11.0 |
6.7 |
그림 13: 전체 생존율 – CHECKMATE-743
조직학을 기반으로 한 사전 지정된 탐색적 분석에서 상피양 조직학 환자 하위 그룹의 OS에 대한 위험 비율(HR)은 0.85(95% CI: 0.68, 1.06)였으며, OPDIVO 및 ipilimumab 군의 중앙값 OS는 18.7개월, 화학 요법 군은 16.2개월이었습니다. 비상피양 조직학 환자 하위 그룹에서 OS에 대한 HR은 0.46(95% CI: 0.31, 0.70)였으며, OPDIVO 및 ipilimumab 군의 중앙값 OS는 16.9개월, 화학 요법 군은 8.8개월이었습니다.
14.6 진행성 신세포 암
1차 신세포 암
CHECKMATE-214
CHECKMATE-214(NCT02231749)는 이전에 치료받지 않은 진행성 RCC 환자를 대상으로 한 무작위 배정(1:1), 공개 라벨 시험이었습니다. 환자는 PD-L1 상태와 관계없이 포함되었습니다. CHECKMATE-214는 뇌 전이, 활동성 자가 면역 질환 또는 전신 면역 억제가 필요한 의학적 상태의 병력이 있거나 현재 앓고 있는 환자를 제외했습니다. 환자는 국제 전이성 RCC 데이터베이스 컨소시엄(IMDC) 예후 점수 및 지역별로 계층화되었습니다.
IMDC 기준에 따라 6가지 예후 위험 요소 중 하나 이상(최초 신세포 암 진단부터 무작위 배정까지 1년 미만, Karnofsky 수행 상태 <80%, 헤모글로빈 정상 하한치 미만, 교정 칼슘 >10mg/dL, 혈소판 수 정상 상한치 초과, 절대 호중구 수 정상 상한치 초과)을 가진 중간/불량 위험 환자에서 효능을 평가했습니다.
환자는 3주마다 4회 OPDIVO 3mg/kg 및 ipilimumab 1mg/kg을 정맥 내로 투여받은 후 2주마다 OPDIVO 3mg/kg을 정맥 내로 투여받는 군(n=425) 또는 6주 주기의 처음 4주 동안 매일 경구로 sunitinib 50mg을 투여받는 군(n=422)에 무작위로 배정되었습니다. 질병 진행이나 허용할 수 없는 독성이 나타날 때까지 치료를 계속했습니다.
시험 모집단 특성은 다음과 같습니다. 중앙값 연령은 61세(범위: 21~85세)였으며, 38%는 65세 이상, 8%는 75세 이상이었습니다. 대부분의 환자는 남성(73%) 및 백인(87%)이었으며, 기준 KPS가 70%~80%인 환자는 26%, 90%~100%인 환자는 74%였습니다.
주요 효능 결과 측정치는 중간/불량 위험 환자에서의 OS, PFS(독립 영상 검토 위원회[IRRC] 평가) 및 확진된 ORR(IRRC 평가)이었습니다. 이 모집단에서 시험 결과 sunitinib에 비해 OPDIVO 및 ipilimumab에 무작위 배정된 환자에서 OS 및 ORR가 통계적으로 유의미하게 개선된 것으로 나타났습니다(표 62 및 그림 14). PD-L1 발현 수준과 관계없이 OS 이점이 관찰되었습니다. 이 시험에서 PFS의 통계적으로 유의미한 개선은 나타나지 않았습니다. 효능 결과는 표 62 및 그림 14에 나와 있습니다.
| a 도달하지 않음 b 계층화된 비례 위험 모델을 기반으로 함. c 계층화된 로그 순위 검정을 기반으로 함. d 통계적 유의성을 달성하기 위해 p-값을 알파 0.002와 비교함. e 계층화된 DerSimonian-Laird 검정을 기반으로 함. f 통계적 유의성을 달성하기 위해 p-값을 알파 0.001과 비교함. g 알파 수준 0.009에서 유의하지 않음. |
||
|
중간/불량 위험 |
||
|
OPDIVO 및 Ipilimumab |
Sunitinib |
|
|
전체 생존율 |
||
|
사망 (%) |
140 (32.9) |
188 (44.5) |
|
중앙값 생존 기간(개월) |
NRa |
25.9 |
|
위험 비율(99.8% CI)b |
0.63 (0.44, 0.89) |
|
|
p-값c,d |
<0.0001 |
|
|
확진된 전체 반응률(95% CI) |
41.6% (36.9, 46.5) |
26.5% (22.4, 31.0) |
|
p-값e,f |
<0.0001 |
|
|
완전 반응(CR) |
40 (9.4) |
5 (1.2) |
|
부분 반응(PR) |
137 (32.2) |
107 (25.4) |
|
반응 지속 기간 중앙값(개월)(95% CI) |
NRa (21.8, NRa) |
18.2 (14.8, NRa) |
|
무진행 생존 |
||
|
질병 진행 또는 사망 (%) |
228 (53.6) |
228 (54.0) |
|
중앙값(개월) |
11.6 |
8.4 |
|
위험 비율(99.1% CI)a |
0.82 (0.64, 1.05) |
|
|
p-값c |
NSg |
|
그림 14: 전체 생존 기간(중간/불량 위험군) – CHECKMATE-214
CHECKMATE-214는 또한 IMDC 기준에 따라 249명의 예후 양호 위험 환자를 OPDIVO 및 ipilimumab(n=125) 또는 sunitinib(n=124)으로 무작위 배정했습니다. 이러한 환자는 유효성 분석 모집단의 일부로 평가되지 않았습니다. OPDIVO 및 ipilimumab를 투여받은 예후 양호 위험 환자의 OS를 sunitinib와 비교한 결과 위험 비율은 1.45(95% CI: 0.75, 2.81)였습니다. 이전에 치료받지 않은 예후 양호 위험을 가진 신세포암종에서 OPDIVO 및 ipilimumab의 유효성은 확립되지 않았습니다.
CHECKMATE-9ER
CHECKMATE-9ER(NCT03141177)는 이전에 치료받지 않은 진행성 RCC 환자를 대상으로 OPDIVO와 cabozantinib 병용 요법을 sunitinib와 비교한 무작위 배정, 공개 라벨 연구였습니다. CHECKMATE-9ER는 자가면역 질환이나 전신 면역억제가 필요한 기타 질환이 있는 환자를 제외했습니다. 환자는 IMDC 예후 점수(양호 vs. 중간 vs. 불량), PD-L1 종양 발현(≥1% vs. <1% 또는 불확정) 및 지역(미국/캐나다/서유럽/북유럽 vs. 기타 지역)에 따라 계층화되었습니다.
환자는 2주마다 OPDIVO 240mg을 정맥 내 투여하고 매일 경구로 cabozantinib 40mg을 투여받거나(n=323), 6주 주기의 처음 4주 동안 매일 경구로 sunitinib 50mg을 투여받았습니다(4주 치료 후 2주 휴약)(n=328). RECIST v1.1에 따른 질병 진행 또는 허용할 수 없는 독성이 나타날 때까지 치료를 계속했습니다. 환자가 임상적으로 안정적이고 연구자에 의해 임상적 이점을 얻는 것으로 간주되는 경우 RECIST로 정의된 질병 진행 이후에도 치료가 허용되었습니다. 종양 평가는 기준 시점, 12주차 무작위 배정 후, 그 후 60주차까지 6주마다, 그 이후에는 12주마다 수행했습니다.
시험 모집단의 특징은 다음과 같습니다. 중앙값 연령 61세(범위: 28~90세), 38%는 65세 이상, 10%는 75세 이상이었습니다. 대부분의 환자는 남성(74%) 및 백인(82%)이었고, 23% 및 77%의 환자는 기준 시점에서 KPS가 각각 70%~80% 및 90%~100%였습니다. IMDC 위험 범주별 환자 분포는 양호 22%, 중간 58%, 불량 20%였습니다.
주요 유효성 결과 측정값은 PFS(BICR 평가)였습니다. 추가 유효성 결과 측정값은 OS 및 ORR(BICR 평가)이었습니다. 이 시험은 sunitinib와 비교하여 OPDIVO 및 cabozantinib로 무작위 배정된 환자에서 PFS, OS 및 ORR가 통계적으로 유의미하게 개선되었음을 입증했습니다. IMDC 위험 범주 및 PD-L1 종양 발현 상태의 사전 지정된 하위 그룹에서 PFS에 대한 일관된 결과가 관찰되었습니다. OS의 사전 계획된 최종 분석을 위해 사전 지정된 사망자 수에 따라 271명의 사망이 관찰되었을 때 업데이트된 OS 분석이 수행되었습니다. 유효성 결과는 표 63 및 그림 15 및 16에 나와 있습니다.
| a Kaplan-Meier 추정치 기준. b 계층화된 Cox 비례 위험 모델. c 계층화된 로그 순위 검정 기준 d 계층화된 로그 순위 검정의 양측 p-값. e 도달하지 않음 f p-값은 이 중간 분석에 대해 할당된 알파 0.0111과 비교됩니다. g Clopper-Pearson 방법을 기반으로 한 CI. h Cochran-Mantel-Haenszel 검정의 양측 p-값. |
||
|
OPDIVO 및 Cabozantinib |
Sunitinib |
|
|
무진행 생존 기간 |
||
|
질병 진행 또는 사망 (%) |
144 (45) |
191 (58) |
|
중앙값 PFS(개월)a (95% CI) |
16.6 (12.5, 24.9) |
8.3 (7.0, 9.7) |
|
위험 비율 (95% CI)b |
0.51 (0.41, 0.64) |
|
|
p-값c,d |
<0.0001 |
|
|
전체 생존 기간 |
||
|
사망 (%) |
67 (21) |
99 (30) |
|
중앙값 OS(개월)a (95% CI) |
NRe |
NR (22.6, NRe) |
|
위험 비율 (98.89% CI)b |
0.60 (0.40, 0.89) |
|
|
p-값c,d,f |
0.0010 |
|
|
업데이트된 전체 생존 기간 |
||
|
사망 (%) |
121 (37) |
150 (46) |
|
Median OS (months)a (95% CI) |
37.7 (35.5, NR) |
34.3 (29.0, NR) |
|
Hazard ratio (95% CI)b |
0.70 (0.55, 0.90) |
|
|
확증된 객관적 반응률(95% CI)g |
55.7% (50.1, 61.2) |
27.1% (22.4, 32.3) |
|
p-값h |
<0.0001 |
|
|
완전 반응 |
26 (8%) |
15 (4.6%) |
|
부분 반응 |
154 (48%) |
74 (23%) |
|
반응 지속 기간 중앙값(월)(95% CI)a |
20.2 (17.3, NRe) |
11.5 (8.3, 18.4) |
그림 15: 무진행 생존 기간 – CHECKMATE-9ER
그림 16: 업데이트된 전체 생존 기간 – CHECKMATE-9ER
탐색적 분석에서 IMDC 위험도가 양호, 중간, 중간/불량 및 불량으로 분류된 환자에 대한 OS의 업데이트된 분석에서 HR(95% CI)은 각각 1.03(0.55, 1.92), 0.74(0.54, 1.01), 0.65(0.50, 0.85) 및 0.49(0.31, 0.79)였습니다.
이전에 치료받은 신세포암
CHECKMATE-025
CHECKMATE-025(NCT01668784)는 이전에 1~2회의 항혈관 생성 요법을 받는 동안 또는 후에 질병이 진행된 진행성 RCC 환자를 대상으로 한 무작위 배정(1:1), 공개 라벨 시험이었습니다. 환자의 Karnofsky 수행 상태(KPS)는 ≥70%여야 했으며 PD-L1 상태와 관계없이 환자가 포함되었습니다. 뇌 전이, 이전 mTOR 억제제 치료, 활동성 자가면역 질환 또는 전신 면역억제가 필요한 질환의 병력이 있는 환자는 제외되었습니다. 환자는 지역, Memorial Sloan Kettering Cancer Center(MSKCC) 위험 그룹 및 이전 항혈관 생성 요법 횟수에 따라 계층화되었습니다. 환자는 무작위로 OPDIVO 3mg/kg을 2주마다 정맥 주입(n=410) 또는 에베롤리무스 10mg을 매일 경구 투여(n=411)받았습니다. 첫 번째 종양 평가는 무작위 배정 후 8주 후에 실시되었으며 그 이후 첫해에는 8주마다, 그 후에는 질병 진행 또는 치료 중단 시까지 12주마다 계속되었습니다. 주요 효능 결과 측정값은 전체 생존 기간(OS)이었습니다.
시험 모집단 특성은 다음과 같습니다. 평균 연령은 62세(범위: 18~88세)였으며 40%는 65세 이상, 9%는 75세 이상이었습니다. 대부분의 환자는 남성(75%) 및 백인(88%)이었으며, 환자의 34% 및 66%는 기준 KPS가 각각 70~80% 및 90~100%였습니다. 대부분의 환자(77%)는 이전에 1회의 항혈관 생성 요법을 받았습니다. MSKCC 위험 그룹별 환자 분포는 양호 34%, 중간 47%, 불량 19%였습니다.
이 시험에서는 최종 분석을 위해 계획된 사건 수의 70%인 398개의 사건이 관찰되었을 때 사전 지정된 중간 분석에서 에베롤리무스와 비교하여 OPDIVO에 무작위 배정된 환자의 OS가 통계적으로 유의미하게 개선된 것으로 나타났습니다. PD-L1 발현 수준과 관계없이 OS 이점이 관찰되었습니다. 효능 결과는 표 64 및 그림 17에 나와 있습니다.
| a 도달하지 않음 b 계층화된 비례 위험 모델을 기반으로 함. c 계층화된 로그 순위 검정을 기반으로 함. d p-값은 이 중간 분석에 할당된 알파 0.0148과 비교됨. |
||
|
OPDIVO |
에베롤리무스 |
|
|
전체 생존 기간 |
||
|
사망 (%) |
183 (45) |
215 (52) |
|
평균 생존 기간(개월)(95% CI) |
25.0 (21.7, NRa) |
19.6 (17.6, 23.1) |
|
위험 비율(95% CI)b |
0.73 (0.60, 0.89) |
|
|
p-값c,d |
0.0018 |
|
|
확인된 전체 반응률(95% CI) |
21.5% (17.6, 25.8) |
3.9% (2.2, 6.2) |
|
평균 반응 지속 기간(개월)(95% CI) |
23.0 (12.0, NRa) |
13.7 (8.3, 21.9) |
|
확인된 반응이 나타날 때까지의 평균 시간(개월)(최소, 최대) |
3.0 (1.4, 13.0) |
3.7 (1.5, 11.2) |
그림 17: 전체 생존 기간 – CHECKMATE-025
14.7 전형적 호지킨 림프종
자가 조혈모세포 이식(HSCT) 실패 후 성인 cHL 환자에서 단일 제제로서 OPDIVO의 효능을 평가한 연구는 두 가지였습니다.
CHECKMATE-205(NCT02181738)은 cHL 환자를 대상으로 한 단일군, 공개 라벨, 다기관, 다중 코호트 임상시험이었습니다. CHECKMATE-039(NCT01592370)은 cHL을 포함한 공개 라벨, 다기관 용량 증량 임상시험이었습니다. 두 연구 모두 종양 PD-L1 상태와 관계없이 환자를 포함했으며 ECOG 수행 상태가 2 이상, 자가면역 질환, 증상이 있는 간질성 폐 질환, 간 트랜스아미나제가 ULN의 3배 이상, 크레아티닌 클리어런스 <40mL/min, 이전 동종 HSCT 또는 24주 이내 흉부 방사선 치료를 받은 환자는 제외했습니다. 또한 두 연구 모두 이전에 폐 독성이 있는 환자의 경우 일산화탄소에 대한 폐의 조정된 확산 용량(DLCO)이 60% 이상이어야 했습니다.
환자들은 질병 진행, 최대 임상적 효과 또는 허용 불가능한 독성이 나타날 때까지 2주마다 OPDIVO 3mg/kg을 정맥 주입받았습니다. 1회 투여가 1주기였습니다. 용량 감량은 허용되지 않았습니다.
IRRC에서 결정한 대로 ORR에 의해 효능을 평가했습니다. 추가적인 결과 측정에는 반응 기간(DOR)이 포함되었습니다.
자가 조혈모세포 이식 실패 및 이식 후 브렌툭시맙 베도틴을 투여받은 CHECKMATE-205 및 CHECKMATE-039에 참여한 95명의 환자에서 효능을 평가했습니다. 평균 연령은 37세(범위: 18~72세)였습니다. 대다수는 남성(64%) 및 백인(87%)이었습니다. 환자들은 이전에 평균 5회의 전신 요법(범위: 2~15회)을 받았습니다. 이들은 평균 27회의 OPDIVO(범위: 3~48회)를 투여받았으며, 치료 기간 중앙값은 14개월(범위: 1~23개월)이었습니다. 효능 결과는 표 65에 나와 있습니다.
| a 2007년 개정된 국제 워킹 그룹 기준에 따름. b 카플란-마이어 추정치. 반응을 보인 환자 중 DOR에 대한 추적 관찰 기간 중앙값(첫 번째 반응 날짜부터 측정)은 9.9개월이었습니다. c + 기호는 중단된 값을 나타냅니다. d 도달하지 않음 |
|
|
CHECKMATE-205 및 CHECKMATE-039 |
|
|
전체 반응률, n (%)a |
63 (66%) |
|
완전 관해율 |
6 (6%) |
|
부분 관해율 |
57 (60%) |
|
반응 기간(개월) |
|
|
반응까지의 시간(개월) |
|
CHECKMATE-205 및 CHECKMATE-039 병합 임상시험에 참여한 환자 258명을 대상으로 자가 조혈모세포 이식(HSCT) 후 재발했거나 진행성 cHL이 나타난 경우에 대한 유효성도 평가했습니다. 분석에는 위에서 설명한 그룹이 포함되었습니다. 평균 연령은 34세(범위: 18~72세)였습니다. 대다수가 남성(59%)이었고 백인(86%)이었습니다. 환자들은 평균 4회(범위: 2~15회)의 이전 전신 요법을 받았으며, 85%는 3회 이상의 이전 전신 요법을 받았고 76%는 이전에 브렌툭시맙 베도틴 치료를 받았습니다. 이전에 브렌툭시맙 베도틴 치료를 받은 195명의 환자 중 17%는 자가 조혈모세포 이식 전에만, 78%는 조혈모세포 이식 후에만, 5%는 조혈모세포 이식 전후에 모두 치료를 받았습니다. 환자들은 평균 21회(범위: 1~48회)의 OPDIVO를 투여받았으며, 치료 기간 중앙값은 10개월(범위: 0~23개월)이었습니다. 유효성 결과는 표 66에 나와 있습니다.
| a Kaplan-Meier 추정. 반응을 보인 환자 중 DOR에 대한 추적 관찰 기간 중앙값(첫 번째 반응 날짜부터 측정)은 6.7개월이었습니다. b PR 기간 중앙값 추정치는 13.1개월(95% CI, 9.5, NE)이었습니다. CR 기간 중앙값에 도달하지 못했습니다. c 도달하지 못함 |
|
|
CHECKMATE-205 및 CHECKMATE-039 |
|
|
전체 반응률, n (%) |
179 (69%) |
|
완전 관해율 |
37 (14%) |
|
부분 관해율 |
142 (55%) |
|
반응 기간(개월) |
|
|
반응까지의 시간(개월) |
|
14.8 재발성 또는 전이성 두경부 편평 세포 암종
CHECKMATE-141(NCT02105636)은 보조, 선행 보조, 일차(절제 불가능한 국소 진행성) 또는 전이성 환경에서 백금 기반 요법을 받는 동안 또는 받은 후 6개월 이내에 질병이 진행된 전이성 또는 재발성 SCCHN 환자를 등록한 무작위 배정(2:1), 활성 대조군, 공개 라벨 시험이었습니다. 이 시험은 자가 면역 질환, 면역 억제가 필요한 의학적 상태, 재발성 또는 전이성 비인두암, 원발 부위를 알 수 없는 편평 세포 암종, 타액선 또는 비편평 조직학(예: 점막 흑색종) 또는 치료받지 않은 뇌 전이가 있는 환자를 제외했습니다. 치료받은 뇌 전이가 있는 환자는 신경학적으로 안정적인 경우 참여할 수 있었습니다. 환자는 무작위로 OPDIVO 3mg/kg을 2주마다 정맥 주입받거나, 연구자 선택에 따라 세툭시맙(400mg/m2을 정맥 내로 초기 용량 투여한 후 250mg/m2을 매주 투여) 또는 메토트렉세이트(40~60mg/m2을 매주 정맥 내로 투여) 또는 도세탁셀(30~40mg/m2을 매주 정맥 내로 투여)을 받았습니다.
무작위 배정은 이전 세툭시맙 치료 여부(예/아니오)에 따라 층화되었습니다. 첫 번째 종양 평가는 무작위 배정 후 9주차에 실시되었고 이후 6주마다 계속되었습니다. 주요 유효성 결과 측정값은 OS였습니다. 추가 유효성 결과 측정값은 PFS 및 ORR이었습니다.
총 361명의 환자가 무작위 배정되었으며, 240명은 OPDIVO군에, 121명은 연구자 선택군(도세탁셀: 45%, 메토트렉세이트: 43%, 세툭시맙: 12%)에 배정되었습니다. 시험 모집단 특성은 다음과 같습니다. 평균 연령은 60세(범위: 28~83세)였으며, 31%는 65세 이상이었고, 83%는 백인, 12%는 아시아인, 4%는 흑인이었으며, 83%는 남성이었습니다. 기준 ECOG 수행 상태는 0(20%) 또는 1(78%)이었고, 76%는 과거/현재 흡연자였으며, 90%는 4기 질환이 있었고, 45%의 환자는 이전에 한 가지 전신 요법만 받았고, 나머지 55%는 두 가지 이상의 전신 요법을 받았으며, 25%는 HPVp16 양성 종양, 24%는 HPV p16 음성 종양, 51%는 상태를 알 수 없었습니다.
이 시험은 사전 지정된 중간 분석(최종 분석을 위해 계획된 사례 수의 78%)에서 연구자 선택에 비해 OPDIVO에 무작위 배정된 환자의 OS가 통계적으로 유의미하게 개선되었음을 입증했습니다. PFS(HR=0.89, 95% CI: 0.70, 1.13) 또는 ORR(니볼루맙의 경우 13.3%[95% CI: 9.3, 18.3], 연구자 선택의 경우 5.8%[95% CI: 2.4, 11.6])에 대해서는 두 군 간에 통계적으로 유의미한 차이가 없었습니다. 유효성 결과는 표 67과 그림 18에 나와 있습니다.
| OPDIVO (n=240) |
세툭시맙, 메토트렉세이트 또는 도세탁셀 (n=121) |
|
|---|---|---|
| a 층화 비례 위험 모델을 기반으로 함. b 층화 로그 순위 검정을 기반으로 함. c p-값은 이 중간 분석에 대해 할당된 알파 0.0227과 비교함. |
||
| 전체 생존율 | ||
| 사망 (%) | 133 (55%) | 85 (70%) |
| 중앙값(개월) (95% CI) |
7.5 (5.5, 9.1) |
5.1 (4.0, 6.0) |
| 위험 비율 (95% CI)a | 0.70 (0.53, 0.92) | |
| p-값b,c | 0.0101 | |
그림 18: 전체 생존율 – CHECKMATE-141
보관된 종양 검체를 PD-L1 IHC 28-8 pharmDx 분석을 사용하여 PD-L1 발현에 대해 회고적으로 평가했습니다. 전체 시험 집단에서 환자의 28%(101/361)가 정량화할 수 없는 결과를 보였습니다. 정량화할 수 있는 결과를 보인 260명의 환자 중 43%(111/260)는 PD-L1 음성 SCCHN(PD-L1을 발현하는 종양 세포가 1% 미만으로 정의됨)을, 57%(149/260)는 PD-L1 양성 SCCHN(PD-L1을 발현하는 종양 세포가 1% 이상으로 정의됨)을 보였습니다. 사전 지정된 탐색적 하위군 분석에서 생존에 대한 위험 비율은 0.89(95% CI: 0.54, 1.45)였으며 PD-L1 음성 하위군에서 니볼루맙군과 화학 요법군의 중앙값 생존 기간은 각각 5.7개월과 5.8개월이었습니다. PD-L1 양성 SCCHN 하위군에서 생존에 대한 HR은 0.55(95% CI: 0.36, 0.83)였으며 니볼루맙군과 화학 요법군의 중앙값 생존 기간은 각각 8.7개월과 4.6개월이었습니다.
14.9 요로상피암
재발 위험이 높은 UC의 보조 요법
CHECKMATE-274(NCT02632409)는 재발 위험이 높은 방광 또는 상부 요로(신우 또는 요관) UC의 근치적 절제술(R0)을 받은 지 120일 이내인 환자를 대상으로 보조 OPDIVO를 투여한 무작위 배정, 이중맹검, 위약 대조 연구였습니다. 재발 위험이 높은 경우는 1) 신보조 시스플라틴을 투여받은 환자의 경우 ypT2-ypT4a 또는 ypN+ 또는 2) 신보조 시스플라틴을 투여받지 않았고 보조 시스플라틴을 투여받을 자격이 없거나 거부한 환자의 경우 pT3-pT4a 또는 pN+으로 정의했습니다. 환자들은 최대 1년 동안 재발하거나 허용할 수 없는 독성이 나타날 때까지 2주마다 OPDIVO 240mg 또는 위약을 정맥 주입받도록 1:1로 무작위 배정되었습니다. 환자들은 병리학적 림프절 상태(N+ 대 N0/x, 제거된 림프절 10개 미만 대 N0, 제거된 림프절 10개 이상), PD-L1을 발현하는 종양 세포(PD-L1 IHC 28-8 pharmDx 분석을 사용하여 중앙 실험실에서 결정한 바와 같이 ≥1% 대 <1%/판단 불가) 및 신보조 시스플라틴 사용(예 대 아니오)을 기준으로 계층화되었습니다.
시험 모집단의 특징은 다음과 같습니다. 중앙값 연령 67세(범위: 30~92세), 남성 76%, 백인 76%, 아시아인 22%, 흑인 0.7%, 아메리카 인디언 또는 알래스카 원주민 0.1%. 림프절 양성 UC 환자 335명(47%) 중 44명(6%)은 근육 비침습성(<pT2) 원발성 종양을 가지고 있었습니다. ECOG 수행 상태는 0(63%), 1(35%) 또는 2(2%)였습니다. 환자의 43%가 이전에 신보조 시스플라틴을 투여받았습니다. 이전에 신보조 시스플라틴을 투여받지 않은 57%의 경우 그 이유는 부적격(22%), 환자 선호도(33%), 기타/보고되지 않음(2%)이었습니다. 환자의 40%에서 종양 PD-L1 발현이 ≥1%였으며, 환자의 21%는 상부 요로 UC였습니다.
주요 효능 결과 측정값은 모든 무작위 배정 환자와 PD-L1 ≥1%를 발현하는 종양이 있는 환자에서 연구자가 평가한 DFS였습니다. DFS는 첫 번째 재발(국소 요로, 국소 비요로 또는 원격 전이) 또는 사망까지의 시간으로 정의되었습니다. 추가 효능 결과 측정값에는 OS가 포함되었습니다.
사전 지정된 중간 분석에서 CHECKMATE-274는 표 68과 그림 19에 표시된 바와 같이 모든 무작위 배정 환자 모집단과 PD-L1 ≥1%의 하위 모집단에서 OPDIVO에 무작위 배정된 환자의 DFS가 위약에 비해 통계적으로 유의미하게 개선되었음을 입증했습니다.
상부 요로 UC 환자(n=149)에 대한 탐색적 하위군 분석에서 니볼루맙군은 위약군에 비해 DFS가 개선되지 않았습니다. 층화되지 않은 DFS 위험 비율 추정치는 1.15(95% CI: 0.74, 1.80)였습니다.
PD-L1 발현이 <1%인 환자(n=414)에 대한 탐색적 하위군 분석에서 층화되지 않은 DFS 위험 비율 추정치는 0.83(95% CI: 0.64, 1.08)였습니다.
OS 데이터는 전체 무작위 배정 모집단에서 사망자의 33%가 발생하여 아직 성숙하지 않았습니다. UTUC 하위 모집단에서는 37명이 사망했습니다(니볼루맙군 20명, 위약군 17명).
| N.R. 도달하지 않음, N.E. 추정 불가 a 기준 이벤트(프로토콜 편차)의 질병 포함: OPDIVO군 n=1 및 위약군 n=3. b Kaplan-Meier 추정치를 기반으로 함. c 이전 신보조 시스플라틴, 병리학적 림프절 상태, PD-L1 상태(≥1% 대 <1%/판단 불가)로 층화된 Cox 비례 위험 모델. 위험 비율은 위약 대비 OPDIVO임. d 이전 신보조 시스플라틴, 병리학적 림프절 상태, PD-L1 상태(≥1% 대 <1%/판단 불가)로 층화된 로그 순위 검정. 모든 무작위 배정 환자에서 통계적 유의성의 경계: p-값 <0.01784. e 이전 신보조 시스플라틴, 병리학적 림프절 상태로 층화된 로그 순위 검정. PD-L1 ≥1%인 모든 무작위 배정 환자에서 통계적 유의성의 경계: p-값 <0.01282. |
||||
|
모든 무작위 배정 환자 |
PD-L1 ≥1% |
|||
|
OPDIVO |
위약 |
OPDIVO |
위약 |
|
|
무병 생존율 |
||||
|
이상 사례a, n (%) |
170 (48) |
204 (57) |
55 (39) |
81 (57) |
|
중앙값 DFS(개월)b |
20.8 |
10.8 |
N.R. |
8.4 |
|
위험 비c |
0.70 |
0.55 |
||
|
p-값 |
0.0008d |
0.0005e |
||
그림 19: 모든 무작위 배정 환자의 무병 생존율 – CHECKMATE-274
절제 불가능 또는 전이성 UC의 1차 치료
CHECKMATE-901(NCT 03036098)은 이전에 치료받지 않은 절제 불가능 또는 전이성 UC 환자를 대상으로 한 무작위 배정, 공표 연구였습니다. 이전의 수술 전 또는 보조 화학 요법은 치료 완료 후 ≥12개월 동안 질병 재발이 발생한 경우 허용되었습니다. 시스플라틴에 적합하지 않은 환자와 활동성 CNS 전이가 있는 환자는 제외되었습니다. 무작위 배정을 위한 층화 요인은 PD-L1 상태(≥1% 대 <1% 또는 확인 불가) 및 간 전이였습니다. 환자는 다음 중 하나를 받도록 1:1로 무작위 배정되었습니다.
- •
- OPDIVO 360mg 및 시스플라틴 70mg/m2를 1일차에 투여하고 겜시타빈 1000mg/m2를 21일 주기의 1일차와 8일차에 최대 6주기 동안 투여한 후 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 4주마다 단일 제제 OPDIVO 480mg을 투여했습니다. 질병 진행이나 허용 불가능한 독성이 없는 경우, OPDIVO는 첫 번째 용량부터 최대 2년 동안 계속되었습니다.
- •
- 질병 진행 또는 허용 불가능한 독성이 나타날 때까지 21일 주기의 1일차에 시스플라틴 70mg/m2를 투여하고 1일차와 8일차에 겜시타빈 1000mg/m2를 최대 6주기 동안 투여했습니다.
주요 효능 결과 측정값은 RECIST v1.1을 사용하는 BICR에서 평가한 OS 및 PFS였습니다. 추가 효능 결과 측정값에는 BICR에서 평가한 ORR이 포함되었습니다.
평균 연령은 65세(범위: 32~86세)였으며, 환자의 51%는 65세 이상이었고 12%는 75세 이상이었으며, 23%는 아시아인, 72%는 백인, 0.3%는 흑인, 0.3%는 아메리카 인디언 또는 알래스카 원주민, 4.9%는 기타, 12%는 히스패닉 또는 라틴계였으며, 77%는 남성이었습니다. 기준 ECOG 수행 상태는 0(53%) 또는 1(46%)이었습니다. 기준선에서 환자의 87%는 전이성 UC를 앓고 있었고, 이 중 20%는 간 전이, 11%는 국소 진행성 UC, 51%는 UC 조직학적 변이형을 앓고 있었습니다. OPDIVO 병용 시스플라틴 기반 화학 요법군의 49명(16%)과 시스플라틴 기반 화학 요법군의 43명(14%)은 최소 1주기의 시스플라틴 투여 후 시스플라틴에서 카보플라틴으로 전환했습니다.
효능 결과는 표 69 및 그림 20과 21에 나와 있습니다.
| a Kaplan-Meier 추정치 기준 | ||
| b 층화 Cox 비례 위험 모델. | ||
| c 층화 로그 순위 검정의 양측 p 값. | ||
| d BICR에서 평가함. | ||
|
OPDIVO 및 시스플라틴 및 겜시타빈 |
시스플라틴 및 겜시타빈(n=304) |
|
|
전체 생존 기간(OS) |
||
|
이벤트, n (%) |
172 (56.6) |
193 (63.5) |
|
중앙값(개월) |
21.7 |
18.9 |
|
위험 비율(95% CI)b |
0.78 |
|
|
p-값c |
0.0171 |
|
|
무진행 생존 기간(PFS)d |
||
|
이벤트, n (%) |
211 (69.4) |
191 (62.8) |
|
중앙값(개월) |
7.9 |
7.6 |
|
위험 비율(95% CI)b |
0.72 |
|
|
p-값c |
0.0012 |
|
|
객관적 반응률(ORR)d |
||
|
반응률, n (%) (95% CI) |
175 (57.6%) (51.8, 63.2) |
131 (43.1%) (37.5, 48.9) |
|
완전 반응률, n (%) |
66 (22%) |
36 (12%) |
|
부분 반응률, n (%) |
109 (36%) |
95 (31%) |
|
반응 지속 기간(DoR) |
||
|
중앙값(개월) |
9.5 |
7.3 |
그림 20: 전체 생존율 – CHECKMATE-901
그림 21: 무진행 생존율 – CHECKMATE-901
이전에 치료받은 적이 있는 진 avanzado 또는 전이성 UC
CHECKMATE-275(NCT02387996)는 백금 기반 화학 요법을 받는 동안 또는 이후에 질병이 진행되었거나 백금 함유 수술 전 또는 보조 화학 요법 요법으로 치료받은 후 12개월 이내에 질병이 진행된 국소 진행성 또는 전이성 UC 환자 270명을 대상으로 한 단일군 임상시험이었습니다. 활동성 뇌 또는 수막 전이, 활동성 자가면역 질환, 전신 면역억제가 필요한 의학적 상태 및 ECOG 수행 상태 >1인 환자는 제외되었습니다. 환자들은 허용할 수 없는 독성 또는 방사선학적 또는 임상적 진 진행이 나타날 때까지 2주마다 OPDIVO 3mg/kg을 정맥 주사로 투여받았습니다. 종양 반응 평가는 처음 48주 동안은 8주마다, 그 이후에는 12주마다 실시되었습니다. 주요 효능 결과 측정에는 RECIST v1.1을 사용하여 IRRC에서 평가한 확증된 ORR 및 DOR이 포함되었습니다.
평균 연령은 66세(범위: 38~90세)였고, 78%는 남성이었고, 86%는 백인이었습니다. 27%는 방광 외 요로상피암이었고 84%는 내장 전이가 있었습니다. 환자의 34%는 이전 백금 기반 수술 전 또는 보조 요법 후 질병이 진행되었습니다. 환자의 29%는 전이성 환경에서 ≥2회의 이전 전신 요법을 받았습니다. 환자의 36%는 이전에 시스플라틴만 투여받았고, 23%는 이전에 카보플라틴만 투여받았고, 7%는 전이성 환경에서 시스플라틴과 카보플라틴을 모두 투여받았습니다. 환자의 46%는 ECOG 수행 상태가 1이었습니다. 환자의 18%는 헤모글로빈이 <10g/dL였고, 환자의 28%는 기준 시점에 간 전이가 있었습니다. 환자들은 PD-L1 상태와 관계없이 포함되었습니다.
종양 검체는 중앙 실험실에서 PD-L1 IHC 28-8 pharmDx 분석을 사용하여 전향적으로 평가했으며, 그 결과는 사전 지정된 분석을 위한 하위 그룹을 정의하는 데 사용되었습니다. 270명의 환자 중 46%는 PD-L1 발현이 ≥1%(종양 세포의 ≥1%가 PD-L1을 발현하는 것으로 정의됨)인 것으로 정의되었습니다. 나머지 54%의 환자는 PD-L1 발현이 <1%(종양 세포의 <1%가 PD-L1을 발현하는 것으로 정의됨)인 것으로 분류되었습니다. 모든 환자와 두 PD-L1 하위 그룹의 확증된 ORR은 표 70에 나와 있습니다. 반응까지의 중앙값은 1.9개월(범위: 1.6~7.2)이었습니다. 수술 전 또는 보조 환경에서만 이전 전신 요법을 받은 77명의 환자에서 ORR은 23.4%(95% CI: 14.5%, 34.4%)였습니다.
| a 카플란-마이어 곡선에서 추정 b 도달하지 않음 |
|||
|
모든 환자 |
PD-L1 <1% |
PD-L1 ≥1% |
|
|
확인된 전체 반응률, n (%) |
53 (19.6%) |
22 (15.1%) |
31 (25.0%) |
|
완전 반응률 |
7 (2.6%) |
1 (0.7%) |
6 (4.8%) |
|
부분 반응률 |
46 (17.0%) |
21 (14.4%) |
25 (20.2%) |
|
반응 지속 기간 중앙값a (개월) (범위) |
10.3 (1.9+, 12.0+) |
7.6 (3.7, 12.0+) |
NRb (1.9+, 12.0+) |
14.10 현미부수체 불안정성이 높거나 불일치 복구 결함이 있는 전이성 대장암
CHECKMATE-142(NCT02060188)는 국소적으로 dMMR 또는 MSI-H 전이성 CRC(mCRC)로 진단되었고 이전에 플루오로피리미딘, 옥살리플라틴 또는 이리노테칸 기반 화학요법으로 치료하는 동안 또는 치료 후 질병이 진행된 환자를 대상으로 실시한 다기관, 비무작위, 다중 병렬 코호트, 공개 라벨 시험이었습니다. 주요 적격 기준은 전이성 질환에 대한 이전 치료를 1회 이상 받았고, ECOG 수행 상태가 0 또는 1이며, 활동성 뇌 전이, 활동성 자가면역 질환 또는 전신 면역억제가 필요한 의학적 질환이 없는 것이었습니다.
단일 약제 OPDIVO MSI-H mCRC 코호트에 등록된 환자는 2주마다 OPDIVO 3mg/kg을 정맥 주입(IV)으로 투여받았습니다. OPDIVO 및 이필리무맙 MSI-H mCRC 코호트에 등록된 환자는 3주마다 OPDIVO 3mg/kg과 이필리무맙 1mg/kg을 4회 정맥 투여받은 후 2주마다 OPDIVO 3mg/kg을 단일 약제로 정맥 주입받았습니다. 두 코호트 모두 허용할 수 없는 독성 또는 방사선학적 진행이 나타날 때까지 치료를 계속했습니다.
종양 평가는 처음 24주 동안에는 6주마다, 그 이후에는 12주마다 실시했습니다. 유효성 결과 측정에는 RECIST v1.1을 사용하여 BICR에서 평가한 ORR 및 DOR이 포함되었습니다.
총 74명의 환자가 단일 약제 MSI-H mCRC OPDIVO 코호트에 등록되었습니다. 연령 중앙값은 53세(범위: 26~79세)였고 23%가 65세 이상, 5%가 75세 이상이었으며, 59%가 남성이었고 88%가 백인이었습니다. 기준 ECOG 수행 상태는 0(43%), 1(55%) 또는 3(1.4%)이었고 36%에서 Lynch 증후군이 보고되었습니다. 74명의 환자 중 72%가 이전에 플루오로피리미딘, 옥살리플라틴 및 이리노테칸으로 치료받았습니다. 각각 7%, 30%, 28%, 19% 및 16%가 전이성 질환에 대해 이전에 0, 1, 2, 3 또는 4회 이상 치료를 받았고, 환자의 42%가 항-EGFR 항체를 투여받았습니다.
총 119명의 환자가 OPDIVO 및 이필리무맙 MSI-H mCRC 코호트에 등록되었습니다. 연령 중앙값은 58세(범위: 21~88세)였고 32%가 65세 이상, 9%가 75세 이상이었으며, 59%가 남성이었고 92%가 백인이었습니다. 기준 ECOG 수행 상태는 0(45%) 및 1(55%)이었고 29%에서 Lynch 증후군이 보고되었습니다. 119명의 환자 중 69%가 이전에 플루오로피리미딘, 옥살리플라틴 및 이리노테칸으로 치료받았습니다. 각각 10%, 40%, 24% 및 15%가 전이성 질환에 대해 이전에 1, 2, 3 또는 4회 이상 치료를 받았고, 29%가 항-EGFR 항체를 투여받았습니다.
이러한 각 단일군 코호트에 대한 유효성 결과는 표 71에 나와 있습니다.
| a OPDIVO로 치료받은 모든 환자(n=74명)의 최소 추적 기간 33.7개월. b OPDIVO 및 이필리무맙으로 치료받은 모든 환자(n=119명)의 최소 추적 기간 27.5개월. c Clopper-Pearson 방법을 사용하여 추정. |
||||
|
OPDIVOa |
OPDIVO 및 이필리무맙b |
|||
|
모든 환자 |
이전 치료 |
모든 환자 |
이전 치료 |
|
|
BICR 기준 전체 반응률; n (%) |
28 (38%) |
17 (32%) |
71 (60%) |
46 (56%) |
|
(95% CI)c |
(27, 50) |
(20, 46) |
(50, 69) |
(45, 67) |
|
완전 반응 (%) |
8 (11%) |
5 (9%) |
17 (14%) |
11 (13%) |
|
부분 반응 (%) |
20 (27%) |
12 (23%) |
54 (45%) |
35 (43%) |
|
반응 지속 기간 |
||||
|
반응 지속 기간이 6개월 이상인 반응자 비율 |
86% |
94% |
89% |
87% |
|
반응 지속 기간이 12개월 이상인 반응자 비율 |
82% |
88% |
77% |
74% |
14.11 간세포암
CHECKMATE-040(NCT01658878)은 sorafenib 치료 중에 병이 진행되었거나 sorafenib을 견딜 수 없었던 간세포암(HCC) 환자를 대상으로 OPDIVO 단독 요법과 ipilimumab 병용 요법의 유fficacy를 평가한 다기관, 다중 코호트, 공개형 시험이었습니다. 다른 적격 기준에는 HCC의 조직학적 확진과 Child-Pugh Class A 간경변이 포함되었습니다. 이 시험은 활동성 자가면역 질환, 뇌 전이, 간성 뇌증 병력, 임상적으로 유의미한 복수, HIV 감염, 또는 B형 간염 바이러스(HBV)와 C형 간염 바이러스(HCV) 또는 HBV와 D형 간염 바이러스(HDV)의 동시 활성 감염이 있는 환자를 제외했지만, 활동성 HBV 또는 HCV 감염만 있는 환자는 적격 대상이었습니다.
종양 평가는 48주 동안 6주마다, 그 이후에는 12주마다 실시했습니다. 주요 유효성 평가 변수는 RECIST v1.1과 HCC에 대한 수정 RECIST(mRECIST)를 사용하여 BICR에서 평가한 확증된 전체 반응률이었습니다. 반응 지속 기간도 평가했습니다.
OPDIVO와 ipilimumab 병용 요법의 유효성은 3주마다 4회 OPDIVO 1mg/kg과 ipilimumab 3mg/kg을 투여받고, 이후 질병 진행이나 허용할 수 없는 독성이 나타날 때까지 2주마다 OPDIVO 240mg을 단독 투여받은 49명의 환자(코호트 4)에서 평가했습니다. 이들의 연령 중앙값은 60세(범위: 18~80세)였고, 88%가 남성이었으며, 74%가 아시아인이었고, 25%는 백인이었습니다. 기준 시점 ECOG 수행 상태는 0(61%) 또는 1(39%)이었습니다. 환자의 57%에게 활동성 HBV 감염이 있었고, 8%에게 활동성 HCV 감염이 있었으며, 35%는 활동성 HBV 또는 HCV 감염의 증거가 없었습니다. HCC의 원인은 16%의 환자에서 알코올성 간 질환이었고, 6%의 환자에서 비알코올성 지방간 질환이었습니다. Child-Pugh 등급 및 점수는 82%의 환자에서 A5였고, 18%의 환자에서 A6였습니다. 80%의 환자에게 간외 전이가 있었고, 35%에게 혈관 침범이 있었으며, 51%에게 400µg/L 이상의 AFP 수치가 나타났습니다. 이전의 암 치료 병력에는 수술(74%), 방사선 요법(29%) 또는 국소 치료(59%)가 포함되었습니다. 모든 환자가 이전에 sorafenib을 투여받았으며, 이 중 10%는 sorafenib을 견딜 수 없었습니다. 29%의 환자는 이전에 2가지 이상의 전신 요법을 받았습니다.
유효성 결과는 표 72에 나와 있습니다. 코호트 4에서 OPDIVO와 ipilimumab 병용 요법에 대한 결과는 최소 28개월의 추적 관찰을 기반으로 합니다.
| a BICR에서 확증됨. b 신뢰 구간은 Clopper 및 Pearson 방법을 기반으로 함. |
|
|
OPDIVO 및 Ipilimumab |
|
|
BICR 기준 전체 반응률,a n (%), RECIST v1.1 |
16 (33%) |
|
(95% CI)b |
(20, 48) |
|
완전 반응 |
4 (8%) |
|
부분 반응 |
12 (24%) |
|
BICR 기준 반응 지속 기간,a RECIST v1.1 |
n=16 |
|
범위(개월) |
4.6, 30.5+ |
|
지속 기간이 6개월 이상인 환자 비율 |
88% |
|
지속 기간이 12개월 이상인 환자 비율 |
56% |
|
지속 기간이 24개월 이상인 환자 비율 |
31% |
|
BICR 기준 전체 반응률,a n (%), mRECIST |
17 (35%) |
|
(95% CI)b |
(22, 50) |
|
완전 반응 |
6 (12%) |
|
부분 반응 |
11 (22%) |
14.12 식도암
절제된 식도암 또는 위식도 접합부암의 보조 요법
CHECKMATE-577(NCT02743494)은 동시 화학방사선 요법(CRT) 후 잔류 병리학적 질환이 있는 완전히 절제된(음성 마진) 식도암 또는 위식도 접합부암 환자 794명을 대상으로 한 무작위 배정, 다기관, 이중맹검 시험이었습니다. 환자들은 무작위로(2:1) 배정되어 16주 동안 2주마다 30분에 걸쳐 OPDIVO 240mg 또는 위약을 정맥 내 주입받았고, 이후 17주차부터 4주마다 30분에 걸쳐 OPDIVO 480mg 또는 위약을 정맥 내 주입받았습니다. 치료는 질병 재발, 허용할 수 없는 독성이 나타나거나 최대 1년 동안 지속되었습니다. 무작위 배정 전 4~16주 이내에 완전 절제를 받은 환자만 등록할 수 있었습니다. 수술 전 CRT를 받지 않았거나, 절제 가능한 IV기 질환, 자가면역 질환 또는 코르티코스테로이드(> 프레드니손 10mg 또는 이에 상응하는 용량, 1일) 또는 기타 면역억제제를 사용한 전신 치료가 필요한 질환이 있는 환자는 시험에서 제외되었습니다. 무작위 배정은 종양 PD-L1 상태(≥1% 대 <1% 또는 판정 불가 또는 평가 불가), 병리학적 림프절 상태(양성 ≥ypN1 대 음성 ypN0) 및 조직학(편평상피세포암 대 선암)에 따라 층화되었습니다. 주요 유효성 평가 변수는 무작위 배정일부터 최초 재발일(원발 절제 부위에서 국소, 국소 진행 또는 원격) 또는 사망일(원인 불문) 중 빠른 날짜까지의 기간으로 정의된 무질병 생존 기간(DFS)이었으며, 이는 후속 항암 치료 전에 연구자가 평가했습니다. 치료를 받은 환자는 2년 동안 12주마다 종양 재발에 대한 영상 검사를 받았고, 3~5년 동안 6~12개월마다 최소 1회 스캔을 받았습니다.
시험 모집단의 특징은 다음과 같습니다. 평균 연령 62세(범위: 26~86세), 36%는 65세 이상, 85%는 남성, 15%는 아시아인, 82%는 백인, 1.1%는 흑인이었습니다. 질병 특징은 초기 진단 시 AJCC 병기 II(35%) 또는 III(65%)의 암종, 초기 진단 시 EC(60%) 또는 GEJC(40%), 연구 등록 시 병리학적 양성 림프절 상태(58%) 및 조직학적으로 확인된 우세한 선암(71%) 또는 편평상피세포암(29%)이었습니다. 기준 종양 PD-L1 상태 ≥1%는 환자의 16%에서 양성이었고 72%에서 음성이었습니다. 기준 ECOG 수행 상태는 0(58%) 또는 1(42%)이었습니다.
CHECKMATE-577은 위약군과 비교하여 OPDIVO군에 무작위 배정된 환자의 DFS가 통계적으로 유의미하게 개선되었음을 입증했습니다. DFS 이점은 종양 PD-L1 발현 및 조직학과 관계없이 관찰되었습니다.
유효성 결과는 표 73과 그림 22에 나와 있습니다.
| a 층화 비례 위험 모델 기준 b 층화 로그 순위 검정 기준 |
||
|
OPDIVO |
위약 |
|
|
무질병 생존 기간 |
||
|
사건 수, n (%) |
241 (45%) |
155 (59%) |
|
중앙값(개월) |
22.4 |
11.0 |
|
위험 비a (95% CI) |
0.69 (0.56, 0.85) |
|
|
p-값b |
0.0003 |
|
그림 22: 무병 생존율 – CHECKMATE-577
절제 불가능한 진행성 또는 전이성 ESCC에 대한 1차 치료
CHECKMATE-648(NCT03143153)은 이전에 치료받지 않은 절제 불가능한 진행성, 재발성 또는 전이성 ESCC(편평 또는 선편평 조직학) 환자를 대상으로 한 무작위 배정, 활성 대조군, 공개 라벨 시험이었습니다. 이 시험에는 종양 세포(TC) PD-L1 발현[PD-L1 종양 비율 점수(TPS)라고도 함]을 평가할 수 있는 종양이 있는 환자가 등록되었으며, 중앙 실험실에서 PD-L1 IHC 28-8 pharmDx 분석을 사용하여 평가했습니다. 무작위 배정에 사용된 PD-L1 염색 종양 검체를 사용하여 환자 종양의 PD-L1 상태에 대한 병합 양성 점수(CPS)를 회고적으로 채점했습니다. 환자는 근치적 의도로 화학 방사선 요법이나 수술을 받을 수 없었습니다. 시험 등록 6개월 이상 전에 완료된 경우 근치적 의도로 사전 치료를 허용했습니다. 이 시험은 증상이 있는 뇌 전이가 있거나, 활동성 자가면역 질환이 있거나, 전신 코르티코스테로이드 또는 면역억제제를 사용했거나, 식도 종양에 인접한 장기로의 종양 침범으로 인해 출혈 또는 누공 위험이 높은 환자는 제외했습니다. 환자는 다음 치료 중 하나를 받도록 무작위 배정되었습니다.
- •
- 1일 및 15일에 OPDIVO 240mg, 1~5일(5일 동안) 동안 1일 1회 플루오로우라실 800mg/m2/일을 정맥 내 투여하고, 1일(4주기 중)에 시스플라틴 80mg/m2을 정맥 내 투여했습니다.
- •
- 2주마다 OPDIVO 3mg/kg을 6주마다 이필리무맙 1mg/kg과 병용 투여했습니다.
- •
- 1~5일(5일 동안) 동안 1일 1회 플루오로우라실 800mg/m2/일을 정맥 내 투여하고, 1일(4주기 중)에 시스플라틴 80mg/m2을 정맥 내 투여했습니다.
환자는 질병 진행, 허용할 수 없는 독성 또는 최대 2년까지 OPDIVO를 투여받았습니다. OPDIVO를 화학 요법과 병용하여 투여받은 환자와 플루오로우라실 및/또는 시스플라틴을 중단한 환자의 경우 치료 요법의 다른 구성 요소를 계속 투여할 수 있었습니다. 이필리무맙으로 인한 이상 반응으로 인해 병용 요법을 중단한 환자는 단일 요법으로 OPDIVO를 계속 투여받을 수 있었습니다.
무작위 배정은 TC PD-L1 발현(≥1% vs. <1% 또는 판정 불가), 지역(동아시아 vs. 아시아 기타 지역 vs. 기타 지역), ECOG 수행 상태(0 vs. 1) 및 전이가 있는 장기 수(≤1 vs. ≥2)별로 계층화되었습니다. 주요 효능 결과 측정값은 TC PD-L1 발현 ≥ 1% 환자의 OS 및 BICR 평가 PFS였습니다. 추가 효능 측정값에는 모든 무작위 배정 환자의 OS, 모든 무작위 배정 환자의 BICR 평가 PFS, TC PD-L1 발현 ≥ 1% 및 모든 무작위 배정 환자의 BICR 평가 ORR이 포함되었습니다. RECIST v1.1에 따른 종양 평가는 최대 48주까지 6주마다 실시했으며, 그 이후에는 12주마다 실시했습니다.
CHECKMATE-648 연구에서 총 970명의 환자가 무작위 배정되었으며, 이 중 965명과 906명의 환자가 각각 기준선에서 정량화 가능한 TC PD-L1 발현과 CPS를 보였습니다. 모든 무작위 배정 환자의 시험 모집단 특성은 중앙값 연령 64세(범위: 26~90세), 47%가 65세 이상, 82%가 남성, 71%가 아시아인, 26%가 백인, 1.1%가 흑인이었습니다. 환자들은 식도에서 편평 세포 암종(98%) 또는 선편평 세포 암종(1.9%)으로 조직학적으로 확진되었습니다. 기준선 ECOG 수행 상태는 0(47.0%) 또는 1(53%)이었습니다.
효능 결과는 표 74 및 그림 23과 24에 나와 있습니다.
| a BICR에서 평가함. b 계층화된 Cox 비례 위험 모델을 기반으로 함. 위험 비는 각 분석 모집단 내에서 화학 요법과 비교하여 각 OPDIVO 함유군에 대해 보고됩니다. c 계층화된 양측 로그 순위 검정을 기반으로 함. S1, S2, S3, S4, S5 각각 0.009, 0.018, 0.005, 0.014, 0.015의 중단 경계와 비교하여 유의미한 p-값 NS: 통계적으로 유의하지 않음, NT: 사전 지정된 계층적 검정 절차에 따라 통계적 유의성을 평가하지 않음 |
||||||
|
시스플라틴 및 플루오로우라실 병용 OPDIVO |
OPDIVO 및 이필리무맙 |
시스플라틴 및 플루오로우라실 |
시스플라틴 및 플루오로우라실 병용 OPDIVO |
OPDIVO 및 이필리무맙 |
시스플라틴 및 플루오로우라실 |
|
|
모든 환자 |
TC PD-L1 발현 ≥1% |
|||||
|
전체 생존율 |
||||||
|
사망 (%) |
209 (65) |
216 (66) |
232 (72) |
98 (62) |
106 (67) |
121 (77) |
|
중앙값(개월) |
13.2 |
12.8 |
10.7 |
15.4 |
13.7 |
9.1 |
|
Hazard ratio (95% CI)b |
0.74 |
0.78 |
– |
0.54 |
0.64 |
– |
|
p-값c |
0.0021S1 |
0.0110S2 |
– |
<0.0001S3 |
0.0010S4 |
– |
|
무진행 생존a |
||||||
|
질병 진행 또는 사망 (%) |
235 (73) |
258 (79) |
210 (65) |
117 (74) |
123 (78) |
100 (64) |
|
중앙값 |
5.8 |
2.9 (2.7, 4.2) |
5.6 |
6.9 |
4.0 |
4.4 |
|
Hazard ratio (95% CI)b |
0.81 |
1.26 |
– |
0.65 |
1.02 |
– |
|
p-값c |
NS |
NT |
– |
0.0023S5 |
NS |
– |
|
전체 반응률, n (%)a, NT |
152 (47.4) |
90 (27.7) |
87 (26.9) |
84 (53.2) |
56 (35.4) |
31 (19.7) |
|
(95% CI) |
(41.8, 53.0) |
(22.9, 32.9) |
(22.1, 32.0) |
(45.1, 61.1) |
(28.0, 43.4) |
(13.8, 26.8) |
|
완전 반응 (%) |
43 (13.4) |
36 (11.1) |
20 (6.2) |
26 (16.5) |
28 (17.7) |
8 (5.1) |
|
부분 반응 (%) |
109 (34.0) |
54 (16.6) |
67 (20.7) |
58 (36.7) |
28 (17.7) |
23 (14.6) |
|
반응 기간(개월)a |
||||||
|
중앙값 |
8.2 |
11.1 |
7.1 |
8.4 |
11.8 |
5.7 |
|
범위 |
1.4+, 35.9+ |
1.4+, 34.5+ |
1.4+, 31.8+ |
1.4+, 34.6+ |
1.4+, 34.5+ |
1.4+, 31.8+ |
그림 23: 전체 생존율 – CHECKMATE-648
그림 24: 무진행 생존율 – CHECKMATE-648
|
(A) 모든 무작위 배정 환자의 PFS |
(B) TC PD-L1 ≥1%인 환자의 PFS |
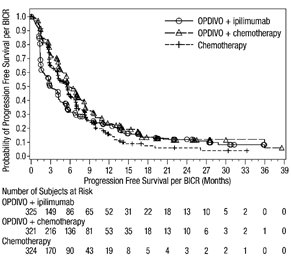 |
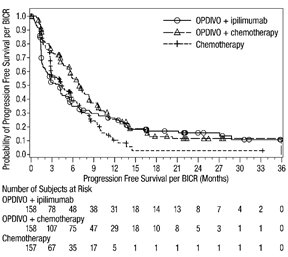 |
TC PD-L1 발현이 1% 미만인 환자(n=492)에 대한 탐색적 하위 그룹 분석이 수행되었습니다. 각 OPDIVO 함유군과 화학 요법을 비교한 OS 결과는 다음과 같습니다.
- •
- OPDIVO + 화학 요법(n=163) vs. 화학 요법(n=165): 비계층화 OS HR은 0.99(95% CI: 0.76, 1.29)였으며, OPDIVO + 화학 요법군의 중간 OS는 12개월(95% CI: 9.9, 15.5)이었고, 화학 요법군의 중간 OS는 12.2개월(95% CI: 10.7, 14)이었습니다.
- •
- OPDIVO + 이필리무맙(n=164) vs. 화학 요법(n=165): 비계층화 OS HR은 0.97(95% CI: 0.74, 1.26)였으며, OPDIVO + 이필리무맙군의 중간 OS는 12개월(95% CI: 10.1, 16.0)이었고, 화학 요법군의 중간 OS는 12.2개월(95% CI: 10.7, 14)이었습니다.
각 OPDIVO 함유군과 화학 요법을 비교하여 CPS(≥1 및 <1)별 PD-L1 상태에 대한 탐색적 하위 그룹 분석도 수행되었습니다. 기준선에서 정량화 가능한 PD-L1 CPS를 가진 906명의 환자 중 OPDIVO + 화학 요법군에서는 278명, OPDIVO + 이필리무맙군에서는 266명, 화학 요법군에서는 280명이 PD-L1 CPS≥1을 가졌습니다. OPDIVO + 화학 요법군에서는 27명, OPDIVO + 이필리무맙군에서는 31명, 화학 요법군에서는 24명이 PD-L1 CPS<1을 가졌습니다.
PD-L1 CPS 상태별 각 비교에 대한 OS 결과는 다음과 같습니다.
- •
- OPDIVO + 화학 요법 vs. 화학 요법: 비계층화 OS HR은 PD-L1 CPS≥1 하위 그룹의 경우 0.69(95% CI: 0.56, 0.84)였고, PD-L1 CPS<1 하위 그룹의 경우 0.98(95% CI: 0.50, 1.95)였습니다.
- •
- OPDIVO + 이필리무맙 vs. 화학 요법: 비계층화 OS HR은 PD-L1 CPS≥1 하위 그룹의 경우 0.76(95% CI: 0.62, 0.93)였고, PD-L1 CPS<1 하위 그룹의 경우 1.0(95% CI: 0.52, 1.94)였습니다.
이전에 치료받은 절제 불가능한 진행성, 재발성 또는 전이성 식도 편평 상피암(ESCC)
ATTRACTION-3(NCT02569242)는 적어도 1회의 플루오로피리미딘 및 백금 기반 요법에 내성이 있거나 불내성이 있는 절제 불가능한 진행성, 재발성 또는 전이성 ESCC 환자를 대상으로 한 다기관, 무작위(1:1), 활성 대조군, 공개 표지 시험이었습니다. 이 시험은 PD-L1 상태에 관계없이 환자를 등록했지만, 종양 검체는 중앙 실험실에서 PD-L1 IHC 28-8 pharmDx 검정을 사용하여 전향적으로 평가했습니다. 이 시험은 탁산 요법에 내성이 있거나 불내성이 있는 환자, 증상이 있거나 치료가 필요한 뇌 전이가 있는 환자, 자가 면역 질환이 있는 환자, 전신 코르티코스테로이드 또는 면역 억제제를 사용하는 환자, 식도 종양에 인접한 기관으로의 명백한 종양 침윤이 있는 환자 또는 식도 또는 호흡기계에 스텐트가 있는 환자를 제외했습니다. 환자는 30분 동안 정맥 주입으로 OPDIVO 240mg을 2주마다 투여하거나, 도세탁셀(75mg/m2, 3주마다 정맥 주입) 또는 파클리탁셀(100mg/m2, 6주 동안 일주일에 한 번 정맥 주입, 그 후 1주일 휴식)로 구성된 탁산 화학 요법을 연구자의 선택에 따라 투여받도록 무작위 배정되었습니다.
무작위 배정은 지역(일본 vs. 세계 기타 지역), 전이가 있는 기관 수(≤1 vs. ≥2) 및 PD-L1 상태(≥1% vs. <1% 또는 불확실)에 따라 계층화되었습니다. 환자는 연구자의 RECIST v1.1에 따라 평가된 질병 진행, 또는 용납할 수 없는 독성이 나타날 때까지 치료를 받았습니다. 종양 평가는 1년 동안 6주마다, 그 후에는 12주마다 수행되었습니다. 주요 유효성 결과 측정은 OS였습니다. 추가적인 유효성 결과 측정은 RECIST v1.1 및 DOR를 사용하여 연구자가 평가한 ORR 및 PFS였습니다.
총 419명의 환자가 무작위 배정되었습니다. 210명은 OPDIVO군에, 209명은 연구자의 선택군(도세탁셀: 31%, 파클리탁셀: 69%)에 배정되었습니다. 시험 모집단 특징은 다음과 같습니다. 중간 연령은 65세(범위: 33~87), 53%가 65세 이상, 87%가 남성, 96%가 아시아인, 4%가 백인이었습니다. 환자의 67%는 ATTRACTION-3에 등록하기 전에 1회의 전신 치료 요법을 받았고, 26%는 2회의 전신 치료 요법을 받았습니다. 기준선 ECOG 수행 상태는 0(50%) 또는 1(50%)이었습니다.
ATTRACTION-3은 연구자의 선택 탁산 화학 요법과 비교하여 OPDIVO에 무작위 배정된 환자의 OS가 통계적으로 유의하게 개선되었음을 보여주었습니다. PD-L1 발현 수준에 관계없이 OS 이점이 관찰되었습니다. 최소 추적 관찰 기간은 17.6개월이었습니다. 유효성 결과는 표 75 및 그림 25에 나와 있습니다.
| a ITT 분석 기반 b 계층화 비례 위험 모델 기반. c 계층화 로그 랭크 검정 기반. d 반응 평가 가능 집합(RES) 분석 기반, OPDIVO군은 n=171, 연구자의 선택군은 n=158. e 계층화 Cochran-Mantel-Haenszel 검정 기반; p 값은 유의하지 않음. f 사전에 지정된 계층적 검정 전략으로 인해 PFS는 검정되지 않았습니다. |
||
|
OPDIVO |
도세탁셀 또는 파클리탁셀 |
|
|
전반적인 생존율a |
||
|
사망(%) |
160 (76%) |
173 (83%) |
|
중간(개월) |
10.9 |
8.4 |
|
위험 비율(95% CI)b |
0.77 (0.62, 0.96) |
|
|
p 값c |
0.0189 |
|
|
전체 반응률d |
33 (19.3) |
34 (21.5) |
|
(95% CI) |
(13.7, 26.0) |
(15.4, 28.8) |
|
완전 반응 (%) |
1 (0.6) |
2 (1.3) |
|
부분 반응 (%) |
32 (18.7) |
32 (20.3) |
|
반응 지속 기간 중앙값(개월) |
6.9 |
3.9 |
|
p-값e |
0.6323 |
|
|
무진행 생존a, f |
||
|
질병 진행 또는 사망 (%) |
187 (89) |
176 (84) |
|
중앙값(개월) |
1.7 |
3.4 |
|
위험 비율 (95% CI)b |
1.1 (0.9, 1.3) |
|
그림 25: 전체 생존율 – ATTRACTION-3
419명의 환자 중 48%가 PD-L1 양성 ESCC(종양 세포의 ≥1%에서 PD-L1 발현)였습니다. 나머지 52%는 PD-L1 음성 ESCC(종양 세포의 <1%에서 PD-L1 발현)였습니다.
PD-L1 상태별 사전 지정된 탐색적 분석에서 OS에 대한 위험 비율(HR)은 0.69(95% CI: 0.51, 0.94)였으며, PD-L1 양성 하위 그룹에서 OPDIVO군과 연구자 선택 치료군의 중앙값 생존 기간은 각각 10.9개월과 8.1개월이었습니다. PD-L1 음성 하위 그룹에서 OS에 대한 HR은 0.84(95% CI: 0.62, 1.14)였으며, OPDIVO군과 연구자 선택 치료군의 중앙값 생존 기간은 각각 10.9개월과 9.3개월이었습니다.
14.13 위암, 위식도 접합부암, 식도 선암종
CHECKMATE-649(NCT02872116)는 이전에 치료받지 않은 진행성 또는 전이성 위암, 위식도 접합부암, 식도 선암종 환자(n=1581)를 대상으로 한 무작위 배정, 다기관, 공개 표지 시험이었습니다. 이 시험에는 PD-L1 상태와 관계없이 환자가 등록되었으며, 종양 검체는 중앙 실험실에서 PD-L1 IHC 28-8 pharmDx 분석을 사용하여 전향적으로 평가되었습니다. 이 시험에서는 알려진 인간 상피 성장 인자 수용체 2(HER2) 양성이거나 치료받지 않은 CNS 전이가 있는 환자는 제외되었습니다. 환자들은 OPDIVO와 화학 요법 병용(n=789) 또는 화학 요법(n=792)을 무작위로 배정받았습니다. 환자들은 다음 치료 중 하나를 받았습니다.
- •
- OPDIVO 240mg + mFOLFOX6(플루오로우라실, 레우코보린, 옥살리플라틴) 2주마다 투여 또는 mFOLFOX6 2주마다 투여
- •
- OPDIVO 360mg + CapeOX(카페시타빈, 옥살리플라틴) 3주마다 투여 또는 CapeOX 3주마다 투여
환자들은 질병 진행, 허용할 수 없는 독성이 나타나거나 최대 2년까지 치료를 받았습니다. OPDIVO와 화학 요법을 병용 투여받은 환자 중 화학 요법을 중단한 환자의 경우 치료 시작 후 최대 2년까지 OPDIVO 단독 요법을 2주마다 240mg, 3주마다 360mg 또는 4주마다 480mg 투여할 수 있었습니다.
무작위 배정은 종양 세포 PD-L1 상태(≥1% 대 <1% 또는 판정 불가), 지역(아시아 대 미국 대 기타 지역), ECOG 수행 상태(0 대 1), 화학 요법(mFOLFOX6 대 CapeOX)으로 계층화되었습니다. PD-L1 CPS ≥5 환자에서 평가된 주요 효능 결과 측정치는 BICR로 평가한 PFS와 OS였습니다. 추가 효능 결과 측정치에는 PD-L1 CPS ≥1 환자와 무작위 배정된 모든 환자에서의 OS 및 PFS, 그리고 PD-L1 CPS ≥1 및 ≥5 환자와 무작위 배정된 모든 환자에서 BICR로 평가한 ORR 및 DOR이 포함되었습니다. 종양 평가는 최대 48주까지 6주마다 RECIST v1.1에 따라 수행되었으며, 그 이후에는 12주마다 수행되었습니다.
시험 모집단 특성은 다음과 같습니다. 중앙값 연령 61세(범위: 18~90세), 39%는 65세 이상, 70%는 남성, 24%는 아시아인, 69%는 백인, 1%는 흑인이었습니다. 기준 ECOG 수행 상태는 0(42%) 또는 1(58%)이었습니다. 환자의 70%는 위에 선암종이 있었고, 16%는 위식도 접합부에, 13%는 식도에 선암종이 있었습니다.
CHECKMATE-649는 PD-L1 CPS ≥5 환자에서 OS 및 PFS가 통계적으로 유의미하게 개선되었음을 입증했습니다. 또한 무작위 배정된 모든 환자에서 OS가 통계적으로 유의미하게 개선된 것으로 나타났습니다. 최소 추적 기간은 12.1개월이었습니다. 효능 결과는 표 76과 그림 26, 27, 28에 나와 있습니다.
| a 계층화된 Cox 비례 위험 모델을 기반으로 함. b 계층화된 로그 순위 검정을 기반으로 함. c BICR로 평가함. d 확증된 반응을 기반으로 함. e 통계적 유의성에 대해 평가하지 않음. |
||||||
|
OPDIVO + mFOLFOX6 |
mFOLFOX6 |
OPDIVO + mFOLFOX6 |
mFOLFOX6 |
OPDIVO + mFOLFOX6 |
mFOLFOX6 |
|
|
모든 환자 |
PD-L1 CPS ≥1 |
PD-L1 CPS ≥5 |
||||
|
전체 생존율 |
||||||
|
사망 (%) |
544 (69) |
591 (75) |
434 (68) |
492 (75) |
309 (65) |
362 (75) |
|
중앙값 |
13.8 |
11.6 |
14.0 |
11.3 |
14.4 |
11.1 |
|
위험 비 |
0.80 (0.71, 0.90) |
0.77 (0.68, 0.88) |
0.71 (0.61, 0.83) |
|||
|
p-값b |
0.0002 |
<0.0001 |
<0.0001 |
|||
|
무진행 생존c |
||||||
|
질병 |
559 (70.8) |
557 (70.3) |
454 (70.8) |
472 (72.1) |
328 (69.3) |
350 (72.6) |
|
중앙값 |
7.7 |
6.9 |
7.5 |
6.9 |
7.7 |
6.0 |
|
위험 비 (95% CI)a |
0.77 (0.68, 0.87) |
0.74 (0.65, 0.85) |
0.68 (0.58, 0.79) |
|||
|
p-값b |
–e |
–e |
<0.0001 |
|||
|
전체 반응률, n (%)c,d |
370 (47) |
293 (37) |
314 (49) |
249 (38) |
237 (50) |
184 (38) |
|
(95% CI) |
(43, 50) |
(34, 40) |
(45, 53) |
(34, 42) |
(46, 55) |
(34, 43) |
|
완전 |
78 (10) |
52 (7) |
65 (10) |
42 (6) |
55 (12) |
34 (7) |
|
부분 |
292 (37) |
241 (30) |
249 (39) |
207 (32) |
182 (38) |
150 (31) |
|
반응 기간(개월)c,d |
||||||
|
중앙값 |
8.5 |
6.9 |
8.5 |
6.9 |
9.5 |
6.9 |
PD-L1 CPS<1 환자(n=265)에 대한 예 exploratory analysis에서 OPDIVO 및 화학 요법군의 OS 중앙값은 13.1개월(95% CI: 9.8, 16.7)이었고 화학 요법군은 12.5개월(95% CI: 10.1, 13.8)이었으며, 층화 HR은 0.85(95% CI: 0.63, 1.15)였습니다.
PD-L1 CPS<5 환자(n=606)에 대한 예 exploratory analysis에서 OPDIVO 및 화학 요법군의 OS 중앙값은 12.4개월(95% CI: 10.6, 14.3)이었고 화학 요법군은 12.3개월(95% CI: 11.0, 13.2)이었으며, 층화 HR은 0.94(95% CI: 0.78, 1.14)였습니다.
그림 26: 전체 생존 기간(모든 환자) – CHECKMATE-649
그림 27: 전체 생존 기간(PD-L1 CPS ≥1) – CHECKMATE-649
그림 28: 전체 생존 기간(PD-L1 CPS ≥5) – CHECKMATE-649
16 공급/보관 및 취급 방법
OPDIVO® (니볼루맙) 주사제는 단회용 바이알에 담긴 투명하거나 유백색의 무색에서 옅은 노란색 용액으로 다음과 같이 제공됩니다.
|
포장 내용 |
NDC |
|
40 mg/4 mL (10 mg/mL) 단회용 바이알 |
0003-3772-11 |
|
100 mg/10 mL (10 mg/mL) 단회용 바이알 |
0003-3774-12 |
|
120 mg/12 mL (10 mg/mL) 단회용 바이알 |
0003-3756-14 |
|
240 mg/24 mL (10 mg/mL) 단회용 바이알 |
0003-3734-13 |
2°C~8°C(36°F~46°F)의 냉장 보관하십시오. 사용할 때까지 원래 포장 상태로 빛을 차단하여 보관하십시오. 냉동하거나 흔들지 마십시오.
17 환자 상담 정보
환자에게 FDA 승인 환자 라벨을 읽도록 지시하십시오 (약물 안내).
면역 매개 이상 반응
환자에게 코르티코스테로이드 치료와 OPDIVO의 보류 또는 중단을 요구할 수 있는 면역 매개 이상 반응의 위험을 알리십시오. 여기에는 다음이 포함됩니다.
- •
- 폐렴: 환자에게 새로운 기침, 가슴 통증 또는 호흡 곤란이 발생하거나 악화되면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- •
- 대장염: 환자에게 설사 또는 심한 복통이 발생하면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- •
- 간염: 환자에게 황달, 심한 메스꺼움 또는 구토, 복부 오른쪽 통증, 무기력증 또는 쉬운 멍이나 출혈이 발생하면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- •
- 내분비 질환: 환자에게 뇌하수체염, 부신 기능 저하증, 갑상선 기능 저하증, 갑상선 기능 항진증 및 당뇨병의 징후 또는 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- •
- 신염 및 신장 기능 장애: 환자에게 소변량 감소, 혈뇨, 발목 부종, 식욕 부진 및 기타 신장 기능 장애 증상이 나타나면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
- •
- 피부 이상 반응: 환자에게 발진이 발생하면 즉시 의료 서비스 제공자에게 연락하도록 지시하십시오 [경고 및 주의 사항 (5.1) 참조].
주입 관련 반응
- •
- 환자에게 주입 관련 반응의 잠재적 위험을 알리십시오 [경고 및 주의 사항 (5.2) 참조].
동종 이식 HSCT의 합병증
- •
- 환자에게 이식 후 합병증의 잠재적 위험을 알리십시오 [경고 및 주의 사항 (5.3) 참조].
태아 독성
- •
- 생식 능력이 있는 여성에게 태아에 대한 잠재적 위험을 알리고 알려진 또는 의심되는 임신을 의료 서비스 제공자에게 알리도록 지시하십시오 [경고 및 주의 사항 (5.4), 특정 인구에 대한 사용 (8.1) 참조].
- •
- 생식 능력이 있는 여성에게 OPDIVO 치료 중 및 마지막 투여 후 최소 5개월 동안 효과적인 피임법을 사용하도록 지시하십시오 [특정 인구에 대한 사용 (8.3) 참조].
수유
- •
- 여성에게 OPDIVO 치료 중 및 마지막 투여 후 5개월 동안 모유 수유를 하지 말도록 지시하십시오 [특정 인구에 대한 사용 (8.2) 참조].
약물 안내문
|
복용 안내
OPDIVO® (옵디보) |
|||
|
OPDIVO 투여를 시작하기 전과 매 회 주입 전에 이 복용 안내를 읽으십시오. 새로운 정보가 있을 수 있습니다. 귀하의 담당 의료 전문가가 ipilimumab와 병용하여 OPDIVO를 처방하는 경우, ipilimumab에 동봉된 복용 안내 또한 읽으십시오. 귀하의 담당 의료 전문가가 cabozantinib와 병용하여 OPDIVO를 처방하는 경우, cabozantinib에 동봉된 환자 정보 또한 읽으십시오. 이 복용 안내는 귀하의 건강 상태 또는 치료에 대해 담당 의료 전문가와 상담하는 것을 대신하지 않습니다. |
|||
|
OPDIVO에 대해 알아야 할 가장 중요한 정보는 무엇입니까? OPDIVO는 귀하의 면역 체계와 함께 작용하여 특정 암을 치료할 수 있는 약물입니다. OPDIVO는 귀하의 면역 체계가 신체 어느 부위에서든 정상 장기 및 조직을 공격하도록 하여 정상적인 기능을 방해할 수 있습니다. 이러한 문제는 때때로 심각해지거나 사망에 이를 수 있습니다. 이러한 문제는 치료 중 언제든지 또는 치료가 끝난 후에도 발생할 수 있습니다. 이러한 문제가 동시에 여러 개 발생할 수 있습니다. 이러한 문제 중 일부는 OPDIVO를 다른 치료법과 병용할 때 더 자주 발생할 수 있습니다. 다음을 포함하여 새롭거나 악화된 징후 또는 증상이 나타나면 즉시 담당 의료 전문가에게 전화하거나 진찰을 받으십시오. 폐 문제. |
|||
|
|
|
|
|
장 문제.
간 문제. |
|||
|
|
||
|
호르몬샘 문제. |
|||
|
|
||
|
신장 문제. |
|||
|
|
||
|
피부 문제. |
|||
|
|
||
|
다른 장기 및 조직에서도 문제가 발생할 수 있습니다. 이것이 OPDIVO에서 발생할 수 있는 면역 체계 문제의 모든 징후 및 증상은 아닙니다. 다음을 포함하여 새롭거나 악화된 징후 또는 증상이 나타나면 즉시 담당 의료 전문가에게 전화하거나 진찰을 받으십시오. |
|||
|
|||
|
즉시 치료를 받으면 이러한 문제가 더 심각해지는 것을 막는 데 도움이 될 수 있습니다. 귀하의 담당 의료 전문가는 OPDIVO 치료 중 이러한 문제가 있는지 확인할 것입니다. 귀하의 담당 의료 전문가는 코르티코스테로이드 또는 호르몬 대체 약물로 귀하를 치료할 수 있습니다. 또한 심각한 부작용이 있는 경우 담당 의료 전문가가 OPDIVO 치료를 지연하거나 완전히 중단해야 할 수도 있습니다. |
|||
|
OPDIVO란 무엇입니까? OPDIVO는 다음을 치료하는 데 사용되는 처방약입니다.
OPDIVO가 흑색종 또는 MSI-H 또는 dMMR 전이성 결장직장암이 있는 12세 미만의 소아 환자에게 안전하고 효과적인지는 알려져 있지 않습니다. OPDIVO가 다른 암 치료를 위해 소아 환자에게 안전하고 효과적인지는 알려져 있지 않습니다. |
|||
|
OPDIVO를 투여받기 전에 다음을 포함한 모든 의학적 상태에 대해 의료 서비스 제공자에게 알리십시오.
처방약과 일반 의약품, 비타민, 허브 보충제를 포함하여 복용하는 모든 약물에 대해 의료 서비스 제공자에게 알리십시오. |
|||
|
OPDIVO는 어떻게 투여받습니까?
|
|||
|
OPDIVO의 가능한 부작용은 무엇입니까? OPDIVO는 다음을 포함한 심각한 부작용을 일으킬 수 있습니다.
|
|||
|
|
||
OPDIVO를 단독으로 사용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
OPDIVO를 ipilimumab과 병용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
OPDIVO를 화학 요법과 병용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
OPDIVO를 ipilimumab 및 화학 요법과 병용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
OPDIVO를 cabozantinib와 병용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
OPDIVO를 fluoropyrimidine 및 백금 함유 화학 요법과 병용했을 때 가장 흔한 부작용은 다음과 같습니다. |
|||
|
|
||
|
이러한 것들이 OPDIVO의 가능한 모든 부작용은 아닙니다. 부작용에 대한 의학적 조언은 의사에게 문의하십시오. 1-800-FDA-1088로 FDA에 부작용을 보고할 수 있습니다. |
|||
|
OPDIVO의 안전하고 효과적인 사용에 대한 일반 정보. 의약품은 때때로 복용 안내서에 나열된 것 이외의 목적으로 처방되기도 합니다. 의료 전문가를 위해 작성된 OPDIVO에 대한 정보는 약사 또는 담당 의료 전문가에게 문의할 수 있습니다. |
|||
|
OPDIVO의 성분은 무엇입니까? 활성 성분: nivolumab 비활성 성분: 만니톨, 펜테트산, 폴리소르베이트 80, 염화나트륨, 시트르산나트륨이수화물, 주사용수. 염산 및/또는 수산화나트륨을 함유할 수 있습니다. 제조업체: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 미국 라이선스 번호 1713 OPDIVO®는 Bristol-Myers Squibb Company의 상표입니다. 나열된 다른 브랜드는 해당 소유자의 상표입니다. 자세한 내용은 1-855-673-4861로 전화하거나 www.OPDIVO.com을 방문하십시오. |
|||
이 복용 안내서는 미국 식품의약국(FDA)의 승인을 받았습니다.
개정일: 2024년 3월
OPDIVO 40 mg/4 mL 대표 포장
사용 가능한 OPDIVO 포장 목록은 공급 방법 섹션을 참조하십시오.
NDC 0003-3772-11
Rx only
Opdivo®
(nivolumab)
주사
40 mg/4 mL
(10 mg/mL)
정맥 주입 전용
1회 투여용 바이알, 사용하지 않은 부분은 폐기하십시오.
동봉된 복약 안내서를 환자에게 제공하십시오.
Bristol Myers Squibb
옵디보 100mg/10mL 대표 포장
NDC 0003-3774-12
Rx only
Opdivo®
(니볼루맙)
주사제
100 mg/10 mL
(10 mg/mL)
정맥 내주사용
일회용 약병; 사용하지 않은 약은 폐기하십시오.
환자에게 동봉된 약물 안내서를 제공하십시오.
브리스톨 마이어스 스쿼이브
OPDIVO 120mg/12mL 대표 포장
NDC 0003-3756-14
Rx only
Opdivo®
(nivolumab)
주사
120 mg/12 mL
(10 mg/mL)
정맥 내 주입 전용
일회용 바이알, 사용하지 않은 부분은 폐기하십시오.
동봉된 복약 안내서를 환자에게 제공하십시오.
Bristol Myers Squibb
옵디보 240mg/24mL 대표 포장
NDC 0003-3734-13
전용 처방전
Opdivo®
(nivolumab)
주사제
240 mg/24 mL
(10 mg/mL)
정맥 내 주입용
일회용 앰플; 사용하지 않은 부분은 폐기하십시오.
환자에게 동봉된 약물 안내서를 제공하십시오.
Bristol Myers Squibb